Глава 9. Немедикаментозні та хірургічні методи лікування
Ортопедичні пристрої для пацієнтів із ревматичними захворюваннями з ураженням суглобів
Ортез — зовнішній ортопедичний пристрій, що забезпечує стабілізацію, розвантаження та корекцію анатомічних і біомеханічних осей, захист суглоба чи різних сегментів опорно-рухової системи. До гетерогенної групи цих пристроїв належать тутори, лонгети, шини, ортопедичні апарати, бандажі, корсети, а також ортопедичні устілки і саме ортопедичне взуття (рис. 9.1). Устілки — унікальний вид ортезів: конструктивно-статичний, на практиці виконує повноцінні динамічні функції (забезпечує оптимальний перерозподіл навантажень не лише у стопі, а й у всіх верхніх ланках опорно-рухової системи).
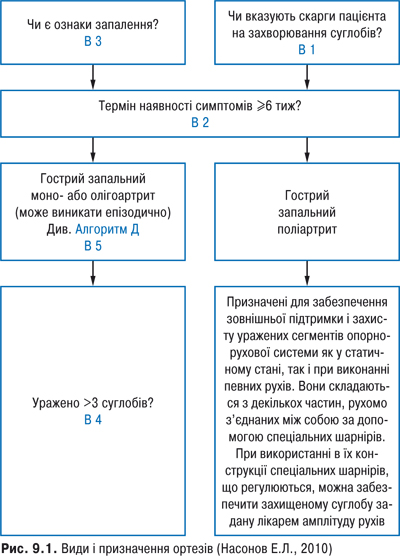
Індивідуальні ортези краще відповідають анатомічним особливостям кожної конкретної особи. Індивідуальні ортези виготовляють за допомогою позитивної моделі сегмента, що ортезують, чи без такої. Таку модель виготовляють за допомогою гіпсових розчинів, термопластичних матеріалів, низькотемпературних пластичних матеріалів, що дозволяє проводити моделювання прямо на тілі пацієнта. Серійно виготовляють різні модульні конструкції, що дозволяє скоротити час побудови моделі. Зниження інтенсивності болю і поліпшення функціонування суглобів — основний критерій оцінки ефективності ортопедичних пристосувань. Виправлення деформацій можливе лише у тому разі, якщо вони не фіксовані й в основному зумовлені змінами в навколосуглобових м’яких тканинах, а також у дітей в період росту. Доказова база на підтримку профілактичних властивостей ортезування зібрана мало, хоча і показано, що застосування статичних ортезів кисті у хворих на РА сприяє уповільненню формування ульнарної девіації пальців. Мета застосування ортезів — зовнішній захист суглоба, правильне функціональне позиціонування суглоба під час руху, стабілізація суглобів, збільшення пасивного обсягу рухів у суглобах, зменшення вираженості болю за рахунок іммобілізації, корекція нефіксованих деформацій (у ряді випадків).
Показаннями до призначення ортезів є активний артрит, синовіт, тендосиновіт, тендовагініт, нестабільність суглоба, розробка, стабілізація і захист суглобів після ортопедичних операцій, зниження функціональної здатності суглоба, особливо у разі неможливості проведення оперативного лікування. Практично для всіх суглобів кінцівок і хребта розроблена величезна кількість ортезів.
Ортези при деформації пальців кисті
У хворих на РА виникає характерна деформація за типом «шиї лебедя» (перерозгинання у проксимальному міжфаланговому суглобі та згинання в дистальному) або «ґудзикової петлі» (згинання в проксимальному і перерозгинання в дистальному міжфаланговому суглобі), що можна поліпшити за рахунок носіння ортеза. Показаннями є нефіксовані деформації пальців типу «шиї лебедя» і «ґудзикової петлі» у хворих на РА. До протипоказань належать фіксовані деформації пальців у результаті кісткового чи фіброзного анкілозу міжфалангових суглобів пальців кисті. Підготовка не потрібна. Пристрій складається з двох кілець, з’єднаних між собою під кутом 45°. При його надяганні одне кільце косопоперечно охоплює проксимальну, а друге — дистальну фалангу пальця. Місце їх з’єднання знаходиться у ділянці волярної складки міжфалангового суглоба. Подібна конструкція перешкоджає перерозгинанню пальця в міжфаланговому суглобі. При використанні ортеза слід особливу увагу приділяти відповідності його параметрів анатомічним особливостям кисті пацієнта. Надягають ортез при виконанні будь-якої ручної праці, а також під час сну. В результаті відбувається покращання стану суглобів, а значить, і функції кисті. Але при цьому віддалені результати і профілактична роль вивчені недостатньо. На ефективність можуть вплинути ступінь вираженості деформації; стан колатеральних зв’язок і вираженість м’язового дисбалансу між згиначами і розгиначами пальців. При невдалому підборі розмірів ортеза пальця в місцях контакту зі шкірою можливе утворення потертостей, що вимагає якнайшвидшого ремоделювання ортеза. Альтернативним методом є хірургічна корекція — артродез міжфалангових суглобів у функціонально-вигідній позиції (зазвичай).
Ортез для I пальця кисті
Патологічні зміни в цій ділянці викликають значний больовий синдром, що призводить до швидкої втрати функціональності суглобів кисті, прогресування запальних змін і підвищення нестабільності суглоба. Мета цієї методики — зменшення вираженості болю, поліпшення функції та запобігання розвитку контрактур шляхом стабілізації I п’ястково-фалангового і зап’ястно-п’ясткового суглоба. До показань належать: блокада суглобів I пальця при РА; «замикається» палець; артроз I зап’ястно-п’ясткового суглоба; хвороба де Кервена. Підготовка не потрібна. При артрозі й артриті застосовують жорсткий або напівжорсткий ортез, що захоплює I п’ястково-фаланговий і зап’ястно-п’ястковий суглоб, залишаючи вільними променезап’ястковий і міжфаланговий суглоби великого пальця. При хворобі де Кервена застосовують комбінований ортез, що іммобілізує зап’ястно-п’ястковий суглоб великого пальця в положенні помірного відведення та променезап’ястковий — у положенні невеликого розгинання і радіального відхилення. Міжфаланговий суглоб залишають вільним. Методика використання — чергування з виконанням вправ.
У результаті відмічають зменшення вираженості болю і поліпшення функції. На ефективність застосування ортезів впливає їх використання на ранніх етапах захворювання. Але достовірних відмінностей в ефективності їх модифікацій не виявлено. Ускладнення не описані. До альтернативних методів відносять місцеве застосування ГК, що виявляється ефективним у 80–90% випадків. При неефективності консервативних заходів показане хірургічне лікування.
Ортез для променезап’ясткового суглоба (робочий ортез кисті)
До значного зниження функціональної здатності кисті при виконанні повсякденних маніпуляцій може призвести артрит променезап’ясткового суглоба, а його нестабільність — до фіксації суглоба у протиприродному положенні, що також призводить до формування стандартних деформацій променезап’ясткового суглоба при РА у вигляді волярного підвивиху і радіального відхилення кісток зап’ястя. Робочі ортези кисті, що стабілізують променезап’ястковий суглоб, широко застосовують у ревматологічній практиці вже понад 30 років, хоча дані щодо користі їх ефективності доволі суперечливі. Фіксація променезап’ясткового суглоба у функціонально вигідній позиції для поліпшення роботи та зменшення вираженості болю при ручній праці — ось головне завдання для використання ортеза з терапевтичною метою. З цього і випливають основні показання — нестабільність і блокада променезап’ясткового суглоба при РА. Підготовка не потрібна.
За допомогою ортеза променезап’ястковий суглоб фіксують у положенні розгинання під кутом ≈30°, а п’ястково-фалангові та міжфалангові суглоби залишають вільними. Підвивихи і виражена нестабільність променезап’ясткового суглоба, вираженість м’язового дисбалансу можуть дещо погіршувати результати цієї лікувальної тактики. Надзвичайна точність у підборі ортеза — запорука вдалого результату. Щодо ускладнень методу повідомлень немає. При неефективності консервативних заходів показане хірургічне лікування: тендосиновектомія, частковий радіоульнарний артродез, резекційна артропластика голівки ліктьової кістки.
Статичний ортез кисті (тутор кисті, долонна шина кисті, кистеутримувач)
Відомо, що при запальних процесах у суглобах та періартикулярних структурах іммобілізація зменшує вираженість болю. Тому метою застосування статичного ортеза кисті є зменшення вираженості регіонарних запальних змін та фіксація суглоба у фізіологічному положенні як профілактика його деформацій і контрактур. Ортези показані при артриті променезап’ясткового, п’ястково-фалангових і міжфалангових суглобів, нефіксованій стадії ульнарної девіації пальців І–ІІІ стадії за Зейфридом, тендиніті й тендосиновіті в ділянці зап’ястка, синдромі карпального каналу, стенозуючому тендосиновіті згиначів пальців кисті, латеральному епікондиліті. До протипоказань відносять стійкі деформації суглобів. Підготовка не потрібна. Ортези виготовляють як серійно, так і індивідуально, застосовуючи різні термопластичні й полімеризуючі матеріали. Для моделювання фіксують кисть у нейтральному положенні: розгинання у променезап’ястковому суглобі під кутом 25–30°, великий палець відведений, п’ястково-фалангові і міжфалангові суглоби в положенні згинання під кутом 15–20°. Важливо усунути нефіксовану ульнарну девіацію пальців. У гострий період артриту ортез використовують постійно, за винятком часу проведення ЛФК, аби зберегти повний обсяг рухів у суглобах кисті і променезап’ястковому суглобі. У підгострий період тутор використовують протягом декількох годин у денний і нічний час.
На жаль, на сьогодні профілактична роль статичних ортезів кисті щодо прогресування ульнарної девіації недостатньо вивчена. Хоча у ряді робіт показано, що на ранніх стадіях захворювання нічна іммобілізація знижує імовірність виникнення ульнарної девіації. Застосування ортезів кисті найбільш ефективне на ранніх стадіях захворювання. Не вартро забувати і про те, що тривала безперервна іммобілізація може вести до розвитку гіпотрофії м’язів. Ортезування часто застосовують на тлі місцевої ГК-терапії. Оперативне лікування показане у разі неефективності консервативних заходів.
Ортез при епікондиліті
Больовий синдром при епікондиліті спричиняє навантаження на ділянки прикріплення сухожиль м’язів до плечової кістки. При цій патології розвантаження запалених ділянок приводить до зменшення вираженості болю і покращання стану суглоба. Ортезування при епікондиліті має зменшити вираженість болю і поліпшити діяльність кисті та ліктьового суглоба. Показаннями до призначення ортезів є латеральний і медіальний епікондиліт плеча, а протипоказаннями — порушення кровообігу в передпліччі та кисті. На підготовчому етапі слід перевірити, чи не порушує ортез кровопостачання у тканинах передпліччя і кисті.
Зовнішній вигляд такого ортеза — щільна стрічка чи манжетка шириною 3–4 см зі щільного нееластичного матеріалу. В деяких модифікаціях ортезів між шарами такої тканини іноді розташовують тонку вставку із пластичного матеріалу, що надає виробу достатньої жорсткості, але при цьому запобігає деформації та скручуванню ортеза, а також сприяє більш рівномірному розподілу тиску під ним по поверхні передпліччя. Ортез розташовують циркулярно навколо передпліччя на відстані 2–3 см від ліктьового суглоба. Він стискає м’язи передпліччя, при цьому відбувається перерозподіл осьових навантажень, що виникають у згиначах і розгиначах кисті при русі, знижується сила натягу сухожиль у місцях їх прикріплення до виростків плечової кістки. Використовують протягом гострого періоду захворювання. У пацієнтів із епікондилітом плеча носіння ортеза підвищує поріг больової чутливості при виконанні тестових вправ. Слід враховувати, що точних даних щодо факторів, які впливають на ефективність ортеза, досі немає. Хоча відомо, що результативність цієї методики можна покращити шляхом застосування в комплексі з місцевою ГК-терапією.
Ортез для шийного відділу хребта
Ураження зв’язкового і м’язового апарату хребта призводить до функціональної нестабільності та спазму, що, у свою чергу, може стати причиною неврологічних і судинних порушень. Тому зовнішня підтримка хребта може сприяти зменшенню вираженості як ревматологічної, так і неврологічної симптоматики. Головними при цьому є захист, стабілізація і розвантаження шийного відділу хребта, а також зменшення спазму м’язів шиї. Тому ортезування хребта показане при болю і нестабільності в шийному відділі хребта. Але нестабільність шийних хребців, що потребує хірургічного лікування, є протипоказанням для цієї методики. Ортезування хребта проводять під контролем візуалізаційних методик, частіше за все — рентгенографії, та після попередньо проведених функціональних проб. Пацієнти віддають перевагу більш м’яким виробам, оскільки вони комфортніші, хоча й не настільки ефективні. Призначають ортез на момент найбільш вираженого больового синдрому, а також при статичних і динамічних навантаженнях, іноді рекомендують використовувати і під час сну. Більш жорсткі конструкції використовують при підвивихах хребців. Використовуючи цей метод лікування, можна очікувати зменшення вираженості болю за рахунок стабілізації хребта та зменшення спазму м’язів. Ефективність методу багато в чому залежить від точності виконання пацієнтом режимів використання ортеза. Важливим ускладненням при неправильно підібраному ортезі є порушення кровопостачання головного мозку. Також описані випадки дисфагії на фоні застосування жорстких виробів.
Груднопоперековий ортез при остеопорозі (груднопоперековий корсет)
Як важливий компонент профілактики переломів та для лікування при больовому синдромі у пацієнтів із ОП використовують зовнішню підтримку і захист хребта. Головними при цьому є зниження ризику розвитку переломів тіл хребців, а також зміцнення м’язів спини, зменшення вираженості больового синдрому, що показано при ОП хребта, компресійних переломах тіл хребців. Обов’язково слід провести рентгенологічне обстеження перед процедурою ортезування. Груднопоперековий ортез — жорстка регульована конструкція, що фіксує одразу поперековий, грудний відділи хребта і плечовий пояс. Верхня частина корсета створює динамічний опір згинанню у грудному відділі хребта за рахунок захоплення плечового пояса, зменшує кіфоз і навантаження на передні відділи тіл грудних хребців. І хоча корсети при ОП призначають досить часто, даних, що підтверджують їх ефективність, недостатньо. Важливим фактором є те, що при тривалому використанні можливий розвиток гіпотрофії м’язів спини. Альтернативні методики не описані.
Ортез для попереково-крижового відділу хребта
Можна зменшити вираженість болю у нижній ділянці спини шляхом застосуванням зовнішніх стабілізуючих пристроїв. Зменшенню спондилолістезу допомагає згладжування поперекового лордозу за рахунок використання корсета. Застосування поперекового ортеза зменшує вираженість компенсаторного болючого спазму і полегшує стан пацієнта при гострому болю у спині. Саме тому зменшення вираженості болю у попереково-крижовому відділі хребта є саме по собі показником ефективності цієї методики. Використовувати зазначений тип ортезів можна при болю в нижній ділянці спини та нестабільності хребців попереково-крижового відділу. Одягають ортез у положенні лежачи на спині. Цей пристрій виглядає як широкий пояс, що охоплює попереково-крижовий відділ хребта. Вираженість його жорсткості може бути різною: від еластичних бандажів без ребер жорсткості до надміцних конструкцій з армуючими елементами з металу чи пластика. Поперекові ортези різних розмірів випускають серійно, їх підбирають індивідуально. Близько 42% пацієнтів відзначають зниження інтенсивності болю при використанні поперекових корсетів, а найбільший знеболювальний ефект відмічають у пацієнтів із нестабільністю хребців. Хоча тривала і повна іммобілізація може призвести до атрофії м’язів, однак при дотриманні принципу уривчастості використання корсета і виконанні зміцнювальних вправ цього вдається уникнути. Найбільш доцільно поєднувати використання поперекових корсетів і кінезотерапію.
Ортез для колінного суглоба (колінний бандаж (наколінник)), апарат на колінний суглоб
Патологію колінного суглоба досить часто відзначають у хворих ревматологічного профілю, особливо при РА та ОА, тому використання іммобілізуючих ортезів у гострій фазі артриту сприяє зменшенню вираженості больового синдрому та місцевих ознак запалення, а також профілактиці появи згинальних контрактур. Залучення в патологічний процес зв’язкового апарату провокує ще більше посилення больового синдрому та появу нестабільності суглоба, тому зовнішня підтримка ортезом допоможе запобігти появі цієї симптоматики. Колінні ортези, що вальгізують та варизують, діють за принципом «трьох точок» і призначені для розвантаження медіального чи латерального надвиростку великогомілкової кістки при відповідних формах гонартрозу. Етапне ортезування колінного суглоба дає позитивні результати при лікуванні згинальних контрактур.
В окрему групу слід виділити динамічні колінні ортези, що дозволяють дозовано обмежувати обсяг рухів у суглобі, тому їх варто застосовувати в реабілітаційний період артропластичних операцій. Якщо розглядати в цілому, то для статичних ортезів головним є забезпечити спокій запаленого суглоба в оптимальному положенні, в той час як для динамічних — зменшити вираженність болю і поліпшити функцію суглоба. Подібне ортезування показане при артриті та артрозі колінного суглоба, нестабільності колінного суглоба через недостатність бічних і хрестоподібних зв’язок, пошкодженні менісків, нестабільності наколінника, етапній розробці суглоба після артропластичних операцій. До протипоказань методу слід віднести порушення кровообігу нижніх кінцівок, причому тромбофлебіт глибоких вен нижніх кінцівок — абсолютне протипоказання. На ранніх етапах варикозного розширення поверхневих вен використання колінних ортезів можливе разом із антиварикозними виробами. Однак перед призначенням колінних ортезів необхідна консультація ангіохірурга чи флеболога для оцінки стану судин нижніх кінцівок.
Існують різні види ортезів залежно від ступеня жорсткості конструкції: м’яко-еластичні колінні бандажі без бічних жорстких ребер, м’яко-еластичні з бічними ребрами жорсткості, колінні ортези з бічними нерегульованими шарнірами і апарати на колінний суглоб із бічними регульованими шарнірами. Більшість із них виготовляють серійно, а апарати на колінний суглоб зазвичай — індивідуально.
За рахунок жорстких ортезів колінний суглоб набуває більшої стійкості при ходьбі, включається пропріоцептивний механізм. Шляхом стабілізації та розвантаження колінного суглоба вираженість больового синдрому зменшується. Точність підбору і зручність при використанні — важливий параметр для досягнення ефективності в лікуванні. Колінні ортези, що вальгізують та варизують, ефективні при нефіксованих нестабільних положеннях гомілки та при куті до 10–15°, але вони мають суттєві недоліки — це труднощі при надяганні та зніманні, громіздкість і низькі естетичні характеристики, що найчастіше і призводить до відмови пацієнтів від їх застосування. Іноді при надмірній компресії м’яких тканин, якщо, наприклад, неправильно підібрати розмір, можуть виникати порушення кровопостачання в ортезованій кінцівці. Альтернативою цьому методу є хірургічне лікування.
Ортез для гомілковостопного суглоба (гомілковостопний бандаж)
Оскільки провідну роль у порушенні діяльності суглоба при артрозі та артриті відіграють виражений больовий синдром і динамічна нестабільність внаслідок залучення у патологічний процес періартикулярних структур, то досягти зменшення вираженість болю і поліпшення функції гомілковостопного суглоба можна шляхом пронації та супінації в підтаранному суглобі, рухів у гомілковостопному суглобі в сагітальній площині, що отримують за рахунок носіння ортезів. Ортезування гомілковостопного суглоба використовують як метод лікування при нестабільності гомілковостопного і підтаранного суглобів, надмірній пронації та відвисанні стопи. Ця методика відносно протипоказана за наявності ознак порушення периферичного кровопостачання нижніх кінцівок. Перед підбором або виготовленням ортеза необхідне проведення ретельної оцінки стану і амплітуди рухів у гомілковостопному і підтаранному суглобах. Подібно до попереднього виду, також існують серійно та індивідуально виготовлені ортези, що поділяються за ступенем жорсткості на м’які (гомілковостопні бандажі), напівтверді і тверді (тутори). Гомілковостопні ортези зумовлюють зменшення вираженості болю і поліпшення параметрів ходьби за рахунок стабілізації гомілковостопного і підтаранного суглобів, але їх ефективність залежить від ступеня нестабільності суглоба і правильності вибору жорсткості ортеза. При правильно підібраному розмірі та конструкції ускладнення, як правило, не виникають. У разі неефективності цих консервативних заходів і прогресуванні деформації показане хірургічне лікування.
Ортез для стопи (ортопедична устілка, супінатор, пронатор)
У ревматологічній практиці однією з найпоширеніших ортопедичних проблем залишається ураження суглобів стопи, що відзначається у 90% пацієнтів із РА і посідає 3-тє за частотою поширення місце у пацієнтів з ОА після патології колінного і кульшових суглобів. Деформація суглобів стопи призводить до порушення нормальної архітектоніки її склепіння, що може негативно впливати не лише на її нормальну біомеханіку, а й призводити до вторинного пошкодження інших груп суглобів через порушення нормального розподілу навантаження на суглоби при ходьбі. Встановлення залежності розподілу динамічних навантажень між латеральним і медіальним виростками великогомілкової кістки від положення стопи стало передумовою для застосування устілок із піднятим латеральним краєм у пацієнтів із медіальним гонартрозом. Тому втрутитися у взаємовідносини у системі стопа — опора можна за рахунок використання різних коригувальних ортопедичних пристроїв. Іншою не менш важливою ортопедичною проблемою може стати різниця в довжині кінцівок >1 см, яка може бути однією з причин больового синдрому в нижній ділянці спини. У цих випадках важливий патогенетичний лікувальний захід — компенсація ортезом довжини укороченої кінцівки. Ортезування проводиться з метою поліпшення функцій стопи за рахунок рівномірного перерозподілу статичних і динамічних навантажень, усунення зон місцевих перевантажень (особливо в ділянці головок плюсневих кісток), установки її в нейтральне положення, зменшення надмірної пронації в підтаранному суглобі у процесі перекату, відновлення ресорної функції. Компенсація різниці довжини нижніх кінцівок може бути профілактичним заходом у запобіганні викривленню тазових кісток. Також важливою є профілактика рецидивування деформацій після реконструктивних операцій на стопі й гомілковостопному суглобі в осіб із ревматичними захворюваннями. Виконання ортезування показане при деформації переднього відділу стопи (hallux valgus, hallux rigidus, молоткоподібна деформація пальців, підвивихи плеснофалангових суглобів), метатарсалгії, плоскій або порожнистій стопі, підошовному фасциті, п’ятковій шпорі, медіальному гонартрозі, станах після реконструктивних операцій на стопі й гомілковостопному суглобі. Протипоказань немає. Для чіткого вибору тактики ортезування необхідно ретельно оцінити стан і функцію стопи з використанням рентгенологічного, подометричного, плантографічного і за наявності — подографічного методів.
Аналогічно до ортезування інших груп суглобів існує дві основні методики застосування ортезів стопи: ортезування з використанням стандартних серійних заготовок або індивідуальне виготовлення. Використання стандартних напівфабрикатів і готових виробів може спростити процедуру ортезування, однак при вираженій деформації стопи стандартні ортези протипоказані, адже шляхом гіперкоррекції можна збільшити вираженість патологічного стану. Технологічно для виготовлення цих типів ортезів використовують побудову гіпсової моделі з негативного відбитку стопи. У результаті носіння ортеза відзначають зменшення вираженості болю і поліпшення параметрів ходьби. У хворих на гонартроз використання устілок зменшує потребу в НПЗП. Профілактична роль ортезів стопи не вивчена. Підбір ортеза проводиться суворо відповідно до індивідуальних параметрів стопи і особливостей функціональних порушень, що забезпечує його максимальну ефективність. Якщо ж ортез підібрати неправильно, наприклад, не врахувавши відповідність рельєфу стопи, то больові відчуття при ходьбі можуть посилитися, крім того, можуть виникнути потертості й мозолі. У цьому разі його використання слід негайно припинити і звернутися за допомогою до фахівця. Альтернативою цього методу може бути використання спеціального ортопедичного взуття. При неефективності консервативних заходів рекомендується хірургічне лікування.
Ортопедичне взуття
Використання раціонального взуття зумовлює як профілактичний, так і лікувальний вплив у пацієнтів з ревматологічною патологією. Не секрет, що у 90% пацієнтів із РА до патологічного процесу залучені й суглоби стопи, причому виражену клінічну симптоматику цього стану відзначають лише у 15–20% випадків. Неправильне та незручне взуття як ніщо інше потенціює деформацію стопи. У наш час існує безліч доказів на підтримку того, що, використовуючи ортопедичне взуття, можна зменшити вираженість болю і покращити ходу у хворих із ураженням стоп і гомілковостопного суглоба при ревматичних хворобах. Більше того, деякі клініцисти абсолютно переконані у тому, що підбір відповідного взуття є найкориснішою із порад пацієнту із патологією суглобів стопи. Але все ж таки головною метою призначення ортопедичного взуття є зменшення вираженості болю і компенсація порушення ходи у пацієнтів з ураженням стоп і гомілковостопних суглобів, а також опосередковане сповільнення прогресування деформацій, підвищення ефективності консервативного лікування, можливість відстрочити необхідність проведення оперативних втручань. Тому ортопедичне взуття показане при деформації переднього відділу стопи у хворих на РА, метатарсалгії, підошовному фасциті та артриті підтаранного і гомілковостопного суглобів, болю у п’ятках. А ось фіксовані деформації стопи є суворим протипоказанням. У разі складної деформації стопи і гомілковостопного суглоба ортопедичне взуття виготовляють індивідуально (за гіпсовою моделлю).
Основні вимоги, які повинен пред’являти лікар до ортопедичного взуття, це — достатня ширина і висота шкарпетки (профілактика стискування пальців), м’яка підошва і ударопоглинаюча устілка (зменшення навантаження на головки плеснових кісток при ходьбі), досить жорсткий внутрішній край взуття (зменшення надмірної пронації та вальгусної деформації в підтаранному і гомілковостопному суглобах), жорсткий задник (стабільність заднього відділу стопи при ходьбі). Висота підбору — не більше 2–3 см. Якщо є така можливість, то варто було б повністю відмовитися від носіння взуття на високих підборах, із завуженим носком і без задника. Найдостовірніший показник якості від використання ортопедичного взуття — очевидне зменшення вираженості болю і поліпшення параметрів ходи. Якість виготовлення і точність відповідності параметрів взуття особливостям деформації стопи і характеру функціональних порушень у конкретного пацієнта допоможуть у досягненні хороших результатів лікування.
Хірургічне лікування — реконструктивні артропластичні операції на передньому і середньому відділі стопи — альтернатива цьому методу, але призначати оперативне лікування слід лише після тривалого курсу консервативної терапії.
Технічні засоби реабілітації
Патологічні зміни у суглобах зазвичай призводять до інтенсивного запалення, альтерації, а згодом і деструкції його структур. Тому основним призначенням цієї категорії пристроїв є покращання якості життя, вільного пересування і самообслуговування хворих, в яких зазначені органічні порушення вже є незворотними, ступінь порушення функціональних здібностей — значним. До таких засобів належать тростини, милиці, ходунки, коляски та крісла, підйомники для ванни тощо. Головним у їх призначенні є досягнення компенсації функціональної недостатності, пов’язаної з порушенням функції опорно-рухової системи, поліпшення якості життя. Тому їх варто призначати при порушенні функцій опорно-рухової системи, особливо ходи. Самостійне використання технічно складних реабілітаційних пристроїв і пристосувань хворими із розумовими порушеннями може стати причиною травм — необхідний контроль медичного чи спеціально навченого персоналу. На підготовчому етапі головне — навчити хворого користуватися необхідним для нього засобом. Технічні засоби вибирають індивідуально, залежно від потреб та активності пацієнта. При підборі висоти тростини пацієнт має стояти у звичайному взутті (підбори повсякденної висоти), руки вільно опущені вздовж тулуба. Висота тростини — це відстань від підлоги до дистальної шкірної складки на внутрішній поверхні променезап’ясткового суглоба. При виборі звичайних милиць вимоги до положення пацієнта аналогічні. Довжину милиці визначають як відстань від підлоги до точки, розташованої нижче складки на ширину долоні. Розташування рукоятки милиць визначають як висоту тростини.
Незважаючи на те що технічні засоби зазвичай використовують у хворих із тривалим та прогресуючим перебігом патології, вираженою функціональною недостатністю опорно-рухового апарату, ця методика також має і певні лікувальні властивості. Використання тростини здатне наполовину зменшити навантаження на уражену нижню кінцівку. При цьому вона повинна розташовуватися в руці з боку, протилежному ураженій нижній кінцівці. Але запорукою успіху все ж таки є правильне навчання пацієнта. Не варто забувати і про те, що використання паличок і тростин може призводити до перевантаження суглобів кисті, у зв’язку з чим перевагу віддають конструкціям із додатковою опорою на передпліччя, як наприклад «канадські палички». Це особливо важливо у хворих на РА з ураженням суглобів верхніх кінцівок. Неправильне застосування технічно складних пристроїв і пристосувань може стати причиною травм.
Спеціальні пристрої для побуту і самообслуговування
На якість життя пацієнтів із ревматичними хворобами значною мірою впливає їх здатність до самообслуговування. Адже втрата основних побутових навичок пацієнтів призводить до значного порушення їх соціальної адаптації. Для осіб із порушенням функцій опорно-рухової системи розроблено численні спеціальні пристосування: потовщені ручки столових приладів; підняті сидіння для унітазу; подовжені захвати для діставання високорозташованих предметів; пристосування для застібання ґудзиків, одягання шкарпеток і панчіх, відкривання банок і т.д. Основним аспектом при цьому є створення можливості самообслуговування та виконання завдань повсякденного життя. Тому цю методику слід рекомендувати у разі виникнення складнощів у побуті і при самообслуговуванні внаслідок ураження суглобів кінцівок. Аналогічно до попереднього методу при використанні цих засобів так само важливо навчити пацієнта ними користуватися. Перед тим, як рекомендувати ті чи інші спеціальні пристосування, лікар-реабілітолог повинен ретельно оцінити активність пацієнта і визначити, що з арсеналу технічних засобів могло би більшою мірою відповідати потребам хворого. Навчання можна проводити у вигляді шкіл пацієнтів або в ході індивідуальних занять, що також дозволить здійснювати періодичний контроль з боку залученого в реабілітаційний процес медичного персоналу.
Фізіотерапевтичне лікування
Фізіотерапія особливо корисна при патології великих суглобів нижніх кінцівок. Для купірування болю, зменшення набряку навколосуглобових тканин, рефлекторного спазму навколосуглобових м’язів, покращання мікроциркуляції, лікування слабкого чи помірного синовіту використовують: вплив електромагнітних полів надвисоких і високих частот; УЗ-терапію (в тому числі фонофорез протизапальних препаратів); короткохвильову діатермію (при відсутності синовіту); мікрохвильову терапію; електрофорез із протизапальними препаратами (диклофенаком, гідрокортизоном, диметилсульфоксидом); лазерну терапію; аплікації теплоносіїв (торф’яну грязь, парафін, озокерит); бальнеотерапію (радонові, сірко-водневі, хлоридно-натрієві, скипидарні, йодобромні ванни); гідротерапію (зменшує гравітаційне навантаження на суглоби, головним чином на кульшовий).
У період загострення основного захворювання, особливо на фоні приєднання реактивного синовіту, можна використовувати ультрафіолетове опромінення в еритемних дозах (5–6 процедур), електричне поле й дециметрові хвилі у слабкотепловій дозі (8–10 процедур), магнітотерапію (10–12 процедур), фонофорез або електрофорез із метамізолом натрію, прокаїном, тримекаїном, диметилсульфоксидом на ділянку ураженого суглоба. Протипоказаннями до застосування ультрафіолетової терапії є супутня ішемічна хвороба серця, транзиторні порушення мозкового кровообігу, тиреотоксикоз, захворювання нирок. Вплив електричним полем ультрависоких частот протипоказаний при вираженій вегетосудинній дистонії, порушенні серцевого ритму, гіпертонічній хворобі ІІБ–ІІІ стадії. Серед різних фізіотерапевтичних методів добре зарекомендував себе електрофорез, що поєднує терапевтичний вплив постійного електричного струму і лікарського засобу, що вводиться. Із механізмів біологічної дії постійного електричного струму можна виділити такі фізико-хімічні ефекти: електроліз — рух заряджених частинок (катіонів і аніонів) до протилежно зарядженого електрода і перетворення їх в атоми з високою хімічною активністю; переміщення заряджених частинок під дією постійного електричного струму викликає зміну іонної кон’юнктури у тканинах і клітинах. Скупчення протилежно заряджених частинок біля біологічних мембран призводить до їх поляризації та утворення додаткових поляризаційних струмів; у результаті зміни проникності біологічних мембран збільшується пасивний транспорт через них великих білкових молекул (амфолітів) та інших речовин — електродифузія; електроосмос — різноспрямований рух молекул води, включених у гідратні оболонки іонів (в основному Na+, K+, Cl–). Під дією електричного струму в тканинах активуються системи регуляції місцевого кровотоку і підвищується вміст біологічно активних речовин (брадикініну, калікреїну, простагландинів) і вазоактивних медіаторів (ацетилхоліну, гістаміну). У результаті просвіт судин шкіри розширюється і виникає гіперемія. Розширення капілярів і підвищення проникності їх стінок внаслідок місцевих нейрогуморальних процесів виникають не лише в місці прикладання електродів, але й у глибоко розташованих тканинах, через які проходить постійний електричний струм. Поряд із посиленням крово- і лімфотоку, підвищенням резорбційної здатності тканин відзначають зниження м’язового тонусу, посилення видільної функції шкіри і зменшення набряку у вогнищі запалення. Крім того, внаслідок електроосмосу знижується компресія больових провідників, більш виражена під анодом. Постійний електричний струм посилює синтез макроергічних з’єднань у клітинах, стимулює обмінно-трофічні процеси у тканинах, підвищує фагоцитарну активність макрофагів, прискорює процеси регенерації, стимулює ретикулоендотеліальну систему, підвищує активність факторів неспецифічного імунітету.
Таким чином, постійний електричний струм виявляє такі лікувальні ефекти: протизапальний, метаболічний, вазодилатуючий, сануючий (дренуючий-дегідратуючий), анальгезивний, міорелаксивний, седативний (на аноді).
Електромагнітні поля високих і надвисоких частот — індуктотермія, дециметро- і сантиметрохвильова терапія — при впливі на суглоби слабкотепловими і тепловими дозами (12–15 процедур на курс лікування) виявляють на артикулярні та періартикулярні тканини виражену теплову дію, збільшують приплив крові до тканин суглоба, посилюють лімфовідтік, процеси дифузії, усувають м’язовий спазм. Це сприяє поліпшенню живлення хряща, чинить розсмоктувальну дію при синовіті, а також позитивно впливає на періартикулярні проліферативні процеси. Індуктотермію застосовують, наприклад, у хворих на ОА І–ІІ стадії, за відсутності або незначному вторинному синовіті, наявності больового синдрому, періартикулярних змінах. Індуктотермія не показана при загостренні вторинного синовіту, а також хворим старечого віку, при ішемічній хворобі серця, атеросклеротичному ураженні судин серця, порушеннях серцевого ритму, вираженому церебральному атеросклерозі, транзиторних порушеннях мозкового кровообігу, клімактеричних розладах, фіброміомі, тиреотоксикозі. Цим хворим призначають процедури дециметро- або сантиметрохвильового впливу. Цей метод можна рекомендувати у фазі ремісії та за відсутності ознак активного запалення.
Дециметро- і сантиметрохвильову терапію застосовують, наприклад, при ОА I–IV стадії за відсутності або при слабких проявах вторинного синовіту, а також при ішемічній хворобі серця з частими нападами стенокардії, у хворих із вираженими клімактеричними розладами, фіброміомою. Знеболювальний ефект, сприятливий вплив на гемодинаміку й обмінні процеси в суглобі виявляють імпульсні струми низької частоти — синусоїдальні модульовані й діадинамічні. Синусоїдальні модульовані струми хворими переносяться краще, ніж діадинамічні, до них менше розвивається «звикання» тканин, тому їм надається перевага. Імпульсні струми низької частоти показані хворим похилого й старечого віку з вираженим больовим синдромом, змінами в періартикулярних тканинах. Імпульсні струми не призначають при явищах вторинного синовіту, а також хворим із порушеннями серцевого ритму з брадикардією чи схильністю до брадикардії.
УЗ-терапію часто використовують у лікуванні різних гострих і хронічних захворювань опорно-рухового апарату. УЗ виявляє теплову (збільшення кровотоку, підвищення больового порогу, інтенсивності метаболізму) і нетеплову (підвищення проникності клітинних мембран, транспорту кальцію через клітинну мембрану, доставки поживних речовин у тканини, фагоцитарної активності макрофагів) дію.
М’язовий спазм є одним із джерел болю і причиною обмеження функції суглобів у хворих ревматологічного профілю. Спазм періартикулярних м’язів викликає підвищення внутрішньосуглобового тиску й навантаження на суглобову поверхню, а також зменшення кровотоку в м’язі, внаслідок чого розвивається місцева ішемія. Тому усунення м’язового спазму має велике значення в лікуванні та реабілітації хворих. Для розслаблення спазмованих м’язів застосовують масаж, глибоке й поверхневе зігрівання (теплові аплікації, інфрачервоне випромінювання, короткохвильову або мікрохвильову діатермію, сауну чи парнy). Місцева аплікація підвищує кровотік в ураженій зоні, зменшує вираженість болю і м’язового спазму, викликає загальне розслаблення. Підвищення кровотоку в м’язах сприяє елімінації метаболітів (молочної кислоти, СО2 та ін.) і припливу джерел енергії (О2, глюкоза та ін.). Ще одним механізмом розслаблення м’язів за допомогою аплікації є зниження збудливості нервово-м’язових веретен.
Аплікації мулу чи торф’яної грязі (температура 38–42 °С), парафіну й озокериту (температура 50–55 °С) призначають у кількості 10–15 процедур на уражений суглоб або на ділянку тіла, що включає уражені суглоби. Аплікації грязі, озокериту й парафіну показані хворим без синовіту або з незначними його проявами, при вираженому больовому синдромі, проліферативних явищах, рефлекторних змінах у м’язах. Їх не застосовують при значних змінах у суглобах, виражених явищах синовіту, а також при ішемічній хворобі серця, гіпертонічній хворобі ІІБ–ІІІ стадії, недостатності кровообігу, варикозному розширенні вен, захворюванні судин ЦНС, гострому і хронічному нефриті й нефрозі тощо.
Лікувальна фізкультура
Лікувальна фізкультура (ЛФК) — метод немедикаментозної терапії, що використовується як основний лікарський засіб раціонального фізичного навантаження шляхом спеціально розроблених вправ. Як важливий компонент реабілітації хворих дія фізичних вправ проявляється у формуванні компенсаторного (тимчасового чи постійного) заміщення порушених функцій, нормалізація діяльності як окремого органа (суглоба), так і організму в цілому. Головні умови ефективності ЛФК: систематичність тренувань (вибір режиму занять, вправ, ступеня фізичного навантаження, плану занять), тренування проводить інструктор з ЛФК у спеціалізованому закладі, регулярність (циклічне чергування навантаження та відпочинку, що виконуються щоденно, самостійно в домашніх умовах), тривалість (необхідно налаштовувати хворого на виконання щоденного фізичного навантаження постійно), збільшення інтенсивності тренування разом зі збільшенням толерантності до звичайних вправ, індивідуальний підхід (режим тренування складається відповідно до фізіологічних потреб організму, а також з урахуванням особливостей та тривалості перебігу хвороби індивідуально для кожного хворого), різні методики (поєднання окремих видів вправ і певних засобів ЛФК). ЛФК має на меті врівноваження нервових процесів шляхом чергування вправ, що зумовлюють стимулювальний вплив на ЦНС з тими, що потенціюють процеси гальмування. Також це дозволяє покращити діяльність дихальної, ендокринної, серцево-судинної та інших систем, поліпшує настрій та емоційний стан хворих. ЛФК також дозволяє покращити рухову активність суглобів за рахунок запобігання розвитку деформації та анкілозів, збільшення амплітуди рухів. Також щоденна рухова активність дозволяє покращити фізичну підготовку пацієнтів, запобігти гіподинамії та м’язовій атрофії, сформувати коректний руховий режим.
Показаннями до фізичного навантаження з лікувальною метою є: формування адекватного рухового режиму пацієнта, запобігання м’язовій атрофії і контрактурам, адаптація дихальної системи до збільшеного фізичного навантаження, покращання показників вентиляції легень, адаптація серцевого м’яза до фізичних вправ та умов гіпоксії, поліпшення процесів гіпоксії. ЛФК на ранніх етапах захворювання сприяє покращанню трофіки синовіальних оболонок та збільшенню еластичності суглобових капсул. Для стимуляції активності мотонейронів виконують вправи навантаження суглобів контралатерального до ураженого суглоба боку. Шляхом електроміографії доведено, що при такому режимі тренування відбувається підвищення амплітуди біопотенціалів у пасивних м’язах за рахунок «синергічної зміни тонусу», яку можна використовувати для профілактики м’язових атрофій на ранніх етапах лікування. Активні рухи в ураженому суглобі (вільні, з опором, з ізометричним напруженням і обтяженням) доповнюють цю схему лікування. Велику роль для відновлення функції ослаблених м’язів опорно-рухового апарату відіграють ізометричні вправи.
Лікувальна фізкультура при ревматоїдному артриті
Історія використання аеробних вправ і силових тренувань м’язів у хворих на РА починається з 1975 р. Тоді дані дослідження відрізнялися за режимом фізичного навантаження, групами хворих, що порівнювалися, кінцевими точками, але все ж таки вдалося отримати певні результати. Щоденне тривале виконання аеробних вправ поліпшує аеробну здатність, силу м’язів, рухливість суглобів, функціональну активність і настрій більше ніж на 57% без погіршення клінічної картини захворювання. У посібниках із ведення хворих на РА американські експерти рекомендують використання силових та аеробних режимів. Регулярність лікувальних тренувань покращує діяльність легеневої системи, поліпшує основні вентиляційні показники, адаптує міокард до раціонального використання кисню, знижує артеріальний тиск, знижує кардіоваскулярний ризик, для чого застосовують тренування в кардіорежимі по півгодини 3 рази на тиждень, допомагає зменшити надмірну масу тіла, що саме по собі є одним із провідних факторів ризику розвитку ОА. Регулярне фізичне навантаження при РА дозволяє відстрочити втрату працездатності хворих, їх подальшої інвалідизації. При цьому збільшується можливість пацієнтів щодо самообслуговування, а також їх соціальна адаптація. Працетерапія — основний компонент комплексу ЛФК, спрямована на збереження функціональності кисті шляхом рутинного виконання дрібних амплітудних точних рухів. Навіть в умовах стаціонару можливе щоденне проведення простих вправ, що дозволяє покращити щипковий захват кисті. До них належать виготовлення ватних, марлевих тампонів, кульок, серветок, розкрій та шиття масок.
До методик ЛФК також відносять роботу на швейній машинці, де працюють в основному згиначі й розгиначі кисті, роботу з пластиліном, що зміцнює абсолютно всі групи м’язів кисті та запобігає розвитку деформації, утворенню контрактур, плетіння дозволяє тренувати тонкі координаційні рухи, приведення і протиставлення першого пальця кисті, супінацію і пронацію, а також усі види захвату. Для оптимального навантаження на кисть при РА необхідно: дотримання прямої осі кисті із передпліччям при виконанні всіх побутових і виробничих рухів, зменшення навантаження на кінцеві фаланги пальців кисті (подушечковий захват), уникати рухів кисті в бік мізинця, зберігати поперечне і повздовжнє склепіння кисті, зміцнювати м’язи кисті з допомогою ЛФК, виконання вправ у півсили, дотримуватися правильного положення кисті у спокої та при ЛФК, зберігаючи пряму вісь, використовувати потовщені конусоподібні ручки, олівці, побутові прилади.
Завдання ЛФК при високому ступені активності РА
Основним є запобігання утворенню згинальних контрактур і збереження функціонально зручного положення кінцівки. Для цього виконують вправи на розслаблення м’язів. Наприклад, у вихідному положенні лежачи на спині звісити з ліжка руку або у вихідному положенні сидячи на стільці опустити руку вздовж тулуба, нахилившись до цього ж боку. Для запобігання контрактурам використовують лікування положенням. Для підтримки функції дихання і кровообігу виконують статичні дихальні вправи, особливо діафрагмальне дихання у вихідному положенні на спині чи на боці із зігнутими колінними і кульшовими суглобами (80–90°), що сприяє збільшенню вентиляції в нижніх відділах легень. Статичні дихальні вправи виконують із поступовим поглибленням дихання та уповільненням видиху, а також збільшенням екскурсії діафрагми. Протягом дня хворим рекомендують часту зміну положень тіла з поворотом на бік, на живіт, на спину. Показано виконання вправ з ізометричним напруженням головки чотириголового м’яза стегна протягом 2–7 с із повторенням по 4–5 разів на день.
Вправи при ураженні верхніх кінцівок: вихідне положення — сидячи, лежачи: плечовий суглоб — відведення до 30°, ліктьовий суглоб — згинання до 90–105° (або розгинання до 180°), положення передпліччя середнє між пронацією і супінацією, променезап’ясткового суглоба — розгинання до 170°, відведення у бік променевої кістки — до 30°, п’ястково-фалангового суглоба — згинання до 135°, міжфалангові суглоби — згинання до 135° (кисть захоплює тенісний м’яч).
Вправи при ураженні суглобів нижніх кінцівок: вихідне положення лежачи на спині: кульшовий суглоб — розгинання до 180°, відведення до 15–25°, ротація назовні — 35–45°, колінний суглоб — розгинання до 180°, гомілковостопний суглоб — розгинання до 90° (не допускати варусного чи вальгусного положення стопи). Початкове положення — лежачи на животі: кульшовий суглоб — розгинання до 180°, відведення до 15–25°, ротація назовні на 10–15°, колінний суглоб — розгинання до 180°.
Завдання ЛФК при помірній активності РА: збільшення амплітуди рухів в уражених суглобах, покращання рухового режиму хворих, корекція рухових стереотипів, тренування рухів, заміна втрачених функцій, підвищення толерантності до навантажень.
Для вирішення цих завдань рекомендують таку послідовність: розслаблення м’язів; розгойдування; махи; вільні динамічні рухи та ізометричні напруження м’язів; вправи зі снарядами; після кожної вправи — розслаблення м’язів.
При РА особливу увагу слід приділяти вправам на розгинання і відведення кінцівки. Рухи в уражених суглобах починають із розслаблення м’язів, махових вправ, потім виконують вільні динамічні рухи з ізометричним напруженням. В одному суглобі рухи виконують багато разів, до досягнення максимальної безболісної амплітуди, потім вправи виконують на інших суглобах. Через 3–5 хв повторні вправи чергують із розслабленням м’язів і дихальними вправами. Для кардіотренувань застосовують вправи для неуражених суглобів за участю м’язів шиї, плечового поясу, рук, грудної клітки. Поступово збільшують тривалість занять і частоту повторень кожного руху до 15–20 разів. Перше тренування проводиться під контролем інструктора з ЛФК, надалі — вправи виконуються хворим самостійно 3–5 разів на день по 30–40 хв. У фазі ремісії тренування ЛФК проводять 1–2 рази на день у залі чи басейні з поступовим підвищенням фізичного навантаження. Перед комплексом вправ можливе проведення масажу чи фізіотерапії (інфрачервоне, короткохвильове, мікрохвильове випромінювання, УЗ-терапія) для зменшення скутості в уражених суглобах і полегшення виконання вправ. На сьогодні з метою відновлення обсягу рухів у суглобах використовують різні фізичні вправи: пасивні (мобілізацію суглоба здійснює методист або його асистент); напівактивні (пацієнт самостійно робить рухи в суглобі, методист/асистент допомагає лише наприкінці кожного руху досягти максимального обсягу); активні (пацієнт самостійно виконує рухи в максимально повному обсязі).
Лікувальна фізкультура при остеоартрозі
ЛФК — основа лікування хворих на ОА. Хоча зв’язок між захворюванням колінних суглобів і зменшенням маси тіла був лише формально вивченим у двох дослідженнях, все ж таки зменшення маси тіла рекомендують практично всім хворим на ОА. Тим більше, що функціональний стан чотириголового м’яза стегна, а саме його слабкість, нерозривно пов’язаний із розвитком нестабільності і больового синдрому в колінному суглобі. Усі вправи, що зміцнюють м’язи стегна, сприяють зменшенню вираженості болю і поліпшенню функцій суглобів при ходьбі. Фізичні вправи не лише сприяють зменшенню вираженості больового синдрому в колінних суглобах при ОА, а й покращують їх функціональну рухливість.
Практичні рекомендації щодо виконання вправ при ОА: вправи можуть зменшити вираженість болю і поліпшити стан хворих на ОА колінних і кульшових суглобів, сприятливий вплив має призначення як загальнозміцнювальних, так і місцевих вправ, сповільнити прогресування захворювання може поліпшення пропріоцепції та збільшення м’язової сили в результаті тренувань, вправи при ОА слід призначати індивідуально, враховуючи особливості стану організму і перебігу захворювання кожного окремого пацієнта, суворе дотримання режиму тренувань є запорукою успіху лікування при ОА, постійне динамічне амбулаторне спостереження пацієнта здатне покращити його прихильність до тренувань.
Основні правила призначення ЛФК при ОА: фізичні вправи необхідно проводити без статичних навантажень (у положенні лежачи, сидячи, в басейні), рухи виконують плавно, повільно, з поступовим підвищенням навантаження (не слід долати біль), тривалість занять 30–40 хв/день (по 10–15 хв 3 рази на день), методику фізичних вправ підбирають і призначають лікарі індивідуально відповідно до тяжкості змін у суглобах і наявності супутніх захворювань, перші заняття проводять під контролем методиста ЛФК для оцінки правильності виконання вправи пацієнтом, надалі пацієнти можуть виконувати їх самостійно.
Вправи для зміцнення періартикулярних м’язів можна розподілити на три групи: 1) ізометричні (скорочення м’яза без зміни його довжини): скорочення м’яза триває 6 с, далі йде розслаблення, вправу повторюють 5–10 разів; паралельно рекомендується коактивація м’язів-антагоністів. S. Himeno та співавтори (1986) виявили, що навантаження розподіляється однаково на поверхні тібіофеморального відділу колінного суглоба, якщо сила м’язів-агоністів врівноважується силою м’язів-антагоністів, що, у свою чергу, знижує загальне навантаження на поверхню суглоба і запобігає місцевому ушкодженню (Baratta R. et al., 1988);
2) ізотонічні (рухи кінцівки в суглобі з додатковим опором або без такого, при яких періартикулярні м’язи вкорочуються або подовжуються); ізотонічні вправи слід проводити без подолання існуючого обсягу рухів та із субмаксимальним опором;
3) ізокінетичні (рухи в суглобі здійснюються в повному обсязі з постійною швидкістю); за допомогою ізокінетичного динамометра опір варіюється таким чином, що збільшення м’язової сили сприяє підвищенню опору, а не підвищенню швидкості руху й навпаки.
При коксартрозі основну увагу приділяють тренуванню м’язів, що відводять і розгинають нижню кінцівку. Підтриманню поясу нижньої кінцівки в нормальному положенні сприяє зміцненню сідничних м’язів, косих м’язів живота, що веде до нормалізації ходи. Зміцнення чотириголового м’яза стегна при гонартрозі сприяє зниженню навантаження на суглобові поверхні та зв’язковий апарат колінного суглоба, а також зменшує згинальні контрактури колінного суглоба, поліпшує опору кінцівки. Але все ж таки головною метою при ЛФК є збереження достатнього обсягу рухів у суглобах. Проте методист із ЛФК повинен враховувати, що надмірне навантаження викликає розвиток і прогресування ОА. Аеробні вправи високої інтенсивності більш ефективно зменшують вираженість симптоматики ОА, ніж вправи помірної та низької інтенсивності. У всякому разі при формулюванні рекомендацій хворому необхідно дотримуватися основного принципу — тренування мають бути не частіше 3 разів на тиждень і тривати не більше 35–40 хв.
Лікувальна фізкультура при анкілозуючому спондиліті
ЛФК при АС є патогенетичною терапією та обов’язково має включати такі компоненти: зменшення вираженості болю і скутості у хребті, поліпшення фізичної функції, збереження обсягу рухів у хребті, збереження дихальної екскурсії грудної клітки.
Плазмаферез
Одним із найпоширеніших методів екстракорпоральної терапії, який використовується для лікування при ревматичних захворюваннях, є плазмаферез (від грец. арheresis — видалення) (плазмообмін). Процедура полягає в поділі крові на клітинні елементи (еритроцити, лейкоцити і тромбоцити) і плазму крові. Плазму крові, відокремлену від клітинних елементів, заміщають альбуміном, свіжозамороженою плазмою крові або фізіологічним розчином. При ексфузії 1 л плазми крові видаляють ≈65% циркулюючих позаклітинних сполук. Найбільш поширений безперервний центрифужний плазмаферез, коли поділ плазми і клітинних елементів відбувається при центрифугуванні цільної крові. За допомогою цієї методики можна отримувати значні обсяги плазми крові, аж до повного її заміщення. Повноцінне видалення циркулюючої плазми крові також проводять за допомогою мембранного чи капілярного плазмаферезу: при цьому кров поділяють на мембранному (капілярному) фільтрі, що має пори певного розміру, пропускають білкові сполуки, воду й електроліти, що містяться в плазмі й затримують клітини крові. Подібним чином розроблено і методики обробки плазми крові: подвійна фільтрація плазми, кріофільтрація та імуносорбція, що застосовуються для більш селективного видалення з кровотоку різних сполук (імуноглобуліни, антитіла до дезоксирибонуклеїнової кислоти (ДНК), ревматоїдного фактора (РФ), циркулюючих імунних комплексів (ЦІК) тощо). Іншим важливим методом є цитоферез, тобто спосіб видалення з кровотоку пулів різних клітин. При подвійній фільтрації плазми крові використовують два капілярних фільтри: на першому відбувається сепарація плазми крові, а за допомогою другого (з меншим діаметром пор) з неї видаляють білкові макромолекулярні з’єднання. Мета подвійної фільтрації плазми крові — більш селективне очищення крові від патологічних сполук (фібриногену, ЦІК, аутоантитіл, деяких прозапальних цитокінів). Переваги подвійної фільтрації плазми крові полягають у видаленні концентрату плазми крові (≈400 мл при обробці 3,5–5 л плазми крові) без необхідності заміщення білковими розчинами.
Основними методиками обробки плазми крові, що застосовуються у лікуванні пацієнтів ревматологічного профілю, є імуносорбція та гранулоцитоферез. Імуносорбція технологічно є аналогом подвійної фільтрації плазми крові, при якій замість другого фільтра використовують різні імуносорбенти. Білок А-сорбент містить білок А, виділений з оболонки стафілокока і здатний з високою селективністю видаляти з циркуляції IgG, у тому числі антиядерні антитіла, РФ і ЦІК. Імуносорбцію призначають в основному для лікування хворих на РА. За допомогою імуносорбенту, що містить декстрану сульфат або амінокислоти (триптофан/фенілаланін), вдається проводити високоспецифічну сорбцію антитіл до ДНК. За ефективністю імуносорбція перевершує подвійну фільтрацію плазми крові. Гранулоцитоферез забезпечує селективне видалення з циркуляції гранулоцитів і моноцитів — клітин, що забезпечують каскад прозапальних та імунних реакцій і беруть безпосередню участь у патогенезі ревматичного захворювання. Тобто ця методика дозволяє призупинити клітинну ланку запалення. Проводять його шляхом перфузії цільної крові через спеціальний фільтр, який містить мікрогранули ацетатцелюлози, що виявляє високий ступінь зв’язування з гранулоцитами і моноцитами. За 1 сеанс гранулоцитоферезу тривалістю 60–70 хв елімінують до 80–90% усіх гранулоцитів і моноцитів, що знаходяться у кров’яному руслі. Призначають при РА, неспецифічному виразковому коліті, гангренозній піодермії.
Основні ревматологічні захворювання, при яких призначають плазмаферез із лікувальною метою
Системний червоний вовчак
Методика плазмаферезу найбільш застосовується саме у лікуванні пацієнтів із СЧВ, оскільки забезпечує безпосереднє видалення з кровотоку антитіл до ДНК, ЦІК, кріоглобулінів, прозапальних цитокінів, деблокування ретикулоендотеліальної системи, що відіграють провідну роль у патологічному процесі цього захворювання. Плазмаферез виходить на передній план терапевтичної тактики особливо у разі неефективності ГК- та імуносупресивної терапії, особливо у пацієнтів із початково високим вмістом антитіл до ДНК і ЦІК, а також при цитопенії. Також відзначено зменшення вираженості позаниркових проявів хвороби, зниження концентрації антитіл до ДНК і ЦІК, поліпшення фагоцитуючої функції ретикулоендотеліальної системи. Оскільки однією з основних проблем терапії СЧВ є пригнічення активності вовчакового нефриту, виникла необхідність оцінити ефективність плазмаферезу у осіб із цим захворюванням. Однак у ході рандомізованих клінічних досліджень (РКД) ефективність плазмаферезу при люпус-нефриті не підтверджена. Також встановлено, що проведення плазмаферезу супроводжувалося більш швидким і значним зниженням показників імунологічної активності хвороби (концентрація антитіл до двоспіральної ДНК, ЦІК і кріоглобулінів у крові). Водночас віддалені результати лікування пацієнтів обох груп істотно не відрізнялися: не виявлено статистично достовірної різниці виживаності, частоти розвитку ниркової недостатності, загострень нефриту і позаниркових проявів СЧВ. За даними 10-річного спостереження за цими двома групами хворих виявилося, що значне поліпшення віддаленої виживаності визначалося декількома факторами, у тому числі швидкістю досягнення ремісії в перші тижні лікування. Ці результати узгоджуються з даними інших авторів про швидкий розвиток позитивного клініко-лабораторного ефекту у хворих на СЧВ після проведення серії процедур плазмаферезу. Є відомості про порівняльну ефективність і швидкість поліпшення клінічного стану пацієнтів при застосуванні плазмаферезу в комбінації з прийомом преднізолону перорально і щомісячної пульс-терапії циклофосфамідом у пацієнтів із люпус-нефритом. Всі ці клінічні пошуки привели до формування плану так званої синхронізованої терапії, заснованої на комбінації плазмаферезу і пульс-терапії циклофосфамідом. На думку авторів цього виду лікування, швидке видалення з циркуляції аутоантитіл за допомогою плазмаферезу приводить до проліферації В-лімфоцитів і гіперпродукції імуноглобулінів із формуванням синдрому рикошету (antibody — rebound) та клінічного погіршення. Припустимо, що завдяки інфузії ударних доз циклофосфаміду вдасться пригнітити молоді клони лімфоцитів на стадії проліферації та індукувати імунодеплецію з розвитком стійкого клінічного ефекту. У ряді повідомлень підтверджували високу клінічну ефективність синхронізуючої терапії у хворих зі швидкопрогресуючим перебігом вовчакового нефриту за відсутності відповіді на консервативну терапію і наявності імунологічної активності.
Але незважаючи на суперечливі результати і недоведену ефективність плазмаферезу, частота використання цього методу лікування у хворих на СЧВ залишається стабільною протягом останніх 5 років. За даними Асоціації гемаферезу, у Франції щорічно до 20 хворих на СЧВ отримують терапію плазмаферезом (≈2% усіх хворих, яким призначають цю процедуру), а у Швеції плазмаферез застосовують при СЧВ у 3% випадків.
Необхідність проведення плазмаферезу при неускладненому перебігу СЧВ залежить від різних чинників, важливе значення серед яких мають вартість лікування і ризик розвитку побічних ефектів. Проте на сьогодні найчастіше плазмаферез використовують як один із найважливіших компонентів терапії у разі критичних станів, зумовлених поліорганною недостатністю чи загрозою життю від уражень різних органів і систем у хворих на СЧВ.
До основних показань проведення плазмаферезу при СЧВ належать:
1. Швидкопрогресуючий вовчаковий нефрит, резистентний до стандартної терапії ГК і цитостатиками. Для індукційної терапії зазвичай використовують комбінацію пригнічувальних доз ГК і циклофосфаміду (пульс-терапія) з подальшим застосуванням мікофенолової кислоти, азатіоприну або циклоспорину. Ранній додаток до стандартної терапії плазмаферезу може сприяти більш швидкому відновленню функцій нирок і поліпшенню віддаленого прогнозу. Плазмаферез показаний хворим зі швидкопрогресуючим нефритом, асоційованим з кріоглобулінемією і розвитком синдрому гіперв’язкості. Залежно від клініко-лабораторних показників і стану хворого частіше призначають від 3 до 5 сеансів плазмаферезу, з інтервалами між процедурами 2–3 доби, а в деяких випадках можливе проведення плазмаферезу протягом 3 тиж. Для профілактики розвитку синдрому рикошету та підвищення ефективності терапії після кожної процедури плазмаферезу призначають інфузію циклофосфаміду по 5 мг/кг маси тіла і метилпреднізолону в дозі 15–20 мг/кг. Плазмаферез протипоказаний хворим із вираженою гіпопротеїнемією (<50 г/л).
2. Геморагічний альвеоліт — рідкісний і мало вивчений прояв СЧВ, частота розвитку якого не перевищує 2%, проте летальний результат при несвоєчасній діагностиці та неправильному лікуванні цього ускладнення сягає 90%. Стандарти лікування пацієнтів із геморагічним пневмонітом не розроблені. У результатах нечисленних пілотних досліджень і описах випадків вказують на позитивний ефект плазмаферезу, синхронізованого з пульс-терапією циклофосфамідом, метилпреднізолоном та імуноглобуліном, на ранніх термінах формування геморагічного альвеоліту. Залежно від ситуації, процедури плазмаферезу проводять щодня або через день, аж до усунення кровохаркання. Циклофосфамід призначають 1–2 рази на тиждень по 500–1000 мг (сумарно не більше 3 г), в поєднанні з антибактеріальними препаратами. Метилпреднізолон показано щоденно в дозі 500–1000 мг.
3. Ураження ЦНС. Тяжкі та прогностично несприятливі ознаки ураження ЦНС при СЧВ виявляють досить рідко (за різними даними — від 2 до 7% випадків). Летальні результати при розвитку кататонічних судом, коми чи поперечного мієліту відзначають у 50–90% випадків. Стандарти лікування ураження нервової системи при СЧВ відсутні. В описах випадків і невеликих серій хворих вказують на доцільність застосування на ранніх стадіях розвитку судомного синдрому, поперечного мієліту, коми, психозу чи оптичної нейропатії плазмаферезу в комбінації із в/в введенням імуноглобуліну і пульс-терапією метилпреднізолоном та циклофосфамідом, а також ритуксимабом. На думку експертів, вирішальне значення у профілактиці летального результату має проведення агресивної терапії в перші години після виникнення тяжких форм нейролюпусу. Плазмаферез протипоказаний при геморагічному інсульті. При появі судомного синдрому, мієліту чи коми, плазмаферез проводять щодня, а після кожної процедури в/в крапельно вводять циклофосфамід по 250–500 мг (сумарно не більше 3 г) і метилпреднізолон по 500–1000 мг. При менш тяжкому ураженні ЦНС плазмаферез призначають 2–3 рази на тиждень і після кожного сеансу здійснюють інфузію циклофосфаміду в дозі 500 мг і метилпреднізолону в дозі 1000 мг.
4. Тромботична тромбоцитопенічна пурпура, для якої характерні інтенсивна агрегація тромбоцитів, множинне мікротромбоутворення у дрібних артеріях і артеріолах, вторинний неімунний гемоліз і тромбоцитопенія споживання. Основними клінічними проявами тромботичної тромбоцитопенічної пурпури є підвищення температури тіла, анемія (проба Кумбса негативна), тромбоцитопенія, нефрит, артеріальна гіпертензія, неврологічні порушення аж до розвитку інсульту. При СЧВ тромботична тромбоцитопенічна пурпура, за різними даними, може виникати у 2–3% дорослих пацієнтів, але при розвитку СЧВ у дитячому віці цей показник досягає 35–50%. Механізми розвитку тромботичної тромбоцитопенічної пурпури при СЧВ недостатньо вивчені. У деяких випадках у пацієнтів виявляють АФЛ. Тромботичну тромбоцитопенічну пурпуру розглядають як стан, що загрожує життю. У 60-х роках XX ст. летальність при цьому ускладненні становила ≈90%, проте завдяки сучасній терапії цей показник знизився до 10–20%. На сьогодні стандартним протоколом лікування у пацієнтів із тромботичною тромбоцитопенічною пурпурою вважають комбінацію плазмаферезу (із заміщенням свіжозамороженої донорської плазми крові >1500 мл плазми за сеанс) з інфузіями імуноглобуліну, циклофосфаміду і метилпреднізолону. Синхронізація плазмаферезу з призначенням ГК і циклофосфаміду служить основним компонентом терапії хворих, що ускладнилася тромботичною тромбоцитопенічною пурпурою. Лікування зазвичай починають з інтенсивного плазмообміну (до 5 сеансів) із заміщенням свіжозамороженою плазмою крові й подальшими в/в інфузіями циклофосфаміду (по 750–1000 мг/м2 поверхні тіла), метилпреднізолону (у дозі 15–20 мг/кг маси тіла) та імуноглобуліну (по 0,5–1 г/кг маси тіла).
5. Катастрофічний АФС, при якому спостерігаються ураження мінімум трьох органів чи систем, що загрожують життю. Катастрофічний АФС при СЧВ вважають ургентним станом, що потребує своєчасної діагностики й ефективного лікування. Основними компонентами терапії при катастрофічному АФС є антикоагулянти, ГК, циклофосфамід, в/в введення імуноглобуліну і повторні курси плазмаферезу (щодня або через день із заміщенням свіжозамороженою плазмою крові). Циклофосфамід і метилпреднізолон вводять в/в після проведення плазмаферезу в дозі 500–1000 мг. Для зниження ризику розвитку вторинної інфекції призначають антибактеріальні та противірусні препарати. Застосування плазмаферезу в комплексній терапії, за даними деяких авторів, сприяє підвищенню виживаності пацієнтів із катастрофічним АФС в 2–2,5 раза. Збільшення ефективності терапії можливе при комбінації плазмаферезу та ритуксимабу.
Хвороба Шегрена
Ця патологія характеризується типовим ураженням екзокринних залоз — «сухий синдром», але не варто забувати, що досить часто можливі й такі тяжкі порушення з боку життєво важливих органів, як гломерулонефрит, виразково-некротичний кріоглобулінемічний васкуліт, альвеоліт, полімієлорадикулоневрит. За умови виникнення поліорганної недостатності прогноз для життя несприятливий, що робить проведення інтенсивної терапії вкрай необхідним. Хоча даних доказової медицини на підтримку ефективності плазмаферезу при хворобі Шегрена немає, на сьогодні є лише окремі повідомлення невеликих, як правило одноцентрових, досліджень про доцільність призначення серійного (4–6 процедур з інтервалами в 2–3 доби) плазмаферезу, синхронізованого з пульс-терапією циклофосфамідом в дозі 500–1000 мг і метилпреднізолоном в дозі 500–1000 мг у пацієнтів із некротизуючим кріоглобулінемічним васкулітом і гломерулонефритом. Тому вибір на користь плазмаферезу при цій патології залишається на розсуд клініциста із врахуванням об’єктивних показників у кожній ситуації.
Системні васкуліти
Оскільки патохімічний механізм є провідним у розвитку клінічної картини системних васкулітів, логічно припустити, що використання плазмаферезу допоможе в усуненні окремих альтеруючих агентів. Ця думка також підтверджена і в ряді пілотних досліджень і при описі окремих випадків хвороб, однак у ході декількох РКД перевагу комбінації плазмаферезу з пульс-терапією циклофосфамідом і метилпреднізолоном перед призначенням лише циклофосфаміду і метилпреднізолону у пацієнтів із ВП, синдромом Черджа — Стросс, регресуючим гломерулонефритом не було виявлено. З іншого боку, застосування плазмаферезу у хворих на системний васкуліт із розвитком прогностично несприятливих форм асоційованого з антинейтрофільними цитоплазматичними антитілами (АНЦА-асоційованого) гломерулонефриту може сприяти значному прискоренню відновлення функцій нирок і поліпшенню віддаленої виживаності. Ретроспективний аналіз декількох досліджень виявив, що проведення плазмаферезу (з частотою до 10 процедур на місяць) дозволило припинити діаліз у 67–100% пацієнтів із прогресуючим гломерулонефритом, у той час як у хворих, які не отримували плазмаферез, цей показник становив 33%.
Ревматоїдний артрит
Проведено чимало спроб використання плазмаферезу з лікувальною метою у хворих на РА. У ряді випадків призначення плазмаферезу виправдано за наявності системних проявів, кріоглобулінемії та синдрому гіперв’язкості. Декілька експериментальних робіт наводять дані про ефективність плазмаферезу в комбінації з підвищеними дозами метотрексату і метилпреднізолону у пацієнтів з РА і системними формами ЮРА. При лікуванні хворих на РА із системними проявами плазмаферез показаний як індукційна терапія по 3–6 процедур з інтервалами 2–3 доби, із синхронним проведенням інфузії метилпреднізолону по 250 мг і метотрексату по 40 мг (сумарно не більше 240 мг, під контролем активності печінкових ферментів у крові та загального аналізу крові). У наш час перспективним напрямком вважають розробку методик селективного видалення з кровотоку патологічних сполук і клітин: білок А-сорбенту (видалення антитіл класу IgG, РФ, ЦІК), гранулоцитаферез (елімінація прозапальних клітин — гранулоцитів і моноцитів). У літературі досить частими є публікації багатьох досліджень на підтримку наявності протизапального ефекту цих процедур у хворих із неефективністю базисних препаратів, включаючи біологічні агенти. Цю ідею вдалося повністю відобразити в результатах сліпого контрольованого дослідження ефективності білка А-сорбенту у хворих на РА. У випробування було включено 99 пацієнтів із тривалістю хвороби 15,5 року і неефективністю >4 БПЗП. Хворим основної групи (52 особи) протягом 12 тиж було призначено процедури плазмаферезу з використанням білка А-сорбенту, а в контрольній групі (47 пацієнтів) проводили імітуючі процедури (sham pheresis). Через 7–8 тиж після закінчення лікування позитивний ефект за критеріями АCR виявлено у 41,7% хворих досліджуваної і у 15,6% пацієнтів контрольної групи. Досягнутий позитивний ефект зберігався досить довго (в середньому протягом 37 тиж). Виявлено, що у випадках неефективності терапії білком А-сорбентом резистентність не вдавалося подолати при застосуванні повторного 12-тижневого курсу. На сьогодні ще в декількох інших відкритих пілотних дослідженнях підтверджена ефективність імуносорбції з використанням білка А-сорбенту у хворих на РА високого ступеня активності, із прогресуючим перебігом і неефективністю БПЗП.
Запальні міопатії
Як йшлося вище, методика плазмаферезу допомагає контролювати титри прозапальних агентів у сироватці крові, навіть якщо цього ефекту не вдалося досягти шляхом медикаментозної терапії. З цієї точки зору, здавалося б, можна розглядати групу захворювань запальних міопатій як показання до призначення екстракорпорального очищення плазми крові. У літературі є повідомлення про декілька відкритих і РКД із вивчення ефективності плазмаферезу у 192 пацієнтів із ДМ і поліміозитом. У РКД за участю 36 хворих на ДМ або поліміозит встановлено, що застосування плазмаферезу не приводить до підвищення ефективності лікування. У відкритих дослідженнях досить висока ефективність 3–4 процедур плазмаферезу відзначена при тривалості захворювання не більше 6 міс.
Хвороба Кавасакі
Досить переконливими на сьогодні є результати доказової медицини стосовно використання плазмаферезу в ревматологічній практиці, але, на жаль, контрольованих досліджень з оцінки ефективності плазмаферезу при хворобі Кавасакі не проводили. В описах окремих випадків хвороби вказують на доцільність плазмаферезу (щодня протягом 3 діб) при загрозі розвитку аневризми і неефективності в/в введення імуноглобуліну у хворих на коронарит.
У цілому ефективність плазмаферезу при ревматичному захворюванні наведена в табл. 9.1.
Таблиця 9.1
Ефективність плазмаферезу при ревматичних захворюваннях (Насонов Е.Л., 2010)
|
Захворювання |
Терапія |
Ефективність |
Тип дослідження |
|
Хвороба Кавасакі |
Плазмаферез |
Не доведена |
Опис випадків |
|
РА |
Плазмаферез |
Не доведена |
Відкриті й контрольовані дослідження |
|
Протеїн А-сорбент |
Помірний ефект |
Контрольоване дослідження |
|
|
Хвороба Шегрена |
Плазмаферез |
Доведено при кріоглобулінемії |
Опис випадків |
|
Запальні міопатії |
Плазмаферез |
Можлива ефективність на ранніх стадіях |
Неконтрольовані дослідження |
|
Системні васкуліти |
Плазмаферез |
Можлива ефективність при ураженні нирок |
Відкриті дослідження |
|
СЧВ |
Плазмаферез, імуносорбція |
Доведено при станах, що загрожують життю, при прогресуючому нефриті |
Відкриті дослідження |
Побічні реакції та ускладнення плазмаферезу
Незважаючи на те що процедура плазмаферезу широко застосовується клініцистами багатьох спеціальностей і в наш час вже нагромаджений великий досвід щодо проведення та ефективності в повсякденній клінічній практиці, варто пам’ятати про те, що використання цієї методики нерозривно пов’язане із ризиком розвитку побічних ефектів у межах від 10 до 20%. Більшість побічних ефектів пов’язують із технологією проведення процедури, використанням матеріалів, обмінними розчинами та підготовкою персоналу.
Під час плазмаферезу і в перші години після його закінчення можливі артеріальна гіпотензія, озноб, алергічні реакції. Розвиток побічних ефектів буває зумовленим частковим гемолізом, активацією комплементу (при контакті клітин крові з пластиковими матеріалами), цитратною гіпокальціємією, гіповолемією. Нерідко відзначають утворення підшкірних гематом у місці пункції периферичних вен. Є поодинокі випадки кровотеч і тромбозів, пов’язаних із коагулогічними і реологічними порушеннями. Побічні ефекти, що виникають при проведенні процедури, мають тимчасовий характер, їх легко купірувати, вони практично не впливають на частоту і тривалість застосування плазмаферезу. Найбільш важливим і суттєвим вважають питання про можливий ризик розвитку серйозних інфекцій після застосування серійного плазмаферезу. За деякими даними, частота бактеріальних і вірусних інфекцій (герпес, цитомегаловірус) підвищується після проведення комбінованої терапії (плазмаферез у поєднанні з пульс-терапією ГК та циклофосфамідом) порівняно з монотерапією ГК та циклофосфамідом. Однак, згідно з результатами інших досліджень, імовірність тяжких інфекцій після плазмаферезу не підвищується.
Профілактикою побічних ефектів і ускладнень плазмаферезу служить, в першу чергу, висока професійна підготовка медичного персоналу, наявність сучасного обладнання, використання фільтрів для сепарації крові чи безперервного режиму центрифугування. При підготовці хворого до процедури необхідно провести дослідження коагулограми, визначити гематокрит, уточнити алергічний анамнез. Плазмаферез протипоказаний за наявності вірусних або бактеріальних інфекцій, алергії на кровозамінники, а також хворим із вираженими порушеннями гемодинаміки (аритмія, артеріальна гіпотензія), значною гіпопротеїнемією (<50 г/л). Режими плазмаферезу у осіб із ревматичними захворюваннями слід підбирати індивідуально залежно від обставин. Найбільш часто призначають 2–3 процедури на тиждень протягом 1–3 тиж. При критичному перебігу хвороби плазмаферез можна проводити щодня або навіть 2 рази на добу аж до усунення загрозливого життю стану.
Лікувальна артроскопія
На сьогодні артроскопія є не лише одним із найточніших методів діагностики патології внутрішньосуглобових структур, а також широко використовується як лікувальний метод. Артроскопію виконують у випадках, коли інші неінвазивні методи діагностики виявилися неефективними. Ця методика володіє такими характеристиками: вища діагностична точність забезпечує проведення малоінвазивних ендоскопічних втручань шляхом використання різноманітного інструментарію, забезпечує виконання оперативних втручань різної складності на різних суглобах, можливість проведення на амбулаторному етапі, менш тривалий післяопераційний період. До переваг методики можна віднести: мінімальну альтерацію структур суглоба, надзвичайну діагностичну інформативність, високий ступінь візуалізації внутрішньоартикулярних структур, вибір та контроль оптимальної терапії, остаточне вирішення питання про необхідність оперативного втручання, нижчу частоту післяопераційних ускладнень, здатність збереження результатів обстеження на зовнішніх носіях та динамічне спостереження за станом здоров’я хворого, коротший та менш тяжкий післяопераційний період.
Перехід від діагностичної до лікувальної артроскопії відбувається тоді, коли виявляють патологію, яку можна усунути одномоментно шляхом малоінвазивного втручання (рис. 9.2).
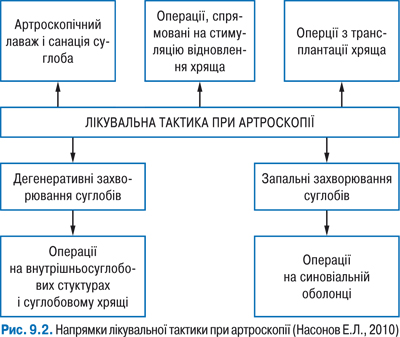
Методика, що базується на видаленні в ході операції пошкоджених структур та евакуації зі струмом води вільних інтраартикулярних тіл, частинок хрящової тканини, запальних агентів — називається методом санації та лаважу. Абразивну хондропластику, субхондральну тунелізацію і створення мікропереломів субхондральної кістки відносять до групи операцій, заснованих на активації репаративних процесів при пенетрації субхондральної кістки, що забезпечує міграцію мезенхімальних клітин кісткового мозку в ділянку хрящового дефекту і заміщення його фіброзним хрящем, що складається переважно з колагену I типу. Методики, засновані на пересадці аутогенної чи алогенної хрящової тканини в альтеровану ділянку, забезпечують відновлення власного гіалінового хряща.
Основна мета лікувальної артроскопічної синовектомії — видалення патологічного вмісту суглоба і покращання його механічної функції при запаленні. Вона також дозволяє поліпшити нормальну функцію суглоба шляхом видалення патологічних запальних тканин та усунення синовіту.
Показанням для проведення артроскопічної синовектомії є хронічний синовіт, який не підлягає медикаментозній корекції протягом ≥6 міс. Існує багато даних на підтримку того, що усунення значного вогнища запалення може уповільнювати прогресування суглобової ерозії та руйнування хряща. Тому деякі автори пропонують виконання синовектомії на ранніх етапах захворювання у пацієнтів молодого віку, аби запобігти змінам у суглобі, що мають рентгенологічні ознаки пошкодження.
Протипоказаннями для виконання артроскопічної синовектомії є будь-які патологічні зміни шкіри в ділянці артроскопічних доступів, інфекція шкірних покривів. До протипоказань не відноситься інфекційний артрит, оскільки на сьогодні інфекційні ураження суглобів є показанням до артроскопічної санації. Кінцеві стадії деформуючого артрозу можна вважати відносним протипоказанням, в основному тому що виконання операції в цьому випадку може бути технічно важким. Більше того, існують повідомлення про те, що у пацієнтів із вираженим ураженням суглоба (IV стадія деструкції) синовектомія дає велику кількість негативних результатів.
При підготовці до артроскопії, як і до інших операцій, важливо вчасно провести обстеження пацієнта для оцінки загальносоматичного стану та дати оцінку операційному й анестезіологічному ризику.
Методика та подальший догляд. Проводять артроскопію під місцевою, регіонарною чи загальною анестезією. Вибір методу анестезії залежить від соматичного і психологічного стану пацієнта, від обсягу оперативного втручання. При операції на суглобах нижніх кінцівок часто використовують спінальну анестезію, що забезпечує хорошу м’язову релаксацію та усуває дискомфорт при використанні турнікету. При місцевому знеболюванні цих властивостей немає. Втручання виконують за допомогою пневматичного турнікету в положенні хворого лежачи на спині. Кінцівку, яку оперують, можна іммобілізувати спеціальним фіксатором у зігнутому положенні під кутом 90°. Для діагностичної артроскопії найчастіше виконують втручання зі стандартних передньозовнішнього і передньовнутрішнього доступів, що знаходяться на 1 см вище суглобової щілини і на 1 см — латеральніше і медіальніше краю власної зв’язки надколінка. Лікувальну артроскопію виконують і з додаткових артроскопічних порталів, залежно від місця локалізації патологічних змін, як, наприклад, задньомедіальний, задньолатеральний, верхньомедіальний, верхньолатеральний та ін. Синовектомія, виконана шляхом артроскопії, дозволяє уникнути певних труднощів, з якими стикаються хірурги при відкритій синовектомії, таких як радикальність резекції та післяопераційні ускладнення. Застосовуючи доступи з додаткових порталів та змінюючи положення оптики під різними кутами зору можна працювати у різних ділянках суглобів, не втрачаючи при цьому прямого візуального контролю. Аналогічно і до відкритої синовектомії екстракцію синовії можна полегшити за рахунок відділення внутрішнього синовіального шару від розміщеного нижче, що можна виконати за допомогою моторизованого бору. Ізометричні вправи й активні рухи в оперованому суглобі можна виконувати відразу після операції. Кінцівка швидко відновлює рухову активність, оскільки артроскопічні доступи не порушують фізіологічної діяльності скелетних м’язів. За умови відсутності болю, набряку та відновлення повного обсягу рухів і сили кінцівки повну активність дозволяють після загоєння ран. У післяопераційний період допомагає також фізіотерапія. Більшість авторів відзначають, що відмова від милиць і відновлення доопераційного обсягу рухів досягається на 7–10-й день після артроскопічної синовектомії колінного суглоба.
Операційні характеристики. На сьогодні у багатьох роботах показана ефективність артроскопічної синовектомії. У дослідженні, проведеному за участю 84 пацієнтів із РА, доведено, що після артроскопічної синовектомії до кінця 5-го року спостереження відзначали достовірне зменшення вираженості больового синдрому, поліпшення функції суглоба, відсутність ознак місцевого запалення. В іншій роботі через 3 роки спостережень відзначено 90% вдалих результатів, але до кінця 5-го року частка позитивних результатів знизилася до 75%. Навіть незважаючи на цю різницю клінічних показників, у цілому в більшості досліджень відзначено появу клінічної ремісії через 2 роки після операції. Внаслідок її малоінвазивності та незначної частки ускладнень, артроскопічну синовектомію можна вважати методом вибору при лікуванні стійких рецидивуючих синовітів колінного суглоба, що не піддаються консервативному лікуванню. Післяопераційні ускладнення після артроскопії виникають рідше, оскільки хірургічна рана значно менша, внаслідок чого больовий синдром буде менш інтенсивним, зменшується необхідна медикаментозна підтримка, реабілітація та госпіталізація, що відрізняє малоінвазивну методику від відкритої, де ускладнення є одним з основних факторів, що обмежують її використання на ранніх етапах захворювання. Знижується ризик розвитку контрактур і необхідність проведення терапевтичного лікування та ЛФК шляхом зменшення інтенсивності післяопераційного больового синдрому. За даними багатьох досліджень, що проводилися в різних країнах, кількість ускладнень після артроскопії становить від 1 до 2%. Так, в одному з досліджень ризик післяопераційної патології був <1%, а в аналізі результатів 8791 операції частота ускладнень становила 1,85%. Найчастішим з них є гемартроз, другий за частотою після післяопераційного інфікування. В одному з багатоцентрових проспективних досліджень показано, що частота інфекційних ускладнень сягала 0,2% (1 випадок на 500 операцій). Відносно частими ускладненнями вважають тромбемболію та анестезіологічні порушення, адже в середньому їх частота становить 0,1% (1 випадок на 1000 операцій). Крім того, виділяють також пошкодження судин і нервів, тромбофлебіт і втрату обсягу рухів у суглобі, пошкодження від стискання турнікетом. З деонтологічних поглядів слід інформувати пацієнта до операції про можливі ускладнення. Варто розуміти, що лише при адекватному підході артроскопія може бути безпечною та ефективною.
Альтернативними методами є артротомія, відкрита синовектомія.
Ендопротезування суглобів
Ендопротезування суглобів — метод хірургічного лікування — один із методів відновної терапії хворих із ревматичним ураженням суглобового апарату, оскільки дозволяє повернути функціональну активність, купірувати больовий синдром, відновити якість життя.
Показання до ендопротезування суглобів:
- Виражений больовий синдром та порушення функції кінцівок при неефективності консервативного лікування та виявлених рентгенологічних змін.
- ОА ІІІ–ІV рентгенологічної стадії.
- Ураження кульшового чи колінного суглобів при РА, хронічному ЮРА, АС та інших ревматичних захворюваннях із виявленими рентгенологічними кістково-деструктивними змінами.
- Асептичний некроз голівки стегнової кістки і прогресування деформації голівки.
- Асептичний некроз виростків великогомілкової чи стегнової кісток із прогресуючою вальгусною чи варусною деформацією кінцівки.
- Зміни в кульшовому суглобі з рентгенологічними ознаками протрузії дна вертлюжної западини.
- Клінічно виявлене вкорочення кінцівки на боці ураження у поєднанні з рентгенологічними змінами.
- Контрактура суглоба, зумовлена виявленими рентгенологічними кістково-деструктивними змінами.
- Фіброзний та кістковий анкілоз суглоба.
- Післятравматичні зміни суглоба, що призводять до порушення опорної функції та розвитку больового синдрому.
Для протезування п’ястково-фалангових суглобів існують такі показання:
- Біль у суглобі, що не піддається консервативному лікуванню.
- Деформація в п’ястково-фаланговому суглобі.
- Підвивих або вивих проксимальних фаланг.
- Ульнарна девіація, яка залишається при активному розгинанні.
- Виявлення деструкції кісток ≥ІІ ступеня при рентгенологічному дослідженні (за Ларсеном).
- Формування контрактури або анкілозу у функціонально невигідному положенні.
- Функціонально невигідна дуга рухів.
- Незадовільний зовнішній вигляд кисті.
При визначенні показань і протипоказань до оперативного втручання необхідно оцінити інтенсивність больового синдрому; ступінь вираженості функціональних порушень; зміни в суглобах за даними рентгенологічного обстеження, а також урахувати стан самого пацієнта, а саме вік, стать, соматичний стан і характер майбутнього втручання.
Протипоказання до ендопротезування суглобів визначають, враховуючи ризики розвитку операційних та післяопераційних ускладнень та анестезіологічного ризику. Також беруть до уваги психоемоційний стан пацієнтів, прогнозують можливості у подальшому активному способі життя. Таким чином, протипоказаннями до оперативного втручання можуть бути:
- Незадовільний соматичний стан пацієнта, виявлені тяжкі супутні захворювання, які значно підвищують анестезіологічні ризики та ризики розвитку операційних та післяопераційних ускладнень.
- Виявлення вогнищ інфекції у місці запланованого оперативного втручання та віддалених ділянках.
- Психічні порушення, які не дозволяють пацієнту адекватно оцінювати свій стан і дотримуватися післяопераційного режиму.
- Множинні ураження суглобів та м’яких тканин, які не дозволять після операції користуватись оперованою кінцівкою та милицями для ходьби.
Анестезіологічні ризики, крім загальних, також включають ураження нижньощелепних суглобів, шийного відділу хребта (особливо нестабільність СІ–СІІ), поперекового відділу (осифікація зв’язок). Ураження серцево-судинної системи пацієнтів потребують більшого контролю як під час операції, так і в післяопераційний період.
Базисні препарати відміняють за 1 тиж до операції та на весь період загоювання рани. Особам, які тривалий період приймають ГК, може знадобитися пульс-терапія.
Необхідно враховувати системні прояви ревматичних захворювань та фармакотерапію. Досить часто у пацієнтів виявляють анемію. Враховуючи майбутні операційні крововтрати необхідно проводити доопераційну терапію і під час операції проводити переливання плазми крові та еритроцитарної маси.
В післяопераційний період з другого дня пацієнтам слід рухатися: ходити з милицями з дозованим навантаженням на оперовану кінцівку, проводити ЛФК. Необхідний ранній початок активних і пасивних рухів оперованої кінцівки (можливе застосування спеціальних пристроїв). На день виписки пацієнт із ендопротезуванням колінного суглоба має сам себе обслуговувати, ходити по сходах. Після операції на кульшовому суглобі є деякі обмеження — згинання, приведення та зовнішня ротація, для профілактики вивиху в суглобі. Післяопераційна реабілітація хворих з ендопротезуванням п’ястково-фалангових суглобів триває близько 6 тиж і включає працетерапію, вправи із предметами, фізіотерапію та носіння динамічної шини.
Найчастіше післяопераційними ускладненнями можуть бути нестабільність елементів ендопротеза та порушення відновлення кісткової тканини за рахунок вторинного ОП. Серед інших ускладнень — вивих стегнового компонента після тотального ендопротезування кульшового суглоба, приєднання вторинної інфекції, переломи стегнової та великогомілкової кісток проксимальніше або дистальніше компонентів ендопротеза, тугорухливість після ендопротезування колінного суглоба.
Глава 10. Фармакотерапія при ревматичних хворобах
Нестероїдні протизапальні препарати в лікуванні ревматичних хвороб
На сьогодні при лікуванні більшості ревматичних захворювань одними з найбільш важливих симптоматичних лікарських засобів залишаються НПЗП. Основними показаннями до призначення НПЗП є запальні процеси різного генезу, гострий чи хронічний біль, лихоманка різної етіології, профілактика тромбозів. Широкий спектр застосування НПЗП зумовлений унікальним поєднанням протизапальної, анальгезивної, жарознижувальної та антитромботичної властивостей, що визначає здатність впливати на всі найбільш характерні симптоми ревматичного захворювання. Такого одночасного поєднання позитивних впливів не має жодна з інших відомих груп лікарських засобів. Саме через це НПЗП широко застосовуються не лише в ревматології, а також і в інших галузях медицини (кардіології, неврології, онкології тощо). Сьогодні до класу НПЗП входить близько 20 лікарських засобів, які залежно від хімічної структури розподіляються на декілька груп: похідні саліцилової, індолової, гетероарілоцтової, пропіонової та еноліокової кислоти тощо. Однак ця класифікація не дозволяє прогнозувати клінічну ефективність або токсичність того чи іншого НПЗП (Насонов Е.Л., 2000).
Прогресивним досягненням стало встановлення того, що провідним механізмом, який визначає як ефективність, так і токсичність сучасних НПЗП, є пригнічення активності ЦОГ — фермента, що регулює біотрансформацію арахідонової кислоти у простагландини, простацикліни і тромбоксан (Simon D.L. et al., 2004). ЦОГ має дві основні ізоформи: ЦОГ-1 та ЦОГ-2. ЦОГ-1 наявна постійно у більшості тканин і належить до «конститутивних» («структурних») ферментів, що регулюють фізіологічні ефекти простагландинів. На противагу їй ЦОГ-2 у нормі в більшості тканин відсутня, проте її рівень суттєво підвищується на фоні розвитку запалення. Пригнічення активності ЦОГ-2 розглядається як найбільш важливий механізм протизапальної та анальгезивної активності НПЗП, а пригнічення ЦОГ-1, у свою чергу, як — розвиток побічних явищ. Але у зв’язку з появою нових фактів про роль ЦОГ-залежного синтезу простагландинів у нормі та при патології, думку про те, що ЦОГ-1 є «фізіологічним», а ЦОГ-2 — «патологічним» ферментом, було переглянуто. Дані останніх досліджень довели фізіологічну роль ЦОГ-2-залежного синтезу простагландинів у репарації виразкової хвороби ШКТ, «адаптивній цитопротекції» клітин ШКТ до токсичних речовин, стресу, регуляції овуляції, функції нирок, синтезі простацикліну ендотеліальними клітинами судинної стінки, репарації переломів кісток (Насонов Е.Л., 2004; Wallance J.L., 2006) (табл. 10.1).
Таблиця 10.1
Основні впливи ЦОГ-1 та ЦОГ-2 на головні фізіологічні функції організму (Насонов Е.Л., 2004; Wallance J.L., 2006)
|
Системи органів |
Функція |
|
ЦОГ-1 |
|
|
ЦНС |
Модуляція передачі нервового імпульсу |
|
Тромбоцити |
Агрегація |
|
ШКТ |
Захист слизової оболонки |
|
Нирки |
Вазодилатація |
|
ЦОГ-2 |
|
|
ЦНС |
Регуляція передачі нервового імпульсу |
|
Активація терморегуляторного центру |
|
|
Ендотелій судин |
Вазодилатація |
|
Антиагрегантний вплив |
|
|
ШКТ |
Регуляція клітинної проліферації під час тканинного відновлення, запалення чи неопластичного процесу |
|
Нирки |
Регуляція водно-електролітного балансу |
|
Регуляція артеріального тиску |
|
Розподіл ЦОГ на «фізіологічну» та «патологічну» не коректний, оскільки обидва ферменти беруть участь як у фізіологічних, так і в патологічних процесах. При лікуванні запальних процесів будь-якої етіології доцільнo застосовувати так звані збалансовані інгібітори ЦОГ. Розподіл молекул за селективністю наведено на рис. 10.1 (Warner G.S. et al., 2004).
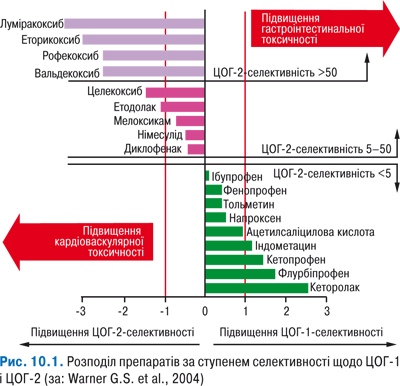
До додаткових механізмів протизапальної та анальгезивної дії НПЗП, що обговорюються і не пов’язані з пригніченням активності ЦОГ, належать пригнічення функції нейтрофільних гранулоцитів, взаємодії лейкоцитів з ендотелієм судин, інгібіція активації фактора транскрипції NF-κβ (регулятора синтезу прозапальних медіаторів), центральні антиноцицептивні і, навіть, опіоїдоподібні ефекти, регуляція апоптозу клітин. НПЗП умовно поділяють на короткої дії (Т½ <6 год) і тривалої дії (Т½ ≥6 год). Проте чіткого зв’язку між Т½ НПЗП у плазмі крові та клінічною ефективністю НПЗП при їх тривалому прийомі простежити не вдалося. Препарати короткої дії накопичуються і тривало наявні в ділянці запалення, наприклад у порожнині суглоба. Основні представники групи НПЗП та їх фармакологічні властивості наведено в табл. 10.2.
Таблиця 10.2
Загальна характеристика НПЗП (Насонов Е.Л. и соавт., 2010)
|
Препарат |
Тmaх, год |
Т½, год |
Доза, мг |
Тривалість дії, год |
Максимальна добова доза, мг |
|
1–2 |
2,5 |
500–1000 |
4–6 |
3000 |
|
|
2 |
1–2 |
50–100 |
8–12 |
150 |
|
|
0,5–1,5 |
2–2,5 |
200–400 |
6–8 |
2400 |
|
|
1–2 |
4,5 |
25–100 |
6–12 |
200 |
|
|
0.5–2 |
1,5 |
50–100 |
6–12 |
200 |
|
|
0,5–1 |
3,5 |
10–30 |
4–6 |
90 |
|
|
2 |
4 |
8–16 |
12 |
16 |
|
|
5–6 |
20 |
7,5–15 |
24 |
15 |
|
|
1–2 |
15 |
250–1000 |
12 |
1250 |
|
|
1–3 |
2,5 |
100–200 |
12 |
400 |
|
|
2–4 |
53 |
10–20 |
24 |
20 |
|
|
2–5 |
4–15 |
100–400 |
12–24 |
400 |
Для клінічної практики велике значення має поділ НПЗП на два основні класи, залежно від селективності щодо ЦОГ-2, на неселективні й селективні НПЗП (табл. 10.3). Деякі дослідники виділяють серед селективних НПЗП підгрупу високоселективних препаратів (так звані коксиби).
Таблиця 10.3
Класифікація НПЗП залежно від селективності щодо ЦОГ-2 (Насонов Е.Л. и соавт., 2010)
|
Група препаратів |
Назва препаратів |
|
Неселективні інгібітори ЦОГ-2 |
Неселективні НПЗП: ацетилсаліцилова кислота, диклофенак, ібупрофен, індометацин, кетопрофен, кеторолак, лорноксикам, напроксен, піроксикам |
|
Селективні інгібітори ЦОГ-2 |
Селективні НПВП: коксиби (целекоксиб, рофекоксиб, вальдекоксиб*, еторикоксиб, лумірококсиб*) Інші (мелоксикам, німесулід, етодолак) |
|
Селективні інгібітори ЦОГ-1 |
Ацетилсаліцилова кислота в низьких дозах |
*Не зареєстровані в Україні.
Ефективність нестероїдних протизапальних препаратів
Системна дія НПЗП зумовлена їх застосуванням у всіх існуючих формах: пероральній, як ректальних свічок та ін’єкцій. Пацієнти із хронічними ревматичними захворюваннями найчастіше лікуються НПЗП у пероральній формі. Існують думки про переваги тієї чи іншої форми препарату, але немає чітких переконливих даних, що, наприклад, ректальні свічки мають переваги у швидкості настання чи вираженості лікувальної дії порівняно із прийомом НПЗП перорально. Ректальні свічки, можливо, доцільно використовувати для зниження ризику розвитку диспепсії, пов’язаної з контактним подразнювальним ефектом цих препаратів. Для короткочасного (не довше 3 днів) лікування гострого болю ін’єкційні форми НПЗП більш показані. Проте при застосуванні ін’єкційних форм НПЗП виникає ймовірність розвитку місцевих постін’єкційних ускладнень. Тому тривале застосування ін’єкційних форм НПЗП у пацієнтів із ревматичним захворюванням протипоказане (Combe B., Velicitat P. et al., 2001). Сучасні форми НПЗП для перорального прийому (з високою біодоступністю) для більш тривалого застосування мають настільки ж виражений анальгезивний ефект, як ін’єкційні. Існує також серйозна доказова база щодо ефективності місцевих форм НПЗП (креми та мазі) для симптоматичної терапії при ОА колінних суглобів і суглобів кистей, а також запальних захворювань м’яких тканин. За даними РКД, мазі з НПЗП достовірно перевершують за своєю дією плацебо, відносно рідко викликають місцеві та системні небажані ефекти, добре переносяться хворими, але в реальній практиці місцеве призначення НПЗП зазвичай розглядають як метод допоміжної терапії. Для лікування у пацієнтів із ревматичними захворюваннями ефективність системного призначення НПЗП добре доведена. Вони мають вищу ефективність, ніж парацетамол. У літературі описано багато РКД, в яких порівнювалась ефективність і безпека неселективних та селективних НПЗП. Доведено, що при РА тривале застосування препаратів цієї групи зумовлює значне зменшення вираженості болю і поліпшення загального самопочуття у 60–70% хворих. Ефективність НПЗП найкраще вивчена при ОА, РА, подагрі, гострому болю. Але варто пам’ятати, що застосування НПЗП при РА слід розглядати як переважно симптоматичний метод лікування, оскільки навіть при тривалому застосуванні у високих дозах ці препарати не сповільнюють прогресування захворювання. Для усунення болю і запалення при АС застосовують НПЗП як препарати першої лінії, це добре доведений факт. У деяких клінічних роботах показано, що багаторічний безперервний прийом НПЗП здатний навіть сповільнити прогресування рентгенологічних змін у хребті (Dougados M., Gueguen A. et al., 1999). НПЗП є препаратами вибору для фармакотерапії при таких ревматичних захворюваннях, як біль у нижній ділянці хребта і ураження м’яких тканин ревматичної природи (плечолопатковий періартрит, тендиніт, бурсит та ін.). Застосування НПЗП у високих дозах розглядають як найбільш доцільний і ефективний спосіб терапевтичного втручання для купірування гострого подагричного артриту. Широко використовують НПЗП у комплексній терапії пацієнтів із ОА. Це дозволяє досягнути швидкого симптоматичного поліпшення. Крім того, хворі на ОА приймають хондропротекторні препарати як базисну терапію, тому застосування НПЗП забезпечує пацієнту комфортне очікування початку дії хондропротекторів, результат застосування яких проявляється не відразу. EULAR та ACR рекомендовано застосування парацетамолу як симптоматичного засобу, як препарату першої лінії для лікування при ОА. Але це не дозволяє досягти значного лікувального ефекту. Серія РКД довела, що у хворих на ОА тривале застосування НПЗП у невисоких дозах значно ефективніше, ніж парацетамол у високих (4 г/добу) дозах. Симптоматична дія НПЗП (целекоксибу) може бути більш вираженою, ніж хондропротекторів. Враховучи неЦОГ-залежні механізми дії німесуліду, а саме: блокування супероксидних радикалів кисню, активності NO-синтетази і, відповідно, утворення оксиду азоту (NO) та пероксинітриту (ONOO), інгібіцію ІЛ-6, які є ключовими медіаторами у процесі руйнування хряща та розвитку запального процесу, відміну апоптозу хондроцитів, блокування колагенази та стромелізину, що приводить до зменшення деградації колагену II типу та протеоглікану, тобто хондропротекторну дію німесуліду, його можна вважати препаратом вибору при ОА. Німесулід є оптимальним вибором для стартової терапії (протягом перших 15 днів) патології опорно-рухового апарату, зокрема ОА. Він не тільки виявляє швидкий і виражений анальгезивний ефект, що істотно покращує якість життя пацієнтів з ОА і підвищує їх прихильність до лікування, але й дозволяє певною мірою модифікувати перебіг захворювання, впливаючи на ряд ключових ланок його патогенезу, в першу чергу пригнічуючи синтез прозапальних цитокінів і металопротеїназ. У РКД важко знайти відповідь на запитання про те, який саме НПЗП має вищу ефективність для тієї чи іншої патології. За можливістю ці препарати слід застосовувати короткотривалими курсами, а також у мінімально низькій дозі, яка контролює сиптоми. Є теоретичні обґрунтування патогенетичного ефекту НПЗП при ОА, а також клінічні дані, що підтверджують уповільнення деструкції хряща при застосуванні окремих препаратів групи НПЗП.
За своїм анальгезивним ефектом селективні НПЗП не поступаються перед неселективними НПЗП, у тому числі при гострому болю. Клінічний досвід свідчить про істотні варіації відповіді в окремо взятих пацієнтів при застосуванні різних препаратів групи НПЗП. У настанні клінічного ефекту мають значення індивідуальні особливості фармакодинаміки різних препаратів, біодоступність, швидкість настання пікової концентрації, швидкість метаболізму, здатність накопичуватися в осередках запалення у більш високій концентрації, ніж у плазмі крові. Для індивідуальних препаратів, що є рацемічними сумішами, важливим є співвідношення D і S — оптичних ізомерів із різною біологічною активністю. Немає чітких даних про те, наскільки ефективне при ревматичному захворюванні застосування НПЗП у низьких дозах у режимі «на вимогу». Немає також переконливих доказів, що підтверджують більш потужну протибольову та протизапальну дію при застосуванні НПЗП у «супратерапевтичних» дозах. Тому не доцільно використовувати ці препарати у дозах, що перевищують рекомендовані. Потрібно застосовувати НПЗП в оптимальних терапевтичних дозах та оптимально короткими курсами.
Диклофенак вважається одним із найбільш безпечних НПЗП. При виборі найбільш раціональною є сучасна форма випуску — капсули ДУО з гранулами різної швидкості вивільнення (25 мг гранул рапірної (швидкодіючої) і 50 мг гранул пролонгованої форми). Форма ДУО забезпечує захист ШКТ, швидкий анальгезивний ефект і тривалу протизапальну дію препарату. Внаслідок розчинення желатинової капсули в шлунку з неї вивільняються гранули. При цьому сам диклофенак не вивільняється в кислому середовищі шлунка завдяки кислототривкій оболонці гранул швидкого вивільнення. Мікророзмір гранул забезпечує їх швидке просування з шлунка в кишечник до місця абсорбції, тому ефект проявляється значно швидше, ніж у звичайної таблетованої форми. 50 мг диклофенаку, що міститься у гранулах пролонгованої дії, завдяки спеціальному шару звільняєтся і абсорбується через 1,5–2 год в тонкому кишечнику, що забезпечує тривалу знеболювальну дію та протизапальний ефект. Максимальна концентрація диклофенаку в плазмі крові досягається вже через 30–60 хв після прийому капсули, але терапевтична концентрація зберігається удвічі довше, ніж після таблетованої форми диклофенаку. Вивільнення активної речовини у значній кількості гранул забезпечує його рівномірний розподіл по всьому травному тракту. Як наслідок вдається уникнути високих локальних концентрацій активної речовини по ходу травного тракту і досягти кращої переносимості диклофенаку натрію. Водночас відсутність високих пікових концентрацій знижує частоту небажаних системних реакцій. При цьому концентрація підтримується без істотних відхилень між максимальним і мінімальним рівнем після введення кожної дози.
При використанні парентеральних форм введення диклофенаку слід враховувати можливість внутрішньовенного введення препарату*.
*В Україні зареєстрований як Наклофен.
Побічні ефекти нестероїдних протизапальних препаратів
Відомо, що НПЗП мають виражену токсичну дію на багато органів і систем. Це пов’язано із пригніченням синтезу простагландинів, які беруть участь у важливих фізіологічних процесах. Частоту виникнення найбільш значимих побічних ефектів наведено в табл. 10.4.
Таблиця 10.4
Побічні ефекти НПЗП (Насонов Е.Л. и соавт., 2010)
|
Побічні ефекти |
Частота, % |
Коментар |
|
Шлунково-кишкові |
||
|
Суб’єктивні симптоми з боку ШКТ: нудота, блювота, диспепсія, діарея, закрепи, печія, біль в епігастральній ділянці |
10–50 |
Частіше розвиваються при тривалому прийомі НПЗП. Часта причина переривання лікування в перші місяці терапії. Погано корелюють з істинною тяжкістю ураження ШКТ: приблизно у половини хворих зі шлунковими кровотечами, пов’язаними з прийомом НПЗП, суб’єктивні скарги відсутні |
|
Ураження слизової оболонки ШКТ: геморагії, ерозії, виразки (НПЗП-гастропатія) |
15–50 |
Клінічне значення «ендоскопічних» виразок до кінця не вивчено. Переважна локалізація — шлунок |
|
Тяжкі ускладнення: прободіння, перфорація, кровотеча |
1–4 пацієнти на рік |
Частота істотно відрізняється залежно від наявності факторів ризику |
|
Ураження кишечнику |
1–5 |
Можлива причина анемії |
|
Ураження печінки |
1–5 |
Клінічне значення помірного підвищення печінкових ферментів не з’ясоване |
|
Ураження стравоходу |
<1 |
|
|
Ниркові |
||
|
Порушення клубочкової фільтрації Підвищення артеріального тиску Сосочковий некроз Інтерстиціальний нефрит |
1–5 <1 |
Найчастіше пов’язане з індометацином |
|
Серцево-судинні |
||
|
Ризик виникнення тромбозу Декомпенсація серцевої недостатності |
1–5 |
Інгібітори ЦОГ-2 у дуже високих дозах Найчастіше індометацин |
|
Неврологічні |
||
|
Головний біль Асептичний менінгіт |
1–5 <1 <0,01 |
Найчастіше індометацин |
|
Шкірні |
||
|
Свербіж, висипання |
<1 |
– |
|
Гематологічні |
||
|
Агранулоцитоз |
<1 |
Найчастіше фенілбутазон, дуже рідко індометацин |
|
Гіперчутливість (бронхіальна астма, кропив’янка, пневмоніт) |
<1 |
Найчастіше ацетилсаліцилова кислота |
|
Інші |
||
|
Ототоксичність Безпліддя (у жінок) Стоматит, сіалоденіт, кардит, васкуліт, панкреатит Сульфонамідна алергія Бронхоспазм Гостра затримка сечі |
<1 <1 <1 <1 <1 Невідома |
Найчастіше ацетилсаліцилова кислота Найчастіше фенілбутазон Целекоксиб (призначення препарату протипоказане) Селективні НПЗП рідше, ніж ацетилсаліцилова кислота і неселективні НПЗП Дворазове підвищення ризику у чоловіків |
Ураження шлунково-кишкового тракту
Ураження верхніх відділів ШКТ у вигляді виразок та їх ускладнень — найбільш важливий прояв токсичної дії ацетилсаліцилової кислоти і неспецифічних НПЗП.
Шлунково-кишковї кровотечі, перфорації виразки і порушення прохідності ШКТ — це патологічні стани, які об’єднані історично сформованим терміном «НПЗП-гастропатії». Застосування НПЗП може призводити до загострення і розвитку ускладнень гастроезофагеальної рефлюксної хвороби, викликати диспептичний симптом, ураження тонкої і товстої кишки (Насонов Е.Л., Каратеев А.Е, 2000). НПЗП-гастропатія зумовлена блокадою ЦОГ-1 і пригніченням синтезу цитопротекторних простагландинів. Це веде до істотного зниження захисного потенціалу слизової оболонки і провокує її пошкодження соляною кислотою і пепсином, які містяться в шлунковому соку. Внаслідок блокади ЦОГ-2 відбувається вплив на агрегацію тромбоцитів, мікроциркуляторні порушення, блокаду ферментних систем мітохондрій клітин слизової оболонки, блокаду NO-синтетази, посилення клітинного апоптозу, вплив на шлункову секрецію, порушення репаративних процесів. Питання значення інфекції H. руlori в патогенезі НПЗП-гастропатії ще до кінця не вивчене. Цей мікроорганізм виявляють у 40–80% пацієнтів із ревматичними захворюваннями залежно від досліджуваної популяції. Можливо, інфікування H. руlori підвищує ймовірність розвитку НПЗП-індукованих виразок, ерозій і шлунково-кишкової кровотечі, однак НПЗП-гастропатія може виникати і у хворих, не інфікованих Н. руlori. За даними РКД, ерадикація H. руlori перед початком прийому НПЗП значно знижує ризик розвитку виразок і ерозій, проте не впливає на частоту рецидивів НПЗП-індукованих виразок і шлунково-кишкових кровотеч (Каратеев А.Е., Насонова В.А., 2004). Застосування НПЗП може спричиняти розвиток пептичного пошкодження слизової оболонки стравоходу з розвитком езофагіту, ерозій і виразок, а також сприяти формуванню пептичної стриктури у хворих із гастроезофагеальним рефлюксом. У осіб, які регулярно приймають НПЗП, зростає у >4 рази порівняно з популяцією ризик розвитку шлунково-кишкових кровотеч і перфорації виразки (≈1 випадок на 100 пацієнто-років). Хворі, які регулярно застосовують НПЗП, гинуть від подібних ускладнень у ≈2 рази частіше, ніж особи, які не одержують НПЗП та/чи отримують ацетилсаліцилову кислоту в низькій дозі (Strand V., 2007). За результатами дослідження, проведеного в Інституті ревматології РАМН (1996–2006), при езофагогастродуоденоскопії серед 6103 первинних пацієнтів із ревматичними захворюваннями, які приймали НПЗП, у 763 (12,5%) було діагностовано виразку шлунка та/чи дванадцятипалої кишки. При ендоскопічному контролі виразки шлунка та/чи дванадцятипалої кишки виявляють у ≥15–40% хворих, які регулярно застосовують НПЗП (Насонов Е.Л., 2000). За даними епідеміологічних досліджень застосування НПЗП підвищує ризик виразкових ускладнень у 4 рази (порівняно з тими пацієнтами, які не приймають НПЗП і навіть ацетилсаліцилову кислоту в низьких дозах (<325 мг)), подвоює ризик виразкових кровотеч (Клиппел Д.Х. и соавт., 2011). Абсолютний ризик виникнення серйозних ШКТ-ускладнень (кровотечі, перфорація чи обструкція) у пацієнтів за відсутності інших факторів ризику становить біля 0,5% на рік, а ризик у пацієнтів із РА досягає 2–4% на рік. Ризик розвитку шлунково-кишкових кровотеч зростає таким чином: ібупрофен < диклофенак < напроксен < індометацин < піроксикам. За даними ряду популяційних досліджень, найбільш високий ризик розвитку шлунково-кишкових кровотеч виникає при застосуванні кеторолаку. Однак результати масштабного РКД (n=11 245) свідчать, що при короткочасному прийомі кеторолаку (2 дні парентерально та 5 — перорально) у хворих після хірургічних операцій частота небезпечних ускладнень з боку ШКТ не вища, ніж при застосуванні диклофенаку та кетопрофену в аналогічному режимі (Насонов Е.Л., Лазебник Л.Б., 2006). У 2006 р. опубліковано результати великого проспективного дослідження щодо оцінки безпеки застосування НПЗП у реальних клінічних умовах. Усього проаналізовано 2777 випадків розвитку ускладнень від НПЗП-терапії. Результати цього дослідження свідчать, що збалансований інгібітор ЦОГ з додатковою дією на 5-ліпоксигеназу — диклофенак отримав досить високу оцінку гастроінтестинальної безпеки (Lanas A., Garcia-Rodriguez L.A., 2006).
Відносно паралельного застосування ацетилсаліцилової кислоти в кардіопрофілактичній дозі є дані, які підтверджують виникнення серйозних побічних ефектів з боку ШКТ. Ацетилсаліцилова кислота в низьких кардіопрофілактичних дозах, що застосовують для профілактики судинних тромбозів, також здатна викликати розвиток серйозних ускладнень з боку ШКТ, передусім кровотеч. Результати метааналізу (24 РКД, n=66 000) свідчать, що частота шлунково-кишкових кровотеч при прийомі ацетилсаліцилової кислоти у низьких дозах у >1,5 раза вища, ніж в осіб, які не отримують ацетилсаліцилової кислоти та інших НПЗП. Заслуговує на увагу поєднане застосування селективних інгібіторів ЦОГ-2 і ацетилсаліцилової кислоти. Так, доведено, що комбінація целекоксибу і ацетилсаліцилової кислоти у низьких дозах (81 мг) набагато рідше викликає розвиток ендоскопічних виразок порівняно з аналогічною комбінацією напроксену (Насонов Е.Л., 2004). Ці дані підтверджують результати популяційних досліджень, згідно з якими у хворих, які отримують целекоксиб разом із низькими дозами ацетилсаліцилової кислоти, серйозні ускладнення з боку ШКТ виникають практично вдвічі рідше, ніж у хворих, які отримують неселективні НПЗП і ацетилсаліцилову кислоту в низьких дозах (Buring J.E., Gaziano J.M., 2004). Є доказові дані про те, що одночасне застосування диклофенаку і ацетилсаліцилової кислоти в кардіопрофілактичній дозі супроводжувалося найнижчим відносним ризиком кровотечі з верхніх відділів ШКТ серед пацієнтів, які приймали ацетилсаліцилову кислоту і один із п’яти НПЗП, які найчастіше використовуються. Застосування інгібіторів протонної помпи супроводжувалось суттєвим зниженням ризику кровотечі з верхніх відділів ШКТ (відносний ризик 0,3). (Lanas A., Garcia-Rodriges L.A., 2006). При високому ризику ускладнень (шлунково-кишкова кровотеча в анамнезі чи перфоративні виразки, рецидивуючі НПЗП-індуковані виразки, поєднання ≥1 факторів ризику). Навіть на фоні прийому селективних НПЗП необхідно проводити медикаментозну профілактику НПЗП-гастропатії із застосуванням інгібіторів протонної помпи. У всіх хворих, які мають фактори ризику, показано проведення ендоскопічного дослідження через 1–3 міс після початку прийому НПЗП. Селективні НПЗП так само безпечні щодо розвитку рецидивів шлунково-кишкової кровотечі, як неселективні НПЗП у комбінації з потужними гастропротекторними препаратами. Згідно з результатами метааналізу, заснованого на даних 31 РКД (39 605 хворих на РА і ОА), небезпечні ускладнення з боку ШКТ виникали у пацієнтів, які приймали целекоксиб, у >2 рази рідше, ніж у контрольній групі — 0,4 і 0,9% відповідно. Два однотипних РКД, заснованих на проведенні повторного ендоскопічного дослідження у хворих на РА (n=659 і n=400), довели набагато нижчу частоту розвитку виразки шлунка і дванадцятипалої кишки при застосуванні целекоксибу (400 мг/добу), порівняно з напроксеном (1000 мг/добу) і диклофенаком (150 мг/добу) (Van H.A. et al., 2000). У масштабних, але відносно короткочасних (4–12 тиж) РКД, доведено безпеку мелоксикаму. Ефективність цього препарату порівнювали з неселективними НПЗП. Вивчали сумарну частоту ускладнень з боку ШКТ (включаючи диспепсію). Вона була нижчою, ніж при прийомі неселективних НПЗП. За даними метааналізу, застосування мелоксикаму в дозі 7,5 мг/добу асоціюється зі зниженням ризику розвитку серйозних ускладнень з боку ШКТ у 2 рази порівняно з неселективними НПЗП. Порівняльна безпека німесуліду вивчена в численних клінічних дослідженнях. В Італії проведено дослідження частоти повідомлень про серйозні небажані ефекти, пов’язані із застосуванням різних НПЗП. Усього проаналізовано 10 608 подібних повідомлень, що надійшли за період з 1988 по 2000 р. Виявилося, що німесулід викликав ускладнення з боку ШКТ у 2 рази рідше, ніж інші НПЗП — 10,4%, в той час як диклофенак — 21,2%, кетопрофен — 21,7%, піроксикам — 18,6%. Ризик розвитку шлунково-кишкової кровотечі при застосуванні різних НПЗП вивчали і в популяційному багатоцентровому дослідженні за типом випадок — контроль (Laporte J.R. et al., 2004). Проведено аналіз 2813 епізодів кровотеч із верхніх відділів ШКТ, контрольну групу становили 7193 хворих без цього ускладнення. Отримані дані продемонстрували, що німесулід більш безпечний щодо гастроінтестинальних побічних ефектів, ніж ряд інших популярних в Європі НПЗП. Так, відносний ризик для німесуліду становив 3,2, для диклофенаку — 3,7, мелоксикаму — 5,7. Ризик госпіталізацій у зв’язку з кровотечами з верхніх відділів ШКТ на фоні прийому НПЗП та інших лікарських засобів оцінювали в дослідженні L.A. Garcia Rodriguez та співавторів. В аналіз було включено 1505 пацієнтів, госпіталізованих із приводу кровотечі з ШКТ та/чи перфорації; групу контролю становили 20 тис. чоловік. Відносний ризик розвитку цих ускладнень істотно розрізнявся всередині групи НПЗП: найбільший відносний ризик встановлений для кеторолаку (відносний ризик=24,7; 95% ДІ 9,6–63,5) і піроксикаму (відносний ризик=9,5; 95% ДІ 6,5–13,8), у той час як для німесуліду — 4,4, що порівняно з групою контролю. Низький рівень гастроінтестинальних ускладнень на тлі застосування німесуліду можна пояснити його властивостями, що відрізняють цей препарат від інших НПЗП: близьким до нейтрального рН (значно вище, ніж у інших НПЗП), слабким ЦОГ-1-опосередкованим інгібуванням гастроінтестинальних протекторних простагландинів, контролем над вивільненням гістаміну, здатністю пригнічувати кислотну продукцію та оксидативний стрес, впливом на 5-ліпооксигеназу і блокуванням вироблення лейкотрієнів. Також німесулід характеризується низьким ризиком гастроінтестинальних ускладнень, які є одним з основних лімітуючих факторів при застосуванні НПЗП. Немає достовірних даних, що свідчать про істотні відмінності між селективними НПЗП щодо ризику розвитку серйозних ускладнень у ШКТ. Ретроспективний аналіз, проведений у Інституті ревматології РАМН, показав відсутність достовірних відмінностей між частотою діагностики при езофагогастродуоденоскопії виразок і ерозій у осіб із ревматичними захворюваннями (n=1172), які приймали целекоксиб, мелоксикам і німесулід. Водночас результати епідеміологічних досліджень (за типом випадок — контроль) свідчать, що целекоксиб щодо ризику розвитку ускладнень з боку ШКТ більш безпечний порівняно з мелоксикамом (Коваленко В.М., Борткевич О.П., 2010).
Значення медикаментозної форми НПЗП
Існує думка про безпеку тієї чи іншої форми НПЗП. Але це лише невірні переконання пацієнтів. Застосування НПЗП у свічках або у формі ін’єкцій не знижує ризику розвитку НПЗП-гастропатії. За даними літератури, НПЗП-гастропатії можуть розвиватися при застосуванні будь-яких лікарських форм. Застосування НПЗП у вигляді ретардних форм, кишково-розчинних таблеток і ректальних свічок не знижує ризику розвитку серйозних ускладнень з боку ШКТ. Це доведено в ретроспективних когортних дослідженнях. За даними Інституту ревматології РАМН, частота діагностики виразок шлунка і/чи дванадцятипалої кишки у хворих, які регулярно приймали НПЗП у формі свічок (n=382), становила 14,1%, у хворих (n=5721), які приймали НПЗП перорально, — 12,4% (р<0,05) (Насонов Е.Л и соавт., 2010).
Діагностика НПЗП-гастропатій
Найбільш високий ризик розвитку НПЗП-гастропатій — після початку прийому цих препаратів (до 3 міс), при більш тривалому прийомі ймовірність подібного ускладнення значно знижується. Часто перебіг НПЗП-індукованих виразок без суб’єктивних симптомів («німі виразки»). Цим самим вони стають ще більш небезпечні. Це «сурогатний маркер» небезпечних ускладнень, таких як шлунково-кишкові кровотечі. Згідно з даними кількох популяційних досліджень, у хворих, які пред’являють скарги на диспепсію і біль у шлунку, серйозні ускладнення з боку ШКТ діагностуються частіше, ніж у тих, хто не відчуває подібних неприємних відчуттів. НПЗП-індуковані виразки та ерозії не мають специфічних особливостей. Застосування НПЗП само по собі має вже знеболювальний ефект. Тому саме цей факт має насторожувати лікаря. Адже «німі виразки» без суб’єктивних симптомів часто можуть супроводжуватися серйозними побічними ефектами з боку ШКТ, а саме кровотечами та перфорацією. Тому пацієнтам, які тривало застосовують НПЗП (1–3 міс) та мають основні фактори ризику, незалежно від наявності клінічних ознак ураження ШКТ, показано проведення ендоскопічного дослідження. Вони потребують періодичного обстеження ШКТ(фіброгастродуоденоскопія) та протекторного впливу — поєднаного застосування інгібіторів протонної помпи. Співвідношення виразок шлунка та дванадцятипалої кишки у осіб із НПЗП-гастропатією становить 1,5/2,0:1, а поєднані виразки шлунка та дванадцятипалої кишки діагностують у ≈5% загальної кількості пацієнтів із НПЗП-індукованими виразками. Розмір НПЗП-індукованих виразок зазвичай невеликий, і лише у 20% хворих їх розмір досягає ≥10 мм. За даними спостережних досліджень і РКД, частота рецидивів НПЗП-індукованих виразок і множинних ерозій впродовж періоду спостереження ≥3–12 міс становить ≥40%. Основним та золотим стандартом діагностики або виключення НПЗП-гастропатії залишається езофагогастродуоденоскопія. Діагностовані цим методом виразки є прямим показанням до проведення відповідних лікувальних і профілактичних заходів. Допоміжним методом діагностики НПЗП-гастропатії є дослідження калу на приховану кров (Насонов Е.Л. и соавт., 2010).
Фактори ризику виникнення НПЗП-гастропатії
На думку провідних експертів, найважливіші фактори ризику НПЗП-гастропатії — наявність в анамнезі виразок, особливо ускладнених кровотечею чи перфорацією, літній вік (≥65 років), застосування НПЗП у високих дозах, ≥2 препаратів цієї групи (включаючи ацетилсаліцилову кислоту в низьких дозах), супутній прийом антикоагулянтів і ГК. Деякі автори виділяють також такі додаткові фактори ризику, як тютюнопаління, прийом алкоголю, наявність тяжких супутніх захворювань з боку серцево-судинної системи, наявність симптомів диспепсії, а також інфікованість H. руlori (табл. 10.5).
Таблиця 10.5
Фактори ризику виникнення НПЗП-гастропатії, на думку провідних експертів (Насонов Е.Л и соавт., 2010)
|
Lain L., 2004 |
Singh G., 2005 |
Lanas A., 2006 |
||
|
Основні |
Додаткові |
Певні |
Ймовірні |
|
|
Наявність виразки в анамнезі |
Прийом антикоагулянтів |
Літній вік |
Інфікованість H. руlori |
Виразкова кровотеча в анамнезі |
|
Літній вік |
Прийом одного НПЗП у високих дозах або декількох НПВП |
Наявність виразки в анамнезі |
Тютюнопаління |
Наявність виразки в анамнезі |
|
Прийом ацетилсаліцилової кислоти у низьких дозах |
Високі дози НПЗП |
Прийом алкоголю |
Вік >60 років |
|
|
Прийом ГК |
Прийом декількох НПЗП одночасно |
Прийом НПЗП у високих дозах |
||
|
Супутній прийом ГК |
Прийом ≥2 НПЗП, включаючи ацетилсаліцилову кислоту в низьких дозах |
|||
|
Супутній прийом |
Супутній прийом антикоагулянтів, ГК, антитромбоцитарних агентів |
|||
|
Коморбідні захворювання |
Інфекція H. руlori Диспепсія |
|||
Лікування при НПЗП-гастропатії
Тривалість курсової терапії має становити не менше 4 тиж, а при великих розмірах і локалізації виразок у шлунку — 8–12 тиж. Припинення прийому НПЗП у більшості хворих само по собі не приводить до рубцювання НПЗП-індукованих виразок, хоча може підвищувати ефективність противиразкової терапії. Інгібітори протонної помпи, такі як омепразол, ланзопразол, пантопразол, езомепразол, є препаратами вибору для лікування при НПЗП-гастропатії. Ефективні при НПЗП-індукованих виразках як дванадцятипалої кишки, так і шлунка і перевершують за своєю лікувальною дією блокатори Н2-рецепторів гістаміну та мізопростол. Інгібітори протонної помпи використовуються в стандартних терапевтичних дозах (наприклад омепразол 40 мг/добу), при цьому немає необхідності у відміні НПЗП та інших протиревматичних препаратів. Згідно з результатами клінічних досліджень (АSTROAUT, OMNIUM тощо), при призначенні інгібітору протонної помпи у стандартних дозах і продовженні прийому НПЗП протягом 8-тижневого терміну рубцювання НПЗП-індукованих виразок шлунка відбувається у >80%, а виразок дванадцятипалої кишки — у 90% хворих (Насонов Е.Л., Каратеев А.Е., 2000). Фактори, які знижують ефективність інгібітора протонної помпи — це великі розміри виразок у шлунку, тютюнопаління. У хворих, не інфікованих Н. руlori, противиразкова дія інгібітору протонної помпи набагато нижча, ніж у інфікованих. Супутній прийом високих доз ГК та цитотоксичних препаратів (таких як метотрексат) здатний уповільнити процес рубцювання НПЗП-індукованих виразок. На сьогодні немає даних, що підтверджують переваги якогось окремого препарату групи інгібіторів протонної помпи у лікуванні пацієнтів із НПЗП-гастропатією. Результати ряду відкритих і невеликих за масштабом РКД свідчать, що ефективність інгібіторів протонної помпи може бути підвищена шляхом їх комбінації з препаратами вісмуту. Ерадикація H. руlori, що проводиться в рамках стандартної противиразкової терапії, не прискорює загоєння НПЗП-індукованих виразок (Насонов Е.Л., Каратеев А.Е., 2000).
Профілактика НПЗП-гастропатії
Проведення активних профілактичних заходів показане перш за все пацієнтам, які мають фактори ризику НПЗП-гастропатії. Найважливіше значення має раціональне застосування НПЗП з урахуванням особливостей клінічної ситуації та фармакологічних властивостей ліків. НПЗП завжди слід призначати в мінімально оптимальних дозах, необхідних для досягнення терапевтичного ефекту, за можливості уникаючи поєднань із препаратами, здатними підвищити ризик розвитку ускладнень з боку ШКТ (низькі дози ацетилсаліцилової кислоти, антикоагулянти, ГК) та застосування НПЗП оптимально короткими курсами. Не слід перевищувати рекомендовані терапевтичні дози, а також комбінувати різні НПЗП (одночасне призначення пероральних і парентеральних форм). Немає даних про те, що певні харчові продукти (запивання таблеток молоком, киселем і т.п.), вживання фітопрепаратів здатні знизити ризик небезпечних ускладнень з боку ШКТ. Перед призначенням НПЗП завжди необхідно оцінити гастроінтестинальний ризик. Якщо пацієнт має фактори ризику НПЗП-гастропатії та потребує протизапальної і анальгезивної терапії, то призначення селективних НПЗП значно знижує ризик розвитку виразок, ерозій та їх ускладнень порівняно з неселективними НПЗП. Але ускладнення з боку ШКТ можуть виникати і при застосуванні селективних НПЗП, особливо у хворих, які мали в анамнезі серйозні ускладнення з боку ШКТ (кровотечі, перфорація, рецидивуючі виразки). Ризик розвитку шлунково-кишкових кровотеч у хворих, які мали цю патологію в анамнезі, на фоні прийому селективних НПЗП такий же, як і при застосуванні неселективних НПЗП у комбінації з інгібіторами протонної помпи. При високому ризику ускладнень (у пацієнтів, які мали в анамнезі шлунково-кишкові кровотечі або перфорації виразки, при рецидивуючих НПЗП-індукованих виразках, при поєднанні ≥2 факторів ризику) навіть на тлі прийому селективних НПЗП слід проводити медикаментозну профілактику НПЗП-гастропатії із застосуванням інгібіторів протонної помпи. На сьогодні доведено, що комбінація селективних НПЗП і інгібіторів протонної помпи більш безпечна в групах високого ризику порівняно з комбінацією неселективних НПЗП та інгібіторів протонної помпи. З метою профілактики НПЗП-гастропатії був спеціально створений препарат мізопростол (синтетичний аналог простагландину Е) — специфічний антагоніст негативної дії НПЗП на слизову оболонку шлунка. У ході масштабного дослідження протягом 6 міс МUСОSА (n=8000) показано, що цей препарат ефективний для профілактики розвитку і рецидивів НПЗП-індукованих виразок шлунка та/чи дванадцятипалої кишки і ерозій, а також шлунково-кишкових кровотеч і перфорації виразок. Мізопростол значно перевершує за профілактичною дією ранітидин і сукральфат. Існує чітка залежність між ефективністю профілактики і добовою дозою мізопростолу (200 мкг 4 рази > 200 мкг 3 рази > 200 мкг 2 рази на добу). У хворих, не інфікованих Н. руlori, мізопростол для профілактики рецидивів НПЗП-індукованих виразок набагато ефективніший інгібітор протонної помпи. Але мізопростол має багато небажаних ефектів (зокрема діарея), що виникають достовірно частіше, ніж при застосуванні інших гастропротекторів, а також незручну схему застосування. Центральне місце у профілактиці НПЗП-гастропатії нині зайняли інгібітори протонної помпи. Їх об’єднує здатність пригнічувати вироблення соляної кислоти і пепсину за рахунок впливу на парієтальні й обкладочні клітини шлунка. Тим самим вони зменшують пошкоджувальну дію кислотно-пептичного фактора — основного фактора «агресії» в патогенезі виразково-ерозивного ушкодження слизової оболонки верхніх відділів ШКТ. Зокрема ланзопразол підвищує оксигенацію слизової оболонки шлунка, стимулює вироблення бікарбонатів, що в поєднанні з пригніченням синтезу пепсину має виражену гастропротекторну дію, підвищуючи потенціал захисних факторів слизової оболонки шлунка, особливо при тривалій підтримувальній терапії. (Singh G., Triadafilopoulos S. et al., 2005). У клінічних дослідженнях показано, що високоселективні НПЗП (коксиби) більш безпечні й значно краще переносяться хворими з гастроінтестинальним ризиком порівняно з комбінацією диклофенаку та мізопростолу (Topol E.J., 2004; Викторов А.П., Проценко Г.А., 2006). На сьогодні інгібітори протонної помпи найбільш ефективні для профілактики розвитку і рецидивів НПЗП-індукованих виразок шлунка та/чи дванадцятипалої кишки і ерозій, а також шлунково-кишкових кровотеч. Інгібітори протонної помпи у змішаних групах хворих (інфікованих і неінфікованих H. руlori) так само ефективні для профілактики розвитку і рецидивів НПЗП-ндукованих виразок і ерозій, як мізопростол, і перевершують за ефективністю блокатори Н2-рецепторів гістаміну. Немає достовірних даних про можливість розвитку серйозних небажаних ефектів при тривалому застосуванні інгібіторів протонної помпи у хворих, які приймають НПЗП, і про переваги якогось окремого препарату групи інгібіторів протонної помпи. На відміну від мізопростолу і інгібіторів протонної помпи досі не доведено, що ризик розвитку шлунково-кишкових кровотеч і перфорації виразок знижується при застосуванні блокаторів Н2-рецепторів гістаміну (Каратеев А.Е., Насонова В.А., 2004). У III Маастрихтській угоді представлено сучасні уявлення про роль інфекції H. руlori у розвитку НПЗП-гастропатії і показання до проведення ерадикації у пацієнтів, які приймають НПЗП. Згідно з цими положеннями, НПЗП-гастропатія та шлунково-кишкові кровотечі можуть виникати і у пацієнтів, не інфікованих H. руlori, водночас ерадикація H. руlori до початку прийому НПЗП дозволяє істотно знизити ризик розвитку НПЗП-індукованих виразок, що показано у двох добре організованих РКД, проведених у Гонконзі. Однак, на відміну від звичайної (H. руlori-асоційованої) виразки, у разі розвитку НПЗП-гастропатії ерадикація H. руlori не дає суттєвої протирецидивної дії. Ерадикація H. руlori не прискорює загоєння НПЗП-індукованих виразок на тлі прийому антисекреторних противиразкових препаратів і не знижує ризик розвитку НПЗП-індукованих виразок, якщо її проводять у осіб, які вже приймають НПЗП. (Насонов Е.Л., Каратеев А.Е., 2000). Тому профілактичний прийом інгібіторів протонної помпи обов’язковий.
Диспепсія, асоційована із застосуванням НПЗП
Різні неприємні відчуття з боку верхніх відділів ШКТ без пошкодження слизової оболонки та ендоскопічно виявлені ураження є результатом застосування НПЗП. Епідеміологічні дослідження свідчать, що НПЗП викликають диспепсію набагато частіше, ніж препарати інших фармакологічних груп, такі як ГК, метилксантини, блокатори кальцієвих каналів та інгібітори ангіотензинперетворювального ферменту (АПФ). Серед хворих, які регулярно приймають НПЗП, диспепсія виникає у 20–40%, при цьому близько 10% пацієнтів переривають прийом НПЗП у зв’язку з розвитком неприємних симптомів з боку ШКТ. Патогенетично диспепсія пов’язана з контактною дією НПЗП. Ці препарати зумовлюють негативний вплив на мембрани епітеліоцитів, що призводить до зворотної дифузії іонів водню в слизову оболонку, з подальшим зниженням рН у підслизовому шарі, стимулюючи больові рецептори. У патогенезі диспепсії відіграє роль здатність НПЗП прискорювати або сповільнювати моторику ШКТ. Найчастіше пацієнти відзначають такі симптоми, як біль, відчуття печії і важкості в епігастральній ділянці, які пов’язують із прийомом НПЗП. Крім того, диспепсія погіршує якість життя пацієнтів із ревматичними захворюваннями і призводить до суттєвих матеріальних витрат через необхідність тривало приймати додатково препарати для купірування ускладнень і проводити різні високовартісні діагностичні процедури. За наявності ознак кишкової кровотечі та гіпоальбумінемії показане проведення діагностичних заходів, що дозволяють виявити патологію тонкої кишки. Використовують такі ендоскопічні методики: ентероскопію і капсульну ендоскопію, а також рентгенівську ентерографію. Порушення проникності стінки тонкої кишки виявляють методиками з використанням помічених молекул або еритроцитів, визначаючи в калі маркери клітинного запалення (наприклад кальпротектин). Ризик розвитку патології тонкої кишки підвищується за наявності дивертикулів, а також хронічних запальних захворювань кишечнику, таких як неспецифічний виразковий коліт і хвороба Крона (Насонов Е.Л., Каратеев А.Е., 2000).
Лікування та профілактика НПЗП-ентеропатії
Раціональне застосування НПЗП — основний метод профілактики НПЗП-ентеропатії. Необхідно обов’язково враховувати фактори ризику (літній вік, супутній прийом ГК, ацетилсаліцилової кислоти в низьких дозах та антикоагулянтів). Особливої обережності слід дотримуватися при призначенні НПЗП особам із хронічними запальними захворюваннями кишечнику, оскільки при хворобі Крона і неспецифічному виразковому коліті прийом неселективних НПЗП може спровокувати тяжку кишкову кровотечу і перфорацію. Згідно з даними серії РКД, застосування високоселективних НПЗП (зокрема целекоксибу) у зазначеного контингенту хворих достовірно знижує ризик розвитку чи рецидиву патології тонкої кишки. Відміна НПЗП здатна знизити ризик розвитку тяжких ускладнень і прискорити процес одужання, проте не приводить до зникнення всіх симптомів НПЗП-ентеропатії. Сульфасалазин і препарати вісмуту здатні зменшувати крововтрату, пов’язану з підвищенням проникності кишкової стінки на тлі прийому НПЗП. Застосування мізопростолу здатне знизити ризик розвитку серйозних ускладнень з боку тонкої кишки при тривалому прийомі НПЗП. Слід пам’ятати, що інгібітори протонної помпи не знижують ризику розвитку НПЗП-ентеропатії.
Застосування НПЗП і патологія товстого кишечнику
При тривалому прийомі НПЗП можливий розвиток патології товстого кишечнику, а саме розвиток ерозій, виразок, перфорації та стриктури товстої кишки, а також ускладнювати перебіг дивертикульозу кишечнику. На фоні прийому НПЗП можуть виникати загострення неспецифічного виразкового коліту і розвинутися коліт, що нагадує запальні захворювання кишечнику.
Ураження печінки, пов’язане із застосуванням НПЗП
Безсимптомне підвищення трансаміназ відзначають у 1–5% хворих, які регулярно приймають НПЗП. Клінічно виражені гепатотоксичні реакції (гострий лікарський гепатит) виникають рідко — близько 1 випадку на 10 тис. хворих, які регулярно приймають НПЗП. У патогенезі НПЗП-асоційованого ураження печінки обговорюють роль блокади ферментних систем циклу Кребса і роз’єднання окисного фосфорилювання (за типом синдрому Рея) в мітохондріях гепатоцитів, блокаду фосфодіестерази IV, порушення екскреції жовчі внаслідок утворення комплексів із жовчними кислотами і ентеропечінкової рециркуляції НПЗП, а також імунологічні порушення. Ураження печінки можуть супроводжувати холестатична жовтяниця чи фульмінантна печінкова недостатність, які здатні призвести до летального кінця. Викликати розвиток серйозних гепатотоксичних реакцій можуть усі НПЗП, включаючи селективні, однак найчастіше вони розвиваються при застосуванні суліндаку. В останні роки в медичній літературі з’явилися повідомлення про випадки розвитку тяжких ускладнень з боку печінки при застосуванні німесуліду. Однак слід зазначити, що, за даними клінічних та епідеміологічних досліджень, гепатотоксичність німесуліду не перевищує гепатотоксичності диклофенаку та ібупрофену. При призначенні НПЗП необхідно завжди враховувати відповідні фактори ризику. Ймовірними факторами ризику ураження печінки на тлі прийому НПЗП є жіноча стать, літній вік, патологія гепатобіліарної системи, тяжкі захворювання, що сприяють погіршенню кровотоку в печінці, поєднаний прийом препаратів, що впливають на метаболізм НПЗП, генетичні аномалії активності ферментів, що визначають біотрансформацію НПЗП та їх метаболітів, гіпоальбумінемія, підвищення активності АлАТ і АсАТ в анамнезі на тлі медикаментозної терапії. При виникненні клінічних ознак ураження печінки або істотних змін лабораторних показників слід негайно відмінити НПЗП. Лікування пацієнтів із гострим медикаментозним гепатитом проводять у спеціалізованому гастроентерологічному відділенні згідно зі стандартами терапії при цій патології. Доцільність призначення спеціальної терапії (у тому числі гепатопротекторів) при бессимптомному підвищенні активності трансаміназ досі не визначена (Насонов Е.Л., Каратеев А.Е., 2000; Chitturi S., Jacob G., 2002). Після початку прийому НПЗП протягом 8–12 тиж необхідно оцінити зміни функціональних ниркових проб.
Ураження серцево-судинної системи
Інша група небажаних побічних ефектів з боку ШКТ — ураження серцево-судинної системи. Прийом НПЗП може призводити до дестабілізації артеріальної гіпертензії, прогресування серцевої недостатності, а також асоціюватися з підвищенням ризику патології серця і судин (інфаркт міокарда, інсульт і раптова коронарна смерть) (Schjerning O. et al., 2011).
Застосування НПЗП і артеріальна гіпертензія
Прийом селективних і неселективних НПЗП може призводити до підвищення артеріального тиску, про це свідчать матеріали ряду РКД і дані метааналізу. Патогенетично гіпертензивний ефект НПЗП пов’язаний із пригніченням фільтрації та посиленням проксимальної канальцевої реабсорбції натрію, підвищенням позаниркової і внутрішньониркової судинної резистентності за рахунок інгібування синтезу простагландинів із вазодилатаційною активністю. Завдяки тому, що посилюється вивільнення норадреналіну з нервових закінчень і підвищується чутливість судинної стінки до дії вазоконстрикторних субстанцій, сповільнюється нирковий кровообіг і клубочкова фільтрація з активацією ренін-ангіотензинової та симпатичної систем, збільшується секреція ендотеліну-1. За даними метааналізу 54 досліджень, прийом неселективних НПЗП призводить до достовірного підвищення артеріального тиску у пацієнтів із артеріальною гіпертензією. За узагальненими даними 50 РКД прийом НПЗП призводить до підвищення артеріального тиску (в середньому на 5 мм рт. ст.), однак цей ефект більш виражений у пацієнтів, які вже отримували антигіпертензивну терапію, ніж в осіб із початково нормальним артеріальним тиском. Результати РКД свідчать, що індометацин, піроксикам і напроксен у середніх дозах та ібупрофен у високій дозі здатні знижувати ефективність блокаторів β-адренорецепторів, діуретиків, інгібіторів АПФ і меншою мірою — блокаторів повільних кальцієвих каналів.
Застосування НПЗП і ризик розвитку серцево-судинних ускладнень
Селективні НПЗП знижують ЦОГ-2-залежний синтез простагландину І2 клітинами судинного ендотелію, не впливаючи на ЦОГ-1-залежний синтез тромбоксану А2 тромбоцитами. Це може призводити до порушення балансу простагландину I2/тромбоксану А2 і до активації, агрегації та адгезії тромбоцитів і підвищення ризику судинного тромбозу. Перші дані щодо значимого підвищення частоти тромбозів при лікуванні рофекоксибом з’явилися в ході дослідження VIGOR (Kerr D.J. et al., 2007). У результаті дослідження APPROVe підтвердили цей факт, що стало підставою для призупинення випуску препарату. У дослідженні АРС, аналогічному APPROVe, встановлено залежне від дози підвищення частоти кардіоваскулярних ускладнень у пацієнтів, які отримували целекоксиб, однак цей факт не отримав підтвердження в ході досліджень РreSAP і АDAPT (Насонов Е.Л., 2010). У 2006 р. було представлено огляд когортних досліджень випадок — контроль, РКД, що стосуються застосування НПЗП для профілактики аденоматозного поліпозу кишечнику, і РКД, в яких порівнювали неселективні й селективні НПЗП у пацієнтів із ревматичними захворюваннями. Метааналіз результатів досліджень випадок — контроль (12 досліджень, n=311 599) не показав достовірного підвищення ризику виникнення інфаркту міокарда в осіб, які приймали НПЗП (Jüni P., Nartey L., 2004.). Результати аналізу трьох РКД профілактичного застосування целекоксибу, рофекоксибу і ацетилсаліцилової кислоти у пацієнтів з аденоматозним поліпозом товстої кишки (n=5365) свідчать про підвищення ризику у пацієнтів, які отримували будь-які з перерахованих препаратів. Матеріали тривалих РКД свідчать про абсолютне наростання частоти виникнення інфаркту міокарда у пацієнтів, які отримували селективні НПЗП порівняно з неселективними НПЗП, але тяжкі ускладнення з боку ШКТ виявляли значно частіше при прийомі неселективних НПЗП. Результати 62 досліджень (n=94 599) показали, що в цілому частота інфаркту міокарда була вищою на фоні прийому селективних НПЗП, ніж неселективних НПЗП, але достовірне підвищення ризику відзначено лише при прийомі рофекоксибу (Насонов Е.Л., 2010). У осіб із кардіоваскулярною патологією часто супутньо відзначають ОА, для лікування якого застосовують НПЗП. Щодо застосування у цих хворих німесуліду, то такі властивості, як активація синтезу інгібітора тканинного активатора плазміногену, блокування синтезу тромбоцитактивуючого фактора, є надзвичайно важливими в запобіганні тромбемболічним ускладненням. Підвищення ризику серцево-судинних захворювань можна розглядати як класспецифічний побічний ефект усіх НПЗП. Однак прийом НПЗП підвищує ймовірність розвитку зазначених патологій набагато менше, ніж інші традиційні фактори ризику кардіоваскулярних ускладнень (Jun-Yan Liu et al., 2010).
Щодо подальшого застосування препарату рофекоксиб, то рішенням засідання розширеної робочої групи АРУ (Дніпропетровськ, 3 листопада 2004 р., Вікторов О.П., Проценко Г.О.) було рекомендовано провести доповнення та уточнення до інструкції для медичного застосування та в листок-вкладиш у розділі «Дозовий режим» — обмежити діапазон разової добової дози 25 мг, обмежити курс призначення препарату до 6 тиж, в розділі «Протипоказання» включити групи ризику осіб з артеріальною гіпертензією, ішемічною хворобою серця, застійною серцевою недостатністю, а також пацієнтів, які перенесли інфаркт міокарда, інсульт, хворих із порушенням мозкового кровообігу, прогресуючими формами атеросклерозу, вікові групи хворих віком ≥70 років. Слід підкреслити, що рекомендації АРУ (листопад 2004 р.), а потім експертів ДФЦ МОЗ України згодом співпали з висновками, до яких прийшли (грудень 2004 — січень 2005 р.) згодом національні служби охорони здоров’я та міжнародна організація (табл. 10.6). Так, у грудні 2004 р. FDA затвердила нові рекомендації щодо безпеки НПЗП — рофекоксиб, вальдекоксиб, целекоксиб і напроксен:
- Оцінюючи показники користь/ризик при медичному застосуванні препаратів целекоксибу і вальдекоксибу, лікар має враховувати нові дані щодо ускладнень, які викликають ці препарати.
- Особам із підвищеним ризиком шлунково-кишкових кровотеч, непереносимістю НПЗП неселективної дії рекомендовано призначити селективні інгібітори ЦОГ-2.
- Питання щодо виникнення серцево-судинних та інших ускладнень, пов’язаних із НПЗП, має вирішуватися з урахуванням індивідуальних особливостей хворого.
- Пацієнти повинні застосовувати НПЗП та інші безрецептурні лікарські засоби відповідно до інструкції. У разі застосування НПЗП >10 діб, необхідно проконсультуватися з лікарем.
Таблиця 10.6
Висновки FDA (07.04.2005 р.) і ЕМЕА (17.02.2005 р.) щодо вибору пацієнтів для призначення селективних інгібіторів ЦОГ-2 (Вікторов О.П., Проценко Г.О., 2006)
|
Показник |
FDA |
EMEA |
|
Вибір пацієнтів для призначення селективних препаратів ЦОГ-2 |
Висока ймовірність гастроінтестинальних кровотеч, непереносимість або неефективність неселективних НПЗП в анамнезі |
|
|
Дозування |
Мінімальні ефективні дози |
|
|
Тривалість безперервного застосування |
Мінімально можливий курс |
|
|
Протипоказання до застосування селективних ЦОГ-2 |
Врахування співвідношення користь/ризик для конкретного пацієнта. Підвищення кардіоваскулярного ризику визнано характерною особливістю цих лікарських засобів |
Пацієнтам з ішемічною хворобою серця чи інфарктом міокарда. Застереження пацієнтам із артеріальною гіпертензією, гіперліпідемією, цукровим діабетом, цереброваскулярними порушеннями, порушеннями гомеостазу |
Зокрема, за результатами вивчення питань серцево-судинної безпеки НПЗП, 07.04.2005 р. FDA прийшла до таких висновків: усі НПЗП можуть підвищувати ризик кардіоваскулярних захворювань.
Тому при призначенні НПЗП необхідно рекомендувати лікарям відповідних профілів керуватися такими правилами:
- Застосування всіх НПЗП протипоказане хворим, які недавно перенесли аортокоронарні шунтування.
- Групами підвищеного ризику також є пацієнти з ішемічною хворобою серця (зі стенокардією чи перенесеним інфарктом міокарда) та цереброваскулярними захворюваннями (перенесли інсульт або з епізодами коронаротромбозу).
- Усі селективні НПЗП та інгібітори ЦОГ-2 слід застосовувати в найнижчих ефективних дозах протягом якомога коротшого часу залежно від завдань лікування кожного конкретного пацієнта.
- Рішення про призначення препаратів приймає лікар, обґрунтовуючи його результатами оцінки серцево-судинного ризику у конкретного пацієнта.
Застосування НПЗП і ризик розвитку серцевої недостатності
Застосування НПЗП підвищує ризик розвитку та декомпенсації застійної серцевої недостатності. За даними популяційних досліджень, ризик госпіталізацій із приводу серцевої недостатності значно зростає у пацієнтів, які вперше почали приймати неселективні НПЗП і рофекоксиб, але не целекоксиб (Насонов Е.Л., 2010).
Профілактика серцево-судинних ускладнень, пов’язаних із прийомом НПЗП
Актуальним питанням, яке досі обговорюється в контексті призначення НПЗП, є взаємодія протизапальних препаратів та низьких доз ацетилсаліцилової кислоти при одночасному їх призначенні з метою як первинної, так і вторинної профілактики тромбоемболічних ускладень (інфаркту міокарда, гострого порушення мозкового кровообігу) (Strand V., 2007). Досить типовою є ситуація в повсякденній клінічній практиці, коли пацієнту з ураженням опорно-рухового апарату (артритом чи артрозом) та супутньою серцево-судинною патологією чи підвищеним ризиком виникнення небажаних серцево-судинних подій ці два препарати призначаються одночасно. Враховуючи належність до однієї групи, а також потенційно спільні механізми дії, фахівці активно вивчали питання клінічної взаємодії у клінічних та експериментальних дослідженнях. (Buring J.E., Gaziano J.M., 2004).
Прийом ацетилсаліцилової кислоти у низьких дозах сприяє як вторинній профілактиці серцево-судинних подій, так і первинній профілактиці інфаркту міокарда, що доведено рядом тривалих клінічних проспективних досліджень. Основним продуктом ЦОГ-1 у тромбоцитах є рівень тромбоксану А2 — потенційного вазоконстриктора, синтез якого за умови блокування ЦОГ-1 знижується, що, у свою чергу, викликає пригнічення активності тромбоцитів. (Hayden M. еt al., 2002). Особливою ознакою ацетилсаліцилової кислоти є те, що незважаючи на досить короткий період напіввиведення препарату, її антитромботичний ефект є незворотним і поширюється на весь життєвий період тромбоцитів, який триває від 7–10 днів, оскільки після разового впливу ацетилсаліцилової кислоти тромбоцити вже не здатні повторно ресинтезувати ЦОГ-1. Унікальною фармакокінетичною властивістю ацетилсаліцилової кислоти є також і те, що всмоктуючись у верхніх відділах ШКТ, вона впливає на практично весь пул циркулюючих тромбоцитів. Таким чином абсорбція 100 мг ацетилсаліцилової кислоти майже повністю пригнічує активність тромбоцитарної ЦОГ-1. Ацетилсаліцилова кислота швидко метаболізується в печінці й має короткий період напіввиведення — від 15 до 20 хв. Отже, пригнічувальна здатність може бути оцінена вже через 5 хв після прийому, сягаючи максимуму через 1 год. Водночас ацетилсаліцилова кислота є відносно слабким інгібітором агрегації тромбоцитів. Тромбоцити на фоні прийому ацетилсаліцилової кислоти можуть бути активовані також цілим переліком потенційних агоністів, здатних посилювати ступінь їх агрегації. Таким чином, функціональні властивості тромбоцитів пригнічуються досить помірно, чим пояснюються нечасті випадки кровоточивості на фоні прийому ацетилсаліцилової кислоти (Patrono C. et al., 2004). Хоч неселективні НПЗП також здатні пригнічувати активність ЦОГ-1, що, в свою чергу, мало б приводити до антитромботичної активності та профілактики розвитку серцево-судинних явищ, але на відміну від ацетилсаліцилової кислоти, неселективні НПЗП здатні лише зворотно зв’язувати активну сторону ізоферменту, зазвичай пригнічуючи синтез тромбоксану тромбоцитами у ступінь, що легко компенсується тромбоцитами по закінченню дозового інтервалу впливу засобу. Отже, кардіопротекторні властивості як неселективних НПЗП, так і інгібіторів ЦОГ-2, не є досить стійкими і достатньо вираженими. Висловлено припущення про ймовірну здатність напроксену відрізнятися від інших представників НПЗП, у функціонально достатній мірі пригнічуючи активність ЦОГ-1 поза межами дозового інтервалу (Van H.А. et al., 2000). Проте недостатньо свідчень на користь того, що напроксен наділений кардіопротекторними властивостями.
Отже, останній наведений факт є ще одним підтвердженням того, що пацієнти, які приймають НПЗП із кардіопротекторною метою, вимушені приймати ацетилсаліцилову кислоту в низьких дозах. Водночас і ацетилсаліцилова кислота, і неселективні НПЗП поділяють один і той самий локус ізоферменту, що стало основою гіпотези про ймовірність конкурентного взаємовпливу цих лікарських засобів. У подальшому цей факт був підтверджений результатами низки фундаментальних експериментальних та клінічних досліджень. Так, у перехресному дослідженні (Cattella-Lawson F. et al., 2001) одночасне застосування 400 мг ібупрофену призводило до антагоністичного впливу на незворотний антитромботичний ефект, що мав би виникати в результаті застосування 81 мг ацетилсаліцилової кислоти. Такого впливу можна було уникнути за рахунок прийому спочатку (за 2 год раніше) ацетилсаліцилової кислоти і лише потім — разової дози ібупрофену. Проте у разі застосування ібупрофену 3 рази на добу, пригнічення антитромботичної активності ацетилсаліцилової кислоти, що призначалася у кислотостійкій кишково-розчинній формі, спостерігалося незалежно від черговості прийому лікарських засобів. В останньому випадку антитромботичні ефекти ацетилсаліцилової кислоти були повністю нівельовані в результаті пролонгованого застосування ібупрофену в мультидозах. Таким чином одночасний прийом ібупрофену та ацетилсаліцилової кислоти призводить до достовірної втрати клінічної ефективності останнього. Водночас застосування ретардної форми диклофенаку 2 рази на добу не змінювало пригінічувального впливу ацетилсаліцилової кислоти на тромбоцити. Така взаємодія гіпотетично може виникати внаслідок нижчого потенціалу та більш короткого періоду дії диклофенаку. Іншою альтернативною гіпотезою може бути те, що диклофенак та ібупрофен у різний спосіб заважають ацетилсаліциловій кислоті досягнути залишку ЦОГ-1. У цьому ж дослідженні встановлено особливості впливу парацетамолу на функцію ЦОГ. Так, виявлено, що парацетамол (препарат широко рекомендований для застосування у хворих на ОА колінних та кульшових суглобів як препарат першої лінії) у дозі 1000 мг/добу є слабким та зворотним інгібітором ЦОГ, який не здатний пригнічувати функції тромбоцитів. Отже, цілком очевидно, що одночасне застосування ацетилсаліцилової кислоти та парацетамолу не впливало на рівень пригнічення ацетилсаліциловою кислотою тромбоксану в сироватці крові та на пригнічення агрегації тромбоцитів. Цілком очікуваним було те, що рофекоксиб (як представник класу селективних інгібіторів) не впливав на ефективність ацетилсаліцилової кислоти у разі їх одночасного застосування, оскільки коксиби є представниками особливого класу НПЗП, здатними до зв’язку лише з гідрофобними каналами, присутніми у ЦОГ-2. Аналогічні дані, що стосувалися вивчення особливостей взаємодії окремих НПЗП, отримано і в іншому дослідженні, проведеному в Шотландії. У дослідження було включено 7107 пацієнтів, які звернулися за медичною допомогою з приводу захворювань серцево-судинної системи і в подальшому спостерігалися протягом 8 років. Автори проводили порівняння між 4 групами: 1) ті, які приймали лише ацетилсаліцилову кислоту (в дозі 325 мг/добу); 2) пацієнти, які отримували ацетилсаліцилову кислоту + ібупрофен; 3) група хворих, які отримували ацетилсаліцилову кислоту + диклофенак; 4) ацетилсаліцилова кислота + інші НПЗП. У результаті виявлено, що порівняно з прийомом лише ацетилсаліцилової кислоти у групі хворих, які приймали одночасно ацетилсаліцилову кислоту та ібупрофен, відносний ризик смертності від серцево-судинних подій становив 1,73 (95% ДІ 1,05–2,84). У двох інших групах одночасного комбінованого прийому ацетилсаліцилової кислоти і диклофенаку та ацетилсаліцилової кислоти й інших НПЗП підвищення такого ризику не виявлено. Серед обмежень цього дослідження автори відзначили неможливість врахування/контролю таких потенційно важливих факторів, як тютюнопаління та фізична активність учасників. Цікаві результати отримано у субаналізі, проведеному за даними 5-річного рандомізованого подвійного сліпого плацебо-контрольованого дослідження з вивчення ефективності 325 мг ацетилсаліцилової кислоти за участю 22 071 учасника (Kurth T. et al., 2003). Перевагою цього дослідження була не лише значна кількість учасників, а й наявність численних кінцевих точок, рандомізація щодо застосування ацетилсаліцилової кислоти, проспективний збір даних щодо прийому НПЗП, а також підтвердження (записи) розвитку серцево-судинних подій (інфаркту міокарда) в анамнезі. Детальне описання прийому НПЗП дозволило згрупувати пацієнтів на тих, які приймали НПЗП періодично та постійно. У результаті виявлено, що постійний прийом НПЗП (>60 днів/рік) асоціювався з підвищенням ризику розвитку інфаркту міокарда. Нерегулярний прийом НПЗП (від 1 до 59 днів/рік) не призводив до підвищення ризику інфаркту міокарда порівняно з групою пацієнтів, які не приймали НПЗП.
На основі отриманих результатів висловлено припущення, що рівень блокування НПЗП ЦОГ-1-інгібуючої активності ацетилсаліцилової кислоти залежить від рівня, з яким той чи інший НПЗП здійснює пригнічення активності ЦОГ-1. Отже, чим більшою є селективність субстрату щодо ЦОГ-2, тим нижчим є шанс блокування антитромбоцитарного впливу ацетилсаліцилової кислоти (табл. 10.7).
Таблиця 10.7
Спосіб зв’язку та рівні ЦОГ-2-селективності окремих представників групи НПЗП (Коваленко В.М., Борткевич О.П., 2010)
|
Препарат |
Спосіб зв’язку |
ЦОГ-2-селективність (середнє значення) |
|
| ЦОГ-1 | ЦОГ-2 | ||
|
Незворотний |
Зворотний |
0,017 |
|
|
Зворотний |
Зворотний |
0,38 |
|
|
Зворотний |
Зворотний |
6,4 |
|
|
Зворотний |
Зворотний |
7,0 |
|
|
Зворотний |
Незворотний |
29 |
|
|
Зворотний |
Незворотний |
130 |
|
|
Луміракоксиб |
Відсутні дані |
Відсутні дані |
1200 |
Дослідження, проведене van J. Ryn та співавторами, було присвячене вивченню фармакодинамічних взаємодій у пацієнтів, які приймали одночасно мелоксикам (у дозі 1 мг/добу) та ацетилсаліцилову кислоту (у дозі 100 мг/добу) (van Ryn J. et al., 2004). Мелоксикам — НПЗП з ЦОГ-2-інгібуючими властивостями, має широкий спектр показань до застосування (доведена ефективність при РА, ОА та АС), наділений одночасно досить сприятливим гастроінтестинальним профілем токсичності (Zeidler H. et al. 2002). Варто відзначити, що мелосикам має ЦОГ-1-інгібуючу здатність, яка є виключно дозозалежною, але у рекомендованих для терапевтичного застосування дозах препарат не здатний ані пригнічувати агрегацію тромбоцитів, ані подовжувати протромбіновий час. Результати проведеного дослідження свідчать, що комбінована терапія ацетилсаліциловою кислотою та мелоксикамом у вищезазначених дозових режимах протягом 7 днів асоціювалась з однаковим рівнем пригнічення тромбоцитів, а рівні антитромбоцитарного ефекту ацетилсаліцилової кислоти як у разі відсутності, так і за наявності мелоксикаму були аналогічними (van Ryn J. et al., 2004).
Питанню оптимізованого та індивідуалізованого підходу до призначення НПЗП присвячена також ціла низка досліджень. Так, при використанні системи оцінки ризику гаcтроінтестинальних подій — SCORE (Stanford Calculator of Risk for Events) — лише на основі відповіді на 4 звичайних питання, підрахувавши суму балів, можна легко визначити ризик несприятливих гастроінтестинальних явищ протягом найближчого року. Отриманий результат стає основою для визначення особливостей призначення протизапальних засобів у пацієнтів із ревматичними захворюваннями (Ambegaonkar A. et al., 2004).
Отже, при призначенні НПЗП, необхідно врахувати гастроінтестинальний та серцево-судинний ризики у осіб із ревматичними захворюваннями. Лікарям слід здійснити нелегкий вибір на користь того чи іншого представника класу НПЗП. Вибір останнього, враховуючи спектр можливих небажаних побічних явищ, часто носить характер найменшого зла — співвідношення між ефективністю та ймовірними побічними явищами.
Раціональне застосування НПЗП, яке враховує особливості клінічної ситуації та наявність супутніх захворювань серцево-судинної системи, — основний метод профілактики кардіоваскулярних ускладнень у осіб із ревматичними захворюваннями. Пацієнтам із високим ризиком кардіоваскулярних ускладнень можна призначати НПЗП лише за суворими показаннями і під ретельним медичним контролем. У цього контингенту хворих доцільно проводити моніторування кардіоваскулярних ускладнень (особливо контроль артеріального тиску) протягом усього періоду прийому НПЗП. Ризик серцево-судинних ускладнень істотно підвищується при тривалому прийомі НПЗП у високих дозах, тому не слід застосовувати ці препарати в дозах, що перевищують рекомендовані. За наявності факторів ризику серцево-судинних ускладнень на тлі прийому НПЗП необхідно призначати ацетилсаліцилову кислоту в низьких дозах. Важливо відзначити, що за даними експериментальних досліджень, деякі НПЗП (ібупрофен, напроксен, індометацин) можуть конкурувати з ацетилсаліциловою кислотою за зв’язування з активним центром ЦОГ-1 і блокувати його антиагрегантну дію. Ці дані підтверджують результати епідеміологічного дослідження з використанням бази даних California Medicade за 1999–2004 рр. Показано, що застосування ацетилсаліцилової кислоти знижує ризик розвитку інфаркту міокарда на тлі лікування рофекоксибом, целекоксибом, мелоксикамом, водночас не відзначено позитивного впливу прийому ацетилсаліцилової кислоти на ризик розвитку інфаркту міокарда у осіб, які приймали індометацин та ібупрофен. При виборі НПЗП для лікування хворих із підвищеним ризиком кардіоваскулярних ускладнень слід мати на увазі, що деякі НПЗП (целекоксиб і, ймовірно, напроксен) рідше викликають кардіоваскулярні побічні ефекти, ніж інші НПЗП (диклофенак, ібупрофен) і в цій ситуації більш доцільні (Насонов Е.Л., 2010; Schjerning O. et al., 2011). Дані щодо призначення НПЗП у хворих із різним рівнем ризику гастроінтестинальних та кардіоваскулярних ускладнень наведено в табл. 10.8.
Таблиця 10.8
Консенсус ACC/ACG/AHA (Американське товариство кардіологів/Американське товариство гастроентерологів/Американська асоціація серця, 2008)
|
Ризик |
Ризик розвитку ускладнень у верхніх відділах ШКТ |
||
| Низький (<0,2%/г) | Помірний (0,2–0,5%/г) | Високий (>0,5%/г) | |
|
Низький (<1%/г) |
НПЗП |
Інгібітори ЦОГ-2 |
Інгібітори ЦОГ-2 + інгібітори протонної помпи |
|
Помірний (1–3%/г) |
НПЗП або інгібітори ЦОГ-2 ± ацетилсаліцилова кислота у низьких дозах |
Інгібітори ЦОГ-2 ± ацетилсаліцилова кислота у низьких дозах ± інгібітори протонної помпи |
Інгібітори ЦОГ-2 ± ацетилсаліцилова кислота у низьких дозах + інгібітори протонної помпи |
|
Високий (>3%/г) |
Інгібітори ЦОГ-2 + ацетилсаліцилова кислота в низьких дозах |
Інгібітори ЦОГ-2 + ацетилсаліцилова кислота у низьких дозах ± інгібітори протонної помпи |
Інгібітори ЦОГ-2 + ацетилсаліцилова кислота у низьких дозах + інгібітори протонної помпи |
Ураження нирок
Потенційно шкідливу дію НПЗП на функцію нирок спричиняють електролітні й водні порушення, інтерстиціальний нефрит і папілярний некроз.
У більшості випадків порушення виявляють у вигляді зниження клубочкової фільтрації з виникненням набряків, незначним підвищенням рівня креатиніну і сечовини в сироватці й гіперкаліємією. Фактори ризику ураження нирок внаслідок застосування НПЗП — літній вік (старше 65 років), прихована ниркова недостатність, застійна серцева недостатність, цироз печінки, застосування діуретиків, дегідратація і зниження артеріального тиску, а також застосування деяких лікарських засобів, включаючи діуретики, аміноглікозиди, циклоспорин, інгібітори АПФ. Порушувати функцію нирок однаковою мірою можуть селективні та неселективні НПЗП. За даними метааналізу, опублікованого в 2006 р., який включав дані 114 РКД (n=116 094), прийом рофекоксибу призводив до наростання ризику ниркових побічних ефектів, у тому числі периферичних набряків, порушень функції нирок. Навпаки, на тлі прийому целекоксибу помірно знижувався ризик порушення функції нирок і розвитку артеріальної гіпертензії. Таку форму ниркової патології, як «анальгетична нефропатія», пов’язують із тривалою ішемією, зумовленою інгібуванням синтезу простагландинів, що призводять до розширення судин. Таке ускладнення розвивається при багаторічному безперервному застосуванні НПЗП, супроводжується повільно прогресуючим некрозом сосочків нирок. Порушення концентраційної функції нирок — основного компоненту анальгетичної нефропатії. У фінальній стадії розвивається хронічна ниркова недостатність (Whelton A., 2001). Пацієнтам із нирковою недостатністю помірного і тяжкого ступеня чи іншими факторами ризику гострої ниркової недостатності необхідно уникати прийому як неселективних НПЗП, так і селективних інгібіторів ЦОГ-2 або застосовувати їх з особливою обережністю. (Ahmad S.R. et al., 2000; Perazella M.A., Eras J., 2000).
Застосування НПЗП і патологія легень
Тривале застосування НПЗП також впливає і на розвиток побічних явищ з боку легеневої системи. У 10–20% пацієнтів із бронхіальною астмою спостерігають гіперчутливість до ацетилсаліцилової кислоти та НПЗП. Це призводить до тяжких загострень астми. Раніше цю патологію називали «аспірин-індукованим респіраторним захворюванням». Нині її класифікують як обтяжене ацетилсаліциловою кислотою респіраторне захворювання. Це визначення пов’язане з розвитком хронічного запалення слизової оболонки верхніх і нижніх дихальних шляхів, синуситу, носового поліпозу і астми. В осіб із поєднанням ревматичного захворювання з бронхіальною астмою віддають перевагу німесуліду, мелоксикаму, целекоксибу, оскільки вони значно рідше викликають це ускладнення (Насонов Е.Л., 2010; Кліппел Дж., 2011).
Застосування НПЗП і репарація переломів
Мало клінічних даних, що стосуються впливу НПЗП на зрощення переломів кісток скелета. Попередні результати свідчать про негативний вплив неселективних НПЗП на загоєння переломів хребта і про відсутність такого у селективних НПЗП. До отримання більш доказових даних все ж слід рекомендувати за можливості обмежувати тривале застосування НПЗП для анальгезії у пацієнтів із переломами кісток.
Застосування НПЗП у період вагітності та годування грудьми
ЦОГ бере участь у регуляції процесів овуляції, тому згідно з теоретичними положеннями та експериментальними даними, прийом НПЗП (як неселективних, так і селективних) може запобігати або сповільнювати овуляцію. Неселективні НПЗП не мають тератогенного ефекту, за наявності серйозних показань їх можна застосовувати у І і ІІ триместр вагітності. Оскільки дані, що стосуються застосування у вагітних селективних НПЗП, відсутні, ці препарати не слід використовувати в період вагітності. Оскільки через 20 тиж після гестації будь-які НПЗП (крім ацетилсаліцилової кислоти в низьких дозах) можуть викликати спазм артеріальної протоки і порушення функції нирок у плода, в цей період будь-які НПЗП (за винятком ацетилсаліцилової кислоти в низьких дозах) слід відмінити. Застосування НПЗП у жінок, які годують грудьми, небажане. За наявності серйозних показань дозволено застосовувати ібупрофен, індометацин, диклофенак, напроксен, піроксикам. Слід враховувати, що годування грудьми відразу після прийому НПЗП знижує ризик надходження препарату в грудне молоко.
Взаємодія НПЗП з іншими препаратами
Оскільки НПЗП метаболізуються в печінці й переробляються мікросомальною оксидазною системою, яка містить цитохром Р450, при їх застосуванні слід очікувати взаємодії лікарських засобів. У терапії пацієнтів із ревматичними захворюваннями найчастіше поєднуються коморбідні стани, тому потрібно враховувати медикаментозну взаємодію, особливо з непрямими антикоагулянтами, діуретиками, блокаторам β-адренорецепторів, інгібіторами АПФ, солями літію (табл. 10.9).
Таблиця 10.9
Медикаментозна взаємодія НПЗП з іншими препаратами, що має клінічне значення (Насонов Е.Л. и соавт., 2010)
|
Препарат |
НПЗП |
Механізм |
Ефект |
|
Антациди, блокатори Н2-рецепторів гістаміну: циметидин, алюмінію оксид |
Дифлунісал |
Зниження метаболізму Утворення комплексу Утворення комплексу Утворення комплексу |
Посилення ефекту Зниження біодоступності 40% Зниження біодоступності 40% Зниження абсорбції |
|
Антибіотики: гентаміцин |
Пригнічення кліренсу |
Підвищення концентрації на 17–46% |
|
|
Антикоагулянти: варфарин |
Фенілбутазон Дифлунісал |
Пригнічення метаболізму варфарину Витіснення з місця зв’язування з білком Те ж |
Підвищення протромбінового індексу Підвищення концентрації вільного варфарину Те ж |
|
Антиконвульсанти: фенобарбітал, фенітоїн |
Фенопрофен Фенілбутазон |
Підвищення метаболізму Підвищення кліренсу фенітоїну Зниження кліренсу фенітоїну |
Немає даних Підвищення концентрації на 200% Підвищення концентрації |
|
Дифлунісал |
Підвищення глюкуронідації саліцилатів Те ж |
Підвищення кліренсу саліцилатів Підвищення кліренсу дифлунісалу |
|
|
Толбутамід |
Збільшення вільної фракції толбутаміду |
Гіпоглікемія |
|
|
Суліндак |
Пригнічення Р450-залежного метаболізму |
Підвищення концентрації циклоспорину на 200% |
|
|
Невідомий Невідомий |
Підвищення концентрації дигоксину Підвищення концентрації індометацину |
||
|
Зниження кліренсу метотрексату |
Токсичність |
||
|
Підвищення кліренсу саліцилатів |
Зниження концентрації саліцилатів |
Застосування місцевих форм
Місцеві форми застосовують у комплексній терапії. Місцеві форми НПЗП широко використовуються у повсякденній медичній практиці й надзвичайно популярні серед пацієнтів із захворюваннями опорно-рухового апарату. Спектр показань для застосування місцевих НПЗП досить широкий: запальні та дегенеративні захворювання суглобів і хребта, травматичні ураження суглобів та періартикулярних тканин, радикуліт, невралгія, тромбофлебіт тощо (Коваленко В.М., Борткевич О.П., 2010). На сьогодні арсенал місцевих препаратів (креми, гелі, мазі, аерозолі, пластирі), що містять той чи інший НПЗП, є надзвичайно великим. Вже традиційно й абсолютно небезпідставно вважається, що аплікаційні форми НПЗП більш безпечні порівняно з їх аналогами для перорального та парентерального застосування, оскільки характеризуються достатніми місцевим протизапальним й анальгезивним впливами, що поєднуються зі сприятливим профілем токсичності за рахунок мінімізації системного всмоктування. Так, на порядок менший рівень потрапляння лікарського засобу до загальному кровотоку асоціюється з меншим накопиченням препарату у органах, чутливих до негативного впливу НПЗП. Окрім того, використання сучасних мазей, кремів та гелів прийнятне у будь-якому віці, за наявності супутньої патології, а у разі проведення комбінованої терапії існує реальна можливість знизити дозу НПЗП, що приймає пацієнт перорально чи парентерально. Серед основних вимог, яким має відповідати лікарський засіб, що містить НПЗП, слід виділити такі (Муравьев Ю.В., 2003): препарат, що використовується місцево, має бути ефективним; зазначена форма лікарського засобу не повинна викликати місцевих токсичних та алергічних реакцій; діюча речовина має досягати органів-мішеней; концентрація препарату в плазмі крові не повинна досягати рівня, що призводить до розвитку залежних від дози побічних явищ; метаболізм та виведення місцевого засобу мають бути аналогічними до тих, що характерні для його системного застосування.
За результатами деяких порівняльних досліджень не виявлено суттєвої різниці при аналізі ефективності застосування окремих місцевих і таблетованих форм НПЗП (Sandelin J. et al., 1997). Метааналіз ефективності НПЗП для місцевого застосування (кетопрофену, ібупрофену, піроксикаму, індометацину та бензидаміну), проведений R.A. Moore та співавторами (1998), який включив дані 86 клінічних досліджень різних мазей та гелів у 10 160 пацієнтів, виявив значну перевагу місцевих НПЗП над плацебо у 2-тижневій терапії як при гострих станах (травма, розтягнення зв’язок тощо), так і хронічній артропатії. Одним із факторів, який аналізувався у цьому метааналізі, була кількість хворих (із гострим та хронічним болем з боку опорно-рухового апарату), яких необхідно пролікувати місцевими НПЗП, щоб досягти позитивного результату (зниження інтенсивності болю на 50%) у одного препарату, за відсутності того самого ефекту у плацебо (Number Needed to Treat). Продемонстровано, що найменша кількість хворих виявилася для кетопрофену, дещо більшою вона була для ібупрофену та піроксикаму. Водночас індометацин та бензидамін за аналогічним показником не відрізнялися від плацебо. Аналогічні дані продемонстровані Н.В. Чічасовою (2001) в ході оцінки впливу різних протизапальних препаратів для місцевого застосування на вираженість болю при ураженні суглобів та хребта. Згідно з отриманими даними зроблено висновок, що ступінь впливу окремих місцевих НПЗП на больовий синдром при ураженні суглобового апарату є зіставним, але незначна перевага продемонстрована при використанні гелю та крему кетопрофену. У пізніше проведеному метааналізі (Мason L. et al., 2004) проаналізовано ефективність 7-денної терапії місцевими формами НПЗП у дорослих із гострим больовим синдромом. У ході аналізу виявлено 26 РКД, в які увійшли 2853 пацієнти, які відповідали необхідним вимогам метааналізу. Так, у 19 із 26 вибраних досліджень місцеві форми НПЗП були ефективніші за плацебо, а в 3 інших (n=433 пацієнти), в яких проводилося порівняння місцевих та пероральних форм НПЗП, не виявлено суттєвої різниці між обома формами препаратів. Непряме порівняння окремих місцевих НПЗП продемонструвало, що кетопрофен був достовірно кращим за інші НПЗП для місцевого застосування, водночас місцеві форми індометацину за ефективністю майже не відрізнялися від плацебо. Місцеві та системні побічні явища, що відзначалися рідко, не відрізнялися між групами пацієнтів, які використовували місцеві НПЗП чи плацебо. В результаті автори дійшли висновку, що 7-денна терапія НПЗП для місцевого застосування ефективна і має сприятливий профіль токсичності в терапії при гострих больових станах.
Для досягнення оптимальної ефективності від застосування будь-якої місцевої форми НПЗП слід керуватися такими принципами (Чичасова Н.В., 2001): враховувати характер ураження суглобів та періартрикулярних тканин. Так, для лікування при артриті, тендосиновіті, міозиті, флебіті використовують мазі та гелі, що містять НПЗП або їх комбінацію з місцевими формами, що містять гепарин. При больових синдромах, пов’язаних із механічним ураженням нервових корінців та периферичних нервів, застосовують препарати, що місять подразнювальні та відволікаючі речовини. В основі їх дії лежить ослаблення сприйняття болю, стимуляція нервових закінчень в інтактній шкірі з подальшим звільненням ендогенних анальгетичних речовин, а також рефлекторне розширення артеріол і капілярів із покращанням мікроциркуляції. Доза препарату залежить від вираженості запального процесу та величини суглоба. Так, на ділянку великих суглобів (колінний, плечовий) одноразово необхідно наносити смугу гелю довжиною від 5 до 10 см, на середні (гомілковостопний, ліктьовий, променезап’ястковий) — від 3 до 5 см, на дрібні суглоби кистей та стоп — 1–2 см. Водночас невисока концентрація діючої речовини, неповне проходження препарату безпосередньо до вогнища запалення визначають необхідність багаторазового нанесення мазі чи гелю на уражену ділянку протягом доби. Встановлено, що найоптимальнішим є 4-разове нанесення місцевого засобу на добу, а при активному запаленні частоту нанесення необхідно збільшити до 5–6 разів.
З метою підвищення ефективності протизапального та анальгезивного ефектів НПЗП для місцевого застосування, цілий ряд досліджень присвячений вивченню можливості використання фонофорезу як способу трансдермального проведення діючої речовини. Проте слід враховувати і той факт, що частина засобів, які вивчалися у цій категорії досліджень, мають низьку провідну здатність УЗ-енергії. Так, використання мазей для фонофорезу недоцільне, оскільки вони не здатні адекватно проводити акустичну хвилю. Водночас препарати на гелевій основі мають більший потенціал до проведення УЗ.
На сьогодні в ревматологічній практиці найбільш обґрунтованою щодо доказової медицини є застосування місцевої терапії НПЗП у хворих на ОА (Коваленко В.М., Борткевич О.П., 2010). Так, використання місцевих форм НПЗП приводиться в усіх рекомендаціях Європейської антиревматичної ліги (European League Against Rheumatism) та Міжнародної асоціації з вивчення остеоартрозу (Osteoarthritis Research Society International), де зазначається що місцеві форми НПЗП мають пріоритет перед пероральними НПЗП у хворих на ОА колінних суглобів або дрібних суглобів кистей легкого чи помірного ступеня тяжкості; при ураженні декількох суглобів, а також при обтяженому алергологічному анамнезі застосування пероральних НПЗП. Водночас рекомендації Американської асоціації болю (American Pain Society) та — ACR в минулому з аналогічною метою пропонували лише місцеву терапію метилсаліцилатом і капсаїцином, але не НПЗП для місцевого використання. Така ситуація легко пояснюється тим, що Американські рекомендації розроблялися й були опубліковані на декілька років раніше, аніж перша місцева форма НПЗП була схвалена для застосування у США. Так, незважаючи на доволі тривалий світовий досвід застосування, лише у жовтні 2007 р. 1% гель диклофенаку натрію став першим препаратом, схваленим для використання для місцевої терапії хворих на ОА в США.
Застосування в клінічній практиці: загальні рекомендації
НПЗП — важливий компонент лікування багатьох ревматичних захворювань, однак, як і для інших препаратів, для них необхідно оцінювати співвідношення користь — ризик. Застосування НПЗП показано всім особам із ревматичними захворюваннями, які супроводжуються болем та пов’язані із запальним чи дегенеративним ураженням органів опорно-рухового апарату. Тривалість курсу лікування НПЗП необхідно визначати індивідуально. Для достовірного висновку про ефективність слід використовувати не менше 2–4 тиж в оптимальній терапевтичній дозі. Можливий ризик розвитку серйозних небажаних ефектів — це основний фактор, який слід враховувати при призначенні НПЗП. Немає достовірних даних, що свідчать про переваги в ефективності окремих препаратів групи НПЗП при певних ревматичних захворюваннях. Тому вибір НПЗП потрібно здійснювати індивідуально, із врахуванням фармакологічних особливостей препарату (див. нижче), клінічної ситуації та наявності факторів ризику небажаних ефектів. Для купірування гострого болю протягом короткого часу (до 3 діб) доцільно використовувати парентеральні форми НПЗП (кеторолак, диклофенак, кетопрофен, мелоксикам та ін.), або німесулід (у розчинній формі), або лорноксикам чи етодолак, що мають виражений анальгезивний ефект. Для тривалого лікування показане застосування НПЗП, що мають середній або тривалий період напіввиведення, перорально чи у вигляді ректальних свічок.
Неселективні НПЗП доцільно призначати хворим, які не мають основних чинників ризику НПЗП-гастропатії (до яких відносять вік старше 65 років, супутню патологію ШКТ, прийом ацетилсаліцилової кислоти в низьких дозах, антикоагулянтів і ГК) і клінічно вираженої патології серцево-судинної системи (у тому числі неконтрольованої артеріальної гіпертензії, серцевої недостатності, тяжкого ураження коронарних артерій). За наявності факторів ризику НПЗП-гастропатії і на тлі прийому ацетилсаліцилової кислоти застосування неселективних НПЗП припустиме лише в поєднанні з інгібітором протонної помпи. Не слід призначати неселективні НПЗП хворим, у яких раніше виникали небезпечні ускладнення з боку ШКТ (кровотеча і перфорація виразки), які страждають на хронічні запальні захворюваннями кишечнику і тяжку патологію серцево-судинної системи. Селективні НПЗП призначають хворим віком старше 65 років, які мають фактори ризику НПЗП-гастропатії або приймають ацетилсаліцилову кислоту в низьких дозах. За наявності тяжкої патології серцево-судинної системи, що супроводжується високим ризиком розвитку судинних тромбозів (ішемічна хвороба серця, ішемічний інсульт, стани після операцій на серці й великих судинах, рецидивуючий тромбофлебіт тощо), застосування селективних НПЗП можливе лише на фоні адекватної антитромботичної терапії. При призначенні НПЗП лікуючий лікар має враховувати специфічні протипоказання і попередження, заявлені фірмою — виробником препарату.
Контроль небажаних ефектів нестероїдних протизапальних препаратів
За відсутності факторів ризику виникнення НПЗП-гастропатії необхідно контролювати загальний аналіз крові, активність печінкових ферментів (АсАТ, АлАТ), креатинін, проводити контроль артеріального тиску 1 раз на 3 міс при безперервному прийомі НПЗП у середніх і високих дозах. Також слід оцінювати суб’єктивні скарги при кожному візиті пацієнта (виникнення чи посилення симптомів з боку ШКТ, набряків і т.д.). За наявності ознак патології ШКТ — проводити ендоскопічне дослідження (езофагогастродуоденоскопію, капсульну ендоскопію, колоноскопію), аналіз калу на приховану кров.
За наявності факторів ризику НПЗП-гастропатії додатково необхідно провести езофагогастродуоденоскопію через 1 міс після початку прийому НПЗП. При виявленні ознак НПЗП-гастропатії визначити наявність Н. руlori будь-яким методом відповідно до стандартів діагностики цього мікроорганізму. Загальний аналіз крові необхідно проводити 1 раз на місяць.
За наявності ще й патології серцево-судинної системи додатково до стандартних обстежень необхідно проводити контроль артеріального тиску при кожному візиті (не рідше 1 разу на місяць), ЕКГ — 1 раз на місяць, оцінювати суб’єктивні скарги (біль за грудиною, наростання задишки, набряків, порушення ритму серця тощо). При прийомі разом з інгібіторами АПФ креатинін у сироватці крові необхідно визначати кожні 3 тиж. За наявності показань — додаткові методи дослідження стану серця і судин.
У разі наявності у хворого порушення функції нирок і/або віку сташе 65 років перед початком застосування НПЗП потрібно визначити кліренс креатиніну. У пацієнтів із порушенням клубочкової фільтрації <60 мл/хв або протеїнурією слід використовувати НПЗП з особливою обережністю.
У 2011 р. в журналі «BMJ» опубліковані результати метааналізу безпеки НПЗП щодо серцево-судинної системи. У нього включено всі великі РКД, в яких порівнювали НПЗП між собою і з плацебо — 31 клінічне випробування за участю 116 429 пацієнтів, які застосовували напроксен, ібупрофен, диклофенак, целекоксиб, еторикоксиб, рофекоксиб, люміракоксиб або плацебо. Згідно з результатами метааналізу жоден із НПЗП не є безпечним щодо серцево-судинної системи. Тому при призначенні НПЗП необхідно зважувати кардіо- та гастроінтестинальні ризики. Високоселективні інгібітори ЦОГ-2 (коксиби) доцільно призначати лише пацієнтам із надзвичайно високим ступенем ризику виникнення гастроінтестинальних ускладнень, за умови, що конкретний пацієнт не має кардіоваскулярного ризику, не приймає ацетилсаліцилову кислоту чи інші дезагреганти, НПЗП призначати лише коротким курсом і в оптимально терапевтичних дозах, також рекомендовано призначення гастропротекторної терапії.
За наявності інших тяжких супутніх захворювань можливість призначення НПЗП слід узгодити з лікарями відповідних спеціальностей. Додатково необхідно забезпечити регулярне обстеження за стандартами діагностики зміни стану відповідних органів і систем (за погодженням із лікарями-фахівцями).
У період вагітності системне застосування НПЗП може становити серйозний ризик для матері й дитини, тому допустиме лише за життєвими показаннями і за узгодженням із фахівцем (акушером-гінекологом), який спостерігає пацієнтку.
Підбір адекватних доз глюкокортикоїдів
Запальні ревматичні хвороби належать до числа основних показань для призначення ГК. У ревматології їх системне застосування є основним (або одним з основних) підходом до лікування більшості тяжких, інвалідизуючих або потенційно смертельних захворювань, таких як СЧВ, більшість форм системного васкуліту, ідіоматична запальна міопатія, а також важливим компонентом терапії РА. ГК застосовують як для системної (перорально, парентерально), так і для місцевої (інтраартикулярно, періартикулярно, зовнішньо) терапії.
Підбір ГК та їх дози (табл. 10.10):
- Надавати перевагу ГК середньої тривалості дії в оптимальній дозі та протягом оптимального часу (не збільшувати період, необхідний для контролю активності хвороби).
- Проводити підбір початкової дози ГК, тривалості терапії та темпів зниження дози, орієнтуючись на стандартизовані клініко-лабораторні параметри активності захворювання (не емпірично) (табл. 10.11).
- За необхідності тривалого застосування ГК (табл. 10.12 і 10.13) швидше переходити на одномоментний прийом усієї дози в ранкові години, а потім — на альтернативний режим терапії.
Таблиця 10.10
Номенклатура доз ГК та їх обґрунтування
|
Категорія |
Доза, мг |
Пульс-терапія |
|||
|
низька |
середня |
висока |
дуже висока |
||
|
Добова доза у преднізолоновому еквіваленті (при застосуванні перорально) |
<7,5 |
>7,5–≤30 |
>30–≤100 |
>100 |
>250 |
|
Обґрунтування |
|||||
|
Насичення рецепторів |
<50% |
>50≤100% |
≤100% |
100% |
100% |
|
Негеномні ефекти |
0 |
Несуттєві |
+ |
+++ |
++++ |
|
Побічні ефекти |
Відносно мало |
Суттєві та дозозалежні |
Тяжкі при тривалому (1,5–2 міс) лікуванні |
Тяжкі. Тривале (>4 тиж) лікування недопустиме |
Відносно мало при лікуванні до 5 діб |
|
Застосування |
Зазвичай підтримуюча терапія |
Початкове лікування при первинно хронічних ревматичних хворобах |
Початкове лікування при підгострих захворюваннях, що не загрожують життю, загостренні чи вісцеральних ураженнях при РА та інших хворобах сполучної тканини |
Початкове лікування при гострих захворюваннях або загостреннях, що загрожують життю (хворобах сполучної тканини), системних васкулітах та РА |
Ударна терапія при гострому або такому, що загрожує життю, перебігу хвороби сполучної тканини, системних васкулітах та РА |
Таблиця 10.11
Розподіл побічної дії ГК за частотою, термінами та умовами виникнення (за: Boumpas D.T. et al., 1991)
|
Побічна дія |
Частота |
Час виникнення |
Умови |
Клінічна оцінка |
|
Підвищення апетиту |
Дуже часто |
На початку лікування |
– |
Не загрозлива для життя |
|
Надмірна маса тіла |
Дуже часто |
На початку лікування |
– |
Не загрозлива для життя |
|
ОП |
Дуже часто |
Пізнє ускладнення |
Починається при застосуванні преднізолону від 7,5 мг/добу |
Потенційно тяжке ускладнення ГК-терапії |
|
Кушингоїдний синдром |
Дуже часто |
В процесі лікування |
Під час інтенсивної та тривалої терапії |
Істотне системне ускладнення |
|
Депресія адренокортикотропної системи |
Дуже часто |
В процесі лікування |
Під час інтенсивної та тривалої терапії |
Потенційно небезпечно для життя, може викликати гостру недостатність кори надниркових залоз |
|
Затримка росту у дітей |
Дуже часто |
Пізнє ускладнення |
Виникає при щоденному прийомі ГК, при альтернативній терапії — мінімальна |
Істотна несприятлива побічна дія |
|
Інфекційні ускладнення |
Дуже часто |
В процесі лікування |
Частіше розвивається у пацієнтів із первинними порушеннями імунітету |
Активізація чи несприятливий перебіг туберкульозу та інших інфекцій |
|
Гіперглікемія |
Часто |
В процесі лікування |
У хворих групи ризику |
Ймовірний розвиток цукрового діабету |
|
Артеріальна гіпертензія |
Часто |
В процесі лікування |
У хворих групи ризику |
Істотне ускладнення ГК-терапії |
|
Ульцерогенний ефект |
Рідко |
В процесі лікування |
У хворих групи ризику |
Небезпечна несприятлива дія |
|
Глаукома |
Рідкісні та непрогнозовані ускладнення |
– |
Немає безпосередньої загрози життю |
|
|
Психоневрологічні ускладнення |
Рідкісні та непрогнозовані ускладнення |
– |
Виникає у пацієнтів зі схильністю до таких станів |
|
Таблиця 10.12
Характер і частота побічних ефектів при тривалому лікуванні ГК
|
Характер побічних явищ |
Препарати ГК |
||||
|
Гідрокортизон |
|||||
|
ОП |
++ |
++ |
++ |
+++ |
++ |
|
Стероїдна виразка шлунка |
++ |
+++ |
+– |
++ |
++ |
|
Пригнічення функції кори надниркових залоз |
++ |
++ |
++ |
+++ |
++ |
|
Затримка натрію і рідини |
+++ |
+ |
+– |
+ |
+– |
|
Артеріальна гіпертензія |
++ |
+ |
+– |
+ |
+– |
|
Втрата калію |
++ |
+ |
+– |
++ |
+ |
|
Міопатія |
++ |
+– |
+– |
++ |
+++ |
|
Активація інфекції |
++ |
++ |
++ |
+++ |
+++ |
|
Психотропний ефект |
++ |
++ |
++ |
+++ |
+– |
|
Кушингоїд |
++ |
++ |
+– |
+++ |
+++ |
|
Гірсутизм |
++ |
++ |
+– |
++ |
++ |
|
Пурпура |
++ |
++ |
++ |
+++ |
+++ |
|
Стриї |
+ |
+ |
– |
+ |
++ |
|
Вугрі |
++ |
++ |
+ |
+ |
++ |
|
Підвищення апетиту |
++ |
++ |
+ |
+++ |
+– |
|
Стероїдний діабет |
++ |
++ |
+ |
+++ |
+ |
Умовні позначки: побічні явища: – немає, +– рідкі, ++ незначні, +++ значні.
Таблиця 10.13
Рекомендації щодо динамічного спостереження пацієнтів, які застосовують ГК
|
Побічні ефекти, що потребують спостереження |
Обстеження до призначення терапії |
Спостереження в динаміці |
Лабораторне обстеження |
|
Артеріальна гіпертензія, гіперглікемія |
Артеріальний тиск, денситометрія у хворих із високим ризиком виникнення ОП |
Артеріальний тиск кожен візит, поліурія, полідипсія, набряки, задишка, порушення зору, ожиріння |
Визначення глюкози у крові та ліпідів у сироватці крові 1 раз на рік |
Значний інтерес становлять нещодавно отримані дані про те, що залежно від дози ефект ГК може реалізуватися на різному рівні.
Так, у низьких концентраціях (>10–12 моль/л) ГК реалізують свою дію за рахунок так званих геномних ефектів (рис. 10.2), для розвитку яких потрібно ≥30 хв; у середніх концентраціях (>10–9 хв) — як геномних, так і рецептор-опосередкованих (1–2 хв); в високих (>10–4 хв) — поряд із вищезазначеними ефектами, певну роль починає відігравати здатність ГК впливати на фізико-хімічні властивості біомембран клітин-мішеней протягом кількох секунд.
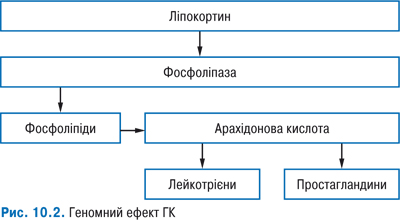
Це дозволяє пояснити відмінності у протизапальній терапії та імуномоделюючій активності ГК при призначенні їх хворим у низьких (<10 мг/добу), середніх/високих (≈1 мг/кг/добу) чи пульс-терапії (1 г/добу).
Терапевтичний ефект виявляється не раніш ніж через 30 хв після утворення гормон-рецепторного комплексу.
Дози, що забезпечують геномний ефект — ≥2,5 мг у преднізолоновому еквіваленті.
Негеномний ефект глюкокортикоїдів:
1. Стабілізація клітинних мембран та мембран органел, зниження проникності капілярного ендотелія, захист клітин від цитотоксичної дії.
2. Пригнічення активності фагоцитуючих мононуклеарів та зниження кліренсу вкритих антитілами еритроцитів і тромбоцитів.
4. Пригнічення міграції лейкоцитів у вогнище запалення.
5. Зниження функціональної активності ендотеліоцитів, моноцитів, макрофагів, нейтрофільних гранулоцитів та фібробластів.
Терапевтичний ефект виявляється через декілька секунд або хвилин.
Дози, що забезпечують виражений негеномний ефект — починаючи із 60 до ≥250 мг у преднізолоновому еквіваленті.
Враховуючи вищевикладене (порівняльний аналіз побічних ефектів ГК і тривалість дії), найбільш безпечним і оптимальним за тривалістю дії для системної терапії ревматичних хвороб є метилпреднізолон.
Методика проведення пульс-терапії
Введення ГК в/в у дуже високих ударних дозах, або пульс-терапія (з англ. pulse — поштовх, удар), з’явилося у клінічній практиці порівняно давно, в середині 1970-х років. Найбільшого розповсюдження пульс-терапія отримала у медицині критичних станів — септичний шок, астматичний статус, гострий інфаркт міокарда з розвитком синдрому Дреслера, набряк Квінке, набряк мозку, синдром Лайєлла та ін. Стандартним вважається застосування пульс-терапії для профілактики та усунення кризу відторгнення трансплантата. Найуспішніше застосування пульс-терапії у хворих із кризом відторгнення, в основі якого лежить цілий ряд імунних порушень, послужило основою для використання пульс-терапії у осіб з аутоімунними ревматичними захворюваннями.
Патофізіологічним підґрунтям до застосування ГК в ударних дозах є їх здатність активно взаємодіяти із системою імунітету та пригнічувати запальні реакції. Одним із найважливіших ефектів пульс-терапії є пригнічення активності нейтрофілів та моноцитів і здатність викликати транзиторну перерозподільну лімфопенію. Завдяки гальмівному впливу пульс-терапії на В-лімфоцити відбувається достатньо стійке зниження продукції імуноглобулінів із подальшим зменшенням утворення аутоантитіл та ЦІК. Велике значення в імуномодулюючій дії пульс-терапії має пригнічення експресії та функціональної активності Fc- та CЗ-рецепторів фагоцитів. Саме цей механізм і забезпечує швидкий клінічний ефект у пацієнтів із аутоімунною цитопенією. Протизапальний та імуномодулюючий ефекти ГК в ударних дозах значною мірою визначаються впливом на систему цитокінів. Пульс-терапія має виражений гальмівний вплив на синтез прозапальних ІЛ-1, -6, -8 та ФНП-α, пригнічує транскрипцію та посилює деградацію генів, що контролюють синтез ІЛ-1- та -2-рецепторів, які займають центральне місце у розвитку імунної відповіді. Через вплив на синтез ліпокортину та металопротеаз, що беруть участь у руйнуванні хряща, реалізується антидеструктивний та протизапальний ефекти пульс-терапії ГК.
До деякого часу залишалося невирішеним питання про дозування, способи введення та про препарат вибору для проведення пульс-терапії. У численних дослідженнях 80–90-х років ХХ ст. доведено, що саме в/в введення ГК в ударних дозах забезпечує вищенаведені протизапальний та імуносупресивний ефекти і значно перевищує за ефективністю пероральне застосування ГК в аналогічних дозах. Препаратом вибору досі, безперечно, є метилпреднізолон, що виявляє мінімальну мінералокортикоїдну активність, а також сильний протизапальний та імуномодулюючий ефект. На відміну від інших ГК-препаратів, метилпреднізолон зумовлює збалансований геномний та негеномний ефекти (табл. 10.14). Концентрація метилпреднізолону в крові пропорційна дозі препарату, що вводиться, зв’язування з білками плазми крові носить лінійний характер, 77% зв’язується з альбуміном. Тривалість дії метилпреднізолону становить 24–72 год після введення, через 24 год 99% препарату виводиться, а тривалість ефекту забезпечується впливом на функцію лімфоцитів. Імуносупресивна та протизапальна активність пульс-терапії залежить від дози, так, в/в введення ≥1000 мг метилпреднізолону веде до взаємодії з усіма ГК-рецепторами, їхнього перезавантаження та експресії, що підвищує ефективність лікування.
Таблиця 10.14
Протизапальний та імунозапальний ефекти метилпреднізолону та преднізолону (за: Badsha H., Edwards C.G., 2003)
|
Показник |
Преднізолон перорально |
Метилпреднізолон в/в |
|
Еквівалент дози |
1 |
0,8 |
|
Тривалість дії, год |
12–36 |
24–72 |
|
Зв’язок із білками |
Зв’язується з альбуміном та кортизол-глобуліном |
77% зв’язується з альбуміном |
|
Протизапальний ефект |
Зниження капілярної проникності, місцевого кровотоку, набрякання ендотелію |
Такий самий |
|
Нейтрофільний ефект |
Підвищення кількості нейтрофілів у периферичній крові, пригнічення міграції нейтрофілів у вогнище запалення |
Більш значне збільшення кількості нейтрофілів протягом 72 год |
|
Лімфоцити |
При дозі 15–100 мг лімфопенія протягом 4–6 год, нормалізація — через 24 год |
Більш глибока лімфопенія протягом 4–6 год, нормалізація — через 24–48 год, пригнічення бластогенезу і трансформації лімфоцитів |
|
Моноцити |
Зменшення кількості моноцитів, фактора міграції та активації макрофагів, гістаміну і простагландинів |
Такий самий |
|
Гуморальний імунітет |
Пригнічення активності В-лімфоцитів та синтезу імуноглобулінів |
Пригнічення активності В-лімфоцитів зберігається протягом 3 міс |
|
Клітинний імунітет |
Регуляція клітинного трафіку, макрофагальної функції, зниження Т-клітин (CD4+/Th1) |
Такий самий |
Найбільше розповсюдження в Європі, Росії та Україні отримав метилпреднізолон.
Преднізолон як засіб проведення пульс-терапії поступається за клінічною ефективністю метилпреднізолону в декілька разів, не має настільки вираженого імуномодулюючого ефекту та часто викликає такі мінералокортикоїдні ефекти, як затримка рідини й артеріальна гіпертензія.
Дексаметазон здатний викликати швидкий та виражений протиалергічний ефект. Його призначення може бути доцільним у хворих на алергічний васкуліт та ураження ЦНС, що супроводжується набряком мозку.
Методика проведення пульс-терапії метилпреднізолоном
Класичною методикою проведення пульс-терапії є в/в введення метилпреднізолону щоденно протягом 3 послідовних днів, з розрахунку 15–20 мг/кг маси тіла хворого на добу (або 1000 мг на 1 м2 поверхні тіла), що становить у еквіваленті близько 1200 мг преднізолону всередину. Доза та схема введення відпрацьовані в експерименті у хворих із кризом відторгнення трансплантату. Препарат розчиняють у 100–250 мл 0,9% ізотонічного розчину натрію хлориду або 5% розчину глюкози і вводять протягом 35–45 хв. Більш повільне введення суттєво знижує клінічну ефективність, в основному за рахунок зниження імуносупресивного ефекту. Швидке введення, за 10–15 хв, може призвести до тяжких ускладнень, навіть до розвитку гострої серцевої недостатності. Більш повільне введення (≈3 год) зі зниженням дози до 10 мг/кг доцільне у хворих із серцево-судинною патологією. Лише за наявності показань у крапельницю додають гепарин (у хворих із синдромом дисемінованого внутрішньосудинного згортання крові, тромбозом), седативні препарати, препарати калію та магнію та серцеві глікозиди. Стимуляція фуросемідом через 15–20 хв після пульс-терапії дозволяється лише у разі анурії чи олігоанурії.
Комбіноване застосування пульс-терапії метилпреднізолоном та циклофосфамідом
Ця методика складається із класичної 3-денної пульс-терапії з додаванням циклофосфаміду на 2-й день, із розрахунку 15–20 мг/кг маси тіла хворого (або 1000 мг/м2 поверхні тіла). Циклофосфамід розчиняють в одному флаконі з метилпреднізолоном у фізіологічному розчині чи у розчині глюкози та вводять в/в крапельно протягом 35–45 хв. Для зниження токсичної дії циклофосфаміду можна рекомендувати хворому багато пити. У деяких випадках 1000 мг метилпреднізолону та 1000 мг циклофосфаміду призначають щомісяця.
Підбір базисних протизапальних препаратів, у тому числі біологічних агентів, для лікування при ревматичних хворобах
Основні положення:
- Терапію базисними протизапальними препаратами (БПЗП) необхідно проводити всім без винятку пацієнтам із достовірними ревматичними захворюваннями (табл. 10.15).
- Терапія БПЗП зменшує вираженість болю в суглобах, покращує функціональну активність та сповільнює прогресування ревматичних захворюваннь.
- Ефективна терапія БПЗП знижує загальну вартість медичного обслуговування пацієнтів із ревматичними захворюваннями.
- Тривалість лікування БПЗП не обмежена, навіть незважаючи на зниження активності захворювання та досягнення ремісії (можливо, зниження дози БПЗП, якщо при цьому не буде загострення).
- Динамічне спостереження за ефективністю та побічними ефектами лікування БПЗП здійснює лікар-ревматолог та (як виняток) лікар загальної практики, але при консультативній підтримці лікаря-ревматолога (табл. 10.16, 10.17).
Таблиця 10.15
Загальна характеристика БПЗП
|
Препарат |
Ефект настає протягом, міс |
Доза |
Основні побічні ефекти |
|
1–2 |
7,5–25 мг/тиж всередину дрібно (максимально 25 мг/тиж) + фолієва кислота 1–5 мг/добу |
Інфекції, шлунково-кишкові (нудота, блювання, виразки слизової оболонки порожнини рота, анорексія, диспепсія), алопеція, гематологічні (цитопенія) |
|
|
2–6 |
400 мг/добу (6 мг/кг/добу) всередину в 2 прийоми після їди |
Ретинопатія |
|
|
1–2 |
0,5 г/добу всередину з поступовим підвищенням до 2–3 г/добу в 2 прийоми після їди |
Шлунково-кишкові (нудота, блювання, диспепсія, біль у животі, діарея), запаморочення, головний біль, слабкість, дратівливість, порушення функції печінки, лейкопенія |
|
|
Препарати золота |
3–6 |
Спочатку пробна доза 10 мг в/м, підтримувальна — 25–50 мг/тиж до сумарної дози 1000 мг, потім — 50 мг на 2–4 тиж |
Шкірний висип, виразковий стоматит, протеїнурія |
|
2–3 |
50–100 мг/добу всередину, максимально — 2,5 мг/кг/добу |
Мієлосупресія, рідко — ураження печінки, лихоманка, ураження ШКТ, інфекції (герпес та ін.), розвиток пухлин |
|
|
3–6 |
250–500 мг/добу всередину у 2 прийоми із поступовим підвищенням дози до 750–1000 мг/добу |
Висипання, шкірний зуд, протеїнурія, гематурія, цитопенія, гіперчутливий пневмоніт, вовчакоподібний синдром, міопатія, міастенія |
|
|
2–3 |
50–100 мг/добу всередину, максимально — 2,5 мг/кг/добу |
Нудота, аменорея, мієлосупресія, геморагічний цистит, ризик інфекції та онкологічні захворювання |
|
|
1–2 |
<5 мг/кг/добу |
Підвищення артеріального тиску, набряки, нефропатія, головний біль, тремор, гірсутизм, інфекції, нудота/блювання, діарея, диспепсія, гіперплазія ясен |
|
|
Іноді після першого введення |
Разова доза 3 мг/кг, потім повторно у тій самій дозі через 2 та 6 тиж, потім кожні 8 тиж |
Інфузійні реакції, інфекції |
|
|
1 |
10—20 мг/добу |
Діарея, алопеція, висипка, головний біль |
Таблиця 10.16
Лабораторні та клінічні порушення, необхідні для негайного припинення лікування протиревматичними препаратами
|
Порушення |
Препарат |
|
Лейкоцити <4,0•109/л |
Всі БПЗП |
|
Нейтрофіли <2,0•109/л |
Всі БПЗП |
|
Тромбоцити <150•109/л |
Всі БПЗП |
|
Протеїнурія >+1 |
Препарати золота, пеніциламін |
|
Гематурія >+1 |
Препарати золота, пеніциламін |
|
Збільшення вдвічі АсАТ або АлАТ або ЛФ |
Азатіоприн, циклоспорин, метотрексат, сульфасалазин |
|
Висипання та виразки в порожнині рота |
Азатіоприн, метотрексат, пеніциламін, солі золота, сульфасалазин |
|
Непояснене зниження рівня альбуміну |
Метотрексат |
|
Раптове виникнення кашлю та задишки |
Метотрексат |
|
Збільшення креатиніну на 30% від вихідного |
Циклоспорин |
|
Збільшення рівня калію |
Циклоспорин |
|
Значне збільшення рівня ліпідів |
Циклоспорин, лефлуномід |
|
Шкірний зуд |
Циклоспорин |
|
Реакція гіперчутливості: ураження шкіри, гепатит, пневмоніт, агранулоцитоз, апластична анемія |
Сульфасалазин |
|
«Сульфасалазиновий» синдром: лихоманка, висипання, порушення функції печінки |
Сульфасалазин |
|
Висипання на шкірі, що нагадує пухирчатку |
Пеніциламін |
Таблиця 10.17
Моніторинг токсичності протизапальних та базових препаратів при ревматичних захворюваннях
|
Препарат |
Токсичні реакції, які потребують моніторингу |
Базове обстеження |
Клінічний/інструментальний контроль |
Лабораторний контроль |
|
ШКТ (кровотечі, виразки) |
Загальний аналіз крові, креатинін, трансамінази |
Темний кал, диспепсія, нудота, блювання, набряки, задишка |
Загальний аналіз крові, трансамінази |
|
|
Ураження сітківки ока |
Офтальмологічне обстеження |
Вимір зору, дослідження поля зору кожні 12 міс |
– |
|
|
Мієлосупресія |
Загальний аналіз крові, трансамінази |
Мієлосупресія, фотосенсибілізація, висипання |
Загальний аналіз крові, 2–4 тиж перші 2 міс, потім — кожні 3 міс |
|
|
Солі золота (в/м) |
Мієлосупресія, протеїнурія |
Загальний аналіз крові, креатинін, трансамінази |
Мієлосупресія, набряки, висипання |
Загальний аналіз крові, сечі кожні 2 тиж |
|
Мієлосупресія, гепатотоксичність, лімфопроліферативні захворювання |
Загальний аналіз крові, креатинін, трансамінази |
Мієлосупресія |
Загальний аналіз крові кожні 2 тиж, потім — кожні 1–3 міс |
|
|
Ниркова недостатність, анемія, артеріальна гіпертензія |
Загальний аналіз крові, креатинін, трансамінази, сечова кислота, артеріальний тиск |
Гіпертрихоз, парестезії, нудота, блювання, гіперплазія ясен, набряки, артеріальний тиск кожні 2 тиж до стабілізації дози, потім — 1 раз в місяць |
Креатинін кожні 2 тиж, до стабілізації дози, потім — 1 раз в місяць. Загальний аналіз крові, трансамінази, калій (періодично) |
|
|
Мієлосупресія ураження печінки (фіброз) та легень (інфільтрати, фібрози) |
Загальний аналіз крові, креатинін, трансамінази, рентгенологічне дослідження грудної клітки |
Мієлосупресія, задишка, нудота, блювання лімфаденопатія |
Загальний аналіз крові, альбумін, креатинін, трансамінази кожні 4 тиж перші 6 міс, потім — кожні 1–2 міс |
|
|
Діарея, алопеція, висипання, головний біль |
Загальний аналіз крові, креатинін, трансамінази |
Діарея, алопеція, інтеркурентні захворювання, захворювання печінки, жовчного міхура, нирок |
Загальний аналіз крові, трансамінази, альбумін, креатинін, кожні 4 тиж перші 6 міс, потім — кожні 1–2 міс |
|
|
Артеріальна гіпертензія, гіперглікемія, ОП |
Артеріальний тиск, біохімічні обстеження, денситометрія |
Поліурія, полідипсія, набряки, задишка, порушення зору, ожиріння, переломи, артеріальний тиск при кожному візиті |
Глюкоза в сечі |
Обмеження:
- Ефективність і токсичність БПЗП важко прогнозувати.
- Тривалі ремісії бувають рідко, при припиненні лікування зазвичай настає загострення.
- На фоні лікування БПЗП деструкція суглобів може прогресувати, навіть незважаючи на зниження клінічної активності захворювання та розвиток клінічної ремісії.
- БПЗП викликають побічні реакції, що диктує необхідність ретельного моніторування у процесі лікування; деякі побічні реакції (потенційно смертельні) потребують негайної відміни лікування.
- Жінкам репродуктивного віку, що приймають БПЗП, необхідна контрацепція.
Метотрексат
1. Препарат вибору (золотий стандарт) при серопозитивному активному РА.
2. Порівняно з іншими БПЗП має найкраще співвідношення ефективність/токсичність.
3. Переривання лікування частіше пов’язане із токсичністю препарату, ніж із відсутністю ефекту.
4. Основний препарат при проведенні комбінованої терапії БПЗП РА.
5. Лікування метотрексатом (порівняно із лікуванням іншими БПЗП) асоціюється зі зниженням ризику летальності, в тому числі кардіоваскулярної.
Рекомендації щодо застосування:
- Метотрексат призначають 1 раз на тиждень (перорально чи парентерально). Більш частий прийом може призвести до розвитку гострих та хронічних токсичних реакцій (табл. 10.18).
- Дробний прийом із проміжком у 12 год (у ранкові та вечірні години).
- У разі відсутності ефекту при пероральному прийомі (при розвитку токсичних реакцій з боку ШКТ) перейти на парентеральне введення (в/м, підшкірно). Відсутність ефекту при пероральному прийомі препарату може бути пов’язана із низькою абсорбцією в ШКТ.
- Початкова доза препарату 7,5 мг/тиж, а у осіб похилого віку та з порушенням функції нирок — 5 мг/тиж. Не призначати пацієнтам із нирковою недостатністю, із тяжким ураженням легень.
- Ефективність і токсичність оцінюють приблизно через 4 тиж. При нормальній переносимості дозу метотрексату підвищують на 2,5–5 мг/тиж.
- Клінічна ефективність метотрексату залежить від дози в діапазоні 7,5–25 мг/тиж. Прийом в дозі >25–30 мг/тиж невиправданий (підвищення ефекту не доведене).
- Для зменшення вираженості побічних ефектів за необхідності рекомендується:
- застосовувати НПЗП короткої дії;
- уникати призначення ацетилсаліцилової кислоти (та за можливістю диклофенаку);
- у день прийому метотрексату замінювати НПЗП на ГК у низьких дозах;
- приймати метотрексат у вечірні години;
- знизити дозу НПЗП до та/чи після прийому метотрексату;
- перейти на прийом іншого НПЗП;
- перейти на парентеральне введення метотрексату;
- призначити протиблювотні засоби;
- приймати фолієву кислоту в дозі 5–10 мг/тиж після прийому метотрексату (прийом фолієвої кислоти знижує ризик розвитку гастроентерологічних і печінкових побічних ефектів та цитопенії);
- виключити прийом алкоголю (підвищує токсичність метотрексату), речовин та харчових продуктів, що містять кофеїн (знижують ефективність метотрексату);
- виключити прийом препаратів з антифолатною активністю (перш за все ко-тримоксазолу).
- При передозуванні метотрексату (або розвитку гострих гематологічних ускладнень) рекомендується прийом фопінікової кислоти (15 мг кожні 6 год), 2–8 доз залежно від дози метотрексату.
Таблиця 10.18
Рекомендації щодо динамічного спостереження пацієнтів, які застосовують метотрексат
|
Обстеження до призначення терапії |
У динаміці |
|
Рентгенографія грудної клітки |
Повторити при розвитку кашлю чи задишки |
|
Загальний аналіз крові |
Щотижня по досягненню стабільної дози, потім — щомісяця |
|
Печінкові ферменти (АсАТ, АлАТ) |
Щотижня по досягненню стабільної дози, потім — щомісяця |
|
Сечовина, креатинін |
Кожні 6–12 міс |
Похідні 4-амінохіноліну
- Поступаються за клінічною ефективністю перед іншими БПЗП.
- Не сповільнюють прогресування деструкції суглобів.
- Позитивно впливають на ліпідний профіль.
- Хлорохін частіше призводить до побічних ефектів, ніж гідроксихлорохін.
Потенційні показники для призначенння:
- Рання стадія, низька активність, відсутність факторів ризику несприятливого прогнозу.
- Недиференційований поліартрит за неможливості виключити дебют системного захворювання сполучної тканини.
Рекомендації щодо застосування:
- Не перевищувати добову дозу: гідроксихлорохін 400 мг (6,5 мг/кг), хлорохін 200 мг (4 мг/кг) (табл. 10.19).
- Проводити офтальмологічний контроль до призначення препаратів цієї групи та кожні 3 міс у процесі лікування — розпитування пацієнта про зорові розлади, дослідження очного дна (пігментація), дослідження полів зору.
- Не призначати пацієнтам із неконтрольованою артеріальною гіпертензією та діабетичною ретинопатією.
- Не використовувати одночасно з лікарськими засобами, що мають споріднення до меланіну (фенотіазини, рифампіцини).
- Пояснювати пацієнту необхідність самоконтролю порушень зору.
- Рекомендувати носіння захисних окулярів у сонячну погоду (незалежно від сезону).
Таблиця 10.19
Рекомендації щодо прийому 4-амінохінолінів
|
Маса тіла, кг |
Доза |
|
57–61 |
1-й день (неділя) — 200 мг/добу, в інші дні — по 400 мг/добу |
|
53–56 |
2 дні (неділя, четвер) — 200 мг/добу, в інші дні — по 400 мг/добу |
|
49–52 |
3 дні (неділя, середа, п’ятниця) — 200 мг/добу, в інші дні — по 400 мг/добу |
|
44–48 |
3 дні (неділя, середа, п’ятниця) — 400 мг/добу, в інші дні — по 200 мг/добу |
|
40–43 |
2 дні (четвер, неділя) — 400 мг/добу, в інші дні — по 200 мг/добу |
- За ефективністю не поступається іншим БПЗП.
- Важливий компонент комбінованої терапії (перш за все з метотрексатом та лефлуномідом).
- Можна застосовувати у пацієнтів, яким протипоказане лікування метотрексатом.
Побічні ефекти при правильному моніторуванні добре контролюються:
- Найчастіше побічні реакції розвиваються в перші 2–3 міс лікування.
- Розвиток цитопенії (і навіть агранулоцитозу) можливий у будь-який період хвороби (необхідний гематологічний контроль протягом усього лікування) (табл. 10.20).
Таблиця 10.20
Рекомендації щодо дінамічного спостереження пацієнтів, які застосовують сульфасалазин
|
Обстеження до призначення терапії |
У динаміці |
|
Загальний аналіз крові |
Кожні 2 тиж до досягнення стабільної дози, потім — кожні 6 тиж |
|
Печінкові ферменти (АсАТ, АлАТ) |
Кожні 6 тиж |
|
Сечовина, креатинін |
Кожні 3 міс |
|
АНФ |
При підозрі на розвиток медикаментозного вовчака |
|
Протокол десинситизації у пацієнтів із потенційною гіперчутливістю до препарату |
Стартова доза становить 50 мг, із поступовим її подвоєнням протягом 4–7 днів |
Рекомендації щодо застосування:
- Звичайно доза для дорослих 2 г (1,5–3 г, 40 мг/кг/добу) по 1 г 2 рази на добу з їжею.
- 1-й тиждень — 500 мг.
- 2-й тиждень — 1000 мг.
- 3-й тиждень — 1500 мг.
- 4-й тиждень — 2000 мг.
- При виникненні болю в горлі, виразок у роті, лихоманки, вираженої слабкості, кровоточивості, шкірного зуду пацієнтам необхідно негайно самостійно відмінити препарат.
Лефлуномід
- За ефективністю не поступається сульфасалазину та метотрексату.
- Перевершує метотрексат та сульфасалазин за впливом на якість життя пацієнтів.
- Частота побічних ефектів нижча, ніж у інших БПЗП.
Основне показання до призначення — недостатня ефективність чи погана переносимість метотрексату.
Рекомендації щодо застосування:
- По 100 мг/добу протягом 3 днів (насичувальна доза), потім — по 20 мг/добу.
- При використанні насичувальної дози наростає ризик переривання терапії внаслідок розвитку побічних ефектів, необхідний ретельний моніторинг побічних реакцій (табл. 10.21).
- На сьогодні більшість експертів рекомендують починати лікування лефлуномідом у дозі, починаючи із 20 мг/добу (або навіть 10 мг/добу), повільне наростання клінічного ефекту рекомендується компенсувати інтенсифікацією супутньої терапії (наприклад ГК у низьких дозах).
Таблиця 10.21
Рекомендації щодо динамічного спостереження пацієнтів, які застосовують лефлуномід
|
Обстеження до призначення терапії |
У динаміці |
|
Загальний аналіз крові |
Кожні 2 тиж протягом 24 тиж, потім — кожні 8 тиж |
|
Печінкові ферменти (АсАТ, АлАТ) |
Кожні 8 тиж |
|
Сечовина, креатинін |
Кожні 8 тиж |
|
Артеріальний тиск |
Кожні 8 тиж |
Препарати золота для парентерального застосування
- Не поступаються за ефективністю метотрексату та сульфасалазину.
- Токсичніші, ніж більшість БПЗП.
- Побічні ефекти можуть розвиватися в будь-який період терапії і навіть після її завершення.
- Необхідний ретельний моніторинг (табл. 10.22).
Таблиця 10.22
Рекомендації щодо динамічного спостереження пацієнтів, які застосовують парентеральні препарати золота
|
Обстеження до призначення терапії |
У динаміці |
|
Загальний аналіз крові |
Перед кожною ін’єкцією |
|
Загальний аналіз сечі |
Перед кожною ін’єкцією |
|
Виключити наявність висипки/виразок у роті |
Перед кожною ін’єкцією |
Препарати другого ряду: рекомендується застосовувати лише при неефективності та протипоказаннях до призначення метотрексату, лефлуноміду та сульфасалазину.
Рекомендації щодо застосування:
Лікування починають із пробної дози 10 мг у 1-й тиждень, у 2-й тиждень — 20 мг, у 3-й тиждень — 50 мг. Цю дозу вводять 1 раз на тиждень протягом 8–12 міс до клініко-лабораторної ремісії чи стабілізації, після чого у 2 рази знижують дозу чи подовжують інтервали між введеннями. При хорошій переносимості та ефективності лікування продовжують роками (3–5 років) 1 раз на місяць.
Циклоспорин
- Рекомендовано застосовувати у разі неефективності інших БПЗП.
- Водночас для циклоспорину характерні: висока частота побічних ефектів і висока частота небажаних медикаментозних взаємодій (табл. 10.23).
Таблиця 10.23
Рекомендації щодо динамічного спостереження пацієнтів, які застосовують циклоспорин
|
Обстеження до призначення терапії |
У динаміці |
|
Артеріальний тиск |
Кожні 2 тиж до досягнення стабільної дози, далі — 1 раз на місяць |
|
Сечовина, креатинін |
Кожні 2 тиж до досягнення стабільної дози, далі — 1 раз на місяць |
|
Печінкові ферменти (АсАТ, АлАТ) |
1 раз на місяць до досягнення стабільної дози, далі — 1 раз на 3 міс |
|
Загальний аналіз крові |
1 раз на місяць до досягнення стабільної дози, далі — 1 раз на 3 міс |
|
Ліпідний профіль |
1 раз на 6 міс |
Азатіоприн, пеніциламін, циклофосфамід, хлорамбуцил
- Застосовують рідко (перш за все у зв’язку із побічними ефектами та відсутністю достовірних даних про вплив на прогресування ураження суглобів).
- Потенційний показник: неефективність інших БПЗП (перш за все метотрексату, лефлуноміду, інфліксимабу) або протипоказання до їх призначення.
В-клітинна терапія, ритуксимаб
Химеричні моноклональні антитіла до CD20. Препарат зареєстрований FDA і EMEA у 2006 р. для лікування при РА у разі неефективності ФНП-терапії. Оптимальний режим терапії продовжують досліджувати. Нові дані доводять, що доза 1000 мг за 1 введення більш ефективна, ніж 500 мг 2 рази на рік. Максимальний термін спостереження зі збереженням ефекту становить до 6 років. Поєднано з ритуксимабом можуть застосовуватись не лише метотрексат, а й інші базисні препарати) (рис. 10.3, 10.4).
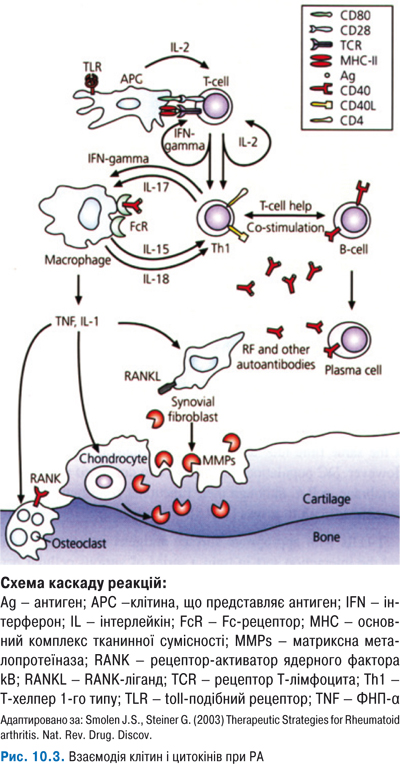
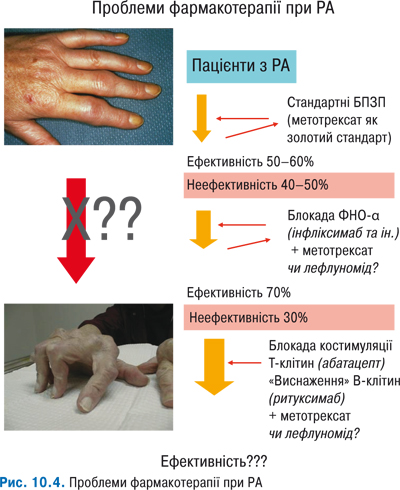
Препарат не призначають при вірусному гепатиті В.
Застосування ритуксимабу потребує настороженності щодо туберкульозу і солідних пухлин (перед початком застосування пацієнтів необхідно обстежити для виявлення активного чи латентного туберкульозу).
На перші введення досить часто виникають інфузійні реакції (35%), які зникають на другій чи наступних інфузіях (до 10%). У 2 випадках відзначали розвиток прогресуючої мультифокальної лейкоенцефалопатії при лікуванні РА. Зрідка фіксували випадки виникнення тяжкого псоріазу під час лікування.
Таким чином, В-клітиннна терапія (ритуксимаб):
- Ритуксимаб ефективний у пацієнтів із РА у разі недостатньої ефективності метотрексату чи інших БПЗП і одного або декількох блокаторів ФНП-α.
- Безпека засобу вважається не до кінця вивченою при РА, її вивчення продовжується.
Моноклональні антитіла до рецептора ІЛ-6, тоцилізумаб
Моноклональні антитіла до рецептора ІЛ-6 — тоцилізумаб, схвалений у Європейському Союзі та деяких інших країнах до застосування в комбінації з метотрексатом або у монотерапії при помірно вираженому чи тяжкому активному РА, лікування яких БПЗП чи блокатором ФНП-α було неефективним або виникали тяжкі побічні реакції.
Тоцилізумаб можна призначати пацієнтам у монотерапії, якщо вони раніше не отримували БПЗП чи метотрексат. Період спостереження в средньому 1,5 року. Результатів введення слід очікувати в інтервалі від 2 до 24 тиж.
Слід зазначити, що ефективність тоцилізумабу не порівнювали з ефективністю блокаторів ФНП-α.
Довготривалий вплив тоцилізумабу на серцево-судинну систему в наш час невідомий. Але у пацієнтів, які отримували тоцилізумаб, відзначали підвищення середніх рівнів ліпідів у плазмі крові натще, в тому числі загального холестерину, ліпопротеїнів низької щільності та тригліцеридів. Додаткове застосування статинів ефективно знижувало рівень ліпідів.
На основі 6-місячних контрольованих досліджень повідомлялося про розвиток перитоніту, перфорацій нижніх відділів ШКТ, нориць та інтраабдомінальних абсцесів. У низки пацієнтів відзначалося зменшення абсолютного числа нейтрофілів (сегментоядерних до рівня 1000 чи <500 клітин/мм3), ці зміни були транзиторними.
Підвищення рівня амінотрансфераз відзначали як при комбінації з метотрексатом, так і при монотерапії, а також підвищення рівня білірубіну (частіше непрямого).
Можливе виникнення бактеріальних інфекцій, туберкульозу, опортуністичних та вірусних інфекцій. Необхідне проведення скринінгу туберкульозу, оскільки були зафіксовані випадки виникнення туберкульозу (EMEA).
Резюме:
- Тоцилізумаб ефективний у разі недостатньої реакції на метотрексат, інші БПЗП або на один чи декілька інгібіторів ФНП-α.
- Препарат ефективний у монотерапії.
- Ефективність тоцилізумабу перевищувала ефективність метотрексату.
- Безпека тоцилізумабу потребує подальшого дослідження шляхом аналізу баз даних.
Препарати, які блокують ФНП-α
Препарати, які блокують ФНП-α, відрізняються за складом, механізмом дії, фармакокінетикою і біофармацевтичними властивостями. У даному випадку увага фокусується на їх схожості. Дослідження, в яких встановлено чітку різницю між препаратами, згадуються лише за необхідності.
Блокатори ФНП-α при ревматоїдному артриті
У більшості випадків блокатори ФНП-α застосовують у комбінації з БПЗП, в основному з метотрексатом, при їх недостатній ефективності.
Адалімубаб і етанерцепт схвалені до застосування при РА у монотерапії. Інфліксимаб дозволено до застосування при РА лише в комбінації з метотрексатом. Але дані досліджень наглядового типу свідчать, що інфліксимаб застосовують і в монотерапії.
Блокатори ФНП-α також застосовують як перший БПЗП.
Комбінація блокатора ФНП-α із метотрексатом вважається більш ефективною, ніж монотерапія блокатором ФНП-α з метою досягнення високих клінічних результатів (ACR 70 і ремісія).
Проведено порівняння метотрексат + блокатор ФНП-α і комбінації традиційних БПЗП + ГК протягом 2 років. Дані свідчать про те, що комбінація традиційних БПЗП + ГК, хоча і ефективніша в деяких пацієнтів, але статистично (на рівні групи) поступається комбінації метотрексат + блокатор ФНП-α (А).
Корекція дози блокатора ФНП-α і час початку дії
Підвищення дози, або зменшення інтервалу між введеннями може надати додатковий ефект при лікуванні інфліксимабом і адалімумабом.
Поодинокими дослідженнями показано, що у разі розвитку ремісії чи досягнення низької активності хвороби може бути успішним зниження дози препарату без зменшення ефекту.
Очікувати відповіді на блокатор ФНП-α зазвичай слід протягом 2–4 тиж від початку терапії при ювенільному ідіопатичному артриті та протягом 12–24 тиж — у разі РА.
Блокатри ФНП-α вірогідно призупиняють радіографічне прогресування, з найкращими результатами в комбінації з БПЗП.
Блокатори ФНП-α і рентгенологічне прогресування
Препарати, які блокують ФНП-α, уповільнюють і/або зупиняють рентгенологічне прогресування РА, навіть у разі відсутності клінічного ефекту у деяких пацієнтів (А).
Найкращі клінічні й рентгенологічні результати досягнуті у тих випадках, коли блокатори ФНП-α застосовують в комбінації з традиційними БПЗП (А).
Термін терапії та заміна одного блокатора ФНП-α іншим
Тривалість відповіді на блокатор ФНП-α може досягати 10 років. Ймовірна втрата відповіді на конкретний блокатор ФНП-α. У таких випадках можлива заміна іншим блокатором ФНП-α, але:
- Якщо хворий не відповідає на один блокатор, то шанси на відповідь при застосуванні іншого теж невисокі.
- При непереносимості першого блокатора ФНП-α можлива відповідь на інший, але підвищується ризик непереносимості.
Ювенільний ідіопатичний артрит
Немає доказів про вищу ефективність того чи іншого блокатора ФНП-α при ювенільному ідіопатичному артриті. Деякі РКД довели, що ефективна доза інфліксимабу 6 мг/кг маси тіла, а не 3 мг/кг.
При супутньому увеїті більш ефективними виявились інфліксимаб та адалімумаб, а не етанерцепт.
Пригнічення ФНП-α робить свій внесок у відновлення росту кісток у дітей. Після застосування препаратів, які блокують ФНП-α, покращується МЩКТ, навіть у разі неповного контролю над хворобою.
Псоріатична артропатія
Блокатири ФНП-α високоефективні для пригнічення маніфестації з боку шкірних проявів і суглобів, а також для лікування при супутньому ентериті й дактиліті.
Ефект проявляється протягом 12 тиж від початку ФНП-терапії. У разі неефективності першого блокатора ФНП-α іноді можна отримати задовільну відповідь на інший блокатор ФНП-α. Доведена стійка клінічна ефективність ФНП-блокаторів і вплив на рентгенологічні зміни протягом 2 років (А, В, С).
Анкілозуючий спондиліт
Блокатири ФНП-α високоефективні для пригнічення маніфестації АС. Відповідь оцінюється у перші 6–12 тиж від початку лікування і може утримуватися до 7 років. При перерваному лікуванні після відновлення терапії блокаторами ФНП-α повторна відповідь досягається у 80% пацієнтів. Немає доказів про вищу ефективність того чи іншого ФНП- блокатора. За даними досліджень, перехід на інший ФНП може виявитись ефективним у разі недостатньої відповіді на перший препарат. Не отримано доказів того, що комбінована терапія в поєднанні зі звичайними БПЗП перевершує монотерапію блокаторами ФНП-α. Основною рекомендацією щодо ведення АС є ASAS консенсус.
За даними МРТ і рентгенографії, застосування ФНП-блокатора протягом 3 років супроводжується значним зменшенням вираженості активного запалення крижово-клубових суглобів і хребта (А).
Безпека блокаторів ФНП-α: нові дані
При аналізі баз даних не підтверджено підвищеного ризику пухлин — ні залежно від тривалості ФНП-терапії, ні від терміну подальшого спостереження.
Безпека блокаторів ФНП—α: туберкульоз
Достовірно підвищений ризик активації латентного туберкульозу. Ризик активації туберкульозу також достовірно високий і при застосуванні ГК. Клінічна маніфестація туберкульозу може бути атиповою (позалегенева, дисемінована), як це часто трапляється в імунокомпроментованих пацієнтів з різних причин. Немає ніяких доказів про вищий ризик реактивації туберкульозу при застосуванні того чи іншого ФНП-блокатора.
У регіонах із високим розповсюдженням туберкульозу (проживання в популяціях із високим ризиком або перебування в умовах можливого інфікування туберкульозу) необхідно враховувати доцільність повторного обстеження. Рекомендується проведення шкірного тесту, ретельний збір анамнезу та рентгенографії грудної клітини. Розроблені нові діагностичні тести для дослідження крові з використанням специфічних антигенів до туберкульозу — тести з вивільненням інтерферону-γ (кватиферон і Т-spot тести), які вважаються високоспецифічними для туберкульозу, особливо після БЦЖ-вакцинації в анамнезі, але також можливі хибновід’ємні та невизначені результати.
Для лікування латентного туберкульозу рекомендовано призначення ізоніазиду за 1 міс до початку лікування блокатором ФНП-α. Консенсус не виключає можливості відновлення лікування ФНП-блокаторами після успішно проведеної протитуберкульозної терапії (С).
Резюме (блокатори ФНП-α):
Препарати, які блокують ФНП-α — ефективні БПЗП. З ними пов’язані значні досягнення в лікуванні пацієнтів із РА, ПсА, АС, ювенільним ідіопатичним артритом та переднім увеїтом, який ускладнює перебіг ювенільного ідіопатичного артриту.
В наш час робляться спроби застосування цих препаратів при інших ревматичних хворобах. Для більш раціонального застосування препаратів, які блокують ФНП-α, необхідне подальше вивчення деяких аспектів їх ефективності, токсичності та загальних принципів застосування.
Інфліксимаб
- Застосовується в комбінації із метотрексатом у разі його недостатньої ефективності, рідше — з іншими БПЗП.
- Ефективний у пацієнтів із недостатньою відповіддю на метотрексат при ранньому та пізньому РА.
- Ефект розвивається швидше, ніж на фоні лікування іншими БПЗП.
- Більш ефективний, ніж пульс-терапія метилпреднізолоном.
- Відносно безпечний у носіїв вірусу гепатиту С.
- Побічні ефекти, що потребують переривання лікування, виникають рідше, ніж на фоні лікування іншими БПЗП.
Показання:
- Відсутність ефекту (неприйнятно висока активність хвороби)на фоні лікування метотрексатом у максимально ефективній та переносимій дозі (до 20 мг/тиж) протягом 3 міс або іншими БПЗП.
- ≥5 припухлих суглобів, підвищення ШОЕ >30 мм/год або СРБ >20 мг/л.
- Відповідає DAS>3,2.
- Неефективність інших БПЗП (за наявності протипоказань до призначення метотрексату).
- Необхідність зниження дози ГК.
- За наявності протипоказань до призначення стандартних БПЗП інфліксимаб можна застосовувати як БПЗП першого ряду.
Протипоказання:
- Відсутність лікування ≥1 БПЗП (перш за все метотрексатом) у повній терапевтичній дозі.
- Припинення загострень.
- Тяжкі інфекційні захворювання (сепсис, септичний артрит, пієлонефрит, остеомієліт, туберкульозна та грибкова інфекції, ВІЛ, гепатити В і С та ін.), злоякісні новоутворення.
- Період вагітності та годування грудьми.
Рекомендації щодо оцінки ефективності терапії інфліксимабом:
- Зниження на ≥20% числа припухлих суглобів.
- Зниження на ≥20% лабораторних показників (ШОЕ, СРБ).
Це відповідає зниженню DAS до 1,2 або DAS на 3,2. Відсутність позитивної динаміки вищенаведених показників через 12 тиж лікування свідчить про неефективність лікування.
Рекомендації щодо застосування:
- Лікування проводиться під контролем лікаря-ревматолога із досвідом діагностики та лікування РА.
- В/в інфузія в дозі 3 мг/кг маси тіла, тривалість інфузії — 2 год.
- Через 2 та 6 тиж після першого введення призначають додаткові інфузії по 3 мг/кг кожна, потім введення повторюють кожні 8 тиж.
- У разі неефективності підвищити дозу препарату, що вводиться або скоротити період між ін’єкціями.
- Необхідно спостерігати за станом здоров’я пацієнта не менше 1–2 год після інфузії для виявлення посттрансфузійних побічних ефектів (має бути в розпорядженні реанімаційне обладнання).
- Повторне призначення інфліксимабу через 2–4 роки після попередньої інфузії може зумовити розвиток гіперчутливості сповільненого типу.
- Ступінь ризику у разі призначення повторних інфузій через період від 15 тиж до 2 років невідомий, тому повторні введення препарату через ≥15 тиж не рекомендуються.
Профілактика туберкульозної інфекції:
- Дисемінація туберкульозної інфекції — потенційно найтяжче ускладнення терапії інфліксимабом.
- Попередній скринінг пацієнтів щодо виявлення туберкульозної інфекції дозволяє знизити ризик ії розвитку на фоні лікування інфліксимабом.
- У всіх пацієнтів до початку терапії та у тих, які вже отримують лікування інфліксимабом, слід провести шкірну туберкулінову пробу (реакцію Манту) та рентгенологічне дослідження легень.
- На фоні лікування інфліксимабом можливі неправдивонегативні результати туберкулінової проби. Рекомендується ретельне клінічне спостереження та динамічне рентгенологічне дослідження легень.
- За наявності негативної шкірної проби дослідження слід повторити через 1 тиж (у 10–15% пацієнтів можливе виявлення позитивних результатів). При негативному результаті повторної проби можливе призначення інфліксимабу.
- У разі позитивної шкірної проби (реакція >0,5 см) слід провести рентгенологічне дослідження легень. За відсутності рентгенологічних змін рекомендовано провести лікування ізоніазидом (300 мг) та вітаміном В6 протягом 6 міс. Через 1 міс можливе призначення інфліксимабу.
- У раз позитивної шкірної пробі та наявності типових ознак туберкульозу і кальцифікованих лімфатичних вузлів середостіння (комплекс Гона) до призначення інфліксимабу необхідно провести не менш ніж 3-місячну терапію ізоніазидом та вітаміном В6. При призначенні ізоніазиду у пацієнтів віком старше 50 років необхідне динамічне спостереження печінкових ферментів.
Профілактика серцевої недостатності:
- У разі відсутності клінічних ознак серцевої недостатності проведення ехоКГ для виявлення порушень функції міокарда не потрібне.
- За наявності компенсованої серцевої недостатності (І та ІІ клас за класифікацією Нью-Йоркської кардіологічної асоціації — NYHA) слід провести ехоКГ: при нормальній фракції викиду (>50%) призначити лікування на фоні ретельного моніторингу; не використовувати високі дози (>3 мг/кг).
- У разі розвитку серцевої недостатності терапію слід припинити й більше не починати.
Етанерцепт
Етанерцепт — рекомбінантний химерний білок рецептора ФНП людини та p75Fc, отриманий за технологією рекомбінантої ДНК методом генної інженерії (в Україні зареєстровано препарат Енбрел® 25 або 50 мг етанерцепту у розчині для ін’єкцій у попередньо наповненому шприці-ручці у комплекті з розчинником та стерильним комплектом для ін’єкцій № 4 у пластиковому контейнері виробництва компанії «Файзер Ейч. Сі. Пі. Корпорейшн». Р.п. № UA/13011/01/01 від 03.07.2013).
Показання до застосування:
РА: в комбінації з метотрексатом, коли відповідь на базисну терапію недостатня, як монотерапія при непереносимості метотрексату, чи у разі, коли тривале лікування метотрексатом не потрібно, а також для лікування тяжкого активного та прогресуючого РА у дорослих пацієнтів, які раніше не отримували терапію метотрексатом; поліартикулярний ювенільний ідіопатичний артрит у дітей та підлітків віком старше 2 років, у яких виявлено недостатню ефективність або непереносимість метотрексату; ПсА активний та прогресуючий у разі недостатньої відповіді на базисну терапію; тяжкий активний АС при недостатній ефективності традиційної терапії; помірний або тяжкий бляшковий псоріаз із наявністю протипоказань та непереносимістю іншої системної терапії або якщо це лікування було неефективним; лікування хронічного тяжкого бляшкового псоріазу у дітей та підлітків віком старше 6 років, у яких при використанні інших методів системної терапії або фототерапії не досягнуто достатнього контролю над перебігом захворювання або відмічено непереносимість такого лікування. Спосіб застосування та дози: препарат вводять підшкірно, перед застосуванням слід нагріти до кімнатної температури (залишити при кімнатній температурі на 10–15 хв). Рекомендована доза 25 мг 2 рази на тиждень або 50 мг 1 раз на тиждень. При бляшковому псоріазі аналогічно або альтернативно можна застосовувати 50 мг 2 рази на тиждень не більше 12 тиж. При поліартикулярному ювенільному ідіопатичному артриті у дітей віком старше 2 років слід застосовувати дозу 0,4 мг/кг маси тіла (максимальная разова доза 25 мг) 2 рази на тиждень. При бляшковому псоріазі у дітей віком старше 6 років — доза 0,8 мг/кг (максимальна разова доза 50 мг) 1 раз на тиждень не більше 24 тиж.
Протипоказання:
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин. Сепсис або ризик його виникнення. Активні інфекційні процеси, включаючи хронічні або локалізовані інфекції.
Побічна дія: інфекції, алергічні реакції, зуд, реакції у місці введення.
Особливості застосування: з обережністю слід застосовувати у пацієнтів із рецидивуючими або хронічними інфекціями, при гепатитах В та С, злоякісних новоутвореннях та гематологічних порушеннях в анамнезі, не можна починати лікування при активному туберкульозі, не можна застосовувати живі вакцини одночасно з лікуванням.
Взаємодія з іншими лікарськими засобами: одночасне застосування з анакінрою, абатацептом та сульфалазином не рекомендується. Не слід змішувати етанерцепт з іншими лікарськими засобами. Категорія відпуску: за рецептом.
Адалімумаб
- Може застосовуватися в комбінації з синтетичними БПЗП (метотрексатом) або у монотерапії.
- Ефективний у пацієнтів із недостатньою відповіддю на синтетичні БПЗП при РА, ювенільному ідіопатичному артриті, ПсА, у пацієнтів з АС.
- Ефект від призначення слід очікувати орієнтовно через 12 тиж.
- При РА адалімумаб зменшує ознаки та симптоми захворювання, зумовлює індукцію клінічної ремісії, пригнічує прогресування структурного ушкодження суглобів та сприяє покращенню функціонального стану.
Показання:
- РА середнього та високого ступеня активності.
- Поліартикулярна форма ЮРА у дітей віком від 4 до 17 років середнього та високого ступеня активності.
- ПсА.
- Активний АС.
Протипоказання:
- Підвищена чутливість до адалімумабу чи будь-якого іншого компонента препарату.
Дозування:
- При РА, ПсА, АС: 40 мг підшкірно кожні 2 тиж. У разі недостатньої ефективності при РА допускається зменшення інтервалу між введеннями до 1 тиж.
- При ЮРА: 24 мг/м2 до 40 мг кожні 2 тиж або при масі тіла від 15 до 30 кг — 20 мг кожні 2 тиж, при масі тіла ≥30 кг — 40 мг кожні 2 тиж.
Рекомендації щодо застосування та застереження:
- До, під час та після лікування адалімумабом пацієнт потребує уважного спостереження з огляду на можливість розвитку інфекцій (у тому числі й туберкульозу).
- До початку лікування адалімумабом пацієнти мають бути обстежені на наявність активного та латентного туберкульозу: слід виконати пробу Манту і рентгенографію грудної клітки.
- Лікування адалімумабом не проводять за наявності активного туберкульозу.
- У разі латентного туберкульозу перед початком лікування адалімумабом необхідно провести специфічне профілактичне лікування.
- У всіх пацієнтів слід виключити наявність злоякісного новоутворення шкіри до та під час застосування адалімумабу.
- Годування грудьми не рекомендується протягом 5 міс після останньої ін’єкції адалімумабу матері у період вагітності.
- Слід обережно призначати адалімумаб пацієнтам — носіям HBV, а у разі призначення — уважно спостерігати за появою ознак та симптомів реактивації HBV.
- Пацієнтам, які отримують адалімумаб, можна проводити вакцинації, за винятком живих вакцин.
- Адалімумаб необхідно з обережністю застосовувати у пацієнтів із хронічною серцевою недостатністю.
Імуноглобулін
- Дані, що свідчать про ефективність імуноглобуліну, відсутні.
- Рутинне застосування не рекомендується.
Системна ензимотерапія
- Має протизапальний, імуномодулюючий, вторинний анальгезивний ефект.
- Може бути використана при РА у монотерапії або в комбінації з НПЗП, базисною терапією та ГК.
Рекомендації щодо застосування:
Надзвичайно важливим у лікуванні пацієнтів з ОА є підбір базових симптоматичних повільно діючих засобів, які виявляють модифікуючу дію та сповільнюють втрату хрящової тканини.
До засобів, внесених до списку клінічних рекомендацій EULAR та прийнятих на Українському конгресі ревматологів 18–20 жовтня 2005 р., належать:
Хондроїтину сульфат
- Хондроїтину сульфат має стандартизоване виробництво. Молекули хондроїтину сульфатів типу А та С властиві лише людині, мають низьку молекулярну масу (17 kD) та доведену біодоступність, завдяки чому вибірково накопичуються в хрящовій тканині.
- Численними дослідженнями показана висока активність хондроїтину сульфату при остеоартриті, дегенеративних захворюваннях хребта (остеохондроз, спондилоартроз).
- Вплив хондроїтину сульфату на розвиток та прогресування деструкції хрящової тканини біохімічно пояснюється його біодоступністю до хондроцитів, які стимулюють біосинтез та інгібують деградацію протеогліканів.
- Доведена його потенційна хондромодифікуюча дія, пов’язана з пригніченням катаболічних (залежних від ІЛ-1 процесів синтезу прозапальних простагландинів) та активацією анаболічних (синтез протеоглікану та гіалуронової кислоти, пригнічення апоптозу хондроцитів) процесів хряща.
- Значно покращує функціональну здатність суглобів.
- Ефективно зменшує вираженість больового синдрому.
Рекомендації щодо застосування:
- Застосовують у добовій дозі 1000 мг всередину (по 1 капсулі 2 рази на добу).
- Рекомендована тривалість початкового курсу терапії — 6 міс.
- Тривалість ефекту післядії становить ≈4–5 міс і залежить від стадії захворювання.
- Зменшення вираженості болю спостерігається вже протягом 1-го місяця лікування.
- Виявляє хорошу переносимість, зіставну із плацебо.
Основні показання до застосування: дегенеративні захворювання суглобів (ОА) та хребта (міжхребцевий остеохондроз, спондилоартроз).
Глюкозаміну сульфат
- Природний компонент суглобового хряща, за хімічною структурою — аміномоносахарид, з низькою молекулярною масою. Виявляє структурно-модифікуючу дію (анаболічну та антикатаболічну дію) та симптомо-модифікуючий ефект — зменшує вираженість болю та покращує функцію суглобів (протизапальна дія).
- Стимулює синтез хондроцитами повноцінних глікозаміногліканів та гіалуронової кислоти сіновіальної рідини, які в сукупності становлять протеоглікани.
- Пригнічує ензими (колагеназу, фосфоліпазу А2 та ін.), що викликають деструкцію хрящової тканини.
- Запобігає виникненню супероксидних радикалів, пригнічує активність лізосомальних ферментів.
- Ініціює процес фіксації сірки під час синтезу хондроїтинсірчаної кислоти та сприяє нормальному відкладенню кальцію в кістковій тканині.
- Запобігає пошкоджувальній дії ГК на хондроцити та порушенню синтезу глікозаміногліканів, індукованому НПЗП.
Рекомендації щодо застосування:
- Саше (1500 мг глюкозаміну сульфату) розчинюють у 200 мл води, приймають за 20 хв до їди протягом 4–12 тиж. За призначенням лікаря курс терапії можна повторювати з інтервалом 2 міс.
- Розчин для в/м введення (глюкозаміну сульфату 400 мг/2 мл в ампулі) вводять 1 раз на 2 дні (або 2 рази на тиждень) протягом 4–6 тиж.
Основні показання до застосування: ОА різної локалізації (у тому числі міжхребцевий остеохондроз, спондилоартроз та ін.), а також хондромаляція надколінка, лопатково-плечовий періартрит.
Діацереїн
- Виявляє антикатаболічну дію — інгібує продукцію ІЛ-1 макрофагами та синовіоцитами, пригнічує синтез металопротеаз у хрящовій тканині.
- Виявляє анаболічну дію — стимулює синтез протеогліканів, глікозаміногліканів та гіалуронової кислоти.
- Зменшує вираженість запалення синовіальної оболонки та пошкодження хряща.
Рекомендації щодо застосування:
- Застосовують у добовій дозі 100 мг всередину (по 50 мг 2 рази на добу).
- Тривалість лікування визначається індивідуально (від 2–6 міс до декількох років).
- Ефект від лікування зберігається протягом 0,5–1 року після припинення терапії.
Основні показання до застосування: дегенеративні захворювання суглобів (ОА) та хребта (міжхребцевий остеохондроз, спондилоартроз).
Комбінована терапія БПЗП
Використовують три основних варіанти комбінованої терапії:
- Починати лікування з монотерапії з подальшим призначенням одного або декількох БПЗП (протягом 8–12 тиж) при збереженні активності (step up).
- Починати лікування з комбінованої терапії з подальшим переходом на монотерапію (через 3–12 міс) при пригніченні активності процесу (step down).
- Проведення комбінованої терапії протягом усього періоду хвороби.
Переваги комбінованої терапії над монотерапією чи певною стратегією комбінованої терапії не доведені.
Є дані про більш високу ефективність комбінованої терапії — метотрексат і циклоспорин, метотрексат і лефлуномід, метотрексат та інфліксимаб, потрійна терапія метотрексатом, сульфасалазином з/без гідроксихлорохіну — порівняно із монотерапією.
За даними інших авторів, комбінована терапія метотрексатом і сульфасалазином або метотрексатом та циклоспорином має таку саму ефективність, але більш високу токсичність порівняно з монотерапією метотрексатом (табл. 10.24).
Таблиця 10.24
Ефективність базових препаратів при ревматичних захворюваннях: комбінована терапія
|
Препарат |
Симптоми |
Функція |
Рентгенологічне прогресування |
|
Одночасна |
|||
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
+ |
|
|
+ |
+ |
+ |
|
|
Метотрексат + анакінра |
+ |
+ |
? |
|
Послідовна |
|||
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
– |
|
|
+ |
+ |
+ |
|
На ранніх стадіях ревматичного захворювання комбінована терапія (як один з її компонентів обов’язково використовується метотрексат) більш ефективна, ніж монотерапія будь-яким іншим БПЗП, але частіше розвиваються побічні ефекти. З цього приводу необхідний більш ретельний моніторинг токсичних реакцій, ніж при проведенні монотерапії.
Вважають, що у пацієнтів із тяжким перебігом ревматичного захворювання лікування слід починати з комбінованої терапії, а у осіб із помірною активністю — з монотерапії з подальшим переводом на комбіновану терапію при недостатній ефективності лікування.
Найбільш перспективний метод комбінованої терапії на будь-якій стадії — комбінація метотрексат + інфліксимаб.
Терапія невідкладних станів при ревматичних хворобах
Лікування аутоімунного кризу у хворих на системний червоний вовчак без ураження нирок
При хронічному чи під гострому перебігу СЧВ без ураження нирок стандартною терапією є преднізолон у низьких та середніх дозах у поєднанні з амінохіноліновими препаратами і НПЗП. Лікування метилпреднізолоном показане при недостатній ефективності стандартної терапії та з метою більш швидкого пригнічення активності. Такі прояви захворювання, як лихоманка, адгезивний або ексудативний полісерозит, міокардит/ендокардит, поліартрит та міозит, еритематозне ураження шкіри — можуть повністю купіруватися при проведенні 3-денної класичної пульс-терапії, що включає 1000 мг метилпреднізолону в/в у 1-й, 2-й та 3-й день і 1000 мг циклофосфаміду — у 1-й день. Зазвичай досягнення повноцінного ефекту пульс-терапією у цих пацієнтів запобігає тривалому застосуванню преднізолону у середніх, а інколи і у високих дозах, що істотно знижує частоту побічних явищ гормональної терапії. В ряді випадків ефективне застосування метилпреднізолону у знижених дозах (100–250 мг/добу) із циклоспорином (5 мг/кг/добу) протягом 6 тиж. Також показаний плазмаферез.
Лікування у разі гематологічного кризу
У разі вираженої аутоімунної гемолітичної анемії (гемоглобін <70 г/л), глибокої тромбоцитопенії (<25 тис.) або панцитопенії проводиться 3-денна пульс-терапія (у деяких випадках доцільне її подовження до 5 днів) із подальшим призначенням метилпреднізолону всередину в дозі від 60 мг/добу. У тяжких випадках до лікування додають азатіоприн (100–150 мг/добу) або циклофосфамід (всередину 150–200 мг/добу, або в/в 800–1000 мг), або імуноглобулін (в/в по 0,5 г/кг маси тіла протягом 3–5 днів).
Лікування у разі церебрального кризу
Будь-які ураження нервової системи можливі у пацієнтів із СЧВ на будь-якій стадії захворювання. У ряді випадків нейролюпус визначає перебіг, тяжкість і життєвий прогноз. Важливо диференціювати вовчакові походження симптоматики від індукованої лікарськими засобами. До найтяжчих клінічних проявів ураження ЦНС при СЧВ належать гострі цереброваскулярні порушення (ішемія, геморагія, емболія), енцефалопатія — вогнищева чи дифузна (парез, параліч, гіперкінез, епіприпадки, сопор, кома), мієлопатія (парапарез, тетрапарез, плегія), міастенічні та психопатологічні синдроми.
Ефективність застосування ГК всередину, навіть у високих дозах (≥1 мг/кг маси тіла) дискутується. У разі неефективності пероральної терапії пульс-терапію метилпреднізолоном призначають протягом 3–5 діб. У найтяжчих випадках (сопор, кома, судоми) лікування доцільно починати з пульс-терапії. У цьому разі використовують комбінацію метилпреднізолону та циклофосфаміду, причому для досягнення клінічного ефекту в деяких випадках в/в введення метилпреднізолону і циклофосфаміду продовжується протягом 5–10 діб (до 10 г метилпреднізолону та 2 г циклофосфаміду). Більш ефективне синхронне застосування плазмаферезу та пульс-терапії метилпреднізолоном із циклофосфамідом. Плазмаферез із синхронним в/в введенням метилпреднізолону 500–1000 мг та циклофосфаміду 200–1000 мг проводять у разі мозкової коми чи судомного синдрому. Застосовують через 1–2 дні (до 5 сеансів), циклофосфаміду сумарно не більше 2 г. Для досягнення більш вираженого ефекту та профілактики інфекційних ускладнень після останнього сеансу призначають в/в імуноглобулін 0,5 мг/кг маси тіла.
Подовжена схема лікування включає циклофосфамід в/в 2 г/тиж протягом 4 тиж, потім — 200 мг 1 раз на тиждень протягом 2–2,5 року.
Вовчаковий нефрит
При найбільш прогностично несприятливому і тяжкому вовчаковому нефриті терапія ГК, безумовно, займає одне з центральних місць. Однак ефективність лікування здебільшого залежить від тривалості нефриту, вираженості ниркової недостатності, морфологічних змін у клубочках нирок. Пероральна доза ГК зазвичай становить від 0,5–1 мг/кг маси тіла в комбінації з азатіоприном, циклофосфамідом (всередину або в/в), мікофенолової кислоти (1–2 г/добу).
Згідно з деякими даними, застосування 3-денної пульс-терапії на ранніх стадіях хвороби при мінімальних змінах ниркової тканини (здебільшого ІІІ морфологічний клас за класифікацією ВООЗ) зазвичай приводить до швидкого, істотного і тривалого (до кількох років) поліпшення або навіть зникнення клініко-лабораторних ознак ураження нирок. У хворих з активним, швидко прогресуючим типом нефриту класична пульс-терапія нерідко приводить до зникнення протеїнурії, еритроцитурії, набряків, покращання азотовидільної функції нирок та нормалізації артеріального тиску. Однак ефект зазвичай буває нестабільним і найбільш виправданим методом лікування цих хворих є програмне застосування пульс-терапії метилпреднізолоном та циклофосфамідом. Щомісячні інфузії метилпреднізолону та циклофосфаміду в ударних дозах на сьогодні визнаються найбільш ефективним методом лікування дифузно-проліферативного вовчакового нефриту.
Частота і тривалість інфузій циклофосфаміду з метилпреднізолоном у хворих із прогресуючим вовчаковим нефритом може варіювати. Зазвичай щомісячні інфузії 1000 мг метилпреднізолону та 1000 мг циклофосфаміду проводять протягом 6 міс та далі — щоквартально протягом 2 років. Тривалість програми і кратність інфузій залежить від швидкості досягнення стійкого ефекту, перш за все нормалізації азотовидільної функції нирок і артеріального тпску. Лімітує проведення програми розвиток побічних реакцій та ускладнень. Найбільш частими причинами зупинення програми є інфекції, лейкопенія, аменорея. Комбінована програмна пульс-терапія може бути неефективною у разі прогресуючого гломерулосклерозу та деяких варіантів мембранозної нефропатії.
Лікування при інших критичних станах
Перебіг СЧВ може серйозно ускладнюватися розвитком ситуацій, що безпосередньо загрожують життю пацієнта. Критичні стани зазвичай відзначають у разі таких синдромів:
1. Геморагічний альвеоліт.
2. Цитопенічний криз із розвитком глибокої тромбоцитопенії (<20•109/л) та анемії.
3. Поперечний мієліт.
4. Судомні напади.
5. Енцефалопатія з розвитком коми.
6. Прогресування нефротичного синдрому зі швидким розвитком оліго-, анурії.
У разі розвитку критичних станів основна лікувальна тактика націлена на запобігання летальному кінцю, що може бути спричинений ураженням життєво важливих органів та систем. Для вирішення цього завдання застосування ГК у високих дозах малоефективне, у зв’язку зі сповільненим розвитком ефекту, а іноді й неможливістю застосування препарата всередину.
У разі встановлення критичного стану необхідно починати проведення пульс-терапії метилпреднізолоном у комбінації з циклофосфамідом. Пульс-терапію зазвичай проводять протягом 3–5 діб (сумарна доза циклофосфаміду — до 2 г) або більше, допоки стан стабілізується. При поперечному мієліті, комі, тромбоцитопенії, альвеоліті ефективність терапії підвищується при синхронізації пульс-терапії метилпреднізолоном та циклофосфамідом із процедурами плазмаферезу. У ряді випадків після завершення синхронної терапії доцільно використовувати в/в інфузії імуноглобуліну (0,3–0,5 г/кг) протягом 1–5 днів.
Окрему проблему становить курація хворих на СЧВ із несприятливим життєвим прогнозом. До факторів, що визначають несприятливий життєвий прогноз при СЧВ, належать початок захворювання у підлітковому віці, розвиток швидко прогресуючого нефриту із нирковою недостатністю на ранніх стадіях захворювання, артеріальна гіпертензія, тромбоцитопенія, ураження ЦНС, блискавичний васкуліт із генералізованим ураженням шкіри та слизової оболонки, висока імунологічна активність та кріоглобулінемія. Зазвичай у пацієнта спостерігається два чи більше обтяжуючих життєвий прогноз факторів. У таких випадках застосування класичної чи комбінованої програмної пульс-терапії буває малоефективне. Надію на подовження життя щонайменш на 10 років у цих хворих демонструє програмне синхронне застосування плазмаферезу із пульс-терапією метилпреднізолоном та циклофосфамідом. Синхронну інтенсивну терапію при виявленні несприятливих факторів необхідно починати якомога раніше і проводити протягом року. На першому етапі проводять 3 процедури плазмаферезу з інтервалом у 2–3 дні, після кожного сеансу вводять по 750–1000 мг метилпреднізолону, після другого — додається 1000 мг циклофосфаміду. Надалі процедури плазмаферезу синхронізовані із введенням метилпреднізолону та циклофосфаміду 1 раз на 1–3 міс. Лікування на другому етапі може змінюватися залежно від швидкості досягнення та стійкості клініко-лабораторного ефекту. Протипоказанням до проведення програмної синхронної інтенсивної терапії є гіпопротеїнемія, рецидивуючі інфекції, аменорея.
Особливості пульс-терапії у хворих на СЧВ:
- Обов’язкове призначення у разі загострення, при неефективності пероральних ГК.
- Раннє призначення при критичних станах.
- Програмне застосування метилпреднізолону та циклофосфаміду у хворих із дифузно-проліферативним вовчаковим нефритом.
- Синхронно із плазмаферезом у хворих із несприятливим життєвим прогнозом.
Катастрофічний антифосфоліпідний синдром
У дяких хворих із АФЛ може виникнути гострий або катастрофічний АФС, який характеризується розвитком судинних оклюзій багатьох органів за короткий період від декількох годин до 7 діб, що призводять до поліорганної недостатності та частим летальним кінцем. Катастрофічний АФС виділяють як особливий варіант, що потребує негайного інтенсивного лікування. Хворі з катастрофічним АФС мають загальні клініко-морфологічні ознаки:
1. Поліорганне ураження (≥3 органів): ураження нирок, нервової системи, шкіри та підшкірної клітковини, міокарда, надниркових залоз, печінки, кишечнику.
2. Морфологічні ознаки оклюзій багатьох органів.
3. Наявність АФЛ (під час розвитку тромбозів можуть бути негативними, що пов’язане із поглиненням антитіл).
4. Помірна тромбоцитопенія, гемолітична анемія, нейтропенія.
Основні принципи терапії при катастрофічній АФС спрямовані на лікування тромботичних ускладнень та профілактику останніх. Серед перших препаратів лікування — антитромботичні препарати прямої дії (гепарин, низькомолекулярні гепарини, гепариноїди, олігопептиди), інфузії свіжозамороженої плазми крові, фібринолізину, урокінази. У разі терапії при тромбозах артеріальних судин першочергова роль належить інгібіторам тромбоцитарного гемостазу (ацетилсаліциловій кислоті, інгібіторам тромбоксансинтетази та тромбоксановим рецепторам (ридогрель, пікотамід), блокатори тромбінових рецепторів (ваніпрост), антагоністи рецепторів ІІb/IІIa (абциксимаб, ептифібатид, тирофібан та ін.). У ряді випадків необхідне застосування похідних простацикліну — ілопрост, алпростадил.
Аутоімунні порушення у поєднанні зі змінами у плазмовій протеолітичній системі крові потребують проведення плазмаферезу та пульс-терапії метилпреднізолоном. Синхронну терапію проводять протягом 1–2 тиж. Плазма крові, що видаляється, заміщується свіжозамороженою, а доза метилпреднізолону в деяких випадках (у разі розвитку надниркової недостатності) може становити до 2 г/добу протягом 5–7 днів. Проведення пульс-терапії із циклофосфамідом можна обговорювати лише за відсутності інфекційних ускладнень. Задовільні результати спостерігаються у разі комбінації пульс-терапії та в/в імуноглобуліну (0,4 г/кг маси тіла протягом 5 діб).
Лікування хворих на системний васкуліт
Системні васкуліти — гетерогенна група захворювань, характерною ознакою яких є запалення судинної стінки. Клінічні прояви системного васкуліту залежать від калібру та локалізації судин і тяжкості супутніх запальних порушень.
ВП — некротизуюче запалення середніх та дрібних артерій без гломерулонефриту, або васкуліт артеріол, капілярів та венул.
Ведення хворих на ВП залежить від тяжкості та розповсюдженості судинної патології. У разі обмеженого ураження судин і відсутності ознак прогресування захворювання зазвичай добре контролюється середніми дозами ГК. При прогресуванні й тяжкому ураженні судин доцільно призначати комбіновану терапію ГК та цитостатиками.
Пульс-терапія метилпредпізолоном (3 дні по 15–20 мг/кг маси тіла з додаванням у 1-й день циклофосфаміду до 1000 мг) призначають у разі активного, тяжкого перебігу з підвищенням креатиніну >500 ммоль/л або з легеневими геморагіями. У ряді випадків проводять 7–10 сеансів плазмаферезу. Доведена ефективність повторювання протягом півроку курсів пульс-терапії метилпреднізолоном та циклофосфамідом.
Гранулематоз Вегенера — гранулематозне запалення респіраторного тракту та некротизуючий васкуліт, який уражає дрібні та середні судини, зазвичай поєднується із некротизуючим гломерулонефритом.
Стандартна терапія при гранулематозі Вегенера (за схемою A. Fauci) базується на пероральному прийомі циклофосфаміду по 2–3 мг/кг/добу в поєднанні із метилпреднізолоном (1 мг/кг/добу) протягом 1 міс з подальшим повільним зниженням дози. Можливе застосування метотрексату та циклоспорину.
Пульс-терапію зазвичай призначають хворим із генералізованою формою гранулематозу Вегенера, за наявності гломерулонефриту, тяжкого увеїту, деяких неврологічних розладів. Пульс-терапія метилпреднізолоном обов’язково комбінується з циклофосфамідом, призначеним в/в або всередину. Достатньо високу ефективність демонструє щомісячне застосування пульс-терапії, особливо у перші місяці захворювання.
Мікроскопічний поліангіїт — некротизуючий васкуліт, що уражає капіляри, венули, артеріоли, у клінічній картині якого домінують явища некротизуючого гломерулонефриту, рідше — легеневого капіляриту.
Лікування при мікроскопічному поліангіїті базується на ранньому застосуванні ГК та цитостатиків. При швидкому прогресуванні ниркової недостатності або проявів легеневих геморагій проводять комбіновану терапію, яка складається із курсів плазмаферезу, пульс-терапії метилпреднізолоном, циклофосфамідом та в/в імуноглобуліну.
Геморагічний васкуліт (васкуліт Шенлейна — Геноха) — васкуліт із IgA-депозитами, що вражає дрібні судини. Типовими є зміни з боку шкіри, суглобів, кишечнику та нирок. За наявності інфекції призначають антибіотики. Ураження шкіри та суглобів контролюється застосуванням НПЗП. Уразі тяжкого перебігу (абдомінальний синдром, кровохаркання, ураження нирок) можливе призначення пульс-терапії з подальшим переходом на ГК всередину. У ряді випадків ефективним є застосування плазмаферезу, циклоспорину, азатіоприну, гепарину, дезагрегантів.
Гігантоклітинний артеріїт — гранулематозний артеріїт аорти та її основних гілок, переважно екстракраніальних гілок сонної артерії, з частим ураженням сонної артерії. Часто поєднується із РПМ.
Основний метод лікування при гігантоклітинному артеріїті — застосування ГК у дозах 20 мг/добу. Лише у разі дуже тяжкого перебігу захворювання доза ГК може бути підвищена до 60–80 мг/добу або призначена пульс-терапія. Пульс-терапія повинна призначатись при несподівано розвиненій сліпоті або прогресуючій втраті зору. На доповнення до терапії ГК в окремих випадках може застосовуватись метотрексат, циклофосфамід, циклоспорин.
Артеріїт Такаясу (неспецифічний аортоартеріїт) — гранулематозне запалення аорти та її основних гілок. Мета лікування при артеріїті Такаясу — пригнічення гострого запалення в судинній стінці, профілактика можливих ускладнень та компенсування симптомів судинної недостатності. Основним методом лікування є застосування ГК у початковій дозі 1 мг/кг маси тіла з подальшим зниженням до підтримувальної. Ефективність лікування становить 20–100%. У разі тяжкого рецидивного перебігу доцільно проводити щомісячні курси пульс-терапії метилпреднізолоном та циклофосфамідом (9–12 міс) із застосуванням преднізолону у невисоких дозах усередину.
Пульс-терапію метилпреднізолоном, частіше в комбінації із циклофосфамідом та плазмаферезом, використовують для лікування при деяких інших системних васкулітах: ОТА (хвороба Вінівартера — Бюргера), есенціальному кріоглобулінемічному васкуліті, ангіїті шкіри, при синдромі Черджа — Стросс.
Особливості призначення пульс-терапії у хворих на системний васкуліт:
- У разі тяжкого перебігу захворювання.
- У комбінації з циклофосфамідом.
Лікування при хворобі Шегрена
Хвороба Шегрена — системне захворювання невідомої етіології, характерною рисою якого є хронічний аутоімунний процес в епітеліальних залозах із розвитком паренхіматозного силоаденіту та сухого кератокон’юнктивіту.
Основною морфологічною патогномонічною ознакою хвороби Шегрена, яка призводить до ураження секретуючих епітеліальних залоз, є вогнищева або вогнищево-дифузна лімфогістіоцитарна інфільтрація, що заміщає паренхіму та веде до деструкції протокової системи залоз. У половині випадків інфільтрація не обмежується тканиною екзокринних залоз та набуває генералізованого характеру із залученням до процесу м’язів, легень, нирок, судин, органів ретикулоендотеліальної системи з розвитком різної тяжкості системних проявів, трансформацією у 4–10% у злоякісні лімфопроліферативні захворювання.
Клінічні прояви хвороби Шегрена можна поділити на дві категорії: симптоми, що пов’язані з гіпофункцією секретуючих епітеліальних залоз (сухий кратокон’юнктивіт, ксеростомія, збільшення слинних та сльозних залоз, рецидивуючий паротит, хронічний атрофічний гастрит, сухість слизової оболонки носа, глотки, гортані, трахеї та ін.), та позазалозисті системні прояви захворювання (рецидивуючий неерозивний артрит, больові згинальні контрактури та дифузний набряк кистей, міозит, регіонарна чи дифузна лімфаденопатія, гепатоспленомегалія, псевдолімфома, лімфома, адгезивний або ексудативний серозит, інтерстиціальний пневмоніт, фокуси лімфоїдної інфільтрації легень, альвеолярний легеневий фіброз, канальцевий ацидоз, інтерстиціальний нефрит, гломерулонефрит, синдром Рейно, рецидивуюча гіпергаммаглобулінемічна та кріоглобулінемічна пурпура, виключно рідко — тромбоцитопенічна пурпура, виразково-некротичний васкуліт, периферична полінейропатія аксонального та демієлінізуючого типу, мононеврит, поліневрит, енцефаломієлополірадикулоневрит, поперечний мієліт, цереброваскуліт, порушення мозкового кровообігу, неврит лицьового, трійчастого нервів).
Зазвичай в основі прогресування та розвитку загрозливих життю системних проявів хвороби Шегрена є генералізований васкуліт або масивна лімфоплазмоцитарна інфільтрація органів і тканин.
Інтенсивну терапію необхідно застосовувати у разі кризового перебігу з метою зниження високої запальної та імунологічної активності, змінення характеру перебігу та покращання прогнозу захворювання.
Показання щодо проведення пульс-терапії метилпреднізолоном при хворобі Шегрена:
1. Довготривале масивне збільшення слинних залоз із наявністю лімфоїдної інфільтрації IV ступеня та синтезом моноклональних імуноглобулінів у біоптатах слинних залоз.
2. Випітний серозит.
3. Псевдолімфома, MALT(mucosa assiated lymphoid tissue) — лімфома, лімфоплазмоцитарна лімфома.
4. Фокуси лімфоїдної інфільтрації легень, альвеолярний легеневий фіброз.
5. Інтерстиціальний нефрит, імунокомплексний кріоглобулінемічний нефрит.
6. Виразково-некротичний васкуліт.
7. Мононеврит, поліневрит, енцефаломієлополірадикулоневрит, поперечний мієліт, цереброваскуліт.
8. Аутоімунна гемолітична анемія та тромбоцитопенія.
9. Тяжка медикаментозна алергія (кропив’янка, набряк Квінке, феномен Артюра).
10. За наявності протипоказань до застосування цитостатиків.
Слід відзначити, що використання пульс-терапії метилпреднізолоном із циклофосфамідом у багатьох випадках більш ефективне, однак, враховуючи участь у процесі печінки пацієнтів із хворобою Шегрена, перед застосуванням циклофосфаміду необхідно перевірити можливість розвитку гепатотоксичного ефекту. Пробно виконують в/м ін’єкцію 200 мг циклофосфаміду і на наступний день перевіряють рівень трансаміназ крові. При підвищенні трансаміназ вище норми від застосування циклофосфаміду в комбінованій пульс-терапії слід відмовитися. Пуль-терапію можна проводити за класичною схемою протягом 3 діб, у тяжких випадках (поліневрит, енцефаломієлополірадикулоневрит, гострий кріоглобулінемічний гломерулонефрит із швидко прогресуючою нирковою недостатністю, виразково-некротичний васкуліт, MALT-лімфома, лімфоплазмоцитарна лімфома) доза метилпреднізолону та циклофосфаміду, що вводять протягом місяця, може досягати 15 та 4 г відповідно. Необхідно ретельно контролювати гематологічні показники, враховуючи можливість мієлосупресії. У проміжках між курсами пульс-терапії, залежно від тяжкості системних проявів та лабораторної активності захворювання, пацієнти мають отримувати 10–60 мг преднізолону. Після досягнення клінічного ефекту та нормалізації показників запальної/імунологічної активності хворих переводять на підтримувальні дози преднізолону/метилпреднізолону та цитостатиків (хлорамбуцилу, циклофосфаміду). З метою зменшення вираженості побічних ефектів циклофосфаміду можливе застосування в/в струминного введення 6,0–8,0 мл гемодеривату з телячої крові депротеїнізованого перед крапельним введенням циклофосфаміду, а також рекомендувати пити велику кількість рідини.
У клінічній картині хвороби Шегрена можуть розвиватись так звані кризові стани. Такими кризовими станами є генералізований виразково-некротичний васкуліт, кріоглобулінемічний гломерулонефрит, поліневрит, цереброваскуліт, енцефаломієлополірадикулоневрит, поперечний мієліт, ішемія верхніх та нижніх кінцівок внаслідок некротизуючого васкуліту. Ці стани мають дуже швидкий перебіг і без використання інтенсивних методів лікування закінчуються летально чи призводять до тяжкої інвалідизації хворих.
Показання до проведення екстракорпоральної терапії при хворобі Шегрена:
Абсолютні:
1. Виразково-некротичний васкуліт.
2. Кріоглобулінемія з моноклональним РФ у кріопреципітатах.
3. Кріоглобулінемічний гломерулонефрит.
4. Енцефаломієлополірадикулоневрит, демієлінізуюча мієлопатія, поліневрит, ішемія верхніх та нижніх кінцівок внаслідок некротизуючого васкуліту.
Відносні:
1. Гіпергаммаглобулінемічна пурпура.
2. Мононеврит.
3. Медикаментозний дерматит, набряк Квінке, феномен Артюра.
4. Псевдолімфома.
5. Альвеолярний легеневий фіброз.
У разі алергічних реакцій, інтерстиціального нефриту з ознаками хронічної ниркової недостатності, а також при тяжких офтальмологічних проявах перевагу надають гемосорбції. В інших випадках системних проявів хвороби Шегрена більш ефективним є плазмаферез, кріоаферез та подвійна фільтрація плазми крові. При кріоглобулінемії краще використовувати кріоаферез та подвійну фільтрацію плазми крові. Зазвичай такі процедури виконують із 3–5-денними перервами. Після закінчення процедури вводять 250–1000 мг метилпреднізолону та 200–1000 мг циклофосфаміду залежно від тяжкості системних проявів хвороби Шегрена. За наявності гіпергаммаглобулінемічної пурпури проводять 3–5 процедур, при кріоглобулінемічній пурпурі — 7–10. Доцільне використання програмних курсів плазмаферезу протягом року до досягнення стійкої ремісії клінічних та лабораторних проявів васкуліту.
Інтенсивна терапія хвороби Шегрена сприяє розвитку стійкої ремісії у хворих із полісерозитом, аутоімунною гемолітичною анемією, гломерулонефритом, некротизуючим васкулітом, медикаментозним дерматитом, цереброваскулітом та сприяє більш сприятливому перебігу захворювання у хворих із моноклональною кріоглобулінемією, альвеолярним легеневим фіброзом, енцефаломієлополірадикулоневритом, поліневритом, MALT-лімфомою та лімфоплазмоцитарною лімфомою.
Особливості пульс-терапії при хворобі Шегрена:
- Класична пульс-терапія при рецидивуючому паротиті та кератокон’юнктивіті.
- Комбінована пульс-терапія метилпреднізолоном та циклофосфамідом у разі розвитку васкуліту.
- Синхронне проведення пульс-терапії та плазмаферезу при станах, що загрожують життю.
Лікування хворих на дермато-/поліміозит
Лікування пацієнтів із дермато-/поліміозитом засноване на тривалому прийомі всередину високих доз ГК-гормонів, 1,5–2 мг преднізолону на 1 кг маси тіла на добу. Саме ця терапія забезпечує здебільшого хороший результат із нерідкою багаторічною ремісією чи навіть видужанням. Пульс-терапія метилпреднізолоном за класичною схемою або в комбінації з циклофосфамідом може бути використана лише у двох клінічних ситуаціях:
- Порушення функції ковтання та дихання за рахунок ураження м’язів відповідних груп.
- При дермато-/поліміозиті з поширеним шкірним синдромом, що не купірується пероральним прийомом преднізолону (можливе поєднання з плазмаферезом та довенним імуноглобуліном).
Побічні ефекти та ускладнення пульс-терапії:
Із врахуванням механізму дії ГК-гормонів ударні дози метилпреднізолону мають відповідні й добре вивчені побічні ефекти та ускладнення (табл. 10.25).
Таблиця 10.25
Побічні ефекти та ускладнення пульс-терапії
|
Побічна дія |
Частота |
Профілактика |
Лікування |
|
Тахікардія |
Часто |
Седативні засоби |
Седативні засоби, атенолол |
|
Гіперемія |
Часто |
Седативні засоби |
|
|
Емоційне збудження |
Рідко |
Седативні засоби |
|
|
Брадикардія |
Рідко |
Немає |
Кардіотонічні засоби |
|
Гіпотонія |
Рідко |
Немає |
|
|
Гикавка |
Рідко |
Немає |
|
|
Ускладнення |
|||
|
Інфекції |
Часто |
Немає |
|
|
Артрити великих суглобів |
Рідко |
Немає |
|
|
Анафілаксія |
Вкрай рідко |
Анамнез |
|
|
Раптова смерть |
Вкрай рідко |
Протипоказання, похилий вік, хвороби серця |
Реанімація |
Побічні явища пульс-терапії метилпреднізолоном — зазвичай тахікардія та гіперемія обличчя, які в тому або іншому ступені спостерігаються у більшості хворих як безпосередньо під час інфузії, так і кілька годин поспіль (зрідка — до 2 діб). У підлітків та у пацієнтів, які мають схильність до тахікардії, профілактично призначають седативні засоби (оксазепам 5–10 мг). Тахікардія зазвичай легко купірується застосуванням 50 мг атенололу. Значно рідше виникають такі побічні явища, як емоційне збудження (безсоння), брадикардія та артеріальная гіпотензія. Застосування седативних та снодійних засобів швидко веде до нормалізації емоційного статусу і сну. Брадикардію та артеріальну гіпотензію відзначають не більш ніж у 1–2% випадків проведення пульс-терапії, зазвичай під час інфузії метилпреднізолону або в перші 1,5–2 год після її закінчення. При перших симптомах розвитку артеріальної гіпотензії та брадикардії — слабкості, запамороченні, нудоті, порушенні зору — необхідно швидко розпочати терапію кардіотоніками, у тяжких випадках застосовувати дексаметазон (16–40 мг в/в). Гикавка виникає вкрай рідко, однак може набувати затяжного характеру (від декількох годин до декількох діб). Купірується підшкірно введенням атропіну.
Серед ускладнень пульс-терапії на першому місці — частий розвиток інтеркурентних інфекцій (бактеріальних та вірусних), зазвичай спостерігається у слабких хворих, при тяжкому загостренні СЧВ, при програмному призначенні пульс-терапії у комбінації з циклофосфамідом. Артрит великих суглобів, зазвичай колінних, спостерігається у <1% хворих. Артрит зазвичай розвивається через декілька годин, рідше діб, після інфузії, купірується застосуванням 100–150 мг індометацину або диклофенаку. Анафілаксія та раптова смерть описані в літературі як поодинокі випадки. Профілактикою анафілаксії є ретельний збір анамнезу, при її розвитку негайне в/в введення дексаметазону 16–40 мг, норепінефрину. Відомі випадкі раптової смерті хворих, які отримували пульс-терапію. Це можливо на фоні шлуночкової аритмії, яка, у свою чергу, спричинена метаболічними порушеннями міокарда. Недоцільно призначати пульс-терапію при розвитку ішемічної хвороби серця, серцевої недостатності, тяжкої аритмії та неконтрольованої артеріальної гіпертензії. Із великою обережністю необхідно проводити пульс-терапію пацієнтам похилого віку. Для зниження ризику кардіальних ускладнень забороняється комбінування пульс-терапії з петльовим діуретиком — фуросемідом.
Місцева терапія при ревматичних хворобах
Методика проведення пункції великих та дрібних суглобів і внутрішньосуглобового введення медикаментозних препаратів
Показання: РА у дорослих та дітей, мікрокристалічний артрит, СЧВ та ЗЗСТ, посттравматичний артрит, ОА з явищами вторинного синовіту, суглобовий синдром при запаленнях кишечнику, ПСА, хворобі Рейтера, плечолопатковому періартриті, синдромі Тітце.
Протипоказання: загальні — бактеріємія, інфікування шкіри та підшкірних тканин в ділянці ін’єкції, гіпокоагуляційні порушення гемостазу; введення ГК — інфекційний артрит, гемартроз, внутрішньосуглобові переломи, остеохондропатія, супутні вірусні захворювання, відсутність ефекту від 2–3 введень у той самий суглоб.
Методика: процедура виконується з дотриманням правил асептики.
При пункції суглобів верхніх кінцівок хворий сидить, руки на столі, при пункції нижніх кінцівок — лежить на кушетці.
Плечовий суглоб. Зазвичай пунктують із передньої поверхні, при цьому щілину суглоба визначають між медіальним боком голівки плечової кістки та суглобовою впадиною лопатки — дещо нижче та латеральніше клювовидного відростка.
Ліктьовий суглоб. Зігнутий під прямим кутом суглоб пунктують із зовнішньобокової поверхні у заглибленні, яке визначається пальпаторно між ліктьовим відростком та надвиростком плечової кістки. Або — пункція з боку задньої поверхні через сухожилля триголового м’яза, над верхнім краєм ліктьового відростка та строго по центру.
Променезап’ястковий суглоб. Пальпаторно визначають заглиблення між сухожиллям власного розгинача II пальця та сухожиллям загального розгинача пальців, потім перпендикулярно вводять голку на глибину 1,5–2 см.
П’ястково-фалангові суглоби. Пальпаторно визначають суглобову щілину, для цього просять хворого розслабити кисть руки і проводять можливе зміщення у п’ястково-фаланговому суглобі. Тракцію пальців хворого проводять однією рукою, а другою роблять пункцію по лінії суглобової щілини, під сухожиллям розгинача.
Проксимальні міжфалангові суглоби. Витягнувши та зігнувши палець хворого під кутом у ≈45°, визначають суглобову щілину, потім роблять пункцію під сухожиллям розгинача.
Колінний суглоб. Хворий лежить на спині з максимально розігнутими колінними суглобами. Пальпаторно визначають верхній край надколінка і намічають точку вколювання на 1–1,5 см проксимальніше краю надколінка. Голку вводять перпендикулярно до зовнішньобокової поверхні суглоба та паралельно до столу чи кушетки, на якій лежить хворий.
Гомілковостопний суглоб. По тильній поверхні суглоба уявно проводять лінію, яка об’єднує нижні кінці гомілок, ділять на три частини. На межі зовнішньої та середньої третини і на 1 см вище неї проводять пункцію (у напрямку до п’яткової кістки) на глибину 2–3 см. При правильному введенні голки в суглоб лікар відчуває її «провал».
Таранно-п’ятковий суглоб. Пальпаторно визначають заглиблення нижче латеральної гомілки, голку вводять на глибину 2–3 см у напрямку до медіального боку стопи.
Плеснофалангові та міжфалангові суглоби стоп. Пункцію проводять із дорзальної поверхні з медіального або латерального боку, під сухожиллям розгинача пальців, тракція пальців полегшує маніпуляцію.
Ускладнення: збільшення вираженості болю в суглобі, збільшення набряку протягом декількох годин (до 2 діб), інфікування суглоба, атрофія підшкірної основи, атрофія м’язів біля місця ін’єкції, депігментація шкіри, гіпертензія, підсилення глікемії у хворих на цукровий діабет, порушення менструального циклу, стероїдна артропатія, остеонекроз, розриви сухожиль, відчуття жару, почервоніння обличчя та верхньої частини тулуба, панкреатит, субкапсулярна катаракта.
Методика проведення періартикулярних блокад
Показання: виражений больовий синдром при ураженнях білясуглобових тканин: капсуліт, бурсит, осифікуючий тендиніт.
Протипоказання: ознаки мацерації, рани, інфікування шкіри та підшкірної основи в ділянці ін’єкції, індивідуальна непереносимість препаратів, бактеріємія, значні гіпокоагуляційні порушення гемостазу.
Основною вимогою до проведення місцевої ін’єкційної терапії є суворе виконання правил асептики. Необхідно дотримуватися таких рекомендацій:
1. Використовувати лише одноразові шприци та голки.
2. Використовувати лише ампульні препарати з дозуванням для одноразового введення, повторне застосування препарату з відкритої ампули заборонене.
3. Руки лікаря мають бути вимиті як для хірургічної маніпуляції, сухі (краще у стерильних рукавичках).
4. В жодному разі не можна торкатися голки. Особливої уваги потребує направлення голки у суглобову порожнину.
5. Набирають лікарські препарати однією голкою, а введення лікарських засобів проводять іншою.
6. Маркують місце укола фломастером або ручкою, потім обробляють місце введення тампоном з антисептиком.
7. Шкіра у місці ін’єкції має бути без ознак ушкодження (мацерації, рани та інші ушкодження шкіри), шкіра обробляється 5% розчином йоду, потім — 70% спиртовим розчином. Після закінчення процедури місце ін’єкції прикривають тампоном, змоченим у спирті, на 2 год.
Періартикулярні блокади використовують при ураженні білясуглобових тканин — капсуліту, бурситу, осифікуючого тендініту — і полягає в інфільтрації больових зон анальгезивною та анестезувальною сумішшю. У хворих на ОА проводять дифузну інфільтрацію перипателярних м’яких тканин сумішами знеболювальних засобів. Інфільтрацію медіальної бокової зв’язки виконують впродовж суглобової лінії, що відповідає місцю кріплення медіального меніска.
Тести для самоконтролю
- Яка мета курортного лiкування хворих на РА?
- вплив на загальну реактивнiсть
- вплив на iмунну реактивнiсть
- покращання функцiї суглобiв
- проведення iндивiдуального лiкування
- лікування, спрямоване на активність процесу
- На якi курорти направляють пацієнтів із РА?
- П’ятигорськ, Трускавець, Юрмала
- Євпаторiя, Юрмала, Поляна
- Трускавець, Миргород, Хмільник
- Юрмала, Єсентуки, Закарпаття
- Євпаторiя, Хмільник
- Трускавець
- Завдання курортного лiкування:
- покращання функцiї суглобiв
- загальне змiцнення органiзму хворого
- покращання процесiв обмiну
- покращання iмунологiчної реактивностi
- лікування захворювання
- Хто проводить медичний вiдбiр пацієнтів із РА на санаторно-курортне лiкування?
- дiльничий лiкар
- ревматолог
- завідувач терапевтичного вiддiлення полiклiнiки
- ординатор ревматологiчного стацiонару
- фізіотерапевт
- Якi показання для направлення пацієнтів із РА на курорт?
- суглобова форма РА в неактивнiй фазi I чи II ступеня активностi, функціональна недостатність I–II класу
- при поєднаннi РА з ОА
- при поєднаннi РА з вадою серця без кардиту
- високий ступінь активності
- загострення процесу
- Якi курорти з радоновими ваннами прийнятнi для лiкування хворих на РА?
- Трускавець, Поляна, Миргород
- Синяк, Саки, Мацеста
- Сонячне Закарпаття, Ейськ, Феодосiя
- ПБК, Одеса, Бердянськ
- Хмільник
- Якi курорти із сiрчановодневими джерелами прийнятнi для лiкування хворих на РА?
- Одеса, Миргород
- Поляна, Трускавець, Моршин
- Синяк, Немирiв, Любень Великий
- Феодосiя, Поляна
- Хмільник, Бердянськ, Квiтка Полонини
- Якi грязевi курорти використовують при лiкуваннi хворих на РА?
- Миргород, Моршин, Хмільник
- Трускавець, Поляна, ПБК
- Одеса, Бердянськ, Євпаторiя, Саки
- Синяк, Немирiв, Сочi
- Бiлокуриха, Ейськ, Феодосiя
- Якi курорти показанi пацієнтам із РА в поєднаннi з порушенням обмiну речовин, кардiосклерозом?
- Хмільник, Цхалтуба, П’ятигорськ Поляна, Миргород
- ПБК, Одеса, Сонячне Закарпаття
- Кисловодськ Бердянськ, Феодосiя
- Якi курорти показанi пацієнтам із РА в поєднаннi з хворобами органiв травлення?
- П’ятигорськ, Єсентуки
- Поляна, Сонячне Закарпаття
- Феодосiя, Бердянськ
- Трускавець, Моршин
- Одеса
- Якi курорти показанi пацієнтам з РА та хворобами периферичної нервової системи?
- Залізноводськ
- Саки, Євпаторiя, Одеса
- Миргород
- Трускавець
- Моршин
- Хворi зi стiйкою артралгiєю та невираженими ексудативними змiнами в суглобах направляються на курорти:
- Синяк, Сочi, Мацеста
- Євпаторiя, Саки, Одеса
- ПБК, Євпаторiя, Бердянськ
- Хмільник
- Феодосiя, Поляна, Слав’янськ
- Феодосiя
- Яка iз названих груп препаратiв найчастіше призводить до утворення виразок ШКТ?
- ГК
- амiнохiнолiновi препарати
- пенiциламiни
- цитостатики
- хондропротектори
- До ускладнень протизапальної терапiї при ревматичних захворюваннях належать:
- виразки ШКТ
- загострення хронiчного холециститу
- загострення хронiчного панкреатиту
- цироз печiнки
- Яка тактика призначення НПЗП хворим із загостренням виразки дванадцятипалої кишки?
- не призначати їх взагалі
- призначати препарати короткими курсами
- призначати НПЗП ректально або внутрішньом’язово
- призначати препарати пiсля прийому їди
- призначати препарати в першу половину дня
- При яких захворюваннях, крiм неспецифічного виразкового коліту, застосовують сульфасалазин як базисний засiб?
- РА
- РА, хронічний перебіг
- ВП
- синдром Шарпа
- АС
- Можливi ускладнення терапiї із застосуванням ГК:
- синдром слабкості синусного вузла
- тахікардiя
- АВ-блокада
- синоаурикулярна блокада
- внутрішньошлуночкові блокади
- Найчастішим ускладненням при терапiї НПЗП у ревматологiї є:
- утворення виразки у шлунку, кишечнику
- малiгнiзацiя виразки у шлунку
- симптоми вiдмiни
- затримка рiдини
- алергiчнi реакцiї
- За номенклатурою доз ГК пульс-терапією є:
- <10 мг
- 10–30 мг
- 30–100 мг
- >100 мг
- >250 мг
- Як класифікуються дози ГК?
- низькі
- фізіологічні
- середні
- високі
- дуже високі
- пульс-терапія
- До iмуносупресивних препаратів належать:
- Протипоказання до призначення циклофосфаміду:
- виражена мієлосупресія
- підвищена чутливість до циклофосфаміду
- період вагітності
- годування грудьми
- нефротичний синдром
- Протипоказання до призначення метотрексату:
- імунодефіцитні стани
- анемія
- асцит плеврит
- виражена мієлосупресія
- псоріаз
- Протипоказання до призначення метотрексату:
- вітряна віспа
- оперізувальний лишай
- стоматит
- пептична виразка шлунка чи дванадцятипалої кишки
- хвороба Крона
- Особливо чутливі до дії метотрексату клітини:
- злоякісних пухлин
- кісткового мозку
- ембріональні
- епітеліальні клітини слизової оболонки кишечнику
- епітеліальні клітини слизової оболонки сечового міхура
- кишкової флори
- При проведеннi цитостатичної терапiї ревматолог має керуватися такими правилами:
- достовiрнiсть дiагнозу
- виявлення протипоказань
- чітка оцiнка клiнiчних показань
- недостатня ефективнiсть ранiше проведеної терапiї
- припущення про наявнiсть у хворого системного васкулiту
- Протипоказання до призначення диклофенаку:
- похилий вiк хворого
- період вагiтності
- алергiчнi прояви
- водіння автомобіля
- перiод годування грудьми
- Показання до призначення пеніциламіну:
- РА
- хвороба Вільсона
- хвороба Рейтера
- отруєння солями важких металів
- первинний біліарний цироз
- Кальцій і вітамін D:
- рекомендуються для профілактики всім хворим, які застосовують ГК
- тривалість лікування обмежена
- стабілізують і сповільнюють швидкість зниження МЩКТ хребта
- рекомендується добова доза вітаміну D 800 МЕ, а елементарного кальцію — 1000–1500 мг
- тривалість лікування не обмежена
- Зазначте похiднi пропiонової кислоти:
- ГК впливають на органiзм таким чином:
- викликають катаболiзм бiлкiв
- викликають глюконеогенез i неолiпiдогенез
- пригнічують кiстково-мозкове кровотворення
- зумовлюють психотропну дiю
- Стимулюють кiстково-мозкове кровотворення
- Найчастiші побiчнi ефекти при тривалому застосуваннi ГК:
- ОП
- інгiбiцiя функцiї кори надниркових залоз
- активацiя iнфекцiї
- ожиріння, гіпертензія
- гіпотензія
Зразки відповідей: 1) 1, 2, 3, 4; 2) 5; 3) 1, 2, 3, 4; 4) 1, 2, 3, 4; 5) 1, 2, 3; 6) 5; 7) 3; 8) 3; 9) 1, 2, 3; 10) 1, 2, 3, 4; 11) 2; 12) 4; 13) 1; 14) 1; 15) 1; 16) 1, 2; 17) 2; 18) 1; 19) 5; 20) 3, 4, 5, 6; 21) 1, 2, 3, 5; 22) 1, 2, 3, 4; 23) 1, 2, 3, 4, 5; 24) 1, 2, 3, 4; 25) 1, 2, 3, 4, 5; 26) 1, 2, 3, 4; 27) 2, 3, 4, 5; 28) 1, 2, 4, 5; 29) 1, 3, 4, 5; 30) 1, 4, 5; 31) 1, 2, 4, 5; 32) 1, 2, 3, 4