ОСТРЫЙ, ПОДОСТРЫЙ, ХРОНИЧЕСКИЙ СИНОВИТ (I СТАДИЯ)
Клиническая картина
Начало заболевания РА чаще всего бывает подострое, реже — острое, еще реже оно с самого начала принимает хронический рецидивирующий характер. В большинстве случаев заболеванию предшествуют простуда, охлаждение, травма, физическое или психическое перенапряжение или же наличие постоянного очага хронической инфекции. Иногда без видимых причин возникают боль в одном, но чаще в нескольких суставах, утренняя скованность, припухлость суставов, ограничение движений. При осмотре: контуры суставов сглажены, дефигурированы, мягкие ткани над ними напряжены, функция нарушена.
При пальпации температура кожных покровов, как правило, повышена, отмечается разлитая болезненность, флюктуация, в коленном суставе определяется баллотирование надколенника. Вначале поражаются межфаланговые, пястно-фаланговые суставы, суставы запястья, стоп, коленные, затем — лучезапястные, локтевые, голеностопные и реже — тазобедренные.
Характерным для ревматоидного артрита является симметричность поражения суставов как нижних, так и верхних конечностей.
Функция суставов в I стадии заболевания ограничена в основном из за боли, обусловленной перерастяжением капсулы и рефлекторным напряжением мышц. Кроме локальных изменений со стороны опорно-двигательного аппарата выявляют нарушение общего состояния больных. Температура тела чаще всего субфебрильная, хотя при остром начале бывает высокой. Отмечается общая слабость, быстрая утомляемость, раздражительность, нарушается сон, аппетит. Характерным симптомом в ранней стадии РА, как указывают А.И. Нестеров, М.Г. Астапенко и другие, является симптом скованности в суставах по утрам.
Сердечные тоны приглушены, нередко прослушивается легкий систолический шум над верхушкой сердца, тахикардия, гипотония, одышка при незначительном физическом напряжении. На ЭКГ снижен вольтаж зубцов Р, Q и Т.
Со стороны желудочно кишечного тракта (ЖКТ) отмечают снижение секреторной функции желудка, диспептические явления, метеоризм, запор. Более чем у 35% больных выявляют нарушение функций печени, почечный синдром.
Нейротрофические нарушения появляются при РА также рано. Так, гипотрофию мышц, особенно разгибателей, удается выявить уже на 2 й неделе заболевания.
Осциллографическое исследование указывает на склонность к гипотонии, а капиллярография — на нарушение капиллярного кровообращения. При капилляроскопии фон мутный, капилляры сужены, ток крови замедлен. При сравнении капилляроскопических данных обеих конечностей зафиксирована незначительная асимметрия по степени сужения и количества капилляров в 1 мм. Проницаемость сосудистой стенки, как показала проба Нестерова, у всех больных оказалась повышенной.
Выраженность геморрагии имеет асимметричный характер. Измерение температуры кожи указывает на постоянное снижение ее в дистальных отделах конечностей с явной асимметрией. В области воспаленных суставов и прилегающих отделов кожная температура оказывается всегда выше нормы. У больных отмечают эмоциональную неустойчивость, симптомы депрессии, плаксивость. Это особенно выражено в острой стадии заболевания или при обострении процесса.
Исследование крови показало, что в начале заболевания развивается нейтрофильный лейкоцитоз с палочкоядерным сдвигом влево, а у некоторых больных постепенно развивается гипохромная анемия. У всех обследуемых, как правило, повышена СОЭ.
Информативными показателями являются биохимические исследования, так как в основе указанного заболевания лежат процессы дезорганизации и разрушения соединительнотканных структур с проникновением в кровь продуктов их распада и метаболитов.
Сниженные показатели антиэластазы как специфического ингибитора эластазы при I, II, III степени активности РА в I стадии заболевания. Хотя на начальных этапах ревматоидного воспаления иногда выявляют высокую концентрацию эластазы.
В I стадии РА отмечают рост α1 ингибитора протеаз (α1 ИП) и, наоборот, снижение α2 макроглобулина (α2 МГ), причем характер этих изменений не зависит от локализации патологического процесса, а обусловлен тяжестью заболевания, то есть, чем тяжелее его течение, тем выше степень активности ревматоидного воспаления и уровень α1 ИП и ниже α2 МГ.
В I фазе II стадии РА выявлено резкое повышение в сыворотке крови содержания белковосвязывающего оксипролина при всех степенях активности патологического процесса соответственно в 2,4; 3,2; 3,7; 4,7 раза выше нормы. Показатель пептидносвязывающего свободного оксипролина также значительно больше нормальных колебаний при 0, I, II, III степени активности РА соответственно в 2,2; 2,6; 3,1; 3,6 раза для пептидносвязывающего оксипролина и в 2,4; 2,7; 3,2; 4,3 раза — для свободного оксипролина. Кроме того, уровень белоксвязывающего, пептидносвязывающего и свободного оксипролина в I фазе II стадии РА был значительно выше, чем в I стадии заболевания.
Что же касается коллагенолитической активности катепсина В, коллагеназы и эластазы, то они также в I стадии РА значительно увеличены по сравнению с нормой при всех степенях активности ревматоидного воспаления, кроме активности коллагеназы при 0 степени активности РА, которая находилась в пределах нормы. Но следует отметить, что уровень и соотношение определяемых ферментов во ІІ и III стадии был выше, чем в I стадии РА. Так, коллагенолитическая активность катепсина В была выше нормы, чем в I стадии заболевания в 1,7; 2,5; 3,2; 3,4 раза, концентрация эластазы в 1,2; 1,3; 1,5; 1,9 раза выше нормы, коллагеназы — в 1,3; 1,4; 1,9 раза выше нормы. В отличие от I стадии РА во II стадии I фазы отмечали нормальные значения активности антиэластазы при всех степенях активности ревматоидного воспаления.
Нормальное содержание α1 ИП (0 степень активности) во II стадии I фазы РА постепенно увеличивалось при I, II и III степени активности патологического процесса (соответственно в 1,2; 1,3; 1,4 раза выше нормы), но было все же несколько ниже, чем в I стадии РА. Снижение α2 МГ проходило не так резко, как в I стадии заболевания, а отклонение от нормальных колебаний наблюдалось при I, II, III степени активности РА соответственно в 1,1; 1,2; 1,4 раза ниже нормы (табл. 3).
Таблица 3. Уровень активности метаболитов коллагена и ферментов сыворотки крови больных с РА (ІІ стадия I фаза)
| Степень активности метаболита коллагена | 0 | I | II | III |
| Белоксвязывающий оксипролин | 2,4 | 3,2 | 3,7 | 4,7 |
| Пептидносвязывающий оксипролин | 2,2 | 2,6 | 3,1 | 3,6 |
| Свободный оксипролин | 2,4 | 2,7 | 3,2 | 4,3 |
| Катепсин В | 1,7 | 2,5 | 3,2 | 3,4 |
| Эластаза | 1,2 | 1,3 | 1,5 | 1,9 |
| Коллагеназа | 1,0 | 1,3 | 1,4 | 1,9 |
| Антиэластаза | 1,0 | 1,0 | 1,0 | 1,0 |
| α1 ИП | 1,0 | 1,2 | 1,3 | 1,4 |
| α2 МГ | 1,0 | 0,9 | 0,8 | 0,8 |
В I фазе II стадии РА происходит повышение по сравнению с физиологической нормой процессов деструкции коллагена, но менее выраженное, чем в I стадии заболевания. В отличие от I стадии РА на 1 е место среди ферментов выходит катепсин В, содержание которого повышалось по сравнению с I стадией и достигало максимальных значений при I и III степени активности ревматоидного воспаления. Эластаза и коллагеназа в I фазе II стадии РА играют значительно меньшую роль, чем в I стадии заболевания, о чем свидетельствует более низкий уровень их концентрации по сравнению с выше указанными ферментами. Ведь воспалительный процесс в I фазе II стадии РА связан с действием кислых гидролаз, прежде всего с катепсином В.
I фаза II стадии РА характеризуется также повышенным уровнем в сыворотке крови α1 ИП как острофазового белка, но его значение меньше, чем в I стадии патологического процесса. Это, по видимому, можно объяснить более высокой концентрацией катепсина В, который является активатором α1 ИП. В I фазе II стадии РА изменение содержания α1 ИП и α2 МГ имело противоположное направление, а уровень их отклонения от нормальных колебаний также зависел от тяжести заболевания и степени активности ревматоидного воспаления.
В I фазе II стадии РА в сыворотке крови выявляли резко повышенный уровень биосинтеза коллагена при 0, I, II и III степени активности воспаления.
Таким образом, I фаза II стадии РА характеризуется повышенными по сравнению с физиологической нормой процессами деградации и биосинтеза коллагена, но, в отличие от I стадии, биосинтетические процессы преобладают над катаболическими. Причем максимальное нарушение равновесия между ними наблюдали при II и особенно III степени активности ревматоидного воспаления.
В I стадии РА в синовиальной жидкости выявлено значительное повышение содержания белоксвязывающего оксипролина (в 2,1; 2,6; 3,0; 3,3 раза выше нормальных значений показателей сыворотки крови), пептидносвязывающего оксипролина (в 2,6; 3,5; 4,1; 4,9 раза выше нормы) и свободного оксипролина (в 1,5; 2,1; 2,9; 3,4 раза выше нормы) при всех степенях активности ревматоидного воспаления. Причем уровень белоксвязывающего и пептидносвязывающего оксипролина был значительно выше, чем в сыворотке крови, а свободный оксипролин оставался практически таким же (табл. 4).
Таблица 4. Уровень активности метаболитов коллагена и ферментов синовиальной жидкости больных при I стадии РА
| Степень активности ферментов/метаболитов/коллагена | 0 | I | II | III |
| Белоксвязывающий оксипролин | 2Д | 2,6 | 3,0 | 3,3 |
| Пептидносвязывающий оксипролин | 2,6 | 3,5 | 4,1 | 4,9 |
| Свободный оксипролин | 1,5 | 2,1 | 2,9 | 3,4 |
| Катепсин В | 1,1 | 1,4 | 1,6 | 1,8 |
| Эластаза | 8,2 | 8,5 | 9,8 | 13,9 |
| Коллагеназа | 6,4 | 7,7 | 8,6 | 10,4 |
| Антиэластаза | 0,66 | 0,62 | 0,5 | 0,43 |
| α1 ИП | 2,8 | 3,4 | 3,7 | 4,6 |
| α2 МГ | 2,7 | 2,6 | 2,3 | 2,1 |
Исследование коллагенолитической активности катепсина В, активности коллагеназы и эластазы показали, что их уровень очень отличается от таковых в сыворотке крови. Так, отмечено резкое повышение активности, прежде всего, эластазы (в 8,2; 8,5; 9,8; 13,9 раза выше нормальных значений сыворотки крови) и коллагеназы (в 6,4; 7,7; 8,6; 10,4 раза выше нормы) в синовиальной жидкости при любой степени активности РА.
Коллагенолитическая активность катепсина В, наоборот, была ниже, чем в сыворотке крови, но все же превышала нормальные значения соответственно в 1,1; 1,4; 1,6; 1,8 раза. Кроме того, отмечено более выраженное снижение активности антиэластазы (в 1,5; 1,6; 1,9; 2,3 раза ниже нормальных значений сыворотки крови) по сравнению с сывороткой крови у пациентов с I стадией РА. Что касается α1 ИП и α2 МГ, то изменения заметно отличались от таковых в сыворотке крови. Так, α1 ИП и α2 МГ в синовиальной жидкости значительно превышали нормальные величины при всех степенях активности ревматоидного воспаления в отличие от сыворотки крови, в которой α2 МГ был ниже нормы. Отмечается значительное увеличение α1 ИП в синовиальной жидкости соответственно в 2,8; 3,4; 3,7; 4,6 раза выше нормы. Содержание α2 МГ, наоборот, постепенно уменьшалось при 0, I, II и III степени активности ревматоидного воспаления, но все же резко превышал нормальные колебания соответственно в 2,7; 2,6; 2,3; 2,1 раза.
Во II стадии I фазы РА в синовиальной жидкости также, как и в I стадии, отмечается повышение концентрации белоксвязывающего (в 3,9; 4,7; 5,7 раза виде нормы), пептидносвязывающего (в 4,5; 5,4; 6,3 раза выше нормальных значений сыворотки крови) и свободного оксипролина (в 2,3; 3,1; 4,0 раза выше нормы) при I, II и III степени активности патологического процесса.
Для II стадии I фазы РА в синовиальной жидкости характерны повышенные значения коллагенолитической активности катепсина В, коллагеназы, эластазы при I, II и III степени активности ревматоидного воспаления (табл. 5). Однако следует подчеркнуть, что их уровень и соотношения были иными, чем при I стадии РА. Так, выявляют дальнейший рост катепсина В в синовиальной жидкости соответственно в 1,8; 2,0; 2,5 раза выше нормальных показателей сыворотки крови.
Таблица 5. Уровень активности метаболитов коллагена и ферментов синовиальной жидкости больных в I фазе II стадии РА
| Ферменты и метаболиты коллагена | I | II | III |
| Белоксвязывающий оксипролин | 3,9 | 4,7 | 5,7 |
| Пептидносвязывающий оксипролин | 4,5 | 5,4 | 6,3 |
| Свободный оксипролин | 2,3 | 3,1 | 4,0 |
| Катепсин В | 1,8 | 2,0 | 2,5 |
| Эластаза | 7,3 | 8,2 | 9,5 |
| Коллагеназа | 5,8 | 7,3 | 8,7 |
| Антиэластаза | 0,7 | 0,55 | 0,52 |
| α1 ИП | 2,4 | 2,6 | 3,3 |
| α2 МГ | 2,7 | 2,5 | 2,2 |
Концентрация эластазы (в 7,3; 8,2; 9,5 раза выше нормальных показателей сыворотки крови) и коллагеназы (соответственно в 5,8; 7,3; 8,7 раза выше нормы), наоборот, несколько уменьшалась по сравнению с I стадией РА.
Активность антиэластазы в синовиальной жидкости в I фазе II стадии РА была также меньше нормальных величин при I, II, III степени активности ревматоидного воспаления, но их отклонение от нормы было меньше, чем в I стадии заболевания (в 1,4; 1,8; 1,9 раза ниже нормы).
У пациентов с РА в I фазе II стадии отмечают такую же динамику содержания α1 ИП и α2 МГ в синовиальной жидкости, как в I стадии, но уровень α1 ИП немного ниже (в 2,4; 2,6; 3,3 раза выше нормальных значений сыворотки крови), а α2 МГ — выше (в 2,7; 2,5; 2,2 раза выше нормы). Следовательно, специфические биохимические показатели в синовиальной жидкости имеют, в основном, те же закономерности, как и в сыворотке крови, но с некоторыми особенностями. Прежде всего, это касается уровня активности эластазы и коллагеназы, показатели которых в синовиальной жидкости намного превышают их значение в сыворотке крови здоровых людей и пациентов в I и IІ фазе II стадии РА. Коллагенолитическая активность катепсина В, наоборот, была несколько ниже по сравнению с показателями в сыворотке крови. Кроме того, уровень белоксвязывающего, пептидносвязывающего оксипролина, α1 ИП и α2 МГ в синовиальной жидкости пациентов с РА I фазе I и II стадии выше, чем в сыворотке крови, а концентрация свободного оксипролина и антиэластазы, наоборот, ниже. В синовиальной жидкости содержится очень большое количество нейтральных протеиназ, которые выделяются фагоцитирующими синовиальными и полиморфонуклеарными лейкоцитами, в частности, эластаза и коллагеназа.
Полученные данные свидетельствуют о том, что нарушение показателей метаболизма коллагена в разных группах проявляются с разной интенсивностью. При этом четко определяются 4 группы, которые соответствуют 0, I, II и III степени активности ревматоидного воспаления.
I стадия характеризуется повышенными по сравнению с физиологической нормой процессами деструкции и биосинтеза коллагена с некоторым преимуществом катаболической фазы.
Анализ биохимических показателей сыворотки крови у больных с РА I стадии показал, что деградация коллагена происходит, прежде всего, за счет эластазной активности, а затем коллагенолитической активности катепсина В и коллагеназы. Эластаза является наиболее деструктивным ферментом в этой стадии заболевания, имеет особенно важное значение на начальном этапе заболевания, играет существенную роль в патогенезе РА и распространении воспалительной реакции. Чем выше активность ревматоидного воспаления, тем выше концентрация эластазы.
В I стадии РА в сыворотке крови отмечается повышение α1 ИП (белок острой фазы воспаления), и, наоборот, снижение α2 МГ. Чем тяжелее протекает заболевание и выше степень активности ревматоидного воспаления, тем более высокий уровень α1 ИП и большее снижение α2 МГ.
В I фазе II стадии РА повышены по сравнению с физиологической нормой процессы деградации и биосинтеза коллагена, в то время как в I стадии биосинтетические процессы преобладают над катаболическими.
Кроме того, в этой фазе II стадии в сыворотке крови наибольшая роль в процессе распада коллагена принадлежит катепсину В (его уровень значительно выше, чем в I стадии). Итак, воспалительный процесс в I фазе II стадии РА связан с действием кислых гидролаз, в частности катепсина В.
В I фазе II стадии РА динамика α1 ИП и α2 МГ имеет те же закономерности, что и в I стадии заболевания, но их отклонения от нормы были значительно меньше.
В I стадии и I фазе II стадии РА нарушается динамическое равновесие между уровнем деградации и биосинтеза коллагена, который является одним из важных патогенетических механизмов РА. Выявлена адекватная связь между степенью нарушения соотношения процессов распада и биосинтеза коллагена и протеазо-ингибиторной системы с одной стороны и уровнем активности ревматоидного воспаления и тяжестью течения патологического процесса — с другой.
Следовательно, показатели метаболизма коллагена являются информативными, всесторонне и объективно отображающими патологические изменения, происходящие в соединительной ткани в целом, а также в очаге поражения (то есть в тканях пораженного сустава), и активность воспалительного процесса.
Иммунологическое исследование
Имуннологическое исследование больных с РА проводили с учетом стадии заболевания при наличии нарушений как со стороны гуморального, так и клеточного звена иммунитета.
Генетически детерминированная склонность к развитию ревматических болезней формируется генами главного комплекса гистосовместимости (ГКГ). ГКГ представлен системой HLA (Human Leukocyte Antigen).
Больные с РА в 90% являются носителями HLA DR1, или одного из трех вариантов HLA DR4 (Dw4, Dwl4, Dwl5).
Вместе с системой HLA важную роль в предрасположенности к развитию РА играют гены, кодирующие синтез Т клеточных клонотипичных рецепторов, гены, кодирующие синтез иммуноглобулинов, и гены, кодирующие синтез половых гормонов.
В настоящее время большое значение уделяется показателям циркулирующих иммунных комплексов (ЦИК), состоящих из иммуноглобулина G (IgG) и ревматоидного фактора.
Циркулирующие иммунные комплексы в норме не должны превышать 90 единиц оптической плотности.
У больных с РА значительно нарушается соотношение Т-лимфоцитов. При этом степень нарушения соотношения регуляторных субпопуляций Т-лимфоцитов (Т-хелперов и Т-супрессоров) не коррелирует с величинами уровня ЦИК. Происходит значительное увеличение по сравнению с нормой количества лимфоцитов и моноцитов и уменьшение (почти в 2 раза) соотношения резеткообразующих Т-лимфоцитов стабильных к Т-лимфоцитам активным (Ес/Еа) и теофиллинчувствительных Т-лимфоцитов к теофиллин резистентным (Етфч/Етфр) у больных с РА I стадии и I фазы II стадии по сравнению с такими же показателями у здоровых людей.
У больных с РА выявлено значительно снижение показателей гуморального звена иммунитета по сравнению с референтными значениями показателей IgА, IgМ, IgG. Показатели же ЦИК были почти в 2 раза выше по сравнению с нормой. Это указывает, что уже на ранних стадиях РА происходят значительные изменения в иммунной системе, а именно, повышение гуморального звена иммунитета и резкое снижение показателей клеточного звена (табл. 6).
Таблица 6. Показатели гуморального иммунитета у больных с синовитом ревматоидного генеза
| Лечение | Ig, г/л | Ig, г/л | lg, г/л | ЦИК |
| До лечения | 1,81±0,11 | 1,23±0,25 | 10,13±11,30 | 169,1±115,2 |
| После лечения | 1,69±0,34 | 1,24±0,27 | 10,08±11,63 | 18,71±20,1 |
| Норма | 2,3±0,5 | 1,3±0,5 | 12,7±12,8 | 90,0±10,0 |
Термографические исследования
Термографические исследования показали, что по характеру трофические и вегетативно трофические нарушения у больных с РА в I стадии протекают в виде двух фаз. При I фазе I стадии РА трофические нарушения локализуются преимущественно в области пораженных суставов, боль в которых носила переменный характер и исчезала на некоторое время после длительного пребывания пациента в постели. Отмечается отечность и пастозность мягких тканей, окружающих сустав. Боль в мышцах преимущественно локального характера. Тест флюктуации зависит от выраженности синовита и может быть отрицательным или положительным. У пациентов в зоне поврежденных суставов выявляют умеренное повышение коленного рефлекса. Дермографизм над поврежденным суставом становился яркокрасным, возникал через 5–7 с после нанесения раздражения и сохранялся на протяжении 3–4 мин.
При бесконтактной тепловизионной термодиагностике наблюдали локальное повышение температуры кожного покрова в зоне поврежденного сустава в пределах 32,2–34,5 °С. Коэффициент термоасимметрии был в пределах 1,2–2,2 °С. Таким образом I фаза трофических нарушений в I стадии РА отражает локальные (местные) изменения.
Во II фазе трофических нарушений I стадии РА боль в суставе имеет стойкий, постоянный характер. Мышечная боль распространяется на четырехглавую мышцу, мышцы голени. Мышцы больной конечности начинают терять тонус, нарастает общая слабость, повышается температура тела, увеличивается СОЭ и лейкоцитоз крови. Тест флюктуации положительный у всех пациентов. Повышается коленный рефлекс и умеренно повышается ахилловый и подошвенный рефлексы на больной конечности. После нанесения раздражения на коже над поврежденным суставом появляется разлитой красный дермографизм с неровными фесточатыми границами, удерживающийся на протяжении 5–6 мин. Развивается гиперестезия по типу «носка» в дистальных отделах нижних конечностей.
При бесконтактной тепловизионной термодиагностике отмечают повышение температуры поверхности кожи над суставом в пределах 33,4– 35,0 °С. Контуры очага воспаления имеют неровные края. В этой фазе воспалительного процесса начинается снижение температуры поверхности кожи в дистальных отделах конечностей до 28,0–29,6 °С. Таким образом, II фаза — это фаза нейротрофических нарушений.
У больных с РА в I фазе II стадии боль четко фокусируется в поврежденном суставе. Сустав увеличен в объеме, находится в рефлекторном вынужденном полусогнутом положении, что является пусковым механизмом развития контрактуры, отмечается положительный симптом флюктуации. В мышцах конечности развиваются гипотония и гипотрофия, особенно разгибателей. Снижаются коленный, ахилловый и подошвенный рефлексы пораженной конечности. Отмечается снижение болевой чувствительности в дистальных отделах. Дермографизм над пораженным суставом имеет вишнево синеватую окраску с признаками отека кожных покровов.
При бесконтактной тепловизионной термодиагностике в этой фазе патологического процесса проявляется симптом термоампутации в дистальных отделах конечностей. Температура кожи над пораженным суставом снижалась до 26,2–28,0 °С. Таким образом в I фазе II стадии РА можно говорить о фазе сегментарных нейротрофических нарушений.
Ультразвуковое исследование пораженных суставов позволяет диагностировать поражения синовиальной оболочки на ранней стадии РА и контролировать эффективность лечения. Исследования проводятся в режиме сонографии и допплерографии.
При I стадии заболевания происходит утолщение синовиальной оболочки пораженного сустава в пределах 4–6 мм, без явлений пролиферации, синовиальная жидкость однородна в большом количестве. У больных с РА в I фазе II стадии происходит значительная пролиферация синовиальной оболочки в пределах 6–12 мм с гроноподобными разрастаниями в полость сустава, при этом синовиальная жидкость остается однородной, но количество ее уменьшается.
Сонографическое исследование позволяет выявить количество жидкости, толщину синовиальной оболочки и толщину капсулы сустава.
При допплеровском исследовании больных в I стадии и в I фазе II стадии отмечают ускорение кровотока в синовии (линейная скорость в пределах 8–12 мм/с).
Сонография или ультразвуковое исследование пораженного сустава на ранних стадиях PA имеет важное диагностическое значение, так как позволяет определить выраженность пролиферации синовиальной оболочки, характер кровотока в ней и его линейную скорость, что является дифференцирующим тестом синовита ревматоидного генеза с синовитами другой этиологии и объективным контролем за эффективностью консервативного лечения больных. Кроме того, сонография или ультразвуковое исследование дают возможность своевременно определить показания к проведению оперативного лечения.
Показанием к синовэктомии является синовит, который не поддается консервативному лечению на протяжении 4–6 мес при утолщении синовиальной оболочки больше 4 мм (Бобко А.Н.).
Рентгеновские изменения в пораженных суставах отражают стадии РА и характеризуются остеопорозом, сужением суставной щели, костными разрастаниями, узурами. Возникает ограничение движений в суставе.
Как известно, биохимические сдвиги в организме больного и, в первую очередь, белковые проявляются рано. У больных в I стадии заболевания уровень общего белка сыворотки крови остается в пределах нормальных значений, хотя в литературе некоторые авторы (Кушелевский Б.П., 1938; 1961)
указывали на увеличение общего количества белка. Со стороны белковых фракций крови общепризнанным является уменьшение количества альбуминов и увеличение содержания глобулинов, в частности альфаи гаммаглобулинов со снижением альбумино глобулинового коэффициента. Белковые сдвиги в I стадии заболевания зависят от остроты течения процесса, то есть чем острее процесс, тем больше степень их выраженности. По выраженности диспротеинемического синдрома можно судить об активности и динамике процесса, а также о степени поражения соединительнотканных структур. Со стороны гликопротеидов сыворотки крови выявлена прямая зависимость между остротой и тяжестью процесса (Тихонравов В.А., 1959; 1962; Пихлак Э.Г., 1968 и др.).
Отмечается повышение дифениламинового показателя — ДФА — при остром и тяжелом течении процесса в начальных стадиях. Это объясняется усиленным разрушением мукополисахаридных комплексов соединительной ткани и наводнением сыворотки крови большим количеством гликопротеидов.
Исследования Анохина с соавторами (1957; 1962) показали, что С реактивный белок (СРБ) в ранней стадии заболевания выявляют у 82% больных и в острой стадии реакция на СРБ бывает резко положительной. Такого же мнения придерживаются В.Н. Дзяк и Б.Т. Безбородько (1967), которые положительную реакцию на СРБ выявили у 70% больных.
Ю.К. Токмачев и И.З. Вульсон (1960), В.И. Анохин с соавторами (1962) и другие отмечали, что при остром течении процесса с явлениями выраженной экссудации нередко отмечают отрицательную реакцию гемагглютинации Ваале – Роузе, в то время как при длительном течении процесса с глубокими патоморфологическими изменениями она оказывается резко положительной.
Длительность первой стадии самая разнообразная: от нескольких месяцев до нескольких лет. При остром прогрессирующем начале болезни первая стадия в течение нескольких месяцев переходит во вторую.
Патоморфологические исследования
Патоморфологические исследования проводил доктор медицинских наук Киевского научно исследовательского института ортопедии Н.Ф. Мороз.
При макроскопическом исследовании капсулы сустава во время операции в I стадии РА с острым течением выражены гиперемия, набухание синовиальной оболочки, гипертрофия синовиальных ворсин. В некоторых случаях поверхность синовиальной оболочки выглядит гладкой и блестящей. В полости сустава содержится повышенное количество мутноватой синовиальной жидкости.
Микроскопически отмечают отек, гиперемию, утолщение синовиальной оболочки, гиперплазию покровных клеток и обильную диффузную и очаговую периваскулярную воспалительную клеточную инфильтрацию. Клеточные инфильтраты состоят из лимфоидных и гистиоцитарных элементов с примесью плазматических клеток и лейкоцитов. Большинство мелких сосудов синовиальной оболочки резко расширены и заполнены эритроцитами или плазмой. В синовиальной оболочке и ворсинах участками выявляют патологическую дезорганизацию соединительной ткани. Коллагеновые волокна выглядят набухшими и гомогенными. При окраске срезов толуидиновым синим по ходу отдельных пучков коллагеновых волокон отмечают яркую разлитую или очаговую гаммаили бета метахромазию, свидетельствующую о мукоидном и фибриноидном набухании коллагеновых волокон. Кроме того, в синовиальной оболочке отмечают выраженные диффузные продуктивные васкулиты с набуханием эндотелия, очагами мукоидной и фибриноидной дезорганизации в средней и наружной оболочке и с периваскулярной хронической воспалительной инфильтрацией. Можно увидеть значительное сужение просвета некоторых сосудов.
В фиброзном слое капсулы сустава очаги мукоидного и фибриноидного набухания, как и очаги воспалительной лимфоидно-плазмоклеточной инфильтрации, выявляют значительно реже, чем в синовиальной оболочке.
При подостром и хроническом течении заболевания в капсуле сустава отмечают аналогичные изменения, но с менее выраженными экссудативными явлениями. Так как в І стадии инфектартрита суставной хрящ и костную ткань эпифизов не иссекали, патоморфологическое исследование их не производилось. В литературе помимо рентгенологических данных также нет других сведений об изменениях в костно хрящевых отделах суставов в этой стадии заболевания.
Обоснование ортопедического лечения
Ортопедохирургическая помощь больным с РА в І стадии заболевания заключается в консервативном и оперативном лечении.
Консервативное лечение направлено на предупреждение развития порочных установок конечностей, создание покоя суставам в период резкого обострения, сохранение амплитуды движений и предупреждение гипотрофии мышц.
Оперативное лечение направлено на устранение очага воспаления, поддерживающего общий процесс, источника воспаления и той среды, которая в дальнейшем продуцирует патологический субстрат грануляций, паннуса, приводящих к разрушению сустава.
Как только больной поступает в терапевтический стационар, его должен осмотреть ортопед травматолог и оформить функциональную карту пораженных суставов. Такой осмотр позволит объективно оценить степень тяжести функциональных нарушений в суставах, своевременно применить правильное лечение (положением), провести иммобилизацию пораженных суставов в функционально выгодном положении и применить комплексные функциональные методы лечения.
Лечение положением дает возможность в период постельного режима избежать неправильных укладок конечностей и тем самым устранить благоприятные условия для развития порочных установок, контрактур. Больного необходимо уложить на жесткую постель, придать конечностям физиологическое положение, следить за правильным положением туловища. Для этой цели в отделении должен быть комплект песочных мешочков, клиновидных подушек, шин.
При поражении плечевых суставов очень рано развиваются приводящие контрактуры плеча. У таких больных верхние конечности необходимо укладывать на клиновидные подушки. Надо предупредить развитие сгибательных и пронационных установок предплечья, а также ладонную флексию и ульнарное отклонение кисти. Для этого широко используют гипсовые или эмалитиновые шины, которые применяют в период обострения процесса, а также во время отдыха или сна больного.
Для тазобедренных суставов типично развитие сгибательно-приводящих контрактур бедер, для коленных — сгибательных контрактур голени с наружной ротацией, вальгусным отклонением.
В голеностопных суставах имеется постоянная тенденция к развитию эквинусных установок с плосковальгусными деформациями стоп. Профилактику указанных деформаций проводят с первого дня лечения путем применения укладок, гипсовых шин, лечебной физкультуры (ЛФК), вытяжения.
Лечащему врачу следует помнить, что кроме общего терапевтического лечения необходима профилактика рефлекторных контрактур.
При остром начале заболевания и выраженном болевом синдроме иммобилизация пораженных суставов способствует значительному уменьшению выраженности боли. Иммобилизационные гипсовые шины должны обеспечивать полный покой конечностей в физиологическом положении, не сдавливать мягкие ткани, не нарушать гемодинамику и лимфоотток, причем иммобилизация пораженных суставов у больных с РА должна проводиться строго дозировано во времени.
Как известно, продолжительная иммобилизация здоровых конечностей ведет к значительному нарушению трофики, развитию контрактур и пр. Исследования О.В. Недригайловой (1961) показали, что неврогенные акинематические контрактуры при иммобилизации возникают на 10–15 й день, миогенные — через 1,5 мес, артрогенные — через 8–10 мес. Причину развития акинематических контрактур О.В. Недригайлова видела в изменении рецепторов и обмена веществ в тканях иммобилизированной конечности, что вызывает возникновение очагов возбуждения в ЦНС, из которой исходят эфферентные импульсы к мышцам, вызывая стойкое их сокращение.
РА — заболевание с общим поражением соединительной ткани, со значительными нейротрофическими изменениями, возникшими под действием неспецифической инфекции, аутоиммунных неспецифических реакций и ведущее к длительному нарушению функции. Следовательно, эластические свойства соединительной ткани у таких больных резко нарушаются, имеется тенденция к раннему развитию мышечных контрактур. Поэтому иммобилизация у больных с РА должна быть не длительной, направлена в основном на создание покоя, что ведет к уменьшению выраженности болевого синдрома и профилактики рефлекторных контрактур.
Больные с РА не должны постоянно находиться в постели, так как именно функция при целенаправленной консервативной терапии позволяет сохранить и нормализовать структуру тканей опорно двигательного аппарата. При поражении суставов пальцев кисти применяют ладонные гипсовые шины до средней трети предплечья с иммобилизацией пальцев в физиологическом положении. При поражении лучезапястного сустава ладонная гипсовая шина накладывалась от головок пястных костей до верхней трети предплечья в тыльной флексии кисти под углом 20–25 °С с обязательным устранением ульнарного отклонения кисти. При поражении локтевого сустава иммобилизацию осуществляют задней гипсовой шиной от срединной линии ладони до верхней трети плеча в среднем положении предплечья между супинацией и пронацией. Иммобилизацию плечевых суставов проводят с помощью клиновидной подушки, в редких случаях применение подушки сочетали с задней гипсовой шиной. Суставы стопы и голеностопные суставы иммобилизировали задней гипсовой шиной до средней или верхней трети голени. При поражениях коленных суставов шина доходила почти до ягодичной складки, при поражениях тазобедренных суставов — до реберной дуги (по задней поверхности).
Продолжительность иммобилизации в I стадии заболевания длится не более 7–10 дней, то есть в период нарастания острых явлений. Затем назначают курс функциональной терапии, иммобилизационные корригирующие шины применяют лишь в часы сна, отдыха.
Как указывалось выше, I стадия РА характеризуется острым, подострым или хроническим синовитом. Длительно существующий или постоянно рецидивирующий синовит является тем пусковым механизмом, который ведет к разрушению сустава. Наличие в суставе постоянного выпота со значительным содержанием белка и ограничение функции сустава создают наиболее благоприятные условия для оседания фибрина на покровный хрящ, синовиальную оболочку, образования обилия спаек, шварт. Одновременно с этим процессом происходит гиперплазия ворсинок синовиальной оболочки, пролиферация последней, разрастание грануляционной ткани, которая, наряду с выпавшим белком и образованием паннуса ведет к развитию продуктивно деформирующего артрита.
Кроме того, в синовиальной оболочке происходят неспецифические иммунопатологические реакции, постоянно поддерживающие хроническое течение процесса или же вызывающие рецидив заболевания.
Из сказанного следует, что синовиальная оболочка является не только причиной вспышки и обострения воспаления, но и источником продукции патологического субстрата| — грануляционной ткани, ведущей к разрушению всех элементов сустава, и служит одним из основных факторов, поддерживающих заболевание и вызывающих его рецидив.
Следовательно, при безуспешности консервативной терапии, прогрессировании патологического процесса необходимо своевременно удалить пораженную синовиальную оболочку, то есть провести синовэктомию.
Таким образом, основная цель оперативного лечения в I стадии прежде всего лечебная. Наш опыт показал, что с помощью хирургического вмешательства достигается ликвидация упорных, не поддающихся консервативной терапии синовитов. Кроме того, синовэктомия позволяет устранить активный патологический очаг, поддерживающий в организме аутоиммунные неспецифические реакции, субстрат, из которого разрастается грануляционная ткань, образующая спайки, шварты, паннус, разрушающие сустав, то есть синовэктомия позволяет ликвидировать воспаление в суставе, приостановить прогрессирование его разрушения, сохранить его статическую и динамическую функцию.
Методы синовэктомий
Синовэктомия межфаланговых суставов. Операцию выполняют под циркулярной инфильтрационной анестезией. Проводят разрез длиной до 5 см над суставом с дугообразной выпуклостью в локтевую сторону по тыльно-лучевой стороне пальца. Рассекают кожу, подкожную клетчатку, фасцию. Рану расширяют крючками. Влагалище сухожилия разгибателя мобилизуют с лучевой стороны, отодвигают крючком в локтевую сторону и вскрывают капсулу сустава. Из полости сустава выделяется синовиальная жидкость. Утолщенную синовиальную оболочку иссекают вначале по тыльной поверхности, а затем, отделив боковую связку, по ладонной. Проводят тщательный гемостаз. Подшивают боковую связку у места отсечения и накладывают кетгутовые швы на капсулу сустава. Рану послойно зашивают наглухо. Оперировать можно 2–3–4 сустава одновременно. Иммобилизацию осуществляют ладонной гипсовой шиной в физиологическом положении пальцев в течение 3–5 дней.
Некоторые авторы применяют два разреза для синовэктомии межфаланговых суставов; один проходит по тыльно лучевой стороне, а второй — по тыльно-локтевой. Наш опыт показал, что с помощью одного разреза вполне можно качественно произвести синовэктомию межфалангового сустава.
При одновременном поражении дистальных и проксимальных межфаланговых суставов в первую очередь оперируют проксимальные суставы. Не рекомендуем одновременно проводить синовэктомию на смежных суставах одного и того же пальца, так как это ведет к развитию тугоподвижности в одном из них. Интервалы между операциями на суставах пальцев первого и второго ряда должны быть не менее 3 мес. Считаем, что проводить второй этап артропластики показано лишь при отсутствии скованности и тугоподвижности в ранее оперированных суставах, при наличии в них достаточной для функции амплитуды движений.
Синовэктомия пястно-фаланговых суставов. Операцию выполняют под местной инфильтрационной анестезией. Разрез длиной 5–6 см прямой, продольный с небольшой дугообразной выпуклостью в локтевую сторону проводят по тыльно-лучевой стороне пястно-фалангового сочленения. Рассекают кожу, подкожную клетчатку, фасцию. Влагалище сухожилия разгибателя мобилизуют по лучевой стороне и рану расширяют крючками. Далее рассекают капсулу сустава и иссекают утолщенную гиперемированную синовиальную оболочку с тыльной, ладонной и боковых поверхностей. При этом пересекают боковую связку, после удаления пораженной синовиальной оболочки и грануляционной ткани концы боковой связки сшивают. Иногда удается с помощью ложечки удалить грануляционную ткань, не пересекая боковых связок. Затем накладывают кетгутовые швы на капсулу сустава; сухожилие разгибателя укладывают на свое место и обязательно фиксируют двумя тремя кетгутовыми швами во избежание его вывиха и развития бокового отклонения пальца. Рану послойно зашивают наглухо. Иммобилизацию осуществляют ладонной гипсовой шиной в функционально выгодном положении пальца в течение 3–5 дней.
При поражении 3 или 5 суставов делают один поперечный разрез кожи по тыльной поверхности кисти на уровне основания головок пястных костей.
Синовэктомия лучезапястного сустава. Операцию проводят под проводниковой или внутрикостной анестезией. Разрез делают длиной 7–8 см по тыльной поверхности с небольшим дугообразным изгибом в локтевую сторону над лучезапястным суставом (по проекционной линии, проходящей по локтевой стороне среднего пальца). Рассекают кожу, подкожную клетчатку, фасцию, затем — тыльную связку лучезапястного сустава по ходу разреза кожи. Рану расширяют крючками, вскрывают влагалище сухожилий и в локтевую сторону отводят общий разгибатель, а в лучевую — разгибатель большого пальца. В рану выступает напряженная капсула сустава, которую рассекают по длине, после чего удаляют синовиальную жидкость и иссекают утолщенную воспаленную синовиальную оболочку. Проводят тщательный гемостаз, накладывают кетгутовые швы на капсулу сустава. Сухожилия разгибателей укладывают на свое место, перекрывают их фасцией (швы на тыльную связку не накладывают) и рану послойно зашивают наглухо. Иммобилизацию осуществляют с помощью ладонной гипсовой шины в течение 5 дней. В тех случаях, когда поражен и дистальный радиоульнарный сустав, необходимо иссечь синовиальную оболочку и в нем. Для этого рассекают межсуставный хрящ (discus articularis) у места его прикрепления к лучевой кости, капсулу сустава и крючками расширяют рану. Затем иссекают синовиальную оболочку. При этом необходимо тщательно ее иссечь из мешковидного выпячивания (recessus sacciformis) и тем самым предупредить рецидив заболевания. При поражении сухожильных влагалищ разгибателей обязательно иссекают пораженную синовиальную оболочку этих влагалищ.
Поражение сухожилий сгибателей проявляется клинически синдромом карпального канала. Больного беспокоит боль по ладонной поверхности кисти и в области лучезапястного сустава, появляются парестезии и чувство онемения в пальцах. Ладонная поверхность лучезапястного сустава припухшая, контуры его сглажены. Постепенно развивается атрофия мышц возвышения первого пальца. Сжатие пальцев в кулак ослаблено и болезненно.
Возникновение синдрома карпального канала объясняется сдавливанием срединного нерва в узком карпальном канале воспаленными утолщенными сухожилиями и плотной поперечной связкой.
В тех случаях, когда консервативная терапия безуспешна, прибегают к оперативному вмешательству.
Под местной инфильтрационной анестезией прямым продольным разрезом по ладонной поверхности в области лучезапястного сустава рассекают кожу, подкожную клетчатку, фасцию. Производят гемостаз и рану раскрывают крючками. Затем рассекают поперечную связку и проводят тендосиновэктомию сгибателей пальцев. Для изоляции сухожилий сгибателей от лучезапястного сустава под них подводят рассеченную поперечную связку и сшивают ее, после чего сухожилия укладывают на место. Сверху сухожилия перекрывают фасцией и рану зашивают послойно наглухо. Иммобилизацию кисти проводят в течение 3 дней.
Проявлением поражения сухожилий сгибателей является щелкающий палец (вследствие нарушения скольжения сухожилий под кольцевидной связкой из за образования в самом сухожилии ревматоидного узелка). При отсутствии эффекта от консервативной терапии показано оперативное лечение. Под местным обезболиванием продольным или поперечным разрезом по дистальной ладонной складке рассекают кожу, подкожную клетчатку, рану расширяют крючками. Затем продольно рассекают кольцевидную связку и освобождают сухожилия сгибателей. Рану послойно зашивают наглухо. Иммобилизация кисти — в течение 3 дней.
Синовэктомия локтевого сустава. Операцию производят под внутрикостной, проводниковой анестезией, наркозом. Наиболее щадящим доступом для синовэктомии считаем доступ Кохера. По латеральному краю трехглавой мышцы плеча на 5 см выше латерального надмыщелка делают вертикальный разрез, на уровне головки лучевой кости поворачивают на локтевую кость, заканчивая его на 5–6 см ниже верхушки локтевого отростка. Рассекают кожу, подкожную клетчатку, фасцию. Тупо расслаивают мышцы до надмыщелка и далее между локтевой мышцей и локтевым разгибателем кисти до капсулы сустава; последнюю вскрывают, удаляют синовиальную жидкость. Рану широко раскрывают крючками и иссекают утолщенную воспаленную синовиальную оболочку по передней и задней поверхности локтевого сустава. Накладывают кетгутовые швы на фиброзную капсулу сустава и рану послойно зашивают наглухо. Иммобилизацию осуществляют задней гипсовой шиной в течение 2–3 дней.
Синовэктомия плечевого сустава. Операцию проводят под местной инфильтрационной анестезией 0,25% раствором новокаина, наркозом. Доступ к суставу — по Бодену. Кожу рассекают по линии проекции дельтовидно грудной борозды. Затем рассекают подкожную клетчатку, фасцию. После тщательного гемостаза выделяют наружную поверхностную вену и сдвигают ее медиально. Далее тупо проходят между дельтовидной и большой грудной мышцами и рану раскрывают крючками. Рассекают глубокий листок фасции и по медиальному краю сухожилия длинной головки двуглавой мышцы плеча вскрывают выступающую напряженную капсулу сустава. Края капсулы расширяют и иссекают в доступных пределах воспаленную синовиальную оболочку. Накладывают кетгутовые швы на фиброзную капсулу сустава. Рану послойно зашивают наглухо. Иммобилизацию осуществляют задней гипсовой шиной на клиновидной подушке в течение 3–5 дней.
Синовэктомию тазобедренного сустава проводить не рекомендуем, так как после нее развивается асептический некроз головки бедренной кости. Это обусловлено тем, что при иссечении синовиальной оболочки и вывихе проксимального конца бедренной кости происходит полное нарушение кровоснабжения головки и последнее не восстанавливается.
Синовэктомия коленного сустава. Операцию проводят под внутрикостным обезболиванием, наркозом. Лучше использовать парапателлярный латеральный доступ. Рассекают кожу, подкожную клетчатку, фасцию и рану расширяют крючками. Затем рассекают капсулу сустава и сухожильное растяжение в промежутке между прямой мышцей бедра и наружной широкой мышцей. Надколенник вывихивают медиально. В тех случаях, когда ткани ригидны и вывихнуть надколенник не удается, рекомендуем Z-образно рассекать собственную связку надколенника. Далее иссекают из передневерхнего и переднебоковых заворотов воспаленную синовиальную оболочку, обязательно следует щадить боковые связки. При утолщении жирового тела последнее иссекают. Удаляют также пораженные мениски. Снимают жгут и проводят тщательный гемостаз. Надколенник укладывают на свое место. При рассечении собственной связки ее сшивают шелком. Фиброзную капсулу сустава и подкожную клетчатку зашивают кетгутом, кожу — шелком. Иммобилизацию осуществляют в течение 3 дней задней гипсовой шиной (срок иммобилизации зависит от того, рассекалась собственная связка надколенника или нет).
Используют для синовэктомии иногда и доступ Пайра или два боковых парапателлярных разреза. Поскольку при медиальных парапателлярных разрезах возможно повреждение или травматизация нервных веточек, что в последующем обусловит ослабление тонуса мышц, капсулы сустава и длительный болевой синдром, мы предпочитаем латеральный парапателлярный доступ (как это рекомендуют Н.А. Воробьев и М.К. Панченко), при котором указанные осложнения не наблюдаются.
Доступом Пайра вскрывают коленный сустав. Если операция проходит без наложения жгута, проводят тотальный гемостаз. Рану расширяют крючками и иссекают синовиальную оболочку с переднебоковых поверхностей коленного сустава. При этом нужно не повредить боковые и крестообразные связки. Иссекают жировое тело.
Разгибают голень, снимают жгут, проводят гемостаз. Надколенник укладывают на свое место, накладывают швы на капсулу сустава, вводят дренажи и рану зашивают послойно. Швы обрабатывают йодом, накладывают асептическую повязку и глубокую гонитную заднюю гипсовую шину.
При необходимости иссечения синовиальной оболочки в заднем отделе сустава дополнительно используют доступ Вильсона — Герберта. Разрез проводят по дорзально латеральной поверхности нижней трети бедра к головке малоберцовой кости и заканчивают на 2–3 см ниже нее. Рассекают кожу, подкожную клетчатку, фасцию, выделяют общий малоберцовый нерв, который на держалке отводят в сторону. Z-образно рассекают сухожилие двуглавой мышцы бедра и, не повреждая наружной боковой связки, остро и тупо отделяют от мыщелка бедренной кости наружную головку икроножной мышцы. Открывается широкий доступ к задневерхнему отделу сустава. Продольно рассекают капсулу сустава и иссекают пораженную синовиальную оболочку. Проводят тщательный гемостаз, накладывают кетгутовые швы на капсулу, подшивают наружную головку икроножной мышцы, сшивают сухожилие двуглавой мышцы бедра и рану послойно зашивают наглухо. Иммобилизацию осуществляют задней гипсовой шиной в течение 3 дней.
Е.Т. Скляренко (1986) разработал методику одномоментной тотальной синовэктомии коленного сустава.
Синовэктомия голеностопного сустава. Операцию выполняют под наркозом, проводниковой анестезией, внутрикостным обезболиванием. Из переднего доступа рассекают кожу, подкожную клетчатку, фасцию, поперечную связку голени и тыльную фасцию стопы с крестообразной
связкой голени. Далее сухожилие передней большеберцовой мышцы крючком смещают медиально, а сухожилие общего разгибателя, большого пальца оттягивают латерально. В рану выступает напряженная капсула голеностопного сустава, которую рассекают продольно и удаляют синовиальную жидкость. Затем, расширив рану крючками, иссекают утолщенную воспаленную синовиальную оболочку. Снимают жгут, проводят тщательный гемостаз. Накладывают кетгутовые швы на фиброзную капсулу. Сшивают поверхностную фасцию и рассеченную связку над сухожилиями. Кожу сшивают шелковыми швами. Иммобилизацию проводят задней гипсовой шиной сапожком в течение 3 дней.
Нередко при РА на ранних стадиях возникает воспаление сухожильных влагалищ стопы. Чаще его выявляют в области влагалища сухожилий малоберцовых мышц, реже — задней большеберцовой мышцы и длинного сгибателя большого пальца. Клинически тендосиновит проявляется припухлостью по ходу сухожилий, болью, варусным или вальгусным отклонением стопы. Активное сгибание стопы затруднено или невозможно, пассивное — резко болезненно. При отсутствии эффекта от консервативной терапии показана операция, которую лучше проводить под местным обезболиванием (с применением жгута) или под проводниковым, внутрикостным. Кожу рассекают по ходу сухожилия на протяжении его поражения. После рассечения кожи, подкожной клетчатки и фасции вскрывают сухожильное влагалище и иссекают воспаленную синовиальную оболочку, спайки. После синовэктомии по возможности восстанавливают сухожильное влагалище или же сухожилие перекрывают фасцией для предупреждения его вывихивания и рану послойно зашивают наглухо. Иммобилизацию проводят в течение 2–3 дней задней гипсовой шиной.
Причиной развития молоточкообразных пальцев, вальгусного отклонения большого пальца у больных с РА считают поражение плюснефаланговых суставов. Опыт показал, что упорные синовиты указанных суставов подлежат оперативному лечению, заключающемуся в иссечении пораженной синовиальной оболочки. Оперативному лечению подлежат также и ревматоидные узлы в местах, подвергающихся сдавлению, так как они являются источником боли и нарушения функции. Удаление их не представляет трудностей, за исключением области кисти, где узлы обычно располагаются вокруг двигательных нервов, как бы окружая их.
Успех синовэктомии во многом зависит от правильного лечения в послеоперационный период. В первые 3 сут после операции основное внимание направлено на борьбу с болью, восстановление общего состояния больного и создание оптимальных условий для первичного заживления раны. Для устранения боли назначают обезболивающие препараты (метамизон натрия, опиоиды), электрофорез новокаина. Назначают по показаниям сердечные, седативные средства, кислородотерапию. К оптимальным условиям, обеспечивающим заживление операционной раны, относят иммобилизацию и борьбу с реактивным отеком. С этой целью назначают УВЧ, электрофорез кальция, магнитотерапию, а для профилактики инфекции — курс антибиотиков.
С первых же дней назначают ЛФК для неоперированных сегментов и суставов конечности (первый период). Это позволяет улучшить гемодинамику, лимфоотток, обменные процессы и предупреждает усиление атрофии и до этого ослабленных мышц. Одновременно рекомендуют дыхательную гимнастику. Со 2–3 го дня назначают упражнения с напряжением и расслаблением мышц оперированной конечности.
Второй период ЛФК начинается с 4–7 х суток после операции. Шину на день снимают и больному разрешают начальные активные и пассивные движения в оперированном суставе. Кроме того, регулярно проводится лечебная гимнастика для остальных сегментов конечности. Основная задача второго периода — восстановить амплитуду движений в оперированном суставе. Вначале с целью облегчения двигательной функции конечности прибегают к помощи средств, позволяющих сделать это (использование скользящих плоскостей, упражнений с помощью манжеток и блоков, металлических шин). Первую неделю занятия с больным обязательно проводит методист. По мере усвоения упражнений назначают самостоятельные упражнения по 2–3 раза в сутки. Длительность и частота занятий обусловливается выраженностью болевого синдрома, волевыми качествами больного, степенью атрофии мышечного аппарата и проявлением синдрома сковывания, ригидности суставов. После восстановления амплитуды движений в суставе назначают упражнения для увеличения силы и выносливости мышц, упражнения с сопротивлением (третий период).
Обычно через 3 нед после синовэктомии амплитуда движений восстанавливается полностью. Нужно иметь в виду, что на 10–12 е сутки из за обширных спаек движения в суставах, особенно в локтевых и коленных, затруднены. В таких случаях помогает методист и, как правило, движения восстанавливаются. Мы не рекомендуем в первые 10 дней форсировать восстановление движений. Увеличение амплитуды движений необходимо проводить по мере заживления послеоперационной раны. Только после снятия швов начинали повышать частоту и длительность занятий.
Обычно через 2 нед после операции на верхних конечностях больные сами начинали обслуживать себя. Если операция произведена на суставах нижних конечностей, то ходить с помощью костылей разрешали после снятия швов (частично нагружая оперированную ногу). После 3 нед разрешали полную нагрузку. Иллюстрацией могут служить следующие краткие выписки из историй болезни.
Больной П., 26 лет, электромонтер, поступил в клинику 27/IV/1967 г. с жалобами на боль в коленных и голеностопных суставах (особенно в правом коленном). Болел в течении 6 мес. Заболевание началось с боли в голеностопных и коленных суставах, в которых быстро прогрессировал воспалительный процесс. Был госпитализирован в районную больницу, где установлен диагноз — РА. Несмотря на проводимое в течение 2 мес лечение (преднизолон, ацетилсалициловая кислота, нестероидные противовоспалительные препараты (НПВП), хлорохин, бензатина бензилпенициллин, витамины), боль продолжалась, синовит коленных суставов не исчезал. При поступлении в клинику общее состояние удовлетворительное, со стороны внутренних органов патологических изменений не выявлено. При ходьбе пользовался двумя костылями, ходил медленно, мелкими шагами, слегка согнув ноги в коленных суставах. Отмечено некоторое ограничение сгибания, отведения, а также ротационных движений в тазобедренных суставах. Оба коленных сустава, особенно правый, увеличены в объеме, контуры их сглажены. В правом коленном суставе определяли значительный выпот. Справа разгибание до 170°, сгибание до 110°, движения резко болезненны; слева разгибание до 175°, сгибание до 80°. В голеностопных суставах движения ограничены, некоторая сглаженность контуров. Рентгенологически выявлен умеренный остеопороз суставных концов обоих коленных суставов, суставная щель справа шире. Анализ крови: эритроциты 4,4·109 Нb — 81 г/л, лейкоциты 10,2·109, СОЭ — 63 мм/ч. Диагноз: РА с преимущественным поражением правого коленного сустава, I стадия. После клинического обследования 5/V/1967 г. произведена операция: синовэктомия правого коленного сустава. При операции выявлены обширные ворсинчатые разрастания синовиальной оболочки. Паннус частично переходит на суставную поверхность мыщелков бедра, крестовидные связки и межмыщелковое возвышение. Синовиальная оболочка и паннус тщательно иссечены; удалены также дегенеративно измененные и истонченные мениски и увеличенное в объеме жировое тело. После операции назначен курс антибиотиков и НПВП. Послеоперационный период протекал гладко, выпота в полость сустава не было, рана зажила первичным натяжением. На 3 й день после операции начата ЛФК (I период): дыхательная гимнастика, активные движения в суставах левой нижней конечности, сокращение четырехглавой мышцы справа. На 8 й день — ЛФК (II период): пассивные движения в правом коленном суставе. На 30 й день — ЛФК (III период): упражнения с сопротивлением; назначен также массаж мышц бедра. Через 1,5 мес после операции полностью восстановлены активные движения в правом коленном суставе и опорноспособность конечности. Одновременно отмечено уменьшение выраженности боли в других суставах. Больной выписан для амбулаторного лечения. В декабре 1967 г. проведен контрольный осмотр. Амплитуда движений — в полном объеме. Контуры сустава не изменены. Послеоперационный рубец безболезненный, не спаян с подлежащими тканями. Работает по своей специальности. Периодически получает противорецидивную терапию.
Больная П., 42 лет, домохозяйка, поступила в клинику 9/VII/1968 г. с жалобами на хромоту, боль и ограничение движений в правом коленном суставе. Больна в течение 8 лет. Заболевание началось постепенно с появления боли в правой стопе, затем в коленных суставах. Периодически лечилась амбулаторно (физические методы, ацетилсалициловая кислота). В последние 3 мес наступило обострение, усилилась боль в правом коленном суставе. Были назначены НПВП, хлорохин, ионофорез гидрокортизона, тепловые процедуры. Однако улучшения не наступило.
При поступлении в клинику общее состояние больной удовлетворительное. Со стороны внутренних органов существенных отклонений от нормы нет. Больная ходит, сильно хромая, щадя правую ногу. Правый коленный сустав увеличен в объеме на 9 см за счет наличия в нем жидкости и утолщения параартикулярных тканей. Контуры сустава сглажены, надколенник баллотирует. Движения возможны по дуге от 175° до 140°, безболезнены. При пальпации сустава отмечена значительная боль, особенно по ходу суставной щели. Рентгенологически определено затемнение физиологических просветлений, контуры мягких тканей сустава растянуты, суставная щель слегка расширена. Анализ крови: эритроциты — 46,1·109, Нb — 71 г/л, лейкоциты — 8,8·109, СОЭ — 58 мм/ч. Диагноз: РА I стадия с преимущественным поражением правого коленного сустава, период обострения.
После клинического обследования 6/VIII/1968 г. произведена операция: синовэктомия правого коленного сустава. Во время операции выявлено значительное утолщение синовиальной оболочки, особенно в верхнем завороте, где ее толщина достигала 1 см. Синовиальные разрастания в виде паннуса переходят на хрящ мыщелков бедра и голени. Хрящ
местами тусклый. Синовиальная оболочка тщательно иссечена, удален паннус с поверхности хряща, а также жировое тело, рана послойно зашита, наложена асептическая повязка, иммобилизация глубокой задней гипсовой шиной.
Хирургическое лечение переднемедиальной нестабильности коленного сустава на ранних стадиях РА
Патогенетически обоснованным на ранних стадиях РА является оперативное лечение — синовэктомия. Синовэктомия позволяет удалить патологический очаг, стимулирующий образование аутоиммунных комплексов, поддерживающий течение и обострение РА, источник появления грануляционной ткани и паннуса.
Синовэктомия показана при стойком или постоянно рецидивирующем синовите, который на протяжении 6–8 мес не поддается комплексному консервативному лечению, в том числе внутрисуставной дефиброзирующей терапии, при наличии утолщения синовиальной оболочки более 5 мм, которое подтверждено данными ультразвукового исследования (УЗИ).
На ранних стадиях заболевания переднюю субтотальную и тотальную синовэктомию проводим через медиальный парапателлярный разрез типа Пайра, который позволяет при необходимости провести укрепление медиального отдела капсульно связочного аппарата. При отсутствии признаков переднемедиальной нестабильности коленного сустава (ПНКС) проводят типичную синовэктомию. В случае значительного натяжения подвздошно берцового тракта последний пересекают с целью устранения вальгусного отклонения голени и сгибательной контрактуры. При существовании ПНКС I степени после окончания синовэктомии выполняют «гофрирование» передней крестообразной связки путем наложения внутрисуставного шва из рассасывающегося синтетического материала («Бехоп» или «Махоп» № 0). Делают дубликатуру капсулы сустава по переднемедиальной поверхности. При этом медиальную часть образованного капсулярного лоскута накладывают на латеральную с умеренным низведением. Степень натяжения капсулы строго индивидуальна и проверяется величиной смещения голени в сагиттальной плоскости при сгибании ее на 30° и 90°. Достаточным натяжением считают такое, при котором смещение голени становится аналогичным противоположной конечности. В случае двустороннего поражения коленных суставов с наличием признаков нестабильности оба лоскута натягивали так, чтобы взаимосмещение мыщелков бедра и большеберцовой кости не превышало 5 мм. После образования дубликатуры капсулы иммобилизацию конечности осуществляли при сгибании голени в суставе под углом 20°.
При наличии сгибательной контрактуры, которую чаще отмечали в I фазе II стадии РА, с целью достижения необходимого уровня радикальности и полного устранения сгибательной контрактуры, выполняют тотальную синовэктомию или синовкапсулэктомию с вмешательством на задних отделах капсулы по методике профессора Е.Т. Скляренко, позволяющей без дополнительных разрезов провести радикальное иссечение патологических тканей из переднего и заднего отделов коленного сустава и одновременно эффективно устранить сгибательную контрактуру.
Механизм развития ПНКС у больных на ранних стадиях РА следующий: при воспалении изменяются прочность и эластичность связок, капсулы сустава, происходит деструкция менисков. На этом фоне постоянное механическое нарастающее напряжение вследствие накопления воспалительной синовиальной жидкости вызывает необратимое удлинение пассивных стабилизаторов с нарастающим ослаблением сектора капсульносвязывающего аппарата коленного сустава (КСАКС), чему благоприятствует анатомическое строение сумочно-связочного аппарата и характер отклонения оси конечности. ПНКС у больных с РА возникает как следствие потери нормальных механических свойств капсулы, связок, разрушения менисков патологическим аутоиммунным воспалением, а также из за действия постоянных растягивающих сил (хронический синовит) и влияния на медиальный отдел КСАКС вальгусного отклонения голени с нарушением физиологического равновесия мышц бедра и нервно рефлекторного контроля. Нестабильность может существовать при отсутствии специфических жалоб больного. Это обусловлено ограничением статической нагрузки на коленный сустав и воспалением, но проявляется сразу же после уменьшения выраженности местного воспалительного процесса в суставе, кроме того, при синовэктомиях и синовкапсулэктомиях происходит ослабление мышц КСАКС и постепенно увеличивается нестабильность.
Следовательно, хирургическое лечение ревматоидного поражения коленного сустава на ранней стадии должно основываться на принципе минимальной травматизации при радикальном устранении очага воспаления и восстановлении стабильности сустава и функции, что является профилактикой быстрого развития вторичных дегенеративно-дистофических процессов в суставе. Исходя из этих принципов при хирургическом лечении ранних стадий ревматоидного поражения коленных суставов с синдромом нестабильности И.В. Гужевским была разработана методика восстановления стабильности коленного сустава за счет подвешивания и натяжения расслабленных составляющих КСАКС.
При наличии клинических симптомов переднемедиальной нестабильности II степени с сонографическим установлением разницы между толщиной латерального и медиального отделов КСАКС и расширением суставной щели более 5,5 мм, операцию синовэктомии необходимо дополнять двухэтапной реконструкцией КСАКС. После окончания удаления синовиальной оболочки проводят «гофрирование» передней крестообразной связки путем наложения внутрисуставного шва из рассасывающего материала («Махоп» или «Охоп» № 1–0). Затем выполняют У-тендокапсулопластику переднемедиального отдела сустава по следующей методике, которая состоит из мобилизации медиальной широкой мышцы бедра, натяжения медиального отдела капсулы сустава и вентрализации поверхностной «гусиной лапки». Медиальную широкую мышцу бедра мобилизуют вместе с полоской медиальной частью сухожильного растяжения надколенника шириной не более 15–20 мм и дистальный конец отделяют от метафиза большеберцовой кости вместе с костным фрагментом. Между собственной связкой надколенника и жировым телом формируют канал с медиальной стороны к латеральной в направлении сверху вниз, через который проводят сформированный лоскут. Сухожильную часть лоскута вместе с костным фрагментом переводят на переднюю поверхность собственной связкой надколенника, натягивают лоскут в положении сгибания в суставе под прямым углом при отсутствии смещения голени в сигитальной плоскости. Костный фрагмент фиксируют винтом с шайбой на передней поверхности медиального мыщелка большеберцовой кости в предварительно сформированное углубление так, чтобы погруженный фрагмент не выступал над уровнем передней поверхности эпифиза большеберцовой кости. К перемещенному лоскуту подшивают рассасывающими нитями сопредельный отдел медиальной зоны сумочно-связочного аппарата коленного сустава и смещенную на переднюю поверхность «гусиную лапку», после чего проверяют степень внешней ротации в положении сгибания голени под прямым углом. Окончательно контролируют эффективность транспозиции и надежность фиксации путем проверки симптома «переднего выдвижного ящика» и внешней ротации голени при ее сгибании под прямым углом по сравнению с симметричным суставом. В суставную полость вводят полихлорвиниловую трубку для активного дренирования. Если послеоперационный период проходит без осложнений, то дренажные трубки удаляют через 48 ч, а движение в суставе начинают на 3 и сутки после операции, после исчезновения острой послеоперационной боли.
ПРОЛИФЕРАТИВНО-ДЕСТРУКТИВНЫЙ ПРОГРЕССИРУЮЩИЙ ПАНАРТРИТ (ІІ СТАДИЯ)
Клиническая картина
Во ІІ стадии РА болевой синдром, припухлость суставов постепенно уменьшаются и на первый план выступает дефигурация симметрично пораженных суставов, которая особенно ярко выражена на фоне незаметно развившейся гипотрофии мышц. Кожные покровы бледные, сухие, истончены, дряблые. Температура кожи в области пораженных суставов повышена. При пальпации явно определяется утолщенная (тестообразной консистенции) капсула сустава. Мышцы, особенно разгибатели, гипотрофичны, сила их ослаблена, тонус снижен. Отмечается повышенная потливость кистей и стоп. На ногтях выражены трофические нарушения в виде повышенной их ломкости, продолговатой исчерченности, утолщения или истончения. В ряде случаев наблюдается чрезмерное разрастание всего ногтя.
Больные во второй стадии заболевания наряду с жалобами на боль отмечают тугоподвижность и развитие порочных установок в пораженных суставах. Именно в этой стадии, вследствие длительности болевого синдрома, пролиферативно-деструктивных изменений в суставах при отсутствии ортопедической профилактики развиваются порочные дискордантные установки, приводящие к потере активности больными и обусловливающие потерю работоспособности. Характер деформаций суставов бывает самым разнообразным. Однако отмечается превалирование сгибательных установок. Так, для плечевого сустава характерны приводящие контрактуры плеча, для локтевого — сгибательно-пронационные установки предплечья, для лучезапястного — ладонная флексия кисти с ульнарным отклонением; для суставов пальцев — сочетание сгибательно-разгибательных контрактур с ульнарным отклонением, подвывихами и вывихами фаланг. В тазобедренном суставе превалируют сгибательно-приводящие контрактуры, в коленном — сгибательные установки с ротацией или вальгусным отклонением голени, а в голеностопном суставе — эквинусные с вальгусной установкой стопы.
Порочные установки в суставах разделены нами на конкордантные и дискордантные. К конкордантным (сочетанным) установкам относят такие деформации суставов с ограничением функции, при которых больные могут пользоваться конечностью. К дискордантным установкам (несочетанным) относят такие, при которых несмотря на частично сохранившуюся подвижность в суставах больные лишены возможности ходить даже с костылями, то есть лишены возможности обслуживать себя. Это тяжелые обездвиженные инвалиды.
Поэтому при формулировке диагноза необходимо указывать не только стадию заболевания, степень функциональной недостаточности сустава, но и отмечать характер деформации: конкордантная или дискордантная. Это дает возможность по диагнозу судить о степени инвалидности больного. Так, больные с функциональной недостаточностью суставов II степени и конкордантными деформациями могут передвигаться, выполнять нетяжелую, в частности домашнюю работу, обслуживать себя, в то время как такие же больные с дискордантными деформациями прикованы к постели и нуждаются в постороннем уходе и обслуживании.
Больные с конкордантными деформациями нижних конечностей при функциональной недостаточности суставов III степени могут передвигаться по маятниковому или циркульному типу, в то время как такие же больные с дискордантными деформациями при сохранившейся функции верхних конечностей прикованы к постели.
Со стороны органов дыхания у большинства больных во II стадии заболевания патологических изменений не отмечается. Можно лишь указать на превалирование брюшного типа дыхания из за поражения реберно-грудинных и реберно-позвонковых суставов, приводящих к ограничению экскурсии грудной клетки, и значительное уменьшение жизненной емкости легких (2200–2500 мл). У 1,5% больных отмечали хронический бронхит. Из анамнеза установлено, что большинство больных подвержены простудным заболеваниям, перенесли пневмонию, неоднократно болели бронхитом; у 1,2% больных диагностированы остаточные явления плеврита.
В литературе имеются указания на частые неспецифические заболевания легких, фиброз плевры, паренхиматозные и интерстициальные ревматоидные пневмонии и плевриты.
М.Г. Астапенко и Э.Г. Пихлак (1966) у 7,8% больных выявили поражение легких, у 2,7% — интерстициальные пневмонии, у 2,3% — стойкое усиление легочного рисунка в базальных отделах и у 2,7% — сухой или экссудативный плеврит. О нарушении проницаемости капиллярной сети убедительно свидетельствует проба Нестерова. Кроме того, у ряда больных отмечают частые носовые кровотечения, подкожные кровоизлияния, возникающие без видимых причин. Со стороны ЖКТ отмечают диспептические нарушения, снижение аппетита, секреторной функции желудка. В литературе описаны случаи абдоминального синдрома, который М.Г. Астапенко и Э.Г. Пихлак объясняют ревматоидным васкулитом органов брюшной полости.
Поражение печени во II стадии РА бывает часто. Так, по нашим данным, нарушение антитоксической функции печени (проба Квика) выявлено у 54% больных. Р.Т. Кричевский (1959) указывал, что кроме нарушения антитоксической и углеводной функции печени нарушается пигментная и протеиногенная функция.
Поражение почек во II стадии — нередкое явление и, по данным различных авторов, отмечено в 3–6% случаев. Характер поражения почек — воспалительный и дистрофический (амилоидоз). У наблюдаемых нами больных поражение почек отмечено у 4,3%. Оно проявлялось в основном альбуминурией, гематурией, снижением экскреторной функции. Нередко изменения в почках носят скрытый характер и требуют целенаправленного, упорного обследования, особенно если больному предстоит хирургическое вмешательство. Часто у больных с РА бывает мочекаменная болезнь.
Нарушения трофики кожи, ногтей и волос, потоотделения, температуры, атрофия мышц, повышение сухожильных рефлексов, нарушение чувствительности, особенно в дистальных отделах конечностей — постоянные спутники II стадии инфектартрита. Поражение нервной системы при РА зависит, с одной стороны, от действия токсинов, с другой — от прогрессивно развивающихся васкулитов.
Рентгенологическая картина (рис. 1а, б): выраженный остеопороз не только эпиметафизарных, но и диафизарных отделов кости. Суставные щели сужены. Суставные концы деформированы с наличием узур и костных обезображивающих разрастаний. В эпифизарных концах участки разрежения костной ткани чередуются с грубыми костными стропилами, которые С.А. Рейнберг относил к элементам «гипертрофической атрофии». Н.С. Косинская (1967) и другие описывали рентгенологическую картину первичных костных поражений ревматоидными гранулемами. Ревматоидные гранулемы поражают различные участки скелета и выявляются на рентгенограммах в виде очагов деструкции неправильной шарообразной или овальной формы размером от 1,5–2 мм до 2,5 см в диаметре. Они бывают единичными и множественными. Динамика их развития различна. Одни длительно остаются стабильными, другие медленно увеличиваются, сливаются в конгломераты; одни подвергаются гиалинизации или превращаются в фиброзные поля, которые могут быть основой для репарации костной ткани, другие нередко распадаются и превращаются в полости с жидким содержимым. Рентгенологическая картина, как указывала Н.С. Косинская, может отражать динамику и тяжесть процесса. Так, появление свежих ревматоидных гранулем в костях, а также размягчение их и прорыв в сустав характеризует активную стадию процесса. Наличие полигранулематозного процесса в костях постоянно наблюдается при тяжелых, упорных, хрониосептических формах полиартрита. Вышеописанные очаги деструкции постоянно наблюдались нами как на рентгенограммах, так и во время операции.
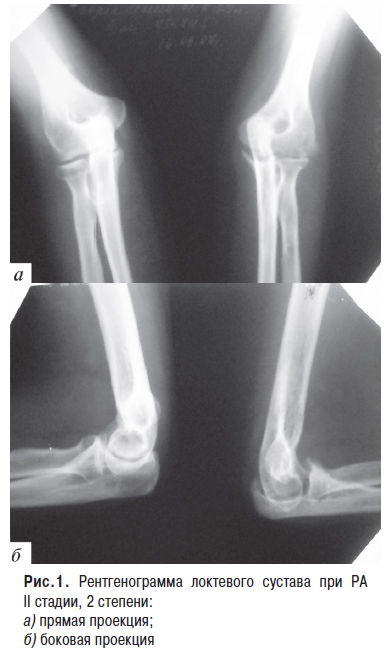
При развившихся дискордантных деформациях имеют место подвывихи, особенно в коленных, пястно фаланговых и межфаланговых суставах. Надколенники утолщены за счет костных разрастаний, нередко спаяны с эпифизом бедренной кости или отделены узкой щелью. Суставная поверхность деформирована. Выявляют оссификаты в собственной связке надколенника, в местах прикрепления трехглавой мышцы плеча, в области сумок большого вертела и плечевого сустава.
В гемограмме у большинства больных отмечают гипохромную анемию, ускоренную СОЭ (30–40 мм/ч, иногда и выше), лейкопению с незначительным сдвигом влево, уменьшение количества или отсутствие эозинофилов. Изменения крови находятся в прямой зависимости от характера течения процесса. Биохимические изменения во II стадии инфектартрита в значительной степени отличаются от таковых в I стадии.
Белковые сдвиги являются чувствительным тестом и объективно отражают физиологические колебания и патологические сдвиги в организме. Изучению белковых сдвигов в сыворотке крови у больных с РА было посвящено много работ отечественных и зарубежных авторов (Михнев А.Л., 1954, Астапенко М.Г., 1956; Тихонравов В.А., 1959; Нестеров А.И. и Сигидин Я.А., 1961; Сачков В.И., 1962 и др.). Выявлена постоянная закономерность между степенью тяжести течения процесса и сдвигами белковых фракций крови, а именно: при обострениях, рецидивах, остром и подостром течении болезни количество альбуминов, как правило, уменьшается, а глобулинов — увеличивается, в частности, альфа- и гамма-глобулинов. Повышение глобулиновых фракций подавляющее большинство авторов объясняют деструкцией соединительной ткани, а также повышенной продукцией аутоантител.
Общее содержание белка сыворотки крови у большинства больных соответствует нормальным величинам как во время обострения, так и в период ремиссии. Альбумино-глобулиновый коэффициент снижен. После хирургического лечения отмечали снижение СОЭ и некоторое уменьшение количества альфа- и гамма-глобулинов.
При РА, как и других коллагенозах, происходит дезорганизация соединительной ткани в силу разрушения мукополисахаридных компонентов, что ведет к увеличению количества гликопротеидов в сыворотке крови. По мнению В.А. Тихонравова (1959), З.Г. Пихлак (1959), М.Г. Астапенко и С.С. Мухина (1963), которые изучали ДФА показатель у больных инфектартритом, показателем активности воспалительного процесса может служить концентрация гликопротеидов сыворотки крови.
ДФА показатель увеличен. СРБ сыворотки крови у больных с РА во ІІ стадии остается резко положительным, однако имеется тенденция к уменьшению его при стихании процесса.
Необходимо подчеркнуть, что повышенная СОЭ, диспротеинемия, положительная ДФА проба и положительная реакция на СРБ могут служить объективными показателями активности процесса у больных инфектартритом во ІІ стадии.
У больных с конкордантными плоско вальгусными деформациями стоп при анкилозах в голеностопном суставе стопы фиксированы под углом 100°. Передний отдел их распластан, выражено латеральное отклонение I пальца, II–V пальцы молоточкообразные, на подошвенной поверхности натоптыши, головки II–V плюсневых костей пальпируются на подошвенной поверхности, болезненны.
У больных с дискордантными деформациями преобладают эквиноварусные деформации стоп или эквинополые стопы и очень редко наблюдается пяточная деформация стопы с латеральным ее отклонением и опущением переднего отдела.
Анкилозы голеностопного и подтаранного суставов возникают у подавляющего большинства больных. В некоторых случаях сохраняется подвижность в суставах среднего отдела стопы.
Кожные покровы истончены с трофическими нарушениями, шелушением. Мышцы голени резко гипотрофичны (спичечные голени). Повышенная ломкость и обезображивание ногтевых пластинок.
На рентгенограммах в III стадии отмечен тяжелый остеопороз с наличием кистовидных просветлений с нечеткими контурами. У больных с фиброзно-костным анкилозом на фоне остеопороза местами прослеживалась суставная щель, в то время как у больных с костным анкилозом четко виден переход костных балок с одного суставного конца на другой. Лабораторные данные: со стороны крови отмечали гипохромную анемию, умеренную лейкопению, повышенное СОЭ в пределах 18–30 мм/ч, снижение альбуминово-глобулинового коэффициента до 1, положительная реакция на СРБ.
Патоморфологические исследования
Во ІІ стадии РА макроскопически в суставах отмечают более выраженные изменения. Причем поражение суставов может быть преимущественно экссудативного или пролиферативного типа. Мягкие ткани области сустава отечны, в полости сустава повышенное количество мутноватой синовиальной жидкости. Суставной хрящ теряет блеск, приобретая мутноватый оттенок.
При пролиферативном типе поражения суставов на первый план выступают разрастание грануляций, поверхностное разрушение хряща. Полость сустава уменьшается в размере и содержит небольшое количество синовиальной жидкости. Капсула сустава утолщена и уплотнена. Синовиальная оболочка неравномерно полнокровна, набухшая, с большим количеством сочных гипертрофированных ворсин. Местами происходит разрастание грануляционной ткани, которая в виде паннуса покрывает краевые участки поверхности суставного хряща. У больных со значительными ограничениями подвижности в суставах степень разрастания паннуса более выражена. Суставная поверхность теряет свой нормальный вид и блеск. Суставной хрящ неравномерно истончается, становится бархатисто матовым с участками выраженной слоистости. На суставной поверхности, особенно у ее краев под паннусом, во всех случаях возникают различной величины и неправильной формы узуры с четкими краями и розоватым или буроватым дном.
При микроскопическом исследовании капсулы сустава выявляется значительная вариабельность изменений в различных участках одного и того же сустава. В синовиальной оболочке и ее ворсинах на первый план выступает картина резкой пролиферации с разрастанием грануляционной и жировой ткани, с неравномерным утолщением слоя покровных клеток. В синовиальной оболочке участки мукоидного и фибриноидного набухания выявляют несколько реже, чем при І стадии заболевания. Определяют очаги разрушения коллагеновых волокон, вплоть до образования мелкоглыбчатой или зернистой белковой массы, дающей положительную окраску на фибрин. В синовиальной оболочке и ее ворсинах — диффузные и очаговые лимфоидно-плазматические и фиброгистиоцитарные инфильтраты. Кроме того, в результате созревания грануляционной ткани и дегенеративных изменений волокнистых структур возникают неравномерно выраженные склеротические изменения. При этом нередко склерозируются целые ворсины и большие участки синовиальной оболочки. Следует заметить, что одновременно с развитием склероза отмечают увеличение количества жировой ткани в синовиальной оболочке и ворсинах.
В одних участках синовиальной оболочки количество сосудов увеличено, а местами — резко уменьшено. Стенки мелких кровеносных сосудов и артериол значительно утолщаются за счет пролиферации и набухания эндотелия и разрастания соединительной ткани в средней оболочке. Просвет их резко сужается. Венулы, наоборот, расширены и переполнены эритроцитами или плазмой. Вокруг многих сосудов имеются лимфоидно-плазматические инфильтраты. При окраске срезов по методу Шуенинова в стенках сосудов и в окружающей их соединительной ткани часто выявляют отложения фибрина.
В фиброзном слое капсулы сустава патологические изменения более выражены, чем при І стадии заболевания. В этой части капсулы одновременно с участками мукоидного и фибриноидного набухания наблюдают склеротические и некробиотические изменения с явлениями гиалиноза. Здесь же появляются скопления жировой ткани. Во многих мелких и средних кровеносных сосудах происходит утолщение всех слоев стенки и резкое сужение просвета. Часто вокруг сосудов отмечают воспалительные лимфоидно-плазмоклеточные и фиброгистиоцитарные инфильтраты.
Микроскопически в суставном хряще отмечены значительные дегенеративно дистрофические и атрофические изменения с явлениями пролиферации хрящевых клеток. В различных отделах суставного хряща они выражены неравномерно. Наибольшие изменения выявляют в участках суставного хряща, которые покрыты паннусом. Здесь хрящ значительно истончен, узурирован и разволокнен. При окраске срезов толуидиновым синим установлено выраженное уменьшение метахромазии. В этих отделах суставного хряща расположение клеток резко нарушено. Многие клетки в участках разволокнения утрачивают морфологические признаки хрящевых клеток и напоминают по строению фибробласты.
Субхондральная костная пластинка истончена и на многих участках разрушена. В этих местах возникают разрастания грануляционной ткани с большим количеством кровеносных капилляров, которые глубоко проникают в вещество хряща. В зоне разрушения суставного хряща со стороны кости сохранившиеся островки хряща подвергаются оссификации. Здесь же в костномозговых полостях отмечены отек и пролиферация скелетогенной ткани с образованием костных балок. В межбалочных пространствах выявляют грануляционную ткань с лимфоидно-плазматическими инфильтратами и многочисленными кистовидно-расширенными синусами. Стенки мелких артериальных сосудов утолщены, просвет их сужен. Иногда встречаются сосуды с облитерированным или тромбированным просветом.
Одновременно с описанной патологической картиной в суставном хряще отмечают и менее измененные участки, преимущественно в центральных отделах суставной поверхности, где хрящ почти всегда оказывался свободным от паннуса. Здесь выявляют неглубокие узуры, выполненные грануляционной тканью. На большом протяжении хрящ сохраняет зональное и изогенное расположение хрящевых клеток и гомогенное строение основного вещества.
При гистологическом исследовании в указанных участках хряща местами отмечают атрофические и дистрофические явления: неравномерное истончение хряща и изменение его тинкториальных свойств в сторону усиления оксифилии; местами — вакуольную и зернистую дистрофию основного вещества хряща, а также клетки с пикнотичными ядрами и вакуолизированной протоплазмой. В этих участках суставного хряща сохраняется истонченная замыкающая субхондральная костная пластинка и со стороны кости не выявлено врастания сосудов в хрящ.
В кости эпифизов вблизи участков малоизмененного суставного хряща и в отдалении от зон его деструкции отмечают выраженные атрофические и дистрофические изменения. Костные балки расположены редко, истончены, со следами резорбции. Межбалочные пространства заполнены жировым костным мозгом, бедным на клеточные элементы.
Венозные синусы костного мозга резко расширены и заполнены эритроцитами или плазмой, что свидетельствует о длительности венозного застоя. В костном мозгу часто выявляют кистовидные образования и кистовидно-расширенные синусы.
Обоснование ортопедического лечения
Из описания клинической и патоморфологической картины ІІ стадии заболевания можно сделать вывод, что в пораженных суставах выражены явления рецидивирующего пролиферативно-деструктивного артрита, который у подавляющего большинства больных служит причиной длительной потери трудоспособности.
Во II стадии в суставах происходят органические изменения, которые постоянно прогрессируют, то есть ведут к дальнейшему разрушению суставов с развитием стойких дискордантных установок и нарушением функции, приводящие в конечном итоге к фиброзному или костному анкилозу крупных и мелких суставов верхних и нижних конечностей.
Отсюда и вытекает необходимость поисков таких методов лечения, которые бы позволили приостановить процесс, не допустить его прогрессирования, устранить развившиеся порочные установки, сохранить или восстановить функцию пораженных суставов и тем самым предупредить тяжелую инвалидизацию большого количества больных молодого и среднего возраста. Этого можно достичь, если в комплексное лечение включить ортопедические методы.
Существующие консервативные методы лечения позволяют уменьшить сенсибилизацию организма, повысить его реактивность, защитные свойства и пр. Однако устранить с их помощью описанных ранее органических изменений в суставах невозможно.
Как известно, источником «зла» при РА является синовиальная оболочка. Именно в ней развиваются неспецифические аутоиммунные процессы, поддерживающие хроническое течение заболевания или вызывающие его рецидив. Именно из нее, синовиальной оболочки, происходит разрастание грануляционной ткани, образование паннуса, который, разрастаясь, захватывает все новые участки суставного хряща, разрушает его и, в конечном итоге, ведет к деструкции, фиброзному или костному анкилозу сустава.
Следовательно, во ІІ стадии заболевания ограничиться лишь одной синовэктомией нельзя. Здесь уже имеются рубцовые изменения со стороны фиброзной капсулы, связок, сухожильных влагалищ. В самих суставах — обилие фиброзных спаек, шварт. Суставные поверхности перекрыты толстым паннусом, деформированы за счет большого количества узур и костно хрящевых разрастаний. Поэтому перед хирургом стоит задача не только убрать источник, поддерживающий артрит, но и придать суставным поверхностям конгруэнтность, исправить порочное положение конечности и восстановить функцию сустава.
Таким образом, характер, сложность и объем операции при ІІ стадии заболевания должны быть строго индивидуальными в зависимости от длительности заболевания, активности процесса и тех пролиферативных и деструктивных изменений, которые произошли в каждом суставе.
Так, если оперативное вмешательство производят в раннюю фазу ІІ стадии и хрящевой покров сустава разрушен незначительно, можно ограничиться синовэктомией, артролизом (удалением грануляционной ткани, спаек, паннуса, хрящевых разрастаний).
В тех случаях, когда хрящевой покров разрушен больше чем наполовину, имеются узуры в оставшемся хряще и выраженные костно хрящевые разрастания, показано (после удаления синовиальной оболочки и грануляционных разрастаний, а также спаек) формирование суставных поверхностей с последующим перекрытием их биологическими прокладками. В ряде случаев при стойких порочных установках приходится производить и капсулэктомию в местах рубцового ее перерождения.
Таким образом, во ІІ стадии заболевания имеются абсолютные показания для хирургического лечения.
Иммобилизация в функционально удобном положении пораженных суставов уменьшает выраженность болевого синдрома, предупреждает перерастяжение мышц. Иммобилизацию проводят вначале постоянно в течение 5–7 дней, а затем, по мере снижения активности процесса и болевого синдрома только на время сна. Кроме того, на пораженные суставы днем назначали фонофорез гидрокортизона, а на ночь область коленного сустава смазывали смесью из трех мазей, взятых в равных соотношениях (гепарин, 10% анестезин, гидрокортизон), а затем накладывали компресс с 30 или 50% раствором диметилсульфоксида (ДМСО).
В период острого синовита больному необходимо соблюдать постельный режим и назначать ЛФК, так как мышечное бездействие может усугубить остеопороз и вызвать значительную мышечную гипотрофию. Поэтому в комплексном лечении применяют ЛФК для нефиксированных сегментов, мышц живота, грудной клетки и для мышечного аппарата иммобилизованной конечности путем волевых сокращений мышц антагонистов (импульсная гимнастика). Это позволяет сохранить двигательные рефлексы, улучшить микроциркуляцию, что в свою очередь усиливает обмен веществ, улучшает энергетические возможности мышечного аппарата и трофику всей конечности.
Учитывая, что гипотония, гипотрофия мышц, особенно разгибателей, развиваются рано, по мере снижения активности процесса и болевого синдрома назначали массаж и электромиостимуляцию.
С помощью импульсной гимнастики, миоэлектростимуляции и массажа удавалось проводить активную профилактику гипотрофии мышц, сохранять их силу и работоспособность.
С целью объективной оценки функционального состояния синовиальной оболочки коленного сустава применяли сцинтиграфическое исследование с помощью внутрисуставного введения 99mТс пертехнетата у 62 больных в различных стадиях, фазах и при высокой активности патологического процесса. После введения 99mТс пертехнетата в количестве 3,7 МБК в объеме 1 мл в течение 30 мин производили запись информации. Изображение сустава на дисплее после введения 99mТс пертехнетата в норме представлялось двояко вогнутым, горизонтально расположенным диском с четкими контурами.
У большинства больных ревматоидным синовитом изображение суставной полости было изменено от незначительного увеличения при умеренном синовите до больших размеров при синовите со значительным выпотом.
Функциональное состояние синовиальной оболочки характеризовалось скоростью всасывания суставной жидкости из полости сустава и оценивалось по времени выведения 99mТс пертехнетата, введенного в сустав.
Обычно, у всех больных с РА отмечали замедленное выведение 99mТс пертехнетата, причем замедление нарастало в соответствии с тяжестью поражения сустава и активностью патологического процесса.
Исследование показало, что сцинтиграфия позволяет выявить субклинические варианты проявления синовита.
У больных со II стадией патологического процесса преобладают экссудативно-пролиферативные и пролиферативно-деструктивные изменения в суставах.
Больные со II стадией заболевания нуждаются в комплексном ортопедическом лечении, цель которого — профилактика порочных установок в непораженных суставах и устранение деформации и восстановление функции в пораженных суставах.
У этих больных менее выражены экссудативные явления, суставы уменьшаются в объеме, болевой синдром становится менее интенсивным, проявляется гипотрофия разгибательной группы мышц, кожа в области суставов истончается, капсула при пальпации — тестообразной консистенции, особенно в области заворотов и складок. В суставах возникают фиксированные порочные установки, чаще в положении сгибания с приведением бедра и наружной ротацией голени. Надколенник срастается с эпифизом.
Консервативное лечение
Консервативное лечение проводят на фоне терапевтического медикаментозного лечения. Кроме того, назначают УФО области позвоночника и надпочечников и воздействие на вегетативную нервную систему с помощью игло-рефлексотерапии. Для подавления воспалительного процесса в суставе местно на область сустава назначают фонофорез с гидрокортизоном, электрофорез кальция, чередуя с раствором лидокаина или со смесью Парфенова. Для уменьшения дезорганизации соединительной ткани суставных хрящей и улучшения обменных процессов в качестве биогенного стимулятора назначают стекловидное тело 2,0 № 30 ежедневно или румалон для регуляции процессов углеводного обмена и функции нервной системы — витамин B12 № 15.
При высокой общей активности заболевания, когда в результате проводимой терапии улучшение не наступает или синовит часто рецидивирует, применяют инфузионную терапию по Е.Т. Скляренко, позволяющую снизить активность патологического процесса, уменьшить концентрацию патологических иммунных комплексов в сосудистом русле, облегчить их выведение из организма и стабилизировать функцию микроциркуляторного русла.
Состав раствора для капельного введения следующий: 400,0 мл реополиглюкина или неогемодеза, полиглюкина, 10 000–15 000 АТрЕ контрикала, 700–10 000 МЕ гепарина, заканчивая капельницу введением 10 ед. инактивации (ЕИК) 10% раствора хлористого кальция. На курс лечения назначали 3–5 капельниц (в зависимости от активности заболевания) с интервалом 3–5 дней. Как правило, после инфузионной терапии уже с первых дней отмечают уменьшение выраженности боли в суставах, скованности, улучшение общего состояния.
Особое значение придают методам местного воздействия на пораженные суставы, направленные на ликвидацию воспаления в них, профилактику процессов рубцевания и развития порочных установок и контрактур. Принимая во внимание, что реактивный фиброз является одним из патогенетических механизмов, приводящих к тугоподвижности и контрактурам, используем антифиброзирующую терапию с помощью внутрисуставного введения фуразолидона (по Скляренко — Перфиловой) — ингибитора синтеза коллагена при локальном воздействии на синовиальную оболочку. С этой целью проводят пункцию пораженного коленного сустава, удаляют воспалительный экссудат и внутрисуставно вводят 0,01–0,02 мг фуразолидона, растворенного в 5000 МЕ гепарина и в 1–2 мл 1% раствора тримекаина (прокаинамида, лидокаина). Количество введений 3–5 через 5–7 дней в зависимости от полученного клинического эффекта.
Не менее остро стоит вопрос о купировании болевого синдрома, лишающего сна, отдыха пациентов, приводящего к нарушению функции сустава, к истощению нервной системы больных. Уже на ранних стадиях заболевания при синовитах в результате болевого синдрома больные стараются придать конечности такое положение, при котором емкость коленного сустава была бы максимальной и тем самым уменьшилось бы давление жидкости на воспаленную синовиальную оболочку. Таким положением для коленного сустава является полусогнутое. Однако при этом нарушается физиологическое равновесие мышц антагонистов, так как разгибатели находятся в положении постоянного перенапряжения, а сгибатели — сокращения. Если при этом учесть, что у больных с РА отмечают общее поражение соединительной ткани, продуктивный васкулит, нарушение трофики, да еще присоединяются к указанным изменениям дополнительные механические нарушения микроциркуляторного русла, то становится ясной причина ранней мышечной гипотрофии и быстрого развития контрактур, еще до возникновения деструктивных изменений в суставе. Поэтому обязательным элементом комплексной терапии на ранних стадиях поражения суставов является применение ортопедического лечения в виде корригирующих шин, гипсовых повязок для создания покоя в острый период, профилактики развития порочных установок и контрактур. При создании покоя конечности функция пораженных суставов значительно ограничивается с дальнейшим развитием фиброзного, а затем костного анкилоза. Контрактуры в этой стадии обусловлены как суставными, так и внесуставными изменениями.
Следовательно, устранение порочных установок на ранних стадиях заболевания является необходимой мерой для восстановления и сохранения функции пораженного сустава. Поэтому наряду с медикаментозным лечением показано ортопедическое лечение, направленное на создание покоя конечности, уменьшение выраженности болевого синдрома, восстановление физиологического равновесия мышц антагонистов, на профилактику мышечных гипотрофий и сохранение амплитуды движений. С этой целью применяют соответствующие укладки конечности в физиологическом положении, манжеточное вытяжение, гипсовые шины, редрессации.
Во II стадии при ограничении движений в пораженных суставах различной степени, при наличии контрактур и отсутствии высокой активности патологического процесса эффективным методом устранения контрактур является метод редрессации с последующим применением этапных гипсовых повязок.
Редрессацию проводят следующим образом: под наркозом или эпидуральной анестезией при полном расслаблении мышц фиксируют проксимальный сегмент конечности и постепенно с нарастающей амплитудой проводят сгибательно-разгибательные движения дистальным сегментом конечности, медленно преодолевая сопротивление, без рывков и резкого насилия, помня о том, что у больных ревматоидным артритом имеется значительный остеопороз костей и при редрессации может легко наступить перелом. После проведения 20–30 движений дистальным сегментом конечности до максимального разгибания или сгибания, конечность фиксируют гипсовой повязкой. Через 3–5 дней редрессацию повторяют до полного устранения контрактуры и восстановления рабочей амплитуды движений в пораженном суставе.
После снятия гипсовой повязки назначают ЛФК, направленную на восстановление амплитуды пассивных и активных движений в суставе, на восстановление силы, выносливости и работоспособности мышц.
Проводят 3–5 таких этапов до полного устранения контрактур. Назначают курс ЛФК, АТФ 1 мл, № 20, витаминотерапию В1, № 15, В6 — 1 мл, № 15, В12 по 200 мг, № 15, шалфейные аппликации на ночь, аппликации нафтальгиновой мази или мази Вишневского в сочетании с компрессом 30–50% раствора димедиметилсульфоксида.
Сочетание ЛФК с медикаментозным и физиотерапевтическим лечением, массаж, миостимуляция значительно ускоряет восстановительный процесс в мышцах, улучшает кровообращение, трофику и сокращает сроки реабилитации.
Для устранения порочных установок при наличии подвывихов используют аппарат Волкова — Оганесяна, который позволяет в течение короткого времени создать необходимый диастаз суставных поверхностей, а затем устранить контрактуру, подвывих и восстановить движение в суставе. Сборка и подгонка аппарата производилась накануне, с учетом степени сгибательной контрактуры. На коже больного красителем наносили метки у мест проведения спиц. Использовали модель аппарата № 4, которая позволяет без дополнительных расчетов и коррекции спиц наложить аппарат в течение 15 мин. При применении аппарата необходимо учесть степень остеопороза из за опасности «прорезывания» спиц. В течение 2–3 дней выраженность болевого синдрома в местах проведения спиц уменьшается, после чего производят дозированную по 1 мм в сутки дистракцию в коленном суставе. В течение 5–7 дней прекращают дистракцию, достигнув расширения суставной щели. Степень подвывиха голени кзади при дистракции уменьшалась, а в некоторых случаях подвывих устранялся. При помощи разгибающего устройства устраняют сгибательную контрактуру. Разгибание проводят медленно, дозированно, под контролем врача.
Порочные установки стоп у больных с РА возникают уже в I стадии заболевания вследствие внесуставных и внутрисуставных воспалительных процессов.
Причинами их возникновения являются упорные или часто рецидивирующие тендосиновиты, тендовагиниты и синовиты с выраженным болевым синдромом. При тендосиновитах и тендовагинитах больной старается придать стопе такое положение, при котором бы исключались напряжение и функция пораженного сухожилия.
При поражении сухожилий медиальной группы (тендосиновит m. tibialis posterius, m. flexor hallucis longus) возникает варусная установка стоп, при тендосиновитах латеральной группы (тендосиновит m. peroneus longus et brevis) — вальгусная установка стоп; при тендосиновитах ахиллова сухожилия больные фиксируют стопу в положении подошвенной флексии, а при поражении сухожилий передней группы (тендосиновит m. extensor digitorum communis, m. tibialis anticus) стопа фиксирована в положении тыльной флексии.
Такое длительное вынужденное положение стоп с нарушением физиологического равновесия мышц антагонистов при отсутствии ортопедического профилактического лечения является пусковым механизмом к развитию контрактур и фиброзных процессов в расслабленной части капсулы сустава и мышцах.
При выраженных синовитах возникают внутрисуставные порочные установки вследствие постоянного давления (особенно при движениях) экссудата на воспаленную и обильно иннервируемую капсулу и синовиальную оболочку. Развивается значительный болевой синдром, для уменьшения выраженности которого больные стараются придать стопе такое положение, при котором емкость сустава была бы максимальной и тем самым уменьшилось бы давление на воспаленную синовиальную оболочку и капсулу.
Таким положением для голеностопного сустава является эквинусная установка стопы, при которой нарушается физиологическое равновесие мышц антагонистов и в дальнейшем создаются благоприятные условия для фиброзных процессов в икроножных мышцах с формированием контрактуры.
Сочетание внесуставных и внутрисуставных поражений приводит к развитию разнообразных сложных порочных установок, переходящих затем в первичные ранние, а в дальнейшем — в поздние деформации стоп. Следовательно, развитие деформаций у больных с РА не неизбежно, а обусловлено отсутствием запрограммированных лечебно-профилактических мероприятий на ранних стадиях заболевания.
Второй причиной образования деформации стопы и голеностопного сустава является не поражение их РА, а длительные вынужденные порочные установки при компенсации укорочения, возникшего из за контрактур в коленном или тазобедренном суставах или же вследствие длительных вынужденных статических установок.
При длительном лежании в постели, когда в коленных и тазобедренных суставах имеются контрактуры, стопы находятся в положении наружного отклонения, возникают плоско вальгусные или же эквино-вальгусные установки. При такой длительной вынужденной установке стоп происходит перерастяжение сумочно-связочного аппарата с медиальной стороны и теряется физиологический тонус, в то время как с латеральной стороны отмечают сморщивание и его рубцевание. В таком положении перонеальная группа мышц находится в постоянном сокращении и при отсутствии ортопедической профилактики (особенно у больных с РА) уже на ранних стадиях происходят рубцовые изменения в сумочно-связочном аппарате на латеральной стороне стопы и голеностопного сустава, в перонеальных мышцах, их влагалищах, что является причиной возникновения вторичных деформаций стоп.
В дальнейшем, при отсутствии ортопедической профилактики возникшие порочные установки в экссудативной стадии заболевания вследствие прогрессирования патологического процесса в суставах, периартикулярных тканях, то есть развития пролиферативных, затем склеротических и наконец анкилозирующих явлений, становятся фиксированными деформациями стоп, которые разделяют на ранние и поздние.
Ранние первичные деформации выявляют у больных в I и начале II фазы при II стадии РА, когда в суставах и периартикулярных тканях возникают пролиферативно-фиброзные изменения, обусловливающие развитие контрактур, которые поддаются консервативному ортопедическому лечению.
Поздние первичные деформации возникают у больных во II и III фазах II и III стадий вследствие деструктивных склеротических из мнений в суставе и периартикулярных тканях.
Поздние первичные деформации консервативными ортопедическими методами устранить не представляется возможным и таковые подлежат хирургическому реконструктивно-восстановительному лечению.
Развитие вторичных деформаций стоп и голеностопного сустава в отличие от первичных происходит при отсутствии острого воспалительного процесса в суставах стоп, голеностопном суставе и периартикулярных тканях. Они возникают вследствие длительных вынужденных порочных установок стоп, в результате развития рубцовых изменений в сморщенном сумочно-связочном аппарате и контрагированных мышцах или вследствие дискордантных деформаций в коленных, тазобедренных суставах.
Исходя из того, что причиной вторичных деформаций стоп и голеностопного сустава являются дискордантные деформации коленных и тазобедренных суставов, то в первую очередь необходимо исправлять и восстанавливать их функцию, то есть причину, а затем добиваться устранения деформации стоп и голеностопного сустава.
Многообразие порочных установок и деформаций при поражении ревматоидным процессом голеностопного сустава, суставов стоп, пальцев и сухожильных влагалищ стало причиной появления в литературе множества классификаций, целью которых была систематизация деформаций, что позволяло бы обосновывать показания для ортопедического лечения.
Так, K. Vainio (1956) за основу классификации взял форму деформаций стоп и выделил следующие деформации: варусные, эквинусные, полые, пяточные и болтающиеся стопы.
Однако предложенная классификация не отражает динамику формирования деформаций, которые начинались с порочных установок уже на ранних стадиях, а констатирует лишь формы возникших деформаций на поздних стадиях заболевания.
W. Dybowski (1965) считал целесообразным учитывать распространенность и тяжесть поражения стопы и выделил три степени:
- Значительные деформации, захватывающие передний и задний отделы стоп с выраженными рентгенологическими изменениями.
- Менее значительные, ограничивавшиеся только передним отделом стоп с небольшими рентгенологическими изменениями.
- Ревматоидные поражения сухожильных влагалищ с невыраженными рентгенологическими изменениями.
Е.Т. Скляренко (1971) при РА выделил 4 группы деформаций, обусловленных локализацией патологического процесса:
- Деформации стоп, возникшие вследствие патологического процесса в голеностопном и подтаранном суставах.
- Деформации, обусловленные локализацией ревматоидного процесса в шопаровом и лисфранковом суставах.
- Деформации, связанные с поражением переднего отдела стопы.
- Тотальные поражения суставов стопы с образованием различных деформаций.
В классификации В.В. Троценко (1975) выделены поражения околосуставных тканей суставов и вторичные деформации.
I. Первичное ревматоидное поражение околосуставного аппарата.
- Ревматоидные поражения околосуставного аппарата области голеностопного сустава и стоп:
а) поражение сухожилий и их влагалищ (тендениты, тендосиновиты, тендовагиниты);
б) поражение околосуставных слизистых сумок (ахиллобурсит, подошвенно пяточные бурситы и др.);
в) поражение жировой клетчатки (панникулиты в области ахиллова сухожилия, подошвенной жировой подушки и др.).
- Ревматоидное поражение суставов:
а) артрит голеностопного сустава;
б) полиартрит суставов среднего отдела стопы; в) полиартрит переднего отдела стопы.
II. Вторичные фиксированные деформации стопы и голеностопного сустава:
- эквинусный тип;
- плоско вальгусный тип;
- варусный тип;
- круглая стопа;
- типичные деформации стоп.
Безусловно, эта классификация наиболее полно отражает характер поражения области голеностопного сустава и стоп, однако она, как и все другие вышеперечисленные классификации, не раскрывает механизма образования деформации и зависимости от стадии заболевания и не может служить основанием для обоснования тактики ортопедического лечения и профилактики.
Учитывая вышесказанное, на основании динамики развития патологического процесса, клинических и рентгенологических проявлений Е.Т. Скляренко предложил следующую классификацию деформаций голеностопного сустава и суставов стоп у больных с РА (табл. 7).
Таблица 7. Классификация деформаций стоп и голеностопного сустава при РА
| Название деформации | Клинико-морфологические проявления патологического процесса | Стадия | Характер деформации | Вид деформации | Ортопедическое лечение |
| I. Порочные установки | 1. Воспаление (экссудация)
а) внесуставное (тендиниты, тендовагиниты, тендосиновиты, бурситы); б) внутрисуставное (синовиты) 2. Вынужденное положение |
І стадия | Конкордантные, нефиксированные | Варусная, вальгусная, эквинусная, пяточная стопа | 1. Консервативное (укладки, гипсовые лонгеты, шины, ортопедическая обувь, стельки, пункция и удаление экссудата с введением медикаментозных веществ)
2. Хирургическое профилактическое (синовэктомия, тендосиновэктомия, бурсэктомия) |
| II. Первичные деформации
Ранние |
Экссудация-пролиферация:
а) внесуставная б) внутрисуставная |
II стадия (I, II фазы) | а) конкордантные;
б) дискордантные |
Вальгусная, варусная, эквинусная стопа, их сочетания, плоскостопие с латеральным отклонением I пальца, молоточкообразные деформации |
1. Консервативное (редрессации, этапные гипсовые повязки, аппараты Волкова — Оганесяна, ортопедическая обувь, стельки)2. Хирургическое (тендосиновэктомия, синовкапсулэктомия, реконструкция переднего отдела стоп, трехсуставный артродез) |
| II. Первичные деформацииПоздние |
Деструкция суставных поверхностей, склероз периартикулярных тканей, внутрисуставные шварты и спайки, фиброзный костный анкилоз |
II стадия (III фаза)
III стадия |
а) конкордантные;
б) дискордантные фиксированные |
Вальгусная, варусная, эквинусная деформации стоп, их сочетание, плоскостопие с латеральным отклонением I пальца, молоточкоооразные деформации |
Хирургическое (артролиз, резекция суставов, остеотомии, артропластика с тотальной капсулэктомией, реконструкция переднего отдела стоп) |
| III. Вторичные деформации | Контрактуры: рубцовые изменения в периартикулярных тканях и капсуле сустава вследствие длительных вынужденных порочных положений без воспалительного процесса в суставе |
II стадия (II,III фаза)
III |
а) конкордантные;
б) дискордантные фиксированные |
Вальгусная, варусная, эквинусная, полая стопа, их сочетания |
Хирургическое: резекции суставов, остеотомии, артролиз, удлинение сухожилий, реконструкция переднего отдела стоп |
Следовательно, тактика ортопедического лечения больных с РА должна строиться исходя из понимания механизма развития деформации, стадии патологического процесса, общего состояния больного, его волевых качеств.
У больных во ІІ стадии заболевания, как было отмечено ранее, кроме синовэктомии необходимо произвести и удаление шварт, паннуса, костно хрящевых разрастаний на суставных концах при условии, если большая поверхность суставных концов перекрыта сохранившимся хрящом. В тех случаях, когда хрящевой покров разрушен, необходимо формировать новые суставные поверхности и перекрывать их прокладками. У больных с РА применение прокладок при артропластике — обязательное условие успеха в силу хронического рецидивирующего течения патологического процесса и универсального поражения соединительной ткани.
Вначале при хирургическом лечении РА производили только механическую обработку суставных поверхностей или применяли аутопрокладки (фасция, кожа), воск. Однако исходы оказались неудовлетворительными ввиду частых рецидивов анкилоза (последний наступал через 6–9 мес после операции).
Причину неудач можно объяснить тем, что при РА выявляют общее поражение соединительной ткани и хроническое рецидивирующее течение патологического процесса. Аутопрокладки (фасции, фасция — жир, мышцы) поражены аутоиммунным процессом и способствуют рецидиву анкилоза.
В дальнейшем использовали аллопрокладки, но и они не предупреждали рецидив анкилоза. Кроме того, аллопрокладки способствовали деструктивным изменениям суставных концов.
Эндопротезы, искусственные суставы, дают также временный результат. Эндопротезы самых современных конструкций не «вживляются», а постоянно являются инородным телом и показаны они больным старших возрастных групп.
С 1962 г. Е.Т. Скляренко применял в качестве прокладок консервированные оболочки семенников быка. Методика заготовок и консервирования разработана в Киевском научно исследовательском институте ортопедии Г.М. Дизик и Н.Н. Мусиенко.
Что собой представляют эти оболочки по анатомо морфологической структуре? В составе стенок семенникового мешка, который образуется путем выпячивания брюшной стенки, имеются все элементы брюшной стенки: серозная оболочка, фасции, мышечный слой и кожа. Оболочки эластичны, плотны, толщина их колеблется от 1 до 3 мм. Размер их достаточен для окутывания самых больших суставов человека при восстановительных операциях.
Забор и консервирование оболочек просты, не требуют специальной техники и аппаратуры.
На бойне отбирают семенные железы только что убитого быка и доставляют в лабораторию консервирования тканей, где производят их обработку. Наружный покров мошонки тщательно моют щетками с мылом в течение 5–7 мин, затем дезинфицируют 2% раствором хлорамина в течение 15–20 мин и в стерильных условиях снимают вместе с мышечным пластом. Остается общая влагалищная оболочка. Ее надрезают стерильными ножницами и легко снимают, после чего обнажается специальная влагалищная оболочка (она тоже должна быть снята и подвергнута консервированию). Обе эти оболочки погружают в 2% раствор хлорамина на 10–12 дней. По истечении этого времени оболочки обычно оказываются стерильными. Следует отметить, что к концу 2 й недели консервирования 2% раствор хлорамина вызывает набухание коллагеновых волокон, благодаря чему происходит уплотнение соединительнотканных структур оболочек. Этот факт особенно важен для качества прокладок.
Для длительного хранения оболочки дополнительно подвергают обработке антибиотиками. В лаборатории консервирования тканей разработан и внедрен метод биологической стерилизации, заключающийся в обработке химиопрепаратами и антибиотиками широкого спектра действия. В течение 40 мин ткани находятся в 10% растворе фталазола, нагретого до 30°, а затем такое же время в растворе, содержащем смесь антибиотиков (стрептомицин, колимицин, левомицетин, мономицин, мицерин и др.). Концентрация антибиотиков — 1 000 000 ЕД на 1 л раствора. От применения пенициллина для биологической стерилизации консервируемых тканей отказались, так как часто микроорганизмы оказываются малочувствительными к нему.
После указанной обработки ткани подвергают бактериологическому контролю. Хранят обработанные стерильные ткани в стерильных стеклянных банках с притертыми пробками или флаконах из под крови с резиновыми пробками. В банке обычно хранят 2–4 оболочки, чтобы хирург не был стеснен в выборе. В эти флаконы наливают консервирующую среду — раствор Белякова 31 Е. Банки закрывают стерильными пробками, завязывают марлевыми салфетками и наклеивают этикетку с указанием наименования ткани, даты и способа консервирования, консервирующей среды и сроков ее смены. Затем их помещают в холодильник и хранят при температуре от –4 до +6 °С. Раствор необходимо менять один раз в 10–15 дней. Оптимальный срок хранения 2–3 мес.
Преимущества данной прокладки таковы: легкость заготовки, простая методика консервирования и хранения, отсутствует необходимость в индивидуальном подборе. Прокладка пригодна для крупных и мелких суставов, перекрывает не только суставные поверхности, но и суставные концы, позволяет начать разработку движений в оперированном суставе в предельно ранние сроки, длительно рассасывается, является надежным препятствием для рецидива анкилоза. Это подтвердили многолетние наблюдения отдаленных исходов более 1000 артропластик крупных и мелких суставов с прокладкой у больных с РА.
Методики операции
Синовэктомия с артропластикой межфалангового сустава. Операцию производят под циркулярной инфильтрационной анестезией. Разрез длиной до 5–6 см проходит по тыльно-лучевой стороне пальца. Вначале его ведут параллельно основной фаланге пальца, а затем на уровне сустава — дугообразно поворачивают латерально и на уровне основания второй фаланги вновь возвращаются к медиальной стороне и заканчивают на уровне средней трети второй фаланги.
После рассечения кожи, подкожной клетчатки, фасции рану расширяют крючками. Сухожилие разгибателя, которое часто бывает истончено и разволокнено, мобилизуют и оттягивают крючками в локтевую сторону. В рану выступает напряженная капсула сустава. Последнюю рассекают продольно и рану расширяют крючками.
Следующий этап операции — иссечение пораженной синовиальной оболочки. При этом боковые связки отделяют от боковых поверхностей головки первой фаланги. С помощью острого долота удаляют разрушенный и оставшийся измененный хрящ, костно хрящевые разрастания. Суставному концу первой фаланги придают форму цилиндра. Затем удаляют разрушенный хрящевой покров, паннус и костно хрящевые разрастания с проксимального суставного конца второй фаланги и придают ему вогнутую форму, соответствующую новосозданной головке первой фаланги. Новосозданные суставные поверхности обрабатывают рашпилем и затем суставную поверхность головки первой фаланги или обе поверхности перекрывают оболочкой семенника быка, которую подшивают кетгутовыми швами к мягким тканям или чрескостно. Суставные поверхности сопоставляют, подшивают отсеченные боковые связки и
зашивают капсулу сустава. Сухожилие разгибателя смещают в сторону лучевой кости, а при разволокнении его сшивают в единый пучок и фиксируют кетгутовыми или капроновыми швами так, чтобы при функции оно не смещалось в локтевую сторону. Рану послойно зашивают наглухо. Иммобилизацию осуществляют ладонной гипсовой шиной в течение 3–5 дней. На 2–3 и сутки начинают ЛФК.
Синовэктомия с артропластикой пястно-фалангового сустава. Операцию выполняют под циркулярной инфильтрационной анестезией. При поражении одного двух суставов применяют продольные разрезы. При поражении всех пястно-фаланговых суставов — поперечный разрез, который проходит по тыльной поверхности кисти на уровне головок пястных костей. После рассечения кожи, подкожной клетчатки, фасции рану расширяют крючками и выделяют сухожилие разгибателя. При поражении его влагалища удаляют разросшуюся грануляционную ткань. Затем продольным разрезом вскрывают выступающую в рану напряженную и растянутую выпотом капсулу сустава и иссекают пораженную синовиальную оболочку вначале с тыльно-боковых поверхностей, а затем, согнув палец, — с ладонной поверхности. Если палец согнуть невозможно из за резкого сужения суставной щели, деформирующих и фиброзных изменений в суставе, вначале формируют суставные поверхности: обрабатывают головку пястной кости, которой придают выпуклую форму, а затем основанию основной фаланги придают вогнутую форму. После этого, согнув палец, свободно иссекают синовиальную оболочку на ладонной поверхности сустава. Суставные поверхности обрабатывают рашпилем. При наличии рубцовых контрактур и отклонения пальцев латерально обязательно иссекают рубцово-измененную капсулу сустава.
Далее сформированный суставной конец пястной кости перекрывают консервированной оболочкой семенника быка, подшивая ее к окружающим мягким тканям, или же перекрывают оба суставных конца. Суставные поверхности сопоставляют и зашивают капсулу сустава. При наличии тенденции к локтевому отклонению фаланги капсулу сустава с лучевой стороны сшивают в виде дупликатуры, а рассеченную часть с локтевой стороны не зашивают. Сухожилие разгибателя укладывают параллельно оси пальца, фиксируют к мягким тканям кетгутовыми швами (особенно при наличии вывихивания его в локтевую сторону), затем обязательно перекрывают фасцией и рану послойно зашивают наглухо. В тех случаях, когда сухожилие разгибателя разволокнено, его сшивают в один пучок тонкими кетгутовыми или капроновыми нитками. Иммобилизация ладонной гипсовой шиной — в течение 3–5 дней.
Синовэктомия с артропластикой лучезапястного сустава. Операцию производят под внутрикостным обезболиванием наркозом. Кожу рассекают прямым или слегка овальным разрезом (при необходимости вмешательства на радиоульнарном сочленении) по тыльной поверхности лучезапястного сустава. Рассекают кожу, подкожную клетчатку, затем — поперечную связку и выделяют сухожилия разгибателей. Если сухожильные влагалища изменены, обязательно иссекают разросшуюся грануляционную ткань, после чего их раздвигают крючками так, что в локтевую сторону отодвигают общий разгибатель, а в лучевую — разгибатель большого пальца. При наличии выпота в рану выступает напряженная капсула сустава (в случае выраженных пролиферативных изменений она имеет тестоватую консистенцию). Продольным разрезом ее вскрывают, раздвигают крючками и иссекают пораженную синовиальную оболочку с тыльно-боковых поверхностей. При отклонении кисти в сторону локтевой кости обязательно частично иссекают боковую локтевую связку запястья.
Далее с помощью долота удаляют измененные ткани суставных поверхностей, создавая диастаз в 1,5–2 см. Суставной поверхности лучевой кости придают вогнутую форму, а костям запястья соответственно — выпуклую. При поражении радиоульнарного сочленения иссекают капсулу сустава с синовиальной оболочкой и частично головку локтевой кости, если она деформирована. После этого появляется возможность иссечь синовиальную оболочку на ладонной поверхности сустава.
Следующий этап — сформированный суставной конец лучевой кости перекрывают консервированной оболочкой семенника быка и подшивают ее к мягким тканям. Суставные поверхности сопоставляют, зашивают капсулу сустава. Сухожилия разгибателей укладывают на свое место, перекрывают фасцией и рану послойно зашивают наглухо. Иммобилизация ладонной гипсовой шиной длится 3–5 дней.
Синовэктомия с атропластикой локтевого сустава. Операцию выполняют под внутрикостным обезболиванием. Наиболее рациональным является доступ Лангенбека.
На 4–5 см выше мыщелков плечевой кости по задней поверхности сустава проводят разрез кожи через верхушку локтевого отростка длиной до 10–12 см. После рассечения кожи, подкожной клетчатки, фасции выделяют сухожилие трехглавой мышцы плеча и Z образно рассекают в сагиттальной или фронтальной плоскости, в зависимости от его толщины. Затем выделяют локтевой нерв и с помощью марлевой держалки оттягивают его медиально. Вскрывают капсулу сустава по задней поверхности и, иссекая пораженную синовиальную оболочку, отделяют мягкие ткани с капсулой сустава от мыщелков плеча, а суставные поверхности вывихивают в рану.
С помощью долота удаляют измененный и пораженный хрящевой покров и суставному концу плечевой кости придают форму «катушки». Сообразно сформированному суставному концу плечевой кости формируют суставную поверхность локтевой кости. Локтевой отросток уменьшают в объеме и укорачивают. Суставным поверхностям придают конгруэнтную форму, укорачивают разросшийся и удлиненный венечный отросток. Тщательно иссекают пораженную синовиальную оболочку на передней поверхности сустава и в проксимальном радиоульнарном сочленении. Головку лучевой кости частично резецируют. Сформированные суставные поверхности обрабатывают фрезами или рашпилем. После этого суставной конец плечевой кости перекрывают консервированной оболочкой семенника быка, которую укрепляют кетгутовыми швами к окружающим мягким тканям.
Суставные поверхности сопоставляют, зашивают фиброзную капсулу сустава. Шелковыми или капроновыми швами сшивают рассеченное сухожилие трехглавой мышцы плеча. Локтевой нерв укладывают в новое ложе и перекрывают его фасцией. Рану послойно зашивают наглухо. Иммобилизацию проводят в течение 3–5 дней задней гипсовой шиной от верхней трети плеча до средней линии ладонной поверхности кисти.
Синовэктомия с артропластикой тазобедренного сустава. Операцию выполняют под интубационным наркозом. Лучше пользоваться доступом Лексера — Кохера. Рассекают кожу, подкожную клетчатку, фасцию и проводят тщательный гемостаз. Затем отбивают верхушку большого вертела с прикрепляющимися мышцами и оттягивают их крючком кверху. Острым и тупым путем проходят между большой ягодичной мышцей и мышцей, напрягающей широкую фасцию бедра до капсулы сустава, которую рассекают продольно по шейке и дополнительно отсекают по передней поверхности шейки. Расширяют рану крючками, пересекают круглую связку, если она не разрушена, и вывихивают головку бедренной кости в рану. Производят иссечение утолщенной и патологически измененной синовиальной оболочки и с помощью долота удаляют оставшийся на головке пораженный хрящ и костно хрящевые разрастания. Для удлинения шейки сбивают большой вертел, и проксимальный конец бедренной кости зашлифовывают рашпилем. После этого новосформированную головку, шейку бедренной кости и частично вертельную область перекрывают консервированной оболочкой семенника быка, которую фиксируют кетгутовыми швами к мягким тканям. Тщательно иссекают костно хрящевые разрастания по краям вертлужной впадины. Обязательно иссекают поперечную связку вертлужной впадины и грануляционную ткань, разросшуюся вокруг нее. Проводят тщательный гемостаз, проксимальный конец бедренной кости вправляют в вертлужную впадину и накладывают кетгутовые швы на капсулу сустава. Верхушку большого вертела с прикрепляющимися мышцами пришивают или прибивают костным трансплантатом к бедренной кости. При этом необходимо помнить о сохранении физиологического тонуса ягодичных мышц. Рану послойно зашивают наглухо. При наличии приводящей контрактуры необходимо произвести миотомию приводящих мышц. Иммобилизация осуществляется кокситной гипсовой повязкой в течение 5 дней, после чего приступают к пассивно активной разработке движений в оперированном суставе.
Синовэктомия с артропластикой коленного сустава. Операцию проводят под наркозом, проводниковой анестезией. Доступ — парапателлярный латеральный. На 3–4 поперечника пальцев выше верхнего полюса надколенника по передней поверхности бедра проводят разрез, который дугообразно огибает надколенник с латеральной стороны и заканчивается ниже бугристости большеберцовой кости. Рассекают кожу, подкожную клетчатку, фасцию и рану расширяют крючками. Далее, выделив собственную связку надколенника, рассекают ее Z-образно во фронтальной или сагиттальной плоскости. Вскрывают капсулу сустава и надколенник вывихивают медиально, широко раскрыв сустав. Удаляют утолщенное склерозированное жировое тело, мениски и опиливают суставные концы, при этом бедренной кости придают выпуклую форму, в виде опрокинутого цилиндра, а большеберцовой — вогнутую. Суставные поверхности обрабатывают электрофрезой и рашпилем и иссекают всю пораженную синовиальную оболочку коленного сустава. Боковые связки сохраняют. Новосозданные суставные концы перекрывают консервированными оболочками семенников быка, которые прикрепляют кетгутовыми швами к окружающим мягким тканям. При необходимости надколенник уменьшают в объеме, его суставную поверхность заглаживают рашпилем и перекрывают консервированной оболочкой семенника быка. Последнюю фиксируют к мягким тканям кетгутовыми швами. Снимают жгут и проводят тщательный гемостаз. Суставные поверхности сопоставляют, надколенник укладывают на свое место, шелковыми или капроновыми швами сшивают собственную связку надколенника и накладывают швы на капсулу сустава. После этого рану послойно зашивают наглухо. Иммобилизацию проводят гонитной повязкой в течение 7 дней. При наличии тенденции к подвывиху голени кзади за верхний метафиз голени проводят спицу и больного укладывают на вытяжение.
Синовэктомия с артропластикой голеностопного сустава. Операцию проводят под наркозом, проводниковой анестезией. Применяют доступ Кохера. На 3–4 см выше наружной лодыжки, отступив на 1 см от малоберцовой кости и параллельно ей проводят разрез кожи, который огибает наружную лодыжку и заканчивается на тыльной поверхности стопы у основания третьей плюсневой кости. После рассечения кожи, подкожной клетчатки, фасции выделяют сухожилия малоберцовых мышц. Последние мобилизуют, а при поражении влагалищ иссекают грануляционную ткань. В тех случаях, когда сухожилия сместить не удается, их Z-образно рассекают. Затем пересекают сумочносвязочный аппарат по наружнопередней поверхности сустава. Стопу максимально супинируют и пересекают связки по заднемедиальной стороне. Теперь блок таранной кости можно вывихнуть в рану. В тех случаях, когда суставная щель сужена и доступ к заднемедиальным связкам практически невозможен, производят частичную резекцию суставных концов, рассекают связки по заднемедиальной стороне и вывихивают блок таранной кости в рану. Вначале моделируют блок таранной кости, чтобы по его размерам соответственно сформировать вилку голени. Блоку придают форму опрокинутого цилиндра, расположенного во фронтальной плоскости. Тщательно убирают костные и рубцовые разрастания с боковых и задней поверхностей сустава. Сформированную суставную поверхность блока обрабатывают рашпилем и соответственно созданному блоку формируют вилку голени. При этом оказываются длинными обе лодыжки, и их почти всегда необходимо укорачивать. При проверке амплитуды движений, конгруэнтности суставных поверхностей необходимо, чтобы передний край большеберцовой кости не упирался в шейку таранной кости, так как это ведет к ограничению тыльного сгибания стопы. В таких случаях его дополнительно закругляют. Затем иссекают пораженную синовиальную оболочку, перекрывают консервированной оболочкой семенника быка суставной конец голени, края прокладки подшивают к мягким тканям кетгутовыми швами. Снимают жгут, проводят гемостаз. Суставные поверхности сопоставляют, накладывают швы на капсулу сустава, рассеченные сухожилия малоберцовых мышц сшивают и рану послойно зашивают наглухо. Иммобилизацию проводят гипсовым сапожком в течение 5 дней.
Как показали клинические наблюдения, включение в комплекс лечения во II стадии заболевания хирургических методов позволило приостановить дальнейшее развитие деформаций и разрушения суставов; предотвратить рецидив патологического процесса; исправить дискордантные установки; восстановить функцию не только сустава, но и конечности в целом и тем самым сохранить работоспособность больного.
Послеоперационный период
При хирургическом лечении больных с РА большое внимание необходимо уделять восполнению кровопотери во время операции. А.И. Трещинский (1962) подчеркивал, что гипотензия после кровопотери на фоне суженных сосудов является тяжелым и грозным осложнением.
После прекращения действия наркоза и перевода больного в палату, как правило, назначают индивидуальный сестринский пост для наблюдения за общим состоянием, пульсом, дыханием, артериальным давлением (АД). При появлении признаков острой надпочечниковой недостаточности (снижение АД, тахикардия, бледность, липкий пот) необходимо срочно начать внутривенное капельное введение гидрокортизона, растворенного в физиологическом растворе натрия хлорида или в 5% растворе глюкозы.
По нашим наблюдениям, такое осложнение может развиться внезапно при любом оперативном вмешательстве или же вскоре после операции у больного РА, независимо от метода обезболивания. Поэтому у постели больного постоянно должна быть готова система для внутривенного введения.
Кроме того, в послеоперационный период в первые 3–4 сут проводится обезболивающая терапия.
Обезболивающую терапию проводят по следующей схеме:
- в течение первых 2 сут — инъекции опиоидов по 1 мл через 6–8 ч;
- метамизол натрия в таблетках по 500 мг с интервалом 6 ч при отсутствии рвоты;
- 1 раз в сутки электрофорез по Парфенову или воротник с бромом по Щербаку;
- в случае нарушения сна на 5–7 е сутки — на ночь снотворные средства.
В первые дни после операции больным в зависимости от общего состояния вводили камфору. Как правило, назначали курс антибиотиков с целью профилактики инфекции, витамины (особенно С, группы В, D), питье щелочных вод.
Лечебная гимнастика. По мере стабилизации общего состояния (обычно на 2–3 и сутки) назначали ЛФК по I периоду. Продолжительность ее определяется индивидуально и зависит от общего состояния больного, течения послеоперационного периода, локализации и характера произведенной операции. Длится I период до снятия гипсовой иммобилизации.
Как известно, ЛФК в послеоперационный период является раздражителем, усиливающим реактивность тканей за счет активной гиперемии, улучшения кровообращения, обмена веществ, и, тем самым, способствует восстановлению и нормализации обменных процессов в организме вообще и репаративных процессов в операционной ране в частности. Для нормализации общего состояния больного рекомендуется утренняя гигиеническая и лечебная гимнастика в виде индивидуальных и групповых занятий.
В комплекс занятий входят упражнения для всех суставов (не подлежащих иммобилизации), мышц туловища. Упражнения для анкилозированных и оперированного суставов состоят в активных сокращениях и расслаблениях мышц антагонистов в изометрическом режиме без двигательного эффекта.
Для борьбы с гипоксией, которая и в послеоперационный период выражена у больных данной группы, кроме кислородной терапии проводится дыхательная гимнастика. Она позволяет нормализовать ритм и глубину дыхательных экскурсий и, тем самым, активно устранять дефицит внешнего дыхания, связанный с ригидностью или анкилозированием суставов грудной клетки, предупреджая возникновение гипостатических пневмоний.
Задача врача и методиста ЛФК заключается не только в обучении упражнениям, но и в постоянном контроле за их выполнением согласно составленному плану занятий.
В I период широко применяют физические методы лечения — электрофорез новокаина, по Парфенову, кальция, УВЧ.
II период начинается с момента снятия гипсовой иммобилизации. Это самый ответственный период после артропластических операций. Основная его задача — максимальное восстановление амплитуды движений в оперированном суставе.
С включением конечности в активную функцию начинается III период. Задачами его являются: а) восстановление силы, выносливости и работоспособности мышц; б) восстановление координации движений; в) выработка приспособительных механизмов.
III период продолжается до устойчивого восстановления максимально возможной функции оперированной конечности.
Решение указанных задач достигается усилиями как обслуживающего персонала, так и самого больного. У перенесших артропластические операции необходимо устранить дезорганизацию мышечно-суставного чувства, наступившую вследствие длительного обездвиживания, выработать правильный двигательный рефлекс, добиваясь, чтобы больной мог успешно работать над восстановлением функции сустава систематически в течение дня с перерывами для отдыха.
Вначале методист обучает больного технике упражнений на здоровой нижней конечности или же на подвижных суставах верхних конечностей. Затем проводит пассивные движения в оперированном суставе. Первые пассивные движения необходимо проводить очень мягко, не вызывая резкой боли, при полном расслаблении мышц оперированной конечности. В противном случае в силу защитной реакции сустав может «замкнуться» и выработается порочный рефлекс, который в дальнейшем приведет к блокированию оперированного сустава.
Лучшие результаты достигаются тогда, когда больной после удаления иммобилизирующей повязки сам с помощью функциональных шин, манжеток, укрепленных на балканской раме, разрабатывает движения под контролем своих ощущений. Это позволяет избежать чрезмерных болевых раздражений, страха разработки и предупреждает развитие рефлекторного защитного напряжения мышц, ведущего к «замыканию» сустава. Во время пассивных движений больной должен следить за правильным положением туловища и оперированной конечности.
Сниженная эластичность мышц, обусловленная, с одной стороны, основным патологическим процессом, а с другой — бездеятельностью и порочным положением конечности, требует умелого проведения упражнений в медленном темпе, при тщательном контроле за правильностью выполняемого движения. В случае быстрой утомляемости требуются более частые паузы для отдыха.
Движения в суставе надо проводить при фиксированном проксимальном сегменте. Например, при движениях в тазобедренном суставе таз должен быть фиксирован, при движениях в локтевом суставе фиксируется плечо и т.д. Это позволяет сосредоточить внимание больного на восстановлении истинной амплитуды движений в суставе и правильной работе мышечных групп, выполняющих то или иное движение.
Кроме восстановления амплитуды движений не меньшее внимание необходимо обращать на восстановление силы, работоспособности и выносливости гипотрофированных мышц. С этой целью для выполнения активных движений вначале используют скользящую поверхность, облегченные исходные положения, упражнения на блоках и манжетах с грузом, а затем широко применяют упражнения с сопротивлением. По мере восстановления амплитуды движений в суставе и силы мышц вводятся сложные упражнения на координацию. Больных обучают самообслуживанию, освоению трудовых процессов, особенно после операций на суставах верхних конечностей. Не менее важно больным, перенесшим операции на суставах нижних конечностей, научиться сидеть, стоять и ходить.
В восстановительный период особое внимание должно уделяться лечению положением, что позволяет избежать после снятия гипсовой иммобилизации развития фиксированных установок. Когда снят гипс, наиболее целесообразно, с функциональной точки зрения, положение больного на спине, причем постель должна быть жесткой и ровной. Подушка подкладывается только под голову. За правильным положением сегментов конечности и туловища должны следить и обслуживающий персонал, и сам больной. Больных с идентичным состоянием следует помещать в одну палату, учитывая при этом их волевые качества, чтобы активные и настойчивые силой примера воздействовали на пассивных и слабовольных.
Во время пассивных и активных движений конечность должна быть обнажена. Во избежание переохлаждения и связанной с ним скованности мышц, отрицательно отражающейся на восстановлении кровообращения в дистальных отделах, нужно одеть шерстяные носки или чулки. При подготовке к ходьбе назначают упражнения для конечности на упор. Для этой цели в ножном конце кровати укрепляют вначале мешочки с песком или дощечки, затем — пружинные упоры, и больные в течение дня многократно производят движения, имитируя нагрузку при ходьбе. Укорочение одной из нижних конечностей компенсируется ортопедической обувью или же, при подвижном голеностопном суставе, простыми набойками, а при анкилозе голеностопного сустава — утолщенной подошвой. Благодаря компенсации укорочения больной занимает более устойчивое положение.
Оперированным на другой нижней конечности разрешается вставать с постели через 3–5 дней после операции. К этому времени болевой синдром уменьшится. Больной может активно тренировать вынос оперированной конечности в облегченном вертикальном положении. Нагрузка на оперированную конечность разрешается не ранее чем через 1 мес после артропластической операции. В это время под влиянием функции уменьшается остеопороз и формируется замыкательная пластинка на новообразованных суставных поверхностях, что предупреждает их деформацию.
ЛФК после артропластических операций на тазобедренном суставе. Движения в тазобедренном суставе осуществляются вокруг трех осей. Сгибание и разгибание происходит в сагиттальной плоскости вокруг фронтальной оси; отведение и приведение — во фронтальной плоскости вокруг сагиттальной оси; ротационные движения — в горизонтальной плоскости вокруг вертикальной оси.
Функциональное лечение должно проводиться при правильном положений больного в постели. Если противоположное бедро анкилозировано в положении сгибания, то во избежание «запрокидывания» таза вперед и для сохранения правильного положения оперированной конечности необходимо под крестец и обе ягодицы подложить мешочек с песком по размеру таза. Оперированную конечность следует удерживать в положении разгибания, а неоперированную под углом, при котором таз находится в правильном положении во фронтальной плоскости.
При одностороннем поражении ягодичные мышцы обычно гипотрофированы и таз наклонен в сторону пораженного сустава. Для правильной установки таза на стороне оперированной конечности под ягодицу подкладывают нужного размера мешочек с песком.
Лечение положением имеет большое значение для восстановления функции. При артропластике тазобедренного сустава бедро следует устанавливать в положении небольшого отведения (95–100°) и полного разгибания без какой либо ротации.
На 1–3 и сутки после операции назначают комплекс упражнений по I периоду: утренняя гигиеническая гимнастика, дыхательная, лечебная гимнастика для функционирующих конечностей и суставов, а для анкилозированных сегментов в оперированной конечности — активное сокращение и расслабление мышц в изометрическом режиме. Обязательны физические методы лечения — электрофорез новокаина, кальция, по Парфенову, УВЧ.
На 10–12 е сутки снимают гипсовую повязку, и с этого момента начинается II период лечебной гимнастики. Первое упражнение этого периода — пассивное сгибание и разгибание бедра на скользящей плоскости. Больной, подтягивая и отпуская шнур, прикрепленный к манжетке, легко производит сгибательные и разгибательные движения. Пятка лежит на ватно-марлевом бублике, а конечность скользит по поверхности подложенного плексигласа или стекла. Амплитуда сгибания увеличивается постепенно, по мере затихания болевого синдрома.
Отведение и приведение проводят также при помощи манжеток и тяги. Рекомендуем пользоваться функциональными шинами. Для упражнений с помощью манжеток шнур перебрасывается через блок, укрепленный на балканской раме. Приводить бедро первые недели не следует, так как это может способствовать вывиху головки бедренной кости. Темп упражнений медленный, 10–15 раз в минуту с частыми перерывами (каждые 3–5 мин); по мере восстановления амплитуды движений, силы и выносливости мышц увеличиваются частота и длительность упражнений, сокращается время отдыха. В течение суток первоначально проводят 6–7 занятий. При значительной ригидности мягких тканей и скованности движений рекомендуют проводить одно занятие и ночью. Поэтому у таких больных снимать манжетку с ноги на ночь не следует. Перемещая манжетку и меняя направление тяги, можно тренировать любую группу мышц на силу и выносливость.
К исходу месяца назначают упражнения с сопротивлением, создаваемым резиновой тягой или дозированными грузами.
Пассивные ротационные движения выполняются методистом. Для этого голень оперированной конечности укладывают на предплечье, и, охватывая подколенную область, производят ротационные движения в тазобедренном суставе. Если больные жалуются на боль, назначают обезболивающую терапию: курс электрофореза с новокаином, анальгетики внутрь, посегментное облучение эритемными дозами кварца, диодинамический ток. Широко применяют массаж, при повышенной реактивности — электрофорез с бромом по Щербаку.
Через 3–4 нед после операции, если другая конечность опороспособна, больным разрешают вставать, не опираясь на оперированную конечность, назначают лечебную гимнастику по III периоду. Сидению обучают не ранее, чем через 2 нед после операции во избежание давления и вторичной деформации пораженной остеопорозом новосозданной головки бедренной кости. Дозированная нагрузка на оперированную конечность допускается не раньше, чем по прошествии 1 мес со времени вмешательства.
Очень важно научить больного правильно стоять, обращая внимание на нормальную постановку головы, туловища, таза, ног и стоп. Следует четко отрабатывать элементы шага: выносить вперед ногу, согнутую в тазобедренном и коленном суставах или прямую, если коленный сустав анкилозирован.
Необходимо проследить, чтобы больной, сгибая бедро, не ротировал конечность и чтобы она находилась под углом 90° по отношению к тазу. Голень, согнутая в коленном суставе, не должна находиться в вальгусном положении. Конечностью, вынесенной вперед, вначале надо коснуться пола пяткой, а затем всей стопой. Нельзя допускать, чтобы во время опоры стопа находилась в порочном положении (варус, вальгус). Коленный и тазобедренный суставы при опоре должны «замыкаться» под углом 180°.
Для обеспечения устойчивости больного следует научить правильно напрягать ягодичные и четырехглавую мышцы. При обучении ритмичному шагу можно применять метроном или счет. Вначале рекомендуют ходить по прямой, затем — по кругу приставным шагом и с поворотами в стороны, назад, перекрестным шагом. После освоения ходьбы по гладкой поверхности (пол) следует обучить ходьбе по неровному грунту (двор, сад), подъему и спуску по лестнице.
Для выработки ритмичной и правильной походки упражнения производят перед зеркалом. При освоении самостоятельной ходьбы таких больных включают в групповые занятия.
ЛФК после артропластики коленного сустава. Коленный сустав — блоковидный, движения в нем происходят только в сагиттальной плоскости (сгибание и разгибание).
Иммобилизацию конечности после операции осуществляют с помощью гонитной гипсовой повязки под углом сгибания 160–170°. Ротация голени, вальгусная или варусная установка должны быть устранены.
На 2–3 и сутки после операции назначают упражнения по I периоду и обезболивающую терапию.
На 3–5 й день (II период ЛФК) гипсовую повязку превращают в заднюю шину. Начинают пассивные движения. С 7 го дня голень помещают на скользящую поверхность. Шнур от манжетки, наложенной на дистальную треть бедра, перебрасывают через блок и конец его дают в руки больному. Под пятку подкладывают ватно-марлевый бублик для облегчения скольжения. При такой укладке больной производит пассивные движения, не вызывая боли и лишь постепенно увеличивая амплитуду движений.
На 10 е сутки со дня операции в программу занятий включают активно пассивные упражнения.
Часто больные вначале не могут раздельно включать необходимые для функции мышцы. Это приводит к одновременному напряжению как сгибателей, так и разгибателей голени, следствием чего является блокирование коленного сустава. Нередко этому способствует болевой синдром. В последующем больные овладевают необходимыми навыками.
Контрактуры в коленном суставе бывают чаще всего сгибательные, что обусловливает перерастяжение четырехглавой мышцы бедра. Поэтому при артропластике коленного сустава особое внимание необходимо уделять улучшению сократительной способности именно этой мышцы. Кроме активных движений назначают электростимуляцию, массаж, упражнения с сопротивлением.
После того как больной начинает выполнять активные движения в коленном суставе, усилия должны быть направлены не только на увеличение амплитуды движений, но и на восстановление силы и выносливости разгибателей и сгибателей голени (III период ЛФК). Для этой цели широко используют упражнения с сопротивлением (резиновая лента, грузы).
Наряду с упражнениями для оперированного коленного сустава проводят упражнения для всех мышечных групп нижних и верхних конечностей и туловища с целью повышения общего тонуса организма.
При подготовке больного к вставанию назначают упражнения с упором на стопу в положении полного разгибания голени в коленном суставе. Вначале упором служит эластичная поверхность, затем более жесткая. Увеличивают время нагрузки. Обычную дозированную нагрузку оперированной конечности разрешают спустя 1 мес со дня операции.
ЛФК после артропластических операций на голеностопном суставе. Иммобилизацию осуществляют с помощью гипсового сапожка. Стопу устанавливают, как правило, под углом 90°.
После уменьшения выраженности боли (на 2–3 и сутки) начинают ЛФК по I периоду.
После заживления операционной раны или несколько раньше (на 7–10 е сутки) назначают лечебную гимнастику по II периоду. Гипсовую повязку превращают в съемную заднюю шину, в которую укладывают конечность на ночь с целью профилактики эквинусной установки стопы. Днем голень укладывают на мешочек с песком так, чтобы пятка свободно свисала. На стопу одевают фланелевый полуносок с подшитыми лямками. Подтягивая лямки, больной делает пассивную тыльную флексию стопы, а ослабляя их — пассивную подошвенную флексию. При выполнении этих движений больной должен постоянно следить за тем, чтобы стопа во время движений не приводилась и не ротировалась. При эквинусных установках стоп наблюдается перерастяжение передней группы мышц голени. Поэтому в восстановительный период развитию их сократительной способности необходимо уделять особое внимание. Для этой цели, кроме активных упражнений, назначают электростимуляцию мышц, массаж, упражнения с сопротивлением.
Овладев поочередным сокращением и расслаблением мышц-антагонистов, больные на 5 й день после операции выполняют активные движения в голеностопном суставе (III период ЛФК). Основное внимание в этот период уделяют повышению силы и выносливости мышц, сгибающих и разгибающих стопу.
Упражнения с сопротивлением (с резиновой лентой) больные проводят самостоятельно и с методистом. Пациент производит активную тыльную флексию стопы и удерживает ее в этом положении, а методист в это время пытается разогнуть или же, наоборот, при подошвенной флексии стопы вывести ее из эквинусной установки.
Дозированную нагрузку на оперированный голеностопный сустав разрешают не ранее чем через 1 мес со дня операции.
ЛФК после артропластических операций на локтевом суставе. Иммобилизацию осуществляют с помощью гипсовой шины при согнутом под углом 90° предплечье. На 2 е сутки после операции назначают активное сгибание и разгибание кисти, пальцев, разведение, сведение их, а также противопоставление первого пальца; волевое сокращение разгибателей и сгибателей предплечья, упражнения для неоперированной верхней конечности, мышц туловища и нижних конечностей, дыхательную гимнастику, обезболивающую терапию.
На 5 е сутки после исчезновения болевого синдрома и значительного уменьшения реактивного отека тканей снимают гипсовую шину и конечность укладывают на скользкую поверхность внутренней стороной плеча так, чтобы оно плотно прилегало к плоскости. Для облегчения скольжения под кисть подкладывают шерстяной или шелковый кусочек материи. Больного обучают активному сгибанию предплечья. Разгибание производится пассивно, причем больной должен научиться максимально расслаблять двуглавую мышцу плеча. Вначале для облегчения движения плоскость должна быть наклонена, а через 5–7 дней ее устанавливают в горизонтальном положении и больному разрешают производить не только активное сгибание, но и разгибание. С восстановлением амплитуды движений и силы сгибателей и разгибателей предплечья скользящую поверхность убирают.
Наряду с активными самостоятельными упражнениями больной ежедневно занимается с методистом, который должен стремиться максимально восстановить амплитуду движений в локтевом суставе и вести контроль за правильным выполнением индивидуальных занятий. При движениях надо следить, чтобы сокращалась группа мышц, которая осуществляет тот или иной двигательный акт; антагонисты при этом должны сохранять расслабленное состояние.
При обучении супинационно-пронационным движениям предплечья методист предлагает больному прижать плечо к грудной клетке, затем берет его кисть в свою, как при рукопожатии, и постепенно, плавно, без насилия и рывков, поворачивает предплечье больного кнаружи. Больной старается помогать методисту, вызывая активное напряжение супинаторов. Когда методист поворачивает предплечье внутрь, больной должен напрягать пронаторы.
Для тренировки мышц плеча на силу и выносливость в конце кровати со стороны головы укрепляют блочок. Манжетку фиксируют в области лучезапястного сустава. Шнур перебрасывают через блочок и к концу его подвешивают груз в 0,5–1 кг. Больной, фиксируя плечо, в постели активно разгибает и сгибает локтевой сустав. Кроме того, для этой цели применяют упражнения с гантелями.
С восстановлением стабильной амплитуды движений назначают упражнения по самообслуживанию: прием пищи, застегивание пуговиц, застежек «молния», удержание мелких и крупных предметов, причесывание и т.п.
Кроме упражнений для оперированного локтевого сустава больной постоянно занимается тренировкой мышц неоперированной верхней конечности, туловища, нижних конечностей, дыхательной гимнастикой.
ЛФК после артропластических операций на лучезапястном суставе. Иммобилизацию осуществляют с помощью ладонной шины в положении небольшой тыльной флексии кисти. На 2–3 и сутки назначают упражнения для пальцев кисти: сгибание, разгибание, сопоставление, разведение. Кроме того, назначают упражнения для локтевого и плечевого суставов оперированной конечности и весь комплекс упражнений для неоперированных конечностей.
После исчезновения болевого синдрома и реактивного отека тканей, обычно на 5–7 е сутки, снимают гипсовую повязку и выполняют упражнения в облегченном положении. Больной прижимает плечо к туловищу, сгибает предплечье в локтевом суставе до угла 90°, устанавливая его в положении, среднем между пронацией и супинацией, и начинает постепенное сгибание и разгибание в лучезапястном суставе.
Ввиду длительного перерастяжения разгибателей из за фиксированной ладонной флексии в лучезапястном суставе до операции восстановление их функции идет медленно. Кроме активно пассивных упражнений для стимуляции функции разгибателей применяют массаж, электростимуляцию. На ночь кисть укладывают в гипсовую шину в положении максимальной тыльной флексии.
Обычно на 3–4 й неделе отмечают удовлетворительную амплитуду движений в лучезапястном суставе и больной относительно свободно пользуется конечностью. В это время назначают упражнения для восстановления силы и выносливости сгибателей и разгибателей кисти — упражнения сгибания и разгибания с небольшими грузами или упражнения с резиновой лентой.
Лечебная гимнастика после артропластики пястно-фаланговых и межфаланговых суставов направлена сначала на восстановление амплитуды движений, а затем — на восстановление силы и хватательных функций кисти. Активно пассивные упражнения начинают обычно на 3 й день после операции. Сначала больного обучают разгибанию и сгибанию фаланг. С восстановлением более или менее стабильной амплитуды движений в суставах назначают упражнения для сопоставления пальцев, захвата предметов, выполнения работ по самообслуживанию. Обычно больные стремятся восстановить функцию первых трех пальцев, а IV и V всегда отстают как в отношении восстановления амплитуды движений, так и в силе. Это можно объяснить, во первых, тем, что больному приходится сосредотачивать внимание одновременно на разработке 2–3 суставов, во вторых, тем, что в хватательной функции кисти основную роль играют именно первые три пальца. Нужно напоминать больному о необходимости разработки и последних двух пальцев, чтобы добиться функциональной полноценности кисти.
Кроме ЛФК широко используются физические методы лечения (электрофорез с ронидазой, новокаином, кальцием, по методу Парфенова, УВЧ, кварцэритема, ультразвук и т.д.) и гидротерапия. После артропластических операций (через 3 мес) назначают санаторно курортное лечение.
СТАДИЯ ФИБРОЗНО-КОСТНЫХ АНКИЛОЗОВ (ІІІ СТАДИЯ)
Клиническая картина
В III стадии при всем разнообразии деформаций конечностей выявляется определенная закономерность — наличие конкордантных, то есть функционально выгодных положений конечностей или дискордантных, то есть порочных.
У всех больных в III стадии заболевания имеются множественные поражения суставов верхних и нижних конечностей. В зависимости от характера поражения, особенностей порочных установок и деформаций можно выделить три группы больных.
К 1-й группе относятся больные с множественными дискордантными деформациями верхних конечностей при сохранившейся удовлетворительной функции нижних. По своему характеру деформации у этих больных стойкие, необратимые, так как имеются костные анкилозы и длительно существующие контрактуры, подвывихи и вывихи. Больные этой группы, имея возможность передвигаться, но не в состоянии пользоваться верхними конечностями в основном из за порочных анкилозов в локтевых суставах или отсутствия хватательной функции кисти. В плечевых суставах изменения относительно незначительные, чаще всего отмечаются в большей или в меньшей степени приводящие контрактуры; в лучезапястных суставах в большинстве случаев функциональные выгодные установки.
2-ю группу составляли больные с поражениями суставов нижних конечностей при сохранившейся удовлетворительной функции верхних. Деформации суставов нижних конечностей носят стойкий, необратимый характер, однако у одних больных они дискордантные, у других же — конкордантные. Особенностью больных с конкордантными деформациями является то, что они могут передвигаться с помощью костылей. Больные с дискордантными деформациями нижних конечностей прикованы к постели.
В 3-ю группу отнесены больные с порочными дискордантными деформациями верхних и нижних конечностей. Если больные 1 й и 2 й группы могут частично себя обслужить, то больные 3 й группы совершенно обездвижены и нуждаются в полном уходе, вплоть до кормления. Большинство суставов верхних и нижних конечностей у пациентов этой группы анкилозированы.
Жалобы больных в основном однообразны и сводятся к невозможности обслужить себя и передвигаться из за порочных положений конечностей. Желания больных в отношении очередности восстановления функции конечностей в разных группах отличаются определенной специфичностью. Так, пациенты 1 й и 3 й групп в первую очередь просят восстановить функцию хотя бы одной верхней конечности, чтобы иметь возможность частично себя обслуживать (принимать пищу, умываться, причесываться). Больные 2 й группы настаивают на исправлении порочных установок нижних конечностей, чтобы приспособиться к передвижению хотя бы с помощью костылей. Кроме того, больные жалуются на периодическую боль в неанкилозированных суставах, общую слабость, приступы сердцебиения, колющую боль в области сердца, плохой сон, отсутствие аппетита, повышенную раздражительность. Иногда эти жалобы связаны с сопутствующими заболеваниями — холецистоангиохолитом, желчнои мочекаменной болезнью.
Клиническая картина PA в III стадии довольно типична. При осмотре в первую очередь обращает на себя внимание вынужденное положение, обусловленное порочными установками в суставах верхних и нижних конечностей. На фоне общего пониженного питания и гипотрофичных мышц рельефно выступают деформированные суставы. Кожные покровы бледные, атрофичные, сухие, за исключением ладонных поверхностей кистей и подошвенных поверхностей стоп, которые чрезмерно потливы. В области деформированных суставов, особенно коленных, голеностопных, лучезапястных и межфаланговых атрофия кожи достигает предельной степени. Кожа резко истончена, шелушащаяся, с просвечивающимися сосудами. У ряда больных выявляют акроцианоз и изменения ногтей (продольная исчерченность, утолщение ногтевых пластинок, увеличение в объеме).
Ввиду значительной атрофии кожных покровов и подкожной жировой клетчатки у больных, особенно мужчин, рельефно выступают контуры мышц не только конечностей, но и туловища. У одних больных грудная клетка участвует в акте дыхания, у других, в связи с ригидностью или анкилозами грудинно-реберных и реберно-позвоночных сочленений, участия не принимает. В этих случаях отмечают положительный симптом Богданова (описанный только при болезни Бехтерева).
На ранних стадиях заболевания грудная клетка, из за возникающей при экскурсии боли, выключается из акта дыхания, а в поздних стадиях из за анкилоза суставов неподвижна, у таких больных развивается брюшной тип дыхания. Симптом Богданова определяют следующим образом: больной стоит спиной к врачу или лежит на спине; врач обеими руками надавливает на брюшную стенку, тем самым выключая ее из акта дыхания, и предлагает больному сделать глубокий вдох. При поражении или анкилозировании суставов грудной клетки она в акте дыхания не участвует, и больной компенсаторно напрягает прикрепляющиеся к ней мышцы шеи, в частности грудинно-ключично-сосцевидные. Это и есть положительный симптом Богданова. Когда суставы грудной клетки интактны, она свободно участвует в акте дыхания, напряжения мышц шеи при вдохе не наблюдается.
По данным спирометрии, у большинства больных в III стадии заболевания объем внешнего дыхания снижен и не превышает 2800–3000 см3. Со стороны органов дыхания у подавляющего большинства больных патологических изменений не выявлено. У некоторых больных (курильщиков) отмечали хронический бронхит.
Со стороны сердечно сосудистой системы выявлены равномерное расширение границ сердца, глухие тоны сердца, склонность к гипотонии. При ЭКГ исследовании отмечены различной степени дистрофические изменения сердечной мышцы. Иногда выявляли недостаточность митрального клапана. У больных с синдромом Бехтерева отмечали гипертоническую болезнь. Пульс у большинства пациентов слабого наполнения и напряжения, лабильный, со склонностью к тахикардии.
Нередко выявляют нарушения болевой, тактильной, температурной чувствительности в дистальных отделах конечностей.
Мышечно-суставное чувство не нарушается. Сухожильные рефлексы сохранены в подвижных сегментах конечностей; при наличии же контрактур или значительном ограничении движений в суставах (тугоподвижность) рефлексы снижены, а в анкилозированных суставах — не вызываются. Кожные рефлексы не менялись, патологических рефлексов не выявлено.
Проявляются значительные нарушения со стороны вегетативной нервной системы: резкая атрофия кожных покровов, сухость, их шелушение, гипертрихоз конечностей, цианотичная окраска дистальных отделов конечностей, потливость ладонных поверхностей кистей и подошвенных поверхностей стоп; общая гипотрофия мышечного аппарата со снижением тонуса и силы мышц. Все указанные выше изменения, как правило, симметричны. Дермографизм обычно возникал на 5–8 й секунде, а исчезал — на 30–60 й секунде. Преобладания красного дермографизма над белым не отмечено. Описанные изменения носят общий характер и, очевидно, представляют собой проявления диэнцефальной патологии, обусловленной длительным и тяжелым инфекционно-аллергическим процессом.
На фоне общего сниженного питания и гипотрофии мышц особенно резко выделяются узлоподобные деформации суставов. Выраженность их зависит от утолщения параартикулярных тканей, наличия подвывихов или вывихов, от варусных и вальгусных отклонений.
Наибольшая степень деформаций отмечена в суставах пальцев, лучезапястных, коленных и локтевых.
Хотя порочные установки верхних и нижних конечностей имеют самый разнообразный характер, все же можно выявить определенную общую закономерность — симметричность и в подавляющем большинстве случаев сгибательный характер контрактур и анкилозов.
Для верхних конечностей характерны порочные установки в виде приводящих контрактур в плечевых суставах, сгибательных контрактур и анкилозов в локтевых. В лучезапястных суставах сгибательные контрактуры или анкилозы сочетаются с ульнарной девиацией кисти. Предплечья фиксированы в положении пронации или же в положении, среднем между пронацией и супинацией.
В пястнофаланговых суставах чаще всего отмечают сгибательные установки, реже разгибательные или деформации пальцев по типу «плавников моржа», «шеи лебедя». Нередко, несмотря на сгибательные контрактуры в суставах пальцев, хватательная функция кисти остается удовлетворительной. Для І пальца при РА характерна разгибательная установка с приводящей контрактурой в положении противопоставления.
Для нижних конечностей типичны сгибательные установки в тазобедренных и коленных суставах с подошвенной флексией стоп или плоско вальгусной их установкой.
Сгибательные контрактуры в тазобедренных суставах часто сочетаются с приведением бедер или одного бедра и отведением другого. Анкилоз в одном тазобедренном суставе может быть в дискордантном, а в другом — в конкордантном положении. Реже наблюдаются анкилозы в тазобедренных и коленных суставах в положении разгибания. В основном их отмечают тогда, когда применялась длительная иммобилизация кокситными гипсовыми повязками в острой стадии РА.
Анкилозы коленных суставов бывают под различными углами сгибания и сочетаются с подвывихом голеней кзади, ротацией кнаружи. Анкилоз коленных суставов в функционально выгодном положении выявляют очень редко.
Для голеностопных суставов характерны подошвенная флексия и вальгусное отклонение стопы с отклонением большого пальца кнаружи, остальные четыре пальца большей частью молоточкообразные и согнуты в межфаланговых суставах.
При рентгенологическом исследовании в III стадии заболевания определяют остеопороз длинных трубчатых и плоских костей. Степень остеопороза прямо пропорциональна тяжести заболевания и степени поражения суставов. У обездвиженных больных остеопороз в анкилозированных суставах достигает крайней степени, в то время как у тех, кто передвигается, выраженность его значительно меньше. В длинных трубчатых костях костномозговой канал расширен из за атрофии кортикального слоя, последний иногда достигает толщины скорлупы куриного яйца. Эпиметафизы утолщены, подчас вздуты с полостями различных размеров.
Рентгенологическая картина анкилозированных крупных суставов однообразна. Костные трабекулы в виде уплотненных пучков переходят с одного суставного конца на другой. В зоне анкилоза структура кости более плотная, чем в остальных суставах. Анкилозирование происходит по направлению силовых линий.
На рентгенограммах тазобедренных суставов при РА и болезни Бехтерева в III стадии, как правило, между дном вертлужной впадины и медиальной поверхностью головки бедренной кости виден сохранившийся участок суставной щели серповидной формы (симптом Скляренко). Это всегда подтверждалось при оперативных вмешательствах на тазобедренных суставах. После разъединения костного анкилоза с верхней, задней, передней и нижней сторон тазобедренного сустава медиальная часть головки бедренной кости оказывалась неспаянной с дном вертлужной впадины. Само дно вертлужной впадины представлялось гладким, покрытым склерозированной хрящеподобной тканью.
Отсутствие сращения между дном вертлужной впадины и головкой объясняется тем, что между ними находится жировое тело, которое является естественной прокладкой.
Таким образом, прослеживаемый на рентгенограммах при анкилозах тазобедренного сустава сохранившийся серповидный участок суставной щели является патогномоничным рентгенологическим дифференциально диагностическим признаком, который никогда не выявляют при анкилозах тазобедренных суставов, возникших на почве других заболеваний (туберкулез, бруцеллез, инфекционный коксит).
Рентгенологическая картина анкилозированных лучезапястных суставов и стоп у больных с РА довольно типична: кости запястья и плюсны слиты в один костный конгломерат, контуры их теряются, выражено продольное расположение трабекул.
При рентгенологическом исследовании у больных с синдромом Бехтерева определяют «бамбуковый позвоночник», полный анкилоз позвоночных суставов и подвздошно крестцовых сочленений. У обездвиженных больных структура тел позвонков не выявляется из за остеопороза, четко вырисовываются лишь их контуры.
В пястно фаланговых и межфаланговых суставах при отсутствии анкилозов нередко можно наблюдать подвывихи, вывихи с обезображиванием суставных концов и остеопорозом.
Даже при отсутствии анкилозов крупных суставов в них отмечали сужение суставной щели с различной степенью обезображивающего остеоартроза.
В плечевых суставах, кроме сужения суставной щели и обезображивающего остеоартроза, наблюдается уплощение головки плечевой кости. Нередко на рентгенограмме можно видеть контуры утолщенной суставной сумки.
У больных с РА в III стадии заболевания осциллографический индекс и форма осциллограмм значительно отклонены от нормы. Лабораторные исследования позволяют объективно оценить общее состояние больного и степень активности патологического процесса, что имеет особое значение для хирургического лечения, определения максимального объема оперативного вмешательства и своевременного применения противорецидивного лечения. Так, у больных с дискордантными деформациями нижних конечностей, с множественным поражением суставов и выраженной гипотрофией различных групп мышц осциллографический индекс был ниже нормы, а у больных с конкордантными деформациями — выше нормы, что указывает на снижение сосудистого тонуса.
У больных с затихшим процессом, нормальной СОЭ, небольшим числом пораженных суставов и конкордантными деформациями на осциллограмме отклонений от нормы не отмечено.
Преобладают две формы осциллограмм. При резко повышенном тонусе сосудов осциллограммы имеют вид уплощенной кривой с малыми осцилляциями, тупыми или закругленными углами вершин. У больных со сниженным сосудистым тонусом осциллограммы были с выраженными отрицательными осцилляциями («артериальный сапожок»). Нередко на осциллограммах отмечали дикротические зубцы.
Наряду с выявленными изменениями тонуса сосудов выявляли различной степени асимметрию осциллограмм на симметричных участках, которая, по видимому, зависит от сроков поражения конечности, степени законченности процесса, угла сгибания, то есть от характера деформации и от степени гипотрофии мышц.
Осциллографические данные соответствуют клинической картине болезни. У большинства пациентов в III стадии заболевания выражена явная тенденция к артериальной гипотонии.
Изменения капилляров и капиллярного кровообращения у больных с РА значительны даже в отдаленных от пораженного сустава участках. При капилляроскопии фон имеет желтую окраску различной интенсивности, иногда мутный. В пальцах нижних конечностей такой фон выражен больше. Капилляры резко удлинены, сужены (в виде тонких длинных нитей). Сужение касается как артериальной, так и венозной части, хотя преобладает в первой. В венозных отделах иногда наблюдаются расширения. Развита прекапиллярная сеть. Нередко в поле зрения попадают беспорядочно расположенные ишемические участки. Количество капилляров в поле зрения резко уменьшено, расстояние между ними увеличено, ток крови определяется нечетко, часто имеет прерывистый характер. У некоторых больных отмечена различная степень выраженности изменений капилляров. При сравнении капилляроскопической картины обеих конечностей выявляют незначительную асимметрию степени сужения и количества капилляров в 1 мм3.
Проницаемость сосудистой стенки, как показывает проба Нестерова, резко повышена. Определяют выраженные сливные геморрагии, особенно в течение первых трех суток. Выраженность геморрагий носит неравномерный характер. Рассасывание геморрагий замедленно вообще, особенно на той конечности, где в каком либо из суставов процесс еще не закончился. Следы геморрагии выявляют даже на 6–7 е сутки.
Температура кожи у больных в III стадии заболевания в дистальных отделах конечностей постоянно снижена, с явной асимметрией. В области суставов с затихшим процессом (анкилоз) температура кожи была в основном одинакова с регистрируемой на околосуставных участках. При еще не закончившейся воспалительной реакции в суставе она оказывалась выше.
Потоотделение (проба Минора) у большинства больных снижено (гипогидроз) с запоздалой реакцией, хотя иногда можно наблюдать интенсивное потоотделение с первых же минут (гипергидроз).
Электромиографические исследования показали, что электрическая активность всех исследуемых мышц верхних и нижних конечностей снижена, то есть налицо выраженное ослабление функционального состояния нервно мышечного аппарата, его проводимости и возбудимости, сократительной способности мышц. Такое ослабление, по-видимому, обусловлено, с одной стороны, хроническим воздействием инфекционно-аллергического процесса, а с другой — длительным обездвиживанием больных из за множественных анкилозов суставов верхних и нижних конечностей в порочном положении.
Со стороны крови в 51% случаев отмечают гипохромную анемию (3,6·1012–3,8·1012 эритроцитов, снижение содержания гемоглобина до 70 г/л). У этих больных течение процесса было тяжелым, с множественным поражением суставов. Показатели лейкограммы у 48% оставались в пределах нормы, у 52% — выявлена лейкопения. В основном это были больные с тяжелым течением процесса. Итак, у пациентов в III стадии заболевания длительный хронический инфекционно-аллергический процесс ведет к некоторому угнетению функции кроветворения.
У большинства больных, несмотря на отсутствие воспалительной реакции в области суставов, СОЭ была повышена, отмечается связь между повышением СОЭ, лейкоцитозом и температурой. Почти у всех больных с «затихшим» процессом температура оставалась нормальной.
Количество протеинов в сыворотке крови было в пределах нормы либо несколько превышало ее, что соответствует данным литературы. Чрезвычайно показательны изменения в соотношении отдельных белковых фракций. У всех больных отмечено уменьшение содержания альбуминов и повышение уровня глобулинов с соответственным изменением альбумино-глобулинового коэффициента, который становится значительно ниже нормы. Содержание глобулинов повышалось за счет всех глобулиновых фракций, но особенно значительно увеличивалось содержание β глобулинов (р<0,001).
Уровень сиаловых кислот, входящих в состав сывороточных гликопротеидов, находится в пределах нормы, часто достигая ее верхних границ. Перенесенное оперативное вмешательство заметно не сказывается на содержании сиаловых кислот в сыворотке крови: наблюдаемые колебания остаются в рамках нормальных величин (р<0,5).
Содержание аминосахаров в костной ткани эпифизов обычно значительно снижено, а вначале заболевания количество их достигает довольно высоких показателей. Содержание коллагена в тканях сустава несколько снижено. Отмечают довольно низкий уровень кальция и фосфора в эпифизах костной ткани на фоне сравнительно высокой активности щелочной фосфатазы (ЩФ).
Таким образом, в III стадии заболевания, которая характеризуется явным преобладанием фиброзно-склеротических и дистрофических изменений над собственно воспалительными, утрачивается как минеральное, так и органическое вещество костной ткани. Органический состав костной ткани уменьшается, по видимому, в основном за счет полисахаридов, так как количество коллагена в тканях сустава снижено незначительно. Это лишний раз подтверждает, что существенные изменения при данном заболевании происходят прежде всего в основном веществе.
Повышение содержания аминосахаров и активности фосфатазы в костной ткани в III стадии заболевания можно предположительно объяснить тем, что в тканях при деструктивных процессах, вероятно, происходит сдвиг обмена веществ в сторону расщепления с преобладанием гидролитических процессов над синтетическими.
Некоторые авторы считают, что гипер-гаммаглобулинемия тем выше, чем ярче проявляются глубокие пролиферативные и деструктивные процессы в синовии и суставном хряще. Нашими исследованиями показано, что значительная гаммаглобулинемия наряду с повышением содержания α1-, α2- и β-глобулинов характерна и для деструктивных процессов в костной ткани эпифизов.
Известно, что дифениламиновый показатель (ДФА показатель) для определения содержания сиаловых кислот бывает чаще повышен у больных в острой фазе заболевания и подтверждает экссудативный характер воспаления. В наших исследованиях выяснилось, что в III стадии заболевания содержание сиаловых кислот находится в пределах нормы. По-видимому, отдельные очаги воспаления в тканях, о которых говорилось выше, существенным образом не влияют на изменение ДФА показателя. Оперативное вмешательство не сказывается на нем, то есть оно не является провоцирующим фактором заболевания.
При РА важна не только точная и своевременная диагностика, но и определение степени активности процесса, а также выбор методов лечения, особенно при решении вопроса об оперативном вмешательстве.
Патоморфологические исследования
В III стадии РА при фиброзном или костном анкилозе суставная полость отсутствует и капсула сустава без видимых границ переходит в фиброзно-жировую ткань, покрывающую патологически измененные суставные концы. При фиброзном анкилозе капсула сустава неравномерно склерозирована, с рубцовыми тяжами, плотно спаяна с окружающими тканями и суставными концами. Суставные поверхности почти на всем протяжении покрыты слоем фиброзной и жировой ткани с небольшими участками — остатками полости сустава.
При гистологическом исследовании в рубцово измененной капсуле сустава и участках замещения ее жировой тканью отмечены выраженные дистрофические и атрофические изменения. В толще гиализированных ворсин выявляют очаги мукоидного набухания и фибриноидного некроза. Хроническая воспалительная инфильтрация выражена значительно слабее, чем во II стадии заболевания. В периваскулярных инфильтратах преобладают клетки фибропластического типа. Количество кровеносных сосудов уменьшается. Стенки мелких артерий и артериол резко утолщены, склерозированы и гиалинизированы, с обширным периваскулярным склерозом. Просветы многих сосудов облитерированы.
При костном анкилозе остатки капсулы спаяны с подлежащей костью и представляют собой гиалинизированую фиброзную ткань с прослойками жировой. В этой фиброзной ткани воспалительные изменения почти не ввыявляют.
Макро- и микроскопические изменения в суставном хряще и кости эпифизов нарастают. Суставный хрящ на большом протяжении разрушается и замещается грануляционной и волокнистой соединительной тканью. Субхондральная замыкающая костная пластинка также полностью разрушена. Из костномозговых полостей грануляционная ткань, сосуды и остеогенная ткань врастают в полость сустава и участвуют в деструкции остатков суставного хряща. Находящаяся между суставными концами фиброзная ткань оссифицируется, что приводит к костному анкилозу.
С образованием костного анкилоза воспалительные изменения в кости почти полностью исчезают. Образованная костная спайка приобретает строение окружающих участков порозной кости. В зоне костного анкилоза, в центре некоторых костных балок выявляют лишь островки основного вещества хряща и остатки дистрофически измененного суставного хряща, окруженного со всех сторон замыкающей тонкой костной пластинкой.
В зоне костного анкилоза — резко выраженный остеопороз и атрофия костных балок. Костномозговые полости расширены и заполнены атрофированным жировым костным мозгом. Наблюдается редукция капиллярной сети. Стенки мелких артерий утолщены и гиалинизированы. Венозные синусы расширены и заполнены зернистым белковым веществом. Часто встречаются крупные и мелкие кистовидные образования.
Обоснование ортопедического лечения
Из вышеизложенного следует, что с помощью консервативных методов лечения восстановить сустав или его функцию невозможно. Хирургическое лечение должно быть элементом комплексного лечения.
Для успешного выполнения восстановительных операций необходима правильная оценка патофизиологических сдвигов в организме больных, целенаправленная общеукрепляющая терапия, ЛФК, физиотерапия, противорецидивное лечение. Кроме хирургического лечения следует также широко применять консервативные ортопедические методы (вытяжение, этапные гипсовые повязки, корригирующие шины и т.п.).
Основная причина недостаточного и медленного внедрения хирургических методов лечения таких больных заключалась в том, что РА — это хроническое рецидивирующее заболевание с нарушениями и изменениями функции ряда жизненно важных органов и систем. Поражение суставов как верхних, так и нижних конечностей всегда бывает множественным, что требует ряда сложных восстановительных операций. Недооценка патофизиологических сдвигов в организме больного была причиной частых операционных и послеоперационных осложнений общего и местного характера. Применение при артропластических операциях биологических прокладок из аутотканей (фасция, жир, кожа, мышца и т.п.) в большинстве случаев не предупреждает рецидивов анкилоза. Важно отметить и то, что хирургическое лечение проводится, как правило, в отрыве от комплексной противорецидивной консервативной терапии. Наконец, необходимо иметь в виду, что исходы хирургического лечения у больных с РА ни в коем случае нельзя сравнивать с результатами аналогичных операций по поводу других заболеваний, так как ни при каком другом заболевании не бывает такого множественного и тяжелого поражения суставов, нервно мышечной системы, соединительной ткани.
Если учесть опыт ведущих хирургов конца XIX и начала XX в. — Р.Р. Вредена, В.А. Оппеля, М.И. Ситенко, Langenbeck и других, доказавших возможность с помощью хирургических методов лечения возвращать «безнадежным» больным способность передвигаться и обслуживать себя, то станет понятной несостоятельность мнения о нецелесообразности хирургического лечения больных с РА. В настоящее время восстановительная хирургия непрерывно развивается.
Базисные препараты по прежнему играют первостепенную роль в комплексной терапии РА, но сейчас наметился новый подход к их назначению. В отличие от хорошо известной тактики постепенного наращивания терапии этой патологии («принцип пирамиды») теперь пропагандируется раннее агрессивное лечение базисными препаратами сразу после установления диагноза, цель которого — обеспечение стойкой ремиссии заболевания.
Основными лекарственными средствами базисной терапии при РА являются: метотрексат, сульфасалазин, перпараты золота, D-пеницилламин, аминохинолиновые препараты. К средствам резерва относятся циклофосфан, азатиоприн, циклоспорин А. Новая группа представлена следующими препаратами: ремикейд (инфликсимаб) — химерные моноклональные антитела к фактору некроза опухоли (ФНО)-α человека; энбрел (этанерцепт) — рекомбинантные растворимые рецепторы к ФНО; тимодепрессин — селективный пепидный иммунодепрессант, действующий на уровне Т- лимфоцитов; лефлуномид и др.
Неэффективные на протяжении 1,5–3 мес базисные препараты должны быть заменены или использованы их комбинации с ГКС в низких дозах, что позволяет снизить активность РА до начала действия первых. 6 мес — критический срок, не позднее которого должна быть подобрана действенная базисная терапия.
Лучшим препаратом для начала базисной терапии при тяжелым течении РА и РВ позитивности, наличии внесуставных проявлений считается метотрексат — цитостатический иммунодепрессант, который хорошо переносится при длительном применении и вызывает меньше побочных эффектов, чем другие лекарственные препараты данной группы.
В процессе лечения базисными препаратами тщательно мониторируют активность болезни и побочные эффекты.
Базисные препараты условно могут быть подразделены на препараты первого и второго ряда. Препараты первого ряда обладают наилучшим соотношением эффективности (достоверно устраняют как клинические симптомы, так и прогрессирование эрозивного процесса в суставах) и переносимости, потому назначаются большинству пациентов.
К базисным препаратам первого ряда относятся следующие:
- метотрексат — золотой стандарт терапии РА. Рекомендуемые дозы — 7,5–25 мг в неделю — подбираются индивидуально путем постепенного повышения на 2,5 мг каждые 2–4 нед до достижения хорошего клинического ответа либо возникновения непереносимости. Препарат принимают внутрь (еженедельно в течение двух последовательных дней дробно в 3–4 приема каждые 12 ч). В случае неудовлетворительной переносимости метотрексата при приеме внутрь за счет диспепсии и других жалоб, связанных с пищеварительным трактом, препарат может быть назначен парентерально (1 в/м или в/в инъекция в неделю);
- лефлуномид. Стандартная схема лечения: внутрь по 100 мг в сутки в течение 3 дней, затем 20 мг/сут постоянно. При риске непереносимости препарата (пожилой возраст, заболевания печени и др.) лечение можно начинать с дозы 20 мг/сут. По эффективности сопоставим с метотрексатом, имеет несколько лучшую переносимость. Есть данные о более высокой эффективности лефлуномида в отношении качества жизни больных, особенно при раннем РА. Стоимость лечения лефлуномидом достаточно высока, поэтому его чаще назначают при наличии противопоказаний к применению метотрексата, его неэффективности или непереносимости, однако могут использовать и как первый базисный препарат;
- сульфасалазин. В клинических испытаниях не уступал по эффективности другим базисным препаратам, однако клиническая практика показывает, что достаточный контроль над течением болезни сульфасалазин обычно обеспечивает при умеренной и низкой активности РА.
Базисные препараты второго ряда применяют значительно реже в связи с меньшей клинической эффективностью и/или большей токсичностью. Их назначают, как правило, при неэффективности или непереносимости препаратов первого ряда.
Базисные препараты способны вызвать значительное улучшение (хороший клинический ответ) приблизительно у 60% пациентов. В связи с медленным развитием клинического эффекта рекомендуется назначение таких лекарственных средств на срок до 6 мес. Длительность лечения определяется индивидуально, типичная продолжительность курса лечения одним препаратом (в случае удовлетворительного ответа на терапию) составляет 2–3 года и более. Большинство клинических рекомендаций подразумевают неопределенно длительное применение поддерживающих доз базисных препаратов для сохранения достигнутого улучшения.
При недостаточной эффективности монотерапии каким либо базисным препаратом может быть избрана схема комбинированной базисной терапии, то есть сочетания 2–3 х базисных препаратов.
Наиболее хорошо зарекомендовали себя следующие сочетания:
- метотрексат + лефлуномид;
- метотрексат + циклоспорин;
- метотрексат + сульфасалазин;
- метотрексат + сульфасалазин + гидроксихлорохин.
В комбинированных схемах препараты обычно применяют в средних дозах. В ряде клинических исследований было продемонстрировано превосходство комбинированной базисной терапии над монотерапией, однако более высокая эффективность комбинированных схем не считается строго доказанной. Комбинация базисных препаратов ассоциирована с умеренным повышением частоты побочных эффектов.
Эффективность хирургического лечения больных в III стадии заболевания не вызывает сомнения. Нужно лишь найти правильный ответ на следующие важные вопросы:
- Можно ли ослабленным длительной интоксикацией больным со значительными изменениями функции жизненно важных органов и систем произвести ряд сложных восстановительных операций на крупных суставах верхних и нижних конечностей без риска ухудшить их состояние?
- Возможно ли предупредить рецидив анкилоза в оперированных суставах?
Наш опыт показал, что при правильном учете патофизиологических сдвигов в организме больного, соответственной предоперационной подготовке и рациональной последовательности хирургических вмешательств возможно успешно выполнить необходимый комплекс восстановительных операций. Однако необходимое условие при этом — проведение хирургических вмешательств в сочетании с консервативным противорецидивным лечением и применением для артропластических операций эффективных прокладок. Должен быть установлен прежде всего действенный диспансерный учет и наблюдение больных.
На современном уровне развития медицинской науки имеются все основания для того, чтобы хирургический метод лечения занял надлежащее место в комплексной терапии больных с РА.
Как было отмечено, успех хирургического лечения зависит от правильной оценки общего состояния больного, характера течения заболевания и патологических изменений опорно двигательного аппарата, волевых качеств пациента и правильно составленного плана оперативных вмешательств. Это имеет особое значение при хирургическом лечении больных в III стадии заболевания, при множественных поражениях суставов с функционально невыгодными установками верхних и нижних конечностей. В процессе лечения индивидуальный план может меняться в зависимости от общего состояния больного и течения послеоперационного периода.
Для функции верхних конечностей в первую очередь необходимо восстановить хватательную способность кисти и движения в локтевых суставах. Исправление порочных установок в лучезапястных суставах показано только при тяжелых дискордантных деформациях.
Тугоподвижность или анкилоз плечевых суставов, если таковой имеется, порочного положения, не требует специальных вмешательств, так как возникает компенсация движений за счет плечевого пояса. В случаях порочных установок в плечевых суставах показана хирургическая реабилитация.
Функциональная недостаточность нижних конечностей у подавляющего большинства больных с РА зависит в основном от порочных, функционально невыгодных установок в тазобедренных и коленных суставах. Анкилозы тазобедренных, коленных, тазобедренных и коленных или голеностопных суставов в функционально выгодном конкордантном положении при хорошей или удовлетворительной функции верхних конечностей дают возможность больным пользоваться костылями. Однако передвижение очень затруднено, особенно у ослабленных хроническим процессом больных.
Анкилозы в функционально выгодном положении у больных с РА отмечают редко. Чаще приходится иметь дело с порочными, функционально невыгодными установками. Односторонние анкилозы в тазобедренном суставе требуют исправления и восстановления функции только при наличии порочного положения. При двусторонних анкилозах необходимо восстановление функции обоих суставов ввиду ригидности или анкилозирования поясничного отдела позвоночника. Небольшие сгибательные функционально выгодные установки в коленных суставах (не превышающие 165°) позволяют больным передвигаться при сохранении подвижности в тазобедренных суставах. Порочные сгибательные установки в коленных суставах под углом меньше 165°, как правило, требуют коррекции.
Для жителей городской местности показаны артропластические операции на обоих коленных суставах, а для сельских жителей, передвигающихся обычно по пересеченной местности и мягкому грунту, целесообразно проводить артропластику одного коленного сустава и корригирующую резекцию другого. В тех случаях, когда угол сгибательных порочных установок в коленных суставах меньше 120° — артропластика весьма затруднительна, следует производить реконструктивные остеопластические операции.
Вряд ли можно считать обоснованными при РА такие операции, как надмыщелковые остеотомии. Они сопряжены с длительной иммобилизацией, способствующей образованию тугоподвижности и анкилозов в пораженных суставах. В таких случаях показаны артропластические резекции, которые позволяют исправить порочную установку голени и восстановить функцию сустава или же выполнить корригирующую резекцию коленного сустава.
Вмешательство на голеностопных суставах показано только в тех случаях, когда имеется резко выраженная плосковальгусная или пяточная деформация стопы или же значительная подошвенная флексия.
В III стадии заболевания предпочтение отдается артропластическим операциям, а не корригирующей остеотомии, резекции, транспозиции и т.п. Это обосновывается следующими положениями: множественные анкилозы даже в функционально выгодном положении не облегчают состояния больного; при артропластике восстановление объема движений в оперированных суставах бывает различным, но в сумме получается удовлетворительная функция конечности.
Составляя план оперативных вмешательств, хирург должен учитывать общее состояние больного, его волевые качества и результаты уже выполненных ранее операций.
Особое значение приобретает оценка волевых качеств больного при решении вопроса об артропластике. Не все пациенты в состоянии преодолеть трудности, с которыми им приходится столкнуться в период разработки движений в оперированном суставе. Одни не могут преодолеть болевой синдром, связанный с мышечной болью и корешковым раздражением; другие не имеют достаточной силы воли для постоянной тренировки мышц и разработки сустава и иногда прекращают ее, считая свое положение непоправимым, становятся пассивными, проводят большую часть суток в постели, что отрицательно сказывается на исходе операции. Особенно часто это бывает, когда больным приходится разрабатывать после операции не один, а два и более суставов. За такими больными нужно вести диспансерное наблюдение, чтобы вовремя устранить болевой синдром, провести противорецидивное лечение, особое внимание уделить психотерапии.
В тех случаях, когда больные со слабыми волевыми качествами пассивны, нецелесообразность артропластических операций очевидна, и их результаты в большинстве своем неутешительны.
Противопоказаниями к оперативному лечению больных с РА в III стадии заболевания являются пожилой возраст, декомпенсация деятельности сердечно сосудистой системы, аритмии, комбинированные пороки сердца, активный туберкулез легких, заболевания печени и почек, амилоидоз внутренних органов.
Во всех других случаях имеются абсолютные показания к хирургическому лечению, так как только с его помощью можно восстановить у «безнадежных» больных функцию анкилозированных суставов.
Для пациентов 1-й группы показано восстановление функции верхних конечностей. Последовательность операций зависит от сохранности хватательной способности кисти. Если у больного отсутствует хватательная способность кисти, она восстанавливается в первую очередь путем артропластических операций на пястнофаланговых, а затем межфаланговых суставах с интервалом в 1,5–2 мес. После улучшения общего состояния больного и стабилизации движений производилось вмешательство на одном локтевом суставе, а спустя 5–6 мес — на другом.
При нарушенной функции верхних конечностей из за порочных анкилозов в локтевых суставах вначале производилась артропластика одного из них, и через 5–6 мес — другого.
У больных с порочными анкилозами локтевых и лучезапястных суставов вначале восстанавливалась функция локтевого сустава одной верхней конечности, а через 3 мес — лучезапястного на противоположной стороне. После восстановления стабильной амплитуды движений в оперированных суставах через 5–6 мес производилась мобилизация второго локтевого сустава.
У больных 2-й группы с симметричными дискордантными деформациями в суставах нижних конечностей хирургическое лечение начиналось с исправления порочных установок в коленных суставах; в зависимости от величины угла сгибания производилась артропластическая или остеопластическая резекция.
Начинать исправление порочной установки тазобедренного сустава при большом углу сгибания в коленном нецелесообразно и чревато рядом осложнений, так как после устранения сгибательной контрактуры в тазобедренном суставе обычная ортопедическая койка для больного уже непригодна ввиду наличия сгибательной порочной установки в коленном суставе. Нужны специальные приспособления для придания возвышенного положения туловищу и удобной укладки разогнутого бедра. После операции голень и стопа оказываются значительно ниже горизонтальной линии туловища. Такое вынужденное, постоянно опущенное положение голени и стопы быстро вызывает гипостатические отеки, не поддающиеся консервативной терапии. Хирург вынужден сокращать интервалы между операциями, что угрожает ухудшением общего состояния больного и препятствует хорошему исходу артропластической операции на тазобедренном суставе. Кроме того, после операции на тазобедренном суставе при еще не восстановленных силах больного нужно производить новое оперативное вмешательство на коленном суставе, а после резекции коленного сустава необходима длительная иммобилизация, которая при неразработанном тазобедренном суставе становится фактором, способствующим рецидиву анкилоза в тазобедренном суставе независимо от вида примененной прокладки.
Поэтому у больных 2 й группы с дискордантными симметричными деформациями нижних конечностей в первую очередь производят остеопластическую резекцию коленного сустава. Затем, когда наступит костный анкилоз коленного сустава и улучшится общее состояние, выполняют артропластику тазобедренного сустава.
В большинстве случаев второй этап хирургического лечения выполнялся не ранее, чем через 3–4 мес после первой операции. Придав одной нижней конечности функционально выгодное положение, усилия медперсонала направлялись на восстановление активной функции, силы и выносливости мышц. Обычно через 3–4 мес после второй операции больного выписывали для амбулаторного лечения и назначали курс санаторно курортного лечения. Лишь с восстановлением стабильной функции тазобедренного сустава, силы и выносливости мышц, что обычно наблюдалось не ранее чем через 10–12 мес после вмешательства, больного вновь госпитализировали для восстановительных операций на другой нижней конечности по аналогичной схеме.
В тех случаях, когда у больных были асимметричные дискордантные деформации нижних конечностей, объем оперативных вмешательств зависел от количества пораженных суставов и характера деформации. Так, если установка в одном тазобедренном суставе была функционально выгодной, а в другом — порочной, то оперативное лечение заключалось в исправлении порочного положения и восстановлении функции только в первом суставе. При порочной установке в одном коленном суставе на другой нижней конечности вначале восстанавливали функцию тазобедренного сустава, а затем, через 4–5 мес (в зависимости от общего состояния, волевых качеств больного и угла сгибательной установки в коленном суставе другой нижней конечности) проводили восстановительную операцию на коленном суставе — артропластику или корригирующую резекцию.
У больных с порочными установками обоих голеностопных суставов при функционально выгодных установках коленных и тазобедренных поэтапно восстанавливают функцию голеностопных суставов с помощью артропластических операций или придают стопам конкордантные положения с помощью корригирующих резекций.
Когда причиной утраты функции нижних конечностей являлись порочные установки в коленных суставах, оперативное лечение начинали с одного коленного сустава и, в зависимости от величины угла сгибания, делали артропластику или остеопластическую резекцию.
Интервал между артропластическими операциями на коленных суставах должен быть не менее 6 мес. Это позволяет сосредоточить внимание больного и персонала на разработке одного сустава и дает возможность максимально восстановить амплитуду движений в нем, силу и выносливость мышц.
Больные с симметричными и асимметричными конкордантными деформациями в суставах нижних конечностей с трудом передвигаются при помощи костылей (маятниковый тип передвижения). Это требует больших затрат сил и энергии, быстро утомляет даже при преодолении небольших расстояний. Больные не могут передвигаться по пересеченной местности, особенно тяжело им подниматься по ступенькам. Когда анкилозированы тазобедренные и коленные суставы, даже в функционально выгодном положении, больные не могут самостоятельно одеться и обуться. В вертикальном положении они неустойчивы, сидеть же вообще не могут, что фактически лишает их возможности пребывания в общественных местах.
Для облегчения состояния этим больным в первую очередь показано восстановление функции тазобедренных суставов, затем — одного из коленных. Интервал между операциями на тазобедренных суставах должен быть не менее 10–12 мес, а между операциями на тазобедренном и коленном — 6–8 мес.
В ряде случаев больные при поражении обоих тазобедренных суставов после восстановления функции одного из них воздерживались от второй операции. Причиной отказа был страх перед операцией, но чаще — уже достигнутое облегчение в связи с восстановлением движений в одном из тазобедренных суставов.
3-ю группу составляли наиболее тяжелые больные с множественными анкилозами суставов верхних и нижних конечностей. У таких пациентов в первую очередь необходимо восстановить функцию верхних конечностей. Это значительно облегчает их положение. Они начинают верить в возможность избавления от состояния полной беспомощности. Если у больного отсутствовала хватательная функция кистей, то в первую очередь восстанавливают ее, производя артропластические операции на пястнофаланговых, а затем межфаланговых суставах. Такая последовательность обусловлена тем, что больные не в состоянии одномоментно разрабатывать два смежных сустава одного и того же пальца. Интервал между операциями на суставах пальцев зависит от степени и времени восстановления стабильной амплитуды движений. Обычно он не превышает 1,5–2 мес. Восстановив хватательную функцию одной кисти, через 1,5–2 мес производят артропластику локтевого сустава.
Если хватательная функция кисти была удовлетворительной, но функция верхних конечностей отсутствовала ввиду анкилоза локтевых суставов, то оперативное лечение начинают с восстановления подвижности одного из них. После 3–5 месячного интервала выполняют аналогичную операцию на другом локтевом суставе.
Интервалы между операциями зависят, как уже ранее указывалось, от общего состояния и волевых качеств больного, степени восстановления силы и выносливости мышечного аппарата.
После восстановления функции верхних конечностей больных выписывали для амбулаторного лечения и улучшения общего состояния. Через 6 мес их госпитализировали повторно для восстановления функции нижних конечностей. При порочных положениях в тазобедренных и коленных суставах исправляли порочное положение одной нижней конечности, а затем — другой, так же как при лечении больных 2 й группы.
Иногда допускали восстановление функции одной верхней конечности, а затем переходили к восстановлению функций нижних конечностей. Это обусловлено стремлением больного как можно быстрее получить способность к передвижению и избавиться от вынужденного положения в постели. Такое отступление от плана операций целесообразно в том случае, если больной после операции сможет пользоваться костылями. Если пациент не в состоянии удерживать костыли, переход к восстановительным операциям на нижних конечностях будет тактической ошибкой.
При появлении в ходе лечения тех или иных противопоказаний к проведению последующих операций следует временно ограничиться только восстановлением функции верхних конечностей.
Приведенные схемы демонстрируют, что последовательность восстановительных оперативных вмешательств при РА зависит от общего состояния больного и стадии заболевания. План оперативного лечения должен быть рациональным, позволяющим без тяжелых, изнуряющих предоперационных манипуляций (вытяжение, закрутки, этапные редрессации, паллиативные операции) кратчайшим путем восстановить подвижность в суставах и тем самым создать условия для самообслуживания и передвижения.
В тех случаях, когда общее состояние больного не позволяет выполнить полный комплекс хирургических вмешательств на верхних и нижних конечностях, ограничиваются восстановлением функции верхних конечностей. Когда по той же причине невозможно устранение порочных положений обеих нижних конечностей, необходимо восстановить функцию одной, что при удовлетворительной функции верхних конечностей дает возможность передвигаться с помощью костылей.
Хирург не должен спешить с выполнением всего комплекса оперативных вмешательств за счет сокращения интервалов между ними, так как это отрицательно сказывается не только на общем состоянии больного, но и на результате операции. Средний срок выполнения комплекса оперативных вмешательств у больных 1-й группы — 10–12 мес, 2-й группы — 2–3 года, 3-й группы — 3–4 года.
В заключение следует еще раз подчеркнуть, что хирургическое лечение больных с РА в ІІІ стадии заболевания при правильном учете патофизиологических сдвигов в организме, индивидуальном плане и характере восстановительных операций, применении эффективных биологических прокладок вполне обосновано и абсолютно показано. Только благодаря введению в комплексную терапию хирургических методов можно снова вернуть к активной жизни таких больных.
Предоперационная подготовка
Успех хирургического лечения при РА во многом зависит от продуманной, педантично проведенной предоперационной подготовки с учетом патофизиологических изменений в организме больного.
Приступая к хирургическому лечению, врач должен исходить из того, что он имеет дело с общим аутоиммунным с рецидивирующим течением заболеванием. В организме таких больных наступают значительные функциональные и органические изменения функции жизненно важных органов и систем. Поэтому все наши мероприятия в предоперационный период должны быть направлены на возможное восстановление, компенсацию этих функций, укрепление и восстановление гипотрофичных, длительно нефункционирующих мышц, на подготовку кожных покровов в области предполагаемых оперативных вмешательств и тренировку волевых качеств больного.
Осуществление указанных мероприятий в предоперационный период достигалось путем общеукрепляющей терапии, санаторно курортного лечения, применения физиотерапевтических методов и ЛФК в комплексе с терапевтическим лечением.
Общеукрепляющая терапия направлена на борьбу с хронической гипоксией, всегда выраженной у больных в III стадии заболевания, на укрепление нервной, сердечно сосудистой, эндокринной систем, нормализацию функции печени и почек.
Физиотерапия и санаторно курортное лечение имеют целью, с одной стороны, максимально восстановить функции жизненно важных органов и систем, а с другой — повысить реактивность организма, улучшить трофику и обменные процессы.
ЛФК позволяет в предоперационный период восстановить двигательные навыки и условные двигательные рефлексы, которые угасли вследствие длительного обездвиживания и морфологических изменений в ЦНС, мышечном аппарате, максимально восстановить движения в еще не анкилозированных суставах, силу и выносливость мышц, улучшить и нормализовать обменные процессы.
С помощью систематической воспитательной работы можно установить контакт с больными, дисциплинировать их, вернуть веру в возможность восстановления функции конечностей и включения в активную жизнь. Особое значение это имеет для больных со слабым типом нервной деятельности.
Исходя из указанных положений в предоперационный период рекомендуется больным с III стадией заболевания пройти курс общеукрепляющего санаторно курортного лечения (радоновые или сероводородные ванны). При отсутствии такой возможности комплексная общеукрепляющая терапия, как правило, проводится в клинике.
В первую очередь принимаются меры борьбы с хронической гипоксией, которая обусловлена ригидностью или анкилозированием суставов грудной клетки, вследствие чего развивается хроническая недостаточность внешнего дыхания. Кроме того, такие больные крайне мало бывают на воздухе. Они годами лежат без движения в плохо проветриваемых комнатах, боясь простуды и обострения процесса. Постоянная недостаточная вентиляция помещения при хронической недостаточности внешнего дыхания почти неминуемо ведет к хронической гипоксии, которая, в свою очередь, влечет за собой функциональные и органические нарушения функции жизненно важных органов и систем, в первую очередь ЦНС.
Борьба с гипоксией — это одновременно и борьба за нормализацию функций ЦНС, ее регуляторных механизмов, словом, за нормализацию всей деятельности организма.
Hoschia (1960) и другие отмечают, что гипоксия печени ведет к гепатоцеллюлярным изменениям и нарушению функции органа. В работах K. Ohler (1957), M. Unchinger (1953) и других убедительно показано, что при поражении печени выделение веществ, нормализующих обменные процессы в сердце, нарушается. Этим авторы объясняли происхождение так называемой гепатогенной недостаточности сердца.
Таким образом, нормализация функции печени — это нормализация биохимических обменных процессов в организме, сердечно сосудистой системе, что чрезвычайно важно при хирургическом лечении, когда больным предстоит ряд тяжелых восстановительных операций на крупных суставах.
В клинике для борьбы с гипоксией назначают дыхательную гимнастику, целью которой является выработка правильного ритма дыхания и восстановление максимально возможной глубины дыхательных экскурсий (за счет этого уменьшается дефицит кислорода в организме).
Дыхательная гимнастика проводится под наблюдением медицинского персонала не менее 3–4 раз в сутки. Кроме того, регулярно применяется кислородная терапия (кислородные подушки, кислородная палатка). В теплое время года больные должны находиться на балконах, верандах или в саду.
Из седативных средств для нормализации функции ЦНС широко используют препараты брома, валерьяны.
М.Г. Астапенко (1956) у больных с РА наблюдала значительное снижение силы и подвижности нервных процессов и в первую очередь — ослабление силы тормозного процесса. Поэтому раздражительным больным с плохим сном в предоперационный период назначают препараты брома, гальванический воротник по Щербаку. Пассивные, апатичные, безучастные к окружающему больные проходят курс лечения кофеином, который, как известно, усиливает процессы раздражения (Гапикс Е.А., Долин А.О., Завальдидр Л.О., цит. по Самойловой З.Т., 1952). При необходимости тонизировать процессы и торможения, и возбуждения назначали смесь брома с кофеином.
С целью улучшения или нормализации функции печени в предоперационный период проводят, кроме кислородной терапии, курс внутривенных (в/в) инъекций 40% раствора глюкозы 20 мл в течение 10–12 дней, инъекции витамина В12 100–300 мкг в течение 30 дней, спленина 1 мл внутримышечно (в/м) 10–12 инъекций. В суточный пищевой рацион необходимо регулярно включать 100 г свежего творога и 30 г натурального меда. При такой предоперационной подготовке на 4–5 й неделе значительно улучшалась антитоксическая функция печени. При наличии у больных воспалительных явлений в области желчного пузыря и желчных ходов проводят курс лечения антибиотиками, назначают диету, минеральные воды, слепое зондирование сульфатом магния по общепринятой схеме.
Для стимуляции и нормализации сердечной деятельности применяют, помимо общих средств борьбы с гипоксией, курс лечения 40% раствором глюкозы (20 мл в/в) в течение 10–12 дней, в/м инъекции АТФ 1 мл в течение 25—30 дней, кокарбоксилазы (по схеме), кофеин в невысоких дозах (0,1 г 3 раза в сутки), который, по данным А.И. Петровского (1952), усиливает и удлиняет систолу, уменьшает диастолу, расширяет коронарные сосуды, улучшает периферическое кровообращение.
В предоперационную подготовку больных с РА в III стадии заболевания обязательно входило насыщение организма витаминами, в частности, групп С, В, D. Витамин С активно участвует в процессах клеточного дыхания, обмена веществ, способствует поддержанию постоянного уровня адреналина, стимулирует работоспособность сердечной мышцы и обладает антитоксическими свойствами. Назначают его в/в с глюкозой и перорально. Витамин В1 усиливает действие витамина С, оказывает ваготропное влияние, способствует окислению продуктов межуточного обмена, в частности, пировиноградной кислоты, накапливающейся не только в сердечной мышце, но и в крови (Петровский А.И., 1952). Витамин D улучшает регуляцию обмена фосфора и кальция, способствует отложению их в костной ткани, то есть предупреждает развитие остеопороза. При явлениях анемии назначают препараты препараты железа — для стимуляции гемоглобинообразования.
У большинства больных с III стадией заболевания имеется скрытая надпочечниковая недостаточность. Причина ее — длительная хроническая инфекция и особенно — продолжительное лечение гормональными препаратами. Для определения функционального состояния коры надпочечников предложен ряд тестов (определение 17 кетостероидов, проба Торна и др.). Определение уровня глюкокортикостероидов (ГКС), в частности 17 кетостероидов, может служить показателем функции коры надпочечников лишь при условии удовлетворительной функции печени. У большинства же пациентов функция печени нарушена. Таким образом, в этом случае определение 17 кетостероидов как теста скрытой надпочечниковой недостаточности теряет свое значение.
Наибольшее распространение в клинической практике для определения функционального состояния коры надпочечников получила проба Торна. Анализируя пробу Торна, необходимо отметить следующее. Подсчет эозинофилов до и через 4 ч после введения 25 ЕД адренокортикотропного гормона (АКТГ) не может считаться безупречным, в полной мере отражающим функциональное состояние коры надпочечников. Как показали клинические наблюдения, длительное лечение ГКС и АКТГ приводит к «экспериментальной болезни Аддисона», которая вне «напряжения» ничем себя клинически не проявляет. Ввиду изложенного, особое значение приобретает анамнез, из которого необходимо выяснить, принимал ли больной и как долго указанные выше гормоны.
Развитие гипотензии обусловлено дефицитом ГКС, потребность в которых при оперативном вмешательстве максимально возрастает, а надпочечники при угнетении их функции не в состоянии ее удовлетворить. Следовательно, предупредить острую надпочечниковую недостаточность возможно только с помощью активизации и нормализации функции коры надпочечников или поддержания необходимого уровня ГКС в организме во время операции путем в/в их введения. Schutz (1959) доказал, что для стимуляции функции коры надпочечников необходимы дозированные напряжения мышц путем ЛФК в сочетании с посегментным ультрафиолетовым облучением. Данную методику он назвал «аутогидрокортизонированием».
С целью профилактики острой надпочечниковой недостаточности ряд авторов (Кованев В.А., 1963; Wilson, 1956 и др.) предложили различные схемы предоперационной гормональной подготовки и послеоперационного гормонального лечения. Но и предоперационная гормональная подготовка не всегда предотвращала возникновение острой адренокортикальной недостаточности. Не случайно Wilson писал, что в случае наступления гипотензии, несмотря на гормональную подготовку, гидрокортизон следует вводить в/в. Jillies (1958), наблюдавший гипотензию у одного из 39 получавших и у одного из 37 пациентов, не получавших гидрокортизон до операции, сделал вывод, что предоперационная гормональная подготовка не предупреждает возникновения этого осложнения. Кроме того, даже непродолжительное применение гормонов коры надпочечников нередко влечет за собой ряд осложнений.
В.А. Кованев (1961) наблюдал у больных при кратковременном применении ГКС эйфорию. В литературе были описаны случаи развития тромбофлебитов и тромбоэмболии. Gieseler (1962) у 6 из 38 больных, которым в пред- и послеоперационный период вводили преднизолон 25 мг в сутки на протяжении 4 дней в убывающих дозах, отметил нарушение углеводного обмена. Учитывая вышеизложенное, целесообразность предоперационной гормональной подготовки сомнительна.
Анестезиолог Я.Л. Заманский (Киевский научно-исследовательский институт ортопедии) выработал следующую тактику ведения больных со скрытой адренокортикальной недостаточностью. Предоперационная гормональная подготовка не проводится. Гидрокортизон в дозе 100–125 мг в 250–300 мл физиологического раствора или 5% раствора глюкозы в 4 приема вводят в/в перед вводным наркозом в начале операции, то есть в наиболее травматичный ее момент, и в конце оперативного вмешательства. Из 69 больных только у одного в послеоперационный период возникла острая адренокортикальная недостаточность вследствие недостаточной дозы препарата. Дополнительное введение 50 мг гидрокортизона нормализовало гемодинамику.
При наличии симптомов хронического бронхита лечебные мероприятия направлены на уменьшение кашля, применяются отхаркивающие средства, муко- и бронхолитики.
При имеющейся мочекаменной болезни проводится соответствующая терапия; при частых приступах оперативное лечение откладывается и больных переводят в урологический стационар. Только после улучшения состояния можно приступать к хирургическому восстановительному лечению.
Ослабленным больным назначают тонизирующие и общеукрепляющие средства, адаптогены и биостимуляторы. В предоперационной подготовке важное значение имеют физиотерапевтические методы лечения. Основная направленность физиотерапевтических методов и санаторно-курортных мероприятий (сероводородные, радоновые ванны) в предоперационный период состоит в том, чтобы, учитывая имеющиеся патофизиологические сдвиги, максимально восстановить функцию жизненно важных органов и систем, повысить реактивность организма, подготовить мягкие ткани в области предполагаемых оперативных вмешательств. Бальнеотерапия улучшает и нормализует периферическое кровообращение, обменные и биохимические процессы, стимулирует защитные способности соединительной ткани, улучшает трофику.
В стационаре в предоперационный период применяют различные формы массажа, десенсибилизирующие средства, посегментное облучение кожи эритемными дозами кварца.
Для улучшения трофики мягких тканей в области предполагаемых оперативных вмешательств, особенно коленных, локтевых, лучезапястных, голеностопных суставов и суставов кисти, назначают парафиновые аппликации. При наличии суставной боли широко используют электрофорез по Парфенову и ультразвук. Важно применение ЛФК. Лечащий врач обязан провести воспитательную работу с больным, выработать стройную систему функционального лечения. Важным аспектом лечения является психотерапия — установление тесного взаимопонимания между врачом и больным, внушение ему уверенности в улучшении его состояния с индивидуальным учетом клинических особенностей, характера, стадии заболевания и волевых качеств больного.
Так как больные в III стадии заболевания обычно длительно находятся в постели в вынужденном положении, у них вырабатывается особый стереотип, перестройка которого представляет значительные трудности не только для самого пациента, но и для лечащего врача. Особое внимание должно уделяться больным с пассивной психической настроенностью. Одним из основных условий успешного лечения являются активные, сознательные и систематические занятия самого больного. Для этого необходимо ознакомить его с анатомо физиологическими особенностями оперируемого сустава, наиболее выгодными положениями сегментов конечностей и методикой восстановления функции. Необходим контакт больного с лечащим врачом и методистом ЛФК. Следует избегать замены врача и методиста, так как это может нарушить уже установленный контакт с ними больного.
Длительная хроническая интоксикация, вынужденное неподвижное положение в постели, недостаточное пребывание на воздухе, потеря аппетита ведут не только к значительным нарушениям опорно-двигательного аппарата, но и всех жизненно важных органов и систем. Поэтому в подготовительный период особое внимание необходимо уделять активизации больного, возможной нормализации общего состояния, что достигается, кроме общетерапевтических методов, средствами ЛФК. В основе ее действия лежат движения, которые являются также биологическим раздражителем, стимулирующим и нормализующим физиологические процессы в организме, улучшающим тканевой обмен, окислительно восстановительные процессы в мышцах, повышающим энергетический баланс организма, коэффициент утилизации кислорода, нормализующим иммунобиологические силы организма.
Назначают активные упражнения для здоровых конечностей, импульсную (изометрическая) гимнастику для мышц анкилозированных сегментов, дыхательную гимнастику. Последняя увеличивает жизненную емкость легких, глубину дыхательных экскурсий грудной клетки и диафрагмы.
Максимальное улучшение функций двигательного аппарата в соответствии с намеченным планом восстановительных операций на конечности достигается систематическими активными упражнениями и волевыми сокращениями мышц анкилозированных сегментов, лечебным массажем.
Лечение положением следует обязательно применять для восстановления статико-динамических функций. Обычно больные с суставными деформациями теряют чувство правильного положения сегментов тела, поэтому в предоперационный период следует научить их следить за этим. Особенно важно, чтобы больной знал, как он должен лежать после операции и снятия гипсовой повязки.
Часто для удержания сегментов оперированной конечности в правильном положении требуются различные приспособления (мешочки с песком, манжетки, гипсовые, эмалитиновые съемные шины).
В общем цель ЛФК в подготовительный период — укрепить общее состояние больного, активизировать и по возможности нормализовать функцию жизненно важных органов и систем, максимально восстановить силу гипотрофированных мышц, выработать правильные условно-двигательные рефлексы в предназначенном для операции суставе. Подготовительный период продолжается от момента поступления больного в стационар до дня операции. Длительность его сугубо индивидуальна и зависит от общего состояния больного, степени тяжести поражения опорно двигательного аппарата, объема намечаемых оперативных вмешательств и в каждом конкретном случае определяется лечащим врачом. Занятия с больными проводились в виде групповых и индивидуальных уроков с методистом, а также самостоятельно. Для самостоятельных занятий больные получали конкретные упражнения, которые должны были выполнять в течение определенного периода. Комплекс упражнений составлялся в соответствии с индивидуальными особенностями больного, ознакомившегося с планом всего курса восстановительного лечения.
Были приняты следующие формы ЛФК: утренняя гигиеническая гимнастика; лечебная гимнастика в виде индивидуальных и групповых занятий; индивидуальные задания; аппаратотерапия; трудотерапия.
Примерная схема упражнений в предоперационный период такова:
- Дыхательные упражнения. Грудное дыхание, направленное на улучшение экскурсий грудной клетки, увеличение силы дыхательных мышц. Максимальный вдох через нос, затем медленный выдох, при этом следует соблюдать ритмичность вдоха и выдоха. При выполнении дыхательных упражнений необходимо кратковременно задерживать дыхание с целью улучшения оксигенации крови. Выдох должен быть более продолжительным, паузы — равномерными во избежание гипервентиляции и головокружения. Гипотрофированные мышцы грудной клетки больше напрягаются, что способствует улучшению их функции. Брюшное дыхание. Вдох с надуванием живота. При максимальном вдохе расширяется нижняя часть грудной клетки и напрягаются мышцы передней брюшной стенки. Выдох напряженный с втягиванием живота. При таких дыхательных упражнениях происходит максимальная экскурсия диафрагмы, способствующая улучшению вентиляции нижних отделов легких и перистальтики кишечника. Количество упражнений для грудного и брюшного дыхания вначале не должно превышать 5–6, затем постепенно увеличивается в зависимости от общего состояния больного. Ритм дыхания 15–18 экскурсий за 1 мин.
- Активные упражнения всех подвижных суставов. Вначале без сопротивления и грузов; по мере улучшения функционального состояния мышц — упражнения, направленные на тренировку силы, статической и динамической выносливости мышечных групп с помощью грузов и резиновых тяг.
- Упражнения для мышц анкилозированных сегментов конечности: а) волевые сокращения в изометрическом режиме; б) электростимуляция.
- Обучение элементам статики, динамики и пользованию костылями — для больных, имеющих возможность сидеть или находиться в вертикальном положении.
- Упражнения для сокращения и расслабления основных групп мышц и отдельной мышцы.
- Массаж перерастянутых мышц и растяжение контрагированных. Непосредственная предоперационная фармакологическая подготовка больных проводится с целью устранения отрицательных эмоций (гидазепам), достижения десенсибилизирующего эффекта путем применения антигистаминных препаратов (цетиризин, деслоратадин, феноксифенадин), снижения возбудимости парасимпатической нервной системы, достижения седативного и анальгезирующего эффекта.
Надежной профилактической мерой острой надпочечниковой недостаточности при оперативном лечении больных с III стадией заболевания оказалась уже упоминавшаяся методика Я.Л. Заманского.
Главным фактором, вызывающим гипотензию у больных с РА, является операционная травма.
Введение гормонов коры надпочечников не предупреждает возникновения гипотензии, зависящей от других причин (невосполненная кровопотеря, снижение сосудистого тонуса). Если учесть, что у больных с РА сосудистый тонус снижен, то вероятность связанных с операцией гемодинамических расстройств по этой причине возрастает.
Многообразие сопутствующей патологии у больных с РА диктует необходимость выбора методов обезболивания, при которых интоксикация была бы минимальной и был обеспечен адекватный газообмен. Но ввиду нередко встречающегося ограничения открывания рта, наличия анкилозов или ригидности шейного отдела позвоночника, поражения хрящей гортани интубация оказывается невозможной, а применение релаксантов опасно, так как управляемое дыхание через маску может оказаться неэффективным.
Gardner и Holmes (1961) рекомендовали прибегать к профилактической трахеостомии в тех случаях, когда эндотрахеальный наркоз почему-либо затруднителен или невозможен. Авторы описывали 5 случаев хирургического вмешательства у больных с ревматоидным полиартритом. В одном случае во время операции произошло нарушение дыхания и пришлось срочно производить трахеостомию. Четверо больных погибли в начале послеоперационного периода.
Продуманная предоперационная подготовка больных с РА с учетом всех патофизиологических сдвигов и рациональная тактика во время операции позволяют свести к минимуму риск оперативных вмешательств.
Хирургические методики
Особенностью хирургического лечения больных с РА в III стадии заболевания является необходимость не только придать конечности функционально выгодное положение, но и стараться максимально восстановить движения в анкилозированных суставах. Основной акцент при хирургическом лечении указанной группы больных делается на артропластические операции.
Выполнять артропластические операции приходится при тяжелых трофических нарушениях как мягких тканей, так и костей. У больных, лишенных возможности передвигаться, остеопороз достигает предельной степени. Кортикальный слой кости резко истончен, нередко он не толще скорлупы куриного яйца. Спонгиозная ткань также атрофична, с большим количеством полостей, наполненных тягучей прозрачной с желтоватым оттенком жидкостью.
Формирование суставных концов при артропластических операциях требует специальных навыков. Не удивительно, что раздаются голоса против артропластических операций у данной группы больных из за остеопороза. Остеопороз не является противопоказанием для артропластических операций. Именно при восстановлении движений в суставе и возвращении конечности ее функции он значительно уменьшается.
Артропластика межфалангового сустава. Операцию выполняют под циркулярной анестезией. Разрез проводят по тыльно-лучевой стороне пальца от средней трети основной фаланги; над суставом его отклоняют дугообразно на тыльную поверхность и на второй фаланге вновь переходят на лучевую сторону до средней трети фаланги. После рассечения мягких тканей до кости сухожилие мобилизуют и сдвигают в локтевую сторону, выделяют с помощью распатора костный анкилоз и разъединяют его долотом или кусачками Листона. Суставные поверхности вывихивают в рану. Дистальному суставному концу основной фаланги придают выпуклую форму, а проксимальному концу второй фаланги — вогнутую. Суставные поверхности отшлифовывают рашпилем. Консервированной оболочкой семенника быка перекрывают только головку основной фаланги. Затем суставные поверхности сопоставляют, сухожилие разгибателя по оси пальца фиксируют кетгутовыми швами и рану послойно зашивают наглухо. Иммобилизацию осуществляют с помощью ладонной гипсовой шины с захватом оперированных пальцев в течении 3 дней.
Fovler артропластику пястно-фалангового сустава и первого межфалангового сустава производил путем резекции головки пястной кости в первом случае и основной фаланги — во втором. Затем выводил пальцы из порочного положения и фиксировал в состоянии диастаза металлической спицей суставные концы в течение 3 нед.
Vainio (1970) на уровне сустава пересекал сухожилие разгибателя и резецировал головку пястной кости. Затем концом дистального отрезка сухожилия перекрывал вновь образованную поверхность фаланги и подшивал его с ладонной стороны пальца. Сухожилие разгибателя восстанавливал путем подшивания проксимального конца к тыльной поверхности дистального отрезка. Боковые связки пястно-фалангового сустава подшивал чрескостными швами к шейке пястной кости.
Сторонником восстановления функции суставов пальцев с помощью металлических суставов был Flatt (1961, 1962). Для пястно-фаланговых суставов он рекомендовал применять дорзальный поперечный разрез, для межфаланговых суставов — боковой с рассечением боковой связки. После вскрытия сустава суставные поверхности вывихивают и удаляют их кусачками. Вскрывают костномозговой канал и внедряют в него стержни искусственного сустава. Если каналы узкие, расширяют их сверлом или зубным бором. Затем дополнительно стержни искусственного сустава хорошо вбивают специальным ударником, при этом, следя, чтобы обе части протеза были расположены строго по оси и параллельно поверхности. После этого сопоставляют обе части протеза и вставляют винт, скрепляющий обе его половины. Рану зашивают послойно наглухо. Иммобилизация необходима в течение 10–12 дней. После снятия швов — ЛФК. Методика ЛФК проводится по схеме, изложенной выше.
Артропластика пястно-фалангового сустава. Операцию выполняют под циркулярной анестезией. Пользуются продольным доступом к каждому суставу по тыльной поверхности от основания головки пястной кости до границы между нижней и средней третью основной фаланги или же одним поперечным разрезом, проходящим на уровне головок пястных костей. После рассечения кожи, подкожной клетчатки, фасции мобилизуют сухожилие разгибателя пальцев. Если оно разорвано, находят его концы и берут на держалки. Затем продольно рассекают рубцово перерожденную капсулу сустава и отделяют ее от подлежащей кости распатором. Выделяют из рубцов место анкилоза. С помощью узкого желобоватого долота производят серповидную резекцию сустава. Величина резецированного участка зависит от наличия сгибательной деформации, то есть чем больше сгибательная деформация, тем больший клин с основанием в тыльную сторону необходимо иссекать. После этого палец выводится из порочного положения. С помощью острого долота и рашпиля моделируют суставные поверхности: суставной поверхности пястной кости придают выпуклую форму, а суставной поверхности основной фаланги — соответственно вогнутую. Созданную головку пястной кости перекрывают консервированной оболочкой семенника быка, которую подшивают узловатыми кетгутовыми швами к мягким тканям или чрескостно. Суставные поверхности сопоставляют, сухожилие разгибателя пальца укладывают на свое место; если его рассекали, — сшивают, а если оно смещается, то фиксируют по оси пальца кетгутовыми нитями. При разрыве производят сухожильную пластику. Рану послойно зашивают.
Иммобилизацию осуществляют с помощью ладонной гипсовой шины с захватом оперированных пальцев в течение 3 дней.
Артропластика лучезапястного сустава. Операцию выполняют под проводниковым обезболиванием, наркозом. Чаще всего применяют продольный тыльный доступ, проходящий через середину сустава. После рассечения кожи, подкожной клетчатки и фасции мобилизуют сухожилия разгибателей пальцев и с помощью крючков раздвигают их в стороны. Затем рассекают утолщенную рубцово измененную и спаянную с подлежащей костной тканью капсулу сустава, после чего из мягких тканей с помощью распатора выделяют место костного анкилоза. Все кости запястья у больных в III стадии заболевания обычно бывают спаяны в сплошной костный конгломерат. Желобоватым широким долотом на высоте изгиба (деформации) резецируют клин, обращенный основанием к тылу. Суставной поверхности лучевой кости придают овально вогнутую форму, а блоку костей запястья — овально выпуклую. Суставные поверхности зашлифовывают рашпилем. Проверяют объем пассивных движений, степень коррекции деформации, величину диастаза. Моделирование считаем достаточным, если полностью выводится кисть из порочного положения и свободна тыльная флексия при наличии диастаза между суставными поверхностями до 2 см. После контроля кисть снова вывихивают и суставную поверхность лучевой кости перекрывают консервированной влагалищной оболочкой семенника быка, которую фиксируют к мягким тканям узловатыми кетгутовыми швами.
Длительная порочная установка кисти в положении ладонной флексии приводит к стойкому перерастяжению сухожилий разгибателей пальцев. Поэтому после выведения кисти из порочного положения иногда приходится укорачивать сухожилия, образуя дупликатуру. Сухожилия укладывают на свое место, тщательно перекрывают фасцией и рану послойно зашивают наглухо. Иммобилизацию осуществляют в течение 5 дней с помощью ладонной гипсовой шины от верхней трети предплечья с захватом всей кисти.
Артропластика локтевого сустава. Операцию выполняют под наркозом. Наиболее рациональный задний доступ Лангенбека, который начинается на 4–5 см выше мыщелка плечевой кости, далее идет через верхушку локтевого отростка и заканчивается ниже него на 5–6 см.
После рассечения кожи, подкожной клетчатки, фасции рану расширяют крючками и выделяют локтевой нерв; затем подводят под него марлевую держалку и отодвигают медиально. Сухожилие трехглавой мышцы плеча в зависимости от его толщины рассекают Z образно в сагиттальной или фронтальной плоскости. Затем разрезают капсулу сустава, которая всегда спаяна с подлежащей костной тканью и с помощью распатора и скальпеля обнажают область костного анкилоза. Острым желобоватым долотом разъединяют костный анкилоз по линии бывшего сустава, что позволяет удобно формировать суставные концы.
Исходя из того, что у больных в III стадии заболевания резко выражен остеопороз, а в эпифизах имеется множество различного размера полостей, придать суставным концам приближающуюся к норме форму не удается. Для предупреждения подвывиха, вывиха предплечья и разболтанности в локтевом суставе считаем целесообразным суставному концу плечевой кости придать форму «катушки». Сформировав суставную поверхность плечевой кости, соответственно формируют суставной конец локтевой кости. При этом необходимо укоротить локтевой отросток. Далее укорачивают чрезмерно выступающий разросшийся венечный отросток, разъединяют анкилоз между лучевой и локтевой костями, головку лучевой кости в зависимости от степени ее деформации частично или полностью резецируют (рис. 2а, б). Проверяют амплитуду пассивных движений: сгибание и разгибание должны быть в полном объеме.
Правильно сформированными суставные концы можно считать лишь тогда, когда пассивно удается полностью разогнуть и согнуть предплечье и нет тенденции к боковым вывихам или подвывихам. Особое внимание надо обращать на передний край суставной поверхности плечевой кости, так как на ней могут быть костные выступы, мешающие сгибанию. Необходимо также иссекать сморщенную рубцово перерожденную капсулу сустава по передней поверхности, которая может быть препятствием для полного разгибания предплечья.
После проверки объема движений, конгруэнтности суставных концов и величины диастаза, который не должен превышать 1,5–2 см, суставной конец плечевой кости перекрывают консервированной оболочкой семенника быка и фиксируют ее к мягким тканям узловатыми кетгутовыми швами.
Суставные поверхности сопоставляют, шелком сшивают сухожилие трехглавой мышцы плеча, новообразованный сустав тщательно перекрывают мягкими тканями, локтевой нерв укладывают на новое место, над ним сшивают мягкие ткани, рану послойно зашивают наглухо. Иммобилизацию осуществляют в течение 3 дней с помощью задней гипсовой шины от верхней трети плеча до головок пястных костей.
Артропластика тазобедренного сустава. Операцию, как правило, производят под наркозом. Наиболее удобным является доступ Лексера. Он не требует специальной укладки больного, дает возможность максимально щадить мышцы, сосуды и нервы, открывает хороший подход к вертлужной впадине и проксимальному концу бедренной кости.
После рассечения кожи, подкожной клетчатки, фасции и отсечения у основания большого вертела большой ягодичной мышцы с помощью долота отбивают верхушку большого вертела с прикрепляющимися мышцами и оттягивают их крючками кверху. Проводят тщательный гемостаз. Затем рассекают капсулу сустава, которая у больных в III стадии заболевания, как правило, рубцово перерождена, утолщена и спаяна на всем протяжении с подлежащей костной тканью.
Рассеченную капсулу сустава с помощью распатора отделяют от шейки бедренной кости и максимально иссекают, так как в противном случае она нередко становится источником параартикулярных разрастаний и обызвествлений. Затем из мягких тканей и рубцов выделяют место сращения головки бедренной кости с вертлужной впадиной и с помощью долота по контуру бывшей головки разъединяют костный анкилоз. Дно вертлужной впадины, как показали наши клинические наблюдения, у больных данной группы никогда не бывает сращено с медиальной поверхностью головки бедренной кости, что отчетливо видно на всех рентгенограммах. Поэтому после разъединения костного анкилоза с верхней, нижней и боковых сторон проксимальный конец бедренной кости легко вывихивают в рану путем сгибания, приведения и ротации бедра. Подчеркиваем, что во время вывихивания необходимо избегать какого либо насилия, так как из за остеопороза шейку бедренной кости можно легко сломать. Чтобы убедиться в полном разъединении костного анкилоза, необходимо произвести пассивные сгибательные и разгибательные движения в тазобедренном суставе. Если они возможны и осуществляются свободно, то костный анкилоз полностью разъединен.
После вывихивания проксимального конца бедренной кости в рану с помощью долота формируют головку и шейку бедренной кости. Шейку, как правило, удлиняют за счет сбивания большого вертела. Полости в сформированной головке плотно тампонируют резецированной спонгиозной тканью и головку зашлифовывают рашпилем. Сформированную головку покрывают влажной салфеткой, и хирург переходит к формированию вертлужной впадины.
В связи с тем, что дно вертлужной впадины не вовлечено в костный анкилоз и покрыто гладкой склерозированной хрящеподобной тканью, приходится формировать и расширять только стенки и края впадины, сбивать костные выступы и разрастания, которые являлись бы препятствием движениям в восстановленном суставе. Обязательно удаляют с помощью долота обызвествленную поперечную связку вертлужной впадины и костные разрастания у нижнего полюса. Это позволяет избежать развития рецидива анкилоза в нижнем участке вертлужной впадины. Шлифовку поверхности вертлужной впадины осуществляют электрофрезами. При этом возникает ожог, который до некоторой степени подавляет репаративный процесс. Вертлужную впадину прокладками не выстилают.
По окончании формирования вертлужной впадины проксимальный конец бедренной кости вправляют и проверяют глубину внедрения головки бедренной кости, объем пассивных движений и величину диастаза между головкой и вертлужной впадиной. Формирование суставных поверхностей считается оконченным, если головка погружается в вертлужную впадину на две трети и возможно пассивное сгибание бедра до острого угла и полное его разгибание и отведение до 20–25°. Диастаз между суставными поверхностями должен быть не менее 1,5–2 см.
После контрольной проверки проксимальный конец бедренной кости снова вывихивают в рану, производят удаление мелких костных фрагментов и тщательный гемостаз. Боковые поверхности вертлужной впадины обрабатывают стерильным воском. Сформированную головку и шейку покрывают консервированной влагалищной оболочкой семенника быка, которая фиксируется к мягким тканям узловатыми кетгутовыми швами. После этого бедренную кость окончательно вправляют в вертлужную впадину. Отбитую верхушку большого вертела с прикрепляющимися к нему мышцами низводят по Во Лами и подшивают к бедренной кости в верхней трети. Фиксация верхушки большого вертела должна быть тщательной и надежной с учетом физиологического натяжения мышц.
Операцию заканчивают послойным зашиванием раны и наложением кокситной гипсовой повязки.
Основоположником аллопластического восстановления тазобедренных суставов является К.М. Сиваш (1967). Методика аллопластики тазобедренного сустава по К.М. Сивашу следующая: положение больного на операционном столе на боку. Разрез кожи продольный длиной 18–20 см через середину большого вертела. Проксимальный и дистальный концы разреза должны находиться на одинаковом расстоянии от верхушки большого вертела. Рассекают кожу, подкожную клетчатку, широкую фасцию. Костную пластинку отбивают с наружной широкой мышцей бедра и оттягивают крючком книзу. Большой вертел с прикрепляющимися мышцами отбивают и оттягивают кверху. По возможности иссекают в пределах операционного поля капсулу сустава, с помощью распатора выделяют из мягких тканей проксимальный конец бедренной кости и перепиливают ее на уровне нижнего края малого вертела. Дистальный отломок отводят в сторону, а шейку с наружной частью головки иссекают желобоватым долотом. Оставшуюся в вертлужной впадине большую часть головки бедренной кости удаляют при помощи грибовидных электрофрез диаметром 30–40 мм. После удаления губчатого вещества головки бедренной кости образовавшуюся впадину обрабатывают ручной грибовидной фрезой, диаметр которой на 3 мм меньше диаметра гнезда протеза вертлужной впадины. Наружная конфигурация ручной фрезы соответствует наружной конфигурации гнезда протеза, а разница в диаметре на 3 мм необходима для получения прочного крепления гнезда протеза со стенками вертлужной впадины. Обработанную вертлужную впадину тампонируют с целью гемостаза и обрабатывают поверхность дистального конца бедренной кости коническими фрезами, имеющими конфигурацию, аналогичную конфигурации штифта протеза. Затем штифт протеза вбивают в костномозговой канал. В тех случаях, когда костномозговой канал оказывается широким, в просвет вбивают костные клинья из резецированной кости. В тех случаях, когда он узкий, его расширяют фрезами, которые по своему диаметру должны соответствовать диаметру штифта протеза.
Далее удаляют из вертлужной впадины тампон, гнездо протеза погружают в нее при помощи воротков. Производят проверку подвижности в протезированном суставе. Большой вертел с помощью шпонки фиксируют к наружной части протеза так, чтобы внутренняя поверхность его плотно соприкасалась с бедренной костью. Отсеченную наружную головку четырехглавой мышцы бедра подшивают к большому вертелу, рану послойно зашивают наглухо. Иммобилизацию автор рекомендует проводить с помощью гипсовой шины.
Эндопротезирование тазобедренного сустава. Положение больного — полубоком. Внешним продольным доступом в вертельной области бедра рассекают кожу, подкожную жировую клетчатку, широкую фасцию бедра. Проводят гемостаз. По внешнему межмыщелковому промежутку выделяют латеральную широкую мышцу бедра вместе с передней и малой ягодичными мышцами и отделяют, не повреждая надкостницу, от бедренной кости кпереди. После чего выделяют передневерхнюю часть капсулы тазобедренного сустава, которую Т образно рассекают и головку бедренной кости вывихивают в рану. После чего проводят остеотомию шейки на 15 мм проксимальнее от малого вертела, согласно шаблону. С помощью долот удаляют головку и шейку бедренной кости, а с помощью фрез и долот — хрящевой покров из вертлужной впадины, и подгоняют ее соответственно впадине протеза. Устанавливают впадину протеза. С помощью сверла и рашпиля подгоняют костно мозговой канал бедренной кости соответственно ножке протеза. Последнюю устанавливают так, чтобы она прочно располагалась в костно мозговом канале. Головку протеза вправляют в вертлужную впадину, проверяют пассивный объем движений во всех плоскостях, устанавливают вакуумный дренаж и рану ушивают послойно. При наличии приводящей контрактуры обязательно проводят миотомию аддукторов.
Артропластика коленного сустава. Артропластику коленного сустава, как правило, выполняют под наркозом. Используют доступ Пайра или латеральный парапателлярный, который согласно топографическим и экспериментальным исследованиям Н.А. Воробьева и М.К. Панченко (1964), наиболее щадящий по отношению к нервам коленного сустава и обеспечивает хирургу широкое поле деятельности.
После разреза кожи и подкожной клетчатки рассекают капсулу сустава, которая у больных в III стадии заболевания обычно бывает утолщенной, рубцово перерожденной и спаянной с подлежащей костной тканью. Далее с помощью распатора отделяют ее вместе с периартикулярными тканями от суставных концов и долотом отбивают анкилозированный надколенник. Из за потери эластичности тканей сместить надколенник медиально не удается, поэтому мы рекомендуем в зависимости от толщины собственной связки надколенника рассечь ее Z образно в сагиттальной или во фронтальной плоскости и без насилия отодвинуть надколенник проксимально или кнутри. Остро и тупо выделяют из мягких тканей область костного анкилоза бедренной и большеберцовой костей.
Так как в большинстве случаев кроме восстановления подвижности в суставе приходится устранять порочную сгибательную установку голени, то из области анкилоза выпиливают клин и удаляют. Это позволяет сразу же устранить порочную сгибательную установку голени и приступить к формированию суставных концов.
Из за выраженного остеопороза и наличия в эпифизах полостей создать форму, приближающуюся к нормальной, практически невозможно. Поэтому дистальному суставному концу бедренной кости придают овальные очертания в виде опрокинутого цилиндра, а проксимальному концу большеберцовой кости — соответственно вогнутую форму.
Сморщенную и рубцово измененную капсулу сустава тщательно иссекают по задней поверхности и проверяют величину диастаза между суставными концами, объем пассивных движений и степень коррекции деформации. Полости в суставных концах после шлифовки и подгонки туго тампонируют иссеченной спонгиозной тканью.
При артропластических операциях на коленных суставах необходимо добиться полного свободного разгибания и сгибания голени до острого угла с наличием диастаза между суставными концами не менее 2 см. Такой диастаз позволяет избежать разболтанности и тугоподвижности в коленном суставе. После проверки объема пассивных движений оба суставных конца вывихивают в рану и целиком перекрывают консервированной оболочкой семенника быка. Прокладки фиксируют к мягким тканям кетгутовыми узловатыми швами. Формируют и шлифуют суставную поверхность надколенника и также перекрывают оболочкой с фиксацией ее кетгутовыми швами к мягким тканям. Таким образом, отдельно перекрывают суставной конец бедренной, большеберцовой кости и суставную поверхность надколенника. Суставные концы сопоставляют, надколенник укладывают на свое место и шелковыми нитками сшивают собственную связку. На капсулу сустава накладывают кетгутовые швы с тщательным перекрытием суставных концов. Рану послойно зашивают наглухо. Иммобилизацию осуществляют кокситной гипсовой повязкой. В случае угрозы заднего подвывиха в послеоперационный период применяют скелетное вытяжение.
Артропластика голеностопного сустава. Операцию выполняют под наркозом. Отдают предпочтение боковым доступам, так как передние не позволяют хирургу манипулировать в заднем отделе голеностопного сустава, что ухудшает исход операции. Доступ Кохера, по нашему мнению, наиболее удобен, он открывает хороший подход ко всем отделам голеностопного сустава и позволяет под визуальным контролем тщательно моделировать суставные концы и иссечь капсулу сустава по задней поверхности.
После рассечения кожи, подкожной клетчатки мобилизуют сухожилия пронаторов и рассекают мягкие ткани до кости. С помощью распатора весь массив мягких тканей с капсулой сустава отделяют от кости и открывают место костного анкилоза суставных концов.
Далее костное сращение с помощью долота разъединяют, таранную кость вывихивают в рану и придают ей форму опрокинутого цилиндра. Затем соответственно моделируют дистальный суставной конец костей голени.
Для предупреждения перелома внутренней лодыжки при вывихе таранной кости в рану рекомендуем над ней сделать дополнительный разрез кожи и долотом разъединить анкилоз между лодыжкой и таранной костью. Сформированные суставные концы зашлифовывают рашпилем.
Проверяют объем пассивных движений в голеностопном суставе.
Следует добиваться свободной тыльной флексии до 20°, подошвенной флексии — до 30° и диастаза между суставными концами в 1,5 см. В тех случаях, когда после формирования сустава лодыжки оказываются длинными, их укорачивают. Суставной конец голени перекрывают консервированной оболочкой семенника быка, которую фиксируют к мягким тканям кетгутовыми швами. Проводят тщательный гемостаз. Сухожилия пронаторов укладывают на свое место, рану послойно зашивают с установкой стопы под углом 90°.
Как уже указывалось, при РА в III стадии наиболее показана артропластика. Однако в практической работе нередко приходится встречаться с такими порочными установками, когда технически провести ее невозможно. Это особенно относится к коленному суставу, в котором нередко выявляют порочные сгибательные установки под прямым или даже острым углом. Кроме этого, приходится сталкиваться с тяжелыми трофическими нарушениями кожных покровов, мышц, сумочно-связочного аппарата, костной системы и т.д. Соединительная ткань у таких больных значительно утрачивает свою эластичность вследствие общего коллагеноза. Сгибательные установки развиваются постепенно, длительно, годами, нередко в период роста организма. Поэтому даже незначительные насильственные расправления голени ведут к перерастяжению сосудисто нервного пучка, что, в свою очередь, приводит к параличам, надрыву интимы сосудов и угрожает возникновением тромбоза и гангрены дистального отдела конечности. В этих случаях решается вопрос о применении других видов операции.
Существующие методики хирургического устранения порочных установок в коленном суставе под углом менее 120° можно разделить на три группы, и в этом плане определять возможность и эффективность их применения при РА. Первая группа методик — это клиновидные резекции коленного сустава с последующим расправлением голени при помощи этапных гипсовых повязок или закруток Момзена. Вторая группа — клиновидные резекции с последующим применением скелетного вытяжения. Третья группа — остеопластические операции на коленном суставе.
Клиновидная резекция коленного сустава при анкилозах с последующим применением этапных гипсовых повязок для коррекции деформации широко применяется в восстановительной хирургии. Однако для исправления порочных сгибательных установок в коленном суставе у больных с РА применять ее весьма рискованно. Каждый этап сопряжен с большим или меньшим насильственным расправлением, вызывающим, как правило, перерастяжение сосудисто нервного пучка. Кроме того, разные отделы конечности испытывают длительное чрезмерное давление, которое при значительных трофических нарушениях кожных покровов и при атрофии подкожной жировой клетчатки быстро ведет к образованию пролежней. Наличие фиброзных изменений в мягких тканях, особенно в периартикулярных, даже при тщательном проведении этапов в большинстве случаев обусловливают возникновение задних подвывихов, а нередко и вывихов голени.
Длительная иммобилизация после операции необходима для наступления анкилоза в функционально выгодном положении, создает условия для развития анкилозов или ригидности в смежных суставах.
Как показали клинические наблюдения, у большинства боль ных с РА в большей или меньшей степени угнетена гипофизарно-надпочечниковая система. Поэтому при всяком, даже небольшом, оперативном вмешательстве, а также при этапных манипуляциях возможно проявление одного из тяжелейших осложнений — острой надпочечниковой недостаточности. Поэтому хирург должен выбирать максимально щадящие методы лечения.
Наконец, учитывая, что у больных обычно имеются множественные порочные установки конечностей и им приходится переносить не одну-две операции, а целый комплекс вмешательств, врач обязан максимально щадить и без того угнетенную психику больного. Нередко после такого мучительного и длительного вмешательства, как резекция сустава с этапной коррекцией с возможными осложнениями со стороны сосудисто нервного пучка и кожных покровов, больной теряет веру в то, что он выдержит все необходимые операции и получит возможность самообслуживания.
Предложение заменять этапные гипсовые повязки закруткой Момзена облегчает положение мало. Эта методика не является щадящей по отношению к сосудисто нервному пучку, кожным покровам, не исключает опасности развития заднего вывиха и подвывиха голени, не уменьшает сроков иммобилизации смежных суставов и не предупреждает развития анкилозов.
Исходя из сказанного, считаем противопоказанным использовать указанные выше методики для лечения сгибательных порочных установок в коленном суставе с углом меньше 120°.
Поэтому этапные гипсовые повязки и закрутки заменены скелетным вытяжением. Такая замена действительно более щадящая по отношению к мягким тканям конечности. Что же касается сосудисто нервного пучка, то он испытывает перерастяжение и при скелетном вытяжении. Опасность таких тяжелых осложнений, как параличи, надрывы интимы магистральных сосудов с последующим тромбозом не исключена. Следующим недостатком методики является ограничение применения необходимых грузов из за резко выраженного остеопороза. Спица легко прорезает кость, пораженную остеопорозом с истонченным кортикальным слоем. Возможность развития заднего вывиха голени также велика. Для предупреждения его необходимо проводить вторую спицу. Однако и в этом случае спица может легко прорезать кость. В функциональном отношении данная методика на длительный срок приковывает больных к постели в вынужденном положении, что создает благоприятные условия для возникновения тугоподвижности в смежных суставах, гипотрофии мышц, пролежней.
Поэтому скелетное вытяжение не применяют для устранения порочных установок в коленном суставе под острым углом, а предпочтение отдают остеопластическим резекциям коленного сустава. Однако для исправления порочных сгибательных установок под прямым углом в коленном суставе у больных с РА не все остеопластические операции применимы. Например, многие рекомендуют технически простую операцию — метаплазию по Вредену. Необходимым условием является создание на проксимальном отломке шипа из кортикального слоя, а на передней поверхности дистального отломка — соответствующего углубления, щели. После коррекции деформации шип должен плотно входить в созданную щель, обеспечивая удержание хорошо сопоставленных отломков. Однако, значительные трофические нарушения в костной системе не позволяют создать необходимый шип, который прочно фиксировал бы после резекции фрагменты и удерживал их при коррекции деформации. Кроме того, ввиду значительно распространенного остеопороза и наличия полостей, создать необходимых размеров щель также невозможно. Следовательно, операция по Вредену не обеспечивает после исправления деформации хорошего удержания и адаптации сформированных фрагментов бедренной кости. Необходимо также отметить тот факт, что после исправления сгибательной установки в коленном суставе под острым углом дистальный фрагмент не меняет положения, значительно выступает кзади и создает неблагоприятные условия для сосудисто нервного пучка (давление).
Остеопластическая резекция по Дега также связана с образованием после резекции шипа на проксимальном конце большеберцовой кости и соответствующего углубления на дистальном эпифизе бедренной кости.
И здесь распространенный остеопороз препятствует созданию соответствующих остепластических компонентов.
Операция Дега и близкие к ней остеопластические резекции Луканова, Дюранте, М.И. Куслика не нашли широкого применения при порочных сгибательных установках в коленных суставах под прямым или острым углом у больных с РА.
Двойная резекция по Б.И. Берлинеру (1953) с иссечением двух прямоугольных треугольников на бедре и на голени наиболее приемлема в этом случае.
Однако операция имеет следующие отрицательные стороны. Во-первых, после иссечения из кости прямоугольных треугольников образуется большой промежуточный фрагмент, кровоснабжение которого значительно нарушено, а это ведет к замедлению консолидации и удлинению сроков иммобилизации. Кроме того, не исключена возможность несращения на одном из участков резекции. Во вторых, после двойной резекции прямоугольных треугольников и коррекции деформации в непосредственном контакте на значительном протяжении находятся эпифизарная и диафизарная части кости, то есть спонгиоз с кортикальным слоем, что также отрицательно сказывается на сроках консолидации и создает опасность несращения. В третьих, при выполнении этой операции наносится дополнительная травма мягким тканям бедра и голени.
В начале своих исследований мы применяли следующую методику. После клиновидной резекции анкилозированного коленного сустава производилась резекция диафиза бедренной кости в нижней трети в целях ее укорочения с последующим металлоостеосинтезом. Метод исключал опасность перерастяжения сосудисто нервного пучка, обеспечивал широкую площадь соприкосновения однородных костных структур (метафизов бедренной и большеберцовой костей), а металлоостеосинтез позволял рано включать в функцию смежные суставы оперированной конечности. Однако клинические наблюдения показали, что такая методика сопряжена с дополнительной травмой мягких тканей при выполнении резекции нижней трети бедра. Она создает неблагоприятные условия для кровоснабжения промежуточного фрагмента, не сокращает сроков консолидации и требует в дальнейшем удаления металлического фиксатора.
В 1961 г. нами была разработана реконструктивная остеопластическая резекция коленного сустава. Операцию проводят под наркозом. Разрез — на 5–6 см выше верхнего полюса надколенника, огибает с латеральной стороны надколенник и заканчивается ниже бугристости большеберцовой кости. Рассекают кожу, подкожную клетчатку, фасцию, рубцово измененную капсулу сустава, спаянную с костной тканью. Остро и тупо расширяют рану в верхнем углу, в промежутке между прямой и латеральной головками четырехглавой мышцы бедра. Края раны раздвигают крючками. С помощью распатора мягкие ткани отделяют от кости на участке костного анкилоза и эпиметафизов бедренной и большеберцовой кости. После этого листовой пилой производят клиновидную резекцию коленного сустава с таким расчетом, чтобы две трети клина исходили из эпифизов бедренной кости, а одна треть — из эпифиза большеберцовой кости. Клин обращен основанием кпереди. Затем иссекают рубцово сморщенную заднюю часть капсулы сустава и мобилизуют суставной конец большеберцовой кости. С помощью желобоватого долота в метафизе большеберцовой кости создают углубление на 3–4 см шириной не больше диаметра бедренной кости и соответственно этому углублению обрабатывают оставшийся после резекции дистальный метафиз бедренной кости. После окончания подгонки дистального конца бедренной кости устраняют сгибание голени с таким расчетом, чтобы дистальный конец бедренной кости вошел в созданное углубление. Иногда при анкилозах под острым углом приходится удлинять или рассекать сухожилия сгибателей голени. После устранения деформации рану послойно зашивают наглухо. Конечность иммобилизуется с помощью гонитной гипсовой повязки. Длительность иммобилизации не превышает 3 мес. В течение этого срока наступает консолидация.
Описанная методика резекции коленного сустава при анкилозах под углом 90° позволяет одномоментно исправить деформацию, избежать перерастяжения сосудисто нервного пучка, создать даже при значительном остеопорозе остеопластические компоненты, которые обеспечивают адаптацию отломков с широкой зоной соприкосновения однородных костных структур, исключают развитие задних подвывихов и вывихов голени, обеспечивают сколоченность фрагментов, что благоприятно сказывается на сроках консолидации.
Методика артродеза межфалангового сустава кисти. Кроме артродеза коленных суставов иногда приходится проводить артродез дистальных межфаланговых суставов II–V пальцев и межфалангового сустава І пальца. Показаниями к артродезу указанных суставов являются дискордантная деформация, подвывих, вывих. Проводить артродез необходимо только в функционально выгодном положении, то есть в положении сгибания под углом 155–165°.
Операцию производят под циркулярной анестезией. Разрез кожи, подкожной клетчатки, капсулы — по тыльной поверхности дистального межфалангового сустава. После рассечения мягких тканей выделяют суставные поверхности. Кусачками Листона или тонким прямым долотом удаляют остатки хряща, рубцовую ткань, костно хрящевые разрастания с суставных поверхностей и последние точно сопоставляют с учетом угла сгибания ногтевой фаланги. После контроля правильной припасовки суставные поверхности в функционально выгодном положении фиксируют металлической спицей, введенной со стороны ногтевой фаланги. Затем рану послойно зашивают наглухо. Иммобилизацию проводят с помощью гипсовой шины с циркулярными гипсовыми турами вокруг оперированных фаланг. Металлические спицы удаляют не ранее чем через 3 нед и осуществляют иммобилизацию гипсовыми повязками в течение 5–6 нед.
Нужно иметь в виду, что анкилозы дистальных межфаланговых суставов наступают не быстро и поэтому включение пальцев в функцию рекомендуем не раньше образования костного анкилоза, подтвержденного рентгенологически. При отсутствии костного анкилоза под действием функции пальца могут развиться вторичная деформация, подвывих или вывих ногтевой фаланги.
Восстановление функции конечностей приводило к явному улучшению трофики, периферического кровообращения, сосудистого тонуса и пр. После операции осцилляторный индекс показывал значительное улучшение сосудистого тонуса.
Нормализовалось ранее пониженное максимальное и минимальное АД. Восстановление функции даже одного сустава улучшало сосудистый тонус на противоположной, не оперированной конечности.
Об улучшении кровоснабжения в послеоперационный период свидетельствуют и данные капилляроскопии у больных в III стадии заболевания, получивших возможность после оперативного лечения передвигаться. Фон капилляров приобретал розоватый оттенок, во всех случаях исчезла его мутноватость. Контуры капилляров становились четкими, просвет их расширялся; возрастало и количество функционирующих капилляров. Ток крови был четким и беспрерывным. Не менялась лишь форма капилляров, что указывало на стойкие структурные изменения.
Хотя проницаемость сосудистой стенки в послеоперационный период не изменялась, однако с улучшением кровообращения и фагоцитарной реакции скорость рассасывания геморрагии значительно возрастала: до хирургического лечения она длилась 6–7 сут, а у больных, получивших возможность передвижения — 3–4 сут.
На основании клинико физиологических исследований в после операционный период можно сделать вывод, что изменения сосудистого тонуса у больных с РА в III стадии имеют в известной мере функциональный характер и частично обратимы при условии исправления порочных установок с последующим восстановлением активной мышечной и суставной функции ранее обездвиженной конечности.
С улучшением трофики оперированных конечностей повышалась температура (на 0,3–0,6°) как проксимальных, так и дистальных отделов; наряду с этим значительно уменьшались акроцианоз и зябкость дистальных отделов, хотя сохранялась асимметрия в смысле указанных тестов.
Улучшались данные электромиографических исследований при восстановлении функции конечностей.
В ранний послеоперационный период (через 1–2 мес) электрическая активность мышц даже снижалась по сравнению с дооперационным.
Снижение электрической активности мышц наблюдалось не только на оперированной конечности, но и на противоположной. Степень же уменьшения величины биопотенциалов на оперированной конечности была всегда больше. Такое снижение электрической активности мышц в ранний послеоперационный период можно объяснить реакцией нервно-мышечного аппарата на оперативное вмешательство, в основе которой лежит рефлекторный характер.
С 3 го месяца после операции электрическая активность мышц постепенно повышалась. Клинически в это время полностью исчезал или резко уменьшался болевой синдром, восстанавливались активные движения в оперированном суставе.
К 6 му месяцу после операции амплитуда движений в суставах становилась в основном стабильной, значительно восстанавливались сила и выносливость мышц, а их электрическая активность приближалась к норме.
Если исход операции был неблагоприятным и больные оставались малоподвижными, то выявляли крайне незначительное повышение биопотенциалов, а в ряде случаев — даже их снижение. Восстановление электрической активности мышц отмечали только при артропластических операциях, когда мышцам возвращалась их функция. В тех случаях, когда только исправлялось порочное положение конечности с помощью остеотомии или чаще артродезирующей резекции, восстановления биопотенциалов мышц не наблюдали.
Таким образом, можно заключить, что восстановительные артропластические операции у больных с РА позволяют не только возвратить функцию сустава, но улучшить или даже приблизить к нормальной функцию нервно мышечного аппарата. Следовательно, изменения нервно мышечного аппарата у этих больных в значительной степени обратимы. С восстановлением активных движений в суставах конечностей вовлекаются в работу соответствующие группы мышц и возобновляются утраченные ранее нервно рефлекторные связи.
Иллюстрацией может послужить следующая краткая выписка из историй болезни.
Больная Ю., 22 лет, инвалид I группы, поступила в клинику Киевского научно-исследовательского института ортопедии 15/IV/1965 г. Заболела в возрасте 10 лет. Заболевание началось постепенно с боли в коленных суставах, затем присоединилась боль в других суставах верхних и нижних конечностей. Лечилась в основном тепловыми процедурами, компрессами. Процесс медленно прогрессировал. Через 2 года установлен диагноз туберкулезного поражения суставов, по поводу чего лечилась несколько месяцев в районной больнице, а затем около года в санатории для больных с костно суставным туберкулезом.
После выписки из санатория отмечалось временное улучшение, но затем постепенно развились контрактуры верхних и нижних конечностей, в результате чего с 1960 г. лишилась возможности самостоятельно передвигаться. С 1963 г. находится в доме инвалидов.
При поступлении в клинику общее состояние удовлетворительное. Рост ниже среднего, кожа и слизистые нормальной окраски. Подкожная жировая клетчатка развита умеренно. Мышцы верхних и нижних конечностей дряблые, атрофичные. Границы сердца в пределах нормы, ясно прослушиваются оба тона. В легких везикулярное дыхание, хрипов нет. Живот мягкий, безболезненный при пальпации, печень и селезенка не увеличены.
Положение больной вынужденное: может только лежать, садится с посторонней помощью. Ходить самостоятельно, принимать пищу и обслуживать себя не может из за множественных дискордантных контрактур и анкилозов в суставах верхних и нижних конечностей. Движения позвоночника во всех отделах несколько ограничены, физиологические искривления сглажены. В плечевых суставах значительное ограничение движений во всех направлениях, подвижность возможна только за счет лопаток. В правом локтевом суставе анкилоз под углом 160° в среднем положении между пронацией и супинацией, в левом — под углом 130° в положении незначительной пронации. В обоих лучезапястных суставах имеются контрактуры в установке легкой ладонной флексии. Кисти деформированы. Движения в пястно-фаланговых и межфаланговых суставах ограничены. Большие пальцы обеих кистей, особенно левой, приведены. Хватательная функция кистей сохранена. В обоих тазобедренных суставах сгибательные контрактуры: справа — движения от 145 до 100°, слева — от 135 до 115°. Оба коленных сустава деформированы, справа движения от 110 до 80°, слева — от 120 до 90°. Установка обоих стоп под прямым углом; справа возможна подошвенная флексия до угла 110°, слева — до угла 130°. Диагноз: РА, III стадия, дискордантные установки верхних и нижних конечностей.
После тщательного клинического обследования был намечен план оперативного лечения, в котором предусматривалось в первую очередь восстановление движений в локтевых суставах, чтобы больная получила возможность самостоятельно обслуживать себя, а также в последующем пользоваться костылями. Во вторую очередь намечалось устранение сгибательных контрактур и восстановление движений в коленных суставах, после чего больная смогла бы самостоятельно ходить, несмотря на сгибательные контрактуры в тазобедренных суставах. В период между операциями предусматривалась выписка больной из стационара для общеукрепляющего лечения.
4/V/1965 г. проведена артропластика правого локтевого сустава с прокладкой консервированной влагалищной оболочкой семенника быка. Через 2,5 мес после операции выписана из клиники с объемом движений по дуге от 160 до 80°. Больная получила возможность самостоятельно принимать пищу.
Поступила повторно 20/ХII/1965 г., а 24/ХII/1965 г. проведена артропластика левого локтевого сустава с такой же прокладкой, как и при первой операции. Выписана из клиники через 2 мес после операции с объемом движений в левом локтевом суставе по дуге от 160 до 80°. После восстановления движений в левом локтевом суставе функциональные возможности больной значительно увеличились: получила возможность самостоятельно одеваться, умываться, причесываться.
В связи с аппендэктомией в феврале 1966 г. реконструктивно-восстановительные операции на нижних конечностях были отсрочены, и в третий раз больная поступила в клинику 30/I/1967 г. 3/III/1967 г. проведена артропластика правого коленного сустава с прокладкой консервированной влагалищной оболочкой семенника быка. Выписана через 1,5 мес после операции с объемом пассивных движений по дуге от 180 до 100°. В четвертый раз поступила для оперативного лечения 23/XI/1967 г. В это время уже могла передвигаться с помощью костылей, нагружая в основном правую (оперированную) ногу. Левую ногу нагружала частично, осуществляя опору только на передний отдел стопы, из за сгибательной контрактуры в коленном суставе. 4/I/1968 г. проведена артропластика левого коленного сустава с такой же прокладкой. Выписана через 1,5 мес с объемом пассивных движений по дуге от 180 до 90°.
Контрольный осмотр произведен 1/II/1969 г. Общее состояние хорошее. Боли в суставах нет. Ходит с костылями, одинаково нагружая обе нижние конечности, ходьба безболезненная. По комнате ходит без костылей, самостоятельно себя обслуживает. В обоих локтевых суставах активные движения по дуге от 160 до 65°, пронация и супинация несколько ограничены, активное разгибание полное, справа сгибание до угла 90°, слева — до 80° при наличии незначительной боковой подвижности. Итак, почти полностью обездвиженная больная в результате четырех операций избавлена от необходимости постоянного постороннего ухода и после 8 лет пребывания в постели получила возможность самостоятельно ходить.
Больной Г., 26 лет, поступил в клинику Киевского научно-исследовательского института ортопедии 26/IX/1964 г. по поводу РА, III стадия с дискордантными деформациями нижних конечностей. Больным считает себя с 12 лет, когда появилась боль в суставах нижних конечностей, особенно в коленных. Боль периодически обострялась, постепенно развивались контрактуры и ограничение движений в тазобедренных, коленных и голеностопных суставах. Периодически получал консервативное лечение в различных стационарах и на курортах (ацетилсалициловая кислота, фенилбутазон, салицилаты, витамины, грязелечение, ванны, ЛФК, массаж). Несмотря на это в результате прогрессирования деформаций и развившихся анкилозов суставов нижних конечностей в порочном положении с 1954 г. потерял возможность передвигаться.
Объективно: вынужденное положение больного — может лежать только на спине, сидит с трудом при посторонней поддержке, стоять и ходить совершенно не может. Кожные покровы и видимые слизистые бледные, питание снижено. Пульс 80 уд./мин, ритмичный, удовлетворительного наполнения. АД 105/70 мм рт. ст. Границы сердца расширены влево на 0,5 см, тоны слегка приглушены, систолический шум на верхушке. Экскурсия легких удовлетворительная, дыхание везикулярное, хрипов нет. Печень и селезенка не увеличены. Сопутствующие заболевания — мочекаменная болезнь, холецистит. Отсутствие движений позвоночника в поясничном отделе. Незначительное ограничение движений в плечевых суставах. В локтевых, лучезапястных и суставах обеих кистей движения в полном объеме. Выраженная гипотрофия мышц нижних конечностей, обе нижние конечности в дискордантной установке. В правом тазобедренном суставе анкилоз под углом сгибания 120° и приведения — 15°, в левом — под углом сгибания 110° и отведения 5° с небольшой наружной ротацией бедер. Оба коленных сустава анкилозированы: справа — под углом 100°, слева — под углом 110° с наружной ротацией голеней. Движений в голеностопных и шопаровых суставах нет; эквинусная установка справа — 115°, слева — 110°. Выраженное продольное и поперечное плоскостопие, молоточкообразные пальцы. Рентгенологически определяются костные анкилозы в тазобедренных, коленных, голеностопных и шопаровых суставах, остеопороз, истончение кортикального слоя длинных трубчатых костей нижних конечностей, грубобалочная структура метафизов.
После клинического обследования 27/Х/1964 г. произведена остеопластическая резекция правого коленного сустава. Послеоперационное течение без осложнений. Через 3 мес отмечали полную консолидацию на месте резекции. 9/II/1965 г. выполнена вторая операция — артропластика правого тазобедренного сустава с прокладкой консервированной влагалищной оболочкой семенника быка. Пассивная разработка движений в суставе начата на 12 й день после операции. Выписан из клиники 9/VI/1965 г. В правом коленном суставе анкилоз в положении полного разгибания, в тазобедренном суставе движения по дуге от 180 до 120°, безболезненные.
Повторно поступил в клинику 20/IX/1965 г. После клинического обследования 1/Х/1965 г. произведена остеопластическая резекция левого коленного сустава. Послеоперационное течение без осложнений. Сращение наступило в положении полного разгибания через 3 мес. После курса общеукрепляющей терапии 17/V/1966 г. сделана артропластика левого тазобедренного сустава по той же методике. Разработка движений начата на 12 й день. Выписан из клиники 21/VII/1966 г. Сгибание в правом тазобедренном суставе возможно до 120°, в левом — до 110° (при наличии полного разгибания). Спустя полгода после последней операции после курса лечебной гимнастики и массажа больной начал ходить с помощью костылей, нагружая обе нижние конечности. В дальнейшем продолжал ходить, однако периодически находился в стационаре по поводу обострения мочекаменной болезни и холецистита.
Поступил для клинического обследования в институт 19/VII/1968 г. Общее состояние вполне удовлетворительное. Ходит в обычной домашней обуви, с небольшими прокладками под пятки с помощью двух костылей. Одинаково нагружает обе нижние конечности, осуществляя шаг за счет активных движений в тазобедренных суставах. Амплитуда движений в них не уменьшилась.
Таким образом, с помощью реконструктивно-восстановительных операций после длительного 12 летнего вынужденного положения в постели, требующего постоянного ухода и обслуживания, больной приобрел способность самостоятельно передвигаться и обслуживать себя.
Осложнения и ошибки
При хирургическом лечении возможны общие и местные осложнения. К первым относятся острая надпочечниковая недостаточность, сердечно сосудистая недостаточность, реактивный психоз; ко вторым — некроз мягких тканей, нагноение операционной раны, подвывихи после реконструктивно-восстановительных операций, невриты и несращение на месте остеопластических резекций.
Острая надпочечниковая недостаточность — одно из наиболее тяжелых осложнений, обусловлена, с одной стороны, хроническим рецидивирующим течением PA, а с другой — продолжительным лечением гормональными препаратами (кортизон, гидрокортизон, преднизолон и др.). Именно это осложнение стало причиной ошибочного суждения, что больным с РА ввиду высокой реактивности организма оперативное лечение противопоказано. Однако в настоящее время знание патогенеза данного осложнения, способов профилактики и средств лечения позволяет свести это осложнение к минимуму.
Надпочечниковая недостаточность может развиваться как во время операции, так и в послеоперационный период; как при операциях на тазобедренном суставе, так и при небольших хирургических вмешательствах под местным обезболиванием.
Хронический аутоиммунный процесс и длительный прием гормональных препаратов приводят к недостаточной функции коры надпочечников вследствие ее нарастающей атрофии. Вне состояния стресса клинически надпочечниковая недостаточность ничем себя не проявляет, но во время операции потребность организма в гормонах значительно возрастает и развиваются дефицит ГКС и гипотензия, не поддающаяся терапии тонизирующими средствами. Только введение ГКС внутривенно может нормализовать гемодинамику и улучшить общее состояние больного.
Вторым тяжелым осложнением в послеоперационный период является сердечно сосудистая недостаточность. Предупреждение ее возможно при условии правильной оценки патофизиологических сдвигов в сердечно сосудистой системе в предоперационный период и соответствующей рациональной общеукрепляющей и медикаментозной подготовке больного.
У оперируемых по поводу РА может возникнуть реактивный психоз как в послеоперационный период, так и в интервалах между операциями. Видимо, возникновение его связано с поражением ЦНС. А.Г. Иванов-Смоленский (1952) показал, что инфекционная интоксикация в первую очередь поражает сравнительно молодые в эволюционном отношении процессы внутреннего торможения. М.Г. Астапенко в работе о состоянии нервной системы у больных с РА (1962) убедительно подтвердила наличие нарушений внутреннего торможения. Кроме снижения силы тормозного и раздражительного процессов, она отмечала расстройство равновесия в сторону преобладания раздражительных реакций. Страх перед операцией, боль в суставах, сомнения в исходе могут стать толчком к развитию реактивного психоза.
Некроз мягких тканей — один из наиболее частых местных осложнений.
Причина его лежит в недостаточной предоперационной подготовке мягких тканей в области предполагаемого вмешательства, неанатомичность, грубость хирургического вмешательства и погрешности в гипсовой технике. Клинические наблюдения убедительно показывают, что при выполнении всех мероприятий в предоперационный период (массаж, физиотерапевтические методы, ЛФК), использовании анатомически обоснованных доступов и соблюдении правил наложения гипсовых повязок количество этих осложнений можно свести к минимуму.
Нагноения операционной раны обусловлены в основном погрешностями соблюдения асептики как во время операции, так и в послеоперационный период, вторичным попаданием инфекции при расхождении швов или при возникновении некроза мягких тканей. Соблюдение правил асептики позволяет предупредить возникновение этого осложнения.
Причиной подвывихов чаще всего бывают технические погрешности и ошибки во время операции и в послеоперационный период.
В основном подвывихи отмечают после артропластики коленного, локтевого и межфалангового суставов, реже — после артропластики тазобедренного и голеностопного.
Причинами подвывиха голени кзади при артропластике коленного сустава являются: формирование несоответствующих суставных поверхностей, особенно при обширной резекции одного из суставных концов; неиссечение рубцово измененной, рубцово сморщенной капсулы сустава по задней поверхности; невыделение из рубцов суставного конца большеберцовой кости; ведение больных без скелетного вытяжения; наличие сгибательной контрактуры в тазобедренном суставе|.
Подвывихи предплечья при артропластике локтевого сустава возникают в основном из за неправильного формирования суставных концов, а именно формирования очень низких одного или обоих бортиков «катушки» на суставном конце плечевой кости, несоответствия суставной поверхности плеча и локтевой кости, чрезмерной резекции венечного отростка локтевой кости или головки лучевой кости.
Подвывихи и вывихи при артропластике межфаланговых и пястно-фаланговых суставов возникают вследствие несоответствия суставных поверхностей, неиссечения рубцово сморщенной капсулы сустава по ладонной поверхности сустава и неустранения смещенных сухожилий разгибателей.
В тазобедренном суставе подвывихи могут наступить вследствие кратковременной иммобилизации при одномоментных устранениях сгибательно приводящих контрактур бедра, при мелких вертлужных впадинах, неудаленных костных разрастаниях в нижнем полюсе вертлужной впадины, которые выталкивают головку бедра при приведении.
В голеностопном суставе подвывихи возникают при несоответствии суставных поверхностей короткой внутренней лодыжке.
Причинами несращения при корригирующих резекциях суставов являются чрезмерная резекция суставных концов и кратковременность иммобилизации. Так при исправлении порочных положений в коленных суставах под острым углом резецируют один из эпифизов, при этом после исправления контрактуры соприкасается слишком узкая часть нижнего отрезка диафиза бедренной кости с широким губчатым концом большеберцовой кости, что способствует вывиху или подвывиху голени.
Послеоперационные невриты чаще всего выявляют после операций на локтевом и коленном суставах. После артропластики локтевого сустава возникает неврит локтевого нерва вследствие грубых манипуляций во время выделения нерва. Реже наблюдаются поздние невриты, которые возникают вследствие травмирования нерва при разработке движений в локтевом суставе из за недостаточного перекрытия его в новом месте мягкими тканями или вследствие ишемии, обусловленной повреждением сопровождающих сосудов при выделении нерва во время операции.
Послеоперационный неврит малоберцового нерва возникает при повреждениях его во время операции или же при сдавлении гипсовой повязкой. Кроме того, он развивается при насильственном одномоментном устранении порочных установок в коленном суставе под острым углом. Совершенствование деталей операции и бережное обращение с нервами во время хирургического вмешательства устраняют возможность этого осложнения.
При хирургическом лечении больных с III стадией заболевания правильная оценка патофизиологических сдвигов в организме больных, рациональная предоперационная подготовка, квалифицированное проведение вмешательства и соблюдение всех необходимых правил ведения больных в послеоперационный период обеспечивают сведение к минимуму возможных общих и местных осложнений.
Следует остановиться на некоторых тактических и технических ошибках.
Тактические ошибки являются следствием неправильной оценки патофизиологических сдвигов в организме больного, неудачного построения плана хирургического вмешательства, необоснованного сокращения интервалов между операциями (особенно артропластическими), применения неэффективных прокладок, проведения хирургического лечения в отрыве от комплексной противорецидивной терапии и, наконец, ошибочного определения сроков иммобилизации, начала лечебной физической культуры.
У больных с сильным типом высшей нервной деятельности исходы хирургического лечения, как правило, бывают хорошими. Это обеспечивается настойчивостью и высокой работоспособностью пациента, желанием и умением трудиться длительное время, не снижая темпов и качества работы. Для больных со слабым типом характерны пассивность, пониженная и ограниченная работоспособность, иногда чрезмерная сонливость. У этих больных, даже после исправления порочных установок и восстановления амплитуды движений в суставах, очень трудно происходит перестройка сложившегося стереотипа. Некоторые из них остаются малоподвижными, хотя технически восстановительные операции выполнены правильно и результат их хороший.
Тактической ошибкой является неправильное составление плана оперативного вмешательства. Совершенно ясно, что при дискордантных деформациях верхних и нижних конечностей не следует начинать оперативное лечение с нижних конечностей, поскольку больной не может не только пользоваться костылями, но даже обслужить себя.
Применение для исправления порочных установок нижних конечностей только резекции суставов и остеотомии не улучшает функционального состояния больных, а лишь превращает дискордантные деформации в конкордантные, однако больной по прежнему остается прикованным к постели.
Безусловной тактической ошибкой следует признать необоснованное сокращение интервалов между артропластическими операциями вообще и на смежных суставах в частности. Опыт показал, что без стабильного восстановления функции одного оперированного сустава нельзя производить операции на других. Больной не в состоянии сосредоточить внимание и распределить силы для одновременной разработки двух трех суставов. А если к тому же послеоперационный период проходил с некоторыми осложнениями, то все это вместе взятое влечет за собой потерю функции оперированных суставов.
Тактическими ошибками являются применение при артропластике у больных с РА прокладок из аутотканей (фасция, жировая клетчатка, мышца и т.п.), а также химическая или термическая обработка суставных концов. Аутопрокладки содержат пораженную коллагенозом соединительнотканную строму, что способствует развитию рецидива анкилоза. Кроме того, у всех больных, которым во время артропластики тазобедренного сустава применяли аутопрокладки, рецидивы анкилоза наступали, как правило, в течение года после операции.
Хирургическое лечение не должно проводиться вне комплекса противорецидивной терапии РА, характеризующегося хроническим рецидивирующим течением. Следовательно, борьба с рецидивами — это борьба за хороший исход хирургического лечения.
Необходимым условием успешного лечения является активный диспансерный учет больных и проведение периодических курсов противорецидивного лечения: НПВП, ацетилсалициловая кислота 1 г в сутки на протяжении 6–18 мес, инъекции стекловидного тела 2 мл в течение 30 дней (2–3 курса в год) и витамин B12 100–200 мкг, посегментное облучение кварцем в осеннее, зимнее и весеннее время; систематическая ЛФК и применение радоновых ванн (Цхалтубо, Мироновка, Хмельник, Белая Церковь).
Тактической ошибкой является длительное применение иммобилизации после артропластических операций. Опыт показывает, что длительная иммобилизация как оперированного, так и смежных суставов у больных с РА быстро ведет к развитию тугоподвижности, ригидности и контрактурам, которые трудно поддаются действию ЛФК и ухудшают функциональные исходы хирургического лечения.
Технические ошибки обусловлены погрешностями хирургического вмешательства. Это прежде всего создание недостаточного диастаза между суставными поверхностями при артропластике, что ведет к тугоподвижности суставов; чрезмерная резекция суставных концов, обусловливающая разболтанность суставов; неполное перекрытие суставных поверхностей биологическими прокладками или смещение их вследствие плохой фиксации, что создает благоприятные условия для возникновения в последующем рецидива анкилоза, формирование инконгруэнтных суставных поверхностей.
Таким образом, при РА должен быть индивидуальный подход к больному с учетом патофизиологических сдвигов в организме, стадии заболевания и патоморфологических изменений опорно-двигательного аппарата. Кроме того, должен быть составлен индивидуальный план последовательности и выбора характера реконструктивно-восстановительных операций, который следует проводить в перманентном комплексном лечении. Все это сведет к минимуму количество ошибок и осложнений и позволит не только сохранить работоспособность больных, но и вернуть к активной жизни считавшихся ранее безнадежными инвалидов.