Лечение при остеоартрозе по-прежнему представляет серьезную проблему несмотря на то, что перечень применяемых препаратов в последнее время значительно пополнился. Прежде всего это связано с тем, что большинство лекарственных средств, применяемых при ОА, оказывают лишь симптоматическое действие. Ранее не была доказана способность какого-либо препарата изменять течение этого заболевания у человека in vivo (Bland J.H., Cooper S.M., 1984; Altman R.D. et al., 1996; Brandt K.D., 2000), что во многом было связано с ограниченными возможностями биохимических и инструментальных методов доказать свойство лекарственных препаратов «модифицировать болезнь», хотя отдельными исследователями (Bland J.H., Cooper S.M., 1984) такая возможность была продемонстрирована для некоторых биомеханических и фармакотерапевтических методов.
В последние годы появился новый класс лекарственных средств, обладающих свойствами модификации структуры суставного хряща. В 2003 г. Европейская антиревматическая лига (EULAR) предложила новые рекомендации по лечению при ОА коленных суставов, а в 2004 г. — тазобедренных суставов, в которых впервые указано модифицирующее действие на суставный хрящ таких лекарственных средств, как глюкозамин и хондроитин (EULAR 2003); хондроитин (EULAR, 2005).
Среди задач лечения при ОА можно выделить следующие: уменьшение выраженности симптомов болезни; улучшение функциональной активности; замедление прогрессирования ОА.
Для выполнения этих задач существуют немедикаментозные и медикаментозные методы лечения. К ним относятся: обучение пациента и социальная поддержка; уменьшение избыточной массы тела; лечебная физкультура; физиотерапия; использование вспомогательных приспособлений, облегчающих передвижение; другие методы реабилитации; нетрадиционные методы лечения (акупунктура, гомеопатия и др.); системная фармакотерапия; местная фармакотерапия (аппликационная, внутрисуставное введение лекарств), а также хирургическое лечение.
Немедикаментозное лечение/реабилитация
Алгоритм лечения больных с ОА имеет свои особенности. Если при подавляющем большинстве болезней, в том числе и неревматических, этапу реабилитации предшествует амбулаторное или стационарное лечение, то при ОА алгоритм выглядит иначе: реабилитация — амбулаторное (реже — стационарное) лечение — реабилитация. Использование фармакотерапии у больных с ОА рекомендуется только при неэффективности реабилитационных мероприятий.
Обучение и социальная поддержка. Методы обучения пациентов с ОА не отличаются от таковых при других заболеваниях. С этой целью обычно издают специальные методические пособия для пациентов, готовят видеоматериалы. В популярном изложении пациенты получают информацию о строении и функции суставов, о сущности болезни, современных и перспективных методах лечения и профилактики. Эти материалы, ориентированные не только на самого больного, но и на его близких, можно распространять индивидуально (лечащие врачи, работники социальных служб), а также в группах взаимопомощи, которые обычно создают при крупных специализированных клиниках. Программы обучения больных, например «Курс самопомощи при артритах», способствуют тому, что у больных уменьшается боль в суставах, поддерживается функция пораженных суставов, сокращается число визитов к врачу, улучшается качество жизни (Lorig K.R. et al., 1985; 1993; Hawley D.J., 1995). Сравнительный метаанализ контролированных исследований эффективности обучающих программ и результатов плацебо-контролированных исследований эффективности НПВП показал, что первые лишь незначительно уступают вторым по влиянию на болевой синдром при ОА (Superio-Cabuslay E. et al., 1996). Привлечение супругов повышает эффективность работы с пациентами (Keefe F.J. et al., 1996). J. Goeppinger и соавторы (1995) отметили, что распространенные по почте программы самопомощи помогли больным — уменьшилась боль в суставах, исчезли ощущение беспомощности, депрессия.
Важной частью работы в рамках обучающих программ является создание у пациентов позитивного оптимистичного отношения к своему заболеванию в связи с тем, что в сознании большинства пациентов болезни суставов ассоциируются с неизбежностью утраты трудоспособности и инвалидной коляской.
Артрологический клуб, организованный при Украинском ревматологическом центре, является примером программы обучения и социальной поддержки пациентов. Несмотря на то, что деятельность клуба ориентирована на общий контингент больных ревматологического профиля, большую часть посещающих заседания составляют пациенты с заболеваниями суставов, в частности ОА. На ежемесячных встречах участников клуба с лекциями выступают ревматологи, методисты по лечебной физкультуре, физиотерапевты, врачи смежных специальностей (ортопеды и др.). В выступлениях делается акцент на простых способах самопомощи, которыми больные могут пользоваться в домашних условиях. Для распространения среди участников клуба готовятся методические пособия по лечебной физкультуре, памятки больным с ОА (см. приложение).
Известно, что при избыточной массе тела отмечается более высокий риск прогрессирования ОА, чем при нормальной массе (Dougados M. et al., 1992; Schouten J.S. et al., 1992). Уменьшение массы тела на 5 кг у женщин ассоциируется со снижением риска развития ОА коленных суставов на 50% (Felson D.T. et al., 1992). Уменьшение массы тела у тучных больных с ОА крупных суставов нижних конечностей является неотъемлемой частью в настоящее время общепризнанной программы немедикаментозного лечения. Результаты небольшого клинического исследования (Williams R.A., Foulsham B.M., 1981) относительно эффективности анорексигенных препаратов у больных с ОА коленных и тазобедренных суставов подтвердили, что уменьшение массы тела в среднем на 3–6 кг коррелирует с уменьшением выраженности симптомов патологии коленного сустава, в меньшей степени — тазобедренного сустава.
Больным с ОА рекомендуется диетическое питание. Необходимо исключить животные жиры, легкоусваиваемые углеводы (сахар, шоколад, кондитерские изделия, белый хлеб), жирные молоко и кефир, сливки, сметану, сгущенное молоко, жирные и полужирные сыры, майонез, свинину, баранину, мясо утки или гуся. При приготовлении блюд следует использовать растительное масло, содержащее полиненасыщенные жирные кислоты (кукурузное, оливковое, подсолнечное, соевое, хлопковое и др.), нежирные сорта мяса (телятина, мясо курицы, индейки, кролика), рыбу (в том числе жирных сортов — лососевые, тунец, сельдь, сардины и др.), овощи (ограничить употребление картофеля) и фрукты, обезжиренные молоко и кефир, нежирные сыры. В комплексной терапии больным можно рекомендовать пищевые добавки, содержащие хондроитин- и глюкозаминсульфаты.
Лечебная физкультура при ОА способствует: профилактике или устранению атрофии периартикулярных мышц (например, четырехглавой мышцы бедра у больных с гонартрозом); профилактике или устранению нестабильности суставов; уменьшению артралгий, улучшению функции пораженных суставов; замедлению дальнейшего прогрессирования ОА; уменьшению массы тела.
Упражнения для увеличения объема движений. Причинами скованности суставов у больных с ОА могут быть: растяжение суставной капсулы, вторичное по отношению к увеличению объема синовиальной жидкости; ретракция суставной капсулы, периартикулярных связок и сухожилий; фиброзный анкилоз сустава различной степени выраженности вследствие потери суставного хряща; неконгруэнтность суставных поверхностей, наличие механического блока (ОФ, суставные «мыши»); мышечный спазм; боль в суставе.
Кроме того, лечащий врач должен учитывать, что снижение объема движений в одном суставе влияет на биомеханику соседних дистально и проксимально расположенных суставов. Учитывая неоспоримость данных по этому вопросу, мы сочли необходимым сослаться на самые первые источники литературы, осветившие данный аспект проблемы. Так, по данным S. Messier и соавторов (1992) и D. Jesevar и соавторов (1993), у больных пожилого возраста с гонартрозом объем движений был уменьшен во всех крупных суставах обеих нижних конечностей (тазобедренном, коленном и голеностопном) по сравнению с лицами контрольной группы без заболеваний суставов. Нарушение биомеханики пораженного сустава ведет к изменению нормальных движений конечности, повышает нагрузку на суставы, повышает энергию потребления при движении, усиливает боль и нестабильность суставов. Более того, ограничение объема движений суставов нижних конечностей изменяет нормальную кинематику походки. Например, у больного с гонартрозом уменьшены угловая скорость и объем движения коленного сустава, однако компенсаторно увеличена угловая скорость тазобедренного сустава по сравнению с лицами контрольной группы, сопоставимой по возрасту, полу и массе тела, без ОА. Не вызывает сомнений, что у больных с гонартрозом повышается нагрузка на непораженную конечность (Messier S. et al., 1992; 1994). В настоящее время общепринятым является тот факт, что длительные пассивные движения оказывают трофическое действие на суставной хрящ и могут способствовать его репарации (Salter R., 1994). Поэтому восстановление функционального объема движений в пораженных суставах является важной задачей немедикаментозного лечения и реабилитации больных с ОА.
В настоящее время с целью восстановления объема движений в суставах используют различные физические упражнения: пассивные (мобилизацию сустава осуществляет методист или его ассистент); полуактивные (пациент самостоятельно совершает движения в суставе, методист/ассистент помогает лишь в конце каждого движения достичь максимального объема); активные (пациент самостоятельно выполняет движения в максимально полном объеме).
Перед комплексом упражнений возможно проведение массажа или физиотерапии (инфракрасное, коротковолновое, микроволновое излучение, ультразвук) для уменьшения скованности в пораженных суставах и облегчения выполнения упражнений.
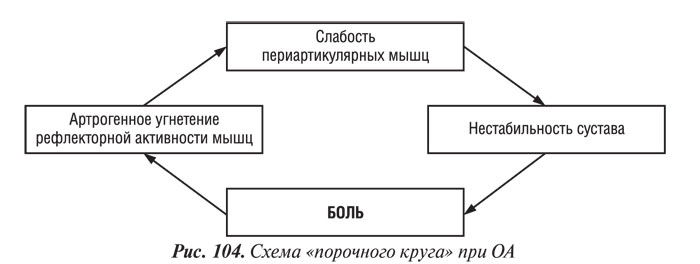
Упражнения для укрепления периартикулярных мышц. В литературе имеется много сообщений о связи ОА коленного сустава и слабости/гипотрофии четырехглавой мышцы бедра (Fischer N. et al., 1991; Hall K. et al., 1993; Madsen O. et al., 1995; O’Reilly S. et al., 1997; Slemenda C. et al., 1997). Результаты этих исследований свидетельствуют о том, что у больных с гонартрозом боль в суставе может являться следствием слабости периартикулярных мышц и их асимметричной активности, что ведет к дестабилизации сустава. Нагрузка на нестабильный сустав вызывает растяжение иннервированных тканей и провоцирует боль, которая угнетает рефлекторную активность скелетных мышц, ограничивая тем самым функцию конечности; таким образом, замыкается «порочный круг» (рис. 104) (Dequekker J. et al., 1993; Ettinger W. et al., 1994). У больных с манифестным ОА коленного сустава часто наблюдают слабость четырехглавой мышцы бедра, непосредственной причиной которой является боль, ограничивающая сознательные движения в суставе, что приводит к развитию атрофии периартикулярных мышц (Hurley M. et al., 1993). Этот феномен получил название «артрогенное угнетение мышц» (АУМ). P. Geborek и соавторы (1989) сообщили об ингибировании функции мышц в нормальных и пораженных ОА коленных суставах при увеличении объема внутрисуставной жидкости и повышении гидростатического давления. В другом исследовании установлено, что максимальная изометрическая сила периартикулярных мышц значительно снижена при наличии выпота, а аспирация избытка жидкости приводит к ее повышению (Fahrer H. et al., 1988). В то же время АУМ наблюдают у больных при отсутствии боли и суставного выпота, что свидетельствует о наличии других механизмов его развития. По данным гистохимического исследования, уменьшение относительного количества фибрилл ІІ типа и диаметра фибрилл І и ІІ типов в средней ягодичной мышце больных с тяжелым коксартрозом, ожидающих операции (артропластика), по сравнению с лицами, составившими контрольную группу (Sirca A. et al., 1980). Относительное увеличение количества фибрилл І типа может обусловливать появление скованности мышц и способствовать развитию ОА. Необходимо отметить, что у части больных без гипотрофии четырехглавой мышцы бедра может наблюдаться слабость этой мышцы (Madsen O. et al., 1997). Это наблюдение свидетельствует о том, что мышечная слабость не всегда обусловлена атрофией периартикулярных мышц или артралгиями и наличием суставного выпота, а чаще мышечной дисфункцией (Slemenda S. et al., 1997). Причинами последней могут быть деформация конечности, усталость мышц или изменения проприорецепторов. Электромиографический анализ четырехглавой мышцы бедра во время изометрического сокращения при сгибании коленного сустава на 30° и 60° показал значительно бо′льшую активность (преимущественно прямой мышцы бедра) у пациентов с варусной деформацией коленного сустава, чем у здоровых лиц (Marks R. et al., 1994). Эти данные объясняют более высокую энергетическую потребность и быструю утомляемость больных с ОА при длительной двигательной активности.
По данным некоторых исследователей (Jan M. et al., 1990; Slemenda S. et al., 1997), слабость четырехглавой мышцы бедра является первичным фактором риска прогрессирования ОА коленных суставов. По данным О. Madsen и соавторов (1997), небольшое увеличение силы мышцы (на 19% от среднего показателя у мужчин и на 27% — у женщин) может привести к снижению риска прогрессирования ОА на 20–30%.
В ходе исследования осуществляли количественную оценку движений экстензора и флексора коленного сустава у больных с гонартрозом: как изометрическое, так и изотоническое сокращение четырехглавой мышцы бедра было менее выражено у больных с остеоартрозом коленного сустава, чем у здоровых волонтеров (Wessel J., 1996). По данным L. Nordersjo и соавторов (1983), активность сокращения сгибателя коленного сустава также была ниже нормальной, но в меньшей степени, чем разгибателя. Изокинетическое исследование обнаружило, что у больных с гонартрозом слабость разгибателя коленного сустава встречается чаще, чем слабость сгибателя (Madsen O. et al., 1996; Slemenda C. et al., 1997).
Являясь естественными амортизаторами ударов, периартикулярные мышцы выполняют защитную функцию. Несмотря на то, что в ряде клинических исследований продемонстрировано влияние упражнений для укрепления четырехглавой мышцы бедра на симптомы ОА у больных с гонартрозом (Fischer N. et al., 1991; Marks R., 1993; Schilke D. et al., 1996), перед началом их выполнения необходимо купировать боль, отечность мягких тканей, удалить суставной выпот с целью максимального устранения феномена АУМ, препятствующего эффективной реабилитации. Более того, давление, генерируемое активностью мышцы сгибателя в коленном суставе с выпотом, влияет на микроциркуляцию суставной жидкости путем сдавления капилляров (Stevens C. et al., 1991).
Упражнения для укрепления периартикулярных мышц можно разделить на три группы:
- изометрические (сокращение мышцы без изменения ее длины): сокращение мышцы длится 6 с, затем следует расслабление, упражнение повторяют 5–10 раз; параллельно рекомендуется коактивация мышц-антагонистов. S. Himeno и соавторы (1986) обнаружили, что нагрузка распределяется одинаково на поверхности ТФО коленного сустава, если сила мышц-агонистов уравновешивается силой мышц-антагонистов, что в свою очередь снижает общую нагрузку на поверхность сустава и предотвращает локальное повреждение (Baratta R. et al., 1988);
- изотонические (движения конечности в суставе с дополнительным сопротивлением или без такового, при которых периартикулярные мышцы укорачиваются или удлиняются); изотонические упражнения следует проводить без преодоления существующего объема движений и с субмаксимальным сопротивлением;
- изокинетические (движения в суставе осуществляются в полном объеме с постоянной скоростью); с помощью изокинетического динамометра сопротивление варьируется таким образом, что увеличение мышечной силы способствует повышению сопротивления, а не увеличению скорости движения и наоборот.
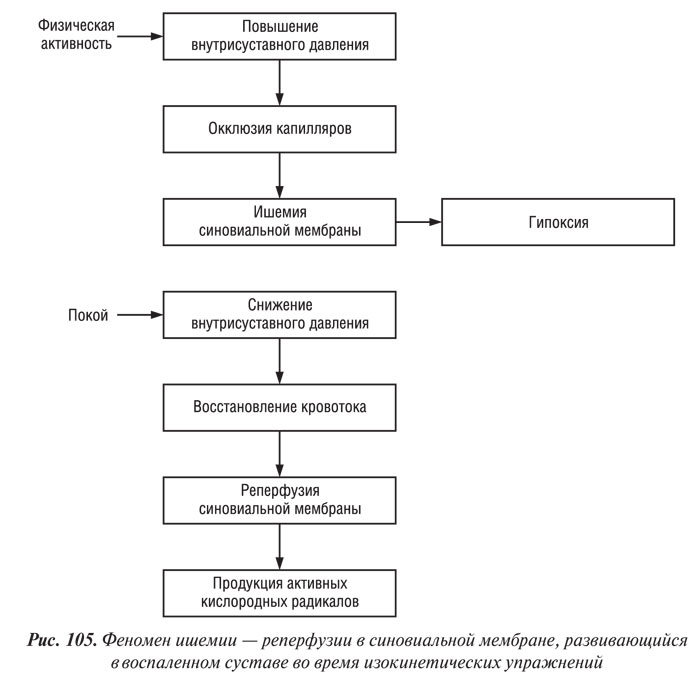
O. Miltner и соавторы (1997) сообщили о влиянии изокинетических упражнений на парциальное давление кислорода (рО2) во внутрисуставных тканях у больных с ОА: скорость 60° в 1 с привела к снижению внутрисуставного рО2 ниже уровня, наблюдаемого в состоянии покоя, тогда как скорость 180° в 1 с вызвала улучшение метаболизма во внутрисуставных структурах. Известно, что патологическое снижение внутрисуставного рО2 имеет разрушительные последствия в отношении метаболизма хондроцитов. Однако наиболее опасной является реоксигенация тканей, возникающая вслед за гипоксией. Результаты исследования, проведенного D. Blake и соавторами (1989), свидетельствуют о том, что при поражении коленного сустава (артриты разной этиологии, в том числе и ОА, осложненный синовит), физические упражнения индуцируют повреждение, опосредованное активными кислородными радикалами. Механизм синовиальной ишемии-реперфузии в настоящее время хорошо известен. При гонартрозе среднее значение рО2 в состоянии покоя значительно снижено. Физические упражнения в коленном суставе с синовитом приводят к выраженному повышению внутрисуставного давления, избыточному давлению перфузии капилляров, а в некоторых случаях и к повышению систолического АД, что вызывает гипоксию тканей (Edmonds S. et al., 1995). В этот период повышенного внутрисуставного давления снижается рО2 синовиальной жидкости. В состоянии покоя внутрисуставное давление снижается, возникает реперфузия (рис. 105) (Blake D. et al., 1989). Доминирующими источниками кислородных радикалов в суставе, пораженном ОА, образующихся в результате феномена гипоксия — реоксигенация, являются эндотелиоциты капилляров и хондроциты (Himeno S. et al., 1986; Baratta R. et al., 1988; Henrotin Y. et al., 1993; Croisier J.L. et al., 1994; Kannus P., 1994; Edmonds S. et al., 1995; Singh D. et al., 1995; Miltner O. et al., 1997). Кислородные радикалы индуцируют повреждение всех компонентов хрящевого матрикса и уменьшают вязкость синовиальной жидкости (Roberts C. et al., 1989; Nurcombe H. et al., 1991; Saari H., 1991). Более того, гипоксия индуцирует синтез и высвобождение эндотелиальными клетками ИЛ-1 — цитокина, ответственного за деградацию суставного хряща (Shreeniwas R. et al., 1992).
Целью упражнений на растяжение является восстановление длины укороченных периартикулярных мышц. Причинами укорочения мышц могут быть длительный спазм мышц, деформация скелета, ограничение движений в суставах. В свою очередь укорочение периартикулярных мышц индуцирует ограничение объема движений в суставе. После 4 нед упражнений на растяжение и изометрических упражнений J. Falconer и соавторы (1992) наблюдали у больных с ОА увеличение объема движений и восстановление походки. G. Leivseth и соавторы (1988) изучали эффективность пассивного растяжения отводящей мышцы бедра у 6 больных с коксартрозом. Чередование растяжения (30 с) и паузы (10 с) повторяли в течение 25 мин 5 дней в неделю на протяжении 4 нед, что привело к увеличению объема отведения бедра в среднем на 8,3° и уменьшению выраженности боли в суставах. При биопсии мышечной ткани выявили гипертрофию фибрилл І и ІІ типа и повышение содержания гликогена. Упражнения на растяжение противопоказаны при наличии выпота в суставе.
Аэробные упражнения. Существует ряд доказательств необходимости проведения программ аэробных упражнений при ОА. Известно, что потребление кислорода и энергии при ходьбе у больных с ОА коленных суставов повышено (Fischer N. et al., 1993). Это, вероятно, связано с изменением нормальной функции суставов и мышц, что приводит к неэффективной локомоции. Нередко больные с гонартрозом имеют избыточную массу тела, у них наблюдается слабость периартикулярных мышц. M. Ries и соавторы (1995) отметили, что тяжесть гонартроза ассоциируется с низким максимальным потреблением кислорода (VО2 max). Это свидетельствует о детренированности сердечно-сосудистой системы у больных с тяжелым гонартрозом вследствие гиподинамии, связанной с выраженным болевым синдромом и ограничением функции пораженной конечности. Результаты относительно недавно проведенных исследований продемонстрировали улучшение физической способности больных с ОА (укорочение времени прохождения определенного расстояния и др.), принимавших участие в лечебных программах аэробных упражнений (Minor M., 1989; Ettinger W. et al., 1994; Fransen M. et al., 1997).
При разработке индивидуальных программ аэробных упражнений необходимо учитывать, какие суставные группы поражены ОА. Например, езду на велосипеде (велоэргометрию) можно рекомендовать больным с гонартрозом с нормальным объемом сгибания в коленном суставе и при отсутствии значительных изменений в ПФО сустава. Плавание и упражнения в воде эффективно снижают нагрузку массы тела на суставы нижних конечностей при коксартрозе и гонартрозе.
Однако методист по лечебной физкультуре должен учитывать, что избыточная нагрузка способствует развитию и прогрессированию ОА (Awbrey B. et al., 1989; Ghosh P. et al., 1989; Konradsen L. et al., 1990; Buckwalter J., 1995; Lane N., 1995). Хотя, по данным W. Rejeski и соавторов (1997), аэробные упражнения высокой интенсивности эффективнее улучшают симптоматику ОА, чем упражнения умеренной и низкой интенсивности. В любом случае при формулировании рекомендаций больному необходимо придерживаться основного принципа — тренировки должны быть не чаще 3 раз в неделю и длиться не более 35–40 мин.
По данным рандомизированного сравнительного исследования эффективности аэробных упражнений и обучающей программы у больных пожилого возраста с гонартрозом, отмечают более значительное улучшение двигательной функции и уменьшение боли в фитнесс-группе по сравнению с группой пациентов, участвовавших только в обучающей программе (Ettinger W. et al., 1997). В другом исследовании было установлено, что у больных с ОА, которые участвовали только в аэробных тренировках (аэробная ходьба, упражнения в воде) в течение 12 нед, наблюдали более выраженное увеличение аэробной способности, увеличение скорости ходьбы, уменьшение беспокойства/депрессии по сравнению с контрольной группой больных, которые выполняли только пассивные упражнения на восстановление объема движений (Minor M. et al., 1989).
Физиотерапия особенно полезна при ОА крупных суставов нижних конечностей. Для купирования боли, уменьшения отека околосуставных тканей, рефлекторного спазма околосуставных мышц, улучшения микроциркуляции, лечения слабого или умеренного синовита используют: воздействие электромагнитных полей сверхвысоких и высоких частот; ультразвуковую терапию (в том числе фонофорез противовоспалительных препаратов); коротковолновую диатермию (при отсутствии синовита); микроволновую терапию; электрофорез противовоспалительных препаратов (вольтарена, гидрокортизона, диметилсульфоксида); лазерную терапию; аппликации теплоносителей (иловой и торфяной грязи, парафина, озокерита); бальнеотерапию (радоновые, серо-водородные, хлоридно-натриевые, скипидарные, йодобромные ванны); гидротерапию (уменьшает гравитационную нагрузку на суставы, главным образом тазобедренный).
В период обострения ОА, обусловленного реактивным синовитом, можно использовать ультрафиолетовое облучение в эритемных дозах (5–6 процедур), электрическое поле и дециметровые волны в слаботепловой дозе (8–10 процедур), магнитотерапию (10–12 процедур), фонофорез или электрофорез метамизола натрия, прокаина, тримекаина, диметилсульфоксида на область пораженного сустава. Противопоказаниями к применению ультрафиолетовой терапии являются сопутствующая ИБС, преходящие нарушения мозгового кровообращения, тиреотоксикоз, заболевания почек. Воздействие электрическим полем УВЧ противопоказаны при выраженной вегетососудистой дистонии, нарушении сердечного ритма, гипертонической болезни ІІБ–ІІІ стадии.
Среди различных физиотерапевтических методов хорошо зарекомендовал себя электрофорез, сочетающий терапевтическое воздействие постоянного электрического тока и вводимого лекарственного средства. Из механизмов биологического действия постоянного электрического тока можно выделить следующие физико-химические эффекты: электролиз — движение заряженных частиц (катионов и анионов) к противоположно заряженному электроду и превращение их в атомы, обладающие высокой химической активностью; перемещение заряженных частиц под действием постоянного электрического тока вызывает изменение ионной конъюнктуры в тканях и клетках. Скопление противоположно заряженных частиц у биологических мембран приводит к их поляризации и образованию добавочных поляризационных токов; в результате изменения проницаемости биологических мембран увеличивается пассивный транспорт через них крупных белковых молекул (амфолитов) и других веществ — электродиффузия; электроосмос — разнонаправленное движение молекул воды, включенных в гидратные оболочки ионов (главным образом Na+, K+, Cl–).
Под действием электрического тока в подлежащих тканях активируются системы регуляции локального кровотока и повышается содержание биологически активных веществ (брадикинина, калликреина, простагландинов) и вазоактивных медиаторов (ацетилхолина, гистамина). В результате просвет сосудов кожи расширяется и возникает гиперемия.
Расширение капилляров и повышение проницаемости их стенок вследствие местных нейрогуморальных процессов возникают не только в месте приложения электродов, но и в глубоко расположенных тканях, через которые проходит постоянный электрический ток. Наряду с усилением крово- и лимфообращения, повышением резорбционной способности тканей наблюдаются ослабление мышечного тонуса, усиление выделительной функции кожи и уменьшение отека в очаге воспаления. Кроме того, вследствие электроосмоса снижается компрессия болевых проводников, более выраженная под анодом.
Постоянный электрический ток усиливает синтез макроэргических соединений в клетках, стимулирует обменно-трофические процессы в тканях, повышает фагоцитарную активность макрофагов, ускоряет процессы регенерации, стимулирует ретикулоэндотелиальную систему, повышает активность факторов неспецифического иммунитета.
Таким образом, постоянный электрический ток обладает следующими лечебными эффектами: противовоспалительным, метаболическим, вазодилатирующим, санирующим (дренирующе-дегидратирующим), анальгетическим, миорелаксирующим, седативным (на аноде) (Боголюбов В.М., Пономаренко Г.Н., 1998; Лукомский И.В. и соавт., 1998).
В период «стихания» обострения, а также в начальной стадии заболевания, когда явления синовита слабо выражены или отсутствуют, показаны воздействия электромагнитными полями высоких и сверхвысоких частот (индуктотермия, дециметровая и сантиметровая волновая терапия), импульсные токи низкой частоты — синусоидальные модулированные и диадинамические, магнитотерапия, лазерное воздействие, фонофорез гидрокортизона. Для стимуляции трофики суставного хряща проводят электрофорез солей лития, кальция, серы, цинка, 0,01% раствора фракций гуминовых кислот хаапсалуской морской лечебной в изотоническом растворе натрия хлорида. Для потенцирования обезболивающего действия применяют электрофорез прокаина, метамизола натрия, салициловой кислоты (Боголюбов В.М., Пономаренко Г.Н., 1998; Лукомский И.В. и соавт., 1998; Гаспарян Л.В., 2000).
Электромагнитные поля высоких и сверхвысоких частот — индуктотермия, дециметро- и сантиметроволновая терапия — при воздействии на суставы слаботепловыми и тепловыми дозами (12–15 процедур на курс лечения) оказывают на артикулярные и периартикулярные ткани выраженное тепловое воздействие, увеличивают приток крови к тканям сустава, усиливают лимфоотток, процессы диффузии, устраняют мышечный спазм. Это способствует улучшению питания хряща, оказывает рассасывающее действие при синовите, а также положительно влияет на периартикулярные пролиферативные процессы. Индуктотермию применяют у больных с ОА І–ІІ стадии, при отсутствии или слабовыраженном вторичном синовите, наличии болевого синдрома, периартикулярных изменений. Индуктотермия не показана при обострении вторичного синовита, а также больным старческого возраста, при ИБС, атеросклеротическом поражении сосудов сердца, нарушениях сердечного ритма, выраженном церебральном атеросклерозе, преходящем нарушении мозгового кровообращения, климактерических расстройствах, фибромиоме, тиреотоксикозе. Этим больным назначают дециметро- или сантиметроволновые воздействия.
Дециметро- и сантиметроволновую терапию применяют при ОА I–IV стадии при отсутствии или слабовыраженном проявлении вторичного синовита, а также при ИБС с частыми приступами стенокардии, у больных с выраженными климактерическими расстройствами, фибромиомой.
Обезболивающий эффект, благоприятное воздействие на гемодинамику и обменные процессы в суставе оказывают импульсные токи низкой частоты — синусоидальные модулированные и диадинамические. Синусоидальные модулированные токи переносятся лучше, чем диадинамические. К ним меньше развивается «привыкание» тканей, поэтому они предпочтительнее. Импульсные токи низкой частоты показаны больным пожилого и старческого возраста с ОА I–IV стадии, выраженным болевым синдромом, изменениями в периартикулярных тканях. Импульсные токи не назначают при явлениях вторичного синовита, а также больным с нарушениями середечного ритма с брадикардией или склонностью к брадикардии.
Ультразвуковую терапию часто используют в лечении различных острых и хронических заболеваний опорно-двигательного аппарата. Ультразвук оказывает тепловое (увеличение кровотока, повышение болевого порога, увеличение интенсивности метаболизма) и нетепловое (увеличение проницаемости клеточных мембран, транспорта кальция через клеточную мембрану, поступления питательных веществ в ткани, фагоцитарной активности макрофагов) действие (Gersten J., 1955; Aleya W. et al., 1956; Dyson M. et al., 1968; Duarte L., 1983). При пульсовом способе подачи ультразвука уменьшаются тепловые эффекты, нетепловые же остаются без изменения, поэтому применение пульсового ультразвука показано больным с ОА при наличии синовита. Ультразвук показан больным с I–IV стадиями ОА без явлений синовита с выраженным болевым синдромом, пролиферативными изменениями в периартикулярных тканях. Ультразвуковая терапия противопоказана при обострении синовита, а также больным старческого возраста с выраженными атеросклеротическими поражениями сосудов сердца и мозга, гипертонической болезнью ІІІ стадии, преходящими нарушениями мозгового кровообращения, при тиреотоксикозе, вегетососудистой дистонии, климактерических расстройствах, фибромиоме, мастопатии.
Мышечный спазм является одним из источников боли и причиной ограничения функции суставов у больных с ОА. Спазм периартикулярных мышц вызывает повышение внутрисуставного давления и нагрузки на суставную поверхность, а также уменьшение кровотока в мышце, вследствие чего развивается локальная ишемия. Поэтому устранение мышечного спазма имеет большое значение в лечении и реабилитации больных с ОА.
Для расслабления спазмированных мышц применяют массаж, глубокое и поверхностное согревание (тепловые аппликации, инфракрасное излучение, коротковолновую или микроволновую диатермию, сауну или парнyю). Местная аппликация повышает кровоток в пораженной зоне, уменьшает боль и мышечный спазм, вызывает общее расслабление. Повышение кровотока в мышцах способствует элиминации метаболитов (молочной кислоты, СО2 и др.) и притоку источников энергии (О2, глюкоза и др.). Кроме того, поверхностное согревание, воздействуя на нервные окончания, оказывает седативное и обезболивающее действие, что было доказано еще в 1958 г. (Lehman J. et al., 1958). Еще одним механизмом расслабления мышц с помощью аппликации является уменьшение возбудимости нервно-мышечных веретен (Fischer E. et al., 1965).
Аппликации иловой или торфяной грязи (температура 38–42 °С), парафина и озокерита (температура 50–55 °С) назначают в количестве 10–15 процедур на пораженный сустав или на часть тела, включающую пораженные суставы. Аппликации грязи, озокерита и парафина показаны больным с I–II стадией ОА без синовита или с незначительными проявлениями, при выраженном болевом синдроме, пролиферативных явлениях, рефлекторных изменениях в скелетных мышцах. Их не применяют при значительных изменениях в суставах, пораженных ОА, выраженных явлениях синовита, а также при ИБС, гипертонической болезни ІІБ–ІІІ стадии, недостаточности кровообращения, варикозном расширении вен, заболевании сосудов ЦНС, остром и хроническом нефрите и нефрозе и др.
Как уже неоднократно отмечалось, суставной хрящ не имеет нервных окончаний и поэтому происходящий в нем процесс деградации не является причиной боли при ОА. Причины боли можно разделить на две группы (Crielaard J.M., Henrotin Y., 1999):
- внутрисуставные: повышение внутрисуставного давления, вызванное суставным выпотом; сверхнагрузка на субхондральную кость; микропереломы трабекул; разрыв внутрисуставных связок; защемление ворсин синовиальной оболочки; растяжение суставной капсулы; воспаление синовиальной оболочки;
- внесуставные: снижение венозного оттока с последующим застоем крови в субхондральной кости; мышечный спазм; воспаление периартикулярных сухожилий (тендинит).
Перед выбором адекватной обезболивающей терапии врачу необходимо определить источник боли. Среди физиотерапевтических методов обезболивающий эффект оказывают аппликация теплоносителей и источников холода, ультразвук, пульсовое электромагнитное поле, ионизация, электротерапия, электроакупунктура и вибротерапия.
В целях уменьшения боли и воспаления можно использовать холод — пакеты со льдом, криогель, локальный охлаждающий спрей, систему подачи охлажденного газа. Поверхностное охлаждение уменьшает мышечный спазм, снижает активность нервно-мышечных веретен и повышает болевой порог (Mennell J., 1973; Benson T. et al., 1974). При ОА эффективно распыление охлаждающих спреев над зоной, где находятся триггерные точки болезненной мышцы (Travell J., 1952).
Глубокое согревание достигается с помощью коротковолновой, микроволновой и ультразвуковой терапии. По данным K. Svarcova и соавторов (1988), коротковолновая диатермия вызывала значительное уменьшение выраженности боли у пациентов с ОА коленных и тазобедренных суставов. Поверхностное согревание с помощью инфракрасного излучения также уменьшает выраженность боли и улучшает функцию пораженных суставов при ОА коленных суставов и суставов кистей.
Благоприятное воздействие на обменные процессы, метаболизм хряща, периферическую гемодинамику и микроциркуляцию оказывает бальнеотерапия — сульфидные, радоновые, йодобромные, хлоридно-натриевые, скипидарные ванны. Если остеоартроз развился у лиц молодого возраста (35–40 лет) без сопутствующих сердечно-сосудистых заболеваний, то применяют ванны со средней концентрацией веществ и газов, с достаточно большой продолжительностью воздействия (15–20 мин) и курса лечения (12–14 процедур). Пациентам старше 45 лет, а также лицам молодого возраста с остаточными явлениями вторичного синовита бальнеотерапию назначают по щадящей методике: ванны с невысокой концентрацией веществ и газов, длительностью не более 8–10 мин, на курс лечения — 8–10 процедур. С учетом возраста больного, сопутствующих сердечно-сосудистых заболеваний можно назначать полуванны, четырех- и двухкамерные ванны, которые легче переносятся больными.
Радоновые ванны рекомендуются больным с І–ІІ стадией ОА с остаточными явлениями синовита, выраженным болевым синдромом и без него, изменениями мышц, нарушением локомоторной функции суставов, с сопутствующими вегетативными нарушениями, климактерическими расстройствами. Сульфидные, хлоридно-натриевые и скипидарные ванны показаны больным с І–ІІ стадией ОА без явлений вторичного синовита, с нарушением локомоторной функции, ожирением, атеросклеротическим поражением сосудов. Йодобромные ванны назначают больным с ОА без явлений синовита, с сопутствующими функциональными изменениями ЦНС, тиреотоксикозом, климактерическими расстройствами, атеросклеротическим поражением сосудов и др.
Противопоказаниями к бальнеотерапии являются обострение синовита, а также ИБС, гипертоническая болезнь ІІБ–ІІІ стадии, выраженное атеросклеротическое поражение коронарных и церебральных сосудов, острые и подострые воспалительные заболевания, а для сульфидных и скипидарных ванн — также заболевания печени и желчных путей, почек.
Использование вспомогательных приспособлений. К ним относятся различные бандажи, наколенники, трости, костыли, ортопедическая обувь и др. Все они способствуют уменьшению нагрузки на пораженный сустав, тем самым уменьшая болевые ощущения. Вместо специальной ортопедической обуви пациенту можно рекомендовать ношение спортивных туфель (кроссовок), снабженных специальными прокладками, снижающими нагрузку на суставы нижних конечностей. D.A. Neumann (1989) обнаружил, что при использовании костыля нагрузка на тазобедренный сустав уменьшается на 50%. Клиновидная прокладка из эластичного материала, которую помещают в обувь под пяточную область под углом 5–10°, эффективна у больных с ОА медиального ТФО коленного сустава, особенно при І–ІІ стадии по Kellgren и Lawrence (Sasaki T., Yasuda K., 1987). При нестабильности коленного сустава или изолированном поражении медиального или латерального отдела сустава эффективно использование наколенников (Barret D.S. et al., 1991).
Медиальная тракция надколенника. При поражении ПФО коленного сустава у больных часто развивается нестабильность надколенника. Стабилизация надколенника различными способами приводит к значительному уменьшению выраженности боли в пораженном суставе, снижению потребности в обезболивающих препаратах. Одним из способов стабилизации надколенника является его фиксация с помощью полоски широкого лейкопластыря (Cushnaghan J. et al., 1994; Kowall M. et al., 1996). Способ стабилизации заключается в следующем: одним концом длинную полоску лейкопластыря закрепляют на наружной поверхности коленного сустава, затем большим пальцем правой руки врач смещает надколенник медиально и фиксирует его в этом положении с помощью лейкопластыря, второй конец которого закрепляет на внутренней поверхности коленного сустава.
Нетрадиционные методы лечения. Нетрадиционные методы лечения при остеохондрозе широко используются во всем мире, в том числе и в Украине. Так, в Великобритании акупунктура доступна 84% пациентов с хронической болью, приблизительно 4000 врачей общей практики и физиотерапевтов получили сертификаты на проведение лечебной акупунктуры (Woollam C.H.M. et al., 1998; Zollman C. et al., 1999). В Германии применение лечебной акупунктуры установлено решениями Федерального комитета врачей и Фондов медицинского страхования от 16 октября 2000 г. (Streiberger K. et al., 2004). Однако эффективность нетрадиционных методов все еще считается сомнительной, поскольку недостаточно изучена в контролируемых клинических испытаниях (MacClenan A.H. et al., 1996; Eisenberg D.M. et al., 1998; Harres P. et al., 2000; Linde K. et al., 2001).
Акупунктура — традиционный китайский метод лечения, представляющий собой стимуляцию определенных точек кожи металлическими иглами. Некоторые другие методики, в частности, мануальную (акупрессуру), электрическую или лазерную стимуляцию точек акупунктуры часто объединяют с традиционным методом под общим названием акупунктура (Filshie J. et al., 1997; Zollman C. et al., 2000). В Китае акупунктуру обычно используют в комбинации с другими традиционными методами лечения, например, фитотерапией. В западных странах акупунктура чаще используется в качестве монотерапии (Linde K. et al., 2001). В основе идеи акупунктуры лежит концепция о потоках Чи (жизненная сила и энергия): расстройства, связанные с изменениями Чи, могут быть предупреждены или излечены стимулированием релевантных точек на поверхности тела (Linde K. et al., 2001).
B.V. Christensen и соавторы (1992) в контролируемом исследовании выявили значительное уменьшение выраженности боли и снижение суточной дозы анальгетиков на фоне акупунктуры у больных с ОА, готовящихся к артропластике (7 пациентов из 42 отказались от операции).
C. Sangdee и соавторы (2002) опубликовали результаты рандомизированного слепого плацебо-контролируемого сравнительного исследования эффективности электроакупунктуры (ЭА), диклофенака и их комбинации у больных с симптоматичным ОА коленных суставов. 192 больных были рандомизированы на 4 группы: плацебо, диклофенак, ЭА и их комбинация. Первичными критериями эффективности служили применение парацетамола, WOMAC, ВАШ боли, функциональный индекс Лекена, время прохождения 50 футов и общая оценка эффективности врачом и пациентом. Из всех включенных пациентов 186 завершили исследование. По таким показателям, как ВАШ боли и индекс Лекена улучшение в группе ЭА было значительно больше выраженным, чем в плацебо-группе или в группе диклофенака. В группе лечения ЭА и диклофенаком отмечено наибольшее улучшение индексов WOMAC.
В двойном слепом контролируемом рандомизированном сравнительном исследовании эффективности и переносимости гомеопатического геля и геля, содержащего пироксикам, приняли участие 184 пациента с ОА коленных суставов (Van Haselen R.A. et al., 2000). В рамках исследования пациентам назначали аппликации 1 г геля 3 раза в сутки в течение 4 нед. На фоне лечения в группе больных, получавших гомеопатическую терапию, ВАШ боли в среднем уменьшился на 16,5 мм, в группе пироксикама — на 8,1 мм (р<0,05). В то же время исследователи не выявили значительной разницы в снижении индекса Ричи между группами (р>0,05). Побочные эффекты были зарегистрированы у 12 больных группы гомеопатии и у 16 пациентов в группе пироксикама (р>0,05). Из них у 7 и 11 пациентов соответственно отмечали местную реакцию, послужившую основанием для досрочного выхода из исследования 2 пациентов из группы гомеопатии и 5 пациентов из группы пироксикама. Анализ результатов исследования позволил авторам сделать вывод о том, что гомеопатический гель был так же эффективен, как и гель пироксикама. Таким образом, использование гомеопатического геля (при необходимости) в комбинации с ненаркотическими анальгетиками может служить терапией выбора для больных гонартрозом.
В другом двойном слепом контролируемом исследовании гомеопатического лечения были продемонстрированы менее обнадеживающие результаты. M. Shipley и соавторы (1983) сравнили эффективность и переносимость гомеопатического препарата Rhus tox 6X и фенопрофена у больных с ОА коленных и тазобедренных суставов. Полученные результаты свидетельствуют о преимуществе фенопрофена как по сравнению с плацебо, так и гомеопатическим препаратом. В то же время Rhus tox 6X не отличался по эффективности от плацебо и значительно уступал фенопрофену. Побочные эффекты достоверно чаще отмечались в группе фенопрофена. Примечательно, что результаты оценки эффективности лечения ревматолога не отличались от таковых врача-гомеопата.
Медикаментозное лечение
Все препараты, применяемые при остеохондрозе, условно делят на две группы:
- симптоматические (symptoms modifying antiosteoarthritis drugs — SMOADs),
- патогенетические, или модифицирующие заболевание (structure modifying или disease modifying antiosteoarthritis drugs — DMOADs).
Разделяют также медленно- и быстродействующие препараты.
Условность такого деления обусловлена недостаточностью знаний о механизмах действия лекарств, применяемых при остеохондрозе. Практически все препараты, применяемые в терапии больных с остеохондрозом (НПВП, депо-ГКС, гиалуроновая кислота, хондроитин сульфат и др.), обладают симптоматическим эффектом, но отличаются различной скоростью наступления эффекта — к быстродействующим симптоматическим средствам можно отнести ненаркотические анальгетики, НПВП, депо-ГКС и другие, а к медленнодействующим — гиалуроновую кислоту, хондроитин сульфат и др.
Так как в настоящее время ни для одного терапевтического агента не доказаны патогенетические свойства, препараты, которые нередко называют «модифицирующими болезнь» или «модифицирующими структуру» (гиалуроновая кислота, хондроитин, глюкозамин-сульфат и др.), нельзя отнести к этой группе. Однако это не означает, что перечисленные препараты, а также другие лекарственные вещества (например, НПВП) не обладают такими свойствами. В то же время нельзя сводить эффект подобных препаратов исключительно к симптоматическому эффекту — в условиях in vivo и in vitro продемонстрирована их способность благоприятно влиять на метаболизм суставного хряща у больных с ОА.
Необходимо помнить, что симптоматические препараты могут оказывать патогенетическое действие и, наоборот, лекарственные средства патогенетического действия могут обладать симптоматическим эффектом.
Таким образом, современную классификацию терапевтических средств при ОА можно представить следующим образом.
Аппликационная терапия — простой и безболезненный способ лечения больных с ОА, дополняющая препараты, назначаемые системно (парацетамол, НПВП и др.). Преимуществами аппликационной терапии являются: непосредственное воздействие на основной очаг поражения — орган-«мишень», а именно — сустав; достижение оптимальной терапевтической концентрации препарата в пораженном органе, что снижает потребность в системно назначаемых фармакологических средствах, при этом уменьшается токсическое воздействие лекарственных препаратов.
Согласно современным требованиям, препарат для местного применения не должен вызывать местных токсических и аллергических реакций; должен достигать органа-«мишени»; концентрация препарата в сыворотке крови не должна достигать уровня, при котором возникают дозозависимые побочные эффекты; метаболизм и выведение препарата должны быть такими же, как при системном применении. При применении аппликаций предполагается создание терапевтической концентрации препарата в тканях в месте нанесения, при этом в общий кровоток поступает лишь незначительное количество вещества, что позволяет практически свести к минимуму системные побочные эффекты (Насонова В.А. и соавт., 1998).
Широкое распространение в аппликационной терапии при остеохондрозе нашли мази с согревающим и отвлекающим эффектом, содержащие как синтетические активные вещества, так и приготовленные на основе пчелиного и змеиного яда финалгон, апизартрон, випратокс. В лечении мышечной и суставной боли традиционно применяются мази, содержащие: ментол в качестве болеутоляющего средства; салицилаты, обладающие анальгезирующим и противовоспалительным свойствами; скипидар — компонент, оказывающий местное раздражающее и анальгетическое действие; эфиры никотиновой кислоты, способствующие расширению кровеносных сосудов.
Капсаицин — алкалоид, полученный из растений семейства пасленовых, стимулирующий высвобождение нейропептида субстанции Р из окончаний периферических нервов и предотвращающий их повторный захват. Локальная аппликация капсаицина приводит к снижению содержания субстанции Р в нейроне в целом, в том числе и в его ветвях, иннервирующих более глубокие ткани, например сустава (Virus R.M. et al., 1979; Fitzgerald M., 1983). В контролируемых клинических исследованиях капсаицин вызвал уменьшение боли в суставах у больных с гонартрозом и ОА суставов кистей. Максимальный эффект достигается спустя 3–4 нед лечения (Altman R.D. et al., 1994).
Применение средств, содержащих НПВП, в виде аппликаций — ибупрофен, пироксикам, диклофенак — обусловлено патогенетически. Для получения клинического эффекта при использовании мазей, содержащих НПВП, необходимо применять их достаточно длительно, соблюдать кратность аппликаций, наносить на кожу достаточное количество препарата. НПВП для местного применения эффективны при острой и хронической боли и часто применяются при ОА как препараты, не вызывающие побочных эффектов со стороны пищеварительного тракта. Однако исследования сравнения эффективности локальных и оральных НПВП при лечении ОА (Evans J.M. et al., 1996; Eccles M. et al., 1998; Moore R.A. et al., 1998) пока не проводились.
Среди НПВП-содержащих средств, применяемых для аппликаций, хорошо зарекомендовал себя Долгит-крем, активным веществом которого является ибупрофен (Насонова В.А. и соавт., 1998; Креминская Н.К., Дейкун А.И., 2000). Долгит-крем зарекомендовал себя как средство контактной лекарственной среды при ультрафонофорезе.
Диметил сульфоксид (димексид) хорошо зарекомендовал себя в лечении больных с остеохондрозом. Его 50% водный раствор в виде аппликаций на пораженный сустав обладает противовоспалительным и обезболивающим эффектом. Кроме того, димексид как хороший растворитель является проводником для пенетрации в мягкие ткани других лекарственных средств (новокаина, анальгина, но-шпы, гидрокортизона). Это средство используется как в аппликационной терапии ОА, так и для улучшения введения лекарств при электрофорезе методом электродрегинга (Балабанова Р.М. и соавт., 1982; Оранский И.Е., 1984; Муравьев Ю.В., 1988).
К недостаткам аппликационной терапии относят невысокую концентрацию лекарственного средства, проникающего в ткани (в среднем до 5% используемого количества). Лекарственный препарат резорбируется в мягкие ткани сквозь выводные протоки потовых и сальных желез, волосяные фолликулы, межклеточные пространства. Степень проникновения препарата зависит от его липофильности и степени увлажнения рогового слоя эпидермиса. Затрудняют проникновение лекарства в глубь тканей барьерные функции кожных покровов, в том числе перепад градиентов рН.
Быстродействующие препараты для лечения остеохондроза
Ненаркотические анальгетики (например, парацетамол) чаще используют в отмывочный период при апробации НПВП. Однако результаты сравнительных исследований, проведенных в 80–90-х годах прошлого века, свидетельствуют о том, что парацетамол может быть альтернативой другим НПВП, обезболивающее и противовоспалительное действие которых бесспорно, в качестве симптоматической терапии при ОА у больных со слабо и умеренно выраженным болевым синдромом.
Механизм действия парацетамола связан со снижением активности окисленных форм циклооксигеназы (ЦОГ)-1 и -2 в ЦНС и спинном мозге (Outllet M., Percival M.D., 2001).
Главный клинический симптом остеохондроза — боль — слабо коррелирует с гистологическими изменениями синовиальной оболочки и суставного хряща. Кроме того, боль при ОА может быть обусловлена не только синовитом, но и растяжением суставной капсулы, связок, а также нервных окончаний в периосте над ОФ, микропереломами трабекул, внутрикостной гипертензией, мышечным спазмом. Исходя из вышесказанного, можно заключить, что при ОА не всегда есть необходимость в противовоспалительном эффекте симптоматического агента (Brandt K.D., 2000).
Результаты сравнительных исследований эффективности и переносимости НПВП у больных с остеохондрозом в подавляющем большинстве случаев демонстрируют умеренную положительную динамику суставного синдрома. Так, например, по данным V.C.H. Tyson и A. Glynne (1980), перед лечением ибупрофеном или беноксапрофеном больные отметили ощущаемую боль на 100 мм ВАШ в среднем на уровне 55 мм, а после 4 нед лечения — на уровне 34 мм, т. е. динамика составила всего 21%. В других исследованиях отмечено, что на фоне лечения НПВП динамика показателей суставного синдрома колебалась между 10–20% и такую же разницу (т. е. 10–20%) регистрировали между результатами в основной группе и в группе плацебо. Обычно больные с ОА на 100 мм ВАШ отмечают исходное значение боли на уровне 40–60 мм, которое на фоне курсовой терапии НПВП уменьшается до 25–45 мм (Levinson D.J., Rubinstein H.M., 1983; Kvien T.K. et al., 1991; Lister B.J. et al., 1993). Поэтому неудивительно, что «простые» анальгетики у многих больных не менее эффективны, чем НПВП.
Лечение парацетамолом больных с ОА коленного сустава различной степени тяжести оказалось эффективным у 30% из них, в том числе и у пациентов, принимавших до исследования НПВП (Dieppe P. et al., 1993; March L. et al., 1994).
J.D. Bradley и соавторы (1991) сравнивали эффективность парацетамола и ибупрофена в рамках двойного слепого плацебо-контролируемого исследования у больных с манифестным гонартрозом с умеренными изменениями суставов на рентгенограммах. Авторы обнаружили, что эффективность «противовоспалительной» дозы ибупрофена (2400 мг/сут) не отличалась от «обезболивающей» дозы ибупрофена (1200 мг/сут), а также парацетамола в дозе 4000 мг/сут. Кроме того, у больных с клиническими признаками синовита (припухлость, выпот) динамика изучаемых показателей под влиянием «противовоспалительной» дозы ибупрофена не отличалась от таковой на фоне лечения парацетамолом. Аналогичные результаты были получены J. Stamp и соавторами (1989), которые сравнивали эффективность и переносимость парацетамола и флурбипрофена у больных с ОА.
J.H. Williams и соавторы (1993) провели двухлетнее двойное слепое плацебо-контролируемое сравнительное исследование эффективности парацетамола в дозе 0,65 г 4 раза в сутки и напроксена 375 мг 2 раза в сутки. Из 178 рандомизированных пациентов лишь 62 завершили исследование, причем в группе принимавших парацетамол количество выбывших незначительно превышало таковое в группе пациентов, принимавших напроксен. Высокий процент отзывов информированных согласий на участие в исследовании, вероятно, обусловлен субоптимальными дозами обоих исследуемых препаратов. По эффективности и переносимости парацетамол и напроксен не отличались между собой.
Сравнительное исследование эффективности парацетамола в дозе 3 г/сут, а также комбинации парацетамола в дозе 3 г/сут и кодеина — 180 мг/сут было прервано, несмотря на отмеченный более выраженный обезболивающий эффект. Причиной преждевременного прекращения исследования была высокая частота побочных эффектов у пациентов, принимавших парацетамол/кодеин (Kjaersgaard-Andersson P. et al., 1990).
По данным P. Seidemann и соавторов (1993), обезболивающий эффект был более выражен при добавлении к парацетамолу (4 г/сут) напроксена в дозе 0,5 или 1 г/сут, причем эта комбинация по эффективности не уступала монотерапии напроксеном в дозе 1,5 г/сут. Несмотря на то, что эти данные требуют подтверждения, они свидетельствуют о целесообразности сочетания парацетамола в терапевтической дозе с напроксеном в низкой дозе (Wollheim F., 1996).
По мнению K.D. Brandt (2000), у 40–50% больных с ОА эффективный контроль боли в суставах можно осуществлять с помощью парацетамола, однако предсказать обезболивающий эффект простых анальгетиков у конкретного пациента не представляется возможным.
Главным преимуществом парацетамола по сравнению с другими НПВП является более низкая токсичность в отношении пищеварительного тракта. Однако передозировка препарата (выше 10 г/сут) ассоциируется с гепатотоксичностью (Farrell G.C., 1986). В проведенном в Швеции популяционном исследовании было обнаружено, что частота госпитализации, связанных с гепатотоксичностью парацетамола, составила 2 случая на 100 тыс. населения в год (Denison H. et al., 1987). У пациентов с заболеваниями печени явления гепатотоксичности наблюдаются при приеме парацетамола в обычных терапевтических дозах (до 4 г/сут) (Benison H. et al., 1987). Результаты клинических наблюдений свидетельствуют о том, что у пациентов с хроническим алкоголизмом явления гепатотоксичности возникают на фоне лечения парацетамолом в дозе < 10 г/сут (Seeff L.B. et al., 1986; Maddrey W.C. et al., 1987). Во избежание побочного действия необходимо назначать парацетамол в минимальной дозе, позволяющей достичь лечебного эффекта, а также не рекомендовать его лицам, больным алкоголизмом (Choquette D. et al., 1999).
Парацетамол не угнетает синтез простагландинов в эпителии почек, однако в эксперименте продемонстрирован его тропизм к сосочкам почек с избыточным накоплением его метаболитов в ткани сосочков, с чем связано развитие характерного для парацетамола папиллярного некроза (Насонова В.А., 2002). Данные литературы свидетельствуют о развитии побочных эффектов со стороны почек при передозировке парацетамола (Kincaid-Smith P., 1986; Sandler D.P. et al., 1989). T.G. Murray и соавторы (1983) не обнаружили связи между хронической почечной недостаточностью (ХПН) и приемом анальгетиков. T.V. Perneger и соавторы (1994) сообщили результаты исследования риска развития ХПН при приеме обезболивающих препаратов безрецептурной группы. По их данным, кумулятивная доза парацетамола более 1000 таблеток удваивает риск развития ХПН. В то же время авторы исследования утверждают, что эти результаты свидетельствуют об отсутствии связи между приемом ацетилсалициловой кислоты и развитием ХПН. Данные T.V. Perneger и соавторов сомнительны и требуют подтверждения. National Kidney Foundation рекомендует парацетамол в качестве обезболивающего препарата выбора у пациентов с нарушением функции почек (Henrich W.L. et al., 1996).
В то же время результаты исследования C.M. Fored и соавторов (2001) материалов Шведского популяционного регистра за 1996–1998 гг. показали, что регулярный прием парацетамола, ацетилсалициловой кислоты или обоих препаратов повышает риск развития ХПН. Авторы подчеркивают, что предшествующие заболевания почек или системная патология являются предрасполагающими факторами. Были обследованы 926 больных с впервые установленным диагнозом почечной недостаточности и 998 лиц контрольной группы, из которых у 918 и 980 соответственно была необходимая документация. Среди больных с почечной недостаточностью ацетилсалициловую кислоту и парацетамол принимали регулярно 37 и 25% соответственно, а в контрольной группе — 19 и 12%. Относительный риск развития почечной недостаточности повышался с увеличением длительности приема и повышением дозы препаратов, которая была более постоянной у принимавших парацетамол, чем ацетилсалициловую кислоту, однако авторы не могли исключить роль предрасполагающих факторов.
Парацетамол не влияет на функцию тромбоцитов, поэтому его можно рекомендовать в качестве препарата выбора больным с ОА, принимающим антикоагулянты (Brandt K.D., 2000).
Парацетамол способен удлинять период полувыведения варфарина главным образом у больных, принимающих последний в дозе выше 10 мг/сут. Поэтому у пациентов, принимающих варфарин с парацетамолом, необходимо тщательно мониторировать показатель протромбинового времени (Fitzmaurice D.A. et al., 1997; Hyiek E.M. et al., 1998).
Наркотические анальгетики не рекомендуется назначать больным с ОА. Из-за высокого риска развития побочных эффектов (тошнота, рвота, запоры, задержка мочи, спутанность сознания, сонливость, психическая и физическая зависимость и др.) дериваты опиума при ОА используют лишь в особых клинических ситуациях (Choquette D. et al., 1999).
Трамадола гидрохлорид — относительно новый анальгетик, представляет собой синтетическое опиоидное средство, имеет два механизма действия:
- взаимодействует с m-опиоидными рецепторами,
- угнетает захват норэпинефрина и серотонина.
В качестве обезболивающего средства трамадола гидрохлорид в дозе 100 мг эффективнее кодеина в дозе 60 мг и сравним с комбинациями кодеина с ацетилсалициловой кислотой или парацетамолом (Sunshine A., 1994; Barkin R.L., 1995). В двухнедельном сравнительном исследовании применения трамадола гидрохлорида (300 мг/сут) и декстропропоксифена (300 мг/сут) у 264 больных с ОА отмечено уменьшение выраженности боли в пораженных суставах у 70% пациентов при лечении трамадола гидрохлоридом и у 50% — декстропропоксифеном (Jensen J.M., Ginsberg F., 1994). Однако первый вызвал бoльшее количество побочных эффектов (главным образом тошноту/рвоту, головокружение). По данным двойного слепого рандомизированного сравнительного исследования эффективности трамадола (300 мг/сут) и диклофенака (150 мг/сут) у 60 больных с ОА (цит. по Wallheim F.A., 1996), в конце 1-й и 4-й недели лечения уменьшение боли в пораженных суставах было одинаковым в обеих группах; в этом исследовании также сообщается о б?льшем числе побочных эффектов при лечении трамадола гидрохлоридом (23 случая) по сравнению с диклофенаком (2 случая). S.F. Roth (1995) обнародовал результаты плацебо-контролированного исследования трамадола у 50 больных с ОА, у которых на фоне НПВП сохраняется болевой синдром. Лечение трамадолом оказалось более эффективным, чем плацебо, но сопровождалось бо′льшим количеством побочных эффектов, главным образом появлением тошноты, запоров, сонливости.
При назначении трамадола в рекомендуемых дозах тяжелые побочные эффекты (угнетение дыхания) не зафиксированы. Для снижения риска возникновения диспепсии целесообразно титровать дозу трамадола гидрохлорида до целевой в течение 4–5 дней, начиная с 50 мг/сут (Choquette D. et al., 1999). F.A. Wallheim (1996), D. Choquette и соавторы (1999) рекомендуют назначать трамадола гидрохлорид больным с ОА только в случае неэффективности или непереносимости НПВП и парацетамола.
Кодеин и декстропропоксифен — представители синтетических опиоидов, которые нередко используют в лечении при ОА в комбинациях с НПВП и/или парацетамолом, несмотря на способность вызывать зависимость. В сравнительном исследовании комбинация парацетамола в дозе 2 г/сут и декстропропоксифена в дозе 180 мг/сут у больных с ОА была эффективнее, чем парацетамол (3 г/сут) и кодеин (180 мг/сут) (Boissier C. et al., 1992). В другом исследовании установлено, что декстропропоксифен и парацетамол лучше переносятся больными, чем дигидрокодеин (Lloyd R.S. et al., 1992). Однако, по данным R.I. Shorr и соавторов (1992), риск переломов бедренной кости у больных пожилого возраста, получавших кодеин или декстропропоксифен, составил 1,6 (95% доверительные интервалы (ДИ)=1,4–1,9), а сочетание кодеина или декстропропоксифена с психотропными средствами (седативными, антидепрессантами и др.) повышало риск переломов до 2,6 (95% ДИ =2,0–3,4).
Нестероидные противовоспалительные препараты (НПВП). Первым широкоизвестным НПВП была салициловая кислота, впервые синтезированная в 1874 г.; вскоре была обнаружена ее эффективность при ревматической лихорадке. В 1875 г. впервые для лечения ревматической лихорадки был использован натрия салицилат. В середине 80-х годов ХІХ в. натрия салицилат получил широкое распространение в качестве препарата для лечения лихорадки различного происхождения (малярия, тиф), ревматической лихорадки, ревматоидного артрита и подагры. Молодой химик Felix Hoffman, работавший в лаборатории Bayer Company в Германии, добавил ацетиловую группу к салициловой кислоте для улучшения ее органолептических свойств (Wordsworth B.P., 1997; Vane J.R., Botting R.M., 2000). Таким образом, более 100 лет назад компания «Bayer» впервые выпустила на фармацевтический рынок препарат Аспирин и по сей день кислота ацетилсалициловая остается одним из самых продаваемых препаратов в мире (более 45 тыс. тонн в год) (Kolts B.E., Achem S.R., 1992).
Появившийся в 1963 г. на фармацевтическом рынке индометацин был продуктом многолетнего поиска новых противовоспалительных агентов. Вскоре после индометацина были созданы такие препараты, как ибупрофен, напроксен, диклофенак и др. «Золотым» стандартом НПВП-терапии до настоящего времени является диклофенак; известных клинических исследований эффективность и безопасность исследуемого препарата оценивается по отношению именно к этому типу НПВП (В. Коваленко, 2004).
По прошествии более века после синтеза ацетилсалициловой кислоты и 40 лет с момента внедрения на фармацевтический рынок индометацина группа НПВП остается предметом интереса и многочисленных споров, в основном в отношении механизмов действия и побочных эффектов.
Первая публикация, в которой отмечалось негативное влияние ацетилсалициловой кислоты на слизистую оболочку пищеварительного тракта, появилась в 1938 г. При гастроскопии у пациентов, принимавших ацетилсалициловую кислоту, обнаружены эрозии и хронические пептические язвы (Douthwaith A., Lintott C.A., 1938). Несколько позже были описаны другие побочные эффекты этого препарата. Успешное применение ацетилсалициловой кислоты у больных с артритами способствовало поиску средств, не уступающих ей по эффективности, но более безопасных, главным образом в отношении пищеварительного тракта. Были разработаны такие препараты, как фенилбутазон, индометацин и фенаматы. Однако все они, обладая аналогичным ацетилсалициловой кислоте антипиретическим, обезболивающим и противовоспалительным действием, вызывали побочные эффекты, характерные для нее. Когда различные химические группы препаратов обладают одинаковыми терапевтическими свойствами и им характерен одинаковый спектр побочных эффектов, становится очевидным, что их активность связана с одним и тем же биохимическим процессом.
В течение нескольких десятилетий фармакологи и биохимики искали механизм действия НПВП. Решение проблемы возникло в ходе исследований простагландинов — группы биологически активных веществ, высвобождающихся из всех тканей за исключением эритроцитов и образующихся под действием фермента циклооксигеназы (ЦОГ) на мобилизированную из клеточных мембран арахидоновую кислоту. J.R. Vane и соавторы из Тhe Royal College of Surgeons обратили внимание, что высвобождение простагландинов из сенсибилизированных клеток легких морских свинок предотвращалось ацетилсалициловой кислотой (Palmer M.A. et al., 1970). Используя супернатант гомогената поврежденных клеток легких морских свинок в качестве источника ЦОГ, J.R. Vane и соавторы (1971) обнаружили дозозависимое угнетение образования простагландинов под действием салициловой и ацетилсалициловой кислот и индометацина.
В дальнейших исследованиях с использованием различных НПВП было установлено, что они не только угнетают ЦОГ, но и их активность в отношении ЦОГ коррелировала с противовоспалительной активностью (Vane J.R. et al., 1994; и др.). Угнетение ЦОГ и, таким образом, угнетение образования простагландинов стали рассматривать в качестве унифицированного механизма действия НПВП.
Таким образом, обезболивающее и противовоспалительное действие НПВП обусловлено угнетением активности ЦОГ — ключевого фермента метаболизма арахидоновой кислоты. Первым этапом воспалительного каскада (рис. 106) является высвобождение полиненасыщенных жирных кислот (в том числе арахидоновой кислоты), соединенных эфирной связью с глицеролом фосфолипидов клеточных мембран, под действием фосфолипаз А2 или С. Свободная арахидоновая кислота является субстратом для комплекса ПГН-синтетазы, включающей активные центры ЦОГ и пероксидазы. ЦОГ конвертирует арахидоновую кислоту в ПГG2, который в свою очередь превращается в ПГН2 под действием пероксидазы. Таким образом, НПВП угнетают превращение арахидоновой кислоты в ПГG2. Кроме того, арахидоновая кислота является субстратом для 5- и 12-липооксигеназ, катализирующих ее превращение в биологически активные лейкотриены и гидроксиэйкозатетраэноиковые кислоты. ПГ обладают провоспалительными свойствами, они повышают проницаемость стенки сосудов и высвобождение брадикининов.

Накопление ПГ коррелирует с интенсивностью воспаления и гипералгезией. Известно, что любая периферическая боль связана с повышением чувствительности специализированных нейронов — ноцицепторов, создающих сигнал, который распознается как боль. Мощным индуктором болевой чувствительности являются ПГ. Сами по себе они не являются модераторами боли, они лишь способны повышать чувствительность ноцицепторов к различным стимулам. ПГ как бы переключают нормальные («молчаливые») ноцицепторы в такое состояние, в котором они легко возбуждаются под влиянием любого фактора (Насонова В.А., 2001).
Особый интерес представляет открытие двух изоформ ЦОГ — ЦОГ-1 и ЦОГ-2, играющих разную роль в регуляции синтеза ПГ (табл. 72). О возможности существования двух форм ЦОГ стали впервые говорить после публикации J.L. Masferrer и соавторов (1990) результатов исследования влияния бактериального полисахарида на синтез ПГ моноцитами человека in vitro. Авторы показали, что дексаметазон блокировал увеличение синтеза ПГ под действием полисахарида, но не влиял на его базальный уровень. Кроме того, угнетение дексаметазоном продукции ПГ сопровождалось синтезом новой ЦОГ. Две изоформы ЦОГ открыли молекулярные биологи, изучавшие неопластическую трансформацию эмбриональных клеток цыпленка (Xie W. et al., 1991). Они обнаружили, что структура индуцибельной формы ЦОГ отличается от конститутивной формы и кодируется другими генами.

ЦОГ-1 — конститутивный фермент, который постоянно присутствует в клетках различных органов и регулирует синтез ПГ, которые обеспечивают нормальную функциональную активность клеток. Уровень активности ЦОГ-1 остается относительно постоянным, в то время как экспрессия ЦОГ-2 повышается до 80 раз при воспалении (Hla T. et al., 1993; Masferrer J.L. et al., 1994; Vane J.R. et al., 1994; Cavanaugh P.F.Jr. et al., 1995). Тем не менее, есть доказательства того, что ЦОГ-1 может также играть роль в воспалении (Vane J.R., 1971), а ЦОГ-2 играет более сложную роль в регуляции физиологических и патологических процессов в организме человека (см. табл. 72). В последние годы изучается роль ЦОГ-2 в развитии не только воспаления, но и других патофизиологических процессов, в первую очередь злокачественной трансформации клеток (Насонов Е.Л., 2000; Janne P.A., Mayer R.J., 2000).
Несмотря на то, что обе изоформы ЦОГ имеют одинаковую молекулярную массу (71 кД), только 60% их аминокислот гомологичны. Они также имеют различную локализацию в клетке: ЦОГ-1 находится главным образом в цитоплазме или эндоплазматическом ретикулуме, тогда как ЦОГ-2 расположена перинуклеарно и в эндоплазматическом ретикулуме.
ЦОГ-2 обусловливает синтез ПГ, которые вызывают воспаление, митогенез, клеточную пролиферацию и деструкцию. Мощными индукторами активности ЦОГ-2 являются ИЛ-1, ФНО, эпидермальный и тромбоцитарный факторы роста и другие, т. е. именно те биологически активные факторы, которые принимают участие в развитии воспаления.
Недавно появились данные о значительной роли ЦОГ-2 в развитии гипералгезии. По обобщенным данным, мРНК ЦОГ-2 способна индуцироваться в спинном мозге после развития периферического воспаления (Smith C.J. et al., 1998). По данным Института ревматологии РАМН, при периферическом воспалении в спинномозговой жидкости повышается уровень ПГ, высокочувствительных к угнетению ЦОГ-2 (Насонова В.А., 2001). Исследования последних лет продемонстрировали, что ЦОГ-2 — естественный (конститутивный) фермент, экспрессирующийся в спинном мозге (Wallace J.L., 1999; Crofford L.J. et al., 2000). Таким образом, ЦОГ-2 индуцирует все участки прохождения болевого импульса — локальный, спинальный и центральный (Beiche F. et al., 1996).
Следовательно результаты исследований последних лет «стирают» четкое разграничение ЦОГ-1 и ЦОГ-2 как конститутивного и индуцибельного, а также физиологического и патологического ферментов. Очевидно, что обе изоформы в одних тканях могут индуцировать воспаление, а в других поддерживать нормальную функцию клеток.
По последним данным, возможно существование еще одной изоформы — ЦОГ-3 (Willoughby D.A. et al., 2000). Исследуя эффекты ингибиторов ЦОГ у лабораторных крыс с экспериментальным плевритом в течение 48 ч после инъекции раздражителя, авторы обнаружили, что селективные ингибиторы ЦОГ-2, а также неселективные ингибиторы ЦОГ (например, индометацин) проявляют противовоспалительную активность в начале воспалительного ответа, что совпадает с экспрессией ЦОГ-2-протеина. Однако через 6 ч селективные ингибиторы ЦОГ-2 прекращали действовать, тогда как неселективные продолжали оказывать действие. В это время экспрессию ЦОГ-2-протеина не наблюдали. Наиболее удивительным оказался тот факт, что через 48 ч, когда воспалительный процесс почти полностью устранили, экспрессия ЦОГ-2 вновь появилась. Этот ЦОГ-2-протеин не вызывал синтеза провоспалительного ПГЕ2 ни в опыте ех vivo с экзогенной арахидоновой кислотой, ни in vivo. Наоборот, в это время наблюдали продукцию in vivo противовоспалительных ПГ (ПГD2 и ПГF2), а также представителя семейства циклопентенонов (15dcoxyD12 14ПГJ2) (Gilroy D.W. et al., 1998).
Угнетение новой изоформы ЦОГ селективными и неселективными ингибиторами ЦОГ-2 в промежутке между 24 ч и 48 ч после введения раздражителя привело к тому, что воспаление не разрешилось (как у нелеченых животных), а персистировало (Gilroy D.W. et al., 1999). По мнению D.A. Willoughby и соавторов (2000), описанный феномен представляет собой третью изоформу ЦОГ — ЦОГ-3, которая в отличие от первых двух вызывает образование противовоспалительных простаноидов.
Доказано, что НПВП угнетают активность обеих изоформ ЦОГ, но их противовоспалительная активность связана с угнетением именно ЦОГ-2.
После изучения трехмерной структуры ЦОГ-1 и ЦОГ-2 оказалось, что изоформы отличаются друг от друга главным образом структурой зоны связывания с субстратом — арахидоновой кислотой. Активная зона ЦОГ-2 более крупная, чем у ЦОГ-1, и имеет вторичный внутренний карман, что играет важную роль, так как, снабдив фармакологический агент «хвостом», комплементарным этому карману, можно получить препарат, размеры которого слишком большие для активной зоны ЦОГ-1, но форма соответствует активной зоне ЦОГ-2 (Picot D. et al., 1994; Luong C. et al., 1996; Vane J.R., Botting R.M., 2000).
Традиционные (неспецифические) НПВП подавляют прежде всего активность ЦОГ-1, чем и объясняется возникновение таких осложнений, как гастропатии, нарушение функции почек, агрегация тромбоцитов, энцефалопатии, гепатотоксичность и др.
НПВП-индуцированные побочные эффекты могут возникать везде, где продуцируются ПГ, чаще всего — в системе пищеварения, почках, печени, системе крови, сердечно-сосудистой системе (Gabriel S.C., 1997). У лиц пожилого возраста некоторые изменения (снижение продукции соляной кислоты в желудке, подвижности стенки желудка и кишечника и кровотока в ней, массы клеток слизистой оболочки, снижение почечного плазмотока, гломерулярной фильтрации, функции канальцев; уменьшение общего объема воды в организме, снижение уровня альбумина в плазме крови; уменьшение сердечного выброса) способствуют повышению риска развития побочных эффектов НПВП. Одновременный прием препаратов нескольких групп (особенно глюкокортикоидов), наличие сопутствующей патологии (болезни сердечно-сосудистой системы, почек, печени, бронхиальная астма) также повышают риск развития токсичности НПВП (Clements P.J., Paulus H.E., 1997).
Наиболее часто побочные эффекты НПВП наблюдаются со стороны пищеварительного тракта (табл. 73, 74).
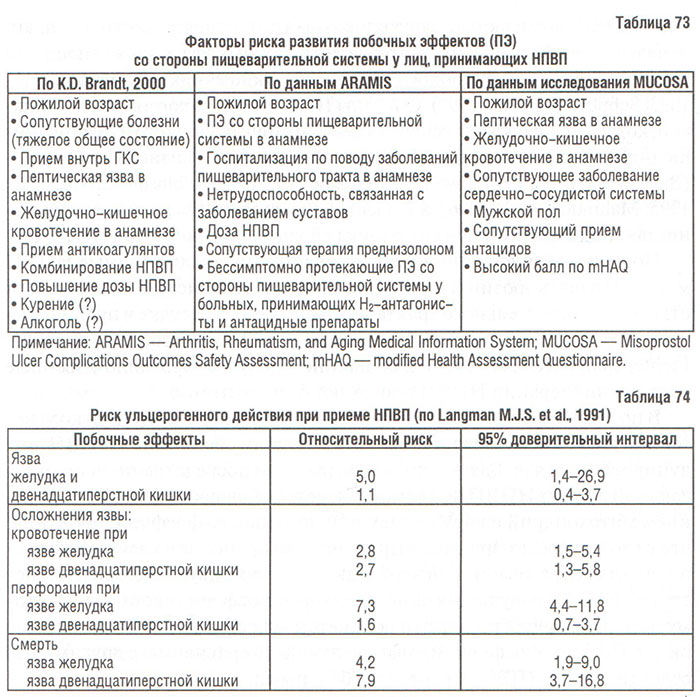
Результаты исследований свидетельствуют о возникновении симптомов со стороны пищеварительного тракта у 30% лиц, принимающих традиционные НПВП (Giercksky K.E. et al., 1989; Larkai E.N. et al., 1989). Среди пациентов пожилого возраста, принимающих НПВП, частота случаев госпитализации по причине развития пептической язвы в 4 раза превышала таковую у лиц той же возрастной группы, не принимающих НПВП (Griffin M.R. et al., 1988; 1991). По данным Arthritis, Rheumatism, and Aging Medical Information System (ARAMIS), у 73 из 1000 больных с ОА, принимающих НПВП в течение 1 года, отмечены серьезные осложнения со стороны пищеварительного тракта. В США среди больных с РА и ОА регистрируют 16,5 тыс. случаев смерти, обусловленной приемом НПВП, что сравнимо со смертностью от СПИДа и значительно превышает смертность от лимфомы Ходжкина, рака шейки матки, миеломной болезни или бронхиальной астмы (Wolfe M.M. et al., 1999). По данным метаанализа 16 контролированных исследований обнаружено, что относительный риск возникновения тяжелых побочных эффектов (тех, что приводят к госпитализации или смерти) со стороны пищеварительного тракта у лиц, принимающих НПВП, был в 3 раза выше, чем у лиц, не принимающих НПВП (Gabriel S.C., 1997). Согласно результатам этого метаанализа, факторами риска возникновения тяжелых побочных эффектов были возраст старше 60 лет, заболевания пищеварительной системы (гастрит, пептическая язва) в анамнезе, сопутствующий прием ГКС; наивысший риск развития побочных реакций со стороны системы пищеварения отмечен в первые три месяца лечения.
Побочные эффекты со стороны пищеварительного тракта включают функциональные расстройства, эзофагит, стриктуры пищевода, гастрит, эрозии слизистой оболочки, язвы, перфорацию, желудочно-кишечное кровотечение, летальный исход (Langman M.J.S., 1988; Fries J.P. et al., 1989; Fries J.P. et al., 1991; Gabriel S.C. et al., 1991; Kurata J., 1991; Miller D.K. et al., 1991; Pinkus T., Griffin M., 1991; Soll A.H. et al., 1991; Allison M.C. et al., 1992; Scheiman J.M., 1992; Bjarnason I. et al., 1993; Garcia Rodriguez L.A., Jick H., 1994; Langman M.J.S. et al., 1994; Wilcox C.M. et al., 1994; Lichtenstein D.R. et al., 1995; Talley N.J. et al., 1995; Mahmud T. et al., 1996; Gabriel S.C., 1997). Кроме хорошо известных влияний НПВП на слизистую оболочку желудка и двенадцатиперстной кишки, появляется все больше данных о развитии побочных эффектов в отношении слизистой оболочки как тонкого, так и толстого кишечника (Bjarnason I. et al., 1993; Schubert T.T. et al., 1993). Описаны НПВП-индуцированные энтеропатии, которые сопровождались образованием стриктур тонкого и толстого кишечника, язв, перфорацией, атрофией ворсинок слизистой оболочки (Bjarnason I. et al., 1993; Kwo P.Y., Tremaine W.J., 1995; Robinson M.H.E. et al., 1995; Mahmud T. et al., 1996). S.E. Gabriel и соавторы (1991) описали нарушение проницаемости стенки кишечника у больных, принимавших НПВП.
По данным эндоскопических исследований, традиционные НПВП могут вызывать эрозии и кровоизлияния в подслизистый слой в любом отделе пищеварительного тракта, но чаще всего в желудке в препилорическом отделе и антруме (Scheiman J.M., 1992; Bjarnason I. et al., 1993; Lichtenstein D.R. et al., 1995). В большинстве случаев эрозивно-язвенные осложнения терапии НПВП протекают бессимптомно.
В последнее время в ряде исследований установлено, что только угнетением ЦОГ-1 невозможно объяснить механизм образования НПВП-индуцированных язв. Важное значение имеет непосредственный повреждающий эффект НПВП на клетки слизистой оболочки желудка с поражением митохондрий и нарушением окислительного фосфорилирования, что в свою очередь нарушает энергетические процессы в клетке. Возможно, что для образования язв необходимо наличие двух факторов — угнетения ЦОГ-1 и нарушения окислительного фосфорилирования. Поэтому, вероятно, флурбипрофен и набуметон — препараты, не нарушающие окислительное фосфорилирование, лучше по сравнению с другими неселективными НПВП переносятся больными.
При постоянном приеме НПВП развитие побочных эффектов зависит от дозирования и длительности терапии (Gabriel S.C., 1997). Прием НПВП на протяжении 3 мес вызывает побочные эффекты со стороны пищеварительного тракта у 1–2% больных, на протяжении года — у 2–5% (Clements P.J., Paulus H.E., 1997).
В настоящее время обсуждается возможная роль Helicobacter pylori в развитии НПВП-индуцированных побочных эффектов со стороны пищеварительной системы (Schieman J.M., 1996; Kurata J., Nogawa A., 1997). Известно, что 95% больных с пептической язвой двенадцатиперстной кишки инфицированы Helicobacter pylori, в то же время в большинстве случаев НПВП-индуцированные побочные эффекты развиваются в слизистой оболочке желудка, где инфицированность составляет 60–80% (Peloso P.M., 1997). Кроме того, механизм повреждения слизистой оболочки пищеварительного тракта Helicobacter pylori не связан с синтезом ПГ (Wallace J., 1994; 1996). Тем не менее, имеются свидетельства, что НПВП играют роль в рецидивировании Helicobacter-индуцированных язв (Heresbach D. et al., 1992; Kim J.G. et al., 1994; Taha A.S. et al., 1995), поэтому пациенты с пептической язвой в анамнезе входят в группу риска развития побочных эффектов при терапии НПВП (см. табл. 74). В настоящее время неизвестно, снижает ли эрадикация Helicobacter pylori риск развития побочных эффектов со стороны пищеварительной системы у больных, получающих НПВП (Marshall B.J., 1994; Rabeneck L., Graham D.Y., 1997).
НПВП могут вызывать побочные эффекты со стороны почек, включая острую почечную недостаточность/преренальную азотемию, ренальную вазоконстрикцию, аллергический интерстициальный нефрит, нефротический синдром, гиперкалиемический/гипоренинемический гипоальдостеронизм, задержку натрия и воды, резистентность к лечению диуретиками, гипонатриемию (Backalew V.M.Jr., Schey H.M., 1986; Cooper K., Bennett W.M., 1987; Eriksson L.O. et al., 1991; Carson J.L., Willet L.R., 1993). Однако данные эпидемиологических исследований свидетельствуют о низком риске развития дисфункции почек под действием НПВП (Whelton A. et al., 1990; Gabriel S.E., 1997).
Нефротоксичность НПВП реализуется с помощью двух механизмов — угнетение синтеза ПГ и идиосинкразия к НПВП. В условиях нормальной перфузии почки не вырабатывают ПГ, поэтому при применении НПВП побочные эффекты не возникают. Снижение перфузии почек (при ХПН и ХСН, дегидратации, болезнях печени, в пожилом возрасте) сопровождается продукцией ПГЕ2 и ПГI2. Эти ПГ индуцируют местную вазодилатацию для поддержания нормального гломерулярного кровотока, а также стимулируют диурез, натрийурез и высвобождение ренина. Если такой пациент принимает НПВП, у него снижаются почечный кровоток и гломерулярная фильтрация, увеличивается секреция антидиуретического гормона, происходит задержка натрия хлорида и воды, подавляется высвобождение ренина (рис. 107). Возникает состояние гипоренинемического гипоальдостеронизма, возможно развитие острой почечной недостаточности. Угнетение НПВП ЦОГ также может привести к гиперкалиемии, особенно у пациентов с сопутствующими заболеваниями, в первую очередь сахарным диабетом, а также к нивелированию эффектов диуретической и антигипертензивной терапии (Clements P.J., Paulus H.E., 1997).
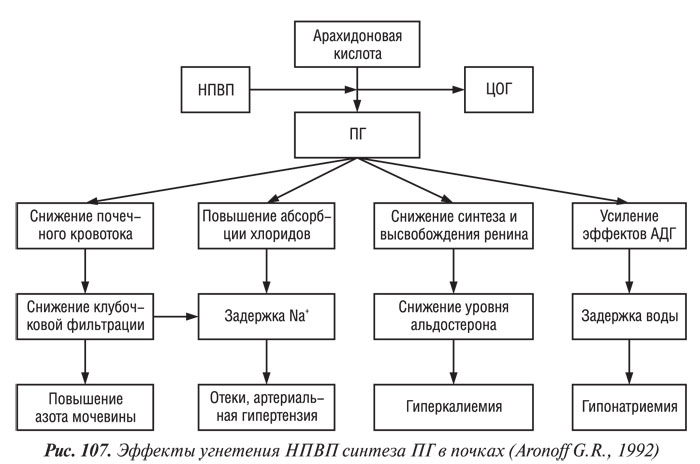
Аллергический интерстициальный нефрит представляет собой проявление идиосинкразии к НПВП, сопровождается лихорадкой, кожной сыпью и эозинофилией, возникает спустя 1–2 нед после начала терапии НПВП и претерпевает обратное развитие при их отмене. К другим проявлениям идиосинкразии к НПВП относят липоидный нефроз и папиллярный некроз (Goodman T.A., Simon L.S., 1994).
В табл. 75 представлены различные типы повреждений печени, ассоциированные с приемом НПВП. Несмотря на то, что гепатотоксичность — редкое проявление непереносимости НПВП, частота развития этого побочного эффекта варьирует при использовании разных препаратов этой группы. Так, повреждение печени при приеме ацетилсалициловой кислоты зависит от дозы препарата и от заболевания — при системной красной волчанке и ювенильном РА гепатотоксичность развивается чаще, чем при других заболеваниях (Brandt K.D., 2000). Гепатопатия, вызванная приемом ацетилсалициловой кислоты, чаще протекает бессимптомно, редко ведет к развитию хронической печеночной недостаточности и очень редко — к летальном исходу.

Кроме того, появились данные о поражении печени нимесулидом (Steenbergen W.V. et al., 1998; Merlani G. et al., 2001).
Большинство больных, принимающих препараты этого класса, относятся к группе лиц пожилого возраста, нуждающихся в постоянной профилактике острых кардиоваскулярных событий. На основании анализа 181 441 историй болезни W.A. Ray и соавторы (2002) пришли к выводу, что несмотря на сочетанное блокирование ЦОГ-1 и ЦОГ-2, неселективные НПВП не оказывают кардиопротекторного действия (в отличие от ацетилсалициловой кислоты в низких дозах), поэтому при необходимости их нужно назначать сочетанно с ацетилсалициловой кислотой. Так, ибупрофен блокирует ингибиторный эффект низких доз ацетилсалициловой кислоты в отношении высвобождения тромбоксана и агрегации тромбоцитов, а более медленно действующий диклофенак обладает отсроченными подобными эффектами и поэтому лучше сочетается с ацетилсалициловой кислотой. В то же время обнаружено, что коксибы и парацетамол не конкурируют с ацетилсалициловой кислотой в низких дозах в отношении дезагрегационной функции (Catella-Lawson R. et al., 2001). Однако ацетилсалициловая кислота способна ухудшать переносимость НПВП, как это было продемонстрировано в исследовании CLASS. Таким образом, при выборе НПВП больному, получающему ацетилсалициловую кислоту в низких дозах, необходимо учитывать характер их взаимодействия.
В последние годы актуальной стала проблема взаимодействия НПВП и гипотензивных препаратов, а также применения НПВП при артериальной гипертензии. Известно, что в связи с подавлением ЦОГ-1, необходимой для поддержания многих физиологических функций, включая почечное кровообращение, НПВП могут нивелировать эффект многих гипотензивных агентов, особенно ингибиторов АПФ и блокаторов β-адренорецепторов. Кроме того, влияние специфических ингибиторов ЦОГ-2 на сердечно-сосудистую систему недостаточно изучено. В рандомизированном сравнительном исследовании применения целекоксиба (200 мг/сут) и рофекоксиба (25 мг/сут) более чем у 800 больных с ОА, получавших гипотензивную терапию по поводу эссенциальной артериальной гипертензии, A. Welton и соавторы (2001) обнаружили, что систолическое АД повысилось у 17% больных, принимавших рофекоксиб, и у 11% принимавших целекоксиб, а диастолическое АД — у 2,3 и 1,5% соответственно. Через 6 нед лечения у больных, получавших рофекоксиб, систолическое АД повысилось в среднем на 2,5 мм рт. ст. по сравнению с исходным, а в группе пациентов, принимавших целекоксиб, даже снизилось на 0,5 мм рт. ст. Авторы пришли к выводу о совместимости коксибов и гипотензивных препаратов, однако переносимость целекоксиба была лучшей — реже развивались отечный синдром и дестабилизация АД. Почти половина больных обеих групп из препаратов гипотензивного ряда получали диуретики, ингибиторы АПФ, антагонисты кальция, блокаторы β-адренорецепторов в виде монотерапии, остальные пациенты в каждой группе (48,5 и 44,9% соответственно — целекоксиб и рофекоксиб) получали комбинированную терапию и более трети (37,9 и 37,1%) в каждой группе — ацетилсалициловую кислоту в низких дозах. Таким образом, больным, принимающим антигипертензивную терапию, необходимо проводить мониторинг АД для выявления побочных эффектов со стороны сердца и почек в случае приема специфических ингибиторов ЦОГ-2. У пациентов, принимающих целекоксиб, отмечали менее выраженный отек и дестабилизацию АД, чем у больных, принимавших рофекоксиб.
Кроме опосредованного ПГ действия НПВП обладают и другими, не связанными с ПГ и ЦОГ, эффектами. Среди них — непосредственное влияние на различные процессы в клетках и клеточных мембранах. Так, НПВП угнетают активацию и хемотаксис нейтрофильных гранулоцитов, снижают продукцию свободных кислородных радикалов в них (Brooks P.M., Day R.O., 1991; Furst D.E., 1994). Являясь липофильными субстанциями, НПВП встраиваются в липидный бислой клеточных мембран и, предотвращая тем самым взаимодействие между белками, угнетают передачу сигнала. Некоторые НПВП in vitro угнетают попадание фагоцитов в зону воспаления (Brooks P.M., Day R.O., 1991; Furst D.E., 1994).
Наряду с ингибицией синтеза ПГ имеются данные о других механизмах анальгетической активности НПВП. К ним относятся: центральное опиоидноподобное антиноцицептивное действие: блокада NMDA-рецепторов (увеличение синтеза кинурениновой кислоты), изменение конформации a-субъединиц G-белка, подавление афферентных болевых сигналов (нейрокинины, глутаминовая кислота), повышение содержания 5-гидрокситриптамина. О существовании ПГ-независимых механизмов косвенно свидетельствуют данные о диссоциации между антивоспалительным (ЦОГ-зависимым) и анальгетическим (антиноцицептивным) эффектами НПВП.
Ряд НПВП влияют на синтез протеогликанов хондроцитами in vitro (Ghosh P., 1988; Rashad S. et al., 1989; Bradley J.D. et al., 1992; Dieppe P.A., Cushnaghan J. et al., 1993; Dieppe P.A., Frankel S.J. et al., 1993; Paulus H., Bulpitt K.J., 1993; Brandt K.D., 1995). J.T. Dinger и M. Parker (1997) предложили классификацию НПВП, основанную на их действии in vitro на синтез компонентов матрикса хряща при ОА:
- ингибирующие: индометацин; напроксен; ибупрофен; нимесулид;
- нейтральные: пироксикам; набуметон;
- стимулирующие: тенидап; ацеклофенак.
Однако экстраполяция результатов таких исследований на организм человека сомнительна. G.J. Carrol и соавторы (1992) осуществляли ежемесячную аспирацию суставной жидкости из коленных суставов у 20 больных с остеохондрозом, принимавших пироксикам, и обнаружили незначительное снижение концентрации кератан сульфата. Несмотря на то, что полученные результаты могут указывать на снижение катаболизма протеогликанов, как подчеркивают авторы, возможны и другие интерпретации. Более подробно сложности толкования результатов исследования «модифицирующих болезнь» свойств препаратов, применяемых при ОА, рассмотрены в главе 4.
Салицилаты угнетают активность фосфолипазы С в макрофагах. Некоторые НПВП in vitro угнетают продукцию ревматоидного фактора, препятствуют адгезии нейтрофильных гранулоцитов к эндотелиоцитам и снижают экспрессию L-селектинов, тем самым угнетая миграцию гранулоцитов в зону воспаления.
Еще одним важным, не связанным с ПГ, биологическим эффектом НПВП является влияние на метаболизм оксида азота (Amin A.R. et al., 1995). Так, НПВП угнетают NF-kВ-зависимую транскрипцию, что ведет к блокированию индуцибельной NO-синтазы. Последняя, индуцированная провоспалительными цитокинами, вырабатывает большое количество NO, что ведет к усилению признаков воспаления — гиперемии, повышению проницаемости сосудов и др. Ацетилсалициловая кислота в терапевтических дозах угнетает экспрессию индуцибельной NO-синтазы и последующую продукцию NO (Amin A.R. et al., 1995).
Таким образом, в зависимости от характера блокирования ЦОГ НПВП делят на селективные и неселективные ингибиторы ЦОГ (табл. 76). Селективные ингибиторы ЦОГ-2 обладают меньшим спектром побочных эффектов и лучшей переносимостью. Относительная селективность НПВП для каждого изомера определяется как соотношение ЦОГ-2/ЦОГ-1 и рассчитывается из показателя IC50 препарата для обеих изоформ, что выражает концентрацию препарата, ингибирующего синтез ПГ на 50% (Pairet M., Engelhardt G., 1996). Коэффициент селективности ниже 1 указывает на относительную селективность к ЦОГ-2, в то время как коэффициент выше 1 — на относительную селективность к ЦОГ-1.

Для определения ЦОГ-селективности НПВП используют различные экспериментальные модели. Необходимо отметить, что прямое сравнение результатов исследований селективности НПВП, полученных в разных лабораториях, невозможно, так как показатели IC50 и соотношение ЦОГ-2/ЦОГ-1 очень варьируют даже при использовании одной и той же методики. Такая вариабельность может зависеть от вида клеток, используемых в качестве модели, типа ферментного препарата, времени инкубации с НПВП, метода индуцирования ЦОГ-2, содержания белков в питательной среде и др. (Pairet M., van Ryn J., 1999). Так, например, набуметон проявляет ЦОГ-2-селективные свойства в модели, использующей мышиный фермент в микросомальных мембранах (Meade E.A. et al., 1993), но его ЦОГ-2-селективности недостаточно, чтобы продемонстрировать ее на моделях фермента человека в клеточных или микросомальных мембранах (Laneuville O. et al., 1994; Churchill L. et al., 1996) или в клетках крови человека ex vivo (Patrignani P. et al., 1994).
Таким образом, для более корректной оценки селективности НПВП необходимо, чтобы результаты были подтверждены на нескольких моделях. Наиболее показательными оказались исследования с использованием клеток крови человека (Patrignani P. et al., 1994; Warner T.D. et al., 1999). Хотя абсолютный показатель может варьировать, порядок соотношения ЦОГ-2/ЦОГ-1, как правило, одинаков, когда соединения исследуются несколькими методами.
Неселективные ингибиторы ЦОГ не утратили своей актуальности в силу высокой противовоспалительной активности, выраженного обезболивающего эффекта, однако их применение сопряжено с бoльшей вероятностью развития побочных эффектов.
Существует несколько десятков НПВП, сходных по химическим, фармакологическим свойствам и механизму действия (табл. 77).
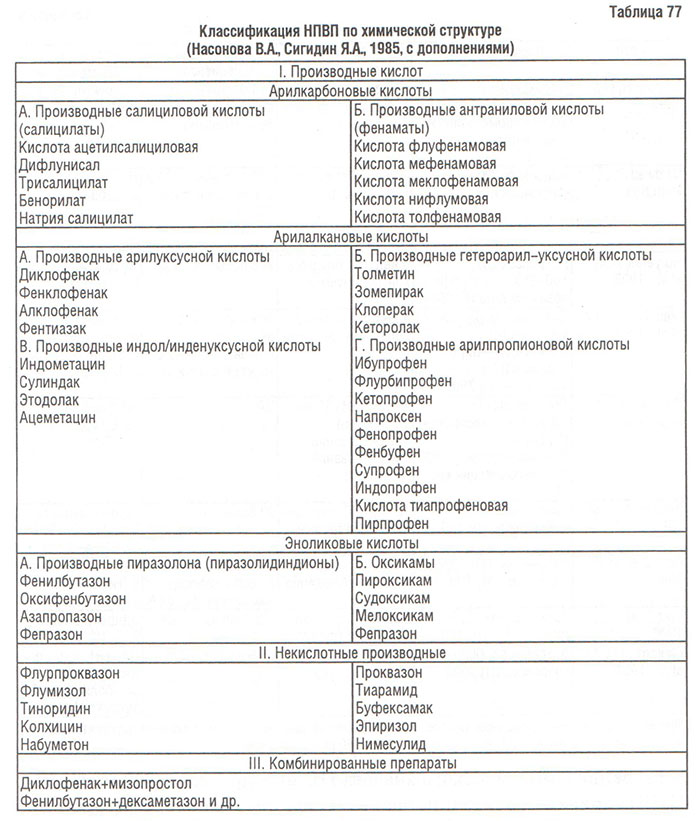
В табл. 78 приведены результаты сравнительных исследований эффективности и безопасности НПВП. Несмотря на то, что все они сопоставимы по дизайну и количеству обследованных пациентов, установлено, что эффективность НПВП выше, чем плацебо, а новые препараты обладают лучшей переносимостью. К настоящему времени не получены четкие доказательства преимущества одного НПВП над другим по эффективности. Даже если по данным многоцентрового исследования выявлены преимущества препарата данной группы, в рутинной клинической практике это часто не находит подтверждения. Однако реально можно оценить и сопоставить переносимость НПВП. Безопасность — основной признак, по которому различаются препараты этой группы.
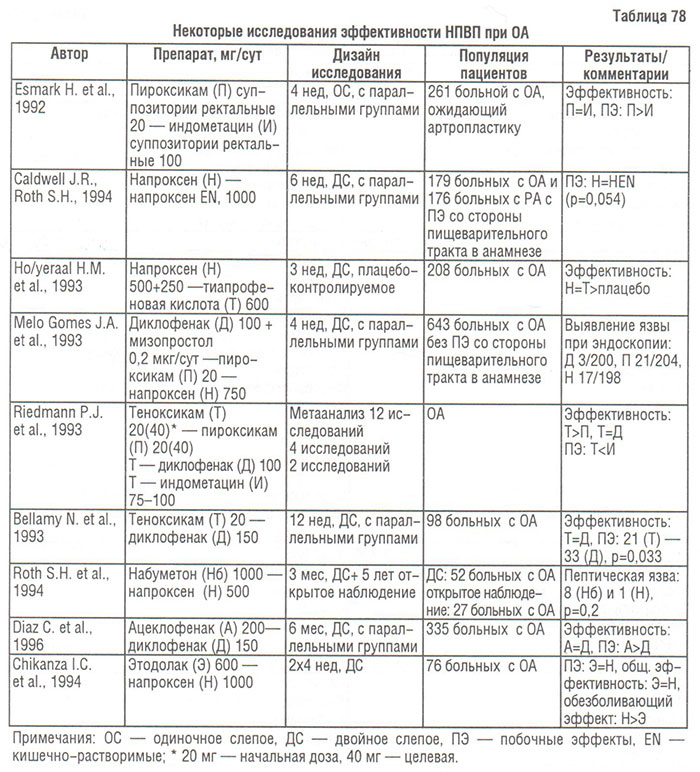
В многоцентровом исследовании The LINK Study было продемонстрировано, что при длительном применении индометацина в 2 раза увеличивается потеря суставного хряща по сравнению с использованием плацебо. Гепатотоксичность чаще наблюдается при лечении диклофенаком. Асептический менингит — редкая, но тяжелая побочная реакция на прием ибупрофена и сулиндака. Цистит — осложнение, которое наблюдают на фоне лечения тиапрофеновой кислотой (Ahmed M., Davison O.W., 1991; Ghosh P. et al., 1993; Harrison W.J. et al., 1994; Mayall F.G. et al., 1994); альвеолит может индуцироваться напроксеном, индометацин вызывает сонливость. Изменения формулы крови, а также различные кожные высыпания изредка могут возникать на фоне приема всех НПВП. По данным N. Bateman (1994), среди неселективных НПВП наиболее безопасны ибупрофен и диклофенак, а наиболее токсичны — пироксикам и азапропазон. Однако D. Henry и соавторы (1996) определили, что переносимость ибупрофена в высоких дозах не отличалась от таковой напроксена и индометацина. В то же время эффективность и безопасность производных пропионовой кислоты послужила основанием для выпуска безрецептурных лекарственных форм этих препаратов (ибупрофен, кетопрофен и напроксен), которые широко используются для купирования боли различной этиологии.
В связи с тем что серьезные побочные эффекты со стороны пищеварительной системы вызваны НПВП, зависят от дозы препарата, назначать ЦОГ-неселективный НПВП больному с ОА для купирования боли следует в низкой, т. е. «анальгетической» дозе, которую можно повысить до «противовоспалительной», если первая оказалась неэффективной. Пациентам группы риска ЦОГ-неселективные НПВП даже в низких дозах необходимо назначать в сочетании с гастропротекторами (Brandt K.D., 2000).
В 6-месячном плацебо-контролированном клиническом исследовании MUCOSA (Misoprostol Ulcer Complications Outcomes Safety Assessment) добавление синтетического аналога ПГ мизопростола (800 мкг/сут) к НПВП привело к снижению частоты серьезных побочных эффектов со стороны пищеварительной системы на 40% по сравнению с плацебо (Silverstein J.E. et al., 1995). При этом, несмотря на большое количество обследованных больных (около 9000 тыс.), снижение с помощью мизопростола риска развития побочных эффектов едва достигло статистической достоверности (р=0,049). Более того, прием мизопростола ассоциировался с другими дозозависимыми побочными эффектами, в частности с диареей. Мизопростол в дозе 400 мкг/сут переносился лучше, чем в дозе 800 мкг/сут, однако по данным фиброгастроскопии в меньшей степени вызывал гастропротекторный эффект (Raskin J.B. et al., 1995).
В качестве альтернативы мизопростолу целесообразно использовать антагонисты Н2-рецепторов (например, фамотидин) или блокаторы протонного насоса (например, омепразол) (Brandt K.D., 2000). Обе группы препаратов продемонстрировали эффективность при лечении и профилактике НПВП-индуцированных язв в исследованиях с использованием фиброгастроскопии (Ekstro P. et al., 1996; Taha A.S. et al., 1996; Hawkey C.J. et al., 1998; Yeomans N.E. et al., 1998). Однако в обычных терапевтических дозах Н2-антагонисты были менее эффективны, чем мизопростол, тогда как омепразол не уступал ему по эффективности при лечении НПВП-индуцированных язв, отличался лучшей переносимостью и характеризовался более низкой частотой рецидивов (Hawkey C.J. et al., 1998).
Мелоксикам — первый на украинском фармацевтическом рынке селективный ингибитор ЦОГ-2. Его способность селективно угнетать ЦОГ-2 исследовалась в многочисленных исследованиях in vitro (см. табл. 9.8) и in vivo. Так, по данным G. Engelhardt и соавторов (1996), изучавших действие мелоксикама и других НПВП (пироксикам, теноксикам, тенидап, диклофенак, напроксен и флурбипрофен) на активность ЦОГ-2 в воспаленных тканях у живых животных (перитонит у мышей и плеврит у крыс), а также на активность ЦОГ-1 в желудке, почках и крови, первый был более сильным ингибитором синтеза ПГЕ2 в воспаленных тканях. Так, при перитонитах у мышей он оказался в 2 раза активнее пироксикама и более чем в 10 раз активнее, чем диклофенак или напроксен, а при плевритах у крыс — в 2 раза эффективнее теноксикама. При плевритах у крыс мелоксикам оказывал эффект такого же порядка по уровню активности, как пироксикам, хотя первый имел менее крутую кривую «доза — ответ». В то время как на фоне приема других НПВП повышалась концентрация ЛТВ4, который принимает участие в механизме развития бронхоспазма при приеме НПВП, доза мелоксикама, достаточная для угнетения ПГЕ2 в воспалительном экссудате не влияла на его концентрацию. Мелоксикам в наименьшей степени угнетал синтез ПГ, опосредованный ЦОГ-1. Результаты данного исследования позволили авторам сделать вывод о том, что у грызунов мелоксикам является сильным ингибитором синтеза ПГ в условиях воспаления, но слабым ингибитором в нормальных физиологических условиях. Пироксикам проявил подобную противовоспалительную активность, но был также более сильным ингибитором физиологического синтеза ПГ.
Безопасность мелоксикама у человека in vivo и его эффективность у больных с ОА была отмечена в многочисленных публикациях. Результаты 3-недельного двойного слепого плацебо-контролированного исследования эффективности и переносимости мелоксикама в дозе 7,5 и 15 мг/сут у больных с манифестным ОА коленных суставов (n=411) подтвердили, что мелоксикам в обеих дозах значительно превосходит плацебо по эффективности и сравним с ним по частоте побочных эффектов (Lund B. et al., 1994).
B. Linden и соавторы (1996) в 6-недельном исследовании сравнивали эффективность и переносимость мелоксикама 15 мг/сут и пироксикама 20 мг/сут в лечении при ОА тазобедренных суставов. В обеих группах у больных отмечено одинаковое снижение индекса тяжести гонатроза (индекса Лекена) и уменьшение боли при движении. На фоне лечения мелоксикамом побочные эффекты со стороны пищеварительного тракта отмечали у 20,9% больных, а в группе пациентов, получавших пироксикам — в 22,8% случаев. Серьезные побочные эффекты со стороны пищеварительной системы были выявлены у 1 больного из 129, получавших мелоксикам, и у 3 из 127, принимавших пироксикам. В другом исследовании, в рамках которого больные с ОА коленного и тазобедренного суставов в течение 6 мес принимали мелоксикам 15 мг/сут или пироксикам 20 мг/сут, о переносимости этих препаратов получены несколько иные данные. В группе пациентов, получавших мелоксикам, частота возникновения побочных эффектов со стороны пищеварительной системы была значительно ниже (24,2%), чем у больных, получавших пироксикам (30,2%), а время до появления побочного действия было продолжительнее (соответственно 163 и 144 дня).
Результаты 6-недельного клинического сравнительного исследования эффективности и безопасности мелоксикама 15 мг/сут и диклофенака (медленного высвобождения) 100 мг/сут у больных с ОА свидетельствуют о незначительном превосходстве первого в отношении общей эффективности лечения, а также выраженности боли в пораженных суставах при ходьбе и в покое (Goie T.H. et al., 1993). Однако у пациентов, принимавших диклофенак, отмечена большая частота развития побочных эффектов со стороны пищеварительной системы (26,2%) по сравнению с группой мелоксикама (16,4%). В 6-месячном исследовании J. Hosie и соавторы (1996) сравнивали эффективность и безопасность мелоксикама в дозе 7,5 мг/сут и диклофенака (медленного высвобождения) 100 мг/сут у больных с ОА. Значительных различий эффективности между исследуемыми препаратами не обнаружено. Однако переносимость мелоксикама оказалась лучшей, чем диклофенака. Несмотря на то что общее количество побочных эффектов в группе мелоксикама было таким же, как и в группе диклофенака, в первой они носили более легкий характер и возникали в более поздний период. Серьезные побочные эффекты чаще отмечали при лечении диклофенаком (22%), чем мелоксикамом (15,8%). У больных, принимавших диклофенак, выявлены значительные отклонения от нормы в лабораторных анализах (снижение гемоглобина, уменьшение количества лейкоцитов, увеличение количества мочевины и изменения в печеночных тестах), в то время как в группе мелоксикама отмечали лишь клинически не значимые изменения лабораторных параметров. В группе диклофенака 18,8% больных отказались от дальнейшего лечения из-за развития побочных эффектов, тогда как пациенты, получавшие мелоксикам — лишь в 12,4% случаев.
Основной задачей многоцентрового проспективного двойного слепого рандомизированного исследования MEloxicam Large-scale International Study Safety Assessment (MELISSA) было изучить переносимость мелоксикама (в Украине зарегистрирован и применяется препарат Мовалис производства компании «Boehringer Ingelheim») в больших относительно нерандомизированных группах больных и дополнить данные, полученные в других исследованиях в более ограниченных условиях (Hawkey C. et al., 1998). В качестве препарата сравнения был выбран диклофенак — препарат с относительно низким уровнем токсичности в отношении пищеварительного тракта (Willkens R.F., 1985; Hosie J. et al., 1996). По результатам исследований M. Distel и соавторов (1996) и J. Hosie и соавторов (1996), доза мелоксикама 7,5 мг/сут была рекомендована к использованию коротким курсом при обострении симптомов ОА. В исследование включили 10 051 больного с ОА, которые были разделены на три группы в зависимости от получаемого лечения (мелоксикам — 7,5 мг/сут, лекарственная форма диклофенака с модифицированным высвобождением активного вещества — 100 мг/сут или плацебо в течение 28 дней). В группе больных, получавших мелоксикам, зарегистрировано значительно меньшее количество побочных эффектов со стороны пищеварительной системы, чем у больных, леченных диклофенаком (рис. 108а). В группе мелоксикама у 5, а в группе диклофенака у 7 пациентов наблюдали серьезные побочные эффекты (ульцерогенное действие, перфорация язвы, желудочно-кишечное кровотечение) (р>0,05). Эндоскопически у 4 пациентов, получавших диклофенак, обнаружены осложнения язвы, в то время как в группе мелоксикама таковых не выявили. В группе мелоксикама общая длительность госпитализации в связи с развитием побочных эффектов составила 5 дней, тогда как в группе диклофенака — 121 день. Среди отказавшихся от лечения в связи с этим 254 (5,48%) больных принимали мелоксикам и 373 пациента (7,96%) — диклофенак (р<0,001). Побочные явления со стороны пищеварительного тракта были причиной отказа больных от продолжения лечения в 3,02% случаев в группе мелоксикама и в 6,14% случаев в группе диклофенака (р<0,001). Однако значительно большее количество больных, получавших мелоксикам, отказались от дальнейшего лечения в связи с недостаточной его эффективностью (80 из 4635 в группе мелоксикама и 49 из 4688 в группе диклофенака, р<0,01). В группе пациентов, принимавших диклофенак, также отмечали более выраженную положительную динамику по ВАШ боли, чем в группе мелоксикама. Таким образом, результаты исследования свидетельствуют о том, что профиль переносимости мелоксикама значительно лучше по сравнению с другими традиционными НПВП, включая диклофенак, что может быть обусловлено ЦОГ-2-селективностью, а также другими причинами (например, дозой).
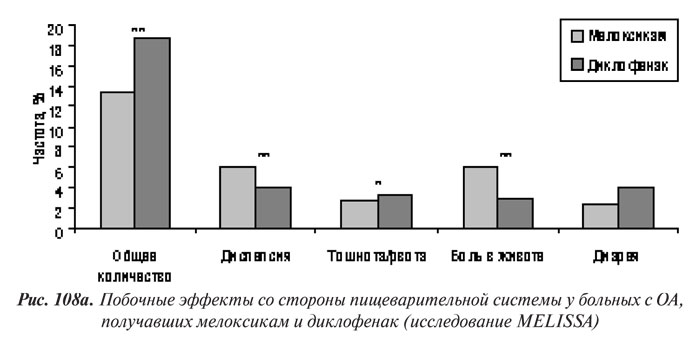
SELECT (Safety and Efficacy Large-scale Evaluation of COX-inhibiting Therapies) — еще одно масштабное многоцентровое двойное слепое рандомизированное исследование с параллельными группами (Dequeker J. et al., 1998). В рамках этого исследования пациенты с манифестным ОА получали рекомендованные дозы мелоксикама (7,5 мг/сут) и пироксикама (20 мг/сут). В группе мелоксикама было 4320 больных с ОА, а в группе пироксикама — 4336. Общая частота побочных эффектов была значительно ниже у пациентов, получавших мелоксикам (22,5%), чем у больных, леченных пироксикамом (27,9%; р<0,001). Это достигалось благодаря значительно более низкой частоте побочных эффектов со стороны пищеварительного тракта (рис. 108б) в группе мелоксикама по сравнению с группой пироксикама (соответственно 10,3 и 15,4%, р<0,001). В то же время эффективность обоих препаратов была одинакова. Серьезные побочные эффекты наблюдали у 16 больных в группе пироксикама и у 7 больных в группе мелоксикама (относительный риск пироксикам/мелоксикам=1,4). Таким образом, результаты исследования SELECT подтверждают результаты других исследований, в которых сравнивали переносимость мелоксикама с другими НПВП, и дополняют данные о связи между селективным угнетением ЦОГ-2 и улучшением переносимости НПВП.
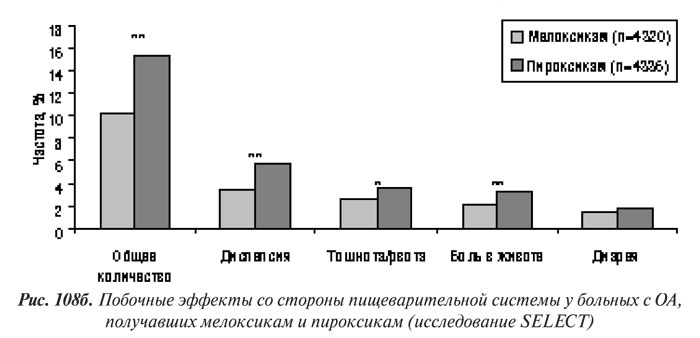
Данные метаанализа 10 рандомизированных сравнительных исследований эффективности и/или переносимости мелоксикама в дозах 7,5 мг/сут и 15 мг/сут и референтных НПВП (пироксикам — 20 мг/сут, диклофенак — 100 мг/сут, напроксен — 750 мг/сут) свидетельствуют, что первый вызывал значительно меньшее количество побочных эффектов по сравнению с референтными НПВП (относительное соотношение — OC — 0,64, 95% ДИ 0,59–0,69) (Schoenfeld P., 1999). В частности, у больных, принимавших мелоксикам, реже отмечалось ульцерогенное действие, перфорация язвы и желудочно-кишечное кровотечение (ОС=0,52, 95% ДИ 0,28–0,96), они реже отказывались от дальнейшего лечения в связи с развитием побочных эффектов (ОС=0,59, 95% ДИ 0,52–0,67), а также реже предъявляли жалобы на диспепсию (ОС=0,73, 95% ДИ 0,64–0,84).
Риск возникновения побочных реакций со стороны пищеварительного тракта меньше даже у лиц, получающих сочетанную терапию мовалисом и кардиопротективными дозами аспирина (Degner F. et al., 2001).
Фармакокинетические свойства препарата Мовалис® (производства компании «Boehringer Ingelheim») позволяют принимать препарат 1 раз в сутки, что способствует соблюдению пациентами режима лечения, особенно при непрерывной терапии тяжелых хронических ревматических заболеваний. Мовалис® могут применять больные пожилого возраста при небольших нарушениях функции почек и печени, так как обладает очень низкой нефро- и гепатотоксичностью. Всасывание и распределение Мовалиса при его сочетанном применении с антацидами, циметидином, дигоксином и фуросемидом не ухудшается, что особенно важно для больных пожилого возраста.
При проведении метаанализа 10 рандомизированных строго контролируемых исследований с участием более 20 000 больных, установлено, что терапия Мовалисом позволяет на 36% снизить риск возникновения осложнений со стороны пищеварительного тракта, на 48% — частоту тяжелых поражений (язвы, перфорации, кровотечения) по сравнению с диклофенаком, пироксикамом и напроксеном (Schoenfeld P., 1995) (табл. 79).
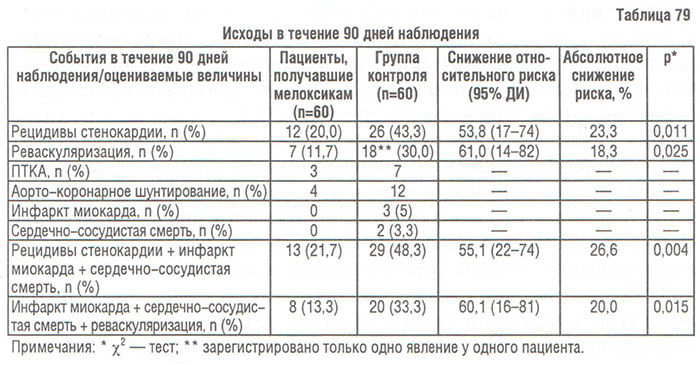
В проспективном исследовании R. Altman и соавторов (2002) пациенты с острыми коронарными синдромами без элевации сегмента ST были рандомизированы в период пребывания в отделении неотложной терапии на группы лечения ацетилсалициловой кислотой и гепарином (n=60) или ацетилсалициловой кислотой, гепарином и мелоксикамом (n=60).
Первичные оцениваемые величины (рецидивы стенокардии, инфаркт миокарда или смерть больного во время пребывания в отделении неотложной терапии) были существенно ниже у пациентов, получавших мелоксикам (15,0% и 38,3% соответственно; р=0,007). Вторичные сложные оцениваемые величины (реваскуляризация коронарных сосудов, инфаркт миокарда или смерть больного) были также значительно ниже у пациентов группы мелоксикама (10,0 и 26,7%; р=0,034). К 90-му дню в группе больных, принимавших мелоксикам, основные и вторичные оцениваемые параметры оставались значительно ниже (21,7 и 48,3%; р=0,004 и 13,3 и 33,3%; р=0,015 соответственно), а также меньшей была необходимость в реваскуляризации (11,7 и 30,0%; р=0,025) (см. табл. 79).
Не было также отмечено побочных явлений, связанных с приемом мелоксикама (Altman R. et al., 2002).
Давая объективную оценку опыту применения НПВП у пациентов с ревматическими заболеваниями, необходимо обратить внимание на результаты исследования IMPROVE (Impact of Meloxicam on Prescription Regimens in Osteoarthritis Versus Everyday Care) (Gagnier P. et al., 2001; 2002; Singh G.S. et al., 2002).
Это мультицентровое слепое рандомизированное открытое исследование, включавшее 1309 пациентов с ОА, проведенное в клиниках США. Пациенты были рандомизированы на 2 группы: в 1-й принимали мелоксикам в дозе 7,5 мг/сут, хотя в зависимости от необходимости она могла быть повышена до 15 мг/сут. Пациенты 2-й группы получали один из НПВП, наиболее часто назначаемых в повседневной практике (рофекоксиб, целекоксиб, напроксен, диклофенак, пироксикам и др.) в общепринятых дозах. Пациенты не принимали никакого другого препарата до включения в исследование и в последующие 6 мес. Терапевтическая эффективность определялась в том случае, когда пациент после окончания исследования не переходил на прием другого НПВП, или когда пациент, заканчивая участие в исследовании, не нуждался в дальнейшем приеме НПВП для лечения при ОА.
В группе больных, принимавших мелоксикам, терапевтический успех достигался существенно чаще, чем в группе пациентов, получавших другие НПВП (67 против 45%). Хотя дизайн исследования не обеспечивал достаточной статистической достоверности для сравнения результатов лечения мелоксикамом с некоторыми НПВП в отдельности, однако частота достижения эффективности в группе пациентов, получавших мелоксикам, была выше, чем у принимавших любое иное средство.
Проблемы, связанные с нежелательными эффектами либо недостаточной эффективностью, чаще возникали в группе пациентов, принимавших другие НПВП. IMPROVE является одним из немногих исследований, в ходе которого у пациентов выясняли о результатах медикаментозного лечения при ОА.
Побочные реакции и недостаточная эффективность чаще наблюдались в группе пациентов, принимавших другие НПВП, чем в группе принимавшей мелоксикам (рис. 109).
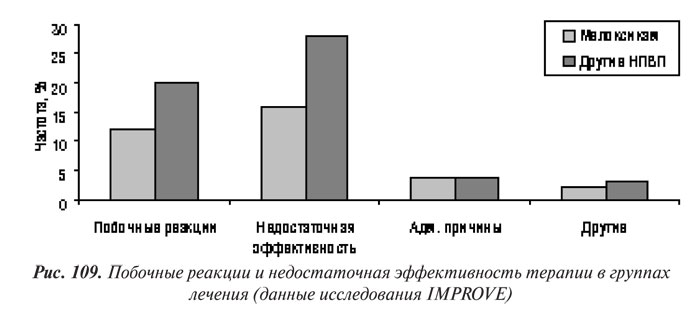
Индекс, оценивающий эффективность устранения болевого синдрома у пациентов, оказался наиболее высоким для групп пациентов, принимающих мелоксикам.
Особый интерес представляют данные, обобщающие результаты применения Мовалиса в различных дозах у 27 000 больных, которые подтверждают, что терапия Мовалисом (по сравнению со стандартными НПВП) не повышает риск развития кардиоваскулярных осложнений (инфаркт миокарда, СН, артериальная гипертензия) и не обладает нефро- и гепатотоксичностью. Кроме того, в последнее время получены интересные данные о возможном кардиопротекторном действии Мовалиса у больных с острым коронарным синдромом (Layton D. et al., 2003). Результаты этого исследования подтверждают принципиальное отличие Мовалиса от других ингибиторов ЦОГ-2, применение которых может, по некоторым данным, приводить к повышению частоты возникновения инфаркта миокарда и тромботических осложнений.
В отличие от других ингибиторов ЦОГ-2, Мовалис имеет особые преимущества. Недавно разработанные парентеральные формы позволяют обоснованно рекомендовать Мовалис для купирования обострения хронической боли при ОА (Del Tacca M. et al., 2002). При внутримышечном введении обезболивающий и противовоспалительный эффекты проявляются через 30–50 мин и сохраняются как минимум 5–6 ч. При внутримышечном введении любого НПВП необходимо убедиться в хорошей местной и системной переносимости, поскольку последняя не зависит от пути введения. Мовалис не вызывает очагового некроза в месте введения и его внутримышечное введение не приводит к повышению уровня кратинфосфокиназы в отличие от кетопрофена, диклофенака и пироксикама.
Системные побочные реакции при применении Мовалиса внутримышечно (15 мг мелоксикама в 1,5 мл раствора) от 3 до 7 дней по частоте и спектру не отличаются от плацебо (Цветкова Е.С. и соавт., 2004).
Последовательное, «ступенчатое» назначение Мовалиса внутримышечно, затем per os, является эффективной схемой лечения обострения хронической боли при ревматических заболеваниях и может быть альтернативой применения стандартных НПВП (Цветкова Е.С. и соавт., 2004).
Особый аспект безопасного применения Мовалиса — это возможность его назначения при проведении ортопедических операций, так как недавно было установлено, что использование Мовалиса позволяет уменьшить количество желудочно-кишечных кровотечений в среднем на 17% по сравнению с диклофенаком и набуметоном.
Преимуществом Мовалиса является также отсутствие отрицательного влияния на суставной хрящ, поскольку в терапевтических концентрациях, в отличие от других НПВП, он не подавляет образование полноценных протеогликанов, снижает уровень ряда ферментов, разрушающих хрящ, и может рассматриваться как «хондронейтральный» и даже как «хондропротективный» препарат (Цветкова Е.С. и соавт., 2004).
Внутримышечная форма мелоксикама
Мелоксикам (Мовалис®) выпускается также в форме инъекций (ампулы, содержащие 15 мг мелоксикама в 1,5 мл раствора). Инъекции мовалиса эффективны, поскольку объем вводимого вещества весьма невелик — всего 1,5 мл, а 90% наивысшей концентрации в плазме крови наблюдается уже спустя 30–50 мин после инъекции, причем наивысшие показатели концентрации в плазме крови достигаются спустя 1,5 ч после укола. Аналогичные параметры для таблетированной формы соответствуют 4–6 и 9 ч.
Инъекции рекомендуется делать исключительно в ягодичную область согласно традиционной методике.
При достижении должного терапевтического эффекта, через 2–3 дня после начала терапии Мовалисом (внутримышечно), пациентов можно «переводить» на прием таблетированной формы препарата. Однако при этом следует учитывать, что суммарная суточная доза препарата Мовалис® не должна превышать 15 мг.
Нимесулид — НПВП, химически отличающийся от других представителей этого класса отсутствием кислотных свойств. Нимесулид — представитель относительно новой группы дериватов сульфонанилида (Bennett A., 1996). Интересно, что первоначально нимесулид характеризовали как слабый ингибитор ЦОГ, что было обнаружено в различных исследованиях in vitro. Предполагалось, что для нимесулида более важным является «непростагландиновый» механизм. По данным J.R Vane и R.M. Botting (1996), коэффициент селективности нимесулида, определенный in vitro с использованием системы интактных клеток, составляет 0,1.
Фармакокинетика препарата связана не только с его селективностью в отношении ЦОГ-2, но и с особенностью его химической структуры (в отличие от других НПВП нимесулид обладает слабыми кислотными свойствами) и временем полувыведения (у нимесулида — 1,5–5 ч, у пироксикама — около 2 дней) (Bennett A., 1996).
Блокирование фермента фосфодиэстеразы IV обусловливает и другие положительные эффекты нимесулида:
- угнетение продукции свободных кислородных радикалов (Magaro M. et al., 1989; Ottonello L. et al., 1992; Capecchi P.L. et al., 1993; Bevilacqua M. et al., 1994; De Mello S.B. et al., 1994),
- блокирование металлопротеаз (стромелизина (протеогликаназы) и коллагеназы) (Bevilacqua M., Magni E., 1993; Pelletier J.P., Martel-Pelletier J., 1993),
- антигистаминный эффект (Berti F. et al., 1990; 1991).
Результаты многочисленных исследований свидетельствуют о высокой эффективности и безопасности нимесулида у больных с ОА. В двойном слепом плацебо-контролируемом исследовании P. Blardi и соавторы (1991) изучали эффективность нимесулида у 40 больных с «ОА различных локализаций» и обнаружили преимущество нимесулида в отношении уменьшения выраженности боли в суставах и утренней скованности. В другом исследовании с аналогичным дизайном R.L. Dreiser и соавторы (1991) обнаружили значительное преимущество нимесулида по сравнению с плацебо в лечении 60 больных с ОА коленных суставов в течение 2 нед по данным ВАШ боли и АФИ Лекена, при этом частота возникновения побочных эффектов в группе больных, получавших препарат, не превышала таковую в группе плацебо.
В табл. 80 обобщены результаты контролируемых исследований, в которых сравнивали эффективность и безопасность нимесулида с референтными НПВП. Длительность лечения в ходе этих исследований колебалась от 3 нед до 6 мес, нимесулид и препараты сравнения назначали в терапевтических дозах, за исключением исследования, проведенного V. Fossaluzza и соавторами (1989), в котором суточная доза напроксена (500 мг) была явно недостаточной. Результаты почти всех исследований, приведенных в табл. 80, свидетельствуют, что нимесулид не уступает по эффективности и безопасности препаратам сравнения.

Целекоксиб, парекоксиб и рофекоксиб выделены в подкласс «Коксибы» — специфические ингибиторы ЦОГ-2 М1А класса по принятой ВОЗ классификации лекарств (единственные представители класса, разрешенные к клиническому применению в Украине).
Выделение этих препаратов в отдельную группу обусловлено: во-первых, тем, что другие специфические ингибиторы ЦОГ-2 (мелоксикам, нимесулид, этодолак, набуметон) были синтезированы до появления гипотезы ЦОГ-2 – селективности, и их способность более выраженно по сравнению с ЦОГ-1 снижать активность ЦОГ-2 выявлена в процессе тестирования всех имевшихся к началу 90-х годов ХХ в. НПВП; во-вторых, в исследованиях in vitro коксибы проявляют гораздо более высокую избирательность в отношении блокады ЦОГ-2.
Результаты многочисленных исследований in vitro, ex vitro и ex vivo cвидетельствуют, что целекоксиб является высокоспецифическим ингибитором ЦОГ-2 и в широком диапазоне концентраций, в том числе превышающих терапевтические, практически не оказывает влияния на активность ЦОГ-1 (Penning T.D. et al., 1997; Isakson P.C. et al., 1999; Simon L.S. et al., 1999).
Для окончательного признания НПВП специфическим ингибитором ЦОГ-2 (а следовательно — имеющим лучший профиль гастроинтестинальной безопасности) в 1998 г. был введен 3-й обязательный критерий оценки: клинические исследования, то есть наличие или отсутствие клинических признаков подавления ЦОГ-1 в виде поражения пищеварительного тракта и подавления ЦОГ-1-зависимой агрегации тромбоцитов. В соответствии с критериями International COX-2 Study Group, для признания вещества специфическим ингибитором ЦОГ-2 с соответствующим клиническим профилем, необходимо сочетание: биохимической, биологической и фармакологической ЦОГ-2-селективности в моделях in vitro и ex vivo; анальгетической и антипиретической активности, сравнимой с традиционными НПВП, а также отсутствие значимого влияния на слизистую оболочку ЖКТ и агрегацию тромбоцитов, что является свидетельством угнетения ЦОГ-1.
«Только на основании биохимического профиля при отсутствии четких клинических данных вещество не может считаться преимущественным или специфическим ингибитором ЦОГ» (Lipsky P. et al., 1998).
После проведения всех тестов специфическими ингибиторами ЦОГ-2 были признаны только коксибы. У препаратов, преимущественно угнетающих ЦОГ-2 (мелоксикам, нимесулид, набуметон), клинически не подтверждено отсутствие действия на ЦОГ-1 (Zhang W. et al., 2004, Lipsky Р. et al., 1998).
Целекоксиб на мировом фармацевтическом рынке представлен препаратом Целебрекс производства компании «Pfizer», одной из 10 крупнейших фармацевтических компаний мира.
Эффективность Целебрекса была изучена при лечении более чем 5000 пациентов с симптомами ОА коленного сустава и бедра в плацебо-контролируемых и сравнительных исследованиях длительностью до 12 нед (Bensen W.G. et al., 1999; Geis G.S. et al., 1999; Zhao S.Z. et al., 1999; Williams G.W. et al., 2000). Лечение Целебрексом приводило к уменьшению выраженности боли, скованности, улучшению индекса WOMAC и функционального состояния больных. При этом эффективность Целебрекса и напроксена была сопоставимой во всех временных точках (Bensen W.G. et al., 1999; Goldstein J.L. et al., 2001). В многоцентровом плацебо-контролируемом исследовании с двойным слепым контролем пациентам с ОА коленного сустава (n=600) назначали целекоксиб (100 мг 2 раза в сутки), диклофенак (50 мг 3 раза в сутки) либо плацебо (McKenna F. Et al., 2001). Оценка основных показателей эффективности свидетельствовала о том, что терапия как диклофенаком, так и целебрексом приводила к статистически достоверному улучшению состояния больных по сравнению с плацебо без значимых различий между двумя НПВП. Оба препарата в одинаковой степени и с одинаковой скоростью уменьшали выраженность боли в течение 24 ч по сравнению с плацебо. В группе диклофенака достоверно чаще отмечали побочные эффекты со стороны пищеварительного тракта. По сравнению с плацебо, значительно чаще повышался уровень печеночных трансаминаз, креатинина и снижалась концентрация гемоглобина, чего не выявляли в группе целекоксиба (рис. 110а).

У более чем 2000, включенных в контролируемые исследования больных РА при приеме целекоксиба отмечена способность достоверно снижать по сравнению с плацебо количество болезненных и отечных суставов; он превосходил плацебо по положительной динамике индекса ответа на лечение ACR 20, лабораторных и функциональных показателей (Simon L.S. et al., 1999; Emery P. Et al., 1999). Направленность и выраженность изменений была такой же, как и у больных, получавших cреднетерапевтические дозы напроксена и диклофенака.
Таким образом, Целебрекс является эффективным НПВП при лечении РА и ОА. По выраженности терапевтического действия он сравним с такими традиционными НПВП как диклофенак, напроксен и ибупрофен.
Дополнительным преимуществом применения Целебрекса у пациентов с ОА, РА и после артропластики является доказательство его положительного влияния на суставной хрящ, подверженный дегенерации. Целекоксиб заметно повышает продукцию протеогликанов, улучшая состояние поврежденной хрящевой ткани (Mastbergen S.C., 2005).
Безопасность лечения целекоксибом. Опубликованные данные свидетельствуют о том, что Целебрекс имеет значительно лучший профиль переносимости и безопасности, чем неспецифические НПВП и по побочным действиям со стороны пищеварительного тракта сравним с плацебо (Simon L.S. et al., 1999; Bensen W.G. et al., 2000; Goldstein J.L. et al., 2000; Silverstein E.F., 2000; McKenna F. et al., 2001)], среди которых наиболее часто упоминают головную боль, диарею, ринит, тошноту, синусит, диспепсию и боль в животе. Частота развития язв при применении Целебрекса и плацебо существенно не отличалась. Она не повышалась при повышении дозы препарата в диапазоне 50–400 мг 2 раза в сутки и была в 3–4 раза ниже, чем при приеме неспецифических ингибиторов ЦОГ. Так, при эндоскопическом контроле после 12 нед лечения больных РА и ОА Целебрексом в указанном диапазоне доз выявлены пептические язвы в 2,7–5,9% случаев, в то время как при терапии напроксеном (500 мг 2 раза в сутки) — в 16,2–17,6%, ибупрофеном (800 мг 3 раза в сутки) — в 23,3%.
При сравнении токсичности целекоксиба в отношении пищеварительного тракта (200 мг 2 раза в день; n=270) и напроксена (500 мг 2 раза в день; n=267) с трехкратным эндоскопическим контролем (через 4, 8 и 12 нед терапии) также подтверждена лучшая переносимость специфического ингибитора ЦОГ-2 у больных с РА и ОА (Goldstein J.L. et al., 2001). Частота образования пептических язв при терапии целекоксибом и напроксеном составила соответственно 4 и 19% через 4 нед терапии (р<0,001), 2 и 14% еще через 4 нед (р<0,001) и 2% против 10% к окончанию исследования (р<0,001). Кумулятивная частота язвообразования за период лечения составила 9% в группе целекоксиба и 41% — напроксена. В группе целекоксиба образование пептических язв наиболее часто было связано с инфицированием Helicоbacter pylori, одновременным употреблением ацетилсалициловой кислоты и наличием пептической язвы в анамнезе. Целекоксиб значительно реже вызывал образование как язв желудка, так и двенадцатиперстной кишки.
По данным обобщенного анализа 31 рандомизированного контролируемого исследования (39 605 пациентов) ежегодная частота язвенных осложнений у больных, получавших Целебрекс, составила 0,3% , и была на 20–30% ниже, чем в группе неселективных НПВП (Moore et al., 2005).
Наиболее крупномасштабное рандомизированное исследование гастроинтестинальной токсичности Целебрекса по сравнению с другими НПВП в течение 6-месячного непрерывного лечения было предпринято в 1998–2000 гг. (исследование CLASS) с участием 8039 больных с РА и ОА (Silverstein E. et al., 2000). Его особенностью было применение Целебрекса в дозе (800 мг в сутки), в 2 и 4 раза превышающей максимальные терапевтические дозы для РА и ОА соответственно, в то время как препараты сравнения назначались в рекомендуемых среднетерапевтических дозах — 2400 мг в сутки ибупрофена и 150 мг диклофенака. Столь значительное превышение дозы Целебрекса не приводило к изменению профиля неблагоприятных эффектов, отмечаемых при более низких дозах. У больных, не получавших одновременно кардиоваскулярные дозы ацетилсалициловой кислоты, частота возникновения одного из язвенных осложнений и сочетания осложнений с симптоматическими язвами верхних отделов желудочно-кишечного тракта при применении целекоксиба была достоверно ниже по сравнению с НПВП: соответственно 0,44% против 1,27% и 1,40% против 2,91%. В общей когорте больных, включавшей и получавших ацетилсалициловую кислоту пациентов, различия были менее выраженными, что подтверждает ульцерогенность ацетилсалициловой кислоты даже в низких дозах. У больных, принимавших Целебрекс, была более низкой частота развития диспептических симптомов и связанного с этим прекращения приема препарата, а также достоверно меньшее количество случаев снижения гемоглобина и/или гематокрита. Кроме того, отмечали низшую токсичность по отношению к почкам: достоверно реже развивались отеки и артериальная гипертензия.
В клинических исследованиях показано, что целекоксиб даже в дозах, намного превышающих максимальные терапевтические (разовая — до 800 мг, суточная — 1200 мг) не подавлял ЦОГ-1-опосредованную агрегацию тромбоцитов (Leese P.T. et al., 2000). В то же время напроксен, ибупрофен и диклофенак в терапевтических дозах вызывали статистически значимое угнетение агрегации, мелоксикам — умеренное подавление агрегации тромбоцитов (Zhang W. et al., 2004). Соответственно, неспецифические НПВП, в отличие от Целебрекса, достоверно удлиняют время кровотечения.
Интересными являются выводы нескольких крупных обсервационных сравнительных исследований гастроинтестинальной безопасности коксибов и традиционного ингибитора ЦОГ-2 мелоксикама. Исследователи подчеркивают статистически достоверное снижение как симптоматических гастроинтестинальных явлений — на 23%, так и осложненных ( перфорации/ кровотечения) поражений пищеварительного тракта — на 44% — при применении целекоксиба в сравнении с мелоксикамом (рис. 110б).
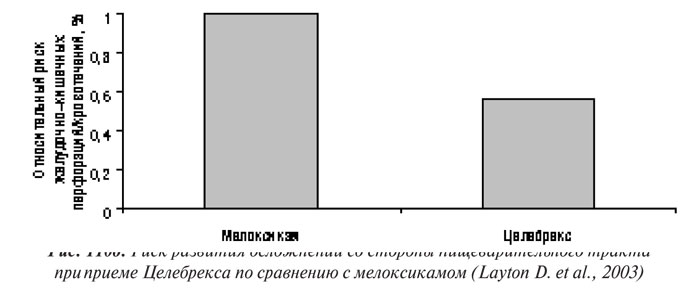
Целебрекс на 44% снижает риск развития осложнений со стороны пищеварительного тракта по сравнению с мелоксикамом.
Эти данные подтверждают и результаты недавнего крупного рандомизованного исследования, включавшего 1,3 млн пациентов, принимавших НПВП (традиционные НПВП, мелоксикам, коксибы).
Именно при применении коксибов отмечено достоверное снижение риска развития желудочно-кишечных кровотечений (рис. 110в).
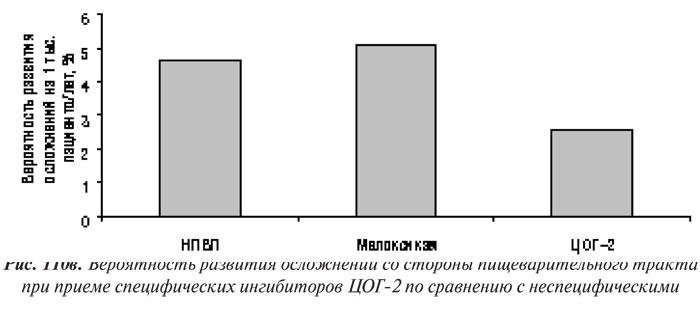
Во избежание развития осложнений со стороны пищеварительного тракта вследствие применения НПВП иногда одновременно назначают так называемые гастропротекторные препараты — ингибиторы протонного насоса (ИПН). Результаты такой стратегии в клинической практике можно оценить с помощью инновационного диагностического метода «камера в капсуле» — капсульная эндоскопия.
Двойное слепое плацебо-контролируемое исследование (Goldstein J.L. et al., 2001) проводилось с целью определить воздействие ибупрофена, представителя класса неспецифических НПВП в сочетании с ИПН и Целебрекса (целекоксиба) — специфического ингибитора ЦОГ-2 — на слизистую оболочку кишечника. В исследовании приняли участие здоровые добровольцы в возрасте от 18 до 70 лет, без значимых отклонений от физиологических показателей слизистой оболочки пищеварительного тракта при обычном и лабораторном обследовании.
Пациенты методом рандомизации были распределены на 3 группы: принимавшие Целебрекс по 200 мг 2 раза в сутки; ибупрофен по 800 мг 3 раза в сутки и омепразол по 20 мг 1 раз в сутки; плацебо. Исследование длилось 2 нед.
Повреждение слизистой оболочки диагностировали с помощью проглатываемой капсулы небольших размеров со встроенной камерой (рис. 110г). Капсула, перемещаясь по пищеварительному тракту, передавала видеоизображение его внутренней поверхности. Такая технология обеспечивает непосредственное проникновение в просвет тонкой кишки и получение изображения на участке пищеварительного тракта между желудком и толстой кишкой, слизистую оболочку которого трудно визуализировать с помощью традиционного эндоскопического исследования.
В ходе исследования были получены данные, свидетельствующие о том, что при назначении комбинации ибупрофена и омепразола в стандартных дозах количество повреждений слизистой оболочки тонкой кишки у человека отмечали почти в 4 раза чаще, чем при приеме Целебрекса в дозе, в 2 раза превышающей стандартную при остеоартрозе. Кроме повреждений слизистой оболочки тонкой кишки в указанной группе была выявлена более высокая степень повреждения слизистой оболочки желудка (рис. 110д).
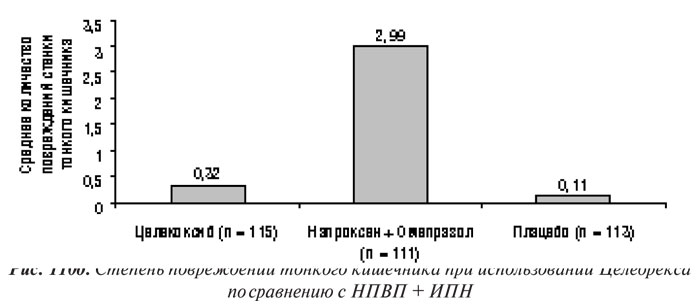
Таким образом, результаты инновационного метода «камера в капсуле» — капсульной эндоскопии являются подтверждением гастроинтестинальной безопасности Целебрекса.
Рекомендуемые дозы Целебрекса для лечения пациентов с остеохондрозом — 200 мг один раз в день или по 100 мг 2 раза в сутки, эффективные дозы для лечения РА несколько выше — по 100–200 мг 2 раза в сутки. Повышение суточной дозы выше 400 мг не сопровождается повышением терапевтического эффекта. С клинической точки зрения важно отметить, что, в отличие от других НПВП, Целебрекс не взаимодействует с непрямыми антикоагулянтами (варфарином) и манинилом (глибенкламидом) (Karim A. et al., 1998).
Кардиоваскулярный профиль Целебрекса. Основываясь на накопленных клинических и обсервационных данных можно отметить, что Целебрекс сравним с неспецифическими НПВП по кардиоваскулярной безопасности: нет статистической разницы в частоте возникновения инфаркта миокарда и серьезных тромботических осложнений (White W.B. et al., 2003; Braham D.S. et al., 2005; Ray W.A. et al., 2002; Kimmel S.E. et al., 2005; Solomon D.H. et al., 2004; Levesque L.E. et al., 2005); сравним по частоте развития гипертензии и отёков (White W.B. et al., 2002).
Вопрос кардиоваскулярной безопасности класса НПВП в целом рассматривается ниже. Для Целебрекса Европейская комиссия и Американская комиссия по контролю качества медикаментов и пищевых продуктов в апреле / июне 2005 г. подтвердили : польза превышает возможные риски (www.fda.gov/bbs/topics/news/2005/NEW01171.html Accessed 17.06.05; www.emea.eu.int/Cox2inhibitors.htm).
Рекомендации относительно применения всех НПВП, включая Целебрекс, касаются назначения минимальных эффективных доз на минимальный необходимый курс терапии с учетом индивидуального риска. Противопоказания для Целебрекса соответствуют таковым для всего класса НПВП.О кардиоваскулярном профиле Целебрекса можно судить по результатам недавно опубликованных данных мультицентрового анализа у 31 клинического рандомизованного исследования, включавшего на более 40 тыс. пациентов (Moore et al., 2005). Так, Целебрекс сравним с неселективными НПВП по частоте риска возникновения осложнений гипертензии (инфаркт, инсульт), почечной недостаточности и отеков. Частота возникновения отеков при применении Целебрекса была значительно ниже, чем при применении рофекоксиба.
Результаты недавно опубликованных исследований (Chenevard R. et al., 2003) свидетельствуют о положительном влиянии сульфонамидных ингибиторов ЦОГ-2 (Целебрекса) на состояние эндотелия пациентов с ишемической болезнью сердца: Целебрекс улучшает состояние эндотелия у пациентов с дисфункцией, снижает уровень СРБ и липопротеинов низкой плотности (ЛПНП) уже через 2 нед применения (Chenevard R. et al., 2003) (рис. 110ж).
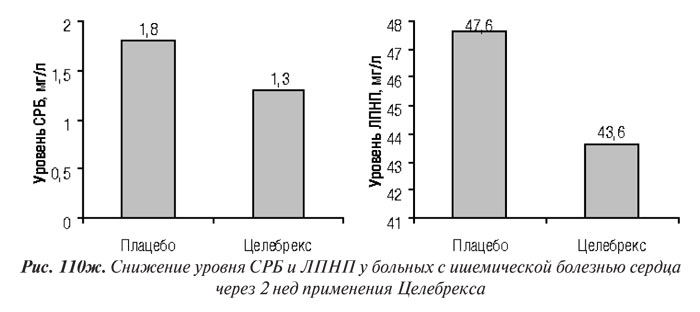
Эти данные служат предпосылкой к проведению новых клинических исследований: в настоящее время обсуждается дизайн первого в мире клинического исследования применения НПВП у пациентов с высоким кардиоваскулярным риском. Это исследование будет проведено с применением Целебрекса (пресс-релиз «Pfizer»).
Таким образом, Целебрекс является первым представителем нового поколения НПВП — специфичных ингибиторов ЦОГ-2, разрешенным к применению для лечения пациентов с РА и ОА. Продемонстрирована достаточно высокая клиническую эффективность препарата, сопоставимая с лечебным действием традиционных НПВП. Целебрекс хорошо переносится, он в несколько раз реже по сравнению с неспецифическими НПВП вызывает язвообразование в верхних отделах желудочно-кишечного тракта и не влияет на функцию тромбоцитов.
Украинские врачи с нетерпением ожидали появления инъекционной формы специфического ингибитора ЦОГ-2. Препарат Династат (инъекционный парекоксиб натрия) компании «Pfizer» — единственный инъекционный специфический ингибитор ЦОГ-2 — уже зарегистрирован в Украине. Препарат оказывает противовоспалительное, жаропонижающее и мощное обезболивающее действие (Talley J.J. et al., 2000).
ДИНАСТАТ можно применять как внутримышечно, так и внутривенно для терапии пре- и постоперационного болевого синдрома. Основным отличительным свойством препарата является мощный анальгетический эффект, сравнимый с эффектом опиоидов в низких дозах, в сочетании с улучшенным профилем гастроинтестинальной безопасности и отсутствием влияния на свертываемость крови, что достигается благодаря избирательному угнетению функции ЦОГ-2.
В мультицентровых контролируемых исследованиях эффективность применения Династата в ортопедической, челюстно-лицевой хирургии и гинекологии была значительно выше 4 мг морфина в/в и сравнима с кеторолаком (Daniels S.E. et al., 2001; Barton S.F. et al., 2002).
Династат обеспечивает быстое и длительное обезболивание — эффект наступает через 7–13 мин в/в или в/м и длится в течение 12 ч (в дозе 40 мг). Дополнительным преимуществом обезболивания Династатом является возможность его комбинации с наркотическими анальгетиками, причем потребность в опиоидах при такой схеме снижается (Zhao S.Z. et al., 2004).
Противопоказания для парекоксиба натрия соответствуют обычным для всех нестероидных противовоспалительных препаратов.
Еще одним представителем группы коксибов является препарат рофекоксиб. В серии клинических исследований была установлена эффективность рофекоксиба у больных с ОА (в дозе 12,5 и 25 мг/сут), РА (25 мг/сут) и синдромом боли в нижней части спины (25 мг/сут) (Schnitzer T.J. et al., 1999; Cannon G.W. et al., 2000; Day R. et al., 2000; Saag K. et al., 2000; Katz N. et al., 2001; Truitt K.E. et al., 2001). По данным двойного слепого плацебо-контролируемого рандомизированного сравнительного исследования применения целекоксиба в дозе 200 мг/сут (63 больных с ОА коленных суставов) и рофекоксиба в дозе 25 мг/сут (59 больных с ОА коленных суставов) (McKenna F. et al., 2001), через 6 нед лечения статистически достоверных различий в положительной динамике основных критериев эффективности на фоне приема целекоксиба и рофекоксиба не обнаружено (р>0,55), в то же время изменения показателей были значительно выше, чем в группе плацебо (р<0,05). Общее количество побочных эффектов в группах целекоксиба и рофекоксиба было одинаковым, однако в первой значительно реже отмечались побочные эффекты со стороны пищеварительного тракта, что свидетельствует о лучшей переносимости целекоксиба по сравнению с рофекоксибом в изучаемых дозах.
Данные оценки влияния коксибов на сердечно-сосудистый прогноз по данным крупных рандомизированных исследований, определявших клиническую эффективность коксибов, приведены в табл. 81. Результаты представленных 5 масштабных рандомизированных контролируемых исследований свидетельствуют о неодинаковом уровне сердечно-сосудистой безопасности коксибов. Так, в исследованиях CLASS и SUCCESS при применении Целебрекса (в том числе в дозах, в 2–4 раза превышавших рекомендуемые для лечения при РА и ОА) отмечена его высокая степень безопасности: не было выявлено повышение риска развития оцениваемых сердечно-сосудистых осложнений на фоне его приема по сравнению с приемом других НПВП (ибупрофена, диклофенака, напроксена). При этом изменения степени риска не было отмечено как среди лиц, получавших кислоту ацетилсалициловую (в случае необходимости вторичной профилактики ИБС), так и у пациентов, не принимавших ее (Silverstein F.E. et al., 2000; White W.B. et al., 2002).
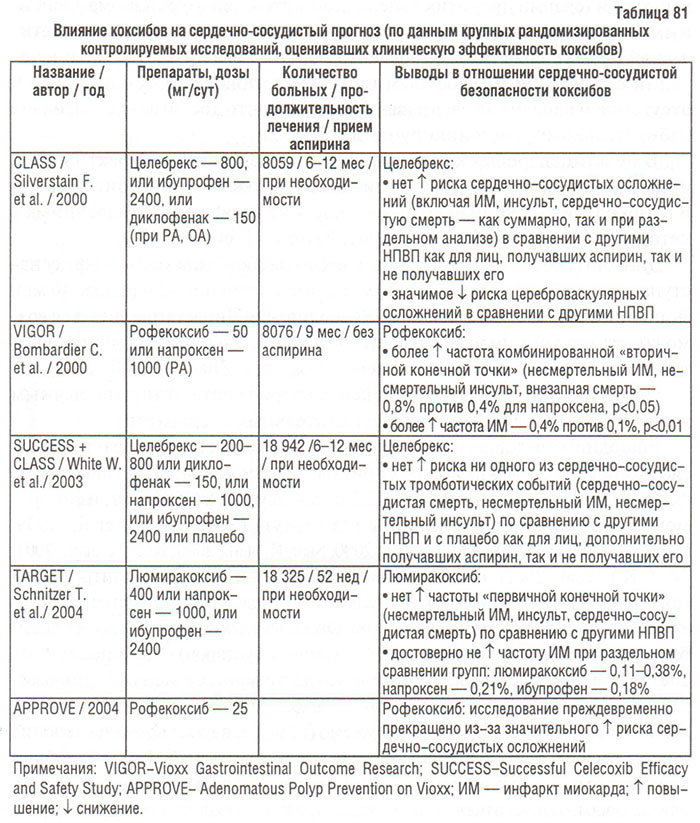
В исследованиях VIGOR и APPROVE было отмечено повышение частоты возникновения сердечно-сосудистых осложнений на фоне применения оригинального рофекоксиба (Bombardier C. et al., 2000). В исследовании TARGET при применении представителя второго поколения коксибов — люмиракоксиба — не выявили статистически значимого повышения частоты сердечно-сосудистых осложнений по сравнению с другими НПВП (Farkouh M.E. et al., 2004).
Оценка влияния коксибов на прогноз лечения по результатам эпидемиологических ретроспективных анализов представлена в табл. 82. Эти данные отличаются, прежде всего, масштабностью проанализированных групп пациентов: D. Graham и соавторы (2004) и А. Whelton и соавторы (2004) включали в исследования, соответственно, более 1,3 млн и более 3 млн человек. Это обеспечивает значительную весомость этих результатов (см. табл. 82). Так, полученные данные свидетельствуют о том, что применение целебрекса не способствует повышению риска возникновения сердечно-сосудистых осложнений (в сравнении как с лицами, не получавшими никаких НПВП, так и с пациентами, принимавшими ЦОГ-2 — неселективные НПВП; включая больных с исходной медикаментозно-контролируемой артериальной гипертензией) (Solomon D. et al., 2004; Mamdani M. et al., 2004), и выявлена тенденция к снижению риска развития инфаркта миокарда и внезапной сердечной смерти на 14% в группе целекоксиба в сравнении с использованием других НПВП с учетом анализа весьма репрезентативной группы (около 1,4 млн человек). Считаем необходимым сообщить о дизайне этого исследования. В исследование были включены больные жители Калифорнии в возрасте 18–84 лет, принимавшие коксибы или другие НПВП с 1.01.1999 г. по 31.12.2001 г.
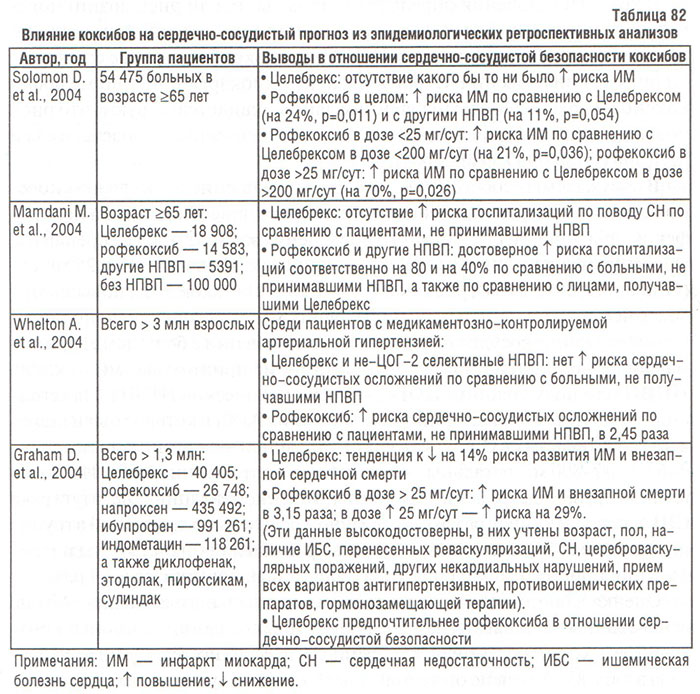
В ходе исследования определяли, повышается ли риск возникновения острого инфаркта миокарда или внезапной сердечной смерти при применении неспецифических НПВП или коксибов, а также сравнивали риск возникновения острого инфаркта миокарда при приеме рофекоксиба и целекоксиба. Полученные данные свидетельствуют, что риск повышался в соотношении 4:1 с учетом даты события, возраста, пола и региона (Graham D. et al., 2004).
В обсуждаемых сообщениях отмечено повышение риска возникновения сердечно-сосудистых осложнений на фоне приема оригинального рофекоксиба, причем степень этого повышения зависит от дозы препарата. Особенно неблагоприятны эффекты дозировок, превышающих 25 мг/сут (Graham D. et al., 2004), риск при использовании такой дозы повышается более чем в 3 раза. У больных, получавших рофекоксиб, отмечено повышение сердечно-сосудистого риска как в сравнении с больными, принимавшими целекоксиб, так и с пациентами, не принимавшими никаких НПВП или получавшими ЦОГ-2 — неспецифические НПВП. На сегодняшний день получены данные исследования АРС, в которое были включены 2000 больных с ОА, из которых 1300 пациентов принимали целекоксиб по 400–800 мг, остальные — плацебо на протяжении 33 мес. Исследование было преждевременно остановлено по рекомендации Института рака США, поскольку риск развития сердечно-сосудистых осложнений в группе целекоксиба (400 мг в сутки) в 2,5 раза превышал таковой группы плацебо, а при приеме целекоксиба в дозе 800 мг риск повышался в 3,4 раза.
Оценка влияния коксибов на уровень артериального давления (АД) на основе данных нескольких недавно проведенных рандомизированных контролируемых и ретроспективных эпидемиологических исследований представлена в табл. 83. Отмечено отсутствие у целебрекса индуцирующего гипертензию потенциала как среди лиц с исходно нормальным АД (Cho J. et al., 2003; Solomon D. et al., 2004; Sowers et al., 2004), так и у пациентов с медикаментозно-контролируемой артериальной гипертензией (Whelton A. et al., 2002).
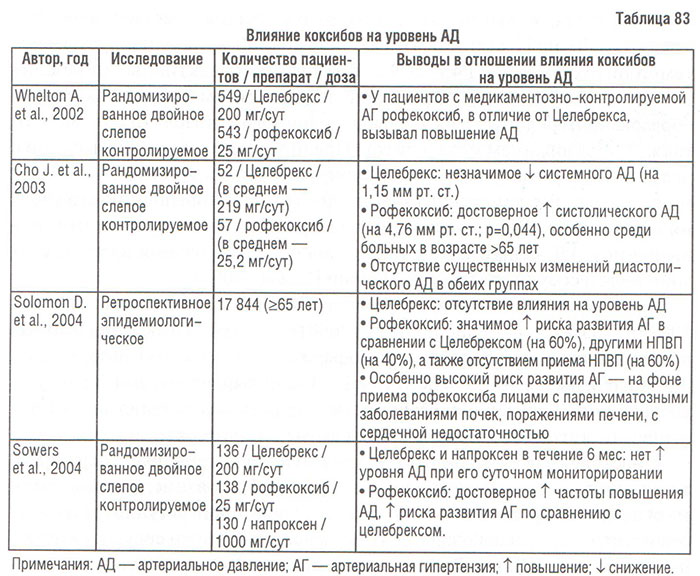
Имеются ли различия между коксибами, которые могли бы объяснить их разное влияние на сердечно-сосудистый прогноз? В настоящее время представлены данные о целом ряде отличий между целекоксибом (Целебрекс) и рофекоксибом, которые мы приводим ниже. Пока недостаточно изучено, в какой мере каждое из них определяет четко установленные в клинической практике различия влияния этих коксибов на прогноз лечения. Возможно, что комплекс фармакокинетических и фармакодинамических различий в сочетании с разным влиянием на функцию эндотелия сосудов является их основой (Rahme E. et al., 2002; Ray W.A. et al., 2002; Fitzgerald G.A., 2003; Weber A. et al., 2004).
Рофекоксиб относится к ингибиторам ЦОГ-2 сульфонового типа (sulfone-type, куда относится также эторикоксиб). Доказано, что этот тип препаратов ассоциирован с оксидативным повреждением липопротеидных частиц, в частности липопротеидов низкой плотности, и, таким образом, оказывает проатерогенный эффект. Проатерогенные эффекты не выявлены при применении ингибиторов ЦОГ-2 сульфонамидного типа (sulfonamide-type) — целекоксиба, валдекоксиба (Hermann M. et al., 2003; Howard P., Delafontaine P., 2003; Walter M.F. et al., 2004).
Имеются также данные о существенных различиях в метаболизме этих коксибов (Krum H. et al., 2004). Так, целекоксиб метаболизируется системой цитохрома CYP P450 2C9 с образованием неактивных метаболитов (Krum H. et al., 2004). Рофекоксиб подвергается метаболическим преобразованиям рядом других энзимов клеточного цитозоля (редуктазами), также с образованием метаболитов. Предполагается, что в связывании с редуктазами метилсульфоны конкурируют с альдостероном, что может приводить к снижению элиминации последнего, повышению его уровня в организме (с последующими электролитными нарушениями, повышением АД, стимуляцией процессов фиброзирования в структурах миокарда и сосудистой стенки) (Krum H. et al., 2004).
В нескольких сообщениях (Chenevard R. et al., 2003; Hermann M. et al., 2003) показано, что целекоксиб способствует улучшению функции эндотелия сосудов. Механизм этого эффекта пока недостаточно изучен, однако считается, что ингибиторы ЦОГ-2 сульфонамидной структуры (целекоксиб, вальдекоксиб) улучшают функцию эндотелия за счет повышения синтеза NO и уменьшения выраженности оксидного стресса.
В настоящее время известно, что эндотелий контролирует сосудистый тонус, рост гладкомышечных клеток, тромбообразование, фибринолиз и многие другие процессы. Установлено, что эндотелий регулирует сосудистый тонус через освобождение сосудорасширяющих и сосудосуживающих факторов. К факторам дилатации, помимо NO, относят: гиперполяризацию эндотелия, простациклин I2, натрийуретический пептид типа С, адреномедулин; к факторам констрикции — эндотелин, тромбоксан А2, простагландин Е2, эндопероскиды и др. (Chenevard R. et al., 2003).
По данным А. Weber и соавторов (2004), целекоксиб существенно ингибирует активность карбоангидразы, что может приводить к умеренному антигипертензивному эффекту.
Механизмы влияния НПВП на риск возникновения сердечно-сосудистых осложнений
Неспецифические и специфические НПВП (коксибы). НПВП представляют гетерогенный класс, включающий различные группы ЦОГ-2 — неспецифических и специфических (коксибы) препаратов. Для обсуждения вопроса о механизмах влияния НПВП на риск возникновения сердечно-сосудистых осложнений необходимо кратко описать механизм действия различных НПВП (рис. 111).
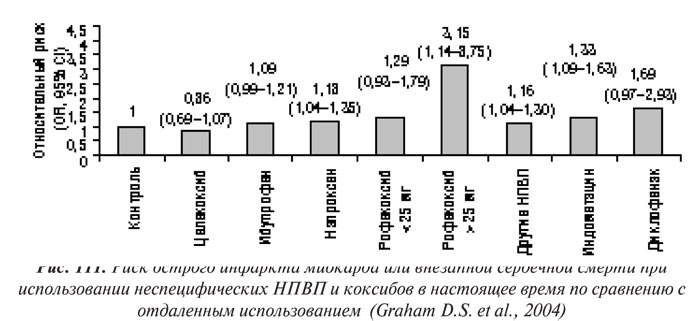
Арахидоновая кислота, высвободившаяся из фосфолипидов клеточных мембран в ответ на различные стимулы, преобразуется в ПГ Н2 под действием содержащихся в цитоплазме клеток ферментов, обозначаемых как ПГ G/H-синтетазы (иначе — ЦОГ-1 и -2). ПГ Н2 далее преобразуется ферментами — тканеспецифичными изомеразами — в различные простаноиды. Кислота ацетилсалициловая и другие неспецифические НПВП ингибируют как ЦОГ-1, так и ЦОГ-2; коксибы специфично ингибируют ЦОГ-2. ЦОГ-1 широко экспрессирована во многих тканях организма (слизистой оболочке пищеварительного тракта, тромбоцитах, эндотелиальных и гладкомышечных клетках, почечных структурах). ЦОГ-2 представлена в некоторых тканях (почки, центральная нервная система, гонады, мочевыводящие пути); ее экспрессия существенно возрастает под влиянием воспалительных стимулов, включая цитокины, эндотоксины, факторы роста (Konstam M.A. et al., 2001; Mukherjee D. et al., 2001; Stiller C.O., Hjemdahl P., 2003; Fitzgerald G.A., 2003; Howard P. et al., 2004; Topol E., Falk G.W., 2004).
Трудно себе представить лекарственное средство, если мы говорим о настоящем, эффективном препарате, которое не оказывало бы побочных действий. Так что проблема побочных эффектов, связанных с приемом НПВП, не нова, она активно изучается с 30-х годов прошлого века. С тех пор ученые пытаются создать препараты, которые сохранили бы все достоинства ацетилсалициловой кислоты или НПВП, но были бы более безопасны. В отношении НПВП речь шла не только о нежелательных явлениях со стороны пищеварительного тракта. Известны их побочные действия, связанные с поражениями сердечно-сосудистой системы. Во всех руководствах 60-х годов ХХ в. отмечается, что при неграмотном применении НПВП могут возникать не только пептические язвы желудка с вытекающими последствиями, но и, например, повышение АД, отеки.
На сегодняшний день полемика, развернувшаяся вокруг коксибов, вышла за эти рамки и актуальна для всего класса НПВП. До настоящего момента отсутствовали данные рандомизованных исследований применения неспецифичных НПВП в отношении сердечно-сосудистого прогноза. По результатам обсервационных исследований можно было говорить о «тренде» изменений. Опубликованные в 2004 г. результаты исследования Graham D. и соавторов заставили задуматься о возможном повышении частоты сердечно-сосудистых осложнений при использовании какого-либо препарата класса НПВП. Последующие публикации подтвердили этот факт. По данным Норвежского исследования (Sudbo J. et.al., 2005) при применении НПВП более 6 мес может повышаться риск кардиоваскулярной смерти. С этими данными созвучны результаты анализа базы MEDICAID, представленные Graham D. на совещании FDA 17 февраля 2005 г. и Johnses S.P. и соавторами (2005), о повышении риска и частоты госпитализаций по поводу кардиоваскулярных событий при использовании практически всех лекарственных средств класса НПВП.
Дискуссия о кардиоваскулярном риске и применении НПВП подошла к логическому завершению. 7 апреля 2005 г. FDA вынесло окончательное решение: признать возможное повышение риска сердечно-сосудистых осложнений побочным эффектом всего класса НПВП (кроме низких доз ацетилсалициловой кислоты), куда входят как последние поколения НПВП-коксибы, так и традиционные, давно используемые НПВП (www.fda.gov). Рекомендации FDA относительно кардиоваскулярной безопасности НПВП (FDA/Center for Drug Evaluation and Research) содержат призыв к производителям всех имеющихся на рынке рецептурных и безрецептурных НПВП пересмотреть инструкции к своим продуктам и включить в них предупреждение. В нем должно подчеркиваться возможное повышение риска кардиоваскулярных событий и хорошо известных, серьезных и потенциально опасных для жизни гастроинтестинальных кровотечений, связанных с приемом этих препаратов… В интернете на сайте FDA (www.fda.gov), а также на сайте Американской ассоциации ревматологов (www.rheumatology.org) можно найти перечень НПВП, в инструкции к которым FDA рекомендует внести предупреждение о возможном повышении риска сердечно-сосудистых осложнений (табл.).
Следует подчеркнуть, что FDA не исключило из перечня НПВП, которые применяют для снятия острой боли и продают без рецепта врача. В инструкцию по их применению также рекомендуется внести соотвествующие предупреждения. Решение основного регуляторного органа США в сфере оборота лекарственных средств без преувеличения можно назвать разумным, отражающим, по сути, взвешенную позицию медицинского сообщества в отношении как новых, так и много лет существующих на фармацевтическом рынке препаратов. Дискуссия о достоинствах и недостатках коксибов всколыхнула более глубокое обсуждение проблем фармакотерапии боли и воспаления, а также тех критериев в рамках доказательной медицины, которым должны соответствовать проводимые исследования этих лекарственных средств. С другой стороны, было четко заявлено, что преимущество новых НПВП, в частности коксибов, при правильном разумном назначении пациентам, имеющим соответствующие показания, превалирует над риском, связанным с их использованием.
FDA заявляет, что имеющиеся данные не подтверждают, что Целекоксиб сравним с неспецифическими НПВП по риску кардиоваскулярных осложнений. Европейская Медицинская Комиссия и FDA подтвердили: для Целебрекса преимущества превосходят возможные риски (www.emea.eu).
Влияние различных НПВП на атеротромбоз. Как уже упоминалось, НПВП существенно отличаются по степени ингибирования изоформ ЦОГ. Кислота ацетилсалициловая ингибирует ЦОГ-1 в 166 раз сильнее по сравнению с ЦОГ-2. Даже в низких дозах она необратимо блокирует до 95% активности ЦОГ-1 в тромбоцитах, обеспечивая устойчивое снижение тромбоксан-А2-зависимой способности к агрегации (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). Это антитромбоцитарное действие кислоты ацетилсалициловой является основным компонентом ее кардиопротекторных эффектов. Определенная роль в их реализации отводится также ее способности улучшать функцию эндотелия и уменьшать выраженность локального внутрисосудистого воспаления. В первую очередь из-за антитромбоцитарного действия ацетилсалициловая кислота является единственным НПВП, используемым с целью превентирования и лечения ИБС. При ее применении с целью первичной профилактики ИБС снижается риск возникновения сердечно-сосудистых осложнений на 15% и развития инфаркта миокарда на 30%; использование же для вторичной профилактики (т.е. у лиц, с ранее диагностированной ИБС) сопровождается снижением на 25% риска развития рекуррентных инфарктов миокарда и других тромботических сосудистых осложнений (Howard P., Delafontaine P., 2004).
Другие неспецифические НПВП (такие, как напроксен, ибупрофен, диклофенак) в терапевтическом диапазоне доз обратимо ингибируют 50–90% активности ЦОГ-1 в тромбоцитах, что определяет умеренное транзиторное блокирование их функции (Rahme E. et al., 2002; Ray W.A. et al., 2002; Verma S. Szmitko P.E., 2003). Небольшой, варьирующий по выраженности и нестойкий антитромбоцитарный эффект, присущий этим НПВП, не дает возможности рассматривать их в качестве потенциальной замены ацетилсалициловой кислоты для кардиопротекторных целей.
ЦОГ-2 — специфические НПВП (коксибы) практически не оказывают влияния на функцию тромбоцитов (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). Предметом дискуссий в течение последних нескольких лет является патофизиологическая значимость вызываемого коксибами локального блокирования ЦОГ-2 в стенке сосудов (на что практически не влияет ацетилсалициловая кислота и лишь в небольшой степени влияют другие неселективные НПВП). С учетом неоднозначной роли ЦОГ-2 в процессах атерогенеза (о чем было сказано выше), эффекты коксибов по ее блокированию могут представляться двояко. С одной стороны, подавление активности ЦОГ-2 в области атеросклеротического поражения может обеспечивать уменьшение локального внутрисосудистого воспаления, снижать риск разрыва атеросклеротической бляшки и замедлять прогрессирование атеротромботических поражений (антиатеротромботические эффекты). С другой стороны, предметом опасений является то, что при действии коксибов будет существенно подавляться синтез простациклина, что может изменять баланс между простациклином и тромбоксаном А2 в пользу последнего и таким образом повышать риск тромбообразования (Reicin A. et al., 2002; Cho J. et al., 2003; Mamdani M. et al., 2003; Stiller C.-O., Hjemdahl P., 2003; Topol E., Falk G.W., 2004). Говоря о влиянии коксибов на процессы атеротромбоза, необходимо отметить, что для целекоксиба к настоящему моменту не представлено данных о наличии протромботических эффектов. Более того, в сообщении R. Chenevard и соавторов (2003) продемонстрировано, что у пациентов с тяжелой ИБС лечение Целебрексом сопровождалось существенным улучшением функции эндотелия и снижением уровня СРБ, рассматриваемого сейчас в качестве независимого фактора риска развития инфаркта миокарда, мозгового инсульта, сердечно-сосудистой летальности (Howard P., Delafontaine P., 2004).
В заключениях FDA и Канадской ревматологической ассоциации (2004), предлагается переводить пациентов, получавших Виокс (оригинальный рофекоксиб), на лечение альтернативными НПВП (коксибами или другими НПВП). Замена на другой коксиб является особенно приемлемой из-за низкой частоты возникновения побочных эффектов со стороны пищеварительного тракта и хорошей сердечно-сосудистой переносимости Целебрекса (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). У лиц с сопутствующей ИБС целесообразно применение комбинации Целебрекса с низкими дозами кислоты ацетилсалициловой с целью вторичной профилактики сердечно-сосудистой патологии (Mukherjee D. et al., 2001).
Перспективы противовоспалительной терапии ОА
Новым направлением в симптоматической терапии ОА и других болезней опорно-двигательного аппарата является использование комбинированных ингибиторов циклооксигеназы и липооксигеназы — ЦОГ и ЛОГ. Данные экспериментальных исследований свидетельствуют о том, что альтернативный (липооксигеназный) путь метаболизма арахидоновой кислоты, который ведет к образованию лейкотриенов (ЛТ), вызывает ряд воспалительных эффектов у пациентов с болезнями суставов (см. рис. 106). Так, ЛТВ4 является одним из самых мощных факторов хемотаксиса лейкоцитов, он также индуцирует продукцию цитокинов Т-лимфоцитами и иммуноглобулинов В-лимфоцитами. Кроме того, так называемые цистеиниловые ЛТ (или пептидолейкотриены) — ЛТС4, ЛТD4 и ЛТЕ4 вызывают ряд воспалительных эффектов, среди них отек, сокращение гладких мышц, что в слизистой оболочке верхних отделов желудочно-кишечного тракта может вызвать ишемию с последующим образованием эрозий и язв. Две другие формы ЛОГ — 12-ЛОГ и 15-ЛОГ — катализируют образование липоксинов, обладающих противовоспалительным действием.
Угнетение циклооксигеназного пути неселективными или селективными НПВП способно вызывать смещение каскада арахидоновой кислоты в сторону липооксигеназного пути с повышением продукции ЛТ и липоксинов. Поэтому было бы целесообразно для получения противовоспалительного и анальгезирующего эффектов блокировать оба пути метаболизма арахидоната — циклооксигеназный и липооксигеназный. Однако важным моментом является сохранение при этом продукции противовоспалительных липоксинов.
Ликофелон — новый фармакотерапевтический агент, блокирующий ЦОГ и 5-ЛОГ. В исследованиях in vitro ликофелон угнетал ЦОГ (IC50~0,16–0,21 mМ) и 5-ЛОГ (IC50~0,18–0,23 mМ) (Laufer S. et al., 1994).
Новая технология, получившая название «хозяин — гость», сообщает «классическим» неселективным НПВП оптимальные фармакокинетические свойства и улучшает их переносимость. PBC — новый фармакотерапевтический агент, в котором молекула пироксикама (молекула-«гость») внедрена в β-циклодекстрин (молекула-«хозяин»). Такая комбинация обеспечивает: высокую растворимость; быструю абсорбцию; минимальный контакт со слизистой оболочкой пищеварительного тракта; почти 100% биодоступность; быстрое начало действия; выраженный обезболивающий эффект при приеме 1 раз в сутки.
В пилотном сравнительном контролируемом исследовании применения РВС (20 мг/сут) и этодолака (400 мг/сут) у 30 больных с синдромом боли в нижнем отделе позвоночника первый оказывал более выраженное обезболивающее действие (Davoli L. et al., 1989). В другом небольшом контролируемом исследовании сравнивали эффективность РВС в дозе 20 мг/сут у 60 пациентов с заболеваниями опорно-двигательного аппарата с внутримышечными инъекциями диклофенака (75 мг) и кетопрофена (100 мг) (Tamburro P., Galasso G., 1989). Все три препарата оказывали быстрое и выраженное обезболивающее действие. Безусловно, судить об эффективности и переносимости РВС по этим исследованиям нельзя, полученные результаты требуют подтверждения в крупных многоцентровых исследованиях.
Рациональное применение НПВП у больных с ОА. Разнообразие НПВП на современном фармацевтическом рынке и обилие нередко противоречивой информации об их фармакодинамике, эффективности и безопасности затрудняет выбор препарата. Далеко не всегда удается экстраполировать результаты многоцентрового контролируемого исследования эффективности на конкретного больного. Как уже было отмечено выше, основным признаком, по которому НПВП различаются между собой, является их переносимость. Доказательства преимуществ одних НПВП над другими в отношении обезболивающих и противовоспалительных свойств отсутствуют. Кроме того, в свете недавних открытий более сложных механизмов участия ЦОГ-1 и ЦОГ-2 в патологических и физиологических процессах, становится очевидным, что селективные и даже специфические (коксибы) ингибиторы ЦОГ-2 не являются «идеальными» НПВП. Для того, чтобы обеспечить эффективное и безопасное лечение, прежде всего необходимо тщательное обследование больного для исключения факторов риска развития побочных эффектов. При обнаружении риска развития гастропатии рационально назначить селективные или специфические ингибиторы ЦОГ-2. Если у конкретного больного неселективный НПВП проявляет выраженную эффективность, его можно назначить в комбинации с мизопростолом, ингибиторами протонного насоса или антагонистами Н2-рецепторов. При наличии признаков почечной недостаточности назначать НПВП нецелесообразно, однако если назначение НПВП необходимо, предпочтение следует отдавать специфическим ингибиторам ЦОГ-2, при этом лечение должно проводиться под тщательным контролем уровня креатинина в сыворотке крови. Больным с риском тромбозов при проведении лечения ингибиторами ЦОГ-2 следует продолжать прием ацетилсалициловой кислоты в низких дозах и тщательно мониторировать состояние пищеварительного тракта. При выборе НПВП из группы неселективных ингибиторов для больного пожилого возраста предпочтение следует отдать дериватам пропионовой кислоты, относящимся к короткоживущим НПВП (быстро всасываются и элиминируются), которые не аккумулируются при нарушении метаболических процессов. Если больной не относится к группе риска развития побочных эффектов, лечение можно начинать как с неселективного, так и с селективного или специфического ингибитора ЦОГ-2. При неэффективности или недостаточной эффективности препарат необходимо заменить.
Системное применение ГКС при ОА не показано, однако внутрисуставные и периартикулярные инъекции пролонгированных (депо) форм ГКС (табл. 84) дают значительный, хотя и временный, симптоматический эффект (Hollander J.L., 1953; Moskowitz R.W. et al., 1970; Gray R.G., Gottleib N.L., 1983; Kirwan J.R., Rankin E., 1997; Brandt K.D., 2002). В связи с тем, что исследования у животных продемонстрировали способность ГКС повреждать суставной хрящ, а частые внутрисуставные инъекции депо-ГКС ассоциируются с разрушением внутрисуставных тканей (Gray R.G., Gottleib N.L., 1983), инъекции депо-ГКС не рекомендуют использовать чаще, чем 3–4 раза в год. Однако H.W. Balch и соавторы (1977), которые ретроспективно оценивали рентгенограммы суставов после повторных инъекций на протяжении 4–15 лет, утверждали, что рациональное применение повторных инъекций этих препаратов не приводит к ускорению прогрессирования болезни по данным рентгенографии.

Особенностью препаратов ГКС, применяемых для внутрисуставного введения, является пролонгированный противовоспалительный и обезболивающий эффект. С учетом длительности эффекта депо-ГКС можно расположить в следующем порядке:
1) гидрокортизона ацетат — выпускается в форме микрокристаллической суспензии во флаконах по 5 мл (125 мг препарата); при внутрисуставном введении из полости практически не всасывается, действие длится от 3 до 7 дней; в связи с относительно слабым и коротким эффектом в последнее время применяется крайне редко;
2) триамцинолона ацетонид — выпускается в форме водной кристаллической суспензии, в ампулах по 1 и 5 мл (40 мг/мл); противовоспалительный и обезболивающий эффект наступает через 1–2 дня после инъекции и длится 2–3 (реже 4) нед; основной недостаток — нередкое развитие атрофии кожи и подкожной жировой клетчатки, некроза сухожилий, связок или мышц в месте введения;
3) метилпреднизолона ацетат — выпускается в форме водной суспензии, в ампулах по 1, 2 и 5 мл (40 мг/мл); по продолжительности и выраженности эффекта почти не отличается от препарата триамцинолона ацетонида; при применении в рекомендуемых дозах риск развития атрофии и некроза мягких тканей в месте введения — минимальный; практически не обладает минералокортикоидной активностью;
4) комбинированный препарат (торговые названия, зарегистрированные в Украине, — Дипроспан®, Флостерон®), содержащий 2 мг бетаметазона динатрия фосфата (высокорастворимый быстровсасывающийся эфир, обеспечивает быстрый эффект) и 5 мг бетаметазона дипропионата (слаборастворимая, медленно-абсорбирующаяся депо-фракция, оказывает пролонгированное действие), выпускается в ампулах по 1 мл, состав препарата обусловливает быстрый (уже через 2–3 ч после внутрисуставного введения) и пролонгированный (3–4 нед) эффект; микронизированная структура кристаллов суспензии обеспечивает безболезненность инъекций.
Локальное внутрисуставное введение триамцинолона гексацетонида вызывало кратковременное уменьшение боли в коленных суставах, пораженных ОА; результаты лечения были лучшими в случаях предварительной аспирации экссудата из суставной полости перед инъекцией (Gaffney K. et al., 1995). P.A. Dieppe и соавторы (1980) продемонстрировали, что локальное внутрисуставное введение ГКС приводит к более выраженному уменьшению боли, чем плацебо.
Основные показания к использованию ГКС при ОА — персистирование синовита на фоне консервативного лечения, а также персистирующее воспаление периартикулярных тканей (тендовагинит, бурсит и др.). Планируя внутрисуставное введение пролонгированных ГКС, необходимо помнить о том, что препараты этой группы противопоказаны при инфекционных артритах различной этиологии, инфицировании кожи и подкожной жировой клетчатки или мышц в зоне введения, сепсисе, гемартрозах (гемофилия, травмы и др.), внутрисуставных переломах. При упорном болевом синдроме и отсутствии синовита, не купирующимся консервативной терапией, не следует вводить ГКС в сустав, надо ввести периартикулярно. При ІІІ–IV стадиях по Kellgren и Lawrence внутрисуставные инъекции ГКС необходимо использовать крайне осторожно, лишь в случае неэффективности консервативных мероприятий.
Важным требованием при проведении внутрисуставных инъекций является соблюдение правил асептики: руки врача должны быть чистыми, желательно в хирургических перчатках; используются только одноразовые шприцы; после набора препарата в шприц непосредственно перед введением иглу меняют на стерильную; эвакуацию внутрисуставной жидкости и введение препарата необходимо производить разными шприцами; зону введения обрабатывают 5% спиртовым раствором йода, затем 70% спиртом; после введения место инъекции прижимают ватным тампоном, смоченным 70% спиртом, и фиксируют пластырем или повязкой не менее чем на 2 ч; при проведении манипуляции персонал и больной не должны разговаривать.
После введения иглы в полость сустава необходимо аспирировать максимальное количество суставной жидкости, что уже способствует некоторому обезболивающему эффекту (снижается внутрисуставное давление, с синовиальной жидкостью из полости удаляются механические и биохимические индукторы воспаления), а также освобождает место для последующего введения лекарственного вещества.
По данным H.J. Kreder и соавторов (1994), негативный эффект внутрисуставных инъекций ГКС у кроликов потенцировался их двигательной активностью. После внутрисуставного введения депо-форм ГКС целесообразно некоторое время не нагружать сустав, так как соблюдение периода покоя после инъекции способствует более выраженному и продолжительному эффекту (Brandt K.D., 2002).
В связи с тем что исследования, проведенные на животных, продемонстрировали способность ГКС повреждать суставной хрящ, а частые внутрисуставные инъекции депо-форм ГКС ассоциируются с разрушением внутрисуставных тканей (Gray R.G., Gottleib N.L., 1983), инъекции не рекомендуют проводить чаще чем 3–4 раза в год. Однако H.W. Balch и соавторы (1977), которые ретроспективно оценивали рентгенограммы суставов после повторных инъекций на протяжении 4–15 лет, утверждали, что рациональное использование повторных инъекций этих препаратов не приводит к ускорению прогрессирования болезни по данным рентгенографии.
Осложнения локальной терапии ГКС можно разделить на внутрисуставные и внесуставные (Младенович В., 1990):
- внутрисуставные: неэффективность внутрисуставной ГКС-терапии вследствие рези стентности тканей сустава к ГКС отмечается у 1–10% больных. Полагают, что в основе механизма этого процесса лежит недостаток ГК-рецепторов в воспаленной синовиальной ткани; усиление боли и припухлости сустава наблюдается у 2–3% больных, что связано с развитием фагоцитоза кристаллов гидрокортизона лейкоцитами синовиальной жидкости; остеопороз и костно-хрящевая деструкция. J.L. Hollander, анализируя результаты длительного лечения 200 больных, наряду с хорошим клиническим эффектом наблюдал быстрое прогрессирование остеопороза у 16% пациентов, эрозирование суставного хряща — у 4% и увеличение костной деструкции суставных поверхностей — у 3% больных; гемартроз; Г.П. Матвеенков и соавторы (1989) наблюдали два случая гемартроза при проведении 19 000 пункций суставов; инфицирование полости сустава с последующим развитием гнойного артрита; наиболее часто инфицирование происходит в коленном суставе, как правило, признаки воспаления появляются через 3 дня после инъекции;
- внесуставные: атрофия кожи в месте инъекции возникает при попадании лекарства во внесуставные ткани и отмечается преимущественно после инъекций ГКС в мелкие суставы: челюстные, межфаланговые, пястнофаланговые; описана атрофия кожи после инъекций в коленный сустав; линейная гипопигментация с проксимальным распространением от сустава; околосуставная кальцификация — может присоединиться к атрофии кожи над суставами; тканевые гранулематозные реакции; разрывы связок и сухожилий, патологические переломы костей.
Медленнодействующие препараты для лечения при ОА. Системная энзимотерапия
Системная энзимотерапия (СЭТ) — вид терапии, основанный на пероральном применении препаратов гидролитических энзимов, преимущественно протеолитического действия, животного и растительного происхождения, позволяющих воздействовать на различные патологические процессы в организме.
Речь идет о резистентных к воздействию желудочного сока таблетированных формах таких энзимов, как папаин, бромелаин (протеиназы растительного происхождения), трипсин и химотрипсин, полученных из поджелудочной железы животных в комбинации с рутином.
При пероральном введении препараты СЭТ оказывают системное действие, проявляющееся в их способности оптимизировать течение воспалительного процесса, нормализовать реологические свойства крови, иммунологические реакции, липопротеидный спектр крови и т.д.
Важно, что при пероральном приеме препаратов практически отсутствуют побочные эффекты, возникающие при применении средств, традиционно используемых в лечении пациентов с ОА.
СЭТ была разработана в 1954 г. М. Вольфом и К. Рансбергером и успешно применяется в Европе и США в лечении пациентов с различными заболеваниями, сопровождающимися воспалительным синдромом.
Кишечно-растворимая форма таблеток обеспечивает доставку энзимов в тонкую кишку, где происходит их всасывание. В крови энзимы связываются с плазматическим белком α2-макроглобулином, за счет чего снижается их антигенность.
После поступления в кровь, в основном в лимфу, протеиназы в связанном с α2-макроглобулином виде проникают в печень и легкие, где воздействуют на макрофаги и функциональные клетки этих органов, изменяя их метаболизм, что проявляется улучшением антитоксической функции печени и усилением барьерной функции легких.
Экзогенные протеиназы, взаимодействуя в крови с α2-макроглобулином, могут влиять на метаболизм биологически активных веществ, выделяющихся в очаге воспаления (брадикинины, лейкокинины). Протеолитические энзимы способны расщеплять указанные пептиды, оказывая противоотечное и противовоспалительное действие, особенно при хронических воспалительных заболеваниях, протекающих с нарушением микроциркуляции. Улучшение микроциркуляции обусловлено фибриногенолитическим действием препаратов СЭТ (Веремеенко К.Н., Коваленко В.Н., 1999), а также способностью повышать активность тканевого активатора плазминогена, угнетаемого вследствие наличия хронического воспалительного процесса (Веремеєнко К.М. та співавт., 2002).
Модуляция активности цитокинов, ТФР-β с помощью препаратов СЭТ (Desser L. еt al., 2001) представляет особый интерес в связи с наблюдаемым при ОА дисбалансом в иммунной системе. Известно, что избыток ИЛ-1 и ФНО играет большую роль в патогенезе синовиита и повреждения хрящевой ткани при ОА, поэтому очень важна способность активированного протеиназой α2-макроглобулина выводить и инактивировать их (Веремеенко К.Н., Коваленко В.Н., 2000).
Учитывая эти свойства препаратов СЭТ и особенности патогенеза ОА, F. Singer впервые в 1990 г. применил Вобэнзим (производитель «Mucos Pharma») в качестве альтернативы лечению диклофенаком. В ходе рандомизированного двойного слепого исследования эффективности Вобэнзима при лечении ОА препарат применяли по 7 драже 3 раза/сут на протяжении 5 нед. Клиническая эффективность СЭТ оказалась сопоставимой с результатами лечения диклофенаком в дозе 100 мг/сут на протяжении аналогичного периода.
В другом двойном слепом проспективном рандомизированном исследовании F. Singer и соавторы (2001) использовали Флогэнзим (производитель «Mucos Pharma») в дозе 6 таблеток в сутки в течение 3 нед и выявили, что препарат является безопасной и эффективной альтернативой использованию диклофенака в лечении при остром гонартрозе. Преимущество лечения Флогэнзимом заключается в выраженном противовоспалительном эффекте и хорошей переносимости (Singer F. еt al., 2001) при отсутствии серьезных побочных реакций.
Baerwald C.H. и соавторы (1999) в двойном слепом проспективном исследовании отметили, что непрерывно нарастающий положительный эффект действия СЭТ на клинические проявления заболевания сохранялся на протяжении всего периода лечения (6 мес), а применение СЭТ в комбинации с НПВП было наиболее эффективным в течение первых 2 мес.
G. Klein и W. Kullich (2000) в рандомизированном, двойном исследовании кратковременного лечения энзимами перорально пациентов с острым остеоартритом с выраженным болевым синдромом по сравнению и с диклофенаком доказали, что оральные энзимы можно считать эффективной и безопасной альтернативой таким НПВП, как диклофенак, в лечении острых гонартритах.
Без сомнения, НПВП, и диклофенак в частности, являются препаратами первого ряда в лечении при ОА. Однако высокая частота возникновения серьезных тяжелых побочных реакций, в том числе скрытых (Shallcross T., Heatley R., 1990; Soil A., Weinstein W. et al., 1991; Baskin W., Ivey K., 1992; Miller D., 1992), связанных с блокадой циклооксигеназы, создает предпосылки для поиска более безопасных методов лечения. Системная энзимотерапия не имеет серьезных побочных эффектов (Klein G. et al., 1976) и обычно хорошо переносится (Reinbold H., Maehder K., 1981; Miehlke K., 1990; Worschnauser S., 1990; Miehlke K., 1991).
Трипсин и бромелаин, которые входят в состав Флогэнзима, инактивируют молекулы адгезии, в том числе IKAM-1, IКАМ-2 и LFA-3, играющие важную роль в индуцировании воспаления (Tanaka Y. et al., 1995). Это действие препарата также способствует снижению интенсивности воспалительной реакции и таким образом регулирует ее течение.
Отек. Уже на ранней стадии воспалительной реакции наблюдается противоотечное действие трипсина и бромелаина (Gaggi R., Biaggi G., 1985). Бромелаин, входящий в состав Флогэнзима, снижает концентрацию брадикинина (Bodi T., 1966), а также редуцирует отек, вызванный арахидоновой кислотой, вероятнее всего, влияя на ее метаболизм (Вальд М. и соавт., 2004). Противоотечному действию протеаз также способствует снижение концентрации гистамина под влиянием прямого ингибирующего действия трипсина на дегрануляцию тучных клеток (Wood G. et al., 1997; Вальд М. и соавт., 2004).
Фибринолиз. Под действием протеаз, входящих в состав Флогэнзима, опосредованно за счет усиления синтеза и высвобождения тканевого активатора плазминогена (тАП) происходит активация фибринолиза эндотелиальными клетками и макрофагами (Веремеєнко К.М. та співавт., 2002), что способствует превращению плазминогена в плазмин. Это приводит к улучшению реологических свойств крови и восстановлению микроциркуляции, что в свою очередь способствует поступлению антибиотиков и химиотерапевтических препаратов в ткани. Флогэнзим обладает выраженной фибриногенолитической активностью за счет содержания бромелаина, способного гидролизовать фибриноген (Веремеенко К.Н. и соавт., 1999), что ведет к снижению его уровня, а, значит, и вязкости крови (Веремеенко К.Н. и соавт., 2000).
Расщепление иммунных комплексов обусловлено действием бромелаина, который подавляет их образование и повышает их клиренс (Ноузе К. и соавт., 1994; Божков В.Е., Мазуров В.И., 1996; Веремеенко К.Н., Коваленко В.Н., 1999). Благодаря активации системы мононуклеарных фагоцитов обеспечивается более интенсивный захват иммунных комплексов макрофагами различных органов и уменьшается их образование вследствие меньшего повреждения клеток в очаге аутоиммунного воспаления (Веремеєнко К.М. та співавт., 2002).
Модуляция рецепторов. Протеазы (в основном трипсин) способны влиять на величину экспрессии рецепторов CD4, CD44 и B7-1 и тем самым повышать порог активации Т-лимфоцитов, что ведет к ограничению гиперактивации воспалительного процесса (Targoni O.S. et al., 1999; Вальд М. и соавт., 2004). Доказано, что протеазы снижают плотность экспрессии адгезивных молекул на аутореактивных Т-лимфоцитах, способствуя снижению активности заболевания (Божков В.Е., Мазуров В.И., 1996).
Клеточная активность. Комплексы α2-М-протеиназы активируют макрофаги легких и печени (клетки Купфера), а также неспецифическую резистентность этих органов и как следствие — всего организма за счет интенсивности фагоцитоза, продукции супероксиданион радикала мононуклеарами, антимикробной защиты в целом (Веремеенко К.Н. и соавт., 2000). Комплексы α2-М-протеиназы активируют и другие клетки системы мононуклеарных фагоцитов (СМФ): макрофаги селезенки, костного мозга, гистиоциты соединительной ткани, кожи, остеокласты, клетки микроглии в нервной системе и т.д. (Фрейдлин И.С., 1984). Это оказывает, в свою очередь, влияние на воспаление (в т.ч. аутоиммунное воспаление), новообразования, артериальную и венозную гиперемию, тромбоз и др. (Веремеенко К.Н. и соавт., 2000).
Рутин обладает противовоспалительным действием, адсорбирует свободные радикалы, стабилизирует эндотелий сосудов (то есть обладает свойством укреплять сосудистую стенку) и тем самым снижает проницаемость сосудисто-тканевых барьеров, что препятствует выходу плазменных белков за пределы сосудистого русла (снижает выраженность отека).
СЭТ в Украине впервые применил В.Н. Коваленко в 1995 г. при лечении больных c РА и ОА. В дальнейшем ее успешно стали использовать в схемах лечения при других ревматических заболеваниях в различных клиниках и центрах Украины.
Клинический опыт лечения больных с ОА (Веремеенко К.Н., Коваленко В.Н., 2000; Пишак О.В., 2000; Шолохова Л.Б., 2001) с использованием препаратов СЭТ Флогэнзима и Вобэнзима в комбинации с НПВП и хондропротекторами доказал клиническую эффективность, безопасность и хорошие отдаленные результаты комбинированной фармакотерапии.
Курс СЭТ повышает функциональную активность фагоцитирующих клеток крови, что сопровождается снижением содержания IgA, ЦИК и α2-макроглобулина в сыворотке крови. Использование СЭТ у больных с ОА с остеопеническими изменениями предотвращает потерю МПК. После курса лечения Флогэнзимом в дозе 2 таблетки 3 раза в сутки на протяжении 3–4 нед отмечается значительное снижение плазменной протеолитической активности, содержания в крови пероксидномодифицированных белков, молекул средней массы при нормализации уровня церулоплазмина и метаболизма углеводно-белковых компонентов соединительной ткани (Пишак О.В., 2002).
Препараты СЭТ являются эффективной и безопасной альтернативой использованию НПВП при лечении пациентов с ОА в период обострения, а также в случае возникновения побочных явлений при применении НПВП. Результаты проведенных исследований показали, что препараты СЭТ способствуют уменьшению воспаления, боли и отека, снижают частоту обострений ОА, улучшают качество жизни и не проявляют побочных эффектов (Wittenberg A. et al., 2000; Singer F. et al., 2001; Шолохова Л.Б., 2001). В настоящее время СЭТ включена в рекомендованные Ассоциацией ревматологов Украины стандарты лечения при ревматических заболеваниях (Коваленко В.Н. и соавт., 2002). Проведены исследования комбинированного применения Флогэнзима и хондропротекторов. Важное преимущество подобной комбинации — это возможность быстрого устранения синовита без побочных явлений.
Таким образом, СЭТ в комплексном лечении при остеоартрозе является эффективной и безопасной альтернативой длительному применению НПВП (Klein G., Kullich W., 2000; Singer F. et al., 2001; Tilwe G. et al., 2001). СЭТ характеризуется клинической эффективностью в сочетании с хорошей переносимостью препаратов в высоких дозах при длительном применении.
Хондропротекторы
Как естественный компонент суставного хряща глюкозамина сульфат (сульфатированное производное естественного аминомоносахарида глюкозамина) был впервые использован как средство, стимулирующее репаративные процессы у больных с ОА, более 20 лет назад. Глюкозамина сульфат обладает хорошей биодоступностью при пероральном применении и благоприятным для остеоартроза фармакокинетическим профилем, включая тропность к суставному хрящу. В условиях in vivo глюкозамин синтезируется хондроцитами из глюкозы в присутствии глутамина. В дальнейшем глюкозамин используется хондроцитами для синтеза гликозаминогликанов и протеогликанов.
Глюкозамин играет важную роль в биохимических процессах, происходящих в суставном хряще, так как он образует полисахаридные цепи основных гликозаминогликанов синовиальной жидкости и хрящевого матрикса (табл. 85).

В контролируемом исследовании W. Noack и соавторы (1994) отметили, что эффективность четырехнедельного лечения глюкозамина сульфатом в дозе 1500 мг/сут (n=126) значительно превышает таковую плацебо (n=126). Эффект лечения стал очевиден спустя 2 нед терапии, впоследствии в течение 2 нед симптомы ОА продолжали ослабевать. Количество побочных эффектов в основной группе статистически не отличалось от такового в группе плацебо.
H. Muller-Fasbender и соавторы (1994) в рандомизированном двойном слепом плацебо-контролируемом исследовании обнаружили, что эффективность четырехнедельной терапии глюкозамина сульфатом в дозе 1500 мг/сут (n=100) эквивалентна таковой ибупрофеном в дозе 1200 мг/сут (n=99) у больных с ОА коленных суставов. Глюкозамина сульфат уступал ибупрофену по скорости наступления эффекта (спустя 2 нед от начала терапии), однако по безопасности значительно превосходил его (6% побочных эффектов в группе глюкозамина сульфата и 35% — в группе ибупрофена; р<0,001). Преждевременное прерывание лечения было зарегистрировано у 1% больных, принимавших глюкозамина сульфат, и у 7% больных, леченных ибупрофеном (р=0,035).
Шестинедельное лечение больных с ОА коленных суставов путем внутримышечного введения препарата (n=79, 400 мг 2 раза в неделю) также оказалось эффективнее плацебо (n=76) по данным рандомизированного двойного слепого исследования (Reichelt A. et al., 1994).
Целью исследования G.X. Qui и соавторов (1998) было сравнение влияния глюкозамина сульфата и ибупрофена на симптомы ОА коленных суставов. В течение 4 нед 88 больных получали глюкозамина сульфат в дозе 1500 мг/сут и 90 больных — ибупрофен в дозе 1200 мг/сут с последующим двухнедельным периодом наблюдения после окончания курса лечения. Авторы обнаружили, что эффективность глюкозамина сульфата эквивалентна таковой ибупрофена, полученный эффект удерживался на протяжении 2 нед после окончания лечения глюкозамина сульфатом.
J.Y. Reginster и соавторы (2001) изучали влияние глюкозамина сульфата в дозе 1500 мг/сут (n=106) на прогрессирование структурных изменений в суставах и симптомы ОА у больных с гонартрозом по сравнению с плацебо (n=106) после трех лет лечения. В группе больных, получавших плацебо, наблюдали прогрессирование сужения суставной щели со средней скоростью 0,1 мм в год, тогда как у больных, леченных глюкозамина сульфатом, прогрессирования сужения суставной щели не отмечено. Таким образом, к концу 3-летней терапии средняя и минимальная высота суставной щели у больных, получавших глюкозамина сульфат, была значительно большей, чем в группе плацебо (р=0,043 и р=0,003 соответственно).
В среднем по данным краткосрочных контролируемых клинических исследований побочные эффекты на фоне лечения глюкозамина сульфатом наблюдались в 15% случаев; примерно с такой же частотой побочные эффекты регистрировали в группах плацебо. Побочные эффекты терапии глюкозамина сульфатом обычно были преходящими, слабо выраженными и проявлялись ощущением дискомфорта и болью в области желудка, запором, диареей, метеоризмом, тошнотой, изредка возникали реакции гиперчувствительности (зудящая кожная сыпь, эритема), очень редко — головная боль, расстройства зрения, выпадение волос.
Хондроитин сульфат — гликозаминогликан, локализующийся во внеклеточном матриксе суставного хряща. Фармакокинетические исследования показали, что при приеме внутрь он хорошо абсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости. В исследованиях in vitro показано, что хондроитин сульфат обладает противовоспалительной активностью, в основном на клеточный компонент воспаления, стимулирует синтез гиалуроновой кислоты и протеогликанов и угнетает действие протеолитических ферментов (Baici A., Bradamante P., 1984).
В. Mazieres и соавторы (1996) в рандомизированном двойном слепом плацебо-контролируемом исследовании изучали эффективность и переносимость хондроитин сульфата у 120 пациентов с ОА коленных и тазобедренных суставов. Больные принимали в течение 3 мес хондроитин сульфат или плацебо по 4 капсулы в сутки с последующей двухмесячной фазой наблюдения, в ходе которой оценивали отдаленные результаты. Первичным критерием эффективности служила потребность в НПВП, выраженная в диклофенаковом эквиваленте (мг). По завершении трехмесячного лечения пациенты, принимавшие хондроитин сульфат, нуждались в значительно меньшем количестве НПВП, чем больные, получавшие плацебо, причем в период наблюдения среднюю суточную дозу НПВП продолжали снижать. Анализ вторичных критериев эффективности (ВАШ, индекс Лекена, общая оценка эффективности врачом и больными) также продемонстрировал статистически достоверное преимущество изучаемого препарата над плацебо. Переносимость хондроитин сульфата была сравнимой с таковой плацебо — побочные эффекты зарегистрированы у 7 больных контрольной группы (гастралгия, запор, диарея, отек век) и у 10 больных контрольной группы (гастралгия, тошнота, диарея, сонливость, сухость слизистой оболочки полости рта).
В другом многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании проводили сравнительную оценку эффективности и переносимости двух режимов дозирования хондроитин сульфата (1200 мг/сут однократно или в 3 приема) у больных с ОА коленных суставов (І–ІІІ стадии по Kellgren и Lawrence) (Bourgeois P. et al., 1998). У больных, получавших хондроитин сульфат, наблюдали значительное снижение индекса Лекена и ВАШ (р<0,01), в то время как в группе плацебо отмечались лишь достоверная положительная динамика ВАШ (р<0,05) и недостоверная тенденция к снижению индекса Лекена (р>0,05). Переносимость хондроитин сульфата была удовлетворительной и сопоставимой с переносимостью плацебо (побочные эффекты наблюдали у 16 из 83 больных, леченных хондроитин сульфатом, и у 12 из 44 больных, получавших плацебо).
В публикации L. Bucsi и G. Poor (1998) обобщены результаты 6-месячного рандомизированного двойного слепого плацебо-контролируемого исследования эффективности и переносимости хондроитин сульфата в дозе 800 мг/сут у 80 больных с ОА коленных суставов (I–III стадия по Kellgren и Lawrence), проведенного в двух центрах. По данным ВАШ в группе хондроитин сульфата наблюдали медленное уменьшение выраженности боли в течение всего исследования (на 23% — через 1 мес, на 36% — через 3 мес, на 43% — к концу лечения), тогда как на фоне плацебо отмечали незначительное снижение показателя (на 12% — через 1 мес, на 7% — через 3 мес и на 3% — к концу исследования). Аналогичную динамику наблюдали со стороны индекса Лекена. Переносимость хондроитин сульфата и плацебо была одинаковой.
D. Uebelhart и соавторы (1998) в пилотном рандомизированном двойном слепом плацебо-контролируемом исследовании изучали влияние хондроитин сульфата (800 мг/сут в течение 1 года) на прогрессирование ОА коленных суставов у 42 больных. Цифровой автоматический анализ рентгенограмм коленных суставов, выполненных перед началом лечения и после его окончания, показал, что у больных, леченных хондроитин сульфатом, наблюдали стабилизацию высоты суставной щели в медиальной области ТФО коленного сустава, тогда как в группе плацебо было достоверное сужение суставной щели.
B.F. Leeb и соавторы (2000) выполнили метанализ 16 публикаций результатов 7 контролируемых исследований эффективности хондроитин сульфата у 372 больных с ОА. Результаты наблюдения в течение 120 и более дней пациентов, получающих хондроитин сульфат в комбинации с НПВП или простыми анальгетиками, свидетельствуют, что по таким показателям, как ВАШ боли и индекс Лекена этот препарат превосходил плацебо. Улучшение в среднем составило 50%. Авторы метанализа пришли к выводу, что хондроитин сульфат может быть полезным в лечении при ОА, однако необходимы дальнейшие более длительные исследования с большим количеством пациентов с тем, чтобы доказать его симптомомодифицирующие свойства.
Изучение в Украине эффективности и переносимости хондроитин сульфата (Структум®, производитель «Pierre Fabre») проведено в открытом 9-месячном многоцентровом исследовании (В.Н. Коваленко, Г.В. Дзяк, Н.М. Шуба, О.Б. Яременко, Е.Ю. Тимошенко). Основную группу составили 30 больных гонартрозом II стадии по Келлгрену-Лоуренсу в возрасте 55–65 лет, которые на протяжении 6 мес получали Структум® 1000 мг/сут и диклофенак 100 мг/сут на протяжении 3 нед, а дальше — по необходимости. Наблюдение больных проводилось до 9 мес от начала исследования. В контрольную группу включили 30 больных, сопоставимых по демографическим и начальным клиническим показателям с пациентами основной группы, которые получали диклофенак 100 мг/сут на протяжении 3 нед, а далее — по потребности. Все больные обследованы клинически по стандартному протоколу исследования суставов, который включал: индекс Лекена для гонартроза (баллы); объем движений в коленных суставах (градусы); оценку болевого синдрома (баллы); оценку подвижности и повседневной деятельности по шкале WOMAC; среднесуточное потребление НПВП (мг) на эквивалент диклофенака; общую оценку эффективности лечения врачом и пациентом по 4-балльной шкале (0 — значительное ухудшение, 1 — ухудшение, 2 — без изменений, 3 — улучшение, 4 — значительное улучшение); общую оценку переносимости препарата по 3-балльной шкале (0 — плохая, 1 — удовлетворительная, 2 — хорошая); рентгенологическое исследование клинически более пораженного коленного сустава в фронтальной и боковой проекциях в положении больного лежа перед включением в исследование и через 9 мес, причем оценку РСЩ осуществляли по фронтальному снимку; лабораторное обследование включало общий анализ крови, биохимический анализ крови с определением креатинина, АЛТ, АСТ, СРБ.
10 больным основной группы и 10 — контрольной, обследованным на базе Украинского ревматологического центра, проводили ультразвуковую диагностику коленных суставов на аппарате SONOLINE Omnia (Siemens) с линейным датчиком с частотой 7,5 Мгц в режиме ortho в стандартных позициях (Backhaus M. et al., 2001). Оценивали состояние костных суставных поверхностей, РСЩ, околосуставных мягких тканей, наличие выпота и некоторые другие параметры.
Статистический анализ данных осуществляли с применением критерия Стьюдента, корреляционного и многофакторного дисперсионного анализа с использованием пакета программ STATGRAPHICS.
Все больные основной и контрольной групп закончили полный 6-месячный курс лечения и наблюдались на протяжении следующих 3 мес. Значительное снижение альгофункционального индекса Лекена отмечено лишь у больных основной группы. Снижение этого показателя отмечалось уже через 3 мес лечения (на 41,2%), а на 9-м месяце наблюдения он был в 2,5 раза ниже по сравнению с первоначальным значением.
В основной группе также наблюдали достоверный прирост и нормализацию объема cгибания в коленных суставах.
У 20 (66,7%) больных основной группы в конце исследования объем движения был в пределах физиологической нормы (130–150°). Как и индекс Лекена, достоверная положительная динамика объема движений наблюдалась уже через 3 мес, а разность с показателями больных контрольной группы становилась статистически значимой через полгода. В контрольной группе увеличение объема движений было несущественным, средний показатель не достиг нормальных величин.
Данные анализа анкеты WOMAC свидетельствуют о том, что в основной группе выявлена статистически значимая положительная динамика выраженности боли в покое и при движении, ограниченной подвижности суставов, затруднений в повседневной деятельности. Достоверное улучшение всех составляющих анкеты WOMAC отмечено как на обоих этапах лечения (3-й и 6-й месяц), так и через 3 мес после завершения приема Структума. В контрольной группе через 9 мес наблюдения существенно уменьшилась лишь выраженность боли при движении. По всем показателям наибольшая количественная разность между основной и контрольной группами наблюдалась на 6-м месяце лечения.
За время лечения уменьшилась потребность в НПВП у пациентов основной группы, причем суточная доза НПВП в перерасчете на эквивалент диклофенака через 3 мес снизилась до 41,0% от исходного уровня, а через 6 мес — до 13,0%. За следующие 3 мес наблюдения этот показатель статистически не изменился (p>0,1).
Следует отметить, что через 6 и 9 мес терапии около 40% больных, принимавших Структум®, смогли отказаться от приема НПВП. В контрольной группе потребление НПВП в перерасчете на эквивалент диклофенака на 3, 6 и 9-м мес наблюдения составляло, соответственно, 87, 74 и 84%. Разность между основной и контрольной группами была возможной, начиная с 3-го мес, и сохранялась до конца исследования (p<0,01).
Полученные нами данные относительно потребности в потреблении НПВП больными с ОА свидетельствуют о преимуществах применения препарата Структум® в лечении этой категории пациентов. Это мнение совпадает с данными других исследователей (Насонова В.А. и соавт., 2001), которые в открытом рандомизированном многоцентровом исследовании указали на снижение потребности в потреблении НПВП при гонартрозе в 5,7 раза на фоне применения препарата Структум®.
Данные рентгенологического исследования коленных суставов свидетельствуют, что достоверной динамики в размерах РСЩ нет ни в основной, ни в контрольной группах (p>0,1). Недостоверные данные рентгенологического исследования, полученные в этом исследовании, могут объясняться как недостатками рентгенологического исследовательского метода относительно выявления ранних изменений в костной ткани, так и непродолжительным периодом наблюдения (Dieppe P., 1995; Altman R.D. et al., 1996; Коваленко В.Н., Борткевич О.П., 2003).
По данным исходной ультразвуковой диагностики, классические признаки ОА коленных суставов (Коваленко В.Н., Борткевич О.П., 2003) выявлены у 100% больных. Они заключались в сужении гиалинового суставного хряща, наличии краевых костных разрастаний (10% в целом по группам, 13,3% — в основной и 6,7% — в контрольной, р<0,05).
В результате проведенной терапии отмечена положительная ультразвуковая динамика у 6 (40,0%) больных основной группы и 4 (26,7%) — контрольной, у которых при первичном исследовании был выявлен выпот в пустоту сустава. У 5 (83,3%) из 6 больных основной группы и 2 (40,0%) из 5 — контрольной отмечено полное исчезновение явлений синовита. Нормализовалась толщина синовиальной оболочки у 3 (75,0%) из 4 больных основной группы и 2 (66,7%) из 3 — контрольной, а также уменьшился отек периартикулярных мягких тканей у всех пациентов. У 4 больных основной группы с наличием (по данным исходной ультразвуковой диагностики) кровотечения в синовиальной оболочке после курса лечения отмечалось его отсутствие, что может свидетельствовать о выраженном противовоспалительном эффекте лечения препаратом Структум®. В контрольной группе у 1 из 2 пациентов кровотечение в синовиальной оболочке сохранялось, что коррелировало с отсутствием положительной клинической динамики.
Таким образом, хондропротекторная терапия препаратом Структум® имела преимущества перед традиционным лечением НПВП (диклофенак) относительно уменьшения проявлений воспаления при длительном наблюдении.
По оценке пациентов, переносимость лечения была существенно лучше в основной группе, чем в контрольной (p<0,05). За 6 мес терапии ни один из пациентов не выбыл из исследования, побочных действий по клиническим и лабораторным данным не отмечалось. Уровень гемоглобина, эритроцитов, лейкоцитов, а также биохимические параметры крови под влиянием обеих схем лечения практически не изменились, показатели колебались в пределах физиологической нормы и их динамика не была статистически значимой, что также свидетельствует о хорошей переносимости лечения по указанной схеме. В основной группе также выявили редкие побочные эффекты НПВП (гастралгия у 2 больных — 6,6%, повышение артериального давления у 2 — 6,6%), которые быстро устранялись путем отмены НПВП или замены на ЦОГ-2-специфические НПВП, применением корригирующей терапии.
В контрольной группе побочные эффекты были отмечены у 10 (33,3%) больных и расценены как незначительные, но требовали замены на другой НПВП (обычно — ЦОГ-2 — селективные НПВП (Целебрекс, Мовалис), назначения корригирующей терапии. 3 больным из 10 с артериальной гипертензией требовалось проведение гипотензивной терапии, которая адекватно снижала АД.
Данные исследований показывают, что оценка эффективности лечения как врачом, так и пациентом была значительно выше при лечении препаратом Структум®, чем в контрольной группе. Это касалось как периода активного лечения (6 мес), так и периода наблюдения больных на протяжении 3 мес.
Подытоживая данные проведенного исследования, хотелось бы подчеркнуть его некоторые, наиболее существенные, результаты.
Так, выраженный клинический эффект препарата Структум® развивается уже через 3 мес после начала терапии, он стабилен и сохраняется через 3 мес после прекращения лечения у 80% больных, причем улучшаются не только субъективные показатели (опросники), но и объективные (объем движений, данные УЗИ). Обратим внимание, что подобные нашим результаты исследования применения Структума получены в России В.А. Насоновой и соавторами (2001), которые свидетельствуют о клиническом улучшении у 90,2% пациентов с ОА, продолжительность эффекта после отмены препарата составляет при гонартрозе 4,6 мес; переносимость Структума хорошая, а побочные реакции отмечали у 2,1% больных.
Особое значение имеет снижение потребности в НПВП, которое достигается при приеме препарата Структум®. Это обусловлено, в первую очередь, снижением риска развития побочных явлений, которые часто наблюдаются на фоне приема НПВП, особенно осложнений со стороны пищеварительного тракта, в том числе желудочно-кишечных кровотечений (Викторов А.П., 1997; Дзяк Г.В., 1997).
Полученные нами в 9-месячном исследовании результаты подтверждаются данными метаанализа 7 плацебо-контролируемых исследований эффективности хондроитин сульфата (Структум®), которые свидетельствуют о том, что по сравнению с плацебо препарат оказывает значительное влияние на болевой синдром и улучшает функцию суставов у больных с ОА, а также приводит к существенному снижению суточной потребности в обезболивающих средствах (Leeb B.F. et al., 2000). Многоцентровое рандомизированное исследование, проведенное в России В.А. Насоновой и соавторами (2001) на базе 9 центров, также продемонстрировало преимущества Структума в лечении при ОА коленных суставов. Это касалось как эффективности препарата относительно болевого и воспалительного синдромов, так и профиля безопасности (В.А. Насонова и соавт., 2001). Данные пилотного рандомизированного двойного слепого плацебо-контролируемого исследования, проведенного D. Uebelhart и соавторами (1998), показали, что у больных гонартрозом на фоне лечения хондроитин сульфатом (800 мг/сут на протяжении 1 года) отмечена стабилизация РСЩ по данным цифровых рентгенограмм, тогда как в группе плацебо РСЩ достоверно суживалась. Поскольку рентгенологический метод, который был применен в этом исследовании, является косвенным относительно оценки суставного хряща, улучшение его ультразвуковых характеристик, которое наблюдалось в нашем исследовании, может служить основой для объективизации хондропротекторного действия хондроитин сульфата (Структум®).
На украинском фармацевтическом рынке недавно было зарегистрировано новое комплексное хондропротекторное средство (БАД) Хомвио-проартрин (производство компании «Хомвиора»), в состав которого входят глюкозамин, хондроитин сульфат, витамин С (аскорбиновая кислота), экстракт зеленого чая, хлорид марганца. О свойствах глюкозамина и хондроитин сульфата описано выше. Витамин С является необходимым компонентом для биосинтеза коллагена: гидроксилирование пролина в гидроксипролин — витамин С-зависимый процесс. Широко известны антиоксидантные свойства аскорбиновой кислоты. Катехины и биофлавоноиды, входящие в состав зеленого чая, также обладают выраженным антиоксидантным действием, угнетают активность провоспалительных ферментов липооксигеназы и ЦОГ. Важным компонентом хомвиопроартрина является хлорид марганца. Это химическое соединение — активатор Mn-зависимых гликозилтрансфераз, активизирующих синтез протеогликанов хрящей. По данным В.Н. Коваленко и соавторов (2004), комбинация Хомвиопроартрина и Флогензима способствует быстрой ликвидации синовита и обеспечивает выраженный обезболивающий и противовоспалительный эффект при отсутствии побочных эффектов.
Алфлутоп — стерильный экстракт морских организмов, состоит из аминокислот, пептидов, глюцидов и микроэлементов — ионов натрия, калия, магния, железа, меди и цинка — медленнодействующий препарат для внутрисуставного и внутримышечного введения, широко применявшийся в Украине. Согласно экспериментальным данным, алфлутоп стимулирует синтез гиалуроновой кислоты, а также может блокировать активность гиалуронидазы (Лукина Г.В., Сигидин Я.А., 2001).
Препараты гиалуроновой кислоты (гилан, гиалган) и гиалуроната натрия (гиалектин) — медленнодействующие противоартрозные агенты, в состав которых входят гиалуроновая кислота или ее натриевая соль — полисахарид, натуральный компонент суставного хряща. Гиалуроновая кислота представляет собой физиологический фактор, принимающий участие в трофике суставного хряща.
Гиалуроновая кислота и ее натриевая соль были предметом многих исследований у больных с остеохондрозом, где в качестве препарата сравнения выступали НПВП или ГКС для внутрисуставного введения.
Результаты проспективного исследования эффективности препарата гиалуроновой кислоты у 43 больных с остеохондрозом со слабо выраженным суставным синдромом продемонстрировали удовлетворительную переносимость и отсутствие побочных эффектов. Препарат оказался неэффективным у больных с наличием суставного выпота и значительными рентгенологическими изменениями в пораженных суставах (Namiki O. et al., 1982).
Сравнение двух дозовых режимов (20 мг и 40 мг) гиалуроновой кислоты с плацебо у больных с ОА коленных суставов продемонстрировало достоверное преобладание эффективности внутрисуставных инъекций гиалуроновой кислоты над плацебо относительно уменьшения боли в пораженных суставах. Более того, положительную динамику показателей суставного синдрома наблюдали еще на протяжении месяца после окончания лечения гиалуроновой кислотой (Bragantini A., Cassini M., 1987).
J. Graf и соавторы (1993) в слепом рандомизированном исследовании эффективности и безопасности гиалуроновой кислоты по сравнению с мукополисахаридом эфиром полисерной кислоты у больных с ОА выявили их удовлетворительную эффективность с достоверным преобладанием гиалуроната.
Результаты сравнения внутрисуставных инъекций гиалуроновой кислоты и метилпреднизолона у больных с ОА свидетельствуют об одинаково высокой эффективности при контролировании симптомов ОА (Pietrogrande V. et al., 1991; Cole A.A. et al., 1996). Была выявлена более длительная ремиссия симптомов ОА после лечения гиалуроновой кислотой, чем после ГКС. G. Leardini и соавторы (1987) рекомендовали гиалуроновую кислоту как альтернативный ГКС препарат для внутрисуставных инъекций.
По данным двойного слепого плацебо-контролируемого исследования эффективности гиалуроновой кислоты (600–1200 kD), у больных с ОА не отмечено существенной разницы в изменении показателей суставного синдрома между группами плацебо и гиалуроновой кислоты. Авторы другого плацебо-контролируемого исследования даже не отмечали статистически существенной динамики показателей в обеих группах. Стратификация по возрасту и тяжести болезни выявила, что гиалуронат был более эффективен, чем плацебо у больных с тяжелым течением болезни в возрасте старше 60 лет.
К настоящему времени сложилось неоднозначное отношение к препаратам гиалуроновой кислоты. Существую данные, свидетельствующие о том, что эффект внутрисуставных инъекций гиалгана слагается из суммы эффектов плацебо и артроцентеза, обязательно проводимого перед инъекцией (Altman R.D. et al., 1998). Более того, данные исследований J.R. Kirwan и E. Rankin (1997) и G.N. Smith и соавторов (1998) свидетельствуют о повреждающем действии гиалуроновой кислоты на суставной хрящ у животных.
По мнению K.D. Brandt (2002), противоречивость результатов клинических исследований гиалуроновой кислоты в некоторой степени зависит от точности введения препарата в полость сустава. Так, по данным A. Johns и соавторов (1997), лишь в 66% случаев депо-метилпреднизолон был введен точно в полость коленного сустава, при этом эффективность лечения коррелировала с точностью попадания в полость сустава. Точность введения препарата увеличивается при проведении предварительной аспирации жидкости (Listrat V. et al., 1997). Кроме того, противоречивость результатов клинических исследований препаратов гиалуроновой кислоты может быть связана с тем, что для их изготовления используются полисахаридные цепи разной молекулярной массы и различного происхождения.
Применение внутрисуставных инъекций гиалуроновой кислоты рекомендуется больным, у которых другие виды лечения неэффективны или вызывают побочные эффекты, требующие прекращение лечения.
Диацереин — дериват антрахинона, способный угнетать продукцию ИЛ-1 (Cruz T.F. et al., 1996), ИЛ-6, ФНО-α и ЛИФ in vitro (Boittin M. et al., 1993; Cruz T.F. et al., 1996; Pelletier J.P. et al., 1997), уменьшать количество рецепторов активатора плазминогена на синовицитах и хондроцитах, тем самым угнетая превращение плазминогена в плазмин (Del Rosso M. et al., 1990), уменьшать образование оксида азота (Cruz T.F. et al., 1996; Pelletier J.P. et al., 1998; Pietrangelo A. et al., 1998). Благодаря этим эффектам диацереин снижает продукцию металлопротеаз коллагеназы (Boittin M. et al., 1993; Cruz T.F. et al., 1996) и стромелизина (Pelletier J.P. et al., 1997) и угнетает высвобождение лизосомальных ферментов, таких, как бета-глюкуронидаза, эластаза и миелопероксидаза (Mian M. et al., 1989). В то же время препарат стимулирует синтез протеогликанов, гликозаминогликанов, гиалуроновой кислоты (Carney S.L. et al., 1995). При экспериментальном моделировании ОА у животных in vivo диацереин эффективно уменьшает воспаление и повреждение суставного хряща, не влияя при этом на синтез ПГ (Bendele A.M. et al., 1996).
Диацереин рассматривают как симптоматический медленнодействующий препарат для лечения ОА (SYSADOA), так как обезболивающий эффект наступает через 2–4 нед лечения, достигает максимума через 4–6 нед и сохраняется на протяжении нескольких месяцев после окончания терапии. В первые 2–3 нед лечения при необходимости можно сочетать терапию диацереином с НПВП или так называемыми простыми анальгетиками. На фоне лечения диацереином наблюдаются следующие побочные эффекты:
- послабление стула (в 7% случаев) в течение первых нескольких дней терапии, в большинстве случаев исчезает спонтанно,
- диарея, боль в эпигастральной области (в 3–5% случаев),
- тошнота, рвота (в < 1% случаев).
M. Lesquesne и соавторы (1998) обнаружили, что потребность больных с ОА коленных и тазобедренных суставов в НПВП на фоне лечения диацереином была статистически значительно меньшей, чем на фоне плацебо. Полученные данные позволили рекомендовать в качестве модифицирующего структуру хряща средство для лечения ОА (EULAR, 2003).
ECHODIAH (Evaluation of the chondromodulating effect of diacerein in hip osteoarthritis) — 3-годичное рандомизированное двойное слепое плацебо-контролируемое исследование, в рамках которого 507 больных коксартрозом получали диацереин 100 мг/сут (255 пациентов) или плацебо (252 пациента) (Dougados M. et al., 2001). Оценку прогрессирования сужения РСЩ осуществляли на рентгенограммах тазобедренных суставов с помощью специальной линейки, выполненной из увеличительного стекла, градуированной по 0,1 мм. 238 (47%) пациентов выбыли из исследования главным образом в связи с развитием побочных эффектов (25% случаев в группе диацереина и 12% случаев в плацебо-группе) и неэффективности лечения (14% — в плацебо-группе и 7% — в группе диацереина). Среди больных, леченных диацереином, рентгенологическое прогрессирование коксартроза (сужение РСЩ на 0,5 мм и более) наблюдали значительно реже, чем в группе больных, получавших плацебо (р<0,05). У пациентов, завершивших 3-годичное лечение диацереином степень сужения РСЩ (0,18± 0,25 мм/год) была значительно ниже, чем в группе больных, получавших в течение 3 лет плацебо (0,23±0,23 мм/год, р=0,042). Однако симптоматического действия диацереина в данном исследовании не наблюдали. Переносимость диацереина была удовлетворительной, наиболее частым побочным эффектом лечения было расстройство стула.
Среди препаратов растительного происхождения, обладающих противоартрозным эффектом, следует отметить экстракт корня имбиря (Zingiber officinale). Имбирь широко использовался в аюрведической медицине — традиционной системе медицинских знаний и практики древних индийцев, применявших комбинации трав. Имбирь используется в Китае и Индии для лечения при головной боли, тошноте, болезнях суставов, острых респираторных инфекциях уже более 2,5 тыс. лет (Grant K.L. et al., 2000). Cодержащиеся в имбире 6-gingerol и 6-shogaol оказывали жаропонижающее, обезболивающее, противовоспалительное, противокашлевое и гипотензивное действие (Suekawa M. et al., 1984). Результаты исследований in vitro свидетельствуют о том, что активные вещества, входящие в состав имбиря, способны угнетать метаболизм арахидоновой кислоты как по циклооксигеназному, так и по липооксигеназному путям (Backon J., 1986; Srivastava K.C. et al., 1992).
Данные многочисленных клинических исследований демонстрируют эффективность экстракта имбиря в лечении больных с ОА. Так, I. Wigler и соавторы (2003) в результате 6-месячного двойного слепого плацебо-контролируемого исследования экстракта имбиря у 29 больных (6 мужчин, 23 женщин) гонартрозом (по критериям ACR, 1986) установили, что в первые 3 мес лечения эффективность экстракта имбиря (определяли по ВАШ боли и ФН) не отличалась от таковой плацебо, однако к концу 6 мес лечения экстракт имбиря был значительно эффективнее плацебо (р<0,001). Один больной основной и 7 больных контрольной группы вышли из исследования из-за неэффективности лечения. Один пациент 1-й группы вышел из исследования из-за развития изжоги (при приеме экстракта имбиря).
R.D. Altman и соавторы (2001) оценили эффективность и безопасность стандартизованного и высококонцентрированного экстракта 2 представителей семейства имбиря Zingiber officinale и Alpinia galanga у 261 больных с ОА коленных суставов в рандомизированном двойном слепом плацебо-контролируемом многоцентровом в параллельных группах 6-недельном исследовании. Анализ результатов показал, что к концу исследования в основной группе у 63%, а плацебо-группе — у 50% пациентов уменьшилась выраженность боли в положении стоя больше чем на 15 мм (р=0,048). При этом выраженность боли в положении стоя в основной группе уменьшилась на 24,5 мм, в плацебо-группе — на 16,4 мм (р=0,005), после прохождения 50 футов — на 15,1 мм в основной группе и на 8,7 мм в плацебо-группе (р=0,016). Также отмечена тенденция к более выраженному снижению индекса WOMAC и уменьшению приема парацетамола в основной группе, по сравнению с плацебо-группой. В то же время пациенты основной группы чаще отмечали развитие побочных эффектов со стороны пищеварительной системы, однако все они были расценены как легкой тяжести.
В проведенном в Украине открытом сравнительном исследовании эффективности Зинаксина (производства компании «Ferrosan») и диклофенака принимали участие 30 больных гонартрозом II–ІІІ рентгенологической стадии по Kellgren и Lawrence в возрасте 50–70 лет, составивших основную группу, которые на протяжении 3 мес получали Зинаксин по 1 капсуле 2 раза в сутки. В контрольную группу вошли 30 больных с ОА, сопоставимых по демографическим и начальным клиническим показателям с пациентами основной группы, получавших диклофенак 100 мг/сут в течение 2 нед, в дальнейшем — по необходимости, с обязательным учетом приема препарата в специально разработанных дневниках. Все больные обследованы в условиях клиники с использованием стандартного протокола обследования суставов, включавшего индекс Лекена для гонартроза, объем движений в коленных суставах, оценку болевого синдрома, подвижности и повседневной активности по шкале WOMAC. Лабораторное исследование включало общий и биохимический с определением креатинина анализы крови. Всем больным проводилось УЗИ коленных суставов на аппарате SONOLINE Omnia (Siemens) с линейным датчиком с частотой 7,5 Мгц в режиме ortho в стандартных позициях.
В обеих группах на фоне лечения определяли положительную динамику исследуемых показателей. В основной группе уже через 1 мес лечения отмечали статистически достоверное снижение альгофункционального индекса Лекена и улучшение объема движений в суставах, к концу исследования — значительное (почти в 2 раза) снижение индекса Лекена и увеличение и нормализация объема движения в пораженных суставах. В то же время в контрольной группе наблюдали лишь тенденцию к снижению индекса Лекена и улучшению объема движений в суставах. Как через 1, так и через 3 мес после начала исследования индекс Лекена и объем сгибания были значительно выше в основной группе, а объем разгибания — значительно ниже, чем в КГ.
В начале исследования у 30,4% больных основной группы диагностирована значительно выраженная (индекс Лекена 11–13 баллов) и у 43,5% — выраженная (8–10 баллов) степени тяжести ОА, к концу исследования у 34,5% пациентов отмечена средняя (5–7 баллов), у 52% — слабая (1–4 балла) степени тяжести ОА. К концу 3 мес исследования альгофункциональный индекс Лекена у большинства больных контрольной группы оставался на уровне значительно выраженной и выраженной степени тяжести.
У пациентов основной группы отмечали достоверный прирост и нормализация объема движений в коленных суставах, который к концу 3 мес достиг физиологической нормы (130–150°). У больных контрольной группы также отмечалось увеличение объема движений в суставах, но средний показатель не достиг нормы.
При анализе показателей болевого синдрома и функционального состояния пациентов основной группы по анкете WOMAC (боль в покое и при нагрузке, ограничение подвижности, затруднения в повседневной деятельности) отмечено достоверное снижение всех показателей через 3 мес после начала исследования. Так, через 3 мес лечения у этих пациентов выраженность боли в покое в среднем уменьшилась в 1,8 раза, 47% из них отметили ее исчезновение.
Для выявления лабораторных маркеров воспаления был проведен общий анализ крови с определением лейкоцитарной формулы и СРБ количественным методом.
По данным анализа динамики острофазовых реактантов, у больных основной группы через 3 мес лечения наблюдали достоверную положительную динамику (р<0,05), причем у пациентов с исходным уровнем СРБ>10 мг/л к концу лечения отмечали снижение и нормализацию этого показателя.
Прочие лабораторные показатели не имели значимой динамики в обеих исследуемых группах и находились в пределах возрастной нормы.
Таким образом, у пациентов основной группы отмечалось явное уменьшение явлений синовита (2,5 раза), а полное исчезновение выпота — почти у половины больных (от 15 больных с наличием выпота в начале до 8 — в конце лечения).
После завершения 3-месячного лечения Зинаксином у пациентов практически не отмечалось двустороннего синовита коленных суставов. Отсутствие же явных воспалительных явлений в коленных суставах к концу терапии не выявлено у большинства — 73,3% (в начале — не более 50%) больных. У пациентов контрольной группы положительная динамика данных УЗИ была незначительной.
Оценка эффективности лечения больным и врачом практически не отличались и свидетельствовала о клинической эффективности препарата. Таким образом, улучшения разной степени выраженности удалось достичь у 90% больных основной группы. Также отмечен явный положительный эффект в отношении основных проявлений ОА, таких как боль, ограничение подвижности, затруднения в повседневной деятельности, уменьшение явлений синовита по данным УЗИ, положительная динамика показателей лабораторных исследований. Необходимо отметить, что достоверную положительную динамику основных клинических проявлений ОА отмечали уже в конце 1-го месяца лечения.
Переносимость Зинаксина была хорошей у 24 пациентов (80%).
У 2 больных побочные действия (растройство стула, гастралгии) отмечались в 1-й месяц, купировались заместительной терапией: ферментными, вяжущими, антацидными препаратами и не требовали отмены Зинаксина — пациенты закончили лечение. Необходимо также отметить, что у большинства участников выявлены сопутствующие сердечно-сосудистые заболевания: артериальная гипертензия, ишемическая болезнь сердца, сердечная недостаточность І степени. За время лечения Зинаксином не было отмечено изменения течения этих заболеваний.
В контрольной группе побочные эффекты были отмечены у 8 (26,6%) больных, у 6 они были расценены как незначительные, но требовали замены на ЦОГ-2 специфический НПВП (Целебрекс) и применения корригирующей терапии. Из 12 больных с артериальной гипертензией 4 требовалась коррекция гипотензивной терапии, которая адекватно снижала АД. Гастралгия и обострение хронических заболеваний пищеварительной системы выявлены у 4 пациентов.
Неомыляющиеся соединения авокадо и сои экстрагируются из плодов авокадо и сои в соотношении 1:2 соответственно. По данным исследований in vitro, они способны угнетать ИЛ-1 и стимулировать синтез коллагена культурой хондроцитов человека (Mouviel A. et al., 1989), угнетать ИЛ-1-индуцированную продукцию стромелизина, ИЛ-6, ИЛ-8, ПГЕ2 и коллагеназы (Henrotin Y. et al., 1998). Клиническая эффективность неомыляющихся соединений авокадо и сои у больных с ОА коленных и тазобедренных суставов была продемонстрирована в двух рандомизированных плацебо-контролированных исследованиях (Blotman F. et al., 1998; Maheu E. et al., 1998). После 6 мес лечения у больных наблюдали статистически достоверную положительную динамику со стороны ВАШ, индекса Лекена и снижение потребности в НПВП. В Украине в настоящее время эти препараты не зарегистрированы.
На рис. 112 приведен алгоритм лечения впервые выявленного ОА коленных суставов.
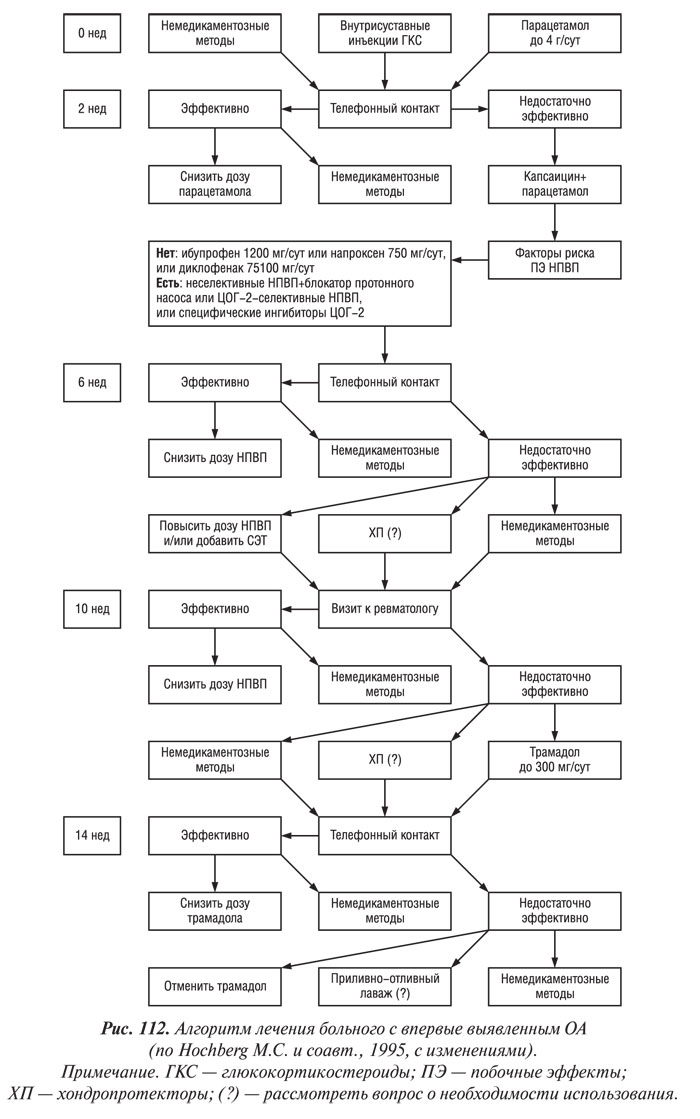
Дифференцированное применение хондроитин сульфата, глюкозамина гидрохлорида и их комбинации в лечении больных остеоартрозом
В настоящее время в терапии при остеохондрозе используются также комбинированные препараты, в состав которых входят глюкозамина гидрохлорид и хондроитин сульфат: Артрон Комплекс («Unipharm Inc.», США); Хомвио-проАртрин («Хомвиора», Германия); Артрофлекс («Terapia»); Терафлекс («Sagmel»).
Известно, что низкомолекулярный хондроитин сульфат (молекулярный вес менее 16,900 Дальтон) лучше абсорбируется в пищеварительной системе (Kelly G.S., 1998; Bali J.P. et al., 2001). 15% его абсорбируется в тонком кишечнике в неизмененном виде даже при молекулярном весе 5–50 тыс. Дальтон (Conte A. et al., 1995). Результаты исследования J. van Blitterswiik Wim и соавторов (2003) свидетельствуют о необходимости дробного дозирования хондроитин сульфата, что обеспечивает существенную аккумуляцию вещества вследствие неполной деполимеризации.
Кроме того, что хондроитин сульфат обеспечивает дополнительный субстрат для построения нормального матрикса суставного хряща, он также обладает противовоспалительным действием, в основном в отношении клеточного компонента воспаления, стимулирует синтез гиалуроновой кислоты и протеогликанов и угнетает активность провоспалительных цитокинов и протеолитических ферментов (De los Reyes G.C. et al., 2000; van Blitterswiik Wim J. et al., 2003). Хондроитин сульфат обеспечивает сульфатирование поврежденных гликозаминогликанов, высвобождая в клетки единицы N-ацетилгалактозамин-сульфата, где последние служат субстратом для гликозилтрансфераз в комплексе Гольджи (Sugahara K., Kitagawa H., 2000; van Blitterswiik Wim J. et al., 2003). Хондроитин сульфат повышает антиоксидантную ферментную активность печени, снижает уровни малонового диальдегида, дозозависимо препятствует развитию оксидативного стресса, обладает свойствами «скевенджера» свободных радикалов (Ha B.J., Lee J.Y., 2003).
Клинические исследования эффективности хондроитин сульфата в лечении больных с ОА подтвердили результаты экспериментальных исследований. В. Mazieres и соавторы (1996) изучали эффективность и переносимость хондроитин сульфата у 120 пациентов с ОА коленных и тазобедренных суставов в рандомизированном двойном слепом плацебо-контролируемом исследовании. Больные в течение 3 мес принимали хондроитин сульфат или плацебо с последующей 2-месячной фазой наблюдения, в ходе которой оценивали отдаленные результаты. Первичным критерием эффективности служила потребность в НПВП, выраженная в миллиграммах эквивалента диклофенака. По завершении 3-месячного лечения пациенты, принимавшие хондроитин сульфат, употребляли значительно меньшее количество НПВП, чем больные группы плацебо, причем в период наблюдения средняя суточная доза НПВП продолжала снижаться. Анализ вторичных критериев эффективности (ВАШ, индекс Лекена, общая оценка эффективности врачом и больными) также продемонстрировал статистически достоверное преимущество изучаемого препарата над плацебо. Переносимость хондроитин сульфата была сравнима с таковой плацебо: побочные эффекты зарегистрированы у 7 больных основной группы (гастралгия, запор, диарея, отек век) и у 10 больных контрольной (гастралгия, тошнота, диарея, сонливость, сухость во рту).
В другом многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании проводили сравнительную оценку эффективности и переносимости двух режимов дозирования хондроитин сульфата (1200 мг/сут однократно или в три приема) у больных с ОА коленных суставов (І–ІІІ стадии по Kellgren и Lawrence) (Bourgeois P. et al., 1998). У больных, получавших хондроитин сульфат, значительно снижался индекс Лекена и ВАШ (р<0,01), в то время как в группе плацебо наблюдали достоверную положительную динамику ВАШ (р<0,05) и недостоверную тенденцию к снижению индекса Лекена (р>0,05). Переносимость хондроитин сульфата была удовлетворительной и сопоставимой с переносимостью плацебо (побочные эффекты отмечали у 16 из 83 больных, принимавших хондроитин сульфат, и у 12 из 44 больных, получавших плацебо).
В публикации L. Bucsi и G. Poor (1998) обобщены результаты 6-месячного рандомизированного двойного слепого плацебо-контролируемого исследования эффективности и переносимости хондроитин сульфата в дозе 800 мг/сут у 80 больных с ОА коленных суставов (I–III стадия по Kellgren и Lawrence), проведенного в двух центрах. По данным ВАШ, в группе больных, принимавших хондроитин сульфат, наблюдали медленное уменьшение выраженности боли в течение всего исследования (на 23% через 1 мес, на 36% — через 3 мес, на 43% — к концу лечения), тогда как на фоне применения плацебо установлено незначительное снижение показателя (на 12% через 1 мес, на 7% — через 3 мес и на 3% — к концу исследования). Аналогичную динамику наблюдали со стороны индекса Лекена. Переносимость хондроитин сульфата и плацебо была эквивалентна.
D. Uebelhart и соавторы (1998) в пилотном рандомизированном двойном слепом плацебо-контролируемом исследовании изучали влияние хондроитин сульфата (800 мг/сут в течение 1 года) на прогрессирование ОА коленных суставов у 42 больных. Результаты цифрового автоматического аанализ рентгенограмм коленных суставов, выполненных перед началом лечения и после его окончания, свидетельствуют, что у больных, принимавших хондроитин сульфат, стабилизировалась РСЩ в медиальной области большеберцово-бедренного отдела коленного сустава, тогда как в группе плацебо наблюдали ее достоверное сужение.
Глюкозамина гидрохлорид — аминомоносахарид, обладающий хорошей биодоступностью при пероральном применении и благоприятным для остеоартроза фармакокинетическим профилем, включая тропность к суставному хрящу. Он практически полностью (около 90%) абсорбируется в тонком кишечнике, поскольку представляет собой достаточно небольшую молекулу (молекулярный вес — 179 Дальтон) (Gregory S., Kelly N.D., 1998), хорошо растворимую в воде; абсолютная биодоступность глюкозамина гидрохлорида составляет 12–44%. После приема внутрь глюкозамина гидрохлорида быстро поступает в суставной хрящ, который является его специфической мишенью (Setnikar I. et al., 1986; 1993; Kelly G.S., 1998; van Blitterswiik Wim J. et al., 2003). Значительная часть глюкозамина гидрохлорида после перорального приема сразу метаболизируется в клетках печени. Свободный глюкозамина гидрохлорид не выявляют в плазме крови, таким образом, скорее всего, он связывается с белками плазмы крови (Setnikar I. et al., 1986; 1993).
Противовоспалительное действие глюкозамина гидрохлорида выражено незначительно, в то же время он обладает высоким стабилизирующим эффектом на суставной хрящ, стимулируя продукцию протеогликанов, и тем самым дополняет эффективность НПВП, снижает потребность в них (Kelly G.S., 1998).
Имеются данные доказательной медицины относительно глюкозамина: в 16 рандомизированных контролируемых исследованиях подтверждены как эффективность, так и безопасность глюкозамина при ОА. В 12 исследованиях из 13 глюкозамин по сравнению с плацебо был более эффективен. В 4 рандомизированных контролируемых исследованиях, в которых сравнивался глюкозамин с НПВП, глюкозамин оказался более эффективным в 2 и равным им по эффективности — еще в 2.
В январе 2001 г. опубликованы данные J.V. Reginster и соавторов (2001), показавшие, что глюкозамин сульфат значительно замедляет прогрессирование ОА, в частности, уменьшает выраженность симптомов и улучшает структуру хряща.
Эти результаты были подтверждением данных независимого исследования, представленного в ноябре 2000 г. на 64-м ежегодном митинге ACR (Филадельфия) (Hughes R.A., Carr A.L. (2000).
Таким образом, глюкозамин уменьшает выраженность симптомов ОА, улучшает течение заболевания, не вызывая серьезных побочных эффектов. Несмотря на статус глюкозамина как пищевой добавки в некоторых странах, полученные данные свидетельствуют о том, что к глюкозамину нужно относиться серьезно.
Результаты многочисленных экспериментальных исследований in vitro и in vivo продемонстрировали такие эффекты глюкозамина гидрохлорида:
- Уменьшение деградации аггрекана суставного хряща путем угнетения фермента аггреканазы (Sandy J.D. et al., 1998; Ilic M.Z. et al., 2003; van Blitterswiik Wim J. et al., 2003).
- Стимуляция mРНК и синтез белка аггрекана, угнетение продукции и ферментной активности матриксных металлопротеаз (Fenton J.L. et al., 2000; Gouze J.N. et al., 2001; Orth M.V. et al., 2002; van Blitterswiik Wim J. et al., 2003).
- Угнетение выработки медиаторов воспаления — ПГЕ2, оксида азота (Fenton J.L. et al., 2000; Gouze J.N. et al., 2001; Shikman A.R. et al., 2001; Orth M.V. et al., 2002; van Blitterswiik Wim J. et al., 2003).
- Дозозависимое угнетение активации NFκβ, индуцированного интерлейкина-1β (ИЛ-1β), а значит — угнетение синтеза провоспалительных медиаторов, стимулированного ИЛ-1β путем NFκβ-зависимого механизма (Largo R. et al., 2003).
- Угнетение экспрессии генов и синтеза ЦОГ-2, индуцированные ИЛ-1β, отсутствие влияния на синтез ЦОГ-1 (Largo R. et al., 2003);
- Угнетение высвобождения ПГЕ2 в матриксе суставного хряща, стимулированного ИЛ-1β (van Blitterswiik Wim J. et al., 2003).
Клинические исследования демонстрируют высокую симптоматическую эффективность глюкозамина гидрохлорида у больных с ОА. Так, в контролируемом исследовании W. Noack и соавторы (1994) продемонстрировали, что эффективность 4-недельного лечения глюкозамина гидрохлоридом пациентов с ОА в дозе 1500 мг/сут (n=126) значительно превышает таковую у больных, получавших плацебо (n=126). Эффективность лечения стала очевидной через 2 нед терапии, в последующем в течение 2 нед выраженность симптомов ОА продолжала уменьшаться. Количество побочных эффектов у больных основной группы статистически не отличалось от таковых в группе плацебо.
H. Muller-Fasbender и соавторы (1994) в рандомизированном двойном слепом плацебо-контролируемом исследовании выявили, что у больных с ОА коленных суставов эффективность 4-недельной терапии глюкозамина гидрохлоридом в дозе 1500 мг/сут (n=100) эквивалентна таковой ибупрофеном в дозе 1200 мг/сут (n= 99). Глюкозамина гидрохлорид уступал ибупрофену по скорости наступления эффекта (через 2 нед после начала терапии), однако по безопасности значительно превосходил его (6% побочных эффектов в группе больных, принимавших глюкозамина гидрохлорид, и 35% — у леченных ибупрофеном, р<0,001). Преждевременное прекращение лечения зарегистрировано у 1% больных, принимавших глюкозамина гидрохлорид, и у 7% пациентов, леченных ибупрофеном (р=0,035).
G.X. Qui и соавторы (1998) в своем исследовании сравнивали влияние глюкозамина гидрохлорида и ибупрофена на выраженность симптомов ОА коленных суставов. В течение 4 нед 88 больных получали глюкозамина гидрохлорид в дозе 1500 мг/сут и 90 — ибупрофен в дозе 1200 мг/сут с 2-недельным периодом наблюдения после окончания курса лечения. Авторы выявили, что эффективность глюкозамина гидрохлорида эквивалентна таковой ибупрофена, полученный эффект удерживался на протяжении 2 нед после окончания лечения.
J.Y. Reginster и соавторы (2001) изучали влияние глюкозамина гидрохлорида в дозе 1500 мг/сут (n=106) на прогрессирование структурных изменений в суставах и выраженность симптомов ОА у больных гонартрозом по сравнению с плацебо (n=106) после 3 лет лечения. В группе больных, получавших плацебо, наблюдали прогрессирование сужения РСЩ со средней скоростью 0,1 мм/год, тогда как у больных, леченных глюкозамина гидрохлоридом, прогрессирования сужения РСЩ не выявили. Таким образом, к концу 3 лет лечения среднее и минимальное сужение РСЩ у больных, принимавших глюкозамина гидрохлорид, было значительно большим, чем в группе плацебо (р=0,043 и р=0,003 соответственно).
Полученные данные о механизмах действия хондроитин сульфата и глюкозамина гидрохлорида создали предпосылки для комбинирования обеих субстанций с целью потенцирования их эффектов. Результаты некоторых экспериментальных и клинических исследований подтверждают перспективность использования такой комбинации. Так, L. Lippello и соавторы (2000) изучали хондропротекторные свойства хондроитин сульфата, глюкозамина гидрохлорида и аскорбата магния в экспериментальной модели ОА. Изучение гистологических срезов суставного хряща коленных суставов кроликов, получавших монотерапию перечисленных препаратов или их комбинацию, показало, что при комбинированном лечении микроскопические изменения в хряще по Mankin были значительно меньше выражены, чем на фоне монотерапии. Результаты пилотного рандомизированного двойного слепого исследования эффективности комбинации хондроитин сульфата и глюкозамина гидрохлорида у больных с различными заболеваниями височно-нижнечелюстного сустава (в том числе и с ОА) продемонстрировали их более высокую эффективность и удовлетворительную переносимость по сравнению с плацебо (Nguyen P., et al., 2001).
Таким образом, к настоящему времени накопилось достаточное количество информации, позволяющее определить «терапевтическую нишу» для каждого из гликозаминогликанов, промотируемых на фармацевтическом рынке, и их комбинаций (табл. 86).
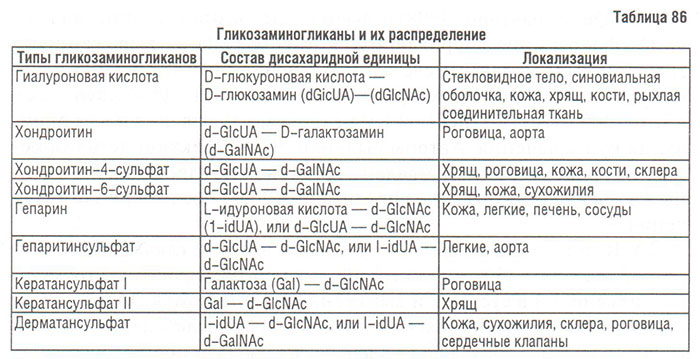
Хирургическое лечение
В монографии мы не ставили цель осветить все аспекты терапии при остеохондрозе, в частности хирургическое (ортопедическое) лечение. Однако, учитывая наш опыт, позволим себе дать рекомендации. Терапевту следует помнить, что каждый больной с ОА, пришедший на прием, независимо от стадии заболевания, должен быть проконсультирован ортопедом, который решает вопрос о необходимости и объеме хирургического вмешательства. Рекомендации хирурга-ортопеда следует обязательно учитывать. Хирургическое лечение при гонартрозе может варьировать от малоинвазивных методик (артроскопические операции) до полной замены сустава протезом (эндопротезирование) — наиболее радикального на сегодня метода лечения (Craemer P., Hochberg M.C., 1997). Кроме того, разрабатываются новые методы хирургического лечения (алло- и аутологическая трансплантация хряща или его клеток), направленные скорее на профилактику заболевания, особенно после травмы, чем на лечение.
Показания к хирургическому лечению:
Артроз плюснефалангового сустава І пальца:
- постоянная резкая боль;
- невозможность носить обычную обувь.
Коксартроз І и ІІ стадии:
- «разгружающие» операции, направленные на перемещение нагрузки на менее патологически измененные отделы.
Коксартроз III и IV стадий:
- проводится эндопротезирование;
- закрытие сустава — артродез.
Гонартроз:
- при І и ІІ стадии гонартроза проводят корригирующую остеотомию для перемещения нагрузки на другие менее патологически измененные отделы;
- в поздних стадиях проводят эндопротезирование.
Санаторно-курортное лечение
На курортное лечение направляют больных с ОА I—III рентгенологической стадии по Келлгрену и Лоуренсу без синовита или при его нерезком обострении. Показаны курорты, на которых используются лечебные грязи, а также с хлоридными, натриевыми и другими минеральными водами (в Украине — Бердянск, Евпатория, Одесса, Саки), с сероводородными водами, с радоновыми водами (в Украине — Хмельник), с азотными слабоминерализованными кремнистыми термальными водами. На санаторно-курортное лечение не направляют больных с ОА IV стадии с резким обострением синовита и наличием противопоказаний к санаторно-курортному лечению.
Критерии качества лечения:
1. Отсутствие или значительное уменьшение проявлений суставного синдрома, отсутствие рецидивов синовита.
2. Улучшение качества жизни пациента.
3. Замедление рентгенологического прогрессирования процесса, деструктивных изменений суставных хрящей (УЗИ суставов, МРТ).
Клиническая классификация, рекомендованная Ассоциацией ревматологов Украины, 2004
I. Первичный (идиопатический).
А. Локализованный (менее 3 суставов)
1. Суставы кистей
2. Суставы стоп
3. Коленные суставы
4. Тазобедренные суставы
5. Позвоночник
6. Другие суставы
Б. Генерализованный (3 и больше суставов)
1. С поражением дистальных и проксимальных межфаланговых суставов (узелки Гебердена и/или Бушара)
2. С поражением крупных суставов
3. Эрозивный
II. Вторичный.
А. Посттравматический
Б. Врожденные, приобретенные или эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.)
В. Метаболические заболевания
1. Охроноз
2. Гемохроматоз
3. Болезнь Вильсона
4. Болезнь Гоше
Г. Эндокринопатии
1. Акромегалия
2. Гиперпаратиреоз
3. Сахарный диабет
4. Гипотиреоз
Д. Болезнь отложения кальция (фосфат кальция, гидроксилапатит)
Э. Нейропатия (болезнь Шарко)
Ж. Другие заболевания (аваскулярный некроз, РА, болезнь Педжета и др.)
III. Рентгенологическая стадия (по Келлгрену и Лоуренсу): 0, I, II, III, IV.
IV. Синовит:
С синовитом,
Без синовита.
V. Функциональная недостаточность суставов:
ФН 0 (сохранена),
ФН I (трудоспособность временно ограничена),
ФН II (трудоспособность утрачена),
ФН III (нуждается в посторонней помощи).
Схема лечения при ОА, предложенная Ассоциацией ревматологов Украины, 2004
1. Противовоспалительная и обезболивающая терапия.
а) Анальгетики:
- ненаркотические: ацетаминофен (парацетамол) до 2 г/сут по потребности;
- наркотические (лишь в случаях неэффективности или непереносимости других препаратов, не длительно): трамадола гидрохлорид (трамал) 50 мг 3 раза в сутки;
б) НПВП — селективные ингибиторы ЦОГ-2:
- мелоксикам (Мовалис) по 7,5–15 мг 1 раз в сутки;
- нимесулид (месулид, нимесил) по 100 мг дважды в сутки;
- целекоксиб (Целебрекс) по 200 мг 1–2 раза в сутки;
в) НПВП — неселективные ингибиторы ЦОГ:
- диклофенак натрия (вольтарен, олфен, диклоберл) по 100–150 мг/сут;
- диклофенак калия (вольтарен-рапид) по 100–150 мг/сут;
- другие.
г) препараты СЭТ:
- Флогэнзим по 2–3 таблетки 3 раза в сутки в течение 3 нед;
- Вобэнзим по 5 таблеток 3 раза по 2–3 недели с дальнейшим переходом на 3 таблетки 3 раза в сутки длительно;
д) пролонгированные формы глюкокортикостероидов внутрисуставно (при неэффективности других противовоспалительных препаратов — не больше 4 инъекций в год):
- депо-медрол (доза 20–40 мг в зависимости от размера суставов);
- бетаметазон (дипроспан) до 2 мг в зависимости от размера суставов.
е) экстракт имбиря (Зинаксин) по 1 капсуле 2 раза в сутки.
2. Хондропротекторы (препараты медленного действия):
а) пероральные:
- хондроитин сульфат (Структум) по 500 мг 2 раза в сутки в течение не меньше 6 мес;
- глюкозамин сульфат по 500–1500 мг 1 раз в сутки в течение 2–3 мес;
- диацереин по 50 мг 2 раза в сутки:
б) парентеральные:
- гиалуроновая кислота (гиалган) по 20 мг внутрисуставно 1 раз в неделю в течение 2 нед, 3 цикла каждые 3 нед.
3. Местное применение НПВП в форме мази и геля:
- олфен-гель;
- вольтарен-гель;
- дип рилиф-гель;
- долгит-крем;
- финал-гель;
- фастум-гель;
- другие.
4. Препараты, улучшающие микроциркуляцию:
- пентоксифиллин (трентал, агапурин) по 100 мг 3 раза в сутки;
- дипиридамол (курантил) 75 мг/сут.
5. Ортопедическое лечение:
а) І–ІІ рентгенологическая стадия по Келлгрену и Лоуренсу:
- корригирующие остеотомии при дисплазии или биомеханических отклонениях;
б) ІІІ–IV рентгенологическая стадия по Келлгрену и Лоуренсу:
- тотальное эндопротезирование;
- артродез пораженного сустава в функционально удобном положении.
6. Лечебная физкультура.
7. Физиотерапевтические процедуры.
8. Санаторно-курортное лечение.
Профилактика остеохондроза
Первичная профилактика остеохондроза должна проводиться еще в детском возрасте. Необходимо следить за правильной позой ребенка за школьной партой во избежание образования юношеского сколиоза с последующим развитием деформирующего спондилеза. Детям необходимы систематические занятия гимнастикой для укрепления мышечно-связочного аппарата. При наличии хотя бы незначительного плоскостопия нужно настойчиво рекомендовать ношение супинаторов для предотвращения дальнейшего опускания свода стопы. При врожденных и приобретенных нарушениях статики (сколиоз, кифоз, дисплазия тазобедренного сустава, О-образные или Х-образные нижние конечности, плоскостопие) необходима консультация ортопеда для возможно ранней коррекции этих нарушений.
Взрослым людям с избыточной массой тела и артралгией и особенно тем лицам, в семьях которых есть больные артрозом, необходимо следить за правильным соотношением между ростом и массой тела, не перегружать суставы, избегать на работе фиксированных поз. Следует выполнять физические упражнения (без перегрузки суставов), особенно рекомендуется плавание с обязательным последующим отдыхом. Полезны общеукрепляющие мероприятия — небольшие прогулки с отдыхом, утренний душ или обтирания, улучшающие кровоснабжение и обмен веществ. Лицам молодого возраста надо учитывать семейное предрасположение к ОА, при выборе профессии избегать видов труда, связанных с перегрузкой и микротравматизацией отдельных суставов (например, при наличии у матери узелков Гебердена и/или Бушара нецелесообразно заниматься работой, сопряженной с повышенной динамической нагрузкой на суставы пальцев рук, например, печатанием на машинке). Этим людям также не следует заниматься тяжелыми видами спорта (тяжелая и легая атлетика, бокс, конькобежный спорт и др.).
При наличии хотя бы минимальных дисплазий и нарушений статики (например, небольшого сколиоза) необходима консультация ортопеда и соответствующее лечение.
Вторичная профилактика заключается в соблюдении мероприятий, препятствующих рецидивированию синовита, — дозированная ходьба, облегченный труд, ходьба с опорой и другие мероприятия, разгружающие суставы.
Прогноз
У больных с коксартрозом (особенно возникшем на фоне дисплазии тазобедренного сустава) в течение нескольких лет может наступить полная инвалидизация. Хотим напомнить об атрофической форме коксартроза (25% случаев) и R6 — оценке по высоте РСЩ, предложенной нами (см. соответствующую главу). При остальных локализациях болезни инвалидность наступает редко, однако часто возникают случаи временной утраты трудоспособности вследствие обострения симптомов суставного синдрома.
При медленном прогрессировании болезни, а также при локализации артроза в нескольких мелких суставах работоспособность больных сохраняется многие годы.
Диспансеризация больных с остеохондрозом
Уже на ранних стадиях ОА крупных суставов (главным образом, коленных и тазобедренных) больных трудоспособного возраста берут на диспансерный учет. Согласно приказу МЗ Украины № 243 от 15.12.1993 г. на диспансерном учете состоят больные с ОА трудоспособного возраста с поражением крупных суставов, преимущественно коленных и тазобедренных, начиная с ранних стадий заболевания.
Для диспансерного учета и длительного амбулаторного лечения больные с ОА могут быть распределены на 4 группы:
- Больные с компенсированным остеохондрозом коленных суставов (без признаков синовита, периартрита);
- Больные с декомпенсированным ОА коленных суставов (с явлениями синовита, периартрита);
- Больные с компенсированным или декомпенсированным коксартрозом;
- Больные с коксартрозом или гонартрозом при наличии сопутствующих заболеваний (мастопатия, фибромиома, выраженные изменения сердечно-сосудистой системы и др.).
Для больных І группы частота плановых вызовов на обследование может составлять 2 раза в год, II группы — 3 раза в год, III группы — 4 раза, для IV группы — 4–5 раз в году.
Рентгенографию суставов для выявления динамики прогрессирования процесса необходимо повторять ежегодно. Общий анализ крови и ревмопробы производят только в периоды плановых вызовов (при необходимости — чаще). Во время плановых вызовов определяют необходимость госпитализации и уточняют показания к физиотерапевтическому и курортному лечению, проводят коррекцию медикаментозной терапии, режима физических нагрузок и др. В процессе диспансерного наблюдения каждые 12 мес на каждого диспансерного больного заполняют этапный эпикриз, в котором, кроме диагноза, группы диспансерного наблюдения и кратности обследования, должны быть отражены рентгенологическая стадия, терапия на всех трех этапах (поликлиника — стационар — курорт), оценка степени прогрессирования и эффективности диспансеризации, а также трудоустройство, переход на инвалидность, изменение диспансерной группы, число дней нетрудоспособности, число случаев обострения в днях.
Рекомендации Европейской антиревматической лиги (EULAR) 2003 г.: доказательный подход к лечению пациентов с остеоартрозом коленных суставов. Отчет специальной комиссии постоянного комитета по международным клиническим, в том числе терапевтическим, исследованиям (ESCISIT)
Введение
Остеохондроз — наиболее распространенное заболевание суставов у пациентов стран Западной Европы. Он характеризуется локальной потерей суставного хряща и замещением костной тканью по центру и краям дефекта. ОА коленного сустава, который поражается чаще всего среди крупных суставов, проявляется инвалидизирующей симптоматикой приблизительно у 10% населения старше 55 лет, у 1/4 из которых выявляется выраженная инвалидизация (Peat G. et al., 2001). Риск утраты трудоспособности ввиду ОА коленных суставов так же велик, как при сердечно-сосудистой патологии, и выше, чем при любых других заболеваниях у лиц пожилого возраста (Guccione A.A. et al., 1994). Согласно отчету ВОЗ о социальных последствиях заболеваний, гонартроз занимает 4-е место среди причин нетрудоспособности у женщин и 8-е — у мужчин (Murray C.J.L., Lopez A.D., 1997). Ежегодные расходы, связанные с ОА, огромны, что обусловлено широкой распространенностью заболевания и высокими затратами на лечение. Рентгенологические признаки ОА коленных суставов обнаруживаются у 30% лиц обоих полов в возрасте старше 65 лет (Cooper С., 1998), среди которых лишь 1/3 отмечают наличие клинических симптомов. Ежегодная частота выполнения артропластики среди жителей Европы в возрасте старше 65 лет варьирует в разных странах, составляя в среднем 0,5–0,7 на 1000 (Dieppe P. et al., 1999).
Среди многочисленных этиологических факторов возникновения ОА коленных суставов наиболее частыми являются общие конституциональные (например, старение, пол, ожирение, наследственность, репродуктивные особенности) и местные неблагоприятные механические факторы (травмы, профессиональные и бытовые факторы, осанка) (Cooper C. et al., 2000; Felson D.T., 2000). В значительной распространенности гонартроза важную роль играют генетические факторы, что подтверждается высоким индексом наследования заболевания (0,39–0,65 — среди близнецов) независимо от предрасполагающих факторов внешней среды или демографических особенностей (Spector T.D. et al., 1996).
ОА коленных суставов характеризуется болевым синдромом и функциональной недостаточностью. Физическая нетрудоспособность, обусловленная болью и ограничением функциональной активности суставов, приводит к снижению качества жизни и повышению риска развития сопутствующей патологии и смертности. Современные подходы к лечению направлены на уменьшение патологической симптоматики с помощью различных методов:
- нефармакологическое лечение (например, образовательные программы, физические упражнения, изменение образа жизни);
- фармакологическое лечение (например, парацетамол, НПВП, местное лечение);
- инвазивные методы лечения (например, внутрисуставные инъекции, лаваж, артропластика).
Основными задачами проводимого лечения являются:
- информирование пациентов об основных симптомах ОА и обучение методам его лечения;
- уменьшение выраженности болевого синдрома;
- улучшение функции пораженного сустава и снижение нетрудоспособности;
- предотвращение или замедление прогрессирования заболевания и его осложнений.
Современные данные об эффективности и целесообразности различных методов лечения имеют значительные различия.
Ранее опубликованы Рекомендации по лечению ОА коленных и тазобедренных суставов Королевского колледжа врачей — Royal College of Physicians (Scott D.L., 1993) и Американского колледжа ревматологов — ACR (American College of Rheumatology Subcommittee on Osteoarthritis Guidelines, 2000). В 1998 г. EULAR создала рабочую группу по оценке методов лечения пациентов с ОА коленных суставов c позиций доказательной медицины. Результатом работы этой группы стало создание Рекомендаций по лечению данной патологии, представленных в 2000 г. (Pendleton A. et al., 2000). Тем не менее, эти Рекомендации учитывали лишь ограниченное число терапевтических подходов и охватывали международный опыт, накопленный до декабря 1998 г. Поэтому нами осуществлен пересмотр международных Рекомендаций, основанный на расширении анализа опубликованных данных литературы до февраля 2002 г. и включения всех методов лечения пациентов с ОА коленных суставов.
Методы
Членство в рабочей группе по созданию Рекомендаций
Члены экспертного совета по ОА коленных суставов были созваны в ноябре 2001 г. для выработки методологии пересмотра базы данных и создания Рекомендаций по лечению пациентов с ОА коленных суставов с позиций доказательной медицины. По инициативе постоянного Комитета по международным клиническим, в том числе терапевтическим, исследованиям (ESCISIT) экспертный совет по ОА включал 19 ревматологов, 4 хирургов-ортопедов и 1 научного сотрудника из 13 стран Европы.
Цели работы Совета:
- описание всех терапевтических подходов к лечению пациентов с ОА коленных суставов и оценка уровня доказательности каждого из существующих методов;
- создание перечня из 10 рекомендаций для лечения больных с ОА коленных суставов, его экспертиза с позиций доказательной медицины и одобрение экспертным Советом (принятие консенсуса);
- выработка 10 рекомендаций для проведения последующих исследований в области ОА коленных суставов в целях совершенствования методики лечения этой патологии.
Обзор с позиций доказательной медицины различных данных лечения пациентов с ОА
Стратегия поиска
Для поддержания преемственности с уже проведенными анализами данных литературы систематически изучали базы данных Medline OVID и BIDS Embase. Для ранее описанных методов лечения поиск охватывал период с января 1999 г. по февраль 2002 г., а для малоизученных ранее — с 1966 г. по февраль 2002 г. Стратегия поиска заключалась в отборе публикаций в виде оригинальных статей, метаанализов, результатов рандомизированных контролируемых, контролируемых и несравнительных исследований, публикуемых на английском или других языках стран Европы. Во внимание не принимались статьи, опубликованные на других языках.
Отбор публикаций
В анализ включали все исследования, в которых авторы оценивали эффективность терапии при ОА в отношении болевого синдрома и/или функциональной активности коленных суставов. Таким образом были выделены 33 терапевтических подхода; группа НПВП была разделена на две подгруппы: традиционные (неселективные) и ЦОГ-2-селективные НПВП (коксибы) (табл. 87).
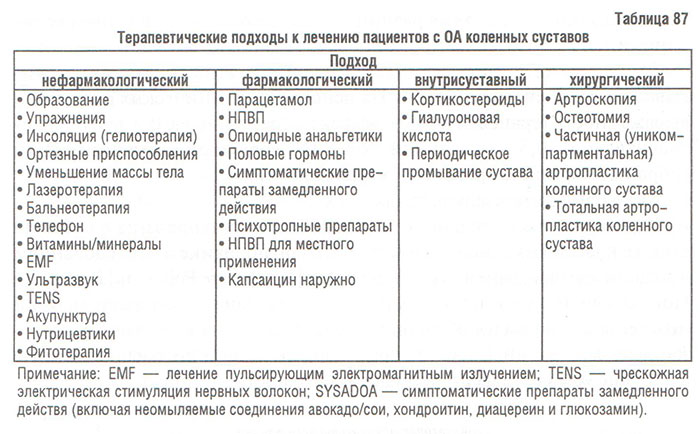
Диагноз ОА коленных суставов устанавливали при наличии у больных клинических и/или рентгенологических признаков ОА коленных суставов. В данный анализ включали только печатные работы, описывавшие исключительно ОА коленных суставов; исследования сочетанного ОА (ОА коленных и тазобедренных суставов) были исключены. При наличии исследований, включенных в предшествующий анализ (2000) и посвященных сочетанному гонартрозу и коксартрозу, мы отбирали из них данные относительно ОА коленных суставов. При отсутствии возможности выполнить изолированный анализ по гонартрозу работа исключалась из анализа.
Оценка качества работ
Методологический дизайн каждого исследования оценивали количественно в соответствии с ранее разработанной шкалой (Downs S.H., Black N., 1998). Эта методологическая шкала включала качественную оценку информации, полученной из каждой отдельной публикации, в частности дизайна и методологии исследования, а также статистической достоверности каждого исследования. Шкала оценки исследования была градуирована в баллах: 0–1 — для 26 вопросов, и 0–2 — для 1 вопроса; максимально возможное количество баллов составляло 28. Расчет размеров выборки оценивали в 1 балл, его отсутствие — в 0. Если в результатах указывались вероятностные величины, это оценивалось как 1, если нет — 0. Один эксперт оценивал публикации на английском языке, другой — подтверждал эту оценку слепым методом. Публикации на других языках стран Европы оценивались индивидуально членами рабочей группы экспертного комитета EULAR, владеющими языком публикации. Все оценки качества работ собирались и регистрировались централизованно.
Оценка выраженности терапевтического эффекта
Количественный анализ эффективности лечения проводили там, где это было возможно, путем определения величины терапевтического эффекта (ES — effect size) в отношении болевого синдрома и функциональной активности сустава. Для этой цели использовали пакет компьютерных программ (Schwarzer R., 2000). ES выражает стандартизованную среднюю разницу оцениваемого показателя между группой лечения и контрольной (Cohen J., 1977) — в данном случае болевого синдрома и функциональной активности сустава. Эта величина отражает различия между двумя группами в стандартизованной форме. В ходе исследования для каждого изучаемого показателя определяли среднюю и характер распределения для исходных и конечных значений в группах плацебо и активного лечения, а также разницу между исходной и конечной величинами.
ES и данные, представленные в этой работе, во всех случаях рассчитывали в сравнении с плацебо. На основании клинических признаков выраженность терапевтического эффекта, составившую 0,2, считали незначительной, 0,5 — умеренной, более 0,8 — большой. Все данные были собраны и зарегистрированы централизованно.
Категории доказательности данных
Категории доказательности данных были адаптированы в соответствии с классификацией Агентства США по политике и исследованиям в области здравоохранения (US Agency for Health Care Policy and Research). Показатели, полученные в результате анализа данных литературы, были отнесены к той или иной группе доказательности в зависимости от дизайна исследований. В табл. 88 представлены категории, расположенные в порядке убывания их степени доказательности.

Выраженность терапевтического эффекта различных методов лечения оценивали в соответствии с наиболее доказательными из имеющихся данных. Если, например, на вопрос можно было ответить с помощью данных 1-й категории доказательности, то в таком случае публикации более слабого дизайна не рассматривались.
Обоснованность предлагаемых Рекомендаций
После подробного анализа категорий достоверности полученных данных члены Редакционного комитета классифицировали обоснованность применения того или иного терапевтического подхода при ОА коленных суставов на степени A–D (табл. 89). Обоснованность рекомендаций применения того или иного метода базировалась не только на уровне доказательности имеющихся данных, но также с учетом выраженности его (ES); профиля побочных эффектов; применимости данных к интересующей популяции; удобству применения; а также экономической обоснованности. Подобным образом можно оценить различные лечебные программы, исходя из потребностей ежедневной клинической практики.

Оценка мнения групп экспертов
Подход к оценке мнения экспертов
После информирования Экспертного комитета о результатах поиска в литературе и степени доказательности данных по каждому из изучаемых терапевтических подходов, согласно пятиступенчатой методике Delphi были предложены 2 группы, каждая из которых включает 10 рекомендаций:
а) заключительные данные экспертизы и основанные на мнениях экспертов рекомендации по лечению;
б) рекомендации по дальнейшим направлениям исследований.
Профиль токсичности
После анализа окончательного списка методов лечения и уровня их доказательности Комиссия оценивала потенциальную токсичность каждого из этих методов. Последняя выражалась в баллах ВАШ, причем 0 означал «отсутствие токсичности», а 100 — «чрезвычайно токсично».
В соответствии со сформировавшимся первоначально мнением экспертов, группу НПВП следовало разделить на традиционные НПВП и коксибы, что и было осуществлено на более позднем этапе.
Уровень доказательности подхода, основанного на мнении эксперта
Исследователи, осуществлявшие поиск по источникам литературы, оценивали уровень доказательности путем ответов по вопроснику, основанном на 10 рекомендациях по лечению пациентов с ОА коленных суставов, предложенных рабочей группой.
Результаты
Подход с позиций доказательной медицины
В процессе поиска данных литературы выявлено 497 новых публикаций, в том числе 103, освещающих результаты инвазивных методов лечения и также включенных в общий анализ. В 99 из них использовали как минимум один из 33 терапевтических методов, 3 представляли собой систематические обзоры, а 1 — метаанализ. Также пересмотрены все публикации, ранее цитированные в предшествующих Рекомендациях EULAR (2000), в результате чего были исключены работы, посвященные изучению ОА не только коленных суставов. В целом, в данное исследование были включены 545 публикаций. Терапевтические подходы, которые больше не используются (например, применение полисахаридов гликозаминогликана), не включались в табличный анализ. В табл. 90 приведены различные терапевтические подходы к ОА коленных суставов с указанием индекса качества исследований и выраженности ES. Табл. 91 содержит оценку уровня доказательности для каждого метода лечения и степень обоснованности рекомендаций применения его по оценкам экспертов рабочей группы.
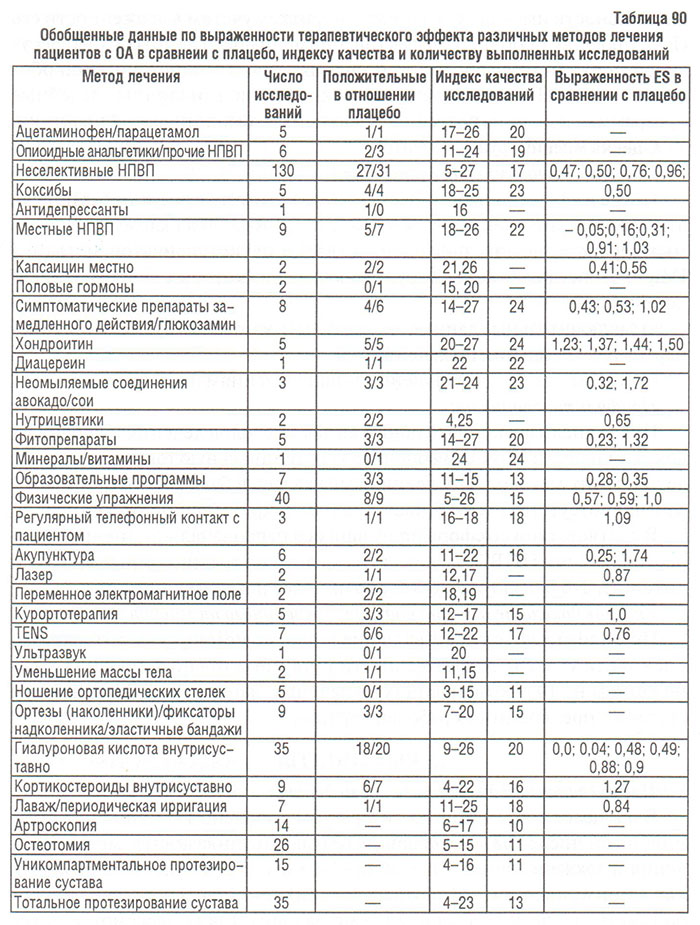

Большое число проанализированных исследований включает применение НПВП. В анализ было включено 135 публикаций с применением НПВП, но только 35 содержали контрольную группу плацебо, а в 5 из них было возможно рассчитать выраженность ES. Медиана индекса качества исследований была значительно выше для публикаций в отношении новых коксибов, чем для работ, выполненных с неселективными НПВП.
Индексы качества исследований значительно варьировали при различных методах лечения. Большинство исследований, выполненных в последние годы, имели более высокое качество дизайна. Медиана качества проведенных испытаний была наиболее высокой для глюкозамина и хондроитин сульфата и самой низкой — для исследований с применением хирургических методик, что коррелировало с уровнем доказательности для каждого из описанных методов лечения.
Из всех 33 терапевтических подходов 29 имели доказательную базу в виде как минимум одного рандомизированного плацебо-контролируемого исследования и были отнесены к категории 1А или 1В. Из исследований с применением хирургических методов лечения доказательный уровень присутствовал только в рандомизированных контролируемых исследованиях, в которых использовались артроскопия±дренаж.
Профиль токсичности
Согласно полученным данным, профиль токсичности НПВП, опиоидных анальгетиков и антидепрессантов при длительном применении был сходен с таковым при хирургическом тотальном эндопротезировании сустава.
После разделения НПВП на неселективные и коксибы, установлено что средняя токсичность неселективных НПВП составила 51 мм, а коксибов — 41 мм по ВАШ (максимум — 100 мм).
Подход, основанный на мнении экспертов
В табл. 92 и 93 приведены заключительные Рекомендации по лечению и дальнейшим исследованиям в области ОА коленных суставов, предложенные Экспертным комитетом EULAR.


Оценка предложений экспертов по Рекомендациям
Предложения упорядочивали по мере важности в ходе обсуждения экспертами Комиссии.
1. Оптимальная схема терапии пациентов с ОА коленных суставов требует комбинации фармакологических и нефармакологических методов лечения
Несмотря на то что данное утверждение логично и отражает общепринятую клиническую практику, прямых доказательств, полученных в рандомизированных контролируемых исследованиях с корректным дизайном, недостаточно для его подтверждения. Существует большое количество непрямых доказательств, полученных в ходе рандомизированных контролируемых исследований, в которых все пациенты получали обезболивающие средства или НПВП, что нефармакологическое лечение обеспечивает дополнительный эффект. Так, установлено, что программы физических упражнений (Petrella R.J., Bartha С., 2000) (индекс качества исследования (QS) 26), физиотерапия (Deyle G.D. et al., 2000) (QS 26), уменьшение массы тела в сочетании с физическими упражнениями (Messier S.P. et al., 2000) (QS 21), образовательные программы (Mazzuca S.A. et al., 1997) (QS 12), использование ортопедических стелек (Sasaki T., Yasuda K., 1985; Tohyama H. et al., 1991) (QS 10, 11) обеспечивают дополнительный эффект в сочетании с обезболивающими средствами и НПВП, что служит достаточной доказательной базой данному утверждению (1B).
2. При лечении пациентов с ОА коленных суставов необходимо учитывать:
- наличие факторов риска для коленного сустава (ожирение, нежелательные механические факторы, повышенная физическая активность);
- наличие общих факторов риска (возраст, сопутствующие заболевания, полимедикация);
- выраженность болевого синдрома и функциональной недостаточности сустава;
- наличие признаков воспаления (например, выпота в суставную полость);
- локализацию и степенью структурных повреждений.
Это положение отражает образец клинической практики и касается клинических маркеров, которые часто используются для принятия конкретных решений. Клинические исследования в основном изучают эффективность монотерапии одним или двумя специфическими методами лечения в высокоселективных гомогенных популяциях пациентов с ОА коленного сустава. Однако полученные данные не могут быть экстраполированы на всю популяцию больных ОА. Результаты исследований предикторов ответа на лечение часто неубедительны статистически и недостаточно информативны. Ярким примером являются два исследования прогностического значения наличия суставного выпота для ответа на внутрисуставное введение ГКС, которые продемонстрировали противоположные результаты (Gaffney V.K. et al., 1995; Jones A., Doherty M., 1996) (QS 22, 17). В одном из них — рандомизированном контролируемом, включавшем 84 пациента, был показан лишь краткосрочный симптоматический эффект применения ГКС по сравнению с плацебо, при этом большая его выраженность отмечена у больных с выпотом. В то же время рандомизированное перекрестное исследование эффективности метилпреднизолона в сравнении с физиологическим раствором не выявило клинических предикторов ответа на лечение, что не позволяет судить о целесообразности применения ГКС только у пациентов с суставным выпотом.
Наряду с ожидаемым эффектом, необходимо принимать во внимание потенциальный риск и стоимость применяемых методов лечения. Целостный подход к лечению больного является общепринятым: он имеет очевидную ценность, но не имеет специфики в случае ОА коленного сустава.
3. Нефармакологическое лечение пациентов с ОА коленных суставов должно включать: регулярные образовательные программы, физические упражнения, поддерживающие средства (трости, ортопедические стельки, фиксация коленного сустава) и уменьшение массы тела
Обучение пациентов и обеспечение их информацией должны стать неотъемлемой частью лечения любого хронического заболевания. Обучение является профессиональной обязанностью врача и должно включать предоставление подробной информации о самой болезни, методах исследования и лечения. Практикующий врач должен адаптировать любую схему терапии к конкретному пациенту, и эта концепция может быть обсуждена с пациентом в период обучения. Результаты нескольких широкомасштабных рандомизированных контролируемых исследований и метаанализов продемонстрировали положительное влияние различных обучающих методик на уменьшение выраженности болевого синдрома, однако лишь незначительное их влияние на функциональное состояние коленных суставов у больных с ОА (Superio-Cabuslay E. et al., 1996). Также показано, что обучение пациентов обусловливает снижение частоты посещений врача и таким образом влияет на стоимость лечения. В исследовании, охватившем 211 пациентов с ОА коленного сустава, 80% стоимости программы самообучения пациентов были возмещены в течение 1 года за счет снижения частоты и стоимости визитов к врачу (Mazzuca S.A. et al., 1999). Подтверждена эффективность таких образовательных методик, как предоставление индивидуализированных обучающих комплектов (Mazzuca S.A. et al., 1997) (QS 12), регулярная телефонная связь с пациентом (Weinberger M. et al., 1989) (QS 17), обучение в группах (Maurer B.T. et al., 1999) (QS 20), тренинг навыков адаптации для больных (Keefe F.J. et al., 1990) (QS 13) и их супругов (Keefe F.J. et al., 1999) (QS 15).
Существуют доказательства, полученные при проведении широкомасштабного рандомизированного контролируемого исследования, что специфические для сустава физические упражнения уменьшают выраженность боли и улучшают функцию коленного сустава у больных c ОА. Однако оптимальная схема упражнений еще не разработана. Физические упражнения можно разделить на специфические для сустава упражнения, направленные на увеличение объема движений и стимуляцию околосуставных мышц, и на общеукрепляющие упражнения, проводимые на свежем воздухе. Их можно организовывать в группах на свежем воздухе (на земле или в воде) или как программы для самостоятельного выполнения в домашних условиях. Рандомизированное контролируемое исследование, выполненное на базе двух центров и охватившее 439 пациентов пожилого возраста с ОА коленных суставов, продемонстрировало повышение способности к выполнению повседневной деятельности среди занимавшихся физическими упражнениями (упражнения на свежем воздухе и нагрузки на сопротивление), по сравнению с контрольной группой (без физических упражнений) (Penninx B.W. et al., 2001) (QS 24). Терапевтическая эффективность выполнения больными c ОА коленных суставов физических упражнений в домашних условиях изучалась в нескольких рандомизированных контролируемых исследованиях, которые продемонстрировали уменьшение выраженности боли и улучшение функциональной подвижности коленного сустава (O’Reilly S.C. et al., 1999; Petrella R.J., Bartha С., 2000; Baker K.R. et al., 2001) (QS 26, 26, 20). Аэробные и изокинетические упражнения также подтвердили свою эффективность в улучшении функции сустава и походки, а также уменьшении выраженности болевого синдрома (Mangione K.K. et al., 1999; Maurer B.T. et al., 1999; Deyle G.D. et al., 2000; Fransen M. et al., 2001) (QS 26, 20, 19, 25). Не выявлено существенных различий между эффективностью физических упражнений, выполняемых в воде или на земле — обе программы обусловливали значительное улучшение функции пораженного сустава и уменьшение выраженности боли (Wyatt F.B. et al., 2001) (QS 17). Примечательно, что некоторые исследования свидетельствуют о длительном (6–18 мес) терапевтическом эффекте физических нагрузок. Выраженность ES для физических упражнений составляла от 0,57 до 1,0.
В рандомизированном контролируемом исследовании у 119 больных с ОА коленных суставов установлено, что эффективность использования пациентами наколенников при варусной деформации превышает таковую у тех, кто не использовал наколенники (Kirklev A. et al., 1999) (QS 20). Другое рандомизированное контролируемое исследование, сравнивавшее эффективность применения клиновидных стелек с использованием обычных ортопедических стелек, не позволило выявить существенных различий между двумя группами пациентов. В то же время у больных, применявших ортопедические стельки с боковым скосом, отмечалось более выраженное снижение суточной потребности в НПВП и повышение комплаентности (Moillefert J.F. et al., 2001) (QS 25). Два контролируемых исследования эффективности ношения ортопедических стелек (Sasaki T., Yasuda K., 1985; Tohyama H. et al., 1991) свидетельствуют о более высоком терапевтическом эффекте этого метода по сравнению с традиционным применением обезболивающих средств (QS 10, 11). Перекрестное исследование эффективности ношения ортопедических стелек и применения НПВП продемонстрировало, что уменьшение выраженности болевого синдрома и улучшение функциональной активности сустава могут быть отчасти обусловлены уменьшением наружного варусного момента и краткосрочным снижением нагрузки на медиальный отдел коленного сустава (Crenshaw S.J. et al., 2000) (QS 15). До настоящего времени не проведены рандомизированные контролируемые испытания эффективности использования тростей или ношения эластических повязок при ОА коленных суставов. Однако в одном краткосрочном перекрестном исследовании у 68 больных с ОА установлено, что применение эластичных повязок может значительно уменьшать выраженность боли в коленных суставах (Hassan B.S. et al., 2002) (QS 20).
Несмотря на то что уменьшение массы тела рекомендуют практически всем больным с ОА, взаимосвязь между ОА коленных суставов и уменьшением массы тела была лишь формально изучена в двух исследованиях. В одном из них — исследовании с участием большой когорты пациентов (Felson D.T. et al., 1992) показано, что уменьшение массы тела снижает риск развития манифестного ОА коленного сустава у женщин (QS 15). Недавно выполненное рандомизированное контролируемое исследование продемонстрировало, что сочетанное уменьшение массы тела с физическими упражнениями обусловливает уменьшение выраженности болевого синдрома и улучшение функции суставов у пациентов пожилого возраста на протяжении по меньшей мере 6 мес; к сожалению, в этой работе отсутствовала группа сравнения, включавшая больных только с уменьшением массы тела (Messier S.P. et al., 2000) (QS 21).
Таким образом, существуют убедительные доказательства того, что обучение пациентов (1А) и физические упражнения (1В) способствуют уменьшению выраженности болевого синдрома в коленных суставах при ОА, кроме того, последние улучшают функциональную подвижность. Использование приспособлений и уменьшение массы тела, вероятно, являются целесообразными мероприятиями у пациентов с гонартрозом, однако они имеют лишь слабую доказательную базу, за исключением ношения наколенников, в отношении которых объективно доказаны (1В) уменьшение выраженности боли и улучшение функции коленных суставов.
4. Парацетамол — пероральный анальгетик, с которого должно начинаться лечение и в случае его эффективности продолжено в виде длительной пероральной терапии
Парацетамол часто используют для самостоятельного лечения в случае легкой или умеренной боли. В опубликованных рекомендациях (ACR, RCP, EULAR) он фигурирует как препарат первого выбора для обезболивания при ОА коленного сустава. Несмотря на то что оценке эффективности парацетамола посвящено достаточное количество исследований, у всех у них был неудачный дизайн или участвовало незначительное количество пациентов. Результаты 6-недельного рандомизированного контролируемого испытания с участием 25 больных c ОА свидетельствуют о значительном уменьшении выраженности боли в покое на фоне применения парацетамола по сравнению с плацебо (Amadio P., Cummings D.M., 1983) (QS 21). Другое 4-недельное рандомизированное контролируемое исследование продемонстрировало, что парацетамол в дозе 4 г/сут не уступает по эффективности ибупрофену в дозе до 2400 мг/сут (Brаdley J.D. et al., 1992) (QS 26). Углубленная оценка этих данных свидетельствует, что даже в случае выраженной боли в коленном суставе развивался одинаковый ответ на ибупрофен и парацетамол (Bradley J.D. et al., 2001) (QS 17). Результаты еще одного рандомизированного контролируемого наблюдения подтвердили, что парацетамол может быть эффективно использован в дозе до 2600 мг/сут в течение 2 лет без развития значительных побочных эффектов; также установлено, что эффективность парацетамола не отличалась от таковой напроксена в дозе 750 мг/сут. В этом исследовании в обеих группах отмечено наибольшее число досрочных выходов больных из исследования, поэтому, по мнению авторов, ни один из препаратов сравнения не соответствовал требованиям для лечения при ОА (Williams H.J. et al., 1993) (QS 23). Вообще оценка эффективности парацетамола затруднительна, поскольку он широко применяется в большинстве рандомизированных контролируемых исследований в качестве дополнительного обезболивающего средства, таким образом относя эти исследования монотерапии различными препаратами в раздел комбинированной терапии. Парацетамол практически не вступает во взаимодействие с другими препаратами, отсутствуют противопоказания к его применению, в том числе у пациентов пожилого возраста.
Таким образом, существуют доказательства (1В), что парацетамол эффективен в лечении пациентов с ОА коленного сустава, что у многих пациентов он сравним с ибупрофеном при краткосрочном использовании и почти также эффективен, как напроксен. Доказано также (1В), что длительный прием парацетамола безопасен. Очевидно, что препарат, сочетающий одновременно эффективность и безопасность, должен рассматриваться в качестве первоочередной терапии при ОА коленного сустава и, в случае эффективности, сохраняться в составе комбинированной терапии на длительное время для адекватного купирования боли.
Недавно в печати развернулась дискуссия по поводу безопасности парацетамола в отношении пищеварительного тракта, в частности в сравнении с НПВП. Недавно опубликованная в журнале передовая статья с обзором современных доступных литературных источников, хорошо описывает состояние вопроса (Abramson S.A., 2002). Авторы приходят к заключению, что современный массив доказательных данных указывает на более высокий профиль безопасности парацетамола в отношении пищеварительного тракта по сравнению с неселективными НПВП.
5. Местные аппликации (НПВП, капсаицин) характеризуются клинической эффективностью и безопасностью
Местные средства широко используются, хорошо переносятся и нравятся пациентам. Два рандомизированных плацебо-контролируемых исследования, охвативших 70 и 155 больных, убедительно продемонстрировали значительные преимущества местных аппликаций диклофенака перед плацебо в плане уменьшения выраженности болевого синдрома (Dreiser R.L., Tisne-Camus M., 1993; Groce D. et al., 1999) (QS 24, 22). Интересно, что в двух других рандомизированных плацебо-контролируемых исследованиях эффективности геля элтенак с включением 290 и 237 пациентов, статистически достоверные различия по воздействию на болевой синдром были получены лишь у больных с тяжелой формой ОА коленных суставов (Sandelin J. et al., 1997; Ottilinger B. et al., 2001) (QS 26, 25). Сравнительные исследования эффективности геля диклофенака с гелем кетопрофена (Woikakul S. et al., 1997) (QS 19), а также геля пироксикама с назначаемым перорально ибупрофеном (Dickson D.J., 1991) (QS 20) продемонстрировали равную эффективность этих лечебных схем. Выраженность ES топических форм широко варьирует (разброс от –0,05 до 1,03), медиана — 0,31. Местные НПВП отличаются хорошей переносимостью. Широкомасштабные исследования в терапевтической практике (Newbery R. et al., 1992) подтверждают безопасность применения топических НПВП (побочные явления выявляют менее чем в 1,5%), причем основным побочным эффектом являются местные кожные реакции. В одном широкомасштабном исследовании типа «случай — контроль» изучалась, но не была обнаружена взаимосвязь между применением местных НПВП и кровотечениями или перфорациями верхних отделов желудочно-кишечного тракта (Evans J.M.M. et al., 1995).
Топическое применение капсаицина (обратимая десенситизация ноцицептивных С-волокон путем воздействия на VR-1 ванилоидные рецепторы), все шире используется при ОА. Путем рандомизированных контролируемых исследований доказана его клиническая эффективность при ОА коленных суставов, причем, возможно, речь идет о длительной эффективности препарата (Deal C.L. et al., 1991) (QS 21). Разброс выраженности ES составляет от 0,41 до 0,56. О системных побочных эффектах терапии не сообщается.
Данные по эффективности местного применения НПВП и капсаицина в лечении при ОА коленных суставов относятся к уровню доказательности 1В, эти виды лечения отличает высокий уровень безопасности.
6. НПВП показаны пациентам, не ответившим на терапию парацетамолом. У пациентов с повышенным риском заболеваний пищеварительного тракта должны использоваться неселективные НПВП в комбинации с гастропротекторными агентами или ингибиторы ЦОГ-2
Существует хорошая доказательная база того, что у некоторых пациентов НПВП более эффективны, чем парацетамол, однако утверждение, что они должны использоваться у больных с неэффективностью парацетамола, хотя и привлекательно, но не имеет доказательной силы. К сожалению, отсутствуют исследования, использующие в качестве критерия включения неэффективность анальгезии парацетамолом.
С учетом наличия незначительного воспалительного компонента при ОА, применение НПВП представляется логически обоснованным у больных с неэффективностью парацетамола, в частности, при наличии явного синовиита. Однако у этого положения нет доказательной базы. Многочисленными исследованиями продемонстрировано, что пероральные НПВП эффективнее плацебо (медиана выраженности ES 0,50; разброс данных — 0,47–0,96) в лечении пациентов с ОА коленных суставов. Кокрановский обзор (Cochrane review) относительной эффективности различных НПВП, используемых при лечении пациентов с ОА коленных суставов, показал, что, несмотря на обилие публикаций по этой теме, многие исследования имеют слабый дизайн; кроме того, не представляется возможным с позиций доказательной медицины сопоставить эффективность общепринятых НПВП в одинаковых дозах (Wation M.C. et al., 2002).
Лишь в нескольких испытаниях непосредственной целью было прямое сравнение парацетамола и НПВП. Они в целом, но не всегда, констатировали, что НПВП более эффективны, хотя и повышают частоту побочных явлений со стороны пищеварительного тракта. В 2-летнем рандомизированном контролируемом исследовании у 178 пациентов (Williams H.J. et al., 1993) (QS 23) сравнивали эффективность парацетамола и напроксена. Напроксен оказался более эффективен при болевом синдроме, чем парацетамол (ES 0,32 — после 42 дней лечения, 0,45 — после 730 дней). Выбывание из исследования большого числа (65%) пациентов связано: с неэффективностью терапии — в группе парацетамола и с высокой частотой побочных эффектов — в группе напроксена. Другое исследование, проведенное у 382 пациентов, сравнивало эффективность и переносимость рофекоксиба, целекоксиба и парацетамола. Установлено, что большая часть пациентов прекратила прием парацетамола на ранних стадиях лечения ввиду его неэффективности, а также то, что парацетамол значительно уступает коксибам по воздействию на болевой синдром; профили побочных эффектов были практически одинаковы во всех группах лечения (Geba G.P. et al., 2002) (QS 23).
Существует распространенное мнение, что селективные ингибиторы предпочтительнее традиционных НПВП, в особенности ввиду низкого риска развития осложнений со стороны пищеварительного тракта. Широкомасштабные исследования, сравнивавшие эффективность и профиль безопасности ингибиторов ЦОГ-2 с неселективными НПВП и плацебо, продемонстрировали преимущества ингибиторов ЦОГ-2 перед плацебо в отношении контроля болевого синдрома и равную эффективность — в сравнении с неселективными НПВП; в то же время применение ингибиторов ЦОГ-2 обусловливало сокращение до 50% частоты возникновения перфоративных процессов, пептических язв и желудочно-кишечных кровотечений. Результаты рандомизированного контролируемого исследования, сравнивавшего применение целекоксиба, диклофенака и плацебо у 600 пациентов в течение 6 нед, свидетельствуют, что оба препарата при отсутствии различий между собой по уменьшению выраженности болевого синдрома значительно превосходили плацебо. Больше осложнений со стороны пищеварительного тракта зарегистрировано в группе диклофенака, в целом лучше переносился целекокосиб (McKenna F. et al., 2001) (Q 21); выраженность ES составила в сравнении с плацебо 0,5. В другом исследовании, сравнивавшем терапевтическую эффективность применения целекоксиба с напроксеном в различных дозировках и плацебо у 1003 пациентов, выявлены одинаковая эффективность медикаментозной терапии, превосходящая эффекты плацебо, и повышенное выбывание пациентов из исследования в группе плацебо ввиду неэффективности; в этом исследовании частота появления незначительных побочных эффектов со стороны пищеварительного тракта была одинаковой для неселективных НПВП и коксибов, хотя в группе напроксена был зарегистрирован один случай острого желудочно-кишечного кровотечения (Bensen W.G. et al., 1999) (QS 25). Современные исследования показывают, что побочные явления со стороны сердечно-сосудистой системы выявляют одинаково часто у пациентов, получающих терапию неселективными НПВП и коксибами.
Недавно опубликованный Кокрановский обзор, включавший публикации до июля 2002 г. включительно, оценил эффективность мероприятий по профилактике осложнений на уровне верхних отделов желудочно-кишечного тракта, связанных с применением НПВП (Rostom A. et al., 2003). Этот обзор, охвативший 40 рандомизированных контролируемых исследований, содержит заключение, что применение мизопростола в любых дозировках позволяет значительно снизить риск пептических язв. Использование антагонистов Н2-рецепторов в стандартных дозах эффективно снижает риск развития пептической язвы двенадцатиперстной кишки, но не влияет на частоту развития язвы желудка. Блокаторы Н2-рецепторов и ингибиторов протонного насоса в удвоенных дозах эффективно снижают риск развития эндоскопически выявляемой пептической язвы двенадцатиперстной кишки и желудка, а также лучше переносятся, чем мизопростол.
Таким образом, имеются данные доказательной медицины категории 1А в пользу использования НПВП при лечении пациентов с ОА коленных суставов. У пациентов с повышенным риском осложнений со стороны пищеварительного тракта доказательные данные указывают на целесообразность применения либо селективных ингибиторов ЦОГ-2, либо неселективных НПВП в комбинации с гастропротекторными препаратами.
7. Опиоидные анальгетики, с парацетамолом или без него, могут применяться у пациентов, которым противопоказаны НПВП, включая селективные ЦОГ-2-ингибиторы, или же последние неэффективны или/и плохо переносимы
Имеются лишь незначительные данные доказательной медицины, полностью поддерживающих это утверждение. Однако косвенные данные указывают на возможность широкого применения опиоидных анальгетиков в повседневной клинической практике в особенности в тех ситуациях, когда возможности применения других лечебных мероприятий ограничены. Существуют косвенные доказательства того, что применение опиоидных анальгетиков позволяет улучшить контроль за болевым синдромом у пациентов, не полностью отвечающих на терапию парацетамолом и/или НПВП. В то же время представляется необходимым учитывать повышенный риск возникновения побочных эффектов, особенно у людей пожилого возраста, и потенциальную зависимость, формирующуюся при приеме препаратов этой группы. В рандомизированном контролируемом исследовании с участием 90 пациентов показано, что терапия при ОА коленных суставов трамадолом позволяет снизить дозы напроксена у пациентов с болевым синдромом, резистентным к напроксену (Schnirzer T.J. et al., 1999) (QS 19). Таким образом, уровень доказательности этого утверждения — 1В.
8. Симптоматические препараты замедленного действия (глюкозамин сульфат, хондроитин сульфат, неомыляемые соединения авокадо/сои, диацереин и гиалуроновая кислота) обладают симптоматическим эффектом и способностью модифицировать структуру
Симптоматические препараты замедленного действия для лечения пациентов с ОА (англ. — SYSADOA) — генерическое название группы, включающей глюкозамин сульфат и его производные, хондроитин сульфат и диацереин. В настоящее время в Европе существуют значительные различия в показаниях к применению препаратов этой группы и их принадлежности к той или иной классификации. В Великобритании, например, они классифицируются скорее как пищевые добавки, нежели как лекарственные препараты, доступные вне пределов аптечной сети и часто используются больными самостоятельно. Такие средства, как полисульфаты гликозаминогликана, уже не используются в странах Европы, поэтому не были включены в наш анализ. Эффективность и целесообразность применения остальных препаратов были оценены индивидуально.
Исследованию хондроитин сульфата и глюкозамин сульфата посвящен опубликованный метаанализ, охвативший исследования вплоть до 1999 г. (McAlindon T.E. et al., 2000). Авторы приходят к заключению, что хондроитин сульфат и глюкозамин сульфат оказывают умеренное или значительное воздействие на выраженность болевого синдрома и функциональную подвижность суставов при ОА по сравнению с плацебо; однако их эффект мог быть преувеличен из-за желания опубликовать положительные результаты. Данные препараты являются безопасными и характеризуются минимумом побочных эффектов. По данным метаанализа, охватившего все опубликованные исследования, выраженность ES для хондроитин сульфата и глюкозамин сульфата составила соответственно 0,78 и 0,44.
В рандомизированном контролируемом сравнительном исследовании хондроитин сульфата и диклофенака, проведенном у 146 пациентов, более быстрое уменьшение выраженности клинических симптомов наблюдалось у больных, применявших НПВП, однако возврат этих симптомов отмечался сразу после отмены терапии; хондроитин сульфат, напротив, характеризовался более медленным началом терапевтического действия, сохранявшемся до 3 мес после окончания лечения (Morreale P. et al., 1996) (QS 20). Еще более недавнее рандомизированное контролируемое исследование (Mazieres B. et al., 2001) (QS 27) продемонстрировало преимущества хондроитин сульфата перед плацебо у 130 пациентов с ОА коленных суставов и еще раз подтвердило сохранение терапевтического эффекта до 1 мес после окончания лечения.
Два рандомизированных контролируемых исследования сравнивали эффект глюкозамин сульфата с ибупрофеном. Первое, проведенное на протяжении 8 нед, показало, что ибупрофен в течение первых 2 нед эффективнее уменьшал выраженность болевого синдрома, однако к 8-й неделе преимущество было на стороне глюкозамин сульфата (Vaz A.L., 1982) (QS 22). Второе исследование, охватившее 4 нед лечения, продемонстрировало более быстрое начало действия ибупрофена, но к 4-й неделе уменьшение выраженности боли и функциональной подвижности сустава было одинаковым в обеих группах (Muller-Fassbender H. et al., 1994) (QS 23). Два других рандомизированных плацебо-контролируемых исследования были опубликованы в дополнение к вышеуказанному метаанализу. У 98 пациентов старшего возраста с гонартрозом среднетяжелого или тяжелого течения на протяжении 2-месячного периода лечения не удалось продемонстрировать статистически достоверных различий между глюкозамин сульфатом и плацебо по влиянию на болевой синдром и функциональную подвижность сустава (Rindone J.P. et al., 2000) (QS 24). Однако на протяжении 3 лет наблюдения у 106 пациентов с ОА легкой и средней степени тяжести отмечено достоверное по сравнению с плацебо замедление сужения РСЩ, уменьшение выраженности болевого синдрома и улучшение функциональной активности суставов (Reginster J.Y. et al., 2001) (QS 26). Это исследование позволяет предположить, что глюкозамин сульфат может быть использован в качестве структурно-модифицирующего препарата при ОА коленных суставов. Только в одном рандомизированном контролируемом исследовании оценивали эффективность сочетанного применения глюкозамин сульфата и хондроитин сульфата; у 93 пациентов с легкой и умеренно выраженной степенью тяжести гонартроза выявлено значительное снижение индекса Лекена к 4-му и 6-му месяцу лечения; в то же время у больных с гонартрозом тяжелой степени не выявлено статистически достоверных различий в эффективности сочетанного применения хондроитин сульфата и глюкозамин сульфата перед плацебо (Das A. Jr., Hammod T.A., 2000) (QS 24). Совокупная выраженность ES глюкозамин сульфата (исключая данные метаанализа) составила 0,53–0,87.
Единственное рандомизированное контролируемое исследование посвящено применению диацереина при ОА коленных суставов. Исследуемый препарат в дозе 100 мг/сут существенно превосходил эффект плацебо по влиянию на болевой синдром и функциональную подвижность сустава. Диацереин, применяемый в более высоких дозах, вызывал многочисленные побочные эффекты (Pelletier J.P. et al., 2000) (QS 22).
Внедрение в клиническую практику гиалуроновой кислоты рассматривалось как качественный прорыв в лечении пациентов с ОА коленных суставов. Особое внимание привлекали изучение эффективности гиалуроновой кислоты в уменьшении выраженности болевого синдрома, улучшении функционального состояния суставов, а также возможности изменения на фоне терапии ОА коленных суставов. Имеется много коммерческих препаратов на основе гиалуроновой кислоты, которые можно разделить на 2 основные группы: высоко- и низкомолекулярные. Признано, что терапевтическая эффективность высокомолекулярных соединений выше. Рандомизированное контролируемое сравнительное исследование эффективности высоко- и низкомолекулярных соединений гиалуроновой кислоты, проведенное на протяжении 12 нед, продемонстрировало, что эффект высокомолекулярного соединения в отношении купирования болевого синдрома значительно выше (Wobia M. et al., 1999) (QS 21). Вплоть до февраля 2002 г. опубликованы результаты 39 клинических испытаний гиалуроновой кислоты при ОА коленных суставов: из 20 плацебо-контролируемых исследований 18 указывали на явное преимущество гиалуроновой кислоты. Выраженность ES, рассчитанная на основании плацебо-контролируемых исследований длительностью от 60 дней до 1 года, значительно превосходила эффект плацебо по влиянию на болевой синдром (ES 0,04, 0,49, 0,88, 0,9) (Dougados M. et al., 1993; Carrabba M. et al., 1995; Corrado E.M. et al., 1995; Huskisson E.C., Donnelly S., 1999) (QS 22, 49, 23, 14). В одном из исследований отмечено снижение индекса Лекена через 1 год терапии (ES 0,36) (Wobia M. et al., 1999).
В нескольких исследованиях изучен структурно-модифицирующий эффект гиалуроновой кислоты. В одном рандомизированном контролируемом исследовании изучали артроскопическую картину коленного сустава до и через 1 год после начала терапии гиалуроновой кислотой. Установлено, что на фоне лечения гиалуроновой кислотой степень структурных повреждений сустава меньше, чем в контрольной группе; в ходе лечения гиалуроновой кислотой у пациентов отмечено улучшение качества жизни и снижение потребности в НПВП (Listrat V. et al., 1997). Другое исследование продемонстрировало снижение потребности во внутрисуставных инъекциях кортикостероидов в течение 1 года наблюдения; авторы предполагают, что структурно-модифицирующий эффект гиалуроновой кислоты проявляется уменьшением количества обострений заболевания (Dougados M. et al., 1993).
Число исследований, изучавших наличие возможных прогностических факторов ответа (предикторов эффективности) на проводимую терапию, минимально. В одном исследовании установлено, что максимальная эффективность гиалуроновой кислоты достигается у пациентов в возрасте старше 60 лет с выраженной функциональной недостаточностью суставов, что документировано динамикой индекса Лекена (Lohmander L.S. et al., 1996) (QS 26). В другом ретроспективном исследовании выявлено, что реакция на гиалуроновую кислоту статистически коррелировала с тяжестью структурных изменений при ОА коленных суставов: более высокая эффективность достигалась у больных с меньшей степенью тяжести заболевания, и ниже — у пациентов с наличием выпота в начале исследования (Lussier A. et al., 1996) (QS 18). Следует отметить, что большинство испытаний внутрисуставного введения гиалуроновой кислоты исключали пациентов с тяжелым ОА. Подводя итог, отметим, что имеется доказательная база, подтверждающая эффективность гиалуроновой кислоты в отношении уменьшения выраженности болевого синдрома (1В) и повышения функциональной активности суставов (1В) у больных гонартрозом. Однако реальное уменьшение выраженности болевого синдрома на фоне терапии гиалуроновой кислотой может быть достигнуто в течение нескольких месяцев (в сравнении с несколькими неделями на фоне лечения кортикостероидами), что связано с более медленным началом действия, необходимостью в назначении курса из 3–5 еженедельных инъекций, что влечет за собой определенные организационные и финансовые сложности. Доказательная база в пользу болезньмодифицирующего эффекта гиалуроновой кислоты остается минимальной.
Термин «симптоматические препараты замедленного действия» касается целого спектра препаратов. И если доказательная база в пользу симптоматического действия двух действующих веществ — глюкозамин сульфата (1А) и хондроитин сульфата (1А) — неуклонно увеличивается, то в отношении других препаратов она чрезвычайно слаба или отсутствует.
9. Внутрисуставные инъекции длительно действующих кортикостероидов показаны при обострении боли в коленном суставе, особенно при наличии суставного выпота
Внутрисуставные инъекции кортикостероидов при ОА коленных суставов используются для уменьшения выраженности воспалительных явлений и болевого синдрома в течение многих лет. Фармакологическое действие кортикостероидов при ОА коленных суставов продемонстрировано во многих исследованиях. В одном рандомизированном контролируемом испытании подтверждено, что кортикостероиды на протяжении 7 дней эффективнее плацебо в уменьшении выраженности болевого синдрома у больных с ОА коленных суставов (выраженность ES 1,27), у части из которых присутствовал суставной выпот (Dieppe P.A. et al., 1980) (QS 19). В другом исследовании с участием 98 пациентов показано существенное различие между кортикостероидами и плацебо в уменьшении выраженности боли и улучшении функциональной активности сустава после 1-й и 4-й недель лечения, однако не отмечено различия на 12-й и 24-й неделе (Ravaud P. et al., 1999) (QS 24). Еще одно рандомизированное контролируемое исследование с включением 84 пациентов подтвердило кратковременный симптоматический эффект кортикостероидов по сравнению с плацебо, а также продемонстрировало лучший результат лечения у больных с наличием выпота (Gaffney V.K. et al., 1995) (QS 22). В то же время рандомизированное перекрестное исследование эффективности метилпреднизолона в сравнении с физиологическим раствором не выявило клинических предикторов ответа на лечение, что не позволяет судить о целесообразности использования ГКС только у пациентов с суставным выпотом (Jones A., Doherty M., 1996) (QS 17).
В заключение следует отметить, что в настоящее время имеются доказательные данные (1В) об эффективности внутрисуставных инъекций кортикостероидов, обусловливающих, однако, лишь относительно краткосрочный эффект. Данные относительно предикторов эффективности внутрисуставных инъекций кортикостероидов отсутствуют, что объясняет необходимость проведения дальнейших исследований в этом направлении.
10. Замещение (артропластика) сустава показана пациентам с рентгенологическими признаками ОА с рефрактерным болевым синдромом и функциональной недостаточностью коленного сустава
Артропластика сустава является необратимым вмешательством, применяемым у пациентов с наиболее тяжелыми формами заболевания, не отвечающих на терапевтические подходы к лечению. Эффективность тотальной артропластики коленного сустава убедительно доказана у инвалидизированных пациентов с тяжелым ОА коленных суставов. В систематическом Кокрановском обзоре сформулирован вывод о том, что артропластика коленного сустава является безопасным и эффективным методом лечения, обеспечивающим улучшение качества жизни (Frankel S. et al., 1990), уменьшение выраженности болевого синдрома и увеличение функциональной подвижности сустава. Доказательная база в поддержку этого утверждения относится к уровню 3 и основана на данных клинических наблюдений и ретроспективных анализов, часто использующих в качестве первичного критерия эффективности время функциональной состоятельности протеза.
Детальный поиск в базе данных литературы позволил выделить 154 исследования хирургических методов лечения пациентов с патологией коленных суставов, содержащих указания на применение 37 различных трехсекционных протезов у 9879 человек (63% с ОА) (Chard J. et al., 1990). Хорошие или отличные результаты в отношении уменьшения выраженности болевого синдрома и улучшения функциональной подвижности на протяжении 5 лет после проведения оперативного вмешательства отмечены у 89% пациентов. Эффективность одно- и двухсекционных протезов, оцениваемая исследователями, оказалась схожей. Авторы обзора приходят к выводу, что все виды артропластики коленного сустава улучшают качество жизни пациентов.
Общепринятый консенсус среди хирургов-ортопедов предусматривает следующие показания к проведению оперативного лечения:
а) наличие ежедневной сильной боли;
б) рентгенологические данные, подтверждающие сужение РСЩ (Manusco C.A. et al., 1996).
Следует отметить, что эти критерии не подтверждены данными доказательной медицины.
Ни в одном рандомизированном контролируемом исследовании эффективность тотальной артропластики не сравнивалась с нехирургическими методами лечения. Хотя известно, что сложность дизайна может быть ограничивающим моментом в проведении рандомизированных испытаний в хирургической практике, и тем не менее эти исследования должны быть осуществлены. Необходимо изучить прогностические факторы оперативного лечения, показания к проведению артропластики, оценить долгосрочную эффективность различных хирургических методик и применения различных протезов. Более того, послеоперационные результаты должен оценивать специалист независимо от хирурга, проводившего операцию.
Обсуждение
Представленные Клинические рекомендации основаны на анализе данных литературы, опубликованных до января 2002 г. включительно, с позиций доказательной медицины. Цель данной публикации — обобщение всех существующих терапевтических подходов к ОА коленных суставов. Представленные данные касаются исключительно гонартроза; исследования, в которых приведенная суммарная статистика не позволяла выделить патологию коленного сустава, были из анализа исключены. Представленные Рекомендации не могут быть экстраполированы на ОА другой локализации. Главная цель настоящей работы — разработать основополагающий документ для специализированной (вторичной) медицинской помощи, на основании которого каждая страна сможет разработать собственные руководящие принципы лечения, а также алгоритмы оказания первичной медицинской помощи. Как указывалось в Рекомендациях 2000 г., частое несоответствие между мнением экспертов и доказательными данными клинических исследований подтверждает значимость собственного опыта и отдельных клинических ситуаций в выборе индивидуального режима лечения.
Обзор данных литературы еще раз высветил необходимость исследования прогностических факторов (предикторов) ответа на индивидуальные схемы лечения, поскольку отмечается явный дефицит этой информации. Ощутимо не хватает сведений об эффективности комбинированного лечения, широко распространенного в рутинной клинической практике.
Гетерогенность оцениваемых различными исследователями показателей затрудняет оценку одного и того же метода лечения на основании сопоставления данных литературы. Разработка более стандартизованных подходов к оценке различных методов лечения нуждается в согласованных международных усилиях.
Рабочая группа попыталась оценить доказательность конкретных методов лечения и дополнить эту оценку субъективным заключением Комитета экспертов по общей безопасности и приемлемости этих методов. Задача данной работы не состояла в выработке дидактического терапевтического алгоритма, несмотря на то, что этот упрощенный подход может оказать непосредственное воздействие на профессионалов в области медицины. Многие факторы, определяющие успех лечения больных с ОА коленных суставов, зависят от самого пациента — например, психосоциальные факторы и влияние на них ОА; сопутствующие заболевания и их лекарственная терапия; оценка пациентом его болезни; доверие больного и предпочтения в плане проводимого лечения, а также предшествующий опыт больного в отношении лечения и проводивших его врачей.
Важное значение имеют также стоимость и обоснованность определенных методов лечения (например, физиотерапии или еженедельных инъекций гиалуроновой кислоты). Таким образом, план лечебных мероприятий у больного с ОА коленных суставов необходимо индивидуализировать, проанализировать и скорригировать в зависимости от реакции пациента; причем он может изменяться у различных пациентов в разных точках мира. С оптимизмом мы можем сообщить, что предлагаемые Рекомендации EULAR представляют широкий спектр терапевтических подходов, из которого нужно выбрать все необходимое для конкретного пациента с ОА коленных суставов. Не существует ни заведомо правильного, ни заведомо ошибочного подхода к лечению, каждый врач должен выбирать терапию, наиболее адекватную для определенного больного в конкретный период и в зависимости от локализации процесса.
Надеемся, что начатая между экспертами в области здравоохранения дискуссия по поводу предложенных терапевтических схем повысит информированность и улучшит результаты лечения при ОА коленных суставов, что приведет к повышению уровня оказываемой медицинской помощи.
Рекомендации Европейской антиревматической лиги (EULAR): доказательный подход к лечению пациентов с остеоартрозом тазобедренных суставов. Отчет специальной комиссии постоянного комитета EULAR по международным клиническим, том числе терапевтическим, исследованиям (ESCISIT)*
Введение
Тазобедренный сустав — второй по частоте поражения при остеоартрозе (ОА). Распространенность ОА тазобедренного сустава составляет от 3 до 11% среди населения западных стран в возрасте старше 35 лет (Felson D.T., 1988; Tepper S., Hochberg M.C., 1993; Lawrence R.C. et al., 1998; Ingvarsson T. et al., 1999; Lanyon P. et al., 2000). Он часто ассоциируется со значительной болью, недееспособностью и ухудшением качества жизни. Несмотря на то что терапевтические походы к лечению пациентов с ОА коленных и тазобедренных суставов сходны и включают фармакологическое, нефармакологическое и хирургическое лечение, между ними имеются некоторые различия. Кроме того, величина эффекта определенного метода лечения может варьировать в зависимости от локализации поражения ОА, что связано с различиями в анатомии, биомеханике, наличием факторов риска развития и прогрессирования заболевания, с доступностью суставов для проведения локальной терапии. Поэтому после разработки рекомендаций для лечения пациентов с ОА коленных суставов (Pendleton A. et al., 2000; Jordan R.M. et al., 2003) Специальная комиссия EULAR сосредоточила внимание на создании аналогичного документа с рекомендациями по лечению пациентов с ОА тазобедренных суставов. Эти рекомендации также разработаны на основе метода Delphi с учетом результатов недавно проведенных научных исследований и мнений экспертов.
Методы
Участники
ESCISIT был создан междисциплинарный комитет по разработке руководства. В исследовании приняли участие 23 эксперта в области ОА (18 ревматологов, 4 хирурга- ортопеда и 1 эпидемиолог) из 14 европейских стран. Цели работы комитета: а) согласование 10 ключевых предложений по лечению пациентов с ОА тазобедренного сустава; б) идентификация и критическая оценка данных научных исследований относительно эффективности и эффективности затрат соответствующих методов лечения; в) создание рекомендаций, основанных на комбинации наилучших из имеющихся доказательных данных и оценке эксперта.
Консенсус экспертов
Каждый член комитета независимо представил 10 предложений, описывающих ключевые методы лечения пациентов с ОА тазобедренных суставов. Согласованное мнение экспертов (консенсус) по этим предложениям достигнуто с использованием метода Delphi. Первоначальные предложения были сведены в один список, похожие или частично совпадающие предложения объединили. Список был возвращен экспертам для выбора из него 10 наиболее важных. Предложения, выбранные большей половиной членов комитета, принимались автоматически, а отобранные одним–тремя экспертами — отклонялись. Предложения, получившие менее половины, но более 3 голосов попадали в очередной раунд Delphi. Эту процедуру повторяли до получения 10 согласованных предложений.
Систематический поиск литературы
Систематический поиск литературы, опубликованной с января 1966 по март 2004 гг., проводили с использованием баз данных Medline, Embase, CINHAL, Cochrane Library. Поиск был как общим, так и специфическим для метода лечения. Стратегия общего метода поиска состояла из двух базовых компонентов: поиска всех возможных вариантов термина «ОА тазобедренного сустава» в базах данных (подробнее см. Appendix 1 по адресу: www.annrheumdis.com/supplemental) и типов исследования в виде систематических обзоров/метаанализов, рандомизированных контролируемых исследований/контролируемых исследований, неконтролируемых исследований, когортных исследований, исследований случай–контроль, перекрестных исследований и экономической оценки методов лечения (подробнее см. Appendix 2 по адресу: www.annrheumdis.com/supplemental). Цель общего метода поиска — обобщение информации о современных методах лечения пациентов с ОА тазобедренного сустава. Результаты этого поиска были сообщены членам комитета перед применением метода Delphi.
После того, как с помощью метода Delphi были составлены 10 предложений, был проведен специфический для методов лечения поиск с целью идентификации данных для каждого из них. Стратегия поиска включала варианты термина «ОА тазобедренного сустава» (см. Appendix 1 по адресу: www.annrheumdis.com/supplemental) и любые существующие термины для специфических методов лечения. Например, для парацетамола были использованы такие термины, как «парацетамол», «ацетаминофен» и «монокомпонентные препараты анальгетиков». Результаты обоих поисков были объединены, а дублирующаяся информация исключена. Сначала использовали метод поиска по медицинским предметным рубрикам во всех базах данных, а в случае невозможности его проведения — поиск по ключевым словам. Все термины поиска по медицинским предметным рубрикам были систематизированы. Дополнительно изучали список ссылок в обзорах и систематических обзорах, и включали все дополнительные исследования, соответствующие критериям включения/исключения. Поиск в Кокрановской библиотеке включал поиск по медицинским предметным рубрикам в базах Кокрановских обзоров, рефератов качественной оценки систематических обзоров, Кокрановского регистра контролируемых исследований, в базе данных экономических оценок Национальной службы здравоохранения Великобритании, в базе данных оценки технологий в здравоохранении. Кроме того, был выполнен тематический поиск по ОА.
Критерии включения/исключения
В анализ включали только исследования с клиническими критериями эффективности терапии при ОА тазобедренного сустава. Основное внимание было сосредоточено на систематических обзорах, рандомизированных контролируемых/контролируемых, неконтролируемых/когортных исследованиях, исследованиях случай—контроль, перекрестных исследованиях, экономической оценке лечения. Исследования, посвященные ОА как коленных, так и тазобедренных (и/или других) суставов были исключены (кроме случаев, когда результаты для больных с ОА тазобедренных суставов представляли отдельно). Исследования терапии при ОА других локализаций или при других хронических заболеваниях суставов были исключены (кроме случаев, когда побочные явления изучали в качестве первичного критерия исхода лечения). Также исключали описание отдельных случаев, исследования на животных, исследования неклинических исходов, обзорные статьи повествовательного характера, комментарии, методические рекомендации.
Категоризация доказательности данных
Данные распределяли по категориям в соответствии с дизайном исследования, используя иерархию данных в нисходящем порядке в зависимости от их качества (табл. 94) (Shekeile P.G. et al., 1999).
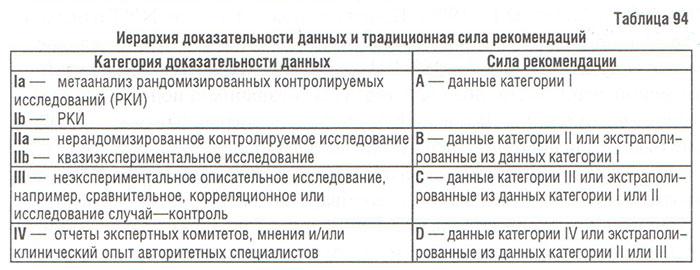
При решении вопросов, касающихся эффективности лечения, использовали наилучшие доступные данные. Например, если вопрос об эффективности вмешательства может быть решен с помощью данных категории Ia (то есть, систематических обзоров РКИ), то исследования с более слабым дизайном (например, РКИ, данные категории Ib) не рассматривали. Вопросы о побочных эффектах лечения решали с использованием результатов как РКИ, так и обсервационных исследований. Несмотря на то что эффективность была оценена специально для ОА тазобедренного сустава, побочные эффекты оценивали специально для метода вмешательства независимо от формы поражения опорно-двигательного аппарата. Вопросы эффективности затрат при лечении решали в соответствии с параметрами, используемыми для оценки эффективности. Например, если эффективность лечения оценивали по уменьшению выраженности боли или количеству сохраненных лет качественной жизни (quality of life years gained — QALY), то использовали только исследования лечения при ОА тазобедренных суставов. Если эффективность лечения определяли по количеству побочных явлений, развитие которых удалось предотвратить, то использовали любые исследования данного метода лечения.
Оценка эффективности лечения и эффективности затрат
Для количественной оценки эффективности лечения использовали такие критерии, как уменьшение выраженности боли или улучшение функции суставов, которые рассчитывали путем определения величины эффекта (ВЭ) и 95% доверительного интервала (95% ДИ) по сравнению с группами плацебо или активного контроля (Hedges L.V., 1982). ВЭ — стандартизованная разность средних, то есть разность средних между показателями групп лечения и контроля, разделенная на стандартное отклонение этой разности. Эта величина не имеет единиц измерения и информативна при сравнении различных методик лечения. Клинически ВЭ, равная 0,2, считается малой, 0,5 — умеренной, а >0,8 — большой (Cohen J., 1988). При наличии более одного систематического обзора для одного и того же метода лечения использовали результаты последнего из этих обзоров. Если систематические обзоры отсутствовали, то использовали соответствующий статистический метод объединения данных (Whitehead A., Whitehead J., 1991). Вычисляли долю пациентов с умеренным — очень хорошим (или >50%) уменьшением выраженности боли или симптомов, а также число больных, которых необходимо пролечить (number needed to treat — NNT) (Cook R.J., Sackett D.L., 1995). Положительное значение NNT означает, что лечение более эффективно, чем контроль, тогда как отрицательное — менее эффективно. NNT и 95% ДИ указывали только в случае их статистической значимости; обозначение «НЗ» (незначимо) использовали для избежания путаницы (Rothman K.J., 1986). Относительный риск (ОР) рассчитывали для побочных явлений (Maistrelli G.L., 1990).
При наличии экономической оценки лечения рассматривали такие показатели: дизайн исследования, сравниваемое лечение, заинтересованную сторону в экономии расходов, временной диапазон, дисконтирование, общую стоимость лечения, эффективность. Также рассчитывали коэффициент эффективности дополнительных затрат (КЭДЗ) (incremental cost effectiveness ratio — ICER). Использовали (при его наличии) индекс QALY, в противном случае применяли такие специфические для болезни критерии, как уменьшение выраженности боли и улучшение функции суставов.
Данные извлекали два исследователя с использованием специальных форм. Перед проведением анализа исследователи обсуждали и согласовывали все расхождения. Неанглоязычные данные исследований обрабатывались исследователями — носителями соответствующих языков.
Сила рекомендаций
В зависимости от категории доказательности данных об эффективности (см. табл. 94) силу рекомендации определяли два члена комитета в соответствии с одним из четырех классов — А–D, затем это решение одобрял комитет. Если отсутствовали специфические для ОА тазобедренного сустава данные, сила рекомендации не могла быть применена. Однако также использовали визуальную аналоговую шкалу (ВАШ). Каждого члена комитета просили отметить на 100-мм шкале силу рекомендации для каждого вмешательства, в соответствии с данными научных исследований (по критериям «эффективность», «безопасность», «эффективность затрат») и клинического опыта. Рассчитывали средние величины и стандартную ошибку средней величины относительно силы рекомендаций для каждого метода лечения. Эта система позволила применить силу рекомендаций в тех случаях, когда специфические для тазобедренного сустава данные по эффективности отсутствовали.
Программа будущих исследований
Каждый член комитета предложил 10 тем для программы будущих исследований, основанных на доступных в настоящее время данных и клиническом опыте лечения пациентов с ОА тазобедренного сустава. Для достижения консенсуса по 10 наиболее важным темам использовали метод Delphi. С этой целью применяли те же критерии, которые использовались при отборе предложений (то есть принятие темы, за которую проголосовали более 50% членов комитета; отклонение темы, за которую проголосовали менее 3 членов комитета; включение темы в следующий раунд Delphi, если за нее проголосовали менее 50% членов комитета, но более 3).
Результаты
Методы лечения и типы доказательных данных научных исследований
В результате общего поиска литературы выявлено 1725 ссылок, из них в базе Medline — 1143, Embase — 357, CINAHL — 46, Cochrane Library — 179. После удаления дублирующихся осталась 1341 ссылка, в том числе 898 — на оригинальные исследования, 443 — на повествовательные обзоры, комментарии, редакторские статьи. На рис. 113 представлено процентное соотношение разных методов лечения пациентов с ОА, использовавшихся в 898 оригинальных исследованиях, а на рис. 114 — дизайн исследований.
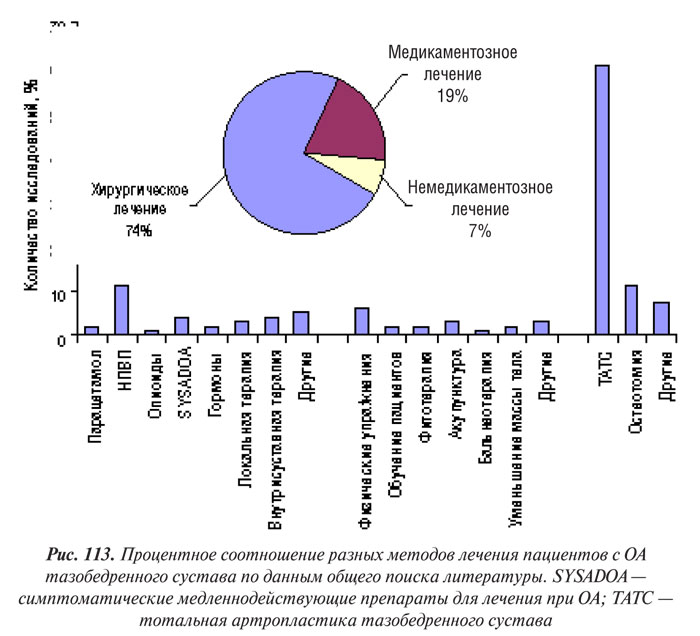
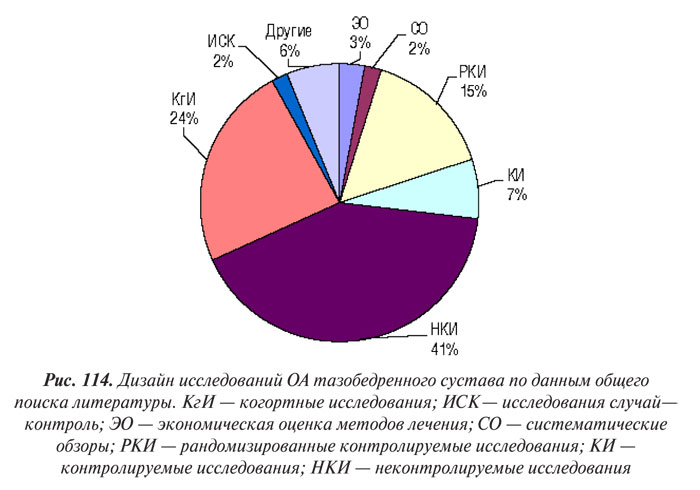
Подход к экспертной оценке
Эксперты были проинформированы о результатах общего поиска литературы, после чего использовали метод Delphi. Из 112 предложений экспертов после проведения 3 анонимных раундов Delphi были согласованы 10 окончательных рекомендаций по лечению пациентов с ОА тазобедренных суставов (табл. 95).
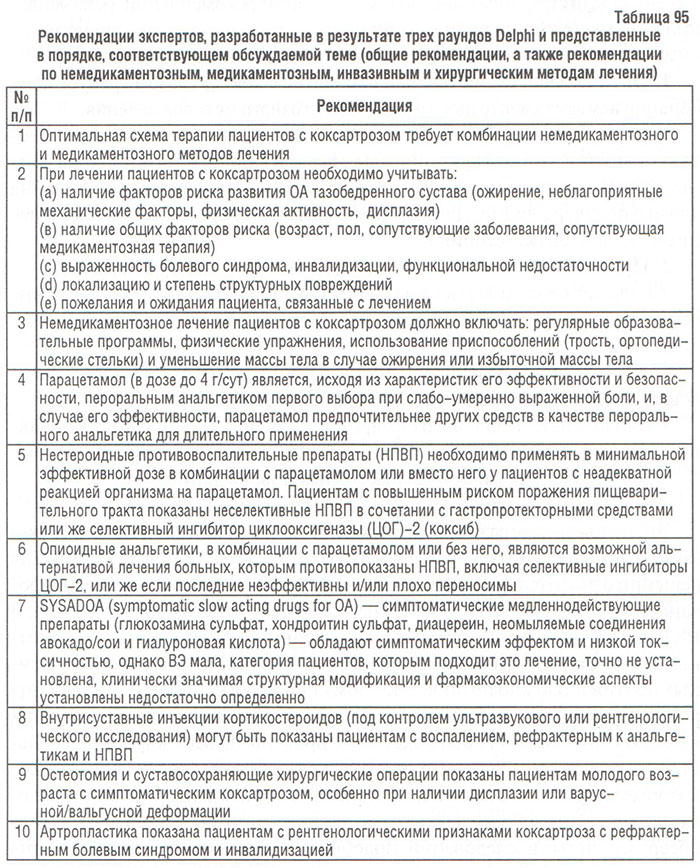
Оценка предложений экспертов по рекомендациям
Результаты, полученные при проведении поиска по отдельным методам лечения, были объединены с результатами общего поиска. После исключения дублирующейся информации и статей, не относящихся к рассматриваемому вопросу, в списке осталось 461 исследование. В их числе: 44 статьи касаются применения парацетамола; 287 — стандартных НПВП, коксибов и гастропротекторов; 41 — SYSADOA; 26 — опиоидных анальгетиков; 7 — внутрисуставных инъекций кортикостероидов; 22 — немедикаментозных методов лечения; 34 — двух видов хирургического лечения. Нижеприведенные предложения были сгруппированы по темам — общие рекомендации, рекомендации по немедикаментозным, медикаментозным, инвазивным и хирургическим методам лечения — без распределения по степени значимости.
1. Оптимальная схема терапии пациентов с коксартрозом требует комбинации немедикаментозного и медикаментозного методов лечения.
Хотя это положение логично и отражает общепринятую клиническую практику, отсутствуют прямые сравнения или доказательные данные клинических исследований с использованием факторного дизайна для его подтверждения. Данное положение подтверждается только мнением экспертов (категория IV).
2. При лечении пациентов с коксартрозом необходимо учитывать:
- наличие факторов риска развития ОА тазобедренного сустава (ожирение, неблагоприятные механические факторы, физическая активность, дисплазия);
- наличие общих факторов риска (возраст, пол, сопутствующие заболевания и сопутствующая медикаментозная терапия);
- выраженность болевого синдрома, инвалидизации, функциональной недостаточности;
- локализацию и степень структурных повреждений;
- пожелания и ожидания пациента, связанные с лечением.
Это положение отражает образец клинической практики и включает указание клинических маркеров, которые часто используются для принятия решений относительно лечения. Однако, хотя оно логически аргументировано, недостаточно экспериментальных данных для его подтверждения. В РКИ преимущественно изучают эффективность одной или двух конкретных монотерапий в высокоселективных гомогенных популяциях, подобранных противоположно по определенному признаку испытуемых с коксартрозом. Поэтому данные, полученные с помощью таких экспериментальных исследований, не могут быть экстраполированы на всю популяцию больных с коксартрозом. Кроме того, из-за исключения многих переменных, которые могут влиять на исход, часто трудно определить предикторы исхода. В связи с этим более адекватные данные могут быть получены в ходе обсервационных исследований, подобно тому, как большое число когортных исследований было проведено для отслеживания возможных исходных факторов риска или предикторов для тотальной артропластики тазобедренного сустава (ТАТС) или остеотомии. Например, возраст, степень дисплазии и степень деформации являются основными предикторами для остеотомии (Maistrelli G.L. et al., 1990; Ohashi H. et al., 2000), а выраженность болевого синдрома, рентгенологическая тяжесть поражения и степень функциональной недостаточности ассоциированы с клиническими исходами проведения ТАТС (Vinciguerra C. et al., 1995; Dougados M. et al., 1999; Nilsdotter A.K. et al., 2001; Maillefert J.F. et al., 2002; Birrel F. et al., 2003).
Эти факторы становятся даже более важными при анализе эффективности затрат. Например, эффективность затрат на селективные ингибиторы ЦОГ-2 высокая только у пациентов с повышенным риском возникновения желудочно-кишечного кровотечения, а эффективность затрат на проведение ТАТС выше у женщин более молодого возраста. Любая тактика ведения больного требует учета мнения пациента и его ожиданий, и целостного подхода, принимающего во внимание сопутствующие заболевания и другие требования лечения. Понятно, что пожелания и ожидания пациента, связанные с лечением, видимо, являются ключевыми компонентами при принятии решения о проведении ТАТС (Haddad F.S. et al., 2001; Mancuso C.A. et al., 2003).
Таким образом, это положение отражает реальность клинической практики и профессиональный вдумчивый подход к лечению пациента. Данные ряда обсервационных исследований и экономических оценок подтверждают целесообразность его применения (категория III).
3. Немедикаментозное лечение пациентов с коксартрозом должно включать: регулярные образовательные программы, физические упражнения, использование приспособлений (трости, ортопедические стельки) и уменьшение массы тела в случае ожирения или избыточной массы тела.
Два систематических обзора были посвящены образовательным программам в лечении пациентов с ОА (Superio-Cabuslay E. et al., 1996; Warsi A. et al., 2003), но ни один из них не содержал данные о подгруппе пациентов с коксартрозом. В обоих обзорах выявили статистически незначимую эффективность образовательной программы по сравнению с группой контроля. ВЭ в одном обзоре, посвященном большему количеству исследований, составила соответственно 0,15 (95% ДИ: от -0,43 до +1,18) и -0,02 (95% ДИ: от -0,51 до +0,47) относительно уменьшения выраженности болевого синдрома и улучшения функции суставов (Superio-Cabuslay E. et al., 1996). В 24-месячное открытое РКИ были включены пациенты с коксартрозом, ожидающие проведения ТАТС. Все пациенты были проинформированы обычным образом и получили информационный листок перед рандомизацией. Методом рандомизации их распределили на 2 группы: пациентам 1-й группы проводили коллективный многопрофильный информационный цикл в течение 2-6-й недели перед операцией, пациенты 2-й — составили группу контроля. Результаты свидетельствуют, что пациенты, участвовавшие в тренинге, отмечали менее выраженную боль, чем таковые из контрольной группы (Giraudet-Le Quintreс J.S. et al., 2003) (табл. 96).
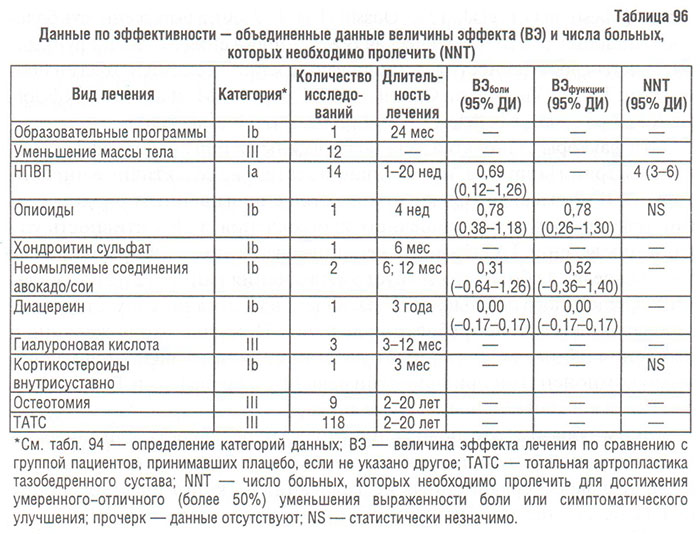
Пять систематических обзоров были посвящены применению физических упражнений (Puett D.W., Griffin M.R., 1994; van Baar M.E. et al., 1999; Fransen M. et al., 2002; 2003; Brosseau L. et al., 2003), но ни одно из вмешательств не проводилось специально относительно лечения тазобедренного сустава. В последнем из обзоров, с наибольшим количеством РКИ, установлено, что ВЭ составила 0,39 (95% ДИ: 0,30–0,47) для уменьшения выраженности боли и 0,31 (95% ДИ: 0,23–0,39) — для улучшения функции суставов. Отсутствуют данные РКИ относительно преимуществ уменьшения массы тела. Тем не менее, в одном систематическом обзоре обсервационных исследований (1 когортное исследование и 11 исследований случай—контроль), посвященном ожирению и риску развития коксартроза, продемонстрирована положительная корреляция между ожирением и коксартрозом в исследованиях типа случай—контроль (отношение шансов (ОШ)=2,3; 95% ДИ: 1,2–4,4), но не в когортном исследовании (ОР=1,03; 95% ДИ: 0,40–2,60) (Lievense A.M. et al., 2002). Возможно, лечение с использованием физических упражнений оказывает эффект на уменьшение массы тела, что в свою очередь может улучшать исход у больных с коксартрозом, но это требует подтверждения результатами дальнейших исследований. Отсутствуют данные научных исследований о применении таких приспособлений, как трость и ортопедические стельки при коксартрозе, хотя они могут способствовать уменьшению нежелательных нагрузок на сустав.
Таким образом, было проведено только одно РКИ (категории Ib), посвященное исключительно применению образовательных программ при лечении пациентов с коксартрозом, результаты которого позволяют предположить, что использование образовательных программ способствует уменьшению выраженности боли. Однако данные исследований (категории Ia) по лечению пациентов с ОА с поражением любого сустава указывают на то, что использование образовательных программ может иметь очень низкую эффективность и не достигать статистически значимой величины. Напротив, несмотря на отсутствие прямых данных относительно коксартроза, физические упражнения, очевидно, полезны при ОА любого типа (категория данных Ia). Имеются некоторые данные, подтверждающие пользу уменьшения массы тела у пациентов с коксартрозом (категория III), но отсутствуют данные относительно приспособлений (трость и ортопедические стельки) (см. табл. 95). Несмотря на отсутствие данных исследований, очевидна целесообразность применения лечебных мероприятий, направленных на уменьшение нежелательных механических нагрузок на пораженный тазобедренный сустав.
4. Парацетамол (в дозе до 4 г/сут) является, исходя из характеристик его эффективности и безопасности, пероральным анальгетиком первого выбора при слабо-умеренно выраженной боли, и, в случае его эффективности, парацетамол предпочтительнее других средств в качестве перорального анальгетика для длительного применения.
Отсутствуют данные плацебо-контролируемых рандомизированных исследований, а также сравнительных исследований эффективности парацетамола исключительно при коксартрозе, хотя этот препарат широко применяют при данном заболевании. В ходе поиска литературы выявлено 3 систематических обзора (Lievense A.M. et al., 2002; Towheed T.E. et al., 2003; Zhang W. et al., 2004). В последнем из них рассмотрены 4 плацебо-контролируемых исследования, 2 из которых проводили с участием пациентов с коксартрозом или гонартрозом в течение 6 нед (Zhang W. et al., 2004). ВЭ относительно уменьшения выраженности боли составила 0,21 (95% ДИ: 0,02–0,41), а NNT для достижения клинического улучшения (умеренного-отличного уменьшения выраженности боли) при терапии парацетамолом в сравнении с плацебо составил 4 (95% ДИ: 2–43). Однако парацетамол уступал по эффективности, но был более безопасен, чем НПВП.
В последнее время стали высказывать опасения относительно возможной гастроинтестинальной токсичности парацетамола. Результаты одного исследования случай—контроль свидетельствуют о том, что прием парацетамола в дозе более 2 г/сут — ассоциирован с повышенным риском перфораций или кровотечений из желудочно-кишечного тракта (ЖКТ) (ОШ=3,6; 95% ДИ: 2,6–5,1) (Garcia Rodriguez L.A., Hernandez-Diaz S., 2001), а данные другого когортного исследования свидетельствуют о дозозависимой связи между парацетамолом и диспепсией (Rahme E. et al., 2002). Однако результаты систематического обзора РКИ подтверждают, что парацетамол вызывает не больше желудочно-кишечных расстройств, чем плацебо (ОР=0,80; 95% ДИ: 0,27–2,37) (Zhang W. et al., 2004). Данные метаанализа исследований случай—контроль также свидетельствуют об отсутствии повышения риска развития желудочно-кишечных кровотечений при приеме парацетамола в дозе 2–4 г/сут (ОР=1,2; 95% ДИ: 0,8–1,7) и отсутствии дозозависимого эффекта в диапазоне доз: менее 2 г, 2–4 г, и более 4 г/сут (Lewis S.C. et al., 2002); эти данные совпадают и с результатами эндоскопических исследований (Muller P. et al., 1990; Jerussi T.P. et al., 1998; Lanza F.L. et al., 1998).
Несмотря на то что высказывались некоторые опасения относительно токсического воздействия парацетамола на почки при его длительном регулярном применении (Barret B.J., 1996), данных, свидетельствующих в пользу такого предположения, мало (Fored C.M. et al., 2001; Rexrode K.M. et al., 2001; Zhang W. 2001) (табл. 97).
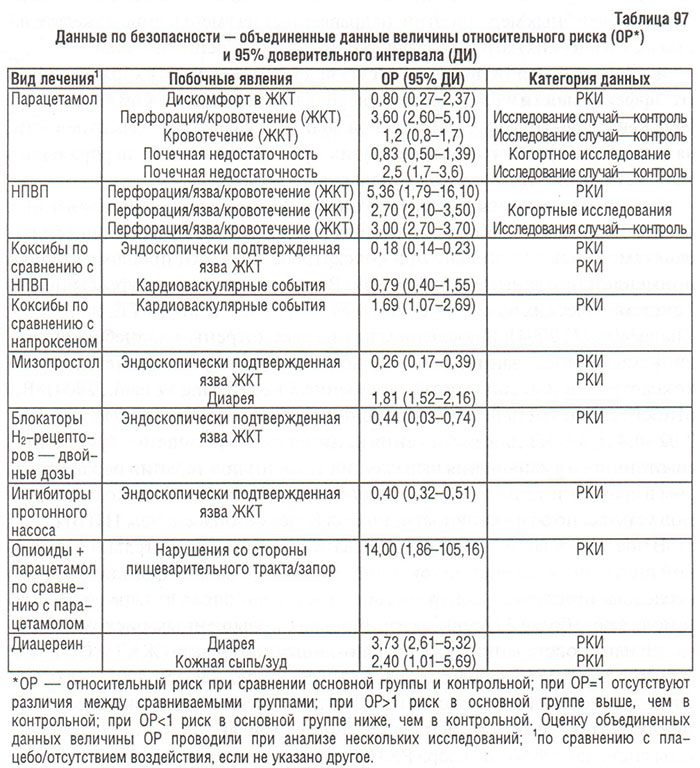
Таким образом, нет прямых сведений, подтверждающих эффективность применения парацетамола при коксартрозе. Однако данные по ОА любой локализации (категория Ia) свидетельствуют о том, что парацетамол эффективен в уменьшении выраженности боли, обусловленной ОА. Несмотря на то что его эффективность ниже, чем стандартных НПВП, он безопаснее при применении в рекомендованных дозах. Отсутствуют данные длительных исследований эффективности или безопасности парацетамола и нет прямых данных об эффективности затрат на его применение при лечении пациентов с коксартрозом. Однако в исследовании с участием пациентов с гонартрозом установлено, что парацетамол превосходит НПВП, НПВП + гастропротекторы и коксибы по величине затрат, необходимых для предотвращения развития одного побочного явления со стороны ЖКТ (Kamath C.C. et al., 2003) (табл. 98).
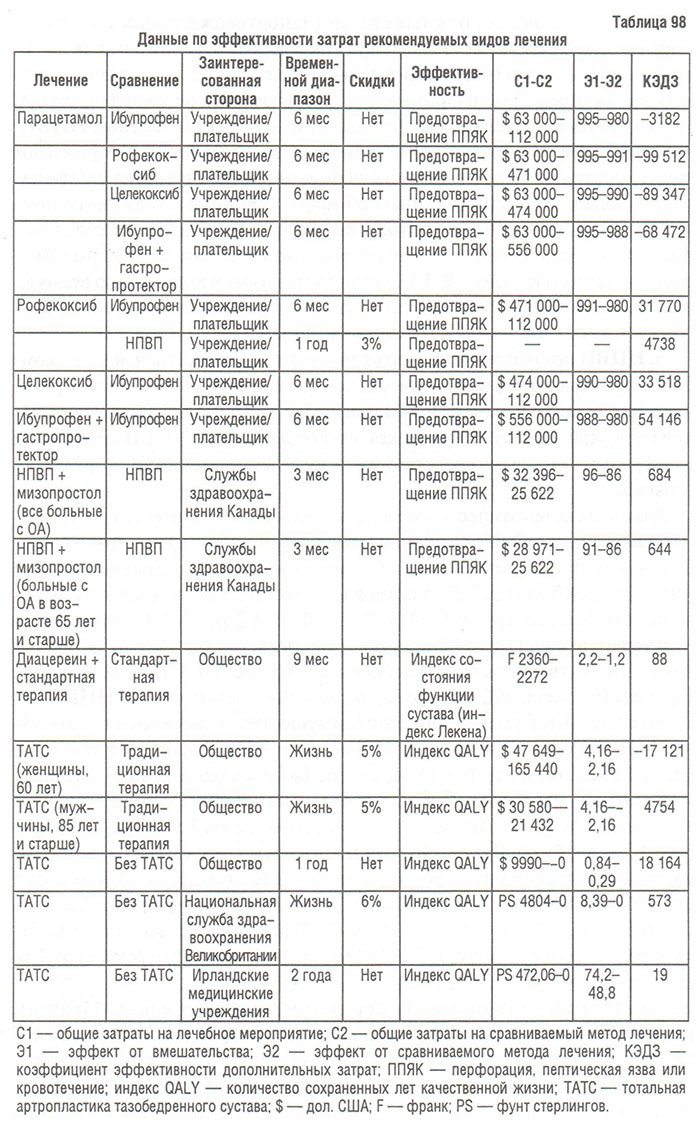
5. НПВП необходимо применять в минимальной эффективной дозе в комбинации с парацетамолом или вместо него у пациентов с неадекватной реакцией организма на парацетамол. Пациентам с повышенным риском поражения пищеварительного тракта показаны неселективные НПВП в сочетании с гастропротекторными средствами или же селективный ингибитор ЦОГ-2 (коксиб).
В одном систематическом обзоре, посвященном применению НПВП, не содержащих ацетилсалициловую кислоту, в лечении пациентов с коксартрозом, проанализированы 14 плацебо-контролируемых исследований (Towheed T. et al., 2000). Установлено, что ВЭ для уменьшения выраженности боли составила 0,69 (95% ДИ: 0,12–1,26), а NNT для достижения терапевтического эффекта по сравнению с плацебо — 4 (95% ДИ: 3–6), что подтверждает целесообразность применения НПВП при коксартрозе (см. табл. 96). Однако характеристики безопасности НПВП относительно ЖКТ уменьшают их преимущества. 6 систематических обзоров было посвящено оценке безопасности НПВП относительно ЖКТ с использованием данных РКИ, когортных исследований и исследований «случай–контроль» (Gabriel S.E. et al., 1991; Bollini P. et al., 1992; Garsia Rodriguez L.A., 1998; Tramer M.R. et al., 2000; Lewis S.C. et al., 2002; Ofman J.J. et al., 2002). Результаты свидетельствуют, что НПВП обусловливают повышенный риск кровотечений из ЖКТ (см. табл. 4), что носит дозозависимый характер (например, величина ОР составляет 2,2 (95% ДИ: 0,8–5,8), 3,2 (1,9–5,5) и 12,2 (5,6–26,7) при применении диклофенака в дозах: менее 75 мг/сут, 75–150 мг/сут и более 150 мг/сут, соответственно) (Lewis S.C. et al., 2002).
В целях минимизации риска поражения пищеварительного тракта в результате применения НПВП был использован ряд стратегий. В 2 систематических обзорах продемонстрировано значительное снижение гастроинтестинальной токсичности при применении коксибов (Deeks J.J. et al., 2002; Rostom A. et al., 2004), однако данные 5 систематических обзоров свидетельствуют в пользу сочетанного применения неселективных стандартных НПВП с такими гастропротекторными средствами, как мизопростол, блокаторы Н2-рецепторов и ингибиторы протонного насоса в двойных дозах (Capurso L. et al., 1991; Shield M.J., 1998; Rostom A. et al., 2000; 2004; Leandro G. et al., 2001). В табл. 97 представлены данные последнего систематического обзора по объединенной оценке ОР развития эндоскопически подтвержденной пептической язвы желудка при назначении коксибов или при сочетанном применении гастропротекторов и НПВП (Rostom A. et al., 2004a). Сходные результаты получены и для других видов пептических язв и их осложнений, однако блокаторы Н2-рецепторов в стандартных дозах являются менее эффективными, чем другие гастропротекторы; также необходима особая осторожность при применении мизопростола, поскольку он повышает риск развития диареи (ОР 1,81; ДИ: 1,52–2,16) (Rostom A. et al., 2004).
Кроме того, высказывались опасения относительно возможных кардиоваскулярных побочных эффектов рофекоксиба (например, инфаркт миокарда и инсульт). Однако систематический обзор 23 клинических исследований показал, что применение рофекоксиба ассоциировано с повышенным риском развития сердечно-сосудистых заболеваний только по сравнению с напроксеном (ОР 1,69; ДИ: 1,07–2,69). Риск не был статистически значимым при сравнении с плацебо (ОР 0,84; ДИ: 0,51–1,38) или «ненапроксеновыми» НПВП (ОР 0,79; ДИ: 0,40–1,55) (Konstam M.A. et al., 2001). Поэтому более частое развитие кардиоваскулярных тромбоэмболических событий при применении рофекоксиба может отражать антитромбоцитарный или какие-либо другие протекторные эффекты напроксена, чем побочные эффекты рофекоксиба. По этому вопросу ведутся дальнейшие исследования.
Другой важный аспект использования коксибов или гастропротекторов — определить, могут ли их дополнительные преимущества оправдать дополнительные затраты на их применение. Проведено 3 экономических анализа с оценкой лечения пациентов с ОА любой локализации (Gabriel S.E. et al., 1993; Pellissier J.M. et al., 2001; Kamath C.C. et al., 2003). Поскольку во всех из них использовали данные о предотвращенных клинически определяемых побочных явлениях со стороны ЖКТ (перфорация, язвообразование или кровотечение) как основной параметр эффективности, результаты можно экстраполировать и на больных коксартрозом. Результаты одного исследования продемонстрировали, что КЭДЗ для коксибов по сравнению с ибупрофеном составляет для рофекоксиба 31769,9 дол. США на одно предотвращенное побочное явление, а для целекоксиба — 33518,5 дол. США. КЭДЗ снижался при повышении у пациентов риска возникновения заболеваний ЖКТ, что указывает на более высокую эффективность затрат при применении коксибов у пациентов с более высоким риском развития кровотечения из ЖКТ. Сходные результаты получены и для гастропротекторных средств, однако с более высоким КЭДЗ, что позволяет предположить, что сопутствующее применение гастропротекторов является более дорогостоящей тактикой лечения (см. табл. 98).
Таким образом, НПВП эффективны в уменьшении выраженности боли при коксартрозе (категория данных — Ia). Однако побочные эффекты НПВП со стороны ЖКТ уменьшают их преимущества (категория Ia). Несмотря на то, что применение коксибов или дополнительное назначение гастропротекторов (мизопростол, блокаторы Н2-рецепторов и ингибиторы протонного насоса в двойных дозах) при терапии стандартными НПВП может значительно снижать частоту развития кровотечений из ЖКТ (категория Ia), эти тактики лечения более дорогостоящие и являются экономически эффективными только у пациентов с более высоким риском развития побочных явлений со стороны ЖКТ.
6. Опиоидные анальгетики, в комбинации с парацетамолом или без него, являются возможной альтернативой лечения пациентов, которым противопоказаны НПВП, включая селективные ингибиторы ЦОГ-2, или же если последние неэффективны и/или плохо переносимы.
В одном систематическом обзоре сообщается, что комбинация парацетамола и кодеина обеспечивает увеличение выраженности обезболивающего эффекта приблизительно на 5% при однократном применении относительно любого типа боли, включая боль при коксартрозе (de Craen A.J.M. et al., 1996). К сожалению, в этом обзоре данные о лечении пациентов с OA тазобедренного сустава не отделены от данных относительно других заболеваний. Кроме того, в обзоре продемонстрировано, что применение парацетамола в сочетании с кодеином являлось причиной большего числа побочных явлений, чем применение одного парацетамола (ОР 2,5; 95 % ДИ: 1,5–4,2). В ходе поиска обнаружены 4 РКИ, посвященные лечению пациентов с коксартрозом: в 1 сравнивали эффективность кодеина с плацебо (Peloso P.M. et al., 2000), а в 3 — парацетамола в сочетании с опиоидным анальгетиком в сравнении с плацебо (Emkey R. et al., 2004), парацетамолом (Kjaersgaard-Andersen P. et al., 1990) или диклофенаком (Parr G. et al., 1989). Установлено, что опиоидное средство (кодеин) превосходило плацебо относительно уменьшения выраженности боли (ВЭ 0,78; 95 % ДИ: 0,38–1,18) и улучшения функции суставов (ВЭ 0,78; 95% ДИ: 0,26–1,30), однако оно также являлось причиной развития большего количества побочных явлений (ОР 1,43; 95% ДИ: 1,09–1,86) (Peloso P.M. et al., 2000). Хотя комбинация парацетамола и опиоидного средства обеспечивала лучшую анальгезию, чем плацебо (ВЭ 0,30; 95% ДИ: 0,05–0,53) (Emkey R. et al., 2004), это лечение было не более эффективным, чем лечение парацетамолом (ВЭ для уменьшения выраженности боли от умеренного до отличного 1,27; 95% ДИ: 0,82–1,98) (Kjaersgaard-Andersen P. et al., 1990) и было менее эффективным по сравнению с лечением диклофенаком (ВЭ –0,18; 95% ДИ: от –0,33 до –0,04) (Parr G. et al., 1989). Более важно то, что такая комбинация явилась причиной большего количества побочных эффектов (ОР 7,25; 95% ДИ: 2,61–20,13), в том числе расстройств верхних отделов ЖКТ, запоров (ОР 14; 95% ДИ: 1,86–105,16) и головокружения или сонливости (ОР 5,00; 95% ДИ: 1,48–16,92) (Emkey R. et al., 2004) и имела больший процент исключения пациентов из исследований (ОР 3,57; 95% ДИ: 1,92–6,62) (Parr G. et al., 1989) (см. табл. 97).
Таким образом, опиоидные анальгетики в комбинации с парацетамолом или без него эффективны при коксартрозе (категория Ib). Однако их эффективность может быть не выше, чем эффективность монотерапии парацетамолом, и ниже эффективности НПВП (категория Ib). Кроме того, опиоидные анальгетики оказывают больше побочных эффектов и обусловливают прекращение лечения по этим причинам (категории Іа и Ib). Эти данные подтверждают, что опиоидные анальгетики следует рекомендовать только пациентам, у которых применение парацетамола, обычных НПВП или коксибов было недостаточно эффективным, или пациентам с противопоказаниями к НПВП/коксибам.
7. SYSADOA — симптоматические медленнодействующие препараты (глюкозамина сульфат, хондроитин сульфат, диацереин, неомыляемые соединения авокадо/сои и гиалуроновая кислота) обладают симптоматическим эффектом и низкой токсичностью, однако ВЭ мала, категория пациентов, которым подходит это лечение, точно не установлена, клинически значимая структурная модификация и фармакоэкономические аспекты установлены недостаточно определенно.
Термин SYSADOA распространяется на ряд лекарственных средств, включая глюкозамина сульфат, хондроитин сульфат, диацереин, неомыляемые соединения авокадо/сои и гиалуроновую кислоту. Классификация этих средств изменяется в зависимости от страны, ее использующей. В Великобритании, например, глюкозамина сульфат и хондроитин сульфат, классифицируются как пищевые добавки, которые продаются без рецепта. Многие систематические обзоры проводились для подтверждения целесообразности перорального применения глюкозамина сульфата (McAlindon T.E. et al., 2000; Towheed T.E. et al., 2001) и хондроитин сульфата (Leeb B.F. et al., 2000; McAlindon T.E. et al., 2000). Однако ни один из них не был специально посвящен коксартрозу. В исследованиях, в которых изучали гонартроз и коксартроз, установлено, что объединенный показатель ВЭ для уменьшения выраженности боли при применении глюкозамина сульфата по сравнению с плацебо составил 0,44 (95% ДИ: 0,24–0,64), а для улучшения функции сустава — 0,41 (95% ДИ: 0,14–0,69), тогда как при применении хондроитин сульфата эти показатели составили 0,78 (95% ДИ: 0,60–0,95) и 0,63 (95% ДИ: 0,32–0,94) соответственно. В одном плацебо-контролируемом РКИ, специально посвященном применению хондроитин сульфата при коксартрозе, было продемонстрировано, что хондроитин сульфат статистически значимо превосходил плацебо относительно уменьшения выраженности боли и улучшения функции суставов через более чем 6 мес после начала лечения. Однако по данным этого исследования ВЭ не рассчитывалась, так как о стандартных отклонениях не сообщалось (Conrozier T., Vignon E., 1992). В ходе систематического поиска литературы не удалось идентифицировать исследования других уровней доказательности специально для коксартроза. Данные о модифицирующем структуру суставов эффекте этих двух средств не получено. В другом РКИ установлено, что внутримышечное введение гликозаминогликан-пептидного комплекса (в настоящее время изъят с рынка) курсами 2 раза в год в течение 5 лет не имело преимуществ по сравнению с плацебо относительно модификации структуры сустава при коксартрозе (Pavelka K. et al., 2000).
В двух систематических обзорах (Little C.V., Parsons T., 2001; Long L. et al., 2001) оценивали эффективность фитотерапии, в том числе при проведении двух РКИ (Blotman F. et al., 1997; Mathieu E. et al., 1998) по применению неомыляемых соединений авокадо/сои при OA разной локализации. В одном из исследований была выделена подгруппа пациентов с коксартрозом (n=50), которых лечили в течение 24 нед (Mathieu E. et al., 1998). Результаты данного исследования свидетельствуют о более существенном уменьшении выраженности боли в основной группе пациентов, чем в группе плацебо (ВЭ 0,76, 95% ДИ: 0,17–1,34). Однако это не подтверждено данными недавно проведенного исследования с большим размером выборки (n=163) и более длительным периодом лечения (1-годичный — для симптоматических результатов и 2-годичный — для структурных изменений) (Lequesne M. et al., 2002). Объединенные величины ВЭ для уменьшения выраженности боли и улучшения функции суставов в этих двух исследованиях не были статистически значимыми (см. табл. 96). Кроме того, лечение неомыляемыми соединениями авокадо/сои в течение 2 лет не имело преимуществ относительно каких-либо улучшений структуры суставов (Lequesne M. et al., 2002).
Данные о применении диацереина не позволяют сделать окончательный вывод. В одном многоцентровом РКИ с участием 507 больных коксартрозом установлено, что терапия диацереином в течение более чем 3 лет не имеет преимуществ по сравнению с плацебо относительно уменьшения выраженности боли (ВЭ 0,00; 95% ДИ: от –0,17 до 0,17) или улучшения функции суставов (ВЭ 0,00; 95% ДИ: от –0,17 до 0,17) (см. табл. 96) (Dougados M. et al., 2001). Однако это исследование планировалось прежде всего с целью выяснить эффективность препарата относительно модификации структуры суставов, а не относительно устранения симптомов заболевания. В другом РКИ с участием 207 пациентов с OA коленного или тазобедренного сустава продемонстрировано, что комбинация диацереина и стандартной терапии более эффективна относительно уменьшения выраженности боли (ВЭ 0,29; 95% ДИ: 0,05–0,57) и улучшения функции суставов (ВЭ 0,35; 95% ДИ: 0,08–0,63), чем применение только стандартной терапии в течение 6 мес (Fagnani F. et al., 1998), хотя данные только по коксартрозу представлены не были.
Однако независимо от своей эффективности диацереин обусловливает повышение частоты развития таких побочных эффектов, как диарея (ОР 3,73; 95% ДИ: 2,61–5,32), кожная сыпь или зуд (ОР 2,40; 95% ДИ: 1,01–5,69) (см. табл. 97) (Dougados M. et al., 2001). Тем не менее, диацереин способен замедлять прогрессию сужения рентгенологической суставной щели (РСЩ) при коксартрозе (Dougados M. et al., 2001). Относительный риск прогрессирования сужения РСЩ, определенный как сужение РСЩі0,5 мм, в течение 3-летнего лечения в сравнении с плацебо составил 0,84 (95% ДИ: 0,71–0,99), при значении NNT=10 (95% ДИ: 5–171). Хотя подобное лечение может иметь более высокую эффективность затрат, чем стандартная терапия при кратковременном применении без учета отдаленных побочных эффектов (см. табл. 98) (Fagnani F. et al., 1998), клиническое соотношение риск/польза при применении диацереина у пациентов с коксартрозом все же должно быть подтверждено.
В отличие от гонартроза, отсутствуют данные РКИ, подтверждающие целесообразность внутрисуставного применения гиалуроновой кислоты при коксартрозе, хотя результаты всех трех неконтролируемых исследований (Brocq O. et al., 2002; Conrozier T. et al., 2003; Vad V.B. et al., 2003) подтвердили существенное уменьшение выраженности боли по сравнению с исходным уровнем.
Таким образом, нет прямого подтверждения клинических преимуществ (относительно уменьшения выраженности боли и улучшения функции суставов) применения глюкозамина сульфата при коксартрозе, хотя имеются данные категории Іа относительно лечения пациентов с OA любой локализации. Применение хондроитин сульфата эффективно для уменьшения выраженности боли и функциональной недостаточности при коксартрозе, что продемонстрировано в одном РКИ (категория Ib). Данные о симптоматических эффектах неомыляемых соединений авакадо/сои и диацереина (категория Ib) неокончательны, а доказательные данные относительно гиалуроновой кислоты — слабые (категория III). Необходимо проведение дальнейших исследований для подтверждения структурно модифицирующего эффекта и эффективности затрат SYSADOA.
8. Внутрисуставные инъекции кортикостероидов (под контролем ультразвукового или рентгенологического исследования) могут быть показаны пациентам с воспалением, рефрактерным к анальгетикам и НПВП.
Три исследования были посвящены коксартрозу (Flanagan J. et al., 1988; Plant M.J. et al., 1997; Waseem M. et al., 2002), но только одно из них является РКИ, в котором сравнили применение комбинации анестетика и стероидного средства с монотерапией анестетиком (Flanagan J. et al., 1988). Однако результаты этого исследования разрознены, поэтому ВЭ не рассчитывали. Частотное отношение для уменьшения выраженности боли составило 1,18 (95% ДИ: 0,68–2,15) и 0,61 (0,23–1,60) за 1 и 3 мес соответственно. Это свидетельствует о том, что подобная комбинация не превосходила по эффективности анестетик при применении у больных коксартрозом. Хотя данные двух неконтролируемых исследований свидетельствуют о некотором кратковременном (Ј3 мес) уменьшении выраженности боли при внутрисуставном применении кортикостероида (Plant M.J. et al., 1997; Waseem M. et al., 2002), результаты могут содержать систематическую ошибку в связи с эффектами плацебо. То есть, в отличие от гонартроза отсутствуют робастные (устойчивые) данные, подтверждающие эффективность внутрисуставного введения стероидного средства при коксартрозе, независимо от имеющихся технических трудностей проведения подобной процедуры. Кроме того, отсутствуют сравнительные данные, подтверждающие повышенную точность процедуры в результате использования ультразвука или рентгенконтроля, и отсутствуют данные о развитии воспаления.
Таким образом, имеются данные категории Ib в пользу этого метода лечения, но результаты исследований не позволяют сделать окончательный вывод, поэтому необходимо проведение плацебо-контролируемых исследований у пациентов с коксартрозом.
9. Остеотомия и суставосохраняющие хирургические операции показаны пациентам молодого возраста с симптоматическим коксартрозом, особенно при наличии дисплазии или варусной/вальгусной деформации.
Остеотомия таза и/или бедренной кости может изменять нагрузки на тазобедренный сустав и таким образом потенциально влиять на клинические признаки и течение коксартроза. Симптоматические и структурные результаты подобного влияния оценивались преимущественно у пациентов с ацетабулярной дисплазией и вальгусной деформацией шейки бедренной кости. Как и в случае ТАТС, большинство доступных исследований являются когортными, поэтому в данной работе не удалось идентифицировать какого-либо РКИ относительно выраженности симптомов или структурных изменений. По крайней мере в 7 ретроспективных когортных исследованиях (Maistrelli G.L. et al., 1990; Tonnis A. et al., 1994; Ohashi H. et al., 2000; Takatori Y. et al., 2001; Murphy S., Deshmukh R., 2002; Yasunaga Y. et al., 2003) и 2 проспективных когортных исследованиях (Siebenrock K.A. et al., 2001; Hasegawa Y. et al., 2002), с периодами наблюдения от 2 до 20 лет изучали как исходы, так и предикторы перед началом исследования, имеющие отношение к данной рекомендации. У пациентов отмечено существенное улучшение клинических (выраженность боли, способность передвигаться и общие показатели функции суставов) и рентгенографических показателей после операции. Более пожилой возраст (Maistrelli G.L. et al., 1990; Siebenrock K.A. et al., 2001), степень рентгенографических изменений (Tonnis A. et al., 1994; Ohashi H. et al., 2000; Takatori Y. et al., 2001; Murphy S., Deshmukh R., 2002), степень дисплазии (Maistrelli G.L. et al., 1990; Tonnis A. et al., 1994) и тяжесть рентгенографических деформаций (Maistrelli G.L. et al., 1990; Ohashi H. et al., 2000) перед началом исследования ассоциировались с худшими клиническими результатами и с неудачным хирургическим вмешательством, которое главным образом определяли как необходимость проведения ТАТС. Поскольку в большинство исследований были включены взрослые люди молодого возраста, у которых отмечались по крайней мере незначительные или умеренно выраженные симптомы (в основном боль в тазобедренном суставе), а также имелось недостаточно данных относительно естественного течения тазобедренных и ацетабулярных деформаций, то необходимо проведение дальнейших исследований с тем, чтобы установить эффективность остеотомии у пациентов с бессимптомным течением болезни и у пациентов разных возрастных групп.
Данные обсервационных исследований также свидетельствуют в пользу целесообразности проведения таких рекомендуемых в последнее время сохраняющих суставы хирургических процедур, как артроскопическая очистка сустава (дебридмент) (Margheritini F., Villar R.N., 1999; Helenius I. et al., 2001) и хирургическое выравнивание тазобедренного сустава с компенсирующей реконструкцией (Ganz R. et al., 2001; Beck M. et al., 2004). Хотя в этих исследованиях отмечено уменьшение выраженности симптомов, но отсутствие контрольных групп с альтернативным методом лечения затрудняет интерпретацию указанных результатов.
Таким образом, недостаточно данных (категория III) об эффективности остеотомии и сохраняющих хирургических процедур у пациентов с коксартрозом. По-видимому, они показаны пациентам более молодого возраста с болезненной дисплазией бедра или деформациями, у которых пока не оправдано проведение ТАТС. Однако следует установить их эффективность и эффективность затрат по сравнению с ТАТС у пациентов более старших возрастных групп и/или с более тяжелыми стадиями коксартроза.
10. Артропластика показана пациентам с рентгенографическими признаками коксартроза с рефрактерным болевым синдромом и инвалидизацией.
Из-за методологических и этических проблем сравнение ТАТС с плацебо или стандартными схемами лечения трудно оценить при проведении РКИ. В ходе поиска литературы нам не удалось найти ни одного РКИ, сравнивавшего плацебо или стандартное лечение с ТАТС. Однако имеется большое количество случаев сравнения различных типов протезов, а также неконтролируемых проспективных исследований (Faulkner A. et al., 1998; Fitzpatrick R. et al., 1998). Один систематический обзор включал 118 неконтролируемых проспективных исследований с участием в общей сложности 77 375 пациентов со средним периодом последующего наблюдения 9,4 года (диапазон 2–20 лет) (Fitzpatrick R. et al., 1998). Процент пациентов с отсутствием боли в конечной точке исследования составил в среднем от 43,2% (95% ДИ: 34–49) до 84,1% (95% ДИ: 46–100), в зависимости от типа протеза. Среднее уменьшение количества баллов по шкале Harris для тазобедренного сустава (максимум — 100 баллов, включая оценку боли — 0–40 баллов, функции — 0–47 баллов, движения — 0–5 баллов и деформации — 0–8 баллов) по сравнению с исходным состоянием, составило от 36 до 46%. Частота ревизионных вмешательств — один из главных показателей эффективности ТАТС — составила от 0,18 (стандартная ошибка средней величины — 0,04) до 2,04 (стандартная ошибка средней величины — 0,19) на 100 человек/год с коррекцией по возрасту, полу и типу артрита тазобедренного сустава. Имеется больше информации относительно различий между протезами (Faulkner A. et al., 1998; Fitzpatrick R. et al., 1998), но она выходит за рамки данной рекомендации.
Более высокие результаты относительно уменьшения выраженности боли и улучшения качества жизни при применении ТАТС были получены в одном небольшом когортном исследовании, проведенном в азиатской стране, в котором сравнивали эффективность ТАТС и консервативной терапии. Однако несмотря на то что в течение первого года после операции ТАТС была эффективнее консервативной терапии, через 5 лет последняя была более эффективной. (Kawasaki M. et al., 2003). Поскольку в этом исследовании был очень малый размер выборки (62 и 45 человек в каждой группе), и отсутствовала коррекция данных по другим влияющим на результат факторам, его результаты могут содержать систематическую ошибку. Были проведены два других когортных исследования, в одном сравнивали количество баллов по анкетам WOMAC и SF-36 (Nilsdotter A.K. et al., 2003), а в другом — выживаемость (Visuri T. et al., 1994) у пациентов с ТАТС и исходной популяцией. Кроме худших функциональных показателей, в группе ТАТС было сходное качество жизни и выживаемость по сравнению с исходной популяцией.
Вопрос о том, должны ли рентгенографические изменения быть одним из критериев для решения вопроса о проведении ТАТС, пока остается открытым. В 6 когортных исследованиях (Vinciguerra C. et al., 1995; Dougados M. et al., 1999; Nilsdotter A-K. et al., 2001; Maillefert J.F. et al., 2002; Birrell F. et al., 2003) (в 4 из них данные доступны для проведения повторного анализа) и в 1 исследовании случай—контроль (Dolin S.J. et al., 2003) продемонстрирована положительная связь между степенью рентгенологических изменений и риском ТАТС (табл. 99). Более высокий риск ТАТС также ассоциировался с наличием выраженной боли и инвалидизации. Таким образом, выраженные рентгенологические изменения, боль и функциональная неспособность — хорошие прогностические показатели для определения необходимости в последующем проведении ТАТС. Однако трудно определить, являются ли они независимыми факторами риска проведения ТАТС или же факторами, которыми в настоящее время руководствуются хирурги для принятия решения о тактике лечения. Тем не менее, когда диагноз OA подтвержден (чаще всего — рентгенологически), это имеет существенное значение и для оценки проблем, связанных непосредственно с состоянием пациента (боль, функциональная неспособность), и для определения потребности в серьезном оперативном вмешательстве.
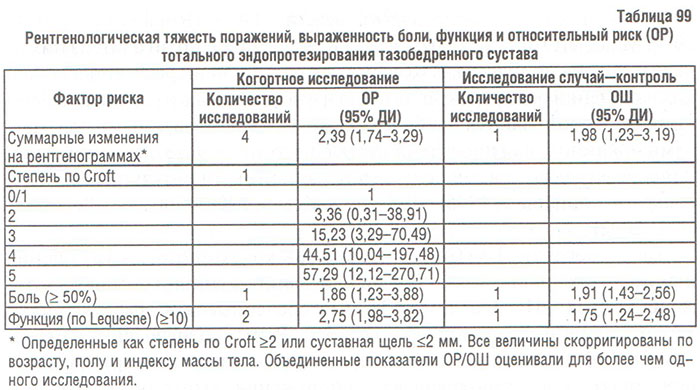
Другой важный вопрос относительно ТАТС состоит в определении того, является ли оно эффективным с точки зрения затрат по сравнению с другими методами лечения. Выявлены 5 исследований с экономической оценкой ТАТС, хотя в одном из них сравнивали различные типы протезов (Faulkner A. et al., 1998), поэтому оно не подходит для рассматриваемой рекомендации. В 4 исследованиях сравнили ТАТС с обычной терапией (Chang R.W. et al., 1996) или с другими видами лечения без ТАТС, при допущении, что отсутствуют затраты и эффекты, связанные с проведением других видов лечения без ТАТС (Rorabeck C.H. et al., 1994; Fitzpatrick R. et al., 1998; O’Shea K. et al., 2002). Результаты исследований свидетельствуют, что для получения дополнительных преимуществ по сравнению с обычным лечением или другими видами лечения без ТАТС, проведение ТАТС требует дополнительных затрат (см. табл. 5). Однако эффективность затрат на него выше у женщин более молодого возраста. Например, по сравнению с обычной терапией ТАТС было рентабельным для женщин в возрасте старше 60 лет (КЭДЗ — 17 121 дол. США на каждый сохраненный год качественной жизни), и менее рентабельным для мужчин в возрасте более 85 лет (КЭДЗ — 4 754 дол. США на каждый сохраненный год качественной жизни ).
Учитывая выгоды и затраты, связанные с проведением ТАТС, выбор оптимального момента для выполнения оперативного вмешательства при OA является решающим. Был предложен ряд критериев для приоритетного направления пациентов на проведение ТАТС (Rorabeck C.H. et al., 1994; Maillefert J.F. et al., 2002; O’Shea K. et al., 2002), но ни один из них не является общепринятым. В то время как роль степени рентгенологических изменений остается недостаточно изученной, боль и нарушения функции суставов являются наиболее важными и согласованными параметрами показаний для проведения тотального эндопротезирования и они непосредственно связаны с послеоперационными результатами (NIH consensus conference, 1995; Nilsdotter A.K. et al., 2001; 2003; Maillefert J.F. et al., 2002).
Таким образом, ТАТС эффективна при коксартрозе для улучшения клинических показателей — боли и нарушения функции суставов (категория данных — III). В целом ТАТС имеет более высокую эффективность затрат у женщин более молодого возраста. Рентгенологических изменений обычно достаточно для подтверждения диагноза коксартроз, а степень тяжести рентгенологического поражения, выраженность боли и степень функциональной неспособности — факторы риска для проведения ТАТС. Имеются убедительные подтверждения и данные о том, что выраженность боли и степень функциональной неспособности являются основными факторами, определяющими необходимость проведения эндопротезирования (категория III)
Направления дальнейших исследований
Первоначально было предложено 95 тем для исследования. 10 из них, согласованные в конечном счете как наиболее важные темы для будущих исследований на основании доступных данных научных исследований и клинической практики, приведены в табл. 100.

Обсуждение
Это первый полный документ, в котором даны рекомендации по ведению пациентов с коксартрозом. В отличие от предыдущих рекомендаций, которые были специально посвящены коксартрозу (Hochberg M.C. et al., 1995) или включавших это заболевание (Scott D.L., 1993; Kwoh C.K. et al., 2002), настоящие рекомендации основаны как на мнении экспертов, так и на данных научных исследований, с четким разделением между ними. Мы использовали детально разработанные методы, в частности методику Delphi, для выработки консенсуса, а также подход доказательной медицины для идентификации и оценки данных научных исследований. Сходная смешанная методика использовалась для разработки рекомендаций EULAR по ведению пациентов с гонартрозом (Pendelton A. et al., 2000; Jordan K.M. et al., 2003). Однако в настоящие рекомендации по коксартрозу мы внесли 3 важных методологических изменения.
Во-первых, мы не учитывали качество исследований, поскольку обнаружили, что это не помогает оценить данные научных исследований, так как подсчет баллов качества подвержен привнесению систематической ошибки в результате качества составления сообщений об исследованиях. Например, данные РКИ, опубликованные до принятия соглашения CONSORT (Begg C. et al., 1996), могут иметь более низкий общий балл качества, чем опубликованные позднее. Таким образом, баллы качества не обязательно отражают точность и надежность данных соответствующего исследования, и не могут использоваться для определения весовых коэффициентов результатов клинического исследования. Поэтому для оценки качества данных научных исследований мы использовали только иерархию данных, которая позволяет четко дифференцировать исследования в зависимости от качества использованной в них методологии, а не качества сообщения результатов. Во-вторых, для представления в настоящей работе общей оценки и точности эффектов лечения мы использовали объединенную ВЭ в последнем систематическом обзоре (или, при необходимости, синтезированные данные) и 95% ДИ.
В-третьих, мы оценили эффективность, побочные эффекты и эффективность затрат каждого метода лечения, а не только их эффективность по данным РКИ, и применили 0–100 мм шкалу ВАШ для оценки силы рекомендаций в целях облегчения учета многофакторных аспектов каждого вида лечения.
Из 21 метода лечения, включенного в 10 рекомендаций, 15 подтверждались данными категорий Ia–IV (табл. 101), но 6 из них либо не имели прямых доказательств (парацетамол, глюкозамин и физические упражнения), либо отражали неубедительные преимущества методов лечения (неомыляемые соединения авокадо/сои, диацереин и внутрисуставные инъекции кортикостероидов) при коксартрозе. Напротив эти виды лечения были эффективны и рекомендованы при гонартрозе (Pendelton A. et al., 2000; Jordan K.M. et al., 2003). Необходимо проведение дальнейших исследований по этим видам лечения при коксартрозе, но имеющиеся данные позволяют предположить, что могут быть истинные различия в эффективности методов лечения пациентов с ОА в зависимости от места поражения. Подобные различия подтверждают необходимость предъявляемых регуляторными органами требований получать данные научных исследований о преимуществах методов лечения для каждой локализации ОА в отдельности. Сходные различия, зависящие от локализации поражения при ОА отмечены и относительно факторов риска развития и прогрессирования ОА, а также корреляции между выраженностью боли и структурными изменениями сустава, что отражает гетерогенность патологического процесса при ОА (Felson D.T. et al., 2000).
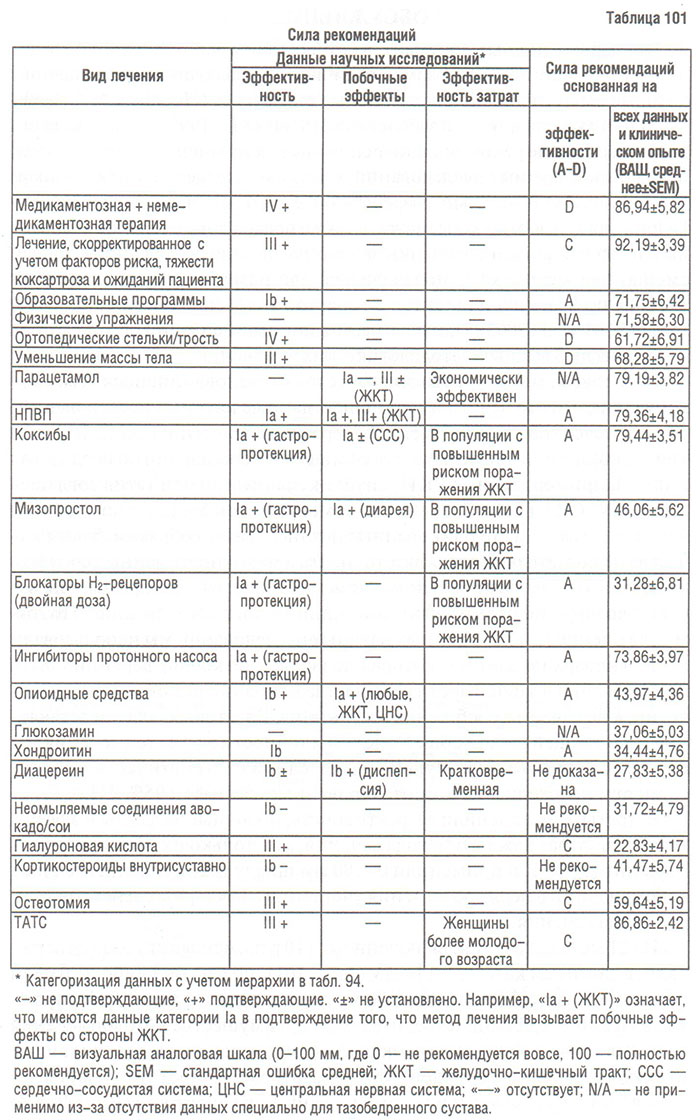
Хотя иерархический подход широко используется для градации качества данных (Shekelle P.G. et al., 1999), его значимость для оценки хирургических методов лечения и побочных эффектов вызывает сомнения (Black N., 1996; 1999). Например, признано, что проведение ТАТС является клинически эффективным лечением при коксартрозе, особенно у пациентов с рефрактерной болью и функциональной недостаточностью, или же при неэффективности традиционного лечения. Однако в связи с этическими и практическими проблемами обеспечения «слепоты» исследований, отсутствуют плацебо-контролируемые или параллельные РКИ нехирургических методов лечения. Данные, свидетельствующие в пользу ТАТС, получены в неконтролируемых или когортных исследованиях, и поэтому относятся к категории III, что не соответствует высокой степени силы рекомендаций в пользу ТАТС, если учитываются все виды данных, а не только данные научных исследований (см. табл. 101). Кроме того, при отсутствии данных, относящихся конкретно к тазобедренному суставу (и, следовательно, отсутствии категорий данных), невозможно применить силу рекомендаций, основанную на иерархии данных. Такие проблемы заставляют сомневаться в способности современных тесно связанных методов проводить категоризацию данных и предоставлять возможность определять силу рекомендации (Black N., 1999).
С целью преодоления этой проблемы мы предприняли так называемое post hoc-исследование, при котором члены комиссии отмечали силу рекомендаций для каждого метода лечения на ВАШ (0–100 мм). В отличие от традиционной ранговой шкалы для силы рекомендаций, ВАШ позволяет учитывать все виды данных научных исследований (эффективность, безопасность и эффективность затрат) и клинический опыт. Еще важнее то, что ВАШ позволяет как уменьшать, так и увеличивать силу рекомендаций, что обеспечивает другую меру оценки, отличную от определения категории данных. Например, сила рекомендаций для НПВП составляет 79%, с учетом высшей категории данных (Ia) по эффективности, тогда как сила рекомендации для тотальной артропластики тазобедренного сустава составляет 86% несмотря на то, что она основана только на III категории данных по эффективности (см. табл. 101).
Имеется несколько ограничений относительно этих рекомендаций. Во-первых, хотя ведение больных с коксартрозом представляло первоочередный интерес при оценке некоторых методов лечения (например, применения парацетамола и упражнений) мы не смогли найти исследований, специально посвященных коксартрозу, или исследований, в которых можно было отдельно выделить данные по коксартрозу. В этом случае мы указывали на отсутствие данных специально по коксартрозу, но учитывали данные смешанных исследований при определении силы рекомендаций. Это может обусловить некоторую неточность, а величину показателей необходимо подтвердить. Во-вторых, данные по ВЭ отобраны из самого последнего систематического обзора с максимальным количеством проанализированных исследований, но который не обязательно является обзором самого высокого качества и наибольшей значимости. Часто требовалось проводить анализ подгрупп, но в большинстве случаев отсутствовали необходимые для этого данные. В-третьих, для оценки эффективности изучали только ВЭ, для оценки исходов относительно выраженности таких симптомов, как боль и функция суставов. Эффективность, не имеющая отношения к этим исходам, непосредственно связанным с пациентом, пока не установлена. Наконец, в имеющейся иерархии данных основное внимание уделено эффективности лечения, тогда как данные по безопасности и эффективности затрат лучше оценивать по дизайну исследований, не относящихся к категории РКИ, поэтому для их оценки требуется использовать специальную систему для определения категории данных. При отсутствии такой специальной системы мы использовали имеющуюся иерархию, но предпочли бы в дальнейшем разработку равноценной системы относительно указанных аспектов лечения.
Таким образом, мы разработали рекомендации по лечению больных коксартрозом, основываясь как на клинической практике, так и на лучших из имеющихся данных научных исследований. Относительно 15 лечебных вмешательств из 21 включенного в 10 главных рекомендаций, имеются данные исследований (категории Ia–IV) подтверждающие целесообразность применения этих вмешательств при коксартрозе, хотя они и варьируют по эффективности, характеру побочных эффектов и эффективности затрат. Относительно 3 методов лечения (парацетамол, глюкозамина сульфат и физические упражнения) отсутствуют данные, относящиеся специально к коксартрозу, а относительно еще 3 (неомыляемые соединения авокадо/сои, диацереин и внутрисуставные инъекции) имеются данные категории I, свидетельствующие либо об отсутствии улучшения относительно уменьшения выраженности симптомов, либо не позволяющие сделать окончательный вывод применительно к пациентам с коксартрозом, даже несмотря на то, что эти методы лечения эффективны при гонартрозе. Очевидно, что необходимо иметь больше данных клинических исследований, относящихся специально к коксартрозу, особенно в связи с тем, что разные методы лечения, по-видимому, имеют различную эффективность в зависимости от места локализации ОА (то есть пораженного сустава). Мы надеемся, что широкое распространение этих рекомендаций и их обсуждение медицинскими работниками будут способствовать углублению наших знаний и повышению интереса к ведению пациентов с коксартрозом и приведут к установлению более высоких стандартов помощи больным коксартрозом.
Фармакоэкономический подход в выборе средств для лечения при остеохондрозе
Фармакоэкономика (Pharmacoeconomics) — наука, целью которой является экономическая оценка эффективности затрат и результатов, связанных с применением лекарственных средств. В странах Западной Европы она развивается с 60–70-х годов XX в.
Предметом исследования фармакоэкономики служат:
1) результаты фармакотерапии, при возможности проведение сравнительного анализа хотя бы двух разных схем лечения (технологий),
2) безопасность и эффективность новых лекарственных средств (ЛС),
3) экономические затраты на проведение фармакотерапии и диагностики,
4) фармакоэпидемиологическая статистика, которая отражает соотношение между экспозицией ЛС и его показателем польза/риск во время лечения определенного заболевания в конкретной популяции после внедрения препарата на рынок,
5) данные рандомизированных клинических испытаний ЛС в группе больных (популяции),
6) данные фармацевтического обеспечения больных, анализ потребления и прогнозирование потребности в ЛС,
7) потребность в препаратах (рассчитывают в абсолютных и относительных, а также в экономических показателях).
Объектами изучения фармакоэкономики являются:
- Затраты (в стоимостных показателях) на эффективную фармакотерапию при различных технологиях, причем одна из технологий связана с фармакотерапией, а другая может включать дополнительные лечебные мероприятия;
- Эффективность фармакотерапии, выраженная в биологических параметрах здоровья (например, изменение уровня гликемии у больных сахарным диабетом, уровня липидемии, продление жизни);
- Эффективность схем лечения (определяется с помощью фармакоэпидемиологических исследований, при наблюдении фиксируют как показатели эффективности действия препарата, так и все наблюдаемые побочные эффекты в популяции).
Привлекательность каждого ЛС определяется по фармакологическим и экономическим критериям. К первому относятся эффективность — способность устранять проявления заболевания, и безопасность — свойство не вызывать побочных явлений со стороны других органов и систем. Из соотношения этих двух свойств выводится общий показатель — фармакотерапевтическая эффективность препарата.
Экономический, количественный, критерий — стоимость ЛС, которая зависит не только и не столько от коммерческого интереса производителя ЛС, сколько от высокого спроса на определенную группу препаратов в связи с распространенностью заболевания, являющегося показанием для его применения. Чтобы достичь сочетания высокого терапевтического эффекта и высокой степени безопасности ЛС, необходимы существенные финансовые затраты, и все они обязательно закладываются в стоимость препарата. Клинические и инструментальные методы установления патогенеза заболевания; фундаментальные изыскания, направленные на определение концепции биологического действия; изобретение химической структуры препарата; разработка биодоступной лекарственной формы; апробация на животных; внедрение в производство и собственно производственный процесс; клинические испытания; информационная поддержка препарата, выписывание рецептов врачами и правильное применение ЛС пациентами — большая часть всей этой сложной, дорогостоящей и чрезвычайно ответственной работы ложится на плечи фармацевтических производителей. И они имеют законные права на получение финансовой прибыли от своей деятельности.
Показатели эффективности, безопасности и стоимости лечения — три кита, на которых зиждется фармакоэкономика. В высокоразвитых странах эта наука давно завоевала прочные позиции, результаты фармакоэкономических исследований играют ключевую роль в регулировании взаимоотношений между производителями ЛС, их потребителями — пациентами, и органами общественного здравоохранения (Заліська О.М., 2002).
Общая структура экономических затрат на заболевание разделяется на прямые, непрямые и дополнительные.
1. Прямые затраты включают:
- Затраты на диагностику заболевания.
- Стоимость ЛС, необходимых на курс лечения.
- Стоимость лабораторных исследований.
- Затраты на устранение побочных эффектов ЛС.
- Стоимость койко-дня.
- Зарплата медицинских работников.
- Затраты на доставку ЛС, питание больного.
- Затраты на выплату помощи в связи с нетрудоспособностью (из фондов социального страхования).
2. Косвенные или непрямые медицинские затраты, связанные с экономическим ущербом от сокращения времени занятости больного, его преждевременной смерти. Это затраты, связанные с невозможностью гражданина в период болезни быть полезным обществу, участвовать в производственном процессе.
3. Дополнительные нематериальные затраты, связанные с заболеванием, обусловлены психоэмоциональными переживаниями пациента и ухудшением качества его жизни (по этим причинам они с трудом поддаются количественной оценке).
В табл. 102 представлены данные исследования затрат на заболевания опорно-двигательного аппарата в США (Yelin E., Callahan L., 1995).

Экономические затраты на ОА представляют особый интерес в связи с высокой медико-социальной и экономической нагрузкой на общество, обусловленной этим заболеванием (наряду с РА).
В последние годы отмечен интенсивный рост фармакоэкономических исследований, что связано с рядом причин, к числу которых относятся: рост расходов на здравоохранение, необходимость решения проблемы лечения ряда заболеваний (ВИЧ, онкологические заболевания), появление новых технологий, улучшение качества жизни, повышение продолжительности жизни, а также насущная необходимость анализа соотношения стоимость/эффективность.
Основными для фармакоэкономики являются следующие методы фармакоэкономического анализа:
1. «Стоимость—эффективность» (cost-effectiveness analysis — СЕА) — оценивают изменения любого параметра, изменяющегося при патофизиологическом состоянии, например: показатели артериального давления, а также снижение финансовых затрат.
2. «Стоимость—выгода» (cost-benefit analysis — CBA) — экономический анализ выгодности затрат, при котором пользу, получаемую от применения конкретного ЛС, выражают в денежной форме через затраты, если прямая экономия средств не сразу очевидна.
3. «Стоимость—полезность» (cost-utility analysis — СUA) — анализ, при котором эффекты выражают через их полезность для потребителя, и оценивают затраты на некоторое дополнительное увеличение продолжительности жизни (например, затраты на дополнительный год полноценной жизни) или другого показателя, имеющего ценность для пациента.
4. «Минимизация стоимости» (cost-minimization) — оценка уменьшения финансовых затрат на лечение.
5. Анализ соотношения между экономическими затратами на лечение и качеством жизни пациента, которое оценивают по показателю дополнительного количества лет стандартного качества жизни (индекс QALY — Quality Adjusted Life Years).
Фармакоэкономические оценки могут использоваться, в частности, для принятия решений о конкретных технологиях (стандартах) лечения, регистрации и закупки ЛС, формирования цен, в оценке результатов клинических испытаний и т.д. Так, нередко полный курс лечения более дорогостоящим препаратом обходится пациенту значительно дешевле, чем при использовании недорогого лекарственного средства, за счет быстрого и стойкого проявления терапевтического эффекта и сокращения сроков госпитализации, поскольку стоимость лекарств составляет всего 10–20% суммы общих госпитальных расходов.
Проведение экспертных оценок препаратов включает оценку следующих параметров:
- Непосредственные клинические эффекты.
- Частота развития осложнений.
- Сохраненные годы жизни.
- Частота инвалидизации по данным ВТЭК о нетрудоспособности.
- Изменение качества жизни.
- Сохраненные годы «качественной» жизни.
- Удовлетворение ожиданий или предпочтений пациента (40% считается нормой).
- Социально-демографические показатели.
- Бюджетные издержки.
Полученные результаты интерпретируются в расчеты, служащие основанием для разработки перечня жизненно важных ЛС и национального руководства для врачей по применению лекарств, составления протоколов ведения больных, разработки формуляров ЛС, составления формулярных списков.
Примером фармакоэкономического исследования может служить проведенная в Великобритании экономическая оценка мелоксикама в сравнении с диклофенаком, пироксикамом и рофекоксибом, на основе чего были смоделированы терапевтические стратегии в лечении при ОА (Tavakoli M., Malek M., 2000). Анализ стоимости/эффективности двух традиционных и наиболее часто назначаемых НПВП (диклофенак с модифицированным высвобождением и пироксикам) и двух новых ингибиторов ЦОГ-2 (мелоксикам и рофекоксиб), а также оценка влияния этих препаратов на бюджет национальной системы здравоохранения Великобритании показывает следующее.
Основаниями для проведения исследования были следующие предпосылки:
- мировой рынок НПВП для лечения при ОА и РА составляет 12,1 млрд долл.;
- ревматические заболевания являются одной из наиболее частых причин обращения к врачам общей практики и поражают в мире одного человека из десяти;
- в 1998 г. было выписано 33 млн рецептов на сумму 254 млн фунтов стерлингов по поводу заболеваний опорно-двигательного аппарата;
- в 1997 г. сумма общих затрат на артриты (сумма прямых и непрямых затрат) составила 733 млн фунтов стерлингов;
- ОА является важнейшей причиной инвалидизации, занимает второе место после сердечно-сосудистых заболеваний как причина тяжелой инвалидности;
- на 250 000 жителей Великобритании ежегодно диагностируется 500–600 новых случаев ОА;
- распространенность ОА повышается с 2% у женщин — до 45 лет до 30% в возрасте 45–64 лет и до 68% — старше 65 лет;
- у мужчин эти цифры составляют 3, 25 и 58% соответственно;
- установлено, что около 50% всех выписанных НПВП предназначены для лечения боли вследствие ОА, 15% — по поводу РА; мелоксикам поступил на рынок Великобритании в 1996 г.;
- в исследованиях in vitro и экспериментальных фармакологических исследованиях установлено, что мелоксикам является селективным ингибитором ЦОГ-2;
- мелоксикам вызывает меньшее количество побочных эффектов со стороны пищеварительного тракта по сравнению с такими традиционными НПВП, как диклофенак;
- эффективность мелоксикама и рофекоксиба эквивалентна эффективности традиционных НПВП;
- применение НПВП сопряжено с побочными эффектами, которые варьируют от диспепсии легкой степени выраженности до ульцерогенного эффекта и его осложнений в виде перфорации и кровотечения, а также с осложнениями со стороны почек, печени и сердечно-сосудистой системы у пациентов группы риска.
Поскольку данные о четырех НПВП не могли быть собраны за один и тот же период времени, были исследованы 2 периода испытаний — 4 нед и 6 мес.
4-недельный период испытания. Данные по мелоксикаму, диклофенаку и пироксикаму (частота побочных эффектов и продолжительность госпитализации за 4-недельный период) базировались на результатах 2 широкомасштабных двойных слепых рандомизированных с участием параллельных групп клинических исследований MELISSA и SELECT (сравнивали мелоксикам в дозе 7,5 мг с неселективными НПВП диклофенаком MR — 100 мг и пироксикамом — 20 мг). Оба испытания отражали анализ назначения НПВП. В исследовании MELISSA 4635 больных получали мелоксикам и 4688 — диклофенак, в исследовании SELECT 4320 получали мелоксикам и 4336 — пироксикам. Включенные в испытания пациенты были в возрасте старше 18 лет, у них диагностировали ОА с преимущественным поражением тазобедренных, коленных суставов, суставов верхних конечностей и позвоночника в фазе обострения.
6-месячный период испытания. Сопоставимые данные по рофекоксибу были собраны за 6-месячный период. Данные по рофекоксибу и диклофенаку были получены из отчета медицинских советников FDA (испытание 069, n=2812). Данные за 6 мес по мелоксикаму основывались на результатах 2 двойных слепых исследованиях с применением препарата в дозе 7,5 мг (n=169) и в дозе 15 мг (n=306). Следует иметь в виду, что отчет FDA содержал только данные о побочных эффектах со стороны пищеварительного тракта, в то время как два клинических испытания по мелоксикаму — данные обо всех неблагоприятных побочных эффектах (табл. 103).

Для моделирования стоимости лечения каждым НПВП (табл. 104) была использована модель, называемая также «деревом принятия решений», с учетом следующих факторов:
1. Факторы риска развития побочных эффектов со стороны пищеварительного тракта включают возраст, наличие пептической язвы в анамнезе, сопутствующее применение ГКС и антикоагулянтов.
2. У около 25% лиц, принимающих НПВП, выявлены эндоскопически подтвержденные язвы.
3. Хотя серьезные побочные эффекты (язва, кровотечение, перфорация) встречаются относительно редко, они могут быть причиной смерти.
4. Ежегодно в США НПВП-индуцированные гастропатии являются поводом для более чем 70 000 случаев госпитализации и причиной более 7000 случаев смерти.

Хотя частота возникновения кровотечений, язв и перфораций невысокая, обусловленные ими расходы могут быть значительными (лапароскопия — 848–1200 фунтов стерлингов, эндоскопия — 139–200 фунтов стерлингов, госпитализация в отделение интенсивной терапии — 910–2500 фунтов стерлингов).
В табл. 105 приведены результаты анализа, направленного на решение вопроса минимизации стоимости лечения больных с ОА на протяжении 28 дней (в ценах 1998 г.).

Данные, представленные в табл. 104 и 105, свидетельствуют, что лечение мелоксикамом требует меньших затрат в расчете на одного пациента по сравнению с терапией диклофенаком и пироксикамом, причем средняя экономия средств при использовании мелоксикама на одного больного за 4 нед составила 5 фунтов стерлингов по сравнению с использованием пироксикама и 21 фунт стерлингов — диклофенака. Результаты 6-месячных исследований показали, что стоимость лечения мелоксикамом ниже (146 фунтов стерлингов) по сравнению с рофекоксибом (166 фунтов стерлингов), что приводит к экономии 3,33 фунта стерлингов на одного больного в месяц. С учетом ежегодного потребления (количество выписанных рецептов) мелоксикама, диклофенака и пироксикама (табл. 106) общая экономия средств при использовании мелоксикама составляет более чем 25 млн фунтов стерлингов в год.

Группа канадских ученых сопоставила стоимость и клинические результаты лечения больных ревматологического профиля с применением целекоксиба, а также НПВП в сочетании с гастропротекторными препаратами (ГПП) (Burke T.A. et al., 2001). Рассматривались такие альтернативные фармакотерапевтические режимы: монотерапия НПВП, монотерапия целекоксибом, комбинированная терапия НПВП + антагонист Н2-гистаминовых рецепторов (АН2) НПВП + ингибитор протонного насоса (ИПН). Сводные результаты вероятности развития побочных эффектов со стороны верхних отделов желудочно-кишечного тракта при проведении лечения по этим схемам представлены в табл. 107.

Построение аналитической модели оценки «стоимость/эффективность» позволяет сопоставить среднюю стоимость разных схем 6-месячного курса лечения одного больного с учетом стоимости ЛС и подсчитанной стоимости устранения побочных эффектов со стороны верхних отделов желудочно-кишечного тракта (табл. 108). Использовали рекомендованные суточные дозы: целекоксиб — 200 мг, НПВП (диклофенак) — 150 мг, ранитидин — 300 мг, омепразол — 40 мг.

В аналитической модели максимально учтены риск возникновения побочных эффектов со стороны верхних отделов желудочно-кишечного тракта и стоимость препаратов, используемых в альтернативных схемах лечения. Результаты анализа свидетельствуют о том, что для монотерапии НПВП характерны самая низкая средняя стоимость и наиболее высокая вероятность ульцерогенеза. Стоимость терапии целекоксибом несущественно отличалась от стоимости лечения НПВП, в то же время вероятность ульцерогенеза была в 3,6 раза ниже (28%). Если стоимость лечения целекоксибом принять за 1, то стоимость монотерапии НПВП составила 0,96, комбинации НПВП + АН2 — 1,51, а НПВП + ИПН — 2,68. Таким образом, использование монотерапии целекоксибом снижает затраты на 34–168% по сравнению с применением комбинированной терапии НПВП + ГПП.
Обобщенный анализ результатов, полученных североамериканскими учеными, свидетельствует, что до 80% больных ревматологического профиля, принимавших участие в исследовании, могли получать терапию целекоксибом без увеличения бюджетных расходов местных органов здравоохранения, в то же время подвергаясь значительно более низкому риску развития побочных эффектов со стороны верхних отделов желудочно-кишечного тракта.
Экстраполяция результатов исследования, проведенного западными учеными, применительно к ситуации в Украине имеет два наиболее существенных ограничения. Во-первых, принимая во внимание зачаточный уровень развития страховой медицины в нашей стране, не представляется возможным с надлежащей степенью точности определить затраты, связанные с устранением различных побочных эффектов. Во-вторых, сегодня в Украине не представлены оригинальные ГПП — ранитидин (Зантак) и омепразол (Лосек).
Остается, однако, возможность сравнить стоимость прямых затрат на проведение монотерапии Целебрексом и монотерапии НПВП. Для исследования на украинском фармацевтическом рынке выбран оригинальный препарат диклофенака Вольтарен (таблетки, покрытые оболочкой, по 50 мг) производства компании «Новартис». В качестве показателя безопасности допустимо принять частоту ульцерогенеза, определенную R. Zabinski, A. Burke и соавторами (2001).
Исходя из данных, представленных в табл. 109, монотерапия Целебрексом по стоимости незначительно (на 5,6%) превышает таковую монотерапии диклофенаком, но при этом позволяет снизить частоту развития побочных эффектов со стороны верхних отделов желудочно-кишечного тракта почти в 3,6 раза. Средневзвешенные розничные цены ЛС в Украине представлены по данным системы исследований рынка «Фармстандарт» компании «МОРИОН» за июль 2004 г.

В начале главы уже упоминалось о терапевтической эквивалентности ЛС. Необходимо отметить, что использование в стандартных схемах лечения генерических препаратов допустимо лишь при соблюдении ряда условий, прежде всего при наличии достоверных данных о биоэквивалентности и терапевтической эквивалентности генерических копий оригинальных препаратов.
В данном исследовании с Целебрексом сравнивали оригинальный препарат Вольтарен, поскольку при использовании для сравнения любой генерической копии диклофенака возможность экстраполировать данные о безопасности (вероятность ульцерогенеза), полученные североамериканскими учеными, была бы исключена. Впрочем, включение в схемы лечения при ОА и РА генерических копий препаратов диклофенака, ранитидина и омепразола может стать предметом отдельного исследования.
Приведенные результаты научных исследований свидетельствуют о том, что в арсенале отечественных ревматологов есть высокоэффективное противовоспалительное и анальгетическое средство с высоким профилем безопасности — препарат Целебрекс. Его применение не только способствует выраженному снижению частоты возникновения побочных явлений противоревматической терапии, но и позволяет избежать существенных дополнительных финансовых затрат на их лечение (Залиская З.О., Снегирев Ф., 2002).
Таким образом, представленные данные по фармакоэкономике на примере ОА свидетельствуют о необходимости внедрения этой практики в Украине. Предварительный анализ отношения к этой проблеме врачей-ревматологов свидетельствует о недостаточной оценке значения фармакоэкономики в их практической деятельности. По результатам опроса, проведенного на занятиях школы ревматологов (май 2002 г., Киев), 34% врачей впервые слышат доклад по фармакоэкономике, 97% опрошенных используют фармакоэкономический подход при выборе ЛС применительно к финансовым возможностям пациента и считают необходимым внедрение в Украине известного в мировой практике опыта. Однако 53% считают, что фармакоэкономика не должна учитываться в практической деятельности врача-ревматолога. Дальнейшее формирование мировоззрения врача в вопросах рационального применения ЛС должно иметь системный подход, который включает как административные, так и образовательные мероприятия, начиная с учреждений МЗ и АМН Украины и заканчивая практическими врачами. Безусловно, такая работа должна проводиться с учетом интересов пациентов.