Каковы очевидные цели лечения подагры в реальной врачебной практике?
- Быстрое уменьшение выраженности острого приступа.
- Профилактика рецидивов подагрических приступов.
- Профилактика либо замедление скорости развития заболевания и его осложнений.
- Профилактика либо устранение факторов, ассоциированных с подагрой и ухудшающих ее течение (ожирение, метаболический синдром, артериальная гипертензия, сердечная недостаточность, хроническая почечная недостаточность, гипертриглицеридемия, диетическая коррекция нежелательных пищевых предпочтений и др.).
Лечебная тактика при подагре основывается на немедикаментозных и медикаментозных принципах оказания медицинской помощи пациенту.
Какова роль пациента в лечебном процессе?
Согласно общепринятому мнению экспертов пациент занимает ведущее место в лечебном процессе и только его осознанное взаимодействие с врачом и приверженность к рекомендациям определяет клиническую эффективность лечебных мероприятий. Именно поэтому специальные образовательные программы для пациентов с подагрой и членов их семей включают следующие элементы специальной подготовки:
- обучение изменению образа жизни, диетическому режиму, исключению алкоголя, уменьшению массы тела при ожирении, отказу от курения, регулярному контролю уровня мочевой кислоты в крови;
- информирование о симптоматике острого подагрического артрита, обострении хронической подагрической артропатии и последствиях неконтролируемой гиперурикемии;
- обучение быстрому купированию подагрической суставной атаки (всегда иметь таблетку в кармане — нестероидные противовоспалительные препараты); отказ от анальгетиков);
- информирование о назначаемых лекарственных средствах (дозировки, побочные эффекты, взаимодействие с другими препаратами, назначаемыми по поводу сопутствующих заболеваний).
Какова современная стратегия медицинской помощи пациенту с подагрой?
С момента выхода в свет первых клинических рекомендаций по ведению подагры экспертов Европейской антиревматической лиги в 2006 г. на мировом фармацевтическом рынке появились новые препараты. В 2016 г. были опубликованы обновленные Рекомендации Европейской антиревматической лиги по лечению подагры (Richette P., Doherty M., Pascual E. et al., 2016 updated European League Against Rheumatism evidence-based recommendations for the management of gout. Ann Rheum Dis, 2016). В создании рекомендаций приняли участие 15 ревматологов, 1 радиолог, 2 врача общей практики, 1 стипендиат, занимающийся научной работой, 2 больных подагрой и 3 эпидемиолога из 12 стран Европы.
Основные принципы терапии подагры согласно обновленным рекомендациям Европейской антиревматической лиги 2016:
А. Каждый пациент с подагрой должен быть полностью информирован о патофизиологии заболевания, наличии эффективных методов лечения, коморбидных заболеваниях, принципах терапии острого приступа артрита и элиминации кристаллов уратов путем пожизненного снижения сывороточного уровня мочевой кислоты ниже целевого уровня.
- Несмотря на то что подагра считается излечимым заболеванием, терапия этой патологии для большинства пациентов пока еще не является оптимальной. В недавно опубликованных исследованиях было доказано, что менее 50% больных подагрой получают уратснижающую терапию, а при ее назначении в большинстве случаев применяют дозы, недостаточные для эффективного снижения уровня мочевой кислоты до целевых значений. С момента публикации последних рекомендаций в 2006 г. выявлены препятствия для эффективного лечения подагры, отмечена значимость недостатка знаний о сущности заболевания, подчеркнуто значение последующего несоблюдения терапевтических рекомендаций. В одном обсервационном исследовании установлен факт более высокого комплаенса к уратснижающей терапии хорошо обученных пациентов, что сопровождалось повышением (на 92%) эффективности лечения в течение 12 мес.
B. Каждый пациент с подагрой должен получать рекомендации относительно образа жизни: уменьшение массы тела при необходимости, отказ от употребления алкоголя (особенно пива и крепких алкогольных напитков) и подслащенных напитков, исключение переедания, чрезмерного потребления мяса и морепродуктов. Следует поощрять потребление обезжиренных молочных продуктов. Необходимо рекомендовать регулярные физические упражнения.
- С момента публикации последних рекомендаций во многих исследованиях было доказано, что снижение массы тела, достигнутое посредством соблюдения диеты или бариатрического вмешательства, является эффективным способом уменьшения содержания мочевой кислоты. Регулярная физическая нагрузка может снизить высокий уровень смертности, ассоциированный с хронической гиперурикемией.
- Доказана взаимосвязь между употреблением мяса, алкоголя и повышением риска развития подагры и острой подагрической атаки.
- Модифицируемые факторы риска, в том числе употребление сладких напитков, апельсинового и яблочного сока, пищи, богатой фруктозой, были описаны еще в 2006 г. В соответствии с данными эпидемиологических исследований существует обратная корреляция между употреблением кофе, вишни и развитием подагры; вишня может снизить частоту развития острых подагрических атак. В ряде исследований зафиксирована аналогичная взаимосвязь между приверженностью к молочным продуктам, особенно обезжиренному молоку и низкокалорийному йогурту, и уровнем урикемии.
С. Каждый пациент с подагрой должен быть систематически скринирован для выявления коморбидных заболеваний и факторов риска развития сердечно-сосудистых заболеваний, включая почечную недостаточность, ишемическую болезнь сердца, сердечную недостаточность, инсульт, атеросклероз периферических артерий, ожирение, гиперлипидемию, артериальную гипертензию, сахарный диабет и курение, профилактика и терапия которых должны рассматриваться как неотъемлемая часть лечения подагры.
- Важность скрининга и лечения артериальной гипертензии, гипергликемии и ожирения у пациентов с подагрой была подчеркнута в предыдущих рекомендациях. С тех пор во многих исследованиях было показано, что гиперурикемия и подагра ассоциированы с хроническим заболеванием почек. В одном популяционном американском исследовании определена распространенность хронических заболеваний почек (≥2 стадии) у пациентов с высоким уровнем урикемии ≥10 мг/дл (549,9 мкмоль/л) и больных подагрой: она составила 86 и 53% соответственно. Хроническое заболевание почек может являться основным фактором риска развития подагры, а подагра — причиной возникновения ренальной дисфункции. Следует рассчитывать скорость клубочковой фильтрации при установлении диагноза подагры в соответствии с классификацией хронических заболеваний почек и регулярно контролировать этот показатель одновременно с измерением уровня мочевой кислоты. Этот пункт также подчеркивает необходимость диагностики других значимых сопутствующих заболеваний, особенно ишемической болезни сердца, сердечной недостаточности, инсульта, заболеваний периферических артерий, сахарного диабета, так как широкомасштабные эпидемиологические исследования доказали, что гиперурикемия и/или подагра — независимые факторы риска развития указанных заболеваний и летального исхода, обусловленного кардиоваскулярными нарушениями.
Какие новые актуальные акценты для врачей по ведению больных подагрой в клинической практике?
11 основных тезисов по ведению больных подагрой (European League Against Rheumatism, 2016), предполагающих базисную квалификационную подготовку врача в области диагностики и лечения гиперурикемии и/или подагры:
1. Лечение во время острых приступов подагры должно быть назначено как можно раньше. Необходимо обучать пациентов распознавать обострение заболевания и самостоятельно принимать препараты. Выбор терапии должен быть основан на предыдущем положительном опыте, на наличии противопоказаний, числе и типе пораженных суставов, времени от начала острого приступа заболевания.
2. Терапией первой линии является назначение колхицина (в течение первых 12 ч) в нагрузочной дозе 1 мг, с последующим приемом 0,5 мг через 1 ч в первый день, и/или нестероидный противовоспалительный препарат (в комбинации с ингибитором протонной помпы, если необходимо), орального кортикостероида (30–35 мг/сут, эквивалентных преднизолону, в течение 3–5 дней) или внутрисуставная аспирация с инъекцией стероида.
Колхицин и нестероидный противовоспалительный препарат не должны назначаться больным с тяжелой почечной недостаточностью. Колхицин также противопоказан больным, получающим ингибиторы Р-гликопротеина и ингибиторы CYP 3A4 (например циклоспорин, кларитромицин).
3. У пациентов с частыми обострениями подагры и противопоказаниями к колхицину, препаратами выбора должны быть нестероидные противовоспалительные препараты, стероиды (орально и в виде инъекций), блокаторы интерлейкина-1.
4. Профилактическая терапия показана в первые 6 мес уратснижающего лечения. С этой целью применяют колхицин в дозе 0,5–1 мг/сут (снижение дозы необходимо больным со снижением функции почек). Альтернативой колхицину являются нестероидные противовоспалительные препараты в низкой дозе.
5. Использование уратснижающей терапии должно обсуждаться с каждым пациентом. Такое лечение показано всем лицам с ≥2 обострениями заболевания в год, имеющими тофусы, уратную артропатию и/или камни в почках. Начинать лечение рекомендовано сразу после установления диагноза подагры у больных в возрасте младше 40 лет или с концентрацией мочевой кислоты >8 мг/дл (480 мкмоль/л) и/или имеющих сопутствующие заболевания (почечная недостаточность, артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность).
6. Начальным таргетным уровнем мочевой кислоты следует считать <6 мг/дл (360 мкмоль/л), у пациентов с тофусами, частыми обострениями, хронической артропатией необходимо стремиться к сывороточной концентрации <5 мг/дл (300 мкмоль/л).
7. Уратснижающую терапию следует начинать с низких доз с последующим титрованием.
8. У больных с нормальной функцией почек аллопуринол рекомендован как препарат первой линии. Стартовая доза — 100 мг/сут, с дальнейшим повышением на 100 мг каждые 2–4 нед. Если не удается достичь таргетного уровня мочевой кислоты, необходимо перейти с аллопуринола на фебуксостат или урокозурики (пробенецид или бензбромарон). С этих препаратов можно начинать терапию, если отмечается непереносимость аллопуринола.
9. У больных с почечной недостаточностью титрование дозы аллопуринола нужно проводить под контролем клиренса креатинина.
10. У пациентов с тяжелым микрокристаллическим артритом, сопровождающимся развитием тофусов и низким качеством жизни, при невозможности достижения требуемого уровня мочевой кислоты показано назначение пеглотиказы.
11. В случае развития подагры у лиц, находящихся на терапии петлевыми или тиазидными диуретиками, при возможности нужно произвести замену мочегонного препарата. Больным подагрой с артериальной гипертензией следует назначать лозартан или блокаторы кальциевых каналов, пациентам с гиперлипидемией — статины или фенофибрат.
Несмотря на большое количество международных и национальных рекомендаций по лечению подагры, внедрение в практику новых противоподагрических препаратов, реальная врачебная практика свидетельствует о том, что количество больных хронической тофусной подагрой не уменьшается и лишь их меньшая часть получает эффективную помощь.
Какие клинические вопросы волнуют врачей в международной клинической практике по данным международной программы «3e-инициатива» (Evidence, Expertise, Exchange, 2013)?
Небезынтересным фактом является общность клинических вопросов в международном информационном поле, волнующих практикующих врачей. Именно в п. 3 документа «3е-инициативы» (2013) представлены ответы на наиболее значимые вопросы, касающиеся лечения, в свете данных доказательной медицины (первые 2 пункта рассмотрены в разделе диагностики).
3. Какова роль глюкокортикоидов, колхицина и нестероидных противовоспалительных препаратов, ингибиторов интерлейкина 1 и парацетамола в лечении острой подагры?
- При остром приступе подагры следует назначать низкие дозы колхицина (до 2 мг/сут), нестероидных противовоспалительных препаратов и/или глюкокортикоидов (внутрисуставно, перорально или внутримышечно в зависимости от сопутствующих заболеваний и риска развития неблагоприятных реакций). Уровень доказательности — 1b.
4. Какие изменения образа жизни (например диета, ограничение потребления алкоголя, уменьшение массы тела, отказ от курения и/или занятия лечебной физкультурой) являются эффективными для лечения и профилактики подагры?
- Пациентам следует рекомендовать здоровый образ жизни, включая снижение избыточной массы тела, регулярное выполнение физических упражнений, отказ от курения, отказ от излишнего приема алкоголя и подслащенных сахаром напитков. Уровень доказательности — 5.
5. Каковы эффективность, соотношение стоимость/эффективность и безопасность уратснижающих препаратов (аллопуринола, фебуксостата, пегуриказы, бензбромарона и пробенецида) в лечении подагры? Какую последовательность или комбинацию уратснижающих препаратов рекомендовать?
- Аллопуринол должен быть препаратом первой линии уратснижающей терапии; в качестве альтернативы могут использоваться урикозурики (например бензбромарон, пробенецид) или фебуксостат; уриказа в качестве монотерапии должна рассматриваться только у больных с тяжелой подагрой, у которых все другие формы терапии неэффективны или противопоказаны. Уровень доказательности — 2b.
6. Какое лечение является наилучшим для предотвращения острого приступа при проведении уратснижающей терапии и как оно должно проводиться? Каково оптимальное время начала уратснижающей терапии после острого приступа подагры?
- Когда назначается уратснижающая терапия, пациент должен быть проинструктирован о возможном риске обострений артрита и их терапии. Профилактика должна проводиться при помощи колхицина (до 1,2 мг/сут), а при наличии противопоказаний для его назначения или плохой переносимости могут быть использованы нестероидные противовоспалительные препараты или низкие дозы глюкокортикоидов. Продолжительность профилактики зависит от индивидуальных особенностей пациента. Уровень доказательности — 5.
7. Как сопутствующие заболевания (например метаболический синдром, кардиоваскулярные, желудочно-кишечные заболевания, гастроинтестинальные болезни и почечная недостаточность) влияют на выбор при подагре конкретных препаратов (например колхицина, аллопуринола и других уратснижающих средств) при остром приступе артрита, хронической подагре и для профилактики острого приступа артрита?
- У пациентов с легкой и умеренной почечной недостаточностью аллопуринол может быть использован при тщательном мониторинге неблагоприятных реакций с назначения низкой начальной дозы (50–100 мг) и титрованием до достижения целевого сывороточного уровня мочевой кислоты. Фебуксостат и бензбромарон — альтернативные препараты, которые могут быть использованы без регулирования дозы. Уровень доказательности — 4.
8. Какой должна быть цель лечения и как должны пациенты с подагрой наблюдаться в динамике (например сообщенный пациентом результат (исход), клинические, биохимические данные и/или методы визуализации)?
- Цель лечения — сывороточный уровень мочевой кислоты — ниже 360 мкмоль/л (6 мг/дл) и, в конечном счете, отсутствие атак подагрического артрита и рассасывание тофусов; мониторинг должен включать контроль сывороточного уровня мочевой кислоты, частоты приступов артрита и размеров тофусов. Уровень доказательности — 2b.
9. Как следует справляться с тофусами?
- Для устранения тофусов следует обеспечить устойчивый сывороточный уровень мочевой кислоты, предпочтительно ниже 300 мкмоль/л (5 мг/дл); оперативное лечение требуется лишь в отдельных случаях (например при компрессии нервов или других мягких тканей, а также при развитии инфекции). Уровень доказательности — 2b.
- Чем ниже уровень мочевой кислоты, тем выше скорость, с которой тофусы уменьшаются в размерах, что указывает на необходимость более низкого целевого уровня мочевой кислоты при наличии тофусов. Каких-либо серьезных исследований, посвященных хирургическому лечению тофусов, нет, и с мнением экспертов трудно не согласиться. Кроме того, при хирургическом удалении тофусов часто развиваются осложнения в виде плохо заживающих свищевых ходов, а также некротических изменений в области наложенных швов.
10. Можем ли мы предотвратить подагрический артрит, поражение почек и сердечно-сосудистые события, снижая сывороточный уровень мочевой кислоты у пациентов с бессимптомной гиперурикемией? Если да, то какими должны быть целевые уровни мочевой кислоты?
- Фармакологическое лечение бессимптомной гиперурикемии для профилактики подагры, заболеваний почек или кардиоваскулярных событий не рекомендуется. Уровень доказательности — 2b.
Каков обобщенный алгоритм лечения подагры?
В реальной клинической практике актуальным является алгоритм лечения подагры, основанный на уточнении типа гиперурикемии (рис. 30).

Рис. 30. Алгоритм лечения подагры (адаптировано по Яременко О.Б., Микитенко А.М., 2013)
Каковы современные возможности контроля подагры?
Основа современной стратегии лечения подагры — достижение уровня мочевой кислоты в сыворотке крови <6,0 мг/дл (360 мкмоль/л), и чем ниже уровень, тем лучше результаты (уменьшение количества атак, размеров и количества тофусов). Очевидно, что добиться такого результата без диетических рекомендаций и применения уратснижающей терапии в большинстве случаев невозможно. Именно поэтому такая терапия должна быть рассмотрена и обсуждена с каждым пациентом c установленным диагнозом подагры после первых проявлений заболевания (рис. 31).
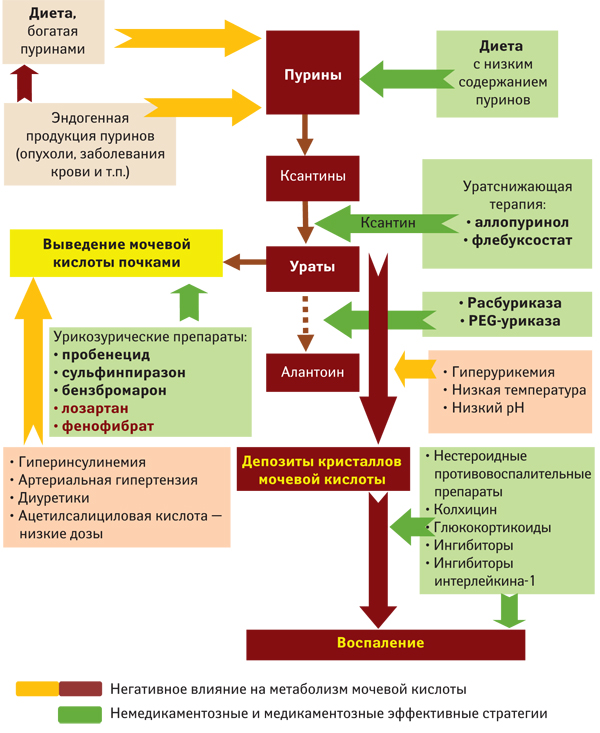
Рис. 31. Патогенетические механизмы подагры и терапевтические стратегии (адаптировано по American College of Rheumatology, 2012)
Такая таргетная стратегия уратснижающей терапии снижает частоту приступов артрита, а в случае растворения кристаллов мочевой кислоты, в том числе тофусных отложений, при сохраняющейся нормоурикемии (целевом уровне мочевой кислоты сыворотки крови) — предотвращает возможность возникновения новых приступов, улучшает качество жизни, уменьшает негативное влияние гиперурикемии на риск развития сердечно-сосудистых заболеваний, функцию почек и смертность. Недавно было проведено международное многоцентровое исследование, одной из целей которого было установление критериев оценки пациентом результатов терапии подагры. Оказалось, что главное реальное пожелание пациентов с подагрой, соответствующее «удовлетворительному контролю над заболеванием», — отсутствие или наличие не более одного приступа артрита в год. И только комплаенс врача и больного, основанный на доверии, взаимопонимании, информированности и взаимодействии, способен обеспечить приверженность к лечению и полный эффективный контроль заболевания.
Какова тактика ведения пациента с подагрой?
Весьма удачной и актуальной является тактическая формула, предложенная M.A. Becker (2010): «Подагра — как спички»: нестероидные противовоспалительные препараты — гасят огонь, колхицин (профилактически) — держит спички мокрыми, ингибиторы ксантиноксидазы — удаляют спички». Понимание сценария течения подагры определяет современную врачебную тактику и ее эффективность (рис. 32).
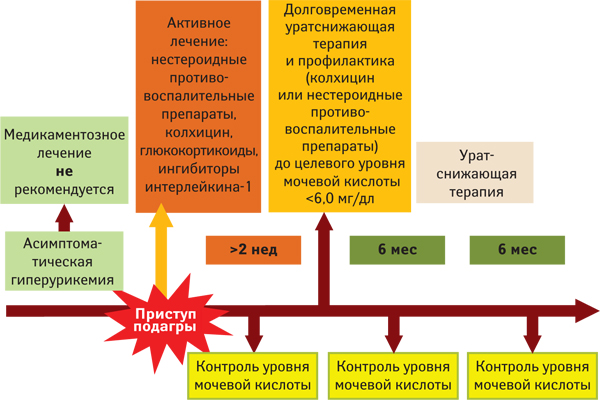
Рис. 32. Сценарий течения подагры и врачебная тактика
Каковы рекомендации European League Against Rheumatism 2016 по лечению обострений у пациентов с подагрой?
Ключевые тезисы терапевтического успеха при подагре определены рекомендациями European League Against Rheumatism 2016 (рис. 33).
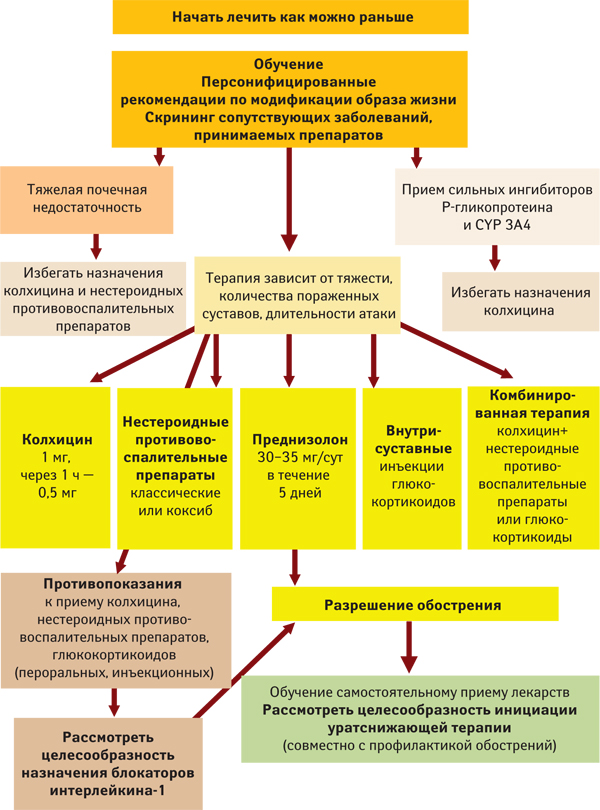
Рис. 33. Рекомендации European League Against Rheumatism 2016 по лечению подагры
Какой должна быть организация медицинской помощи пациенту с гиперурикемией?
Во-первых, необходимо определить индивидуальные относительно конкретного пациента факторы риска (ожирение, артериальная гипертензия, сахарный диабет 2-го типа, гипер- и дислипидемия, микроальбуминурия и др.), провести стратификацию по риску сердечно-сосудистых осложнений и определить суммарный риск по шкале SCORE.
Во-вторых, своевременно (неотложно!) планировать лечение гиперурикемии, которое состоит в восстановлении баланса между продукцией мочевой кислоты и ее выведением. Своевременное выявление и адекватное лечение больных с гиперурикемией важно потому, что этот фактор риска является модифицированным, то есть таким, который поддается коррекции и может оказать влияние на изменение прогноза развития сердечно-сосудистых осложнений и жизни к лучшему.
Независимо от стадии заболевания, от асимптоматической гиперурикемии до хронической тофусной подагры, всем пациентам должны быть даны рекомендации по соблюдению низкопуриновой диеты и образу жизни.
Базисная терапия предполагает применение урикодепрессивных препаратов (аллопуринола, тиопуринола, фебуксостата, оротовой кислоты), которые можно комбинировать с урикозурическими (пробенецид, сульфинпиразон, бензбромарон, бензйодарон, этамид), а в случае наличия уролитиаза — назначать уриколитические препараты.
Нефармакологические методы дополняют, но не заменяют базисное лечение подагры. К ним относятся мероприятия по уменьшению массы тела, необходимость придерживаться низкопуриновой диеты (стол № 6 и 6е по М. Певзнеру), ограничение употребления алкоголя (особенно пива и вин, содержащих молибден — кофактор ксантиноксидазы), фито-, бальнео-, физиотерапия.
Что означает базисная терапия подагры?
Базисная терапия направлена на нормализацию пуринового обмена. Главный ее принцип — длительное, беспрерывное применение противоподагрических препаратов (урикодепрессивных, урикозурических и комбинированных) до достижения целевого сывороточного уровня мочевой кислоты <6 мг/дл (360 мкмоль/л), который должен поддерживаться на протяжении всей жизни пациента.
Любая базисная уратснижающая терапия должна начинаться с низких доз препаратов и впоследствии титроваться путем повышения, пока целевой сывороточный уровень мочевой кислоты не будет достигнут. Такая тактика постепенного повышения дозы уратснижающих препаратов преследует несколько задач:
- снижение частоты острых приступов артрита в первые месяцы после инициации лечения;
- обеспечение лучшей приверженности к лечению;
- возможности использования минимальных эффективных доз, что снизит вероятность развития дозозависимых нежелательных реакций.
Сегодня уратснижающая терапия может применяться и с целью снижения кардиоваскулярного риска, и улучшения качества жизни пациентов с подагрой благодаря непосредственному снижению риска метаболических нарушений и состояний, как и их осложнений, ассоциированных с сывороточными уровнями мочевой кислоты.
Какая тактика рекомендована European League Against Rheumatism 2016 по коррекции гиперурикемии у больных подагрой?
Ключевым критерием эффективности терапевтических подходов в лечении подагры является коррекция гиперурикемии (рис. 34).

Рис. 34. Рекомендации European League Against Rheumatism 2016 по коррекции гиперурикемии
Кому назначается уратснижающая терапия?
- Клинические проявления: 2 и более атаки подагры, наличие тофусов, наличие мочекаменной болезни.
- Группы риска: артериальная гипертензия, ожирение, гиперлипидемия, инсулинорезистентность, сахарный диабет 2-го типа, метаболический синдром, прием ингибиторов ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II.
- Редкие почечные синдромы (например магний-теряющая почка).
Каким образом достигается гипоурикемический эффект?
Существует 3 механизма достижения гипоурикемического эффекта (рис. 35):
1) усиление выведения мочевой кислоты почками (пробенецид, бензбромарон, магниевая соль оротовой кислоты);
2) уменьшение образования мочевой кислоты (угнетение ксантиноксидазы аллопуринолом и фебуксостатом; магниевая соль оротовой кислоты);
3) прямая деградация растворимых уратов (пеглотиказа).

Рис. 35. Метаболизм мочевой кислоты и механизм действия уратснижающих и урикозурических препаратов
Каковы задачи уратснижающей терапии?
- Уменьшение выраженности/устранение подагрических атак.
- Замедление прогрессирования хронической болезни почек;
- снижение кардиальных рисков при наличии метаболического синдрома, сахарного диабета 2-го типа, артериальная гипертензия;
- уменьшение размеров тофусов.
Снижение концентрации мочевой кислоты обеспечивает непосредственное улучшение функции почек, восстановление эффекта петлевых диуретиков, кардиопротекторный эффект, уменьшение необходимости применения нестероидных противовоспалительных препаратов, оказывающих негативный вазопрессорный кардио- и ренальные эффекты.
Какие препараты применяются с урикодепрессивной целью?
Урикодепрессивные препараты угнетают образование мочевой кислоты в организме человека, основные из них:
- Аллопуринол. В соответствии с Рекомендациями European League Against Rheumatism, аллопуринол является основным урикодепрессивным препаратом в программе уратснижающей терапии при хронической гиперурикемии. Этот препарат блокирует фермент ксантиноксидазу, вследствие чего угнетается преобразование гипоксантина в ксантин и далее — в мочевую кислоту. Аллопуринол также оказывает мощное антиоксидантное действие, с которым и связывают его позитивное влияние на состояние больных с гиперурикемией.
Аллопуринол эффективнее плацебо даже в низких дозах (300 мг/сут), повышение дозы до 600–800 мг/сут приводит к достижению целевого уровня мочевой кислоты у 75–85% пациентов. Следует помнить, что максимальная доза препарата — 900 мг/сут. Но даже низкие его дозы (300 мг/сут) могут быть эффективны в 30–50% случаев. Метаанализ свидетельствует о схожей частоте побочных эффектов и высоком профиле безопасности применения различных уратснижающих препаратов. Повышение дозы аллопуринола необходимо не только для снижения частоты обострений, которые в этом случае развиваются реже, но и для снижения риска развития кожных реакций.
Недавнее популяционное исследование в Великобритании показало, что прием аллопуринола при подагре ассоциирован со снижением риска смерти на 19%.
Аллопуринол в высоких дозах (600 мг/сут) у пациентов со стенокардией показал себя в качестве эффективного антиишемического средства, а у пациентов с сердечной недостаточностью те же высокие дозы препарата двукратно снижали смертность, хотя механизм этого клинического эффекта пока до конца не изучен.
- Действие препарата начинается на 2-е сутки, период полувыведения достигает 22 ч, что дает возможность назначать его однократно на протяжении суток в утренние часы, когда концентрация мочевой кислоты достигает максимальных значений. Средняя суточная доза составляет 400–800 мг. После прекращения приема препарата содержание мочевой кислоты возвращается к исходному уровню уже через 4–6 дней, что, как правило, сопровождается ухудшением течения суставного синдрома. Поэтому препарат долго, беспрерывно следует принимать в поддерживающих дозах.
- Прием аллопуринола может сопровождаться некоторыми редкими, но потенциально опасными для жизни эффектами. Так, могут отмечаться эритематозное десквамативное высыпание с зудом от умеренного до тяжелого токсического эпидермального некролиза, лихорадка, гепатит, эозинофилия, ухудшение функции почек — этот симптомокомплекс называют синдромом гиперчувствительности к аллопуринолу. Данный синдром опосредован реакцией больных на метаболит этого препарата — оксипуринол. У пациентов пожилого возраста отмечают более высокий риск развития катаракты. В обычных условиях период полувыведения оксипуринола составляет 20 ч, а при почечной недостаточности может достигать 10 сут.
- По рекомендациям экспертов European League Against Rheumatism, в случае возникновения синдрома гиперчувствительности к аллопуринолу следует попробовать улучшить состояние больного при помощи нефармакологических методов (коррекции диеты, ограничения употребления алкоголя, уменьшения массы тела и др.). В случае неэффективности этих мероприятий рекомендуется провести десенсибилизацию к аллопуринолу. Однако она не показана пациентам с тяжелыми побочными реакциями или с синдромом гиперчувствительности к аллопуринолу.
- Аллопуринол может усиливать действие непрямых антикоагулянтов, повышает концентрацию теофиллина, в связи с чем требуется снижение дозы теофиллина.
Таким образом, целесообразно титрование дозы аллопуринола, и, если результат не достигнут, следующим шагом будет замена на другой ингибитор ксантиноксидазы (фебуксостат).
- Фебуксостат — 2-(3-циано-4-изобутоксифенил)-4-метилтиазол-5-карбоксильная кислота, мощный селективный непуриновый ингибитор ксантиноксидазы, метаболизируется в печени и почти не экскретируется почками, что позволяет применять его при неэффективности терапии аллопуринолом, при непереносимости аллопуринола, в том числе из-за аллергических реакций, у пациентов с легкой или умеренной почечной недостаточностью.
В Украине, как и в Европе, препарат зарегистрирован в дозах 80 и 120 мг, последняя — максимальная суточная доза, возможность достижения целевого уровня мочевой кислоты при применении которой превышает 80% начальной дозы 40 мг. Титрование в течение 2 нед до 80 мг, при недостижении целевого уровня мочевой кислоты — до 120 мг в течение 2 нед. Средняя эффективная доза 80 мг в 1,5–2 раза эффективнее 300 мг аллопуринола.
Клинические исследования показали высокую эффективность этого препарата в сравнении с аллопуринолом, при этом профиль безопасности и переносимости фебуксостата значительно превосходит таковой аллопуринола. Отдельно следует отметить, что при лечении фебуксостатом не требуется коррекции дозы у пациентов пожилого возраста и его применение не противопоказано у пациентов с хронической почечной недостаточностью.
Согласно Рекомендациям Европейского агентства по лекарственным средствам (European Medicines Agency — EMА) 2013 г., с некоторой осторожностью следует применять фебуксостат у пациентов с уже диагностированными ишемической болезнью сердца и хронической сердечной недостаточностью, несмотря на то, что в исследованиях показано значительное снижение общей и кардиальной смертности у пациентов с гиперурикемией на фоне лечения фебуксостатом. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) не указывает на подобные ограничения при применении фебуксостата.
- Пеглотиказа. Пациентам с кристалл-верифицированной тяжелой, изнуряющей хронической тофусной подагрой и низким качеством жизни, у которых целевой сывороточный уровень мочевой кислоты не достигнут при применении любых других доступных лекарственных препаратов в максимальной дозе (включая комбинации), показана пеглотиказа.
Пеглотиказа, препарат пегилированной уриказы, продуцируемый генетически модифицированным штаммом Escherichia coli и катализирующий окисление мочевой кислоты в аллантоин, — последний шанс при рефрактерности к ингибиторам ксантиноксидазы, урикозурикам и их комбинации. Назначение препарата позволяет достичь целевого уровня мочевой кислоты у 42% пациентов, но широкое его применение ограничено из-за частых аллергических реакций и высокой стоимости.
Пеглотиказа — 8 мг, внутривенная инфузия один раз в 2 нед на протяжении 12–16 нед. Контроль уровня мочевой кислоты, глюкозо-6-фосфатдегидрогеназы перед каждой инфузией. Требует премедикации антигистаминными препаратами и глюкокортикостероидами. Профилактика обострения должна быть начата за ≥7 дней до введения пеглотиказы.
- Высокий риск инфузионных реакций (26% против 5% при введении плацебо) даже при проведении премедикации, особенно у пациентов без ответа на лечение и при наличии антител к пеглотиказе. Анафилактические реакции развиваются у 5% пациентов (в группе плацебо — 0%). Нет данных относительно безопасности и эффективности пеглотиказы при перерыве в лечении больше чем 4 нед. Не назначать пациентам с дефицитом глюкозо-6-фосфатдегидрогеназы; назначать осторожно больным с застойной сердечной недостаточностью (мало данных о безопасности, в клинических исследованиях зафиксированы осложнения).
- Тиопуринол. Действие тиопуринола связано с блокадой глутаминфосфорибозилтрансферазы. Препарат назначают в дозах, аналогичных аллопуринолу.
- Оротовая кислота (витамин В12) — природный метаболит, промежуточный продукт в образовании пиримидиновых нуклеотидов. Формирование пуриновых нуклеотидов тесно связано с синтезом пиримидиновых нуклеотидов. В регулировании этого соотношения важную роль играет 5-фосфорибозилпирофосфат, путем связывания которого можно получить гипоурикемический эффект. Оротовая кислота повышает также урикозурию. Установлена способность оротовой кислоты стимулировать синтез аденозинтрифосфата в клетке, что улучшает ее энергетическое обеспечение. Усиливая образование рибозы, она активирует пентозный цикл и оказывает противовоспалительное действие. Хорошо известно гиполипидемическое действие оротовой кислоты. Эффективность 2000 мг оротовой кислоты в снижении уровня мочевой кислоты в плазме крови сопоставима с 300 мг аллопуринола. Едва ли не самым главным приоритетом препарата является его безопасность. Не существует также противопоказаний для его назначения при подагрической нефропатии, как при латентном, так и при уролитиазном и протеинурическом ее вариантах. Лечение оротовой кислотой проводят курсами по 3 нед в дозе 1,5–3 г/сут в 3 приема до еды с перерывами на 3 нед (лучшим выбором является ее магниевая соль).
- Абсолютные противопоказания для оротовой кислоты неизвестны, за исключением гиперкалиемии, когда можно назначать ее магниевую соль. Среди доступных на украинском рынке препаратов для коррекции гиперурикемии следует обратить внимание на препарат оротата магния, выпускающийся в таблетках по 500 мг. Противопоказаниями для назначения магния оротата являются повышенная чувствительность к компонентам препарата, гипермагниемия, гипокальциемия, мочекаменная болезнь (фосфатные и кальциево-магниевые конкременты), нарушение функции почек, выраженная брадикардия и атриовентрикулярная блокада (I–II степени), а также детский возраст. Как недостаток его применения возможна диарея. Этот препарат может быть использован при непереносимости/плохой переносимости аллопуринола или как самостоятельная альтернативная терапия, в том числе у беременных и кормящих. Более половины беременных, имеющих повышенный уровень мочевой кислоты и эпизодические проявления подагры, начиная со ІІ триместра. С учетом способности снижать аппетит, его применение у данной категории пациентов становится особенно привлекательным.
- Фенофибрат. Единственный среди фибратов существенно снижает уровень мочевой кислоты и замедляет темпы прогрессирования подагрического поражения почек.
- Тиениловая кислота (диуретик) — имеет преимущественно уридепрессивное действие, существенно снижает содержание мочевой кислоты в сыворотке крови уже через несколько часов после первого приема, назначается больным подагрой с артериальной гипертензией в дозе 250 мг/сутки в 1–2 приема на протяжении нескольких месяцев или лет.
- Чтобы предотвратить острое повышение содержания мочевой кислоты в моче после ее приема (камни, острая закупорка канальцев уратами с почечной недостаточностью), за 3 дня до назначения отменяют другие диуретики, рекомендуют также достаточный водный режим на протяжении 3 дней до назначения и собственно при назначении. Не комбинируют с антагонистами альдостерона и снижают дозу антикоагулянтов при совместном назначении.
- Сибутрамин — препарат, который используется для уменьшения массы тела у больных ожирением. По результатам последних исследований, лечение сибутрамином способствует значительному снижению уровня мочевой кислоты в сыворотке крови.
Как правильно планировать долговременную уратснижающую терапию в интересах больного подагрой?
Общепринятым критерием эффективности программ медицинской реабилитации пациентов с хроническими заболеваниями сегодня является качество жизни. Установлено, что к улучшению показателя «качественно прожитый год жизни» (quality-adjusted life-year — QALY) приводят назначение фебуксостата в фиксированной дозе или при эскалации дозы, что позволяет эффективнее контролировать гиперурикемию, а также замена аллопуринола фебуксостатом или фебуксостата аллопуринолом.
Опубликованы данные фармакоэкономического анализа 5-летнего применения аллопуринола и фебуксостата, который показал, что при незначительно более высокой стоимости фебуксостат позволяет на 30% повысить вероятность хорошего ответа на лечение.
Наиболее экономически и клинически оправданна схема «аллопуринол — фебуксостат», обосновывающая стартовую тактику уратснижающей терапии с аллопуринолом и последующей его заменой на фебуксостат при недостижении у пациента таргетных уровней мочевой кислоты в сыворотке крови. У некоторых пациентов с подагрой аллопуринол неэффективен даже в максимальной дозе.
Еще в 2008 г. Национальный институт здоровья и клинического совершенствования Великобритании (National Institute for Health and Clinical Excellence — NICE) представил результаты фармакоэкономического анализа терапии фебуксостатом в дозах 80, 120 мг и аллопуринолом в дозе 300 мг в течение 1 и 2 лет. Эффективность проводимой терапии составила 16 574 и 15 545 фунтов стерлингов за качественно прожитый год жизни соответственно. Эксперты института рекомендовали использовать фебуксостат у пациентов с подагрой, которые нечувствительны к аллопуринолу или имеют противопоказания к его назначению.
Что должен знать врач при проведении уратснижающей терапии аллопуринолом?
Аллопуринол — неселективный ингибитор фермента ксантиноксидазы. Он препятствует превращению гипоксантина в ксантин и далее в мочевую кислоту. Ее содержание в крови снижается, одновременно уменьшается урикозурия. Как следствие, отсутствует риск образования уратных камней в мочевых путях. Препарат можно применять при патологии почек, но без выраженной почечной недостаточности. Лечение аллопуринолом продолжается многие годы, практически непрерывно.
Показаниями для назначения аллопуринола являются:
- подтвержденный диагноз «хронический подагрический артрит»;
- гиперсекреция мочевой кислоты (более 800 мг/сут без диеты и более 600 мг при низкопуриновой диете);
- поражение почек со снижением клиренса креатинина менее 80 мл/мин;
- образование тофусов в мягких тканях и субхондральной кости;
- нефролитиаз;
- стойкое повышение уровня мочевой кислоты более 13 мг/дл у мужчин и более 10 мг/дл — у женщин;
- противопоказания к назначению урикозурических препаратов;
- проведение цитотоксической терапии или рентгенотерапии по поводу лимфопролиферативных заболеваний;
- подагра, не контролируемая урикозурическими агентами и колхицином, манифестирующая затяжными атаками и/или неконтролируемой гиперурикемией;
- признаки подагрической нефропатии.
При выборе аллопуринола в качестве уратснижающей терапии необходимо помнить следующее:
- не рекомендуется начинать терапию при острой суставной атаке;
- назначать следует не ранее чем через 2 нед после купирования приступа острого артрита, постепенно титровать дозу до эффективной, отслеживая возможные нежелательные явления;
- если приступ развился на фоне терапии аллопуринолом, прием препарата следует продолжить, но снизить дозу;
- необходимо тщательное титрование дозы;
- для профилактики острых приступов артрита, иногда возникающих на старте лечения, и предупреждения развития аллергических и тяжелых побочных реакций начальные дозы должны быть низкими;
- о правильном подборе дозы свидетельствует скорость снижения уровня гиперурикемии — не более 0,1–0,6 мг/дл, или 10% от исходных цифр в течение месяца;
- для профилактики острого приступа в начале приема аллопуринола возможно назначение низких доз колхицина или нестероидных противовоспалительных препаратов;
- при отмене аллопуринола отмечается быстрое (в течение 3–4 дней) повышение уровня мочевой кислоты;
- после возникновения артрита требуются повторные исследования уровня мочевой кислоты, поскольку во время приступов ее уровень обычно ниже, чем в период между приступами.
Начальная доза аллопуринола составляет 50–100 мг/сут, затем ее ежедневно повышают на 100 мг и доводят до 200–300 мг при легких и до 400–500 мг при средних и тяжелых формах заболевания. Тем не менее в клинической практике широко используемая доза аллопуринола составляет 300 мг/сут (90–95% пациентов с подагрой), но для контроля гиперурикемии этого довольно часто бывает недостаточно. Экспертами Управление по контролю за пищевыми продуктами и лекарственными средствами США одобрены дозировки до 800 мг/сут.
Уровень мочевой кислоты в сыворотке крови начинает снижаться на 2–3-й день терапии и достигает нормальных значений на 7–10-й день. По мере уменьшения гиперурикемии снижается и доза аллопуринола. Стойкая нормализация урикемии, как правило, отмечается через 4–6 мес, после чего назначается поддерживающая доза — 100 мг/сут.
Снижение частоты и интенсивности приступов, размягчение и рассасывание тофусов наблюдают через 6–12 мес приема препарата. После продолжительного лечения могут полностью исчезнуть хронические суставные проявления.
Заметного влияния на подагрическую нефропатию препарат не оказывает. При снижении функции почек доза аллопуринола определяется исходя из значений клиренса креатина. Если клиренс креатинина более 60 мл/мин, суточная доза может составлять 200 мг, менее 40 мл/мин — не должна превышать 100 мг, ниже 10 мл/мин — 100 мг 1 раз в 3 дня. Применение более высоких доз может усугубить хроническую почечную недостаточность. Это связано с тем, что аллопуринол блокирует пуриновый распад до ксантина, уровень последнего в крови и в моче возрастает многократно. Ксантинемия и ксантинурия негативно воздействуют на почки.
Среди недостатков терапии аллопуринолом указывают на развитие серьезных нежелательных реакций в виде прогрессирующей почечной недостаточности, гепатотоксичности, аллергических реакций, в том числе тяжелых: синдрома Стивенса — Джонсона, эпидермальный некролиз, DRESS-синдром (синдром лекарственно-индуцированной гиперчувствительности с эозинофилией). К возможным причинам развития таких тяжелых реакций на аллопуринол относят носительство гена HLA-В 5801, которое с высокой частотой отмечают в разных этнических популяциях, особенно распространено в Азии (17%).
Побочные реакции на аллопуринол:
- отмечают в 5–20% случаев;
- чаще — обострение подагры;
- реже — макулопапулезные высыпания (2–3,5%);
- редко— синдром гиперчувствительности к аллопуринолу. Среднее время развития — на 3-й и 5-й неделе: лихорадка, острый дерматит, острый гепатит, нефрит, лейкоцитоз, эозинофилия.
Эффективное лечение основано на ранней диагностике, своевременной немедленной отмене препарата, поддерживающих мероприятиях. Эффективность стероидов не доказана.
Взаимодействие аллопуринола с другими препаратами может быть клинически значимым. Так, сочетанное применение аллопуринола с ампициллином либо амоксициллином повышает риск развития аллергических реакций, кожных проявлений и анафилактоидных реакций; при применении с каптоприлом замедляет метаболизм теофиллина. При сочетанном применении с непрямыми антикоагулянтами или производными кумарина необходимо снизить дозы последних, так как возникает ингибирование метаболизма и повышение эффективности, необходим более частый контроль показателей свертывания крови. При применении препарата с азатиоприном, меркаптопурином, циклофосфамидом повышается не только терапевтический эффект, но и токсический эффект последних. При сочетании с высокими дозами салицилатов снижается эффективность самого препарата.
Противопоказаниями к применению аллопуринола служат выраженные нарушения функции печени, гемохроматоз, бессимптомная гиперурикемия (кроме злокачественных заболеваний с гиперурикемией), беременность, детский возраст.
Почему нужны новые препараты для лечения подагры?
Необходимость введения в клиническую практику новых препаратов, обладающих патогенетическим действием при подагре, была подтверждена результатами наблюдательного исследования CACTUS, проведенного во Франции и Греции. В исследовании приняли участие 3079 пациентов с подагрой. Средний уровень мочевой кислоты — 8,7 мг/дл. Все пациенты получали рекомендации по диете и модификации образа жизни. На момент включения в исследование 81,5% из них получали уратснижающую терапию, преимущественно аллопуринол.
Изучены причины недостаточной эффективности лечения подагры и его прекращения пациентами. Среди причин прекращения приема препарата указывали: отсутствие эффекта в отношении снижения уровня мочевой кислоты — 47% пациентов, отсутствие уменьшения выраженности симптомов болезни — 34%, плохой комплаенс — 23%.
Однако существует мнение, что низкая чувствительность к аллопуринолу отмечается редко и связана, как правило, с низким комплаенсом, неадекватными дозами и продолжающимся употреблением пациентами алкоголя.
Что должен знать врач при проведении уратснижающей терапии фебуксостатом?
Фебуксостат — это новые возможности уратснижающей терапии (European League Against Rheumatism, 2016). Это — мощный селективный непуриновый ингибитор ксантиноксидазы, его константа ингибирования in vitro составляет <1 нМ. Установлено, что фебуксостат в отличие от аллопуринола подавляет активность как окисленной, так и восстановленной формы фермента (аллопуринол связывается только с окисленной формой фермента, и эта связь более слабая). При этом ингибирование ксантиноксидазы осуществляется посредством образования высокоаффинных связей. Фебуксостат практически не влияет на активность других ферментов пуринового и пиримидинового метаболизма.
Характерен естественный печеночный метаболизм: глюкуронизация и оксидация. Почечная экскреция фебуксостата и активных метаболитов <10% дозы.
Препарат показан больным подагрой, не ответившим на лечение аллопуринолом или имеющим противопоказания к его назначению.
Производитель препарата Аденурик® (фебуксостат) — Menarini International Operations Luxembourg S.A. (LUX). После перорального приема Аденурик® абсорбируется быстро и в большом объеме — от 82 до 86%. Период полувыведения составляет от 4 до 18 ч и зависит от дозы препарата. Прием пищи не влияет на скорость всасывания и концентрацию вещества в плазме крови.
Связь активного вещества с белками крови достигает практически 100%. Метаболизируется Аденурик® преимущественно в печени, благодаря связыванию с глюкуронилтрансферазой и в незначительной степени с участием ферментов системы цитохромов Р450. Около 50% препарата выводится с мочой в связанном виде.
Начальная терапевтическая доза фебуксостата составляет 80 мг/сут. Если в течение месяца концентрация мочевой кислоты в крови не снижается до целевых значений, дозу повышают до 120 мг/сут.
Эффект терапии отмечается через 4–5 нед, исчезновение симптомов — в течение 3–4 мес.
Важно, что фебуксостат в отличие от аллопуринола не ассоциируется с прогрессированием хронической почечной недостаточности. Фармакокинетика препарата не изменяется у пациентов с легкой или средней степенью почечной дисфункции.
Взаимодействие Аденурика с другими препаратами клинически незначимо. Ибупрофен и варфарин не влияют на связывание фебуксостата с белками плазмы крови. Получены данные об отсутствии взаимодействия фебуксостата с колхицином, напроксеном, индометацином.
Противопоказаниями для приема фебуксостата являются индивидуальная непереносимость и хроническая сердечная недостаточность. С особой осторожностью следует применять препарат при развитии гиперурикемии на фоне химиотерапии. Из наиболее частых (меньше одного случая на тысячу) побочных эффектов следует отметить головокружение, тошноту, диарею и головную боль.
Какова тактика уратснижающей терапии у пациентов с нарушенной функцией почек?
В соответствии с Рекомендациями European League Against Rheumatism (2016) у пациентов с нарушенной функцией почек максимальная доза аллопуринола должна быть скорригирована исходя из клиренса креатинина. Если целевой сывороточный уровень мочевой кислоты не может быть достигнут при этой дозе, пациента следует перевести на прием фебуксостата либо бензбромарона с аллопуринолом или без него, исключая пациентов с расчетной скоростью клубочковой фильтрации <30 мл/мин.
У этой категории пациентов следует помнить о повышении риска развития тяжелых аллергических реакций в рамках синдрома гиперчувствительности к аллопуринолу, вероятность которого повышается при сниженной почечной функции, что служит основанием для индивидуального вычисления допустимой дозы препарата в зависимости от скорости клубочковой фильтрации.
Развитие таких реакций происходит редко, может быть связано с носительством гена HLA В5801, отмечаемого преимущественно в популяциях стран Азии (Корея, Тайвань и др.). Высокий уровень смертности при их развитии требует строгого контроля применения препарата в случае наличия факторов риска. Однако существуют исследования, ставящие под сомнение необходимость лимитирования дозы аллопуринола при хронической почечной недостаточности.
Препаратами выбора при хронической болезни почек являются фебуксостат и урикозурики. У пациентов с хронической болезнью почек эффективность фебуксостата превышает таковую аллопуринола в случае применения последнего в низких дозах, рассчитанных исходя из клиренса креатинина.
Какие препараты используются с урикозурической целью?
Большой проблемой является отсутствие в Украине зарегистрированных урикозуриков (препараты, повышающие выведение мочевой кислоты почками) без перспективы их появления в ближайшее время. В большинстве случаев для адекватной терапии достаточно аллопуринола и фебуксостата, но для некоторых пациентов, резистентных к терапии ингибиторами ксантиноксидазы, урикозурические препараты — это едва ли не единственная возможность контролировать заболевание.
Использование урикозурических средств ограничено: их назначают только как альтернативу аллопуринолу при почечном типе гиперурикемии с недостаточным выведением мочевой кислоты (<1,8 ммоль/сут), но лишь при отсутствии хронической почечной недостаточности, уролитиаза, заболеваний печени и желудочно-кишечного тракта. Необходимо отметить, что у почти половины больных есть такие противопоказания. Необходимо принять во внимание и то, что при гиперпродукции уратов, снижении диуреза и наличии почечных конкрементов урикозурические средства обусловливают увеличение выделения мочевой кислоты почками, способствуют выпадению ее кристаллов в мочевых путях, провоцируя приступы почечной колики.
- Пробенецид. На протяжении 1-й недели применяют в дозе 0,25 г 2 раза в сутки. В случае недостаточного эффекта через 3–4 дня дозу начинают повышать каждую неделю на 0,5 г. Между приступами хронической подагры назначают поддерживающую терапию пробенецидом в дозе 0,25 г 1–2 раза в сутки. Препарат нельзя комбинировать с аллопуринолом (усиление выраженности побочных эффектов).
- Наиболее частыми побочными эффектами являются головная боль, диспепсия, диарея, дерматит, лихорадка, анемия. Предостережение: возможно обострение подагры.
- Сульфинпиразон. Назначают в дозе 0,2–0,6 г/сут в 2–4 приема на протяжении 2–6 мес. Препарат является производным пиразолона, поэтому проявляет противовоспалительную активность. У больных с сердечной недостаточностью сульфинпиразон может усиливать отечный синдром.
- Возможны тяжелые осложнения со стороны почек, печени, провоцирует обострение язвенной болезни, в связи с чем для плановой терапии не используется.
- Бензбромарон. Не только усиливает выделение уратов почками (тормозит канальцевую реабсорбцию), но также тормозит синтез пуриновых оснований и всасывание мочевой кислоты из кишечника. Его дозу можно не снижать при умеренной почечной недостаточности (в отличие от аллопуринола). Для него не характерны серьезные побочные реакции (у 3–4% пациентов развивается диарея и зудящая кожная сыпь), однако необходим контроль лечения в связи с гепатотоксичностью. Назначают по 50–100 мг 3 раза в сутки. Можно комбинировать с аллопуринолом.
- Комбинированный препарат, содержащий 100 мг аллопуринола и 20 мг бензбромарона — сочетает действие обоих антиподагрических средств: ингибирует синтез мочевой кислоты и повышает ее экскрецию с мочой. Назначают по 1 таблетке в сутки.
- Этебенецид. По выраженности урикозурического эффекта уступает сульфинпиразону и пробенециду. Препарат принимают в дозе 0,35–0,7 г 4 раза в сутки на протяжении 10–12 дней с последующим перерывом на протяжении 5–7 дней (в год необходимо 3–4 курса лечения).
- Ферментные препараты разрушают мочевую кислоту. Уратоксидаза окисляет мочевую кислоту, превращая ее в неактивный алантоин, который быстро растворяется в воде и выводится из организма с мочой. Препараты назначают при компенсированной стадии хронической почечной недостаточности по 1000–2000 ЕД в сутки на протяжении 2 недель.
- Лозартан. Оказывает урикозурическое действие путем блокады реабсорбции уратов и единственный среди других антигипертензивных препаратов достоверно снижает уровень мочевой кислоты в плазме крови.
- Энтеросорбция — прием сорбентов приводит к фиксации уратов на поверхности препаратов, не препятствует их всасыванию в кровь (30% мочевой кислоты реабсорбируется из желудочно-кишечного тракта), что ведет к снижению урикемии.
Каков алгоритм лечения острого подагрического артрита?
В соответствии с современными Рекомендациями European League Against Rheumatism (2016) лечение острого приступа артрита при подагре должно начинаться как можно раньше. Хорошо информированные пациенты должны быть обучены самостоятельному принятию решения о начале терапии при появлении первых симптомов. Выбор препарата должен быть основан на данных предшествующего собственного опыта пациента и наличии противопоказаний к инициации приема того или другого лекарственного средства. Пациенту предлагается держать «таблетку в кармане», хотя данная рекомендация основана исключительно на мнении экспертов.
В качестве препаратов первой линии противовоспалительной терапии рассматриваются нестероидные противовоспалительные препараты, колхицин и глюкокортикостероиды. Сравнительно недавний систематический обзор показал, что нестероидные противовоспалительные препараты (в том числе селективные ингибиторы циклооксигеназы-2), глюкокортикостероиды (перорально и внутримышечно), колхицин и ингибитор интерлейкина-1β (канакинумаб) являются эффективными методами лечения при острых приступах (рис. 36).
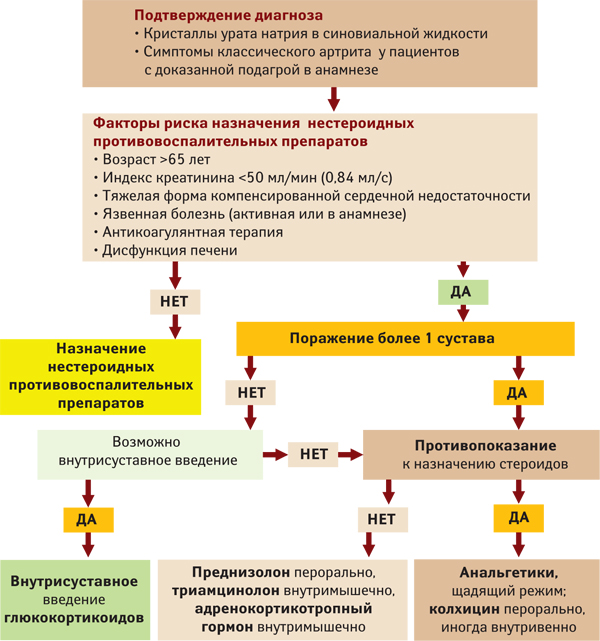
Рис. 36. Алгоритм лечения острого подагрического артрита (по Максудовой А.Н., Салихову И.Г., Хабирову Р.А., 2008)
Наиболее сложным является выбор препарата, осуществляемый исходя из анализа противопоказаний (табл. 17). По некоторым данным, частота абсолютных или относительных противопоказаний к назначению нестероидных противовоспалительных препаратов в зависимости от частоты приступов артрита (чем она выше, тем вероятнее наличие противопоказаний) у пациентов с подагрой колеблется от 78,7 до 91,5%, колхицина — от 46,5 до 47,1%, глюкокортикоидов — от 87,3 до 96,4%.
Таблица 17
Фармакотерапия острой подагры (адаптировано по Terkeltaub R.A., 2003)
|
Препарат/дозы |
Предостережения |
Комментарии |
|
Нестероидные противовоспалительные препараты |
||
|
Индометацин по 50 мг 3 раза в сутки на протяжении 4–10 дней Сулиндак по 200 мг 2 раза в сутки Диклофенак по 75 мг 2 раза в сутки Нимесулид по 100 мг 2 раза в сутки Мелоксикам 7,5–15 мг 1 раз в сутки (per os, внутримышечно) |
Применять с осторожностью у пациентов пожилого возраста, больных с почечной, сердечной недостаточностью, язвенной болезнью, заболеваниями печени и у тех, кто принимает антикоагулянты (варфарин) Не назначать ацетилсалициловую кислоту и производные пропионовой кислоты! |
Любой нестероидный противовоспалительный препарат эффективный кроме ацетилсалициловой кислоты и производных пропионовой кислоты (кетопрофен, напроксен)! Применять до уменьшения выраженности симптомов + от нескольких дней до недели после |
|
Глюкокортикостероиды |
||
|
Преднизолон per os по 20–40 мг в сутки 2–3 дня, потом постепенно снизить дозу за 10–14 дней Метилпреднизолон 20–40 мг внутрисуставно однократно Метилпреднизолон 80–120 мг внутримышечно однократно |
Не назначать пациентам с септическим поражением суставов и с осторожностью назначать больным с сахарным диабетом |
Любой глюкокортикостероид per os эффективен. Внутрисуставное введение считается лечением выбора только тогда, когда поражены 1–2 легкодоступных сустава |
|
Колхицин |
||
|
Колхицин по 0,6 мг per os 2–3 раза в сутки Дозы (в зависимости от клиренса креатинина):
|
Не назначать пациентам с тяжелой почечной или печеночной недостаточностью, поскольку это может привести к супрессии костного мозга и нейромиопатии |
Избегать внутривенного введения; лучше начинать лечение в первые 24 ч от начала приступа; наиболее частые побочные эффекты — тошнота, рвота и диарея; пациентам пожилого возраста необходимо снизить дозу |
При наличии абсолютных противопоказаний и/или неэффективности нестероидных противовоспалительных препаратов, колхицина и глюкокортикостероидов, а также отсутствии текущей инфекции, с целью купирования острого артрита возможно применение моноклональных антител к интерлейкину-1 (канакинумаб).
Целесообразность персонифицированного выбора режима терапии обусловлена и индивидуальными особенностями больного, и гетерогенностью собственно подагрического процесса, протекающего с вовлечением многих органов и систем организма, что существенно модифицирует фармакодинамику препаратов, приводя к кумуляции нежелательных эффектов.
Каковы подходы к выбору нестероидных противовоспалительных препаратов в лечении?
Терапия нестероидными противовоспалительными препаратами занимает лидирующие позиции в лечении как при остром приступе, так и хронического подагрического артрита. Считается, чем раньше назначен препарат, тем быстрее может быть достигнут анальгетический эффект. Нестероидные противовоспалительные препараты следует применять в максимальных суточных дозах, которые могут быть снижены по мере уменьшения выраженности симптоматики. Выбор конкретного нестероидного противовоспалительного препарата во многом зависит от личных предпочтений. И селективные ингибиторы циклооксигеназы-2, и традиционные нестероидные противовоспалительные препараты эффективны при лечении острых приступов подагрического артрита. По эффективности инъекционные формы не превосходят пероральные.
Недавний систематический обзор, объединяющий результаты 6 рандомизированных клинических исследований (851 пациент), продемонстрировал одинаковый эффект эторикоксиба (120 мг/сутки), индометацина и диклофенака при остром артрите, с лучшей у эторикоксиба переносимостью со стороны желудочно-кишечного тракта. Другой селективный ингибитор циклооксигеназы-2 — целекоксиб также продемонстрировал сопоставимый с индометацином эффект в отношении умеренной и выраженной боли у пациентов с острым подагрическим артритом. Еще в одном систематическом обзоре был сделан вывод о том, что нестероидные противовоспалительные препараты и селективные ингибиторы циклооксигеназы-2 демонстрируют эквивалентные преимущества в плане уменьшения выраженности боли, отечности и улучшения общего самочувствия, однако традиционные нестероидные противовоспалительные препараты отличаются более высокой частотой отмены из-за побочных эффектов.
Каким нестероидным противовоспалительным препаратам следует отдавать предпочтение при лечении острого приступа подагрического артрита?
Нестероидные противовоспалительные препараты считаются лекарственными средствами первой линии. Они должны применяться в максимальной суточной дозе и отменяются через 1–2 дня после уменьшения выраженности симптомов артрита. Желательно назначать препараты, обладающие доказанной эффективностью в отношении острой боли. По эффективности инъекционные формы не превосходят пероральные.
Большинство сравнительных исследований показали сопоставимую эффективность ряда нестероидных противовоспалительных препаратов. В то же время результаты крупного рандомизированного исследования продемонстрировали, что нимесулид в дозе 200 мг/сут по сравнению с диклофенаком натрия в дозе 150 мг/сут быстрее купирует симптомы артрита при подагре и может быть эффективен даже у пациентов с негативным опытом приема других нестероидных противовоспалительных препаратов, олиго- и полиартритом, длительностью артрита более 3 мес. Наиболее часто применяют нимесулид и пациенты с подагрой самостоятельно, без предписаний врача, используя нестероидные противовоспалительные препараты для купирования приступов артрита.
По мнению экспертов, эффективность нимесулида при острой боли, когда воспаление является преобладающим компонентом, может быть объяснена быстрым началом анальгетического действия — через 15 мин после приема. Последнее обусловлено максимально быстрым высвобождением препарата благодаря гранулированной форме выпуска. Кроме того, нимесулид обладает хорошим профилем безопасности. Сказанное предполагает возможность широкого применения препарата для лечения острой боли.
Нимесулид является одним из наиболее популярных в Украине нестероидных противовоспалительных препаратов. Это лекарственное средство было синтезировано доктором G. Moore в биохимической лаборатории ЗМ (подразделение «Riker Laboratories») и лицензирован в 1980 г. швейцарской фирмой. Сегодня его назначают в 50 странах мира, а именно в странах Европейского Союза, Южной и Центральной Америки, Китае, Индии, странах Юго-Восточной Азии. Главным преимуществом нимесулида как селективного ингибитора циклооксигеназы является значительно более низкий риск развития побочных эффектов со стороны желудочно-кишечного тракта по сравнению с традиционными неселективными нестероидными противовоспалительными препаратами.
Объективная оценка данных литературы не подтверждает существовавшую до недавнего времени мысль некоторых зарубежных авторов (более с эмоциональной, но не научной составляющей) о более высоком уровне гепатотоксичности нимесулида по сравнению с другими нестероидными противовоспалительными препаратами. По данным доказательной медицины, нимесулид является не более опасным относительно влияния на функциональное состояние печени, чем другие представители этого класса препаратов. Частота побочных эффектов при его длительном применении не превышает 1,5%, а риск повышения артериального давления существенно ниже, чем при использовании других нестероидных противовоспалительных препаратов.
Получены также данные об отсутствии негативной динамики биохимических показателей повреждения гепатоцитов или проявлений холестаза при лечении подагры нимесулидом. Особое внимание привлекают данные, свидетельствующие об отсутствии ухудшения печеночных показателей у больных, которые принимали нимесулид, с существенно повышенным исходным уровнем аланинаминотрансферазы. Эти результаты свидетельствуют об отсутствии существенной гепатотоксичности у нимесулида и позволяют его назначать при наличии показаний даже у больных с признаками сопутствующей патологии печени.
Какова роль колхицина в купировании острого приступа подагры?
Альтернативой нестероидным противовоспалительным препаратам как лекарственное средство первой линии может стать колхицин. В Европе (за исключением Франции) он уступает нестероидным противовоспалительным препаратам по частоте применения и популярности. Колхицин — алкалоид, получаемый из растения Colchicum autumnale — безвременника осеннего, используется для лечения острой подагры на протяжении многих десятилетий. Согласно современным международным и национальным рекомендациям для купирования острой атаки артрита целесообразным считается назначение у большинства пациентов низких доз колхицина (1,5 мг в первые сутки (1 мг сразу и через 1 час еще 0,5 мг) и по 1 мг со следующего дня).
Клиническая практика показывает, что эффективность низких доз колхицина была эквивалентна высоким в том случае, если колхицин в низких дозах назначали в течение первых 12 ч после начала острого приступа артрита. Колхицин оказывается гораздо менее эффективным, если его назначают после 12–24 ч от начала приступа. Именно при раннем назначении низкие дозы препарата не уступают по эффективности высоким, но в первом случае вероятность развития побочных реакций невысока и сопоставима с плацебо, во втором — достигает 100%. Соответственно, более позднее назначение может потребовать более высоких доз препарата, что практически всегда заканчивается развитием нежелательных реакций.
В случаях почечной недостаточности или при лечении статинами и врач, и пациент должны проявлять настороженность в отношении потенциальной нейро- и миотоксичности колхицина как средства профилактики острых приступов артрита. Следует также избегать сочетанного назначения ингибиторов Р-гликопротеина (циклоспорин A) или ингибиторов CYP 3А4 (кларитромицин, эритромицин, кетоконазол, дилтиазем, верапамил и др.). Кроме того, отличительной чертой колхицина является отсутствие прямого анальгетического действия, и моментального уменьшения боли ожидать не следует.
Как назначать глюкокортикоиды при остром приступе подагры?
Назначение глюкокортикоидов для купирования острого приступа подагры возможно в виде внутрисуставных (после удаления синовиальной жидкости), внутримышечных инъекций или внутрь.
Пероральный прием преднизолона в суточной дозе 30–35 мг/сут демонстрирует высокую эффективность и рекомендуется экспертами Американского колледжа ревматологов и Европейской антиревматической лиги в качестве терапии первой линии при лечении острого приступа подагры. При этом стартовая доза преднизолона 30–35 мг/сут назначается на несколько (3–6) дней с последующей быстрой (в течение 1 нед) полной отменой.
Внутримышечное введение глюкокортикоидов может быть применено в случае полиартикулярного поражения суставов. Внутрисуставные инъекции стероидов оказываются очень эффективными и рекомендованы как Американским колледжем ревматологов, так и Европейской антиревматической лигой, при моно- или полиартикулярном поражении суставов, несмотря на отсутствие рандомизированных клинических исследований.
Однако важно отметить, что, вопреки бытующему мнению, прием преднизолона не эффективнее применения нестероидных противовоспалительных препаратов. Так, сравнение двух режимов терапии (преднизолон 35 мг/сут и напроксен 1000 мг/сут) у пациентов с острым подагрическим артритом показало отсутствие различий в динамике интенсивности боли при сопоставимой частоте нежелательных эффектов. Кроме того, глюкокортикоиды не безопаснее нестероидных противовоспалительных препаратов, поскольку они способны усугубить течение артериальной гипертензии и сахарного диабета.
Преднизолон в дозе 30–35 мг/сут хотя и эффективен, но не превосходит по анальгетическому действию и безопасности напроксен и индометацин. Пока прием глюкокортикоидов при купировании острого приступа артрита при подагре не получил широкого распространения, по крайней мере в нашей стране, хотя это могло бы расширить возможности терапии в некоторых случаях. По данным недавнего исследования, внутримышечная инъекция 7 мг бетаметазона эффективнее диклофенака натрия в дозе 75 мг 2 раза в сутки, что подтверждает возможность применения инъекционных форм глюкокортикоидов; тем не менее опасность огульного использования инъекций глюкокортикоидов недооценивается.
Возможно назначение коротких курсов глюкокортикоидов (парентерально метилпреднизолон по 500 мг на протяжении 2 дней или бетаметазон 7 мг одноразово). Клиническая эффективность глюкокортикоидов достигает лишь 50%, нежелательным является развитие синдрома рикошета (повторное обострение артрита), но терапия глюкокортикоидами может служить своеобразным «мостом» к назначению антигиперурикемической программы лечения.
Следует учитывать метаболические нарушения при лечении глюкокортикоидами: повышение артериального давления — до 47% случаев, безболевая ишемия миокарда по данным мониторинга электрокардиограммы — у 13% пациентов, повышение уровня глюкозы и иммунореактивного инсулина в сыворотке крови — у 23%, повышение уровня холестерина — у 47% и уровня триглицеридов — у 14%.
Таким образом, терапия глюкокортикоидами требует тщательного мониторинга в условиях стационара для предупреждения нежелательных побочных реакций со стороны сердечно-сосудистой системы.
Каковы характеристики глюкокортикоидов, применяемых для локальной инъекционной терапии острого подагрического артрита?
Врачебная практика требует дифференцированного подхода к выбору глюкокортикоидов для локальной инъекционной терапии (табл. 18).
Каковы показания для внутрисуставного введения глюкокортикоидов?
При остром подагрическом приступе (моноартрите) высокоэффективно локальное внутрисуставное введение глюкокортикоидов как короткого (гидрокортизон), так и пролонгированного действия.
Противопоказаниями являются сомнения относительно диагноза (септический артрит), гнойные повреждения кожи вокруг сустава, выраженный остеопороз.
Каковы дозы и порядок внутрисуставного введения глюкокортикоидов?
Тактика внутрисуставного применения глюкокортикоидов в терапии подагры и дозы препаратов основываются на размерах и количестве суставов (табл. 19).
Таблица 19
Дозы глюкокортикоидов для внутрисуставного введения (адаптировано по Тер-Вартаньян С.Х. и соавт., 1997)
|
Размер и количество суставов |
Доза препарата, мл |
Частота введения |
Повторное введение в другие суставы |
|
Крупные (коленные),1 |
1,0 |
Не чаще 1 раза в 3 мес |
Через 7 дней |
|
Средние (локтевые, плечевые), 2 |
0,5 |
||
|
Мелкие (межфаланговые, пястно-фаланговые), 4–5 |
0,1–0,2 |
Не чаще 1 раза в 1,5–2 мес |
Каковы особенности тактики лечения острой подагры?
Лечение острого приступа подагрического артрита желательно начинать в первые 24 ч, что позволяет быстро купировать симптомы. Известны следующие 3 основные направления лечения подагрического артрита: колхицин, нестероидные противовоспалительные препараты и глюкокортикоиды.
Препаратами первого выбора для лечения острой подагры общепризнаны нестероидные противовоспалительные препараты. Считается, что при раннем их назначении, в первые 48 ч приступа, выбор лекарственного средства не имеет значения (кроме ацетилсалициловой кислоты, которая способствует утяжелению клинических симптомов).
В случае невозможности применения колхицина, нестероидных противовоспалительных препаратов и глюкокортикоидов целесообразно назначение ингибиторов интерлейкина-1. В некоторых странах Европы, в том числе в Украине, зарегистрирован препарат канакинумаб. Он показан пациентам с тяжелым хроническим подагрическим артритом, резистентным к другой противовоспалительной терапии, или с сопутствующими заболеваниями, лимитирующими прием нестероидных противовоспалительных препаратов, глюкокортикоидов и колхицина, в отсутствие текущей инфекции.
Эффект канакинумаба превышает таковой глюкокортикоидов и колхицина, при этом сохраняется на протяжении 2–3 мес. Указанный период является оптимальным для назначения уратснижающих препаратов, так как каждый из них, независимо от механизма действия, в первые месяцы применения увеличивает риск новых приступов артрита.
Каковы показания для назначения глюкокортикоидов при хронической подагре?
Показаниями для назначения глюкокортикоидов служат:
- хронический подагрический артрит;
- пожилой возраст;
- наличие противопоказаний к назначению нестероидных противовоспалительных препаратов (гастропатия, хроническая почечная недостаточность), сопутствующие заболевания в фазе обострения;
- длительность моно- или олигоартрита более 5 мес;
- длительность моно- или олигоартрита более 1 мес, несмотря на лечение нестероидными противовоспалительными препаратами.
Удаление синовиальной жидкости и введение внутрисуставно глюкокортикоидов может быть эффективным и безопасным лечением при острой атаке. Несмотря на широкое применение на практике, рандомизированных контролируемых исследований не проводили. Отмечена высокая частота развития синдрома отмены (rebound-синдрома).
Существуют ли методы местного воздействия при подагрическом артрите?
Пациентам с острым и хроническим артритом назначают:
- артикулярные аппликации 20–33% раствора диметилсульфоксида в соединении с 15% раствором поливинилпиролидона и этидроновой кислоты ежедневно по 30 мин на протяжении 10 дней;
- 2% раствор этидроновой кислоты применяют еще и per os по 15 мл 2 раза в сутки до приема пищи курсами по 2 нед ежемесячно;
- артикулярные аппликации смеси диметилсульфоксида с жидкими формами нестероидных противовоспалительных препаратов.
Какой уровень урикемии следует считать оптимальным с точки зрения эффективности лечения подагры?
В Рекомендациях European League Against Rheumatism (2016) по лечению подагры была сохранена стратегия поддержания сывороточного уровня мочевой кислоты ниже целевого (<6 мг/дл; 360 мкмоль/л, точки насыщения, выше которой возникает вероятность кристаллизации, а ниже — кристаллы рассасываются). Эта терапевтическая цель лечения подагры позволяет достичь полного контроля над болезнью и отражает современные возможности уратснижающей терапии.
Однако обновленный вариант рекомендаций предполагает снижение порогового значения мочевой кислоты сыворотки крови до более низкого (<5 мг/дл; 300 мкмоль/л) у пациентов с тяжелой тофусной подагрой, так как в этом случае наблюдается почти линейная обратная зависимость между сывороточным уровнем мочевой кислоты и скоростью рассасывания тофусов. В последующем, при полном рассасывании отложений кристаллов и при отсутствии приступов артрита (как правило, для получения такого эффекта требуется несколько лет), целевой уровень может быть изменен на стандартный. Данное положение согласуется с рекомендациями Американского колледжа ревматологов, но не соответствует Британским национальным рекомендациям, в которых целевой уровень мочевой кислоты <5 мг/дл (300 мкмоль/л) рекомендуется поддерживать вне зависимости от тяжести подагры.
О необходимости поддержания такого низкого сывороточного уровня мочевой кислоты ведутся дискуссии, поскольку в физиологических концентрациях мочевая кислота может реализовывать антиоксидантные и нейропротекторные свойства, а при крайне низких значениях мочевой кислоты сыворотки крови возрастает риск развития нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, что послужило поводом определить нижний предел уровня мочевой кислоты (<3 мг/дл; 180 мкмоль/л), многолетнее поддержание которого нежелательно.
Подобные данные, косвенно подтверждающие нейропротекторное действие мочевой кислоты, были продемонстрированы и у пациентов с подагрой при изучении риска развития у них болезни Альцгеймера. Однако эти данные противоречивы. Так, недавний метаанализ, включивший 11 исследований, неожиданнейшим образом засвидетельствовал отсутствие различий в сывороточном уровне мочевой кислоты при болезни Альцгеймера по сравнению со здоровыми людьми.
Вместе с тем данные одного из фрагментов крупного исследования Rotterdam Scan Study продемонстрировали прямую корреляцию между сывороточным уровнем мочевой кислоты и атрофией белого вещества головного мозга, а также худшими показателями по шкалам, оценивающим когнитивные функции у пацентов с гиперурикемией.
Каковы показания для постоянного лечения манифестного течения подагры — «симптомной» гиперурикемии?
Пожизненное назначение антигиперурикемических лекарств показано в следующих случаях (табл. 20):
- более 2–3 случаев приступов подагры за 1–2 года;
- нефролитиаз (уратные или кальциевые камни);
- образование тофусов;
- хронический подагрический артрит с образованием костных эрозий;
- асимптомная гиперурикемия, при концентрации мочевой кислоты в крови >12 мг/дл или содержании мочевой кислоты в суточной моче >1100 мг (с целью снижения риска развития уратного нефролитиаза).
Таблица 20
Фармакотерапия для снижения уровня уратов у пациентов с хронической подагрой (адаптировано по Terkeltaub R.A., 2003)
|
Препарат/дозы |
Предостережения |
Комментарии |
|
Аллопуринол по 50–300 мг/сут (максимальная суточная доза — 800 мг) Коррекция начальной дозы по клиренсу креатинина:
|
|
|
|
Пробенецид сначала по 250 мг 2 раза в сутки, постепенно повышать дозу до 500 мг/сут |
|
|
|
Фебуксостат по 80–120 мг/сут |
не рекомендуется у пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью! |
|
Пациентам в возрасте моложе 40 лет при очень высоком уровне мочевой кислоты в сыворотке крови (более 480 мкмоль/л) и/или с коморбидностью (хроническая почечная недостаточность, артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность) уратснижающая терапия должна назначаться сразу же после установления диагноза. Ключевым тезисом фармакотерапии является достижение целевого уровня мочевой кислоты у пациентов с хронической подагрой (рис. 37).

Рис. 37. Ключевой тезис Европейской антиревматической лиги: «Остановите страдания пациентов с подагрой! Поддерживайте уровень мочевой кислоты <6 мг/дл (360 мкмоль/л)»
Препарат первой линии терапии — аллопуринол. Его применяют для лечения подагры уже более 50 лет, он достаточно хорошо изучен. Терапия аллопуринолом начинается с дозы 50–100 мг/сут, каждые 2–4 нед доза повышается на 50–100 мг до достижения целевого уровня мочевой кислоты (<360 мкмоль/л). Такие дозы и режим приема снижают риск обострений артрита и возникновения кожных аллергических реакций.
Эффект аллопуринола дозозависимый, поэтому низкие дозы (≤300 мг/сут) позволяют достичь целевого уровня мочевой кислоты менее чем в половине случаев. В большинстве случаев оправдано применение высоких доз — до 900 мг/сут, хотя такая терапия сопряжена с высоким риском развития нежелательных побочных явлений, особенно тяжелых кожных реакций.
С осторожностью препарат следует применять при наличии хронической болезни почек. Эффективность аллопуринола в отношении замедления прогрессирования хронической болезни почек пока не доказана.
Последние данные подтверждают, что длительный прием аллопуринола при подагре благоприятно влияет на отдаленный прогноз, вероятно, за счет снижения сердечно-сосудистого риска.
Препарат второй линии терапии — фебуксостат, другой ингибитор ксантиноксидазы. Лекарственное средство применяют в большинстве стран с 2009 г. Он более эффективен и безопасен при умеренном снижении скорости клубочковой фильтрации. Фебукcоcтат назначается в дозе от 40 до 120 мг/сут, медленное титрование дозы, как при назначении аллопуринола, не требуется. Это, с одной стороны, позволяет быстро достичь желаемого эффекта — снижения сывороточного уровня мочевой кислоты и растворения ее депозитов (тофусов), с другой — высока вероятность обострений артрита в первые месяцы терапии.
Стандартные дозы фебуксостата эффективнее аллопуринола в отношении снижения уровня урикемии (целевой уровень достигается чаще), в том числе у пациентов с хронической болезнью почек. При хронической болезни почек следует отдать предпочтение фебукcоcтату. Профиль сердечно-сосудистой безопасности препарата пока не изучен.
Препарат третьей линии терапии — внутривенные инфузии пеглотиказы, препарата уриказы — фермента, метаболизирующего мочевую кислоту до безопасного аллантоина. Препарат, применяемый при резистентности к любым другим методам лечения, вводится каждые 2 нед. Стоимость 1 инъекции превышает 5000 дол. США, что ограничивает возможность его широкого применения.
В случае недостаточной эффективности ингибиторов ксантиноксидазы возможно назначение урикозуриков (бензбромарона, пробенецида, лезинурада), в том числе в комбинации с ингибиторами ксантиноксидазы. При асимптоматической гиперурикемии назначение уратснижающих препаратов неоправданно. Следует ограничиться терапией, направленной на коррекцию факторов риска.
Так как в начале приема любых уратснижающих препаратов риск развития артрита повышается, в первые 6 мес лечения должна быть рассмотрена возможность назначения профилактической противовоспалительной терапии колхицином или нестероидными противовоспалительными препаратами, назначаемыми в низких дозах с учетом рисков возникновения неблагоприятных событий.
Как лечить тофусную подагру?
Цель лечения тофусной подагры — эффективное снижение уровня мочевой кислоты в сыворотке крови, что способствует резорбции уратов из тофусов. Положительный результат можно получить при длительном лечении аллопуринолом. Концентрацию мочевой кислоты в крови следует поддерживать как минимум на 1,0 мг/дл ниже верхней границы нормы (6,8 мг/дл). Профилактический прием колхицина в таблетках или нестероидных противовоспалительных препаратов снижает частоту развития подагрических приступов.
О чем свидетельствуют данные доказательной медицины по эффективности лечения хронической подагры?
В ходе масштабных клинических исследований (APEX, FACT, CONFIRMS, CACTUS, FORTE) фебуксостат доказал более мощный, чем у аллопуринола или плацебо, эффект (табл. 21).
Таблица 21
Основные международные исследования по уратснижающей терапии с применением аллопуринола и фебуксостата у пациентов с подагрой
|
Исследование |
Пациенты |
Препараты сравнения, длительность лечения |
Результаты, эффективность |
Результаты, безопасность |
|
FACT (2005) |
N=760, средний возраст — 52 года, уровень мочевой кислоты — 583,0±9,8 мкмоль/л |
Аллопуринол 300 мг/сут и фебуксостат 80–120 мг/сут, 52 нед |
В группе фебуксостата 80 мг достигали цели чаще, чем в группе аллопуринола 300 мг (53 и 21% соответственно) |
Группы не различались по частоте побочных реакций и серьезных побочных реакций |
|
APEX (2008) |
N=1073, средний возраст — 52 года, уровень мочевой кислоты — 583,0±9,8 мкмоль/л |
Плацебо, аллопуринол 300 мг/сут и фебуксостат 80–120 мг/сут, 28 нед |
Оба препарата эффективнее плацебо. В группе фебуксостата 80 мг достигали цели чаще, чем в группе аллопуринола 300 мг (76 и 41% соответственно) |
Группы не различались по частоте побочных эффектов и серьезных побочных эффектов |
|
EXCEL (2009) (открытая фаза исследований FACT и APEX) |
N=1086, средний возраст — 51 года, уровень мочевой кислоты — 583,0±9,8 мкмоль/л |
Аллопуринол 300 мг/сут и фебуксостат 80–120 мг/сут, 40 мес |
Оба препарата при длительном применении способствовали достижению целевого уровня мочевой кислоты при сокращении частоты приступов, которые через 32 мес практически прекратились |
— |
|
CONFIRS (2010) |
N=2268, средний возраст — 53 года, уровень мочевой кислоты — 583,0±9,8 мкмоль/л |
Аллопуринол 300 мг/сут и фебуксостат 40–80 мг/сут, 6 мес |
В группе фебуксостата 80 мг достигали цели чаще, чем в группе аллопуринола 300 мг (67 и 42% соответственно) |
Группы не различались по частоте побочных эффектов и серьезных побочных эффектов |
Так, эффективность фебуксостата и аллопуринола сравнивали в 2 клинических исследованиях фазы III APEX и FACT. В обоих исследованиях фебуксостат оказался значительно эффективнее аллопуринола в дозе 300 мг/сут в снижении уровня мочевой кислоты. При исходном уровне мочевой кислоты ≥0,600 мкмоль/л целевых значений достигли 41% пациентов при применении дозы фебуксостата 80 мг и 48% — дозы 120 мг, 9% — при приеме аллопуринола.
Удержать целевой уровень мочевой кислоты в исследовании APEX удалось 48 и 65% получавших фебуксостат в дозах 80 и 120 мг соответственно и только 22%, принимавших аллопуринол, в исследовании FACT таковых оказалось 53, 62 и 21% соответственно.
Уменьшение зон тофусов зафиксировано у 83% пациентов, получавших 80 мг фебуксостата, у 66% пациентов, получавших 120 мг фебуксостата, и у 50% больных, получавших аллопуринол.
В исследовании FACT в группах фебуксостата 80 и 120 мг/сут значительно больше пациентов достигли уровня мочевой кислоты в сыворотке крови менее 300 мкмоль/л на последнем визите, чем в группе аллопуринола 300 мг/сут — 47 и 66% против 13% соответственно. Различий в частоте обострений между 3 группами терапии не отмечено.
Исследование APEX включало пациентов с нарушением функции почек. Терапия фебуксостатом не только хорошо переносилась, но и была эффективной. Снижение концентрации мочевой кислоты в сыворотке крови наблюдалось у 44 и 45% пациентов, получавших 80 мг и 120 мг фебуксостата соответственно. В группе плацебо и аллопуринола уровень мочевой кислоты за время терапии не изменился.
Во время последних 3 визитов у пациентов в возрасте старше 65 лет значения мочевой кислоты менее 360 мкмоль/л отмечены у 75%, получавших фебуксостат, и 46%, принимавших аллопуринол. Переносимость терапии фебуксостатом оценивалась как хорошая.
Пациенты, закончившие фазу III исследований FACT и APEX, были включены в открытую фазу исследования EXCEL. Двухлетние результаты исследования EXCEL продемонстрировали, что, благодаря поддержанию сывороточных концентраций мочевой кислоты на уровне 360 мкмоль/л, более чем 97% пациентам не требовалось лечение обострений подагры. Размеры тофусов также уменьшились.
Пациенты, не достигшие сывороточного уровня мочевой кислоты менее 0,360 мкмоль/л, были переведены с аллопуринола на фебуксостат. В результате уровень мочевой кислоты снизился у 67% пациентов. Лишь у 9%, переведенных с фебуксостата на аллопуринол, уровень мочевой кислоты не превышал 360 мкмоль/л.
В обоих долговременных и двойных слепых исследованиях отмечена относительно высокая частота острых атак подагры в первые несколько недель после инициации лечения фебуксостатом и окончания профилактики колхицином или напроксеном.
В открытое клиническое исследование FOCUS, продолжавшееся 5 лет, были включены 116 пациентов, закончивших исследование II фазы. В течение всего периода наблюдения независимо от дозы фебуксостата количество достигших целевого уровня мочевой кислоты оставалось относительно стабильным: в первый год — 79% пациентов, во второй — 77%, в третий — 84%, четвертый — 90%. Число нуждающихся в противовоспалительной терапии уменьшилось, особенно в первые 2 года наблюдения.
Через 4 года терапии из 26 пациентов с тофусной подагрой у 76,9% наблюдалась значительная редукция тофусов. Среди нежелательных эффектов терапии указывали диарею, головную боль, гиперлипидемию, повышение уровня печеночных ферментов.
В исследовании CONFIRMS сравнивали эффективность и безопасность фебуксостата и аллопуринола у 2269 пациентов. Фебуксостат назначали в дозах 40 и 80 мг/сут, аллопуринол — 200 или 300 мг/сут в зависимости от почечной функции (при скорости клубочковой фильтрации 30–59 мл/мин/1,73 м2 доза аллопуринола составляла 200 мг/сут). Конечными контрольными точками были доля пациентов с сывороточным уровнем мочевой кислоты менее 6,0 мг/дл и с легкой или умеренной почечной дисфункцией, а также с уровнем мочевой кислоты в сыворотке крови менее 6,0 мг/дл. Безопасность лечения оценивали по частоте возникновения сердечно-сосудистых событий и смерти.
В группах фебуксостата 40, 80 мг и аллопуринола первичные точки были достигнуты в 45, 67 и 42% случаев соответственно. Снижение уровня мочевой кислоты при нарушении функции почек было более значительным при применении фебуксостата в дозе 80 мг (72%), чем при использовании фебуксостата 40 мг (50%) и аллопуринола (42%). Однако фебуксостат в дозе 40 мг продемонстрировал более высокую эффективность, чем аллопуринол (p=0,021). Частота побочных эффектов в группах терапии не различалась.
Сердечно-сосудистые осложнения в группе фебуксостата 40 мг не наблюдались, в группе фебуксостата 80 мг — отмечались в 0,4% случаев, как и в группе аллопуринола.
Таким образом, фебуксостат 80 мг оказался более эффективным по сравнению с фебуксостатом 40 мг и аллопуринолом. У пациентов с нарушением функции почек фебуксостат в обеих дозах был эффективнее, чем аллопуринол. Безопасность аллопуринола и фебуксостата была сопоставимой. Различий по побочным эффектам получено не было.
Метаанализ результатов 8 рандомизированных контролируемых исследований свидетельствует, что количество достигших уровня мочевой кислоты в сыворотке крови менее 6,0 мг/дл значительно выше в группах фебуксостата 80 и 120 мг/сут, чем в группах аллопуринола 100 или 300 мг/сут. Однако достижение целевых уровней сопоставимо между группами фебуксостата 40 мг и аллопуринола 300 мг. По безопасности фебуксостат во всех дозах сопоставим с аллопуринолом.
Таким образом, представленные данные дают основания полагать, что фебуксостат является эффективным средством для снижения уровня мочевой кислоты. Фебуксостат в дозе 80 мг/сут по эффективности превосходит аллопуринол в дозе 300 мг/сут, при этом обладает лучшим профилем безопасности и переносимости. Кроме того, при лечении фебуксостатом не требуется коррекции дозы у пациентов пожилого возраста, его применение не противопоказано лицам с хронической почечной недостаточностью.
Каковы терапевтические возможности предупреждения и лечения поражения почек при подагре?
Клинические проявления подагры не ограничиваются классическими приступами артрита и сопровождаются поражением почек (подагрическая нефропатия), характеризуются склонностью к камнеобразованию и формированию уратной нефропатии, связанной с постепенным отложением микролитов в интерстиции и пирамидках почек, развитием вялотекущего хронического воспаления, часто приводящего к снижению экскреторной функции почек. В связи с этим в комбинированной терапии больных подагрой следует учитывать высокий риск повреждения почек и применять препараты, способствующие растворению и предупреждению образования мочекислых и смешанных камней.
При всех клинических вариантах болезни, особенно при изолированной асимптоматической гиперурикозурии, нефролитиазе и уратной нефропатии, применяют средства, воздействующие на рН мочи (табл. 22). Изменение рН мочи способствует улучшению растворения оксалата кальция, препятствует его кристаллизации и комплексообразованию в моче.
Таблица 22
Средства, изменяющие рН мочи
|
Состав |
Лекарственная форма |
Применение |
|
Препарат, содержащий пиперазин, натрия бензоат, гексаметилентетрамин, лития бензоат |
Порошок в стеклянных банках по 100 г |
Внутрь перед едой по чайной ложке в 0,5 стакана воды 3–4 раза в сутки |
|
Препарат, содержащий кислоту лимонную, тринатрия цитрат, калия гидрокарбонат |
Гранулы в пакетах по 200 г |
От 2 раз в сутки по 1 мерной ложке ˗до 3 раз в сутки по 2 мерных ложки |
|
Продукт, содержащий экстракты фукуса, травы филлантуса нирури, травы десмодиума стираксолистого |
Гранулы в упаковке по 3 г |
По 3 г утром и днем после еды и 6 г вечером после еды |
При применении урикозурических препаратов необходимо препятствовать чрезмерному закислению мочи. Применение цитратных препаратов (калий-натрий-тригидропентацитратный комплекс) дополнительно к ингибиторам ксантиноксидазы у пациентов с гиперурикемией снижает уровень мочевой кислоты в крови, повышает скорость клубочковой фильтрации и улучшает функцию почек. А при уратной нефропатии длительное лечение частично восстанавливает функцию почек.
В этом плане интерес представляет и калия-натрия-гидроцитратный комплекс, продемонстрировавший существенное влияние на пируновый обмен: снижение уровня мочевой кислоты, повышение экскреции мочевой кислоты с мочой и поддержание рН мочи на уровне 6,2–6,8. Более того, отмечено уменьшение размеров конкрементов в почках по данным ультразвукового исследования. Заслуживает внимания и факт независимого антигипертензивного эффекта и стабилизации артериального давления у пациентов с гиперурикемией и артериальной гипертензией. Препарат назначают по 3 мерные ложки в сутки (5–7,5 г гранул, что эквивалентно 44–66 ммоль щелочи), внутрь, после еды в 3 приема.
Препарат, содержащий пиридоксина гидрохлорид, магния цитрат, кислоту лимонную, натрия цитрат, калия цитрат, в отличие от остальных представителей группы цитратных смесей, способствует растворению камней из сочетания мочевой кислоты и щавелевокислого кальция.
При применении цитратных препаратов рекомендуется регулярное исследование рН мочи. Контроль pH мочи следует проводить при помощи индикаторных бумажных полосок и цветной шкалы.
Какие еще группы лекарственных препаратов используют для лечения уратной нефропатии?
Применение антиметаболитов, азатиоприна и 6-меркаптопурина при подагрической нефропатии основано на их тормозящем влиянии на синтез пуринов. Они способны повышать клубочковую фильтрацию, уменьшать протеинурию, отложение иммунных комплексов на базальных мембранах капилляров и клеточную гломерулярную пролиферацию. При почечной недостаточности они противопоказаны.
Как предотвратить развитие острого подагрического приступа в начале или на фоне лечения антигиперурикемическими препаратами?
С целью профилактики развития острых приступов подагры на протяжении первых 6–12 мес лечения необходимо повышать дозу антигиперурикемического препарата постепенно, одновременно назначая низкие дозы нестероидных противовоспалительных препаратов 2 раза в сутки, или колхицин внутрь по 0,6 мг 2 раза в сутки. Если у больного отмечают хроническую почечную недостаточность, то дозы препаратов снижают в соответствии со степенью нарушения функции почек.
Профилактику следует начинать за 2 нед до начала уратснижающей терапии. У пациентов без тофусов профилактику следует проводить на протяжении 6 мес. Оптимальная длительность профилактики у пациентов с тофусами не определена, возможно, ее следует проводить вплоть до исчезновения тофусов.
Как планировать медикаментозную профилактику новых приступов подагрического артрита?
Необходимость медикаментозной профилактики обусловлена повышением частоты возникновения приступов артрита после назначения любой уратснижающей терапии, что способствует плохой приверженности к лечению. Возникновение таких приступов связано с дисперсией кристаллов моноурата натрия в начальной фазе их растворения. Эти вопросы следует детально обсуждать с пациентом. Рекомендуется проводить профилактику в течение 6 мес. Нестероидные противовоспалительные препараты (напроксен 250 мг 2 раза в сутки) и колхицин (0,6 мг/сут) продемонстрировали в этом отношении сопоставимую эффективность, а решение о назначении конкретного препарата принимает лечащий врач.
При длительном применении колхицина требуется максимальная осторожность в случае сочетанного назначения с ингибиторами ГМГ-КоА-редуктазы (статинами), но в противовес этому — потенциальная польза колхицина, связанная с профилактикой сердечно-сосудистых событий у пациентов с подагрой, сахарным диабетом и в общей популяции. Так, существуют данные о том, что 4-летний прием препарата ассоциировался с трехкратным снижением риска возникновения острого коронарного синдрома. В среднем профилактическая терапия проводилась чуть более полугода. Более длительное осуществление профилактического лечения вряд ли оправдано, так как учащение приступов происходит далеко не всегда, особенно при соблюдении правил титрования дозы аллопуринола.
Что нового в лечении подагры?
В последние десятилетия развивается направление снижения общего содержания уратов у пациентов с тяжелой тофусной подагрой при помощи рекомбинантного фермента уриказы (в норме отсутствует у человека) — разбуриказы. Рекомбинантная уриказа превращает мочевую кислоту в алантоин. Этот препарат применяют для лечения синдрома лизиса опухолей, а в последнее время — и при резистентной к лечению тофусной подагре. Однако при длительном его применении может развиться антигенный ответ. Сегодня разработана пегилированная форма препарата с удлиненным периодом полувыведения и более низким риском развития аллергических реакций.
Препарат пеглотиказа (PEG-уриказа) является ферментом, метаболизирует мочевую кислоту в безвредное вещество, эффективен при резистентных случаях подагры, одобрен Управлением по контролю за пищевыми продуктами и лекарственными средствами США в 2010 г. Пеглотиказа в дозе 8 мг (инфузии каждые 2 нед) у пациентов с тяжелой подагрой и рефрактерностью/непереносимостью адекватных доз урикодепрессивных препаратов может быть эффективной ~ у 40% пациентов. Однако высокий риск анафилаксии при внутривенном введении требует сочетания с антигистаминными препаратами.
Появление группы препаратов ингибиторов интерлейкина-1 если и не стало прорывом в лечении приступов артрита, то глобально изменило возможности симптоматической терапии у пациентов наиболее тяжелым течением заболевания, с резистентностью и/или наличием абсолютных противопоказаний к любой стандартной, в том числе, комбинированной терапии.
Применение ингибиторов интерлейкина-1 пока не слишком распространено из-за их высокой стоимости, но более эффективно, чем назначение инъекционных глюкокортикоидов и колхицина. В Украине зарегистрирован препарат канакинумаба, ингибитор интерлейкина-1β, открывающий новые возможности в купировании боли и других признаков артрита, улучшении качества жизни пациентов с подагрой, резистентных к любой другой, в том числе, комбинированной, противовоспалительной терапии. Использование его для длительной профилактики артрита благодаря продолжительному периоду полувыведения позволяет снизить вероятность обострений уже в первые месяцы ее инициации.
На сегодня изучено влияние 3 ингибиторов интерлейкина-1 на течение подагры: канакинумаб (анти-интерлейкин-1 моноклональные антитела), анакинра и рилонацепт (препараты, предотвращающие связывание интерлейкина-1 с его рецептором).
На ежегодном Европейском конгрессе ревматологов в 2018 г. было репортировано, что канакинумаб значительно снижал частоту возникновения приступов подагры, более чем наполовину по сравнению с плацебо, независимо от базового уровня мочевой кислоты сыворотки крови. Канакинумаб — моноклональное антитело, которое блокирует воспалительный путь, опосредованный интерлейкином-1β и по механизму действия не влияет на сывороточный уровень мочевой кислоты. Он лицензирован для лечения некоторых редких аутовоспалительных заболеваний. На сегодня были опубликованы и данные о его эффективности в предотвращении приступов подагры у пациентов при наличии противопоказаний к стандартной терапии. В настоящее время препарат не одобрен для этого показания.
Эти данные являются вторичным анализом исследования CANTOS (Canakinumab ANti-inflammatory Thrombosis Outcomes Study; 10 061 пациент с атеросклерозом, высокочувствительный С-реактивный белок ≥2 мг/л и повышенным сердечно-сосудистым риском), предполагавшего проверку воспалительной теории атеросклероза и применения канакинумаба с целью вторичной профилактики сердечно-сосудистых событий. Выявлено благоприятное влияние препарата на исходы, связанные с атеросклерозом, а также частоту приступов подагры. Канакинумаб не влиял на сывороточный уровень уратов, однако снижал уровень высокочувствительного C-реактивного белка.
Заслуживают внимания и данные последних исследований о применении канакинумаба в дозе 50 мг/сут на протяжении 16 нед как более эффективного препарата, для предотвращения атак подагрического артрита при инициации уратснижающей терапии по сравнению с колхицином в стандартной дозе.
Управление по контролю за пищевыми продуктами и лекарственными средствами США зарегистрировало препарат лезинурада, созданный американскими учеными. Он относится к группе селективных ингибиторов реабсорбции мочевой кислоты и обладает способностью блокировать URAT1, который является транспортером органических анионов, что способствует выведению мочевой кислоты из организма.
Эффективность лезинурада была доказана в ходе клинических исследований с участием более 1500 пациентов. Было установлено, что наиболее эффективным является прием препарата в суточной дозе 200 мг. Однако принимать лезинурад следует только в сочетании с ингибиторами ксантиноксидазы, так как он обладает нефротоксичностью. Согласно решению Управления по контролю за пищевыми продуктами и лекарственными средствами США компания-производитель должна провести дополнительные исследования для выявления других возможных побочных эффектов (в частности кардиотоксичности).
Нужно ли лечить бессимптомную гиперурикемию?
Распространенность бессимптомной гиперурикемии среди населения составляет 2–13%. Многие годы врачи сомневались, но назначали гипоурикемические средства при бессимптомной гиперурикемии. В наши дни такая тактика признана неоправданной и слишком дорогостоящей. Несмотря на высокий риск подагрического артрита при гиперурикемии, особенно при очень высокой концентрации мочевой кислоты в сыворотке крови, профилактическое применение гипоурикемических средств не имеет смысла, так как в большинстве случаев при гиперурикемии подагра так и не развивается. Более того, структурные изменения в почках и тофусы никогда не выявляются до первого приступа подагры.
Бессимптомную гиперурикемию нельзя считать причиной нарушения функции почек, и назначение гипоурикемических средств не влияет на течение заболеваний почек. Хотя подагра часто сопровождается мочекаменной болезнью, а у многих пациентов с этой патологией отмечают гиперурикемию, риск образования камней при бессимптомной гиперурикемии не установлен. Нельзя также считать гиперурикемию независимым фактором риска развития атеросклероза.
Таким образом, ввиду высокой стоимости и токсичности гипоурикемических средств их назначение при бессимптомной гиперурикемии оправдано только при риске возникновения острой мочекислой нефропатии. Массовые обследования для выявления бессимптомной гиперурикемии также не оправданы. Однако если гиперурикемия выявлена, следует установить и по возможности устранить ее причину. Кроме того, необходимо лечить сопутствующие болезни, такие как артериальная гипертензия, гиперхолестеринемия, сахарный диабет и ожирение. Пациентам без подагры и с уровнем сывороточной концентрации мочевой кислоты 540 мкмоль/л и ниже следует назначать немедикаментозное лечение.
Итак, асимптоматическая гиперурикемия не служит показанием к назначению соответствующего лечения. Необходима только коррекция предрасполагающих факторов. При этом именно правильное питание — основа лечения. Однако у пациентов с длительно повышенным (до 10 мг/дл) уровнем мочевой кислоты в крови риск развития острого приступа подагры повышен на 90%, и многие врачи назначают лечение до развития подагрической атаки.
В каких случаях следует лечить бессимптомную гиперурикемию?
Единственное исключение составляет профилактика острой мочекислой нефропатии у больных с новообразованиями при назначении цитостатиков. Лечение бессимптомной гиперурикемии показано или при резком повышении уровня мочевой кислоты в крови, например, при синдроме распада опухоли, или при гиперурикемии высокой степени (концентрация мочевой кислоты в сыворотке крови >12 мг/дл или содержание мочевой кислоты в суточной моче >1100 мг). У половины больных, имеющих такой высокий уровень мочевой кислоты в крови, отмечают уратный нефролитиаз.
Каковы особенности кардиопротекции при подагре?
Признанные стандарты лечения и профилактики сердечно-сосудистых заболеваний в мировой лечебной практике имеют обратную сторону возможных нежелательных воздействий лекарств на разные виды обмена, когда нарушение одного компонента гомеостаза приводит к каскаду патогенетических реакций, нарушая другие виды обмена с формированием модели метаболического синдрома. Именно таким образом повышается риск развития случаев терапевтически индуцированной подагры. В связи с этим особое значение приобретает метаболическая безопасность выбора лекарственных препаратов (отсутствие воздействия не только на липидный и углеводный обмен, но и на уровень мочевой кислоты в сыворотке крови) в программах длительного лечения артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, особенно у пациентов с гиперурикемией и подагрой.
Что касается лекарств, которые применяются в практической кардиологии, то сегодня об их влиянии на уровень мочевой кислоты в крови и липидный спектр известно следующее:
- Ингибиторы ангиотензинпревращающего фермента являются метаболически нейтральным классом препаратов, поскольку они не влияют на метаболизм пуринов, глюкозы и липидов. Существуют отдельные данные о том, что именно периндоприл как представитель ингибиторов ангиотензинпревращающего фермента обладает свойством снижать уровень мочевой кислоты у больных артериальной гипертензией. Необходимо учитывать и то, что при длительном комбинированном приеме ингибиторов ангиотензинпревращающего фермента с аллопуринолом возможно развитие нейтропении. При их назначении с нестероидными противовоспалительными препаратами в условиях хронической почечной недостаточности существенно повышается риск развития гиперкалиемии, побочных эффектов и снижается эффективность.
- Блокаторы рецепторов ангиотензина II (типа АТ1) могут быть альтернативой ингибиторам ангиотензинпревращающего фермента при их непереносимости или неэффективности в лечении кардиологической патологии при подагре именно за счет метаболических эффектов (улучшение липидного спектра со снижением общего холестерина, повышением уровня липопротеидов высокой плотности, снижение содержания мочевой кислоты, что свойственно лозартану). Особенностью представителя этого класса препаратов — лозартана — является наличие уникального урикозурического эффекта, что позволяет использовать его при лечении пациентов как с метаболическим синдромом, так и с подагрой.
- Блокаторы кальциевых каналов не оказывают негативного влияния на уровни глюкозы и мочевой кислоты, а также метаболизм липидов. Наряду с кардиопротекторным действием (амлодипин, лацидипин, верапамил, дилтиазем) проявляют нефропротекторное действие, особенно у пациентов с подагрой, у которых отмечают как артериальную гипертензию, так и нефропатию, поскольку способны вызвать дилатацию афферентной артериолы клубочка, тормозить пролиферацию клеток мезангия и уменьшать степень протеинурии, пассаж макромолекул через мезангий (верапамил, дилтиазем). При комбинации блокаторов кальциевых каналов с ингибиторами ангиотензинпревращающего фермента, блокаторов кальциевых каналов с блокаторами рецепторов ангиотензина достигаются оптимальные кардио- и нефропротекторные эффекты.
- Блокаторы бета-адренорецепторов не могут быть использованы при подагре в связи с их гиперурикемическим эффектом. Считается, что только при применении кардиоселективных блокаторов бета-адренорецепторов при дисфункции миокарда левого желудочка не возникает существенного повышения уровня мочевой кислоты в сыворотке крови. Что касается блокаторов бета-адренорецепторов с альфа-блокирующим эффектом, их воздействие на гиперурикемию неизвестно.
- Диуретики. Тиазидные диуретики обусловливают развитие подагры (тиазид-индуцированная подагра) или усиливают гиперурикемию и гиперкалиемию, поэтому назначение их при подагре, особенно при поражении почек, считается противопоказанным. Они потенцируют экскрецию уратов и повышают риск развития хронического тубулоинтерстициального нефрита. При условии, что гидрохлоротиазид у пациента эффективно контролирует артериальное давление, возможно, следует рекомендовать постоянный, а не интермиттирующий прием диуретика, поскольку последняя схема повышает риск развития обострений подагры.
Преимущество при подагре отдают антагонистам альдостерона, механизм действия которых не обусловливает развитие гиперурикемии и образование в почках камней. При развитии хронической почечной недостаточности применение этих лекарств потребует контроля уровня калия в крови, а при терминальной стадии — отмены.
Несмотря на опасность развития или усиления выраженности гиперурикемии, петлевые диуретики назначают в случае отечного синдрома при сердечной недостаточности и в клинических случаях, когда антагонисты альдостерона опасны в отношении развития гиперкалиемии. Гиперурикемический эффект петлевых диуретиков значительно ниже, чем у тиазидных. Считают, что оптимальным выбором диуретика при подагрических пороках сердца в случае развития сердечной недостаточности и артериальной гипертензии является тиениловая кислота, которая имеет не только диуретический и антигипертензивный, но и гиперурикемический эффект (преимущественно урикодепрессивный).
- Блокаторы имидазолиновых рецепторов 1-го типа являются метаболически нейтральными препаратами, которые в ближайшее время, возможно, найдут свое место в лечении пациентов с метаболическим синдромом и подагрой.
- Не изучено влияние метаболических кардиоцитопротекторов (триметазидина, препаратов янтарной кислоты и др.) на состояние пуринового обмена.
Таким образом, важными являются выводы о том, что ингибиторы ангиотензинпревращающего фермента и блокаторы кальциевых каналов имеют слабый урикозурический эффект, но не снижают уровень мочевой кислоты в сыворотке крови, а селективные блокаторы бета-адренорецепторов не влияют на ее уровень. Особое внимание привлекает препарат лозартан — единственный среди антагонистов АТ1-рецепторов ангиотензина ІІ, который благодаря особенностям фармакодинамики молекулы (но не активных метаболитов) существенно снижает уровень мочевой кислоты в сыворотке крови путем влияния на реабсорбцию уратов в проксимальных канальцах почек.
На чем базируются приоритеты лозартана в кардиологической практике?
Уникальный урикозурический эффект лозартана привлек внимание при анализе результатов исследования LIFE (Losartan Intervention For Endpoint reduction in hypertension — Исследование влияния лозартана на конечные точки при гипертензии, 2002), в котором сравнивали активность лозартана и атенолола. Главные результаты исследования состояли в оценке риска возникновения первичных инсультов при 2 режимах терапии артериальной гипертензии. Было показано достоверное снижение риска возникновения фатального и нефатального инсульта у пациентов с изолированной систолической артериальной гипертензией (скорректированное снижение риска 40%; р=0,02), с фибрилляцией предсердий (скорректированное снижение риска 49%; р=0,018) и у пациентов без сердечно-сосудистых заболеваний (скорректированное и нескорректированное снижение риска 34%; р<0,001) в группе больных, которые принимали лозартан, в сравнении с атенололом.
В то же время на фоне лечения лозартаном было определено достоверное снижение частоты случаев возникновения сахарного диабета (скорректированное и нескорректированное снижение риска 25%; р<0,001), что акцентировало метаболические эффекты препарата. Относительно урикозурического эффекта лозартана был проведен повторный анализ результатов исследования LIFE в зависимости от уровней мочевой кислоты в сыворотке крови и их динамики. Повышение содержания мочевой кислоты на протяжении исследования было достоверно более значительным (р<0,0001) в группе больных, которые получали атенолол (на 44,4±72,5 мкмоль/л) по сравнению с пациентами, получавшими лозартан (на 17,0±69,8 мкмоль/л).
Содержание мочевой кислоты и частота сердечно-сосудистых заболеваний в общей группе наблюдения были достоверно сильно связаны (р<0,0001). Вклад содержания мочевой кислоты в воздействие лозартана на первичную комбинированную конечную точку составил 29% (14–107%), р=0,0004. Связь между динамическим уровнем мочевой кислоты и повышенным сердечно-сосудистым риском оказалась сильнее у женщин (р<0,0001) по сравнению с мужчинами (р=0,066), хотя связь «пол–результат» была статистически незначительной (р=0,079).
Таким образом, исследование LIFE первым продемонстрировало связь снижения уровня мочевой кислоты в сыворотке крови с положительным влиянием на частоту возникновения осложнений при лечении артериальной гипертензии. Однако и сегодня досконально не выяснено, является ли это взаимодействие причинно-следственным.
Следует сделать акцент и на том, что лозартан также обладает способностью устранять гиперурикемию, связанную с применением тиазидных и тиазидоподобных диуретиков. Проведенные многочисленные исследования с различными комбинациями сартанов и тиазидных диуретиков продемонстрировали уникальность данного свойства молекулы лозартана. Ни один из сартанов, кроме лозартана, не обладал способностью снижать уровень мочевой кислоты при комбинации с тиазидными и тиазидоподобными диуретиками.
Эти данные позволяют рассматривать лозартан как препарат выбора у больных артериальной гипертензией с симптомной и бессимптомной гиперурикемией, в том числе вызванной применением тиазидных и тиазидоподобных диуретиков.
Действительно ли лозартан позволяет оптимизировать программу антигипертензивной терапии у больных подагрой или гиперурикемией при сочетании с артериальной гипертензией?
Основанием для рациональной фармакотерапии у этой группы больных является главный обобщенный тезис: антигипертензивный препарат, кроме эффекта собственно снижения артериального давления, дополнительно должен снижать частоту развития сердечно-сосудистых осложнений, что является сутью первичной профилактики высокого риска сердечно-сосудистых заболеваний.
В контексте первичной профилактики инсультов такая возможность доказана в исследовании LIFE для лозартана, который, безусловно, отвечает всем критериям метаболической безопасности и способствует существенному стабильному урикозурическому эффекту. В последнее десятилетие тактика по отношению к сартанам — блокаторам рецепторов ангиотензина II как к антигипертензивной группе препаратов, дорогостоящей альтернативе ингибиторов ангиотензинпревращающего фермента, применение которой считали целесообразным лишь при их непереносимости, сегодня изменилась, показания к применению значительно расширились и включают различные варианты артериальной гипертензии высокого и очень высокого риска.
Результаты исследования LIFE RENAAL (The Reduction of Endpointsin NIDDM with the Angiotensin II Antagonist Losartan, 2001) доказали, что за счет предупреждения осложнений, угрожающих жизни, можно достичь значительного снижения расходов на ведение больных. Повысилась уверенность врачей в способности улучшить прогноз для широкого круга больных, учитывая появление в Украине высокоэффективного генерика лозартана, который продемонстрировал полную биоэквивалентность оригинальному лозартану, а в клинической практике — хорошую переносимость и приверженность пациентов при безоговорочном приоритете соотношения стоимость/клинический эффект.
Каковы основные принципы кардиопротекции при подагре?
1. Диета с ограничением пуринов.
2. Диетическая коррекция гиперактивности симпатической нервной системы: ограничение употребления белков, поваренной соли, насыщенных жиров, уменьшение массы тела, отказ от курения. Назначение диеты, богатой ненасыщенными жирными кислотами.
3. Снижение активности основного заболевания: применение адекватных доз нестероидных противовоспалительных препаратов в виде различных лекарственных форм — растворы, таблетки, мази, ректальные свечи.
4. Адекватная и длительная уратснижающая терапия.
5. Отмена лекарств с негативным метаболическим воздействием: глюкокортикоидов (вызывают гипергликемию, гиперлипидемию и гиперурикемию); неселективных блокаторов бета-адренорецепторов (приводят к развитию гиперурикемии), тиазидных и тиазидоподобных диуретиков (вызывают гиперурикемию, гипокалиемию), препаратов разных групп, которые вызывают гиперурикемию, — леводопы, этамбутола, ацетилсалициловой кислоты, никотиновой кислоты.
6. Отмена препаратов с кардиотоксическим действием — сердечных гликозидов, цитостатиков.
7. При коморбидных состояниях применение метаболически нейтральных групп кардиологических препаратов — ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II, блокаторов кальциевых каналов, блокаторов имидазолиновых рецепторов, блокаторов альфа-1 адренорецепторов и их рациональных комбинаций.
8. Антиагреганты (дипиридамол).
9. Антитромбоцитарные средства (клопидогрель, тиклопидин).
10. Контроль и адекватная коррекция артериальной гипертензии метаболически нейтральными классами антигипертензивных средств. Помимо лозартана (одобрен при подагре еще в 2006 г.), обновленные рекомендации включают блокаторы кальциевых каналов.
11. Коррекция и эффективный контроль гиперлипидемии: статины (аторвастатин), фенофибрат, которые обладают умеренным урикозурическим действием.
Можно ли сегодня контролировать инсулинорезистентность с целью кардиопротекции у пациентов с метаболическим синдромом?
Поскольку инсулинорезистентность в наше время признается важной патогенетической составляющей компонентов метаболического синдрома, то врачу в общей клинической практике необходимо четко знать фармакодинамический профиль основных кардиологических, а также антидиабетических препаратов, потому что они по-разному влияют на ее уровень (табл. 23).
Таблица 23
Влияние сердечно-сосудистых и антидиабетических препаратов на инсулинорезистентность (по Кайдашеву И.П. и соавт., 2009)
|
Препараты |
Эффекты на инсулинорезистентность |
Детали |
|
Тиазолидиндионы (глитазоны) |
Благоприятный |
Агонисты рецепторов, активируемых пероксисомными пролифераторами-гамма, образование глюкозы в печени |
|
Метформин |
Благоприятный |
|
|
Антагонисты альфа1-адренорецепторов, например, доксазозин |
Благоприятный |
|
|
Антагонисты кальция |
Эффект слабый, прямой эффект отсутствует (нейтральный) |
|
|
Ингибиторы ангиотензинпревращающего фермента |
Благоприятный |
Возможно, через ангиотензин II/эндотелин |
|
Антагонисты рецепторов ангиотензина II |
Нет эффекта |
|
|
Исключение: телмисартан |
Благоприятный |
Агонизм рецепторов, активируемых пероксисомными пролифераторами-гамма |
|
Тиазидные диуретики |
Неблагоприятный |
Высвобождение панкреатического инсулина |
|
Блокаторы бета-адренорецепторов |
Неблагоприятный |
|
|
Антигипертензивные препараты центрального действия (клонидин, метилдопа, моксонидин, рилменидин) |
Возможно, слабые эффекты |
Через депрессию симпатической нервной системы |
Так, чрезвычайно интересными являются данные, полученные в последнее время, о том, что назначение метформина больным подагрой с нарушением углеводного обмена снижает уровень мочевой кислоты в среднем на 22% и снижает частоту приступов болезни.
Особенности антигипертензивной терапии при подагре
Артериальная гипертензия у больных подагрой может быть как симптоматической при подагрической нефропатии, так и эссенциальной. Установлена положительная корреляционная связь между уровнями артериального давления и мочевой кислоты. Артериальной гипертензией является как фактором риска возникновения подагры, так и фактором, который ускоряет развитие хронической почечной недостаточности. Именно поэтому антигипертензивная терапия должна планироваться с учетом воздействия лекарств на метаболизм мочевой кислоты и наличие нефропротекторного эффекта.
Доказанным сегодня является влияние антигипертензивных препаратов на обмен мочевой кислоты, а именно: лозартан повышает экскрецию мочевой кислоты почти на 30%, а амлодипин угнетает реабсорбцию мочевой кислоты. При необходимости включения в лечебные программы тиазидных диуретиков рациональной считается комбинация гидрохлоротиазида и лозартана, при этом последний нивелирует диуретик-индуцированную гиперурикемию и снижает риск возникновения приступов подагры. Известен и нефропротекторный эффект ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II и блокаторов кальциевых каналов, которым следует отдавать предпочтение в программах длительного контроля артериального давления у этой категории больных.
Каковы особенности лечения подагры после трансплантации органов?
В этих клинических случаях лечение острых приступов подагры является сложной задачей. Терапия циклоспорином и почечная недостаточность служат относительными противопоказаниями для назначения нестероидных противовоспалительных препаратов, а назначение колхицина с азотиоприном может быть поводом для развития тяжелой нейтропении. Урикозурические препараты могут быть неэффективными вследствие низкой клубочковой фильтрации (<50 мл/мин). Наиболее безопасным является назначение глюкокортикоидов и введение их в суставы. Необходимо также время от времени делать посев синовиальной жидкости на флору.
Эффективны ли пищевые добавки и витаминные комплексы при лечении подагры и гиперурикемии?
Оказывается, почти каждый четвертый пациент с подагрой использует пищевые добавки и витаминные комплексы, как с целью терапии артрита, так и для снижения уровня мочевой кислоты в сыворотке крови.
Анализ клинических наблюдений свидетельствует о том, что применение альтернативных и комплементарных методов в 5 раз увеличивало стоимость лечения. Однако сегодня не выявлены лучшие результаты при добавлении к стандартной терапии альтернативных методов в показателях, отражающих качество жизни пациентов, частоту приступов артрита, уровень мочевой кислоты в сыворотке крови.
Следует отметить, что данные об эффективности альтернативных методов лечения острых артритов при подагре, за исключением применения криотерапии (низкий уровень доказательности), отсутствуют.
Какими должны быть советы больным подагрой?
Режим:
- физическая активность;
- нормализация массы тела (контроль объема талии, массы тела).
Обувь:
- внимание! Не носить узкую обувь;
- обувь должна быть соответствующей по размеру и комфортной;
- каблук не должен превышать 1,5–2 см.
Современный взгляд на диетические «предпочтения»
В отношении нефармакологических методов лечения и профилактики подагры Европейская антиревматическая лига еще в 2006 г. рекомендовала предоставлять пациентам полную информацию относительно заболевания и его лечения, оценивать сопутствующие заболевания, уменьшать массу тела и потребление калорий, ограничить потребление алкоголя. Согласно внесенным в 2014 и 2016 г. дополнениям не рекомендуются напитки с высоким содержанием фруктозы (например кукурузный сироп), алкогольное и безалкогольное пиво (из-за высокой концентрации пуринов) и крепкие спиртные напитки, при этом 1–2 порции сухого вина в этом отношении интактны.
Потребление кофе обратно коррелирует с сывороточным уровнем мочевой кислоты и обусловливает снижение риска развития подагры, независимо от содержания в нем кофеина. Установлено, что обезжиренное, в том числе сухое, молоко снижает частоту приступов артрита. Недостоверное снижение сывороточного уровня мочевой кислоты отмечается при приеме 2 доз экстракта зеленого чая.
Новые данные о влиянии диетических факторов на риск развития гиперурикемии и подагры значительно отличаются от существовавших до недавнего времени диетических рекомендаций. Наряду с традиционным запретом продуктов с высоким содержанием пуринов (морепродукты, сардины, мясо) в настоящее время рекомендуется включение в рацион грибов и продуктов растительного происхождения, богатых пуринами (спаржа, цветная капуста, шпинат, чечевица, соя, овсяные хлопья). Получены убедительные данные о том, что они не повышают уровень мочевой кислоты и не обусловливают развитие подагры.
Суточное потребление белка не должно превышать 70 г, поскольку избыток белковой пищи усиливает продукцию эндогенных пуринов.
Ежедневное употребление нежирных молочных продуктов, в том числе низкожирового йогурта или 2 стаканов (480 мл) снятого молока способствует снижению заболеваемости подагрой. Содержащиеся в молочных продуктах белки: казеин и лактальбумин снижают уровень мочевой кислоты путем повышения ее экскреции с мочой.
Каковы диетические правила для пациентов с гиперурикемией?
При гиперурикемии и подагре главная роль отводится диетическому питанию. Основная цель диеты — снижение содержания мочекислых соединений в организме. Если на 5–7-й день диетического питания уровень мочевой кислоты в крови не снижается, то речь идет, скорее всего, о вторичной подагре, вызванной сильным снижением фильтрации в почках или массивным распадом собственных тканей организма.
Основные диетические правила
- Исключение или ограничение количества продуктов, богатых пуриновыми основаниями.
- Введение продуктов, не содержащих пуриновые основания или с низким их содержанием. Данные продукты должны полностью покрывать потребности организма в калориях и питательных веществах (белки, жиры, углеводы).
- Введение достаточного количества жидкости. При употреблении большого количества жидкости (не менее 2 л воды в день, не считая жидких блюд) увеличивается количество циркулирующей крови и ускоряется фильтрация в почках. Благодаря увеличившемуся объему крови концентрация мочевой кислоты снижается и не происходит ее отложение в виде солей в мягких тканях. Интенсивная же фильтрация в почках препятствует отложению уратов в почечной лоханке и мочевом пузыре. При наличии хронических заболеваний почек нужно уточнить необходимость обильного питья у лечащего врача, так как в этом случае оно может привести к резкому повышению артериального давления.
- Уменьшение массы тела. В большинстве случаев избавление от избыточных килограммов улучшает работу внутренних органов, благодаря чему мочевая кислота лучше выводится из организма. Кроме того, уменьшается количество липидов и липопротеинов, циркулирующих в крови и способствующих накоплению мочевой кислоты.
Полезные комментарии:
- Мясо молодых животных содержит больше пуриновых оснований, чем мясо взрослых животных, поэтому необходимо избегать или хотя бы ограничивать его употребление. Также рекомендуется ограничить употребление насыщенных жиров (подсолнечное масло, сливочное масло), так как в условиях гиперлипидемии становится затруднительной экскреция (выделение) мочевой кислоты почками.
- При подагре назначают диету № 6 по М. Певзнеру. Цель этой диеты состоит в нормализации обмена веществ (в особенности пуринов) и снижении образования в организме мочевой кислоты (табл. 24).
Таблица 24
Диеты № 6 и № 6е по химическому составу и энергетической ценности
|
Номер диеты |
Белки (г) |
Жиры (г) |
Углеводы (г) |
Энергетическая ценность (ккал) |
|
6 |
80–90 |
80–90 |
350 |
≈2570 |
|
6е |
70 |
80 |
240 |
≈1950 |
Режим питания при диете № 6 дробный, 4–6 раз в день. Кулинарная обработка продуктов обычная. Исключение составляет только обработка мяса, птицы и рыбы. Их необходимо предварительно отваривать, потому что при варке около половины пуриновых оснований, содержащихся в продукте, переходит в бульон. После варки мясные продукты можно использовать для приготовления различных блюд. От употребления в пищу полученного бульона лучше воздержаться. Мясные и рыбные блюда допускается включать в меню не чаще 2–3 раз в неделю, при этом их не должно быть более 150 г.
- Раз в неделю рекомендуется проводить кефирные, молочные, фруктовые разгрузочные дни. При проведении разгрузочных дней пациент должен употреблять большое количество жидкости (не менее 2,5 л в день), если нет противопоказаний со стороны сердечно-сосудистой и мочевыделительной системы.
- При избыточной массе тела рекомендуется ее уменьшить. Однако снижать массу тела необходимо медленно, приблизительно по 1 кг в месяц. Ни в коем случае не рекомендуется голодание, так как голодание, так же как и низкокалорийная диета, приводит к повышенному образованию кетоновых тел и к повышению содержания мочевой кислоты в крови с последующим приступом подагры.
- В период обострения болезни рекомендуются более строгие ограничения в диете. На весь период обострения назначается диета № 6е по М. Певзнеру (табл. 24), которая состоит преимущественно из жидкой пищи: молоко, молочнокислые продукты, кисели, компоты, фруктовые и овощные соки, овощные супы, жидкие каши.
- Учитывая уменьшенный объем растительных и особенно животных жиров в обеих диетах, пациентам необходимо назначить дополнительный курс приема витаминов. Дело в том, что некоторые витамины (А, D, E, K) являются жирорастворимыми и почти не содержатся в растительной пище. Чтобы не допустить возникновение гиповитаминоза и, как следствие, сопутствующих ему заболеваний, необходимо принимать данные витамины дополнительно в составе витаминно-минеральных комплексов.
- Целесообразно выпивать жидкость до 2–2,5 л в сутки: воду с включением щелочных минеральных напитков (щелочная реакция мочи уменьшает превращение урата натрия в менее растворимую мочевую кислоту), снятое молоко, фруктовые соки, не содержащие сахар. В отличие от предыдущих диетических наставлений рекомендуются чаи (особенно зеленые), кофе.
- В чае содержится большое количество полифенолов и антиоксидантов, которые предотвращают окисление холестерола липопротеинов низкой плотности, подавляют активацию тромбоцитов и снижают содержание С-реактивного протеина.
- Доказано, например, что употребление более 5 чашек кофе в день оказывает умеренный урикозурический эффект. Длительное употребление кофе ассоциировано со снижением риска развития подагры. Этот напиток во многочисленных исследованиях показал способность уменьшать выраженность воспаления и дисфункции эндотелия, повышать чувствительность тканей к инсулину, снижать риск развития сахарного диабета 2-го типа.
Продукты, содержащие большое количество пуринов (более 150 мг на 100 г продукта):
- говяжьи внутренние органы (мозги, почки, печень, язык, поджелудочная железа);
- сардины;
- анчоусы;
- мелкие креветки;
- скумбрия;
- бобовые культуры.
Продукты с умеренным уровнем содержания пуринов (50–150 мг на 100 г продукта):
- большинство видов мяса (говядина, баранина, курятина);
- рыба;
- ракообразные.
Продукты с низким уровнем содержания пуринов (0–15 мг на 100 г продукта):
- молоко;
- сыр;
- яйца;
- икра рыб;
- крупы;
- орехи;
- мед;
- овощи и фрукты.
Диетические рекомендации при подагре
Исключить:
- мясо молодых животных и птиц (телятина, молодая баранина, цыплята), свинина; мясные бульоны; соусы; копчености, колбасы, консервы, холодец, печень, почки, мозги, язык;
- морепродукты; сардины и рыба других жирных сортов, особенно жареная; рыбные консервы, икра;
- соленые и острые сыры;
- пряности: перец, хрен, горчица;
- спиртные напитки: пиво! (50 мл этанола в сутки безопаснее, чем 250 мл пива), портвейн и подобные крепленые вина, водка, коньяк, виски;
- кремовые торты, пирожные;
- фруктоза и сахаросодержащие напитки;
- богатые фруктозой фрукты (яблоки, апельсины) и соки из них;
- малина, инжир, виноград.
Ограничить:
- отварное мясо (150 г, до 3 раз в неделю), домашняя птица, кролик, говядина, баранина;
- сало;
- отварная рыба нежирных сортов (160–170 г, до 3 раз в неделю);
- зеленый лук, петрушка, перец, редис, баклажаны, помидоры (до 2–3 штук в сутки);
- томатная паста, кетчуп;
- орехи — кедровые, миндаль, фисташки, фундук; семечки;
- изделия из слоеного и сдобного теста, белый хлеб;
- слива, авокадо.
Разрешено:
- супы овощные, картофельные, крупяные, холодные (окрошка, свекольник), борщи, отвары из нежирных сортов мяса, рыбы, птицы;
- масло растительное, сливочное;
- яйца (1 штука в день);
- крупы, макаронные изделия;
- молочные продукты, в том числе йогурт низкой жирности или снятое молоко;
- овощи (в любом количестве и в любой кулинарной обработке), в том числе богатые пуринами (спаржа, цветная капуста, шпинат, бобовые); грибы;
- томатный, сметанный, молочный соусы, лимонная кислота, лимонный сок, ванилин, корица, уксус, лавровый лист, укроп;
- 250 мл вина в день. Рекомендуется не менее 3 безалкогольных дней в неделю!
- конфеты, мед, мармелад, зефир;
- хлеб пшеничный и ржаной, выпечка;
- фрукты, сухофрукты и ягоды, особенно вишня (кроме нерекомендованных);
- морсы, кисели, компоты, квас, щелочные минеральные воды («Нафтуся», «Ессентуки № 17», «Лужанская», «Боржоми», «Поляна Квасова»).
Можно ли употреблять пациентам с подагрой вино? Имеет ли значение качество вина? Важно ли сухое вино или крепленое?
Крепленые вина, конечно, нельзя употреблять пациентам с подагрой, в них много сахара, фруктозы. Вредность сухого вина, приготовленного по всем технологическим правилам, когда для его приготовления ничего не добавляется кроме винограда, минимальна. Хотя, конечно, все зависит от количества. Чрезмерное употребление вина может обусловливать развитие и усугубление течения подагры.
Можно ли голодать при подагре?
Длительное голодание противопоказано. Доказано, что именно рациональная диета (приоритет низкокалорийной диеты в сравнении с ограничением пуринов) облегчает течение подагры, снижает гиперурикемию, снижает частоту и тяжесть приступов подагры, но не излечивает ее, поэтому лечение болезни, как и соблюдение диетических правил, должно быть практически постоянным, пожизненным.
Показано ли санаторно-курортное лечение при подагре?
- Больным подагрой показано санаторно-курортное лечение на грязевых и бальнеотерапевтических курортах с радоновыми, сульфидными, хлоридными, натриевыми, йодобромистыми водами.
- При поражении почек исключены курорты с сульфидными водами.
- В Украине подагру лечат на курортах: Карпаты, Закарпатье, Трускавец, Евпатория, Саки, Хмельник, Ирпень, Пуща-Водица, Немиров, Миргород, Моршин, Феодосия, Одесса.
- В Европе подагру лечат на курортах: Кьянчано Терме, Фьюджи, Италия; Слэник-Молдова, Румыния; Атомска баня, Сербия; Марианске-Лазне, Теплице, Карловы Вары, Чехия; Баден-Баден, Германия; Хисаря, Болгария; Баден, Австрия.
- В Японии эффективным является лечение на курорте Ноборибецу Онсэн на острове Хоккайдо.
- Противопоказано санаторно-курортное лечение при остром подагрическом приступе, частых приступах артрита, нарушении функции почек.
Примечание. Памятка для пациентов с подагрой прилагается.
Можно ли излечить подагру?
Сегодня ревматологи считают, что подагра — один из немногих артритов, который можно вылечить.
Подагру как системное заболевание полностью излечить нельзя, но можно эффективно контролировать. В ранний период болезни те средства, которые затрачиваются на лечение для того, чтобы человек практически не терял трудоспособность, — минимальны. Стоимость вовремя начатого лечения существенно ниже стоимости терапии, начатой тогда, когда уже возникли осложнения. Если вовремя начать лечение, то пациент может принимать препараты и при этом жить как практически здоровый человек.
Каковы реалии прогноза при подагре?
Прогноз при подагре относительно благоприятный, особенно при проведении адекватной терапии. В 20–50% клинических случаев развивается нефролитиаз, осложняющийся вторичным пиелонефритом и развитием хронической почечной недостаточности — ведущей причины летальных исходов. Развитие хронической почечной недостаточности может быть также обусловлено подагрической нефропатией.
Возможна ли профилактика подагры?
В основе первичной профилактики подагры лежит диета и уменьшение массы тела у пациентов с высоким риском развития заболевания. Комплаенс врача и пациента, его приверженность к персонифицированной программе лечения дает возможность улучшить прогноз для жизни и проводить вторичную профилактику: стабилизировать течение заболевания, избежать прогрессирования почечных осложнений, предупредить развитие или прогрессирование проявлений метаболического синдрома, сердечно-сосудистых заболеваний и сердечно-сосудистых событий.
Как повысить приверженность пациентов с подагрой к лечению?
Как и при лечении любого заболевания, требующего регулярного приема лекарственных средств, эффективность терапии подагры и подагрического артрита в значительной мере зависит от приверженности пациентов лечению.
На Европейском конгрессе ревматологов в Амстердаме (European League Against Rheumatism, 2018) были продемонстрированы результаты значительного улучшения клинических исходов у больных подагрой, которые получали на мобильный телефон ежедневное текстовое сообщение о необходимости принять аллопуринол, что оказало существенную помощь в контроле уровней сывороточных уратов.
Сотрудники клиники при Национальном университете Сингапура (National University Hospital in Singapore) сообщили в онлайн-издании «Journal of Clinical Nursing», что средний показатель приверженности лечению в когорте пациентов с подагрой умеренный, лишь 44,4% пациентов показали высокий уровень выполнения врачебных рекомендаций. Ученые установили, что влияние на приверженность к лечению оказывали следующие факторы, которые следует учитывать при ведении пациентов с подагрой:
- вера в эффективность назначенных лекарственных препаратов;
- наличие жены/мужа;
- наличие сопутствующих заболеваний.