ОПРЕДЕЛЕНИЕ
Сердечной недостаточностью (СН) называют патофизиологическое состояние, при котором сердце вследствие нарушения своей насосной функции не может удовлетворять потребности метаболизма тканей.
Указанное состояние может проявляться клиническими признаками ХСН или ОСН и ассоциируется с повышенным риском смерти этих пациентов.
Перечень основных терминов, которые нередко употребляются для описания разных клинических форм или вариантов СН, в действующей МКБ-10 соответствует рубрикам I50.0, I50.1, I50.9.
I50.0. Застойная сердечная недостаточность
Болезнь сердца застойного характера
Правожелудочковая недостаточность (вторичная по отношению к недостаточности левых отделов сердца)
I50.1. Левожелудочковая недостаточность
Острый отек легких
Сердечная астма
Недостаточность левых отделов сердца
I50.9. Сердечная недостаточность без уточнения
Бивентрикулярная недостаточность
Кардиальная, сердечная или миокардиальная недостаточность
За период после принятия МКБ-10 (1992) появились новые клинические термины, применяющиеся в международных рекомендациях по диагностике и лечению СН. Современная терминология, употребляющаяся для характеристики клинических особенностей разных категорий больных с ХСН, приведена в соответствующем разделе.
По определению Рабочей группы по сердечной недостаточности Украинской ассоциации кардиологов (2006), ХСН — это клинический синдром, типичными чертами которого являются снижение толерантности к физическим нагрузкам, задержка в организме жидкости, прогрессирующий характер и ограничение продолжительности жизни.
ЭПИДЕМИОЛОГИЯ
По разным подсчетам ХСН в настоящее время болеют по меньшей мере от 15 до 23 млн человек. По данным национальных регистров разных стран средний (без учета возраста) показатель распространенности ХСН в популяции колеблется от 1 до 5%. Указанные колебания могут быть, в частности, связаны с отсутствием унифицированных международных эпидемиологических критериев СН. С возрастом распространенность СН прогрессивно возрастает. Так, по данным Фремингемского исследования распространенность СН среди мужчин возрастает от 0,8% в возрастной категории 50–59 лет до 6,6% — в возрасте 80–89 лет (у женщин от 0,8 до 7,9% соответственно).
Анализ результатов долговременного популяционного наблюдения, осуществленного в рамках того же Фремингемского исследования, показал, что риск возникновения СН в течение жизни составляет 21% у мужчин и 20% — у женщин и является существенным даже при условии отсутствия развития ИМ (11 и 15% соответственно).
Заболеваемость — количество случаев впервые диагностированной СН в течение года в популяции — представляет по разным данным от 150 до 500 случаев на 100 тыс. населения (0,15–0,5%), причем среди лиц в возрасте старше 45 лет этот показатель каждые 10 лет удваивается. Указанное выше 40-летнее Фремингемское популяционное наблюдение показало, что заболеваемость СН среди мужчин повышается от 0,3% в возрастном промежутке 35–65 лет до 1,2% в возрасте 85–94 года, а среди женщин — от 0,2 до 0,9% соответственно.
В течение последних 30–40 лет в Европе и Северной Америке, несмотря на снижение смертности от сердечно-сосудистых причин, отмечают постоянный рост распространенности ХСН. В США количество госпитализаций по поводу СН с 1971 до 1994 г. увеличилось в 4 раза, а количество смертельных случаев вследствие СН с 1970 до 1993 г. — в 3 раза. На протяжении последующих 20–30 лет в Европе и Америке прогнозируют рост распространенности ХСН на 30–40%, что связывают с постоянной тенденцией к увеличению удельного веса населения старших возрастных групп и увеличением (вследствие улучшения лечения) продолжительности жизни пациентов с сердечно-сосудистыми заболеваниями и сахарным диабетом.
Прогноз больных с клиническими проявлениями ХСН очень серьезный, что отражает такой ее фундаментальный признак, как прогрессирующий характер. По данным Фремингемского исследования (наблюдение с 1948 по 1988 г.) средняя продолжительность жизни с момента установления диагноза ХСН составляла 1,7 года для мужчин и 3,2 года для женщин, а показатель 5-летней выживаемости — 25 и 38% соответственно. Даже в современных условиях (данные Британии на 2001 г.) выживаемость пациентов с клинически манифестированной ХСН на протяжении 5 лет ниже, чем у больных с впервые диагностированными злокачественными эпителиальными опухолями разных локализаций, кроме рака легкого.
Клинический прогноз ХСН тем хуже, чем выше степень ее клинической тяжести. Так, показатель смертности в течение 1 года у больных с ХСН I–II ФК по NYHA составляет 6–10%, возрастая до 25–40% у больных с тяжелой (IV ФК по NYHA) ХСН.
Пациенты с симптомной ХСН, но относительно сохраненной систолической функцией ЛЖ (ФВ <40–45%) характеризуются лучшей (приблизительно вдвое — по данным 5-летнего наблюдения) выживаемостью, чем пациенты с ХСН и сниженной ФВ ЛЖ.
Лучшую выживаемость женщин по сравнению с мужчинами с ХСН объясняют несколькими причинами, в частности меньшей распространенностью среди них ИБС, большей долей больных с сохраненной систолической функцией ЛЖ и, возможно, лучшими компенсаторными возможностями организма относительно противодействия снижению сердечного выброса.
Результаты масштабных многоцентровых плацебо-контролируемых клинических исследований свидетельствуют (см. ЛЕЧЕНИЕ), что комбинированное применение нейрогуморальных антагонистов (ингибиторы АПФ или антагонисты рецепторов ангиотензина II, блокаторы β-адренорецепторов, антагонисты альдостерона) предоставляет возможность существенным образом снизить смертность больных с клинически манифестированной ХСН — до 6–10% в год.
Лечение больных с ХСН требует больших средств, объем которых в странах Западной Европы и Северной Америке составляет 1–2% общих затрат на здравоохранение; ⅔ этих средств приходится на стационарное лечение больных с ХСН, которых госпитализируют по поводу декомпенсации их клинического состояния. Согласно так называемым фармакоэкономическим подсчетам, стоимость оказания медицинской помощи пациентам с ХСН в странах Западной Европы (Франция, Нидерланды, Германия, Бельгия) возрастает пропорционально тяжести их клинического состояния, составляя в год для больных I–II ФК в среднем 827 евро, III — 2029 евро и IV, клинически наиболее тяжелого, — 13 994 евро. Соответствующие подсчеты показали, что постоянный прием ингибиторов АПФ и блокаторов β-адренорецепторов больными с ХСН, снижая риск повторных госпитализаций по поводу декомпенсации кровообращения, требует меньше затрат, чем неоднократные эпизоды стационарного лечения, обусловленные неполучением необходимой систематической терапии указанными нейрогуморальными антагонистами.
По современным эпидемиологическим и статистическим данным у больных с ХСН 75–80% смертельных исходов имеют кардиальную природу, причем приблизительно в половине случаев они соответствуют критериям внезапной смерти, другая же половина пациентов гибнет от прогрессирующей насосной СН. Остальные 20–25% смертельных случаев среди больных с ХСН приходится на некардиальные причины, среди которых ведущая роль принадлежит пневмонии, ТЭЛА и мозговому инсульту.
Приведенные данные свидетельствуют об актуальности СН как медико-социальной проблемы и обосновывают необходимость широкого внедрения современных стандартов ее лечения и профилактики в нашей стране.
ФАКТОРЫ РИСКА
Эпидемиологические исследования четко продемонстрировали ведущую роль АГ и ИБС как популяционных факторов риска СН (табл. 2.1). Впрочем, вычленение роли каждого из указанных факторов в возникновении ХСН является проблематичным, поскольку АГ и ИБС сосуществуют приблизительно у 40% таких больных. По данным как эпидемиологических данных, так и современных многоцентровых исследований, ХСН сопряжена с ИБС у 60–65% больных.
Таблица 2.1
Популяционные факторы риска развития ХСН среди лиц в возрасте 40–89 лет по данным Фремингемского исследования (по Levy D. et al., 1996)
| Фактор риска | Распространенность фактора риска в популяции, % | Повышение риска по сравнению с популяционным показателем, % | ||
| мужчины | женщины | мужчины | женщины | |
| АД ≥140/90 | 60 | 62 | 2,1 | 3,4 |
| ИМ | 10 | 3 | 6,3 | 6,0 |
| Стенокардия | 11 | 9 | 1,4 | 1,7 |
| Диабет | 8 | 5 | 1,8 | 3,7 |
| ГЛЖ | 4 | 3 | 2,2 | 2,9 |
| Клапанные пороки сердца | 5 | 8 | 2,5 | 2,1 |
В последнее время увеличилось количество данных относительно более весомого, чем это представлялось ранее, значения АГ как фактора риска развития СН. Подчеркивается, что роль АГ как фактора риска и каузальной причины клинически имеющейся ХСН в эпидемиологических исследованиях недооценивается, поскольку при развитии последней ранее повышенное АД у многих больных снижается до нормы вследствие насосной несостоятельности сердца. Результаты анализа, проведенного Национальным институтом сердца, легких и крови США, свидетельствуют, что у 75% больных с ХСН ранее отмечали АГ. Последняя повышает риск развития СН пропорционально степени повышения АД, причем повышение САД является более значимым в отношении развития ХСН, чем повышение ДАД, независимо от возраста и пола (табл. 2.2).
Таблица 2.2
Структура повышения АД как фактора риска развития СН (по Kannel W., 1996)
| Повышение АД | Возраст 35 лет–64 года | Возраст 65 лет–94 года | ||
| мужчины | женщины | мужчины | женщины | |
| САД | 3,1* | 4,4 | 1,8 | 2,4 |
| ДАД | 1,4 | 2,9 | 1,6 | 1,2 |
| Пульсового | 3,4 | 3,0 | 2,3 | 2,2 |
*Повышение риска по сравнению с популяцией данной возрастной категории.
Перенесенный ИМ является наиболее значимым независимым фактором риска развития ХСН как в общей популяции, так и среди больных с АГ. Весомыми факторами риска ХСН являются также сахарный диабет, ГЛЖ, клапанные пороки сердца. Среди пациентов с АГ, сахарным диабетом и наличием ГЛЖ у женщин отмечают более высокий риск возникновения СН (табл. 2.3, см. табл. 2.1).
Таблица 2.3
Факторы риска развития ХСН среди пациентов с АГ (по Levy D. et al., 1996)
| Фактор риска | Повышение риска по сравнению с популяционным показателем | |
| мужчины | женщины | |
| ИМ | 5,54 | 5,99 |
| Стенокардия | 1,35 | 1,71 |
| Диабет | 1,78 | 3,57 |
| ГЛЖ | 1,97 | 2,80 |
| Клапанные пороки сердца | 2,40 | 1,96 |
По данным Фремингемского исследования среди пациентов с ИБС и/или ГЛЖ фактором риска ХСН выступает уменьшение жизненной емкости легких (повышение риска у женщин в 2,3 раза, у мужчин — в 1,8).
Уровень общего ХС в плазме крови является относительно слабым предиктором развития ХСН, однако высокое значение соотношения уровня общего ХС к ХС ЛПВП в плазме крови выступает значимым фактором риска ХСН. Последнее касается и наличия ожирения, которое является опосредованным фактором риска СН с учетом его патогенетической связи с АГ, сахарным диабетом, ГЛЖ и дислипидемией.
ЭТИОЛОГИЯ ХСН
Наиболее частой нозологической причиной СН в Европе и США в настоящее время считают ИБС, которую, по данным эпидемиологических и многоцентровых клинических исследований, диагностируют у 60–75% таких больных. Есть веские основания считать, что 2-е место среди этиологических факторов ХСН занимает системная АГ, однако частое сочетание ИБС и АГ затрудняет оценку истинной роли последней в возникновении ХСН. Так, по статистическим и эпидемиологическим данным ИБС и АГ (отдельно или в сочетании) обусловливают возникновение 75–80% всех случаев СН.
Среди других причин развития ХСН ведущими являются ДКМП и клапанные пороки сердца, на остальные причины ХСН (табл. 2.4) в развитых странах приходится в целом не более 5% случаев.
Таблица 2.4
Наиболее актуальные заболевания и состояния, способные обусловить СН
ИБС
|
АГ
|
Кардиомиопатии
|
Клапанные или врожденные пороки сердца
|
Аритмии
|
Миокардиты
|
Поражение перикарда
|
Вторичная кардиомиопатия
|
Легочная гипертензия
|
Следует отметить, что в Афро-Азиатском регионе структура этиологических факторов ХСН иная, в ней основное место занимают клапанные пороки и первичные поражения миокарда.
С практической точки зрения важно выделить те причины ХСН или ОСН, которые являются потенциально обратимыми и при соответствующих условиях могут быть полностью устранены.
К ним относятся тахи- и брадиаритмия, ишемия и гибернация миокарда, клапанные пороки сердца, легочная тромбоэмболия, миокардит, побочное действие или передозировка лекарственных средств, алкоголь.
ПАТОФИЗИОЛОГИЯ ХСН
Снижение насосной способности сердца может быть следствием таких факторов:
1) гемодинамической перегрузки желудочков (в большинстве случаев ЛЖ);
2) первичного поражения миокарда;
3) нарушения наполнения ПЖ или ЛЖ. Перегрузка ЛЖ может быть обусловлена повышенным сопротивлением систолическому выбросу крови («перегрузка давлением») или повышенным диастолическим объемом крови («перегрузка объемом»). Первый вариант отмечают при АГ и аортальном стенозе, второй — при аортальной недостаточности. Перегрузка ПЖ давлением характерна для легочной гипертензии и стеноза ЛА, объемом — для септальных дефектов со сбросом слева направо.
Первичное поражение сердечной мышцы выявляют при ИБС и некоронарогенных поражениях. При ИБС такое поражение по характеру не является диффузным и может проявляться некрозом (при остром ИМ), постинфарктными рубцовыми изменениями, ишемией и гибернацией (см. далее) миокарда. Вместе с тем для некоронарогенных заболеваний миокарда характерно диффузное поражение последнего (ДКМП, большинство миокардитов, вторичные кардиомиопатии).
Нарушение наполнения ЛЖ или ПЖ отмечают при укорочении диастолы (тахисистолии), при наличии механического препятствия его наполнению (перикардит, AV-стеноз, миксома) и при нарушениях его расслабления в диастолу. Последнее наблюдают при рестриктивных поражениях миокарда, его ишемии, концентрической гипертрофии (АГ, ГКМП), аортальный стеноз).
Приведенные патофизиологические факторы снижения насосной способности сердца нередко сочетаются. Например, при аортальном стенозе или АГ с ГЛЖ перегрузка последнего давлением сочетается с нарушением его диастолического наполнения; а при наличии постинфарктного кардиосклероза у пациента с ИБС и сопутствующей АГ перегрузка давлением и диастолическая дисфункция ЛЖ сочетаются с первичным поражением миокарда.
При отсутствии радикального этиотропного корригирующего влияния (преимущественно хирургического при наличии показания) каждый из трех вышеуказанных главных факторов выступает в роли перманентно действующего триггера (запускающего фактора) возникновения и дальнейшего развития ХСН.
Патофизиологические механизмы прогрессирования СН
Неадекватность сердечного выброса метаболическим потребностям тканей инициирует специфичные для СН адаптивные изменения со стороны системной нейрогуморальной регуляции, сердца, сосудов, почек, скелетных мышц, которые, взаимодействуя между собой по принципу порочного круга, предопределяют постоянное прогрессирование СН.
Ремоделирование сердца
В современном понимании это комплекс структурно-функциональных изменений тех или иных отделов сердца, вызванный неадекватными гемодинамическими условиями их функционирования или их первичным поражением. На практике клиницист сталкивается в первую очередь с ремоделированием левых отделов сердца, в частности ЛЖ.
Ремоделирование ЛЖ — совокупность патологических изменений величины, массы и формы ЛЖ с соответствующим нарушением его нормального функционирования. Характерными макропризнаками ремоделированного ЛЖ являются его гипертрофия, дилатация и деформация (так называемая сферизация) полости. Объединение последних трех признаков является типичным для первично-миокардиального поражения и перегрузки объемом. Для СН, обусловленной перегрузкой давлением и/или нарушением диастолического наполнения ЛЖ, выраженная дилатация последнего не является характерной, за исключением финальной клинической стадии, когда компенсаторные возможности гипертрофированного ЛЖ практически исчерпаны.
Главный фундаментальный признак ремоделирования ЛЖ — ГЛЖ. Это приспособительный феномен, направленный на поддержание способности первично пораженного или перегруженного миокарда развивать достаточное внутрижелудочковое давление в систолу путем уменьшения рабочей нагрузки на единицу его массы. Однако в процессе эволюции гипертрофия миокарда теряет свое приспособительное значение и становится одним из факторов прогрессирования ХСН. Это объясняется тем, что, в отличие от физиологической, так называемой рабочей гипертрофии (у спортсменов, здоровых лиц, занимающихся интенсивной физической работой), гипертрофия миокарда при его перегрузке или повреждении является биологически неполноценной. Неполноценность патологической гипертрофии миокарда, в частности, состоит в том, что при ней:
а) рост массы миофибрилл преобладает над ростом массы митохондрий;
б) увеличение площади мембраны отстает от роста общей массы кардиомиоцита;
в) рост массы миокарда опережает рост капилляров;
г) происходит интенсивное периваскулярное образование соединительной ткани (реактивный фиброз);
д) наблюдается трансформация процессов белкового синтеза в сторону образования изоформ регуляторных и эффекторных протеинов, присущих эмбриональному периоду (так называемая фетализация миокардиального фенотипа).
В результате указанных изменений развиваются энергодефицит, перегрузка ионами Са2+ и неполноценное функционирование гипертрофированных кардиомиоцитов с соответствующим нарушением систолической и/или диастолической функции ЛЖ. В формировании диастолической несостоятельности миокарда важная роль также принадлежит фиброзным (очаговым или диффузным) изменениям ремоделированного ЛЖ.
Для СН, обусловленной первичным поражением миокарда ЛЖ или его перегрузкой объемом, а также для терминального клинического этапа гипертензивного сердца характерна так называемая миогенная дилатация ЛЖ. Последняя отражает невозможность ЛЖ обеспечивать объем систолического выброса крови в аорту пропорционально объему полости ЛЖ в конце диастолы (физиологический механизм Франка — Старлинга) (рис. 2.1). Такой ситуации, как правило, соответствуют снижение величины ФВ ЛЖ (<40%) и сферизация полости последнего, то есть приближение ее формы к шарообразной (в отличие от нормальной эллипсоидной). Такой вариант ремоделирования ЛЖ отмечают в 60–70% случаев клинически манифестированной ХСН.
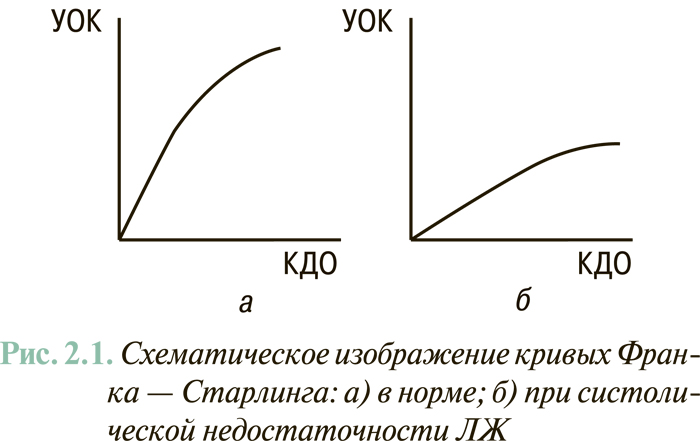
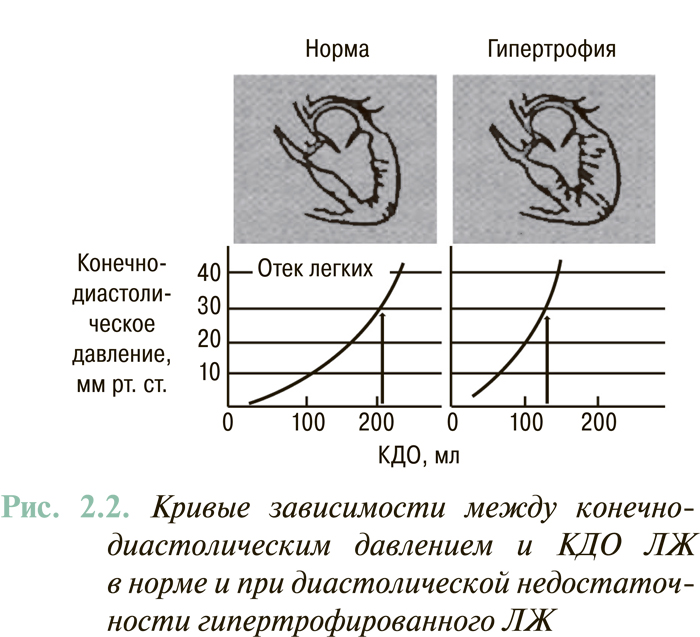
У 30–40% пациентов с СН отмечают нормальную или субнормальную ФВ ЛЖ (>45%). Наличие клинических признаков СН у больных этой категории связывают исключительно или преимущественно с нарушениями диастолического наполнения ЛЖ. В повседневной клинической практике этот вариант СН чаще всего выявляют у больных с гипертензивным сердцем и тахисистолическим нарушением ритма сердца. Для этого варианта СН характерен сдвиг кривой «конечно-диастолическое давление — КДО» влево, при котором гиперволемия в малом круге кровообращения, вплоть до отека легких, может возникать при нормальном объеме ЛЖ (рис. 2.2).
Нейрогуморальная активация
Снижение сердечного выброса обусловливает ряд системных компенсаторных реакций, направленных на поддержание достаточного перфузионного давления в сосудистой системе. Последнее обеспечивается «включением» соответствующих компенсаторных механизмов, которые можно условно разделить на кардиальные, сосудистые и почечные.
К кардиальным механизмам компенсации кровообращения при СН принадлежат повышение ЧСС, рост инотропной (сократительной) функции миокарда и его гипертрофия. Сосудистый механизм компенсации представлен системной периферической вазоконстрикцией, направленной на поддержание необходимого системного АД. Почечный путь компенсации кровообращения состоит в задержке ионов Na+ и воды, направленный на увеличение ОЦК, то есть на то же поддержание системного АД.
Мобилизационные нейрогуморальные системы
Указанные «мобилизационные» компенсаторные реакции опосредствованы несколькими нейрогуморальными системами: САС, ренин-ангиотензиновой (РАС), альдостероном, аргинин-вазопресином (синонимы: вазопресин, АДГ) и системой эндотелина.
САС. Как известно, ее основными структурными звеньями являются афферентные нервные волокна, центральные адренергические структуры, эфферентные пре- и постганглионарные симпатические волокна, симпатические терминали с α2-адренорецепторами и тканевые β- и α1-адренорецепторы, а также эффекторные гормоны норадреналин и адреналин.
Активация САС при СН возникает на наиболее раннем этапе дисфункции ЛЖ. Стимуляция β1— та β2-адренорецепторов миокарда норадреналином и адреналином обусловливает повышение его сократительной способности и ЧСС, а стимуляция норадреналином сосудистых α1-адренорецепторов — периферическую артериоло- и венулоконстрикцию. Кроме того, норадреналин, возбуждая α1-адренорецепторы миокарда, действует как один из факторов его гипертрофии, а стимуляция почечных β1-адренорецепторов опосредует секрецию почками ренина — ключевого энзима, запускающего активацию РАС.
РАС — многокомпонентная энзимогормональная система, которая играет ключевую роль в регуляции давления в сосудистой системе и объема жидкости в организме. Первичным субстратом РАС выступает ангиотензиноген, превращающийся под влиянием ренина в ангиотензин I. Последний в свою очередь под влиянием АПФ трансформируется в ангиотензин II — основной действующий гормон РАС. Ангиотензин II посредством взаимодействия со своими тканевыми рецепторами первого типа (АТ1-рецепторы) вызывает системную вазоконстрикцию, стимулирует процессы гипертрофии миокарда и индуцирует синтез альдостерона надпочечниками (см. далее). Кроме этого, стимулирует выброс норадреналина симпатическими терминалями и образование эндотелина-1 и вазопрессина.
Компоненты РАС, находящиеся и подвергающиеся вышеописанной энзимной трансформации в циркуляторном русле, определяются как циркулирующая РАС, а те, которые содержатся и трансформируются с помощью энзимов в тканях, как тканевая РАС. Активация последней играет ключевую роль в ремоделировании ЛЖ при СН.
Альдостерон — минералокортикоид, ведущим патофизиологическим эффектом которого при ХСН является задержка жидкости в организме за счет стимуляции реабсорбции ионов Na+. Кроме того, альдостерон стимулирует коллагенообразование в миокарде и оказывает вазоконстрикторное действие. Поскольку мощным индуктором синтеза альдостерона является ангиотензин II, в литературе наряду с термином «РАС» часто употребляется термин «РААС».
Эндотелин-1 — эффекторный (действующий) гормон так называемой системы эндотелина, экспрессия и активация компонентов которой происходит преимущественно в клетках эндотелия. Эндотелин-1 более мощный вазоконстриктор, чем ангиотензин II, и подобно ему стимулирует гипертрофию миокарда и гипертрофию гладкомышечного слоя периферических сосудов, а также секрецию катехоламинов, ренина, альдостерона, вазопрессина.
Вазопрессин, синтезирующийся в задней доле гипофиза, стимулирует канальцевую реабсорбцию воды и оказывает системное вазоконстрикторное действие.
Контррегуляторные системы
Наряду с нейрогуморальными системами, обеспечивающими компенсаторные реакции мобилизационной направленности, при ХСН функционирует ряд гуморальных систем (НУП, адреномедуллин, группа так называемых эндотелийзависимых контррегуляторных факторов), оказывающих контррегуляторное действие по отношению к эффектам САС, РААС, вазопрессина, эндотелина. Физиологическая роль указанных систем состоит в контроле выраженности вышеприведенных мобилизационных реакций системы кровообращения и тем самым — защите так называемых органов-мишеней (сердце, сосуды, почки, скелетные мышцы) от потенциально опасных для них последствий перманентной гиперактивации РААС, САС, эндотелина, вазопрессина (роль «буфера»).
НУП, предсердный и так называемый МНУП, синтезируются кардиомиоцитами предсердий и желудочков в ответ на их растяжение и повышение давления в последних. НУП стимулируют натрийурез и диурез, оказывают вазодилатирующее и антипролиферативное действие, а также угнетают секрецию ренина, альдостерона, эндотелина-1, вазопрессина и норадреналина. Влиянию НУП во многом подобно действие адреномедуллина.
Эндотелийзависимые контррегуляторные факторы представлены брадикинином, так называемыми вазодилататорными простагландинами и оксидом азота (NO). Все они продуцируются клетками эндотелия и оказывают вазорелаксирующее, антипролиферативное и антитромботическое действие.
К вазодилататорным простагландинам относятся простациклин и PgE2. Их важной особенностью является способность к поддержанию почечного кровотока в условиях гипоперфузии почек за счет дилатации преимущественно их афферентных артериол.
Оксид азота (NO), или эндотелийзависимый фактор расслабления сосудов, продуцируется клетками эндотелия под влиянием специфического энзима — эндотелиальной NO-синтетазы (eNOS). Кроме эффекта вазодилатации, NO угнетает активацию моноцитов и тромбоцитов, которая является одним из ключевых звеньев так называемого иммуновоспалительного процесса (см. далее) и тромбообразования при ХСН.
Брадикинин обладает самостоятельным вазодилатирующим и антипролиферативным действием и, кроме этого, стимулирует синтез вазодилататорных простагландинов и NO. Следует помнить, что он расщепляется на неактивные пептиды тем же энзимом, который катализирует образование ангиотензина II из ангиотензина I, а именно — АПФ. Поэтому рост активности РААС при ХСН приводит к повышенному распаду брадикинина и соответственно — снижению его концентрации и уменьшению образования NO и простациклина.
Изменения со стороны сосудистой системы
При клинически манифестированной ХСН периферические сосуды (в большей степени артериальные) находятся в состоянии перманентной констрикции, что обусловлено постоянным действием существенно повышенных концентраций ангиотензина II, норадреналина, эндотелина-1, вазопрессина на гладкомышечный слой их стенки. Кроме этого, ангиотензин II и эндотелин-1 обусловливают гипертрофию последнего. Сужение просвета сосудов, наряду с гипертрофией их мышечного слоя, которое характерно также для АГ, получило название «ремоделирование сосудов». Выраженность этого феномена возрастает с клиническим прогрессированием ХСН.
Характерным для ХСН изменением со стороны сосудов является также нарушение функции эндотелия. Существенную роль в реализации этого феномена играет снижение концентрации оксида азота, которое обусловлено, во-первых, угнетением его синтеза в эндотелиоцитах и, во-вторых — повышением его биохимической (свободнорадикальной) инактивации. Вследствие снижения концентрации NO в стенке сосудов в значительной степени уменьшается защитное действие физиологических концентраций NO в отношении вазоконстрикции, тромбообразования и активации клеточного звена системного воспаления, играющих существенную роль в прогрессировании ХСН.
Изменения со стороны почек
Под действием вазоконстрикторных нейрогормонов уменьшается почечный кровоток, что приводит к уменьшению клубочковой фильтрации и стимуляции высвобождения ренина юкстагломерулярным аппаратом почек. Вследствие прямого действия альдостерона на клетки канальцев активируется реабсорбция Na+ и воды и наряду с этим увеличивается экскреция К+ и Mg2+.
Изменения со стороны скелетных мышц
Вследствие гипоперфузии периферических мышц развивается их хроническая гипоксия с соответствующим нарушением метаболизма, изменениями ультраструктуры, снижением функциональных возможностей, уменьшением массы.
Основные этапы клинического прогрессирования ХСН: патофизиологическая характеристика
Доклинический этап СН (бессимптомная дисфункция ЛЖ)
Характеризуется прежде всего активацией САС, что обеспечивает мобилизацию инотропной и хронотропной функций сердца, увеличение притока к нему крови по венам и поддержание нормального уровня АД. 0дновременно происходит активация НУП. Существенного роста активности циркулирующих РААС, эндотелина-1 и вазопрессина не наблюдается, что объясняется соответствующим антагонистическим действием НУП. Идут процессы гипертрофии сердечной мышцы, опосредуемые активированной локальной миокардиальной РААС, а также норадреналином (через α1— адренорецепторы) и эндотелином-1.
Переход доклинической СН в клинически манифестную обусловливают несколько факторов:
- на фоне дилатации левого предсердия и перманентного повышения в нем давления развивается десенситизация (потеря чувствительности) расположенных в нем барорецепторов, раздражение которых в норме ограничивает чрезмерную активацию центрального симпатического тонуса и секрецию вазопрессина; постепенно формируется десенситизация почечных и сосудистых рецепторов к НУП;
- на фоне перманентной гиперстимуляции миокарда катехоламинами развивается десенситизация его β-адренорецепторного аппарата, что снижает сократительную реакцию сердца на циркулирующие катехоламины;
- усугубляется энергодефицит кардиомиоцитов, который определяется вышеуказанной априорной биологической неполноценностью патологической гипертрофии миокарда.
В результате приведенных изменений, во-первых, теряется контроль НУП над активацией САС, РААС, эндотелина-1 и вазопрессина, что делает возможным «беспрепятственную» реализацию их периферического и антидиуретического эффектов и таким образом предопределяет рост пред- и постнагрузки на сердце. Во-вторых, снижается эффективность систолы желудочков, уменьшается сердечный выброс, что в свою очередь стимулирует дальнейшую активацию гормональных систем мобилизационной направленности по принципу порочного круга. В-третьих, в связи с постепенным повышением давления наполнения левого предсердия и ЛЖ происходит дальнейшая активация миокардиальной РААС и системы эндотелина, которые стимулируют дальнейшую гипертрофию миокарда.
Фаза развернутых клинических проявлений хронической застойной СН
Мобилизационные реакции сердечно-сосудистой системы окончательно теряют свое компенсаторное физиологическое значение и выступают в роли патогенных факторов, определяющих структурно-функциональную деградацию органов (тканей)-мишеней. Это обусловливает резкий дисбаланс между постоянно нарастающей активностью САС, РААС, эндотелина и вазопрессина, с одной стороны, и недостаточной выраженностью эффектов контррегуляторных систем — с другой1. Так, несмотря на циркуляцию в кровотоке НУП в высоких концентрациях, последние не оказывают ожидаемого «буферного» эффекта вследствие десенситизации их тканевых рецепторов и значительного снижения почечного кровотока. С другой стороны, высокая активность АПФ в стенке сосудов, кроме повышенного образования ангиотензина II, вызывает деградацию брадикинина и опосредованно — угнетение стимулированного брадикинином синтеза NO. Кроме этого, ангиотензин II стимулирует разрушение NO через усиление выработки свободных радикалов, способных химически нейтрализовать последний.
Перманентная гиперстимуляция миокарда высокими концентрациями катехоламинов предопределяет перегрузку ионами Са2+ митохондрий, критический дефицит макроэргических соединений и, как следствие этого, — активацию кальцийзависимых протеаз и фосфолипаз с дальнейшим некрозом части кардиомиоцитов и развитием очагов репаративного (замещающего) фиброза. Нарастающая пропорционально повышению концентрации циркулирующего норадреналина десенситизация миокардиальных β-адренорецепторов приводит к критическому (до 50% нормы) снижению сократительного ответа миокарда на катехоламины. Одновременно вызванное гипоперфузией скелетных мышц нарушение их метаболизма, действуя через локализованные в мышцах так называемые метаболические рецепторы, становится сигналом для дальнейшей, опосредствованной через ЦНС активации САС2.
Высокие концентрации ангиотензина II и эндотелина-1, стимулируя в миокарде образование коллагеновых волокон, стимулируют и обратный процесс — деструкцию соединительнотканного «каркаса» сердечной мышцы с помощью специфических энзимов — так называемых матриксных металлопротеиназ, что способствует прогрессированию дилатации полости ЛЖ.
В фазе выраженных циркуляторных нарушений и системного тканевого дизметаболизма инициируется механизм иммуновоспалительного ответа организма, ключевым звеном которого является активация синтеза гуморальных медиаторов системного воспаления, так называемых провоспалительных цитокинов (ФНО-α, интерлейкины-1, -6, -8) иммунокомпетентными клетками. Основными эффектами указанных цитокинов являются угнетение биосинтеза белка, внутриклеточного транспорта глюкозы, анорексия, дальнейшая активация матриксных металлопротеиназ, угнетение сократительной способности миокарда и периферических мышц, угнетение образования NO эндотелием, а также стимуляция апоптоза3 кардиомиоцитов, миоцитов скелетных мышц и лимфоцитов.
В активации провоспалительных цитокинов ключевую роль играет гиперпродукция свободных радикалов на фоне угнетения энзимов антиоксидантной защиты в условиях системной гипоксии (так называемый оксидативный, или оксидантный стресс).
Физиологический смысл роста синтеза провоспалительных цитокинов при ХСН заключается прежде всего в активации катаболических процессов и апоптоза в скелетных мышцах, поскольку само уменьшение массы скелетных мышц является последним резервом для приведения потребностей организма в кислороде и питательных веществах в соответствие с критически ограниченными возможностями их доставки. Действительно, на фоне выраженного повышения концентрации циркулирующих ФНО-α и других провоспалительных цитокинов отмечают уменьшение массы тела, обусловленное главным образом гипотрофией скелетных мышц (кахектические изменения). Однако одновременно по аналогичному механизму происходит активация апоптоза и катаболических процессов в миокарде, что не позволяет сбалансировать ситуацию4.
Как результат полного исчерпания резервов компенсации наступает смерть от прогрессирующей насосной недостаточности сердца.
Внезапная сердечная смерть и ее механизмы у больных с ХСН
Как указывалось выше, до 50% больных с ХСН не доживают до финального этапа декомпенсации сердца, а умирают внезапно, нередко на фоне стабильного клинико-гемодинамического состояния. В большинстве (>80%) случаев внезапная сердечная смерть наступает вследствие возникновения желудочковой аритмии высоких градаций, которые при ХСН, как правило, носят бессимптомный характер. Установлено, что основным непосредственным механизмом остановки кровообращения является вторичная (то есть трансформировавшаяся из желудочковой тахикардии) фибрилляция желудочков — 67,5%. Значительно реже это первичная фибрилляция желудочков (8,3%) и брадиаритмии (16,5%). Патогенетические факторы внезапной аритмической смерти при ХСН можно сгруппировать таким образом:
1) специфические для ХСН миокардиальные нарушения;
2) нейрогуморальные факторы;
3) ишемия;
4) ятрогенные факторы.
Рассмотрим их последовательно.
- В формировании аритмогенного субстрата в декомпенсированной сердечной мышце принимают участие основные звенья его ремоделирования. В патологически гипертрофированном миокарде отмечают снижение активности ионных насосов (Са2+-АТФаза саркоплазматического ретикулума, Na+-, К+-АТФаза сарколеммы) и синтеза протеинов калиевых каналов, что вызывает перегрузку цитозоля кардиомиоцитов ионами Са2+. Результатом последней является удлинение ПД кардиомиоцитов, в результате чего увеличивается так называемая триггерная активность миокарда, состоящая в генерации эктопических электрических импульсов по типу спонтанных деполяризаций. Дилатация ЛЖ обусловливает открытие в сарколемме кардиомиоцитов так называемых stretch-зависимых (то есть активированных растяжением клетки) натриевых каналов, что способствует возникновению таких же спонтанных деполяризационных импульсов. Возникновению и поддержанию желудочковой тахикардии способствуют механизмы ге-entry (обратный вход возбуждения, тесно связанный с наличием миокардиального фиброза) и повышение автоматизма кардиомиоцитов, что является одним из последствий их кальциевой перегрузки.
- Перманентная активация РААС и САС является не только опосредствованным (через ремоделирование сердца), но и прямым фактором аритмогенеза.
Возбуждение β-адренорецепторного аппарата в условиях гиперкатехоламинемии путем активации сарколеммальных кальциевых каналов L-типа и угнетения кальциевого насоса обусловливает тот же феномен перегрузки цитозоля кардиомиоцитов ионами кальция. Последний усугубляется также в связи с перманентной активацией миокардиальных α-адренорецепторов повышенными концентрациями норадреналина.
Роль циркулирующей РААС в аритмогенезе при ХСН заключается прежде всего в стимуляции гиперпродукции альдостерона, следствием чего является гипокалиемия и гипомагниемия, что в свою очередь выступает фактором эктопии миокарда. - Хорошо известна роль миокардиальной ишемии в генезе опасных для жизни желудочковых аритмий, которая ассоциирована с перегрузкой кардиомиоцитов ионами Са2+ и их свободнорадикальным повреждением.
- К ятрогенным факторам злокачественных желудочковых эктопических нарушений ритма при ХСН принадлежат: дигиталисная интоксикация; неправильное применение петлевых и тиазидных диуретиков, что приводит к гипокалиемии и гипомагниемии; применение негликозидных инотропных средств; прием антиаритмических препаратов I класса (см. ЛЕЧЕНИЕ).
ДИАГНОСТИКА ХСН
Клинические симптомы ХСН
Выявление субъективных и объективных (физикальных) признаков СН является начальным этапом ее диагностики.
Субъективные симптомы ХСН
Субъективными симптомами ХСН являются:
- одышка при физической нагрузке;
- ночная пароксизмальная одышка;
- ортопноэ;
- кашель при физической нагрузке и/или ночью;
- слабость, быстрая утомляемость при физической нагрузке;
- никтурия;
- олигурия;
- жалобы на уменьшение массы тела;
- симптомы со стороны ЖКТ и ЦНС.
Одышка (компенсаторное повышение частоты дыхательных движений), ограничивающее переносимость физических нагрузок, является наиболее ранним и частым клиническим симптомом СН у больных с насосной недостаточностью левых отделов сердца. Одышка является результатом рефлекторного возбуждения дыхательного центра в ответ на повышение легочно-капиллярного давления и наличие транссудата в интерстициальном пространстве легких, что ограничивает экскурсию (повышает ригидность) легких, снижая эффективность каждого дыхательного цикла. Если на начальном этапе СН одышка возникает при выполнении бытовых нагрузок средней интенсивности (типично — при ходьбе), то при тяжелой ХСН сопровождает наименьшее физическое усилие пациента. Для больных с изолированной недостаточностью правых отделов сердца одышка при нагрузке менее характерна, поскольку у этих больных отсутствует повышение легочно-венозного давления. Однако при выраженной изолированной правожелудочковой декомпенсации возможна довольно значительная одышка, факторами которой являются гипоперфузия дыхательных мышц и метаболический ацидоз на фоне значительно сниженного сердечного выброса.
Пароксизмальная ночная одышка в классическом виде — это внезапное пробуждение пациента от ощущения удушья с немедленной потребностью сесть или встать на ноги, с сопутствующим частым дыханием. Пребывание в вертикальном положении способствует уменьшению выраженности указанных симптомов от нескольких до 30–40 мин. Пароксизмальная ночная одышка обусловлена насосной недостаточностью левых отделов сердца, вызванной увеличением притока к ним крови в горизонтальном положении тела, вследствие чего повышается легочно-венозное и легочно-капиллярное давление и формируется интерстициальный отек легких. Имеются данные, что во внезапном характере возникновения проявлений пароксизмальной ночной одышки определяющую роль играют спонтанные колебания центрального симпатического тонуса во время сна.
Ортопноэ — ощущение удушья и одышки в горизонтальном положении, которое исчезает или значительно уменьшается после перехода в вертикальное. По гемодинамическому механизму возникновение ортопноэ сходно с пароксизмальной ночной одышкой. Есть основания считать, что ортопноэ в большей степени отражает перманентный характер гиперволемии малого круга кровообращения, чем пароксизмальная ночная одышка.
Непродуктивный (сухой) кашель, рефлекторно возникающий при физической нагрузке и/или ночью, тоже является следствием легочного застоя, распространяющегося в том числе и на бронхиальную систему. Не следует забывать, что сухой кашель при ХСН иногда может быть побочным действием ингибиторов АПФ, но тогда он не связан с физической нагрузкой и горизонтальным положением тела.
Слабость и утомляемость являются следствием уменьшения силы, выносливости и массы скелетных мышц, особенно нижних конечностей, обусловленных их гипоперфузией. Снижение функциональной способности периферических мышц при ХСН обусловлены патологическим перераспределением в ней изоформ миозина, энергодефицитом, снижением плотности β2— адренорецепторов, свободнорадикальным стрессом, апоптозом миоцитов. Слабость у пациентов с ХСН обычно более выражена после приема пищи, что обусловлено перераспределением лимитированного кровотока в органы брюшной полости.
Никтурия — довольно частый и ранний признак ХСН. В дневной период в условиях сниженного сердечного выброса вертикальное положение тела (преимущественно) и физическая активность (как факторы перераспределения крови), а также адренергическая вазоконстрикция приводят к снижению почечного кровотока и соответственно клубочковой фильтрации. Ночью в горизонтальном положении приток крови к почкам увеличивается, во время сна снижается секреция норадреналина (соответственно увеличивается почечный кровоток) и потому количество выделяемой мочи увеличивается.
Олигурия, в отличие от никтурии, характеризует тяжелую ХСН с низким сердечным выбросом, высоким уровнем циркулирующих ангиотензина II, альдостерона, вазопрессина и критически сниженным почечным кровотоком.
Жалобы на уменьшение массы тела предоставляют дополнительную диагностическую информацию относительно динамики и индивидуального прогноза заболевания, поскольку свидетельствуют о значительно активированных патофизиологических механизмах прогрессирования ХСН. Клинически значимой считается потеря >7,5% массы тела в течение последних 6 мес. Механизмы потери массы тела у больных с ХСН приведены ниже.
Абдоминальные жалобы — тяжесть в эпигастральной области,тошноту, иногда рвоту, запор, диарею, анорексию отдельно или в различных комбинациях отмечают больные с явлениями застоя большого круга кровообращения. Они являются следствием таких изменений, как гепатомегалия, асцит, отек кишечника. Имеются данные, что в происхождении анорексии, которую отмечают у значительной части пациентов с тяжелой ХСН, играет роль соответствующее центральное действие ФНО-α.
Не стоит забывать, что указанные симптомы могут быть проявлением любого другого сопутствующего заболевания со стороны ЖКТ.
Симптомы со стороны ЦНС — сонливость, возбуждение, бессонница, спутанность сознания, дезориентация и т.п. возможны при терминальной ХСН, при критическом снижении сердечного выброса. Чаще их регистрируют у больных пожилого и старческого возраста.
Объективные клинические признаки ХСН
К основным объективным клиническим признакам, которые дают основания подозревать ХСН, принадлежат:
- двусторонние периферические отеки;
- гепатомегалия;
- набухание и пульсация шейных вен, гепатоюгулярный рефлюкс;
- асцит, гидроторакс (двусторонний или правосторонний);
- выслушивание двусторонних влажных хрипов в легких;
- тахипноэ;
- тахисистолия;
- альтернирующий пульс;
- расширение перкуторных границ сердца;
- III (протодиастолический) тон;
- IV (пресистолический) тон;
- акцент II тона над ЛА;
- снижение нутритивного статуса пациента при общем осмотре.
Периферические отеки у пациентов с ХСН являются признаком декомпенсации большого круга кровообращения. Если причиной ХСН является дисфункция левых отделов сердца, этот признак характеризует поздний этап развития этого синдрома. Известно, что появлению отеков предшествует аккумуляция в организме приблизительно 5 л внесосудистой жидкости. Наиболее типична локализация отеков на стопах и голенях, хотя при значительно выраженных застойных явлениях они могут охватывать бедра, мошонку, крестец. Анасарка — тотальный отек подкожной клетчатки, вплоть до невозможности пункции периферических вен развивается на терминальном этапе ХСН. Характерным признаком периферических отеков, вызванных декомпенсацией сердца, является их двусторонняя локализация. Наличие отеков обоих нижних конечностей разной степени выраженности не исключает ХСН, поскольку может отражать сопутствующее одностороннее нарушение лимфо- и венозного оттока. При изолированной недостаточности правых отделов сердца отеки появляются на более раннем этапе декомпенсации.
Периферический отечный синдром может также возникать при других клинических состояниях, что требует проведения соответствующей дифференциальной диагностики (см. далее).
Ключевыми звеньями патогенеза кардиогенного отечного синдрома являются активация РААС, САС, аргинин-вазопрессина, гиперальдостеронизм, снижение почечного кровотока и венозный застой (схема 2.1).
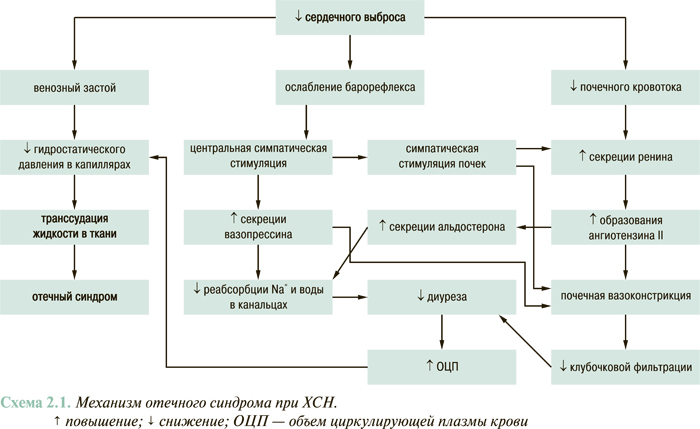
Гепатомегалия, набухание и пульсация шейных вен, гепатоюгулярный рефлюкс являются признаками системной венозной гипертензии, возникающей вследствие невозможности сердца адекватно перекачивать кровь из венозной системы в артериальную. Простым признаком повышения венозного давления является отсутствие спадения яремных вен на вдохе. При этом, в отличие от механической обструкции верхней полой вены, пульсация яремных вен сохраняется. Другим объективным признаком кардиогенной системной венозной гипертензии является гепатоюгулярный рефлюкс, а именно увеличение набухания и пульсации яремных вен при нажатии на область живота (правый верхний квадрант) в течение 20–30 с в горизонтальном положении больного.
Асцит — позднее проявление декомпенсации большого круга кровообращения, обусловленное транссудацией жидкости в брюшную полость из ее вен на фоне значительно и длительно повышенного венозного давления у больных с ХСН. Наиболее выражен асцит при констриктивном перикардите и пороках трикуспидальных клапанов. Выраженный напряженный асцит требует дифференциальной диагностики с синдромом портальной гипертензии, обусловленным прежде всего билиарным циррозом печени.
Гидроторакс выявляют приблизительно у И больных с бивентрикулярной СН. Хотя по своему характеру он является двусторонним, в большинстве случаев значительное количество жидкости накапливается справа. Гидроторакс при ХСН представляет собой транссудат из плевральных вен. Может быть проявлением не только системной венозной гипертензии, а и хронической гиперволемии малого круга кровообращения, поскольку плевральные вены впадают не только в систему верхней полой вены, а и частично в легочные вены.
У больных с ХСН при наличии гидроторакса необходимо проведение дифференциальной диагностики, прежде всего с экссудативным плевритом инфекционного и онкологического происхождения.
Крепитирующие влажные хрипы в легких возникают вследствие транссудации жидкости в альвеолы с дальнейшим перемещением в бронхиолы и обусловлены гиперволемией малого круга кровообращения при насосной недостаточности левых отделов сердца. Указанные хрипы выслушиваются с двух сторон, локализуются в нижних отделах легких и сопровождаются притуплением перкуторного тона. Их наличие свидетельствует о высоком риске возникновения острого альвеолярного отека легких, а также является сигналом для проведения неотложной диуретической терапии. Если на фоне адекватного ответа на диуретическую терапию на протяжении 1–2 сут отсутствует положительная динамика в виде значительного уменьшения или исчезновения хрипов в легких, следует исключить сопутствующую двустороннюю нижнедолевую пневмонию, которая нередко развивается у этих больных.
Тахипноэ (то есть количество дыхательных движений >20 в 1 мин), определяемое в состоянии покоя, свидетельствует о значительном повышении легочно-капиллярного давления, вызванного насосной недостаточностью левых отделов сердца. Нуждается в проведении дифференциальной диагностики со многими другими состояниями (табл. 2.5).
Таблица 2.5
Симптомы, наблюдаемые как при ХСН, так и при других патологических состояниях
| Одышка | Кашель | Слабость | Тахисистолия | Периферические отеки | Гепатомегалия | Гидроторакс | Асцит |
|
|
|
|
|
|
|
|
Тахисистолию (ЧСС >80 уд./мин) отмечают у большинства пациентов с ХСН, если не проводится терапия препаратами, снижающими ЧСС (блокаторы β-адренорецепторов, сердечные гликозиды). У пациентов с декомпенсированной СН и синусовым ритмом тахикардия является опосредованным через САС адаптивным механизмом, направленным на поддержание необходимого МОК в условиях сниженной систолической способности ЛЖ. При фибрилляции предсердий самостоятельным патогенетическим фактором тахисистолии является дисфункция AV-узла, что требует применения терапии, направленной на нормализацию частоты желудочковых сокращений.
Альтернирующий пульс можно рассматривать как диагностический критерий СН в случаях сохраненного синусового ритма. О нем речь идет в случаях, когда при равномерных промежутках между пульсовыми ударами отмечают разное их наполнение. На сфигмограмме это проявляется пульсовыми волнами разной амплитуды. При объективном исследовании больного альтернация пульса наиболее четко определяется на а. femoralis. Механизм альтернирующего пульса состоит в колебаниях САД вследствие вариаций ударного объема ЛЖ, связанных с выраженной миокардиальной недостаточностью (кардиомиоциты не успевают восстановить необходимое количество макроэргических соединений для последующего сокращения). Этим механизмом объясняется то, что альтернация пульса нередко возникает непосредственно после эктопических желудочковых сокращений (единичных или групповых), а также то, что она может быть индуцирована быстрой электростимуляцией предсердий. Альтернирующий пульс — маркер выраженной систолической дисфункции ЛЖ. Он не наблюдается при СН, основной причиной которой является нарушение диастолического наполнения желудочков.
Расширение перкуторных границ сердца одновременно влево и вверх отмечают при ХСН с систолической дисфункцией ЛЖ, что свидетельствует о дилатации ЛЖ и левого предсердия (ИБС, декомпенсированное гипертензивное сердце, аортальная и митральная регургитации без бивентрикулярной недостаточности). На этапе развития последней наблюдается также и расширение правой границы относительной тупости сердца вправо (указывает на дилатацию правого предсердия). Расширение перкуторных границ сердца только вправо характерно для изолированной недостаточности его правых отделов (первичная или вторичная легочная гипертензия, трикуспидальные пороки, стеноз ЛА), а также для митрального стеноза, осложненного легочной гипертензией. В последнем случае указанный признак объединяется со смещением границы относительной тупости сердца вверх. Тотальное расширение перкуторных границ сердца выявляют у пациентов с СН, вызванной экссудативным перикардитом, декомпенсированным митральным пороком, диффузным миокардитом с систолической дисфункцией обоих желудочков, а также в случаях, когда к насосной недостаточности ЛЖ присоединяется недостаточность правых отделов сердца (см. выше). Для больных с констриктивным перикардитом характерны нормальные границы сердца.
III (протодиастолический) тон может быть определен только у больных с синусовым ритмом. Является маркером значительно выраженной систолической дисфункции, возникая вследствие резкого замедления притока крови в ЛЖ в конце фазы его быстрого наполнения. Аускультативный феномен в виде трехчленного ритма с указанным дополнительным (низкочастотным) III тоном в протодиастолу получил название «протодиастолический ритм галопа». Наличие III протодиастолического тона ассоциировано с неудовлетворительным прогнозом выживания. Хотя патологический III тон является высокоспецифичным для систолической ХСН, иногда он может наблюдаться при аневризме ЛЖ без признаков СН.
IV (предсердный) тон, в отличие от III патологического, отражает нарушение не систолической, а диастолической функции ЛЖ. Возникает вследствие затрудненного изгнания крови левым предсердием в условиях сниженной эластичности ЛЖ в последнюю фазу диастолы. IV предсердный тон может наблюдаться у больных с диастолической дисфункцией ЛЖ как с клиническими признаками застойной СН, так и без них.
Акцент II тона на ЛА у больных с насосной недостаточностью левых отделов сердца свидетельствует о наличии легочной гипертензии.
Сниженный нутритивный статус является довольно частым признаком клинически манифестной ХСН. У 12–16% пациентов выявляют кахексию (ИМТ <20 кг/м2 или масса тела <80% идеальной).
Исходя из современных представлений, можно выделить два главных фактора прогрессирующей потери массы тела у больных с ХСН:
а) дисфункция органов пищеварения (печени, поджелудочной железы, тонкого кишечника) в условиях хронического венозного застоя (так называемый синдром мальабсорбции);
б) уменьшение массы периферических мышц в условиях их оксидантного стресса и эффектов противовоспалительных цитокинов, прежде всего ФНО-α (инсулинорезистентность, угнетение процессов белкового синтеза, апоптоз миоцитов).
Будучи неспецифическим признаком, уменьшение массы тела при ХСН требует исключения сопутствующих состояний, которые могут быть его причиной (онкологическое заболевание, хронические инфекции и т.д.).
Комплексная оценка клинических симптомов и признаков ХСН
Оценка возможности диагностирования СН на основании лишь клинических симптомов должна базироваться на учете двух ключевых обстоятельств. Во-первых, в реальной клинической практике у конкретного пациента отмечают лишь часть (нередко меньшую) вышеприведенных симптомов, которые определяются рядом факторов — характером дисфункции сердца и ее этиологической причиной, выраженностью циркуляторных нарушений, индивидуальными особенностями организма. Во-вторых, ни один из описанных выше клинических симптомов СН, если их оценивать отдельно, не имеет одновременно достаточной чувствительности5 и специфичности6. Например, одышка и слабость — достаточно чувствительные признаки, поскольку возникают у большинства пациентов с ХСН. В то же время они малоспецифичны, поскольку наблюдаются при многих других патологических состояниях. Наоборот, такие признаки, как протодиастолический ритм галопа, пульсирующие расширенные яремные вены, двусторонние крепитирующие хрипы, являются высокоспецифичными, но вместе с тем малочувствительными симптомами, поскольку у многих больных с ХСН отсутствуют.
Уверенность начинающего врача относительно простоты диагностики СН на основании лишь одной клинической симптоматики легко исчезает при ознакомлении с табл. 2.5.
Поскольку ни один из клинических симптомов ХСН не имеет самостоятельного диагностического значения, первичная диагностика ХСН должна базироваться лишь на комплексной оценке всех имеющихся симптомов. Диагноз ХСН тем более вероятен, чем большее количество соответствующих симптомов, особенно высокоспецифичных, выявлено у пациента (табл. 2.6). Результатом указанной первичной диагностики СН является установление предварительного диагноза, который должен быть подтвержден, уточнен и расширен с помощью соответствующих инструментальных методов.
Таблица 2.6
Чувствительность и специфичность* отдельных клинических симптомов при подтвержденной ХСН (Harlan W. et al., 1997; Cleland J., et al., 2002)
| Симптомы и признаки | Чувствительность, % | Специфичность, % |
| Одышка | 66–82 | 52 |
| Пароксизмальное ночное удушье | 33 | 76 |
| Ортопноэ | 21 | 81 |
| Двусторонние влажные хрипы в легких | 13 | 91 |
| Набухание/пульсация яремных вен | 10 | 97 |
| III протодиастолический тон | 31 | 95 |
| Тахисистолия >100 уд./мин | 7 | 99 |
| Периферические отеки | 23–55 | 80 |
| Слабость | 68 | — |
*Приемлемым уровнем чувствительности или специфичности признака считается его значение >70%, высоким >85–90%.
Инструментальная диагностика ХСН
Основными инструментально-диагностическими методами, применение которых оправдано практически у всех больных с симптомами ХСН, являются эхоКГ, рентгенография органов грудной клетки и ЭКГ.
ЭхоКГ
ЭхоКГ играет ведущую роль в объективизации СН. Диагностические возможности современного УЗИ сердца обобщены на схеме 2.2.

Важнейший параметр внутрисердечной гемодинамики — ФВ ЛЖ — интегральный показатель систолической функции сердца, показывающий, какая часть крови КДО ЛЖ выбрасывается в аорту в систолу. С физиологической точки зрения ФВ свидетельствует о степени систолического сокращения волокон миокарда в систолу. Чтобы достичь правильного методологического определения и трактования этого показателя, следует учитывать несколько положений.
- Определение ФВ ЛЖ с помощью известной формулы Teicholz на базе данных эхоКГ в М-режиме не является адекватным у пациентов со сферизацией дилатированного ЛЖ и его регионарной дисфункцией (ИБС). Поэтому данный показатель следует определять с помощью двухмерной эхоКГ, желательно на основе использования модифицированного алгоритма (метода) Симпсона.
- Воспроизводимость результатов определения ФВ ЛЖ разными исследователями довольно низкая. Поэтому при динамическом наблюдении больного желательно осуществлять повторные исследования на той же ультразвуковой системе тем же специалистом.
- В случае существенной митральной регургитации ФВ ЛЖ не может служить мерой оценки систолической функции ЛЖ, поскольку, несмотря на адекватное сокращение миокардиальных волокон, необходимый ударный объем не обеспечивается вследствие возвращения значительной части крови в систолу ЛЖ в левое предсердие. Поэтому оценивая тяжесть состояния и прогноз таких пациентов, следует опираться не на величину ФВ, а на ФК заболевания, выраженность циркуляторных нарушений и объем регургитации на митральном клапане.
Допплер-эхоКГ-исследование трансмитрального диастолического потока крови и кровотока по легочным венам (рис. 2.3) разрешает получить информацию относительно способности ЛЖ к расслаблению и снижению его эластичности (способности к растяжению). С этой целью определяются такие показатели, как время изоволюмического расслабления ЛЖ (IVRТ), соотношение пиковых скоростей раннего (А) и позднего (Е) (систола предсердий) наполнения предсердий (Е/А), время замедления скорости раннего диастолического потока (ОТ). Для уточнения значимости показателей трансмитрального потока целесообразно оценивать дополнительно поток в легочных венах: соотношение скорости и потока в систолу и диастолу желудочков (PVs/PVd), а также соотношение продолжительности потока в систолу предсердия через митральный клапан и в легочной вене (MVAdur/ PVARdur).
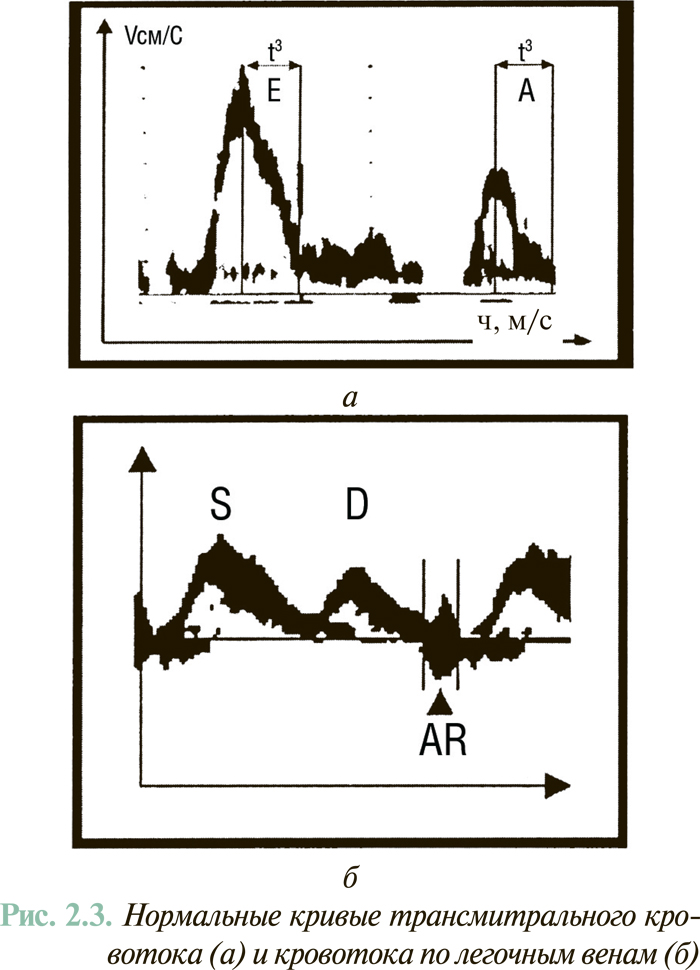
Исходя из данных допплеровского исследования трансмитрального кровотока и потока в легочных венах выделяют следующие типы нарушения диастолической функции ЛЖ (рис. 2.4).
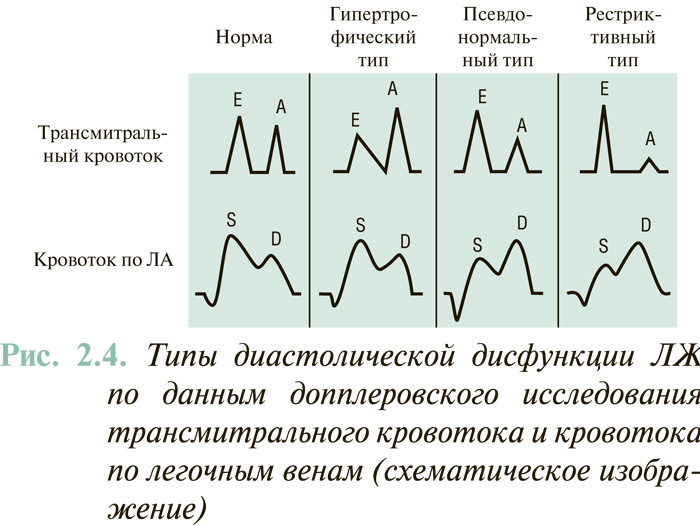
- Нарушение релаксации ЛЖ при нормальном давлении наполнения (синоним: гипертрофический тип диастолической дисфункции): уменьшение Е с компенсаторным нарастанием А. Величина Е/А <1, отмечается увеличение IVRT и DT. При этом PVs/PVd >1, MVAdur/PVARdur >1.
- «Псевдонормальное» наполнение ЛЖ: нарушение релаксации в связи с повышением давления наполнения. За счет повышения давления наполнения ЛЖ показатели Е/А, IVRT, DT в пределах нормы, однако PVs/PVd <1, MVAdur/PVARdur <1.
- Рестриктивный тип наполнения: значительное увеличение Е за счет роста раннедиастолического трансмитрального градиента давления, обусловленное высоким давлением в левом предсердии, Е/А >2, уменьшение IVRT и DT. Также отмечается дальнейшее уменьшение PVs/PVd и MVAdur/PVARdur. Патологическое повышение отношения Е/А может быть следствием двух гемодинамических ситуаций. Первую из них отмечают при рестриктивных поражениях миокарда (амилоидоз, фиброэластоз, гемохроматоз, саркоидоз). В этом случае за счет значительного снижения пассивно-эластичных свойств миокарда значительно снижается скорость позднего диастолического наполнения ЛЖ (А), а за счет компенсаторного повышения давления в левом предсердии может ускоряться раннее диастолическое наполнение ЛЖ (рост Е). Несколько иную ситуацию наблюдают при систолической дисфункции ЛЖ, когда выраженное повышение левопредсердного и легочно-венозного давления обусловливает быстрый ток крови в полость дилатированного ЛЖ (повышение Е). Вместе с тем поздний («предсердный») диастолический поток таким же образом замедляется за счет высокого давления наполнения ЛЖ.
Нарушенная релаксация (гипертрофический тип), псевдонормальный и рестриктивный типы наполнения ЛЖ отражают умеренную, среднюю и тяжелую степени его диастолической дисфункции соответственно.
Следует помнить, что по методологическим причинам сфера применения допплер-эхоКГ-оценки диастолической функции ЛЖ ограничивается пациентами с сохраненным синусовым ритмом и без недостаточности клапанов сердца.
Рентгенография органов грудной клетки
Рентгенография органов грудной клетки является необходимой составляющей диагностических исследований при СН и способна предоставить врачу важную клиническую информацию.
На начальном этапе инструментальной диагностики СН рентгенография органов грудной клетки дает возможность определить увеличение размеров сердца, что сразу делает диагноз СН высокодостоверным. Общепринятый объективный критерий кардиомегалии — повышение кардиоторакального индекса (отношение наибольшего поперечного размера сердца к наибольшему внутреннему поперечному размеру грудной клетки) >50% (рис. 2.5).
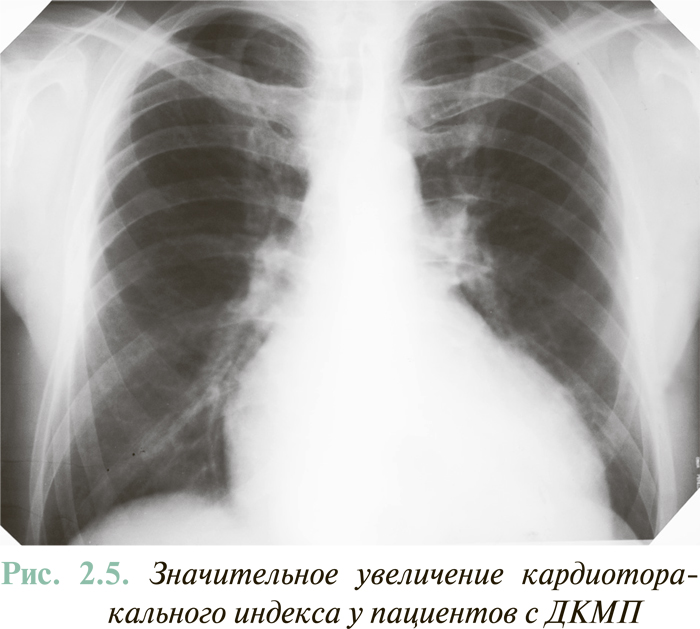
В то же время величина кардиоторакального индекса <50% автоматически не исключает наличия СН, поскольку при некоторых заболеваниях сердца признаки СН возможны при нормальных или незначительно увеличенных его размерах. Прежде всего это касается диастолической СН (см. ниже). Снижение кардиоторакального индекса, наряду с соответствующей динамикой эхоКГ-показателей, является информативным критерием эффективности лечения пациентов с ХСН и систолической дисфункцией ЛЖ.
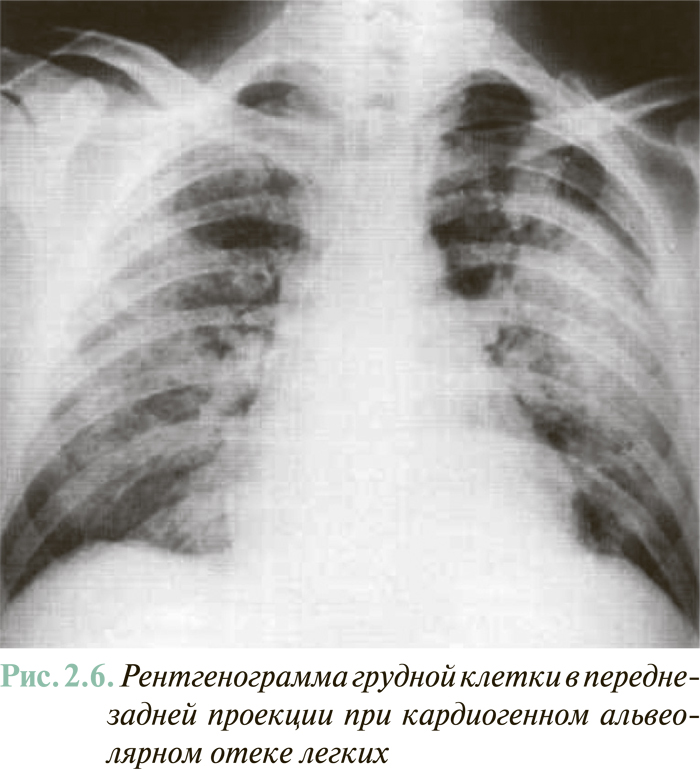
Рентгенографическое исследование предоставляет также ценную информацию относительно наличия и выраженности застойных явлений в легких как при установлении диагноза СН, так и при динамическом наблюдении больного. Ранними признаками легочно-венозного застоя является перераспределение кровотока в верхних отделах легких с соответствующим обогащением в них сосудистого рисунка. Большая степень гиперволемии легких (в случае если легочно-капиллярное давление >20 мм рт. ст.) сопровождается признаками наличия транссудата, который локализуется периваскулярно и перибронхиально в области корней легких, делая последние визуально малоструктурированными, «размытыми», и постепенно распространяется на периферию. Маркером интерстициального отека легких являются так называемые В-линии Керли (Кеrlеу Р., 1933) — обычно 3–5 тонких (1–2 мм) параллельных затемненных линий длиной 0,5–3 см, локализованных в области реберно-диафрагмального угла и боковых базальных отделах легких. Линии Керли является результатом наличия жидкости в междолевых щелях и расширения лимфатических сосудов. В случае превышения легочно-капиллярного давления >25 мм рт. ст. может возникать массивный плевральный выпот и/ или альвеолярный отек легких (типичная рентгенологическая картина последнего — массивное двустороннее затемнение, которое распространяется от корней легких в направлении периферии, подобно «крыльям мотылька» (рис. 2.6).
Рентгенологическими признаками легочноартериальной гипертензии, которая у взрослых является наиболее частым фактором насосной недостаточности правых отделов сердца (см. ЭТИОЛОГИЯ ХСН), является выбухание ствола ЛА, наличие округлых теней дилатованных ветвей ЛА в области расширенных корней, «обрыв» артериальных ветвей на уровне сегментарных сосудов с дальнейшим отсутствием сосудистого рисунка по периферии легочных полей.
Важной функцией рентгенографии грудной клетки на этапе уточнения диагноза ХСН является также дифференциальная диагностика с заболеваниями дыхательной системы.
Рентгенографическое исследование также является главным средством диагностики и контроля эффективности лечения таких осложнений СН, как застойная пневмония, гидроторакс, тромбоэмболия ветвей ЛА.
Электрокардиография
Рутинная ЭКГ в 12 отведениях на начальном этапе формирования диагноза может предоставить помощь в определении этиологии и отягчающих факторов возможной СН — например в случаях выявления признаков крупноочагового рубцового кардиосклероза ЛЖ, гипертрофии отделов сердца, полной блокады ножек (прежде всего левой) пучка Гиса, тахиаритмии.
Прогностическая ценность наличия патологических изменений на ЭКГ при установлении диагноза СН низкая (не более 50–60%), поскольку все эти изменения возможны и у больных без нарушения насосной функции сердца. Наоборот, прогностическая ценность отсутствия патологических изменений на ЭКГ относительно отсутствия СН >90%. Это означает, что в случае нормальной ЭКГ можно с достаточно высокой степенью достоверности (>90%) исключить диагноз СН.
При ХСН наиболее важную роль ЭКГ играет как средство контроля эффективности и безопасности медикаментозного лечения больных сердечными гликозидами, блокаторами β-адренорецепторов, амиодароном, диуретиками (при этом оценивают ритм, проводимость, признаки насыщения дигиталисом, продолжительность интервала Q–T, наличие электролитных нарушений).
С целью получения дополнительной информации для диагностики СН при динамическом наблюдении этих больных используют различные инструментальные методы.
Радионуклидная вентрикулография
Радионуклидная вентрикулография может быть полезной в случае трудностей с получением полноценной диагностической информации с помощью эхоКГ-исследования (проблемы с так называемым ультразвуковым окном). Этот метод дает возможность с высокой точностью оценивать глобальную и сегментарную систолическую функцию обоих желудочков и показатели их диастолической функции. Постоянное усовершенствование диагностических ультразвуковых систем сделало применение радионуклидной вентрикулографии в последние годы менее актуальным.
Магнитно-резонансное исследование сердца
Магнитно-резонансное исследование (МРИ) сердца — наиболее точный и воспроизводимый метод определения массы, объема полостей, ФВ желудочков, объема клапанных регургитаций и минутного объема сердца (МОС). Применение МРИ ограничивается высокой стоимостью соответствующей аппаратуры и самого исследования.
Холтеровское мониторирование ЭКГ
Не играет самостоятельной роли в диагностировании СН. В то же время у пациентов с уже установленным диагнозом ХСН суточное мониторирование ЭКГ дает возможность выявлять желудочковые аритмии высоких градаций, которые являются маркером повышенного риска возникновения внезапной сердечной смерти.
Кроме этого, холтеровское мониторирование позволяет выявлять эпизоды тахи- и брадисистолических нарушений ритма или безболевой ишемии миокарда, которые при СН могут быть причиной транзиторных эпизодов левожелудочковой недостаточности или синкопальных проявлений.
Оценка вариабельности ритма сердца (ВРС) (суточная — по данным холтеровского мониторирования или на основании регистрации 5-минутных отрезков ЭКГ с помощью соответствующих компьютерных программ) может предоставить дополнительную информацию для оценки индивидуального прогноза ХСН (см. ниже) и объективизировать корригирующее влияние терапии нейрогуморальными антагонистами при нарушенной автономной регуляции сердца у этих больных. В качестве рутинного диагностического метода при ХСН ВРС пока что не применяют.
Пробы с дозированной физической нагрузкой
Пробы с дозированной физической нагрузкой не являются средством диагностики ХСН. Впрочем, если результат ВЭМ или пробы на тредмиле с максимальной физической нагрузкой соответствует норме, диагноз СН, как правило, можно исключить.
Роль нагрузочных тестов при ХСН заключается в объективизации функционального состояния больных и оценке эффективности их лечения. С этой целью в специализированных медицинских учреждениях иногда применяют ступенчато-возрастающие пробы на ВЭМ или тредмиле с определением общего времени нагрузки/общего объема выполненной работы, а также, при наличии спироэргометрического оборудования — потребление кислорода на максимуме достигнутой нагрузки (VO2max). Последний подход является «золотым стандартом» определения толерантности к физической нагрузке у пациентов с ХСН, поскольку уровень VO2max более всего (среди других клинико-инструментальных показателей) коррелирует со способностью больных выполнять бытовые физические нагрузки и с прогнозом их выживания. Определенным недостатком указанных проб является то, что основной критерий их прекращения при ХСН — невозможность выполнять дальнейшую работу в связи с одышкой — является субъективным.
В рутинной клинической практике с целью объективизации функционального состояния и контроля эффективности лечения пациентов с ХСН можно применять тест с 6-минутной ходьбой, который является достаточно информативным и довольно безопасным. Его проведение противопоказано пациентам с гемодинамически нестабильной ХСН (гиперволемическое состояние, артериальная гипотензия), наличием эпизодов желудочковой тахикардии и клинико-электрокардиографическими признаками дестабилизации ИБС.
Результаты теста с 6-минутной ходьбой хорошо коррелируют с ФК больных, установленным по клиническим критериям, и с величиной VO2mах (табл. 2.7).
Таблица 2.7
Критерии ФК больных с ХСН по данным теста с 6-минутной ходьбой
| ФК | Дистанция, пройденная за 6 мин, м | Максимальное потребление кислорода, мл·кг-1·мин-1 |
| 0 (отсутствие явной или скрытой СН) | >550 | >22,0 |
| 1 (бессимптомная дисфункция ЛЖ) | 426–550 | 18,1–22,0 |
| II | 301–425 | 14,1–18,0 |
| III | 150–300 | 10,1–14,0 |
| IV | <150 | ≤10 |
Стресс-эхоКГ с добутамином
Введение добутамина в низких дозах (инфузия со скоростью 5–10 мкг·кг-1·мин-1) может применяться у пациентов с ХСН на почве ИБС и систолической дисфункцией ЛЖ для оценки жизнеспособности акинетичных зон миокарда, с целью определения показаний к его реваскуляризации.
Чреспищеводная эхоКГ
Чреспищеводная эхоКГ не является рутинным средством диагностики ХСН. Применять ее как альтернативный метод можно в случаях плохого ультразвукового окна при трансторакальном доступе. Благодаря более высоким возможностям визуализации по сравнению с рутинной эхоКГ она позволяет, в частности, более точно оценить состояние клапанного аппарата сердца, лучше выявить внутрипредсердные тромбы и септальные предсердные дефекты.
Оценка функции внешнего дыхания
Оценка функции внешнего дыхания не является средством диагностики СН. Определение ее параметров (ОФВ1, ОФВ1/ФЖЕЛ) осуществляется в отдельных случаях с целью исключения бронхолегочной причины одышки.
Инвазивные методы исследования сердца
Инвазивные методы исследования сердца не применяют с целью установления диагноза ХСН, однако по специальным показаниям могут осуществляться на дальнейших этапах исследования больного.
Так, коронароангиография (КАГ) целесообразна в случаях, когда с помощью других клинико-инструментальных методов невозможно провести дифференциальную диагностику между коронарным и некоронарным происхождением СН, особенно при ее рефрактерности к терапии. Другим показанием к проведению КАГ является решение вопроса относительно реваскуляризации ЛЖ у лиц с ХСН, обусловленной ИБС, при наличии стенокардии, эпизодов миокардиальной ишемии или зон жизнеспособного (гибернированного) миокарда, выявленных с помощью добутаминового стресс-теста. КАГ также показана пациентам с ХСН, являющимися кандидатами для хирургической коррекции митральной регургитации и/или аортального порока сердца.
Катетеризация ЛЖ с контрастной вентрикулографией (является частью протокола общего коронаровентрикулографического исследования) предоставляет возможность точного определения давления наполнения ЛЖ, лучшей визуализации его аневризм.
Катетеризация правых отделов сердца с инвазивным мониторингом давления заклинивания в ЛА. Ее проведение оправдано только у больных с ОСН (шок, альвеолярный отек легких), рефрактерной к стандартной программе интенсивной терапии.
Лабораторные методы исследования в диагностике СН
Определение содержания НУП в плазме крови
Показано, что повышение концентрации циркулирующих НУП — предсердного, так называемого МНУП и его N-концевого фрагмента (NT-МНУП) является ранним маркером дисфункции ЛЖ — как систолической, так и диастолической. В последние годы этот подход получил статус диагностического стандарта.
Высокая чувствительность повышения концентрации циркулирующих МНУП или КТ-МНУП (>90%) относительно наличия дисфункции ЛЖ, с одной стороны, и внедрение экспрессметодик их определения — с другой, позволяет рекомендовать их как первостепенный скрининговый диагностический метод у больных с симптомами вероятной СН (прежде всего, одышкой), а также для исключения доклинической дисфункции ЛЖ. Поскольку специфичность повышения МНУП или КТ-МНУП в определении дисфункции ЛЖ уступает его чувствительности (повышение их уровня возможно, в частности, при острых коронарных синдромах, ТЭЛА, почечной недостаточности), целесообразно использовать этот тест как метод исключения СН в случаях нормального уровня указанных пептидов. При повышенном уровне МНУП или КТ-МНУП, выявленном по экспресс-методике, следующим шагом является проведение эхоКГ.
В последнее время продемонстрировано, что высокий уровень циркулирующего МНУП и отсутствие его выраженной обратной динамики на фоне лечения является более точным предиктором плохого прогноза у больных с тяжелой ХСН, чем такие показатели, как ФВ ЛЖ, количественная оценка клинического состояния больного в баллах и VО2mах .
Преимуществом экспресс-определения МНУП или КТ-МНУП с целью оценки динамики левожелудочковой функции в процессе лечения пациентов с ХСН является значительно лучшая воспроизводимость результатов измерения по сравнению с результатами эхоКГ-исследования.
Гематологические и биохимические анализы
Рекомендованными стандартными (обязательными) лабораторными исследованиями при ХСН являются: 1) общий анализ крови (гемоглобин, количество эритроцитов, лейкоцитов и тромбоцитов, гематокрит); 2) общий анализ мочи; 3) биохимический анализ крови, а именно электролиты (К+, Cа+) плазмы крови, креатинин плазмы крови, печеночные ферменты и билирубин, уровень глюкозы крови.
Определение наличия анемии имеет клиническое значение по нескольким причинам. Во-первых, хорошо известно, что коррекция анемии как фактора, усугубляющего симптоматику ХСН, способствует улучшению клинико-функционального состояния больного. Во-вторых, наличие анемии сопряжено с худшим прогнозом выживания таких пациентов. В-третьих, анемия может свидетельствовать о наличии клинически актуальной сопутствующей патологии, нуждающейся в соответствующем лечении.
Повышение гематокрита может свидетельствовать о наличии полицитемии при легочном генезе одышки, с другой же стороны — своевременно сигнализировать о сгущении крови на фоне чрезмерно интенсивной диуретической терапии.
Лимфоцитопения является независимым предиктором плохого выживания при ХСН.
Общий анализ мочи, кроме выявления возможного сопутствующего заболевания почек, позволяет определить наличие и уровень протеинурии, которая может быть одним из признаков конечного этапа ХСН («застойная почка»).
Контроль электролитов крови является важным элементом оценки клинического состояния больного и мониторинга безопасности проводимой терапии.
Гипокалиемия, с одной стороны, является одним из возможных проявлений вторичного гиперальдостеронизма, характерного для декомпенсированной ХСН, с другой же — может возникать во время активной терапии петлевыми и/или тиазидными диуретиками. Гипокалиемия повышает риск развития фатальных желудочковых аритмий, в связи с чем ее необходимо своевременно корригировать повышением доз калийсберегающих диуретиков и, при необходимости, инфузией глюкозо-инсулино-калиевой смеси. Поэтому при стационарном лечении пациентов с декомпенсированной ХСН необходимо регулярно контролировать уровень К+ плазмы крови (в определенных клинических ситуациях — ежесуточно).
Гиперкалиемия (К+ плазмы крови >5,5 ммоль/л) может возникать при ХСН в двух основных случаях. Во-первых, у больных с тяжелой ХСН появление гиперкалиемии, несмотря на активное лечение петлевыми диуретиками, часто является признаком перехода ХСН в терминальную фазу с прогрессивным ухудшением почечной функции вследствие критического снижения сердечного выброса (для этой ситуации характерно сочетание гиперкалиемии с повышением креатинина плазмы крови). Во-вторых, она может быть следствием избыточной коррекции гипокалиемии (чрезмерное применение калийсберегающих диуретиков, инфузий глюкозо-калиевой смеси). Гиперкалиемия также может быть проявлением побочного действия ингибиторов АПФ, блокаторов рецепторов ангиотензина II и антагонистов альдостерона, особенно при их сочетанном применении. Выраженная гиперкалиемия характеризуется повышенным риском возникновения блокад и брадисистолических нарушений ритма, вплоть до асистолии.
Гипонатриемия у пациентов с ХСН может быть следствием двух различных клинических ситуаций. При первой из них снижение концентрации Na+ в плазме крови отражает значительную выраженность гиперволемии (часто при анасарке), а следовательно, имеет относительный характер («гипонатриемия разведения») Гипонатриемия такого происхождения, как правило, устраняется при успешном преодолении отечного синдрома. В другом случае гипонатриемия может возникать у больных с тяжелой ХСН на фоне продолжительной интенсивной (нередко чрезмерной) терапии диуретиками, которая сочетается с недостатком поступления хлорида натрия в организм. Факторами последней могут быть полная бессолевая диета, анорексия, рвота (особенно при их сочетании). Гипонатриемия этого типа, как правило, сопровождается выраженной компенсаторной активацией соответствующих нейрогормональных систем (РАС, аргинин-вазопрессин) и рассматривается как маркер плохого прогноза выживания.
Повышение уровня креатинина в плазме крови может свидетельствовать о наличии как самостоятельного декомпенсированного заболевания почек, так и о переходе ХСН в терминальную фазу (см. выше). Другой причиной повышения концентрации циркулирующего креатинина может быть терапия ингибиторами АПФ и/или блокаторами рецепторов ангиотензина II (см. ЛЕЧЕНИЕ). Повышение уровня креатинина отмечается и при чрезмерной диуретической терапии, которая приводит к снижению системного АД, общего объема циркулирующей жидкости и соответственно гипоперфузии почек («преренальная азотемия»). Кроме того, повышение уровня креатинина может свидетельствовать о нарушении азотвыделительной функции почек, вызванной лекарственными препаратами, использующимися для лечения осложнений ХСН и сопутствующих состояний (примером может быть нефротоксическое действие антибиотиков при терапии застойной или тромбинфарктной пневмонии).
Повышение активности печеночных ферментов в плазме крови (АлАТ, ГГТ), а также циркулирующего билирубина может быть маркером дисфункции печени, вызванной застойными явлениями в ней. Успешное лечение декомпенсации кровообращения обычно сопровождается их обратной динамикой.
Кроме того, наличие и степень печеночной дисфункции, определяемой с помощью лабораторных тестов, необходимо учитывать при назначении и мониторированнии эффектов применяемых при ХСН препаратов, которые характеризуются исключительно или преимущественно печеночным путем выведения (карведилол, амиодарон, дигитоксин, некоторые другие).
Кроме вышеприведенных рекомендованных к стандартному применению показателей, важную дополнительную информацию при ХСН могут предоставлять некоторые другие лабораторные тесты.
Концентрацию мочевой кислоты в крови целесообразно определять больным с тяжелой ХСН исходя из следующих соображений. Во-первых, необходимо контролировать гиперурикемию, которая, как известно, нередко осложняет длительное регулярное применение петлевых и/или тиазидных диуретиков в значительных дозах. Во-вторых, интенсивность образования мочевой кислоты является маркером выраженности системного оксидантного (свободнорадикального) повреждения тканей, а ее высокий уровень в крови является предиктором плохого выживания пациентов с ХСН. Поэтому полезно определять уровень мочевой кислоты в динамике, с учетом коррекции осуществляемого медикаментозного лечения.
Тиреотропный гормон. Определение его уровня в крови целесообразно с целью исключения гипер- или гипотиреоза как причины или как отягощающего фактора СН, а также при подозрении на дисфункцию щитовидной железы на фоне продолжительного приема амиодарона.
Кардиоспецифические ферменты. Необходимо определять в случаях внезапного ухудшения показателей гемодинамики с целью исключения ИМ.
СРБ. Определение его уровня в крови помогает при исключении воспалительного генеза СН (диффузный миокардит).
МНО. Его определение является международным стандартом диспансерного наблюдения больных, принимающих непрямые антикоагулянты. Определение протромбинового индекса является суррогатным подходом, который по определенным объективным причинам до сих пор практикуется в странах СНГ.
КЛИНИЧЕСКАЯ ТЕРМИНОЛОГИЯ
Лево- и правосердечная недостаточность. Левожелудочковая, левопредсердная, правожелудочковая и бивентрикулярная недостаточность
О левосердечной (или «левосторонней») СН речь идет в случаях, когда вследствие насосной недостаточности сердца, возникающей на уровне его левых отделов, наблюдаются симптомы и признаки легочно-венозного застоя (гиперволемия малого круга кровообращения). В большинстве случаев левосердечная СН по своему механизму левожелудочковая, поскольку является следствием хронической или острой декомпенсации ЛЖ (при ИБС, гипертензивном сердце, митральной и аортальной регургитациях). О левопредсердной недостаточности речь идет в случаях митрального стеноза, редко — левопредсердной миксомы.
При длительно существующей постепенно прогрессирующей левосердечной недостаточности создаются условия для возникновения сопутствующей насосной недостаточности правых отделов сердца. К таким факторам принадлежат: а) ремоделирование и энергетическая недостаточность межжелудочковой перегородки как общего для обоих желудочков анатомического образования; б) хроническое повышение давления наполнения ПЖ, обусловленное дилатацией ЛЖ; в) увеличение нагрузки на ПЖ вследствие повышения системного давления в ЛА за счет повышения тонуса ее артериол (рефлекторный защитный механизм, направленный на ограничение кровотока в легких с целью снижения легочно-венозного давления). При появлении у таких больных признаков насосной недостаточности ПЖ в виде застойных явлений в большом круге кровообращения речь идет о присоединении к имеющейся недостаточности левых отделов сердца и правожелудочковой недостаточности, которая по механизму своего возникновения носит вторичный характер. В подобном случае нередко применяют термин «бивентрикулярная», или тотальная СН. Вместе с тем бивентрикулярная СН может возникать и в начале заболевания, когда выраженное поражение миокарда обоих желудочков возникает одновременно (при ДКМП, диффузном миокардите).
Изолированная правожелудочковая недостаточность является следствием исчерпания резервов компенсации или механического затруднения наполнения ПЖ, например при констриктивном перикардите. Изолированная правожелудочковая недостаточность отмечается при декомпенсированном легочном сердце, стенозе устья ЛА, ТЭЛА. Недостаточность большого круга кровообращения можно характеризовать как правопредсердную в редких случаях изолированного трикуспидального стеноза, правопредсердной миксомы и аномалии Эбштейна.
ОСН и ХСН
В клинической практике под ОСН обычно понимают быстрое возникновение выраженных клинических признаков насосной недостаточности сердца, чаще всего его левых отделов. В последнем случае наблюдают значительно выраженные одышку и объективные признаки застойных явлений в легких, имеющие тенденцию к нарастанию и трансформации в альвеолярный отек легких. Наиболее частой причиной острой левожелудочковой недостаточности является острый ИМ (со значительным объемом поражения или/и острой митральной недостаточностью вследствие разрыва папиллярной мышцы). Другими причинами ОСН могут быть гипертензивный криз, выраженная тахи- и брадиаритмия, неконтролируемые инфузии значительного количества жидкости у больных с хронической «левосердечной» недостаточностью. Возникновение отека легких как крайней степени острой левопредсердной недостаточности характерно для критического митрального стеноза.
Быстрое снижение насосной функции сердца может сопровождаться развитием кардиогенного шока с типичными для него гипотензией, олигурией и признаками гипоперфузии периферических тканей. Как форма ОСН кардиогенный шок характерен главным образом для ИМ. Кроме критической насосной недостаточности ЛЖ, при ИМ кардиогенный шок возникает в случае медленного развития тампонады сердца при небольшом разрыве сердечной мышцы. Кардиогенный шок возможен и в случаях стойкой, рефрактерной к терапии желудочковой тахикардии.
Кардиогенным шоком манифестируется также острая правожелудочковая недостаточность при массивной ТЭЛА.
Систолическая и диастолическая СН
В большинстве случаев клинические проявления СН обусловлены снижением систолической способности ЛЖ, показателем которой является существенное уменьшение величины его ФВ (<40–45%). Вместе с тем уменьшение УОК может быть вызвано и неадекватным наполнением одного или обоих желудочков вследствие нарушений процессов их активного расслабления или/и пассивного растяжения, сокращения диастолы, а также механических препятствий (табл. 2.8). При этом сократительная способность желудочков существенно не нарушается, о чем свидетельствует нормальная величина их ФВ.
Таблица 2.8
Факторы и механизмы диастолической СН
| Причины | Патофизиологические факторы | Механизмы |
| ИБС | Ишемия
Репаративный (постинфарктный) фиброз |
Замедление активной релаксации ЛЖ
Замедление пассивного расслабления ЛЖ |
| АГ
ГКМП Аортальный стеноз |
ГЛЖ
Фиброз |
Замедление активной релаксации ЛЖ
Замедление пассивного расслабления ЛЖ |
| Рестриктивные поражения миокарда (амилоидоз, гемохроматоз, саркоидоз, фиброэластоз) | Снижение пассивно-эластических свойств миокарда | Замедление пассивного расслабления желудочков |
| Митральный стеноз | Механическое препятствие наполнению ЛЖ | Уменьшение поступления крови в ЛЖ |
| Констриктивный перикардит | Механическое препятствие наполнению ПЖ | Резкое уменьшение диастолического объема ПЖ и ЛЖ |
| Тахисистолия | Сокращение диастолы | Уменьшение диастолического объема ПЖ и ЛЖ |
Объективизировать наличие и особенности диастолической дисфункции сердца можно с помощью допплер-эхоКГ-исследования трансмитрального кровотока и потока крови по легочным венам (см. выше).
Систолическая и диастолическая недостаточность ЛЖ не являются понятиями, тождественными соответственно систолической или диастолической его дисфункции, поскольку каждая из последних может с помощью инструментальных методов определяться и у пациентов без клинических признаков СН.
В таких случаях речь идет о том или ином типе доклинической (бессимптомной) дисфункции ЛЖ.
У многих пациентов с ИБС и АГ с клиническими проявлениями СН с помощью инструментального исследования выявляют сочетание признаков диастолической дисфункции ЛЖ с субнормальными величинами его ФВ (в пределах 45–50%). В такой ситуации с патофизиологической точки зрения можно говорить о «смешанном» типе СН, однако пока что этот термин не получил статус клинического.
Диференциально-диагностические критерии разграничения преимущественно систолического и диастолического типов дисфункции ЛЖ представлены в табл. 2.9 и 2.10.
Таблица 2.9
Клинические и рентгенологические критерии отличия систолической и диастолической дисфункции ЛЖ
| Клинико-рентгенологические данные | Систолическая дисфункция | Диастолическая дисфункция |
| Основные причины СН | 1. Первичное поражение миокарда (распространенный ИМ, ДКМП, диффузный миокардит)
2. Конечная стадия гипертензивного сердца, аортального стеноза, митральной недостаточности |
1. ГЛЖ и нарушение релаксации ЛЖ при гипертензивном сердце, ГКМП, аортальном стенозе, рестриктивных поражениях миокарда |
| Перкуссия | Кардиомегалия | Расширение границ тупости сердца отсутствует или умеренное |
| Аускультация | Тоны приглушены, нередко III протодиастолический тон | Тоны чаще обычной звучности, нередко III пресистолический тон |
| Рентгенография | Кардиоторакальный индекс >50% | Кардиоторакальный индекс <50% |
Таблица 2.10
ЭхоКГ-критерии отличия систолической и диастолической дисфункции ЛЖ
| Показатель | Систолическая дисфункция ЛЖ | Диастолическая дисфункция ЛЖ |
| ФВ ЛЖ | <45% | >45–50% (при ГКМП нередко увеличена) |
| Дилатация ЛЖ | Характерна | Отсутствует |
| Дилатация левого предсердия | Характерна | Характерна |
| Толщина стенок ЛЖ в диастолу | Нормальная или уменьшенная | Утолщение (кроме рестриктивных поражений миокарда) |
| Тип наполнения ЛЖ по данным допплеровского исследования трансмитрального кровотока | Рестриктивный | Гипертрофический или псевдонормальный (рестриктивный — при рестриктивных поражениях миокарда) |
ХСН с сохраненной систолической функцией ЛЖ
Это понятие является более широким, чем диастолическая СН, поскольку объединяет все случаи клинически манифестированной ХСН с ФВ ЛЖ >45%. Кроме вышеописанных случаев «чистой» диастолической СН, сюда можно отнести: а) «смешанный» тип СН; б) правожелудочковую недостаточность при хроническом легочном сердце; в) СН, которая может возникать при выраженных брадисистолических нарушениях ритма (невозможность обеспечения адекватного МОК при нагрузке). Некоторые авторы распространяют указанный термин и на СН при митральной недостаточности, базируясь на нормальной величине ФВ ЛЖ при этом пороке. Тем не менее это представляется недостаточно корректным, поскольку в данной гемодинамической ситуации величина ФВ свидетельствует лишь о способности волокон миокарда ЛЖ к систолическому сокращению, но не о самой систолической способности ЛЖ, которая в таких случаях снижена вследствие возвращения существенного объема крови в левое предсердие в систолу.
По данным различных исследований, ХСН с сохраненной систолической функцией ЛЖ выявляют в 22–50% случаев этого синдрома.
ХСН с повышенным сердечным выбросом
Более чем в 95% случаев ХСН несоответствие снижения сердечного выброса метаболическим потребностям тканей возникает вследствие снижения последнего. Хотя при некоторых клинических состояниях, характеризующихся гиперкинетическим типом кровообращения, вышеуказанная неадекватность и, соответственно, клинические признаки СН могут появляться при повышенном МОК. К таким состояниям относятся тиреотоксикоз, тяжелая анемия, болезнь Педжета, артериовенозные фистулы, сепсис.
К патогенетическим факторам развития этой формы СН относят хроническую перегрузку сердца объемом, хроническую симпатоадреналовую активацию, вторичную метаболическую миокардиопатию, вызванную основным заболеванием (тиреотоксикозом, анемией, септицемией). Сердечный индекс у этих больных обычно умеренно повышен (>4 л·мин-1·м2), однако ниже того, какой был до появления у них СН.
В отличие от больных с ХСН со сниженным сердечным выбросом и клиническими признаками периферической вазоконстрикции (холодные и бледные конечности, сниженное АД, компенсаторное увеличение артериовенозной разницы по кислороду), у пациентов с ХСН и повышенным МОК отмечают периферическую вазодилатацию (теплая и нередко гиперемированная кожа), повышенное пульсовое давление, нормальную или сниженную артериовенозную кислородную разницу.
Стандарты терапии при этой форме СН не разработаны, поскольку решающее значение имеет этиотропное лечение таких больных.
Застойная СН. Декомпенсированная и стабильная СН
Термин «застойная сердечная недостаточность» является синонимом клинически выраженной СН с объективными признаками задержки жидкости в организме. Его в течение длительного времени использовали (преимущественно в западной литературе) как понятие, эквивалентное ХСН. В последнее время в этом значении его применяют значительно реже, поскольку, благодаря прогрессу в области фармакотерапии ХСН (широкое применение нейрогуморальных антагонистов) и организации системы амбулаторной помощи, в западных странах увеличивается количество пациентов, поддерживаемых в течение длительного времени в эуволемическом состоянии. Для характеристики состояния этих пациентов все чаще используют понятие «стабильная ХСН» или «гемодинамически стабильная ХСН». По отношению к больным с явными признаками задержки жидкости, которые являются кандидатами на стационарное лечение, в международной литературе теперь обычно применяют термин «декомпенсированная ХСН».
Недостаточность кровообращения. Хроническая недостаточность кровообращения
Указанные термины, являющиеся синонимами соответственно СН и ХСН и использовавшиеся в течение многих лет в странах бывшего СССР, теперь имеют лишь историческое значение. Можно допустить, что в свете современных представлений о значимости системных периферических и метаболических нарушений в прогрессировании клинически манифестированной ХСН, термин «хроническая недостаточность кровообращения», является более уместным с патофизиологической точки зрения. Тем не менее, с учетом глобальных интеграционных процессов, переход на современную терминологию представляется оптимальным.
Окончательный диагноз ХСН
Диагноз СН базируется на двух глобальных критериях: 1) наличии тех или иных субъективных и объективных симптомов СН; 2) объективизации с помощью инструментальных методов структурных изменений сердца и его дисфункции (систолической или диастолической) в состоянии покоя. Последний момент имеет принципиальный характер, поскольку исключает случаи транзиторного ухудшения функции сердца во время физической нагрузки вследствие других причин. Примером может быть преходящее снижение ФВ ЛЖ на высоте нагрузочной пробы, вызванное индуцированной ишемией миокарда, у больных с ИБС без СН.
Дополнительным критерием является положительный клинический ответ на лечение СН. Его роль состоит в том, что в ургентных случаях он может временно заменить второй из указанных двух главных диагностических критериев. Тем не менее для установления окончательного диагноза СН инструментальная объективизация дисфункции сердца остается обязательной.
Последовательность диагностических действий врача после выявления им клинических симптомов, которые могут свидетельствовать о наличии ХСН, приведена на схеме 2.3.
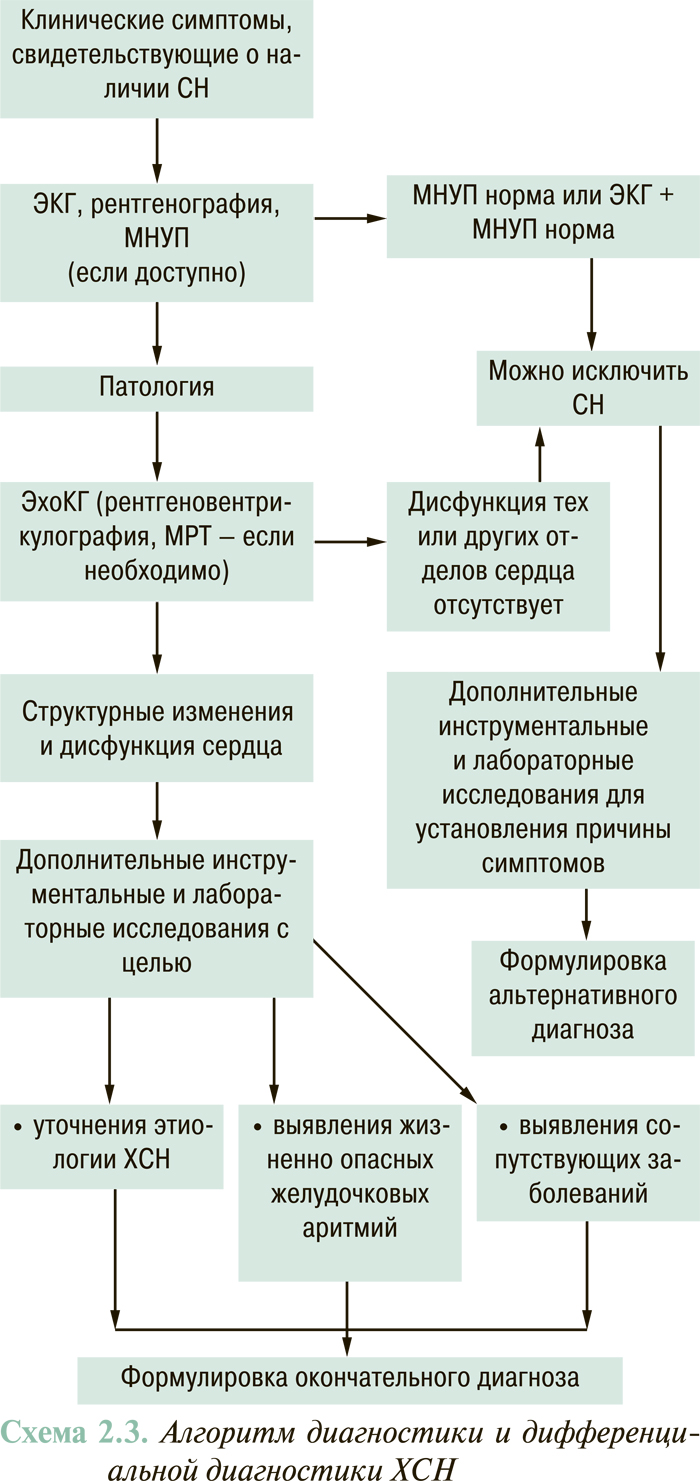
Дифференциальная диагностика СН подразумевает: а) исключение других патологических состояний, проявляющихся подобными субъективными симптомами (см. табл. 2.5); б) исключение ХСН с дальнейшим установлением альтернативного диагноза. Особое значение дифференциальная диагностика СН приобретает в ургентных ситуациях (как правило, при остром приступе одышки), когда точность и оперативность диагностики имеют решающее значение для больного. Кроме общеизвестных дифференциально-диагностических признаков (табл. 2.11 в качестве примера), исключению ХСН или констатации ее высокой вероятности способствует экспресс-определение циркулирующего МНУП или NT-МНУП. Так, в многоцентровом исследовании BNP (2002) прогностическая значимость повышенного уровня NT-МНУП относительно наличия ХСН составляла 83%, а прогностическая значимость нормального его уровня относительно отсутствия ХСН — 85%.
Таблица 2.11
Дифференциальная диагностика сердечной астмы (интерстициального отека легких)
| Данные | Сердечная астма | БА | Тромбоэмболия легочной артерии |
| Анамнестические данные | Заболевание сердца (ИБС, порок), АГ, СН | БА; аллергические реакции | Тромбофлебит, продолжительная иммобилизация; оперативное вмешательство; фибрилляция предсердий |
| Объективный статус | Бледность; холодный пот; холодный акроцианоз | Умеренный теплый цианоз | Теплый цианоз верхней части туловища (возможно) |
| Положение больного | Сидя со спущенными ногами | Сидя или стоя с упором на руки | Сидя или лежа |
| Одышка | Инспираторная, иногда смешанная | Экспираторная | Инспираторная или смешанная |
| Аускультация | Влажные хрипы | Жесткое дыхание с удлиненным выдохом; сухие свистящие хрипы | Акцент II тона над ЛА |
| Характер мокроты | Много, пенистая | Плохо отходит, стеклообразная | Мало, иногда с кровью |
| АД | Чаще повышенное | Часто повышенное | Чаще нормальное или сниженное |
| ЭКГ | Часто признаки гипертрофии ЛЖ и его перегрузки; Р mitrale | Часто Р pulmonale | Возможно появление в динамике правограммы, синдрома QIII–SI, Р pulmonale |
| Рентгенография легких | Усиленный рисунок; сниженная пневматизация; линии Керли | Диффузное повышение пневматизации | Чаще обеднение рисунка; возможно наличие клинообразной тени |
| ЭхоКГ | Дилатация и снижение ФВ ЛЖ; дилатация левого предсердия | Чаще визуализация затрудненная; часто дилатация ПЖ | Возможна дилатация ПЖ |
Следует помнить о возможности сочетания СН с любым заболеванием, сопровождающимся теми или иными общими с ней признаками (например отечный синдром — при сопутствующем заболевании почек; тахикардия и одышка при нагрузке — в случае анемии). В подобных случаях правильная оценка истинной тяжести ХСН и эффективности ее лечения базируется на клиническом опыте врача и обязательном применении объективных инструментальных и лабораторных методов, в том числе при динамическом наблюдении больного. Примеры формулирования клинических диагнозов приведены в табл. 2.12.
Таблица 2.12
Примеры клинических диагнозов
| Диагноз | ||
| № п/п | Предыдущий или клинический (до лечения) | Заключительный (после лечения) |
| 1 | ИБС: постинфарктный кардиосклероз, хроническая аневризма переднеперегородочного отдела ЛЖ. СН IIА стадии с систолической дисфункцией ЛЖ, III ФК | Тот же; II ФК |
| 2 | ДКМП, постоянная форма фибрилляции предсердий. СН IIБ стадии с систолической дисфункцией ЛЖ, IV ФК | Тот же; III ФК |
| 3 | ИБС: стабильная стенокардия напряжения, II ФК, постинфарктный кардиосклероз, СН I стадии с сохраненной систолической функцией ЛЖ* | Тот же |
| 4 | Гипертоническая болезнь III стадии, гипертензивное сердце. СН IIА стадии с сохраненной систолической функцией ЛЖ, III ФК | Тот же; II ФК |
| 5 | ГКМП, обструктивная форма, СН IIА стадии с сохраненной систолической функцией ЛЖ, III ФК | Тот же; II ФК |
| 6 | Ревматизм, активность I степени, ревмокардит, комбинированный аортальный порок с преобладанием недостаточности IV стадии, СН IIА стадии с сохраненной систолической функцией ЛЖ, III ФК | Тот же; III ФК |
| 7 | Ревматизм, активность I степени, ревмокардит, митральный стеноз IV стадии, трикуспидальная недостаточность, СН IIБ стадии с сохраненной систолической функцией ЛЖ, IV ФК | Тот же; III ФК |
| 8 | Гипертоническая болезнь III стадии, гипертрофия ЛЖ, ИБС: постинфарктный кардиосклероз, постоянная форма фибрилляции предсердий, СН IIБ стадии с систолической дисфункцией ЛЖ, IV ФК | Тот же; III ФК |
*Если у больного стабильная стенокардия напряжения, то в диагнозе указывают только ФК последней, ФК ХСН не приводят.
КЛАССИФИКАЦИЯ ХСН
Основные термины:
- Клиническая стадия СН
- Вариант СН
- ФК пациента
Коды по МКБ-10: I50, I50.1, I50.9.
Клинические стадии: I; IIА; IIБ; III.
СН I, СН IIА; СН IIБ; СН III соответствуют критериям I, IIА, IIБ и III стадии хронической недостаточности кровообращения по классификации Н.Д. Стражеско и В.Х. Василенко (1935):
I — начальная недостаточность кровообращения; проявляется только при физической нагрузке (одышка, тахикардия, утомляемость); в покое гемодинамика и функции органов не нарушены.
II — выраженная длительная недостаточность кровообращения; нарушение гемодинамики (застой в малом и большом кругу кровообращения и т.п.), нарушение функции органов и обмена веществ, проявляющееся в покое;
период А — начало стадии, нарушение гемодинамики выражено умеренно; отмечают нарушение функции сердца или только какого-то его отдела;
период Б — конец длительной стадии: глубокие нарушения гемодинамики, страдает вся сердечно-сосудистая система.
III — конечная, дистрофическая недостаточность кровообращения; тяжелые нарушения гемодинамики, стойкие изменения обмена веществ и функций органов, необратимые изменения структуры тканей и органов.
Варианты СН:
- С систолической дисфункцией ЛЖ: ФВ ЛЖ <45%;
- С сохраненной систолической функцией ЛЖ: ФВ ЛЖ >45%.
ФК пациентов по критериям NYHA:
I ФК — пациенты с заболеванием сердца, у которых выполнение обычных физических нагрузок не вызывает одышки, усталости или сердцебиения.
II ФК — пациенты с заболеванием сердца и умеренным ограничением физической активности. Одышку, усталость, сердцебиение отмечают при выполнении обычных физических нагрузок.
III ФК — пациенты с заболеванием сердца и выраженным ограничением физической активности. В состоянии покоя жалобы отсутствуют, но даже при незначительных физических нагрузках возникают одышка, усталость, сердцебиение.
IV ФК — пациенты с заболеванием сердца, у которых любой уровень физической активности вызывает указанные выше субъективные симптомы. Последние возникают также в состоянии покоя.
Примечания:
- Стадия СН отражает этап клинической эволюции данного синдрома, тогда как ФК пациента является динамической характеристикой, которая может изменяться под влиянием лечения (приложение — табл. 2.13).
- Определение вариантов СН (с систолической дисфункцией или с сохраненной систолической функцией ЛЖ) возможно лишь при наличии соответствующих данных эхоКГ-исследования.
Таблица 2.13
Ориентировочное соответствие клинических стадий СН и ФК
| Стадия СН | ФК пациента |
| I | II ФК (на фоне адекватного лечения — I ФК) |
| IIА | III ФК (на фоне адекватного лечения — II ФК, иногда I ФК) |
| IIБ | IV ФК (на фоне адекватного лечения — II ФК, иногда III ФК) |
| III | IV ФК (иногда на фоне адекватного лечения — II ФК) |
Действующая отечественная классификация ХСН предусматривает применение трех основных терминов, каждый из которых несет самостоятельное клиническое содержание.
Критерии клинических стадий СН (СН I, СН IIА, СН IIБ та СН III общеизвестны, поскольку соответствуют таковым для I, IIА, IIБ и III стадии недостаточности кровообращения по классификации Н.Д. Стражеско — В.Х. Василенко. При принятии действующей классификации IV Национальным конгрессом кардиологов Украины в 2000 г. констатировано, что на сегодня нет оснований отказываться от формулировки стадий ХСН, поскольку это соответствует отечественной клинической традиции и адекватно регламентирует принятие решений при проведении медико-социальной экспертизы. Одновременно термин «недостаточность кровообращения» заменен термином «сердечная недостаточность», который в настоящее время является в мире общепринятым.
Термин «ФК пациента» является относительно новым для отечественной практики официальным термином, свидетельствующим о способности больного выполнять бытовые физические нагрузки. Для определения у больных ФК от I до IV в действующей классификации использованы критерии NYHА, верифицированные с помощью методики определения максимального потребления кислорода (VО2mах).
Может возникнуть вопрос: насколько необходимо характеризовать состояние больного с помощью ФК, если классификацией предусмотрено деление ХСН на стадии, которые, без сомнения, более глубоко отображают клиническое состояние пациентов? На самом деле здесь не существует противоречия, поскольку вышеупомянутые характеристики наполнены различным смыслом. Стадию ХСН следует рассматривать в контексте клинической эволюции этого синдрома — как ее очередной этап с присущим ему спектром регуляторных сдвигов, адаптационных возможностей и структурно-функциональных изменений органов (тканей)-мишеней: сердца, сосудов, почек, печени, скелетных мышц. В то же время ФК пациента с ХСН может динамично меняться: или ухудшаться (возрастать) под влиянием разных патогенетических факторов (например при появлении персистирующей тахиаритмии), или улучшаться (уменьшаться) под влиянием соответствующего лечения. Приведем такой пример. У пациента с циркуляторными изменениями, соответствующими СН ПБ стадии, в результате активной гемодинамической разгрузки с помощью диуретиков, дигоксина и нитратов в течение недели устранены отечный синдром и клинические признаки гиперволемии легких, уменьшилась в размерах печень. При этом переносимость физической нагрузки улучшилась — констатирован переход из IV во II–III ФК. Означает ли это, что у больного также изменилась стадия ХСН со IIБ на IIА? Бесспорно нет, поскольку у этого пациента отмена или даже неадекватное снижение дозы диуретика на протяжении последующих нескольких дней могут привести к рецидиву тяжелого отечного синдрома и ухудшению толерантности к физической нагрузке (возвращение в IV ФК). Говорить об обратимости клинической стадии ХСН означает игнорировать определение ХСН как синдрома с прогрессирующим течением. Совсем другой является ситуация, когда радикальное этиотропное корригирующее влияние (а именно хирургическое вмешательство) устраняет саму причину ХСН (например протезирование клапанов сердца), поскольку в этом случае речь идет не об обратной эволюции стадий ХСН, а об устранении условий для самого существования ХСН.
Взаимосвязь между клиническими стадиями ХСН и ФК пациента приведена в приложении к действующей классификации (см. табл. 2.13).
Важным в действующей классификации является выделение вариантов СН с систолической дисфункцией ЛЖ (при ФВ ЛЖ <45%) и без таковой (ФВ ЛЖ >45%). Практическое значение применения вышеуказанного критерия систолической дисфункции ЛЖ заключается прежде всего в том, что международные стандарты фармакотерапии ХСН разработаны именно для категории больных с ФВ ЛЖ <40–45%, которые характеризуются низким уровнем выживаемости независимо от нозологической причины ХСН. Поэтому указание в диагнозе наличия клинически значимой систолической дисфункции ЛЖ является важным, учитывая необходимость соблюдения соответствующих стандартов их лечения.
ОСЛОЖНЕНИЯ ХСН
Аритмии
Желудочковые эктопические сокращения регистрируют при холтеровском мониторировании почти у всех больных с систолической дисфункцией ЛЖ, в том числе приблизительно у половины — неустойчивую желудочковую тахикардию. У пациентов со средним количеством эктопических сокращений более 10 за 1 ч при суточном мониторировании ЭКГ отмечают повышенный риск возникновения внезапной сердечной смерти, электрофизиологические механизмы которой приведены выше в соответствующем разделе. Важно помнить, что внезапно умирают в течение 1 года 15–20% больных с ХСН и ФВ <30%.
Фибрилляция предсердий. По данным Фремингемского эпидемиологического исследования фибрилляцию предсердий у больных с клинически манифестированной ХСН отмечают в 4 раза чаще, чем в общей популяции. Как указано выше, тахисистолическая форма фибрилляции предсердий является одной из причин возникновения СН. С другой стороны, появление фибрилляции предсердий у пациента с уже существующей СН является одним из факторов дальнейшей декомпенсации кровообращения и повышенного риска возникновения инсульта, обусловленного мозговой тромбоэмболией.
Тромбоэмболические осложнения
Частота выявления тромболических осложнений по данным различных исследований у больных с ХСН составляет 1,5–3,5% в год, причем 1-е место среди них занимает инсульт. Согласно базе данных исследования VНеFТ, частота возникновения инсульта в течение года у этих пациентов составляла 1,8%, периферических тромбоэмболий — 0,1%, ТЭЛА — 0,3%. Подобные результаты получены при ретроспективном анализе базы данных исследований SOLVD, SAVE и РROМISЕ. К факторам тромбоэмболий при СН принадлежат:
а) снижение объемной и линейной скорости системного кровотока;
б) дисфункция эндотелия с соответствующей активацией тромбоцитарного звена гемостаза;
в) дисбаланс свертывающей/противосвертывающей систем крови в прокоагулянтную сторону вследствие нейрогуморальной и иммуновоспалительной активации (ангиотензин II, противовоспалительные цитокины);
г) пристеночное тромбообразование в полостях предсердий при постоянной форме фибрилляции предсердий и/или в дилатированных полостях желудочков;
д) иногда чрезмерно интенсивная диуретическая терапия, приводящая к сгущению крови;
г) значительное снижение физической активности (у пациентов с тяжелой ХСН).
Фибрилляция предсердий является ведущим фактором развития артериальных тромбоэмболий, которые в 90% имеют мозговую локализацию (инсульт). Другими факторами риска возникновения тромбоэмболии при ХСН являются низкая ФВ ЛЖ, низкая толерантность к физической нагрузке, наличие подвижного тромба в полости ЛЖ.
Пневмония
Пневмония является частым следствием легочного застоя при тяжелой рефрактерной СН или при неадекватной ее терапии.
Недостаточность азотовыделительной функции почек
Недостаточность азотовыделительной функции почек характерна в первую очередь для терминальной ХСН. Анализ базы многоцентровых исследований свидетельствует о том, что клиренс креатинина умеренно снижается у 25–50% больных с клинически манифестированной ХСН, возрастая по мере усугубления тяжести их клинического состояния. Причиной почечной недостаточности при ХСН является уменьшение клубочковой фильтрации вследствие снижения сердечного выброса и хронической констрикции афферентных (прегломерулярных) артериол почек.
Печеночная недостаточность
Печеночная (гепатоцеллюлярная) недостаточность возникает прежде всего вследствие хронического венозного застоя и (в части случаев) значительно выраженных цирротических изменений в печени. Снижение уровня билирубина и/или печеночных ферментов может быть дополнительным маркером гемодинамического улучшения в процессе лечения пациентов с ХСН. Прогрессирующая функциональная недостаточность печени у больных с терминальной ХСН является отражением ее гипоперфузии, обусловленной критическим уменьшением сердечного выброса.
Сердечная кахексия
Сердечную кахексию отмечают у больных с ХСН, как правило в ее терминальной фазе. Потеря массы тела происходит за счет скелетных мышц, а также жировой и костной ткани. Основными факторами указанных изменений являются нарушение всасывания питательных веществ в застойном кишечнике; снижение аппетита, в том числе центрального генеза; гиподинамия; активация системы провоспалительных цитокинов; апоптоз скелетных мышц; снижение чувствительности тканей к инсулину и гормону роста.
Предикторы клинического прогноза
Ориентировочная оценка прогноза выживаемости больного с ХСН актуальна по двум причинам. Во-первых, это необходимо для определения индивидуальной тактики диспансеризации (интенсивности наблюдения) пациентов, что способствует улучшению качества их жизни и уменьшению потребности в повторных госпитализациях. Во-вторых, это помогает определить показания для применения современных немедикаментозных/хирургических методов лечения (ресинхронизирующая электрокардиостимуляция желудочков, ИКД, трансплантация сердца).
Под предиктором (от англ. рrеdiсt — предусматривать) того или другого клинического осложнения в настоящее время понимают определенный параметр состояния больного, который позволяет с достаточной степенью вероятности прогнозировать возникновение у него через определенный промежуток времени указанного осложнения (при ХСН — прежде всего летального исхода). Такие клинические предикторы определяют на основании данных клинико-инструментального исследования и наблюдения пациентов, используя соответствующие математические методы (модель пропорциональных рисков Кокса, множественная регрессия, построение так называемых актуарных кривых выживания в группах с разными значениями изучаемого показателя и др.).
Возможности индивидуального прогнозирования течения ХСН являются ограниченными, поскольку известные в литературе соответствующие прогностические маркеры отражают вероятность выживания больших групп больных, а не отдельных пациентов. Вместе с тем для определения оптимальной тактики ведения больных (в частности определения показаний к кардиотрансплантации и других хирургических методов лечения) врачу целесообразно учитывать признаки, наличие каждого из которых у пациентов с клинически манифестированной ХСН связано с плохим прогнозом выживания.
В табл. 2.14 приведены предикторы низкой выживаемости больных с ХСН в течение 1–5 лет, установленные на основании данных различных клинических и эпидемиологических исследований.
Таблица 2.14
Показатели низкой выживаемости у больных с ХСН
| Клинические | Инструментальные | Лабораторные |
| III–IV ФК по NYHA | Стойкая артериальная гипотензия | Гипонатриемия (Na+ плазмы крови <135 ммоль/л) |
| Остановка кровообращения в анамнезе | Расширение QRS (>0,12 c) | Гиперкреатининемия (>200 мкмоль/л) |
| Масса тела меньше нормы | Низкая (<30%) ФВ ЛЖ | Уровень билирубина выше нормы |
| Нарушения дыхания (типа Чейн — Стокса) во время сна | Сопутствующая систолическая дисфункция ПЖ | Анемия (<12 г/л) |
| Максимальное потребление кислорода <11 мл/мин/м2 (спироэргометрия) | Высокий (>3000 пкг/мл) уровень циркулирующего НУП | |
| Желудочковая тахикардия |
ПРОФИЛАКТИКА СН
Мероприятия по первичной профилактике СН, то есть предупреждение развития последней у разных категорий кардиологических больных, основываются прежде всего на соответствующих данных доказательной медицины.
Больные с АГ
В метаанализе P. Meredith и L. Ostergren (2006) продемонстрировано, что контроль АД на должном уровне с помощью любых (оценивавшихся совокупно) антигипертензивных средств в наибольшей мере отражается именно на развитии СН (52%) по сравнению с развитием мозгового инсульта, ИБС и сердечно-сосудистой смерти (снижение риска на 38; 16 и 21% соответственно).
Крупнейший на сегодня метаанализ исследований сравнительной эффективности антигипертензивных препаратов — BPLTTC (29 клинических исследований, охвативших более 162 тыс. пациентов) показал, что длительное применение ингибиторов АПФ сопровождается более низким риском развития СН по сравнению с длительным приемом как плацебо, так и антагонистов кальция (в обоих случаях относительный риск — 0,82). Примечательно, что прием антагонистов кальция характеризовался большим риском появления СН по сравнению как с плацебо (относительный риск — 1,21), так и приемом блокаторов β-адренорецепторов и диуретиков (относительный риск — 1,33). В свою очередь ингибиторы АПФ и блокаторы β-адренорецепторов/диуретики, оказывая сопоставимый антигипертензивный эффект, существенно не различались между собой в отношении вероятности возникновения СН.
Примером результативной первичной профилактики СН у больных с АГ ингибиторами АПФ могут служит данные мультицентрового исследования PROGRESS, продемонстрировавшего действенность периндоприла во вторичной профилактике развития мозговых инсультов. В субпопуляции пациентов с АГ, вошедших в данное исследование (2916 (48%) человек), лечение, базирующееся на периндоприле в течение 4 лет, позволило снизить риск возникновения застойной СН на 27% (при сопоставимых уровнях АД в группах активного лечения и плацебо).
Пациенты с ИБС
Статины
В хрестоматийном исследовании 4S длительное (>5 лет) применение симвастатина у пациентов с хронической ИБС и повышенным уровнем общего ХС в плазме крови (5,5–8,0 ммоль/л) обусловливало, помимо снижения смертности пациентов на 30%, также достоверное уменьшение количества случаев возникновения СН на 21%.
Блокаторы β-адренорецепторов
Хотя данные многоцентровых исследований относительно влияния блокаторов β-адренорецепторов на частоту возникновения СН у пациентов с ИБС по сравнению с плацебо отсутствуют (а в настоящее время подобные исследования уже не могут быть спланированы из этических соображений), целесообразность их применения с целью первичной профилактики СН у пациентов с ИБС основана на достаточно мощных предпосылках. Во-первых, хорошо известна патогенетическая роль повышения активности САС в трансформации доклинической СН в клинически явную. Во-вторых, блокаторы β-адренорецепторов существенно снижают риск развития ИМ, который, как указывалось выше, является наиболее значимым фактором риска СН. Наконец, по данным ряда больших многоцентровых исследований (USCP, MERIT-HF, CIBIS-II, COPERNICUS) блокаторы β-адренорецепторов существенно замедляют прогрессирование симптомной систолической ХСН (см. ЛЕЧЕНИЕ ХСН).
Ингибиторы АПФ
По данным метаанализа соответствующих многоцентровых исследований, длительное применение ингибиторов АПФ на 23% снижает по сравнению с плацебо риск возникновения СН у пациентов с ИБС (Dagenais G.R. et al., 2006). Наиболее демонстративны в этом смысле результаты двух известных мега-исследований — HOPE (2000, рамиприл) и EUROPA (2003, периндоприл). Первое из них, HOPE охватило более 9297 больных без признаков СН с высоким сердечно-сосудистым риском (ИМ в анамнезе, стенокардия, клинически значимый периферический атеросклероз или сахарный диабет в сочетании с одним из таких факторов риска, как «мягкая» гипертензия, гиперхолестеринемия, курение, микроальбуминурия), которым проводили терапию ацетилсалициловой кислотой, блокаторами β-адренорецепторов, тиазидными диуретиками). В результате длительного (в среднем 4,5 года) применения рамиприла, включенного в указанную схему фармакотерапии, отмечали достоверное снижение (по сравнению с плацебо) суммарного количества сердечно-сосудистых осложнений (ИМ, инсульт, кардиоваскулярная смерть), а также случаев возникновения СН на 23% (рис. 2.7).
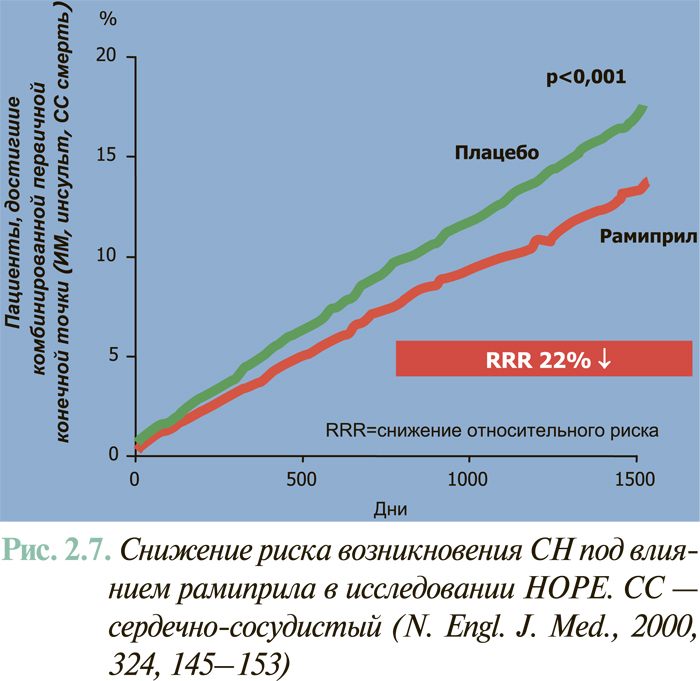
В исследование EUROPA (2003) включили 12 236 пациентов с ИБС без клинических признаков СН (как в сочетании с АГ, так и без нее), которые получали соответствующую современную стандартную фармакотерапию (>90% — антитромбоцитарные средства, около % — блокаторы β-адренорецепторов и статины), 65% из которых перенесли ИМ и 55% — хирургическую реваскуляризацию ЛЖ. У половины пациентов в указанную терапию включали плацебо, у половины — периндоприл. Средняя продолжительность наблюдения составила 4,2 года, а в качестве первичной «конечной точки» рассматривалось общее количество случаев сердечно-сосудистой смерти, ИМ и остановки сердца. В группе периндоприла указанной «конечной точки» достигли на 20% меньше больных, чем в группе плацебо (488 и 603 соответственно, различие высокодостоверно: р=0,0003). Наряду с этим в группе периндоприла по сравнению с группой плацебо зафиксировано уменьшение количества госпитализаций вследствие возникновения СН на 39% (рис. 2.8).
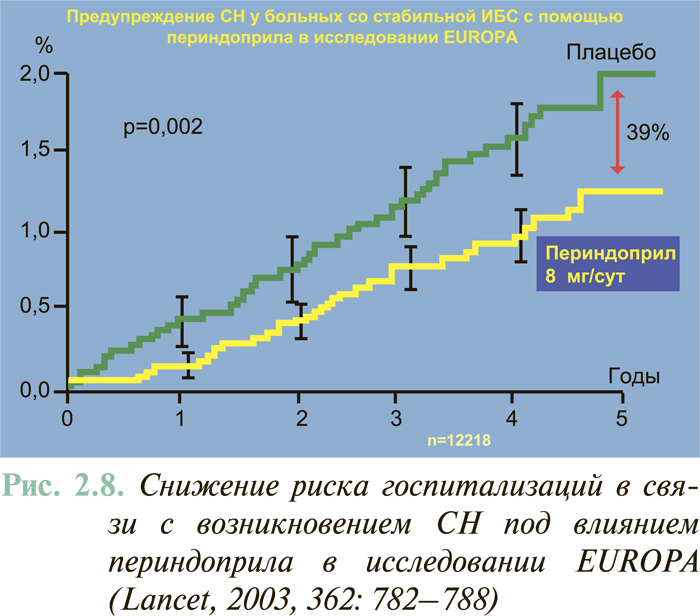
Таким образом у разных категорий пациентов с сердечно-сосудистыми заболеваниями без признаков ХСН риск возникновения клинических проявлений последней снижают следующие мероприятия:
- При АГ — медикаментозный контроль АД на целевом уровне.
- При хронических формах ИБС, в том числе в сочетании с АГ, — длительное применение ингибиторов АПФ (периндоприла или рамиприла) и статинов.
- После острого ИМ — длительное применение блокаторов β-адренорецепторов и ингибиторов АПФ.
Кроме этого, по мнению экспертов, базирующемся на обобщении клинического опыта, к путям первичной профилактики ХСН относятся: при персистирующих тахиаритмиях — их устранение или адекватный контроль ЧСС, при пороках клапанного аппарата сердца — их своевременная хирургическая коррекция.
ЛЕЧЕНИЕ ХСН: ОБЩИЕ ЗАМЕЧАНИЯ
Этиотропное лечение при СН
После установления диагноза СН врачу необходимо решить: а) возможно ли устранение самой СН за счет радикальной (хирургической) коррекции ее причины; б) в случае отсутствия такой возможности, использованы ли все имеющиеся возможности оптимизации текущего лечения этиологической причины СН. Оценка современных возможностей этиотропного лечения СН приведена в табл. 2.15.
Таблица 2.15
Этиотропное лечение при СН: современные возможности* (модифицировано по A. Timmis, 2003)
| Причина СН | Путь коррекции | Ведущая детерминанта успеха | Вероятность устранения СН |
| Хроническая ИБС | Реваскуляризация (аортокоронарное шунтирование или стентирование) | Достаточная масса гибернированного миокарда | Умеренная |
| Аневризма ЛЖ | Аневризмэктомия | Резидуальная функция ЛЖ | Высокая |
| АГ | Нормализация АД | Регресс гипертрофии ЛЖ | Умеренная |
| ДКМП | — | — | — |
| ГКМП | Хирургическое или электрофизоиологическое устранение градиента обструкции ЛЖ | Не известна | Низкая/умеренная |
| Рестриктивная кардиомиопатия | — | — | — |
| Алкогольная кардиомиопатия | Отказ от употребления алкоголя | Продолжительность злоупотребления | Умеренная |
| Клапанные пороки | Клапанное протезирование | Степень дисфункции ЛЖ | Высокая |
| Коррекция митрального стеноза | Выраженность структурных изменений легочных артериол | Высокая | |
| Констриктивный перикардит | Перикардэктомия | Адекватность выполнения хирургического вмешательства | Высокая |
| Тахисистолическая ФП | Восстановление синусового ритма
Медикаментозный или хирургический (абляция с ЭКС) контроль ЧСС |
Стабильное удержание синусового ритма
Продолжительность тахисистолии |
Высокая
Умеренная |
*Кроме трансплантации сердца.
К сожалению, в большинстве случаев радикальное устранение причины ХСН невозможно, что определяет необходимость постоянного, в течение всей жизни, лечения больного с четким осознанием врачом тех целей, которых они должны достичь в процессе этого лечения.
Цели лечения при ХСН:
1. Обеспечение максимально возможного для больного уровня качества жизни предусматривает:
а) уменьшение или, лучше, устранение основных клинических симптомов СН;
б) уменьшение количества повторных госпитализаций больного по поводу декомпенсации кровообращения;
в) достижение двух указанных выше целей при хорошей переносимости соответствующего лечения;
г) содействие максимально возможной социальной адаптации пациента путем высококачественного диспансерного наблюдения (информирование/обучение/консультирование).
2. Увеличение продолжительности жизни больного. Эта цель должна достигаться за счет применения тех фармакологических средств, которые способны влиять на патофизиологические механизмы прогрессирования ХСН и возникновение внезапной сердечной смерти и таким образом снижать риск смерти этих больных.
Вышеуказанные цели могут быть достигнуты за счет:
а) целенаправленной модификации пациентом образа жизни и соблюдения соответствующих специальных наставлений;
б) немедикаментозных лечебных мероприятий;
в) медикаментозного лечения;
г) хирургических, механических и электрофизиологических средств лечения.
Модификация образа жизни и соблюдение специальных рекомендаций
Прекращение курения, поскольку последнее повышает риск дестабилизации ИБС и тромбообразования, активирует САС, вызывает периферическую вазоконстрикцию и уменьшает дыхательный резерв.
Алкоголь категорически противопоказан больным с алкогольной кардиомиопатией, а также пациентам с застойной декомпенсированной СН. Другим категориям больных с гемодинамически стабильной ХСН употребление алкоголя ограничивается его эпизодическим употреблением не более 20 мл этанола в сутки, что эквивалентно 50 мл крепкого напитка (водка, коньяк) или 150–200 мл вина. Ежедневное употребление алкоголя не допускается.
Питание и питьевой режим. Всем пациентам с СН рекомендуется ограничить потребление поваренной соли (NaCl) — не более 3 г/сут, что достигается исключением из рациона соленых продуктов (твердые сыры, колбасы, копчености, маринованные продукты и т.п.) и отсутствием досаливания готовой пищи.
Пациентам с декомпенсированной СН показано ограничение соли не более 1,5 г/сут, что подразумевает приготовление пищи без нее.
Ограничение потребления жидкости. Больным с гемодинамически стабильной ХСН разрешается употреблять до 1,5–2 л жидкости в сутки. Пациентам с декомпенсированной СН при необходимости проведения активной диуретической терапии суточное поступление жидкости в организм должно ограничиваться и контролироваться (не более 1,0–1,2 л).
Набор пищевых продуктов (исходя из общей калорийности рациона) должен определяться с учетом массы тела пациента, находящегося в компенсированном (без признаков гиперволемии) состоянии. При ожирении (ИМТ >30 кг/м2) калорийность рациона должны быть ограничена. Наоборот, при уменьшении массы тела (ИМТ <20 кг/м2) пища должна быть высококалорийной с достаточным содержанием белка. Ограничение белковой составляющей рациона может осуществляться как вынужденная мера лишь в случаях почечной недостаточности.
Самоконтроль массы тела. Регулярное (2–3 раза в неделю) взвешивание на домашних (одних и тех же) весах позволяет своевременно выявить начало декомпенсации кровообращения еще на доклиническом этапе. Относительно быстрое (>2 кг за 2–3 дня) увеличение массы тела обычно служит сигналом начала задержки жидкости в организме. Это позволяет своевременно внести коррективы в схему лечения — прежде всего в режим применения диуретиков.
Режим физической активности. Существенное ограничение физической активности (постельный или «палатный» режим) рекомендуют только при выраженной декомпенсации гемодинамики, по поводу которой в условиях стационара проводится соответствующее активное лечение. Во всех других случаях показана регулярная (ежедневная) физическая активность (ходьба и легкие физические упражнения циклического характера до появления умеренной усталости), что в определенной степени снижает активацию САС, улучшает периферический кровоток и метаболизм скелетных мышц, предотвращает уменьшение массы тела и позволяет поддерживать необходимую переносимость бытовых физических нагрузок. Регулярная легкая физическая активность (в пределах, приемлемых для больного) показана даже при тяжелой (IV ФК) гемодинамически стабильной ХСН.
Сексуальная активность при условии стабильной гемодинамики и эуволемического состояния существенно не ограничивается. Пациентам с ХСН следует рекомендовать избегать избыточного эмоционального напряжения (иметь постоянного партнера), поскольку чрезмерная симпатоадреналовая активация повышает риск дестабилизации гемодинамики и возникновения опасных желудочковых аритмий.
Вакцинация. Поскольку при ХСН грипп и пневмония часто выступают в качестве факторов дестабилизации гемодинамики, рекомендуется проводить противогриппозную и противопневмококковую иммунизацию этих больных.
Контрацепция. Пациенткам с клинически манифестованной ХСН желательно избегать беременности, учитывая повышенный риск смертельного исхода в поздний период беременности и во время родов. Несмотря на достаточную безопасность новейших пероральных контрацептивных средств, нельзя исключить, что риск тромбоэмболических осложнений, связанный с их применением, у пациенток с ХСН более высок, чем в общей популяции. Применение внутриматочных спиралей у женщин с ХСН является безопасным, исключая случаи клапанных пороков сердца (повышенный риск инфекции).
Путешествия. Не рекомендуется пребывание в условиях высокогорья, жары и высокой влажности. Оптимальным средством для осуществления путешествия является непродолжительный авиаперелет. Длительного пребывания в неподвижном состоянии больным с ХСН следует избегать, прежде всего в связи с повышенным риском тромбоза вен нижних конечностей и таза. Коррекция доз лекарственных препаратов, прежде всего диуретиков, в непривычных для пациента климатических условиях носит сугубо индивидуальный характер.
Физические тренировки показаны больным с гемодинамически стабильной, медикаментозно контролируемой ХСН II–III ФК. Регулярное выполнение циклических нагрузок умеренной интенсивности (упражнения статического характера противопоказаны!) улучшает качество жизни пациентов за счет роста толерантности к физической нагрузке, предотвращает уменьшение мышечной массы и, возможно, способствует улучшению прогноза выживания. Реализация программ физической реабилитации больных с ХСН находится в совместной компетенции врача лечебной физкультуры и кардиолога. Противопоказаниями к физическим тренировкам является:
- декомпенсированная застойная СН;
- активный миокардит;
- клапанные стенозы;
- цианотические врожденные пороки сердца;
- желудочковые аритмии высоких градаций;
- некорригированная тахисистолия;
- отсутствие надлежащего контроля стенокардии антиангинальными препаратами.
Фармакологические средства, назначения которых следует избегать (табл. 2.16)
Таблица 2.16
Препараты, которые нежелательно применять при лечении больных с ХСН
| Группа средств | Побочные эффекты |
| НПВП, в том числе коксибы | Ухудшение почечного кровотока, задержка жидкости
Ослабление терапевтического действия ингибиторов АПФ и диуретиков |
| Глюкокортикоиды* | Задержка жидкости, гипокалиемия |
| Антиаритмические средства I класса | Усугубление систолической дисфункции ЛЖ и аритмогенный эффект, повышение риска смерти |
| Антагонисты кальция** (кроме амлодипина и фелодипина) | Усугубление систолической дисфункции ЛЖ (верапамил, дилтиазем)
Активация САС (дигидропиридины) |
| Трициклические антидепрессанты, препараты лития | Снижение сократительной способности миокарда |
*Возможное спорадическое парентеральное применение для коррекции гипотензии; **ограничение не касается диастолической СН.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ХСН С СИСТОЛИЧЕСКОЙ ДИСФУНКЦИЕЙ ЛЖ
Общие замечания
Фармакотерапия является основным лечебным подходом при ХСН. С учетом прогрессирующего характера последней медикаментозное лечение пациентов должно осуществляться в течение всей их жизни и контролироваться (то есть оцениваться и надлежащим образом корригироваться) врачом. На сегодня детально разработан алгоритм лечения пациентов с ХСН и систолической дисфункцией ЛЖ, как базирующийся на значительном массиве данных доказательной медицины, то есть на результатах оценки эффективности и безопасности соответствующих групп медикаментозных средств у данной категории больных в масштабных (многоцентровых) плацебо-контролируемых исследованиях.
Учитывая вышеприведенные цели лечения при ХСН (улучшение качества и увеличение продолжительности жизни больных) соответствующие фармакологические средства можно условно разделить на симптоматические и улучшающие выживание пациентов. Первые улучшают гемодинамику и клиническое состояние больных, хотя их способность улучшать долгосрочный прогноз выживания не является строго доказанной (петлевые и тиазидные диуретики, сердечные гликозиды). Вторые, а именно нейрогуморальные антагонисты, блокируют на разных уровнях активность ключевых нейрогуморальных систем — «проводников» прогрессирования ХСН и таким образом способствуют увеличению продолжительности жизни пациентов (ингибиторы АПФ, блокаторы β-адренорецепторов, антагонисты рецепторов альдостерона и блокаторы рецепторов ангиотензина II). Кроме того, комбинированное применение нейрогуморальных антагонистов, благодаря улучшению кровообращения и угнетению механизмов аритмогенеза, уменьшает частоту госпитализаций таких больных в связи с ухудшением их клинического состояния (схема 2.4).

Таким образом, именно нейрогуморальные антагонисты выполняют роль краеугольного камня в современном лечении при ХСН.
Диуретики
Диуретики (салуретики) показаны всем больным с ХСН (табл. 2.17) и признаками задержки жидкости в организме. Профилактическое (в поддерживающем режиме) применение диуретиков показано также пациентам со склонностью к гиперволемии, то есть с предшествующим отечным синдромом, который был купирован терапией теми же диуретическими средствами, осуществлявшейся в активном режиме.
Таблица 2.17
Диуретики для перорального приема в лечении пациентов с ХСН
| Диуретик | Начальная разовая доза, мг | Максимальная доза, мг/сут | Продолжительность действия, ч | Особенность |
| Петлевой | ||||
| Фуросемид | 20–40
1–2 раза в сутки |
500 | 6–8 | Снижение абсорбции при системном венозном застое |
| Буметанид* | 0,5–1,0
2 раза в сутки |
10 | 6–8 | Снижение абсорбции при системном венозном застое |
| Торасемид | 5–20
1 раз в сутки |
200 | 6–12 | Единственный диуретик с почти 100% биодоступностью |
| Тиазидный/тиазидоподобный | ||||
| Гидрохлоротиазид | 25–50
1 раз в сутки |
75 | 6–12 | Неэффективен при СКФ <30 мл/мин |
| Метолазон* | 2,5
1 раз в сутки |
10 | 8–24 | Эффективен при снижении СКФ до 10 мл/мин |
*В Украине не зарегистрированы.
СКФ — скорость клубочковой фильтрации.
Первостепенная роль диуретиков как симптоматических средств терапии при ХСН мотивирована тремя ключевыми положениями. Во-первых, их клинико-гемодинамический эффект наступает раньше (на протяжении нескольких часов), чем других средств. Во-вторых, диуретики являются единственной группой препаратов, способных обеспечивать полный контроль над задержкой жидкости в организме, то есть достижение и поддержку эуволемического состояния. Кроме того, адекватное применение диуретиков является необходимой предпосылкой для реализации у больных с ХСН ожидаемых эффектов других препаратов и прежде всего нейрогуморальных антагонистов.
Влияние диуретиков на долгосрочный прогноз выживания пациентов с ХСН в специально спланированных клинических исследованиях не изучен, поскольку в этом случае невозможно формирование группы плацебо (исходя из этических соображений). Вместе с тем вполне очевидно, что применение диуретиков у больных с проявлениями легочного застоя снижает риск возникновения у них острого альвеолярного отека легких.
Механизмы и особенности действия
Универсальным механизмом действия мочегонных препаратов является стимуляция натрийуреза и диуреза за счет угнетения канальцевой реабсорбции Na+.
Петлевые диуретики, являющиеся наиболее мощными мочегонными средствами, блокируют реабсорбцию ионов Na+ на всем участке восходящего отдела петли Генле и, соответственно, угнетают процесс концентрирования мочи. Повышают экскрецию ионов Na+ на 20–25% и в значительной мере сохраняют этот эффект даже при критически сниженной почечной функции (скорость клубочковой фильтрации <10 мл/мин).
Тиазидные диуретики угнетают реабсорбцию Na+ в дистальных канальцах и в кортикальном сегменте восходящей части петли Генле. Снижают экскрецию Na+ на 5–10% и неэффективны у больных со значительно сниженной скоростью клубочковой фильтрации (<30 мл/мин).
Метолазон (тиазидоподобный диуретик, в Украине не зарегистрирован) блокирует реабсорбцию Na+ как в дистальных, так и проксимальных канальцах и сохраняет эффективность при значительном нарушении почечной функции (снижение скорости клубочковой фильтрации в пределах 10–30 мл/мин).
По данным клинических исследований, адекватное применение диуретиков у больных с застойной СН достаточно быстро уменьшает или устраняет одышку, признаки легочного застоя, периферические отеки, снижает венозное давление и давление наполнения ЛЖ. Тем не менее диуретики при длительном применении в качестве монотерапии недостаточно эффективны для поддержки больных в клинически стабильном состоянии. Это связывают с активированием ими РААС (контррегуляторный ответ организма на уменьшение ОЦК), что вызывает необходимость постепенного повышения доз мочегонных средств по принципу порочного круга.
Данное обстоятельство обусловливает необходимость обязательного комбинированного применения диуретиков и антагонистов РААС (ингибиторов АПФ или антагонистов ангиотензина II) у больных с клинически манифестированной ХСН.
Тактика применения
Дозирование и некоторые фармакологические характеристики современных диуретиков, применяющихся в лечении ХСН, приведены выше (см. табл. 2.17).
Различают активную и поддерживающую фазы диуретической терапии.
Активную терапию мочегонными средствами применяют у больных с клиническими признаками задержки жидкости в организме, добиваясь их полного устранения. Для этого применяют диуретики в дозах, обеспечивающих повышение диуреза, приводящих к ежесуточной потере массы тела приблизительно на 1 кг при соответствующей отрицательной разности между количеством введенной и количеством выделенной жидкости (желательно измерять). Активное лечение пациентов с ХСН при гиперволемии обычно начинают с умеренных доз мочегонных средств, назначаемых перорально (фуросемид 20–40 мг/сут, торасемид 10–20 мг/сут или гидрохлоротиазид 25–50 мг/сут). При необходимости дозы постепенно повышают до достижения эуволемического состояния (исчезновение отеков, гидроторакса, ортопноэ, гепатомегалии, признаков повышения давления в яремных венах). Активное лечение при тяжелом отечном синдроме (периферические отеки, асцит, анасарка) может сопровождаться потерей массы тела в течение нескольких недель на 15–30 кг.
Активная фаза лечения мочегонными средствами длится до тех пор, пока не будут достигнуты указанные выше целевые эффекты. У большинства стационарных больных с ХСН (III–IV ФК), как правило, применяют петлевые диуретики в связи с их мощным эффектом и относительной независимостью последнего от почечной дисфункции. Петлевые диуретики можно применять в комбинации с тиазидными для усиления диуретического ответа у рефрактерных к лечению больных.
В активную фазу лечения мочегонными средствами ограничивают употребление с пищей хлорида натрия (<1,5 г/сут) и общего количества жидкости (не более 1,0–1,2 л/сут). Оптимальная модель активной диуретической терапии предусматривает также регулярный контроль АД, электролитов (Na+ и К+; желательно Mg2+), а также креатинина плазмы крови и гематокрита с целью предотвращения возникновения и своевременной коррекции вероятных осложнений (см. ниже) такого лечения.
Поддерживающая фаза терапии мочегонными средствами состоит в регулярном приеме диуретика (при необходимости — комбинации диуретиков) в режиме, обеспечивающем поддержание эуволемического состояния, достигнутого в течение активной фазы лечения (основной критерий поддержания такого состояния — отсутствие увеличения массы тела). Оптимальный для амбулаторных условий подход предусматривает определение самым больным своей массы тела и в случае необходимости консультирование с врачом относительно коррекции доз мочегонных средств.
Проблемы, возникающие при лечении диуретиками больных с ХСН и пути их решения
Рефрактерность. Под рефрактерностью к мочегонной терапии следует понимать неудовлетворительный диуретический эффект и соответственно отсутствие уменьшения массы тела у больных с бесспорными клиническими признаками задержки жидкости в организме, несмотря на применение петлевого диуретика в высоких (приближающихся к максимальным) дозах. В этих случаях рекомендуют следующие мероприятия (которые нередко сочетаются):
- Применение петлевого диуретика внутривенно (при выраженной гиперволемии отмечают нарушение абсорбции пероральных диуретических средств вследствие отека слизистой оболочки кишечника). Имеются данные о достижении большего эффекта при инфузионном введении фуросемида по сравнению со струйным.
- Комбинирование петлевого диуретика с гидрохлоротиазидом.
- Назначение петлевого диуретика 2 раза в сутки.
- Включение в схему мочегонной терапии метолазона как мощного диуретика резерва (необходим тщательный контроль уровня электролитов и креатинина плазмы крови в связи с риском возникновения «профузного» диуреза).
- Добавление продолжительных (в течение нескольких суток в интермиттирующем режиме) инфузий допамина в так называемых диуретических (стимулирующих допаминергические рецепторы почек) дозах, то есть 1–2 мкг·кг-1·мин-1.
Дизэлектролитемия. Поскольку салуретики увеличивают экскрецию ионов не только Na+, а также К+ и Mg2+, они могут вызвать гипокалиемию и гипомагниемию, на фоне которых существенно возрастает риск развития опасных для жизни желудочковых аритмий. Риск указанных электролитных нарушений повышается при комбинировании петлевых и тиазидных диуретиков. С целью их предупреждения салуретик комбинируют с ингибитором АПФ и антагонистом альдостерона (обычно — спиронолактон 50–100 мг/ сут), угнетающими экскрецию К+ и Mg2+. При значительно выраженном диуретическом ответе (выделение больным нескольких литров мочи ежедневно в течение нескольких суток) для корригирования электролитных нарушений возможно временное применение под соответствующим лабораторным контролем спиронолактона в максимальных дозах (до 200 мг/сут) и/или внутривенных инфузий препаратов калия, калия/магния (глюкоза-инсулино-калиевая смесь, К+, Мg2+-аспарагинат).
Артериальная гипотензия и азотемия. Эти нарушения у больных с ХСН, находящихся на диуретической терапии, могут возникать в двух различных ситуациях. У пациентов без явных признаков задержки жидкости указанные изменения обычно обусловлены чрезмерным уменьшением объема циркулирующей плазмы крови с соответствующим снижением почечного кровотока (так называемая преренальная азотемия) вследствие передозировки диуретиков. У больных же с тяжелой застойной ХСН гипотензия и преренальная азотемия являются следствием критического снижения сердечного выброса, и их коррекция требует сочетания активной диуретической терапии с инфузионной инотропной поддержкой или применением средств, увеличивающих почечный кровоток (упомянутые выше «диуретические» дозы допамина).
Кроме электролитных нарушений, гипотензии и азотемии, проявлением побочного действия петлевых и тиазидных мочегонных средств могут быть метаболические сдвиги (гиперурикемия, гипергликемия), кожная сыпь, ототоксический эффект (петлевые диуретики, кроме торасемида), а также метаболический алкалоз. Последний может быть устранен применением ингибиторов карбоангидразы (ацетазоламид 1,0–1,5 г/ сут на протяжении нескольких суток).
Калийсберегающие диуретики
Калийсберегающие диуретики применяют в активной фазе диуретической терапии для предотвращения и профилактики гипокалиемии и гипомагниемии и усиления диуретического ответа. Независимо от особенностей механизма действия (спиронолактон является антагонистом альдостерона, а триамтерен и амилорид прямо влияют на дистальные канальцы), калийсберегающие диуретики угнетают активную реабсорбцию Na+ и одновременно экскрецию калия и магния. В отличие от амилорида и триамтерена с их быстрым началом действия (3 ч), эффект спиронолактона развивается более медленно, но и длится дольше за счет длительно существующих активных метаболитов (табл. 2.18).
Таблица 2.18
Калийсберегающие диуретики в лечении ХСН
| Препарат | Диапазон доз для профилактики/лечения гипокалиемии, мг | Продолжительность действия, ч | Особенность |
| Спиронолактон | 25–200 (перорально) | 24–48 (за счет активных метаболитов) | Максимальный эффект при регулярном приеме наступает в течение 3 сут |
| Триамтерен | 50–200 (перорально) | 8 | Не комбинировать с фуросемидом (влияет на элиминацию) |
| Амилорид | 5–40 (перорально) | 18–24 |
Побочное действие. Наиболее существенными возможными проявлениями побочного действия калийсберегающих диуретиков являются гиперкалиемия и гинекомастия (последняя — при применении спиронолактона). С целью профилактики гиперкалиемии рекомендуют:
а) не назначать калийсберегающие диуретики при уровнях К+ плазмы крови >5,0 ммоль/л и креатинина плазмы крови >220 мкмоль/л;
б) сразу не назначать калийсберегающие диуретики в высоких дозах (например спиронолактона >100 мг /сут);
в) регулярно проводить контроль уровня электролитов плазмы крови;
г) быть внимательным при комбинировании калийсберегающих диуретиков с ингибиторами АПФ, даже при сопутствующем приеме салуретика.
Гинекомастию, часто с болевыми ощущениями, отмечают приблизительно в 10% случаев применения спиронолактона. Ее причиной является неселективный характер связывания им тканевых рецепторов к кортикоидным гормонам. Кроме минералокортикоидных, спиронолактон в определенной степени блокирует андрогенные, прогестероновые и глюкокортикоидные рецепторы). Появление гинекомастии требует отмены спиронолактона.
Длительное применение антагонистов альдостерона (спиронолактон или эплеренон) с целью улучшения клинического прогноза ХСН рассматривается в соответствующем разделе.
Ингибиторы АПФ
Ингибиторы АПФ необходимо обязательно (кроме случаев наличия противопоказаний к их применению или непереносимости) назначать всем больным с ХСН и систолической дисфункцией ЛЖ (ФВ ЛЖ <45%), обусловленной ИБС, АГ или ДКМП.
В связи с недостаточным количеством данных доказательной медицины относительно клинической эффективности и безопасности ингибиторов АПФ у пациентов с СН другого происхождения (клапанные регургитации, соr pulmonale и т.п.) их применение в качестве обязательной терапии у указанных категорий пациентов нельзя считать достаточно обоснованным.
Механизм действия
Состоит в угнетении АПФ, который катализирует образование ангиотензина II и вместе с тем стимулирует распад брадикинина на неактивные фрагменты. Следствием снижения концентрации ангиотензина II в циркуляторном русле и тканях является угнетение ряда вызываемых им эффектов, тесно связанных с прогрессированием и плохим прогнозом ХСН, таких как:
- периферическая и ренальная вазоконстрикция;
- задержка Na+ и воды с одновременным повышением экскреции К+;
- гипертрофия и формирование фиброза миокарда;
- увеличение образования супероксидного аниона — важного фактора и проводника оксидантного повреждения тканей;
- стимуляция синтеза альдостерона, экспрессии эндотелина-1, секреции вазопрессина и норадреналина, угнетение фибринолиза (посредством увеличения выработки ингибитора тканевого активатора плазминогена).
Следствием блокирования процесса деградации брадикинина является повышение его концентрации в тканях и рост продукции брадикинин-зависимых эндотелиальных контррегуляторных факторов — оксида азота и вазодилататорных простагландинов (схема 2.5). Помимо периферической вазодилатации, стимуляция эндотелиальных контррегуляторных факторов под влиянием ингибитора АПФ предопределяет их эндотелийпротекторное и антитромбоцитарное действие, лежащее в основе способности этой группы препаратов снижать риск развития связанных с поражением сосудов клинических катастроф, в частности риск возникновения дестабилизации ИБС и реинфаркта (см. ниже).
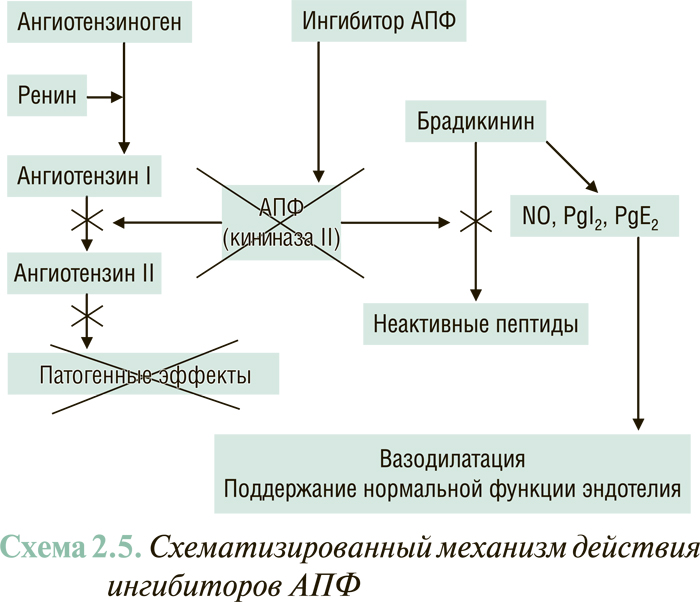
Многочисленные плацебо-контролируемые исследования продемонстрировали, что у больных с ХСН ингибиторы АПФ при длительном применении обусловливают улучшение клинической симптоматики, повышение толерантности к физическим нагрузкам и предотвращают прогрессирование дилатации и систолической дисфункции ЛЖ, снижая соответственно риск повторных госпитализаций. В отличие от традиционных периферических вазодилататоров, гемодинамическая разгрузка декомпенсированного сердца под влиянием ингибиторов АПФ не только не сопровождается активацией САС, но и сопровождается патогенетически благоприятным повышением парасимпатической составляющей регуляции ритма сердца.
Важным клиническим свойством ингибиторов АПФ является их способность улучшать клинический прогноз больных с ХСН. Речь идет о таких доказанных в многоцентровых исследованиях эффектах, как:
а) улучшение под их влиянием долгосрочной выживаемости больных с ХСН (как за счет снижения риска смерти от прогрессирующей насосной недостаточности сердца, так и внезапной смерти вследствие аритмии);
б) снижение на фоне приема ингибиторов АПФ риска повторных коронарных событий (реинфаркт, нестабильная стенокардия) у больных с ХСН, обусловленной ИБС (табл. 2.19).
Таблица 2.19
Многоцентровые исследования ингибиторов АПФ при ХСН и у больных после ИМ с систолической дисфункцией ЛЖ
| Исследование, год | Пациенты | Ингибиторы АПФ, доза | Продолжительность наблюдения | Основные результаты по сравнению с группой плацебо |
| СОNSENSUS (1987) | n=253, ХСН (IV ФК) | Эналаприл до 20 мг/сут | До 20 мес | ↓ смертности за 6 мес на 40%
↓ смертности за 1 год на 31% |
| VНеFТII (1991) | n=804, ХСН (I–III ФК) | Эналаприл до 20 мг/сут | В среднем 2,5 года | ↓ смертности на 28% по сравнению с больными, принимающими комбинацию изосорбида динитрата с гидралазином
↓ риска внезапной смерти на 38% |
| SOLVD Тrеаtment (1991) | n=2569, ХСН (I–III ФК) с ФВ ЛЖ <35% | Эналаприл до 20 мг/сут | В среднем 41 мес | ↓ смертности на 16%
↓ риска реинфаркта на 23% ↓ риска нестабильной стенокардии на 20% |
| SАVЕ (1992) | n=2231 с острым ИМ без клинически выраженной СН, с ФВ ЛЖ <40% | Каптоприл до 150 мг/сут | В среднем 42 мес | ↓ смертности на 19%
↓ риска реинфаркта на 25% ↓ риска фатального реинфаркта на 32% |
| ТRАСЕ (1992) | n=1749 с острым ИМ и ФВ <35% | Трандолаприл 4 мг/сут | 24–50 мес | ↓ смертности на 22%
↓ риска внезапной смерти на 24% |
| АIRЕ (1994) | n=2006 с острым ИМ и признаками застойной СН | Рамиприл до 5 мг/сут | В среднем 15 мес | ↓ смертности на 27%
↓ риска внезапной смерти на 30% |
Тактика применения
Абсолютными противопоказаниями к применению ингибиторов АПФ являются период беременности и кормления грудью; билатеральный стеноз почечных артерий; данные об аллергии (ангионевротический отек) при применении любого препарата данной группы в анамнезе.
Принципиальный алгоритм назначения ингибиторов АПФ состоит в применении в начале лечения его в минимальных дозах и дальнейшем постепенном (в течение нескольких недель) их повышении (титровании) до максимально переносимых под контролем клинико-лабораторных показателей. В идеальном случае в результате титрования следует достигать так называемых целевых доз ингибиторов АПФ (табл. 2.20), поскольку именно при применении в таких дозах были получены указанные положительные, относительно улучшения клинического прогноза больных, результаты соответствующих многоцентровых исследований.
Таблица 2.20
Ингибиторы АПФ при ХСН и/или систолической дисфункции ЛЖ
| Препарат | Доза, кратность приема препарата в сутки | |
| начальная | целевая | |
А — с доказанным влиянием на прогноз
|
2,5 мг 1–2 раза
6,25 мг 3 раза 2,5 мг 1 раз 1,25–2,5 мг 1 раз 1 мг 1 раз |
10–20 мг 2 раза
25–50 мг 3 раза 20–40 мг 1 раз 5 мг 2 раза 40 мг 1 раз |
Б — можно применять
|
5 мг 1 раз
2 мг 1 раз 5 мг 2 раза |
40 мг 1 раз
8 мг 1 раз 20 мг 2 раза |
Перед началом лечения ингибиторами АПФ следует оценить степень риска их применения у конкретного больного с точки зрения возможности возникновения таких проявлений побочного действия, как выраженная симптомная гипотензия, азотемия и гиперкалиемия. Ингибиторы АПФ не следует назначать больным с ХСН и уровнем САД <90 мм рт.ст. и уровне К+ плазмы крови >5,4 ммоль/л.
Не следует также назначать ингибиторы АПФ больным с тяжелой СН и низким сердечным выбросом, которые получают внутривенные инотропные средства (симпатомиметики или ингибиторы ФДЭ). Больным со склонностью к артериальной гипотензии следует пересмотреть схему предшествующей терапии с точки зрения возможной отмены вазодилататоров или/и снижения дозы диуретика перед назначением ингибитора АПФ.
Начальную дозу ингибитора АПФ назначают при условии отмены или снижения дозы диуретика в течение последних 24 ч. После приема первой дозы ингибитора АПФ следует рекомендовать больному оставаться в кровати (сидя или лежа) в течение 2–4 ч, на протяжении которых желательно каждый час измерять АД и контролировать состояние пациента.
Дальнейшее измерение АД, наряду с оценкой уровня К+ и креатинина плазмы крови, может осуществляться после каждого последующего повышения дозы ингибитора АПФ, то есть каждые 1–2 нед. Во время поддерживающей терапии больного стабильной, достигнутой путем титрования, дозой ингибитора АПФ указанные лабораторные тесты сначала следует проводить каждые 3 мес, а в дальнейшем при условии нормальных показателей — с интервалом в 6 мес.
При правильном назначении и адекватно контролируемой поддерживающей терапии (о чем свидетельствуют данные современных многоцентровых исследований) ингибиторы АПФ хорошо переносят >90% больных с ХСН.
Проблемы, которые могут возникать при клиническом применении ингибиторов АПФ
Гипотензия. Практически у всех больных с ХСН при лечении ингибиторами АПФ отмечают снижение уровня АД по отношению к исходному, а у части больных — гипотензию (САД <100 мм рт. ст.). В большинстве случаев гипотензия является бессимптомной и не достигает значительной (<85 мм рт. ст.) степени. Риск выраженной, сопровождающейся головокружением и даже синкопальными эпизодами, гипотензии имеется преимущественно в начале лечения ингибиторами АПФ. Факторами ее риска являются начальное САД <100 мм рт. ст., гипонатриемия <135 ммоль/л; тяжелая СН; значительный объем диуреза; сопутствующее лечение нитратами. Большинство из указанных факторов могут быть устранены (отмена или снижение дозы нитратов, временное увеличение потребления соли), что обычно дает возможность начать лечение ингибиторами АПФ.
Ухудшение азотовыделительной функции почек регистрируют у 15–30% больных с тяжелой ХСН и у 5–10% других пациентов. Его механизм состоит в преобладающей дилатации эфферентных почечных артериол под влиянием ингибиторов АПФ, поскольку ангиотензин II оказывает вазоконстрикторный эффект преимущественно именно на них. В результате снижается клубочковое фильтрационное давление и соответственно — клиренс креатинина (так называемая постренальная азотемия). Факторами риска последней являются IV ФК больного по NYHA, гипонатриемия, сопутствующие заболевания почек, форсированный диурез. Клиническое значение индуцированной приемом ингибиторов АПФ азотемии не следует преувеличивать. В большинстве случаев она уменьшается или исчезает после снижения дозы диуретиков и/или ингибиторов АПФ. Уровень креатинина плазмы крови до 200 мкмоль/л не является мотивом для отмены ингибиторов АПФ. В многоцентровых исследованиях повышение креатинина ограничивало продолжение терапии ингибиторами АПФ лишь у 1–3% пациентов.
Гиперкалиемия. В случае возникновения последней мероприятием первой линии является отмена антагонистов альдостерона. При необходимости следующим шагом является снижение дозы ингибиторов АПФ. Полная отмена ингибиторов АПФ в связи с возникновением гиперкалиемии требуется достаточно редко.
Кашель. Непродуктивный кашель, связанный с повышением концентрации брадикинина и некоторых других вазоактивных субстанций в бронхах, отмечают у 5–10% больных. Следует помнить, что: а) наличие бронхообструктивных заболеваний не является фактором риска появления такого кашля; б) его выраженность дозозависима. Учитывая исключительно важное (с позиции влияния на клинический прогноз ХСН) значение лечения ингибиторами АПФ, следует рекомендовать больным продолжать их прием в случаях, если кашель умеренный и не слишком беспокоит пациента. При ощутимом дискомфорте, вызванном этим кашлем, ингибитор АПФ необходимо заменить антагонистами рецепторов ангиотензина II.
Ангионевротический отек возникает в <1% случаев применения ингибиторов АПФ, не зависит от дозы препарата и представляет потенциальную опасность для жизни пациента. Развитие ангионевротического отека требует полного отказа от применения в будущем любого другого препарата этого класса.
К спорадическим проявлениям побочного действия ингибиторов АПФ относятся изменение вкусовых ощущений и нейтропения (риск последней выше при приеме каптоприла).
Блокаторы β-адренорецепторов
Блокаторы β-адренорецепторов следует назначать всем больным (кроме случаев противопоказаний и непереносимости) с ХСН II–IV ФК и систолической дисфункцией ЛЖ (обусловленной ИБС, АГ или ДКМП), находящимся на поддерживающей терапии ингибиторами АПФ и диуретиками и имеющим стабильную гемодинамику.
Мотивы для применения блокаторов β-адренорецепторов при ХСН
Современная доктрина использования блокаторов β-адренорецепторов при ХСН основывается на почти 30-летнем опыте соответствующих экспериментальных и клинических пилотных исследований и мотивирована результатами широко известных многоцентровых исследований — US Саrvedilоl Неаrt Failure Program (USCP, 1996), CIBIS-II (1999), MERIT-HF (1999) и COPERNICUS (2001), охвативших в общем >10 тыс. больных. Принципиальная схема их проведения была однотипной: пациентам с клинически манифестированной ХСН и систолической дисфункцией ЛЖ, которые принимали стандартное на то время лечение (ингибитор АПФ и диуретик, а также во многих случаях — дигоксин), назначали дополнительно блокаторы β-адренорецепторов (так называемая группа активного лечения) или плацебо. Согласно принципам доказательной медицины группы активного лечения и плацебо существенным образом не отличались по количеству участников и основным демографическим, клиническим и гемодинамическим показателям. Продолжительность наблюдения пациентов колебалась от 6 (USCP) до 21 мес (MERIT-HF, COPERNICUS) .
Прием блокаторов β-адренорецепторов, изучавшихся в указанных исследованиях (а именно карведилола, бизопролола, а также метопролола сукцината в лекарственной форме с замедленным высвобождением (CR/XL)), приводил к снижению (статистически высокодостоверному) частоты летальных исходов за период наблюдения на 34–65%, случаев внезапной смерти на 41–56% по сравнению с пациентами, принимавшими плацебо (табл. 2.21). Об улучшении клинического течения XCH также свидетельствовало снижение риска госпитализации больных на 20–35%.
Таблица 2.21
Обоснование применения блокаторов β-адренорецепторов при ХСН: данные доказательной медицины
| Препарат | Исследование, год публикации | Пациенты | Средняя продолжительность наблюдения, мес | Основные результаты по сравнению с группой плацебо |
| Карведилол | USСР (1996) | n=1094, II–IV ФК с ФВ ЛЖ <35% | 6 | ↓ смертности на 65%
↓ внезапной смерти на 56% |
| СОРЕRNIСUS (2001) | n=2289, IV ФК с ФВ ЛЖ <25% | 21 | ↓ смертности на 35% | |
| Метопролол сукцинат (форма СR/XL) | МЕRIТ-НF (1999) | n=3991, II–IV ФК с ФВ ЛЖ <40 % | 21 | ↓ смертности на 38%
↓ внезапной смерти на 41% |
| Бизопролол | СІBIS-II (1999) | n=2647, III–IV ФК с ФВ ЛЖ <35% | 15 | ↓ смертности на 35%
↓ внезапной смерти на 44% |
| Небиволол | SENIORS (2004) | n=2128, II–III ФК, возраст >70 лет | 21 | ↓ комбинированного показателя кардиоваскулярной смерти и госпитализаций на 14% |
В отличие от ингибиторов АПФ с их унитарным механизмом действия (угнетение АПФ), различные блокаторы β-адренорецепторов существенно отличаются по фармакологическим характеристикам (селективность, внутренняя симпатомиметическая активность, дополнительные свойства) и поэтому, по мнению экспертов, данные относительно влияния на клиническое течение конкретного блокатора β-адренорецепторов не могут автоматически переноситься на другие препараты этого класса.
Как показано выше, на сегодня существуют убедительные доказательства благоприятного влияния на долгосрочную выживаемость больных с ХСН лишь трех указанных блокаторов β-адренорецепторов. В законченном в 2004 г. многоцентровом исследовании SENIORS получены результаты, свидетельствующие об улучшении клинического течения ХСН у больных в возрасте старше 70 лет (а именно, снижение комбинированного показателя риска кардиоваскулярной смертности и госпитализации независимо от исходной величины ФВ ЛЖ) под влиянием селективного блокатора β-адренорецепторов небиволола, что позволило включить данный препарат в действующие Европейские рекомендации по лечению ХСН (2005).
Относительно других блокаторов β-адренорецепторов, то соответствующим образом спланированные многоцентровые исследования их влияния на прогноз жизни больных с ХСН или не проводились (пропранолол, атенолол, бетаксолол, соталол), или не продемонстрировали достоверного положительного результата (буциндолол).
Кроме увеличения продолжительности жизни пациентов с ХСН и снижения риска их повторных госпитализаций, указанные блокаторы β-адренорецепторов способны улучшать при длительном применении клиническое состояние больных (снижать ФК заболевания), уменьшать дилатацию и повышать ФВ ЛЖ. Данные метаанализа показали, что по расчетному показателю «количество летальных случаев, предотвращенных среди 1000 больных, получавших лечение в течение года», карведилол существенно опережает бизопролол и метопролол CR/XL (соответственно 71; 41 и 38), а по способности улучшать ФВ ЛЖ — метопролол CR/XL. Такое преимущество карведилола связывают с неселективным характером β-адреноблокады и наличием у него дополнительных фармакологических свойств (см. ниже). Кроме этого, карведилол можно рассматривать как блокатор β-адренорецепторов выбора у больных с ФВ ЛЖ ≤25%, поскольку является единственным представителем этого класса препаратов, продемонстрировавшим в специально спланированном большом исследовании (СОРЕRNIСUS, 2001) способность улучшать прогноз жизни этой категории пациентов (рис. 2.9).
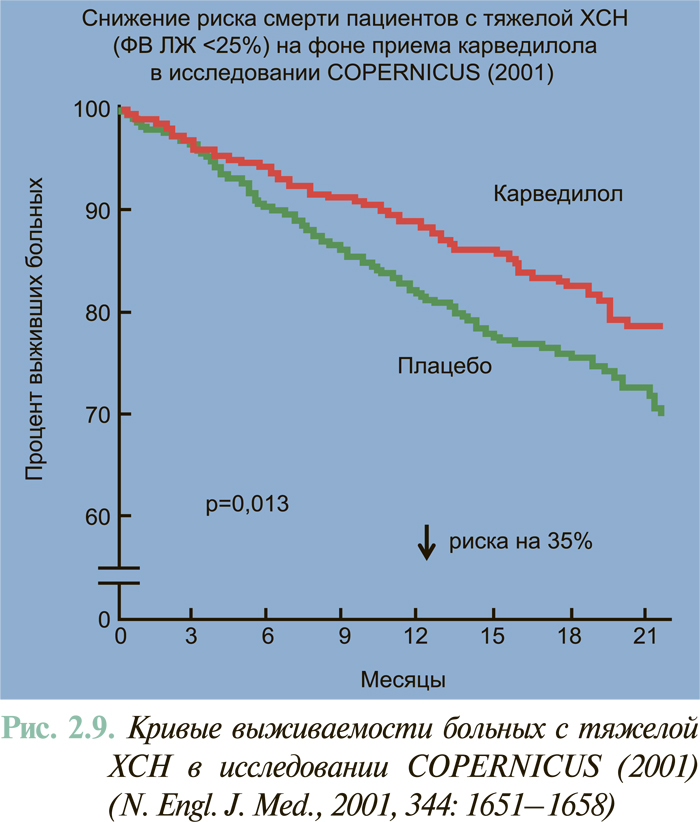
Необходимо учитывать, что все основные данные относительно благоприятного влияния блокаторов β-адренорецепторов на прогноз выживания больных с ХСН получены в результате применения тактики, при которой блокаторы β-адренорецепторов присоединяли к ингибиторам АПФ и в дальнейшем препараты обоих классов постоянно принимали сочетанно. В такой ситуации вполне справедливо говорить о синергетическом терапевтическом действии двух указанных групп нейрогуморальных антагонистов. Таким образом, исходя из данных доказательной медицины, врач может рассчитывать на реализацию ожидаемых терапевтических эффектов блокаторов β-адренорецепторов у больных с ХСН именно при их комбинированном применении с ингибиторами АПФ.
Механизмы терапевтического эффекта блокаторов β-адренорецепторов при ХСН
У больных с ХСН блокаторы β-адренорецепторов оказывают терапевтическое действие путем нейтрализации ряда патогенных эффектов, обусловленных перманентно существующей гипернорадреналинемией.
Ключевыми механизмами влияния блокаторов β-адренорецепторов на кардиомиоциты декомпенсированного миокарда является устранение перегрузки кардиомиоцитов Са2+ и увеличение продолжительности диастолы.
Это обусловливает:
а) восстановление энергетического потенциала кардиомиоцитов (то есть устранение дефицита макроэргических соединений);
б) устранение ишемии;
в) предотвращение некроза кардиомиоцитов;
г) регресс так называемой фетальной (свойственной эмбриональному периоду) трансформации миокардиального фенотипа;
д) улучшение сократительной функции кардиомиоцитов;
е) снижение электрической нестабильности миокарда и соответственно риска развития фатальной желудочковой аритмии;
ж) предотвращение апоптоза кардиомиоцитов.
С другой стороны, действие блокаторов β-адренорецепторов у пациентов с ХСН состоит в том, что при этом синдроме они выступают как системные нейрогуморальные антагонисты, поскольку угнетают РААС на начальном этапе ее активации (блокада β1-опосредованной секреции ренина) и путем снижения образования ангиотензина II — гиперсекрецию норадреналина.
Под влиянием блокаторов β-адренорецепторов у больных с систолической дисфункцией ЛЖ также улучшается барорефлекторный ответ и вегетативная регуляция сердца, степень нарушения которых прямо сопряжена с уровнем смертности таких пациентов.
Терапевтическое действие карведилола при ХСН, кроме эффектов, обусловленных β-адреноблокадой, связано также с его: а) α1— антагонистической активностью (периферическая вазодилатация, угнетение стимулов к гипертрофии и аритмогенной активации миокарда, опосредованных через α1-адренорецепторы) и б) со способностью препарата угнетать активированный у больных с ХСН процесс образования в тканях свободных радикалов за счет специфического химического связывания последних. Карведилол пока остается единственным блокатором β-адренорецепторов, который продемонстрировал способность повышать ФВ ЛЖ у пациентов с ИБС и его систолической дисфункцией за счет восстановления функционирования гибернированных («отключенных» вследствие выраженной перманентной гипоперфузии) зон миокарда (исследование CHRISTMAS, 2002).
Тактика и особенности применения
Тактика назначения блокаторов β-адренорецепторов у больных с систолической ХСН отличается от той, которая применяется у кардиологических больных других категорий. Она базируется на понимании принципиальных отличий между «острыми» гемодинамическими эффектами этого класса препаратов, с одной стороны, и длительным защитным действием по отношению к декомпенсованному миокарду — с другой. В первом случае речь идет об относительно быстром замедлении ЧСС и угнетении сократимости миокарда в ответ на одноразовое введение блокатора β-адренорецепторов, что закономерно предопределяет снижение МОК и для больных с систолической дисфункцией ЛЖ является неблагоприятным и даже потенциально опасным. Во втором случае речь идет о постепенной перестройке, на фоне хронической блокады β-адренорецепторов, метаболизма, функции и ультраструктуры кардиомиоцитов декомпенсированного сердца, что обеспечивает их более продолжительное выживание и адекватное функционирование. Клиническими эквивалентами такой перестройки являются улучшение систолической функции ЛЖ (так называемый парадокс длительной β-адреноблокады при ХСН), редукция симптоматики и увеличение продолжительности жизни больных.
Эмпирически разработанная и проверенная временем специальная технология назначения блокаторов β-адренорецепторов при ХСН (с очень низких доз с дальнейшим постепенным их повышением на протяжении нескольких месяцев до поддерживающей) направлена на профилактику отрицательных «острых» гемодинамических эффектов β-адреноблокады (снижение систолического выброса крови) до тех пор, пока не начнут проявляться благоприятные длительные клиникогемодинамические эффекты последней.
Блокаторы β-адренорецепторов не следует назначать пациентам с ХСН с явными признаками задержки жидкости в организме, нуждающимся в активной диуретической терапии, а также лицам, получающим внутривенную терапию по поводу декомпенсации ХСН. Лечебные мероприятия по устранению клинических признаков легочного застоя и отечного синдрома следует проводить до тех пор, пока не будут соблюдены вышеуказанные условия для начала лечения блокаторами β-адренорецепторов.
Противопоказаниями для назначения блокаторов β-адренорецепторов при ХСН являются: бронхообструктивный синдром; ЧСС <60 уд./мин; синдром слабости синусного узла; AV-блокада II–III степени (если не имплантирован водитель ритма); облитерирующее поражение артерий конечностей с соответствующими симптомами в состоянии покоя; выраженная артериальная гипотензия (САД <85 мм рт. ст.).
Поскольку отсутствуют доказательства клинической полезности применения блокаторов β-адренорецепторов у больных с ХСН, обусловленной клапанными или врожденными пороками сердца и легочным сердцем, назначение препаратов этой группы в качестве обязательной терапии указанным категориям пациентов не показано.
Согласно вышеупомянутой технологии назначения блокаторов β-адренорецепторов пациентам с ХСН лечение данными препаратами следует начинать с минимальных доз с дальнейшим повышением последних каждые 1–3 нед до достижения максимально клинически переносимой дозы, с учетом целевой (табл. 2.22, схема 2.6).
Таблица 2.22
Ориентировочная* схема титрования блокаторов β-адренорецепторов у больных с ХСН и систолической дисфункцией ЛЖ
| Препарат | Начальная доза (мг), кратность приема | Дозы на очередных этапах титрования, мг/сут | Целевая доза, мг/сут | Общий период титрования |
| Бизопролол | 1,25 — 1 раз в сутки | 2,5–3,75–5–7,5–10 | 10 | |
| Карведилол | 3,125 — 2 раза в сутки | 12,5–25–37,5–50 | 50 | |
| Метопролол CR/XL | 12,5 — 1 раз в сутки | 25–50–100–150–200 | 200 | От нескольких недель до нескольких месяцев |
| Небиволол | 1,25 — 1 раз в сутки | 2,5–5–7,5–10 | 10 |
*В зависимости от индивидуального клинического состояния больного возможен более медленный режим титрования доз указанных блокаторов β-адренорецепторов. Эта возможность состоит в повышении суточной дозы препарата на очередном этапе титрования не в 2, а в 1,5 раза и увеличении интервалов между очередными этапами титрования.
Повышение дозы блокатора β-адренорецепторов на этапах ее клинического титрования (см. табл. 2.22) возможно лишь в случае, если пациент адекватно переносил предыдущую. Необходимо отложить любое запланированное повышение дозы блокатора β-адренорецепторов до тех пор, пока побочные эффекты (гипотензия, признаки задержки жидкости, брадикардия), связанные с предыдущей, более низкой дозой препарата, не исчезнут.
С целью устранения артериальной гипотензии как фактора, препятствующего плановому повышению дозы блокатора β-адренорецепторов, рекомендуется: а) снижение дозы диуретика и/или ингибитора АПФ (в дальнейшем постепенное восстановление дозы ингибитора АПФ крайне желательно, в то время как необходимость восстановления дозы диуретика следует определять клинически); б) назначение разовых доз блокатора β-адренорецепторов, ингибитора АПФ, диуретика в разные часы в течение дня.
На протяжении первых 1–2 нед после назначения блокатора β-адренорецепторов у некоторых больных могут несколько усиливаться признаки декомпенсации кровообращения (появление ортопноэ, увеличение массы тела). Это не является поводом для отмены блокатора β-адренорецепторов, а указанные признаки должны быть устранены временным повышением поддерживающей дозы диуретика (табл. 2.23).
Таблица 2.23
Возможные проблемы, связанные с титрованием блокаторов β-адренорецепторов и пути их преодоления
| Проблема | Тактические возможности |
| Гипотензия | Рекомендовать применение ингибиторов АПФ и блокаторов β-адренорецепторов в разное время суток (обычно с интервалом в 2 ч). Временно снизить дозу ингибиторов АПФ. Если больной принимает нитропрепарат — снизить его дозу, рассмотреть возможность отмены. Если больной находится в эуволемическом состоянии — попробовать снизить дозу диуретика. В случае если блокатор β-адренорецепторов — карведилол, рекомендовать принимать его с пищей (замедляет абсорбцию) |
| Брадикардия | Если больной принимает дигоксин или амиодарон — снизить дозу, клинически оценить возможность отмены. Снизить дозу блокатора β-адренорецепторов. Учитывать возможность имплантации пейсмейкера (водителя сердечного ритма) |
| Углубление признаков СН (увеличение одышки при ходьбе, появление ортопноэ, пастозности голеней) | Убедиться в отсутствии самостоятельных причин для этого (тахиаритмия, дестабилизация ИБС). Если есть основания — откорригировать режим потребления жидкости/хлорида натрия. Повысить дозу диуретика. Если последние мероприятия неэффективны — снизить дозу блокатора β-адренорецепторов |
При замедлении ритма сердца <55 сокращений в 1 мин дозу блокатора β-адренорецепторов необходимо снизить в 2 раза, а если это наблюдается при приеме начальной дозы, врачу следует пересмотреть назначения относительно возможности отмены других препаратов с отрицательным хронотропным действием или же отменить блокатор β-адренорецепторов.
Следует придерживаться схемы титрования блокаторов β-адренорецепторов (см. табл. 2.22), однако длительность периодов между повышением доз препарата (этапами титрования) может быть увеличена врачом по клиническим мотивам (например устранение артериальной гипотензии, интеркуррентное заболевание). В последних случаях доза блокатора β-адренорецепторов может быть временно снижена.
Желательным является достижение целевой дозы соответствующего блокатора β-адренорецепторов. Лечение блокатором β-адренорецепторов, если не возникает признаков его непереносимости, должно быть постоянным; в случае резкой отмены препарата возможно клиническое ухудшение, вплоть до острой декомпенсации кровообращения.
Антагонисты рецепторов альдостерона
Целесообразность применения антагонистов альдостерона как нейрогуморальных антагонистов, способных улучшать прогноз больных с ХСН, имеет серьезное патофизиологическое обоснование.
Во-первых, установлено, что снижение уровня циркулирующего альдостерона под влиянием ингибиторов АПФ у значительной части больных с ХСН не достигается или утрачивается со временем (так называемый эффект выскальзывания альдостерона). Это связано с тем, что, кроме ангиотензина II, синтез альдостерона стимулируется и другими физиологическими факторами (АКТГ, повышение уровня циркулирующего К+ и др.).
Во-вторых, альдостерон — самостоятельный мощный фактор формирования миокардиального фиброза и развития дисэлектролитемии (гипокалиемии, гипомагниемии), которые играют важную роль в возникновении опасных для жизни желудочковых аритмий. Кроме того, альдостерон оказывает самостоятельное вазоконстрикторное действие и угнетающее действие на барорефлекс (последнее обстоятельство является дополнительным фактором активации САС).
Клиническая целесообразность применения при ХСН антагонистов альдостерона как нейрогуморальных антагонистов подтверждена в двух известных многоцентровых исследованиях — RALES (1999) и EPHESUS (2003), результаты которых позволили рекомендовать применение данной группы препаратов с целью улучшения долгосрочного клинического прогноза определенных категорий больных с ХСН.
В исследовании RАLES, в которое вошли 1663 пациента с ХСН III–IV ФК и ФВ ЛЖ <35%, постоянно получавших диуретик и ингибитор АПФ (часть больных — также блокатор β-адренорецепторов), дополнительное назначение спиронолактона в дозе 25 мг/сут и его прием на протяжении 2 лет сопровождались достоверным снижением, по сравнению с плацебо, смертности на 30% (рис. 2.10), внезапной смерти — на 29%, количества госпитализаций в связи с прогрессированием ХСН — на 35% при небольшом риске развития гиперкалиемии (2%).
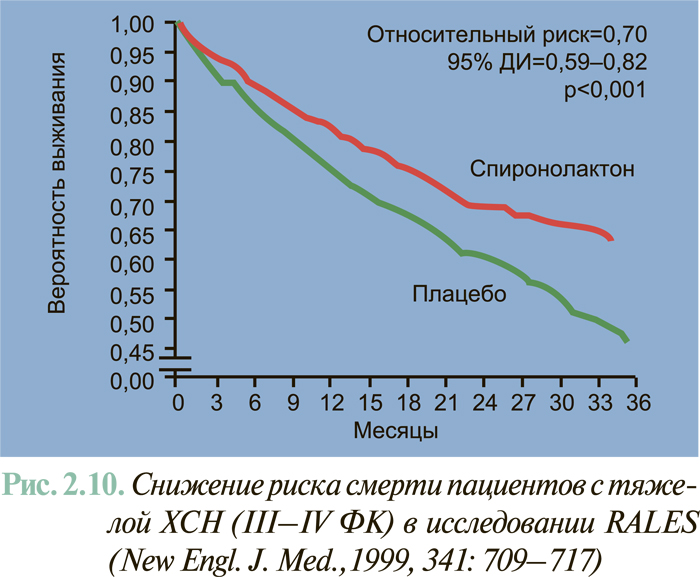
Исследование EPHESUS охватило больных, у которых в острый период ИМ была выявлена систолическая дисфункция ЛЖ (ФВ <40%) в сочетании с клиническими признаками застойной СН или сахарным диабетом. Присоединение в промежутке между 3–14-ми сутками после ИМ к базисной терапии (ингибиторы АПФ — у 87%, блокаторы β-адренорецепторов — у 75% больных) селективного антагониста альдостерона эплеренона (25 мг, с повышением до 50 мг/сут) и дальнейший его прием в течение 3 лет способствовал снижению, по сравнению с плацебо, смертности от любых причин на 15%, внезапной сердечной смерти — на 21% при относительно небольшом риске развития гиперкалиемии (5,5%).
Таким образом, длительное применение спиронолактона в дозе 25 мг/сут показано как средство стандартной терапии у больных с выраженной ХСН (III–IV ФК). Эплеренон может быть рекомендован с целью улучшения долгосрочного прогноза у пациентов после ИМ с систолической дисфункцией ЛЖ, имеющих признаки СН или сопутствующий сахарный диабет.
Назначение антагонистов альдостерона противопоказано пациентам с концентрацией К+ в плазме крови >5,0 ммоль/л и креатинина >200 мкмоль/л.
Начальная суточная доза спиронолактона составляет 12,5 мг, эплеренона — 25 мг. В случае, если в течение 1 мес уровень К+ плазмы крови остается <5,0 ммоль/л и не наблюдается значительного ухудшения азотовыделительной функции почек, дозу препаратов повышают до максимальной поддерживающей — 25 мг для спиронолактона, 50 мг — для эплеренона.
Рекомендованные сроки контроля уровня К+ и креатинина плазмы крови на фоне приема антагонистов альдостерона: через 3; 7 дней и через 1 мес после начала терапии, затем ежемесячно на протяжении первых 3 мес лечения. При уровне К+ 5,0–5,5 ммоль/л необходимо снизить дозу антагониста альдостерона в 2 раза, а при уровне К+ >5,5 ммоль/л — отменить препарат.
Дигоксин
Ключевым механизмом действия гликозидов наперстянки является угнетение активности сопряженного с клеточной мембраной ионного насоса — Nа+К+-АТФазы.
Угнетение Nа+К+-АТФазы кардиомиоцитов приводит к росту концентрации ионов Са2+ в их цитозоле и соответственно — повышению сократительной способности миофиламентов (положительный инотропный эффект).
Угнетение Nа+К+-АТФазы в афферентных парасимпатических волокнах повышает чувствительность артериальных и предсердных барорецепторов и, соответственно, центральный парасимпатический тонус с одновременным снижением тонуса симпатического. Следствием этого является снижение секреции вазопрессина задней долей гипофиза и норадреналина симпатическими терминалями (выражено умеренно). Следствием роста активности парасимпатического отдела вегетативной нервной системы под влиянием дигиталиса является отрицательное хронотропное действие и замедление предсердно-желудочковой проводимости. Последнее обусловливает снижение частоты желудочковых сокращений у пациентов с фибрилляцией предсердий при применении препаратов этой группы.
Кроме того, посредством механизма, связанного с угнетением Ш’/К‘-А’ТФазы почечных канальцев, дигиталис угнетает секрецию ренина.
Вопрос применения препаратов дигиталиса при ХСН следует рассматривать отдельно для больных с фибрилляцией предсердий и для пациентов с сохраненным синусовым ритмом.
В течение длительного времени препараты дигиталиса с успехом эмпирически применяют при мерцательной аритмии для нормализации и контроля частоты желудочковых сокращений. У больных с фибрилляцией предсердий и клиническими признаками ХСН такой контроль особенно важен, поскольку, как показано в ряде непродолжительных (1–3 мес) плацебо-контролируемых исследований, это способствует редукции симптоматики, повышению толерантности к физической нагрузке и улучшению качества жизни больных. Хотя плацебо-контролируемых исследований влияния контроля ритма при фибрилляции предсердий с помощью дигиталиса на долгосрочный прогноз выживания больных с ХСН не проводили (из этических соображений), хорошо известно, что неконтролируемая тахисистолия при фибрилляции предсердий является серьезным фактором риска возникновения декомпенсации кровообращения и неудовлетворительного прогноза. Поэтому препараты дигиталиса следует обязательно (за исключением противопоказаний) назначать всем больным с ХСН и тахисистолической формой фибрилляции предсердий, независимо от наличия систолической дисфункции ЛЖ.
Современные рекомендации относительно применения дигоксина у больных с систолической ХСН и синусовым ритмом основываются на данных многоцентровых исследований PROVED (1991), RADIANCE (1992) и прежде всего DIG (1997). В первых двух из них установлено, что в группе больных, у которых в схеме постоянного поддерживающего лечения дигоксин был заменен на плацебо, количество госпитализаций по поводу декомпенсации СН при дальнейшем наблюдении было в 2 раза (PROVED) и почти в 6 раз (RADIANCE) больше, чем в когорте больных, продолжающих лечение дигоксином. Широко известное мега-исследование DIG, в которое вошли 7788 больных с ХСН и синусовым ритмом, продемонстрировало, что длительный (до 5 лет) прием дигоксина на фоне базисной терапии диуретиком и ингибитором АПФ в целом достоверно не влиял на выживаемость больных по сравнению с плацебо (рис. 2.11), однако на 28% снижал (по сравнению с той же группой плацебо) количество госпитализаций по поводу усугубления симптомов СН (рис. 2.12). Таким образом, был сделан вывод, что у больных с синусовым ритмом дигоксин влияет на клиническое течение ХСН, снижая риск декомпенсации, но при этом не увеличивает продолжительность жизни.
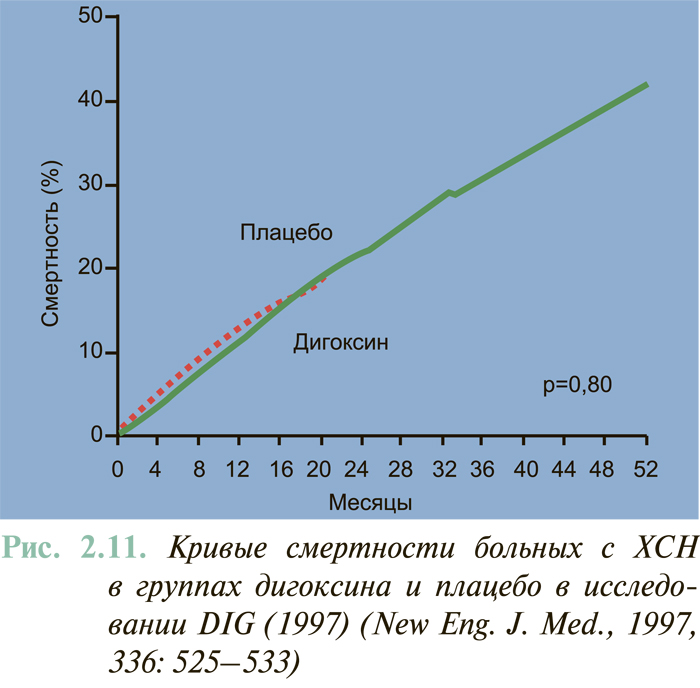

Выполненный впоследствии субанализ данных исследования DIG позволил установить, что вышеуказанное «нейтральное» влияние дигоксина на выживаемость пациентов с ХСН и синусовым ритмом явилось результатом двух противоположных тенденций: 1) статистически значимого возрастания смертности пациентов при концентрациях препарата в плазме крови >1,2 нг/мл (соответствует его дозам >0,25 мг/сут при сохраненной азотовыделительной функции почек) и 2) статистически значимого снижения риска смерти пациентов с концентрацией дигоксина в плазме крови <0,9 нг/мл, что соответствует его дозам <0,25 мг/сут) при отсутствии влияния на смертность концентрации препарата 0,9–1,1 нг/мл, примерно соответствующих его суточной дозе 0,25 мг.
Пациентам с ХСН, систолической дисфункцией ЛЖ и синусовым ритмом дигоксин показан с целью снижения риска госпитализаций в связи с декомпенсацией гемодинамики в тех случаях, когда, несмотря на применение ингибиторов АПФ, диуретиков и блокаторов β-адренорецепторов, их клинико-функциональное состояние соответствует III–IV ФК по NYHA. Если на фоне указанной комбинированной терапии, включающей дигоксин, клиническое состояние больного удается улучшить до II ФК, поддерживающее применение дигоксина необходимо продолжить.
Дозы и особенности применения
Дигоксин занимает главное место среди препаратов дигиталиса при лечении пациентов с ХСН не только в связи с имеющимися данными доказательной медицины (см. выше), а и благодаря его сбалансированным фармакологическим свойствам (табл. 2.24).
Таблица 2.24
Фармакологические свойства дигоксина
| Абсорбция, % | 60–75 |
| Связывание с белками плазмы крови, % | 25 |
| Период полувыведения, ч | 36 (24–46) |
| Путь элиминации | Почечный |
| Начало действия, мин: | |
| в/в | 5–30 |
| per os | 30–90 |
| Пик эффекта, ч: | |
| в/в | 2–4 |
| per os | 3–6 |
| Продолжительность эффекта, сут | 2–6 |
Начало лечения дигоксином с внутривенного введения оправдано у пациентов с тахисистолической фибрилляцией предсердий и признаками декомпенсации кровообращения. Обычно вводят путем инфузии в течение 15–20 мин 0,25 или 0,5 мг препарата (в зависимости от частоты желудочковых сокращений, массы тела и возраста пациента). При необходимости 0,125–0,25 мг дигоксина могут быть дополнительно введены не ранее чем через 4 ч. В дальнейшем рекомендован переход на пероральный прием препарата.
Во всех других случаях при ХСН лечение дигоксином начинают перорально, сразу начиная с поддерживающей дозы (0,125 или 0,25 мг/сут в 1–2 приема; у лиц пожилого возраста соответственно 0,0625 или 0,125 мг/сут). Для длительного поддерживающего лечения больных с ХСН применение доз дигоксина >0,25 мг не рекомендуется, поскольку это может повышать риск возникновения смерти от желудочковых аритмий.
Следует помнить, что в отличие от больных с фибрилляцией предсердий, у пациентов с синусовым ритмом выраженность снижения ЧСС не следует расценивать как критерий клинической эффективности дигоксина.
Если у пациентов с фибрилляцией предсердий поддерживающая доза дигоксина 0,125–0,25 мг/сут не обеспечивает надлежащего контроля ЧСС (нормосистолии), необходимо не повышать ее, а достигать указанной цели с помощью комбинирования дигоксина с блокаторами β-адренорецепторов после достижения эуволемического состояния больного. При комбинировании блокаторов β-адренорецепторов с дигоксином в большинстве случаев оптимальная доза последнего не превышает 0,125 мг/сут.
Дигиталисная интоксикация
При невозможности организма элиминировать препарат дигиталиса пропорционально его введению возникают признаки передозировки.
Кардиальные признаки дигиталисной интоксикации представляют потенциальную опасность для жизни и хорошо известны: желудочковая аритмия вплоть до стойкой желудочковой тахикардии или фибрилляции желудочков, предсердная тахикардия с неполной AV-блокадой, синусовая брадикардия, синоатриальные и AV-блокады разной степени.
Возможны симптомы со стороны ЖКТ: анорексия (ранний признак), тошнота, рвота, диарея. Со стороны нервной системы возможны депрессия, нарушение ориентации, парестезии. Реже отмечают офтальмологические проявления (затуманенность или выпадание полей зрения, визуализация предметов в зеленых тонах). Казуистическими являются симптомы, связанные со стимуляцией эстрогенов (гинекомастия, галакторея).
Профилактика дигиталисной интоксикации
Основой ее является учет либо коррекция потенциальных факторов, обусловливающих снижение элиминации дигоксина. К ним относятся почечная недостаточность, преклонный возраст, гипотиреоз, а также сопутствующий прием таких препаратов, как амиодарон, хинидин, верапамил, пропафенон, флекаинид.
У больных с почечной недостаточностью дозу дигоксина необходимо снижать на 30–70% (в зависимости от степени нарушения азотовыделительной функции), а у пациентов пожилого возраста — в 2 раза (по 0,125 мг ежедневно или через день). При значительно выраженной азотемии вместо дигоксина можно назначать дигитоксин с его печеночным путем элиминации. Поддерживающая доза дигитоксина составляет 0,07–0,1 мг/сут и снижается при печеночной недостаточности.
Следует избегать комбинирования дигоксина с амиодароном, верапамилом, хинидином, флекаинидом и пропафеноном, а также не применять указанные средства для лечения аритмий, которые могут быть связаны с дигиталисной интоксикацией.
Гипокалиемия и гипомагниемия как факторы электрической нестабильности миокарда повышают риск кардиальных проявлений побочного действия дигиталиса (желудочковые аритмии).
Применение препаратов дигиталиса у больных с желудочковыми аритмиями высоких градаций (III–IV степени) является небезопасным и, следовательно, не показано.
Применение строфантина и препаратов ландыша не предусмотрено действующими международными и отечественными стандартами лечения ХСН, а значит, не имеет достаточного основания для применения в современной клинической практике.
Антагонисты рецепторов ангиотензина II
Механизм их действия состоит в высокоселективной полной блокаде тканевых рецепторов к ангиотензину II первого типа (АТ1-рецепторы), посредством которых реализуются его основные патогенные эффекты при ХСН. С патофизиологической точки зрения имеется два основания для применения этой группы препаратов при ХСН. Во-первых, образование ангиотензина II в миокарде и стенке сосудов происходит не только посредством АПФ, а и посредством других (АПФ-независимых) путей, опосредованных рядом других энзимов. Именно с этим механизмом связывают феномен «выскальзывания» ангиотензина II, который состоит в постепенном возвращении его концентрации в плазме крови к начальным значениям в процессе продолжительного применения ингибиторов АПФ. Во-вторых, строго говоря, непреодолимые побочные эффекты ингибиторов АПФ — кашель и ангионевротический отек связаны не с блокадой ангиотензина II, а с брадикинин-потенциирующей гранью их действия.
Таким образом, теоретическая почва для клинического применения антагонистов рецепторов ангиотензина II состоит в достижении полной блокады эффектов ангиотензина II при одновременном преодолении наиболее значимых проявлений их побочного действия.
Современный взгляд на применение антагонистов рецепторов ангиотензина II базируется на результатах трех больших многоцентровых исследований — ELITE-II (2000), ValHeFT (2001) и CHARM (2003), в которых было продемонстрировано, что:
1) антагонисты рецепторов ангиотензина II подобно ингибиторам АПФ улучшают прогноз выживания больных с «систолической» ХСН по сравнению с плацебо (СНАRМ);
2) антагонисты рецепторов ангиотензина II не имеют преимущества перед ингибиторами АПФ относительно благоприятного влияния на выживаемость больных с «систолической» ХСН (ELITE-II);
3) комбинирование антагонистов рецепторов ангиотензина II с ингибиторами АПФ не приводит к дополнительному снижению смертности больных, но достоверно уменьшает количество повторных госпитализаций по поводу СН (VаlНеFТ, CHARM).
Не до конца выясненным на сегодня остается вопрос клинической оправданности присоединения антагонистов рецепторов ангиотензина II к комбинированному лечению ингибиторами АПФ и блокаторами β-адренорецепторов, поскольку в одном из исследований (VаlНеFТ) такая тройная комбинация даже ухудшала прогноз выживания больных, в другом же (CHARM) не влияла на него.
Таким образом, антагонисты рецепторов ангиотензина II:
а) следует назначать в тех случаях, когда клиническая непереносимость ингибиторов АПФ проявляется кашлем или идиосинкразией (ангионевротический отек);
б) могут присоединяться к ингибиторам АПФ с целью улучшения клинического течения ХСН в случаях непереносимости блокаторов β-адренорецепторов;
в) кандесартан можно назначать больным с ХСН II–III ФК по NYHA, которые уже принимают ингибиторы АПФ и блокаторы β-адренорецепторов, с целью дальнейшего снижения риска сердечно-сосудистой смерти и повторных госпитализаций.
Антагонисты рецепторов ангиотензина II не следует назначать при ХСН раньше, чем ингибиторы АПФ, и заменять ими последние у пациентов, которые нормально переносят ингибиторы АПФ.
Противопоказания к назначению и контроль таких возможных побочных эффектов блокады ангиотензина II, как гипотензия, азотемия и гиперкалиемия, при приеме антагонистов рецепторов ангиотензина II аналогичны тем, что и при приеме ингибиторов АПФ. Комбинирование ингибиторов АПФ и антагонистов рецепторов ангиотензина II целесообразно лишь при возможности регулярного мониторирования уровней К+, креатинина плазмы крови и АД.
Учитывая то, что данные доказательной медицины, заложенные в основу рекомендаций по применению антагонистов рецепторов ангиотензина II при ХСН, получены прежде всего в результате соответствующих исследований вальзартана и кандесартана, именно эти антагонисты рецепторов ангиотензина II желательно применять у таких больных. Начальная доза вальзартана — 20–40 мг 2 раза в сутки, кандесартана — 4–8 мг 1 раз в сутки. В дальнейшем при адекватной переносимости дозу повышают в 2 раза каждые 2 нед до достижения целевой (для вальзартана — 160 мг 2 раза в сутки, кандесартана — 32 мг 1 раз в сутки).
Алгоритм применения основных средств патогенетической терапии ХСН с систолической дисфункцией ЛЖ приведен в табл. 2.25.
Таблица 2.25
Стандартные средства медикаментозного лечения ХСН с систолической дисфункцией ЛЖ: алгоритм применения
| Степень ХСН | Ингибитор АПФ | Антагонист рецепторов ангиотензина II | Диуретик | Блокатор β-адренорецепторов | Антагонист альдостерона | Дигоксин |
| Бессимптомная дисфункция ЛЖ (I ФК) | Показан | При непереносимости ингибитора АПФ | Не показан | После ИМ | После ИМ (эплеренон) | При фибрилляции предсердий |
| Умеренная СН (II ФК) | Показан | При непереносимости ингибитора АПФ или в комбинации с ингибитором АПФ | При склонности к задержке жидкости | Показан | После ИМ (эплеренон) | а) При фибрилляции предсердий
б) при синусовом ритме — сохранить в случаях перехода из III–IV ФК |
| Выраженная СН (III–IV ФК) | Показан | При непереносимости ингибитора АПФ или в комбинации с ингибитором АПФ | Показан; комбинация диуретиков | Показан | Показан (спиронолактон) | Показан |
| Конечная стадия СН (необратимый IV ФК) | Показан | При непереносимости ингибитора АПФ или в комбинации с ингибитором АПФ | Показан; комбинация диуретиков | Показан | Показан (спиронолактон) | Показан |
ФАРМАКОЛОГИЧЕСКИЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ У ОТДЕЛЬНЫХ КАТЕГОРИЙ БОЛЬНЫХ С ХСН
Антитромботические препараты
Непрямые антикоагулянты
Механизм их терапевтического действия состоит в торможении биохимического преобразования витамина К, стимулирующего прокоагуляционную трансформацию (активацию) ряда белков — факторов свертывания крови (протромбин, VII, IX, X). Эталонным непрямым антикоагулянтом (НАК) считается варфарин, поскольку практически все данные доказательной медицины относительно антитромботической эффективности НАК получены именно в результате испытания этого препарата. По данным метаанализа соответствующих мультицентровых исследований у больных с фибрилляцией предсердий на фоне приема варфарина по сравнению с применением плацебо наблюдается значительное (на 62%) снижение риска возникновения мозгового инсульта, причем наибольшая профилактическая эффективность варфарина относительно мозгового инсульта наблюдалась именно
у больных с ХСН. Согласно современным рекомендациям, постоянное профилактическое применение НАК безусловно показано таким категориям пациентов с ХСН:
а) с постоянной или пароксизмальной формой фибрилляции предсердий;
б) перенесенным тромбоэмболическим эпизодом любой локализации;
в) с мобильным тромбом в полости ЛЖ;
г) с неоперированным гемодинамически значимым митральным стенозом.
Прием непрямых антикоагулянтов должен сопровождаться регулярным мониторингом МНО (в пределах 2,0–3,0) или в качестве суррогатного подхода — протромбинового индекса (в пределах 50–60%).
У больных с ХСН мониторинг безопасности профилактического приема НАК должен быть особенно тщательным с учетом двух существенных обстоятельств.
При развитии или прогрессировании гепатоцеллюлярной недостаточности, обусловленной хроническим венозным застоем (при терминальной ХСН — и гипоперфузией почек), угнетается печеночный биосинтез факторов свертывания крови, в том числе и вышеуказанных, что может обусловливать потенцирование эффекта НАК с соответствующим резким возрастанием риска возникновения опасных для жизни кровотечений. Возможна и обратная ситуация: по мере стабилизации гемодинамических показателей, устранения гиперволемии пациента и, соответственно, улучшения функционального состояния печени прежняя доза НАК может стать недостаточной для поддержания МНО на целевом уровне, и поэтому необходимо проведение коррекции дозы в сторону ее повышения.
У НАК достаточно широкий спектр взаимодействий с лекарственными средствами, способными либо усиливать, либо ослаблять их эффект. В табл. 2.26 представлены те из них, которые актуальны для пациентов с сердечно-сосудистыми заболеваниями, в том числе с ХСН, независимо от механизмов их взаимодействия с НАК. Необходимость сочетанного назначения пациентам с ХСН сразу нескольких препаратов лишь для базисной терапии, не говоря о лечении при осложнениях, требует владения информацией о лекарственном взаимодействии с целью принятия решения о назначении того или иного препарата сочетанно с НАК (например многих антибиотиков), а также для проведения строгого контроля за МНО и клиническим статусом пациента.
Таблица 2.26
Некоторые лекарственные средства, взаимодействующие с НАК
| Препараты, усиливающие действие НАК | Препараты, ослабляющие действие НАК |
| Амиодарон
Гепарин Нитроглицерин Пропафенон Статины Стрептокиназа Тиклопидин Фибраты Хинидин |
Антациды
Антигистаминные Витамин К (антидот) Аскорбиновая кислота Рифампицин Спиронолактон |
| Антибиотики:
Цефалоспорины Аминогликозиды Пенициллины Ципрофлоксацин Тетрациклин Хлорамфеникол |
|
| Флуконазол
Триметоприм |
|
| Анаболические стероиды ГКС
Тиреоидные гормоны Аллопуринол |
Антитромбоцитарные средства
Длительное применение ацетилсалициловой кислоты (100–160 мг/сут) у пациентов с ХСН показано в 2 случаях: а) как вынужденная альтернатива при наличии противопоказаний к непрямым антикоагулянтам; б) как составляющая стандартной терапии больных после ИМ. В последнее время получены данные (многоцентровые исследования WASH, 2002, WATCH, 2004) относительно способности ацетилсалициловой кислоты (даже применяемой в стандартной профилактической дозе 160 мг/сут) достоверно повышать по сравнению с варфарином риск госпитализации по поводу декомпенсации кровообращения у пациентов с клинически манифестированной ХСН и ФВ ЛЖ <35%. Возможно, это связано с механизмом действия ацетилсалициловой кислоты, заключающемся в блокировании синтеза простагландинов, в том числе и вазодилататорных (простациклин, PgE2), играющих существенную роль в регуляции почечного кровотока при выраженной ХСН. Поэтому в последние рекомендации Европейского общества кардиологов по лечению ХСН включено положение об осторожности относительно назначения ацетилсалициловой кислоты пациентам, предрасположенным к повторным госпитализациям по поводу декомпенсации кровообращения. Вполне очевидно, что данное предостережение может касаться и больных, госпитализированных в состоянии гиперволемии. Применение у указанной категории больных тиенопиридинов (тиклопидин или клопидогрел) как альтернативной антитромбоцитарной стратегии лечения является патогенетически обоснованным, однако требует изучения в соответствующих клинических исследованиях.
До проведения специально спланированных исследований влияния ацетилсалициловой кислоты на прогноз-модулирующую эффективность ингибиторов АПФ у пациентов с ХСН нет достаточных оснований не рекомендовать сочетанное применение указанных средств у этой категории больных.
Поскольку введение низкомолекулярных гепаринов снижает по сравнению с плацебо риск возникновения глубоких венозных тромбозов у больных, подвергающихся длительной иммобилизации, временное применение этих лекарственных средств с целью профилактики тромбозов у пациентов с тяжелой декомпенсированной ХСН, находящихся преимущественно на постельном режиме, является целесообразным.
Нитраты
Инфузионную или пероральную терапию нитратами можно применять у больных с декомпенсированной ХСН, особенно ишемической этиологии, с уровнем САД >100 мм рт. ст. и клиническими признаками легочного застоя, поскольку она ускоряет преодоление застойных явлений по сравнению с терапией только диуретиками и облегчает субъективное состояние этих пациентов.
Доказанными в клинических исследованиях полезными фармакологическими эффектами нитратов у больных с декомпенсированной ХСН являются: 1) уменьшение объема ЛЖ и снижение давления его наполнения; 2) уменьшение объема митральной регургитации; 3) повышение ФВ ЛЖ; 4) снижение периферического сосудистого сопротивления; 5) увеличение коронарного кровотока; 6) антиишемическое действие; 6) улучшение эндотелиальной функции за счет восстановления в сосудистой стенке пула оксида азота, существенно уменьшенного при ХСН.
Нитроглицерин — инфузия, начиная с 20 мкг/мин с постепенным при необходимости повышением до 200 мкг/мин под контролем АД.
Изосорбида динитрат — инфузия, начиная с 1 мг/ч с постепенным повышением при необходимости до 10 мг/ч (под контролем АД). Перорально (желательно в виде ретардной формы) — от 10 до 80 мг/сут.
Изосорбида мононитрат — перорально по 10–80 мг 1–2 раза в сутки.
После устранения признаков легочного застоя нитраты необходимо отменять, кроме пациентов со стенокардией, нуждающихся в их регулярном применении.
Негликозидные инотропные средства
У больных с ХСН их применение оправдано как паллиативный подход с целью улучшения системной гемодинамики и симптоматики в конечной клинической стадии этого синдрома, при наличии признаков периферической гипоперфузии, олигурии и рефрактерности к другим терапевтическим средствам.
Допамин. Агонист β- (преимущественно β1-) адренорецепторов. В дозе <2,5 мкг·кг-1·мин-1 — агонист допаминергических рецепторов; в дозе >5 мкг·кг-1·мин-1 — дозозависимый агонист α1-адренорецепторов. Как инотропное средство применяют у больных с конечной клинической стадией ХСН при наличии у них артериальной гипотензии и олигурии инфузионно в дозе 2,5–10 мкг·кг-1·мин-1.
Добутамин. Агонист β- (преимущественно β1-) адренорецепторов и умеренный α1-агонист. Можно применять у рефрактерных к лечению стандартными средствами больных в конечной клинической стадии, преимущественно с наличием гипотензии, в дозе от 2–3 до 15–20 мкг·кг-1·мин-1. Длительность непрерывной инфузии не должна превышать 48–72 ч вследствие развития тахифилаксии. Отмена добутамина должна быть медленной (поэтапное снижение скорости инфузии) с учетом риска резкого ухудшения гемодинамики в случае внезапного окончания введения препарата.
Левосимендан. Положительный инотропный агент с сопутствующим периферическим вазодилатирующим эффектом. В отличие от симпатомиметиков, традиционных ингибиторов ФДЭ (милринон, амринон, эноксимон) и сердечных гликозидов, оказывает инотропное действие не за счет повышения внутриклеточной концентрации ионов Са2+, а путем повышения чувствительности миофиламентов к последним (повышение связывания тропонина С с Са2+). Вследствие этого улучшение под действием левосимендана сократительной функции миокарда не сопровождается, в отличие от указанных средств, существенным повышением потребности миокарда в кислороде и ухудшением релаксации сердечной мышцы. По сравнению с другим негликозидными инотропными средствами лечение левосименданом характеризуется наиболее низким риском возникновения жизненно опасных желудочковых аритмий. Вазодилатирующее действие левосимендана обусловлено его свойствами активатора АТФ-зависимых калиевых каналов, результатом чего является снижение пред- и постнагрузки на сердце, повышение почечного и коронарного кровотока. В многоцентровом исследовании LIDO (2002) с участием больных с декомпенсированной тяжелой СН выявлена лучшая, чем у добутамина, способность левосимендана уменьшать легочно-капиллярное давление и увеличивать сердечный выброс, умеренно снижая при этом АД; через 6 ч после прекращения инфузии указанные гемодинамические эффекты левосимендана, в отличие от эффектов добутамина, сохранялись. Одновременный прием блокаторов β-адренорецепторов ограничивал терапевтическое действие добутамина, однако не влиял на эффекты левосимендана. Наиболее существенным результатом указанного исследования оказалось статистически достоверное преимущество 24-часовой инфузии левосимендана над 24-часовой инфузией добутамина относительно влияния на выживание больных с декомпенсированной ХСН в течение последующих 2 нед, 1-го и 6-ти месяцев.
С учетом имеющихся данных доказательной медицины левосимендан в настоящее время рекомендован для лечения больных с тяжелой декомпенсированной ХСН при условии отсутствия у них выраженной гипотензии (<85 мм рт. ст.). Лечение начинают с введения быстрой нагрузочной дозы (болюса) препарата — 12–24 мг/кг массы тела в течение 10 мин — с дальнейшей его инфузией со скоростью 0,05–0,2 мг·кг-1·мин-1 в течение 24 ч.
Профилактика внезапной сердечной смерти у больных с ХСН и применение антиаритмических средств
Первичная профилактика внезапной сердечной смерти — это комплекс фармакотерапевтических и других мероприятий, направленных на предотвращение внезапной сердечной смерти у пациентов с повышенным риском ее возникновения, но не имеющих в анамнезе реанимационных мероприятий по поводу фибрилляции/трепетания желудочков или гемодинамически неэффективной стойкой желудочковой тахикардии. О важности первичной профилактики внезапной сердечной смерти у больных с дисфункцией ЛЖ свидетельствуют такие данные. Выявление у больного после ИМ >10 желудочковых эктопических сокращений в 1 ч свидетельствует о повышении риска аритмической смерти в 4 раза, а сочетание этого признака со сниженной (<40%) ФВ ЛЖ увеличивает вероятность внезапной сердечной смерти в 16 раз. Вторичная профилактика предусматривает осуществление соответствующих мероприятий по предотвращению внезапной сердечной смерти у лиц, реанимированных после внезапной остановки кровообращения.
Данные доказательной медицины относительно способности нейрогуморальных антагонистов предотвращать внезапную сердечную смерть у пациентов с СН (первичная профилактика) обобщены в табл. 2.27.
Таблица 2.27
Способность нейрогуморальных антагонистов предотвращать внезапную сердечную смерть у больных с СН
| Группы средств, соответствующие многоцентровым исследованиям | Препарат | Снижение риска внезапной сердечной смерти по сравнению с плацебо, % |
| Ингибиторы АПФ | ||
|
VHеFTII (1991) |
Эналаприл | 38 |
| АIRЕ (1993) | Рамиприл | 30 |
| ТRАСЕ (1996) | Трандолаприл | 24 |
| Блокаторы β-адренорецепторов (базисная терапия включала ингибиторы АПФ) | ||
|
USСР (1996) |
Карведилол | 56 |
| СІВІS-II (1999) | Бизопролол | 44 |
| МЕRIТ-НF (1999) | Метопролол СR/XL | 41 |
| Антагонисты рецепторов альдостерона (базисная терапия включала ингибиторы АПФ и у части больных — блокаторы β-адренорецепторов)
|
||
| RALES (1999) | Спиронолактон | 29 |
| ЕРНЕSUS (2003) | Эплеренон | 21 |
Таким образом, комбинированное применение нейрогуморальных антагонистов у пациентов с систолической дисфункцией ЛЖ существенно снижает вероятность внезапной сердечной смерти. Вместе с тем даже при этом риск возникновения последней у указанных пациентов остается повышенным.
В такой ситуации вызывает интерес возможность применения фармакологических средств, способных угнетать эктопическую активность желудочков. Однако по данным многоцентровых исследований доказано, что антиаритмические средства I класса (IА — хинидин, новокаинамид, IB — этмозин/морицизин) и IС-класса (флекаинид, энкаинид) существенно повышают риск возникновения внезапной сердечной смерти у больных после ИМ, особенно с систолической дисфункцией ЛЖ. Аналогичные данные получены относительно антиаритмического агента III класса d-соталола («чистый» блокатор калиевых каналов без β-адреноблокирующей активности) (исследование SWORD, 1996). Изученный в многоцентровом исследовании DIАМОND-СНF новый блокатор калиевых каналов дофетилид при длительном применении не повышал, но и не снижал риск внезапной сердечной смерти.
Что касается амиодарона, то в метаанализе 13 плацебо-контролируемых исследований (АТМА, 1997), охвативших 6553 больных с желудочковыми аритмиями высоких градаций, его длительный прием (0,5–2,5 г) в дозах 150–400 мг/сут ассоциировался с достоверным снижением внезапной сердечной смерти на 29% (в том числе в подгруппах больных с манифестированной ХСН — на 23%, с ФВ ЛЖ <35% — на 27%, при III–IV ФК по NYНА — на 24%), а также смертности от любых причин на 13%. Результаты анализа базы данных наибольших многоцентровых исследований амиодарона ЕМХАТ и САМХАТ, вошедших в указанный метаанализ, свидетельствуют, что редуцирующее влияние амиодарона на частоту возникновения сердечной и аритмичной смерти оказалось наибольшим в когорте больных, где амиодарон включали в терапию, которая содержала блокаторы β-адренорецепторов. С другой стороны, в крупном исследовании SCD-HeF (2005), где сравнивали влияние на клинический прогноз ХСН имплантированного кардиовертера-дефибриллятора (ИКД) и амиодарона, последний не имел преимущества перед плацебо относительно влияния на смертность больных (рис. 2.13).
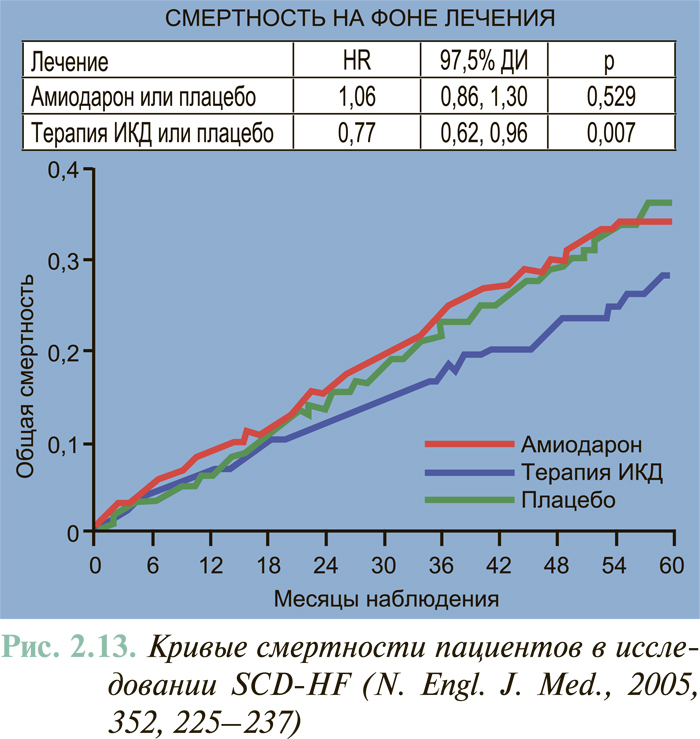
В то же время эффективность амиодарона в первичной профилактике внезапной сердечной смерти, в том числе у больных с ХСН, является доказанной (исследование CASCADE, 1993). Необходимо помнить, что амиодарон — единственный из антиаритмических препаратов, который при длительном пероральном применении не ухудшает сократительную функцию миокарда.
Таким образом, антиаритмическое средство III класса амиодарон по крайней мере не ухудшает прогноз выживания больных с ХСН и может применяться для лечения у них желудочковых аритмий, сопровождающихся симптомами, в том числе в случае успешно реанимированной внезапной сердечной смерти. Кроме того, у больных с ХСН амиодарон можно применять в соответствии с общепринятыми показаниями, а именно для: а) восстановления синусового ритма при суправентрикулярных тахиаритмиях, в том числе фибрилляции предсердий; б) удержания восстановленного синусового ритма у указанной категории больных; в) повышения успешности плановой электрической кардиоверсии.
Высокая целесообразность использования автоматических ИКД с целью первичной профилактики аритмической смерти у больных, перенесших ИМ с выраженной систолической дисфункцией ЛЖ, продемонстрирована в масштабных (1232 и 2521 больных соответственно) многоцентровых исследованиях MADIT-II (2002) и SCD-HeFT (2005). В первом из них применение ИКД у больных после ИМ с ФВ ЛЖ <30% (имплантировался без учета документированных желудочковых аритмий) дополнительно к стандартной медикаментозной схеме лечения в течение 20 мес обусловило достоверно меньшую (на 28%) частоту летальных случаев по сравнению с группой больных, которые получали только стандартную фармакотерапию. В исследовании SCD-HeFT применение ИКД в дополнение к оптимальной стандартной фармакотерапии ХСН у больных с клинически явной ХСН и ФВ ЛЖ <35% обусловило достоверное снижение смертности больных на 23% в течение почти 5-летнего наблюдения по сравнению с группой «плацебо + оптимальная фармакотерапия».
Приоритетность использования ИКД во вторичной профилактике аритмической смерти у больных с систолической дисфункцией ЛЖ обоснована ранее по данным многоцентровых исследований AVID (1997) и CASH (2000).
С учетом вышеприведенных данных, ИКД показан больным с систолической дисфункцией ЛЖ, имеющим в анамнезе остановку кровообращения или стойкую гемодинамически малоэффективную желудочковую тахикардию.
Имплантация ИКД также целесообразна с целью профилактики внезапной сердечной смерти у больных, перенесших (не менее чем 40 дней назад) ИМ, с ФВ ЛЖ <30–35% и принимающих стандартное лечение, включающее ингибиторы АПФ (антагонисты рецепторов ангиотензина II) и блокаторы β-адренорецепторов.
СОВРЕМЕННЫЕ ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ ТЯЖЕЛОЙ ХСН
Ресинхронизация желудочков
Существенное нарушение внутрижелудочковой проводимости (QRS >120 мс) отмечают не менее чем у У больных с ХСН, причем приблизительно у 15% — полную блокаду левой ножки пучка Гиса. Задержка межжелудочковой и внутрижелудочковой проводимости предопределяет асинхронизм в сокращении желудочков, что снижает эффективность сердца как насоса. Составляющими его насосной несостоятельности при значительных нарушениях являются:
- нарушение координации сокращения сегментов ЛЖ;
- снижение трансмитрального кровотока вследствие сокращения времени диастолического наполнения;
- увеличение периода митральной регургитации;
- дополнительное повышение давления наполнения ЛЖ и в результате уменьшение его ударного объема.
Между степенью расширения комплекса QRS и смертностью пациентов с ХСН существует прямая зависимость. Самостоятельным фактором ухудшения гемодинамики и прогноза выживания при ХСН является сочетание удлинения интервала QRS с замедлением AV-проведения. Оптимальное ускорение последнего позволяет увеличить время диастолического наполнения желудочков и их систолическую способность.
С целью улучшения насосной функции сердца у пациентов с систолической дисфункцией ЛЖ и гемодинамически значимыми нарушениями желудочковой проводимости в 1990-х годах разработан метод ресинхронизирующей электрокардиостимуляции желудочков (РЭКС). В современном виде он заключается в постоянной электрокардиостимуляции трех камер сердца: один электрод имплантируется в правое предсердие, второй — в ПЖ, а третий (через каротидный синус) — в ЛЖ. Во время процедуры с установлением электродов индивидуально подбирается такое время AV-задержки (пауза между навязанным сокращением предсердий и желудочков), которое обеспечивает максимальный систолический выброс крови по данным допплер-эхоКГ (рис. 2.14).
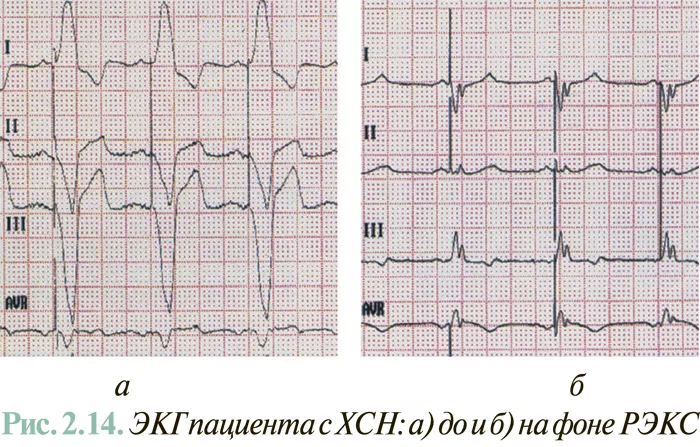
По результатам клинических исследований применение постоянной РЭКС сопровождается повышением ФВ ЛЖ, сердечного выброса, уменьшением КДО и КСО ЛЖ (рис. 2.15) и объема митральной регургитации, повышением толерантности к физической нагрузке и улучшением качества жизни пациентов.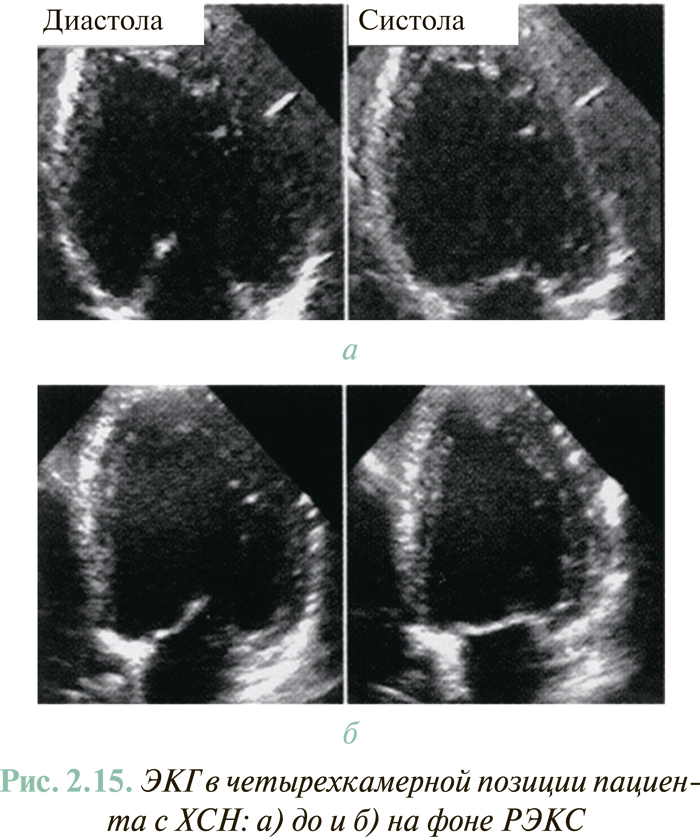
В серии многоцентровых клинических исследований РЭКС при ХСН, проведенных в конце 1990-х — начале 2000-х годов. (CONTAK-CD, MUSTIC, MIRACLE), показана способность РЭКС улучшать долгосрочный клинический прогноз соответствующего контингента больных с ХСН. По данным метаанализа указанных исследований, который охватил в целом 1634 пациента, применение РЭКС в течение 3–6 мес приводило к снижению риска смерти от прогрессирующей СН на 51% и количества госпитализаций по поводу декомпенсации ХСН на 29%. По результатам наиболее масштабного (813 больных) многоцентрового исследования РЭКС при ХСН CARE-HF (2005) применение данного метода у пациентов с ХСН III–IV ФК с нарушением внутрижелудочковой проводимости и ФВ ЛЖ <35%, находившимся на оптимизований фармакотерапии, снижало количество летальных исходов в течение периода наблюдения (почти 2,5 года) на 36% по сравнению с аналогичной группой пациентов, получающих только оптимизованное медикаментозное лечение (рис. 2.16). При увеличении периода наблюдения еще на 8 мес снижение риска смерти вследствие насосной недостаточности сердца по сравнению с группой только фармакологического лечения составило 45%, снижение частоты внезапной сердечной смерти — на 46%.
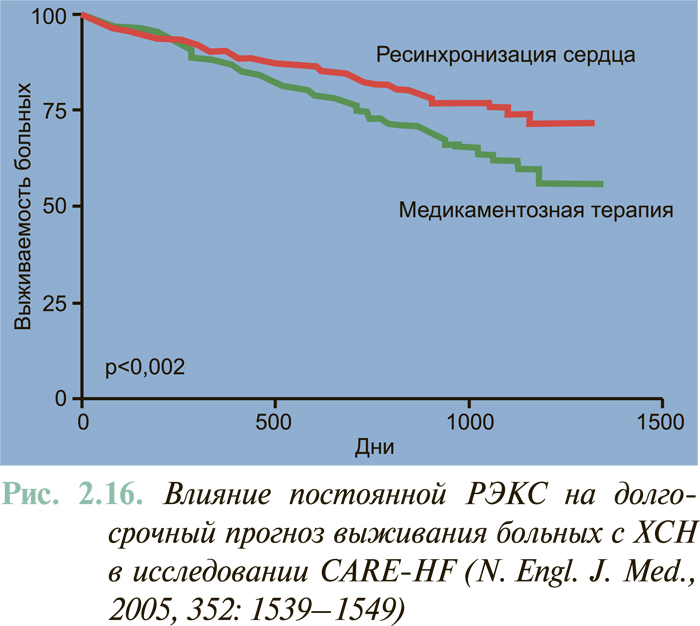
Основываясь на приведенных выше данных доказательной медицины, современные рекомендации по лечению ХСН определяют показания к постоянной бивентрикулярной РЭКС как наличие клинического статуса на уровне III–IV ФК по NYHA, несмотря на оптимальную медикаментозную терапию, у пациентов со сниженной ФВ ЛЖ и желудочковой асинхронией (QRS >120 мс).
Сочетанное применение РЭКС и ИКД
Комбинированное применение двух указанных методов дает возможность одновременно влиять на две основные причины смерти больных с ХСН — от насосной недостаточности сердца и внезапных желудочковых аритмий (прежде всего — вторичной фибрилляции желудочков).
В большом (1520 лиц) многоцентровом исследовании СОМРАNION (2004) продемонстрировано, что у больных с ХСН, обусловленной ИБС или ДКМП III–IV ФК с ФВ ЛЖ <35%, получающих оптимальную медикаментозную терапию, продолжительное (в среднем в течение 15 мес) комбинированное применение РЭКС и ИКД сопровождалось снижением риска смерти по сравнению с только медикаментозной терапией (диуретики, ингибиторы АПФ, блокаторы β-адренорецепторов, спиронолактон) в большей мере (на 36%), чем применение РЭКС в сочетании с медикаментозным лечением (на 24%). Целесообразность применения данного комбинированного метода в указанной категории больных с целью улучшения прогноза выживания и снижения риска госпитализации нашло отражение в международных рекомендациях по лечению ХСН (2005).
Имплантированные устройства помощи ЛЖ
Имплантированные устройства помощи ЛЖ — это постоянно работающие устройства вспомогательного кровообращения, локализованные внутри тела пациента.
Нынешнее поколение имплантированных устройств помощи ЛЖ представлено компактными устройствами, которые функционируют по следующему общему принципу. В брюшную полость поддиафрагмально имплантируется стационарное нагнетающее устройство (насос или турбина с беспрерывным нагнетанием крови), которое имеет внешний (батарейный) источник питания. Циркуляторный контур содержит: 1) магистраль (трубку), вшитую одним концом в верхушку ЛЖ, а другим соединенную с нагнетающим устройством; 2) сам насос (или турбину); 3) магистраль, один конец которой соединен с нагнетающим устройством, а другой вшит в восходящую аорту (рис. 2.17). Таким образом большая часть крови, попадающая в ЛЖ, перекачивается в аорту автоматически, что, с одной стороны, обеспечивает гемодинамическую разгрузку систолически несостоятельного сердца (и соответственно кардиопротекторный эффект), а с другой — позволяет поддерживать на должном уровне МОК.
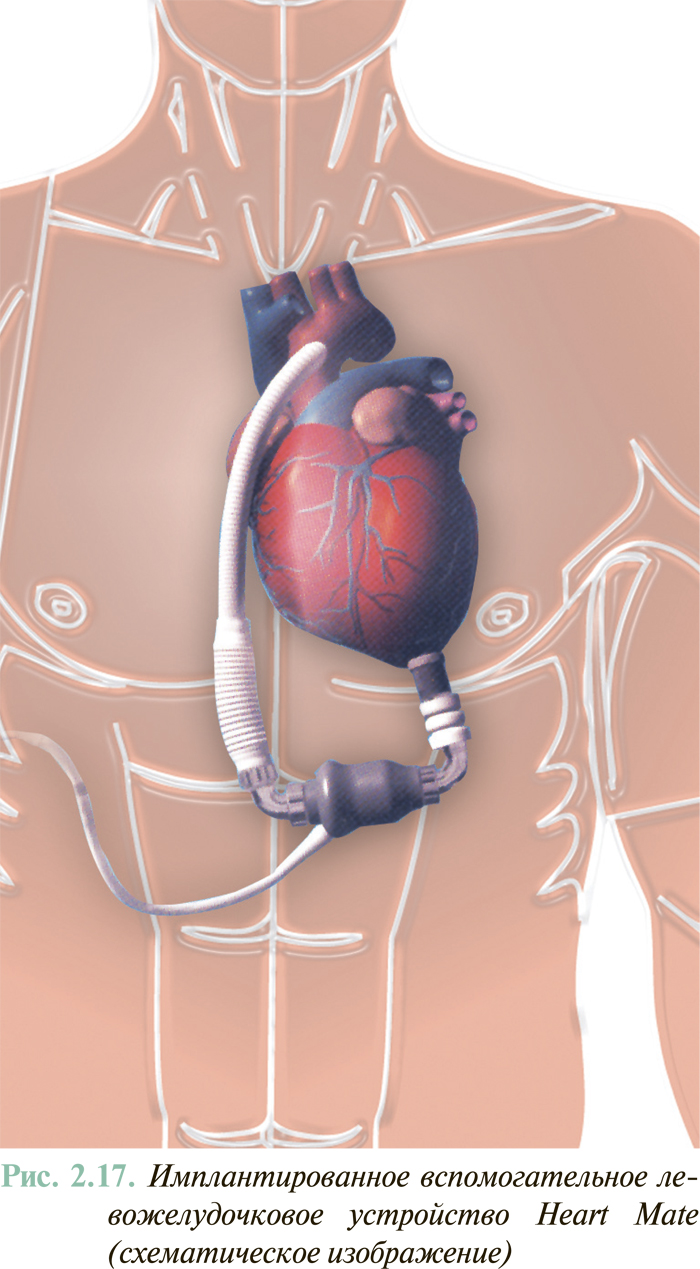
Одним из последних технологических достижений в сфере имплантированных устройств помощи ЛЖ является так называемое полностью имплантированное устройство («Lion Heart»), в котором элемент питания расположен стационарно внутри тела пациента, а его подзарядка осуществляется с помощью электромагнитной энергии, которая передается из закрепленного на коже стационарного источника. Последнее устройство может сниматься на определенное время, например на период занятий плаванием. Такая конструкция позволяет исключить риск инфекционных осложнений, связанных с постоянным наличием выведенного из полости тела на кожу больного кабеля расположенной снаружи батареи.
В США зарегистрировано два официальных показания для имплантированных устройств помощи ЛЖ: а) как «мост» к кардиотрансплантации и б) с целью достижения максимально возможной продолжительности жизни у больных с рефрактерной СН. В многоцентровое исследование REMATCH (2002) включили 129 больных с терминальной стадией ХСН (ФВ ЛЖ <25%; IV ФК в течение последних 3 мес; VО2mах <12 мг·кг-1·мин-1; >70% пациентов находились на инфузионной инотропной терапии), которые были рандомизированы на 2 сопоставимые по численности и основным клиническим показателям группы — с применением имплантированных устройств помощи ЛЖ и без него. Все указанные пациенты по разным причинам не рассматривались как кандидаты на кардиотрансплантацию. Длительное применение имплантированных устройств помощи ЛЖ позволило достичь значительного увеличения продолжительности и улучшения качества жизни пациентов (табл. 2.28). Среди больных, ожидающих трансплантацию сердца, применение имплантированных устройств помощи ЛЖ позволило дожить до вмешательства 75% пациентов.
Таблица 2.28
Основные результаты исследования REMATCH (Rose E.A. et al., 2001)
| Показатель | Группа больных | p | |
| Имплантированные устройства помощи ЛЖ + медикаментозная терапия (n=68) | Только медикаментозная терапия (n=61) | ||
| Доля выживания больных, %: | |||
| — на протяжении 1 года | 52 | 25 | 0,002 |
| — на протяжении 2 лет | 26 | 8 | 0,09 |
| Средний функциональный класс через 1 год | II | IV | |
| Оценка качества жизни в баллах: | |||
| а) интегральная оценка физической способности по 36 показателям; | 46 | 21 | 0,01 |
| б) интегральная оценка эмоционального состояния | 64 | 17 | 0,03 |
Установлено, что использование имплантированных устройств помощи ЛЖ уменьшает выраженность нейрогуморальной активации, обусловливает снижение ФНО-α в биоптатах ткани миокарда.
Считается также целесообразным применение имплантированных устройств помощи ЛЖ у больных с острой декомпенсированной СН при потенциально обратимой ее причине (например диффузный миокардит) с целью поддержания насосной функции сердца («вмешательство спасения»).
Абсолютными противопоказаниями к применению имплантированных устройств помощи ЛЖ являются септический шок, нарушения со стороны системы гемостаза, мультиорганная недостаточность, стойкая легочно-артериальная гипертензия, наличие протезированных клапанов сердца, разрыв межжелудочковой перегородки.
Относительными противопоказаниями (иными словами, факторами риска неудовлетворительного эффекта имплантированных устройств помощи ЛЖ) являются аортальная регургитация >II степени, значительная насосная недостаточность ПЖ (низкий ударный индекс, выраженная трикуспидальная недостаточность), ТЭЛА давностью <2 нед, предшествующая длительная интубация, старческий возраст, онкологические заболевания с ожидаемым выживанием <5 лет, печеночная недостаточность с тенденцией к прогрессированию, злокачественные желудочковые аритмии (в последнее время применяется тактика комбинированного применения имплантированных устройств помощи ЛЖ и ИКД).
Применение имплантированных устройств помощи ЛЖ ассоциируют с риском возникновения осложнений инфекционного характера (30–60% в год), тромбоэмболий (7–20%), кровотечения (9–21%), реже — неадекватным функционированием устройства (4–12%). Использование имплантированных устройств помощи ЛЖ с внутренним элементом питания (см. выше) позволило снизить частоту возникновения инфекционных осложнений до 11% в год.
Широкое внедрение современных высокотехнологических хирургических методов лечения тяжелой ХСН (РЭКС, ИКД, имплантированных устройств помощи ЛЖ) ограничивается их высокой стоимостью, что в особенности касается имплантированных устройств помощи ЛЖ.
Хирургическая коррекция митральной регургитации у больных с дилатированным ЛЖ без органической недостаточности митрального клапана
Хотя указанное вмешательство способствует улучшению гемодинамики и клинического состояния у этой категории больных, отсутствие соответствующих рандомизированных исследований его влияния на долгосрочный прогноз пока еще не позволяет рекомендовать хирургическую коррекцию митральной регургитации как стандартный способ лечения этих пациентов.
Реваскуляризация миокарда
Учитывая отсутствие данных мультицентровых исследований относительно положительного влияния данного вмешательства на симптоматику коронарогенной ХСН и нарушенную систолическую функцию ЛЖ у таких больных, хирургическая или чрескожная реваскуляризация последнего не может, по мнению европейских экспертов по ХСН (2005), быть рекомендована как средство стандартного лечения данного клинического контингента. В то же время, учитывая данные ряда хирургических клиник о способности реваскуляризационных вмешательств улучшать клиническую симптоматику ХСН ишемического происхождения, возможность реализации данного подхода можно рассматривать индивидуально у отдельных пациентов с ХСН на почве ИБС.
Парциальная вентрикулотомия ЛЖ
Иссечение части свободной стенки ЛЖ с целью устранения его дилатации экспертами США (Рекомендации АСС/АНА, 2005) и Европы (Рекомендации ЕБС, 2005) признано недостаточно эффективным и в связи с этим — нецелесообразным.
Трансплантация сердца
Основным показанием для кардиотрансплантации является тяжелая СН (IV ФК), рефрактерная к любому медикаментозному лечению, которая не может быть скорригирована другими хирургическими методами.
Критериями первоочередного отбора больных с ХСН для кардиотрансплантации являются:
- выраженная функциональная недостаточность (VO2mах <50% надлежащего);
- невозможность обходиться без регулярной инфузионной поддержки инотропными средствами;
- высокий риск смерти на протяжении 1 года, рассчитанный по специальной методике;
- возраст пациента <60 лет;
- удовлетворительная функция почек и печени;
- высокая комплаентность (податливость лечению) и мотивированность пациента и членов его семьи.
Другими показаниями к выполнению кардиотрансплантации являются резистентные к любым методам лечения злокачественные желудочковые аритмии и тяжелая ИБС с рефрактерной к медикаментозной терапии стенокардией при невозможности хирургической реваскуляризации миокарда.
Противопоказания к проведению кардиотрансплантации приведены в табл. 2.29.
Таблица 2.29
Противопоказания к трансплантации сердца
| Хроническое злоупотребление алкоголем (или употребление наркотических веществ) в данное время |
| Отсутствие необходимого контакта (сотрудничества) с больным |
| Хронические психические заболевания (неадекватно контролируемые) |
| Злокачественные заболевания |
| Леченные злокачественные новообразования с продолжительностью ремиссии <5 лет |
| Неконтролируемые инфекционные процессы различной локализации |
| Почечная недостаточность (клиренс креатинина <50 мл/мин, креатинин плазмы крови >250 мкмоль/л), не поддающаяся коррекции |
| Стойкое высокое сопротивление в системе ЛА (средний транслегочный градиент давления >15 мм рт. ст., систолическое давление в ЛА >60 мм рт. ст.) |
| Недавно перенесенная тромбоэмболия |
| Пептическая язва в фазе обострения |
| Печеночная недостаточность тяжелой степени |
| Сахарный диабет с мультиорганной патологией |
| Инфицированность вирусом гепатита В или С (подтвержденная лабораторно) с поражением печени (по данным биопсии) |
| ВИЧ-инфекция |
| ХОБЛ с выраженной недостаточностью функции внешнего дыхания (показатель FEV1 <1 л) |
Как правило, осуществляется так называемая ортотопическая методика кардиотрансплантации, которая состоит в субтотальном, с сохранением задней стенки предсердий, изъятии пораженного сердца с дальнейшим формированием предсердного, аортального и легочно-артериального анастомозов с донорским сердцем.
Операционный риск является значительно более низким по сравнению с риском возникновения ближайших (преимущественно на протяжении первых 2 мес) осложнений (отторжение донорского сердца, сепсис). Стенозирующий атеросклероз коронарных сосудов как позднее осложнение кардиотрансплантации может развиться уже через 1 год после ее выполнения. Особенностью ИБС трансплантированного (денервированного) сердца является отсутствие болевого синдрома, что диктует необходимость регулярного контроля ЭКГ.
Оптимальная модель ведения больных с трансплантированным сердцем предусматривает:
- постоянное иммуносупрессивное лечение;
- периодические эндомиокардиальные биопсии с целью своевременного выявления гистологических признаков отторжения;
- антибиотикотерапию при малейших признаках инфекции;
- коррекцию гиперхолестеринемии и других сердечно-сосудистых факторов риска.
В США и странах Западной Европы выживание пациентов в течение 5 лет после кардиотрансплантации составляет 70–80%, причем среди лиц трудоспособного возраста к работе возвращаются до % прооперированных.
Поскольку глобальной проблемой является недостаток донорских сердец, кардиотрансплантация даже в экономически развитых странах остается средством радикальной помощи абсолютному меньшинству больных, которым она показана.
ДЕКОМПЕНСИРОВАННАЯ ХСН
Как известно, ОСН может возникать впервые (de novo) или эпизодически у пациентов без ХСН (табл. 2.30). Однако большинство (до 80%) случаев острой декомпенсации сердца является следствием ухудшения гемодинамики именно у больных с ХСН.
Таблица 2.30
Вероятные причины возникновения ОСН у больных без ХСН
| Острый ИМ |
| Гипертензивный криз |
| Тахикардия |
| Токсемия, прежде всего септическая |
| Острая аортальная или митральная недостаточность вследствие деструкции клапана при бактериальном эндокардите |
| Разрыв папиллярных мышц или межжелудочковой перегородки |
| Отрыв сhordaе tendinae |
| Острый диффузный миокардит |
Среди больных с острой декомпенсацией ХСН большинство составляют пациенты с систолической дисфункцией и дилатацией ЛЖ (по разным данным — от 72 до 87%). При этом до 25% таких больных имеют относительно сохраненную (>45%) ФВ ЛЖ.
Учет возможных факторов возникновения декомпенсации кровообращения у больных с ХСН (табл. 2.31) важен по крайней мере по двум причинам. Во-первых, это служит одной из предпосылок правильного ведения больного уже на начальном этапе лечения. Во-вторых, выявление таких факторов в каждом конкретном случае помогает сделать необходимые индивидуальные акценты в рекомендациях относительно дальнейшего амбулаторного ведения пациента перед будущей выпиской из стационара.
Таблица 2.31
Факторы, способствующие декомпенсации клинического состояния больных с ХСН
| ИМ, дестабилизация ИБС |
| Неконтролируемая АГ |
| Суправентрикулярная тахиаритмия, прежде всего фибрилляция предсердий |
| Стойкая желудочковая тахикардия |
| Вирусные инфекции, обострение ХОБЛ |
| Острая пневмония |
| ТЭЛА |
| Прогрессирующая почечная или печеночная недостаточность |
| Некомпенсированный сахарный диабет |
| Анемия |
| Дисфункция щитовидной железы |
| Период беременности |
| Злоупотребление алкоголем |
| Несоблюдение рекомендаций относительно применения лекарственных средств |
| Несоблюдение рекомендаций относительно питьевого режима, режима физической активности |
| Неадекватно назначенная поддерживающая терапия |
| Ятрогения (например назначение лекарственного средства, применение которого противопоказано при ХСН, массивная инфузионная терапия по поводу сопутствующего заболевания без учета наличия у больного ХСН и т.п.) |
Актуальность проблемы лечения декомпенсированной ХСН определяется в первую очередь неутешительными данными соответствующей статистики. Смертность таких больных в течение 1 мес с момента госпитализации составляет 5–10%, возрастая в течение последующих 6 и 12 мес до 20 и 30–40% соответственно; 44% из них в течение 6 мес госпитализируются повторно, а 16% — не менее 2 раз.
Основными задачами лечения больных с декомпенсированной ХСН являются:
- Устранение соответствующих клинических симптомов, восстановление эуволемического состояния пациента.
- Восстановление удовлетворительных лабораторных показателей (нормализация активности печеночных ферментов, уровня билирубина, креатинина, снижение уровня МНУП).
- Инициация стратегии дальнейшего поддерживающего лечения, направленного на профилактику повторных госпитализаций и увеличение продолжительности жизни пациента.
Для улучшения насосной функции сердца и нормализации системной гемодинамики используют инфузионное и болюсное введение диуретиков (табл. 2.32), вазодилататоров и положительных инотропных средств, а также по показаниям — устройств для механического поддержания гемодинамики и хирургическую коррекцию причины СН. Показанием к кратковременному (не более нескольких суток, с дальнейшим переходом на пероральную форму) инфузионному применению сердечных гликозидов (дигоксин) является тяжелая декомпенсированная ХСН при наличии тахисистолической формы фибрилляции предсердий.
Таблица 2.32
Петлевые диуретики для внутривенного применения в лечении декомпенсированной ХСН
| Диуретик | Начальная доза, мг | Максимальная доза, мг | Инфузия |
| Фуросемид | 20–40 | 200 | 40 мг болюсно, затем 10–40 мг/ч |
| Торасемид | 10–20 | 100 | 20 мг болюсно, затем 5–20 мг/ч |
| Буметанид | 0,5–1,0 | 4 | 1 мг болюсно, затем 0,5–2,0 мг/ч |
Алгоритм применения вышеуказанных средств излагается в разделе руководства, посвященном ОСН.
После стабилизации гемодинамики переход на поддерживающую пероральную терапию в большинстве случаев возможен в течение 24–48 ч. В дальнейшем важным является: 1) инициирование приема нейрогуморальных антагонистов, направленного на снижение риска смерти и повторных госпитализаций (начало титрования ингибиторов АПФ, а со временем блокаторов β-адренорецепторов); 2) информирование больного относительно его поведения и самоконтроля (диета, питьевой режим, определение массы тела, значение и режим постоянного применения лекарственных средств).
Если больной ранее не получал нейрогуморальных антагонистов, возможность начала титрования ингибиторов АПФ может быть рассмотрена после начальной стабилизации гемодинамического состояния, начиная с 48 ч от момента начала активного лечения. Инициация терапии блокаторами β-адренорецепторов осуществляется на дальнейшем этапе стационарного лечения, исходя из требования достижения эуволемического состояния.
ЛЕЧЕНИЕ ПАЦИЕНТОВ С БЕССИМПТОМНОЙ СИСТОЛИЧЕСКОЙ ДИСФУНКЦИЕЙ ЛЖ
В эту клиническую группу входят больные, у которых по данным инструментального исследования выявлено уменьшение величины ФВ ЛЖ, но которые не обращаются к врачу по поводу типичных для СН жалоб, не имеют явных объективных признаков застойной СН и не получают лечения по поводу ХСН.
Хотя в разных эпидемиологических исследованиях использовали различные критерии систолической дисфункции ЛЖ, распространенным ее эхоКГ-критерием является величина ФВ ЛЖ <40%. Распространенность установленной по данному критерию бессимптомной дисфункции (БСД) ЛЖ в популяции взрослых колеблется, по данным разных исследований, от 0,9 до 3,4%, что является сопоставимым с распространенностью клинически выраженной ХСН. Распространенность БСД ЛЖ значительно выше среди мужчин (в 2–4 раза по сравнению с женщинами), среди лиц пожилого возраста и у пациентов с ранее установленным диагнозом ИБС (4–8,5%).
При проспективном наблюдении ежегодно регистрируют появление клинически выраженной СН у 5–20% пациентов с БСД ЛЖ; ежегодно умирают 5,1–10,5% лиц с БСД ЛЖ. Указанный уровень смертности занимает промежуточное место между уровнями смертности, регистрирующимися у пациентов, перенесших ИМ с сохраненной ФВ ЛЖ, и у больных с клинически манифестированной систолической дисфункцией ЛЖ.
Скрининговые исследования уровней циркулирующего МНУП или его N-концевого фрагмента в определенных когортах пациентов с сердечно-сосудистыми заболеваниями с повышенным риском развития БСД ЛЖ (после ИМ, с неконтролируемой АГ, сопутствующим сахарным диабетом и некоторые др.) представляются целесообразными с точки зрения отбора пациентов для дальнейшего эхоКГ-исследования.
Учитывая высокую вероятность трансформации БСД ЛЖ в клинически выраженную СН с ее значительно худшим прогнозом, приоритетной задачей является назначение пациентам с БСД ЛЖ лечения, способного уменьшить прогрессирование СН и предотвратить появление клинических симптомов ХСН.
Специально спланированные клинические исследования по данному вопросу с вовлечением достаточного количества пациентов на сегодня проведены только для одной группы препаратов, а именно ингибиторов АПФ. В известном многоцентровом исследовании SAVE (1992), в которое были включены пациенты с БСД ЛЖ после ИМ, длительный прием каптоприла ассоциировался с уменьшением количества госпитализаций по поводу клинически выраженной СН на 22%. Наиболее весомые результаты относительно влияния ингибиторов АПФ на клинический прогноз пациентов с БСД ЛЖ получены в исследованиях SОLVD Prevention (1992) и ретроспективном субисследовании Х-SOLVD (2003). В так называемое профилактическое исследование SОLVD (SОLVD Prevention) включили 4228 пациентов с БСД ЛЖ, половина из которых получала эналаприл в дозе 10 мг 2 раза в сутки (с предшествующим клиническим титрованием, начиная с начальной дозы 2,5 мг 2 раза в сутки), а другая половина — плацебо. Дальнейшее продолжительное (около 4 лет) наблюдение пациентов продемонстрировало выраженное (на 37%) и достоверное снижение риска развития СН у пациентов, которые принимали эналаприл, по сравнению с группой плацебо (рис. 2.18).
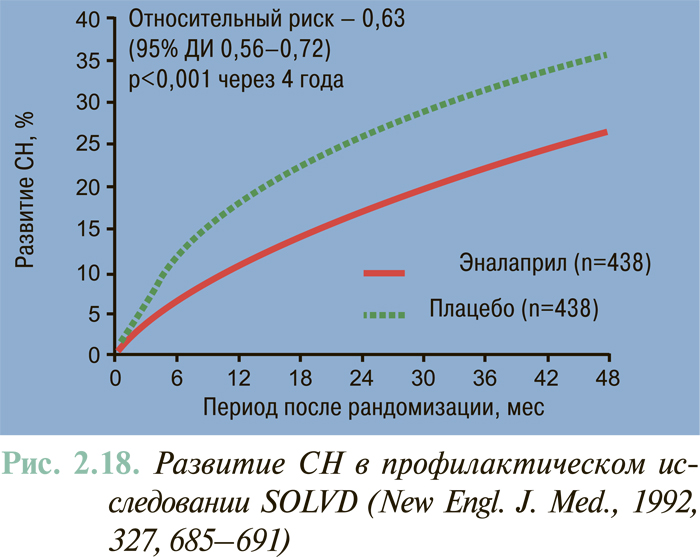
Кроме того, прием эналаприла по сравнению с плацебо сопровождался достоверно меньшей частотой развития нестабильной стенокардии и ИМ (соответственно на 14 и 24%).
В ретроспективном субисследовании Х-SOLVD прослежено влияние применения эналаприла в течение 4 лет на дальнейшую «клиническую судьбу» пациентов с учетом того, что после окончания исследования SOLVD больные группы плацебо были переведены на дальнейшее постоянное лечение данным препаратом. Наблюдение пациентов в течение последующих 8 лет (удалось проследить судьбу почти всех исследуемых) показало, что выживаемость больных, которые начали принимать эналаприл еще до появления клинических признаков СН, со временем начала повышаться по сравнению с больными, принимавшими плацебо, с соответствующим достоверным различием через 12 лет наблюдения (рис. 2.19).
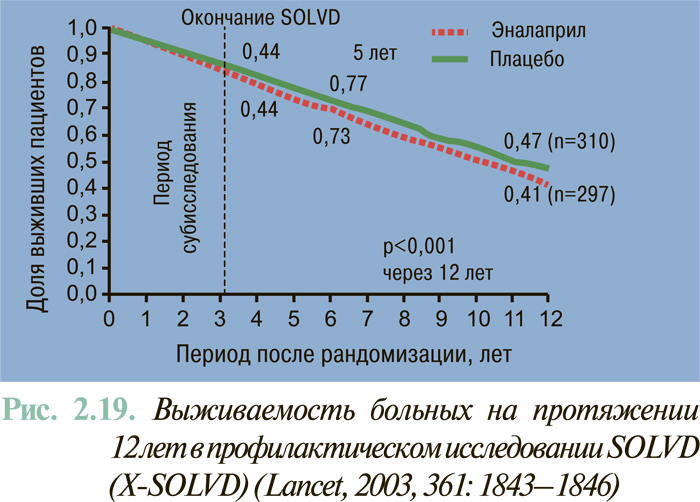
Указанная разница достигнута за счет показателя смертности от сердечно-сосудистых причин, поскольку смертность среди указанных больных от некардиальной патологии достоверно не отличалась. По расчетным данным (Х-SOLVD) раннее назначение эналаприла в исследовании SOLVD Prevention привело к росту средней продолжительности жизни на 9,2 мес.
Таким образом, назначение и постоянное применение ингибиторов АПФ (с формальных позиций доказательной медицины — именно эналаприла) является стандартом лечения пациентов с доклинической систолической дисфункцией ЛЖ.
Несмотря на отсутствие специально спланированных соответствующих исследований, есть основания предполагать, что применение блокаторов β-адренорецепторов дополнительно к базисной терапии ингибиторами АПФ у пациентов с БСД ЛЖ будет способствовать дальнейшему улучшению клинического прогноза таких больных, подобно тому, как это имеет место при комбинировании указанных средств у больных с клинически манифестированной ХСН. Весомым аргументом в пользу такой точки зрения являются результаты многоцентрового исследования САРRIСОRN (2001). Они показали, что включение больным с компенсированной гемодинамикой, но сниженной ФВ ЛЖ (<40%) в острый период ИМ в стандартную базисную терапию (включающую ингибитор АПФ), блокатора β-адренорецепторов карведилола и дальнейший длительный (в среднем 1,3 года) прием последнего ассоциировался с достоверным снижением общей смертности на 23%, нефатального ИМ — на 41% по сравнению с группой больных, которые вместо карведилола получали плацебо. В действующих Европейских рекомендациях по лечению ХСН предусмотрено комбинирование ингибиторов АПФ и блокаторов β-адренорецепторов как стандартный подход у пациентов с БСД ЛЖ, перенесших ИМ.
ЛЕЧЕНИЕ БОЛЬНЫХ С ХСН И СОХРАНЕННОЙ СИСТОЛИЧЕСКОЙ ФУНКЦИЕЙ ЛЖ
С учетом возможности и характера лечения указанный клинический контингент можно разделить на две основные группы. К первой из них принадлежат пациенты, у которых существует принципиальная возможность устранения симптомов СН путем хирургической коррекции ее причины (клапанные пороки сердца, констриктивный перикардит, предсердная миксома, брадисистолии, нуждающиеся в имплантации электрокардиостимулятора). Вторая, более многочисленная группа представлена пациентами с клинически манифестированной ХСН разного нозологического происхождения с нормальной (>50%) или субнормальной (45–50%) ФВ ЛЖ, у которых невозможно проведение хирургической коррекции, и основной лечебной стратегией является медикаментозное лечение (табл. 2.33). Как отмечалось выше, у большинства таких больных ведущую роль в происхождении симптомов СН играет диастолическая дисфункция ЛЖ (гипертензивное сердце, ишемия, ГКМП, тахисистолии). Отдельно выделяют изолированную правожелудочковую недостаточность, обусловленную легочной гипертензией различного происхождения.
Таблица 2.33
Медикаментозные средства и потенциальные механизмы их терапевтического действия у больных с диастолической ХСН
| Класс препаратов | Механизмы терапевтического влияния |
| Ингибиторы АПФ*
Антагонисты рецепторов ангиотензина II** |
Регресс гипертрофии и фиброза ЛЖ
Антигипертензивное действие Улучшение активной релаксации ЛЖ |
| Блокаторы β-адренорецепторов*** | Увеличение периода диастолического наполнения
Антиишемическое действие Антигипертензивное действие |
| Недигидропиридиновые антагонисты кальция (верапамил) | Улучшение активной релаксации ЛЖ
Антиишемическое действие Антигипертензивное действие |
| Диуретики | Устранение застойных явлений |
*Не показаны при ГКМП, рестриктивной КМП; **в многоцентровом исследовании СНАRМ (2003) кандесартан достоверно снижал по сравнению с плацебо частоту госпитализаций по поводу СН; ***не нуждаются в применении такой жесткой (медленной) схемы титрования, как больные с ХСН и систолической дисфункцией ЛЖ.
Поскольку данные доказательной медицины (то есть специально спланированных завершенных плацебо-контролируемых многоцентровых исследований) относительно положительного влияния современных медикаментозных средств на клинический прогноз диастолической/преимущественно диастолической ХСН крайне ограничены, современные рекомендации по лечению таких больных базируются на патофизиологических предпосылках и результатах ограниченных исследований клинической фармакодинамики соответствующих медикаментозных средств.
1. Контроль АД на целевом уровне. Его важность мотивируется такими положениями:
а) большинство случаев диастолической ХСН связаны с наличием АГ;
б) само по себе повышение АД является фактором снижения активной релаксации ЛЖ;
в) ГЛЖ, обусловленная его перегрузкой сопротивлением, ассоциируется с нарушением его пассивно-эластических свойств и, соответственно, диастолической податливости;
г) у пациентов с АГ нормализация АД является одной из предпосылок к регрессии ГЛЖ;
д) адекватная антигипертензивная терапия приводит к значительному (по данным метаанализа 2006 г. — на 52%) снижению частоты возникновения клинически выраженной ХСН.
2. Поддержание нормальной ЧСС с целью улучшения диастолического наполнения желудочков (адекватный контроль ЧСС при постоянной форме фибрилляции предсердий или устранение синусовой тахикардии).
3. Восстановление синусового ритма у больных с фибрилляцией предсердий с целью повышения сердечного выброса за счет восстановления предсердной составляющей диастолического наполнения ЛЖ.
4. Устранение (предотвращение) ишемии миокарда с помощью медикаментозной терапии или путем хирургической реваскуляризации ЛЖ.
5. Контроль волемического состояния пациентов с помощью диуретиков. У больных с диастолической ХСН это требует определенной осторожности, поскольку в условиях форсированного диуреза дальнейшее уменьшение диастолического наполнения желудочков обусловливает снижение сердечного выброса и, соответственно, системного АД (прежде всего — у больных с рестриктивными поражениями миокарда и ГКМП).
При наличии объективизированных инструментальными методами нарушений релаксации ЛЖ не показано применение сердечных гликозидов в связи с возможностью усугубления указанных нарушений вследствие способности этого класса средств повышать концентрацию свободного внутриклеточного Са2+.
6. Применение нейрогуморальных антагонистов (ингибиторов АПФ, блокаторов β-адренорецепторов, антагонистов рецепторов ангиотензина II), в том числе в комбинации.
7. Применение верапамила с целью нормализации ЧСС в случаях непереносимости блокаторов β-адренорецепторов.
Терапия больных с декомпенсированным легочным сердцем представляет отдельную междисциплинарную проблему, освещение которой выходит за пределы этого издания. Современные подходы к лечению таких пациентов предусматривают применение диуретиков, оксигенотерапии, вазодилататоров (дифференцированно), ингаляционного оксида азота, вазодилататорных простагландинов, антагонистов рецепторов эндотелина-1.
ОСОБЕННОСТИ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ХСН У БОЛЬНЫХ СТАРЧЕСКОГО ВОЗРАСТА
По результатам последних исследований — европейского IMPROVEMENT-HF (данные из 15 стран) и российского эпидемиологического ЭПОХА-О-ХСН, средний возраст больных с клинически манифестированной ХСН составляет 70 и 69 лет соответственно. Таким образом, приблизительно половина пациентов с ХСН — старше 70 лет. Указанный клинический контингент является более проблемным для клиницистов, о чем свидетельствует худшая выживаемость таких пациентов и более высокие показатели частоты и продолжительности их госпитализаций по сравнению с больными более младшего возраста. На долю лиц в возрасте старше 70 лет приходится приблизительно ⅔ всех койко-дней по поводу ХСН. Данная ситуация в определенной мере связана с недооценкой многими врачами особенностей патогенетических механизмов, диагностики и лечения ХСН в старческом возрасте.
Особенности ХСН в возрасте старше 70 лет определяются тремя кардинальными факторами, к которым относятся: 1) присущие старению специфические физиологические изменения сердечно-сосудистой системы; 2) характерные для пожилого возраста физиологические изменения других органов и систем; 3) присущие старческому возрасту сопутствующие заболевания и нарушения.
По данным C.T. Lien и соавторов (2002) частота сопутствующей патологии в когорте лиц в возрасте 65–98 лет распределилась таким образом: заболевания опорно-двигательного аппарата с болевым синдромом — 41%, психоэмоциональные нарушения (бессонница, депрессия, возбуждение) — 39%, когнитивные нарушения7 — 35–38% (по разным шкалам оценки), бронхолегочные заболевания — 30%, недержание мочи — 29%, цереброваскулярная патология — 26%, гипотиреоз — 22%, железодефицитная анемия — 14%, сахарный диабет — 10%. Высокий удельный вес сопутствующей патологии в значительной степени определяет особенности лечения и диагностики у пациентов с ХСН старческого возраста.
Диагностическая чувствительность таких субъективных признаков СН, как пароксизмальная ночная одышка и ортопноэ (14 и 38% соответственно), у больных старческого возраста ниже, чем в общей популяции пациентов с ХСН. Причинами этого являются наличие у многих из таких лиц когнитивных нарушений, а также маскирование указанных симптомов снотворными средствами, нередко принимаемых людьми старческого возраста в связи с бессонницей. У этих пациентов с ХСН также отмечают более низкую (38%) специфичность такого диагностического признака, как одышка, поскольку последняя может возникать и при бронхолегочной патологии и анемии, более часто (см. выше) выявляемых у пациентов указанной возрастной категории.
С когнитивными нарушениями связывают и тот факт, что в 14% случаев наличие у лиц старческого возраста объективных клинических признаков застойной СН не сопровождается субъективными жалобами. Лишь ¼ таких пациентов поступает в стационар по поводу жалоб, типичных для ХСН, но вместе с тем около половины из них госпитализируются по другим мотивам (неврологические нарушения, падения с травмированием, болезни опорно-двигательного аппарата, пневмония и т.п.). Учитывая эти данные, следует подчеркнуть необходимость консультирования врачом-интернистом практически всех лиц старческого возраста, госпитализуемых в стационар любого профиля. С другой стороны, по этим же причинам у больных старческого возраста повышается роль эхоКГ-исследования как ключевого звена объективизации диагноза ХСН.
Возрастные изменения сердечно-сосудистой системы во многом предопределяют особенности ХСН в старческом возрасте.
По мере старения через механизм апоптоза постепенно уменьшается количество кардиомиоцитов — приблизительно на 35% между 30 и 70 годами. Вместе с тем компенсаторно увеличивается масса каждого кардиомиоцита, в результате чего общий объем этих клеток не изменяется. Не претерпевает существенных изменений и общая масса соединительной ткани в миокарде, но происходит определенная ее качественная трансформация, заключающаяся в повышении содержания коллагена. В результате индекс массы миокарда у людей старческого возраста без АГ остается без существенных изменений. У людей в возрасте старше 75–80 лет в миокарде начинают выявляться амилоидные включения. ЛЖ у людей старческого возраста в норме приобретает черты концентрического ремоделирования (уменьшение объема полости и увеличение толщины стенки без существенного роста массы), что связывают с пропорциональным возрасту повышением постнагрузки на сердце вследствие возрастных изменений (снижение эластичности) периферических артерий. На молекулярном уровне наблюдается, в первую очередь, снижение активности одного из ключевых ионных насосов — Са2+-АТФазы саркоплазматического ретикулума, который, как известно, контролирует возврат ионов Са2+ в саркоплазматический ретикулум во время релаксации сердечной мышцы. Снижение синтеза в миокарде протеина Са2+-АТФазы саркоплазматического ретикулума, очевидно, является адаптационным механизмом, направленным на энергосбережение. Однако отрицательными последствиями снижения активности указанного насоса являются перегрузка ионами Са2+ цитозоля кардиомиоцита и замедление активного расслабления желудочков.
Основные показатели систолической и насосной функции сердца — ФВ ЛЖ, УОК и МОК в процессе нормального старения в состоянии покоя существенно не изменяются. В то же время вследствие упоминавшихся выше возрастных изменений миокарда на структурном и молекулярном уровнях пропорционально возрасту происходит ухудшение как активного, так и пассивного расслабления ЛЖ. Особенно страдает активная релаксация последнего, о чем свидетельствует снижение приблизительно на 50% скорости раннего наполнения ЛЖ в 70-летнем возрасте по сравнению с 30-летним, что сопровождается соответствующей реверсией (<1) соотношения Е/А.
Старение также сопровождается пропорциональным возрасту снижением толерантности к физической нагрузке, что обусловлено: 1) ограничением хроно- и инотропного резервов сердца вследствие снижения чувствительности миокардиальных β-адренорецепторов; 2) энергодефицитом миокарда, обусловленным повышением конечно-систолического миокардиального стресса (вследствие повышенного артериального сопротивления) и, возможно, относительной коронарной недостаточностью вследствие уменьшения в миокарде количества капилляров (пропорционально возрасту); 3) невозможностью полноценной реализации механизма Франка — Старлинга вследствие: а) указанного выше энергодефицита кардиомиоцитов и б) ограничения диастолической способности ЛЖ к наполнению.
Указанные выше возрастные изменения обусловливают, с одной стороны, более высокую распространеннось ХСН среди людей пожилого и старческого возраста, с другой — существенное повышение роли диастолической дисфункции в генезе СН у таких больных. Так, сохраненная систолическая функция ЛЖ отмечена в 14,5% всех случаев клинически явной ХСН среди лиц в возрасте младше 65 лет, в 32,6% случаев — среди лиц 66–75 лет и в 49,6% случаев — среди пациентов старше 75 лет. По данным других авторов, диастолическая ХСН наблюдается приблизительно у 50% пациентов старческого возраста, причем в возрасте старше 80 лет сохраненную систолическую функцию ЛЖ отмечают в 70% всех случаев ХСН.
Характерной особенностью ХСН в старческом возрасте является увеличение количества больных с постоянной формой фибрилляции предсердий, что определяется существенной ролью дистолических нарушений в данной когорте пациентов (рис. 2.20).
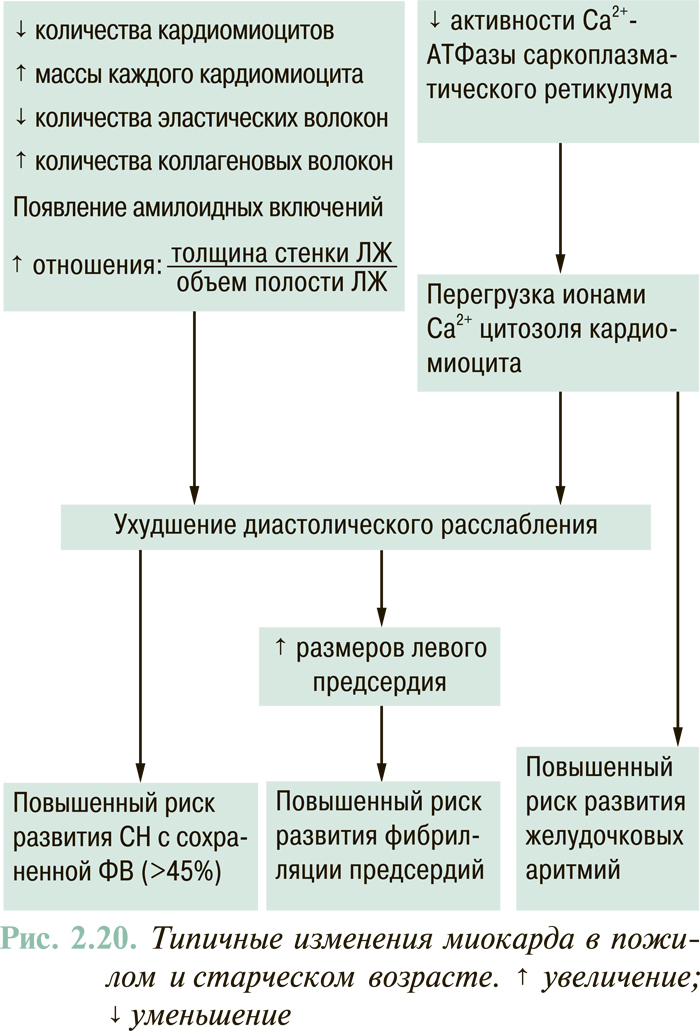
Одним из ключевых звеньев патогенеза ХСН является эндотелиальная дисфункция. Как уже указывалось выше, причинами угнетения при ХСН синтеза эндотелиоцитами оксида азота (NO) является замедление системного кровотока, оксидантный стресс, действие повышенных концентраций ангиотензина II и противовоспалительных цитокинов. Отрицательными для течения ХСН следствиями дисфункции эндотелия является ограничение контррегуляторного вазодилататорного ответа, активация системного иммунного воспаления, повышение риска внутрисосудистого тромбоза. В последнее время показано, что при ХСН большая степень эндотелиальной дисфункции ассоциируется с меньшей продолжительностью жизни больных. Значение эндотелиальной дисфункции у пациентов с ХСН старческого возраста является особо актуальным с учетом, с одной стороны, пропорционального возрасту ухудшения NO-продуцирующей функции эндотелия и физиологической роли оксида азота в обеспечении активного расслабления ЛЖ — с другой.
Как известно, действующий стандарт фармакологического лечения ХСН предусматривает применение прежде всего диуретиков, ингибиторов АПФ, блокаторов β-адренорецепторов, а также (по показаниям) антагонистов рецепторов ангиотензина II, дигоксина и антагонистов альдостерона.
Диуретики. С применением мочегонных средств у лиц старческого возраста могут быть связаны следующие клинические проблемы.
- Меньшая действенность тиазидных диуретиков. Последние являются неэффективными при скорости клубочковой фильтрации <30 мл/мин. Поэтому, с учетом пропорционального возрасту физиологического снижения скорости клубочковой фильтрации, целесообразность применения тиазидных диуретиков при ХСН в пожилом и старческом возрасте в качестве монотерапии является сомнительной.
- Более существенный, чем у больных более молодого возраста, риск развития гипотензии и азотемии на фоне активного диуреза, вызванного применением петлевых диуретиков. В связи с этим рекомендуется не начинать лечение у пациентов указанной возрастной группы с высоких доз диуретиков и тщательно контролировать уровень АД и креатинина плазмы крови.
- Недержание мочи у ⅓ больных старческого возраста. Это предусматривает возможность катетеризации мочевого пузыря на период наиболее активной диуретической терапии у таких пациентов.
- Возможность наличия у мужчин старческого возраста выраженной гипертрофии предстательной железы, в том числе ранее не диагностированной, в связи с чем таким пациентам показана консультация уролога и при необходимости — осуществление временной катетеризации мочевого пузыря на период активного диуреза.
Ингибиторы АПФ. Данные метаанализа 5 наибольших многоцентровых исследований эффективности ингибиторов АПФ при ХСН и постинфарктной систолической дисфункции ЛЖ свидетельствуют, что их редуцирующее влияние на риск смерти, реинфаркта и повторных госпитализаций не зависит от возраста пациентов. В то же время с возрастом растет достоверность возникновения таких сопряженных с приемом ингибиторов АПФ осложнений, как ортостатическая гипотензия, азотемия и гиперкалиемия. Субанализ многоцентрового исследования ATLAS (1999) показал, что на фоне применения лизиноприла больными в возрасте старше 70 лет гипотензия развивается приблизительно в 1,5 раза чаще, а азотемия и гиперкалиемия в 2 раза чаще, чем у лечившихся аналогичными дозами лизиноприла пациентов в возрасте младше 70 лет.
Приведенные данные свидетельствуют о необходимости особенно тщательного контроля АД и соответствующих лабораторных показателей у больных старческого возраста во время титрования дозы ингибиторов АПФ.
Целевых доз ингибиторов АПФ у больных с ХСН пожилого возраста удается достичь реже, чем у пациентов более молодого возраста. Однако неизвестно, можно ли официально рекомендованные целевые дозы ингибиторов АПФ рассматривать как оптимальные для пациентов данной возрастной категории — ведь указанные рекомендации базируются на данных тех многоцентровых исследований (SOLVD Treatment, VeFT II, ATLAS), средний возраст участников которых был существенно ниже, колеблясь между 61 и 64 годами.
Дигоксин. В ранее цитировавшемся мультицентровом исследовании DIG способность дигоксина снижать частоту госпитализаций по поводу декомпенсации кровообращения не зависела от возраста пациентов, однако по мере увеличения возраста повышался риск дигиталис-ной интоксикации. Последнее обстоятельство связывают с пропорциональным возрасту физиологическим снижением почечной клубочковой фильтрации, что обусловливает замедление элиминации дигоксина. Именно поэтому согласно рекомендациям Европейского общества кардиологов поддерживающая доза дигоксина у больных пожилого и старческого возраста должна составлять ¼–½ обычной для пациентов молодого и зрелого возраста, а именно 0,0625–0,125 мг/сут.
Блокаторы β-адренорецепторов. Рекомендации относительно применения блокаторов β-адренорецепторов у больных старческого возраста аналогичны таковым для всей популяции больных с ХСН. Субанализ многоцентровых исследований бизопролола (CIBIS-II), метопролола CR/XL (MERIT-HF) и карведилола (COPERNICUS) свидетельствует о сопоставимости прогноз-модулирущего влияния указанных блокаторов β-адренорецепторов в подгруппах пациентов с ХСН старческого возраста и более молодых возрастных категорий. Исследование SENIORS (2004) дало возможность дополнить рекомендации по лечению больных с ХСН в возрасте старше 70 лет еще одним блокатором β-адренорецепторов — небивололом, характеризующимся высоким профилем клинической переносимости, что связано с наибольшей, по сравнению с другими блокаторами β-адренорецепторов, β1-селективностью данного препарата.
Учитывая нередко сниженную комплаентность, значительную вероятность возникновения или обострения сопутствующей внутренней патологии и повышенный риск побочных эффектов лекарственной терапии, больные с ХСН старческого возраста нуждаются в тщательном диспансерном наблюдении. Последнее предусматривает: а) по возможности более частые повторные осмотры; б) патронажные визиты медсестры; в) регулярное сотрудничество врача и родственников пациента. Внедренный в ряде западных стран подход к курации больных с ХСН старческого возраста в амбулаторных условиях предусматривает мониторирование их клинического состояния медсестрой на дому и активное регулярное посещение поликлиники, что позволяет улучшить качество жизни таких пациентов и снизить потребность в повторных госпитализациях. Сотрудничество близких родственников таких пациентов с врачом относительно контролирования признаков СН и регулярного приема лекарственных средств в домашних условиях является одним из ключевых моментов их успешной курации вне стационара.
1Существует обратная зависимость между активностью ренина плазмы крови, концентрацией циркулирующих ангиотензина II, альдостерона и эндотелина, с одной стороны, и продолжительностью жизни больных с ХСН — с другой.
2Концентрация норадреналина в плазме крови прямо коррелирует со степенью тяжести ХСН (ФК), риском смерти больных и обратно — с величиной ФВ ЛЖ.
3Энергозависимый генетически кодированный механизм «самоуничтожения» клетки, принципиально отличный от некроза.
4Уровень циркулирующего ФНО-α в плазме крови прямо коррелирует с клинической выраженностью ХСН и обратно — с продолжительностью жизни больного и его ИМТ. Наиболее высокий уровень ФНО-α выявляют у пациентов с кардиальной кахексией.
5Чувствительность — процент наличия определенного признака среди больных с несомненно подтвержденной ХСН.
6Специфичность — процент отсутствия определенного признака среди пациентов с несомненным отсутствием ХСН.
7Когнитивная функция — психическая способность индивидуума к усвоению и обработке информации.
ЛИТЕРАТУРА
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Даниелян М.О. (2003) Первые результаты национального эпидемиологического исследования — эпидемиологическое обследование больных ХСН в реальной практике (по обращаемости) — ЭПОХА-В-ХСН. Сердечная недостаточность. 4(3): 116-120.
- Воронков Л.Г. (2004) Хронічна серцева недостатність. Четверта хвиля, Київ, 198 с.
- Малая Л.Т., Горб Г.Ю., Рачинский И.Д.(1994) Хроническая недостаточность кровообращения. Здоров’я, Киев, 624 с.
- Стражеско Н.Д. (1955) Избранные труды. Проблемы патофизиологии кровообращения. Изд-во АН УССР, 400 с.
- Яновский Г.В., Устименко Э.В., Семененко О.И., Воронков Л.Г. (2004) Факторы, определяющие выживаемость больных с хронической сердечной недостаточностью. Укр. кардіол. журн., 3: 21-25.
- ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult / Abraham W.T., Chin M.H., Feldman A.M. et al. 2005, American College of Cardiology Foundation and the American Heart Association. 82 p.
- AIRE: The Acute Infarction Ramipril Efficacy (AIRE) study Investigators. Effect of ramipril on mortality and morbidity of survivors in acute myocardial infarction with clinical evidence of heart failure (1993) Lancet, 42: 821-828.
- Amiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomized trials (1997) Lancet, 350: 1417-1424.
- Angeja B., Grossman W. (2003) Evaluation and management of diastolic heart failure. Circulation, 107: 659-663.
- Bardy G.H., Lee K.L., Mark D.B. et al. (2005) Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N. Engl. J. Med., 352: 225-237.
- Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively — designed overviews of randomised trials (2003) Lancet, 362: 1527-1535.
- BristowM.R., Saxon L.A., Boehmer J. et al. (2004) Cardiac-resynchronization therapy an implantable defibrillator with or without in advanced chronic heart failure. New Engl. Med. J., 350: 2140-2150.
- CIBIS-II Investigators and Committees. The cardiac insuffiency bisoprolol Study II (CIBIS-II) : a randomized trial (1999) Lancet, 353: 9-13.
- Cleland J.G.F., Pennel D.J., Ray S.G. et al. (2003) On behalf of the CHRISTMAS (Carvedilol Hibernation Reversible Ischaemia Trial: Marker of Success) investigators. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS) trial): randomized controlled trial. Lancet, 362: 1421.
- Cleland J.G.F., Doubert J.C., Freemantle N. et al. (2005) Cardiac Resynchronization-Heart Failure (CARE-HF) Study investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N. Engl. J. Med., 352: 1539-1549.
- Cohn. J.N., Levine B., Olivari M.T. et al. (1984) Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N. Engl. J. Med., 311: 819-823.
- Cohn J.W., Ferrari R., Sharpe N. (2000) Cardiac remodeling — concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. On behalf of the International Forum of Cardiac Remodeling. J. Amer. Coll. Cardiol., 35: 569-582.
- Cohn J.W., Tognoni G. (2001) A randomized trial of the angiotensin receptor blocker valsartan in chronic heart failure. New Engl. J. Med., 345: 1667-1675.
- Cowburn R.L, Cleland J.G.F. , Coats L.J.S., Komajda M. (1998) Risk stratification in chronic heart failure. Eur. Heart J., 19: 696-710.
- Cowie M.R., Wood D.A., Coats A.J. (1999) Incidence and aetiology of heart failure: a population — based study. Eur. Heart J., 20: 412-428.
- Cowie M.R., Jourdain P., Maisel A. et al. (2003) Clinical applications of B-type natriuretic peptide (BNP) testing. Eur. Heart J., 24: 1710-1718.
- Dagenais G., Pogue J., Fox K. et al. (2006) Angiotensin-converting-enzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure a combined analysis of three trials. Lancet, 368: 581-588.
- Eur. Study Group on Diastolic Heart Failure How to diagnose diastolic heart failure (1998) Eur. Heart J., 19: 990-1003.
- Faris R., Flather M., Purcell H. et al. (2002) Current evidence supporting the role of diuretics in heart failure : a meta analysis of randomized controlled trials. Int. J. Cardiol., 82: 149-158.
- Flather M.D., Jusuf S., Kober L. et al. (2000) Long-term ACE- inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE— Inhibitor Myocardial Infarction Collaborative Group. Lancet, 35: 1575-1581.
- Flather M.D., Shibata M.C., Coats A.J.S. et al. (2005) Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). European Heart J., 26: 215-225.
- Granger C.B., Me Murray J.J.V., Yusuf S. et al. (2003) Effect of candesartan in patients with chronic heart failure and reduced left ventricular systolic function and intolerant to ACE inhibitors: the CHARM — Alternative Trial. Lancet, 362: 772-777.
- Heart Failure. Contemporary Diagnosis and Management / B.H. Greenberg, D.D. Hermann (Eds) (2003) Handbook in Health Care Co., Pennsylvania, 312 p.
- Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting enzyme inhibitor, ramipril, on death from cardiovascular causes, myocardial infarction, and stroke in high risk patients (2000) New Engl. J. Med., 324: 145-153.
- Heart Failure / Mann D.L. (Ed.) (2004) Philadelphia, 812 p.
- Jong P., Yusuf S., Rousseau M.F. et al. (2003) Effect of enalapril on 12-year survival life expectancy in patients with left ventricular systolic dysfunction: a follow-up study. Lancet, 361: 1843-1846.
- Katz A.M. (2000) Heart Failure. Patohphysiology, Molecular Biology and Clinical Management. Lippincott Williams and Wilkins, Philadelphia, 381 p.
- Levy D., Larson M.G., Vasan R.S. et al. (1996) The progression from hypertension to congestive heart failure. JAMA, 275: 1557-1562.
- Me Murray J.J V., Kendall M.J. (2002) Beta-blockers in Heart Failure. Martin Dunitz, London, 108 p.
- Me Murray J.J.V, Ostergren J., Swedberg K. et al. (2003) Effects of candesartan in patients with chronic heart failure and reduced left ventricular systolic function treated with ACE inhibitor: the CHARM — Added Trial. Lancet, 362: 767-771.
- MERIT-HF Study Group (1999) Effect of metoprolol CR/XL in chronic heart failure. Metoprolol CR/XR Randomized Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet, 353: 2001-2007.
- Nieminen M.S. et al.(2005) Execute summary of the guidelines on the diagnosis and treatment of acute heart failure The Task Force on Acute Heart Failure of the European Society of Cardiology. Eur. Heart J., 26: 384-416.
- Packer M., Bristow M.R., Cohn J.N. et al. (1996) The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. New Engl. J. Med., 334: 1349-1355.
- Packer M., Coats A.J.S., Fowler M.B. et al. (2001) For the Carvedilol Prospective Randomise Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. New Engl. J. Med., 344: 1651-1658.
- Pitt B., Zannad F., Remme W. J. et al. (1999) The effect of spironolactone on mortality in patients wirh severe heart failure / Randomized Aldactone Evaluation Study Investigators. New Engl. J. Med., 341: 709-717.
- Pitt B., Poole-Wilson P.A., Segal R. et al. (2000) On behalf of the ELITE II Investigators. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial — the Losartan Heart Failure Survival Study ELITE II. Lancet, 355: 1582-1587.
- Pitt В., Remme W., Zannad F. et al. (1999) Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. New Engl. J. Med., 348: 1309-1321.
- Pfeffer M.A., Braunwald E., Meye L.A. et al. (1992) Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. New Engl. J. Med., 327: 669-677.
- Rose E.A., Gellijns A.C., Moskowitz A.J. (2001) Long-term use of a left ventricular assist device for end-stage heart failure. New Engl. J. Med.., 345: 1435-1443.
- Rostagno C, Galanti G., Comeglio M. et al. (2000) Comparison of different methods of functional evaluation patients with heart failure. Eur. J. Heart Failure, 2: 273-280.
- Stewart S. Mac Intyre K., Hole D.Y. (2001) More malignant than cancer? Five — year survival for heart failure. Eur. J. Heart Failure, 3: 315-322.
- Swedberg K., Eneroth P., Kjekshus J., Wilhelms J. (1990) Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. Circulation, 82: 1730-1736.
- Swedberg K., Cleland J., Dargie H. et al. (2005) Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (Update 2005). Europ. Heart J., 26:1115-1140.
- The Digitalis Investigation Group (1997) The effect of digoxin on mortality and morbidity in patients with heart failure. New Engl. J. Med., 336: 525-533.
- The European Trial on Reduction of Cardiac Events with Perindopril in Stable Coronary Artery Disease Investigators (2003) Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet, 362: 782-788.
- TRACE: Torp-Petersen C., Kober L., Carlsen J. (1996) Angiotensin-converting enzyme inhibition after myocardial infarction: the Trandolapril Cardiac Evaluation Study. Amer. Heart J., 132: 235-243.
- Wang T.J. Levy D., Benjamin E.J., VasanR.S. (2003) The epidemiology of «asymptomatic» left ventricular systolic dysfunction, implications for screening. Ann. Intern., 138: 907-916.