Общие принципы лечения гипердислипидемии
Современная стратегия лечения гипердислипидемии исходит из представлений о необходимости внедрения наиболее раннего, мощного и иногда агрессивного подхода к проведению гиполипидемических мероприятий с целью минимизации риска возникновения кардиоваскулярных и метаболических событий (Rader D.J., Daugherty A., 2008; Steinberg D. et al., 2008). Поскольку гиперлипидемии представляют собой гетерогенную группу нарушений липидного обмена, то индивидуализация гиполипидемических мероприятий является залогом их успешности. При этом рекомендации большинства медицинских ассоциаций, имеющих наиболее высокий уровень репутации, склонны предлагать медицинскому сообществу именно индивидуализированные протоколы профилактики и лечения гиперлипидемий в зависимости от величины исходного кардиоваскулярного риска у конкретного пациента. Исходя из допущения о том, что индивидуальный кардиоваскулярный риск очень близок к риску, рассчитанному на основании популяционных критериев, до начала любого вмешательства требуется уточнить его величину. В рутинной клинической практике последняя оценивается по системе Framingham или SCORE. В обоих случаях кардиоваскулярный риск рассчитывается по формуле:
| КВР = | 10-летний риск фатального или нефатального инсульта, включая ТИА | + | 10-летний риск фатального и нефатального инфаркта миокарда |
где КВР — кардиоваскулярный риск, ТИА — транзиторная ишемическая атака.
Тем не менее, существуют определенные принципы, следование которым должно обеспечить достижение основных целей терапии в максимально возможных случаях. Фактически существуют три основных направления в лечении гиперлипидемий: модификация образа жизни, в которой первостепенное место занимают расширение физической активности, отказ от вредных привычек (уменьшение употребления алкоголя, прекращение курения) и гиполипидемическая диета; медикаментозное лечение (в том числе и сопутствующих кардиоваскулярных заболеваний, сахарного диабета и ожирения) и инвазивные методы (гравитационная хирургия крови, аферез, шунтирующие операционные процедуры). Кроме того, в стадии разработки находятся методы лечения гиперлипидемии, основанные на внедрении с помощью векторной РНК части генома, обеспечивающей ресинтез рецепторов к ЛПНП, что, как полагают, позволит преодолеть рефрактерность к терапии и снизить вероятность использования инвазивных методов лечения.
Гиполипидемическая диета
Лечение при гиперлипидемии должно быть основано на обязательном применении диеты, основными принципами которой являются: уменьшение массы тела при ее избытке; расширение потребления овощей и фруктов, а также редукция общей калорийности пищи. Последнее обеспечивается за счет сбалансированного приема пищевых продуктов, содержащих 55% углеводов, 10–15% белка и до 30% жиров, включая по 10% насыщенных, мононенасыщенных жирных кислот и ПНЖК, ХС <300 мг/день и 35 мг/день клетчатки, получаемой в основном в виде бобовых. Традиционно принято считать, что в том случае, когда указанные мероприятия рассматриваются как не- или малоэффективные (потеря массы тела <4–5 кг в течение 8 нед), то потребление жира необходимо снизить до 20–25%, а ХС — до 150 мг/день и меньше (Gardner C.D. et al., 2007).
В табл. 9.1 приведены рекомендации Европейского общества кардиологов, касающиеся категорий продуктов, рекомендованных для ежедневного употребления при проведении гиполипидемических мероприятий.
Таблица 9.1 Диетические рекомендации Европейского общества кардиологов
| Категория продуктов | Продукты | ||
| Рекомендуемые | Употребление которых необходимо ограничить | Употребление которых нежелательно | |
| Злаки | Хлеб грубого помола, овсяная каша, хлопья различных злаков, макаронные изделия из цельных зерен и коричневый рис | Макаронные изделия из белой муки, белый рис | Круассан, булочки бриошь |
| Молочные продукты | Обезжиренные молоко, йогурт, творог | Частично обезжиренные молоко, творог, обезжиренный или нежирный сыр, нежирный йогурт | Цельное молоко, сгущенное молоко, сливки, искусственное молоко, жирный сыр, жирный йогурт |
| Супы | Овощные, консоме | Все остальные | Супы с большим содержанием жира, крем-супы |
| Рыба | Вареная, копченая, жареная рыба без кожи | Жареная рыба на рекомендуемом масле | Икра, жареная рыба на неизвестном масле или жире |
| Морепродукты | Устрицы, гребешки | Мидии, омары, креветки, кальмары | – |
| Мясо и другие продукты | Индейка, курица, телятина, дичь, свинина, кролик, молодая баранина. Один-два раза в неделю — постная говядина, ветчина, свинина. Белок яйца | Гуси, утки, любое мясо с видимым включением жира, сосиски, салями, паштеты. Два яйца в неделю | – |
| Жиры | Подсолнечное масло, кукурузное, оливковое, рапсовое, виноградных косточек. Мягкие сорта маргарина, содержащие повышенное количество моно- и ПНЖК | – | Сливочное масло, шпиг, сало, топленый жир, твердые маргарины |
| Фрукты и овощи | Овощи, а также бобовые: свежие и высушенные бобы, фасоль, чечевица, сладкая кукуруза, вареный картофель | Жареный картофель, картофель-фри, приготовленные с применением рекомендуемых жиров | Жареный картофель, картофель-фри, овощи или рис, приготовленные на нерекомендуемом или неизвестном масле/жире, чипсы, соления |
| Десерты | Фруктовое мороженое, желе, пудинги на «снятом» молоке, фруктовые салаты, «гоголь-моголь» | – | Сливочное мороженое, пудинги, пирожки, приготовленные со сливочным маслом или сливками |
| Выпечка | – | Песочные и бисквитные пирожные, приготовленные на ненасыщенных маргаринах и жирах | Коммерческие песочные пирожные, бисквиты, пироги, пудинги и т.п. |
| Кондитерские изделия | Лукум, нуга, карамельные конфеты | Марципан, халва | Шоколад, ирис, сливочная помадка |
| Орехи | Грецкие орехи, каштан, миндаль | Кешью, арахис, фисташки | Кокосовый орех, соленые орехи |
| Напитки | Чай, фильтрованый или растворимый кофе, низкокалорийные безалкогольные напитки | Алкогольные напитки, нежирные напитки из какао | Шоколадные напитки, солодовые напитки, сваренный кофе, безалкогольные напитки |
| Приправы | Перец, горчица, пряные травы, специи | Салатные соусы с низким содержанием жира | Добавление соли, салатных соусов, майонеза и др. |
Рекомендации пациентам должны содержать простые и понятные сведения о рациональном характере питания, позволяющем редуцировать исходный кардиоваскулярный риск. В то же время, не следует рассматривать гиполипидемическую диету как чрезвычайно действенный способ в достижении рекомендованного уровня липидов в плазме крови, особенно у пациентов очень высокого риска, с сопутствующими метаболическими нарушениями (см. далее, глава 9). Так, при проведении программ возникновения кардиоваскулярных событий установлено, что диета с ограничением жиров (как насыщенных, так и не насыщенных) дает очень скромные клинические результаты. Аналогичную эффективность демонстрирует подход, направленный на обогащение пищевого рациона свежими фруктами и овощами. Кроме того, не получено доказательств эффективности изменения потребления клетчатки, волокон, кальция, натрия или рыбы. Вместе с тем, влияние одновременно ≥3 хорошо доказанных советов по диете оказались более эффективными, чем рекомендации, содержащие меньшее количество советов.
Без сомнения, диетические ограничения должны присутствовать как компонент во всех рекомендациях врача, касающихся модификации образа жизни, но они не должны подменять собой иные способы лечения.
Повышение физической активности
Повышение физической активности относится к наиболее понятным и редко выполняемым рекомендациям врача. Многие эксперты полагают, что стандартизированный подход (40 мин физической нагрузки в сутки в темпе выше среднего) не является оптимальным и может быть предложен только ограниченному контингенту. В большинстве случаев выбор варианта проведения физических упражнений и их модификаций (шейпинг, ходьба, бег, гимнастика) адресуется субъективному мнению врача.
Медикаментозная гиполипидемическая терапия
Медикаментозные и инвазивные методы лечения гиперлипидемий имеют свои показания, часто являющиеся атрибутом величины инициального кардиоваскулярного риска, зависящие от возраста и гендерной принадлежности пациентов, фенотипа самой гиперлипидемии и многих других обстоятельств (Липовецкий Б.М., 2000). Более подробно последние рассматриваются ниже.
Тем не менее, следует четко сформировать у пациента мнение о необходимости придерживаться рекомендаций о модификации образа жизни и правилах применения гиполипидемических лекарственных средств. Желательно обстоятельно оговорить необходимость мониторирования эффективности и безопасности проводимой терапии. Не следует пренебрегать элементами обучения пациента, включая обсуждение сведений о некоторых деталях фармакокинетики и фармакодинамики назначаемых гиполипидемических лекарственых средств. Установлено, что приверженность пациента к терапии в значительной мере определяется уровнем понимания состояния собственного здоровья и возможности достижения успеха лечения.
Основные гиполипидемические лекарственные средства
Современная классификация гиполипидемических лекарственных средств основана на их преимущественном механизме действия. По этому принципу все гиполипидемические препараты могут быть разделены на следующие основные группы (табл. 9.2).
- Препараты, препятствующие всасыванию липидов в кишечнике — к ним относятся секвестранты желчных кислот (анионообменные смолы — колестирамин, колестипол); неспецифические энтеросорбенты, ингибиторы абсорбции ХС (эзетимиб).
- Препараты, усиливающие катаболизм ТГ — фибраты (безафибрат, гемфиброзил, ципрофибрат, фенофибрат).
- Препараты, подавляющие синтез ХС — ингибиторы ГМГ-КоА-редуктазы (симвастатин, правастатин, ловастатин, флувастатин, аторвастатин, розувастатин, питавастатин).
- Препараты, снижающие выработку ЛПНП и ЛПОНП — производные никотиновой кислоты (никофураноза, аципимокс, эндурацин) и препараты на основе ω-3 ПНЖК (рыбий жир, максепа, эйконол, полиен, ловаза, омакор).
- Стимуляторы эндогенного эндоцитоза (пробукол).
- Прямые ингибиторы СЕТР (торцетрапиб).
Таблица 9.2 Гиполипидемические лекарственные средства
| Класс лекарственных средств | Основные препараты и их доза | Влияние на липидный спектр, % | Противопоказания | Побочные эффекты | Частота выявляемости побочных эффектов, % | |
| Статины | Аторвастатин (10–80 мг)
Ловастатин (20–80 мг) Питавастатин (2–4 мг) Правастатин (20–40 мг) Розувастатин (10–40 мг) Симвастатин (5–80 мг) Флувастатин (20–80 мг) |
ЛПНП
ЛПВП ТГ |
↓18–55
↑5–15 ↓7–30 |
Абсолютные
Гепатоцеллюлярная недостаточность Относительные Одновременный прием некоторых препаратов |
Миопатия
Повышение печеночных ферментов |
~1 |
| Секвестранты желчных кислот | Колестирамин (4–16 г)
Колестипол (5–20 г) |
ЛПНП
ЛПВП ТГ |
↓15–30
↑3–5 нет или ↑ |
Абсолютные
Дисбеталипопротеидемия ТГ >400 мг/дл Относительные ТГ >200 мг/дл |
ЖКТ-расстройства
Обстипации Ухудшение всасывания других лекарственных препаратов |
20 |
| Никотиновая кислота | 1–3 г | ЛПНП
ЛПВП ТГ |
↓5–25
↑15–35 ↓25–50 |
Абсолютные
Хроническое заболевание печени Тяжелая подагра Относительные Сахарный диабет Гиперурикемия Язва желудка, двенадцатиперстной кишки |
Жар, приливы
Гипергликемия Гиперурикемия Подагра ЖКТ-расстройства Гепатотоксичность |
50–80 |
| Фибраты | Гемфиброзил (1200 мг)
Фенофибрат (100–300 мг) Клофибрат (2000 мг) Безафибрат (400–600 мг) Этофибрат (300–1500 мг) |
ЛПНП
ЛПВП ТГ |
↓5–20
↑10–25 ↓20–50 |
Абсолютные
Тяжелые заболевания печени или почек |
Диспепсия
Желчно-каменная болезнь Миопатия |
11–20 |
| Ингибиторы абсорбции ХС |
Эзетимиб (10 мг) | ЛПНП
ЛПВП ТГ |
↓5–25
↑2–3 ↓6–11 |
Относительные
Заболевание печени |
Головная боль
Боль в животе Диарея |
? |
Выбор инициального гиполипидемического препарата основан на многих факторах, в том числе фенотипе гиперлипидемии, популяции пациентов, структуре системы здравоохранения, характере программ профилактики (первичная или вторичная), наличия коморбидных состояний, инициального кардиоваскулярного риска, ожидаемой эффективности лечения, профиля безопасности того или иного лекарственного средства, риске возможного взаимодействия с другими препаратами и др. Тем не менее, чаще всего предварительный выбор гиполипидемического лекарственного средства производят на основании фенотипа гиперлипидемии и коморбидных состояний, тяжесть которых часто рассматривается в рамках эволюции атеротромбоза. Пример подобного подхода представлен на рис. 9.1.
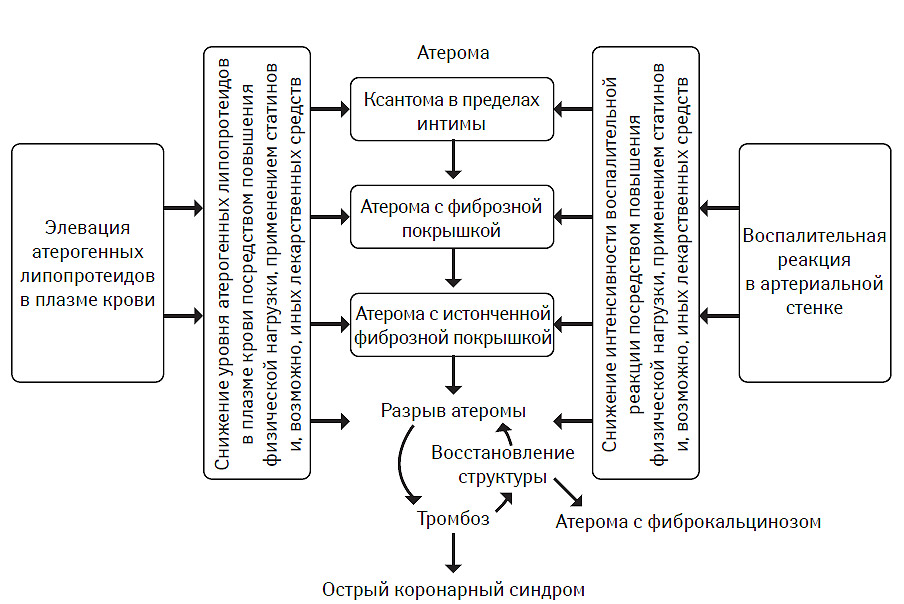
Рис. 9.1. Современная концепция терапевтической интервенции при атеротромбозе
Так, при гиперхолестеринемии предпочтение отдается статинам как препаратам первой линии. В качестве альтернативы обычно предлагают секвестранты желчных кислот или эзетимиб. При смешанной форме гиперлипидемии статины сохраняют свои позиции как препараты первой линии, в качестве альтернативы можно рассмотреть фибраты, секвестранты желчных кислот или эзетимиб. При изолированной гипертриглицеридемии наиболее предпочтительны фибраты, производные никотиновой кислоты или секвестранты желчных кислот. Прямые ингибиторы СЕТР (торцетрапиб) после появления сведений об их негативном влиянии на частоту возникновения кардиоваскулярных событий не рекомендованы к клиническому применению, а клинические испытания их эффективности и безопасности пока прекращены. Препараты, содержащие ω-З ПНЖК, не рекомендованы для проведения программ первичной профилактики возникновения кардиоваскулярных событий независимо от фенотипа гиперлипидемии. Их применение возможно как дополнение к статинам при проведении вторичных профилактических мероприятий.
Инвазивные методы лечения гиперлипидемий
При доказанной неэффективности медикаментозной терапии пациентам с высокой гиперхолестеринемией показаны хирургические методы коррекции дислипопротеидемии, в частности ЛПНП-аферез через колонки с моно- и поликлональными антителами к ЛПНП и каскадную плазмофильтрацию через колонки с гепарином.
Принципы рационального комбинирования различных гиполипидемических мероприятий
В рекомендациях Всемирной организации здравоохранения (ВОЗ) по лечению гиперлипидемии выделяются пять групп наблюдения, в лечении которых используются различные сочетания тех или иных подходов к достижению контроля за гиперлипидемией.
Группа А включает лиц с умеренной гиперхолестеринемией: содержание ХС в сыворотке крови 200–250 мг/дл (5,2–6,5 ммоль/л), ТГ <200 мг/дл (<2,3 ммоль/л). Достаточно эффективна одна диета, медикаментозная терапия редко бывает необходима.
Группа В включает лиц с уровнем ХС 250–300 мг/дл (6,5–7,8 ммоль/л). Если тщательно соблюдаемая диета не дает удовлетворительных результатов, следует рассмотреть возможность медикаментозного лечения, обычно это секвестранты желчных кислот в невысоких дозах.
Группа С включает лиц с гипертриглицеридемией: ХС в сыворотке крови <200 мг/дл (<5,2 ммоль/л), ТГ 200–500 мг/дл (2,3–5,6 ммоль/л). У многих из них также низок уровень ХС ЛПВП. Лечение в основном состоит в уменьшении избыточной массы тела и в уменьшении употребления алкоголя. Назначается гиполипидемическая диета. Медикаментозное лечение обычно не применяется, но может рассматриваться, если высокий уровень ТГ связан с семейной комбинированной гиперлипидемией или с наличием других факторов высокого риска развития атеросклероза.
Группа D включает лиц с повышенным содержанием в сыворотке крови ХС: 200–300 мг/дл (5,2–7,8 ммоль/л) и ТГ: 200–500 мг/дл (2,3–5,6 ммоль/л). У этих пациентов может быть комбинированная гиперлипидемия, диагностика которой включает обследование семьи. Хотя повышение уровня липидов умеренное, это нарушение ассоциируется с повышенным риском развития ИБС. Лечение состоит в уменьшении избыточной массы тела и в гиполипидемической диете. Для незначительного числа пациентов требуется медикаментозное лечение одновременно с диетой. Иногда бывает необходима комбинированная медикаментозная терапия.
Группа Е включает лиц с тяжелой гиперлипидемией: содержание ХС >300 мг/дл (>7,8 ммоль/л) и/или ТГ >500 мг/дл (>5,6 ммоль/л). Пациенты с уровнем ХС >300 мг/дл (>7,8 ммоль/л) и с нормальным содержанием ТГ обычно имеют семейную гиперхолестеринемию и особенно высокий риск развития ИБС. Терапия обычно включает диету и одно или два гиполипидемических лекарства: секвестранты желчных кислот в сочетании с одним из фибратов (или ингибиторов синтеза ХС) либо с никотиновой кислотой. Для хиломикронемии не существует подходящей медикаментозной терапии, она лечится диетой с низким содержанием жиров. Ремнантная гиперлипидемия (тип III) обычно проявляется в виде значительного повышения как ХС, так и ТГ. Она очень часто связана с коронарным и периферическим атеросклерозом, в большинстве случаев требуется лечение диетой и лекарствами, обычно фибратами. Семейная гипертриглицеридемия, подобно хиломикронемии, может привести к острому панкреатиту. Она часто сопровождается сахарным диабетом. В лечении необходимы контроль массы тела, диета, в тяжелых случаях — фибраты или никотиновая кислота.
Наиболее известным документом, регламентирующим деятельность врача при проведении гиполипидемических мероприятий, является клиническое руководство по лечению гиперлипидемии в соответствии с требованиями Adult Treatment Panel III (АТР ІІІ), последние изменения которого были произведены в 2004 г. (Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults, 2001; Grundy S.M. et al., 2004; Спасокукоцкий А.Л., 2005). Действующий вариант этих рекомендаций в сопоставлении с редакцией 2001 г. приведен ниже.
Основные положения клинического руководства по лечению гиперлипидемии в соответствии с требованиями АТР ІІІ
Руководство 2001 г.
- изучить имеющиеся данные, касающиеся ИБС и высокого уровня ХС в крови, особенно данные, полученные со времени публикации предыдущего руководства National Cholesterol Education Program (NCEP) (1993);
- в соответствующих случаях обновить имеющиеся рекомендации по ведению взрослых пациентов с гиперхолестеринемией.
Дополнение 2004 г.
- рассмотреть результаты 5 клинических исследований, проведенных в последнее время, и оценить их влияние на ведение пациентов с гиперхолестеринемией;
- на основании научных данных составить руководство, помогающее специалистам и общественности принимать соответствующие меры для снижения риска ИБС и сердечно-сосудистых заболеваний.
Рассматриваемые заболевания/патологические состояния
- высокий уровень ХС в крови (гиперхолестеринемия);
- ИБС;
- метаболический синдром.
Целевая популяция
- оценка риска: взрослые в возрасте ≥20 лет;
- лечение/ведение: взрослые с высоким уровнем ХС в крови.
Рассматриваемые вмешательства и практики
Оценка риска/диагностика
1. Определение уровня липопротеидов натощак (общего ХС , ХС ЛПНП, ХС ЛПВП и ТГ).
2. Выявление основных факторов риска, а также факторов риска, обусловленных нездоровым образом жизни, и новых факторов риска.
3. Определение 10-летнего риска ИБС по Фремингемской шкале оценки риска (Framingham scoring).
Первичная и вторичная профилактика ИБС посредством гиполипидемической терапии, направленной на снижение уровня ХС ЛПНП
1. Лечебные изменения образа жизни (therapeutic lifestyle changes) (ЛИОЖ), в том числе диетотерапия, уменьшение массы тела и повышенная физическая активность.
2. Медикаментозная терапия, включающая ингибиторы ГМГ-КоА-редуктазы (статины), секвестранты желчных кислот, никотиновую кислоту и производные фиброевой кислоты (фибраты).
Рассматриваемые основные исходы
- уровень ХС в сыворотке крови;
- заболеваемость и смертность, обусловленные ИБС;
- общая смертность (смертность, обусловленная и необусловленная ИБС);
- риск коронарного ишемического события.
Методы сбора/отбора данных
- «ручной» поиск источников литературы (первичные источники);
- «ручной» поиск источников литературы (вторичные источники);
- поиск в электронных базах данных.
Описание методов сбора/отбора данных
Руководство 2001 г.
Источники литературы, относящиеся к каждой рассматриваемой проблеме, определяли члены группы экспертов, а также выявляли с помощью поиска в электронной базе MEDLINE (США).
Дополнение 2004 г.
Со времени публикации руководства в 2001 г., сокращенно — АТР III, были опубликованы данные 5 больших клинических исследований по терапии статинами с клиническими конечными точками; эти исследования были рассмотрены при составлении данного дополнения. Рабочая группа проанализировала результаты 5 указанных исследований и оценила их влияние на рекомендации руководства АТР III.
Методы оценки качества и силы доказательств
Метод взвешивания данных в соответствии с рейтинговой системой (см. ниже).
Рейтинговая система оценки силы доказательств
Тип доказательств
A: большие рандомизированные контролируемые клинические испытания.
B: менее масштабные рандомизированные контролируемые клинические испытания и метаанализ других клинических исследований.
C: обсервационные исследования и исследования обменных процессов.
D: клинический опыт.
Сила доказательств
1. Очень сильное доказательство.
2. Доказательство средней силы.
3. Отчетливая тенденция.
Описание методов формулировки рекомендаций
Комиссия экспертов, составлявших руководство АТР III, при подготовке этого доказательного доклада выполняла 4 важных задачи. Во-первых, она систематически проводила обзор литературы и принимала решения о том, какие источники дают необходимую информацию. Во-вторых, она синтезировала имеющиеся данные литературы в группу сформулированных доказательств. Такой синтез также требовал принятия решения о категории и силе доказательств. В-третьих, комиссия подготовила рекомендации, основанные на сформулированных доказательствах; эти рекомендации являются согласованным мнением о клинической значимости каждого сформулированного доказательства. В-четвертых, комиссия разработала комплексный набор рекомендаций и руководств на основе отдельных рекомендаций.
Анализ затрат
Эффективность затрат прямо пропорциональна исходному риску в популяции и обратно пропорциональна стоимости лекарственных средств на единицу снижения уровня ЛПНП. Поскольку исходный риск повышается, а стоимость эффективных лекарственных средств снижается, то проведение мероприятий, направленных на снижение уровня ХС посредством статинов, становится более рентабельным. Эффективность затрат также является функцией исходов и затрат с течением времени. Эффективность затрат становится выше по мере повышения общего риска развития коронарных ишемических событий. Вторичная профилактика несомненно является экономически эффективной, и почти всегда — более экономически эффективной по сравнению с первичной, за исключением случаев, когда последнюю проводят лицам, у которых риск развития первого коронарного ишемического события (например у пациентов с сахарным диабетом) равен риску повторного события у лиц с клиническими проявлениями ИБС. С помощью общих стандартных критериев для сравнения установлено, что у лиц с симптоматической ИБС снижение ЛПНП посредством терапии статинами является очень эффективным в отношении затрат. Эффективность затрат сходна для лиц, у которых риск ИБС сравним с таковым у лиц с ранее перенесенным коронарным ишемическим событием (так называемые риски, эквивалентные ИБС). Эффективность затрат снижается по мере снижения исходного риска в популяции. Снижение уровня ЛПНП экономически эффективно в рамках первичной профилактики у лиц группы высокого риска; при более низких значениях 10-летнего риска такая гиполипидемическая терапия неэффективна. Независимо от уровня риска эффективность затрат в значительной степени зависит от стоимости лекарственных средств. Так, в докладе АТР III отмечено прогрессивное уменьшение затрат на 1 год сохраненной качественной жизни (QALY) при каждом снижении стоимости гиполипидемических средств. Эти данные были получены на основе анализа эффективности затрат проведенных в последние годы клинических испытаний терапии лекарственными средствами, снижающими уровень ЛПНП. Был сделан вывод о том, что затраты на каждый сохраненный год качественной жизни в значительной степени зависят от стоимости лекарственных средств. Также показано экспоненциальное повышение затрат при более низком уровне абсолютного риска.
Описание метода утверждения руководства
Руководство 2001 г.
Доклад АТР III был одобрен Координационным комитетом NCEP, в состав которого вошли представители 41 медицинской организации и институтов США.
Дополнение 2004 г.
После составления проекта дополнения он прошел несколько этапов научного рецензирования: вначале — в Координационном комитете NCEP, в состав которого вошли 35 представителей различных ведущих медицинских, общественных и правительственных институтов США, а затем — в научных и руководящих комитетах Американской кардиологической ассоциации (American Heart Association) и Американском кардиологическом колледже (American College of Cardiology). Тщательно изучили проект около 90 рецензентов. На основании рецензий дополнение было одобрено Национальным институтом сердца, легких и крови (National Heart, Lung, and Blood Institute), Американским кардиологическим колледжем и Американской кардиологической ассоциацией.
Основные рекомендации
Дополнение 2004 г.
Значение последних клинических исследований для алгоритма терапии в АТР III
По сравнению с рекомендациями предыдущей версии руководства (ATP II) комиссия экспертов, исходя из данных ранее проведенных клинических испытаний статинов, рекомендовала расширить область применения и повысить интенсивность гиполипидемической терапии для пациентов групп повышенного риска. В АТР III значительно увеличено количество жителей США, которым рекомендована гиполипидемическая терапия. Проведенные в последние годы клинические испытания статинов предоставили новую информацию о пользе лечения гиполипидемическими средствами для тех категорий лиц, в отношении которых в докладе АТР III не было возможности предоставить окончательные рекомендации в отношении медикаментозной терапии. В целом результаты этих последних испытаний убедительно подтвердили обоснованность рекомендаций АТР III, в частности — пользу терапии лекарственными средствами, снижающими ЛПНП, для пациентов с сахарным диабетом и лиц пожилого возраста. Более того, они предоставили новую информацию об эффективности снижения риска у тех пациентов группы высокого риска, имеющих относительно низкий уровень ХС ЛПНП. Несмотря на то что пока еще продолжается всестороннее изучение пользы снижения ХС ЛПНП у пациентов группы повышенного риска, имеющих низкий или очень низкий уровень ХС ЛПНП, последние результаты исследований открывают путь применению гиполипидемических средств у пациентов с очень высоким абсолютным риском, которым такая дополнительная терапия с наибольшей вероятностью принесет клиническую пользу.
В табл. 9.3 приведены целевые и критические уровни ХС ЛПНП из АТР III, а также предлагаемые в дополнении 2004 г. изменения алгоритма лечения в отношении ХС ЛПНП на основании доказательств, полученных в последних клинических испытаниях. Важные изменения указаны в примечаниях к табл. 9.3 и резюмированы ниже в табл. 9.4.
Таблица 9.3 Целевые и критические уровни ХС ЛПНП (из АТР III) для проведения ЛИОЖ и медикаментозной терапии у пациентов различных групп риска, а также предлагаемые изменения на основании данных последних клинических испытаний
| Группа риска | Целевой уровень ХС ЛПНП, мг/дл | Критический уровень ХС ЛПНП, при котором рекомендуется принятие мер, мг/дл | |
| ЛИОЖ | Медикаментозная терапия | ||
| Высокий риск: ИБС1 или риск, эквивалентный ИБС2 (10-летний риск >20%) | <100 (по усмотрению: <70)6 | ≥1008 | ≥10010 (<100 мг/дл: рассмотреть вопрос о вариантах медикаментозной терапии)9 |
| Умеренно высокий риск: >2 факторов риска3 (10-летний риск 10–20%)4 | <1307 | ≥1308 | ≥130 (100–129 мг/дл: рассмотреть вопрос о вариантах медикаментозной терапии)11 |
| Умеренный риск: >2 факторов риска3 (10-летний риск <10%)4 | <130 | ≥130 | ≥160 |
| Низкий риск: 0–1 факторов риска5 | <160 | ≥160 | ≥190 (160–189 мг/дл: гиполипидемическая терапия по усмотрению) |
1ИБС включает наличие в анамнезе инфаркта миокарда, нестабильной стенокардии, стабильной стенокардии, хирургические вмешательства на коронарных артериях (ангиопластика или шунтирование) или же доказательства клинически значимой ишемии миокарда.
2Риски, эквивалентные ИБС, включают клинические проявления некоронарных форм атеросклероза (атеросклероз периферических артерий, аневризма брюшной аорты и атеросклероз сонных артерий [транзиторная ишемическая атака или инсульт в результате поражения сонных артерий, или обструкция сонной артерии, составляющая >50%]), сахарный диабет и множественные (>2) факторы риска при 10-летнем риске развития тяжелых форм ИБС >20%.
3Факторы риска включают табакокурение, артериальную гипертензию (артериальное давление ≥140/90 мм рт. ст. или прием антигипертензивных лекарственных средств), низкий уровень ХС ЛПВП (<40 мг/дл), раннее развитие ИБС в семейном анамнезе (ИБС у родственника первой степени родства по мужской линии — в возрасте <55 лет; ИБС у родственницы первой степени родства по женской линии — в возрасте <65 лет) и возраст (мужчины в возрасте ≥45 лет; женщины в возрасте ≥55 лет).
4В сети Интернет имеются специальные электронные калькуляторы для подсчета 10-летнего риска (www.nhlbi.nih.gov/guidelines/cholesterol).
5Почти все лица с 0–1 фактором риска имеют 10-летний риск <10%, поэтому нет необходимости в оценке у них этого показателя.
6Наличие очень высокого риска свидетельствует о целесообразности достижения необязательного целевого уровня ХС ЛПНП порядка <70 мг/дл, а у пациентов с высоким уровнем ТГ — достижения ХС липопротеидов невысокой плотности (сумма ХС ЛПОНП и ХС ЛПНП) порядка <100 мг/дл.
7Целевой уровень ХС ЛПНП по усмотрению — <100 мг/дл.
8Каждый пациент группы высокого или умеренно высокого риска, имеющий факторы риска, связанные с образом жизни (например ожирение, низкая физическая активность, повышение уровня ТГ, низкий уровень ХС ЛПВП или метаболический синдром), является, независимо от уровня ХС ЛПНП, кандидатом для проведения ЛИОЖ для изменения этих факторов риска.
9Гиполипидемическую терапию для снижения ЛПНП рекомендуется проводить с интенсивностью, позволяющей достичь не менее 30–40% снижения уровня ХС ЛПНП.
10Если исходный уровень ХС ЛПНП составляет <100 мг/дл, то назначение гиполипидемического средства для снижения уровня ЛПНП является терапией по усмотрению на основании результатов имеющихся клинических испытаний. Если у пациента группы высокого риска низкий уровень ХС ЛПВП или высокий уровень ТГ, можно рассмотреть вопрос о целесообразности назначения препарата группы фибратов или никотиновой кислоты в комбинации с гиполипидемическим средством для снижения ЛПНП.
11Если у пациентов группы умеренно высокого риска уровень ХС ЛПНП (исходный или при проведении ЛИОЖ) составляет 100–129 мг/дл, то назначение гиполипидемического средства для достижения уровня ХС ЛПНП <100 мг/дл является терапией по усмотрению, исходя из результатов имеющихся клинических испытаний.
Таблица 9.4 Рекомендации по изменению примечаний к алгоритму лечения (из АТР III) для снижения уровня ХС ЛПНП
|
В некоторых рекомендуемых изменениях предложены варианты терапии в отношении достижения более низких целевых уровней ХС ЛПНП, чем представленные в АТР III, а также варианты выбора терапии. Результаты последних испытаний дают больше оснований для проведения более интенсивной гиполипидемической терапии, однако все проблемы, связанные с очень низким уровнем ЛПНП, не решены. При таком уровне врач должен в конечном счете исходить из клинического опыта при оценке риска для пациента, а также эффективности, безопасности и стоимости различных методов терапии. Эти вопросы можно обсудить в следующем контексте.
В отношении пациентов группы высокого риска рекомендуемый целевой уровень ХС ЛПНП составляет <100 мг/дл. Однако достижение целевого уровня <70 мг/дл является терапией по усмотрению (то есть рациональной клинической стратегией в отношении пациентов, относимых к группе очень высокого риска, на основании данных новых клинических испытаний). ЛИОЖ рекомендуется пациентам группы высокого риска во всех случаях, когда уровень ХС ЛПНП составляет ≥100 мг/дл. Более того, любой пациент группы высокого риска при наличии факторов риска, связанных с нездоровым образом жизни (например ожирение, низкая физическая активность, повышение уровня ТГ, низкий уровень ХС ЛПВП или метаболический синдром), является кандидатом для ЛИОЖ, независимо от уровня ХС ЛПНП, в целях изменения указанных факторов риска. Как и ранее, во всех случаях, когда исходная концентрация ХС ЛПНП составляет ≥130 мг/дл, рекомендуется одновременное начало проведения терапии гиполипидемическим средством для снижения ЛПНП и диетотерапии. Если уровень ХС ЛПНП составляет 100–129 мг/дл, то сегодня придерживаются такой же тактики терапии. Если исходный уровень ХС ЛПНП составляет <100 мг/дл и пациент относится к группе очень высокого риска, то достижение уровня ХС ЛПНП <70 мг/дл является терапией по усмотрению, что обосновано результатами клинических испытаний. Пациентам группы высокого риска, у которых повышен уровень ТГ или низкий уровень ХС ЛПВП, дополнительно к проводимой гиполипидемической терапии для снижения уровня ЛПНП можно рассмотреть вопрос о назначении фибратов или никотиновой кислоты.
В отношении пациентов группы умеренно высокого риска (10-летний риск — 10–20%) целевой уровень ХС ЛПНП составляет <130 мг/дл. Однако достижение целевого уровня <100 мг/дл является терапией по усмотрению на основании данных исследований по первичной профилактике. ЛИОЖ следует проводить всем пациентам этой группы, у которых уровень ХС ЛПНП составляет ≥130 мг/дл. И в этом случае любой пациент группы умеренно высокого риска, имеющий факторы риска, связанные с образом жизни (например ожирение, низкая физическая активность, повышение уровня ТГ, низкий уровень ХС ЛПВП или метаболический синдром), является кандидатом для проведения ЛИОЖ, независимо от уровня ХС ЛПНП, в целях изменения указанных факторов риска. Если концентрация ХС ЛПНП после ЛИОЖ составляет ≥130 мг/дл, следует рассмотреть вопрос о назначении гиполипидемического средства для достижения и поддержания целевого уровня ХС ЛПНП <130 мг/дл. При уровне ХС ЛПНП 100–129 мг/дл (исходном или при проведении ЛИОЖ) назначение гиполипидемического средства для достижения целевого уровня ХС ЛПНП <100 мг/дл является терапией по усмотрению на основании доказательств дополнительной эффективности, полученных в клинических испытаниях.
Начиная гиполипидемическую терапию для снижения уровня ЛПНП у пациента группы высокого или умеренно высокого риска, нельзя не учитывать как эффективность ЛИОЖ в снижении уровня ЛПНП, так и в снижении риска посредством других механизмов. Изменение образа жизни должно быть неотъемлемой частью терапии, направленной на снижение риска. При проведении гиполипидемической терапии для снижения ЛПНП у пациента группы высокого или умеренно высокого риска по возможности следует достичь снижения уровня ХС ЛПНП минимум на 30–40% (помимо снижения, достигнутого за счет диетотерапии). Что касается лиц, относящихся к группам более низкого риска, то рекомендации по изменению целевых и критических уровней для терапии отсутствуют.
Руководство 2001 г.
ХС ЛПНП — первостепенная цель терапии
Результаты экспериментов на животных, лабораторных и эпидемиологических исследований, а также изучение генетических форм гиперхолестеринемии свидетельствуют о том, что повышенный уровень ХС ЛПНП является основной причиной ИБС. Кроме того, в недавно проведенных исследованиях получены устойчиво воспроизводимые результаты, доказывающие, что терапия, направленная на снижение уровня ЛПНП, снижает риск развития ИБС. Исходя из этого, в АТР III сохранено определение, согласно которому повышенный уровень ХС ЛПНП является первостепенной целью гиполипидемической терапии. Поэтому первостепенные цели терапии и критические уровни, при которых необходимо ее начинать, указаны по отношению к ХС ЛПНП.
Оценка риска — первый этап в системе мер по снижению риска
Базовый принцип профилактики состоит в том, что интенсивность терапии, направленной на снижение риска, следует корригировать в зависимости от величины абсолютного риска у каждого пациента. Следовательно, первым этапом в выборе гиполипидемической терапии для снижения ЛПНП является оценка степени риска у данного пациента. Оценка риска требует определения уровня ХС ЛПНП в рамках комплексного анализа липопротеидов и выявления сопутствующих факторов риска.
У всех взрослых в возрасте ≥20 лет 1 раз в 5 лет следует определять уровень липопротеидов крови натощак (общий ХС, ХС ЛПНП, ХС ЛПВП и ТГ). Если взятие проб проводят после еды, то информативны только показатели общего ХС и ХС ЛПВП. В таком случае, если уровень общего ХС составляет ≥200 мг/дл или уровень ЛПВП — <40 мг/дл, требуется определить спектр липопротеидов, что необходимо для правильного ведения пациента на основе определенного уровня ЛПНП. Существует непрерывная взаимосвязь ХС ЛПНП и риска развития ИБС в рамках широкого диапазона значений уровня ХС ЛПНП — от низких до высоких. В связи с этим в АТР III принята классификация значений уровня ХС ЛПНП (табл. 9.5), а также классификация значений уровня общего ХС и ХС ЛПВП.
К факторам, определяющим степень риска, кроме ХС ЛПНП, относятся: наличие или отсутствие ИБС, другие клинические формы атеросклероза и основные факторы риска, не относящиеся к ЛПНП (табл. 9.6, среди факторов риска не учитывается уровень ЛПНП, поскольку цель подсчета указанных факторов риска состоит в модификации проводимой терапии, направленной на снижение ЛПНП).
Таблица 9.5 Классификация уровней ЛПНП, общего ХС и ХС ЛПВП в крови по АТР III
| Общий ХС | ХС ЛПНП | ХС ЛПВП | |||
| Уровень в крови, мг/дл | Оценка уровня | Уровень в крови, мг/дл | Оценка уровня | Уровень в крови, мг/дл | Оценка уровня |
| <200 | Желательный | 100–129 | Близкий к оптимальному/выше оптимального | <40 | Низкий |
| 200–239 | Погранично высокий | 130–159 | Погранично высокий | ≥60 | Высокий |
| ≥240 | Высокий | 160–189 | Высокий | – | – |
| ≥190 | Очень высокий | – | – | ||
Таблица 9.6 Основные факторы риска (не считая ХС ЛПНП), изменяющие целевые уровни ЛПНП1
|
1В АТР III сахарный диабет рассматривается в качестве фактора риска, эквивалентного ИБС.
2Уровень ХС ЛПВП ≥60 мг/дл подсчитывают в качестве отрицательного фактора риска; при его наличии вычитают один фактор риска из их общей суммы.
На основе факторов, определяющих степень риска (не считая ЛПНП), в АТР III установлены три группы риска, которые изменяют целевые уровни ЛПНП и методы гиполипидемической терапии. В табл. 9.7 установлены эти группы и представлены соответствующие целевые уровни ХС ЛПНП.
Таблица 9.7 Три группы риска, изменяющие целевые уровни ХС ЛПНП (мг/дл)
| Группа риска | Целевой уровень ХС ЛПНП, мг/дл |
| ИБС и риск, эквивалентный ИБС | <100 |
| Множественные (>2) факторы риска* | <130 |
| 0–1 фактор риска | <160 |
*Факторы риска, изменяющие целевые уровни ЛПНП, см. табл. 9.6.
К 1-й группе (самого высокого риска) относятся лица с ИБС и риском, эквивалентным ИБС. У последних существует риск развития основных коронарных событий, равный риску имеющейся ИБС (то есть 10-летний риск >20%, при котором у >20 из 100 лиц этой группы риска в течение 10 лет будет отмечено развитие ИБС или повторного коронарного ишемического события). К рискам, эквивалентным ИБС, относятся:
- другие клинические формы атеросклероза (атеросклероз периферических артерий, аневризма брюшной аорты и симптоматическое поражение сонных артерий);
- сахарный диабет;
- множественные факторы риска, обусловливающие 10-летний риск развития ИБС >20%.
Сахарный диабет считают риском, эквивалентным ИБС, поскольку он предопределяет высокий риск развития ИБС в течение 10 лет (частично из-за того, что он нередко связан с множественными факторами риска). Кроме того, поскольку у пациентов с сахарным диабетом и инфарктом миокарда отмечают необычно высокую смертность в ранний постинфарктный или отдаленный период, обосновано проведение более интенсивной профилактики. У лиц с ИБС или риском, эквивалентным ИБС, целевой уровень ХС ЛПНП является самым низким (<100 мг/дл).
К 2-й группе риска относятся лица со множественными (>2) факторами риска, у которых 10-летний риск ИБС составляет ≤20%. Риск оценивают по Фремингемской шкале оценки риска (табл. 9.8). Основные факторы риска, не считая повышенного уровня ХС ЛПНП, используют для определения наличия множественных факторов риска, изменяющих целевые и критические уровни ЛПНП для гиполипидемической терапии (см. табл. 9.5). Целевой уровень ХС ЛПНП для лиц с множественными (>2) факторами риска составляет <130 мг/дл.
Таблица 9.8 Оценка 10-летнего риска по Фремингемской шкале (адаптировано из полного руководства АТР III)
| Возраст, лет | Риск, баллы | |
| М1 | Ж2 | |
| 20–34 | –9 | –7 |
| 35–39 | –4 | –3 |
| 40–44 | 0 | 0 |
| 45–49 | 3 | 3 |
| 50–54 | 6 | 6 |
| 55–59 | 8 | 8 |
| 60–64 | 10 | 10 |
| 65–69 | 11 | 12 |
| 70–74 | 12 | 14 |
| 75–79 | 13 | 16 |
| Общий ХС, мг/дл | Риск, баллы | |||||||||
| Возраст, лет | ||||||||||
| 20–39 | 40–49 | 50–59 | 60–69 | 70–79 | ||||||
| М | Ж | М | Ж | М | Ж | М | Ж | М | Ж | |
| <160 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 160–199 | 4 | 4 | 3 | 3 | 2 | 2 | 1 | 1 | 0 | 1 |
| 200–239 | 7 | 8 | 5 | 6 | 3 | 4 | 1 | 2 | 0 | 1 |
| 240–279 | 9 | 11 | 6 | 8 | 4 | 5 | 2 | 3 | 1 | 2 |
| ≥280 | 11 | 13 | 8 | 10 | 5 | 7 | 3 | 4 | 1 | 2 |
| Табакокурение | Риск, баллы | |||||||||
| Возраст | ||||||||||
| 20–39 лет | 40–49 лет | 50–59 лет | 60–69 лет | 70–79 лет | ||||||
| М | Ж | М | Ж | М | Ж | М | Ж | М | Ж | |
| Курильщик | 8 | 9 | 5 | 7 | 3 | 4 | 1 | 2 | 1 | 1 |
| Некурильщик | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Уровень ЛПВП в крови, мг/дл | Риск, баллы | |
| М | Ж | |
| ≥60 | –1 | –1 |
| 50–59 | 0 | 0 |
| 40–49 | 1 | 1 |
| <40 | 2 | 2 |
| Систолическое артериальное давление, мм рт. ст. | Риск, баллы | |||
| Без лечения | Принимающие лечение | |||
| М | Ж | М | Ж | |
| <120 | 0 | 0 | 0 | 0 |
| 120–129 | 0 | 1 | 1 | 3 |
| 130–139 | 1 | 2 | 2 | 4 |
| 140–159 | 1 | 3 | 2 | 5 |
| ≥160 | 2 | 4 | 3 | 6 |
| М | Ж | ||
| Сумма баллов | 10-летний риск, % | Сумма баллов | 10-летний риск, % |
| <0 | <1 | <9 | <1 |
| 0 | 1 | 9 | 1 |
| 1 | 1 | 10 | 1 |
| 2 | 1 | 11 | 1 |
| 3 | 1 | 12 | 1 |
| 4 | 1 | 13 | 2 |
| 5 | 2 | 14 | 2 |
| 6 | 2 | 15 | 3 |
| 7 | 3 | 16 | 4 |
| 8 | 4 | 17 | 5 |
| 9 | 5 | 18 | 6 |
| 10 | 6 | 19 | 8 |
| 11 | 8 | 20 | 11 |
| 12 | 10 | 21 | 14 |
| 13 | 12 | 22 | 17 |
| 14 | 16 | 23 | 22 |
| 15 | 20 | 24 | 27 |
| 16 | 25 | ≥25 | ≥30 |
| ≥17 | ≥30 | – | – |
1М — мужчины; 2Ж — женщины.
К 3-й группе риска относятся лица, имеющие 0–1 фактор риска; за редкими исключениями 10-летний риск у лиц данной группы составляет <10%, целевой уровень ХС ЛПНП — <160 мг/дл.
Метод оценки риска: подсчет основных факторов риска и оценка 10-летнего риска развития ИБС
Методика оценки степени риска у лиц без клинических проявлений ИБС или других клинических форм атеросклероза состоит из 2 этапов.
На первом этапе подсчитывают количество факторов риска (см. табл. 9.6). На втором этапе для лиц с множественными (>2) факторами риска проводят оценку 10-летнего риска по Фремингемской шкале (см. табл. 9.8) для выявления лиц, у которых ближайший (10-летний) риск является основанием для назначения интенсивной терапии. Оценка 10-летнего риска развития ИБС является дополнительным (кроме подсчета факторов риска) этапом оценки риска, однако этапом обоснованным, поскольку он позволяет лучше определить цели интенсивной терапии для пациентов, которым она принесет пользу. Если у пациента имеется 0–1 фактор риска, то оценку риска по Фремингемской шкале проводить не обязательно, поскольку в данном случае 10-летний риск редко достигает величин, при которых необходимо интенсивное вмешательство; тем не менее, очень высокий уровень ЛПНП у таких пациентов может служить основанием для рассмотрения вопроса о назначении медикаментозной терапии для снижения отдаленного риска. К факторам риска, используемым при оценке по Фремингемской шкале, относятся: возраст, уровень общего ХС и ХС ЛПВП, артериальное давление и табакокурение. Уровень общего ХС используют для оценки 10-летнего риска в связи с более обширной Фремингемской базой данных в отношении этого показателя по сравнению с ХС ЛПНП, который является главной целью гиполипидемической терапии. При оценке по Фремингемской шкале лиц с множественными факторами риска распределяют на подгруппы согласно уровню 10-летнего риска развития ИБС: >20%, 10–20% и <10%. Следует отметить, что 2 этапа оценки можно провести в обратной последовательности, получив, по существу, тот же результат*. В АТР III при начальной оценке риска используют основные факторы риска в целях определения основного риска. Все остальные методы снижения риска для коррекции тактики лечения следует рассматривать только после определения основного риска.
*Если оценку по Фремингемской шкале проводят перед подсчетом факторов риска, то после этого лиц, у которых риск составляет <10%, подразделяют посредством подсчета факторов риска — с множественными (>2) факторами риска и с 0–1 фактором риска — в целях определения соответствующего целевого уровня ЛПНП (см. табл. 9.7).
Значение прочих факторов риска в процессе оценки риска
В АТР III признан тот факт, что на риск развития ИБС влияют другие факторы, не включенные в группу основных независимых факторов риска (см. табл. 9.6). Среди них — факторы риска, обусловленные нездоровым образом жизни, и новые факторы риска. К первым относятся: ожирение, низкая физическая активность и атерогенная диета; ко вторым относятся: ЛП (а), состояния, предшествующие тромбообразованию (протромботические) и воспалению, повышение уровня глюкозы в крови натощак и признаки субклинического атеросклероза. Факторы риска, обусловленные нездоровым образом жизни, являются непосредственной мишенью клинического вмешательства, но их не используют для определения целевого уровня ХС ЛПНП при гиполипидемической терапии. Новые факторы риска качественно не изменяют целевой уровень ХС ЛПНП; тем не менее, они, по-видимому, в различной степени повышают риск развития ИБС и у определенных пациентов могут быть информативны в отношении коррекции интенсивности терапии, направленной на снижение риска. Их наличие может влиять на клиническое заключение при принятии решения о тактике лечения.
Метаболический синдром
У многих людей отмечают комплекс основных факторов риска, факторов риска, обусловленных нездоровым образом жизни, и новых факторов риска, которые обусловливают развитие патологического состояния, называемого метаболическим синдромом. К факторам риска, характерным для метаболического синдрома, относятся: абдоминальное ожирение, атерогенная дислипидемия (триада: повышение уровня ТГ, мелких частиц ЛПНП, снижение уровня ХС ЛПВП), артериальная гипертензия, инсулинорезистентность (с непереносимостью глюкозы/без нее), а также состояния, способствующие тромбообразованию и воспалению. В АТР III указывается, что по отношению к главной цели терапии, направленной на снижение риска, — снижение уровня ХС ЛПНП — метаболический синдром является второстепенной целью. Методы диагностики и терапии метаболического синдрома описаны ниже (см. Польза мер, не имеющих отношения к снижению уровня ЛПНП: метаболический синдром как второстепенная цель терапии).
Связь между оценкой риска и эффективностью затрат
Основная цель АТР III — согласовать интенсивность терапии, направленной на снижение ЛПНП, с величиной абсолютного риска. При лечении каждого пациента с повышенным уровнем ХС ЛПНП используют изменения образа жизни, которые эффективны для снижения уровня ЛПНП. Лица с относительно высоким риском также являются кандидатами для проведения медикаментозной терапии, которая очень эффективна, однако влечет значительные дополнительные расходы на лечение. Критические уровни для назначения медикаментозной терапии основываются преимущественно на оценке соотношения риска и пользы: очевидно, что пациенты с повышенным риском получат от терапии больше пользы. Однако критические уровни для рекомендуемого ведения пациентов, базирующиеся на терапевтической эффективности, сравнивают с принятыми современными стандартами эффективности затрат. Изменения образа жизни — самые экономически эффективные меры снижения риска ИБС. Однако даже в этом случае многим пациентам для достижения максимальной пользы требуется проведение терапии, направленной на снижение ЛПНП. Фармакотерапия является главным источником расходов при лечении, направленном на снижение уровня ЛПНП, и она доминирует в анализе эффективности затрат. Однако в настоящее время стоимость гиполипидемических препаратов постоянно меняется и, очевидно, она будет снижаться. В данном докладе указывается, что по мере снижения цен на лекарственные препараты станет возможным расширить показания для фармакотерапии, назначая ее лицам, относящимся к группам более низкого риска, и при этом такое лечение все же будет экономически эффективным. Кроме того, в АТР III указывается, что некоторые пациенты с высоким отдаленным риском являются кандидатами для проведения фармакотерапии для снижения уровня ЛПНП, даже с учетом того, что применение лекарственных средств может быть экономически неэффективным в свете современных стандартов.
Первичная профилактика посредством ЛПНП-снижающей терапии
Первичная профилактика ИБС предоставляет наибольшую возможность уменьшить бремя ИБС в мире. Клинические подходы к первичной профилактике базируются на мерах общественного здравоохранения, которые требуют изменения образа жизни, в том числе: 1) снижения потребления пищевых продуктов, богатых насыщенными жирами и ХС; 2) повышения физической активности; 3) контроля массы тела в целях снижения уровня ХС и риска развития ИБС на популяционном уровне, однако клиническая тактика направлена на усиление профилактических мер для лиц групп более выского риска. Одной из целей первичной профилактики является снижение отдаленного (>10 лет), а также ближайшего (≤10 лет) риска. Целевые уровни ЛПНП при первичной профилактике зависят от величины абсолютного риска развития ИБС у данного пациента (то есть вероятности развития ишемического коронарного события в ближайший или отдаленный период); чем выше риск, тем ниже целевой уровень ЛПНП. ЛИОЖ является основой клинических мер по первичной профилактике. Тем не менее, некоторые пациенты с повышенным риском в связи с высоким или очень высоким уровнем ХС ЛПНП или множественными факторами риска являются кандидатами для назначения лекарственных средств, снижающих ЛПНП. Результаты недавно проведенных испытаний по первичной профилактике свидетельствуют, что фармакотерапия, снижающая уровень ЛПНП, снижает риск развития основных коронарных событий и внезапной коронарной смерти даже в ближайший период.
Каждому пациенту с повышенным уровнем ХС ЛПНП или другими формами гиперлипидемии перед началом гиполипидемической терапии следует провести клиническое или лабораторное обследование для исключения вторичной дислипидемии. К причинам вторичной дислипидемии относятся:
- сахарный диабет;
- гипотиреоз;
- болезнь печени с холестазом;
- хроническая почечная недостаточность;
- прием лекарственных средств, способствующих повышению ХС ЛПНП и снижению ХС ЛПВП (гестагены, анаболические стероиды и кортикостероиды).
После исключения причин вторичной дислипидемии или в соответствующих случаях их устранения терапией устанавливают в соответствии с группой риска данного пациента (см. табл. 9.7) целевые уровни для гиполипидемической терапии при первичной профилактике.
Вторичная профилактика посредством ЛПНП-снижающей терапии
Результаты недавно проведенных клинических испытаний продемонстрировали, что гиполипидемическая терапия снижает общую смертность, смертность в результате коронарных событий, частоту развития основных коронарных событий, уменьшает количество проводимых хирургических вмешательств на коронарных артериях и частоту инсультов у лиц с ИБС. Как указано выше, уровень ХС ЛПНП <100 мг/дл является оптимальным; поэтому АТР III устанавливает уровень ХС ЛПНП <100 мг/дл в качестве целевого для терапии при вторичной профилактике. Целесообразность такого целевого уровня подтверждается данными клинических испытаний как с клиническими, так и с ангиографическими конечными точками, а также данными проспективных эпидемиологических исследований. Этот же целевой уровень следует устанавливать и для лиц с рисками, эквивалентными ИБС. При госпитализации пациентов по поводу острых коронарных синдромов или для проведения оперативных вмешательств на коронарных артериях следует определять основные показатели липидов и липопротеидов в крови до поступления в больницу или в течение 24 ч после него. Врач может руководствоваться ими при назначении гиполипидемической терапии перед или после выписки пациента из стационара. Может потребоваться коррекция терапии через 12 нед.
ЛПНП-снижающая терапия у лиц 3 групп риска
Два основных метода гиполипидемической терапии — ЛИОЖ и медикаментозная терапия. Оба метода будут подробно описаны ниже. В разделе «ЛИОЖ при ЛПНП-снижающей терапии» подчеркивается значение ограничения потребления продуктов, богатых насыщенными жирами и ХС. При ЛИОЖ также уделяется большое внимание уменьшению массы тела и повышению физической активности при наличии метаболического синдрома или ассоциированных с ним липидных факторов риска (повышенный уровень ТГ или ХС ЛПВП). В табл. 9.9 указаны целевые уровни и критические уровни ХС ЛПНП для начала проведения ЛИОЖ и для рассмотрения вопроса о характере фармакотерапии для лиц 3 групп риска: 1) ИБС и риски, эквивалентные ИБС; 2) множественные (>2) факторы риска (10-летний риск 10–20% и <10%); 3) 0–1 фактор риска.
Таблица 9.9 Целевые и критические уровни ХС ЛПНП для ЛИОЖ и медикаментозной терапии у лиц 3 групп риска (предлагаемые изменения на основании данных последних клинических испытаний — см. табл. 9.3)
| Группа риска | Целевой уровень ХС ЛПНП, мг/дл | Уровень ЛПНП для начала ЛИОЖ, мг/дл | Уровень ЛПНП, при котором рекомендуется фармакотерапия, мг/дл |
| ИБС или риски, эквивалентные ИБС (10-летний риск >20%) | <100 | ≥100 | ≥130 (при 100–129 мг/дл: рассмотреть вопрос о вариантах фармакотерапии)1 |
| >2 факторов риска (10-летний риск ≤20%) | <130 | ≥130 | При 10-летнем риске 10–20%: ≥130
при 10-летнем риске <10%: ≥160 |
| 0–1 фактор риска2 | <160 | ≥160 | ≥190 (при 160–190 мг/дл: рассмотреть вопрос о вариантах фармакотерапии, снижающей ЛПНП) |
1Некоторые специалисты рекомендуют в данной группе применение лекарственных средств для снижения ЛПНП в случаях, когда посредством ЛИОЖ невозможно достичь целевого уровня ХС ЛПНП <100 мг/дл. Другие специалисты предпочитают применять лекарственные средства, преимущественно влияющие на уровень ТГ и ЛПВП, например никотиновую кислоту или фибраты. Также возможно принятие клинического решения об отсрочке проведения фармакотерапии в этой подгруппе пациентов.
2Почти у всех лиц с 0–1 фактором риска 10-летний риск составляет <10%, поэтому необходимость в его оценке отсутствует.
ИБС и риски, эквивалентные ИБС
У лиц с ИБС и рисками, эквивалентными ИБС, терапия для снижения ЛПНП значительно снижает риск развития основных коронарных событий и инсульта и обеспечивает очень благоприятное соотношение затрат и эффективности. Критические уровни для начала ЛИОЖ и фармакотерапии см. табл. 9.9.
Рекомендации
Если исходный уровень ХС ЛПНП составляет ≥130 мг/дл, следует начинать ЛИОЖ и максимально контролировать прочие факторы риска. Более того, большинству пациентов необходимо принимать лекарственное средство, снижающее ЛПНП, для достижения уровня ХС ЛПНП <100 мг/дл; таким образом, для достижения целевых уровней терапию лекарственным препаратом, снижающим ЛПНП, можно начать одновременно с ЛИОЖ.
Если уровень ХС ЛПНП (исходный или при проведении терапии, снижающей ЛПНП) составляет 100–129 мг/дл, возможно применение нескольких терапевтических подходов:
- начать или повысить интенсивность ЛИОЖ и/или фармакотерапии, специально направленных на снижение уровня ЛПНП;
- уделять особое внимание уменьшению массы тела и повышению физической активности у лиц с метаболическим синдромом;
- отложить применение или повышение интенсивности терапии, направленной на снижение ЛПНП, и начать терапию, направленную на другие липидные и нелипидные факторы риска; если у пациента повышен уровень ТГ или ХС ЛПВП, рассмотреть целесообразность применения других лекарственных средств, модифицирующих уровень липидов в крови (например никотиновой кислоты или фибратов).
Если исходный уровень ХС ЛПНП составляет <100 мг/дл, нет необходимости в дальнейшем проведении терапии для снижения содержания ЛПНП. Тем не менее, следует порекомендовать пациентам самостоятельно соблюдать диетотерапию при ЛИОЖ в целях поддержания оптимального уровня ЛПНП. В настоящее время выполняется несколько клинических испытаний по изучению пользы снижения ХС ЛПНП до уровня значительно <100 мг/дл. Пока же следует уделять особое внимание контролю других липидных и нелипидных факторов риска и терапии метаболического синдрома (при его наличии).
Множественные (>2) факторы риска и 10-летний риск ≤20%
Лицам с множественными (>2) факторами риска и 10-летним риском ≤20% интенсивность терапии корригируют в зависимости от степени 10-летнего риска и уровня ХС ЛПНП. Характер терапевтического подхода к пациентам каждой подгруппы резюмирован в табл. 9.9.
Рекомендации
Множественные (>2) факторы риска и 10-летний риск 10–20%. В этой группе целевой уровень ХС ЛПНП составляет <130 мг/дл. Цель терапии — снижение как ближайшего, так и отдаленного риска развития ИБС. Если исходный уровень ХС ЛПНП составляет ≥130 мг/дл, начинают ЛИОЖ и продолжают в течение 3 мес. Если при следовании мерам ЛИОЖ через 3 мес ЛПНП сохраняется на уровне ≥130 мг/дл, необходимо рассмотреть возможность начала фармакотерапии для снижения ЛПНП в целях достижения целевого уровня ЛПНП <130 мг/дл. Применение лекарственных средств, снижающих ЛПНП, в данной группе риска снижает риск развития ИБС и является экономически эффективным. Если при проведении только мер ЛИОЖ уровень ЛПНП падает <130 мг/дл, можно продолжать ЛИОЖ без назначения фармакотерапии. У лиц пожилого возраста (≥65 лет) необходимо принять клинически обоснованное решение о том, насколько строго соблюдать данные рекомендации; разные факторы, в том числе сопутствующие заболевания, общее состояние здоровья и вопросы социального характера, могут оказать влияние на принятие решения о характере терапии, при этом возможно проведение менее интенсивной терапии.
Множественные (>2) факторы риска и 10-летний риск <10%. В этой группе целевой уровень ХС ЛПНП также составляет <130 мг/дл. Однако цель терапии состоит преимущественно в снижении степени отдаленного риска. Если исходный уровень ХС ЛПНП составляет ≥130 мг/дл, начинают следовать рекомендациям диетотерапии при ЛИОЖ в целях снижения содержания ХС ЛПНП. Если при проведении только мер ЛИОЖ уровень ЛПНП составляет <160 мг/дл, их следует продолжать. Как правило, лекарственные средства для снижения ЛПНП применять не рекомендуется, поскольку у пациента отсутствует высокая степень ближайшего риска. В то же время, если уровень ХС ЛПНП составляет ≥160 мг/дл, можно рассмотреть вопрос о целесообразности проведения медикаментозной терапии в целях достижения уровня ХС ЛПНП <130 мг/дл; главной целью терапии является снижение степени отдаленного риска. Экономическая эффективность при этом минимальна, однако лекарственная терапия может быть целесообразной для замедления развития коронарного атеросклероза и для снижения отдаленного риска развития ИБС.
0–1 фактор риска
У большинства лиц с 0–1 фактором риска 10-летний риск составляет <10%. Ведение таких пациентов осуществляется в соответствии с рекомендациями, представленными в табл. 9.8. Целевой уровень ХС ЛПНП у лиц данной группы риска составляет <160 мг/дл. Главная цель терапии состоит в снижении степени отдаленного риска. Терапией первой линии являются меры ЛИОЖ. Если через 3 мес после начала ЛИОЖ уровень ХС ЛПНП составляет <160 мг/дл, продолжают меры ЛИОЖ. Однако, если после адекватного следования мерам ЛИОЖ уровень ХС ЛПНП составляет 160–189 мг/дл, то возможным вариантом лечения является лекарственная терапия, что зависит от клинически обоснованного решения. К факторам, наличие которых свидетельствует в пользу проведения фармакотерапии, относятся:
- серьезный единичный фактор риска (курение большого числа сигарет, плохо контролируемая артериальная гипертензия, раннее развитие ИБС в семейном анамнезе или же очень низкий уровень ХС ЛПВП);
- множественные факторы риска, обусловленные нездоровым образом жизни, и новые факторы риска (если измерены их показатели);
- 10-летний риск, достигающий почти 10% (при его измерении; см. также табл. 9.8).
Если несмотря на проведение ЛИОЖ уровень ХС ЛПНП составляет ≥190 мг/дл, необходимо рассмотреть вопрос о назначении фармакотерапии для достижения целевого уровня ЛПНП <160 мг/дл.
Цель применения лекарственных средств, снижающих ЛПНП, у лиц с 0–1 фактором риска и повышенным уровнем ХС ЛПНП (≥160 мг/дл) заключается в замедлении развития коронарного атеросклероза, что позволит снизить отдаленный риск. Эта цель может противоречить соображениям экономической эффективности терапии; поэтому при отборе пациентов для проведения лекарственной терапии необходимо принятие клинически обоснованного решения, хотя имеются достаточные основания для применения лекарственных средств при уровне ХС ЛПНП ≥190 мг/дл после проведения ЛИОЖ.
Что касается лиц, у которых ХС ЛПНП ниже целевого уровня, что установлено уже при первом посещении врача, то им необходимо дать инструкции в отношении изменения образа жизни, периодического прохождения обследований и контроля других факторов риска.
ЛИОЖ при ЛПНП-снижающей терапии
В АТР III рекомендуется применять многосторонний подход к изменению образа жизни для снижения риска развития ИБС. Данный подход называется лечебным изменением образа жизни (ЛИОЖ). Его основные особенности:
- ограниченное потребление насыщенных жиров (<7% общего числа калорий) и ХС (<200 мг/сут) (суточная потребность в питательных веществах при ЛИОЖ представлена в табл. 9.10);
- дополнительные терапевтические возможности, способствующие снижению уровня ЛПНП, например потребление растительных станолов/стеролов (2 г/сут) и повышенное потребление вязкой (растворимой) клетчатки (10–25 г/сут);
- уменьшение массы тела;
- повышение физической активности.
Таблица 9.10 Состав диеты при ЛИОЖ
Насыщенные жиры1
Полиненасыщенные жиры
Мононенасыщенные жиры
Общее количество жиров
Углеводы2
Клетчатка
Белки
ХС
Суточная калорийность (энергетическая ценность) диеты3
|
1Трансжирные кислоты являются еще одной формой жиров, способствующих повышению ЛПНП, потребление которой следует ограничить.
2Углеводы должны потребляться преимущественно с пищей, богатой комплексом углеводов, в том числе с крупами (особенно полученными из цельных зерен), фруктами и овощами.
3Суточное расходование энергии должно происходить вследствие как минимум умеренной физической активности (расходование ≈200 ккал/сут).
Примерная последовательность этапов ЛИОЖ представлена на рис. 9.2.
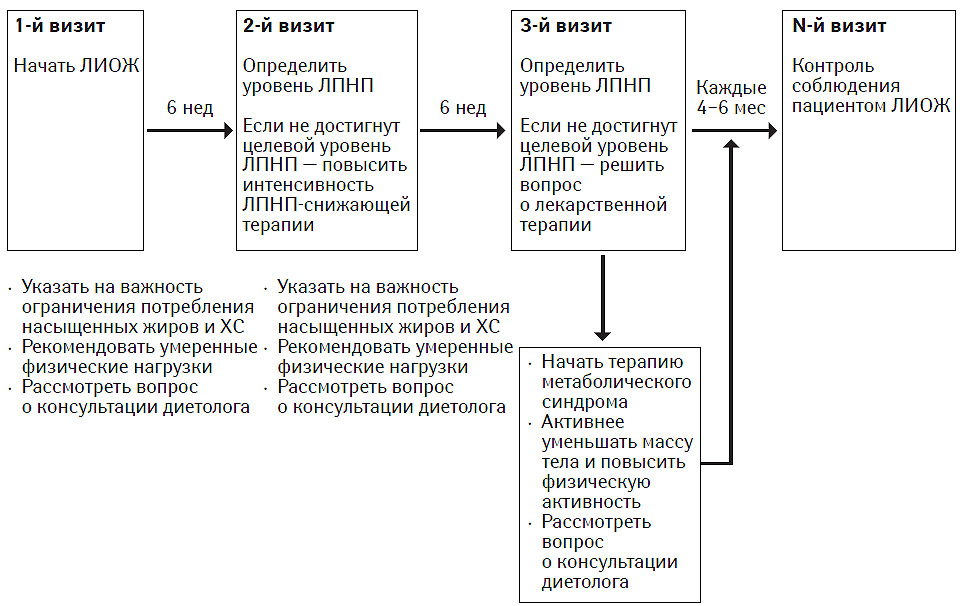
Рис. 9.2. Примерная схема этапов ЛИОЖ
В начале ЛИОЖ прежде всего снижают потребление насыщенных жиров и ХС с пищей для снижения концентрации ХС ЛПНП. В целях укрепления общего состояния здоровья в АТР III о диете при ЛИОЖ содержатся рекомендации по диетотерапии. Допускается потребление общего количества жиров в диапазоне 25–35% суточной калорийности диеты при том условии, что ограничивается потребление насыщенных жиров и трансжирных кислот (трансжирные кислоты являются стереоизомерами природных цисжирных кислот и содержатся в таких пищевых продуктах, как маргарин). Увеличенное потребление общего количества жиров, преимущественно в виде ненасыщенных жиров, помогает снизить уровень ТГ и повысить уровень ХС ЛПВП у лиц с метаболическим синдромом. В соответствии с АТР III рекомендуется умеренная физическая активность. Реакцию организма на проведение этих мер проверяют через 6 нед по уровню ХС ЛПНП; если не достигнут целевой уровень ХС ЛПНП, можно дополнительно принять другие меры диетотерапии для снижения ЛПНП, например прием станолов/стеролов растительного происхождения и вязкой клетчатки.
После максимального снижения уровня ХС ЛПНП посредством диетотерапии основное внимание уделяют ведению лиц с метаболическим синдромом и ассоциированными липидными факторами риска. Большинство пациентов с указанными патологическими состояниями имеют избыточную массу тела или ожирение, а также ведут малоподвижный образ жизни. Терапия для уменьшения массы тела у лиц с ожирением или избыточной массой тела способствует снижению ЛПНП и приносит дополнительную пользу, в том числе за счет устранения других липидных и нелипидных факторов риска.
Помощь в ведении лиц с избыточной массой тела или ожирением оказывает «Клиническое руководство по выявлению, оценке и терапии избыточной массы тела и ожирения у взрослых» (Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults, 1998), подготовленное в рамках образовательной программы по ожирению Национального института сердца, легких и крови (National Heart, Lung and Blood Institute Obesity Education Initiative). Дополнительного снижения риска можно достичь за счет одновременного повышения физической активности.
На всех этапах диетотерапии врачам рекомендуется направлять пациентов на консультацию к специалистам-диетологам.
Медикаментозная терапия для достижения целевого уровня ХС ЛПНП
Часть пациентов с высоким ближайшим и отдаленным риском развития ИБС дополнительно к проведению ЛИОЖ нуждаются в назначении гиполипидемических средств для достижения целевого уровня ХС ЛПНП (см. табл. 9.9). При медикаментозной терапии всегда необходимо неукоснительно продолжать проведение ЛИОЖ. К средствам, влияющим на метаболизм липопротеидов, в настоящее время относятся: ингибиторы ГМГ-КоА-редуктазы (статины), секвестранты желчных кислот, никотиновая кислота и фибраты (табл. 9.11).
Таблица 9.11 Лекарственные средства, влияющие на обмен липопротеидов
| Группа лекарственных средств | Влияние на уровень липидов/липопротеидов | Побочные эффекты | Противопоказания | Результаты клинических испытаний |
| Ингибиторы ГМГ-КоА-редуктазы (статины)1 | ЛПНП: ↓ на 18–55%
ЛПВП: ↑ на 5–15% ТГ: ↓ на 7–30% |
• миопатия
• повышение активности печеночных ферментов |
Абсолютные:
• активная или хроническая форма болезни печени Относительные: • одновременное применение некоторых препаратов2 |
Уменьшение числа случаев развития основных коронарных событий, смерти вследствие ИБС, необходимости в проведении операций на коронарных сосудах, случаев инсульта, снижение общей смертности |
| Секвестранты желчных кислот3 | ЛПНП: ↓ на 15–30%
ЛПВП: ↑ на 3–5% ТГ: отсутствует |
• желудочно-кишечные расстройства
• запор • ухудшение всасывания других лекарственных средств |
Абсолютные:
• дисбеталипопротеидемия • уровень ТГ >400 мг/дл Относительные: • уровень ТГ >200 мг/дл |
Уменьшение числа основных коронарных событий и случаев смерти вследствие ИБС |
| Препараты никотиновой кислоты4 | ЛПНП: ↓ на 5–25%
ЛПВП: ↑ на 15–35% ТГ: ↓ на 20–50% |
• приливы крови
• гипергликемия • гиперурикемия (или подагра) • расстройства со стороны верхних отделов пищеварительного тракта • гепатотоксичность |
Абсолютные:
• ХБП • тяжелая форма подагры Относительные: • сахарный диабет • гиперурикемия • пептическая язва |
Уменьшение числа основных коронарных событий и, возможно, общей смертности |
| Фибраты5 | ЛПНП: ↓ на 5–20%
(возможно повышение при высоком уровне ТГ) ЛПВП: ↑ на 10–20% ТГ: ↓ на 20–50% |
• диспепсия
• холелитиаз • миопатия • необъяснимые случаи смерти вследствие заболеваний, не относимых к ИБС, в исследовании ВОЗ |
Абсолютные:
• тяжелая болезнь почек • тяжелая болезнь печени Относительные: • уровень ТГ >200 мг/дл |
Уменьшение числа основных коронарных событий |
1Суточные дозы: ловастатин — 20–80 мг, симвастатин — 20–80 мг, флувастатин — 20–80 мг, аторвастатин — 10–80 мг, церивастатин — 0,4–0,8 мг.
2Циклоспорин, макролидные антибиотики, различные противогрибковые препараты и средства, ингибирующие ферменты системы цитохрома Р450 (необходима осторожность при назначении фибратов и препаратов никотиновой кислоты).
3Суточные дозы: колестирамин — 4–16 г, колестипол — 5–20 г, колезевелам — 2,6–3,8 г.
4Суточные дозы препаратов никотиновой кислоты: с немедленным высвобождением (в кристаллической форме) — 1,5–3 г, с замедленным высвобождением — 1–2 г, с длительным высвобождением — 1–2 г.
5Суточные дозы: гемфиброзил — по 600 мг 2 раза в сутки, фенофибрат — 200 мг, клофибрат — по 1000 мг 2 раза в сутки.
Источник: краткое содержание АТР III (Third Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Executive Summary; www.nhlbi.nih.gov/guidelines/cholesterol/atp3xsum.pdf).
Вторичная профилактика: медикаментозная терапия при ИБС и рисках, эквивалентных ИБС
У лиц с ИБС и рисками, эквивалентными ИБС, цель терапии состоит в достижении уровня ХС ЛПНП <100 мг/дл. Критические уровни для начала проведения ЛИОЖ и фармакотерапии — см. табл. 9.9; подход к терапии также обсуждался выше (см. ИБС и риски, эквивалентные ИБС). Большинству пациентов с ИБС необходимо проведение медикаментозной терапии для снижения ЛПНП. Другие липидные факторы риска также могут стать основанием для назначения фармакотерапии. Независимо от того, применяют или не применяют фармакотерапию для изменения уровня липидов в крови, наличие нелипидных факторов риска требует внимания врача и принятия мер для их устранения.
У лиц, госпитализированных по поводу основного коронарного события, необходимо при поступлении или в течение 24 ч после него измерить уровень ХС ЛПНП. На основании этого можно принимать решение о тактике лечения. В целом, лицам, госпитализированным по поводу коронарного события или хирургического вмешательства на коронарных артериях, следует перед выпиской из больницы назначить медикаментозное лечение в случае, если уровень ХС ЛПНП составляет ≥130 мг/дл. При уровне ЛПНП 100–129 мг/дл следует принять клинически обоснованное решение о целесообразности назначения лекарственной терапии до выписки из больницы, учитывая, что уровень ХС ЛПНП начинает снижаться в первые несколько часов после развития события и значительно снижается через 1–2 сут после этого и может оставаться низким в течение многих недель. Поэтому исходный уровень ХС ЛПНП, установленный при поступлении в больницу, может быть значительно ниже обычно отмечаемого у данного пациента. Некоторые специалисты полагают, что медикаментозную терапию следует проводить всякий раз, когда при госпитализации пациента по поводу патологического состояния, связанного с ИБС, уровень ХС ЛПНП составляет >100 мг/дл. Начало проведения фармакотерапии до выписки пациента из стационара имеет 2 преимущества. Во-первых, в это время пациенты имеют особенно высокую мотивацию для выполнения всех вмешательств, направленных на снижение риска. Во-вторых, неудача на начальном этапе проведения назначенного лечения является одной из причин «пробела в терапии», поскольку амбулаторное наблюдение часто является менее адекватным и систематическим.
ЛПНП-снижающая терапия в целях первичной профилактики
Критические уровни ЛПНП для решения вопроса о медикаментозной терапии при первичной профилактике — см. табл. 9.9. Общий подход к проведению лекарственной терапии отражен на рис. 9.3.
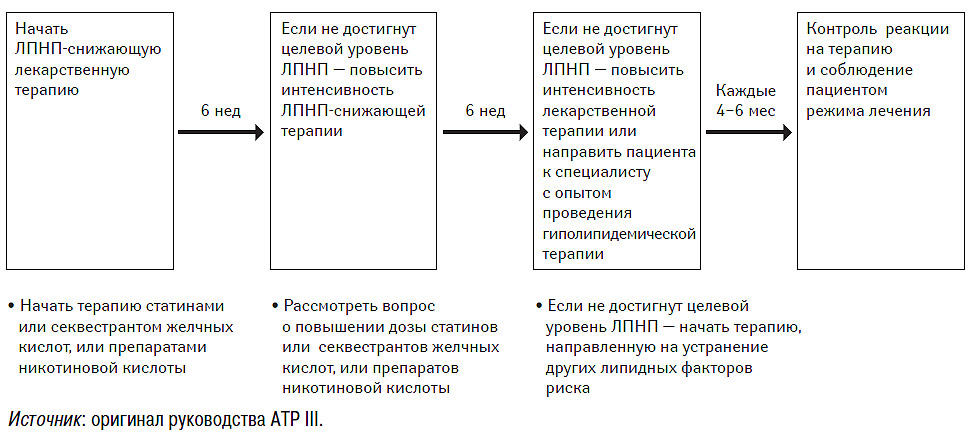
Рис. 9.3. Последовательность проведения медикаментозной терапии
Вопрос о начале проведения лекарственной терапии в целях первичной профилактики, как правило, решается при 3-м посещении врача в рамках проведения диетотерапии (приблизительно через 12 нед после начала ЛИОЖ и ее неэффективности в достижении целевого уровня ЛПНП) (см. рис. 9.2). Даже после начала медикаментозной терапии следует продолжать ЛИОЖ. Как и в случае ЛИОЖ, главной целью медикаментозной терапии является достижение целевого уровня ХС ЛПНП. В связи с этим следует начать фармакотерапию. Обычно начинают с препаратов группы статинов, но можно назначить и секвестрант желчных кислот или никотиновую кислоту. В большинстве случаев лечение статинами необходимо начинать с невысоких доз. У многих пациентов это способствует достижению целевого уровня ХС ЛПНП без применения препарата в более высоких дозах. Реакцию организма на лечение следует проверить через 6 нед после начала медикаментозной терапии. Если целевой уровень достигнут, можно продолжать поддерживающую терапию препаратом в данной дозе. Однако если не удалось достичь целевого уровня, можно повысить интенсивность ЛПНП-снижающей терапии за счет повышения дозы статина либо комбинацией статина с секвестрантом желчных кислот или никотиновой кислотой.
Через 12 нед после начала медикаментозной терапии следует опять проверить реакцию на лечение. Если все еще не удалось достичь целевого уровня ХС ЛПНП, можно рассмотреть вопрос о дальнейшем повышении интенсивности фармакотерапии. Если целевого уровня нельзя достичь посредством стандартной ЛПНП-снижающей терапии, рекомендуется направить пациента к специалисту с опытом проведения гиполипидемической терапии. После достижения целевого уровня ХС ЛПНП следует уделить внимание другим липидным и нелипидным факторам риска. После этого можно осуществлять периодический контроль состояния здоровья пациентов через каждые 4–6 мес, а при необходимости и чаще.
Польза мер, не имеющих отношения к снижению уровня ЛПНП: метаболический синдром как второстепенная цель терапии
Накапливаются факты, свидетельствующие о том, что риск развития ИБС можно снизить не только посредством ЛПНП-снижающей терапии, а и путем влияния на другие факторы риска. Одной из возможных второстепенных целей терапии является метаболический синдром, который представляет собой комплекс липидных и нелипидных факторов риска, обусловленных метаболическими нарушениями. Данный синдром тесно связан с генерализованным нарушением обмена веществ, называемым инсулинорезистентность, при котором снижается эффективность физиологического действия инсулина. Отложение избыточного количества жира (особенно наличие абдоминального ожирения) и низкая физическая активность способствуют развитию инсулинорезистентности, но некоторые лица также имеют генетическую предрасположенность к развитию инсулинорезистентности.
Факторы риска развития метаболического синдрома чрезвычайно согласуются друг с другом и в совокупности повышают риск развития ИБС при любом уровне ХС ЛПНП. Исходя из целей АТР III диагноз «метаболический синдром» ставят в случае наличия 3 или более факторов риска, представленных в табл. 9.12. Эти факторы включают сочетание качественных и пограничных факторов риска, которые можно легко измерить в клинической практике.
Таблица 9.12 Клинические показатели метаболического синдрома
| Фактор риска | Величина показателя, свидетельствующая о наличии риска |
| Абдоминальное ожирение1
Мужчины Женщины |
Окружность талии2
>102 см >88 см |
| ТГ | ≥150 мг/дл |
| ХС ЛПВП
Мужчины Женщины |
<40 мг/дл
<50 мг/дл |
| Артериальное давление | ≥130/≥85 мм рт. ст. |
| Глюкоза крови натощак | ≥110 мг/дл |
1Избыточная масса тела и ожирение ассоциированы с инсулинорезистентностью и метаболическим синдромом. Однако наличие абдоминального ожирения имеет более высокую корреляцию с метаболическими факторами риска по сравнению с повышением индекса массы тела. В связи с этим для выявления обусловленного избыточной массой тела компонента метаболического синдрома рекомендуется простое измерение окружности талии.
2У некоторых пациентов мужского пола могут отмечаться множественные метаболические факторы риска, но при минимальном увеличении окружности талии (например порядка 94–102 см). У таких пациентов может иметься значительная генетическая предрасположенность к инсулинорезистентности. Поэтому изменение образа жизни может принести им пользу, как и мужчинам, у которых отмечается качественный показатель увеличения окружности талии.
Ведение пациентов с метаболическим синдромом имеет 2 цели: 1) устранение причин, лежащих в его основе (то есть ожирения и низкой физической активности) и 2) устранение ассоциированных с ним нелипидных и липидных факторов риска.
Устранение причин, лежащих в основе метаболического синдрома
К методам терапии первой линии в отношении всех липидных и нелипидных факторов риска, ассоциированных с метаболическим синдромом, относятся уменьшение массы тела и повышение физической активности, которые эффективно уменьшают влияние этих факторов риска. Поэтому при наличии метаболического синдрома после осуществления соответствующего контроля ХС ЛПНП, при ЛИОЖ необходимо уделять особое внимание уменьшению массы тела и повышению физической активности.
Контроль массы тела. В АТР III избыточная масса тела и ожирение отнесены к основным факторам риска развития ИБС, поэтому они определены в качестве непосредственной мишени для терапевтических вмешательств. Уменьшение массы тела способствует снижению уровня ЛПНП и ослаблению влияния всех факторов риска метаболического синдрома. Рекомендуемые подходы к уменьшению избыточной массы тела и ожирения представлены в «Клиническом руководстве по выявлению, оценке и терапии избыточной массы тела и ожирения у взрослых» (Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults, 1998), подготовленном в рамках образовательной программы по ожирению Национального института сердца, легких и крови (National Heart, Lung and Blood Institute Obesity Education Initiative).
Физическая активность. Низкая физическая активность также относится к основным факторам риска развития ИБС. Она приводит к увеличению липидных и нелипидных факторов риска метаболического синдрома. Кроме того, низкая физическая активность может приводить к дальнейшему повышению риска за счет снижения адаптационных свойств сердечно-сосудистой системы и ухудшения коронарного кровотока. Регулярные физические нагрузки способствуют снижению уровня ЛПОНП, повышению уровня ХС ЛПВП и, у некоторых лиц, снижению уровня ЛПНП, а также уровня артериального давления, инсулинорезистентности и благоприятно влияют на функционирование сердечно-сосудистой системы. В связи с этим в АТР III рекомендуется, чтобы регулярные физические нагрузки стали стандартным компонентом ведения пациентов с высоким уровнем ХС в сыворотке крови. Накопленные доказательства в пользу данной рекомендации представлены в Докладе главного хирурга США по физической активности (Physical activity and health: a report of the Surgeon General. Atlanta [GA], Georgia: U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, 1996, 300 p.; www.cdc.gov/nccdphp/sgr/sgr.htm).
Специальные методы лечения для устранения липидных и нелипидных факторов риска
Кроме устранения основных факторов риска, методы терапии, направленные на устранение липидных и нелипидных факторов риска метаболического синдрома, позволят снизить риск развития ИБС. К таким методам относятся лечение артериальной гипертензии, применение ацетилсалициловой кислоты у пациентов с ИБС для уменьшения выраженности протромботического состояния, а также снижение повышенного уровня ТГ и повышение низкого уровня ХС ЛПВП (см. Лечение при специфических дислипидемиях).
Специальные вопросы
Лечение при специфических дислипидемиях
Очень высокий уровень ХС ЛПНП (>190 мг/дл). У пациентов с очень высоким уровнем ХС ЛПНП обычно имеются генетические формы гиперхолестеринемии: моногенная семейная гиперхолестеринемия, семейный дефект гена аполипопротеина В (гипо- и абеталипопротеидемия) и полигенная гиперхолестеринемия. Раннее выявление этих нарушений посредством определения уровня ХС у лиц молодого возраста необходимо для предотвращения раннего развития ИБС. Обследование членов семьи имеет важное значение для выявления родственников со сходными патологическими состояниями. Эти нарушения часто требуют проведения комбинированной лекарственной терапии (статинами и секвестрантами желчных кислот) для достижения целевых уровней ЛПНП.
Повышенный уровень ТГ в сыворотке крови. Результаты недавно проведенного метаанализа проспективных исследований свидетельствуют, что повышение уровня ТГ также является независимым фактором риска развития ИБС. К факторам, способствующим повышению уровня (выше нормы) ТГ в общей популяции, относятся: ожирение и избыточная масса тела, низкая физическая активность, табакокурение, злоупотребление алкоголем, потребление пищевых продуктов с высоким содержанием углеводов (>60% энергетической ценности диеты), некоторые заболевания (например сахарный диабет 2-го типа, хроническая почечная недостаточность, нефротический синдром), определенные лекарственные средства (например кортикостероиды, эстрогены, ретиноиды, блокаторы β-адренорецепторов в высоких дозах) и генетические нарушения — семейная смешанная гиперлипидемия, семейная гипертриглицеридемия и семейная дисбеталипопротеидемия.
В клинической практике повышенный уровень ТГ в сыворотке крови чаще всего отмечается у лиц с метаболическим синдромом, хотя наличие вторичных или генетических факторов может привести к повышению уровня ТГ. В АТР III принята следующая классификация уровня ТГ в сыворотке крови:
- нормальный: <150 мг/дл;
- погранично высокий: 150–199 мг/дл;
- высокий уровень: 200–499 мг/дл;
- очень высокий: ≥500 мг/дл.
Выявление того факта, что повышение уровня ТГ — независимый фактор риска развития ИБС, позволяет предположить наличие атерогенных свойств у некоторых липопротеидов, богатых ТГ. К последним относятся частично расщепленные ЛПОНП, обычно называемые ремнантными липопротеидами. В клинической практике ХС ЛПОНП является наиболее доступным показателем атерогенных ремнантных липопротеидов. Таким образом, ХС ЛПОНП может служить мишенью гипохолестеринемической терапии. В АТР III сумма ХС ЛПНП и ХС ЛПОНП [называемая ХС липопротеидов невысокой плотности (или: общий ХС минус ХС ЛПВП)] определена в качестве второстепенной цели терапии у лиц с высоким уровнем ТГ (≥200 мг/дл). Целевой уровень ХС липопротеидов невысокой плотности у лиц с высоким уровнем ТГ в сыворотке крови можно установить на 30 мг/дл выше по сравнению с уровнем ХС ЛПНП (табл. 9.13) исходя из того, что нормальный уровень ХС ЛПОНП составляет ≤30 мг/дл.
Таблица 9.13 Сравнение целевых уровней ХС ЛПНП и ХС липопротеидов невысокой плотности для 3 групп риска
| Группа риска | Целевой уровень ХС ЛПНП, мг/дл | Целевой уровень ХС липопротеидов невысокой плотности, мг/дл |
| ИБС и риск, эквивалентный ИБС (10-летний риск ИБС — 20%) | <100 | <130 |
| Множественные (>2) факторы риска и 10-летний риск ИБС ≤20% | <130 | <160 |
| 0–1 фактор риска | <160 | <190 |
Тактика лечения при повышенном уровне ТГ зависит от причин и степени его повышения. Первостепенная цель терапии для всех лиц с повышенным уровнем ТГ заключается в достижении целевого уровня ХС ЛПНП. Если уровень ТГ является погранично высоким (150–199 мг/дл), следует также уделить внимание уменьшению массы тела и повышению физической активности. При высоком уровне ТГ (200–499 мг/дл) уровень ХС липопротеидов невысокой плотности становится второстепенной целью терапии. Помимо уменьшения массы тела и повышения физической активности, у лиц группы высокого риска можно рассмотреть вопрос о проведении лекарственной терапии для достижения целевого уровня ХС липопротеидов невысокой плотности. Есть два подхода к проведению медикаментозной терапии. Первый — целевого уровня ХС липопротеидов невысокой плотности можно достичь за счет повышения интенсивности терапии лекарственным средством для снижения ЛПНП; второй — можно присоединить препарат никотиновой кислоты или фибратов (если соблюдается необходимая осторожность) для достижения целевого уровня ХС липопротеидов невысокой плотности за счет дальнейшего снижения уровня ХС ЛПОНП. В редких случаях, когда уровень ТГ очень высокий (≥500 мг/дл), начальная цель терапии состоит в предотвращении развития острого панкреатита путем снижения уровня ТГ. Данный подход требует назначения диеты с очень низким содержанием жиров (≤15% суточной калорийности диеты), уменьшения массы тела, повышения физической активности и, как правило, назначения лекарственных средств, снижающих уровень ТГ (фибратов или никотиновой кислоты). Только после снижения уровня ТГ порядка <500 мг/дл основной акцент терапии смещается в сторону снижения уровня ЛПНП для снижения риска ИБС.
Сниженный уровень ХС ЛПВНП. Низкий уровень ХС ЛПВП является сильным независимым прогностическим фактором ИБС. В АТР III низкий уровень ХС ЛПВП составляет <40 мг/дл (в предыдущем Руководстве 1994 г. — <35 мг/дл). В настоящем Руководстве низкий уровень ХС ЛПВП влияет на цель ЛПНП-снижающей терапии, а также используется в качестве фактора риска для оценки 10-летнего риска развития ИБС.
Имеется ряд причин снижения уровня ХС ЛПВП, многие из которых ассоциированы с инсулинорезистентностью (то есть повышенный уровень ТГ, избыточная масса тела и ожирение, низкая физическая активность, сахарный диабет 2-го типа). К другим причинам относятся табакокурение, употребление с пищей очень большого количества углеводов (>60% суточной калорийности диеты) и прием некоторых лекарственных средств (например блокаторов β-адренорецепторов, анаболических стероидов, гестагенов).
В АТР III не установлена цель для повышения уровня ЛПВП. Несмотря на то что результаты клинических испытаний позволяют предположить, что повышение уровня ЛПВП может снизить риск, пока недостаточно доказательств для определения целевого уровня терапии. Кроме того, применение имеющихся в настоящее время лекарственных средств не способствует устойчивому повышению уровня ХС ЛПВП. Тем не менее, низкий уровень ЛПВП требует внимания клинициста и ведения пациента в соответствии с нижеуказанной последовательностью. У всех лиц с низким уровнем ХС ЛПВП первостепенной целью терапии является достижение целевого уровня ХС ЛПНП посредством соблюдения указаний данного Руководства. После достижения целевого уровня ЛПНП основное внимание уделяют уменьшению массы тела и повышению физической активности (при наличии метаболического синдрома). В случаях когда низкий уровень ХС ЛПВП сочетается с высоким уровнем ТГ (200–499 мг/дл), второстепенной целью становится достижение целевого уровня ХС липопротеидов невысокой плотности в соответствии с вышепредставленными указаниями. При уровне ТГ <200 мг/дл (изолированное снижение уровня ХС ЛПВП) можно назначить лекарственные средства, повышающие ЛПВП (фибраты или никотиновую кислоту); однако терапия по поводу изолированного низкого уровня ЛПВП в основном применяется в качестве резервной для лиц с ИБС и рисками, эквивалентными ИБС.
Диабетическая дислипидемия. Данное нарушение является по существу атерогенной дислипидемией (высокий уровень ТГ, низкий — ЛПВП, наличие мелких плотных субфракций ЛПНП) у лиц с сахарным диабетом 2-го типа. Хотя повышенный уровень ТГ и/или низкий уровень ХС ЛПВП часто отмечают у лиц с сахарным диабетом, результаты клинических испытаний свидетельствуют в пользу достижения определенного уровня ХС ЛПНП в качестве первостепенной цели терапии, как это установлено для пациентов без сахарного диабета. Поскольку в АТР III сахарный диабет указан в качестве риска, эквивалентного ИБС, то целевой уровень ХС ЛПНП для лечения большинства пациентов с сахарным диабетом составит <100 мг/дл. Кроме того, при уровне ХС ЛПНП ≥130 мг/дл большинству пациентов с сахарным диабетом потребуется терапия лекарственными средствами, снижающими ЛПНП, начиная одновременно с ЛИОЖ для достижения целевого уровня ЛПНП. При уровне ХС ЛПНП (исходном или в ходе проведения терапии) в диапазоне 100–129 мг/дл имеется несколько возможных вариантов терапии: повышение интенсивности ЛПНП-снижающей терапии, дополнительное назначение лекарственного средства для устранения атерогенной дислипидемии (фибратов или никотиновой кислоты) или осуществление более интенсивных мер контроля других факторов риска, включая гипергликемию. При уровне ТГ ≥200 мг/дл второстепенной целью гипохолестеринемической терапии становится уровень ХС липопротеидов невысокой плотности. В отношении лиц пожилого возраста (>65 лет) с сахарным диабетом, но без наличия каких-либо дополнительных факторов риска ИБС, за исключением возраста, необходимо принять клинически обоснованное решение о степени соблюдения рекомендаций данного руководства в отношении интенсивности проводимого лечения; на принятие решения о тактике лечения и в пользу проведения более щадящей терапии может повлиять наличие разных факторов, включая сопутствующие заболевания, общее состояние здоровья пациента и некоторые социальные факторы.
Особые замечания в отношении различных подгрупп пациентов
Мужчины среднего возраста (35–65 лет). В целом у мужчин риск развития ИБС выше, чем у женщин. У мужчин среднего возраста особенно высока распространенность основных факторов риска, они предрасположены к абдоминальному ожирению и развитию метаболического синдрома. Значительная доля всех случаев ИБС приходится на мужчин среднего возраста. В связи с этим у многих мужчин данной возрастной группы высок риск ИБС, и тем, у кого уже имеется ИБС, необходимо проведение интенсивной ЛПНП-снижающей терапии.
Женщины в возрасте 45–75 лет. У женщин ИБС обычно развивается на 10–15 лет позже по сравнению с мужчинами; поэтому большинство случаев ИБС регистрируют у женщин в возрасте >65 лет. Все факторы риска влияют на развитие ИБС у женщин, и большая часть случаев раннего развития ИБС (в возрасте <65 лет) у них отмечается при наличии множественных факторов риска и метаболического синдрома. Вопреки ранее существовавшему мнению о том, что половые различия в степени риска развития ИБС отражают защитный эффект эстрогенов у женщин, результаты недавно проведенных испытаний по первичной и вторичной профилактике заставили сомневаться в пользе заместительной гормональной терапии для снижения риска ИБС у женщин в постменопаузальный период. Напротив, благоприятные эффекты терапии статинами у женщин, установленные в результате клинических испытаний, свидетельствуют о предпочтительности применения для снижения риска развития ИБС гипохолестеринемических средств по сравнению с гормонозаместительной терапией. В целях вторичной профилактики лечение женщин проводят так же, как и мужчин. В целях первичной профилактики общий подход руководства АТР III применим равным образом как к женщинам, так и мужчинам. Однако при принятии клинически обоснованных решений о применении гипохолестеринемических средств следует учитывать более позднее развитие ИБС у женщин.
Лица пожилого возраста (мужчины в возрасте >65 лет и женщины >75 лет). В целом, большинство новых случаев коронарных ишемических событий и коронарной смерти отмечают у лиц пожилого возраста (≥65 лет). Высокий уровень ХС ЛПНП и низкий уровень ХС ЛПВП еще сохраняют прогностическую ценность в отношении развития ИБС у лиц пожилого возраста. Однако выявление прогрессирующего субклинического атеросклероза посредством неинвазивного исследования может оказаться полезным для подтверждения наличия высокого риска ИБС у лиц пожилого возраста. В клинические испытания по применению статинов при вторичной профилактике было включено значительное число лиц пожилого возраста, преимущественно 65–75 лет. В этих испытаниях доказано значительное снижение риска ИБС у лиц пожилого возраста в результате терапии статинами. Таким образом, по-видимому, нет необходимости в каких-либо жестких возрастных ограничениях при отборе пациентов с наличием ИБС для проведения ЛПНП-снижающей терапии. В целях проведения первичной профилактики у лиц пожилого возраста ЛИОЖ является терапией первой линии. Тем не менее, применение лекарственных средств, снижающих ЛПНП, также возможно в отношении лиц пожилого возраста группы повышенного риска в связи с наличием множественных факторов риска или при прогрессирующем субклиническом атеросклерозе.
Взрослые молодого возраста (мужчины 20–35 лет, женщины 25–45 лет). В данной группе ИБС отмечают редко, за исключением случаев наличия у пациента сильных факторов риска (например семейная гиперхолестеринемия, курение большого числа сигарет или сахарный диабет). Несмотря на то что клиническую форму ИБС выявляют в данном возрасте относительно редко, возможно быстрое прогрессирование коронарного атеросклероза на ранних стадиях. Частота развития коронарного атеросклероза в более раннем возрасте коррелирует с основными факторами риска. В частности, результаты длительных проспективных исследований свидетельствуют, что повышенный уровень ХС в сыворотке крови у взрослых молодого возраста является прогнозом повышенной частоты раннего развития ИБС в среднем возрасте. Таким образом, выявление факторов риска у взрослых молодого возраста является важной целью, поскольку снижение ХС ЛПНП посредством изменения образа жизни предоставляет возможность замедлить или предотвратить развитие ИБС в более позднем возрасте. Взрослым молодого возраста с уровнем ХС ЛПНП ≥130 мг/дл следует назначить ЛИОЖ и акцентировать внимание на важности его значения.
Особое внимание следует уделять курящим мужчинам молодого возраста с высоким уровнем ХС ЛПНП (160–189 мг/дл); они могут являться кандидатами на терапию лекарственными средствами, снижающими ЛПНП. При наличии очень высокого уровня ХС ЛПНП (≥190 мг/дл) у взрослых молодого возраста рекомендуется проведение медикаментозной терапии по схеме, используемой при лечении взрослых других возрастных групп. Лицам с тяжелыми генетическими формами гиперхолестеринемии может потребоваться назначение лекарственных средств, снижающих ЛПНП (например статин + секвестрант желчных кислот).
Расовые и этнические группы. Среди афроамериканцев наиболее высокая общая смертность вследствие ИБС и самая высокая внегоспитальная смертность от ИБС из всех этнических групп в США, особенно среди лиц более молодого возраста. Несмотря на то что причины более высокой смертности вследствие ИБС среди афроамериканцев полностью не установлены, она может буть обусловлена, по крайней мере частично, высокой распространенностью коронарных факторов риска. У афроамериканцев чаще, чем у белых, фиксируют артериальную гипертензию, гипертрофию миокарда левого желудочка (ЛЖ), сахарный диабет, табакокурение, ожирение, низкую физическую активность и множественные факторы риска развития ИБС. Другие этнические группы и национальные меньшинства США представляют латиноамериканцы, коренные американцы, уроженцы островов Азиатско-Тихоокеанского региона и Южной Азии. Хотя ограниченные данные позволяют предположить, что расовые и этнические группы несколько отличаются по степени исходного риска развития ИБС, этих данных оказалось недостаточно для того, чтобы эксперты АТР III смогли изменить общие рекомендации по ведению лиц с гиперхолестеринемией в данных группах.
Соблюдение рекомендаций по ЛПНП-снижающей терапии
Соблюдение рекомендаций АТР III как пациентами, так и медицинскими работниками является решающим фактором для приближения к той эффективности лечения, польза от которого продемонстрирована в клинических испытаниях по гиполипидемической терапии. Внимание соблюдению рекомендаций необходимо уделять в целях достижения по возможности самой высокой степени снижения риска развития ИБС. Поэтому в АТР III рекомендуется использовать современные многопрофильные методы охвата целевых групп пациентов, врачей и систем оказания медицинской помощи для достижения эффективности рекомендаций руководства по первичной и вторичной профилактике на уровне всего населения страны (табл. 9.14).
Таблица 9.14 Вмешательства для улучшения соблюдения рекомендаций
В отношении пациента
В отношении врача и медицинского учреждения
В отношении системы оказания медицинской помощи
|
Клинические алгоритмы
1. Обязанности врача при первом визите пациента (рис. 9.4).
2. Подходы к лечению лиц с ИБС или рисками, эквивалентными ИБС (рис. 9.5).
3. Подходы к терапии у лиц с множественными факторами риска, 10-летним риском 10–20% (рис. 9.6).
4. Подходы к лечению пациентов со множественными (>2) факторами риска, 10-летним риском <10% (рис. 9.7).
5. Подходы к терапии у лиц с 0–1 фактором риска (рис. 9.8).
6. Примерная схема этапов ЛИОЖ (см. рис. 9.2).
7. Последовательность проведения медикаментозной терапии (см. рис. 9.3).
Доказательства в пользу рекомендаций
Вид доказательств в пользу рекомендаций
Руководство 2001 г.
Доказательства получены на основе результатов клинических испытаний, проспективных эпидемиологических исследований, доклада главного хирурга США по физической активности и метаанализа проспективных исследований. Ранжирование доказательств представлено в оригинале доклада АТР III (см. также Рейтинговая система оценки силы доказательств).
Дополнение 2004 г.
Доказательства получены на основе результатов пяти клинических испытаний.
Польза/вред от внедрения рекомендаций руководства
Потенциальная польза
Эффективное выявление, оценка и терапия при гиперхолестеринемии у взрослых могут способствовать снижению заболеваемости и смертности вследствие ИБС.
Вопросы общей смертности и терапетической безопасности
- Польза от снижения уровня ХС в отношении смертности. Терапия, направленная на снижение уровня ЛПНП, способствует снижению общей смертности (то есть продлевает жизнь за счет снижения заболеваемости ИБС). Эта польза от терапии не была точно установлена в ранее проведенных испытаниях, в которых применяли вмешательства с ограниченным снижением уровня ХС (на 10%); в некоторых из указанных испытаний установлены неблагоприятные эффекты в отношении заболеваний, не относимых к ИБС. Однако в клинических испытаниях с применением статинов, в которых уровень ХС снижался на 20% и не повышалась смертность вследствие заболеваний, не относимых к ИБС, неопровержимо доказано снижение смертности.
- Польза от снижения уровня ХС при вторичной профилактике в отношении смертности. Данные о пользе снижения уровня ХС для продолжительности жизни особенно убедительны у пациентов с ИБС и других групп высокого риска, что обусловлено высокой смертностью в ближайший период при отсутствии лечения пациентов данных групп, а также большой долей случаев смерти вследствие ИБС. У лиц с установленной ИБС уменьшение числа случаев смерти вследствие ИБС в результате проведения эффективной гипохолестеринемической терапии неоспоримо превышает значимость каких-либо побочных эффектов медикаментозной терапии.
- Польза от снижения уровня ХС при первичной профилактике в отношении смертности. Результаты клинических испытаний, касающиеся первичной профилактики с применением статинов, продемонстрировали значительное снижение смертности вследствие ИБС, отсутствие повышения смертности, не обусловленной ИБС, а также отчетливую тенденцию к снижению общей смертности. В связи с меньшей долей случаев смерти, обусловленных ИБС, в испытаниях по первичной профилактике (по сравнению с отмечаемой при вторичной профилактике) последняя тенденция не является значимой. Клинические испытания с применением статинов проводили в среднем в течение 5 лет; обсервационные исследования большей продолжительности служат более наглядным свидетельством потенциального влияния снижения ХС на смертность на протяжении всей жизни пациента. Отсутствие общего снижения смертности при проведении клинических испытаний по первичной профилактике до открытия статинов можно объяснить незначительным снижением уровня ХС (<10%) и, в некоторых случаях, неблагоприятными эффектами в отношении заболеваний, не относимых к ИБС, которые не отмечали при терапии статинами.
Возможный вред
Побочные эффекты медикаментозной терапии
1. Ингибиторы ГМГ-КоА-редуктазы (статины):
- миопатия;
- повышение активности печеночных ферментов.
2. Секвестранты желчных кислот:
- ЖКТ-расстройства;
- запор;
- ухудшение всасывания других лекарственных средств.
3. Препараты никотиновой кислоты:
- приливы крови;
- гипергликемия;
- гиперурикемия (или подагра);
- расстройства верхних отделов пищеварительного тракта;
- гепатотоксичность.
4. Фибраты:
- диспепсия;
- холелитиаз;
- миопатия;
- необъяснимые смертные случаи вследствие заболеваний, не относимых к ИБС, отмеченные в исследовании, проведенном ВОЗ.
Противопоказания
Противопоказания для проведения медикаментозной терапии
1. Ингибиторы ГМГ-КоА-редуктазы (статины)
Абсолютные:
- активная или хроническая форма заболевания печени.
Относительные:
- одновременное применение некоторых лекарственных средств (циклоспорина, макролидных антибиотиков, различных противогрибковых препаратов и средств, ингибирующих систему цитохрома Р450 [необходима осторожность при применении фибратов и никотиновой кислоты]).
2. Секвестранты желчных кислот
Абсолютные:
- дисбеталипопротеидемия;
- уровень ТГ >400 мг/дл.
Относительные:
- уровень ТГ >200 мг/дл.
3. Никотиновая кислота
Абсолютные:
- ХБП;
- тяжелая форма подагры.
Относительные:
- сахарный диабет;
- гиперурикемия;
- пептическая язва.
4. Фибраты
Абсолютные:
- тяжелое заболевание почек;
- заболевание печени.
Алгоритмы принятия решения по диагностике, лечению и профилактике гиперлипидемий
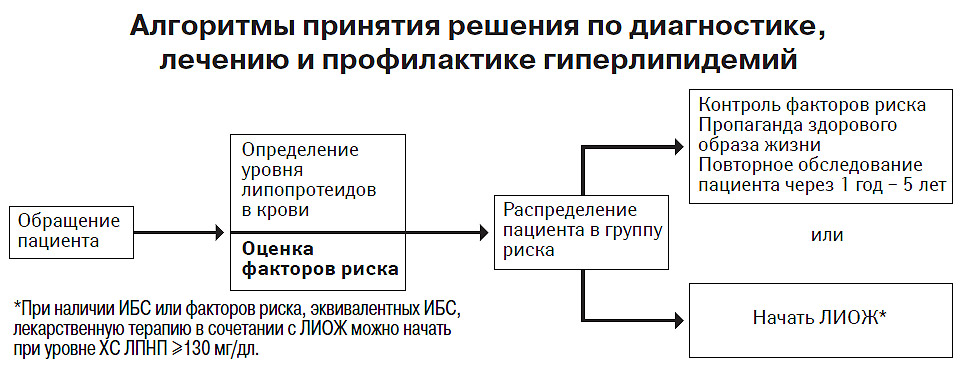
Рис. 9.4. Алгоритм действий врача при первичном обращении пациента
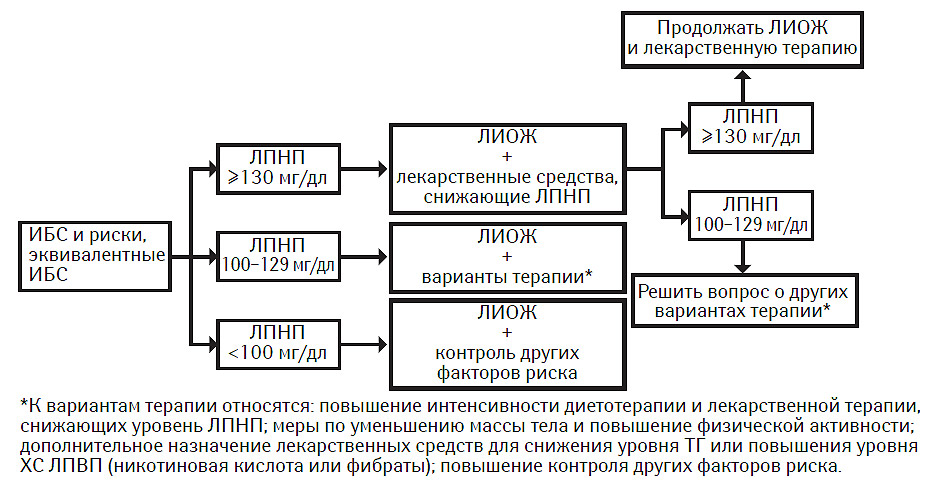
Рис. 9.5. Алгоритм терапии для лиц с ИБС или рисками, эквивалентными ИБС (целевой уровень ЛПНП <100 мг/дл)
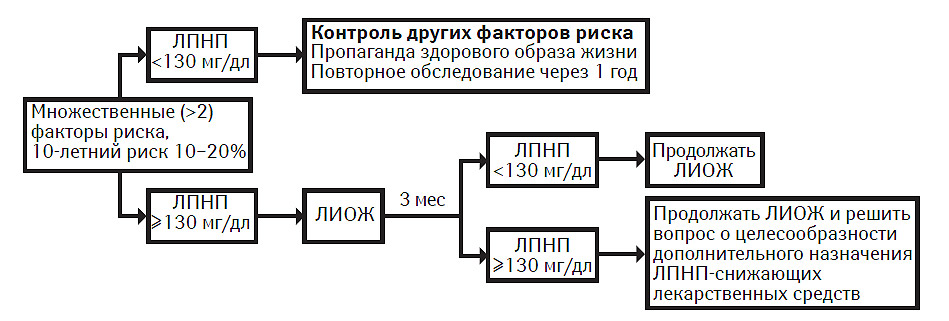
Рис. 9.6. Алгоритм терапии для лиц с множественными факторами риска, с 10-летним риском 10–20% (целевой уровень ЛПНП <130 мг/дл; назначение лекарственных средств возможно при необходимости достижения целевого уровня ХС ЛПНП в случае, если после проведения ЛИОЖ уровень ХС ЛПНП составляет ≥130 мг/дл)
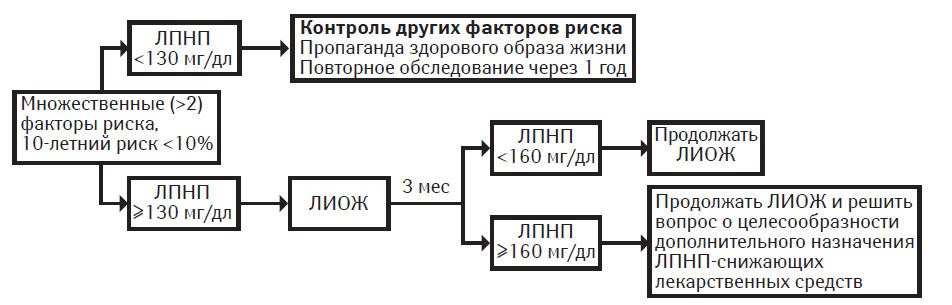
Рис. 9.7. Алгоритм терапии для лиц с множественными (>2) факторами риска, с 10-летним риском <10% (целевой уровень ЛПНП <130 мг/дл; назначение лекарственных средств возможно в случае, если после проведения ЛИОЖ уровень ХС ЛПНП составляет ≥160 мг/дл)
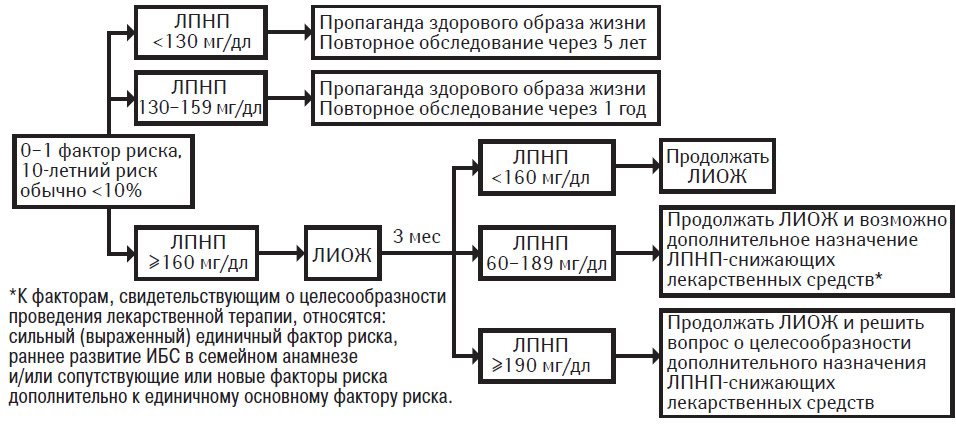
Рис. 9.8. Алгоритм терапии для лиц с 0–1 фактором риска (целевой уровень ЛПНП <160 мг/дл; назначение лекарственных средств возможно в случае, если после проведения ЛИОЖ уровень ХС ЛПНП составляет ≥190 мг/дл; если ХС ЛПНП составляет 160–189 мг/дл, то возможно проведение лекарственной терапии на основе клинически обоснованной целесообразности)
Основные принципы лечения гиперлипидемий в соответствии с рекомендациями British Hyperlipidaemia Association (1993; 2002)
Принципиальных различий в подходах к диагностике и лечению гиперлипидемий между действующими рекомендациями British Hyperlipidaemia Association и NCEP Adult Treatment Panel III нет. Эксперты обеих организаций исходят из необходимости оценки агрессивности программ профилактики кардиоваскулярных событий/метаболических нарушений/панкреатита в зависимости от исходного риска их возникновения. Вместе с тем, в рекомендациях British Hyperlipidaemia Association предлагается выделение приоритетности в назначении гиполипидемических лекарственных средств пациентам независимо от эффективности немедикаментозной терапии, включающей диетические ограничения и иные направления в модификации образа жизни (Betteridge D.J. et al., 1993). Так, приоритетность в инициальном назначении гиполипидемических лекарственных средств имеют пациенты с документированной ИБС (в том числе перенесшие инфаркт миокарда, аортокоронарное шунтирование или иные реваскуляризационные процедуры, трансплантацию сердца), лица с множественными (>2) факторами риска, особенно с семейными формами гиперлипидемий, лица мужского пола, а также женщины в постменопаузальный период с асимптомной гиперхолестеринемией. Выбор инициального гиполипидемического препарата, а также препарата второй линии представлен в табл. 9.15.
Таблица 9.15 Выбор препаратов первой и второй линии для лечения гиперлипидемии в соответствии с рекомендациями British Hyperlipidaemia Association
| Тип гиперлипидемии по Фредриксону | Уровень ХС | Уровень ТГ | Уровень ЛПНП | Тяжесть гиперлипидемии | Выбор гиполипидемического препарата | |
| Первая линия | Вторая линия | |||||
| Тип IIa | ↑ | Нормальный или ↑ | ↑ | Умеренная | Секвестранты желчных кислот | Фибраты |
| Тяжелая | Статины | Пробукол | ||||
| Секвестранты желчных кислот + статины | ? | |||||
| Тип IIb | ↑ | ↑ | ↑ | Умеренная | Фибраты | ? |
| Тяжелая | Секвестранты желчных кислот + статины | Секвестранты желчных кислот + фибраты | ||||
| Тип III | ↑ | ↑ | Нормальный или ↓ | Обычно тяжелая | Фибраты | Статины |
| Тип IV | Нормальный или ↑ | ↑ | ↑ | Умеренная | Фибраты | Статины |
| Тяжелая | Фибраты + статины | ? | ||||
| Тип V | ↑ | ↑ | ↑ | Всегда тяжелая | Фибраты + статины | Статины + ω-3 ПНЖК |
В целом эти рекомендации сохраняют основные принципиальные подходы к лечению гиперлипидемий, изложенные выше, делая исключение только для детей в возрасте младше 5 лет. Более подробно тактика лечения в этой популяции рассматривается в главе 15.
Основные принципы гиполипидемической терапии в соответствии с UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008)
Отличительной особенностью этого документа (Cooper A. et al., 2008) является настоятельное требование к обязательному измерению плазменного содержания общего ХС, ХС ЛПНП, ХС ЛПВП и ТГ с последующим расчетом величины кардиоваскулярного риска до проведения любых программ первичной профилактики возникновения сердечно-сосудистых событий. Кардиоваскулярный риск может быть оценен в соответствии с системой Framingham (1991), PROCAM coronary heart disease risk (2003), ASSIGN (2008), QRISK (2008), SCORE (2002) или Joint British recommendations on prevention of coronary heart disease in clinical practice (British Cardiac Society, British Hyperlipidaemia Association, British Hypertension Society, endorsed by the British Diabetic Association, 1998; Empana J.P., et al., 2003; Hippisley-Cox J. et al., 2008).
Эксперты UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008) полагают, что система оценки риска Framingham (1991) не в полной мере удовлетворяет требованиям к точному измерению величины кардиоваскулярного риска (Hense H.W. et al., 2003; Hippisley-Cox J. et al., 2007). Так, результаты исследования Framingham получены в результате наблюдения за фиксированной популяцией лиц, проживающих в США в период с 1960 по 1970 г. (Bastuji-Garin S. et al., 2002). Кроме того, наблюдается отчетливая тенденция к недооценке риска европейской популяции на основании шкал системы Framingham, а также имеются серьезные ограничения для экстраполяции данных Framingham на популяцию лиц с ранними случаями возникновения ИБС в семье и иными дополнительными факторами риска (Bastuji-Garin S. et al., 2002; Cappuccio F.P. et al., 2002; Brindle P. et al., 2003; Brindle P.M. et al., 2006a; b), в том числе артериальной гипертензией, особенно при проведении антигипертензивной терапии (Grover S.A. et al., 1995; Hetlevik I. et al., 1999; Gigerenzer G., Edwards A., 2003). Кроме того, при проведении скрининговых мероприятий необходимо учитывать еще расовые и этнические различия (Brindle P. et al., 2003; Brindle P. et al., 2006). Все это послужило основанием для предпочтения иных систем оценки кардиоваскулярного риска, таких как ASSIGN (2008), QRISK (2008) или SCORE (2002) (Beswick A.D. et al., 2008). Желательным является использование нескольких шкал оценки риска (Beswick A.D. et al., 2008; Hippisley-Cox J. et al., 2008). В дальнейшем используется наиболее высокая величина риска, полученная в одной из выше приведенных шкал. Однако, по мнению J. Hippisley-Cox и соавторов (2008), точность, воспроизводимость и прогностическая ценность системы QRISK (2008) является наиболее высокой.
Калькуляторы для оценки кардиоваскулярного риска можно получить в свободном доступе по адресам:
www.bmj.com/cgi/content/short/bmj.39261.471806.55v1
www.bmj.com/cgi/eletters/335/7611/136#174181
В том случае, когда у пациента подозревают одну из семейных форм гиперлипидемии, рекомендуется дополнительная оценка данных семейного анамнеза и результатов объективных/дополнительных методов исследования с целью идентификации ИБС у пробанда и/или родственников первой степени родства. Аналогичный подход рекомендован для всех случаев верификации тяжелой гиперлипидемии независимо от ее этиологии. Основные подходы к стратегии проведения программ первичной и вторичной профилактики кардиоваскулярных событий представлены в Приложении.
Необходимо отметить, что, в отличие от рекомендаций NCЕP АТР III в UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008), акцент при инициальной оценке состояния нарушений липидного обмена делается на измерение содержания общего ХС, ХС ЛПВП, а также расчета их соотношения. Предполагается, что последнее как компонент в расчете величины кардиоваскулярного риска может повысить точность его оценки (Grover S.A. et al., 1995). Так, у лиц с содержанием общего ХС в плазме крови 5,2 ммоль/л и ХС ЛПВП 0,7 ммоль/л их соотношение будет составлять 7,4 ед., что подтверждает наличие высокого риска возникновения ИБС, несмотря на популяционно нормальный уровень общего ХС. Напротив, у лиц с содержанием общего ХС 8 ммоль/л и ХС ЛПВП 1,6 ммоль/л соотношение данных показателей существенно ниже и будет составлять 5,0 ед. Это указывает на то, что, несмотря на наличие гиперхолестеринемии, реализующейся преимущественно за счет ХС ЛПВП, величина кардиоваскулярного риска меньше, чем таковая у пациентов с более низким уровнем ХС ЛПВП без гиперхолестеринемии. Таким образом, по мнению S.A. Grover и соавторов (1995), анализ соотношения общий ХС/ХС ЛПВП может оказаться особенно полезным при оценке величины кардиоваскулярного риска у лиц с многочисленными факторами риска.
Рекомендации по модификации образа жизни отличаются некоторой сдержанностью. Оригинальный документ содержит сведения, касающиеся ограничения общего калоража пищи на 30%, снижения употребления насыщенных жиров на 10% и рекомендации о желательной замене насыщенных жирных кислот на ПНЖК на фоне уменьшения общего потребления ХС с пищей до 300 мг/сут. Причем необходимо отметить, что эксперты UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008) не считают нужным рекомендовать применение препаратов, содержащих ω-3 ПНЖК, растительные стеролы и станолы, в программах первичной профилактики кардиоваскулярных событий и у беременных с высоким кардиоваскулярным риском. Кроме того, необходимо отметить, что, несмотря на общепризнанное правило об ограничении употребления жирной пищи и обогащении пищевого рациона овощами и фруктами, каких-либо специально спланированных рандомизированных контролируемых исследований, в которых бы тестировалась эта гипотеза с точки зрения эффективности программ первичной профилактики, не проведено. Тем не менее, указанная рекомендация занимает прочное место среди традиционных направлений модификации образа жизни. Напротив, существует хорошо спланированное исследование STARS (St Thomas’ Atherosclerosis Regression Study), посвященное оценке влияния расширения употребления в пищу свежих овощей и фруктов, а также снижения суточного потребления жиров, в отношении частоты возникновения твердой клинической конечной точки: кардиоваскулярная смерть, инфаркт миокарда, потребность в проведении ангиопластики или инсульт (Watts G.F. et al., 1992). Оказалось, что гиполипидемическая диета способна редуцировать частоту возникновения всех кардиоваскулярных событий на 35% (р<0,05), а также благоприятно отражалась на снижении тяжести и количества эпизодов стенокардии (р<0,05) (Watts G.F. et al., 1992). Таким образом, эффективность гиполипидемической диеты доказана для программ вторичной превенции, хотя объем накопленных сведений также невелик.
Полный текст клинических рекомендаций по модификации образа жизни (в том числе уменьшения массы тела, отказа от курения и употребления алкоголя), а также использования гиполипидемической диеты, можно свободно получить по адресам:
www.eatwell.gov.uk/healthydiet
http://guidance.nice.org.uk/CG43
www.5aday.nhs.uk
Рекомендации по расширению физической активности должны соответствовать следующим условиям: 30 мин в умеренном темпе, не менее 5 раз в неделю. Пациенты, которые не могут в силу своего состояния выполнить подобные рекомендации, должны придерживаться совета о необходимости выполнения тренирующей нагрузки без изменения профиля безопасности для эволюции своего заболевания. Интенсивность физической нагрузки в этом случае регламентируется врачом, а временной интервал ее выполнения должен быть не менее 10 мин/день.
Выбор гиполипидемической терапии в программах первичной или вторичной профилактики возникновения кардиоваскулярных событий должен быть осуществлен с учетом объема и уровня полученных для каждого из препаратов доказательств. При этом перед началом терапии необходимо по возможности модифицировать все идентифицированные факторы риска, включая артериальную гипертензию, курение, избыточную массу тела, употребление алкоголя, сахарный диабет/метаболический синдром, а также провести скрининг в отношении возможной дисфункции щитовидной железы. Если по каким-либо причинам не представляется возможным достичь устойчивого контроля над указанными факторами риска, включая недостаток времени для проведения эффективных мероприятий, гиполипидемическая терапия должна быть назначена с рекомендациями о продолжении модификации образа жизни и контроля за ней.
Собственно выбор инициального гиполипидемического препарата в соответствии с UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008) также отличается от ранее цитируемых источников. Так, для проведения первичной профилактики в когорте пациентов с 10-летним риском развития кардиоваскулярных событий >20% рутинно рекомендуются статины как препараты с наиболее оптимальным профилем эффективности и безопасности, что может иметь определяющее значение для пациентов с коморбидными состояниями. При этом в качестве инициального препарата предлагается симвастатин в дозе 40 мг/сут. Если существует опасность клинически значимого взаимодействия с другими лекарственными средствами, особенно вовлекаемыми в деградацию на системе цитохромов, то в качестве инициального препарата необходимо рассмотреть правастатин в средних дозах. Эксперты дополнительно указывают на отсутствие существенной необходимости применения высоких доз статинов для рутинной клинической практики в программах первичной профилактики. Вместе с тем, если целевой уровень ХС ЛПНП не достигается, необходимо заменить симвастатин аторвастатином в средних дозах. Обращается внимание на то, что нет крайней необходимости в повторении измерений содержания липидов в плазме крови при проведении программ первичной профилактики, если терапия статином уже осуществляется. Отметим, что для первичной профилактики фибраты, секвестранты желчных кислот и производные никотиновой кислоты резервируются только для тех случаев, когда статины оказываются или малоэффективными, или плохо переносятся и требуется их отмена. Эзетимиб рекомендован для лечения пациентов с семейной гиперхолестеринемией в монотерапии или в сочетании со статинами. Комбинация статина с фибратом, производным никотиновой кислоты или секвестрантом желчных кислот, а также с ω-3 ПНЖК при проведении программ первичной превенции не рекомендована. В программах вторичной профилактики инициальным классом лекарственных средств являются статины. Причем выбор молекулы должен определяться, в том числе, и ожидаемой стоимостью лечения. Интенсивная стратегия лечения с применением препаратов в высоких дозах оправдана для пациентов с острым коронарным синдромом или для тех лиц, которые на протяжении приема более низких доз не достигли рекомендованного уровня общего ХС (<4 ммоль/л) и ХС ЛПНП (<2 ммоль/л). Фибраты, производные никотиновой кислоты, секвестранты желчных кислот рекомендованы пациентам, прежде всего, при непереносимости статинов. Эзетимиб может быть добавлен к статину при лечении больных с несемейной или гетерозиготной семейной гиперхолестеринемией.
Мониторинг уровня безопасности при лечении статинами должен осуществляться непрерывно, измерение концентрации печеночных трансаминаз и билирубина рекомендовано каждые 3 мес лечения. Измерение уровня КФК или альдолазы требуется только при появлении клинических признаков миопатии/миозита. Использование комбинации гиполипидемических препаратов требует более пристального внимания к мониторированию уровня безопасности.
Таким образом, в рекомендациях UK National Collaborating Centre for Primary Care and Royal College of General Practitioners (2008) реализованы принципы гиполипидемической терапии с разумным уровнем достаточности, эффективности, безопасности при серьезном отношении к стоимости лекарственных средств и экономизации ресурсов системы здравоохранения.
Стратегия лечения первичных гиперлипидемий
Первичная гиперлипидемия является достаточно редкой генетической аномалией, манифестация которой тесно связана с погрешностями в диете и снижением уровня физической активности. Чаще всего идентифицируются следующие формы первичной гиперлипидемии: первичная гиперхолестеринемия, первичная гипертриглицеридемия и комбинированные формы. Общие принципы отбора кандидатов для фармакологической гиполипидемической терапии, а также стратегия проведения последней представлены в табл. 9.16 и на рис. 9.9. Более подробно детализацию способа принятия решения при лечении различных форм нарушений липидного обмена см. в Приложении к данному руководству.
Таблица 9.16 Общие принципы отбора кандидатов для фармакологической гиполипидемической терапии
| Характеристика пациентов | Особенности липидного профиля плазмы крови |
| Пациенты с документированной ИБС | Общий ХС >4 ммоль/л, ХС ЛПНП >2,7 ммоль/л |
| Пациенты с сахарным диабетом 2-го типа | Общий ХС >6,5 ммоль/л
или Общий ХС >5,5 ммоль/л, ХС ЛПНП <0,9 ммоль/л |
| Пациенты с семейной гиперхолестеринемией | |
| Пациенты с отягощенным семейным анамнезом, связанным с ранним возникновением случаев ИБС (родственники первой степени родства в возрасте <60 лет) | |
| Пациенты с артериальной гипертензией | |
| Пациенты с документированным облитерирующим атеросклерозом сосудов нижних конечностей | |
| Пациенты, перенесшие инфаркт миокарда | Общий ХС >4,8 ммоль/л, ХС ЛПНП >3,3 ммоль/л |
| Пациенты с содержанием ХС ЛПВП <0,9 ммоль/л | Общий ХС >6,5 ммоль/л |
| Мужчины в возрасте 35–75 лет | Общий ХС >7,5 ммоль/л
или ТГ >4 ммоль/л |
| Женщины в постменопаузальный период в возрасте <75 лет | |
| Другие пациенты, не включенные в вышеуказанные группы | Общий ХС >8,5 ммоль/л
или ТГ >8 ммоль/л |
| Все пациенты должны придерживаться гиполипидемической диеты (≥8 нед)
Рекомендации приемлемы при наличии у пациента не более чем 1 фактора кардиоваскулярного риска (для остальных случаев см. Рекомендации NCEP APT III) |
|

Рис. 9.9. Принципиальная схема фармакологического лечения различных нарушений липидного обмена
КФК — креатинфосфокиназа.
Семейная гиперхолестеринемия
В соответствии с действующими клиническими рекомендациями (Marks D. et al., 2000) современная стратегия лечения семейной гиперхолестеринемии должна основываться на использовании немедикаментозных (преимущественно диеты) и фармакологических (в основном рекомендованы статины и секвестранты желчных кислот) методов.
Статины рекомендованы как препараты первой линии для большинства пациентов с семейной гиперхолестеринемией (см. рис. 9.9). Переносимость терапии высокая, частота отказов от лечения, связанная с возникновением побочных эффектов, обычно не превышает 1%, а случаи серьезных побочных эффектов редки (Keech A. et al., 1994). В этой популяции пациентов гиполипидемический потенциал статинов существенно зависит от качества молекулы препарата. Так, наибольшая степень снижения ХС ЛПНП (около 60%) была достигнута при применении аторвастатина в дозе 80 мг/сут, тогда как симвастатин в дозе 40 мг/сут способствовал редукции этого показателя только на 40% от исходного уровня (McCrindle B.W. et al., 2003). Другие представители этого класса также рекомендованы для лечения семейной гиперхолестеринемии, однако, за исключением розувастатина, приводят к более скромным результатам (Baigent C. et al., 2005). Отметим, что в настоящее время розувастатин резервируется для пациентов, при лечении которых с помощью монотерапии другими представителями этого класса лекарственных средств не удается достичь целевого уровня ХС ЛПНП. В то же время большинство статинов позволяют повысить содержание ЛПВП в плазме крови приблизительно на 6–10%, а также снизить уровень ТГ на 10–15%, хотя более выраженная редукция содержания ТГ могла быть достигнута у пациентов с изолированной гипертриглицеридемией (Jones P. et al., 1998).
У пациентов с семейной гиперхолестеринемией нередко возникают ситуации, когда даже при применении статинов в высоких дозах или их комбинации с фибратами невозможно достичь рекомендованного уровня ХС ЛПНП. В этих ситуациях рекомендованы секвестранты желчных кислот, систематическое применение которых позволяет дополнительно редуцировать уровень ХС ЛПНП на 25%. В то же время, широкое применение этих лекарственных средств серьезным образом лимитировано низким уровнем переносимости (диарея, тошнота, обстипации) и потенциально высоким риском взаимодействия как с пищевыми продуктами (витаминами), так и некоторыми лекарственными средствами. Вместе с тем, отсутствие потенциально негативных побочных эффектов в отношении почечной и печеночной функции, а также метаболизма скелетных мышц, позволяет рассматривать секвестранты желчных кислот в качестве одних из наиболее оптимальных лекарственных средств при проведении гиполипидемической терапии в детской практике, особенно у новорожденных. В то же время проведенный недавно метаанализ показал, что статины имеют приемлемый уровень эффективности и безопасности у детей в возрасте старше 8 лет с гетерозиготной формой наследственной гиперхолестеринемии (Avis H.J. et al., 2007). К настоящему времени получены убедительные доказательства клинической эффективности и высокого уровня безопасности у детей и подростков с семейной гиперхолестеринемией аторвастатина, ловастатина, правастатина (Knipscheer H.C. et al., 1996; Clauss S.B. et al., 2005; McCrindle B.W. et al., 2005).
Для повышения эффективности статинов в детской практике часто дополнительно применяют эзетимиб (Kwiterovich P.O. Jr., 2008; van der Graaf А. et al., 2008). В завершившемся недавно крупном рандомизированном клиническом исследовании, посвященном этому вопросу, комбинированное применение симвастатина и эзетимиба у подростков с гетерозиготной формой семейной гиперхолестеринемии приводило к реализации синергичного гиполипидемического эффекта и отличалось высоким уровнем безопасности при крайне низкой частоте возникновения побочных эффектов (van der Graaf А. et al., 2008). Все это позволяет надеяться, что эзетимиб придет на смену секвестрантам желчных кислот у детей старшего возраста и подростков. В то же время данных, позволяющих рекомендовать эзетимиб у новорожденных и детей раннего возраста, недостаточно. В этой связи у данной категории пациентов альтернативы секвестрантам желчных кислот пока нет (Kwiterovich P.O. Jr., 2008).
В соответствии с рекомендациями American Heart Association (AHA) в этой когорте пациентов выявляют приверженность к гиполипидемической и низкокалорийной диете. Так, снижение употребления жира до 30% дневного калоража позволяет достичь снижения концентрации общего ХС в плазме крови на 10–15% (Clarke R. et al., 1996; 1997; Tang J.L. et al., 1998). Обогащение пищевого рациона свежими овощами и фруктами, а также повышение потребления ПНЖК позволяет существенным образом снизить атерогенность гиперлипидемии (Miettinen T.A. et al., 1995; Weststrate J.A., Meijer G.W., 1998; Jones P.J. et al., 2000). Тем не менее, следует обращать внимание и на тот факт, что приверженность пациента к медикаментозному лечению может быть тесно связана с расширением диетического диапазона (Kasper D.L. et al., 2001; Kwiterovich P.O. Jr., 2008). Подходы к лечению других форм наследственных гиперлипидемий — см. рис. 9.9.
Современные подходы к лечению гипертриглицеридемии
В лечении при гипертриглицеридемии рассматривают возможность достижения адекватного контроля за эволюцией тех заболеваний, которые привели к повышению уровня ТГ в плазме крови, а также отказ от применения лекарственных средств и диеты, способствующих формированию этого синдрома (Dietary Guidelines for Americans, 2005). Немаловажное значение придается обучению пациентов и модификации их образа жизни (Healthy lifestyle: diet and nutrition, 2005).
Медикаментозная стратегия лечения при гипертриглицеридемии направлена, прежде всего, на снижение риска развития ИБС. Поскольку пациенты с повышением уровня ТГ в плазме крови метаболически гетерогенны, то решение вопроса о выборе лекарственного средства основывается, в том числе, и на наличии и тяжести сопутствующих нарушений липидного обмена (Berneis K.K., Krauss R.M., 2002).
Концентрация ТГ в плазме крови в пределах 1000–1500 мг/дл (11,3–16,9 ммоль/л) требует назначения фибратов для реверсии высокого риска развития панкреатита (Brunzell J.D., Schrott H.G., 1973). Успех от лечения мягкой и умеренной гипертриглицеридемии в отношении редукции кардиоваскулярного риска менее четко определен (Birjmohun R.S. et al., 2005).
Модификация образа жизни
Мероприятия, направленные на уменьшение массы тела, у пациентов с мягкой и умеренной гипертриглицеридемией способствуют редукции уровня ТГ в среднем на 22% и повышению ХС ЛПВП на 9%. Отметим, что содержание мелких и плотных гранул ЛПНП при этом снижается почти на 40% (Purnell J.Q. et al., 2000). Многие исследователи отмечают, что аэробные физические нагрузки (≥4 ч/нед) оказываются чрезвычайно эффективными в отношении снижения избыточного пула ТГ, в том числе и постпрандиального уровня ТГ (Tuomilehto J. et al., 2001; Knowler W.C. et al., 2002; Blair S.N., LaMonte M.J., 2005; Duncan G.E. et al., 2005; Lichtenstein A.H. et al., 2006). При этом аэробные тренировки способствуют повышению пула ХС ЛПВП, редукции апо-В и ТГ (Ross R. et al., 2000; Leon A.S., Sanchez O.A., 2001).
Ограничение употребления в пищу жирных продуктов, а также использование углеводной диеты может способствовать значительной редукции содержания ТГ, ХС ЛПНП и повышению ХС ЛПВП (Lichtenstein A.H. et al., 2006). В то же время употребление в пищу простых углеводов может негативно отразиться на постпрандиальном уровне ТГ. В этой связи замещение насыщенных жиров и углеводов ПНЖК является более оптимальным шагом (GISSI-Prevenzione Investigators, 1999; Havel P.J., 2005). Так, использование ω-3 производных ПНЖК в качестве пищевых добавок может способствовать редукции уровня ТГ в плазме крови (Harris W.S., 2007) и уменьшению количества кардиоваскулярных событий (GISSI-Prevenzione Investigators, 1999). Вместе с тем, результаты ряда метаанализов, посвященных этому вопросу, не продемонстрировали позитивного влияния этого метода лечения на величину кардиоваскулярной смертности, несмотря на подтверждение значительной реверсии исходно повышенного плазменного пула ТГ (Hooper L. et al., 2006).
Отказ от курения часто приводит к позитивным изменениям липидного профиля вообще и снижению уровня ТГ в частности. Более того, хорошо известно благоприятное влияние отказа от курения на кардиоваскулярную и общую смертность (Healthy lifestyle: diet and nutrition, 2005).
Употребление алкоголя ассоциируется с редукцией риска атеротромбоза, но при этом риск других кардиоваскулярных заболеваний, в том числе артериальной гипертензии и мозгового геморрагического инсульта, существенным образом возрастает (Healthy lifestyle: diet and nutrition, 2005). Умеренное употребление алкоголя (не более 2 унций для мужчин и 1 унции для женщин в сутки) рассматривается как относительно безопасное в когорте лиц с низкой предрасположенностью к развитию алкоголизма (Taskinen M.R., Nikkilä E.A., 1997; Erkelens D.W., Brunzell J.D., 1980; Phillips N.R. et al., 1981). Однако пациенты с тяжелой гипертриглицеридемией должны воздержаться от употребления алкоголя вообще в связи с высоким риском панкреонекроза, а у лиц с мягкой триглицеридемией (<5,6 ммоль/л) употребление алкоголя в низких дозах не предотвращает постпрандиального увеличения уровня ТГ (Erkelens D.W., Brunzell J.D., 1980; Phillips N.R. et al., 1981).
Медикаментозная терапия
При документированной гипертриглицеридемии медикаментозное лечение рассматривается как необходимое в следующих случаях: высокий риск панкреатита, семейная агрегация с ИБС, документированная ИБС, наличие смешанной формы гиперлипидемии, особенно при верификации повышения ХС ЛПНП и снижения ХС ЛПВП.
Статины
У пациентов с высоким риском развития кардиоваскулярных заболеваний в качестве препаратов первой линии обычно рассматриваются статины даже в случае нормального или сниженного уровня ХС ЛПНП (Grundy S.M. et al., 2004). Позитивное влияние статинов на выживаемость пациентов высокого кардиоваскулярного риска доказано в многочисленных рандомизированных клинических исследованиях (Shepherd J. et al., 1995; Downs J.R. et al., 1998). Однако необходимо признать, что статины не относятся к лекарственным средствам, лидирующим в списке наиболее активно редуцирующих уровень ТГ в крови. Исключение составляет только розувастатин, который в этом отношении не уступает фибратам и обеспечивает почти 50% редукции уровня ТГ (Naples M. et al., 2007). Последнее обстоятельство рассматривается как чрезвычайно важное, поскольку принято считать, что отсутствие снижения избыточно повышенного уровня ТГ даже после достижения целевого уровня ХС ЛПНП и ХС ЛПВП создает так называемый резидуальный риск (Fruchart J.C., Gotto A.M. Jr., 2007). Именно он и обеспечивает сохраняющийся риск возникновения любых неблагоприятных клинических исходов даже в том случае, когда контроль за уровнем ХС ЛПНП, ХС ЛПВП, апо-В и апо-А фактически идеален. Кажущаяся «адекватность» контроля за липидным профилем является результатом отказа от мониторирования других не менее важных, чем вышеперечисленные, компонентов и продуктов метаболизма липидов, таких как апо-С-II, LpL, LpA и т.п. (Fouchier S.W. et al., 2007; Nierman M.C. et al., 2007). Разработка стратегии модификации резидуального риска — чрезвычайно сложная и до сих пор нерешенная задача (Zechner R., Goldberg I.J., 2007).
Таким образом, модуляция концентрации ТГ в плазме крови с помощью статинов признается важным фактором снижения кардиоваскулярного риска (Fruchart J.C., 2007). Кроме того, в когорте больных сахарным диабетом 2-го типа или с семейной смешанной гиперлипидемией путем снижения уровня ТГ посредством применения статинов можно дополнительно достичь существенной редукции риска возникновения микрососудистых осложнений (Brown V., 2007; Davidson M.H., 2007).
Производные никотиновой кислоты
Добавление производных никотиновой кислоты к статинам или применение первых в качестве монотерапии могло бы быть альтернативным методом в достижении адекватного контроля над гиперлипидемией у пациентов с высоким риском возникновения ИБС с элевацией ТГ, ХС ЛПНП и снижением апо-А/ЛПВП. Никотиновая кислота не только приводит к снижению избыточного пула ТГ, но и позволяет достичь дополнительного снижения ХС ЛПНП. Так, в одном из первых клинических исследований, посвященном оценке улучшения клинических исходов у пациентов с документированным атерослерозом и ИБС, — Coronary Drug Project — никотиновая кислота способствовала не только 15% редукции риска возникновения инфаркта миокарда у лиц мужского пола с гиперхолестеринемией и повышением ХС ЛПНП (Clofibrate and niacin in coronary heart disease, 1975), но и приводила к 10% снижению общей смертности на протяжении 15 лет наблюдения (Canner P.L. et al., 1986). Позже в рандомизированном клиническом исследовании ARBITER-2 (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol-2) предотвращение прогрессирования каротидного атеросклероза было достигнуто с помощью терапии статинами (Taylor A.J. et al., 2004). Никотиновая кислота в комбинации с другими гиполипидемическими лекарственными средствами оказалась также эффективной в отношении ограничения прогрессирования атеросклероза у пациентов с гипертриглицеридемией и высоким риском возникновения ИБС. Так, ниацин (никотиновая кислота в форме контролированного освобождения) в сочетании с симвастатином обладал способностью к редукции риска возникновения ИБС в популяции пациентов с низким уровнем ХС ЛПВП, погранично-высоким уровнем ТГ (Brown B.G. et al., 2001).
Существуют данные о том, что ниацин в комбинации с секвестрантом жирных кислот колестиполом существенным образом редуцирует частоту кардиоваскулярных событий и снижает риск прогрессирования коронарного атеросклероза в когорте лиц мужского пола с повышенным уровнем апо-В (Brown G. et al., 1990). Никотиновая кислота обладает сопоставимой клинической эффективностью как в кристаллической форме, так и в форме контролированного освобождения (extended-release form) (Meyers C.D. et al., 2003). Основным ограничением к ее широкому применению являются нежелательные побочные эффекты, в основном покраснение кожи и кожный зуд (Maccubbin D. et al., 2007). Вместе с тем, частота их возникновения может быть существенным образом минимизирована при обучении пациентов рациональному применению лекарственного средства.
Фибраты
Фибраты рассматриваются как один из основных классов гиполипидемических лекарственных средств, модифицирующих уровень ТГ в плазме крови (De Haan W. et al., 2007). Результаты многочисленных рандомизированных клинических исследований показали их позитивное влияние на ближайшие и отдаленные клинические исходы, однако этот класс веществ оказался не способным редуцировать вероятность возникновения фатальных кардиоваскулярных событий и величину общей смертности.
Впервые подобные результаты были получены еще на заре гиполипидемической эры при изучении эффективности клофибрата в исследовании The coronary drug project (1972). Впоследствии эти выводы оказались справедливы и для других представителей фибратов. Так, в исследовании Affairs High-Density Lipoprotein Cholesterol Intervention Trial (HIT) при применении гемфиброзила отмечалось снижение частоты возникновения первичной комбинированной конечной точки — случаев ИБС и нефатального инфаркта миокарда, тогда как в отношении редукции вторичной конечной точки — фатального инфаркта миокарда и/или смертности от всех причин — не было достигнуто уровня статистической значимости (Rubins H.B. et al., 1999). Эти данные явились основанием для формирования мнения о том, что именно фибраты можно рассматривать в качестве препаратов первой линии для лечения мягкой и умеренной изолированной гипертриглицеридемии. Кроме того, этот класс веществ может быть добавлен к статинам в случаях их недостаточной эффективности в отношении редукции уровня ТГ. Вместе с тем, одним из наиболее весомых сдерживающих факторов широкого применения фибратов являются их побочные эффекты, в частности гастроинтестинальные, снижающие приверженность пациентов к терапии (Frick M.H. et al., 1987). Отметим, что добавление фибратов к статинам может обусловливать повышение риска возникновения рабдомиолиза, что потенциально ограничивает широкое применение этой комбинации (Oh R. et al., 2008). Вместе с тем, величина абсолютного риска подобного осложнения популяционно минимальна (Davidson M.H., 2001).
Лечение гипертриглицеридемии у больных сахарным диабетом 2-го типа и метаболическим синдромом
У пациентов с документированным сахарным диабетом 2-го типа применение статинов в качестве гиполипидемических средств считается наиболее оправданным в силу их доказанной способности к редукции кардиоваскулярной смертности и летальности, улучшения клинических исходов, в том числе и кардиоваскулярных, и качества жизни (Grundy S.M. et al., 2004). В то же время достоверно установлено, что больные с метаболическим синдромом имеют достаточно высокий уровень апо-В в крови и должны подвергаться агрессивной гиполипидемической терапии преимущественно статинами (Brunzell J.D. et al., 2008).
Наиболее часто показанием к добавлению фибратов к статинам у пациентов с сахарным диабетом 2-го типа является неадекватная активность последних в отношении редукции уровня ТГ в плазме крови (Haffner S. et al., 2008). Кроме того, именно в этой популяции пациентов при изолированной гипертриглицеридемии чаще всего назначают монотерапию фибратами. Однако подобный подход не всегда оказывается клинически эффективным. Так, в исследовании FIELD (Fenofibrate Intervention and Event Lowering in Diabetes Trial) применение фенофибрата не привело к снижению частоты возникновения первичной конечной точки — нефатального инфаркта миокарда или всех фатальных случаев ИБС (Keech A. et al., 2005). Более того, некоторое снижение частоты развития нефатального инфаркта миокарда в этом рандомизированном клиническом исследовании было компенсировано небольшим увеличением случаев фатальных кардиоваскулярных событий. Отметим, что попытки использовать производные никотиновой кислоты (ниацин) в лечении гипертриглицеридемии у пациентов с сахарным диабетом 2-го типа также оказались противоречивыми, что привело к отказу от применения этого класса веществ в качестве препаратов первой линии в этой когорте пациентов. Оказалось, что ниацин способен ухудшать контроль за гликемией у больных сахарным диабетом, в то же время существуют данные о том, что этот класс лекарственных средств может быть применен для лечения гипертриглицеридемии только в популяции больных с контролируемым сахарным диабетом (Elam M.B. et al., 2000; Brown B.G. et al., 2001; Grundy S.M. et al., 2002; Oh R. et al., 2008). При этом, у больных сахарным диабетом 2-го типа статины уже в средних терапевтических дозах позволяют достичь значительной редукции ХС ЛПНП, апо-В, а также уровня ТГ, что позитивно отражается на клинических исходах и качестве жизни пациентов (Muchacka-Bianga M. et al., 2006).
Лечение гипертриглицеридемии у пациентов с отягощенным семейным анамнезом в отношении ИБС
Необходимо отметить, что многие пациенты с повышенными уровнями ТГ в плазме крови и отягощенным семейным анамнезом в отношении ИБС могут существенным образом различаться между собой по содержанию апо-В и не-ХС ЛПВП. Особенно это характерно для больных с семейными формами гипертриглицеридемией. Это оказывается особенно важным, поскольку клиническими рекомендациями не предусмотрен рутинный анализ и (или) генетическое исследование в отношении содержания апо-В (Brunzell J.D. et al., 2008; Oh R. et al., 2008). До тех пор пока основные биохимические дефекты для каждой из генетически опосредованных форм гипертриглицеридемий не будут достаточно четко определены, решение о применении того или иного класса гиполипидемических лекарственных средств с целью модификации кардиоваскулярного риска остается прерогативой субъективного мнения врача (Brunzell J.D. et al., 2008; Oh R. et al., 2008).
Согласно NCEP целевые уровни для ТГ, в отличие от ХС ЛПНП и ХС ЛПВП, отсутствуют. В то же время терапия фибратами рекомендуется при их уровне в крови >1000 мг/дл (>13 ммоль/л) с целью редукции высокого риска развития панкреатита. Если в результате гиполипидемических мероприятий достигнут целевой уровень ХС ЛПНП, то имеет смысл обеспечить дополнительное снижение уровня ТГ, если он исходно >200 мг/дл (>2,6 ммоль/л), хотя какие-либо доказательные данные по этому вопросу отсутствуют и рекомендация основана на мнении экспертов (Cleeman J.I., 1998; Brunzell J.D. et al., 2008; Oh R. et al., 2008).
Таким образом, оптимальный фармакологический подход с целью контроля гипертриглицеридемии остается довольно неопределенным. Особенно это касается принятия решения о гиполипидемическом препарате первой линии. Фактически неясно, с какого именно лекарственного средства следует начинать терапию — с фибрата, производных никотиновой кислоты или статина, а также не установлен алгоритм рационального комбинирования этих лекарственных средств (Brunzell J.D. et al., 2008; Oh R. et al., 2008).
Имеющиеся к настоящему времени данные позволяют предположить, что у пациентов с семейно отягощенным анамнезом в отношении ИБС, а также у лиц с уже документированной ИБС имеются все основания для инициального назначения статина в монотерапии или в комбинации с производными никотиновой кислоты. Наиболее оптимистично выглядит применение статинов с благоприятным терапевтическим потенциалом в отношении редукции содержания ТГ в плазме крови (розувастатин, питавастатин). Это позволяет существенным образом не только сократить расходы на лечение за счет отказа от дополнительного применение фибрата, но и сохранить высокий уровень безопасности и приверженности к терапии. Фибраты резервируются для пациентов с мягкой и умеренной изолированной гипертриглицеридемией, а также для лиц с низким и умеренным кардиоваскулярным риском, поскольку они не продемонстрировали позитивного влияния на редукцию частоты фатальных кардиоваскулярных событий. Роль ω-3 ненасыщенных жирных кислот в контексте настоящего обсуждения представляется неясной. Вероятно, необходимо продолжить исследования в этом направлении с целью более детального изучения стратегии лечения гипертриглицеридемии у пациентов различных популяций и величины тотального кардиоваскулярного риска. Скорее всего, отбор кандидатов для терапии этим классом лекарственных средств адресуется субъективному мнению врача. Тем не менее, необходимо отметить, что в большинстве рандомизированных клинических исследований применились весьма различные дозы ω-3 ненасыщенных жирных кислот: от 1 до 4 г/сут. Можно предположить, что для достижения наиболее оптимального гиполипидемического результата необходимо применять суточную дозу близкую к 4 г/сут.
Основные подходы к лечению смешанных форм гиперлипидемий — см. рис. 9.9. В соответствии с действующими клиническими рекомендациями наряду с модификацией образа жизни показана медикаментозная терапия. Последняя основана на использовании комбинации статинов с фибратами или ω-3 ПНЖК. Альтернативным подходом может явиться так называемая step-down терапия, при которой используются высокие дозы статинов (особенно аторвастатина, а при его низкой эффективности — розувастатина) для наиболее раннего достижения целевого уровня липидов. Следующим этапом является попытка снижения дозы с последующей ее фиксацией на оптимальном для конкретного пациента уровне, при котором наблюдается оптимальное соотношение эффективность/безопасность.
В том случае, когда не представляется возможным достичь устойчивого снижения уровня ЛПНП и ТГ у пациентов со смешанными формами гиперлипидемии, рекомендованным является добавление фибратов. Комбинация статинов с ниацином при этом выглядит менее перспективной (Moon Y.S., Kashyap M.L., 2002). Роль ω-3 ПНЖК в настоящее время широко обсуждается (Nordoy A. et al., 1998; Davidson M.H. et al., 2007). Однако многие данные свидетельствуют об отсутствии позитивного влияния этого класса лекарственных средств в отношении твердых клинических конечных точек (Burr M.L. et al., 1989; Lewis A. et al., 2004; Frost L., Vestergaard P., 2005; Mozaffarian D., Rimm E.B., 2006), хотя в отдельном рандомизированном клиническом исследовании доказана возможность снижения риска внезапной сердечной смерти (Lee K.W. et al., 2004). Таким образом, статины сохраняют свои позиции как основной компонент комбинированной терапии у пациентов со смешанными формами гиперлипидемий, тогда как в отношении фибратов и ω-3 ПНЖК единства мнений пока нет.
Экстракорпоральные методы лечения различных форм гиперлипидемий
Экстракорпоральные методы лечения дислипидемий впервые были введены в клиническую практику в 1969 г. J. de Gennes, а позднее G. Tompson была предпринята попытка использовать обычный плазмаферез у пациентов с гомозиготной формой гиперлипопротеидемии. Аналогичные подходы к лечению часто рефрактерных к медикаментозной терапии видов нарушений липидного обмена получили широкое распространение в Германии. Наиболее часто применялись различные преципитации ЛПНП с гепарином в кислой среде (Heparin Extracorporal LDL Precipitation — HELP), а также иммуносорбция ЛПНП, ЛПНП-аферез с декстран-сульфатом, иммуносорбция ЛПНП с поли- и моноклональными антителами (Thompson G.R. et al., 1975; Fuchs C. et al., 1983; Yokoyama S. et al., 1985). В настоящее время ЛПНП-аферез представляет собой наиболее эффективное средство выбора при лечении тяжелых наследственных гиперлипопротеидемий, рефрактерных к медикаментозной терапии. Этот метод экстракорпоральной терапии достаточно дорогостоящий. Наибольшим опытом его клинического использования обладают японские специалисты. Установлено, что при применении ЛПНП-афереза в комбинации с низкокалорийной диетой и максимальной медикаментозной терапией у больных с наследственной формой гиперлипопротеидемии удается стабилизировать атеросклеротический процесс в коронарных артериях в 50% случаев и даже индуцировать его реверсию у 30% пациентов при снижении уровня общего ХС в плазме крови до 100 мг/дл (2,6 ммоль/л). Негативные побочные эффекты при таком подходе отмечаются достаточно редко (<4% случаев) и связаны в основном с возникновением железодефицитной анемии и эпизодами артериальной гипотензии в ортостазе. Предполагается, что артериальная гипотензия в значительной мере может быть обусловлена существенным снижением клиренса эндогенного брадикинина, оказывающего выраженный вазодилатирующий эффект. Активация брадикина отмечается преимущественно в первые часы после начала процедуры афереза и часто наблюдалась у пациентов, принимавших иАПФ.
По данным многоцентрового рандомизированного клинического исследования LARS использование ЛПНП-афереза с декстран-сультфатом у 37 пациентов с семейными формами гиперлипидемии (7 пациентов с гомозиготной, 25 — с гетерозиготной и 5 — с комбинированной формой) отмечена выраженная регрессия коронарного атеросклероза у больных с поражением ≥2 артерий. Вместе с тем, несмотря на проведение процедуры афереза у 5 (13,5%) больных наблюдалось прогрессирование заболевания, а у 18 (48,6%) каких-либо значимых изменений не выявлено. При этом в рандомизированном клиническом исследовании FHRS (Familial Hypercholesterolemia Regression Study) показано, что ЛПНП-аферез не продемонстрировал существенных преимуществ перед медикаментозной терапией в отношении возможности реверсии коронарного атеросклероза и частоты улучшений переносимости физической нагрузки при проведении пробы с дозированной нагрузкой на тредмиле по протоколу Брюса. Таким образом, возможности гравитационной хирургии в лечении пациентов с наследственными формами гиперлипидемии до сих пор однозначно не определены. Более подробно о различных методах экстракорпоральной эксфузии крови у пациентов с гиперлипидемией см. главу 10.
Литература
- Липовецкий Б.М. (2000) Клиническая липидология. Наука, Санкт-Петербург, с. 92.
- Спасокукоцкий А.Л. (перевод и редакция) (2005) Ведение пациентов с гиперхолестеринемией (реферат руководства). Укр. мед. часопис, 1(45): 5–25.
- Avis H.J., Vissers M.N., Stein E.A. et al. (2007) A systematic review and meta-analysis of statin therapy in children with familial hypercholesterolemia. Arteriosclerosis, Thromb. Vascular Biology, 27: 1803–1810.
- Baigent C., Keech A., Kearney P.M. et al. (2005) Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet, 366: 1267–1278.
- Bastuji-Garin S., Deverly A., Moyse D. et al. (2002) The Framingham prediction rule is not valid in a European population of treated hypertensive patients. J. Hypertens., 20: 1937–1980.
- Berneis K.K., Krauss R.M. (2002) Metabolic origins and clinical significance of LDL heterogeneity. J. Lipid. Res., 43: 1363–1379.
- Beswick A.D., Brindle P., Fahey T. et al. (2008) A systematic review of risk scoring methods and clinical decision aids used in the primary prevention of coronary heart disease. CG67 Lipid Modification: guideline appendix K. London: National Collaborating Centre for Primary Care and Royal College of General Practitioners.
- Betteridge D.J., Dodson P.M., Durrington P.N. et al. (1993) Management of hyperlipidaemia: guidelines of the British Hyperlipidaemia Association: Postgrad. Med. J., 69: 359–369.
- Birjmohun R.S., Hutten B.A., Kastelein J.J. et al. (2005) Efficacy and safety of high-density lipoprotein cholesterol-increasing compounds: a meta-analysis of randomized controlled trials. J. Am. Coll. Cardiol., 45: 185–197.
- Blair S.N., LaMonte M.J. (2005) How much and what type of physical activity is enough? What physicians should tell their patients. Arch. Intern. Med., 165: 2324–2325.
- Brindle P., Emberson J., Lampe F., Walker M. et al. (2003) Predictive accuracy of the Framingham coronary risk score in British men: prospective cohort study. BMJ, 327: 1267–1272.
- Brindle P., May M., Gill P., Cappuccio F. et al. (2006) Primary prevention of cardiovascular disease: a web-based risk score for seven British black and minority ethnic groups. Heart, 92: 1595–1602.
- Brindle P.M., Beswick A.D., Fahey T. et al. (2006) The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: A systematic review. Heart, 92: 1752–1759.
- British Cardiac Society, British Hyperlipidaemia Association, British Hypertension Society, endorsed by the British Diabetic Association (1998) Joint British recommendations on prevention of coronary heart disease in clinical practice. Heart, 80(Suppl. 2): S1–S29.
- Brown B.G., Zhao X.Q., Chait A. et al. (2001) Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N. Engl. J. Med., 345: 1583–1592.
- Brown G., Albers J.J., Fisher L.D. et al. (1990) Regression of coronary artery disease as a result of intensive lipid-lowering therapy in men with high levels of apolipoprotein B. N. Engl. J. Med., 323: 1289–1298.
- Brown V. (2007) Clinical trial evidence supporting fibrate therapy to reduce CVD and microvascular complications in patients with diabetes. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007; New York, NY. Abstract 15.
- Brunzell J.D., Davidson M., Furberg C.D. et al. (2008) Lipoprotein management in patients with cardiometabolic risk: consensus conference report from the American Diabetes Association and the American College of Cardiology Foundation. J. Am. Coll. Cardiol., 51: 1512–1524.
- Brunzell J.D., Schrott H.G. (1973) The interaction of familial and secondary causes of hypertriglyceridemia: role in pancreatitis. Trans. Assoc. Am. Physicians, 86: 245–254.
- Burr M.L., Fehily A.M., Gilbert J.F. et al. (1989) Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet, 2: 757–761.
- Canner P.L., Berge K.G., Wenger N.K. et al. (1986) Fifteen year mortality in Coronary Drug Project patients: long-term benefit with niacin. J. Am. Coll. Cardiol., 8: 1245–1255.
- Cappuccio F.P., Oakeshott P., Strazzullo P. et al. (2002) Application of Framingham risk estimates to ethnic minorities in United Kingdom and implications for primary prevention of heart disease in general practice: cross sectional population based study. BMJ, 325: 1271–1274.
- Cardiovascular Health Study (CHS) (2005) National Heart, Lung, and Blood Institute. Available at: http://www.nhlbi.nih.gov/resources/deca/descriptions/chs.htm. Accessed June 6, 2005.
- Clarke R., Frost C., Collins R. et al. (1997) Dietary lipids and blood cholesterol: quantitative meta-analysis of metabolic ward studies. BMJ, 314: 112–117.
- Clauss S.B., Holmes K.W., Hopkins P. et al. (2005) Efficacy and safety of lovastatin therapy in adolescent girls with heterozygous familial hypercholesterolemia. Pediatrics, 116: 682–688.
- Cleeman J.I. (1998) Detection and evaluation of dyslipoproteinemia. Endocrinol. Metab. Clin. North Am., 27: 597–611.
- Clofibrate and niacin in coronary heart disease (1975) JAMA, 231: 360–381.
- Cooper A., Nherera L., Calvert N. et al. (2008) Clinical Guidelines and Evidence Review for Lipid Modification: cardiovascular risk assessment and the primary and secondary prevention of cardiovascular disease. London: National Collaborating Centre for Primary Care and Royal College of General Practitioners, 2008.
- Coronary Artery Risk Development in Young Adults (CARDIA) (2005) National Heart, Lung, and Blood Institute (http://www.nhlbi.nih.gov/resources/deca/descriptions/cardia.htm). Accessed June 6, 2005.
- Davidson M.H. (2001) Safety profiles for the HMG-CoA reductase inhibitors. Drugs, 61: 197–206.
- Davidson M.H. (2007) Weighing the evidence for adding a second drug to statin in the patient with mixed hyperlipidemia. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 12.
- Davidson M.H., Stein E.A., Bays H.E. et al. (2007) Efficacy and tolerability of adding prescription omega-3 fatty acids 4 g/d to simvastatin 40 mg/d in hypertriglyceridemic patients: an 8-week, randomized, double-blind, placebo-controlled study. Clin. Ther., 29: 1354–1367.
- De Haan W., van der Hoogt C.C., Westererp M. et al. (2007) Fenofibrate increases HDL-cholesterol by reducing cholesteryl ester transfer protein expression. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 37.
- Dietary Guidelines for Americans 2005 (2005) US Department of Health and Human Services (http://www.health.gov/dietaryguidelines/dga2005/document/pdf/DGA2005.pdf). Accessed February 2, 2005.
- Downs J.R., Clearfield M., Weis S. et al., The AFCAPS/TexCAPS Research Group (1998) Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPs/TexCAPS. JAMA, 279: 1615–1622.
- Duncan G.E., Anton S.D., Sydeman S.J. et al. (2005) Prescribing exercise at varied levels of intensity and frequency: a randomized trial. Arch. Intern. Med., 165: 2362–2369.
- Elam M.B., Hunninghake D.B., Davis K.B. et al. (2000) Effect of niacin on lipid and lipoprotein levels and glycemic control in patients with diabetes and peripheral arterial disease: the ADMIT study: a randomized trial: Arterial Disease Multiple Intervention Trial. JAMA, 284: 1263–1270.
- Empana J.P., Ducimetiere P., Arveiler D. et al. (2003) Are the Framingham and PROCAM coronary heart disease risk functions applicable to different European populations? The PRIME Study. Eur. Heart J., 24: 1903–1911.
- Erkelens D.W., Brunzell J.D. (1980) Effect of controlled alcohol feeding on triglycerides in patients with outpatient `alcohol hypertriglyceridemia.’ J. Hum. Nutr., 34: 370–375.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (2001) Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA, 285: 2486–2497.
- Ford E.S., Mokdad A.H., Giles W.H. et al. (2003) Serum total cholesterol concentrations and awareness, treatment, and control of hypercholesterolemia among US adults. Circulation, 107: 2185–2189.
- Fouchier S.W., Smelt A.H., Defesche J.C. et al. (2007) Genetic variation in the angiopoietin-like 3 gene in hypertriglyceridemic patients. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 58.
- Fredrickson D.S., Lees R.S. (1965) A system for phenotyping hyperlipidaemia. Circulation, 31: 321–327.
- Frick M.H., Elo O., Haapa K. et al. (1987) Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia: safety of treatment, changes in risk factors, and incidence of coronary heart disease. N. Engl. J. Med., 317: 1237–1245.
- Frost L., Vestergaard P. (2005) ω-3 Fatty acids consumed from fish and risk of atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am. J. Clin. Nutr., 81, 50–54.
- Fruchart J.C., Gotto A.M. Jr. (2007) Session: Treating residual risk: Reducing triglycerides. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism. October 4–7, 2007, New York, NY.
- Fruchart J.C. (2007) Role of elevated triglycerides and reduced HDL-C in residual CVD risk remaining after statin therapy. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 14.
- Fuchs C., Windisch M., Wieland H. et al. (1983) Selective continuous extracorporeal elimination of low density lipoproteins from plasma by heparin precipitation without cations. In: M.J. Lysaght, H.J. Gurland (Eds.). Plasma Separation and Plasma Fractionation. Karger, Basel, p. 272–280.
- Gardner C.D., Kiazand A., Alhassan S. et al. (2007) Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. JAMA, 297: 969–977.
- Gigerenzer G., Edwards A. (2003) Simple tools for understanding risks: from innumeracy to insight. BMJ, 327: 741–744.
- GISSI-Prevenzione Investigators (Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico) (1999) Dietary supplementation with ω-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet, 354: 447–455.
- Grover S.A., Coupal L., Hu X.P. (1995) Identifying adults at increased risk of coronary disease. How well do the current cholesterol guidelines work? JAMA, 274: 801–806.
- Grundy S.M., Cleeman J.I., Merz C.N. et al.; National Heart, Lung, and Blood Institute; American College of Cardiology Foundation; American Heart Association (2004) Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation, 110: 227–239.
- Grundy S.M., Vega G.L., McGovern M.E. et al. (2002) Efficacy, safety, and tolerability of once-daily niacin for the treatment of dyslipidemia associated with type 2 diabetes: results of the Assessment of Diabetes Control and Evaluation of the Efficacy of Niaspan Trial. Arch. Intern. Med., 162: 1568–1576.
- Haffner S. (1998) Management of dyslipidemia in adults with diabetes. Diabetes Care, 21: 160–178.
- Harris W.S. (2007) Omega-3 fatty acids for treatment of hyperlipidemia: mechanisms and evidence. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism. October 4–7, 2007, New York, NY. Abstract 11.
- Havel P.J. (2005) Dietary fructose: implications for dysregulation of energy homeostasis and lipid/carbohydrate metabolism. Nutr. Rev., 63: 133–157.
- Healthy lifestyle: diet and nutrition (2005) American Heart Association (http://www.americanheart.org/presenter.jhtml?identifier=1200010). Accessed February 2, 2005.
- Hense H.W., Schulte H., Lowel H. et al. (2003) Framingham risk function overestimates risk of coronary heart disease in men and women from Germany — results from the MONICA Augsburg and the PROCAM cohorts. Eur. Heart J., 24: 937–945.
- Hetlevik I., Holmen J., Kruger O. (1999) Implementing clinical guidelines in the treatment of hypertension in general practice. Evaluation of patient outcome related to implementation of a computer-based clinical decision support system. Scand. J. Prim. Health Care, 17: 35–40.
- Hippisley-Cox J., Coupland C., Vinogradova Y. et al. (2007) Derivation and validation of QRISK, a new cardiovascular disease risk score for the United Kingdom: prospective open cohort study. BMJ, 335: 136.
- Hippisley-Cox J., Coupland C., Vinogradova Y. et al. (2008) Performance of the QRISK cardiovascular risk prediction algorithm in an independent UK sample of patients from general practice: a validation study. Heart, 94: 34–39.
- Hooper L., Thompson R.L., Harrison R.A. et al. (2006) Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review. BMJ, 332: 752–760.
- Jones P., Kafonek S., Laurora I. et al. (1998) Comparative dose efficacy study of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with hypercholesterolemia (the CURVES study). Am. J. Cardiol., 81(Pt. 5): 582–587.
- Jones P.J., Raeini-Sarjaz M., Ntanios F. et al. (2000) Modulation of plasma lipids levels and cholesterol kinetics by phytosterol versus phytostanol-esters. J. Lipid Res., 41: 697–705.
- Kasper D.L., Fauci A.S., Longo D.L. et al. (2001) Harrison’s Principles of Internal Medicine. The McGraw-Hill Companies, Inc., New York.
- Keech A., Collins R., MacMahon S. et al. (1994) Three-year followup of the Oxford Cholesterol Study: assessment of the efficacy and safety of simvastatin in preparation for a large mortality study. Eur. Heart J., 15(Pt. 2): 255–269.
- Keech A., Simes R.J., Barter P. et al. (2005) Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes (the FIELD Study): randomised controlled trial. Lancet, 366: 1849–1861.
- Knipscheer H.C., Boelen C.C., Kastelein J.J. et al. (1994) Short-term efficacy and safety of pravastatin in 72 children with familial hypercholesterolemia. Pediatr. Res., 39: 867–871.
- Knowler W.C., Barrett-Connor E., Fowler S.E. et al. (2002) Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N. Engl. J. Med., 346: 393–403.
- Kwiterovich P.O. Jr. (2008) Recognition and management of dyslipidemia in children and adolescents. J. Clin. Endocrinol. Metab., 93(11): 4200–4209.
- Lamarche B., Tchernof A., Moorjani S. et al. (1997) Small, dense low-density lipoprotein particles as a predictor of the risk of ischemic heart disease in men: prospective results from the Québec Cardiovascular Study. Circulation, 95: 69–75.
- Lee K.W., Hamaad A., MacFadyen R.J. et al. (2004) Effects of dietary fat intake in sudden death: reduction of death with omega-3 fatty acids. Curr. Cardiol. Rep., 6: 371–378.
- Leon A.S., Sanchez O.A. (2001) Response of blood lipids to exercise training alone or combined with dietary intervention. Med. Sci Sports Exerc., 33 (Suppl.): S502–S515.
- Lewis A., Lookinland S., Beckstrand R.L. et al. (2004) Treatment of hypertriglyceridemia with omega-3 fatty acids: a systematic review. J. Am. Acad. Nurse Pract., 16: 384–395.
- Lichtenstein A.H., Appel L.J., Brands M. et al. (2006) Summary of American Heart Association Diet and Lifestyle Recommendations revision 2006. Arterioscler. Thromb. Vasc. Biol., 26: 2186–2191.
- Maccubbin D., Mitchel Y.B., Sirah W. et al. (2007) Lipid-altering efficacy and flushing profile of ER niacin/laropiprant in patients with dyslipidemia. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 38.
- Marks D., Wonderling D., Thorogood M. et al. (2000) Screening for hypercholesterolaemia versus case finding for familial hypercholesterolaemia: a systematic review and cost-effectiveness analysis. Health Technol. Assess., 4(29): 1–123.
- McCrindle B.W., Ose L., Marais A.D. (2003) Efficacy and safety of atorvastatin in children and adolescents with familial hypercholesterolemia or severe hyperlipidemia: a multicenter, randomized, placebo-controlled trial. J. Pediatr., 143: 74–80.
- Meyers C.D., Carr M.C., Park S. et al. (2003) Varying cost and free nicotinic acid content in over-the-counter niacin preparations for dyslipidemia. Ann. Intern. Med., 139: 996–1002.
- Miettinen T.A., Puska P., Gylling H. et al. (1995) Reduction of serum cholesterol with sitostanol-ester margarine in a mildly hypercholesterolaemic population. N. Engl. J. Med., 333: 1308–1312.
- Moon Y.S., Kashyap M.L. (2002) Niacin extended release/lovastatin: combination therapy for lipid disorders. Expert. Opin. Pharmacother., 3: 1763–1771.
- Mozaffarian D., Rimm E.B. (2006) Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA, 296: 1885–1899.
- Muchacka-Bianga M., Deja G., Jarosz-Chobot P. et al. (2006) Evaluation of selected risk factors of atherosclerosis in children with type 1 diabetes mellitus and hypercholesterolemia. Endokrynol.Diabetol. Chor. Przemiany. Materii. Wieku. Rozw., 12(1): 25–30.
- Multi-Ethnic Study of Atherosclerosis (MESA) (2005) MESA Web (http://mesa-nhlbi.org/). Accessed June 6, 2005.
- Naples M., Federico L.M., Xu E. et al. (2007) Effect of rosuvastatin on insulin sensitivity in an animal model of insulin resistance: Evidence for statin-induced hepatic insulin sensitization. Atherosclerosis, 198: 94–103.
- National Cholesterol Education Program (2001) Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA, 285(19): 2486–2497.
- Nierman M.C., Zuurman M., Hutten B.A. et al. (2007) LPLS447X is associated with attenuated albuminuria related cardiovascular risk in males. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism; October 4–7, 2007, New York, NY. Abstract 57.
- Nordoy A., Bonaa K.H., Nilsen H. et al. (1998) Effects of simvastatin and omega-3 fatty acids on plasma lipoproteins and lipid peroxidation in patients with combined hyperlipidaemia. J. Intern. Med., 243: 163–170.
- Oh R., Malani A., Ammar H. et al. (2008) Hypertriglyceridemia, N. Engl. J. Med., 358: 310–310.
- Phillips N.R., Havel R.J., Kane J.P. (1981) Levels and interrelationships of serum and lipoprotein cholesterol and triglycerides: association with adiposity and the consumption of ethanol, tobacco, and beverages containing caffeine. Arteriosclerosis, 1: 13–24.
- Purnell J.Q., Kahn S.E., Albers J.J. et al. (2000) Effect of weight loss with reduction of intra-abdominal fat on lipid metabolism in older men. J. Clin. Endocrinol. Metab., 85: 977–982.
- Rader D.J., Daugherty A. (2008) Translating molecular discoveries into new therapies for atherosclerosis. Nature, 451: 904–913.
- Ross R., Dagnone D, Jones P.J.H. et al. (2000) Reduction in obesity and related comorbid conditions after diet-induced weight loss or exercise-induced weight loss in men: a randomized, controlled trial. Ann. Intern. Med., 133: 92–103.
- Rubins H.B., Robins S.J., Collins D. et al. (1999) Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N. Engl. J. Med., 341: 410–418.
- Sanderson S.L., Iverius P.H., Wilson D.E. (1991) Successful hyperlipemic pregnancy. JAMA, 265: 1858–1860.
- Shepherd J., Cobbe S.M., Ford I. et al., West of Scotland Coronary Prevention Study Group (1995) Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N. Engl. J. Med., 333: 1301–1307.
- Steinberg D., Glass C.K., Witztum J.L. (2008) Evidence mandating earlier and more aggressive treatment of hypercholesterolemia. Circulation, 118: 672–677.
- Tang J.L., Armitage J.M., Lancaster T. et al. (1998) Systematic review of dietary intervention trials to lower blood total cholesterol in free-living subjects. BMJ, 316: 1213–1220.
- Taskinen M.R., Nikkilä E.A. (1977) Nocturnal hypertriglyceridemia and hyperinsulinemia following moderate evening intake of alcohol. Acta Med. Scand., 202: 173–177.
- Taylor A.J., Sullenberger L.E., Lee H.J. et al. (2004) Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol (ARBITER) 2: a double-blind, placebo-controlled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation, 110: 3512–3517.
- The coronary drug project (1972) JAMA, 221: 918–918.
- Thompson G.R., Lowenthal R., Myant N.B. (1975) Plasma exchange in the management of homozygous familial hypercholesterolaemia. Lancet, 1: 1208–1211.
- Tuomilehto J., Lindström J., Eriksson J.G. et al. (2001) Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N. Engl. J. Med., 344: 1343–1350.
- van der Graaf А., Cuffie-Jackson C., Vissers M.N. et al. (2008) Efficacy and safety of coadministration of ezetimibe and simvastatin in adolescents with heterozygous familial hypercholesterolemia. J. Am. Coll. Cardiol., 52: 1421–1429.
- Watts G.F., Lewis B., Brunt J.N. et al. (1992) Effects on coronary artery disease of lipid-lowering diet, or diet plus cholestyramine, in the St Thomas’ Atherosclerosis Regression Study (STARS). Lancet, 339: 563–569.
- Weststrate J.A., Meijer G.W. (1998) Plant sterol-enriched margarines and reduction of plasma total- and LDL-cholesterol concentrations in normocholesterolaemic and mildly hypercholesterolaemic subjects. Eur. J. Clin. Nutr., 52: 334–343.
- Yokoyama S., Hayashi R., Santani, M. et al. (1985) Selective removal of low density lipoprotein by plasmapheresis in familial hypercholesterolaemia. Arteriosclerosis, 5: 613–622.
- Zechner R., Goldberg I.J. Session (2007) Lipid metabolism. Program and abstracts of the XVI International Symposium on Drugs Affecting Lipid Metabolism, October 4–7, 2007, New York, NY.