Лікування при ОА продовжує залишатися серйозною проблемою незважаючи на те, що перелік застосовуваних препаратів останнім часом значно поповнився. Насамперед це пов’язане з тим, що більшість лікарських засобів, що застосовують при ОА, мають лише симптоматичну дію. Відсутність раніше доведених властивостей лікарських препаратів «модифікувати хворобу» чи будь-якого препарату змінювати перебіг цього захворювання у людини in vivo (Bland J.H., Cooper S.M., 1984; Altman R.D. et al., 1996; Brandt K.D., 2000), багато в чому була пов’язана з обмеженими можливостями біохімічних та інструментальних методів, хоча окремими дослідниками (Bland J.H., Cooper S.M., 1984) така можливість була продемонстрована для деяких біомеханічних і фармакотерапевтичних методів.
В останні роки з’явився новий клас лікарських засобів, що мають властивості модифікувати структури суглобового хряща. У 2003 р. Європейська антиревматична ліга (EULAR) запропонувала нові рекомендації з лікування при ОА колінних суглобів, в 2004 р. — кульшових суглобів, а в 2007 р. — ОА суглобів кисті, у яких вперше зазначена модифікуюча дія на суглобовий хрящ таких лікарських засобів, як глюкозамін і хондроїтин (EULAR 2003); хондроїтин (EULAR, 2005). Водночас Міжнародна асоціація дослідження ОА (Osteoarthritis Research Society International — OARSI) розробила схожі, проте комбіновані рекомендації для ОА колінних та кульшових суглобів (Zhang W. et al., 2007; 2008). Крім того, нещодавно Національний інститут здоров’я та клінічного мистецтва (National Institute for Health and Clinical Excellence — NICE) разом із Колегією терапевтів Великобританії опублікував настанову для ОА повністю (2008). Хоча між всіма цими рекомендаціями є різниця в окремих деталях, проте існує загальноприйнята домовленість щодо основних завдань, принципів та підбору оптимальних методів лікування хворих на ОА.
Серед завдань лікування при ОА можна виокремити такі: освіта та інформування пацієнта, зменшення вираженості симптомів хвороби; покращення функціональної активності; сповільнення прогресування ОА.
Для виконання цих завдань існують немедикаментозні й медикаментозні методи лікування. До них належать навчання пацієнта й соціальна підтримка; зменшення надмірної маси тіла; лікувальна фізкультура; фізіотерапія; використання допоміжних пристосувань, що полегшують пересування; інші методи реабілітації; нетрадиційні методи лікування (акупунктура, гомеопатія та ін.); системна фармакотерапія; місцева фармакотерапія (аплікаційна, внутрішньосуглобове введення лікарських засобів), а також хірургічне лікування.
НЕМЕДИКАМЕНТОЗНЕ ЛІКУВАННЯ/РЕАБІЛІТАЦІЯ
Алгоритм лікування хворих на ОА має свої особливості. Якщо при переважній більшості хвороб, у тому числі й неревматичних, етапу реабілітації передує амбулаторне чи стаціонарне лікування, то при ОА алгоритм виглядає інакше: реабілітація — амбулаторне (рідше — стаціонарне) лікування — реабілітація. Застосування фармакотерапії у хворих на ОА рекомендується лише при неефективності реабілітаційних заходів.
Навчання й соціальна підтримка. Методи навчання пацієнтів з ОА не відрізняються від таких при інших захворюваннях. З цією метою зазвичай видають спеціальні методичні посібники для пацієнтів, готують відеоматеріали. У популярному викладенні пацієнти одержують інформацію про будову й функції суглобів, про сутність хвороби, сучасні та перспективні методи лікування й профілактики. Ці матеріали, орієнтовані не лише на самого хворого, але й на його близьких, можна поширювати індивідуально (лікарі, працівники соціальних служб), а також у групах взаємодопомоги, які, як правило, створюють при великих спеціалізованих клініках. Програми навчання хворих, наприклад «Курс самодопомоги при артритах», сприяють тому, що у хворих зменшується вираженість болю у суглобах, підтримується функція уражених суглобів, зменшується кількість візитів до лікаря, поліпшується якість життя (Lorig K.R. et al., 1985; 1993; Hawley D.J., 1995). Порівняльний метааналіз контрольованих досліджень ефективності навчальних програм і результатів плацебо-контрольованих досліджень ефективності НПЗП показав, що перші лише незначно поступаються перед другими за впливом на больовий синдром при ОА (Superio-Cabuslay E. et al., 1996). Участь подружніх пар підвищує ефективність роботи з пацієнтами (Keefe F.J. et al., 1996). J. Goeppinger та співавтори (1995) відзначили, що розповсюджені поштою програми самодопомоги суттєво допомогли хворим — зменшився біль у суглобах, зникло відчуття безпорадності, депресія.
Важливою частиною роботи в рамках навчальних програм є створення у пацієнтів позитивного оптимістичного ставлення до свого захворювання у зв’язку з тим, що у свідомості більшості пацієнтів хвороби суглобів асоціюються з неминучістю втрати працездатності й інвалідною коляскою.
Артрологічний клуб, організований при Українському ревматологічному центрі, є прикладом програми навчання й соціальної підтримки пацієнтів. Незважаючи на те що діяльність клубу орієнтована на загальний контингент хворих ревматологічного профілю, більшість із відвідуючих засідання становлять пацієнти із захворюваннями суглобів, зокрема ОА. На щомісячних зустрічах учасників клубу з лекціями виступають ревматологи, методисти з лікувальної фізкультури, фізіотерапевти, лікарі суміжних спеціальностей (ортопеди та ін.). У виступах робиться акцент на простих способах самодопомоги, якими хворі можуть користуватися в домашніх умовах. Для поширення серед учасників клубу готуються методичні посібники з лікувальної фізкультури, пам’ятки хворим на ОА (див. Додаток).
Відомо, що при надмірній масі тіла відзначається більш високий ризик прогресування ОА, ніж при нормальній масі (Dougados M. et al., 1992; Schouten J.S. et al., 1992). Зменшення маси тіла на 5 кг у жінок асоціюється зі зниженням ризику розвитку ОА колінних суглобів на 50% (Felson D.T. et al., 1992). Зменшення маси тіла у пацієнтів із надмірною масою з ОА великих суглобів нижніх кінцівок є на сьогодні невід’ємною частиною загальновизнаної програми немедикаментозного лікування. Результати невеликого клінічного дослідження (Williams R.A., Foulsham B.M., 1981) щодо ефективності анорексигенних препаратів у хворих на ОА колінних і кульшових суглобів підтвердили, що зменшення маси тіла в середньому на 3–6 кг корелює зі зменшенням вираженості симптомів патології колінного суглоба, меншою мірою — кульшового суглоба.
Хворим на ОА рекомендується дієтичне харчування. Необхідно виключити тваринні жири, вуглеводи, що легко засвоюються (цукор, шоколад, кондитерські вироби, білий хліб), молочні продукти з високим вмістом жиру: молоко і кефір, вершки, сметану, згущене молоко, жирні та напівжирні сири, майонез, свинину, баранину, м’ясо качки або гуски. Для готування страв слід використовувати рослинну олію, що містить поліненасичені жирні кислоти (кукурудзяну, оливкову, соняшникову, соєву, бавовняну та ін.), вживати нежирні сорти м’яса (телятину, м’ясо курки, індички, кроля), рибу (у тому числі жирних сортів — лососеві, тунець, оселедець, сардини та ін.), городину (обмежити вживання картоплі) і фрукти, знежирене молоко і кефір, нежирні сири. У комплексній терапії хворим можна рекомендувати харчові добавки, що містять хондроїтин і глюкозамінсульфати.
Лікувальна фізкультура при ОА сприяє профілактиці чи усуненню атрофії періартикулярних м’язів (наприклад чотириголового м’яза стегна у хворих на гонартроз); профілактиці або усуненню нестабільності суглобів; зменшенню вираженості артралгії, покращанню функції уражених суглобів; уповільненню подальшого прогресування ОА; зменшенню маси тіла.
Вправи для збільшення обсягу рухів. Причинами скутості суглобів у хворих на ОА можуть бути розтягнення суглобової капсули, вторинне по відношенню до збільшення об’єму синовіальної рідини; ретракція суглобової капсули, періартикулярних зв’язок і сухожиль; фіброзний анкілоз суглоба різних ступенів внаслідок втрати суглобового хряща; неконгруентність суглобових поверхонь, наявність механічного блоку (остеофіти, суглобові «миші»); м’язовий спазм; біль у суглобі.
Крім того, лікар має враховувати, що зменшення обсягу рухів в одному суглобі впливає на біомеханіку сусідніх дистально й проксимально розташованих суглобів. Враховуючи незаперечність даних щодо цього питання, нами визнано необхідним посилання на найперші джерела літератури, що освітили цей аспект проблеми. Так, за даними S. Меssier та співавторів (1992) і D. Jesevar та співавторів (1993) у пацієнтів похилого віку з гонартрозом обсяг рухів був зменшений у всіх великих суглобах обох нижніх кінцівок (кульшовому, колінному й гомілковостопному) порівняно з особами контрольної групи без захворювання суглоба. Порушення біомеханіки ураженого суглоба веде до зміни нормальних рухів кінцівки, підвищує навантаження на суглоби, підвищує енергію споживання при русі, посилює біль і нестабільність суглобів. Крім того, обмеження обсягу рухів суглобів нижніх кінцівок змінює нормальну кінематику ходьби. Наприклад, у хворого на гонартроз зменшені кутова швидкість і обсяг руху колінного суглоба, однак компенсаторно збільшена кутова швидкість кульшового суглоба порівняно з особами контрольної групи, порівнянною за віком, статтю і масою тіла, без ОА. Не викликає сумнівів, що у хворих на гонартроз підвищується навантаження на неуражену кінцівку (Messier S. et al., 1992; 1994). На сьогодні загальноприйнятним є той факт, що тривалі пасивні рухи виявляють трофічну дію на суглобовий хрящ і можуть сприяти його репарації (Salter R., 1994). Тому відновлення функціонального обсягу рухів в уражених суглобах є важливим завданням немедикаментозного лікування та реабілітації хворих на ОА.
На сьогодні з метою відновлення обсягу рухів у суглобах використовують різні фізичні вправи: пасивні (мобілізацію суглоба здійснює методист або його асистент); напівактивні (пацієнт самостійно робить рухи в суглобі, методист/асистент допомагає лише наприкінці кожного руху досягти максимального обсягу); активні (пацієнт самостійно виконує рухи в максимально повному обсязі).
Перед комплексом вправ можливе проведення масажу або фізіотерапії (інфрачервоне, короткохвильове, мікрохвильове випромінювання, ультразвук) для зменшення скутості в уражених суглобах і полегшення виконання вправ.
Вправи для зміцнення періартикулярних м’язів. У літературі є багато повідомлень про зв’язок ОА колінного суглоба і слабкості/гіпотрофії чотириголового м’яза стегна (Fischer N. et al., 1991; Hall K. et al., 1993; Madsen О. et al., 1995; O’Reilly S. et al., 1997; Slemenda C. et al., 1997). Результати цих досліджень свідчать про те, що у хворих на гонартроз біль у суглобі може бути наслідком слабкості періартикулярних м’язів та їх асиметричної активності, що веде до дестабілізації суглоба. Навантаження на нестабільний суглоб викликає розтягнення іннервованих тканин і провокує біль, який пригнічує рефлекторну активність м’язів скелета, обмежуючи цим функцію кінцівки; таким чином, замикається порочне коло (рис. 12.1) (Dequekker J. et al., 1993; Ettinger W. et al., 1994). У пацієнтів із маніфестним ОА колінного суглоба часто спостерігають слабкість чотириголового м’яза стегна, безпосередньою причиною якої є біль, що обмежує свідомі рухи в суглобі та призводить до розвитку атрофії періартикулярних м’язів (Hurley M. et al., 1993). Цей феномен названий артрогенним пригнічення м’язів.
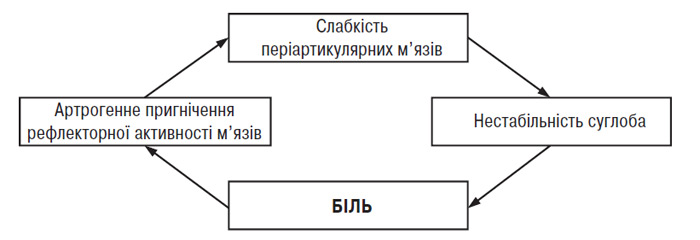
Рис. 12.1. Схема порочного кола при ОА
P. Geborek та співавтори (1989) повідомили про інгібування функції м’язів у нормальних і уражених ОА колінних суглобах при збільшенні об’єму внутрішньосуглобової рідини і підвищенні гідростатичного тиску. В іншому дослідженні встановлено, що максимальна ізометрична сила періартикулярних м’язів значно знижена при наявності випоту, а надмірна аспірація рідини призводить до її підвищення (Fahrer H. et al., 1988). Водночас артрогенне пригнічення м’язів спостерігають у хворих при відсутності болю й суглобового випоту, що свідчить про наявність інших механізмів його розвитку. За даними гістохімічного дослідження відзначено зменшення відносної кількості фібрил ІІ типу й діаметра фібрил І і ІІ типу в середньому сідничному м’язі пацієнтів із тяжким коксартрозом, які очікують на операцію (артропластику), порівняно з особами контрольної групи (Sirca A. et al., 1980). Відносне збільшення кількості фібрил І типу може зумовлювати появу скутості м’язів і спричиняти розвиток ОА. Необхідно відзначити, що у частини хворих без гіпотрофії чотириголового м’яза стегна може спостерігатися слабкість цього м’яза (Madsen O. et al., 1997). Це спостереження свідчить про те, що м’язова слабкість не завжди зумовлена атрофією періартикулярних м’язів або артралгією і наявністю суглобового випоту, а частіше — м’язовою дисфункцією (Slemenda S. et al., 1997). Причинами останньої можуть бути деформація кінцівки, втома м’язів або зміни пропріорецепторів. Електроміографічний аналіз чотириголового м’яза стегна під час ізометричного скорочення при згинанні колінного суглоба на 30° і 60° показав значно більшу активність (переважно прямого м’яза стегна) у пацієнтів із варусною деформацією колінного суглоба, ніж у здорових осіб (Marks R. et al., 1994). Ці дані пояснюють більш високу енергетичну потребу і швидку стомлюваність хворих на ОА при тривалій руховій активності.
За даними деяких дослідників (Jan M. et al., 1990; Slemenda S. et al., 1997) слабкість чотириголового м’яза стегна є первинним чинником ризику прогресування ОА колінних суглобів. За даними О. Madsen та співавторів (1997) невелике збільшення сили м’яза (на 19% від середнього показника у чоловіків і на 27% — у жінок) може привести до зниження ризику прогресування ОА на 20–30%.
У ході дослідження здійснювали кількісну оцінку рухів екстензора і флексора колінного суглоба у хворих на гонартроз: як ізометричне, так і ізотонічне скорочення чотириголового м’яза стегна було менш виражене у хворих на ОА колінного суглоба, ніж у здорових волонтерів (Wessel J., 1996). За даними L. Nordersjo та співавторів (1983) активність скорочення згинача колінного суглоба також була нижча нормальної, але меншою мірою, ніж розгинача. Ізокінетичне дослідження виявило, що у хворих на гонартроз слабкість розгинача колінного суглоба відзначають частіше, ніж слабкість згинача (Madsen O. et al., 1996; Slemenda C. et al., 1997).
Як природний амортизатор ударів, періартикулярні м’язи виконують захисну функцію. Незважаючи на те що в ряді клінічних досліджень продемонстрований вплив вправ для зміцнення чотириголового м’яза стегна на симптоми ОА у хворих на гонартроз (Fischer N. et al., 1991; Marks R., 1993; Schilke D. et al., 1996), перед початком їх виконання необхідно купірувати біль, набряклість м’яких тканин, видалити суглобовий випіт з метою максимального усунення феномену артрогенного пригнічення м’язів, що перешкоджає ефективній реабілітації. Більше того, тиск, що генерується активністю м’яза згинача в колінному суглобі при наявності в ньому випоту, впливає на мікроциркуляцію суглобової рідини шляхом стиснення капілярів (Stevens C. et al., 1991).
Вправи для зміцнення періартикулярних м’язів можна розділити на три групи:
- ізометричні (скорочення м’яза без зміни його довжини): скорочення м’яза триває 6 с, далі йде розслаблення, вправу повторюють 5–10 разів; паралельно рекомендується коактивація м’язів-антагоністів. S. Himeno та співавтори (1986) виявили, що навантаження розподіляється однаково на поверхні ТФВ колінного суглоба, якщо сила м’язів-агоністів врівноважується силою м’язів-антагоністів, що, у свою чергу, знижує загальне навантаження на поверхню суглоба й запобігає локальному ушкодженню (Baratta R. et al., 1988);
- ізотонічні (рухи кінцівки в суглобі з додатковим опором або без такого, при яких періартикулярні м’язи вкорочуються або подовжуються); ізотонічні вправи слід проводити без подолання існуючого обсягу рухів та із субмаксимальним опором;
- ізокінетичні (рухи в суглобі здійснюються в повному обсязі з постійною швидкістю); за допомогою ізокінетичного динамометра опір варіюється таким чином, що збільшення м’язової сили сприяє підвищенню опору, а не збільшенню швидкості руху й навпаки.
O. Miltner та співавтори (1997) повідомили про вплив ізокінетичних вправ на парціальний тиск кисню (рО2) у внутрішньосуглобових тканинах у хворих на ОА: швидкість 60° на 1 с призвела до зниження внутрішньосуглобового рО2 нижче рівня, що спостерігається у стані спокою, тоді як швидкість 180° на 1 с викликала покращання метаболізму у внутрішньосуглобових структурах. Відомо, що патологічне зниження внутрішньосуглобового рО2 має руйнівні наслідки відносно метаболізму хондроцитів. Однак найнебезпечнішою є реоксигенація тканин, що виникає слідом за гіпоксією. Результати дослідження, проведеного D. Blake та співавторами (1989), свідчать про те, що при ураженні колінного суглоба (артрити різної етіології в тому числі й ОА, ускладнений синовіт) фізичні вправи індукують ушкодження, опосередковане активними кисневими радикалами. Механізм синовіальної ішемії-реперфузії на сьогодні добре відомий. При гонартрозі середнє значення рО2 у стані спокою значно знижене. Фізичні вправи в колінному суглобі із синовітом призводять до вираженого підвищення внутрішньосуглобового тиску, надмірного тиску перфузії капілярів, а в деяких випадках — і до підвищення систолічного артеріального тиску, що викликає гіпоксію тканин (Edmonds S. et al., 1995). У цей період підвищеного внутрішньосуглобового тиску знижується рО2 синовіальної рідини. У стані спокою внутрішньосуглобовий тиск знижується, виникає реперфузія (рис. 12.2) (Blake D. et al., 1989). Домінуючими джерелами кисневих радикалів у суглобі, ураженому ОА, що утворюються в результаті феномену гіпоксія — реоксигенація, є ендотеліоцити капілярів і хондроцити (Himeno S. et al., 1986; Baratta R. et al., 1988; Henrotin Y. et al., 1993; Croisier J.L. et al., 1994; Kannus P., 1994; Edmonds S. et al., 1995; Singh D. et al., 1995; Miltner O. et al., 1997). Кисневі радикали індукують ушкодження всіх компонентів хрящового матрикса й зменшують в’язкість синовіальної рідини (Roberts C. et al., 1989; Nurcombe H. et al., 1991; Saari H., 1991). Більше того, гіпоксія індукує синтез і вивільнення ендотеліальними клітинами ІЛ-1 — цитокіну, відповідального за деградацію суглобового хряща (Shreeniwas R. et al., 1992).
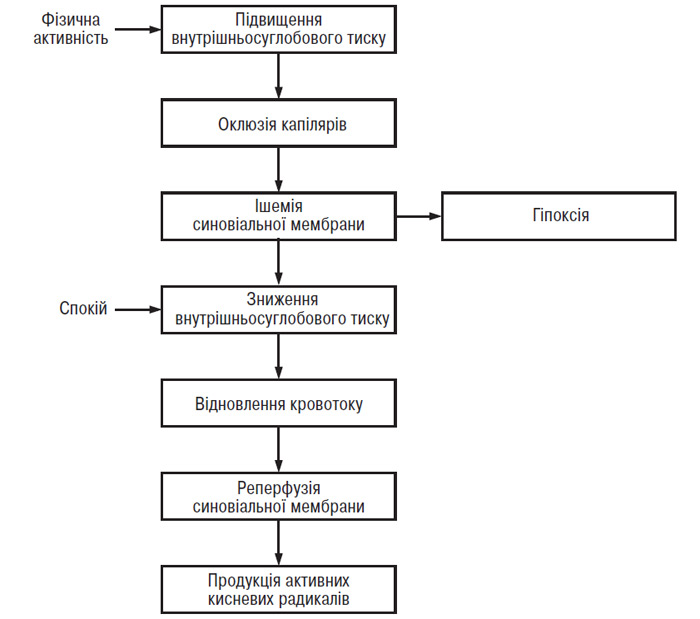
Рис. 12.2. Феномен ішемії — реперфузії в синовіальній мембрані, що розвивається в запаленому суглобі під час ізокінетичних вправ
Метою вправ на розтягнення є відновлення довжини вкорочених періартикулярних м’язів. Причинами вкорочення м’язів можуть бути тривалий спазм м’язів, деформація скелета, обмеження рухів у суглобах. У свою чергу вкорочення періартикулярних м’язів індукує обмеження обсягу рухів у суглобі. Після 4 тиж вправ на розтягнення та ізометричних вправ J. Falconer та співавтори (1992) спостерігали у хворих на ОА збільшення обсягу рухів і відновлення ходьби. G. Leivseth та співавтори (1988) вивчали ефективність пасивного розтягнення відвідного м’яза стегна у 6 хворих на коксартроз. Чергування розтягнення (30 с) і паузи (10 с) повторювали протягом 25 хв 5 днів на тиждень протягом 4 тиж, що призвело до збільшення обсягу відведення стегна в середньому на 8,3° і зменшення вираженості болю в суглобах. При біопсії м’язової тканини виявили гіпертрофію фібрил І і ІІ типу та підвищення вмісту глікогену. Вправи на розтягнення протипоказані при наявності випоту в суглобі.
Аеробні вправи. Існує ряд доказів необхідності проведення програм аеробних вправ при ОА. Відомо, що споживання кисню й енергії при ходьбі у хворих на ОА колінних суглобів підвищене (Fischer N. et al., 1993). Це, ймовірно, пов’язане зі зміною нормальної функції суглобів і м’язів, що призводить до неефективної локомоції. Нерідко у хворих на гонартроз надмірна маса тіла, слабкість періартикулярних м’язів. M. Ries та співавтори (1995) відзначили, що тяжкість гонартрозу асоціюється з низьким максимальним споживанням кисню (VО2max). Це свідчить про детренованість серцево-судинної системи у хворих із тяжким гонартрозом внаслідок гіподинамії, пов’язаної з вираженим больовим синдромом і обмеженням функції ураженої кінцівки. Результати недавно проведених досліджень продемонстрували поліпшення фізичної здатності хворих на ОА (скорочення часу проходження певної відстані та ін.), що брали участь у лікувальних програмах аеробних вправ (Minor M., 1989; Ettinger W. et al., 1994; Fransen M. et al., 1997).
При розробці індивідуальних програм аеробних вправ необхідно враховувати, які суглобові групи уражені ОА. Наприклад, їзду на велосипеді (велоергометрію) можна рекомендувати хворим на гонартроз із нормальним об’ємом згинання в колінному суглобі і при відсутності значних змін у ПФВ суглоба. Плавання та вправи у воді ефективно знижують навантаження маси тіла на суглоби нижніх кінцівок при коксартрозі й гонартрозі.
Проте методист з лікувальної фізкультури має враховувати, що надмірне навантаження спричиняє розвиток і прогресування ОА (Awbrey B. et al., 1989; Ghosh P. et al., 1989; Konradsen L. et al., 1990; Buckwalter J., 1995; Lane N., 1995). Хоча, за даними W. Rejeski та співавторів (1997), аеробні вправи високої інтенсивності більш ефективно поліпшують симптоматику ОА, ніж вправи помірної та низької інтенсивності. У всякому разі при формулюванні рекомендацій хворому необхідно дотримуватися основного принципу — тренування мають бути не частіше 3 разів на тиждень і тривати не більше 35–40 хв.
За даними рандомізованого порівняльного дослідження ефективності аеробних вправ і навчальної програми у хворих похилого віку з гонартрозом, відзначають більш значне покращання рухової функції та зменшення вираженості болю у фітнесс-групі порівняно із групою пацієнтів, які брали участь лише в навчальній програмі (Ettinger W. et al., 1997). В іншому дослідженні встановлено, що у хворих на ОА, які брали участь тільки в аеробних тренуваннях (аеробна ходьба, вправи у воді) протягом 12 тиж, спостерігали більш виражене збільшення аеробної здатності, швидкості ходьби, зменшення занепокоєння/депресії порівняно з контрольною групою хворих, які виконували лише пасивні вправи на відновлення обсягу рухів (Minor M. et al., 1989).
Фізіотерапія особливо корисна при ОА великих суглобів нижніх кінцівок. Для купірування болю, зменшення набряку навколосуглобових тканин, рефлекторного спазму навколосуглобових м’язів, покращання мікроциркуляції, лікування слабкого чи помірного синовіту використовують вплив електромагнітних полів надвисоких і високих частот; ультразвукову терапію (в тому числі фонофорез протизапальних препаратів); короткохвильову діатермію (при відсутності синовіту); мікрохвильову терапію; електрофорез протизапальних препаратів (диклофенаку, гідрокортизону, диметилсульфоксиду); лазерну терапію; аплікації теплоносіїв (торф’яну грязь, парафін, озокерит); бальнеотерапію (радонові, сірководневі, хлоридно-натрієві, скипидарні, йодобромні ванни); гідротерапію (зменшує гравітаційне навантаження на суглоби, головним чином кульшовий).
У період загострення ОА, зумовленого реактивним синовітом, можна використовувати ультрафіолетове опромінення в еритемних дозах (5–6 процедур), електричне поле й дециметрові хвилі у слабкотепловій дозі (8–10 процедур), магнітотерапію (10–12 процедур), фонофорез або електрофорез метамізолу натрію, прокаїну, тримекаїну, диметилсульфоксиду на ділянку ураженого суглоба. Протипоказаннями до застосування ультрафіолетової терапії є супутня ішемічна хвороба серця, минущі порушення мозкового кровообігу, тиреотоксикоз, захворювання нирок. Вплив електричним полем ультрависокої частоти протипоказаний при вираженій вегетосудинній дистонії, порушенні серцевого ритму, гіпертонічній хворобі ІІБ–ІІІ стадії.
Серед різних фізіотерапевтичних методів добре зарекомендував себе електрофорез, що поєднує терапевтичний вплив постійного електричного струму і лікарського засобу, що вводиться. Із механізмів біологічної дії постійного електричного струму можна виділити такі фізико-хімічні ефекти: електроліз — рух заряджених частинок (катіонів і аніонів) до протилежно зарядженого електроду і перетворення їх в атоми, що мають високу хімічну активність; переміщення заряджених частинок під дією постійного електричного струму викликає зміну іонної кон’юнктури у тканинах і клітинах. Скупчення протилежно заряджених частинок біля біологічних мембран призводить до їх поляризації і утворення додаткових поляризаційних струмів; в результаті зміни проникності біологічних мембран збільшується пасивний транспорт через них великих білкових молекул (амфолітів) та інших речовин — електродифузія; електроосмос — різноспрямований рух молекул води, включених у гідратні оболонки іонів (головним чином Na+, K+, Cl–).
Під дією електричного струму в прилеглих тканинах активуються системи регуляції локального кровотоку і підвищується вміст біологічно активних речовин (брадикініну, калікреїну, ПГ) і вазоактивних медіаторів (ацетилхоліну, гістаміну). Внаслідок цього просвіт судин шкіри розширюється і виникає гіперемія.
Розширення капілярів і підвищення проникності їх стінок внаслідок місцевих нейрогуморальних процесів виникають не лише в місці прикладання електродів, але й у глибоко розташованих тканинах, через які проходить постійний електричний струм. Поряд із посиленням крово- та лімфотоку, підвищенням резорбційної здатності тканин спостерігаються послаблення м’язового тонусу, посилення видільної функції шкіри і зменшення набряку у вогнищі запалення. Крім того, внаслідок електроосмосу знижується компресія больових провідників, більш виражена під анодом.
Постійний електричний струм посилює синтез макроергічних з’єднань у клітинах, стимулює обмінно-трофічні процеси у тканинах, підвищує фагоцитарну активність макрофагів, прискорює процеси регенерації, стимулює ретикулоендотеліальну систему, підвищує активність факторів неспецифічного імунітету.
Таким чином, постійний електричний струм має такі лікувальні ефекти: протизапальний, метаболічний, вазодилативний, сануючий (дренуючий-дегідратуючий), анальгезивний, міорелаксуючий, седативний (на аноді) (Боголюбов В.М., Пономаренко Г.Н., 1998; Лукомский И.В. и соавт., 1998).
У період стихання загострення, а також у початковій стадії захворювання, коли явища синовіту слабко виражені або відсутні, показане застосування впливу електромагнітними полями високих і надвисоких частот (індуктотермія, дециметрова і сантиметрова хвильова терапія), імпульсні струми низької частоти — синусоїдальні модульовані та діадинамічні, магнітотерапія, лазерний вплив, фонофорез гідрокортизону. Для стимуляції трофіки суглобового хряща проводять електрофорез солей літію, кальцію, сірки, цинку, 0,01% розчину фракцій гумінових кислот хаапсалуської морської лікувальної грязі в ізотонічному розчині натрію хлориду. Для потенціювання знеболювальної дії застосовують електрофорез прокаїну, метамізолу натрію, саліцилової кислоти (Боголюбов В.М., Пономаренко Г.Н., 1998; Лукомский И.В. и соавт., 1998; Гаспарян Л.В., 2000).
Електромагнітні поля високих і надвисоких частот — індуктотермія, дециметро- і сантиметрохвильова терапія — при впливі на суглоби слабкотепловими і тепловими дозами (12–15 процедур на курс лікування) виявляють на артикулярні та періартикулярні тканини виражену теплову дію, збільшують приплив крові до тканин суглоба, посилюють лімфовідтік, процеси дифузії, усувають м’язовий спазм. Це сприяє поліпшенню живлення хряща, виявляє розсмоктувальну дію при синовіті, а також позитивно впливає на періартикулярні проліферативні процеси. Індуктотермію застосовують у хворих на ОА І–ІІ стадії, при відсутності або незначному вторинному синовіті, наявності больового синдрому, періартикулярних змін. Індуктотермія не показана при загостренні вторинного синовіту, а також хворим старечого віку, при ішемічній хворобі серця, атеросклеротичному ураженні судин серця, порушеннях серцевого ритму, вираженому церебральному атеросклерозі, минущих порушеннях мозкового кровообігу, клімактеричних розладах, фіброміомі, тиреотоксикозі. Цим хворим призначають процедури дециметро- або сантиметрохвильового впливу.
Дециметро- і сантиметрохвильову терапію застосовують при ОА I–IV стадії при відсутності або слабких проявах вторинного синовіту, а також при ішемічній хворобі серця з частими нападами стенокардії, у пацієнтів із вираженими клімактеричними розладами, фіброміомою.
Знеболювальний ефект, сприятливий вплив на гемодинаміку й обмінні процеси в суглобі виявляють імпульсні струми низької частоти — синусоїдальні модульовані й діадинамічні. Синусоїдальні модульовані струми хворими переносяться краще, ніж діадинамічні, до них менше розвивається «звикання» тканин, тому їм надається перевага. Імпульсні струми низької частоти показані хворим похилого й старечого віку з ОА I–IV стадії, вираженим больовим синдромом, змінами в періартикулярних тканинах. Імпульсні струми не призначають при явищах вторинного синовіту, а також хворим із порушеннями серцевого ритму із брадикардією чи схильністю до брадикардії.
Ультразвукову терапію часто використовують у лікуванні різних гострих і хронічних захворювань опорно-рухового апарату. Ультразвук виявляє теплову (збільшення кровотоку, підвищення больового порогу, підвищення інтенсивності метаболізму) і нетеплову (підвищення проникності клітинних мембран, транспорт кальцію через клітинну мембрану, доставка поживних речовин у тканини, фагоцитарна активність макрофагів) дію (Gersten J., 1955; Aleya W. et al., 1956; Dyson M. et al., 1968; Duarte L., 1983). При пульсовому способі подачі ультразвуку знижується тепловий ефект, нетеплова дія залишається без зміни, тому застосування пульсового ультразвуку показане хворим на ОА при наявності синовіту. Ультразвук показаний пацієнтам з ОА I–IV стадії без явищ синовіту з вираженим больовим синдромом, проліферативними змінами в періартикулярних тканинах. Ультразвукова терапія протипоказана при загостренні синовіту, а також хворим старечого віку з вираженим атеросклеротичним ураженням судин серця й мозку, гіпертонічною хворобою ІІІ стадії, минущими порушеннями мозкового кровообігу, при тиреотоксикозі, вегетосудинній дистонії, клімактеричних розладах, фіброміомі, мастопатії.
М’язовий спазм — одне із джерел болю і причина обмеження функції суглобів у хворих на ОА. Спазм періартикулярних м’язів викликає підвищення внутрішньосуглобового тиску й навантаження на суглобову поверхню, а також зменшення кровотоку в м’язі, внаслідок чого розвивається локальна ішемія. Тому усунення м’язового спазму має велике значення в лікуванні і реабілітації хворих на ОА.
Для розслаблення спазмованих м’язів застосовують масаж, глибоке й поверхневе зігрівання (теплові аплікації, інфрачервоне випромінювання, короткохвильову або мікрохвильову діатермію, сауну або парнy). Місцева аплікація підвищує кровотік в ураженій зоні, зменшує біль і м’язовий спазм, викликає загальне розслаблення. Підвищення кровотоку в м’язах сприяє елімінації метаболітів (молочної кислоти, СО2 та ін.) і припливу джерел енергії (О2, глюкоза тощо). Крім того, поверхневе зігрівання, впливаючи на нервові закінчення, виявляє седативну й знеболювальну дію, що доведено ще в 1958 р. (Lehman J. et al., 1958). Ще одним механізмом розслаблення м’язів за допомогою аплікації є зменшення збудливості нервово-м’язових веретен (Fischer E. et al., 1965).
Аплікації мулу або торф’яної грязі (температура 38–42 °С), парафіну й озокериту (температура 50–55 °С) призначають у кількості 10–15 процедур на уражений суглоб або на частину тіла, що включає уражені суглоби. Аплікації грязі, озокериту й парафіну показані хворим з ОА I–II стадії без синовіту або з незначними його проявами, при вираженому больовому синдромі, проліферативних явищах, рефлекторних змінах у м’язах скелета. Їх не застосовують при значних змінах у суглобах, уражених ОА, виражених явищах синовіту, а також при ішемічній хворобі серця, гіпертонічній хворобі ІІБ–ІІІ стадії, недостатності кровообігу, варикозному розширенні вен, захворюванні судин ЦНС, гострому і хронічному нефриті й нефрозі та ін.
Як неодноразово відзначалося, оскільки суглобовий хрящ не має нервових закінчень, процес деградації, що відбувається в ньому, не є причиною болю при ОА. Причини болю можна поділити на дві групи (Crielaard J.M., Henrotin Y., 1999):
- внутрішньосуглобові: підвищення внутрішньосуглобового тиску, викликане суглобовим випотом; надмірне навантаження на субхондральну кістку; мікропереломи трабекул; розрив внутрішньосуглобових зв’язок; защемлення ворсин синовіальної оболонки; розтягнення суглобової капсули; запалення синовіальної оболонки;
- позасуглобові: зниження венозного відтоку з подальшим застоєм крові в субхондральній кістці; м’язовий спазм; запалення періартикулярних сухожиль (тендиніт).
Проводячи вибір адекватної знеболювальної терапії лікареві необхідно визначити джерело болю. Серед фізіотерапевтичних методів знеболювальний ефект виявляють аплікація теплоносіїв або джерел холоду, ультразвук, пульсове електромагнітне поле, іонізація, електротерапія, електроакупунктура та вібротерапія.
З метою зменшення вираженості болю й запалення можна використовувати холод — пакети з льодом, кріогель, локальний охолоджувальний спрей, систему подачі охолодженого газу. Поверхневе охолодження зменшує м’язовий спазм, знижує активність нервово-м’язових веретен і підвищує больовий поріг (Mennell J., 1973; Benson T. et al., 1974). При ОА ефективне розпилення охолоджувальних спреїв над зоною, де знаходяться тригерні точки больового м’яза (Travell J., 1952).
Глибоке зігрівання досягається за допомогою короткохвильової, мікрохвильової та ультразвукової терапії. За даними K. Svarcova та співавторів (1988) короткохвильова діатермія викликала значне зменшення вираженості болю у пацієнтів з ОА колінних і кульшових суглобів. Поверхневе зігрівання за допомогою інфрачервоного випромінювання також зменшує вираженість болю й поліпшує функцію уражених суглобів при ОА колінних суглобів і суглобів кистей.
Сприятливий вплив на обмінні процеси, метаболізм хряща, периферичну гемодинаміку й мікроциркуляцію виявляє бальнеотерапія — сульфідні, радонові, йодобромні, хлоридно-натрієві, скипидарні ванни. Якщо ОА розвинувся у осіб молодого (35–40 років) віку без супутніх серцево-судинних захворювань, то застосовують ванни із середньою концентрацією речовин і газів, досить великою тривалістю впливу (15–20 хв) і курсу лікування, що складається з 12–14 процедур. Пацієнтам віком старше 45 років, а також особам молодого віку із залишковими явищами вторинного синовіту бальнеотерапію призначають за щадною методикою: ванни з невисокою концентрацією речовин і газів, тривалістю не більше 8–10 хв, на курс лікування — 8–10 процедур. З урахуванням віку пацієнтам із супутніми серцево-судинними захворюваннями можна призначати напівванни, чотири- і двокамерні ванни, які легше переносяться хворими.
Радонові ванни рекомендуються хворим з ОА І–ІІ стадії із залишковими явищами синовіту, вираженим больовим синдромом і без нього, змінами м’язів, порушенням локомоторної функції суглобів, із супутніми вегетативними порушеннями, клімактеричними розладами. Сульфідні, хлоридно-натрієві й скипидарні ванни показані хворим із ОА І–ІІ стадії без явищ вторинного синовіту, з порушенням локомоторної функції, ожирінням, атеросклеротичним ураженням судин. Йодобромні ванни призначають хворим на ОА без явищ синовіту, із супутніми функціональними змінами ЦНС, тиреотоксикозом, клімактеричними розладами, атеросклеротичним ураженням судин тощо.
Протипоказаннями до бальнеотерапії є загострення синовіту, а також ішемічна хвороба серця, гіпертонічна хвороба ІІБ–ІІІ стадії, виражене атеросклеротичне ураження коронарних і церебральних судин, гострі та підгострі запальні захворювання, а для сульфідних і скипідарних ванн — також захворювання печінки й жовчних шляхів, нирок.
Використання допоміжних пристосувань. До них належать різні бандажі, наколінники, ціпок, милиці, ортопедичне взуття тощо. Усі вони сприяють зменшенню навантаження на уражений суглоб, тим самим зменшуючи больові відчуття. Замість спеціального ортопедичного взуття пацієнтові можна рекомендувати носіння спортивного взуття (кросівок) зі спеціальними прокладками, що знижують навантаження на суглоби нижніх кінцівок. D.A. Neumann (1989) виявив, що при використанні милиці навантаження на кульшовий суглоб зменшується на 50%. Клиноподібна прокладка з еластичного матеріалу, яку поміщають у взуття під п’яткову ділянку під кутом 5–10°, ефективна у хворих на ОА медіального ТФВ колінного суглоба, особливо при І–ІІ стадії за класифікацією Келлгрена — Лоуренса (Sasaki T., Yasuda K., 1987). При нестабільності колінного суглоба чи ізольованому ураженні медіального або латерального відділу суглоба ефективне використання наколінників (Barret D.S. et al., 1991).
Медіальна тракція надколінка. При ураженні ПФВ колінного суглоба у хворих часто розвивається нестабільність надколінка. Стабілізація надколінка різними способами призводить до значного зменшення інтенсивності болю в ураженому суглобі, зниження потреби в знеболювальних препаратах. Одним із засобів стабілізації надколінка є його фіксація за допомогою смужки широкого лейкопластиру (Cushnaghan J. et al., 1994; Kowall M. et al., 1996). Спосіб стабілізації полягає в наступному: одним кінцем довгу смужку лейкопластиру закріплюють на зовнішній поверхні колінного суглоба, потім великим пальцем правої руки лікар зміщає надколінок медіально й фіксує його в цьому положенні за допомогою лейкопластиру, другий кінець якого закріплює на внутрішній поверхні колінного суглоба.
Нетрадиційні методи лікування. Нетрадиційні методи лікування при ОА широко використовують в усьому світі, зокрема в Україні. Так, у Великобританії акупунктура доступна 84% пацієнтів із хронічним болем, приблизно 4000 лікарів загальної практики та фізіотерапевтів одержали сертифікати на проведення лікувальної акупунктури (Woollam С.H.M. et al., 1998; Zollman C. et al., 1999). У Німеччині застосування лікувальної акупунктури затверджене рішеннями Федерального комітету лікарів і Фонду медичного страхування від 16 жовтня 2000 р. (Streiberger K. et al., 2004). Однак ефективність нетрадиційних методів все ще вважається сумнівною, оскільки недостатньо вивчена в контрольованих клінічних випробуваннях (Macclenan A.H. et al., 1996; Eisenberg D.M. et al., 1998; Harres P. et al., 2000; Linde K. et al., 2001).
Акупунктура — традиційний китайський метод лікування, що полягає у стимуляції певних точок на тілі металевими голками. Деякі інші методики, зокрема мануальну (акупресуру), електричну чи лазерну стимуляцію точок акупунктури, часто поєднують із традиційним методом під загальною назвою «акупунктура» (Filshie J. et al., 1997; Zollman C. et al., 2000). У Китаї акупунктуру зазвичай використовують у комбінації з іншими традиційними методами лікування, наприклад фітотерапією. У західних країнах акупунктуру частіше використовують як монотерапію (Linde K. et al., 2001). В основі ідеї акупунктури лежить концепція про потоки Чи (життєва сила й енергія): розладам, пов’язаним зі змінами Чи, можна запобігти або вилікувати стимулюванням релевантних точок на поверхні тіла (Linde K. et al., 2001).
B.V. Christensen та співавтори (1992) у контрольованому дослідженні виявили значне зменшення вираженості болю й зниження добової дози анальгетиків на фоні акупунктури у хворих на ОА, що готуються до артропластики (7 пацієнтів із 42 відмовилися від операції).
C. Sangdee та співавтори (2002) опублікували результати рандомізованого сліпого плацебо-контрольованого порівняльного дослідження ефективності електроакупунктури, диклофенаку та їх комбінації у хворих із симптоматичним ОА колінних суглобів. 192 пацієнти були рандомізовані на 4 групи: плацебо, диклофенак, електроакупунктура та їх комбінація. Первинними критеріями ефективності служили застосування парацетамолу, WOMAC, ВАШ болю, функціональний індекс Лекена, час проходжения 50 футів і загальна оцінка ефективності лікарем і пацієнтом. Із усіх включених пацієнтів 186 завершили дослідження. За такими показниками, як ВАШ болю та індекс Лекена покращання у групі електроакупунктури було значно більш вираженим, ніж у групі плацебо чи диклофенаку. У групі лікування електроакупунктурою і диклофенаком відзначене найбільше покращання індексів WOMAC.
У подвійному сліпому контрольованому рандомізованому порівняльному дослідженні ефективності й переносимості гомеопатичного гелю та гелю, що містить піроксикам, взяли участь 184 пацієнти з ОА колінних суглобів (van Haselen R.A. et al., 2000). У рамках дослідження пацієнтам призначали аплікації 1 г гелю 3 рази на добу протягом 4 тиж. На фоні лікування у групі хворих, які одержували гомеопатичну терапію, ВАШ болю в середньому знизився на 16,5 мм, у групі піроксикаму — на 8,1 мм (р<0,05). Водночас дослідники не виявили значної різниці у зниженні індексу Річі між групами (р>0,05). Побічні ефекти були зареєстровані у 12 хворих групи гомеопатії та у 16 пацієнтів групи піроксикаму (р>0,05). З них у 7 та 11 пацієнтів відповідно відзначали місцеву реакцію, що зумовила достроковий вихід дослідження 2 пацієнтів групи гомеопатії та 5 пацієнтів групи піроксикаму. Аналіз результатів дослідження дозволив авторам зробити висновок про те, що гомеопатичний гель був так само ефективний, як і гель піроксикаму. Таким чином, використання гомеопатичного гелю (при необхідності) у комбінації з ненаркотичними анальгетиками може бути терапією вибору для хворих на гонартроз.
В іншому подвійному сліпому контрольованому дослідженні гомеопатичного лікування були продемонстровані менш обнадійливі результати. M. Shipley та співавтори (1983) порівняли ефективність і переносимість гомеопатичного препарату на основі лікарської рослини токсидендрон і фенопрофену у хворих на ОА колінних і кульшових суглобів. Отримані результати свідчать про перевагу фенопрофену як порівняно із плацебо, так і з гомеопатичним препаратом. Водночас останній не відрізнявся за ефективністю від плацебо й значно поступався фенопрофену. Побічні ефекти вірогідно частіше відзначали у групі фенопрофену. Характерно, що результати оцінки ефективності лікування ревматолога не відрізнялися від таких лікаря-гомеопата.
МЕДИКАМЕНТОЗНЕ ЛІКУВАННЯ
Всі препарати, що застосовуються при остеоартрозі, умовно поділяють на дві групи:
- симптоматичні (symptoms modifying antiosteoarthritis drugs — SMOADs),
- патогенетичні, або модифікуючі захворювання (structure modifying або disease modifying antiosteoarthritis drugs — DMOADs).
Розрізняють також повільно- і швидкодіючі препарати.
Умовність такого розподілу зумовлена недостатністю знань про механізм дії ліків, що застосовуються при ОА. Практично всі препарати, що застосовуються в терапії хворих на ОА (НПЗП, депо-ГК, гіалуронова кислота, хондроїтин сульфат та ін.), мають симптоматичний ефект, але відрізняються різною швидкістю настання ефекту — до швидкодіючих симптоматичних засобів можна віднести ненаркотичні анальгетики, НПЗП, депо-ГК та інші, а до повільнодіючих — гіалуронову кислоту, хондроїтину сульфат та ін.
Оскільки на сьогодні для жодного терапевтичного агента не доведені патогенетичні властивості, препарати, які часто називають модифікуючими хворобу або модифікуючими структуру (гіалуронова кислота, хондроїтин, глюкозаміну сульфат та ін.), не можна віднести до цієї групи. Проте це не означає, що зазначені препарати, а також інші лікарські речовини (наприклад НПЗП) не мають таких властивостей. Водночас не можна вважати ефект подібних препаратів винятково симптоматичним — в умовах in vivo та in vitro продемонстрована їх здатність позитивно впливати на метаболізм суглобового хряща у хворих на ОА.
Класифікація препаратів, що застосовуються при ОА, розроблена Об’єднаним комітетом ВООЗ і ILAR (за: Lequesne M. et al., 1994):
1. Препарати симптоматичної дії (symptoms modifying antiosteoarthritis drugs — SMOADs):
- швидкодіючі;
- повільнодіючі (symptomatic slow-acting drugs for osteoarthritis — SYSADOA).
2. Препарати патогенетичної дії (disease modifying antiosteoarthritis drugs — DMOADs).
Необхідно пам’ятати, що симптоматичні препарати можуть виявляти патогенетичну дію і, навпаки, лікарські засоби патогенетичної дії можуть мати симптоматичний ефект.
Аплікаційна терапія — простий і безболісний спосіб лікування хворих на остеоартроз, що доповнює терапію препаратами системної дії (парацетамол, НПЗП та ін.). Перевагами аплікаційної терапії є: безпосередній вплив на основне вогнище ураження — орган-«мішень», а саме — суглоб; досягнення оптимальної терапевтичної концентрації препарату в ураженому органі, що знижує потребу в системному призначенні фармакологічних засобів, при цьому зменшується токсичний вплив лікарських препаратів.
Згідно із сучасними вимогами, препарат для місцевого застосування не має викликати місцевих токсичних і алергічних реакцій; повинен досягати органа-«мішені»; концентрація препарату в сироватці крові не повинна досягати рівня, при якому виникають дозозалежні побічні ефекти; метаболізм і виведення препарату повинні бути такими ж, як при системному застосуванні. При застосуванні аплікацій передбачається створення терапевтичної концентрації препарату в тканинах у місці нанесення, при цьому в загальний кровотік надходить лише незначна кількість речовини, що дозволяє практично звести до мінімуму системні побічні ефекти (Насонова В.А. и соавт., 1998).
Значне поширення в аплікаційній терапії при остеоартрозі набули мазі із зігрівальним і відволікаючим ефектом, що містять як синтетичні активні речовини, так і приготовані на основі бджолиної та зміїної отрути. У лікуванні м’язового й суглобового болю традиційно застосовуються мазі, що містять ментол як болезаспокійливий засіб; саліцилати, що мають анальгезивні та протизапальні властивості; скипидар — компонент, що виявляє місцеву подразнювальну й анальгезивну дію; ефіри нікотинової кислоти, що сприяють розширенню кровоносних судин.
Капсаїцин — алкалоїд, одержаний із рослин сімейства пасльонових, стимулює вивільнення нейропептиду субстанції Р із закінчень периферичних нервів, попереджаючи його повторне захоплення. Локальна аплікація капсаїцину призводить до зниження вмісту субстанції Р у нейроні в цілому, в тому числі у його гілках, що іннервують більш глибокі тканини, наприклад суглоба (Virus R.M. et al., 1979; Fitzgerald M., 1983). У контрольованих клінічних дослідженнях капсаїцин викликав зменшення вираженості болю в суглобах у хворих на гонартроз і ОА суглобів кистей. Максимальний ефект досягається через 3–4 тиж лікування (Altman R.D. et al., 1994).
Застосування засобів, що містять НПЗП, у вигляді аплікацій — ібупрофен, піроксикам, диклофенак — обґрунтовано патогенетично. Для одержання клінічного ефекту при використанні мазей, що містять НПЗП, необхідно застосовувати їх досить тривалий час, дотримуватися кратності аплікацій, наносити на шкіру достатню кількість препарату. НПЗП для місцевого застосування ефективні при гострому й хронічному болю і часто використовуються при ОА як препарати, що не викликають побічних ефектів з боку травного тракту. Однак дослідження порівняння ефективності НПЗП для місцевого і перорального застосування при лікуванні ОА (Evans J.M. et al., 1996; Eccles M. et al., 1998; Moore R.A. et al., 1998) досі не проводилися.
Серед засобів, які містять НПЗП, що застосовуються для аплікацій, добре зарекомендував себе крем, активною речовиною якого є ібупрофен (Насонова В.А. и соавт., 1998; Креминская Н.К., Дейкун А.И., 2000). Він зарекомендував себе як засіб контактного лікарського середовища при проведенні ультрафонофорезу.
Диметилсульфоксид добре зарекомендував себе в лікуванні хворих на ОА. Його 50% водний розчин у вигляді аплікацій на уражений суглоб виявляє протизапальний і знеболювальний ефект. Крім того, димексид як хороший розчинник є провідником для пенетрації в м’які тканини інших лікарських засобів (прокаїну, метамізолу натрію, дротаверину, гідрокортизону). Цей засіб використовується як в аплікаційній терапії ОА, так і для покращення введення ліків при електрофорезі методом електродрегінгу (Балабанова Р.М. и соавт., 1982; Оранский И.Е., 1984; Мурах Ю.В., 1988).
До недоліків аплікаційної терапії належить невисока концентрація лікарського засобу, що проникає у тканини (у середньому до 5% використовуваної кількості). Лікарський препарат резорбується в м’які тканини через вивідні протоки потових і сальних залоз, волосяні фолікули, міжклітинні простори. Ступінь проникнення препарату залежить від його ліпофільності та ступеня зволоження рогового шару епідермісу. Утруднюють проникнення лікарських засобів у глиб тканин бар’єрні функції шкірного покриву, у тому числі перепад градієнтів рН.
Швидкодіючі препарати для лікування остеоартрозу
Ненаркотичні анальгетики (наприклад парацетамол) частіше використовують в період вимивання при апробації НПЗП. Однак результати порівняльних досліджень, проведених у 80–90-х роках ХХ ст., свідчать про те, що парацетамол як симптоматична терапія при ОА у хворих зі слабко та помірно вираженим больовим синдромом, може бути альтернативою іншим НПЗП, що мають незаперечну протизапальну та знеболювальну дію.
Механізм дії парацетамолу пов’язаний зі зниженням активності окиснених форм ЦОГ-1 та -2 у ЦНС і спинному мозку (Outllet M., Percival M.D., 2001).
Головний клінічний симптом остеоартрозу — біль — слабко корелює з гістологічними змінами синовіальної оболонки і суглобового хряща. Крім того, біль при ОА може бути зумовлений не тільки синовітом, але й розтягненням суглобової капсули, зв’язок, а також нервових закінчень у періості над остеофітами, мікропереломами трабекул, внутрішньокістковою гіпертензією, м’язовим спазмом. Отже, можна зробити висновок, що при ОА не завжди є необхідність у протизапальному ефекті симптоматичного засобу (Brandt K.D., 2000).
Результати порівняльних досліджень ефективності й переносимості НПЗП у хворих на ОА у переважній більшості випадків демонструють помірну позитивну динаміку суглобового синдрому. Так, за даними V.C.H. Tyson і A. Glynne (1980) перед лікуванням ібупрофеном або беноксапрофеном хворі відзначали біль, що відчувається на 100 мм ВАШ, у середньому на рівні 55 мм, а після 4 тиж лікування — на рівні 34 мм, тобто динаміка становила всього 21%. В інших дослідженнях відзначено, що на фоні лікування НПЗП динаміка показників суглобового синдрому варіювала між 10–20% і таку ж різницю (тобто 10–20%) реєстрували між результатами в основній групі та у групі плацебо. Зазвичай хворі на ОА на 100 мм ВАШ відзначають вихідне значення болю на рівні 40–60 мм, яке на фоні курсової терапії НПЗП зменшується до 25–45 мм (Levinson D.J., Rubinstein H.M., 1983; Kvien T.K. et al., 1991; Lister B.J. et al., 1993). Тому не дивно, що прості анальгетики у багатьох хворих не менш ефективні, ніж НПЗП.
Лікування парацетамолом хворих на остеоартроз колінного суглоба різного ступеня тяжкості виявилося ефективним у 30%, в тому числі і у пацієнтів, які приймали НПЗП до дослідження (Dieppe P. et al., 1993; March L. et al., 1994).
J.D. Bradley та співавтори (1991) порівнювали ефективність парацетамолу та ібупрофену в рамках подвійного сліпого плацебо-контрольованого дослідження у хворих із маніфестним гонартрозом із помірними змінами суглобів на рентгенограмах. Автори виявили, що ефективність протизапальної дози ібупрофену (2400 мг/добу) не відрізнялася від знеболювальної дози ібупрофену (1200 мг/добу), а також парацетамолу в дозі 4000 мг/добу. Крім того, у хворих із клінічними ознаками синовіту (припухлість, випіт) динаміка досліджуваних показників під впливом протизапальної дози ібупрофену не відрізнялася від такої на фоні лікування парацетамолом. Аналогічні результати одержані J. Stamp та співавторами (1989), які порівнювали ефективність і переносимість парацетамолу і флурбіпрофену у хворих на ОА.
J.H. Williams та співавтори (1993) провели дворічне подвійне сліпе плацебо-контрольоване порівняльне дослідження ефективності парацетамолу в дозі 0,65 г 4 рази на добу і напроксену 375 мг 2 рази на добу. Із 178 рандомізованих пацієнтів лише 62 завершили дослідження, причому в групі, де приймали парацетамол, кількість вибулих незначно перевищувала кількість таких у групі, де приймали напроксен. Високий відсоток відкликань інформованих згод на участь у дослідженні, ймовірно, зумовлений субоптимальними дозами обох досліджуваних препаратів. За ефективністю і переносимістю парацетамол і напроксен не відрізнялися між собою.
Порівняльне дослідження ефективності парацетамолу в дозі 3 г/добу, а також комбінації парацетамолу в дозі 3 г/добу і кодеїну — 180 мг/добу було перерване, незважаючи на відзначений більш виражений знеболювальний ефект. Причиною передчасного припинення дослідження була висока частота побічних ефектів у пацієнтів, які приймали парацетамол/кодеїн (Kjaersgaard-Andersson P. et al., 1990).
За даними P. Seidemann та співавторів (1993) знеболювальний ефект був більш виражений при додаванні до парацетамолу (4 г/добу) напроксену в дозі 0,5 або 1 г/добу, причому ця комбінація за ефективністю не поступалася монотерапії напроксеном у дозі 1,5 г/добу. Незважаючи на те що ці дані потребують підтвердження, вони свідчать про доцільність комбінації парацетамолу в терапевтичній дозі з напроксеном у низькій дозі (Wollheim F., 1996).
На думку K.D. Brandt (2000) у 40–50% хворих на ОА ефективний контроль болю в суглобах можна здійснювати за допомогою парацетамолу, однак передбачити знеболювальний ефект простих анальгетиків у конкретного пацієнта неможливо.
Головна перевага парацетамолу порівняно з іншими НПЗП — більш низька токсичність відносно шлунково-кишкового тракту (ШКТ). Однак передозування препарату (вище 10 г/добу) асоціюється з гепатотоксичністю (Farrell G.C., 1986). У проведеному в Швеції популяційному дослідженні виявлено, що частота госпіталізації, пов’язана з гепатотоксичністю парацетамолу, становила 2 випадки на 100 тис. населення на рік (Denison H. et al., 1987). У пацієнтів із захворюваннями печінки явища гепатотоксичності спостерігаються при прийомі парацетамолу у звичайних терапевтичних дозах (до 4 г/добу) (Benison H. et al., 1987). Результати клінічних спостережень свідчать про те, що у пацієнтів із хронічним алкоголізмом явища гепатотоксичності виникають на фоні лікування парацетамолом у дозі <10 г/добу (Seeff L.B. et al., 1986; Maddrey W.C. et al., 1987). З метою уникнення побічної дії необхідно призначати парацетамол у мінімальній дозі, що дозволяє досягти лікувального ефекту, а також не рекомендувати його хворим на алкоголізм (Choquette D. et al., 1999).
Парацетамол не пригнічує синтез ПГ в епітелії нирок, проте в експерименті продемонстровано його тропізм до сосочків нирок із надмірним накопиченням його метаболітів у тканині сосочків, з чим пов’язаний розвиток характерного для парацетамолу папілярного некрозу (Насонова В.А., 2002). Дані літератури свідчать про розвиток побічних ефектів з боку нирок при передозуванні парацетамолу (Kincaid-Smith P., 1986; Sandler D.P. et al., 1989). T.G. Murray та співавтори (1983) не виявили зв’язку між хронічною нирковою недостатністю і прийомом анальгетиків. T.V. Perneger та співавтори (1994) повідомили результати дослідження ризику розвитку хронічної ниркової недостатності при прийомі знеболювальних препаратів безрецептурної групи. За їх даними кумулятивна доза парацетамолу більше 1000 таблеток подвоює ризик розвитку хронічної ниркової недостатності. Водночас автори дослідження стверджують, що ці результати свідчать про відсутність зв’язку між прийомом ацетилсаліцилової кислоти і розвитком хронічної ниркової недостатності. Дані T.V. Рerneger та співавторів сумнівні й потребують підтвердження. National Kidney Foundation рекомендує парацетамол як знеболювальний препарат вибору у пацієнтів із порушенням функції нирок (Henrich W.L. et al., 1996).
Водночас результати дослідження C.M. Fored та співавторів (2001) матеріалів Шведського популяційного реєстру за 1996–1998 рр. показали, що регулярний прийом парацетамолу, ацетилсаліцилової кислоти або обох препаратів підвищує ризик розвитку хронічної ниркової недостатності. Автори підкреслюють, що попередні захворювання нирок або системна патологія є факторами, що підвищують схильність до цього. Було обстежено 926 хворих із вперше встановленим діагнозом ниркової недостатності та 998 осіб контрольної групи, з яких у 918 і 980 відповідно була необхідна документація. Серед хворих із нирковою недостатністю ацетилсаліцилову кислоту і парацетамол приймали регулярно 37 і 25% відповідно, а в контрольній групі — 19 і 12%. Відносний ризик розвитку ниркової недостатності підвищувався зі збільшенням тривалості прийому та підвищенням дози препаратів, яка була більш постійною у тих, які приймали парацетамол, ніж ацетилсаліцилову кислоту, проте автори не могли виключити роль факторів, що підвищують схильність до розвитку ниркової недостатності.
Парацетамол не впливає на функцію тромбоцитів, тому його можна рекомендувати як препарат вибору хворим на ОА, які приймають антикоагулянти (Brandt K.D., 2000). Парацетамол здатний подовжувати період напіввиведення варфарину в основному у хворих, які приймають останній у дозі вище 10 мг/добу. Тому у пацієнтів, які приймають варфарин із парацетамолом, необхідно ретельно моніторувати показник протромбінового часу (Fitzmaurice D.A. et al., 1997; Hyiek E.M. et al., 1998).
Наркотичні анальгетики не рекомендується призначати хворим на ОА. Внаслідок високого ризику розвитку побічних ефектів (нудота, блювота, запор, затримка сечі, сплутаність свідомості, сонливість, психічна й фізична залежність та ін.) деривати опіуму при ОА застосовують лише в особливих клінічних ситуаціях (Choquette D. et al., 1999).
Трамадолу гідрохлорид — відносно новий анальгетик — синтетичний опіоїдний засіб, що має два механізми дії:
- взаємодіє з µ-опіоїдними рецепторами;
- пригнічує захоплення норадреналіну і серотоніну.
У ролі знеболювального засобу трамадолу гідрохлорид у дозі 100 мг більш ефективний, ніж кодеїн в дозі 60 мг і порівнюється з комбінаціями кодеїну з ацетилсаліциловою кислотою чи парацетамолом (Sunshine A., 1994; Barkin R.L., 1995). У 2-тижневому порівняльному дослідженні застосування трамадолу гідрохлориду (300 мг/добу) і декстропропоксифену (300 мг/добу) у 264 хворих на ОА відзначено зменшення вираженості болю в уражених суглобах у 70% пацієнтів при лікуванні трамадолу гідрохлоридом і у 50% — декстропропоксифеном (Jensen J.M., Ginsberg F., 1994). Однак перший викликав більшу кількість побічних ефектів (в основному нудоту/блювоту, запаморочення). За даними подвійного сліпого рандомізованого порівняльного дослідження ефективності трамадолу (300 мг/добу) і диклофенаку (150 мг/добу) у 60 хворих на ОА (за: Wallheim F.A., 1996), наприкінці 1-го і 4-го тижня лікування зменшення вираженості болю в уражених суглобах було однаковим в обох групах; у цьому дослідженні також повідомляється про більшу кількість побічних ефектів при лікуванні трамадолу гідрохлоридом (23 випадки) порівняно з диклофенаком (2 випадки). S.F. Roth (1995) оприлюднив результати плацебо-контрольованого дослідження щодо застосування трамадолу у 50 хворих на ОА, у яких на фоні прийому НПЗП зберігався больовий синдром. Лікування трамадолом виявилося ефективнішим, ніж плацебо, але супроводжувалося більшою кількістю побічних ефектів, головним чином нудотою, запором, сонливістю.
При застосуванні трамадолу в рекомендованих дозах тяжкі побічні ефекти (пригнічення дихання) не зафіксовані. Для зниження ризику виникнення диспепсії доцільно титрувати дозу трамадолу гідрохлориду до цільової протягом 4–5 днів, починаючи з 50 мг/добу (Choquette D. et al., 1999). F.A. Wallheim (1996), D. Choquette та співавтори (1999) рекомендують призначати трамадолу гідрохлорид хворим на ОА лише у разі неефективності або непереносимості НПЗП і парацетамолу.
Кодеїн і декстропропоксифен — представники синтетичних опіоїдів, які нерідко використовують у лікуванні при ОА в комбінаціях із НПЗП та/чи парацетамолом, незважаючи на здатність викликати залежність. У порівняльному дослідженні комбінація парацетамолу в дозі 2 г/добу і декстропропоксифену в дозі 180 мг/добу у хворих на ОА була більш ефективною, ніж парацетамол (3 г/добу) і кодеїн (180 мг/добу) (Boissier C. et al., 1992). В іншому дослідженні встановлено, що декстропропоксифен і парацетамол краще переносяться хворими, ніж дигідрокодеїн (Lloyd R.S. et al., 1992). Однак за даними R.I. Shorr та співавторів (1992) ризик переломів стегнової кістки у хворих похилого віку, які застосовували кодеїн або декстропропоксифен, становив 1,6 (95% ДІ становив 1,4–1,9), а комбінація кодеїну або декстропропоксифену із психотропними засобами (седативними, антидепресантами та ін.) підвищувала ризик переломів до 2,6 (95% ДІ становив 2,0–3,4).
Амітриптилін і антидепресанти. Доказова база щодо доцільності застосування трициклічних антидепресантів у низьких дозах у ролі анальгетичних засобів при ОА є доволі обмеженою і стосується переважно іміпраміну. Однак амітриптилін у низьких дозах потенційно може використовуватися при рефрактерному больовому синдромі у хворих на ОА, що супроводжується порушенням сну. Депресія — дуже частий супутній патологічний стан у пацієнтів з ОА, і саме в тaких випадках успішне лікування депресії супроводжується зменшенням інтенсивності больового синдрому та покращанням працездатності хворих (National Institute for Health and Clinical Excellence, 2008).
НПЗП. Першим широковідомим НПЗП була саліцилова кислота, вперше синтезована у 1874 р.; незабаром виявлено її ефективність при ревматичній лихоманці. У 1875 р. вперше для лікування ревматичної лихоманки використано натрію саліцилат. У середині 80-х років ХІХ ст. натрію саліцилат одержав широке розповсюдження як препарат для лікування лихоманки різного походження (малярія, тиф), ревматичної лихоманки, РА і подагри. Молодий хімік Felix Hoffman, який працював у лабораторії «Bayer Company» в Німеччині, додав ацетилову групу до саліцилової кислоти з метою поліпшення її органолептичних властивостей (Wordsworth B.P., 1997; Vane J.R., Botting R.M., 2000). Таким чином, понад 100 років тому компанія «Bayer» вперше випустила на фармацевтичний ринок препарат ацетилсаліцилової кислоти і донині він залишається одним із засобів, що має найбільший обсяг продаж у світі (понад 45 тис. тонн на рік) (Kolts B.E., Achem S.R., 1992).
Індометацин, що з’явився на фармацевтичному ринку в 1963 р., був продуктом багаторічного пошуку нових протизапальних агентів. Незабаром після індометацину були створені такі препарати, як ібупрофен, напроксен, диклофенак та ін. Золотим стандартом НПЗП-терапії досі є диклофенак; у всіх відомих клінічних дослідженнях ефективність і безпека досліджуваного препарату оцінюється по відношенню саме до цього типу НПЗП (Коваленко В., 2004).
Більше ніж через сторіччя після синтезу ацетилсаліцилової кислоти і 40 років із моменту впровадження на фармацевтичний ринок індометацину група НПЗП залишається предметом інтересу і численних суперечок, в основному щодо механізмів дії та побічних ефектів.
Перша публікація, у якій відзначався негативний вплив ацетилсаліцилової кислоти на слизову оболонку травного тракту, з’явилася у 1938 р. При гастроскопії у пацієнтів, які приймали ацетилсаліцилову кислоту, виявлені ерозії та хронічні пептичні виразки (Douthwaith A., Lintott C.A., 1938). Дещо пізніше були описані інші побічні ефекти цього препарату. Успішне застосування ацетилсаліцилової кислоти у хворих на артрит сприяло пошуку засобів, що не поступаються їй за ефективністю, але більш безпечних, в основному по відношенню до ШКТ. Були розроблені такі препарати, як фенілбутазон, індометацин і фенамати. Однак усі вони, маючи аналогічну ацетилсаліциловій кислоті антипіретичну, протизапальну, знеболювальну дію, викликали побічні ефекти, характерні для першої. Якщо різні хімічні групи препаратів мають однакові терапевтичні властивості та характерний однаковий спектр побічних ефектів, стає очевидним, що їх активність пов’язана з тим самим біохімічним процесом.
Протягом декількох десятиріч фармакологи й біохіміки шукали механізм дії НПЗП. Проблема була розв’язана в ході досліджень ПГ — групи біологічно активних речовин, що вивільняються з усіх тканин, за винятком еритроцитів, і що утворюються з мобілізованої із клітинних мембран арахідонової кислоти під дією ферменту ЦОГ. J.R. Vane та співавтори із Тhe Royal College of Surgeons звернули увагу, що вивільненню ПГ із сенсибілізованих клітин легень морських свинок запобігала ацетилсаліцилова кислота (Palmer M.A. et al., 1970). Використовуючи супернатант гомогената ушкоджених клітин легень морських свинок як джерела ЦОГ, J.R. Vane та співавтори (1971) виявили дозозалежне пригнічення утворення ПГ під дією саліцилової, ацетилсаліцилової кислот і індометацину.
У подальших дослідженнях із застосуванням різних НПЗП встановлено, що вони не лише пригнічують ЦОГ, а їх активність по відношенню до ЦОГ корелює із протизапальною активністю (Vane J.R. et al., 1994). Пригнічення ЦОГ і, таким чином, пригнічення утворення ПГ стали розглядати як уніфікований механізм дії НПЗП.
Таким чином, протизапальна та знеболювальна дія НПЗП зумовлені пригніченням активності ЦОГ — ключового ферменту метаболізму арахідонової кислоти. Першим етапом запального каскаду (рис. 12.3) є вивільнення поліненасичених жирних кислот (у тому числі арахідонової кислоти), з’єднаних ефірним зв’язком із гліцеролом фосфоліпідів клітинних мембран, під дією фосфоліпаз А2 або С. Вільна арахідонова кислота є субстратом для комплексу ПГН2-синтетази, що включає активні центри ЦОГ і пероксидази. ЦОГ конвертує арахідонову кислоту в ПГG2, який, у свою чергу, перетворюється в ПГН2 під дією пероксидази. Таким чином, НПЗП пригнічують перетворення арахідонової кислоти у ПГG2. Крім того, арахідонова кислота є субстратом для 5- і 12-ліпооксигеназ (ЛОГ), що каталізують її перетворення в біологічно активні лейкотрієни (ЛТ) та гідроксиейкозотетраєнові кислоти. ПГ мають протизапальні властивості, підвищують проникність стінки судин і вивільнення брадикінінів.
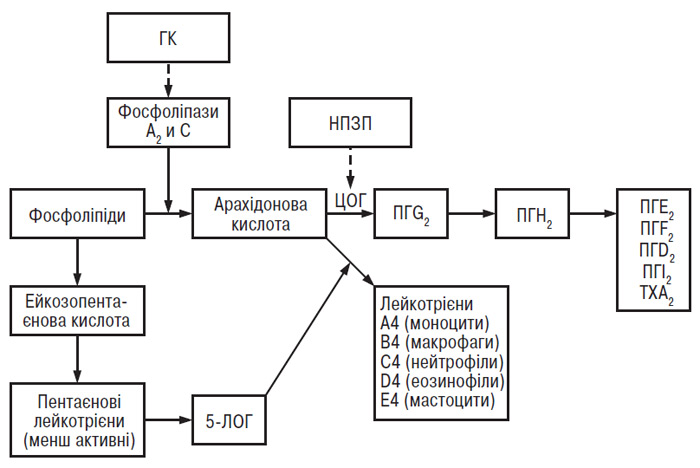
Рис. 12.3. Метаболізм арахідонової кислоти (ТХ — тромбоксан)
Накопичення ПГ корелює з інтенсивністю запалення та гіпералгезією. Відомо, що будь-який периферичний біль пов’язаний із підвищенням чутливості спеціалізованих нейронів — ноцицепторів, що створюють сигнал, який розпізнається як біль. Потужним індуктором больової чутливості є ПГ. Власне вони не є модераторами болю, а лише здатні підвищувати чутливість ноцицепторів до різних стимулів. ПГ ніби перемикають нормальні («мовчазні») ноцицептори в такий стан, у якому вони легко збуджуються під впливом будь-якого фактора (Насонова В.А., 2001).
Особливий інтерес становить відкриття двох ізоформ ЦОГ — ЦОГ-1 і -2, що відіграють різну роль у регуляції синтезу ПГ (табл. 12.1). Про можливість існування двох форм ЦОГ вперше заговорили після публікації J.L. Masferrer та співавторів (1990) результатів дослідження впливу бактеріального полісахариду на синтез ПГ моноцитами людини in vitro. Автори показали, що дексаметазон блокував підвищення синтезу ПГ під дією полісахариду, але не впливав на його базальний рівень. Крім того, пригнічення дексаметазоном продукції ПГ супроводжувалося синтезом нової ЦОГ. Дві ізоформи ЦОГ відкрили молекулярні біологи, які вивчали неопластичну трансформацію ембріональних клітин курчати (Xie W. et al., 1991). Вони виявили, що структура індуцибельної форми ЦОГ відрізняється від конститутивної форми й кодується іншими генами.
Таблиця 12.1
Функціональна активність ЦОГ-1 та -2
| Функція | ЦОГ-1 | ЦОГ-2 |
| Гомеостатична/фізіологічна |
|
|
| Патологічна |
|
|
ЦОГ-1 — конститутивний фермент, який постійно наявний у клітинах різних органів і регулює синтез ПГ, що забезпечують нормальну функціональну активність клітин. Рівень активності ЦОГ-1 залишається відносно постійним, в той час як експресія ЦОГ-2 підвищується до 80 разів при запаленні (Hla T. et al., 1993; Masferrer J.L. et al., 1994; Vane J.R. et al., 1994; Cavanaugh P.F.Jr. et al., 1995). Проте є докази того, що ЦОГ-1 може також відігравати роль у запаленні (Vane J.R., 1971), а ЦОГ-2 відіграє більш складну роль у регуляції фізіологічних і патологічних процесів в організмі людини (див. табл. 12.1). В останні роки вивчається роль ЦОГ-2 у розвитку не лише запалення, але й інших патофізіологічних процесів, перш за все злоякісної трансформації клітин (Насонов Е.Л., 2000; Janne P.A., Mayer R.J., 2000).
Незважаючи на те що обидві ізоформи ЦОГ мають однакову молекулярну масу (71 кД), тільки 60% їх амінокислот гомологічні. Вони також мають різну локалізацію в клітині: ЦОГ-1 перебуває в основному в цитоплазмі або ендоплазматичному ретикулумі, тоді як ЦОГ-2 розташована перинуклеарно і в ендоплазматичному ретикулумі.
ЦОГ-2 зумовлює синтез ПГ, які викликають запалення, мітогенез, клітинну проліферацію й деструкцію. Потужними індукторами активності ЦОГ-2 є ІЛ-1, ФНП, епідермальний і тромбоцитарний фактори росту тощо, тобто саме ті біологічно активні фактори, які беруть участь у розвитку запалення.
Нещодавно з’явилися дані про значну роль ЦОГ-2 у розвитку гіпералгезії. За узагальненими даними мРНК ЦОГ-2 здатна індукуватися у спинному мозку після розвитку периферичного запалення (Smith C.J. et al., 1998). За даними Інституту ревматології РАМН при периферичному запаленні у спинномозковій рідині підвищується рівень ПГ, високочутливих до пригнічення ЦОГ-2 (Насонова В.А., 2001). Дослідження останніх років продемонстрували, що ЦОГ-2 — природний (конститутивний) фермент, який експресується у спинному мозку (Wallace J.L., 1999; Crofford L.J. et al., 2000). Таким чином, ЦОГ-2 індукує всі ділянки проходження больового імпульсу — локальний, спінальний і центральний (Beiche F. et al., 1996).
Отже, результати досліджень останніх років стирають чітке розмежування ЦОГ-1 і -2 як конститутивного та індуцибельного, а також фізіологічного і патологічного ферментів. Очевидно, що обидві ізоформи в одних тканинах можуть індукувати запалення, а в інших — підтримувати нормальну функцію клітин.
Згідно з останніми даними можливе існування ще однієї ізоформи — ЦОГ-3 (Willoughby D.A. et al., 2000). Досліджуючи ефекти інгібіторів ЦОГ у лабораторних щурів з експериментальним плевритом протягом 48 год після ін’єкції подразника, автори виявили, що селективні інгібітори ЦОГ-2, а також неселективні інгібітори ЦОГ (наприклад індометацин) проявляють протизапальну активність на початку запальної відповіді, що збігається з експресією ЦОГ-2-протеїну. Однак через 6 год селективні інгібітори ЦОГ-2 припиняли дію, тоді як неселективні продовжували виявляти дію. В цей час експресію ЦОГ-2-протеїну не спостерігали. Найбільш дивним виявився той факт, що через 48 год, коли запальний процес майже повністю було усунуто, експресія ЦОГ-2 з’явилася знову. Цей ЦОГ-2-протеїн не викликав синтезу прозапального ПГЕ2 ні у досвіді ех vivo з екзогенною арахідоновою кислотою, ні in vivo. Навпаки, в цей час спостерігали продукцію in vivo протизапальних ПГ (ПГD2 і ПГF2), а також представника сімейства циклопентенонів (15dcoxyD12 14ПГJ2) (Gilroy D.W. et al., 1998).
Пригнічення нової ізоформи ЦОГ селективними й неселективними інгібіторами ЦОГ-2 у проміжку між 24 і 48 год після введення подразника призвело до того, що запалення не завершилось (як у нелікованих тварин), а персистувало (Gilroy D.W. et al., 1999). На думку D.A. Willoughby та співавторів (2000) описаний феномен є третьою ізоформою ЦОГ — ЦОГ-3, яка, на відміну від перших двох, викликає утворення протизапальних простаноїдів.
Доведено, що НПЗП пригнічують активність обох ізоформ ЦОГ, але їх протизапальна активність пов’язана із пригніченням саме ЦОГ-2.
Після вивчення тривимірної структури ЦОГ-1 і -2 виявилося, що ізоформи відрізняються одна від одної головним чином структурою зони зв’язування із субстратом — арахідоновою кислотою. Активна зона ЦОГ-2 більша, ніж у ЦОГ-1, і має вторинну внутрішню кишеню, що відіграє важливу роль, тому що, забезпечивши фармакологічний агент «хвостом», комплементарним до цієї кишені, можна одержати препарат, розміри якого занадто великі для активної зони ЦОГ-1, проте форма відповідає активній зоні ЦОГ-2 (Picot D. et al., 1994; Luong C. et al., 1996; Vane J.R., Botting R.M., 2000).
Традиційні (неспецифічні) НПЗП пригнічують насамперед активність ЦОГ-1, чим і пояснюється виникнення таких ускладнень, як гастропатія, порушення функції нирок, агрегація тромбоцитів, енцефалопатія, гепатотоксичність та ін.
НПЗП-індуковані побічні ефекти можуть виникати скрізь, де продукуються ПГ, найчастіше — у системі травлення, нирках, печінці, системі крові, серцево-судинній системі (Gabriel S.C., 1997). У осіб похилого віку деякі зміни (зниження продукції соляної кислоти в шлунку, моторної активності стінки шлунка й кишечнику та кровотоку в ній, маси клітин слизової оболонки, зниження ниркового плазмотоку, гломерулярної фільтрації, функції канальців нирок; зменшення загального об’єму води в організмі, зниження рівня альбуміну в плазмі крові; зменшення серцевого викиду) сприяють підвищенню ризику розвитку побічних ефектів НПЗП. Одночасний прийом препаратів кількох груп (особливо ГК), наявність супутньої патології (хвороби серцево-судинної системи, нирок, печінки, бронхіальна астма) також підвищують ризик розвитку токсичності НПЗП (Clements P.J., Paulus H.E., 1997).
Найчастіше побічні ефекти НПЗП спостерігаються з боку ШКТ (табл. 12.2 і 12.3).
Таблиця 12.2
Фактори ризику розвитку побічних ефектів (ПЕ) з боку ШКТ у осіб, які приймають НПЗП
| За: Brandt K.D., 2000 | За даними ARAMIS | За даними дослідження MUCOSA |
|
|
|
ARAMIS — Arthritis, Rheumatism, and Aging Medical Information System; MUCOSA — Misoprostol Ulcer Complications Outcomes Safety Assessment; mHAQ — modified Health Assessment Questionnaire.
Таблиця 12.3
Ризик ульцерогенної дії при прийомі НПЗП (за: Langman M.J.S. et al., 1991)
| Побічні ефекти | Відносний ризик | 95% ДІ |
Виразка
|
5,0
1,1 |
1,4–26,9
0,4–3,7 |
| Ускладнення виразки
— кровотеча при виразці
— перфорація при виразці
|
2,8
2,7 7,3 1,6 |
1,5–5,4
1,3–5,8 4,4–11,8 0,7–3,7 |
Смерть внаслідок виразки
|
4,2
7,9 |
1,9–9,0
3,7–16,8 |
Результати досліджень свідчать про виникнення симптомів з боку ШКТ у 30% осіб, які застосовують традиційні НПЗП (Giercksky K.E. et al., 1989; Larkai E.N. et al., 1989). Серед пацієнтів похилого віку, які приймають НПЗП, частота випадків госпіталізації внаслідок розвитку пептичної виразки в 4 рази перевищувала таку в осіб тієї ж вікової категорії, які не приймають НПЗП (Griffin M.R. et al., 1988; 1991). За даними Arthritis, Rheumatism, and Aging Medical Information System (ARAMIS) у 73 із 1000 хворих на ОА, які приймають НПЗП протягом 1 року, відзначено серйозні ускладнення з боку ШКТ. У США серед хворих на РА і ОА реєструють 16,5 тис. випадків смерті, зумовленої прийомом НПЗП, що можна порівняти зі смертністю від СНІДу й значно перевищує смертність від лімфоми Ходжкіна, рака шийки матки, мієломної хвороби чи бронхіальної астми (Wolfe M.M. et al., 1999). За даними метааналізу результатів 16 контрольованих досліджень виявлено, що відносний ризик виникнення тяжких побічних ефектів (тих, які призводять до госпіталізації або смерті) з боку ШКТ у осіб, які приймають НПЗП, був у 3 рази вищим, ніж у осіб, які не приймають НПЗП (Gabriel S.C., 1997). Згідно з результатами цього метааналізу, факторами ризику виникнення тяжких побічних ефектів були вік старше 60 років, захворювання травної системи (гастрит, пептична виразка) в анамнезі, супутній прийом ГК; найвищий ризик розвитку побічних реакцій з боку системи травлення відзначено у перші 3 міс лікування.
Побічні ефекти з боку ШКТ включають функціональні розлади, езофагіт, стриктури стравоходу, гастрит, ерозії слизової оболонки, виразки, перфорацію, шлунково-кишкову кровотечу, летальний результат (Langman M.J.S., 1988; Fries J.P. et al., 1989; Fries J.P. et al., 1991; Gabriel S.C. et al., 1991; Kurata J., 1991; Miller D.K. et al., 1991; Pinkus T., Griffin M., 1991; Soll A.H. et al., 1991; Allison M.C. et al., 1992; Scheiman J.M., 1992; Bjarnason I. et al., 1993; Garcia Rodriguez L.A., Jick H., 1994; Langman M.J.S. et al., 1994; Wilcox C.M. et al., 1994; Lichtenstein D.R. et al., 1995; Talley N.J. et al., 1995; Mahmud T. et al., 1996; Gabriel S.C., 1997). Крім добре відомого впливу НПЗП на слизову оболонку шлунка й дванадцятипалої кишки, з’являється все більше даних про розвиток побічних ефектів відносно слизової оболонки як тонкого, так і товстого кишечнику (Bjarnason I. et al., 1993; Schubert T.T. et al., 1993). Описані НПЗП-індуковані ентеропатії, які супроводжувалися утворенням стриктур тонкого й товстого кишечнику, виразок, перфорацією, атрофією ворсинок слизової оболонки (Bjarnason I. et al., 1993; Kwo P.Y., Tremaine W.J., 1995; Robinson M.H.E. et al., 1995; Mahmud T. et al., 1996). S.E. Gabriel та співавтори (1991) описали порушення проникності стінки кишечнику у хворих, які приймають НПЗП.
За даними ендоскопічних досліджень традиційні НПЗП можуть спричиняти ерозії та крововиливи в підслизову оболонку в будь-якому відділі травного тракту, але найчастіше в препілоричному відділі шлунку й антрумі (Scheiman J.M., 1992; Bjarnason I. et al., 1993; Lichtenstein D.R. et al., 1995). У більшості випадків ерозивно-виразкові ускладнення терапії НПЗП мають безсимптомний перебіг.
Останнім часом у ряді досліджень встановлено, що лише пригніченням ЦОГ-1 неможливо пояснити механізм утворення НПЗП-індукованих виразок. Важливе значення має безпосередній ушкоджувальний ефект НПЗП на клітини слизової оболонки шлунка з ураженням мітохондрій і порушенням окисного фосфорилювання, що, у свою чергу, порушує енергетичні процеси у клітині. Вірогідно, утворення виразок спричинене наявністю двох факторів — пригніченням ЦОГ-1 і порушенням окисного фосфорилування. Тому, імовірно, флурбіпрофен і набуметон — препарати, що не порушують окисного фосфорилування — краще переносяться хворими порівняно з іншими неселективними НПЗП.
При постійному застосуванні НПЗП розвиток побічних ефектів залежить від дозування і тривалості терапії (Gabriel S.C., 1997). Прийом НПЗП протягом 3 міс викликає побічні ефекти з боку ШКТ у 1–2% пацієнтів, протягом року —2–5% (Clements P.J., Paulus H.E., 1997).
Фактори ризику розвитку побічних ефектів з боку нирок у хворих, які приймають НПЗП (Brandt K.D., 2000)
- наявність патології нирок;
- цукровий діабет;
- артеріальна гіпертензія;
- застійна серцева недостатність;
- цироз печінки;
- зменшення об’єму циркулюючої крові (прийом діуретиків, геморагії, діарея, підвищене потовиділення).
На сьогодні обговорюється можлива роль Helicobacter pylori у розвитку НПЗП-індукованих побічних ефектів з боку травної системи (Schieman J.M., 1996; Kurata J., Nogawa A., 1997). Відомо, що 95% хворих із пептичною виразкою дванадцятипалої кишки інфіковані Helicobacter pylori, водночас у більшості випадків НПЗП-індуковані побічні ефекти розвиваються у слизовій оболонці шлунка, де інфікованість становить 60–80% (Peloso P.M., 1997). Крім того, механізм ушкодження слизової оболонки ШКТ Helicobacter pylori не пов’язаний із синтезом ПГ (Wallace J., 1994; 1996). Проте є свідчення, що НПЗП відіграють роль у рецидивуванні Helicobacter-індукованих виразок (Heresbach D. et al., 1992; Kim J.G. et al., 1994; Taha A.S. et al., 1995), тому пацієнти з пептичною виразкою в анамнезі входять у групу ризику розвитку побічних ефектів при терапії НПЗП (див. табл. 12.3). На сьогодні невідомо, чи знижує ерадикація Helicobacter pylori ризик розвитку побічних ефектів з боку травної системи у хворих, які одержують НПЗП (Marshall B.J., 1994; Rabeneck L., Graham D.Y., 1997).
НПЗП можуть викликати побічні ефекти з боку нирок, включаючи гостру ниркову недостатність/преренальну азотемію, ренальну вазоконстрикцію, алергічний інтерстиціальний нефрит, нефротичний синдром, гіперкаліємічний/гіпоренінемічний гіпоальдостеронізм, затримку натрію й води, резистентність до лікування діуретиками, гіпонатріємію (Backalew V.M.Jr., Schey H.M., 1986; Cooper K., Bennett W.M., 1987; Eriksson L.O. et al., 1991; Carson J.L., Willet L.R., 1993). Однак дані епідеміологічних досліджень свідчать про низький ризик розвитку дисфункції нирок під дією НПЗП (Whelton А. et al., 1990; Gabriel S.E., 1997).
Нефротоксичність НПЗП реалізується за допомогою двох механізмів — пригнічення синтезу ПГ та ідіосинкразія до НПЗП. В умовах нормальної перфузії нирки не виробляють ПГ, тому при застосуванні НПЗП побічні ефекти не виникають. Зниження перфузії нирок (при хронічній нирковій і хронічній серцевій недостатності, дегідратації, хворобах печінки, у осіб похилого віку) супроводжується продукцією ПГЕ2 і ПГI2. Ці ПГ індукують місцеву вазодилатацію для підтримки нормального гломерулярного кровотоку, а також стимулюють діурез, натрійурез і вивільнення реніну. Якщо такий пацієнт приймає НПЗП, у нього знижуються нирковий кровотік і гломерулярна фільтрація, підвищується секреція антидіуретичного гормону, відбувається затримка натрію хлориду й води, пригнічується вивільнення реніну (рис. 12.4). Виникає стан гіпоренінемічного гіпоальдостеронізму, можливий розвиток гострої ниркової недостатності. Пригнічення НПЗП ЦОГ також може призвести до гіперкаліємії, особливо у пацієнтів із супутніми захворюваннями, перш за все цукровим діабетом, а також до нівелювання ефектів діуретичної та антигіпертензивної терапії (Clements Р.J., Paulus H.E., 1997).
Рис. 12.4. Ефекти пригнічення НПЗП синтезу ПГ у нирках (Aronoff G.R., 1992). АДГ — антидіуретичний гормон
Алергічний інтерстиціальний нефрит — це прояв ідіосинкразії до НПЗП, супроводжується лихоманкою, шкірним висипом і еозинофілією, виникає через 1–2 тиж після початку терапії НПЗП і піддається зворотному розвитку при їх відміні. До інших проявів ідіосинкразії до НПЗП належить ліпоїдний нефроз і папілярний некроз (Goodman T.A., Simon L.S., 1994).
У табл. 12.4 наведені різні типи уражень печінки, асоційовані з прийомом НПЗП. Незважаючи на те що гепатотоксичність — рідкий прояв непереносимості НПЗП, частота розвитку цього побічного ефекту варіює залежно від того, які препарати цієї групи застосовували. Так, ураження печінки при прийомі ацетилсаліцилової кислоти залежить від дози препарату і від захворювання — при системному червоному вовчаку і ювенільному РА гепатотоксичність розвивається частіше, ніж при інших захворюваннях (Brandt K.D., 2000). Перебіг гепатопатії, спричиненої прийомом ацетилсаліцилової кислоти, частіше проходить безсимптомно, рідко призводить до розвитку хронічної ниркової недостатності й дуже рідко — до летального результату.
Таблиця 12.4
Типи НПЗП-індукованих уражень печінки (Brandt K.D., 2000)
| Гепатоцелюлярний | Холестатичний | Змішаний |
| Кислота ацетилсаліцилова
Диклофенак Ібупрофен |
Беноксапрофен
Набуметон |
Суліндак
Піроксикам Напроксен |
Крім того, з’явилися дані про ураження печінки німесулідом (Steenbergen W.V. et al., 1998; Merlani G. et al., 2001).
Більшість хворих, які приймають препарати цього класу, — особи похилого віку, що потребують проведення постійної профілактики гострих кардіоваскулярних подій. На підставі аналізу 181 441 історій хвороби W.A. Ray та співавтори (2002) дійшли висновку, що незважаючи на поєднане блокування ЦОГ-1 та -2, неселективні НПЗП не виявляють кардіопротекторної дії (на відміну від ацетилсаліцилової кислоти в низьких дозах), тому при необхідності їх слід призначати разом із ацетилсаліциловою кислотою. Так, ібупрофен блокує інгібіторний ефект ацетилсаліцилової кислоти у низьких дозах відносно вивільнення тромбоксану й агрегації тромбоцитів, а більш повільно діючий диклофенак має відстрочені подібні ефекти й тому краще поєднується з ацетилсаліциловою кислотою. Водночас виявлено, що коксиби і парацетамол не конкурують із ацетилсаліциловою кислотою в низьких дозах відносно дезагрегаційної функції (Catella-Lawson R. et al., 2001). Проте ацетилсаліцилова кислота здатна погіршувати переносимість НПЗП, як це було продемонстровано в дослідженні CLASS. Таким чином, при виборі НПЗП хворому, який приймає ацетилсаліцилову кислоту в низьких дозах, необхідно враховувати характер їх взаємодії.
В останні роки актуальною стала проблема взаємодії НПЗП і гіпотензивних препаратів, а також застосування НПЗП при артеріальній гіпертензії. Відомо, що у зв’язку із пригніченням ЦОГ-1, необхідної для підтримки багатьох фізіологічних функцій, включаючи нирковий кровообіг, НПЗП можуть нівелювати ефект багатьох гіпотензивних агентів, особливо інгібіторів АПФ і блокаторів β-адренорецепторів. Крім того, вплив специфічних інгібіторів ЦОГ-2 на серцево-судинну систему недостатньо вивчений. У рандомізованому порівняльному дослідженні застосування целекоксибу (200 мг/добу) і рофекоксибу (25 мг/добу) у більше ніж 800 хворих на ОА, які одержували гіпотензивну терапію з приводу есенційної артеріальної гіпертензії, A. Welton та співавтори (2001) виявили, що систолічний артеріальний тиск підвищився у 17% хворих при застосуванні рофекоксибу, і у 11% — целекоксибу, а діастолічний артеріальний тиск — у 2,3 і 1,5% відповідно. Через 6 тиж лікування у хворих, які застосовували рофекоксиб, систолічний артеріальний тиск підвищився в середньому на 2,5 мм рт. ст. порівняно з вихідним, а в групі пацієнтів, які приймали целекоксиб, навіть знизився на 0,5 мм рт. ст. Автори дійшли висновку про сумісність коксибів і гіпотензивних препаратів, однак переносимість целекоксибу була кращою — рідше розвивалися набряковий синдром і дестабілізація артеріального тиску. Майже половина хворих обох груп із препаратів гіпотензивного ряду одержували діуретики, інгібітори АПФ, антагоністи кальцію, блокатори β-адренорецепторів у вигляді монотерапії, інші пацієнти в кожній групі (48,5 і 44,9% відповідно — целекоксиб і рофекоксиб) одержували комбіновану терапію і більше ⅓ (37,9 і 37,1%) у кожній групі — ацетилсаліцилову кислоту в низьких дозах. Таким чином, хворим, у яких застосовують антигіпертензивну терапію, необхідно проводити моніторинг артеріального тиску для виявлення побічних ефектів з боку серця й нирок у разі прийому специфічних інгібіторів ЦОГ-2. У пацієнтів, які застосовували целекоксиб, відзначали менш виражені набряки і дестабілізацію артеріального тиску, ніж у хворих, які одержували рофекоксиб.
НПЗП, що викликають побічні ефекти з боку печінки (Brandt K.D., 2000):
Дуже рідко:
- Ібупрофен
- Індометацин
- Напроксен
- Оксапрозин
- Піроксикам
Рідко:
- Диклофенак
- Фенілбутазон
- Суліндак
Крім опосередкованої ПГ дії, НПЗП виявляють також інші, не пов’язані із ПГ і ЦОГ, ефекти. Серед них — безпосередній вплив на різні процеси у клітинах і клітинних мембранах. Так, НПЗП пригнічують активацію і хемотаксис нейтрофільних гранулоцитів, знижують продукцію вільних кисневих радикалів у них (Brooks P.M., Day R.O., 1991; Furst D.E., 1994). Будучи ліпофільними субстанціями, НПЗП вбудовуються в ліпідний бішар клітинних мембран і, запобігаючи тим самим взаємодії між білками, пригнічують передачу сигналу. Деякі НПЗП in vitro пригнічують міграцію фагоцитів у зону запалення (Brooks P.M., Day R.O., 1991; Furst D.E., 1994).
Поряд з інгібіцією синтезу ПГ є дані про інші механізми анальгезивної активності НПЗП. До них належать центральна опіоїдоподібна антиноціцептивна дія: блокада NMDA-рецепторів (підвищення синтезу кінуренінової кислоти), зміна конформації a-субодиниць G-білка, пригнічення аферентних больових сигналів (нейрокініни, глутамінова кислота), підвищення вмісту 5-гідрокситриптаміну. Про існування ПГ-незалежних механізмів побічно свідчать дані про дисоціацію між антизапальним (ЦОГ-залежним) і анальгезивним (антиноціцептивним) ефектами НПЗП.
Ряд НПЗП впливають на синтез протеогліканів хондроцитами in vitro (Ghosh P., 1988; Rashad S. et al., 1989; Bradley J.D. et al., 1992; Dieppe P.A., Cushnaghan J. et al., 1993; Dieppe P.A., Frankel S.J. et al., 1993; Paulus H., Bulpitt K.J., 1993; Brandt K.D., 1995). J.T. Dinger і M. Parker (1997) запропонували класифікацію НПЗП, що ґрунтується на їх дії in vitro на синтез компонентів матрикса хряща при ОА:
- інгібуючі: індометацин, напроксен, ібупрофен, німесулід;
- нейтральні: піроксикам, набуметон;
- стимулювальні: тенідап, ацеклофенак.
Проте екстраполяція результатів цих досліджень на організм людини сумнівна. G.J. Carrol та співавтори (1992) здійснювали щомісячну аспірацію суглобової рідини з колінних суглобів у 20 хворих на ОА, які приймали піроксикам, і виявили незначне зниження концентрації кератан сульфату. Незважаючи на те що одержані результати можуть свідчити про зниження катаболізму протеогліканів, як підкреслюють автори, можливі й інші інтерпретації. Більш докладно складності тлумачення результатів дослідження модифікуючих хворобу властивостей препаратів, що застосовуються при ОА, розглянуто в главі 4.
Саліцилати пригнічують активність фосфоліпази С у макрофагах. Деякі НПЗП in vitro пригнічують продукцію ревматоїдного фактора, перешкоджають адгезії нейтрофільних гранулоцитів до ендотеліоцитів і знижують експресію L-селектинів, тим самим пригнічуючи міграцію гранулоцитів у зону запалення.
Ще одним важливим, не пов’язаним із ПГ, біологічним ефектом НПЗП є вплив на метаболізм оксиду азоту (Amin A.R. et al., 1995). Так, НПЗП пригнічують NF-κB-залежну транскрипцію, що веде до блокування індуцибельної NО-синтази. Остання, індукована прозапальними цитокінами, виробляє велику кількість NO, що веде до посилення ознак запалення — гіперемії, підвищення проникності судин та ін. Ацетилсаліцилова кислота в терапевтичних дозах пригнічує експресію індуцибельної NО-синтази і подальшу продукцію NO (Amin A.R. et al., 1995).
Таким чином, залежно від характеру блокування ЦОГ НПЗП поділяють на селективні й неселективні інгібітори ЦОГ (табл. 12.5). Селективні інгібітори ЦОГ-2 мають менший спектр побічних ефектів і кращу переносимість. Відносна селективность НПЗП для кожного ізомеру визначається як співвідношення ЦОГ-2/-1 і розраховується з показника IC50 препарату для обох ізоформ, що виражає концентрацію препарату, яка інгібує синтез ПГ на 50% (Pairet M., Engelhardt G., 1996). Коефіцієнт селективності <1 вказує на відносну селективність до ЦОГ-2, у той час як коефіцієнт >1 — на відносну селективність до ЦОГ-1.
Таблиця 12.5
Класифікація НПЗП залежно від їх здатності селективно блокувати активність ЦОГ-1 або -2 (Frolich J., 1997)
| Селективні інгібітори ЦОГ-1 | Інгібітори ЦОГ-1 та -2 | Селективні інгібітори ЦОГ-2 |
Високоселективні інгібітори ЦОГ-2 |
| Кислота ацетилсаліцилова в низьких дозах | Більшість НПЗП | Мелоксикам
Набуметон Етодолак |
Целекоксиб
Рофекоксиб Флосулід |
Для визначення ЦОГ-селективності НПЗП використовують різні експериментальні моделі. Необхідно відзначити, що пряме порівняння результатів досліджень селективності НПЗП, отриманих у різних лабораторіях, неможливе, оскільки показники IC50 і співвідношення ЦОГ-2/-1 дуже варіюють навіть при використанні однієї й тієї ж методики. Така варіабельність може залежати від виду клітин, що використовуються у ролі моделі, типу ферментного препарату, часу інкубації з НПЗП, методу індукування ЦОГ-2, вмісту білків у поживному середовищі тощо (Pairet M., van Ryn J., 1999). Так, набуметон проявляє ЦОГ-2-селективні властивості на моделі, що використовує мишачий фермент у мікросомальних мембранах (Meade E.A. et al., 1993), але його ЦОГ-2-селективності недостатньо, щоб продемонструвати її на моделях ферменту людини в клітинних або мікросомальних мембранах (Laneuville O. et al., 1994; Churchill L. et al., 1996) або в клітинах крові людини ex vivo (Patrignani P. et al., 1994).
Таким чином, для більш коректної оцінки селективності НПЗП необхідно, щоб результати були підтверджені на декількох моделях. Найбільш показовими виявилися дослідження з використанням клітин крові людини (Patrignani P. et al., 1994; Warner T.D. et al., 1999). Хоча абсолютний показник може варіювати, порядок співвідношення ЦОГ-2/-1, як правило, однаковий, коли сполуки досліджуються кількома методами.
Неселективні інгібітори ЦОГ не втратили своєї актуальності у зв’язку із високою протизапальною активністю, наявністю вираженого знеболювального ефекту, однак їх застосування поєднується з більшою імовірністю розвитку побічних ефектів.
Існує кілька десятків НПЗП, подібних за хімічними, фармакологічними властивостям і механізмом дії (табл. 12.6).
Таблиця 12.6
Класифікація НПЗП за хімічною структурою (Насонова В.А., Сигидин Я.А., 1985, з доповненнями)
| I. Похідні кислот | |
| Арилкарбонові кислоти | |
| А. Похідні саліцилової кислоти (саліцилати)
Кислота ацетилсаліцилова Дифлунісал Трисаліцилат Бенорилат Саліцилат натрію |
Б. Похідні антранілової кислоти (фенамати)
Кислота флуфенамова Кислота мефенамова Кислота меклофенамова Кислота ніфлумова Кислота толфенамова |
| Арилалканові кислоти | |
| А. Похідні арилоцтової кислоти
Диклофенак Фенклофенак Алклофенак Фентіазак В. Похідні індол/індолоцтової кислоти Індометацин Суліндак Етодолак Ацеметацин |
Б. Похідні гетероарилоцтової кислоти
Толметин Зомепірак Клоперак Кеторолак Г. Похідні арилпропіонової кислоти Флурбіпрофен Напроксен Фенопрофен Фенбуфен Супрофен Індопрофен Кислота тіапрофенова Пірпрофен |
| Енолікові кислоти | |
| А. Похідні піразолону (піразолідиндіони)
Фенілбутазон Оксифенбутазон Азапропазон Фепрозон |
Б. Оксиками
Судоксикам Мелоксикам Фепразон |
| II. Некислотні похідні | |
| Флурпроквазон
Флуфізон Тіноридин Колхіцин Набуметон |
Проквазон
Тіарамід Буфексамак Епіразол |
| III. Комбіновані препарати | |
| Диклофенак+мізопростол
Фенілбутазон+дексаметазон та ін. |
|
У табл. 12.7 наведені результати порівняльних досліджень ефективності й безпеки НПЗП. Незважаючи на те що всі вони порівнянні за дизайном і кількістю обстежених пацієнтів, встановлено, що ефективність НПЗП вища, ніж плацебо, а нові препарати мають кращу переносимість. Досі не одержано чітких доказів переваги одного НПЗП над іншим за ефективністю. Навіть якщо за даними багатоцентрового дослідження виявлено переваги препарату цієї групи, у рутинній клінічній практиці це часто не знаходить підтвердження. Проте реально можна оцінити й порівняти переносимость НПЗП. Безпека — основна ознака, за якою відрізняються препарати цієї групи.
Таблиця 12.7
Деякі дослідження ефективності НПЗП при остеоартрозі
| Автор | Препарат, мг/добу | Дизайн дослідження | Популяція пацієнтів | Результати/коментарі |
| Esmark H. et al., 1992 | Піроксикам (П) супозиторії ректальні 20 — індометацин (І) супозиторії ректальні 100 | 4 тиж, ОС, з паралельними групами | 261 хворий на ОА, який очікує артропластику | Ефективність: П=І, ПЕ: П>І |
| Caldwell J.R., Roth S.H., 1994 | Напроксен (Н) — напроксен НEN, 1000 | 6 тиж, ПС, із паралельними групами | 179 хворих на ОА і 176 хворих на РА з ПЕ з боку ШКТ в анамнезі | ПЕ: Н=НEN (р=0,054) |
| Hoyeraal H.M. et al., 1993 | Напроксен (Н) 500+250 — тіапрофенова кислота (Т) 600 | 3 тиж, ПС, плацебо-контрольоване | 208 хворих на ОА | Ефективність:
Н=Т>плацебо |
| Melo Gomes J.A. et al., 1993 | Диклофенак (Д) 100 + мізопростол 0,2 мкг/добу піроксикам (П) 20 — напроксен (Н) 750 | 4 тиж, ПС, із паралельними групами | 643 хворих на ОА без ПЕ з боку ШКТ в анамнезі | Виявлення виразки при ендоскопії: Д 3/200, П 21/204, Н 17/198 |
| Riedmann P.J. et al., 1993 | Теноксикам (Т) 20 (40)* — піроксикам (П) 20 (40)
Т — диклофенак (Д) 100 Т — індометацин (І) 75–100 |
Метааналіз
12 досліджень 4 досліджень 2 досліджень |
ОА | Ефективність:
Т>П, Т=Д ПЕ: Т<І |
| Bellamy N. et al., 1993 | Теноксикам (Т) 20 — диклофенак (Д) 150 | 12 тиж, ПС, з паралельними групами | 98 хворих на ОА | Ефективність: Т=Д, ПЕ: 21 (Т) —33 (Д); р=0,033 |
| Roth S.H. et al., 1994 | Набуметон (Нб) 1000 — напроксен (Н) 500 | 3 міс, ПС + 5 років відкрите спостереження | ПС: 52 хворих на ОА
відкрите спостереження: 27 хворих на ОА |
Пептична виразка: 8 (Нб) і 1 (Н); р=0,2 |
| Diaz C. et al., 1996 | Ацеклофенак (А) 200 — диклофенак (Д) 150 | 6 міс, ПС, з паралельними групами | 335 хворих на ОА | Ефективність:
А=Д, ПЕ: А>Д |
| Chikanza I.C. et al., 1994 | Етодолак (Е) 600 — напроксен (Н) 1000 | 2х4 тиж, ПС | 76 хворих на ОА | ПЕ: Е=Н, загальна ефективність: Е=Н, знеболювальний ефект: Н>Е |
ОС — одиночне сліпе; ПС — подвійне сліпе; ПЕ — побічні ефекти; EN — кишково-розчинні; *20 мг — початкова доза; 40 мг — цільова доза.
У багатоцентровому дослідженні The LINK Study продемонстровано, що при тривалому застосуванні індометацину в 2 рази збільшується втрата суглобового хряща порівняно із використанням плацебо. Гепатотоксичність частіше спостерігається при лікуванні диклофенаком. Асептичний менінгіт — рідка, але тяжка побічна реакція на прийом ібупрофену і суліндаку. Цистит — ускладнення, яке відзначають на фоні лікування тіапрофеновою кислотою (Ahmed M., Davison O.W., 1991; Ghosh P. et al., 1993; Harrison W.J. et al., 1994; Mayall F.G. et al., 1994); альвеоліт може індукуватися напроксеном, індометацин викликає сонливість. Зміни формули крові, а також різні шкірні висипання зрідка можуть виникати на фоні прийому всіх НПЗП.
За даними N. Bateman (1994) серед неселективних НПЗП найбільш безпечні ібупрофен і диклофенак, а найбільш токсичні — піроксикам і азапропазон. Однак D. Henry та співавтори (1996) визначили, що переносимість ібупрофену у високих дозах не відрізнялася від такої напроксену й індометацину. Водночас ефективність і безпека похідних пропіонової кислоти була підставою для випуску безрецептурних лікарських форм цих препаратів (ібупрофен, кетопрофен і напроксен), які широко використовують для купірування болю різної етіології.
У зв’язку з тим, що серйозні побічні ефекти з боку ШКТ спричинені НПЗП, залежать від дози препарату, призначати ЦОГ-неселективний НПЗП хворому на ОА для купірування болю слід у низькій, тобто анальгезивній дозі, яку можна підвищити до протизапальної, якщо перша виявилася неефективною. Пацієнтам групи ризику ЦОГ-неселективні НПЗП навіть у низьких дозах необхідно призначати в комбінації з гастропротекторами (Brandt K.D., 2000).
У 6-місячному плацебо-контрольованому клінічному дослідженні MUCOSA (Misoprostol Ulcer Complications Outcomes Safety Assessment) додавання синтетичного аналога ПГ мізопростолу (800 мкг/добу) до НПЗП зумовило зниження частоти серйозних побічних ефектів з боку травної системи на 40% порівняно із плацебо (Silverstein J.E. et al., 1995). При цьому, незважаючи на велику кількість обстежених хворих (близько 9 тис.), зниження за допомогою мізопростолу ризику розвитку побічних ефектів ледь досягло статистичної достовірності (р=0,049). Більше того, прийом мізопростолу асоціювався з іншими дозозалежними побічними ефектами, зокрема з діареєю. Мізопростол у дозі 400 мкг/добу переносився краще, ніж у дозі 800 мкг/добу, проте за даними фіброгастроскопії меншою мірою виявляв гастропротекторний ефект (Raskin J.B. et al., 1995).
Як альтернативу мізопростолу доцільно використовувати антагоністи Н2-рецепторів (наприклад фамотидин) або блокатори протонного насосу (наприклад омепразол) (Brandt K.D., 2000). Обидві групи препаратів продемонстрували ефективність при лікуванні та профілактиці НПЗП-індукованих виразок у дослідженнях із використанням фіброгастроскопії (Ekstro P. et al., 1996; Taha A.S. et al., 1996; Hawkey C.J. et al., 1998; Yeomans N.E. et al., 1998). Проте у звичайних терапевтичних дозах Н2-антагоністи були менш ефективними, ніж мізопростол, тоді як омепразол не поступався йому за ефективністю при лікуванні НПЗП-індукованих виразок, відрізнявся кращою переносимістю і характеризувався більш низькою частотою рецидивів (Hawkey C.J. et al., 1998).
Ацеклофенак (дериват фенілоцтової кислоти), — 2-[2,6-дихлорфеніл]амінофенілацетооцтова кислота) — новий препарат групи НПЗП, близький за структурою до диклофенаку. Ацеклофенак має доволі простий фармакокінетичний профіль. Так, він швидко та повністю всмоктується (максимальна концентрація досягається вже через 1–3 год після прийому) та активно зв’язується з білками плазми крові (>99%). Для ацеклофенаку характерний 4-годинний (3,6–6,2) період напіврозпаду, який виключає можливість акумуляції препарату (наприклад у піроксикаму), навіть у разі тривалого використання. Ацеклофенак має 100% біоеквівалентність, а абсорбція препарату не знижується при прийомі разом з їжею. У синовіальній рідині концентрація ацеклофенаку становить 50% від такої у плазмі крові. Ацеклофанак метаболізується переважно в печінці з утворенням кількох метаболітів, з яких найбільш значимим є 4-гідроксиацеклофенак, що елімінується переважно із сечею (>66%) (Wood S.G. et al., 1990).
Суттєвої різниці у фармакокінетиці ацеклофенаку після одноразового та повторних прийомів у осіб різного віку не відзначено (Creamer J., 1992). Також не виявлено різниці у кліренсі креатиніну та N-ацетилглюкозамінідази у різних вікових групах. Зазначені фармакокінетичні особливості препарату особливо важливі для осіб похилого віку з характерною для них поліморбідністю. Відмічено незначне сповільнення фармакокінетики ацеклофенаку у пацієнтів із цирозом печінки, що стало підґрунтям для рекомендації призначення половини терапевтичної дози цим хворих та необхідності проведення ретельного моніторингу. У разі помірної ниркової недостатності значимих змін у фармакокінетиці ацеклофенаку не виявлено, але оскільки ацеклофенак екскретується переважно нирками, за наявності клінічної картини необхідний ретельний контроль динаміки функціональних змін з боку нирок.
Ацеклофенак доволі швидко та значною мірою зв’язується з білками плазми крові, саме тому доцільним є вивчення його взаємодії з іншими лікарськими засобами. Так, при поєднаному застосуванні ацеклофенаку та діуретиків змін артеріального тиску та осмолярності сечі не відмічено. Будь-які клінічні ефекти при поєднаному використанні ацеклофенаку з антидіабетичними препаратами відсутні, хоча трапляються поодинокі випадки гіпо- та гіперглікемії, що потребує індивідуального підбору дозування гіпоглікемічних засобів. Поєднання прийому ацеклофенаку та варфарину призводило до незначного підвищення концентрації останнього у плазмі крові, проте суттєвого впливу на згортання крові не відмічено.
Одним із ключових механізмів дії ацеклофенаку, як і інших препаратів групи НПЗП, є пригнічення експресії ЦОГ. Згідно з даними дослідження P.S. Lindburg та співавторів (2000), в якому проводили порівняння ацеклофенаку з целекоксибом та рофекоксибом щодо пригнічення активності ЦОГ-1 та -2 у цільній крові людини, продемонстровано, що ацеклофенак пригнічує активність обох ізоферментів, але переважно експресію ЦОГ-2, наближаючись таким чином до групи НПЗП, що селективно інгібують ЦОГ-2. Вибірковий інгібуючий вплив ацеклофенаку на активність ЦОГ-2 була також підтверджена дослідженням Y. Henrotin та співавторів (2001), у якому ацеклофенак у кількості 0,3–30,0 мкмоль/л селективно пригнічував саме експресію ЦОГ-2 у здорових та уражених ОА хондроцитах людини.
Основні фармакологічні ефекти ацеклофенаку (Grau M. et al., 1991; Almirall Prodespharma S.A., 2003; Murherjee P., 2001):
- Пригнічення синтезу ПГ, включаючи ПГЕ2;
- Селективне пригнічення експресії ЦОГ-2;
- Пригнічення ІЛ-1β та -6, ФНП-α;
- Зниження експресії молекул адгезії (L-селектин, VCAM-1 (васкулярна молекула клітинної адгезії 1));
- Пригнічення продукції оксиду кисню;
- Стимулювання синтезу протеогліканів та гіалуронової кислоти;
- Пригнічення гальмування синтезу глікозаміногліканів, ІЛ-1;
- Пригнічення експресії металопротеїназ (ММП-1 та -3);
- Демонструє антиоксидантні властивості, впливаючи на вільні радикали;
- Гальмування проліферації синовіоцитів.
Лікувальний ефект ацеклофенаку реалізується також шляхом пригнічення синтезу таких прозапальних цитокінів, як ІЛ-1β та -6, ФНП-α, молекул адгезії, пригнічення продукції оксиду азоту і шляхом впливу на вільні радикали. Відомо, що саме ІЛ-1β пригнічує синтез хондроцитів та активує деградацію хряща, підвищуючи виділення протеолітичних ферментів. Важливими є дані про вплив ацеклофенаку на процеси деградації матрикса хряща за рахунок пригнічення активності ІЛ-1β та стимулювальний ефект на синтез глюкозаміногліканів у остеоартритичному хрящі (Dingle J.T. et al., 1997; Almirall Prodespharma S.A., 2003) У свою чергу, E. Maneiro та співавтори (2001) виявили стимулювальний вплив ацеклофенаку на синтез антагоніста рецепторів ІЛ-1β хондроцитами людини, а його похідне 4-гідроксиацеклофенак може пригнічувати ІЛ-1-опосередковану продукцію ММП.
Біологічні ефекти ацеклофенаку на метаболізм гіалінового хряща при ОА (Almirall Prodespharma S.A., 2003; Murherjee P. et al., 2001; Kornasoff D. et al., 1997):
- Селективно пригнічує активність ЦОГ-2 у культурі хондроцитів ураженого ОА хряща
- Стимулює синтез протеогліканів, глікозаміногліканів, гіалуронової кислоти
- Пригнічує ІЛ-1-опосередковану продукцію ММП
- Індукція активності антагоніста рецептора ІЛ-1, що синтезується синовіоцитами та хондроцитами
- Пригнічення продукції ІЛ-6 хондроцитами
- Зниження продукції оксиду азоту хондроцитами ураженого ОА хряща
- Пригнічення продукції ІЛ-1β, ФНП-α в культурі синовіоцитів, виділених із ураженого ОА хряща
- Гальмування апоптозу хондроцитів
Інгібуючий ефект ацеклофенаку на ПГЕ2 було продемонстровано не лише в експерименті, але й у клініці на прикладі зниження рівня ПГЕ2 у синовіальній рідині при загостренні ОА колінного суглоба (Martel-Pelletier J. et al., 1997) і ПГЕ2 у лейкоцитах периферичної крові після прийому в дозі 200 мг ацеклофенаку щоденно протягом тривалого періоду у хворих на ОА (Gonzales E. et al., 1994).
В експерименті на моделі гострого та хронічного артриту у собак, індукованого внутрішньосуглобовим введенням кристалів урату натрію, ацеклофенак виявляв протизапальну та анальгезивну активність, подібну до диклофенаку, незначно нижчу, ніж у індометацину та вищу, ніж у напроксену та фенілбутазону. Характерно, що при цьому ацеклофенак проявляв не лише терапевтичну, а й превентивну дію, запобігаючи розвитку артриту у тварин (Grau M. et al., 1991). Частота розвитку виразок ШКТ згідно з даними цього дослідження при прийомі ацеклофенаку була нижчою порівняно із диклофенаком та напроксеном у 4,2 та 3,7 раза відповідно.
Ефективність ацеклофенаку при ОА колінних суглобів оцінювали у декількох подвійних сліпих рандомізованих дослідженнях з піроксикамом (Perez Busquier M. et al., 1997), диклофенаком (Ward D.E. et al., 1995), напроксеном (Kornasoff D. et al., 1997). Тривалість лікування становила 2–3 міс. Ефективність ацеклофенаку щодо пригнічення інтенсивності болю (як у спокої так і під час руху), зменшення ексудативних явищ у суглобах та покращання функціональної активності хворих була суттєво вищою порівняно з плацебо, та еквівалентна диклофенаку, піроксикаму і напроксену. Аналіз динаміки основних показників патологічного процесу не виявив достовірної різниці між групами хворих, хоча позитивна динаміка швидше розвивалась у хворих, які отримували ацеклофенак.
Доцільність застосування того чи іншого препарату в клінічній практиці є недоведеною без детального вивчення його переносимості. Так, у зазначених дослідженнях відміна препарату внаслідок неефективності відзначена у 4,2% (Kornasoff D. et al., 1997) та 4,5% (Perez Busquier M. et al., 1997) хворих. Особливу увагу приділяли моніторингу побічних явищ. Перш за все оцінювали побічні ефекти з боку ШКТ, при цьому враховували всі симптоми та об’єктивні ознаки, які можуть бути пов’язані з цією патологією. Встановлено, що спектр побічних явищ при лікуванні ацеклофенаком дуже близький до такого при лікуванні іншими НПЗП, але суттєво відрізняється за частотою їх розвитку. Так, за такими симптомами, як нудота, діарея, метеоризм, запор, виразковий коліт суттєвих відмінностей між ацеклофенаком та НПЗП, з якими його порівнювали, не виявлено. Частота зазначених побічних явищ у хворих, які приймали ацеклофенак, варіювала від 8 до 26%, а в контрольній групі — від 15 до 36% (Kornasoff D. et al., 1997; Perez Busquier M. et al., 1997) відповідно. При цьому у переважній більшості випадків потреби у відміні препарату не виникло. Частота кишкових кровотеч при лікуванні ацеклофенаком становила 1,29%, а у пацієнтів, які приймали диклофенак, піроксикам або індометацин, — від 0 до 8,8%.
На користь хорошої переносимості ацеклофенаку свідчать результати великого проспективного відкритого багатоцентрового дослідження SAMM (Safety Assessment of Marketed Medicines), в яке були включені 10 142 хворих на РА, ОА та анкілозивний спондилоартрит (Huskinsson E.C. et al., 2000), та проводилась оцінка безпеки застосування ацеклофенаку та диклофенаку. Так, 7890 включених у дослідження хворих приймали ацеклофенак у дозі 100 мг 2 рази на добу, а 2252 — диклофенак у дозі 75 мг 2 рази на добу протягом 12 міс. Групи були рандомізовані за віком, статтю, нозологічними формам, тривалістю захворювання та гастроентерологічним анамнезом, включаючи пептичну виразку, шлункову та кишкову диспепсію і біль у епігастральній ділянці. 91,4% включених у дослідження пацієнтів хворіли на ОА. Критеріями виключення були особи із загостренням пептичної виразки, ураженням нирок (рівень креатиніну >360 мкмоль/л), хворі на бронхіальну астму, в період вагітності та особи з гіперчутливістю до НПЗП та ацетилсаліцилової кислоти. Попередню терапію (за винятком ібупрофену) відміняли за 30 днів до початку проведення дослідження. 12-місячний період лікування завершили 27,9% хворих групи ацеклофенаку та 27% — групи диклофенаку. Обидва препарати мали хорошу переносимість, а побічні ефекти, що розвивалися, розцінювались як легкі та помірно виражені. Загалом частота побічних явищ у групі ацеклофенаку становила 22,4%, а в групі диклофенаку — 27,1%. При цьому найчастіше виникали симптоми з боку ШКТ і становили 10,6 та 15,2% (р<0,01) у групі ацеклофенаку та диклофенаку відповідно. Скарги на диспепсію, нудоту, біль у животі та діарею були у 1,3; 1,5; 1,8 та 2,5 раза вищими у групі диклофенаку. Крім того, у хворих відмічали порушення з боку нервової системи, такі як запаморочення, депресії та головний біль, частіше при прийомі ацеклофенаку (3%), ніж диклофенаку (1,9%).
Серед інших побічних явищ при прийомі ацеклофенаку менше ніж у 5% хворих виявляли свербіж, шкірне висипання та дерматит.
Припинили лікування 59% хворих, які отримували ацеклофенак та 63,7% — диклофенак. Серед причин у 15,6% — неефективність, у 14,9% — розвиток побічних явищ, у 10,1% — неможливість спостереження.
Отже, в результаті проведеного дослідження доведено, що застосування ацеклофенаку супроводжується меншою кількістю побічних явищ з боку ШКТ та характеризується кращою переносимістю. Механізм цього явища залишається остаточно невідомим, але в результаті гастроскопічного дослідження встановлено, що при використанні ацеклофенаку вміст гексозаміну у слизовій оболонці шлунку підвищувався, а локальний кровообіг не змінювався. При цьому саме прийом ацеклофенаку приводив до достовірного зниження pH шлунку (р<0,05). Відзначимо, що при лікуванні диклофенаком відбувається як зниження рівня гексозаміну, так і порушення локального кровообігу.
Інший аналіз частоти шлунково-кишкових кровотеч із верхніх відділів ШКТ, проведений у 142 776 осіб протягом 18-місячного періоду, підтвердив ці дані, продемонструвавши перевагу ацеклофенаку: найвища частота такого серйозного ускладнення, як кровотеча із ШКТ, відзначена при застосуванні піроксикаму, кетолораку та індометацину (Llorente M.J., 1998).
Аналогічний профіль токсичності ацеклофенаку підтверджується результатами метааналізу 13 рандомізованих подвійних досліджень ІІІ фази, в які загалом було включено 3574 хворих на ОА, РА чи анкілозивний спондилоартрит. За результатами цього метааналізу доведено, що частота розвитку побічних явищ та відміни прийому ацеклофенаку була значно нижчою (р<0,0001), ніж інших НПЗП, з якими проводили порівняння (Peris F. et al., 1996).
Серед дуже рідких побічних ефектів при лікуванні ацеклофенаком зазначали поодинокі випадки гіперчутливості. У частини хворих відмічено підвищення рівня печінкових ферментів, проте аналогічне підвищення зафіксоване і в групах порівняння, проте відміна препаратів була зазвичай рідкісним явищем (Dooley M. et al., 2001).
Заслуговують на увагу результати Європейського багатоцентрового дослідження (Lemmel E.M. et al., 2002), в яке були включені 23 402 пацієнти із РА, ОА, анкілозивним спондилоартритом, а також із постопераційним та посттравматичним болем, болем у нижній ділянці спини. Мета цього дослідження — встановити ступінь задоволення хворих та лікарів лікуванням, а також оцінити комплаєнтність пацієнтів до рекомендованої терапії. Так, на початку дослідження 41% включених пацієнтів оцінили інтенсивність больового синдрому як виражену, проте вже під час другого візиту цей показник зменшився до 5%, а третього — до 3% відповідно. Аналогічне зниження відмічене і у тих хворих, які оцінили інтенсивність болю як помірно виражену. Вже під час другого візиту 13% хворих цієї категорії не відчували болю взагалі. Понад 89% пацієнтів відмітили значне покращання самопочуття вже під час другого візиту. Іншим важливим показником, який оцінювали в ході цього дослідження, був ступінь задоволеності хворих лікуванням, яке вони отримували. В результаті встановлено, що незалежно від причини болю, вже під час другого візиту при лікуванні ацеклофенаком були задоволені 87% осіб, третього — 90% відповідно. Ступінь комплаєнтності пацієнтів до лікування ацеклофенаком також мав досить високий рівень. Так, виявилося, що рекомендована доза (дворазовий прийом по 100 мг ацеклофенаку) була підтримана 94% пацієнтів, незалежно від показань до прийому препарату. Профіль токсичності ацеклофенаку, згідно з даними зазначеного дослідження, був розцінений як задовільний.
Фармакоекономічний метааналіз (Peris F. et al., 1996) продемонстрував, що краща переносимість ацеклофенаку порівняно з іншими, більш відомими неселективними НПЗП, зумовлює менші витрати, пов’язані з усуненням побічних явищ, і тим самим створює більш визначену перспективу для системи охорони здоров’я.
Таким чином, ацеклофенак — це НПЗП, який за своєю ефективністю не поступається стандартним лікарським засобам цього класу. Його застосування доцільне при цілому спектрі ревматичних захворювань і, особливо при ОА, з урахуванням його здатності стимулювати хондробласти і хондроцити до синтезу повноцінних протеогліканів, глюкозаміногліканів та гіалуроновї кислоти. І в цьому плані ацеклофенак можна розглядати з позицій препарату, що має хондропротекторні властивості. Переважний вплив на ЦОГ-2 забезпечує хорошу переносимість та сприятливий профіль токсичності препарату. Частота розвитку побічних явищ при тривалому застосуванні ацеклофенаку достовірно нижча порівняно із такою при використанні класичних НПЗП і подібна до селективних інгібіторів ЦОГ-2.
Мелоксикам — перший на українському фармацевтичному ринку селективний інгібітор ЦОГ-2. Його здатність селективно пригнічувати ЦОГ-2 досліджувалася в численних дослідженнях in vitro та in vivo. Так, за даними G. Engelhardt та співавторів (1996), які вивчали дію мелоксикаму та інших НПЗП (піроксикам, теноксикам, тенідап, диклофенак, напроксен і флурбіпрофен) на активність ЦОГ-2 у тканинах живих тварин в умовах запалення (перитоніт у мишей і плеврит у щурів), а також на активність ЦОГ-1 у шлунку, нирках і крові, перший був більш сильним інгібітором синтезу ПГЕ2 у тканинах в умовах запалення. Так, при перитоніті у мишей він виявився в 2 рази активнішим, ніж піроксикам, і більше ніж у 10 разів активніший від диклофенаку або напроксену, а при плевриті у щурів — у 2 рази ефективніший від теноксикаму. При плевриті у щурів мелоксикам за рівнем активності виявляв ефект такого ж порядку, як піроксикам, хоча перший мав менш круту криву «доза — відповідь». У той час, як на фоні прийому інших НПЗП підвищувалася концентрація ЛТВ4, який бере участь у механізмі розвитку бронхоспазму при прийомі НПЗП, доза мелоксикаму, достатня для пригнічення ПГЕ2 у запальному ексудаті не впливала на його концентрацію. Мелоксикам у найменшому ступені пригнічував синтез ПГ, опосередкований ЦОГ-1. Результати цього дослідження дозволили авторам зробити висновок про те, що у гризунів мелоксикам є сильним інгібітором синтезу ПГ в умовах запалення, але слабким інгібітором у нормальних фізіологічних умовах. Піроксикам виявив подібну протизапальну активність, але був також більш сильним інгібітором фізіологічного синтезу ПГ.
Безпека мелоксикаму у людини in vivo та його ефективність у хворих на ОА була відзначена в численних публікаціях. Результати 3-тижневого подвійного сліпого плацебо-контрольованого дослідження ефективності й переносимості мелоксикаму в дозі 7,5 і 15 мг/добу у хворих з маніфестним ОА колінних суглобів (n=411) підтвердили, що мелоксикам в обох дозах значно перевершує плацебо за ефективністю і порівнянний з ним за частотою побічних ефектів (Lund B. et al., 1994).
B. Linden та співавтори (1996) у 6-тижневому дослідженні порівнювали ефективність і переносимість мелоксикаму 15 мг/добу і піроксикаму 20 мг/добу при лікуванні ОА кульшових суглобів. В обох групах у хворих відзначено однакове зниження індексу тяжкості гонартрозу (індексу Лекена) і зменшення вираженості болю під час руху. На фоні лікування мелоксикамом побічні ефекти з боку ШКТ відзначали у 20,9% хворих, а в групі пацієнтів, які одержували піроксикам — у 22,8% випадків. Серйозні побічні ефекти з боку ШКТ виявлено в 1 хворого зі 129, які одержували мелоксикам, і у 3 із 127, які приймали піроксикам. В іншому дослідженні, у рамках якого хворі на ОА колінного і кульшового суглобів протягом 6 міс одержували мелоксикам 15 мг/добу або піроксикам 20 мг/добу, про переносимість цих препаратів одержані дещо інші дані. У групі мелоксикаму частота виникнення побічних ефектів з боку травної системи була значно нижчою (24,2%), ніж у хворих групи піроксикаму (30,2%), а час до появи побічної дії був більш тривалим (163 і 144 дні відповідно).
Результати 6-тижневого клінічного порівняльного дослідження ефективності й безпеки мелоксикаму 15 мг/добу і диклофенаку (повільного вивільнення) 100 мг/добу у хворих на ОА свідчать про незначну перевагу першого відносно загальної ефективності лікування, а також вираженості болю в уражених суглобах при ході та у спокої (Goie T.H. et al., 1993). Проте у пацієнтів, які приймали диклофенак, відзначена вища частота розвитку побічних ефектів з боку ШКТ (26,2%) порівняно із групою мелоксикаму (16,4%). У 6-місячному дослідженні J. Hosie та співавтори (1996) порівнювали ефективність і безпеку мелоксикаму в дозі 7,5 мг/добу і диклофенаку (повільного вивільнення) 100 мг/добу у хворих на ОА. Значних відмінностей ефективності між досліджуваними препаратами не виявлено. Однак переносимість мелоксикаму виявилася кращою, ніж диклофенаку. Незважаючи на те що загальна кількість побічних ефектів у групі мелоксикаму була такою, як і в групі диклофенаку, у першій вони носили більш легкий характер і виникали у більш пізній період. Серйозні побічні ефекти частіше відзначали при лікуванні диклофенаком (22%), ніж мелоксикамом (15,8%). У хворих, які приймали диклофенак, виявлено значні відхилення від норми в лабораторних аналізах (зниження рівня гемоглобіну, зменшення кількості лейкоцитів, підвищення рівня сечовини й зміни печінкових тестів), в той час, як у групі мелоксикаму відзначали лише клінічно незначимі зміни лабораторних параметрів. У групі диклофенаку 18,8% осіб відмовилися від подальшого лікування у зв’язку з розвитком побічних ефектів, тоді як пацієнти, які одержували мелоксикам — лише у 12,4% випадків.
Основне завдання багатоцентрового проспективного подвійного сліпого рандомізованого дослідження MЕloxicam Large-scale International Study Safety Assessment (MELISSA) — вивчити переносимість мелоксикаму у великих відносно нерандомізованих групах хворих і доповнити дані, отримані в інших дослідженнях у більш обмежених умовах (Hawkey C. et al., 1998). Препаратом порівняння був диклофенак — лікарський засіб із відносно низьким рівнем токсичності щодо ШКТ (Willkens R.F., 1985; Hosie J. et al., 1996). За результатами досліджень M. Distel та співавторів (1996) і J. Hosie та співавторів (1996) доза мелоксикаму 7,5 мг/добу була рекомендована до використання коротким курсом при загостренні симптомів ОА. У дослідження включили 10 051 хворого на ОА. Учасників розподілили на три групи залежно від одержуваного лікування (мелоксикам — 7,5 мг/добу, лікарська форма диклофенаку з модифікованим вивільненням активної речовини — 100 мг/добу або плацебо протягом 28 днів). У групі мелоксикаму зареєстрована значно менша кількість побічних ефектів з боку травної системи, ніж у хворих, які одержували диклофенак (рис. 12.5). У 5 пацієнтів групи мелоксикаму та у 7— групи диклофенаку спостерігали серйозні побічні ефекти (ульцерогенна дія, перфорація виразки, шлунково-кишкова кровотеча) (р>0,05). Ендоскопічно у 4 пацієнтів, які одержували диклофенак, виявлено загострення виразки, в той час як у групі мелоксикаму не виявили. У групі мелоксикаму загальна тривалість госпіталізації у зв’язку з розвитком побічних ефектів становила 5 днів, тоді як у групі диклофенаку — 121 день. Серед пацієнтів, які у зв’язку з цим відмовилися від лікування, 254 (5,48%) хворих одержували мелоксикам і 373 (7,96%) — диклофенак (р<0,001). Побічні явища з боку ШКТ були причиною відмови хворих від продовження лікування у 3,02% випадків у групі мелоксикаму і в 6,14% — у групі диклофенаку (р<0,001). Проте значно більша кількість хворих, які одержували мелоксикам, відмовилися від подальшого лікування у зв’язку з недостатньою його ефективністю (80 із 4635 у групі мелоксикаму і 49 з 4688 — у групі диклофенаку; р<0,01). У групі пацієнтів, які одержували диклофенак, також відзначали більш виражену позитивну динаміку за ВАШ болю, ніж у групі мелоксикаму. Таким чином, результати дослідження свідчать про те, що профіль переносимості мелоксикаму значно кращий порівняно з іншими традиційними НПЗП, включаючи диклофенак, що може бути зумовлено ЦОГ-2-селективністю, а також іншими причинами (наприклад дозуванням).

Рис. 12.5. Побічні ефекти з боку травної системи у хворих на ОА, які одержували мелоксикам і диклофенак (дослідження MELISSA)
SELECT (Safety and Efficacy Large-scale Evaluation of Cox-inhibiting Therapies) — ще одне масштабне багатоцентрове подвійне сліпе рандомізоване дослідження з паралельними групами (Dequeker J. et al., 1998). У рамках цього дослідження пацієнти з маніфестним ОА одержували рекомендовані дози мелоксикаму (7,5 мг/добу) і піроксикаму (20 мг/добу). У групі мелоксикаму було 4320 хворих на ОА, а в групі піроксикаму — 4336. Загальна частота побічних ефектів була значно нижчою у пацimg-osteo ієнтів, які одержували мелоксикам (22,5%), ніж у хворих, які приймали піроксикам (27,9%; р<0,001). Це досягнуто завдяки значно нижчій частоті побічних ефектів з боку ШКТ (рис. 12.6) у групі мелоксикаму порівняно із групою піроксикаму (відповідно 10,3 і 15,4%; р<0,001).
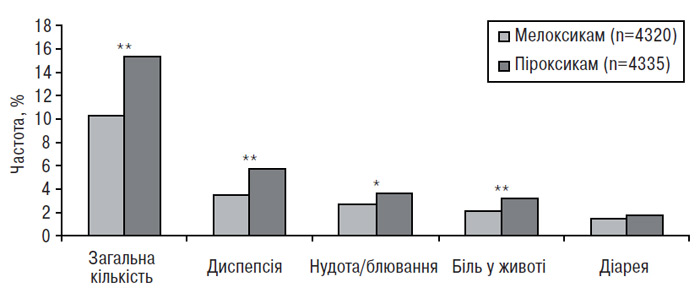
Рис. 12.6. Побічні ефекти з боку травної системи у хворих на ОА, які одержували мелоксикам і піроксикам (дослідження SELECT)
Водночас ефективність обох препаратів була однаковою. Серйозні побічні ефекти спостерігали у 16 хворих у групі піроксикаму і у 7 — мелоксикаму (піроксикам/мелоксикам ВР=1,4). Таким чином, результати дослідження SELECT підтверджують дані інших досліджень, у яких порівнювали переносимість мелоксикаму з іншими НПЗП, і доповнюють відомості про зв’язок між селективним пригніченням ЦОГ-2 і покращанням переносимості НПЗП.
Дані метааналізу 10 рандомізованих порівняльних досліджень ефективності та/чи переносимості мелоксикаму в дозах 7,5 і 15 мг/добу і референтних НПЗП (піроксикам — 20 мг/добу, диклофенак — 100 мг/добу, напроксен — 750 мг/добу) свідчать, що перший викликав значно меншу кількість побічних ефектів порівняно з референтними НПЗП (ВШ=0,64, 95% ДІ 0,59–0,69) (Schoenfeld P., 1999). Зокрема, у хворих, які приймали мелоксикам, рідше відзначали ульцерогенну дію, перфорацію виразки й шлунково-кишкову кровотечу (ВШ=0,52, 95% ДІ 0,28–0,96), вони рідше відмовлялися від подальшого лікування у зв’язку з розвитком побічних ефектів (ВШ=0,59, 95% ДІ 0,52–0,67), а також рідше пред’являли скарги на диспепсію (ВШ=0,73, 95% ДІ 0,64–0,84).
Ризик виникнення побічних реакцій з боку ШКТ нижчий навіть у осіб, які одержують поєднану терапію мелоксикамом і кардіопротекторними дозами ацетилсаліцилової кислоти (Degner F. et al., 2001).
Фармакокінетичні властивості мелоксикаму дозволяють призначати препарат 1 раз на добу, що сприяє дотриманню пацієнтами режиму лікування, особливо при безперервній терапії тяжких хронічних ревматичних захворювань. Мелоксикам можуть застосовувати хворі похилого віку при значному порушенні функції нирок і печінки, оскільки він має дуже низьку нефро- і гепатотоксичність. Всмоктування й розподіл мелоксикаму при його поєднаному застосуванні з антацидами, циметидином, дигоксином і фуросемідом не погіршується, що особливо важливо для хворих похилого віку.
При проведенні метааналізу 10 рандомізованих суворо контрольованих досліджень за участю понад 20 тис. хворих встановлено, що терапія мелоксикамом дозволяє на 36% знизити ризик виникнення ускладнень із боку травного тракту, на 48% — частоту тяжких уражень (виразки, перфорації, кровотечі) порівняно з диклофенаком, піроксикамом і напроксеном (Schoenfeld P., 1995) (табл. 12.7).
Таблиця 12.7
Результати протягом 90 днів спостереження
| Події протягом 90 днів спостереження/оцінювані величини | Група мелоксикаму (n=60) | Група контролю (n=60) | Зниження ВР (95% ДІ) | Абсолютне зниження ризику, % | р* |
| Рецидиви стенокардії, n (%) | 12 (20,0) | 26 (43,3) | 53,8 (17–74) | 23,3 | 0,011 |
| Реваскуляризація, n (%) | 7 (11,7) | 18** (30,0) | 61,0 (14–82) | 18,3 | 0,025 |
| Перкутанне коронарне втручання, n (%) | 3 | 7 | — | — | — |
| Аортокоронарне шунтування, n (%) | 4 | 12 | — | — | — |
| Інфаркт міокарда, n (%) | 0 | 3 (5) | — | — | — |
| Серцево-судинна смерть, n (%) | 0 | 2 (3,3) | — | — | — |
| Рецидиви стенокардії + інфаркт міокарда + серцево-судинна смерть, n (%) | 13 (21,7) | 29 (48,3) | 55,1 (22–74) | 26,6 | 0,004 |
| Інфаркт міокарда + серцево-судинна смерть + реваскуляризація, n (%) | 8 (13,3) | 20 (33,3) | 60,1 (16–81) | 20,0 | 0,015 |
*χ2 — тест; **зареєстровано лише 1 явище в 1 пацієнта.
У проспективному дослідженні R. Altman та співавторів (2002) пацієнти з гострим коронарним синдромом без елевації сегмента ST були рандомізовані в період перебування у відділенні невідкладної терапії на групи лікування ацетилсаліциловою кислотою та гепарином (n=60) або ацетилсаліциловою кислотою, гепарином і мелоксикамом (n=60).
Первинні величини, що оцінювалися (рецидиви стенокардії, інфаркт міокарда чи смерть хворого під час перебування у відділенні невідкладної терапії), були суттєво нижчі у пацієнтів, які одержували мелоксикам (15,0 і 38,3% відповідно; р=0,007). Вторинні складні величини, що оцінювалися (реваскуляризація коронарних судин, інфаркт міокарда чи смерть хворого) були також значно нижчі у пацієнтів групи мелоксикаму (10,0 і 26,7%; р=0,034). До 90-го дня у групі хворих, які приймали мелоксикам, основні та вторинні оцінювані параметри залишалися значно нижчими (21,7 і 48,3%; р=0,004 і 13,3 і 33,3%; р=0,015 відповідно), а також меншою була необхідність у реваскуляризації (11,7 і 30,0%; р=0,025) (див. табл. 12.7). Також не відзначено побічних явищ, пов’язаних із прийомом мелоксикаму (Altman R. et al., 2002).
Проводячи об’єктивну оцінку досвіду застосування НПЗП у пацієнтів з ревматичними захворюваннями, необхідно звернути увагу на результати дослідження IMPROVE (Impact of Meloxicam on Prescription Regimens in Osteoarthritis Versus Everyday Care) (Gagnier P. et al., 2001; 2002; Singh G.S. et al., 2002). Це мультицентрове сліпе рандомізоване відкрите дослідження, що включало 1309 пацієнтів з ОА, проведене у клініках США. Пацієнти були рандомізовані на дві групи: у 1-й приймали мелоксикам у дозі 7,5 мг/добу, хоча при необхідності вона могла бути підвищена до 15 мг/добу. Пацієнти 2-ї групи одержували один із НПЗП, найбільш часто призначуваний у повсякденній практиці (рофекоксиб, целекоксиб, напроксен, диклофенак, піроксикам та ін.) у загальноприйнятих дозах. Пацієнти не приймали ніякого іншого препарату до включення в дослідження та у наступні 6 міс. Терапевтична ефективність визначалася в тому випадку, коли пацієнт після закінчення дослідження не переходив на прийом іншого НПЗП, або коли пацієнт, закінчуючи участь у дослідженні, не потребував подальшого прийому НПЗП для лікування при ОА.
У групі хворих, які приймали мелоксикам, терапевтичний успіх досягався суттєво частіше, ніж у групі пацієнтів, які одержували інші НПЗП (67 проти 45%). Хоча дизайн дослідження не забезпечував достатньої статистичної достовірності для порівняння результатів лікування мелоксикамом з іншими НПЗП окремо, проте частота досягнення ефективності у групі пацієнтів, які одержували мелоксикам, була вищою, ніж у групах, де приймали будь-який інший засіб.
Проблеми, пов’язані з небажаними реакціями чи недостатньою ефективністю, частіше виникали у групі пацієнтів, які приймали інші НПЗП. IMPROVE — одне з небагатьох досліджень, у ході якого у пацієнтів з’ясовували про результати медикаментозного лікування при ОА.
Побічні реакції та недостатню ефективність частіше відзначали у групі пацієнтів, які приймали інші НПЗП, ніж у групі мелоксикаму (рис. 12.7).
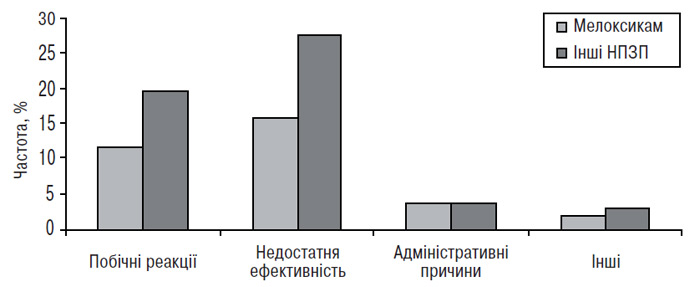
Рис. 12.7. Побічні реакції та недостатня ефективність терапії у групах лікування (дані дослідження IMPROVE)
Індекс, що оцінює ефективність усунення больового синдрому у пацієнтів, виявився найвищим для груп пацієнтів, які приймали мелоксикам.
Особливий інтерес становлять дані, що узагальнюють результати застосування мелоксикаму у різних дозах у 27 тис. хворих, які підтверджують, що терапія мелоксикамом (порівняно зі стандартними НПЗП) не підвищує ризик розвитку кардіоваскулярних ускладнень (інфаркт міокарда, серцева недостатність, артеріальна гіпертензія) і не виявляє нефро- і гепатотоксичного ефектів. Крім того, останнім часом отримані дані про можливу кардіопротекторну дію мелоксикаму у пацієнтів із гострим коронарним синдромом (Layton D. et al., 2003). Результати цього дослідження підтверджують принципову відмінність мелоксикаму від інших інгібіторів ЦОГ-2, застосування яких може, за деяким даними, призводити до підвищення частоти виникнення інфаркту міокарда і тромботичних ускладнень.
На відміну від інших інгібіторів ЦОГ-2, мелоксикам має особливі переваги. Недавно розроблені парентеральні форми дозволяють обґрунтовано рекомендувати мелоксикам для купірування загострення хронічного болю при ОА (Del Tacca M. et al., 2002). При внутрішньом’язовому введенні знеболювальний і протизапальний ефекти проявляються через 30–50 хв і зберігаються як мінімум 5–6 год. При внутрішньом’язовому введенні будь-якого НПЗП слід переконатися в хорошій місцевій та системній переносимості, оскільки остання не залежить від шляху введення. Мелоксикам не викликає вогнищевого некрозу в місці введення і його внутрішньом’язове введення не призводить до підвищення рівня кратинфосфокінази, на відміну від кетопрофену, диклофенаку й піроксикаму.
Системні побічні реакції при застосуванні мелоксикаму внутрішньом’язово (15 мг мелоксикаму в 1,5 мл розчину) від 3 до 7 днів за частотою і спектром не відрізняються від плацебо (Цветкова Е.С. и соавт., 2004).
Послідовне, східчасте призначення мелоксикаму внутрішньом’язово, а потім per os є ефективною схемою лікування загострення хронічного болю при ревматичних захворюваннях і може бути альтернативою застосування стандартних НПЗП (Цветкова Е.С. и соавт., 2004).
Особливий аспект безпечного застосування мелоксикаму — це можливість його призначення при проведенні ортопедичних операцій, оскільки нещодавно встановлено, що використання цього засобу дозволяє зменшити кількість шлунково-кишкових кровотеч в середньому на 17% порівняно з диклофенаком і набуметоном.
Перевагою мелоксикаму є також відсутність негативного впливу на суглобовий хрящ, оскільки в терапевтичних концентраціях, на відміну від інших НПЗП, він не пригнічує утворення повноцінних протеогліканів, знижує рівень ряду ферментів, що руйнують хрящ, і може розглядатися як хондронейтральний і навіть як хондропротективний препарат (Цветкова Е.С. и соавт., 2004).
Внутрішньом’язова форма мелоксикаму. Мелоксикам випускають також у формі ін’єкцій (ампули, що містять 15 мг мелоксикаму в 1,5 мл розчину). Ін’єкції мелоксикаму ефективні, оскільки об’єм речовини, що вводиться, досить невеликий — всього 1,5 мл, а 90% максимальної концентрації в плазмі крові спостерігається вже через 30–50 хв після ін’єкції, причому найвищі показники концентрації в плазмі крові досягаються через 1,5 год після ін’єкції. Аналогічні параметри для таблетованої форми — 4–6 і 9 год відповідно.
Ін’єкції рекомендується робити винятково в сідничну ділянку згідно із традиційною методикою.
При досягненні необхідного терапевтичного ефекту, через 2–3 дні після початку терапії мелоксикамом (внутрішньом’язово), пацієнтів можна переводити на прийом таблетованої форми препарату. Однак при цьому слід враховувати, що сумарна добова доза мелоксикаму не має перевищувати 15 мг.
Німесулід — НПЗП, що хімічно відрізняється від інших представників цього класу відсутністю кислотних властивостей. Німесулід — представник відносно нової групи дериватів сульфонаніліду (Bennett A., 1996). Відзначимо, що спочатку німесулід характеризувався як слабкий інгібітор ЦОГ, що виявлено в різних дослідженнях in vitro. Передбачалося, що для німесуліду більш важливим є «непростагландиновий» механізм дії. За даними J.R. Vane і R.M. Botting (1996), коефіцієнт селективності німесуліду, визначений in vitro з використанням системи інтактних клітин, становить 0,1.
Фармакокінетика препарату пов’язана не лише з його селективністю щодо ЦОГ-2, але й з особливістю його хімічної структури (на відміну від інших НПЗП німесулід має слабкі кислотні властивості) і періодом напіввиведення (у німесуліду — 1,5–5 год, у піроксикаму — близько 2 днів) (Bennett A., 1996).
Блокування ферменту фосфодіестерази IV зумовлює й інші позитивні ефекти німесуліду:
- пригнічення продукції вільних кисневих радикалів (Magaro M. et al., 1989; Ottonello L. et al., 1992; Capecchi P.L. et al., 1993; Bevilacqua M. et al., 1994; De Mello S.B. et al., 1994);
- блокування металопротеаз (стромелізину (протеогліканази) і колагенази) (Bevilacqua M., Magni E., 1993; Pelletier J.P., Martel-Pelletier J., 1993);
- антигістамінний ефект (Berti F. et al., 1990; 1991).
Результати численних досліджень свідчать про високу ефективність і безпеку німесуліду у хворих на ОА. У подвійному сліпому плацебо-контрольованому дослідженні P. Blardi та співавтори (1991) вивчали ефективність німесуліду у 40 хворих на ОА різних локалізацій і виявили перевагу німесуліду відносно зменшення вираженості болю в суглобах і ранкової скутості. В іншому дослідженні з аналогічним дизайном R.L. Dreiser та співавтори (1991) виявили значну перевагу німесуліду порівняно із плацебо при лікуванні 60 хворих на ОА колінних суглобів протягом 2 тиж за даними ВАШ болю і альгофункціонального індекса Лекена, при цьому частота виникнення побічних ефектів у групі хворих, які одержували німесулід, не перевищувала такої в групі плацебо.
У табл. 12.8 узагальнені результати контрольованих досліджень, у яких порівнювали ефективність та безпеку німесуліду з референтними НПЗП. Тривалість лікування в ході цих досліджень коливалася від 3 тиж до 6 міс, німесулід і препарати порівняння призначали в терапевтичних дозах, за винятком дослідження, проведеного V. Fossaluzza і співавторами (1989), у якому добова доза напроксену (500 мг) була вочевидь недостатньою. Результати майже всіх наведених досліджень свідчать, що німесулід не поступається за ефективністю та безпекою перед препаратам порівняння.
Таблиця 12.8
Контрольовані дослідження ефективності німесуліду (200 мг/добу) порівняно з іншими НПЗП (за: Lequesne M.G., 1996)
| Автор, рік | Пацієнти | НПЗП, мг/добу | Тривалість | Ефективність | ПЕ* |
| Fossaluzza V. et al., 1991 | Гонартроз (n=40) | Напроксен (нап), 500 | 4 тиж | нім=нап | нім=6/20 (6/2)
нап=6/20 (8/5) |
| Dreiser R.L. et al., 1991 | Гонартроз і коксартроз (n=59) | Піроксикам (пір), 20 | 3 тиж | нім=пір | нім=5/29 (9/9)
пір= 2/30 (3/3) |
| Dreiser R.L. et al., 1991 | Гонартроз і коксартроз (n=55) | Кетопрофен (кето), 200 | 2 міс | нім=кето | нім=7/28 (14/8)
кето=5/27 (5/4) |
| Quattrini M. et al., 1992 | Гонартроз (n=112) | Напроксен (нап), 1000 | 1 міс | нім=нап | нім=4/60 (5/4)
нап=4/60 (5/5) |
| Porto A., 1993 | Гонартроз і коксартроз (n=89) | Диклофенак (дикло), 150 | 1 міс | нім=дикло | нім=11/44 (21/10)
дикло=11/45 (19/14) |
| Lucker P.W. et al., 1993 | Коксартроз (n=199) | Етодолак (ето), 600 | 3 міс | нім=ето | нім=39/100 (102/44)
ето=34/99 (72/25) |
| Huskisson E.C. et al., 1996 | Гонартроз і коксартроз (n=279) | Диклофенак (дикло), 150 Диклофенак (дикло), 150 | 6 міс | нім=дикло | нім=88/135 (177/84)
дикло=98/144 (176/124) |
*Кількість хворих з побічними ефектами (ПЕ)/загальна кількість хворих у групі (загальна кількість випадків ПЕ/кількість випадків ПЕ з боку травної системи); нім — німесулід.
Водночас у світі станом на 01.01.2006 р. при медичному застосуванні німесуліду всього було зареєстровано 1364 випадки побічних реакцій (з них 9 летальних), які проявилися 2263 системними розладами. При цьому домінували порушення з боку гепатобіліарної системи, травного тракту та алергічні побічні реакції. Зокрема, було зареєстровано порушення з боку печінки — 128 (5,6%) випадків, гепатиту — 145 (6,4%), жовтяниці — 41 (1,8%), білірубінемії — 16 (0,7%). Розлади з боку травного тракту проявлялися болем у животі у 66 (2,8%) випадках, діареєю — 44 (1,9%), нудотою — 39 (1,7%), блюванням — 32 (1,4%), виразкою — 66 (2,9%), виразкою з кровотечею —15 (0,7%). Алергічні побічні реакції проявлялися ангіоневротичним набряком у 169 (7,4%) випадках, набряком Квінке — 62 (2,7%), анафілактичним шоком — у 5 (0,2%), змінами з боку шкіри — у 405 (17,8%). Згідно з даними дослідження, проведеного у Швейцарії, встановлено причинно-наслідковий зв’язок між застосуванням німесуліду та виникненням гепатотоксичних ефектів (перший прояв у вигляді жовтяниці — у 90% випадків). В Італії описано випадки печінкової недостатності серед новонароджених, матері яких приймали німесулід (Bjarnason I. et al., 2005). Комітет з лікарських засобів для використання людиною (Committee for Medicinal Products for Human Use — СHМР) Європейського агентства з лікарських засобів (European Medicines Agency — ЕМЕА) у науковому висновку від 24.07.2003 р. повідомив про сприятливе співвідношення користь — ризик щодо німесуліду, але рекомендував обмежити застосування препаратів системної дії лікуванням гострих больових синдромів, симптоматичним лікуванням болю при остеоартрозі та первинній дисменореї, а використання місцевих форм — лікуванням болю, зумовленого розтягненням зв’язок і травматичним тендинітом. У своєму висновку від 17.12.2003 р. СHМР виступив із пропозицією заборонити продаж таблеток німесуліду по 200 мг, також зазначалося, що співвідношення користь — ризик у препаратів німесуліду для системного й місцевого застосування сприятливе, однак їх продаж може бути дозволений за умов розміщення в інформаційних листках-вкладишах нової короткої характеристики цього лікарського засобу:
1. Терапевтичні показання:
- усунення гострого болю;
- симптоматичне лікування болю при ОА;
- терапія первинної дисменореї.
2. Дозування та спосіб введення:
Препарати німесуліду слід застосовувати протягом максимально короткого часу, залежно від клінічної картини.
Дорослі: таблетки, розчинні та шипучі таблетки; таблетки, вкриті оболонкою; капсули, тверді капсули по 100 мг; гранули або порошок для приготування суспензії для перорального застосування (50 або 100 мг); 1,2 та 5% розчин для приготування суспензії для перорального застосування (з розрахунку по 100 мг 2 рази на добу після прийому їжі). Особи похилого віку: немає потреби знижувати добову дозу. Дітям віком молодше 12 років препарати німесуліду протипоказані. Підліткам віком 12–18 років: враховуючи кінетичний профіль у дорослих та фармакодинамічні параметри німесуліду, немає необхідності в корекції дози. Недостатність функції нирок: немає потреби в корекції дози у хворих із помірним та середнім ступенем ниркової недостатності (кліренс креатиніну — 30–80 мл/хв). Препарати німесуліду протипоказані пацієнтам із гострою нирковою недостатністю (кліренс креатиніну <30 мл/хв).
3. Протипоказання:
- відома гіперчутливість до німесуліду чи будь-яких допоміжних компонентів препарату;
- реакції гіперчутливості в анамнезі (бронхоспазм, риніт, кропив’янка тощо) у відповідь на введення ацетилсаліцилової кислоти чи інших НПЗП;
- гепатотоксичні реакції на німесулід в анамнезі;
- виразка шлунка чи дванадцятипалої кишки в активній фазі, рецидиви виразки чи шлунково-кишкові кровотечі, судинно-мозкова кровотеча в анамнезі, інші види кровотеч в активній фазі чи будь-які порушення з боку системи крові;
- серйозні порушення згортання крові;
- гостра серцева недостатність;
- печінкова недостатність;
- вік до 12 років;
- ІІІ триместр вагітності та період годування грудьми.
Однак навіть дотримання вищенаведених обмежень при медичному застосуванні препаратів німесуліду не дало змоги уникнути несприятливих наслідків. Так, 15.05.2007 р. в Ірландії було призупинено дію торгових ліцензій на всі лікарські засоби для перорального застосування, що містять німесулід, у зв’язку з отриманням повідомлень про 6 нових випадків печінкової недостатності, що потребували пересадки печінки (WHO, 2007).
З урахуванням цього МОЗ України видало накази від 27.09.2007 р. № 596 «Про внесення змін до інструкцій для медичного застосування лікарських засобів, що містять діючу речовину німесулід» та від 02.06.2008 р. № 291 «Про припинення дії реєстраційного посвідчення на лікарські засоби, які містять діючу речовину німесулід» з урахуванням рекомендацій Європейського агентства лікарських засобів (ЕМЕА) від 21.09.2007 р. (регулюючий документ ЕМЕА/432604/2007) щодо застосування лікарських засобів, що містять діючу речовину німесулід та висновку Науково-технічної ради ДП «Державний фармакологічний центр» Міністерства охорони здоров’я України щодо ефективності, безпеки та якості лікарських засобів, які містять діючу речовину німесулід, від 19.01.2009 р. № 186/2.7-4. Таке рішення в нашій країні прийняте у зв’язку з невиконанням багатьма фармацевтичними компаніями державних регуляторних актів щодо внесення змін в інструкції на препарати німесуліду з метою запобігання тяжким побічним реакціям (зокрема обмежити застосування препарату до 15 днів, проводити контроль показників функціонального стану печінки, вказати на протипоказання до застосування німесуліду у дітей віком молодше 12 років і пацієнтам з порушенням функції печінки).
Целекоксиб, парекоксиб і рофекоксиб виділені в підклас «Коксиби» — специфічні інгібітори ЦОГ-2 М1А класу за прийнятою ВООЗ класифікацією лікарських засобів (єдині представники класу, дозволені до клінічного застосування в Україні).
Виділення цих препаратів в окрему групу зумовлене: по-перше, тим, що інші специфічні інгібітори ЦОГ-2 (мелоксикам, німесулід, етодолак, набуметон) були синтезовані до появи гіпотези ЦОГ-2 — селективності, а їх здатність більше знижувати активність ЦОГ-2, порівняно із ЦОГ-1, виявлена у процесі тестування всіх НПЗП, відомих до початку 90-х років ХХ ст.; по-друге, у дослідженнях in vitro коксиби виявляють набагато вищу вибірковість відносно блокади ЦОГ-2.
Результати численних досліджень in vitro, ex vitro і ex vivo cвідчать, що целекоксиб — високоспецифічний інгібітор ЦОГ-2 і в широкому діапазоні концентрацій, в тому числі тих, які перевищують терапевтичні, практично не виявляє впливу на активність ЦОГ-1 (Penning T.D. et al., 1997; Isakson P.C. et al., 1999; Simon L.S. et al., 1999).
Для остаточного визнання НПЗП специфічним інгібітором ЦОГ-2 (а отже, таким, що має кращий профіль гастроінтестинальної безпеки) у 1998 р. введено третій обов’язковий критерій оцінки: клінічні дослідження, тобто наявність або відсутність клінічних ознак пригнічення ЦОГ-1 у вигляді ураження травного тракту і пригнічення ЦОГ-1-залежної агрегації тромбоцитів. Відповідно до критеріїв International COX-2 Study Group для визнання речовини специфічним інгібітором ЦОГ-2 із відповідним клінічним профілем, необхідна комбінація: біохімічної, біологічної та фармакологічної ЦОГ-2-селективності в моделях in vitro і ex vivo; анальгезивної та антипіретичної активності, що порівнюється із традиційними НПЗП, а також відсутність значимого впливу на слизову оболонку ШКТ і агрегацію тромбоцитів, що є свідченням пригнічення ЦОГ-1.
«Тільки на підставі біохімічного профілю при відсутності чітких клінічних даних речовина не може вважатися переважним або специфічним інгібітором ЦОГ» (Lipsky P. et al., 1998).
Ефективність целекоксибу була вивчена при лікуванні понад 5 тис. пацієнтів із симптомами ОА колінного суглоба та стегна в плацебо-контрольованих і порівняльних дослідженнях тривалістю до 12 тиж (Bensen W.G. et al., 1999; Geis G.S. et al., 1999; Zhao S.Z. et al., 1999; Williams G.W. et al., 2000). Лікування целекоксибом приводило до зменшення вираженості болю, скутості, поліпшення індексу WOMAC і функціонального стану хворих. При цьому ефективність целекоксибу і напроксену була порівняною за всіма часовими точками (Bensen W.G. et al., 1999; Goldstein J.L. et al., 2001). У багатоцентровому плацебо-контрольованому дослідженні з подвійним сліпим контролем пацієнтам з ОА колінного суглоба (n=600) призначали целекоксиб (100 мг 2 рази на добу), диклофенак (50 мг 3 рази на добу) або плацебо (Mckenna F. еt al., 2001). Оцінка основних показників ефективності свідчила про те, що терапія як диклофенаком, так і целекоксибом призводила до статистично достовірного покращання стану хворих порівняно із плацебо без значимих відмінностей між двома НПЗП. Обидва препарати однаковою мірою та з однаковою швидкістю зменшували вираженість болю протягом 24 год порівняно із плацебо. У групі диклофенаку вірогідно частіше відзначали побічні ефекти з боку ШКТ. Порівняно із плацебо значно частіше підвищувався рівень печінкових трансаміназ, креатиніну і знижувалася концентрація гемоглобіну, чого не виявляли в групі целекоксибу (рис. 12.8).
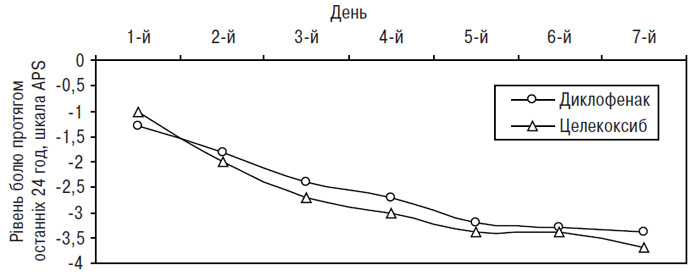
Рис. 12.8. Ефективність целекоксибу порівнянна із неспецифічними НПЗП. APS — American Pain Society
У більше ніж 2 тис. включених у контрольовані дослідження хворих на РА при прийомі целекоксибу відзначена здатність достовірно знижувати порівняно із плацебо кількість болючих і набряклих суглобів; препарат перевершував плацебо за позитивною динамікою індексу відповіді на лікування ACR 20, лабораторних і функціональних показників (Simon L.S. et al., 1999; Emery P. et al., 1999). Спрямованість і вираженість змін була такою ж, як і у хворих, які застосовували напроксен і диклофенак у cредньотерапевтичних дозах.
Таким чином, целекоксиб є ефективним НПЗП при лікуванні РА та ОА. За вираженістю терапевтичної дії він порівнянний з такими традиційними НПЗП як диклофенак, напроксен і ібупрофен.
Додатковою перевагою застосування целекоксибу у пацієнтів з ОА, в тому числі після артропластики, є доказ його позитивного впливу на суглобовий хрящ, що знаходиться в стадії дегенерації. Целекоксиб помітно підвищує продукцію протеогліканів, покращуючи стан ушкодженої хрящової тканини (Mastbergen S.C., 2005).
Безпека лікування целекоксибом. Опубліковані дані свідчать про те, що цей препарат має значно кращий профіль переносимості й безпеки, ніж неспецифічні НПЗП і за побічною дією з боку травного тракту порівнянний із плацебо (Simon L.S. et al., 1999; Bensen W.G. et al., 2000; Goldstein J.L. et al., 2000; Silverstein E.F., 2000; Mckenna F. et al., 2001). Серед побічних явищ найчастіше зазначають головний біль, діарею, риніт, нудоту, синусит, диспепсію і біль у животі. Частота розвитку виразок при застосуванні целекоксибу і плацебо суттєво не відрізнялася. Вона не підвищувалася при підвищенні дози препарату в діапазоні 50–400 мг 2 рази на добу і була у 3–4 рази нижчою, ніж при прийомі неспецифічних інгібіторів ЦОГ. Так, при ендоскопічному контролі після 12 тиж лікування хворих на РА і ОА целекоксибом у зазначеному діапазоні доз виявлено пептичні виразки у 2,7–5,9% випадків, у той час як при терапії напроксеном (500 мг 2 рази на добу) — у 16,2–17,6%, ібупрофеном (800 мг 3 рази на добу) — у 23,3%.
При порівнянні токсичності целекоксибу щодо травного тракту (200 мг 2 рази на добу; n=270) і напроксену (500 мг 2 рази на добу; n=267) із триразовим ендоскопічним контролем (через 4; 8 і 12 тиж терапії) також підтверджена краща переносимість специфічного інгібітору ЦОГ-2 у хворих на РА і ОА (Goldstein J.L. et al., 2001). Частота утворення пептичних виразок при терапії целекоксибом і напроксеном становила 4 і 19% відповідно через 4 тиж терапії (р<0,001), 2 і 14% — ще через 4 тиж (р<0,001) і 2% проти 10% — до закінчення дослідження (р<0,001). Кумулятивна частота виразкоутворення за період лікування становила 9% у групі целекоксибу і 41% — напроксену. У групі целекоксибу утворення пептичних виразок найчастіше було пов’язане з інфікуванням Helicоbacter pylory, одночасним застосуванням ацетилсаліцилової кислоти і наявністю пептичної виразки в анамнезі. Целекоксиб значно рідше викликав утворення виразок як шлунка, так і дванадцятипалої кишки.
За даними узагальненого аналізу 31 рандомізованого контрольованого дослідження (39 605 пацієнтів) щорічна частота виразкових ускладнень у хворих, які одержували целекоксиб, становила 0,3%, і була на 20–30% нижчою, ніж у групі неселективних НПЗП (Moore R.A. et al., 2005).
Найбільш великомасштабне рандомізоване дослідження гастроінтестинальної токсичності целекоксибу порівняно з іншими НПЗП протягом 6-місячного безперервного лікування було почато у 1998–2000 рр. (дослідження CLASS) за участю 8039 хворих на РА і ОА (Silverstein E. et al., 2000). Його особливістю було застосування целекоксибу в дозі 800 мг/добу, що у 2 і 4 рази перевищувала максимальні терапевтичні дози для РА і ОА відповідно, в той час як препарати порівняння призначали в рекомендованих средньотерапевтичних дозах — 2400 мг/добу ібупрофену і 150 мг — диклофенаку. Настільки значне перевищення дози целекоксибу не призводило до зміни профілю несприятливих ефектів, що відмічалися при більш низьких дозах. У хворих, які не одержували одночасно ацетилсаліцилової кислоти у кардіоваскулярних дозах, частота виникнення одного з виразкових ускладнень і комбінації ускладнень із симптоматичними виразками верхніх відділів ШКТ при застосуванні целекоксибу була вірогідно нижчою порівняно з НПЗП: 0,44% проти 1,27% і 1,40% проти 2,91% відповідно. У загальній когорті хворих, в яку було включено пацієнтів, які застосовували ацетилсаліцилову кислоту, відмінності були менш вираженими, що підтверджує ульцерогенність ацетилсаліцилової кислоти навіть у низьких дозах. У хворих, які приймали целекоксиб, була нижча частота розвитку диспептичних симптомів і пов’язаного і цим припинення прийому препарату, а також вірогідно менша кількість випадків зниження гемоглобіну і/або гематокриту. Крім того, відзначали нижчу токсичність щодо нирок: вірогідно рідше розвивалися набряки і артеріальна гіпертензія.
У клінічних дослідженнях показано, що целекоксиб навіть у дозах, що набагато перевищують максимальні терапевтичні (разова — до 800 мг, добова — 1200 мг) не пригнічував ЦОГ-1-опосередковану агрегацію тромбоцитів (Leese P.T. et al., 2000). Водночас напроксен, ібупрофен і диклофенак у терапевтичних дозах викликали статистично значиме пригнічення агрегації, мелоксикам — помірне пригнічення агрегації тромбоцитів (Zhang W. et al., 2004). Відповідно, неспецифічні НПЗП, на відміну від целекоксибу, вірогідно подовжують час кровотечі.
Заслуговують на увагу висновки декількох великих обсерваційних порівняльних досліджень гастроінтестинальної безпеки коксибів і традиційного інгібітору ЦОГ-2 мелоксикаму. Дослідники підкреслюють статистично достовірне зниження як симптоматичних гастроінтестинальних явищ — на 23%, так і ускладнених (перфорації/кровотечі) уражень травного тракту — на 44% — при застосуванні целекоксибу порівняно з мелоксикамом (рис. 12.9).
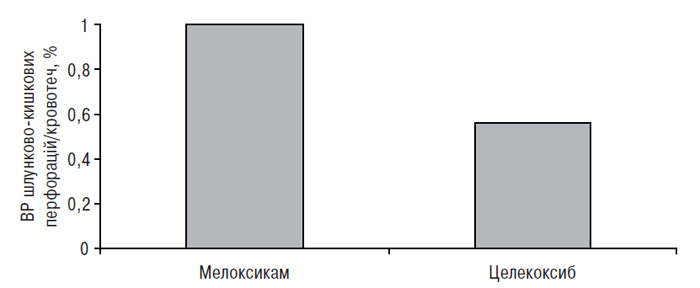
Рис. 12.9. Ризик розвитку ускладнень з боку ШКТ при прийомі целекоксибу порівняно з мелоксикамом (Layton D. et al., 2003)
Целекоксиб на 44% знижує ризик розвитку ускладнень з боку травного тракту порівняно з мелоксикамом.
Ці дані підтверджують і результати нещодавно проведеного великого рандомізованого дослідження, що включало 1,3 млн пацієнтів, які приймали НПЗП (традиційні НПЗП, мелоксикам, коксиби).
Саме при застосуванні коксибів відзначено достовірне зниження ризику розвитку шлунково-кишкових кровотеч (рис. 12.10).
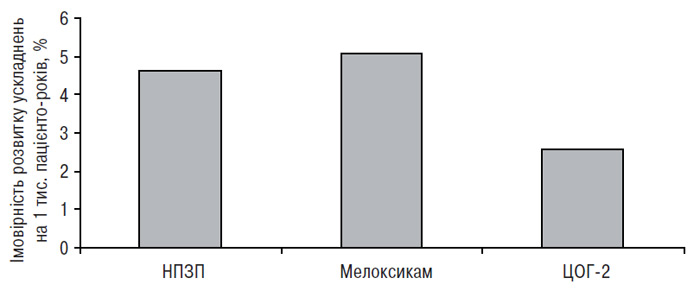
Рис. 12.10. Імовірність розвитку ускладнень з боку травного тракту при прийомі специфічних інгібіторів ЦОГ-2 порівняно із неспецифічними НПЗП
Щоб уникнути розвитку ускладнень з боку ШКТ внаслідок застосування НПЗП іноді одночасно призначають так звані гастропротекторні препарати — інгібітори протонного насосу (ІПН). Результати такої стратегії в клінічній практиці можна оцінити за допомогою інноваційного діагностичного методу «камера в капсулі» — капсульна ендоскопія.
Подвійне сліпе плацебо-контрольоване дослідження (Goldstein J.L. et al., 2001) проводили з метою визначення впливу ібупрофену, представника класу неспецифічних НПЗП у комбінації з ІПН і целекоксибу — специфічного інгібітору ЦОГ-2 — на слизову оболонку кишечнику. У дослідженні взяли участь здорові добровольці віком від 18 до 70 років, без значних відхилень від фізіологічних показників слизової оболонки ШКТ при звичайному і лабораторному обстеженні.
Пацієнти методом рандомізації були розподілені на три групи: ті, які приймали целекоксиб по 200 мг 2 рази на добу; ібупрофен — по 800 мг 3 рази на добу і омепразол — по 20 мг 1 раз на добу; плацебо. Дослідження тривало 2 тиж.
Ушкодження слизової оболонки діагностували за допомогою капсули невеликих розмірів, що проковтували, із вбудованою камерою (рис. 12.11). Переміщаючись по травному тракту, капсула передавала відеозображення його внутрішньої поверхні. Така технологія забезпечує безпосереднє проникнення у просвіт тонкої кишки та одержання зображення на ділянці травного тракту між шлунком і товстою кишкою, слизову оболонку якого важко візуалізувати за допомогою традиційного ендоскопічного дослідження.

Рис. 12.11. «Камера в капсулі» — капсульна ендоскопія
Дані, отримані у дослідженні, свідчать про те, що при застосуванні комбінації ібупрофену й омепразолу в стандартних дозах частота ушкоджень слизової оболонки тонкої кишки у людини була майже в 4 рази вища, ніж при прийомі целекоксибу в дозі, що у 2 рази перевищує стандартну при ОА. Крім ушкоджень слизової оболонки тонкої кишки в зазначеній групі виявлено більш високий ступінь ушкодження слизової оболонки шлунка (рис. 12.12).
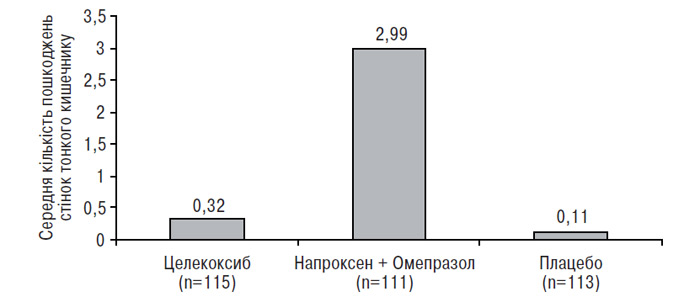
Рис. 12.12. Ступінь ушкоджень тонкого кишечнику при застосуванні целекоксибу порівняно з НПЗП + ІПН
Таким чином, результати інноваційного методу «камера в капсулі» — капсульної ендоскопії є підтвердженням гастроінтестинальної безпеки целекоксибу.
Рекомендовані дози целекоксибу для лікування пацієнтів з ОА — 200 мг 1 раз на добу або по 100 мг 2 рази на добу, ефективні дози для лікування РА дещо вищі — по 100–200 мг 2 рази на добу. Підвищення добової дози понад 400 мг не супроводжується підвищенням терапевтичного ефекту. З клінічної точки зору важливо відзначити, що, на відміну від інших НПЗП, целекоксиб не взаємодіє з непрямими антикоагулянтами (варфарином) і глібенкламідом (Karim A. et al., 1998).
Кардіоваскулярний профіль целекоксибу. Ґрунтуючись на накопичених клінічних і обсерваційних даних можна відзначити, що целекоксиб порівнянний із неспецифічними НПЗП за ступенем кардіоваскулярної безпеки: немає статистичної різниці за частотою виникнення інфаркту міокарда і серйозних тромботичних ускладнень (Ray W.A. et al., 2002; White W.B. et al., 2003; Solomon D.H. et al., 2004; Braham D.S. et al., 2005; Kimmel S.E. et al., 2005; Levesque L.E. et al., 2005); за частотою розвитку гіпертензії та набряків (White W.B. et al., 2002).
Питання кардіоваскулярної безпеки класу НПЗП загалом розглядається нижче. Для целекоксибу Європейська та Американська комісія з контролю якості медикаментів і харчових продуктів у квітні/червні 2005 р. підтвердили: користь перевищує можливі ризики (www.fda.gov/bbs/topics/news/2005/NEW01171.html Accessed 17.06.05; www.emea.eu.int/Cox2inhibitors.htm).
Рекомендації щодо застосування всіх НПЗП, включаючи целекоксиб, стосуються призначення мінімальних ефективних доз на мінімальний необхідний курс терапії з урахуванням індивідуального ризику. Протипоказання для целекоксибу відповідають таким для всього класу НПЗП. Кардіоваскулярний профіль целекоксибу можна оцінювати за результатами нещодавно опублікованих даних мультицентрового аналізу 31 клінічного рандомізованого дослідження, що включав близько 40 тис. пацієнтів (Moore R.A. et al., 2005). Так, целекоксиб порівнянний із неселективними НПЗП за частотою ризику виникнення ускладнень артеріальної гіпертензії (інфаркт, інсульт), ниркової недостатності та набряків. Частота виникнення набряків при застосуванні целекоксибу була значно нижчою, ніж при застосуванні рофекоксибу.
Результати опублікованих досліджень (Chenevard R. et al., 2003) свідчать про позитивний вплив сульфонамідних інгібіторів ЦОГ-2 на стан ендотелію пацієнтів з ішемічною хворобою серця: целекоксиб покращує стан ендотелію у пацієнтів з його дисфункцією, знижує рівень СРБ і ліпопротеїнів низької щільності (ЛПНЩ) вже через 2 тиж застосування (Chenevard R. et al., 2003) (рис. 12.13).
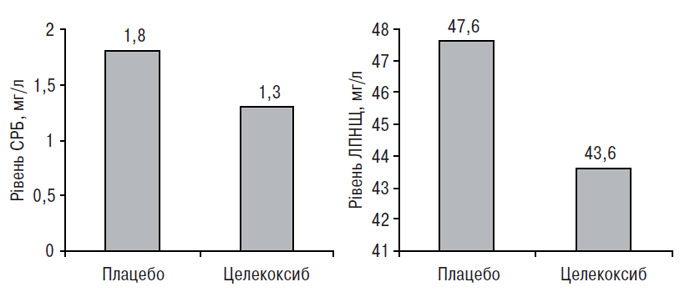
Рис. 12.13. Зниження рівня СРБ і ЛПНЩ у осіб з ішемічною хворобою серця через 2 тиж застосування целекоксибу
Ці дані служать передумовою до проведення нових клінічних досліджень: на сьогодні обговорюється дизайн першого у світі клінічного дослідження застосування НПЗП у пацієнтів із високим кардіоваскулярним ризиком. Це дослідження буде проведене із застосуванням целекоксибу.
Таким чином, целекоксиб є першим представником нового покоління НПЗП — специфічних інгібіторів ЦОГ-2, дозволеним до застосування для лікування пацієнтів із РА і ОА. Продемонстрована досить висока клінічна ефективність препарату, порівнянна з лікувальною дією традиційних НПЗП. Целекоксиб добре переноситься, він у кілька разів рідше порівняно із неспецифічними НПЗП викликає утворення виразок у верхніх відділах ШКТ і не впливає на функцію тромбоцитів.
Лікарі України з нетерпінням очікували появу ін’єкційної форми специфічного інгібітору ЦОГ-2. Ін’єкційний парекоксиб натрію — єдиний ін’єкційний специфічний інгібітор ЦОГ-2 — вже зареєстровано в Україні. Препарат виявляє протизапальну, жарознижувальну і потужну знеболювальну дію (Talley J.J. et al., 2000).
Парекоксиб натрію можна застосовувати як внутрішньом’язово, так і внутрішньовенно для терапії пре- і постопераційного больового синдрому. Основною відмінною властивістю препарату є потужний анальгезивний ефект, порівнянний з ефектом опіоїдів у низьких дозах, у комбінації з покращеним профілем гастроінтестинальної безпеки та відсутністю впливу на згортання крові, що досягається завдяки вибірковому пригніченню функції ЦОГ-2.
У мультицентрових контрольованих дослідженнях ефективність застосування ін’єкційного парекоксибу в ортопедичній, щелепно-лицьовій хірургії та гінекології була значно вищою від застосування 4 мг морфіну внутрішньовенно і порівнянна з кеторолаком (Daniels S.E. et al., 2001; Barton S.F. et al., 2002).
Парекоксиб натрію забезпечує швидке і тривале знеболювання — ефект настає через 7–13 хв при внутрішньовенному чи внутрішньом’язовому введенні і триває протягом 12 год (у дозі 40 мг). Додатковою перевагою знеболювання цим препаратом є можливість його комбінації з наркотичними анальгетиками, причому потреба в опіоїдах при цій схемі застосування знижується (Zhao S.Z. et al., 2004). Протипоказання для парекоксибу натрію відповідають звичайним для всіх НПЗП.
Ще одним представником групи коксибів є препарат рофекоксиб. У серії клінічних досліджень встановлено ефективність рофекоксибу у хворих на ОА (у дозі 12,5 і 25 мг/добу), РА (25 мг/добу) і синдромі болю в нижній ділянці спини (25 мг/добу) (Schnitzer T.J. et al., 1999; Cannon G.W. et al., 2000; Day R. et al., 2000; Saag K. et al., 2000; Katz N. et al., 2001; Truitt K.E. et al., 2001). За даними подвійного сліпого плацебо-контрольованого рандомізованого порівняльного дослідження застосування целекоксибу в дозі 200 мг/добу (63 хворих на ОА колінних суглобів) і рофекоксибу — в дозі 25 мг/добу (59 хворих на ОА колінних суглобів) (Mckenna F. et al., 2001) через 6 тиж лікування статистично достовірних відмінностей у позитивній динаміці основних критеріїв ефективності на фоні прийому целекоксибу і рофекоксибу не виявлено (р>0,55), водночас зміни показників були значно вищі, ніж у групі плацебо (р<0,05). Загальна кількість побічних ефектів у групах целекоксибу і рофекоксибу була однаковою, однак у першої значно рідше відзначали побічні ефекти з боку ШКТ, що свідчить про кращу переносимість целекоксибу порівняно з рофекоксибом у досліджуваних дозах.
Оцінка впливу коксибів на серцево-судинний прогноз за даними великих рандомізованих досліджень, що визначали клінічну ефективність коксибів, наведена в табл. 12.9. Результати представлених 5 масштабних рандомізованих контрольованих досліджень свідчать про неоднаковий рівень серцево-судинної безпеки коксибів. Так, у дослідженнях CLASS і SUCCESS при застосуванні целекоксибу (в тому числі в дозах, що в 2–4 рази перевищували рекомендовані для лікування при РА і ОА) відзначено його високий ступінь безпеки: не виявлено підвищення ризику розвитку оцінюваних серцево-судинних ускладнень на фоні його прийому порівняно з прийомом інших НПЗП (ібупрофену, диклофенаку, напроксену). При цьому зміна ступеня ризику не була відзначена як серед осіб, які одержували ацетилсаліцилову кислоту (у разі потреби вторинної профілактики ішемічної хвороби серця), так і у пацієнтів, які не приймали її (Silverstein F.E. et al., 2000; White W.B. et al., 2002).
Таблиця 12.9
Вплив коксибів на серцево-судинний прогноз (за даними великих рандомізованих контрольованих досліджень, що оцінювали клінічну ефективність коксибів)
| Назва/автор/рік | Препарати, дози (мг/добу) | Кількість хворих/тривалість лікування/прийом ацетилсаліцилової кислоти | Висновки щодо серцево-судинної безпеки коксибів |
| CLASS/Silverstain F. et al./2000 | Целекоксиб — 800 або
ібупрофен — 2400, або диклофенак — 150 (при РА, ОА) |
8059/6–12 міс/при необхідності | Целекоксиб:
|
| VIGOR/Bombardier C. et al./2000 | Рофекоксиб — 50 або
напроксен — 1000 (РА) |
8076/9 міс/без ацетилсаліцилової кислоти | Рофекоксиб:
|
| SUCCESS + CLASS/White W. et al./2003 | Целекоксиб — 200–800 або
диклофенак — 150, або напроксен — 1000, або ібупрофен — 2400 або плацебо |
18 942/6–12 міс/при необхідності | Целекоксиб:
|
| TARGET/Schnitzer T. et al./2004 | Люміракоксиб — 400 або напроксен — 1000, або ібупрофен — 2400 | 18 325/52 тиж/при необхідності | Люміракоксиб:
|
| APPROVE/2004 | Рофекоксиб — 25 | Рофекоксиб: дослідження передчасно припинено у зв’язку зі значним ↑ ризику серцево-судинних ускладнень |
VIGOR — Vioxx Gastrointestinal Outcome Research; SUCCESS — Successful Celecoxib Efficacy and Safety Study; APPROVE — Adenomatous Polyp Prevention on Vioxx; ІМ — інфаркт міокарда; ↑ підвищення; ↓ зниження.
У дослідженнях VIGOR і APPROVE відзначене підвищення частоти виникнення серцево-судинних ускладнень на фоні застосування оригінального рофекоксибу (Bombardier C. et al., 2000). У дослідженні TARGET при застосуванні представника другого покоління коксибів (люміракоксибу) не виявили статистично значимого підвищення частоти серцево-судинних ускладнень порівняно з іншими НПЗП (Farkouh M.E. et al., 2004).
Оцінка впливу коксибів на прогноз лікування за результатами епідеміологічних ретроспективних аналізів наведена в табл. 12.10. Ці дані відрізняються, насамперед, масштабністю проаналізованих груп пацієнтів: D. Graham та співавтори (2004) і А. Whelton та співавтори (2004) включили у дослідження понад 1,3 млн і понад 3 млн людей відповідно. Це забезпечує значну вагомість цих результатів. Так, одержані дані свідчать про те, що застосування целекоксибу не спричиняє підвищення ризику виникнення серцево-судинних ускладнень (порівняно як з особами, які не одержували ніяких НПЗП, так і з пацієнтами, що приймали ЦОГ-2 — неселективні НПЗП; включаючи хворих із вихідною медикаментозно-контрольованою артеріальною гіпертензією) (Solomon D. et al., 2004; Mamdani M. et al., 2004), і виявлена тенденція до зниження ризику розвитку інфаркту міокарда і раптової серцевої смерті на 14% у групі целекоксибу порівняно із застосуванням інших НПЗП з урахуванням аналізу досить репрезентативної групи (близько 1,4 млн осіб). Вважаємо за необхідне повідомити про дизайн цього дослідження. У дослідження були включені хворі на ОА жителі Каліфорнії віком 18–84 роки, які застосовували коксиби чи інші НПЗП з 01.01.1999 г. по 31.12.2001 г.
Таблиця 12.10
Вплив коксибів на серцево-судинний прогноз із епідеміологічних ретроспективних аналізів
| Автор, рік | Група пацієнтів | Висновки відносно серцево-судинної безпеки коксибів |
| Solomon D. et al., 2004 | 54 475 хворих віком ≥65 років |
|
| Mamdani M. et al., 2004 | Вік ≥65 років: целекоксиб — 18 908; рофекоксиб — 14 583, інші НПЗП — 5391; без НПЗП — 100 тис. |
|
| Whelton A. et al., 2004 | Усього >3 млн дорослих | Серед пацієнтів із медикаментозно-контрольованою АГ:
|
| Graham D. et al., 2004 | Усього >1,3 млн: целекоксиб — 40 405; рофекоксиб — 26 748; напроксен — 435 492; ібупрофен — 991 261; індометацин — 118 261; а також диклофенак, етодолак, піроксикам, суліндак |
|
ІМ — інфаркт міокарда; СН — серцева недостатність; ↑ підвищення; ↓ зниження.
У ході дослідження визначали, чи підвищується ризик виникнення гострого інфаркту міокарда чи раптової серцевої смерті при застосуванні НПЗП або коксибів, а також порівнювали ризик виникнення гострого інфаркту міокарда при прийомі рофекоксибу і целекоксибу. Одержані дані свідчать, що ризик підвищувався у співвідношенні 4:1 з урахуванням дати події, віку, статі й регіону (Graham D. et al., 2004).
В обговорюваних повідомленнях відзначено підвищення ризику виникнення серцево-судинних ускладнень на фоні прийому оригінального рофекоксибу, причому ступінь цього підвищення залежить від дози препарату. Особливо несприятливі ефекти дозувань, що перевищують 25 мг/добу (Graham D. et al., 2004), ризик при застосуванні такої дози підвищується більше ніж у 3 рази. У хворих, які одержували рофекоксиб, відзначено підвищення серцево-судинного ризику як порівняно із хворими, які приймали целекоксиб, так і з пацієнтами, що не приймали ніяких НПЗП або одержували ЦОГ-2-неспецифічні НПЗП. На сьогодні отримані дані дослідження АРС, у яке було включено 2 тис. хворих на ОА, з яких 1300 пацієнтів приймали целекоксиб по 400–800 мг, інші — плацебо протягом 33 міс. Дослідження було передчасно зупинене за рекомендацією Інституту раку США, оскільки ризик розвитку серцево-судинних ускладнень у групі целекоксибу (400 мг/добу) в 2,5 раза перевищував такий у групі плацебо, а при прийомі целекоксибу в дозі 800 мг ризик підвищувався в 3,4 раза. Факт підвищення ризику розвитку серйозних кардіоваскулярних подій був також підтверджений і при застосуванні таких ЦОГ-2-специфічних інгібіторів, як парекоксиб та вальдекоксиб, призводячи до формування думки про можливий класоспецифічний ефект (Nussmeier N.A. et al., 2005).
Але в той же час результати іншого дослідження Prevention of Colorectal Sporadic Adenomatous Polyps (PreSAP), на відміну від дослідження АРС, не виявили підвищення кардіоваскулярного ризику у целекоксибу порівняно з плацебо у 1561 хворих (Arber N. et al., 2006). Різниця у дозах целекоксибу, що призначались у двох дослідженнях — 400 мг 1 раз на добу у дослідженні PreSAP та 200 або 400 мг 2 рази на добу у дослідженні АРС дозволяють припустити, що виникнення кардіоваскулярних подій може бути пов’язане як з дозою, так із фармакокінетикою целекоксибу (Arber N. et al., 2006).
Оцінка впливу коксибів на рівень артеріального тиску на основі даних декількох недавно проведених рандомізованих контрольованих і ретроспективних епідеміологічних досліджень наведена в табл. 12.11. Відзначена відсутність у целекоксибу індукуючого гіпертензію потенціалу як серед осіб із вихідним нормальним артеріальним тиском (Cho J. et al., 2003; Solomon D. et al., 2004; Sowers et al., 2004), так і у пацієнтів з медикаментозно-контрольованою артеріальною гіпертензією (Whelton A. et al., 2002).
Таблиця 12.11
Вплив коксибів на рівень АТ
| Автор, рік | Дослідження | Кількість пацієнтів/препарат/доза | Висновки щодо впливу коксибів на рівень АТ |
| Whelton A. et al., 2002 | Рандомізоване подвійне сліпе контрольоване | 549/целекоксиб/ 200 мг/добу
543/рофекоксиб/ 25 мг/добу |
|
| Cho J. et al., 2003 | Рандомізоване подвійне сліпе контрольоване | 52/целекоксиб/ у середньому — 219 мг/добу
57/рофекоксиб/ у середньому — 25,2 мг/добу |
|
| Solomon D. et al., 2004 | Ретроспективне епідеміологічне | 17 844 (вік ≥65 років) |
|
| Sowers et al., 2004 | Рандомізоване подвійне сліпе контрольоване | 136/целекоксиб / 200 мг/добу
138/рофекоксиб / 25 мг/добу 130/напроксен / 1000 мг/добу |
|
АТ — артеріальний тиск; АГ — артеріальна гіпертензія; ↑ підвищення; ↓ зниження.
Чи є відмінності між коксибами, які могли б пояснити їх різний вплив на серцево-судинний прогноз? На сьогодні існують дані про цілий ряд відмінностей між целекоксибом і рофекоксибом, які наведено нижче. Поки недостатньо вивчено, наскільки кожна із них визначає чітко встановлені у клінічній практиці відмінності впливу цих коксибів на прогноз лікування. Можливо, комплекс фармакокінетичних і фармакодинамічних відмінностей у комбінації з різним впливом на функцію ендотелію судин є їх основою (Rahme E. et al., 2002; Ray W.A. et al., 2002; Fitzgerald G.A., 2003; Weber A. et al., 2004).
Рофекоксиб належить до інгібіторів ЦОГ-2 сульфонового типу (sulfone-type, куди також належить еторикоксиб). Доведено, що цей тип препаратів асоційований з оксидативним ушкодженням ліпопротеїнових часток, зокрема ЛПНЩ, і, таким чином, виявляє проатерогенний ефект. Проатерогенні ефекти не виявлені при застосуванні інгібіторів ЦОГ-2 сульфонамідного типу (sulfonamide-type) — целекоксибу, валдекоксибу (Hermann M. et al., 2003; Howard P., Delafontaine P., 2003; Walter M.F. et al., 2004).
Є також дані про істотні відмінності в метаболізмі цих коксибів (Krum H. et al., 2004). Так, целекоксиб метаболізується системою цитохрому P450 2C9 з утворенням неактивних метаболітів (Krum H. et al., 2004). Рофекоксиб зазнає метаболічних перетворень за участю ряду інших ензимів клітинного цитозолю (редуктазами), також із утворенням метаболітів. Передбачається, що у зв’язуванні з редуктазами метилсульфони конкурують із альдостероном, що може призводити до зниження елімінації останнього, підвищення його рівня в організмі (з подальшими електролітними порушеннями, підвищенням артеріального тиску, стимуляцією процесів фіброзування у структурах міокарда та судинної стінки) (Krum H. et al., 2004).
У декількох повідомленнях (Chenevard R. et al., 2003; Hermann M. et al., 2003) показано, що целекоксиб сприяє поліпшенню функції ендотелію судин. Механізм цього ефекту поки недостатньо вивчений, однак вважається, що інгібітори ЦОГ-2 сульфонамідної структури (целекоксиб, вальдекоксиб) покращують функцію ендотелію за рахунок підвищення синтезу NO і зменшення вираженості оксидного стресу.
На сьогодні відомо, що ендотелій контролює судинний тонус, ріст гладком’язових клітин, тромбоутворення, фібриноліз і багато інших процесів. Встановлено, що ендотелій регулює судинний тонус шляхом вивільнення судинорозширювальних і судинозвужувальних факторів. До факторів дилатації, крім NO, відносять: гіперполяризацію ендотелію, простациклін I2, натрійуретичний пептид типу С, адреномедулін; до факторів констрикції — ендотелін, тромбоксан А2, ПГЕ2, ендопероксиди тощо (Chenevard R. et al., 2003).
За даними А. Weber та співавторів (2004) целекоксиб суттєво інгібує активність карбоангідрази, що може приводити до помірного антигіпертензивного ефекту.
Механізми впливу НПЗП на ризик виникнення серцево-судинних ускладнень
Неспецифічні та специфічні НПЗП (коксиби). НПЗП представляють гетерогенний клас, що включає різні групи ЦОГ-2-неспецифічних і ЦОГ-2-специфічних (коксиби) препаратів. Для обговорення питання про механізми впливу НПЗП на ризик виникнення серцево-судинних ускладнень необхідно коротко описати механізм дії різних НПЗП (рис. 12.14).
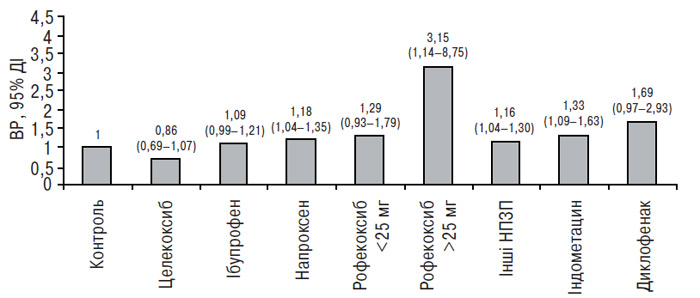
Рис. 12.14. Ризик виникнення гострого інфаркту міокарда чи раптової серцевої смерті при застосуванні неспецифічних НПЗП і коксибів на сьогодні порівняно з віддаленим використанням (Graham D.S. et al., 2004)
Арахідонова кислота, що вивільнилася із фосфоліпідів клітинних мембран у відповідь на різні стимули, перетворюється в ПГН2 під дією клітин, що утримуються у цитоплазмі, ферментів, позначуваних як ПГG/H-синтетази (інакше — ЦОГ-1 та -2). ПГН2 далі перетворюється ферментами — тканиноспецифічними ізомеразами — у різні простаноїди. Ацетилсаліцилова кислота та інші неспецифічні НПЗП інгібують як ЦОГ-1, так і ЦОГ-2; коксиби специфічно інгібують ЦОГ-2. ЦОГ-1 широко експресована у багатьох тканинах організму (слизовій оболонці травного тракту, тромбоцитах, ендотеліальних і гладком’язових клітинах, ниркових структурах). ЦОГ-2 представлена в деяких тканинах (нирки, ЦНС, гонади, сечовивідні шляхи); її експресія суттєво зростає під впливом запальних стимулів, включаючи цитокіни, ендотоксини, фактори росту (Konstam M.A. et al., 2001; Mukherjee D. et al., 2001; Fitzgerald G.A., 2003; Stiller C.O., Hjemdahl P., 2003; Howard P. et al., 2004; Topol E., Falk G.W., 2004).
Важко уявити лікарський засіб, який би був справді ефективний і не виявляв жодної побічної дії. Проблема побічних ефектів, пов’язаних із прийомом НПЗП, не нова, вона активно вивчається з 30-х років ХХ ст. З того часу вчені намагаються створити препарати, які зберегли б усі позитивні якості ацетилсаліцилової кислоти або НПЗП, але були б більш безпечними. Щодо НПЗП йшлося не тільки про небажані явища з боку ШКТ. Відомі їх побічні дії, пов’язані з ураженням серцево-судинної системи. У всіх настановах 60-х років ХХ ст. відзначається, що при нераціональному застосуванні НПЗП можуть виникати не лише пептичні виразки шлунка з усіма їх наслідками, але й, наприклад, підвищення артеріального тиску, набряки.
На сьогодні полеміка, що розвернулася навколо коксибів, вийшла за рамки лише коксибів і актуальна для всього класу НПЗП. До останного часу були відсутні дані рандомізованих досліджень застосування неспецифічних НПЗП щодо серцево-судинного прогнозу. За результатами обсерваційних досліджень можна було говорити про тенденцію змін. Опубліковані в 2004 р. результати дослідження D. Graham та співавторів змусили задуматися про можливе підвищення частоти серцево-судинних ускладнень при застосуванні будь-якого препарату класу НПЗП. Наступні публікації підтвердили цей факт. За даними Норвезького дослідження (Sudbo J. et al., 2005) при застосуванні НПЗП понад 6 міс може підвищуватися ризик кардіоваскулярної смерті. З цими даними співзвучні результати аналізу бази MEDICAID, представлені D. Graham на нараді FDA 17 лютого 2005 р. і S.P. Johnses та співавторами (2005) про підвищення ризику й частоти госпіталізацій з приводу кардіоваскулярних подій при застосуванні практично всіх лікарських засобів класу НПЗП.
Дискусія про кардіоваскулярний ризик і застосування НПЗП підійшла до логічного завершення. 7 квітня 2005 р. FDA винесло остаточне рішення: визнати за можливе підвищення ризику серцево-судинних ускладнень побічним ефектом усього класу НПЗП (крім ацетилсаліцилової кислоти у низьких дозах), куди входять як останні покоління НПЗП — коксиби, так і традиційні, що давно використовуються НПЗП. Рекомендації FDA відносно кардіоваскулярної безпеки НПЗП (FDA/Center for Drug Evaluation and Research) містять заклик до виробників всіх наявних на ринку рецептурних і безрецептурних НПЗП переглянути інструкції до своїх продуктів і включити в них попередження. У ньому необхідно підкреслити можливе підвищення ризику кардіоваскулярних подій і добре відомих, серйозних і потенційно небезпечних для життя гастроінтестинальних кровотеч, пов’язаних із прийомом цих препаратів. В інтернеті на сайті FDA (www.fda.gov), а також на сайті Американської асоціації ревматологів (www.rheumatology.org) міститься перелік НПЗП, в інструкції до яких FDA рекомендує внести попередження про можливе підвищення ризику серцево-судинних ускладнень (табл. 12.12).
Таблиця 12.12
| Інгібітори ЦОГ-2, в інструкції яких необхідно внести зміни | |
| специфічні | неспецифічні |
| Целекоксиб, рофекоксиб, валдекоксиб | Диклофенак, дифлунізал, етодолак, фенопрофен, флурбіпрофен, ібупрофен, індометацин, етопрофен, кеторолак, мефенамінова кислота, мелоксикам, набуметон, напроксен, оксапрозин, піроксикам, салсалат, суліндак, толметин |
Слід підкреслити, що FDA не виключило з переліку НПЗП, які застосовують для усунення гострого болю й продають без рецепта лікаря. В інструкцію для медичного застосування також рекомендується внести відповідні попередження. Рішення основного регуляторного органа США у сфері обігу лікарських засобів без перебільшення можна назвати розумним, що по суті відображає зважену позицію медичного співтовариства по відношенню як до нових, так і багато років існуючих на фармацевтичному ринку препаратів. Дискусія про позитивні й негативні властивості коксибів сколихнула глибоке обговорення проблем фармакотерапії болю й запалення, а також тих критеріїв у рамках доказової медицини, яким повинні відповідати проведені дослідження цих лікарських засобів. З іншого боку, було чітко заявлено, що перевага нових НПЗП, зокрема коксибів, при правильному раціональному призначенні пацієнтам, за відповідними показаннями, превалює над ризиком, пов’язаним з їх використанням.
FDA заявляє, що наявні дані не підтверджують, що целекоксиб порівнянний із неспецифічними НПЗП за ризиком розвитку кардіоваскулярних ускладнень. Європейська медична комісія і FDA підтвердили: для целекоксибу переваги перевершують можливі ризики (www.emea.eu).
Більше того, в ході аналізу, проведеного Agency for Healthcare Research and Quality, на основі значної доказової бази зроблено спробу порівняти ефективність і профіль токсичності всіх НПЗП. Цей систематичний огляд продемонстрував, що кардіоваскулярний профіль токсичності напроксену є помірно кращим порівняно з будь-яким представником ЦОГ-специфічних інгібіторів. Так, встановлено наявність 3,3 додаткових інфаркти міокарда у кожної 1 тис. хворих, які отримували ЦОГ-інгібітор порівняно з напроксеном протягом року. Водночас кардіоваскулярна безпека інших неселективних НПЗП (переважно диклофенаку та ібупрофену) була аналогічною до такої при застосуванні ЦОГ-2-специфічних інгібіторів (Chou R. et al., 2006).
Вплив різних НПЗП на атеротромбоз. Як вищезазначено, НПЗП суттєво відрізняються за ступенем інгібування ізоформ ЦОГ. Ацетилсаліцилова кислота інгібує ЦОГ-1 в 166 раз сильніше порівняно із ЦОГ-2. Навіть у низьких дозах вона незворотно блокує до 95% активності ЦОГ-1 у тромбоцитах, забезпечуючи стійке зниження тромбоксан-А2-залежної здатності до агрегації (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). Ця антитромбоцитарна дія ацетилсаліцилової кислоти є основним компонентом її кардіопротекторних ефектів. Певна роль у їх реалізації приділяється також її здатності поліпшувати функцію ендотелію та зменшувати вираженість локального внутрішньосудинного запалення. Перш за все у зв’язку з антитромбоцитарною дією ацетилсаліцилова кислота є єдиним НПЗП, що використовується із превентивною метою та з метою лікування ішемічної хвороби серця. При її застосуванні з метою первинної профілактики ішемічної хвороби серця знижується ризик виникнення серцево-судинних ускладнень на 15% і розвитку інфаркту міокарда — на 30%; використання ж для вторинної профілактики (тобто у осіб із раніше діагностованою ішемічною хворобою серця) супроводжується зниженням на 25% ризику розвитку рекурентних інфарктів міокарда та інших тромботичних судинних ускладнень (Howard P., Delafontaine P., 2004).
Інші неспецифічні НПЗП (такі як напроксен, ібупрофен, диклофенак) у терапевтичному діапазоні доз зворотно інгібують 50–90% активності ЦОГ-1 у тромбоцитах, що визначає помірне транзиторне блокування їх функції (Rahme E. et al., 2002; Ray W.A. et al., 2002; Verma S., Szmitko P.E., 2003). Незначний, що варіює за вираженістю та нестійкий антитромбоцитарний ефект, властивий цим НПЗП, не дає можливості розглядати їх як потенційну заміну ацетилсаліциловій кислоті з кардіопротекторною метою.
ЦОГ-2-специфічні НПЗП (коксиби) практично не виявляють впливу на функцію тромбоцитів (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). Предметом дискусій протягом останніх декількох років є патофізіологічна значимість локального блокування ЦОГ-2 у стінці судин, зумовленого коксибами (на що практично не впливає ацетилсаліцилова кислота і лише незначною мірою впливають інші неселективні НПЗП). З урахуванням неоднозначної ролі ЦОГ-2 у процесах атерогенезу (про що зазначено вище), ефекти коксибів щодо її блокування можна оцінювати з різних точок зору. З одного боку, пригнічення активності ЦОГ-2 в ділянці атеросклеротичного ураження може забезпечувати зменшення локального внутрішньосудинного запалення, знижувати ризик розриву атеросклеротичної бляшки і сповільнювати прогресування атеротромботичних уражень (антиатеротромботичні ефекти). З іншого боку, предметом побоювань є те, що при дії коксибів буде суттєво пригнічуватися синтез простацикліну, що може змінювати баланс між простацикліном і тромбоксаном А2 на користь останнього і таким чином підвищувати ризик тромбоутворення (Reicin A. et al., 2002; Cho J. et al., 2003; Mamdani M. et al., 2003; Stiller C.-O., Hjemdahl P., 2003; Topol E., Falk G.W., 2004). Говорячи про вплив коксибів на процеси атеротромбозу, слід відзначити, що для целекоксибу на сьогодні не представлено даних про наявність протромботичних ефектів. Більше того, у повідомленні R. Сhenevard та співавторів (2003) продемонстровано, що у пацієнтів із тяжкою ішемічною хворобою серця лікування целекоксибом супроводжувалося істотним покращанням функції ендотелію і зниженням рівня СРБ, що розглядається на сьогодні у ролі незалежного фактора ризику розвитку інфаркту міокарда, мозкового інсульту, серцево-судинної летальності (Howard P., Delafontaine P., 2004).
У висновках FDA і Канадської ревматологічної асоціації (2004) пропонується переводити пацієнтів, які одержували оригінальний рофекоксиб, на лікування альтернативними НПЗП (коксибами чи іншими НПЗП). Заміна на інший коксиб є особливо прийнятною внаслідок низької частоти виникнення побічних ефектів з боку травного тракту і хорошої серцево-судинної переносимості целекоксибу (Verma S., Szmitko P.E., 2003; Howard P., Delafontaine P., 2004). У осіб із супутньою ішемічною хворобою серця доцільне застосування комбінації целекоксибу з ацетилсаліциловою кислотою у низьких дозах з метою вторинної профілактики серцево-судинної патології (Mukherjee D. et al., 2001).
Перспективи протизапальної терапії ОА
Новим напрямком у симптоматичній терапії ОА та інших хвороб опорно-рухового апарата є використання комбінованих інгібіторів ЦОГ і ЛОГ. Дані експериментальних досліджень свідчать про те, що альтернативний (ліпооксигеназний) шлях метаболізму арахідонової кислоти, який веде до утворення ЛТ, викликає ряд запальних ефектів у пацієнтів із хворобами суглобів (див. рис. 12.3). Так, ЛТВ4 є одним із найпотужніших факторів хемотаксису лейкоцитів, він також індукує продукцію цитокінів Т-лімфоцитами й імуноглобулінів В-лімфоцитами. Крім того, так звані цистеїнілові ЛТ (або пептидолейкотрієни) — ЛТС4, ЛТD4 і ЛТЕ4 викликають ряд запальних ефектів, серед них набряк, скорочення гладких м’язів слизової оболонки верхніх відділів ШКТ може викликати ішемію з подальшим утворенням ерозій і виразок. Дві інші форми ЛОГ — 12-ЛОГ і 15-ЛОГ — каталізують утворення ліпоксинів, що мають протизапальну дію.
Пригнічення циклооксигеназного шляху неселективними або селективними НПЗП здатне викликати зміщення каскаду арахідонової кислоти у бік ліпооксигеназного шляху з підвищенням продукції ЛТ і ліпоксинів. Тому було б доцільно для одержання протизапального і анальгезивного ефектів блокувати обидва шляхи метаболізму арахідонату — циклооксигеназний і ліпооксигеназний. Однак важливим моментом є збереження при цьому продукції протизапальних ліпоксинів.
Лікофелон — новий фармакотерапевтичний агент, що блокує ЦОГ і 5-ЛОГ. У дослідженнях in vitro лікофелон пригнічував ЦОГ (IC50~0,16–0,21 mМ) і 5-ЛОГ (IC50~0,18–0,23 mМ) (Laufer S. et al., 1994).
Нова технологія, що одержала назву «хазяїн — гість», надає класичним неселективним НПЗП оптимальні фармакокінетичні властивості й поліпшує їх переносимість. PBC — новий фармакотерапевтичний агент, у якому молекула піроксикаму (молекула-«гість») впроваджена в β-циклодекстрин (молекула-«хазяїн»). Така комбінація забезпечує: високу розчинність; швидку абсорбцію; мінімальний контакт зі слизовою оболонкою ШКТ; майже 100% біодоступність; швидкий початок дії; виражений знеболювальний ефект при прийомі 1 раз на добу.
У пілотному порівняльному контрольованому дослідженні застосування РВС (20 мг/добу) і етодолаку (400 мг/добу) у 30 хворих із синдромом болю в нижньому відділі хребта перший виявляв більш виражену знеболювальну дію (Davoli L. et al., 1989). В іншому невеликому контрольованому дослідженні порівнювали ефективність РВС у дозі 20 мг/добу у 60 пацієнтів із захворюваннями опорно-рухового апарата із внутрішньом’язовими ін’єкціями диклофенаку (75 мг) і кетопрофену (100 мг) (Tamburro P., Galasso G., 1989). Всі три препарати виявляли швидку й виражену знеболювальну дію. Безумовно, робити висновки про ефективність і переносимість РВС за результатами цих досліджень не можна, отримані результати потребують підтвердження у великих багатоцентрових дослідженнях.
Раціональне застосування НПЗП у хворих на ОА. Різноманітність НПЗП на сучасному фармацевтичному ринку і наявність нерідко суперечливої інформації про їх фармакодинаміку, ефективність і безпеку утруднює вибір препарату. Далеко не завжди вдається екстраполювати результати багатоцентрового контрольованого дослідження ефективності на конкретного хворого. Як відзначено вище, основною ознакою, за якою НПЗП розрізняються між собою, є їх переносимість. Докази переваг одних НПЗП над іншими щодо знеболювальних і протизапальних властивостей відсутні. Крім того, у світлі недавніх відкриттів більш складних механізмів участі ЦОГ-1 і -2 у патологічних і фізіологічних процесах, стає очевидним, що селективні й навіть специфічні (коксиби) інгібітори ЦОГ-2 не є ідеальними НПЗП. Для того, щоб забезпечити ефективне та безпечне лікування, насамперед необхідно ретельне обстеження хворого для виключення факторів ризику розвитку побічних ефектів. При виявленні ризику розвитку гастропатії раціонально призначити селективні або специфічні інгібітори ЦОГ-2. Якщо у конкретного хворого неселективний НПЗП виявляє виражену ефективність, його можна призначити в комбінації з мізопростолом, ІПН чи антагоністами Н2-рецепторів. При наявності ознак ниркової недостатності призначати НПЗП недоцільно, однак, якщо застосування НПЗП необхідне, перевагу слід віддавати специфічним інгібіторам ЦОГ-2, при цьому лікування необхідно проводити під ретельним контролем рівня креатиніну в сироватці крові. Хворим із ризиком тромбозу при проведенні лікування інгібіторами ЦОГ-2 слід продовжувати прийом ацетилсаліцилової кислоти в низьких дозах і ретельно моніторувати стан ШКТ. При виборі НПЗП із групи неселективних інгібіторів для пацієнта похилого віку перевагу слід віддати дериватам пропіонової кислоти, що відносяться до короткоживучих НПЗП (швидко всмоктуються та елімінуються), які не кумулюються при порушенні метаболічних процесів. Якщо хворий не належить до групи ризику розвитку побічних ефектів, лікування можна починати як із неселективного, так і із селективного чи специфічного інгібітору ЦОГ-2. При неефективності або недостатній ефективності препарат необхідно замінити.
З метою оптимізації застосування НПЗП були численні спроби впровадити рекомендації щодо раціонального використання НПЗП (Hochberg M.C. et al., 1995; American College of Rheumatology Subcommittee on Osteoarthritis Guidelines, 2000; Simon L.S. et al., 2002), останні з яких були розроблені у лютому 2008 р. (Zhang W. et al., 2008). Так, у рекомендаціях ACR 1995 р., що розглядали фармакологічні аспекти терапії ОА кульшового суглобу препаратом першої лінії для усунення болю у зазначеного контингенту хворих був визнаний парацетамол, а неселективні НПЗП слід було призначати при неадекватному контролі інтенсивності больового синдрому парацетамолом. Ці рекомендації розробляли з урахуванням вираженої гастроінтестинальної токсичності неселективних НПЗП (Hochberg M.C. et al., 1995). Переглянуті рекомендації ACR 2000 р. вже пропонували застосування ЦОГ-2-селективних інгібіторів у ролі препаратів другої лінії для пригнічення болю у хворих на ОА, і називали їх препаратами вибору після парацетамолу. Основою цих рекомендацій став більш безпечний профіль гастроінтестинальної токсичності ЦОГ-2-селективних інгібіторів порівняно з неселективними НПЗП, особливо у популяції пацієнтів високого ризику. Однак в той же час із обігу на фармакологічному ринку США було вилучено рофекоксиб через доведене підвищенням ризику розвитку серйозних серцево-судинних подій (US Food and Drug Administration, 2007). Згідно із зазначеними рекомендаціями ACR було рекомендовано використовувати неселективні НПЗП замість парацетамолу, або разом з ним у разі, якщо пригнічення больового синдрому було неадекватним (American College of Rheumatology Subcommittee on Osteoarthritis Guidelines, 2000). Аналогічно до вищезазначених, рекомендації Американської асоціації болю (American Pain Society) 2002 р. також визначили парацетамол як знеболювальний препарат першої лінії (Simon L.S. et al., 2002).
Опубліковані у 2008 р. рекомендації OARSI були розроблені для лікування хворих на ОА колінного і кульшового суглобу, основані на результатах порівняльного аналізу даних літератури та існуючих рекомендацій для лікування ОА. Згідно з існуючими рекомендаціями, OARSI відмічає, що парацетамол (у дозі до 4 г/добу) може використовуватись як засіб початкової терапії у хворих із слабко та помірно вираженим болем внаслідок ОА кульшового та колінного суглобу. У разі неадекватної відповіді на парацетамол, якщо біль та/чи запалення є вираженими, OARSI рекомендує у ролі альтернативної терапії НПЗП у найнижчих ефективних дозах на найкоротший період. Важливою рисою зазначених рекомендацій 2008 р. є те, що парацетамол застосовують для терапії слабкого та помірно вираженого больового синдрому, в той час НПЗП рекомендуються для симптоматичного лікування пацієнтів, що страждають від болю та запалення одночасно. Ці оновлені рекомендації базуються на відомому факті, що анальгетики, зокрема парацетамол виявляють лише знеболювальну дію (Walker-Bone K. et al., 2000; Dieppe P.A., Lohmander L.S., 2005), не зумовлюючи протизапального впливу на уражений суглоб. Актуальним залишається призначення пацієнтам із підвищеним ризиком розвитку гастроінтестинальних побічних явищ з метою гастропротекції у ролі супутньої терапії ІПН або мізопростол.
Із врахуванням підвищеного ризику розвитку гастроінтестинальних та серцево-судинних побічних явищ у хворих на ОА, які одержують НПЗП, для клініцистів було запропоновано просту схему стратифікації ризику для вибору найбільш оптимального НПЗП, беручи до уваги наявні фактори ризику гастроінтестинальних та серцево-судинних побічних явищ (Scheiman J.M., Fendrick A.M., 2007). Так, для хворих, які не мають факторів ризику серцево-судинних явищ або низький ризик розвитку гастроінтестинальних побічних явищ доцільним є вибір монотерапії одним із неселективних НПЗП. Для пацієнтів без серцево-судинних факторів ризику, але з підвищеним ризиком розвитку гастроінтестинальних побічних явищ або тих, хто не приймає ацетилсаліцилової кислоти, рекомендованою є монотерапія ЦОГ-2-селективним інгібітором або комбінованою терапією неселективним НПЗП із ІПН з метою зниження гастроінтестинального ризику (Lewis J.D. et al., 2005; Scheiman J.M. et al., 2006). Для хворих, які мають підвищений серцево-суднний ризик та для тих, хто потребує профілактичного застосування ацетилсаліцилової кислоти, слід призначати неселективні НПЗП, які не протидіють антитромботичному ефекту останнього. Водночас продемонстровано, що супутнє застосування ібупрофену пацієнтами, що отримують ацетилсаліцилову кислоту, знижує кардіопротекторний вплив останньої (Catella-Lawson F. et al., 2001). Проте зазначений ефект не був виявлений у хворих, які поєднано отримували ацетилсаліцилову кислоту та напроксен (Farkouh M.E. et al., 2006). При необхідності проведення гастропротекції у цих пацієнтів рекомендованими є ІПН, а от призначення ЦОГ-2-селективних інгібіторів слід уникати у заначених хворих (Scheiman J.M., Fendrick A.M., 2005; 2007).
Глюкокортикоїди у лікуванні ОА. Системне застосування ГК при ОА не показане, однак внутрішньосуглобові та періартикулярні ін’єкції пролонгованих (депо-) форм ГК (табл. 12.13) дають значний, хоча й тимчасовий симптоматичний ефект (Hollander J.L., 1953; Moskowitz R.W. et al., 1970; Gray R.G., Gottleib N.L., 1983; Kirwan J.R., Rankin E., 1997; Brandt K.D., 2002).
Таблиця 12.13
Основні препарати депоформ ГК
| Препарат | Вміст активної речовини в 1 мл суспензії |
| Триамциномен | 40 мг триамцинолону ацентоніду |
| Бетаметазон | 2 мг бетаметазону динатрія фосфату і 5 мг бетаметазону дипропіонату |
| Метилпреднізолон | 40 мг метилпреднізолону ацетату |
Ефект введених у порожнину суглоба лікарських засобів, перш за все ГК, опосередкований взаємодією з відповідними рецепторами клітин, що інфільтрують синовіальну оболонку, беруть участь у розвитку синовіту. Перелік протипоказань для проведення локальної терапії ГК невеликий і може бути поділений на абсолютні та відносні протипоказання. Так, до абсолютних протипоказань для внутрішньосуглобових ін’єкцій ГК належить локальний чи системний інфекційний процес, до відносних — виражена деформація чи деструкція суглоба; виражений навколосуглобовий остеопороз, нестабільність суглоба; порушення згортальної функції крові.
Оскільки дослідження у тварин продемонстрували здатність ГК ушкоджувати суглобовий хрящ, а часті внутрішньосуглобові ін’єкції депо-ГК асоціюються з руйнуванням внутрішньосуглобових тканин (Gray R.G., Gottleib N.L., 1983), ін’єкції депо-ГК не рекомендують використовувати частіше, ніж 3–4 рази на рік. Проте H.W. Balch та співавтори (1977), які ретроспективно оцінювали рентгенограми суглобів після повторних ін’єкцій протягом 4–15 років, стверджували, що раціональне застосування повторних ін’єкцій цих препаратів не призводить до прискорення прогресування хвороби за даними рентгенографії.
У зв’язку з неоднозначністю позицій різних дослідників та спеціалістів щодо доцільності проведення локальної терапії ГК радою експертів за участю провідних ревматологів та ортопедів травматологів України була прийнята резолюція «Стратегія управління болем у суглобах та запаленням з використанням внутрішньосуглобових ін’єкцій ГК», основні пункти якої нижченаведені:
- Використання внутрішньосуглобових ін’єкцій ГК доцільне при лікуванні хворих на ОА, РА, які мають перебіг як моно-/олігоартрити.
- Внутрішньосуглобові ін’єкції ГК призначають при загостренні моноартриту на фоні ефективного в цілому базисного лікування; у період відпрацьовування базисної терапії у пацієнтів із хронічними запальними захворюваннями суглобів; при неможливості проведення адекватної базисної терапії. Ключові критерії вибору ГК-препарату для внутрішньосуглобового введення: швидкий знеболювальний ефект, тривалий протизапальний ефект, мінімальне дозування діючої речовини, мінімально виражена місцево-дистрофічна дія.
- Обмежене використання ін’єкційних ГК на основі тріамцинолону в зв’язку із вираженою місцево-дистрофічною дією.
- Для запобігання ГК-індукованій хондродеструкції внутрішньосуглобове введення ГК проводити не частіше 3–4 разів на рік в 1 суглоб з інтервалом між ін’єкціями 3–4 міс.
- Визнати неприйнятним призначення ін’єкційних ГК внутрішньосуглобово безперервним курсом з метою запобігання розвитку ГК-індукованої хондродеструкції, а також системним побічним ефектам ГК-терапії.
- Дотримання рекомендацій частоти, кратності, техніки введення ін’єкційних ГК забезпечує потужний протизапальний ефект, практично не піддаючи хворого ризику істотних ускладнень.
- Внутрішньосуглобові ін’єкції проводяться лікарем-ревматологом/ ортопедом-травматологом із відповідною підготовкою щодо техніки проведення ін’єкції; в умовах спеціально обладнаного кабінету для внутрішньосуглобових ін’єкцій (в умовах спеціалізованого відділення стаціонару) чи чистої перев’язної (малої операційної) у стаціонарі чи поліклініці.
Особливістю препаратів ГК, що застосовують для внутрішньосуглобового введення, є пролонгований протизапальний і знеболювальний ефект. З урахуванням тривалості ефекту депо-ГК можна розташувати в такому порядку:
1) гідрокортизону ацетат — випускається у формі мікрокристалічної суспензії у флаконах по 5 мл (125 мг препарату); при внутрішньосуглобовому введенні з порожнини практично не всмоктується, дія триває від 3 до 7 днів; у зв’язку з відносно слабким і коротким ефектом останнім часом застосовується дуже рідко;
2) триамцинолону ацетонід — випускається у формі водної кристалічної суспензії, в ампулах по 1 і 5 мл (40 мг/мл); протизапальний і знеболювальний ефект настає через 1–2 дні після ін’єкції і триває 2–3 (рідше 4) тиж; основний недолік — часто розвиток атрофії шкіри й підшкірної жирової клітковини, некрозу сухожиль, зв’язок або м’язів у місці введення;
3) метилпреднізолону ацетат — випускається у формі водної суспензії, в ампулах по 1; 2 і 5 мл (40 мг/мл); за тривалістю і вираженістю ефекту майже не відрізняється від триамцинолону ацетоніду; при застосуванні в рекомендованих дозах ризик розвитку атрофії та некрозу м’яких тканин у місці введення мінімальний; практично не має мінералокортикоїдної активності;
4) комбінований препарат, що містить 2 мг бетаметазону динатрію фосфату (високорозчинний ефір, що швидко всмоктується, забезпечує швидкий ефект) і 5 мг бетаметазону дипропіонату (слабкорозчинна депофракція, що повільно абсорбується, має пролонговану дію), випускається в ампулах по 1 мл, склад препарату зумовлює швидкий (вже через 2–3 год після внутрішньосуглобового введення) і пролонгований (3–4 тиж) ефект; мікроіонізована структура кристалів суспензії забезпечує безболісність ін’єкцій.
Локальне внутрішньосуглобове введення триамцинолону гексацетоніду викликало короткочасне зменшення вираженості болю в колінних суглобах, уражених ОА; результати лікування були кращими у разі попередньої аспірації ексудату із суглобової порожнини перед ін’єкцією (Gaffney K. et al., 1995). P.A. Dieppe та співавтори (1980) продемонстрували, що локальне внутрішньосуглобове введення ГК призводить до більш вираженого зменшення болю, ніж плацебо.
Основні показання до застосування ГК при ОА — персистування синовіту на фоні консервативного лікування, а також персистуюче запалення періартикулярних тканин (тендовагініт, бурсит та ін.). Плануючи внутрішньосуглобове введення пролонгованих ГК, необхідно пам’ятати про те, що препарати цієї групи протипоказані при інфекційних артритах різної етіології, інфікуванні шкіри й підшкірної жирової клітковини або м’язів у зоні введення, сепсисі, гемартрозах (гемофілія, травми та ін.), внутрішньосуглобових переломах. При вираженому тривалому больовому синдромі та відсутності синовіту, що не купірується консервативною терапією, ГК слід вводити не у суглоб, а періартикулярно. При ОА ІІІ–IV стадії за класифікацією Келлгрена — Лоуренса внутрішньосуглобові ін’єкції ГК необхідно використовувати вкрай обережно, лише у разі неефективності консервативних заходів.
Важливою вимогою при проведенні внутрішньосуглобових ін’єкцій є дотримання правил асептики: руки лікаря повинні бути чистими, бажано в хірургічних рукавичках; використовуються тільки одноразові шприци; після набору препарату в шприц безпосередньо перед введенням голку міняють на стерильну; евакуацію внутрішньосуглобової рідини і введення препарату необхідно проводити різними шприцами; ділянку введення обробляють 5% спиртовим розчином йоду, потім — 70% спиртом; після введення місце ін’єкції притискають ватним тампоном, змоченим 70% спиртом, і фіксують пластирем або пов’язкою не менше ніж на 2 год; при проведенні маніпуляції персонал і хворий не повинні розмовляти.
Після введення голки в порожнину суглоба необхідно провести аспірацію максимальної кількості суглобової рідини, що зумовлює деякий знеболювальний ефект (знижується внутрішньосуглобовий тиск, разом із синовіальною рідиною з порожнини видаляються механічні й біохімічні індуктори запалення), а також звільняється місце для подальшого введення лікарської речовини.
За даними H.J. Kreder та співавторів (1994) негативний ефект внутрішньосуглобових ін’єкцій ГК у кроликів потенціювався їх руховою активністю. Після внутрішньосуглобового введення депо-форм ГК доцільно деякий час не навантажувати суглоб, оскільки дотримання періоду спокою після ін’єкції сприяє більш вираженому й тривалому ефекту (Brandt K.D., 2002).
У зв’язку з тим що дослідження, проведені на тваринах, продемонстрували здатність ГК ушкоджувати суглобовий хрящ, а часті внутрішньосуглобові ін’єкції депо-форм ГК асоціюються з руйнуванням внутрішньосуглобових тканин (Gray R.G., Gottleib N.L., 1983), ін’єкції не рекомендують проводити частіше ніж 3–4 рази на рік. Однак H.W. Balch та співавтори (1977), які ретроспективно оцінювали рентгенограми суглобів після повторних ін’єкцій протягом 4–15 років, стверджували, що раціональне використання повторних ін’єкцій цих препаратів не призводить до прискорення прогресування хвороби за даними рентгенографії.
Ускладнення локальної терапії ГК можна розділити на внутрішньосуглобові та позасуглобові (Младенович В., 1990):
- внутрішньосуглобові: неефективність внутрішньосуглобової ГК-терапії внаслідок резистентності тканин суглоба до ГК відзначають у 1–10% хворих. Припускають, що в основі механізму цього процесу — нестача ГК-рецепторів у синовіальній тканині з ознаками запалення, посилення болю й припухлості суглоба спостерігається у 2–3% хворих, що пов’язано із розвитком фагоцитозу кристалів гідрокортизону лейкоцитами синовіальної рідини; остеопороз і кістково-хрящова деструкція. J.L. Hollander, аналізуючи результати тривалого лікування 200 хворих, разом із хорошим клінічним ефектом спостерігав швидке прогресування остеопорозу у 16% пацієнтів, ерозування суглобового хряща —4% і збільшення кісткової деструкції суглобових поверхонь — 3% хворих; гемартроз; Г.П. Матвєєнков та співавтори (1989) відзначали два випадки гемартрозу при проведенні 19 тис. пункцій суглобів; інфікування порожнини суглоба з подальшим розвитком гнійного артриту; найчастіше інфікування відбувається в колінному суглобі, як правило, ознаки запалення з’являються через 3 дні після ін’єкції;
- позасуглобові: атрофія шкіри в місці ін’єкції виникає при потраплянні лікарської речовини у позасуглобові тканини й відзначається переважно після ін’єкцій ГК у дрібні суглоби: щелепні, міжфалангові, п’ястково-фалангові; описана атрофія шкіри після ін’єкцій у колінний суглоб; лінійна гіпопігментація із проксимальним поширенням від суглоба; навколосуглобова кальцинація може приєднатися до атрофії шкіри над суглобами; тканьові гранульоматозні реакції; розриви зв’язок і сухожиль, патологічні переломи кісток.
Повільнодіючі препарати для лікування при ОА
Системна ензимотерапія (СЕТ) — вид терапії, що ґрунтується на пероральному застосуванні препаратів гідролітичних ензимів, переважно протеолітичної дії, тваринного і рослинного походження, що дозволяють впливати на різні патологічні процеси в організмі.
Йдеться про резистентні до впливу шлункового соку таблетовані форми таких ензимів, як папаїн, бромелаїн (протеїнази рослинного походження), трипсин і хімотрипсин, одержані з підшлункової залози тварин у комбінації з рутином.
При пероральному введенні препарати СЕТ виявляють системну дію, що проявляється в їх здатності оптимізувати перебіг запального процесу, нормалізувати реологічні властивості крові, імунологічні реакції, ліпопротеїдний спектр крові тощо.
Важливо, що при пероральному прийомі препаратів практично відсутні побічні ефекти, які виникають при застосуванні традиційних засобів при лікуванні пацієнтів з ОА.
СЕТ була розроблена у 1954 р. М. Вольфом і К. Рансбергером і успішно застосовується в Європі та США в лікуванні пацієнтів із різними захворюваннями, що супроводжуються запальним синдромом.
Кишково-розчинна форма таблеток забезпечує доставку ензимів у тонку кишку, де відбувається їх всмоктування. У крові ензими зв’язуються з плазматичним білком α2-макроглобуліном, за рахунок чого знижується їх антигенність.
Потрапивши в кров, в основному в лімфу, протеїнази у зв’язаному з α2-макроглобуліном вигляді проникають у печінку й легені, де впливають на макрофаги та функціональні клітини цих органів, змінюючи їх метаболізм, що проявляється покращанням антитоксичної функції печінки і посиленням бар’єрної функції легень.
Екзогенні протеїнази, взаємодіючи в крові α2-макроглобуліном, можуть впливати на метаболізм біологічно активних речовин, що виділяються у вогнищі запалення (брадикініни, лейкокініни). Протеолітичні ензими здатні розщеплювати зазначені пептиди, виявляючи протинабрякову і протизапальну дію, особливо при хронічних захворюваннях запального характеру, що мають перебіг із порушенням мікроциркуляції. Покращання мікроциркуляції зумовлено фібриногенолітичною дією препаратів СЕТ (Веремеенко К.Н., Коваленко В.Н., 1999), а також здатністю підвищувати активність тканинного активатора плазміногену, пригніченого внаслідок наявності хронічного запального процесу (Веремеєнко К.М. та співавт., 2002).
Модуляція активності цитокинів, ТФР-β за допомогою препаратів СЕТ (Desser L. еt al., 2001) становить особливий інтерес у зв’язку із дисбалансом в імунній системі, що спостерігається при ОА. Відомо, що надлишок ІЛ-1 і ФНП відіграє велику роль у патогенезі синовіту й ушкодженні хрящової тканини при ОА, тому дуже важлива здатність активованого протеїназою α2-макроглобуліну виводити та інактивувати їх (Веремеенко К.Н., Коваленко В.Н., 2000).
Враховуючи ці властивості препаратів СЕТ і особливості патогенезу ОА, F. Singer вперше у 1990 р. застосував препарат, що містить комбінацію протеолітичних ферментів (панкреатин, папаїн, бромелаїн, ліпаза, амілаза, трипсин, хімотрипсин, рутозид), як альтернативу лікуванню диклофенаком. У ході рандомізованого подвійного сліпого дослідження ефективності цього препарату при лікуванні ОА його застосовували по 7 драже 3 рази на добу протягом 5 тиж. Клінічна ефективність СЕТ виявилася порівнянною з результатами лікування диклофенаком у дозі 100 мг/добу протягом аналогічного періоду.
В іншому подвійному сліпому проспективному рандомізованому дослідженні F. Singer та співавтори (2001) використовували інший комбінований препарат, що містить протеолітичні ферменти (трипсин, бромелаїн, рутозид) у дозі 6 таблеток на добу протягом 3 тиж і виявили, що цей засіб є безпечною та ефективною альтернативою застосування диклофенаку в лікуванні при гострому гонартрозі. Перевага лікування цим препаратом полягає у вираженому протизапальному ефекті та хорошій переносимості (Singer F. еt al., 2001) при відсутності серйозних побічних реакцій.
Baerwald C.H. та співавтори (1999) у подвійному сліпому проспективному дослідженні відзначили, що безперервно наростаючий позитивний ефект дії СЕТ на клінічні прояви захворювання зберігався протягом всього періоду лікування (6 міс), а застосування СЕТ у комбінації з НПЗП найбільш ефективне протягом перших 2 міс.
G. Klein і W. Kullich (2000) у рандомізованому подвійному дослідженні короткого курсу лікування ензимами перорально пацієнтів із гострим ОА і вираженим больовим синдромом порівняно з прийомом диклофенаку довели, що пероральні ензими можна вважати ефективною та безпечною альтернативою таким НПЗП, як диклофенак у лікуванні гострих гонартритів.
Без сумніву, НПЗП, і диклофенак зокрема, є препаратами першого ряду в лікуванні при ОА. Проте висока частота виникнення серйозних важких побічних реакцій, у тому числі прихованих (Shallcross T., Heatley R., 1990; Soil A., Weinstein W. et al., 1991; Baskin W., Ivey K., 1992; Miller D., 1992), пов’язаних із блокадою ЦОГ, створює передумови для пошуку більш безпечних методів лікування. СЕТ не має серйозних побічних ефектів (Klein G. et al., 1976) і зазвичай добре переноситься (Reinbold H., Maehder K., 1981; Miehlke K., 1990; Worschnauser S., 1990; Miehlke K., 1991).
Трипсин і бромелаїн, які входять до складу ензимних препаратів, інактивують молекули адгезії, в тому числі IKAM-1 та -2, LFA-3, що відіграють важливу роль в індукуванні запалення (Tanaka Y. et al., 1995). Ця дія препарату також сприяє зниженню інтенсивності запальної реакції і таким чином регулює її перебіг (табл. 12.14).
Таблиця 12.14
Спектр лікувальної дії протеїназ, що входять до складу пероральних ензимів (Божков В.Е., Мазуров В.И., 1996)
| Протеїназа | Набряк | Фібриноліз | Розщеплення імунних комплексів | Модуляція рецепторів | Клітинна активність |
| Бромелаїн | +++ | + | ++ | + | + |
| Трипсин | ++ | +++ | — | ++ | + |
Набряк. Вже на ранній стадії запальної реакції спостерігається протинабрякова дія трипсину і бромелаїну (Gaggi R., Biaggi G., 1985). Бромелаїн знижує концентрацію брадикініну (Bodi T., 1966), а також редукує набряк, спричинений арахідоновою кислотою, найбільш імовірно впливаючи на її метаболізм (Вальд М. и соавт., 2004). Протинабряковій дії протеаз також сприяє зниження концентрації гістаміну під впливом прямої інгібуючої дії трипсину на дегрануляцію тучних клітин (Wood G. et al., 1997; Вальд М. и соавт., 2004).
Фибриноліз. Під дією протеаз, що входять до складу ензимів для пероральної терапії, опосередковано за рахунок посилення синтезу й вивільнення тканинного активатора плазміногену відбувається активація фібринолізу ендотеліальними клітинами і макрофагами (Веремеєнко К.М. та співавт., 2002), що сприяє перетворенню плазміногену у плазмін. Це приводить до покращання реологічних властивостей крові й відновлення мікроциркуляції, що, в свою чергу, сприяє проникненню антибіотиків і хіміотерапевтичних препаратів у тканини. Ензимні препарати мають виражену фібриногенолітичну активність за рахунок вмісту бромелаїну, який здатний гідролізувати фібриноген (Веремеенко К.Н. и соавт., 1999), що веде до зниження його рівня, а отже, і в’язкості крові (Веремеенко К.Н. и соавт., 2000).
Розщеплення імунних комплексів зумовлено дією бромелаїну, який пригнічує їх утворення та підвищує їх кліренс (Ноузе К. и соавт., 1994; Божков В.Е., Мазуров В.И., 1996; Веремеенко К.Н., Коваленко В.Н., 1999). Завдяки активації системи мононуклеарних фагоцитів забезпечується більш інтенсивне захоплення імунних комплексів макрофагами різних органів і зменшується їх утворення внаслідок меншого ушкодження клітин у вогнищі аутоімунного запалення (Веремеєнко К.М. та співавт., 2002).
Модуляція рецепторів. Протеази (в основному трипсин) здатні впливати на величину експресії рецепторів CD4, CD44 і B7-1 і тим самим підвищувати поріг активації Т-лімфоцитів, що веде до обмеження гіперактивації запального процесу (Targoni O.S. et al., 1999; Вальд М. и соавт., 2004). Доведено, що протеази знижують щільність експресії адгезивних молекул на аутореактивних Т-лімфоцитах, сприяючи зниженню активності захворювання (Божков В.Е., Мазуров В.И., 1996).
Клітинна активність. Комплекси α2-М-протеїнази активують макрофаги легень і печінки (клітини Купфера), а також неспецифічну резистентність цих органів і як наслідок — всього організму за рахунок інтенсивності фагоцитозу, продукції супероксиданіон радикалу мононуклеарами, антимікробного захисту загалом (Веремеенко К.Н. и соавт., 2000). Комплекси α2-М-протеїнази активують і інші клітини системи мононуклеарних фагоцитів (СМФ): макрофаги селезінки, кісткового мозку, гістіоцити сполучної тканини, шкіри, остеокласти, клітини мікроглії в нервовій системі тощо (Фрейдлин И.С., 1984). Це виявляє, у свою чергу, вплив на запалення (в тому числі аутоімунне запалення), новотворення, артеріальну й венозну гіперемію, тромбоз тощо (Веремеенко К.Н. и соавт., 2000).
Рутин виявляє протизапальну дію, адсорбує вільні радикали, стабілізує ендотелій судин (тобто має властивість зміцнювати судинну стінку) і тим самим знижує проникність судинно-тканинних бар’єрів, що перешкоджає виходу плазмових білків за межі судинного русла (знижує вираженість набряку).
СЕТ в Україні вперше застосував В.Н. Коваленко в 1995 р. при лікуванні хворих на РА і ОА. Надалі її успішно стали використовувати у схемах лікування при інших ревматичних захворюваннях у різних клініках і центрах України.
Клінічний досвід лікування хворих на ОА (Веремеенко К.Н., Коваленко В.Н., 2000; Пишак О.В., 2000; Шолохова Л.Б., 2001) із застосуванням препаратів СЕТ в комбінації з НПЗП і хондропротекторами довів клінічну ефективність, безпеку й хороші віддалені результати комбінованої фармакотерапії.
Курс СЕТ підвищує функціональну активність фагоцитуючих клітин крові, що супроводжується зниженням вмісту IgА, циклічного імунного комплексу і α2-макроглобуліну в сироватці крові. Використання СЕТ у хворих на ОА з остеопенічними змінами запобігає втраті МЩКТ. Після курсу лікування препаратами ензимотерапії в дозі 2 таблетки 3 рази на добу протягом 3–4 тиж виявляють значне зниження плазмової протеолітичної активності, вмісту в крові пероксидномодифікованих білків, молекул середньої маси при нормалізації рівня церулоплазміну та метаболізму вуглеводно-білкових компонентів сполучної тканини (Пишак О.В., 2002).
Препарати СЕТ — ефективна та безпечна альтернатива використання НПЗП при лікуванні пацієнтів із ОА в період загострення, а також у разі виникнення побічних явищ при застосуванні НПЗП. Результати проведених досліджень свідчать, що препарати СЕТ сприяють зменшенню вираженості запалення, болю й набряку, знижують частоту загострень ОА, поліпшують якість життя і не викликають побічних ефектів (Wittenberg A. et al., 2000; Singer F. et al., 2001; Шолохова Л.Б., 2001). На сьогодні СЕТ включена в рекомендовані Асоціацією ревматологів України стандарти лікування при ревматичних захворюваннях (Коваленко В.Н. и соавт., 2004). Проведено дослідження комбінованого застосування препаратів СЕТ і хондропротекторів. Важлива перевага подібної комбінації — можливість швидкого усунення синовіту без побічних явищ.
Таким чином, СЕТ у комплексному лікуванні ОА — ефективна і безпечна альтернатива тривалому застосуванню НПЗП (Klein G., Kullich W., 2000; Singer F. et al., 2001; Tilwe G. et al., 2001). СЕТ характеризується клінічною ефективністю в поєднанні з хорошою переносимістю препаратів у високих дозах при тривалому застосуванні.
Хондропротектори
Як природній компонент суглобового хряща глюкозаміну сульфат (сульфатоване похідне природного аміномоносахариду глюкозаміну) був вперше використаний як засіб, що стимулює репаративні процеси у хворих на ОА, понад 20 років тому. Глюкозаміну сульфат має хорошу біодоступність при пероральному застосуванні і сприятливий для ОА фармакокінетичний профіль, включаючи тропність до суглобового хряща. В умовах in vivo глюкозамін синтезується хондроцитами із глюкози у присутності глутаміну. Надалі глюкозамін використовується хондроцитами для синтезу глікозаміногліканів і протеогліканів.
Глюкозамін відіграє важливу роль у біохімічних процесах, що відбуваються в суглобовому хрящі, він утворює полісахаридні ланцюги основних глікозаміногліканів синовіальної рідини і хрящового матрикса (табл. 12.15).
Таблиця 12.15
Фармакодинамічні ефекти глюкозаміну сульфату
| Дія | Дані досліджень |
| Анаболічна |
|
| Антикатаболічна |
|
| Протизапальна |
|
У контрольованому дослідженні W. Noack та співавтори (1994) відзначили, що ефективність 4-тижневого лікування глюкозаміну сульфатом у дозі 1500 мг/добу (n=126) значно перевищує ефективність плацебо (n=126). Ефект лікування став очевидним через 2 тиж терапії, згодом протягом 2 тиж вираженість симптомів ОА продовжувала зменшуватися. Кількість побічних ефектів в основній групі статистично не відрізнялася від такої в групі плацебо.
H. Muller-Fasbender та співавтори (1994) у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні виявили, що ефективність 4-тижневої терапії глюкозаміну сульфатом у дозі 1500 мг/добу (n=100) еквівалентна цій ібупрофену в дозі 1200 мг/добу (n=99) у хворих на ОА колінних суглобів. Глюкозаміну сульфат поступався ібупрофену за швидкістю настання ефекту (через 2 тиж від початку терапії), однак за безпекою значно перевершував його (6% побічних ефектів у групі глюкозаміну сульфату і 35% — у групі ібупрофену; р<0,001). Передчасне переривання лікування зареєстроване у 1% хворих, які приймали глюкозаміну сульфат, і у 7% хворих, які лікувалися ібупрофеном (р=0,035).
Результати 6-тижневого лікування хворих на ОА колінних суглобів шляхом внутрішньом’язового введення глюкозаміну сульфату (n=79, 400 мг 2 рази на тиждень) виявили вищу ефективність препарату порівняно з плацебо (n=76) за даними рандомізованого подвійного сліпого дослідження (Reichelt A. et al., 1994).
Мета дослідження G.X. Qui та співавторів (1998) — порівняння впливу глюкозаміну сульфату та ібупрофену на симптоми ОА колінних суглобів. Протягом 4 тиж 88 хворих одержували глюкозаміну сульфат у дозі 1500 мг/добу і 90 хворих — ібупрофен у дозі 1200 мг/добу з подальшим 2-тижневим періодом спостереження після закінчення курсу лікування. Автори виявили, що ефективність глюкозаміну сульфату еквівалентна такій ібупрофену, одержаний ефект утримувався протягом 2 тиж після закінчення лікування глюкозаміну сульфатом.
J.Y. Reginster та співавтори (2001) вивчали вплив глюкозаміну сульфату в дозі 1500 мг/добу (n=106) на прогресування структурних змін у суглобах і симптоми ОА у хворих на гонартроз порівняно із плацебо (n=106) після 3 років лікування. У групі хворих, які одержували плацебо, спостерігали прогресування звуження суглобової щілини із середньою швидкістю 0,1 мм на рік, тоді як у хворих, які лікувалися глюкозаміну сульфатом, прогресування звуження суглобової щілини не відзначено. Таким чином, до кінця 3-річної терапії середня та мінімальна висота суглобової щілини у хворих, які одержували глюкозаміну сульфат, була значно більшою, ніж у групі плацебо (р=0,043 і р=0,003 відповідно).
У середньому за даними короткострокових контрольованих клінічних досліджень побічні ефекти на фоні лікування глюкозаміну сульфатом спостерігалися в 15% випадків; приблизно з такою ж частотою побічні ефекти реєстрували в групах плацебо. Побічні ефекти терапії глюкозаміну сульфатом зазвичай були минущими, слабко вираженими і проявлялися відчуттям дискомфорту та болю в ділянці шлунка, запором, діареєю, метеоризмом, нудотою, зрідка виникали реакції гіперчутливості (шкірний висип зі свербежем, еритема), дуже рідко — головний біль, розлади зору, випадання волосся.
Хондроїтину сульфат — глікозаміноглікан, що локалізується в позаклітинному матриксі суглобового хряща. Фармакокінетичні дослідження показали, що при прийомі внутрішньо він добре абсорбується і визначається у високих концентраціях у синовіальній рідині. У дослідженнях in vitro показано, що хондроїтину сульфат проявляє протизапальну активність в основному на клітинний компонент запалення, стимулює синтез гіалуронової кислоти і протеогліканів та пригнічує дію протеолітичних ферментів (Baici A., Bradamante P., 1984).
В. Mazieres та співавтори (1996) у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні вивчали ефективність і переносимість хондроїтину сульфату у 120 пацієнтів з ОА колінних і кульшових суглобів. Хворі приймали протягом 3 міс хондроїтину сульфат або плацебо по 4 капсули на добу з подальшою 2-місячною фазою спостереження, у ході якої оцінювали віддалені результати. Первинним критерієм ефективності була потреба в НПЗП, виражена в диклофенаковому еквіваленті (мг). По завершенню 3-місячного лікування пацієнти, які приймали хондроїтину сульфат, потребували значно меншої кількості НПЗП, ніж хворі групи плацебо, причому в період спостереження середню добову дозу НПЗП продовжували знижувати. Аналіз вторинних критеріїв ефективності (ВАШ, індекс Лекена, загальна оцінка ефективності лікарем і хворими) також продемонстрував статистично достовірну перевагу досліджуваного препарату над плацебо. Переносимість хондроїтину сульфату була порівнянною із такою плацебо — побічні ефекти зареєстровані у 7 хворих контрольної групи (гастралгія, запор, діарея, набряк повік) і у 10 хворих контрольної групи (гастралгія, нудота, діарея, сонливість, сухість слизової оболонки порожнини рота).
В іншому багатоцентровому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні проводили порівняльну оцінку ефективності й переносимості двох режимів дозування хондроїтину сульфату (1200 мг/добу в 1 або в 3 прийоми) у хворих на ОА колінних суглобів (І–ІІІ стадія за класифікацією Келлгрена — Лоуренса) (Bourgeois P. et al., 1998). У хворих, які одержували хондроїтину сульфат, спостерігали значне зниження індексу Лекена й ВАШ (р<0,01), у той час як у групі плацебо відзначали лише достовірну позитивну динаміку ВАШ (р<0,05) і недостовірну тенденцію до зниження індексу Лекена (р>0,05). Переносимість хондроїтину сульфату була задовільною і порівнянною із переносимістю плацебо (побічні ефекти спостерігали у 16 із 83 хворих, які лікувалися хондроїтину сульфатом, і у 12 із 44 хворих, які одержували плацебо).
У публікації L. Bucsi і G. Poor (1998) узагальнені результати 6-місячного рандомізованого подвійного сліпого плацебо-контрольованого дослідження ефективності й переносимості хондроїтину сульфату в дозі 800 мг/добу у 80 хворих на ОА колінних суглобів (I–III стадія за класифікацією Келлгрена — Лоуренса), проведеного у двох центрах. За даними ВАШ у групі хондроїтину сульфату спостерігали повільне зменшення вираженості болю протягом всього дослідження (на 23% — через 1 міс, на 36% — через 3 міс, на 43% — до кінця лікування), тоді як на фоні плацебо відзначали незначне зниження показника (на 12% — через 1 міс, на 7% — через 3 міс і на 3% — до кінця дослідження). Аналогічну динаміку спостерігали щодо індексу Лекена. Переносимість хондроїтину сульфату і плацебо була однаковою.
D. Uebelhart та співавтори (1998) у пілотному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні вивчали вплив хондроїтину сульфату (800 мг/добу протягом 1 року) на прогресування ОА колінних суглобів у 42 хворих. Цифровий автоматичний аналіз рентгенограм колінних суглобів, виконаних перед початком лікування і після його закінчення, показав, що у хворих, які одержували хондроїтину сульфат, спостерігали стабілізацію висоти суглобової щілини в медіальній ділянці ТФВ колінного суглоба, тоді як у групі плацебо було достовірне звуження суглобової щілини.
B.F. Leeb та співавтори (2000) виконали метаналіз 16 публікацій результатів 7 контрольованих досліджень ефективності хондроїтину сульфату у 372 хворих на ОА. Результати спостереження протягом 120 і більше днів пацієнтів, які одержують хондроїтину сульфат у комбінації з НПЗП або простими анальгетиками, свідчать, що за такими показниками, як ВАШ болю та індекс Лекена цей препарат перевершував плацебо. Покращання в середньому становило 50%. Автори метаналізу дійшли висновку, що хондроїтину сульфат може бути корисним у лікуванні при ОА, однак необхідні подальші триваліші дослідження з більшою кількістю пацієнтів для того, щоб довести його симптомомодифікуючі властивості.
Вивчення в Україні ефективності й переносимості хондроїтину сульфату проведено у відкритому 9-місячному багатоцентровому дослідженні (В.Н. Коваленко, Г.В. Дзяк, Н.М. Шуба, О.Б. Яременко, Е.Ю. Тимошенко). Основну групу становили 30 хворих на гонартроз II стадії за класифікацією Келлгрена — Лоуренса віком 55–65 років, які протягом 6 міс одержували хондроїтину сульфат по 1000 мг/добу і диклофенак — по 100 мг/добу протягом 3 тиж, а у подальшому — за необхідністю. Спостереження хворих проводили до 9 міс від початку дослідження. У контрольну групу включили 30 пацієнтів, порівнянних за демографічними і початковими клінічними показниками із пацієнтами основної групи, які одержували диклофенак 100 мг/добу протягом 3 тиж, а у подальшому — за потребою. Всі хворі обстежені клінічно за стандартним протоколом дослідження суглобів, який включав індекс Лекена для гонартрозу (бали); обсяг рухів у колінних суглобах (градуси); оцінку больового синдрому (бали); оцінку рухливості й повсякденної діяльності за шкалою WOMAC; середньодобове споживання НПЗП (мг) на еквівалент диклофенаку; загальну оцінку ефективності лікування лікарем і пацієнтом за 4-бальною шкалою (0 — значне погіршення, 1 — погіршення, 2 — без змін, 3 — покращання, 4 — значне покращання); загальну оцінку переносимості препарату за 3-бальною шкалою (0 — погана, 1 — задовільна, 2 — хороша); рентгенологічне дослідження клінічно більш ураженого колінного суглоба у фронтальній і бічний проекціях у положенні хворого лежачи перед включенням у дослідження і через 9 міс, причому оцінку РСЩ здійснювали за фронтальним знімком; лабораторне обстеження включало загальний аналіз крові, біохімічний аналіз крові з визначенням креатиніну, АлАТ, АсАТ, СРБ.
У 10 хворих основної групи і 10 — контрольної, обстежених на базі Українського ревматологічного центру, проводили УЗД колінних суглобів на апараті SONOLINE Omnia («Siemens») з лінійним датчиком із частотою 7,5 Мгц в режимі ortho у стандартних позиціях (Backhaus M. et al., 2001). Оцінювали стан кісткових суглобових поверхонь, РСЩ, навколосуглобових м’яких тканин, наявність випоту і деякі інші параметри. Статистичний аналіз даних здійснювали із застосуванням критерію Стьюдента, кореляційного і багатофакторного дисперсійного аналізу з використанням пакета програм STATGRAPHICS.
Усі хворі основної та контрольної груп закінчили повний 6-місячний курс лікування і перебували під спостереженням протягом наступних 3 міс. Значне зниження альгофункціонального індексу Лекена відзначено лише у хворих основної групи. Зниження цього показника виявили вже через 3 міс лікування (на 41,2%), а на 9-му місяці спостереження він був в 2,5 раза нижчим порівняно з первинним значенням.
В основній групі також спостерігали достовірне збільшення і нормалізацію обсягу згинання в колінних суглобах. У 20 (66,7%) хворих основної групи наприкінці дослідження обсяг руху був у межах фізіологічної норми (130–150°). Як і індекс Лекена, достовірна позитивна динаміка обсягу рухів спостерігалася вже через 3 міс, а різниця з показниками хворих контрольної групи була статистично значимою через 6 міс. У контрольній групі збільшення обсягу рухів було несуттєвим, середній показник не досягав нормальних величин.
Дані аналізу анкети WOMAC свідчать про те, що в основній групі виявлена статистично значима позитивна динаміка вираженості болю у стані спокою та під час руху, обмеженості рухливості суглобів, утруднень у повсякденній діяльності. Достовірне поліпшення всіх складових анкети WOMAC відзначено як на обох етапах лікування (3-й і 6-й місяць), так і через 3 міс після завершення прийому хондроїтину сульфату. У контрольній групі через 9 міс спостереження суттєво зменшилася лише вираженість болю під час руху. За всіма показниками найбільша кількісна різниця між основною і контрольною групами спостерігалася на 6-му місяці лікування.
За час лікування зменшилася потреба у НПЗП у пацієнтів основної групи, причому добова доза НПЗП у перерахунку на еквівалент диклофенаку через 3 міс знизилася до 41,0% від вихідного рівня, а через 6 міс — до 13,0%. За наступні 3 міс спостереження цей показник статистично не змінився (p>0,1).
Слід зазначити, що через 6 і 9 міс терапії близько 40% хворих, які приймали хондроїтину сульфат, змогли відмовитися від прийому НПЗП. У контрольній групі застосування НПЗП у перерахунку на еквівалент диклофенаку на 3; 6 і 9-му місяці спостереження становило 87; 74 і 84% відповідно. Різниця між основною і контрольною групами була вірогідною, починаючи з 3-го місяця і зберігалася до кінця дослідження (p<0,01).
Отримані нами дані щодо потреби у застосуванні НПЗП хворими на ОА свідчать про переваги хондроїтину сульфату в лікуванні цієї категорії пацієнтів. Ця думка збігається з даними інших дослідників (Насонова В.А. и соавт., 2001), які у відкритому рандомізованому багатоцентровому дослідженні вказали на зниження потреби у споживанні НПЗП при гонартрозі в 5,7 раза на фоні застосування препарату хондроїтину сульфату.
Дані рентгенологічного дослідження колінних суглобів свідчать, що достовірної динаміки в розмірах РСЩ немає ні в основній, ні в контрольній групах (p>0,1). Недостовірні рентгенологічні дані, отримані в цьому дослідженні, можуть пояснюватися як недоліками рентгенологічного як дослідного методу щодо виявлення ранніх змін у кістковій тканині, так і нетривалим періодом спостереження (Dieppe P., 1995; Altman R.D. et al., 1996; Коваленко В.Н., Борткевич О.П., 2003).
За даним вихідної УЗД класичні ознаки ОА колінних суглобів (Коваленко В.Н., Борткевич О.П., 2003) виявлено у 100% хворих. Вони полягали у звуженні гіалінового суглобового хряща, наявності крайових кісткових розростань (10% загалом по групах, 13,3% — в основній та 6,7% — у контрольній; р<0,05).
В результаті проведеної терапії відзначена позитивна ультразвукова динаміка у 6 (40,0%) хворих основної групи і у 4 (26,7%) — контрольної, у яких при первинному дослідженні виявлено випіт у порожнину суглоба. У 5 (83,3%) із 6 хворих основної групи і 2 (40,0%) із 5 — контрольної відзначено повне зникнення явищ синовіту. Нормалізувалася товщина синовіальної оболонки у 3 (75,0%) із 4 хворих основної групи і у 2 (66,7%) із 3 — контрольної, а також зменшився набряк періартикулярних м’яких тканин у всіх пацієнтів. У 4 хворих основної групи із наявністю (за даними вихідної УЗД) кровотечі в синовіальній оболонці після курсу лікування відзначалася її відсутність, що може свідчити про виражений протизапальний ефект лікування хондроїтину сульфатом. У контрольній групі у 1 із 2 пацієнтів кровотеча в синовіальній оболонці зберігалася, що корелювало з відсутністю позитивної клінічної динаміки.
Таким чином, хондропротекторна терапія хондроїтину сульфатом мала переваги перед традиційним лікуванням НПЗП (диклофенак) щодо зменшення проявів запалення при тривалому спостереженні.
За оцінкою пацієнтів переносимість лікування була суттєво кращою в основній групі, ніж у контрольній (p<0,05). За 6 міс терапії жоден із пацієнтів не вибув із дослідження, побічних дій за даними клінічних і лабораторних досліджень не відзначено. Рівень гемоглобіну, еритроцитів, лейкоцитів, а також біохімічні параметри крові під впливом обох схем лікування практично не змінилися, показники коливалися у межах фізіологічної норми та їх динаміка не була статистично значимою, що також свідчить про хорошу переносимість лікування за зазначеною схемою. В основній групі також виявили невелику кількість побічних ефектів НПЗП (гастралгія — у 2 (6,6%), підвищення артеріального тиску — у 2 (6,6%) хворих), які швидко були усунуті шляхом відміни НПЗП або заміни на ЦОГ-2-специфічні НПЗП, призначенням коригувальної терапії.
У контрольній групі побічні ефекти відзначені у 10 (33,3%) хворих і розцінені як незначні, але потребували переходу на інший НПЗП (зазвичай — ЦОГ-2-селективні НПЗП, призначення коригувальної терапії. 3 хворим із 10 з артеріальною гіпертензією було потрібне проведення гіпотензивної терапії, яка адекватно знижувала артеріальний тиск.
Дані досліджень свідчать, що оцінка ефективності лікування як лікарем, так і пацієнтом була значно вищою при лікуванні хондроїтину сульфатом, ніж у контрольній групі. Це стосувалося як періоду активного лікування (6 міс), так і періоду подальшого спостереження хворих протягом 3 міс.
Підсумовуючи дані проведеного дослідження, зазначимо його деякі, найбільш істотні, результати. Так, виражений клінічний ефект хондроїтину сульфату розвивається вже через 3 міс після початку терапії, він стабільний і зберігається через 3 міс після припинення лікування у 80% хворих, причому поліпшуються не лише суб’єктивні показники (опитувальники), але й об’єктивні (обсяг рухів, дані УЗД). Звернемо увагу, що подібні до наших, результати дослідження застосування хондроїтину сульфату отримані в Росії В.А. Насоновою та співавторами (2001), які свідчать про клінічне покращання у 90,2% пацієнтів з ОА, тривалість ефекту після відміни препарату становить при гонартрозі 4,6 міс; переносимість хондроїтину сульфату хороша, а побічні реакції відзначали у 2,1% хворих.
Особливе значення має зниження потреби в НПЗП, яке досягається при застосуванні хондроїтину сульфату. Це зумовлено, перш за все, зниженням ризику розвитку побічних явищ, які часто спостерігаються на фоні прийому НПЗП, особливо ускладнень з боку ШКТ, у тому числі шлунково-кишкових кровотеч (Викторов А.П., 1997; Дзяк Г.В., 1997).
Отримані нами у 9-місячному дослідженні результати підтверджуються даними метааналізу 7 плацебо-контрольованих досліджень ефективності хондроїтину сульфату, які свідчать про те, що порівняно із плацебо препарат зумовлює виражений вплив на больовий синдром і покращує функцію суглобів у хворих на ОА, а також приводить до істотного зниження добової потреби в знеболювальних засобах (Leeb B.F. et al., 2000). Багатоцентрове рандомізоване дослідження, проведене в Росії В.А. Насоновою та співавторами (2001) на базі 9 центрів, також продемонструвало переваги хондроїтину сульфату в лікуванні при ОА колінних суглобів. Це стосувалося як ефективності препарату щодо больового й запального синдромів, так і профілю безпеки (Насонова В.А. и соавт., 2001). Дані пілотного рандомізованого подвійного сліпого плацебо-контрольованого дослідження, проведеного D. Uebelhart і співавторами (1998), показали, що у хворих на гонартроз на фоні лікування хондроїтину сульфатом (800 мг/добу протягом 1 року) відзначено стабілізацію РСЩ за даними цифрових рентгенограм, тоді як у групі плацебо РСЩ вірогідно звужувалася. Оскільки рентгенологічний метод, застосований у цьому дослідженні, є непрямим щодо оцінки стану суглобового хряща, поліпшення його ультразвукових характеристик, яке спостерігалося в нашому дослідженні, може бути основою для об’єктивізації хондропротекторної дії хондроїтину сульфату.
На українському фармацевтичному ринку нещодавно зареєстровано новий комплексний хондропротекторний засіб, до складу якого входять глюкозамін, хондроїтину сульфат, аскорбінова кислота, екстракт зеленого чаю, хлорид марганцю. Про властивості глюкозаміну і хондроїтину сульфату описано вище. Вітамін С — необхідний компонент для біосинтезу колагену: гідроксилювання проліну в гідроксипролін — вітамін С-залежний процес. Широко відомі антиоксидантні властивості аскорбінової кислоти. Катехіни і біофлавоноїди, що входять до складу зеленого чаю, також мають виражену антиоксидантну дію, пригнічують активність прозапальних ферментів ЛОГ і ЦОГ. Важливим компонентом цього засобу є хлорид марганцю. Це хімічна сполука — активатор Mn-залежних глікозилтрансфераз, що активізують синтез протеогліканів хряща. За даними В.М. Коваленка та співавторів (2004) комбінація хондропротекторних засобів та препаратів СЕТ сприяє швидкому усуненню синовіту і забезпечує виражений знеболювальний і протизапальний ефект при відсутності побічних ефектів.
Стерильний екстракт морських організмів складається з амінокислот, пептидів, глюцидів і мікроелементів — іонів натрію, калію, магнію, заліза, міді й цинку. Це повільнодіючий препарат для внутрішньосуглобового і внутрішньом’язового введення, що широко застосовується в Україні. Згідно з експериментальними даними цей комбінований препарат стимулює синтез гіалуронової кислоти, а також може блокувати активність гіалуронідази (Лукина Г.В., Сигидин Я.А., 2001).
Препарати гіалуронової кислоти (гілан, гіалган) і гіалурон натрію (гіалектин) — повільнодіючі протиартрозні агенти, до складу яких входить гіалуронова кислота чи її натрієва сіль — полісахарид, натуральний компонент суглобового хряща. Гіалуронова кислота — це фізіологічний фактор, що бере участь у трофіці суглобового хряща.
Гіалуронова кислота та її натрієва сіль були предметом багатьох досліджень у хворих на ОА, де в ролі препарату порівняння були НПЗП або ГК для внутрішньосуглобового введення. Результати проспективного дослідження ефективності препарату гіалуронової кислоти у 43 хворих на ОА зі слабко вираженим суглобовим синдромом продемонстрували задовільну переносимість і відсутність побічних ефектів. Препарат виявився неефективним у хворих із наявністю суглобового випоту і значними рентгенологічними змінами в уражених суглобах (Namiki O. et al., 1982).
Порівняння двох режимів дозування (20 і 40 мг) гіалуронової кислоти з плацебо у хворих на ОА колінних суглобів продемонструвало достовірну перевагу ефективності внутрішньосуглобових ін’єкцій гіалуронової кислоти над плацебо щодо зменшення вираженості болю в уражених суглобах. Крім того, позитивну динаміку показників суглобового синдрому відзначали ще протягом 1 міс після закінчення лікування гіалуроновою кислотою (Bragantini A., Cassini M., 1987).
J. Graf та співавтори (1993) у сліпому рандомізованому дослідженні ефективності й безпеки гіалуронової кислоти порівняно з мукополісахарид ефіром полісірчаної кислоти у хворих на ОА виявили їх задовільну ефективність із достовірною перевагою гіалуронату.
Результати порівняння внутрішньосуглобових ін’єкцій гіалуронової кислоти й метилпреднізолону у хворих на ОА свідчать про однаково високу ефективність щодо контролювання симптомів ОА (Pietrogrande V. et al., 1991; Cole A.A. et al., 1996). Виявлено більш тривалу ремісію симптомів ОА після лікування гіалуроновою кислотою, ніж після ГК. G. Leardini та співавтори (1987) рекомендували гіалуронову кислоту як альтернативний ГК-препарат для внутрішньосуглобових ін’єкцій.
За даними подвійного сліпого плацебо-контрольованого дослідження ефективності гіалуронової кислоти (600–1200 кД), у хворих на ОА не відзначено істотної різниці у зміні показників суглобового синдрому між групами плацебо та гіалуронової кислоти. Автори іншого плацебо-контрольованого дослідження навіть не відзначали статистично істотної динаміки показників в обох групах. Стратифікація за віком і тяжкістю хвороби виявила, що гіалуронат був більш ефективним, ніж плацебо у осіб із тяжким перебігом хвороби віком старше 60 років.
На сьогодні склалося неоднозначне ставлення до препаратів гіалуронової кислоти. Існують дані, що свідчать про те, що ефект внутрішньосуглобових ін’єкцій гіалгану складається із суми ефектів плацебо й артроцентезу, обов’язково проведеного перед ін’єкцією (Altman R.D. et al., 1998). Більше того, дані досліджень J.R. Kirwan і E. Rankin (1997) і G.N. Smith та співавторів (1998) свідчать про ушкоджувальну дію гіалуронової кислоти на суглобовий хрящ у тварин.
На думку K.D. Brandt (2002) суперечливість результатів клінічних досліджень гіалуронової кислоти у деякій мірі залежить від точності введення препарату в порожнину суглоба. Так, за даними A. Johns та співавторів (1997), лише у 66% випадків депо-метилпреднізолон був введений точно в порожнину колінного суглоба, при цьому ефективність лікування корелювала з точністю потрапляння в порожнину суглоба. Точність введення препарату підвищується при проведенні попередньої аспірації рідини (Listrat V. et al., 1997). Крім того, суперечливість результатів клінічних досліджень препаратів гіалуронової кислоти може бути пов’язана з тим, що для їх виготовлення використовують полісахаридні ланцюги різної молекулярної маси й різного походження.
Застосування внутрішньосуглобових ін’єкцій гіалуронової кислоти рекомендується хворим, у яких інші види лікування неефективні чи викликають побічні ефекти, що потребують припинення лікування.
Діацереїн — дериват антрахінону, здатний пригнічувати продукцію ІЛ-1 (Cruz T.F. et al., 1996), ІЛ-6, ФНП-α і ЛІФ in vitro (Boittin M. et al., 1993; Cruz T.F. et al., 1996; Pelletier J.P. et al., 1997), зменшувати кількість рецепторів активатора плазміногену на синовіцитах і хондроцитах, тим самим пригнічуючи перетворення плазміногену в плазмін (Del Rosso M. et al., 1990), зменшувати утворення оксиду азоту (Cruz T.F. et al., 1996; Pelletier J.P. et al., 1998; Pietrangelo A. et al., 1998). Завдяки цим ефектам діацереїн знижує продукцію металопротеаз колагенази (Boittin M. et al., 1993; Cruz T.F. et al., 1996) і стромелізину (Pelletier J.P. et al., 1997) та пригнічує вивільнення лізосомальних ферментів, таких, як бета-глюкуронідаза, еластаза і мієлопероксидаза (Mian M. et al., 1989). Водночас препарат стимулює синтез протеогліканів, глікозаміногліканів, гіалуронової кислоти (Carney S.L. et al., 1995). При експериментальному моделюванні ОА у тварин in vivo діацереїн ефективно зменшує запалення й ушкодження суглобового хряща, не впливаючи при цьому на синтез ПГ (Bendele A.M. et al., 1996).
Діацереїн розглядають як симптоматичний повільнодіючий препарат для лікування ОА (SYSADOA), у зв’язку із тим, що знеболювальний ефект настає через 2–4 тиж лікування, досягає максимуму через 4–6 тиж і зберігається протягом кількох місяців після закінчення терапії. У перші 2–3 тиж лікування при необхідності можна поєднувати терапію діацереїном із НПЗП або так званими простими анальгетиками. На фоні лікування діацереїном відзначали такі побічні ефекти:
- послаблення випорожнень (у 7% випадків) протягом перших кількох днів терапії, у більшості випадків зникає спонтанно;
- діарея, біль в епігастральній ділянці (у 3–5% випадків);
- нудота, блювання (у <1% випадків).
У Кокранівському огляді, опублікованому у 2006 р., узагальнені дані 7 контрольованих рандомізованих досліджень, опублікованих до 2004 р., у яких взяли участь 2026 пацієнтів (Fidelix T.S.A. et al., 2006). Цей метааналіз продемонстрував хоч і незначну, але постійну ефективність діацереїну при ОА. Так, діацереїн достовірно значимо зменшував інтенсивність больового синдрому порівняно з плацебо у хворих на ОА колінних та кульшових суглобів. Проте структурно-модифікуючий ефект продемонстровано лише для ОА кульшового суглобу (Dougados M. et al., 2001). Серед побічних явищ найчастіше виникала діарея (42%).
Результатами іншого метааналізу, проведеного B. Rintelen та співавторами (2006), в який увійшли 19 контрольованих рандомізованих досліджень із 23, що вдалося виявити в різноманітних базах даних щодо оцінки симптомомодифікуючого впливу діацереїну, встановлено, що діацереїн значно полегшував симптоми захворювання порівняно з плацебо та виявляв ефективність, подібну до такої у НПЗП, але на відміну від останніх, характеризується більш тривалим періодом дії. Водночас, маючи схожу з НПЗП переносимість, діацереїн не викликав тяжких побічних явищ, які часто реєструються при застосуванні НПЗП.
На результатах деяких із цих досліджень слід зупинитися більш детально. Так, саме M. Lesquesne та співавтори (1998) виявили, що потреба хворих на ОА колінних і кульшових суглобів у НПЗП на фоні лікування діацереїном була статистично значно меншою, ніж на фоні плацебо. Отримані дані дозволили рекомендувати останній як засіб, що модифікує структуру хряща для лікування пацієнтів із ОА (EULAR, 2003).
ECHODIAH (Evaluation of the chondromodulating effect of diacerein in hip osteoarthritis) — 3-річне рандомізоване подвійне сліпе плацебо-контрольоване дослідження, у рамках якого 507 хворих на коксартроз одержували діацереїн 100 мг/добу (255 пацієнтів) або плацебо (252 пацієнта) (Dougados M. et al., 2001). Оцінку прогресування звуження РСЩ здійснювали на рентгенограмах кульшових суглобів за допомогою спеціальної лінійки, виконаної зі збільшувального скла, градуйованої по 0,1 мм. Із дослідження вибули 238 (47%) пацієнтів головним чином у зв’язку з розвитком побічних ефектів (25% випадків у групі діацереїну і 12% — у плацебо-групі) та неефективності лікування (14% — у плацебо-групі та 7% — у групі діацереїну). Серед хворих, які застосовували діацереїн, рентгенологічне прогресування коксартрозу (звуження РСЩ на ≥0,5 мм) спостерігали значно рідше, ніж у групі плацебо (р<0,05). У пацієнтів, які завершили 3-річне лікування діацереїном ступінь звуження РСЩ (0,18± 0,25 мм/рік) була значно нижчою, ніж у групі хворих, які одержували протягом 3 років плацебо (0,23±0,23 мм/рік; р=0,042). Проте симптоматичної дії діацереїну в цьому дослідженні не відзначали. Переносимість діацереїну була задовільною, найчастішим побічним ефектом лікування був розлад випорожнень.
В іншому дослідженні отримані докази ефективності та вираженої післядії діацереїну порівняно з піроксикамом (Louthrenoo W. et al., 2007). Виражений анальгезивний еффект, що спостерігався наприкінці 16-тижневого лікування, зберігався і протягом наступних 8 тиж без лікування. Відзначено, що відповідь на терапію в кінці лікування була однаковою, а після припинення лікування (протягом 8 тиж спостереження) була у 2 рази більшою у групі хворих, яких лікували діацереїном (78 і 43% відповідно).
У контрольованому рандомізованому дослідженні, проведеному в Китаї, було включено 223 хворих на ОА колінних суглобів, 106 з яких отримували діацереїн і 107 — диклофенак протягом 12 тиж з подальшим спостереженням протягом 5 тиж (Zheng W.J. et al. 2006). Ефективність препаратів була практично одинаковою: покращання стану досягнуто у 65,4% хворих, які отримували діацереїн і у 61,6% — диклофенак. Виражена післядія спостерігалася лише у групі діацереїну протягом 4 тиж після припинення лікування. Переносимість діацереїну була хорошою, небажані побічні явища відмічали у 35,7% хворих, диклофенаку — у 45,1%.
Порівняння діацереїну з плацебо у 168 хворих на ОА колінних суглобів, які отримували лікування протягом 3 міс, виявило статистично значуще покращання у пацієнтів, які отримували діацереїн вже через 1 міс від початку терапії та збереження його до кінця лікування. Виражена післядія діацереїну спостерігалася протягом 2 міс після припинення лікування (Pavelka K. et al., 2007). Небажані побічні явища відмічали у 50% хворих, які одержували діацереїн і у 28,6% — плацебо (статистично недостовірне). Серед побічних явищ часто виникали послаблення випорожнень, діарея і гастралгія, які в більшості випадків припинялися при продовженні лікування. У частини хворих спостерігалася зміна забарвлення сечі, що не мало клінічного значення. Відхилення лабораторних показників функції нирок та печінки не зареєстроване.
Таким чином, проведені клінічні дослідження продемонстрували, що діацереїн є перспективним препаратом для лікування різних форм ОА.
Серед препаратів рослинного походження, що мають протиартрозний ефект, слід зазначити екстракт кореня імбиру (Zingiber officinale). Імбир широко використовувався в аюрведичній медицині — традиційній системі медичних знань і практики прадавніх індійців, що застосовували комбінації трав. Імбир використовується в Китаї та Індії для лікування при головному болю, нудоті, хворобах суглобів, гострих респіраторних інфекціях вже понад 2,5 тис. років (Grant К.L. et al., 2000). 6-gingerol і 6-shogaol, що містяться в імбирі, виявляють жарознижувальну, знеболювальну, протизапальну, протикашльову і гіпотензивну дію (Suekawa M. et al., 1984). Результати досліджень in vitro свідчать, що активні речовини, які входять до складу імбиру, здатні пригнічувати метаболізм арахідонової кислоти як циклооксигеназним, так і ліпооксигеназним шляхом (Backon J., 1986; Srivastava K.C. et al., 1992).
Дані численних клінічних досліджень демонструють ефективність екстракту імбиру в лікуванні хворих на ОА. Так, I. Wigler та співавтори (2003) у результаті 6-місячного подвійного сліпого плацебо-контрольованого дослідження екстракту імбиру в 29 хворих на гонартроз (6 чоловіків, 23 жінки) (за критеріями ACR, 1986) встановлено, що в перші 3 міс лікування ефективність екстракту імбиру (визначали за ВАШ болю і ФН) не відрізнялася від такої плацебо, проте до кінця 6 міс лікування екстракт імбиру був значно ефективнішим за плацебо (р<0,001). 1 хворий з основної та 7 — з контрольної групи вийшли із дослідження через неефективність лікування, 1 пацієнт з основної групи вийшов із дослідження у зв’язку з розвитком печії (при прийомі екстракту імбиру).
R.D. Altman та співавтори (2001) оцінили ефективність і безпеку стандартизованого і висококонцентрованого екстракту двох представників сімейства імбиру Zingiber officinale і Alpinia galanga у 261 хворого на ОА колінних суглобів у рандомізованому подвійному сліпому плацебо-контрольованому багатоцентровому в паралельних групах 6-тижневому дослідженні. Аналіз результатів свідчить, що до кінця дослідження в основній групі у 63%, а плацебо-групі — у 50% пацієнтів зменшилася вираженість болю в положенні стоячи більше ніж на 15 мм (р=0,048). При цьому вираженість болю в положенні стоячи в основній групі зменшилася на 24,5 мм, у плацебо-групі — на 16,4 мм (р=0,005), після проходження 50 футів — на 15,1 мм в основній групі і на 8,7 мм — у плацебо-групі (р=0,016). Також відзначена тенденція до більш вираженого зниження індексу WOMAC і зменшення прийому парацетамолу в основній групі, порівняно із плацебо-групою. Водночас пацієнти основної групи частіше відзначали розвиток побічних ефектів з боку ШКТ, однак всі вони були розцінені як легкі.
У проведеному в Україні відкритому порівняльному дослідженні ефективності комбінованого препарату, що містить екстракт імбиру та екстракт альпінії і диклофенаку, брали участь 30 хворих на гонартроз II–ІІІ рентгенологічної стадії за класифікацією Келлгрена — Лоуренса віком 50–70 років, що становили основну групу, які протягом 3 міс одержували цей препарат по 1 капсулі 2 рази на добу. У контрольну групу ввійшли 30 хворих на ОА, порівнянних за демографічними і початковими клінічними показниками з пацієнтами основної групи, які одержували диклофенак 100 мг/добу протягом 2 тиж, надалі — за необхідністю, з обов’язковим обліком прийому препарату в спеціально розроблених щоденниках. Усі хворі обстежені в умовах клініки з використанням стандартного протоколу обстеження суглобів, що включав індекс Лекена для гонартрозу, обсяг рухів у колінних суглобах, оцінку больового синдрому, рухливості та повсякденної активності за шкалою WOMAC. Лабораторне дослідження включало загальний і біохімічний для визначенням креатиніну аналізи крові. Всім хворим проводили УЗД колінних суглобів на апараті SONOLINE Omnia («Siemens») з лінійним датчиком з частотою 7,5 МГц в режимі ortho у стандартних позиціях.
В обох групах на фоні лікування визначали позитивну динаміку досліджуваних показників. В основній групі вже через 1 міс лікування відзначали статистично достовірне зниження альгофункціонального індексу Лекена й покращання обсягу рухів у суглобах, до кінця дослідження — значне (майже в 2 рази) зниження індексу Лекена і збільшення та нормалізацію обсягу руху в уражених суглобах. Водночас у контрольній групі спостерігали лише тенденцію до зниження індексу Лекена і покращання обсягу рухів у суглобах. Як через 1, так і через 3 міс після початку дослідження показники індексу Лекена та обсягу згинання були значно вищі в основній групі, а обсягу розгинання — значно нижчими, ніж у контрольній групі.
На початку дослідження у 30,4% хворих основної групи діагностований значно виражений (індекс Лекена 11–13 балів) і у 43,5% — виражений (8–10 балів) ступінь тяжкості ОА, до кінця дослідження у 34,5% пацієнтів відзначено середній (5–7 балів), 52% — слабкий (1–4 бали) ступінь тяжкості ОА. До кінця 3-го місяця дослідження альгофункціональний індекс Лекена у більшості хворих контрольної групи залишався на рівні значно вираженого та вираженого ступеня тяжкості.
У пацієнтів основної групи відзначали достовірний приріст і нормалізацію обсягу рухів у колінних суглобах, який до кінця 3 міс досяг фізіологічної норми (130–150°). У хворих контрольної групи також відзначалося збільшення обсягу рухів у суглобах, але середній показник не досяг норми.
При аналізі показників больового синдрому і функціонального стану пацієнтів основної групи за анкетою WOMAC (біль у спокої та при навантаженні, обмеження рухливості, утруднення в повсякденній діяльності) відзначено достовірне зниження всіх показників через 3 міс після початку дослідження. Так, через 3 міс лікування у цих пацієнтів вираженість болю у спокої у середньому зменшилась у 1,8 раза, 47% з них відзначили її зникнення.
Для виявлення лабораторних маркерів запалення проведено загальний аналіз крові з визначенням лейкоцитарної формули і СРБ кількісним методом.
За даними аналізу динаміки гострофазових реактантів, у хворих основної групи через 3 міс лікування спостерігали достовірну позитивну динаміку (р<0,05), причому у пацієнтів із вихідним рівнем СРБ >10 мг/л до кінця лікування відзначали зниження і нормалізацію цього показника.
Інші лабораторні показники не мали значимої динаміки в обох досліджуваних групах і перебували у межах вікової норми.
Таким чином, у пацієнтів основної групи відзначали явне зменшення явищ синовіту (2,5 раза), а повне зникнення випоту — майже у половини хворих (від 15 хворих із наявністю випоту на початку, до 8 — наприкінці лікування).
Після завершення 3-місячного лікування комплексним рослинним препаратом у пацієнтів практично не відзначалося двостороннього синовіту колінних суглобів. Відсутність явних запальних явищ у колінних суглобах до кінця терапії виявлено у більшості — 73,3% (на початку — не більше 50%) хворих. У пацієнтів контрольної групи позитивна динаміка даних УЗД була незначною.
Оцінка ефективності лікування хворим і лікарем практично не відрізнялася і свідчила про клінічну ефективність препарату. Таким чином, покращання різного ступеня вираженості вдалося досягти у 90% хворих основної групи. Також виявлено значний позитивний ефект щодо основних проявів ОА, таких як біль, обмеження рухливості, утруднення в повсякденній діяльності, зменшення явищ синовіту за даними УЗД, позитивна динаміка показників лабораторних досліджень. Необхідно зазначити, що достовірну позитивну динаміку основних клінічних проявів ОА виявили вже наприкінці 1-го місяця лікування.
Переносимість комплексного рослинного препарату була хорошою у 24 (80%) пацієнтів.
У 2 хворих побічні дії (розлад випорожнення, гастралгія) відзначалися в 1-й місяць, купірувалися замісною терапією: ферментними, антацидними, препаратами з в’яжучим ефектом, і не потребували відміни препарату, при цьому всі пацієнти закінчили курс лікування. Необхідно також зазначити, що у більшості учасників виявлені супутні серцево-судинні захворювання: артеріальна гіпертензія, ішемічна хвороба серця, серцева недостатність І ступеня. За час лікування не відзначено змін перебігу цих захворювань.
У контрольній групі побічні ефекти виявлено у 8 (26,6%) хворих, у 6 вони були розцінені як незначні, але потребували заміни препарату на ЦОГ-2-специфічний НПЗП (целекоксиб) і застосування коригувальної терапії. Із 12 хворих на артеріальну гіпертензію для 4 потребувалася корекція гіпотензивної терапії, з метою адекватного зниження артеріального тиску. Гастралгію та загострення хронічних захворювань ШКТ виявлено у 4 пацієнтів.
Неомилювані сполуки авокадо та сої екстрагуються із плодів авокадо і сої у співвідношенні 1:2. За даними досліджень in vitro, вони здатні пригнічувати ІЛ-1 і стимулювати синтез колагену культурою хондроцитів людини (Mouviel A. et al., 1989), пригнічувати ІЛ-1-індуковану продукцію стромелізину, ІЛ-6 та -8, ПГЕ2 і колагенази (Henrotin Y. et al., 1998). Клінічна ефективність неомилюваних сполук авокадо і сої у хворих на ОА колінних і кульшових суглобів була продемонстрована у двох рандомізованих плацебо-контрольованих дослідженнях (Blotman F. et al., 1998; Maheu E. et al., 1998). Після 6 міс лікування у хворих спостерігали статистично достовірну позитивну динаміку з боку ВАШ, індексу Лекена та зниження потреби в НПЗП. В Україні на сьогодні ці препарати не зареєстровані.
На рис. 12.15 наведено алгоритм лікування вперше виявленого ОА колінних суглобів.
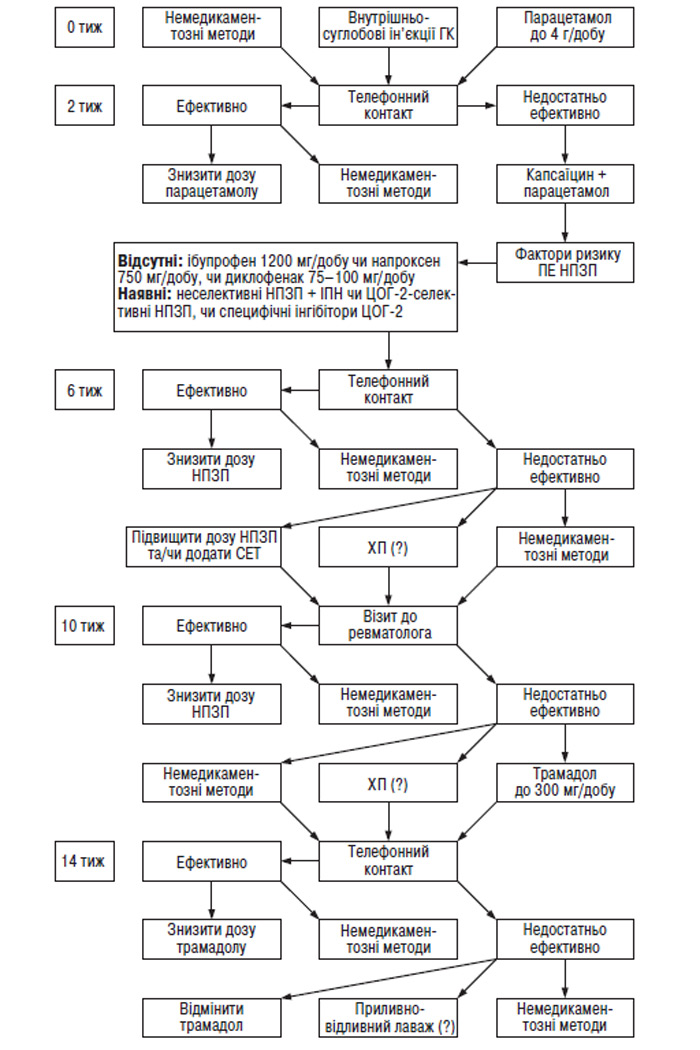
Рис. 12.15. Алгоритм лікування хворого із вперше виявленим ОА (за: Hochberg M.C. et al., 1995, зі змінами). ПЕ — побічні ефекти; ХП — хондропротектори; (?) — розглянути питання про необхідність використання
Диференційоване застосування хондроїтину сульфату, глюкозаміну гідрохлориду та їх комбінації в лікуванні хворих на ОА
На сьогодні в терапії при ОА використовують також комбіновані препарати, до складу яких входять глюкозаміну гідрохлорид і хондроїтину сульфат.
Відомо, що низькомолекулярний хондроїтину сульфат (молекулярна маса <16,900 Да) краще абсорбується в травній системі (Kelly G.S., 1998; Bali J.P. et al., 2001). 15% його абсорбується в тонкому кишечнику в незміненому вигляді навіть при молекулярній масі 5–50 тис. Да (Conte A. et al., 1995). Результати дослідження J. van Blitterswiik Wim та співавторів (2003) свідчать про необхідність дробового дозування хондроїтину сульфату, що забезпечує істотну кумуляцію речовини внаслідок неповної деполімеризації.
Крім того, що хондроїтину сульфат забезпечує додатковий субстрат для побудови нормального матрикса суглобового хряща, він виявляє протизапальну дію, в основному щодо клітинного компонента запалення, стимулює синтез гіалуронової кислоти і протеогліканів і пригнічує активність прозапальних цитокінів і протеолітичних ферментів (De los Reyes G.C. et al., 2000; van Blitterswiik Wim J. et al., 2003). Хондроїтину сульфат забезпечує сульфатування ушкоджених глікозаміногліканів, вивільняючи в клітини одиниці N-ацетилгалактозамін-сульфату, де останні є субстратом для глікозилтрансфераз у комплексі Гольджі (Sugahara K., Kitagawa H., 2000; van Blitterswiik Wim J. et al., 2003). Хондроїтину сульфат підвищує антиоксидантну ферментну активність печінки, знижує рівні малонового діальдегіду, дозозалежно перешкоджає розвитку оксидантного стресу, має властивості «скевенджера» вільних радикалів (Ha B.J., Lee J.Y., 2003).
Клінічні дослідження ефективності хондроїтину сульфату в лікуванні хворих на ОА підтвердили результати експериментальних досліджень. В. Mazieres та співавтори (1996) вивчали ефективність і переносимість хондроїтину сульфату у 120 пацієнтів з ОА колінних і кульшових суглобів у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні. Хворі протягом 3 міс приймали хондроїтину сульфат або плацебо з подальшою 2-місячною фазою спостереження, у ході якої оцінювали віддалені результати. Первинним критерієм ефективності служила потреба в НПЗП, виражена еквівалента диклофенаку (мг). По закінченню 3-місячного лікування пацієнти, які приймали хондроїтину сульфат, потребували значно меншої кількості НПЗП, ніж хворі групи плацебо, причому в період спостереження середня добова доза НПЗП продовжувала знижуватися. Аналіз вторинних критеріїв ефективності (ВАШ, індекс Лекена, загальна оцінка ефективності лікарем і хворими) також продемонстрував статистично достовірну перевагу досліджуваного препарату над плацебо. Переносимість хондроїтину сульфату була порівнянна з такою плацебо: побічні ефекти зареєстровано у 7 хворих основної групи (гастралгія, запор, діарея, набряклість повік) і у 10 — контрольної (гастралгія, нудота, діарея, сонливість, сухість у роті).
В іншому багатоцентровому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні проводили порівняльну оцінку ефективності й переносимості двох режимів дозування хондроїтину сульфату (1200 мг/добу в 1 або 3 прийоми) у хворих на ОА колінних суглобів (І–ІІІ стадії за класифікацією Келлгрена — Лоуренса) (Bourgeois P. et al., 1998). У хворих, які одержували хондроїтину сульфат, значно знижувався індекс Лекена і ВАШ (р<0,01), в той час як у групі плацебо спостерігали достовірну позитивну динаміку ВАШ (р<0,05) і недостовірну тенденцію до зниження індексу Лекена (р>0,05). Переносимість хондроїтину сульфату була задовільною і порівнянною з переносимістю плацебо (побічні ефекти відзначали у 16 із 83 хворих, які приймали хондроїтину сульфат, і у 12 із 44 хворих, які одержували плацебо).
У публікації L. Bucsi і G. Poor (1998) узагальнені результати 6-місячного рандомізованого подвійного сліпого плацебо-контрольованого дослідження ефективності й переносимості хондроїтину сульфату в дозі 800 мг/добу у 80 хворих на ОА колінних суглобів (I–III стадія за класифікацією Келлгрена — Лоуренса), проведеного у двох центрах. За даними ВАШ у групі хворих, які приймали хондроїтину сульфат, спостерігали повільне зменшення вираженості болю протягом всього дослідження (на 23% через 1 міс, на 36% — через 3 міс, на 43% — до кінця лікування), тоді як на фоні застосування плацебо встановлено незначне зниження показника (на 12% через 1 міс, на 7% — через 3 міс і на 3% — до кінця дослідження). Аналогічну динаміку спостерігали з боку індексу Лекена. Переносимість хондроїтину сульфату й плацебо була еквівалентною.
D. Uebelhart та співавтори (1998) у пілотному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні вивчали вплив хондроїтину сульфату (800 мг/добу протягом 1 року) на прогресування ОА колінних суглобів у 42 хворих. Результати цифрового автоматичного аналізу рентгенограм колінних суглобів, виконаних перед початком лікування і після його закінчення, свідчать, що у хворих, які приймали хондроїтину сульфат, стабілізувалася РСЩ у медіальному відділі великогомілково-стегнового відділу колінного суглоба, тоді як у групі плацебо спостерігали її достовірне звуження.
Глюкозаміну гідрохлорид — аміномоносахарид, що має хорошу біодоступність при пероральному застосуванні та сприятливий для ОА фармакокінетичний профіль, включаючи тропність до суглобового хряща. Він практично повністю (близько 90%) абсорбується в тонкому кишечнику, оскільки становить собою досить невелику молекулу (молекулярна маса — 179 Да) (Gregory S., Kelly N.D., 1998), добре розчинну у воді; абсолютна біодоступність глюкозаміну гідрохлориду становить 12–44%. Після прийому внутрішньо глюкозаміну гідрохлорид швидко надходить у суглобовий хрящ, який є для нього специфічною мішенню (Setnikar І. et al., 1986; 1993; Kelly G.S., 1998; van Blitterswiik Wim J. et al., 2003). Значна частина глюкозаміну гідрохлориду після перорального прийому відразу метаболізується у клітинах печінки. Вільний глюкозаміну гідрохлорид не виявляють у плазмі крові, таким чином, швидше за все, він зв’язується з білками плазми крові (Setnikar I. et al., 1986; 1993).
Протизапальна дія глюкозаміну гідрохлориду виражена незначною мірою, водночас він має високий стабілізувальний ефект на суглобовий хрящ, стимулюючи продукцію протеогліканів, і тим самим доповнює ефективність НПЗП, знижує потребу в них (Kelly G.S., 1998).
Є дані доказової медицини щодо глюкозаміну: в 16 рандомізованих контрольованих дослідженнях підтверджені як ефективність, так і безпека глюкозаміну при ОА. У 12 дослідженнях із 13 глюкозамін порівняно з плацебо більш ефективний. У 4 рандомізованих контрольованих дослідженнях, у яких порівнювали глюкозамін із НПЗП, глюкозамін виявився більш ефективним у 2 і рівним їм за ефективністю — ще у 2 дослідженнях.
У січні 2001 р. опубліковані дані J.V. Reginster та співавторів (2001) про те, що глюкозаміну сульфат значно сповільнює прогресування ОА, зокрема зменшує вираженість симптомів і покращує структуру хряща. Ці результати були підтвердженням даних незалежного дослідження, представленого в листопаді 2000 р. на 64-му щорічному мітингу ACR (Філадельфія) (Hughes R.A., Carr A.L., 2000).
Таким чином, глюкозамін зменшує вираженість симптомів ОА, покращує перебіг захворювання, не викликаючи серйозних побічних ефектів. Незважаючи на статус глюкозаміну як харчової добавки в деяких країнах, отримані дані свідчать про те, що до глюкозаміну потрібно ставитися серйозно.
Результати численних експериментальних досліджень in vitro та in vivo продемонстрували такі ефекти глюкозаміну гідрохлориду:
1. Зменшення деградації агрекану суглобового хряща шляхом пригнічення ферменту агреканази (Sandy J.D. et al., 1998; Ilic M.Z. et al., 2003; van Blitterswiik Wim J. et al., 2003).
2. Стимуляція мРНК і синтез білка агрекану, пригнічення продукції та ферментної активності ММП (Fenton J.L. et al., 2000; Gouze J.N. et al., 2001; Orth M.V. et al., 2002; van Blitterswiik Wim J. et al., 2003).
3. Пригнічення вироблення медіаторів запалення — ПГЕ2, оксиду азоту (Fenton J.L. et al., 2000; Gouze J.N. et al., 2001; Shikman A.R. et al., 2001; Orth M.V. et al., 2002; van Blitterswiik Wim J. et al., 2003).
4. Дозозалежне пригнічення активації NF-ҡβ, індукованого ІЛ-1β, а значить — пригнічення синтезу протизапальних медіаторів, стимульованого ІЛ-1β шляхом NF-ҡβ-залежного механізму (Largo R. et al., 2003).
5. Пригнічення експресії генів і синтезу ЦОГ-2, індуковані ІЛ-1β, відсутність впливу на синтез ЦОГ-1 (Largo R. et al., 2003).
6. Пригнічення вивільнення ПГЕ2 у матриксі суглобового хряща, стимульованого ІЛ-1β (van Blitterswiik Wim J. et al., 2003).
Клінічні дослідження демонструють високу симптоматичну ефективність глюкозаміну гідрохлориду у хворих на ОА. Так, у контрольованому дослідженні W. Noack та співавтори (1994) продемонстрували, що ефективність 4-тижневого лікування глюкозаміну гідрохлоридом пацієнтів із ОА в дозі 1500 мг/добу (n=126) значно перевищує таку у хворих, які одержували плацебо (n=126). Ефективність лікування стала очевидною через 2 тиж терапії, надалі протягом 2 тиж вираженість симптомів ОА продовжувала зменшуватися. Кількість побічних ефектів у хворих основної групи статистично не відрізнялася від таких у групі плацебо.
H. Muller-Fasbender та співавтори (1994) у рандомізованому подвійному сліпому плацебо-контрольованому дослідженні виявили, що у хворих на ОА колінних суглобів ефективність 4-тижневої терапії глюкозаміну гідрохлоридом у дозі 1500 мг/добу (n=100) еквівалентна такій ібупрофеном у дозі 1200 мг/добу (n=99). Глюкозаміну гідрохлорид поступається ібупрофену за швидкістю настання ефекту (через 2 тиж після початку терапії), однак за безпекою значно перевершував його (6% побічних ефектів у групі хворих, які приймали глюкозаміну гідрохлорид, і 35% — у тих, хто лікувався ібупрофеном; р<0,001). Передчасне припинення лікування зареєстровано в 1% хворих групи глюкозаміну гідрохлориду і у 7% — групи ібупрофену (р=0,035).
G.X. Qui та співавтори (1998) у дослідженні порівнювали вплив глюкозаміну гідрохлориду та ібупрофену на вираженість симптомів ОА колінних суглобів. Протягом 4 тиж 88 хворих одержували глюкозаміну гідрохлорид у дозі 1500 мг/добу і 90 — ібупрофен у дозі 1200 мг/добу із 2-тижневим періодом спостереження після закінчення курсу лікування. Автори виявили, що ефективність глюкозаміну гідрохлориду еквівалентна такій ібупрофену, одержаний ефект утримувався протягом 2 тиж після закінчення лікування.
J.Y. Reginster та співавтори (2001) вивчали вплив глюкозаміну гідрохлориду в дозі 1500 мг/добу (n=106) на прогресування структурних змін у суглобах і вираженість симптомів ОА у хворих на гонартроз порівняно із плацебо-групою (n=106) після 3 років лікування. У групі хворих, які одержували плацебо, спостерігали прогресування звуження РСЩ із середньою швидкістю 0,1 мм/рік, тоді як у хворих, які одержували глюкозаміну гідрохлорид, прогресування звуження РСЩ не виявили. Таким чином, до кінця 3 років лікування середнє і мінімальне звуження РСЩ у хворих, які приймали глюкозаміну гідрохлорид, було значно більшим, ніж у групі плацебо (р=0,043 і р=0,003 відповідно).
Одержані дані про механізми дії хондроїтину сульфату і глюкозаміну гідрохлориду створили передумови для комбінування обох субстанцій із метою потенціювання їх ефектів. Результати деяких експериментальних і клінічних досліджень підтверджують перспективність використання цієї комбінації. Так, L. Lippello та співавтори (2000) вивчали хондропротекторні властивості хондроїтину сульфату, глюкозаміну гідрохлориду і аскорбата магнію на експериментальній моделі ОА. Вивчення гістологічних зрізів суглобового хряща колінних суглобів кроликів, що одержували монотерапію зазначеними препаратами або їх комбінацію, показало, що при комбінованому лікуванні мікроскопічні зміни у хрящі за Mankin були значно менше виражені, ніж на фоні монотерапії. Результати пілотного рандомізованого подвійного сліпого дослідження ефективності комбінації хондроїтину сульфату і глюкозаміну гідрохлориду у осіб із різними захворюваннями скронево-нижньощелепного суглоба (в тому числі й з ОА) продемонстрували їх вищу ефективність і задовільну переносимість порівняно із плацебо (Nguyen P. et al., 2001).
Таким чином, на сьогодні нагромадилася достатня кількість інформації, що дозволяє визначити терапевтичну нішу для кожного із глікозаміногліканів, що просуваються на фармацевтичному ринку та їх комбінацій (табл. 12.16).
Таблиця 12.16
Глікозаміноглікани та їх розподіл
| Типи глікозаміногліканів | Склад дисахаридної одиниці | Локалізація |
| Гіалуронова кислота | D-глюкуронова кислота — D-глюкозамін (dGlcUA)—(dGlcNAc) | Склоподібне тіло, синовіальна оболонка, шкіра, хрящ, кістки, пухка сполучна тканина |
| Хондроїтин | d-GlcUA — D-галактозамін (d-GаINAc) | Рогівка, аорта |
| Хондроїтин-4-сульфат | d-GlcUA — d-GаINAc | Хрящ, рогівка, шкіра, кості, склера |
| Хондроїтин-6-сульфат | d-GlcUA — d-GаINAc | Хрящ, шкіра, сухожилля |
| Гепарин | L-ідуронова кислота — d-GlcNAc (1-idUA), або d-GlcUA — d-GlcNAc | Шкіра, легені, печінка, судини |
| Гепарин сульфат | d-GlcUA — d-GlcNAc, або I-idUA — d-GlcNAc | Легені, аорта |
| Кератан сульфат I | Галактоза (Gal) — d-GlcNAc | Рогівка |
| Кератан сульфат II | Gal — d-GlcNAc | Хрящ |
| Дерматан сульфат | I-idUA — d-GlcNAc, або I-idUA — d-GаINAc | Шкіра, сухожилля, склера, рогівка, серцеві клапани |
Новий напрямок терапії ОА — аутологічна кондиціонована сироватка (Orthokine)
На сьогодні необхідність у додаткових методах лікування хворих на ОА стимулює продовження пошуку альтернативних, симптомо-модифікуючих, а можливо, хворобо-модифікуючих, препаратів, з вагомою доказовою базою, основою терапевтичної дії яких є вплив на основні механізми патологічного процесу. Наразі встановлено, що ОА супроводжується механічною та біологічною дисфункцією суглоба, характеризується великою кількістю одноманітних молекулярних та біологічних процесів, центральним патологічним феноменом якого є деструкція гіалінового хряща. Одним із первинних молекулярних морфологічних проявів ОА є локальне звільнення цитокінів, найважливішим серед яких є ІЛ-1 — медіатор, що потенційно відповідає за деструкцію хряща (Goldring M.B., 2000; Goldring S.R., Goldring M.B., 2004; Karsenty G., 2005). Додаткове вироблення внутрішньоклітинних прозапальних факторів зумовлює подальшу деструкцію гіалінового хряща за рахунок дисбалансу метаболізму матриксу.Численні локальні методи лікування біологічного походження, що мають на меті впливати на дисбаланс цитокінів, знаходяться або на етапі розробки, або на початкових стадіях клінічного використання. Природний інгібітор ІЛ-1 — антагоніст рецептора ІЛ-1 (ІЛ-1ра) потенційно здатний обмежувати внутрішньосуглобову дію ІЛ-1 (Arend W.P., 2002a) і в такий спосіб контролювати патологічний процес. ІЛ-1рa є конкурентним рецепторним антагоністом ІЛ-1, афінним до рецепторів ІЛ-1 I та II типу (Arend W.P., 2002). Одна з гіпотез його впливу полягає в тому, що локальна концентрація ІЛ-1рa при дегенеративних захворюваннях опорно-рухового апарату є надто низькою для того, щоб пригнічувати деструкцію хряща, м’язів, структур хребта, та інших суглобових компонентів. Відрізняючись у деталях, опубліковані дослідження загалом доводять, що для ефективної блокади всіх рецепторів до ІЛ-1, або ІЛ-1-опосередкованих ефектів, потрібне 10–1000-кратне перевищення концентрації ІЛ-1рa над ІЛ-1 (Svenson M. et al., 1993; Arend W.P., 2002). Ці дані відображено у багатьох експериментах щодо зв’язування різноманітних рецепторів і зазвичай наведені рекомбінантними формами ІЛ-1рa, і, таким чином, не можуть повністю відображати природну біологічну функцію поліглікозильованого ІЛ-1рa-протеїну in vivo. На сьогодні невідомим залишається, чи повна блокада біологічно активних рецепторів ІЛ-1 необхідна для того, щоб здійснювати суттєвий вплив на такі патологічні стани, як ОА. Доведено, що багато з натуральних та рекомбінантних протизапальних цитокінів та розчинних рецепторів, що вводяться в організм, проявляють різні дисоційовані властивості для ІЛ-1α; -1β та -1рa (Svenson M. et al., 1993), можуть порушувати сигнальні властивості ІЛ-1-рецепторів і перешкоджати розвитку запалення.
Результати серії досліджень свідчили про ефективність ІЛ-1ра, що використовували у формі внутрішньосуглобових ін’єкцій на моделях ОА у собак та в пілотному дослідженні у людей (Evans C.H., 2005).
W.P. Arend та співавтори (2000; 2002) продемонстрували, що поверхнево-зв’язаний імуноглобулін G (IgG), як і молекули типу ліпополісахариду (ЛПС) форбол мирістат ацетат, ІЛ-1 та ФНП-α індукують продукцію ІЛ-1рa ізольованими людськими моноцитами. В результаті розроблено нову технологію, що дозволяє досягти подібної індукції ІЛ-1рa без необхідності покриття поверхні IgG. Експериментальне тестування різноманітних матеріалів, наприклад пластичних полімерів, скла та кварцу, призвело до ідентифікації боросилікатного скла як найбільш придатної поверхні для індукції ІЛ-1рa-продукції de novo та його акумуляції, без супутньої конкурентної продукції ІЛ-1β у цільній крові.
Метод, що базується на експозиції лейкоцитів крові на апірогенній поверхні (наприклад скляних сферах) викликає акумуляцію протизапальних цитокінів, таких як ІЛ-1ра, та різноманітних факторів росту, включаючи ІФР-1, тромбоцитарний фактор росту, ТФР-β1, у рідкій субстанції крові. Продукти, що звільняються мононуклеарами та тромбоцитами у процесі отримання аутологічної кондиційованої сироватки (АКС), що частково відбувається із внутрішньоклітинних резервуарів, а частково — синтезуються de novo. Невід’ємна частка акумуляції ІЛ-1рa відбувається шляхом синтезу de novo, як було продемонстровано в цільній людській крові шляхом пригнічення акумуляції ІЛ-1рa циклогексимідом (cycloheximide). Список цитокінів, присутніх в АКС, можливо, ширший, ніж виявлені у ній, а середні показники концентрації виявлених цитокінів мали високе стандартне відхилення, що вказує на значну варіабельність концентрацій цитокінів між особами (Evans C.H., 2005).
АКС розроблена у середині 90-х років ХХ ст. під час спроби отримати ін’єкційний матеріал, багатий на ендогенний ІЛ-1ра, для внутрішньосуглобових ін’єкцій як новий метод лікування ОА. Це спостереження лягло в основу виробництва АКС, яку вводять в уражений суглоб серією з 6 ін’єкцій (2 рази на тиждень протягом 3 тиж). Ін’єкція АКС в уражену тканину зумовила клінічну ефективність та безпеку в експериментальних моделях на тваринах та в дослідженнях, у тому числі у людини для лікування ОА, стенозу хребтового каналу, грижі міжхребцевих дисків та м’язових ушкоджень. Цей метод лікування на сьогодні доступний для населення кількох країн Європи, а також широко використовується для лікування ОА у коней. У останніх застосування АКС значно покращує клінічну симптоматику кульгавості й може захищати хрящ від деградації (Wehling P. et al., 2007). Попередні дані, отримані у ході декількох великих обсерваційних досліджень, дали поштовх для перевірки гіпотези, що АКС є кращою за фізіологічний розчин та ГК у ролі внутрішньосуглобової терапії для зменшення ознак та симптомів ОА колінного суглоба.
Було висунуто гіпотезу про те, що доклінічні та клінічні ефекти, які виявляють при використанні АКС, не можуть бути зумовлені окремими компонентами, а, очевидно, є результатом синергічної дії всіх факторів, що містяться в АКС. Стратифікація пацієнтів з ОА колінних суглобів за віком (Evans C.H., 2005) не виявила чіткої кореляції між визначеними в АКС рівнями ІЛ-1рa та лікувальним ефектом. Таким чином, клінічна ефективність не може бути зумовлена виключно концентрацією ІЛ-1рa. Із врахуванням того, що багато цитокінів (фактори росту) акумулюються у сироватці крові, стає зрозумілим, що клінічні ефекти, відмічені у проведених дослідженнях, можуть частково бути результатом ендогенних механізмів заживлення рани, активованих експозицією клітин крові до сторонніх поверхонь, що індукує такі механізми, як коагуляційний каскад та відновлення тканин.
Експериментальну модель ОА використовували у коней понад 10 років для оцінки патофізіологічних процесів та біологічних маркерів захворювання, а також контрольованої оцінки ефективності лікувальних субстанцій. У дослідженні, проведеному в Колорадському державному університеті, оцінювали вплив внутрішньосуглобового введення АKС, що застосовували для лікування експериментально індукованого ОА у 16 коней, на клінічні, біохімічні та гістологічні параметри (Wehling P. et al., 2007).
У експерименті ОА отриманий за допомогою артроскопії в одному середньому зап’ястному суглобі у кожного з 16 коней. 8 плацебо- та 8 АKС-лікованим коням, ін’єкційно вводили в уражений артритом суглоб: 6 мл фосфат-буферний сольовий розчин (ФБР) або 6 мл АKС на 14; 21; 28 і 35-й день відповідно; ФБР вводили в інший «хибнооперований» суглоб. Аналіз включав клінічну оцінку кульгавості та дослідження синовіальної рідини (проводили кожні 2 тиж); основні патологічні та гістологічні дослідження хряща, а також зразків синовіальної оболонки, що виконували при розтині піддослідних тварин (некропсії). Побічних явищ, пов’язаних із лікуванням, не виявлено. У коней, яких лікували АKС, відмічене значне клінічне покращання щодо кульгавості, на відміну від тих, яких лікували плацебо.
Аналіз синовіальної рідини суглобів, уражених і не уражених ОА, при лікуванні АKС показав збільшення відсоткового вмісту нейтрофільних гранулоцитів і загальної популяції лейкоцитів. Так, у суглобах, уражених ОА, відсотковий вміст лейкоцитів становив 11,4%, а в «хибно-оперованих» суглобах — 6,8%. Ці зміни не розцінювали як достовірні.
Концентрація ІЛ-1рa в синовіальній рідині (за оцінкою утилізації людських анти-ІЛ-1рa антитіл) була незмінною при лікуванні АKС, протягом усього періоду дослідження. При оцінці концентрації ІЛ-1рa у синовіальній рідині за оцінкою утилізації мишачих анти-IЛ-1рa-антитіл середні показники, підраховані для обох суглобів АKС-лікованих коней на 35-й та 70-й день, були значимо підвищені (р=0,005), порівняно із середніми величинами, підрахованими для обох суглобів коней, у які вводили плацебо.
Інше варте уваги спостереження цього дослідження: середня концентрація ІЛ-1рa в синовіальній рідині в усіх суглобах коней АKC-лікованої групи значно підвищувалася з часом порівняно із середньою величиною в усіх суглобах коней плацебо-лікованої групи. Ці відмінності ставали достовірними на 35-й день і залишалися значущими на 70-й день. Хоч концентрація ІЛ-1рa була у декілька разів вищою в уражених ОА суглобах, в які вводили АKС, припускається, що підвищена концентрація ІЛ-1рa у синовіальній рідині — явище системне. Подібне ставало очевидним після переносу генів кінського ІЛ-1рa. Ці дані дозволяють припустити, що введення ІЛ-1рa в організм стимулює ендогенне вироблення ІЛ-1рa.
При дослідженнях некропсій загальна кількість ерозій суглобового хряща і геморагій синовіальної оболонки в уражених ОА суглобах зменшувалася (з 4,2±0,6 до 2,9±0,6), однак ця різниця не була достовірною (р=0,093). Гістологічне дослідження синовіальної оболонки виявило значне зменшення вираженості гіперплазії інтими в суглобах, уражених ОА, при лікуванні АКС (кількість 0,4±0,3), порівняно з плацебо у суглобах, уражених ОА (кількість 1,3±0,3).
Результати цього дослідження (перше контрольоване дослідження на конях) показали значне покращання клінічних ознак і гістологічної картини в уражених ОА суглобах коней після лікування АKС порівняно з плацебо. На основі цих результатів досліджень виникла необхідність проведення подальших контрольованих досліджень для оцінки цього виду лікування з паралельним вивченням механізмів дії АKС (Wehling P. et al., 2007).
Перші дані щодо клінічної ефективності та безпеки АKС отримані в рандомізованому контрольованому дослідженні (Німецьке дослідження щодо остеоартриту, The German Osteoarthritis Trial, GOAT) університет Дюссельдорфа, Німеччина, представленому в 2007 р. на з’їзді Американської академії ортопедів-хірургів (American Academy of Orthopedic Surgeons, AAOS) у Сан-Дієго (Wehling P. et al., 2007; Baltzer A.W. et al., 2009).
Пацієнти з підтвердженим ОА колінних суглобів (n=376) були включені у проспективне рандомізоване подвійне сліпе дослідження із трьома паралельними групами, в якому проведене порівняння внутрішньосуглобових ін’єкцій АKС, гіалуронану та плацебо (сольовий розчин). Ефективність оцінювали за допомогою валідизованого опитувальника, який заповнювали пацієнти (індекс WOMAC — Western Ontario and McMaster Universities Arthritis Index), та ВАШ через 7 тиж, на 3-му і 6-му місяці лікування. Безпеку оцінювали за частотою і тяжкістю побічних явищ.
Пацієнти, включені в дослідження віком старше 30 років погодилися відмовитись від прийому всіх анальгетиків та НПЗП як мінімум на 6 міс. У всіх пацієнтів був ідіопатичний ОА тривалістю не менше 3 міс, діагноз встановлювали згідно з критеріями ACR; з рентгенографічними змінами колінних суглобів ІІ–ІІІ ступеня за класифікацією Келлгрена — Лоуренса і значенням ВАШ болю у положенні стоячи як мінімум 50 мм за 100-міліметровою шкалою на момент включення в дослідження. Для оцінки інтенсивності болю прийом анальгетиків та протизапальних препаратів був призупинений до початку терапії досліджуваними препаратами.
Період «відмивання» становив 2 тиж від включення в дослідження до першої ін’єкції. Протягом цього періоду пацієнтам дозволяли приймати парацетамол (до 4 г/добу) при необхідності як знеболювальний засіб на період дослідження, з можливістю використання у разі болю іншої локалізації.
Під час кожного візиту оцінювали дані щодо переносимості трьох досліджуваних препаратів за наявністю будь-яких побічних явищ з моменту останнього візиту. Побічні явища, що локалізувались у колінному суглобі, в який проводили ін’єкції, включали біль, набряк або випіт і розцінювалися таким самим чином (тобто як побічні явища), хоча вони також могли бути і симптомами ОА.
У результаті дослідження були рандомізовані й отримали лікування (як мінімум проведення однієї внутрішньосуглобової ін’єкції) 376 пацієнтів. Пацієнти у групі АKС отримали 6 ін’єкцій по 2 мл 2 рази на тиждень протягом 3 тиж; особи в групах гіалуронану та плацебо отримали 6 ін’єкцій по 2 мл 2 рази на тиждень протягом 3 тиж + 3 аплікації мазі (з проміжком в 1 тиж) за весь 3-тижневий період лікування. У зв’язку з різною в’язкістю медикаментів застосовувані лікарські засоби могли бути розпізнані при проведенні маніпуляцій лікарем, який здійснював процедуру, але не пацієнтом. Дослідник проводив ін’єкцію, а незалежний оцінювач, не залучений у процес лікування, оцінював ефективність та безпеку в того самого пацієнта. Таким чином, ані пацієнти, ані оцінювач не володіли інформацією про вид лікування. Пацієнт і оцінювач залишались «засліпленими» протягом всього періоду дослідження.
26-тижневе дослідження було завершене протоколом, заповненим у 345 хворих (345 колінних суглобів). В усіх групах лікування використання внутрішньосуглобових ін’єкцій приводило до значного зниження показників WOMAC. Проте відповідь на АKС була значно кращою. Сила відповіді на АKС порівняно як з гіалуронаном, так і з сольовим розчином, була достовірно вищою за сумарним індексом WOMAC в усіх часових точках. Описово на 26-му тижні кількість і відсоток пацієнтів як мінімум з 50% покращанням симптоматики (за сумарним індексом WOMAC), порівняно з вихідними рівнями, був найвищим у групі АKС. Середнє покращання у пацієнтів, які отримували гіалуронан та сольовий розчин, було меншим, ніж у групі АKС (p<0,001). Не виявлено достовірної різниці між лікуванням ін’єкціями гіалуронану та сольовим розчином (p>0,05).
Частота побічних реакцій була зіставна між групами АKС і плацебо (p>0,05), тоді як у групі гіалуронану їх було значно більше (p<0,05 порівняно з АKС і сольовим розчином). Зафіксовані лише місцеві побічні реакції. У цій серії не відмічено появи інфекційних ускладнень.
Результати дослідження показали, что АKС мала значний лікувальний ефект щодо головних симптомів ОА колінних суглобів через 6 міс. Хорошу переносимість цієї лікарської форми підтвердила мала кількість зареєстрованих побічних реакцій. Внаслідок аутогенного походження АKС потенційний ризик розвитку побічних реакцій після лікування цим лікарським засобом мінімальний. Результати свідчать, що АKС набагато ефективна і добре переноситься при лікуванні ОА колінних суглобів (Baltzer A.W. et al,, 2009)
Інші перспективні напрямки терапії ОА
На сьогодні деякі питання терапії ОА вивчені досить добре, а інші інтенсивно вивчаються, особливо це стосується встановлення нових тактик і напрямків терапії, які потенційно здатні загальмувати прогресування захворювання. Успішні результати нещодавно проведених досліджень у хворих на ОА визначили декілька напрямків, що, очевидно, відіграють важливу роль в еволюції розвитку хвороби та виникненні характерних структурних змін у суглобах. У табл. 12.17 наведено узагальнені стратегії, які є найбільш логічними, обнадійливими та перспективними напрямками розробки хворобо-модифікуючої терапії ОА.
Таблиця 12.17
Найбільш привабливі терапевтичні напрямки розробки лікарських засобів із хворобо-модифікуючою дією у пацієнтів із ОА (за: Pelletier J.P. et al., 2006)
| Мета | Приклади (за наявності) |
| Запальний процес |
|
| Ліганд до ППАР-γ* | |
| Деградація хряща | MMP-13, агреканаза-2 (ADAMTS-5) |
| Фактори ремоделювання субхондральної кістки |
*ППАР — пероксисом проліфератор-активований рецептор.
Вплив на запалену синовіальну оболонку
Серед важливих структурних змін, характерних для ОА, важливе місце належить запаленню синовіальної оболонки. Синтез та виділення численних медіаторів запалення тканиною є важливим фактором розвитку та/чи прогресування структурних змін при ОА. Як зазначалося раніше, серед усіх прозапальних факторів IЛ-1β відіграє центральну роль у патофізіології OA. Таким чином, фактори, які регулюють його синтез та/чи активність, є перспективними напрямками терапії ОА. Інший підхід є ширшим і включає активацію та підвищення рівня факторів, здатних пригнічувати прозапальні цитокіни та інші катаболічні фактори.
Для специфічного пригнічення продукції/активності IЛ-1β у серії досліджень продемонстровано можливість використання різноманітних підходів. Останні включають блокування рецепторів, нейтралізацію цитокінів розчинними рецепторами або моноклональними антитілами, блокування формування активного IЛ-1β або пригнічення сигнальних клітинних шляхів ІЛ-1β. Як зазначалося раніше, одним із перспективних напрямків є використання рекомбінантного людського ІЛ-1рa. Цей фактор є конкурентним антагоністом ІЛ-1, який блокує впливи ІЛ-1 без жодної встановленої агоністичної активності. Результати досліджень доводять, що анакінра (рекомбінантний людський IЛ-1рa), при підшкірному введенні, є безпечним та ефективним препаратом у хворих на РА, який здатен сповільнювати рентгенографічне прогресування захворювання (Schiff M.H. et al., 2004). Проте його швидкий кліренс, як і складність з’ясування питання, яка кількість введеного матеріалу акумулюється у суглобах уражених ОА, сприяли розвитку напрямку отримання лікарського засобу для внутрішньосуглобового введення (Chevalier X. et al., 2005). Відкрите проспективне багатоцентрове дослідження проводились із використанням шести дозувань IЛ-1рa від 0.05 мг до 150 мг. Дослідження було подвійно-сліпим щодо дози, яку призначали хворому. Достовірне покращання симптомів ОА колінних суглобів спостерігалося після 3 міс терапії у хворих, які отримували IЛ-1рa у дозі 150 мг. Результати пілотного дослідження, однак, не підтверджуються іншим нещодавно проведеною ІІ фазою подвійного сліпого дослідження (Chevalier X. et al., 2004).
Розчинні рецептори відіграють важливу фізіологічну роль у нейтралізації цитокінів. Трансмембранний домен обох ІЛ-1 рецепторів (рецептора І ІЛ-1 та рецептора ІІ ІЛ-1) чутливий до лізису протеазами, приводить до вивільнення розчинних форм рецепторів (рIЛ-1р). Вільний IЛ-1 зв’язується зі специфічними рIЛ-1р, призводячи до зменшення кількості IЛ-1, що здатен зв’язуватися зі специфічними мембранними рецепторами. Однак ІЛ-1рa також зв’язує рІЛ-1р, але зв’язувальна афінність рІЛр для обох ізоформ IЛ-1 та IЛ-1рa відрізняється. II тип рІЛ-1р більш швидко зв’язується ІЛ-1β порівняно з IЛ-1ра; водночас І тип рIЛ-1р зв’язує IЛ-1рa з більшою афінністю (Dinarello C.A., 1996). Саме тому стратегія використання ІІ типу рIЛ-1р самостійно або в комбінації з IЛ-1рa виглядає більш перспективною. Проте розчинні рецептори мають короткий період напіврозпаду у плазмі крові, саме тому необхідним є використання їх повторних доз із метою нейтралізації ефектів цитокіну. Це обмеження можна зняти за умови кон’югації розчинних рецепторів із протеолітичним фрагментом людського IgG, який потенційно здатен подовжити період напіврозпаду цих молекул. Інша альтернатива, яка може використовуватись аналогічно до стратегії використання ФНП-α — полімеризація розчинних рецепторів, що може знизити антигенні властивості молекул та подовжити період їх напіврозпаду.
Продемонстровано, що після зв’язування IЛ-1 з рецептором І клітинної мембрани для формування високоафінного рецепторного комплексу в процес залучається додатковий протеїн для ІЛ-1 (IL-1 receptor accessory protein) (IЛ-1рДП). Після утворення зазначений комплекс ініціює внутрішньоклітинний сигнальний каскад (Liege S. et al., 2000; Casadio R. et al., 2001). На моделі колаген-індукованого артриту, лікування з використанням рІЛ-1рДП було більш ефективним як профілактика (Smeets R.L. et al., 2003). Більше того, рIL-1рДП є специфічним клітинним інгібітором ІЛ-1, оскільки індукція функціонального пригнічення виникає лише при зв’язуванні IЛ-1 з рецептором ІЛ-1 І типу. Однак рIЛ-1рДП може також взаємодіяти із ІІ типом рецепторів рIЛ-1р, призводячи до формування розчинного IЛ-1 фагоцитарного рецептора. Результати досліджень довели, що рIЛ-1рДП зв’язується за типом ліганд-зв’язку з ІІ типом рIЛ-1р, підвищуючи афінність IЛ-1α та -1β до II типу рIЛ-1р приблизно у 100 разів, водночас лишаючи незмінною афінність IЛ-1рa до ІІ типу рIЛ-1р, таким чином збільшуючи пригнічення активності IЛ-1 як IЛ-1рa, так і рIЛ-1рДП (Smith D.E. et al., 2003).
Подібною до стратегії нейтралізації IЛ-1 є розроблений Economides та співавторами (2003) високоаффінний «капкан» для ІЛ-1 в результаті комбінації позаклітинних доменів як рецептора І типу ІЛ-1, так і IЛ-1рДП. Зазначений «капкан» IЛ-1 зв’язує переважно IЛ-1β. На сьогодні розпочато ІІ фазу КД щодо її використання у ролі терапії хворих на РА (Gabay C., 2003).
Використання антитіл проти IЛ-1 або І типу рецепторів ІЛ-1 є іншим напрямком нейтралізації цього цитокіну. Основним фактором, що зумовлює доцільність використання того чи іншого типу антитіл, є їх клінічна ефективність. Концепція зводиться до використання химерних або людських моноклональних антитіл, які мають бути менш імуногенними порівняно з мишиними моноклональними антитілами (вперше використаними у хворих на РА). Наразі відсутні будь-які дослідження щодо їх використання у пацієнтів із ОА.
IЛ-1β синтезується у вигляді попередника (про-IЛ-1β), задля утворення зрілого цитокіну має бути розщеплений цистеїнзалежною протеазою, що називається IЛ-1β-перетворювальний фермент (або каспаза-1). У тканинах, уражених ОА, зазначений фермент також залучається у процес дозрівання IЛ-1β (Saha N. et al., 1999). Крім того, він також є відповідальним за розщеплення та вивільнення зрілого IЛ-18. Таким чином, інгібітор зазначеного ферменту буде блокувати активацію двох дуже сильних прозапальних цитокінів. Встановлено, що інгібітор IЛ-1β-перетворювального ферменту здатен знижувати прогресування суглобового ураження у двох експериментальних моделях ОА у мишей (Rudolphi K. et al., 2003). Нещодавне КД, проведене за участю хворих на РА, було призупинене у зв’язку з високою токсичністю досліджуваного препарату.
Активність IЛ-1 опосередковується через його зв’язок лише з І типом рецепторів; ІІ тип рецепторів не опосередковує активність IЛ-1. Після зв’язування IЛ-1 з І типом рецепторів, виникає індукція множинного фосфорилювання, що регулює експресію генів. У цей процес залучаються серинтреонінові кінази родини мітогенактивованих протеїнкіназ та каскади NF-κB. На сьогодні встановлено, що суперродина мітогенактивованих протеїнкіназ складається із щонайменше трьох основних та окремих сигнальних шляхів: позаклітинних сигнал-регульованих протеїнкіназ, c-Jun амінозалишкових кіназ або стрес-активованих протеїнкіназ та кіназ родини р38.
На сьогодні лише в 1 експериментальному дослідженні in vivo виявлено терапевтичний ефект специфічного інгібітору позаклітинної сигнал-регулюючої протеїнкінази дослідження під назвою PD198306, у експериментальних кролів (Pelletier J.P. et al., 2003). При цьому відзначено достовірне зменшення структурних змін, зокрема ступеня деструкції хряща та ширини остеофітів, а також ступеня тяжкості синовіального запалення.
Інгібітори c-Jun амінозалишкових кіназ також продемонстрували профілактичний вплив на виникнення кісткової та хрящової деструкції при РА (Han Z. et al., 2001; Vincenti M.P. et al., 2001; Bogoyevitch M.A. et al., 2004). Однак небагато відомо про ефекти зазначених сполук у моделях OA. Нещодавно встановлено, що феніл N-терт-бутилнітрон, здатен знижувати IЛ-1-індуковану експресію ММП-13 шляхом пригнічення c-Jun амінозалишкового кіназного шляху у хондроцитах при OA (Ahmed S. et al., 2003).
Інгібітор p38 SB203580 виявляє протизапальний ефект у експлантатах хряща у тваринних моделях ОА. У експлантатах хряща биків, він блокував IЛ-1-опосередковане розщеплення колагену, в той же час деградація протеоглікану залишалася незмінною (Ridley S.H. et al., 1997). Незважаючи на те що інгібітори p38 мітоген-активованих протеїнкіназ сповільнюють синтез протеогліканів хряща у відповідь на ТФР-β, їх синтез у відповідь на ІФР-I залишається незмінним. На моделях РА у вигляді колаген-індукованного артриту у тварин SB203580 пригнічував продукцію ФНП-α та IЛ-6, знижував ступінь запалення, сповільнював швидкість формування суглобових уражень (Badger A.M. et al., 1996). Крім того, інгібітори p38 також здaтні знижувати рівень NO.
Блокування індукованого NO
NO — цікава ціль у контексті ОА щонайменше з двох причин. По-перше, NO та його побічні продукти здатні до індукції запальної складової ОА; NO може підвищувати активність ЦОГ-2/ПГЕ2 та є відповідальним за посилення ознак і симптоматики захворювання. По-друге, NO здатен викликати ураження та деструкцію тканин. Саме тому, існує припущення, що зниження рівнів індукованої NO-синтази (ферменту, відповідального за посилену продукцію NO) може не лише зменшувати симптоматику, але й потенційно здатне сповільнювати прогресування ОА, дозволяючи впливати на обидві ланки процесу одночасно. Зазначена гіпотеза підтримується позитивними результатами досліджень in vivo щодо вивчення прогресування уражень суглобів у дослідженнях, проведених на моделях ОА у коней (Pelletier J.P. et al., 1998; 1999; 2000).
Пероксисом проліфератор-активований рецептор гамма (ППАР-γ)
Пероксисом проліфатор-активовані рецептори (peroxisome proliferator-activated receptors) (ППАP) — нуклеарні фактори транскрипції, що діють як протизапальні агенти. На сьогодні ідентифіковано та клоновано три різні ППАР: ППAР-α, -β та -γ. Серед усіх ППАP існує припущення, що ППAР-γ є ключовим фактором, що діє як основний протизапальний агент. Установлено, що ППАР синтезуються різноманітними клітинами, включаючи людські хондроцити та синовіальні фібробласти (Fahmi H. et al., 2001; 2002). Більше того, дезокси-δ12, 14 ПГJ2, метаболіт ЦОГ-2-активності, природний ліганд ППAР-γ, який демонструє також протизапальні властивості, що реалізуться ППAР-γ-залежним абo ППAР-γ-незалежним способом. In vitro дезокси-δ12, 14 ПГJ2 пригнічує IЛ-1-індуковану продукцію MMП-13, ЦОГ-2, NO, а також деградацію протеоглікану в хондроцитах, тa IЛ-1-індуковану мікросомальну ПГE синтазу-1 у синовіоцитах (Bordji K. et al., 2000; Boyault S. et al., 2001; Cheng S. et al., 2004); останній фермент є ключовим кроком при формуванні ПГE2. In vivo синтетичні ліганди ППAР-γ — розиглітазон та піоглітазон — зменшували вираженість симптомів запалення та гістологічних уражень у моделі колагеніндукованого артриту (Cuzzocrea S. et al., 2003), а також у моделі ОА у гвінейських свиней (Kobayashi T. et al., 2005) відповідно.
Мішень — деструкція хряща
Одна із основних причин деградації хряща полягає у деструкції матриксу, що індукується підвищеними рівнями цілого ряду протеолітичних ферментів, основними серед яких є дві родини ферментів: ММП, які руйнують основні компоненти позаклітинного матриксу, та ADAMTS – родина, що опосередковує переважно втрату агрекану хряща.
У людському хрящі, ураженому OA, найбільш значимими ММП є колагенази, стромієлізин та желатинази. Пригнічення синтезу/активності цих ферментів у ролі лікування ОА знаходиться у фокусі інтенсивних досліджень вже протягом багатьох років. На сьогодні найбільш перспективною стратегією є використання хімічних молекул, що блокують активність ММП. Активність ММП контролюється цілим рядом шляхів, але найважливіші стосуються пригінчення їх синтезу і трансформації попередників у активні форми ММП. Ефективність цілої низки цих компонентів вже вивчається у КД, причому отримані дані демонструють, що використання інгібіторів ММП може викликати деякі побічні явища з боку опорно-рухового апарату, зокрема відчуття скутості у суглобах, фіброплазії суглобів, а також акумуляцію колагену І типу в уражених суглобах (Renkiewicz R. et al., 2003). Припускається, що пригнічення шеддази (sheddase) (специфічного пригнічення перетворювального ферменту ФНП-α/ADAM-17) може бути відповідальним за зазначені побічні явища. Спроби розробки лікарських засобів наразі спрямовані на селективне пригнічення протеаз, більше ніж широке пригнічення їх активності. Основна причина цього базується на гіпотезі, що зазначений напрямок дозволить уникнути певних побічних явищ. Проте розробити сполуки, що мають селективно пригнічувати активність окремих представників ММП, досить важко. На сьогодні MMП-13 був визнаний найбільш привабливою мішенню для лікування ОА, і зараз вже розроблені сполуки, що виявляють переважно ММП-13-селективну активність (Engel C.K. et al., 2005; Wu J. et al., 2005).
Доксициклін (аналог тетрацикліну) продемонстрував у дослідженнях in vitro та ex vitro здатність пригнічувати синтез та активність колагенази, желатинази та знижувати прогресування захворювання у двох моделях на тваринах при застосуванні у ролі профілактичного лікування. У нещодавно проведених дослідженнях встановлено, що при пероральному використанні доксициклін здатен сповільнювати рівень рентгенологічного прогреcування ОА колінних суглобів (Brandt K.D. et al., 2005).
Протеази, відповідальні за розщеплення агрекану, називаються агреканазами. У тканинах суглоба виявлено 2 зазначених ферменти — агреканаза-1 тa агреканаза-2 (Abbaszade I. et al., 1999; Tortorella M.D. et al., 1999). Зазначені ферменти належать до родини ADAMTS та були в подальшому названі ADAMTS-4 тa ADAMTS-5 відповідно. Результати досліджень встановили, що ADAMTS-5 є превалюючим ферментом, залученим у процес при ОА (Glasson S.S. et al., 2005; Stanton H. et al., 2005). Синтезовані інгібітори зі спрямованою дією проти MMП часто паралельно пригнічують активність агреканаз. Однак справжнього селективного інгібітора агреканази досі не виявлено, спроби виявити інгібітори ФНП-α-перетворювального ферменту виявили цілий ряд компонентів з вираженою агреканазною селективністю (Cherney R.J. et al., 2003). Так, виявлено селективний інгібітор агреканази та MMП-13 (Noe M.C. et al., 2005).
Вплив на ремоделювання субхондральної кістки
Основна мета лікування хворих на ОА — покращення стану чи запобігання деформації та деструкції структур суглобів пацієнта. Існує гіпотеза, що при ОА субхондральна кістка більше, ніж хрящ може бути місцем основних патофізіологічних подій (Lajeunesse D. et al., 2003; Martel-Pelletier J. et al., 2005). Саме тому відома є думка, що напрямки терапії, здатні впливати на ремоделювання кістки, можуть блокувати або щонайменше пом’якшувати прогресування не лише змін у тканинах, але й зміни хряща. У більшості досліджень при доклінічних моделях ОА виходили з того, що зміни у субхондральній кістці носять переважно резорбтивний характер, саме тому існує припущення, що перспективним напрямком для сповільнення прогресування ОА є призначення антирезорбтивних агентів.
При лікуванні кальцитоніном (Manicourt D.H. et al., 1999) у експериментальних собак з AКС-моделлю OA виявлено зниження рівня у сечі біомаркерів кісткової резорбції (pyridinium crosslinks), тяжкості патологічних змін хряща та розміру остеофітів. Подібні результати відзначено у аналогічній експериментальній моделі ОА при використанні бісфосфонату етиндронату (Myers S.L. et al., 1999; Howell D.S. et al., 1999) та у АКС моделі ОА у крис (Hayami T. et al., 2004) при лікуванні алендронатом. Ефект алендронату був пов’язаний з його дією на зниження локального синтезу активного ТФР-β та MMП-9 у кістці, a також MMП-13 у хрящі. Ці результати співпадають з дослідженням, що проводилося на АКС моделі у собак з використанням лікофелону, подвійного інгібітору 5-ЛОГ та активності ЦОГ, що пригнічує розвиток патологічних змін хряща та резорбцію субхондральної кістки шляхом зниження синтезу ММП-13 та катепсину К (Pelletier J.P. et al., 2005). Загалом ці дані посилюють уявлення про те, що терапевтичні втручання, що ефективно пригнічують кісткову резорбцію, потенційно можуть розглядатись як напрямок базисної терапії ОА.
Більшість останніх досягнень щодо базових молекулярних патологічних механізмів, що призводять до кісткового ремоделювання/резорбції при захворюваннях суглобів, таких як ОА, допоможуть відкрити нові терапевтичні стратегії у клінічній практиці. Наприклад, вже продемонстровано, що деякі фактори, зокрема ліганд активуючого рецептора нуклеарного фактору-κB (receptor activator of nuclear factor-κB (RANK) ligand) тa oстеопротегерин є ключовими факторами, залученими у процес кісткової резорбції. Надмірна продукція RANK-ліганду та/чи дефіцит остеопротегерину здатні таким чином викликати підвищення кісткової резорбції. Проводяться дослідження щодо використання остеопротегерину та анти-RANK-ліганду антитілами з метою перевірки їх ефективності у лікуванні остеопорозу (McClung M.R. et al., 2006) тa кісткових ерозій у хворих на РА. Потенціал зазначених агентів у ролі базисних препаратів ОА дуже великий із врахуванням важливого місця ремоделювання субхондральної кістки при ОА та його можливої ролі у патофізіології деградації хряща. Лише результати відповідних КД будуть здатні дати відповіді на це запитання.
Фармакогеноміка
Швидкий розвиток знань у галузі геноміки та протеоміки зумовив революційний підхід до нових напрямків терапії цілого ряду захворювань. Присутність лише клітин однієї популяції у тканині хряща значно полегшує отримання генотеку комплементарної ДНК тканин здорового та ураженого ОА хряща, які є необхідними для визначення білків-мішеней. Останні можуть використовуватися для скринінгу потенційно перспективних сполук.
Вже ідентифіковано декілька генів кандидатів — потенційних мішеней для терапії ОА (Attur M.G. et al., 2000; Aigner T. et al., 2001; 2002; Bau B. et al., 2002; Cho C.H., Nuttall M.E., 2002; Bateman J., 2005), включаючи цілий ряд молекул, таких як катепсин К, каспази, ММП, цитокіни. Сподіваємося, що цей терапевтичний напрямок приведе до швидкого та успішного лікування ОА у майбутньому.
Генна терапія
Сучасне використання генної терапії у лікуванні ОА — результат успіхів у ідентифікації основних патофізіологічних механізмів, що лежать в основі захворювання. Основним принципом генної терапії є те, що захворювання слід лікувати, виходячи з контролю експресії цілого ряду генів, що є відповідальними за синтез факторів, залучених у процес деградації хряща (антикатаболічні) та/чи тих, що сприяють відновленню хряща (анаболічні) (Gelse K. et al., 2005). Основною перевагою використання генної терапії є те, що на додаток до забезпечення більш ефективного варіанта отримання молекул, молекули потрапляють у точно визначене місце. Для захворювань суглобів існує можливість переносу генів непрямим методом використовуючи клітини хазяїна або прямим шляхом використання плазмідної ДНК, створюючи різні типи переносників задля покращання ефективності. Досі перенос генів у синовіальну оболонку був більш успішним, аніж перенос генів у хрящ.
Вже ідентифіковано цілий ряд природних молекул, які можуть протидіяти зв’язуванню цитокіну з його рецептором. Серед них IЛ-1рa (вищезазначено) інтенсивно вивчається щодо його здатності протидіяти розвитку та прогресуванню ОА. Дослідження продемонстрували позитивні ефекти при використанні стратегії генної терапії in vivo з використанням IЛ-1рa на двoх експериментальних моделях OA (Pelletier J.P. et al., 1997; Fernandes J.C. et al., 1999). Більше того, функціональна геноміка з відновлення людських рецепторів ІІ типу IЛ-1р із використанням генної терапії, проведена in vitro на хондроцитах людини і тварин, продемонструвала, що відновлення II типу IЛ-1р достовірно захищає клітини від сигналів IЛ-1 (Attur M.G. et al., 2002).
На сьогодні вивчається цілий ряд стратегій, що приводять до стимуляції анаболізму хряща та репарації структур суглобів. Це включає використання факторів росту, таких як представники родини ТФР-β, ІФР-I тa фактору росту фібробластів, які продемонстрували здатність до стимуляції формування репараційних тканин, схожих на гіаліновий хрящ. Саме тому видавалося можливим, що перенос зазначених генів до ОА клітин суглоба, наприклад хондроцитів, може стати важливим напрямком базисної терапії ОА щодо відновлення ушкодженого хряща. Однак, хоча використання факторів росту може бути успішним у репарації дефектів хряща у осіб молодого віку, їх може бути недостатньо для репарації уражень, що виникають внаслідок персистенції тривалого дегенеративного ОА процесу, при якому старі клітини стають нечутливими до цілого ряду факторів росту або інших факторів, з якими вони взаємодіють. Більше того, використання факторів росту у терапії ОА — окремий напрямок для подальших досліджень, із рядом проблем, які потребують вирішення: серед них ефективність впливу деяких факторів росту на формування остеофітів та їх неспроможність протидіяти впливу цілого ряду катаболічних факторів.
Кількість засобів, які можуть модифікувати перебіг ОА, доступних на сьогодні, надзвичайно мала. Однак основні успіхи у розумінні процесу захворювання та останні розробки з використанням нових технологій, які можуть оцінити та якісно визначити еволюцію структурних змін при ОА, все це є складовими для розробки нових і ефективних базисних препаратів для терапії ОА.
Концепція Національного інституту здоров’я та клінічного мистецтва (National Institute for Health and Clinical Excellence) основних принципів терапії, яку має отримувати кожен хворий на ОА, наведена на рис. 12.16.
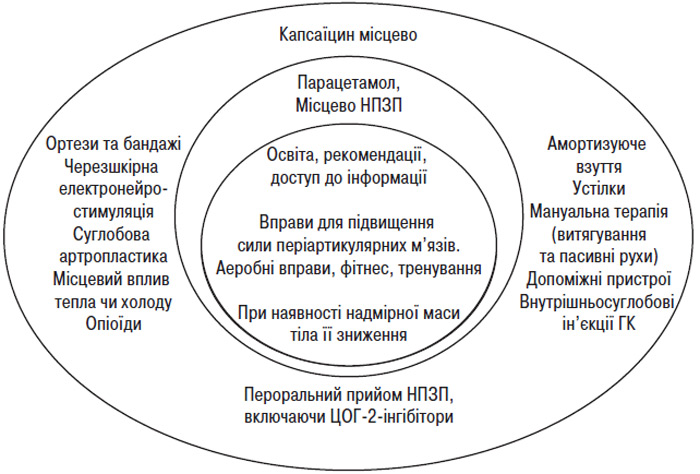
Рис. 12.16. Концепція Національного інституту здоров’я та клінічного мистецтва (National Institute for Health and Clinical Excellence) основних принципів терапії, яку має отримувати кожен хворий на ОА з додатковими методами, що підбираються кожному пацієнту індивідуально чи в різні періоди
ХІРУРГІЧНЕ ЛІКУВАННЯ
У монографії ми не мали за мету освітити всі аспекти терапії при ОА, зокрема хірургічне (ортопедичне) лікування. Однак, враховуючи наш досвід, дозволимо дати рекомендації. Терапевт має пам’ятати, що кожний пацієнт із ОА, який прийшов на прийом, незалежно від стадії захворювання, потребує консультації ортопеда, який вирішує питання про необхідність і обсяг хірургічного втручання. Рекомендації хірурга-ортопеда слід обов’язково враховувати. Хірургічне лікування при гонартрозі може варіювати від малоінвазивних методик (артроскопічні операції) до повної заміни суглоба протезом (ендопротезування) — найбільш радикального на сьогодні методу лікування (Craemer P., Hochberg M.C., 1997). Крім того, розробляються нові методи хірургічного лікування (ало- і аутологічна трансплантація хряща чи його клітин), спрямовані більше на профілактику захворювання, особливо після травми, ніж на лікування.
Показання до хірургічного лікування
Артроз плеснофалангового суглоба I пальця:
- постійний різкий біль;
- неможливість носити звичайне взуття.
Коксартроз І і ІІ стадії:
- розвантажувальні операції спрямовані на переміщення навантаження на відділи, що менш патологічно змінені.
Коксартроз III і IV стадії:
- проводиться ендопротезування;
- закриття суглоба — артродез.
Гонартроз:
- при І і ІІ стадії гонартрозу проводять коригувальну остеотомію з метою переміщення навантаження на інші менш патологічно змінені відділи;
- у пізніх стадіях проводять ендопротезування.
САНАТОРНО-КУРОРТНЕ ЛІКУВАННЯ
На курортне лікування направляють хворих на ОА I–III рентгенологічної стадії за класифікацією Келлгрена — Лоуренса без синовіту або при його нерізкому загостренні. Показані курорти, на яких використовують лікувальну грязь, а також курорти із хлоридними, натрієвими та іншими мінеральними водами (в Україні — Бердянськ, Євпаторія, Одеса, Саки), із сірководневими, радоновими водами (в Україні — Хмільник), з азотними слабкомінералізованими крем’янистими термальними водами. На санаторно-курортне лікування не направляють хворих на ОА IV стадії з різким загостренням синовіту і наявністю протипоказань до санаторно-курортного лікування.
Критерії якості лікування:
1. Відсутність або значне зменшення проявів суглобового синдрому, відсутність рецидивів синовіту.
2. Покращання якості життя пацієнта.
3. Сповільнення рентгенологічного прогресування процесу, деструктивних змін суглобових хрящів (УЗД суглобів, МРТ).
КЛІНІЧНА КЛАСИФІКАЦІЯ, РЕКОМЕНДОВАНА АСОЦІАЦІЄЮ РЕВМАТОЛОГІВ УКРАЇНИ, 2004
I. Первинний (ідіопатичний)
А. Локалізований (<3 суглобів)
1. Суглоби кистей
2. Суглоби стоп
3. Колінні суглоби
4. Кульшові суглоби
5. Хребет
6. Інші суглоби
Б. Генералізований (≥3 суглобів)
1. З ураженням дистальних і проксимальних міжфалангових суглобів (вузлики Гебердена і/або Бушара)
2. З ураженням великих суглобів
3. Ерозивний
II. Вторинний
А. Посттравматичний
Б. Вроджені, набуті або ендемічні захворювання (хвороба Пертеса, синдром гіпермобільності тощо)
В. Метаболічні захворювання
1. Охроноз
2. Гемохроматоз
3. Хвороба Вільсона
4. Хвороба Гоше
Г. Ендокринопатії
1. Акромегалія
2. Гіперпаратиреоз
3. Цукровий діабет
4. Гіпотиреоз
Д. Хвороба відкладання кальцію (фосфат кальцію, гідроксилапатит)
Е. Нейропатія (хвороба Шарко)
Є. Інші захворювання (аваскулярний некроз, РА, хвороба Педжета та ін.)
III. Рентгенологічна стадія (за класифікацією Келлгрена — Лоуренса): 0, I, II, III, IV
IV. Синовіт
- Із синовітом
- Без синовіту
V. Функціональна недостатність (ФН) суглобів
- ФН 0 (збережена)
- ФН I (працездатність тимчасово обмежена)
- ФН II (працездатність втрачена)
- ФН III (потребує сторонньої допомоги)
СХЕМА ЛІКУВАННЯ ПРИ ОА, ЗАПРОПОНОВАНА АСОЦІАЦІЄЮ РЕВМАТОЛОГІВ УКРАЇНИ, 2004
1. Протизапальна й знеболювальна терапія:
а) Анальгетики:
- ненаркотичні: парацетамол — до 2 г/добу за потребою;
- наркотичні (лише у разі неефективності чи непереносимості інших препаратів нетривало): трамадол — 50 мг 3 рази на добу;
б) НПЗП — селективні інгібітори ЦОГ-2:
- мелоксикам — по 7,5–15 мг 1 раз на добу;
- німесулід — по 100 мг 2 рази на добу;
- целекоксиб — по 200 мг 1–2 рази на добу;
в) НПЗП — неселективні інгібітори ЦОГ:
- диклофенак натрію — по 100–150 мг/добу;
- диклофенак калію — по 100–150 мг/добу;
- інші.
г) препарати СЕТ:
- комбінований ензимний препарат (трипсин, бромелаїн, рутозид) — по 2–3 таблетки 3 рази на добу протягом 3 тиж;
- комбінований ензимний препарат (панкреатин, папаїн, бромелаїн, ліпаза, амілаза, трипсин, хімотрипсин, рутозид) — по 5 таблеток 3 рази на добу по 2–3 тиж у подальшому з переходом на 3 таблетки 3 рази на добу тривалий час;
д) пролонговані форми ГК внутрішньосуглобово (при неефективності інших протизапальних препаратів — не більше 4 ін’єкцій на рік):
- метилпреднізолон — доза 20–40 мг залежно від розміру суглобів;
- бетаметазон — до 2 мг залежно від розміру суглобів.
е) екстракт імбиру — по 1 капсулі 2 рази на добу.
2. Хондропротектори (препарати повільної дії):
а) пероральні:
- хондроїтину сульфат — по 500 мг 2 рази на добу протягом не менше 6 міс;
- глюкозаміну сульфат — по 500–1500 мг 1 раз на добу протягом 2–3 міс;
- діацереїн по 50 мг 2 рази на добу:
б) парентеральні:
- гіалуронова кислота — по 20 мг внутрішньосуглобово 1 раз на тиждень протягом 2 тиж, 3 цикли кожні 3 тиж.
3. Місцеве застосування НПЗП у формі мазі та гелю:
- диклофенак та його солі у формі гелю;
- ібупрофен у формі гелю та крему;
- піроксикам у формі гелю;
- кетопрофен у формі гелю;
- інші.
4. Препарати, що покращують мікроциркуляцію:
- пентоксифілін — по 100 мг 3 рази на добу;
- дипіридамол — по 75 мг/добу.
5. Ортопедичне лікування:
а) І–ІІ рентгенологічна стадія за класифікацією Келлгрена — Лоуренса:
- коригувальні остеотомії при дисплазії чи біомеханічних відхиленнях;
б) ІІІ–IV рентгенологічна стадія за класифікацією Келлгрена — Лоуренса:
- тотальне ендопротезування;
- артродез ураженого суглоба у функціонально зручному положенні.
6. Лікувальна фізкультура.
7. Фізіотерапевтичні процедури.
8. Санаторно-курортне лікування.
ПРОФІЛАКТИКА ОА
Первинну профілактику ОА слід проводити ще в дитячому віці. Необхідно стежити за правильною позою дитини за шкільною партою, щоб уникнути розвитку юнацького сколіозу з подальшим розвитком деформівного спондильозу. Дітям необхідні систематичні заняття гімнастикою для зміцнення м’язово-зв’язкового апарату. При наявності хоча б незначної плоскостопості потрібно наполегливо рекомендувати носіння супінаторів для запобігання подальшого опускання склепіння стопи. При вроджених і набутих порушеннях статики (сколіоз, кіфоз, дисплазія кульшового суглоба, О-подібні або Х-подібні нижні кінцівки, плоскостопість) необхідна консультація ортопеда для ранньої корекції цих порушень.
Дорослим людям з надмірною масою тіла й артралгією і особливо особам, у родинах яких є хворі на артроз, необхідно стежити за правильним співвідношенням між ростом і масою тіла, не перевантажувати суглоби, уникати під час виконання роботи фіксованих поз. Слід виконувати фізичні вправи (без перевантаження суглобів), особливо рекомендується плавання з обов’язковим подальшим відпочинком. Корисні загальнозміцнювальні заходи — невеликі прогулянки з відпочинком, ранковий душ або обтирання, з метою покращання кровообігу та обміну речовин. Особам молодого віку слід враховувати сімейну схильність до ОА, при виборі професії уникати видів праці, пов’язаних із перевантаженням і мікротравматизацією окремих суглобів (наприклад при наявності у матері вузликів Гебердена і/або Бушара недоцільно займатися роботою, пов’язаною з підвищеним динамічним навантаженням на суглоби пальців рук, наприклад друкування на машинці). Таким людям також не слід займатися важкими видами спорту (важка й легка атлетика, бокс, ковзанярський спорт тощо).
При наявності хоча б мінімальних дисплазій і порушень статики (наприклад невеликого сколіозу) необхідна консультація ортопеда та відповідне лікування.
Вторинна профілактика полягає в дотриманні заходів, що перешкоджають рецидивуванню синовіту, — дозована ходьба, полегшена праця, ходьба з опорою та інші заходи, що розвантажують суглоби.
Прогноз
У хворих на коксартроз (особливо, якщо він розвинувся на фоні дисплазії кульшового суглоба) протягом кількох років може настати повна інвалідизація, особливо при розвитку атрофічної форми коксартрозу (25% випадків). При інших локалізаціях хвороби інвалідність настає рідко, проте часті випадки тимчасової втрати працездатності внаслідок загострення симптомів суглобового синдрому.
При повільному прогресуванні хвороби, а також при локалізації артрозу в кількох дрібних суглобах працездатність хворих зберігається протягом багатьох років.
ДИСПАНСЕРИЗАЦІЯ ХВОРИХ НА ОА
Вже на ранніх стадіях ОА великих суглобів (в основному колінних і кульшових) хворих працездатного віку беруть на диспансерний облік. Згідно з наказом МОЗ України № 243 від 15.12.1993 р. на диспансерному обліку перебувають хворі на ОА працездатного віку з ураженням великих суглобів, переважно колінних і кульшових, починаючи з ранніх стадій захворювання.
Для диспансерного обліку і тривалого амбулаторного лікування хворі на ОА можуть бути розподілені на 4 групи:
I — хворі з компенсованим ОА колінних суглобів (без ознак синовіту, періартриту);
II — хворі з декомпенсованим ОА колінних суглобів (з явищами синовіту, періартриту);
III — хворі з компенсованим або декомпенсованим коксартрозом;
IV — хворі з коксартрозом або гонартрозом при наявності супутніх захворювань (мастопатія, фіброміома, виражені зміни серцево-судинної системи та ін.).
Для хворих І групи частота планових викликів на обстеження може становити 2 рази на рік, II групи — 3 рази на рік, III групи — 4 рази, для IV групи — 4–5 разів на рік.
Рентгенографію суглобів для виявлення динаміки прогресування процесу необхідно повторювати щорічно. Загальний аналіз крові та ревмопроби проводять лише в періоди планових викликів (при необхідності — частіше). Під час планових викликів визначають необхідність госпіталізації та уточнюють показання до фізіотерапевтичного і курортного лікування, проводять корекцію медикаментозної терапії, режиму фізичних навантажень та ін. У процесі диспансерного спостереження кожні 12 міс на кожного диспансерного хворого заповнюють етапний епікриз, у якому, крім діагнозу, групи диспансерного спостереження і кратності обстеження, мають бути відображені рентгенологічна стадія, терапія на всіх трьох етапах (поліклініка — стаціонар — курорт), оцінка ступеня прогресування та ефективності диспансеризації, а також працевлаштування, перехід на інвалідність, зміни диспансерної групи, кількість днів непрацездатності та випадків загострення в днях.
РЕКОМЕНДАЦІЇ ЄВРОПЕЙСЬКОЇ АНТИРЕВМАТИЧНОЇ ЛІГИ (EULAR) 2003 р.: ДОКАЗОВИЙ ПІДХІД ДО ЛІКУВАННЯ ПАЦІЄНТІВ З ОСТЕОАРТРОЗОМ КОЛІННИХ СУГЛОБІВ. ЗВІТ СПЕЦІАЛЬНОЇ КОМІСІЇ ПОСТІЙНОГО КОМІТЕТУ З МІЖНАРОДНИХ КЛІНІЧНИХ, У ТОМУ ЧИСЛІ ТЕРАПЕВТИЧНИХ, ДОСЛІДЖЕНЬ (ESCISIT)
Вступ
Остеоартроз (ОА) — найпоширеніше захворювання суглобів у пацієнтів країн Західної Європи. Він характеризується локальною втратою суглобового хряща і заміщенням кістковою тканиною по центру і краях дефекту. ОА колінного суглоба, який уражується найчастіше серед великих суглобів, проявляється інвалідизуючою симптоматикою приблизно у 10% населення віком старше 55 років, у 1/4 з яких виявляється виражена інвалідизація (Peat G. et al., 2001). Ризик втрати працездатності у зв’язку із ОА колінних суглобів такий же високий, як при серцево-судинній патології, і вищий, ніж при будь-яких інших захворюваннях у осіб похилого віку (Guccione A.A. et al., 1994). Згідно зі звітом ВООЗ про соціальні наслідки захворювань, гонартроз займає 4-те місце серед причин непрацездатності у жінок і 8-ме — у чоловіків (Murray C.J.L., Lopez A.D., 1997). Щорічні витрати, пов’язані з ОА, величезні, що зумовлене значною поширеністю захворювання і високими витратами на лікування. Рентгенологічні ознаки ОА колінних суглобів виявляються у 30% осіб обох статей віком старше 65 років (Cooper С., 1998), серед яких лише у 1/3 відзначають наявність клінічних симптомів. Щорічна частота виконання артропластики серед жителів Європи віком старше 65 років варіює в різних країнах, становлячи в середньому 0,5–0,7 на 1000 населення (Dieppe P. et al., 1999).
Серед численних етіологічних факторів виникнення ОА колінних суглобів найчастішими є загальні конституціональні (наприклад вік, стать, ожиріння, спадковість, репродуктивні особливості) та місцеві несприятливі механічні фактори (травми, професійні й побутові фактори, постава) (Cooper C. et al., 2000; Felson D.T., 2000). У значній поширеності гонартрозу важливу роль відіграють генетичні фактори, що підтверджується високим індексом успадковування захворювання (0,39–0,65 — серед близнюків) незалежно від факторів схильності, зовнішнього середовища чи демографічних особливостей (Spector T.D. et al., 1996).
ОА колінних суглобів характеризується больовим синдромом і ФН. Фізична непрацездатність, зумовлена болем і обмеженням функціональної активності суглобів, призводить до зниження якості життя і підвищення ризику розвитку супутньої патології й смертності. Сучасні підходи до лікування спрямовані на зменшення патологічної симптоматики за допомогою різних методів:
- нефармакологічне лікування (наприклад освітні програми, фізичні вправи, зміна способу життя);
- фармакологічне лікування (наприклад парацетамол, НПЗП, місцеве лікування);
- інвазивні методи лікування (наприклад внутрішньосуглобові ін’єкції, лаваж, артропластика).
Основними завданнями проведеного лікування є:
- інформування пацієнтів про основні симптоми ОА та навчання методам його лікування;
- зменшення вираженості больового синдрому;
- покращання функції ураженого суглоба і зниження непрацездатності;
- запобігання чи сповільнення прогресування захворювання і його ускладнень.
Сучасні дані про ефективність і доцільність різних методів лікування мають значні відмінності.
Раніше опубліковані Рекомендації з лікування ОА колінних і кульшових суглобів Королівського коледжу лікарів — Royal College of Physicians (Scott D.L., 1993) і Американського коледжу ревматологів — ACR (American College of Rheumatology Subcommittee on Osteoarthritis Guidelines, 2000). У 1998 р. EULAR створила робочу групу з оцінки методів лікування пацієнтів з ОА колінних суглобів з позицій доказової медицини. Результатом роботи цієї групи стало створення Рекомендацій з лікування цієї патології, представлених у 2000 р. (Pendleton A. et al., 2000). Проте ці Рекомендації враховували лише обмежену кількість терапевтичних підходів і охоплювали міжнародний досвід, накопичений до грудня 1998 р. Тому нами здійснено перегляд міжнародних Рекомендацій, що ґрунтується на розширеному аналізі опублікованих даних літератури до лютого 2002 р. і включенні всіх методів лікування пацієнтів з ОА колінних суглобів.
Методи
Членство в робочій групі щодо створення Рекомендацій
Члени експертної ради з ОА колінних суглобів були скликані в листопаді 2001 р. для вироблення методології перегляду бази даних і створення Рекомендацій щодо лікування пацієнтів з ОА колінних суглобів з позицій доказової медицини. За ініціативою постійного Комітету з міжнародних клінічних, у тому числі терапевтичних, досліджень (ESCISIT) експертна Рада з ОА включала 19 ревматологів, 4 хірургів-ортопедів і 1 наукового співробітника з 13 країн Європи.
Мета роботи Ради:
- опис усіх терапевтичних підходів до лікування пацієнтів з ОА колінних суглобів і оцінка рівня доказовості кожного з існуючих методів;
- створення переліку з 10 рекомендацій для лікування хворих на ОА колінних суглобів, його експертиза з позицій доказової медицини і схвалення експертною Радою (прийняття консенсусу);
- вироблення 10 рекомендацій для проведення наступних досліджень щодо ОА колінних суглобів з метою вдосконаленя методики лікування цієї патології;
- огляд з позицій доказової медицини різних даних лікування пацієнтів з ОА
Стратегія пошуку
З метою збереження зв’язку з уже проведеними аналізами даних літератури систематично вивчали бази даних Medline OVID і BIDS Embase. Для описаних раніше методів лікування пошук охоплював період із січня 1999 р. по лютий 2002 р., а для маловивчених раніше — з 1966 р. по лютий 2002 р. Стратегія пошуку полягала у відборі публікацій у вигляді оригінальних статей, метааналізів, результатів рандомізованих контрольованих (РКД), контрольованих (КД) і непорівняльних досліджень, що публікуються англійською чи іншими мовами країн Європи. До уваги не бралися статті, опубліковані іншими мовами.
Відбір публікацій
В аналіз включали всі дослідження, у яких автори оцінювали ефективність терапії при ОА щодо больового синдрому і/або функціональної активності колінних суглобів. Таким чином було виділено 33 терапевтичні підходи; група НПЗП була розділена на дві підгрупи: традиційні (неселективні) і ЦОГ-2-селективні НПЗП (коксиби) (табл. 12.18).
Таблиця 12.18
Терапевтичні підходи до лікування пацієнтів з ОА колінних суглобів
| Підхід | |||
| нефармакологічний | фармакологічний | внутрішньосуглобовий | хірургічний |
|
|
|
|
EMF — лікування пульсуючим електромагнітним випромінюванням; TENS — черезшкірна електрична стимуляція нервових волокон; SYSADOA — симптоматичні препарати сповільненої дії (включаючи неомильні сполуки авокадо/сої, хондроїтин, діацереїн і глюкозамін).
Діагноз ОА колінних суглобів встановлювали при наявності у хворих клінічних і/або рентгенологічних ознак ОА колінних суглобів. У цей аналіз включали тільки друковані роботи, що описували винятково ОА колінних суглобів; дослідження поєднаного ОА (ОА колінних і кульшових суглобів) були виключені. При наявності досліджень, включених у попередній аналіз (2000) і присвячених поєднаному гонартрозу і коксартрозу, ми відбирали з них дані відносно ОА колінних суглобів. При відсутності можливості виконати ізольований аналіз щодо гонартрозу робота виключалася з аналізу.
Оцінка якості робіт
Методологічний дизайн кожного дослідження оцінювали кількісно відповідно до раніше розробленої шкали (Downs S.H., Black N., 1998). Ця методологічна шкала включала якісну оцінку інформації, отриманої з кожної окремої публікації, зокрема дизайну й методології дослідження, а також статистичної вірогідності кожного дослідження. Шкала оцінки дослідження градуйована в балах: 0–1 — для 26 запитань, і 0–2 — для 1 запитання; максимально можлива кількість балів становила 28. Розрахунки розмірів вибірки оцінювали в 1 бал, його відсутність — у 0. Якщо в результатах вказувалися вірогідні величини, це оцінювалося як 1, якщо немає — 0. Один експерт оцінював публікації англійською мовою, інший — підтверджував цю оцінку сліпим методом. Публікації іншими мовами країн Європи оцінювалися індивідуально членами робочої групи експертного комітету EULAR, що володіють мовою публікації. Усі оцінки якості робіт збиралися й реєструвалися централізовано.
Оцінка вираженості терапевтичного ефекту
Кількісний аналіз ефективності лікування проводили там, де це було можливо, шляхом визначення величини терапевтичного ефекту (ВЕ — effect size — ES) відносно больового синдрому і функціональної активності суглоба. Для цієї мети використовували пакет комп’ютерних програм (Schwarzer R., 2000). ВЕ виражає стандартизовану середню різницю оцінюваного показника між групою лікування і контрольною (Cohen J., 1977) — у цьому разі больового синдрому і функціональної активності суглоба. Ця величина відображає відмінності між двома групами у стандартизованій формі. У ході дослідження для кожного досліджуваного показника визначали середню та характер розподілу для вихідних і кінцевих значень у групах плацебо і активного лікування, а також різницю між вихідною і кінцевою величинами.
ES і дані, наведені в цій роботі, у всіх випадках розраховували порівняно із плацебо. На підставі клінічних ознак вираженість терапевтичного ефекту, що становила 0,2, вважали незначною, 0,5 — помірною, >0,8 — великою. Усі дані були зібрані й зареєстровані централізовано.
Категорії доказовості даних
Категорії доказовості даних були адаптовані відповідно до класифікації Агентства США з політики і дослідженням в галузі охорони здоров’я (US Agency for Health Care Policy and Research). Показники, отримані в результаті аналізу даних літератури, були віднесені до тієї чи іншої групи доказовості залежно від дизайну досліджень. У табл. 12.19 наведено категорії, розміщені в порядку зменшення їх ступеня доказовості.
Таблиця 12.19
Категорії доказовості даних
| Категорія | Дані |
| 1А | Метааналіз РКД |
| 1В | Хоча б одне РКД |
| 2А | Хоча б одне нерандомізоване контрольоване дослідження |
| 2В | Хоча б одне квазіекспериментальне дослідження |
| 3 | Описові дослідження, зокрема порівняльні, корелятивні або опис випадку порівняно з контролем |
| 4 | Повідомлення експертних комітетів або думок і/чи клінічний досвід авторитетних авторів |
Вираженість терапевтичного ефекту різних методів лікування оцінювали відповідно до найбільш доказових із наявних даних. Якщо, наприклад, на запитання можна було відповісти за допомогою даних 1-ї категорії доказовості, то в цьому разі публікації більш слабкого дизайну не розглядалися.
Обґрунтованість пропонованих Рекомендацій
Після докладного аналізу категорій вірогідності отриманих даних члени Редакційного комітету класифікували обґрунтованість застосування того чи іншого терапевтичного підходу при ОА колінних суглобів на ступені A–D (табл. 12.20). Обґрунтованість рекомендацій застосування того чи іншого методу базувалася не тільки на рівні доказовості наявних даних, але також з урахуванням вираженості його (ES); профілю побічних ефектів; можливості застосування даних до популяції, що становить інтерес; зручності застосування; а також економічної обґрунтованості. Подібним чином можна оцінити різні лікувальні програми, виходячи із потреб щоденної клінічної практики.
Таблиця 12.20
Обґрунтованість рекомендацій застосування різних терапевтичних підходів
| Ступінь | Пропонована рекомендація базується безпосередньо на |
| A | даних 1-ї категорії доказовості |
| B | даних 2-ї категорії або екстрапольованих рекомендацій, що ґрунтуються на даних 1-ї категорії доказовості |
| C | даних 3-ї категорії або екстрапольованих рекомендацій, що ґрунтуються на даних 1-ї чи 2-ї категорії доказовості |
| D | даних 4-ї категорії або екстрапольованих рекомендацій, що ґрунтуються на даних 2-ї чи 3-ї категорії доказовості |
Оцінка думки груп експертів
Після інформування Експертного комітету про результати пошуку в літературі й ступеня доказовості даних щодо кожного з досліджуваних терапевтичних підходів за п’ятиступінчастою методикою Delphi були запропоновані 2 групи, кожна з яких включає 10 рекомендацій:
а) заключні дані експертизи і засновані на думках експертів рекомендації з лікування;
б) рекомендації щодо подальших напрямків досліджень.
Профіль токсичності
Після аналізу остаточного списку методів лікування і рівня їх доказовості Комісія оцінювала потенційну токсичність кожного із цих методів. Остання виражалася в балах ВАШ, причому 0 означав «відсутність токсичності», а 100 — «надзвичайно токсично».
Відповідно до думки експертів, що сформувалася початково, групу НПЗП доцільно було розділити на традиційні НПЗП і коксиби, що й здійснено на більш пізньому етапі.
Рівень доказовості підходу, заснованого на думці експерта
Дослідники, які здійснювали пошук за джерелами літератури, оцінювали рівень доказовості шляхом відповідей за опитувальником, заснованому на 10 рекомендаціях щодо лікування пацієнтів з ОА колінних суглобів, запропонованих робочою групою.
Результати
Підхід з позицій доказової медицини
У процесі пошуку даних літератури виявлено 497 нових публікацій, у тому числі 103 результати, які висвітлюють інвазивні методи лікування і також включені у загальний аналіз. У 99 з них використовували як мінімум 1 із 33 терапевтичних методів, 3 — систематичні огляди, а 1 — метааналіз. Також переглянуто всі публікації, раніше цитовані в попередніх Рекомендаціях EULAR (2000), в результаті чого були виключені роботи, присвячені вивченню ОА не тільки колінних суглобів. Загалом у це дослідження було включено 545 публікацій. Терапевтичні підходи, які більше не використовуються (наприклад застосування полісахаридів глікозаміноглікану), не включалися в табличний аналіз. У табл. 12.21 наведені різні терапевтичні підходи до ОА колінних суглобів із вказівкою індексу якості досліджень і вираженості ВЕ. Табл. 12.22 містить оцінку рівня доказовості для кожного методу лікування і ступінь обґрунтування і рекомендацій його застосування за оцінками експертів робочої групи.
Таблиця 12.21
Узагальнені дані щодо вираженості ВЕ різних методів лікування пацієнтів з ОА порівняно із плацебо, індексу якості й кількості виконаних досліджень
| Метод лікування | Кількість досліджень | Позитивні щодо плацебо | Індекс якості досліджень | Вираженість ВЕ порівняно із плацебо | |
| Парацетамол | 5 | 1/1 | 17–26 | 20 | — |
| Опіоїдні анальгетики/інші НПЗП | 6 | 2/3 | 11–24 | 19 | — |
| Неселективні НПЗП | 130 | 27/31 | 5–27 | 17 | 0,47; 0,50; 0,76; 0,96; |
| Коксиби | 5 | 4/4 | 18–25 | 23 | 0,50 |
| Антидепресанти | 1 | 1/0 | 16 | — | — |
| Місцеві НПЗП | 9 | 5/7 | 18–26 | 22 | –0,05;0,16;0,31;0,91;1,03 |
| Капсаїцин місцево | 2 | 2/2 | 21,26 | — | 0,41;0,56 |
| Статеві гормони | 2 | 0/1 | 15, 20 | — | — |
| Симптоматичні препарати сповільненої дії/глюкозамін | 8 | 4/6 | 14–27 | 24 | 0,43; 0,53; 1,02 |
| Хондроїтин | 5 | 5/5 | 20–27 | 24 | 1,23; 1,37; 1,44; 1,50 |
| Діацереїн | 1 | 1/1 | 22 | 22 | — |
| Неомилювані сполуки авокадо/сої | 3 | 3/3 | 21–24 | 23 | 0,32; 1,72 |
| Нутрицевтики | 2 | 2/2 | 4,25 | — | 0,65 |
| Фітопрепарати | 5 | 3/3 | 14–27 | 20 | 0,23; 1,32 |
| Мінерали/вітаміни | 1 | 0/1 | 24 | 24 | — |
| Освітні програми | 7 | 3/3 | 11–15 | 13 | 0,28; 0,35 |
| Фізичні вправи | 40 | 8/9 | 5–26 | 15 | 0,57; 0,59; 1,0 |
| Регулярний телефонний контакт із пацієнтом | 3 | 1/1 | 16–18 | 18 | 1,09 |
| Акупунктура | 6 | 2/2 | 11–22 | 16 | 0,25; 1,74 |
| Лазер | 2 | 1/1 | 12,17 | — | 0,87 |
| Змінне електромагнітне поле | 2 | 2/2 | 18,19 | — | — |
| Курортотерапія | 5 | 3/3 | 12–17 | 15 | 1,0 |
| TENS | 7 | 6/6 | 12–22 | 17 | 0,76 |
| Ультразвук | 1 | 0/1 | 20 | — | — |
| Зменшення маси тіла | 2 | 1/1 | 11,15 | — | — |
| Носіння ортопедичних устілок | 5 | 0/1 | 3–15 | 11 | — |
| Ортези (наколінники)/фіксатори надколінка/еластичні бандажі | 9 | 3/3 | 7–20 | 15 | — |
| Гіалуронова кислота внутрішньосуглобово | 35 | 18/20 | 9–26 | 20 | 0,0; 0,04; 0,48; 0,49; 0,88; 0,9 |
| ГК внутрішньосуглобово | 9 | 6/7 | 4–22 | 16 | 1,27 |
| Лаваж/періодична іригація | 7 | 1/1 | 11–25 | 18 | 0,84 |
| Артроскопія | 14 | — | 6–17 | 10 | — |
| Остеотомія | 26 | — | 5–15 | 11 | — |
| Унікомпартментальне протезування суглоба | 15 | — | 4–16 | 11 | — |
| Тотальне протезування суглоба | 35 | — | 4–23 | 13 | — |
Таблиця 12.22
Оцінка рівня доказовості для кожного методу лікування і ступінь обґрунтованості Рекомендацій щодо його застосування за оцінками експертів робочої групи
| Метод лікування | Рівень доказовості методу лікування | Вираженість ВЕ (розкид) | Ступінь обґрунтованості Рекомендацій до застосування |
| Парацетамол | 1B | — | A |
| Опіоїдні анальгетики/інші НПЗП | 1B | — | B |
| Неселективні НПЗП | 1A | 0,47–0,96 | A |
| Коксиби | 1B | 0,5 | A |
| Антидепресанти | 1B | — | B |
| Місцеві НПЗП | 1A | –0,05–1,03 | A |
| Капсаїцин місцево | 1A | 0,41–0,56 | A |
| Статеві гормони | 2B | — | C |
| Симптоматичні препарати сповільненої дії/глюкозамін | 1A | 0,43–1,02 | A |
| Хондроїтин | 1A | 1,23–1,50 | A |
| Діацереїн | 1B | — | B |
| Неомилювані сполуки авокадо/сої | 1B | 0,32–1,72 | B |
| Нутрицевтики | 1B | 0,65 | B |
| Фітопрепарати | 1B | 0,23–1,32 | B |
| Мінерали/вітаміни | 1B | — | C |
| Освітні програми | 1A | 0,28–0,35 | A |
| Фізичні вправи | 1B | 0,57–1,0 | A |
| Регулярний телефонний контакт із пацієнтом | 1B | 1,09 | B |
| Акупунктура | 1B | 0,25–1,74 | B |
| Лазер | 1B | 0,87 | B |
| Змінне електромагнітне поле | 1B | — | B |
| Курортотерапія | 1B | 1,0 | C |
| TENS | 1B | 0,76 | B |
| Ультразвук | 1B | — | C |
| Зменшення маси тіла | 1B | — | B |
| Носіння ортопедичних устілок | 1B | — | B |
| Ортези (наколінники)/фіксатори надколінка/еластичні бандажі | 1B | — | B |
| Гіалуронова кислота внутрішньосуглобово | 1B | 0,0–0,9 | B |
| ГК внутрішньосуглобово | 1B | 1,27 | A |
| Лаваж/періодична іригація | 1B | 0,84 | B |
| Артроскопія | 1B | — | C |
| Остеотомія | 3 | — | С |
| Унікомпартментальне протезування суглоба | 3 | — | С |
| Тотальне протезування суглоба | 3 | — | С |
Велика кількість проаналізованих досліджень включає застосування НПЗП. В аналіз було включено 135 публікацій із застосування НПЗП, але лише 35 містили контрольну групу плацебо, а в 5 з них був можливим розрахунок вираженість ВЕ. Медіана індексу якості досліджень була значно вищою для публікацій щодо нових коксибів, ніж для робіт, виконаних із неселективними НПЗП.
Індекси якості досліджень значно варіювали при різних методах лікування. Більшість досліджень, виконаних за останні роки, мали більш високу якість дизайну. Медіана якості проведених досліджень була найвищою для глюкозаміну і хондроїтину сульфату та найнижчою — для досліджень із застосуванням хірургічних методик, що корелювало з рівнем доказовості для кожного з описаних методів лікування.
Із усіх 33 терапевтичних підходів 29 мали доказову базу у вигляді як мінімум 1 рандомізованого плацебо-контрольованого дослідження і були віднесено до категорії 1А або 1В. Серед досліджень із застосуванням хірургічних методів лікування доказовий рівень був присутній тільки в РКД, у яких використовували артроскопію ± дренаж.
Профіль токсичності
Згідно отриманим даним, профіль токсичності НПЗП, опіоїдних анальгетиків і антидепресантів при тривалому застосуванні був подібний такому при хірургічному тотальному ендопротезуванні суглоба.
Після поділу НПЗП на неселективні й коксиби, встановлено що середня токсичність неселективних НПЗП становила 51 мм, а коксибів — 41 мм за ВАШ (максимум — 100 мм).
Підхід, заснований на думці експертів
У табл. 12.23 і 12.24 наведені заключні Рекомендації з лікування та подальшого дослідження щодо ОА колінних суглобів, запропоновані Експертним комітетом EULAR.
Таблиця 12.23
Заключний перелік 10 рекомендацій щодо лікування пацієнтів з ОА колінних суглобів, заснований на даних доказової медицини й думці експертів
| № з/п | Рекомендація |
| 1 | Оптимальна схема терапії пацієнтів з ОА колінних суглобів потребує комбінації нефармакологічних і фармакологічних методів лікування |
| 2 | Лікування пацієнтів з ОА колінних суглобів має враховувати:
а) наявність факторів ризику для розвитку ОА колінного суглоба (ожиріння, небажані механічні фактори, підвищена фізична активність) b) наявність загальних факторів ризику (вік, супутні захворювання, полімедикація) с) вираженість больового синдрому та ФН суглоба d) наявність ознак запалення (наприклад випоту в суглобову порожнину) е) локалізацію і ступінь структурних уражень |
| 3 | Нефармакологічне лікування пацієнтів з ОА колінних суглобів має включати: регулярні освітні програми, фізичні вправи, підтримувальні засоби (ціпок, змішані ортези, фіксація колінного суглоба) і зменшення маси тіла |
| 4 | Парацетамол — пероральний анальгетик, з якого слід починати лікування, та у разі його ефективності продовжити у вигляді тривалої пероральної терапії |
| 5 | Місцеві аплікації (НПЗП, капсаїцин) характеризуються клінічною ефективністю та безпекою |
| 6 | НПЗП показані пацієнтам, що не відповіли на терапію парацетамолом. У пацієнтів із підвищеним ризиком захворювань травного тракту рекомендують застосовувати неселективні НПЗП у комбінації з гастропротекторними агентами або інгібітори ЦОГ-2 |
| 7 | Опіоїдні анальгетики, з парацетамолом або без нього, можуть застосовуватися у пацієнтів, яким протипоказані НПЗП, включаючи селективні інгібітори ЦОГ-2, або ж останні неефективні та/або погано переносяться |
| 8 | SYSADOA — симптоматичні препарати сповільненої дії (глюкозаміну сульфат, хондроїтину сульфат, неомилювані сполуки авокадо/сої, діацереїн, гіалуронова кислота) мають симптоматичну дію і здатні модифікувати структуру |
| 9 | Внутрішньосуглобові ін’єкції тривало діючих ГК показані при загостренні больового синдрому в колінному суглобі, особливо при наявності суглобового випоту |
| 10 | Артропластика (колінного) суглоба показана пацієнтам із рентгенологічними ознаками ОА колінних суглобів із рефрактерним больовим синдромом і вираженою ФН колінного суглоба |
Таблиця 12.24
Рекомендації для проведення подальших досліджень щодо ОА колінних суглобів (на думку експертів)
| № з/п | Рекомендація |
| 1 | Виявлення клінічних прогностичних факторів відповіді на фармакологічне й нефармакологічне лікування |
| 2 | Формування єдиних Рекомендацій щодо надання результатів клінічних досліджень (КД) у пацієнтів з ОА колінних суглобів |
| 3 | Дослідження мають включати оцінку якості життя, функціональної активності суглоба і больового синдрому |
| 4 | Нові візуальні методи дослідження, такі як МРТ і УЗД, потребують валідації в якості методів діагностики й моніторингу в пацієнтів з ОА колінних суглобів |
| 5 | Ширше застосування РКД для оцінки успіху використання нефармакологічних методів терапії пацієнтів із ОА колінних суглобів |
| 6 | Виявлення найбільш раціональних і ефективних фізичних вправ при ОА колінних суглобів |
| 7 | Визначення тканинних ефектів, ефективності та безпеки тривалого застосування селективних інгібіторів ЦОГ-2 |
| 8 | Оцінка клінічної значимості структурної модифікації хряща |
| 9 | Визначення чітких показань до аортропластики суглоба |
| 10 | Необхідна оцінка ефективності й економічної вигоди від хірургічного втручання |
Оцінка пропозицій експертів за Рекомендаціями
Пропозиції впорядковували за ступенем важливості в ході обговорення експертами Комісії.
1. Оптимальна схема терапії пацієнтів з ОА колінних суглобів потребує комбінації фармакологічних і нефармакологічних методів лікування.
Незважаючи на те що це твердження логічне й відображає загальноприйняту клінічну практику, прямих доказів, отриманих у РКД із коректним дизайном, недостатньо для його підтвердження. Існує велика кількість непрямих доказів, отриманих у ході РКД, у яких всі пацієнти одержували знеболювальні засоби або НПЗП, що нефармакологічне лікування забезпечує додатковий ефект. Так, встановлено, що програми фізичних вправ (Petrella R.J., Bartha С., 2000) (індекс якості дослідження (QS) 26), фізіотерапія (Deyle G.D. et al., 2000) (QS 26), зменшення маси тіла в комбінації з фізичними вправами (Messier S.P. et al., 2000) (QS 21), освітні програми (Mazzuca S.A. et al., 1997) (QS 12), використання ортопедичних устілок (Sasaki T., Yasuda K., 1985; Tohyama H. et al., 1991) (QS 10; 11) забезпечують додатковий ефект у комбінації зі знеболювальними засобами й НПЗП, що служить достатньою доказовою базою цьому твердженню (1B).
2. При лікуванні пацієнтів з ОА колінних суглобів необхідно враховувати:
- наявність факторів ризику для колінного суглоба (ожиріння, небажані механічні фактори, підвищена фізична активність);
- наявність загальних факторів ризику (вік, супутні захворювання, полімедикація);
- вираженість больового синдрому і ФН суглоба;
- наявність ознак запалення (наприклад випоту в суглобову порожнину);
- локалізацію й ступінь структурних ушкоджень.
Це положення відображає зразок клінічної практики й стосується клінічних маркерів, які часто використовують для прийняття конкретних рішень. КД в основному вивчають ефективність монотерапії одним або двома специфічними методами лікування у високоселективних гомогенних популяціях пацієнтів з ОА колінного суглоба. Проте отримані дані не можуть бути екстрапольовані на всю популяцію хворих на ОА. Результати досліджень предикторів відповіді на лікування часто непереконливі статистично й недостатньо інформативні. Яскравим прикладом є два дослідження прогностичного значення наявності суглобового випоту для відповіді на внутрішньосуглобове введення ГК, які продемонстрували протилежні результати (Gaffney V.K. et al., 1995; Jones A., Doherty M., 1996) (QS 22; 17). В одному з них — РКД, що включало 84 пацієнти, був показаний лише короткочасний симптоматичний ефект застосування ГК порівняно із плацебо, при цьому більшу його вираженість відзначено у хворих із випотом. Водночас рандомізоване перехресне дослідження ефективності метилпреднізолону порівняно з фізіологічним розчином не виявило клінічних предикторів відповіді на лікування, що не дозволяє робити висновок про доцільність застосування ГК лише у пацієнтів із суглобовим випотом.
Окрім очікуваного ефекту, необхідно брати до уваги потенційний ризик і вартість застосовуваних методів лікування. Цілісний підхід до лікування хворого є загальноприйнятним: він має очевидну цінність, але не має специфіки у разі ОА колінного суглоба.
3. Нефармакологічне лікування пацієнтів з ОА колінних суглобів має включати: регулярні освітні програми, фізичні вправи, підтримувальні засоби (ціпок, ортопедичні устілки, фіксація колінного суглоба) і зменшення маси тіла.
Навчання пацієнтів і забезпечення їх інформацією має стати невід’ємною частиною лікування будь-якого хронічного захворювання. Навчання є професійним обов’язком лікаря й має включати надання докладної інформації про саму хворобу, методи діагностики і лікування. Практикуючий лікар повинен адаптувати будь-яку схему терапії до конкретного пацієнта, і ця концепція може бути обговорена з пацієнтом у період навчання. Результати кількох широкомасштабних РКД і метааналізів продемонстрували позитивний вплив різних навчальних методик на зменшення вираженості больового синдрому, проте лише незначний їх вплив на функціональний стан колінних суглобів у хворих на ОА (Superio-Cabuslay E. et al., 1996). Також показано, що навчання пацієнтів зумовлює зниження частоти відвідувань лікаря і у такий спосіб впливає на вартість лікування. У дослідженні, що охопило 211 пацієнтів з ОА колінного суглоба, 80% вартості програми самонавчання пацієнтів були відшкодовані протягом 1 року за рахунок зниження частоти та вартості візитів до лікаря (Mazzuca S.A. et al., 1999). Підтверджена ефективність таких освітніх методик, як надання індивідуалізованих навчальних комплектів (Mazzuca S.A. et al., 1997) (QS 12), регулярний телефонний зв’язок із пацієнтом (Weinberger M. et al., 1989) (QS 17), навчання у групах (Maurer B.T. et al., 1999) (QS 20), тренінг навичок адаптації для хворих (Keefe F.J. et al., 1990) (QS 13) та їх подружжя (Keefe F.J. et al., 1999) (QS 15).
Існують докази, отримані при проведенні широкомасштабного РКД, що специфічні для суглоба фізичні вправи зменшують вираженість болю і поліпшують функцію колінного суглоба у хворих на ОА. Однак оптимальна схема вправ ще не розроблена. Фізичні вправи можна розділити на специфічні для суглоба вправи, спрямовані на збільшення обсягу рухів і стимуляцію навколосуглобових м’язів, і на загальнозміцнювальні вправи, проведені на свіжому повітрі. Їх можна організовувати у групах на свіжому повітрі (на землі чи у воді) або як програми для самостійного виконання в домашніх умовах. РКД, виконане на базі двох центрів, що охопило 439 пацієнтів похилого віку з ОА колінних суглобів, продемонструвало підвищення здатності до виконання повсякденної діяльності серед тих, що займалися фізичними вправами (вправи на свіжому повітрі та навантаження на опір), порівняно з контрольною групою (без фізичних вправ) (Penninx B.W. et al., 2001) (QS 24). Терапевтична ефективність виконання хворими на ОА колінних суглобів фізичних вправ у домашніх умовах вивчалася в декількох РКД, які продемонстрували зменшення вираженості болю і поліпшення функціональної рухливості колінного суглоба (O’Reilly S.C. et al., 1999; Petrella R.J., Bartha С., 2000; Baker K.R. et al., 2001) (QS 26; 26; 20). Аеробні та ізокінетичні вправи також підтвердили свою ефективність у покращанні функції суглоба й ходьби, а також зменшенні вираженості больового синдрому (Mangione K.K. et al., 1999; Maurer B.T. et al., 1999; Deyle G.D. et al., 2000; Fransen M. et al., 2001) (QS 26; 20; 19; 25). Не виявлено істотних відмінностей між ефективністю фізичних вправ, виконуваних у воді або на землі — обидві програми зумовлювали значне поліпшення функції ураженого суглоба і зменшення вираженості болю (Wyatt F.B. et al., 2001) (QS 17). Слід відмітити, що деякі дослідження свідчать про тривалий (6–18 міс) терапевтичний ефект фізичних навантажень. Вираженість ВЕ для фізичних вправ становила від 0,57 до 1,0.
У РКД за участю 119 хворих на ОА колінних суглобів встановлено, що ефективність використання пацієнтами наколінників при варусній деформації перевищує таку серед тих, хто не використовував наколінники (Kirklev A. et al., 1999) (QS 20). Інше РКД, що порівнювало ефективність застосування клиноподібних устілок із використанням звичайних ортопедичних устілок, не дозволило виявити істотних відмінностей між двома групами пацієнтів. Водночас у хворих, які застосовували ортопедичні устілки з бічним скосом, відзначалося більш виражене зниження добової потреби в НПЗП і підвищення комплаєнтності (Moillefert J.F. et al., 2001) (QS 25). Два контрольовані дослідження ефективності носіння ортопедичних устілок (Sasaki T., Yasuda K., 1985; Tohyama H. et al., 1991) свідчать про вищий терапевтичний ефект цього методу порівняно із традиційним застосуванням знеболювальних засобів (QS 10; 11). Перехресне дослідження ефективності носіння ортопедичних устілок і застосування НПЗП продемонструвало, що зменшення вираженості больового синдрому і покращання функціональної активності суглоба можуть бути частково зумовлені зменшенням зовнішнього варусного моменту й короткостроковим зниженням навантаження на медіальний відділ колінного суглоба (Crenshaw S.J. et al., 2000) (QS 15). Досі не проведені РКД ефективності використання ціпка чи носіння еластичних пов’язок при ОА колінних суглобів. Однак в одному короткостроковому перехресному дослідженні у 68 хворих на ОА встановлено, що застосування еластичних пов’язок може значно зменшувати вираженість болю в колінних суглобах (Hassan B.S. et al., 2002) (QS 20).
Незважаючи на те що зменшення маси тіла рекомендують практично всім хворим на ОА, взаємозв’язок між ОА колінних суглобів і зниженням маси тіла був лише формально вивченим у 2 дослідженнях. В одному з них — дослідженні за участю великої когорти пацієнтів (Felson D.T. et al., 1992) — показано, що зменшення маси тіла знижує ризик розвитку маніфестного ОА колінного суглоба у жінок (QS 15). Нещодавно виконане РКД продемонструвало, що поєднання зменшення маси тіла із фізичними вправами зумовлює зменшення вираженості больового синдрому і поліпшення функції суглобів у пацієнтів похилого віку протягом щонайменше 6 міс; на жаль, у цій роботі була відсутня група порівняння, що включала хворих тільки зі зменшенням маси тіла (Messier S.P. et al., 2000) (QS 21).
Таким чином, існують переконливі докази того, що навчання пацієнтів (1А) і фізичні вправи (1В) сприяють зменшенню вираженості больового синдрому в колінних суглобах при ОА, крім того, останні покращують функціональну рухливість. Використання пристосувань і зменшення маси тіла, ймовірно, є доцільними заходами у пацієнтів із гонартрозом, однак вони мають лише слабку доказову базу, за винятком носіння наколінників, щодо яких об’єктивно доведено (1В) зменшення вираженості болю й покращання функції колінних суглобів.
4. Парацетамол — пероральний анальгетик, з якого має починатися лікування і у разі його ефективності продовжено у вигляді тривалої пероральної терапії.
Парацетамол часто використовують для самостійного лікування у разі легкого чи помірного болю. В опублікованих рекомендаціях (ACR, RCP, EULAR) він фігурує як препарат першого вибору для знеболювання при ОА колінного суглоба. Незважаючи на те що оцінці ефективності парацетамолу присвячена достатня кількість досліджень, усі вони мали невдалий дизайн або проходили за участю незначної кількості пацієнтів. Результати 6-тижневого РКД за участю 25 хворих на ОА свідчать про значне зменшення вираженості болю у спокої на фоні застосування парацетамолу порівняно з плацебо (Amadio P., Cummings D.M., 1983) (QS 21). Інше 4-тижневе РКД продемонструвало, що парацетамол у дозі 4 г/добу не поступається за ефективністю ібупрофену в дозі до 2400 мг/добу (Brаdley J.D. et al., 1992) (QS 26). Поглиблена оцінка цих даних свідчить, що навіть у разі вираженого болю в колінному суглобі розвивалась однакова відповідь на ібупрофен і парацетамол (Bradley J.D. et al., 2001) (QS 17). Результати ще одного РКД підтвердили, що парацетамол може бути ефективно використаний в дозі до 2600 мг/добу протягом 2 років без розвитку значних побічних ефектів; також встановлено, що ефективність парацетамолу не відрізнялася від такої напроксену в дозі 750 мг/добу. У цьому дослідженні в обох групах відзначено найбільшу кількість дострокових виходів хворих із дослідження, тому, на думку авторів, жоден із препаратів порівняння не відповідав вимогам лікування при ОА (Williams H.J. et al., 1993) (QS 23). Взагалі оцінка ефективності парацетамолу утруднена, оскільки він широко застосовується у більшості РКД у ролі додаткового знеболювального засобу, тому такі дослідження відносять до монотерапії різними препаратами у розділ комбінованої терапії. Парацетамол практично не вступає у взаємодію з іншими препаратами, відсутні протипоказання до його застосування, у тому числі для пацієнтів похилого віку.
Таким чином, існують докази (1В), що парацетамол ефективний при лікуванні пацієнтів з ОА колінного суглоба, що у багатьох хворих він порівняний із ібупрофеном при короткочасному застосуванні і майже такий же ефективний, як напроксен. Доведено також (1В), що тривалий прийом парацетамолу безпечний. Очевидно, що препарат, який поєднує одночасно ефективність і безпеку, слід розглядати в якості першочергової терапії при ОА колінного суглоба й, у разі ефективності, зберігатися у складі комбінованої терапії на тривалий час для адекватного купірування болю.
Відбулася дискусія у засобах масової інформації щодо безпеки парацетамолу відносно ШКТ, зокрема порівняно з НПЗП. Опублікована в журналі передова стаття з оглядом сучасних доступних джерел літератури, добре описала стан питання (Abramson S.A., 2002). Автори прийшли до висновку, що сучасний масив доказових даних свідчить про більш високий профіль безпеки парацетамолу щодо ШКТ порівняно із неселективними НПЗП.
5. Місцеві аплікації (НПЗП, капсаїцин) характеризуються клінічною ефективністю та безпекою.
Місцеві засоби широко використовуються, добре переносяться і подобаються пацієнтам. Результати двох рандомізованих плацебо-контрольованих досліджень, що охопили 70 і 155 хворих, переконливо продемонстрували значні переваги місцевих аплікацій диклофенаку перед плацебо щодо зменшення вираженості больового синдрому (Dreiser R.L., Tisne-Camus M., 1993; Groce D. et al., 1999) (QS 24; 22). Відзначимо, що у двох інших рандомізованих плацебо-контрольованих дослідженнях ефективності гелю диклофенаку із включенням 290 і 237 пацієнтів, статистично достовірні відмінності щодо впливу на больовий синдром були отримані лише у хворих із тяжкою формою ОА колінних суглобів (Sandelin J. et al., 1997; Ottilinger B. et al., 2001) (QS 26; 25). Порівняльні дослідження ефективності гелю диклофенаку з гелем кетопрофену (Woikakul S. et al., 1997) (QS 19), а також гелю піроксикаму із призначеним перорально ібупрофеном (Dickson D.J., 1991) (QS 20) продемонстрували однакову ефективність цих лікувальних схем. Вираженість ВЕ топічних форм широко варіює (розкид від –0,05 до 1,03), медіана — 0,31. Місцеві НПЗП відрізняються хорошою переносимістю. Широкомасштабні дослідження в терапевтичній практиці (Newbery R. et al., 1992) підтверджують безпеку застосування топічних НПЗП (побічні явища виявляють менше ніж у 1,5%), причому основним побічним ефектом є місцеві шкірні реакції. В одному широкомасштабному дослідженні типу випадок — контроль вивчався, але не був виявлений взаємозв’язок між застосуванням місцевих НПЗП і виникненням кровотеч або перфорацій верхніх відділів ШКТ (Evans J.M.M. et al., 1995).
Топічне застосування капсаїцину (зворотна десенситизація ноціцептивних С-волокон шляхом впливу на VR-1 ванілоїдні рецептори) все ширше використовується при ОА. Шляхом РКД доведена його клінічна ефективність при ОА колінних суглобів, причому, можливо, йдеться про тривалу ефективність препарату (Deal C.L. et al., 1991) (QS 21). Розкид вираженості ВЕ становить від 0,41 до 0,56. Про системні побічні ефекти терапії не повідомляється.
Дані щодо ефективності місцевого застосування НПЗП і капсаїцину в лікуванні ОА колінних суглобів належать до рівня доказовості 1В, ці види лікування відрізняє високий рівень безпеки.
6. НПЗП показані пацієнтам, які не відповіли на терапію парацетамолом. У пацієнтів із підвищеним ризиком захворювань травного тракту слід використовувати неселективні НПЗП у комбінації з гастропротекторними агентами чи інгібітори ЦОГ-2.
Існує хороша доказова база того, що у деяких пацієнтів НПЗП більш ефективні, ніж парацетамол, проте твердження, що їх слід використовувати у хворих із неефективністю парацетамолу, хоча й привабливе, але не має доказової сили. На жаль, відсутні дослідження, що використовують у ролі критерію включення неефективність анальгезії парацетамолом.
З урахуванням наявності незначного запального компоненту при ОА застосування НПЗП логічно обґрунтоване у хворих із неефективністю парацетамолу, зокрема при явному синовіті. Проте у цього положення немає доказової бази. Численними дослідженнями продемонстровано, що пероральні НПЗП більш ефективні, ніж плацебо (медіана вираженості ВЕ 0,50; розкид даних — 0,47–0,96) у лікуванні пацієнтів з ОА колінних суглобів. Кокранівський огляд (Cochrane review) відносної ефективності різних НПЗП, що використовують при лікуванні пацієнтів з ОА колінних суглобів, показав, що, незважаючи на достатність публікацій з цієї теми, багато досліджень мають слабкий дизайн; крім того, неможливо з позицій доказової медицини зіставити ефективність загальноприйнятих НПЗП в однакових дозах (Wation M.C. et al., 2002).
Лише в декількох дослідженнях безпосередньою метою було пряме порівняння парацетамолу і НПЗП. Вони загалом, але не завжди, констатували, що НПЗП більш ефективні, хоча й підвищують частоту побічних явищ з боку ШКТ. У 2-річному РКД у 178 пацієнтів (Williams H.J. et al., 1993) (QS 23) порівнювали ефективність парацетамолу і напроксену. Напроксен виявився більш ефективний при больовому синдромі, ніж парацетамол (ES 0,32 — після 42 днів лікування, 0,45 — після 730 днів). Вибування із дослідження великої кількості (65%) пацієнтів пов’язане: з неефективністю терапії — у групі парацетамолу і високою частотою побічних ефектів — у групі напроксену. В іншому дослідженні, проведеному за участю 382 пацієнтів, порівнювали ефективність і переносимість рофекоксибу, целекоксибу і парацетамолу. Встановлено, що більшість пацієнтів припинили прийом парацетамолу на ранніх стадіях лікування у зв’язку його неефективністю, а також те, що парацетамол значно поступається коксибам за впливом на больовий синдром; профілі побічних ефектів були практично однакові у всіх групах лікування (Geba G.P. et al., 2002) (QS 23).
Існує поширена думка, що селективні інгібітори мають перевагу над традиційними НПЗП, особливо завдяки низькому ризику розвитку ускладнень з боку ШКТ. Широкомасштабні дослідження, що порівнювали ефективність і профіль безпеки інгібіторів ЦОГ-2 з неселективними НПЗП і плацебо, продемонстрували переваги інгібіторів ЦОГ-2 перед плацебо відносно контролю больового синдрому й рівня ефективності — порівняно із неселективними НПЗП; водночас застосування інгібіторів ЦОГ-2 зумовлювало зниження до 50% частоти виникнення перфоративних процесів, пептичних виразок і шлунково-кишкових кровотеч. Результати РКД, в якому порівнювали застосування целекоксибу, диклофенаку і плацебо у 600 пацієнтів протягом 6 тиж, свідчать, що обидва препарати при відсутності відмінностей між ними щодо зменшення вираженості больового синдрому, значно перевершували плацебо. Більше ускладнень з боку ШКТ зареєстровано в групі диклофенаку, загалом краще переносився целекоксиб (Mckenna F. et al., 2001) (Q 21); вираженість ВЕ порівняно з плацебо становила 0,5. В іншому дослідженні, де порівнювали терапевтичну ефективність застосування целекоксибу з напроксеном у різних дозуваннях і плацебо у 1003 пацієнтів, виявлено однакову ефективність медикаментозної терапії, що перевершує ефекти плацебо, і підвищене вибування пацієнтів із дослідження в групі плацебо внаслідок неефективності; у цьому дослідженні частота появи незначних побічних ефектів з боку ШКТ була однаковою для неселективних НПЗП і коксибів, хоча у групі напроксену зареєстровано один випадок гострої шлунково-кишкової кровотечі (Bensen W.G. et al., 1999) (QS 25). Сучасні дослідження показують, що побічні явища з боку серцево-судинної системи виявляють однаково часто у пацієнтів, які одержують терапію неселективними НПЗП і коксибами.
Опублікований Кокранівский огляд, в якому містилися публікації до липня 2002 р. включно, оцінив ефективність заходів щодо профілактики ускладнень на рівні верхніх відділів ШКТ, пов’язаних із застосуванням НПЗП (Rostom A. et al., 2003). На основі цього огляду, що охопив 40 РКД, зроблено висновок, що застосування мізопростолу в будь-якому дозуванні дозволяє значно знизити ризик виникнення пептичних виразок. Використання антагоністів Н2-рецепторів у стандартних дозах ефективно знижує ризик розвитку пептичної виразки дванадцятипалої кишки, але не впливає на частоту розвитку виразки шлунка. Блокатори Н2-рецепторів та ІПН в подвоєних дозах ефективно знижують ризик розвитку пептичної виразки дванадцятипалої кишки й шлунка, що виявлються ендоскопічно, а також краще переносяться, ніж мізопростол.
Таким чином, є дані доказової медицини категорії 1А на користь застосування НПЗП при лікуванні пацієнтів з ОА колінних суглобів. У пацієнтів із підвищеним ризиком ускладнень з боку ШКТ доказові дані вказують на доцільність застосування селективних інгібіторів ЦОГ-2 або неселективних НПЗП у комбінації з гастропротекторними препаратами.
7. Опіоїдні анальгетики, з парацетамолом або без нього, можна застосовувати у пацієнтів, яким протипоказані НПЗП, включаючи селективні ЦОГ-2-інгібітори, або ж останні неефективні або/і погано переносимі.
Відомі незначні дані доказової медицини, що повністю підтримують це твердження. Однак непрямі дані підтверджують можливість широкого застосування опіоїдних анальгетиків у повсякденній клінічній практиці, особливо в тих ситуаціях, коли можливості застосування інших лікувальних заходів обмежені. Існують побічні докази того, що застосування опіоїдних анальгетиків дозволяє покращити контроль над больовим синдромом у пацієнтів з недостатньою відповіддю на терапію парацетамолом і/або НПЗП. Водночас вважається за необхідне враховувати підвищений ризик виникнення побічних ефектів, особливо у людей похилого віку, і потенційну залежність, що формується при прийомі препаратів цієї групи. У РКД за участю 90 пацієнтів показано, що терапія при ОА колінних суглобів трамадолом дозволяє знизити дози напроксену в пацієнтів із больовим синдромом, резистентним до напроксену (Schnirzer T.J. et al., 1999) (QS 19). Таким чином, рівень доказовості цього твердження — 1В.
8. Симптоматичні препарати сповільненої дії (глюкозаміну сульфат, хондроїтину сульфат, неомилювані сполуки авокадо/сої, діацереїн і гіалуронова кислота) мають симптоматичний ефект і здатність модифікувати структуру.
Симптоматичні препарати сповільненої дії для лікування пацієнтів з ОА (англ. — SYSADOA) — генерична назва групи, що включає глюкозаміну сульфат і його похідні, хондроїтину сульфат і діацереїн. На сьогодні в Європі існують значні відмінності в показаннях до застосування препаратів цієї групи і їх належності до тієї чи іншої класифікації. У Великобританії, наприклад, вони класифікуються швидше як харчові добавки, ніж як лікарські препарати, доступні поза межами аптечної мережі й часто використовуються хворими самостійно. Такі засоби, як полісульфати глікозаміноглікану, вже не використовуються в країнах Європи, тому не були включені в наш аналіз. Ефективність і доцільність застосування інших препаратів оцінені індивідуально.
Дослідженню хондроїтину сульфату і глюкозаміну сульфату присвячено опублікований метааналіз, що охопив дослідження аж до 1999 р. (Mcalindon T.E. et al., 2000). Автори доходять висновку, що хондроїтину сульфат і глюкозаміну сульфат виявляють помірний або значний вплив на вираженість больового синдрому і функціональну рухливість суглобів при ОА порівняно із плацебо; однак їх ефект міг бути перебільшеним через бажання опублікувати позитивні результати. Ці препарати є безпечними й характеризуються мінімумом побічних ефектів. За даними метааналізу, що охопив всі опубліковані дослідження, вираженість ВЕ для хондроїтину сульфату і глюкозаміну сульфату становила відповідно 0,78 і 0,44.
У порівняльному РКД хондроїтину сульфату і диклофенаку, проведеному за участю 146 пацієнтів, більш швидке зменшення вираженості клінічних симптомів спостерігалося у хворих, які застосовували НПЗП, проте повернення цих симптомів відзначалося відразу після відміни терапії; хондроїтину сульфат, навпаки, характеризувався більш повільним початком терапевтичної дії, що зберігалася до 3 міс після закінчення лікування (Morreale P. et al., 1996) (QS 20). Ще більш недавно проведене РКД (Mazieres B. et al., 2001) (QS 27) продемонструвало переваги хондроїтину сульфату перед плацебо у 130 пацієнтів з ОА колінних суглобів і ще раз підтвердило збереження терапевтичного ефекту до 1 міс після закінчення лікування.
Два РКД порівнювали ефективність глюкозаміну сульфату з ібупрофеном. Перше дослідження, проведене протягом 8 тиж, показало, що ібупрофен протягом перших 2 тиж ефективніше зменшував вираженість больового синдрому, однак до 8-го тижня перевага була на боці глюкозаміну сульфату (Vaz a.L., 1982) (QS 22). Інше дослідження, що охопило 4 тиж лікування, продемонструвало більш швидкий початок дії ібупрофену, але до 4-го тижня зменшення вираженості болю і функціональної рухливості суглоба було однаковим в обох групах (Muller-Fassbender H. et al., 1994) (QS 23). Результати двох інших рандомізованих плацебо-контрольованих досліджень були опубліковані на додаток до вищенаведеного метааналізу. У 98 пацієнтів старшого віку із гонартрозом средньотяжкого чи тяжкого перебігу протягом 2-місячного періоду лікування не вдалося продемонструвати статистично достовірних відмінностей між глюкозаміну сульфатом і плацебо щодо впливу на больовий синдром і функціональну рухливість суглоба (Rindone J.P. et al., 2000) (QS 24). Однак протягом 3 років спостереження у 106 пацієнтів з ОА легкого й середнього ступеня відзначено достовірне, порівняно із плацебо, сповільнення звуження РСЩ, зменшення вираженості больового синдрому й покращання функціональної активності суглобів (Reginster J.Y. et al., 2001) (QS 26). Ці дослідження дозволяють припустити, що глюкозаміну сульфат може бути використаним у ролі структурномодифікуючого препарату при ОА. Лише в одному РКД оцінювали ефективність поєднаного застосування глюкозаміну сульфату і хондроїтину сульфату; у 93 пацієнтів із легким та помірним ступенем тяжкості гонартрозу виявлено значне зниження індексу Лекена до 4-го і 6-го місяця лікування; водночас у хворих на гонартроз тяжкого ступеня не виявлено статистично достовірних відмінностей ефективності поєднаного застосування хондроїтину сульфату і глюкозаміну сульфату перед плацебо (Das A. Jr., Hammod T.A., 2000) (QS 24). Сукупна вираженість ВЕ глюкозаміну сульфату (крім даних метааналізу) становила 0,53–0,87.
Єдине РКД присвячене застосуванню діацереїну при ОА колінних суглобів. Досліджуваний препарат у дозі 100 мг/добу суттєво перевершував ефект плацебо щодо впливу на больовий синдром і функціональну рухливість суглоба. Діацереїн при застосовуванні у більш високих дозах викликав численні побічні ефекти (Pelletier J.P. et al., 2000) (QS 22).
Впровадження в клінічну практику гіалуронової кислоти розглядалося як якісний прорив у лікуванні пацієнтів з ОА колінних суглобів. Особлива увага приділялась вивченню ефективності гіалуронової кислоти щодо зменшення вираженості больового синдрому, поліпшення функціонального стану суглобів. Є багато препаратів на основі гіалуронової кислоти, які можна розділити на 2 основні групи: високо- і низькомолекулярні. Визнано, що терапевтична ефективність високомолекулярних сполук вища. Порівняльне РКД ефективності високо- та низькомолекулярних сполук гіалуронової кислоти, проведене протягом 12 тиж, продемонструвало, що ефект високомолекулярної сполуки щодо купірування больового синдрому значно вищий (Wobia M. et al., 1999) (QS 21). До лютого 2002 р. опубліковані результати 39 КД гіалуронової кислоти при ОА колінних суглобів: із 20 плацебо-контрольованих досліджень 18 вказували на явну перевагу гіалуронової кислоти. Вираженість ВЕ, розрахована на підставі плацебо-контрольованих досліджень тривалістю від 60 днів до 1 року, значно перевищувала ефективність плацебо за впливом на больовий синдром (ES 0,04; 0,49%; 0,8; 0,9) (Dougados M. et al., 1993; Carrabba M. et al., 1995; Corrado E.M. et al., 1995; Huskisson E.C., Donnelly S., 1999) (QS 22; 49; 23; 14). В одному з досліджень відзначено зниження індексу Лекена через 1 рік терапії (ES 0,36) (Wobia M. et al., 1999).
У декількох дослідженнях вивчений структурно-модифікуючий ефект гіалуронової кислоти. В одному РКД вивчали артроскопічну картину колінного суглоба до і через 1 рік після початку терапії гіалуроновою кислотою. Встановлено, що на фоні лікування гіалуроновою кислотою ступінь структурних ушкоджень суглоба нижчий, ніж у контрольній групі; в ході лікування гіалуроновою кислотою у пацієнтів відзначено поліпшення якості життя й зниження потреби у НПЗП (Listrat V. et al., 1997). Інші дослідження продемонстрували зниження потреби у внутрішньосуглобових ін’єкціях ГК протягом 1 року спостереження; автори припускають, що структурно-модифікуючий ефект гіалуронової кислоти проявляється зменшенням кількості загострень захворювання (Dougados M. et al., 1993).
Кількість досліджень, що вивчали наявність можливих прогностичних факторів відповіді (предикторів ефективності) на проведену терапію, мінімальна. В одному дослідженні встановлено, що максимальна ефективність гіалуронової кислоти досягається у пацієнтів віком старше 60 років із вираженою ФН суглобів, що документовано динамікою індексу Лекена (Lohmander L.S. et al., 1996) (QS 26). В іншому ретроспективному дослідженні виявлено, що реакція на гіалуронову кислоту статистично корелювала з тяжкістю структурних змін при ОА колінних суглобів: більш висока ефективність була досягнута у хворих із нижчим ступенем тяжкості захворювання, і низька — у пацієнтів із наявністю випоту на початок дослідження (Lussier A. et al., 1996) (QS 18). Слід зазначити, що більшість досліджень щодо внутрішньосуглобового введення гіалуронової кислоти виключали пацієнтів із тяжким ОА. Підводячи підсумок, відзначимо, що є доказова база, що підтверджує ефективність гіалуронової кислоти відносно зменшення вираженості больового синдрому (1В) і підвищення функціональної активності суглобів (1В) у хворих на гонартроз. Проте реальне зменшення вираженості больового синдрому на фоні терапії гіалуроновою кислотою може бути досягнуто протягом кількох місяців (порівняно з кількома тижнями на фоні лікування ГК), що пов’язано з більш повільним початком дії, необхідністю у застосуванні курсу з 3–5 щотижневих ін’єкцій, що має певні організаційні й фінансові складності. Доказова база на користь хворобомодифікуючого ефекту гіалуронової кислоти залишається мінімальною.
Термін «симптоматичні препарати сповільненої дії» стосується цілого спектра препаратів. І якщо доказова база на користь симптоматичної дії двох діючих речовин — глюкозаміну сульфату (1А) і хондроїтину сульфату (1А) — неухильно збільшується, то у відношенні інших препаратів вона надзазвичай слабка чи взагалі відсутня.
9. Внутрішньосуглобові ін’єкції тривало діючих ГК показані при загостренні болю в колінному суглобі, особливо при наявності суглобового випоту.
Внутрішньосуглобові ін’єкції ГК при ОА колінних суглобів виконують для зменшення вираженості запальних явищ і больового синдрому протягом багатьох років. Фармакологічна дія ГК при ОА колінних суглобів продемонстрована в багатьох дослідженнях. В одному РКД підтверджено, що ГК протягом 7 днів більш ефективні від плацебо щодо зменшення вираженості больового синдрому у хворих на ОА колінних суглобів (вираженість ВЕ 1,27), у частини з яких був наявний суглобовий випіт (Dieppe P.A. et al., 1980) (QS 19). В іншому дослідженні за участю 98 пацієнтів показана істотна відмінність між ГК і плацебо щодо зменшення вираженості болю і поліпшення функціональної активності суглоба після 1-го і 4-го тижнів лікування, однак не відзначено відмінності на 12-й і 24-й тиждень (Ravaud P. et al., 1999) (QS 24). Ще одне РКД із включенням 84 пацієнтів підтвердило короткочасний симптоматичний ефект ГК порівняно з плацебо, а також продемонструвало кращий результат лікування у хворих з наявністю випоту (Gaffney V.K. et al., 1995) (QS 22). Водночас рандомізоване перехресне дослідження ефективності метилпреднізолону порівняно з фізіологічним розчином не виявило клінічних предикторів відповіді на лікування, що не дозволяє оцінювати доцільність використання ГК лише у пацієнтів із суглобовим випотом (Jones A., Doherty M., 1996) (QS 17).
Відзначимо, що на сьогодні є доказові дані (1В) щодо ефективності внутрішньосуглобових ін’єкцій ГК, що зумовлюють, однак, лише відносно короткостроковий ефект. Дані щодо предикторів ефективності внутрішньосуглобових ін’єкцій ГК відсутні, що пояснює необхідність проведення подальших досліджень у цьому напрямку.
10. Заміщення (артропластика) суглоба показана пацієнтам із рентгенологічними ознаками ОА з рефрактерним больовим синдромом і ФН колінного суглоба.
Артропластика суглоба є незворотним втручанням, що застосовується у пацієнтів із найтяжчими формами захворювання, які не відповідають на терапевтичні заходи щодо лікування. Ефективність тотальної артропластики колінного суглоба переконливо доведена у інвалідизованих пацієнтів із тяжким ОА колінних суглобів. У систематичному Кокранівському огляді сформульований висновок про те, що артропластика колінного суглоба є безпечним і ефективним методом лікування, що забезпечує покращання якості життя (Frankel S. et al., 1990), зменшення вираженості больового синдрому та збільшення функціональної рухливості суглоба. Доказова база на підтримку цього твердження відноситься до рівня 3 і ґрунтується на даних клінічних спостережень і ретроспективних аналізів, в яких часто у ролі первинного критерію ефективності використовують час функціональної здатності протезу.
Детальний пошук у базі даних літератури дозволив виділити 154 дослідження хірургічних методів лікування пацієнтів із патологією колінних суглобів, що містять дані про застосування 37 різних трисекційних протезів у 9879 людей (63% з ОА) (Chard J. et al., 1990). Хороші або відмінні результати відносно зменшення вираженості больового синдрому і поліпшення функціональної рухливості протягом 5 років після проведення оперативного втручання відзначені у 89% пацієнтів. Ефективність одно- і двосекційних протезів, оцінювана дослідниками, виявилася подібною. Автори огляду прийшли до висновку, що всі види артропластики колінного суглоба поліпшують якість життя пацієнтів.
Загальноприйнятий консенсус серед хірургів-ортопедів передбачає такі показання до проведення оперативного лікування:
а) наявність щоденного сильного болю;
б) рентгенологічні дані, що підтверджують звуження РСЩ (Manusco C.A. et al., 1996).
Слід зазначити, що ці критерії не підтверджені даними доказової медицини.
У жодному РКД ефективність тотальної артропластики не порівнювалася з нехірургічними методами лікування. Хоча відомо, що складність дизайну може бути обмежуючим моментом у проведенні РКД у хірургічній практиці, проте ці дослідження необхідно провести. Необхідно вивчити прогностичні фактори оперативного лікування, показання до проведення артропластики, оцінити довгострокову ефективність різних хірургічних методик і застосування різних протезів. Більше того, післяопераційні результати має оцінювати фахівець незалежно від хірурга, який проводив операцію.
Обговорення
Представлені Клінічні рекомендації ґрунтуються на аналізі даних літератури, опублікованих до січня 2002 р. включно, з позицій доказової медицини. Мета цієї публікації — узагальнення всіх існуючих терапевтичних підходів до ОА колінних суглобів. Наведені дані стосуються винятково гонартрозу; дослідження, у яких наведена сумарна статистика не дозволяла виділити патологію колінного суглоба, були виключені з аналізу. Наведені Рекомендації не можуть бути екстрапольовані на ОА іншої локалізації. Головна мета цієї роботи — розробити основний документ для спеціалізованої (вторинної) медичної допомоги, на підставі якого кожна країна зможе розробити власні керівні принципи лікування, а також алгоритми надання первинної медичної допомоги. Як зазначено в Рекомендаціях 2000 р., та невідповідність, що часто виникає між думкою експертів і доказовими даними КД, підтверджує значимість власного досвіду й окремих клінічних ситуацій у виборі індивідуального режиму лікування.
Огляд даних літератури ще раз висвітив необхідність дослідження прогностичних факторів (предикторів) відповіді на індивідуальні схеми лікування, оскільки відзначається явний дефіцит цієї інформації. Відчутно не вистачає відомостей про ефективність комбінованого лікування, широко розповсюдженого в рутинній клінічній практиці.
Гетерогенність оцінюваних різними дослідниками показників утруднює оцінку одного й того ж методу лікування на підставі зіставлення даних літератури. Розробка більш стандартизованих підходів до оцінки різних методів лікування потребує погоджених міжнародних зусиль.
Робоча група спробувала оцінити доказовість конкретних методів лікування й доповнити цю оцінку суб’єктивним висновком Комітету експертів щодо загальної безпеки й прийнятності цих методів. Завдання цієї роботи не полягало у виробленні дидактичного терапевтичного алгоритму, незважаючи на те що цей спрощений підхід може виявити безпосередній вплив на професіоналів у галузі медицини. Багато факторів, що визначають успіх лікування у хворих на ОА колінних суглобів, залежать від самого пацієнта — наприклад психосоціальні фактори і вплив на них ОА; супутні захворювання та їх лікарська терапія; оцінка пацієнтом його хвороби; довіра хворого та його переваги щодо проведеного лікування, а також попередній досвід хворого відносно лікування і лікарів, які його проводили.
Важливе значення мають також вартість і обґрунтованість певних методів лікування (наприклад фізіотерапії чи щотижневих ін’єкцій гіалуронової кислоти). Таким чином, план лікувальних заходів у хворого на ОА колінних суглобів необхідно індивідуалізувати, проаналізувати й скоригувати залежно від реакції пацієнта; причому він може змінюватися у різних пацієнтів та в різних точках світу. З оптимізмом можемо повідомити, що пропоновані Рекомендації EULAR становлять широкий спектр терапевтичних підходів, з якого потрібно вибрати все необхідне для конкретного пацієнта з ОА колінних суглобів. Не існує ні свідомо правильного, ні свідомо помилкового підходу до лікування, кожен лікар має вибирати терапію, найбільш адекватну для певного хворого в конкретний період і залежно від локалізації процесу.
Сподіваємося, що почата між експертами в галузі охорони здоров’я дискусія з приводу запропонованих терапевтичних схем підвищить поінформованість і поліпшить результати лікування при ОА колінних суглобів, що приведе до підвищення рівня медичної допомоги.
РЕКОМЕНДАЦІЇ ЄВРОПЕЙСЬКОЇ АНТИРЕВМАТИЧНОЇ ЛІГИ (EULAR): ДОКАЗОВИЙ ПІДХІД ДО ЛІКУВАННЯ ПАЦІЄНТІВ З ОСТЕОАРТРОЗОМ КУЛЬШОВИХ СУГЛОБІВ. ЗВІТ СПЕЦІАЛЬНОЇ КОМІСІЇ ПОСТІЙНОГО КОМІТЕТУ EULAR ЩОДО МІЖНАРОДНИХ КЛІНІЧНИХ, У ТОМУ ЧИСЛІ ТЕРАПЕВТИЧНИХ ДОСЛІДЖЕНЬ (ESCISIT)*
*Переклад статті, опублікованої в журналі «Annals of the Rheumatic Diseases», 2005, 64: 669–681, надано для публікації представництвом компанії «Євромедекс» в Україні і схвалено Українською асоціацією ревматологів України.
Вступ
Кульшовий суглоб — другий за частотою ураження при остеоартрозі (ОА). Поширеність ОА кульшового суглоба становить 3–11% серед населення західних країн віком старше 35 років (Felson D.T., 1988; Tepper S., Hochberg M.C., 1993; Lawrence R.C. et al., 1998; Ingvarsson T. et al., 1999; Lanyon P. et al., 2000). Це захворювання часто асоціюється зі значним болем, недієздатністю й погіршенням якості життя. Незважаючи на те що терапевтичні походи до лікування пацієнтів з ОА колінних і кульшових суглобів подібні та включають фармакологічне, нефармакологічне і хірургічне лікування, між ними є деякі відмінності. Крім того, величина ефекту (ВЕ) певного методу лікування може варіювати залежно від локалізації ураження ОА, що пов’язано з відмінностями в анатомії, біомеханіці, наявністю факторів ризику розвитку й прогресування захворювання, із доступністю суглобів для проведення локальної терапії. Тому після розробки рекомендацій для лікування пацієнтів із ОА колінних суглобів (Pendleton A. et al., 2000; Jordan R.M. et al., 2003) спеціальна комісія EULAR зосередила увагу на створенні аналогічного документа з рекомендаціями щодо лікування пацієнтів із ОА кульшових суглобів. Ці рекомендації також розроблені на основі методу Delphi з урахуванням результатів нещодавно проведених наукових досліджень і думок експертів.
Методи
Учасники
ESCISIT був створений міждисциплінарний комітет щодо розробки керівництва. У дослідженні взяли участь 23 експерти в галузі ОА (18 ревматологів, 4 хірурги-ортопеди та 1 епідеміолог) з 14 європейських країн. Мета роботи комітету: а) узгодження 10 ключових пропозицій щодо лікування пацієнтів з ОА кульшового суглоба; б) ідентифікація та критична оцінка даних наукових досліджень щодо клінічної ефективності й ефективності витрат відповідних методів лікування; в) створення рекомендацій, заснованих на комбінації найкращих із наявних доказових даних та оцінці експерта.
Консенсус експертів
Кожний член комітету незалежно надав 10 пропозицій, що описують ключові методи лікування пацієнтів з ОА кульшових суглобів. Погоджена думка експертів (консенсус) щодо цих пропозицій досягнута з використанням методу Delphi. Первісні пропозиції були зведені в один список, схожі або ті, що частково співпадають, пропозиції об’єднали. Список було повернуто експертам для вибору з нього 10 найважливіших. Пропозиції, вибрані більшістю членів комітету, приймалися автоматично, а відібрані одним-трьома експертами — відхилялися. Пропозиції, що одержали менше половини, але більше 3 голосів потрапляли в черговий раунд Delphi. Цю процедуру повторювали до одержання 10 погоджених пропозицій.
Систематичний пошук літератури
Систематичний пошук літератури, опублікованої із січня 1966 по березень 2004 рр., проводили з використанням баз даних Medline, Embase, CINHAL, Cochrane Library. Пошук був як загальним, так і специфічним для методу лікування. Стратегія загального методу пошуку складалася з двох базових компонентів: пошуку всіх можливих варіантів терміна «ОА кульшового суглоба» у базах даних (докладніше див. Appendix 1 за адресою: www.annrheumdis.com/supplemental) і типів дослідження у вигляді систематичних оглядів/метааналізів, РКД/КД, неконтрольованих досліджень, когортних досліджень, досліджень випадок — контроль, перехресних досліджень і економічної оцінки методів лікування (докладніше див. Appendix 2 за адресою: www.annrheumdis.com/supplemental). Мета загального методу пошуку — узагальнення інформації про сучасні методи лікування пацієнтів з ОА кульшового суглоба. Результати цього пошуку були повідомлені членам комітету перед застосуванням методу Delphi.
Після того, як за допомогою методу Delphi було складено 10 пропозицій, проведено специфічний для методів лікування пошук з метою ідентифікації даних для кожного з них. Стратегія пошуку включала варіанти терміна «ОА кульшового суглоба» (див. Appendix 1 за адресою: www.annrheumdis.com/supplemental) і будь-які існуючі терміни для специфічних методів лікування. Наприклад, для парацетамолу були використані такі терміни, як «парацетамол», «ацетамінофен» і «монокомпонентні препарати анальгетиків». Результати обох пошуків були об’єднані, а інформація, що дублюється, виключена. Спочатку використовували метод пошуку за медичними предметними рубриками у всіх базах даних, а у разі неможливості його проведения — пошук за ключовими словами. Усі терміни пошуку за медичними предметними рубриками були систематизовані. Додатково вивчали список посилань в оглядах і систематичних оглядах, включаючи всі додаткові дослідження, що відповідають критеріям включення/виключення. Пошук у Кокранівській бібліотеці включав пошук за медичними предметними рубриками у базах Кокранівських оглядів, рефератів якісної оцінки систематичних оглядів, Кокранівського реєстру контрольованих досліджень, у базі даних економічних оцінок Національної служби охорони здоров’я Великобританії, у базі даних оцінки технологій в охороні здоров’я. Крім того, виконано тематичний пошук щодо ОА.
Критерії включення/виключення
В аналіз включали тільки дослідження із клінічними критеріями ефективності терапії при ОА кульшового суглоба. Основна увага була зосереджена на систематичних оглядах, РКД/КД, неконтрольованих/когортних дослідженнях, дослідженнях випадок — контроль, перехресних дослідженнях, економічній оцінці лікування. Дослідження, присвячені ОА як колінних, так і кульшових (і/чи інших) суглобів були виключені (крім випадків, коли результати для хворих на ОА кульшових суглобів наводилися окремо). Дослідження терапії при ОА інших локалізацій або при інших хронічних захворюваннях суглобів були виключені (крім випадків, коли побічні явища вивчали як первинний критерій результату лікування). Також виключали опис окремих випадків, дослідження на тваринах, дослідження неклінічних результатів, оглядові статті описового характеру, коментарі, методичні рекомендації.
Категоризація доказовості даних
Дані розподіляли за категоріями відповідно до дизайну дослідження, використовуючи ієрархію даних у нисхідному порядку залежно від їх якості (табл. 12.25) (Shekeile P.G. et al., 1999).
Таблиця 12.25
Ієрархія доказовості даних і традиційна сила рекомендацій
| Категорія доказовості даних | Сила рекомендації |
| Ia — метааналіз РКД
Ib — РКД |
А — дані категорії I |
| Iia — нерандомізоване контрольоване дослідження
Iib — квазіекспериментальне дослідження |
В — дані категорії II або екстрапольовані з даних категорії I |
| III — неекспериментальне описове дослідження, наприклад порівняльне, кореляційне або дослідження випадок — контроль | С — дані категорії III або екстрапольовані з даних категорії I або II |
| IV — звіти експертних комітетів, думки і/або клінічний досвід авторитетних фахівців | D — дані категорії IV або екстрапольовані з даних категорії II або III |
При розв’язанні питань, що стосуються ефективності лікування, використовували найкращі доступні дані. Наприклад, якщо питання про ефективність втручання може бути вирішене за допомогою даних категорії Ia (тобто систематичних оглядів РКД), то дослідження з більш слабким дизайном (наприклад РКД, дані категорії Ib) не розглядали. Питання про побічні ефекти лікування вирішували з використанням результатів як РКД, так і обсерваційних досліджень. Незважаючи на те що ефективність була оцінена спеціально для ОА кульшового суглоба, побічні ефекти оцінювали спеціально для методу втручання незалежно від форми ураження опорно-рухового апарату. Питання ефективності витрат при лікуванні вирішували відповідно до параметрів, що використовуються для оцінки ефективності. Наприклад, якщо ефективність лікування оцінювали за зменшенням вираженості болю чи кількістю збережених років якісного життя (quality of life years gained — QALY), то використовували тільки дослідження лікування при ОА кульшових суглобів. Якщо ефективність лікування визначали за кількістю побічних явищ, розвитку яких вдалося запобігти, то використовували будь-які дослідження цього методу лікування.
Оцінка ефективності лікування за ефективністю витрат
Для кількісної оцінки ефективності лікування використовували такі критерії, як зменшення вираженості болю чи поліпшення функції суглобів, які розраховували шляхом визначення ВЕ і 95% ДІ порівняно із групами плацебо або активного контролю (Hedges L.V., 1982). ВЕ — стандартизована різниця середніх, тобто різниця середніх між показниками груп лікування і контролю, поділена на стандартне відхилення цієї різниці. Ця величина не має одиниць виміру й інформативна при порівнянні різних методик лікування. Клінічно ВЕ, що дорівнює 0,2, вважається малою, 0,5 — помірною, а >0,8 ― великою (Cohen J., 1988). При наявності більше одного систематичного огляду для того самого методу лікування використовували результати останнього із цих оглядів. Якщо систематичні огляди були відсутні, то використовували відповідний статистичний метод об’єднання даних (Whitehead A., Whitehead J., 1991). Обчислювали частку пацієнтів із помірним — дуже хорошим (або >50%) зменшенням вираженості болю чи симптомів, а також кількість хворих (яких необхідно пролікувати для досягнення одного хорошого результату або запобігання одному небажаному ефекту — Ред.) (number needed to treat — NNT) (Cook R.J., Sackett D.L., 1995). Позитивне значення NNT означає, що лікування більш ефективне, ніж контроль, тоді як негативне — менш ефективне. NNT і 95% ДІ вказували тільки у разі їх статистичної значимості; позначення «НЗ» (незначиме) використовували для запобігання плутанини (Rothman K.J., 1986). Відносний ризик (ВР) розраховували для побічних явищ (Maistrelli G.L., 1990).
При наявності економічної оцінки лікування розглядали такі показники: дизайн дослідження, порівнюване лікування, заінтересовану в економії витрат сторону, часовий діапазон, дисконтування, загальну вартість лікування, ефективність. Також розраховували коефіцієнт ефективності додаткових витрат (КЕДВ) (incremental cost effectiveness ratio — ICER (інкрементальний коефіцієнт вартість — ефективність — Ред.)). Використовували (при його наявності) індекс QALY (що відображає якісно прожиті роки — Ред.), а якщо ні, то застосовували такі специфічні для хвороби критерії, як зменшення вираженості болю і поліпшення функції суглобів.
Дані розглядали два дослідники з використанням спеціальних форм. Перед проведенням аналізу дослідники обговорювали й погоджували всі відмінності. Неангломовні дані досліджень оброблялися дослідниками — носіями відповідних мов.
Сила рекомендацій
Залежно від категорії доказовості даних про ефективність (див. табл. 12.25) силу рекомендацій визначали два члени комітету відповідно до одного з чотирьох класів — А–D, потім це рішення схвалював комітет. Якщо були відсутні специфічні для ОА кульшового суглоба дані, сила рекомендації не могла бути застосована. Однак також використовували візуальну аналогову шкалу (ВАШ). Кожного члена комітету просили відзначити на 100-міліметровій шкалі силу рекомендації для кожного втручання, відповідно до даних наукових досліджень (за критеріями «ефективність», «безпека», «ефективність витрат») і клінічного досвіду. Розраховували середні величини й стандартну помилку середньої величини щодо сили рекомендацій для кожного методу лікування. Ця система дозволила застосувати силу рекомендацій у тих випадках, коли специфічні для кульшового суглоба дані щодо ефективності були відсутні.
Програма майбутніх досліджень
Кожний член комітету запропонував 10 тем для програми майбутніх досліджень, що ґрунтуються на доступних на сьогодні даних і клінічному досвіді лікування пацієнтів з ОА кульшового суглоба. Для досягнення консенсусу з 10 найбільш важливих тем використовували метод Delphi. З цією метою застосовували ті ж критерії, які використовувалися при відборі пропозицій (тобто прийняття теми, за яку проголосували більше 50% членів комітету; відхилення теми, за яку проголосували менше 3 членів комітету; включення теми в наступний раунд Delphi, якщо за неї проголосували менше 50% членів комітету, але більше 3).
Результати
Методи лікування й типи доказових даних наукових досліджень
У результаті загального пошуку літератури виявлено 1725 посилань, з них у базі Medline — 1143, Embase — 357, CINAHL — 46, Cochrane Library — 179. Після видалення тих, що дублюються, залишилося 1341 посилання, в тому числі 898 — на оригінальні дослідження, 443 — на оповідальні огляди, коментарі, редакторські статті. На рис. 12.17 наведене процентне співвідношення різних методів лікування пацієнтів з ОА, що використовувалися у 898 оригінальних дослідженнях, а на рис. 12.18 — дизайн досліджень.
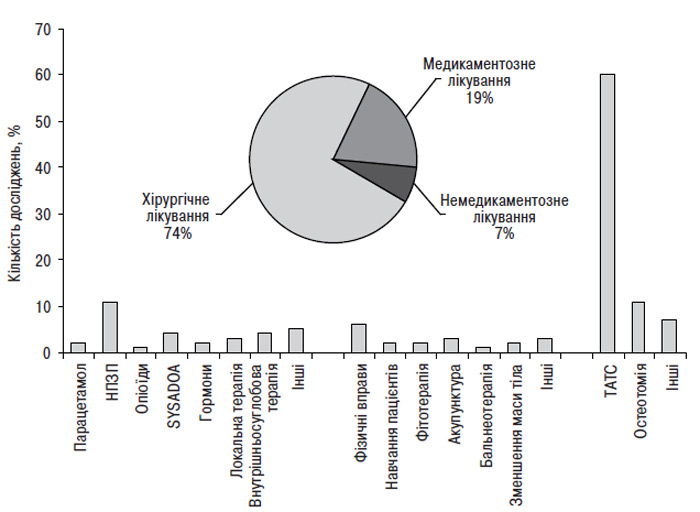
Рис. 12.17. Процентне співвідношення різних методів лікування пацієнтів із ОА кульшового суглоба за даними загального пошуку літератури. SYSADOA — симптоматичні повільнодіючі препарати для лікування при ОА; ТАТС — тотальна артропластика кульшового суглоба
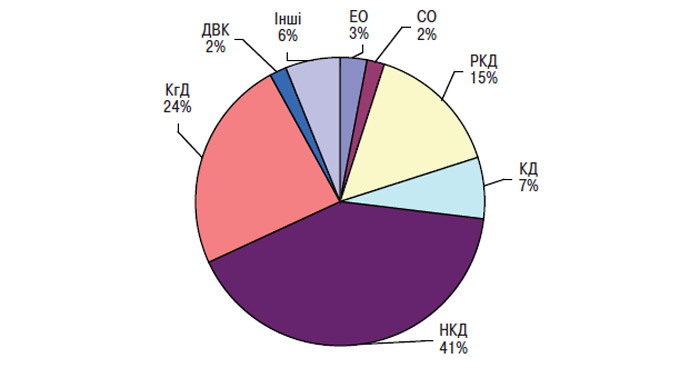
Рис. 12.18. Дизайн досліджень ОА кульшового суглоба за даними загального пошуку літератури. КгД — когортні дослідження; ДВК — дослідження випадок — контроль; ЕО — економічна оцінка методів лікування; СО — систематичні огляди; РКД — рандомізовані контрольовані дослідження; КД — контрольовані дослідження; НКД — неконтрольовані дослідження
Підхід до експертної оцінки
Експерти були поінформовані про результати загального пошуку літератури, після чого використовували метод Delphi. Із 112 пропозицій експертів після проведення 3 анонімних раундів Delphi було погоджено 10 остаточних рекомендацій щодо лікування пацієнтів із ОА кульшових суглобів (табл. 12.26).
Таблиця 12.26
Рекомендації експертів, розроблені в результаті трьох раундів Delphi й наведені в порядку, відповідному до обговорюваної теми (загальні рекомендації, а також рекомендації з немедикаментозних, медикаментозних, інвазивних і хірургічних методів лікування)
| № з/п | Рекомендація |
| 1 | Оптимальна схема терапії пацієнтів із коксартрозом потребує комбінації немедикаментозного й медикаментозного методів лікування |
| 2 | При лікуванні пацієнтів із коксартрозом необхідно враховувати:
а) наявність факторів ризику розвитку ОА кульшового суглоба (ожиріння, несприятливі механічні фактори, фізична активність, дисплазія) в) наявність загальних факторів ризику (вік, стать, супутні захворювання, супутня медикаментозна терапія) с) вираженість больового синдрому, інвалідизацію, ФН d) локалізацію і ступінь структурних ушкоджень е) побажання й очікування пацієнта, пов’язані з лікуванням |
| 3 | Немедикаментозне лікування пацієнтів із коксартрозом має включати: регулярні освітні програми, фізичні вправи, використання пристосувань (ціпок, ортопедичні устілки) і зменшення маси тіла у разі ожиріння чи надмірної маси тіла |
| 4 | Парацетамол (у дозі до 4 г/добу) є, враховуючи характеристики його ефективності й безпеки, пероральним анальгетиком першого вибору при помірно вираженому болю, і, у разі його ефективності, парацетамол переважає інші засоби в ролі перорального анальгетика для тривалого застосування |
| 5 | Нестероїдні протизапальні препарати (НПЗП) необхідно застосовувати в мінімальній ефективній дозі в комбінації з парацетамолом або замість нього у пацієнтів із неадекватною реакцією організму на парацетамол. Пацієнтам із підвищеним ризиком ураження травного тракту показані неселективні НПЗП у комбінації з гастропротекторними засобами або ж селективний інгібітор ЦОГ-2 (коксиб) |
| 6 | Опіоїдні анальгетики, у комбінації з парацетамолом або без нього, є можливою альтернативою лікування хворих, яким протипоказані НПЗП, включаючи селективні інгібітори ЦОГ-2, або ж якщо останні неефективні й/або погано переносяться |
| 7 | SYSADOA (Symptomatic Slow Acting Drugs for OA) — симптоматичні повільнодіючі препарати (глюкозаміну сульфат, хондроїтину сульфат, діацереїн, неомилювані сполуки авокадо/сої та гіалуронова кислота) — мають симптоматичний ефект і низьку токсичність, однак ВЕ мала, категорія пацієнтів, яким підходить це лікування, точно не встановлена, клінічно значима структурна модифікація та фармакоекономічні аспекти недостатньо визначені |
| 8 | Внутрішньосуглобові ін’єкції ГК (під контролем ультразвукового або рентгенологічного дослідження) можуть бути показані пацієнтам із запаленням, що рефрактерно до анальгетиків і НПЗП |
| 9 | Остеотомія і суглобозберігаючі хірургічні операції показані пацієнтам молодого віку із симптоматичним коксартрозом, особливо при наявності дисплазії чи варусної/вальгусної деформації |
| 10 | Артропластика показана пацієнтам із рентгенологічними ознаками коксартрозу з рефрактерним больовим синдромом та інвалідизацією |
Оцінка пропозицій експертів щодо рекомендацій
Результати, отримані при проведенні пошуку за окремими методами лікування, були об’єднані з результатами загального пошуку. Після виключення інформації, що дублюється, і статей, що не стосуються розглянутого питання, у списку залишилося 461 дослідження. Серед них: 44 статті, що стосуються застосування парацетамолу; 287 — стандартних НПЗП, коксибів і гастропротекторів; 41 — SYSADOA; 26 — опіоїдних анальгетиків; 7 — внутрішньосуглобових ін’єкцій ГК; 22 — немедикаментозних методів лікування; 34 — двох видів хірургічного лікування. Нижченаведені пропозиції були згруповані за темами — загальні рекомендації, рекомендації щодо немедикаментозних, медикаментозних, інвазивних і хірургічних методів лікування — без розподілу за ступенем значимості.
1. Оптимальна схема терапії пацієнтів із коксартрозом потребує комбінації немедикаментозного й медикаментозного методів лікування.
Хоча це положення логічне й відображає загальноприйняту клінічну практику, відсутні прямі порівняння чи доказові дані КД із використанням факторного дизайну для його підтвердження. Це положення підтверджується лише думкою експертів (категорія IV).
2. При лікуванні пацієнтів із коксартрозом необхідно враховувати:
- наявність факторів ризику розвитку ОА кульшового суглоба (ожиріння, несприятливі механічні фактори, фізична активність, дисплазія);
- наявність загальних факторів ризику (вік, стать, супутні захворювання й супутня медикаментозна терапія);
- вираженість больового синдрому, інвалідизації, ФН;
- локалізацію й ступінь структурних ушкоджень;
- побажання й очікування пацієнта, пов’язані з лікуванням.
Це положення відображає зразок клінічної практики і включає вказівки клінічних маркерів, які часто використовуються для прийняття рішення щодо лікування. Однак, хоча воно логічно аргументовано, недостатньо експериментальних даних для його підтвердження. У РКД переважно вивчають ефективність однієї чи двох конкретних монотерапій у високоселективних гомогенних популяціях, підібраних протилежно за певною ознакою досліджуваних із коксартрозом. Тому дані, отримані за допомогою таких експериментальних досліджень, не можуть бути екстрапольовані на всю популяцію хворих на коксартроз. Крім того, через виключення багатьох змінних, які можуть впливати на результат, часто тяжко визначити предиктори результату. У зв’язку з цим більш адекватні дані можуть бути отримані в ході обсерваційних досліджень, подібно до того, як велика кількість когортних досліджень проведена для відстеження можливих вихідних факторів ризику або предикторів для тотальної артропластики кульшового суглоба (ТАТС) або остеотомії. Наприклад, вік, ступінь дисплазії та ступінь деформації є основними предикторами для остеотомії (Maistrelli G.L. et al., 1990; Ohashi H. et al., 2000), а вираженість больового синдрому, рентгенологічний ступінь ураження і ступінь ФН асоційовані із клінічними результатами проведення ТАТС (Vinciguerra C. et al., 1995; Dougados M. et al., 1999; Nilsdotter a.K. et al., 2001; Maillefert J.F. et al., 2002; Birrel F. et al., 2003).
Ці фактори стають навіть більш важливими при аналізі ефективності витрат. Наприклад, ефективність витрат на селективні інгібітори ЦОГ-2 висока лише у пацієнтів із підвищеним ризиком виникнення шлунково-кишкової кровотечі, а ефективність витрат на проведення ТАТС вища у жінок більш молодого віку. Будь-яка тактика ведення хворого потребує урахування думки пацієнта та його очікувань, і цілісного підходу з урахуванням супутніх захворювань та інших вимог лікування. Зрозуміло, що побажання та очікування пацієнта, пов’язані з лікуванням, очевидно, є ключовими компонентами при прийнятті рішення про проведення ТАТС (Haddad F.S. et al., 2001; Mancuso C.A. et al., 2003).
Таким чином, це положення відображає реальність клінічної практики й професійний вдумливий підхід до лікування пацієнта. Дані ряду обсерваційних досліджень і економічних оцінок підтверджують доцільність його застосування (категорія III).
3. Немедикаментозне лікування пацієнтів із коксартрозом має включати: регулярні освітні програми, фізичні вправи, використання пристосувань (ціпок, ортопедичні устілки) і зменшення маси тіла у разі ожиріння чи надмірної маси тіла.
Два систематичні огляди були присвячені освітнім програмам у лікуванні пацієнтів з ОА (Superio-Cabuslay E. et al., 1996; Warsi A. et al., 2003), але жоден з них не містив дані про підгрупу пацієнтів із коксартрозом. В обох оглядах виявили статистично незначиму ефективність освітньої програми порівняно із групою контролю. ВЕ в одному огляді, присвяченому більшій кількості досліджень, становила відповідно 0,15 (95% ДІ: від –0,43 до +1,18) і –0,02 (95% ДІ: від –0,51 до +0,47) щодо зменшення вираженості больового синдрому й поліпшення функції суглобів (Superio-Cabuslay E. et al., 1996). У 24-місячне відкрите РКД було включено пацієнтів із коксартрозом, які очікують проведення ТАТС. Усі пацієнти були проінформовані звичайним способом і одержали інформаційний листок перед рандомізацією. Методом рандомізації їх розподілили на дві групи: пацієнтам 1-ї групи проводили колективний багатопрофільний інформаційний цикл протягом 6 тиж перед операцією, пацієнти 2-ї — становили групу контролю. Результати свідчать, що пацієнти, які брали участь у тренінгу, відзначали менш виражений біль, ніж ті, які входили в контрольну групу (Giraudet-Le Quintreс J.S. et al., 2003) (табл. 12.27).
Таблиця 12.27
Дані щодо ефективності — об’єднані дані ВЕ і NNT
| Вид лікування | Категорія* | Кількість досліджень | Тривалість лікування | ВЕ болю (95% ДІ) |
ВЕ функції (95% ДІ) |
NNT (95% ДІ) |
| Освітні програми | Ib | 1 | 24 міс | — | — | — |
| Зменшення маси тіла | III | 12 | — | — | — | — |
| НПЗП | Ia | 14 | 1–20 тиж | 0,69 (0,12–1,26) | — | 4 (3–6) |
| Опіоїди | Ib | 1 | 4 тиж | 0,78 (0,38–1,18) | 0,78 (0,26–1,30) | NS |
| Хондроїтину сульфат | Ib | 1 | 6 міс | — | — | — |
| Неомилювані сполуки авокадо/сої | Ib | 2 | 6; 12 міс | 0,31 (–0,64–1,26) | 0,52 (–0,36–1,40) | — |
| Діацереїн | Ib | 1 | 3 роки | 0,00 (–0,17–0,17) | 0,00 (–0,17–0,17) | — |
| Гіалуронова кислота | III | 3 | 3–12 міс | — | — | — |
| ГК внутрішньосуглобово | Ib | 1 | 3 міс | — | — | NS |
| Остеотомія | III | 9 | 2–20 років | — | — | — |
| ТАТС | III | 118 | 2–20 років | — | — | — |
*Див. табл. 12.25 — визначення категорій доказовості даних; ВЕ — величина ефекту лікування порівняно з плацебо-групою; NNT — кількість хворих, яких необхідно пролікувати для досягнення помірного-відмінного (>50%) зменшення вираженості болю або симптоматичного покращання; — дані відсутні; NS — статистично незначимо.
П’ять систематичних оглядів були присвячені застосуванню фізичних вправ (Puett D.W., Griffin M.R., 1994; van Baar M.E. et al., 1999; Fransen M. et al., 2002; 2003; Brosseau L. et al., 2003), але жодне із втручань не проводилося спеціально щодо лікування кульшового суглоба. В останньому з оглядів, з найбільшою кількістю РКД, встановлено, що ВЕ становила 0,39 (95% ДІ: 0,30–0,47) для зменшення вираженості болю і 0,31 (95% ДІ: 0,23–0,39) — для покращання функції суглобів. Відсутні дані РКД щодо переваг зменшення маси тіла. Проте в одному систематичному огляді обсерваційних досліджень (1 когортне дослідження та 11 досліджень випадок — контроль), присвяченому ожирінню й ризику розвитку коксартрозу, продемонстрована позитивна кореляція між ожирінням і коксартрозом у дослідженнях типу випадок — контроль (ВШ=2,3; 95% ДІ: 1,2–4,4), але не в когортному дослідженні (ВР=1,03; 95% ДІ: 0,40–2,60) (Lievense A.M. et al., 2002). Можливо, лікування з використанням фізичних вправ виявляє ефект на зменшення маси тіла, що, у свою чергу, може поліпшувати результат у хворих на коксартроз, але це потребує підтвердження результатами подальших досліджень. Відсутні дані наукових досліджень про застосування таких пристосувань, як ціпок і ортопедичні устілки при коксартрозі, хоча вони можуть сприяти зменшенню небажаних навантажень на суглоб.
Таким чином, проведене лише одне РКД (категорії Ib), присвячене винятково застосуванню освітніх програм при лікуванні пацієнтів із коксартрозом, результати якого дозволяють припустити, що використання освітніх програм сприяє зменшенню вираженості болю. Однак дані досліджень (категорії Ia) щодо лікування пацієнтів з ОА з ураженням будь-якого суглоба свідчать про те, що використання освітніх програм може мати дуже низьку ефективність і не досягати статистично значимої величини. Навпаки, незважаючи на відсутність прямих даних щодо коксартрозу, фізичні вправи, очевидно, корисні при ОА будь-якого типу (категорія даних Ia). Є деякі дані, що підтверджують користь зменшення маси тіла у пацієнтів із коксартрозом (категорія III), але відсутні дані щодо пристосувань (ціпок та ортопедичні устілки) (див. табл. 12.26). Незважаючи на відсутність даних досліджень, очевидна доцільність застосування лікувальних заходів, спрямованих на зменшення небажаних механічних навантажень на уражений кульшовий суглоб.
4. Парацетамол (у дозі до 4 г/добу) є, виходячи з характеристик його ефективності й безпеки, пероральним анальгетиком першого вибору при помірно вираженому болю, і, у разі його ефективності, парацетамол має переваги над іншими засобами як пероральний анальгетик для тривалого застосування.
Відсутні дані плацебо-контрольованих рандомізованих досліджень, а також порівняльних досліджень ефективності парацетамолу винятково при коксартрозі, хоча цей препарат широко застосовують при цьому захворюванні. У ході пошуку літератури виявлено 3 систематичні огляди (Lievense A.M. et al., 2002; Towheed T.E. et al., 2003; Zhang W. et al., 2004). В останньому з них розглянуто 4 плацебо-контрольовані дослідження, 2 з яких проводили за участю пацієнтів із коксартрозом або гонартрозом протягом 6 тиж (Zhang W. et al., 2004). ВЕ щодо зменшення вираженості болю становив 0,21 (95% ДІ: 0,02–0,41), а NNT для досягнення клінічного покращання (помірного-відмінного зменшення вираженості болю) при терапії парацетамолом порівняно із плацебо становив 4 (95% ДІ: 2–43). Однак парацетамол поступався за ефективністю, але був більш безпечним, ніж НПЗП.
Останнім часом висловлюються побоювання щодо можливої гастроінтестинальної токсичності парацетамолу. Результати одного дослідження випадок — контроль свідчать про те, що прийом парацетамолу в дозі >2 г/добу асоційований із підвищеним ризиком розвитку перфорацій або кровотеч зі ШКТ (ВШ=3,6; 95% ДІ: 2,6–5,1) (Garcia Rodriguez L.A., Hernandez-Diaz S., 2001), а дані іншого когортного дослідження свідчать про дозозалежний зв’язок між парацетамолом і диспепсією (Rahme E. et al., 2002). Однак результати систематичного огляду РКД підтверджують, що парацетамол викликає не більше шлунково-кишкових розладів, ніж плацебо (ВР=0,80; 95% ДІ: 0,27–2,37) (Zhang W. et al., 2004). Дані метааналізу досліджень випадок — контроль також свідчать про відсутність підвищення ризику розвитку шлунково-кишкових кровотеч при прийомі парацетамолу в дозі 2–4 г/добу (ВР=1,2; 95% ДІ: 0,8–1,7) і відсутності дозозалежного ефекту в діапазоні доз: <2 г; 2–4 г і >4 г/добу (Lewis S.C. et al., 2002); ці дані відповідають результатам ендоскопічних досліджень (Muller P. et al., 1990; Jerussi T.P. et al., 1998; Lanza F.L. et al., 1998).
Незважаючи на висловлювані побоювання щодо токсичного впливу парацетамолу на нирки при його тривалому регулярному застосуванні (Barret B.J., 1996), даних, що свідчать на користь такого припущення, недостатньо (Fored C.M. et al., 2001; Rexrode K.M. et al., 2001; Zhang W. 2001) (табл. 12.28).
Таблиця 12.28
Дані щодо безпеки: об’єднані дані величини ВР і 95% ДІ
| Вид лікування1 | Побічні явища | ВР* (95% ДІ) | Категорія даних |
| Парацетамол | Дискомфорт у ШКТ
Перфорація/кровотеча (ШКТ) Кровотеча (ШКТ) Ниркова недостатність Ниркова недостатність |
0,80 (0,27–2,37)
3,60 (2,60–5,10) 1,2 (0,8–1,7) 0,83 (0,50–1,39) 2,5 (1,7–3,6) |
РКД
Дослідження випадок — контроль Дослідження випадок — контроль Когортне дослідження Дослідження випадок — контроль |
| НПЗП | Перфорація/виразка/кровотеча (ШКТ)
Перфорація/виразка/кровотеча (ШКТ) Перфорація/виразка/кровотеча (ШКТ) |
5,36 (1,79–16,10)
2,70 (2,10–3,50) 3,00 (2,70–3,70) |
РКД
Когортні дослідження Дослідження випадок — контроль |
| Коксиби порівняно із НПЗП | Ендоскопічно підтверджена виразка ШКТ
Кардіоваскулярні події |
0,18 (0,14–0,23)
0,79 (0,40–1,55) |
РКД
РКД |
| Коксиби порівняно з напроксеном | Кардіоваскулярні події | 1,69 (1,07–2,69) | РКД |
| Мізопростол | Ендоскопічно підтверджена виразка ШКТ
Діарея |
0,26 (0,17–0,39)
1,81 (1,52–2,16) |
РКД
РКД |
| Блокатори Н2-рецепторів — подвійні дози | Ендоскопічно підтверджена виразка ШКТ | 0,44 (0,03–0,74) | РКД |
| Інгібітори протонного насосу (ІПН) | Ендоскопічно підтверджена виразка ШКТ | 0,40 (0,32–0,51) | РКД |
| Опіоїди + парацетамол порівняно з парацетамолом | Порушення з боку ШКТ/запор | 14,00 (1,86–105,16) | РКД |
| Діацереїн | Діарея
Шкірний висип/свербіж |
3,73 (2,61–5,32)
2,40 (1,01–5,69) |
РКД
РКД |
*ВР — відносний ризик при порівнянні основної та контрольної групи; при ВР=1 відсутні відмінності між порівнюваними групами; при ВР>1 ризик в основній групі вищий, ніж у контрольній; при ВР<1 ризик в основній групі нижчий, ніж у контрольній. Оцінку об’єднаних даних величини ВР проводили при аналізі декількох досліджень; 1порівняно з плацебо/відсутністю впливу, якщо не зазначено інше.
Таким чином, немає прямих відомостей, що підтверджують ефективність застосування парацетамолу при коксартрозі. Проте дані щодо ОА будь-якої локалізації (категорія Ia) свідчать про те, що парацетамол ефективний у зменшенні вираженості болю, зумовленої ОА. Незважаючи на те що його ефективність нижча, ніж стандартних НПЗП, він більш безпечний при застосуванні в рекомендованих дозах. Відсутні дані тривалих досліджень ефективності чи безпеки парацетамолу і прямі дані щодо ефективності витрат на його застосування при лікуванні пацієнтів із коксартрозом. Однак у дослідженні за участю пацієнтів із гонартрозом встановлено, що парацетамол перевершує НПЗП, НПЗП + гастропротектори і коксиби за величиною витрат, необхідних для запобігання розвитку одного побічного явища з боку ШКТ (Kamath C.C. et al., 2003) (табл. 12.29).
Таблиця 12.29
Дані щодо ефективності витрат рекомендованих видів лікування
| Лікування | Порівняння | Заінтересована сторона | Період | Знижки | Ефективність | З1–З2 | Е1–Е2 | КЕДВ |
| Парацетамол | Ібупрофен | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $63 000–112 000 | 995–980 | –3182 |
| Рофекоксиб | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $63 000–471 000 | 995–991 | –99 512 | |
| Целекоксиб | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $63 000–474 000 | 995–990 | –89 347 | |
| Ібупрофен + гастропротектор | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $63 000–556 000 | 995–988 | –68 472 | |
| Рофекоксиб | Ібупрофен | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $471 000–112 000 | 991–980 | 31 770 |
| НПЗП | Установа/ платник |
1 рік | 3% | Запобігання ППВК | — | — | 4738 | |
| Целекоксиб | Ібупрофен | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $474 000–112 000 | 990–980 | 33 518 |
| Ібупрофен + гастропротектор | Ібупрофен | Установа/ платник |
6 міс | Немає | Запобігання ППВК | $556 000–112 000 | 988–980 | 54 146 |
| НПЗП + мізопростол (усі хворі на ОА) | НПЗП | Служби охорони здоров’я Канади | 3 міс | Немає | Запобігання ППВК | $32 396–25 622 | 96–86 | 684 |
| НПЗП + мізопростол (хворі на ОА віком ≥65 років) | НПЗП | Служби охорони здоров’я Канади | 3 міс | Немає | Запобігання ППВК | $28 971–25 622 | 91–86 | 644 |
| Діацереїн + стандартна терапія | Стандартна терапія | Суспільство | 9 міс | Немає | Індекс стану функції суглоба (індекс Лекена) | F2360–2272 | 2,2–1,2 | 88 |
| ТАТС (жінки, 60 років) | Традиційна терапія | Суспільство | Життя | 5% | Індекс QALY | $47 649–165 440 | 4,16–2,16 | –17 121 |
| ТАТС (чоловіки, ≥85 років) | Традиційна терапія | Суспільство | Життя | 5% | Індекс QALY | $30 580–21 432 | 4,16–2,16 | 4754 |
| ТАТС | Без ТАТС | Суспільство | 1 рік | Немає | Індекс QALY | $9990–0 | 0,84–0,29 | 18 164 |
| ТАТС | Без ТАТС | Національна служба охорони здоров’я Великобританії | Життя | 6% | Індекс QALY | PS4804–0 | 8,39–0 | 573 |
| ТАТС | Без ТАТС | Ірландські медичні заклади | 2 роки | Немає | Індекс QALY | PS472,06–0 | 74,2–48,8 | 19 |
З1 — загальні витрати на лікувальний захід; З2 — загальні витрати на порівнюваний метод лікування; Е1 — ефект від втручання; Е2 — ефект від порівнюваного методу лікування; КЕДВ — коефіцієнт ефективності додаткових витрат; ППВК — перфорація, пептична виразка або кровотеча; індекс QALY — кількість збережених років якісного життя; ТАТС — тотальна артропластика кульшового суглоба; $ — дол. США; F — франк; PS — фунт стерлінгів.
5. НПЗП необхідно застосовувати в мінімальній ефективній дозі в комбінації з парацетамолом або замість нього у пацієнтів із неадекватною реакцією організму на парацетамол. Пацієнтам із підвищеним ризиком ураження ШКТ показані неселективні НПЗП у комбінації з гастропротекторними засобами або ж селективний інгібітор ЦОГ-2 (коксиб).
В одному систематичному огляді, присвяченому застосуванню НПЗП, що не містять ацетилсаліцилової кислоти, в лікуванні пацієнтів із коксартрозом, проаналізовано 14 плацебо-контрольованих досліджень (Towheed T. et al., 2000). Встановлено, що ВЕ для зменшення вираженості болю становила 0,69 (95% ДІ: 0,12–1,26), а NNT для досягнення терапевтичного ефекту порівняно з плацебо — 4 (95% ДІ: 3–6), що підтверджує доцільність застосування НПЗП при коксартрозі (див. табл. 12.27). Однак характеристики безпеки НПЗП відносно ШКТ зменшують їх переваги. 6 систематичних оглядів було присвячено оцінці безпеки НПЗП відносно ШКТ із використанням даних РКД, когортних досліджень і досліджень випадок — контроль (Gabriel S.E. et al., 1991; Bollini P. et al., 1992; Garsia Rodriguez L.A., 1998; Tramer M.R. et al., 2000; Lewis S.C. et al., 2002; Ofman J.J. et al., 2002). Результати свідчать, що НПЗП зумовлюють підвищений ризик розвитку кровотеч із ШКТ (див. табл. 12.28), що носить дозозалежний характер (наприклад величина ВР становить 2,2 (95% ДІ: 0,8–5,8), 3,2 (1,9–5,5) і 12,2 (5,6–26,7) при застосуванні диклофенаку в дозах <75 мг/добу, 75–150 мг/добу і >150 мг/добу відповідно) (Lewis S.C. et al., 2002).
З метою мінімізації ризику ураження ШКТ внаслідок застосування НПЗП використано ряд стратегій. У 2 систематичних оглядах продемонстровано значне зниження гастроінтестинальної токсичності при застосуванні коксибів (Deeks J.J. et al., 2002; Rostom A. et al., 2004), проте дані 5 систематичних оглядів свідчать на користь поєднаного застосування неселективних стандартних НПЗП з такими гастропротекторними засобами, як мізопростол, блокатори Н2-рецепторів та ІПН в подвійних дозах (Capurso L. et al., 1991; Shield M.J., 1998; Rostom A. et al., 2000; 2004; Leandro G. et al., 2001). Наведено дані останнього систематичного огляду щодо об’єднаної оцінки ВР розвитку ендоскопічно підтвердженої пептичної виразки шлунка (див. табл. 12.28) при застосуванні коксибів або поєднаному застосуванні гастропротекторів і НПЗП (Rostom A. et al., 2004a). Подібні результати отримані також для інших видів пептичних виразок та їх ускладнень, проте блокатори Н2-рецепторів у стандартних дозах менш ефективні, ніж інші гастропротектори; також необхідна особлива обережність при застосуванні мізопростолу, оскільки він підвищує ризик розвитку діареї (ВР 1,81; ДІ: 1,52–2,16) (Rostom A. et al., 2004).
Крім того, висловлювалися побоювання щодо можливих кардіоваскулярних побічних ефектів рофекоксибу (наприклад інфаркт міокарда та інсульт). Проте систематичний огляд 23 КД показав, що застосування рофекоксибу асоційоване з підвищеним ризиком розвитку серцево-судинних захворювань тільки порівняно з напроксеном (ВР 1,69; ДІ: 1,07–2,69). Ризик не був статистично значимим при порівнянні із плацебо (ВР 0,84; ДІ: 0,51–1,38) або «ненапроксеновими» НПЗП (ВР 0,79; ДІ: 0,40–1,55) (Konstam M.A. et al., 2001). Тому більш частий розвиток кардіоваскулярних тромбоемболічних подій при застосуванні рофекоксибу може відображати антитромбоцитарний чи будь-які інші протекторні ефекти напроксену, ніж побічні ефекти рофекоксибу. З метою вивчення цього питання проводяться подальші дослідження.
Інший важливий аспект використання коксибів або гастропротекторів — визначити, чи можуть їх додаткові переваги виправдати додаткові витрати на їх застосування. Проведено 3 економічні аналізи щодо оцінки лікування пацієнтів з ОА будь-якої локалізації (Gabriel S.E. et al., 1993; Pellissier J.M. et al., 2001; Kamath C.C. et al., 2003). Оскільки в усіх із них використовували дані про клінічно визначені побічні явища з боку ШКТ, яких вдалося запобігти (перфорація, виразкоутворення чи кровотеча) як основний параметр ефективності, результати можна екстраполювати і на пацієнтів із коксартрозом. Результати одного дослідження продемонстрували, що КЕДВ для коксибів порівняно з ібупрофеном становить для рофекоксибу 31769,9 дол. США на 1 побічне явище, яке вдалося запобігти, а для целекоксибу — 33518,5 дол. США. КЕДВ знижувався при підвищенні у пацієнтів ризику виникнення захворювань ШКТ, що вказує на більш високу ефективність витрат при застосуванні коксибів у пацієнтів із вищим ризиком розвитку кровотечі із ШКТ. Подібні результати отримані й для гастропротекторних засобів, однак з більш високим КЕДВ, що дозволяє припустити, що супутнє застосування гастропротекторів — більш дороговартісна тактика лікування (див. табл. 12.29).
Таким чином, НПЗП ефективні у зменшенні вираженості болю при коксартрозі (категорія даних — Ia). Однак побічні ефекти НПЗП із боку ШКТ зменшують їхні переваги (категорія Ia). Незважаючи на те що застосування коксибів або додаткове призначення гастропротекторів (мізопростол, блокатори Н2-рецепторів та ІПН в подвійних дозах) при терапії стандартними НПЗП може значно знижувати частоту розвитку кровотеч із ШКТ (категорія Ia), ці тактики лікування більш дороговартісні та економічно ефективні лише у пацієнтів із більш високим ризиком розвитку побічних явищ з боку ШКТ.
6. Опіоїдні анальгетики у комбінації з парацетамолом або без нього, є можливою альтернативою лікування пацієнтів, яким протипоказані НПЗП, включаючи селективні інгібітори ЦОГ-2, або якщо останні неефективні та/або погано переносяться.
В одному систематичному огляді повідомляється, що комбінація парацетамолу і кодеїну забезпечує збільшення вираженості знеболювального ефекту приблизно на 5% при одноразовому застосуванні щодо будь-якого типу болю, включаючи біль при коксартрозі (de Craen А.J.M. et al., 1996). На жаль, у цьому огляді дані щодо лікування пацієнтів з OA кульшового суглоба не відділені від даних щодо інших захворювань. Крім того, в огляді продемонстровано, що застосування парацетамолу в комбінації з кодеїном було причиною більшої кількості побічних явищ, ніж застосування одного парацетамолу (ВР 2,5; 95% ДІ: 1,5–4,2). У ході пошуку виявлено 4 РКД, присвячені лікуванню пацієнтів із коксартрозом: у 1 порівнювали ефективність кодеїну із плацебо (Peloso P.M. et al., 2000), а в 3 — парацетамолу в комбінації з опіоїдним анальгетиком порівняно із плацебо (Emkey R. et al., 2004), парацетамолом (Kjaersgaard-Andersen P. et al., 1990) або диклофенаком (Parr G. et al., 1989). Встановлено, що опіоїдний засіб (кодеїн) перевершував плацебо щодо зменшення вираженості болю (ВЕ 0,78; 95% ДІ: 0,38–1,18) і покращання функції суглобів (ВЕ 0,78; 95% ДІ: 0,26–1,30), однак водночас був причиною розвитку більшої кількості побічних явищ (ВР 1,43; 95% ДІ: 1,09–1,86) (Peloso p.M. et al., 2000). Хоча комбінація парацетамолу та опіоїдного засобу забезпечувала кращу аналгезію, ніж плацебо (ВЕ 0,30; 95% ДІ: 0,05–0,53) (Emkey R. et al., 2004), це лікування було не більш ефективним, ніж лікування парацетамолом (ВЕ для зменшення вираженості болю від помірного до відмінного 1,27; 95% ДІ: 0,82–1,98) (Kjaersgaard-Аndersen P. et al., 1990) і було менш ефективним порівняно з лікуванням диклофенаком (ВЕ –0,18; 95% ДІ: від –0,33 до –0,04) (Parr G. et al., 1989). Більш важливим є те, що така комбінація була причиною більшої кількості побічних ефектів (ВР 7,25; 95% ДІ: 2,61–20,13), у тому числі розладів з боку верхніх відділів ШКТ, запорів (ВР 14; 95% ДІ: 1,86–105,16) і запаморочення чи сонливості (ОР 5,00; 95% ДІ: 1,48–16,92) (Emkey R. et al., 2004) і мала більший відсоток виключення пацієнтів із досліджень (ВР 3,57; 95% ДІ: 1,92–6,62) (Parr G. et al., 1989) (див. табл. 12.28).
Таким чином, опіоїдні анальгетики в комбінації з парацетамолом або без нього ефективні при коксартрозі (категорія Ib). Проте їх ефективність може бути не вищою, ніж ефективність монотерапії парацетамолом, і нижчою від ефективності НПЗП (категорія Ib). Крім того, опіоїдні анальгетики виявляють більше побічних ефектів і зумовлюють припинення лікування з цих причин (категорії Іа і Ib). Ці дані підтверджують, що опіоїдні анальгетики слід рекомендувати тільки пацієнтам, у яких застосування парацетамолу, звичайних НПЗП або коксибів було недостатньо ефективним, або пацієнтам із протипоказаннями до НПЗП/коксибів.
7. SYSADOA — симптоматичні повільнодіючі препарати (глюкозаміну сульфат, хондроїтину сульфат, діацереїн, неомилювані сполуки авокадо/сої і гіалуронова кислота) виявляють симптоматичний ефект і низьку токсичність, проте малу ВЕ, категорія пацієнтів, яким підходить це лікування, точно не встановлена, клінічно значима структурна модифікація і фармакоекономічні аспекти встановлені недостатньо виразно.
Термін SYSADOA поширюється на ряд лікарських засобів, включаючи глюкозаміну сульфат, хондроїтину сульфат, діацереїн, неомилювані сполуки авокадо/сої та гіалуронову кислоту. Класифікація цих засобів змінюється залежно від країни, що її використовує. У Великобританії, наприклад, глюкозаміну сульфат і хондроїтину сульфат, класифікуються як харчові добавки, які продаються без рецепта. Багато систематичних оглядів проводилися для підтвердження доцільності перорального застосування глюкозаміну сульфату (Mcalindon T.E. et al., 2000; Towheed T.E. et al., 2001) і хондроїтину сульфату (Leeb B.F. et al., 2000; Mcalindon T.E. et al., 2000). Проте жоден із них не був спеціально присвячений коксартрозу. У дослідженнях, у яких вивчали гонартроз і коксартроз, встановлено, що об’єднаний показник ВЕ для зменшення вираженості болю при застосуванні глюкозаміну сульфату порівняно із плацебо становив 0,44 (95% ДІ: 0,24–0,64), а для покращання функції суглоба — 0,41 (95% ДІ: 0,14–0,69), тоді як при застосуванні хондроїтину сульфату ці показники становили 0,78 (95% ДІ: 0,60–0,95) і 0,63 (95% ДІ: 0,32–0,94) відповідно. В 1 плацебо-контрольованому РКД, спеціально присвяченому застосуванню хондроїтину сульфату при коксартрозі, продемонстровано, що хондроїтину сульфат статистично значимо перевершував плацебо щодо зменшення вираженості болю та покращання функції суглобів більше ніж через 6 міс після початку лікування. Проте за даними цього дослідження ВЕ не розраховувалася, тому що про стандартні відхилення не повідомлялося (Conrozier T., Vignon E., 1992). У ході систематичного пошуку літератури не вдалося ідентифікувати дослідження інших рівнів доказовості спеціально для коксартрозу. Дані щодо модифікуючого структуру суглобів ефекту цих двох засобів не отримано. В іншому РКД встановлено, що внутрішньом’язове введення глікозаміноглікан-пептидного комплексу (на сьогодні вилучений з ринку) курсами 2 рази на рік протягом 5 років не мало переваг порівняно із плацебо щодо модифікації структури суглоба при коксартрозі (Pavelka K. et al., 2000).
У 2 систематичних оглядах (Little C.V., Parsons T., 2001; Long L. et al., 2001) оцінювали ефективність фітотерапії, в тому числі при проведенні 2 РКД (Blotman F. et al., 1997; Mathieu E. et al., 1998) щодо застосування неомилюваних сполук авокадо/сої при OA різної локалізації. В 1 з досліджень було виділено підгрупу пацієнтів із коксартрозом (n=50), яких лікували протягом 24 тиж (Mathieu E. et al., 1998). Результати цього дослідження свідчать про більш істотне зменшення вираженості болю в основній групі пацієнтів, ніж у групі плацебо (ВЕ 0,76, 95% ДІ: 0,17–1,34). Однак це не підтверджено даними нещодавно проведеного дослідження з більшим розміром вибірки (n=163) і більш тривалим періодом лікування (1 річний — для симптоматичних результатів і 2-річний — для структурних змін) (Lequesne М. et al., 2002). Об’єднані величини ВЕ для зменшення вираженості болю і покращання функції суглобів у цих двох дослідженнях не були статистично значимі (див. табл. 12.27). Крім того, лікування неомилюваними сполуками авокадо/сої протягом 2 років не мало переваг щодо будь-яких покращань структури суглобів (Lequesne M. et al., 2002).
Дані про застосування діацереїну не дозволяють зробити остаточний висновок. В 1 багатоцентровому РКД за участю 507 хворих на коксартроз встановлено, що терапія діацереїном протягом більше 3 років не має переваг порівняно із плацебо щодо зменшення вираженості болю (ВЕ 0,00; 95% ДІ: від –0,17 до 0,17) або поліпшення функції суглобів (ВЕ 0,00; 95% ДІ: від –0,17 до 0,17) (див. табл. 12.27) (Dougados М. et al., 2001). Однак це дослідження планувалося насамперед з метою з’ясування ефективності препарату щодо модифікації структури суглобів, а не щодо усунення симптомів захворювання. В іншому РКД за участю 207 пацієнтів з OA колінного чи кульшового суглоба продемонстровано, що комбінація діацереїну і стандартної терапії більш ефективна щодо зменшення вираженості болю (ВЕ 0,29; 95% ДІ: 0,05–0,57) і поліпшення функції суглобів (ВЕ 0,35; 95% ДІ: 0,08–0,63), ніж застосування лише стандартної терапії протягом 6 міс (Fagnani F. et al., 1998), хоча дані тільки щодо коксартрозу представлені не були.
Однак, незалежно від своєї ефективності, діацереїн зумовлює підвищення частоти розвитку таких побічних ефектів, як діарея (ВР 3,73; 95% ДІ: 2,61–5,32), шкірний висип або свербіж (ВР 2,40; 95% ДІ: 1,01–5,69) (див. табл. 12.28) (Dougados M. et al., 2001). Проте діацереїн може сповільнювати прогресію звуження рентгенологічної суглобової щілини (РСЩ) при коксартрозі (Dougados М. et al., 2001). Відносний ризик прогресування звуження РСЩ, визначений як звуження РСЩ на 0,5 мм, протягом 3-річного лікування порівняно з плацебо, становив 0,84 (95% ДІ: 0,71–0,99), при значенні NNT=10 (95% ДІ: 5–171). Хоча подібне лікування може мати більш високу ефективність витрат, ніж стандартна терапія при короткочасному застосуванні без урахування віддалених побічних ефектів (див. табл. 12.29) (Fagnani F. et al., 1998), клінічне співвідношення ризик — користь при застосуванні діацереїну в пацієнтів із коксартрозом все-таки потребує підтвердження.
На відміну від гонартрозу, відсутні дані РКД, що підтверджують доцільність внутрішньосуглобового застосування гіалуронової кислоти при коксартрозі, хоча результати всіх 3 неконтрольованих досліджень (Brocq O. et al., 2002; Conrozier T. et al., 2003; Vad V.B. et al., 2003) підтвердили істотне зменшення вираженості болю порівняно з вихідним рівнем.
Таким чином, немає прямого підтвердження клінічних переваг (щодо зменшення вираженості болю і покращання функції суглобів) застосування глюкозаміну сульфату при коксартрозі, хоча є дані категорії Іа щодо лікування пацієнтів з OA будь-якої локалізації. Застосування хондроїтину сульфату ефективне для зменшення вираженості болю і ФН при коксартрозі, що продемонстроване в 1 РКД (категорія Ib). Дані про симптоматичні ефекти неомилюваних сполук авакадо/сої та діацереїну (категорія Ib) неостаточні, а доказові дані відносно гіалуронової кислоти — слабкі (категорія III). Необхідне проведення подальших досліджень для підтвердження модифікуючого ефекту і ефективності витрат SYSADOA.
8. Внутрішньосуглобові ін’єкції ГК (під контролем ультразвукового або рентгенологічного дослідження) можуть бути показані пацієнтам із запаленням, рефрактерним до анальгетиків і НПЗП
У 3 дослідженнях вивчали терапію при коксартрозі (Flanagan J. et al., 1988; Plant M.J. et al., 1997; Waseem M. et al., 2002), але лише 1 з них — РКД, у якому порівнювали застосування комбінації анестетика і стероїдного засобу з монотерапією анестетиком (Flanagan J. et al., 1988). Однак результати цього дослідження розрізнені, тому ВЕ не розраховували. Частотне відношення для зменшення вираженості болю становило 1,18 (95% ДІ: 0,68–2,15) і 0,61 (0,23–1,60) за 1 і 3 міс відповідно. Це свідчить про те, що подібна комбінація не перевершувала за ефективністю анестетик при застосуванні у хворих на коксартроз. Хоча дані 2 неконтрольованих досліджень свідчать про деяке короткочасне (3 міс) зменшення вираженості болю при внутрішньосуглобовому застосуванні ГК (Plant M.J. et al., 1997; Waseem M. et al., 2002), результати можуть містити систематичну помилку у зв’язку з ефектами плацебо. Тобто, на відміну від гонартрозу, відсутні робастні (стійкі) дані, що підтверджують ефективність внутрішньосуглобового введення стероїдного засобу при коксартрозі, незалежно від наявних технічних труднощів проведення подібної процедури. Крім того, відсутні порівняльні дані, що підтверджують підвищену точність процедури в результаті використання ультразвуку або рентгенконтролю, і відсутні дані про розвиток запалення.
Таким чином, є дані категорії Ib на користь цього методу лікування, але результати досліджень не дозволяють зробити остаточний висновок, тому необхідне проведення плацебо-контрольованих досліджень у пацієнтів із коксартрозом.
9. Остеотомія і суглобозберігаючі хірургічні операції показані пацієнтам молодого віку із симптоматичним коксартрозом, особливо при наявності дисплазії чи варусної/вальгусної деформації.
Остеотомія таза і/або стегнової кістки може змінювати навантаження на кульшовий суглоб і таким чином потенційно впливати на клінічні ознаки й перебіг коксартрозу. Симптоматичні та структурні результати подібного впливу оцінювали переважно у пацієнтів з ацетабулярною дисплазією і вальгусною деформацією шийки стегнової кістки. Як і у разі ТАТС, більшість доступних досліджень є когортними, тому в цій роботі не вдалося ідентифікувати будь-якого РКД щодо вираженості симптомів або структурних змін. Принаймні в 7 ретроспективних когортних дослідженнях (Maistrelli G.L. et al., 1990; Tonnis A. et al., 1994; Ohashi H. et al., 2000; Takatori Y. et al., 2001; Murphy S., Deshmukh R., 2002; Yasunaga y. et al., 2003) і у 2 проспективних когортних дослідженнях (Siebenrock K.A. et al., 2001; Hasegawa Y. et al., 2002), з періодами спостереження від 2 до 20 років вивчали як остаточні результати, так і предиктори перед початком дослідження, що мають відношення до цієї рекомендації. У пацієнтів відзначено істотне покращання клінічних (вираженість болю, здатність пересуватися і загальні показники функції суглобів) і рентгенографічних показників після операції. Більш похилий вік (Maistrelli G.L. et al., 1990; Siebenrock K.A. et al., 2001), ступінь рентгенографічних змін (Tonnis A. et al., 1994; Ohashi H. et al., 2000; Takatori Y. et al., 2001; Murphy S., Deshmukh R., 2002), ступінь дисплазії (Maistrelli G.L. et al., 1990; Tonnis A. et al., 1994) і тяжкість рентгенографічних деформацій (Maistrelli G.L. et al., 1990; Ohashi H. et al., 2000) перед початком дослідження асоціювалися з гіршими клінічними результатами і з невдалим хірургічним втручанням, яке головним чином визначали як необхідність проведення ТАТС. Оскільки у більшість досліджень були включені дорослі люди молодого віку, у яких відзначалися принаймні незначні або помірно виражені симптоми (в основному біль у кульшовому суглобі), а також було недостатньо даних щодо природного перебігу кульшових і ацетабулярних деформацій, необхідне проведення подальших досліджень з метою встановлення ефективності остеотомії у пацієнтів із безсимптомним перебігом хвороби і у пацієнтів різних вікових груп.
Дані обсерваційних досліджень також свідчать на користь доцільності проведення таких рекомендованих останнім часом суглобозберігаючих хірургічних процедур, як артроскопічне очищення суглоба (дебридмент) (Margheritini F., Villar R.N., 1999; Helenius I. et al., 2001) і хірургічне вирівнювання кульшового суглоба з компенсуючою реконструкцією (Ganz R. et al., 2001; Beck M. et al., 2004). Хоча в цих дослідженнях відзначено зменшення вираженості симптомів, але відсутність контрольних груп з альтернативним методом лікування утрудняє інтерпретацію зазначених результатів.
Таким чином, недостатньо даних (категорія III) щодо ефективності остеотомії та зберігаючих хірургічних процедур у пацієнтів із коксартрозом. Очевидно, вони показані пацієнтам більш молодого віку з болючою дисплазією стегна чи деформаціями, при яких поки не виправдане проведення ТАТС. Однак слід визначити їх ефективність і ефективність витрат порівняно з ТАТС у пацієнтів більш старших вікових груп і/або з більш тяжкими стадіями коксартрозу.
10. Артропластика показана пацієнтам із рентгенографічними ознаками коксартрозу з рефрактерним больовим синдромом та інвалідизацією.
Через методологічні та етичні проблеми порівняння ТАТС із плацебо або стандартними схемами лікування тяжко оцінити при проведенні РКД. У ході пошуку літератури нам не вдалося знайти жодного РКД плацебо, що порівнювало стандартне лікування з ТАТС. Однак є велика кількість випадків порівняння різних типів протезів, а також неконтрольованих проспективних досліджень (Faulkner A. et al., 1998; Fitzpatrick R. et al., 1998). Один систематичний огляд включав 118 неконтрольованих проспективних досліджень за участю в цілому 77 375 пацієнтів із середнім періодом подальшого спостереження 9,4 року (діапазон 2–20 років) (Fitzpatrick R. et al., 1998). Відсоток пацієнтів із відсутністю бою в кінцевій точці дослідження становив у середньому від 43,2% (95% ДІ: 34–49) до 84,1% (95% ДІ: 46–100), залежно від типу протезу. Середнє зменшення кількості балів за шкалою Harris для кульшового суглоба (максимум — 100 балів, включаючи оцінку болю — 0–40 балів, функції — 0–47 балів, руху — 0–5 балів і деформації — 0–8 балів) порівняно з вихідним станом, становило від 36 до 46%. Частота ревізійних втручань — один із головних показників ефективності ТАТС — становила від 0,18 (стандартна помилка середньої величини — 0,04) до 2,04 (стандартна помилка середньої величини — 0,19) на 100 людей/рік із корекцією за віком, статтю і типом артриту кульшового суглоба. Є більше інформації щодо відмінностей між протезами (Faulkner A. et al., 1998; Fitzpatrick R. et al., 1998), але вона виходить за рамки цієї настанови.
Більш високі результати щодо зменшення вираженості болю й покращання якості життя при застосуванні ТАТС були отримані в 1 невеликому когортному дослідженні, проведеному в азіатській країні, у якому порівнювали ефективність ТАТС і консервативної терапії. Однак, незважаючи на те що протягом 1-ого року після операції ТАТС була ефективніша від консервативної терапії, через 5 років остання виявилася більш ефективною (Kawasaki M. et al., 2003). Оскільки в цьому дослідженні був дуже малий розмір вибірки (62 і 45 осіб у кожній групі) і була відсутня корекція даних за іншими факторами, що впливають на результат, результати дослідження можуть містити систематичну помилку. Було проведено 2 інші когортні дослідження, в одному порівнювали кількість балів за анкетами WOMAC і SF-36 (Nilsdotter A.K. et al., 2003), а в іншому — виживаність (Visuri T. et al., 1994) у пацієнтів із ТАТС і вихідною популяцією. Крім гірших функціональних показників, у групі ТАТС була подібна якість життя і виживаність порівняно з вихідною популяцією.
Питання про те, чи рентгенографічні зміни мають бути одним із критеріїв для вирішення питання про проведення ТАТС, поки залишається відкритим. У 6 когортних дослідженнях (Vinciguerra C. et al., 1995; Dougados M. et al., 1999; Nilsdotter A-K. et al., 2001; Maillefert J.F. et al., 2002; Birrell F. et al., 2003) (у 4 з них дані доступні для проведення повторного аналізу) і в 1 дослідженні випадок — контроль (Dolin S.J. et al., 2003) продемонстровано позитивний зв’язок між ступенем рентгенологічних змін і ризиком ТАТС (табл. 12.30). Більш високий ризик ТАТС також асоціювався з наявністю вираженого болю й інвалідизації. Таким чином, виражені рентгенологічні зміни, біль і ФН ― прогностичні показники для визначення необхідності в подальшому проведенні ТАТС. Проте важко визначити, чи є вони незалежними факторами ризику проведення ТАТС або факторами, якими на сьогодні керуються хірурги для прийняття рішення щодо тактики лікування. Однак, якщо діагноз OA підтверджений (найчастіше — рентгенологічно), це має істотне значення і для оцінки проблем, пов’язаних безпосередньо зі станом пацієнта (біль, ФН), і для визначення потреби в серйозному оперативному втручанні.
Таблиця 12.30
Рентгенологічна тяжкість уражень, вираженість болю, функція та ВР тотального ендопротезування кульшового суглоба
| Фактор ризику | Когортне дослідження | Дослідження випадок — контроль | ||
| Кількість досліджень | ВР (95% ДІ) |
Кількість досліджень | ВШ (95% ДІ) |
|
| Сумарні зміни на рентгенограмах* |
4 | 2,39 (1,74–3,29) | 1 | 1,98 (1,23–3,19) |
| Ступінь за Croft | 1 | |||
| 0/1 | 1 | |||
| 2 | 3,36 (0,31–38,91) | |||
| 3 | 15,23 (3,29–70,49) | |||
| 4 | 44,51 (10,04–197,48) | |||
| 5 | 57,29 (12,12–270,71) | |||
| Біль (≥50%) | 1 | 1,86 (1,23–3,88) | 1 | 1,91 (1,43–2,56) |
| Функція (за Lequesne) (≥10) | 2 | 2,75 (1,98–3,82) | 1 | 1,75 (1,24–2,48) |
*Визначені як ступінь за Croft ≥2 або РСЩ ≤2 мм. Всі величини скориговані за віком, статтю та індексом маси тіла. Об’єднані показники ВР/ВШ оцінювали для більше ніж одного дослідження.
Інше важливе питання відносно ТАТС полягає у визначенні того, чи є воно ефективним з погляду витрат порівняно з іншими методами лікування. Виявлено 5 досліджень з економічною оцінкою ТАТС, хоча в 1 з них порівнювали різні типи протезів (Faulkner A. et al., 1998), тому воно не підходить для розглянутої рекомендації. У 4 дослідженнях порівнювали ТАТС із звичайною терапією (Chang R.W. et al., 1996) або з іншими видами лікування без ТАТС, зробивши припущення, що відсутні витрати й ефекти, пов’язані з проведенням інших видів лікування без ТАТС (Rorabeck C.H. et al., 1994; Fitzpatrick R. et al., 1998; O’shea K. et al., 2002). Результати досліджень свідчать, що для одержання додаткових переваг порівняно зі звичайним лікуванням або іншими видами лікування без ТАТС, проведення ТАТС потребує додаткових витрат (див. табл. 12.29). Проте ефективність витрат на нього вища у жінок більш молодого віку. Наприклад, порівняно зі звичайною терапією ТАТС було рентабельним для жінок віком старше 60 років (КЕДВ — 17 121 дол. США на кожний збережений рік якісного життя), і менш рентабельним для чоловіків віком старше 85 років (КЕДВ — 4 754 дол. США на кожний збережений рік якісного життя).
Враховуючи вигоди й витрати, пов’язані із проведенням ТАТС, вибір оптимального моменту для виконання оперативного втручання при OA є вирішальним. Запропоновано ряд критеріїв для пріоритетного направлення пацієнтів на проведення ТАТС (Rorabeck C.H. et al., 1994; Maillefert J.F. et al., 2002; O’shea K. et al., 2002), але жоден із них не є загальноприйнятим. У той час як роль ступеня рентгенологічних змін залишається недостатньо вивченою, біль і порушення функції суглобів є найбільш важливими й погодженими параметрами показань для проведення тотального ендопротезування і вони безпосередньо пов’язані з післяопераційними результатами (NIH consensus conference, 1995; Nilsdotter A.K. et al., 2001; 2003; Maillefert J.F. et al., 2002).
Таким чином, ТАТС ефективна при коксартрозі для покращання клінічних показників — вираженості болю і порушення функції суглобів (категорія даних — III). Загалом ТАТС має більш високу ефективність витрат у жінок більш молодого віку. Рентгенологічних змін зазвичай достатньо для підтвердження діагнозу коксартрозу, а ступінь тяжкості рентгенологічного ураження, вираженість болю і ступінь ФН — фактори ризику для проведення ТАТС. Є переконливі підтвердження й дані про те, що вираженість болю і ступінь ФН є основними факторами, що визначають необхідність проведення ендопротезування (категорія III).
Напрямки подальших досліджень
Спочатку було запропоновано 95 тем для дослідження. 10 з них, погоджені в остаточному висновку як найважливіші теми для майбутніх досліджень на підставі доступних даних наукових досліджень і клінічної практики, наведені в табл. 12.31.
Таблиця 12.31
Напрямки подальших досліджень — рекомендації, розроблені в ході трьох раундів Delphi
| № з/п | Рекомендація |
| 1 | Необхідно проводити подальші РКД щодо вивчення медикаментозних і немедикаментозних методів лікування, у яких визначають результати, специфічні для коксартрозу |
| 2 | Необхідне подальше вивчення біологічних маркерів для оцінки прогресування коксартрозу |
| 3 | Необхідно встановити клінічні предиктори відповіді на медикаментозні й немедикаментозні втручання при коксартрозі |
| 4 | Необхідно встановити, чи можуть SYSADOA при тривалому прийомі сповільнити прогресування коксартрозу й відстрочити ТАТС |
| 5 | Потрібне проведення РКД щодо терапії ін’єкційними засобами (ГК, гіалуронат), при коксартрозі |
| 6 | Необхідно визначити найбільш діючі та ефективні програми фізичних вправ при коксартрозі |
| 7 | Необхідні дослідження з відповідним дизайном для визначення порівняльної ефективності та ефективності витрат нехірургічних і хірургічних методів лікування |
| 8 | Необхідні погоджені критерії щодо показань і вибору часу проведення ТАТС |
| 9 | Необхідне проведення проспективних популяційних досліджень для поглиблення знань про фактори ризику розвитку й прогресування коксартрозу |
| 10 | Необхідна валідація нових методик візуалізації (МРТ, УЗД) для встановлення діагнозу й оцінки результатів у дослідженнях з коксартрозу |
Обговорення
Це перший повний документ, у якому наведено рекомендації щодо ведення пацієнтів із коксартрозом. На відміну від попередніх рекомендацій, які були спеціально присвячені коксартрозу (Hochberg M.C. et al., 1995) або включали це захворювання (Scott D.L., 1993; Kwoh C.K. et al., 2002), справжні рекомендації ґрунтуються як на думці експертів, так і на даних наукових досліджень, із чітким поділом між ними. Нами використані детально розроблені методи, зокрема методика Delphi, для вироблення консенсусу, а також підхід доказової медицини для ідентифікації та оцінки даних наукових досліджень. Подібна змішана методика використовувалася для розробки рекомендацій EULAR щодо ведення пацієнтів із гонартрозом (Pendelton A. et al., 2000; Jordan K.M. et al., 2003). Однак у справжні рекомендації з коксартрозу ми внесли 3 важливі методологічні зміни.
По-перше, ми не враховували якість досліджень, оскільки виявили, що це не допомагає оцінити дані наукових досліджень, тому що підрахунок балів якості піддається привнесенню систематичної помилки в результаті якості складання повідомлень про дослідження. Наприклад, дані РКД, опубліковані до прийняття угоди CONSORT (Begg C. et al., 1996), можуть мати більш низький загальний бал якості, ніж опубліковані пізніше. Таким чином, бали якості не обов’язково відображають точність і надійність даних відповідного дослідження, і не можуть бути використані для визначення коефіцієнтів результатів КД. Тому для оцінки якості даних наукових досліджень нами використані тільки ієрархія даних, яка дозволяє чітко диференціювати дослідження залежно від якості використаної в них методології, а не якості повідомлення результатів. По-друге, для надання в цій роботі загальної оцінки і точності ефектів лікування нами використані об’єднана ВЕ в останньому систематичному огляді (або при необхідності, синтезовані дані) і 95% ДІ.
По-третє, оцінювали ефективність, побічні ефекти та ефективність витрат кожного методу лікування, а не лише їх ефективність за даними РКД, і застосували 0–100 мм шкалу ВАШ для оцінки сили рекомендацій з метою полегшення обліку багатофакторних аспектів кожного виду лікування.
Із 21 методу лікування, включеного в 10 рекомендацій, 15 підтверджувалися даними категорій Ia–IV (табл. 12.32), але 6 з них або не мали прямих доказів (парацетамол, глюкозамін і фізичні вправи), або відображали непереконливі переваги методів лікування (неомилювані сполуки авокадо/сої, діацереїн і внутрішньосуглобові ін’єкції ГК) при коксартрозі. Навпаки, ці види лікування були ефективні й рекомендовані при гонартрозі (Pendelton A. et al., 2000; Jordan K.M. et al., 2003). Необхідне проведення подальших досліджень щодо цих видів лікування при коксартрозі, але наявні дані дозволяють припустити, що можуть бути справжні відмінності в ефективності методів лікування пацієнтів з ОА залежно від місця ураження. Подібні відмінності підтверджують необхідність пропонованих регуляторними органами вимог одержувати дані наукових досліджень про переваги методів лікування для кожної локалізації ОА окремо. Подібні відмінності, що залежать від локалізації ураження при ОА, відмічені і щодо факторів ризику розвитку та прогресування ОА, а також кореляції між вираженістю болю і структурними змінами суглоба, що відображає гетерогенність патологічного процесу при ОА (Felson D.T. et al., 2000).
Хоча ієрархічний підхід широко використовується для градації якості даних (Shekelle P.G. et al., 1999), його значимість для оцінки хірургічних методів лікування та побічних ефектів викликає сумніви (Black N., 1996; 1999). Наприклад, визнано, що проведення ТАТС є клінічно ефективним лікуванням при коксартрозі, особливо у пацієнтів із рефрактерним болем і ФН, або ж при неефективності традиційного лікування. Однак у зв’язку з етичними й практичними проблемами забезпечення «сліпоти» досліджень, відсутні плацебо-контрольовані або паралельні РКД нехірургічних методів лікування. Дані, що свідчать на користь ТАТС, отримані в неконтрольованих або когортних дослідженнях, і тому належать до категорії III, що не відповідає високому ступеню сили рекомендацій на користь ТАТС, якщо враховуються всі види даних, а не тільки дані наукових досліджень (див. табл. 12.32). Крім того, при відсутності даних, що стосуються конкретно до кульшового суглоба (і, отже, відсутності категорій даних), неможливо застосувати силу рекомендацій, засновану на ієрархії даних (Black N., 1999).
Таблиця 12.32
Сила рекомендацій
| Вид лікування | Дані наукових досліджень* | Сила рекомендацій заснована на | |||
| Ефективність | Побічні ефекти | Ефективність витрат | |||
| ефективності (A–D) | усіх даних і клінічному досвіді (ВАШ, середнє ± SEM) | ||||
| Медикаментозна + немедикаментозна терапія | IV + | — | — | D | 86,94±5,82 |
| Лікування, скориговане з урахуванням факторів ризику, тяжкості коксартрозу і очікувань пацієнта | III + | — | — | C | 92,19±3,39 |
| Освітні програми | Ib + | — | — | A | 71,75±6,42 |
| Фізичні вправи | — | — | — | N/A | 71,58±6,30 |
| Ортопедичні устілки/ціпок | IV + | — | — | D | 61,72±6,91 |
| Зменшення маси тіла | III + | — | — | D | 68,28±5,79 |
| Парацетамол | — | Ia –, III ± (ШКТ) | Економічно ефективний | N/A | 79,19±3,82 |
| НПЗП | Ia + | Ia +, III + (ШКТ) | — | A | 79,36±4,18 |
| Коксиби | Ia + (гастропротекція) | Ia ± (ССС) | У популяції з підвищеним ризиком ураження ШКТ | A | 79,44±3,51 |
| Мізопростол | Ia + (гастропротекція) | Ia + (діарея) | У популяції з підвищеним ризиком ураження ШКТ | A | 46,06±5,62 |
| Блокатори H2-рецепорів (подвійна доза) | Ia + (гастропротекція) | — | У популяції з підвищеним ризиком ураження ШКТ | A | 31,28±6,81 |
| ІПН | Ia + (гастропротекція) | — | — | А | 73,86±3,97 |
| Опіоїдні засоби | Ib + | Ia + (будь-які, ШКТ, ЦНС) | — | A | 43,97±4,36 |
| Глюкозамін | — | — | — | N/A | 37,06±5,03 |
| Хондроїтин | Ib | — | — | A | 34,44±4,76 |
| Діацереїн | Ib ± | Ib + (диспепсія) | Короткочасна | Не доведена | 27,83±5,38 |
| Неомилювані сполуки авокадо/сої | Ib – | — | — | Не рекомендується | 31,72±4,79 |
| Гіалуронова кислота | III + | — | — | С | 22,83±4,17 |
| ГК внутрішньосуглобово | Ib – | — | — | Не рекомендується | 41,47±5,74 |
| Остеотомія | III + | — | — | С | 59,64±5,19 |
| ТАТС | III + | — | Жінки більш молодого віку | С | 86,86±2,42 |
*Категоризація даних з урахуванням ієрархії в табл. 12.25; «–» не підтверджують; «+» підтверджують; «±» не встановлено. Наприклад, «Ia + (ШКТ)» означає, що є дані категорії Ia на підтвердження того, що метод лікування викликає побічні ефекти з боку ШКТ. ВАШ — візуальна аналогова шкала (0–100 мм, де 0 — не рекомендується зовсім, 100 — повністю рекомендується); SEM — стандартна помилка середньої; ССС — серцево-судинна система; ЦНС — центральна нервова система; «—» відсутній; N/A — не застосовано внаслідок відсутності даних спеціально для кульшового суглоба.
З метою вирішення цієї проблеми ми почали так зване post hoc-дослідження, при якому члени комісії визначали силу рекомендацій для кожного методу лікування за ВАШ (0–100 мм). На відміну від традиційної рангової шкали для сили рекомендацій, ВАШ дозволяє враховувати всі види даних наукових досліджень (ефективність, безпеку й ефективність витрат) і клінічний досвід. Найважливіше, що ВАШ дозволяє як зменшувати, так і збільшувати силу рекомендацій, що забезпечує іншу міру оцінки, що відрізняється від визначення категорії даних. Наприклад, сила рекомендацій для НПЗП становить 79%, з урахуванням вищої категорії даних (Ia) щодо ефективності, тоді як сила рекомендації для тотальної артропластики кульшового суглоба становить 86%, незважаючи на те що вона заснована тільки на III категорії даних за ефективністю (див. табл. 12.32).
Є кілька обмежень щодо цих рекомендацій. По-перше, хоча ведення хворих на коксартроз становило першочерговий інтерес при оцінці деяких методів лікування (наприклад застосування парацетамолу і фізичних вправ) ми не змогли знайти досліджень, спеціально присвячених коксартрозу, або досліджень, у яких можна було окремо виділити дані щодо коксартрозу. У цьому разі ми вказували на відсутність даних спеціально щодо коксартрозу, але враховували дані змішаних досліджень при визначенні сили рекомендацій. Це може зумовити деяку неточність, а величину показників необхідно підтвердити. По-друге, дані щодо ВЕ відібрані із найостаннішого систематичного огляду з максимальною кількістю проаналізованих досліджень, але який не обов’язково є оглядом найвищої якості й найбільшої значимості. Часто ставало потрібним проводити аналіз підгруп, але в більшості випадків були відсутні необхідні для цього дані. По-третє, для оцінки ефективності вивчали тільки ВЕ, для оцінки результатів щодо вираженості таких симптомів, як біль і функція суглобів. Ефективність, що не має відношення до цих результатів, безпосередньо пов’язаних із пацієнтом, поки не встановлена. Нарешті, у наявній ієрархії даних основна увага приділена ефективності лікування, тоді як дані щодо безпеки та ефективності витрат краще оцінювати за дизайном досліджень, що не належать до категорії РКД, тому для їх оцінки потрібно використовувати спеціальну систему для визначення категорії даних. При відсутності такої спеціальної системи використовували наявну ієрархію, але у подальшому віддали б перевагу розробці рівноцінної системи щодо зазначених аспектів лікування.
Таким чином, нами розроблено рекомендації з лікування хворих на коксартроз, що ґрунтуються як на клінічній практиці, так і на кращих даних з наявних наукових досліджень. Відносно 15 лікувальних втручань із 21 включеного в 10 головних рекомендацій, є дані досліджень (категорії Ia–IV) що підтверджують доцільність застосування цих втручань при коксартрозі, хоча вони й варіюють за ефективністю, характером побічних ефектів і ефективністю витрат. Відносно 3 методів лікування (парацетамол, глюкозаміну сульфат і фізичні вправи) відсутні дані, що стосуються спеціально коксартрозу, а відносно ще 3 (неомилювані сполуки авокадо/сої, діацереїн і внутрішньосуглобові ін’єкції) є дані категорії I, що свідчать або про відсутність покращання щодо зменшення вираженості симптомів, або ті, що не дозволяють зробити остаточного висновку стосовно пацієнтів із коксартрозом, навіть незважаючи на те, що ці методи лікування ефективні при гонартрозі. Очевидно, що необхідно мати більше даних КД, що стосуються саме коксартрозу, особливо у зв’язку з тим, що різні методи лікування, очевидно, мають різну ефективність залежно від місця локалізації ОА (тобто ураженого суглоба). Сподіваємося, що поширення цих рекомендацій та їх обговорення медичними працівниками будуть сприяти поглибленню наших знань і підвищенню інтересу до ведення пацієнтів із коксартрозом і приведуть до встановлення більш високих стандартів допомоги хворим на коксартроз.
РЕКОМЕНДАЦІЇ ЄВРОПЕЙСЬКОЇ АНТИРЕВМАТИЧНОЇ ЛІГИ (EULAR): ДОКАЗОВИЙ ПІДХІД ДО ЛІКУВАННЯ ПРИ ОСТЕОАРТРОЗІ СУГЛОБІВ КИСТІ: «ЗВІТ СПЕЦІАЛЬНОЇ КОМІСІЇ ПОСТІЙНОГО КОМІТЕТУ З МІЖНАРОДНИХ КЛІНІЧНИХ ДОСЛІДЖЕНЬ, ВКЛЮЧАЮЧИ ТЕРАПЕВТИЧНІ (ESCISIT)»*
*Переклад статті, опублікованої в журналі «Annals of the Rheumatic Diseases» online 17 Oct 2006; doi:10.1136/ard.2006.062091, виконаний О.П. Борткевичем, Ю.В. Бєлявською, Н.С. Бойчук (Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» АМН України) при підтримці представництва компанії «Євромедекс» в Україні.
Вступ
Остеоартроз (ОА) суглобів кисті — широко розповсюджене захворювання (Cushnaghan J., Dieppe P., 1991; Mannoni A. et al., 2000), хоча його поширення різниться залежно від того визначення, яке використовується. Так, у більшості людей віком старше 55 років відзначають рентгенологічні зміни, характерні для ОА, що уражують як мінімум один суглоб кисті (Dahaghin S. et al., 2005b), тоді як тільки у 1/5 цієї популяції відзначають симптоматику, характерну для ОА суглобів кисті (Dahaghin S. et al., 2005a). Кореляція між симптомами і рентгенологічними змінами є навіть меншою для ОА суглобів кисті порівняно з ОА кульшового чи колінного суглоба. Хоча більшість пацієнтів з ОА суглобів кисті можуть ніколи не звертатися за медичною допомогою (Oliveiria S.A. et al., 1995; Zhang Y.Q. et al., 2002), його вплив на розвиток непрацездатності достовірний (Zhang Y.Q. et al., 2002; Dahaghin S. et al., 2005a, b;). Важливо, що більшість клінічних наслідків ОА суглобів кисті залежать від локалізації (наприклад порушення стискання або точного хапання, невдоволеність естетичним видом) і відрізняються від таких при ОА колінних і кульшових суглобів. Крім того, порівняно з великими суглобами, менший розмір і можливість легкого доступу до суглобів кисті роблять їх більш доступними для проведення різних видів втручань. У зв’язку з відмінністю в анатомії, функції, факторах ризику та результатах ОА різних локалізацій процес може по-різному відповідати на той самий вид терапії. Таким чином, втручання при ОА повинні оцінюватися залежно від локалізації процесу.
Після розробки окремих доказових рекомендацій для лікування при ОА кульшового і колінного суглобів (Pendleton A. et al., 2000; Jordan K.M. et al., 2003; Zhang W. et al., 2005) Робоча група з ОА Європейської антиревматичної ліги (EULAR) була вповноважена в 2005 р. розробити рекомендації для лікування при ОА суглобів кисті. Як і раніше, було погоджено, що рекомендації будуть розроблені на підставі доказової бази, що включає систематичні огляди досліджень і думки експертів.
Методи
Учасники
Мультидисциплінарна робоча група була вповноважена ESCISIT. 21 експерт з ОА (16 ревматологів, 1 фізіотерапевт, 1 хірург-ортопед, 2 суміжні фахівці в галузі охорони здоров’я, 1 експерт в області доказової медицини), що представляють 15 європейських країн, погодилися взяти участь у дослідженні.
Мета дослідження: 1) узгодження ключових пропозицій щодо лікування при ОА суглобів кисті; 2) ідентифікація і критична оцінка результатів досліджень ефективності й вартості — ефективності значимих методів лікування; 3) розробка рекомендацій, що ґрунтуються на сукупності найкращих доказових методів лікування і думці експертів.
Консенсус експертів
Кожному учасникові запропонували незалежно представити 10 пропозицій щодо ключових аспектів лікування ОА суглобів кисті. Узгодження цих пропозицій було досягнуто шляхом використанням методу Delphi. Вихідні пропозиції згрупували в єдиний список. При необхідності пропозиції редагували з урахуванням граматики англійської мови і загальні, схожі за суттю пропозиції комбінували. Список був повернутий експертам з проханням вибрати 10 найбільш важливих позицій. Пропозиції приймалися автоматично за умови вибору їх більше ніж половиною учасників, тоді як пропозиції, що одержали тільки 1–3 голоси, автоматично видаляли. Пропозиції, що одержали менше 50% голосів, але більше ніж 3 голоси, включали в наступний раунд Delphi. Метод Delphi призупиняли, коли не залишалося пропозицій, які одержували між 3 і 50% голосів. Первинно не обмежувалася кількість остаточно обраних пропозицій.
Систематичний пошук літератури
Систематичний пошук літератури, опублікованої в період між січнем 1945 р. і січнем 2006 р., проводили з використанням баз даних MEDLINE (1966-), Old Medline (1950-), EMBASE (1980-), CINAHL (1980-), Science Citation Index через Web of Science (WOS) (1945-), Allied Complementary Medicine (AMED 1985-) і Cochrane Library — Кокранівської бібліотеки (з 1996 р. до сьогодні). Пошук у Кокранівській бібліотеці включав Кокранівські огляди, реферати якісної оцінки систематичних оглядів, Кокранівський реєстр контрольованих досліджень, базу даних економічних оцінок NHS, базу даних оцінки технологій здоров’я, бібліографічні деталі економічних розрахунків NHS. Пошук складався як із загального, так і специфічного для кожного методу лікування. Загальна стратегія пошуку включала дві основні складові: будь-яка термінологія, що включає ОА суглобів кисті в базі даних (Доповнення 1), і типи досліджень у формі систематичних оглядів/метааналізів, рандомізованих контрольованих досліджень (РКД)/контрольованих досліджень (КД), неконтрольованих досліджень, когортних досліджень, досліджень випадок — контроль, перехресних досліджень і економічних оцінок (Доповнення 2). Обидві складові пошуку узагальнені для одержання інформації про сучасні доступні методи лікування з літератури. Узагальнені результати повідомлені членам комітету перед обробкою за допомогою методу Delphi.
Після методу Delphi проведений специфічний для кожного методу лікування пошук з метою визначення доведених методів лікування для кожної специфічної позиції. Стратегія пошуку включала термін «ОА суглобів кисті» (Доповнення 1) і будь-які існуючі терміни для специфічних методів лікування. Так, для парацетамолу використані терміни «парацетамол», «ацетомінофен» і «прості анальгетики». Результати загального і специфічного пошуку поєднувалися, а інформація, що повторювалася, виключалася. За можливістю використовували метод пошуку за назвами медичних тем, а також метод ключових слів. Також вивчали список посилань у систематичних оглядах, включаючи будь-які додаткові дослідження, відповідні до критеріїв включення/виключення.
Критерії виключення/включення
До досліджень з прямою доказовою базою включали тільки дослідження, що розглядають терапію і клінічний результат ОА суглобів кисті. Дослідження, що вивчають ОА декількох локалізацій, включалися тільки за умови наявності окремих даних щодо ОА суглобів кисті. Особлива увага приділялася систематичним оглядам, РКД/КД, неконтрольованим дослідженням/когортним дослідженням, економічним оцінкам. Опис окремих випадків, оглядові статті, редакційні статті й коментарі виключали. Також виключали дослідження на здорових добровольцях і тваринах (рис. 12.19).
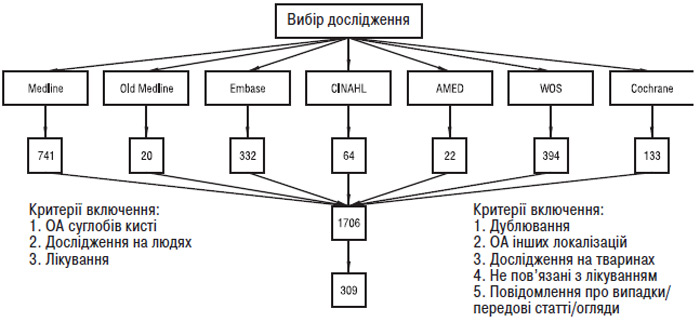
Рис. 12.19. Пошук літератури і відбір досліджень
Рівень доказовості
Докази ефективності розподілені на категорії відповідно до характеристик дизайну досліджень із використанням ієрархії даних (Shekelle P.G. et al., 1999) (табл. 12.33).
Таблиця 12.33
Рівень доказовості
| Ia Метааналіз РКД
Ib РКД |
| IIa КД без рандомізації
IIb Квазіекспериментальне дослідження |
| III Неекспериментальні описові дослідження, такі як порівняльні, кореляційні, дослідження випадок — контроль |
| IV Звіти комітетів, експертів, думка чи клінічний досвід авторитетних фахівців або те й інше |
При відповідях на запитання використовували найкращі доступні дані. Наприклад, якщо питання щодо ефективності втручання може бути вирішено за допомогою даних рівня доказовості Іа (тобто систематичний огляд РКД), тоді дослідження з більш слабким рівнем доказовості Іb не розглядали. При наявності декількох систематичних оглядів з того самого питання використовували результати останнього систематичного огляду, що містить найбільшу кількість досліджень. Питання щодо побічних ефектів вирішували з використанням як РКД, так і спостережливих досліджень незалежно від ОА суглобів кисті, оскільки РКД не є обов’язковим кращим методом для оцінки побічних ефектів, ОА суглобів кисті не є станом, при якому б оцінювали побічні ефекти потенційних втручань. Питання вартість — ефективність вирішували відповідно до результатів вимірювання ефективності. Наприклад, якщо ефективність оцінювали як «зменшення вираженості болю», використовували тільки дослідження при ОА суглобів кисті. Якщо ефективність лікування визначали за «кількістю побічних ефектів, яких вдалося уникнути», розглядалися будь-які дослідження даного методу втручання.
При відсутності прямої доказової бази з ОА суглобів кисті вивчали будь-які докази по лікуванню при ОА інших локалізацій. Однак у таких випадках підтримку пропозиції розглядали як думку експертів (IV); нами прямо не екстрапольована категорія доказовості повідомлень при ОА інших локалізацій на ОА суглобів кисті.
Вимір результатів
1. Ефективність.
Для оцінки ефективності лікування, величини ефекту (ВЕ) порівняно із плацебо чи активним контролем, специфічним для кожної позиції, розрахували тривалість за больовими показниками. ВЕ — стандартна середня різниця середніх, а саме середня різниця між основною групою (що одержує лікування) і контрольною групою, розділена на стандартне відхилення цієї різниці. Цей показник не має одиниць виміру й інформативний при порівнянні різних методів лікування. Клінічно ВЕ=0,2 вважається малою, ВЕ=0,5 помірною, а ВЕ>0,8 великою (Cohen J., 1988). Для дихотомічних даних, таких як частка пацієнтів зі зменшенням вираженості болю на 50%, визначали кількість пацієнтів, що потребують лікування (NNT) (Cook R.J., Sackett D.L., 1995). NNT є передбачуваною кількістю пацієнтів, що потребують лікування для досягнення цільового ефекту від лікування. 95% ДІ для NNT розраховували з використанням методики D.G. Аltman (1998).
2. Побічні ефекти.
Для побічних ефектів з РКД і когортних досліджень розраховували узагальнений відносний ризик (ВР) — як випадковий, з перехресних досліджень — як переважаючий ризик, тоді як у дослідженнях випадок — контроль розраховували оdds ratio — відношення шансів (ВШ) (Kleinbaum D.G. et al., 1982). Обидва показники демонстрували, у скільки разів частіше (або рідше) розвиваються побічні ефекти у пацієнта з лікуванням/втручанням порівняно з пацієнтами, які не проходили лікування. ВР або ВШ=1 відповідає непідвищеному рівню, тоді як ВР або ВШ>1 або <1 відповідає підвищеному або зниженому ризику відповідно.
3. Економічні розрахунки.
Для економічних розрахунків зростаючий рівень витрати — ефективність (ICER) розраховували як різницю у вартості між двома методами лікування, поділену на їх різницю за ефективністю. За можливістю використовували показник QALY (quality-adjusted life year) — років якості життя — для оцінки ефективності, інших хворобоспецифічних результатів, таких як зменшення вираженості болю, покращання функціонального стану. Додатково критично оцінювали дизайн дослідження, порівняльність, перспективність, часовий діапазон, дисконтування, загальні витрати — ефективність. Результати, наведені в точкових оцінках (наприклад середнє) і 95% ДІ, визначали іншим способом. Статистичний пул розглядали як підходящий (Whitehead A., Whitehead J.. 1991) при наявності більше ніж одного дослідження, а систематичний огляд був відсутнім.
Сила рекомендацій
Сила рекомендацій була класифікована з використанням EULAR візуальної аналогової шкали (ВАШ) і звичайних шкал (Zhang W. et al., 2005; 2006). Учасників попросили оцінити силу рекомендацій для кожної пропозиції з використанням як 0–100 мм ВАШ (0 мм=не рекомендується взагалі; 100 мм=повністю рекомендується) і А–Е зазвичай шкали (А = повністю рекомендується; В = настійно рекомендується; С = помірно рекомендується; D=слабко рекомендується; Е=не рекомендується). Учасники оцінювали кожну пропозицію з урахуванням доказовості дослідження (ефективності, безпеки, вартості — ефективності) та їх клінічної експертизи (логістики, сприйнятливості, переносимості і уподобань пацієнтів). Надалі розраховували середній показник ВАШ і 95% ДІ, і частку повністю або настійно рекомендованих (А–В) за кожною пропозицією.
Програма майбутніх досліджень
Кожного члена комітету попросили запропонувати до 10 тем для програм майбутніх досліджень, що ґрунтуються на доступних на сьогодні даних і клінічному досвіді лікування при ОА суглобів кисті. Схожі пропозиції були об’єднані, після чого з використанням методу Delphi досягнуто визначення 10 найбільш важливих тем. З цією метою застосовували критерії, подібні до використаних для відбору пропозицій (а саме ухвалювали ті, що одержали більше 50% голосів, виключали ті, у яких було менше 3 голосів, в наступний раунд включали пропозиції, що одержали менше 50%, але більше 3 голосів).
Результати
Методи лікування і типи дослідницьких даних
Загальний пошук визначив 1706 посилань. Серед них 309 відповідали критеріям включення й виключення (див. рис. 12.19). 48 із 309 досліджень були РКД або КД, у яких оцінені різні моделі лікування, включаючи нефармакологічні (наприклад навчання й вправи), фармакологічні (наприклад парацетамол і НПЗП), хірургічне лікування (наприклад трапецієектомія та інтерпозиційна артропластика проти трапецієектомії) (рис. 12.20). Визначали рівень доказовості систематичних оглядів і економічних розрахунків. Однак у більшості досліджень був неекспериментальний дизайн, такий як дослідження випадок — контроль або перехресні дослідження (рис. 12.21).
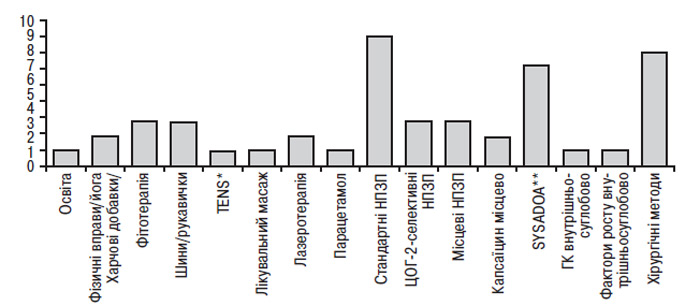
Рис. 12.20. Види лікування, вивчені РКД і КД. *Черезшкірна електростимуляція нервів; **повільнодіючі препарати для лікування ОА
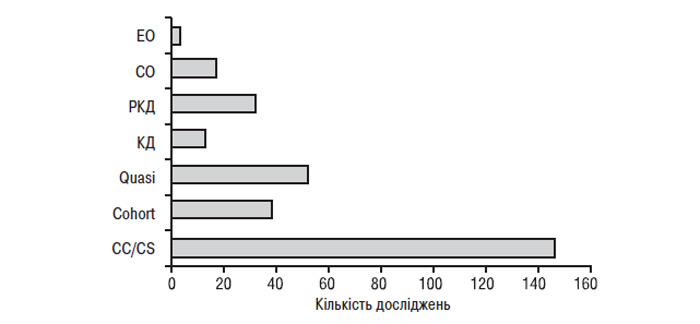
Рис. 12.21. Типи даних щодо ОА cуглобів кисті. ЕО — економічна оцінка; СО — систематичний огляд; Quasi — аналогічні експерименти, Cohort — когортні дослідження, CC/CS — дослідження типу випадок — контроль або дослідження з перехресним дизайном
Підхід експертної оцінки
Експерти поінформовані про результати загального пошуку літератури з наступним використанням методу Delphi. Із 158 вихідних пропозицій 11 остаточно погоджені як рекомендації після 3 анонімних раундів Delphi (табл. 12.34).
Таблиця 12.34
Рекомендації експертів, розроблені на підставі 3 раундів Delphi відповідно до завдання (загальні, нефармакологічні, фармакологічні, інвазивні та хірургічні)
| № з/п | Рекомендація | СР (95% ДІ) | |
| ВАШ 100 | А–В 100% | ||
| 1 | Оптимальне лікування при ОА суглобів кисті потребує комбінації нефармакологічних і фармакологічних лікувальних модальностей, індивідуалізованих з урахуванням потреб пацієнта | 95 (92; 98) | 100 |
| 2 | Лікування при ОА суглобів кисті має бути індивідуалізоване згідно з локалізацією ОА; факторам ризику (вік, стать, побічні механічні фактори); типу ОА (вузликовий, ерозивний, травматичний); наявності запалення; тяжкості структурних змін; вираженості болю, рівня непрацездатності й обмеження якості життя; супутньої патології та поєднаному застосуванню лікарських засобів (включаючи ОА інших локалізацій); побажанням і перевагам пацієнтів | 84 (76; 92) | 92 |
| 3 | Навчання щодо захисту суглобів (як уникнути побічних механічних факторів) разом із режимом вправ (що включають як вправи для обсягу рухів, так і силові вправи) рекомендуються для всіх пацієнтів з ОА суглобів кисті | 59 (45; 74) | 38 |
| 4 | Місцеві аплікації тепла (парафіновий віск, гаряче вологе обгортання та ін.), особливо перед проведенням вправ, і ультразвук є ефективними методами лікування | ||
| Повне | 56 (40; 71) | 33 | |
| Теплове | 77 (69; 85) | 77 | |
| Ультразвук | 25 (15; 36) | 0 | |
| 5 | Рекомендуються шини для великого пальця і ортези для профілактики/корекції латерального відхилення та згинальних деформацій | 67 (57; 77) | 69 |
| 6 | Місцева терапія є пріоритетною порівняно із системними способами лікування, особливо при мінімальному чи помірному болю і при ураженні тільки кількох суглобів. НПЗП і капсаїцин місцево — ефективний і безпечний метод лікування при ОА суглобів кисті | 75 (68; 83) | 86 |
| 7 | З урахуванням ефективності та безпеки парацетамол (до 4 г/добу) є пероральним анальгетиком першого вибору, у разі позитивного результату — кращим анальгетиком для тривалого перорального застосування | 87 (78; 96) | 92 |
| 8 | Пероральні НПЗП слід застосовувати в мінімальній ефективній дозі при неадекватній реакції на парацетамол. Пацієнтам із підвищеним ризиком виникнення гастроінтестинальних подій показані неселективні НПЗП у комбінації з гастропротекторними засобами або селективні інгібітори ЦОГ-2. При ризику виникнення серцево-судинних подій коксиби протипоказані, у цих випадках неселективні НПЗП є препаратами вибору | 81 (74; 88) | 100 |
| 9 | SYSADOA (глюкозамін, хондроїтину сульфат, діацереїн, неомилювані сполуки авокадо/сої, внутрішньосуглобові введення гіалуронової кислоти) зумовлюють симптоматичні ефекти і низьку токсичність, однак ВЕ низька, пацієнти, яким підходить це лікування, не визначені, а клінічно значимі структурно-модифікуючі та фармакоекономічні переваги не визначені | 63 (48; 76) | 69 |
| 10 | Внутрішньосуглобові ін’єкції ГК тривалої дії ефективні при сильно вираженому болю при ОА, особливо ОА трапеціометакарпального суглоба | 60 (47; 74) | 46 |
| 11 | Хірургічне втручання (інтерпозиційна артропластика, остеотомія, артродез) є ефективним лікуванням при тяжкому ОА великого пальця і показано пацієнтам із вираженим больовим синдромом і/або непрацездатністю при неефективності консервативного лікування | 68 (56; 79) | 62 |
СР — сила рекомендацій; ВАШ — візуальна аналогова шкала; НПЗП — нестероїдні протизапальні препарати; SYSADOA — симптоматичні повільнодіючі препарати при ОА.
Оцінка рекомендацій
Результати, отримані при проведенні пошуку за окремими методами лікування, були додані в базу даних оцінки кожної рекомендації і модальності кожної рекомендації. Нижченаведені рекомендації згруповані за темами (загальні, нефармакологічні, фармакологічні, інвазивні та хірургічні) без розподілу за значимістю.
1. Оптимальне лікування при ОА суглобів кисті потребує комбінації нефармакологічних і фармакологічних лікувальних модальностей, індивідуалізованих з урахуванням потреб пацієнта.
Рівень доказовості IV
Сила рекомендацій (95% ДІ): 95 (92; 98)
Хоча це положення логічне й ґрунтується на загальній клінічній практиці, відсутні прямі порівняння чи дані КД зі спеціально розробленим дизайном, що підтверджують це положення. Положення підтверджує тільки думка експертів (категорія IV).
2. Лікування при ОА суглобів кисті має бути індивідуалізоване згідно з локалізацією ОА; факторами ризику (вік, стать, побічні механічні фактори); типом ОА (вузликовий, ерозивний, травматичний); наявністю запалення; тяжкості структурних змін; вираженістю болю, рівнем непрацездатності та обмеження якості життя; супутньою патологією та поєднаним застосуванням лікарських засобів (включаючи ОА інших локалізацій); побажанням і перевагам пацієнтів.
Рівень доказовості IV
Сила рекомендацій (95% ДІ): 84 (76; 92)
Це положення включає певну кількість факторів, отриманих при оцінці пацієнтів, які можуть бути використані для прийняття клінічного рішення. Проте хоча воно має значиму загальну логічну аргументованість, відомо недостатньо експериментальних даних на його підтримку. РКД переважно досліджують ефективність однієї чи двох специфічних монотерапій у високоселективних гомогенних популяціях, підібраних протилежно за певною ознакою осіб з ОА суглобів кисті. Тому дані, отримані за допомогою таких експериментальних досліджень, не можуть прямо екстраполюватися на загальну популяцію осіб з ОА суглобів кисті, особливо при наявності супутньої патології. Крім того, через виключення багатьох змінних, які можуть впливати на ефективність, часто буває важко визначити предиктори результату (позитивні або негативні). Будь-яка тактика ведення хворого потребує врахування думки пацієнта і його очікувань, а також цілісного підходу, із врахуванням супутніх захворювань та інших аспектів лікування (Carr A.J. et al., 2001; Carr A.J., Higgisson I.J., 2001).
Отже, це положення є прагматичною спробою використання найкращого індивідуального підходу до кожного пацієнта, але підтримується тільки думкою експертів (рівень IV).
3. Навчання, що стосується захисту суглобів (як уникнути побічних механічних факторів) разом із режимом вправ (що включають як вправи для обсягу рухів, так і силові вправи) рекомендується для всіх пацієнтів з ОА суглобів кисті.
Рівень доказовості ІV
Сила рекомендацій (95% ДІ): 59 (45; 74)
В одному РКД у 40 пацієнтів з ОА суглобів кисті зіставляли програму захисту суглобів у комбінації із силовими вправами в домашніх умовах порівняно тільки з інформацією щодо ОА суглобів кисті (Stamm T.A. et al., 2002). NNT пацієнтів щодо поліпшення загальної функції суглобів становило 2% (95% ДІ 1,6) і відображало достовірну клінічну ефективність комбінованого лікування (табл. 12.35). Однак порівнювана група не була ідеальним контролем для оцінки цієї пропозиції, і оскільки обидва елементи лікування не порівнювалися прямо, нами не встановлено, чи була ефективність зумовлена силовими вправами, програмою захисту суглобів або обома складовими, тому необхідні подальші дослідження з певним дизайном і більшою кількістю учасників для одержання відповіді на ці питання. Більше того, «захист суглобів» зазвичай є ширшим навчальним методом лікування і залишається невідомо, чи стосується його ефективність прямого запобігання побічних механічних факторів. Навчання щодо захисту суглобів більш вивчене і оцінюється як ефективне у пацієнтів із РА (Hammond A., Freeman K., 2004), однак чи є воно узагальнюючим при незапальному ОА, залишається невідомим. Безпосередньо роль вправ для обсягу рухів при ОА суглобів кисті не вивчали.
Проте поєднані навчання і вправи є добре встановленими модальностями лікування при станах, що супроводжуються хронічним больовим синдромом, включаючи ОА. За даними двох систематичних оглядів встановлено, що у пацієнтів з ОА різних локалізацій навчання достовірно зменшує вираженість болю (ВЕ=0,06; 9% ДІ 0,23; 0,42), відзначено функціональне покращання (ВЕ=0,02; 95% ДІ 0,02; 0,10) (Warsi A. et al., 2003; Chodosh J. et al., 2005), однак обидва ці ефекти є незначними. Вправи демонструють більшу ВЕ для зменшення вираженості болю (ВЕ=0,32; 95% ДІ 0,23; 0,42) і функціональне покращання (ВЕ=0,32; 95% ДІ 0,23; 0,41) (Roddy E. et al., 2005).
Отже, дані по роль навчання і вправ у лікуванні при ОА суглобів кисті є недостатніми. Ця рекомендація підтримується переважно думкою експертів (рівень ІV).
4. Місцеві аплікації тепла (парафіновий віск, гаряче вологе обгортання та ін.), особливо перед вправами, і ультразвук є ефективними методами лікування.
Рівень доказовості ІV
Сила рекомендацій (95% ДІ)
Повне: 56 (40; 71)
Теплове: 77 (69; 85)
Ультразвук: 25 (15; 36)
Не існує КД щодо ролі тепла чи ультразвуку специфічно для ОА суглобів кисті. Кокранівський систематичний огляд проводили щодо термотерапії при ОА загалом (Brosseau L. et al., 2003). Проте включили тільки 3 РКД, жодне не проводили для ОА суглобів кисті, і лише в 1 вивчали додаткові ефекти місцевих аплікацій, гаряче (холодне) обгортання з фізіотерапією при ОА колінних суглобів. Дані дослідження свідчать про те, що на 3-му тижні не існувало різниці між комбінуванням гарячого обгортання і фізіотерапією, холодного обгортання і фізіотерапією і лише фізіотерапією. Не вивчали також і ролі преаплікацій тепла чи холоду перед вправами. Однак добре відома роль локальних аплікацій тепла як ефективного й безпечного засобу зменшення вираженості болю, але визначення цього ефекту в сліпих КД є проблемним.
Прямого вивчення впливу ультразвуку при ОА суглобів кисті не проводили, проте його роль оцінювали при ОА великих суглобів. Кокранівський систематичний огляд 3 РКД продемонстрував, що ультразвук не має переваг перед плацебо або короткохвильовою діатермією у пацієнтів з ОА тазостегнового або колінного суглоба (Robison V.A. et al., 2001; 2005).
Необхідно відзначити, що прямі дані досліджень щодо ефективності місцевих аплікацій тепла чи ультразвуку в ролі передлікування чи в комбінації з іншими фізичними методами в ролі терапії у пацієнтів з ОА суглобів кисті є недостатніми, а також не існує позитивних даних досліджень щодо ефективності ультразвуку при ОА тазостегнового або колінного суглоба. Таким чином, ця рекомендація ґрунтується на думці експертів (рівень доказовості ІV).
5. Рекомендуються шини для великого пальця й ортези для профілактики/корекції латерального відхилення і згинальних деформацій.
Не існує плацебо-контрольованих або контрольованих досліджень без шин для підтримки вищезазначеного твердження. У двох невеликих (n=26; n=21) РКД із перехресним дизайном порівнювали ефективність лікування при використанні цілої шини (що покриває основу великого пальця і зап’ястка) порівняно з половинною шиною (що захищає тільки основу великого пальця) у пацієнтів з ОА I п’ястково-фалангового суглоба (Weiss S. et al., 2000; 2004). Результати дослідження свідчать про більш виражене полегшення болю в пацієнтів при використанні цілої шини порівняно з половинною шиною (ВЕ=0,64; 95% ДІ 0,02; 1,26) Об’єднана NNT для поліпшення щоденної активності пацієнтів становило 4 (95% ДІ 2; 13) (див. табл. 12.35). На жаль, у цих дослідженнях не вивчали ефекти шин щодо латерального відхилення та згинальної деформації. В іншому невеликому перехресному дослідженні порівнювали різні типи цілої шини й виявили відсутність відмінностей між ними (Buurke J.H. et al., 1999).
Таблиця 12.35
Дані ефективності — об’єднані ВЕ й NNT
| Лікування | Рівень* | Дослідження, кількість (пацієнт) | Тривалість | ВЕ болю (95% ДІ) | ВЕ функції (95% ДІ) | NNT (95% ДІ) | Посилання |
| Навчання + вправи vs інформація щодо ОА | Ib | 1 (40) | 3 міс | – | – | 2 (1; 6) | Stamm T.A. et al., 2002 |
| Шина (повна vs половинна) | Iа | 2 (47) | 1 тиж | 0,64 (0,02; 1,26) | – | 4 (2;13) | Weiss S. et al., 2000; 2004 |
| НПЗП | Ia | 2 (654) | 2–4 міс | 0,69 (0,20; 0,60) | 0,17 (–0,03; 0,36) | 3 (2; 6) | Dreiser R.L. et al., 1993; Grifka J.K. et al., 2004 |
| НПЗП місцево | Iа | 2 (131) | 2–3 роки | 0,77 (0,32; 1,22) | NS | Lin G. et al., 2004 | |
| Капсаїцин місцево | Iа | 2 (318) | 4 тиж | – | – | 3 (2; 5) | Zang W.Y. et al., 1994 |
| Хондроїтину сульфат | Ib | 1 (92) | 3 роки | – | – | NS | Verbruggen G. et al., 2002 |
| Хондроїтину полісульфат | Ib | 1 (130) | 3 роки | – | – | 8 (4; 166) | Verbruggen G. et al., 2002 |
| ГК внутрішньосуглобово | Ib | 1 (40) | 24 тиж | NS | NS | NS | Meenagh G.K. et al., 2004 |
| Хірургія
Т + LRTI/IA vs T TJR vs T+IA |
Ia | 7 (384) | 3–66 міс | –0,17 (–0,57; 0,24)
–0,3 (–1,07; 0,47) |
0,03 (–0,37; 0,4) | NS | Wajon A. et al., 2005,
Wajon A. et al., 2005 |
*Див. табл. 12.33 — визначення; n — кількість досліджень; ВЕ — величина ефекту лікування порівняно із плацебо, якщо не зазначено інше; NNT — кількість пацієнтів, що потребують лікування для одержання ефекту помірного — відмінного (>50%) зменшення вираженості болю або симптоматичного покращання; «—» дані недоступні; NS — незначимо (статистично); T — трапецієектомія, LTTI — реконструкція зв’язки та інтерпозиція сухожилля; ІА — інтерпозиційна артропластика; TJR — повна заміна суглоба.
Таким чином, незалежно від думки дослідників, необхідні дані плацебо-контрольованих і контрольованих досліджень без застосування шин. Однак, можливо, захист за допомогою шин при ОА основи великого пальця потребує використання променево-зап’ясткового компонента для підвищення їх клінічної ефективності (рівень доказовості Іа).
6. При середньому і низькому ступені вираженості болоьвого синдрому, а також при залученні в процес декількох суглобів місцеве лікування має переваги перед системним. Місцеве застосування НПЗП і капсаїцин є ефективним і безпечним методом лікування при ОА суглобів кисті.
Рівень доказовості Іа
Сила рекомендацій (95% ДІ): 75 (68; 83)
НПЗП місцевого застосування вперше запропоновані як альтернатива пероральному лікуванню в 1982 р., коли результати першого плацебо-контрольованого дослідження продемонстрували ефективність мазі троламіну саліцилату при лікуванні пацієнтів із гонартрозом. Відтоді були опубліковані результати ще 2 плацебо-контрольованих досліджень при ОА суглобів кисті. (Talke M., 1985; Rothacker D. et al., 1994; Rothacker D.Q. et al., 1998; Zacher J. et al., 2001) При систематичному огляді щодо місцевих НПЗП у 2005 р. (Lin J. et al., 2004) результати кількох досліджень при ОА суглобів кисті продемонстрували ефективність місцевого застосування НПЗП і рівноцінність ефекту щодо зменшення вираженості больового синдрому порівняно з пероральними НПЗП (ВЕ=–0,05; 95% ДІ –0,27; 0,17). Більше того, частота розвитку побічних ефектів з боку ШКТ не перевищувала такої в групі плацебо (ВР=0,81; 95% ДІ 0,43; 1,56). Дані щодо шлунково-кишкової безпеки підтверджуються результами інших систематичних оглядів РКД щодо вивчення впливу місцевих НПЗП на м’язово-скелетний біль, де виявлена менша кількість подій з боку ШКТ, ніж при застосуванні пероральних НПЗП (Moore R.A. et al.. 1998). На додаток результати популяційного КД з участю 1101 пацієнта з верхньою шлунково-кишковою кровотечею і перфорацією порівняно з контрольною групою, порівнянною за віком і статтю, що включає 6593 особи, жителів Тейсайд (Шотландія) (Evans J.M.M. et al., 1995), продемонстрували, що шлунково-кишкова кровотеча і перфорація вірогідно асоціюються із застосуванням пероральних НПЗП (ВШ 2,59; 95%ДІ 2,12; 3,16), але не із застосуванням місцевих НПЗП (ВШ 1,45; 95% ДІ 0,84; 2,50).
Систематичний огляд щодо місцевого застосування капсаїцину в лікуванні хронічного больового синдрому, включаючи ОА (Zhang W.Y. et al., 1994), складався з 2 плацебо-контрольованих РКД при ОА суглобів кисті (МсСarthy G.M. et al., 1992; Schnitzer T. et al., 1994). Результати свідчать про те, що місцеве застосування капсаїцину більш ефективне порівняно із плацебо в досягненні клінічного покращання (NNT=3, 95% ДІ 2; 5) протягом 4 тиж (табл. 12.36). Проте у деяких країнах, наприклад у Франції, капсаїцин не застосовують.
На закінчення відзначимо, що застосування місцевих форм НПЗП і капсаїцину ефективне при ОА суглобів кисті (Iа). Крім незначних шкірних реакцій, ці місцеві агенти не викликають більше системних побічних ефектів порівняно із плацебо.
7. З урахуванням ефективності та безпеки парацетамол (до 4 г/добу) є пероральним анальгетиком першого вибору, у разі позитивного результату — кращим анальгетиком для тривалого перорального застосування.
Рівень доказовості IV
Сила рекомендацій (95% ДІ): 87 (76; 96)
Таблиця 12.36
Дані щодо безпеки — ВР, ВШ і 95% ДІ
| Вид лікування* | Побічний ефект | ВР/ВШ (95%ДІ) | Категорія даних |
| Парацетамол | Дискомфорт ШКТ | 0,80 (0,27; 2,37) | РКД (Zhang W. et al., 2004) |
| ШКТ перфорація/кровотеча | 3,60 (2,60; 5,10) | Дослідження випадок — контроль (Garcia Rodriguez L.A., Hernandez-Diaz S., 2001) | |
| ШКТ кровотеча | 1,2 (0,8; 1,7) | Дослідження випадок — контроль (Levis S.C. et al., 2002) | |
| Ниркова недостатність | 2,5 (1,7; 3,6) | Дослідження випадок — контроль (Fored C.M. et al., 2001) | |
| Ниркова недостатність | 0,83 (0,50; 1,39) | Когортне дослідження (Rexrode K.M. et al., 2001) | |
| НПЗП місцево | Симптоми з боку ШКТ | 0,81 (0,43; 1,56) | РКД (Lin J. et al., 2004) |
| ШКТ перфорація/кровотеча | 1,45 (0,84; 2,50) | Дослідження випадок — контроль (Evans J.M.M. et al.,1995) | |
| Глюкозаміну сульфат | Будь-які | 0,97 (0,88;1,08) | РКД (Towheed T.E. et al., 2005) |
| Діцереїн | Діарея | 3,98 (2,90; 5,47) | РКД (Dougados M. et al., 2001; Pham T. et al., 2004) |
| НПЗП | ШКТ перфорація/кровотеча | 5,36 (1,79; 16,10) | РКД (Ofman J.J. et al., 2002) |
| ШКТ перфорація/кровотеча | 2,70 (2,10; 3,50) | Когортні дослідження (Ofman J.J. et al., 2002) | |
| ШКТ перфорація/кровотеча | 3,00 (2,70; 3,70) | Дослідження випадок — контроль (Ofman J.J. et al., 2002) | |
| Протектори ШКТ і НПЗП | |||
| Н2-блокатори і НПЗП | Тяжкі ускладнення з боку ШКТ | 0,33 (0,01; 8,14) | РКД (Hooper L. et al., 2004) |
| Симптоматичні виразки | 1,46 (0,06; 35,53) | РКД (Hooper L. et al., 2004) | |
| Кардіоваскулярні та ниркові події | 0,53 (0,08; 3,46) | РКД (Hooper L. et al., 2004) | |
| ІПН + НПЗП | Тяжкі ускладнення з боку ШКТ | 0,46 (0,07; 2,92) | РКД (Hooper L. et al., 2004) |
| Симптоматичні виразки | 0,09 (0,02; 0,47) | РКД (Hooper L. et al., 2004) | |
| Кардіоваскулярні та ниркові події | 0,78 (0,10; 6,26) | РКД (Hooper L. et al., 2004) | |
| Мізопростол + НПЗП | Тяжкі ускладнення з боку ШКТ | 0,57 (0,36; 0,91) | РКД (Hooper L. et al., 2004) |
| Симптоматичні виразки | 0,36 (0,20; 0,67) | РКД (Hooper L. et al., 2004) | |
| Кардіоваскулярні та ниркові події | 1,78 (0,26; 12,07) | РКД (Hooper L. et al., 2004) | |
| Діарея | 1,81 (1,52; 2,61) | РКД (Capurso L., Koch M., 1991) | |
| ЦОГ-2-селективні | Тяжкі ускладнення з боку ШКТ | 0,61 (0,34; 1,10) | РКД (Hooper L. et al., 2004) |
| Симптоматичні виразки | 0,41 (0,26; 0,65) | РКД (Hooper L. et al., 2004) | |
| Кардіоваскулярні та ниркові події | 0,95 (0,55; 1,66) | РКД (Hooper L. et al., 2004) | |
| Коксиби | Тяжкі ускладнення з боку ШКТ | 0,55 (0,38; 0,80) | РКД (Hooper L. et al., 2004) |
| Симптоматичні виразки | 0,49 (0,38; 0,62) | РКД (Hooper L. et al., 2004) | |
| Кардіоваскулярні та ниркові події | 1,19 (0,80; 1,75) | РКД (Hooper L. et al., 2004) | |
| Хірургічні методи | |||
| Т + ЗР/АП | Будь-які | 2,12(1,24; 3,60) | РКД (Wajon A. et al., 2005) |
| ПС, Т + АП | Будь-які | 5,00(0,26; 95,02) | РКД (Wajon A. et al., 2005) |
ВР розраховували для РКД або когортних досліджень, а ВШ — для випадок — контрольованих досліджень при ВР (ВШ)=1 відсутні відмінності між порівнюваними групами; при ВР (або ВШ>1 ризик в основній групі вищий, ніж у контрольній; при ВР (або ВШ)<1 ризик в основній групі нижчий, ніж у контрольній. Результати поєднували, якщо включали >1 дослідження. *Порівняно із плацебо/відсутністю впливу, якщо не зазначене інакше; ІПН — інгібітори протонного насоса; Т — трапеціоектомія; ЗР — зв’язкова реконструкція; АП — артропластика; ПС — протезування суглобів.
Хоча для лікування при ОА суглобів кисті парацетамол застосовують десятиріччями, плацебо-контрольованих досліджень не проводили. Результати прямого порівняння НПЗП і парацетамолу при ОА суглобів кисті демонструють перевагу НПЗП (Rovetta G., Monteforte P., 2001; Rovetta G. et al., 2001), але чи ефективний парацетамол при ОА суглобів кисті залишається нез’ясованим. Докази з метою підтримки його застосування в більшості випадків екстрапольовані з досліджень щодо ОА інших локалізацій, таких як кульшовий або колінний суглоби (Jordan K.M. et al., 2003; Zhang W. et al., 2005). Наприклад, 2 останні систематичні огляди продемонстрували, що парацетамол має найкращий анальгезивний ефект при ОА будь-якого суглоба з ВЕ=0,21 (95% ДІ 0,02; 0,41) і NNT 2 (95% ДІ 1; 3), хоча ефективність НПЗП вища (Zhang W. et al., 2004; Towheed T.E., 2005).
Клінічні рішення ґрунтуються не лише на ефективності, але й на можливих побічних ефектах і величині витрат. Дані аналізу серйозних побічних явищ свідчать про те, що парацетамол більш безпечний і вигідний щодо витрат, необхідних на запобігання подій з боку ШКТ, ніж НПЗП (Zhang W. et al., 2005). Існує кілька повідомлень, що припускають можливість розвитку побічних явищ з боку ШКТ при застосуванні парацетамолу (Garcia Rodriguez L.A., Hernandez-Diaz S., 2001). Однак це не було підтверджено (Lewis S.C. et al., 2002), а також добре відомо, що у зв’язку з безпекою з боку ШКТ парацетамол є пріоритетним засобом, який призначають пацієнтам з високим ризиком ускладнень з боку ШКТ.
Недавній метааналіз РКД продемонстрував однакову кількість побічних симптомів з боку ШКТ при прийомі як парацетамолу, так і плацебо (Zhang W. et al., 2004) (див. табл. 12.36). Хоча дискомфорт з боку ШКТ, відзначений у ході досліджень, слід диференціювати з тяжкими подіями з боку ШКТ, такими як кровотеча, перфорація, обструкція; водночас ендоскопічні дослідження продемонстрували відсутність гострої патології слизової оболонки при прийомі парацетамолу, хоча існує необхідність проведення КД для підтвердження цього положення.
Відомі також деякі дані щодо нефротоксичності парацетамолу (див. табл. 12.36), проте доказова база на підтвердження цього твердження недостатня (Fored C.M. et al., 2001; Rexrode K.M. et al., 2001). Дискусія ведеться навколо гепатотоксичності. Хоча гостре отруєння при самостійному застосуванні парацетамолу в надвисоких дозах є потенційно летальним, гепатотропність парацетамолу в рекомендованих терапевтичних дозах не є предметом обговорення. Дискусії ж з приводу кардіо- і цереброваскулярної безпеки парацетамолу відсутні. У той час як кілька досліджень показали ризик виникнення кардіоваскулярних подій при застосуванні інгібіторів ЦОГ-2, таких як рофекоксиб (Bombardier C. et al., 2000; Juni P. et al., 2004), вальдекоксиб (Aldington S. et al., 2005), целекоксиб (Solomon S.D. et al., 2005), немає відомостей про виникнення кардіоваскулярної патології при застосуванні парацетамолу. Крім того, традиційні НПЗП (неселективні інгібітори ЦОГ-2) також можуть зумовлювати потенційне виникнення кардіоваскулярних побічних ефектів (www.nih.gov/news/pr/dec2004/od-20/htm.). Таким чином парацетамол має хороше співвідношення користь/ризик і є пероральним анальгетиком першого ряду у пацієнтів із хронічним болем різного генезу, включаючи ОА суглобів кисті.
Слід зазначити, що ефективність парацетамолу при ОА суглобів кисті не була прямо доведена. Ця рекомендація підтримується доказовою базою, екстрапольованою із досліджень при ОА інших суглобів (Іа і думка експертів (IV). Однак анальгезивний ефект парацетамолу вищий, ніж НПЗП, цей препарат безпечніший і дешевший, саме тому є анальгетиком першого ряду у пацієнтів з ОА суглобів кисті. Таким чином, загалом ця рекомендація підтримується переважно думкою експертів.
8. Пероральні НПЗП слід застосовувати в мінімальній ефективній дозі при неадекватній реакції на парацетамол. Пацієнтам із підвищеним ризиком виникнення гастроінтестинальних подій показані неселективні НПЗП у комбінації з гастропротекторними засобами або селективні інгібітори ЦОГ-2. При ризику виникнення серцево-судинних подій коксиби є протипоказаними, у таких випадках неселективні НПЗП є препаратами вибору.
Рівень доказовості I
(95% ДІ):81 (74; 88)
На відміну від великої кількості РКД щодо ОА колінних і кульшових суглобів (Jordan K.M. et al., 2003; Zhang W. et al., 2005) тільки 3 плацебо-контрольованих дослідження з НПЗП відповідали необхідним критеріям включення/виключення.
У цих КД оцінювали ефективність меклофенамату (100 мг 3 рази на добу протягом 4 тиж у 41 пацієнта), ібупрофену (800 мг/добу — 2 тиж у 60 пацієнтів) і люміракоксибу (200 або 400 мг/добу у 594 пацієнтів із 4 країн) (Seiler V., 1983; Dreiser R.L. et al., 1993; Grifka J.K. et al., 2004). Результати всіх 3 досліджень продемонстрували перевагу НПЗП перед плацебо. Отримані дані при реаналізі (Dreiser R.L. et al., 1993; Grifka J.K. et al., 2004) свідчать про зменшення вираженості болю ВЕ=0,40 (95% ДІ 0,20; 0,60), NNT 3 (95% ДІ 2; 6) (див. табл. 12.35). Люміракоксиб у дозі 200 мг/добу виявився таким же ефективним, як і по 400 мг/добу, що доводить можливість застосування препарату в мінімальній дозі при ОА суглобів кисті.
Також висловлювалися побоювання щодо ШКТ-токсичності НПЗП (Ofman J.J. et al., 2004). Оскільки ризик виникнення токсичності з боку ШКТ при застосуванні НПЗП є дозозалежним і підвищується з віком (Levis S.C. et al., 2002), застосування НПЗП для терапії при ОА залежить від віку й обмежується супутньою патологією (Jordan K.M. et al., 2003; Zhang W. et al., 2005). Для оптимізації прийому НПЗП запропоновано кілька схем, що захищають ШКТ: НПЗП + ІПН; НПЗП + Н2-антагоністи; НПЗП + мізопростол; селективні інгібітори ЦОГ-2 (включаючи селективні інгібітори ЦОГ-2 і коксиби). Отримана доказова база, що ці схеми знижують ризик розвитку ендоскопічно підтверджених виразок (Rostom A. et al., 2004). Систематичний огляд 112 РКД (74 666 учасників), який включав 3 масштабні дослідження CLASS (n=8059) (Silverstein F.E. et al., 2000), VIGOR (n=8076) (Bombardier C. et al., 2000), TARGET (n=18325) (Farkouh M.E. et al., 2004), надав доказову базу щодо відношення серйозних ускладнень з боку ШКТ і симптоматичних виразок (див. табл. 12.36) (Hooper L. et al., 2004). При супутньому застосуванні Н2-антагоністів, ІПН, мізопростолу або використанні селективних інгібіторів ЦОГ-2 ризик виникнення НПЗП-асоційованих симптоматичних виразок знижується на 50–90% (див. табл. 12.36). Однак ці схеми слід застосовувати з обережністю, оскільки вони також мають токсичність, наприклад розвиток діареї при застосуванні мізопростолу (Capurso L. et al., 1991) або кардіоренальна токсичність при застосуванні коксибів (Juni P. et al., 2004; Aldington S. et al., 2005; Solomon S.D. et al., 2005). Несподівані результати щодо кардіо- та цереброваскулярних подій, пов’язаних із застосуванням напроксену і одержаних у дослідженнях ADAPT (протизапальна терапія при хворобі Альцгеймера — US Department of Health and Human Services, 2006) (www.nih.gov/news/pr/dec2004/od-20/htm), свідчать про те, що характерна для коксибів кардіоваскулярна патологія виникає і при застосуванні напроксену, що підтверджує виникнення цього побічного ефекту у всього класу НПЗП, а не тільки коксибів. Точно так само, як варіює ризик розвитку подій з боку ШКТ, при застосуванні різних агентів серед коксибів, може варіювати ризик розвитку кардіоренальної токсичності при застосуванні НПЗП. Необхідні подальші дослідження, незважаючи на наявність прагматичних порад щодо застосування цих агентів, опублікованих ЕМЕА (www.emea.eu.int) і FDA (www.fda.gov).
Розглядаючи співвідношення вартість — ефективність, можна зробити висновок, що коксиби є більш вигідними порівняно з комплексним застосуванням із протекторами ШКТ в аспекті запобігання подій з боку ШКТ (перфорація, виразки, кровотеча) (Zhang Y.O. et al.,2005), тоді як одночасне застосування протекторів ШКТ більш вигідне щодо вартості/QALY.(Elliott R.A. et al., 2005) Таким чином, всі стратегії потребують додаткових витрат порівняно із застосуванням традиційних НПЗП і є кращими для пацієнтів високого ризику щодо розвитку кровотечі з боку ШКТ.
Застосування НПЗП різниться в країнах Європи. Так, у Великобританії НПЗП призначають лише тим пацієнтам, у яких парацетамол виявився неефективним, тоді як в Австрії НПЗП є препаратами першого ряду при лікуванні ОА. Зіставляючи користь і ризик, зумовлений пероральним прийомом НПЗП, питання про їх призначення має ґрунтуватися на характерологічних особливостях пацієнта (Рекомендація 1 або 2) і рішення про їх застосування необхідно приймати після проведення відвертої та детальної бесіди з пацієнтом.
Таким чином, НПЗП є ефективними препаратами при симптомах ОА суглобів кисті (Ia), однак не виключений розвиток тяжких побічних ефектів з боку ШКТ (Ia). Хоча всі гастропротекторні заходи (ІПН, мізопростол або селективні інгібітори ЦОГ-2) знижують ризик виникнення побічних явищ з боку ШКТ на 50–90% (Ia), профіль їх безпеки залишається нез’ясованим (Іb). При їх застосуванні необхідні додаткові засоби, але витрати доцільні у пацієнтів із високим ризиком розвитку ускладнень з боку ШКТ.
9. SYSADOA (глюкозамін, хондроїтину сульфат, неомилювані сполуки авокадо/сої, діацереїн, внутрішньосуглобові введення гіалуронової кислоти) зумовлюють симптоматичний ефект з низькою токсичністю, проте ВЕ низька, пацієнти, яким це лікування підходить, не визначені, а клінічно значимі, структурно-модифікуючі та фармакоекономічні переваги не визначені.
Рівень доказовості 1b–IV для різних SYSADOA
Сила рекомендацій (95% ДІ):63 (48; 76)
Доказова база за SYSADOA (повільнодіючі препарати) переважно ґрунтується на РКД щодо ОА колінних суглобів (Jordan K.M. et al, 2003), а дані щодо ОА інших локалізацій — нечисленні (Zhang W. et al., 2005). Так, проведений систематичний огляд 15 плацебо-контрольованих досліджень щодо глюкозаміну (12 РКД при ОА колінного суглоба, 1 — при ОА колінного/кульшового суглобів, 2 — не специфікували суглоби по локалізації ураження) (Towheed T.E. et al., 2005). Слід зазначити, що глюкозаміну сульфат вивчали в 14 із 15 досліджень, а глюкозаміну гідрохлорид — лише в 1. Результати показали ефективність препаратів глюкозаміну сульфату щодо зменшення вираженості больового синдрому і його неефективність у покращанні фізичної функції та зменшенні скутості. У 2 РКД при ОА колінного суглоба встановлена мала, але статистично достовірна структурно-модифікуюча дія глюкозаміну сульфату та його безпека при 3-річному застосуванні з відсутністю побічних ефектів (ВР=0,97; 95% ДІ 0,88; 1,08) (Reginster J.-Y. et al., 2001; Pavelka K.et al., 2002).
Два РКД щодо вивчення хондроїтину сульфату проводили при ОА суглобів кисті: 1 з них — плацебо-контрольоване РКД (Verbruggen G. et al., 2002) інше нерандомізоване КД, де оцінювали ефективність хондроїтину сульфату + напроксен порівняно з напроксеном у монотерапії при ерозивному ОА міжфалангових суглобів (Rovetta G. et al., 2002). Насправді плацебо-контрольоване РКД було нічим іншим, як звітом проведених двох самостійних досліджень щодо порівняння хондроїтину сульфату із плацебо і хондроїтину полісульфату із плацебо (див. табл. 12.35). Результати свідчать, що після закінчення 3-річного періоду хондроїтин сульфат виявився не більш ефективним, ніж плацебо (NNT=15; 95% ДІ 12,5), тоді як хондроїтин полісульфат був більш ефективним у запобіганні подальшому рентгенологічному прогресуванню (розвитку ерозивних змін) (NNT=8; 95% ДІ 4; 166) (Verbruggen G. et al., 2002). Дані щодо опису симптоматики й функції відсутні, таким чином залишається не відомим, чи має цей ефект будь-яке клінічне значення і чи виявляють хондроїтин сульфат або полісульфат різні дії. Після закінчення 2 років дані нерандомізованого КД не показали переваги напроксену + хондроїтину сульфату порівняно з напроксеном у монотерапії щодо запобігання рентгенологічному прогресуванню ерозивного ОА суглобів кисті.
Дані щодо застосування неомилюваних сполук авокадо/сої при ОА суглобів кисті відсутні. У систематичному огляді декількох РКД неомилюваних сполук авокадо/сої, присвячених ОА колінних і кульшових суглобів (Ernst E., 2003), встановлена більш висока ефективність неомилюваних сполук авокадо/сої щодо зменшення вираженості болю і поліпшення функціонального стану з більшою ефективністю при ОА кульшового, ніж колінного суглоба, але кількісні дані на користь цього відсутні. Порівняльні об’єднані 2 РКД у пацієнтів із ОА кульшового суглоба продемонстрували ВЕ за рівнем зменшення болю, який не мав статистичної вірогідності (Zhang W. et al., 2005), але обидва дослідження були тривалими (>24 тиж), а одне первинно було розроблене з метою оцінки структурно-модифікуючого ефекту через 2 роки (Maheu E. et al., 1998; Lequesne M. et al., 2002).
Також відсутні дані щодо застосування діацереїну при ОА суглобів кисті. П’ять плацебо-контрольованих РКД були присвячені ОА колінного й кульшового суглобів (Nguyen M. et al., 1994; Lequesne M. et al., 1998; Pelletier J.P. et al., 2000; Dougados M. et al., 2001; Pham T. et al., 2004). Результати цих досліджень виявилися гетерогенними з об’єднаним ВЕ=0,22 (95%ДІ 0,01; 0,42) щодо зменшення вираженості болю і 0,03 (95% ДІ –0,11; 0,16) щодо поліпшення функції. Два дослідження, де вивчали структурно-модифікуючий ефект діацереїну, показали різні результати: статистично достовірний структурно-модифікуючий ефект відмічали при ОА кульшового суглоба (Dougados M. et al., 2001), тоді як при ОА колінного суглоба цей ефект був відсутнім (Pham T. et al., 2004). Дані КД мали різні періоди лікування (3 роки при ОА кульшового суглоба, 1 рік — при ОА колінного суглоба), можливо, більш тривале лікування буде кращим у разі ОА колінного суглоба, що потребує подальшого дослідження. Результати цих 2 КД визначили діарею як значимий побічний ефект на фоні лікування діацереїном (ВР=3,98; 95% ДІ 2,90; 5,47).
Поки доцільність внутрішньосуглобового застосування гіалуронової кислоти при коксартрозі й гонартрозі вивчається (Lo G.H. et al., 2003; Aggarwal A., Sempowski I.P., 2004; Band P.A. et al., 2004; Wang C. et al., 2004; Arrich J. et al., 2005; Bellamy N. et al., 2005; Conrozier T., Vignon E., 2005; Modawal A. et al., 2005; Pagnano M., Westrich G., 2005), дані доказової бази при ОА суглобів кисті недостатні. В 1 неконтрольованому КД при ОА трапецієп’ясткового суглоба 16 пацієнтам внутрішньосуглобово вводили гіалуронову кислоту по 10 мг/тиж протягом 5 тиж (Schumacher H.R. et al., 2004). Через 5 міс вираженість болю зменшилася на 46% у спокої і на 27% при русі. В 1 активному контрольованому РКД порівнювали внутрішньосуглобове введення гіалуронової кислоти і ГК при ОА трапецієп’ясткового суглоба. За даними дослідження гіалуронова кислота і ГК мають однакову ефективність щодо зменшення вираженості болю, однак гіалуронова кислота має більш тривалий ефект (Fuchs S. et al., 2006)
Таким чином, лише хондроїтину сульфат досліджений в аспекті структурно-модифікуючого ефекту при ОА суглобів кисті (Іb), проте дані не остаточні. Внутрішньосуглобове введення гіалуронової кислоти може бути корисним у лікуванні ОА трапецієп’ясткового суглоба (IIb). Використання інших SYSADOA переважно ґрунтується на даних, екстрапольованих при ОА колінного або кульшового суглоба і, таким чином, первинно підтримується тільки думкою експертів. Обережно слід застосовувати і діацереїн при лікуванні ОА суглобів кисті, оскільки він може викликати розвиток діареї як побічного явища (Ia).
10. Внутрішнсуглобові ін’єкції ГК тривалої дії ефективні при сильно вираженому болю при ОА, особливо ОА трапецієметакарпального суглоба.
Рівень доказовості Ib
Сила рекомендацій (95% ДІ): 60 (47; 74)
Результати 1 невеликого плацебо-контрольованого РКД (n=40) підтверджують це визначення (Meenagh G.K. et al., 2004). У 40 центрах пацієнтам із симптомами ОА трапецієп’ясткового суглоба рандомізовано призначали внутрішньосуглобово 5 мг триамцінололу гексацетоніду (0,25 мл) або 0,9% (0,25 мл) фізіологічного розчину. Клінічна оцінка складалася з оцінки вираженості болю, скутості, загальної оцінки стану пацієнтом і дослідником, яку проводили на 4; 12 і 24-му тижні. Статистично достовірної різниці між групами у будь-яких часових точках і результатах не відзначали. На жаль, за даними не розраховували ВЕ і NNT. Водночас дані 1 неконтрольованого дослідження свідчили про високу ефективність щодо зменшення вираженості болю у пацієнтів з ОА трапецієметакарпального суглоба при внутрішньосуглобовому введенні ГК в 1-й місяць, але не на 3; 6 і 12-му місяці після ін’єкції (Joshi R., 2005).
Таки чином, дані про короткотривалий ефект внутрішньосуглобового введення ГК у пацієнтів з ОА трапецієп’ясткового суглоба, отримані в 1 неконтрольованому дослідженні, не підтверджуються одним РКД (Іb). Проте це РКД не має достатньої сили. Чи є цей вид терапії більш ефективним при більш гострому нападі болю, не вивчалося. Таким чином ця рекомендація підтримується лише думкою експертів (IV).
11. Хірургічне втручання (інтерпозиційна артропластика, остеотомія, артродез) є ефективним лікуванням при тяжкому ОА великого пальця і показане пацієнтам із вираженим больовим синдромом і/або непрацездатністю при неефективності консервативного лікування.
Рівень доказовості III
Сила рекомендацій (95% ДІ): 68 (56; 79)
Хоча РКД не проводили через методологічні й етичні проблеми, результати проведених численних досліджень свідчать про ефективність хірургічного лікування ОА основи великого пальця при рефрактерності до проведеної консервативної терапії. Хірургічні методи лікування, які застосовують на сьогодні при ОА основи великого пальця, включають артродез, трапецієектомію окремо чи в комбінації з синтетичною або біологічною інтерпозицією, остеотомію, протезування суглоба. Кожний із цих методів має позитивні й негативні сторони. У 2 недавно проведених систематичних оглядах розглядали хірургічні втручання при ОА основи великого пальця (Martou G. et al., 2004; Wajon A. et al., 2005), останній з яких проведений Кокранівською групою з вивчення м’язово-скелетної патології і складався з 7 РКД/КД (383 пацієнти з ОА основи великого пальця). В огляді порівнювали комбінацію хірургічних методів лікування (трапецієектомія + реконструкція зв’язок й інтерпозиція сухожилля або інтерпозиційна артропластика) і просто трапецієектомія. Доведено, що комбінована хірургічна тактика не має переваг у зменшенні вираженості болю (ВЕ=–0,03; 95% ДІ –0,57; 0,24) і функціональному покращанні стану суглоба (ВЕ=0,03; 95% ДІ –0,37; 0,44). Більше того, комбіноване хірургічне лікування є причиною розвитку великої кількості побічних ефектів (м’язова грижа, болючість швів, сенсорні й неврологічні зміни, нестабільність, місцевий больовий синдром), ніж звичайне хірургічне втручання (ВР=2,12 (1,24; 3,60). Навіть тотальне ендопротезування суглоба не мало переваг перед комбінованим хірургічним лікуванням (Wajon A. et al., 2005).
Другий систематичний огляд складався з 18 досліджень (2 РКД, 1 проспективне і 15 ретроспективних досліджень). Кількісні дані були відсутні, але результати конкурували з Кокранівським оглядом, підтверджуючи відсутність переваг, але більшу кількість ускладнень при застосуванні комбінованого способу хірургічного лікування (Martou G. et al., 2004).
Таким чином, хірургічне лікування показане пацієнтам зі стійким больовим синдромом при рефрактерності консервативних методів лікування (III). Не слід застосовувати комбіновану хірургічну тактику, що при однаковій ефективності зумовлює розвиток багатьох небажаних симптомів, побічних явищ.
Напрямки подальших досліджень
Після 3 раундів Delfi розроблено 8 рекомендацій для подальших досліджень (табл. 12.37).
Таблиця 12.37
Напрямки подальших досліджень
| № з/п | Рекомендація |
| 1 | При ОА суглобів кисті КД слід проводити залежно від локалізації процесу (І палець, міжфалангові суглоби), форми рентгенологічної стадії (ерозивна, неерозивна, вузликова) і вивчити клінічні предиктори відповіді |
| 2 | Детальне вивчення фізіотерапевтичних методів лікування (ультразвук, лазер, місцеві теплові процедури — парафін, віск) |
| 3 | Дослідження, спрямовані на визначення найбільш оптимальної форми або комбінації вправ (силові вправи чи вправи для обсягу рухів) при ОА суглобів кисті |
| 4 | Подальші дослідження для кращої оцінки симптоматичного і структурно-модифікуючого ефекту |
| 5 | Переваги внутрішньосуглобового введення ГК або гіалуронової кислоти як при ОА I пальця, так і при ОА міжфалангових суглобів |
| 6 | Необхідні вивчення впливу повільнодіючих протиревматичних, а також біологічних препаратів (особливо антиФНП-терапії) при ерозивному міжфаланговому ОА, оцінка можливого симптоматичного або структурно-модифікуючого ефекту даних препаратів |
| 7 | Ефективність і безпека при тривалому застосуванні парацетамолу, НПЗП, слабких опіоїдів потребує подальшої оцінки та порівняння |
| 8 | Потенційні переваги хірургічного лікування перед консервативним, найбільш оптимальні хірургічні втручання при ОА основи великого пальця потребують подальшого вивчення |
Обговорення
Це перший повний документ, розроблений EULAR, у якому дано рекомендації з ведення пацієнтів з ОА суглобів кисті. Як і в попередніх рекомендаціях, присвячених коксартрозу й гонартрозу (Pendleton A.B. et al., 2000; Jordan K.M. et al., 2003; Zhang W., Doherty M. et al., 2005), справжні рекомендації мають доказово обґрунтований формат, який представлений як думкою експертів, так і результатами наукових досліджень з поділом між ними. Нами використаний метод Delphi для розробки рекомендацій, а також підхід доказової медицини для ідентифікації та оцінки даних наукових досліджень. Також застосовували EULAR ВАШ для оцінки сили рекомендацій і рівня узгодженості за кожною позицією. Ґрунтувалися не лише на доказових дослідженнях, а також на думці кожного експерта, беручи до уваги ефективність, безпеку, доступність, логічні доповнення та прихильність пацієнтів до лікування. Оскільки доказово обґрунтована методологія продовжує розвиватися, вважаємо, що цій системі формування і надання рекомендацій можна довіряти.
Наведені рекомендації з лікування ОА суглобів кисті розроблені міжнародною мультидисциплінарною групою. Раніше більше уваги приділяли проблемі ведення пацієнтів з ОА великих суглобів, таких як колінного й кульшового. Це відбувалося, незважаючи на високу поширеність ОА суглобів кисті в популяції (Cushnaghan J., Dieppe P., 1991; Oliveria S.A. et al., 1995; Mannoni A. et al., 2000; Zhang Y.Q. et al., 2002; Dahaghin S. et al., 2005a; b). Більшість рекомендацій розробляли і впроваджували ревматологи, рекомендації сфокусовані на ОА колінного або кульшового суглоба і відрізняються відповідною специфікою. Значна увага приділена великим суглобам, доцільності й ефективності хірургічного лікування, зокрема ендопротезування. Це і є однією з відмінностей при порівнянні ОА суглобів кисті, колінного і кульшового суглобів, а саме особливостей анатомії, функціонування, факторів ризику розвитку ОА, перебігу і результату захворювання, доступності для різних видів втручань (місцеві аплікації, ін’єкції) і різних відповідей на один вид лікування (наприклад НПЗП) (Svensson О. et al., 2006). Тому EULAR і створив іншу групу для розробки окремих рекомендацій при ОА колінних суглобів, кульшового і кистей. Хоча КД, спрямованих на вивчення коксартрозу менше, ніж при гонартрозі (Pendleton А.B. et al., 2000; Jordan K.M. et al., 2003; Zhang W., Doherty M. et al., 2005), очевидно, що відомо недостатньо КД для розробки рекомендацій при ОА суглобів кисті (Mejjad O., Maheu E., 2000; Towheed T.E., 2005), що зумовило появу великої кількості рекомендацій з рівнем доказовості IV. Крім того, багато з ідентифікованих нами КД щодо ОА суглобів кисті мали низьку якість дизайну дослідження, і це є основним упередженням, що обмежує їх інтерпретацію і впровадження в клінічну практику. Нами також опубліковані рекомендації щодо дизайну майбутніх КД з надією на те, що ці побажання допоможуть покращити їх якість (Maheu E. et al., 2006). Дискусії навколо цих рекомендацій щодо лікування, а також пропозицій відносно подальшої галузі вивчення відображають основні пріоритетні завдання. Є кілька обмежень щодо цих рекомендацій. По-перше, недостатня доказова база досліджень при ОА суглобів кисті обмежує деякі запропоновані методи лікування. По-друге, невелика кількість можливих методів лікування обмежує кількість рекомендацій. По-третє, з урахуванням розробки дослідної стратегії цілком можливо, що деякі важливі дослідження були пропущені. По-четверте, нами розглянуті результати вузьких фахівців, а не лікарів загальної практики, терапевтів, у той час коли більшість пацієнтів одержують медичну допомогу на первинному етапі. І, нарешті, рекомендації слід формувати, виходячи з таких основних джерел, як дослідницька база, думки експертів, перспективи для пацієнта (Hynes R.B. et al., 1996). У попередніх рекомендаціях EULAR думку пацієнтів не враховували. Надалі будуть розроблені шляхи, завдяки яким можна буде враховувати думку європейських пацієнтів.
Під час засідання робочої групи відзначено, що існує безліч положень щодо клінічного діагнозу ОА кисті та декількох субтипів ОА суглобів кисті, які можуть відрізнятися за результатами і стратегією лікування.
На завершення відзначимо, що нами розроблено 11 рекомендацій, що включають 17 методів лікування при ОА суглобів кисті. Враховано і клінічний досвід, і доказову базу КД. Для багатьох методів лікування існує нестача дослідної доказової бази при ОА суглобів кисті, що відображає потребу в проведенні подальших добре спланованих КД. Віримо, що дані будуть сприяти поглибленню знань і покращать якість лікування пацієнтів з ОА суглобів кисті.
Подяка
Автори висловлюють подяку Європейській антиревматичній лізі за фінансову підтримку, Helen Richardson за логістичну підтримку, Jane Robertson за пошук літератури й розробку бази даних.
ФАРМАКОЕКОНОМІЧНИЙ ПІДХІД У ВИБОРІ ЗАСОБІВ ДЛЯ ЛІКУВАННЯ ПРИ ОА
Фармакоекономіка (Pharmacoeconomics) — наука, метою якої є економічна оцінка ефективності витрат і результатів, пов’язаних із застосуванням лікарських засобів. У країнах Західної Європи вона розвивається з 60–70-х років XX ст.
Предметом дослідження фармакоекономіки є: 1) результати фармакотерапії, при можливості проведення порівняльного аналізу хоча б двох різних схем лікування (технологій); 2) безпека й ефективність нових лікарських засобів; 3) економічні витрати на проведення фармакотерапії і діагностики; 4) фармакоепідеміологічна статистика, яка відображає співвідношення між експозицією лікарського засобу і його показником користь/ризик під час лікування певного захворювання в конкретній популяції після впровадження препарату на ринок; 5) дані рандомізованих КД лікарського засобу у групі хворих (популяції); 6) дані фармацевтичного забезпечення хворих, аналіз споживання й прогнозування потреби в лікарському засобі; 7) потреба у препаратах (розраховують в абсолютних і відносних, а також в економічних показниках).
Об’єктами вивчення фармакоекономіки є: 1) витрати (у вартісних показниках) на ефективну фармакотерапію при різних технологіях, причому одна з технологій пов’язана з фармакотерапією, а інша може включати додаткові лікувальні заходи; 2) ефективність фармакотерапії, виражена в біологічних параметрах здоров’я (наприклад зміна рівня глікемії у хворих на цукровий діабет, рівня ліпідемії, подовження життя); 3) ефективність схем лікування (визначається за допомогою фармакоепідеміологічних досліджень, при спостереженні фіксують як показники ефективності дії препарату, так і всі спостережувані побічні ефекти в популяції).
Привабливість кожного лікарського засобу визначається за фармакологічними і економічними критеріями. До першого належать ефективність — здатність усувати прояви захворювання, і безпека — властивість не викликати побічних явищ з боку інших органів і систем. Зі співвідношення цих двох властивостей виводиться загальний показник — фармакотерапевтична ефективність препарату.
Економічний, кількісний критерій — вартість лікарського засобу, яка залежить не тільки й не стільки від комерційного інтересу виробника лікарського засобу, скільки від високого попиту на певну групу препаратів у зв’язку з поширеністю захворювання, що є показанням для його застосування. Щоб досягти комбінації високого терапевтичного ефекту та високого ступеня безпеки лікарського засобу, необхідні істотні фінансові витрати, і всі вони обов’язково закладаються у вартість препарату. Клінічні й інструментальні методи встановлення патогенезу захворювання; фундаментальні пошуки, спрямовані на визначення концепції біологічної дії; винахід хімічної структури препарату; розробка біодоступної лікарської форми; апробація на тваринах; впровадження у виробництво й власне виробничий процес; КД; інформаційна підтримка препарату, виписування рецептів лікарями й правильне застосування лікарського засобу пацієнтами — більша частина всієї цієї складної, дорогої та надзазвичай відповідальної роботи лягає на плечі фармацевтичних виробників. І вони мають законні права на одержання фінансового прибутку від своєї діяльності.
Показники ефективності, безпеки й вартості лікування — три кити, на яких ґрунтується фармакоекономіка. У високорозвинених країнах ця наука давно завоювала міцні позиції, результати фармакоекономічних досліджень відіграють ключову роль у регулюванні взаємин між виробниками лікарського засобу, їх споживачами — пацієнтами, і органами суспільної охорони здоров’я (Заліська О.М., 2002).
Загальна структура економічних витрат на захворювання розподіляється на прямі, непрямі й додаткові.
1. Прямі витрати включають:
- Витрати на діагностику захворювання.
- Вартість лікарського засобу, необхідних на курс лікування.
- Вартість лабораторних досліджень.
- Витрати на усунення побічних ефектів лікарського засобу.
- Вартість ліжко-дня.
- Зарплата медичних працівників.
- Витрати на доставку лікарського засобу, харчування хворого.
- Витрати на виплату допомоги у зв’язку з непрацездатністю (з фондів соціального страхування).
2. Непрямі медичні витрати, пов’язані з економічним збитком від скорочення часу зайнятості хворого, його передчасної смерті. Це витрати, пов’язані з неможливістю громадянина у період хвороби бути корисним суспільству, брати участь у виробничому процесі.
3. Додаткові нематеріальні витрати, пов’язані із захворюванням, зумовлені психоемоційними переживаннями пацієнта й погіршенням якості його життя (з цих причин вони із труднощами піддаються кількісній оцінці).
У табл. 12.38 наведені дані дослідження витрат на захворювання опорно-рухового апарату в США (Yelin E., Callahan L., 1995).
Таблиця 12.38
Дослідження витрат на захворювання опорно-рухового апарату (артрит) у США
| Рік | Витрати на хворих з артритом | |
| загальні, млрд дол. | прямі*,% від загальних витрат | |
| 1992 | 64,8 | 23 |
| 1995 | 82,4 | 23,6 |
*59% прямих витрат припадало на соціальне обслуговування хворих і візити середнього медичного персоналу; 15,5% прямих витрат становили витрати на медикаментозне лікування, і більша частина з них зумовлена застосуванням НПЗП.
Економічні витрати на ОА становлять особливий інтерес у зв’язку з високим медико-соціальним і економічним навантаженням на суспільство, зумовленим цим захворюванням (поряд з РА).
В останні роки відзначено інтенсивне зростання фармакоекономічних досліджень, що пов’язано з рядом причин, до яких належать: ріст витрат на охорону здоров’я, необхідність розв’язання проблеми лікування ряду захворювань (ВІЛ, онкологічні захворювання), поява нових технологій, покращення якості життя, підвищення тривалості життя, а також нагальна потреба аналізу співвідношення вартість/ефективність.
Основними для фармакоекономіки є такі методи фармакоекономічного аналізу:
1. «Вартість — ефективність» (cost-effectiveness analysis — СЕА) — оцінюють зміни будь-якого параметра, що змінюється при патофізіологічному стані, наприклад: показники артеріального тиску, а також зниження фінансових витрат.
2. «Вартість — вигода» (cost-benefit analysis — CBA) — економічний аналіз вигідності витрат, при якому користь, що одержують від застосування конкретного лікарського засобу, виражають у грошовій формі через витрати, якщо пряма економія засобів не відразу очевидна.
3. «Вартість — корисність» (cost-utility analysis — СUA) — аналіз, при якому ефекти виражають через їх корисність для споживача, і оцінюють витрати на деяке додаткове збільшення тривалості життя (наприклад, витрати на додатковий рік повноцінного життя) або іншого показника, що має цінність для пацієнта.
4. «Мінімізація вартості» (cost-minimization) — оцінка зменшення фінансових витрат на лікування.
5. Аналіз співвідношення між економічними витратами на лікування і якістю життя пацієнта, яке оцінюють за показником додаткової кількості років стандартної якості життя (індекс QALY — Quality Adjusted Life Years).
Фармакоекономічні оцінки можуть використовуватися, зокрема, для прийняття рішень про конкретні технології (стандарти) лікування, реєстрації й закупівлі лікарського засобу, формування цін, в оцінці результатів КД тощо. Так, нерідко повний курс лікування більш дорогим препаратом обходиться пацієнтові значно дешевше, ніж при використанні недорогого лікарського засобу, за рахунок швидкого і стійкого терапевтичного ефекту та скорочення строків госпіталізації, оскільки вартість ліків становить всього 10–20% суми загальних госпітальних витрат.
Проведення експертних оцінок препаратів включає оцінку таких параметрів:
- Безпосередні клінічні ефекти.
- Частота розвитку ускладнень.
- Збережені роки життя.
- Частота інвалідизації за даними ЛТЕК про непрацездатність.
- Зміна якості життя.
- Збережені роки якісного життя.
- Задоволення очікувань або переваг пацієнта (40% вважається нормою).
- Соціально-демографічні показники.
- Бюджетні витрати.
Отримані результати інтерпретуються в розрахунки, що служать основою для розробки переліку життєво важливих лікарських засобів і національної настанови для лікарів щодо застосування ліків, складання протоколів ведення хворих, розробки формулярів лікарських засобів, складання формулярних списків.
Прикладом фармакоекономічного дослідження може служити проведена у Великобританії економічна оцінка мелоксикаму порівняно з диклофенаком, піроксикамом і рофекоксибом, на основі чого були змодельовані терапевтичні стратегії в лікуванні при ОА (Tavakoli M., Malek M., 2000). Аналіз вартості/ефективності двох традиційних, тих, що найчастіше призначаються НПЗП (диклофенак з модифікованим вивільненням і піроксикам) і двох нових інгібіторів ЦОГ-2 (мелоксикам і рофекоксиб), а також оцінка впливу цих препаратів на бюджет національної системи охорони здоров’я Великобританії свідчить про нижчезазначене.
Основами для проведення дослідження були такі передумови:
- світовий ринок НПЗП для лікування при ОА і РА становить 12,1 млрд дол.;
- ревматичні захворювання — одна з найчастіших причин звернення до лікарів загальної практики і вражають кожного 10-го у світі;
- у 1998 р. було виписано 33 млн рецептів на суму 254 млн фунтів стерлінгів із приводу захворювань опорно-рухового апарату;
- у 1997 р. сума загальних витрат на артрити (сума прямих і непрямих витрат) становила 733 млн фунтів стерлінгів;
- ОА — найважливіша причина інвалідизації, посідає 2-ге місце після серцево-судинних захворювань як причина тяжкої інвалідності;
- на 250 тис. жителів Великобританії щорічно діагностують 500–600 нових випадків ОА;
- поширеність ОА підвищується з 2% у жінок віком молодше 45 років до 30% — 45–64 років і до 68% — старше 65 років;
- у чоловіків ці цифри становлять 3; 25 і 58% відповідно;
- встановлено, що близько 50% всіх виписаних НПЗП призначені для усунення болю внаслідок ОА, 15% — з приводу РА;
- мелоксикам з’явився на ринку Великобританії у 1996 р.;
- у дослідженнях in vitro і експериментальних фармакологічних дослідженнях встановлено, що мелоксикам є селективним інгібітором ЦОГ-2;
- мелоксикам викликає меншу кількість побічних ефектів з боку ШКТ порівняно з такими традиційними НПЗП, як диклофенак;
- ефективність мелоксикаму і рофекоксибу еквівалентна ефективності традиційних НПЗП;
- застосування НПЗП пов’язане з побічними ефектами, які варіюють від диспепсії легкого ступеня до ульцерогенного ефекту і його ускладнень у вигляді перфорації та кровотечі, а також із ускладненнями з боку нирок, печінки та серцево-судинної системи у пацієнтів групи ризику.
Оскільки дані про чотири НПЗП не могли бути зібрані за один і той самий період, аналізували два періоди дослідження — 4 тиж і 6 міс:
- 4-тижневий період дослідження. Дані щодо мелоксикаму, диклофенаку і піроксикаму (частота побічних ефектів і тривалість госпіталізації за 4-тижневий період) базувалися на результатах 2 широкомасштабних подвійних сліпих рандомізованих за участю паралельних груп КД MELISSA і SELECT (порівнювали мелоксикам у дозі 7,5 мг із неселективними НПЗП диклофенаком MR — 100 мг і піроксикамом — 20 мг). Обидва дослідження відображали аналіз призначення НПЗП. У дослідженні MELISSA 4635 хворих одержували мелоксикам і 4688 — диклофенак, у дослідженні SELECT 4320 одержували мелоксикам і 4336 — піроксикам. Вік включених у дослідження пацієнтів становив старше 18 років, у них діагностували ОА з переважним ураженням кульшових, колінних суглобів, суглобів верхніх кінцівок і хребта у фазі загострення;
- 6-місячний період дослідження. Порівняні дані щодо рофекоксибу були зібрані за 6-місячний період. Дані щодо рофекоксибу і диклофенаку були отримані зі звіту медичних радників FDA (дослідження 069, n=2812). Дані за 6 міс по мелоксикаму ґрунтувалися на результатах 2 подвійних сліпих досліджень із застосуванням препарату в дозі 7,5 мг (n=169) і в дозі 15 мг (n=306). Слід мати на увазі, що звіт FDA містив тільки дані про побічні ефекти з боку ШКТ, у той час як 2 КД щодо мелоксикаму — дані про всі несприятливі побічні ефекти (табл. 12.39).
Таблиця 12.39
Порівняльні дані про частоту розвитку ПЕ з боку ШКТ при прийомі НПЗП — мелоксикаму і диклофенаку (за даними дослідження MELISSA)
| Показник | Мелоксикам 7,5 мг | Диклофенак 100 мг |
| Кількість хворих, що приймали НПЗП | 35 | 4688 |
| Кількість госпіталізацій внаслідок ПЕ, n (%) | 3 (0,06) | 11 (0,23) |
| Середній період госпіталізації внаслідок ПЕ | 1,7 дня | 11,3 дня |
| Загальна кількість днів госпіталізації внаслідок ПЕ | 5 | 121 |
| Загальна кількість днів, проведених у відділенні реанімації внаслідок ПЕ | 0 | 31 |
Для моделювання вартості лікування кожним НПЗП (табл. 12.40) використано модель, що називається також «деревом прийняття рішень», з урахуванням таких факторів:
1. Фактори ризику розвитку побічних ефектів з боку ШКТ включають вік, наявність пептичної виразки в анамнезі, супутнє застосування ГК і антикоагулянтів.
2. У близько 25% осіб, що приймають НПЗП, виявлено ендоскопічно підтверджені виразки.
3. Хоча серйозні побічні ефекти (виразка, кровотеча, перфорація) відзначаються відносно рідко, вони можуть бути причиною смерті.
4. Щорічно у США НПЗП-індуковані гастропатії є приводом для більше ніж 70 тис. випадків госпіталізації і причиною більше 7 тис. випадків смерті.
Таблиця 12.40
Вартість різних НПЗП на курс лікування тривалістю 28 днів
| Препарат | Вартість НПЗП на курс лікування (фунти стерлінгів) |
| Диклофенак із сповільненим вивільненням 100 мг | 9,36 |
| Піроксикам 20 мг | 3,95 |
| Мелоксикам 7,5 мг | 9,33 |
| Рофекоксиб | 21,58 |
Хоча частота виникнення кровотеч, виразок і перфорацій невисока, спричинені ними витрати можуть бути значними (лапароскопія — 848–1200 фунтів стерлінгів, ендоскопія — 139–200 фунтів стерлінгів, госпіталізація у відділення інтенсивної терапії — 910–2500 фунтів стерлінгів).
У табл. 12.41 наведені результати аналізу, спрямованого на вирішення питання мінімізації вартості лікування хворих на ОА протягом 28 днів (у цінах 1998 р.).
Таблиця 12.41
Вартість лікування різними НПЗП у перерахунку на 1 хворого
| Препарат | Вартість на 1 хворого (фунти стерлінгів) |
| Диклофенак із сповільненим вивільненням 100 мг | 51 |
| Піроксикам 20 мг | 35 |
| Мелоксикам 7,5 мг | 30 |
Вартість розраховували в цінах 1998 р.
Дані, наведені в табл. 12.40 і 12.41, свідчать, що лікування мелоксикамом потребує менших витрат у розрахунку на 1 пацієнта порівняно з терапією диклофенаком і піроксикамом, причому середня економія засобів при використанні мелоксикаму на 1 хворого за 4 тиж становила 5 фунтів стерлінгів порівняно з використанням піроксикаму і 21 фунт стерлінгів — диклофенаку. Результати 6-місячних досліджень свідчать, що вартість лікування мелоксикамом нижча (146 фунтів стерлінгів) порівняно з рофекоксибом (166 фунтів стерлінгів), що приводить до економії 3,33 фунта стерлінгів на 1 хворого на місяць. З урахуванням щорічного споживання (кількість виписаних рецептів) мелоксикаму, диклофенаку і піроксикаму (табл. 12.42) загальна економія засобів при використанні мелоксикаму становить більше ніж 25 млн фунтів стерлінгів на рік.
Таблиця 12.42
Щорічне споживання різних НПЗП (розраховане на основі кількості виписаних рецептів)
| Препарат | Кількість рецептів, виписаних на НПЗП з приводу ОА | Частка ринку НПЗП за даними про кількість рецептів,% |
| Мелоксикам | 303 900 | 7,46 |
| Піроксикам | 109 800 | 2,70 |
| Диклофенак | 1 184 900 | 29,09 |
Група канадських вчених зіставила вартість і клінічні результати лікування хворих ревматологічного профілю із застосуванням целекоксибу, а також НПЗП у комбінації з гастропротекторними препаратами (ГПП) (Burke T.A. et al., 2001). Розглядалися такі альтернативні фармакотерапевтичні режими: монотерапія НПЗП, монотерапія целекоксибом, комбінована терапія НПЗП + антагоніст Н2-гістамінових рецепторів (АН2) НПЗП + ІПН. Зведені результати ймовірності розвитку побічних ефектів з боку верхніх відділів ШКТ при проведенні лікування за цими схемами наведені в табл. 12.43.
Таблиця 12.43
Імовірність розвитку побічних ефектів (ПЕ) з боку ШКТ
| Схема лікування | Побічні ефекти з боку ШКТ | ||||
| Помірні | Серйозні | Симптоматична виразка | Анемія | Смерть | |
| НПЗП | 16,98 | 0,56 | 5,89 | 1,02 | 0,07 |
| Целекоксиб | 9,90 | 0,21 | 1,64 | 0,29 | 0,03 |
| НПЗП+АН2 | 12,05 | 0,55 | 3,83 | 0,67 | 0,07 |
| НПЗП+ІПН | 10,87 | 0,28 | 1,94 | 0,34 | 0,03 |
Побудова аналітичної моделі оцінки вартість — ефективність дозволяє зіставити середню вартість різних схем 6-місячного курсу лікування 1 хворого з урахуванням вартості ЛС і підрахованої вартості усунення побічних ефектів з боку верхніх відділів ШКТ (табл. 12.44). Використовували рекомендовані добові дози: целекоксиб — 200 мг, НПЗП (диклофенак) — 150 мг, ранітидин — 300 мг, омепразол — 40 мг.
Таблиця 12.44
Вартість різних схем 6-місячного курсу лікування з урахуванням вартості ЛС і усунення ПЕ з боку верхніх відділів ШКТ
| Схема лікування | Середні витрати (канадські долари) на добу | Середні витрати на 6-місячний курс лікування | Середні витрати на 6-місячний курс лікування з урахуванням вартості усунення ПЕ з боку ШКТ | Безпека (частота виникнення симптоматичної виразки), % |
| НПЗП | 0,75 | 135 | 262 | 5,89 |
| Целекоксиб | 1,25 | 225 | 273 | 1,64 |
| НПЗП+АН2 | 1,84 | 331 | 413 | 3,83 |
| НПЗП+ІПН | 3,86 | 695 | 731 | 1,94 |
В аналітичній моделі максимально враховані ризик виникнення побічних ефектів з боку верхніх відділів ШКТ і вартість препаратів, що застосовують в альтернативних схемах лікування. Результати аналізу свідчать про те, що для монотерапії НПЗП характерні найнижча середня вартість і найвища ймовірність ульцерогенезу. Вартість терапії целекоксибом несуттєво відрізнялася від вартості лікування НПЗП, водночас імовірність ульцерогенезу була в 3,6 раза нижчою (28%). Якщо вартість лікування целекоксибом прийняти за 1, то вартість монотерапії НПЗП становила 0,96, комбінації НПЗП + АН2 — 1,51, а НПЗП + ІПН — 2,68. Таким чином, використання монотерапії целекоксибом знижує витрати на 34–168% порівняно із застосуванням комбінованої терапії НПЗП + ГПП (гастропротекторні препарати)
Узагальнений аналіз результатів, отриманих північноамериканськими вченими, свідчить, що до 80% хворих ревматологічного профілю, які брали участь у дослідженні, могли одержувати терапію целекоксибом без збільшення бюджетних витрат місцевих органів охорони здоров’я, водночас піддаючись значно більш низькому ризику розвитку побічних ефектів з боку верхніх відділів ШКТ.
Екстраполяція результатів дослідження, проведеного західними вченими, щодо до ситуації в Україні має два найбільш істотні обмеження. По-перше, беручи до уваги зародковий рівень розвитку страхової медицини в нашій країні, неможливо з належним ступенем точності визначити витрати, пов’язані з усуненням різних побічних ефектів. По-друге, сьогодні в Україні не представлені оригінальні ГПП — ранітидин і омепразол.
Проте залишається можливість порівняти вартість прямих витрат на проведення монотерапії целекоксибом і монотерапії НПЗП. Для дослідження на українському фармацевтичному ринку вибрано оригінальний препарат диклофенаку (таблетки, покриті оболонкою, по 50 мг). За показник безпеки приймемо частоту ульцерогенезу, що визначена R. Zabinski, A. Burke та співавторами (2001).
Виходячи з даних, наведених у табл. 12.45, монотерапія целекоксибом за вартістю незначно (на 5,6%) перевищує монотерапію диклофенаком, але при цьому дозволяє знизити частоту розвитку побічних ефектів з боку верхніх відділів ШКТ майже в 3,6 раза. Середньозважені роздрібні ціни лікарських засобів в Україні наведені за даними системи досліджень ринку «Фармстандарт» компанії «МОРІОН» за липень 2004 р.
Вищезазначено про терапевтичну еквівалентність лікарського засобу. Необхідно відзначити, що використання в стандартних схемах лікування генеричних препаратів припустиме лише при дотриманні ряду умов, насамперед при наявності достовірних даних про біоеквівалентність і терапевтичну еквівалентність генеричних копій оригінальних препаратів.
Таблиця 12.45
Вартість двох схем фармакотерапії при ОА в Україні (грн.) і ступінь їх безпеки (імовірність виникнення серйозних ПЕ за даними R. Zabinski, А. Burke та співавторів, 2001)*
| Препарат | Середньозважена роздрібна ціна 1 табл. (капс.) | Вартість добової дози | Вартість 6 місячного курсу лікування | Частота виникнення симптоматичної виразки, % |
| Диклофенак (оригінальний) | 2,38 (50 мг) | 7,14 (150 мг) | 1285,2 | 5,89 |
| Целекоксиб | 6,16 (200 мг) | 6,16 (200 мг) | 1108,8 | 1,64 |
*Рекомендована средньотерапевтична доза диклофенаку для лікування при ОА — 150 мг/добу, целекоксибу для лікування ОА — 200 мг/добу.
У цьому дослідженні з целекоксибом порівнювали оригінальний препарат диклофенаку, оскільки при використанні для порівняння будь-якої генеричної копії диклофенаку можливість екстраполювати дані щодо безпеки (імовірність ульцерогенезу), отримані північноамериканськими вченими, була б виключена. Втім, включення у схеми лікування при ОА і РА генеричних копій препаратів диклофенаку, ранітидину і омепразолу може стати предметом окремого дослідження.
Наведені результати наукових досліджень свідчать про те, що в арсеналі вітчизняних ревматологів є високоефективний протизапальний і анальгезивний засіб з високим профілем безпеки — препарат целекоксиб. Його застосування не лише сприяє вираженому зниженню частоти виникнення побічних явищ протиревматичної терапії, але й дозволяє уникнути істотних додаткових фінансових витрат на їх лікування (Залиская З.О., Снегирев Ф., 2002).
Таким чином, наведені фармакоекономічні дані на прикладі ОА свідчать про необхідність впровадження цієї практики в Україні. Попередній аналіз відношення до цієї проблеми лікарів-ревматологів свідчить про недостатню оцінку значення фармакоекономіки в їх практичній діяльності. За результатами опитування, проведеного на заняттях школи ревматологів (травень 2002 р., Київ), 34% лікарів вперше чують доповідь з фармакоекономіки, 97% опитаних використовують фармакоекономічний підхід при виборі лікарського засобу щодо фінансових можливостей пацієнта і вважають за необхідне впровадження в Україні відомого у світовій практиці досвіду. Однак 53% вважають, що фармакоекономіка не повинна враховуватися в практичній діяльності лікаря-ревматолога. Подальше формування світогляду лікаря в питаннях раціонального застосування лікарського засобу повинно мати системний підхід, який включає як адміністративні, так і освітні заходи, починаючи з установ МЗ і АМН України й закінчуючи практичними лікарями. Безумовно, така робота має проводитися з урахуванням інтересів пацієнтів.