Соликва (Soliqua) (343541) - инструкция по применению ATC-классификация
Соликва инструкция по применению
Состав
Вспомогательные вещества: глицерин (85%); метионин; метакрезол; цинка хлорид; кислота хлористоводородная, концентрированная; натрия гидроксид; вода для инъекций
Инсулин гларгин - 100 ЕД/мл
Ликсисенатид - 50 мкг/мл
Фармакологические свойства
фармакодинамика. Механизм действия. Препарат Соликва — это комбинация двух действующих веществ с взаимодополняющими механизмами действия для улучшения контроля гликемии, а именно инсулина гларгина (аналог базального инсулина, главной целью которого является контроль уровня глюкозы в плазме крови натощак) и ликсисенатида (агонист рецепторов глюкагоноподобного пептида-1 (ГПП-1), действие которого направлено на контроль постпрандиального уровня глюкозы).
Инсулин гларгин. Важнейшим действием инсулина, в том числе инсулина гларгина, является регуляция метаболизма глюкозы. Инсулин и его аналоги снижают уровень глюкозы в крови за счет стимуляции ее захвата периферическими тканями, в частности скелетными мышцами и жировой тканью, а также угнетения образования глюкозы в печени. Инсулин угнетает липолиз и протеолиз, а также стимулирует синтез белков.
Ликсисенатид является агонистом рецепторов ГПП-1. Рецепторы ГПП-1 являются мишенью природного ГПП-1 — эндогенного гормона инкретина, который потенцирует глюкозозависимую секрецию инсулина β-клетками и угнетает секрецию глюкагона α-клетками поджелудочной железы.
Ликсисенатид стимулирует секрецию инсулина при повышении уровня глюкозы в крови, не влияя при этом на секрецию инсулина и возникновение гипогликемии. Одновременно угнетается секреция глюкагона. В случае возникновения гипогликемии спасательный механизм в виде секреции глюкагона сохраняется. Постпрандиальное введение ликсисенатида также замедляет опорожнение желудка, снижая таким образом скорость абсорбции и поступления в систему кровообращения глюкозы, содержащейся в пище.
Фармакодинамика. Комбинация инсулина гларгина и ликсисенатида не влияет на фармакодинамику инсулина гларгина. Влияние комбинации инсулина гларгина и ликсисенатида на фармакодинамику ликсисенатида не изучали в рамках исследований I фазы.
Учитывая относительно постоянный профиль «концентрация/время» инсулина гларгина в течение 24 ч без выраженных пиков при применении его отдельно, профиль «скорость утилизации глюкозы/время» был подобным при применении комбинации инсулина гларгина и ликсисенатида.
Период действия инсулинов, в том числе препарата Соликва, может отличаться у разных лиц и даже быть разным у одного и того же человека.
Инсулин гларгин. По результатам клинических исследований с применением инсулина гларгина (100 ЕД/мл) гипогликемический эффект на молярной основе (то есть при применении одинаковых доз) инсулина гларгина при его в/в введении приблизительно такой же, как человеческого инсулина.
Ликсисенатид. По результатам 28-дневного плацебо-контролируемого исследования среди пациентов с сахарным диабетом 2-го типа применение ликсисенатида в дозе 5–20 мкг вызвало статистически значимое снижение постпрандиального уровня глюкозы после завтрака, обеда и ужина.
Опорожнение желудка. После приема стандартной меченной исследуемой пищи в рамках указанного выше исследования подтверждено, что ликсисенатид замедляет опорожнение желудка, снижая таким образом скорость постпрандиальной абсорбции глюкозы. Эффект замедления опорожнения желудка поддерживался до завершения исследования.
Клиническая эффективность и безопасность. Безопасность и эффективность препарата Соликва по контролю гликемии оценивали в трех рандомизированных клинических исследованиях с участием пациентов с сахарным диабетом 2-го типа:
– добавление к метформину (у пациентов, не получавших инсулин);
– переход с базального инсулина;
– переход с агониста рецепторов ГПП-1.
В каждом из исследований с активным контролем терапия препаратом Соликва приводила к клинически и статистически значимому улучшению уровня гликированного гемоглобина (HbA1c).
Достижение наиболее низких уровней HbA1c и более значительного снижения уровня HbA1c не приводило к повышению частоты возникновения гипогликемии при комбинированном лечении по сравнению с монотерапией инсулином гларгином (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
В рамках клинического исследования с добавлением препарата к метформину лечение начиналось с 10 делений дозы (10 ЕД инсулина гларгина и 5 мкг ликсисенатида). В рамках клинического исследования с переходом с базального инсулина начальная доза составляла 20 делений дозы (20 ЕД инсулина гларгина и 10 мкг ликсисенатида) или 30 делений дозы (30 ЕД инсулина гларгина и 10 мкг ликсисенатида) (см. ПРИМЕНЕНИЕ) в зависимости от предварительного дозирования инсулина. В обоих исследованиях титрование дозы осуществлялось один раз в неделю, учитывая уровень глюкозы в плазме крови натощак, который определялся самостоятельно.
Добавление метформина (у пациентов, не получавших инсулин). Клиническое исследование среди пациентов с сахарным диабетом 2-го типа, у которых на фоне лечения пероральным противодиабетическим препаратом не отмечалось должного контроля заболевания. Всего в рамках открытого 30-недельного исследования с активным контролем были рандомизированы 1170 пациентов с сахарным диабетом 2-го типа для оценки эффективности и безопасности препарата Соликва по сравнению с отдельными его компонентами — инсулином гларгином (100 ЕД/мл) и ликсисенатидом (20 мкг).
Пациенты с сахарным диабетом 2-го типа, получавшие лечение метформином в виде монотерапии или метформином в сочетании с другим пероральным противодиабетическим препаратом, которым мог быть препарат сульфонилмочевины, глиниды, ингибитор натрийзависимого котранспортера глюкозы-2 (НЗКТГ-2) или ингибитор дипептидилпептидазы-4 (ДПП-4), и у которых не отмечалось должного контроля заболевания на фоне данного лечения (уровни HbA1c колебались в пределах 7,5–10,0% у пациентов, ранее получавших метформин в виде монотерапии, и в пределах 7,0–9,0% у пациентов, ранее получавших лечение метформином в сочетании с другим пероральным противодиабетическим препаратом), были включены в вводный период в течение 4 нед. На протяжении этой вводной фазы осуществлялась оптимизация лечения метформином, а прием других пероральных противодиабетических препаратов прекращался. В конце вводного периода пациенты, у которых продолжали отмечать ненадлежащий контроль заболевания (уровни HbA1c колебались в пределах 7–10%), были рандомизированы в группы, получавшие препарат Соликва, инсулин гларгин или ликсисенатид. Из 1479 пациентов, которые были включены в вводную фазу исследования, 1170 были рандомизированы. Главными причинами, которые не позволяли включить пациентов в рандомизационную фазу исследования, были уровни глюкозы в плазме крови натощак >13,9 ммоль/л и уровни HbA1c <7% или >10% в конце вводной фазы исследования.
Характеристики популяции рандомизированных пациентов с сахарным диабетом 2-го типа были следующими: средний возраст составлял 58,4 года, при этом возраст большинства пациентов (57,1%) — 50–64 года, 50,6% пациентов были мужчинами. Средний индекс массы тела (ИМТ) на исходном уровне составил 31,7 кг/м2, при этом у 63,4% пациентов ИМТ составлял >30 кг/м2. Средняя продолжительность сахарного диабета составляла около 9 лет. Метформин был обязательной фоновой терапией, а 58% пациентов получали на скрининге и другой пероральный противодиабетический препарат, которым у 54% пациентов был препарат сульфонилмочевины.
На 30-й неделе лечение препаратом Соликва приводило к статистически значимому улучшению уровней HbA1c (р<0,0001) по сравнению с отдельными компонентами. По результатам предварительно определенного анализа этой первичной конечной точки отмеченные различия согласовывались относительно исходных уровней HbA1c (<8% или ≥8%) или перорального противодиабетического лечения на исходном уровне (метформин в виде монотерапии или метформин в комбинации с другим пероральным противодиабетическим препаратом).
Информация о других конечных точках исследования приведена в табл. 1 и на рис. 1.
Таблица 1.
Результаты клинического исследования с добавлением препарата к метформину на 30-й неделе (популяция пациентов, получавших лечение)
| Препарат Соликва | Инсулин гларгин | Ликсисенатид | |
| Количество пациентов, которые получали лечение | 468 | 466 | 233 |
| Уровень HbA1c (%) | |||
| Исходный уровень (среднее значение, после вводной фазы) | 8,1 | 8,1 | 8,1 |
| Завершение исследования (среднее значение) | 6,5 | 6,8 | 7,3 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −1,6 | −1,3 | −0,9 |
| Различие в сравнении с инсулином гларгином (95% доверительный интервал) (р-значение) | −0,3 (−0,4; −0,2) (<0,0001) | ||
| Различие в сравнении с ликсисенатидом (95% доверительный интервал) (р-значение) | −0,8 (−0,9; −0,7) (<0,0001) | ||
| Количество пациентов (%), у которых были достигнуты уровни HbA1c <7% на 30-й неделе* | 345 (74%) | 277 (59%) | 77 (33%) |
| Уровень глюкозы в плазме крови натощак (ммоль/л) | |||
| Исходный уровень (среднее значение) | 9,88 | 9,75 | 9,79 |
| Завершение исследования (среднее значение) | 6,32 | 6,53 | 8,27 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −3,46 | −3,27 | −1,50 |
| Изменение в сравнении с инсулином гларгином, определенное методом наименьших квадратов (среднее значение) (95% доверительный интервал) (р-значение) | −0,19 (−0,420: 0,0381) (0,1017) | ||
| Изменение в сравнении с ликсисенатидом, определенное методом наименьших квадратов (среднее значение) (95% доверительный интервал) (р-значение) | −1.96 (−2,246; −1,682) (< 0,0001) | ||
| Постпрандиальный уровень глюкозы через 2 ч после приема пищи (ммоль/л)** | |||
| Исходный уровень (среднее значение) | 15,19 | 14.61 | 14.72 |
| Завершение исследования (среднее значение) | 9,15 | 11,35 | 9.99 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов | −5,68 | −3,31 | −4,58 |
| Изменение в сравнении с инсулином гларгином, определенное методом наименьших квадратов (среднее значение) (95% доверительный интервал) | −2,38 (−2,79; −1,96) | ||
| Изменение в сравнении с ликсисенатидом, определенное методом наименьших квадратов (среднее значение) (95% доверительный интервал) | −1,10 (−1,63; −0,57) | ||
| Средняя масса тела, кг | |||
| Исходный уровень (среднее значение) | 89,4 | 89,8 | 90,8 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов | −0,3 | 1,1 | −2.3 |
| Сравнение с инсулином гларгином (95% доверительный интервал) (р-значение) | −1,4 (−1,9; −0,9) (<0,0001) | ||
| Сравнение с ликсисенатидом (95% доверительный интервал)* | 3,01 (1,4; 2,6) | ||
| Количество пациентов (%), у которых были достигнуты уровни НЬА1с <7,0% без прироста массы тела на 30-й неделе | 202 (43,2%) | 117 (25,1%) | 65 (27,9%) |
| Пропорциональное различие в сравнении с инсулином гларгином (95% доверительный интервал) (р-значение) | 18,1 (12,2; 24,0) (<0,0001) | ||
| Пропорциональное различие в сравнении с ликсисенатидом (95% доверительный интервал)* | 15,2 (8,1; 22,4) | ||
| Суточная доза инсулина гларгина | |||
| Доза инсулина на 30-й неделе, определенная методом наименьших квадратов (среднее значение) | 39,8 | 40,5 | Не применимо |
*Не включено в предварительно определенной процедуре исследования постепенного снижения уровней.
**Постпрандиальный уровень глюкозы через 2 ч после приема пищи минус уровень глюкозы перед приемом пищи.
Рис. 1. Средние уровни HbA1c (%) во время визитов в течение 30 нед лечения
У пациентов группы препарата Соликва отмечено статистически значимо большее снижение среднего профиля уровня глюкозы в плазме крови, определяемого самостоятельно в 7 временных точках, от исходного уровня до 30-й недели (−3,35 ммоль/л), по сравнению с пациентами группы инсулина гларгина (−2,66 ммоль/л, отличие −0,69 ммоль/л) и с пациентами группы ликсисенатида (−1,95 ммоль/л, отличие −1,40 ммоль/л) (р<0,0001 для обоих сравнений). На всех временных точках на 30-й неделе средние уровни глюкозы в плазме крови были ниже в группе препарата Соликва по сравнению как с группой инсулина гларгина, так и с группой ликсисенатида, за исключением только уровней глюкозы натощак, которые были подобными в группе препарата Соликва и в группе инсулина гларгина.
Переход с базального инсулина. Клиническое исследование среди пациентов с сахарным диабетом 2-го типа, у которых на фоне лечения базальным инсулином не отмечалось должного контроля заболевания. В целом 736 пациентов с сахарным диабетом 2-го типа приняли участие в рандомизированном 30-недельном с активным контролем открытом с 2 группами лечения в параллельных группах многоцентровом исследовании с оценкой эффективности и безопасности препарата Соликва в сравнении с инсулином гларгином (100 ЕД/мл).
Пациенты с сахарным диабетом 2-го типа, подлежащие скринингу, получали лечение базальным инсулином в течение не менее 6 мес в стабильной дозе 15–40 МЕ в виде монотерапии или в комбинации с одним или двумя пероральными гипогликемическими препаратами (метформин, препарат сульфонилмочевины, глиниды, ингибитор натрийзависимых котранспортеров глюкозы (НЗКТГ)-2 или ингибитор дипептидилпептидазы (ДПП)-4). При этом уровни HbA1c у них составляли 7,5–10% (средний уровень HbA1c на скрининге — 8,5%), а уровень глюкозы в плазме крови натощак составлял ≤10,0 или ≤11,1 ммоль/л в зависимости от предыдущего противодиабетического лечения.
После скрининга пациентов, которые были определены пригодными для участия в исследовании (n=1018), включали в 6-недельную вводную фазу, в течение которой пациенты продолжали получать инсулин гларгин или были переведены на лечение инсулином гларгином в случае, если они получали другой базальный инсулин; при этом осуществлялось титрование/стабилизация дозы инсулина на фоне продолжения терапии метформином (если его принимали ранее). Лечение любыми другими пероральными гипогликемическими препаратами прекращалось.
После завершения вводного периода пациенты, у которых уровни HbA1c составляли 7–10%, уровень глюкозы в плазме крови натощак составлял ≤7,77 ммоль/л, а суточная доза инсулина гларгина — 20–50 ЕД, были рандомизированы в группу препарата Соликва (n=367) или в группу инсулина гларгина (n=369).
Характеристики популяции данных пациентов с сахарным диабетом 2-го типа были следующими. Средний возраст составил 60,0 лет, при этом возраст большинства пациентов (56,3%) — 50–64 года, 53,3% пациентов были женского пола. Средний ИМТ на исходном уровне составил 31,1 кг/м2, при этом у 57,3% пациентов ИМТ составлял ≥30 кг/м2. Средняя продолжительность сахарного диабета составляла около 12 лет, а средняя продолжительность предварительного лечения базальным инсулином — около 3 лет. На скрининге 64,4% пациентов в качестве базального инсулина получали инсулин гларгин, а 95,0% — по крайней мере один пероральный противодиабетический препарат.
На 30-й неделе лечение препаратом Соликва приводило к статистически значимому улучшению уровней НbА1с (р <0,0001) по сравнению с инсулином гларгином.
Информация о других конечных точках исследования приведена в табл. 2 и на рис. 2.
Таблица 2.
Результаты клинического исследования среди пациентов с сахарным диабетом 2-го типа, у которых отмечался надлежащий контроль заболевания на фоне лечения базальным инсулином на 30-й неделе (популяция пациентов, получавших лечение)
| Препарат Соликва | Инсулин гларгин | |
| Количество пациентов, получивших лечение | 366 | 365 |
| Уровень НbА1с (%) | ||
| Исходный уровень (среднее значение, после вводной фазы) | 8,1 | 8,1 |
| Завершение лечения (среднее значение) | 6,9 | 7,5 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −1,1 | −0,6 |
| Различие в сравнении с инсулином гларгином (95% доверительный интервал) (р-значение) | −0,5 (−0.6; −0,4) (<0,0001) | |
| Количество пациентов (n (%)), у которых были достигнуты уровни НbА1с <7% на 30-й неделе* | 201 (54,9%) | 108 (29,6%) |
| Уровень глюкозы в плазме крови натощак, ммоль/л | ||
| Исходный уровень (среднее значение) | 7,33 | 7,32 |
| Завершение исследования (среднее значение) | 6,78 | 6,69 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −0.35 | −0,46 |
| Различие в сравнении с инсулином гларгином (95% доверительный интервал) | 0,11 (−0,21; 0,43) | |
| Постпрандиальный уровень глюкозы через 2 ч после приема пищи, ммоль/л** | ||
| Исходный уровень (среднее значение) | 14,85 | 14,97 |
| Завершение исследования (среднее значение) | 9,91 | 13,41 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −4,72 | −1,39 |
| Изменение в сравнении с инсулином гларгином, определенное методом наименьших квадратов (среднее значение) (95% доверительный интервал) | −3,33 (−3,89; −2,77) | |
| Средняя масса тела, кг | ||
| Исходный уровень (среднее значение) | 87,8 | 87,1 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −0,7 | 0,7 |
| Сравнение с инсулином гларгином (95% доверительный интервал) (р-значение) | −1.4 (−1.8: −0,9) (<0,0001) | |
| Количество пациентов (%), у которых достигнуты уровни НbА1с <7,0% без прироста массы тела на 30-й неделе | 125 (34,2%) | 49 (13,4%) |
| Пропорциональное различие в сравнении с инсулином гларгином (95% доверительный интервал) (р-значение) | 20,8 (15,0; 26,7) (<0,0001) | |
| Суточная доза инсулина гларгина | ||
| Исходный уровень (среднее значение) | 35,0 | 35,2 |
| Конечная точка (среднее значение) | 46,7 | 46,7 |
| Изменение дозы инсулина на 30-й неделе, определенное методом наименьших квадратов (среднее значение) | 10,6 | 10,9 |
*Не включено в предварительно определенной процедуре исследования постепенного снижения уровней.
**Постпрандиальный уровень глюкозы через 2 ч после приема пищи минус уровень глюкозы перед приемом пищи.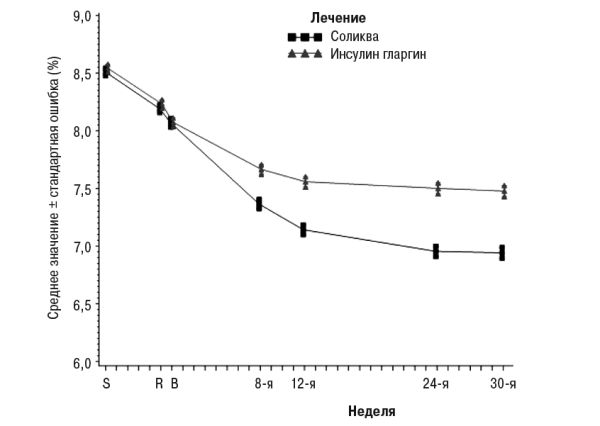
Рис. 2. Средние уровни HbA1c (%) во время визитов в течение 30 нед лечения
Переход с агониста рецепторов ГПП-1. Клиническое исследование среди пациентов с сахарным диабетом 2-го типа, у которых на фоне лечения агонистом рецепторов ГПП-1 не отмечалось должного контроля заболевания. Эффективность и безопасность препарата Соликва по сравнению с неизмененным предыдущим лечением агонистом рецепторов ГПП-1 изучали в 26-недельном рандомизированном открытом исследовании. В исследовании участвовали 514 пациентов с сахарным диабетом 2-го типа, у которых не отмечалось надлежащего контроля (уровень HbA1c — 7–9% включительно) заболевания, и получавших лечение лираглутидом или эксенатидом в течение не менее 4 мес или дулаглутидом, албиглутидом или эксенатидом с пролонгированным высвобождением в течение не менее 6 мес (все препараты вводились в максимально переносимой дозе) и метформином в виде монотерапии или в сочетании с пиоглитазоном, ингибитором НЗКТГ-2 или с обоими. Отобранные пациенты были рандомизированы или для приема препарата Соликва, или для продолжения приема предыдущего агониста рецепторов ГПП-1 в дополнение к предыдущему лечению пероральными противодиабетическими препаратами.
На скрининге 59,7% субъектов получали агонист рецепторов ГПП-1 один или два раза в сутки, а 40,3% получали агонист рецепторов ГПП-1 раз в неделю. Во время скрининга 6,6% субъектов получали пиоглитазон, а 10,1% — ингибитор НЗКТГ-2 в комбинации с метформином. Характеристики популяции исследования следующие: средний возраст составлял 59,6 года, 52,5% субъектов — мужчины. Средняя продолжительность заболевания сахарным диабетом составляла 11 лет, средняя продолжительность предварительного лечения агонистами рецепторов ГПП-1 — 1,9 года, средний ИМТ — около 32,9 кг/м2, средняя расчетная скорость клубочковой фильтрации — 87,3 мл/мин/1,73 м2 и у 90,7% пациентов отмечена расчетная скорость клубочковой фильтрации ≥60 мл/мин.
На 26-й неделе лечение препаратом Соликва приводило к статистически значимому улучшению уровней HbA1c (р<0,0001). Предварительно определенный анализ подтипа агониста рецепторов ГПП-1 (один/два раза в сутки или неделю), использованного во время скрининга, показал, что изменение HbA1c на 26-й неделе было аналогичным для каждой подгруппы и согласуется с первичным анализом для всей популяции. Средняя суточная доза Соликва на 26-й неделе составляла 43,5 деления дозы.
Информация о других конечных точках исследования приведена в табл. 3 и на рис. 3.
Таблица 3.
Результаты клинического исследования среди пациентов с сахарным диабетом 2-го типа, у которых отмечался надлежащий контроль заболевания на фоне лечения агонистами рецепторов ГПП-1 на 26-й неделе (популяция пациентов, получивших лечение)
| Препарат Соликва | Агонист рецепторов ГПП-1 | |
| Количество пациентов, получивших лечение | 252 | 253 |
| Уровень HbA1c (%) | ||
| Исходный уровень (среднее значение, после вступительной фазы) | 7,8 | 7,8 |
| Завершение лечения (среднее значение) | 6,7 | 7,4 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (среднее значение) | −1,0 | −0,4 |
| Различие в сравнении с агонистом рецепторов к ГПП-1 (95% доверительный интервал) (р-значение) | −0.6 (−0.8; −0,5) (< 0,0001) | |
| Количество пациентов (n (%)), у которых достигнут уровень НbА1с <7% на 26-й неделе | 156 (61,9%) | 65 (25,7%) |
| Пропорциональное различие в сравнении с агонистом рецепторов ГПП-1 (95% доверительный интервал) (р-значение) | 36,1% (28,1%: 44,0%) (<0,0001) | |
| Уровень глюкозы в плазме крови натощак, ммоль/л | ||
| Исходный уровень (доверительный интервал) | 9,06 | 9,45 |
| Завершение исследования (доверительный интервал) | 6,86 | 8,66 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (доверительный интервал) | −2,28 | −0,60 |
| Различие в сравнении с агонистом рецепторов к ГПП-1 (95% доверительный интервал) (р-значение) | −1,67 (−2.00; −1,34) (<0,0001) | |
| Постпрандиальный уровень глюкозы через 2 ч после приема пищи, ммоль/л* | ||
| Исходный уровень (доверительный интервал) | 13,60 | 13,78 |
| Завершение исследования (доверительный интервал) | 9,68 | 12,59 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (доверительный интервал) | −4,0 | −1,11 |
| Изменение в сравнении с агонистом рецепторов к ГПП-1, определенное методом наименьших квадратов (доверительный интервал) (95% доверительный интервал) (р-значение) | −2,9 (−3,42; −2,28) (<0,0001) | |
| Средняя масса тела, кг | ||
| Исходный уровень (доверительный интервал) | 93,01 | 95,49 |
| Изменение в сравнении с исходным уровнем, определенное методом наименьших квадратов (доверительный интервал) | 1,89 | −1,14 |
| Сравнение с агонистом рецепторов ГПП-1 (95% доверительный интервал) (р-значение) | −3,03 (2,417; 3,643) (<0,0001) | |
*Постпрандиальный уровень глюкозы через 2 ч после приема пищи минус уровень глюкозы перед приемом пищи.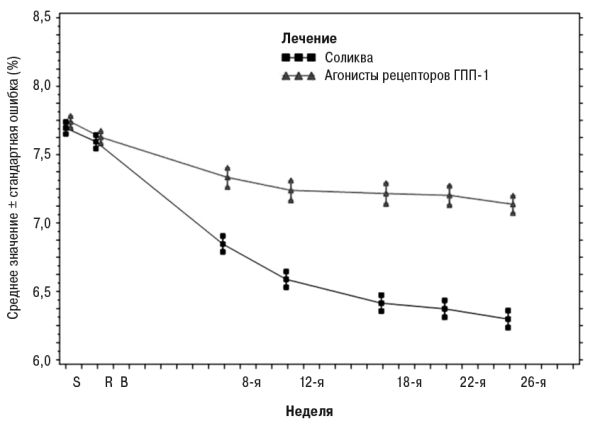
Рис. 3. Средние уровни HbA1c (%) во время визитов в течение 26 нед лечения
Одновременное применение препарата Соликва с ингибиторами НЗКТГ-2 подтверждается анализом подгрупп из трех рандомизированных клинических исследований 3-й фазы (119 пациентов, получавших комбинацию инсулина гларгина/ликсисенатида с фиксированным соотношением, которые также получали ингибиторы НЗКТГ-2).
Одно исследование, проведенное в Европе и Северной Америке, включало данные 26 пациентов (10,1%), которые одновременно получали комбинацию инсулина гларгина и ликсисенатида с фиксированным соотношением, метформин и ингибиторы НЗКТГ-2. Еще два исследования 3-й фазы из специализированной японской программы клинического развития, проведенные с участием пациентов, не достигших достаточного контроля гликемии с помощью пероральных противодиабетических препаратов, предоставили данные по 59 пациентам (22,7%) и 34 пациентам (21,1%) соответственно, которые одновременно получали ингибиторы НЗКТГ-2 и комбинацию инсулина гларгина и ликсисенатида с фиксированным соотношением.
Данные этих 3 исследований показывают, что начало применения препарата Соликва у пациентов с недостаточным контролем лечения, которые получали ингибиторы НЗКТГ-2, приводит к более значительному улучшению уровней НbА1с, чем препараты сравнения. У пациентов, получавших ингибиторы НЗКТГ-2, не выявлено повышенного риска гипогликемии и значимых различий в общем профиле безопасности по сравнению с теми, кто не получал ингибиторы НЗКТГ-2.
Исследования с изучением влияния на сердечно-сосудистые события. Безопасность инсулина гларгина и ликсисенатида в отношении сердечно-сосудистых событий изучалась в рамках клинических исследований ORIGIN и ELIXA соответственно. Отдельного исследования по изучению влияния препарата Соликва на сердечно-сосудистые события не проводили.
Инсулин гларгин. Исследование снижения частоты сердечно-сосудистых осложнений при инициальном применении инсулина гларгина (исследование ORIGIN) было открытым рандомизированным исследованием, которое включало 12 537 пациентов и в рамках которого сравнивали лечение препаратом Лантус со стандартным лечением на момент первого возникновения серьезного нежелательного явления со стороны сердечно-сосудистой системы. Серьезное нежелательное явление со стороны сердечно-сосудистой системы включало смерть вследствие сердечно-сосудистого события, нефатальный инфаркт миокарда и нефатальный инсульт. Медиана продолжительности контрольного наблюдения в рамках исследования составила 6,2 года. Частота серьезных нежелательных явлений со стороны сердечно-сосудистой системы в рамках исследования ORIGIN была подобной между группой, получавшей препарат инсулин гларгин, и группой, получавшей стандартное лечение (отношение рисков (95% доверительный интервал) касательно серьезных нежелательных явлений со стороны сердечно-сосудистой системы: 1,02 (0,94: 1,11).
Ликсисенатид. Исследование ELIXA было рандомизированным двойным слепым плацебо-контролируемым многонациональным, в рамках которого осуществлялась оценка сердечно-сосудистых осложнений при лечении ликсисенатидом у пациентов с сахарным диабетом 2-го типа (n=6068) после недавно перенесенного острого коронарного синдрома. Первичной комбинированной конечной точкой по эффективности было время до первого возникновения любого из следующих нежелательных явлений: смерть вследствие сердечно-сосудистого события, нефатальный инфаркт миокарда, нефатальный инсульт или госпитализация по поводу нестабильной стенокардии. Медиана продолжительности контрольного наблюдения в рамках исследования составила 25,8 и 25,7 мес в группе ликсисенатида и плацебо соответственно.
Частота первичной конечной точки была подобной между группой ликсисенатида (13,4%) и группой плацебо (13,2%): отношение рисков для ликсисенатида по сравнению с плацебо составило 1,017 с ассоциированным 2-сторонним 95% доверительным интервалом 0,886–1,168.
Фармакокинетика. Абсорбция. Соотношение инсулин гларгин/ликсисенатид существенно не влияет на фармакокинетику инсулина гларгина и ликсисенатида в препарате Соликва.
После п/к введения комбинации инсулин гларгин/ликсисенатид у пациентов с сахарным диабетом 1-го типа инсулин гларгин не демонстрировал выраженного пика. Экспозиция инсулина гларгина после введения комбинации инсулин гларгин/ликсисенатид составляла 86–88% от экспозиции, которая отмечалась при отдельных одновременных инъекциях инсулина гларгина и ликсисенатида. Такое различие нельзя считать клинически значимым.
После п/к введения комбинации инсулин гларгин/ликсисенатид у пациентов с сахарным диабетом 1-го типа медиана Тmax ликсисенатида находилась в диапазоне 2,5–3,0 ч. AUC была сопоставимой, в то время как отмечалось незначительное снижение Сmax ликсисенатида на 22–34% по сравнению с Сmax, выявленной при отдельных одновременных инъекциях инсулина гларгина и ликсисенатида; однако маловероятно, что такое снижение может быть клинически значимым.
Клинически значимые различия в скорости абсорбции ликсисенатида при его применении в виде монотерапии после п/к введения в область живота, дельтовидной мышцы или бедра отсутствуют.
Распределение. Ликсисенатид характеризуется низким (55%) уровнем связывания с белками плазмы крови человека. Прогнозируемый объем распределения ликсисенатида после п/к введения комбинации инсулин гларгин/ликсисенатид (несвязанный объем распределения, Vz/F) составляет около 100 л. Прогнозируемый объем распределения инсулина гларгина после п/к введения комбинации инсулин гларгин/ликсисенатид (объем распределения в равновесном состоянии, Vss/F) составляет около 1700 л.
Метаболизм и элиминация. Результаты исследования с изучением метаболизма у пациентов с сахарным диабетом, получавших инсулин гларгин в виде монотерапии, свидетельствуют о том, что инсулин гларгин быстро метаболизируется на уровне карбоксильного конца В-цепи с образованием двух активных метаболитов — М1 (21А-глицин-инсулин) и М2 (21А-глицин-дез-30В-треонин-инсулин). В плазме крови главным циркулирующим соединением является метаболит М1. Фармакокинетические и фармакодинамические данные свидетельствуют о том, что эффект п/к инъекции инсулина гларгина главным образом зависит от экспозиции метаболита М1.
Как и все пептиды, ликсисенатид выводится путем клубочковой фильтрации с последующей канальцевой реабсорбцией и последующим метаболическим расщеплением до меньших пептидов и аминокислот, которые опять включаются в белковый метаболизм. После многократного введения у пациентов с сахарным диабетом 2-го типа средний терминальный Т½ составлял около 3 ч, а средний воображаемый клиренс (CL/F) — около 35 л/ч.
Особые популяции пациентов. Пациенты с нарушением функции почек. У пациентов с легким (клиренс креатинина, рассчитанный по формуле Кокрофта — Голта, 60–90 мл/мин), умеренным (клиренс креатинина 30–60 мл/мин) и тяжелым (клиренс креатинина 15–30 мл/мин) нарушением функции почек AUC ликсисенатида возрастала на 46; 51 и 87% соответственно.
Применение инсулина гларгина у пациентов с нарушением функции почек не исследовалось. Тем не менее у пациентов с нарушением функции почек потребность в инсулине может быть снижена вследствие снижения метаболизма инсулина.
Пациенты с нарушением функции печени. Поскольку ликсисенатид выделяется главным образом почками, у пациентов с острой или хронической печеночной недостаточностью никаких фармакокинетических исследований не проводилось. Влияние нарушения функции печени на фармакокинетику ликсисенатида не предвидится.
Применение инсулина гларгина у пациентов с сахарным диабетом и нарушением функции печени не исследовалось. У пациентов с нарушением функции печени потребность в инсулине может быть уменьшена в связи со снижением способности к глюконеогенезу и снижением метаболизма инсулина.
Возраст, расовая принадлежность, пол и масса тела
Инсулин гларгин. Влияние возраста, расовой принадлежности и пола на фармакокинетику инсулина гларгина не изучали. По результатам анализа подгрупп, сформированных по возрасту, расовой принадлежностью и полу, в рамках контролируемых клинических исследований среди взрослых пациентов, получавших инсулин гларгин (100 ЕД/мл), каких-либо различий в отношении безопасности и эффективности не выявлено.
Ликсисенатид. Возраст не оказывает клинически значимого влияния на фармакокинетику ликсисенатида. В рамках исследования фармакокинетики среди пожилых людей без сахарного диабета введение ликсисенатида в дозе 20 мкг приводило к среднему повышению AUC ликсисенатида у этих лиц на 29% (11 участников исследования были в возрасте 65–74 лет и 7 участников — в возрасте ≥75 лет) по сравнению с 18 лицами в возрасте 18–45 лет, что, вероятно, связано со снижением функции почек в группе лиц пожилого возраста. Этническая принадлежность не оказывает клинически значимого влияния на фармакокинетику ликсисенатида, о чем свидетельствуют результаты фармакокинетических исследований, проведенных с участием пациентов европеоидной рассы, а также японской и китайской национальности.
Пол не оказывает клинически значимого влияния на фармакокинетику ликсисенатида.
Масса тела не имеет клинически значимого влияния на AUC ликсисенатида.
Иммуногенность. При наличии антител к ликсисенатиду его экспозиция и вариабельность экспозиции существенно повышаются независимо от дозы.
Доклинические данные по безопасности. Каких-либо исследований на животных с применением комбинации инсулина гларгина и ликсисенатида для оценки токсичности при многократном введении, канцерогенеза, генотоксичности или токсического воздействия на репродуктивную систему не проводилось.
Инсулин гларгин. Доклинические данные, полученные в стандартных исследованиях фармакологической безопасности, токсичности при многократном введении, генотоксичности, канцерогенного потенциала и токсического влияния на репродуктивную систему, свидетельствуют об отсутствии каких-либо специфических рисков для человека при применении инсулина гларгина.
Ликсисенатид. В рамках 2-летних исследований канцерогенности при п/к введении препарата у крыс и мышей наблюдались нелетальные С-клеточные опухоли щитовидной железы, которые были расценены как обусловленные негенотоксичным механизмом, опосредованным рецепторами к ГПП-1, к которому грызуны особенно чувствительны. С-клеточная гиперплазия и аденома выявлены у крыс на фоне применения всех исследуемых доз, а максимальную дозу, при которой не отмечались побочные эффекты, определить не удалось. У мышей эти эффекты возникали и при уровне экспозиции, в 9,3 раза превышавшем экспозицию у людей при применении терапевтических доз препарата. У мышей не отмечено С-клеточных карцином, а у крыс они возникали при уровне экспозиции, примерно в 900 раз превышавшем экспозицию у людей при применении терапевтических доз.
В рамках 2-летнего исследования канцерогенности при п/к введении препарата у мышей отмечено 3 случая аденокарциномы эндометрия со статистически значимым повышением частоты этого заболевания в группе применения средних доз, которые обусловили уровень экспозиции, превышавший экспозицию у людей в 97 раз. Каких-либо эффектов, связанных с применением препарата, не отмечено.
Результаты исследований на животных не свидетельствуют о каком-либо непосредственном вредном воздействии препарата на фертильность самцов и самок крыс. У собак, которым вводился ликсисенатид, отмечали обратимые нарушения в яичках и придатках яичек. У здоровых мужчин не отмечено какого-либо влияния препарата на сперматогенез, связанного с применением препарата.
В исследованиях с изучением влияния препарата на внутриутробное развитие у крыс на фоне всех исследуемых доз ликсисенатида (при уровнях экспозиции, в 5 раз превышавших экспозицию у людей) и у кроликов при введении высоких доз препарата (при уровнях экспозиции, в 32 раза превышавших экспозицию у людей) отмечали пороки развития, замедление роста плода, задержку оссификации и побочные эффекты со стороны скелета. В обеих моделях исследуемых животных отмечалось незначительное токсическое действие на материнский организм, проявлявшееся в виде уменьшения потребления пищи и массы тела. Рост новорожденных крысят был замедлен среди самцов, которые подвергались воздействию высоких доз ликсисенатида в течение позднего гестационного периода и лактации, с небольшим повышением смертности среди крысят.
Показания Соликва
для лечения взрослых пациентов с недостаточно контролируемым сахарным диабетом 2-го типа с целью улучшения контроля гликемии как дополнение к диете и упражнениям, а также к метформину с ингибиторами НЗКТГ-2 или без них (результаты исследований влияния на контроль гликемии и исследованные группы пациентов см. в разделе ОСОБЫЕ УКАЗАНИЯ и Фармакодинамика).
Применение Соликва
препарат Соликва доступен в двух типах шприц-ручек с различными опциями дозирования, а именно шприц-ручка Соликва (10–40) и шприц-ручка Соликва (30–60) соответственно. Отличие между дозировками шприц-ручек связано с их диапазонами дозирования.
Соликва 100 ЕД/мл + 50 мкг/мл в предварительно заполненной шприц-ручке — диапазон дозирования составляет 10–40 ЕД инсулина гларгина в комбинации с 5–20 мкг ликсисенатида (шприц-ручка Соликва (10–40)).
Соликва 100 ЕД/мл + 33 мкг/мл в предварительно заполненной шприц-ручке — диапазон дозирования составляет 30–60 ЕД инсулина гларгина в комбинации с 10–20 мкг ликсисенатида (шприц-ручка Соликва (30–60)).
Во избежание ошибок в применении врач, который назначает препарат, должен убедиться, что в рецепте указаны правильные дозы и диапазон делений доз шприц-ручки.
Доза должна подбираться индивидуально с учетом индивидуального ответа больного, а ее титрование осуществляется в соответствии с потребностью пациента в инсулине. Доза ликсисенатида повышается или снижается вместе с дозой инсулина гларгина и также зависит от того, какая шприц-ручка используется.
Начальная доза. Терапию базальным инсулином или агонистом рецепторов ГПП-1 или пероральным гипогликемическим лекарственным средством, за исключением метформина и ингибиторов НЗКТГ-2, перед началом применения препарата Соликва следует прекратить.
Начальная доза препарата Соликва определяется на основании предварительного противодиабетического лечения, при этом рекомендуемая начальная доза ликсисенатида не должна превышать 10 мкг.
Таблица 4.
Начальная доза препарата Соликва
| Предыдущая терапия | ||||
| Пациенты, ранее не получавшие инсулин (пероральные противодиабетические препараты или агонист рецептора ГПП-1 | Инсулин гларгин (100 ЕД/мл)** >20 до <30 ЕД | Инсулин гларгин (100 ЕД/мл)** >30 до <60 ЕД | ||
| Начальная доза и тип шприц-ручки | Шприц-ручка Соликва (10–40) | 10 делений дозы (10 ЕД/5 мкг) | 20 делений дозы (20 ЕД/10 мкг)* | |
| Шприц-ручка Соликва (30–60) | 30 делений дозы (30 ОД/10 мкг)* | |||
*Единиц инсулина гларгина (100 ЕД/мл)/микрограмм ликсисенатида.
**Если применялся другой базальный инсулин:
– при применении базального инсулина два раза в сутки или инсулина гларгина (300 ЕД/мл) предыдущая общая суточная доза должна быть снижена на 20% при выборе начальной дозы препарата Соликва;
– при применении любого другого базального инсулина должно применяться такое же правило, как и для инсулина гларгина (100 ЕД/мл).
Максимальная суточная доза составляет 60 ЕД инсулина гларгина и 20 мкг ликсисенатида, что соответствует 60 делениям дозы.
Инъекция препарата Соликва должна осуществляться один раз в сутки в пределах 1 ч до еды. Желательно, чтобы прандиальная инъекция выполнялась перед одним и тем же приемом пищи ежедневно, после того, как пациент выберет наиболее удобный для себя прием пищи.
Титрование дозы. Препарат Соликва должен вводиться в соответствии с индивидуальными потребностями пациента в инсулине. Контроль гликемии рекомендуется оптимизировать путем коррекции дозы на основании уровня глюкозы в плазме крови натощак (см. Фармакодинамика). При переводе на этот препарат и в течение первых недель после этого рекомендуется осуществлять тщательный мониторинг уровня глюкозы.
Если пациент начинает использовать шприц-ручку Соликва (10–40), тог доза может титроваться до 40 делений дозы.
Для дозирования >40 делений в сутки титрование следует продолжать с использованием шприц-ручки Соликва (30–60).
Если пациент начинает использовать шприц-ручку Соликва (30–60), то доза может титроваться до 60 делений дозы.
Для общего суточного дозирования >60 делений дозы препарат Cоликва нe должен применяться.
Пациенты, которые корректируют количество или время введения препарата, должны осуществлять это только под контролем с соответствующим мониторингом уровня глюкозы (см. ОСОБЫЕ УКАЗАНИЯ).
Особые категории пациентов
Пациенты пожилого возраста (≥65 лет). Препарат Соликва может применяться у пациентов пожилого возраста. Доза должна быть подобрана в индивидуальном порядке с учетом результатов мониторинга уровня глюкозы. У пациентов пожилого возраста прогрессирующее ухудшение функции почек может стать причиной постоянного снижения потребности в инсулине. Коррекция дозы ликсисенатида в зависимости от возраста не требуется. Опыт терапевтического применения препарата Соликва у пациентов в возрасте ≥75 лет ограничен.
Пациенты с нарушением функции почек. Препарат Соликва не рекомендуется применять у пациентов с тяжелым нарушением функции почек и при терминальной стадии болезни почек, поскольку опыт терапевтического применения ликсисенатида в таких случаях недостаточен.
У пациентов с легким или умеренным нарушением функции почек коррекция дозы ликсисенатида не требуется.
У пациентов с нарушением функции почек потребность в инсулине может быть уменьшена в связи со снижением метаболизма инсулина.
У пациентов с легким или умеренным нарушением функции почек, применяющих препарат Соликва, может возникать необходимость в частом мониторинге уровня глюкозы и в соответствующей коррекции дозы.
Пациенты с нарушением функции печени. У пациентов с нарушением функции печени коррекция дозы ликсисенатида не требуется (см. Фармакокинетика). У пациентов с нарушением функции печени потребность в инсулине может быть уменьшена в связи со снижением способности к глюконеогенезу и снижением метаболизма инсулина. У пациентов с нарушением функции печени может возникать необходимость в частом мониторинге уровня глюкозы и соответствующей коррекции дозы препарата Соликва.
Дети и подростки. Препарат Соликва не предусмотрен для применения у детей.
Способ введения. Препарат Соликва следует вводить путем п/к инъекции в области живота, дельтовидной мышцы или бедра.
Места для инъекций должны меняться в пределах одной анатомической области (живота, дельтовидной мышцы или бедра) от одной инъекции к другой с целью снижения риска возникновения липодистрофии и/или кожного амилоидоза (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Пациенты должны быть проинструктированы относительно постоянной необходимости в использовании новой иглы. Повторное использование иглы инсулиновой шприц-ручки повышает риск ее блокировки, что может приводить к введению недостаточной или чрезмерной дозы препарата. Препарат Соликва не допустимо отбирать из картриджа предварительно наполненной шприц-ручки в шприц, поскольку это может привести к тяжелой передозировке (см. Особые предосторожности при применении препарата).
Особые предосторожности при применении препарата). Перед первым применением шприц-ручку следует извлечь из холодильника и подержать при температуре не выше 25 °С в течение 1–2 ч.
Перед использованием проверяют картридж шприц-ручки. Его можно использовать только тогда, когда в нем содержится прозрачный бесцветный р-р, который по консистенции напоминает воду, без видимых твердых частиц.
Препарат Соликва нельзя смешивать с любым другим инсулином или разводить. При смешивании или разведении может измениться профиль действия препарата во времени; кроме этого, смешивание с другими препаратами может привести к образованию осадка.
Перед каждой инъекцией всегда необходимо подключать новую иглу. Повторно использовать иглы нельзя. Пациент должен утилизировать иглу после каждой инъекции.
В случае блокировки иглы пациентам необходимо следовать инструкциям, описанным в Шаге 3 Инструкции по использованию (см. ниже).
Пустые шприц-ручки ни в коем случае нельзя использовать повторно, они должны быть надлежащим образом утилизированы.
Если кажется, что шприц-ручка повреждена, не следует ее использовать. Следует взять новую. Не нужно пытаться самостоятельно починить шприц-ручку.
Для предотвращения возможной передачи заболеваний каждая шприц-ручка должна использоваться только одним пациентом.
Перед каждой инъекцией необходимо проверять этикетку, чтобы избежать путаницы между препаратом Соликва и другими инъекционными гипогликемическими лекарственными средствами, включая два различных типа шприц-ручек с препаратом Соликва (см. ОСОБЫЕ УКАЗАНИЯ).
Перед применением препарата Соликва следует внимательно прочитать Инструкцию по использованию шприц-ручки Соликва.
Важная информация по использованию шприц-ручки Соликва
Шприц-ручка предназначена для личного использования и не следует передавать ее другим лицам.
Нельзя использовать шприц-ручку в случае ее повреждения или при наличии сомнений в правильности ее функционирования.
Всегда следует проводить тест на безопасность.
Всегда необходимо иметь запасную шприц-ручку и запасные иглы на случай потери или повреждения основного набора.
Что нужно знать для проведения инъекции
Перед использованием шприц-ручки следует спросить своего врача или медсестру, как делается инъекция.
Если есть какие-либо сложности с использованием шприц-ручки, например из-за проблем со стороны зрения, следует обратиться за помощью.
Перед использованием шприц-ручки следует перечитать инструкцию. В случае несоблюдения этих установок можно получить слишком высокую или низкую дозу препарата.
Принадлежности, которые потребуются при введении этого препарата:
- новая стерильная игла (см. Шаг 2);
- смоченный спиртом тампон;
- устойчивый к прокалыванию контейнер для использованных игл и шприц-ручек.
Инструкция по использованию шприц-ручки Соликва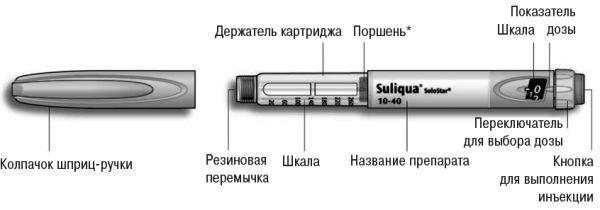
Рис. 4. Шприц-ручка Соликва.
*Поршень не будет видно, пока не будут введены несколько доз.
Шаг 1. Проверить свою шприц-ручку.
Не менее чем за 1 ч до проведения инъекции достать новую шприц-ручку из холодильника. Введение холодного препарата является более болезненным.
А. Проверить название препарата и дату окончания срока годности на этикетке шприц-ручки.
Убедиться в том, что взят нужный препарат. Данная шприц-ручка персикового цвета с коричневой кнопкой для выполнения инъекции.
Не использовать эту шприц-ручку, если нужна доза меньше 10 шагов дозы или если нужно более 40 шагов дозы. Следует обсудить с врачом, какая шприц-ручка лучше всего подходит для нужд пациента.
Не использовать шприц-ручку после окончания ее срока годности.
В. Снять колпачок со шприц-ручки.
С. Убедиться в том, что препарат является прозрачным.
Не использовать шприц-ручку, если р-р препарата является мутным на вид, окрашенным или содержит частицы.
Шаг 2. Присоединить новую иглу.
Не использовать иглы повторно. Для выполнения каждой инъекции всегда использовать новую стерильную иглу. Это помогает предотвращать блокировку иглы, загрязнение и занесение инфекции.
Всегда использовать только такие иглы, которые совместимы для использования с препаратом Соликва.
А. Взять новую иглу и отклеить защитную пленку.
В. Держать иглу прямо и закрутить ее на шприц-ручку до закрепления. Не прикручивать иглу слишком сильно.
С. Снять внешний колпачок с иглы. Следует сохранить его — он понадобится позже.
D. Снять внутренний колпачок иглы и выбросить его.
Пользование иглами
Следует обращаться с иглами с осторожностью — это необходимо, чтобы предотвратить укол иглой и перекрестное инфицирование.
Шаг 3. Выполнить тест на безопасность.
Всегда выполнять тест на безопасность перед каждой инъекцией — это необходимо, чтобы:
– проверить, что шприц-ручка и игла работают правильно;
– убедиться в том, что будет получена необходимая доза препарата.
А. Выбрать 2 шага дозы, вращая переключатель для выбора дозы, чтобы указатель дозы указывал на черту «2».
В. Нажать кнопку для выполнения инъекции до упора.
Если с кончика иглы будет выходить р-р препарата, шприц-ручка работает правильно. Переключатель для выбора дозы вернется в положение «0».
Если р-р препарата не выходит: может понадобиться повторить этот шаг до 3 раз, прежде чем можно будет увидеть р-р препарата.
Если р-р препарата не выходит и после третьего раза, игла может быть заблокирована. Если такое произойдет:
– следует заменить иглу (см. Шаг 6 и Шаг 2);
– после этого выполнить тест на безопасность повторно (Шаг 3).
Если и после этого р-р препарата не выходит из кончика иглы, не следует использовать эту шприц-ручку. Следует использовать новую шприц-ручку.
Не использовать шприц для отбора р-ра препарата из шприц-ручки.
Если будут видны пузырьки воздуха. Можно увидеть пузырьки воздуха в р-ре препарата. Это нормальное явление, они не окажут вредного влияния.
Шаг 4. Выбрать дозу.
Следует использовать эту шприц-ручку только для введения однократной ежедневной дозы объемом 10–40 шагов.
Никогда не выбирать дозу либо не нажимать на кнопку для выполнения инъекции без присоединенной иглы. Это может повредить шприц-ручку.
А. Убедиться в том, что игла присоединена к шприц-ручке и указатель дозы указывает на «0».
В. Поворачивать переключатель для выбора дозы, пока указатель дозы не укажет на нужную дозу.
Если переключатель повернут дальше, чем нужно, можно вернуть его обратно.
Если в шприц-ручке осталось недостаточно единиц для нужной дозы, переключатель для выбора дозы остановится после набора того количества единиц, которое осталось в шприц-ручке.
Если нельзя набрать полную дозу, которая назначена, следует использовать новую шприц-ручку или ввести столько шагов дозы, сколько осталось, а остальную дозу ввести из новой шприц-ручки. В этом и только в этом случае разрешается вводить частичную дозу менее 10 шагов дозы. Для того чтобы завершить выбор нужной дозы, всегда следует использовать другую шприц-ручку с препаратом Соликва (10–40), а не любую другую шприц-ручку.
Как считывать данные в окне отображения дозы. Не использовать шприц-ручку, если нужная однократная доза составляет менее 10 шагов дозы — эти шаги дозы обозначены белыми цифрами на черном фоне.
Количество единиц препарата в шприц-ручке. Шприц-ручка содержит всего 300 шагов дозы. Можно выбирать свою дозу в 1 шаг дозы.
Не использовать эту шприц-ручку, если нужна однократная доза менее 10 шагов дозы или если нужно более 40 шагов дозы.
Каждая шприц-ручка содержит более одной суточной дозы.
Шаг 5. Ввести необходимую дозу.
Если есть ощущение, что трудно нажимать на кнопку для выполнения инъекции, не следует прилагать усилия для ее нажатия, поскольку вследствие этого можно сломать шприц-ручку.
Заменить иглу (см. Шаг 6. Отключить иглу и Шаг 2. Присоединить новую иглу), после чего выполнить тест по безопасности (см. Шаг 3).
Если все равно трудно нажимать на кнопку, следует взять новую ручку.
Не использовать шприц для отбора р-ра препарата из шприц-ручки.
А. Выбрать место для выполнения инъекции в соответствии с рис. 5.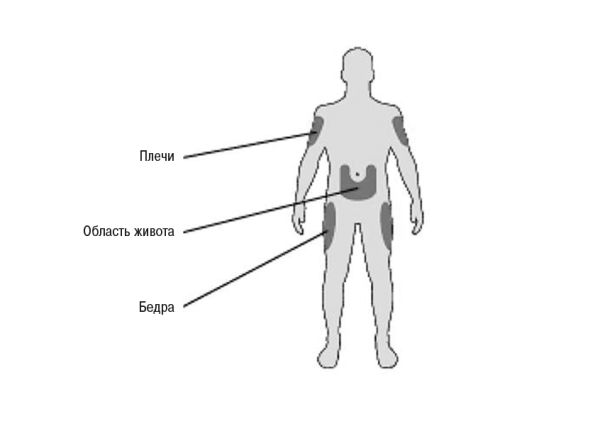
Рис. 5. Места для выполнения инъекции
В. Ввести иглу себе в кожу так, как показывал врач или медицинская сестра.
При этом пока не следует касаться кнопки для выполнения инъекции.
С. Положить большой палец руки на кнопку для выполнения инъекции. После этого нажать ее до упора и удерживать в таком положении.
Не нажимать на кнопку под углом — большой палец может заблокировать вращение переключателя для выбора дозы.
Удерживать кнопку для выполнения инъекции в нажатом положении и после того, как будет видно в окне отображения дозы «0», медленно сосчитать до 10.
Это необходимо для того, чтобы убедиться в получении полной дозы препарата.
Е. После удержания кнопки и медленного счета до 10 отпустить кнопку для выполнения инъекции. После этого извлечь иглу из кожи.
Шаг 6. Отключить иглу.
Следует обращаться с иглами с осторожностью — это необходимо, чтобы предотвратить укол иглой и перекрестное инфицирование.
Не надевать снова внутренний колпачок иглы.
А. Взять внешний колпачок иглы за его самую широкую часть. Держать иголку прямо и ввести ее назад, во внешний колпачок иглы. После этого крепко прижать их друг к другу.
Игла может проколоть колпачок, если он надевается под углом.
В. Взять внешний колпачок иглы за его самую широкую часть и сжать его в этом месте. Другой рукой повернуть шприц-ручку несколько раз для отсоединения иглы.
Если игла не отделилась с первого раза, следует попробовать снова.
С. Выбросить использованную иглу в устойчивый к проколам контейнер или в соответствии с рекомендациями врача или местного уполномоченного органа.
D. Надеть колпачок шприц-ручки назад на шприц-ручку.
Не класть шприц-ручку обратно в холодильник.
Инструкция по хранению. Перед первым использованием шприц-ручки хранить в холодильнике при температуре 2–8° С в защищенном от света месте. Не замораживать.
После первого использования шприц-ручку следует хранить не более 28 дней при комнатной температуре ниже 25 °С в защищенном от света месте.
Не класть шприц-ручку обратно в холодильник.
После каждой инъекции на шприц-ручку следует снова надевать колпачок для защиты от света. Нельзя хранить шприц-ручку с прикрепленной к ней иглой.
Эксплуатация. Со шприц-ручкой следует обращаться с осторожностью. Если кажется, что шприц-ручка повреждена, не следует пытаться ее починить, следует взять новую.
Защита шприц-ручки от пыли и грязи: внешнюю поверхность шприц-ручки можно очищать, протирая ее влажной тканью (смоченной только водой). Не погружать в жидкость, не промывать и не смазывать шприц-ручку — это может ее повредить.
Утилизация шприц-ручки: перед утилизацией шприц-ручки следует снять с нее иглу. Выбрасывать шприц-ручку так, как рекомендовано местными регуляторными органами.
Дети. Безопасность и эффективность препарата Соликва для лечения детей в возрасте до 18 лет не установлены. Данные по этому поводу отсутствуют.
Противопоказания
гиперчувствительность к действующим веществам или любому вспомогательному веществу, входящему в состав препарата.
Побочные эффекты
побочными реакциями, о которых чаще всего сообщалось во время лечения Соликва, были гипогликемия и нарушения со стороны ЖКТ (см. Описание отдельных нежелательных реакций).
Побочные реакции, связанные с применением препарата, выявленные в ходе клинических исследований, приводятся в табл. 5 по категориям «система — орган — класс» в порядке убывания частоты: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10 000 до <1/1000), очень редко (≥1/10 000), частота неизвестна (невозможно оценить по имеющимся данным).
Таблица 5.
Побочные реакции, связанные с применением препарата, которые отмечались в ходе клинических исследований
| Категории «система — орган — класс» MedDRA | Очень часто | Часто | Нечасто | Частота неизвестна |
| Инфекционные и паразитарные заболевания | Назофарингит, инфекция верхних дыхательных путей | |||
| Нарушения со стороны иммунной системы | Крапивница | |||
| Метаболические и алиментарные нарушения | Гипогликемия | |||
| Нарушения со стороны нервной системы | Головокружение | Головная боль | ||
| Нарушения со стороны ЖКТ | Тошнота, диарея, рвота | Диспепсия, боль в животе | ||
| Нарушения со стороны кожи и подкожных тканей | Кожный амилоидоз, липодистрофия | |||
| Общие нарушения и реакции в месте введения препарата | Повышенная утомляемость, реакции в месте инъекции | |||
Описание отдельных побочных реакций. Гипогликемия. В табл. 6 приведены данные о частоте документированной симптоматической гипогликемии (<3,9 ммоль/л) и тяжелой гипогликемии при применении препарата Соликва и препарата сравнения.
Таблица 6.
Побочные реакции в виде документированной симптоматической гипогликемии или тяжелой гипогликемии
| Пациенты, ранее не получавшие инсулин | Переход с базального инсулина | Переход с агониста рецепторов ГПП-1 | |||||
| Препарат Соликва | Инсулин гларгин | Ликсисенатид | Препарат Соликва | Инсулин гларгин | Препарат Соликва | Агонист рецепторов ГПП-1 | |
| n | 469 | 467 | 233 | 365 | 365 | 255 | 256 |
| Задокументированная симптоматическая гипогликемия* | |||||||
| Пациенты, у которых возникла побочная реакция, n | 120 (25,6%) | 110 (23,6%) | 15 (6,4%) | 146 (40,0%) | 155 (42,5%) | 71 (27,8%) | 6 (2.3%). |
| Количество побочных реакций на пациенто-год, n | 1,44 | 1,22 | 0,34 | 3,03 | 4,22 | 1,54 | 0,08 |
| Тяжелая гипогликемия** | |||||||
| Количество побочных реакций на пациенто-год, n | 0 | <0,01 | 0 | 0,02 | <0,01 | <0,01 | 0 |
*Задокументированная симптоматическая гипогликемия определялась как событие, во время которого типичные симптомы гипогликемии сопровождались определенной концентрацией глюкозы в плазме крови <3,9 ммоль/л.
**Тяжелая симптоматическая гипогликемия определялась как явление, которое требовало помощи другого лица для активного введения углеводов, глюкагона или проведения других реанимационных мероприятий.
Нарушения со стороны ЖКТ (тошнота, рвота и диарея) были побочными реакциями, о которых часто сообщалось в течение периода лечения. У пациентов, получавших лечение препаратом Соликва, частота связанной тошноты, диареи и рвоты составляла 8,4; 2,2 и 2,2% соответственно. Побочные реакции в виде расстройств со стороны ЖКТ в основном были легкой степени и имели преходящий характер.
Нарушения со стороны иммунной системы. Об аллергических реакциях (крапивница), вероятно связанных с применением препарата Соликва, сообщали у 0,3% пациентов. О случаях генерализованных аллергических реакций, включая анафилактические реакции и ангионевротический отек, сообщали при пострегистрационном применении инсулина гларгина и ликсисенатида.
Иммуногенность. Применение препарата Соликва может приводить к образованию антител к инсулину гларгину и/или ликсисенатиду.
Частота случаев образование антител к инсулину гларгину составила 21,0 и 26,2%. Примерно у 93% пациентов отмечалась перекрестная реактивность антител к инсулину гларгину относительно человеческого инсулина. Частота образования антител к ликсисенатиду составляла около 43%. Ни статус антител к инсулину гларгину, ни статус антител к ликсисенатиду не оказывал клинически значимого влияния на безопасность или эффективность препарата.
Нарушения со стороны кожи и подкожных тканей. Липодистрофия и кожный амилоидоз могут возникать в месте инъекции инсулина и приводить к задержке абсорбции инсулина из него. Постоянная смена мест инъекции в пределах одного участка тела может помочь уменьшить выраженность или предотвратить эти реакции.
Реакции в месте инъекции. У некоторых пациентов (1,7%), получавших терапию, которая включала введение инсулина, в том числе препарата Соликва, отмечались покраснение, местный отек и зуд в месте инъекции.
ЧСС. При применении агонистов рецепторов ГПП-1 сообщалось о повышении ЧСС; транзиторный рост ЧСС отмечали также и в рамках некоторых исследований применения ликсисенатида. По результатам всех исследований 3-й фазы применение препарата Соликва не приводило к повышению средней ЧСС.
Сообщение о подозреваемых побочных реакциях после утверждения лекарственного средства является важной процедурой. Это позволяет продолжать мониторинг соотношения «польза/риск» для данного лекарственного средства. Медицинских работников просят сообщать обо всех подозреваемых побочных реакциях в Государственный экспертный центр МЗ Украины
Особые указания
препарат Соликва не должен применяться у пациентов с сахарным диабетом 1-го типа или для лечения диабетического кетоацидоза.
Гипогликемия была нежелательной реакцией, о которой сообщалось чаще всего при лечении препаратом Соликва (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Гипогликемия может возникать, если доза Соликва выше, чем необходимо.
Факторы, которые повышают склонность к гипогликемии, требуют особенно тщательного мониторинга и могут приводить к необходимости коррекции дозы препарата. К таким факторам относятся следующие:
– изменение места инъекции;
– повышение чувствительности к инсулину (например при устранении стрессовых факторов);
– необычная, чрезмерная или длительная физическая нагрузка;
– сопутствующее заболевание (например сопровождающееся рвотой, диареей);
– неадекватный прием пищи;
– пропуск приема пищи;
– употребление алкоголя;
– некоторые некомпенсированные эндокринные расстройства (например гипотиреоз и недостаточность передней доли гипофиза или коры надпочечников);
– одновременное применение других лекарственных средств (см. ВЗАИМОДЕЙСТВИЯ);
– при применении ликсисенатида и/или инсулина в комбинации с препаратами сульфонилмочевины может повышаться риск возникновения гипогликемии, в связи с чем препарат Соликва не должен применяться в комбинации с препаратами сульфонилмочевины.
Дозу Соликва следует подбирать индивидуально с учетом клинического ответа, а ее титрование осуществляется в соответствии с потребностью пациента в инсулине (см. ПРИМЕНЕНИЕ).
Острый панкреатит. Применение агонистов рецепторов ГПП-1 ассоциируется с риском развития острого панкреатита. Сообщалось о небольшом количестве случаев острого панкреатита на фоне применения ликсисенатида, хотя наличие причинно-следственной связи с приемом препарата не установлено. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита, таких как постоянная сильная боль в животе. В случае подозрения на панкреатит применение препарата Соликва необходимо прекратить; если острый панкреатит подтверждается, ликсисенатид назначать больше нельзя. У пациентов с наличием панкреатита в анамнезе следует соблюдать осторожность при назначении препарата.
Тяжелое заболевание ЖКТ. Применение агонистов рецепторов ГПП-1 может быть ассоциировано с нежелательными реакциями со стороны ЖКТ. Применение препарата Соликва не исследовали у пациентов с тяжелыми желудочно-кишечными заболеваниями, включая тяжелый гастропарез, в связи с чем применение лекарственного средства Соликва у таких пациентов не рекомендуется.
Тяжелое нарушение функции почек. Терапевтический опыт применения препарата у пациентов с тяжелым нарушением функции почек (клиренс креатинина <30 мл/мин) и при терминальной стадии болезни почек отсутствует. Применение препарата у пациентов с тяжелым нарушением функции почек и при терминальной стадии болезни почек не рекомендуется (см. ПРИМЕНЕНИЕ и Фармакокинетика).
Одновременное применение других лекарственных средств. Замедление опорожнения желудка, обусловленное применением ликсисенатида, может снижать скорость абсорбции лекарственных средств, применяемых перорально. Препарат Соликва следует применять с осторожностью у пациентов, получающих лекарственные средства, для которых необходима быстрая абсорбция в ЖКТ, требующих тщательного клинического мониторинга или имеющих узкий терапевтический индекс. Конкретные рекомендации по приему таких лекарственных средств приведены в разделе ВЗАИМОДЕЙСТВИЯ.
Дегидратация. Пациентам, получающим препарат Соликва, необходимо сообщать о потенциальном риске дегидратации, связанном с побочными эффектами со стороны ЖКТ, и у таких пациентов должны приниматься меры для предотвращения гиповолемии.
Образование антител. Применение препарата Соликва может приводить к образованию антител к инсулину гларгину и/или ликсисенатиду. В редких случаях наличие таких антител может вызывать необходимость в коррекции дозы препарата Соликва с целью устранения склонности к развитию гипер- или гипогликемии.
Предотвращение ошибок в применении лекарственного средства. Пациенты должны быть проинструктированы о необходимости обязательной проверки маркировки шприц-ручки перед каждой инъекцией во избежание случайной путаницы между двумя различными дозировками препарата Соликва и с другими инъекционными гипогликемическими лекарственными средствами.
Во избежание ошибок в дозировке и потенциальной передозировки и пациенты, и медицинские работники никогда не должны использовать шприц для забора лекарственного средства из картриджа шприц-ручки.
Ситуации, в которых применение лекарственного средства не исследовалось. Применение препарата Соликва не исследовалось в комбинации с ингибиторами ДПП-4, препаратами сульфонилмочевины, глинидами и пиоглитазоном.
Вспомогательные вещества. Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на одну дозу, то есть можно считать, что оно практически не содержит натрия.
Это лекарственное средство содержит метакрезол, который может привести к аллергическим реакциям.
Применение в период беременности или кормления грудью. Препарат Соликва не рекомендуется применять женщинам репродуктивного возраста, которые не используют средства контрацепции.
Беременность. Не существует клинического опыта применения препарата Соликва у беременных. Не существует клинических данных, полученных в ходе контролируемых клинических исследований, по применению препарата Соликва, инсулина гларгина или ликсисенатида в период беременности. Большой объем данных по применению инсулина гларгина у беременных (более 1000 случаев беременности) указывает на то, что инсулин гларгин не вызывает специфических нежелательных воздействий на течение беременности, а также пороков развития у плода/новорожденного и не оказывает токсического воздействия на него. Исследования на лабораторных животных не выявили признаков влияния инсулина гларгина на репродуктивную систему.
Не существует надлежащих данных по применению ликсисенатида у беременных. Результаты исследований на животных свидетельствуют о наличии токсического воздействия ликсисенатида на репродуктивную систему (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА. Доклинические данные по безопасности).
Препарат Соликва не должен применяться в период беременности. Если пациентка планирует беременность или беременность уже наступила, применение препарата Соликва следует прекратить.
Кормление грудью. Неизвестно, экскретируются ли инсулин гларгин или ликсисенатид в грудное молоко у человека. Препарат Соликва не должен применяться во время кормления грудью.
Репродуктивная функция. Исследования на лабораторных животных не выявили непосредственного вредного влияния ликсисенатида или инсулина гларгина на репродуктивную функцию.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Препарат Соликва не вызывает или оказывает незначительное влияние на способность управлять транспортными средствами или работать с другими механизмами. Способность пациента к концентрации внимания и скорость его реакции могут нарушаться вследствие возникновения гипогликемии или гипергликемии или, например, вследствие зрительных расстройств. Это может быть опасным в ситуациях, когда эти качества особенно важны (например при управлении транспортным средством или работе с механизмами).
Пациентам необходимо посоветовать принимать необходимые меры предосторожности во избежание гипогликемии во время управления транспортным средством или работы с механизмами. Это особенно важно для тех пациентов, у которых первые признаки развития гипогликемии слабо выражены или вообще отсутствуют, а также для тех больных, у которых часто возникает гипогликемия. Необходимо тщательно взвешивать, стоит ли садиться за руль или работать с другими механизмами в таком состоянии.
Взаимодействия
каких-либо исследований с изучением взаимодействия лекарственного средства Соликва с другими лекарственными средствами не проводилось. Информация, приведенная ниже, основывается на результатах исследований, проведенных с отдельными компонентами препарата.
Фармакодинамические взаимодействия. Существует ряд веществ, которые влияют на метаболизм глюкозы, в связи с чем их применение может приводить к необходимости коррекции дозы лекарственного средства Соликва.
К веществам, которые могут усиливать гипогликемический эффект и повышать склонность к гипогликемии, относятся противодиабетические лекарственные средства, ингибиторы АПФ, дизопирамид, фибраты, флуоксетин, ингибиторы МАО, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные антибиотики.
К веществам, которые могут ослаблять гипогликемический эффект, относятся кортикостероиды, даназол, диазоксид, диуретики, глюкагон, изониазид, эстрогены и прогестины, производные фенотиазина, соматропин, симпатомиметики (например эпинефрин, сальбутамол, тербуталин), гормоны щитовидной железы, атипичные антипсихотические лекарственные средства (например клозапин и оланзапин) и ингибиторы протеаз.
Блокаторы β-адренорецепторов, клонидин, соли лития или алкоголь могут как усиливать, так и ослаблять гипогликемическое действие инсулина. Пентамидин может вызывать гипогликемию, после которой иногда может развиться гипергликемия.
Кроме того, под действием симпатолитических средств, таких как блокаторы β-адренорецепторов, клонидин, гуанетидин и резерпин, признаки адренергической контррегуляции могут ослабляться или совсем исчезать.
Фармакокинетические взаимодействия. Ликсисенатид является пептидом и не метаболизируется с участием цитохрома Р450. По результатам исследований в условиях in vitro ликсисенатид не влиял на активность исследуемых изоферментов цитохрома Р450 и транспортеров человека.
О каких-либо фармакокинетических взаимодействиях инсулина гларгина неизвестно.
Влияние опорожнения желудка на пероральные лекарственные средства. Замедление опорожнения желудка, обусловленное применением ликсисенатида, может снижать скорость абсорбции лекарственных средств, применяемых перорально. За состоянием пациентов, получающих лекарственные средства, имеющие узкий терапевтический индекс или требующие тщательного клинического мониторинга, должен осуществляться тщательный надзор, особенно в начале лечения ликсисенатидом. Эти лекарственные средства следует принимать в стандартизированном порядке относительно приема ликсисенатида. Если такие лекарственные средства необходимо принимать с пищей, то пациентам нужно рекомендовать по возможности принимать их с тем приемом пищи, когда не вводится ликсисенатид.
Что касается пероральных лекарственных средств, эффективность которых особенно зависит от пороговых концентраций, например антибиотиков, то пациентам нужно рекомендовать принимать такие лекарственные средства менее чем за 1 ч до или через 4 ч после инъекции ликсисенатида.
Кишечно-растворимые лекарственные формы, содержащие вещества, чувствительные к расщеплению в желудке, необходимо принимать за 1 ч до или через 4 ч после инъекции ликсисенатида.
Парацетамол использовался в качестве модели лекарственного средства для оценки влияния ликсисенатида на опорожнение желудка. После однократного приема парацетамола в дозе 1000 мг AUC и Т½ парацетамола оставались неизмененными, независимо от времени приема препарата (до или после инъекции ликсисенатида). При применении препарата через 1 ч или через 4 ч после введения 10 мкг ликсисенатида Сmax парацетамола снижалась на 29 и 31% соответственно, а медиана Тmax увеличивалась на 2,0 и 1,75 ч соответственно. Прогнозируется, что при введении ликсисенатида в поддерживающей дозе 20 мкг будет отмечаться еще большее увеличение Тmax и снижение Сmax парацетамола. При приеме парацетамола за 1 ч до введения ликсисенатида Сmax и Тmax парацетамола не изменялись.
Учитывая приведенные результаты, необходимость в коррекции дозы парацетамола отсутствует, но удлинение Тmax, которое отмечали, когда парацетамол принимали через 1–4 ч после введения ликсисенатида, следует учитывать в случае, когда для эффективности необходимо быстрое начало действия.
Пероральные контрацептивы. Однократный прием перорального контрацептива (этинилэстрадиола 0,03 мг/левоноргестрела 0,15 мг) за 1 ч до или через 11 ч после введения 10 мкг ликсисенатида не оказывал влияние на Сmax, AUC, Т½ и Тmax этинилэстрадиола и левоноргестрела.
Прием перорального контрацептива через 1 ч или через 4 ч после введения ликсисенатида не влиял на AUC и Т½ этинилэстрадиола и левоноргестрела, хотя Сmax этинилэстрадиола снижалась на 52 и 39% соответственно, Сmax левоноргестрела снижалась на 46 и 20% соответственно, а медиана Тmax увеличивалась на 1–3 ч. Такое снижение Сmax имеет ограниченную клиническую значимость и необходимость в коррекции дозы пероральных контрацептивов отсутствует.
Аторвастатин. При одновременном применении ликсисенатида в дозе 20 мкг и аторвастатина в дозе 40 мг, которые принимали утром в течение 6 дней, экспозиция аторвастатина не менялась, в то время как Сmax снижалась на 31%, a Тmax продлевался на 3,25 ч.
Такого повышения Сmax не выявлено в случае, когда аторвастатин принимали вечером, а ликсисенатид вводился утром, но AUC и Сmax аторвастатина при этом увеличивались на 27 и 66% соответственно.
Эти изменения не являются клинически значимыми, поэтому необходимости в коррекции дозы аторвастатина при одновременном применении с ликсисенатидом нет.
Варфарин и другие производные кумарина. При одновременном применении варфарина в дозе 25 мг и многократном введении ликсисенатида в дозе 20 мкг не отмечалось какого-либо влияния на AUC или международное нормализованное отношение, в то время как Сmax снижалась на 19%, a Тmax продлевался на 7 ч.
Учитывая эти данные, необходимости в коррекции дозы варфарина при его одновременном применении с ликсисенатидом не существует; однако в начале и при завершении лечения ликсисенатидом у пациентов, принимающих варфарин и/или другие производные кумарина, рекомендуется осуществлять частый мониторинг международного нормализованного отношения.
Дигоксин. При одновременном применении ликсисенатида в дозе 20 мкг и дигоксина в дозе 0,25 мг в равновесном состоянии AUC дигоксина не изменялась. При этом Тmax дигоксина увеличился на 1,5 ч, а Сmax снизилась на 26%.
Учитывая эти данные, необходимости в коррекции дозы дигоксина при одновременном применении с ликсисенатидом нет.
Рамиприл. При одновременном применении ликсисенатида в дозе 20 мкг и рамиприла в дозе 5 мг в течение 6 дней AUC рамиприла увеличилась на 21%, в то время как Сmax снизилась на 63%. При этом AUC и Сmax активного метаболита (рамиприлата) не менялись. Значение Сmax рамиприла и рамиприлата увеличилось примерно на 2,5 ч.
Учитывая эти данные, необходимости в коррекции дозы рамиприла при одновременном применении с ликсисенатидом нет.
Несовместимость. Это лекарственное средство нельзя смешивать с любым другим инсулином или разводить.
Передозировка
в случае введения более высокой, чем необходимо, дозы препарата Соликва могут возникнуть нежелательные реакции в виде гипогликемии и расстройств со стороны ЖКТ. Эпизоды гипогликемии легкой степени, как правило, могут быть устранены пероральным приемом углеводов. Может возникнуть необходимость в коррекции дозы лекарственного средства и внесении изменений в режим питания или физической активности.
Более тяжелые эпизоды гипогликемии, сопровождающиеся комой, судорогами или неврологическими нарушениями, нуждаются во в/м или п/к введении глюкагона или в/в введении концентрированного р-ра глюкозы. Поскольку гипогликемия может возникнуть повторно даже после очевидного улучшения клинического состояния пациента, необходимыми мерами могут быть длительный прием углеводов и наблюдение за состоянием пациента.
В случае нежелательных реакций со стороны ЖКТ должна быть начата соответствующая поддерживающая терапия в соответствии с клиническими признаками и симптомами, выявленными у пациента.
Условия хранения
шприц-ручки, которые не находятся в использовании. Хранить в холодильнике (при температуре 2–8 °С). Не замораживать и не допускать контакта с морозильным отделением или накопителями холода.
Хранить шприц-ручку во внешней картонной упаковке для защиты от света.
Шприц-ручки после первого использования. Срок годности после первого использования шприц-ручки — 28 дней.
Хранить при температуре ниже 25 °С. Не замораживать. Не охлаждать. Не хранить с прикрепленной иглой. Хранить шприц-ручку в месте, защищенном от источников прямого тепла и света. После каждой инъекции на шприц-ручку следует снова надевать колпачок для защиты от света.