Форма випуску
Склад i формула
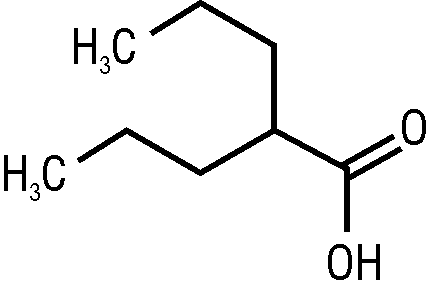
MESH, USPDDN: 2-пропілпентанова кислота.
Фармакологічні властивості
виявляє протисудомну дію при різних видах судом та епілепсії; існують два механізми протисудомної дії препарату: перший - прямий фармакологічний ефект, пов’язаний з концентрацією вальпроату в плазмі та головному мозку; другий - непрямий, пов’язаний з метаболітами вальпроату, які залишаються в мозку, з модифікаціями нейромедіаторів, прямою дією на мембрану, після введення вальпроату підвищується рівень ГАМК; знижує тривалість проміжної фази сну та одночасно збільшує фазу повільно- хвильового сну.
Показання
первинна генералізована епілепсія: малі епілептичні напади/абсансна епілепсія, масивні білатеральні міоклонічні судоми, великі напади епілепсії з міоклонією або без неї, доброякісна парціальна епілепсія, зокрема роландична епілепсія, фотосенситивні форми епілепсії; як монотерапія або в комбінації з іншими протиепілептичними засобами при: вторинній генералізованій епілепсіії, особливо с-м Веста (судоми у дітей раннього віку) та с-м Леннокса-Гасто; парціальній епілепсії, з простою або комплексною симптоматикою (психосенсорні форми, психомоторні форми); епілепсії, із вторинною генералізацією; змішаних формах епілепсії, (генералізованих та парціальних). Лікування епізодів манії, асоційованих з біполярними афективними розладами, при наявності протипоказань до застосування або непереносимості літію. Профілактика рецидивів дистимічних епізодів у дорослих пацієнтів з біполярними розладами, у яких при лікуванні епізодів манії є терапевтична відповідь на терапію вальпроатом.
Застосування
епілепсія: монотерапія першої лінії- добові дози 25 мг/кг для дітей; 20-25 мг/кг для підлітків; 20 мг/кг для дорослих; 15-20 мг/кг для осіб літнього віку; початкова добова доза 10-15 мг/кг, її підвищувати з інтервалом 2-3 дні, досягаючи рекомендованої добової дози ч/з тижд.; буває необхідним застосування добових доз, вищих за 25 мг/кг для осіб літнього віку, 30 мг/кг для дорослих або підлітків чи 25 мг/кг для дітей, якщо ці дози все ще не дозволяють досягти контролю судом, можна продовжувати підвищувати дози; якщо добова доза перевищує 50 мг/кг, розділяти її на 3 прийоми, необхідні додаткові клінічне спостереження і контроль показників біохімічного аналізу крові; у комбінації з іншими протиепілептичними засобами: розпочинати застосування таким самим чином, як і при монотерапії першої лінії; середня добова доза ідентична дозі для монотерапії, у деяких випадках ця доза може бути збільшена на 5-10 мг/кг; епізоди манії у пацієнтів з біполярними розладами: у дорослих рекомендована початкова доза 20 мг/кг/добу, її необхідно швидше збільшувати, доки не буде досягнута мінімальна терапевтична доза, яка дозволяє досягти бажаного клінічного ефекту, який досягається при концентрації вальпроату у плазмі крові від 45 до 125 мкг/мл; рекомендована підтримуюча доза при лікуванні біполярного розладу 1000-2000 мг/добу, рідко доза може бути збільшена до МДД - 3000 мг/добу; профілактика рецидивів епізодів манії, якими супроводжуються біполярні розлади: доза відповідає найменшій ефективній дозі, яка дозволяє належним чином контролювати симптоми г. манії у даного пацієнта; МДД 3000 мг; добову дозу сиропу розділяють на 2 прийоми - для дітей до 1 р., на 3 прийоми - для дітей від 1 р.; середня добова доза: немовлята та діти до 12 р.: 30 мг/кг маси тіла; діти (від 12 р.) та дорослі: 20-30 мг/кг маси тіла; дітям до 3 р. винятково у вигляді монотерапії, якщо очікувана користь від лікування переважає ризик розвитку захворювання печінки та панкреатиту у пацієнтів цієї вікової групи; оптимальної дози для пацієнта, який вже застосовує протиепілептичні засоби, досягати поступово, протягом 2 тижн., потім зменшувати дозу іншого протиепілептичного засобу; для пацієнта, який не застосовує інші протиепілептичні препарати, дозу збільшувати поступово кожні 2-3 дні, щоб досягти оптимальної дози приблизно протягом тижня; у разі необхідності комбінованого лікування з іншими протиепілептичними препаратами їх додавати поступово; у разі неможливості прийому p/os через 4-6 год. після останнього прийому табл. рекомендоване в/в введення у вигляді безперервної інфузії добової дози протягом 24 год або розділивши добову дозу на 4 інфузії, тривалістю 1 год кожна (доза зазвичай становить 20-30 мг/кг/добу); при необхідності швидкого досягнення і підтримання ефективної концентрації у плазмі: в/в ін’єкція протягом 5 хв у дозі 15 мг/кг болюсно; потім - постійна інфузія зі швидкістю 1 мг/кг/год з поступовим коригуванням швидкості введення для забезпечення рівня вальпроату в крові приблизно 75 мг/л, потім швидкість введення змінюють залежно від клінічного перебігу.
Протипоказання
гіперчутливість до вальпроату, дивальпроату, вальпроміду або до будь- якого з компонентів препарату в анамнезі; г. гепатит і хр. гепатит, випадки тяжкого гепатиту в індивідуальному або сімейному анамнезі пацієнта, особливо спричинені ЛЗ, печінкова порфірія; комбінація з мефлохіном і екстрактом звіробою; пацієнти з відомими мітохондріальними розладами, спричиненими мутаціями в ядерному гені, що кодує мітохондріальний фермент полімеразу гамма, наприклад із с-мом Альперса-Гуттенлохера, дітям віком до двох років, у яких підозрюється наявність розладу, пов’язаного з полімеразою гамма, а також пацієнтам з порушенням орнітинового циклу в анамнезі; для сиропу p/os.: непереносимість фруктози, с-м мальабсорбції глюкози та галактози, дефіцит сахарозо-ізомальтази (через наявність у складі препарату сахарози та сорбітолу).
Побічна дія
анемія, тромбоцитопенія; панцитопенія, лейкопенія; ураження кісткового мозку, включаючи істинну еритроцитарну аплазію, агранулоцитоз; макроцитарна анемія, макроцитоз; зменшення рівнів фібриногену або збільшення тривалості часу кровотечі; аплазія червоного кісткового мозку або істинна еритроцитарна аплазія; зменшення кількості тромбоцитів у крові до 10 000-30 000/мм3; зниження рівня факторів коагуляції (щонайменше одного), патологічні результати тестів на коагуляцію, дефіцит біотину/ дефіцит біотинідази; підвищення апетиту, збільшення маси тіла; гіпонатріємія; гіперамоніємія, стан сплутаності свідомості, галюцинації, агресія, збудження, порушення уваги; анормальна поведінка, психомоторна гіперактивність, труднощі з навчанням; тремор; екстрапірамідні розлади, ступор, сонливість, судоми, погіршення пам’яті, головний біль, ністагм, запаморочення після в/в ін’єкції; кома, енцефалопатія, летаргія, оборотний паркінсонізм, атаксія, парестезія, дрібноамплітудний постуральний тремор, оборотна деменція, пов’язана з оборотною мозковою атрофією, когнітивний розлад; глухота; кровотеча, васкуліт; нудота; блювання, захворювання ясен, стоматит, біль у верхній частині живота, діарея, панкреатит, іноді летальний; ураження печінки; гіперчутливість, транзиторна та/або дозозалежна алопеція; ангіоневротичний набряк, висипання, проблеми з волоссям; токсичний епідермальний некроліз, с-м Стівенса-Джонсона, мультиформна еритема, с-м лікарської гіперчутливості з еозинофілією і системними симптомами (DRESS); екзантематозні висипання; НН, ураження нирок; енурез, нетримання сечі, тубулоінтерстиціальний нефрит, оборотний с-м Фанконі, дисменорея; аменорея; чоловіче безпліддя, полікістоз яєчників; гінекомастія; плевральний випіт; с-м неадекватної секреції АДГ (СНС АДГ), гіперандрогенія (гірсутизм, вірилізм, акне, облисіння у чоловіків та/або збільшення андрогену); гіпотиреоз; мієлодисплатичний с-м; зменшення мінеральної щільності кісткової тканини, остеопенія, остеопороз і переломи; СЧВ, рамбдоміоліз; гіпотермія; нетяжкі периферичні набряки; дезорієнтація.