Фазлодекс (Faslodex)
Фазлодекс інструкція із застосування
Склад
Фулвестрант - 50 мг/мл
Фармакологічні властивості
Фармакодинаміка.
Механізм дії та фармакодинамічні ефекти.
Фулвестрант є конкурентним антагоністом естрогенових рецепторів (ЕР), спорідненість до яких порівнянна з естрадіолом. Фулвестрант блокує трофічну дію естрогенів, не проявляючи часткової агоністичної (естрогеноподібної) активності. Механізм дії пов’язаний із негативною регуляцією рівнів білків ЕР. Клінічні дослідження за участю жінок у постменопаузальний період з первинним раком молочної залози показали, що фулвестрант порівняно з плацебо значно знижує рівень білків ЕР при пухлинах із позитивними ЕР. Спостерігалося також значне зменшення експресії прогестеронових рецепторів, що узгоджується з відсутністю характерних агоністам естрогенів ефектів. Також показано, що фулвестрант у дозі 500 мг більшою мірою, ніж фулвестрант у дозі 250 мг, пригнічує ЕР і маркер проліферації Ki67 у пухлинах молочної залози при неоад’ювантному лікуванні жінок у постменопаузі.
Клінічна безпека та ефективність застосування препарату на пізніх стадіях раку молочної залози.
Монотерапія.
Клінічне дослідження ІІІ фази було проведено за участю 736 жінок у період постменопаузи з поширеним раком молочної залози, у яких відмічали рецидив захворювання на тлі чи після ад’ювантної ендокринної терапії або прогресування після ендокринної терапії з приводу поширеного захворювання. У дослідженні брали участь 423 пацієнтки, у яких хвороба прогресувала або відзначався рецидив на тлі антиестрогенної терапії (підгрупа АЕ), і 313 пацієнток, у яких хвороба прогресувала або рецидивувала на тлі лікування інгібітором ароматази (підгрупа АІ). Це дослідження порівнювало ефективність та безпеку застосування Фазлодексу в дозі 500 мг (n=362) з Фазлодексом у дозі 250 мг (n=374). Головною кінцевою точкою була виживаність без прогресування захворювання (ВБП); ключові вторинні кінцеві точки ефективності включали частоту об’єктивної відповіді (ЧОВ), частоту клінічної ефективності (ЧКЕ) і загальну виживаність (ЗВ). Результати ефективності для дослідження CONFIRM узагальнено нижче у табл. 1.
Таблиця 1. Узагальнення результатів аналізу головної кінцевої точки ефективності (ВБП) і ключових вторинних кінцевих точок ефективності у дослідженні CONFIRM
| Перемінна | Тип оцінки; порівняння лікування | Фазлодекс 500 мг (n=362) | Фазлодекс 250 мг (n=374) | Порівняння між групами (Фазлодекс 500 мг/Фазлодекс 250 мг) | ||
| ВР | 95% ДІ | p-значення | ||||
| ВБП | K–M медіана у місяцях; ВР | |||||
| Усі пацієнти | 6,5 | 5,5 | 0,80 | 0,68, 0,94 | 0,006 | |
| Підгрупа AE (n=423) | 8,6 | 5,8 | 0,76 | 0,62, 0,94 | 0,013 | |
| Підгрупа AI (n=313)a | 5,4 | 4,1 | 0,85 | 0,67, 1,08 | 0,195 | |
| ЗВb | K-M медіана у місяцях; ВР | |||||
| Усі пацієнти | 26,4 | 22,3 | 0,81 | 0,69, 0,96 | 0,016c | |
| Підгрупа AE (n=423) | 30,6 | 23,9 | 0,79 | 0,63, 0,99 | 0,038c | |
| Підгрупа AI (n=313)a | 24,1 | 20,8 | 0,86 | 0,67, 1,11 | 0,241c | |
| Перемінна | Тип оцінки; порівняння лікування | Фазлодекс 500 мг (n=362) | Фазлодекс 250 мг (n=374) | Порівняння між групами (Фазлодекс 500 мг/Фазлодекс 250 мг) | ||
| Абсолютна різниця у % | 95% ДІ | |||||
| ЧОВd | % пацієнтів з ОВ; абсолютна різниця у % | |||||
| Усі пацієнти | 13,8 | 14,6 | –0,8 | –5,8, 6,3 | ||
| Підгрупа AE (n=296) | 18,1 | 19,1 | –1,0 | 8,2, –9,3 | ||
| Підгрупа AI (n=205)a | 7,3 | 8,3 | –1,0 | –5,5, 9,8 | ||
| ЧКЕe | % пацієнтів з КЕ; абсолютна різниця у % | |||||
| Усі пацієнти | 45,6 | 39,6 | 6,0 | –1,1, 13,3 | ||
| Підгрупа AE (n=423) | 52,4 | 45,1 | 7,3 | –2,2, 16,6 | ||
| Підгрупа AI (n=313)a | 36,2 | 32,3 | 3,9 | –6,1, 15,2 | ||
аФазлодекс показаний пацієнткам, чия хвороба рецедивувала чи прогресувала на тлі антиестрогенної терапії. Результати у підгрупі АІ неостаточні.
bЗначення ЗВ представлене для остаточного аналізу виживаності при 75% обробці даних.
сНомінальне р-значення без будь-яких коригувань, зроблених для повторюваності між первинними аналізами ЗВ при 50% обробці та оновленими аналізами виживаності при 75% обробці даних.
dЧОВ була проаналізована у пацієнток, відповідь яких оцінювалася на вихідному рівні (тобто вони мали прояви захворювання, які можна було оцінити на вихідному рівні: 240 пацієнток у групі застосування Фазлодексу в дозі 500 мг і 261 пацієнтка у групі застосування Фазлодексу в дозі 250 мг).
eПацієнти із кращою об’єктивною відповіддю у вигляді повної відповіді, частковою відповіддю або стабілізацією захворювання впродовж ≥24 тиж.
ВБП — виживаність без прогресування захворювання; ВР — відношення ризиків; ОВ — об’єктивна відповідь; КЕ — клінічна ефективність; К–М: Каплан — Мейєр; ДІ — довірчий інтервал; AI — інгібітор ароматази; АЕ — антиестроген.
Було проведено рандомізоване подвійне сліпе з подвійним маскуванням мультицентрове дослідження фази 3 з вивчення ефективності Фазлодексу 500 мг порівняно з анастрозолом 1 мг у жінок у постменопаузальний період з місцево-поширеним або метастатичним раком молочної залози з позитивними естроген- і/або прогестерон-рецепторами, які раніше не отримували гормонотерапії. Загалом 462 пацієнтки були послідовно рандомізовані 1:1 у групу фулвестранту 500 мг або анастрозолу 1 мг.
Рандомізація була стратифікована за ознаками захворювання (місцево-поширений або метастатичний рак), попередньо проведеною хіміотерапією у разі поширеного захворювання та клінічними проявами захворювання.
Первинною кінцевою точкою ефективності була ВБП, за оцінкою дослідника відповідно до RESIST1.1 (Response Evaluation Criteria in Solid Tumors). Ключовими вторинними точками ефективності були прийняті ЗВ та ЧОВ.
Медіана віку пацієнток, залучених у це дослідження, становила 63 роки (у діапазоні від 39 до 90 років). У більшості (87,0%) пацієнток спостерігалася метастатична форма захворювання на початку дослідження. У 55% пацієнток виявляли метастази у внутрішніх органах на початку дослідження. Загалом 17,1% пацієнток отримували хіміотерапію раніше у зв’язку з поширеним захворюванням; 84,2% пацієнток мали вимірювані прояви захворювання.
Достовірні результати спостерігалися у більшості пацієнток з попередньо визначених підгруп. У підгрупі пацієнток із метастазами не у внутрішніх органах (n=208), які отримували Фазлодекс, ВР становило 0,592 (95% ДІ 0,419–0,837) порівняно з пацієнтками, які отримували анастрозол. У підгрупі пацієнток із метастазами у внутрішні органи (n=254), які отримували Фазлодекс 500 мг, ВР становив 0,993 (95% ДІ 0,740–1,331), порівняно з пацієнтками, які отримували анастрозол. Результати ефективності дослідження FALCON наведені в табл. 2 та на графіку.
Таблиця 2. Узагальнення результатів аналізу первинної кінцевої точки ефективності (ВБП) і ключових вторинних кінцевих точок ефективності у дослідженні FALCON (оцінювання дослідником, вибірка «усі рандомізовані пацієнти відповідно до призначеного лікування»)
| Показник | Фазлодекс 500 мг (n=230) | Анастрозол 1 мг (n=232) |
| ВБП | ||
| Кількість випадків ВБП (%) | 143 (62,2%) | 166 (71,6%) |
| ВБП ВР (95% ДІ) та р-значення | ВР 0,797 (0,637–0,999) р=0,0486 | |
| Медіана ВБП (місяць (95% ДІ)) | 16,6 (13,8–21,0) | 13,8 (12,0– 16,6) |
| Кількість випадків ЗВ* | 67 (29,1%) | 75 (32,3%) |
| ЗВ ВР (95% ДІ) та р-значення | ВР 0,875 (0,629–1,217) р=0,4277 | |
| ЧОВ** | 89 (46,1%) | 88 (44,9%) |
| ЧОВ ВШ (95% ДІ) та р-значення | ВШ 1,074 (0,716–1,614) р=0,7290 | |
| Медіана тривалості відповіді (міс) | 20,0 | 13,2 |
| ЧКЕ | 180 (78,3%) | 172 (74,1%) |
| ЧКЕ ВШ (95% ДІ) та p-значення | ВШ 1,253 (0,815–1,932) р=0,3045 | |
ВШ — відношення шансів.
*(31% обробка) — не фінальний аналіз ЗВ.
**Для пацієнток із вимірюваними проявами хвороби.
Графік 1. Крива ВБП за Капланом — Мейєром (оцінка дослідника, вибірка «усі рандомізовані пацієнти відповідно до призначеного лікування») — дослідження FALCON.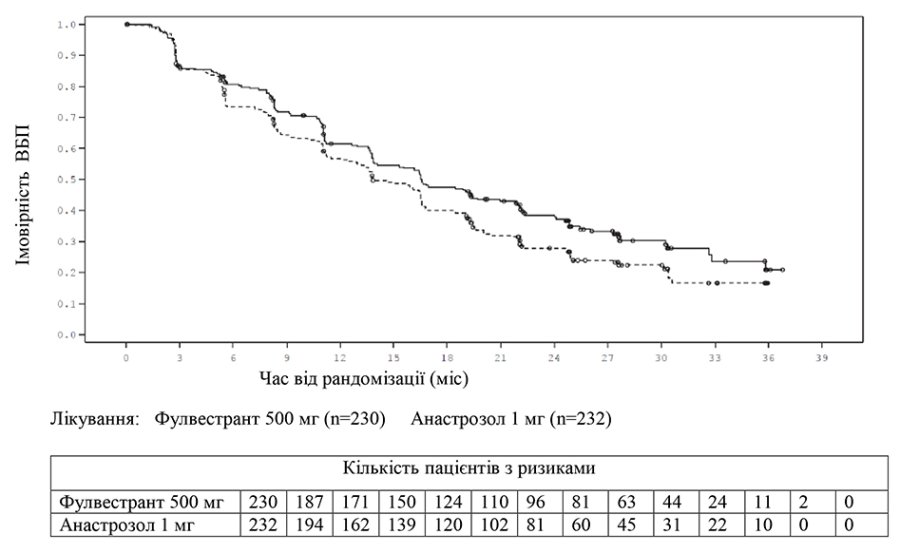
Два клінічні дослідження ІІІ фази 3 проведені в цілому за участю 851 жінки у період постменопаузи з пізніми стадіями раку молочної залози, у яких відмічали рецидив захворювання на тлі чи після ад’ювантної гормональної терапії або прогресування після гормональної терапії з приводу пізніх стадій захворювання. 77% популяції дослідження хворіли на рак молочної залози з позитивними естрогеновими рецепторами. У цих дослідженнях порівнювали безпеку та ефективність щомісячного введення лікарського засобу Фазлодекс у дозі 250 мг зі щоденним введенням 1 мг анастрозолу (інгібітора ароматази). Загалом Фазлодекс у щомісячній дозі 250 мг був принаймні настільки ж ефективним, як анастрозол, у значенні виживаності без прогресування захворювання, об’єктивної відповіді і часу до смерті. Між двома групами лікування не було статистично значущої різниці за жодною із цих кінцевих точок. Головною кінцевою точкою була виживаність без прогресування захворювання. Об’єднаний аналіз обох досліджень показав, що прогресування спостерігалося у 83% пацієнток, які отримували Фазлодекс, порівняно з 85% жінок, які отримували анастрозол. Об’єднаний аналіз обох досліджень виявив, що ВР для лікарського засобу Фазлодекс у дозі 250 мг та анастрозолу щодо параметра виживаності без прогресування захворювання становило 0,95 (95% ДІ 0,82–1,10). Рівень об’єктивної відповіді для лікарського засобу Фазлодекс у дозі 250 мг становив 19,2% порівняно з 16,5% для анастрозолу. Медіана часу до смерті становила 27,4 міс для пацієнток, які отримували Фазлодекс, і 27,6 міс для жінок, які отримували анастрозол. ВР лікарського засобу Фазлодекс у дозі 250 мг та анастрозолу щодо часу до смерті становило 1,01 (95% ДІ 0,86–1,19).
Комбінована терапія з палбоциклібом.
Міжнародне рандомізоване подвійне сліпе мультицентрове дослідження ІІІ фази в паралельних групах для вивчення застосування лікарського засобу Фазлодекс 500 мг з палбоциклібом 125 мг порівняно із застосуванням лікарського засобу Фазлодекс 500 мг з плацебо проводилося за участю жінок із гормон-рецептор-позитивним (HR-позитивним), негативним за рецептором епідермального фактора росту людини 2 (HER2) місцевопоширеним раком молочної залози, який не піддається резекції або променевій терапії з лікувальною метою, незалежно від статусу менопаузи, у яких захворювання прогресувало після раніше проведеної ендокринної терапії у складі (нео)ад’ювантної терапії або при метастазах.
Загалом 521 жінку в період пре-/пери- та постменопаузи з прогресуванням захворювання протягом 12 міс або після завершення ад’ювантної ендокринної терапії, або протягом 1 міс чи після завершення попередньої ендокринної терапії поширеного захворювання було рандомізовано у співвідношенні 2:1 до групи застосування лікарського засобу Фазлодекс з палбоциклібом або лікарського засобу Фазлодекс з плацебо та стратифіковано за задокументованою чутливістю до попередньої гормональної терапії, статусом менопаузи на момент включення у дослідження (в період пре-/пери- або постменопаузи) та наявністю метастазів у внутрішні органи. Жінки в період пре-/перименопаузи отримували агоніст лютеїнізуючого гормону релізинг-гормону (ЛГРГ) гозерелін. Пацієнти з поширеним/метастатичним, симптоматичним, вісцеральним захворюванням із ризиком небезпечних для життя ускладнень у короткостроковій перспективі (включно з пацієнтками з масивним неконтрольованим випотом (плевральним, перикардіальним, перитонеальним), легеневим лімфангітом і ураженням печінки понад 50%) не могли бути залучені в дослідження.
Пацієнтки продовжували отримувати призначене лікування до об’єктивного прогресування захворювання, збільшення вираженості симптомів, неприйнятної токсичності, смерті або відкликання згоди на участь у дослідженні. Перехресна зміна лікування в групах не дозволялася.
Пацієнтки були ретельно розподілені за початковими демографічними і прогностичними характеристиками у групи Фазлодекс плюс палбоцикліб та групу Фазлодекс плюс плацебо. Медіана віку включених у дослідження пацієнток становила 57 років (діапазон 29; 88). У кожній групі лікування більшість учасниць дослідження належали до європеоїдної раси, мали зареєстровану чутливість до попередньої гормональної терапії та були в періоді постменопаузи. Приблизно 20% пацієнток були в періоді пре-/перименопаузи. Усі пацієнтки попередньо отримували системну терапію, і більшість учасниць кожної групи лікування попередньо отримували хіміотерапію з приводу первинного діагнозу. Більш ніж половина пацієнток (62%) мали функціональний статус за ECOG PS 0, у 60% пацієнток відмічали метастази у внутрішні органи і 60% учасниць отримали більше 1 попередньої гормональної терапії з приводу первинного діагнозу.
Первинною кінцевою точкою дослідження була виживаність без прогресування захворювання, визначеного за критеріями RECIST 1.1, за оцінкою дослідника. Додаткові аналізи ВБП було визначено на підставі оцінки незалежної центральної радіологічної експертизи. Вторинні кінцеві точки включали ОВ, ЧКЕ, ЗВ, безпеку та час до збільшення вираженості симптомів (TTD) за кінцевою точкою інтенсивності болю.
Дослідження досягло своєї основної кінцевої точки — тривалої ВБП за оцінками дослідника при проміжному аналізі 82% запланованих даних ВБП; результати були вищими заздалегідь визначеної межі ефективності Хейбіттла — Пето (α=0,00135), демонструючи статистично значуще подовження ВБП і клінічно значущий ефект лікування. Медіана виживаності без прогресування захворювання при застосуванні комбінації Фазлодекс плюс палбоцикліб та комбінації Фазлодекс плюс плацебо становила 11,2 міс та 4,6 міс відповідно. Більш докладну інформацію щодо ефективності наведено у табл. 3.
Після середнього періоду подальшого спостереження тривалістю 45 міс було проведено заключний аналіз ЗВ на основі 310 небажаних явищ (60% від рандомізованих пацієнтів). Виявлено різницю в середній ЗВ тривалістю 6,9 міс у групі застосування палбоциклібу з фулвестрантом у порівнянні з плацебо з фулвестрантом; цей результат не був статистично достовірним на заданому рівні значущості 0,0235 (односторонній). У групі застосування плацебо з фулвестрантом 15,5% з рандомізованих пацієнтів отримували палбоцикліб та інші інгібітори циклінзалежної кінази як наступні курси лікування після прогресування захворювання.
Результати аналізів ВБП та дані заключної ЗВ, оцінені дослідником у дослідженні PALOMA3, представлено в табл. 3.
Таблиця 3. Результати щодо ефективності, дослідження PALOMA3 (за оцінкою дослідника, вибірка пацієнтів «усі рандомізовані пацієнти відповідно до призначеного лікування»)
| Показники | Оновлений аналіз (дата закінчення збору даних — 23 жовтня 2015 р.) | |
| Фазлодекс плюс палбоцикліб (N=347) | Фазлодекс плюс плацебо (N=174) | |
| Виживаність без прогресування | ||
| Медіана, міс (95% ДІ) | 11,2 (9,5; 12,9) | 4,6 (3,5; 5,6) |
| ВР (95% ДІ) і р-значення | 0,497 (0,398; 0,620), p<0,000001 | |
| Вторинні кінцеві точки ефективності* | ||
| ОВ, % (95% ДІ) | 26,2 (21,7; 31,2) | 13,8 (9,0; 19,8) |
| ОВ (прояви захворювання, які піддаються вимірюванню), % (95% ДІ) | 33,7 (28,1; 39,7) | 17,4 (11,5; 24,8) |
| ЧКЕ, % (95% ДІ) | 68,0 (62,8; 72,9) | 39,7 (32,3; 47,3) |
| Заключна ЗВ (дата завершення збору даних — 13 квітня 2018) | ||
| Число подій, % | 201 (57,9) | 109 (62,6) |
| Медіана, міс (95% ДІ) | 34,9 (28,8–40,0) | 28,0 (23,6–34,6) |
| ВР (95% ДІ) і р-значення† | 0,814 (0,644–1,029) p=0,0429†* | |
Результати вторинних кінцевих точок базуються на підтверджених та непідтверджених відповідях згідно з критеріями RECIST 1.1.
*Статистично недостовірно.
†Односторонні р-значення, стратифіковані згідно з лог-ранговим критерієм за наявністю вісцеральних метастазів та чутливістю до попередньої ендокринної терапії на момент рандомізації.
Зниження ризику прогресування захворювання або смерті на користь групи застосування Фазлодекс плюс палбоцикліб спостерігалося в усіх окремих підгрупах пацієнток, визначених за показниками стратифікації й початковими характеристиками. Ефект був показовим у жінок у пре-/перименопаузі (ВР 0,46; 95% ДІ 0,28–0,75) та жінок у постменопаузі (ВР 0,52; 95% ДІ 0,40–0,66), а також у пацієнток з метастазами у внутрішні органи (ВР 0,50; 95% ДІ 0,38–0,65) та пацієнток без метастазів у внутрішні органи (ВР 0,48; 95% ДІ 0,33–0,71). Користь також спостерігалася незалежно від ліній попередньої терапії за наявності метастазів, при 0 (ВР 0,59; 95% ДІ 0,37–0,93), 1 (ВР 0,46; 95% ДІ 0,32–0,64), 2 (ВР 0,48; 95% ДІ 0,30–0,76) або ≥3 ліній (ВР 0,59; 95% ДІ 0,28–1,22). Додаткові показники ефективності (ОВ і час до першої відповіді пухлини (ЧПВ)), які оцінювали в підгрупах пацієнтів із вісцеральним захворюванням або без нього, показано у табл. 4.
Таблиця 4. Результати дослідження PALOMA3 щодо ефективності при вісцеральному та невісцеральному захворюванні (вибірка «усі рандомізовані пацієнти відповідно до призначеного лікування»)
| Показники | Вісцеральне захворювання | Невісцеральне захворювання | ||
| Фазлодекс плюс палбоцикліб (N=206) | Фазлодекс плюс плацебо (N=105) | Фазлодекс плюс палбоцикліб (N=141) | Фазлодекс плюс плацебо (N=69) | |
| ОВ, % (95% ДІ) | 35,0 (28,5; 41,9) | 13,3 (7,5; 21,4) | 13,5 (8,3; 20,2) | 14,5 (7,2; 25,0) |
| ЧПВ*, медіана, міс (діапазон) | 3,8 (3,5; 16,7) | 5,4 (3,5; 16,7) | 3,7 (1,9; 13,7) | 3,6 (3,4; 3,7) |
*Результати відповідей на підставі підтверджених і непідтверджених відповідей.
Було зібрано інформацію про симптоми, про які повідомляли пацієнти, і проведено загальну оцінку якості життя з використанням анкети, розробленої Європейською організацією досліджень і лікування раку (EORTC) (QLQ)-C30, і модуля для раку молочної залози (EORTC QLQ-BR23). Загалом 335 пацієнтів із групи застосування лікарського засобу Фазлодекс з палбоциклібом і 166 пацієнтів із групи застосування лікарського засобу Фазлодекс з плацебо відповіли на питання анкети на початку дослідження і принаймні під час першого візиту після початку.
Час до погіршення був заздалегідь встановлений як час між початковим рівнем болю й першим виникненням збільшення ≥10 балів у порівнянні з початковим станом за шкалою больового симптому. Включення палбоциклібу до схеми лікування лікарським засобом Фазлодекс призвело до значної затримки часу до збільшення вираженості болю в порівнянні із застосуванням лікарського засобу Фазлодекс з плацебо (в середньому 8,0 міс порівняно з 2,8 міс, ВР 0,64; 95% ДІ 0,49–0,85; p<0,001).
Вплив на ендометрій у постменопаузальний період.
Доклінічні дані свідчать про відсутність стимулювального впливу фулвестранту на ендометрій у постменопаузальний період. Двотижневе дослідження за участю здорових добровольців у постменопаузальний період, які отримували етинілестрадіол по 20 мкг/добу, показало, що порівняно з попереднім лікуванням плацебо, попереднє лікування Фазлодексом у дозі 250 мг призводило до значного зменшення стимулювального впливу на ендометрій у постменопаузальний період за даними ультразвукового вимірювання товщини ендометрія.
Неоад’ювантне лікування тривалістю до 16 тиж у пацієнтів із раком молочної залози, які отримували лікування або Фазлодексом у дозі 500 мг або Фазлодексом у дозі 250 мг, не призводило до клінічно значущих змін у товщині ендометрія, що вказувало на відсутність агоністичного впливу. На сьогодні немає доказів небажаного впливу на ендометрій при лікуванні пацієнток із раком молочної залози. Немає доступних даних щодо морфологічної структури ендометрія.
У двох короткострокових дослідженнях (1 і 12 тиж) за участю пацієнток у пременопаузальний період із доброякісними гінекологічними захворюваннями між групами лікування фулвестрантом і плацебо не спостерігалося жодних статистично значущих відмінностей у товщині ендометрія, що підтверджено даними ультразвукового обстеження.
Вплив на кістки.
Довгострокові дані стосовно впливу фулвестранту на кістки відсутні. Неоад’ювантне лікування тривалістю до 16 тиж у пацієнтів із раком молочної залози, які отримували лікування або Фазлодексом у дозі 500 мг або Фазлодексом у дозі 250 мг, не призводило до клінічно значущих змін у рівнях сироваткових маркерів кісткового ремоделювання.
Педіатрична популяція.
Фазлодекс не показаний для лікування дітей. Європейська агенція з лікарських засобів дозволила не подавати результати досліджень із застосування лікарського засобу Фазлодекс в усіх підгрупах пацієнтів дитячого віку з раком молочної залози (інформацію про застосування лікарського засобу у дітей див. розділ ЗАСТОСУВАННЯ).
У відкритому дослідженні фази 2 досліджували безпеку, ефективність і фармакокінетику фулвестранту у 30 дівчаток віком від 1 до 8 років з наростаючим передчасним статевим дозріванням, пов’язаним із синдромом Олбрайта — Мак-К’юна — Штернберга (MAS). Діти отримували щомісячно в/м 4 мг/кг фулвестранту. У цьому 12-місячному дослідженні вивчався спектр кінцевих точок щодо ефективності застосування препарату при MAS. Результати дослідження показали зниження частоти вагінальних кровотеч і зниження темпів дозрівання кісткового віку. Мінімальні рівноважні концентрації фулвестранту в дітей у цьому дослідженні узгоджувалися з концентраціями препарату в дорослих (див. розділ Фармакокінетика). Жодних нових питань, пов’язаних із безпекою застосування препарату, не виникло у ході проведення цього невеликого дослідження, однак п’ятирічні дані ще не доступні.
Фармакокінетика.
Всмоктування.
Після введення Фазлодексу у в/м ін’єкції пролонгованої дії фулвестрант повільно всмоктується, а Cmax у плазмі крові досягається приблизно через 5 днів. При режимі застосування Фазлодексу у дозі 500 мг рівні експозиції рівноважного стану або близького до нього досягаються протягом першого місяця лікування (середнє значення (коефіцієнт варіації): AUC 475 (33,4%) нг∙добу/мл, Cmax 25,1 (35,3%) нг/мл, Cmin 16,3 (25,9%) нг/мл відповідно). У рівноважному стані концентрації фулвестранту у плазмі крові зберігаються у межах відносно вузького діапазону із приблизно триразовою різницею між максимальною та мінімальною концентраціями. Після в/м введення в діапазоні дозування від 50 до 500 мг експозиція приблизно пропорційна до дози.
Розподіл.
Фулвестрант екстенсивно і швидко розподіляється. Значний уявний об’єм розподілу в рівноважному стані, що становить приблизно від 3 до 5 л/кг маси тіла, свідчить про переважно екстраваскулярний розподіл. Фулвестрант значною мірою (99%) зв’язується з білками плазми крові. Головними компонентами зв’язування є фракції ЛПДНЩ, ЛПНЩ і ЛПВЩ. Досліджень взаємодії щодо конкурентного зв’язування білків не проводилося. Роль глобуліну, що зв’язується зі статевими гормонами, не встановлена.
Біотрансформація.
Метаболізм фулвестранту повністю не вивчений, але включає комбінацію численних можливих метаболічних шляхів біотрансформації, що є аналогічними до метаболічних шляхів біотрансформації ендогенних стероїдів. Ідентифіковані метаболіти (включаючи метаболіти 17-кетон, сульфон, 3-сульфат, 3- і 17-глюкуронід) в антиестрогенних моделях є або менш активними, або демонструють подібну до фулвестранту активність. Дослідження з використанням препаратів печінки людини та рекомбінантних людських ферментів показують, що CYP 3A4 є єдиним ізоферментом Р450, що бере участь в окисненні фулвестранту; однак вважається, що in vivo переважають не пов’язані з Р450 шляхи метаболізму. In vitro дані свідчать, що фулвестрант не пригнічує ізоферменти CYP 450.
Виведення.
Фулвестрант виводиться переважно у метаболізованій формі. Основний шлях видалення — з калом, при цьому менше 1% виводиться із сечею. Фулвестрант має високий кліренс, 11±1,7 мл/хв/кг, що свідчить про високий печінковий коефіцієнт екстракції. Кінцевий Т½ після в/м введення визначається швидкістю всмоктування та оцінений як 50 днів.
Особливі групи пацієнтів.
При популяційному фармакокінетичному аналізі даних досліджень фази 3 не виявлено відмінностей у фармакокінетичному профілі фулвестранту з огляду на вік (діапазон від 33 до 89 років), масу тіла (від 40 до 127 кг) або расову належність.
Порушення функції нирок.
Ступінь впливу легкого чи помірного порушення функції нирок на фармакокінетику фулвестранту не досягає клінічно істотного значення.
Порушення функції печінки.
Фармакокінетика фулвестранту оцінювалась у клінічному дослідженні з використанням одноразової дози препарату, проведеному за участю жінок з легким та помірним порушенням функції печінки (клас A та B за Чайлдом — П’ю). Нетривало застосовували препарат у високій дозі для в/м ін’єкцій. Порівняно зі здоровими особами у жінок із порушенням функції печінки спостерігалося збільшення AUC майже у 2,5 раза. Очікується, що збільшення експозиції до такої величини у пацієнтів, яким вводиться Фазлодекс, буде добре переноситися. Дані жінок із тяжким порушенням функції печінки (клас C за Чайлдом — П’ю) не оцінювалися.
Педіатрична популяція.
Фармакокінетика фулвестранту оцінювалась у клінічному дослідженні, проведеному за участю 30 дівчаток з наростаючим передчасним статевим дозріванням, пов’язаним із синдромом MAS (див. розділ Фармакодинаміка). Пацієнти педіатричного профілю мали вік від 1 до 8 років і отримували в/м фулвестрант у дозі 4 мг/кг щомісяця. Геометрична середня (стандартне відхилення) мінімальна концентрація у рівноважному стані і AUCss становили 4,2 (0,9) нг/мл і 3680 (1020) нг·год/мл відповідно. Хоча отримані дані обмежені, рівноважні мінімальні концентрації фулвестранту у дітей, імовірно, узгоджуються з такими у дорослих.
Показання Фазлодекс
Фазлодекс показаний:
• як монотерапія при місцево-поширеному або з метастазами раку молочної залози з естрогенпозитивними рецепторами у жінок у період постменопаузи:
– які раніше не отримували гормональну терапію;
– або у разі рецидиву хвороби під час чи після ад’ювантної антиестрогенної терапії чи прогресування хвороби під час антиестрогенної терапії;
• у комбінації з палбоциклібом для лікування HR-позитивного, HER2-негативного місцевопоширеного або метастатичного раку молочної залози в жінок, які отримували попередню ендокринну терапію (див. Фармакодинаміка).
У жінок у період пременопаузи або перименопаузи комбіноване лікування з палбоциклібом слід проводити в комбінації з агоністом ЛГРГ.
Застосування Фазлодекс
Дозування.
Дорослі жінки (включаючи осіб літнього віку).
Рекомендована доза становить 500 мг з інтервалом 1 міс, через 2 тиж після першої ін’єкції вводиться додаткова доза 500 мг.
При застосуванні Фазлодексу у комбінації з палбоциклібом також див. коротку характеристику палбоциклібу.
Жінкам у пре-/перименопаузальний період перед початком та під час комбінованої терапії препаратом Фазлодекс та палбоциклібом слід застосовувати агоністи ЛГРГ відповідно до локальних стандартів клінічної практики.
Особливі групи пацієнтів
Порушення функції нирок.
Для пацієнтів із порушенням функції нирок від легкого до помірного ступеня тяжкості (кліренс креатиніну ≥30 мл/хв) коригування дози не потрібно. Ефективність та безпеку лікарського засобу не оцінювали у пацієнтів із тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв), тому цим пацієнтам препарат слід застосовувати з обережністю (див. розділ ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Порушення функції печінки. Для пацієнтів із порушенням функції печінки від легкого до помірного ступеня тяжкості коригування дози не потрібне. Однак цим пацієнтам Фазлодекс слід застосовувати з обережністю з огляду на можливе зростання експозиції фулвестранту. Дані щодо пацієнтів із тяжким порушенням функції печінки відсутні (див. розділи ПРОТИПОКАЗАННЯ, ОСОБЛИВОСТІ ЗАСТОСУВАННЯ і Фармакокінетика).
Спосіб застосування. Фазлодекс слід вводити у двох послідовних повільних (1–2 хв на ін’єкцію) в/м ін’єкціях по 5 мл, по одній у кожну сідницю (сідничну ділянку).
У зв’язку з близькістю розміщення сідничного нерва слід дотримуватися обережності при введенні препарату Фазлодекс у верхній зовнішній квадрант сідничної ділянки.
Інструкція з введення
Препарат слід вводити відповідно до місцевих правил проведення в/м ін’єкцій великого об’єму.
ПРИМІТКА.. У зв’язку із близькістю розміщення сідничного нерва слід дотримуватися обережності при введенні препарату Фазлодекс у верхній зовнішній квадрант сідничної ділянки (див. розділ ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Застереження: не стерилізувати в автоклаві безпечну голку (вкриту ковпачком підшкірну голку «BD SafetyGlideтм») перед використанням.
Упродовж усього часу використання та видалення руки повинні знаходитися позаду голки.
Для кожного з двох шприців
| • Витягнути скляний циліндр шприца з картриджа і перевірити, чи він не пошкоджений. • Відкрити зовнішню упаковку безпечної голки («BD SafetyGlide™»). • Розчини для парентерального введення перед застосуванням слід перевірити візуально на наявність твердих частинок і зміни кольору. • Тримати шприц ребристою частиною вверх (С). Іншою рукою взяти ковпачок (А) і обережно нахиляти назад і вперед до тих пір, коли ковпачок від’єднається і його можна буде зняти, не крутити (див. мал. 1). | Малюнок 1 |
| • Зняти ковпачок (А), рухаючи його у напрямку вверх. Для збереження стерильності не торкатися наконечника шприца (В) (див. мал. 2). | Малюнок 2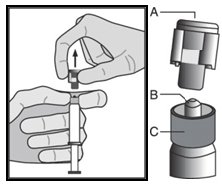 |
| • Приєднати безпечну голку до насадки Люера і прокрутити до щільного прилягання (див. мал. 3). • Перевірити, щоб голка була закріплена на наконечнику шприца Люера, перед переміщенням з вертикальної площини. • Витягнути захисний ковпачок з голки прямо, щоб уникнути пошкодження кінчика голки. • Наблизити заповнений шприц до точки введення. • Зняти з голки ковпачок. • Видалити зі шприца надлишок повітря. | Малюнок 3 |
| • Вводити повільно внутрішньом’язово (1–2 хвилини/ін’єкцію) у сідницю (сідничну ділянку). Для зручності користувача зріз голки повинен бути направлений на плече важеля (див. мал. 4). | Малюнок 4 |
| • Одразу після виведення голки натиснути одним пальцем на плече важеля, щоб активувати захисний поршневий механізм (див. мал. 5). ПРИМІТКА. При активації тримати голку направленою у бік від себе та інших. Прислухатися до клацання та візуально переконатися, що кінчик голки повністю закрився. | Малюнок 5 |
Утилізація
Попередньо заповнені шприци призначені тільки для одноразового використання.
Будь-які невикористані вироби медичного призначення або відходи необхідно утилізувати відповідно до місцевих вимог.
Діти. Безпека та ефективність Фазлодексу для дітей віком від народження до 18 років не встановлені. Доступна на сьогодні інформація наведена в розділах Фармакокінетика і Фармакодинаміка, однак рекомендацій щодо дозування зробити не можна.
Протипоказання
гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин.
Вагітність і лактація (див. Застосування у період вагітності чи годування грудьми).
Тяжка печінкова недостатність (див. розділи ОСОБЛИВОСТІ ЗАСТОСУВАННЯ і Фармакокінетика).
Побічна дія
Резюме профілю безпеки
Монотерапія
У цьому розділі наведено інформацію щодо всіх побічних реакцій, повідомлення про які отримано з клінічних досліджень, післяреєстраційних досліджень або спонтанних повідомлень. В об’єднаній вибірці даних монотерапії фулвестрантом побічними реакціями, про які повідомляється найчастіше, є реакції у місці ін’єкції, астенія, нудота та підвищення рівня печінкових ферментів (АлАТ, АсАТ, ЛФ).
Наведені у табл. 5 категорії частоти побічних реакцій розраховані на підставі даних групи лікування препаратом Фазлодекс 500 мг з об’єднаного аналізу безпеки досліджень, де порівнювалися Фазлодекс 500 мг та Фазлодекс 250 мг (CONFIRM (дослідження D6997C00002), FINDER 1 (дослідження D6997C00004), FINDER 2 (дослідження D6997C00006) та NEWEST (дослідження D6997C00003)), або ж з окремого дослідження FALCON (дослідження D699BC00001), в якому порівнювалися Фазлодекс 500 мг та анастрозол 1 мг. Якщо частота побічних реакцій у об’єднаному аналізі безпеки та у FALCON відрізнялася, то брали найвищу частоту. Частота у наведеній табл. 5 була визначена на підставі даних щодо усіх повідомлених побічних реакцій, незалежно від оцінки дослідником причинного зв’язку. Медіана тривалості лікування фулвестрантом 500 мг в об’єднаній вибірці даних (зокрема в наведених вище дослідженнях та дослідженні FALCON) становила 6,5 міс.
Перелік побічних реакцій у вигляді таблиці
Наведені нижче побічні реакції класифіковані за частотою та класами систем органів. Частоту визначено таким чином: дуже часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100). У межах групи за частотою побічні реакції зазначені у порядку зменшення їхньої серйозності.
Таблиця 5. Побічні реакції, про які повідомлялося у пацієнтів під час монотерапії препаратом Фазлодекс
| Побічні реакції, класифіковані відповідно до частоти і класу систем органів | ||
| Інфекції та інвазії | Часто | Інфекції сечовивідних шляхів |
| З боку імунної системи | Дуже часто | Реакції гіперчутливостіe |
| Нечасто | Анафілактичні реакції | |
| З боку метаболізму та харчування | Часто | Анорексіяа |
| З боку нервової системи | Часто | Головний біль |
| З боку судин | Дуже часто | Припливиe |
| Часто | Венозна тромбоемболіяa | |
| З боку травного тракту | Дуже часто | Нудота |
| Часто | Блювання, діарея | |
| З боку печінки та жовчовивідних шляхів | Дуже часто | Підвищення рівнів печінкових ферментів (АлАТ, АсАТ, ЛФ)а |
| Часто | Підвищення рівня білірубінуa | |
| Нечасто | Печінкова недостатністьс, f, гепатитf, підвищення рівня гамма-глутамілтранспептидазиf | |
| З боку шкіри та підшкірної клітковини | Дуже часто | Висипe |
| З боку скелетно-м’язової системи та сполучної тканини | Дуже часто | Біль у суглобах та скелетних м’язахd |
| Часто | Біль у спиніа | |
| З боку репродуктивної системи та молочних залоз | Часто | Вагінальна кровотечаe |
| Нечасто | Вагінальний кандидозf, лейкореяf | |
| Загальні розлади та стани у місці введення препарату | Дуже часто | Астеніяа, реакції у місці ін’єкціїb |
| Часто | Периферична нейропатіяe, ішіасe | |
| Нечасто | Геморагії у місці ін’єкціїf, гематоми у місці ін’єкціїf, невралгіяc,f | |
| З боку крові та лімфатичної системи | Часто | Зменшення кількості тромбоцитівe |
aВключено побічні реакції на препарат, для яких зв’язок із Фазлодексом не може бути встановлений у зв’язку з основним захворюванням.
bТермін «реакції у місці ін’єкції» не включає у себе терміни «геморагії у місці ін’єкції» і «гематома у місці ін’єкції», «ішіас», «невралгія», «периферична нейропатія».
cРеакція не спостерігалася у великих клінічних дослідженнях (CONFIRM, FINDER 1, FINDER 2, NEWEST).
Частота була розрахована з використанням верхньої межі 95% ДІ для оцінки точки. Вона розраховувалася як 3/560 (де 560 — це кількість пацієнтів у великих клінічних дослідженнях), що відповідає частоті категорії «нечасто».
dВключає артралгію та рідше — м’язово-кістковий біль, міалгію та біль у кінцівках.
eНаявні деякі відмінності між частотою побічних реакцій у відповідних категоріях щодо органів та систем органів у дослідженні з безпеки та дослідженні FALCON.
fНебажані реакції не спостерігали в дослідженні FALCON.
Опис окремих побічних реакцій.
Наведений опис базується на аналізі безпеки групи із 228 пацієнток, які отримали щонайменше одну дозу фулвестранту, та групи із 232 пацієнток, які отримали щонайменше одну дозу анастрозолу в дослідженні фази 3 FALCON.
Біль у суглобах та кістково-м’язовий біль.
За даними дослідження FALCON, кількість пацієнтів, що повідомили про біль у суглобах та кістково-м’язовий біль, становила 65 (31,2%) та 48 (24,1%) при прийомі фулвестранту та анастрозолу відповідно. Із 65 пацієнток, які отримували Фазлодекс, 40% (26/65) пацієнток відмічали суглобовий та кістково-м’язовий біль впродовж першого місяця лікування, 66,2% (43/65) пацієнток — впродовж перших 3 міс лікування. Жоден із пацієнтів не повідомляв про випадки ступеня ≥3 за CTCAE або про випадки, що потребували зниження дози препарату, тимчасового припинення прийому або відміни лікування препаратом у зв’язку з цими побічними реакціями.
Комбінована терапія з палбоциклібом.
Загальний профіль безпеки фулвестранту при застосуванні в комбінації з палбоциклібом ґрунтується на даних 517 пацієнток із HR-позитивним, HER2-негативним місцевопоширеним або метастатичним раком молочної залози в рандомізованому дослідженні PALOMA3 (див. розділ Фармакодинаміка). Найбільш поширеними (≥20%) побічними реакціями будь-якого ступеня, про які повідомлялося в пацієнток, які отримували фулвестрант у комбінації з палбоциклібом, були нейтропенія, лейкопенія, інфекції, втома, нудота, анемія, стоматит, діарея, тромбоцитопенія і блювання. Найбільш поширеними (≥2%) побічними реакціями ≥3-го ступеня були нейтропенія, лейкопенія, інфекції, анемія, підвищення рівня АсАТ, тромбоцитопенія та втома.
У табл. 6 наведено дані про побічні реакції, що відзначалися в дослідженні PALOMA3.
Медіана лікування фулвестрантом становила 11,2 міс у групі застосування фулвестранту + палбоциклібу та 4,8 міс у групі застосування фулвестранту + плацебо. Середня тривалість лікування палбоциклібом у групі застосування фулвестранту + палбоциклібу становила 10,8 міс.
Таблиця 6. Побічні реакції за даними дослідження PALOMA3 (N=517)
| Клас систем органів Частота Термін переважного використанняa | Фазлодекс + палбоцикліб (N=345) | Фазлодекс + плацебо (N=172) | ||
| Усі ступені n (%) | Ступінь ≥3 n (%) | Усі ступені n (%) | Ступінь ≥3 n (%) | |
| Інфекційні та паразитарні захворювання | ||||
| Дуже часто | ||||
| Інфекціїb | 188 (54,5) | 19 (5,5) | 60 (34,9) | 6 (3,5) |
| Порушення з боку крові та лімфатичної системи | ||||
| Дуже часто | ||||
| Нейтропеніяc | 290 (84,1) | 240 (69,6) | 6 (3,5) | 0 |
| Лейкопеніяd | 207 (6,0) | 132 (38,3) | 9 (5,2) | 1 (0,6) |
| Анеміяe | 109 (31,6) | 15 (4,3) | 24 (14,0) | 4 (2,3) |
| Тромбоцитопеніяf | 88 (25,5) | 10 (2,9) | 0 | 0 |
| Нечасто | ||||
| Фебрильна нейтропенія | 3 (0,9) | 3 (0,9) | 0 | 0 |
| Порушення з боку обміну речовин і харчування | ||||
| Дуже часто | ||||
| Погіршення апетиту | 60 (17,4) | 4 (1,2) | 18 (10,5) | 1 (0,6) |
| Порушення з боку нервової системи | ||||
| Часто | ||||
| Дисгевзія | 27 (7,8) | 0 | 6 (3,5) | 0 |
| Порушення з боку органів зору | ||||
| Часто | ||||
| Підвищене сльозовиділення | 25 (7,2) | 0 | 2 (1,2) | 0 |
| Нечіткість зору | 24 (7,0) | 0 | 3 (1,7) | 0 |
| Сухість очей | 15 (4,3) | 0 | 3 (1,7) | 0 |
| Порушення з боку органів дихання, грудної клітки та середостіння | ||||
| Часто | ||||
| Носова кровотеча | 25 (7,2) | 0 | 4 (2,3) | 0 |
| Розлади з боку ШКТ | ||||
| Дуже часто | ||||
| Нудота | 124 (35,9) | 2 (0,6) | 53 (30,8) | 1 (0,6) |
| Стоматитg | 104 (30,1) | 3 (0,9) | 24 (14,0) | 0 |
| Діарея | 94 (27,2) | 0 | 35 (20,3) | 2 (1,2) |
| Блювання | 75 (21,7) | 2 (0,6) | 28 (16,3) | 1 (0,6) |
| Порушення з боку шкіри та підшкірної клітковини | ||||
| Дуже часто | ||||
| Алопеція | 67 (19,4) | Не застосовується | 11 (6,4) | Не застосовується |
| Висипh | 63 (18,3) | 3 (0,9) | 10 (5,8) | 0 |
| Часто | ||||
| Сухість шкіри | 28 (8,1) | 0 | 3 (1,7) | 0 |
| Загальні порушення та реакції в місці введення | ||||
| Дуже часто | ||||
| Втома | 152 (44,1) | 9 (2,6) | 54 (31,4) | 2 (1,2) |
| Лихоманка | 47 (13,6) | 1 (0,3) | 10 (5,8) | 0 |
| Часто | ||||
| Астенія | 27 (7,8) | 1 (0,3) | 13 (7,6) | 2 (1,2) |
| Результати лабораторних досліджень | ||||
| Дуже часто | ||||
| Підвищення рівня АсАТ | 40 (11,6) | 11 (3,2) | 13 (7,6) | 4 (2,3) |
| Часто | ||||
| Підвищення рівня АлАТ | 30 (8,7) | 7 (2,0) | 10 (5,8) | 1 (0,6) |
N/n — кількість пацієнтів.
aЗазначено переважні терміни (ПТ) для реакцій згідно з MedDRA 17.1.
bУсі ПТ, що належать до класу «Інфекційні та паразитарні захворювання».
cНейтропенія включає такі ПТ: нейтропенія, знижений рівень нейтрофілів.
dЛейкопенія включає такі ПТ: лейкопенія, знижений рівень лейкоцитів.
eАнемія включає такі ПТ: анемія, зниження рівня гемоглобіну, зниження рівня гематокриту.
fТромбоцитопенія включає такі ПТ: тромбоцитопенія, зниження рівня тромбоцитів.
gСтоматит включає такі ПТ: афтозний стоматит, хейліт, глосит, глосоденія, виразки в ротовій порожнині, запалення слизових оболонок, біль у ротовій порожнині, орофарингеальний дискомфорт, орофарингеальний біль, стоматит.
hВисип включає такі ПТ: висип, макулопапульозний висип, висип зі свербежем, еритематозний висип, папульозний висип, дерматит, вугреподібний дерматит, токсичні шкірні висипи.
Опис окремих побічних реакцій
Нейтропенія.
У дослідженні PALOMA3, у якому застосовували фулвестрант у поєднанні з палбоциклібом, повідомлялося про нейтропенію будь-якого ступеня у 290 (84,1%) пацієнтів, про нейтропенію 3-го ступеня — у 200 (58,0%) пацієнтів, а про нейтропенію 4-го ступеня — у 40 (11,6%) пацієнтів. У групі застосування фулвестранту + плацебо (n=172) повідомлялося про нейтропенію будь-якого ступеня в 6 (3,5%) пацієнтів. Про випадки нейтропенії 3- і 4-го ступеня в групі застосування фулвестранту + плацебо не повідомлялося.
У пацієнтів, які отримували фулвестрант у комбінації з палбоциклібом, медіана часу до першого епізоду нейтропенії становила 15 днів (діапазон: 13–512 днів), а медіана тривалості нейтропенії ≥3-го ступеня становила 16 днів. У 3 (0,9%) пацієнтів, які отримували фулвестрант у комбінації з палбоциклібом, повідомлялося про випадки фебрильної нейтропенії.
Повідомлення про підозрювані побічні реакції.
Важливо повідомляти про підозрювані побічні реакції після реєстрації лікарського засобу. Це дозволяє продовжувати контроль за співвідношенням користь/ризик при застосуванні лікарського засобу. Медичних працівників просять повідомляти про будь-які підозрювані побічні реакції.
Особливості застосування
Фазлодекс слід з обережністю застосовувати пацієнтам із порушенням функції печінки від легкого до помірного ступеня тяжкості (див. розділи ЗАСТОСУВАННЯ, ПРОТИПОКАЗАННЯ і Фармакокінетика).
Фазлодекс слід з обережністю застосовувати пацієнтам із тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв).
Враховуючи в/м шлях введення, Фазлодекс слід з обережністю застосовувати при лікуванні хворих на геморагічний діатез, тромбоцитопенію або тих, хто приймає антикоагулянти.
Тромбоемболічні реакції зазвичай спостерігаються у жінок із поширеним раком молочної залози, які були зареєстровані у клінічних дослідженнях Фазлодексу (див. розділ ПОБІЧНІ РЕАКЦІЇ). Це слід враховувати при призначенні Фазлодексу пацієнтам, які входять до групи ризику.
При введенні препарату Фазлодекс повідомляли про реакції, пов’язані з місцем ін’єкції, включаючи ішіас, невралгію, нейропатичний біль та периферичну нейропатію. У зв’язку із близькістю розміщення сідничного нерва слід дотримуватися обережності при введенні препарату Фазлодекс у верхній зовнішній квадрант сідничної ділянки (див. розділи ЗАСТОСУВАННЯ та ПОБІЧНІ РЕАКЦІЇ).
Не існує даних довгострокових досліджень щодо впливу фулвестранту на кістки. Через механізм дії фулвестранту існує потенційний ризик розвитку остеопорозу.
Безпека й ефективність застосування Фазлодексу (як монотерапія або в комбінації з палбоциклібом) пацієнтам із критичним захворюванням внутрішніх органів не досліджувалися.
При комбінації лікарського засобу Фазлодекс із палбоциклібом див. також коротку характеристику лікарського засобу палбоциклібу.
Вплив на дослідження естрадіолу за допомогою антитіл.
У зв’язку зі структурною подібністю фулвестранту та естрадіолу фулвестрант може впливати на результати досліджень рівня естрадіолу, що проводяться на основі реакції з антитілами, і спричиняти отримання хибнопідвищених рівнів естрадіолу.
Етанол.
Фазлодекс містить 10% мас./об. етанолу (спирту) як допоміжну речовину, тобто до 500 мг в одній ін’єкції, що еквівалентно 10 мл пива чи 4 мл вина. Це може нашкодити пацієнтам з алкоголізмом, а також це потрібно враховувати особам з груп високого ризику, зокрема з ураженням печінки та епілепсією.
Бензиловий спирт.
Фазлодекс містить бензиловий спирт як допоміжну речовину, що може спричиняти алергічні реакції.
Педіатрична популяція.
Фазлодекс не рекомендується для застосування дітям та підліткам, оскільки його безпеку та ефективність для цієї вікової групи не встановлено (див. розділ Фармакодинаміка).
Застосування у період вагітності чи годування грудьми
Жінки репродуктивного віку.
Пацієнткам репродуктивного віку слід рекомендувати використовувати ефективні засоби контрацепції під час лікування Фазлодексом та протягом 2 років після введення останньої дози.
Вагітність.
Фазлодекс протипоказаний у період вагітності (див. розділ ПРОТИПОКАЗАННЯ). Показано, що фулвестрант проходить через плацентарний бар’єр після одноразового в/м введення препарату у щурів і кролів. Дослідження на тваринах виявили репродуктивну токсичність, включаючи зростання частоти аномалій та смерті плода. Якщо пацієнтка завагітніла у період лікування Фазлодексом, її слід поінформувати про потенційну небезпеку для плода та потенційний ризик переривання вагітності.
Грудне вигодовування.
Під час лікування Фазлодексом грудне вигодовування слід припинити. Фулвестрант екскретується в молоко у лактуючих щурів. Невідомо, чи виділяється фулвестрант у грудне молоко людини. Враховуючи можливість виникнення у немовлят, які перебувають на грудному вигодовуванні, серйозних небажаних реакцій, спричинених фулвестрантом, годування грудьми протипоказане у період застосування цього лікарського засобу (див. розділ ПРОТИПОКАЗАННЯ).
Фертильність.
Вплив Фазлодексу на фертильність у людини не досліджений.
Здатність впливати на швидкість реакції при керуванні транспортними засобами чи роботі з іншими механізмами.
Фазлодекс не впливає або має незначний вплив на здатність керувати транспортними засобами та працювати з іншими механізмами. Однак, оскільки при лікуванні Фазлодексом повідомлялося про дуже часті випадки астенії, пацієнтам, у яких під час керування транспортними засобами або роботі з механізмами розвинулася ця побічна реакція, слід дотримуватися обережності.
Взаємодія з іншими лікарськими засобами
Дослідження клінічної взаємодії з мідазоламом (субстратом CYP 3A4) продемонструвало, що фулвестрант не пригнічує CYP 3A4. Дослідження клінічної взаємодії з рифампіцином (індуктором CYP 3A4) та кетоконазолом (інгібітором CYP 3A4) не показали клінічно значущих змін у кліренсі фулвестранту. Таким чином для пацієнтів, яким одночасно призначені фулвестрант та інгібітори або індуктори CYP 3А4, корекція дози не потрібна.
Несумісність. Оскільки дослідження сумісності відсутні, цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Передозування
Є окремі повідомлення про випадки передозування Фазлодексу у людей. У разі передозування рекомендується проводити симптоматичне підтримувальне лікування. У дослідженнях на тваринах високі дози фулвестранту не спричиняли інших ефектів крім тих, що прямим або непрямим чином пов’язані з антиестрогенною дією.
Умови зберігання
при температурі 2–8 °С у недоступному для дітей місці. Зберігати попередньо заповнені шприци в оригінальній упаковці для захисту від світла.
Температурні коливання поза діапазоном від 2 до 8 °С повинні бути обмежені. При цьому слід уникати зберігання при температурі вище 30 °C і не перевищувати 28-денного періоду, при якому середня температура зберігання продукту становить нижче 25 °C (але вище 2–8 °С). Після коливань температури препарат повинен бути негайно повернутий у рекомендовані умови зберігання (зберігання і транспортування в холодильнику при температурі 2–8 °С). Температурні коливання чинять кумулятивний ефект на якість препарату, і 28-денний період не повинен перевищуватися протягом 4-річного терміну придатності Фазлодексу. Вплив температур нижче 2 °С не призводить до пошкодження препарату за умови, що препарат не зберігається при температурі нижче –20 °C.