Значний прорив у галузі електрокардіофізіології наприкінці XIX сторіччя здійснив Вільям Ейнтховен, який створив ЕКГ-апарат і вивчав її зміни при хворобах серця. За цикл робіт у цьому напрямку йому було присвоєно Нобелівську премію. Багато працювали в галузі електрокардіофізіології такі науковці, як А. Веллер, Т. Льюїс, російський вчений А. Ф. Самойлов.
У 2015 р. відбувся 100-річний ювілей відомого американського вченого Нормана Холтера. Він отримав звання магістра фізики, хімії, вивчав ядерну медицину. Н. Холтер запропонував добове моніторування ЕКГ. На його честь цей метод називається холтерівським моніторуванням ЕКГ [30].
У 40–70% здорових осіб при холтерівському моніторуванні ЕКГ протягом 24–48 год виявляють шлуночкові аритмії, у тому числі у 1–4% випадків — складні. Ектопічна активність шлуночків визначається у 75–90% хворих на гострий ІМ в перші 72 год захворювання і зумовлює високу частоту РСС. Парні та політопні шлуночкові екстрасистоли виявляють у 70–90% хворих із СН; ШТ — у 40–80% випадків, і в 33–47% випадків вони спричиняють РСС.
Отже, аритмії та блокади серця наявні в терапевтичній практиці дуже часто. Відомо, що екстрасистолічна аритмія спостерігається у кожної людини впродовж життя, а ФП має тенденцію до прогресивного зростання з кожним прожитим роком. За даними AHA, від пароксизмальних порушень ритму серця щороку помирають 300 000 – 600 000 жителів, тобто смерть настає щохвилини.
Класифікація порушень ритму і провідності серця та порушень утворення імпульсу (ААУ, 2018; ВАКУ, 2018) [26, 60]
Коди МКХ-10:
І49.8 — синусова тахікардія (більше 90 комплексів за хвилину); синусова брадикардія (менше 60 комплексів за хвилину); синусова аритмія.
І45.5 — зупинка (відмова) синусного вузла.
І49.8 — вислизаючі комплекси та ритми — передсердні: повільні, прискорені; з АV-з’єднання: повільні, прискорені; шлуночкові: повільні, прискорені.
І45.8 — АV-дисоціації.
І49.8 — міграція надшлуночкового водія ритму.
Екстрасистолія («передчасна деполяризація» — термін наведено згідно з МКХ-10):
І49.1 — передсердна.
І49.2 — передсердно-шлуночкова (АV).
І49.3 — шлуночкова:
- поодинока (до 30 ектопічних комплексів на годину);
- часта (30 і більше ектопічних комплексів на годину);
- алоритмія (бі-, три-, квадригеменія);
- поліморфна;
- парна;
- рання (R–T).
І47.1 — тахікардії — реципрокні: хронічні, пароксизмальні; вогнищеві (ектопічні): хронічні, пароксизмальні (ПТ).
Надшлуночкові тахікардії:
- синопередсердна (синоатріальна);
- передсердна (атріальна);
- передсердно-шлуночкова (АV);
- вузлова:
- звичайного типу;
- незвичайного типу;
- з додатковими шляхами проведення:
- ортодромна;
- антидромна.
ШТ:
І47.2 — нестійка (від 3 шлуночкових комплексів до 30 с):
- мономорфна;
- поліморфна.
І47.2 — стійка (від 3 шлуночкових комплексів триваліше 30 с):
- мономорфна;
- поліморфна.
І47.0 — постійнозворотна:
- мономорфна;
- поліморфна.
І48.0 — фібриляція і тріпотіння передсердь (ФП і ТП):
- пароксизмальна (ПТ) (ритм відновлюється самостійно в межах 7 діб)*:
- брадисистолічна (частота шлуночкових скорочень (ЧШС) <60 за хвилину)**;
- тахісистолічна (ЧШС >110 за хвилину)**;
- персистуюча (епізод, що триває понад 7 діб, коли для відновлення синусового ритму необхідне втручання)*:
- брадисистолічна (ЧШС <60 за хвилину)**;
- тахісистолічна (ЧШС >110 за хвилину)**;
- тривало персистуюча (епізод, що триває 1 рік та більше, коли синусовий ритм доцільно відновлювати)*:
- брадисистолічна (ЧШС <60 за хвилину)**;
- тахісистолічна (ЧШС >110 за хвилину)**;
- постійна (коли синусовий ритм відновити неможливо або недоцільно)*:
- брадисистолічна (ЧШС <60 за хвилину)**;
- тахісистолічна (ЧШС >110 за хвилину)**.
Примітки. *Усі форми можуть бути такими, що вперше виникли; **вказується при клінічно значущому стані.
І49.0 — ФШ і тріпотіння шлуночків.
Порушення проведення імпульсу:
І45.5 — синоаурикулярні блокади; АV-блокади:
І44.0 — І ступеня;
І44.1 — ІІ ступеня:
- І типу;
- ІІ типу;
І44.2 — ІІІ ступеня.
Внутрішньошлуночкові блокади.
Однопучкові блокади:
І45.0 — БПНПГ.
І44.4 — блокада передньоверхнього розгалуження лівої ніжки пучка Гіса.
І44.5 — блокада задньонижнього розгалуження лівої ніжки пучка Гіса:
- постійні;
- минаючі.
І45.2 — двопучкові блокади:
- БЛНПГ;
- БПНПГ та передньоверхнього розгалуження лівої ніжки пучка Гіса;
- БПНПГ та задньонижнього розгалуження лівої ніжки пучка Гіса.
І45.3 — трипучкові блокади.
Комбіновані порушення утворення і проведення імпульсу:
І49.4 — парасистолія:
- передсердна;
- з AV-з’єднання;
- шлуночкова.
Захворювання, синдроми і феномени:
І49.8 — ідіопатичні форми аритмій; синдроми та ЕКГ-феномени перезбудження шлуночків:
- WPW-синдром;
- синдром укороченого інтервалу P–R (Лауна — Ганонга — Лівайна).
І49.8 — синдром ранньої реполяризації шлуночків:
- вроджений;
- набутий.
І49.5 — синдром слабкості синусового вузла.
І46.9 — синдром Морганьї — Адамса — Стокса.
І49.8 — аритмогенна дисплазія ПШ.
І49.8 — синдром Бругада.
І49.0 — синдром Фредеріка.
І46.1 — РСС (аритмічна) — смерть, що настала протягом 1 год після появи перших симптомів захворювання або суттєвого погіршення стану хворого на тлі стабільного хронічного перебігу захворювання:
- з відновленням серцевої діяльності:
- ФШ;
- асистолія;
- електромеханічна дисоціація (зазначається за можливості);
- РСС (незворотна):
- ФШ;
- асистолія;
- електромеханічна дисоціація (зазначається за можливості);
- зупинка серця (смерть, що настала більше ніж через 1 год після появи чи посилення симптомів захворювання);
- з відновленням серцевої діяльності;
- зупинка серця (незворотна).
Аритмії при нормальній або порушеній функції кардіостимуляторів різного типу
У діагнозі слід зазначити кардіохірургічні втручання та пристрої, використані для лікування при аритміях і порушеннях провідності серця (із зазначенням методу та дати втручання) — катетерні (радіочастотні та ін.) деструкції, імплантації водіїв ритму та ІКД, проведення кардіоверсії чи дефібриляції (зазначається дата останньої) тощо.
Приклади формулювання діагнозу:
1. Міокардіофіброз, пароксизмальна передсердно-шлуночкова вузлова реципрокна тахікардія (звичайного типу). СН 0 стадії.
2. Допоміжні провідні шляхи. WPW-синдром, пароксизмальна передсердно-шлуночкова реципрокна ортодромна тахікардія. СН 0 стадії.
Існує прогностична класифікація шлуночкових аритмій, запропонована J.T. Bigger (1987), та Ізраїльська класифікація значних, незначних і небезпечних аритмій серця. За класифікацією Bigger аритмії поділяються на доброякісні, злоякісні та потенційно злоякісні. При останніх необхідне застосування негайної терапії ААП, а доброякісні спеціального лікування не потребують. Слід зазначити, що такий розподіл аритмій є умовним. Робочу класифікацію аритмій серця (В. І. Денесюк, 1999), удосконалену і опубліковану в 2015 р., наведено в табл. 2.99.
Таблиця 2.99. Удосконалена робоча клініко-прогностична класифікація життєвозагрозливих порушень ритму та провідності серця при різних ССЗ [71]
|
Тяжкість порушень ритму та провідності серця |
Вид аритмій та блокад серця |
|
І. Безпечні порушення ритму та провідності серця |
|
|
ІІ. Небезпечні для життя аритмії та блокади серця |
|
|
ІІІ. Злоякісні порушення ритму та провідності серця |
|
|
IV. Фатальні аритмії |
|
За результатами дослідження, у обстежених хворих на стабільну і нестабільну стенокардію в поєднанні з АГ безпечні аритмії та блокади серця визначали у 32 (0,5%), небезпечні для життя — у 18 (5,4%), злоякісні аритмії та блокади серця — у 20 (6,0%), фатальні аритмії — у 17 (5,1%) хворих. Ці аритмії не визначались у 249 (74,7%) хворих [17].
Таким чином, запропонована удосконалена робоча клініко-прогностична класифікація аритмій та блокад серця при різних формах ІХС дає змогу визначити ступінь тяжкості та загрозу для життя, прогнозувати можливе виникнення злоякісних і фатальних аритмій, блокад серця та здійснювати вторинну профілактику, спрямовану на продовження тривалості життя і запобігання виникненню серцевої смерті.
За характером перебігу розрізняють гострі, хронічні, рецидивуючі, а також безперервно рецидивуючі пароксизмальні порушення ритму серця.
Приклади формулювання діагнозу:
1. ІХС. Стабільна стенокардія напруження, ІІІ ФК. Дифузний кардіосклероз, нестійка поліморфна ШТ. СН ІІА стадії, діастолічний варіант, ІІІ ФК.
2. Дифузний міокардіофіброз. Пароксизмальна передсердна тахікардія. СН І стадії, ІІ ФК.
3. Ідіопатична аритмія: персистуюча ФП, брадисистолічна форма, стан після медикаментозної кардіоверсії (дата).
2.8.1 Екстрасистолічна аритмія та парасистолія
Суправентрикулярні екстрасистоли
Суправентрикулярні екстрасистоли у здорових людей протягом доби виникають в 43–100% випадків і збільшуються з віком, а у кількості понад 30 за годину вони спостерігаються у 2–5% здорових людей.
До суправентрикулярних (надшлуночкових) екстрасистол належать синоатріальна, передсердна, вузлова екстрасистолія. За кількістю екстрасистоли розподіляються на дуплети (дві екстрасистоли підряд) і триплети (три екстрасистоли підряд).
Суправентрикулярна синоатріальна екстрасистолія виникає рідко. Відбувається передчасне виникнення зубця Р такої ж форми, як і в інших зубців Р синусового походження без змін комплексу QRS. У цьому разі компенсаторна пауза відсутня, що відрізняє синоатріальну екстрасистолію від передсердної. Передсердна екстрасистолія — це передчасне збудження та скорочення серця імпульсом, який знаходиться в ЛП або правому передсерді [19, 26, 55].
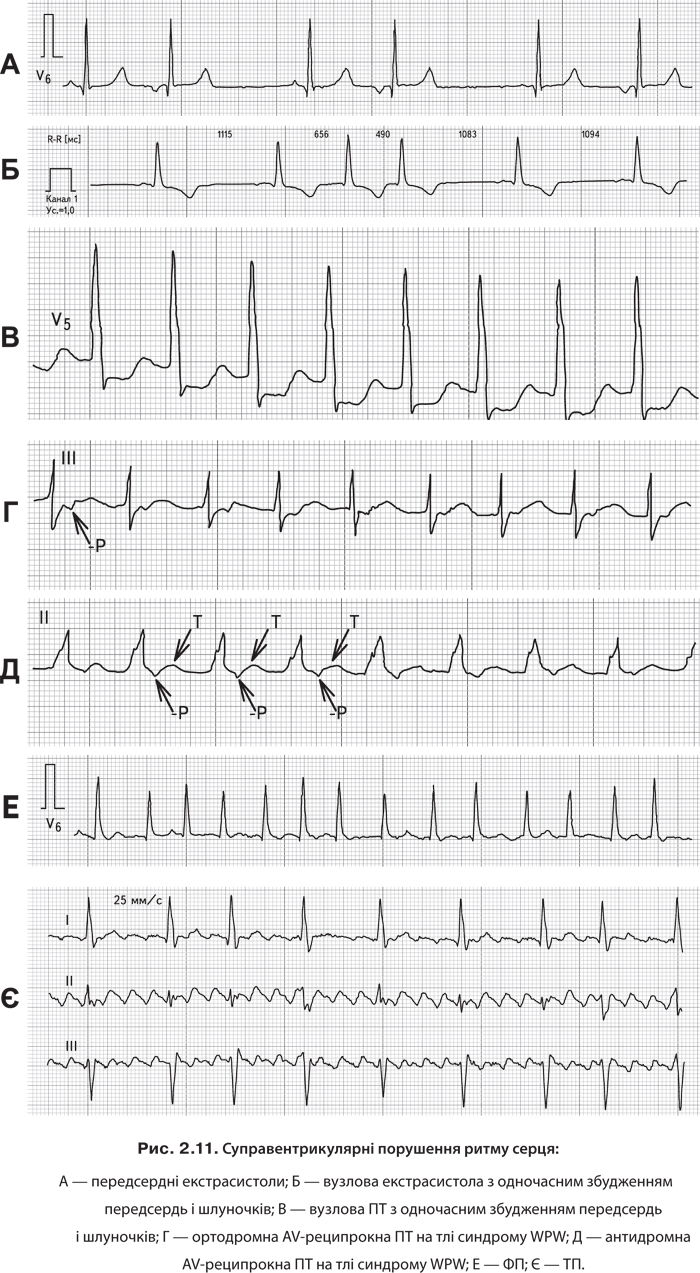
Діагностику аритмій проілюстровано на рис. 2.11 та наведено в алгоритмі 2.44.
|
Алгоритм 2.44. ЕКГ-критерії діагностики передсердної екстрасистолії [19] Реєструється передчасна позачергова поява зубця Р; за ним слідує комплекс QT. Спостерігається деформація або зміни полярності зубця Р в екстрасистолічному комплексі. Визначається незмінений шлуночковий комплекс QRS, схожий за формою на звичайні нормальні комплекси QRS синусового походження. Після передсердної екстрасистолії наявна неповна компенсаторна пауза. |
АV-(вузлова) екстрасистолія. Відомо, що пейсмекерна активність властива середній та нижній частинам АV-з’єднання. Ектопічний імпульс, який виникає в АV-з’єднанні, направляється вгору і вниз по провідній системі (вгору — по передсердях, вниз — по шлуночках). Ретроградне збудження по передсердях призводить до виникнення негативного зубця Р. При екстрасистолі з одночасним збудженням передсердь і шлуночків негативний зубець Р зливається з комплексом QRS, і тому він на ЕКГ не диференціюється. У разі виникнення екстрасистоли із АV-з’єднання з передчасним збудженням шлуночків, а потім передсердь, на ЕКГ спочатку з’являється комплекс QRS, а потім негативний зубець Р, розміщений на сегменті ST. Шлуночковий комплекс QRS при АV-екстрасистолі частіше буває незміненим (алгоритм 2.45).
|
Алгоритм 2.45. ЕКГ-критерії діагностики екстрасистолії із АV-з’єднання [19] 1. Передчасна позачергова поява на ЕКГ незміненого шлуночкового комплексу QRS, подібного за формою на інші комплекси QRS синусового походження. 2. Якщо передчасний імпульс виникає в середній частині АV-з’єднання, то негативний зубець Р нашаровується на комплекс QRS, тому він відсутній; якщо з нижньої частини АV-з’єднання, то негативний зубець Р визначається після комплексу QRS на сегменті ST. 3. Наявність неповної компенсаторної паузи. |
Прогноз переважно сприятливий: результати РКД свідчать, що суправентрикулярна екстрасистолія, на відміну від шлуночкової, не пов’язана з підвищеним ризиком виникнення РСС.
Шлуночкова екстрасистолія
Шлуночкова екстрасистолія — найпоширеніше порушення ритму серця. При холтерівському моніторуванні ЕКГ шлуночкові екстрасистоли фіксуються в 40–90% випадків як у здорових, так і у хворих людей. Поширеність шлуночкових екстрасистол значно зростає за наявності органічних захворювань серця.
Визначення. Шлуночкова екстрасистолія — це порушення ритму серця від імпульсу, який виникає в різних ділянках провідної системи шлуночків. Джерелом шлуночкової екстрасистолії можуть бути ніжки пучка Гіса або волокна Пуркіньє. У результаті відзначених електрофізіологічних особливостей відбувається неодночасне збудження ЛШ і ПШ. Неодночасна деполяризація шлуночків призводить до розщеплення та розширення комплексу QRS (до 0,12 с і більше), форма якого нагадує БНПГ. Сегмент ST і зубець Т направляються у протилежний основному комплексу QRS бік. При лівошлуночковій екстрасистолії основний комплекс QRS направлений донизу в І, aVL, V5–6 -відведеннях і вгору — в ІІІ аVF і V1–2-відведеннях. У разі розвитку правошлуночкової екстрасистолії комплекс QRS має протилежне направлення в цих відведеннях [19, 26].
Для оцінки прогностичної значущості шлуночкової екстрасистолії В. Lown, M. Wolf (1971) запропонували градації, які згодом були модифіковані M. Ryan та співавторами (співавтори з В. Lown). За результатами холтерівського моніторування ЕКГ розрізняють 5 класів шлуночкової екстрасистолії:
0 клас — відсутність шлуночкових екстрасистол за 24 год;
1 клас — реєструється ˂30 шлуночкових екстрасистол за 1 год;
2 клас — реєструється >30 шлуночкових екстрасистол за 1 год;
3 клас — реєструються поліморфні шлуночкові екстрасистоли;
4а клас — реєструються мономорфні парні шлуночкові екстрасистоли;
4б клас — реєструються поліморфні парні шлуночкові екстрасистоли;
5 клас — реєструється ≥3 підряд шлуночкових екстрасистол в межах не більше 30 с (розцінюється як нестійка шлуночкова ПТ) (доповнення класифікації у 1971 р.).
Клініка та діагностика шлуночкових екстрасистол наведені в алгоритмах 2.46 –2.48.
|
Алгоритм 2.46. ЕКГ-критерії діагностики шлуночкової екстрасистолії [19] 1. Передчасні позачергові змінені комплекси QRS. 2. Значне розширення і деформація шлуночкового комплексу QRS, що становить ≥0,12 с. 3. Розміщення сегмента ST і зубця Т в екстрасистолічному комплексі дискордантно відносно основного комплексу QRS. 4. Відсутність перед шлуночковою екстрасистолою зубця Р. 5. Наявність після шлуночкової екстрасистоли повної компенсаторної паузи (не завжди). 6. Інтервал зчеплення (на відміну від шлуночкової парасистолії) однаковий. 7. При лівошлуночковій екстрасистолії комплекс QRS направлений донизу у І, aVL, V5–6-відведеннях, а в V1–2 — доверху; при правій шлуночковій екстрасистолії, навпаки, комплекс QRS направлений доверху у І, aVL і V5–6-відведеннях, а в V1–2 грудних відведеннях — донизу. |
|
Алгоритм 2.47. Критерії діагностики функціональних шлуночкових екстрасистол [19] 1. Відсутнє органічне захворювання серця в анамнезі. 2. Амплітуда комплексу QRS становить ≥20 мм. 3. Електрична вісь серця має нормальне положення. 4. Ширина комплексу QRS не перевищує 0,11 с. 5. Сегмент ST і зубець Т на ЕКГ направлені протилежно (дискордантно) відносно комплексу QRS. 6. Зубці Т асиметричні. 7. Алоритмія чи шлуночкові екстрасистоли ІІІ–V градацій відсутні. 8. Атропінова проба призводить до зменшення або зникнення екстрасистол. 9. Кількість екстрасистол після фізичного навантаження не збільшується. 10. Розміри та порожнини серця не збільшені, а ФВ за даними ехоКГ не змінена. 11. Ефективне лікування спостерігається після застосування седативних засобів. |
|
Алгоритм 2.48. Критерії діагностики органічних шлуночкових екстрасистол [19] 1. Визначають органічне захворювання серця. 2. Амплітуда комплексу QRS становить ≤10 мм. 3. Електрична вісь серця частіше зміщується вліво (рідко — вправо). 4. Ширина комплексу QRS становить ≥0,12 с (чим він триваліший, тим частіше наявне органічне захворювання серця). 5. Комплекс QRS розщеплений або зазубрений. 6. Зубець Т симетричний і має різноспрямоване (дискордантне) положення відносно комплексу QRS, а при ішемії міокарда може мати односпрямоване (конкордантне) положення. 7. Сегмент ST спочатку розміщений горизонтально, а потім направляється вгору чи донизу від ізолінії. 8. Визначається алоритмія чи шлуночкові екстрасистоли ІІІ–V градацій. 9. Атропінова проба не зменшує (інколи збільшує) кількість шлуночкових екстрасистол. 10. Кількість шлуночкових екстрасистол після фізичного навантаження збільшується. 11. Розміри та порожнини серця за даними ехоКГ збільшені, ФВ зменшується, ААП ефективні. |
Парасистолія
Визначення. Парасистолія — одночасне співіснування двох незалежних один від одного водіїв ритму серця. При парасистолії одним із водіїв ритму серця є синоатріальний вузол, другим — конкуруючий імпульс, розміщений у передсердях, АV-з’єднанні чи шлуночках.
Етіологія. Причини парасистолії ті самі, що й екстрасистолії.
Патогенез. Вважають, що парацентр (ектопічний водій ритму) — це вогнище клітин, здатних до спонтанної діастолічної деполяризації, нормального та аномального автоматизму. Ектопічний водій ритму серця (чи парацентр) постійно генерує імпульси, частота яких здебільшого становить 20–60 на 1 хв (інколи — 20–400 імпульсів на 1 хв). При цьому існують одночасно два незалежних один від одного водії ритму, зумовлені як «блокадою входу», так і «блокадою виходу» [17].
«Блокада входу» перешкоджає входженню синусових імпульсів у парацентр і його розрядці, однак не перешкоджає виходу імпульсів із парацентру. Часто імпульси, що генерує парацентр, не збуджують серце, і деякі імпульси не виходять із парацентру. Якщо послаблюється блокада входу, то збільшується кількість поодиноких чи послідовних збуджень міокарда парасистолічними імпульсами. Проте результатом послаблення блокади входу буде запізнення наступних парасистол або розрядка парацентру з його короткочасною зупинкою (інтермітована парасистолія). При цьому кратність міжектопічних інтервалів відображає характерну для парасистолії блокаду виходу 2 : 1; 3 : 1; 4 : 1 тощо. Якщо блокада виходу постійна, то відсутня можливість виникнення парасистолічних скорочень. У разі зникнення блокади виходу із парацентру пропускається велика кількість ектопічних імпульсів, і тоді утворюється парасистолічний ритм або парасистолічна тахікардія [19, 55].
Класифікація. Розрізняють передсердну, АV-, шлуночкову парасистолію.
Клініка та діагностика парасистолії наведені в алгоритмах 2.49–2.52.
|
Алгоритм 2.49. Критерії ЕКГ-діагностики парасистолії з використанням класичної тріади [19] Відсутня стійкість інтервалів між синусовим та наступними за ним парасистолічними комплексами (інтервали зчеплення між ними різні). У нормі коливання інтервалів зчеплення у спокої не перевищує 0,1 с, а при парасистолії вони значно перевищують цю норму. Характерне правило загального ділення: довжина найкоротшого інтервалу між двома послідовними парасистолами (автоматизм парацентру) перебуває у прямому математичному співвідношенні з іншими, тривалішими міжектопічними інтервалами. Останні є добутком загального дільника (довжина базального парасистолічного циклу) на кількість пропущених (що з’явилися на ЕКГ) парасистол. Наявність зливних комплексів парасистолічного та синусового (непарасистолічного) імпульсів є патогномонічною ознакою парасистолії. |
|
Алгоритм 2.50. Критерії ЕКГ-діагностики передсердної парасистолії [19] Парасистолічні зубці Р1 відрізняються за формою та/чи полярністю від синусових зубців, які стають зазубреними, розщепленими, двофазними або приплюснутими (шлуночковий комплекс QRS не змінюється). Передектопічні інтервали (інтервали зчеплення) варіюють, але меншою мірою, ніж при шлуночковій парасистолії. У деяких випадках зберігається правило загального дільника; в інших воно порушується в результаті моделювання довжини парасистолічного циклу. Передсердні екстрасистоли впливають на синоатріальний вузол. |
|
Алгоритм 2.51. Критерії ЕКГ-діагностики парасистолії із АV-з’єднання [19] Парасистолічні комплекси QRS вузькі, хоч інколи вони можуть бути аберантними. Зубці Р1 співпадають з комплексами QRS чи реєструються позаду них інверсією в ІІ, ІІІ, aVF-відведеннях. Інколи порушується правило загального дільника. При АV-парасистолії відсутні умови для утворення зливних комплексів QRS, якщо імпульс із парацентру (як і в нормі) розповсюджується по провідній системі шлуночків. Рідко формуються зливні зубці Р в результаті нашарування ретроградного Р1 на синусовий Р-зубець. Активність АV-парацентрів становить у більшості випадків 35–50 на 1 хв. |
|
Алгоритм 2.52. Критерії ЕКГ-діагностики шлуночкової парасистолії [19] Шлуночковий комплекс QRS деформований і становить ≥0,12 с. Тривалість інтервалів зчеплення різна. Зубець Р на ЕКГ відсутній. Під впливом фізичного навантаження та введення ізопреналіну, що стимулюють симпатичну НС, збільшується не тільки автоматизм синоатріального вузла, але в деяких випадках і парацентру. |
Розвиток резистентної форми порушень ритму серця спричиняють такі чинники: тяжкість ураження міокарда та наявність тяжких супутніх захворювань (ЦД, ХОЗЛ, хронічний гепатит, цироз печінки, хронічний пієло- та гломерулонефрит, остеохондроз шийного відділу хребта), розвиток ХСН, значне збільшення розмірів та об’ємів серця, зниження інотропної (насосної) функції серця, концентричний та ексцентричний тип ремоделювання, тривалість аритмії, часті епізоди ПТ, ФП, ТП, похилий та старечий вік, неадекватне лікування, значні порушення мікроциркуляції (судинні, позасудинні та внутрішньосудинні), гуморальної системи (збільшення синтезу норепінефрину, адреналіну), імунної системи, іонно-клітинної рівноваги (гіпокаліємія, гіпомагніємія), функціонального стану клітинних каналів, електрофізіологічних властивостей кардіоміоцитів, активація ПОЛ, зниження АОСЗ, розвиток гіпоксемії, гіпоксії, декомпенсованого метаболічного та респіраторного ацидозу та алкалозу тощо. Чим більше таких факторів, тим частіше виникає резистентність до лікування аритмії [19].
Лікування екстрасистолічної аритмії здійснюється за допомогою ААП.
Класифікація ААП (V. Williams, 1970; D. Harrison, 1986)
Клас І. Препарати, що блокують швидкі натрієві канали.
Клас 1А. Помірне сповільнення проведення імпульсу та подовження часу реполяризації:
- хінідин;
- прокаїнамід;
- дизопірамід;
- гілуритмал.
Клас 1В. Мінімальне сповільнення проведення імпульсу, вкорочення потенціалу дії:
- лідокаїн;
- мексилетин;
- токаїнід;
- фенітоїн.
Клас 1С. Виражене сповільнення проведення імпульсу, мінімальне подовження часу реполяризації:
- пропафенон;
- флекаїнід;
- етацизин;
- енкаїнід;
- алапінін;
- морацизин.
Клас ІІ. ББА:
- пропранолол;
- метопролол;
- есмолол;
- атенолол.
Клас ІІІ. Препарати, що блокують калієві канали.
Препарати, що подовжують потенціал дії:
- аміодарон, дронедарон;
- бретилій;
- соталол;
- ібутилід.
Клас ІV. Препарати, що сповільнюють АV-проведення імпульсу.
Блокатори повільних кальцієвих каналів (АК):
Класифікацію ААП за механізмом їх основної дії наведено в табл. 2.100.
Таблиця 2.100. Класифікація ААП за механізмом їх основної дії
|
Місце дії |
Препарат |
|
Передсердя |
Дофетилід, ібутилід |
|
Шлуночки |
Лідокаїн, мекситил, токаїнід |
|
АV-вузол |
Аденозин, ББА, АК (верапаміл, дилтіазем), дигоксин |
|
Передсердя, шлуночки, допоміжні AV-провідні шляхи |
Аміодарон, пропафенон, флекаїнід, прокаїнамід, дизопірамід, хінідин, соталол, дронедарон |
Особливості застосування ААП у вагітних та їх безпеку узагальнено в табл. 2.101. Слід зазначити, що абсолютно безпечних ААП для вагітних не існує.
Таблиця 2.101. Класифікація лікарських препаратів та їх безпека для плода (FDA, USA, 2002)
|
Категорії |
Визначення |
ААП |
|
А |
Контрольовані дослідження у вагітних не виявили ризику для плода |
— |
|
B |
Ризик не доведений. За результатами РКД у вагітних фетотоксичність препарату не виявлена, але в експерименті токсична дія описана, або за результатами експерименту фетотоксичність не спостерігалась, однак досліджень у вагітних не проводили. Ризик фетотоксичності визначається, однак вона незначна |
Лідокаїн, соталол, морацизин |
|
C |
Ризик не може бути адекватно оцінений. Фетотоксичність препарату не досліджена в РКД або в експерименті показано токсичну дію препарату. Потенційний ефект препарату перевищує ризик фетотоксичності |
Хінідин, дизопірамід, прокаїнамід, флекаїнід, пропафенон, пропранолол, метопролол, ібутилід, верапаміл, дилтіазем, дигоксин, аденозин |
|
D |
В експериментальних клінічних дослідженнях доведений ризик для плода. Препарат розцінюється як небезпечний або може застосовуватись у вагітних за життєвими показаннями, а також у разі неефективності чи неможливості застосування препаратів, які належать до класів A, B, C |
Фенітоїн, аміодарон, атенолол |
|
X |
Небезпечний для плода препарат: негативний вплив цього лікарського засобу на плід перевищує потенційну користь для майбутньої матері |
— |
Існує нова класифікація під назвою «Сициліанський гамбіт», в якій відображений молекулярний рівень дії ААП, що має більш теоретичне, ніж практичне значення.
Коротка електрофізіологічна характеристика ААП
ААП І класу:
1. Зменшують швидкість початку деполяризації (фаза 0 потенціалу дії), що супроводжується суттєвим сповільненням проведення електричного імпульсу по передсердях і системі Гіса — Пуркіньє.
2. Зменшують швидкість спонтанної діастолічної деполяризації (фаза 4 потенціалу дії), що призводить до зниження автоматизму ектопічних центрів ІІ і ІІІ порядку, також синоатріального вузла (ІА і ІС груп).
3. Знижують амплітуду потенціалу дії та збільшують межовий потенціал, у зв’язку з чим збудливість міокарда передсердь і шлуночків зменшується.
4. ААП ІА класу трохи підвищують частоту синусового ритму, подовжують інтервал Р–Q, розширюють комплекс QRS, інтервал Q–T, пригнічують функцію синоатріального вузла з розвитком синусової брадикардії, спричиняють БНПГ та АV-блокаду дистального типу.
5. ААП ІВ класу діють переважно на процес початку деполяризації клітин (систему Гіса — Пуркіньє та міокард шлуночків), практично не впливають на АV-з’єднання і на функцію синусового вузла.
6. ААП ІС класу пригнічують початкову деполяризацію, сповільнюють збудження в системі Гіса — Пуркіньє, міокарді передсердь і шлуночків, пригнічують функцію синоатріального вузла, АV-провідність.
Протипоказання до призначення ААП І класу: постінфарктний кардіосклероз, аневризма ЛШ, ГЛШ (товщина стінок >14 мм), дисфункція ЛШ, ХСН.
ААП ІІ класу (ББА):
1. Знижують автоматизм синоатріального вузла та інших ектопічних вогнищ.
2. Сповільнюють АV-провідність і провідність по додаткових провідних шляхах (пучок Кента тощо).
3. Підвищують поріг фібриляції ішемізованого міокарда шлуночків.
4. Суттєво не впливають на рефрактерні періоди клітин системи Гіса — Пуркіньє, міокард передсердь і шлуночків.
Детальніша характеристика та особливості клінічної фармакології ББА наведені в табл. 2.102.
Таблиця 2.102. Фармакологічні особливості окремих ББА (згідно з Braunwald, 2012)
|
Характеристика |
Пропранолол |
Метопролол |
Атенолол |
Бісопролол |
Бетаксолол |
Небіволол |
Карведилол |
|
Добова доза, мг/добу |
40–480 |
50–200 |
25–100 |
2,5–20 |
5–20 |
2,5–10 |
12,5–50 |
|
Біодоступність, % дози |
30 |
50 |
40 |
90 |
90 |
90 |
25–35 |
|
Зв’язування білками, % |
93 |
12 |
<5 |
30 |
50–60 |
98 |
98 |
|
Період напіввиведення, год |
3,5–6 |
14–25 |
6–9 |
7–15 |
12–22 |
12–24 |
7–11 |
|
Домінуючий шлях виведення |
Печінка |
Нирки |
Печінка (50%), |
Нирки |
Печінка |
Печінка |
Печінка |
|
Адреноблокаторна селективність |
β1, β2 |
+β1 |
+β1 |
++β1 |
+β1 |
+β1 |
+β1, β2, а |
|
Ліпофільність |
+++ |
++ |
0 |
+ |
0 |
0 |
+ |
Примітка. +, ++, +++ — ступені вираженості.
ААП ІІІ класу:
1. Блокують калієві, частково швидкі натрієві, повільні кальцієві канали; чинять бета- та альфа-блокуючу дію.
2. Пригнічують автоматизм синоатріального вузла та ектопічних центрів.
3. Підвищують поріг ФШ.
ААП ІV класу (АК):
1. Блокують повільні кальцієві канали.
2. Зберігають нормальну провідність у міокарді передсердь, шлуночків додаткових провідних шляхах (пучок Кента).
3. Пригнічують тригерну активність серцевих волокон.
4. Підвищують поріг ФШ і передсердь.
5. Знижують автоматизм синоатріального вузла, АV-з’єднання та інших ектопічних центрів.
Дози ААП наведено в таблиці 2.103.
Таблиця 2.103. Дозування основних ААП при аритміях серця
|
Назва ААП |
Спосіб застосування |
Середня разова |
Кількість прийомів на день |
Середня добова доза, мг |
|
ААП І класу |
||||
|
Хінідин |
П |
200–400 |
3–6 |
1600–2000 |
|
Дизопірамід |
П |
200 |
3 |
600 |
|
в/в |
150 |
1 |
150 |
|
|
Прокаїнамід |
в/в; в/м |
1000 |
1–2 |
1000–2000 |
|
Лідокаїн |
в/в; в/м |
200 |
3–5 |
600–1000 |
|
Мексилетин |
П |
200 |
3 |
600 |
|
В/в |
250 |
1–2 |
250–500 |
|
|
Етацизин |
П |
50 |
3 |
150 |
|
в/в |
50 |
1–2 |
50–100 |
|
|
Пропафенон |
П |
150 |
4 |
600 |
|
в/в |
70 |
1 |
70 |
|
|
Алапінін |
П |
25–50 |
3 |
75–150 |
|
ААП ІІ класу |
||||
|
Пропранолол |
П |
40–80 |
3 |
120–240 |
|
в/в |
1–5 |
1 |
1–5 |
|
|
П |
50–100 |
1–2 |
100–200 |
|
|
П |
50–100 |
1–2 |
100–200 |
|
|
П |
5–10 |
1–2 |
10 |
|
|
П |
25 |
1–2 |
50 |
|
|
П |
5 |
1–2 |
5–10 |
|
|
ААП ІІІ класу |
||||
|
П |
200–400 |
3 |
600–1200 |
|
|
В/в |
300 |
2 |
600 |
|
|
П |
40–80 |
3 |
120–240 |
|
|
Бретилій |
в/в, в/м |
50 |
2–3 |
100–150 |
|
ААП ІV класу |
||||
|
П |
40–80 |
3 |
120–240 |
|
|
в/в |
50 |
2–3 |
100–150 |
|
|
Дилтіазем |
П |
60–90 |
3 |
180–270 |
Примітки. П — перорально. Насичуюча доза аміодарону становить 150–300 мг в/в; потім — повільна інфузія 900 мг зі швидкістю 1 мг/хв протягом 6 год; підтримувальна швидкість введення 0,5 мг/хв протягом 18 год.
Практично всім ААП властива аритмогенна (проаритмогенна) дія. Особливо небезпечна дія властива ААП ІА, ІС класів — відбувається подовження інтервалу Q–T, комплексу QRS, що в деяких випадках призводить до розвитку ШТ, у тому числі «пірует»-тахікардії і навіть ФШ. Тому важливим напрямком в аритмології є вивчення предикторів (факторів ризику) аритмогенної дії ААП (табл. 2.104).
Таблиця 2.104. Предиктори аритмогенної дії ААП з можливим розвитком шлуночкової проаритмії
|
ААП ІА і ІІІ класу |
ААП ІС класу |
|
1. Різні предиктори аритмогенної дії:
2. Додавання до ААП інших ліків:
3. Синусова брадикардія:
|
Різні предиктори аритмогенної дії:
|
Принципи підбору антиаритмічної терапії при постійних або часто рецидивуючих аритміях [19, 26, 34, 71]
З урахуванням безпеки ААП оцінку їхньої ефективності слід розпочинати з ББА та аміодарону. У разі неефективності монотерапії аміодарон поєднують з ББА. Якщо немає брадикардії та подовження інтервалу P–R, можна поєднувати аміодарон з будь-яким ААП. У хворих із брадикардією до аміодарону можна додавати ББА піндолол, якому притаманна внутрішньосимпатоміметична активність; він не знижує ЧСС. Поєднання ББА з аміодароном ефективніше знижує смертність, ніж монотерапія. За неефективності цих препаратів застосовують ААП ІС класу — пропафенон у поєднанні з ББА чи іАПФ, що зменшує вираженість і частоту побічних реакцій. Інші ААП І класу менш ефективні і спричиняють більше побічних реакцій.
Показання до лікування при суправентрикулярній екстрасистолії:
- погана переносимість суправентрикулярної екстрасистолії;
- високий ризик ФП при мітральному стенозі, патології передсердь;
- часта суправентрикулярна екстрасистолія (700–1000 на добу і більше).
Показання до лікування шлуночкової екстрасистолії:
- прогресуючий перебіг захворювання з істотним збільшенням кількості шлуночкової екстрасистолії;
- часті політопні, парні, групові шлуночкові екстрасистолії, загрозливі щодо виникнення ШТ, ФШ;
- алоритмія (бі-, три-, квадригеменія), короткі «пробіжки» ШТ, які супроводжуються СН;
- шлуночкові екстрасистолії на фоні небезпечних аритмій (синдром подовженого інтервалу Q–T, пролапс мітрального клапана);
- шлуночкові екстрасистолії на фоні ГКС, синдрому WPW, синдрому Кларка — Леві — Крітеско.
За наявності суб’єктивної непереносимості екстрасистолії показані раціональна психотерапія, седативні засоби, транквілізатори, антидепресанти. У разі досягнення стійкого седативного й антиаритмічного ефектів добова доза ААП протягом кожних 6–7 днів знижується на ⅓ до повної відміни. При поодиноких монофокусних шлуночкових екстрасистоліях у хворих на ССЗ без порушень гемодинаміки і коронарного кровообігу призначати ААП не варто. У хворих на ССЗ і структурними захворюваннями міокарда з загрозою ФШ, ШТ застосовують ББА, іАПФ, БРА, антагоністи альдостерону, аміодарон і пропафенон.
Стандарти лікування при екстрасистолії наведені в алгоритмі 2.53.
|
Алгоритм 2.53. Лікування при екстрасистолічній аритмії, резистентній до терапії [19] Суправентрикулярна екстрасистолія: Крок 1. Монотерапія АК верапамілом (120–240 мг/добу), ББА метопрололом, бісопрололом — 5–10 мг/добу, БКК аміодароном — 600–1000 мг/добу, соталолом — 80–160 мг/добу. Крок 2. Комбінована терапія з іАПФ або сартанами:
БРА та іАПФ опосередковано чинять антиаритмічну дію, посилюють дію основних ААП та зменшують їхні побічні ефекти. Дигоксин у монотерапії не застосовують, а в поєднанні з ББА, АК верапамілом або аміодароном його побічні реакції значно зменшуються. При поєднаному лікуванні хворих з аміодароном і верапамілом дозу дигоксину слід знижувати на 50%, оскільки відбувається накопичення дигоксину та верапамілу в крові. ААП І класу у пацієнтів із суправентрикулярною екстрасистолією при органічному ураженні міокарда (ІМ, ДКМП тощо) не застосовують у зв’язку з високим ризиком виникнення проаритмогенного ефекту, що може призводити до ФШ. Шлуночкова екстрасистолія (РКД САST, 1989): Крок 1. Монотерапія ААП І класу (лідокаїн, пропафенон, етацизин, мекситил, алапінін, дизопірамід) і ІІІ класу (аміодарон) у середніх терапевтичних дозах. Препарати ІА, ІС класу і аміодарон зменшують як суправентрикулярні, так і шлуночкові екстрасистоли. Дронедарон при тривалому застосуванні може спричиняти розвиток злоякісних аритмій серця. ААП І класу застосовують при неорганічних захворюваннях серця; ААП ІІІ класу — при органічній патології серця. Крок 2. Комбіноване лікування:
|
Примітка. ААП І класу можна застосовувати тільки короткочасно: у разі тривалого застосування (впродовж місяців, років) смертність підвищується у 2,5–3,5 раза (РКД СAST). Сартанам властива більша опосередкована антиаритмічна дія, ніж іАПФ.
Критерії ефективності антиаритмічної терапії (за B. Lown):
1) зменшення на 70–80% загальної кількості шлуночкових екстрасистол на добу;
2) зменшення на 90% і більше кількості парних шлуночкових екстрасистол;
3) пригнічення на 100% «пробіжок» шлуночкової ПТ і ранніх шлуночкових екстрасистол за типом R на Т.
Стандарти диференційованого лікування при парасистолії наведено в алгоритмі 2.54.
|
Алгоритм 2.54. Диференційоване лікування при суправентрикулярній та шлуночковій парасистолії [19] Загальні заходи: 1. Функціональні парасистоли лікувати не потрібно. 2. Здійснюється етіотропне лікування захворювання. 3. Корекція гіпокаліємії, гіпомагніємії, порушень ПОЛ та АОСЗ. Крок 1. Лікування при суправентрикулярній парасистолії: 1. Верапаміл по 240 мг/добу чи дилтіазем по 90–180 мг/добу. 2. ББА (анаприлін, метопролол, бісопролол) в оптимальних дозах. Крок 2. Аміодарон у 1-й тиждень — 600 мг/добу, у 2-й тиждень і надалі — 200–400 мг/добу. Лікування шлуночкової парасистолії: Крок 1. Лікування одним ААП: 1. ББА + препарат магнію + триметазидин. 2. Аміодарон + препарати магнію (сірчанокисла магнезія) + триметазидин. Крок 2. Комбіноване лікування ААП: 1. ББА у низьких дозах + ААП І класу в середніх терапевтичних дозах + препарати магнію + іАПФ (чи БРА). 2. Аміодарон у дозі 200–600 мг/добу (насичення проводиться за схемою) + препарати магнію + іАПФ (чи БРА). |
Примітка. ААП І класу застосовують короткими курсами лікування впродовж 1–4 тиж, оскільки при тривалому їх застосуванні підвищується смертність пацієнтів. З метою зменшення проаритмогенних ефектів ААП І класу їх слід комбінувати з іАПФ або БРА.
У разі частої монотопної шлуночкової екстрасистолії (від декількох тисяч до 20–30 тис./добу), резистентної до антиаритмічної терапії, та неможливості тривалого застосування ААП, їх поганого перенесення чи несприятливого прогнозу виконується ЕФД з метою уточнення локалізації та здійснення радіочастотної абляції аритмогенного вогнища.
Профілактика. Первинна профілактика передбачає запобігання розвитку захворювань серця та судин, вторинна — застосування таких препаратів, як аміодарон, соталол, ББА і ААП І класу (останні застосовують коротким курсом терапії).
2.8.2. Пароксизмальні тахікардії
Згідно з даними ААК, у США від аритмій серця щорічно помирають 300 000–600 000 осіб.
Визначення. ПТ — це напад серцебиття з ЧСС 140–220 уд./хв з правильним (регулярним) ритмом.
Етіологія та патогенез — див. розділ 2.8.1. Схема провідних шляхів серця наведена на рис. 12 (див. кольорову вкл.).
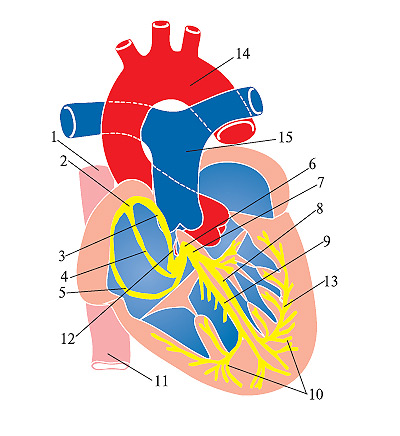 Рис. 12. Схематичне зображення провідної системи серця [адаптовано за: Настанова з кардіології / За ред. В.М. Коваленка, 2009]
Рис. 12. Схематичне зображення провідної системи серця [адаптовано за: Настанова з кардіології / За ред. В.М. Коваленка, 2009]1 — верхня порожниста вена; 2 — синусно-передсердний вузол; 3 — передній міжвузловий і міжпередсердний тракт Бахмана; 4 — середній міжвузловий тракт Венкебаха; 5 — задній міжвузловий тракт Горіла; 6 — передсердно-шлуночковий вузол; 7 — передсердно-шлуночковий пучок; 8 — ліва ніжка передсердно-шлуночкового пучка; 9 — права ніжка пучка Гіса; 10 — субендокардіальна сітка волокон Пуркіньє; 11 — нижня порожниста вена; 12 — коронарний синус; 13 — передня гілка лівої ніжки пучка Гіса; 14 — аорта; 15 — задній легеневий стовбур
2.8.2.1. Пароксизмальні надшлуночкові тахікардії
Суправентрикулярні ПТ становлять 4/5 від загальної кількості тахікардій, які займають проміжне положення між потенційно фатальними аритміями і доброякісними порушеннями ритму серця. До них належать синоатріальні, передсердні та АV-ПТ.
Частою причиною розвитку суправентрикулярної ПТ є синдром WPW (передзбудження шлуночків), який трапляється в загальній популяції з частотою 0,1–0,3% (у чоловіків частіше, ніж у жінок). У 80% хворих із синдромом WPW спостерігаються реципрокні тахікардії. Ризик РСС у хворих із синдромом WPW низький і становить 0,15–0,39% за період спостереження від 3 до 10 років. Однак у 50% раптово померлих осіб із синдромом WPW причиною смерті є епізод тахіаритмії.
Класифікація надшлуночкових тахікардій
Реципрокні:
- хронічні;
- пароксизмальні (ПТ).
Вогнищеві (ектопічні):
- хронічні;
- пароксизмальні (ПТ).
Надшлуночкові тахікардії:
- синопередсердна (синоатріальна);
- передсердна (атріальна);
- передсердно-шлуночкова (АV-);
- вузлова:
- звичайного типу;
- незвичайного типу;
- з додатковими шляхами проведення:
- ортодромна;
- антидромна.
Клініка суправентрикулярної ПТ:
1. Раптово виникає серцебиття, шум у вухах, кардіалгія в результаті збільшення ЧСС та потреби міокарда в кисні.
2. Біль у животі, спричинений спазмом мезентеріальних судин.
3. Уриноспастика (urina spastica) — світла сеча, часте сечовипускання.
4. Запаморочення — спазм судин головного мозку з розвитком ішемії.
Критерії діагностики ПТ наведені в алгоритмах 2.55–2.60.
|
Алгоритм 2.55. ЕКГ-критерії діагностики синоатріальної ПТ [19] 1. Зубець Р знаходиться на своєму місці та не відрізняється від синусного, хоч інколи при вираженій тахікардії він може дещо зменшуватися. 2. Комплекс QRS не змінюється. 3. Під час нападу тахікардії інколи може виникати АV-блокада І–ІІ ступеня. 4. Епізоди тахікардії провокуються і купіруються черезстравохідною електростимуляцією передсердь. 5. При в/в болюсному введенні 10–30 мг АТФ напад не припиняється, хоча ЧСС знижується і виникає короткочасна АV-блокада ІІ ступеня. |
|
Алгоритм 2.56. ЕКГ-критерії діагностики пароксизмальної передсердної ектопічної тахікардії [19] 1. Зубець Р зазубрений, розщеплений або двофазний, знаходиться перед комплексом QRS. 2. Комплекс QRS нормальний. 3. Тривалість інтервалу R–R різна, що виключає механізм re-еntry. 4. Інколи під час нападу виникає АV-блокада ІІ ступеня з періодичним випадінням окремих комплексів. |
|
Алгоритм 2.57. ЕКГ критерії діагностики пароксизмальної передсердної реципрокної тахікардії [19] 1. Зубець Р деформований і часто нашаровується на зубець Т попереднього шлуночкового комплексу при високій тахікардії. 2. Комплекс QRS нормальний, а при високій ЧСС можливий розвиток функціональної блокади однієї з ніжок пучка Гіса з аберантними комплексами QRS у результаті порушення проведення імпульсів по шлуночках. Відстань між інтервалами R–R однакова. 3. З метою ідентифікації зубця Р та оцінки аберантних комплексів QRS показане проведення черезстравохідної електростимуляції передсердь або реєстрація ритмограми на фоні проведення вагусних проб (останні сповільнюють ЧСС), що приводить до більш чіткого визначення зубця Р та зниження аберантності. 4. Можливий розвиток АV блокади І–ІІ ступеня. |
|
Алгоритм 2.58. ЕКГ-критерії діагностики пароксизмальної АV-тахікардії (див. рис. 2.11) 1. Напад виникає раптово та закінчується з підвищенням ЧСС до 140–220 уд./хв при збереженні правильного ритму (інтервал R–R однаковий, що підтверджує механізм re-еntry). 2. Наявність у ІІ, ІІІ та aVF-відведеннях негативних зубців Р, розміщених позаду комплексів QRS на сегменті ST, які можуть також зливатися з ними та не реєструватися на ЕКГ. 3. Визначаються нормальні та незмінені шлуночкові комплекси QRS, подібні на ті, що реєструвалися до виникнення епізодів ПТ (за винятком випадків аберацій шлуночкового комплексу QRS у результаті порушення проведення імпульсів по них). |
|
Алгоритм 2.59. Критерії діагностики пароксизмальної ортодромної АV-тахікардії при синдромі WPW [19] 1. ЧСС становить ≥170–220 уд./хв., ритм серця правильний, інтервали R–R однакової тривалості. 2. Негативні зубці Р частіше не реєструються, оскільки вони нашаровуються на шлуночковий комплекс QRS (інколи негативні зубці Р знаходяться після комплексу QRS у результаті ретроградної активації передсердь). 3. Шлуночкові комплекси QRS не деформуються (імпульси в шлуночки поступають по АV-з’єднанню). 4. АТФ проба припиняє напад тахікардії в 95–100%. 5. Черезстравохідна електростимуляція передсердь призупиняє напад ПТ. |
|
Алгоритм 2.60. ЕКГ-критерії діагностики антидромної пароксизмальної АV-тахікардії при синдромі WPW 1. Тахікардія розпочинається з передсердної екстрасистоли, розповсюджується до шлуночків через пучок Кента, оскільки він блокований у вході в АV-вузол, у результаті чого шлуночковий комплекс QRS становить 0,1–0,11 с, однак не деформується (віддзеркалює максимальне перезбудження шлуночків, коли вони збуджуються неодночасно). 2. ЧСС становить 170–250 уд./хв. 3. Зубці Р не реєструються, оскільки вони нашаровуються на кінцеву частину комплексу QRS (інколи негативний зубець Р розміщений після комплексу QRS). 4. Черезстравохідна електростимуляція передсердь дозволяє припинити напад антидромної ПТ. |
Ектопічна ПТ виникає в результаті появи патологічного імпульсу в передсердях, АV-вузлі, які утворюються в діастолу (такий механізм називають спонтанною діастолічною деполяризацією).
У нормі синусовий імпульс спричиняє розрядку імпульсів у провідній системі (ектопічних латентних пейсмекерів), за рахунок чого зберігається синусовий ритм. У патології при гіперкатехоламінемії активуються клітини мембран міоцитів і виникає патологічний водій ритму з ЧСС >140 уд./хв.
Клінічні та диференційні ознаки ектопічної ПТ:
1. Пароксизм тахікардії виникає поступово протягом декількох хвилин (період «розігріву») та поступово закінчується (період «охолодження»).
2. Невисока ЧСС (140–160 уд./хв).
3. Пульс то прискорюється, то сповільнюється.
4. Напад неможливо провокувати частою або дуже частою черезстравохідною електрокардіостимуляцією.
5. Електрична кардіоверсія не провокує і не нормалізує напад.
Тахікардії з вузькими комплексами QRS [19, 60]
Тахікардія з вузькими комплексами QRS (комплекс QRS <120 мс) може спричинятися формулюванням імпульсів у синусовому вузлі (синусова тахікардія), петлею re-entry у синусовому вузлі або прилеглій ділянці передсердя (синусова реципрокна тахікардія), в передсерді (передсердна тахікардія, ТП та ФП), в ділянці AV-вузла — пучок Гіса (тахікардія AV-з’єднання), а також у результаті re-entry, що виникає в AV-вузлі або в перехідній зоні по периметру AV-вузла — AV-вузлова реципрокна тахікардія або re-entry, при яких AV-вузол і пучок Гіса утворюють шлях антеградної AV-провідності, а додатковий AV-шлях забезпечує ретроградне проведення — ортодромна AV-реципрокна тахікардія. Досить часто ретельний аналіз ЕКГ у 12 відведеннях, особливо якщо вдається зареєструвати її в ході масажу каротидного синуса чи іншої вагусної проби, полегшує встановлення правильного діагнозу. Правильна ідентифікація місця виникнення передсердної активності, її частота та зв’язок зі шлуночковим ритмом мають велике значення.
У разі ортодромної ПТ імпульс проходить в антеградному напрямку по основному шляху (AV-вузлі, передсердях) і повертається ретроградно по додатковому шляху. Комплекс QRS не збільшується. Ця ПТ купірується і провокується ЕКС. ЕІТ ефективна.
Тахікардії з широкими комплексами QRS [19, 26]
За широкими комплексами QRS (>120 мс) важливо диференціювати надшлуночкову тахікардію від ШТ. При лікуванні пацієнтів із надшлуночковою тахікардією препарати, що призначаються парентерально, особливо верапаміл або дилтіазем, є потенційно небезпечними, оскільки можуть зумовити розвиток колапсу у хворих зі ШТ. Якщо діагноз «надшлуночкова тахікардія» неможливо підтвердити або заперечити, то тахіаритмію слід розцінювати як ШТ і проводити відповідне лікування.
Тахікардії з широкими комплексами QRS можна поділити на 3 групи: надшлуночкова тахікардія з БНПГ; надшлуночкова тахікардія з проведенням по додатковому передсердно-шлуночковому з’єднанню; ШТ.
Надшлуночкова тахікардія з БНПГ. БНПГ може визначатися первинно чи виникати лише під час тахікардії, коли одна з гілок пучка Гіса перебуває в рефрактерному періоді у зв’язку з частим ритмом. БНПГ може виникнути при будь-якій надшлуночковій тахікардії. Якщо під час ортодромної AV-реципрокної тахікардії розвивається БНПГ, то частота тахікардії може знизитися, якщо блокована ніжка пучка Гіса розміщена на тому ж боці, що й додаткове передсердно-шлуночкове з’єднання.
Надшлуночкова тахікардія з проведенням по додатковому передсердно-шлуночковому з’єднанню. Надшлуночкова тахікардія за участю додаткового передсердно-шлуночкового з’єднання може виникати під час передсердної тахікардії, ТП, ФП, AV-вузлової реципрокної тахікардії чи антидромної реципрокної тахікардії. Остання виникає при антеградному проведенні по додатковому передсердно-шлуночковому з’єднанню і ретроградному проведенні по AV-вузлу чи іншому додатковому передсердно-шлуночковому з’єднанню.
Антидромна ПТ. Імпульс проходить через пучок Кента і повертається по основному шляху. Комплекс QRS розширений до 0,10 с. Трапляється у 5% випадків.
Для діагностики і вивчення патогенезу аритмій велике значення мають функціональні проби і різні методи дослідження.
Використання різних проб і спеціальних методів дослідження для діагностики аритмій і блокад серця:
1. Холтерівське моніторування ЕКГ — найбільш інформативний метод вивчення аритмій серця, який дозволяє реєструвати ЕКГ у спокої, під час їжі, фізичних і психоемоційних навантажень протягом ≥24 год з автоматичним аналізом порушень ритму серця. Цей метод дозволяє найточніше оцінювати ЧСС, кількість порушень ритму серця, їх розподіл протягом доби залежно від наявності ішемії міокарда чи без неї. Холтерівське моніторування ЕКГ дозволяє реєструвати пароксизмальні порушення ритму серця, розвиток ектопічних реципрокних (re-entry) тахікардій, «вагусних» та «адренергічних» порушень ритму та провідності серця, здійснювати контроль за клінічною ефективністю ААП.
2. Проба з фізичним навантаженням (велоергометрія, тредміл) може провокувати виникнення аритмій серця під час навантаження і в ранній відновлювальний період внаслідок активації симпатоадреналової системи, підвищення синтезу катехоламінів і ЧСС з розвитком гіпоксії міокарда та метаболічного ацидозу. Збільшення кількості екстрасистол під час навантаження при високій ЧСС або в першу хвилину після його закінчення свідчить про можливий зв’язок з ІХС, а «доброякісні» аритмії зникають під час навантаження і відновлюються через 3–5 хв після його закінчення. Розвиток ПТ є абсолютним або відносним протипоказанням до виконання навантажувальних проб.
3. Проба з атропіном допомагає виявити вплив блукаючого нерва на характер аритмії, коли вводять в/в 0,02 мг/кг маси тіла атропіну з подальшою реєстрацією ЕКГ через 5; 15; 45 і 60 хв. При вираженій ваготонії ЧСС зростає до ≥40%, а кількість екстрасистол зменшується або вони зникають.
4. Ортостатична проба дозволяє уточнити залежність аритмій від стану вегетативної НС. При переході в горизонтальне положення можуть виникати функціональні (вагусні) аритмії, у вертикальне — аритмії можуть бути спричинені структурними ураженнями серця за рахунок активації симпатичної НС.
5. Добутамінова проба заснована на в/в введенні препарату в дозі 250 мг до виникнення ектопічної аритмії в результаті підвищення ЧСС, потреби міокарда в кисні і підвищення АТ. Коли виникає аритмія, введення добутаміну припиняють.
6. Проба з пропранололом ґрунтується на в/в введенні препарату в дозі 0,1 мг/кг (але не більше 10 мг) з подальшою реєстрацією ЕКГ через 5; 15; 45 та 60 хв. При гіперактивності симпатичної НС негативний зубець Т стає позитивним і сегмент ST стає на ізолінії, що свідчить про функціональні зміни в міокарді. Якщо негативний зубець Т залишається без змін або він поглиблюється, це зумовлено органічними змінами в міокарді.
7. Проба з ізопреналіном застосовується для провокації ектопічної активності міокарда з виникненням аритмій. Пацієнту в/в вводять 0,5 мг ізопреналіну зі швидкістю 30–40 крапель/хв. Під впливом препарату підвищується ЧСС, потреба міокарда в кисні, підвищується робота серця, збудливість міокарда і виникають аритмії серця (навіть ШТ за типом «пірует»).
8. Ендокардіальне ЕФД — еталонний метод діагностики суправентрикулярних і шлуночкових порушень ритму серця, а також підбору ААП. Пацієнтам вводять один або більше багатоелектродних катетерів у різні камери серця. Одночасна реєстрація імпульсів з багатьох точок дає змогу картувати послідовність збудження міокарда передсердь, АV-вузла, шлуночків і виявити аномальні шляхи проведення імпульсів.
9. Черезстравохідне ЕФД виконують з метою оцінки функціонального стану синусового вузла, АV-проведення, наявності додаткових шляхів проведення імпульсів, надшлуночкової ПТ.
10. Реєстрація пізніх потенціалів застосовується для виявлення аритмогенного субстрату в міокарді. При цьому в ураженому міокарді визначають низькоамплітудні високочастотні електричні сигнали наприкінці комплексу QRS або на початку сегмента ST, що свідчить про сповільнення проведення імпульсу і може стати субстратом для повторного входу хвилі збудження. За допомогою пізніх потенціалів шлуночків виявляють підвищений ризик фатальних аритмій після перенесеного ІМ.
11. Ехокардіографія дозволяє виявити функціональні чи органічні зміни в міокарді. При функціональних змінах у міокарді вводять ААП ІА, ІС класу, при органічних (ремоделюванні серця) — аміодарон.
З метою диференційної діагностики різних форм суправентрикулярної ПТ можна використовувати схему, рекомендовану ACC та ESC (табл. 2.105).
Таблиця 2.105. Диференційна діагностика різних форм тахікардій за допомогою в/в введення аденозину
|
Результат введення аденозину |
Форма тахікардії |
|
Зміни ЧСС відсутні |
|
|
Поступове сповільнення ЧСС, після чого настає повторне прискорення ритму |
|
|
Раптове припинення тахікардії |
|
Аритмії можна також умовно розподілити залежно від необхідності надання невідкладної допомоги (табл. 2.106).
Таблиця 2.106. Умовний розподіл порушень ритму і провідності залежно від необхідності надання невідкладної терапії
|
Аритмії, що потребують невідкладної терапії |
Аритмії, що не потребують невідкладної терапії |
|
|
Основні принципи невідкладної допомоги при ПТ:
1. При безсимптомних (зі стабільною гемодинамікою) нападах хворі потребують відновлення синусового ритму за допомогою вагусних проб і таблетованих медикаментів в амбулаторних умовах.
2. При частих симптомних нападах відновлення ритму здійснюється бригадами швидкої допомоги за допомогою в/в введення лікарських засобів.
3. При нестабільній гемодинаміці (гіпотензія, розвиток ІМ) рекомендується електрична кардіоверсія.
Особливості лікування при пароксизмальній ектопічній (вогнищевій) передсердній тахікардії:
1. Необхідно відмінити дигоксин, який спричиняє АV-блокаду і зумовлює розвиток цієї аритмії.
2. У значної частини хворих пароксизмальну ектопічну (вогнищеву) передсердну тахікардію купірують аденозином (АТФ), однак часто після його введення спостерігається трансформація її в ПТ з АV-блокадою.
3. Для купірування цієї аритмії застосовують АК верапаміл, дилтіазем, ББА в/в, які хоч рідко, але можуть купірувати її чи знизити ЧСС у результаті розвитку АV-блокади.
4. Застосування ААП ІА чи ІС класу призводить до пригнічення автоматизму, збільшення тривалості потенціалу дії і як наслідок — купірування цієї аритмії у деяких пацієнтів. Але слід пам’ятати, що ці препарати протипоказані при СН (у цьому разі краще застосовувати аміодарон).
5. Передсердна стимуляція чи введення аденозину (АТФ) може призвести до транзиторного постстимуляційного сповільнення частоти виникнення ПТ, в основі якої лежить аномальний автоматизм, але ці методи не купірують напад. Електрична кардіоверсія теж рідко купірує цю аритмію, однак у пацієнтів з механізмом mісro re-entry чи тригерною активністю кардіоверсія ефективна. Електрична кардіоверсія часто застосовується у випадках, коли медикаментозна терапія неефективна.
Спеціальних РКД стосовно лікування при пароксизмальній ектопічній (вогнищевій) передсердній тахікардії досі не здійснено.
Невідкладна терапія при ПТ з вузьким комплексом QRS та стабільною гемодинамікою передбачає такі заходи [19, 26]:
Купірування нападу ПТ з вузьким комплексом QRS за допомогою вагусних прийомів (проби Вальсальви, сильне натужування впродовж 10–15 с після глибокого вдиху, блювотного рефлексу шляхом подразнення кореня язика чи задньої стінки глотки, масажу каротидного синуса, «рефлексу занурювання» обличчя в холодну воду, який найефективніший тощо), що активують блукаючий нерв і сповільнюють АV-провідність (відновлення синусового ритму спостерігається часто). Масаж каротидного синуса виконують хворому в лежачому положенні нижче рівня кута нижньої щелепи та вище щитоподібного хряща протягом 5–10 с (тільки з одного боку). Купіруючий ефект вагусних проб становить 70–90%. Однак слід пам’ятати, що масаж каротидного синуса, зокрема, може спричинити порушення мозкового кровообігу і не рекомендується людям похилого віку, які хворіють на поширений атеросклероз. Проба з натискуванням на очні яблука має ризик ушкодження сітківки. Для хворих із ГКС та з порушенням мозкового кровообігу небезпечним може бути натужування. Вагусні проби не рекомендуються за наявності синдрому WPW (!).
У разі відсутності клінічного ефекту від вагусних проб застосовують протиаритмічні препарати. Препаратом вибору є аденозин (АТФ) або АК недигідропіридинового ряду верапаміл чи дилтіазем (їхня ефективність становить в цілому 90%) чи ББА при в/в введенні, що характеризуються швидким початком дії та коротким періодом напіввиведення. Пацієнтам із тяжкою формою бронхіальної астми аденозин не вводять; хворим, які отримують теофілін, для досягнення ефекту необхідні вищі дози препарату; при цьому дипіридамол потенціює дію аденозину. Застосування препаратів тривалої дії АК і ББА у пацієнтів із частими передсердними та шлуночковими екстрасистолами має свою перевагу, оскільки вони є пусковим механізмом непароксизмальної суправентрикулярної тахікардії.
Аденозин чи ЕІТ — методи вибору при гемодинамічній суправентрикулярній ПТ. Необхідно пам’ятати, що аденозин може спровокувати ФП у 1–15% випадків на тривалий час і бути небезпечним для хворих із синдромом передзбудження шлуночків. Побічні реакції аденозину: задишка, почервоніння обличчя, головний біль, які минають через 30 с.
Купірування ПТ із зубцем Р, який знаходиться після комплексу QRS, підтверджує діагноз АV-реципрокної тахікардії.
Рекомендації щодо усунення надшлуночкової тахікардії з вузькими комплексами (згідно з Рекомендаціями робочої групи з порушень ритму серця ВАКУ, 2018):
1. Купірування тахікардій слід починати з вагусних проб, що впливають на AV-провідність.
2. У разі відсутності ефекту пацієнтам зі стабільною гемодинамікою слід починати в/в введення ААП. Препаратами вибору є аденозин (АТФ) або АК верапаміл. Перевагу надають в/в введенню аденозину.
3. У разі неефективності аденозину, АК або в/в ББА необхідно виконати синхронізовану кардіоверсію.
Невідкладна допомога при АV-вузловій реципрокній тахікардії зі стабільною гемодинамікою та її профілактика:
1. Для лікування пацієнтів із частими та стійкими нападами такої тахікардії, якщо хворі відмовляються від катетерної абляції, перевагу надають застосуванню ААП.
2. При лікуванні пацієнтів без структурної патології міокарда, які резистентні до препаратів, що сповільнюють АV-провідність (АК, ББА, дигоксин), надають перевагу ААП ІС класу пропафенону та флекаїніду.
3. У переважній більшості таких випадків ААП ІІІ класу аміодарон і соталол не застосовують.
4. ААП ІА класу прокаїнамід застосовують обмежено, оскільки їх потрібно призначати тривало, вони характеризуються помірною ефективністю та аритмогенною дією.
5. Профілактичне застосування АК, ББА у хворих з АV-вузловою реципрокною тахікардією дало такі результати: РКД невеликої групи пацієнтів показало, що пероральне застосування верапамілу в дозі 360/480 мг/добу зменшує кількість і тривалість нападів. Тенденція до більш вираженого позитивного ефекту спостерігалася при застосуванні верапамілу у високих дозах.
6. Дигоксин (0,375 мг/добу), верапаміл (240 мг/добу) і пропранолол (240 мг/добу), що застосовувалися перорально при рандомізованому дослідженні у 11 хворих, мали однакову ефективність.
7. Віддалений ефект перорального застосування ААП флекаїніду при цій аритмії вивчений у відкритому дослідженні. Флекаїнід у дозі 200–300 мг/добу повністю запобігає виникненню ПТ у 65% пацієнтів. Результатами декількох рандомізованих подвійних сліпих досліджень підтверджено ефективність флекаїніду в профілактиці пароксизмів, що привело також до збільшення інтервалів між нападами, однак флекаїнід протипоказаний пацієнтам зі структурними захворюваннями серця. Препарати ІС класу часто поєднували з ББА з метою підвищення ефективності та зниження ризику АV-проведення 1 : 1 у разі виникнення ТП. Флекаїніду притаманна вища ефективність при постійній терапії, ніж верапамілу.
8. ААП ІС класу пропафенон також ефективний, що встановлено у плацебо-контрольованому дослідженні.
9. ААП ІІІ класу соталол в РКД у хворих з цією аритмією знижував частоту нападів тахікардії, а дофетилід у дозі 500 мг 2 рази на добу зменшив кількість нападів на 50% протягом 6 міс. У іншому відкритому дослідженні аміодарон при в/в введенні (5 мг/кг впродовж >5 хв) купірував напад у 8 із 9 хворих. Препарат безпечний при органічних захворюваннях серця і зниженні ФВ ЛШ.
Робоча група з порушень ритму серця ВАКУ (2018) опублікувала Рекомендації з невідкладної допомоги і тривалого лікування при суправентрикулярній тахікардії. При антидромній надшлуночковій ПТ не слід застосовувати серцеві глікозиди, верапаміл, дилтіазем, ББА (пропранолол, атенолол, надолол, метопролол), соталол у зв’язку з можливістю покращувати проведення імпульсу по допоміжному шляху та виникнення тріпотіння чи ФШ (!).
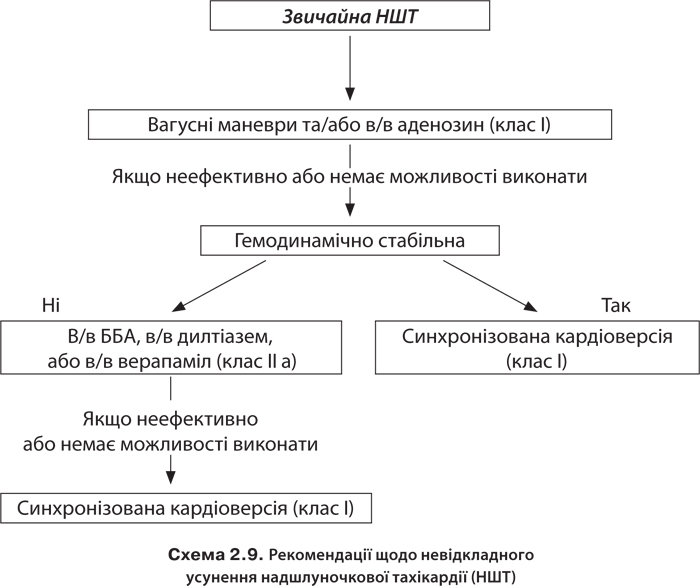
Рекомендації лікування при надшлуночковій ПТ АКК, ААС, ЄТК (2015) та ВАКУ (2016) наведені в схемі 2.9 і табл. 2.107.
Таблиця 2.107. Рекомендації з невідкладної допомоги при гемодинамічно стабільній надшлуночковій ПТ із правильним ритмом
|
ЕКГ-ознака |
Рекомендації |
Клас |
Рівень доказовості |
Ефективність |
|
Надшлуночкова ПТ з вузьким комплексом QRS |
Вагусні проби |
І |
В |
Високоефективно |
|
Аденозин |
І |
А |
Високоефективно |
|
|
Верапаміл, дилтіазем |
І |
А |
Високоефективно |
|
|
ББА |
ІІb |
С |
Низькоефективно |
|
|
Аміодарон |
ІІb |
С |
Низькоефективно |
|
|
Дигоксин |
ІІb |
С |
Низькоефективно |
|
|
Надшлуночкова ПТ з широким комплексом QRS надшлуночкова ПТ/ФП (при синдромі передекзитації) |
Флекаїнід |
І |
В |
Високоефективно |
|
Ібутилід |
І |
В |
Високоефективно |
|
|
Прокаїнамід |
І |
В |
Високоефективно |
|
|
Електрична кардіоверсія |
І |
С |
Високоефективно |
|
|
Тахікардія з широким комплексом QRS невідомої етіології |
Прокаїнамід |
І |
В |
Високоефективно |
|
Соталол |
І |
В |
Високоефективно |
|
|
Аміодарон |
І |
В |
Високоефективно |
|
|
Електрична кардіоверсія |
І |
В |
Високоефективно |
|
|
Лідокаїн |
ІІb |
В |
Малоефективно |
|
|
Аденозин |
ІІb |
С |
Малоефективно |
|
|
ББА |
ІІІ |
С |
Не показано |
|
|
Верапаміл |
ІІІ |
С |
Не показано |
|
|
Тахікардія з широким комплексом QRS невідомої етіології у хворих з дисфункцією ЛШ |
Аміодарон |
І |
В |
Високоефективно |
|
Електрична кардіоверсія |
І |
В |
Високоефективно |
|
|
Лідокаїн |
І |
В |
Високоефективно |
Примітка. Всі зазначені препарати вводять в/в. Препарати не призначають пацієнтам із дисфункцією ЛШ. Аденозин застосовують з обережністю при тяжкій патології коронарних судин внаслідок можливого виникнення синдрому міжкоронарного обкрадання. Можна використовувати для терапії першої лінії при катехоламіночутливих тахікардіях.
Рекомендації з тривалого ведення пацієнтів з AV вузловою реципрокною тахікардією — див. табл. 2.108.
Таблиця 2.108. Рекомендації з тривалого ведення пацієнтів з AV вузловою реципрокною тахікардією (АВВРТ)
|
Клінічна оцінка |
Рекомендація |
Клас |
Рівень доказовості |
|
Гемодинамічно нестабільна АВВРТ, що погано переноситься |
Катетерна абляція |
І |
В |
|
Верапаміл, дилтіазем, ББА, соталол, аміодарон |
ІІa |
С |
|
|
Флекаїнід, пропафенон |
ІІa |
С |
|
|
Рецидивуюча симптомна АВВРТ |
Катетерна абляція |
І |
В |
|
Верапаміл, дилтіазем |
І |
В |
|
|
ББА |
І |
С |
|
|
Дигоксин |
ІІb |
С |
|
|
Рецидивуюча АВВРТ, що не відповідає на введення ББА, АК, пацієнт не погоджується на проведення радіочастотної абляції |
Флекаїнід, пропафенон |
ІІa |
В |
|
Аміодарон, соталол |
ІІb |
С |
|
|
АВВРТ з нечастими та поодинокими пароксизмами, які доцільно повністю контролювати |
Катетерна абляція |
І |
В |
|
Задокументована суправентрикулярна ПТ з подвійним АV-вузлом, додатковим шляхом чи поодинокими ехо-ударами під час електрофізіологічного дослідження |
Верапаміл, дилтіазем, ББА, флекаїнід, пропафенон |
І |
С |
|
Катетерна абляція |
І |
С |
|
|
Нечасті АВВРТ, що добре переносяться |
Терапію не застосовують, вагусні проби |
І |
В |
|
Застосування медикаментів лише для усунення нападу |
І |
С |
|
|
Верапаміл, дилтіазем, ББА |
І |
В |
|
|
Катетерна абляція |
І |
В |
Рекомендації ААС і ЭТК стосовно купірування пароксизмів суправентрикулярної тахікардії наведені в табл. 2.109.
Таблиця 2.109. Методи купірування пароксизмальної суправентрикулярної тахікардії (адаптовано за АСС/АНА/ESС, 2003)
|
ЕКГ |
Метод |
Клас рекомендацій |
|
Суправентрикулярна тахікардія з вузьким комплексом QRS |
Вагусні проби |
І |
|
Аденозин |
І |
|
|
Верапаміл |
І |
|
|
ББА |
ІІb |
|
|
Аміодарон |
ІІb |
|
|
Дигоксин |
ІІb |
|
|
Суправентрикулярна тахікардія або ФП при синдромі WPW і Кларка — Леві — Крітеско |
Флекаїнід |
І |
|
Ібутилід |
І |
|
|
Прокаїнамід |
І |
|
|
ЕІТ |
І |
|
|
Неуточнена тахікардія з широким комплексом QRS |
Прокаїнамід |
І |
|
Соталол |
І |
|
|
Аміодарон |
І |
|
|
ЕІТ |
І |
|
|
Лідокаїн |
ІІb |
|
|
Аденозин |
Іb |
|
|
ББА |
ІІІ |
|
|
Верапаміл |
ІІІ |
|
|
Неуточнена тахікардія з широким комплексом QRS при наявності дисфункції ЛШ |
Аміодарон |
І |
|
ЕІТ |
І |
|
|
Лідокаїн |
І |
При введенні розчину АТФ на фоні застосування ББА може виникати ризик перехідного пригнічення синусового вузла з розвитком тяжкої брадикардії і навіть асистолії після купірування ектопічного ритму. Може також спостерігатися непередбачений ефект впливу аденозину на тонус судин у хворих із вазоспастичною стенокардією з можливим розвитком тяжкого ангінозного нападу. У разі розвитку затяжного нападу стенокардії на тлі застосування АТФ його антагоністом є теофілін (!).
Верапаміл слід призначати тільки у разі тахікардії з вузьким комплексом QRS. Призначення цього препарату при аберантних тахікардіях, коли причина аберації не встановлена, може стати фатальною помилкою, оскільки при антидромній ПТ з подовженим комплексом QRS верапаміл не показаний (!).
Отже, комбінація верапамілу з ББА може спричинити тяжку брадикардію, артеріальну гіпотензію і навіть асистолію, а введення АК дилтіазему з ББА є безпечнішим.
Однак в останніх рекомендаціях підкреслюється, що при масажі каротидного синуса може виникнути перехідна ішемія мозку або інсульт. Масаж недоцільно проводити при вислуховуванні шуму над сонною артерією (!).
Рекомендації щодо лікування при суправентрикулярних аритміях ACC/AHA/ESC (2015) узагальнено в алгоритмі 2.61.
|
Алгоритм 2.61. Лікування при ортодромній та антидромній пароксизмальній суправентрикулярній тахікардії на тлі синдрому WPW [19] І. Лікування пароксизмальної ортодромної тахікардії з вузьким комплексом QRS: Крок 1. 1. Вагусні проби (проба Вальсальви, масаж каротидного синуса, викликання блювотного рефлексу, занурювання обличчя в холодну воду, присідання навпочіпки). 2. АТФ — 10–30 мг або аденозин — 6–12 мг в/в болюсно впродовж 1–3 с (блокує калієві канали). Крок 2а. Підвищення рефрактерного періоду допоміжних провідних шляхів серця: аміодарон — 300–450 мг в/в струминно чи соталол — 40 мг в/в струминно. Крок 2б. Застосування ААП ІС і ІА класу:
Крок 3. При частих нападах тахікардії проводять абляцію, деструкцію та хірургічне перерізання додаткових провідних шляхів серця. ІІ. Лікування при антидромній ПТ з широким комплексом QRS: Крок 1. Вагусні проби; АТФ вводити небезпечно, оскільки після його застосування може виникати ФШ. Крок 2. Підвищення рефрактерного періоду додаткових провідних шляхів серця:
Крок 3. При частих і резистентних до лікування нападах тахікардії виконується абляція, деструкція і хірургічне розрізання допоміжних провідних шляхів серця. Хворим з антидромною ПТ з широким комплексом QRS виконувати негайну катетерну абляцію недоцільно. ІІІ. Лікування при надшлуночковій ПТ з широким комплексом QRS невідомої етіології:
ІV. Лікування при надшлуночковій ПТ з широким комплексом QRS невідомої етіології у хворих із дисфункцією ЛШ: Крок 1.
Крок 2. Електрична кардіоверсія. |
Тривале лікування хворих з аритміями на тлі додаткових шляхів проведення і імпульсу наведено в табл. 2.110.
Таблиця 2.110. Рекомендації щодо тривалої терапії пацієнтів з аритмією за наявності додаткових шляхів проведення
|
Вид аритмії |
Рекомендації |
Ефективність |
|
WPW-синдром (преекзитація та симптоматичні аритмії, що добре переносяться) |
Катетерна абляція |
Високоефективно |
|
Флекаїнамід, пропафенон, соталол, аміодарон |
Ефективно |
|
|
ББА |
Низькоефективно |
|
|
Верапаміл, дилтіазем, дигоксин |
Не показано |
|
|
WPW-синдром (із ФП і AV-реципрокною тахікардією), що швидко проводиться |
Катетерна абляція |
Високоефективно |
|
Флекаїнамід, пропафенон, соталол, аміодарон |
Ефективно |
|
|
ББА |
Низькоефективно |
|
|
Верапаміл, дилтіазем, дигоксин |
Не показано |
|
|
Поодинокі або нечасті епізоди AV-реципрокної тахікардії (без преекзитації) |
Вагусні проби |
Високоефективно |
|
Верапаміл, дилтіазем |
Високоефективно |
|
|
ББА |
Ефективно |
|
|
Катетерна абляція |
Ефективно |
|
|
Соталол, аміодарон |
Низькоефективно |
|
|
Флекаїнамід, пропафенон |
Низькоефективно |
|
|
Дигоксин |
Не показано |
|
|
Преекзитація, асимптоматична |
Катетерна абляція |
Ефективно |
Лікування при аномальній синусовій тахікардії здебільшого симптоматичне. ББА можуть бути ефективні й мають призначатися як терапія першої лінії більшості пацієнтам із цією тахікардією. Можна вважати, що БКК, такі як верапаміл і дилтіазем, також ефективні.
Особливості невідкладної терапії при надшлуночковій ПТ із широким комплексом QRS:
1. Для купірування суправентрикулярної ПТ з широким комплексом QRS за відсутності порушень гемодинаміки (згідно з даними нечисленних РКД) необхідно застосовувати прокаїнамід чи соталол в/в.
2. З цією метою аміодарону надається перевага перед прокаїнамідом і соталолом при лікуванні пацієнтів зі зниженою ФВ ЛШ або ознаками СН.
3. В окремих випадках (наприклад ПТ з передзбудженням шлуночків) застосовується альтернативна терапія аміодароном.
4. Якщо у хворого немає гемодинамічних порушень, можна застосовувати флекаїнід чи ібутилід в/в в оптимальних дозах.
5. Для купірування неритмічної тахікардії з широким комплексом QRS (ФП з допоміжними передсердно-шлуночковими з’єднаннями) рекомендується ЕІТ.
Надшлуночкові тахікардії у вагітних
Передсердні екстрасистоли у період вагітності реєструються в 50% випадків і добре переносяться; пароксизми суправентрикулярної тахікардії — у 3–4 випадках на 10 000 спостережень (останні у 20% пацієнток виникають значно частіше) [19, 26].
У вагітних певні складнощі виникають від можливого небезпечного впливу ААП на плід, особливо в І триместр вагітності.
Невідкладна терапія при АV-(вузловій) ПТ у вагітних:
1. Застосування вагусних проб, а в разі їх неефективності слід призначати аденозин (АТФ) в оптимальних дозах у І та ІІІ триместр вагітності.
2. Якщо аденозин неефективний, необхідно використовувати ББА (пропранолол чи метопролол).
3. АК верапаміл вводити в/в небезпечно в зв’язку з можливим ризиком розвитку артеріальної гіпотензії у матері з подальшою гіпоксією плода.
4. У літературі є повідомлення про те, що електрична кардіоверсія найбезпечніша при надшлуночковій ПТ у відновленні синусового ритму в усі періоди вагітності.
Особливості й тактику лікування при суправентрикулярній ПТ у вагітних розглянуто в табл. 2.111.
Таблиця 2.111. Рекомендації з тактики лікування при надшлуночковій ПТ у вагітних [19, 26]
|
Стратегія лікування |
Рекомендації |
Ефективність |
|
Невідкладне лікування при пароксизмальній суправентрикулярній тахікардії |
Вагусні проби |
Високоефективно |
|
Аденозин |
Високоефективно |
|
|
Електрична кардіоверсія |
Високоефективно |
|
|
Метопролол, пропранолол |
Ефективно |
|
|
Верапаміл |
Малоефективно |
|
|
Профілактичне лікування при пароксизмальній суправентрикулярній тахікардії |
Дигоксин |
Високоефективно |
|
Метопролол |
Високоефективно |
|
|
Пропранолол |
Ефективно |
|
|
Соталол* |
Ефективно |
|
|
Хінідин, пропафенон |
Малоефективно |
|
|
Верапаміл |
Малоефективно |
|
|
Прокаїнамід |
Малоефективно |
|
|
Катетерна абляція |
Малоефективно |
|
|
Атенолол |
Не показано |
|
|
Аміодарон |
Не показано |
Примітка. *ААП, які не зареєстровані в Україні.
Профілактика аритмій серця у вагітних:
1. Препаратами першої лінії є дигоксин, ББА (пропранолол, метопролол). Дигоксин безпечний і його часто застосовують при суправентрикулярних аритміях у вагітних. Пропранолол і метопролол ефективніші й безпечніші, однак їх не слід призначати жінкам у І триместр вагітності. Дослідження показали, що частота виникнення ускладнень у вагітних при застосуванні ББА не вища, ніж у групі плацебо, однак пропранолол при застосуванні в І триместр затримує внутрішньоутробний розвиток плода. Кардіоселективні ББА безпечніші, вони менше впливають на периферичну вазодилатацію і тонус матки.
2. Якщо ББА неефективні, то у вагітних з цими аритміями застосовують ААП ІІІ класу соталол. Його також застосовують при ФП і шлуночкових аритміях, але досвід застосування цього препарату недостатній, тому його слід призначати тільки за показаннями і в мінімальних ефективних дозах.
3. ААП ІС класу флекаїнід у період вагітності протипоказаний, а пропафенон не слід застосовувати в І триместр вагітності (у ІІ та ІІІ триместр вагітності не зареєстровано негативного впливу препарату на плід).
4. ААП ІА класу хінідин відносно задовільно переноситься вагітними, але він інколи спричиняє у плода тромбоцитопенію і токсичне ураження 8-ї пари черепномозкових нервів. Із цієї групи препаратів застосовують тільки прокаїнамід для надання невідкладної допомоги.
5. Застосування ААП ІІІ класу аміодарону обмежують у вагітних з аритміями. Цей препарат застосовують лише у тому разі, коли аритмії загрожують життю вагітних при відсутності клінічних ефектів від інших медикаментозних засобів.
Однак з метою вторинної профілактики надшлуночкових аритмій серця при ССЗ застосовують АК (верапаміл, дилтіазем), ББА (метопролол, бісопролол), в оптимальних дозах. ААП І класу пропафенон можна застосовувати тільки коротким курсом лікування (2–4 тиж), коли визначаються відносні ознаки СН.
2.8.2.2. Шлуночкова тахікардія
Визначення. ШТ — це частий та регулярний ритм (>140 уд./хв) за рахунок імпульсів з ектопічного вогнища шлуночків. Клінічна систематизація шлуночкових порушень ритму — див. табл. 2.112.
Таблиця 2.112. Клінічна систематизація шлуночкових порушень ритму
|
Критерії систематизації |
Систематизація |
|
1. Кількість, морфологія |
|
|
2. Тривалість |
|
|
3. Характер змін ЕКГ |
|
|
4. Прогностичне |
|
Примітка. ШЕ — шлуночкові екстрасистоли.
Причини виникнення поліморфної ШТ:
1. ІХС та інші захворювання міокарда.
2. Синдром подовженого інтервалу Q–T, зумовлений патологією білка іонів К+-каналів, рідше — Na+-каналів.
3. Синдром Бругада, зумовлений дефектом Na+-каналів, який призводить до різнобічності потенціалу дії в товщі міокарда й односпрямованого блоку. При ньому відбувається підйом сегмента ST у відведеннях V1–V3 за рахунок зниження потенціалу дії в епікарді та розвиток БПНПГ, подовження інтервалу Q–T (у 50% хворих) та розвиток ШТ, «пірует»-тахікардії, ФШ.
4. Синдром укороченого інтервалу Q–T супроводжується частим виникненням РСС (внаслідок ШТ і ФШ або ФП і ТП). В основі синдрому лежить дефект генів, в результаті чого відбувається вкорочення 2-ї і 3-ї фази висхідного калієвого току в трьох типах клітин (ендо-, міо- і перикардіальних).
5. Виникнення «пірует»-тахікардії спричиняє застосування ААП, які подовжують тривалість інтервалу Q–T і чинять проаритмогенну дію (ААП ІС і ІІІ класів, антигістамінні препарати, антибіотики макроліди, фторхінолони, симпатоміметики, бронходилататори, серцеві глікозиди, кокаїн, антидепресанти, нейролептики, протигрибкові та протималярійні препарати — всього 200 препаратів) (!).
Фактори ризику виникнення поліморфної ШТ:
- жіноча стать;
- гіпокаліємія, гіпомагніємія, застосування діуретиків;
- брадикардія та попереднє подовження інтервалу Q–T;
- ІМ з систолічною дисфункцією;
- знижена ФВ ЛШ і наявність ХСН;
- ГЛШ (товщина стінок >14 мм);
- значна ішемія міокарда (зміщення сегмента ST над чи під ізолінією на 3–5 мм і більше);
- шлуночкові екстрасистоли ІІІ–V градацій можуть запускати «пірует»-тахікардію (інтервал зчеплення становить <400 мс);
- порушення мозкового кровообігу (особливо субарахноїдальний крововилив) може спричинити «пірует»-тахікардію.
Патогенез. ШТ частіше виникає за механізмом re-entry.
Клініка ШТ подібна до суправентрикулярної ПТ, але тяжка, оскільки виникає СН і прогресивно понижується АТ, може виникати ФШ. Часто виникають синкопальні стани; І тон може бути посилений або спостерігається «гарматний» тон Стражеска в результаті одночасного скорочення шлуночків та передсердь.
ЕКГ-діагностика шлуночкової ПТ наведена в алгоритмах 2.62 і 2.63, рис. 2.12.
|
Алгоритм 2.62. ЕКГ-критерії діагностики ШТ [19] 1. Напад серцебиття виникає раптово і раптово закінчується, супроводжується підвищенням ЧСС від 140 до 220 уд./хв при збереженні правильного ритму. 2. Визначається розщеплення та розширення комплексу QRS, що становить ≥0,12 с з дискордантним зміщенням сегмента ST та зубця Т. 3. Спостерігається повна АV-дисоціація, що супроводжується повним роз’єднанням між частим ритмом шлуночків (комплексом QRS) і нормальним ритмом передсердь (зубцем Р). Іноді реєструються поодинокі комплекси РТ, що виходять із синусового вузла («захватні» скорочення шлуночків). |
|
Алгоритм 2.63. Клінічні та ЕКГ-критерії діагностики ШТ за типом «пірует» [19] Важливе місце належить аритміям при синдромі подовженого інтервалу Q–T, на фоні якого виникають пароксизми ШТ за типом «пірует»). ШТ за типом «пірует» (фр. torsade de pointes — «поворот на пуантах») — форма поліморфної ШТ; синоніми: двонаправлена веретеноподібна ШТ, «серцевий балет», «танок точок», «оберти навколо точки». Основна небезпека цього захворювання полягає в частій трансформації «torsade de pointes» у ФШ, що нерідко призводить до смерті хворого (20% випадків). У 1966 р. в Паризькій клініці Ларибуазьє F. Dessertene описав специфічну веретеноподібну ШТ, яка переходить у ФШ і зупинку серця у хворих з подовженим інтервалом Q–T. Крок 1. Клінічні критерії діагностики ШТ за типом «пірует». Неспецифічні критерії (можуть виникати при будь-якій формі тахіаритмії):
У людей із вродженим синдромом подовженого інтервалу Q–T напади ШТ спричиняються адренергічною активацією (наприклад стрес, холод, фізичне навантаження). Крок 2. ЕКГ-критерії діагностики ШТ за типом «пірует»:
|

У разі підозри чи для підтвердження шлуночкової аритмії необхідне здійснення неінвазивних та інвазивних досліджень (згідно з практичними Європейськими рекомендаціями, 2015).
Неінвазивні дослідження:
- ЕКГ у 12 відведеннях у стані спокою;
- ЕКГ-моніторинг;
- ЕКГ з фізичним навантаженням;
- ЕхоКГ — для оцінки функції ЛШ.
- Холтерівське моніторування ЕКГ:
- при встановленні ІХС;
- в осіб, які пережили амбулаторні реанімаційні заходи при РСС;
- у хворих зі шлуночковою аритмією, в яких є підозра на ішемію міокарда.
Інвазивні:
- коронарна ангіографія;
- інвазивне електрофізіологічне дослідження серця.
Пароксизмальні «пірует»-тахікардії короткі (<20 с), однак вони можуть бути стійкими і в 10–20% випадків переходити у ФШ.
Відрізнити ШТ від надшлуночкової тахікардії з аберантними комплексами складно, тому використовують критерії Бругада:
1. Якщо в жодному грудному відведенні немає комплексів виду RS, тахікардію вважають шлуночковою.
2. Якщо інтервал від початку комплексу QRS до самої глибокої точки зубця S хоча б в одному грудному відведенні >100 мс, то це ШТ.
3. Якщо комплексів QRS більше, ніж зубців Р (повна АV-дисоціація), то тахікардію вважають шлуночковою (ШТ).
4. Тахікардію вважають шлуночковою (ШТ), якщо форма комплексу QRS відповідає усім критеріям ШТ.
J. T. Bіgger (1983) запропонував прогностичну класифікацію шлуночкових аритмій (табл. 2.113):
1. Безпечні аритмії — будь-які екстрасистоли та епізоди ШТ, які не спричиняють порушень гемодинаміки, в осіб без ознак органічного ураження серця.
2. Потенційно небезпечні аритмії — шлуночкові аритмії, які не спричиняють порушень гемодинаміки, в осіб з органічними ураженнями серця.
3. Небезпечні для життя аритмії (злоякісні аритмії) — епізоди ШТ, які супроводжуються порушеннями гемодинаміки чи фатальними аритміями. У хворих із небезпечними для життя шлуночковими аритміями зазвичай наявні виражені органічні ураження серця (чи «електрична хвороба серця»: синдром подовженого інтервалу Q–Т, синдром Бругада).
Таблиця 2.113. Класифікація шлуночкових аритмій за прогностичною значущістю
|
Порівнювані критерії |
Доброякісні |
Потенційно злоякісні |
Злоякісні |
|
Ризик РСС |
Дуже низький |
Низький або помірний |
Високий |
|
Клінічні прояви |
Серцебиття, виявлене при плановому огляді |
Серцебиття, виявлені |
Серцебиття, синкопальні стани, зупинка серця в анамнезі |
|
Структурне ураження серця |
Зазвичай немає |
Є |
Є |
|
Рубець або гіпертрофія серця |
Немає |
Є |
Є |
|
ФВ ЛШ |
Нормальна (>55%) |
Помірно знижена (30–55%) |
Значно знижена (<30%) |
|
Частота ШЕ |
Незначна чи помірна |
Помірна |
Помірна або значна |
|
Порівнювані критерії |
Доброякісні |
Потенційно злоякісні |
Злоякісні |
|
Парні ШЕ чи нестійка (тривалістю <30 с) ШТ |
Немає |
Є |
Є |
|
Стійка (тривалістю >30 с) ШТ |
Немає |
Немає |
Є |
|
Гемодинамічні наслідки аритмій |
Немає |
Немає або незначні |
Помірні або виражені |
Примітка. ШЕ — шлуночкові екстрасистоли.
Необхідно зазначити, що у хворих із перехідними тахікардіями з широким комплексом QRS під час нормального ритму на ЕКГ може спостерігатися виражене порушення реполяризації — депресія сегмента ST.
Невідкладна допомога при стійкій шлуночковій аритмії (згідно з Рекомендаціями ЄТК щодо лікування пацієнтів зі шлуночковими аритміями та запобігання РСС, 2015)
Пацієнтам зі стійкою ШТ та нестабільною гемодинамікою рекомендована кардіоверсія постійним струмом. У осіб з гемодинамічно значущою, але стабільною ШТ, за відсутності структурного захворювання серця — в/в введення флекаїніду або ББА, або аміодарону, або верапамілу.
Можливість в/в введення прокаїнаміду чи флекаїніду можна розглядати у пацієнтів без тяжкої СН або за підозри на ішемію; в/в введення лідокаїну є помірно ефективним при мономорфній ШТ; в/в введення верапамілу чи ББА слід виконувати пацієнтам із фасцикулярною ШТ ЛШ.
ААП для лікування при шлуночковій аритмії, доступні в більшості європейських країн, наведено в табл. 2.114.
Таблиця 2.114. ААП для лікування при шлуночковій аритмії, доступні в більшості європейських країн
|
Лікарський |
Пероральна доза, мг/добу |
Часті чи важливі прояви побічної дії |
Показання |
Протипоказання та застереження |
|
Аміодарон (!!!) |
200–400 |
Гіпотиреоїдизм та гіпертиреоїдизм, нефропатія, відкладання на рогівці, фоточутливість, знебарвлення шкіри, гепатотоксичність, синусова брадикардія, подовження інтервалу Q–T та періодична TdP |
ШТ, ФШ |
Захворювання та одночасне лікування, пов’язане з подовженням інтервалу Q–T, спадковий LQTS; синусова брадикардія (крім випадків зупинки серця); СССВ (крім випадків наявності пейсмекера); тяжке порушення АV-провідності (крім випадків наявності пейсмекера); декомпенсована СН або кардіоміопатія |
|
ББА (!!) |
Різна |
Бронхоспазм, гіпотензія, синусова брадикардія, АV-блокада, стомлюваність, депресія, сексуальні розлади, збільшення маси тіла |
ШЕ, ШТ, LQTS |
Тяжка синусова брадикардія та СССВ (крім випадків наявності пейсмекера), порушення АV-провідності (крім випадків наявності пейсмекера); гостра фаза ІМ (уникати при брадикардії, гіпотензії, недостатності ЛШ, некомпенсованій СН; стенокардії Принцметала) |
|
Дизопірамід (ІА) |
250–750 |
Негативний інотропний ефект, подовження комплексу QRS, АV-блокада, проаритмія (ТП, мономорфна ШТ, періодична TdP), антихолінергічний ефект |
ШТ, ШЕ |
Тяжкий СССВ (крім випадків наявності пейсмекера), тяжке порушення АV-провідності (крім випадків наявності пейсмекера); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; зниження ФВ ЛШ; гіпотензія |
|
Флекаїнід (ІС) |
200–400 |
Негативний інотропний ефект, розширення комплексу QRS, АV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP), підвищена частота смертності після ІМ |
ШЕ, ШТ |
Дисфункція синусового вузла (крім випадків наявності пейсмекера), ФП/ТП (без одночасного застосування блокаторів АV-проведення); тяжке порушення АV-провідності (крім випадків наявності пейсмекера); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гемодинамічно значна вада клапана серця; синдром Бругада; спадкове LQTS (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Мексилетин (ІВ) |
450–900 |
Тремор, дизартрія, запаморочення, порушення з боку ШКТ, гіпотензія, синусова брадикардія |
ШТ, LQTS |
Дисфункція синусового вузла (крім випадків наявності пейсмекера), тяжке порушення АV-провідності (крім випадків наявності пейсмекера); тяжка СН; знижена ФВ ЛШ; спадкове LQTS (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Пропафенон (ІС) |
450–900 |
Негативний інотропний ефект, порушення з боку ШКТ, подовження комплексу QRS, АV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP) |
ШЕ, ШТ |
Тяжка синусова брадикардія та СССВ (крім випадків наявності пейсмекера), ФП/ТП (без одночасного застосування речовин, які блокують АV-проведення); тяжке порушення АV-провідності (крім випадків наявності пейсмекера); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; синдром Бругада; спадкове LQTS (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Хінідин (ІА) |
600–1600 |
Нудота, діарея, порушення слуху та зору, сплутаність свідомості, гіпотензія, тромбоцитопенія, гемолітична анемія, анафілаксія, подовження комплексу QRS та інтервалу Q–Т, TdP |
ШТ, ФШ, LQTS, синдром Бругада |
Тяжкий СССВ (крім випадків наявності пейсмекера), тяжке порушення АV-провідності (крім випадків наявності пейсмекера); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гіпотензія, спадковий LQTS, одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Ранолазин (ІВ) |
750–2000 |
Сплутаність свідомості, нудота, запор, гіпотензія, порушення з боку ШКТ, головний біль, висип, синусова брадикардія, подовження інтервалу Q–T |
LQTS3 |
Тяжка синусова брадикардія та СССВ (крім випадків наявності пейсмекера), тяжка СН; спадковий синдром подовження інтервалу Q–T (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Соталол (ІІІ) |
160–320 |
Як і для інших ББА, а також при TdP |
ШТ, аритмогенна дисплазія ПШ |
Тяжка синусова брадикардія та СССВ (крім випадків наявності пейсмекера), порушення АV-провідності (крім випадків наявності пейсмекера); тяжка СН; стенокардія Принцметала; спадкове LQTS, одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Верапаміл (IV) |
120–480 |
Негативний інотропний ефект (особливо у пацієнтів зі зниженою ФВ ЛШ), висип, порушення з боку ШКТ, гіпотензія, синусова брадикардія, АV-блокада, ШТ |
Фасцикулярна лівошлуночкова тахікардія |
Тяжка синусова брадикардія та СССВ (крім випадків наявності пейсмекера), тяжке порушення АV-провідності (крім випадків наявності пейсмекера); ІМ у гострій фазі (за винятком брадикардії, гіпотензії, недостатності ЛШ); СН; знижена ФВ ЛШ; ТП або ФП, пов’язані з додатковими шляхами проведення (наприклад при синдромі WPW) |
Примітка. Tdp — torsade de pointes; ШЕ — шлуночкові екстрасистоли.
Невідкладна допомога хворим при резистентній шлуночковій «пірует»-тахікардії наведена в алгоритмі 2.64.
|
Алгоритм 2.64. Невідкладна терапія резистентної форми ШТ за типом «пірует» [19] Крок 1. Сірчанокисла магнезія 10 мл 10% розчину в/в струминно, потім 80 мл 25% розчину сірчанокислої магнезії на 400 мл ізотонічного розчину натрію хлориду в/в крапельно (магній — препарат вибору). При цій аритмії виникає гіпомагніємія. Крок 2. Корекція електролітних порушень і відміна препаратів, які можуть провокувати «пірует»-тахікардію. Крок 3. Показана ЕІТ для купірування «пірует»-тахікардії. Крок 4. Для профілактики виникнення «пірует»-тахікардії — імплантація ЕКС з ЧСС 70–125 уд./хв у поєднанні з ББА. Краще виконувати ІКД. |
Особливості застосування ААП при «пірует»-тахікардії та ШТ без неї [19, 26]:
1. Застосування ААП класу ІА, ІС і ІІІ для купірування «пірует»-тахікардії протипоказане у зв’язку з тим, що всі вони тією чи іншою мірою призводять до подовження інтервалу Q–T, що є фактором ризику виникнення ФШ.
2. При вроджених та ідіопатичних синдромах, подовженому інтервалі Q–T для профілактики виникнення ПТ за типом «пірует» призначають ББА у високих дозах, здійснюють видалення лівого зіркового ганглію, а в разі неефективності цих заходів застосовують імплантацію ЕКС (стимуляція з частотою 70–125 за 1 хв) у поєднанні з ББА чи ІКД (!).
3. При шлуночковому прискореному ритмі початкова доза ААП ІВ класу лідокаїну повинна становити 1,5 мг/кг маси тіла (нижча доза неефективна). Загальна доза лідокаїну при повторному введенні не має перевищувати 3 мг/кг маси тіла, а підтримувальна доза — 2–3 мг/хв (рідко — 1–4 мг/хв). Переконливо доведено, що превентивне введення лідокаїну для запобігання розвитку шлуночкових аритмій підвищує летальність при ІМ за механізмом rе-entry.
4. При шлуночковій «пірует»-тахікардії препаратом вибору є прокаїнамід, але його застосування обмежується тим, що він викликає артеріальну гіпотензію. Цей препарат ризиковано вводити при шлуночковій ПТ на тлі подовженого інтервалу Q–T.
5. Для синдрому подовженого інтервалу Q–T характерне виникнення «пірует»-тахікардії. Препаратом першого ряду при цій аритмії є не лідокаїн, а сульфат магнію (2–2,5 г в/в). Ефективним може бути прискорення серцевого ритму за допомогою інфузії ізопреналіну (від 2 до 20 мг/хв) чи прискорюваної електрокардіостимуляції. Однак прискорення ЧСС у цих пацієнтів є фактором ризику ФШ, тому останні методи не знайшли широкого застосування.
6. Застосування препаратів калію не є серйозним базовим ААП, за винятком гіпокаліємії. Однак як допоміжний засіб ці препарати застосовують, особливо у пацієнтів перед кардіоверсією.
Первинна медична допомога при ШТ
Хворі зі шлуночковими порушеннями ритму підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитись у районних поліклініках, а за необхідності додаткових обстежень — у міських кардіологічних диспансерах та діагностичних центрах.
Вторинна (спеціалізована) медична допомога
Термінова госпіталізація до відділення інтенсивної терапії необхідна у разі виникнення нападу потенційно загрозливих аритмій, при порушеннях гемодинаміки (втрата свідомості, ГКС, артеріальна гіпотензія).
Планова госпіталізація до кардіологічного стаціонару показана за наявності в анамнезі нападів ШТ, суб’єктивної непереносимості аритмії, неефективності медикаментозного лікування на амбулаторному етапі.
Третинна (високоспеціалізована) медична допомога
Обстеження і лікування у високоспеціалізованому кардіологічному чи кардіохірургічному стаціонарі необхідне для виконання деяких неінвазивних та інвазивних досліджень. Госпіталізація показана для вирішення питання про вибір тактики лікування аритмії (за умови її неефективності за місцем проживання), а також для застосування хірургічних методів лікування.
Профілактична медикаментозна терапія при ШТ та профілактика РСС у пацієнтів із ХСН:
1. Терапія іАПФ (або при непереносимості — БРА), ББА рекомендуються пацієнтам із СН при систолічній дисфункції (ФВ ЛШ <40%) для зниження рівня загальної смертності.
2. ІКД рекомендується для зниження рівня РСС у пацієнтів із ФВ <35% через ≥3 міс ОМТ, а також щонайменше через 6 тиж після ІМ.
Методи профілактики рецидивів ШТ при дисфункції міокарда з розвитком ХСН наведені в алгоритмі 2.65.
|
Алгоритм 2.65. Методи профілактики рецидивів ШТ при дисфункції міокарда з розвитком ХСН [19] Крок 1. ББА (метопролол — 100 мг/добу, бісопролол — 5–10 мг/добу, карведилол — 25–50 мг/добу) в поєднанні з іАПФ (еналаприл, раміприл, лізиноприл), чи БРА, які чинять опосередковану антиаритмічну дію шляхом корекції нейрогуморальних змін. Крок 2. Аміодарон — 200–400 мг/добу в поєднанні з іАПФ або БРА в оптимальних дозах упродовж місяців і років. Соталол — 80–160 мг/добу в поєднанні з іАПФ або сартанами в оптимальних дозах упродовж місяців і років. Крок 3. Бретилій у дозі 10–30 мг/кг маси тіла в поєднанні з іАПФ або БРА в оптимальних дозах. |
Уточнене профілактичне застосування ААП при поліморфній ШТ:
1. Аміодарон у хворих зі злоякісними шлуночковими аритміями (ФШ/ШТ) є препаратом вибору для вторинної профілактики РСС. Соталол необхідно використовувати тільки тоді, коли аміодарон протипоказаний (за ефективністю він поступається аміодарону).
2. Поєднане застосування ББА і аміодарону знижує як антиаритмічну, так і загальну летальність.
3. При ШТ з «каналопатіями» показане застосування аміодарону.
4. У хворих із подовженим інтервалом Q–T для профілактики РСС показане застосування ББА у максимально переносимих дозах, а в разі їхньої неефективності — ІКД. При вираженій синусовій брадикардії з розвитком брадизалежних аритмій і синкопальних станів показана імплантація ЕКС (у поєднанні із застосуванням ББА). Цим пацієнтам необхідно обмежувати фізичні навантаження.
5. При катехоламін-індукованих ШТ рекомендують обмеження фізичних навантажень, а у разі неефективності — застосування ББА.
6. При синдромі Бругада призначають хінідин (однак ефективність його не доведена) та аміодарон, який зменшує виникнення суправентрикулярних, шлуночкових аритмій. Методом вибору є ІКД.
7. У пацієнтів із вкороченим інтервалом Q–T застосовують патогенетично ААП І класу, які подовжують інтервал Q–T. Найефективнішим виявився хінідин, який при інших ШТ практично не використовують, а при «пірует»-тахікардії він протипоказаний. ААП ІІІ класу аміодарон у цих хворих неефективний. Метод вибору — ІКД.
2.8.3. Фібриляція та тріпотіння передсердь
Частота виникнення цього порушення ритму серця за попередніми розрахунками становить 1–2% у загальній популяції та підвищується з віком. Ішемічний інсульт у пацієнтів з цією патологією в середньому трапляється у 2–7 разів частіше, ніж без неї. Персистуюча ФП наявна в 40% випадків. У 2010 р. у світі налічувалося 33,5 млн осіб із ФП. Це захворювання спричиняє підвищення смертності вдвічі.
2.8.3.1. Фібриляція передсердь
Визначення. ФП — дуже часта, хаотична діяльність волокон передсердь із частотою імпульсів у передсердях 350–600 за 1 хв; вони затримуються в АV-вузлі і спричиняють неритмічне скорочення шлуночків.
Етіологія. ФП часто наявна при ІХС (ІМ, стенокардії, постінфарктному кардіосклерозі), кардіоміопатіях, тиреотоксикозі, набутих і вроджених вадах серця, міокардитах, синдромі WPW і СССВ, алкогольному ураженні міокарда, ТЕЛА тощо.
Патогенез. Існує декілька теорій стосовно причин виникнення ФП. Її може спричиняти розвиток колового руху хвилі збудження, направлення якого постійно змінюється [3, 4]. Згідно з іншою теорією, в передсердях виникає один чи декілька вогнищ ектопічного збудження з частотою ≥350 імпульсів за 1 хв. Як причину виникнення ФП розглядають також зниження ефективного рефрактерного періоду передсердь або підвищення парасимпатичного тонусу вегетативної НС.
Класифікація різних форм ФП:
1. Пароксизмальна (ритм відновлюється самостійно в межах 7 діб):
- брадисистолічна (ЧШС <60 за 1 хв);
- тахісистолічна (ЧШС >110 за 1 хв).
2. Персистуюча (епізод, що триває від 8 діб до року, коли для відновлення синусового ритму необхідне втручання):
- брадисистолічна (ЧШС <60 за 1 хв);
- тахісистолічна (ЧШС >110 за 1 хв).
3. Тривало персистуюча (епізод, що триває ≥1 рік, коли синусовий ритм доцільно відновлювати):
- брадисистолічна (ЧШС <60 за 1 хв);
- тахісистолічна (ЧШС >110 за 1 хв).
4. Постійна (коли відновити синусовий ритм неможливо або недоцільно):
- брадисистолічна (ЧШС <60 за 1 хв);
- тахісистолічна (ЧШС >110 за 1 хв).
Виділяють такі патогенетичні варіанти ФП:
- адренергічна (катехоламінзалежна) ФП (частіше хворіють жінки; ФП виникає вдень і пов’язана з фізичним чи психоемоційним напруженням, вживанням чаю, кави, алкоголю; характеризується пітливістю, підвищенням ЧСС, підвищенням АТ, нудотою, може закінчуватися частим сечовипусканням);
- вагусна ФП (частіше хворіють чоловіки середнього віку, особливо після вживання алкоголю; напад виникає вночі на фоні брадикардії);
- німа форма ФП (зумовлена ускладненнями (інсульт, тахікардіоміопатія); діагностується випадково).
Нерідко трапляються змішані форми ФП. Виділяють також генетичні форми ФП (дефекти генів, білків калієвих каналів, конексину 40). Розрізняють первинну (ідіопатичну) і вторинну ФП (при хворобах серця, судин і легень). Залежно від ЧСС ФП може класифікуватись як тахісистолічна, брадисистолічна чи нормосистолічна. У деяких пацієнтів з ідіопатичною ФП не визначається жодна з цих форм захворювання. Ідіопатична ФП трапляється в 10–30% випадків (табл. 2.115).
Таблиця 2.115. Класи ФП залежно від вираженості симптомів за EHRA (European Heart Rhythm Association)
|
Клас EHRА |
Пояснення |
|
І |
Відсутність симптомів |
|
ІІ |
«Помірні симптоми»: нормальна щоденна діяльність без змін |
|
ІІІ |
«Серйозні симптоми»: нормальна щоденна діяльність змінена |
|
IV |
«Симптоми інвалідизації»: нормальна щодення діяльність порушена |
Чинники, які зумовлюють та підтримують ФП:
- тригерна активність або автоматизм міозитів;
- зниження швидкості проведення імпульсу;
- дисперсія провідності;
- гіперчутливість до катехоламінів і ацетилхоліну.
Клініка. Хворі скаржаться на виникнення нападу серцебиття, біль у ділянці серця за типом кардіалгії, задишку, запаморочення (інколи втрату свідомості). В анамнезі ІХС, СН, ДКМП, мітральний стеноз. Пульс частий, аритмічний, дефіцит пульсу (різниця між ЧСС та пульсом). АТ часто знижується. Межі відносної тупості серця та аускультація спричинені основним захворюванням. При декомпенсації серця збільшується печінка, з’являються набряки на ногах.
Клінічна характеристика ФП/ТП залежно від переваги вегетативної НС (P. Coumel, 1994) наведена в табл. 2.116.
Таблиця 2.116. Клінічна характеристика ФП/ТП залежно від переваги вегетативної НС (P. Coumel, 1994)
|
Вагусна форма |
Адренергічна форма |
|
1. Переважає в осіб чоловічої статі (≈80% випадків). 2. Виникнення пароксизмів у віці близько 40–50 років. 3. Часто відсутні видимі ураження серця. 4. Аритмія носить переважно пароксизмальний характер. 5. Пароксизми виникають переважно вночі у спокої, після прийому їжі та вживання алкоголю. 6. Аритмії передує прогресуюча синусова брадикардія. Часто ФП поєднується з ТП |
1. Трапляється рідше, ніж вагусна форма. 2. Пароксизми виникають у денний час. 3. Пароксизми виникають частіше після фізичних, психоемоційних і стресових перевантажень. 4. Може поєднуватися з тиреотоксикозом і кардіоміопатіями. 5. Передує синусова тахікардія, при цьому ЧСС ≈90 уд./хв. 6. Введення ізопротеронолу може провокувати виникнення аритмії |
Електрофізіологічні фактори ризику та ЕКГ-критерії діагностики ФП наведені в алгоритмах 2.66; 2.67 та на рис. 2.11.
|
Алгоритм 2.66. Електрофізіологічні фактори ризику виникнення ФП [19] 1. Наявність внутрішньопередсердних і міжпередсердних блокад, що призводять до порушення проведення імпульсів у передсердях і супроводжуються розширенням зубця Р до ≥0,11 с. 2. Поява розщепленого, двогорбого зубця Р з перевагою негативної хвилі V1 у грудному відведенні. 3. Визначення передсердної рефрактерності та її дисперсії. 4. Розвиток вразливості передсердь — здатності одного чи декількох передсердних екстрастимулів у ранню фазу діастоли викликати епізод аритмії. 5. Фрагментована електрична активність передсердь внаслідок електричної дезорганізації окремих вогнищ передсердь, що призводить до збільшення тривалості передсердної відповіді на 150%. |
|
Алгоритм 2.67. ЕКГ-критерії діагностики ФП [19] 1. На ЕКГ визначається відсутність зубця Р. 2. Реєструються безладні хвилі f різної амплітуди впродовж усього серцевого циклу, які краще визначаються в V1–2, ІІ, ІІІ, aVF-відведеннях. 3. Визначається різна відстань між комплексами QRS (інтервали R–R різні). 4. Комплекси QRS у більшості випадків нормальні, не деформовані й не розширені. 5. Амплітуда зубців R може бути різної величини (електрична альтернація). |
Тактика ведення пацієнта
Для визначення типу ФП необхідно оцінити час початку епізоду аритмії. У більшості пацієнтів із ФП тривалістю <48 год можна виконати кардіоверсію на фоні застосування НМГ. Якщо ФП продовжується >48 год, або якщо є сумніви щодо тривалості епізоду аритмії, перед кардіоверсією можна провести трансезофагеальну ехоКГ, щоб виключити наявність внутрішньосерцевого тромбу.
До плану обстеження цих хворих належать виконання ехоКГ, тести на оцінку щитоподібної залози (ТТГ); розгорнутий клінічний аналіз крові; вимірювання рівня креатиніну в сироватці крові; аналіз на протеїнурію; вимірювання АТ і тести на наявність ЦД (глюкоза крові натще, глікозильований гемоглобін); виявлення показників функції печінки; проведення навантажувальних проб. Пацієнти з персистуючими ознаками дисфункції ЛШ та/чи ознак ішемії міокарда є кандидатами для проведення коронарографії.
Стратегія ведення пацієнтів із ФП має на меті зменшення вираженості симптоматики та запобігання виникненню тяжких ускладнень, асоційованих із ФП. Профілактика ускладнень, пов’язаних із ФП, здійснюється за допомогою антитромботичної терапії, контролю ЧШС та належного лікування супутніх серцевих захворювань.
Стратифікація ризику інсульту і тромбоемболій
Ризик інсульту у пацієнтів із пароксизмальною ФП приблизно дорівнює тому, який спостерігається при персистуючій чи постійній ФП за наявності факторів ризику. Найпростіша схема оцінки ризику тромбоемболій згідно зі шкалою CHADS2 заснована на бальній системі, що враховує наявність у хворих СН (1 бал), АГ (1 бал), вік >75 років (1 бал), наявність ЦД (1 бал), інсульту (2 бали). Схема стратифікації ризику інсульту CHADS2 повинна використовуватися як простий початковий (легкий для запам’ятовування) та водночас обов’язковий інструмент оцінки ризику інсульту, що найкраще підходить для лікарів ланки надання первинної допомоги та неспеціалістів. Пацієнтам, які отримали ≥2 балів за шкалою CHADS2, рекомендована постійна пероральна антикоагулянтна терапія — наприклад за допомогою АВК варфарину (3–6 мг 1 раз на добу) з досягненням рівнів МНВ у діапазоні 2,0–3,0; якщо таке лікування протипоказане, застосовується інгібітор фактора Ха ривароксабан по 20 мг/добу. Для пацієнтів, які отримали 0–1 бал за шкалою CHADS2, або якщо показана детальніша оцінка ризику інсульту, рекомендовано використовувати всебічний ризик-орієнтований підхід з урахуванням інших факторів ризику тромбоемболічних ускладнень, відображений у вигляді бальної системи оцінки, яка називається шкалою CHA2DS2-VASc.
До «серйозних» факторів ризику (які раніше називалися «факторами високого ризику») належать раніше перенесений інсульт, транзиторна ішемічна атака чи тромбоемболічні ускладнення, а також старечий вік (≥75 років), мінімальний стеноз або протезовані клапани серця. До «клінічно значущих несерйозних факторів ризику» (раніше називалися «факторами помірного ризику») належать наявність СН зі систолічною дисфункцією ЛШ (ФВ ЛШ ≤40%), АГ тощо. «Клінічно значущі несерйозні фактори ризику» включають належність до жіночої статі, вік 65–74 років та наявність ІМ, ускладнення аортальної антисклеротичної бляшки та захворювання периферичних артерій.
Ризик-орієнтований підхід ведення пацієнтів із неклапанною ФП може позначатися CHA2DS2-VASc — шкала оцінки ризику, що враховує такі фактори, як наявність СН (1 бал), АГ (1 бал); вік ≥75 років (2 бали); наявність ЦД (1 бал), інсульту (2 бали), судинних захворювань (1 бал); вік 65–74 років (1 бал); жіноча стать (1 бал) (табл. 2.117).
Таблиця 2.117. Ризик тромбоемболій при ФП неклапанної етіології за шкалою CНA2DS2-VASc
|
Фактор ризику |
Бали |
|
Застійна СН/дисфункція ЛШ |
1 |
|
АГ |
1 |
|
Вік >75 років |
2 |
|
ЦД |
1 |
|
Інсульт/транзиторні ішемічні атаки/тромбоемболії |
2 |
|
Захворювання судин |
1 |
|
Вік 65–74 роки |
1 |
|
Стать (жіноча) |
1 |
|
Максимальна кількість балів |
9 |
|
0 балів — антитромботична терапія не призначається або АСК по 100–325 мг/добу. 1 бал — АСК чи антикоагулянтна терапія невизначено довго. Перевага надається НПАК (апіксабан, ривароксабан, дабігатран при неклапанній патології, варфарин — при клапанній патології). |
|
Ризик кровотечі за шкалою HAS-BLED — табл. 2.118.
Таблиця 2.118. Ризик кровотечі за шкалою HAS-BLED
|
Літера |
Клінічна характеристика |
Бали |
|
Н |
АГ |
1 |
|
А |
Порушення ниркової та печінкової функції (1 бал кожний) |
1 або 2 |
|
S |
Інсульт |
1 |
|
В |
Кровотеча |
1 |
|
L |
Лабільний MHB |
1 |
|
Е |
Похилий вік (наприклад >65 років) |
1 |
|
D |
Ліки або алкоголь (1 бал кожний) |
1 або 2 |
|
Максимальна кількість балів |
9 |
|
|
Якщо показник ≥3 балів — це високий ризик кровотеч, потрібно надавати перевагу НПАК і обов’язково регулярно обстежувати пацієнта. Можливе зниження дози антикоагулянту. |
||
Гіпертензією в цій шкалі вважається САТ >160 мм рт. ст. Порушення ниркової функції визначено як наявність хронічного діалізу, ниркової трансплантації чи креатиніну в сироватці крові >200 ммоль/л. Порушення функції печінки визначено як хронічна печінкова хвороба (наприклад цироз печінки) або біохімічне підтвердження значного печінкового порушення (наприклад білірубін більше ніж удвічі перевищує верхню межу норми і АсАТ/АлАТ/лужна фосфатаза перевищує верхню межу норми більше ніж у 3 рази). Кровотеча розглядається як наявність в анамнезі кровотеч і/або схильність до кровотеч — наприклад геморагічний діатез, анемія тощо. Лабільне МНВ означає, що рівень МНВ перебуває в терапевтичному діапазоні <60% часу.
Лікування при ФП [19, 23, 26, 61, 62]
Сучасні рекомендації із застосування антитромботичної терапії
Рекомендації із застосуванням антитромботичної терапії ґрунтуються на наявності (або відсутності) факторів ризику інсульту та тромбоемболічних ускладнень, а не на штучному поділі пацієнтів на групи високого, помірного чи низького ризику.
Пацієнтам, які мають один «серйозний» фактор ризику або ≥2 «клінічно значущих несерйозних» факторів ризику, що відповідає ≥2 балам за шкалою CHA2DS2-VASc, рекомендована постійна терапія пероральними антикоагулянтами (варфарин, дабігатран, ривароксабан, апіксабан або ендоксабан). Пацієнтам, які мають один «клінічно значущий несерйозний» фактор, що відповідає 1 балу за шкалою CHA2DS2-VASc, рекомендовано або пероральний антикоагулянт, або АСК (75–325 мг/добу). Пероральний антикоагулянт має перевагу порівняно з АСК.
Пацієнтам, у яких відсутні фактори ризику, що відповідає 0 балів за шкалою CHA2DS2-VASc, рекомендовано АСК (75–325 мг/добу) або відсутність антитромботичної терапії. Антитромботична терапія має перевагу порівняно з антитромбоцитарним препаратом АСК.
Якщо пацієнту показана терапія пероральними антикоагулянтами, рекомендують дабігатран (прямий інгібітор тромбіну) в дозі 150 мг 2 рази на добу, який розглядається як альтернативний препарат варфарину з коригуванням дози. Дабігатран інгібує вільний тромбін у плазмі крові та спричинену тромбіном агрегацію тромбоцитів, тож йому притаманні як антикоагулянтні, так і антиагрегантні властивості. Варфарин спричиняє подовження МНВ, тож його застосування слід припинити за 5 діб до будь-якого оперативного втручання, щоб воно могло знизитися до належного рівня. Для здійснення переходу з АВК на ривароксабан чи апіксабан, необхідно припинити застосування варфарину та почати терапію інгібіторами фактора Ха (ривароксабан по 20 мг 1 раз на добу або апіксабан 5 мг 2 рази на добу). Вже з наступного дня при МНВ ≤3,0 ривароксабан не потребує регулярного контролю згортальної системи крові. У пацієнтів, які отримують парентеральні антикоагулянти, прийом ривароксабану слід розпочинати за 0–2 год до моменту наступного планового введення парентерального препарату (наприклад НМГ) або у момент припинення введення парентерального препарату (наприклад НФГ для в/в введення). При переході з ривароксабану, апіксабану чи ендоксабану на парентеральні антикоагулянти необхідно припинити застосування препарату, а першу дозу парентерального антикоагулянту ввести у момент, коли повинна бути прийнята наступна доза ривароксабану [1, 34, 72].
Клінічна фармакологія НПАК наведена в табл. 2.119, рекомендації щодо діагностики та початкового ведення пацієнтів з ФП — в табл. 2.120.
Таблиця 2.119. Фармакокінетичні властивості НПАК
|
Показник |
Дабігатран |
Апіксабан |
Ендоксабан |
Ривароксабан |
|
Частка діючої речовини, виведеної шляхом ниркового кліренсу, від абсорбованої дози |
80% |
27% |
50% |
35% |
|
Біодоступність |
3–7% |
59% |
62% |
66% без прийому їжі; майже 100% при прийомі разом з їжею |
|
Частка діючої речовини, виведеної шляхом ниркового кліренсу, від введеної дози |
4% |
12–29% |
37% |
33% |
|
Ухвалено до застосування при КК≥ |
≥30 мл/хв |
≥15 мл/хв |
≥15 мл/хв |
≥15 мл/хв |
|
Рекомендації щодо дозування |
КК ≥50 мл/хв; немає потреби в корекції (150 мг двічі на добу) |
Креатинін у сироватці крові ≥1,5 мг/дл; немає потреби в корекції дози (5 мг двічі на добу) |
КК ≥50 мл/хв; немає потреби в корекції (60 мг один раз на добу) |
КК ≥50 мл/хв; немає потреби в корекції (20 мг один раз на добу) |
|
Дозування при ХХН |
Якщо КК 30–49 мл/хв, можливий прийом препарату у дозі 150 мг двічі на добу, однак слід розглянути режим дозування 110 мг двічі на добу. Режим дозування 75 мг двічі на добу схвалений лише у США. Якщо КК 15–30 мл/хв, якщо КК 30–49 мл/хв та інші чинники |
КК 15–29 мл/хв — 2–5 мг двічі на добу. Якщо наявні 2 із 3 таких критеріїв:
|
КК 15–49 мл/хв — 30 мг раз на добу |
КК 15–49 мл/хв — 15 мг один раз на добу |
|
Протипоказання |
КК <30 мл/хв |
КК <15 мл/хв |
КК <15 мл/хв |
КК <15 мл/хв |
Таблиця 2.120. Рекомендації щодо діагностики та початкового ведення пацієнтів з ФП
|
Рекомендації |
Клас |
Рівень |
|
Діагноз ФП потребує документації даними ЕКГ |
І |
В |
|
У пацієнтів із недіагностованою ФП необхідно намагатися записати ЕКГ на фоні симптомів, які викликали підозру щодо ФП |
І |
В |
|
Для кількісної оцінки пов’язаних із ФП симптомів рекомендується використання простої шкали симптомів (шкала EHRA) |
І |
В |
|
Усім пацієнтам із ФП необхідно провести ретельне фізикальне обстеження, а також зібрати у них дані анамнезу, які можуть стосуватися патології серця та аритмії |
І |
С |
|
Пацієнтам із тяжкими симптомами, документованою чи підозрюваною патологією серця або за наявності факторів ризику рекомендується виконання ехоКГ |
І |
В |
|
Під час подальшого спостереження пацієнтів, які отримують ААП, слід регулярно записувати ЕКГ у 12 відведеннях |
І |
С |
|
У пацієнтів із підозрою на симптомну ФП слід зважити доцільність додаткового ЕКГ-моніторування з метою документування аритмії |
ІІа |
В |
|
Необхідно зважити доцільність додаткового ЕКГ-моніторування з метою виявлення «німої» аритмії, якщо у пацієнта може розвинутися пов’язане з ФП ускладнення |
ІІа |
В |
|
У пацієнтів із ФП, які отримують засоби для контролю ЧСС, слід зважати доцільність проведення холтерівського моніторування ЕКГ з метою оцінки ефективності контролю ЧСС або визначення наявності брадикардії |
ІІа |
С |
|
У активних пацієнтів молодого віку, які отримують засоби для контролю ЧСС, слід зважити доцільність проведення навантажувальних проб (з фізичним навантаженням) з метою оцінки ефективності контролю СШС |
ІІа |
С |
|
У пацієнтів із симптомною ФП або пов’язаними з ФП ускладненнями слід зважити доцільність направлення до кардіолога |
ІІа |
С |
|
Структурований план подальшого спостереження пацієнта, складений спеціалістом, корисний для ведення хворого лікарем загальної практики або дільничним спеціалістом |
ІІа |
С |
|
У пацієнтів, які отримують засоби для контролю серцевого ритму, можна зважити доцільність проведення повторних ЕКГ з метою оцінки ефективності лікування |
ІІb |
В |
|
Більшість пацієнтів із ФП можуть отримати переваги від регулярного спостереження у спеціаліста в ході подальшого їх спостереження |
ІІb |
С |
Проведення кардіоверсії при ФП
Пароксизмальна форма ФП — це та форма фібриляції, яка не потребує кардіоверсії, оскільки ритм відновлюється самостійно в межах 7 діб. Тактика ведення цих пацієнтів після самостійного відновлення ритму передбачає контроль ЧСС (або контроль ритму) та профілактику тромбоемболічних ускладнень за схемою: 0 балів за шкалою CHA2DS2-VASc — антитромботичної терапії пацієнт не потребує; 1 бал — АСК або пероральний антикоагулянт; ≥2 балів — постійно пероральний антикоагулянт. Якщо гемодинаміка нестабільна, ці пацієнти розглядаються як кандидати для електричної кардіоверсії (схема 2.10).

Постійна форма фібриляції (коли синусовий ритм відновити неможливо або недоцільно) теж не потребує кардіоверсій. Стратегія ведення цих пацієнтів передбачає тільки контроль ЧСС (за допомогою ББА, АК або дигоксину) та профілактику тромболітичних ускладнень (за шкалою CHA2DS2-VASc). Персистуюча форма фібриляції — це та форма, коли для відновлення синусового ритму необхідне медикаментозне чи електричне втручання.
Кардіоверсія (відновлення синусового ритму) буває негайною та плановою, медикаментозною та електричною. Кардіоверсія завжди має супроводжуватись антикоагулянтною терапією. Пероральна антикоагулянтна терапія вважається обов’язковою (3 тиж) перед плановою медикаментозною або електричною кардіоверсією при ФП, епізод якої триває >48 год, або при ФП, коли тривалість епізоду аритмії невідома. АВК варфарин у дозі 3–6 мг/добу слід призначати під контролем МНВ (2,0–3,0) протягом 3 тиж перед кардіоверсією та продовжувати після кардіоверсії впродовж 4 тиж. За відсутності можливості контролювати МНВ замість варфарину слід призначати або інгібітор Ха-фактора ривароксабан в дозі 20 мг 1 раз на добу, або прямий інгібітор тромбіну дабігатран у дозі 150 мг 2 рази на добу, або апіксабан 5 мг 2 рази на добу, або ендоксабан 60 мг 1 раз на добу, які не потребують контролю МНВ. Пацієнтам із факторами ризику інсульту ≥2 балів за шкалою CHA2DS2-VASc або рецидиву ФП застосування варфарину чи ривароксабану призначають пожиттєво, за будь-якого ритму після кардіоверсії. Пацієнтам із чітко визначеним початком епізоду ФП <48 год кардіоверсія може бути виконана з підтримкою гепарином. Пацієнтам із факторами ризику інсульту після такої кардіоверсії має бути призначений пероральний антикоагулянт, який застосовується надалі пожиттєво; при цьому до того часу, поки МНВ не досягне терапевтичного рівня (2,0–3,0), слід продовжувати введення НФГ або НМГ. Пацієнти, які не мають факторів ризику тромбоемболічних ускладнень, не потребують застосування пероральних антикоагулянтів. Пацієнтам із ФП, епізод якої триває >48 год, та ознаками нестабільності гемодинаміки (стенокардія, ІМ, шок або набряк легень), слід виконати невідкладну кардіоверсію; перед процедурою кардіоверсії призначається НФГ або НМГ в/в. Після кардіоверсії слід розпочати терапію варфарином, ривароксабаном або дабігатраном; при цьому введення гепарину слід продовжувати, поки МНВ не досягне терапевтичного рівня (2,0–3,0). Тривалість терапії пероральним антикоагулянтом (4 тиж або пожиттєво) залежатиме від наявності факторів ризику інсульту.
Від початку ФП до кардіоверсії необхідно контролювати ЧСС (схема 2.11). У стабільних пацієнтів такий контроль може бути досягнутий пероральним застосуванням ББА (метопрололом, бісопрололом) або недигідропіридиновими БКК (верапамілом або дилтіазидом). Тяжким пацієнтам із нестабільною геодинамікою корисними можуть бути верапаміл або метопролол в/в. У гострий період рекомендоване в/в введення препаратів наперстянки чи аміодарону з метою контролю ЧСС у пацієнтів з ФП та супутньою СН або за наявності АГ. За наявності передзбудження шлуночків перевагу слід надавати протиаритмічним препаратам І класу або аміодарону. У разі ФП із передзбудженням протипоказані ББА, недигідропіридинові БКК, дигоксин та аденозин. У невідкладній клінічній ситуації цільова ЧШС зазвичай становить 80–100 уд./хв. У пацієнтів із низькою ФВ ЛШ може застосовуватися аміодарон. ФП із низькою ЧШС може відповідати на атропін (0,5–2 мг в/в), але багато пацієнтів із симптомною брадиаритмією можуть потребувати або виконання кардіоверсії, або імплантації тимчасового водія ритму з електродом у ПШ [18, 23, 26].
Рекомендації щодо вибору препарату для контролю ЧСС при ФП (ААС, 2014)
ББА повинні назначатися після стабілізації пацієнта з декомпенсованою СН. Вибір ББА (наприклад кардіоселективного) залежить від клінічного стану хворого.
Дигоксин як засіб терапії першої лінії зазвичай не використовується. Він може комбінуватися з ББА і/або недигідропіридиновим БКК, коли контроль шлуночкового ритму недостатній, і може бути корисний пацієнтам із СН. Для тривалого контролю ЧСС аміодарон у зв’язку з профілем побічних ефектів слід використовувати у разі неефективності або непереносимості ББА чи недигидропіридинових БКК.
Клінічна фармакологія ААП, які сповільнюють ритм серця, наведена в табл. 2.121 та 2.122.
Таблиця 2.121. Препарати для застосування перорально з метою контролю ЧШС у хворих із ФП
|
Препарат |
Навантажувальна доза |
Початок дії |
Підтримувальна доза |
|
Контроль ЧШС |
|||
|
Дилтіазем |
Відповідає підтримувальній дозі |
2–4 год |
120–360 мг/добу, існує форма з уповільненим вивільненням |
|
Метопролол |
Відповідає підтримувальній дозі |
4–6 год |
25–100 мг 2 рази на добу всередину |
|
Пропранолол |
Відповідає підтримувальній дозі |
60–90 хв |
80–240 мг/добу всередину |
|
Верапаміл |
Відповідає підтримувальній дозі |
1–2 год |
120–360 мг/добу, існує форма з уповільненим вивільненням |
|
Аміодарон |
800 мг/добу протягом 1 тиж всередину; 600 мг/добу протягом 1 тиж всередину; 400 мг/добу протягом 4–6 тиж |
1–3 тиж |
200 мг/добу всередину |
Таблиця 2.122. Лікарські засоби, які використовуються в/в та перорально для контролю ЧСС
|
Лікарський засіб |
Доза для в/в введення |
Звичайна підтримувальна доза для перорального прийому |
|
ББА |
||
|
Метопролол CR/XL |
2,5–5 мг |
100–200 мг один раз на добу (ER) |
|
Бісопролол |
Не застосовується |
2,5–10 мг один раз на добу |
|
Атенолол |
Не застосовується |
25–100 мг один раз на добу |
|
Пропранолол |
1 мг |
10–40 мг 3 рази на добу |
|
Карведилол |
Не застосовується |
3,125–25 мг 2 рази на добу |
|
Недигідропіридинові БКК |
||
|
Верапаміл |
5 мг |
Від 40 мг 2 рази на добу до 360 мг (ER) один раз на добу |
|
Дилтіазем |
Не застосовується |
Від 60 мг 3 рази на добу до 360 мг (ER) один раз на добу |
|
Глікозиди наперстянки |
||
|
Дигоксин |
0,5–1 мг |
0,125–0,5 мг один раз на добу |
|
Інші |
||
|
Аміодарон |
5 мг/кг протягом 1 год та 50 мг/год (підтримувальна доза) |
100–200 мг один раз на добу |
Примітка. ER — лікарська форма сповільненого вивільнення.
Застосування електричної кардіоверсії при ФП
Показання до планової електричної кардіоверсії:
- неефективність медикаментозної терапії у пацієнтів із персистуючою ФП;
- непереносимість ААП або ризик, пов’язаний з їх призначенням;
- прогресування СН, погіршення кровопостачання серця, мозку, нижніх кінцівок, спричинені тахікардією;
- наявність даних про те, що лише кардіоверсія була раніше ефективною для встановлення синусового ритму при ФП.
Показання до невідкладної електричної кардіоверсії:
- пароксизм ФП з високою ЧШС на тлі гострого ІМ, нестабільної стенокардії;
- пароксизм ФП, який супроводжується симптоматичною гіпотензією, ГСН або прогресуючою ХСН;
- тяжкий пароксизм ФП, який не піддається медикаментозному лікуванню.
Проведення фармакологічної кардіоверсії при ФП [19, 23, 60, 61, 67]
Згідно з існуючими рекомендаціями, перед відновленням ритму при ФП необхідно оцінити наявність у хворого гемодинамічної нестабільності. Якщо вона визначається, виконують електричну, а не фармакологічну кардіоверсію. Тактика купірування персистуючої форми ФП різна. При структурних органічних захворюваннях серця застосовують аміодарон; за відсутності структурних змін — пропафенон чи флекаїнід. Слід зазначити, що в різних країнах ці препарати по-різному застосовують при ФП. Так, у Франції при ФП застосовують лише аміодарон, а пропафенон і флекаїнід не застосовують. У Нідерландах у 75% випадків застосовують флекаїнід; в Італії аміодарон і пропафенон призначають приблизно в 50% випадків.
Згідно із сучасними європейськими рекомендаціями, пропафенон відносять до препаратів першого ряду для виконання фармакологічної кардіоверсії при персистуючій формі ФП (клас рекомендацій 1, рівень доказовості А) у пацієнтів з мінімальними структурними змінами в міокарді [19, 26, 70].
Європейська асоціація ритму серця (EHRA) у 2013 р. визначила термін «відсутність структурних змін у міокарді», який вживається у таких випадках:
- відсутність ІМ з зубцем Q в анамнезі;
- відсутність ГКМП;
- ФВ ЛШ >45%;
- відсутність застійної чи прогресуючої стадії СН вище ІІ А;
- відсутність вроджених або ревматичних вад серця;
- відсутність вираженої ГЛШ (товщина однієї зі стінок ≤14 мм).
Пацієнтам із персистуючої формою ФП, незважаючи на адекватний контроль ЧСС, виконується фармакологічна кардіоверсія ФП за допомогою болюсного введення протиаритмічного препарату. В окремих амбулаторних пацієнтів може бути прийнятою повторна пероральна фармакологічна кардіоверсія, підхід «таблетка в кишені», таблетка пропафенону 450–600 мг одноразово, оскільки раніше була показана безпека такого втручання. Для виконання фармакологічної кардіоверсії ритму при ФП (яка розпочалася нещодавно) можуть бути застосовані декілька препаратів [23, 60] (табл. 2.123, 2.124).
Таблиця 2.123. Препарати, які застосовуються для фармакологічної кардіоверсії ритму при ФП, яка розпочалася нещодавно
|
Препарат |
Доза |
Подальша доза |
Ризики |
|
Аміодарон |
5 мг/кг в/в протягом 1 год або 600–800 мг на добу у кілька прийомів перорально (після загального навантаження до 10 г |
50 мг/год або після загального навантаження до 10 г перорально, 200 мг 1 раз на добу перорально |
Флебіт, артеріальна гіпотензія. Сповільнює ЧШС. Затримує конверсію ФП до синусового ритму |
|
Пропафенон |
2 мг/кг в/в протягом 10 хв або 450–600 мг перорально |
Не підходить для пацієнтів із вираженим структурним ураженням серця. Може подовжувати комплекс QRS; дещо сповільнює ЧШС, але може також підвищувати ЧШС через трансформацію ФП у ТП із проведенням імпульсів до шлуночків у співвідношенні 1 : 1 |
Таблиця 2.124. Рекомендації з фармакологічної кардіоверсії
|
Рекомендації |
Клас |
Рівень |
|
Якщо перевага надається фармакологічній кардіоверсії і у пацієнта немає органічного захворювання серця, для кардіоверсії ФП, епізод якої розпочався нещодавно, рекомендоване застосування флекаїніду або пропафенону в/в |
І |
А |
|
У пацієнта з органічним ураженням серця і з ФП, епізод якої розпочався нещодавно, рекомендоване застосування аміодарону в/в |
І |
А |
|
У деяких пацієнтів з ФП, епізод якої розпочався нещодавно, та без значущого структурного ураження серця слід зважити доцільність застосування однократної високої дози флекаїніду або пропафенону перорально (підхід «таблетка в кишені», забезпечивши безпеку цього лікування за допомогою попередньої перевірки цієї стратегії в контрольованих клінічних умовах) |
ІІа |
В |
|
Дигоксин (РД А), верапаміл, соталол, метопролол (РД В), інші ББА (РД С) неефективні для конверсії ФП, епізод якої розпочався нещодавно, до синусового ритму і не рекомендуються для застосування з цією метою |
ІІІ |
А, В, С |
Дигоксин та верапаміл не є ефективними препаратами для припинення ФП. Таким чином, у пацієнтів з ФП, епізод якої розпочався нещодавно (тривалістю <48 год), можна зробити спробу фармакологічної кардіоверсії до синусового ритму за допомогою в/в введення флекаїніду або пропафенону (якщо у пацієнта немає органічного ураження серця чи якщо воно незначне), чи аміодарону (якщо наявне органічне захворіння серця). Обов’язковим є застосування гепарину в/в при невідкладній кардіоверсії або варфарину чи ривароксабану за 3 тиж до планової кардіоверсії та продовжувати застосування пероральних антикоагулянтів протягом 1 міс після будь-якої кардіоверсії.
Лікування ФП наведено в сучасних джерелах літератури [4, 19, 26, 61, 62, 70] і алгоритмі 2.68, табл. 2.125, 2.126.
|
Алгоритм 2.68. Вибір медикаментозної терапії та електричної кардіоверсії у хворих із ФП і ТП Показання до медикаментозної терапії: 1. Тривалість аритмії до 1 року (персистуюча форма). 2. Відсутнє ураження клапанного апарату серця. 3. Розмір ЛП становить 40–45 мм. 4. ФВ >50%. 5. Вік хворих <60 років. Показання до електричної кардіоверсії: 1. Тривалість аритмії до 1 року. 2. Визначається ураження клапанного апарату серця. 3. Розмір ЛП становить 45–50 мм. 4. ФВ <50%. 5. Вік хворих >60 років. Показання для в/в введення ААП при ФП з метою кардіоверсії: 1. Тривалість ФП до 1 року. 2. Відсутність факторів ризику ШТ за типом «пірует». 3. Нормальна тривалість інтервалу Q–T. 4. Вміст калію і магнію в крові в межах норми (калію >4 мекв/л, магнію >1,5 мекв/л). 5. Відсутність брадикардії, значної ГЛШ та лівошлуночкової недостатності. 6. Економічна користь. 7. Свіжа рана грудної клітки. 8. Хворий не може приймати препарати перорально. Показання для перорального застосування ААП при ФП з метою кардіоверсії: 1. Тривалість ФП до 1 року. 2. Відсутність порушень провідності в системі Гіса — Пуркіньє. 3. Відсутність дисфункції синусового вузла, структурного захворювання серця, активної ішемії міокарда, систолічної дисфункції ЛШ і лівошлуночкової недостатності. 4. Обґрунтована небезпека, оскільки без застосування ААП відбудеться негайний рецидив. 5. Низька вартість. |
Таблиця 2.125. Застосування блокаторів АV-проведення для зниження ЧСС при ФП
|
Препарат |
Початкова доза |
Початок дії |
Підтримувальна терапія |
|
Дилтіазем |
0,25 мг/кг в/в за 2 хв |
2–7 хв |
5–15 мг/кг в/в крапельно |
|
Верапаміл |
5–10 мг в/в протягом 2 хв |
3–5 хв |
Не застосовується |
|
Есмолол |
500 мкг в/в протягом 1 хв |
2–5 хв |
50–200 мкг/кг/хв |
|
Пропранолол |
0,15 мг/кг в/в |
5 хв |
Не застосовується |
|
Дигоксин |
0,25 мг в/в кожні 2 год |
30 хв–2 год |
0,125–0,25 мг/добу |
Таблиця 2.126. Рекомендовані дози найчастіше застосовуваних ААП та основні застереження щодо них
|
Препарат |
Доза |
Головні протипоказання та застереження |
Зміни на ЕКГ, які зумовлюють необхідність зниження дози або відміни препарату |
Сповільнення проведення імпульсу |
|
Етацизин |
50–100 мг 3 рази на добу |
Протипоказаний при систолічній СН. Слід обережно застосовувати за наявності ураження провідної системи серця та порушенні функції нирок |
Тривалість QRS зростає на >25% початкового рівня |
Незначне |
|
Пропафенон |
150–300 мг 3 рази на добу |
Протипоказаний при ІХС, при зниженні ФВ/ЛШ. Застосовувати обережно за наявності ураження провідної системи серця та дисфункції нирок |
Тривалість QRS зростає на >25% початкового рівня |
Незначне |
|
Соталол |
80–160 мг 2 рази на добу |
Протипоказаний при значній ГЛШ, систолічній СН, вже існуючому подовженні інтервалу Q–Т, гіпокаліємії, КК <50 мг/мл. Помірна дисфункція нирок потребує ретельного коригування дози |
Інтервал Q–Т >500 мс |
Подібне |
|
Аміодарон |
600 мг |
Застосовувати обережно у разі одночасного прийому препаратів, які подовжують інтервал Q–Т, при СН. Дози АВК та дигоксину мають бути знижені |
Інтервал Q–Т >500 мс |
На 10–12 уд./хв при ФП |
|
Дронедарон |
400 мг |
Протипоказаний при СН в анамнезі або на цей момент, нестабільній СН, токсичних реакціях з боку печінки та легень, пов’язаних із попереднім застосуванням аміодарону; на фоні одночасного прийому препаратів, які подовжують інтервал Q–Т; на фоні одночасного прийому інгібіторів CYP 3A4 та при КК <30 мг/мл. Дози дигоксину мають бути знижені. Підвищення вмісту креатиніну в сироватці крові на 0,1–0,2 мг/дл є поширеним явищем і не відображає погіршення функції нирок |
Інтервал Q–Т >500 мс |
На 10–12 уд./хв при ФП |
Схему виконання медикаментозної кардіоверсії ФП наведено в алгоритмі 2.69.
|
Алгоритм 2.69. Медикаментозна кардіоверсія при ФП [19] Крок 1. Переведення тахі- в нормосистолічну форму ФП за допомогою ББА анаприліну (5 мг в/в); АК верапамілу (5 мг в/в струминно); дигоксину (0,5 мг в/в краплинно). Ці препарати дуже рідко відновлюють синусовий ритм. Крок 2. Введення препаратів із багатогранною дією:
Крок 3. Для підсилення дії та зменшення побічних реакцій цих препаратів їх комбінують з іАПФ або БРА, чи Амр, яким властива опосередкована антиаритмічна дія. Крок 4. Підтримувальна антиаритмічна терапія: якщо напади повторюються 1 раз у 4 міс і частіше, постійно застосовують аміодарон (200–400 мг/добу), пропафенон (300–600 мг/добу) в комбінації з іАПФ або БРА, чи Амр, що чинять опосередковану антиаритмічну дію. |
Вибір ААП залежно від форми ФП здійснюється з урахуванням особливостей початку аритмії (адренергічна або вагус-опосередкована) за такою наведеною схемою 2.12.
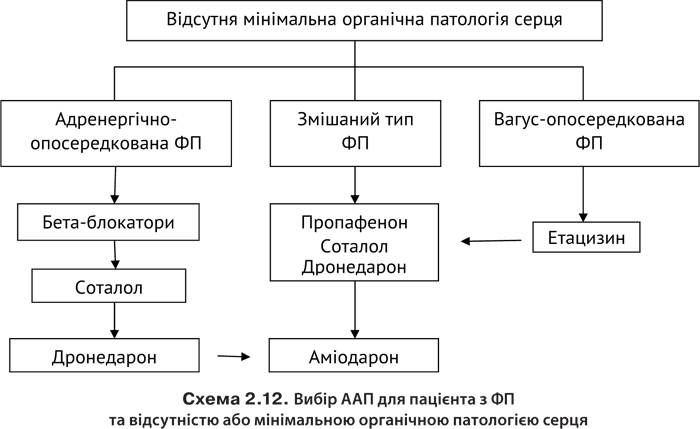
Лікування при ФП у двох стратегічних напрямках [19, 26, 61, 67, 70]
Контроль ритму — відновлення синусового ритму з подальшим профілактичним призначенням аміодарону або пропафенону. Контроль ЧСС здійснюється шляхом застосування ББА, дигоксину і варфарину під контролем МНВ (2,0–3,0). Середній термін відновлення синусового ритму при персистуючій ФП після застосування пропафенону становить 2–6 год, аміодарону — 8–18 год. При ІМ, ФВ <30%, синдромі WPW, Клерка — Леві — Крітеско, концентричній ГЛШ купірування ФП здійснюється аміодароном.
Катетерна абляція легеневих вен ефективніша, ніж абляція АV-вузла. При ФП на фоні синдрому WPW протипоказані серцеві глікозиди, АК, ББА, оскільки вони блокують проведення імпульсу по основному шляху та прискорюють його проведення по допоміжному провідному шляху, тому ЧСС підвищується, і це є загрозою розвитку ФШ (!) (табл. 2.127).
Таблиця 2.127. Збереження синусового ритму або контролю ЧСС у хворих з персистуючою ФП: переваги та недоліки
|
Переваги/недоліки |
Контроль ритму |
Контроль ЧСС |
|
Переваги |
|
|
|
Недоліки |
|
|
Як свідчать результати РКД AFFIRM (2004), виживаність хворих за умови здійснення контролю за ритмом суттєво підвищується. Автори підручника спостерігали два випадки контролю ритму: перший хворий з періодичними рецидивами ФП живе 50 років, інший — 40 років (!). За даними стокгольмського дослідження з ФП (2009), виживаності хворих сприяє подальше збереження синусового ритму протягом 3 міс. Такі ж дані наводяться в РКД RACE (2005), DIAMOND (2004).
На користь збереження ритму свідчать поєднання епізодів ФП із вираженими клінічними симптомами, молодим і середнім віком, усунення мітрального стенозу, тиреотоксикозу, малих структурних змін у серці, нормальний розмір ЛП, тривалість ФП протягом кількох тижнів або місяців.
У літературі за даними ESC (2006) наводиться інформація про ефективність ААП при ФП (табл. 2.128 і 2.129).
Таблиця 2.128. Рекомендації щодо вибору ААП для проведення кардіоверсії при ФП тривалістю менше 7 діб (ESС, 2006)
|
Препарат |
Спосіб введення |
Клас, рівень доказовості |
|
Препарати з доведеною ефективністю |
||
|
Дофетилід |
Перорально |
І, А |
|
Флекаїнід |
Перорально |
І, А |
|
Препарат |
Спосіб введення |
Клас, рівень доказовості |
|
Ібутилід |
в/в |
І, А |
|
Пропафенон |
Перорально або в/в |
І, А |
|
Аміодарон |
Перорально або в/в |
ІІ, А |
|
Препарати, які застосовувати недоцільно |
||
|
Дигоксин |
Перорально або в/в |
ІІІ, В |
|
Соталол |
Перорально або в/в |
ІІІ, В |
Таблиця 2.129. Рекомендації щодо вибору ААП для проведення медикаментозної кардіоверсії при ФП тривалістю більше 7 діб (ESС, 2006)
|
Препарат |
Спосіб ведення |
Клас, рівень доказовості |
|
Препарати з доведеною ефективністю |
||
|
Дофетилід |
Перорально |
І, А |
|
Аміодарон |
Перорально або в/в |
ІІ, А |
|
Ібутилід |
в/в |
І, А |
|
Препарати, які застосовувати недоцільно |
||
|
Дигоксин |
Перорально або в/в |
ІІІ, В |
|
Соталол |
Перорально або в/в |
ІІІ, В |
ААП ІА класу є засобами першого ряду, але вони значно менш ефективні, ніж препарати ІІІ класу аміодарон та ІС класу пропафенон і етацизин. Отже, найефективнішими ААП у лікуванні при ФП є аміодарон та пропафенон. Пропафенон ефективніший і швидше нормалізує ритм серця, ніж хінідин. Цей препарат добре переноситься, він безпечний, і хворий може самостійно застосовувати його перорально для купірування пароксизму ФП.
У зв’язку з високою ефективністю і хорошою переносимістю ААП досить популярним є відновлення синусового ритму при ФП за допомогою перорального застосування ліків.
При синдромах перезбудження шлуночків (WPW, Кларка — Леві — Крітеско), при ІМ, нестабільній стенокардії, тяжкому ураженні міокарда (концентрична гіпертрофія, ФВ <30%) купірування ФП здійснюється аміодароном.
Згідно з даними РКД, ефективність пропафенону при в/в введенні у пацієнтів із ФП становить до 90%, при пероральному — 70% протягом 8 год. ААП ІІІ класу відновлюють ритм повільно. Протягом 24 год після в/в введення аміодарону, подібно до перорального прийому хінідину, ритм відновлюється у більше ніж 80% пацієнтів з персистуючою формою ФП. Однак перевага аміодарону порівняно з ААП І класу полягає у сповільненні ЧСС шлуночків, що дозволяє уникнути небезпеки переходу ФП у ТП з можливим проведенням імпульсів 1 : 1 чи 2 : 1 і розвитком тахікардії. Поряд з цим аміодарон, на відміну від ААП І класу, не знижує інотропної функції серця. Слід підкреслити, що дигоксин, ББА, АК верапаміл та дилтіазем неефективні для швидкого відновлення синусового ритму, але корисні для сповільнення ЧСС до здійснення медикаментозної кардіоверсії, оскільки ААП при високій ЧСС шлуночків неефективні (!). При розвитку органічних ССЗ і СН призначають аміодарон; при неорганічних змінах у міокарді — пропафенон, флекаїнід.
Виконуючи електричну кардіоверсію, слід враховувати попередню та супутню терапію. Само по собі застосування дигоксину не виключає проведення ЕІТ, але насичення дигоксином є протипоказанням до її виконання у зв’язку з ризиком розвитку ФШ. Застосування аміодарону підвищує антифібриляторний поріг, тому може потребувати застосування вищої енергії нанесеного розряду при ЕІТ. Енергія розряду залежить від характеру порушення ритму серця: при ТП і суправентрикулярній ПТ необхідно проводити ЕІТ розрядом 50 Дж; при мономорфній ШТ — 100 Дж; при поліморфній ШТ — 200 Дж, а при ФП і ПТ — розрядом в 100–200 Дж.
Показання до невідкладної електричної кардіоверсії:
- пароксизмальна, персистуюча форма ФП з високою ЧСС на фоні гострого ІМ, нестабільної стенокардії;
- пароксизм ФП, який супроводжується артеріальною гіпотензією (кардіогенним шоком), ГСН чи ХСН;
- тяжкий пароксизм ФП, який не піддається медикаментозній корекції.
Електрична кардіоверсія ефективніша при персистуючій ФП (ефективність становить 80–98%), ніж медикаментозна.
Показання до планової електричної кардіоверсії при ФП:
- неефективність і непереносимість ААП;
- прогресування СН, погіршення кровопостачання серця, мозку, нижніх кінцівок, пов’язаних з тахіаритмією.
Протипоказання до електричної кардіоверсії:
- інтоксикація серцевими глікозидами;
- тромб у передсердях, розмір лівого передсердя >5 см;
- тромбоемболічні ускладнення в анамнезі;
- гіпокаліємія;
- некомпенсована ХСН;
- гострі інфекційні захворювання;
- відмова пацієнта від ЕІТ.
При кардіоверсії завжди проводять антикоагулянтну терапію. Пероральна антикоагулянтна терапія є обов’язковою перед плановою медикаментозною чи електричною кардіоверсією, коли епізод триває >48 год. Лікування проводять такими непрямими антикоагулянтами:
1. АВК варфарином у дозі 3–6 мг/добу протягом 3 тиж перед кардіоверсією під контролем МНВ (2,0–3,0); терапію продовжують 4 тиж після кардіоверсії.
2. Інгібітором Xа-фактора ривароксабаном у дозі 20 мг/добу або апіксабаном у дозі 5 мг 2 рази на добу без контролю МНВ.
3. Прямим інгібітором тромбіну дабігатраном у дозі 150 мг 2 рази на добу без контролю МНВ.
4. У пацієнтів із високим ризиком тромбоемболічних ускладнень застосовують гепарин (при тривалості ФП <48 год і виконанні кардіоверсії). Після кардіоверсії продовжують призначати непрямі антикоагулянти протягом 4 тиж.
Планову кардіоверсію виконують після 3-тижневого застосування варфарину або НПАК, препаратів калію, ААП. Її здійснюють натще; наркоз забезпечують шляхом в/в введення гексобарбіталу, тіопенталу чи пропанідиду.
У хворих із застійною СН з низькою ФВ ЛШ катетерна абляція легеневих вен є більш ефективним методом лікування при ФП, резистентної до ААП, ніж абляція АV-вузла з бівентрикулярною електрокардіостимуляцією (!).
Порівняння результатів РКД PABA-СHF та AF-СHF дає підстави вважати, що у хворих із застійною СН, спричиненою систолічною дисфункцією ЛШ, використання катетерної абляції легеневих вен, мабуть, перспективніший метод лікування при ФП, ніж медикаментозна антиаритмічна терапія.
Для профілактики рецидивів ФП кращим препаратом є аміодарон, який застосовують тривало у дозі 200–400 мг/добу. Рекомендації доказової медицини щодо лікування при ФП узагальнено в табл. 2.130.
Таблиця 2.130. Лікування при ФП згідно з рекомендаціями доказової медицини
|
Назва |
Клінічні рекомендації |
Клас, |
|
Фармакологічна кардіоверсія |
Застосування флекаїніду, дофетиліду, пропафенону або ібутиліду рекомендують для фармакологічної кардіоверсії ФП |
І, А |
|
Застосування аміодарону необхідне для фармакологічної кардіоверсії ФП як у стаціонарних, так і в амбулаторних умовах |
ІІа, А |
|
|
Синхронізована електрична кардіоверсія |
R-синхронізовану кардіоверсію постійним струмом негайно виконують хворим із ФП у поєднанні з ішемією міокарда і симптомною артеріальною гіпотензією, стенокардією чи СН, коли не вдається усунути тахісистолію фармакологічними засобами |
І, С |
|
Негайну кардіоверсію постійним струмом рекомендують хворим із ФП і допоміжним пучком Кента при розвитку тахікардії чи нестабільності гемодинаміки |
І, С |
|
|
Кардіоверсію виконують хворим при життєзагрозливих проявах ФП на фоні стабільної гемодинаміки. У разі раннього рецидиву ФП повторну електричну кардіоверсію постійним струмом можна виконувати після терапії ААП |
І, С |
|
|
Профілактика тромбоемболій |
Терапію варфарином рекомендують хворим, які мають більше одного фактора ризику (вік ≥75 років, АГ, СН, ФВ ЛШ <35% і ЦД) |
І, А |
|
Підбираючи антикоагулянтну терапію, визначати МНВ потрібно один раз на тиждень, а після досягнення стійкого рівня гіпокоагуляції — щомісячно |
І, А |
|
|
Хворим із низьким ризиком і протипоказаннями до прийому антикоагулянту варфарину застосовують АСК у дозі 75–325 мг/добу |
І, А |
|
|
Профілактичну терапію антикоагулянтами рекомендують як при ФП, так і при ТП |
І, С |
|
|
У хворих із ФП, що не мають клапанного протеза, для виконання хірургічної діагностичної процедури, яка має ризик кровотеч, можна перервати прийом антикоагулянту не більше ніж на 1 тиж без застосування гепарину натрію (!) |
ІІа, С |
|
|
У хворих із ФП після ТБКА або хірургічної реваскуляризації для профілактики розвитку тромбів можна застосовувати АСК (75–100 мг/добу) і/або клопідогрель (75 мг/добу) одночасно з антикоагулянтом, однак прийом цих препаратів пов’язаний із підвищеним ризиком кровотеч |
ІІb, С |
|
|
Профілактика тромбоемболій |
Тривалість застосування клопідогрелю визначається типом імплантованого стента (від 1 міс при імплантації простого металевого стента до 3,6 або 12 міс при імплантації інших типів, після чого застосування варфарину продовжують у монотерапії у разі відсутності рецидиву ГКС). Після призначення варфарину в комбінації з клопідогрелем або АСК необхідно ретельно контролювати дози препаратів |
ІІb, С |
|
Особливості профілактики тромбоемболічних ускладнень при ФП тривалістю >48 год |
При тривалості ФП ≥48 год або при невідомій тривалості ФП рекомендують застосовувати антикоагулянтну терапію варфарином до досягнення МНВ впродовж 2–3 тиж до виконання кардіоверсії і 4 тиж після кардіоверсії (незалежно від способу її виконання) |
|
|
Особливості профілактики тромбоемболічних ускладнень при ФП тривалістю >48 год |
При тривалості ФП 48 год виконують трансезофагеальну ехоКГ для оцінки наявності тромбів у ЛП і його вушку. Відбір антикоагулянтної терапії до і після кардіоверсії здійснюється на стратифікації ризику тромбоемболії у хворого |
І, В |
|
ІІа, С |
||
|
Якщо при трансезофагеальній ехоКГ тромби в ЛП не виявлені, кардіоверсію необхідно виконувати одразу після антикоагулянтної терапії НФГ (спочатку в/в болюсно, потім — постійна інфузія до збільшення АЧТЧ в 1,5–2 рази від контрольного значення) і продовжувати її доти, поки після застосування варфарину МНВ не збільшиться до 2–3. Варфарин продовжують призначати протягом 4 тиж після кардіоверсії |
ІІа, В |
|
|
Профілактика тромболітичних ускладнень, контроль та корекція ЧСС |
Комбінація дигоксину з ББА або АК верапамілом чи дилтіаземом показана хворим при ФП для контролю ЧСС у спокої та при фізичному навантаженні. Вибір препарату має бути індивідуальним; необхідно уникати розвитку брадикардії |
І, С |
|
Можна використовувати абляцію АV-вузла при ФП із допоміжним шляхом проведення імпульсу для контролю ЧСС, коли медикаментозна терапія недостатньо ефективна чи виникають серйозні побічні ефекти |
ІІа, В |
|
|
Якщо хворому із ФП із синдромом WPW електрична кардіоверсія протипоказана, можна вводити аміодарон або прокаїнамід в/в |
ІІа, С |
|
|
Підтримання синусового ритму |
Хворим із ФП на фоні відсутності органічних захворювань серця призначають пропафенон, починаючи з амбулаторного етапу, для профілактики пароксизмів |
ІІа, В |
|
Катетерна абляція — альтернатива фармакологічній терапії для запобігання зворотній ФП у хворих із нормальними розмірами або незначним розширенням ЛП |
ІІа, С |
Стратегія ведення пацієнта після відновлення синусового ритму полягає у профілактиці тромболітичних ускладнень, контролі ЧСС та корекції ритму серця, оптимальному лікуванні супутніх ССЗ. Ці завдання не є взаємовиключальними і можуть виконуватися одночасно. Контроль ЧСС має бути початковим підходом до ведення хворих похилого віку з ФП та невираженою симптоматикою (1 бал за шкалою EHRA). Контроль ритму рекомендований пацієнтам із симптомною ФП (≥2 балів за шкалою EHRA), незважаючи на адекватний контроль ЧСС. У пацієнтів із пароксизмальною, перисистуючою чи постійною ФП рекомендується здійснювати контроль ЧСС за допомогою фармакологічних засобів (ББА, недигідропіридинові БКК, препарати наперстянки чи комбінації цих засобів). При ФП із передзбудженням шлуночків або у пацієнтів із ФП в анамнезі для контролю ЧСС слід надавати перевагу таким препаратам, як пропафенон чи аміодарон. Доцільно ініціювати терапію з використанням протоколу гнучкого контролю ЧСС, спрямованого на забезпечення ЧСС на рівні <110 уд./хв у стані спокою. Слід застосовувати стратегію більш жорсткого контролю ЧСС, якщо симптоми персистують або якщо розвивається тахікардіоміопатія, незважаючи на здійснюваний гнучкий контроль ЧСС; при цьому слід утримувати ЧСС на рівні <80 уд./хв у стані спокою та <110 уд./хв — при помірному фізичному навантаженні. Після досягнення цільових рівнів ЧСС рекомендоване проведення 24-годинного холтерівського моніторування ЕКГ для оцінки безпеки цього лікування. При непостійних формах ФП доцільно забезпечувати контроль ЧСС за допомогою призначення дронедарону, за винятком пацієнтів із нестабільною СН ІІІ–IV ФК за NYHA. Дигоксин показаний пацієнтам із СН та дисфункцією ЛШ, а також особам, які ведуть малорухомий спосіб життя.
Прогнозування ФП і ТП після успішної кардіоверсії наведено в алгоритмі 2.70.
|
Алгоритм 2.70. Прогнозування рецидиву ФП і ТП після успішної електричної 1. Тривалість ФП >2 тиж. 2. Наявність рецидивів аритмії в анамнезі. 3. Неадекватна чи непостійна підтримувальна антиаритмічна терапія. 4. Значна дилатація порожнин серця. 5. Збільшення розміру ЛП до ≥45 мм. 6. Зниження ФВ до ≤40%. 7. ХСН І–ІІІ стадії. 8. Ревматичні або вроджені вади серця (при ІХС рецидиви виникають рідше). 9. Виражений активний запальний процес. 10. Похилий та старечий вік. |
За наявності 6 із 10 ознак напади ФП і ТП рецидивують у 90% пацієнтів.
Особливості вибору оптимального препарату для корекції ЧСС наведено в табл. 2.131.
Таблиця 2.131. Особливості вибору оптимального препарату для корекції ЧСС при постійній формі ФП
|
Препарат |
Особливо показані |
Небажані чи протипоказані |
|
Дигоксин |
СН (у комбінації з ББА) |
ГКМП, синдром WPW |
|
ББА |
ІХС, АГ, СН (у комбінації з серцевими глікозидами) |
Синдром WPW |
|
Верапаміл, дилтіазем |
АГ, ІХС |
СН, синдром WPW |
|
Соталол |
Синдром WPW |
В інших ситуаціях — препарат резерву |
|
Аміодарон |
Синдром WPW |
В інших ситуаціях — препарат вибору |
У ситуаціях, коли медикаментозні препарати виявляються неефективними для контролю ЧСС або протипоказані, альтернативою є метод радіочастотної абляції з деструкцією чи модифікацією АV-вузла. За допомогою деструкції АV-вузла відбувається повне переривання проходження імпульсу від передсердь до шлуночків, що вимагає подальшої імплантації ЕКС ДДД (R) MS при пароксизмальній формі ФП і VVІR — у пацієнтів із постійною формою ФП.
Згідно з рекомендаціями доказової медицини, при персистуючій та хронічній формі ФП рекомендується застосування антикоагулянтів непрямої дії (варфарину). В американському РКД SPAF ІІ порівняльне вивчення ефективності варфарину та АСК у профілактиці ішемічного інсульту у хворих із ФП продемонструвало приблизно однакову їхню ефективність. Однак здійснене в Європі дослідження ЕАFT продемонструвало велику перевагу варфарину над АСК у профілактиці повторних ішемічних інсультів у хворих із ФП. У цих дослідженнях наводяться такі рекомендації антитромботичної терапії при постійній формі ФП:
- у разі виконання планової кардіоверсії з тривалістю епізоду >48 год рекомендується до її виконання приймати варфарин (МНВ 2,0–3,0) або пероральні антикоагулянти непрямої дії ривароксабан, апіксабан, дабігатран протягом 3 тиж, а після кардіоверсії необхідно застосовувати варфарин або НПАК упродовж 4 тиж;
- перед виконанням ургентної електричної кардіоверсії рекомендується в/в введення НФГ з подальшим застосуванням варфарину;
- аналогічний підхід до застосування антикоагулянтів рекомендований при ТП;
- антикоагулянтна терапія не застосовується у тому разі, якщо епізод ФП триває <48 год.
При постійній формі ФП за допомогою черезстравохідної ехоКГ у 3–15% діагностують тромби в ЛП; після застосування антикоагулянтів непрямої дії протягом декількох тижнів вони зникають. Ризик розвитку інсульту у хворих із тромбом у ЛП становить близько 15% випадків на рік, що свідчить про необхідність застосування антикоагулянтів. Останнім часом з’явилися поодинокі дослідження, які свідчать про те, що навіть при пароксизмальній і тим більше персистуючій формі ФП утворюються тромби в ЛП; саме тому при персистуючій та постійній формах ФП необхідно обов’язково застосовувати варфварин або пероральні антикоагулянти непрямої дії.
Необхідно враховувати ослаблення ефекту варфарину при вживанні зеленого чаю, кави, алкоголю, риби, бобових, журавлини та посилення його дії під впливом аміодарону, пропафенону, антибіотиків.
Профілактика ФП. Кращими препаратами для профілактики ФП є аміодарон, який застосовують у дозі 200–400 мг/добу протягом місяців чи років. Проте існують рекомендації щодо застосування цих препаратів у нижчих дозах. Дронедарон може знижувати летальність, інсульти, ІМ, РСС, але є повідомлення, що він спричиняє смерть при СН. Необхідно зазначити, що існує багато інших ААП, ефективних у профілактиці рецидивів ФП (дофетилід, азимілед), яких немає на фармакологічному ринку України.
Сучасні міжнародні рекомендації щодо застосування ААП при ФП наведені в табл. 2.132 та алгоритмі 2.71.
Таблиця 2.132. Рекомендовані дози ААП для збереження синусового ритму після купірування ФП (профілактика рецидивів) (AHA/ACC/HRS, 2014)
|
Препарат |
Добова доза, мг |
Можливі побічні реакції |
|
Аміодарон |
100–400 |
Фотосенсибілізація, пневмотоксичність, полінейропатія, диспепсії, брадикардія, ШТ за типом «пірует», гепатотоксичність, дисфункція щитоподібної залози |
|
Дронедарон |
200–400 |
Не слід застосовувати при СН ІІІ–ІV ФК, а також при СН впродовж 4 тиж |
|
Дофетилід |
0,125–0,250 |
|
|
Пропафенон |
450–900 |
ШТ, застійна СН, трансформація в ТП з високою ЧСС |
|
Соталол |
160–320 |
ШТ за типом «пірует», СН, брадикардія, загострення ХОЗЛ або бронхообструктивного синдрому |
Примітка. ЗСН — застійна серцева недостатність.
Соталол (препарат ІІІ класу) призначають у дозі 80–100–320 мг/добу впродовж місяців і років, але він менш ефективний, ніж аміодарон. ААП ІС класу пропафенон у дозі 300–450 мг/добу за ефективністю поступається двом попереднім препаратам цього класу, які нерідко мають проаритмічний ефект, тому тривало їх застосовувати не варто (оскільки вони спричиняють зростання смертності). Проте при комбінації пропафенону з іАПФ, БРА та АМР побічні реакції виникають рідше.
Лікування у разі кровотеч при застосуванні НПАК має свої особливості (схема 2.13).
Результати багатоцентрових досліджень з профілактики ФП свідчать про те, що ББА бісопролол, атенолол, карведилол, метопролол можуть бути корисними для підтримання синусового ритму після кардіоверсії у деяких хворих із ФП. Однак є повідомлення, що бісопролол не покращує виживаності пацієнтів із ХСН або навіть може підвищувати смертність.
Останні досягнення профілактики ФП:
1. Останні дані свідчать про те, що іАПФ і БРА є ефективними засобами для запобігання виникненню ФП у хворих із ЦД із систолічною дисфункцією ЛШ (однак вони не завжди ефективні). Крім того, в комплексі з ААП вони сприяють підтриманню синусового ритму у хворих з ФП після кардіоверсії. У пацієнтів похилого віку з гіпертонічною хворобою та супутнім ЦД БРА та іАПФ ефективніше перешкоджають виникненню ФП, ніж ББА та АК (!). Поряд з цим БРА більшою мірою запобігають виникненню ФП, ніж іАПФ, у пацієнтів із гіпертонічною хворобою. У комплексі з ААП вони сприяють підтриманню синусового ритму у хворих із ФП після кардіоверсії, а також знижують імовірність негайних рецидивів під час електричної кардіоверсії.
2. При часто рецидивуючій формі ФП БРА (лозартан) у дозі 100 мг/добу та іАПФ лізиноприл у дозі 20 мг/добу підвищують ефективність протирецидивної дії аміодарону (200 мг/добу при ФП протягом 6-місячної терапії). У монотерапії вищу ефективність має лозартан.
3. При лікуванні аритмій серця у хворих з гіперхолестеринемією застосування статинів супроводжується значним зниженням імовірності рецидиву ФП після кардіоверсії.
Таким чином, іАПФ, БРА і статини теж можуть знижувати ймовірність виникнення ФП чи його рецидивування після кардіоверсії. Поряд із цим слід підкреслити, що при ФП АК верапаміл і БРА посилюють профілактичну ефективність ААП ІА, ІС і ІІІ класу (зокрема аміодарону, пропафенону та хінідину).
У хворих із ФП за допомогою підтримання синусового ритму при постійному прийомі ААП і повторних електричних кардіоверсіях не знижується підвищений ризик розвитку ішемічного інсульту та інших тромбоемболічних ускладнень. Декілька РКД показали, що підхід, спрямований на підтримання синусового ритму, не приводить до зниження імовірності тромбоемболічних ускладнень, але значно підвищує ризик небезпечних для життя аритмогенних побічних ефектів ААП. Профілактична антиаритмічна терапія після кардіоверсії у зв’язку з ФП більш виправдана у чоловіків і хворих зі збереженою систолічною функцією ЛШ. Отже, для останньої категорії хворих ААП — єдиний надійний засіб знизити ризик розвитку інсульту та інших тромбоемболічних ускладнень на фоні застосування антикоагулянту варфарину в пацієнтів із хронічною (перманентною, постійною) ФП (табл. 2.133).
Таблиця 2.133. Засоби досягнення безпеки лікування ФП для пацієнта
|
Заходи |
Клінічні рекомендації |
Рівень доказовості |
|
Фармакологічна кардіоверсія |
Дигоксин і соталол для фармакологічної кардіоверсії застосовувати не рекомендується |
А |
|
Хінідин, прокаїнамід, дизопірамід і дофетилід не бажано застосовувати амбулаторно для відновлення синусового ритму |
В |
|
|
Синхронізована електрична кардіоверсія |
Часте повторення електричної кардіоверсії не рекомендується пацієнтам, у яких часто повторюються епізоди ФП |
С |
|
Електрична кардіоверсія протипоказана пацієнтам з ознаками дигіталісної інтоксикації або гіпокаліємії |
С |
|
|
Дигоксин не рекомендується застосовувати в монотерапії для контролю ЧСС у хворих із пароксизмами ФП |
В |
|
|
Катетерну абляцію АV-вузла не рекомендується виконувати без попереднього здійснення медикаментозного контролю ЧСС у хворих із ФП |
С |
|
|
Фарамакологічний контроль ЧСС |
Застосовувати в/в АК верапаміл та дилтіазем не рекомендують хворим із ФП і декомпенсованою СН |
С |
|
Застосовувати в/в дигоксин або АК верапаміл і дилтіазем не рекомендують хворим із ФП і синдромом WPW, оскільки препарати можуть призвести до підвищення ЧСС |
С |
|
|
Профілактика тромбоемболічних ускладнень |
Довготривала гіпокоагуляція варфарином рекомендується для первинної профілактики інсульту у хворих віком до 60 років без ССЗ (ізольована ФП або відсутність факторів ризику тромбоемболії) |
С |
|
Антиаритмічна терапія при певних клінічних ситуаціях |
Пацієнтам з ІМ не рекомендують застосовувати ААП ІС класу |
С |
|
ББА, соталол, пропафенон і аденозин не рекомендують застосовувати при розвитку ФП у пацієнтів із бронхообструктивними захворюваннями легень |
С |
Згідно з даними проведених багатоцентрових досліджень, необхідно впроваджувати такі рекомендації доказової медицини для вторинної профілактики ФП:
1. Серед ААП перше місце у профілактиці ФП посідають препарати ІІІ класу — аміодарон в дозі 200–400 мг/добу (ефективність наближається до 80%), дофетилід (70%), азимілід (60%); соталол у дозі 160–960 мг/добу запобігає виникненню рецидивів ФП у 50–55% хворих.
2. З-поміж ААП І класу найефективніше виникненню рецидивів ФП запобігає пропафенон у дозі 450–600 мг/добу (ефективність — 70%); йому дещо поступається флекаїнід (ефективність у дозі 200–300 мг/добу досягає 60–65%); ефективність хінідину та інших препаратів ІА класу становить близько 50%.
3. При рецидивах ФП на фоні органічних захворювань серця краще застосовувати ААП ІІІ класу, а на фоні неорганічних захворювань серця — ААП І класу.
4. У хворих із рецидивами ФП на фоні клінічних проявів ХСН слід застосовувати ААП ІІІ класу (аміодарон) або їх комбінацію з ББА. Дронедарон знижує смертність, ризик розвитку ІМ, інсульту, проте є повідомлення, що його необхідно обмежувати у тривалому застосуванні, оскільки він може спричиняти розвиток електричної нестабільності міокарда і підвищення смертності при СН.
5. У результаті вивчення впливу на розвиток смертності двох методів лікування при ФП встановлено, що нормалізація ритму серця у цих пацієнтів із подальшим застосуванням антиаритмічної терапії не має суттєвих переваг над переведенням персистуючої форми ФП у постійну з подальшим застосуванням препаратів, що регулюють ЧСС, і антикоагулянтів.
Результати досліджень дозволяють дійти до таких висновків: по-перше, у хворих із персистуючою формою ФП віком понад 65 років і тих, які мають високий ризик смерті або хоч один фактор ризику розвитку інсульту, стратегія контролю синусового ритму не має переваг над стратегією контролю ЧСС за умови постійної антикоагулянтної терапії; однак власний багаторічний досвід авторів і останні публікації свідчать, що ця тактика лікування при ФП з нормалізацією синусового ритму має переваги над контролем ЧСС. По-друге, хворим із ФП у віці старше 65 років, які мають фактори ризику розвитку ішемічного інсульту, незважаючи на відновлений та підтримуваний на фоні постійної антиаритмічної терапії синусовий ритм, необхідна постійна антикоагулянтна терапія варфарином із цільовим значенням МНВ 2,0–3,0 чи НПАК, без контролю за згортальною системою крові.
Отже, складається враження, що у хворих із персистуючою формою ФП жодна із двох стратегій лікування не має достовірних переваг. Проте з’являються публікації, що у цих пацієнтів краще нормалізувати ритм серця, що значно покращує якість життя і зменшує прогресування СН. У своїй практичній діяльності автори частіше вдаються до нормалізації ритму серця при ФП із подальшим застосуванням антиаритмічної та антитромбоцитарної (у деяких випадках антикоагулянтної) терапії, що більш позитивно впливає на якість життя пацієнтів, ніж лікування, спрямоване на контроль ЧСС.
6. У хворих із постійною формою ФП дигоксин знижує ЧСС лише у спокої, а ББА — як у спокої, так і при фізичному навантаженні. На основі досвіду багаторічної клінічної роботи автори підручника для нормалізації ЧСС у цих пацієнтів зазвичай застосовують дигоксин у поєднанні з ББА, що рекомендуються ЄТК та ААУ.
7. При ФП ААП застосовують диференційовано:
- у хворих без органічних уражень міокарда (ідіопатична ФП) — ААП С і ІА класу призначають на нетривалий період;
- у пацієнтів із ІХС з вираженими структурними змінами і дисфункцією ЛШ — ААП ІІІ класу аміодарон;
- у пацієнтів із гіпертонічною хворобою з ГЛШ — аміодарон, дронедарон; без ГЛШ — пропафенон, етацизин, дизопірамід (на нетривалий період);
- у пацієнтів з ХСН — ААП ІІІ класу.
Такий диференційований підхід до вторинної профілактики ФП зменшує первинні кінцеві точки та покращує якість життя.
Згідно з даними доказової медицини, при ФП тривалістю більше 7 діб рекомендують 5 ААП: дофетилід, аміодарон, ібутилід, флекаїнід, пропафенон і тільки 5 ААП, які застосовуються в Україні: аміодарон, дронедарон, пропафенон, флекаїнід та хінідин. Пероральне застосування аміодарону при персистуючій формі ФП у дослідженні GEFAСA показало, що препарат відновлював синусовий ритм у 48% пацієнтів. Пропафенон відновлював ритм серця при персистуючій ФП у 40,6% випадків, однак він частіше, ніж аміодарон, зумовлював проаритмогенний ефект.
8. Для профілактики виникнення нападів ФП доцільно застосовувати БРА або іАПФ, особливо в комбінації з аміодароном, яким властива непряма антиаритмічна та посилююча дія за рахунок покращення нейрогуморальних факторів. Це новий напрямок запобігання виникненню рецидивів ФП, який тепер активно розробляється і впроваджується у практичну кардіологію.
2.8.3.2. Тріпотіння передсердь
Визначення. ТП характеризується правильним ритмом передсердь із частотою близько 250–350 за 1 хв із розвитком у більшості випадків передсердно-шлуночкової блокади, що забезпечує рідший ритм шлуночків.
Етіологія ТП така сама, як ФП.
Патогенез. Механізм розвитку ТП схожий із ФП. За однією з теорій, при ТП відбувається тривалий круговий рух збудження в передсердях; інша теорія стосується функціонування передсердного ектопічного вогнища. Є дані про можливе співіснування обох зазначених механізмів; при цьому виникає фізіологічна АV-блокада ІІ ступеня (2 : 1; 3 : 1; 4 : 1 тощо). Вища частота (1 : 1) трапляється при синдромі WPW, після введення атропіну, при фізичному навантаженні. Частіше наявна регулярна нормосистолічна форма ТП, тому пульс буває регулярним і аритмія нерідко виникає непомітно.
Клінічні ознаки ТП такі самі, як ознаки ФП. Проте при регулярній формі ТП хворі часто не відчувають розвитку аритмії, і її діагностують випадково при реєстрації ЕКГ. ЕКГ-критерії діагностики ТП наведені в алгоритмі 2.72.
|
Алгоритм 2.72. Критерії ЕКГ-діагностики ТП [19] 1. Наявність на ЕКГ частих, від 200 до 350 за 1 хв, регулярних і однакових хвиль F, які мають характерну пилкоподібну форму в ІІ, ІІІ, aVF-, V1–2-відведеннях. 2. При регулярній формі аритмії спостерігається правильний і регулярний шлуночковий ритм з однаковими інтервалами хвиль F–F, окрім випадків змін ступеня АV-провідності в момент реєстрації ЕКГ. 3. У разі нерегулярної форми ТП тривалість інтервалів R–R різна. 4. Спостерігаються нормальні незмінені шлуночкові комплекси QRS, яким нерідко передує постійна кількість передсердних хвиль F (2 : 1, 3 : 1, 4 : 1 тощо). 5. Рідко спостерігаються аберантні шлуночкові комплекси QRS, спричинені порушенням внутрішньошлуночкової провідності при частому ритмі серця. |
Лікування. На відміну від ФП, основним методом лікування ТП є не медикаментозна терапія, а радіочастотна катетерна абляція каватрикуспідального перешийка, розміщеного між тристулковим клапаном і місцем впадіння нижньої порожнистої вени у правому передсерді. Ефективність радіочастотної абляції становить 90–95%.
Особливості лікування при ТП:
1. Для купірування типового ТП на будь-якому етапі можна використовувати черезстравохідну стимуляцію передсердь (особливо при неперенесенні ААП). При пароксизмі ТП у ⅔ випадків досягається відновлення синусового ритму; у ⅓ випадків ТП трансформується у ФП.
2. При використанні ЕІТ для купірування ТП необхідний розряд меншої потужності (100–200 Дж).
Невідкладна терапія при ТП:
1. Невідкладна терапія у хворих із ТП залежить від їхнього клінічного стану. Якщо у пацієнта визначається порушення гемодинаміки або застійна СН, показана синхронна електрична кардіоверсія розрядом ≤50 Дж.
2. Черезстравохідна або передсердна стимуляція є методом вибору для відновлення синусового ритму при ТП, оскільки медикаментозна кардіоверсія малоефективна.
3. ААП ІС класу можуть сповільнити частоту скорочень передсердь або покращити АV-провідність, що призводить до парадоксального збільшення скорочень шлуночків.
4. Для купірування ТП застосовують також АК верапаміл та дилтіазем. Результати двох РКД, у яких оцінювалося використання дилтіазему у лікуванні хворих із ТП і ФП, свідчать про зниження ЧСС, однак дилтіазем був ефективнішим у хворих із ФП. У цих пацієнтів артеріальна гіпотензія була основною побічною реакцією, яка спостерігалась у 10% пацієнтів. У проспективному відкритому рандомізованому дослідженні порівнювали клінічні ефекти дилтіазему і дигоксину. При застосуванні дилтіазему контрольоване зниження ЧСС спостерігалося через 30 хв, дигоксину — через >4 год.
5. Велике РКД з визначенням порівняльної ефективності лікування при ТП дигоксином та аміодароном показало перевагу застосування аміодарону при в/в введенні. Однак в/в введення аміодарону було менш ефективним у зниженні ЧСС, ніж АК і ББА. Водночас ББА, аміодарон і АК рідко приводили до відновлення синусового ритму.
6. Незалежно від методу відновлення синусового ритму, після 48 год ТП необхідно застосовувати антикоагулянти, ефективність яких підтверджена численними РКД з доказової медицини.
7. Клінічна ефективність електричної кардіоверсії при ТП становить 95–100%, передсердної та трансезофагеальної надчастотної стимуляції — в середньому 82%. Доведено, що прокаїнамід, ібутилід, пропафенон підвищують ефективність електрокардіостимуляції. Ще ефективніша стимуляція електростимулами, яка використовується в сучасних штучних водіях ритму. Стимуляція може закінчуватися розвитком ФП, яка легше піддається відновленню синусового ритму.
8. Ефективність катетерної абляції при ТП становить 90–100%. Рецидиви ФП після катетерної абляції залежать від наявності ФП перед абляцією. У тих пацієнтів, у яких до абляції домінувало ТП, частота рецидивів ФП після абляції становить 38% випадків.
Робоча група з порушень ритму серця АКУ (2005) опублікувала Рекомендації з невідкладної терапії при тріпотінні передсердь (табл. 2.134). Особливості тривалого лікування при ТП наведено в табл. 2.135.
Таблиця 2.134. Рекомендації з невідкладної терапії при ТП [26, 60]
|
Клінічна ситуація/стратегія терапії |
Рекомендації |
Ефективність |
|
Гемодинамічне ТП |
||
|
Відновлення ритму; контроль ЧСС |
Невідкладна кардіоверсія |
Високоефективно |
|
ББА |
Ефективно |
|
|
Верапаміл чи дилтіазем |
Ефективно |
|
|
Дигоксин |
Малоефективно |
|
|
Аміодарон |
Малоефективно |
|
|
ТП без гемодинамічних порушень |
||
|
Відновлення ритму |
Передсердна чи черезстравохідна стимуляція |
Високоефективно |
|
Електрична кардіоверсія |
Високоефективно |
|
|
Ібутилід* |
Ефективно |
|
|
Флекаїнід |
Малоефективно |
|
|
Пропафенон |
Малоефективно |
|
|
Соталол |
Малоефективно |
|
|
Прокаїнамід |
Малоефективно |
|
|
Аміодарон |
Малоефективно |
|
|
Контроль ЧСС |
Дилтіазем чи верапаміл |
Високоефективно |
|
ББА |
Малоефективно |
|
|
Дигоксин |
Малоефективно |
|
|
Аміодарон |
Малоефективно |
|
Примітка. *ААП, не зареєстровані в Україні.
Таблиця 2.135. Рекомендації з тривалого лікування при ТП [19, 26]
|
Клінічна ситуація/стратегія терапії |
Рекомендації |
Ефективність |
|
ТП виникло вперше, пароксизм ТП переноситься добре |
Черезстравохідна стимуляція |
Високоефективно |
|
Електрична кардіоверсія |
Високоефективно |
|
|
Ібутилід* |
Ефективно |
|
|
Флекаїнід |
Малоефективно |
|
|
Пропафенон |
Малоефективно |
|
|
Соталол |
Малоефективно |
|
|
Прокаїнамід |
Малоефективно |
|
|
Аміодарон |
Малоефективно |
|
|
Рецидивування ТП, яке добре переноситься |
Катетерна абляція |
Високоефективно |
|
Дофетилід |
Ефективно |
|
|
Аміодарон, соталол, флекаїнід, хінідин, пропафенон, прокаїнамід, дизопірамід |
Малоефективно |
|
|
ТП переноситься погано |
Катетерна абляція |
Високоефективно |
|
ТП, яке виникає під час лікування ФП ААП ІС класу чи аміодароном |
Катетерна абляція |
Ефективно |
|
Відміна призначеного ААП і застосування іншого |
Високоефективно |
|
|
ТП, рефрактерне до ААП |
Катетерна абляція |
Ефективно |
Примітка. *ААП, не зареєстровані в Україні.
Існують різні методи лікування при ТП. Послідовність терапевтичних заходів при резистентній формі ТП представлена в алгоритмі 2.73.
|
Алгоритм 2.73. Купірування резистентної до лікування форми ТП [19] Крок 1. 1. Верапаміл чи дилтіазем в оптимальних дозах. 2. іАПФ (еналаприл 10–20 мг/добу) або 3. БРА кандесартан (8,0–16,0 мг/добу). 4. Діуретики при набряковому синдромі (фуросемід — 40 мг/добу, торасемід — 10 мг/добу). 5. АСК, гепарин чи фраксипарин в оптимальних дозах. Крок 2. Черезстравохідна електростимуляція передсердь з метою купірування ТП або переведення ТП у ФП і подальше лікування останньої. Крок 3. Застосування ААП І і ІІІ класу малоефективне. 1. Пропафенон — 600 мг/добу перорально або 75 мг в/в (малоефективно); ібутилід в Україні не застосовується. 2. Прокаїнамід — 2 г чи етацизин — 50 мг в/в (малоефективно). 3. Аміодарон — 300–600 мг в/в чи 1000–1200 мг перорально (малоефективно); дронедарон — 400 мг/добу (недостатньо вивчений, існують різні дані). Крок 4. ЕІТ або планова катетерна абляція. |
Примітка. За показаннями лікування ТП розпочинають з ЕІТ або кроку 2.
Слід зазначити, що ТП важче купірувати, ніж ФП, тому за допомогою серцевого глікозиду дигоксину та черезстравохідної стимуляції передсердь у деяких випадках вдається перевести ТП у ФП, а потім лікувати останню за загальними принципами.
Резюме. Засобом вибору при пароксизмах ТП є електрична кардіоверсія або черезстравохідна стимуляція передсердь. Серед медикаментозних засобів для відновлення ритму серця при ТП застосовують верапаміл чи пропафенон та аміодарон, але вони недостатньо ефективні при цій патології.
Профілактика. Первинна профілактика ТП — це запобігання виникненню захворювань серця та судин; вторинна профілактика передбачає тривале застосування перш за все аміодарону впродовж місяців і років у дозі 200–400 мг/добу в поєднанні з БРА або іАПФ.
2.8.4. Синдром подовженого інтервалу Q–T
Визначення. Синдром подовженого інтервалу Q–T (СПІQT, синдром сповільненої реполяризації) — це подовження коригованого інтервалу Q–T (електричної систоли) >0,46 с. Цей синдром належить до каналопатій.
На сьогодні СПІQT розглядають як групу схожих за патогенезом, клінічною картиною, перебігом і прогнозом станів, об’єднаних ступенем подовження інтервалу Q–T і можливим розвитком РСС. На сьогодні цей синдром залишається однією з головних причин смерті в розвинених країнах (15–20% усіх випадків смерті).
Етіологія. Розрізняють вроджений і набутий СПІQT. Спадкові форми: синдром Джервелла — Ланге — Нільсена (поєднання нападів втрати свідомості і РСС із вродженою глухонімотою), синдром Романо — Уорда (без вродженої глухонімоти).
Набутий СПІQT виявляють при ССЗ (ІХС, АГ, ДКМП, ГКМП, СН, пролапсі мітрального клапана з регургітацією крові, вроджених вадах серця), а також при ЦД, хронічному алкоголізмі, феохромоцитомі, гіпотермії, ХОЗЛ тощо.
Стосовно патогенезу СПІQT висуваються такі гіпотези:
1. Гіпотеза симпатичного дисбалансу припускає порушення правобічної симпатичної іннервації серця з перевагою лівобічних симпатичних вузлів. Нині цю гіпотезу переглянуто: останнім часом виявлені генетичні ознаки СПІQT. Порушення іонообміну стосується головним чином калієвих, натрієвих і кальцієвих струмів, що може збільшувати або зменшувати час реполяризації шлуночків, призводити до електрофізіологічної неоднорідності та створювати передумови для розвитку шлуночкових тахіаритмій, ФШ і РСС. Є надія, що розуміння генетичної основи цих синдромів приведе до генетичної терапії.
2. Гіпотеза внутрішньосерцевих аномалій, яка є основною, пояснюється теорією про патологію іонних каналів. Мутації у генах, відповідальних за розвиток СПІQT, призводять до порушення функціонування іонних каналів і збільшення тривалості потенціалу дії в кардіоміоцитах або пізніх післядеполяризацій з розвитком шлуночкової «пірует»-тахікардії.
Фактори, які провокують аритмії при СПІQT [19, 26]:
1. Фізичне (особливо під час плавання) та емоційне навантаження (різкий шум, гнів) можуть провокувати появу синкопе в результаті підвищення концентрації катехоламінів.
2. Розвиток брадикардії, яка спостерігається при цьому синдромі.
3. Поява вираженої хвилі U і комплексів Т–U за рахунок подовження постдеполяризації в ендокарді шлуночків.
4. Альтернуючий зубець Т — зміна його амплітуди, полярності та інтервалу Q–T із супутніми змінами комплексу QRS.
5. Симпатична стимуляція СПІQT може стати тригерним фактором для розвитку аритмій.
Клініка. У пацієнтів із СПІQT спостерігається запаморочення чи втрата свідомості на певний час на тлі основного захворювання. На ЕКГ визначають подовжений інтервал Q–T >0,46 с і нерідко різні шлуночкові порушення ритму серця. Загрозливою аритмією при СПІQT є шлуночкова «пірует»-тахікардія, яка у 20% випадків спричиняє ФШ.
Стандарти діагностики та лікування СПІQT наведені в алгоритмі 2.74.
|
Алгоритм 2.74. Діагностика та лікування СПІQT [60] Крок 1. Діагностування синдрому згідно з критеріями. Великі критерії:
Малі критерії:
Вірогідний діагноз встановлюється, якщо наявні 2 великі критерії або 1 великий та 2 малі критерії. Крок 2. Встановлення етіології СПІQT. Вроджені форми:
Набуті форми:
Крок 3. Лікування СПІQT при набутих формах. Етап 1. Медикаментозна профілактика шлуночкових порушень ритму:
Етап 2. Седативна терапія після синкопальних, іпохондричних станів, клінічної смерті та депресії:
Етап 3. ІКД в комбінації з ББА (у разі неефективності медикаментозної терапії) або застосування електрокардіостимуляції (виражена брадикардія із синкопальними станами). Етап 4. Ліва шийно-грудна ганглійектомія, яка усуває симпатичний дисбаланс іннервації серця (у разі неефективності попереднього лікування). Крок 4. Лікування СПІQT при вроджених формах:
Крок 5. Профілактичні заходи. Вчасне адекватне лікування залежно від форми захворювання. Уникати фізичних навантажень при типі LQT1 і емоційного перевантаження при типі LQT2. Для профілактики РСС застосовують ББА, іАПФ, АМР, АСК, статини [4, 5]. |
Триває розроблення неспецифічної терапії СПІQT: у разі захворювання 1-го типу найефективніші ББА; 2-го типу — препарати калію; 3-го типу — блокатори швидких натрієвих каналів (мексилетин). Новим препаратом для лікування хворих із вродженим СПІQT 1-го і 2-го типу є нікорандил, що відкриває АТФ-чутливі калієві канали кардіоміоцитів. Перспективне лікування СПІQT — це розробка генетичної терапії, яка наразі здається безнадійно далекою.
2.8.5. Синдром Бругада
Синдром Бругада належить до каналопатій і був описаний у 1992 р., коли в клініках Бельгії, Іспанії та США лікарі брати Педро, Джозеф і Рамон Бругади описали синдром РСС в осіб без структурного захворювання серця. Він частіше спостерігається вночі, уві сні, у чоловіків молодого чи середнього віку. За даними ехоКГ зміни з боку системи кровообігу не виявлені. На ЕКГ реєструється атипова БПНПГ зі значним підйомом сегмента ST над ізолінією у V1–V3 та інверсією зубця Т (часто у поєднанні з АV-блокадою І ступеня) [19].
Встановлено, що це вроджений дефект гена SCN5A, що локалізується у третій хромосомі (3 р21–24), яка контролює функцію натрієвих каналів і відповідає за електричну стабільність серця. При цьому реєструється атипова БПНПГ, напади ШТ, ФШ і часті синкопальні стани. Коронарографія встановлює нормальну прохідність КА, збережену функцію ЛШ і ПШ, відсутність гіпертрофії ЛШ і ПШ. Схему діагностики та лікування синдрому Бругада наведено в алгоритмі 2.75.
|
Алгоритм 2.75. Діагностика та лікування синдрому Бругада [19] Крок 1. Симптоми, які дозволяють запідозрити синдром Бругада: Клініка синкопального стану, РСС, шлуночкової ПТ чи ФШ. Крок 2. Критерії діагностики синдрому Бругада: 1. ЕКГ-критерії: підйом сегмента ST у V1–V2, епізоди шлуночкової ПТ, БПНПГ. 2. Провокаційні проби з ААП ІА та ІС класу (прокаїнамід, пропафенон, флекаїнід) з виникненням проаритмічних ефектів. Крок 3. Визначення варіанта синдрому Бругада:
Залежно від форм елевації сегмента ST виділяють три типи синдрому Бругада:
Крок 4. Діагностика синдрому Бругада за допомогою фармакологічних проб. Введення в/в одного з препаратів (ААП 1-го класу):
Крок 5. Лікування при синдромі Бругада Наразі достовірно ефективного медикаментозного лікування при синдромі Бругада не існує. З метою профілактики РСС використовують ІКД. |
Примітка. Під час проведення проб можлива індукція небезпечних серцевих аритмій (навіть ФШ), тому необхідно бути готовим до проведення реанімаційних заходів.
Диференційна діагностика синдрому Бругада наведена на рис. 2.13.
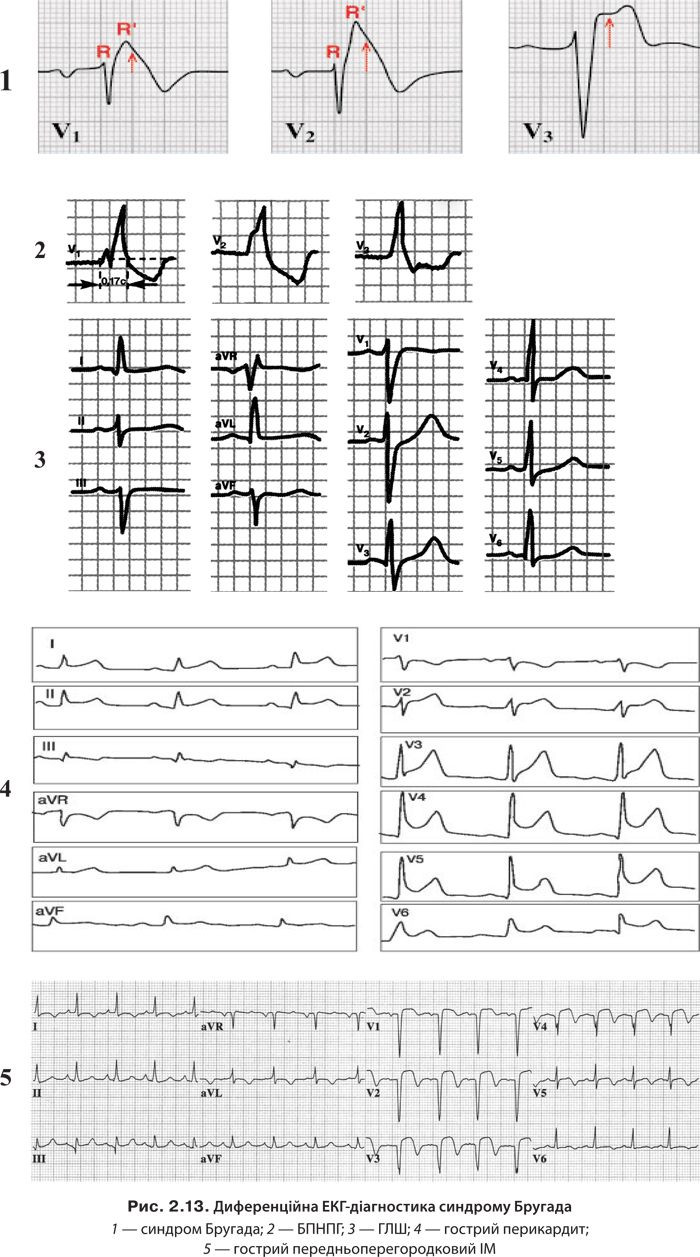
2.8.6. Раптова серцева смерть. Фібриляція шлуночків, асистолія та електромеханічна дисоціація
РСС
Визначення. РСС, або первинна зупинка серця — це смерть у присутності свідків, яка настає при ІХС раптово впродовж 1 год з моменту появи ознак захворювання, або в осіб, які за одну добу до цього були абсолютно здоровими, чи у хворих, які перебували в задовільному стані. До РСС не належить смерть від ІМ більше ніж за 1 год від початку його виникнення, а також від шоку та набряку легень, оскільки причиною смерті є не захворювання, а зазначені ускладнення. У США РСС щорічно виникає у 180 000–450 000 осіб.
РСС значно «помолодшала» і можлива навіть у віці 20–30 років. У 80–90% випадків РСС виникає на догоспітальному етапі, до приїзду швидкої допомоги. Майже 50% усіх померлих від ІМ помирають у першу годину після появи ознак захворювання. Хворі на ХСН ІІІ–ІV ФК (класифікація NYHA) у 50% випадків помирають від ФШ (!).
Етіологія. Причиною РСС у 80–90% випадків є ІХС (ІМ, різні форми стенокардії, постінфарктний кардіосклероз, фатальні аритмії та блокади серця); ФШ, асистолія, синдром Бругада, «пірует»-тахікардія та інші злоякісні шлуночкові аритмії; повна АV-блокада із синкопальними станами, кардіоміопатії, гіпертонічна хвороба, набуті та вроджені вади серця, аномалії провідної системи серця (синдроми WPW, Кларка — Леві — Крітеско), пролапс мітрального клапана з регургітацією крові, тампонада серця, ХСН тощо. Вона може виникати також при захворюваннях органів дихання (бронхіальна астма, ХОЗЛ, ТЕЛА), травлення (загальні отруєння, перитоніти, гепатити, цирози печінки, кровотечі), при застосуванні симпатоміметиків (норепінефрин, епінефрин, допамін, фенілефрин), бронхолітиків (сальбутамол, фенотерол тощо), ААП (хінідин, дизопірамід, флекаїнід, аміодарон, верапаміл) тощо.
Зупинка серця може виникати раптово — на тлі нормального стану здоров’я чи помірно виражених симптомів захворювань серця; у результаті погіршення функції системи кровообігу та дихальної системи (порушення прохідності дихальних шляхів, різке прогресування легеневої недостатності); на тлі прогресування тяжких захворювань.
Основні фактори ризику РСС [5, 19]:
- стійка ШТ і зупинка серця в анамнезі;
- перенесений ІМ, коли ШТ та ФШ виникають впродовж року в 5% випадків;
- систолічна дисфункція ЛШ та СН;
- синкопальні стани кардіального походження;
- «пробіжки» ШТ і ШЕ ІІІ–V градацій.
Другорядні фактори ризику:
- АГ, ГЛШ, особливо в осіб похилого віку;
- гіперліпідемія;
- інтенсивна фізична активність під час тренування у спортсменів;
- вживання алкоголю у великих дозах, тютюнопаління;
- підвищення ЧСС, ЦД;
- подовження інтервалу Q–T >40 мс.
Патогенез. Вважають, що основною причиною РСС є аритмії, блокади серця та розвиток електричної нестабільності міокарда.
До пускових факторів РСС належать:
1) гостро виникла ішемія міокарда, зумовлена коронароспазмом, тромбозом, у тому числі реперфузією, підвищенням потреби міокарда в кисні;
2) дисбаланс вегетативного статусу з перевагою симпатичного;
3) порушення метаболізму міокарда (гіпокаліємія, гіпомагніємія);
4) токсичні фактори, в тому числі застосування симпатоміметиків, бронхолітиків, ААП, що підвищують збудливість міокарда чи подовжують інтервал Q–T.
Причиною РСС при захворюваннях серця та судин є фатальні аритмії: ФШ (85% випадків), асистолія (10%) та електромеханічна дисоціація (5% випадків). Частка пацієнтів, які вижили після хоча б одного епізоду фатальних аритмій, незначна і становить приблизно 19% загальної кількості.
Прогноз. Критерії прогнозування РСС систематизовані в алгоритмах 2.76 і 2.77.
|
Алгоритм 2.76. Прогнозування РСС у пацієнтів із ІХС [60] 1. Тяжкі ураження міокарда, що супроводжуються ішемією (часті напади стенокардії, депресія сегмента ST у спокої та при фізичному навантаженні). 2. Перенесений ІМ і наявність зубця Q на ЕКГ. 3. В анамнезі успішна реанімація після ФШ та асистолії. 4. ХСН ІІБ–ІІІ стадії (класифікація NYHA III–IV ФК). 5. Дисфункція міокарда та зниження ФВ до ≤35%. 6. Виражена кардіомегалія та збільшення розмірів порожнин серця (за даними ехоКГ). 7. Виражена ГЛШ або окремих камер серця. 8. Електрична нестабільність серця (шлуночкова екстрасистолія ІІІ–V градацій, ШТ багатофокусна або за типом «пірует»), альтернація зубця Т. 9. Синоатріальна або АV-блокада ІІ–ІІІ ступеня. 10. СССВ із синкопальними епізодами. 11. Порушення реполяризації (виражені зміни зубця Т на ЕКГ). 12. Збільшення інтервалу Q–T >0,46 с і дисперсія інтервалу Q–T. 13. Пізні потенціали шлуночків. 14. Зниження варіабельності ритму серця. 15. Гіпокаліємія та гіпомагніємія. 16. Поєднання цих факторів. |
|
Алгоритм 2.77. Прогнозування серцевої смерті у пацієнтів із некоронарними захворюваннями [60] 1. Тяжке ураження серця, що супроводжується кардіомегалією. 2. Виражений розвиток гіпертрофії міокарда, збільшення розмірів і порожнин серця за даними ехоКГ (дилатаційний чи змішаний гіпертрофічно-дилатаційний тип ремоделювання). 3. Дисфункція міокарда та зниження ФВ до ≤35%. 4. ХСН ІІБ–ІІІ стадії (класифікація NYHA ІІІ–ІV ФК). 5. Електрична нестабільність міокарда (шлуночкові екстрасистоли ІІІ–V градацій, шлуночкова ПТ багатофокусна чи за типом «пірует»). 6. Синоатріальна блокада та АV-блокада ІІ ступеня ІІ–ІІІ типу. 7. СССВ. 8. Порушення деполяризації (комплексу QRS) і реполяризації зубця Т на ЕКГ. 9. Подовження інтервалу Q–T >0,46 с і зміни його дисперсії. 10. Пізні потенціали шлуночків. 11. Зниження варіабельності ритму серця. 12. Гіпокаліємія та гіпомагніємія. 13. Поєднання цих факторів. |
За наявності 10 із 16 факторів РСС виникає протягом 5 років у 65% випадків. За наявності 8 із 13 факторів РСС виникає протягом 5 років в 70% випадків.
Фібриляція шлуночків
Визначення. ФШ — хаотичне аритмічне збудження та неефективне скорочення окремих м’язових волокон міокарда з дуже високою частотою (>300 за 1 хв). У 75–90% випадків безпосередньою причиною смерті є ФШ, яка у 80–85% хворих виникає після епізодів ШТ, при цьому нерідко (25% випадків) після тахікардії за типом «пірует».
Патогенез ФШ складний і до кінця не вивчений. Виникнення тріпотіння і ФШ зумовлені розвитком механізму re-еntry.
Клініка. Основні клінічні симптоми раптової зупинки кровообігу:
1) відсутність пульсу на сонних та стегнових артеріях;
2) зупинка дихання;
3) розширення зіниць;
4) втрата свідомості;
5) сірувато-блідий колір слизової оболонки і шкіри;
6) тонічні та клонічні судоми;
7) атонія та арефлексія.
Стандарти ЕКГ-діагностики ФШ наведено в алгоритмі 2.78.
|
Алгоритм 2.78. ЕКГ-діагностика тріпотіння та ФШ [19] ЕКГ-критерії тріпотіння шлуночків: 1. Часті (250–300 за 1 хв) регулярні чи майже регулярні хвилі порівняно великої амплітуди, широкі осциляції, в яких неможливо визначити сегмент ST, зубці T, R і S. 2. Амплітуда хвиль однакова і нагадує синусоїдну криву. ЕКГ-критерії ФШ: 1. Нерегулярні, неоднакової форми та амплітуди хвилі фібриляції з частотою >300 за 1 хв. 2. Комплекс QRS, сегмент ST і зубець Т залежно від амплітуди хвиль важко диференціюються чи не розпізнаються. 3. Ізоелектрична лінія не визначається. Амплітуда хвиль фібриляції має тенденцію до зменшення. |
У розвитку ФШ виділяють чотири стадії:
1) стадія тріпотіння шлуночків — на ЕКГ реєструються високоамплітудні хвилі з частотою 250–300 за 1 хв (тривалістю 2 с);
2) судомна стадія (1 хв), за якою відбуваються хаотичні некоординовані скорочення окремих ділянок міокарда з появою на ЕКГ високоамплітудних хвиль із частотою до 600 за 1 хв;
3) стадія мікрохвильова ФШ тривалістю до 3 хв. На ЕКГ — низькоамплітудні хвилі з частотою до 1000 за 1 хв;
4) атонічна стадія — порушення окремих ділянок міокарда, що згасають; на ЕКГ наростає тривалість і зниження амплітуди хвиль та їхньої частоти до 400 за 1 хв.
Ознаки дуже високого ризику ФШ [5, 19, 26, 68]:
- наявність епізодів зупинки кровообігу або синкопальних (пов’язаних із тахіаритміями) станів в анамнезі;
- зниження ФВ ЛШ <30–40%;
- тахікардія у спокої;
- низька варіабельність синусового ритму в осіб, які перенесли ІМ;
- наявність пізніх шлуночкових потенціалів у осіб, які перенесли ІМ.
Зазначимо, що патогномонічних (чутливих та специфічних) предикторів розвитку РСС не існує. Однак у осіб без фатальних захворювань найвагомішими симптомами, які допомагають передбачати виникнення РСС, є виражена брадикардія, тахікардія, порушення дихання, а також порушення свідомості. У пацієнтів, які перебувають у критичному стані, неспецифічним предиктором РСС є значне прогресування та негативна динаміка захворювання [3–5, 19, 26].
При дуже високому ризику РСС необхідна ІКД. Для впливу на причину виникнення РСС у пацієнтів із ІХС необхідно виконати коронарографію і залежно від її результатів та показань застосувати ТБКА, стентування або АКШ.
Реанімаційні заходи при ФШ представлені в алгоритмі 2.79, при асистолії — 2.80, при електромеханічній дисоціації — 2.81.
|
Алгоритм 2.79. Стандарти послідовності реанімаційних заходів при ФШ [19] Крок 1. Діагностика раптової зупинки кровообігу впродовж 10 с. Крок 2. Зареєструвати ЕКГ, на якій при ФШ визначається крива неправильної форми, а зубці не піддаються диференціації. Крок 3. Покласти хворого на підлогу чи на щит. Крок 4. Нанести різкий удар кулаком, занесеним приблизно на 20 см над грудною кліткою, по нижній третині груднини. Крок 5. Зробити непрямий масаж серця (100 компресій за 1 хв) та штучне дихання із рота в рот чи з рота в ніс (у співвідношенні 30 : 2). Не можна переривати масаж більше ніж на 10 с. Краще для штучного дихання використовувати апарат (мішок Амбу). Виживаність пацієнтів, яким дефібриляція проведена в перші 3 хв з моменту зупинки кровообігу, становить 74%. Кожна хвилина затримки зменшує можливість успішної дефібриляції на 10%. Сила натискання на електрод дефібрилятора повинна становити 8 кг. Якщо немає тісного контакту електрода зі шкірою, утворюються опіки. Крок 6. Виконати електричну дефібриляцію розрядом відповідно 200; 300 і 360 Дж за допомогою біфазного дефібрилятора. Якщо ФШ зберігається, то через 2 хв повторюють нанесення розряду з енергією 360 Дж. За допомогою монофазного дефібрилятора енергія першого розряду становить 360 Дж. Класичне розташування електродів: друге міжребер’я справа від груднини; зліва — на рівні розташування грудного електрода V4–V5. При передньозадньому розташуванні один електрод встановлюється медіальніше лівого соска, другий — під лівою лопаткою. Більш ефективна друга локалізація електродів (ЄТК, 2015). Крок 7. Інтубувати трахею та забезпечити венозний доступ. Крок 8. Ввести 1 мл 1% розчину (0,5 мг) адреналіну в/в кожні 3–5 хв (не менше 1–2 разів). За відсутності венозного доступу адреналін вводять ендотрахеально (2–2,5 мг). Раніше адреналін вводили внутрішньосерцево. Крок 9. Знову виконати електричну дефібриляцію розрядом 360 Дж. Крок 10. Ввести 300 мг аміодарону, за його відсутності — 1 мг/кг лідокаїну в/в струминно і через 2 хв виконати дефібриляцію розрядом 360 Дж. Крок 11. Знову виконати електричну дефібриляцію розрядом 360 Дж. |
Примітка. Препарати кальцію не вводять, оскільки вони можуть поглиблювати післяреанімаційну ішемію головного мозку та серця.
Серцево-легенева реанімація включає дві стадії:
І стадія (має три етапи — САВ):
С (Сіrсulatіon) — штучне підтримання кровотоку. У перші 30 с зупинки серця — прекардіальний удар, потім — непрямий масаж серця.
А (Аіr) — відновлення прохідності дихальних шляхів.
В (Breathіng) — штучна вентиляція легень рот у рот.
ІІ стадія (САВ + Д):
Д (Drugs) — медикаментозна терапія зупинки кровообігу: вводять 2–3 мг адреналіну, одноразово болюсно в/в при асистолії, при якій активується вагус. Якщо електрична дефібриляція виконується в перші 3 хв, виживаність може досягати 74%, а якщо вона проводиться пізніше, то виживаність становить <40% випадків. Встановлено, що у разі безуспішної дефібриляції аміодарон ефективніший, ніж лідокаїн.
Призупиняти серцево-легеневу реанімацію можна тільки тоді, коли були використані всі доступні методи і не спостерігались ознаки її ефективності протягом 30 хв (відрахунок часу необхідно вести не від початку проведення серцево-легеневої реанімації, а з того моменту, коли вона перестала бути ефективною, тобто через 30 хв, протягом яких відсутня електрична активність серця).
У разі неефективності реанімаційних заходів настає смерть. Розрізняють соціальну смерть — частково зворотний стан, що характеризується незворотною втратою функцій кори головного мозку (декортикація) при збереженні вегетативних функцій; біологічну смерть — незворотний стан, коли повернення до життя організму як цілісної системи вже неможливе; смерть мозку — повне і незворотне припинення усіх функцій головного мозку, зареєстроване при працюючому серці, на фоні штучної вентиляції легень, інфузійної та медикаментозної терапії.
Ефективність серцево-легеневої реанімації на догоспітальному етапі не перевищує 40%, а з-поміж пацієнтів, у яких вона виконана у стаціонарі, виживає лише 14–17%. Більшість хворих, у яких виконання серцево-легеневої реанімації відновлює діяльність серця, помирають протягом 3 діб від постреанімаційної дисфункції міокарда [3, 19, 26, 60].
Під час компресій грудної клітки відбувається частковий газообмін (оксигенація крові та виведення СО2) за принципами високочастотної штучної вентиляції легень, що також може сприяти компенсуванню респіраторної потреби організму. Припинення компресій грудної клітки на час проведення дихання «рот у рот» призводить до критичного зниження тиску в аорті та величин мозкового й коронарного кровообігу. Між тим вдування повітря в дихальні шляхи підвищує внутрішньоплевральний тиск і зменшує величину венозного повернення до серця. Під час вдування в дихальні шляхи повітря (500–600 мл) підвищується ризик потрапляння його до шлунка та його перерозтягнення, що спричиняє регургітацію та аспірацію в дихальних шляхах шлункового вмісту.
Існують повідомлення про те, що зниження частоти штучного дихання приводить до покращення результатів серцево-легеневої реанімації. В Японії у великому проспективному дослідженні (4068 пацієнтів) доведено, що виконання лише компресій супроводжувалося достовірним покращенням результатів реанімації порівняно з традиційними заходами серцево-легеневої реанімації. Тому за останньою схемою реанімацій співвідношення непрямого масажу серця і дихання «рот у рот» становить 30 : 2. Для медиків не буде помилкою виконувати штучний масаж серця безперервно протягом кількох хвилин, а вентиляцію легень розпочати пізніше і виконувати її значно рідше. Медикам пропонується самостійно вибирати методику проведення реанімації залежно від власного досвіду та конкретних обставин (!).
Шанси на успішну реанімацію значно підвищуються у разі усунення факторів «4 Г» і «4 Т».
До факторів «4 Г» належать: 1) гіпоксемія; 2) гіповолемія; 3) гіпо-, гіперкаліємія, гіпокальціємія, ацидоз; 4) гіпотермія.
Фактори «4 Т»: 1) тугий (напружений) пневмоторакс; 2) тампонада серця; 3) токсичне ураження; 4) ТЕЛА.
Доцільно звернути увагу на такі рекомендації стосовно реанімаційних заходів [19, 26, 60]:
- для підвищення серцевого викиду і зменшення навантаження на міокард компресії необхідно виконувати непрямий масаж серця протягом 2 хв після дефібриляції навіть при відновленні серцевого ритму;
- якщо після дефібриляції ритм серця не відновлено, другий і подальший розряд доцільно застосовувати лише після додаткових циклів компресій;
- заходи серцево-легеневої реанімації можуть бути ефективними лише тоді, коли їх вживають протягом перших 5 хв з моменту розвитку РСС;
- затримка виконання компресій грудної клітки на кожну хвилину призводить до зниження виживаності на 10–15%;
- на сьогодні одним із головних шляхів покращення ефективності непрямого масажу серця є значне скорочення перерви під час його виконання (навіть на проведення штучного дихання та повторних дефібриляцій);
- для підвищення ефективності реанімаційних заходів необхідно оснастити дефібриляторами не лише всі машини швидкої допомоги, лікарні, кабінети функціональної діагностики, але й громадські місця (аеропорти, супермаркети, спортивні центри тощо).
Типові помилки при проведенні серцево-легеневої реанімації:
1. Затримка початку проведення серцево-легеневої реанімації, втрата часу на діагностичні, організаційні та лікувальні процедури.
2. Неправильна техніка проведення закритого масажу серця, здебільшого недостатня частота (<100 за 1 хв) і недостатня глибина (<4–5 см) компресій або перерва між ними >10 с.
3. Неправильна техніка штучної вентиляції легень: не забезпечена прохідність дихальних шляхів, герметичність при вдуванні повітря (найчастіше маска нещільно прилягає до обличчя пацієнта), повільне вдування повітря.
4. Пізній початок введення адреналіну або інтервали між ін’єкціями, що перевищують 5 хв.
5. Затримка з виконанням електричної дефібриляції одразу після введення медикаментозних засобів без попередніх (протягом 2 хв) компресій грудної клітки та штучної вентиляції легень.
6. Передчасне призупинення реанімаційних заходів.
7. Застосування електричного розряду у разі відсутності ФШ суттєво погіршує результати серцево-легеневої реанімації, тому дефібриляцію у стаціонарі проводять за умов ЕКГ-підтвердження ФШ.
Будь-яка помилка у виконанні серцево-легеневої реанімації може стати фатальною.
Актуальним питанням є вивчення ефективності антиаритмічної терапії залежно від клінічних станів (табл. 2.136).
Таблиця 2.136. Рекомендації ЄТК щодо профілактики РСС
|
Клінічні стани |
Клас І (засоби І ряду) |
Клас ІІа (засоби ІІ ряду) |
Клас ІІb (засоби ІІІ ряду) |
|
Перенесений ІМ: первинна профілактика |
|||
|
Дисфункція ЛШ |
ББА; іАПФ; АМР |
Аміодарон; ШКД (якщо ФВ <30%) |
— |
|
ФВ <30% + спонтанна нестійка ШТ + індукована за допомогою ЕФД стійка ШТ |
ШКД |
— |
— |
|
Перенесений ІМ: вторинна профілактика |
|||
|
Перенесена ФШ |
ШКД |
||
|
Гемодинамічно неспроможна стійка ШТ |
ШКД |
Аміодарон; ББА |
— |
|
ДКМП: первинна профілактика |
іАПФ; ББА |
АМР |
Аміодарон; ШКД |
|
ДКМП: вторинна профілактика |
ШКД; іАПФ; ББА |
АМР |
Аміодарон |
Примітки. Клас І — доцільність застосовування беззаперечно доведена; клас ІІa — доцільність застосування повністю переважає; клас ІІb — доцільність/ефективність застосування менш доведена; ШКД — штучний кардіовертер-дефібрилятор.
Асистолія
Асистолія — відсутність скорочення серця. На ЕКГ визначається пряма лінія.
Реанімаційні заходи при асистолії та електромеханічній дисоціації розглянуто в алгоритмах 2.80 і 2.81.
|
Алгоритм 2.80. Реанімаційні заходи при асистолії Крок 1. Непрямий масаж серця та штучне дихання з рота в рот чи з рота в ніс. Крок 2. Адреналін вводять у дозі 1 мг в/в чи ендотрахеально (2–2,5 мг). Дозу можна підвищувати у разі відсутності клінічного ефекту. Застосування атропіну при серцево-легеневій реанімації не рекомендується (ERC, 2010). Крок 3. Виконання ендокардіальної електрокардіостимуляції; чим раніше вона розпочата, тим вища її ефективність. Крок 4. Бікарбонат натрію при асистолії краще не вводити, якщо зупинка кровообігу не дуже тривала чи виникла на тлі компенсованого ацидозу. Його вводять тільки при гіперкаліємії та отруєнні трициклічними антидепресантами, коли рН становить <7,1. Крок 5. Дефібриляція при асистолії протипоказана, оскільки вона може уражати міокард і перешкоджати відновленню електричної активності серця. |
|
Алгоритм 2.81. Послідовність реанімаційних заходів при електромеханічній дисоціації) Непрямий масаж серця та штучна вентиляція легень ↓ Налагодити в/в інфузію ↓ Адреналін 0,5–1 мг 1 : 10 000 розчину в/в струминно (введення препарату кожні 5 хв) ↓ Інтубація трахеї, яка виконується одночасно з іншими реанімаційними заходами ↓ Можливе застосування бікарбонату натрію (ефективність його сумнівна) в дозі 1 мекв/кг; можна вводити його кожні 10 хв у дозі, що становить половину |
Електромеханічна дисоціація
Електромеханічна дисоціація — це відсутність механічного скорочення серця при збереженні електричної активності. Клінічно пульс на сонній артерії не визначається. У цих випадках на ЕКГ протягом декількох хвилин реєструють ідіовентрикулярний ритм, який переходить в асистолію.
Ефективність антиаритмічної терапії згідно з даними доказової медицини і РКД:
1. У РКД V-HeFT за даними 2-річного спостереження виявлено зниження смертності у хворих на ХСН на фоні застосування іАПФ еналаприлу порівняно з хворими, які приймали комбінацію блокатора α-адренорецептора гідралазину з ізосорбіду динітратом у результаті зниження РСС, особливо у пацієнтів із помірною СН (однак відомо, що гідралазин збільшує розвиток ГЛШ).
2. У РКД RALES показано, що терапія АМР спіронолактоном у поєднанні з діуретиком, іАПФ та дигоксином супроводжувалася значним зниженням загальної смертності та РСС. Вважають, що ця позитивна динаміка зумовлена нормалізацією вмісту калію в крові та регресом інтерстиційного фіброзу, спричиненого альдостероном.
3. Метааналіз РКД у хворих із підозрою на ІМ показав, що в/в застосування магнію в ранній період захворювання супроводжувалося зниженням смертності на 45%. Однак у пізніших дослідженнях ефективність магнію при ІМ не підтвердилася.
4. Тривале застосування інгібіторів фосфодіестерази (мілринон) у РКД PROMІSE супроводжувалося підвищенням загальної смертності в результаті збільшення ЧСС, оскільки вони призводять до підвищення збудливості міокарда, тому в таких хворих їх не можна застосовувати.
5. ААП ІА, ІВ, ІС класу виявились недієвими у профілактиці РСС; вони, навпаки, її значно підвищують, про що свідчать дані численних РКД.
6. Новий блокатор калієвих каналів дофетилід у РКД DІAMOND не знижував РСС у хворих, які перенесли ІМ з дисфункцією ЛШ.
7. У канадському РКД СAMІAT і європейському дослідженні EMІAT вивчали вплив аміодарону на хворих із постінфарктним кардіосклерозом, ускладненим шлуночковою екстрасистолією. У цих дослідженнях аміодарон достовірно знижував ризик аритмічної та кардіальної смерті. Отже, аміодарон — єдиний ААП, який безпечно та ефективно запобігає виникненню РСС в результаті зменшення шлуночкової екстрасистолії. В іншому дослідженні показано, що додаткове застосування ББА до терапії аміодароном приводить до підвищення ефективності цього профілактичного лікування в 2,2 разу за рахунок зниження аритмічної смерті та в 1,8 раза — ризику серцевої смерті.
Доцільність профілактики РСС за допомогою ББА і аміодарону розглянуто в табл. 2.137.
Таблиця 2.137. Доцільність застосування ББА і аміодарону для запобігання РСС (адаптовано за S. Prіorі et al., 2001)
|
Рекомендації |
Категорія пацієнтів і тип профілактики РСС |
|
Користь та безпека ББА |
|
|
Докази або думка експертів на користь застосування ББА |
|
|
Аргументи на користь застосування ББА слабші |
|
|
Немає підстав для застосування ББА |
|
|
Докази або думка експертів на користь застосування аміодарону |
|
|
Аргументи на користь застосування аміодарону слабші |
|
Низкою РКД з вивчення ефективності застосування штучних кардіовертерів-дефібриляторів у профілактиці РСС доведено, що кардіовертери-дефібрилятори ефективніше запобігають РСС, ніж аміодарон, при злоякісних шлуночкових аритміях. При цьому ААП перешкоджають виникненню РСС, а кардіовертери-дефібрилятори її купірують.
Схему первинної профілактики РСС наведено в табл. 2.138.
Таблиця 2.138. Первинна профілактика РСС у хворих на ІМ, які перенесли ІМ, та з ХСН за даними ЄТК
|
Препарати |
Рекомендації |
Рівень доказовості |
|
ББА |
Клас І |
А |
|
іАПФ |
Клас І |
В |
|
Ліпідознижувальні засоби |
Клас І |
А |
|
Аміодарон |
Клас І |
А |
|
Омега-3-ПНЖК |
Клас ІІa |
В |
|
АМР |
Клас І |
В |
У багатьох країнах нині часто застосовують ІКД.
Абсолютні показання до ІКД:
1. Перенесена клінічна смерть, спричинена ФШ/ШТ, не пов’язана з перехідною причиною.
2. Спонтанні пароксизми стійкої ШТ.
3. Синкопальні стани неясного походження в поєднанні з індукцією при ЕФД, ШТ або ФШ і неефективністю/неможливістю призначення ААП.
4. Нестійка ШТ, яку викликають при ЕФД і не купірує прокаїнамід на фоні постінфарктного кардіосклерозу і дисфункції ЛШ.
Відсутні протипоказання до ІКД:
1. Аритмогенна дисплазія ПШ з багатьма аритмогенними вогнищами (в тому числі після абляції).
2. ДКМП (ІКД у поєднанні з прийомом аміодарону та бівентрикулярною стимуляцією у хворих з QRS >150 мс з метою синхронізації діяльності шлуночків).
3. ГКМП та ін.
Протипоказання до ІКД:
1. Безперервно рецидивуюча ШТ.
2. Синдром WPW.
3. Термінальна застійна СН тощо.
Результати як клінічних досліджень, так і економічного аналізу підтверджують обґрунтоване застосування ІКД у первинній профілактиці РСС, оскільки ці апарати суттєво збільшують тривалість життя пацієнтів активного працездатного віку. Порівняно з медикаментозною профілактикою РСС (застосування аміодарону) ІКД мають суттєві переваги. Отже, ІКД є безальтернативним засобом профілактики РСС, а необхідність застосування медикаментозної терапії залишається незалежною від того, показана ІКД чи ні. В останні роки мінімізовано кількість ускладнень, пов’язаних з імплантацією електродів. Суттєво збільшилася тривалість терміну служби приладів (у середньому до 6–8 років). Сьогодні ІКД — багатофункціональний апарат, що рятує життя, покращує його якість, допомагає лікарю у використанні інших методів лікування, тому впровадження цього досить дорогого методу в Україні допоможе суттєво знизити РСС (!).
Схему профілактичного лікування після успішно виконаної дефібриляції наведено в алгоритмі 2.82.
|
Алгоритм 2.82. Превентивне лікування після успішно виконаної дефібриляції серця, спрямоване на запобігання виникненню постконверсійних аритмій [19] Крок 1. Лікування основного захворювання. Крок 2. Корекція іонних порушень клітинних мембран кардіоміоцитів:
Крок 3. Корекція порушень ПОЛ і АОСЗ:
Крок 4. Проведення антифібриляторної терапії за допомогою ААП чи іАПФ, сартанів або АМР:
Поряд із цим антифібриляторна дія властива статинам (аторвастатин 20 мг/добу тощо). |
Результати багатоцентрових досліджень з доказової медицини дозволяють дійти таких висновків:
1. Ризик РСС у пацієнтів, які перенесли ІМ, знижується після застосування ББА, сартанів, іАПФ і статинів, а у пацієнтів з СН — іАПФ (еналаприлу, лізиноприлу, валсартану тощо), ББА (метопрололу сукцинату, бісопрололу, карведилолу) та АМР (спіронолактону, еплеренону). Тривале застосування нейрогуморальних антагоністів у хворих із систолічною дисфункцією ЛШ супроводжується достовірним зниженням ризику РСС, найбільш вираженим при комбінації ББА з іАПФ чи сартанами.
2. ІКД суттєво знижує РСС.
3. Спостереження американських лікарів хворих, які перенесли ІМ, показали, що у пацієнтів, які вживали морську рибу принаймні один раз на тиждень, відносний ризик РСС достовірно знижувався порівняно з тими, хто їв рибу менше ніж 1 раз на місяць. Доведено, що вживання морських продуктів, які містять омега-3-ПНЖК, було також пов’язане зі зниженням ризику РСС.
4. В осіб, які регулярно виконують помірні фізичні навантаження (наприклад робота в саду або прогулянка) чи вправи підвищеної інтенсивності >60 хв/тиж, ризик РСС був приблизно на 70% нижчим, ніж у осіб, які не виконували фізичних навантажень. Отримані дані свідчать, що для профілактики РСС необхідно використовувати регулярні та нерегулярні фізичні навантаження.
5. Надмірне і тривале вживання алкоголю підвищує ризик виникнення РСС.
Отже, застосування ББА, аміодарону, БРА, іАПФ, спіронолактону, статинів, АСК, а також ІКД, споживання морської риби, помірні фізичні навантаження достовірно подовжують тривалість життя, знижують смертність та покращують якість життя (!).
Результати рандомізованих плацебо-контрольованих досліджень свідчать, що лідокаїн підвищує летальність у хворих після перенесеного ІМ. Мегадослідження САSТ (1985–1995) переконливо довело, що при застосуванні енкаїніду, флекаїніду та морацизину смертність підвищується в ≥2,5 раза при тривалому їх застосуванні. ААП ІІІ класу соталол, за даними дослідження SWORD (3000 хворих), також підвищує смертність в середньому в 1,7 раза у пацієнтів із ІХС після перенесеного ІМ, ускладненого ХСН з ФВ <40%.
У багатоцентровому дослідженні SPAF встановлено, що у пацієнтів із ФП і ускладненою ХСН після застосування хінідину сульфату або новокаїнаміду ризик смерті зріс у 5,8 раза.
У дослідженні DІAMOND (1500 хворих) ААП І класу дофетилід, навпаки, виявився ефективним. Він перешкоджав виникненню ФП, що дало змогу уникнути повторної госпіталізації пацієнтів, але не кардіальної смерті.
Ефективність ААП ІІІ класу аміодарону вивчалася у 13 рандомізованих дослідженнях, результати яких були зведені в метааналізі ATMA (понад 6500 пацієнтів). Виявлено, що у хворих на ХСН після перенесеного ІМ при тривалому застосуванні аміодарону впродовж 2,5 року спостерігалося зниження загальної смертності на 13%, а частоти РСС — на 29%. У дослідженнях EMІAT, СAMІAT доведено, що при ХСН після застосування аміодарону спостерігалося додаткове зниження ризику смерті через кардіальні причини в 1,8 раза, коли цей препарат комбінували з ББА.
У багатоцентровому дослідженні ESVEM (1993) встановлено, що протиаритмічний препарат соталол ефективніший від прокаїнаміду, пропафенону, хінідину сульфату у пацієнтів із шлуночковою ПТ, однак гемодинамічні побічні реакції соталолу обмежують перспективу його широкого застосування при ХСН.
Тривале застосування АМР (спіронолактон у невисоких дозах — 25 мг/добу) при ХСН значно знижує ризик смерті (в середньому на 29%). Аналогічні дані отримані в рандомізованому дослідженні PHESUS (6632 пацієнтів), коли при тривалому застосуванні іншого АМР еплеренону у пацієнтів із ІХС після перенесеного ІМ частота РСС знизилася в середньому на 21%.
Встановлено, що метопролол знижує частоту РСС після ІМ на 40%, а бісопролол у пацієнтів з ХСН майже вдвічі (на 44–46%) знижує частоту РСС (PKД MERІT-HF, СІBІS-ІІ, СІBІS-ІІІ). ААП ІС класу підвищують ризик РСС (РКД СAST, СAST-ІІ, ESVEM).
При шлуночкових порушеннях ритму серця на фоні ХСН краще застосовувати БРА (менш ефективні іАПФ), а також бісопролол і карведилол, що приводять до регресу ГЛШ, нормалізації рівня калію і магнію в крові, а у разі їхньої неефективності — аміодарон.
Серед статинів встановлена перевага аторвастатину (розувастатину) стосовно впливу на тверді кінцеві точки. Навіть такий протисклеротичний препарат, як симвастатин, незалежно від використаної дози, поступається аторвастатину в запобіганні серйозним серцево-судинним ускладненням.
Останнім часом для профілактики виникнення РСС почали застосовувати омега-3-ПНЖК, згідно з рекомендаціями ЄТК і ААС. У великому РКД GІSSІ-Prevenzіone доведено, що додавання до традиційної терапії омега-3-ПНЖК дозволяє знизити РСС на 45%. Вважають, що виражений антиаритмічний ефект омега-3-ПНЖК зумовлений тим, що вміст у ньому докозагексаєнової та ейкозапентаєнової кислот сприяє електричній стабілізації мембран кардіоміоцитів, що зменшує розвиток хвиль повторного колового руху імпульсу (re-еntry).
Ефективним препаратом у профілактиці виникнення РСС є АСК у дозі 75–100–162 мг/добу. Вищу дозу АСК необхідно застосовувати у пацієнтів із ІХС з надмірною масою тіла та ожирінням. Однак слід пам’ятати, що у 30% пацієнтів, які приймали цей препарат з профілактичною метою, він неефективний.
Фактори схильності до виникнення аритмогенних реакцій при застосуванні ААП:
1. Дисфункція ЛШ підвищує ризик аритмогенної дії препаратів (окрім аміодарону) на 5–20%).
2. Вроджене та набуте подовження тривалості інтервалу Q–Т ААП ІА і ІІІ класу.
3. Поєднання ААП з дигоксином та діуретиками (петльовими і тіазидами).
4. Похилий та старечий вік.
5. Гіпокаліємія, гіпомагніємія.
6. Знижена функція нирок, печінки.
7. ХСН ІІБ–ІІІ стадії (ІІІ–IV ФК за NYHA).
Помилки та необґрунтовані призначення препаратів у разі недотримання рекомендацій доказової медицини:
1. Призначення ААП при функціональних аритміях може призвести до розвитку аритмогенного ефекту і ФШ. Слід враховувати співвідношення потенційної небезпеки і користі ААП.
2. Згідно з результатами багатоцентрового дослідження СAST, ААП І класу (енкаїнід, флекаїнід, етацизин) не слід призначати хворим після перенесеного ІМ тривало, оскільки вони підвищують летальність у 2,5–3,6 раза порівняно з плацебо.
3. ААП І класу не слід призначати при органічних захворюваннях серця (при некоронарних захворюваннях серця можна), оскільки вони пригнічують інотропну функцію серця та негативно впливають на прогноз життя.
4. Комбінована терапія ААП здатна не тільки підсилювати дію, але й посилювати сумарну побічну реакцію лікарських засобів.
5. Найпоширенішою помилкою у профілактиці тромбоемболічних ускладнень у хворих із постійною формою ФП є призначення АСК замість антикоагулянтів непрямої дії (варфарину та НПАК — апіксабану, ривароксабану тощо).
6. Недостатня підготовка лікарів у виконанні медикаментозної чи електричної кардіоверсії при затяжному нападі ФП (застосування прямих і непрямих антикоагулянтів в адекватних дозах під необхідним контролем лікування).
2.8.7. Блокади серця
У пацієнтів із захворюваннями серця та судин часто виникають блокади серця. Відомо, що проведення імпульсу збудження може бути сповільнене чи перерване найчастіше у трьох вогнищах провідної системи серця:
1) від синусового вузла до правого передсердя (синоатріальна блокада);
2) із передсердь у шлуночки (АV-блокада);
3) трапляються також внутрішньошлуночкові порушення провідності (БНПГ) [22].
Рідше трапляється порушення провідності у передсердях (внутрішньопередсердна блокада Бахмана).
2.8.7.1. Синоатріальна блокада
Синоатріальна блокада характеризується сповільненням чи випадінням імпульсу, який іде із синоатріального вузла до передсердь, що зумовлено різними змінами електрофізіологічних властивостей водія ритму, внутрішньопередсердної провідної системи та міокарда передсердь.
Етіологія. Причиною розвитку синоатріальної блокади є виражена ваготонія чи підвищення чутливості каротидного синусу, ІХС, міокардити, кардіоміопатії, інтоксикація серцевими глікозидами, ААП, симпатоміметиками; СССВ, гіпокаліємія, вади серця.
Патогенез. При цій блокаді відбувається припинення утворення імпульсу або зменшення його до субпорогової величини та розвиток блокади до його проведення.
Клініка. Розрізняють три ступені синоатріальної блокади. При І ступені блокади всі синусові імпульси проводяться до передсердь, однак із запізненням. ЕКГ не змінюється, діагностика її відбувається лише при внутрішньосерцевому ЕФД. ІІ ступінь блокади характеризується тим, що деякі з синусових імпульсів не досягають передсердь. Тому у цих хворих виникають перебої або «завмирання» серця, інколи спостерігається короткочасне запаморочення або відчуття дезорієнтації. У разі тривалої зупинки серця виникають напади синдрому Морганьї — Адамса — Стокса. При дослідженні пульсу та аускультації серця визначають паузи. У разі виникнення синоатріальної блокади з частими випадіннями серцевого циклу 2 : 1; 3 : 1 визначається брадикардія. Стандарти ЕКГ-діагностики синоатріальної блокади наведено в алгоритмі 2.83.
|
Алгоритм 2.83. ЕКГ-діагностика синоатріальної блокади ІІ ступеня [19] 1. На ЕКГ визначається періодичне випадіння зубців Р і шлуночкового комплексу Q–T. 2. Виникає тривала пауза між сусідніми зубцями Р чи R, яка дорівнює двом (рідше трьом-чотирьом) звичайним інтервалам Р–Р чи R–R (незалежно від кількості випадінь зубця Р). Розрізняють два типи синоатріальної блокади ІІ ступеня. Тип І (Самолова — Венкебаха) характеризується тим, що відбувається поступове подовження синоатріальної провідності. Тип ІІ (Мобітца) характеризується наявністю довгих пауз, тривалість яких дорівнює подвоєному інтервалу R–R (час проведення імпульсу від синусового вузла до міокарда правого передсердя залишається постійним у кожному серцевому циклі). |
Лікування при синоатріальній блокаді спрямоване на терапію основного захворювання. Необхідно відмінити лікарські засоби, що сповільнюють синоатріальну провідність (ББА, аміодарон, ААП ІА і ІС класу, верапаміл, дилтіазем, дигоксин).
У хворих на ІМ у гострий період сповільнення синоатріальної провідності може виникнути в результаті асептичного запалення, яке зменшується під впливом ГК в середніх терапевтичних дозах.
Для зниження активності блукаючого нерва у цих пацієнтів застосовують атропін (0,5–1 мл 0,1% розчину), ефедрин (1 мл 5% розчину) підшкірно, ізопреналін у дозі 5–10 мг 3 рази на добу сублінгвально. ЧСС підвищують АК ДГП ряду (ніфедипін пролонгованої дії по 10–20 мг/добу), а також бронхолітик теофілін — по 0,3 г/добу.
У разі відсутності клінічного ефекту від проведеного лікування та повторних нападах синдрому Морганьї — Адамса — Стокса виконують постійну або короткочасну електрокардіостимуляцію.
2.8.7.2. Атріовентрикулярні блокади
Визначення. АV-блокади — це часткове чи повне порушення провідності на шляху проходження імпульсу від передсердь до шлуночків.
Класифікація. Залежно від стійкості розрізняють такі АV-блокади:
1) гострі, перехідні (транзиторні);
2) інтермітуючі;
3) хронічні (постійні, фіксовані).
За тяжкістю виділяють АV-блокаду І ступеня (неповну), ІІ ступеня Мобітца І і ІІ, неповну 2 : 1, 3 : 1 та ІІІ ступеня (повну) АV-блокаду.
Клініка. При АV-блокаді І ступеня змін пульсу та випадіння скорочень серця не відбувається. При ІІ ступені АV-блокади спостерігається періодичне випадіння пульсової хвилі та скорочень серця. При ІІІ ступені АV-блокади (2 : 1, 3 : 1) ритм серця рідкий, інколи вислуховується гарматний тон Стражеска в результаті одночасного скорочення передсердь і шлуночків. Стандарти ЕКГ-діагностики АV-блокад наведено в алгоритмі 2.84 та на рис. 2.14.
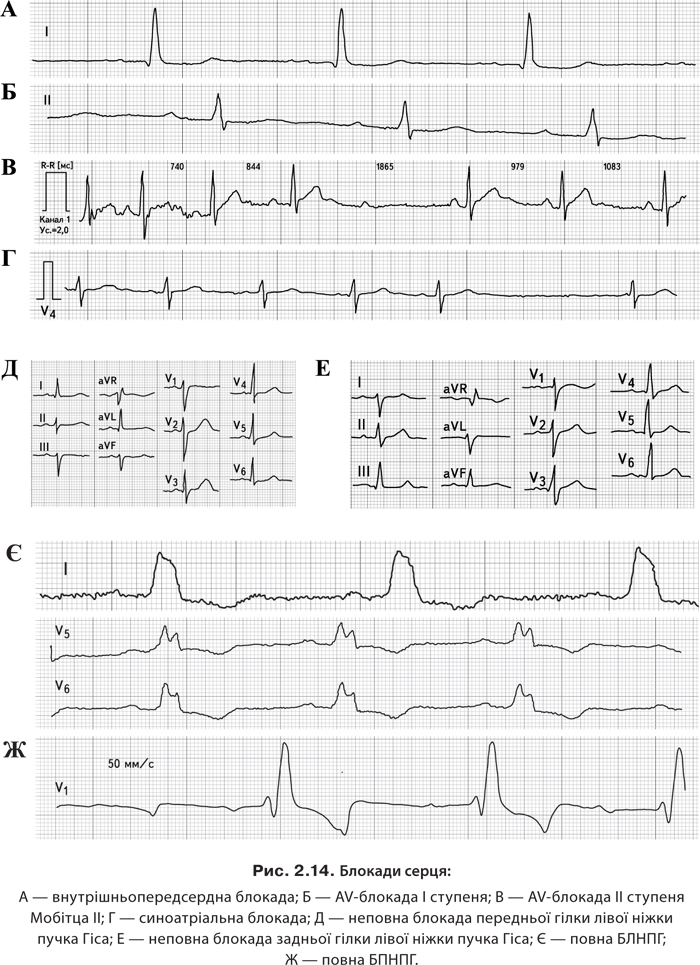
|
Алгоритм 2.84. ЕКГ-діагностика АV-блокад різних ступенів [19] 1. АV-блокада І ступеня характеризується збільшенням інтервалу P–Q (R) більше норми на тлі незмінених зубців ЕКГ. 2. Неповна АV-блокада ІІ ступеня. 2.1. Тип І Мобітца супроводжується поступовим подовженням інтервалу P–Q (R) з наступним випадінням шлуночкового комплексу QT (періоди Самойлова —Венкебаха) та збереженим зубцем Р. 2.2. У разі антероградної блокади ІІ ступеня при типі Мобітца ІІ реєструється зубець Р і випадіння шлуночкового комплексу QT без поступового збільшення інтервалу P–Q (R), який залишається нормальним або подовженим. 2.3. АV-блокада ІІ ступеня типу 2 : 1, 3 : 1. На ЕКГ випадає кожний другий (2 : 1) чи два або більше підряд шлуночкових комплексів (блокада 3 : 1 тощо), що призводить до різкої брадикардії та синкопальних станів. Виражена шлуночкова брадикардія спричиняє утворення замісних скорочень і ритмів. 3. АV-блокада ІІІ ступеня (повна АV-блокада). 3.1. Настає повне роз’єднання діяльності передсердь і шлуночків (повна АV-дисоціація), коли зубці Р можуть реєструватись у різні моменти систоли та діастоли шлуночків (інколи він нашаровується на комплекс QRS чи зубець Т і деформує їх). 3.2. Передсердя збуджуються регулярними імпульсами, що виходять із синусового вузла зі звичайною частотою виникнення зубця Р; джерелом збудження шлуночків є АV-з’єднання (комплекс QRS не змінений, проксимальна блокада) чи одна із ніжок пучка Гіса (комплекс QRS деформований, широкий, дистальна блокада); ЧСС становить 40–50 уд./хв. |
Прогноз. Середня тривалість життя у хворих із повною АV-блокадою після першого нападу синдрому Морганьї — Адамса — Стокса без імплантації ЕКС становить приблизно 2,5 року. При ІМ передньої стінки АV-блокада ІІ–ІІІ ступеня зумовлена тяжким ураженням лівошлуночкової перегородки і асоціюється з поганим прогнозом (смертність від СН або ФШ становить 80–90% випадків). При нижньому ІМ блокада частіше проксимальна і зворотна.
Синдром Фредеріка супроводжується повною АV-блокадою у поєднанні з ФП чи ТП. При цьому реєструють хвилі f або F, а відстань R–R однакова; ЧСС становить 40–60 уд./хв, зубець Р відсутній.
Принципи лікування АV-блокад:
1. У пацієнтів з уперше виниклою АV-блокадою необхідно здійснити терапію основного захворювання, яка може усунути порушення провідності серця.
2. Необхідно відмінити всі ААП, які сповільнюють АV-провідність.
3. Підвищують ЧСС, покращують АV-провідність і зменшують негативний вплив парасимпатичної НС на синусовий вузол та АV-провідність атропін, препарати красавки (малоефективні), АК ніфедипін, симпатоміметики, бронходилататор теофілін тощо. Атропін може зменшувати АV-блокаду тільки при підвищенні активності парасимпатичного нерва, але не ішемії. Він ефективніший при АV-блокаді нижнього, ніж переднього ІМ, і неефективний при повній АV-блокаді, а при АV-блокаді ступеня Мобітца ІІ атропін необхідно застосовувати обережно, оскільки він може навіть знизити ЧШС. Атропін не впливає на пересаджене серце. З-поміж симпатоміметиків зазвичай віддають перевагу ізопреналіну в таблетках по 5 мг під язик або у вигляді в/в інфузії (в дозі від 0,5 до 5–7 мкг/хв). ГК застосовують при міокардиті (чинять протизапальну дію), а при ІХС вони неефективні. Салуретики, що виводять калій і покращують АV-провідність, показані тільки при гіперкаліємії.
4. ЕКС імплантують при АV-блокаді ІІ ступеня типу ІІ Мобітца та ІІІ ступеня, що супроводжується синкопальними нападами синдрому Морганьї — Адамса — Стокса.
5. У разі виникнення синдрому Морганьї — Адамса — Стокса надають невідкладну допомогу в повному обсязі.
У гострий період ІМ тривалість повної АV-блокади залежить від локалізації та розмірів некротичного вогнища; в більшості випадків вона минає самостійно. Імплантація постійного ЕКС здійснюється приблизно через 1 міс від початку розвитку захворювання. При захворюваннях серця імплантація ЕКС дозволяє усунути синкопальні стани, однак це не знижує ризику виникнення РСС.
2.8.7.3. Блокади ніжок і гілок пучка Гіса
Визначення. Внутрішньошлуночкові блокади — сповільнення чи повне призупинення проведення збудження до міокарда шлуночків, спричинені ураженням провідної системи серця на рівні ніжок пучка Гіса чи їх розгалужень. Близько 80% хворих із внутрішньошлуночковими блокадами мають органічні захворювання серця.
Етіологія. Блокади ніжок і гілок пучка Гіса виникають при хронічній ІХС, ІМ, АГ, ревматизмі, набутих і вроджених вадах серця, кардіоміопатіях, міокардитах, кардіосклерозах, ЦД, ожирінні, тиреотоксикозі, алкогольному ураженні серця тощо.
Патогенез. Блокади ніжок і гілок пучка Гіса супроводжуються сповільненням чи повним припиненням проведення імпульсу збудження по одній, двох чи трьох гілках пучка Гіса.
Класифікація. Розрізняють такі внутрішньошлуночкові блокади:
1. Однопучкові блокади:
а) БПНПГ;
б) блокада лівої ніжки передньої гілки;
в) блокада лівої ніжки задньої гілки.
2. Двопучкові блокади:
а) блокада обох гілок (повна блокада) лівої ніжки;
б) блокада правої ніжки та лівої передньої гілки;
в) блокада правої ніжки та лівої задньої гілки.
3. Трипучкові блокади — одночасне ураження всіх трьох гілок пучка Гіса з розвитком повної АV-блокади (тобто двопучкова блокада + АV-блокада).
Залежно від стійкості внутрішньошлуночкових блокад розрізняють:
1) постійну (фіксовану) блокаду;
2) перехідну блокаду;
3) переміжну (інтермітуючу) блокаду;
4) альтернуючу блокаду;
5) латентну блокаду.
Останні чотири варіанти блокад відносять до непостійних внутрішньошлуночкових блокад.
Однопучкові блокади
Повна БПНПГ характеризується тим, що імпульси надходять спочатку до ЛШ, збуджують його і безпосередньо по міокарду поступово розповсюджуються на ПШ. У людей молодого віку у 50% випадків БПНПГ не пов’язана із захворюваннями серця.
ЕКГ-діагностика блокад ніжок пучка Гіса наведена в алгоритмах 2.85–2.91; див. рис. 2.14.
|
Алгоритм 2.85. ЕКГ-діагностика повної БПНПГ [19] 1. У правих грудних відведеннях у V1–2 і рідше в ІІІ, aVF-відведеннях реєструється розширений комплекс QRS. 2. Наявність у лівих грудних відведеннях V5–6 і в І, aVL-відведеннях розширеного, глибокого і нерідко зазубреного зубця S. 3. Тривалість комплексу QRS становить ≥0,12 с. 4. Спостерігається депресія сегмента ST з випуклістю, направленою догори, і негативний або двофазний зубець Т у V1 і рідше — у ІІІ відведеннях. |
|
Алгоритм 2.86. ЕКГ-діагностика неповної БПНПГ [19] 1. Наявність у відведенні V1 комплексу QRS за типом rSr1 чи rSR1, а в І, V6 відведеннях — дещо розширеного зубця S. 2. Тривалість комплексу QRS становить 0,09–0,11 с. 3. Зубець Р та інтервали R–R не змінені. |
|
Алгоритм 2.87. ЕКГ-діагностика блокади лівої передньої гілки пучка Гіса [19] 1. Визначається різке відхилення електричної осі серця вліво (кут ← альфа ≥30°). 2. Комплекс QRS в І, aVL-відведеннях за типом qR; у ІІІ, aVF-відведеннях — за типом rS. 3. Тривалість комплексу QRS становить 0,08–0,11 с. |
|
Алгоритм 2.88. ЕКГ-діагностика блокади лівої ніжки задньої гілки пучка Гіса [19] 1. Визначається різке відхилення електричної осі серця вправо (кут ← альфа >120°). 2. Форма шлуночкового комплексу QRS в І, aVL-відведеннях за типом rS, у ІІІ та aVF-відведеннях — за типом qR. 3. Тривалість комплексу QRS коливається в межах 0,08–0,11 с. |
|
Алгоритм 2.89. ЕКГ-діагностика повної БЛНПГ [19] 1. В І, aVL, V5–6 відведеннях визначається розширення та деформація комплексу QRS з розщепленою чи широкою вершиною зубця R. 2. В V1–2, ІІІ, aVF-відведеннях спостерігається розширення комплексу QRS, що має вигляд QS чи rS з розщепленим або широким зубцем S. 3. Тривалість комплексу QRS становить ≥0,12 с. 4. В І, aVL, V5–6 відведеннях реєструється дискордантне відносно QRS зміщення сегмента ST та негативний або двофазний зубець Т. 5. Електрична вісь серця найчастіше зміщується вліво. |
|
Алгоритм 2.90. ЕКГ-діагностика повної блокади правої ніжки у поєднанні з блокадою лівої ніжки передньої гілки пучка Гіса [19] 1. Реєструються ознаки, характерні для БПНПГ (наявність у відведенні V1 деформованого комплексу QRS (rSR1) М-подібної форми, що становить ≥0,12 с). 2. Спостерігається депресія сегмента ST і формується негативний чи двофазний зубець Т у V1 і (рідше) в ІІІ, aVF-відведеннях. 3. Визначається різке відхилення електричної осі серця вліво, що характерно для блокади лівої ніжки передньої гілки пучка Гіса. |
|
Алгоритм 2.91. ЕКГ-діагностика повної блокади правої ніжки у поєднанні з блокадою лівої ніжки задньої гілки пучка Гіса [19] 1. На ЕКГ визначаються ознаки повної БПНПГ, що супроводжуються наявністю в V1–2 грудних відведеннях деформованого комплексу QRS (rSR1)) М-подібної форми, що становить ≥0,12 с. 2. Спостерігається депресія сегмента ST з формуванням негативного або двофазного зубця Т у V1 і (рідше) в ІІІ, aVF-відведеннях. 3. Реєструється відхилення електричної осі серця вправо (кут альфа ≥120°) за відсутності ознак гіпертрофії ПШ. |
Блокада лівої ніжки передньої гілки пучка Гіса характеризується тим, що деполяризація ПШ не змінена. Збудження міокарда ЛШ відбувається в два етапи: спочатку імпульс по неураженій гілці проводиться на задню стінку, збуджуючи міокард, а потім — по широкій сітці анастомозів проникає в міокард передньобічної стінки ЛШ.
Блокада лівої ніжки задньої гілки пучка Гіса характеризується тим, що імпульс не надходить до задньонижнього відділу ЛШ. Спочатку збуджується міокард переднього, а потім — задньонижнього відділу ЛШ.
Двопучкові блокади
До двопучкових (біфасцикулярних) належать повна БЛНПГ, повна блокада правої ніжки у поєднанні з блокадою лівої ніжки передньої гілки пучка Гіса і повна блокада правої ніжки у поєднанні з блокадою задньої гілки пучка Гіса. При цьому відбувається блокада двох пучків провідної системи.
Повна БЛНПГ супроводжується одночасним ураженням передньої та задньої гілок лівої ніжки. Спочатку імпульс надходить по неураженій правій ніжці до ПШ, збуджує його, а потім поступово розповсюджується на міокард ЛШ. У результаті цього відбувається утворення широкого і деформованого комплексу QRS, а також порушення процесу реполяризації.
Повна блокада правої ніжки у поєднанні з блокадою лівої ніжки передньої гілки пучка Гіса характеризується наявністю ознак обох цих блокад.
Повна блокада правої ніжки та лівої ніжки задньої гілки пучка Гіса характеризується ЕКГ-ознаками обох цих блокад. Ця блокада трапляється рідше, але вона частіше переходить у повну АV-блокаду.
Трипучкові блокади
Трипучкова (трифасцикулярна) блокада характеризується порушенням провідності одночасно по трьох гілках пучка Гіса. У хворих із повною трипучковою блокадою електричний імпульс не проводиться від передсердь до шлуночків і виникає повна АV-блокада ІІІ ступеня. Відбувається повне відокремлення скорочень передсердь і шлуночків. Шлуночки збуджуються від шлуночкового водія ритму, передсердя — від ектопічного центру, розміщеного в них. Імпульс по шлуночках проводиться неодночасно, і тому комплекс QRS розщеплений, розширений і становить ≥0,12 с. Порушується також реполяризація, що супроводжується депресією сегмента ST і формуванням негативного чи двофазного зубця Т (дистальна блокада).
Клініка внутрішньошлуночкових блокад зумовлена основним захворюванням. Зазначимо, що повна блокада правої ніжки, ізольована блокада окремих гілок лівої ніжки пучка Гіса, а також їхнє поєднання самі по собі не впливають негативно на інотропну та насосну функцію серця. Однак БПНПГ, що гостро виникає, негативно впливає на функцію гіпертрофованого міокарда ПШ. При виникненні повної БЛНПГ спостерігається більш виражена дисфункція ЛШ і зниження інотропної та насосної функції міокарда, що ускладнює перебіг захворювання, спричиняє розвиток ХСН, ГЛШ, кардіомегалії та зменшення тривалості життя пацієнтів.
Лікування внутрішньошлуночкових блокад розроблено недостатньо. Насамперед здійснюється лікування, спрямоване на основне захворювання. Хворих із безсимптомними блокадами необхідно брати на диспансерний облік. При розвитку повної АV-блокади з синкопальними епізодами здійснюється імплантація постійного ЕКС, яка може призводити до зменшення розвитку РСС.
У разі розвитку ХСН застосовується лікування діуретиками, іАПФ, БРА, які зменшують ремоделювання та об’єми порожнин серця, опосередковано підвищують інотропну функцію міокарда і покращують якість життя хворих. ААП сповільнюють проведення збудження за системою Гіса — Пуркіньє, можуть поглиблювати блокади серця, тому їх не призначають. Серцеві глікозиди при внутрішньошлуночкових блокадах не протипоказані, однак їх не можна застосовувати при АV-блокадах ІІ–ІІІ ступеня.
З метою покращення мембранних процесів у кардіоміоцитах застосовують цитопротектор (триметазидин), мембранопротектори та антиоксиданти (кверцетин, комплекс кверцетину з повідоном і натрію гідроксид тощо), які можуть частково зменшувати виникнення ФШ та асистолії (!).
Імплантація ЕКС здійснюється при біфасцикулярних і трифасцикулярних блокадах. Це дозволяє усунути симптоми (синкопе), але ризик виникнення РСС не знижується, оскільки ця група пацієнтів має високий ризик розвитку шлуночкових аритмій.