Гострий інфаркт міокарда
Содержание
- ВИЗНАЧЕННЯ ГОСТРОГО ІМ
- КЛАСИФІКАЦІЯ
- ЕПІДЕМІОЛОГІЯ
- КЛІНІКА ТА КЛІНІЧНІ ДЕФІНІЦІЇ
- Гострий інфаркт міокарда із зубцем Q
- Гострий інфаркт міокарда без патологічного зубця Q
- Рецидивний та повторний ІМ
- Гостра коронарна недостатність
- Етіологія та патогенез гострого інфаркту міокарда
- ФАКТОРИ РИЗИКУ НЕСПРИЯТЛИВОГО ПЕРЕБІГУ ГОСТРОГО ІНФАРКТУ МІОКАРДА
- ПРОФІЛАКТИКА
- Первинна профілактика
- Вторинна профілактика
- ДІАГНОСТИКА
- Встановлення діагнозу та рання стратифікація ризику
- Лабораторна діагностика
- Диференційна діагностика
- ЛІКУВАННЯ ГОСТРОГО ІНФАРКТУ МІОКАРДА ТА ЙОГО УСКЛАДНЕНЬ
- Догоспітальна чи рання госпітальна допомога
- Профілактика, діагностика та лікування ускладнень гострого періоду ІМ
- Стандартні засоби терапії та профілактики в гострій фазі захворювання
- ВЕДЕННЯ ХВОРИХ З ОСОБЛИВИМИ ТИПАМИ ІНФАРКТУ
- ВЕДЕННЯ ХВОРИХ ІЗ СПЕЦИФІЧНИМИ ВНУТРІШНЬОГОСПІТАЛЬНИМИ УСКЛАДНЕННЯМИ
- ОЦІНКА РИЗИКУ У ХВОРИХ З ГОСТРИМ ІМ
- Строки
- Клінічна оцінка і подальші обстеження
- Оцінка життєздатності міокарда, оглушення та гібернація
- Оцінка ризику аритмії
- ЛІКУВАЛЬНО-ПРОФІЛАКТИЧНІ ЗАХОДИ В ПОСТІНФАРКТНИЙ ПЕРІОД
- Психологічні та соціально-економічні аспекти
- Поради щодо способу життя
- Фізична активність
- ЛІТЕРАТУРА
ВИЗНАЧЕННЯ ГОСТРОГО ІМ
Гострий інфаркт міокарда визначають за клінічними, електрокардіографічними, біохімічними та патоморфологічними характеристиками. Визнано, що термін «гострий інфаркт міокарда» відображає смерть кардіоміоцитів, викликану тривалою ішемією. На ЕКГ можна виявити ознаки ішемії міокарда — зміни ST і T, а також ознаки некрозу міокарда, зокрема конфігурації комплексу QRS. Робоче визначення гострого прогресуючого ІМ (з елевацією сегмента ST) сформульовано у такий спосіб: пацієнти з наявністю больового синдрому (біль за грудиною, що може іррадіювати в руки, під ліву лопатку, в нижню щелепу, шию, спину, триває понад 20 хв, не купірується нітрогліцерином), підвищенням сегмента ST (у точці J) >0,2 мВ у >2 суміжних прекордіальних відведеннях і >0,1 мВ в >1 дистантних відведеннях. Також до ознак гострого ІМ можна віднести блокаду лівої ніжки пучка Гіса на ЕКГ, якщо є дані, що свідчать, що вона виникла вперше і напередодні обстеження. Інші варіанти гострого ІМ буде розглянуто далі.
Додаткову інформацію для уточнення діагнозу гострого ІМ на фоні клінічних симптомів гострої ішемії міокарда (час розвитку, обсяг ураженого міокарда) можна одержати за допомогою аналізу біомаркерів, які більш детально буде описано далі.
Діагноз встановлюють із зазначенням дати виникнення (до 28 діб), локалізації (передня стінка, передньоверхівковий, передньобоковий, передньоперегородковий, діафрагмальний, нижньобоковий, нижньозадній, нижньобазальний, верхівковобоковий, базальнолатеральний, верхньобоковий, бічний, задній, задньобазальний, задньобоковий, задньоперегородковий, перегородковий, ПШ). Слід зазначити тип гострого ІМ: первинний, рецидивний або повторний (у цьому разі вказувати розміри та локалізацію необов’язково).
При наявності різних ускладнень гострого ІМ їх необхідно включати у формулювання діагнозу із зазначенням дати розвитку (окремо не шифрують). Також у діагнозі вказують такі лікувальні втручання, як АКШ (із наведенням кількості шунтів), транслюмінальна ангіопластика і стентування з вказівкою судин, балонна контрапульсація, електроімпульсна терапія (ЕІТ), тимчасова (зазначити строки) або постійна електрокардіостимуляція (ЕКС), абляція. Для кожної лікувальної процедури необхідно зазначати дату (термін) проведення.
Формулювати діагноз слід в такій послідовності:
- причина розвитку гострого ІМ (наприклад ІХС);
- раптова коронарна смерть із реанімацією;
- гострий ІМ (з відповідними уточненнями); ускладнення ІМ (з відповідними уточненнями);
- наявність різних форм кардіосклерозу (при постінфарктному кардіосклерозі по можливості зазначити дату, глибину та локалізацію всіх попередніх ІМ);
- СН (із зазначенням ступеня).
КЛАСИФІКАЦІЯ
Згідно з МКХ-10 серед різновидів гострого інфаркту міокарда виділяють:
- гострий ІМ з наявністю патологічного зубця Q (I21.0–I21.3);
- гострий ІМ без патологічного зубця Q (I21.4);
- гострий ІМ (неуточнений — у разі утрудненої діагностики I21.9);
- рецидивний ІМ (I22);
- повторний ІМ (I22);
- гостра коронарна недостатність (проміжний I24.8).
Ускладнення гострого інфаркту класифікують таким чином:
- ГСН (класи I-IV за Killip, I50.1);
- порушення серцевого ритму і провідності (шлуночкова тахікардія, фібриляція шлуночків, прискорений ідіовентрикулярний ритм, фібриляція та тріпотіння передсердь, суправентрикулярна аритмія, суправентрикулярна і шлуночкова екстрасистолія, атріовентрикулярна блокада I-III ступеня, відмова синусного вузла, асистолія I44–I49);
- зовнішній розрив серця (гострий і підгострий — із формуванням псевдоаневризми) з гемоперикардом (I23.0) і без гемоперикарда (I23.3);
- внутрішній розрив серця (з формуванням дефекту межпредсердної перегородки I23.1, дефекту міжшлуночкової перегородки I23.2, розрив сухожильної хорди I23.4, надрив і відрив папілярного м’яза I23.5);
- тромбоутворення у порожнинах серця (I23.6);
- тромбоемболія малого і великого кола кровообігу (I23.8);
- рання постінфарктна дилатація з формуванням гострої аневризми серця (I23.7);
- епістенокардитичний перикардит (Pericarditis epistenocardica);
- синдром Дресслера (I24.1);
- рання (від 72 год до 28 діб) постінфарктна стенокардія (I20.0).
ЕПІДЕМІОЛОГІЯ
Незважаючи на певні успіхи в лікуванні гострого інфаркту міокарда в більшості індустріальних країн, ця патологія залишається лідером серед основних причин захворюваності й смертності. За статистичними даними, частота гострого ІМ серед чоловічого населення віком старше 40 років коливається в різних регіонах світу від 2 до 6 на 1000. Захворюваність на гострий ІМ у США становить 1,5 млн осіб/рік, дестабілізація ІХС стає причиною щорічної смерті приблизно 500 тис. осіб. Показник смертності внаслідок дестабілізації ІХС в Україні за 2005 р. становить 707 на 100 тис. населення. Серед жінок гострий ІМ відзначають приблизно в 2 рази рідше. Відповідно до офіційної статистики, міське населення хворіє частіше, ніж сільські жителі, але ці дані слід оцінювати обережно, з урахуванням можливих відмінностей щодо виявності захворювання. Інформація про догоспітальну летальність неоднорідна (зокрема, у США цей показник становить приблизно 50% всіх випадків гострого ІМ; за даними реєстра MONICA — приблизно 30%, причому відношення кількості випадків догоспітальної смерті до випадків госпітальної знижується з віком, становлячи від 15,6% у осіб віком молодше 50 років до 2,0% у пацієнтів старше 70 років). Найбільшу кількість випадків догоспітальної смерті у осіб з гострим ІМ становить раптова смерть у 1-шу годину захворювання. Більше половини пацієнтів з установленим діагнозом ІХС вмирають раптово. Приблизно в 30% випадків раптова смерть є першим проявом ІХС і найчастіше пов’язана із злоякісними шлуночковими аритміями (шлуночкова тахікардія чи фібриляція шлуночків). Практично всі випадки первинної фібриляції шлуночків відбуваються в перші 4 год гострої ішемії міокарда. Стійку шлуночкову тахікардію з переходом у фібриляцію шлуночків відзначають трохи пізніше, вона досягає максимальної частоти розвитку через >24 год після розвитку гострого ІМ. Значно рідше первинне порушення ритму — асистолія. Внутрішньолікарняна летальність у найбільш кваліфікованих лікувальних закладах становила у 1960 р. 20–25%, а до кінця 1980-х років знизилася до 10–15%. Відповідно до італійського реєстра BLITZ, на сьогодні цей показник становить 7,4% (7,5% — для гострого ІМ з елевацією сегмента ST, 5,2% — для гострого коронарного синдрому без елевації сегмента ST). Частота реєстрації гострого ІМ з елевацією сегмента ST на момент госпіталізації становила 65% усіх гострих коронарних синдромів. До факторів, що визначають успішність боротьби з цією патологією, можна із впевненістю віднести профілактичну стратегію, підтримувану державою, і поліпшення стандартів лікування. До соціально-профілактичних програм відносять профілактику факторів ризику ІХС та її ускладнень — рекомендації щодо відмови від тютюнопаління та надмірного вживання алкоголю (>40 г чистого алкоголю на добу); боротьбу з надлишковою масою тіла шляхом раціонального харчування та фізичної активності; контроль рівня АТ і глюкози крові; запобігання хронічним стресам. Безумовно, ці програми можуть бути застосовані перш за все до груп населення, у яких, крім зазначених (тих, що модифікуються), факторів ризику існують ті, що не модифікуються, такі як чоловіча стать, похилий вік, сімейний анамнез ІХС. Також велике значення має поширення знань серед населення (особливо груп ризику гострого ІМ) про специфічні симптоми захворювання, що дозволяє зменшити проміжок часу від появи перших симптомів до звертання за кваліфікованою медичною допомогою. Значний внесок у виконання вищезазначених програм здійснює кардіологічна диспансеризація, за допомогою якої проводять відбір пацієнтів, яким показана фармакологічна і/чи хірургічна модифікація перебігу ІХС.
КЛІНІКА ТА КЛІНІЧНІ ДЕФІНІЦІЇ
Гострий інфаркт міокарда із зубцем Q
У вітчизняних класифікаціях цей термін раніше поділяли на великовогнищевий і трансмуральний гострий ІМ, що було однією з основних розбіжностей з міжнародною класифікацією. Відповідно до глибини розташування вогнища ураження у товщі серцевого м’яза великовогнищевий ІМ може переважно займати субепікардіальний, субендокардіальний чи інтрамуральний шари міокарда, що буде відображатися у специфічній графіці ЕКГ (якщо вогнище ураження поширюється на субепікардіальний шар, на ЕКГ превалюють елевації сегмента ST, інтрамуральне і субендокардіальне ураження супроводжуються формуванням виражених депресій ST із глибокими негативними зубцями Т). Загальною рисою цих підваріантів є формування патологічного зубця Q і у більшості випадків — зниження амплітуди зубця R у відведеннях, що відповідають локалізації ураження, тоді як дрібновогнищевий, субепікардіальний, субендокардіальний або інтрамуральний ІМ мають перебіг без формування зубця Q і вираженого зниження амплінення глибини ураження можуть дати рівень ферментемії та ступінь порушення регіонарної скоротності за даними двомірної ехоКГ. Електрокардіографічно гострий ІМ із зубцем Q може бути визначений при наявності патологічного зубця Q у відведеннях V1–V3 або при наявності зубця Q тривалістю >0,03 с у відведеннях I, II, aVL, aVF, V4, V або V6. Патологічним вважається зубець Q, що становить >0,25 амплітуди зубця R у тому ж відведенні. З обережністю слід оцінювати подібні зміни у відведенні III (зокрема не підтверджені у відведенні aVF), оскільки вони можуть бути зумовлені особливостями розташування серця у грудній клітці (у цьому разі необхідно обов’язково зареєструвати відведення III на фазі вдиху, додаткові відведення). У ряді випадків можна спостерігати комплекси (q)r, коли «рудиментарний» зубець R не враховують, а зубець S розцінюють як патологічний комплекс QS. Особливо утруднена верифікація патологічних зубців Q у разі гіпертрофії міокарда і/чи порушень внутрішньошлуночкової провідності. У цьому разі більш інформативна електрокардіотопограма.
Патогенетично гострий ІМ із зубцем Q — етап розвитку гострого ІМ, коли обсяг ураженого (некротизованого) міокарда вже значний, причому амплітуда і тривалість зубця Q може непрямо свідчити про глибину ураження міокарда, а кількість відведень із наявністю патологічного зубця Q — про його поширеність. Найчастіше гострий ІМ із зубцем Q діагностують при переході ІМ з найгострішої фази в гостру і потім у підгостру. При пізно встановленому діагнозі, якщо до моменту першого запису ЕКГ зміни сегмента ST відсутні, слід пам’ятати, що самі по собі зубці Q можуть бути ознакою раніше перенесеного інфаркту. У цьому разі, при відсутності архівних ЕКГ та інших медичних записів, дані анамнезу можуть бути підтверджені виявленням ділянок стоншення серцевої стінки на ехоКГ.
Гострий інфаркт міокарда без патологічного зубця Q
Цей термін відповідає поняттю «дрібновогнищевий ІМ» і означає гострий коронарний синдром, що завершився формуванням вогнища ураження (некрозу) міокарда, але недостатньо великого (за глибиною), щоб привести до формування патологічних зубців Q на ЕКГ. Неточність цього визначення полягає в тому, що у зв’язку з відсутністю патологічних зубців Q можна говорити не про незначне поширення інфаркту, а лише про незначну глибину ураження міокарда. Як приклад приводять випадки, коли вогнище ураження, при стійких змінах на ЕКГ у вигляді негативних зубців Т, відзначених у всіх грудних відведеннях і при наявності відповідної клініки та високого рівня ферментемії, можна розцінювати як поширений інтрамуральний ІМ, тоді як відсутність патологічних зубців Q дає можливість віднести його до «гострого ІМ без зубця Q».
Топічно можна виділити ізольовані субепікардіальний (діагностують рідко внаслідок специфічної анатомії коронарного дерева), субендокардіальний та інтрамуральний підваріанти дрібновогнищевого ІМ, які розрізняються за ЕКГ-графіком. Зокрема, одним із типових ЕКГ-проявів інтрамурального гострого ІМ є наявність стійких негативних зубців Т. Проте ця ознака недостатньо специфічна і може виявлятися при нестабільній стенокардії, гіпертрофії міокарда, метаболічних порушеннях і бути наслідком раніше перенесеного структурного ураження міокарда (коронарної чи некоронарної природи) і перикарда. Субендокардіальний варіант інфаркту може мати перебіг як за типом «гострий ІМ без зубця Q», так і за типом «гострий ІМ із зубцем Q» (відносно рідко). Він характеризується ураженням переважно субендокардіальних відділів міокарда, тоді як інтрамуральні та субепікардіальні відділи міокарда можуть зберігати свою життєздатність. Найчастіше є наслідком дистального ураження коронарних артерій, мікроемболізації коронарного русла. ЕКГ-картина має ряд особливостей: величина вектора збудження міокарда не змінюється, оскільки він бере початок від провідної системи шлуночків, закладеної під ендокардом, і досягає неушкодженого епікарда. На ЕКГ можуть визначатися неглибокий патологічний зубець Q (необов’язково), невелике зниження зубця R, депресія сегмента ST, можливі інверсія чи двофазність зубця Т у відведеннях I, V1–V4 при передній локалізації інфаркту, у відведеннях III і aVF — при нижній (задній) і у відведеннях aVL, V5–V6 — при бічній локалізації. У міру розвитку ІМ відбувається часткове чи повне нівелювання депресії сегмента ST із формуванням стійких негативних зубців Т. Слід акцентувати увагу на глибину депресії сегмента ST у відведеннях, розташованих над ділянкою інфаркту >0,2 мВ, оскільки менш виражені зміщення сегмента ST, наприклад 0,1 мВ, характерні для субендокардіальної ішемії, а не інфаркту. Крім того, до ознак ішемії необхідно віднести її нестійкість: зміни, як правило, виникають на фоні стресу чи фізичного навантаження, часто нівелюються через кілька хвилин після усунення провокуючого фактора, прийому нітрогліцерину. Депресія при субендокардіальному інфаркті може визначатися до 3 днів. Так чи інакше, для уточнення діагнозу необхідна динамічна реєстрація ЕКГ по можливості з аналізом архівних записів, зіставлення біохімічних та інших клінічних та інструментальних критеріїв.
Рецидивний та повторний ІМ
Ці поняття відносять відповідно до тих випадків, коли після першого перенесеного гострого ІМ формується другий і більше. Причому рецидив гострого ІМ розвивається в період — від 3 до 28 діб з моменту розвитку вихідного інфаркту, а після закінчення цього періоду слід говорити про повторний ІМ. Якщо ЕКГ-діагностика розмірів і локалізації вогнища ураження утруднена, зазначати її у діагнозі не обов’язково.
Гостра коронарна недостатність
Це поняття приблизно відповідає міжнародному терміну «гострий коронарний синдром» і використовується як проміжний діагноз у ранній період захворювання. Встановлення цього діагнозу ґрунтується на виявленні елевації чи депресії сегмента ST у поєднанні з тривалим (>20 хв) ангінозним болем. Характерно, що за кордоном широко використовують класифікацію, відповідно до якої всі випадки дестабілізації ІХС об’єднані в поняття «гострий коронарний синдром» і залежно від наявності чи відсутності елевації сегмента ST в перші години захворювання поділяють на гострий коронарний синдром з елевацією сегмента ST (до нього відносять поняття «інфаркт міокарда з елевацією сегмента ST» — ST elevation miocardial infarction, STEMI, а також випадки, які відповідають часто вживаному у вітчизняній літературі терміну «гостре порушення коронарного кровообігу», які у подальшому не закінчуються формуванням некрозу міокарда) і на гострий коронарний синдром без елевації сегмента ST (до якого можна віднести випадки нестабільної стенокардії, дрібновогнищевого гострого ІМ з депресією чи без депресії сегмента ST). Особливість цієї класифікації в тому, що вона побудована за ступенем прояву міокардіальної ішемії, в той час як класифікація, що враховує наявність або відсутність патологічного зубця Q, передбачає градацію за глибиною ураження серцевого м’яза і відповідно стосується більш пізнього періоду захворювання. Доцільність цієї «ранньої», робочої класифікації зумовлена тим, що сучасні підходи до лікування раннього періоду гострого ІМ диференційовані перш за все за ступенем прояву ішемії та істотно впливають на перебіг підгострого періоду захворювання. Зокрема, в еру реперфузійної терапії поширена тотальна ішемія міокарда з елевацією ST на ЕКГ далеко не у всіх випадках призводить до формування ІМ із зубцем Q. З іншого боку, динамічність процесів, що відбуваються в рамках дестабілізації ІХС, припускає можливість переходу захворювання з одного клінічного варіанта в інший. Отже, при використанні терміна «гостра коронарна недостатність» доцільне уточнення характеру та ступеня ішемічних змін на ЕКГ, що супроводжують захворювання (із зазначенням наявності чи відсутності елевації сегмента ST на ЕКГ), що надалі сприятиме вибору адекватної тактики лікування.
Етіологія та патогенез гострого інфаркту міокарда
На сьогодні загальновизнана гіпотеза про патофізіологічну роль коронаротромбозу в розвитку гострого інфаркту міокарда, висунута у 1909 р. М.Д. Стражеском і В.П. Образцовим, а в 1912 р. — J.B. Herrick. Причиною гострого ІМ, як і інших форм гострого коронарного синдрому, у >90% випадків є раптове зменшення коронарного кровотоку, викликане атеросклерозом у поєднанні з тромбозом, з наявністю чи без супутньої вазоконстрикції. Рідко відзначають гострий ІМ як наслідок септичної (тромбо-)емболії коронарної артерії чи внутрішньокоронарний тромбоз як наслідок запального процесу в ендотелії судини при коронаритах різного генезу. Також описані випадки гострого ІМ, що розвинувся на фоні ізольованого коронароспазму інтактних артерій (частіше інтоксикаційної природи).
Серед етіологічних факторів, що спричиняють розвиток гострого інфаркту міокарда, перше місце займає атеросклероз. Інші фактори ризику ІМ — також фактори ризику розвитку атеросклерозу. До «великих» факторів ризику відносять деякі форми гіпер- і дисліпопротеїнемії, АГ, тютюнопаління, низьку фізичну активність, порушення вуглеводного обміну (особливо цукровий діабет II типу), ожиріння, вік пацієнта старше 50 років (середній вік госпіталізованих хворих із гострим ІМ в Італії — 67 років). Дійсно, порушення ліпідного обміну діагностують у хворих із гострим ІМ значно частіше, ніж у здорових людей (особливо дисліпопротеїнемії II6 і III типу).В той час як АГ є доведеним фактором ризику ІМ, симптоматичні форми АГ не поєднані з високим ризиком ІМ. Це можна пояснити особливостями патогенезу до локальних спазмів артерій. Результати поширених досліджень свідчать про підвищення частоти ІМ серед тих, хто палить. Пояснюють це тим, що речовини, які утворюються при згорянні тютюну (перш за все нікотин), ушкоджують ендотелій судин і спричиняють вазоспазм, а високий вміст карбоксигемоглобіну в крові тих, хто палить, знижує здатність крові до транспорту кисню. Надмірна маса тіла (ІМТ >30) — фактор ризику прогресування атеросклерозу та ІМ, особливо при абдомінальному типі ожиріння. У хворих зі зниженою фізичною активністю на фоні розвитку атеросклерозу недостатньо ефективно відбувається адаптивний розвиток колатералей у міокарді й толерантність кардіоміоцитів до ішемії (феномен прекондиції). Крім того, внаслідок гіподинамії відбувається неадекватне підвищення тонусу САС у разі нерегулярних значних фізичних і психоемоційних навантажень. Хронічне підвищення рівня глюкози і продуктів незавершеного вуглеводного обміну в крові при цукровому діабеті призводить до ураження ендотелію та розвитку поліангіопатії.
При поєднанні >2 зазначених факторів ступінь ризику підвищується пропорційно. Крім перерахованих, існує ще безліч «малих» факторів ризику (подагра, псоріаз, дефіцит фолієвої кислоти та ін.), питома вага яких у загальній структурі захворювання відносно невелика.
Клінічні прояви і наслідки залежать від локалізації обструкції, ступеня і тривалості ішемії міокарда. Зокрема, існують відмінності у ступені прояву больового синдрому і стресової активації РААС, зумовлені наявністю гіпертензії, тахікардії, гіперглікемії, лейкоцитозу з анеозинофілією в перші години захворювання. Характерно, що під час розвитку гострого ІМ зі стійкою елевацією сегмента ST формується «червоний» тромб, що містить значно більшу кількість еритроцитів. Така відмінність від «тромбоцитарного», або «білого» тромбу, пов’язаного з розвитком гострого коронарного синдрому без стійкої елевації сегмента ST, свідчить про більш глибоке і тривале порушення реологічних і коагуляційних властивостей крові та про більш стійкі тромбогенні зміни в ендотелії ураженої ділянки коронарної артерії. Отже, при гострому ІМ з елевацією сегмента ST розвивається переважно оклюзивний і персистувальний тромбоз. Приблизно у 2/3–3/4 випадків формуванню коронарного тромбу передує раптовий розрив бляшки (ураженої запаленням, багатої ліпідами бляшки, покритої тонкою фіброзною оболонкою). Інші випадки пов’язують із механізмами, не визначеними до кінця, такими як ерозія бляшки. У 3/4 випадків бляшки, які ставали базисом для оклюзивного тромбоутворення під час гострого ІМ, викликали лише незначний або помірний стеноз, що передувало розвитку інфаркту (зрозуміло, що саме в цих випадках тромболітична терапія (ТЛТ) є максимально ефективною). Втім, на фоні вираженого стенозу розриви бляшок призводять до більш частого розвитку гострого ІМ (порівняно з незначними стенозами). ІМ, викликаний повною оклюзією коронарної артерії, розвивається через 20–30 хв після початку вираженої ішемії (відсутність кровотоку по артерії чи колатералях) і прогресує з часом від субендокардіальної до субепікардіальної ділянки (феномен фронту хвилі). Реперфузія та залучення колатералей можуть запобігати виникненню некрозу чи сприяють зменшенню його розмірів (зберігаючи в середньому до 70% ішемізованого міокарда периінфарктної зони). Наявність же тривалої стенокардії перед розвитком гострого ІМ може спричиняти формування розвинених колатералей, що зумовлює збереження чи тривалу підтримку життєздатності зони ішемії (при коронарній ангіографії розвинені колатералі визначають у 30% випадків гострого ІМ). У цих хворих відзначена тенденція до менш вираженого ураження міокарда, рідшого розвитку СН і меншої летальності; у віддалений період після гострого ІМ насосна функція серця у них зберігається більшою мірою. При тривалості коронарної оклюзії >6 год лише невелика частина (10–15%) ішемізованого міокарда залишається життєздатною. Наявність субкритичного, але стійкого кровотоку може розширити часове вікно для порятунку міокарда шляхом повної реперфузії (рис. 1.1).
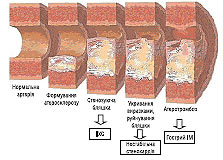
Рис. 1.1. Патогенетичні стадії атеросклерозу
Відповідь на розрив бляшки динамічна: аутогенний тромбоз і тромболізис, часто асоційовані з вазоспазмом, розвиваються одночасно, викликаючи минущу обструкцію кровотоку.
У невеликій частці випадків тромб, що викликав розвиток гострого ІМ, може бути зруйнований у перші години від початку захворювання власною фібринолітичною системою організму при сприянні ендогенних вазодилататорів, що усувають коронароспазм. У цьому разі говорять про спонтанний (чи аутогенний) лізис тромбу і реканалізацію коронарної артерії, що зумовила інфаркт. Клінічно цей варіант перебігу гострого ІМ характеризується раннім (до проведення реперфузійної терапії) регресом симптоматики і ЕКГ-ознак, рівень ферментемії та обсяг ураженого міокарда за даними досліджень у підгострій фазі захворювання виявляються менше, ніж у разі неспроможності аутогенної фібринолітичної системи.
Основними модуляторами активації фібринолітичного проферменту плазміногена та дволанцюгової урокінази, які також беруть участь у каскаді фібринолізу, є tPA, що виробляється ендотелієм і його антагоніст — швидко реагуючий інгібітор активатора плазміногена PAI-1. Їх співвідношення у плазмі крові визначає фібринолітичний потенціал крові. Порушення балансу між цими двома пептидами (підвищення рівня PAI-1 при нормальному чи зниженому рівні tPA) у плазмі крові зафіксоване у гострий період ІМ і пов’язане з ризиком розвитку повторного інфаркту, 30-денної смерті після перенесеного ІМ. Також відомо, що ангіотензин II і його метаболіт ангіотензин IV викликають підвищення виробітку PAI-1 клітинами ендотелію. З іншого боку, РААС тісно пов’язана з калікреїн-кініновою системою таким чином, що АПФ забезпечує деградацію брадикініну (рис. 1.2).
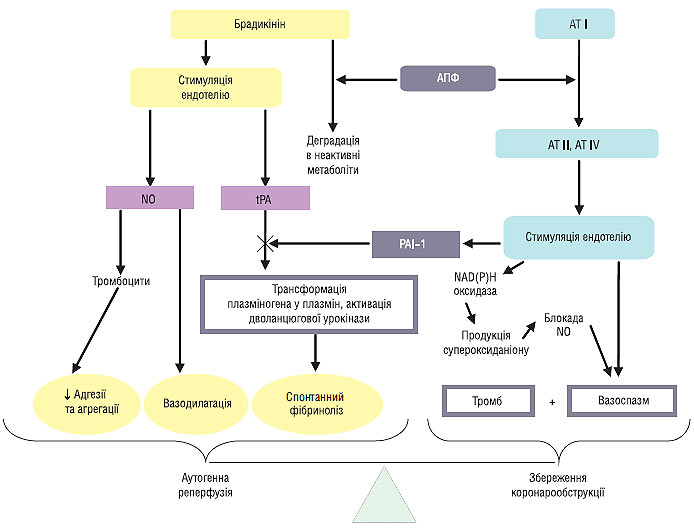
Рис. 1.2. Механізм спонтанної реканалізації коронарної артерії, що спричинила інфаркт
Ще однією причиною неефективності аутогенної реперфузії є недостатня дія вазорелаксуючих агентів, і як наслідок цього — триваючий вазоспазм. Брадикінін — стимулятор виробітку ендогенного ендотеліального фактора розслаблення (NO). Оскільки продукти деградації брадикініну таких властивостей не мають, вірогідно, що гіперфункція внутрішньосудинної РААС, крім зниження фібринолітичної активності, призводить також до порушення судинорозширювального потенціалу крові.
У свою чергу РААС призводить до інактивації NO шляхом перетворення його супероксид-аніона в неактивний пероксинітрит. Супероксид-аніон утворюється при участі мембранної
NAD(P)H оксидази і ендотеліальної NO-синтетази. При цьому пригнічуються і інші короткотермінові системні ефекти NO — інгібування АДФ-залежної адгезії та агрегації тромбоцитів, інгібування адгезії тромбоцитів до ендотелію шляхом блокади дегрануляції тромбоцитів. Унаслідок цього виникає підвищення проагрегаційного потенціалу крові, що стимулює початкові етапи утворення коронарного тромбозу і ретромбозу.
При коронарному тромбозі початкова обструкція кровотоку, як правило, починається з агрегації тромбоцитів за участю фібрина (рис. 1.3).

Рис. 1.3. Стенозуюча атеросклеротична бляшка
Ще одним несприятливим наслідком руйнування атеросклеротичної бляшки і коронарного тромбозу є дистальна емболізація тромботичними і атероматозними масами, що веде до мікросудинної обструкції і може перешкоджати успішній реперфузії міокарда на тканинному рівні, незважаючи на відновлення адекватної прохідності артерії, що зумовила інфаркт (рис. 1.4).
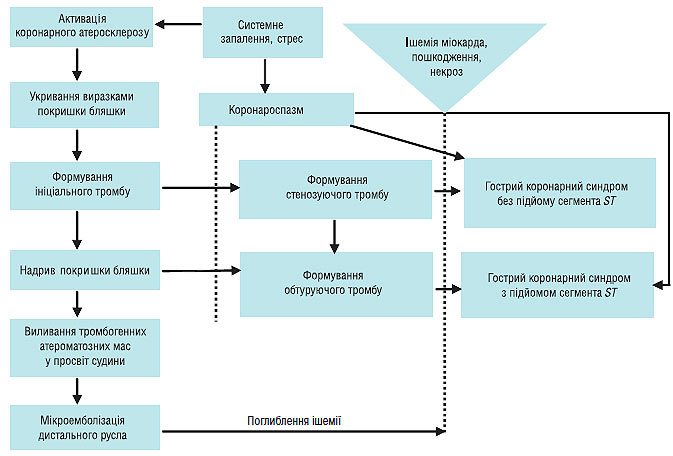
Рис. 1.4. Розвиток гострого коронарного синдрому
Розвиток оклюзії коронарної судини веде до загибелі кардіоміоцитів. Від рівня і тривалості оклюзії судини залежить величина вогнища некрозу міокарда. Порушення коронарного кровотоку і розвиток некрозу міокарда запускають каскад нейрогуморальних реакцій, запального і проліферативного процесу. Всі ці структурно-функціональні та метаболічні перебудови міокарда призводять до ремоделювання порожнини ЛШ: дилатації порожнини ЛШ, зміни його геометрії та розвитку гіпертрофії, що може призвести до появи СН і визначає віддалений прогноз у пацієнтів, які перенесли гострий ІМ (рис. 1.5).
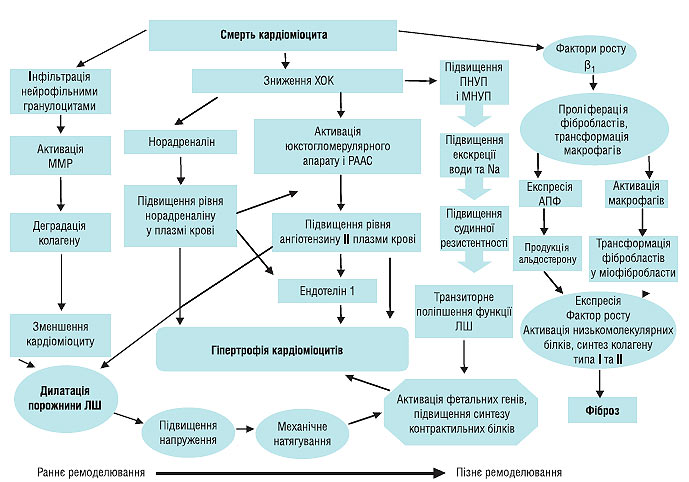
Рис. 1.5. Патогенез постінфарктного ремоделювання порожнини ЛШ (адаптовано за St. John Sutton, 2000). ПНУП — передсердний натрійуретичний пептид; МНУП — мозковий натрійуретичний пептид; ММР — матриксні металопротеази
У перебігу гострого інфаркту міокарда можна виділити декілька патогенетичних періодів. Продромальний період, або так званий передінфарктний стан, визначають за різним даними у 30–60% випадків. Середня тривалість цього періоду 7 днів, часто його початок збігається з фізичним або психоемоційним навантаженням, причому найбільш несприятливими є «малі», але регулярні стреси, постійний стресовий стан. Клінічно його характеризують виникнення чи значне почастішання і посилення тяжкості нападів стенокардії (так звана нестабільна стенокардія), а також зміни загального стану (слабкість, стомлюваність, зниження настрою, тривога, порушення сну). Дія антиангінальних засобів стає, як правило, менш ефективною. Відзначають, що нестабільна стенокардія, навіть якщо хворий не звертався за медичною допомогою, може розв’язатися самостійно без розвитку гострого ІМ, чому сприяють вищеописані механізми. Проте оцінити тяжкість і обсяг можливого ураження міокарда за клінічною картиною передінфарктного стану вкрай важко, тому до всіх хворих, які поступили у стаціонар з клінікою нестабільної стенокардії, необхідно застосовувати ту ж лікувально-діагностичну тактику, що й до хворих із гострим ІМ, крім проведення тромболізису (див. нижче). За відсутності ознак стабілізації стану хворого, якому проводять інтенсивну терапію, показана коронарографія з вирішенням питання про доцільність та обсяг інвазивних втручань.
Найгостріший період (час від виникнення ішемії міокарда до перших проявів його некрозу) триває звичайно від 30 хв до 2 год. Початок цього періоду, як правило, відповідає моменту максимального ангінозного болю, до якого може приєднуватися характерна іррадіація (в руку, плече, надпліччя, ключицю, шию, нижню щелепу, міжлопаткову ділянку). У ряді випадків біль має затяжний або хвилеподібний характер, що при збереженні «гострофазової» графіки ЕКГ без формування негативних зубців Т може свідчити про інтермітуючу коронарну обструкцію (флотуючий тромб, активація спонтанного фібринолізу) чи приєднання нових ділянок ураження серцевого м’яза. Безбольову форму гострого ІМ діагностують рідко, найчастіше цей діагноз встановлюють post factum. Інші клінічні прояви пов’язані з гіперактивацією вегетативної (як симпатичної, так і парасимпатичної) нервової системи і в ряді випадків вираженим рефлекторним зниженням насосної функції серця (різка слабкість, відчуття нестачі повітря, страх смерті, профузний піт, задишка у стані спокою, нудота і блювання). СН у цей період захворювання розвивається, насамперед, як лівошлуночкова, найбільш ранніми її проявами є задишка і зниження пульсового тиску, у тяжких випадках — серцева астма чи набряк легень, що нерідко поєднується з розвитком кардіогенного шоку. Різні порушення серцевого ритму та провідності відзначають практично у всіх хворих.
Гострий період настає по закінченню найгострішого періоду і триває близько 2 діб — до остаточного відокремлення вогнища некрозу. При рецидивному перебігу гострого ІМ тривалість гострого періоду може збільшуватися до >10 днів; часто ускладнюється вираженим резорбційним синдромом. Протягом цього періоду відбувається вимивання у периферичну кров кардіоспецифічних ферментів; динаміка їх вимивання може також свідчити про розміри ураження міокарда.
Підгострий період, що відповідає інтервалу від повного відокремлення вогнища некрозу до заміщення його первинною сполучною тканиною, триває приблизно 28 днів. У цей час у деяких хворих з’являються клінічні симптоми, пов’язані із зменшенням маси функціонуючого міокарда (СН) і його електричною нестабільністю (аритмія серця). Прояви резорбційного синдрому поступово зменшуються, ускладнення гострого періоду в цей час звичайно розв’язуються; виявлення в цей період збільшення СН, аритмії серця, постінфарктної стенокардії потребує медикаментозної і в ряді випадків інвазивної корекції. Звичайно, в підгострий період хворі проходять реабілітаційне лікування у стаціонарі. Особливості ведення хворого з інфарктом у реабілітаційному відділенні визначаються розміром некрозу міокарда, демографічними характеристиками пацієнта та наявністю чи відсутністю супутніх захворювань. Після зникнення симптомів і при мінімальному ураженні міокарда пацієнт може бути переведений у реабілітаційне відділення вже через декілька днів. У разі вираженої дисфункції ЛШ або при високому ступені ризику нових подій необхідна більш тривала госпіталізація.
Постінфарктний період завершує перебіг гострого ІМ, оскільки наприкінці нього передбачається остаточне формування щільного рубця в зоні інфаркту. Вважають, що при типовому перебігу великовогнищевого ІМ постінфарктний період триває приблизно 6 міс. У цей час поступово розвивається компенсаторна гіпертрофія збереженого міокарда, завдяки якій СН, що виникла у більш ранній період ІМ, у деяких хворих може бути усунена. Проте при великих розмірах ураження міокарда повна компенсація не завжди можлива і ознаки СН зберігаються чи наростають. Процеси рубцювання також можуть супроводжуватися формуванням стійкого аритмогенного субстрату і хронічної аневризми серця, дилатацією порожнин серця з розвитком вторинної клапанної недостатності, що, як і стійка постінфарктна стенокардія, може потребувати хірургічної корекції.
ФАКТОРИ РИЗИКУ НЕСПРИЯТЛИВОГО ПЕРЕБІГУ ГОСТРОГО ІНФАРКТУ МІОКАРДА
Раніше до несприятливих факторів, що погіршують перебіг гострого ІМ, крім розмірів і локалізації інфаркту, традиційно відносили похилий вік, жіночу стать, наявність супутнього цукрового діабету, АГ, інші соціальні, спадкові фактори та супутні захворювання. Тепер у зв’язку з появою нових медичних технологій структура факторів ризику змінилася: велике значення як для раннього, так і віддаленого прогнозу у осіб, які перенесли гострий ІМ, має терапія гострої фази захворювання, час звертання за медичною допомогою.
Найбільший позитивний ефект на результати лікування гострого ІМ в останні роки виявило вдосконалення алгоритмів лікування, спрямованих на відновлення прохідності коронарної артерії, що зумовила інфаркт. У великих рандомізованих дослідженнях у пацієнтів із гострим ІМ із застосуванням ТЛТ 30-денна летальність виявлена у межах 6—10%, тоді як у дослідженнях із застосуванням ПКВ за той же період летальність становила 2,5%. Проте слід зазначити, що до хірургічних досліджень включали в основному ретельно відібраний контингент хворих (зокрема, виключали пацієнтів похилого віку або тих, які мають виражений системний атеросклероз, що, з одного боку, створює труднощі при проведенні пункції великих артерій, а з іншого — є досить надійною «гарантією» багатосудинного ураження коронарного русла і відповідно фактором, що погіршує прогноз). Крім того, аналіз реальної ситуації в кардіологічній практиці свідчить, що багато пацієнтів не одержують оптимальної (відповідно до сучасних алгоритмів) терапії, що включає тромболізис. Зокрема, серійні спостереження в Північній Америці і Європі дозволяють припустити, що частота ТЛТ при гострому ІМ в цих регіонах в середньому становить до 40%. В Італії частота ТЛТ становить 50% загальної кількості випадків госпіталізації хворих із гострим коронарним синдромом. Крім того, деякі з пацієнтів проходять лікування не в кардіореанімаційних відділеннях, а у віковій структурі хворих особи похилого віку мають більшу питому вагу, ніж у когортах багатоцентрових досліджень. Таким чином, можна очікувати, що госпітальна летальність серед реальних хворих із гострим ІМ буде вищою, ніж за результатами досліджень із застосуванням тромболізису і ангіопластики. За результатами спостереження випадків лікування гострого ІМ у реальній клінічній практиці сформовано список предикторів ранньої (30-денної) смертності у хворих із гострим ІМ (табл. 1.1).
Таблиця 1.1 Предиктори 30-денної смертності після гострого ІМ(McGovern P.G., 1996)
| Показник | Так, n (%)* | Ні, n (%)* | p | p (мульти-варіаційний) |
| Чоловіча стать | 94 (14,8) | 101 (23,9) | <0,001 | НД |
| Тромболізис | 32 (14,0) | 122 (22,4) | <0,05 | НД |
| ВКП | 112 (15,0) | 83 (36,0) | <0,001 | <0,001 (0,4)# |
| Тютюнопаління | 71 (14,6) | 61 (20,8) | <0,05 | НД |
| Сімейний анамнез ІХС | 29 (10,3) | 96 (20,6) | <0,001 | НД |
| ЛШН | 112 (31,0) | 48 (10,4) | <0,001 | <0,01 (1,7)# |
| Кардіогенний шок | 61 (78,2) | 99 (13,3) | <0,001 | <0,001 (19)# |
| Шлуночкова аритмія | 50 (34,3) | 110 (16,3) | <0,001 | <0,001 (3)# |
| AV-блокада | 26 (48,2) | 135 (17,6) | <0,001 | НД |
| Реінфаркт | 26 (60,0) | 132 (17,0) | <0,001 | <0,01 (3,9)# |
| Вік (середній) | 73 роки (які померли в стаціонарі) | 67 роки (які пережили стаціонарний період) | <0,001 | <0,001 (1,05)# |
*n — кількість пацієнтів, які померли в стаціонарі, з наявністю або без наявності ознаки; % — частка пацієнтів, які померли в стаціонарі, серед пацієнтів із наявністю і без наявності ознаки; #відношення шансів; ВКП — відділення коронарної патології; ЛШН — лівошлуночкова недостатність; НД — недостовірно.
За даними таблиці до незалежних предикторів ранньої смерті після перенесеного гострого ІМ можна віднести лікування гострої фази ІМ поза відділенням коронарної патології (кардіореанімації), наявність гострої лівошлуночкової недостатності (ГЛШН) і кардіогенного шоку, розвиток шлуночкових аритмій і рецидиву гострого ІМ протягом госпітального періоду. Також у цьому аналізі незалежним предиктором ранньої летальності після гострого ІМ був похилий вік.
При аналізі факторів ризику несприятливого перебігу віддаленого постінфарктного періоду (5-річне спостереження) було визначено такі предиктори, як постінфарктний кардіосклероз (після ІМ, що аналізувався), відсутність реперфузійної терапії в гострій фазі захворювання, наявність у сімейному анамнезі ІХС, серцева блокада, відсутність ацетилсаліцилової кислоти в терапії постінфарктного періоду та похилий вік. Проте до незалежних предикторів несприятливого результату віднесені похилий вік і наявність лівошлуночкової недостатності в стаціонарі (табл. 1.2).
Таблиця 1.2. Предиктори смерті після гострого ІМ протягом 5-річного спостереження (McGovern P.G., 1996)
| Показник | Так, n (%)* | Ні, n (%)* | p | p (мультиваріаційний) |
| Чоловіча стать | 196 (30,9) | 161 (38,2) | <0,05 | НД |
| ІМ в анамнезі | 92 (42,3) | 198 (33,7) | <0,001 | НД |
| Тромболізис | 54 (24,1) | 219 (40,2) | <0,001 | НД |
| Цукровий діабет | 58 (44,6) | 230 (33,8) | <0,05 | НД |
| Тютюнопаління в анамнезі | 147 (30,1) | 115 (39,1) | <0,05 | НД |
| Сімейний анамнез ІХС | 61 (21,5) | 185 (39,9) | <0,001 | НД |
| ГЛШН | 184 (51,0) | 110 (23,8) | <0,001 | <0,001 (2,7)# |
| Шлуночкова аритмія | 64 (43,8) | 229 (33,9) | <0,05 | НД |
| Внутрішньосерцеві блокади | 33 (61,1) | 261 (33,9) | <0,001 | НД |
| Призначення ацетилсаліцилової кислоти при виписці | 98 (17,6) | 37 (38,1) | <0,001 | НД |
| Вік (середній) | 72,3 року (які померли при віддаленому спостереженні) | 65,6 року (які пережили період спостереження) | <0,001 | <0,001 (1,05)# |
*n — кількість пацієнтів, які померли протягом віддаленого спостереження, з наявністю чи без наявності ознаки; % — частка пацієнтів, які померли протягом віддаленого спостереження, серед пацієнтів із наявністю і без наявності ознаки; #відношення шансів.
На підставі отриманих даних побудована як загальна крива виживаності після перенесеного гострого ІМ (рис. 1.6), так і криві виживаності при наявності та відсутності лівошлуночкової недостатності в гострий період ІМ (рис. 1.7).
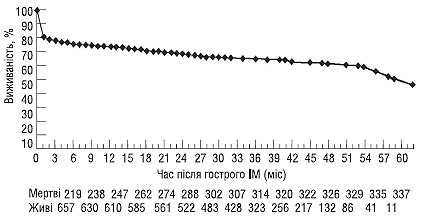
Рис. 1.6. Виживаність після перенесеного гострого ІМ (McGoern P.G., 1996)

Рис. 1.7. Виживаність після перенесеного ІМ залежно від наявності ГЛШН (McGovern P.G., 1996)
Як видно з малюнків, найбільша кількість хворих, які перенесли гострий ІМ, вмирають в ранній (до 2 міс) постінфарктний період, наявність ознак ГЛШН у стаціонарі при цьому має істотний вплив.
Інший великий реєстр CENIC (Mattos et al., 2004), що включає дані про 9371 пацієнта з гострим ІМ та елевацією сегмента ST, які пройшли реперфузійну терапію у вигляді первинної ангіопластики чи тромболізису з подальшою «ПКВ порятунку» протягом 24 год від початку гострого ІМ, як основний фактор ризику госпітальної летальності також виділив наявність ГЛШН у стаціонарі; крім цього, такими факторами були багатосудинне ураження коронарного дерева та неефективність тромболізису і/або ПКВ за даними коронаровентрикулографії.
Аналіз даних про >10 тис. хворих із гострим ІМ у дослідженні GISSI-3 також свідчить про негативний прогностичний вплив дилатації порожнини ЛШ >60 мл/м2 на летальність і розвиток СН після гострого ІМ. Аналізуючи фактори, що сприяють розвитку дилатації порожнини ЛШ, більшість авторів довели значення величини зони некрозу і передньої локалізації ураження. Відомі різні дані про взаємозв’язок анамнестичних характеристик, перебігу 1-ї доби інфаркту та впливу лікування.
Ще одним фактором, що визначає віддалений прогноз у пацієнтів, які перенесли ІМ і розвиток застійної СН, є постінфарктне ремоделювання порожнини ЛШ. До ремоделювання порожнини ЛШ серця призводять структурно-функціональні ураження міокарда. Це загальновідомий факт, доведений у багатьох дослідженнях як на експериментальній моделі, так і у клінічній практиці.
ПРОФІЛАКТИКА
Первинна профілактика
Первинна профілактика гострого ІМ збігається з мірами первинної профілактики інших форм ІХС, а у пацієнтів із встановленим атеросклерозом коронарних артерій серця включає також усунення чи зменшення впливу факторів ризику розвитку гострого ІМ, що актуально і при вторинній профілактиці (попередження повторного ІМ). До головних факторів ризику відносять АГ, гіпер- і дисліпопротеїнемію, порушення вуглеводного обміну (особливо цукровий діабет), тютюнопаління, недостатню фізичну активність, ожиріння. Пацієнтам із ІХС необхідне постійне активне лікування, що попереджає напади стенокардії та сприяє розвитку колатералей у системі коронарних артерій.
Хворі з АГ підлягають диспансерному нагляду. Їм проводять патогенетичну і антигіпертензивну терапію, що забезпечує оптимальний для кожного пацієнта рівень АТ і спрямована на попередження гіпертонічних кризів. За наявності гіперхолестеринемії велике значення має дієта для лікування і профілактики атеросклерозу. Доцільно застосовувати статини, фібрати, омега-3-поліненасичені жирні кислоти, розчинну харчову клітковину. Тривале застосування вітамінів, зокрема А, С, Е і нікотинової кислоти, не впливало на ризик розвитку гострого ІМ та інших серцевих подій. Дієта зі зниженим змістом вуглеводів, а за необхідності і медикаментозна терапія, показані хворим зі зниженою толерантністю до глюкози і явним цукровим діабетом, а також хворим з ожирінням. Кардіологічна диспансеризація має обов’язково включати популяризацію серед населення здорового способу життя з виключенням тютюнопаління, заняттями фізичною культурою та спортом. Достатня фізична активність перешкоджає виникненню і розвитку ІХС, сприяє розвитку колатералей в системі коронарних артерій серця, знижує схильність до тромбоутворення і розвитку ожиріння. Особливе значення заняття фізкультурою мають для пацієнтів, рухова активність яких недостатня за умовами трудової діяльності чи з інших причин. Одна з важливих складових профілактики гострого ІМ — кваліфіковане лікування хворих із встановленим діагнозом стенокардії і коронарного атеросклерозу. Профілактичні заходи, що застосовують у пацієнтів цієї категорії, істотно не відрізняються від вторинної профілактики у хворих, які перенесли ІМ.
Вторинна профілактика
Тютюнопаління
Досвід тривалих спостережень свідчить про те, що припинення куріння дозволяє знизити смертність протягом наступних декількох років більше ніж у 2 рази. Потенційно це найбільш ефективний захід вторинної профілактики; слід докласти значних зусиль для відмови від куріння. У гострій фазі захворювання більшість пацієнтів не палять, протягом періоду відновлення їм слід допомогти перебороти шкідливу звичку. Поновлення куріння нерідко відзначають після повернення хворого додому, тому під час періоду реабілітації він потребує підтримки і порад.
Дієта і харчові добавки
Ліонське дослідження впливу дієти на серце довело, що середземноморська дієта знижує частоту рецидивів у пацієнтів, які перенесли перший ІМ, принаймні, протягом 4 років. Всім пацієнтам варто радити середземноморську дієту, що характеризується малою кількістю насичених жирів, значним вмістом поліненасичених жирів, фруктів та овочів. Вважають, що вживання в їжу жирної риби принаймні 2 рази на тиждень знижує ризик реінфаркту і смерті. Додавання до дієти омега-3-поліненасичених жирних кислот з риб’ячого жиру (1 г/добу), але не вітаміну Е, асоціювалося з достовірним зниженням смертності від усіх причин та ймовірності раптової смерті. Немає доказів доцільності застосування після перенесеного інфаркту харчових добавок, які містять антиоксиданти, проте додавання до раціону добавок, що містять харчову клітковину (>4,0 г розчинної клітковини на 1,735 ккал раціону), знижувало серцево-судинну смертність. Призначення фолієвої кислоти доцільно у разі підвищення вмісту в крові гомоцистеїну.
Антитромбоцитарна й антикоагулянтна терапія
За результатами метааналізу Antiplatelet Trialists Collaboration виявлене зниження приблизно на 25% імовірності реінфаркту і смерті після перенесеного ІМ. У проаналізованих дослідженнях доза ацетилсаліцилової кислоти коливалася в межах 75–325 мг/ добу. Є свідчення того, що застосування цього засобу у більш низьких дозах забезпечує досягнення ефекту з меншою кількістю побічних проявів. Дослідження, виконані в період до широкого застосування ацетилсаліцилової кислоти, довели ефективність пероральних антикоагулянтів у запобіганні реінфаркту і смерті після перенесеного ІМ. У цих дослідженнях пацієнтів рандомізували не пізніше ніж через 2 тиж після інфаркту. Ефективність рутинного застосування пероральних антикоагулянтів, на противагу ацетилсаліциловій кислоті, у хворих в постінфарктний період оцінювали в дослідженні АFTER. При лікуванні цих пацієнтів не отримано чітких переваг порівняно із застосуванням ацетилсаліцилової кислоти. Можливо, пероральне застосування антикоагулянтів виявилося б корисним для окремих категорій пацієнтів, зокрема для хворих із великою зоною акінезії передньої локалізації, фібриляцією передсердь або наявністю ехокардіографічно доведеного тромбу в ЛШ, але великих рандомізованих досліджень у цьому напрямку не проводили. Ацетилсаліцилова кислота у поєднанні з фіксованою низькою дозою пероральних антикоагулянтів не є більш ефективною для запобігання нових ішемічних подій, ніж ацетилсаліцилова кислота у монотерапії. Помірно- і високоінтенсивна пероральна терапія антикоагулянтними засобами (МНО >2,0) у поєднанні з ацетилсаліциловою кислотою забезпечила зменшення кількості реоклюзій після успішного лізису порівняно з монотерапією ацетилсаліциловою кислотою. У двох дослідженнях (ASPECT-2, 2002 й WARIS-2, 2002) таке поєднання препаратів дозволило також зменшити загальну кількість випадків смерті, реінфаркту та інсульту у пацієнтів у постінфарктний період, але відзначено достовірне збільшення кількості нефатальних ускладнень, зумовлених кровотечами. Результати дослідження CLARITY TIMI 28 показали ефективність комбінованого застосування клопідогрелу та ацетилсаліцилової кислоти у осіб із гострим ІМ після реперфузійної терапії. І хоча особливо відзначають, що перевагу у групі клопідогрелу отримано лише за показником поновлення кровотоку в коронарній артерії, що зумовила інфаркт, результати дослідження COMMIT із застосуванням клопідогрелу як додаткової до ацетилсаліцилової кислоти терапії при гострому ІМ у 46 тис. пацієнтів продемонстрували достовірне зниження загальної смертності на 7%. Крім того, вже доведена ефективність клопідогрелу для вторинної профілактики після перенесеного гострого коронарного синдрому без стійкої елевації сегмента ST (CURE, 2001). Можливість призначення пероральних антикоагулянтів необхідно розглядати у пацієнтів, які не переносять ацетилсаліцилову кислоту. У цих хворих клопідогрел є хорошим альтернативним засобом антитромбоцитарної терапії.
Блокатори β-адренорецепторів
У декількох дослідженнях і метааналізах показано, що засоби, які блокують β-адренорецептори, знижують летальність та ймовірність реінфаркту після перенесеного гострого ІМ на 20–25%. Позитивні результати отримані в дослідженнях із пропранололом, метопрололом, тимололом, ацебутололом і карведилолом. Втім, у менших за обсягом дослідженнях із застосуванням інших блокаторів β-адренорецепторів отримано подібні результати. Метааналіз 82 рандомізованих досліджень свідчить на користь тривалого застосування блокаторів β-адренорецепторів з метою зниження захворюваності й летальності після гострого ІМ, навіть якщо було застосовано фібринолітичні засоби водночас з інгібіторами АПФ. Виражене зниження летальності у осіб із СН на фоні застосування блокаторів β-адренорецепторів дає підстави для застосування цих препаратів у пацієнтів у постінфарктний період. Аналіз даних проведених досліджень свідчить про те, що блокатори β-адренорецепторів без внутрішньої симпатоміметичної активності слід призначати всім пацієнтам після перенесеного ІМ за відсутності протипоказань.
Антагоністи кальцію
Докази можливого сприятливого впливу антагоністів кальцію значно слабші, ніж блокаторів β-адренорецепторів. Результати ранніх досліджень із застосуванням верапамілу і дилтіазему дозволили припустити, що ці препарати можуть запобігати реінфаркту і смерті. У дослідженні INTERCEPT за участю 874 пацієнтів із гострим ІМ без застійної СН, у яких проводили терапію фібринолітичними засобами, 6-місячне застосування дилтіазему в дозі 300 мг/добу зменшило кількість коронарних втручань. Застосування верапамілу і дилтіазему може бути доцільним при протипоказаннях до призначення блокаторів β-адренорецепторів, особливо при обструктивних захворюваннях дихальних шляхів. Слід бути обережним при призначенні цих препаратів пацієнтам з порушеною функцією шлуночків. Дигідропіридинові антагоністи кальцію у монотерапії призводять до підвищення летальності хворих із гострим ІМ [7], тому це лікування слід призначати лише за наявності чітких клінічних показань. І хоча результати субаналізу дослідження ASCOT [3] дають підстави вважати, що комбінована терапія аторвастатином, амлодипіном і периндоприлом у пацієнтів із ризиком розвитку ІХС знижує загальну смертність на 11% (p<0,025) і частоту всіх кардіоваскулярних подій на 16% (p<0,0001), рутинне призначення амлодипіну як доповнення до терапії блокаторами β-адренорецепторів та інгібіторами АПФ хворим після ІМ потребує додаткових досліджень із залученням великої кількості пацієнтів.
Інгібітори АПФ
За результатами декількох досліджень встановлено, що інгібітори АПФ знижують летальність після перенесеного гострого ІМ зі зниженою залишковою функцією ЛШ. У дослідження SAVE (1992) включали пацієнтів у середньому через 11 днів після гострої події. У всіх ФВ була <40% при радіоізотопній вентрикулографії і не було ознак маніфестної ішемії при навантажувальному тесті. Протягом 1-го року не відзначено сприятливого впливу на смертність, але в наступні 3–5 років смертність знизилась на 19% (з 24,6 до 20,4%). Водночас навіть протягом 1-го року виявлено зменшення реінфарктів і випадків виникнення СН.
У дослідженні AIRE (1993) пацієнтів, у яких з’явилися клінічні чи рентгенологічні ознаки СН, рандомізували для терапії раміприлом в середньому через 5 днів після початку ІМ. Через 15 міс смертність знизилась з 22,6 до 16,9% (відносне зниження на 27%).
У дослідженні TRACE (1995) лікування трандолаприлом або плацебо починалося в середньому через 4 дні після інфаркту, ускладненого дисфункцією ЛШ. Індекс рухливості стінки у всіх пацієнтів становив <1,2. У середньому через 108 тиж спостереження смертність становила 34,7% у групі активного лікування і 42,3% — у групі плацебо. Автори цього дослідження надалі спостерігали пацієнтів протягом мінімум 6 років і довели підвищення очікуваної тривалості життя на 15,3 міс (27%). З урахуванням результатів трьох досліджень доцільно призначати інгібітори АПФ пацієнтам, у яких після гострої події виникала СН із ФВ <40% або індексом рухливості стінки < 1,2, за умови відсутності протипоказань. Слід зазначити, що докази ефективності терапії інгібіторами АПФ отримані переважно у хворих із передньою локалізацією ІМ.
Дані тривалого дослідження ефективності інгібіторів АПФ у пацієнтів у постінфарктний період, а також дані дослідження HOPE [20] свідчать про користь призначення цих препаратів щонайменше протягом 4–5 років, навіть за відсутності дисфункції ЛШ. Досягнутий ефект може бути навіть вищим у пацієнтів із цукровим діабетом, які перенесли ІМ. Тривале застосування інгібітора АПФ після перенесеного ІМ, подібно до ацетилсаліцилової кислоти і блокаторів β-адренорецепторів, виправдане, якщо пацієнти добре переносять ці препарати. Результати дослідження EUROPA підтвердили ефективність застосування периндоприлу у хворих після перенесеного ІМ [14]. Призначення периндоприлу пацієнтам із низьким ступенем ризику незалежно від наявності СН, АГ, цукрового діабету призводило до зниження імовірності повторних ІМ на 24%, розвитку СН — на 39%.
Ліпідознижувальна терапія
Скандинавське дослідження впливу симвастатину на виживаність (4S, 1994) довело користь зниження рівня ліпідів у популяції 4444 пацієнтів зі стенокардією і/чи після ІМ з рівнями ХС у сироватці крові 212–308 мг/дл (5,5–8,0 ммоль/л) після застосування дієтичних заходів. Пацієнтів не включали у дослідження до 6 міс після гострого інфаркту; була відібрана група хворих із відносно низьким ступенем ризику. В середньому через 5,4 року загальна смертність у групі лікування симвастатином знизилася на 30% (12% у групі плацебо і 8% — у групі симвастатину), що при перерахуванні результатів означає 33 врятовані життя на 1000 пацієнтів, які одержували лікування протягом цього періоду. Було відзначене істотне зниження смертності внаслідок коронарних причин, а також потреби у виконанні шунтувальних хірургічних втручань. Користь застосування симвастатину у пацієнтів віком старше 60 років була такою ж, як і у хворих молодшої вікової групи.
У дослідженні CARE (1996) 4159 пацієнтів після ІМ з «середніми» рівнями ХС (в середньому — 209 мг/дл) одержували правастатин 40 мг або плацебо протягом 3–20 міс після гострої події. Правастатин забезпечив відносне зниження ризику фатальних коронарних подій або реінфаркту на 24%. Подібні сприятливі ефекти відзначено в підгрупі пацієнтів, яким виконали реваскуляризацію міокарда. Дослідження LIPID (1998) об’єднало близько 9 тис. пацієнтів із перенесеним раніше ІМ або нестабільною стенокардією і рівнем ХС у широкому діапазоні: 42% — <213 мг/дл (5,5 ммоль/л), 44% — у межах 213–250 мг/дл (5,5–6,4 ммоль/л) і 13% — 251 мг/дл (6,5 ммоль/л). Хворих рандомізували для отримання терапії 40 мг правастатину чи плацебо протягом 6 років. Лікування правастатином дозволило знизити ймовірність коронарної смерті на 24%, ризик (ре-)ІМ — на 29% [8].
Результати дослідження ASCOT підтвердили ефективність терапії аторвастатином у пацієнтів із порушенням обміну ліпідів щодо розвитку коронарних подій (зокрема фатальних). Нещодавно в дослідженні JUPITER було доведено, що терапія розувастатином (20 мг/добу) дозволяє знизити частоту виникнення кінцевої точки (смерть, коронарні події, інсульт) більше ніж у 2 рази (р<0,00001) у пацієнтів середнього віку з з підвищенням рівня СРБ >2 мг/л навіть за умов нормального ліпідного спектра, без попередніх кардіальних подій.
Інший препарат групи ліпідознижувальних засобів — нікотинова кислота. Донедавна застосування її з цією метою було обмежене у зв’язку з коротким періодом дії, необхідністю ін’єкційного введення та виражених побічних ефектів (гіперемія). Проте в останні роки з’явилися повідомлення, що нова пероральна пролонгована форма нікотинової кислоти була успішно використана в лікуванні дисліпідемії у пацієнтів із цукровим діабетом. Більше того, порівняння ефективності пролонгованої форми нікотинової кислоти і гемфіброзилу довело перевагу першого засобу в лікуванні дисліпідемії. Однак для оцінки можливості включення цього препарату в терапію постінфарктних хворих необхідне проведення спеціальних досліджень. Загальний вплив ліпідознижувальної терапії на госпітальну летальність у хворих із гострим коронарним синдромом оцінено в дослідженні PURSUIT (рис. 1.8).

Рис. 1.8. Вплив ліпідознижувальної терапії на летальність після гострого коронарного синдрому
Загалом ліпідознижувальні засоби слід призначати пацієнтам, які відповідають критеріям включення в вищенаведені дослідження. Стати-ни призначають у тому разі, якщо, незважаючи на дотримання дієтичних заходів, вміст рівня загального ХС >190 мг/ дл (4,9 ммоль/л) і/або ХС ЛПНЩ >115 мг/ дл (2,97 ммоль/л). Результати дослідження HPS (2001) дозволяють припустити, що рекомендації щодо застосування статинів мають поширюватися і на пацієнтів з нижчим рівнем ліпідів, включаючи хворих похилого віку (рис. 1.9).
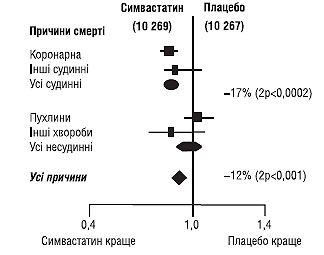
Рис. 1.9. Вплив застосування симвастатину на летальність у хворих із гіперхолестеринемією і факторами ризику кардіальної смерті (адаптоване за HPS Group, 2000)
У пацієнтів із низьким рівнем ХС ЛПВП слід оцінити необхідність призначення статинів. Залишаються протиріччя щодо часу початку терапії. Дані нещодавно опублікованого дослідження свідчать, що перевага може бути у раннього і агресивного лікування ліпідознижувальними засобами, незалежно від рівня ХС (рис. 1.10).
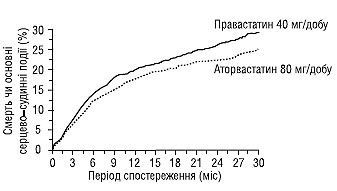
Рис. 1.10. Порівняння впливу агресивної (80 мг аторвастатину) і традиційної (40 мг правастатину) ліпідознижувальної терапії на летальність у хворих із гострим коронарним синдромом (адаптовано за PROVE-IT TIMI 22 Investigators Group, 2004)
Отже, підсумовуючи, наведемо перелік профілактичних засобів, що застосовуються у пацієнтів після перенесеного гострого ІМ з елевацією сегмента ST (табл. 1.4).
Таблиця 1.4. Вторинна профілактика: резюме
| Рекомендація | Клас | Рівень доказів |
| Припинити куріння | I | С |
| Оптимальний контроль глікемії у пацієнтів з цукровим діабетом | I | В |
| Контроль АТ у пацієнтів з АГ | I | С |
| Середземноморська дієта | I | В |
| Додавання до їжі 1 г риб’ячого жиру і омега-3-поліненасичених жирних кислот | I | В |
| Ацетилсаліцилова кислота 75—160 мг/добу | I | А |
| При непереносимості ацетилсаліцилової кислоти: клопідогрел 75 мг/добу | II b | С |
| Пероральний антикоагулянт | II а | В |
| Пероральні блокатори β-адренорецепторів: усім пацієнтам без протипоказань | I | А |
| Продовження терапії інгібітором АПФ, яка була почата в 1-й день | I | А |
| Статини: якщо загальний ХС >190 мг/дл і/або ХС ЛПНЩ >115 мг/дл | I | А |
| Фібрати: якщо ХС ЛПВЩ <45 мг/ дл і ТГ >200 мг/дл | II а | А |
| Антагоністи кальцію (дилтіазем або верапаміл), за наявності протипоказань до призначення блокаторів β-адренорецепторів і відсутності СН | II b | В |
ДІАГНОСТИКА
Встановлення діагнозу та рання стратифікація ризику
Швидке встановлення діагнозу і рання стратифікація ризику у пацієнтів, які звертаються з гострим болем у грудях, важливі для виявлення тих хворих, у яких раннє втручання може поліпшити наслідки захворювання. З іншого боку, коли діагноз «гострий інфаркт міокарда» виключено, основна увага може бути приділена виявленню інших серцевих або несерцевих причин симптомів. Спочатку слід встановити робочий діагноз — гострий коронарний синдром з елевацією сегмента ST.
Клінічна картина. Зазвичай підставою для цього є виражений біль у грудях тривалістю >20 хв, що не зменшується після прийому нітрогліцерину. Важливими для діагностичного пошуку є попередній анамнез ІХС, іррадіація болю в шию, нижню щелепу чи ліву руку. Біль може бути не дуже інтенсивним; у людей похилого віку поширені такі симптоми, як втома, задишка, непритомність, синкопе. Не існує специфічних фізикальних ознак, що дозволяють встановити діагноз «інфаркт міокарда». Проте у багатьох пацієнтів з’являються симптоми, характерні для активації вегетативної нервової системи (бліда шкіра, пітливість), а також розвивається гіпотензія чи зниження пульсового тиску. Можуть відзначати нерегулярний пульс, брадикардію чи тахікардію, третій тон серця, вологі хрипи в нижніх відділах легень.
Необхідно якнайшвидше зареєструвати ЕКГ.
У разі елевації сегмента ST або появи нової чи ймовірно нової блокади лівої ніжки пучка Гіса призначають специфічну терапію чи проводять заходи для її початку (реперфузійна терапія, призначення ацетилсаліцилової кислоти або при її непереносимості чи наявності даних про попередню неефективність — тієнопіридини, а також антикоагулянти; у разі передньої локалізації гострого ІМ або супутньої АГ — інгібітори АПФ, блокатори β-адренорецепторів, нітропрепарати тощо). Використання ЕКГ при наведених ознаках є ключовим при веденні гострої фази гострого ІМ (рис. 1.11).
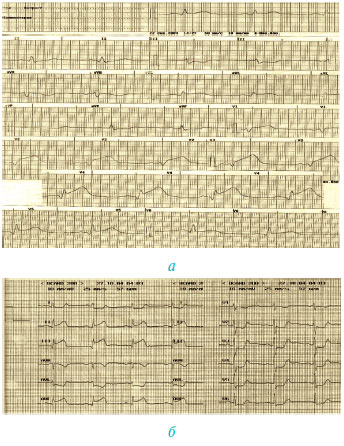
Рис. 1.11. ЕКГ найгострішої фази ІМ : а) передньої локалізації; б) задньої локалізації
Проте картина ЕКГ часто неоднозначна, і навіть при підтвердженому ІМ можуть відразу не виявитися його класичні ознаки — елевація сегмента ST і нові патологічні зубці Q. Необхідно одержати повторні записи ЕКГ і за можливістю проводити порівняння нових ЕКГ з попередніми записами. Для встановлення діагнозу в окремих випадках (інфаркт задньої стінки) корисно зареєструвати ЕКГ у додаткових відведеннях, наприклад V7 і V8, за Слопаком (S1–S4). У всіх хворих необхідно якнайшвидше почати моніторування ЕКГ для виявлення життєво небезпечних аритмій. У гострій фазі захворювання слід проводити аналіз крові на сироваткові маркери, але для вирішення питання про початок реперфузійної терапії в більшості випадків не потрібно очікувати результатів цього аналізу.
Корисною методикою обстеження хворих із гострим грудним болем є двомірна ехоКГ. Регіональні порушення рухливості стінки з’являються протягом секунд після виникнення коронарної оклюзії, до формування некрозу. Втім порушення рухливості стінки не є специфічними для гострого ІМ і можуть бути зумовлені ішемією, раніше перенесеним інфарктом (особливо у поєднанні зі стоншанням відповідних ділянок стінки ЛШ), вираженими порушеннями внутрішньошлуночкової провідності. Двомірна ехоКГ винятково важлива для встановлення діагнозу в інших випадках болю у грудній клітці, зокрема гострого розшарування аорти, ексудативного перикардиту, масивної легеневої емболії. Відсутність порушень рухливості стінки дозволяє виключити лише наявність поширеного ІМ — в ряді випадків дрібновогнищеве ураження міокарда може не супроводжуватися явними порушеннями сегментарної скоротності (особливо у поєднанні з гіпертрофією міокарда).
Коли анамнез, ЕКГ і маркери некрозу не свідчать про діагноз «гострий інфаркт міокарда», пацієнтові слід провести стрес-тестування з метою встановлення діагнозу ІХС.
Лабораторна діагностика
На даному етапі головним маркером ураження міокарда можна вважати МВ-фракцію КФК (КФК-МВ). КФК-МВ має високу клінічну специфічність для діагностики розвитку ІМ. Як доповнення чи альтернатива КФК-МВ можуть визначатися серцеві тропоніни T та I (кількісний аналіз), міоглобін, які характеризуються високою специфічністю до тканини міокарда, а також високою чутливістю. Дещо різним є профіль вимивання КФК-МВ і тропонінів у периферичну венозну кров. Так, діагностично значимі концентрації КФК-МВ визначають у середньому на 30–60 хв раніше, ніж тропонінів, проте, гіпертропонінемія триває приблизно на 1 тиж довше, ніж підвищення рівня КФК-МВ, що, безсумнівно, дуже інформативно у разі діагностики гострого ІМ post factum (особливо з урахуванням того факту, що специфічність іншого «пізнього» маркера ураження міокарда — ЛДГ — значно нижча такої для обох попередніх маркерів). Останнім часом розроблено нові маркери ураження міокарда (білок, що зв’язує жирні кислоти, глікоген-фосфорилаза ВВ, легкі ланцюжки міозину), які поки не знайшли широкого застосування в клініці (рис. 1.12).

Рис. 1.12. Маркери ураження міокарда (криві вимивання в плазмі крові)
На сьогодні в Україні існують швидкі імунохроматографічні тести (Cito test) для визначення кардіомаркерів: тропоніну І, КФК-МВ, міоглобіну (табл. 1.5). Вони дають можливість:
- на догоспітальному етапі створити максимально швидкий відбір пацієнтів із гострим коронарним синдромом, які потребують невідкладної медичної допомоги, і вибрати оптимальну тактику ведення хворих;
- провести диференційний діагноз і встановити діагноз гострого ІМ і СН;
- обстежити пацієнта в будь-яких умовах, зокрема поза лікувальним закладом;
- одержати результат тестування через 10 хв.
Таблиця 1.5. Характеристики тестів
| Показник | Початок підвищення, год | Пік активності, год | Нормалізація |
| Міоглобін | 2-4 | 9-12 | 24-36 год |
| КФК-МВ | 3-8 | 9-30 | 48-72 год |
| Тропонін | 4-6 | 12-24 | 1-2 тиж |
| КФК-МВ | Тропонін I | Міоглобін | |
| Пороговий рівень, нг/мл | 5 | 0,5 | 50 |
| Чутливість, % | 100 | 98,7 | 100 |
| Специфічність, % | 99,8 | 98,4 | 97,7 |
| Точність, % | 99,8 | 98,5 | 98 |
Диференційна діагностика
Типовий клінічний випадок гострого ІМ найчастіше доводиться диференціювати з такими причинами синдрому болю у грудях, як розшарування грудного відділу аорти, тромбоемболія в системі ЛА, гострий (частіше вірусний) перикардит, виражений корінцевий синдром. Враховують наявність факторів ризику коронарного атеросклерозу, ангінозний анамнез, характер і динаміку больового нападу, реакцію пацієнта на вазодилататори і наркотичні анальгетики, динаміку АТ, надалі — результати об’єктивного огляду, ЕКГ, ехоКГ, лабораторних аналізів. Зокрема, при розшаруванні аорти біль частіше локалізується в міжлопатковому просторі, резистентний до дії нітратів, в анамнезі — неконтрольована АГ, виражені зміни на ЕКГ відсутні, кардіальні маркери у межах норми, відзначають виражений лейкоцитоз із зміщенням лейкоцитарної формули вліво; уточнення діагнозу можливе при проведенні ехоКГ, контрастної аортографії, КТ. Для виключення перикардиту слід звертати увагу на анамнез перенесених респіраторно-вірусних інфекцій, наявність шуму тертя перикарда, відсутність динаміки кардіальних маркерів, дані ехоКГ, залежність болю від фази дихання і положення тіла. При плекситі й загостренні остеохондрозу з корінцевим синдромом біль частіше локалізований зліва чи справа від грудини і залежить від положення тіла, фази дихання. Майже завжди при пальпації вдається виявити точки найбільшої болючості в місці виходу відповідних нервових корінців при відсутності інших специфічних для гострого ІМ клініко-інструментальних ознак. При емболії гілок ЛА біль відчувається, як правило, трохи глибше, ніж при гострому ІМ, часто супроводжується пароксизмальною задишкою чи ядухою, відзначають колапс, гіперемію верхньої половини тіла. Зміни ЕКГ у ряді випадків нагадують картину гострого ІМ нижньої локалізації, відрізняючись від неї ознаками гострого перевантаження правих відділів серця; надалі можливі клінічні прояви сегментарної чи дольової пневмонії, збільшення печінки та інші ознаки правошлуночкової недостатності, кровохаркання; в анамнезі важливо звернути увагу на наявність тромбофлебіту, геморою, операцій на органах малого тазу, кісткових переломів і поширених травм м’яких тканин; гіперферментемія не характерна; дані ехоКГ підтверджують виражену легеневу гіпертензію. При гастралгічній формі гострого ІМ може бути помилково встановлений діагноз гострого живота. Симптоми подразнення очеревини в цьому разі відсутні, лейкоцитоз не такий виражений. При нижній локалізації гострого ІМ без елевації сегмента ST графіка ЕКГ буває подібною до змін при гострому панкреатиті; встановити правильний діагноз дозволяє аналіз амілази крові та діастази сечі. Безбольова форма гострого ІМ, що має перебіг із симптомами лівошлуночкової недостатності, у хворих з АГ клінічно може нагадувати виражений гіпертонічний криз. У сумнівних випадках доцільніше припустити виникнення гострого ІМ і терміново госпіталізувати хворого.
Початкова діагностика гострого ІМ (рис. 1.13):
- біль/дискомфорт у грудній клітці;
- анамнестичні та соціальні фактори ризику ІХС (анамнез ІХС (зокрема сімейний), чоловіча стать, стреси, зрілий вік, ІМТ >30, АГ, цукровий діабет, периферичний атеросклероз, тютюнопаління, подагра, регулярний прийом ацетилсаліцилової кислоти та ін.);
- елевація сегмента ST або (підозрювана) нова блокада лівої ніжки пучка Гіса, виявлені на ЕКГ при госпіталізації. Часто необхідне проведення додаткових ЕКГ;
- підвищені маркери некрозу міокарда (КФК-МВ, тропоніни). Для вирішення питання про необхідність реперфузійної терапії не потрібно очікувати результатів.
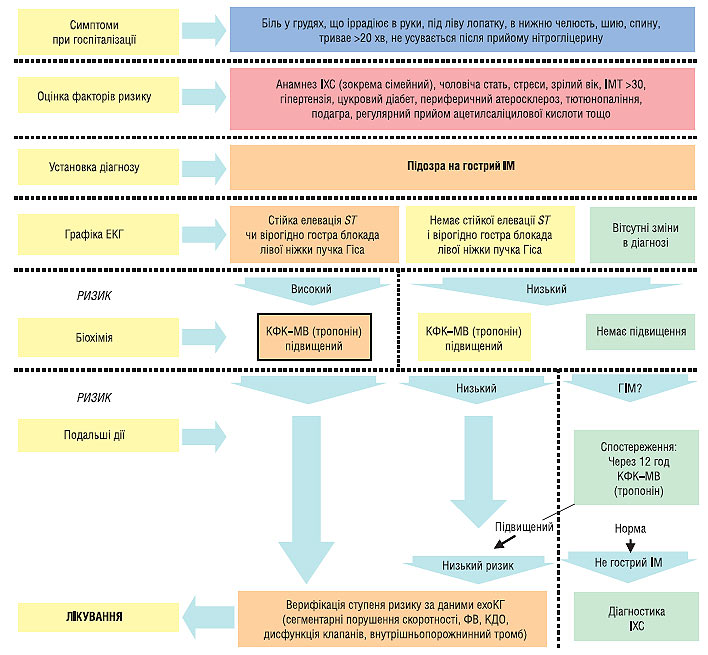
Рис. 1.13. Алгоритм ведення пацієнта з підозрою на гострий ІМ
ЛІКУВАННЯ ГОСТРОГО ІНФАРКТУ МІОКАРДА ТА ЙОГО УСКЛАДНЕНЬ
Первинна мета лікування полягає в запобіганні смерті. Однак ведення хворих з ІМ обов’язково спрямоване на зведення до мінімуму дискомфорту пацієнтів та обмеження ступеня ураження міокарда, запобігання розвитку СН.
Виокремлюють чотири фази лікування:
- Невідкладні заходи. Основні завдання цієї фази надання допомоги полягають у швидкому встановленні діагнозу, усуненні болю, профілактиці чи лікуванні ускладнень захворювання (гемодинамічних і аритмічних).
- Ранні заходи. Принципове завдання цієї фази — якомога швидший початок реперфузійної терапії для обмеження розмірів інфаркту, запобігання розширенню зони некрозу (extension) і ранньому ремоделюванню (ехpansion), лікування таких ускладнень, як СН, шок, загрозливих для життя аритмій.
- Подальші заходи з метою подолання ускладнень, що виникають пізніше.
- Оцінка ризику і заходи з метою профілактики прогресу ІХС, нового інфаркту, СН і смерті.
Ці фази здійснюють на етапах догоспітальної допомоги, у відділенні/блоці невідкладної кардіологічної допомоги, у спеціалізованому відділенні для постінфарктних хворих або у звичайному відділенні кардіологічного профілю (за відсутності спеціалізованих відділень).
Догоспітальна чи рання госпітальна допомога
Заходи при зупинці кровообігу і дихання
Базисну підтримку життя і розгорнуті заходи щодо підтримки життя необхідно здійснювати у розширеному обсязі в умовах спеціалізованої допомоги згідно з відповідними рекомендаціями.
Особи, які не мають належної підготовки чи обладнання, мають почати заходи щодо базисної підтримки життя відповідно до Європейських рекомендацій з серцево-легеневої реанімації та невідкладної допомоги при серцево-судинних захворюваннях і раптовій смерті 2001 р., доповнені в 2005 р. До загальних положень можна віднести такі:
- інтервал часу від першого контакту з пацієнтом особи (осіб), які проводять реанімаційні заходи, до початку цих заходів, має бути мінімальним (бажано близько 10 с). Ні збір даних про хворого, ні оформлення документації, ні нюанси транспортування не можуть призводити до збільшення цього інтервалу (чи до виникнення тривалих пауз у проведенні реанімаційних заходів);
- первинні реанімаційні заходи, що включають як мінімум непрямий масаж серця в ділянці нижньої третини грудини (100–120 поштовхів за хв), в ряді випадків здатні підтримати життєздатність пацієнта протягом часу, достатнього для початку розгорнутих реанімаційних заходів;
- в той час, як непрямий масаж серця хворого вже сам по собі допомагає підтримувати легеневу вентиляцію на мінімальному рівні за умови забезпечення прохідності дихальних шляхів, штучна вентиляція легень методами «рот у рот» або «рот у ніс» не є адекватною заміною фізіологічному акту дихання, оскільки в одержуваній хворим газовій суміші процентний вміст СО2 підвищений. Крім того, такий підхід до вентиляції легень поєднаний з ризиком інфекції. Раціональніше використовувати дихальні маски;
- при проведенні непрямого масажу серця та вентиляції легень їх співвідношення за частотою має становити 30:2. Ефективність заходів слід оцінювати за появою пульсації магістральних артерій;
- при порушенні серцевої діяльності, що супроводжується відсутністю пульсації на магістральних судинах, перш за все слід припустити наявність у хворого фібриляції шлуночків або гемодинамічно неефективної шлуночкової тахікардії до уточнення причини зупинки кровообігу за допомогою ЕКГ та інших інструментальних методів;
- електрична дефібриляція — єдиний ефективний метод відновлення серцевої діяльності в більшості випадків раптової зупинки кровообігу. Кожна хвилина після настання зупинки серця знижує імовірність успішного результату дефібриляції на 10%;
- на сьогодні рекомендують проводити дефібриляцію ударами прямого струму із двофазною формою хвилі зниженої амплітуди та енергією 200 Дж для перших двох ударів і 360 Дж — для наступних. Серед двофазних найбільш ефективним вважають імпульс з формою плато кожної з фаз, що экспонентно зменшується (рис. 1.14).
- електрод, що накладається на грудину, розташовують на верхній частині правої половини грудної клітки під ключицею. Електрод, що накладається на верхівку серця, розміщують дещо латеральніше точки нормальної проекції верхівкового поштовху, але не на молочну залозу у жінок. Полярність електродів вирішального значення не має;
- бригади швидкої допомоги (мінімум 3 особи), які направляють на випадки із втратою свідомості та/чи болем у грудях, мають бути оснащені дефібрилятором (бажано — автоматичним зовнішнім дефібрилятором), електрокардіографом і засобами подачі кисню, а медичний персонал — мати досвід роботи з цими приладами та навички проведення серцево-легеневої реанімації (СЛР);
- у багатьох випадках СЛР і дефібриляція самі по собі не дозволяють повернути або зберегти хворому життя, тому для збільшення шансів пацієнта на виживання необхідно проводити також спеціалізовану кардіологічну допомогу (що включає відновлення коронарного кровотоку у разі розвитку гострого ІМ);
- ЕКГ хворого із зупинкою кровообігу та дихання необхідно одержати в максимально короткий термін. Інтерпретацію ЕКГ має проводити кваліфікований персонал на місці чи за допомогою трансляції. Середній медичний персонал, при певному рівні підготовки, також може верифікувати життєвонебезпечні аритмії та асистолію;
- медикаментозну підтримку слід почати відразу після верифікації стану серцевої діяльності за даними ЕКГ (внутрішньовенне чи внутрішньо-серцеве введення епінефрину, атропіну при асистолії та дрібнохвильовій фібриляції, застосування аміодарону та лідокаїну при шлуночковій тахіаритмії);
- для забезпечення своєчасності й адекватності проведення загальних, а потім і спеціалізованих реанімаційних заходів необхідна координація дій бригад швидкої допомоги та співробітників кардіореанімаційних відділень (зокрема заздалегідь повідомити стаціонар про доставку пацієнта, що планується);
- тривалість реанімаційних заходів за відсутності ефекту має становити на догоспітальному етапі мінімум 30 хв, у стаціонарі — мінімум 15 хв з моменту констатації факту зупинки кровообігу.

Рис. 1.14. Форми імпульсу для електричної дефібриляції: а) монофазний; б) двофазний прямокутний; в) двофазний з формою плато, що експонентно зменшується
Симптоматичне лікування
Зменшення болю, задишки і збудження
Зменшення болю має першочергове значення, не лише з гуманної точки зору, але й тому, що біль пов’язаний з активацією симпатичної системи, що призводить до вазоконстрикції та збільшення постнавантаження на серце (хоча немає прямих доказів того, що симптоматичне усунення больового синдрому опіоїдами поліпшує віддалений прогноз порівняно з іншими антиангінальними засобами). У цьому контексті найчастіше застосовують внутрішньовенні опіоїди — морфін (наприклад в дозі 4–10 мг морфіну з додатковим введенням по 2 мг з інтервалами 5 хв до зникнення болю); слід уникати внутрішньом’язових і підшкірних ін’єкцій, з урахуванням більшого проміжку часу до максимального клінічного ефекту і його неконтрольованості. Може виникнути необхідність у повторному введенні препарату. Можливі побічні ефекти — нудота, блювання, гіпотензія з брадикардією, утруднення дихання, у чоловіків — затримка сечовиділення спазматичного генезу. У разі коли опіоїди не дозволяють усунути біль при повторному застосуванні, іноді ефективним засобом є внутрішньовенне введення блокаторів β-адренорецепторів і/або нітратів. Кисень (2–4 л/хв через маску або носовий катетер) слід призначати пацієнтам з ознаками СН або шоку. Неінвазивне моніторування насичення крові киснем (SpO2) істотно допомагає у прийнятті рішення про призначення кисню чи у тяжких випадках допоміжної вентиляції легень.
Як правило, реакцією на біль і обставини, внаслідок яких виникає серцевий напад, є збудження. Дуже важливо заспокоїти пацієнта. При сильному збудженні корисно призначити препарат групи транквілізаторів (бензодіазепінового ряду), але в більшості випадків достатній ефект може бути отриманий після терапії опіоїдами.
Усунення нудоти, блювання, гіпотонії та брадикардії
Ці симптоми часто виникають в початковій фазі гострого коронарного синдрому у зв’язку з підвищеною активністю блукаючого нерва і/чи побічних ефектів наркотичних анальгетиків, нітратів і блокаторів β-адренорецепторів. Для усунення нудоти і блювання можна застосовувати протиблювотні засоби, наприклад метоклопрамід (20 мг внутрішньовенно, в разі потреби з повторним введенням, до досягнення загальної дози 60 мг). Вираженість брадикардії, яку визначають у поєднанні з гіпотонією чи без неї, і яка зберігається після купірування болю і нудоти, можна зменшити за допомогою атропіну. При рефлекторній гіпотонії, викликаній зниженням чутливості судинної стінки до вазопресорів, також доцільне введення ГКС. Стійка гіпотонія, вірогідніше, є ознакою кардіогенного шоку як прояву тяжкого ураження міокарда.
Відновлення та підтримка адекватного коронарного кровотоку
У пацієнтів із клінічними ознаками ІМ і стійкою елевацією сегмента ST або вірогідно новою блокадою лівої ніжки пучка Гіса слід здійснити механічну чи фармакологічну реперфузію за відсутності очевидних протипоказань.
Фібринолітична терапія
На сьогодні у рандомізованих дослідженнях ефективності тромболітичних препаратів порівняно з плацебо чи одного фібринолітичного засобу порівняно з іншим взяли участь >150 тис. пацієнтів. Переконливо доведено сприятливий вплив фібринолітичної терапії на пацієнтів, у яких від виникнення симптомів ІМ пройшло не більше 12 год. Метааналіз цих досліджень свідчить, що у пацієнтів, госпіталізованих протягом 6 год від початку симптомів, з елевацією сегмента ST або блокадою ніжки пучка Гіса, введення тромболітичних засобів дозволяє запобігти приблизно 30 смертельних випадків на 1000 хворих, які отримували лікування, а введення в період 7–12 год від початку симптомів — 20 смертельних випадків на 1000 пацієнтів.
У 1988 р. доведено суттєвий додатковий ефект застосування ацетилсаліцилової кислоти в комбінації з фібринолітиками, що зумовило запобігання 50 смертельних випадків на 1000 хворих, які лікувалися. Сприятливий ефект терапії відзначали у всіх попередньо визначених підгрупах. Найбільший ефект виявлено у пацієнтів із найвищим ступенем ризику. У пацієнтів віком старше 75 років, лікування яких проводили протягом перших 24 год, вплив на виживання був незначним і статистично недостовірним. Проте, якщо ТЛТ здійснювали протягом перших 12 год від початку появи симптомів, летальність вірогідно знизилася на 26–29,4%. Найбільш ефективна фібринолітична терапія хворих, у яких збережені зубці R у поєднані з елевацією сегмента ST (ранні строки коронарообструкції). На рис. 1.15 наведено результати аналізу ефективності ТЛТ залежно від часу її проведення.
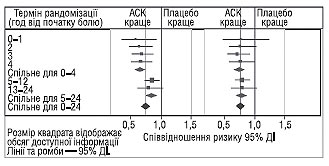
Рис. 1.15. Оцінка ефективності застосування стрептокінази (СК), ацетилсаліцилової кислоти (АСК) і фібринолітичної терапії в різний період від початку гострого ІМ (адаптоване за ISIS-2 collaborative grup, 1988)
Результат порівняння різних методів відновлення коронарного кровотоку — висновок про необхідність його відновлення якомога раніше будь-яким доступним методом та у найбільш ранній термін. Позитивний ефект ТЛТ буде максимальним, якщо вона здійснюється в максимально ранній період від початку симптомів. Зокрема, максимальне зниження летальності виявляли у разі, якщо лікування починалося протягом перших 2 год захворювання. Аналіз досліджень із включенням >6000 пацієнтів свідчить, що при догоспітальному тромболізісі рання смертність знижувалася на 15–20%; є дані про практично однакову ефективність догоспітального тромболізису та первинної ПКВ. При затримці введення тромболітичних засобів на кожну годину кількість смертельних випадків збільшувалося на 1,6 на 1000 пацієнтів, які лікуються. Дані великого рандомізованого дослідження свідчать, що при проведенні ТЛТ через 6–24 год від початку гострого ІМ, її ефективність в середньому відповідає такій для плацебо, хоча частота ангіографічно підтвердженого відкриття коронарної артерії, що зумовила інфаркт, при проведенні ТЛТ альтеплазою у період до 24 год від початку гострого ІМ залишається істотно вищою, ніж у пацієнтів, яким ТЛТ взагалі не проводили. Враховуючи результати великих досліджень, можна говорити, що клінічна ефективність ТЛТ (зокрема терапії альтеплазою) перевищує таку для плацебо лише у період до 12 год від початку гострого ІМ.
Ускладнення фібринолітичної терапії
ТЛТ асоціюють із деяким збільшенням кількості інсультів (приблизно на 3,9 на 1000 пацієнтів, які лікувалися), причому «надлишкові» інсульти переважно відзначали протягом 1-го дня від початку лікування. Ранні інсульти були найбільшою мірою зумовлені церебральною кровотечею; більш пізні інсульти частіше визначали як тромботичні чи емболічні. Частина «надлишкових» інсультів припадала на пацієнтів, які померли в подальшому; це необхідно враховувати при проведенні оцінки смертності (підвищення на 1,9 на 1000 хворих). Тяжкі нецеребральні кровотечі (що потребують переливання крові або є життєво небезпечними), можуть виникати у 4–13% хворих, які лікувалися. Джерело кровотечі переважно пов’язане з місцем процедури. Незалежні предиктори нецеребральної кровотечі — похилий вік, недостатня маса тіла, жіноча стать. Істотними предикторами виникнення внутрішньочерепних кровотеч вважають похилий вік, недостатню масу тіла, жіночу стать, перенесені раніше захворювання мозкових судин або АГ в анамнезі, систолічну і діастолічну гіпертензію на момент госпіталізації.
Застосування стрептокінази може асоціюватися з гіпотензією, але тяжкі алергічні реакції відзначають рідко. Користь від рутинного призначення гідрокортизону не доведена. При виникненні гіпотензії слід зменшити швидкість введення стрептокінази, а в разі потреби — тимчасово припинити інфузію, надати пацієнтові горизонтальне положення з піднятими нижніми кінцівками, збільшити об’єм подачі кисню. Іноді необхідно ввести атропін або поповнити об’єм внутрішньо-судинної рідини. Пресорні аміни не рекомендовані для лікування гіпотензії, що супроводжує введення стрептокінази, якщо АТ може бути нормалізований застосуванням вищезазначених засобів. У деяких випадках може знадобитися інфузія допаміну зі швидкістю 5–10 мкг/кг/хв.
Порівняння фібринолітичних засобів
На сьогодні існує велика кількість тромболітичних препаратів (стрептокіназа, урокіназа, аністреплаза, тканинний активатор плазміногена альтеплаза, мутантні форми tPA: TNK-тенектеплаза, rPA-ретеплаза, nPA-ланотеплаза). Адекватну реканалізацію коронарної артерії, що зумовила інфаркт, при проведенні ТЛТ (за даним коронарографії відповідає градації TIMI-3) реєструють у 34–50% випадків. Вона залежить від виду препарату, що використовувався [5]. Проте в дослідженнях ISIS-3 і GISSI-2 не виявили відмінностей у показниках смертності при застосуванні стрептокінази і тканинного активатора плазміногена чи аністреплази. Крім того, додаткове підшкірне введення гепарину не знижувало смертності порівняно з терапією без його застосування. У дослідженні GUSTO порівнювали прискорене введення t-PA (тканинного активатора плазміногена) протягом 90 хв зі звичайною схемою введення протягом 3 год. Прискорене введення t-PA і внутрішньовенне введення гепарину, контрольоване за показником АЧТЧ, дозволило зменшити кількість смертельних випадків на 10 серед 1000 пацієнтів, які лікувалися. У дослідженні GUSTO-I смертність за 30-денний період при застосуванні t-PA була вірогідно нижчою, ніж при застосуванні стрептокінази. Ризик розвитку інсульту за даними дослідження GUSTO-I був вищим при застосуванні t-PA порівняно зі стрептокіназою (0,7 і 0,5% відповідно; р=0,03).
Останні дослідження в галузі ТЛТ при гострому ІМ присвячені порівнянню прискореного режиму введення t-PA з одноболюсним (у разі TNK і rPA) або двоболюсним (для rPA) введенням мутантних форм тканинного активатора плазміногена. Так, болюсне введення зареєстрованого в Україні TNK-tPA з корекцією залежно від маси тіла еквівалентне прискореній інфузії t-PA за показником смертності через 30 днів. Цей захід асоціюють з істотним зниженням частоти виникнення немозкових кровотеч і зменшенням потреби в переливанні крові. Здійснення фібринолітичної терапії болюсом дозволяє швидко застосувати її в госпіталі чи на догоспітальному етапі і знизити ризик помилок, пов’язаних із введенням препарату. Вибір фібринолітичного засобу буде залежати від індивідуальної оцінки ризику та користі, а також від факторів доступності та вартості. Для пацієнтів, яким тромболізис здійснюють після 4 год з моменту розвитку симптомів, кращі результати можуть дати препарати з вищим ступенем фібриноспецифічності.
Клінічні наслідки ТЛТ
Для зменшення кількості ускладнень і летальності у хворих із гострим ІМ, за відсутності очевидних протипоказань, слід якнайшвидше застосовувати фібринолітичні засоби і ацетилсаліцилову кислоту, які створюють взаємодоповнюючий ефект. На даному етапі мета — почати фібриноліз протягом 90 хв з моменту звертання пацієнта за медичною допомогою («від звертання до введення голки») або протягом 30 хв після госпіталізації («від дверей до введення голки»). У пацієнтів з ІМ, що формується повільно або хвилеподібно (stuttering), слід здійснювати серійну реєстрацію ЕКГ або моніторування сегмента ST, клінічну оцінку і повторні аналізи сироваткових маркерів для діагностики ІМ.
Фібринолітичну терапію не слід призначати пацієнтам, у яких ІМ розвився >12 год тому за відсутності ознак збереження ішемії (за належними ЕКГ-критеріями для проведення фібринолізу). Пацієнти похилого віку за відсутності протипоказань також мають одержувати фібринолітичну терапію, якщо немає умов для своєчасного виконання механічної реперфузії. Слід зазначити, що пізніше проведення реперфузійної терапії в умовах значної некротизації з порушенням цілісності коронарного русла нижче місця обструкції може привести до геморагічної конверсії ІМ із значним поширенням його на неушкоджені ділянки серцевого м’яза. У цьому разі прогноз для пацієнта може бути навіть гіршим, ніж при відмові від проведення реперфузійної терапії.
Відомі дані про те, що фібринолітична терапія, зумовлюючи відкриття коронарної артерії, що спричинила інфаркт, і тим самим обмежуючи зону некрозу міокарда, запобігає розвитку ранньої постінфарктної дилатації порожнини ЛШ і дисфункції ЛШ, що є одним із основних факторів, які поліпшують прогноз при гострому ІМ.
Протипоказання до фібринолітичної терапії
Абсолютні та відносні протипоказання до фібринолітичної терапії наведені у табл. 1.6. Слід зазначити, що цукровий діабет і, зокрема, діабетична ретинопатія не є протипоказанням до фібринолітичної терапії. Травматичну реанімацію розглядають як відносне протипоказання для здійснення тромболізису.
Таблиця 1.6. Протипоказання до фібринолітичної терапії
| Абсолютні протипоказання |
|
| Відносні протипоказання |
|
Режими фібринолітичної терапії
Дозування сучасних фібринолітичних засобів та інформація щодо потреби в супутньому застосуванні антитромбінів наведені у табл.1.7.
Таблиця 1.7. Дозування сучасних фібринолітичних засобів*
| Тромболітичні препарати | Початкове лікування | Супутні антитромбіни |
| Стрептокіназа | 1,5 млн МО в 100 мл 5% глюкози чи ізотонічного розчину NaCl протягом 30–60 хв | Гепарин внутрішньовенно болюсно (60 МО/кг) з подальшою інфузією протягом 48 год під контролем АЧТВ у межах 50–70 мс), або еноксапарин 30 мг болюсно (у пацієнтів віком >75 років без болюса), далі підшкірно 1 мг/кг (у пацієнтів >75 років — 0,75 мг/кг) не більше 80 мг 2 рази (при підвищенні рівня креатиніну >2,5 мг/дл у чоловіків або 2 мг/дл у жінок, або якщо кліренс креатиніну <30 мл/хв — 1 раз) на добу протягом 3–8 діб, або фондапаринукс (якщо рівень креатиніну у сироватці крові <3 мг/дл) 2,5 мг болюсно, далі 2,5 мг підшкірно 1 раз на добу від 3 до 8 діб |
| Альтеплаза (t-PA) | 15 мг внутрішньовенно болюсно; 0,75 мг/кг протягом 30 хв, далі — 0,5 мг/кг протягом 60 хв; загальна доза не має перевищувати 100 мг | |
| Тенектеплаза | Внутрішньовенно болюсно в дозі 0,5 мг/кг протягом 10 с; загальна доза не має перевищувати 50 мг (10 000 ОД) |
*Наведено інформацію щодо препаратів, зареєстрованих в Україні. N.B. Ацетилсаліцилову кислоту слід призначати всім пацієнтам за відсутності протипоказань до застосування цього препарату.
Повторне призначення фібринолітичного засобу
Якщо є ознаки реоклюзії чи реінфаркту з поновленням елевації сегмента ST або блокадою ніжки пучка Гіса, необхідно знову призначати фібринолітичну терапію (за відсутності умов для здійснення механічної реперфузії). Повторно протягом >3 діб від першого введення не слід призначати стрептокіназу, оскільки антитіла до стрептокінази зберігаються протягом, принаймні, 10 років у концентраціях, які можуть вплинути на її активність. Альтеплаза (t-PA) і TNK-tPA не ведуть до формування антитіл. Проте слід пам’ятати, що повторне застосування фібринолітичних засобів може призвести до підвищення ризику геморагічних ускладнень.
Додаткова антикоагулянтна і антитромбоцитарна терапія
Незалежні й додаткові сприятливі ефекти ацетилсаліцилової кислоти описані вище. Точно не відомо, чи сприяє ацетилсаліцилова кислота фібринолізу, запобіганню реоклюзії або обмеженню мікросудинних ефектів активації тромбоцитів. У дослідженнях пізньої реоклюзії ацетилсаліцилова кислота була більш ефективним засобом у запобіганні подальших клінічних подій, ніж у підтримці прохідності коронарної артерії. Спочатку пацієнт має розжувати першу дозу 150–325 мг (не застосовувати ацетилсаліцилову кислоту в захисній оболонці!), потім щодня приймати засіб у більш низькій дозі (125–175 мг) перорально. Якщо пероральний прийом неможливий, ацетилсаліцилову кислоту можна ввести внутрішньовенно (250 мг). При її непереносимості показане призначення клопідогрелу. У разі комбінації клопідогрелу з ацетилсаліциловою кислотою доза останньої може становити 75–100 мг.
Агрегація та адгезія тромбоцитів пригнічувалась ацетилсаліциловою кислотою лише частково, прогрес був досягнутий завдяки розробці інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa, які блокують кінцевий етап агрегації тромбоцитів та їх адгезію до ділянок ураженого ендотелію. Ангіографічні дослідження довели здатність цих препаратів разом із половинною дозою фібринолітиків і зниженою дозою гепарину поліпшувати коронарний кровотік подібно до повної дози фібринолітиків, але з більш повною тканинною реперфузією. Застосування цих препаратів у двох великих дослідженнях не знижувало летальність протягом 30 днів і кількість внутрішньочерепних кровотеч, хоча зменшувало кількість рецидивів інфарктів. Також на фоні їх застосування відзначено збільшення кількості немозкових кровотеч (переважно спонтанних), особливо у пацієнтів похилого віку. Тому не рекомендують рутинне застосування фібринолітичного засобу у зниженій дозі разом з абсиксимабом або іншими парентеральними інгібіторами глікопротеїнових рецепторів тромбоцитів IIb/IIIa. Необхідна подальша оцінка можливих сприятливих ефектів цієї комбінованої терапії у пацієнтів окремих підгруп, наприклад у хворих з найвищим ступенем ризику або планованим виконанням ПКВ.
В останні роки підтвердили висловлену раніше теорію про те, що фібринолітичні агенти (перш за все стрептокіназа) виявляють власну прокоагулянтну активність внаслідок активації вивільнення тромбіну, глобального ураження ендотелію з розвитком його дисфункції. Відзначено, що системна ТЛТ стрептокіназою підвищує активність тромбіну в 3 рази і призводить до протромбіногенних зрушень в калікреїн-кініновій системі. Це зумовило необхідність розробки ад’ювантної терапії, що могла б компенсувати постфібринолітичний сплеск тромбінової активності.
Ефективність застосування гепарину вивчали у багатьох дослідженнях під час або після фібринолізу, особливо разом із застосуванням тканинного активатора плазміногена. Гепарин не покращує результати лізису згустку фібринолітиком, болюс-не введення навіть у високих дозах (до 300 МО/кг маси тіла), за даними ангіографії, не призводить до підвищення частоти спонтанного відкриття коронарної артерії. Проте прохідність коронарної артерії через години і дні після ТЛТ тканинним активатором плазміногена краща при одночасному застосуванні гепарину. Тривале внутрішньовенне застосування гепарину не дозволяло запобігти реоклюзії після досягнення успішного коронарного фібринолізу, підтвердженого ангіографічним методом. Аналізуючи наведені факти, можна зробити висновок, що, не виявляючи власної тромборуйнівної активності, гепарин (принаймні при контрольованому внутрішньовенному інфузійному введенні) має профілактичні властивості щодо коронарного ретромбозу, особливо в період прокоагулянтного порушення в системі згортання, викликаного системним фібринолізом. Під час внутрішньовенної терапії гепарином необхідне ретельне моніторування показника АЧТЧ (який не має перевищувати 70 с, тому що надвисокі його значення асоціюються з більшою імовірністю смерті, кровотечі та реінфаркту). Слід зазначити, що в більшості досліджень щодо застосування внутрішньовенно гепарину у хворих у гострий період ІМ середні показники АЧТЧ не досягали цільових значень протягом перших 48 год захворювання, з чим може бути пов’язаний ряд негативних результатів, отриманих у вищенаведених дослідженнях. Незважаючи на відсутність прямих доказів розвитку клінічно значимого синдрому рикошету при різкій відміні гепарину у хворих з гострим ІМ, теоретичні передумови для використання схеми лікування з поступовим зниженням дози препарату (і можливим переходом на підшкірне введення) все-таки досить переконливі. Таким чином, інфузію гепарину після терапії фібринолітиком можна припинити через 48 год і перейти на підшкірне введення низькомолекулярного чи звичайного гепарину. Продовження терапії гепарином внутрішньовенно може бути поєднане з розвитком специфічного ускладнення — «гепарин-індукованої» тромбоцитопенії та збільшенням кількості геморагій, що слід враховувати. Приводом для прийняття цієї тактики може бути ішемія, що тривалий час зберігається (особливо за відсутності можливості здійснити механічну чи повторну фармакологічну реперфузію).
Низькомолекулярний гепарин — підфракція стандартного гепарину з молекулярною масою близько 4500 Да (молекулярна маса нефракціонованого гепарину 12 000–15 000 Да). Має ряд теоретичних переваг порівняно зі стандартним гепарином. Серед них — краще запобігання нового утворення тромбіну внаслідок більшого ступеня пригнічення фактора Ха, кращий передбачуваний фармакокінетичний профіль, менше зв’язування з протеїнами, менша активація тромбоцитів, нижча частота виникнення тромбоцитопенії, відсутність необхідності контролю АЧТЧ. Низькомолекулярні гепарини вивчені у великих дослідженнях у пацієнтів з гострим коронарним синдромом без елевації сегмента ST, але лише недавно їх застосування почали досліджувати в комбінації з фібринолітичними засобами при гострому ІМ. Виконані раніше клінічні дослідження дозволяють припустити, що низькомолекулярний гепарин порівняно з нефракціонованим гепарином може знизити ризик зворотної ішемії та формування тромбів у шлуночках, хоча і за рахунок більшої частоти кровотеч. У 3 нещодавно проведених ангіографічних дослідженнях застосування еноксапарину натрію чи дальтепарину натрію асоціювалося з тенденцією до зниження ризику реоклюзії та/чи більш тривалим збереженням прохідності судини, що зумовила інфаркт. В ASSENT-3, першому великому дослідженні щодо застосування низькомолекулярного гепарину на фоні TNK-tPA, еноксапарин натрію (30 мг внутрішньовенно болюсно і 1 мг/кг підшкірно кожні 12 год) протягом 7 днів знижував ризик внутрішньогоспітального реінфаркту чи внутрішньогоспітальної рефрактерної ішемії порівняно з гепарином. При цьому в дослідженні не відзначали підвищення частоти внутрішньочерепних кровотеч (за винятком незначного збільшення кількості немозкових кровотеч порівняно з гепарином). Тенденція до зниження летальності через 30 днів свідчила на користь еноксапарину натрію, хоча протягом 1 року спостереження не виявлено різниці у смертності між групами пацієнтів, які отримують нефракціонований і низькомолекулярний гепарини. У дослідженні ASSENT-3 PLUS (2002) догоспітальне призначення еноксапарину натрію супроводжувалося істотним підвищенням ризику виникнення внутрішньочерепних кровотеч порівняно із застосуванням гепарину у пацієнтів віком старше 75 років. Результати дослідження ExTRACT TIMI-25 свідчать, що еноксапарин натрію, який призначали як ад’ювантну терапію у хворих із гострим ІМ та елевацією сегмента ST, які одержували реперфузійну терапію, вже через 48 год приводив до зниження частоти розвитку рецидиву ІМ на 36% і випадків проведення ургентної реваскуляризації — на 22% порівняно з інфузій-ною терапією нефракціонованим гепарином. Через 1 міс від початку лікування ці співвідношення зберігалися, тоді як зниження 30-денної смертності у групі еноксапарину натрію мало лише характер тенденції. Крім того, терапія еноксапарином натрієм асоціювалася з істотним (на 50%) підвищенням частоти великих кровотеч до 30-ї доби лікування, що, безумовно, слід враховувати при виборі антикоагулянта і схеми лікування осіб із гострим ІМ і високим ризиком кровотеч. У цьому дослідженні застосовували апробовану раніше у хворих із гострим ІМ схему введення: 30 мг еноксапарину натрію внутрішньовенно болюсно на початку тромболітичної терапії, потім — підшкірні ін’єкції із розрахунку 1 мг/кг маси тіла (але не більше 100 мг) кожні 12 год протягом 5 днів. Істотне доповнення до схеми терапії стосувалося зниження дози препарату на 25% і виключення внутрішньовенного болюса у пацієнтів віком старше 75 років, що дозволило уникнути підвищення частоти внутрішньочерепних крововиливів під час терапії еноксапарином натрієм. З урахуванням переконливих доказів користі від застосування наведеної схеми лікування еноксапарином натрієм її можна рекомендувати для застосування при лікуванні гострого ІМ. Проте доцільно модифікувати цю схему у пацієнтів із високим ризиком кровотеч (перш за все у хворих із загостренням гастриту та пептичною виразкою шлунка в анамнезі) із зниженням дози препарату на 25% і виключенням внутрішньовенного болюса. З метою додаткового зниження ризику геморагії у цих пацієнтів виправдане включення до супутньої терапії блокаторів протонного насосу (омепразол, ланзопразол тощо).
У раніше проведених дослідженнях в доповнення до фібринолітиків застосовували прямі інгібітори тромбіну — бівалірудин, лепірудин, аргатробан, ефегатран. Ці препарати покращували прохідність коронарних артерій і знижували частоту кровотеч порівняно з гепарином. Незважаючи на це, у двох великомасштабних дослідженнях при застосуванні гірудину на фоні фібринолітичної терапії не виявлено чітких клінічних переваг порівняно з гепарином. У дослідженні HERO-2 бівалірудин в комбінації зі стрептокіназою не знижував смертність протягом 30 днів порівняно із застосуванням гепарину внутрішньовенно. При внутрішньовенному введенні бівалірудину протягом 48 год випадки реінфаркту відзначені рідше, але при цьому недостовірно збільшилася кількість нецеребральних кровотеч. Рекомендовані дози гепарину наведено у табл. 1.8.
Таблиця 1.8
| А) Супутня терапія антикоагулянтами
Нефракціонований гепарин: внутрішньовенно болюсно: 60 МО/кг, максимум 4000 МО внутрішньовенна інфузія: 12 МО/кг протягом 24–48 год, максимум — 1000 МО/год, цільовий АЧТЧ — 50–70 мс1 моніторування АЧТЧ: 3; 6; 12; 24 год від початку терапії Еноксапарин (якщо рівень креатиніну у сироватці крові <2,5 мг/дл у чоловіків або <2 мг/дл у жінок або кліренс креатиніну >30 мл/хв)2: для пацієнтів віком <75 років: внутрішньовенно болюсно 30 мг і через 15 хв — підшкірна ін’єкція 1 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб); для пацієнтів віком >75 років: підшкірна ін’єкція 0,75 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб). Фондапаринукс (якщо рівень креатиніну у сироватці крові <3 мг/дл): внутрішньовенно болюсно: 2,5 мг підшкірні ін’єкції: 2,5 мг 1 раз на добу протягом госпітального періоду, але не більше 8 діб Б) Супутня терапія антикоагулянтами у разі необхідності проведення хворому коронарних втручань Нефракціонований гепарин: внутрішньовенне (болюсне) введення в дозі, необхідній для проведення процедури (у разі одночасного застосування блокаторів ІІВ/ІІІА рецепторів дозу гепарину необхідно знизити) Еноксапарин (якщо після останнього введення пройшло >8 год): внутрішньовенно болюсно 30 мг незалежно від віку та рівня креатиніну В) Терапія антикоагулянтами у пацієнтів, які не одержували реперфузійної терапії Еноксапарин (якщо креатиніну у сироватці крові <2,5 мг/дл у чоловіків або <2 мг/дл у жінок або кліренс креатиніну >30 мл/хв)2: для пацієнтів віком <75 років: внутрішньовенно болюсно 30 мг і через 15 хв — підшкірна ін’єкція 1 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб); для пацієнтів віком >75 років: підшкірна ін’єкція 0,75 мг/кг (повторювати кожні 12 год протягом госпітального періоду, але не більше 8 діб). Фондапаринукс (якщо рівень сироваткового креатиніну <3 мг/дл): внутрішньовенно болюсно: 2,5 мг підшкірні ін’єкції: 2,5 мг 1 раз на добу протягом госпітального періоду, але не більше 8 діб |
1За необхідності можливий перехід на підшкірні ін’єкції низькомолекулярного гепарину чи фондапаринуксу;
2якщо кліренс креатиніну (за формулою Cockroft — Gault) протягом періоду лікування становить <30 мл/хв, єдине дозування еноксапарину становить 1 мг/кг підшкірно 1 раз на добу.
Щодо проблеми антикоагулянтної терапії при гострому коронарному синдромі слід зазначити, що в останні роки з’явилася нова група препаратів, з якою пов’язані надії щодо оптимізації лікування цих хворих. Це селективні інгібітори Ха-фактора, за хімічною структурою — пентасахаридна послідовність, що становить активну щодо зазначеного фактора Ха частину молекули гепарину. Проведене велике рандомізоване дослідження MICHELANGELO: OASIS 5, у якому брали участь понад 20 тис. пацієнтів із гострим коронарним синдромом без елевації сегмента ST. У цьому дослідженні пентасахарид фондапаринукс натрію в дозі 2,5 мг 1 раз на добу був так само ефективний, як і еноксапарин натрію у запобіганні летального кінця, нефатального ІМ і рефрактерної ішемії протягом 9 діб після включення в дослідження. Проте застосування пентасахариду на 17% знизило 30-денну летальність, на 11% — 6-місячну летальність і на 47% — частоту великих геморагічних ускладнень. Більше того, при застосуванні пентасахариду значно знизилася частота виникнення гепариніндукованої тромбоцитопенії. Отримані перші результати дослідження MICHELANGELO: OASIS 6, у якому брали участь >12 тис. хворих із гострим ІМ та елевацією сегмента ST. Це дослідження показало, що пентасахарид, який призначали в дозі 2,5 мг 1 раз на добу до 9-ї доби при гострому ІМ, дозволив знизити частоту розвитку смерті й реінфаркту до 30-ї доби на 18% у хворих, яким не проводили ургентної ангіопластики, а частота геморагічних ускладнень при його застосуванні була навіть дещо нижчою, ніж у хворих контрольної групи, які одержували нефракціонований гепарин. За даними пілотних досліджень, у пацієнтів із гострим ІМ та елевацією сегмента ST на фоні введення альтеплази застосування пентасахарида порівняно із внутрішньовенним введенням нефракціонованого гепарину зумовило зниження частоти реоклюзій і реваскуляризацій протягом 1-го тижня захворювання.
Перкутанні коронарні втручання
Серед перкутанних коронарних втручань, які здійснюють в перші години ІМ, розрізняють первинну ПКВ, ПКВ у поєднанні з фармакологічною реперфузійною терапією і «ПКВ порятунку» (rescue PCI) після невдалої спроби фармакологічної реперфузії. Останнім часом велику увагу приділяють порівнянню клінічної ефективності різних стратегій, які комбінують фармакологічні та хірургічні підходи.
Первинна ПКВ
Під цим терміном розуміють ангіопластику і/або стентування без попередньої чи супутньої фібринолітичної терапії. Первинній ПКВ віддають перевагу, якщо її можна виконати протягом 90 хв з моменту контакту хворого з медичним персоналом. Найбільші переваги первинна ПКВ має порівняно з ТЛТ у хворих похилого віку (>65 років) і у молодих пацієнтів, які перебувають у стані кардіогенного шоку до моменту початку лікування. Здійснення первинної ПКВ можливе за наявності досвідченої бригади, в яку входять не лише інтервенційні кардіологи, але й допоміжний персонал, що має відповідний досвід.
Якщо пацієнта госпіталізують у медичний заклад, де відсутні умови для виконання катетеризації, необхідно провести ретельну індивідуальну оцінку потенційних переваг механічної репер-фузії порівняно з ризиком, а також потенційними витратами часу на транспортування хворого в найближчу лабораторію катетеризації серця. Нещодавно в дослідженні DANAMI-2 стратегію рутинного перевезення хворих у спеціалізований госпіталь для виконання первинної ПКВ порівнювали зі стратегією внутрішньогоспітального тромболізису. Перевезення хворих із територіальних госпіталів у центри інвазивної кардіології дозволяли здійснювати протягом 3 год. В середньому період транспортування каретою швидкої допомоги становив <32 хв, а час від прибуття в територіальний госпіталь до початку ПКВ («від дверей до ПКВ») — <2 год. Через 30 днів відзначали достовірне зменшення загальної кількості летальних випадків, реінфаркту та інсульту у пацієнтів, яких перевозили для здійснення первинної ПКВ (8,5% порівняно з 14,2%; р<0,002), тоді як зниження смертності було недостовірним (6,5% проти 8,6%; р=0,20). Результати цього дослідження підтверджені дослідженнями PRAGUE і PRAGUE-2, а також іншими великими дослідженнями. У реальній практиці, відповідно до італійського реєстру BLITZ, середній час доставки в госпіталь становив 129 хв, час «від дверей до голки» — 45 хв, а «від дверей до ПКВ» — 85 хв. Суттєвим доповненням до стратегії первинної ПКВ були дані, отримані в цих дослідженнях щодо рівної ефективності первинної ПКВ і ТЛТ, якщо лікування починалося раніше, ніж через 3 год від початку розвитку симптомів гострого ІМ. Первинна ПКВ ефективна для забезпечення та підтримки прохідності коронарної артерії і при цьому позбавлена ризику кровотеч, характерних для фібринолітичної терапії. Рандомізовані клінічні дослідження з метою порівняння своєчасної первинної ПКВ та фібринолітичної терапії у кваліфікованих центрах з великим обсягом процедур свідчать про ефективніше відновлення прохідності, нижчу частоту виникнення реоклюзії, поліпшення залишкової функції ЛШ і більш сприятливих клінічних результатах після первинної ПКВ. Рутинна установка коронарного стента у пацієнта з гострим ІМ знижує потребу в реваскуляризації цільової судини, але асоціюється лише з тенденцією до зниження смертності чи реінфаркту порівняно з первинною ангіопластикою. У пацієнтів із протипоказаннями до фібринолітичної терапії рівень захворюваності та смертності вищий, ніж у хворих без протипоказань. Первинну ПКВ можуть успішно виконувати у більшості цих пацієнтів.
У сучасних оптимізованих алгоритмах фібринолізису застосовують антикоагулянти та антитромбоцитарні препарати (блокатори глікопротеїнових рецепторів IIb/IIIa). Так, за даними досить великої кількості досліджень (INTRO AMI, AMI-SK, ASSENT-3, TIMI 14, ENTIRE-TIMI, HERO-2, GUSTO V) частота реканалізації артерії, що спричинила інфаркт, з адекватним тканинним кровотоком TIMI-3 досягає 70%.
ПКВ у поєднанні з фібринолізом
Виконання ПКВ негайно після фібринолітичної терапії стрептокіназою з метою сприяння реперфузії чи зниження ризику реоклюзії в дослідженні PRAGUE не виправдало надій. Проте ефективність і безпека ПКВ після введення тромболітиків підвищилися внаслідок накопичення досвіду виконання процедур, появи стентів і більш могутніх антитромбоцитарних засобів (антагоністів глікопротеїнових рецепторів тромбоцитів IIb/IIIa і тієнопіридинів), а також догоспітального болюсного тромболізису половинною дозою з подальшим проведенням ангіографії в найближчий час і ПКВ у разі збереження оклюзії артерії, що спричинила інфаркт.
«ПКВ порятунку»
«ПКВ порятунку» (rescue PCI) визначають як виконання ПКВ на коронарній артерії, яка після фібринолітичної терапії залишається закритою. При цьому враховують, що попередня ТЛТ могла бути проведена як на догоспітальному етапі, так і у відділенні невідкладної кардіологічної допомоги, яке не має катетеризаційної лабораторії для проведення коронаровентрикулографії. Обмежений досвід показує тенденцію до сприятливих наслідків реканалізації артерії, що спричинила інфаркт, методом ангіопластики у разі неефективності тромболізису (табл. 1.9).
Таблиця 1.9. Огляд рандомізованих досліджень щодо застосування ПКВ і тромболізису при гострому ІМ
| Дослідження | Порівнювані групи | n | Тромболітик | Передній ГІМ, % | Шок, % | Час до ТЛТ, год | Час до ПКВ, год | Смерть/смерть або СН, % |
| Belenkie et al. (1992) | ТЛТ — >ЧTKA?*
ТЛТ |
16
12 |
CK або tPA | 53,6 | 0 | 4,3±1,0 | 6,3
33,3 |
|
| Rescue I (1994) | ТЛТ — >ЧTKA?
ТЛТ |
78
73 |
CK або tPA | 100 | 0 | 4,5±1,9 | 5,1/6
9,6/17 |
|
| TAMI 1** (1994) | Первинна ЧTKA
ТЛТ |
49
59 |
CK або tPA | 41
42 |
0 | 2,9
4,5 |
2,8 | 6,1
1,7 |
| PRAGUE (1999) | ТЛТ — >ЧTKA?
ТЛТ Первинна ЧTKA |
100
99 101 |
CK | 12
18 13 |
||||
| Vermeer et al (1999) | Первинна ЧTKA
ТЛТ — >ЧTKA? ТЛТ |
75
74 75 |
tPA | 48
59 45 |
0 | 2,5
2,25 |
3,6
4,0 |
5
6 5 |
| MERLIN (2004) | ТЛТ — >ЧTKA?
ТЛТ |
153
154 |
CK 96%
(або tPA) |
48,4
40,3 |
0 | 3,0
2,8 |
5,5 | 9,8/34
11/40,9 |
*«ПКВ порятунку»; **хворі з коронарним кровотоком TIMI 2; СК — стрептокіназа.
Результати дослідження PACT свідчать про безпеку і вищу (порівняно зі стандартною ТЛТ) ефективність догоспітального болюсного тромболізису половинною дозою з подальшим перевезенням хворого в територіальний госпіталь для виконання ангіографії і при потребі — «ПКВ порятунку». Слід зазначити, що другу половину дози фібринолітика в цьому дослідженні хворі одержували лише після проведення ангіографії, якщо артерія, що спричинила інфаркт, виявлялася повністю (або >75%) відкритою.
Основна проблема у впровадженні алгоритму первинної (догоспітальної) ТЛТ з подальшою «ПКВ порятунку» — складність неінвазивного визначення ступеня ефективності тромболізису в найближчі години від початку ТЛТ. Оскільки проведення коронароангіографії для визначення необхідності «ПКВ порятунку» само по собі є складною процедурою з певним ступенем ризику і потребує доставки хворого в катетеризаційну лабораторію, доцільне виділення групи хворих у гострій фазі ІМ, які пройшли ТЛТ, яким ангіографія показана перш за все. Період для оцінки ефективності ТЛТ має становити 3 год, критерієм ефективності слід вважати зниження елевації сегмента ST (у відведеннях з найбільш вираженою елевацією) >50% при передній локалізації гострого ІМ та >70% — у разі задньої локалізації.
За даними дослідження ASSENT-3 коронарне втручання у пацієнтів, які одержали повну дозу фібринолітичного засобу в поєднанні з антагоністом рецепторів глікопротеїну IIb/IIIa, може супроводжуватися підвищеним ризиком ускладнень, спричинених кровотечами.
Хірургічне шунтування коронарних артерій
Кількість пацієнтів, які потребують хірургічного шунтування коронарних артерій в гострій фазі ІМ, обмежена. Втім, це втручання може бути показане після невдалої ПКВ, коли під час катетеризації раптово виникла оклюзія коронарної артерії або у разі, коли виконання ПКВ за результатами ангіографії не може вважатися ефективним рішенням проблеми. Крім того, шунтування коронарних артерій здійснюють у окремих пацієнтів з кардіогенним шоком або у поєднанні з хірургічним лікуванням дефекту міжшлуночкової перегородки чи мітральної регургітації, зумовленої дисфункцією або розривом папілярного м’яза. Показанням для хірургічного шунтування коронарних артерій була і є наявність багатосудинного ураження коронарного дерева в підгострий період захворювання. Зокрема, шведські дослідники довели позитивний вплив на 1-річну смертність реваскуляризації, яку виконували через 2 тиж після початку гострого ІМ. Узагальнення рекомендацій з реперфузійної терапії наведені у табл. 1.10.
Таблиця 1.10. Реперфузійна терапія: резюме
| Рекомендації |
| Реперфузійна терапія показана всім пацієнтам з болем/дискомфортом у грудній клітці в перші 12 год, що асоціюються з елевацією сегмента ST або (вірогідно) новою блокадою ніжки пучка Гіса на ЕКГ |
| Первинна ПКВ |
| Метод вибору при виконанні досвідченою бригадою протягом <90 хв після першого контакту з медичним персоналом |
| Показана пацієнтам у стані шоку та/чи з протипоказаннями до фібринолітичної терапії |
Антагоністи рецепторів GP IIb/IIIa і первинна ПКВ:
|
| а) клопідогрел в дозі 75 мг/добу показано у комбінації з низькою (до 100 мг/добу) дозою ацетилсаліцилової кислоти всім хворим із гострими коронарними синдромами як засіб, що попереджає реоклюзію після реперфузійної терапії (за відсутності протипоказань); б) оптимальна навантажувальна доза клопідогрелу становить 300 мг, проте за наявності ризику ускладнень (вік >75 років, тромболітична терапія у хворих навіть із помірним ризиком геморагічних ускладнень, зокрема у пацієнтів, які одержували внутрішньовенно болюсно антикоагулянт) клопідогрел бажано призначати без навантажувальної дози; в) тривалість лікування клопідогрелом після перенесеного ІМ у пацієнтів, які одержували реперфузійну терапію, має становити від 1 міс до 1 року (залежно від переносимості препарату) |
|
«ПКВ порятунку» Після невдалого тромболізису у пацієнтів із поширеним інфарктом, якщо: |
| Фібринолітична терапія |
| За відсутності протипоказань (див. табл. 1.5) і якщо первинну ПКВ не можна виконати в найкоротший термін (протягом 90 хв з моменту контакту хворого з медичним персоналом), фармакологічну реперфузію слід розпочати якомога раніше Вибір фібринолітичних засобів залежить від індивідуалізованої оцінки користі та ризику, доступності та вартості |
| У пацієнтів, госпіталізованих протягом <6 год з моменту появи симптомів, перевагу віддають більш фібрино-специфічним засобам, таким як тенектеплаза чи альтеплаза |
| Початок фібринолітичної терапії на догоспітальному етапі за наявності відповідного обладнання та співпраці персоналу швидкої допомоги з певним стаціонаром, при чому перевагу віддають болюсному внутрішньовенному введенню фібриноспецифічних засобів |
| Повторне призначення неімуногенного літичного засобу за наявності ознак реоклюзії та неможливості механічної реперфузії |
| Якщо хворий раніше не приймав ацетилсаліцилову кислоту, розжувати її в дозі 150–325 мг (таблетки без оболонки!) |
| Разом з альтеплазою (та іншими тромболітиками) — визначення дози гепарину залежно від маси тіла з частим проведенням її корекції відповідно до АЧТВ |
Профілактика, діагностика та лікування ускладнень гострого періоду ІМ
Порушення гемодинаміки
У цій групі об’єднані найтиповіші порушення гемодинаміки, які можуть виникати при ІМ (табл. 1.11). Крім того, СН може бути наслідком аритмічних або механічних ускладнень.
Таблиця 1.11. Клінічний спектр станів гемодинаміки при ІМ та їх лікування
| Стан гемодинаміки | Показники гемодинаміки, клінічні особливості, лікування |
| Нормальний | Нормальні показники АТ, ЧСС і дихання, адекватний периферичний кровообіг |
| Гіпердинамічний | Тахікардія, звучні тони серця, адекватний периферичний кровообіг. Показані блокатори β-адренорецепторів |
| Брадикардія — гіпотензія | «Тепла» гіпотензія, брадикардія, венодилатація, нормальний тиск в яремних венах, знижена перфузія тканин. Зазвичай — при нижній локалізації ІМ, іноді провокується опіатами. Коригується застосуванням атропіну і/чи кардіостимуляції |
| Гіповолемія | Веноконстрикція, знижений тиск в яремних венах, знижена перфузія тканин. Коригується інфузією рідини |
| Інфаркт правого шлуночка | Високий тиск в яремних венах, знижена перфузія тканин або шок, брадикардія, гіпотензія (див. текст) |
| Насосна недостатність | Тахікардія, тахіпное, знижений пульсовий тиск, знижена перфузія тканин, гіпоксемія, набряк легень (див. текст) |
| Кардіогенний шок | Значно знижена перфузія тканин, олігурія, тяжка гіпотензія, знижений пульсовий тиск, тахікардія, набряк легень, похолодіння кінцівок, гіпергідроз, порушення свідомості різного ступеня тяжкості (див. текст) |
Найчастіший варіант порушень гемодинаміки під час гострої фази ІМ — лівошлуночкова недостатність, асоційована з поганим коротко- і довгостроковим прогнозом виживаності. Її клінічні симптоми — задишка, синусова тахікардія, третій тон серця і вологі хрипи в легенях, спочатку в базальних відділах, пізніше — у всіх легеневих полях. В ряді випадків лівошлуночкова недостатність супроводжується гострою недостатністю мітрального клапана (внаслідок дисфункції або відриву папілярного м’яза, розтягнення мітрального кільця). В цій ситуації зниження постнавантаження на ЛШ (частина крові іде назад у ліве передсердя проти низького градієнта тиску) може приводити до тимчасового зменшення проявів гострої ішемії (біль, зміни на ЕКГ) і «поліпшення» показників сегментарної скоротності за даними двомірної ехоКГ на фоні зниження системного АТ, але явища застою в легенях, навпаки, прогресують і при відповідному ступені мітральної недостатності може розвинутися кардіогенний шок. Проте навіть виражений застій у легенях може не супроводжуватися аускультативними ознаками. Якщо до лівошлуночкової недостатності приєднується гостра правошлуночкова, розвивається так званий синдром малого викиду (low output). До його клінічних проявів належить зменшення або зникнення застійних явищ у легенях при вираженому зниженні системного тиску, що не коригуються інотропами. Через розвантаження ЛШ також можуть відзначати тимчасове поліпшення його скоротності, але зниження проявів його ішемії та перевантаження носить тимчасовий характер. Некоригований синдром малого викиду часто трансформується у справжній кардіогенний шок. Повторну аускультацію серця і легень необхідно здійснювати у всіх пацієнтів у ранній період ІМ разом із оцінкою інших життєво важливих ознак.
До загальних заходів відносять моніторування порушень ритму, оцінку електролітних порушень, своєчасну діагностику супутніх станів, зокрема дисфункцію клапанів або захворювання легень. Ступінь вираженості застійних явищ у легенях можна оцінити за допомогою рентгенографії. ЕхоКГ необхідна для оцінки вираженості ураження міокарда, механічної функції шлуночків і виявлення ускладнень, зокрема мітральної регургітації та дефекту міжшлуночкової перегородки, які можуть викликати порушення насосної функції серця. У осіб із тяжкою СН, шоком і синдромом малого викиду перкутанна чи хірургічна реваскуляризація можуть підвищити виживаність.
Ступінь лівошлуночкової недостатності класифікують за Кілліп (Killip): клас 1 — відсутність вологих хрипів або третього тону серця; клас 2 — ділянка, на якій вислуховуються хрипи, займає <50% аускультативної поверхні легень або наявність третього тону серця; клас 3 — ділянка хрипів займає >50% аускультативної поверхні легень; клас 4 — кардіогений шок.
Незначна і помірна СН
Необхідно з самого початку призначати кисень, але бути обережним за наявності хронічного захворювання легень. Рекомендують моніторування насичення крові киснем. Найбільш зручна і доступна методика оцінки ефективності зовнішнього дихання — пульсоксиметрія, що є опцією більшості сучасних кардіореанімаційних моніторних систем. Незначна СН коригується нітратами, діуретиками (фуросемід 20–40 мг або торасемід в дозі 5–10 мг повільно внутрішньовенно, за необхідності з повторним введенням через 1–4 год; нітрогліцерин внутрішньовенно або нітрати перорально). Дозу нітрогліцерину слід титрувати під контролем АТ для уникнення гіпотензії. Інгібітори АПФ необхідно призначити протягом 24 год за відсутності гіпотензії, гіповолемії чи тяжкої ниркової недостатності. Останнім часом все більшу роль у терапії лівошлуночкової недостатності при гострому ІМ відводять антагоністам альдостерону. Найбільш відомий і поширений препарат цієї групи — спіронолактон. Результати рандомізованого дослідження за участю 1663 хворих із СН III–IV класу за NYHA (ФВ 05%) при тривалому застосуванні спіронолактону в дозі 25 мг/добу свідчать про зниження смертності внаслідок будь-якої причини протягом 2 років на 24% порівняно з плацебо (p<0,001). До недоліків спіронолактону слід віднести велику кількість побічних ефектів, серед яких основне місце займає гінекомастія. Інший препарат з цієї групи — еплеренон — позбавлений цієї побічної дії. У дослідженні EPHESUS у хворих із гострим ІМ, ускладненим СН, призначали тривалу терапію еплереноном порівняно з плацебо. Частота настання смерті внаслідок будь-якої причини у групі лікування еплереноном становила 14,4%, тоді як у групі плацебо — 16,7% (p=0,008); комбінований показник кардіоваскулярної смертності та регоспіталізацій з приводу серцево-судинних захворювань становив 26,7% проти 30% у групі плацебо (p=0,002). Найвищий ефект отримано у групі хворих зі зниженою ФВ ЛШ.
Виражена СН
Дослідження газового складу артеріальної крові (за Аструпом)
Це дослідження дозволяє оцінити ступінь оксигенації (рО2), дихальну функцію (pCO2), кислотно-лужний стан (pH) і його порушення. Таким чином, проведення цього дослідження показане всім пацієнтам із тяжкою СН. Неінвазивні методи дослідження: пульсоксиметрія та визначення СО2 у повітрі, що видихається, можуть замінити дослідження за Аструпом (рівень доказовості
C), але лише не при станах, що супроводжуються малим викидом або вазоконстрикторним шоком. Визначення венозної сатурації О2 (наприклад із центральних вен) проводять для загального визначення адекватності оксигенації організму.
Пульсоксиметр
Це простий неінвазивний пристрій, що визначає артеріальну сатурацію гемоглобіну киснем (SaO2, SpO2). Визначення SaO2 зазвичай не має погрішності >2% при визначенні цього показника оксиметром, якщо тільки у пацієнта немає кардіогенного шоку. Пульсоксиметрію слід проводити безперервно будь-якому пацієнтові, який перебуває в нестабільному стані, або при респіраторній підтримці з концентрацією кисню в повітрі, що видихається (FiO2) більше, ніж у повітрі. Також необхідно проводити виміри цього показника через певні проміжки часу (щогодини) будь-якому пацієнтові, який одержує оксигенотерапію у зв’язку з гострою декомпенсацією.
Артеріальний катетер
Показання до введення артеріального катетера — необхідність безперервного аналізу АТ внаслідок гемодинамічної нестабільності або за необхідності повторного лабораторного дослідження артеріальної крові. Частота ускладнень після установки радіального катетера діаметром 2 дюйми і розміром 20 G невисока.
Центральний венозний катетер
Центральний венозний катетер дозволяє одержати доступ до венозної крові і, таким чином, його установка показана при об’ємній інфузійній терапії, введенні різних лікарських засобів, моніторингу ЦВТ і визначенні венозної сатурації кисню (SvO2) у верхній порожнистій вені чи правому передсерді, що дає важливі дані про транспорт кисню. Необхідно уникати переоцінки результатів визначення тиску в правому передсерді, оскільки цей показник у пацієнтів із гострою СН дуже слабко корелює з тиском у лівому передсерді, тиском наповнення ЛШ. Вимір ЦВТ неінформативний при трикуспідальній регургітації та вентиляції легень у режимі позитивного тиску наприкінці видиху.
Катетер у ЛА
Катетер у ЛА (КЛА) — флотуючий балонний катетер, за допомогою якого можна виміряти тиск у верхній порожнистій вені, правому передсерді, ПШ, ЛА, а також визначити серцевий викид. Сучасні катетери дозволяють визначати серцевий викид напівбезперервним способом, оцінювати змішану венозну сатурацію, КДО і ФВ ПШ. Хоча установка КЛА для діагностики гострої СН при гострому ІМ зазвичай не потрібна, його можна використати для розмежування кардіогенних та некардіогенних причин у пацієнтів із поєднаною патологією чи захворюванням легень. КЛА також використовують для визначення тиску заклинювання в ЛА, серцевого викиду та інших гемодинамічних параметрів як провідник для терапії при дифузних захворюваннях легень і гемодинамічній нестабільності, незважаючи на проведене лікування. Тиск заклинювання в ЛА не зовсім точно відображає кінцево-діастолічний тиск ЛШ у пацієнтів із мі-тральним стенозом, аортальною регургітацією, міжшлуночковим шунтом, високим тиском в дихальних шляхах або надлишковою жорсткістю ЛШ при його гіпертрофії, при цукровому діабеті, фіброзі ендокарда, введенні інотропних засобів, ожирінні, ішемії. Значна трикуспідальна регургітація, що часто виявляється у пацієнтів із гострою СН, може також впливати на визначення серцевого викиду методом термодилюції. Використання КЛА рекомендовано у пацієнтів з гемодинамічною нестабільністю, незадовільною відповіддю на класичну терапію, а також у осіб із комбінацією застою та гіпоперфузії. В таких випадках імплантація катетера необхідна з метою забезпечення оптимальної інфузійної терапії та для контролю введення вазоактивних та інотропних засобів. Внаслідок того, що частота ускладнень підвищується з частотою використання КЛА, необхідно вводити катетер при відповідній клінічній ситуації (зазвичай після визначення водно-електролітного стану) і видаляти його відразу, як тільки в ньому зникає необхідність (наприклад при оптимізації терапії діуретиками і вазодилататорами).
Кисень, петльовий діуретик і периферичний вазодилататор
Ці заходи слід призначати за наявності ознак периферичної гіпоперфузії та вираженого застою в легенях при збереженому системному тиску. Якщо немає вираженої гіпотензії, необхідно почати введення нітрогліцерину з дози 0,25 мкг/кг/хв, із підвищенням дози кожні 5 хв до зниження АТ на 15 мм рт. ст. або до зниження САТ до значення не нижче 90 мм рт. ст. Як зазначено вище, слід оцінити доцільність вимірювання тиску в ЛА і тиску заклинювання в легеневих капілярах, а також серцевого викиду за допомогою балонного флотаційного катетера (Сван — Ганза). Тиск заклинювання має бути <20 мм рт. ст., серцевий індекс >2 л/хв/м2. Серед діуретиків перевагу слід віддавати петльовим у зв’язку з більшою вираженістю їх ефекту щодо усунення застійних явищ в малому колі кровообігу. Рекомендовано почати терапію із внутрішньовенного введення (можливе краплинне введення в ізотонічному розчині натрію хлориду) фуросеміду в дозі 40–80 мг (добова доза не має перевищувати 120 мг). Хоча введення фуросеміду в розчині гідрокарбонату натрію може бути виправдане з погляду фармакодинаміки, до цієї методики слід ставитися з обережністю при відсутності даних про кислотно-лужний стан крові. При недостатньому діуретичному ефекті доцільно продовжити діуретичну терапію торасемідом (внутрішньовенне краплинне введення в ізотонічному розчині NaCl у дозі 5–20 мг). Також додатковий ефект може бути отриманий при застосуванні антагоністів альдостерону (спіронолактон, еплеринон). При вираженому ацидозі препаратом вибору може бути етакринова кислота. За наявності у хворого вираженої толерантності до діуретиків (особливо у поєднані із значними застійними явищами в легенях) як ад’ювантну терапію останнім часом випробовують рекомбінантний мозковий НУП — несиритид. Згідно з даними закордонних дослідників внутрішньовенне застосування несиритиду в навантажувальній дозі 2 мкг/кг з подальшою інфузією в дозі 0,01 мкг/кг/хв у хворих зі значною СН знижувало частоту повторних звертань до стаціонару з приводу СН протягом 30 тиж на 13%. Але для широкого застосування цього препарату необхідні додаткові дослідження. Якщо, незважаючи на вищенаведені заходи і введення 100% кисню через маску зі швидкістю 8–10 л/хв (при адекватному застосуванні бронходилататорів), не вдається підтримувати парціальне напруження кисню >60 мм рт. ст. (при прямому вимірі у крові), показана ендотрахеальна інтубація зі штучною вентиляцією легень. Причиною гострої СН може бути оглушення (реперфузія з затримкою поновлення скоротності) чи гібернація (зниження перфузії зі збереженням життєздатності) міокарда. Реваскуляризація міокарда, перфузія якого знижена, може сприяти поліпшенню функції шлуночків. При вираженій лівошлуночковій недостатності із застійними явищами в легенях і серцевій астмі, рефрактерними до нітратів і сечогінних засобів, препаратом вибору може служити морфін. При внутрішньовенному введенні у вигляді гідрохлориду в дозі 0,5–1 мл 1% розчину знижує тиск у малому колі кровообігу, блокує симпатичну гіперактивацію, сповільнює ЧСС, проявляє виражену седативну дію.
Респіраторна підтримка без ендотрахеальної інтубації (неінвазивна вентиляція)
Для респіраторної підтримки використовують дві основні техніки: в режимі постійного підвищеного тиску та неінвазивну вентиляцію з позитивним тиском. Неінвазивна вентиляція з підвищеним тиском дозволяє проводити механічну вентиляцію без ендотрахеальної інтубації. Безперечно те, що одну із цих технік завжди необхідно використати до інтубації трахеї та проведення штучної вентиляції легень. Використання неінвазивних технік дозволило значно знизити необхідність в інтубації трахеї та проведенні штучної вентиляції легень. Використання постійного підвищеного тиску здатне відновити функцію легень і викликає підвищення функціонального залишкового об’єму. Покращується піддатливість легень, зменшується градієнт трансдіафрагмального тиску, знижується активність діафрагми. Все це зумовлює зменшення роботи, пов’язаної з диханням, і загальне зниження метаболізму в організмі. Неінвазивна вентиляція з підвищеним тиском — більш складна методика, що потребує використання спеціального апарата. Додаткове використання режиму позитивного тиску наприкінці видиху дозволяє проводити підтримку за типом постійного підвищеного тиску (також відома як дворівнева підтримка позитивного тиску). Фізіологічно позитивна дія цього режиму вентиляції подібна до постійного підвищення тиску, проте надає також підтримку вдиху, що ще більше зменшує енергетичні витрати на дихання і метаболічні потреби організму. Респіраторна підтримка в режимі постійного підвищеного тиску у пацієнтів із кардіогенним набряком легень поліпшує оксигенацію, зменшує симптоматику гострої СН, а також веде до зниження потреби в ендотрахеальній інтубації. Застосування режиму неінвазивної вентиляції з підвищеним тиском приводить до зменшення необхідності ендотрахеальної інтубації, що не зумовлювало зниження смертності та поліпшення довгострокових функціональних показників. Таким чином, використання режимів постійного підвищеного тиску та неінвазивної вентиляції з підвищеним тиском при гострому кардіогенному набряку легень асоційоване з достовірним зменшенням потреби в інтубації трахеї та штучної вентиляції легень.
Інотропні засоби
Можуть бути використані за наявності стійкої та вираженої системної гіпотензії. Якщо є ознаки гіпоперфузії нирок, рекомендують допамін внутрішньовенно в дозі 2,5–5,0 мкг/кг/хв. Якщо домінує застій у легенях, перевагу віддають добутаміну, починаючи з дози 2,5 мкг/кг/хв. Дозу можна поступово підвищувати з 5–10-хвилинними інтервалами до 10 мкг/кг/хв чи до поліпшення стану гемодинаміки. Відносно застосування інотропних агентів для компенсації порушень системної гемодинаміки на сьогодні існує точка зору, що, незважаючи на поліпшення якості життя та показників гемодинаміки (системне АТ, швидкість клубочкової фільтрації, периферичний кровоток, органна функція), ця терапія асоціюється з підвищенням кардіальної смертності внаслідок більш швидкого вичерпання контрактильного ресурсу серцевого м’яза, розвитку толерантності до екзогенних (і ендогенних) вазопресорів і викликаного їх надлишковою концентрацією проаритмогенного ефекту. Це твердження справедливе для таких інотропів, як допамін, добутамін, норепінефрин, інгібітори ФДЕ і серцеві глікозиди, що підтверджено результатами великих рандомізованих досліджень. Такий ефект пов’язаний з тим, що більшість із цих препаратів підвищує міокардіальну скоротність за рахунок підвищення внутрішньоклітинної концентрації вільного кальцію. Це значно збільшує енерговитрати та утилізацію кисню міокардом, позбавленого зовнішніх джерел кисню і макроергів. Певна зміна поглядів у цьому напрямку можлива з появою нового класу інотропних препаратів, зокрема левосимендану. Ця речовина стійко зв’язується із тропоніном С і стабілізує його стан, підвищуючи відповідь актоміозинових містків на стимуляцію кальцієм. При внутрішньовенному застосуванні левосимендану в дозі 8–24 мкг/кг внутрішньоклітинна концентрація кальцію залишається постійною, скоротна здатність серцевого м’яза підвищується, але збільшення використання макроергів не відбувається. Також виявлено здатність цього препарату здійснювати вазодилатацію як артеріального, так і венозного русла (припускають, що за рахунок відкриття чутливих до АТФ калієвих каналів у гладком’язових клітинах). Це підтверджено фактом зниження тиску заклинювання в ЛА та загального судинного опору у хворих із застійною СН. Період напіврозпаду речовини в плазмі крові становить в середньому 80 год, тому ефект однієї дози зберігається досить довго. Результати порівняння ефективності левосимендану (8–24 мкг/кг навантажувальна доза протягом 10 хв з подальшою інфузією 0,1–0,2 мкг/кг/хв протягом доби) і добутаміну (інфузія 5–10 мкг/кг/хв) у хворих із декомпенсованою застійною СН свідчать про більш виражене поліпшення кардіогемодинаміки, вазодилативного ефекту і зниження 30-денної летальності (6,8% порівняно з 17% у групі добутаміна). Про ефективність препарату у хворих, у яких тяжка СН виникла внаслідок гострого ІМ з елевацією сегмента ST, свідчать результати дослідження RUSSLAN, в якому отримано достовірне зниження приблизно на 54% летальності протягом 1-ї доби гострого ІМ і на 42% — 14-денної летальності порівняно з плацебо. Ці дані підтверджені також результатами окремих дослідників.
У табл. 1.12 наведено порівняльну характеристику найбільш відомих з існуючих на сьогодні інотропних агентів.
Таблиця 1.12. Порівняльна характеристика інотропних агентів, які використовують при гострому ІМ, ускладненому тяжкою СН
| Показник | Левосимендан | Мільринон | Добутамін | Допамін |
| Клас препарату | Кальцієвий сенситайзер | Інгібітор ФДЕ | Катехоламін | Катехоламін |
| t внутрішньоклітинного вмісту Са2+ | Ні | Так | Так | Так |
| Підвищення контрактильності | Так | Так | Так | Так |
| Вазодилативний ефект | Коронарний і системний | Периферичний | Слабкий периферичний | Слабкий периферичний |
| Підвищення споживання О2 | Ні | Ні | Так | Так |
| Аритмогенний потенціал | На сьогодні не відзначено | Шлуночкові (12,1%) та надшлуночкові (3,8%) аритмії | Шлуночкова ектопічна активність (5%) | Шлуночкова ектопічна активність (5%) |
| Спосіб введення | Внутрішньовенно | Внутрішньовенно, перорально | Внутрішньовенно | Внутрішньовенно |
| Взаємодія з іншими лікарськими препаратами | Не виражена | Невелика кількість взаємодій | Не виражена | Антагоністи допамінових рецепторів (метоклопрамід) послаблюють ефект допаміну |
| Поєднання з блокаторами β-адренорецепторів | Можливо | Можливо | Можливо | Можливо |
| Побічні ефекти | Головний біль, гіпотензія | Шлуночкові аритмії, гіпотензія головний біль | Тахікардія, шлуночкові тахіаритмії | Тахікардія, шлуночкові тахіаритмії |
Кардіогенний шок
Кардіогенний шок (справжній) — клінічний стан гіпоперфузії, що характеризується зниженням САТ <90 мм рт. ст. і підвищенням центрального тиску наповнення >20 мм рт. ст. або зниженням серцевого індексу <1,8 л/хв/м2. Інші характеристики шоку — необхідність введення внутрішньовенних інотропних засобів і/ чи внутрішньоаортальної балонної контрпульсації для підтримки САТ на рівні >90 мм рт. ст. і серцевого індексу >1,8 л/хв/м2. Рання ТЛТ знижує імовірність виникнення кардіогенного шоку. Для встановлення діагнозу кардіогенного шоку необхідно виключити інші причини гіпотензії, такі як гіповолемія, вазовагальні реакції, електролітні розлади, побічні ефекти лікарських засобів чи аритмії. Звичайно кардіогенний шок асоціюється з великим ураженням ЛШ, але може також виникати при ІМ ПШ. Функцію ЛШ і наявність асоційованих механічних ускладнень слід оцінювати методом двомірної допплєрехокардіографії. Оцінку стану гемодинаміки зазвичай здійснюють балонним флотуючим катетером. Варто прагнути до досягнення тиску наповнення (заклинювання в легеневих капілярах) принаймні 15 мм рт. ст. с серцевим індексом >2 л/кг/хв. З метою поліпшення функції нирок можна застосувати допамін у низьких дозах (2,5–5 мкг/кг/хв), а також за необхідності — додатково призначати добутамін (5–10 мкг/кг/хв).
У клінічній практиці зазвичай припускають, що кардіогенний шок супроводжується ацидозом. Внаслідок того що катехоламіни малоефективні в кислому середовищі, корекція ацидозу має важливе значення. Як «місток» до проведення механічних втручань рекомендують підтримувальне лікування за допомогою внутрішньоаортальної балонної контрпульсації.
Контрпульсація — стандартний компонент лікування пацієнтів із кардіогенним шоком або тяжкою лівошлуночковою недостатністю при дотриманні таких умов:
- поліпшення не настає, незважаючи на об’ємну інфузію, інотропну підтримку і введення вазодилататорів;
- є виражена мітральна регургітація чи розрив міжшлуночкової перегородки — з метою гемодинамічної стабілізації для проведення діагностичних заходів або лікування;
- є тяжка ішемія міокарда — для підготовки до коронарної ангіографії і реваскуляризації.Синхронізовану внутрішньоаортальну балонну контрпульсацію проводять шляхом роздуття та здуття балона об’ємом 30–50 мл, розміщеного у грудній аорті через стегновий доступ. Роздування балона у діастолу підвищує аортальний діастолічний тиск і коронарний кровотік, тоді як здування у систолу зменшує пост-навантаження і полегшує викид крові з ЛШ. Внутрішньоаортальна балонна контрпульсація може значно покращити гемодинаміку; за наявності певних станів її використання полегшує проведення подальших заходів (наприклад коронарну реваскуляризацію, заміну клапана, пересадку серця) або допомагає досягти повного одужання (наприклад раннє оглушення міокарда після гострого ІМ або операції на серці, міокардит). Внутрішньоаортальна балонна контрпульсація протипоказана при розшаровуючій аневризмі аорти чи клінічно значимій аортальній недостатності. Її також не слід застосовувати при тяжких ураженнях периферичних судин, причинах гострої СН, що не коригуються, поліорганній недостатності.
На ранніх стадіях захворювання необхідно розглянути можливість проведення невідкладної ПКВ чи хірургічного втручання. Якщо це неможливо або ці втручання можуть бути виконані лише після тривалої затримки, слід застосувати фібринолітичну терапію.
Пересадка серця може розглядатися як лікувальний захід при тяжкій гострій СН з відомим несприятливим прогнозом. Прикладом може бути циркулярний трансмуральний гострий ІМ із несприятливим прогнозом після реваскуляризації. Проте пересадка серця неможлива доти, поки не досягнуто стабілізації стану природним способом або за допомогою допоміжного кровообігу (балонної контрпульсації). В загальному вигляді рекомендації з ведення хворих із гострим ІМ, тяжкою СН і кардіогенним шоком наведені в табл. 1.13.
Таблиця 1.13. Резюме: насосна недостатність і шок
Кисень Фуросемід: 20–40 мг внутрішньовенно, за необхідності — повторно з інтервалами 1–4 год Нітрогліцерин за відсутності гіпотензії Інгібітори АПФ за відсутності гіпотензії, гіповолемії чи ниркової недостатності
Кисень Фуросемід Нітрогліцерин за відсутності гіпотензії Інотропні засоби: допамін, добутамін та/чи левосимендан Оцінка стану гемодинаміки за допомогою балонного флотуючого катетера Підтримка вентиляції при неадекватному насиченні киснем Оцінка можливості ранньої реваскуляризації
Кисень Оцінка стану гемодинаміки за допомогою балонного флотуючого катетера Інотропні засоби: допамін і добутамін Підтримка вентиляції при неадекватному насичені киснем Внутрішньоаортальна балонна контрпульсація Оцінка можливості застосування ранньої реваскуляризації міокарда |
Механічні ускладнення гострого ІМ
Рання постінфарктна дилатація і формування аневризми ЛШ
Одним із найтиповіших наслідків поширеного гострого ІМ є ремоделювання ЛШ. Порожнина ЛШ втрачає свою еліпсовидну форму за рахунок загибелі кардіоміоцитів і заміщення загиблих клітин сполучною тканиною, перерозподілу об’ємного навантаження на неушкоджений міокард. З 1-ї по 14-ту добу гострого ІМ у зміні геометрії порожнини ЛШ переважає процес дилатації, надалі на перший план виходить компенсаторна гіпертрофія неураженого міокарда.
Виділяють від 2 до 4 періодів постінфарктного ремоделювання серця. Перший період (раннє ремоделювання) реєструють у перші 24–72 год, триває він 7–14 діб від початку ІМ. Гістологічно цей період відповідає закінченню некротичної стадії гострого ІМ і формуванню «молодого» рубця, що складається з грануляційної тканини з рясною мережею тонкостінних судин, які становлять фібробласти і тонкі волокна колагену. Процеси ремоделювання в перші 24–72 год (некротична фаза гострого ІМ) у більшому ступені залежать від обсягу ураження міокарда, рівня ураження коронарного русла, прохідності коронарної артерії, що спричинила інфаркт, стану тканинної перфузії.
До факторів, що впливають на процеси раннього ремоделювання на 7–14-й добі, відносять наявність і поширеність зон резидуальної ішемії та «оглушення» міокарда, вираженість запальної реакції у відповідь на розвиток гострого ІМ, ступінь активації САС і РААС, процесу апоптозу кардіоміоцитів.
Більшість авторів, що вивчають проблему постінфарктного ремоделювання порожнини ЛШ, відзначають провідну роль прохідності коронарної артерії, що спричинила інфаркт, період її відкриття та рівень ураження судини. Найбільш важливим фактором, що впливає на активізацію процесів ремоделювання, на сьогодні вважають тканинну перфузію міокарда — наявність адекватної мікроциркуляції в зоні ураження. Проте поза залежністю від прохідності коронарної артерії, що спричинила інфаркт, при різному рівні ураження судини і розвитку колатерального кровотоку відзначають різний обсяг зони некрозу.
З огляду на обсяг зони ішемізованого міокарда, що кровопостачається ураженою ділянкою коронарного русла, можна припустити і величину некротичного ураження. Рівень оклюзії коронарної артерії, тип коронарного кровообігу в більшій мірі визначають розмір зони некрозу і допускають можливість розвитку більш-менш вираженого ремоделювання порожнини ЛШ.
Найбільш несприятливий варіант постінфарктного ремоделювання — рання сегментарна постінфарктна дилатація з формуванням аневризми ЛШ. Причинами несприятливого перебігу процесів ремоделювання, крім величини ураження міокарда, можуть бути перевантаження ЛШ (причому в перші години захворювання переважає постнавантаження внаслідок гіперфункції «стресорних» систем організму, в подальшому з розвитком застою в малому колі кровообігу та формуванням підвищеного діастолічного тиску в лівому передсерді — збільшення переднавантаження), неспроможність грануляційної тканини при прискореній резорбції вогнища некрозу. Клінічно гостра аневризма серця може проявлятися збільшенням явищ СН, появою прекардіальної пульсації. На ехоКГ відзначається ділянка випинання стінки ЛШ (при інфаркті перегородкової локалізації випинання її відбувається в порожнину ПШ відповідно до градієнта тиску) з її стоншенням, обмежена по периферії перешийком. Втім, на ранніх стадіях формування аневризми серця не завжди вдається виявити ці ехоКГ-ознаки. У цьому разі більш надійна ознака — наявність стійкого дискінезу (парадоксального руху) стінки в систолу. При великому ураженні з різким зниженням тотальної скоротності ЛШ дискінез може не визначатися, тоді слід звернути увагу на ділянки повного акінезу. Найбільш несприятливим наслідком гострої аневризми серця є її розрив (див. далі). За локалізацією розрив ділянки ураження буває периферичним (раннім, що виникає переважно в перші 72 год) і центральним, (що виникає в період відносної стабілізації зони некрозу). Несприятливим явищем, що істотно підвищує ризик раннього розриву, є гіперкінез сегментів, що прилягають до ділянки некрозу. Пізній розрив відбувається на фоні стоншення стінки аневризми і характеризується неспроможністю процесів рубцювання. До інших наслідків формування гострої аневризми слід віднести збільшення на її фоні явищ СН, турбулентність кровотоку в ЛШ, формування тромбу в порожнині аневризми з можливими тромбоемболічними ускладненнями.
Розрив вільної стінки
Гострий розрив вільної стінки
Клінічна картина характеризується серцево-судинним колапсом з електромеханічною дисоціацією, тобто збереженням електричної активності при втраті серцевого викиду і відсутності пульсу. Стандартні заходи серцево-легеневої реанімації неефективні, оскільки зазвичай це закінчується фатальним результатом протягом декількох хвилин. Дуже рідко хворого вдається прооперувати (рис. 1.16).
Рис. 1.16. Розрив вільної стінки
Підгострий розрив вільної стінки
Приблизно у 25% випадків невелика кількість крові потрапляє в порожнину перикарда, що викликає наростаючі порушення гемодинаміки. Клінічна картина може нагадувати реінфаркт з огляду на поновлення болю і реелевацію сегмента ST, але частіше відзначають раптове погіршення стану гемодинаміки з минущою чи стійкою гіпотензією. Розвиваються класичні ознаки тампонади серця, які можна підтвердити ехоКГ-методом. Хоча під час ехоКГ зазвичай не можна встановити локалізацію розриву, можна верифікувати наявність рідини в перикарді з ознаками тампонади або без них (рис. 1.17).

Рис. 1.17. Гемотампонада серця (згусток у порожнині перикарда)
Для діагностики підгострого розриву вільної стінки недостатньо виявити лише рідину в перикарді, оскільки цю ознаку відзначають досить часто після гострого ІМ. Типова знахідка — ехогенна маса в перикардіальному просторі, що нагадує згусток (гемоперикард). Слід розглянути необхідність негайного хірургічного втручання залежно від клінічного стану. Перикардіоцентез може сприяти корекції тампонади у пацієнтів у стані шоку в період очікування перед хірургічним втручанням. У певній частці випадків прогресу гемотампонади при підгострому розриві міокарда заважає розвиток запального процесу в перикардіальній сумці з формуванням фібринозних спайок і тромбоутворення в місці розриву. У цьому разі часто формується так звана псевдоаневризма серця з досить специфічними ультразвуковими та рентгенологічними ознаками (рис. 1.18).
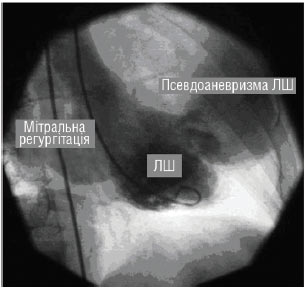
Рис. 1.18. Псевдоаневризма ЛШ (вентрикулографія)
Розрив міжшлуночкової перегородки
Дефект міжшлуночкової перегородки, або синдром Бернгейма, може розвитися в ранні строки ІМ; частота цього ускладнення становить приблизно 1—2% всіх випадків інфаркту. Якщо не виконати хірургічної корекції, летальність становить 54% протягом 1-го тижня і 92% — протягом 1-го року. Діагноз можна запідозрити при значному погіршенні клінічних проявів. Його підтверджують аускультативно (поява гучного систолічного шуму), методом ехоКГ і/або шляхом виявлення підвищення вмісту кисню в крові ПШ. Проте шум може бути м’яким або взагалі відсутнім. ЕхоКГ-дослідження дозволяє встановити локалізацію та розмір дефекту міжшлуночкової перегородки. Шунтування крові зліва направо підтверджують кольоровим допплєрівським методом і кількісно оцінюють методом пульсової допплєрехокардіографії. Оцінку пікової швидкості потоку через місце розриву методом постійної допплєрехокардіографії використовують для виміру систолічного тиску в ПШ (ЛА).
Медикаментозне лікування вазодилататорами, наприклад внутрішньовенним нітрогліцерином, може забезпечити деяке поліпшення стану у разі відсутності кардіогенного шоку. Але найбільш ефективним методом підтримки кровообігу в період підготовки до хірургічної корекції є внутрішньоаортальна балонна контрпульсація. Ургентне втручання дає єдиний шанс для виживання при великому постінфарктному дефекті міжшлуночкової перегородки з кардіогенним шоком. Навіть за відсутності гемодинамічної нестабільності раннє хірургічне втручання показане також у зв’язку з тим, що розмір дефекту може збільшитися.
При вирішенні питання про проведення хірургічного втручання слід виконати доопераційну коронарну ангіографію і за необхідності встановити шунти. Предиктори поганого прогнозу захворювання після хірургічного втручання — кардіогенний шок, задня локалізація процесу, дисфункція ПШ, вік, значний часовий проміжок від моменту розриву перегородки та здійснення хірургічного втручання. Госпітальна смертність після хірургічних втручань у межах 25–60%, а серед пацієнтів, які вижили, функціональний стан у 95% відповідає СН класу І або ІІ за NYHA.
Мітральна регургітація
Мітральна регургітація — поширене ускладнення гострого ІМ. Існують три механізми гострої мітральної регургітації:
- розширення кільця мітрального клапана внаслідок дилатації та дисфункції ЛШ;
- дисфункція папілярного м’яза зазвичай внаслідок ІМ нижньої локалізації;
- розрив папілярного м’яза.
Розрив папілярного м’яза, як правило, проявляється раптовим погіршенням стану гемодинаміки. У зв’язку з раптовістю і тяжкістю підвищення тиску в лівому передсерді шум часто буває м’яким. Ступінь мітральної регургітації найкраще оцінити методом кольорової допплєрехокардіографії.
Найчастіша причина часткового чи тотального розриву папілярного м’яза — малий інфаркт задньомедіального папілярного м’яза в басейні правої чи обгинаючої артерії. У деяких пацієнтів для встановлення остаточного діагнозу необхідна черезстравохідна ехоКГ.
Кардіогенний шок і набряк легень із тяжкою мітральною регургітацією потребують невідкладного хірургічного лікування. Під час підготовки проводять внутрішньоаортальну балонну контрпульсацію, доцільне виконання коронарної ангіографії.
Протезування клапана — метод вибору при розриві папілярного м’яза, хоча в деяких випадках можна спробувати усунути дефект. Якщо немає розриву папілярного м’яза, доцільно здійснити спробу механічної реперфузії артерії, що спричинила інфаркт.
Внутрішньопорожнинне тромбоутворення
Внутрішньопорожнинне тромбоутворення, як правило, супроводжує поширений інфаркт передньої стінки ЛШ серця. Поява цього феномену перш за все носить захисний характер. При великому ураженні передньої стінки ЛШ відбувається стоншення стінки, порушення її скоротної здатності, аж до парадоксального руху, що викликає місцевий турбулентний рух крові. У місці інфаркту часто відзначають запальну реакцію ендокарда. Всі ці явища спричиняють пристінкове тромбоутворення. При вираженому порушенні скоротної функції, особливо сегментарної, з формуванням аневризми серця пристінкове тромбоутворення може переростати у внутрішньопорожнинне. Внутрішньопорожнинний тромб втрачає профілактичне значення, може істотно порушувати кардіогемодинаміку і становить загрозу тромбоемболічних ускладнень (рис. 1.19).
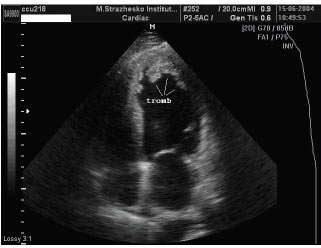
Рис. 1.19. Внутрішньопорожнинне тромбоутворення, крайове відшарування тромбу від ендокарда верхівки ЛШ (ехоКГ)
При виникненні внутрішньопорожнинного тромбу необхідне проведення активної антикоагулянтної терапії з включенням гепаринів і непрямих антикоагулянтів.
При розвитку дилатації порожнини ЛШ з наявністю постінфарктної аневризми і внутрішньопорожнинного тромбу можливе проведення оперативного втручання, що включає аневризмектомію, тромбектомію і АКШ.
Профілактика та лікування аритмій і порушень провідності
Аритмії та порушення провідності надзвичайно поширені в перші години після ІМ. У деяких випадках, зокрема при шлуночковій тахікардії, фібриляції шлуночків і повній AV-блокаді, виникає
загроза для життя, що потребує проведення негайної корекції. Часто аритмії є проявом серйозного основного захворювання, наприклад ішемії, що зберігається, насосної недостатності, змін вегетативного тонусу, гіпоксії, розладів електролітного (гіпокаліємія) чи кислотно-лужного стану, що потребують уваги та проведення заходів щодо їх корекції. Необхідність лікування та ступінь його невідкладності в основному залежать від гемодинамічних наслідків порушення ритму. Індукція стійкої мономорфної шлуночкової тахікардії під час проведення програмованої стимуляції шлуночків у підгострий період гострого ІМ — досить надійний маркер ризику розвитку шлуночкових тахіаритмій надалі, але в гострій фазі ІМ цей метод непридатний. Рутинне застосування програмованої стимуляції шлуночків в підгострий період гострого ІМ показане лише у хворих з високим ступенем ризику розвитку загрозливих для життя шлуночкових аритмій, а також для оцінки ефективності антиаритмічної терапії у цих пацієнтів. Для виявлення хворих з високим аритмічним ризиком останнім часом використовують неінвазивні показники варіабельності серцевого ритму, порушень процесів деполяризації та реполяризації міокарда, але проблема ще далека від остаточного рішення.
Шлуночкові ектопічні ритми
Шлуночкові ектопічні ритми майже завжди відзначають у 1-й день захворювання; поширеними є складні екстрасистолічні аритмії: поліморфні комплекси, короткі епізоди тахікардії, феномен Н-на-T. За Лауном (Lown) шлуночкові екстрасистоли поділяють на 5 типів:
I — мономорфна з частотою <5 на 1 хв;
II — мономорфна з частотою >5 на 1 хв;
III — поліморфна;
IV — парна шлуночкова екстрасистола (а) або групи з 3–5 шлуночкових екстрасистол (b);
V — рання з феноменом R-на-Т.
Незважаючи на зручність використання цієї класифікації для формулювання діагнозу у конкретного хворого, значення цих аритмій як предикторів фібриляції шлуночків або стійкої шлуночкової тахікардії сумнівне. Якщо шлуночкові аритмії не поєднуються з дисфункцією ЛШ, то немає потреби в окремій терапії.
Шлуночкова тахікардія
Епізоди нестійкої (до 30 с) шлуночкової тахікардії (ШТ) можуть бути добре переносимі і не обов’язково потребують лікування. Більш тривалі епізоди можуть викликати гіпотензію і СН з можливим переходом у фібриляцію шлуночків. Також виділяють ранню ШТ (виникає в перші 48 год гострого ІМ) і пізню, яку асоціюють з гіршим прогнозом. За морфологією розрізняють мономорфну і поліморфну ШТ, за ЧСС — швидку (>170 комплексів за 1 хв) і повільну (120–170 комплексів за 1 хв).
Препарати першої лінії за відсутності протипоказань — блокатори β-адренорецепторів. При стабільній стійкій мономорфній ШТ як початкове лікування може бути застосований прокаїнамід і/або лідокаїн у разі, якщо ШТ носить ішемічний характер. Спочатку застосовують навантажувальну дозу лідокаїну 1 мг/кг маси тіла внітрішньовенно, потім — половину цієї дози кожні 8–10 хв до максимальної дози 4 мг/кг або здійснюють тривалу інфузію в дозі 1–3 мг/хв. Проте у пацієнтів із зворотною стійкою шлуночковою тахікардією, що потребує кардіоверсії, або у разі фібриляції шлуночків перевага може бути віддана внутрішньовенному введенню аміодарону (5 мг/кг маси тіла протягом 1-ї години, потім 900–1200 мг протягом 24 год). При збереженні гемодинамічно значимої шлуночкової тахікардії показана електрична кардіоверсія. За відсутності або тимчасовій неможливості застосування дефібрилятора необхідно спробувати застосувати прекардіальний удар. Важливо відрізнити справжню шлуночкову тахікардію від прискореного ідіовентрикулярного ритму, що зазвичай є нешкідливим наслідком реперфузії, коли частота ритму шлуночків зберігається <120 уд./хв.
На рис. 1.20 відображено алгоритм лікування стійкої ШТ відповідно до об’єднаних рекомендацій АСС/АНА, Європейського кардіологічного товариства (ESC) від 2006 р.
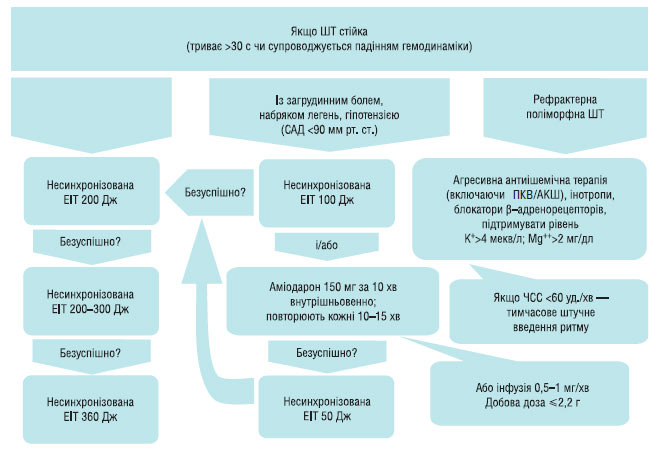
Рис. 1.20. Алгоритм дій при шлуночковій тахікардії (рекомендації АСС/АНА, 2004)
Фібриляція шлуночків
Слід негайно провести дефібриляцію відповідно до міжнародних рекомендацій по серцево-легеневій реанімації 2005 р. Більш докладний алгоритм наведено на рис. 1.21, який показує порядок фармакотерапії та ЕІТ відповідно до об’єднаних рекомендацій ААС/АНА/ESC від 2006 р.
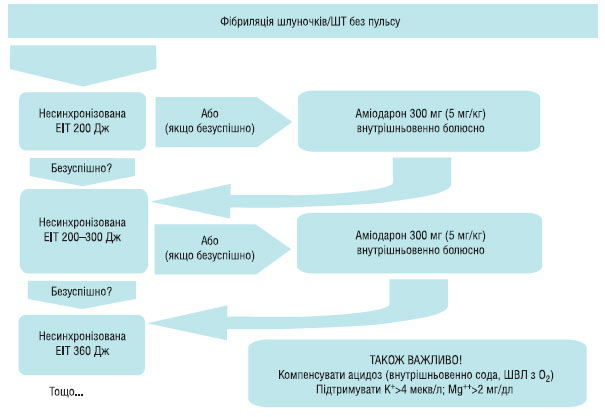
Рис. 1.21. Алгоритм дій при фібриляції шлуночків та ШТ «без пульсу». ШВЛ — штучна вентиляція легень
Суправентрикулярні аритмії
Фібриляція передсердь — ускладнення ІМ у 15–20% випадків і часто асоціюється з тяжким ураженням ЛШ і СН. Також її причинами можуть бути інфаркт передсердь (частіше при тромбозі у правій коронарній артерії), перикардит. Безпосередніми причинами початку та збереження аритмії є розтягнення передсердь, надлишкова симпатична активність і електролітний дисбаланс. Зазвичай аритмія проходить спонтанно. Епізоди можуть тривати від хвилин до годин і часто повторюються. У багатьох випадках частота шлуночкового ритму не підвищується, аритмія добре переноситься і лікування не потрібне. В інших ситуаціях тахікардія спричиняє виникнення СН і тому необхідне негайне лікування. З метою уповільнення частоти ритму у багатьох пацієнтів ефективні блокатори β-адренорецепторів, але аміодарон може бути більш ефективним для усунення аритмії. Застосування прокаїнаміду чи пропафенону менш прийнятне з огляду на значний кардіодепресивний ефект першого та проаритмогенний ефект другого. Можливе також виконання кардіоверсії. Проте її застосовують лише за необхідності, враховуючи високу частоту рецидивів. У загальному вигляді схему лікування стійкої миготливої аритмії чи тріпотіння передсердь наведено на рис. 1.22.
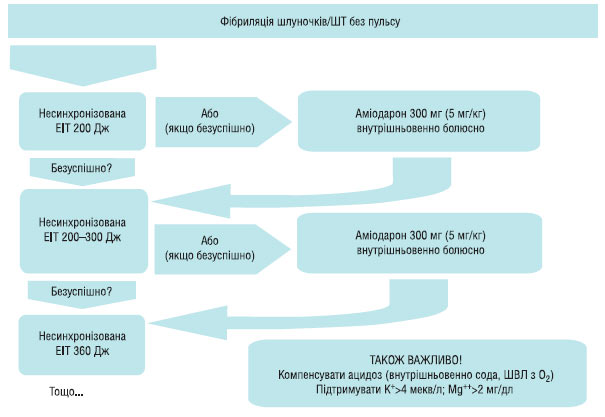
Рис. 1.22. Алгоритм дій при стійкій фібриляції (ФП) або тріпотінні передсердь (ТП)
Інші суправентрикулярні тахікардії діагностують рідко; зазвичай проходять самостійно. Вони можуть також припинятися при масажі каротидного синуса. Ефективними часто виявляються блокатори β-адренорецепторів; не рекомендують застосовувати верапаміл. Якщо виключено тріпотіння передсердь і стан гемодинаміки стабільний, одним із можливих засобів лікування є аденозин; під час введення препарату необхідне моніторування ЕКГ. При поганій переносимості аритмії слід провести кардіоверсію. Відповідно до рекомендацій Європейського товариства кардіологів послідовність дій при пароксизмальній суправентрикулярній тахікардії така (рис. 1.23).
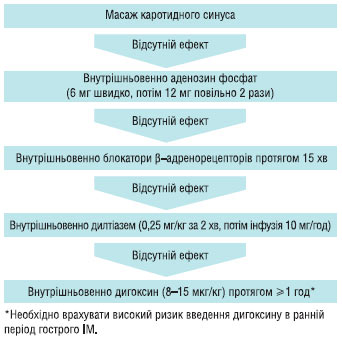
Рис. 1.23. Фармакотерапія пароксизмальної суправентрикулярної тахікардії за типом re-entry
Синусова брадикардія і блокади серця
Синусову брадикардію можуть відзначати протягом перших годин захворювання, особливо при ІМ нижньої локалізації чи застосуванні опіоїдів у високих дозах. Її може супроводжувати досить виражена гіпотензія. В цьому разі слід застосувати атропін внутрішньовенно, починаючи з дози 0,3–0,5 мг з повторними введеннями через кожні 5 хв до досягнення загальної дози 1,5–2,0 мг. Якщо при цьому відсутня реакція на введення атропіну, може бути рекомендована тимчасова кардіостимуляція. Слід зазначити, що фармакологічні стимулятори серцевої діяльності (амінофілін) не рекомендовані до застосування в подібній ситуації.
AV-блокада виникає в 14% випадків гострого ІМ з елевацією сегмента ST, найчастіше асоціюється з гострим ІМ нижньої локалізації і має прогностичне значення для внутрішньогоспітальної летальності. АV-блокада І ступеня не потребує лікування. АV-блокада ІІ ступеня типу I (Мобітц I або Венкебаха) зазвичай рідко викликає негативні гемодинамічні ефекти. При порушеннях гемодинаміки слід спочатку ввести атропін, а за відсутності ефекту — проводити кардіостимуляцію.
АV-блокада ІІ ступеня типу II (Мобітц II) і повна АV-блокада є показаннями для введення стимулюючого електрода, якщо брадикардія викликає гіпотензію чи СН. При тяжких розладах гемодинаміки необхідно розглянути можливість послідовної АV-стимуляції. Розвиток нової блокади ніжки пучка Гіса чи геміблокади зазвичай свідчить про великий інфаркт передньої локалізації. В цьому разі висока ймовірність виникнення повної АV-блокади, а також насосної недостатності. Як профілактичне може бути показане введення тимчасового електроду. Після АV-блокади, дво- або трипучкової блокади, а також електричної кардіоверсії може виникати асистолія. Якщо введено електрод, у цій ситуації необхідно спробувати здійснити кардіостимуляцію. Інший шлях — масаж серця та штучна вентиляція легень, а також трансторакальна кардіостимуляція. За наявності АV-блокади високого ступеня, а також у багатьох випадках дво- чи трипучкової блокади слід установити трансвенозний електрод для кардіостимуляції. У загальному вигляді схему лікування AV-блокади наведено на рис. 1.24.
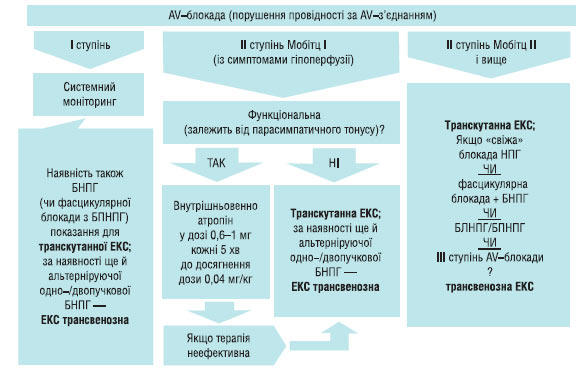
Рис. 1.24. Алгоритм дій при AV-блокаді на фоні гострого ІМ. БНПГ — блокада ніжок пучка Гіса; БПНПГ — блокада правої ніжки пучка Гіса; БЛНПГ — блокада лівої ніжки пучка Гіса
У відношенні транскутанної стимуляції можна відзначити, що у вітчизняній клінічній практиці цей метод практично не використовують, перевагу віддають профілактичному встановленню транс-венозного електрода зі стимуляцією в режимі «деманд». Деякі кардіологи віддають перевагу підключичному підходу, але його варто уникати на фоні або невдовзі після введення фібринолітиків. У цій ситуації доцільно вибирати альтернативні доступи.
Стандартні засоби терапії та профілактики в гострій фазі захворювання
Ацетилсаліцилова кислота та інші антитромбоцитарні засоби
Переконливі докази ефективності ацетилсаліцилової кислоти одержані в дослідженні ISIS-2. У цьому дослідженні доведено додатковий сприятливий вплив ацетилсаліцилової кислоти на результати лікування стрептокіназою. Існує обмежений ряд протипоказань до застосування ацетилсаліцилової кислоти: її не слід призначати пацієнтам з гіперчутливістю, пептичною виразкою в стадії загострення, патологічними змінами гемограми або тяжкими захворюваннями печінки. Іноді ацетилсаліцилова кислота є пусковим фактором бронхоспазму у пацієнтів з БА. На відміну від фібринолітичної терапії, немає чітких доказів зв’язку між ефективністю ацетилсаліцилової кислоти та періодом від початку симптомів. Незважаючи на це, ацетилсаліцилову кислоту необхідно якомога раніше призначати всім пацієнтам з гострим ІМ або підозрою на інфаркт. Цей препарат мають одержувати 85–95% пацієнтів з гострим ІМ. Слід пам’ятати про необхідність контролю кількості тромбоцитів і нейтрофільних гранулоцитів. Результати дослідження ESPRIT свідчать про те, що профілактична дія ацетилсаліцилової кислоти може бути посилена комбінацією з ретардною формою діпиридамола, проте для прийняття рішення про доцільність рутинного використання цієї комбінації даних недостатньо. За наявності протипоказань до застосування ацетилсаліцилової кислоти слід розглянути можливість призначення тієнопіридинів, які мають інший механізм дії та позбавлені властивих ацетилсаліциловій кислоті побічних ефектів. Найбільш істотний недолік перших тієнопіридинів (тиклопідин) при застосуванні їх у хворих із гострим ІМ — занадто тривалий період досягнення максимуму їх клінічної ефективності, в той час як ацетилсаліцилова кислота починає діяти з перших хвилин після прийому під язик або внутрішньовенної інфузії. Поява тієнопіридинів нового покоління (клопідогрел, празугрел) з розробкою навантажувальних режимів застосування наблизили швидкість їх клінічного ефекту до такого у ацетилсаліцилової кислоти. Щодо комбінованого застосування ацетилсаліцилової кислоти і тієнопіридинів при гострому коронарному синдромі можна сказати таке: дані проведеного великого рандомізованого дослідження CLARITY TIMI 28 продемонстрували істотне зниження частоти 30-добової комбінованої кінцевої точки (кровоток 0-го або 1-го ступеня за TIMI на контрольній ангіограмі, смерть внаслідок будь-якої причини або розвиток рецидиву ІМ). У дослідженні COMMIT-CCS у 46 тис. пацієнтів з ІМ виявлене зниження частоти смерті, реінфаркту та інсульту на 9% при комбінованій терапії ацетилсаліциловою кислотою і клопідогрелом тривалістю >14 днів. Новий препарат з цієї групи — CS-747 або празугрел у 3 пілотних дослідженнях у здорових добровольців в навантажувальній (60 мг) і підтримувальній (5–20 мг) дозі продемонстрував більш повне (на 58% порівняно із клопідогрелом) і стабільне інгібування агрегації тромбоцитів з нижчою частотою малих кровотеч, ніж широко відомий аналог клопідогрел у навантажувальній/підтримувальній дозі. Ці дані підтверджені у великому дослідженні TRITON TIMI 38 у пацієнтів із ІХС (рис. 1.25).
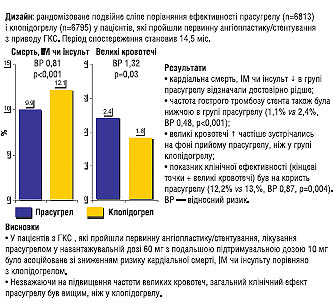
Рис. 1.25. Результати порівняння терапії празугрелом і клопідогрелом у хворих із гострим коронарним синдромом (ГКС), які пройшли первинну ангіопластику і стентування (адаптовані за TRITON TIMI 38 Study Group, 2007)
Застосування тієнопіридинів як додаткового до ацетилсаліцилової кислоти препарату виправдано тим фактом, що приблизно у 50% випадків відзначають так звану резистентність до ацетилсаліцилової кислоти, коли прийом ацетилсаліцилової кислоти не викликає селективної блокади метаболізму арахідонової кислоти з оптимізацією співвідношення продукції простагландинів і тромбоксану А2. У такій ситуації блокада АДФ-залежних рецепторів адгезії тромбоцитів тієнопіридинами дуже важлива для зниження схильності до тромбоутворення. Альтернативними щодо похідних тієнопіридинів є такі пероральні препарати, як ривароксабан і субстанція AZD6140, дослідження із застосування яких у хворих із гострим коронарним синдром (TIMI 46 ATLAS, PLATO) ще не завершені.
Ще одна група антитромбоцитарних препаратів — блокатори глікопротеїнових рецепторів IIB/IIIA. На сьогодні декілька інфузійних препаратів цієї групи (абсиксимаб, ептифібатид і тирофібан) є золотим стандартом антитромбоцитарної терапії при проведенні ПКВ чи стентування з метою пригнічення тромбоутворення в зоні дилатації коронарної артерії, що спричинила інфаркт. Відома інформація про позитивний ефект щодо зниження частоти ургентних ПКВ при застосуванні абсиксимабу і половинної дози тенектеплази як модифікації реперфузійної терапії (дослідження ASSENT-3), хоча за показником 1-річної смертності достовірної різниці між цією тактикою і режимом введення повної дози тенектеплази з додаванням прямого антикоагулянта не було. Крім обов’язкової внутрішньовенної інфузії протягом не менше 1 доби, до негативних рис цих препаратів слід віднести їх високу вартість і збільшення геморагічних ускладнень при їх застосуванні (порівняно з еноксапарин натрієм і нефракціонованим гепарином).
Антиаритмічні засоби
Хоча показано здатність лідокаїну знижувати частоту виникнення фібриляції шлуночків в гострій фазі ІМ, цей препарат істотно підвищує ризик асистолії. Результати метааналізу 14 досліджень виявили недостовірне підвищення летальності у пацієнтів, які одержували лідокаїн, порівняно з плацебо. Рутинне профілактичне застосування цього препарату не виправдане.
Як видно на рис. 1.26, в результаті проведеного метааналізу досліджень ефекту застосування антиаритмічної терапії у пацієнтів у різний період після перенесеного гострого ІМ єдиними препаратами, що знижують ризик аритмічних подій, виявилися блокатори β-адренорецепторів і аміодарон, причому ефективність останнього дещо перевищувала таку для блокаторів β-адренорецепторів.

Рис. 1.26. Порівняльна характеристика ефективності застосування різних класів антиаритмічних препаратів у хворих з гострим ІМ
Найбільш імовірним поясненням такої ефективності представника третьої групи анти-аритмічних препаратів порівняно з препаратами першої групи є особливість його механізму дії. На відміну від препаратів першої групи, аміодарон призводить до подовження реполяризації, перш за все в неуражених ішемією ділянках міокарда. З огляду на те, що в ішемізованій периінфарктній зоні реполяризація подовжується в силу дисфункції іонних каналів (переважно повільних калієвих), при застосуванні аміодарону різниця в тривалості реполяризації між «здоровим» та ішемізованим міокардом нівелюється. Отже, зникають передумови для розвитку шлуночкових тахіаритмій за типом re-entry. У спеціально проведеному субаналізі дослідження CAMIAT встановлено (рис. 1.27), що ефективність комбінації аміодарону і блокатора β-адренорецепторів перевершує таку для кожного з цих препаратів окремо, причому якщо вихідна ЧСС у пацієнта становила >70 уд./хв, то відзначали додаткове підвищення ефективності комбінованого застосування цих препаратів, що дозволяє рекомендувати таку комбінацію для лікування пацієнтів після гострого ІМ з факторами ризику раптової смерті (особливо з підвищенням ЧСС у спокої >70 уд./хв).
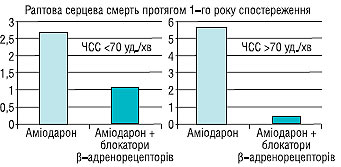
Рис. 1.27. Застосування аміодарону і блокаторів β-адренорецепторів у хворих, які перенесли ІМ
Одним із можливих пояснень цього факту може бути гіпотеза, відповідно до якої антиаритміки третьої групи мають таку властивість, як зворотна частотна залежність (reverse rate dependency). Суть цього феномену полягає в тому, що ступінь подовження реполяризації при використанні цих препаратів тим менший, чим вища ЧСС у певній точці (для аміодарону ця точка перебуває між 70 і 80 уд./хв, тоді як для інших антиаритміків третьої групи вона, імовірно, ще нижча), тому при тахікардії медикаментозне подовження інтервалу Q–T у неуражених зонах серцевого м’яза перестає компенсувати електрофізіологічні порушення в периінфарктній зоні. Підтвердженням цієї гіпотези можуть також служити результати досліджень EMIAT (за наявності вихідного рівня ЧСС >84 уд./хв частота аритмічних подій на фоні лікування аміодароном становила 54%, тоді як у групі хворих із ЧСС <63 уд./хв аритмія виникала лише у 17% випадків) і ECMA (якщо в ході лікування аміодароном не вдавалося досягти ЧСС <80, аритмія виникала у 59% випадків, тоді як уповільнення ритму серця до <63 уд./хв асоціювалося з розвитком аритмії всього лише у 12% випадків). Таким чином, можна припустити, що застосування на доповнення до аміодарону блокаторів β-адренорецепторів сприяє зниженню ЧСС, «виводячи» аміодарон у зону його найвищої ефективності, що й зумовлює додатковий ефект такої комбінації. До негативних якостей аміодарону можна віднести відносно високий відсоток таких побічних явищ, як пневмосклероз, фотосенсибілізація, дисфункція щитовидної залози при його тривалому застосуванні. Ефективність недавно розробленої модифікації аміодарону, позбавленої атома йоду і багатьох його побічних ефектів, — дронедарону — у хворих після гострого ІМ поки не доведена.
Блокатори β-адренорецепторів
У гострій фазі ІМ проведено чимало досліджень щодо застосування блокаторів β-адренорецепторів з урахуванням здатності цих препаратів продовжувати діастолу, поліпшувати перфузію міокарда, особливо субендокарда, обмежувати зону некрозу, знижувати частоту фатальних аритмій, послабляти біль і знижувати частоту інших ускладнень, особливо у хворих без супутньої ТЛТ. Також серед ефектів блокаторів β-адренорецепторів — доведене зменшення кількості реінфарктів після ТЛТ і зниження ранньої летальності. За даними сукупного аналізу 28 досліджень внутрішньовенне застосування блокаторів β-адренорецепторів забезпечує абсолютне зниження летальності через 7 днів з 4,3% до 3,7%, або 6 врятованих життів на 1000 пацієнтів, які лікувалися. Ці дослідження здійснювалися до впровадження фібринолітичних засобів або первинної ПКВ. У проведених рандомізованих дослідженнях, в яких здійснювали внутрішньовенну блокаду β-адренорецепторів на фоні застосування фібринолітиків, кількість подій була занадто малою для того, щоб зробити певні висновки. Ретроспективний аналіз застосування атенололу в дослідженні GUSTO-I (1996) і систематичний огляд не свідчать на користь рутинного раннього внутрішньовенного застосування блокаторів β-адренорецепторів. Проте тривале їх застосування в постінфарктний період має певні переваги (рис. 1.28, 1.29).
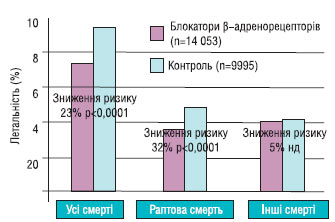
Рис. 1.28. Зниження кардільної смертності при застосуванні блокаторів β-адренорецепторів в постінфарктний період

Рис. 1.29. Метааналіз досліджень щодо застосування блокаторів β-адренорецепторів при гострому ІМ
Призначення внутрішньовенних блокаторів β-адренорецепторів особливо показане при тахікардії (за відсутності СН), відносній гіпертензії або коли біль не проходить після введення опіоїдів. Всі хворі без протипоказань мають одержувати перорально блокатори β-адренорецепторів, проте, спочатку доцільно оцінити відповідь пацієнта на цю форму терапії шляхом застосування препарату короткої дії (рис. 1.30).

Рис. 1.30. Ефективність раннього внутрішньовенного застосування блокаторів β-адренорецепторів при гострому ІМ (7-денна летальність, %)
Доцільність раннього (на 3-ю–21-у добу гострого ІМ) застосування блокаторів β-адренорецепторів підтверджена у дослідженнях із використанням багатьох блокаторів β-адренорецепторів, зокрема пропранололу і карведилолу.
Слід зазначити, що серед препаратів, інгібуючих хронотропну функцію серця, з’явився новий клас — інгібітори автоматизму клітин — водіїв ритму синусного вузла (представник класу препарат івабрадин). Цей препарат сповільнює частоту генерації імпульсів клітинами синусного вузла шляхом впливу на мембранні If -канали, але не впливаючи при цьому на адренергічні рецептори серця і судин. Таким чином, терапія цим препаратом зумовлює контрольований ізольований негативний хронотропний ефект. Нещодавно закінчено рандомізоване клінічне дослідження BEAUTYFUL щодо застосування івабрадину як ад’ювантної терапії у хворих із стабільною ІХС і дисфункцією ЛШ, яке показало, що терапія івабрадином знижує ризик розвитку фатального та нефатального інфаркту у цих пацієнтів на 36% (р<0,001). Проте дані масштабних досліджень по застосуванню цього препарату у хворих з гострим коронарним синдромом поки відсутні. Протягом тривалого часу обговорювали питання доцільності застосування блокаторів β-адренорецепторів при проведенні реваскуляризації. За даними останніх досліджень поліпшення перебігу гострого ІМ при застосуванні блокаторів β-адренорецепторів пов’язане з більшим спектром ефектів цього класу препаратів (рис. 1.31).

Рис. 1.31. Вплив часу призначення блокаторів β-адренорецепторів у хворих з гострим ІМ
Нітрати
Метааналіз 10 досліджень із раннім внутрішньовенним введенням нітратів, виконаним у 2041 пацієнта, виявив достовірне зниження летальності приблизно на И. Аналіз результатів GISSI-3 у 19 394 хворих із гострим ІМ свідчить, що ефективність комбінації нітратів та інгібіторів АПФ щодо зниження смертності та ішемічних ускладнень перевершує таку для кожного з цих препаратів окремо (рис. 1.32).
>70 років
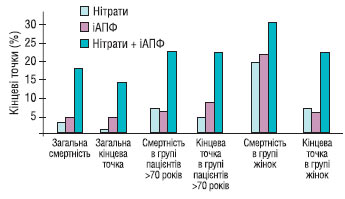
Рис. 1.32. Зниження кардіальної летальності при сумісному застосуванні нітратів та інгібіторів АПФ у хворих з гострим ІМ
При рутинному застосуванні нітратів не відзначали достовірного зниження летальності. У дослідженні ISIS-4 пероральний ізосорбіду мононітрат призначали з початку захворювання протягом 1 міс, докази ефективності препарату не отримані. У дослідженні ESPRIM (1994) також не доведена користь застосування молсидоміну, донора NO. Отже, внутрішньовенне застосування нітратів показане за наявності больового синдрому, гострої СН, в окремих випадках — для корекції АГ. Доведено, що внутрішньовенне введення нітратів може сприяти обмеженню зони некрозу (рис. 1.33).

Рис. 1.33. Ефект внутрішньовенної інфузії нітрогліцерину (НТГ) щодо обмеження зони некрозу у хворих із гострим ІМ
Застосування форм нітратів внутрішньовенно дозволяє запобігати дилатації порожнини ЛШ, розвитку ішемічних ускладнень інфаркту та знижувати внутрішньогоспітальну летальність (рис. 1.34).

Рис. 1.34. Ефекти внутрішньовенної інфузії нітрогліцерину у хворих з гострим ІМ. ВГЛ — внутрішньогоспітальна летальність
Таким чином, пероральні нітрати слід призначати хворим для лікування і профілактики дисфункції ЛШ у поєднанні з інгібіторами АПФ. Крім того, є дані, що свідчать про те, що нітрогліцерин здатний пригнічувати адгезію і агрегацію тромбоцитів.
Аденозин
На сьогодні відсутні дані щодо вираженого позитивного ефекту аденозину на клінічний перебіг гострого ІМ. У рандомізованих дослідженнях AMISTAD і AMISTAD II отримані дані, що свідчать про зменшення розміру інфаркту (за даними позитронно-емісійної томографії) у хворих із гострим ІМ, які в гострий період захворювання одержували терапію аденозином. Достовірної інформації про вплив такої терапії на прогноз дослідники не одержали внаслідок недостатньої кількості пацієнтів. Проте одержану в дослідженні ATTACC тенденцію до зниження кардіоваскулярної смертності протягом 1 року у хворих із гострим ІМ передньої локалізації після призначення аденозину у вигляді інфузії (10 мкг/кг/хв протягом 6 год в перші години гострого ІМ) необхідно підтвердити проведенням рандомізованих досліджень із залученням більшої кількості хворих для з’ясування питання щодо можливості рутинного використання аденозину як ад’ювантної терапії при гострому ІМ передньої локалізації.
Антагоністи кальцію
Метааналіз досліджень із застосуванням антагоністів кальцію при гострому ІМ виявив негативну тенденцію щодо їх впливу на коротко- і довгостроковий прогноз. Тому для використання антагоністів кальцію (особливо короткої дії) з профілактичною метою в гострій фазі ІМ немає підстав.
Інгібітори AПФ
Встановлено, що інгібітори АПФ слід призначати пацієнтам зі зниженою ФВ або проявами СН в ранній фазі захворювання. У дослідженнях GISSI-3, ISIS-4, FAMIS застосування інгібіторів АПФ з 1-го дня захворювання незначно, але вірогідно знижувало летальність протягом наступних 4–6 тиж. Втім, у дослідженні CONSENSUS II сприятливого впливу еналаприлату на перебіг гострого ІМ не виявлено. Очевидно, це зумовлено або випадковими факторами, або раннім введенням препарату внутрішньовенно у високій дозі, що призводить до артеріальної гіпотензії.
Результати систематичного аналізу досліджень ефективності інгібіторів АПФ в ранній період ІМ свідчать про безпеку і хорошу переносимость цих препаратів у помірних дозах (табл. 1.14). Їх прийом асоціюють із незначним, але достовірним зниженням летальності після 30 днів від початку захворювання, причому в основному сприятливий ефект досягають протягом 1-го тижня. На сьогодні існує одностайна згода щодо початку застосування інгібіторів АПФ в гострий період ІМ у хворих із дисфункцією ЛШ, наявністю СН, цукрового діабету, АГ, з передньою локалізацією інфаркту, за відсутності протипоказань.
Таблиця 1.14. Дозування інгібіторів АПФ після ІМ в контрольованих дослідженнях
| Дослідження, препарат | Початкова доза | Цільова доза |
| CONSENSUS II, еналаприл | Еналаприлат 1 мг в/в, далі 2–5 мг 2 рази на добу із збільшенням до 20 мг при хорошій переносимості | До 20 мг |
| GISSI-3, лізиноприл | 5 мг | До 10 мг |
| ISIS-4, каптоприл | 6,25 мг; через 2 год — 12,5 мг, через 10–12 год — 25 мг | До 50 мг 2 рази на добу |
| CHINESE, каптоприл | 6,25 мг; через 2 год — 12,5 мг | До 12,5 мг 3 рази на добу |
| SMILE, зофеноприл | 7,5 мг; повторно через 12 год, при хорошій переносимості — подвоєння дози | До 30 мг 2 рази на добу |
| AIRE, раміприл | 2,5 мг 2 рази на добу, збільшення до 5 мг 2 рази на добу | До 5 мг 2 рази на добу |
| SAVE, каптоприл | 6,25 мг; при хорошій переносимості — до 25 мг 3 рази на добу | До 50 мг 3 рази на добу |
| TRACE, трандолаприл | 0,5 мг | До 4 мг |
У багатоцентрових дослідженнях (SAVE, AIRE, TRACE, SMILE, CCS-1, CATS, ISIS-4, GISSI-3) відзначене зниження летальності в госпітальний період гострого ІМ і підвищення виживаності у віддалений термін захворювання. Інгібітори АПФ застосовують з метою профілактики ремоделювання ЛШ, розвитку та прогресування СН.
Проте, незважаючи на численні дослідження, присвячені застосуванню препаратів цієї групи у хворих із гострим ІМ, на сьогодні залишається відкритим питання про доцільність застосування інгібіторів АПФ в перші години розвитку ІМ, оскільки у більшості великих досліджень оцінювали ефективність призначення інгібіторів АПФ у період 24–72 год від початку розвитку захворювання (рис. 1.35). Слід врахувати той факт, що в перші години захворювання ці препарати можуть викликати гіпотензію з можливим збільшенням порушення коронарної перфузії.

Рис. 1.35. Застосування інгібіторів АПФ у хворих з гострим ІМ
Каптоприл — один із перших препаратів, розроблених для модифікації активності РААС. Історично роль даного каскаду складається у швидких адаптивних реакціях, що регулює взаємини між серцево-судинною системою і життєво важливими органами при раптових стресах та ураженнях. Однак при хронічній стимуляції РААС відбуваються тривалі й малооборотні розлади її регуляції. Причому оскільки «розбалансуванню» піддаються як ендокринна (внутрішньосудинна), так і тканинні РААС, відповідно і наслідки цих порушень можуть бути досить різноманітні. До таких наслідків можна віднести стійке підвищення периферичного судинного опору, фіброз і гіпертрофію міокарда, порушення функції ендотелію і зниження фібринолітичних властивостей крові.
Терапевтичні завдання, які можна ставити перед інгібіторами АПФ у найгострішій фазі ІМ, стосуються впливу на функцію ендотелію, фібринолітичний баланс, а також на стан тромбоцитарної ланки гемостазу. З урахуванням вищезазначених механізмів регуляції судинного тонусу, тромбоутворення і аутогенного фібринолізу швидка блокада ендокринної РААС у най-гострішій фазі ІМ, що перешкоджає руйнуванню брадикініну, здатна не лише викликати брадикінін-опосередковану вазодилатацію коронарних артерій, але й полегшити лізис тромбу, який спричинив цей інфаркт, а також сприяти запобіганню ранньої тромботичної реоклюзії коронарної судини, включаючи реперфузійні мікросудинні тромбоемболічні ускладнення. Результати дослідження HEART дали клінічне підтвердження цій гіпотезі. Зокрема, раміприл, застосований у перші 24 год гострого ІМ, привів до істотного (p<0,02) зниження активності PAI-1 до кінця 2-го тижня інфаркту. Зауважимо, що як у цьому дослідженні, так і у дослідженнях із лізиноприлом у хворих з АГ і у пацієнтів похилого віку цей ефект інгібіторів АПФ не був пов’язаний з їх гіпотензивною дією. Дослідження ефекту інгібування АПФ за допомогою інфузії еналаприлату (5 мкг/хв) на вазодилатацію і фібринолітичний баланс плазми крові проведений Pretorius і співавторами. У цій роботі виявлене значне підвищення концентрації tPA у плазмі крові на фоні інфузії еналаприлату. Еналаприлат потенціював ефекти екзогенного брадикініну як на вазодилатацію, так і на підвищення концентрації tPA. Характерно, що в дослідженні вивчений також вплив специфічної блокади брадикінінових рецепторів препаратом HOE 140 на вищезазначені ефекти брадикініну. В результаті отримане блокування ефектів як ендогенного, так і екзогенного брадикініну на вазодилатацію та фібринолітичний баланс плазми крові, причому навіть терапія еналаприлатом не приводила до змін фібринолітичного балансу і вазодилатації.
З приводу лабораторної верифікації ефекту інгібіторів АПФ на фібриноліз стверджується, що описаний вплив на концентрацію tPA і PAI-1 відзначено для різних інгібіторів АПФ, що дає підстави припускати наявність «класового» ефекту інгібіторів АПФ на фібриноліз. У зазначеному аспекті каптоприл — найбільш швидкодіючий інгібітор АПФ, водорозчинність якого зумовлює більш активний його блокуючий вплив саме на внутрішньосудинну РААС. Крім того, за частотою клінічних проявів підвищеного рівня брадикініну в крові («брадикініновий» кашель, гіпотензія) каптоприл має переваги практично над всіма відомими представниками цього класу препаратів.
Щодо додаткових позитивних механізмів блокади АПФ у найгострішій фазі ІМ за допомогою каптоприлу також відзначають таке: препарат є одним з небагатьох інгібіторів АПФ, що містять вільну SH-групу. Загальновідомий факт, що довгостроковий вазодилатуючий ефект екзогенних нітратів забезпечується їх перетворенням у тривало живучі донори NO-S-нітрозотіоли, стійкі до оксидантної інактивації супероксид-аніоном. Виснаження у плазмі крові молекул, що містять вакантні тіолові (SH) групи (L-аргінін, метіонін), призводить до розвитку так званої толерантності до нітратів I типу і, як наслідок цього, до зниження їх вазодилативного і антиангінального ефектів. При цьому толерантність розвивається як до екзогенного, так і до ендогенного NO, тому що механізми накопичення і трансформації нітрозотіолів відбуваються за однаковим біохімічним каскадом. Зниження рівня вільного NO в плазмі крові відбувається шляхом перетворення його супероксид-аніоном у неактивний пероксинітрит. У цьому разі каптоприл виявляє подвійну дію: по-перше, може виступати у ролі донатора сульфгідрильних груп і стимулювати не лише брадикінін-опосередковану, але й нітрат-опосередковану вазодилатацію. Крім того, каптоприл блокує опосередковану ангіотензином II активацію мембранної NAD(P)H оксидази і, отже, знижує продукцію супероксид-аніона. Таким чином, стимулюючи підвищення у крові рівня NO шляхом підвищення його продукції та зниження його інактивації, каптоприл тим самим потенціює і інші короткочасні системні ефекти NO — інгібування АДФ-залежної адгезії та агрегації тромбоцитів, інгібування адгезії тромбоцитів до ендотелію шляхом блокади дегрануляції тромбоцитів. Це положення підтверджене при вивченні ефектів каптоприлу на агрегацію та адгезію тромбоцитів у ранній постінфарктний період.
Ще один можливий механізм позитивного впливу блокади АПФ на перебіг найгострішої фази ІМ полягає в наступному. Як мембранна кініназа II, АПФ каталізує деградацію багатьох макромолекул, до яких, зокрема, відносять енкефаліни та бета-нео-ендорфін. Запобіганням розпаду цих речовин також частково можна пояснити одержане в деяких дослідженнях зниження частоти рецидивного чи пролонгованого ангінозного статусу в гострій фазі ІМ на фоні лікування каптоприлом.
Група інгібіторів АПФ неоднорідна, складається з препаратів ліпофільних і гідрофільних, з наявністю сульфгідрильних груп короткої і тривалої дії. Застосування більшості інгібіторів АПФ довело їх клінічну ефективність при гострому ІМ порівняно з плацебо. Проте повномасштабного порівняння ефективності різних інгібіторів АПФ дотепер не проводили. Результати проведеного дослідження (SMILE-2) прямого порівняння лізиноприлу і нового представника ліпофільних інгібіторів АПФ — зофеноприлу свідчать про порівнянну ефективність обох препаратів у запобіганні кардіальних подій у постінфарктний період. Це ще раз доводить, що дані метааналізів, у яких порівнюють ефективність різних інгібіторів АПФ у різних дослідженнях (і у різних категорій пацієнтів), не можуть замінити інформації, що одержують при прямому порівнянні цих препаратів в одному дослідженні.
Блокатори рецепторів ангіотензину II першого типу
Результати численних досліджень щодо застосування інгібіторів АПФ при гострому ІМ показали достовірне зниження летальності в госпітальний період ІМ і підвищення виживаності у віддалений період захворювання. Проте, незважаючи на високу ефективність інгібіторів АПФ — при гострому ІМ, на сьогодні систематизовані дані про можливі обмеження при застосуванні цієї групи препаратів. При цьому відзначені виражений сухий кашель (брадикініновий ефект), гіпотензія, що потребують відміни препарату. У більшості представників класу інгібіторів АПФ виявлений феномен зниження ефективності дії препарату.
Зниження ефективності інгібіторів АПФ спричиняє активація АПФ-незалежного шляху трансформації АІ в АІІ через хімази, CAGE (chymostatin — sensitive angiotensin II — generating enzyme), катепсин G. Утворення АІІ можливе безпосередньо з ангіотензиногену, в обхід стадії утворення АІ (тканинний активатор плазміногена, катепсин G, тонін). Блокатори рецепторів ангіотензину II (БРА) першого типу, дія яких не залежить від шляху перетворення ангіотензину II, блокуючи його ефекти на рівні рецепторів, однаково впливають на системні й тканинні ефекти.
Ряд дослідників оцінювали ефективність блокаторів рецепторів ангіотензину II при гострому ІМ. У пілотних дослідженнях блокатори рецепторів ангіотензину II визначені як препарати, що не поступаються перед інгібіторами АПФ. Разом з тим за результатами дослідження OPTIMAAL (The Optimal Therapy in Myocardial Infarction with Angiotensin II Antagonist Losartan), що оцінювало ефективність застосування лозартану порівняно з каптоприлом, не виявлені переваги блокаторів рецепторів ангіотензину II перед інгібіторами АПФ. На сьогодні проведене інше багатоцентрове дослідження VALsartan In Acute myocardial iNfarcTion (VALIANT), у якому для лікування 14 500 хворих з високим ступенем ризику після перенесеного гострого ІМ застосовували вальзартан, каптоприл та їх комбінацію. У цьому дослідженні доведена однакова ефективність вальзартану і каптоприлу за відсутності додаткового ефекту комбінованого застосування цих груп препаратів. Суперечливість результатів досліджень як при гострому ІМ, так і при СН лише підтримує інтерес до вивчення ефективності інгібіторів АПФ, блокаторів рецепторів ангіотензину II, а також їх комбінацій. Крім того, немає переконливих доказів щодо однакової ефективності всіх представників класу блокаторів рецепторів ангіотензину II у хворих із гострим ІМ. Показанням до призначення блокаторів рецепторів ангіотензину II залишається непереносимість інгібіторів АПФ.
Незважаючи на те що в багатьох проведених раніше дослідженнях як при СН, так і при гострому ІМ не отримано даних про перевагу блокаторів рецепторів ангіотензину II над інгібіторами АПФ, вивчення в цій галузі не припинені.
Результати останніх досліджень у нормотоніків і пацієнтів з метаболічним синдромом свідчать, що антагоністи рецепторів ангіотензину II першого типу, що викликають підвищення у крові його концентрації за механізмом зворотного зв’язку, щодо описаних функцій ендотелію проявляють ефект, відмінний від ефекту інгібіторів АПФ. Антагоністи рецепторів ангіотензину II першого типу знижують рівень активності tPA, знижуючи при цьому рівень PAI-1 значно менше, ніж інгібітори АПФ, причому для цих препаратів визначається нівелювання ефекту на рівень PAI-1 при тривалому застосуванні. Більше того, деякі дослідники відзначають відсутність впливу антагоністів рецепторів ангіотензину II першого типу на рівень PAI-1 або навіть деяке підвищення рівня PAI-1 у відповідь на блокаду ангіотензинових рецепторів першого типу. Одним із можливих пояснень того, що за даними більшості досліджень блокада цих рецепторів не призводить до значного підвищення рівня PAI-1, є неоднозначність впливу ангіотензину II на рівень антифібринолітичного агента. Крім вищеописаної прямої стимуляції ендотеліальної продукції PAI-1, ангіотензин II стимулює також ангіотензинові рецептори другого типу, що призводить до опосередкованого збільшення продукції брадикініну та NO. Дослідження Bouchie і співавторів показало, що NO поряд із натрійуретичними факторами блокує експресію PAI-1 в ендотелії. Проте, зважаючи на результати вищенаведених досліджень, можна зробити висновок, що позитивний ефект стимуляції ангіотензином II рецепторів другого типу частково нівелюється його опосередкованою блокувальною дією на фібриноліз.
Магній
Результати метааналізу досліджень ефективності препаратів магнію при гострому ІМ дозволили зробити висновок про вірогідність їх ефекту. Проте проведене пізніше дослідження ISIS-4 не підтвердило цього, хоча існували відмінності щодо недостатньої дози магнію в цьому дослідженні. Нещодавно опубліковані результати великого дослідження MAGIC підтвердили відсутність позитивного впливу рутинного призначення солей магнію хворим із гострим ІМ, хоча внутрішньовенне введення солей магнію може бути застосоване у хворих із подовженням інтервалу Q–T і наявністю поліморфних шлуночкових тахікардій. Солі магнію протипоказані при серцевих блокадах або погіршенні функціонування нирок.
Препарати з мембранопротекторними властивостями
Різні патологічні процеси, що розвиваються в серці при ішемії і реперфузії (як в умовах експерименту, так і у пацієнтів із нестабільною стенокардією або гострим ІМ), беруть участь в ураженні мембранних структур кардіоміоцитів. Серед них принципове значення мають збільшення утворення вільних радикалів, перекисне окислення ліпідів, кальцієве перевантаження, запалення, ацидоз, пригнічення антиоксидантної системи організму. Ці процеси не є взаємовиключаючими і діють синергічно, доповнюючи один одного. Головна мета заходів, спрямованих на захист мембранних систем кардіоміоцитів, — знизити ступінь їх ураження, перешкоджаючи переходу оборотних змін у необоротні. На цій концепції базується використання мембранопротекторів.
Мембранопротектори впливають на міокард, що сприяє обмеженню ішемічного і реперфузійного ураження. За переважаючим впливом на одну із ланок патологічного процесу препарати можна умовно розподілити на кілька груп, а саме ті, які:
1) інактивують вільні радикали і процеси перекисного окиснення ліпідів (природні та синтетичні антиоксиданти);
2) знижують утворення прооксидантних факторів шляхом впливу на джерела їх утворення (блокатори β-адренорецепторів, інгібітори ліпоксигеназ);
3) оптимізують метаболічні процеси кардіоміоцитів (убіхинон, триметазидин);
4) стабілізують мембрани кардіоміоцитів (екзогенний фосфокреатин, фосфатидилхолін, прогестерон, глюкокортикоїди);
5) підвищують активність і потужність антиоксидантних ферментів (силімарин, селеніт натрію, препарати супероксиддисмутази).
Триметазидин
За останні роки отримані дані про ефективність застосування триметазидину, який має пряму захисну дію на клітину без впливу на гемодинаміку. В терапевтичних концентраціях триметазидин прискорює відновлення енергетичних запасів клітини ізольованого серця щура під час реперфузії, сприяє збереженню нормального рівня АТФ. Захисна дія триметазидину на функцію мітохондрій доведена в дослідах на ізольованому перфузованому серці щура в умовах ішемії і ре-перфузії. Препарат зменшував викликане кальцієвим перевантаженням пригнічення окисного фосфорилювання АДФ шляхом впливу гідролітичних форм мітохондріальної АТФази, інгібуючи рух іонів водню через мембрану мітохондрій.
Механізм дії триметазидину полягає в інгібуванні ферменту β-окиснення жирних кислот — 3-кетоацил-КоА-тіолази, що полегшує процес аеробного окиснення глюкози та забезпечує краще використання залишкового кисню ішемізованою клітиною. Триметазидин сприяє внутрішньоклітинній підтримці синтезу АТФ, поліпшенню обміну фосфоліпідів клітинних мембран, зменшенню тканинного ацидозу, попередженню кальцієвого перевантаження та підтримці скоротної функції міокарда. Це відображено в результатах експериментальних і клінічних досліджень при гострій ішемії та реперфузії міокарда. У дослідах in vitro триметазидин інгібував агрегацію тромбоцитів, стимульовану тромбіном, колагеном, арахідоновою кислотою, кальцієвим іонофором і АДФ, а в дослідах in vivo перешкоджав росту внутрішньокоронарного тромбоцитарного тромбу. Встановлено, що триметазидин змінює плинність зовнішнього шару плазматичної мембрани тромбоцитів та еритроцитів людини. Крім того, виявлене зменшення інфільтрації нейтрофільними гранулоцитами зони ризику при введенні триметазидину за 30 хв до лігування коронарної артерії, що сприяє обмеженню остаточної зони некрозу. Цей механізм частково пояснює зменшення розміру зони некрозу при експериментальній регіональній ішемії міокарда під впливом триметазидину. В експериментальних дослідженнях на серці кролика відзначене значне зменшення виходу КФК із кардіоміоцитів та обмеження розмірів ІМ, переважно за рахунок впливу на «зону ризику». На ізольованому серці щура додавання до перфузійного розчину триметазидину приводило до зменшення дисфункції ЛШ і поліпшення постішемічного відновлення скоротної здатності міокарда, дозволяло попередити порушення електрофізіологічних властивостей кардіоміоцитів, викликаних ішемією.
Вищенаведені результати експериментальних досліджень підтверджують теоретичні обґрунтування необхідності застосування триметазидину в клінічній практиці. Проводили широке дослідження препарату при призначенні пацієнтам із хронічною ІХС (рекомендований Європейським товариством кардіологів). При проведенні ПКВ у хворих з гострим ІМ внутрішньовенне болюсне введення триметазидину з подальшим внутрішньовенним крапельним введенням препарату протягом 48 год зумовлювало більш швидке зниження сегмента ST до ізолінії і перешкоджало його реелевації, що пов’язують з більш ранньою реперфузією міокарда та зменшенням реперфузійних уражень.
Одержані дані про вплив триметазидину на вегетативну нервову систему. Birand і співавтори встановили, що попередній прийом триметазидину сприяє зниженню тонусу симпатичного та підвищенню тонусу вагусного відділу вегетативної нервової системи при проведенні ПКВ у осіб з ІХС. Водночас виявлено, що застосування триметазидину в ранній період гострого ІМ призводить до підвищення тонусу парасимпатичної нервової системи й не впливає на виявлення ППШ (неінвазивний маркер електричної нестабільності міокарда).
При застосуванні препарату вірогідно збільшується ФВ ЛШ у хворих із СН, що розвинулась після ІМ. Нами проведені дослідження з раннього використання таблетованої форми триметазидину у хворих з гострим ІМ. На фоні терапії триметазидином рідше виникали загрозливі для життя аритмії, AV-блокади, виявлено зменшення маси некротизованого міокарда (за даним неінвазивних маркерів — скорочення часу нормалізації активності КФК-МВ у сироватці крові), що сприяло попередженню розвитку ранньої дилатації порожнини ЛШ.
Незважаючи на результати дослідження EMIP-FR, опубліковані у 2000 р., де показана перевага внутрішньовенного введення триметазидину лише у хворих без втручань щодо реваскуляризації міокарда, теоретичні обґрунтування та проведені пілотні дослідження дають підстави для призначення метаболічно активного препарату триметазидину не тільки при лікуванні хворих зі стабільною стенокардією, але й при реваскуляризаційних втручаннях і розвитку гострого ІМ.
Кверцетин
Науково-дослідні роботи останнього часу показали, що в основі патологічних процесів у серці лежить порушення функціонування мембран клітин. Це такі мембранні механізми, як активація фосфоліпаз та оксигеназ, утворення вільних радикалів, активація перекисного окиснення ліпідів. Особливу роль грає активація ліпоксигеназ та утворення її похідних (лейкотрієнів LTC4-LTE4, LTB4, ліпоксинів), які звужують коронарні судини, проявляють аритмогенну, проагрегантну дію. Тому гальмування активності ліпоксигеназ — важливий напрямок у лікуванні хворих з гострим ІМ.
Протягом останніх років проводяться інтенсивні дослідження інгібіторів ліпоксигеназ. Багато препаратів цієї групи, виявляючи ряд позитивних властивостей, спричиняють безліч побічних ефектів, тому застосування їх у клінічній практиці неможливе. Найбільш перспективним представником інгібіторів ліпоксигеназ є біофлавоноїд кверцетин, що впливає на активність ферментів, які беруть участь у деградації фосфоліпідів (фосфоліпаза, ліпоксигеназа, ЦОГ), ферментів, які беруть участь у вільнорадикальних процесах, ферментів продукції NO, протеїнкінази та ін. Кверцетин запобігає збільшенню внутрішньоклітинного Са++ у тромбоцитах і гальмує їх агрегацію, тобто гальмує процеси тромбогенезу. До основних позитивних властивостей препарату відносять його вазодилататорну дію, що частково опосередкована поліпшенням біодоступності NO. Великий інтерес представляють дослідження з вивчення антиоксидантної активності флавоноїдних речовин, мембранозахисні властивості яких проявляються у здатності інактивувати вільні радикали, інгібувати утворення супероксид-радикала і гідроксильних радикалів, збільшувати ефективність ферментативного антиоксидантного захисту, стабілізувати структуру клітинної мембрани.
Результати експериментальних і клінічних досліджень свідчать, що лікарські форми кверцетину зменшують реперфузійне порушення колатерального кровообігу в серці, попереджають феномен невідновлення кровотоку (no-reflow) в коронарних судинах, поліпшують гемодинаміку, зменшують обсяг некротизованого міокарда та проявляють протиаритмічну дію [1].
Інгібуючий вплив кверцетину на процеси перекисного окиснення ліпідів був експериментально і клінічно підтверджений при вивченні його захисної дії на міокард при ішемії. Препарат, обмежуючи накопичення продуктів перекисного окиснення ліпідів, запобігає окисненню аскорбінової кислоти і адреналіну, тривале окиснення яких здатне активізувати перекисне окиснення ліпідів.
Істотним недоліком кверцетину була нерозчинність у воді, тобто низька біологічна доступність. З розробкою першої у світі водорозчинної форми кверцетину принципово розширилися можливості застосування його в невідкладній кардіології, а саме при гострому ІМ.
Кверцетин — аглікон флавоноїдного глікозиду рутину. При гострому ІМ кверцетин може бути застосований у всіх трьох формах: у вигляді таблеток, гранул кверцетину та розчину для внутрішньовенного введення. Перший досвід стосувався таблеток кверцетину, які при гострому ІМ призначали з 1-ї доби захворювання на фоні базисного лікування, що приводило до зменшення розміру зони некрозу (за даними серійного визначення кардіоспецифічного ізоферменту КФК-МВ), кількості епізодів болю в 1-шу добу захворювання, застосування наркотичних анальгетиків з метою знеболювання, AV-блокад, шлуночкових екстрасистол та епізодів шлуночкових тахіаритмій (фібриляція шлуночків/шлуночкова тахікардія (ФШ/ШТ)). Особливістю впливу таблеток кверцетину на рівень гіперферментемії КФК-МВ була відсутність впливу на значення піка активності ферменту та зменшення кількості повторних піків КФК-МВ, прискорення часу нормалізації рівня ферменту в крові. Госпітальний період хвороби при лікуванні кверцетином характеризувався меншою порівняно з групою контролю кількістю ускладнень — клінічних проявів СН, постінфарктної стенокардії, шлуночкових і надшлуночкових аритмій. Кількість хворих із шлуночковою екстрасистолією протягом усього часу спостереження серед хворих, які одержують кверцетин, була істотно меншою. Позитивний вплив препарату на електричну стабільність серця підтверджено під час проведення програмованої стимуляції шлуночків (інвазивного ЕФД). На фоні лікування кверцетином шлуночкову тахікардію (як головну детермінанту ризику раптової смерті в постінфарктний період) відзначали на 60% рідше, ніж у хворих контрольної групи.
Це стало основою розробки нового методу лікування гострого ІМ із застосуванням розчинної у воді форми кверцетину. Для швидкого впливу на уражений міокард під час розвитку гострого ІМ цю лікарську форму вводили внутрішньовенно крапельно за спеціальною схемою. Раннє застосування внутрішньовенної форми кверцетину в комплексній терапії гострого ІМ покращує клінічний перебіг захворювання: зменшує вираженість аритмічного синдрому, гострої лівошлуночкової недостатності, рецидивів больового синдрому, частоти застосування наркотичних анальгетиків. Антиаритмічна дія кверцетину може бути зумовлена як проявом його мембранопротекторної дії, так і поліпшенням внутрішньо-серцевої гемодинаміки, зменшенням міокардіального стресу під впливом препарату. З іншого боку, позитивна дія розчинної форми флавоноїда кверцетину зумовлена його впливом на біологічно активні регуляторні речовини (NO, лейкотрієни), зменшенням прооксидантного стресу.
Препарат поліпшує електрофізіологічні властивості міокарда та запобігає появі порушень ЕКГ високого розрізнення — ППШ, позитивно впливає на тонус і регуляторні здатності вегетативної нервової системи.
Найбільш ефективно кверцетин впливає на величину зони некрозу та процеси ремоделювання порожнини ЛШ у хворих з відкритою коронарною артерією, що зумовила інфаркт, на фоні ТЛТ, при дисфункції міокарда ЛШ і у пацієнтів із високим лейкоцитозом.
Введення кверцетину до початку терапії фібринолітичним агентом дозволяє перебороти тромборезистентність і підвищити частоту реканалізації коронарної артерії, що спричинила інфаркт.
Кверцетин стабілізує мембрани кардіоміоцитів шляхом інгібування перекисного окиснення ліпідів. Кількість дієнових кон’югатів знижується вже через 2 год після початку введення препарату, а максимальний ефект настає на 5-й добі захворювання.
У клінічних умовах доведено його здатність гальмувати активність ліпоксигенази, що проявляється у стійкому зниженні кількості лейкотрієну С4 протягом всього періоду спостереження, що зменшує патологічний вплив ішемії та реперфузії на міокард.
Результати аналізу динаміки змін NO2 свідчать, що під дією кверцетину стаціонарний рівень циркулюючого метаболіту NO порівняно з контрольною групою значно знижується. Це може свідчити про вплив препарату на індукцію синтезу NO2 клітинами крові або на зміни метаболізму цієї біологічно активної речовини, що має короткий період життя.
Таким чином, включення кверцетину в схему лікування пацієнтів із гострим ІМ покращує клінічний перебіг захворювання, приводить до зменшення розміру ІМ, підвищує електричну стабільність серця, виявляє протизапальну та антиоксидантну дію.
Фосфокреатинін
На сьогодні у клінічній практиці вже добре себе зарекомендував і досить широко використовується екзогенний креатинфосфат — синтетичний аналог ендогенного макроерга, що відіграє важливу роль в енергозабезпеченні функцій кардіоміоцитів. Під впливом фосфокреатиніну показано зменшення ушкоджувального впливу ішемії на клітинну мембрану кардіоміоцитів і відсутність їх гіпоксичної контрактури при ре-перфузії. Внутрішньовенна інфузія препарату зменшувала площу ішемічного ураження серцевого м’яза, значно скорочуючи зону відносної ішемії міокарда, і призводила до обмеження розмірів некрозу у кроликів з експериментальним гострим ІМ. Виявлена захисна дія фосфокреатиніну на ішемізований міокард при реперфузії за рахунок збільшення колатерального кровотоку, поліпшення стану мікроциркуляторного русла та реологічних властивостей еритроцитів, підвищення їх пластичності. У кровоносному руслі фосфокреатинін сприяє швидкому зв’язуванню АДФ-індуктора агрегації тромбоцитів та утворенню АТФ, що є потужним антиагрегаційним фактором. Це запобігає агрегації тромбоцитів на ураженій судинній стінці та у вогнищі ішемічного ураження. Фосфокреатинін запобігає швидкому утворенню малонового діальдегіду, зменшує вихід КФК, КФК-МВ, ЛДГ. Препарат може проявляти антипероксидантну дію (непрямим шляхом), не викликаючи активації антиоксидантних ферментів і деградації перекису водню, але впливаючи на субстрат перекисного окиснення ліпідів — мембранні фосфоліпіди. Введення фосфокреатиніну перед оклюзією коронарної артерії запобігає накопиченню лізофосфогліцеридів і ряду інших продуктів деградації фосфоліпідів в зоні ішемії. В ряді робіт доведено, що екзогенний фосфокреатинін має антиаритмічну активність, запобігає розвитку фібриляції шлуночків в умовах експериментальної гострої ішемії міокарда.
Дослідження фармакокінетики фосфокреатиніну показали, що внутрішньовенне введення препарату супроводжується швидким зникненням його з крові. При цьому перша фаза введення характеризується часом напіввиведення 5–7 хв, а друга фаза — близько 50 хв. Позаклітинний фосфокреатинін не може підтримувати внутрішньоклітинний енергетичний метаболізм у зв’язку з низькою швидкістю проникнення в клітину, але може мати значення в збереженні деяких сарколемальних пулів фосфокреатиніну чи АТФ. Екзогенний фосфокреатинін здатний стабілізувати мембрану після приєднання до її зовнішньої поверхні без проникнення в клітини.
Введення фосфокреатиніну хворим із гострим ІМ супроводжувалося інгібуванням процесів перекисного окинення ліпідів, зниженням кортизолеми, що відображає зменшення органічних уражень клітинних мембран, викликаних гіпоксією та стресом.
У ряді досліджень підтверджена можливість використання фосфокреатиніну як ефективного лікарського засобу для лікування гострого ІМ з метою обмеження зони некротизованого міокарда, зниження частоти розвитку загрозливих для життя порушень ритму, СН, розривів серця, з можливою тенденцією до зниження летальності. Виявлено, що застосування фосфокреатиніну не пізніше 6 год від початку гострого ІМ має потужну антиаритмічну дію як на ішемічні, так і на реперфузійні порушення ритму. Основними проявами кардіопротекторної дії екзогенного фосфокреатиніну при гострому ІМ вважалося зменшення обсягу ішемічного ураження та підвищення скоротної здатності серцевого м’яза. Застосування фосфокреатиніну у вищих дозах (до 80 г/добу) зумовлювало значне поліпшення клінічного перебігу гострого ІМ, ускладненого набряком легень і кардіогенним шоком. Дані багатоцентрових італійських досліджень щодо застосування фосфокреатиніну при гострому ІМ показали швидку нормалізацію сегмента ST і значне зменшення вираженості шлуночкових аритмій у групі хворих, які одержували фосфокреатинін, вже протягом 1-ї години після появи симптомів гострого ІМ. Ці ж автори відзначили зниження ступеня вираженості асинергії ЛШ за даним двомірної ехокардіографії, наявність статистично значимого зменшення вимивання КФК-МВ, сумарної глибини зубця Q на ЕКГ після закінчення лікування фосфокреатиніном.
Згідно з результатами проведених нами досліджень у хворих із гострим ІМ при застосуванні фосфокреатиніну вірогідно раніше наставала нормалізація рівня КФК і КФК-МВ, рідше реєструвалися затяжні та багатопікові форми кривих активності КФК-МВ, що призводило до зменшення маси некротизованого ураження міокарда і свідчило про кардіопротекторну дію препарату. Це дозволяло обмежувати процеси раннього ремоделювання порожнини ЛШ, підтримувати систолічну функцію міокарда. Обмеження зони некрозу під впливом фосфокреатиніну, очевидно, забезпечується поліпшенням мікроциркуляції, стабілізацією мембран життєздатних кардіоміоцитів і збереженням внутрішньоклітинного пула АТФ.
Наведені дані свідчать як про перспективність застосування фосфокреатиніну при гострому ІМ, так і про необхідність подальших досліджень щодо виявлення місця фосфокреатиніну серед інших кардіоактивних фармакологічних препаратів. Захист ішемізованого міокарда за допомогою фосфокреатиніну може підвищити ефективність лікування хворих із гострим ІМ.
Ліпін
Основу будови мембрани, що відмежовує клітину та її органели від навколишнього середовища і є матриксом для занурених у неї білкових молекул, становить ліпідний біошар. В умовах ішемії та реперфузії його функції порушуються. В експериментальних роботах вивчена руйнуюча мембрану дія фосфоліпаз, які перетворюють нормальні ліпіди мембрани в детерговані. Тому цілком обґрунтоване використання фосфоліпідів, головних компонентів ліпідного біошару, для заміщення виникаючих дефектів, що приводить до відновлення порушеної бар’єрної функції мембран і стабілізації мембранних білків. Одним із препаратів, здатних відновлювати функціональну активність уражених мембран шляхом введення компонентів ліпідного шару, є ліпін, препарат на основі природного фосфатидилхоліну, — суспензія одношарових фосфатидилхолінових ліпосом у фізіологічному розчині.
У роботах останніх років показано, що лецитинові ліпосоми проявляють антиоксидантну, антигіпоксичну дію та сприяють підтримці енергетичного метаболізму тканин, що перебувають у стані гіпоксії. В умовах експериментального гострого ІМ на фоні застосування ліпіну відзначали стабілізацію мембран кардіоміоцитів, зменшення структурних уражень внутрішньоклітинних органел і контрактурних скорочень міофібрил. Застосування препарату сприяло зменшенню зони некрозу та частоти розвитку порушень ритму. Ці ефекти могли б істотно покращати клінічний перебіг гострого ІМ, проте на сьогодні не існує досить переконливих доказів клінічної ефективності використання ліпіну у хворих із гострим ІМ.
Триметилгідразинія пропіонат
Певний теоретичний та клінічний інтерес становить препарат триметилгідразинію пропіонат — засіб, що впливає на метаболічну ланку трансформації ішемії клітини в її некроз.
При ішемії гліколіз і глікогеноліз — найбільш енергетично вигідні шляхи синтезу АТФ, але утилізація обмеженої кількості кисню, що надходить в зону ішемії, здійснюється головним чином за рахунок окиснення вільних жирних кислот. Це відбувається внаслідок підвищення їх вмісту в плазмі крові внаслідок посилення ліполізу (стрес, застосування гепарину).
Таким чином, тісний зв’язок функції міокарда та стану енергетичного обміну при ішемії і ре-перфузії теоретично може зумовити можливість застосування триметилгідразинію пропіоната, в основі дії якого лежить стимуляція окиснення глюкози шляхом пригнічення окиснення вільних жирних кислот в результаті зменшення їх транспорту в мітохондріях.
За даними малочислених експериментальних робіт триметилгідразинія пропіонат сприяє зменшенню маси вогнища некрозу, проявляє вазодилативну дію на коронарні й периферичні артерії, має антиішемічний ефект, зменшує електричну нестабільність міокарда.
Незважаючи на теоретичне обґрунтування доцільності його застосування при СН і у хворих із гострим ІМ, на сьогодні не існує переконливих доказів (досліджень) його застосування у клінічній практиці кардіолога (на відміну від неврології). При цьому, попри бажання ряду клініцистів рекомендувати препарат для призначення хворим з СН і гострим ІМ, вважаємо це передчасним.
Рекомендації з профілактичної терапії в гострій фазі ІМ наведені в табл. 1.15.
Таблиця 1.15. Засоби базисної терапії в гострій фазі ІМ
| Рекомендації |
| Ацетилсаліцилова кислота 150–250 мг (форма без оболонки) |
| Пероральний блокатор β-адренорецепторів всім пацієнтам без протипоказань |
| Пероральний інгібітор АПФ у 1-й день захворювання всім пацієнтам без протипоказань |
| Нітрати за наявності постінфарктної ішемії чи лівошлуночкової недостатності |
| Клопідогрел у пацієнтів, яким проведено реперфузійну терапію |
ВЕДЕННЯ ХВОРИХ З ОСОБЛИВИМИ ТИПАМИ ІНФАРКТУ
Інфаркт ПШ
Діагностика інфаркту ПШ має важливе значення, оскільки це захворювання може проявлятися кардіогенним шоком, але стратегія лікування відрізняється від такої при шоці в результаті тяжкої дисфункції ЛШ. ІМ ПШ можна запідозрити за наявності специфічної клінічної тріади, коли гіпотензія, чисті легеневі поля і підвищення тиску в яремних венах визначають у пацієнтів з інфарктом нижньої локалізації. Елевація сегмента ST у відведенні V4R дозволяє запідозрити інфаркт ПШ; реєстрацію ЕКГ у цьому відведенні необхідно обов’язково здійснювати у всіх випадках шоку, а можливо, рутинно. Поява зубців Q та запідозрити діагноз інфаркту ПШ. При ехоКГ-дослідженні типовими для інфаркту ПШ є такі ознаки: дилатація, гіпокінез або акінез ПШ, дилатація правого передсердя, поява вираженої трикуспідальної регургітації в результаті дилатації трикуспідального кільця (рис. 1.36).

Рис. 1.36. Трикуспідальна регургітація (імпульсно-волнова допплєрографія)
Якщо інфаркт ПШ відіграє роль у виникненні гіпотензії або шоку, важливо підтримувати пере-днавантаження ПШ. За можливістю бажано уникати застосування засобів із вазодилатуючою дією, зокрема опіоїдів, нітратів, діуретиків та інгібіторів АПФ. У багатьох випадках ефективне внутрішньовенне навантаження рідиною. Інфаркт ПШ часто ускладнюється фібриляцією передсердь. Це порушення ритму необхідно швидко усувати шляхом проведення кардіоверсії, оскільки передсердя вносить істотний внесок у наповнення ПШ. Подібним чином у разі виникнення блокади серця слід здійснити двокамерну кардіостимуляцію, незважаючи на підвищення ризику індукованої катетером фібриляції шлуночків. Деякому сумніву піддавали ефективність фібринолітичної терапії при інфаркті ПШ, але вона безперечно показана у пацієнтів із гіпотензією. Інший можливий шлях — пряма ПКВ, що здатна швидко поліпшити показники гемодинаміки.
ІМ у хворих на цукровий діабет
Приблизно четверта частина всіх пацієнтів з ІМ хворіють на цукровий діабет, надалі цей показник може підвищитися. Слід зазначити, що пацієнти з цукровим діабетом можуть звертатися з атиповими симптомами, досить частим ускладненням у них є СН. У пацієнтів з ІМ на фоні цукрового діабету смертність у 2 рази вища, ніж у пацієнтів без діабету (рис. 1.37).
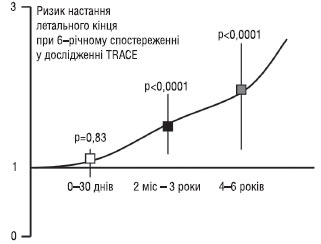
Рис. 1.37. Вплив цукрового діабету на прогноз при гострому ІМ
Незважаючи на той факт, що лише деякі з препаратів, що застосовуються в гострий період ІМ, прямо протипоказані хворим на цукровий діабет, слід визнати, що пацієнти з цукровим діабетом у реальній практиці не одержують такого ж активного лікування, як інші хворі з гострим ІМ. Попри це, діабет не є протипоказанням для проведення фібринолітичної терапії, навіть за наявності ретинопатії. Відзначено, що застосування блокаторів β-адренорецепторів та інгібіторів АПФ у них може бути навіть більш ефективним, ніж у пацієнтів без діабету, а ризик виникнення ускладнень незначний порівняно з користю лікування (рис. 1.38).
Гостра фаза захворювання часто характеризується погіршенням контролю метаболічних показників, а гіперглікемія є незалежним предиктором смертності. Показано, що суворий контроль рівня глікемії шляхом внутрішньовенного застосування суміші глюкоза–інсулін як у хворих з діабетом I, так і II типу з подальшою терапією багаторазовими дозами інсуліну здатний знизити летальність при тривалому спостереженні.
ВЕДЕННЯ ХВОРИХ ІЗ СПЕЦИФІЧНИМИ ВНУТРІШНЬОГОСПІТАЛЬНИМИ УСКЛАДНЕННЯМИ
Тромбоз глибоких вен і емболія легень
Ці ускладнення нині діагностують відносно нечасто, крім випадків тривалого постільного режиму у зв’язку з виникненням СН. Запобігти цьому ускладненню можна шляхом застосування низькомолекулярного гепарину у профілактичних дозах. Лікування здійснюють терапевтичними дозами низькомолекулярного гепарину, після чого протягом 3–6 міс продовжують терапію пероральними антикоагулянтами.
Внутрішньошлуночковий тромб і системна емболія
При ехоКГ-дослідженні в порожнині шлуночків можуть виявлятися тромби, особливо у пацієнтів з обширним інфарктом передньої локалізації (рис. 1.39). Якщо тромби мобільні або виступають у порожнину шлуночків, спочатку слід призначити внутрішньовенно нефракціонований або низько молекулярний гепарин (НМГ), пізніше — пероральні антикоагулянти протягом принаймні 3–6 міс.
Перикардит
ІМ може ускладнюватися гострим перикардитом, що асоціюється з погіршенням прогнозу. При перикардиті виникає біль у грудній клітці, який може бути помилково інтерпретований як рецидив інфаркту чи рання постінфарктна стенокардія. Особливість болю — його різкий, колючий характер, зв’язок із положенням тіла та фазами дихання. Діагноз підтверджують за наявності шуму тертя перикарда. При вираженому больовому синдромі застосовують пероральну чи внутрішньовенну форму ацетилсаліцилової кислоти у високих дозах, НПЗП або ГКС. Геморагічний випіт у перикард з виникненням тампонади серця відзначають нечасто; його виникнення може бути пов’язане з антикоагулянтною терапією. Зазвичай виявляють методом ехоКГ. При виражених розладах гемодинаміки здійснюють перикардіоцентез.
Пізні шлуночкові аритмії
Шлуночкова тахікардія і фібриляція шлуночків, які виникають протягом 1-го дня захворювання, мають низьку цінність для передбачення зворотних аритмій. При більш пізньому виникненні аритмії можуть відновлюватися і асоціюються з високим ризиком смерті. Шлуночкові тахікардія або фібриляція шлуночків протягом першого тижня після ІМ асоціюються з більш розповсюдженим ураженням міокарда; слід завжди здійснювати ретельну оцінку анатомії коронарних артерій і функції шлуночків. При високій імовірності індукції аритмії на фоні ішемії необхідно розглянути можливість реваскуляризації методом ПКВ або шляхом хірургічного втручання. Якщо це малоімовірно, існує можливість застосування інших терапевтичних підходів, у тому числі комбіноване призначення блокаторів β-адренорецепторів, аміодарону, інгібіторів АПФ, статинів, або імплантація дефібрилятора (у хворих з низкою ФВ).
Постінфарктна стенокардія та ішемія
Стенокардія — зворотна чи індукована ішемія — в ранній постінфарктний період потребує наступного обстеження.
Рутинна ПКВ за відсутності спонтанної чи індукованої ішемії не поліпшує функції ЛШ та виживання. Проте при лікуванні стенокардії — зворотної чи індукованої ішемії, зумовленої реоклюзією чи залишковим стенозом, певне значення має реваскуляризація (ПКВ чи хірургічне шунтування коронарних артерій), яка також може бути корисною при лікуванні аритмій, асоційованих зі стійкою ішемією (рис. 1.40). Хоча в декількох дослідженнях показано, що прохідність коронарної артерії, яка зумовила інфаркт, є маркером сприятливого тривалого прогнозу, немає даних про те, що пізня ПКВ з єдиною метою поновлення прохідності судини впливає на пізні події. Це питання вивчається на сьогодні у рандомізованих дослідженнях.

Рис. 1.40. Ураження коронарних судин як причина ранньої постінфарктної стенокардії
Хірургічне шунтування коронарних артерій може бути показане, якщо симптоми не коригуються іншими засобами або якщо при коронарній ангіографії виявляють стеноз стовбура лівої коронарної артерії чи трисудинне ураження зі зниженою функцією ЛШ, при яких хірургічне лікування поліпшує прогноз.
Фізична активність у пацієнтів із гострим ІМ
Пацієнтам з ураженням ЛШ рекомендовано постільний режим протягом перших 2-3 діб. До цього часу стає очевидною ймовірність ускладнення інфаркту. При неускладнених випадках пацієнт може починати сідати на 3-тю добу, йому дозволяють самообслуговування і самостійний прийом їжі. На 5-ту добу хворим дозволяють стояти, на 7-му — ходити по палаті. Розширення фізичного режиму починають з 2-го тижня, збільшуючи довжину ходи на 50–75–100 м/добу, а з 12-ї доби починають освоювати підйом по сходах (по 2 сходинки на день). Якщо ІМ ускладнювався СН, шоком або тяжкими аритміями, слід продовжувати постільний режим. У цьому разі розширення фізичної активності має здійснюватися повільніше, залежно від симптомів і поширення ураження міокарда.
ОЦІНКА РИЗИКУ У ХВОРИХ З ГОСТРИМ ІМ
Строки
Клінічна картина перебігу гострого періоду ІМ значною мірою визначає подальший прогноз. Одні з найчастіших причин смерті в постінфарктний період — шлуночкові тахіаритмії та раптова кардіальна смерть. У 2001 р. Європейське товариство кардіологів у співпраці з АНА і АСС випустило рекомендації щодо профілактики раптової смерті. Зазначені в цих рекомендаціях маркери ризику раптової смерті (разом зі ступенем їх доказовості) наведені в табл. 1.16.
Таблиця 1.16. Маркери ризику розвитку раптової смерті після гострого ІМ (рекомендації Європейського товариства кардіологів, 2006)
| Маркери ризику |
| Анамнестичні фактори ризику |
| ФВ ЛШ |
| Зниження варіабельності ритму серця |
| КДО ЛШ |
| Шлуночкова екстрасистолія |
| Епізоди шлуночкової тахікардії |
| ЧСС у спокої (>70 уд./хв) |
| ППШ |
| Тривалість інтервалу Q–T |
| Результати ЕФД |
| Динаміка зубця T на ЕКГ |
| Турбулентність серцевого ритму |
| «Відкрита» коронарна артерія, що зумовила інфаркт |
Крім того, велике значення на сьогодні приділяють оцінці маркерів системного запалення, оскільки участь запальної реакції в патогенезі гострого коронарного синдрому на сьогодні не підлягає сумніву. Зокрема, велике значення надають підвищенню у крові рівня інтерлейкінів (ІЛ)-1β, -6 та -8 і ФНП-α, що асоціюється з вираженим прогресуванням дисфункції ЛШ. В експериментальних роботах відзначена пряма негативна інотропна та кардіодепресивна дія ІЛ-1β, -6 і ФНП-α. Виявлено, що значний вплив на динаміку формування некротичного вогнища і подальшої дилатації порожнини ЛШ має запальна реакція організму, що супроводжує процес некрозу міокарда. Запальна реакція при виникненні некрозу зумовлена необхідністю заміщення загиблих кардіоміоцитів сполучною тканиною. Разом з тим, запальна реакція може збільшувати ішемічне та реперфузійне ураження міокарда та спричиняти поширення зони некрозу. Виражена активація нейтрофільних гранулоцитів при гострому ІМ впливає на функцію міокарда. Видалення нейтрофільних гранулоцитів з крові або додавання субстанцій, що інгібують лейкоцитарну інфільтрацію, у дослідженнях на тваринах сприяє зменшенню розмірів ІМ. В експерименті доведена пряма ушкоджуюча дія на міокард іншого маркера системного запального процесу — СРБ. Результати досліджень останніх років показали значення тривалого підвищення рівня СРБ у гострий період ІМ для розвитку та прогресування дилатації порожнини ЛШ, дисфункції ЛШ. Згідно з сучасними даними СРБ активує систему комплементу, а кінцевим продуктом цього є комплекс, що атакує мембрану кардіоміоцитів і викликає порушення її функції зі зміною іонної проникності, підвищення внутрішньоклітинної концентрації кальцію і загибель клітин.
Після гострого ІМ важливо виявити пацієнтів з високим ризиком виникнення віддалених подій, таких як реінфаркт і смерть. Бажано вчасно провести втручання для запобігання цих подій. Оскільки ризик виникнення подій знижується з часом, бажано здійснювати ранню оцінку ризику. Клінічне обстеження, оцінка розміру інфаркту та функції ЛШ у спокої необхідно здійснювати протягом перших 24–48 год, але час подальшого обстеження залежатиме від особливостей оснащення медичного закладу. Традиційно пробу з максимальним навантаженням на велоергометрі чи тредмілі виконують протягом 6 тиж для виявлення індукції ішемії. Більш новими засобами ранньої оцінки ризику є ехоКГ з добутаміном. Цей метод дозволяє розрізняти ішемію у віддалених ділянках, а також у життєздатному міокарді, що зберігається в зоні інфаркту. Стрес-ехокардіографію можна виконувати на 2-му тижні захворювання при неускладненому перебігу інфаркту та можна використовувати для оцінки необхідності проведення коронарної ангіографії та корекції медикаментозної терапії. Якщо первинне коронарне втручання (ангіопластика/ стентування) закінчилося успішно, рання оцінка ризику має менше значення. В цьому разі можна допустити, що ураження коронарної артерії, яка спричинила інфаркт, вдалося усунути і стабілізувати, основна проблема полягає у виявленні індукованої ішемії в інших басейнах. Цим пацієнтам доцільно здійснити стрес-тестування в амбулаторних умовах через 6 тиж з використанням ЕКГ або методів візуалізації серця. Велике значення у стратифікації ризику коронарних подій і раптової смерті надають останнім часом таким неінвазивним методикам, як холтерівське моніторування ЕКГ, аналіз варіабельності серцевого ритму, двомірна ехоКГ в динаміці захворювання; досліджують методики аналізу порушень деполяризації та реполяризації.
Клінічна оцінка і подальші обстеження
На рис. 1.41 наведено алгоритм оцінки ризику після ІМ, а в табл. 1.17 — показання для методів візуалізації. Клінічними індикаторами високого ризику в гострій фазі є АГ, стійка СН, злоякісні аритмії, стійкий біль у грудній клітці чи рання стенокардія при мінімальному навантаженні. Пацієнти із цими клінічними маркерами переважно старшого віку, частіше мають декілька факторів ризику, перенесений у минулому ІМ і є кандидатами для ранньої коронарної ангіографії (див. табл. 1.16).
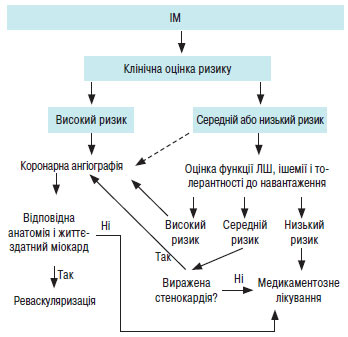
Рис. 1.41. Алгоритм оцінки ризику після ІМ
Таблиця 1.17. Резюме рекомендацій щодо візуалізації та навантажувальних тестів
| Обстеження | При вступі | Протягом 48 год | Перед випискою | Після виписки1 |
| ЕхоКГ у спокої | Якщо необхідно для встановлення діагнозу | Для оцінки функції ЛШ і наявності тромбів | Для оцінки функції ЛШ, СН або нового шуму2 | |
| Стрес-ехоКГ | Для оцінки життєздатного міокарда та ішемії3 | Якщо не проведена перед випискою або після первинної ПКВ | ||
| Стрес-ЕКГ | Для оцінки ішемії міокарда | Якщо не проведена перед випискою або після первинної ПКВ | ||
| Коронарна ангіографія | Якщо необхідно для первинної ПКВ | Коли є клінічні ознаки високого ризику | Коли візуалізація дозволяє виявити ознаки високого ризика, середнього ризику з симптомами або коли симптоми не проходять |
1Перевага віддається ранній оцінці ризику;
2ехокардіографія у спокої показана при будь-якій стадії СН, шоку чи появі нового шуму;
3вибір оптимального методу залежить від місцевих можливостей, але перевага віддається візуалізації.
Якщо під час ангіографії анатомія коронарного русла відповідно підходить для втручання і є ознаки ішемізованого життєздатного міокарда, показана реваскуляризація.
Для пацієнтів без клінічних маркерів високого ризику характерний більш низький рівень ризику, але серед них є такі, у яких події трапляються пізніше, тому їм показана така стратифікація ризику. Хоча цим пацієнтам часто виконують коронарну ангіографію, доцільно почати з неінвазивного обстеження. По закінченні гострої фази ІМ прогноз тісно пов’язаний зі ступенем дисфункції ЛШ, поширеністю і тяжкістю залишкової ішемії. Обидва ці параметри можна оцінити методами перфузійної сцинтиграфії міокарда або ехоКГ. ФВ і КСО — виражені предиктори смертності, а у пацієнтів з порушеною функцією ЛШ перфузійна візуалізація особливо корисна, оскільки життєздатний, але ішемізований міокард може стати субстратом для таких серцевих подій.
Ступінь ризику високий у пацієнтів, ФВ яких за даними візуалізації серця становить <35% або у хворих з великою або глибокою індукованою ішемією, з ураженням >50% іншого життєздатного міокарда. Цим пацієнтам необхідно виконувати коронарну ангіографію, їх ведуть так само, як пацієнтів із високим ступенем ризику, що оцінювався лише за клінічними критеріями.
Ступінь ризику низький у пацієнтів, ФВ яких за даними візуалізації серця становить >50% або у пацієнтів з обмеженою чи незначно індукованою ішемією і ураженням <20% іншого життєздатного міокарда, особливо при виникненні ішемії в зоні інфаркту, а не у віддаленій зоні. Цих пацієнтів можна лікувати медикаментозно, крім випадків, коли втручання необхідне для усунення симптомів.
Пацієнтів, які за критеріями візуалізації не належать до високого чи низького ризику, можна вести залежно від клінічних симптомів. Наприклад, пацієнти зі стійкою стенокардією, що адекватно не контролюється медикаментами, є кандидатами для проведення коронарної ангіографії і можливого подальшого втручання. Водночас пацієнтів із мінімальними чи контрольованими симптомами можна починати лікувати медикаментозно.
Всім пацієнтам необхідно здійснити оцінку метаболічних маркерів ризику, включаючи рівні загального ХС, ХС ЛПНЩ і ЛПВЩ, ТГ натще, а також глюкози плазми крові.
Оцінка життєздатності міокарда, оглушення та гібернація
Оцінка життєздатності міокарда і визначення ішемії після перенесеного інфаркту — взаємодоповнюючі завдання, оскільки лише життєздатний міокард може бути ішемізованим, а з метою вирішення цих завдань використовують подібні методи візуалізації серця. Дисфункція ЛШ після гострого ІМ може бути зумовлена некрозом, оглушенням життєздатного міокарда в зоні інфаркту, гібернацією життєздатного міокарда чи всіма трьома причинами. Просте оглушення має проходити протягом 2 тиж після гострого ішемічного ураження, якщо зникає ішемія. При збереженні ішемії затяжне оглушення переходить у гібернацію, коли для поновлення функції потрібна реваскуляризація. Ці концепції мають найбільше значення у пацієнтів із тяжким ураженням функції ЛШ після гострого ІМ, коли вирішується потреба у реваскуляризації з метою поліпшення функції. Значення цього зменшується для пацієнтів, у яких симптоми дисфункції ЛШ не домінують.
Існує кілька методів оцінки життєздатності міокарда. Для початкового обстеження найпоширенішим є стрес-ехокардіграфія з добутаміном.
Результати проведення стрес-ехоКГ після ІМ достатньо точно продемонстрували вплив на віддалений прогноз виявлення оглушеного і гібернованого міокарда. Також за наявності життєздатного та відсутності ішемізованого міокарда після гострого ІМ, при пробі з добутаміном і атропіном, визначали практично 100% виживаність хворих протягом 12 міс, тоді як за відсутності життєздатного міокарда будь-якого типу виживаність знижується до 94%, а за наявності лише ішемізованого міокарда — до 90%. У хворих із дисфункцією ЛШ після перенесеного гострого ІМ та виявленою при стрес-ехоКГ із добутаміном ішемії міокарда як при двофазній реакції, так і при елевації сегмента ST під час проби є можливість відновлення функції та геометрії ЛШ шляхом реваскуляризації міокарда.
Оцінка ризику аритмії
У пацієнтів з імовірно високим ризиком порушень ритму доцільне проведення холтерівського моніторування ЕКГ та неінвазивних ЕФД. Прогностичне значення у пацієнтів у постінфарктний період мають показники варіабельності серцевого ритму, чутливості барорефлексу та пізні потенціали. Проте необхідний додатковий клінічний досвід для того щоб визначити, наскільки ці дослідження додають діагностичної інформації у порівнянні зі звичайними прогностичними тестами. Попередні результати дослідження MADIT II (2002) свідчать про поліпшення прогнозу виживаності при імплантації дефібрилятора у пацієнтів після перенесеного раніше ІМ з ФВ <30%, незалежно від результатів ЕФД.
ЛІКУВАЛЬНО-ПРОФІЛАКТИЧНІ ЗАХОДИ В ПОСТІНФАРКТНИЙ ПЕРІОД
Мета лікувально-профілактичних заходів у постінфарктний період — відновити максимально повноцінне життя пацієнта, включаючи повернення до праці. Під час проведення реабілітації необхідно враховувати фізичні, психологічні та соціально-економічні фактори. Реабілітація показана пацієнтам з тяжкою дисфункцією ЛШ. Процес слід починати якомога раніше після госпіталізації і продовжувати протягом наступних тижнів і місяців. Детальний розбір принципів і методів реабілітації наведено у спеціальних доповідях відповідної робочої групи Європейського товариства кардіологів. Медикаментозне ведення постінфарктного періоду, або вторинна медикаментозна профілактика ІМ, детально розглянуто вище.
Психологічні та соціально-економічні аспекти
У пацієнтів із гострим ІМ майже завжди виникає почуття тривоги. Тому пацієнта необхідно заспокоїти і пояснити суть захворювання. Важливо також запобігти появі депресії та дратівливості, які частіше з’являються після повернення додому. Варто визнати поширеність феномену заперечення; в гострій фазі захворювання це має захисний ефект, але надалі може утруднювати сприйняття діагнозу (рис. 1.42 і 1.43).

Рис. 1.42. Поширеність ендогенної депресії при ІХС

Рис. 1.43. Вплив ендогенної депресії на перебіг гострого ІМ та постінфарктного періоду
Наявність у хворого типу особистості D може вплинути на клінічний перебіг у пацієнтів з порушеною функцією ЛШ після ІМ, а зниження емоційного навантаження під час реабілітаційної програми — поліпшити прогноз. Перед випискою з госпіталю необхідно обговорити питання про повернення до роботи та поновлення інших видів активності. У деяких випадках розвитку депресивного стану доцільно призначення лікування антидепресантами без проаритмогенного ефекту.
Поради щодо способу життя
Під час госпіталізації слід обговорити з пацієнтами та їх партнерами можливі причини ІХС, дати індивідуальні поради щодо способу життя (режиму та характеру харчування, контролю маси тіла, тютюнопаління та фізичних навантажень).
Фізична активність
Всім пацієнтам необхідно дати рекомендації щодо фізичної активності залежно від перебігу відновлюваного періоду після серцевого нападу, беручи до уваги вік, рівень активності до інфаркту і фізичні обмеження. Важливим елементом, що допомагає прийняти отпимальне рішення, є навантажувальна проба перед випискою, що не лише надає корисну клінічну інформацію, але й дозволяє заспокоїти занадто тривожного пацієнта. Метааналіз реабілітаційних програм, виконаних у період до впровадження методів реперфузії, які передбачали включення навантажень, дозволяє допустити істотне зниження летальності. Слід визнати, що крім впливу на летальність, навантажувальна реабілітація може мати інші сприятливі ефекти, зокрема сприяти розвитку колатералей. Відомі дані про поліпшення толерантності до навантаження, загального стану серцево-судинної системи, принаймні під час активного періоду тренувань, навіть у пацієнтів похилого віку. Зокрема, у дослідженні ETICA регулярне фізичне тренування помірної інтенсивності у пацієнтів з ІХС після проведення коронарної ангіопластики привело до підвищення обсягу переносимого навантаження та зменшення частоти кардіальних подій надалі без істотного впливу на динаміку прохідності прооперованої судини. Цілком логічно, що позитивний ефект від фізичного тренування зумовлений поступовим пристосуванням метаболізму міокарда до ішемічних умов, а не припиненням прогресування атеросклерозу. Рекомендована частота навантажень для досягнення значимого підвищення функціонального стану становить 3–5 рази на тиждень. Кожне підвищення фізичної працездатності на одну сходинку асоціюють зі зниженням ризику летального кінця від всіх причин на 8–14%. Отже, після оцінки ризику всім пацієнтам, які перенесли ІМ з тяжкою дисфункцією ЛШ, слід порадити взяти участь у реабілітаційній програмі.
ЛІТЕРАТУРА
-
- ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society (2006) Eur. Heart J., 27(17): 2099—2140.
- Antman E.M., Hand M., Armstrong P.W. et al. (2007) Focused update of the ACC/ AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Group to Review New Evidence and Update the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction). Circulation. 2008; 117: 296—329.
- Bjorn Dahlof, Peter S. Sever, Neil R. et al. (2005) Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet, 366: 895-906.
- Boden W. van Gilst W.H., Scheldewaert R. et al. (2000) Diltiazem in acute myocardial infarction treated with thrombolytic agents: a randomised placebo-controlled trial. Lancet, 355: 1751-1756.
- Cohen M., Antman E.M., Gurfinkel E. et al. (2000) Impact of enoxaparin low molecular weight heparin in patients with Q-wave myocardial infarction. Am. J. Cardiol, 86: 553—556, A9.
- Eric J. Topol. (2005) Acute Coronary Syndromes. Marcel Dekker Inc.
- Goldbourt U., Behar S., Reicher-Reiss H. et al. (1993) Early administration of nifedipine in suspected acute myocardial infarction. The Secondary Prevention Reinfarction Israel Nifedipine Trial 2 study. Arch Intern Med,153: 345-353.
- Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels (1998) N. Engl. J. Med., 339: 1349-1357.
- Mezilis N.E., Partenakis F.I., Kanakaraki M.K. et al. (2000) Dobutamine- vs exercise-induced ST segment elevation early after Q wave myocardial infarction. Prediction of functional recovery after revascularization. Eur. Heart J., 21: 814-822.
- Nieminen M.S., Moiseyev V.S., Andrejevs N. et al. (1999) Randomized study on safety and effectiveness of levosimendan in patients with left ventricular failure after an acute myocardial infarction (RUSSLAN Trial). Circulation, 100 (18 Sup-pl. I): I-646.
- Pfeffer M.A., McMurray J.J.V., Velazques E.J. et al. (2003) Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N. Engl. J. Med., 349: 1893-1906.
- Rubins H.B., Robins S.J., Collins D. et al. (1999) Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N. Engl. J. Med., 341: 410-418.
- Sabatine M.S, Cannon C.P, Gibson C.M. et al. (2005) Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N. Engl. J. Med., 352: 1179-1189.
- Sica D.A. (2004) EUROPA: has anything new been learned with angiotensinconverting enzyme inhibitors? J. Clin. Hypertens. (Greenwich), 6(2): 91-95.
- Silber S., Albertsson P., Aviles F.F. et al. (2005) Guidelines for percutaneous coronary interventions: the task force for percutaneous coronary interventions of the European Society of Cardiology. Eur. Heart J., 26: 804-847.
- Stenestrand U., Wallentin L. (2002) Early revascularization and 1-year survival in 14-day survivors of acute myocardial infarction: a prospective cohort study. Lancet, 359: 1805-1811.
- Streppel M.T., Arends L.R., van’t Veer P. et al. (2005) Dietary fiber and blood pressure: a meta-analysis of randomized placebo-controlled trials. Arch Intern Med., 165: 150-156.
- Task Force on Acute Heart Failure of the European Society of Cardiology. Guidelines on the diagnosis and treatment of acute heart failure (2005) Sophia Antipo-lis (FR): European Society of Cardiology, 36 p.
- The Assessment of the Safety and Efficacy of a New Thrombolytic Agent-3 (ASSENT-3) investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab or unfractionated heparin: the ASSENT-3 randomised trial in acute myocardial infarction (2001) Lancet, 358: 605-613.
- The Heart Outcomes Prevention Evaluation Study Investigators: Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients (2000) N. Engl. J. Med., 342: 145-153.
- The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology: Frans Van de Werf, Chair, Diego Ardissino, Amadeo Betriu, Dennis V. Cokkinos, Erling Falk, Keith A.A. Fox, Desmond Julian, Maria Lengyel, Franz-Josef Neumann, Witold Ruzyllo, Christian Thygesen, S. Richard Underwood, Alec Vahanian, Freek W.A. Verheugt, William Wij ns. Management of acute myocardial infarction in patients presenting with ST-segment elevation (2003) Eur. Heart J., 24: 28-66.
- van Es R.F., Jonker J.J.C., Verheugt F.W.A. et al. (2002) Aspirin and coumadin after acute coronary syndromes (the ASPECT-2 study): a randomised controlled trial. Lancet, 360: 109-113.
- Widimsky P., Budesinsky T., Vorac D. et al. (2003) Long distance transport for primary angioplasty vs immediate thrombolysis in acute myocardial infarction. Final results of the randomized national multicenter trial-PRAGUE-2. Eur. Heart J., 24: 94-104.
- Yusuf S., Mehta S.R. et al. (2006) Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA, 295(13): 1579-1580.
- Zj lstra F., Hoorntje J.C.A., DeBoer M.-J. et al. (1999) Long-term benefit of primary angioplasty as compared with thrombolytic therapy for acute myocardial infarction. N. Engl. J. Med., 341: 1413-1419.