ВИЗНАЧЕННЯ
СН називають патофізіологічний стан, при якому серце внаслідок порушення своєї насосної функції не може задовольняти потреби метаболізму тканин.
Зазначений стан може проявлятися клінічними ознаками ХСН або ГСН і асоціюється з підвищеним ризиком смерті таких пацієнтів.
Перелік основних термінів, які часто вживаються для опису різних клінічних форм або варіантів СН, у діючій МКХ-10 відповідає рубрикам I50.0, I50.1, I50.9.
I50.0. Застійна серцева недостатність
Хвороба серця застійного характеру
Правошлуночкова недостатність (вторинна стосовно недостатності лівих відділів серця)
I50.1. Лівошлуночкова недостатність
Гострий набряк легень
Серцева астма
Недостатність лівих відділів серця
I50.9. Серцева недостатність без уточнення
Бівентрикулярна недостатність
Кардіальна, серцева або міокардіальна недостатність
За період після прийняття МКХ-10 (1992) з՚явилися нові клінічні терміни, що застосовуються в міжнародних рекомендаціях з діагностики і лікування СН. Сучасна термінологія, що вживається для характеристики клінічних особливостей різних категорій хворих із ХСН, наведена у відповідному розділі.
За визначенням Робочої групи по серцевій недостатності Української асоціації кардіологів (2006), ХСН — це клінічний синдром з прогресуючим характером, типовими рисами якого є зниження толерантності до фізичних навантажень, затримка в організмі рідини і обмеження тривалості життя.
ЕПІДЕМІОЛОГІЯ
За різними підрахунками Хронічна серцева недостатність на сьогодні хворіють щонайменше від 15 до 23 млн чоловік. За даними національних реєстрів різних країн середній (без врахування віку) показник поширеності ХСН у популяції коливається від 1 до 5%. Зазначені коливання можуть бути, зокрема, пов՚язані з відсутністю уніфікованих міжнародних епідеміологічних критеріїв СН. З віком поширеність СН прогресивно зростає. Так, за даними Фремінгемського дослідження поширеність СН серед чоловіків зростає від 0,8% у віковій категорії 50–59 років до 6,6% — у віці 80–89 років (у жінок від 0,8 до 7,9% відповідно).
Аналіз результатів довгострокового популяційного спостереження, здійсненого в рамках того ж Фремінгемського дослідження, показав, що ризик виникнення СН протягом життя становить 21% у чоловіків і 20% — у жінок і є істотним навіть за умови відсутності розвитку ІМ (11 і 15% відповідно).
Захворюваність — кількість випадків вперше діагностованої СН протягом року в популяції — згідно з різними даними становить від 150 до 500 випадків на 100 тис. населення (0,15–0,5%), причому серед осіб у віці понад 45 років цей показник кожні 10 років подвоюється. Зазначене вище Фремінгемське популяційне спостереження, тривалістю 40 років, показало, що захворюваність СН серед чоловіків підвищується від 0,3% у віковому проміжку 35–65 років до 1,2% у віці 85–94 роки, а серед жінок — від 0,2 до 0,9% відповідно.
Протягом останніх 30–40 років у Європі та Північній Америці, незважаючи на зниження смертності від серцево-судинних причин, відзначають постійне зростання розповсюдженості ХСН. У США кількість госпіталізацій з приводу СН за період з 1971–1994 рр. збільшилася в 4 рази, а кількість смертельних випадків внаслідок СН у період 1970–1993 рр. — у 3 рази. У наступні 20–30 років у Європі та Америці прогнозують ріст розповсюдженості ХСН на 30–40%, що пов՚язують з постійною тенденцією до збільшення питомої ваги населення старших вікових груп і збільшенням (внаслідок поліпшення лікування) тривалості життя пацієнтів із серцево-судинними захворюваннями та цукровим діабетом.
Прогноз хворих із клінічними проявами ХСН дуже серйозний, що відображає таку її фундаментальну ознаку, що як прогресуючий характер. За даними Фремінгемського дослідження (спостереження з 1948 по 1988 р.) середня тривалість життя з моменту встановлення діагнозу ХСН становила 1,7 року для чоловіків і 3,2 року для жінок, а показник 5-річної виживаності — 25 і 38% відповідно. Навіть у сучасних умовах (за даними Британії на 2001 р.) виживаність пацієнтів з клінічно маніфестованою ХСН протягом 5 років нижча, ніж у хворих із вперше діагностованими злоякісними епітеліальними пухлинами різних локалізацій, крім раку легені.
Клінічний прогноз ХСН тим гірше, чим вище ступінь її клінічної тяжкості. Так, показник смертності протягом 1 року у хворих із ХСН I–II ФК за NYHA становить 6–10%, зростаючи до 25–40% у хворих з тяжкою (IV ФК за NYHA) ХСН.
Пацієнти із симптомною ХСН, але відносно збереженою систолічною функцією ЛШ (ФВ <40–45%) характеризуються кращою (приблизно вдвічі — за даними 5-річного спостереження) виживаністю, ніж пацієнти з ХСН і зниженою ФВ ЛШ.
Кращу виживаність жінок порівняно із чоловіками з ХСН пояснюють декількома причинами, зокрема меншою поширеністю серед них ІХС, більшою часткою хворих зі збереженою систолічною функцією ЛШ і, можливо, кращими компенсаторними можливостями організму щодо протидії зниженню серцевого викиду.
Результати масштабних багатоцентрових плацебо-контрольованих клінічних досліджень свідчать (див. ЛІКУВАННЯ), що комбіноване застосування нейрогуморальних антагоністів (інгібітори АПФ або антагоністи рецепторів ангіотензину II, блокатори β-адренорецепторів, антагоністи альдостерону) дозволяє істотно знизити смертність хворих із клінічно маніфестованою ХСН до 6–10% на рік.
Лікування хворих з ХСН вимагає значних коштів, обсяг яких у країнах Західної Європи та Північної Америки становить 1–2% загальних витрат на охорону здоров’я; ⅔ цих засобів припадає на стаціонарне лікування хворих із ХСН, яких госпіталізують з приводу декомпенсації їх клінічного стану. Згідно з так званими фармакоекономічними підрахунками, вартість надання медичної допомоги пацієнтам із ХСН у країнах Західної Європи (Франція, Нідерланди, Німеччина, Бельгія) зростає пропорційно тяжкості їх клінічного стану, становлячи на рік для хворих I–II ФК у середньому 827 євро, III — 2029 євро і IV, клінічно найбільш тяжкого,— 13 994 євро. Відповідні підрахунки показали, що постійний прийом інгібіторів АПФ і блокаторів β-адренорецепторів хворими з ХСН, знижуючи ризик повторних госпіталізацій з приводу декомпенсації кровообігу, вимагає менше витрат, ніж повторні епізоди стаціонарного лікування, зумовлені неотриманням необхідної систематичної терапії зазначеними нейрогуморальними антагоністами.
Згідно з сучасними епідеміологічними і статистичними даними у хворих із ХСН 75–80% смертельних випадків мають кардіальну природу, причому приблизно в половині випадків вони відповідають критеріям раптової смерті, інша половина пацієнтів помирає від прогресуючої насосної СН. Інші 20–25% смертельних випадків серед хворих із ХСН доводиться на некардіальні причини, серед яких провідна роль належить пневмонії, ТЕЛА і мозковому інсульту.
Наведені дані свідчать про актуальність СН як медико-соціальної проблеми і обґрунтовують необхідність широкого впровадження сучасних стандартів її лікування та профілактики в нашій країні.
Фактори ризику
Епідеміологічні дослідження чітко продемонстрували провідну роль АГ і ІХС як популяційних факторів ризику СН (табл. 2.1). Втім, виділення ролі кожного із зазначених факторів у виникненні ХСН є проблематичним, оскільки АГ та ІХС співіснують приблизно у 40% таких хворих. За даними як епідеміологічних, так і сучасних багатоцентрових досліджень ХСН поєднана з ІХС у 60–65% хворих.
Таблиця 2.1
Популяційні фактори ризику розвитку ХСН серед осіб віком 40–89 років за даними Фремінгемського дослідження (за Levy D. et al., 1996)
| Фактор ризику | Розповсюдженість фактора ризику у популяції, % | Підвищення ризику порівняно з популяційним показником, % | ||
| чоловіки | жінки | чоловіки | жінки | |
| АТ ≥140/90 | 60 | 62 | 2,1 | 3,4 |
| ІМ | 10 | 3 | 6,3 | 6,0 |
| Стенокардія | 11 | 9 | 1,4 | 1,7 |
| Діабет | 8 | 5 | 1,8 | 3,7 |
| ГЛШ | 4 | 3 | 2,2 | 2,9 |
| Клапанні вади серця | 5 | 8 | 2,5 | 2,1 |
За останній час збільшилась кількість даних щодо більш вагомого, ніж це уявляли раніше, значення АГ як фактора ризику розвитку СН. Підкреслюється, що роль АГ як фактора ризику і каузальної причини клінічно наявної ХСН в епідеміологічних дослідженнях недооцінюється, оскільки при розвитку останньої раніше підвищений АТ у багатьох хворих знижується до норми внаслідок насосної неспроможності серця. Результати аналізу, проведеного Національним інститутом серця, легень і крові США, свідчать, що у 75% хворих із ХСН раніше відзначали АГ. Остання підвищує ризик розвитку СН пропорційно ступеню підвищення АТ, причому підвищення САТ є більш значимим відносно розвитку ХСН, ніж підвищення ДАТ, незалежно від віку і статі (табл. 2.2).
Таблиця 2.2
Структура підвищення АТ як фактора ризику розвитку СН (за Kannel W., 1996)
| Підвищення АТ | Вік 35–64 роки | Вік 65–94 роки | ||
| чоловіки | жінки | чоловіки | жінки | |
| САТ | 3,1* | 4,4 | 1,8 | 2,4 |
| ДАТ | 1,4 | 2,9 | 1,6 | 1,2 |
| Пульсового | 3,4 | 3,0 | 2,3 | 2,2 |
*Підвищення ризику порівняно з популяцією цієї вікової категорії.
Перенесений ІМ є найбільш значимим незалежним фактором ризику розвитку ХСН як у загальній популяції, так і серед хворих із АГ. Вагомими факторами ризику ХСН є також цукровий діабет, ГЛШ, клапанні вади серця. Серед пацієнтів із АГ, цукровим діабетом і наявністю ГЛШ у жінок відзначають більш високий ризик виникнення СН (табл. 2.3, див. табл. 2.1).
Таблиця 2.3
Фактори ризику розвитку ХСН серед пацієнтів із АГ (за Levy D. et al., 1996)
| Фактор ризику | Підвищення ризику порівняно з популяційними показниками | |
| чоловіки | жінки | |
| ІМ | 5,54 | 5,99 |
| Стенокардія | 1,35 | 1,71 |
| Діабет | 1,78 | 3,57 |
| ГЛШ | 1,97 | 2,80 |
| Клапанні вади серця | 2,40 | 1,96 |
За даними Фремінгемського дослідження серед пацієнтів із ІХС і/або ГЛШ фактором ризику ХСН виступає зменшення життєвої ємкості легень (підвищення ризику у жінок у 2,3 раза, у чоловіків — у 1,8).
Рівень загального ХС у плазмі крові є відносно слабким предиктором розвитку ХСН, проте високе значення співвідношення рівня загального ХС до ХС ЛПВЩ у плазмі крові виступає значимим фактором ризику ХСН. Останнє стосується і наявності ожиріння, що є опосередкованим чинником ризику СН з урахуванням його патогенетичного зв՚язку з АГ, цукровим діабетом, ГЛШ і дисліпідемією.
ЕТІОЛОГІЯ ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ
Найбільш частою етіологічною причиною СН у Європі та США на сьогодні вважають ІХС, яку, за даними епідеміологічних і багатоцентрових клінічних досліджень, діагностують у 60–75% таких хворих. Є вагомі підстави вважати, що друге місце серед етіологічних факторів ХСН займає системна АГ, проте часте поєднання ІХС і АГ утруднює оцінку справжньої ролі останньої у виникненні ХСН. Так, за статистичними та епідеміологічними даними ІХС та АГ (окремо або у поєднанні) зумовлюють виникнення 75–80% усіх випадків СН.
Серед інших причин розвитку ХСН провідними є ДКМП і клапанні вади серця, на інші причини ХСН (табл. 2.4) у розвинених країнах припадає в цілому не більше 5% випадків.
Таблиця 2.4
Найбільш актуальні захворювання і стани, які можуть викликати СН
ІХС
|
АГ
|
Кардіоміопатії
|
Клапанні або вроджені вади серця
|
Аритмії
|
Міокардити
|
Ураження перикарда
|
Вторинна кардіоміопатія
|
Легенева гіпертензія
|
Слід зазначити, що в Афро-Азіатському регіоні структура етілогічних факторів ХСН інша, у ній основне місце займають клапанні вади і первинні ураження міокарда.
З практичної точки зору важливо виділити ті причини ХСН або ГСН, які є потенційно оборотними і при відповідних умовах можуть бути повністю усунуті. До них відносяться тахі- і брадиаритмія, ішемія і гібернація міокарда, клапанні вади серця, легенева тромбоемболія, міокардит, побічна дія або передозування лікарських засобів, алкоголь.
ПАТОФІЗІОЛОГІЯ ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ
Зниження насосної здатності серця може бути наслідком таких факторів:
- гемодинамічне перевантаження шлуночків (у більшості випадків ЛШ);
- первинне ураження міокарда;
- порушення наповнення ПШ або ЛШ.
Перевантаження ЛШ може бути зумовлене підвищеним опором систолічному викиду крові («перевантаження тиском») або підвищеним діастолічним об’ємом крові («перевантаження об’ємом»). Перший варіант відзначають при АГ і аортальному стенозі, другий — при аортальній і мітральній недостатності. Перевантаження ПШ тиском характерне для легеневої гіпертензії і стенозу ЛА, об’ємом — для септальних дефектів зі скиданням крові зліва направо.
Первинне ураження серцевого м՚яза виявляють при ІХС і некоронарогенних ураженнях. При ІХС таке ураження за характером не є дифузним і може проявлятися некрозом (при гострому ІМ), постінфарктними рубцевими змінами, ішемією та гібернацією (див. далі) міокарда. Разом з тим для некоронарогенних захворювань міокарда характерне дифузне ураження останнього (ДКМП, більшість міокардитів, вторинні кардіоміопатії).
Порушення наповнення ЛШ або ПШ відзначають при укороченні діастоли (тахісистолії), при наявності механічної перешкоди його наповненню (перикардит, AV-стеноз, міксома) і при порушеннях його розслаблення в діастолу. Останнє відзначають при рестриктивних ураженнях міокарда, його ішемії, концентричній гіпертрофії (АГ, ГКМП), аортальному стенозі.
Наведені патофізіологічні фактори зниження насосної здатності серця нерідко поєднуються. Наприклад, при аортальному стенозі або АГ із ГЛШ перевантаження останнього тиском поєднується з порушенням його діастолічного наповнення; а при наявності постінфарктного кардіосклерозу у пацієнта з ІХС і супутньою АГ перевантаження тиском і діастолічна дисфункція ЛШ поєднуються з первинним ураженням міокарда.
При відсутності радикального етіотропного коригуючого впливу (переважно хірургічного при наявності показань) кожний із трьох вищевказаних основних факторів виступає в ролі перманентно діючого тригера (запускаючого фактора) виникнення і подальшого розвитку ХСН.
Патофізіологічні механізми прогресування СН
Неадекватність серцевого викиду метаболічним потребам тканин ініціює специфічні для СН адаптивні зміни з боку системної нейрогуморальної регуляції, серця, судин, нирок, скелетних м՚язів, які, взаємодіючи між собою за принципом порочного кола, визначають постійне прогресування СН.
Ремоделювання серця
У сучасному розумінні це комплекс структурно-функціональних змін тих або інших відділів серця, викликаний неадекватними гемодинамічними умовами їх функціонування або їх первинним ураженням. На практиці клініцист зустрічається в першу чергу з ремоделюванням лівих відділів серця, зокрема ЛШ.
Ремоделювання ЛШ — сукупність патологічних змін величини, маси і форми ЛШ з відповідним порушенням його нормального функціонування. Характерними макроознаками ремодельованого ЛШ є його гіпертрофія, дилатація і деформація (так звана сферизація) порожнини. Поєднання останніх трьох ознак є типовим для первинно-міокардіального ураження і перевантаження об’ємом. Для СН, зумовленої перевантаженням тиском і/або порушенням діастолічного наповнення ЛШ, виражена дилатація останнього не характерна, за винятком фінальної клінічної стадії, коли компенсаторні можливості гіпертрофованого ЛШ практично вичерпані.
Головна фундаментальна ознака ремоделювання ЛШ — ГЛШ. Це пристосувальний феномен, спрямований на підтримку здатності первинно ураженого або перевантаженого міокарда розвивати достатній внутрішньошлуночковий тиск у систолу шляхом зменшення робочого навантаження на одиницю його маси. Проте у процесі еволюції гіпертрофія міокарда втрачає своє пристосувальне значення і стає одним із факторів прогресування ХСН. Це пояснюється тим, що, на відміну від фізіологічної, так званої робочої гіпертрофії (у спортсменів, здорових осіб, що займаються інтенсивною фізичною працею), гіпертрофія міокарда при його перевантаженні або ушкодженні є біологічно неповноцінною. Неповноцінність патологічної гіпертрофії міокарда, зокрема, полягає в тому, що при ній:
а) зростання маси міофібрил переважає над зростанням маси мітохондрій;
б) збільшення площі мембрани відстає від росту загальної маси кардіоміоцита;
в) ріст маси міокарда випереджає ріст капілярів;
г) відбувається інтенсивне периваскулярне утворення сполучної тканини (реактивний фіброз);
д) відзначається трансформація процесів білкового синтезу у напрямку утворення ізоформ регуляторних і ефекторних протеїнів, властивих ембріональному періоду (так звана феталізація міокардіального фенотипу).
У результаті зазначених змін розвиваються енергодефіцит, перевантаження іонами Са2+ і неповноцінне функціонування гіпертрофованих кардіоміоцитів з відповідним порушенням систолічної і/або діастолічної функції ЛШ. У формуванні діастолічної неспроможності міокарда важлива роль також належить фіброзним (вогнищевим або дифузним) змінам ремодельованого ЛШ.
Для СН, зумовленої первинним ураженням міокарда ЛШ або його перевантаженням об’ємом, а також для термінального клінічного етапу гіпертензивного серця характерна так звана міогенна дилатація ЛШ. Остання відображає неможливість ЛШ забезпечувати об’єм систолічного викиду крові в аорту пропорційно об’єму порожнини ЛШ наприкінці діастоли (фізіологічний механізм Франка — Старлінга) (рис. 2.1). У такій ситуації, як правило, відповідно відбувається зниження величини ФВ ЛШ (<40%) і сферизація порожнини останнього, тобто наближення її форми до кулястої (на відміну від нормальної еліпсоїдної). Такий варіант ремоделювання ЛШ визначають у 60–70% випадків клінічно маніфестованої ХСН.
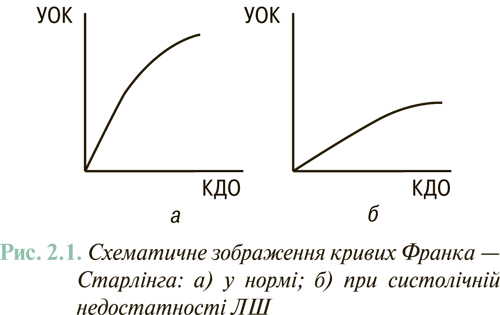
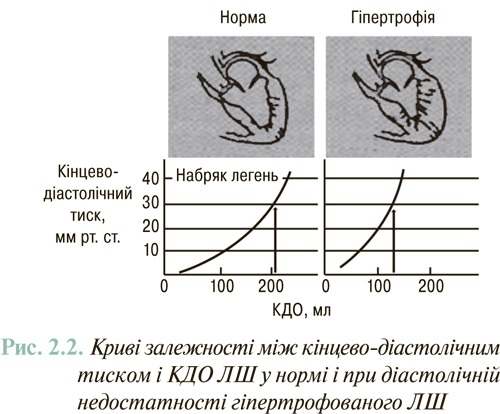
У 30–40% пацієнтів із СН відзначають нормальну або субнормальну ФВ ЛШ (>45%). Наявність клінічних ознак СН у хворих цієї категорії пов՚язують винятково або переважно з порушеннями діастолічного наповнення ЛШ. У повсякденній клінічній практиці цей варіант СН найчастіше виявляють у хворих з гіпертензивним серцем і тахісистолічними порушеннями ритму серця. Для цього варіанта СН характерний зсув кривої «кінцево-діастолічного тиску — КДО» вліво, при цьому гіперволемія в малому колі кровообігу, аж до набряку легень, може виникати при нормальному об’ємі ЛШ (рис. 2.2).
Нейрогуморальна активація
Зниження серцевого викиду зумовлює ряд системних компенсаторних реакцій, спрямованих на підтримку достатнього перфузійного тиску в судинній системі. Останнє забезпечується «включенням» відповідних компенсаторних механізмів, які можна умовно розділити на кардіальні, судинні і ниркові.
До кардіальних механізмів компенсації кровообігу при СН належать підвищення ЧСС, ріст інотропної (скорочувальної) функції міокарда і його гіпертрофія. Судинний механізм компенсації представлений системною периферичною вазоконстрикцією, спрямованою на підтримку необхідного системного АТ. Нирковий шлях компенсації кровообігу полягає в затримці іонів Nа+ і води, спрямований на збільшення ОЦК, тобто також на підтримку системного АТ.
Мобілізаційні нейрогуморальні системи
Зазначені «мобілізаційні» компенсаторні реакції опосередковані декількома нейрогуморальними системами: САС, ренін-ангіотензиновою (РАС), альдостероном, аргінін-вазопресином (синоніми: вазопресин, АДГ) і системою ендотеліну.
САС. Як відомо, її основними структурними ланками є аферентні нервові волокна, центральні адренергічні структури, еферентні пре- і постгангліонарні симпатичні волокна, симпатичні терміналії з α2-адренорецепторами і тканинні β- і α1-адренорецептори, а також ефекторні гормони норадреналін і адреналін.
Активація САС при СН виникає на найбільш ранньому етапі дисфункції ЛШ. Стимуляція β1— та β2-адренорецепторів міокарда норадреналіном і адреналіном зумовлює підвищення його скорочувальної здатності і ЧСС, а стимуляція норадреналіном судинних α1-адренорецепторів — периферичну артеріоло- і венулоконстрикцію. Крім того, норадреналін, збуджуючи α1-адренорецептори міокарда, діє як один із факторів його гіпертрофії, а стимуляція ниркових β1-адренорецепторів опосередковує секрецію нирками реніну — ключового ензиму, що запускає активацію РАС.
РАС — багатокомпонентна ензимогормональна система, що відіграє основну роль у регуляції тиску в судинній системі і об’єму рідини в організмі. Первинним субстратом РАС виступає ангіотензиноген, що перетворюється під впливом реніну в ангіотензин І. Останній у свою чергу під впливом АПФ трансформується в ангіотензин II — основний діючий гормон РАС. Ангіотензин II взаємодіючи зі своїми тканинними рецепторами першого типу (АТ1-рецептори), викликає системну вазоконстрикцію, стимулює процеси гіпертрофії міокарда та індукує синтез альдостерону наднирковими залозами (див. далі). Крім цього, він стимулює викид норадреналіну симпатичними терміналями і утворення ендотеліну-1 і вазопресину.
Компоненти РАС, які перебувають під впливом описаної вище ензимної трансформації в циркуляторному руслі, визначаються як циркулююча РАС, а ті, які локалізуються і трансформуються за допомогою ензимів у тканинах, як тканинна РАС. Активація останньої відіграє ключову роль у ремоделюванні ЛШ при СН.
Альдостерон — мінералокортикоїд, основним патофізіологічним ефектом якого при ХСН є затримка рідини в організмі за рахунок стимуляції реабсорбції іонів Nа+. Крім того, альдостерон стимулює колагеноутворення в міокарді і чинить вазоконстрикторну дію. Оскільки потужним індуктором синтезу альдостерону є ангіотензин II, у літературі поряд з терміном «РАС» часто вживається термін «РААС».
Ендотелін-1 — ефекторний (діючий) гормон так званої системи ендотеліну, експресія і активація компонентів якої відбувається переважно в клітинах ендотелію. Ендотелін-1 більш потужний вазоконстриктор, ніж ангіотензин II, і подібно до нього стимулює гіпертрофію міокарда і гіпертрофію гладком’язового шару периферичних судин, а також секрецію катехоламінів, реніну, альдостерону, вазопресину.
Вазопресин, що синтезується в задній частці гіпофізу, стимулює канальцеву реабсорбцію води і чинить системну вазоконстрикторну дію.
Контррегуляторні системи
Поряд з нейрогуморальними системами, що забезпечують компенсаторні реакції мобілізаційної спрямованості, при ХСН функціонує ряд гуморальних систем (НУП, адреномедулін, група так званих ендотелійзалежних контррегуляторних факторів), що здійснюють контррегуляторну дію стосовно ефектів САС, РААС, вазопресину, ендотеліну. Фізіологічна роль зазначених систем полягає в контролі вираженості вищенаведених мобілізаційних реакцій системи кровообігу і тим самим — захисту так званих органів-мішеней (серце, судини, нирки, скелетні м՚язи) від потенційно небезпечних для них наслідків перманентної гіперактивації РААС, САС, ендотеліну, вазопресину (роль «буфера»).
НУП, передсердний і так званий МНУП, синтезуються кардіоміоцитами передсердь і шлуночків у відповідь на їх розтягнення та підвищення тиску в останніх. НУП стимулює натрійурез і діурез, чинить вазодилатуючу і антипроліферативну дію, а також пригнічує секрецію реніну, альдостерону, ендотеліну-1, вазопресину і норадреналіну. Дія адреномедуліну багато в чому подібна впливу НУП.
Ендотелійзалежні контррегуляторні фактори представлені брадикініном, так званими вазодилататорними простагландинами і оксидом азоту (NO). Усі вони продукуються клітинами ендотелію і здійснюють вазорелаксуючу, антипроліферативну і антитромботичну дію.
До вазодилататорних простагландинів належать простациклін та РgЕ2. Важливою їх особливістю є здатність до підтримки ниркового кровотоку в умовах гіпоперфузії нирок за рахунок дилатації переважно їх аферентних артеріол.
Оксид азоту (NО), або ендотелійзалежний фактор розслаблення судин, продукується клітинами ендотелію під впливом специфічного ензиму — ендотеліальної NO-синтетази (еNOS). Крім ефекту вазодилатації, NО пригнічує активацію моноцитів і тромбоцитів, що є однією з ключових ланок так званого імунозапального процесу (див. далі) і тромбоутворення при ХСН.
Брадикінін має самостійну вазодилатуючу і антипроліферативну дію і, крім цього, стимулює синтез вазодилататорних простагландинів та NО. Слід пам՚ятати, що він розщеплюється на неактивні пептиди тим самим ензимом, що каталізує утворення ангіотензину II з ангіотензину I, а саме — АПФ. Тому зростання активності РААС при ХСН призводить до підвищеного розпаду брадикініна і відповідно зниження його концентрації та зменшення утворення NО і простацикліну.
Зміни з боку судинної системи
При клінічно маніфестованій ХСН периферичні судини (більшою мірою артеріальні) перебувають в стані перманентної констрикції, що зумовлено постійною дією суттєво підвищених концентрацій ангіотензину II, норадреналіну, ендотеліну-1, вазопресину на гладком’язовий шар їх стінки. Крім цього, ангіотензин II й ендотелін-1 зумовлюють гіпертрофію останнього. Звуження просвіту судин, поряд з гіпертрофією їх м՚язового шару, що характерно також для АГ, отримало назву «ремоделювання судин». Вираженість цього феномену зростає в міру клінічного прогресування ХСН.
Характерною для ХСН зміною з боку судин є також порушення функції ендотелію. Істотну роль у реалізації цього феномену грає зниження концентрації оксиду азоту, що зумовлене, по-перше, пригніченням його синтезу в ендотеліоцитах і, по-друге, підвищенням його біохімічної (вільнорадикальної) інактивації. Внаслідок зниження концентрації NО у стінці судин у значній мірі зменшується захисна дія фізіологічних концентрацій NО у відношенні вазоконстрикції, тромбоутворення та активації клітинної ланки системного запалення, що відіграє істотну роль у прогресуванні ХСН.
Зміни з боку нирок
Під дією вазоконстрикторних нейрогормонів зменшується нирковий кровотік, що призводить до зменшення клубочкової фільтрації та стимуляції вивільнення реніну юкстагломерулярним апаратом нирок. Внаслідок прямої дії альдостерону на клітини канальців активується реабсорбція Nа+ і води, поряд з цим збільшується екскреція К+ і Mg2+.
Зміни з боку скелетних м’язів
Внаслідок гіпоперфузії периферичних м՚язів розвивається їх хронічна гіпоксія з відповідним порушенням метаболізму, змінами ультраструктури, зниженням функціональних можливостей, зменшенням маси.
Основні етапи клінічного прогресування ХСН: патофізіологічна характеристика
Доклінічний етап СН (безсимптомна дисфункція ЛШ)
Характеризується насамперед активацією САС, що забезпечує мобілізацію інотропної та хронотропної функцій серця, збільшення припливу до нього крові по венах і підтримка нормального рівня АТ. Одночасно відбувається активація НУП. Суттєвого зростання активності циркулюючих РААС, ендотеліну-1 і вазопресину не відзначають, що пояснюється відповідною антагоністичною дією НУП. Ідуть процеси гіпертрофії серцевого м՚яза, опосередковані активованою локальною міокардіальною РААС, а також норадреналіном (через α1-адренорецептори) і ендотеліном-1.
Перехід доклінічної СН у клінічно маніфестовану зумовлюють декілька факторів:
- на фоні дилатації лівого передсердя та перманентного підвищення в ньому тиску розвивається десенситизація (втрата чутливості) розташованих у ньому барорецепторів, подразнення яких в нормі обмежує надмірну активацію центрального симпатичного тонусу і секрецію вазопресину; поступово формується десенситизація ниркових і судинних рецепторів до НУП;
- на фоні перманентної гіперстимуляції міокарда катехоламінами розвивається десенситизація його β-адренорецепторного апарату, що знижує скорочувальну реакцію серця на циркулюючі катехоламіни;
- збільшується енергодефіцит кардіоміоцитів, що визначається вищевказаною апріорною біологічною неповноцінністю патологічної гіпертрофії міокарда.
У результаті наведених змін, по-перше, втрачається контроль НУП над активацією САС, РААС, ендотеліну-1 і вазопресину, що робить можливим «безперешкодну» реалізацію їх периферичного та антидіуретичного ефектів і у такий спосіб визначає ріст перед- і постнавантаження на серце. По-друге, знижується ефективність систоли шлуночків, зменшується серцевий викид, що у свою чергу стимулює подальшу активацію гормональних систем мобілізаційної спрямованості за принципом порочного кола. По-третє, у зв’язку з поступовим підвищенням тиску наповнення лівого передсердя і ЛШ відбувається подальша активація міокардіальної РААС і системи ендотеліну, які стимулюють подальшу гіпертрофію міокарда.
Фаза розгорнутих клінічних проявів хронічної застійної СН
Мобілізаційні реакції серцево-судинної системи остаточно втрачають своє компенсаторне фізіологічне значення і виступають у ролі патогенних факторів, що визначають структурно-функціональну деградацію органів (тканин)-мішеней. Це зумовлює різкий дисбаланс між постійно наростаючою активністю САС, РААС, ендотеліну і вазопресину, з одного боку, і недостатньою вираженістю ефектів контррегуляторних систем — з іншого1.
Так, незважаючи на циркуляцію в кровотоці НУП у високих концентраціях, останні не здійснюють очікуваного «буферного» ефекту внаслідок десенситизації їх тканинних рецепторів і значного зниження ниркового кровотоку. З іншого боку, висока активність АПФ у стінці судин, крім підвищеного утворення ангіотензину II, викликає деградацію брадикініну і опосередковано — пригнічення стимульованого брадикініном синтезу NО. Крім цього, ангіотензин II стимулює руйнування NО шляхом посилення продукції вільних радикалів, здатних хімічно нейтралізувати останній.
Перманентна гіперстимуляція міокарда високими концентраціями катехоламінів зумовлює перевантаження іонами Са2+ мітохондрій, критичний дефіцит макроергічних сполук і, як наслідок цього, — активацію кальційзалежних протеаз і фосфоліпаз з подальшим некрозом частини кардіоміоцитів і розвитком вогнищ репаративного (замінного) фіброзу. Наростання пропорційне підвищенню концентрації циркулюючого норадреналіну десенситизації міокардіальних β-адренорецепторів призводить до критичного (до 50% норми) зниження скорочувальної відповіді міокарда на катехоламіни. Одночасно викликане гіпоперфузією скелетних м՚язів порушення їх метаболізму, діючи через локалізовані в м՚язах так звані метаболічні рецептори, стає сигналом для подальшої, опосередкованої через ЦНС активації САС2.
Високі концентрації ангіотензину II і ендотеліну-1, стимулюючи в міокарді утворення колагенових волокон, стимулюють і зворотний процес — деструкцію сополучнотканинного «каркаса» серцевого м՚яза за допомогою специфічних ензимів — так званих матриксних металопротеїназ, що сприяє прогресуванню дилатації порожнини ЛШ.
У фазі виражених циркуляторних порушень і системного тканинного дизметаболізму ініціюється механізм імунозапальної відповіді організму, ключовою ланкою якого є активація синтезу гуморальних медіаторів системного запалення, так званих прозапальних цитокінів (ФНП-α, інтерлейкіни-1, -6, -8) імунокомпетентними клітинами. Основними ефектами зазначених цитокінів є пригнічення біосинтезу білка, внутрішньоклітинного транспорту глюкози, анорексія, подальша активація матриксних металопротеїназ, пригнічення скорочувальної здатності міокарда та периферичних м՚язів, утворення NО ендотелієм, а також стимуляція апоптозу3 кардіоміоцитів, міоцитів скелетних м’язів і лімфоцитів.
В активації прозапальних цитокінів ключову роль відіграє гіперпродукція вільних радикалів на фоні пригнічення ензимів антиоксидантного захисту в умовах системної гіпоксії (так званий оксидативний, або оксидантний стрес).
Фізіологічний зміст зростання синтезу прозапальних цитокінів при ХСН полягає насамперед в активації катаболічних процесів та апоптозу в скелетних м՚язах, оскільки саме зменшення маси скелетних м՚язів є останнім резервом для приведення потреби організму в кисні та поживних речовинах у відповідність з критично обмеженими можливостями їх доставки. Дійсно, на фоні значного підвищення концентрації циркулюючих ФНП-α та інших прозапальних цитокінів відзначають зменшення маси тіла, зумовлене головним чином гіпотрофією скелетних м՚язів (кахектичні зміни). Але одночасно за аналогічним механізмом відбувається активація апоптозу та катаболічних процесів у міокарді, що не дозволяє збалансувати ситуацію4.
Як результат повного вичерпання резервів компенсації наступає смерть від прогресуючої насосної недостатності серця.
Раптова серцева смерть і її механізми у хворих із ХСН
Як вище було вказано, до 50% хворих із ХСН не доживають до фінального етапу декомпенсації серця, а вмирають раптово, часто на фоні стабільного клініко-гемодинамічного стану. У більшості випадків (>80%) раптова серцева смерть настає внаслідок виникнення шлуночкової аритмії високих градацій, які при ХСН, як правило, мають безсимптомний характер. Встановлено, що основним безпосереднім механізмом зупинки кровообігу є вторинна (тобто трансформована з шлуночкової тахікардії) фібриляція шлуночків — 67,5%. Значно рідше це первинна фібриляція шлуночків (8,3%) і брадиаритмії (16,5%).
Патогенетичні фактори раптової аритмічної смерті при ХСН можна об’єднати у такий спосіб:
- специфічні для ХСН міокардіальні порушення;
- нейрогуморальні фактори;
- ішемія;
- ятрогенні фактори.
Розглянемо їх послідовно.
1. У формуванні аритмогенного субстрату в декомпенсованому серцевому м՚язі беруть участь основні ланки його ремоделювання. У патологічно гіпертрофованому міокарді визначають зниження активності іонних насосів (Са2+-АТФаза саркоплазматичного ретикулума, Nа+-К+-АТФаза сарколеми) і синтезу протеїнів калієвих каналів, що викликає перевантаження цитозолю кардіоміоцитів іонами Са2+. Результатом останнього є подовження ПД кардіоміоцитів, у результаті чого збільшується так звана тригерна активність міокарда, що являє собою генерацію ектопічних електричних імпульсів по типу спонтанних деполяризацій. Дилатація ЛШ зумовлює відкриття в сарколемі кардіоміоцитів так званих stretch-залежних (тобто активованих розтягненням клітини) натрієвих каналів, що сприяє виникненню таких самих спонтанних деполяризаційних імпульсів. Виникненню і підтримці шлуночкової тахікардії сприяють механізми rе-entry (зворотний вхід збудження, тісно пов՚язаний з наявністю міокардіального фіброзу) та підвищення автоматизму кардіоміоцитів, що є одним із наслідків їх кальцієвого перевантаження.
2. Перманентна активація РААС і САС є не тільки опосередкованим (через ремоделювання серця), але і прямим фактором аритмогенезу.
Порушення β-адренорецепторного апарату в умовах гіперкатехоламінемії шляхом активації сарколемальних кальцієвих каналів L-типу і пригнічення кальцієвого насоса зумовлює той же феномен перевантаження цитозолю кардіоміоцитів іонами кальцію. Останній збільшується також у зв’язку з перманентною активацією міокардіальних α1-адренорецепторів підвищеними концентраціями норадреналіну.
Роль циркулюючої РААС в аритмогенезі при ХСН полягає насамперед у стимуляції гіперпродукції альдостерону, наслідком чого є гіпокаліємія і гіпомагніємія, що в свою чергу виступає фактором ектопії міокарда.
3. Добре відома роль міокардіальної ішемії в генезі небезпечних для життя шлуночкових аритмій, що асоційована з перевантаженням кардіоміоцитів іонами Са2+ та їх вільнорадикальним пошкодженням.
4. До ятрогенних факторів злоякісних шлуночкових ектопічних порушень ритму при ХСН належать дигіталісна інтоксикація; неправильне застосування петльових і тіазидних діуретиків, що призводить до гіпокаліємії і гіпомагніємії; застосування неглікозідних інотропних засобів; прийом антиаритмічних препаратів I класу (див. ЛІКУВАННЯ).
ДІАГНОСТИКА ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ
Клінічні симптоми ХСН
Виявлення суб՚єктивних і об՚єктивних (фізикальних) ознак СН є початковим етапом її діагностики.
Суб’єктивні симптоми ХСН
Суб՚єктивними симптомами ХСН є:
- задишка при фізичному навантаженні;
- нічна пароксизмальна задишка;
- ортопное;
- кашель при фізичному навантаженні і/або вночі;
- слабкість, швидка стомлюваність при фізичному навантаженні;
- ніктурія;
- олігурія;
- скарги на зменшення маси тіла;
- симптоми з боку ЖКТ і ЦНС.
Задишка (компенсаторне підвищення частоти дихальних рухів), що обмежує переносимість фізичних навантажень, є найбільш раннім і частим клінічним симптомом СН у хворих з насосною недостатністю лівих відділів серця. Задишка є результатом рефлекторного збудження дихального центра у відповідь на підвищення легенево-капілярного тиску і наявність транссудату в інтерстиціальному просторі легень, що обмежує екскурсію (підвищує ригідність) легень, знижуючи ефективність кожного дихального циклу. Якщо на початковому етапі СН задишка виникає при виконанні побутових навантажень середньої інтенсивності (типово — під час ходи), то при тяжкій ХСН супроводжує найменше фізичне зусилля пацієнта. Для хворих з ізольованою недостатністю правих відділів серця задишка при навантаженні менш характерна, оскільки у цих хворих відсутнє підвищення легенево-венозного тиску. Проте при вираженій ізольованій правошлуночковій декомпенсації можлива досить значна задишка, факторами якої є гіпоперфузія дихальних м՚язів і метаболічний ацидоз на фоні значно зниженого серцевого викиду.
Пароксизмальна нічна задишка в класичному розумінні — це раптове пробудження пацієнта від відчуття ядухи з негайною потребою сісти або встати на ноги, із супутнім частим диханням. Перебування у вертикальному положенні сприяє зменшенню вираженості зазначених симптомів від декількох до 30–40 хв. Пароксизмальна нічна задишка зумовлена насосною недостатністю лівих відділів серця, що викликана збільшенням припливу до них крові в горизонтальному положенні тіла, внаслідок чого підвищується легенево-венозний і легенево-капілярний тиск і формується інтерстиціальний набряк легень. Є дані, що у раптовому характері виникнення проявів пароксизмальної нічної задишки визначальну роль грають спонтанні коливання центрального симпатичного тонусу під час сну.
Ортопное — відчуття ядухи і задишки в горизонтальному положенні, що зникає або значно зменшується після переходу у вертикальне. За гемодинамічним механізмом виникнення ортопное подібно з пароксизмальною нічною задишкою. Є підстави вважати, що ортопное у більшій мірі відображає перманентний характер гіперволемії малого кола кровообігу, ніж пароксизмальна нічна задишка.
Непродуктивний (сухий) кашель, що рефлекторно виникає при фізичному навантаженні і/або вночі, теж є наслідком легеневого застою, що поширюється в тому числі і на бронхіальну систему. Не слід забувати, що сухий кашель при ХСН іноді може бути побічною дією інгібіторів АПФ, але тоді він не пов՚язаний з фізичним навантаженням і горизонтальним положенням тіла.
Слабкість і стомлюваність є наслідком зменшення сили, витривалості і маси скелетних м՚язів, особливо нижніх кінцівок, зумовлених їх гіпоперфузією. Зниження функціональної здатності периферичних м՚язів при ХСН зумовлені патологічним перерозподілом у них ізоформ міозину, енергодефіцитом, зниженням щільності β2-адренорецепторів, вільнорадикальним стресом, апоптозом міоцитів. Слабкість у пацієнтів із ХСН зазвичай більш виражена після прийому їжі, що зумовлено перерозподілом лімітованого кровотоку в органи черевної порожнини.
Ніктурія — досить часта й рання ознака ХСН. У денний період в умовах зниженого серцевого викиду вертикальне положення тіла і фізична активність (як фактори перерозподілу крові), а також адренергічна вазоконстрикція призводять до зниження ниркового кровотоку і відповідно клубочкової фільтрації. Вночі в горизонтальному положенні приплив крові до нирок збільшується, під час сну знижується секреція норадреналіну (відповідно збільшується нирковий кровотік) і тому кількість сечі, що виділяється, збільшується.
Олігурія, на відміну від ніктурії, характеризує тяжку ХСН з високим рівнем циркулюючих ангіотензину II, альдостерону, вазопресину та критично зниженим нирковим кровотоком.
Скарги на зниження маси тіла надають додаткову діагностичну інформацію щодо динаміки та індивідуального прогнозу захворювання, оскільки свідчать про значно активовані патофізіологічні механізми прогресування ХСН. Клінічно значимою вважається втрата ≥7,5% маси тіла протягом останніх 6 міс. Механізми втрати маси тіла у хворих із ХСН наведені нижче.
Абдомінальні скарги — тяжкість в епігастральній області, нудоту, іноді блювання, запор, діарею, анорексію окремо або в різних комбінаціях відзначають хворі з явищами застою великого кола кровообігу. Вони є наслідком таких змін, як гепатомегалія, асцит, набряк кишечнику. Є дані, що в походженні анорексії, що визначається у значної частини пацієнтів із тяжкою ХСН, відіграє роль відповідна центральна дія ФНП-α.
Не варто забувати, що зазначені симптоми можуть бути проявом будь-якого іншого супутнього захворювання з боку ШКТ.
Симптоми з боку ЦНС — сонливість, збудження, безсоння, сплутаність свідомості, дезорієнтація і т.п. можливі при термінальній ХСН, при критичному зниженні серцевого викиду. Частіше їх реєструють у хворих похилого і старечого віку.
Об’єктивні клінічні ознаки ХСН
До основних об՚єктивних клінічних ознак, які дають підстави підозрювати ХСН, належать:
- двосторонні периферичні набряки;
- гепатомегалія;
- набряк та пульсація шийних вен, гепатоюгулярний рефлюкс;
- асцит, гідроторакс (двобічний або правобічний);
- наявність при аускультації двобічних вологих хрипів у легенях;
- тахіпное;
- тахісистолія;
- альтернувальний пульс;
- розширення перкуторних границь серця;
- III (протодіастолічний) тон;
- IV (пресистолічний) тон;
- акцент II тону над ЛА;
- зниження нутритивного статусу пацієнта при загальному огляді.
Периферичні набряки у пацієнтів із ХСН є ознакою декомпенсації великого кола кровообігу. Якщо причиною ХСН є дисфункція лівих відділів серця, ця ознака характеризує пізній етап розвитку цього синдрому. Відомо, що появі набряків передує кумуляція в організмі приблизно 5 л позасудинної рідини. Найбільш типова локалізація набряків на стопах і гомілках, хоча при значно виражених застійних явищах вони можуть охоплювати стегна, мошонку, крижі. Анасарка — тотальний набряк підшкірної клітковини, аж до неможливості пункції периферичних вен розвивається на термінальному етапі ХСН. Характерною ознакою периферичних набряків, викликаних декомпенсацією серця, є їх двобічна локалізація. Наявність набряків обох нижніх кінцівок різного ступеня вираженості не виключає ХСН, оскільки може відображати супутнє однобічне порушення лімфо- і венозного відтоку. При ізольованій недостатності правих відділів серця набряки з՚являються на більш ранньому етапі декомпенсації.
Периферичний набряковий синдром може також виникати при інших клінічних станах, що вимагає проведення відповідної диференційної діагностики (див. далі).
Ключовими ланками патогенезу кардіогенного набрякового синдрому є активація РААС, САС, аргінін-вазопресину, гіперальдостеронізм, зниження ниркового кровотоку та венозний застій (схема 2.1).
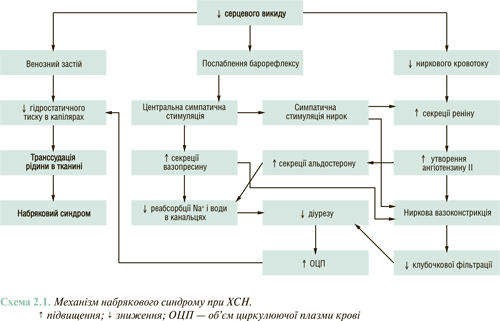
Гепатомегалія, набрякання і пульсація шийних вен, гепатоюгулярний рефлюкс є ознаками системної венозної гіпертензії, що виникає внаслідок неможливості серця адекватно перекачувати кров з венозної системи в артеріальну. Простою ознакою підвищення венозного тиску є відсутність спадіння яремних вен на вдиху. При цьому, на відміну від механічної обструкції верхньої порожнистої вени, пульсація яремних вен зберігається. Іншою об՚єктивною ознакою кардіогенної системної венозної гіпертензії є гепатоюгулярний рефлюкс, а саме збільшення набрякання і пульсації яремних вен при натисканні на ділянку живота (правий верхній квадрант) протягом 20–30 с в горизонтальному положенні хворого.
Асцит — більш пізній прояв декомпенсації великого кола кровообігу, зумовлений транссудацією рідини в черевну порожнину з її вен на фоні значного і тривалого підвищення венозного тиску у хворих із ХСН. Найбільш виражений асцит при констриктивному перикардиті та вадах трикуспідального клапана. Виражений напружений асцит вимагає диференційної діагностики з синдромом портальної гіпертензії, зумовленим насамперед біліарним цирозом печінки.
Гідроторакс виявляють приблизно у ⅓ хворих з бівентрикулярною СН. Хоча за своїм характером він є двобічним, у більшості випадків значна кількість рідини накопичується справа. Гідроторакс при ХСН являє собою транссудат з плевральних вен. Може бути проявом не тільки системної венозної гіпертензії, а й хронічної гіперволемії малого кола кровообігу, оскільки плевральні вени впадають не тільки в систему верхньої порожнистої вени, а й частково в легеневі вени.
У хворих із ХСН при наявності гідротораксу необхідне проведення диференційної діагностики, насамперед з ексудативним плевритом інфекційного або онкологічного походження.
Крепітувальні вологі хрипи в легенях виникають внаслідок транссудації рідини в альвеоли з подальшим переміщенням у бронхіоли і зумовлені гіперволемією малого кола кровообігу при насосній недостатності лівих відділів серця. Зазначені хрипи вислуховуються з обох боків, локалізуються в нижніх відділах легень і супроводжуються притупленням перкуторного тону. Наявність таких хрипів свідчить про високий ризик виникнення гострого альвеолярного набряку легень, а також є сигналом для проведення невідкладної діуретичної терапії. Якщо на фоні адекватної відповіді на діуретичну терапію протягом 1–2 діб відсутня позитивна динаміка у вигляді значного зменшення або зникнення хрипів у легенях, необхідно виключити супутню двобічну нижньодольову пневмонію, що нерідко розвивається у таких хворих.
Тахіпное (тобто кількість дихальних рухів >20 за 1 хв), що визначається в стані спокою, свідчить про значне підвищення легенево-капілярного тиску, зумовленого насосною недостатністю лівих відділів серця. Необхідне проведення диференційної діагностики з багатьма іншими станами (табл. 2.5).
Таблиця 2.5
Симптоми, які спостерігаються як при ХСН, так і при інших патологічних станах
| Задишка | Кашель | Слабкість | Тахісистолія | Периферичні набряки |
Гепатомегалія | Гідроторакс | Асцит |
|
|
|
|
|
|
|
|
Тахісистолію (ЧСС >80 уд./хв) відзначають у більшості пацієнтів із ХСН, якщо не проводиться терапія препаратами, що знижують ЧСС (блокатори β-адренорецепторів, серцеві глікозиди). У пацієнтів із декомпенсованою СН і синусовим ритмом тахікардія є опосередкованим через САС адаптивним механізмом, спрямованим на підтримку необхідного ХОК в умовах зниженої систолічної здатності ЛШ. При фібриляції передсердь самостійним патогенетичним фактором тахісистолії є дисфункція AV-вузла, що вимагає застосування терапії, спрямованої на нормалізацію частоти шлуночкових скорочень.
Альтернувальний пульс можна розглядати як діагностичний критерій СН у випадках збереженого синусового ритму. Про нього йде мова у випадках, коли при рівномірних проміжках між пульсовими ударами визначають різне їх наповнення. На сфігмограмі це проявляється пульсовими хвилями різної амплітуди. При об՚єктивному дослідженні хворого альтернація пульсу найбільш чітко визначається на а. femoralis. Механізм альтернувального пульсу полягає в коливаннях САТ внаслідок варіацій ударного об՚єму ЛШ, пов՚язаних з вираженою міокардіальною недостатністю (кардіоміоцити не встигають відновити необхідну кількість макроергічних з՚єднань для наступного скорочення). Цим механізмом пояснюється те, що альтернація пульсу нерідко виникає безпосередньо після ектопічних шлуночкових скорочень (одиничних або групових), а також те, що вона може бути індукована швидкою електростимуляцією передсердь. Альтернувальний пульс — маркер вираженої систолічної дисфункції ЛШ. Він не відзначається при СН, основною причиною якої є порушення діастолічного наповнення шлуночків.
Розширення перкуторних границь серця одночасно вліво і вгору відзначають при ХСН з систолічною дисфункцією ЛШ, що свідчить про дилатацію ЛШ і лівого передсердя (ІХС, декомпенсоване гіпертензивне серце, аортальна і мітральна регургітації без бівентрикулярної недостатності). На етапі розвитку останньої спостерігається також і розширення правої границі відносної тупості серця вправо, що вказує на дилатацію правого передсердя. Розширення перкуторних границь серця тільки вправо характерно для ізольованої недостатності його правих відділів (первинна або вторинна легенева гіпертензія, трикуспідальні вади, стеноз ЛА), а також для мітрального стенозу, ускладненого легеневою гіпертензією. В останньому випадку зазначена ознака поєднується зі зміщенням границь відносної тупості серця вгору. Тотальне розширення перкуторних границь серця виявляють у пацієнтів зі СН, викликаною ексудативним перикардитом, декомпенсованою мітральною вадою, дифузним міокардитом із систолічною дисфункцією обох шлуночків, а також у випадках, коли до насосної недостатності ЛШ приєднується недостатність правих відділів серця (див. вище). Для хворих з констриктивним перикардитом характерні нормальні границі серця.
III (протодіастолічний) тон може бути ви-значений тільки у хворих із синусовим ритмом. Він є маркером значно вираженої систолічної дисфункції, виникаючи внаслідок різкого сповільнення припливу крові до ЛШ наприкінці фази його швидкого наповнення. Аускультативний феномен у вигляді тричленного ритму із зазначеним додатковим (низькочастотним) III тоном у протодіастолу отримав назву «протодіастолічний ритм галопу». Наявність III протодіастолічного тону асоційована з незадовільним прогнозом виживаності. Хоча патологічний III тон є високоспецифічним для систолічної ХСН, іноді він може спостерігатися при аневризмі ЛШ без ознак СН.
IV (передсердний) тон, на відміну від III патологічного, відображає порушення не систолічної, а діастолічної функції ЛШ. Виникає внаслідок затрудненого вигнання крові лівим передсердям в умовах зниженої еластичності ЛШ в останню фазу діастоли. IV передсердний тон може спостерігатися у хворих з діастолічною дисфункцією ЛШ як із клінічними ознаками застійної СН, так і без них.
Акцент II тону на ЛА у хворих з насосною недостатністю лівих відділів серця свідчить про наявність легеневої гіпертензії.
Знижений нутритивний статус хворого є досить частою ознакою клінічно маніфестованої ХСН. У 12–16% пацієнтів виявляють кахексію (ІМТ <20 кг/м2 або маса тіла <80% ідеальної).
Виходячи з сучасних уявлень, можна виділити два основних фактори прогресуючої втрати маси тіла у хворих із ХСН:
а) дисфункція органів травлення (печінки, підшлункової залози, тонкого кишечнику) в умовах хронічного венозного застою (так званий синдром мальабсорбції);
б) зменшення маси периферичних м՚язів в умовах їх оксидантного стресу та ефектів протизапальних цитокинів, насамперед ФНП-α (інсулінорезистентність, пригнічення процесів білкового синтезу, апоптоз міоцитів).
Будучи неспецифічною ознакою, зменшення маси тіла при ХСН вимагає виключення супутніх станів, які можуть бути його причиною (онкологічне захворювання, хронічні інфекції і т.д.).
Комплексна оцінка клінічних симптомів і ознак ХСН
Оцінка можливості діагностування СН на підставі лише клінічних симптомів повинна базуватися на врахуванні двох ключових обставин. По-перше, у реальній клінічній практиці у конкретного пацієнта визначають лише частину (нерідко меншу) вищенаведених симптомів, що визначається рядом факторів — характером дисфункції серця, її етіологічною причиною, виразністю циркуляторних порушень, індивідуальними особливостями організму. По-друге, жоден з описаних вище клінічних симптомів СН, якщо їх оцінювати окремо, не має одночасно достатньої чутливості5 та специфічності6. Наприклад, задишка і слабкість — досить чутливі ознаки, оскільки виникають у більшості пацієнтів із ХСН. У той же час вони малоспецифічні, оскільки спостерігаютья при багатьох інших патологічних станах. Навпаки, такі ознаки, як протодіастолічний ритм галопу, пульсація розширених яремних вен, двобічні крепітувальні хрипи, є високоспецифічними, але разом з тим малочутливими симптомами, оскільки у багатьох хворих із ХСН відсутні.
Впевненість лікаря-початківця щодо простоти діагностики СН на підставі лише однієї клінічної симптоматики легко зникає при ознайомленні з табл. 2.5.
Оскільки жоден з клінічних симптомів ХСН не має самостійного діагностичного значення, первинна діагностика ХСН повинна базуватися лише на комплексній оцінці всіх наявних симптомів. Діагноз ХСН тим більше ймовірний, чим більша кількість відповідних симптомів, особливо високоспецифічних, виявлених у пацієнта (табл. 2.6). Результатом зазначеної первинної діагностики СН є встановлення попереднього діагнозу, який повинен бути підтверджений, уточнений і розширений за допомогою відповідних інструментальних методів.
Таблиця 2.6
Чутливість і специфічність* окремих клінічних симптомів при підтвердженій ХСН (Harlan W. et al., 1997; Cleland J., et al., 2002)
|
Симптоми і ознаки |
Чутливість, % |
Специфічність, % |
|
Задишка |
66–82 |
52 |
|
Пароксизмальна нічна задишка |
33 |
76 |
|
Ортопное |
21 |
81 |
|
Двобічні вологі хрипи в легенях |
13 |
91 |
|
Набухання/пульсація яремних вен |
10 |
97 |
|
III протодіастолічний тон |
31 |
95 |
|
Тахісистолія >100 уд./хв |
7 |
99 |
|
Периферичні набряки |
23–55 |
80 |
|
Слабкість |
68 |
– |
*Прийнятним рівнем чутливості або специфічності ознаки вважається його значення >70%, високим >85–90%.
Інструментальна діагностика ХСН
Основними інструментально-діагностичними методами, застосування яких виправдано практично у всіх хворих із симптомами ХСН, є ехоКГ, рентгенографія органів грудної клітки та ЕКГ.
ЕхоКГ
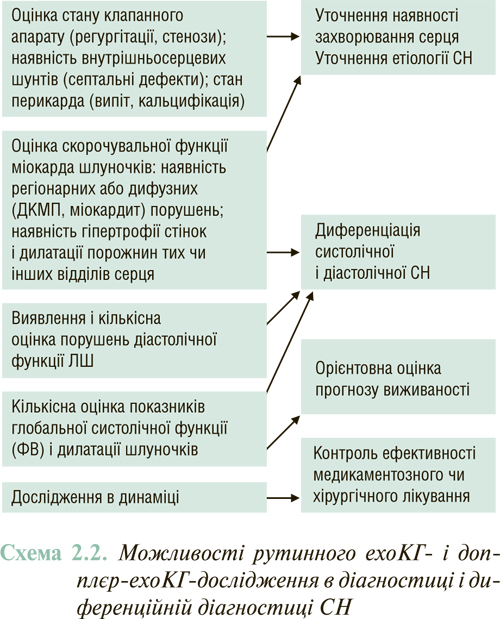
ЕхоКГ відіграє провідну роль в об՚єктивізації СН. Діагностичні можливості сучасного УЗД серця узагальнені на схемі 2.2.
Найважливіший параметр внутрішньосерцевої гемодинаміки — ФВ ЛШ— інтегральний показник систолічної функції серця, що показує, яка частина крові КДО ЛШ викидається в аорту в систолу. З фізіологічної точки зору ФВ свідчить про ступінь систолічного скорочення волокон міокарда в систолу. Щоб досягти правильного методологічного визначення і трактування цього показника, варто враховувати кілька положень.
- Визначення ФВ ЛШ за допомогою відомої формули Теіcholz на базі даних ехоКГ у М-режимі не є адекватним у пацієнтів зі сферизацією дилатованого ЛШ і його регіонарною дисфункцією (ІХС). Тому цей показник слід визначати за допомогою двовимірної ехоКГ, бажано на основі використання модифікованого алгоритму (методу) Сімпсона.
- Відтворюваність результатів визначення ФВ ЛШ різними дослідниками досить низька. Тому при динамічному спостереженні хворого бажано здійснювати повторні дослідження на тій самій ультразвуковій системі і тим самим фахівцем.
- У випадку істотної мітральної регургітації ФВ ЛШ не може служити мірою оцінки систолічної функції ЛШ, оскільки, незважаючи на адекватне скорочення міокардіальних волокон, необхідний ударний об’єм не забезпечується внаслідок повернення значної частини крові в систолу ЛШ у ліве передсердя. Тому оцінюючи тяжкість стану та прогноз таких пацієнтів, необхідно спиратися не на величину ФВ, а на ФК, вираженість циркуляторних порушень та об’єм регургітації на мітральному клапані.
Допплєр-ехоКГ-дослідження трансмітрального діастолічного потоку крові і кровотоку по легеневих венах (рис. 2.3) дозволяє отримати інформацію щодо здатності ЛШ до розслаблення і зниження його еластичності (здатності до розтягання). З цією метою визначаються такі показники, як час ізоволюмічного розслаблення ЛШ (IVRТ), співвідношення пікових швидкостей раннього (А) і пізнього (Е) (систола передсердь) наповнення передсердь (Е/А), час уповільнення швидкості раннього діастолічного потоку (DТ). Для уточнення значимості показників трансмітрального потоку доцільно оцінювати додатково потік у легеневих венах: співвідношення швидкості і потоку в систолу та діастолу шлуночків (PVs/PVd), а також співвідношення тривалості потоку в систолу передсердя через мітральний клапан та у легеневій вені (MVAdur/PVARdur).
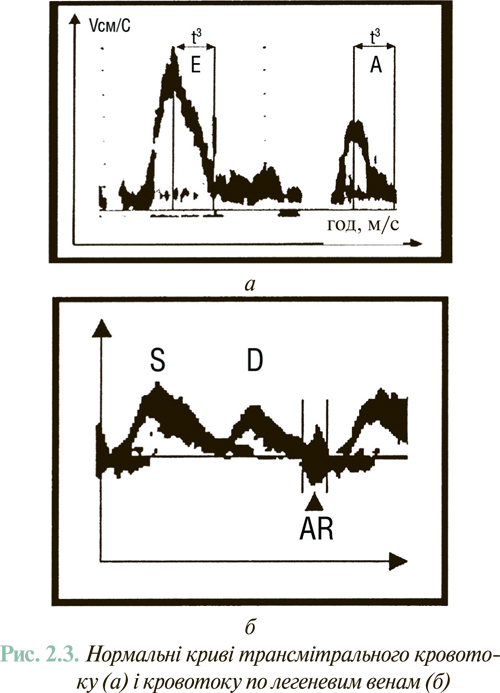
За даними допплєрівського дослідження трансмітрального кровотоку та потоку в легеневих венах виділяють наступні типи порушення діастолічної функції ЛШ (рис. 2.4).

1. Порушення релаксації ЛШ при нормальному тиску наповнення (синонім: гіпертрофічний тип діастолічної дисфункції): зменшення Е з компенсаторним зростанням А. Величина Е/А <1, відзначається збільшення IVRT та DT. При цьому PVs/PVd >1, MVAdur/PVARdur >1.
2. «Псевдонормальне» наповнення ЛШ: порушення релаксації у зв՚язку з підвищенням тиску наповнення. За рахунок підвищення тиску наповнення ЛШ показники Е/А, IVRT, DT у межах норми, проте PVs/PVd <1, MVAdur/PVARdur <1.
3. Рестриктивний тип наповнення: значне збільшення Е за рахунок росту ранньодіастолічного трансмітрального градієнта тиску, зумовлене високим тиском у лівому передсерді, Е/А >2, зменшення IVRT та DT. Також визначається подальше зменшення PVs/PVd і MVAdur/PVARdur. Патологічне підвищення співвідношення Е/А може бути наслідком двох гемодинамічних ситуацій. Першу з них відзначають при рестриктивних ураженнях міокарда (амілоїдоз, фіброеластоз, гемохроматоз, саркоїдоз). У цьому випадку за рахунок значного зниження пасивно-еластичних властивостей міокарда значно знижується швидкість пізнього діастолічного наповнення ЛШ (А), а за рахунок компенсаторного підвищення тиску в лівому передсерді може прискорюватися раннє діастолічне наповнення ЛШ (ріст Е). Дещо іншу ситуацію відзначають при систолічній дисфункції ЛШ, коли виражене підвищення лівопередсердного та легенево-венозного тиску зумовлює швидкий потік крові в порожнину дилатованого ЛШ (підвищення Е). Разом з тим пізній («передсердний») діастолічний потік у такий же спосіб сповільнюється за рахунок високого тиску наповнення ЛШ.
Порушена релаксація (гіпертрофічний тип), псевдонормальний і рестриктивний типи наповнення ЛШ відображають відповідно помірний, середній і тяжкий ступені його діастолічної дисфункції.
Слід пам՚ятати, що відповідно до можливостей методу сфера застосування допплєр-ехоКГ-оцінки діастолічної функції ЛШ обмежується пацієнтами зі збереженим синусовим ритмом і без недостатності клапанів серця.
Рентгенографія органів грудної клітки
Рентгенографія органів грудної клітки є необхідною складовою діагностичних досліджень при СН і може надати лікареві важливу клінічну інформацію.
На початковому етапі інструментальної діагностики СН рентгенографія органів грудної клітки дає можливість визначити збільшення розмірів серця, що відразу робить діагноз СН високодостовірним. Загальноприйнятий об՚єктивний критерій кардіомегалії — підвищення кардіоторакального індексу (відношення найбільшого поперечного розміру серця до найбільшого внутрішнього поперечного розміру грудної клітки) >50% (рис. 2.5).
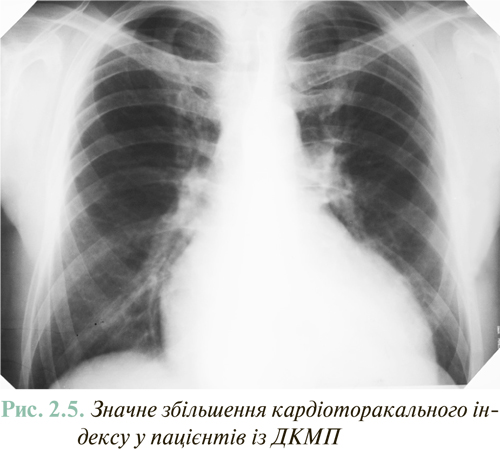
У той же час величина кардіоторакального індексу <50% автоматично не виключає наявності СН, оскільки при деяких захворюваннях серця ознаки СН можливі при нормальних або незначно збільшених його розмірах. Насамперед це стосується діастолічної СН (див. нижче). Зниження кардіоторакального індексу, поряд з відповідною динамікою ехоКГ-показників, є інформативним критерієм ефективності лікування пацієнтів із ХСН і систолічною дисфункцією ЛШ.
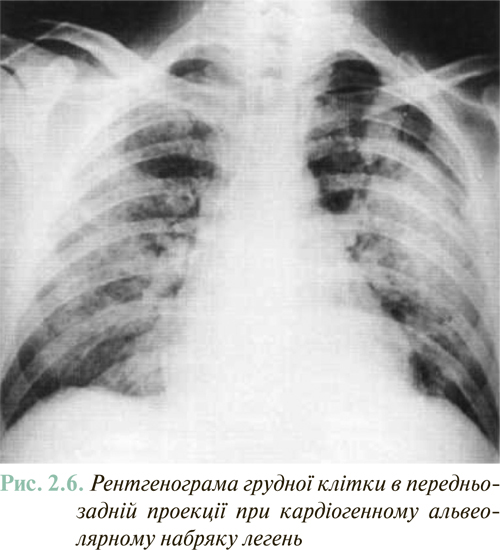
Рентгенографічне дослідження надає також важливу інформацію щодо наявності і вираженості застійних явищ у легенях як при діагностиці СН, так і при динамічному спостереженні хворого. Ранніми ознаками легенево-венозного застою є перерозподіл кровотоку у верхніх відділах легень з відповідним збагаченням у них судинного малюнка. Більший ступінь гіперволемії легень (у випадку якщо легенево-капілярний тиск >20 мм рт. ст.) супроводжується ознаками наявності транссудату, що локалізується периваскулярно і перибронхіально в області коренів легень, що робить останні візуально малоструктурованими, «розмитими», і поступово поширюється на периферію. Маркером інтерстиціального набряку легень є так звані В-лінії Керлі (Кегlеу Р., 1933) — зазвичай 3–5 тонких (1–2 мм) паралельних затемнених ліній довжиною 0,5–3 см, локалізованих в області реберно-діафрагмального кута та бічних базальних відділів легень. Лінії Керлі є результатом наявності рідини в міждольових щілинах і розширення лімфатичних судин. У випадку перевищення легенево-капілярного тиску >25 мм рт. ст. може виникати масивний плевральний випіт і/або альвеолярний набряк легень (типова рентгенологічна картина останнього — масивне двобічне затемнення, що поширюється від коренів легень у напрямку периферії, подібно «крилам метелика» (рис. 2.6).
Рентгенологічними ознаками легенево-артеріальної гіпертензії, що у дорослих є найбільш частим фактором насосної недостатності правих відділів серця (див. ЕТІОЛОГІЯ ХСН), є вибухання стовбура ЛА, наявність округлих тіней дилатованих гілок ЛА в ділянці розширених коренів, «обрив» артеріальних гілок на рівні сегментарних судин з подальшою відсутністю судинного малюнка по периферії легеневих полів.
Важливою функцією рентгенографії грудної клітки на етапі уточнення діагнозу ХСН є також диференційна діагностика із захворюваннями дихальної системи.
Рентгенографічне дослідження також є головним засобом діагностики та контролю ефективності лікування таких ускладнень СН, як застійна пневмонія, гідроторакс, тромбоемболія гілок ЛА.
Електрокардіографія
Рутинна ЕКГ у 12 відведеннях на початковому етапі формування діагнозу може надати допомогу у визначенні етіології та обтяжуючих факторів можливої СН — наприклад у випадках виявлення ознак великовогнищевого рубцьового кардіосклерозу ЛШ, гіпертрофії відділів серця, повної блокади ніжок (насамперед лівої) пучка Гіса, тахіаритмії.
Прогностична цінність наявності патологічних змін на ЕКГ при встановленні діагнозу СН низька (не більше 50–60%), оскільки всі ці зміни можливі і у хворих без порушення насосної функції серця. Навпаки, прогностична цінність відсутності патологічних змін на ЕКГ щодо відсутності СН >90%. Це означає, що у випадку нормальної ЕКГ можна з досить високим ступенем вірогідності (>90%) виключити діагноз СН.
При ХСН найбільш важливу роль відіграє ЕКГ як засіб контролю ефективності та безпеки медикаментозного лікування хворих серцевими глікозидами, блокаторами β-адренорецепторів, аміодароном, діуретиками (при цьому оцінюють ритм, провідність, ознаки насичення дигіталісом, тривалість інтервалу Q–T, наявність електролітних порушень).
З метою отримання додаткової інформації для діагностики СН при динамічному спостереженні цих хворих використовують різні інструментальні методи.
Радіонуклідна вентрикулографія
Радіонуклідна вентрикулографія може бути корисною у випадку труднощів з отриманням повноцінної діагностичної інформації за допомогою ехоКГ-дослідження (проблеми з так званим ультразвуковим вікном). Цей метод дає можливість з високою точністю оцінювати глобальну та сегментарну систолічну функцію обох шлуночків і показники їх діастолічної функції. Постійне вдосконалення діагностичних ультразвукових систем зробило застосування радіонуклідної вентрикулографії в останні роки менш актуальним.
Магнітно-резонансне дослідження серця
Магнітно-резонансне дослідження (МРД) серця — найбільш точний і відтворюваний метод визначення маси, об’єму порожнин, ФВ шлуночків, об’єму клапанних регургітацій і ХОК. Застосування МРД обмежується високою вартістю відповідної апаратури і самого дослідження.
Контрастне дослідження коронарного русла за допомогою спіральної КТ може застосовуватися у випадках сумнівів щодо етіології ХСН з метою виключення ІХС — головним чином у випадках неможливості виконання з тих чи інших мотивів селективної коронароангіографії.
Холтерівське моніторування ЕКГ
Не відіграє самостійної ролі в діагностиці СН. Холтерівське моніторування ЕКГ не відіграє ролі у встановленні діагнозу ХСН. Утім, воно дозволяє виявляти наявність і оцінювати вираженість суправентрикулярних та шлуночкових аритмій, порушень провідності серця, а також епізодів безбольової міокардіальної ішемії, які можуть провокувати поглиблення проявів СН.
Окрім цього, добове моніторування ЕКГ є оптимальним підходом до оцінки ефективності контролю частоти шлуночкових скорочень у хворих із ХСН та постійною формою фібриляції передсердь.
Проби з дозованим фізичним навантаженням
Проби з дозованим фізичним навантаженням не є засобом діагностики ХСН. Утім, якщо результат ВЕМ або проби на тредмілі з максимальним фізичним навантаженням відповідає нормі, діагноз СН, як правило, можна виключити.
Роль навантажувальних тестів при ХСН полягає в об՚єктивізації функціонального стану хворих та оцінці ефективності їх лікування. З цією метою в спеціалізованих медичних установах іноді застосовують східчасто-зростаючі проби на ВЕМ або тредмілі з визначенням загального часу навантаження/загального обсягу виконаної роботи, а також при наявності спіроергометричного устаткування, споживання кисню на максимумі досягнутого навантаження (VO2max). Останній підхід є золотим стандартом визначення толерантності до фізичного навантаження у пацієнтів із ХСН, оскільки рівень VO2mах найбільше (серед інших клініко-інструментальних показників) корелює зі здатністю хворих виконувати побутові фізичні навантаження та із прогнозом їх виживаності. Певним недоліком зазначених проб є те, що основний критерій їх припинення при ХСН — неможливість виконувати подальшу роботу в зв՚язку з задишкою — є суб՚єктивним.
У рутинній клінічній практиці з метою об՚єктивізації функціонального стану та контролю ефективності лікування пацієнтів із ХСН можна застосовувати тест з 6-хвилинною ходою, що є досить інформативним і досить безпечним. Його проведення протипоказано пацієнтам із гемодинамічно нестабільною ХСН (гіперволемічний стан, артеріальна гіпотензія), наявністю епізодів шлуночкової тахікардії і клініко-електрокардіографічними ознаками дестабілізації ІХС.
Результати тесту з 6-хвилинною ходою добре корелюють із ФК хворих, встановленим за клінічними критеріями, і з величиною VO2mах (табл. 2.7).
Таблиця 2.7
Критерії ФК хворих із ХСН за даними тесту з 6-хвилинною ходою
|
ФК |
Дистанція, пройдена за 6 хв, м |
Максимальне споживання кисню, мл·кг-1·хв-1 |
|
0 (відсутність наявної або прихованої СН) |
>550 |
>22,0 |
|
1 (безсимптомна дисфункція ЛШ) |
426–550 |
18,1–22,0 |
|
II |
301–425 |
14,1–18,0 |
|
III |
150–300 |
10,1–14,0 |
|
IV |
<150 |
≤10 |
Стрес-ехоКГ з добутаміном
Введення добутаміну в низьких дозах (інфузія зі швидкістю 5–10 мкг·кг-1·хв-1) може застосовуватися у пацієнтів із ХСН на фоні ІХС і систолічною дисфункцією ЛШ для оцінки життєздатності акінетичних та гіпокінетичних зон міокарда, при визначенні показань до його реваскуляризації.
Черезстравохідна ехоКГ
Черезстравохідна ехокардіографія не є рутинним засобом діагностики ХСН. Мотивами для її застосування можуть бути погане ультразвукове «вікно», підозра на дисфункцію протезу мітрального клапана, необхідність виключення тромбозу вушка лівого передсердя, уточнення діагнозу дефекту міжпередсердної перегородки, підозра на ендокардит.
Оцінка варіабельності ритму серця
Оцінка варіабельності ритму серця (ВРС) (добова — за даними холтерівського моніторування або на підставі реєстрації 5-хвилинних відрізків ЕКГ за допомогою відповідних комп՚ютерних програм) може надати додаткову інформацію для оцінки індивідуального прогнозу ХСН (див. нижче) і об’єктивізувати коригуючий вплив терапії нейрогуморальними антагоністами при порушеній автономній регуляції серця у таких хворих. У якості рутинного діагностичного методу при ХСН ВРС поки що не застосовують.
Оцінка функції зовнішнього дихання
Оцінка функції зовнішнього дихання не є засобом діагностики СН. Визначення її параметрів (ОФВ1, ОФВ1/ФЖЕЛ) здійснюється в окремих випадках з метою виключення бронхолегеневої причини задишки або оцінки вираженості супутньої ХОХЛ.
Інвазивні методи дослідження серця
Інвазивні методи дослідження серця не застосовують з метою встановлення діагнозу ХСН, проте за спеціальними показаннями можуть здійснюватися на подальших етапах обстеження хворого.
Так, коронароангіографія (КАГ) доцільна у випадках, коли за допомогою інших клініко-інструментальних методів неможливо провести диференційну діагностику між коронарним і некоронарним походженням СН, особливо при її рефрактерності до терапії. Іншим показанням до проведення КАГ є розв’язання питання відносно реваскуляризації ЛШ у осіб із ХСН, зумовленою ІХС, при наявності стенокардії, епізодів міокардіальної ішемії або зон життєздатного (гібернованого) міокарда, виявлених за допомогою добутамінового стрес-тесту. КАГ також показана пацієнтам із ХСН, що є кандидатами для проведення хірургічної корекції мітральної регургітації та/або аортальної вади серця.
Катетеризація ЛШ із контрастною вентрикулографією (є частиною протоколу загального коронаровентрикулографічного дослідження) надає можливість точного визначення тиску наповнення ЛШ, кращої візуалізації його аневризм.
Катетеризація правих відділів серця з інвазивним моніторингом тиску заклинювання в ЛА. Її проведення виправдано тільки у хворих із ГСН (шок, альвеолярний набряк легень), рефрактерною до стандартної програми інтенсивної терапії.
Лабораторні методи дослідження в діагностиці СН
Визначення змісту НУП у плазмі крові
Показано, що підвищення концентрації циркулюючих НУП — передсердного, так званого мозкового (МНУП) і його N-кінцевого фрагмента (NT-pro-МНУП) є раннім маркером дисфункції ЛШ — як систолічної, так і діастолічної. В останні роки цей підхід отримав статус діагностичного стандарту.
Висока чутливість підвищення концентрації циркулюючих МНУП або NТ-pro-МНУП (>90%) щодо наявності дисфункції ЛШ, з одного боку, і впровадження експрес-методик їх визначення — з іншого, дозволяє рекомендувати цей метод як першорядний скринінговий діагностичний метод у хворих із симптомами ймовірної СН (насамперед задишкою), а також з метою виключення доклінічної дисфункції ЛШ. Оскільки специфічність підвищення МНУП або NТ-pro-МНУП у визначенні дисфункції ЛШ поступається його чутливості (підвищення їх рівня можливо, зокрема, при гострих коронарних синдромах, ТЕЛА, нирковій недостатності), доцільно використовувати цей тест як метод виключення СН у випадках нормального рівня зазначених пептидів.
Алгоритм діагностики СН на базі експрес-визначення НУП у плазмі поданий на схемі 2.3.
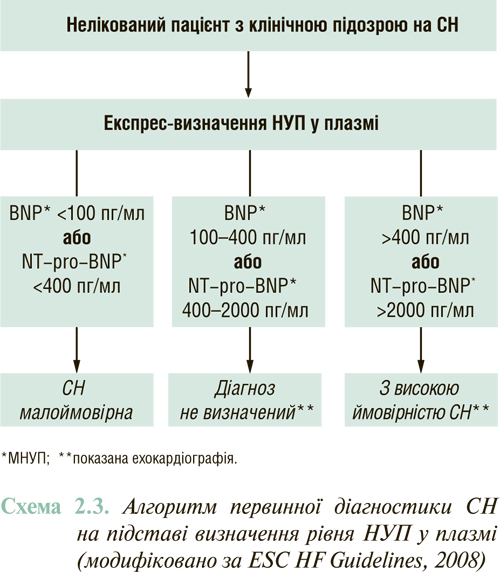
У випадках діагностованої ХСН повторне визначення BNP або NT-pro-BNP може використовуватись з метою об’єктивізації ефективності лікування, оскільки зниження його концентрації у плазмі поєднане з кращим прогнозом виживаності та зі зниженням ризику повторних госпіталізацій таких пацієнтів.
Гематологічні і біохімічні аналізи
Рекомендованими стандартними (обов՚язковими) лабораторними дослідженнями при ХСН є: 1) загальний аналіз крові (гемоглобін, кількість еритроцитів, лейкоцитів і тромбоцитів, гематокрит); 2) загальний аналіз сечі; 3) біохімічний аналіз крові, а саме електроліти (К+, Nа+) плазми крові, креатинін плазми крові, печінкові ферменти і білірубін, рівень глюкози крові.
Визначення наявності анемії має клінічне значення з кількох причин. По-перше, добре відомо, що корекція анемії як фактора, що збільшує симптоматику ХСН, сприяє поліпшенню клініко-функціонального стану хворого. По-друге, наявність анемії пов’язана з гіршим прогнозом виживаності таких пацієнтів. По-третє, анемія може свідчити про наявність клінічно актуальної супутньої патології, що потребує відповідного лікування.
Підвищення гематокриту може свідчити про наявність поліцитемії при легеневому генезі задишки, з іншого боку — вчасно сигналізувати про згущення крові на фоні надмірно інтенсивної діуретичної терапії.
Лімфоцитопенія є незалежним предиктором поганої виживаності при ХСН.
Загальний аналіз сечі, крім виявлення можливого супутнього захворювання нирок, дозволяє визначити наявність і рівень протеїнурії, що може бути однією з ознак кінцевого етапу ХСН («застійна нирка»).
Контроль електролітів крові є важливим елементом оцінки клінічного стану хворого і моніторингу безпеки проведеної терапії.
Гіпокаліємія, з одного боку, є одним з можливих проявів вторинного гіперальдостеронізму, характерного для декомпенсованої ХСН, з іншого — може виникати під час активної терапії петльовими і/або тіазидними діуретиками. Гіпокаліємія підвищує ризик розвитку фатальних шлуночкових аритмій, у зв՚язку з чим її необхідно вчасно коригувати шляхом підвищення доз калійзберігаючих діуретиків і, за необхідності, інфузією глюкозо-інсуліно-калієвої суміші. Тому при стаціонарному лікуванні пацієнтів з декомпенсованою ХСН необхідно регулярно контролювати рівень К+ плазми крові (у певних клінічних ситуаціях — щодобово).
Гіперкаліємія (рівень К+ плазми крові >5,5 ммоль/л) може виникати при ХСН у двох основних випадках. По-перше, у хворих із тяжкою ХСН поява гіперкаліємії, незважаючи на активне лікування петльовими діуретиками, часто є ознакою переходу ХСН у термінальну фазу з прогресивним погіршенням ниркової функції внаслідок критичного зниження серцевого викиду (для цієї ситуації характерне поєднання гіперкаліємії з підвищенням креатиніну плазми крові). По-друге, вона може бути наслідком надлишкової корекції гіпокаліємії (надмірне застосування калійзберігаючих діуретиків, інфузій глюкозо-калієвої суміші). Гіперкаліємія також може бути проявом побічної дії інгібіторів АПФ, блокаторів рецепторів ангіотензину II і антагоністів альдостерону, особливо при їх сумісному застосуванні. Виражена гіперкаліємія характеризується підвищеним ризиком виникнення блокад і брадисистолічних порушень ритму, аж до асистолії.
Гіпонатріємія у пацієнтів із ХСН може бути наслідком двох різних клінічних ситуацій. При першій з них зниження концентрації Nа+ в плазмі крові відображає значну вираженість гіперволемії (часто при наявності анасарки), а отже, має відносний характер («гіпонатріємія розведення») Гіпонатріємія такого походження, як правило, усувається при успішному подоланні набрякового синдрому. В іншому випадку гіпонатріємія може виникати у хворих із тяжкою ХСН на фоні тривалої інтенсивної (нерідко надмірної) терапії діуретиками, що поєднується з недостатнім надходженням хлориду натрію в організм. Факторами останньої можуть бути повна безсольова дієта, анорексія, блювання (особливо при їх поєднанні). Гіпонатріємія такого типу, як правило, супроводжується вираженою компенсаторною активацією відповідних нейрогормональних систем (РАС, аргінін-вазопресин) і розглядається як маркер поганого прогнозу виживаності.
Підвищення рівня креатиніну в плазмі крові може свідчити про наявність як самостійного декомпенсованого захворювання нирок, так і про перехід ХСН у термінальну фазу (див. вище). Іншою причиною підвищення концентрації циркулюючого креатиніну може бути терапія інгібіторами АПФ та/або блокаторами рецепторів ангіотензину II (див. ЛІКУВАННЯ). Підвищення рівня креатиніну відзначається й при надмірній діуретичній терапії, що призводить до зниження системного АТ, загального об’єму циркулюючої рідини і відповідно гіпоперфузії нирок («преренальна азотемія»). Крім того, підвищення рівня креатиніну може свідчити про порушення азотвидільної функції нирок, викликаної лікарськими препаратами, що використовуються для лікування ускладнень ХСН і супутніх станів (прикладом може бути нефротоксична дія антибіотиків при терапії застійної або тромбінфарктної пневмонії).
Підвищення активності печінкових ферментів у плазмі крові (АлАТ, ГГТ), а також циркулюючого білірубіну може бути маркером дисфункції печінки, викликаної застійними явищами в ній. Успішне лікування декомпенсації кровообігу звичайно супроводжується їх зворотною динамікою.
Крім того, наявність і ступінь печінкової дисфункції, що визначається за допомогою лабораторних тестів, необхідно враховувати при призначенні та моніторуванні ефектів застосовуваних при ХСН препаратів, які характеризуються винятково або переважно печінковим шляхом виведення (карведилол, аміодарон, дигітоксин, деякі інші).
Крім вищенаведених рекомендованих до стандартного застосування показників, важливу додаткову інформацію при ХСН можуть надавати деякі інші лабораторні тести.
Концентрацію сечової кислоти в крові доцільно визначати хворим із тяжкою ХСН виходячи з наступних міркувань. По-перше, необхідно контролювати гіперурикемію, що, як відомо, нерідко ускладнює тривале регулярне застосування петльових та/або тіазидних діуретиків у значних дозах. По-друге, інтенсивність утворення сечової кислоти є маркером вираженості системного оксидантного (вільнорадикального) ушкодження тканин, а її високий рівень в крові є предиктором поганої виживаності пацієнтів із ХСН. Тому корисно визначати рівень сечової кислоти в динаміці, з урахуванням корекції медикаментозного лікування, що проводиться.
Тиреотропний гормон. Визначення його рівня в крові доцільно з метою виключення гіпер- або гіпотиреозу як причини або як обтяжувального фактора СН, а також при підозрі на дисфункцію щитовидної залози на фоні тривалого прийому аміодарону.
Кардіоспецифічні ферменти. Необхідно визначати у випадках раптового погіршення показників гемодинаміки з метою виключення ІМ.
СРБ. Визначення його рівня в крові допомагає при виключенні запального генезу СН (дифузний міокардит).
МНВ. Його визначення є міжнародним стандартом диспансерного спостереження хворих, що приймають непрямі антикоагулянти (НАК). Визначення протромбінового індексу є сурогатним підходом, що за певних об՚єктивних причин дотепер практикується в країнах СНД.
КЛІНІЧНА ТЕРМІНОЛОГІЯ
Ліво- і правосерцева недостатність. Лівошлуночкова, лівопередсердна, правошлуночкова і бівентрикулярна недостатність
Про лівосерцеву (або «лівобічну») СН мова йде у випадках, коли внаслідок насосної недостатності серця, що виникає на рівні його лівих відділів, спостерігаються симптоми та ознаки легенево-венозного застою (гіперволемія малого кола кровообігу). У більшості випадків лівосерцева СН за своїм механізмом лівошлуночкова, оскільки є наслідком хронічної або гострої декомпенсації ЛШ (при ІХС, гіпертензивному серці, мітральній та аортальній регургітаціях). Про лівопередсердну недостатність мова йде у випадках мітрального стенозу, рідко — лівопередсердної міксоми.
При довгостроково існуючій поступово прогресуючій лівосерцевій недостатності створюються умови для виникнення супутньої насосної недостатності правих відділів серця. До таких факторів належать: а) ремоделювання і енергетична недостатність міжшлуночкової перегородки як загального для обох шлуночків анатомічного утворення; б) хронічне підвищення тиску наповнення ПШ, зумовлене дилатацією ЛШ; в) збільшення навантаження на ПШ внаслідок підвищення системного тиску в ЛА за рахунок підвищення тонусу її артеріол (рефлекторний захисний механізм, спрямований на обмеження кровотоку в легенях з метою зниження легенево-венозного тиску). З появою у таких хворих ознак насосної недостатності ПШ у вигляді застійних явищ у великому колі кровообігу мова йде про приєднання до наявної недостатності лівих відділів серця ще і правошлуночкової недостатності, що за механізмом свого виникнення носить вторинний характер. У подібному випадку часто застосовують термін «бівентрикулярна», або тотальна СН. Разом з тим бівентрикулярна СН може виникати і на початку захворювання, коли виражене ураження міокарда обох шлуночків виникає одночасно (при ДКМП, дифузному міокардиті).
Ізольована правошлуночкова недостатність є наслідком вичерпання резервів компенсації або механічного утруднення наповнення ПШ, наприклад при констриктивному перикардиті. Ізольована правошлуночкова недостатність відзначається при декомпенсованому легеневому серці, стенозі устя ЛА, ТЕЛА. Недостатність великого кола кровообігу можна характеризувати як правопередсердну у нечисленних випадках ізольованого трикуспідального стенозу, правопередсердної міксоми та аномалії Ебштейна.
ГСН І ХСН
У клінічній практиці під ГСН розуміють швидке виникнення виражених клінічних ознак насосної недостатності серця, найчастіше його лівих відділів. В останньому випадку спостерігають значно виражені задишку та об՚єктивні ознаки застійних явищ у легенях, що мають тенденцію до наростання і трансформації в альвеолярний набряк легень. Найбільш частою причиною гострої лівошлуночкової недостатності є гострий ІМ (зі значним об’ємом ураження або/і гострою мітральною недостатністю внаслідок розриву папілярного м՚яза). Іншими причинами ГСН можуть бути гіпертензивний криз, виражена тахі- і брадиаритмія, неконтрольовані інфузії значної кількості рідини у хворих з хронічною лівосерцевою недостатністю. Виникнення набряку легень як крайнього ступеня гострої лівопередсердної недостатності характерно для критичного мітрального стенозу.
Швидке зниження насосної функції серця може супроводжуватися розвитком кардіогенного шоку з типовими для нього гіпотензією, олігурією та ознаками гіпоперфузії периферичних тканин. Як форма ГСН кардіогенний шок характерний головним чином для ІМ. Крім критичної насосної недостатності ЛШ, при ІМ кардіогенний шок виникає у випадку повільного розвитку тампонади серця при невеликому розриві серцевого м՚яза. Кардіогенний шок можливий і у випадках стійкої, рефрактерної до терапії шлуночкової тахікардії.
Кардіогенним шоком маніфестується також гостра правошлуночкова недостатність при масивній ТЕЛА.
Систолічна та діастолічна СН
У більшості випадків клінічні прояви СН зумовлені зниженням систолічної здатності ЛШ, показником якої є істотне зменшення величини його ФВ (<40–45%). Разом з тим зменшення УОК може бути викликане і неадекватним наповненням одного або обох шлуночків внаслідок порушень процесів їх активного розслаблення або/і пасивного розтягнення, скорочення діастоли, а також механічних перешкод (табл. 2.8). При цьому скорочувальна здатність шлуночків істотно не порушується, про що свідчить нормальна величина їх ФВ.
Таблиця 2.8
Фактори і механізми діастолічної СН
|
Причини |
Патофізіологічні фактори |
Механізми |
|
ІХС |
Ішемія Репаративний (постінфарктний) фіброз |
Сповільнення активної релаксації ЛШ Сповільнення пасивного розслаблення ЛШ |
|
АГ ГКМП Аортальний стеноз |
ГЛШ Фіброз |
Сповільнення активной релаксації ЛШ Сповільнення пасивного розслаблення ЛШ |
|
Рестриктивні ураження міокарда (амілоїдоз, гемохроматоз, саркоїдоз, фіброеластоз) |
Зниження пасивно-еластичниих властивостей міокарда |
Сповільнення пасивного розслаблення шлуночків |
|
Мітральний стеноз |
Механічна перешкода наповненню ЛШ |
Зменшення надходження крові в ЛШ |
|
Констриктивний перикардит |
Механічна перешкода наповненню ПШ |
Різке зменшення діастолічного об’єму ПШ і ЛШ |
|
Тахісистолія |
Скорочення діастоли |
Зменшення діастолічного об’єму ПШ і ЛШ |
Об’єктивізувати наявність і особливості діастолічної дисфункції серця можна за допомогою допплєр-ехоКГ-обстеження трансмітрального кровотоку і потоку крові по легеневих венах (див. вище).
Систолічна і діастолічна недостатність ЛШ не є поняттями, тотожними відповідно систолічній або діастолічній його дисфункції, оскільки кожна з останніх може за допомогою інструментальних методів визначатися і у пацієнтів без клінічних ознак СН.
У таких випадках мова йде про той або інший тип доклінічної (безсимптомної) дисфункції ЛШ.
У багатьох пацієнтів із ІХС та АГ з клінічними проявами СН за допомогою інструментального дослідження виявляють поєднання ознак діастолічної дисфункції ЛШ з субнормальними значеннями його ФВ (у межах 45–50%). У такій ситуації з патофізіологічної точки зору можна говорити про «змішаний» тип СН, проте цей термін не отримав статус клінічного.
Диференційно-діагностичні критерії розмежування переважно систолічного та діастолічного типів дисфункції ЛШ представлені в табл. 2.9 і 2.10.
Таблиця 2.9
Клінічні та рентгенологічні критерії відмінності систолічної і діастолічної дисфункції ЛШ
| Клініко-рентгенологічні дані | Систолічна дисфункція | Діастолічна дисфункція |
| Основні причини СН |
|
|
| Перкусія | Кардіомегалія | Розширення границь серцевої тупості відсутнє або помірне |
| Аускультація | Тони приглушені, нерідко III протодіастолічний тон |
Тони частіше звучні, нерідко III пресистолічний тон |
| Рентгенографія | Кардіоторакальний індекс >50% | Кардіоторакальний індекс <50% |
Таблиця 2.10
ЕхоКГ-критерії відмінності систолічної і діастолічної дисфункції ЛШ
| Показник | Систолічна дисфункція ЛШ | Діастолічна дисфункція ЛШ |
| ФВ ЛШ | ≤45% | >45–50% (при ГКМП нерідко збільшена) |
| Дилатація ЛШ | Характерна | Відсутня |
| Дилатація лівого передсердя | Характерна | Характерна |
| Товщина стінок ЛШ у діастолу | Нормальна або зменшена | Потовщена (крім рестриктивних уражень міокарда) |
| Тип наповнення ЛШ за даними допплєрівського дослідження трансмітрального кровотоку | Рестриктивний | Гіпертрофічний або псевдонормальний (рестриктивний — при рестриктивних ураженнях міокарда) |
ХСН зі збереженою фракцією викиду ЛШ
Це поняття є більш широким, ніж діастолічна СН, оскільки поєднує всі випадки клінічно маніфестованої ХСН із ФВ ЛШ >45%. Крім вищеописаних випадків «чистої» діастолічної СН, сюди можна віднести: а) «змішаний» тип СН; б) правошлуночкову недостатність при хронічному легеневому серці; в) СН при мітральних та аортальних вадах за величини ФВ ЛШ >45%; г) СН, що може виникати при виражених брадисистолічних порушеннях ритму (неможливість забезпечення адекватного ХОК при навантаженні).
За даними різних досліджень ХСН зі збереженою фракцією викиду ЛШ виявляють у 22–50% випадків цього синдрому.
ХСН із підвищеним серцевим викидом
Більш ніж в 95% випадків ХСН невідповідність зниження серцевого викиду метаболічним потребам тканин виникає внаслідок зниження останнього. Хоча при деяких клінічних станах, що характеризуються гіперкінетичним типом кровообігу, вищевказана неадекватність і відповідно клінічні ознаки СН можуть з՚являтися при підвищеному ХОК. До таких станів відносяться тиреотоксикоз, тяжка анемія, хвороба Педжета, артеріовенозні фістули, сепсис.
До патогенетичних факторів розвитку цієї форми СН належать хронічне перевантаження серця об’ємом, хронічна симпатоадреналова активація, вторинна метаболічна кардіоміопатія, викликана основним захворюванням (тиреотоксикозом, анемією, септицемією). Серцевий індекс у таких хворих звичайно помірно підвищений (>4 л·хв-1·м2), проте нижчий того, який був до появи у них СН.
На відміну від хворих із ХСН зі зниженим серцевим викидом і клінічними ознаками периферичної вазоконстрикції (холодні і бліді кінцівки, знижений АТ, компенсаторне збільшення артеріовенозної різниці за киснем), у пацієнтів із ХСН і підвищеним ХОК відзначають периферичну вазодилатацію (тепла шкіра, часто її гіперемія), підвищений пульсовий тиск, нормальна або знижена артеріовенозна різниця за киснем.
Стандарти терапії при цій формі СН не розроблені, оскільки вирішальне значення має етіотропне лікування таких хворих.
Застійна СН. Декомпенсована і стабільна СН
Термін «застійна серцева недостатність» є синонімом клінічно вираженої СН із об՚єктивними ознаками затримки рідини в організмі. Протягом тривалого часу його використовували (переважно в західній літературі) як поняття, еквівалентне ХСН. Останнім часом у цьому значенні його застосовують значно рідше, оскільки, завдяки прогресу в галузі фармакотерапії ХСН (широке застосування нейрогуморальних антагоністів) і організації системи амбулаторної допомоги, в західних країнах збільшується кількість пацієнтів, яких підтримують протягом тривалого часу в еуволемічному стані. Для характеристики стану цих пацієнтів усі частіше використовують поняття «стабільна ХСН» або «гемодинамічно стабільна ХСН». Стосовно хворих із явними ознаками затримки рідини в організмі, які є кандидатами на стаціонарне лікування, у літературі тепер зазвичай застосовують термін «декомпенсована ХСН».
Недостатність кровообігу. Хронічна недостатність кровообігу
Зазначені терміни, що є синонімами відповідно СН і ХСН і які використовувалися протягом багатьох років у країнах колишнього СРСР, тепер мають лише історичне значення. Можна припустити, що у світлі сучасних уявлень про значимість системних периферичних і метаболічних порушень у прогресуванні клінічно маніфестованої ХСН, термін «хронічна недостатність кровообігу», є більш доречним з патофізіологічної точки зору. Проте з урахуванням глобальних інтеграційних процесів перехід на сучасну термінологію вбачається оптимальним.
Остаточний діагноз ХСН
Діагноз СН базується на двох глобальних критеріях: 1) наявності тих або інших суб՚єктивних та об՚єктивних симптомів СН; 2) об՚єктивізації за допомогою інструментальних методів структурних змін серця і його дисфункції (систолічної або діастолічної) у стані спокою. Останній момент має принциповий характер, оскільки виключає випадки транзиторного погіршення функції серця під час фізичного навантаження внаслідок інших причин. Прикладом може бути минуще зниження ФВ ЛШ на висоті навантажувальної проби, викликане індукованою ішемією міокарда, у хворих із ІХС без СН.
Додатковим критерієм є позитивна клінічна відповідь на лікування СН. Його роль полягає в тому, що в ургентних випадках він може тимчасово замінити другий із зазначених двох головних діагностичних критеріїв. Проте для встановлення остаточного діагнозу СН інструментальна об՚єктивізація дисфункції серця залишається обов՚язковою.
Послідовність діагностичних дій лікаря після виявлення ним клінічних симптомів, які можуть свідчити про наявність ХСН, наведена на схемі 2.4.
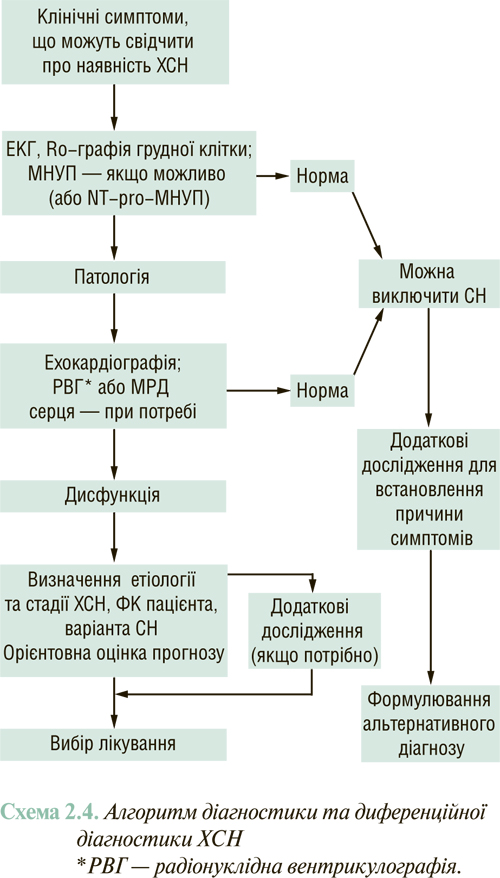
Диференційна діагностика СН передбачає: а) виключення інших патологічних станів, що проявляються подібними суб՚єктивними симптомами (див. табл. 2.5); б) виключення ХСН з подальшим встановленням альтернативного діагнозу. Особливого значення диференційна діагностика СН набуває в ургентних ситуаціях (як правило, при гострому нападі задишки), коли точність та оперативність діагностики мають вирішальне значення для хворого. Крім загальновідомих диференційно-діагностичних ознак (табл. 2.11 як приклад), виключенню СН або констатації її високої ймовірності сприяє експрес-визначення циркулюючого МНУП або NТ-pro-МНУП (див. схему 2.3). Так, у багатоцентровому дослідженні ВNP (2002) прогностична значимість підвищеного рівня NТ-pro-МНУП щодо наявності ХСН становила 83%, а прогностична значимість нормального його рівня щодо відсутності ХСН — 85%.
Таблиця 2.11
Диференційна діагностика серцевої астми (інтерстиціального набряку легень)
| Дані | Серцева астма | БА | ТЕЛА |
| Анамнестичні дані | Захворювання серця (ІХС, вада), АГ, СН | БА; алергічні реакції | Тромбофлебіт, тривала іммобілізація; оперативне втручання; фібриляція передсердь |
| Об’єктивний статус | Блідість; холодний піт; холодний акроцианоз | Помірний теплий ціаноз | Теплий ціаноз верхньої частини тулуба (можливо) |
| Положення хворого | Сидячи зі спущеними ногами | Сидячи або стоячи спираючись на руки | Сидячи або лежачи |
| Задишка | Інспіраторна, іноді змішана |
Експіраторна | Інспіраторна або змішана |
| Аускультація | Вологі хрипи | Жорстке дихання з подовженим видихом; сухі свистячі хрипи | Акцент II тону над ЛА |
| Характер мокроти | Багато, мокрота піниста | Відходить погано, скловидна | Мало, інколи з кров՚ю |
| АТ | Частіше підвищений | Часто підвищений | Частіше нормальний або знижений |
| ЕКГ | Часто ознаки гіпертрофії ЛШ і його перевантаження; Р mitrale | Часто Р pulmonale | Можлива поява в динаміці правограми, синдрому QIII–S1, Р pulmonale |
| Рентгенографія легень | Посилений малюнок; знижена пневматизація; лінії Керли | Дифузне підвищення пневматизації | Частіше збіднення малюнка; можлива наявність клиноподібної тіні |
| ЕхоКГ | Дилатація і зниження ФВ ЛШ; дилатація лівого передсердя | Частіше візуалізація утруднена; часто дилатація ПШ | Можлива дилатація ПШ |
Слід пам՚ятати про можливості поєднання СН з будь-яким захворюванням, що супроводжується тими або іншими спільними з нею ознаками (наприклад набряковий синдром — при супутньому захворюванні нирок; тахікардія і задишка при навантаженні у випадку анемії). У подібних випадках правильна оцінка справжньої тяжкості ХСН та ефективності її лікування базується на клінічному досвіді лікаря і обов՚язковому застосуванні об՚єктивних інструментальних і лабораторних методів, у тому числі при динамічному спостереженні хворого. Приклади формулювання клінічних діагнозів наведені в табл. 2.12.
Таблиця 2.12
Приклади клінічних діагнозів
| Діагноз | ||
| № з/п | Попередній або клінічний (до лікування) |
Заключний (після лікування) |
| 1 | ІХС: постінфарктний кардіосклероз, хронічна аневризма передньоперегородкового відділу ЛШ. СН IIА стадії із систолічною дисфункцією ЛШ, III ФК | Той же; II ФК |
| 2 | ДКМП, постійна форма фібриляції передсердь. СН IIБ стадії із систолічною дисфункцією ЛШ, IV ФК | Той же; III ФК |
| 3 | ІХС: стабільна стенокардія напруження, II ФК, постінфарктний кардіосклероз, СН I стадії зі збереженою систолічною функцією ЛШ* | Той же |
| 4 | Гіпертонічна хвороба III стадії, гіпертензивне серце. СН IIА стадії зі збереженою систолічною функцією ЛШ, III ФК | Той же; II ФК |
| 5 | ГКМП, обструктивна форма, СН IIА стадії зі збереженою систолічною функцією ЛШ, III ФК | Той же; II ФК |
| 6 | Хронічна ревматична хвороба серця, активність I ступеня, ревмокардит, комбінована аортальна вада з переважанням недостатності, СН IIА стадії зі збереженою систолічною функцією ЛШ, III ФК | Той же; III ФК |
| 7 | Хронічна ревматична хвороба серця, активність I ступеня, ревмокардит, мітральний стеноз, трикуспідальна недостатність, СН IIБ стадії зі збереженою систолічною функцією ЛШ, IV ФК | Той же; III ФК |
| 8 | Гіпертонічна хвороба III стадії, гіпертрофія ЛШ, ІХС: постінфарктний кардіосклероз, постійна форма фібриляції передсердь, СН IIБ стадії із систолічною дисфункцією ЛШ, IV ФК | Той же; III ФК |
*Якщо у хворого стабільна стенокардія напруження, то в діагнозі зазначають тільки ФК останньої, ФК ХСН не приводять
КЛАСИФІКАЦІЯ ХСН АСОЦІАЦІЇ КАРДІОЛОГІВ УКРАЇНИ
Основні терміни:
- Клінічна стадія СН;
- Варіант СН;
- ФК пацієнта.
Коди за МКХ-10: I50, I50.1, I50.9.
Клінічні стадії: I; IIА; IIБ; III.
СН I, СН IIА; СН IIБ; СН III відповідають критеріям I, IIА, IIБ і III стадії хронічної недостатності кровообігу за класифікацією М.Д. Стражеска і В.Х. Василенка (1935):
I — початкова недостатність кровообігу; проявляється тільки при фізичному навантаженні (задишка, тахікардія, стомлюваність); у спокої гемодинаміка і функції органів не порушені.
II — виражена тривала недостатність кровообігу; порушення гемодинаміки (застій у малому і великому колі кровообігу і т.п.), порушення функції органів та обміну речовин, що проявляється в спокої;
період А — початок стадії, порушення гемодинаміки виражені помірно; відзначають порушення функції серця або тільки якогось його відділу;
період Б — кінець тривалої стадії: глибокі порушення гемодинаміки, страждає вся серцево-судинна система.
III — кінцева, дистрофічна недостатність кровообігу; тяжкі порушення гемодинаміки, стійкі зміни обміну речовин і функцій органів, необоротні зміни структури тканин та органів.
Варіанти СН:
- із систолічною дисфункцією ЛШ: ФВ ЛШ ≤45%;
- із збереженою систолічною функцією ЛШ: ФВ ЛШ >45%.
ФК пацієнтів за критеріями NYHA:
I ФК — пацієнти із захворюванням серця, у яких виконання звичайних фізичних навантажень не викликає задишки, втоми або серцебиття.
II ФК — пацієнти із захворюванням серця і помірним обмеженням фізичної активності. Задишку, втому, серцебиття відзначають при виконанні звичайних фізичних навантажень.
III ФК — пацієнти із захворюванням серця і вираженим обмеженням фізичної активності. У стані спокою скарги відсутні, але навіть при незначних фізичних навантаженнях виникають задишка, втома, серцебиття.
IV ФК — пацієнти із захворюванням серця, у яких будь-який рівень фізичної активності викликає зазначені вище суб՚єктивні симптоми. Останні виникають також у стані спокою.
Примітки:
- Стадія СН відображає етап клінічної еволюції цього синдрому, тоді як ФК пацієнта є динамічною характеристикою, що може змінюватися під впливом лікування (додаток — табл. 2.13).
- Визначення варіантів СН (із систолічною дисфункцією або із збереженою систолічною функцією ЛШ) можливе лише при наявності відповідних даних ехоКГ-дослідження.
Таблиця 2.13
Орієнтовна відповідність клінічних стадій СН і ФК
|
Стадія СН |
ФК пацієнта |
|
I |
II ФК (на фоні адекватного лікування — I ФК) |
|
IIА |
III ФК (на фоні адекватного лікування — II ФК, іноді I ФК) |
|
IIБ |
IV ФК (на фоні адекватного лікування — II ФК, іноді III ФК) |
|
III |
IV ФК (іноді на фоні адекватного лікування — II ФК) |
Коментар. Діюча вітчизняна класифікація ХСН передбачає застосування трьох основних термінів, кожний з яких несе самостійний клінічний зміст.
Критерії клінічних стадій СН (СН I, СН IIА, СН IIБ та СН III загальновідомі, оскільки відповідають таким для I, IIА, IIБ і III стадії недостатності кровообігу за класифікацією М.Д. Стражеска — В.Х. Василенка. При прийнятті діючої класифікації IV Національним конгресом кардіологів України в 2000 р. констатовано, що на сьогодні немає підстав відмовлятися від формулювання стадій ХСН, оскільки це відповідає вітчизняній клінічній традиції і адекватно регламентує прийняття рішень при проведенні медико-соціальної експертизи. Одночасно термін «недостатність кровообігу» замінений терміном «серцева недостатність», що у цей час є в світі загальноприйнятим.
Термін «функціональний клас пацієнта» є відносно новим для вітчизняної практики офіційним терміном, який відображає спроможність хворого виконувати побутові фізичні навантаження. Для визначення у хворих ФК від I до IV у діючій класифікації використані критерії NYНА, верифіковані за допомогою методики визначення максимального споживання кисню (VО2mах).
Може виникнути питання: наскільки необхідно характеризувати стан хворого за допомогою ФК, якщо класифікацією передбачений розподіл ХСН на стадії, які, без сумніву, більш глибоко відображають клінічний стан пацієнтів? Насправді тут не існує протиріччя, оскільки вищезгадані характеристики наповнені різним змістом. Стадію ХСН слід розглядати в контексті клінічної еволюції цього синдрому — як її черговий етап з властивим йому спектром регуляторних порушень, адаптаційних можливостей і структурно-функціональних змін органів (тканин)-мішеней: серця, судин, нирок, печінки, скелетних м՚язів. У той же час ФК пацієнта із ХСН може динамічно змінюватися: або погіршуватися (зростати) під впливом різних патогенетичних факторів (наприклад з появою персистуючої тахіаритмії), або покращуватися (зменшуватися) під впливом відповідного лікування. Наведемо такий приклад. У пацієнта з циркуляторними змінами, що відповідають СН IIБ стадії, в результаті активного гемодинамічного розвантаження за допомогою діуретиків, дигоксина і нітратів протягом тижня усунуті набряковий синдром і клінічні ознаки гіперволемії легень, зменшилася в розмірах печінка. При цьому переносимість фізичного навантаження покращилася — констатовано перехід з IV у II–III ФК. Чи означає це, що у хворого також змінилася стадія ХСН із IIБ на IIА? Безперечно ні, оскільки у цього пацієнта відміна або навіть неадекватне зниження дози діуретика протягом наступних декількох днів можуть призвести до рецидиву тяжкого набрякового синдрому і погіршення толерантності до фізичного навантаження (повернення в IV ФК). Говорити про оборотність клінічної стадії ХСН означає ігнорувати визначення ХСН як синдрому з прогресуючим перебігом. Зовсім іншою є ситуація, коли радикальний етіотропний коригуючий вплив, (а саме хірургічне втручання), усуває безпосередньо причину ХСН (наприклад протезування клапанів серця), оскільки в цьому випадку мова йде не про зворотну еволюцію стадій ХСН, а про усунення умов для самого існування ХСН.
Взаємоз’язок між клінічними стадіями ХСН і ФК пацієнта наведений в додатку до діючої класифікації (див. табл. 2.13).
Важливим у діючій класифікації є виділення варіантів СН із систолічною дисфункцією ЛШ (при ФВ ЛШ ≤45%) і без такої (ФВ ЛШ >45%). Практичне значення застосування вищевказаного критерію систолічної дисфункції ЛШ полягає насамперед у тому, що міжнародні стандарти фармакотерапії ХСН розроблені саме для категорії хворих з ФВ ЛШ <40–45%, які характеризуються низьким рівнем виживаності незалежно від нозологічної причини ХСН. Тому вказівка в діагнозі наявності клінічно значимої систолічної дисфункції ЛШ є важливою, враховуючи необхідність дотримання відповідних стандартів їх лікування.
УСКЛАДНЕННЯ ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ
Аритмії
Шлуночкові ектопічні скорочення реєструють при холтерівському моніторуванні майже у всіх хворих із систолічною дисфункцією ЛШ, у тому числі приблизно у половини — нестійку шлуночкову тахікардію. У пацієнтів із середньою кількістю ектопічних скорочень >10 за 1 год при добовому моніторуванні ЕКГ відзначають підвищений ризик виникнення раптової серцевої смерті, електрофізіологічні механізми якої наведені вище у відповідному розділі. Важливо пам՚ятати, що раптово вмирають протягом 1 року 15–20% хворих із ХСН і ФВ <30%.
Фібриляція передсердь. За даними Фремінгемського епідеміологічного дослідження фібриляцію передсердь у хворих із клінічно маніфестованою ХСН відзначають у 4 рази частіше, ніж у загальній популяції. Як зазначено вище, тахісистолічна форма фібриляції передсердь є однією з причин виникнення СН. З іншого боку, поява фібриляції передсердь у пацієнта із вже існуючою СН є одним із факторів подальшої декомпенсації кровообігу та підвищеного ризику виникнення інсульту, зумовленого мозковою тромбоемболією.
Тромбоемболічні ускладнення
Частота виявлення тромбоемболічних ускладнень, за даними різних досліджень, у хворих із ХСН становить 1,5–3,5% на рік, причому 1-ше місце серед них займає інсульт. Відповідно до бази даних дослідження VНеFТ частота виникнення інсульту протягом року у цих пацієнтів становила 1,8%, периферичних тромбоемболій — 0,1%, ТЕЛА — 0,3%. Подібні результати отримані при ретроспективному аналізі бази даних досліджень SОLVD, SАVЕ і РRОМІSЕ.
До факторів тромбоемболій при СН належать:
- зниження об՚ємної і лінійної швидкості системного кровотоку;
- дисфункція ендотелія з відповідною активацією тромбоцитарної ланки гемостазу;
- дисбаланс згортальної/протизгортальної систем крові в бік прокоагуляції внаслідок нейрогуморальної та імунозапальної активації (ангіотензин II, протизапальні цитокіни);
- пристінкове тромбоутворення в порожнинах передсердь при постійній формі фібриляції передсердь і/або в дилатованих порожнинах шлуночків;
- іноді надмірно інтенсивна діуретична терапія, що призводить до згущення крові;
- значне зниження фізичної активності (у пацієнтів із тяжкою ХСН).
Фібриляція передсердь є основним фактором розвитку артеріальних тромбоемболій, які в 90% мають мозкову локалізацію (інсульт). Іншими факторами ризику виникнення тромбоемболії при ХСН є низька ФВ ЛШ, низька толерантність до фізичного навантаження, наявність рухливого тромбу в порожнині ЛШ.
Пневмонія
Пневмонія є частим наслідком легеневого застою при тяжкій рефрактерній СН або при неадекватній її терапії.
Недостатність азотовидільної функції нирок
Недостатність азотовидільної функції нирок характерна в першу чергу для термінальної ХСН. Аналіз бази багатоцентрових досліджень свідчить про те, що кліренс креатиніну помірно знижується у 25–50% хворих із клінічно маніфестованою ХСН, зростаючи в міру збільшення тяжкості їх клінічного стану. Причиною ниркової недостатності при ХСН є зменшення клубочкової фільтрації внаслідок зниження серцевого викиду і хронічної констрикції аферентних (прегломерулярних) артеріол нирок.
Печінкова недостатність
Печінкова (гепатоцелюлярна) недостатність виникає насамперед внаслідок хронічного венозного застою і (у частини випадків) значно виражених циротичних змін у печінці. Зниження рівня білірубіну і/або печінкових ферментів може бути додатковим маркером гемодинамічного покращання в процесі лікування пацієнтів із ХСН. Прогресуюча функціональна недостатність печінки у хворих із термінальною ХСН є відображенням її гіпоперфузії, зумовленої критичним зменшенням серцевого викиду.
Серцева кахексія
Серцеву кахексію відзначають у хворих із ХСН, як правило, в її термінальній фазі. Втрата маси тіла відбувається за рахунок скелетних м՚язів, а також жирової і кісткової тканини. Основними факторами зазначених змін є порушення всмоктування поживних речовин у застійному кишечнику; зниження апетиту, в тому числі центрального генезу; гіподинамія; активація системи прозапальних цитокінів; апоптоз скелетних м՚язів; зниження чутливості тканин до інсуліну і гормону росту.
ПРЕДИКТОРИ КЛІНІЧНОГО ПРОГНОЗУ
Орієнтовна оцінка прогнозу виживаності хворого із ХСН актуальна по двом причинам. По-перше, це необхідно для визначення індивідуальної тактики диспансеризації (інтенсивності спостереження) пацієнтів, що сприяє поліпшенню якості їх життя і зменшенню потреби в повторних госпіталізаціях. По-друге, це допомагає визначити показання для застосування сучасних немедикаментозних/хірургічних методів лікування (ресинхронізуюча електрокардіостимуляція (РЕКС) шлуночків, імплантований кардіовертер-дефібрилятор (ІКД), трансплантація серця).
Під предиктором (від англ. рrеdiсt — передбачати) того або іншого клінічного ускладнення на сьогодні розуміють певний параметр стану хворого, що дозволяє з достатнім ступенем імовірності прогнозувати виникнення у нього через певний проміжок часу зазначеного ускладнення (при ХСН — насамперед летального кінця). Такі клінічні предиктори визначають на підставі даних клініко-інструментального дослідження і спостереження пацієнтів, використовуючи відповідні математичні методи (модель пропорційних ризиків Кокса, множинна регресія, побудова так званих актуарних кривих виживаності у групах із різними значеннями досліджуваного показника та ін.).
Можливості індивідуального прогнозування перебігу ХСН є обмеженими, оскільки відомі в літературі відповідні прогностичні маркери відображають імовірність виживаності великих груп хворих, а не окремих пацієнтів. Разом з тим для визначення оптимальної тактики ведення хворих (зокрема визначення показань до кардіотрансплантації та інших хірургічних методів лікування) лікареві доцільно враховувати ознаки, наявність кожної з яких у пацієнтів з клінічно маніфестованою ХСН пов՚язана з поганим прогнозом виживаності.
У табл. 2.14 наведено предиктори низької виживаності хворих із ХСН протягом 1–5 років, встановлені на підставі даних різних клінічних і епідеміологічних досліджень.
Таблиця 2.14
Показники очікуваної низької виживаності у хворих з ХСН
| Клініко-демографічні | Інструментальні | Лабораторні |
| ІІІ–ІV за NYHA Похилий вік Зупинка кровообігу в анамнезі Нижча за норму маса тіла Ниркова недостатність Анемія Супутній цукровий діабет Супутня ХОХЛ Психічна депресія Погана прихильність до лікування Розлади дихання під час сну Аортальний стеноз |
Стійка гіпотензія Розширення QRS (>0,12с) Низька (<30 %) ФВ ЛШ Складні шлуночкові аритмії Тахісистолія Супутня систолічна дисфункція ПШ Рестриктивний тип наповнення ЛШ Максимальне cпоживання кисню <11 мл/хв/м2 (спіроергометрія) |
Високий рівень циркулюючих НУП (BNP >700 пкг/мл NT-pro-BNP >3000 пкг/мл) Гіпонатріємія (Na+ <135 ммоль/л) Підвищений рівень тропоніну Креатинін плазми >200 мкмоль/л Рівень білірубіну вищий за норму Анемія <120 г/л Гіперурикемія >600 мкмоль/л |
ПРОФІЛАКТИКА СН
Заходи первинної профілактики СН, тобто попередження розвитку останньої у різних категорій кардіологічних хворих, ґрунтуються насамперед на відповідних даних доказової медицини.
Хворі з АГ
У метааналізі P. Meredith і L. Ostergren (2006) продемонстровано, що контроль АТ на належному рівні за допомогою будь-яких (що оцінювалися сукупно), антигіпертензивних засобів у найбільшому ступені відображається саме на розвитку СН (52%) порівняно з розвитком мозкового інсульту, ІХС і серцево-судинної смерті (зниження ризику на 38; 16 і 21% відповідно).
Найбільший на сьогодні метааналіз досліджень порівняльної ефективності антигіпертензивних препаратів— BPLTTC (29 клінічних досліджень, які охопили >162 тис. пацієнтів) показав, що тривале застосування інгібіторів АПФ супроводжується нижчим ризиком розвитку СН порівняно з тривалим прийомом як плацебо, так і антагоністів кальцію (в обох випадках відносний ризик — 0,82). Примітно, що прийом антагоністів кальцію характеризувався вищим ризиком появи СН порівняно як з плацебо (відносний ризик — 1,21), так і з прийомом блокаторів β-адренорецепторів і діуретиків (відносний ризик — 1,33). У свою чергу інгібітори АПФ і блокатори β-адренорецепторів/діуретики, виявляючи порівнянний антигіпертензивний ефект, істотно не розрізнялися між собою відносно ймовірності виникнення СН.
Прикладом результативної первинної профілактики СН у хворих з АГ інгібіторами АПФ можуть бути дані мультицентрового дослідження PROGRESS, що продемонструвало дієвість периндоприлу у вторинній профілактиці розвитку мозкових інсультів. У субпопуляції пацієнтів з АГ, що ввійшли в це дослідження (2916 (48%) чоловік), лікування, що базується на периндоприлі протягом 4 років, дозволило знизити ризик виникнення застійної СН на 27% (при порівнянних рівнях АТ у групах активного лікування і плацебо).
Пацієнти з ІХС
Статини
У хрестоматійному дослідженні 4S тривале (>5 років) застосування симвастатину у пацієнтів із хронічною ІХС і підвищеним рівнем загального ХС у плазмі крові (5,5–8,0 ммоль/л) зумовлювало, крім зниження смертності пацієнтів на 30%, також достовірне зменшення кількості випадків виникнення СН на 21%.
Блокатори β-адренорецепторів
Хоча дані багатоцентрових досліджень щодо впливу блокаторів β-адренорецепторів на частоту виникнення СН у пацієнтів із ІХС порівняно з плацебо відсутні (а в наш час подібні дослідження вже не можуть бути сплановані з етичних міркувань), доцільність їх застосування з метою первинної профілактики СН у пацієнтів з ІХС базується на досить потужних передумовах. По-перше, добре відома патогенетична роль підвищення активності САС у трансформації доклінічної СН у клінічно явну. По-друге, блокатори β-адренорецепторів істотно знижують ризик розвитку ІМ, що, як було вказано вище, є найбільш значимим фактором ризику СН. Нарешті, за даними ряду великих багатоцентрових досліджень (USCP, MEPIT-HF, CIBIS-II, COPERNICUS) блокатори β-адренорецепторів істотно сповільнюють прогресування симптомної систолічної ХСН (див. ЛІКУВАННЯ ХСН).
Інгібітори АПФ
За даними метааналізу відповідних багатоцентрових досліджень тривале застосування інгібіторів АПФ на 23% знижує порівняно з плацебо ризик виникнення СН у пацієнтів з ІХС (Dagenais G.R. et al., 2006). Найбільш демонстративні в цьому результати двох відомих мегадосліджень — HOPE (2000, раміприл) і EUROPA (2003, периндоприл). Перше з них, HOPE охопило більше 9297 хворих без ознак СН і високим серцево-судинним ризиком (ІМ в анамнезі, стенокардія, клінічно значимий периферичний атеросклероз або цукровий діабет у поєднанні з одним із таких факторів ризику, як «м՚яка» гіпертензія, гіперхолестеринемія, паління, мікроальбумінурія), яким проводили терапію ацетилсаліциловою кислотою, блокаторами β-адренорецепторів, тіазидними діуретиками). У результаті тривалого (в середньому 4,5 року) застосування раміприлу, включеного в зазначену схему фармакотерапії, відзначали достовірне зниження (порівняно з плацебо) сумарної кількості серцево-судинних ускладнень (ІМ, інсульт, кардіоваскулярна смерть), а також випадків виникнення СН на 23% (рис. 2.7).
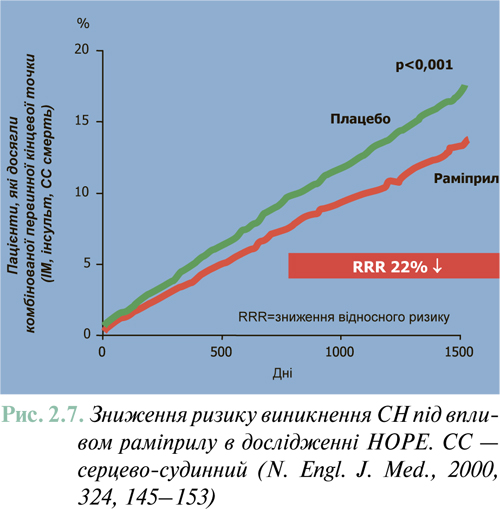
У дослідження EUROPA (2003) включили 12 236 пацієнтів із ІХС без клінічних ознак СН (як у поєднанні з АГ, так і без неї), які отримували відповідну сучасну стандартну фармакотерапію (>90% — антитромбоцитарні засоби, біля ⅔ — блокатори β-адренорецепторів і статини), 65% з яких перенесли ІМ і 55% — хірургічну реваскуляризацію ЛШ. У половини пацієнтів у зазначену терапію включали плацебо, у половини — периндоприл. Середня тривалість спостереження склала 4,2 року, а в якості первинної «кінцевої точки» розглядалася загальна кількість випадків серцево-судинної смерті, ІМ і зупинки серця. У групі периндоприлу зазначеної «кінцевої точки» досягли на 20% менше хворих, ніж у групі плацебо (488 і 603 відповідно, розходження високодостовірне: р=0,0003). Поряд з цим у групі периндоприлу порівняно з групою плацебо зафіксоване зменшення кількості госпіталізацій внаслідок виникнення СН на 39% (рис. 2.8).
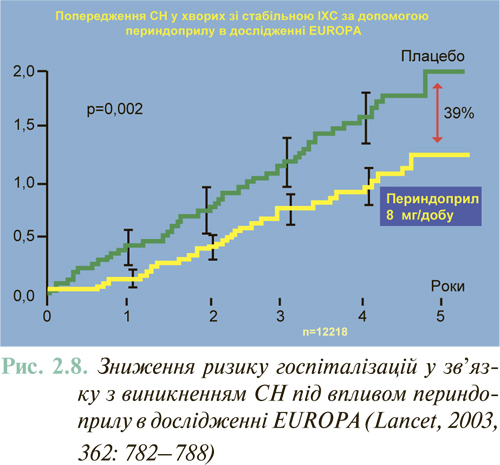
Отже, у різних категорій пацієнтів із серцево-судинними захворюваннями без ознак ХСН ризик виникнення клінічних проявів останньої знижують наступні заходи:
- При АГ — медикаментозний контроль АТ на цільовому рівні.
- При хронічних формах ІХС, у тому числі у поєднанні з АГ, — тривале застосування інгібіторів АПФ (периндоприлу або раміприлу) і статинів.
- Після гострого ІМ — тривале застосування блокаторів β-адренорецепторів та інгібіторів АПФ.
Крім цього, на думку експертів, яка базується на узагальненні клінічного досвіду, до шляхів первинної профілактики ХСН належать: при персистуючих тахіаритміях — їх усунення або адекватний контроль ЧСС, при вадах клапанного апарату серця — їх своєчасна хірургічна корекція.
ЛІКУВАННЯ ХРОНІЧНОЇ СЕРЦЕВОЇ НЕДОСТАТНОСТІ: ЗАГАЛЬНІ ЗАУВАЖЕННЯ
Етіотропне лікування при СН
Після встановлення діагнозу СН лікарю необхідно вирішити: а) чи можливе усунення самої СН за рахунок радикальної (хірургічної) корекції її причини; б) у випадку відсутності такої можливості, чи використані всі наявні можливості оптимізації поточного лікування етіологічної причини СН. Оцінка сучасних можливостей етіотропного лікування СН наведена в табл. 2.15.
Таблиця 2.15
Етіотропне лікування при СН: сучасні можливості* (модифіковано за A. Timmis, 2003)
| Причина СН | Шлях корекції | Провідна детермінанта успіху | Імовірність усунення СН |
| Хронічна ІХС | Реваскуляризація (АКШ або аортокоронарне стентування) |
Достатня маса гібернованого міокарда | Помірна |
| Аневризма ЛШ | Аневризмектомія | Резидуальна функція ЛШ | Висока |
| АГ | Нормалізація АТ | Регрес ГЛШ | Помірна |
| ДКМП | — | — | — |
| ГКМП | Хірургічне або електрофізіологічне усунення градієнта обструкції ЛШ | Не відома | Низька/помірна |
| Рестриктивна кардіоміопатія | — | — | — |
| Алкогольна кардіоміопатія | Відмова від вживання алкоголя | Тривалість зловживання | Помірна |
| Клапанні вади | Клапанне протезування | Ступінь дисфункції ЛШ | Висока |
| Корекція мітрального стенозу | Вираженість структурних змін легеневих артеріол | Висока | |
| Констриктивний перикардит | Перикардектомія | Адекватність проведення хірургічного втручання | Висока |
| Тахісистолічна фібриляція передсердь | Відновлення синусового ритму Медикаментозний або хірургічний (абляція з електрокардіостимуляцією) контроль ЧСС |
Стабільне підтримання синусового ритму Тривалість тахісистолії |
Висока
Помірна |
На жаль, у більшості випадків радикальне усунення причини ХСН неможливе, що визначає необхідність постійного, протягом всього життя лікування хворого з чітким усвідомленням лікарем тих цілей, які повинні бути досягнені в процесі цього лікування.
Мета лікування при ХСН
1. Забезпечення максимально можливого для хворого рівня якості життя передбачає:
а) зменшення або, краще, усунення основних клінічних симптомів СН;
б) зменшення кількості повторних госпіталізацій хворого з приводу декомпенсації кровообігу;
в) досягнення двох зазначених вище цілей при хорошій переносимості відповідного лікування;
г) сприяння максимально можливій соціальній адаптації пацієнта шляхом високоякісного диспансерного спостереження (інформування/навчання/консультування).
2. Збільшення тривалості життя хворого. Ця мета повинна досягатися за рахунок застосування тих фармакологічних засобів, які здатні впливати на патофізіологічні механізми прогресування ХСН і виникнення раптової серцевої смерті і у такий спосіб знижувати ризик смерті цих хворих.
Вищевказані цілі можуть бути досягнуті за рахунок:
а) цілеспрямованої модифікації пацієнтом способу життя та дотримання відповідних спеціальних настанов;
б) немедикаментозних лікувальних заходів;
в) медикаментозного лікування;
г) хірургічних, механічних та електрофізіологічних засобів лікування.
Модифікація способу життя і дотримання спеціальних рекомендацій
Відмова від тютюнопаління, оскільки останнє підвищує ризик дестабілізації ІХС та тромбоутворення, активує САС, посилює периферичну вазоконстрикцію та зменшує дихальний резерв.
Уникнення вживання алкоголю, оскільки останній може чинити негативну інотропну дію, сприяє підвищенню АТ та підвищує ризик аритмій
Харчування та питний режим. Усім хворим із СН рекомендують обмежити споживання харчової солі (NaCl) — не більше 3 г/добу, що досягається виключенням з раціону солоних продуктів та відмовою від досолювання готової їжі.
Обмеження споживання рідини хворим з гемодинамічно стабільною ХСН є помірним — дозволяється вживати до 1,5–2 л/добу. При декомпенсованій СН, що потребує активної діуретичної терапії, добове надходження рідини в організм має контролюватися і бути обмеженим (не більше 1—1,2 л/добу).
Добір харчових продуктів, виходячи з загальної калорійності раціону, має визначатися з огляду на масу тіла пацієнта, який перебуває у компенсованому (без ознак гіперволемії) стані. Їжа хворих з ХСН має бути висококалорійною та містити достатньо білка, калію та магнію. При ожирінні (ІМТ7 >30 кг/м2) калорійність раціону має бути обмежена. Обмеження білкової складової раціону є вимушеним заходом лише у випадках вираженої ниркової недостатності.
Самоконтроль маси тіла. Регулярне (2–3 рази на тиждень) зважування на домашніх вагах дозволяє своєчасно виявити ознаки декомпенсації кровообігу на її доклінічному етапі. Відносно швидке (≥2 кг за 3 дні) збільшення маси тіла зазвичай є сигналом затримки рідини в організмі. Це дозволяє своєчасно внести корективи в схему лікування, насамперед щодо режиму застосування діуретиків.
Режим фізичної активності. Істотне обмеження фізичної активності (постільний або палатний режим) рекомендоване лише при декомпенсованій (з явищами вираженої гіперволемії) СН. В усіх інших випадках показана регулярна щоденна фізична активність у межах, які не супроводжуються виникненням таких симптомів СН, як задишка, серцебиття.
Вакцинація. Оскільки при ХСН грип та пневмонія часто є чинниками гемодинамічної дестабілізації, протигрипозна та протипневмококова імунізація у таких хворих є бажаною.
Сексуальна активність. У пацієнтів III–IV ФК за NYHA сексуальна активність має бути обмеженою, оскільки може підвищувати ризик декомпенсації гемодинаміки. Як засіб запобігання задишки та ангінозного болю під час статевого акту може бути корисним профілактичний сублінгвальний прийом нітрогліцерину.
Втім, слід враховувати, що нітрогліцерин і будь-які інші нітропрепарати, а також молсідомін, є несумісними з сильденафілом та іншими інгібіторами ФДЕ-5.
Контрацепція. Пацієнткам з клінічно маніфестною ХСН бажано уникати вагітності з огляду на підвищений ризик виникнення серйозних ускладнень та смерті на пізніх етапах вагітності та під час пологів. Пацієнтки мають бути поінформовані, що зазначений ризик є вищим порівняно з ризиком ускладнень, пов’язаних із контрацепцією.
Подорожі. Не рекомендується перебування на високогір’ї в умовах спеки та високої вологості. Оптимальним засобом пересування до місця призначення є не надто тривалий авіапереліт. Тривалого перебування у нерухомому стані хворим із ХСН слід уникати у зв’язку з підвищеним ризиком тромбозу глибоких вен нижніх кінцівок або тазу. Корекція доз лікарських речовин, насамперед діуретиків, у незвичних кліматичних умовах має індивідуалізований характер.
Лікування нічних розладів дихання. Оскільки епізоди апное (центрального або обструктивного походження) під час сну поєднані з підвищеним ризиком смерті та інших серцево-судинних ускладнень, заходи, спрямовані на їх пом’якшення або усунення, можуть бути рекомендовані відповідним пацієнтам. До них зокрема належать зменшення маси тіла (за наявності ожиріння) та відмова від вживання алкоголю і тютюнопаління. У пацієнтів з обструктивним нічним апное, документованим даними полісомнографії, можливе застосування спеціальних пристроїв з подовженим позитивним тиском повітря на вдиху.
Лікування психічної депресії. Зважаючи на значну (20–40%) поширеність розладів депресивного характеру при ХСН, слід мати на увазі доцільність консультування психотерапевтом таких пацієнтів.
Фізичні тренування показані хворим з гемодинамічно стабільною, медикаментозно контрольованою ХСН ІІ або ІІІ ФК. Регулярне виконання ізотонічних (динамічних) навантажень помірної інтенсивності (аеробних) дозволяє поліпшити якість життя пацієнтів за рахунок зростання толерантності до фізичного навантаження, запобігання зменшенню м’язової маси і може сприяти поліпшенню прогнозу виживаності. Натомість, вправи ізометричного (статичного) характеру та навантаження високої інтенсивності (анаеробні) протипоказані. Реалізація програм фізичної реабілітації хворих із ХСН знаходиться у спільній компентенції фахівця лікувальної фізкультури та кардіолога і має здійснюватися за відповідними стандартизованими рекомендаціями. Протипоказаннями до фізичних тренувань є декомпенсована СН, міокардит, клапанні стенози, «сині» вроджені вади серця, симптомні шлуночкові аритмії, нескоригована тахісистолія, відсутність належного контролю стенокардії антиангінальними препаратами.
Фармакологічні засоби, призначення яких слід уникати (табл. 2.16)
Таблиця 2.16
Препарати, які небажано застосовувати при лікуванні хворих із ХСН
|
Група засобів |
Побічні ефекти |
|
НПЗП |
Погіршення ниркового кровотоку, затримка рідини Послаблення терапевтичної дії інгібіторів АПФ та діуретиків |
|
Глюкокортикоїди* |
Затримка рідини, гіпокаліємія |
|
Антиаритмічні засоби I класу |
Поглиблення систолічної дисфункції ЛШ і аритмогенний ефект, підвищення ризику смерті |
|
Антагоністи кальцію** (крім амлодипіну і фелодипіну) |
Поглиблення систолічної дисфункції ЛШ (верапаміл, дилтіазем) Активація САС (дигідропіридини) |
|
Трициклічні антидепресанти, препарати літію |
Зниження скоротливої здатності міокарда |
*Можливе спорадичне парентеральне застосування для корекції гіпотензії; **обмеження не стосується діастолічної СН.
МЕДИКАМЕНТОЗНЕ ЛІКУВАННЯ ХСН ІЗ СИСТОЛІЧНОЮ ДИСФУНКЦІЄЮ ЛШ
Загальні зауваження
Фармакотерапія є основним лікувальним підходом при ХСН. З урахуванням прогресуючого характеру останньої, медикаментозне лікування пацієнтів повинно здійснюватися протягом всього їх життя та контролюватися (тобто оцінюватись і належним чином коригуватись) лікарем. На сьогодні детально розроблений алгоритм лікування пацієнтів із ХСН і систолічною дисфункцією ЛШ, який базується на значному масиві даних доказової медицини, тобто на результатах оцінки ефективності та безпеки відповідних груп медикаментозних засобів у цієї категорії хворих у масштабних (багатоцентрових) плацебо-контрольованих дослідженнях.
Враховуючи вищенаведені цілі лікування при ХСН (поліпшення якості та збільшення тривалості життя хворих) відповідні фармакологічні засоби можна умовно розділити на симптоматичні та ті, що покращують виживаність пацієнтів. Перші покращують гемодинаміку і клінічний стан хворих, хоча їх здатність покращувати довгостроковий прогноз виживаності не є суворо доведеною (петльові й тіазидні діуретики, серцеві глікозиди). Другі, а саме нейрогуморальні антагоністи, блокують на різних рівнях активність ключових нейрогуморальних систем — «провідників» прогресування ХСН і у такий спосіб сприяють збільшенню тривалості життя пацієнтів (інгібітори АПФ, блокатори β-адренорецепторів, антагоністи рецепторів альдостерону та блокатори рецепторів ангіотензину II). Крім того, комбіноване застосування нейрогуморальних антагоністів, завдяки поліпшенню кровообігу і пригніченню механізмів аритмогенезу, знижує частоту госпіталізацій таких хворих у зв՚язку з погіршенням їх клінічного стану (схема 2.5).
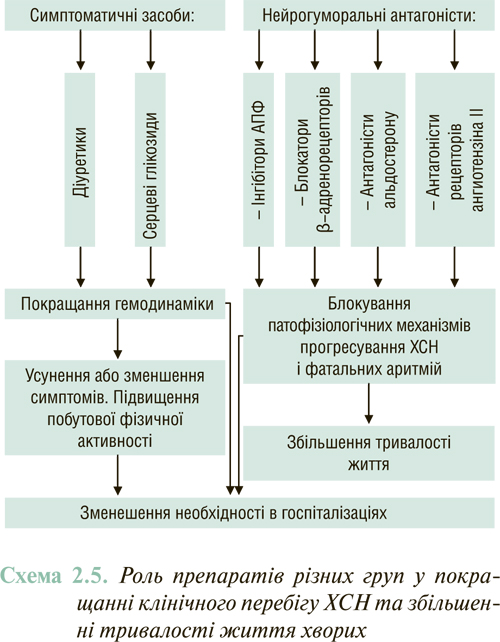
Таким чином, саме нейрогуморальні антагоністи виконують роль наріжного каменя в сучасному лікуванні при ХСН.
Діуретики
Діуретики (салуретики) показані всім хворим з ХСН (табл. 2.17) і ознаками затримки рідини в організмі. Профілактичне (у підтримувальному режимі) застосування діуретиків показане також пацієнтам зі схильністю до гіперволемії, тобто з набряковим синдромом, що був усунутий за допомогою терапії тими ж діуретичними засобами, яку проводили в активному режимі.
Таблиця 2.17
Діуретики для перорального прийому в лікуванні пацієнтів із ХСН
| Діуретик | Початкова одноразова доза, мг |
Максимальна доза, мг/добу |
Тривалість дії, год | Особливість |
| Петльові | ||||
| Фуросемід | 20–40 1–2 рази на добу |
400 | 6–8 | Зниження абсорбції у разі системного венозного застою |
| Буметанід* | 0,5–1,0 2 рази на добу |
10 | 6–8 | Зниження абсорбції у разі системного венозного застою |
| Торасемід | 5–10 1 раз на добу |
100 | 6–12 | Єдиний діуретик з майже 100% біодоступністю |
| Тіазидні | ||||
| Гідрохлоротіазид | 25 1 раз на добу |
100 | 6–12 | Неефективний при ШКФ <30 мл/хв |
| Метолазон* | 2,5 1 раз на добу |
10 | 8–24 | Ефективний при зниженні ШКФ до 10 мл/хв |
Першорядна роль діуретиків як симптоматичних засобів терапії при ХСН мотивована трьома ключовими положеннями. По-перше, їх клініко-гемодинамічний ефект наступає раніше (протягом декількох годин), ніж інших засобів. По-друге, діуретики є єдиною групою препаратів, здатних забезпечувати повний контроль над затримкою рідини в організмі, тобто досягнення і підтримку еуволемічного стану. Крім того, адекватне застосування діуретиків є необхідною передумовою для реалізації у хворих із ХСН очікуваних ефектів інших препаратів і насамперед нейрогуморальних антагоністів.
Вплив діуретиків на довгостроковий прогноз виживаності пацієнтів із ХСН у спеціально спланованих клінічних дослідженнях не вивчений, оскільки в цьому випадку неможливо формування групи плацебо (виходячи з етичних міркувань). Разом з тим цілком очевидно, що застосування діуретиків у хворих з проявами легеневого застою знижує ризик виникнення у них гострого альвеолярного набряку легень.
Механізми і особливості дії
Універсальним механізмом дії сечогінних препаратів є стимуляція натрійурезу та діурезу за рахунок пригнічення канальцевої реабсорбції Nа+.
Петльові діуретики, що є найбільш потужними сечогінними засобами, блокують реабсорбцію іонів Nа+ на всій ділянці висхідного відділу петлі Генле і відповідно пригнічують процес концентрування сечі. Підвищують екскрецію іонів Nа+ на 20–25% і в значній мірі зберігають цей ефект навіть при критично зниженій нирковій функції (швидкість клубочкової фільтрації <10 мл/хв).
Тіазидні діуретики пригнічують реабсорбцію Nа+ в дистальних канальцях і в кортикальному сегменті висхідної частини петлі Генле. Знижують екскрецію Nа+ на 5–10% і є неефективними у хворих із значно зниженою швидкістю клубочкової фільтрації (<30 мл/хв).
Метолазон (тіазидоподібний діуретик, в Україні не зареєстрований) блокує реабсорбцію Nа+ як у дистальних, так і проксимальних канальцях і зберігає ефективність при значному порушенні ниркової функції (зниження швидкості клубочкової фільтрації в межах 10–30 мл/хв).
За даними клінічних досліджень адекватне застосування діуретиків у хворих із застійною СН досить швидко зменшує або усуває задишку, ознаки легеневого застою, периферичні набряки, знижує венозний тиск і тиск наповнення ЛШ. Проте діуретики при тривалому застосуванні в якості монотерапії недостатньо ефективні для підтримки хворих у клінічно стабільному стані. Це пов՚язують з активуванням ними РААС (контррегуляторна відповідь організму на зменшення ОЦК), що викликає необхідність поступового підвищення доз сечогінних засобів за принципом порочного кола.
Ця обставина зумовлює необхідність обов՚язкового комбінованого застосування діуретиків та антагоністів РААС (інгібіторів АПФ або антагоністів ангіотензину II) у хворих із клінічно маніфестованою ХСН.
Тактика застосування
Дозування і деякі фармакологічні характеристики сучасних діуретиків, що застосовуються в лікуванні ХСН, наведені вище (див. табл. 2.17).
Розрізняють активну та підтримувальну фази діуретичної терапії.
Активну терапію сечогінними засобами застосовують у хворих з клінічними ознаками затримки рідини в організмі, домагаючись їх повного усунення. Для цього застосовують діуретики в дозах, які забезпечують підвищення діурезу, що призводить до щодобової втрати маси тіла приблизно на 1 кг при відповідній негативній різниці між кількістю введеної і кількістю виділеної рідини (бажано вимірювати). Активне лікування пацієнтів з ХСН при гіперволемії зазвичай починають з помірних доз сечогінних засобів, які призначаються перорально (фуросемід 20–40 мг/добу, торасемід 5–10 мг/добу або гідрохлоротіазид 25 мг/добу). При необхідності дози поступово підвищують до досягнення еуволемічного стану (зникнення набряків, гідротораксу, ортопное, гепатомегалії, ознак підвищення тиску в яремних венах). Активне лікування при тяжкому набряковому синдромі (периферичні набряки, асцит, анасарка) може супроводжуватися втратою маси тіла протягом декількох тижнів на 15–30 кг.
Активна фаза лікування сечогінними засобами триває поки не будуть досягнуті зазначені вище цільові ефекти. У більшості стаціонарних хворих з ХСН (III–IV ФК), як правило, застосовують петльові діуретики у зв՚язку з їх потужним ефектом і відносною незалежністю останнього від ниркової дисфункції. Петльові діуретики можна застосовувати в комбінації з тіазидними для посилення діуретичної відповіді у хворих рефрактерних до лікування.
В активну фазу лікування сечогінними засобами обмежують вживання з їжею хлориду натрію (<1,5 г/добу) і загальну кількість рідини (не більше 1,0–1,2 л/добу). Оптимальна модель активної діуретичної терапії передбачає також регулярний контроль АТ, електролітів (Nа+ і К+; бажано Мg2+), а також креатиніну плазми крові і гематокриту з метою запобігання виникнення та своєчасної корекції ймовірних ускладнень (див. нижче) такого лікування.
Підтримувальна фаза терапії сечогінними засобами складається в регулярному прийомі діуретика (за необхідності — комбінації діуретиків) у режимі, що забезпечує підтримку еуволемічного стану, який було досягнуто протягом активної фази лікування (основний критерій підтримки такого стану — відсутність збільшення маси тіла). Оптимальний для амбулаторних умов підхід передбачає визначення самим хворим своєї маси тіла і в разі потреби — консультації з лікарем щодо корекції дози сечогінних засобів.
Проблеми, що виникають при лікуванні діуретиками хворих із ХСН, і шляхи їх вирішення
Рефрактерність. Під рефрактерністю до сечогінної терапії варто розуміти незадовільний діуретичний ефект і відповідно відсутність зменшення маси тіла у хворих з безперечними клінічними ознаками затримки рідини в організмі, незважаючи на застосування петльового діуретика у високих дозах (таких, що наближуються до максимальних).
У таких випадках рекомендують наступні заходи (які нерідко поєднуються):
- Корекція питного режиму та споживання солі з їжею, аналіз усіх призначень (виключення можливого прийому НПЗП).
- Підвищення дози діуретика.
- Застосування петльового діуретика внутрішньовенно — в тому числі шляхом інфузійного крапельного введення.
- Комбінування петльового діуретика з гідрохлоротіазидом.
- Призначення антагоніста альдостерону в якості калійзберігаючого діуретичного агента.
- Призначення петльового діуретика 2 рази на добу (при пероральному прийомі — на порожній шлунок).
- Заміна одного петльового діуретика на інший.
- Додання до петльового діуретика (загалом — до кількох діб в інтермітуючому режимі) інфузії допаміну в так званих діуретичних дозах (1–2 мкг·кг-1·хв-1).
- Додання тривалих (протягом декількох діб в інтермітуючому режимі) інфузій допаміну в так званих діуретичних (стимулюючих допамінергічні рецептори нирок) дозах, тобто 1–2 мкг·кг-1·хв-1.
Дизелектролітемія. Оскільки салуретики збільшують екскрецію іонів не тільки Nа+, а також К+ і Мg2+, вони можуть викликати гіпокаліємію і гіпомагніємію, на фоні яких істотно зростає ризик розвитку небезпечних для життя шлуночкових аритмій. Ризик зазначених електролітних порушень підвищується при комбінуванні петльових і тіазидних діуретиків. З метою попередження цього салуретик комбінують із інгібітором АПФ і антагоністом альдостерону (зазвичай спіронолактон 50–100 мг/добу), що пригнічує екскрецію К+ і Мg2+. При значно вираженій діуретичній відповіді (виділення хворим декількох літрів сечі щодня протягом декількох діб) для коригування електролітних порушень можливе тимчасове застосування під відповідним лабораторним контролем спіронолактону в максимальних дозах (до 200 мг/добу) і/або внутрішньовенних інфузій препаратів калію, калію/магнію (глюкозо-інсуліно-калієва суміш, К+, Мg2+-аспарагінат).
Артеріальна гіпотензія і азотемія. Ці порушення у хворих із ХСН, яким проводиться діуретична терапія, можуть виникати у двох різних ситуаціях. У пацієнтів без явних ознак затримки рідини зазначені зміни звичайно зумовлені надмірним зменшенням об’єму циркулюючої плазми крові з відповідним зниженням ниркового кровотоку (так звана преренальна азотемія) внаслідок передозування діуретиків. У хворих із тяжкою застійною ХСН гіпотензія і преренальна азотемія є наслідком критичного зниження серцевого викиду, і їх корекція вимагає поєднання активної діуретичної терапії з інфузійною інотропною підтримкою або застосування засобів, що збільшують нирковий кровотік (згадані вище «діуретичні» дози допаміну).
Крім електролітних порушень, гіпотензії і азотемії, проявом побічної дії петльових і тіазидних сечогінних засобів можуть бути метаболічні порушення (гіперурікемія, гіперглікемія), шкірний висип, ототоксичний ефект (петльові діуретики, крім торасеміду), а також метаболічний алкалоз. Останній може бути усунутий застосуванням інгібіторів карбоангідрази (ацетазоламід 1,0–1,5 г/добу протягом декількох діб).
Калійзберігаючі діуретики
Калійзберігаючі діуретики застосовують в активній фазі діуретичної терапії для запобігання і профілактики гіпокаліємії і гіпомагніємії та посилення діуретичної відповіді. Незалежно від особливостей механізму дії (спіронолактон є антагоністом альдостерону, а тріамтерен і амілорид прямо впливають на дистальні канальці), калійзберігаючі діуретики пригнічують активну реабсорбцію Nа+ і одночасно екскрецію калію і магнію. На відміну від амілориду і тріамтерену з їх швидким початком дії (3 год), ефект спіронолактону розвивається більш повільно, але і триває довше за рахунок довгостроково існуючих активних метаболітів (табл. 2.18).
Таблиця 2.18
Калійзберігаючі діуретики в лікуванні ХСН
|
Препарат |
Діапазон доз для профілактики/лікування гіпокаліємії, мг |
Тривалість дії, год |
Особливість |
|
Спіронолактон |
25–200 |
24–48 (за рахунок активних метаболітів) |
Максимальний ефект при регулярному прийомі настає протягом 3 діб |
|
Тріамтерен |
50–200 |
8 |
Не комбінувати з фуросемідом (впливає на елімінацію) |
|
Амілорид |
5–40 |
18–24 |
Побічна дія. Найбільш істотними можливими проявами побічної дії калійзберігаючих діуретиків є гіперкаліємія і гінекомастія (остання — при застосуванні спіронолактону). З метою профілактики гіперкаліємії рекомендують:
а) не призначати калійзберігаючі діуретики при рівні К+ плазми крові >5,0 ммоль/л і креатиніну плазми крові >220 мкмоль/л;
б) відразу не призначати калійзберігаючі діуретики у високих дозах (наприклад спіронолактону >100 мг/добу);
в) регулярно проводити контроль рівня електролітів плазми крові;
г) бути уважним при комбінуванні калійзберігаючих діуретиків з інгібіторами АПФ, навіть при супутньому прийомі салуретика.
Гінекомастію, часто з больовими відчуттями, відзначають приблизно в 10% випадків застосування спіронолактону. Її причиною є неселективний характер зв՚язування спіронолактоном тканинних рецепторів до кортикоїдних гормонів. Крім мінералокортикоїдних, спіронолактон певною мірою блокує андрогенні, прогестеронові та глюкокортикоїдні рецептори. Поява гінекомастії вимагає відміни спіронолактону.
Тривале застосування антагоністів альдостерону (спіронолактон або еплеренон) з метою поліпшення клінічного прогнозу ХСН розглядається у відповідному розділі.
Інгібітори АПФ
Інгібітори АПФ необхідно обов՚язково (крім випадків наявності протипоказань до їх застосування або непереносимості) призначати всім хворим із ХСН і систолічною дисфункцією ЛШ (ФВ ЛШ ≤45%), зумовленою ІХС, АГ або ДКМП.
У зв՚язку з недостатньою кількістю даних доказової медицини щодо клінічної ефективності та безпеки інгібіторів АПФ у пацієнтів із СН іншого походження (клапанні регургітації, соr pulmonale і т.п.) їх застосування як обов՚язкової терапії у зазначених категорій пацієнтів не можна вважати достатньо обґрунтованим.
Механізм дії інгібіторів АПФ
Полягає в пригніченні АПФ, що каталізує утворення ангіотензину II і разом з тим стимулює розпад брадикініну на неактивні фрагменти. Наслідком зниження концентрації ангіотензину II в циркуляторному руслі і тканинах є пригнічення ряду його ефектів, тісно пов՚язаних з прогресуванням і поганим прогнозом ХСН, таких як:
- периферична і ренальна вазоконстрикція;
- затримка Nа+ і води з одночасним підвищенням екскреції К+;
- гіпертрофія і формування фіброзу міокарда;
- збільшення утворення супероксидного аніона — важливого фактора і провідника оксидантного пошкодження тканин;
- стимуляція синтезу альдостерону, експресії ендотеліну-1, секреції вазопресину і норадреналіну, пригнічення фібринолізу (за допомогою збільшення утворення інгібітору тканинного активатора плазміногену).
Наслідком блокування процесу деградації брадикініну є підвищення його концентрації в тканинах і ріст продукції брадикінінзалежних ендотеліальних контррегуляторних факторів — оксиду азоту і вазодилататорних простагландинів (схема 2.6). Крім периферичної вазодилатації, стимуляція ендотеліальних контррегуляторних факторів під впливом інгібітору АПФ визначає їх ендотелійпротекторну та антитромбоцитарну дію, що лежить в основі здатності цієї групи препаратів знижувати ризик розвитку пов՚язаних з ураженням судин клінічних катастроф, зокрема ризик виникнення дестабілізації ІХС і реінфаркту (див. нижче).
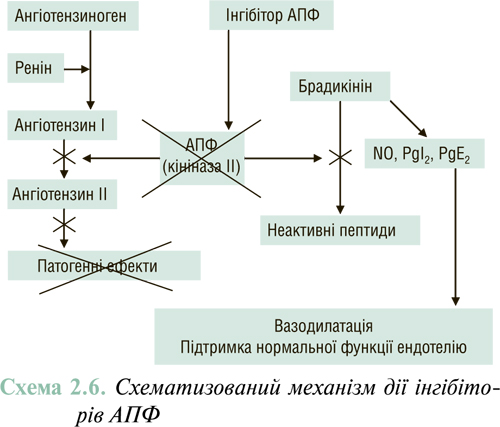
Численні плацебо-контрольовані дослідження продемонстрували, що у хворих із ХСН інгібітори АПФ при тривалому застосуванні зумовлюють покращання клінічної симптоматики, підвищення толерантності до фізичних навантажень і запобігають прогресуванню дилатації і систолічної дисфункції ЛШ, знижуючи відповідно ризик повторних госпіталізацій. На відміну від традиційних периферичних вазодилататорів, гемодинамічне розвантаження декомпенсованого серця під впливом інгібіторів АПФ не тільки не супроводжується активацією САС, а й поєднане із патогенетично сприятливим підвищенням парасимпатичної складової регуляції ритму серця.
Важливою клінічною властивістю інгібіторів АПФ є їх здатність покращувати клінічний прогноз хворих із ХСН. Мова йде про такі доведені у багатоцентрових дослідженнях ефекти, як:
а) покращання під їх впливом довгострокової виживаності хворих із ХСН (як за рахунок зниження ризику смерті від прогресуючої насосної недостатності серця, так і раптової смерті внаслідок аритмії);
б) зниження на фоні прийому інгібіторів АПФ ризику повторних коронарних подій (реінфаркт, нестабільна стенокардія) у хворих із ХСН, яка зумовлена ІХС (табл. 2.19).
Таблиця 2.19
Багатоцентрові дослідження інгібітіорів АПФ при ХСН та у хворих після ІМ із систолічною дисфункцією ЛШ
| Дослідження, рік | Пацієнти | Інгібітори АПФ, доза | Тривалість спостереження | Основні результати порівняно з групою плацебо |
| СОNSENSUS (1987) | n=253, ХСН (ІV ФК) | Еналаприл до 20 мг/добу | До 20 міс | ↓ смертності за 6 міс на 40% ↓ смертності за 1 рік на 31% |
| VНеFТII (1991) | n=804, ХСН (І–ІІІ ФК) |
Еналаприл до 20 мг/добу | У середньому 2,5 року | ↓ смертності на 28% порівняно з хворими, які приймають комбінацію ізосорбіду динітрату з гідралазином ↓ ризику раптової смерті на 38% |
| SOLVD Тrеаtment (1991) | n=2569, ХСН (І–ІІІ ФК) із ФВ ЛШ <35% |
Еналаприл до 20 мг/добу | У середньому 41 міс | ↓ смертності на 16% ↓ ризику реінфаркту на 23% ↓ ризику нестабільної стенокардії на 20% |
| SАVЕ (1992) | n=2231 з гострим ІМ без клінічно вираженої СН, із ФВ ЛШ <40% | Каптоприл до 150 мг/добу | У середньому 42 міс | ↓ смертності на 19% ↓ ризику реінфаркту на 25% ↓ ризику фатального реінфаркту на 32% |
| ТRАСЕ (1992) | n=1749 з гострим ІМ і ФВ <35% | Трандолаприл 4 мг/добу |
24–50 міс | ↓ смертності на 22% ↓ ризику раптової смерті на 24% |
| АIRЕ (1994) | n=2006 з гострим ІМ і ознаками застійної СН | Раміприл до 5 мг/добу | У середньому 15 міс | ↓ смертності на 27% ↓ ризику раптової смерті на 30% |
Тактика застосування інгібіторів АПФ
Протипоказаннями до застосування інгібіторів АПФ є період вагітності і годування груддю; білатеральний стеноз ниркових артерій; дані про алергію в анамнезі (ангіоневротичний набряк) при застосуванні будь-якого препарату цієї групи; критичний аортальний стеноз; рівень К+ у плазмі крові >5,0 ммоль/л; рівень креатиніну >220 ммоль/л.
Принциповий алгоритм призначення інгібіторів АПФ полягає у застосуванні на початку лікування його в мінімальних дозах і подальшому поступовому (протягом декількох тижнів) їх підвищенні (титруванні) до максимально переносимих доз під контролем клініко-лабораторних показників. В ідеальному випадку в результаті титрування необхідно досягати так званих цільових доз інгібіторів АПФ (табл. 2.20). Саме при застосуванні в таких цільових дозах були отримані зазначені позитивні, щодо поліпшення клінічного прогнозу хворих, результати відповідних багатоцентрових досліджень.
Таблиця 2.20
Інгібітори АПФ при ХСН і/або систолічній дисфункції ЛШ
|
Препарат |
Доза, кратність прийому препарату на добу |
|
|
початкова |
цільова |
|
|
А — з доведеним впливом на прогноз
|
2,5 мг 1–2 рази 6,25 мг 3 рази 2,5 мг 1 раз 1,25–2,5 мг 1 раз 1 мг 1 раз |
10–20 мг 2 рази 50 мг 3 рази 20–40 мг 1 раз 5 мг 2 рази 4 мг 1 раз |
|
Б — можна застосовувати
|
5 мг 1 раз 2 мг 1 раз 5 мг 2 рази |
40 мг 1 раз 8 мг 1 раз 20 мг 2 рази |
Перед початком лікування інгібіторами АПФ слід оцінити ступінь ризику їх застосування у конкретного хворого з огляду можливості виникнення таких проявів побічної дії, як виражена симптомна гіпотензія, азотемія і гіперкаліємія. Інгібітори АПФ не слід призначати хворим із ХСН і рівнем САТ <90 мм рт. ст. і при рівні К+ плазми крові >5,0 ммоль/л.
Не слід також призначати інгібітори АПФ хворим із тяжкою СН і низьким серцевим викидом, які отримують внутрішньовенні інотропні засоби (симпатоміметики або інгібітори ФДЕ). Хворим зі схильністю до артеріальної гіпотензії слід переглянути схему попередньої терапії з огляду можливої відміни вазодилататорів і/або зниження дози діуретика перед призначенням інгібітору АПФ.
Початкову дозу інгібітору АПФ призначають за умови відміни або зниження дози діуретика протягом останніх 24 год. Після прийому першої дози інгібітору АПФ варто рекомендувати хворому залишатися в ліжку (сидячи або лежачи) протягом 2–4 год, у цей період бажано щогодини вимірювати АТ і контролювати стан пацієнта.
Подальше вимірювання АТ, поряд з оцінкою рівня К+ і креатиніну плазми крові, може здійснюватися після кожного наступного підвищення дози інгібітору АПФ, тобто кожні 1–2 тиж. Під час підтримувальної терапії хворого стабільною, досягнутою шляхом титрування дозою інгібітору АПФ, зазначені лабораторні тести спочатку необхідно проводити кожні 3 міс, а в подальшому, за умови нормальних показників, — з інтервалом 6 міс.
При правильному призначенні та адекватній контрольованій підтримувальній терапії інгібітори АПФ добре переносять >90% хворих із ХСН.
Проблеми, які можуть виникати при клінічному застосуванні інгібіторів АПФ
Гіпотензія. Практично у всіх хворих із ХСН при лікуванні інгібіторами АПФ відзначають зниження рівня АТ по відношенню до вихідного, а у частини хворих — гіпотензію (САТ <100 мм рт. ст.). У більшості випадків гіпотензія є безсимптомною і не досягає значного (≤85 мм рт. ст.) ступеня. Ризик вираженої гіпотензії, що супроводжується запамороченням і навіть синкопальними епізодами, бувають переважно на початку лікування інгібіторами АПФ. Факторами її ризику є початкове САТ <100 мм рт. ст., гіпонатріємія <135 ммоль/л; тяжка СН; значний об’єм діурезу; супутнє лікування нітратами. Більшість із зазначених факторів можуть бути усунуті (відміна або зниження дози нітратів, тимчасове збільшення споживання солі), що зазвичай дає можливість почати лікування інгібіторами АПФ.
Погіршення азотовидільної функції нирок реєструють у 15–30% хворих із тяжкою ХСН і у 5–10% інших пацієнтів. Його механізм проявляється в переважній дилатації еферентних ниркових артеріол під впливом інгібіторів АПФ, оскільки ангіотензин II чинить вазоконстрикторний ефект переважно саме на них. У результаті знижується клубочковий фільтраційний тиск і відповідно — кліренс креатиніну (так звана постренальна азотемія). Факторами ризику останньої є IV ФК хворого за NYНА, гіпонатріємія, що супроводжують захворювання нирок, форсований діурез. Клінічне значення індукованої прийомом інгібіторів АПФ азотемії не слід перебільшувати. У більшості випадків вона зменшується або зникає після зниження дози діуретиків і/або інгібіторів АПФ. Рівень креатиніну плазми крові до 250 мкмоль/л не є показанням для відміни інгібіторів АПФ. У багатоцентрових дослідженнях підвищення рівня креатиніну обмежувало продовження терапії інгібіторами АПФ лише у 1–3% пацієнтів.
Гіперкаліємія. У випадку виникнення останньої заходом першої лінії є відміна антагоністів альдостерону. При необхідності наступним кроком є зниження дози інгібіторів АПФ. Необхідність повної відміни інгібіторів АПФ у зв՚язку з виникненням гіперкаліємії виникає досить рідко.
Алгоритм тактики лікаря при підвищенні креатиніну плазми крові та появі гіперкаліємії на фоні лікування інгібіторами АПФ (або антагоністами ангіотензину II) наведений у табл. 2.21.
Таблиця 2.21
Тактика лікаря при виникненні порушення азотовидільної функції нирок та/або гіперкаліємії під час прийому інгібіторів АПФ
|
Побічна дія |
Тактика |
|
Підвищення креатиніну плазми крові |
а) При підвищенні до 50% від початкового рівня, але не більше 250 мкмоль/л — подальший моніторинг показника без зміни дози б) При підвищенні >250 мкмоль/л, але <300 мкмоль/л — знизити дозу інгібітору АПФ вдвічі; подальший моніторинг в) При підвищенні >300 мкмоль/л — відмінити інгібітор АПФ, оцінити подальшу динаміку показника |
|
Гіперкаліємія |
а) При підвищенні К+ плазми крові >5,5 ммоль/л — відмінити (якщо їх отримує хворий) калійзберігаючий діуретик чи препарат калію; знизити дозу інгібітору АПФ вдвічі, здійснювати моніторинг показника б) При підвищенні К+ >6,0 ммоль/л — відмінити інгібітор АПФ, оцінити подальшу динаміку показника |
Кашель. Непродуктивний кашель, пов՚язаний з підвищенням концентрації брадикініну та деяких інших вазоактивних субстанцій у бронхах, відзначають у 5–10% хворих. Слід пам՚ятати, що: а) наявність бронхообструктивних захворювань не є чинником ризику появи такого кашлю; б) його вираженість дозозалежна. З огляду на винятково важливе (з позиції впливу на клінічний прогноз ХСН) значення лікування інгібіторами АПФ, слід рекомендувати хворим продовжувати їх прийом у випадках, якщо кашель помірний і не занадто турбує пацієнта. При відчутному дискомфорті, викликаному цим кашлем, інгібітор АПФ необхідно замінити антагоністом рецепторів ангіотензину II.
Ангіоневротичний набряк виникає у <1% випадків застосування інгібіторів АПФ, не залежить від дози препарату і становить потенційну небезпеку для життя пацієнта. Розвиток ангіоневротичного набряку вимагає повної відмови від застосування в майбутньому будь-якого іншого препарату цього класу.
До спорадичних проявів побічної дії інгібіторів АПФ відносяться зміна смакових відчуттів і нейтропенія (ризик останньої вище при прийомі каптоприлу).
Блокатори β-адренорецепторів
Блокатори β-адренорецепторів слід призначати всім хворим (крім випадків протипоказань і непереносимості) з ХСН II–IV ФК і систолічною дисфункцією ЛШ (зумовленою ІХС, АГ або ДКМП), які перебувають на підтримувальній терапії інгібіторами АПФ і діуретиками та мають стабільну гемодинаміку.
Мотиви для застосування блокаторів β-адренорецепторів при ХСН
Сучасна доктрина використання блокаторів β-адренорецепторів при ХСН ґрунтується на майже 30-річному досвіді відповідних експериментальних і клінічних пілотних досліджень і ґрунтується на результатах широко відомих багатоцентрових досліджень — US Саrvedilоl Неаrt Failure Ргоgrаm (USСР, 1996), СІВIS-II (1999), МЕRІТ-Н (1999) і СОРЕRNIСUS (2001), що охопили загалом >10 тис. хворих. Принципова схема їх проведення була однотипною: пацієнтам з клінічно маніфестованою ХСН і систолічною дисфункцією ЛШ, які приймали стандартне на той час лікування (інгібітор АПФ і діуретик, а також у багатьох випадках — дигоксин), призначали додатково блокатори β-адренорецепторів (так звана група активного лікування) або плацебо. Відповідно до принципів доказової медицини групи активного лікування і плацебо істотно не відрізнялися за кількістю учасників та основним демографічними, клінічними і гемодинамічним показниками. Тривалість спостереження пацієнтів коливалася від 6 (USСР) до 21 міс (МЕRIТ-Н, СОРЕRNIСUS).
Застосування блокаторів β-адренорецепторів, що вивчалися в зазначених дослідженнях (а саме карведилолу, бізопрололу, а також метопрололу сукцинату в лікарській формі з уповільненим вивільненням (CR/XL)), призводило до зниження (статистично високодостовірного) частоти летальних результатів за період спостереження на 34–65%, випадків раптової смерті на 41–56% порівняно з пацієнтами, що приймали плацебо (табл. 2.22). Про покращання клінічного перебігу ХСН також свідчило зниження ризику госпіталізації хворих на 20–35%.
Таблиця 2.22
Обгрунтування застосування блокаторів β-адренорецепторів при ХСН: дані доказової медицини
| Препарат | Дослідження, рік публікації | Пацієнти | Середня тривалість спостереження, міс |
Основні результати порівняно з групою плацебо |
| Карведилол | USСР (1996) | n=1094, II–IV ФК із ФВ ЛШ <35% | 6 | ↓ смертності на 65% ↓ раптової смерті на 56% |
| СОРЕRNIСUS (2001) | n=2289, IV ФК із ФВ ЛШ <25% | 21 | ↓ смертності на 35% | |
| Метопролол сукцинат (форма СR/XL) |
МЕRІТ-НF (1999) | n=3991, II–IV ФК із ФВ ЛШ <40 % | 21 | ↓ смертності на 38% ↓ раптової смерті на 41% |
| Бізопролол | СІВІS-ІІ (1999) |
n=2647, III–IV ФК із ФВ ЛШ <35% |
15 | ↓ смертності на 35% ↓ раптової смерті на 44% |
| Небіволол | SENIORS (2004) |
n=2128, II–III ФК, вік >70 років |
21 | ↓ комбінованого показника кардіоваскулярної смерті і госпіталізацій на 14% |
На відміну від інгібіторів АПФ із їх унітарним механізмом дії (пригнічення АПФ), різні блокатори β-адренорецепторів істотно відрізняються за фармакологічними характеристиками (селективність, внутрішня симпатоміметична активність, додаткові властивості) і тому, на думку експертів, дані щодо впливу на клінічний перебіг конкретного блокатора β-адренорецептора не можуть автоматично переноситися на інші препарати цього класу.
Як показано вище, на сьогодні існують переконливі докази сприятливого впливу на довгострокову виживаність хворих із ХСН лише трьох зазначених блокаторів β-адренорецепторів. У закінченому у 2004 р. багатоцентровому дослідженні SENIORS отримані результати, які свідчать про покращання клінічного перебігу ХСН у хворих віком старше 70 років (а саме зниження комбінованого показника ризику кардіоваскулярної смертності і госпіталізації незалежно від вихідної величини ФВ ЛШ) під впливом селективного блокатора β-адренорецепторів небівололу, що дозволило включити цей препарат у діючі Європейські рекомендації з лікування ХСН (2005).
Щодо інших блокаторів β-адренорецепторів, то відповідним чином сплановані багатоцентрові дослідження їх впливу на прогноз життя хворих із ХСН або не проводилися (пропранолол, атенолол, бетаксолол, соталол), або не продемонстрували достовірного позитивного результату (буциндолол).
Крім збільшення тривалості життя пацієнтів із ХСН і зниження ризику їх повторних госпіталізацій, зазначені блокатори β-адренорецепторів здатні поліпшувати при тривалому застосуванні клінічний стан хворих (знижувати ФК захворювання), зменшувати дилатацію і підвищувати ФВ ЛШ. Дані метааналізу показали, що за розрахунковим показником «кількість летальних випадків, відвернених серед 1000 хворих, що отримували лікування протягом року», карведилол істотно випереджає бізопролол і метопролол CR/XL (відповідно 71; 41 і 38), а за здатністю покращувати ФВ ЛШ — метопролол CR/XL. Таку перевагу карведилолу пов՚язують із неселективним характером β-адреноблокади та наявністю у нього додаткових фармакологічних властивостей (див. нижче). Крім цього, карведилол можна розглядати як блокатор β-адренорецепторів вибору у хворих із ФВ ЛШ ≤25%, оскільки він є єдиним представником цього класу препаратів, що продемонстрував у спеціально спланованому великому дослідженні (СОРЕRNIСUS, 2001) здатність поліпшувати прогноз життя цієї категорії пацієнтів (рис. 2.9).
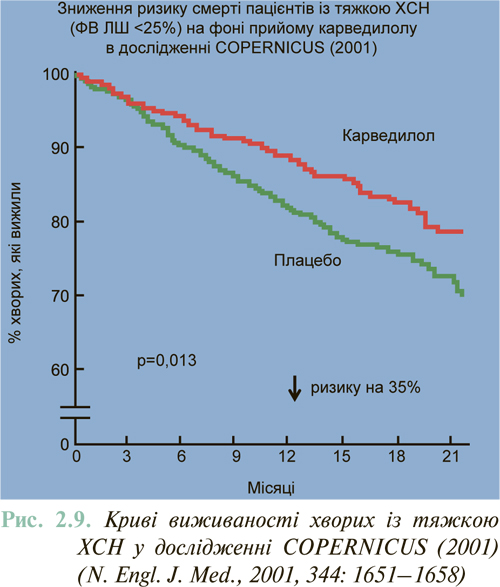
Слід враховувати, що всі основні дані щодо сприятливого впливу блокаторів β-адренорецепторів на прогноз виживаності хворих із ХСН отримані в результаті застосування тактики, при якій блокатори β-адренорецепторів приєднували до інгібіторів АПФ і в подальшому препарати обох класів постійно приймали поєднано. У такій ситуації цілком справедливо говорити про синергічну терапевтичну дію двох зазначених груп нейрогуморальних антагоністів. Таким чином, виходячи з даних доказової медицини, лікар може розраховувати на реалізацію очікуваних терапевтичних ефектів блокаторів β-адренорецепторів у хворих із ХСН саме при їх комбінованому застосуванні з інгібіторами АПФ.
Механізми терапевтичного ефекту блокаторів β-адренорецепторів при ХСН
У хворих із ХСН блокатори β-адренорецепторів виявляють терапевтичну дію шляхом нейтралізації ряду патогенних ефектів, зумовлених перманентно існуючою гіпернорадреналінемією.
Ключовими механізмами впливу блокаторів β-адренорецепторів на кардіоміоцити декомпенсованого міокарда є усунення перевантаження кардіоміоцитів Са2+ і збільшення тривалості діастоли.
Це зумовлює:
а) відновлення енергетичного потенціалу кардіоміоцитів (тобто усунення дефіциту макроергічних з՚єднань);
б) усунення ішемії;
в) запобігання некрозу кардіоміоцитів;
г) регрес так званої фетальної (властивої ембріональному періоду) трансформації міокардіального фенотипу;
д) покращання скорочувальної функції кардіоміоцитів;
е) зниження електричної нестабільності міокарда і відповідно до ризику розвитку фатальної шлуночкової аритмії;
ж) запобігання апоптозу кардіоміоцитів.
З іншого боку, дія блокаторів β-адренорецепторів у пацієнтів із ХСН полягає в тому, що при цьому синдромі вони виступають як системні нейрогуморальні антагоністи, оскільки пригнічують РААС на початковому етапі її активації (блокада β1-опосередкованої секреції реніну), і шляхом зниження утворення ангіотензину II — гіперсекрецію норадреналіну.
Під впливом блокаторів β-адренорецепторів у хворих із систолічною дисфункцією ЛШ також покращується барорефлекторна відповідь і вегетативна регуляція серця, ступінь порушення яких прямо поєднаний із рівнем смертності таких пацієнтів.
Терапевтичний ефект карведилолу при ХСН, крім ефектів, зумовлених β-адреноблокадою, пов՚язаний також з його: а) α1-антагоністичною активністю (периферична вазодилатація, пригнічення стимулів до гіпертрофії і аритмогенної активації міокарда, опосередкованих через α1-адренорецептори) і б) зі здатністю препарату пригнічувати активований у хворих із ХСН процес утворення в тканинах вільних радикалів за рахунок специфічного хімічного зв՚язування останніх. Карведилол поки залишається єдиним блокатором β-адренорецепторів, що продемонстрував здатність підвищувати ФВ ЛШ у пацієнтів із ІХС і його систолічною дисфункцією за рахунок відновлення функціонування гібернованих («відключених» внаслідок вираженої перманентної гіпоперфузії) зон міокарда (дослідження СHRISТМAS, 2002).
Тактика і особливості застосування
Тактика призначення блокаторів β-адренорецепторів у хворих із систолічною ХСН відрізняється від тієї, яка застосовується у кардіологічних хворих інших категорій. Вона базується на розумінні принципових відмінностей між «гострими» гемодинамічними ефектами цього класу препаратів, з одного боку, і тривалою захисною дією щодо декомпенсованого міокарда — з іншого. У першому випадку йдеться про відносно швидке уповільнення ЧСС і пригнічення скоротності міокарда у відповідь на одноразове введення блокатора β-адренорецепторів, що закономірно визначає зменшення ХОК і для хворих з систолічною дисфункцією ЛШ є несприятливим і навіть потенційно небезпечним. У другому випадку йдеться про поступову перебудову (на фоні хронічної блокади β-адренорецепторів) метаболізму, функції і ультраструктури кардіоміоцитів декомпенсованого серця, що забезпечує їх більш тривалу виживаність та адекватне функціонування. Клінічними еквівалентами такої перебудови є покращання систолічної функції ЛШ (так званий парадокс тривалої β-адреноблокади при ХСН), редукція симптоматики та збільшення тривалості життя хворих.
Емпірично розроблена і перевірена часом спеціальна технологія призначення блокаторів β-адренорецепторів при ХСН (з дуже низьких доз з подальшим поступовим їх підвищенням протягом декількох місяців до підтримувальної) спрямована на профілактику негативних «гострих» гемодинамічних ефектів β-адреноблокади (зниження систолічного викиду крові) поки не почнуть проявлятися сприятливі тривалі клініко-гемодинамічні ефекти останньої.
Блокатори β-адренорецепторів не слід призначати пацієнтам із ХСН із явними ознаками затримки рідини в організмі, які потребують активної діуретичної терапії, а також особам, що отримують внутрішньовенну терапію з приводу декомпенсації ХСН. Лікувальні заходи щодо усунення клінічних ознак легеневого застою та набрякового синдрому слід проводити доти, поки не будуть досягнуті вищевказані умови для початку лікування блокаторами β-адренорецепторів.
Протипоказаннями для призначення блокаторів β-адренорецепторів при ХСН є: клінічно маніфестований бронхообструктивний синдром (сам по собі дігноз ХОХЛ не є протипоказанням); ЧСС 55–60 уд./хв; синдром слабкості синусного вузла; AV-блокада II–III ступеня (якщо не імплантований водій ритму); виражена артеріальна гіпотензія (САТ <90 мм рт. ст.).
Оскільки немає достатніх доказів клінічної ефективності застосування блокаторів β-адренорецепторів у хворих із ХСН, зумовленої клапанними або вродженими вадами серця і легеневим серцем, призначення препаратів цієї групи як обов՚язкова терапія зазначеним категоріям пацієнтів не показане.
Відповідно до вищезгаданої технології призначення блокаторів β-адренорецепторів пацієнтам із ХСН лікування цими препаратами слід починати з мінімальних доз з подальшим підвищенням останніх кожні 2–4 тиж до досягнення максимально клінічно переносимої дози, з урахуванням цільової (табл. 2.23, схема 2.7).
Таблиця 2.23
Орієнтовна* схема титрування блокаторів β-адренорецепторів у хворих із ХСН і систолічною дисфункцією ЛШ
| Препарат | Початкова доза (мг), кратність прийому |
Дози на чергових етапах титрування (мг/добу) |
Цільова доза (мг), кратність прийому |
Загальний період титрування |
| Бізопролол | 1,25 × 1 раз на добу | 2,5–3,75–5–7,5–10 | 10 × 1 раз на добу | Від декількох тижнів до декількох місяців |
| Карведилол | 3,125 × 2 рази на добу | 12,5–25–37,5–50 | 25 × 2 рази на добу* | |
| Метопролол CR/XL | 12,5 × 1 раз на добу | 25–50–100–150–200 | 200 × 1 раз на добу | |
| Небіволол | 1,25 × 1 раз на добу | 2,5–5–7,5–10 | 10 × 1 раз на добу |
*В окремих пацієнтів при хорошій переносимості можливе подальше підвищення добової дози до 75 мг (37,5 × 2 рази) та 100 мг (50 × 2 рази)
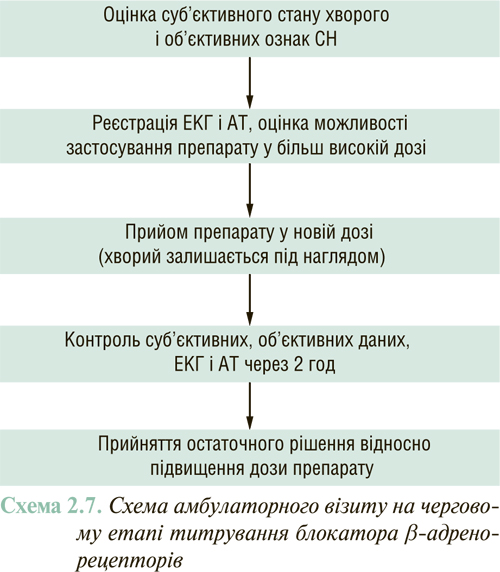
Підвищення дози блокатора β-адренорецепторів на етапах її клінічного титрування (див. табл. 2.23) можливе лише у випадку, якщо пацієнт адекватно переносив попередню. Необхідно відкласти будь-яке заплановане підвищення дози блокатора β-адренорецепторів поки побічні ефекти (гіпотензія, ознаки затримки рідини, брадикардія), пов՚язані з попередньою, більш низькою дозою препарату, не зникнуть.
З метою усунення артеріальної гіпотензії як фактора, що перешкоджає плановому підвищенню дози блокатора β-адренорецепторів, рекомендується: а) зниження дози діуретика і/або інгібітору АПФ (в подальшому поступове відновлення дози інгібітору АПФ вкрай бажано, у той час як необхідність відновлення дози діуретика слід визначати клінічно); б) призначення разових доз блокатора β-адренорецепторів, інгібітору АПФ, діуретика в різні години протягом дня.
Протягом перших 1–2 тиж після призначення блокатора β-адренорецепторів у деяких хворих можуть посилюватися ознаки декомпенсації кровообігу (поява ортопное, збільшення маси тіла). Це не є приводом для відміни блокатора β-адренорецепторів, а зазначені ознаки повинні бути усунуті тимчасовим підвищенням підтримувальної дози діуретика (табл. 2.24).
Таблиця 2.24
Можливі проблеми, пов’язані з титруванням блокаторів β-адренорецепторів, і шляхи їх подолання
|
Проблема |
Тактичні можливості |
|
Гіпотензія |
Рекомендувати прийом інгібіторів АПФ і блокаторів β-адренорецепторів у різний час доби (зазвичай з інтервалом у 2 год). Тимчасово знизити дозу інгібіторів АПФ. Якщо хворий приймає нітропрепарат — знизити його дозу, розглянути можливість відміни. Якщо хворий знаходиться в еуволемічному стані — спробувати знизити дозу діуретика. Безсимптомна гіпотензія не потребує втручання, але надалі не слід підвищувати дозу блокатора β-адренорецепторів |
|
Брадикардія |
Якщо хворий приймає дигоксин або аміодарон — знизити дозу, клінічно оцінити можливість відміни. Знизити дозу блокатора β-адренорецепторів або відмінити його. Враховувати можливість імплантації пейсмейкера (водія серцевого ритму) |
|
Поглиблення ознак СН (збільшення задишки під час ходи, поява ортопное, пастозності гомілок) |
Пересвідчитися у відсутності самостійних причин для цього (тахіаритмія, дестабілізація ІХС). При необхідності — відкоригувати режим вживання рідини/хлориду натрію. Підвищити дозу діуретика. Якщо останні заходи не ефективні — знизити дозу блокатора β-адренорецепторів |
При уповільненні ритму серця <55 скорочень за 1 хв дозу блокатора β-адренорецепторів необхідно знизити в 2 рази, а якщо це спостерігається при прийомі початкової дози, лікарю слід переглянути призначення щодо можливості відміни інших препаратів з негативною хронотропною дією або ж відмінити блокатор β-адренорецепторів.
Необхідно дотримуватися схеми титрування блокаторів β-адренорецепторів (див. табл. 2.23), проте тривалість періодів між підвищенням доз препарату (етапами титрування) може бути збільшена лікарем за клінічними показаннями (наприклад усунення артеріальної гіпотензії, інтеркурентне захворювання). У таких випадках доза блокатора β-адренорецепторів може бути тимчасово знижена.
Бажаним є досягнення цільової дози відповідного блокатора β-адренорецепторів. Лікування блокатором β-адренорецепторів, якщо не виникає ознак його непереносимості, повинне бути постійним; у випадку різкої відміни препарату можливе клінічне погіршення, аж до розвитку гострої декомпенсації кровообігу.
Антагоністи альдостерону
Доцільність застосування антагоністів альдостерону як нейрогуморальних антагоністів, здатних покращувати прогноз хворих із ХСН, має серйозне патофізіологічне обґрунтування.
По-перше,встановлено, що зниження рівня циркулюючого альдостерону під впливом інгібіторів АПФ у значної частини хворих із ХСН не досягається або згодом втрачається (так званий ефект вислизання альдостерону). Це пов՚язане з тим, що, крім ангіотензину II, синтез альдостерону стимулюється й іншими фізіологічними факторами (АКТГ, підвищення рівня циркулюючого К+ та ін.).
По-друге, альдостерон — самостійний потужний фактор формування міокардіального фіброзу і розвитку диселектролітемії (гіпокаліємії, гіпомагніємії), які відіграють важливу роль у виникненні небезпечних для життя шлуночкових аритмій. Крім того, альдостерон зумовлює самостійну вазоконстрикторну дію і пригнічує барорефлекс (остання обставина є додатковим чинником активації САС).
Клінічна доцільність застосування при ХСН антагоністів альдостерону як нейрогуморальних антагоністів підтверджена у двох відомих багатоцентрових дослідженнях — RALES (1999) і ЕРНЕSUS (2003), результати яких дозволили рекомендувати застосування цієї групи препаратів з метою покращання довгострокового клінічного прогнозу певних категорій хворих з ХСН.
У дослідженні RАLЕS, у яке ввійшли 1663 пацієнти з ХСН III–IV ФК і ФВ ЛШ ≤35%, що постійно отримували діуретик і інгібітор АПФ (частина хворих — також блокатор β-адренорецепторів), додаткове призначення спіронолактону в дозі 25–50 мг/добу і його прийом протягом 2 років супроводжувалися достовірним зниженням, порівняно з плацебо, смертності на 30% (рис. 2.10), раптової смерті — на 29%, кількості госпіталізацій у зв՚язку з прогресуванням ХСН — на 35% при невеликому ризику розвитку гіперкаліємії (2%).
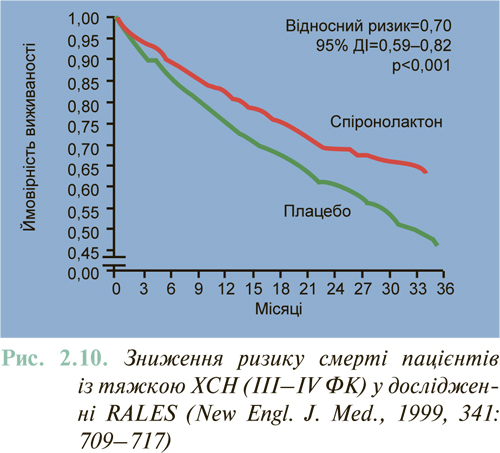
Дослідження ЕРНЕSUS охопило хворих, у яких у гострий період ІМ була виявлена систолічна дисфункція ЛШ (ФВ <40%) у поєднанні з клінічними ознаками застійної СН або цукровим діабетом. Приєднання в проміжку між 3–14-ю добою після ІМ до базисної терапії (інгібітори АПФ — у 87%, блокатори β-адренорецепторів — у 75% хворих) селективного антагоніста альдостерону еплеренону (25 мг, з підвищенням до 50 мг/добу) і подальший його прийом протягом 3 років сприяв зниженню, порівняно з плацебо, смертності від будь-яких причин на 15%, раптової серцевої смерті — на 21% при відносно невеликому ризику розвитку гіперкаліємії (5,5%).
Тривале застосування спіронолактону або еплерону в дозі до 50 мг/добу показано як засіб стандартної терапії у хворих з вираженою ХСН (III–IV ФК). Еплеренон також може бути рекомендований з метою покращання довгострокового прогнозу у пацієнтів після ІМ з систолічною дисфункцією ЛШ, що мають ознаки СН або супутній цукровий діабет.
Протипоказаннями до призначення антагоністів альдостерону є: 1) рівень К+ у плазмі крові >5,0 ммоль/л; 2) креатинін плазми крові >220 мкмоль/л; 3) прийом калійзберігаючих діуретиків інших груп (амілорид, тріамтерен) або препаратів калію; 4) поєднаний прийом інгібітору АПФ та антагоніста рецепторів ангіотензину ІІ.
Початкова добова доза спіронолактону та еплеренону становить 25 мг. У випадку, якщо протягом 1 міс рівень К+ плазми крові залишається <5,0 ммоль/л і не спостерігається значного погіршення азотовидільної функції нирок, дозу препаратів підвищують (50 мг/добу).
Рекомендовані терміни контролю рівня К+ і креатиніну плазми крові на фоні прийому антагоністів альдостерону: через тиждень і через 1 міс після початку терапії, потім щомісяця протягом перших 3 міс лікування, надалі 1 раз на 6 міс.
Алгоритм дій лікаря у разі виникнення найбільш типових проявів побічної дії антагоністів альдостерону наведений у табл. 2.25.
Таблиця 2.25
Можливі прояви побічної дії антагоністів альдостерону, тактика лікаря
|
Побічна дія |
Тактика |
|
Гіперкаліємія |
При К+ плазми крові >5,0 ммоль/л — знизити дозу антагоніста альдостерону вдвічі, контролювати показник у динаміці При зростанні К+ плазми крові >6,0 ммоль/л — відмінити антагоніст альдостерону, оцінити подальшу динаміку показника |
|
Погіршення азотовидільної функції нирок |
При креатиніні плазми крові >250 мкмоль/л — знизити дозу антагоніста альдостерону вдвічі, контролювати показник у динаміці При зростанні креатиніну >300 мкмоль/л — відмінити антагоніст альдостерону, оцінити подальшу динаміку показника |
|
Розвиток гінекомастії |
Замінити спіронолактон на еплеренон (селективний антагоніст рецепторів альдостерону) |
Дигоксин
Ключовим механізмом дії глікозидів наперстянки є пригнічення активності сполученого з клітинною мембраною іонного насоса — Nа+/К+-АТФази.
Пригнічення Nа+/К+-АТФази кардіоміоцитів призводить до зростання концентрації іонів Са2+ у їх цитозолі і відповідно — підвищення скорочувальної здатності міофіламентів (позитивний інотропний ефект).
Пригнічення Nа+/К+-АТФази в аферентних парасимпатичних волокнах підвищує чутливість артеріальних і передсердних барорецепторів і відповідно центральний парасимпатичний тонус з одночасним зниженням тонусу симпатичного. Наслідком цього є зниження секреції вазопресину задньою долею гіпофіза та норадреналіну симпатичними терміналями (виражено помірно). Наслідком росту активності парасимпатичного відділу вегетативної нервової системи під впливом дигіталісу є негативна хронотропна дія та сповільнення передсердно-шлуночкової провідності. Останнє зумовлює зниження частоти шлуночкових скорочень у пацієнтів із фібриляцією передсердь при застосуванні препаратів цієї групи.
Крім того, за допомогою механізму, пов՚язаного з пригніченням Nа+/К+-АТФази ниркових канальців, дигіталіс пригнічує секрецію реніну.
Питання застосування препаратів дигіталісу при ХСН слід розглядати окремо для хворих з фібриляцією передсердь і для пацієнтів зі збереженим синусовим ритмом.
Протягом тривалого часу препарати дигіталісу з успіхом емпірично застосовують при миготливій аритмії для нормалізації і контролю частоти шлуночкових скорочень. У хворих із фібриляцією передсердь і клінічних ознаках ХСН такий контроль особливо важливий, оскільки, як показано в кількох нетривалих (1–3 міс) плацебо-контрольованих дослідженнях, це сприяє редукції симптоматики, підвищенню толерантності до фізичного навантаження та поліпшенню якості життя хворих. Хоча плацебо-контрольованих досліджень впливу контролю ритму при фібриляції передсердь за допомогою дигіталісу на довгостроковий прогноз виживаності хворих з ХСН не проводили (з етичних міркувань), добре відомо, що неконтрольована тахісистолія при фібриляції передсердь є серйозним чинником ризику виникнення декомпенсації кровообігу та незадовільного прогнозу. Тому препарати дигіталісу треба обов՚язково (за винятком протипоказань) призначати всім хворим з ХСН і тахісистолічною формою фібриляції передсердь (частота скорочень шлуночків у стані спокою >80 уд./хв), незалежно від наявності систолічної дисфункції ЛШ.
Сучасні рекомендації щодо застосування дигоксину у хворих із систолічною ХСН і синусовим ритмом ґрунтуються на даних багатоцентрових досліджень РRОVЕ (1991), RАDIANCE (1992) і насамперед DIG (1997). У перших двох з них встановлено, що в групі хворих, у яких у схемі постійного підтримувального лікування дигоксин був замінений на плацебо, кількість госпіталізацій з приводу декомпенсації СН при подальшому спостереженні було в 2 рази (РRОVЕ) і майже в 6 разів (RАDIАNСЕ) більше, ніж у когорті хворих, що продовжують лікування дигоксином. Широко відоме дослідження DIG , в яке ввійшли 7788 хворих із ХСН і синусовим ритмом, продемонструвало, що тривалий (до 5 років) прийом дигоксину на фоні базисної терапії діуретиком та інгібітором АПФ в цілому вірогідно не впливав на виживаність хворих порівняно з плацебо (рис. 2.11), проте на 28% знижував (порівняно з тією ж групою плацебо) кількість госпіталізацій з приводу збільшення симптомів СН (рис. 2.12). Таким чином, було зроблено висновок, що у хворих із синусовим ритмом дигоксин впливає на клінічний перебіг ХСН, знижуючи ризик декомпенсації, але при цьому не збільшує тривалість життя.
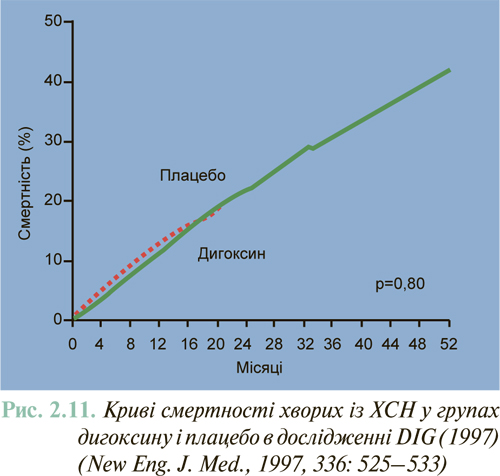
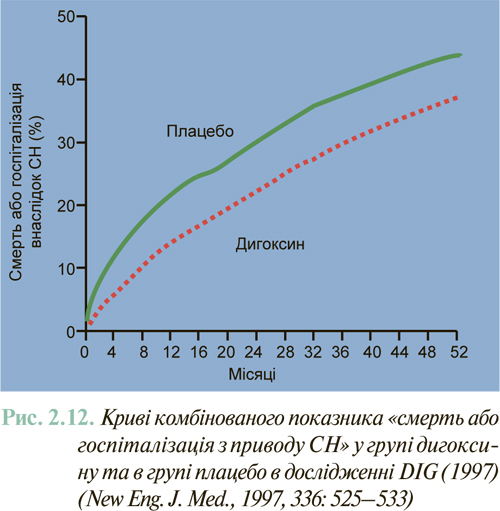
Виконаний згодом субаналіз цього дослідження DIG дозволив встановити, що вищевказаний «нейтральний» вплив дигоксину на виживаність пацієнтів із ХСН і синусовим ритмом є результатом двох протилежних тенденцій: 1) статистично значимого зростання смертності пацієнтів при концентраціях препарату в плазмі крові ≥1,2 нг/мл (відповідає його дозам >0,25 мг/добу при збереженій азотовидільній функції нирок) і 2) статистично значимого зниження ризику смерті пацієнтів із концентрацією дигоксину в плазмі крові <0,9 нг/мл, що відповідає його дозам <0,25 мг/добу) при відсутності впливу на смертність концентрації препарату 0,9–1,1 нг/мл, приблизно відповідних його добовій дозі 0,25 мг.
Пацієнтам із СН, систолічною дисфункцією ЛШ і синусовим ритмом дигоксин показаний з метою зниження ризику госпіталізацій у зв՚язку з декомпенсацією гемодинаміки в тих випадках, коли, незважаючи на застосування інгібіторів АПФ, діуретиків і блокаторів β-адренорецепторів клінічні симптоми ХСН зберігаються.
Дози і особливості застосування
Дигоксин займає головне місце серед препаратів дигіталісу при лікуванні пацієнтів із ХСН не тільки в зв՚язку з наявними даними доказової медицини (див. вище), а і завдяки його збалансованим фармакологічним властивостям (табл. 2.26).
Таблиця 2.26
Фармакологічні властивості дигоксину
|
Абсорбція, % |
60–75 |
|
Зв’язування з білками плазми крові, % |
25 |
|
Період напіввиведення, год |
36 (24–46) |
|
Шлях елімінації |
Нирковий |
|
Початок дії, хв: внутрішньовенно |
5–30 |
|
реr os |
30–90 |
|
Пік ефекту, год: внутрішньовенно |
2–4 |
|
реr os |
3–6 |
|
Тривалість ефекту, діб |
2–6 |
Початок лікування дигоксином з внутрішньовенного введення виправданий у пацієнтів із тахісистолічною фібриляцією передсердь і ознаками декомпенсації кровообігу. Зазвичай вводять шляхом інфузії протягом 15–20 хв 0,25 або 0,5 мг препарату (залежно від частоти шлуночкових скорочень, маси тіла та віку пацієнта). При необхідності 0,125–0,25 мг дигоксину можуть бути додатково введені не раніше ніж через 4 год. У подальшому рекомендований перехід на пероральний прийом препарату.
У всіх інших випадках при ХСН лікування дигоксином починають перорально, відразу починаючи з підтримувальної дози (0,125 або 0,25 мг/добу за 1–2 прийоми; у осіб похилого віку відповідно 0,0625 або 0,125 мг/добу). Для тривалого підтримувального лікування хворих із ХСН застосування доз дигоксину >0,25 мг не рекомендується, оскільки це може підвищувати ризик виникнення смерті від шлуночкових аритмій.
Слід пам՚ятати, що на відміну від хворих із фібриляцією передсердь, у пацієнтів із синусовим ритмом вираженість зниження ЧСС не слід розцінювати як критерій клінічної ефективності дигоксину.
Якщо у пацієнтів з фібриляцією передсердь підтримувальна доза дигоксину 0,125–0,25 мг/добу не забезпечує належного контролю ЧСС (нормосистолії), необхідно не підвищувати її, а досягати зазначеної мети за допомогою комбінування дигоксину з блокаторами β-адренорецепторів після досягнення еуволемічного стану хворого. При комбінуванні блокаторів β-адренорецепторів із дигоксином у більшості випадків оптимальна доза останнього не перевищує 0,125 мг/добу.
Дигіталісна інтоксикація
При неможливості організму елімінувати препарат дигіталісу пропорційно його введенню виникають ознаки передозування.
Кардіальні ознаки дигіталісної інтоксикації становлять потенційну небезпеку для життя і добре відомі: шлуночкова аритмія аж до стійкої шлуночкової тахікардії або фібриляції шлуночків, передсердна тахікардія з неповною AV-блокадою, синусова брадикардія, синоатріальні і AV-блокади різного ступеня.
Можливі симптоми з боку ШКТ: анорексія (рання ознака), нудота, блювання, діарея. З боку нервової системи можливі депресія, порушення орієнтації, парестезії. Рідше відзначають офтальмологічні прояви (затуманення або випадіння полів зору, візуалізація предметів у зелених тонах). Казуїстичними є симптоми, пов՚язані зі стимуляцією естрогенів (гінекомастія, галакторея).
Профілактика дигіталісної інтоксикації
Основою її є врахування або корекція потенційних факторів, що зумовлюють зниження елімінації дигоксину. До них відносяться ниркова недостатність, похилий вік, гіпотиреоз, а також супутній прийом таких препаратів, як аміодарон, хінідин, верапаміл, пропафенон, флекаїнід.
У хворих із нирковою недостатністю дозу дигоксину необхідно знижувати на 30–70% (залежно від ступеня порушення азотовидільної функції), а у пацієнтів похилого віку — в 2 рази (по 0,125 мг щодня або через день). При значно вираженій азотемії замість дигоксину можна призначати дигітоксин, який має печінковий шлях елімінації. Підтримувальна доза дигітоксину становить 0,07–0,1 мг/добу і знижується при печінковій недостатності.
Слід уникати комбінації дигоксину з аміодароном, верапамілом, хінідином, флекаїнідом і пропафеноном, а також не застосовувати зазначені засоби для лікування аритмій, які можуть бути пов՚язані з дигіталісною інтоксикацією.
Гіпокаліємія і гіпомагніємія як фактори електричної нестабільності міокарда підвищують ризик кардіальних проявів побічної дії дигіталісу (шлуночкові аритмії).
Застосування препаратів дигіталісу у хворих зі шлуночковими аритміями високих градацій (III–IV ступеня) є небезпечним і, отже, не показане.
Використання строфантину та корглікону не передбачене жодними чинними рекомендаціями з лікування ХСН, а отже, не існує достатніх підстав для їх застосовування у сучасній клінічній практиці.
Антагоністи рецепторів ангіотензину II
Механізм їх дії полягає у високоселективній повній блокаді тканинних рецепторів до ангіотензину II першого типу (АТ1-рецептори), за допомогою яких реалізуються його основні патогенні ефекти при ХСН. З патофізіологічної точки зору є дві підстави для застосування цієї групи препаратів при ХСН. По-перше, утворення ангіотензину II в міокарді і стінці судин відбувається не тільки за допомогою АПФ, а й за допомогою інших (АПФ-незалежних) шляхів, опосередкованих поруч інших ензимів. Саме з цим механізмом пов’язують феномен «вислизання» ангіотензину II, що проявляється у поступовому поверненні його концентрації в плазмі крові до початкових значень у процесі тривалого застосування інгібіторів АПФ. По-друге, побічні ефекти інгібіторів АПФ, такі як кашель та ангіоневротичний набряк пов՚язані не з блокадою ангіотензину II, а з їх брадикінін-потенціюючою дією.
Таким чином, теоретичне обґрунтування для клінічного застосування антагоністів рецепторів ангіотензину II являє собою досягнення повної блокади ефектів ангіотензину II при одночасному подоланні найбільш значимих проявів їх побічної дії.
Сучасний погляд на застосування антагоністів рецепторів ангіотензину II базується на результатах трьох великих багатоцентрових досліджень — ЕLІТЕ-ІІ (2000), VаlНеFТ (2001) і СНАRМ (2003), у яких було продемонстровано, що:
1) антагоністи рецепторів ангіотензину II, подібно інгібіторам АПФ, поліпшують прогноз виживаності хворих із «систолічною» ХСН порівняно з плацебо (СНАRМ);
2) антагоністи рецепторів ангіотензину II не мають переваги над інгібіторами АПФ щодо сприятливого впливу на виживаність хворих із «систолічною» ХСН (ЕLІТЕ-ІІ);
3) комбінування антагоністів рецепторів ангіотензину II з інгібіторами АПФ не призводить до додаткового зниження загальної смертності хворих, але вірогідно знижує кардіоваскулярну смертність та зменшує кількість повторних госпіталізацій з приводу СН (VаlНеFТ, СНАRМ).
Таким чином, призначення антагоністів рецепторів ангіотензину ІІ, з метою зниження ризику смерті з кардіоваскулярних причин та ризику госпіталізацій з приводу декомпенсації кровообігу, рекомендується наступним категоріям хворих з клінічно маніфестованою ХСН та ФВ ЛШ ≤40–45%:
1) пацієнтам з непереносимістю інгібіторів АПФ у вигляді кашлю або ангіоневротичного набряку;
2) пацієнтам, що отримують інгібітори АПФ, але не можуть одержувати лікування блокаторами β-адренорецепторів внаслідок протипоказань до їх призначення або їх непереносимості;
3) пацієнтам III–IV ФК, що отримують інгібітори АПФ та блокатори β-адренорецепторів, і при цьому не отримують антагоністів альдостерону.
Антагоністи рецепторів ангіотензину II не слід призначати при ХСН раніше, ніж інгібітори АПФ, і замінювати ними останні у пацієнтів, які нормально переносять інгібітори АПФ.
Протипоказання до призначення та контроль таких можливих побічних ефектів блокади ангіотензину II, як гіпотензія, азотемія і гіперкаліємія, при прийомі антагоністів рецепторів ангіотензину II аналогічні таким, що і при прийомі інгібіторів АПФ. Поєднаний прийом інгібітору АПФ та антагоніста альдостерону є протипоказанням до призначення антагоніста рецепторів ангіотензину II. Комбінування інгібіторів АПФ і антагоністів рецепторів ангіотензину II доцільне лише при можливості регулярного моніторування рівнів К+, креатиніну плазми крові й АТ.
Зважаючи на те, що дані доказової медицини, закладені в основу рекомендацій по застосуванню антагоністів рецепторів ангіотензину II при ХСН, отримані насамперед у результаті відповідних досліджень вальзартану та кандесартану (ValHeFT, CHARM), саме ці антагоністи рецепторів ангіотензину II слід застосовувати у таких хворих. Початкова доза вальзартану — 20–40 мг 2 рази на добу, кандесартану — 4–8 мг 1 раз на добу. У подальшому при адекватній переносимості дозу підвищують в 2 рази кожні 2 тиж до досягнення цільової (для вальзартану — 160 мг 2 рази на добу, кандесартану — 32 мг 1 раз на добу).
Алгоритм застосування основних засобів патогенетичної терапії ХСН із систолічною дисфункцією ЛШ наведений у табл. 2.27.
Таблиця 2.27
Стандартні засоби медикаментозного лікування ХСН із систолічною дисфункцією ЛШ: алгоритм застосування
| Ступінь ХСН | Інгібітор АПФ | Антагоніст рецепторів ангіотензину II |
Діуретик | Блокатор β-адренорецепторів |
Антагоніст альдостерону |
Дигоксин |
| Безсимптомна дисфункція ЛШ (I ФК) |
Показаний | При непереносимості інгібітору АПФ | Не показаний | Після ІМ | Після ІМ (еплеренон) | При фібриляції передсердь |
| Помірна СН (II ФК) |
Показаний | При непереносимості інгибітору АПФ або в комбінації з інгібітором АПФ | При схильності до затримки рідини | Показаний | Після ІМ (еплеренон) | При фібриляції передсердь |
| Виражена СН (III–IV ФК) |
Показаний | При непереносимості інгібітору АПФ або в комбінації з інгібітором АПФ | Показаний; комбінація діуретиків | Показаний | Показаний | Показаний |
| Кінцева стадія СН (необоротний IV ФК) | Показаний | При непереносимості інгібітору АПФ або в комбінації з інгібітором АПФ | Показаний; комбінація діуретиків | Показаний | Показаний | Показаний |
СЕРЦЕВО-СУДИННІ ФАРМАКОЛОГІЧНІ ЗАСОБИ, ЩО ЗАСТОСОВУЮТЬСЯ В ОКРЕМИХ КАТЕГОРІЙ ХВОРИХ ІЗ ХСН
Антитромботичні препарати
Непрямі антикоагулянти
Механізм їх терапевтичної дії полягає в гальмуванні біохімічного перетворення вітаміну К, що стимулює прокоагуляційну трансформацію (активацію) ряду білків — факторів згортання крові (протромбін, VII, IX, X). Еталонним НАК вважається варфарин, оскільки практично всі дані доказової медицини відносно антитромботичної ефективності НАК отримані саме в результаті випробування цього препарату. За даними метааналізу відповідних мультицентрових досліджень у хворих із фібриляцією передсердь на фоні прийому варфарину порівняно із застосуванням плацебо, спостерігається значне (на 62%) зниження ризику виникнення мозкового інсульту, причому найбільша профілактична ефективність варфарину щодо мозкового інсульту відзначалася саме у хворих із ХСН. Відповідно до сучасних рекомендацій постійне профілактичне застосування НАК безумовно показане таким категоріям пацієнтів із ХСН:
а) з постійною, персистуючою або пароксизмальною формою фібриляції передсердь;
б) з перенесеним тромбоемболічним епізодом будь-якої локалізації;
в) з тромбом (-ами) у порожнині (-ах) серця;
г) з гемодинамічно значимим мітральним стенозом.
Прийом НАК повинен супроводжуватися регулярним моніторингом МНВ (у межах 2,0–3,0) або як сурогатний підхід — протромбінового індексу (у межах 50–60%).
У хворих з ХСН моніторинг безпеки профілактичного прийому НАК повинен бути особливо ретельним з урахуванням двох суттєвих обставин.
При розвитку або прогресуванні гепатоцелюлярної недостатності, зумовленої хронічним венозним застоєм (при термінальній ХСН — і гіпоперфузією нирок), пригнічується печінковий біосинтез факторів згортання крові, в тому числі й вищевказаних, що може зумовлювати потенціювання ефекту НАК з відповідним різким зростанням ризику виникнення небезпечних для життя кровотеч. Можлива і зворотна ситуація: в міру стабілізації гемодинамічних показників, усунення гіперволемії пацієнта і відповідно поліпшення функціонального стану печінки, колишня доза НАК може стати недостатньою для підтримки МНВ на цільовому рівні, і тому необхідне проведення корекції дози у бік її підвищення.
У НАК досить широкий спектр взаємодій з лікарськими засобами, здатними або посилювати, або послаблювати їх ефект. У табл. 2.28 представлено ті з них, які є актуальними для пацієнтів із серцево-судинними захворюваннями, у тому числі з ХСН, незалежно від механізмів їх взаємодії з НАК. Необхідність поєднаного призначення пацієнтам із ХСН відразу декількох препаратів лише для базисної терапії, не говорячи про лікування при ускладненнях, вимагає володіння інформацією про лікарську взаємодію з метою ухвалення рішення про призначення того або іншого препарату поєднано з НАК (наприклад багатьох антибіотиків), а також для проведення ретельного контролю за МНВ та клінічним статусом пацієнта.
Таблиця 2.28
Деякі лікарські засоби, які взаємодіють з НАК
| Препарати, які посилюють дію НАК | Препарати, які послаблюють дію НАК |
| Аміодарон Ацетилсаліцилова кислота Гепарин Дипіридамол Карведилол Нітрогліцерин Ніфедипін Пентоксифілін Пропафенон Статини Стрептокіназа Тиклопідин Фібрати Хінідин |
Антациди Антигістамінні Вітамін К (антидот) Аскорбінова кислота Рифампіцин Спіронолактон |
| Антибіотики: Цефалоспорини Аміноглікозиди Пеніциліни Ципрофлоксацин Тетрациклін Еритроміцин Хлорамфенікол |
|
| Флуконазол Триметоприм |
|
| Анаболічні стероїди ГКС Тиреоїдні гормони Алопуринол |
Антитромбоцитарні засоби
Тривале застосування ацетилсаліцилової кислоти (100–160 мг/добу у пацієнтів із ХСН показано в 2 випадках: а) як вимушена альтернатива при наявності протипоказань до НАК; б) як складова стандартної терапії хворих після ІМ. Існують дані (багатоцентрових досліджень WASH, 2002, WATCH, 2004) щодо здатності ацетилсаліцилової кислоти (навіть при застосовуванні в стандартній профілактичній дозі 160 мг/добу) вірогідно підвищувати порівняно з варфарином ризик госпіталізації з приводу декомпенсації кровообігу у пацієнтів із клінічно маніфестованою ХСН і ФВ ЛШ <35%. Можливо, це пов՚язане з механізмом дії ацетилсаліцилової кислоти, що полягає в блокуванні синтезу простагландинів, у тому числі і вазодилататорних (простациклін, PgE2), що відіграють суттєву роль у регуляції ниркового кровотоку при вираженій ХСН. В останні рекомендації Європейського товариства кардіологів по лікуванню ХСН включене положення доцільності врахування зазначених вище доказових даних при лікуванні відповідної категорії пацієнтів. Цілком очевидно, що подібне застереження може стосуватися і хворих, госпіталізованих у стані гіперволемії. Застосування у зазначеної категорії хворих тієнопіридинів (тиклопідин або клопідогрел) як альтернативної антитромбоцитарної стратегії лікування є патогенетично обґрунтованим, проте вимагає вивчення у відповідних клінічних дослідженнях.
До проведення спеціально спланованих досліджень впливу ацетилсаліцилової кислоти на прогноз-модулюючу ефективність інгібіторів АПФ у пацієнтів із ХСН немає достатніх підстав не рекомендувати поєднане застосування зазначених засобів у цієї категорії хворих.
Оскільки введення низькомолекулярних гепаринів знижує порівняно з плацебо ризик виникнення глибоких венозних тромбозів у хворих з необхідністю тривалої іммобілізації, тимчасове застосування цих лікарських засобів з метою профілактики тромбозів у пацієнтів із тяжкою декомпенсованою ХСН, що перебувають переважно на постільному режимі, є доцільним.
Нітрати
Регулярний прийом пролонгованих нітратів рекомендований пацієнтам з ХСН на ґрунті ІХС, у яких, незважаючи на прийом блокаторів β-адренорецепторів у складі стандартної схеми лікування, зберігається стенокардія.
Інфузійну або пероральну терапію нітратами можна застосовувати у хворих із декомпенсованою ХСН, особливо ішемічної етіології, з рівнем САТ >100 мм рт. ст. і клінічними ознаками легеневого застою, оскільки вона прискорює подолання застійних явищ порівняно з терапією тільки діуретиками та полегшує суб՚єктивний стан таких пацієнтів.
Доведеними в клінічних дослідженнях корисними фармакологічними ефектами нітратів у хворих із декомпенсованою ХСН є: 1) зменшення об’єму ЛШ і зниження тиску його наповнення; 2) зменшення об’єму мітральної регургітації; 3) підвищення ФВ ЛШ; 4) зниження периферичного судинного опору; 5) збільшення коронарного кровотоку; 6) антиішемічна дія.
Нітрогліцерин — інфузія, починаючи з 20 мкг/хв з поступовим при необхідності підвищенням до 200 мкг/хв під контролем АТ.
Ізосорбіду динітрат — інфузія, починаючи з 1 мг/год з поступовим підвищенням при необхідності до 10 мг/год (під контролем АТ). Перорально (бажано у вигляді ретардної форми) — від 10 до 80 мг/добу.
Ізосорбіду мононітрат — перорально по 10–80 мг 1–2 рази на добу.
Після усунення ознак легеневого застою нітрати необхідно відміняти, крім пацієнтів із нападами стенокардії, що зберігаються.
Неглікозидні інотропні засоби
У хворих із ХСН їх застосування виправдане в якості паліативного підходу з метою поліпшення системної гемодинаміки і симптоматики в кінцевій клінічній стадії цього синдрому, при наявності ознак периферичної гіпоперфузії, олігурії та рефрактерності до інших терапевтичних засобів.
Допамін. Агоніст β- (переважно β1-) адренорецепторів. У дозі <2,5 мкг·кг-1·хв-1 — агоніст допамінергічних рецепторів; у дозі >5 мкг·кг-1·хв-1 — дозозалежний агоніст α1-адренорецепторів. У якості інотропного засобу призначають хворим у кінцевій клінічній стадії ХСН при наявності у них артеріальної гіпотензії й олігурії, інфузійно в дозі 2,5–10 мкг·кг-1·хв-1.
Добутамін. Агоніст β- (переважно β1-) адренорецепторів і помірний α1-агоніст. Можна застосовувати у рефрактерних до лікування стандартними засобами хворих у кінцевій клінічній стадії ХСН, переважно з наявністю гіпотензії, у дозі від 2–3 до 15–20 мкг·кг-1·хв-1. Тривалість безперервної інфузії не повинна перевищувати 48–72 год внаслідок розвитку тахіфілаксії. Відміну добутаміну слід проводити повільно (поетапне зниження швидкості інфузії) з урахуванням ризику різкого погіршення гемодинаміки у випадку раптового припинення введення препарату.
Левосимендан. Позитивний інотропний агент із супутнім периферичним вазодилатуючим ефектом. На відміну від симпатоміметиків, традиційних інгібіторів ФДЕ (мілринон, амринон, еноксимон) і серцевих глікозидів, чинить інотропну дію не за рахунок підвищення внутрішньоклітинної концентрації іонів Са2+, а шляхом підвищення чутливості міофіламентів до останнього (підвищення зв՚язування тропоніну С з Са2+). Внаслідок цього покращання скорочувальної функції міокарда під дією левосимендану не супроводжується істотним підвищенням потреби міокарда в кисні і погіршенням релаксації серцевого м՚яза, на відміну від дії інгібіторів ФДЕ. Порівняно з іншими неглікозидними інотропними засобами лікування левосименданом характеризується найнижчим ризиком виникнення життєво небезпечних шлуночкових аритмій. Вазодилатуюча дія левосимендану зумовлена його властивостями активатора АТФ-залежних калієвих каналів, результатом чого є зниження перед- і постнавантаження на серце, підвищення ниркового і коронарного кровотоку. У багатоцентровому дослідженні LIDO (2002) за участю хворих з декомпенсованою тяжкою СН виявлена краща, ніж у добутаміну, здатність левосимендану знижувати легенево-капілярний тиск і збільшувати серцевий викид, помірно знижуючи при цьому АТ; через 6 год після припинення інфузії зазначені гемодинамічні ефекти левосимендану, на відміну від ефектів добутаміну, зберігалися. Одночасний прийом блокаторів β-адренорецепторів обмежував терапевтичну дію добутаміну, проте не впливав на ефекти левосимендану.
З урахуванням сучасних даних доказової медицини левосимендан на сьогодні рекомендований для лікування хворих із тяжкою декомпенсованою ХСН за умови відсутності у них вираженої гіпотензії (≤85 мм рт. ст.). Лікування починають з введення швидкої навантажувальної дози (болюсу) препарату — 12–24 мг/кг маси тіла протягом 10 хв — з подальшою його інфузією зі швидкістю 0,05–0,2 мг/кг/хв протягом 24 год.
Профілактика раптової серцевої смерті у хворих із ХСН і застосування антиаритмічних засобів
Первинна профілактика раптової серцевої смерті — це комплекс фармакотерапевтичних й інших заходів, спрямованих на запобігання раптової серцевої смерті у пацієнтів із підвищеним ризиком її виникнення, але таких, що не мають в анамнезі реанімаційних заходів з приводу фібриляції/тріпотіння шлуночків або гемодинамічно неефективної стійкої шлуночкової тахікардії. Про важливість первинної профілактики раптової серцевої смерті у хворих із дисфункцією ЛШ свідчать такі дані. Виявлення у хворого після ІМ >10 шлуночкових ектопічних скорочень за 1 год свідчить про підвищення ризику аритмічної смерті в 4 рази, а поєднання цієї ознаки зі зниженої (<40%) ФВ ЛШ підвищує ймовірність раптової серцевої смерті в 16 разів. Вторинна профілактика передбачає здійснення відповідних заходів щодо запобігання раптової серцевої смерті у осіб, реанімованих після раптової зупинки кровообігу.
Дані доказової медицини щодо здатності нейрогуморальних антагоністів запобігати раптовій серцевій смерті у пацієнтів із СН (первинна профілактика) узагальнені в табл. 2.29.
Таким чином, комбіноване застосування нейрогуморальних антагоністів у пацієнтів із систолічною дисфункцією ЛШ істотно знижує ймовірність раптової серцевої смерті. Разом з тим навіть при цьому ризик виникнення останньої у зазначених пацієнтів залишається підвищеним. У такій ситуації викликає інтерес можливість застосування фармакологічних засобів, здатних пригнічувати ектопічну активність шлуночків. Проте за даними багатоцентрових досліджень доведено, що антиаритмічні засоби І класу (ІА — хінідин, новокаїнамід, ІВ — морацизин) і ІС-класу (флекаїнід, енкаїнід) істотно підвищують ризик виникнення раптової серцевої смерті у хворих після ІМ, особливо з систолічною дисфункцією ЛШ. Аналогічні дані отримані відносно антиаритмічного агента III класу d-соталола («чистий» блокатор калієвих каналів без β-адреноблокувальної активності) (дослідження SWORD, 1996). Вивчений у багатоцентровому дослідженні DІАМОND-СН новий блокатор калієвих каналів дофетилід при тривалому застосуванні не підвищував, але і не знижував ризик раптової серцевої смерті.
Таблиця 2.29
Здатність нейрогуморальних антагоністів запобігати раптовій серцевій смерті у хворих із СН
|
Групи засобів, які відповідають багатоцентровим дослідженням |
Препарат |
Зниження ризику раптової серцевої смерті порівняно з плацебо, % |
|
Інгібітори АПФ VHеFтII (1991) АIRЕ (1993) ТRАСЕ (1996) |
Еналаприл Раміприл Трандолаприл |
38 30 24 |
|
Блокатори β-адренорецепторів (базисна терапія включала інгібітори АПФ) USСР (1996) CІBІS-ІІ (1999) МЕRIТ-НF (1999) |
Карведилол Бізопролол Метопролол СR/XL |
56 44 41 |
|
Антагоністи рецепторів альдостерону (базисна терапія включала інгібітори АПФ і у частини хворих — блокатори β-адренорецепторів) RALES (1999) ЕРНЕSUS (2003) |
Спіронолактон Еплеренон |
29 21 |
Що стосується аміодарону, то в метааналізі 13 плацебо-контрольованих досліджень (АТМА, 1997), що охопили 6553 хворих зі шлуночковими аритміями високих градацій, його тривалий прийом (0,5–2,5 г) у дозах 150–400 мг/добу асоціювався з достовірним зниженням раптової серцевої смерті на 29% (у тому числі в підгрупах хворих із маніфестованою ХСН — на 23%, з ФВ ЛШ <35% — на 27%, при ІІІ–І ФК за NYНА — на 24%), а також смертності від будь-яких причин на 13%. Результати аналізу бази даних найбільших багатоцентрових досліджень аміодарону ЕМІАТ і САМІАТ, що ввійшли в зазначений метааналіз, свідчать, що редукуючий вплив аміодарону на частоту виникнення серцевої й аритмічної смерті виявився найбільшим у когорті хворих, де аміодарон включали до комбінованої терапії, яка містила блокатори β-адренорецепторів. З іншого боку, у великому дослідженні SCD-HeF (2005), де порівнювали вплив на клінічний прогноз ХСН ІКД й аміодарону, останній не мав переваги над плацебо щодо впливу на смертність хворих (рис. 2.13).
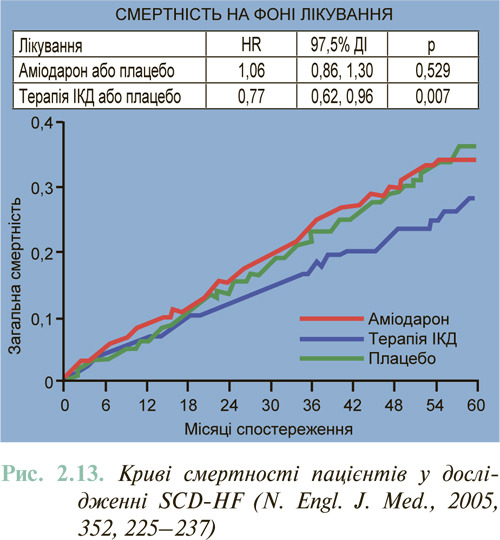
У той же час ефективність аміодарону в первинній профілактиці раптової серцевої смерті, в тому числі у хворих із ХСН, є доведеною (дослідження CASCADE, 1993). Необхідно пам՚ятати, що аміодарон — єдиний з антиаритмічних препаратів, який при тривалому пероральному застосуванні не погіршує скорочувальну функцію міокарда.
Таким чином, антиаритмічний засіб ІІІ класу аміодарон принаймні не погіршує прогноз виживаності хворих із ХСН і може застосовуватися для лікування у них шлуночкових аритмій, що супроводжуються симптомами, в тому числі і у випадку успішно реанімованої раптової серцевої смерті. Крім того, у хворих із ХСН аміодарон можна застосовувати відповідно до загальноприйнятих показань, а саме для: а) відновлення синусового ритму при суправентрикулярних тахіаритміях, у тому числі фібриляції передсердь; б) утримання відновленого синусового ритму у зазначеної категорії хворих; в) підвищення успішності планової електричної кардіоверсії.
Висока доцільність використання автоматичних ІКД з метою первинної профілактики аритмічної смерті у хворих, які перенесли ІМ з вираженою систолічною дисфункцією ЛШ, продемонстрована в масштабних (1232 і 2521 хворих відповідно) багатоцентрових дослідженнях МАDІТ-ІІ (2002) і SCD-HeFT (2005). У першому з них застосування ІКД у хворих після ІМ з ФВ ЛШ ≤30% (імплантувався без урахування документованих шлуночкових аритмій) додатково до стандартної медикаментозної схеми лікування протягом 20 міс зумовило вірогідно меншу (на 28%) частоту летальних випадків порівняно з групою хворих, які отримували тільки стандартну фармакотерапію. У дослідженні SCD-HeFT застосування ІКД у доповнення до оптимальної стандартної фармакотерапії ХСН у хворих з клінічно явною ХСН і ФВ ЛШ <35% зумовило достовірне зниження смертності хворих на 23% протягом майже 5-річного спостереження порівняно з групою «плацебо + оптимальна фармакотерапія».
Пріоритетність використання ІКД при вторинній профілактиці аритмічної смерті у хворих із систолічною дисфункцією ЛШ обґрунтована раніше за даними багатоцентрових досліджень АVІD (1997) і САSН (2000).
Отже, виходячи з даних доказової медицини, існуючих на сьогодні, імплантація кардіовертера-дефібрилятора показана у наступних випадках:
1) з метою вторинної профілактики раптової аритмічної смерті: хворим із систолічною дисфункцією ЛШ незалежно від наявності клінічних симптомів СН, які перенесли епізод (-и) фібриляції шлуночків або шлуночкової тахікардії з нестабільною гемодинамікою чи синкопальними проявами і отримують оптимальну схему стандартної медикаментозної терапії, за умови орієнтовного очікуваного прогнозу виживаності у задовільному функціональному стані >1 року.
2) з метою первинної профілактики раптової аритмічної смерті:
а) показана хворим II—III ФК за NYHA з ФВ ЛШ ≤35%, що перенесли ІМ не раніше, ніж 40 днів тому, які отримують оптимальну схему стандартної медикаментозної терапії, за умови орієнтовного очікуваного сприятливого прогнозу виживаності >1 року;
б) показана хворим з ДКМП II–III ФК за NYHA з ФВ ЛШ ≤35%, які отримують оптимальну схему стандартної фармакотерапії, за умови орієнтовного очікуваного сприятливого прогнозу виживаності >1 року.
ЗАСТОСУВАННЯ ІНЖЕНЕРНИХ ПРИСТРОЇВ У ЛІКУВАННІ ТЯЖКОЇ ХСН
Ресинхронізація шлуночків
Істотне порушення внутрішньошлуночкової провідності (QRS ≥120 мс) відзначають не менш ніж у ⅓ хворих із ХСН, причому приблизно в 15% — повну блокаду лівої ніжки пучка Гіса. Затримка міжшлуночкової і внутрішньошлуночкової провідності визначає асинхронізм у скороченні шлуночків, що знижує ефективність роботи серця як насоса. Складовими його насосної неспроможності при значних порушеннях є:
- порушення координації скорочення сегментів ЛШ;
- зниження трансмітрального кровотоку внаслідок скорочення часу діастолічного наповнення;
- збільшення періоду мітральної регургітації;
- додаткове підвищення тиску наповнення ЛШ і в результаті зменшення його ударного об’єму.
Між ступенем розширення комплексу QRS і смертністю пацієнтів із ХСН існує пряма залежність. Самостійним фактором погіршення гемодинаміки і прогнозу виживаності при ХСН є поєднання подовження інтервалу QRS з уповільненням AV-провідності. Оптимальне прискорення останнього дозволяє збільшити час діастолічного наповнення шлуночків і їх систолічну здатність.
З метою покращання насосної функції серця у пацієнтів із систолічною дисфункцією ЛШ і гемодинамічно значимими порушеннями шлуночкової провідності в 1990-х роках розроблений метод РЕКС шлуночків. У сучасному вигляді він полягає в постійній електрокардіостимуляції трьох камер серця: один електрод імплантується в праве передсердя, другий — у ПШ, а третій (через каротидний синус) — у ЛШ. Під час процедури із установленням електродів індивідуально підбирається такий час AV-затримки (пауза між нав՚язаним скороченням передсердь і шлуночків), що забезпечує максимальний систолічний викид крові за даними допплєр-ехоКГ (рис. 2.14).
За результатами клінічних досліджень застосування постійної РЕКС супроводжується підвищенням ФВ ЛШ, серцевого викиду, зменшенням КДО і КСО ЛШ (рис. 2.15) і об’єму мітральної регургітації, підвищенням толерантності до фізичного навантаження та поліпшенням якості життя пацієнтів.
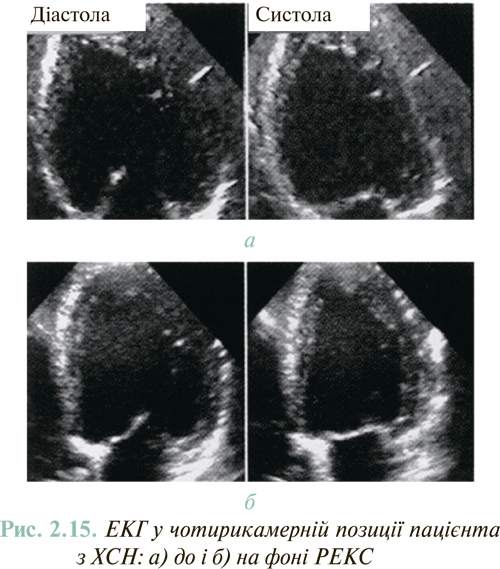
У серії багатоцентрових клінічних досліджень РЕКС при ХСН, проведених наприкінці 1990-х — початку 2000-х років. (СONТАК-С, МUSТІС, МІRAСLЕ), показана здатність РЕКС поліпшувати довгостроковий клінічний прогноз відповідного контингенту хворих із ХСН. За даними метааналізу зазначених досліджень, який охопив у цілому 1634 пацієнти, застосування РЕКС протягом 3–6 міс приводило до зниження ризику смерті від прогресуючої СН на 51% і кількості госпіталізацій з приводу декомпенсації ХСН на 29%. За результатами наймасштабнішого (813 хворих) багатоцентрового дослідження РЕКС при ХСН CARE-HF (2005) застосування цього методу у пацієнтів із ХСН III–IV ФК з порушенням внутрішньошлуночкової провідності і ФВ ЛШ ≤35%, що знаходилися на оптимізованій фармакотерапії, знижувало кількість летальних кінців протягом періоду спостереження (майже 2,5 року) на 36% порівняно з аналогічною групою пацієнтів, що отримували тільки оптимізоване медикаментозне лікування (рис. 2.16). При збільшенні періоду спостереження ще на 8 міс зниження ризику смерті внаслідок насосної недостатності серця порівняно з групою тільки фармакологічного лікування склало 45%, зниження частоти раптової серцевої смерті — на 46%.
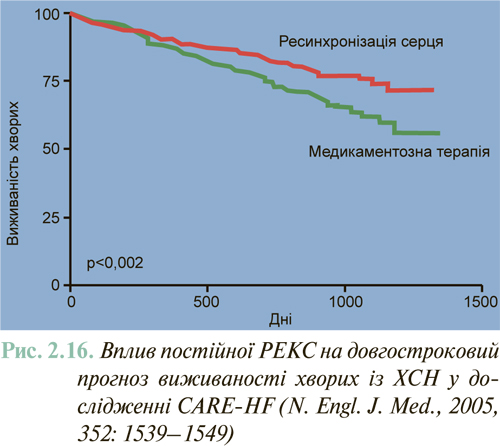
Ґрунтуючись на наведених вище даних доказової медицини, сучасні рекомендації з лікування ХСН визначають показання до постійної бівентрикулярної РЕКС (так званий режим CRT-P) як наявність клінічного статусу на рівні III–IV ФК за NYHA, незважаючи на оптимальну медикаментозну терапію, у пацієнтів зі зниженою ФВ ЛШ і шлуночковою асинхронією (QRS ≥120 мс).
Постійна РЕКС з паралельною функцією дефібрилятора (режим CRT-D)
Комбіноване застосування двох зазначених методів дає можливість одночасно впливати на дві основні причини смерті хворих із ХСН — від насосної недостатності серця і від раптових шлуночкових аритмій (насамперед — вторинної фібриляції шлуночків).
У великому (1520 осіб) багатоцентровому дослідженні СОМРАNION (2004) продемонстровано, що у хворих із ХСН, зумовленою ІХС або ДКМП III–IV ФК із ФВ ЛШ <35% та тривалістю QRS ≥120 мс, що отримують оптимальну медикаментозну терапію, тривале (у середньому протягом 15 міс) комбіноване застосування РЕКС та ІКД супроводжувалося зниженням ризику смерті порівняно з тільки медикаментозною терапією (діуретики, інгібітори АПФ, блокатори β-адренорецепторів, спіронолактон) у більшій мірі (на 36%), ніж застосування РЕКС у поєднанні з медикаментозним лікуванням (на 24%). Доцільність застосування цього комбінованого методу в зазначеній категорії хворих із метою поліпшення прогнозу виживаності і зниження ризику госпіталізації знайшло відображення в міжнародних рекомендаціях із лікування ХСН (2005; 2008).
Імплантовані пристрої допомоги ЛШ
Імплантовані пристрої допомоги ЛШ (ІПДЛШ) — це постійно працюючі пристрої допоміжного кровообігу, локалізовані всередині тіла пацієнта.
Нинішнє покоління ІПДЛШ представлено компактними пристроями, які функціонують за наступним загальним принципом. У черевну порожнину піддіафрагмально імплантується стаціонарний нагнітаючий пристрій (насос або турбіна з безперервним нагнітанням крові), що має зовнішнє (батарейне) джерело живлення. Циркуляторний контур містить: 1) магістраль (трубку), що одним кінцем вшита у верхівку ЛШ, а іншим з՚єднана з нагнітаючим пристроєм; 2) сам насос (або турбіна); 3) магістраль, один кінець якої з՚єднаний з нагнітаючим пристроєм, а інший вшитий у висхідну аорту (рис. 2.17). У такий спосіб більша частина крові, що потрапляє в ЛШ, перекачується в аорту автоматично, що, з одного боку, забезпечує гемодинамічне розвантаження систолічно неспроможного серця (і відповідно кардіопротекторний ефект), а з іншого — дозволяє підтримувати на належному рівні ХОК.
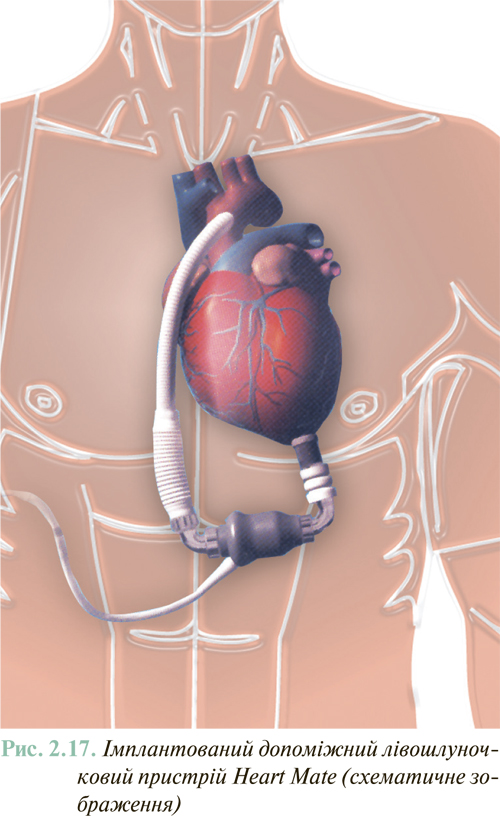
У багатоцентрове дослідження RЕМАТСН (2002) включили 129 хворих з термінальною стадією ХСН (ФВ ЛШ <25%; IV ФК протягом останніх 3 міс; VО2mах <12 мг/кг·хв; >70% пацієнтів перебували на інфузійній інотропній терапії), які були рандомізовані на 2 порівнювані за чисельністю та основними клінічними показниками групи — із застосуванням ІПДЛШ і без них. Усі зазначені пацієнти з різних причин не розглядалися як кандидати на кардіотрансплантацію. Тривале застосування ІПДЛШ дозволило досягти збільшення тривалості і поліпшення якості життя пацієнтів (табл. 2.30). Серед хворих, що очікують трансплантацію серця, застосування ІПДЛШ дозволило дожити до втручання 75% пацієнтів.
Таблиця 2.30
Основні результати дослідження RЕМАТСН (Rose E.A. et al., 2001)
| Показник | Група хворих | p | |
| ІПДЛШ + медикаментозна терапія (n=68) | Тільки медикаментозна терапія (n=61) | ||
Частка виживаності хворих, %:
|
52
26 |
25
8 |
0,002
0,09 |
| Середній ФК через 1 рік | II | IV | |
| Оцінка якості життя, балів:
а) інтегральна оцінка фізичної здатності за 36 показниками; б) інтегральна оцінка емоційного стану |
46
64 |
21
17 |
0,01
0,03 |
Встановлено, що використання ІПДЛШ зменшує вираженість нейрогуморальної активації, зумовлює зниження ФНП-α у біоптатах тканини міокарда.
Можуть застосовуватися у окремих хворих з тяжкою рефрактерною до лікування ХСН у її кінцевій стадії за наступними показаннями: а) як «міст» для трансплантації серця; б) як засіб тимчасового підтримання гемодинаміки при тяжкому гострому міокардиті; в) в окремих пацієнтів як засіб подовження та поліпшення якості життя в кінцевій клінічній стадії ХСН.
Абсолютними протипоказаннями до застосування ІПДЛШ є септичний шок, порушення з боку системи гемостазу, мультиорганна недостатність, стійка легенево-артеріальна гіпертензія, наявність протезованих клапанів серця, розрив міжшлуночкової перегородки.
Відносними протипоказаннями (іншими словами, факторами ризику незадовільного ефекту ІПДЛШ) є аортальна регургітація >II ступеня, значна насосна недостатність ПШ (низький ударний індекс, виражена трикуспідальна недостатність), ТЕЛА давністю <2 тиж, попередня тривала інтубація, старечий вік, онкологічні захворювання з очікуваною виживаністю <5 років, печінкова недостатність з тенденцією до прогресування, злоякісні шлуночкові аритмії (останнім часом використовується тактика комбінованого застосування ІПДЛШ та ІКД).
Застосування ІПДЛШ асоціюють з ризиком виникнення ускладнень інфекційного характеру (30–60% на рік), тромбоемболій (7–20%), кровотечі (9–21%), рідше — неадекватним функціонуванням пристрою (4–12%). Використання ІПДЛШ із внутрішнім елементом живлення дозволило знизити частоту виникнення інфекційних ускладнень до 11% на рік.
Широке впровадження сучасних високотехнологічних хірургічних методів лікування тяжкої ХСН (РЕКС, ІКД, ІПДЛШ) обмежується їх високою вартістю, що особливо стосується ІПДЛШ.
Показання до хірургічного лікування при ХСН
Категорії хворих з симптомною ХСН та/або дисфункцією ЛШ, яким показана консультація кардіохірурга
1. Пацієнти з наявністю типових проявів ІХС (стенокардія, перенесений ІМ) та/або відповідних даних коронароангіографії.
Оскільки ефективність реваскулярізації ЛШ значною мірою визначається ступенем збереженості життєздатного міокарда в зоні відновлення кровотоку, важливим є визначення його наявності за допомогою відповідних діагностичних методів, таких як ехокардіографія з добутаміном або МРД з добутаміном.
2. Пацієнти з тяжким аортальним стенозом (площина отвору <1,0 см2, градієнт тиску на клапані >50 мм), що супроводжується симптомами СН та/або зниженням ФВ ЛШ <50%.
3. Пацієнтам з тяжкою аортальною недостатністю (об’єм регургітації ≥60 мл, фракція регургітації ≥50%), що супроводжується симптомами СН та/або зниженням ФВ ЛШ <50%.
4. Пацієнти з тяжкою (об’єм регургітації ≥60 мл, фракція регургітації ≥50%) мітральною недостатністю органічного характеру з ФВ ЛШ >30%.
5. Пацієнти з тяжкою (об’єм регургітації ≥60 мл, фракція регургітації ≥50%) функціональною (відносною) мітральною недостатністю, що супроводжується симптомами СН, попри оптимальне медикаментозне лікування.
6. Пацієнти з мітральним стенозом, що супроводжується симптоматикою СН, при площі отвору <1,5 см2.
7. Пацієнти зі значною за розмірами мішкоподібною аневризмою ЛШ за наявності симптомів СН.
Кардіоміопластика та парціальна лівобічна вентрикулектомія (операція Батісти) не рекомендуються ані для лікування ХСН будь-якої етіології, ані як альтернатива трансплантації серця.
ТРАНСПЛАНТАЦІЯ СЕРЦЯ
Перспектива трансплантації серця може розглядатися у хворих з тяжкою СН (необоротний IV ФК за NYHA), рефрактерною до будь-яких інших методів лікування. Провідними критеріями, що дозволяють розглядати пацієнта як потенційного кандидата для трансплантації серця, є критичне зниження функціональної здатності (за даними спіроергометрії <10 мл/кг/хв) та неможливість обходитися без регулярної інфузійної підтримки неглікозидними інотропними засобами. Додатковими умовами є хороша інформованість, психоемоційна стабільність пацієнта та його прихильність до активного лікування.
Протипоказаннями до трансплантації серця є зловживання алкоголем або вживання наркотичних речовин; відсутність належного контакту (готовності до співпраці) з лікарями; серйозні психічні захворювання; злоякісні пухлини (якщо після лікування — ремісія не менше 5 років); системні захворювання з мультиорганним ураженням, активні інфекційні процеси, виражена ниркова недостатність (кліренс креатиніну <50 мл/хв), стійка тяжка легенева гіпертензія, нещодавно перенесена тромбоемболія (-ї), виражена печінкова недостатність, інші серйозні супутні захворювання з несприятливим прогнозом.
Як правило, здійснюється так звана ортотопічна методика кардіотрансплантації, що полягає в субтотальному, із збереженням задньої стінки передсердь, вилученні ураженого серця з подальшим формуванням передсердного, аортального і легенево-артеріального анастомозів із донорським серцем.
Операційний ризик є значно нижчим порівняно з ризиком виникнення найближчих (переважно протягом перших 2 міс) ускладнень (відторгнення донорського серця, сепсис). Стенозувальний атеросклероз коронарних судин як пізнє ускладнення кардіотрансплантації може розвинутися вже через 1 рік після її виконання. Особливістю ішемічної хвороби трансплантованого (денервованого) серця є відсутність больового синдрому, що зумовлює необхідність регулярного контролю ЕКГ.
Оптимальна модель ведення хворих із трансплантованим серцем передбачає:
- постійне імуносупресивне лікування;
- періодичні ендоміокардіальні біопсії з метою своєчасного виявлення гістологічних ознак відторгнення;
- антибіотикотерапію при найменших ознаках інфекції;
- корекцію гіперхолестеринемії та інших серцево-судинних факторів ризику.
У США і країнах Західної Європи виживаність пацієнтів протягом 5 років після кардіотрансплантації становить 70–80%, причому серед осіб працездатного віку до роботи повертаються до ⅔ прооперованих.
Оскільки глобальною проблемою є нестача донорських сердець, кардіотрансплантація навіть в економічно розвинених країнах залишається засобом радикальної допомоги абсолютній меншості хворих, яким вона показана.
Схематичний алгоритм лікувальної допомоги пацієнтам з ХСН та систолічною дисфункцією ЛШ наведений на схемі 2.8
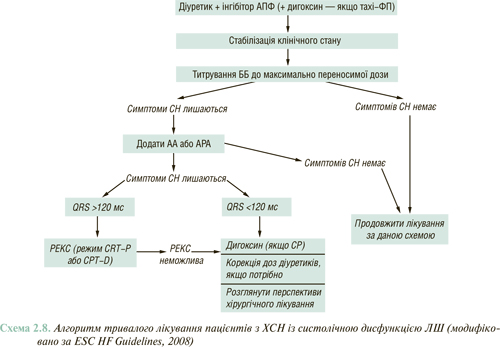
ДЕКОМПЕНСОВАНА ХСН
Як відомо, ГСН може виникати вперше (de nоvо) або епізодично у пацієнтів без ХСН (табл. 2.31). Проте більшість (до 80%) випадків гострої декомпенсації серця є наслідком погіршення гемодинаміки саме у хворих із ХСН.
Таблиця 2.31
Імовірні причини виникнення ГСН у хворих без ХСН
|
Гострий ІМ |
|
Гіпертензивний криз |
|
Тахікардія |
|
Токсемія, перш за все септична |
|
Гостра аортальна або мітральна недостатність внаслідок деструкції клапана при бактеріальному ендокардиті |
|
Розрив папілярних м’язів або міжшлуночкової перегородки |
|
Відрив сhordaе tendinae |
|
Гострий дифузний міокардит |
Серед хворих із гострою декомпенсацією ХСН більшість становлять пацієнти із систолічною дисфункцією і дилатацією ЛШ (за різними даними — від 72 до 87%). При цьому до 25% таких хворих мають відносно збережену (>45%) ФВ ЛШ.
Врахування можливих факторів виникнення декомпенсації кровообігу у хворих із ХСН (табл. 2.32) важливо принаймні з двох причин. По-перше, це слугує однією з передумов правильного ведення хворого вже на початковому етапі лікування. По-друге, виявлення таких факторів у кожному конкретному випадку допомагає зробити необхідні індивідуальні акценти в рекомендаціях щодо подальшого амбулаторного ведення пацієнта перед майбутньою випискою зі стаціонару.
Таблиця 2.32
Фактори, що сприяють декомпенсації клінічного стану хворих із ХСН
|
ІМ, дестабілізація ІХС |
|
Неконтрольована АГ |
|
Суправентрикулярна тахіаритмія, перш за все фібриляція передсердь |
|
Стійка шлуночкова тахікардія |
|
Вірусні інфекції, загострення ХОХЛ |
|
Гостра пневмонія |
|
ТЕЛА |
|
Прогресуюча ниркова або печінкова недостатність |
|
Некомпенсований цукровий діабет |
|
Анемія |
|
Дисфункція щитовидної залози |
|
Період вагітності |
|
Зловживання алкоголем |
|
Невиконання рекомендацій відносно застосування лікарських засобів |
|
Невиконання рекомендацій відносно питного режиму, режиму фізичної активності |
|
Неадекватно призначена підтримувальна терапія |
|
Ятрогенія (наприклад призначення лікарського засобу, застосування якого протипоказане при ХСН, масивна інфузійна терапія з приводу супутнього захворювання без урахування наявності у хворого ХСН і т.п.) |
Актуальність проблеми лікування декомпенсованої ХСН визначається в першу чергу невтішними даними відповідної статистики. Смертність таких хворих протягом 1 міс з моменту госпіталізації становить 5–10%, зростаючи протягом наступних 6 і 12 міс до 20 і 30–40% відповідно; 44% з них протягом 6 міс госпіталізуються повторно, а 16% — не менш 2 разів.
Основними завданнями лікування хворих із декомпенсованою ХСН є:
- Усунення відповідних клінічних симптомів, відновлення еуволемічного стану пацієнта.
- Відновлення задовільних лабораторних показників (нормалізація активності печінкових ферментів, рівня білірубіну, креатиніну, зниження рівня МНУП).
- Ініціація стратегії подальшого підтримувального лікування, спрямованого на профілактику повторних госпіталізацій і збільшення тривалості життя пацієнта.
Для покращання насосної функції серця і нормалізації системної гемодинаміки використовують інфузійне і болюсне введення діуретиків (табл. 2.33), вазодилататорів і позитивних інотропних засобів, а також за показаннями — пристроїв для механічної підтримки гемодинаміки та хірургічну корекцію причини СН. Показанням до короткочасного (не більше кількох діб, з подальшим переходом на пероральну форму) інфузійного застосування серцевих глікозидів (дигоксин) є декомпенсована ХСН при наявності тахісистолічної форми фібриляції передсердь.
Таблиця 2.33
Петльові діуретики для внутрішньовенного застосування в лікуванні декомпенсованої ХСН
|
Діуретик |
Початкова доза, мг |
Максимальна доза, мг |
Інфузія |
|
Фуросемід |
20–40 |
200 |
40 мг болюсно, далі 10–40 мг/год |
|
Торасемід |
10–20 |
100 |
20 мг болюсно, далі 5–20 мг/год |
|
Буметанід |
0,5–1,0 |
4 |
1 мг болюсно, далі 0,5–2,0 мг/год |
Алгоритм застосування вищевказаних засобів викладено в розділі настанови, присвяченому ГСН.
Після стабілізації гемодинаміки перехід на підтримувальну пероральну терапію в більшості випадків можливий протягом 24–48 год. У подальшому важливим є: 1) ініціювання прийому нейрогуморальних антагоністів, спрямованого на зниження ризику смерті та повторних госпіталізацій (початок титрування інгібіторів АПФ, а згодом блокаторів β-адренорецепторів); 2) інформування хворого щодо його поведінки та самоконтролю (дієта, питний режим, контроль маси тіла, значення і режим постійного застосування лікарських засобів).
Якщо хворий раніше не отримував нейрогуморальних антагоністів, можливість початку титрування інгібіторів АПФ може бути розглянута після початкової стабілізації гемодинамічного стану, починаючи з 48 год від моменту початку активного лікування. Ініціація терапії блокаторами β-адренорецепторів здійснюється на подальшому етапі стаціонарного лікування, виходячи з вимоги досягнення еуволемічного стану.
ЛІКУВАННЯ ПАЦІЄНТІВ ІЗ БЕЗСИМПТОМНОЮ СИСТОЛІЧНОЮ ДИСФУНКЦІЄЮ ЛШ
У цю клінічну групу входять хворі, у яких за даними інструментального дослідження виявлено зменшення величини ФВ ЛШ, але які не звертаються до лікаря з приводу типових для СН скарг, не мають явних об՚єктивних ознак застійної СН і не отримують лікування з приводу ХСН.
Хоча в різних епідеміологічних дослідженнях використовували різні критерії систолічної дисфункції ЛШ, розповсюдженим її ехоКГ-критерієм є величина ФВ ЛШ <40%. Поширеність встановленої за цим критерієм безсимптомної дисфункції (БСД) ЛШ у популяції дорослих варіює, за даними різних досліджень, від 0,9 до 3,4%, що є порівнянним з поширеністю клінічно вираженої ХСН. Поширеність БСД ЛШ значно вище серед чоловіків (в 2–4 рази порівняно з жінками), серед осіб похилого віку і у пацієнтів з раніше встановленим діагнозом ІХС (4–8,5%).
При проспективному спостереженні щорічно реєструють появу клінічно вираженої СН у 5–20% пацієнтів із БСД ЛШ; щорічно вмирають 5,1–10,5% осіб із БСД ЛШ. Зазначений рівень смертності займає проміжне місце між рівнями смертності, що реєструються у пацієнтів, які перенесли ІМ зі збереженою ФВ ЛШ, і у хворих з клінічно маніфестованою систолічною дисфункцією ЛШ.
Скринінгові дослідження рівнів циркулюючого МНУП або його N-кінцевого фрагмента в певних когортах пацієнтів із серцево-судинними захворюваннями з підвищеним ризиком розвитку БСД ЛШ (після ІМ, з неконтрольованою АГ, супутнім цукровим діабетом і деякі ін.) є доцільними з погляду відбору пацієнтів для подальшого ехоКГ-дослідження.
Враховуючи високу ймовірність трансформації БСД ЛШ у клінічно виражену СН із її значно гіршим прогнозом, пріоритетним завданням є призначення пацієнтам із БСД ЛШ лікування, спрямованого на зменшення прогресування СН і запобігання появі клінічних симптомів ХСН.
Спеціально сплановані клінічні дослідження з цього питання із залученням достатньої кількості пацієнтів на сьогодні проведені тільки для однієї групи препаратів, а саме інгібіторів АПФ. У відомому багатоцентровому дослідженні SAVE (1992), у яке були включені пацієнти з БСД ЛШ після ІМ, тривалий прийом каптоприлу асоціювався зі зменшенням кількості госпіталізацій з приводу клінічно вираженої СН на 22%. Найбільш вагомі результати щодо впливу інгібіторів АПФ на клінічний прогноз пацієнтів із БСД ЛШ отримані в дослідженнях SОLVD Prevention (1992) і ретроспективному субдослідженні Х-SОLVD (2003). У так зване профілактичне дослідження SОLVD (SОLVD Prevention) включили 4228 пацієнтів із БСД ЛШ, половина з яких отримувала еналаприл у дозі 10 мг 2 рази на добу (з попереднім клінічним титруванням, починаючи з початкової дози 2,5 мг 2 рази на добу), а інша половина — плацебо. Подальше тривале (близько 4 років) спостереження пацієнтів продемонструвало виражене (на 37%) і достовірне зниження ризику розвитку СН у пацієнтів, які приймали еналаприл, порівняно з групою плацебо (рис. 2.18).
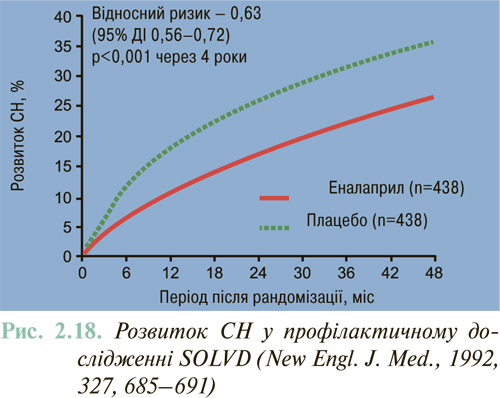
Крім того, прийом еналаприлу порівняно з плацебо супроводжувався вірогідно нижчою частотою розвитку нестабільної стенокардії та ІМ (відповідно на 14 і 24%).
У ретроспективному субдослідженні Х-SOLVD простежено вплив застосування еналаприлу протягом 4 років на подальшу «клінічну долю» пацієнтів із урахуванням того, що після закінчення дослідження SOLVD хворі групи плацебо були переведені на подальше постійне лікування цим препаратом. Спостереження пацієнтів протягом наступних 8 років (вдалося простежити долю майже всіх досліджуваних) показало, що виживаність хворих, які почали приймати еналаприл ще до появи клінічних ознак СН, згодом почала підвищуватися порівняно з хворими, що приймали плацебо, з відповідним достовірним розходженням через 12 років спостереження (рис. 2.19).
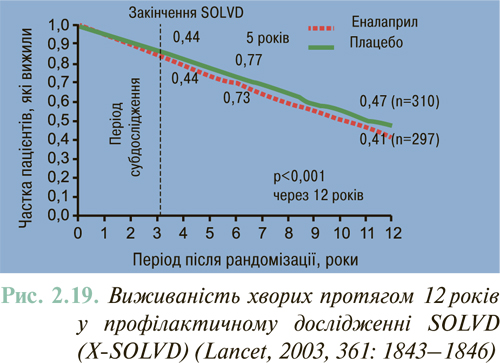
Вказана різниця досягнута за рахунок показника смертності від серцево-судинних причин, оскільки смертність серед зазначених хворих від некардіальної патології вірогідно не відрізнялася. За розрахунковим даними (Х-SOLVD) раннє призначення еналаприлу в дослідженні SOLVD Prevention привело до зростання середньої тривалості життя на 9,2 міс.
Таким чином, призначення та постійне застосування інгібіторів АПФ (з формальних позицій доказової медицини — саме еналаприлу) є стандартом лікування пацієнтів із доклінічною систолічною дисфункцією ЛШ.
Незважаючи на відсутність спеціально спланованих відповідних досліджень, є підстави припускати, що застосування блокаторів β-адренорецепторів додатково до базисної терапії інгібіторами АПФ у пацієнтів із БСД ЛШ буде сприяти подальшому поліпшенню клінічного прогнозу таких хворих, подібно тому, як це має місце при комбінуванні зазначених засобів у хворих із клінічно маніфестованою ХСН. Вагомим аргументом на користь такої точки зору є результати багатоцентрового дослідження САРRІСОRN (2001). Вони показали, що додання хворим із компенсованою гемодинамікою, але зниженою ФВ ЛШ (<40%) у гострий період ІМ до стандартної базисної терапії (яка вже включає інгібітор АПФ) блокатора β-адренорецепторів карведилолу і подальший тривалий (у середньому 1,3 року) прийом останнього асоціювався з достовірним зниженням загальної смертності на 23%, нефатального ІМ — на 41% порівняно з групою хворих, які замість карведилолу отримували плацебо. У діючих Європейських рекомендаціях з лікування ХСН передбачено комбінування інгібіторів АПФ і блокаторів β-адренорецепторів як стандартний підхід у пацієнтів із БСД ЛШ, які перенесли ІМ.
ЛІКУВАННЯ ХВОРИХ ІЗ ХСН І ЗБЕРЕЖЕНОЮ СИСТОЛІЧНОЮ ФУНКЦІЄЮ ЛШ
З урахуванням можливості і характеру лікування зазначений клінічний контингент можна розділити на дві основні групи. До першої з них належать пацієнти, у яких існує принципова можливість усунення симптомів СН шляхом хірургічної корекції її причини (клапанні вади серця, констриктивний перикардит, передсердна міксома, брадисистолії, які потребують імплантації електрокардіостимулятора). Друга, численніша група представлена пацієнтами з клінічно маніфестованою ХСН різного етіологічного походження з нормальною (≥50%) або субнормальною (45–50%) ФВ ЛШ, у яких неможливе проведення хірургічної корекції, і основною лікувальною стратегією є медикаментозна терапія (табл. 2.34). Як відзначалося вище, у більшості таких хворих провідну роль у походженні симптомів СН відіграє діастолічна дисфункція ЛШ (гіпертензивне серце, ішемія, ГКМП, тахісистолії). Окремо виділяють ізольовану правошлуночкову недостатність, зумовлену легеневою гіпертензією різного походження.
Таблиця 2.34
Медикаментозні засоби і потенційні механізми їх терапевтичної дії у хворих із діастолічною ХСН
|
Клас препаратів |
Механізми терапевтичного впливу |
|
Інгібітори АПФ* Антагоністи рецепторів ангіотензину II** |
Регрес гіпертрофії і фіброзу ЛШ Антигіпертензивна дія Покращання активної релаксації ЛШ |
|
Блокатори β-адренорецепторів*** |
Збільшення періоду діастолічного наповнення Антиішемічна дія Антигіпертензивна дія |
|
Недигідропіридинові антагоністи кальцію (верапаміл, дилтіазем) |
Покращання активної релаксації ЛШ Антиішемічна дія Антигіпертензивна дія |
|
Діуретики |
Ліквідація явищ застою |
*Не показані при ГКМП, рестриктивній КМП; **у багатоцентровому дослідженні СНАRМ (2003) кандесартан вірогідно знижував порівняно з плацебо частоту госпіталізацій з приводу СН; ***не мають потреби в застосуванні такої жорсткої (повільної) схеми титрування, як при систолічній дисфункції ЛШ.
Оскільки дані доказової медицини (тобто спеціально спланованих завершених плацебо-контрольованих багатоцентрових досліджень) щодо позитивного впливу сучасних медикаментозних засобів на клінічний прогноз діастолічної/переважно діастолічної ХСН вкрай обмежені, сучасні рекомендації з лікування таких хворих базуються на патофізіологічних передумовах і результатах обмежених досліджень клінічної фармакодинаміки відповідних медикаментозних засобів.
1. Контроль АТ на цільовому рівні. Його важливість мотивується такими положеннями:
а) більшість випадків діастолічної ХСН пов՚язані з наявністю АГ;
б) саме по собі підвищення АТ є чинником зниження активної релаксації ЛШ;
в) ГЛШ, зумовлена його перевантаженням опором, асоціюється з порушенням його пасивно-еластичних властивостей і відповідно діастолічної піддатливості;
г) у пацієнтів із АГ нормалізація АТ є однією з передумов до регресії ГЛШ;
д) адекватна антигіпертензивна терапія приводить до значного (за даними метааналізу 2006 р. — на 52%) зниження частоти виникнення клінічно вираженої ХСН.
2. Підтримка нормальної ЧСС з метою поліпшення діастолічного наповнення шлуночків (адекватний контроль ЧСС при постійній формі фібриляції передсердь або усунення синусової тахікардії).
3. Відновлення синусового ритму у хворих із фібриляцією передсердь з метою підвищення серцевого викиду за рахунок відновлення передсердної складової діастолічного наповнення ЛШ.
4. Усунення (запобігання) ішемії міокарда за допомогою медикаментозної терапії або шляхом хірургічної реваскуляризації ЛШ.
5. Контроль волемічного стану пацієнтів за допомогою діуретиків. У хворих із діастолічною ХСН це вимагає певної обережності, оскільки в умовах форсованого діурезу подальше зменшення діастолічного наповнення шлуночків зумовлює зниження серцевого викиду і відповідно системного АТ (насамперед у хворих із рестриктивними ураженнями міокарда і ГКМП).
При наявності об’єктивізованих інструментальними методами порушень релаксації ЛШ не показане застосування серцевих глікозидів у зв’язку з можливістю збільшення зазначених порушень внаслідок здатності цього класу засобів підвищувати концентрацію вільного внутрішньоклітинного Са2+.
6. Застосування нейрогуморальних антагоністів (інгібіторів АПФ, блокаторів β-адренорецепторів, антагоністів рецепторів ангіотензину II), у тому числі в комбінації.
7. Застосування верапамілу або дилтіазему з метою нормалізації ЧСС у випадках непереносимості блокаторів β-адренорецепторів.
Терапія хворих з декомпенсованим легеневим серцем являє окрему міждисциплінарну проблему, висвітлення якої виходить за межі цього видання. Сучасні підходи до лікування таких пацієнтів передбачають застосування діуретиків, оксигенотерапії, вазодилататорів (диференційовано), інгаляційного оксиду азоту, вазодилататорних простагландинів, антагоністів рецепторів ендотеліну-1.
ОСОБЛИВОСТІ ДІАГНОСТИКИ І ЛІКУВАННЯ ХСН У ХВОРИХ СТАРЕЧОГО ВІКУ
За результатами останніх досліджень — європейського IMPROVEMENT-HF (дані з 15 країн) і російського епідеміологічного ЭПОХА-О-ХСН, середній вік хворих з клінічно маніфестованою ХСН становить 70 і 69 років відповідно. Таким чином, приблизно половина пацієнтів із ХСН — старше 70 років. Зазначений клінічний контингент є більш проблемним для клініцистів, про що свідчить гірша виживаність таких пацієнтів і більш високі показники частоти і тривалості їх госпіталізацій порівняно з хворими молодшого віку. На осіб віком старше 70 років доводиться приблизно ⅔ усіх ліжко-днів з приводу ХСН. Ця ситуація певною мірою пов՚язана з недооцінкою багатьма лікарями особливостей патогенетичних механізмів, діагностики і лікування ХСН у старечому віці.
Особливості ХСН у віці старше 70 років визначаються трьома кардинальними факторами, до яких відносяться: 1) притаманні старінню специфічні фізіологічні зміни серцево-судинної системи; 2) характерні для похилого віку фізіологічні зміни інших органів і систем; 3) властиві старечому віку супутні захворювання та порушення.
За даними C.T. Lien і співавторів (2002) частота супутньої патології в когорті осіб у віці 65–98 років розподілилася у такий спосіб: захворювання опорно-рухового апарату з больовим синдромом — 41%, психоемоційні порушення (безсоння, депресія, збудження) — 39%, когнітивні порушення8 — 35–38% (за різними шкалами оцінки), бронхолегеневі захворювання — 30%, нетримання сечі — 29%, цереброваскулярна патологія — 26%, гіпотиреоз — 22%, залізодефіцитна анемія — 14%, цукровий діабет — 10%. Висока питома вага супутньої патології в значній мірі визначає особливості лікування і діагностики пацієнтів із ХСН старечого віку.
Діагностична чутливість таких суб՚єктивних ознак СН, як пароксизмальна нічна задишка і ортопное (14 і 38% відповідно), у хворих старечого віку нижче, ніж у загальній популяції пацієнтів із ХСН. Причинами цього є наявність у багатьох таких осіб когнітивних порушень, а також маскування зазначених симптомів снодійними засобами, які люди старечого віку нерідко приймають у зв՚язку з безсонням. У таких пацієнтів із ХСН також відзначають більш низьку (38%) специфічність такої діагностичної ознаки, як задишка, оскільки остання може виникати і при бронхолегеневій патології й анемії, які частіше (див. вище) виявляють у пацієнтів зазначеної вікової категорії.
З когнітивними порушеннями пов՚язують і той факт, що в 14% випадків наявність у осіб старечого віку об՚єктивних клінічних ознак застійної СН не супроводжується суб՚єктивними скаргами. Лише ¼ таких пацієнтів госпіталізують з приводу скарг, типових для ХСН, але разом з тим біля половини з них госпіталізуються з інших причин (неврологічні порушення, падіння з травмуванням, хвороби опорно-рухового апарату, пневмонія і т.п.). Враховуючи наведені дані, слід підкреслити необхідність консультування лікарем-інтерністом практично всіх осіб старечого віку, яких госпіталізують до стаціонару будь-якого профілю. З іншого боку, з цих же причин у хворих старечого віку підвищується роль ехоКГ-дослідження як ключової ланки об՚єктивізації діагнозу ХСН.
Вікові зміни серцево-судинної системи багато в чому визначають особливості ХСН у старечому віці.
По мірі старіння через механізм апоптозу поступово зменшується кількість кардіоміоцитів — приблизно на 35% між 30 і 70 роками. Разом з тим компенсаторно збільшується маса кожного кардіоміоцита, в результаті чого загальний об’єм цих клітин не змінюється. Суттєво не змінюється і загальна маса сполучної тканини в міокарді, але відбувається певна її якісна трансформація, що полягає в підвищенні вмісту колагену. В результаті індекс маси міокарда у людей старечого віку без АГ залишається без істотних змін. У людей у віці старше 75–80 років у міокарді починають виявлятися амілоїдні включення. ЛШ у людей старечого віку в нормі здобуває риси концентричного ремоделювання (зменшення об’єму порожнини і збільшення товщини стінки без істотного росту маси), що зв՚язують з пропорційним віку підвищенням постнавантаження на серце внаслідок вікових змін (зниження еластичності) периферичних артерій. На молекулярному рівні спостерігається в першу чергу зниження активності одного із ключових іонних насосів — Са2+-АТФази саркоплазматичного ретикулума, що, як відомо, контролює повернення іонів Са2+ у саркоплазматичний ретикулум під час релаксації серцевого м՚яза. Зниження синтезу в міокарді протеїну Са2+-АТФази саркоплазматичного ретикулума, очевидно, є адаптаційним механізмом, спрямованим на енергозбереження. Проте негативними наслідками зниження активності зазначеного насоса є перевантаження іонами Са2+ цитозолю кардіоміоцита та сповільнення активного розслаблення шлуночків.
Основні показники систолічної і насосної функції серця — ФВ ЛШ, УОК і ХОК у процесі нормального старіння в стані спокою істотно не змінюються. У той же час внаслідок згадуваних вище вікових змін міокарда на структурному та молекулярному рівнях пропорційно віку відбувається погіршення як активного, так і пасивного розслаблення ЛШ. Особливо страждає активна релаксація останнього, про що свідчить зниження приблизно на 50% швидкості раннього наповнення ЛШ в 70-річному віці порівняно із 30-річним, що супроводжується відповідною реверсією (<1) співвідношення Е/А.
Старіння також супроводжується пропорційним віку зниженням толерантності до фізичного навантаження, що зумовлене: 1) обмеженням хроно- й інотропного резервів серця внаслідок зниження чутливості міокардіальних β-адренорецепторів; 2) енергодефіцитом міокарда, зумовленим підвищенням кінцево-систолічного міокардіального стресу (внаслідок підвищеного артеріального опору) і, можливо, відносною коронарною недостатністю внаслідок зменшення в міокарді кількості капілярів (пропорційно віку); 3) неможливістю повноцінної реалізації механізму Франка — Старлінга внаслідок: а) зазначеного вище енергодефіциту кардіоміоцитів і б) обмеження діастолічної здатності ЛШ до наповнення.
Зазначені вище вікові зміни зумовлюють, з одного боку, більш високу розповсюдженість ХСН серед людей похилого та старечого віку, з іншого боку — суттєве підвищення ролі діастолічної дисфункції в генезі СН у таких хворих. Так, збережена систолічна функція ЛШ відзначена у 14,5% всіх випадків клінічно явної ХСН серед осіб віком молодше 65 років, у 32,6% випадків — серед осіб 66–75 років і у 49,6% випадків — серед пацієнтів старше 75 років. За даними інших авторів діастолічна ХСН відзначається приблизно у 50% пацієнтів старечого віку, причому віком старше 80 років збережену систолічну функцію ЛШ відзначають в 70% всіх випадків ХСН.
Характерною рисою ХСН у старечому віці є збільшення кількості хворих із постійною формою фібриляції передсердь, що визначається істотним значенням діастолічних порушень у цій когорті пацієнтів (схема 2.9).
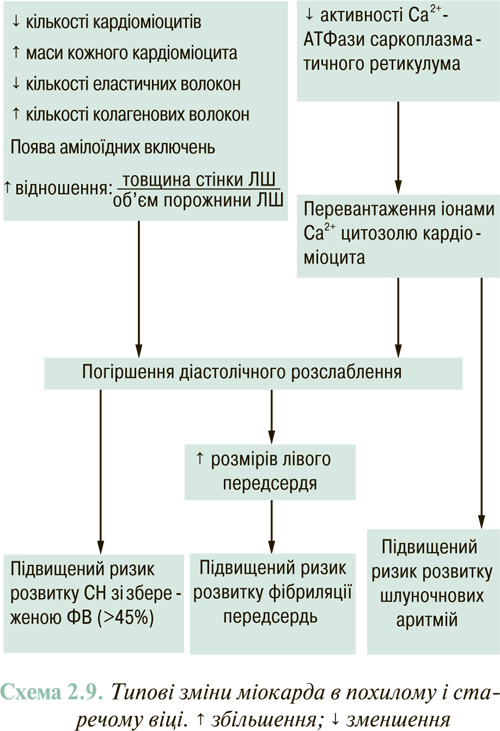
Однією з ключових ланок патогенезу ХСН є ендотеліальна дисфункція. Як було зазначено вище, причинами пригнічення при ХСН синтезу ендотеліоцитами оксиду азоту (NO) є сповільнення системного кровотоку, оксидантний стрес, дія підвищених концентрацій ангіотензину II і протизапальних цитокінів. Негативними для перебігу ХСН наслідками дисфункції ендотелія є обмеження контррегуляторної вазодилататорної відповіді, активація системного імунного запалення, підвищення ризику внутрішньосудинного тромбозу. Останнім часом показано, що при ХСН більша ступінь ендотеліальної дисфункції асоціюється з меншою тривалістю життя хворих. Значення ендотеліальної дисфункції у пацієнтів із ХСН старечого віку є особливо актуальною з урахуванням, з одного боку, пропорційно віку погіршення NO-продукуючої функції ендотелію і фізіологічної ролі оксиду азоту в забезпеченні активного розслаблення ЛШ — з іншої.
Як відомо, діючий стандарт фармакологічного лікування ХСН передбачає застосування насамперед діуретиків, інгібіторів АПФ, блокаторів β-адренорецепторів, а також (за показаннями) антагоністів рецепторів ангіотензину II, дигоксину і антагоністів альдостерону.
Діуретики. Із застосуванням сечогінних засобів у осіб старечого віку можуть бути пов՚язані наступні клінічні проблеми.
- Менша дієвість тіазидних діуретиків. Останні є неефективними при швидкості клубочкової фільтрації <30 мл/хв. Тому, з урахуванням пропорційного віку фізіологічного зниження швидкості клубочкової фільтрації, доцільність застосування тіазидних діуретиків при ХСН у осіб похилого та старечого віку в якості монотерапії є сумнівною.
- Істотніший, ніж у хворих молодшого віку, ризик розвитку гіпотензії та азотемії на фоні активного діурезу, викликаного застосуванням петльових діуретиків. У зв՚язку з цим рекомендується не починати лікування пацієнтів зазначеної вікової групи з високих доз діуретиків і ретельно контролювати рівень АТ і креатиніну плазми крові.
- Нетримання сечі у ⅓ хворих старечого віку. Це передбачає можливість катетеризації сечового міхура на період найбільш активної діуретичної терапії у таких пацієнтів.
- Можливість наявності у чоловіків старечого віку вираженої гіпертрофії передміхурової залози, у тому числі раніше не діагностованої, у зв՚язку з чим таким пацієнтам показана консультація уролога і при необхідності — проведення тимчасової катетеризації сечового міхура на період активного діурезу.
Інгібітори АПФ. Дані метааналіза 5 найбільших багатоцентрових досліджень ефективності інгібіторів АПФ при ХСН і постінфарктній систолічній дисфункції ЛШ свідчать, що їх редукуючий вплив на ризик смерті, реінфаркта та повторних госпіталізацій не залежить від віку пацієнтів. У той же час з віком зростає вірогідність виникнення таких поєднаних з прийомом інгібіторів АПФ ускладнень, як ортостатична гіпотензія, азотемія та гіперкаліємія. Субаналіз багатоцентрового дослідження ATLAS (1999) показав, що на фоні застосування лізиноприлу хворими віком старше 70 років гіпотензія розвивається приблизно в 1,5 раза частіше, а азотемія і гіперкаліємія в 2 рази частіше, ніж у пацієнтів, які отримували терапію аналогічними дозами лізиноприлу віком молодше 70 років.
Наведені дані свідчать про необхідність особливо ретельного контролю АТ і відповідних лабораторних показників у хворих старечого віку під час титрування дози інгібіторів АПФ.
Цільових доз інгібіторів АПФ у хворих із ХСН похилого віку вдається досягти рідше, ніж у пацієнтів молодшого віку. Проте невідомо, чи можна офіційно рекомендовані цільові дози інгібіторів АПФ розглядати як оптимальні для пацієнтів цієї вікової категорії — адже зазначені рекомендації базуються на даних тих багатоцентрових досліджень (SOLVD Trеatment, VeFT II, ATLAS), середній вік учасників яких був істотно нижче, коливаючись між 61 і 64 роками.
Дигоксин. За даними мультицентрового дослідження DIG (наводилися раніше) здатність дигоксину знижувати частоту госпіталізацій з приводу декомпенсації кровообігу не залежала від віку пацієнтів, проте у міру збільшення віку підвищувався ризик дигіталісної інтоксикації. Останню обставину пов՚язують з пропорційним віку фізіологічним зниженням ниркової клубочкової фільтрації, що зумовлює уповільнення елімінації дигоксину. Саме тому відповідно до рекомендацій Європейського товариства кардіологів підтримувальна доза дигоксину у хворих похилого і старечого віку повинна становити ¼–½ звичайної для пацієнтів молодого і зрілого віку, а саме 0,0625–0,125 мг/добу.
Блокатори β-адренорецепторів. Рекомендації щодо застосування блокаторів β-адренорецепторів у хворих старечого віку аналогічні таким для всієї популяції хворих із ХСН. Субаналіз багатоцентрових досліджень бізопрололу (CIBIS-II), метопрололу CR/XL (MERIT-HF) і карведилолу (COPERNICUS) свідчить про порівнянність прогноз-модулюючого впливу зазначених блокаторів β-адренорецепторів у підгрупах пацієнтів із ХСН старечого віку і молодших вікових категорій. Дослідження SENIORS (2004) дало можливість доповнити рекомендації з лікування хворих із ХСН віком старше 70 років ще одним блокатором β-адренорецепторів — небівололом, який характеризується високим профілем клінічної переносимості, що пов՚язане з найбільшою, порівняно з іншими блокаторами β-адренорецепторів, β1-селективністю цього препарату.
З огляду на нерідко знижену комплаєнтність, значну ймовірність виникнення або загострення супутньої внутрішньої патології та підвищений ризик побічних ефектів фармакотерапії, хворі із ХСН старечого віку мають потребу в ретельному диспансерному спостереженні. Останнє передбачає: а) по можливості частіші повторні огляди; б) патронажні візити медсестри; в) регулярне співробітництво лікаря з родичами пацієнта. Впроваджений у ряді західних країн підхід до курації хворих із ХСН старечого віку в амбулаторних умовах передбачає моніторування їх клінічного стану медсестрою вдома та активне регулярне відвідування поліклініки, що дозволяє поліпшити якість життя таких пацієнтів і знизити потребу в повторних госпіталізаціях. Співробітництво близьких родичів таких пацієнтів із лікарем щодо контролювання ознак СН і регулярного прийому лікарських засобів у домашніх умовах є одним із ключових моментів їх успішної курації поза стаціонаром.
ЛІТЕРАТУРА
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Даниелян М.О. (2003) Первые результаты национального эпидемиологического исследования — эпидемиологическое обследование больных ХСН в реальной практике (по обращаемости) — ЭПОХА-В-ХСН. Сердечная недостаточность. 4(3): 116–120.
- Воронков Л.Г. (2004) Хронічна серцева недостатність. Четверта хвиля, Київ, 198 с.
- Малая Л.Т., Горб Г.Ю., Рачинский И.Д. (1994) Хроническая недостаточность кровообращения. Здоров’я, Киев, 624 с.
- Стражеско Н.Д. (1955) Избранные труды. Проблемы патофизиологии кровообращения. Изд-во АН УССР, 400 с.
- Яновский Г.В., Устименко Э.В., Семененко О.И., Воронков Л.Г. (2004) Факторы, определяющие выживаемость больных с хронической сердечной недостаточностью. Укр. кардіол. журн., 3: 21–25.
- ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult/Abraham W.T., Chin M.H., Feldman A.M. et al. 2005, American College of Cardiology Foundation and the American Heart Association. 82 p.
- AIRE: The Acute Infarction Ramipril Efficacy (AIRE) study Investigators. Effect of ramipril on mortality and morbidity of survivors in acute myocardial infarction with clinical evidence of heart failure (1993) Lancet, 42: 821–828.
- Amiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomized trials (1997) Lancet, 350: 1417–1424.
- Angeja B., Grossman W. (2003) Evaluation and management of diastolic heart failure. Circulation, 107: 659–663.
- Bardy G.H., Lee K.L., Mark D.B. et al. (2005) Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N. Engl. J. Med., 352: 225–237.
- Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively — designed overviews of randomised trials (2003) Lancet, 362: 1527–1535.
- Bristow M.R., Saxon L.A., Boehmer J. et al. (2004) Cardiac-resynchronization therapy an implantable defibrillator with or without in advanced chronic heart failure. New Engl. Med. J., 350: 2140–2150.
- CIBIS-II Investigators and Committees. The cardiac insuffiency bisoprolol Study II (CIBIS-II) : a randomized trial (1999) Lancet, 353: 9–13.
- Cleland J.G.F., Pennel D.J., Ray S.G. et al. (2003) Оn behalf of the CHRISTMAS (Carvedilol Hibernation Reversibbe Ischaemia Tral: Marker of Success) investigators. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS) trial): randomized controlled trial. Lancet, 362: 1421.
- Cleland J.G.F., Doubert J.C., Freemantle N. et al. (2005) Cardiac Resynchronization-Heart Failure (CARE-HF) Study investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N. Engl. J. Med., 352: 1539–1549.
- Cohn. J.N., Levine B., Olivari M.T. et al. (1984) Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N. Engl. J. Med., 311: 819–823.
- Cohn J.W., Ferrari R., Sharpe N. (2000) Cardiac remodeling — concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. On behalf of the International Forum of Cardiac Remodeling. J. Amer. Coll. Cardiol., 35: 569–582.
- Cohn J.W., Tognoni G. (2001) A randomized trial of the angiotensin receptor blocker valsartan in chronic heart failure. New Engl. J. Med., 345: 1667–1675.
- Cowburn R.L., Cleland J.G.F., Coats L.J.S., Komajda M. (1998) Risk stratification in chronic heart failure. Eur. Heart J., 19: 696–710.
- Cowie M.R., Wood D.A., Coats A.J. (1999) Incidence and aetiology of heart failure: a population — based study. Eur. Heart J., 20: 412–428.
- Cowie M.R., Jourdain P., Maisel A. et al. (2003) Clinical applications of B-type natriuretic peptide (BNP) testing. Eur. Heart J., 24: 1710–1718.
- Dagenais G., Pogue J., Fox K. et al. (2006) Angiotensin-converting-enzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure a combined analysis of three trials. Lancet, 368: 581–588.
- Dickstein K., Cohen-Solal A., Fillipatos G. et al. (2008) ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. Eur. Heart J., 29: 2388–2442.
- Eur. Study Group on Diastolic Heart Failure How to diagnose diastolic heart failure (1998) Eur. Heart J., 19: 990–1003.
- Faris R., Flather M., Purcell H. et al. (2002) Current evidence supporting the role of diuretics in heart failure : a meta analysis of randomized controlled trials. Int. J. Cardiol., 82: 149–158.
- Flather M.D., Jusuf S., Kober L. et al. (2000) Long-term ACE- inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE — Inhibitor Myocardial Infarction Collaborative Group. Lancet, 35: 1575–1581.
- Flather M.D., Shibata M.C., Coats A.J.S. et al. (2005) Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur. Heart J., 26: 215–225.
- Granger C.B., Me Murray J.J.V., Yusuf S. еt al. (2003) Effect of candesartan in patients with chronic heart failure and reduced left ventricular systolic function and intolerant to ACE inhibitors: the CHARM — Alternative Trial. Lancet, 362: 772–777.
- Heart Failure. Contemporary Diagnosis and Management/B.H. Greenberg, D.D. Hermann (Eds) (2003) Handbook in Health Care Co., Pennsylvania, 312 p.
- Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting enzyme inhibitor, ramipril, on death from cardiovascular causes, myocardial infarction, and stroke in high risk patients (2000) New Engl. J. Med., 324: 145–153.
- Heart Failure/Mann D.L. (Ed.) (2004) Philadelphia, 812 p.
- Jong P., Yusuf S., Rousseau M.F. et al. (2003) Effect of enalapril on 12-year survival life expectancy in patients with left ventricular systolic dysfunction: a follow-up study. Lancet, 361: 1843–1846.
- Katz A.M. (2000) Heart Faiture. Patоphysiology, Molecular Biology and Clinical Management. Lippincott Williams and Wilkins, Philadelphia, 381 p.
- Levy D., Larson M.G., Vasan R.S. et al. (1996) The progression from hypertension to congestive heart failure. JAMA, 275: 1557–1562.
- Mс Murray J.J.V., Kendall M.J. (2002) Beta-blockers in Heart Failure. Martin Dunitz, London, 108 p.
- Mс Murray J.J.V., Ostergren J., Swedberg K. et al. (2003) Effects of candesartan in patients with chronic heart failure and reduced left ventricular systolic function treated with ACE inhibitor: the CHARM — Added Trial. Lancet, 362: 767–771.
- MERIT-HF Study Group (1999) Effect of metoprolol CR/XL in chronic heart failure. Metoprolol CR/XR Randomized Intervention Trial in Congestive Heart Failure (MERIT— HF). Lancet, 353: 2001–2007.
- Nieminen M.S. et al. (2005) Execute summary of the guidelines on the diagnosis and treatment of acute heart failure The Task Force on Acute Heart Failure of the European Society of Cardiology. Eur. Heart J., 26: 384–416.
- Packer M., Bristow M.R., Cohn J.N. et al. (1996) The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. New Engl. J. Med., 334: 1349–1355.
- Packer M., Coats A.J.S., Fowler M.В. et al. (2001) For the Carvedilol Prospective Randomise Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. New Engl. J. Med., 344: 1651–1658.
- Pitt B., Zannad F., Remme W. J. et al. (1999) The effect of spironolactone on mortality in patients with severe heart failure//Randomized Aldactone Evaluation Study Investigators. New Engl. J. Med., 341: 709–717.
- Pitt B., Pоole-Wilson P.A., Segal R. et al. (2000) Оn behalf of the ELITE II Investigators. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial — the Losartan Heart Failure Survival Study ELITE II. Lancet, 355: 1582–1587.
- Pitt В., Remme W., Zannad F. et al. (1999) Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. New Engl. J. Med., 348: 1309–1321.
- Pfeffer M.A., Braunwald E., Мeуе L.A. et al. (1992) Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. New Engl. J. Med., 327: 669–677.
- Rose E.A., Gellijns A.C., Moskowitz A.J. (2001) Long-term use of a left ventricular assist device for end-stage heart failure. New Engl. J. Med., 345: 1435–1443.
- Rostagno C, Galanti G., Comeglio M. et al. (2000) Comparison of different methods of functional evaluation patients with heart failure. Eur. J. Heart Failure, 2: 273–280.
- Stewart S., Mac Intyre K., Hole D.Y. (2001) More malignant than cancer? Five — year survival for heart failure. Eur. J. Heart Failure, 3: 315–322.
- Swedberg K., Eneroth P., Kjekshus J., Wilhelms J. (1990) Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. Circulation, 82: 1730–1736.
- Swedberg K., Cleland J., Dargie H. et al. (2005) Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (Update 2005). Eur. Heart J., 26:1115–1140.
- he Digitalis Investigation Group (1997) The effect of digoxin on mortality and morbidity in patients with heart failure. New Engl. J. Med., 336: 525–533.
- The European Trial on Reduction of Cardiac Events with Perindopril in Stable Coronary Artery Disease Investigators (2003) Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet, 362: 782–788.
- TRACE: Torp-Petersen C., Kober L., Carlsen J. (1996) Angiotensin-converting enzyme inhibition after myocardial infarction: the Trandolapril Cardiac Evaluation Study. Amer. Heart J., 132: 235–243.
- Wang T.J., Levy D., Benjamin E.J., Vasan R.S. (2003) The epidemiology of «asymptomatic» left ventricular systolic dysfunction, implications for screening. Ann. Intern., 138: 907–916.
1Існує зворотний зв’язок між активністю реніну плазми крові, концентрацією циркулюючих ангіотензину II, альдостерону й ендотеліну, з одного боку, та тривалістю життя хворих з ХСН — з другого.
2Концентрація норадреналіну в плазмі крові прямо корелює зі ступенем тяжкості ХСН (ФК), ризиком смерті хворих і обернено — з величиною ФВ ЛШ.
3Енергозалежний генетично кодований механізм «самознищення» клітини, який принципово відрізняється від некрозу.
4Рівень циркулюючого ФНП-α у плазмі крові прямо корелює з клінічною вираженістю ХСН і обернено — з тривалістю життя хворого та його ІМТ. Найбільш високий рівень ФНП-α виявляють у пацієнтів з кардіальною кахексією.
5Чутливість — відсоток наявності певної ознаки серед хворих із безсумнівно підтвердженою ХСН.
6Специфічність — відсоток відсутності певної ознаки серед пацієнтів із безсумнівно відсутньою ХСН.
7Визначають як відношення маси тіла (кг) до квадрату зросту (м2).
8Когнітивна функція — психічна здатність особи до засвоєння та обробки інформації.