Екстрасистолія — найпоширеніше порушення серцевого ритму, що може значно впливати на якість життя хворих, бути маркером структурно-функціональних змін міокарда та свідчити про ймовірність виникнення небезпечних для життя аритмій серця. Удосконалення стратегії ведення хворих з екстрасистолічною аритмією, насамперед, пов’язане з розвитком концепції стратифікації ризику, тобто розподілу пацієнтів на групи залежно від ступеня ризику смерті з усіх причин і, зокрема, раптової серцевої смерті. Крім того, активно впроваджуються сучасні інструментальні методи діагностики аритмій серця, перш за все — амбулаторне моніторування ЕКГ. У клінічній практиці існує очевидна потреба у створенні погоджених рекомендацій щодо ведення хворих з екстрасистолією, узагальненні діагностичних і терапевтичних підходів. У цих рекомендаціях розглядають принципи ЕКГ-діагностики екстрасистолії та парасистолії, основні методи обстеження хворих, а також шляхи вибору тактики лікування. Публікація підготовлена на основі сучасних настанов з ЕКГ-діагностики, сучасних погоджених рекомендацій діагностики та лікування аритмій серця і стратифікації ризику.
ЕТІОЛОГІЯ
Появу екстрасистолії можуть викликати будь-які структурні захворювання серця. Особливо часто її виявляють у хворих із гострим ІМ і хронічною ІХС. Втім, екстрасистолія може виникати також при інших ураженнях міокарда, в тому числі субклінічних. У багатьох хворих з екстрасистолією за допомогою доступних інструментальних методів дослідження не знаходять будь-яких ознак ураження серця.
Найчастішими причинами і факторами, асоційованими з екстрасистолією є:
1. Хвороби міокарда, ендокарда і коронарних артерій серця: ІХС, міокардити, міокардіофіброз, кардіоміопатії, вади серця. АГ або гіпотензія, СН, а також порушення коронарного кровообігу також спричиняють появу екстрасистолії.
2. Електролітний дисбаланс (гіпокаліємія, гіперкаліємія, гіпомагніємія, гіпокальціємія), порушення кислотно-лужного балансу.
3. Гіпоксія: захворювання легень, легенева гіповентиляція (наприклад під час проведення операції).
4. Травматичні впливи: травма грудної клітки, операція на серці, катетеризація порожнин серця, травми головного й спинного мозку.
5. Порушення вегетативної регуляції: НЦД, неврози, діенцефаліт, симпатичний гангліоніт і трунцит, психоемоційне напруження.
6. Патологічні рефлекси, зумовлені захворюваннями органів травлення (пептична виразка, жовчнокам’яна хвороба, панкреатит, діафрагмальна грижа, коліт та ентероколіт, особливо якщо вони супроводжуються метеоризмом, закрепом або порушенням електролітного балансу); дистрофічні зміни у шийному і грудному відділах хребта (остеохондроз, спондилоартроз); хвороби бронхів та легень, особливо які супроводжуються виснажливим кашлем; аденома передміхурової залози.
7. Діагностичні процедури: ендоскопія (бронхоскопія, гастроскопія, лапароскопія, цистоскопія, кольпоскопія, ректоскопія), пункція, масаж каротидного синуса, натискання на очні яблука, затримка дихання на глибокому вдиху.
8. Алергія: харчова, медикаментозна, мікробна, професійна, побутова.
9. Фармакодинамічна і токсична дія лікарських засобів, таких як серцеві глікозиди, хінідин, прокаїнамід, засоби для наркозу (особливо циклопропан, фторотан, ефір), морфін, глюкокортикоїди, препарати калію, кальцію, трициклічні антидепресанти (амітриптилін), похідні фенотіазіну, дифрил, фенілбутазон, саліцилати, гідразид ізонікотинової кислоти, атропін, ефедрин, епінефрин, едепіран, орципреналін.
ПАТОГЕНЕЗ
Електрофізіологічні механізми. Основні електрофізіологічні механізми екстрасистолії — re-entrу (зворотний вхід збудження) і постдеполяризація. В основі виникнення екстрасистол можуть лежати також механізми асинхронного відновлення збудливості міокарда і патологічного автоматизму.
Умови формування механізму re-entrу:
а) наявність стійкої замкнутої петлі, довжина якої залежить від периметра незбудливої анатомічної перешкоди, навколо якої рухається імпульс;
б) односпрямована блокада проведення в одному із сегментів петлі re-entrу;
в) ретроградне повернення збудження по раніше заблокованому сегменту до точки вихідної деполяризації, що до цього часу вийшла зі стану рефрактерності.
Рання постдеполяризація виникає при зупинці чи уповільненні реполяризації ПД, що починається при потенціалі спокою 75–90 мВ. Існує два підвиди ранньої постдеполяризації. При першому вона формується при затримці реполяризації у фазі 2-го ПД, тобто на рівні мембранних потенціалів від –3 мВ до –30 мВ; при другому підвиді реполяризація затримується у фазі 3-го ПД, тобто на рівні мембранних потенціалів від –50 до –70 мВ. ПД може змінюватися під впливом таких факторів, як гіперкатехоламінемія, гіпокаліємія, ацидоз, гіпокальціємія, ішемія, дія аконітину, метаболіту прокаїнаміду, соталолу тощо. Під впливом цих факторів посилюється деполяризуючий потік іонів, що входять у клітину (так званий потік Nа+-вікна) у фазі плато з подовженням ПД та одночасним гальмуванням реполяризації у фазі 3. Встановлено також зв’язок ранньої постдеполяризації з електрогенним кальцій-іонообмінним механізмом і, можливо, зі збільшенням входу іонів кальцію, що підтверджується можливістю пригнічення верапамілом коливань потенціалу у фазах 2 і 3 ПД.
Пізня постдеполяризація — електричні осциляції в фазі 4 ПД, яким зазвичай передує гіперполяризація клітинної мембрани. Якщо амплітуда цих осциляцій збільшується і досягає порогу збудження, виникає наведений імпульс — новий передчасний ПД. Збільшення амплітуди затриманої постдеполяризації виникає при підвищенні концентрації іонів кальцію у клітинах. Затримана постдеполяризація стимулюється прискоренням серцевого ритму. Такий феномен можна виявити при синусовій тахікардії у пацієнтів з ІХС, ГЛШ, кардіоміопатією.
ОБСТЕЖЕННЯ ХВОРИХ
Обстеження хворих з екстрасистолічною аритмією повинно включати методи, що забезпечують діагностику порушень серцевого ритму, визначення клінічного і прогностичного значення аритмії, вибір лікування та оцінку його ефективності.
Анамнез. При опитуванні хворого з’ясовують таку інформацію:
1. Суб’єктивні прояви аритмії (серцебиття, перебої в роботі серця, поштовхи або «завмирання» серця, дискомфорт у грудях, відчуття нестачі повітря, задишка, запаморочення, синкопальні стани), тривалість існування порушень ритму.
2. Наявність факторів, що провокують аритмію (фізичне навантаження, психоемоційний стрес, певний час доби, положення тіла, прийом їжі, алкоголь, тютюнопаління).
3. Перенесені за останній час захворювання.
4. Фонова кардіальна патологія.
5. Попередній прийом антиаритмічних препаратів (яких саме, їх разові й добові дози, тривалість прийому, ефективність, побічні явища).
Клінічне обстеження. Виявлення аритмій при аускультації серця чи при пальпації периферичних артерій. Наявність клінічних ознак СН.
Лабораторні методи дослідження. Визначення вмісту калію, натрію, креатиніну в сироватці крові, активності тиреотропного гормону.
ІНСТРУМЕНТАЛЬНІ МЕТОДИ — ЕКГ-ДІАГНОСТИКА ЕКСТРАСИСТОЛІЇ
Екстрасистоли — передчасні комплекси, що зазвичай мають фіксований інтервал зчеплення з попереднім імпульсом базисного ритму. За локалізацією розрізняють суправентрикулярні (синусові, передсердні, з АV-з’єднання) і шлуночкові екстрасистоли.
Синусові екстрасистоли та екстрасистоли з АV-з’єднання виявляють рідко, відповідно у 0,2 і 2% випадків. Значно частіше, за даними М.С. Кушаковского (1992), реєструють передсердні (25%) і шлуночкові (62,6%) екстрасистоли. Синусові екстрасистоли характеризуються незмінною формою зубця Р та відсутністю компенсаторної паузи. Точно діагностувати синусову екстрасистолію можна лише за допомогою інвазивного ЕКГ-обстеження.
Передсердні екстрасистоли ідентифікують за двома основними ознаками: передчасним (щодо основного ритму), зміненим за формою і/чи полярністю зубцем Р, а також дещо збільшеною порівняно зі звичайним серцевим циклом постекстрасистолічною паузою. Частіше відзначають нижньопередсердні екстрасистоли з негативним зубцем Р перед комплексом QRS у відведеннях II, III, аVF (рис. 1.1). При лівонижньопередсердних екстрасистолах негативний зубець Р реєструють також у відведеннях I, аVL, V5–V6, а у відведенні V1 іноді екстрасистолічний зубець Р має двогорбу форму («щит і меч» або «купол і шпиль»). Інтервал P–Q передсердних екстрасистол може бути вкорочений — до 0,09 с, нормальної тривалості чи подовжений (>0,20 с), що залежить від місця виникнення та умов АV-проведення ектопічного імпульсу.
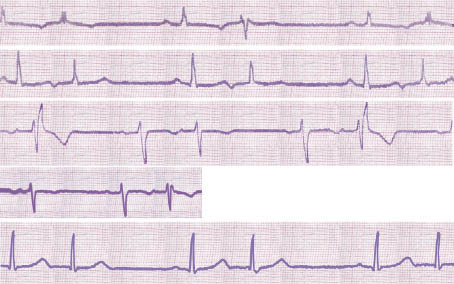
Рис. 1.1. Часта поодинока, нижньопередсердна екстрасистолія з періодами бігемінії та аберантним проведенням за типом блокади передньої гілки лівої ніжки пучка Гіса. Феномен Ашмана: аберантні комплекси реєструють лише після більш тривалих серцевих циклів
Комплекс QRS передсердної екстрасистоли іноді має аберантну (змінену) форму внаслідок функціональної внутрішньошлуночкової блокади, що виникає при проведенні передчасного імпульсу (рис. 1.1–1.2). Такі екстрасистоли необхідно диференціювати із шлуночковими екстрасистолами, особливо якщо ектопічний зубець Р нашаровується на зубець Т попереднього комплексу, який при цьому дещо деформується. Аберантні комплекси QRS суправентрикулярних екстрасистол найчастіше мають вигляд неповної чи повної блокади правої ніжки пучка Гіса і трифазну форму у відведеннях V1 (rSr’ або rSR’) і V6 (QRS). Іноді вони можуть мати форму інших порушень внутрішньошлуночкової провідності (див. рис. 1.1). Імовірність виникнення аберантного шлуночкового комплексу підвищується при ранніх передсердних екстрасистолах (при інтервалі зчеплення <44% попереднього Р–Р) і екстрасистолах, що виникають при низькій частоті базисного ритму або коли передектопічному інтервалу передує подовжений R–R (феномен Ашмана) (див. рис. 1.1).
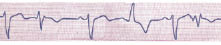
Рис. 1.2. Передсердні екстрасистоли з аберантним проведенням (2-й, 6-й комплекси) і шлуночкова екстрасистола (4-й комплекс). Зменшення інтервалу зчеплення екстрасистоли асоціюється з вищим ступенем аберації
Блокована передсердна екстрасистола (передчасне збудження передсердь без подальшого збудження шлуночків) виникає внаслідок блокади ектопічного імпульсу в АV-з’єднанні, що перебуває у стані абсолютної рефрактерності. Глибоке проникнення екстрасистолічного імпульсу в ділянку АV-з’єднання може призводити до подовження інтервалу P–Q у наступних комплексах, появи періодики Венкебаха і навіть виникнення короткочасної субтотальної чи повної АV-блокади (рис. 1.3). Блокована передсердна екстрасистолія може імітувати синоатріальну блокаду чи синусову брадикардію (блокована передсердна бігемінія) у тих випадках, коли екстрасистолічний зубець Р нашаровується на зубець Т попереднього комплексу.
Екстрасистоли з АV-з’єднання поділяють на такі ЕКГ-варіанти:
а) з одночасним збудженням передсердь і шлуночків;
б) з попереднім збудженням шлуночків;
в) з вентрикуло-атріальною блокадою I ступеня;
г) приховані екстрасистоли.
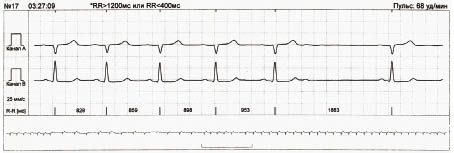
Рис. 1.3. Блокована передсердна екстрасистола (6-й зубець Р)
При екстрасистолії з АV-з’єднання імпульс одночасно поширюється вгору до передсердь (ретроградно) і вниз (антероградно) до шлуночків. Співвідношення швидкості ретроградного і антероградного проведення визначає ЕКГ-картину АV-екстрасистолії. При АV-екстрасистолії з одночасним збудженням передсердь і шлуночків на ЕКГ зазвичай реєструють передчасний комплекс QRS суправентрикулярної форми; зубець Р’ на поверхневій ЕКГ непомітний, але його можна ідентифікувати іншими методами (посилена, черезстравохідна чи внутрішньопередсердна електрограми). Для екстрасистол з АV-з’єднання з попереднім порушенням шлуночків характерна реєстрація на ЕКГ передчасного комплексу QRS, частіше суправентрикулярної форми, на сегменті ST або зубці Т якого розміщений негативний (у відведеннях II, III, аVF) зубець Р’.
Якщо в АV-екстрасистолі інтервал R–Р’ триває >0,20 с, то говорять про сповільнення ретроградного проведення, що може бути провісником виникнення реципрокних імпульсів і ритмів. У разі повної ретроградної блокади екстрасистолічного імпульсу можлива поява вставної екстрасистоли з АV-з’єднання чи реєстрація екстрасистоли з повною компенсаторною паузою (вузлові екстрасистоли). Для екстрасистол з АV-з’єднання вважається типовою суправентрикулярна форма комплексу QRS, але він може мати також аберантний вид, частіше за типом блокади правої ніжки пучка Гіса (повної чи неповної), що ускладнює диференційну діагностику аберантних АV-екстрасистол із шлуночковими. Імпульс АV-екстрасистоли може блокуватися одночасно в антеро- та ретроградному напрямку — приховані АV-екстрасистоли. Ці екстрасистоли не реєструють на ЕКГ, але вони імітують різні форми порушення АV-провідності: АV-блокаду I ступеня, що з’являється періодично; чергування нормальних і подовжених інтервалів P–Q при прихованій АV-тригемінії; АV-блокаду II ступеня 1-го типу, II ступеня 2-го типу (блокада псевдо-Мобітц I) або II ступеня з проведенням 2:1. Наявність прихованої АV-екстрасистолії можна припустити у разі чергування на ЕКГ порушень АV-провідності та реалізованих в антероградному напрямку АV-екстрасистол. У цих випадках внутрішньосерцеве електрофізіологічне дослідження дозволяє виявити приховані АV-екстрасистоли чи виявити іншу причину порушення провідності.
Основні ЕКГ-ознаки шлуночкових екстрасистол:
1) передчасна поява розширеного та деформованого відносно основного ритму комплексу QRS без попереднього зубця Р, крім пізніх екстрасистол, перед якими реєструються зубці Р, що не мають електрофізіологічного зв’язку із шлуночковими екстрасистолами;
2) найчастіше — наявність повної компенсаторної паузи.
Форма шлуночкових екстрасистол залежить не лише від локалізації джерела екстрасистолії, але й від швидкості та шляху поширення імпульсу в шлуночках. Тому ЕКГ дає можливість орієнтовно встановити розташування ектопічного вогнища за морфологією екстрасистолічного комплексу. Якщо шлуночкова екстрасистола має вигляд блокади правої ніжки і лівої передньої гілки пучка Гіса, джерело її перебуває в системі лівої задньої гілки пучка Гіса, тобто в задній стінці ЛШ; якщо шлуночкова екстрасистола має вигляд блокади правої ніжки і задньої нижньої гілки пучка Гіса, джерело її перебуває у лівій передній гілці пучка Гіса; якщо шлуночкова екстрасистола має вигляд повної блокади лівої ніжки пучка Гіса, джерело її перебуває у правій ніжці пучка Гіса.
Комплекс QRS лівошлуночкової екстрасистоли у правих грудних відведеннях має моно- чи біфазну форму: R, q, RR’, RS, Rs; а в лівих — rS або QS. Комплекс QRS правошлуночкової екстрасистоли у правих грудних відведеннях має форму r або QS, а в лівих — R (табл. 1.1). Якщо шлуночкова екстрасистола виникає в ділянці міжшлуночкової перегородки, зазвичай тривалість і форма її незначно відрізняються від комплексу QRS основного ритму. Форма QRS типу rSR’ у відведенні V1 характерна для екстрасистоли з лівої половини міжшлуночкової перегородки, а тип R або q у відведенні V6 — для екстрасистол із правої половини перегородки. Спрямованість комплексу QRS екстрасистолічного комплексу у всіх грудних відведеннях вгору дозволяє припустити локалізацію джерела шлуночкової екстрасистоли в базальних відділах серця, а спрямованість комплексу QRS вниз — у ділянці верхівки (див. табл. 1.1). У складних для топічної діагностики випадках точне джерело екстрасистоли не вказують, обмежуючись висновком про наявність шлуночкових екстрасистол.
Інтервали зчеплення монотопних шлуночкових екстрасистол однакові, незважаючи на те що форма їх може бути різною (у цьому разі вони є поліморфними). Коливання інтервалів зчеплення монотопних екстрасистол зазвичай не перевищує 0,06–0,10 с. Політопні шлуночкові екстрасистоли мають різні за тривалістю інтервали зчеплення й, як правило, різну форму комплексів QRS. Дві екстрасистоли підряд називаються парними (рис. 1.4), а 3–5 — груповими, «залповими» (рис. 1.5), або пробіжками шлуночкової тахікардії. Виділяють також ранні та дуже ранні шлуночкові екстрасистоли (R на Т) (рис. 1.6). Екстрасистолія може бути нерегулярною (монотопна чи політопна), а поява її з певною закономірністю визначається як алоритмія (бігемінія, тригемінія, квадригемінія тощо).
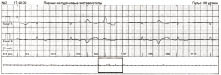
Рис. 1.4. Поодинока і парна політопна шлуночкова екстрасистолія
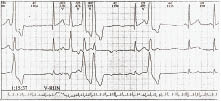
Рис. 1.5. Групові політопні шлуночкові екстрасистоли

Рис. 1.6. Рання шлуночкова екстрасистола R на Т
Інтерпольовані передсердні або шлуночкові екстрасистоли реєструють між двома нормальними комплексами QRS, зазвичай на фоні брадикардії (рис. 1.7).
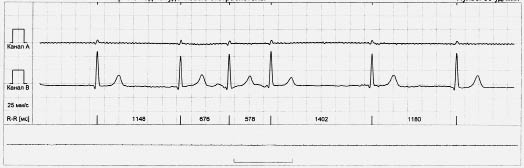
Рис. 1.7. Інтерпольована передсердна екстрасистола
Шлуночкову екстрасистолію на фоні фібриляції передсердь необхідно диференціювати з аберантними шлуночковими комплексами. Укорочений кардіоцикл при фібриляції передсердь, що закінчується аберантним шлуночковим комплексом, на відміну від передекстрасистолічного інтервалу, не супроводжується компенсаторною паузою і йому передує подовжений інтервал R–R. Аберантні комплекси QRS, як правило, мають форму блокади правої ніжки пучка Гіса різного ступеня вираженості у відведенні V1 (rSR’, rSr’), а лівошлуночкові екстрасистоли — форму R, RS, Rs, q, RR’ або Rr’ (табл. 1.2).
Екстрасистолія нерідко супроводжується різними змінами хроно- і дромотропної функцій серця (постекстрасистолічні феномени). Серед них найчастіше відзначають неспецифічні зміни зубця Т, зворотні (реципрокні) імпульси, збільшення тривалості серцевого циклу більше ніж на 0,3 с, а також АV-блокада I ступеня. Не частіше ніж у 1% випадків визначають постекстрасистолічну АV-дисоціацію, АV-блокаду II ступеня (рис. 1.8), активацію передсердного або АV-ритму, зникнення блокади ніжки пучка Гіса, зникнення чи появу феномену преекзитації, зникнення чи появу пароксизмальної АV- вузлової реципрокної тахікардії, зміни сегмента ST.
ІНСТРУМЕНТАЛЬНІ МЕТОДИ — ЕКГ-ДІАГНОСТИКА ПАРАСИСТОЛІЇ
Парасистолія — автономна активність ектопічного центру, що не залежить від основного серцевого ритму і співіснує з ним. Подвійне ритмоутворення стає можливим завдяки захисту парацентру від розрядки більш частими імпульсами основного ритму, зазвичай — синоатріального вузла (так звана блокада входу чи захисна блокада). Проте внаслідок блокади виходу не всі імпульси парацентру викликають порушення міокарда. Парацентр — це група уражених клітин, здатних до спонтанної діастолічної деполяризації. Клітини, розміщені навколо ядра парацентру, настільки гіпополяризовані, що створюють умови для виникнення одно- чи двонаправленої блокади.
За локалізацією парацентру розрізняють парасистолії: шлуночкові, з АV-з’єднання, передсердні, синусові, з додаткових передсердно-шлуночкових шляхів, об’єднані (з різних відділів провідної системи серця) і дубльовані чи множинні (з тієї ж камери серця). Виділяють такі ЕКГ-варіанти парасистолічних ритмів: брадикардична парасистолія з блокадою входу, тахікардична парасистолія із блокадою виходу, інтермітуюча парасистолія, перехідна між екстра- і парасистолією (атипова) форма множинної парасистолії (з декількох камер серця), штучна парасистолія (на фоні штучного водія ритму).
Характерні ознаки парасистолії (рис. 1.9):
1. Коливання передектопічних інтервалів мономорфних комплексів QRST або PQRST, що не перевищують у спокої 80–100 мс.
2. Правило кратності: довжина міжектопічних інтервалів кратна найбільш короткому інтервалу між двома послідовними парасистолами, що відображає автоматизм парацентру. Проте нерідко відзначають відхилення від цього правила, зумовлені помірними коливаннями автоматизму парацентру та порушеннями провідності в міокарді, що оточує парацентр.
3. Зливні комплекси, що вказують на те, що частина міокарда збуджується синусовим, а інша його частина — парасистолічним імпульсом. При шлуночковій парасистолії реєструють зливні комплекси QRS, а при суправентрикулярній — зливні зубці Р.
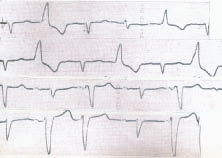
Рис. 1.9. Шлуночкова парасистолія, брадикардитична форма парасистолічного алгоритму: коливання передектопічного інтервалу, фіксований міжектопічний інтервал, зливні комплекси QRS (4-й і 6-й III відведення)
Найчастіше виявляють безперервну брадикардитичну (<60 імпульсів/хв) шлуночкову парасистолію. Зазвичай автоматизм парацентру нижчий від автоматизму синусного вузла. Імпульси з парацентру викликають збудження міокарда шлуночків у тому разі, якщо вони потрапляють у нерефрактерну фазу. При відсутності розрядки синусного вузла після шлуночкової парасистолії, як правило, відзначають компенсаторну паузу. Якщо парасистола проводиться ретроградно на передсердя, то за парасистолічним комплексом QRS виявляють негативний зубець Р у II, III, аVF-відведеннях і неповну компенсаторну паузу.
Безперервна тахікардитична шлуночкова парасистолія з блокадою виходу — рідший варіант парасистолії, при якому парацентр генерує імпульси частіше, ніж основний водій ритму. Блокада виходу II ступеня 1-го типу проявляється періодикою Венкебаха міжектопічних інтервалів. Вони стають прогресивно коротшими і закінчуються тривалою паузою, меншою від подвоєного найкоротшого інтервалу між парасистолами.
Для блокади виходу II ступеня 2-го типу характерна відсутність чергової парасистоли або кількох підряд, причому інтервал між парасистолами кратний найкоротшому інтервалу між ними. При зникненні блокади виходу виникає парасистолічна тахікардія (з частотою >100 імпульсів/хв) або прискорений парасистолічний ритм (з частотою <100 імпульсів/хв).
Інтермітуючу шлуночкову парасистолію відзначають при непостійній активності парацентру. В основі цієї форми парасистолії лежить справжня, більш-менш тривала зупинка парацентру з подальшим відновленням його активності. Інтермітування виникає при тимчасовому зникненні блокади входу і розрядці парацентру.
Парасистолію з ділянки АV-з’єднання частіше відзначають у двох варіантах: з одночасним збудженням передсердь і шлуночків або з попереднім збудженням шлуночків. В останньому випадку зубці Р’ інвертовані у відведеннях II, III, aVF і можуть формуватися зливні зубці Р. Передсердну парасистолію найчастіше виявляють у брадикардитичній формі. Ектопічні зубці Р відрізняються формою, а іноді полярністю від синусових. При передсердній парасистолії також можуть формуватися зливні зубці Р. Парасистолія з фіксованим передектопічним інтервалом — атипова форма парасистолії. Ця ситуація виникає при збігу автоматизму незалежних водіїв ритму або внаслідок барорецепторного рефлексу із синокаротидних зон. При виконанні хворим фізичного навантаження або після атропінової проби відбувається відновлення зміненого передектопічного інтервалу.
ІНШІ МЕТОДИ ІНСТРУМЕНТАЛЬНОЇ ДІАГНОСТИКИ
Ритмографія — реєстрація тривалості інтервалів R–R у вигляді вертикальних штрихів на паперовій стрічці при швидкості її руху 10 мм/с, що дозволяє провести кількісну характеристику екстрасистолії у спокої та при функціональних пробах; виявити наявну і приховану алоритмію, пароксизмальний характер екстрасистолії, визначити коливання інтервалів зчеплення; чітко розпізнати парасистолію; оцінити стан вегетативної регуляції серцевого ритму. Домінування на ритмограмі дихальних хвиль (коливання тривалості серцевих циклів з періодом 3–7 с) свідчить про перевагу парасимпатичного тонічного впливу на серце. Відсутність дихальної аритмії і домінування повільних хвиль серцевого ритму (коливання тривалості серцевих циклів з періодами >10 с) вказує на посилення симпатичного тонусу на фоні зниження парасимпатичних впливів.
Визначення вихідного вегетативного тонусу доцільно проводити у хворих з екстрасистолією з двох причин: по-перше, у багатьох пацієнтів відзначають різні варіанти порушень вегетативної регуляції, по-друге, більшість відомих антиаритмічних препаратів можуть цілеспрямовано змінювати функціональний стан симпатичного та парасимпатичного відділів вегетативної нервової системи, що може потенціювати або знижувати антиаритмічну дію лікарських засобів. Більш точні дані про стан вегетативної регуляції можна одержати при оцінці варіабельності ритму серця методом добового моніторування ЕКГ.
Холтерівське моніторування ЕКГ дозволяє реєструвати ЕКГ без обмеження рухового режиму хворого протягом ≥24 год з подальшим автоматизованим аналізом запису. Оцінюють загальну кількість екстрасистол за час спостереження, їх розподіл протягом доби, зв’язок із фізичними чи емоційними навантаженнями, ЧСС, прийомом їжі, зміною положення тіла, минущими епізодами ішемії міокарда.
Холтерівське моніторування ЕКГ — еталонний метод діагностики щодо нечастої екстрасистолії, а також оцінки тяжкості передчасних шлуночкових або надшлуночкових скорочень, виявлених під час реєстрації ЕКГ. Холтерівське моніторування ЕКГ дозволяє точніше, ніж короткочасна реєстрація ЕКГ, здійснювати якісну та кількісну оцінку порушень серцевого ритму внаслідок значно більшої кількості оцінюваних ектопічних комплексів. Поодинокі суправентрикулярні або шлуночкові екстрасистоли — досить часта знахідка при холтерівському моніторуванні ЕКГ у практично здорових осіб.
Для виявлення екстрасистол при автоматичній обробці сигналу ЕКГ використовують коефіцієнт передчасності — відношення різниці між базовим інтервалом R–R (RRn) і передекстрасистолічним інтервалом R–R (RRex) до базового інтервалу R–R (рис. 1.10).
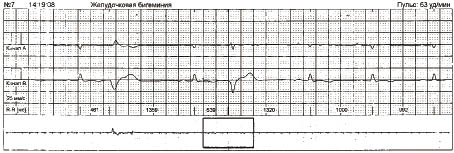
Рис. 1.10. Визначення коефіцієнта передчасності
Скорочення розцінюється як передчасне, якщо цей показник >20%.
Порівняння циркадних змін кількості екстрасистол і ЧСС дозволяє відрізняти тахі- і брадизалежні форми екстрасистолії. Одним із найпоширеніших добових типів розподілу екстрасистолії є вагусний (вагозалежний або нічний), коли передчасні комплекси реєструють більше ніж у 1,5 раза частіше в пасивний період доби на фоні сповільнення синусового ритму. Вагозалежну шлуночкову екстрасистолію частіше виявляють у людей молодого віку без ознак патології серця, нерідко випадково, пацієнти її не відчувають. Така форма екстрасистолії переважно не має потреби в антиаритмічній терапії. При адренергічному (симпатозалежному чи денному типі) середня кількість екстрасистол за годину в 1,5 раза більша в активний період доби, а екстрасистоли часто пов’язані з прискоренням синусового ритму. Адренергічний тип шлуночкової екстрасистолії більш характерний для людей похилого віку, особливо з ІХС, АГ, вадами серця, ДКМП і ГКМП, міокардіофіброзом. На відміну від вагусного типу така екстрасистолія не є доброякісною, нерідко при цьому захворюванні необхідне призначення антиаритмічних препаратів. Дуже часто немає зв’язку між кількістю екстрасистол, періодом доби та ЧСС. Можуть також відзначати гектичний тип розподілу екстрасистол зі значним коливанням їх кількості в різний час. Така висока ектопічна активність протягом короткого періоду іноді може бути пов’язана з рецидивною ішемією міокарда. Загалом застосування холтерівського моніторування ЕКГ істотно підвищує можливість виявлення екстрасистолії та парасистолії, залежність від часу доби, уточнення її форм і варіантів.
Метод холтерівського моніторування ЕКГ дозволяє оцінювати зміни варіабельності серцевого ритму протягом доби. Зокрема, зниження стандартного показника варіабельності серцевого ритму — стандартного відхилення інтервалів R–R протягом доби (SDNN) <50 мс свідчить про дисбаланс вегетативної регуляції серцевого ритму і є одним із предикторів виникнення раптової судинної смерті у хворих із постінфарктним кардіосклерозом, систолічною дисфункцією ЛШ і СН і збереженим синусовим ритмом. Найбільш потужним провісником ризику виникнення життєво небезпечної аритмії було поєднання низької варіабельності серцевого ритму зі зниженою ФВ ЛШ і порушеною чутливістю барорефлексу (дослідження ATRAMI, 1998). Підкреслимо, що часта шлуночкова екстрасистолія — обмеження для оцінки тимчасових і спектральних показників варіабельності серцевого ритму.
При холтерівському моніторуванні ЕКГ звертають увагу також на тривалість і варіабельність інтервалу зчеплення, а також тривалість інтервалу Q–T. Важлива оцінка добових коливань коригованого інтервалу Q–T, навіть при його незначному збільшенні може збільшуватися тривалість чутливого періоду серцевого циклу та схильність до виникнення пароксизмів пірует-тахікардії.
Повторне холтерівське моніторування ЕКГ на фоні лікування дозволяє оцінити ефективність призначеної терапії. З урахуванням виражених спонтанних коливань частоти виникнення аритмій серця розроблені критерії ефективності антиаритмічної терапії у хворих із шлуночковими аритміями:
а) зменшення загальної кількості шлуночкових екстрасистол за 1 добу на >50–75%;
б) зменшення кількості парних і ранніх шлуночкових екстрасистол на ≥90%;
в) повне усунення епізодів шлуночкової тахікардії;
г) при поліморфній шлуночковій екстрасистолії — зменшення кількості морфологічних типів екстрасистол до 1–2.
Про аритмогенну дію антиаритмічного препарату свідчать:
- збільшення загальної кількості екстрасистол у 3–4 рази;
- збільшення кількості парних шлуночкових екстрасистол та епізодів нестійкої шлуночкової тахікардії протягом 1 доби в 10 разів;
- поява раніше не документованої стійкої шлуночкової тахікардії.
Оцінюючи адекватність лікування антиаритмічним препаратом, крім наведених критеріїв, необхідно також враховувати особливості його впливу на синусовий ритм, провідність, частоту ішемічних епізодів.
Інтерпретація даних холтерівського моніторування ЕКГ при оцінці ефективності антиаритмічної терапії має певні обмеження. При застосуванні антиаритмічних препаратів 1-го класу за класифікацією V. Williams оцінка ефективності за зазначеними кількісними критеріями не дозволяє передбачити поліпшення прогнозу виживаності хворих при тривалому лікуванні. Більше того, використання деяких препаратів (флекаїніду, енкаїніду) у контрольованих дослідженнях асоціювалося зі значним підвищенням імовірності раптової судинної смерті. З огляду на це у пацієнтів із тяжким структурним ураженням міокарда (дисфункція ЛШ після перенесеного ІМ або при ДКМП, з/без СН) лікування починають із проведення терапії етіопатогенетичної спрямованості: коригують ішемію та гемодинамічні порушення. За наявності дисфункції ЛШ і частих симптомних шлуночкових екстрасистолій до базисної превентивної терапії (інгібітори АПФ, блокатори β-адренорецепторів, ацетилсаліцилова кислота, статини) додають аміодарон або соталол — засоби з доведеною ефективністю у профілактиці злоякісних шлуночкових аритмій. Слід зазначити, що блокатори β-адренорецепторів і аміодарон можуть призначати емпірично, з урахуванням доведеної здатності цих препаратів поліпшувати прогноз виживаності хворих і незалежно від зміни кількості порушень серцевого ритму. У цьому разі холтерівське моніторування ЕКГ доцільно проводити в динаміці для оцінки перебігу порушень серцевого ритму на фоні антиаритмічної терапії. А в ситуаціях, коли застосування антиаритмічних препаратів викликано перш за все клінічною значимістю порушень ритму, а не їх прогностичним значенням, визначальним критерієм ефективності препарату є зменшення вираженості симптомів, зумовлених аритмією. Відзначимо також, що найбільш ефективним засобом профілактики раптової серцевої смерті у пацієнтів із критеріями її високого ризику є імплантація внутрішнього кардіовертера-дефібрилятора.
Проби з фізичним навантаженням (проба Майстра, степ-тест, ВЕМ, тредміл-тест) можуть провокувати появу екстрасистолічної аритмії під час навантаження та у ранній відновлювальний період внаслідок підвищення активності САС, збільшення викиду катехоламінів, розвитку тканинної гіпоксії, ацидозу. У пацієнтів із хронічною ІХС під час проведення ВЕМ шлуночкові екстрасистоли виявляють у 60% обстежених, а їх частота нерідко корелює зі зміщенням сегмента ST. Під впливом фізичного навантаження можуть змінитися кількість і градація екстрасистолії: збільшення кількості екстрасистол під час навантаження при високій ЧСС або в першу хвилину після її припинення свідчить про можливий її зв’язок з ІХС; доброякісні екстрасистоли, як правило, зникають під час навантаження і відновлюються через 3–5 хв після її закінчення. Слід враховувати діагностичне обмеження проби з навантаженням: у частини хворих не вдається спровокувати екстрасистолію, діагностовану раніше; у 11–40% пацієнтів зі здоровим серцем при фізичному навантаженні може з’явитися поодинока екстрасистолія, а у 5% — парна; у деяких хворих при фізичному навантаженні можуть зникати навіть групові й ранні екстрасистоли.
Ортостатична проба дозволяє уточнити характер екстрасистолічної аритмії: стабільна екстрасистолія існує у спокої та при функціональних пробах; лабільна екстрасистолія напруження з’являється чи посилюється при ортостатичній пробі і стандартному навантаженню потужністю 50 Вт; лабільна екстрасистолія спокою зникає при ортостатичній пробі та фізичному навантаженні потужністю 50 Вт і з’являється після переходу в горизонтальне положення. Вважається, що лабільна екстрасистолія напруження і стабільна екстрасистолія найбільш імовірно пов’язані з наявністю захворювання серця і/або стійкого субстрату аритмії, а лабільна екстрасистолія спокою, як правило, — функціональна (вагусна).
Для уточнення зв’язку екстрасистолічної аритмії з впливом симпатичного та парасимпатичного відділів вегетативної нервової системи проводять також деякі фармакологічні проби.
Проба з атропіном дозволяє виявити вплив вагуса на характер екстрасистолії. Після запису вихідної ЕКГ внутрішньовенно вводять атропіну сульфат в дозі 0,02 мг/кг маси тіла з постійною реєстрацією ЕКГ на фоні дії препарату. У перші 15–30 с після введення препарату проявляється холіноміметична фаза дії, а потім починається холінолітична. При вираженій ваготонії ЧСС зростає до ≥40%, а кількість екстрасистол зменшується або вони зникають.
Пробу із пропранололом проводять для уточнення впливу симпатичного відділу вегетативної нервової системи на характер екстрасистолії. Після запису вихідної ЕКГ препарат вводять внутрішньовенно в дозі 0,1 мг/кг маси тіла (але не більше 10 мг) з постійною реєстрацією ЕКГ на фоні дії препарату. Зміна характеру екстрасистолії може бути оцінена також після перорального прийому пропранолола в дозі 1 мг/кг та реєстрації ЕКГ через 60; 90 і 120 хв.
Пробу з ізопреналіном застосовують для провокації ектопічної активності міокарда шлуночків і/чи передсердь. Хворому під ЕКГ-контролем внутрішньовенно крапельно вводять ізопреналін 0,5 мг у 200,0 мл фізіологічного розчину зі швидкістю 30–40 крапель/хв до виникнення ектопічної активності міокарда чи досягнення субмаксимальної ЧСС. Пробу використовують також для оцінки індивідуальної ефективності антиаритмічних препаратів. З цією метою на очікуваному максимумі дії антиаритмічного препарату повторно внутрішньовенно в тій же дозі вводять ізопреналін. Препарат, на очікуваному максимумі дії якого не вдається спровокувати ектопічну активність міокарда, вважається ефективним. За відсутності антиаритмічного ефекту пробу повторюють з іншим препаратом. Необхідно враховувати те, що підвищення ЧСС при введенні ізопреналіну може призводити до пригнічення ектопічної активності міокарда. У цьому разі не вдається виявити джерело аритмії. Крім того, дія ізопреналіну припиняється лише через 30–40 хв після закінчення введення, що може призводити до стійкої шлуночкової тахіаритмії, а також до нестабільності гемодинаміки пацієнта. З огляду на це для провокації аритмії краще використовувати добутамінову пробу.
Добутамінова проба. Добутамін — селективний стимулятор β1-адренорецепторів, дія якого припиняється через 3 хв після закінчення введення. Хворому під контролем ЕКГ і АТ вводять внутрішньовенно крапельно добутамін у дозі 250 мг в 250 мл 5% розчину глюкози до виникнення ектопічної активності міокарда. У разі провокування аритмії введення добутаміну припиняють. Пробу використовують також для підбору ефективного антиаритмічного препарату, аналогічно до проби з ізопреналіном. У сучасній кардіологічній клініці поширений метод стрес-ехоКГ з добутаміном, що дозволяє оцінити життєздатність міокарда у пацієнтів із ІХС при вирішенні питання про хірургічну або ендоваскулярну реваскуляризацію коронарних артерій.
Реєстрація ППШ спрямована на виявлення елементів електрокардіосигналу, що виникає під час систоли шлуночків, — прояв їх тригерної активності. Для реєстрації ППШ використовують біполярні ортогональні відведення X, Y, Z за Франко з посиленням, усередненням і фільтрацією комплексу QRS і подальшою комп’ютерною обробкою даних. ППШ за методикою M.B. Simson (1981) визначають у діапазоні 40–250 Гц при амплітуді сигналу до 40 мкВ за 40–60 мс до закінчення комплексу QRS.
Прогностично несприятливе виявлення ППШ у хворих із низькою ФВ ЛШ і пароксизмами шлуночкової тахікардії. Імовірність виникнення епізодів аритмії у цих пацієнтів у 10 разів вища, ніж у хворих із низькою ФВ без ППШ.
ЕхоКГ проводять для уточнення впливу як екстрасистолії, так і антиаритмічних препаратів на стан гемодинаміки. Метод дозволяє оцінити розміри камер серця в систолу та діастолу, ФВ, товщину стінок серця, масу міокарда ЛШ, співвідношення КДО і маси міокарда ЛШ, виявити зони гіпо- та акінезії, локальної гіпертрофії, клапанні дефекти, феномен постекстрасистолічного посилення, дисплазію міокарда ПШ. Зменшення ФВ ЛШ <40% у хворих із коронарною недостатністю асоціюється з підвищенням ризику раптової судинної смерті. Серцевий викид можна точніше визначити за допомогою радіоізотопної вентрикулографії чи коронаровентрикулографії.
Черезстравохідну електрограму (електрофізіологічне дослідження) реєструють із метою визначення характеру порушення передсердь, що дозволяє диференціювати шлуночкову і передсердну аберантну екстрасистолію, виявити блоковані передсердні екстрасистоли, не ідентифіковані на ЕКГ, а також вентрикулоатріальне проведення імпульсів. З огляду на важливу роль дисфункції синусного вузла та провідної системи серця у виникненні аритмій може з’явитися необхідність у проведенні електрофізіологічного обстеження. При проведенні черезстравохідного електрофізіологічного дослідження у хворих з екстрасистолією оцінюють функцію синусного вузла, стан АV- проведення, наявність додаткових шляхів проведення, точку екстрасистолії (мінімальна частота стимуляції, при якій екстрасистолія припиняється).
Внутрішньосерцеве електрофізіологічне дослідження — сучасний метод діагностики порушень ритму і провідності серця, визначення показань для кардіостимуляції, радіочастотної катетерної абляції та імплантації кардіовертера-дефібрилятора. Дослідження виконують у спеціально обладнаних лабораторіях. У хворих з екстрасистолією абсолютних показань для проведення внутрішньосерцевого електрофізіологічного дослідження немає. Це дослідження може бути здійснене лише за необхідності встановлення зв’язку порушень ритму серця з синкопальними та передсинкопальними станами. Хворим із безсимптомним перебігом екстрасистолії електрофізіологічне обстеження не показане.
КЛІНІЧНЕ ТА ПРОГНОСТИЧНЕ ЗНАЧЕННЯ
ЕКСТРАСИСТОЛІЇ ТА ПАРАСИСТОЛІЇ
Клінічне значення екстрасистолії в основному визначається її типом і градацією, наявністю симптомів, характером основного захворювання, ступенем ураження серця та функціональним станом міокарда. Часта політопна суправентрикулярна екстрасистолія на фоні синусової тахікардії, як правило, зумовлена структурним ураженням серця і може спровокувати виникнення тахіаритмії. Часта передсердна екстрасистолія — провісник виникнення згодом фібриляції передсердь. Наявність нечастої надшлуночкової екстрасистолії у осіб без патології серця вважається варіантом норми, за винятком тих випадків, коли вона провокує суправентрикулярні тахіаритмії.
Шлуночкові екстрасистоли у осіб без структурного ураження серця не становлять загрози для життя. Їх виявляють при холтерівському моніторуванні ЕКГ у більшості практично здорових осіб всіх вікових груп, причому у 10% вони політопні й рідко — групові. Таким чином, шлуночкова екстрасистолія не обов’язково свідчить про супутню кардіальну патологію, а за відсутності захворювання серця не є провісником підвищення захворюваності й смертності. З іншого боку, у хворих із вираженим структурним ураженням серця та дисфункцією міокарда, особливо на фоні постінфарктного кардіосклерозу або СН, виявлення частої шлуночкової екстрасистолії — додатковий прогностично несприятливий фактор.
Ектопічну активність шлуночків відзначають у 75–90% пацієнтів із гострим ІМ у перші 72 год захворювання, вона визначає високу частоту раптової серцевої смерті в цей момент, але не корелює з рівнем смерті протягом 1 року. Наявність шлуночкової екстрасистолії у більш пізній період захворювання свідчить про несприятливий довгостроковий прогноз. Так, частоту шлуночкових екстрасистол менше 1-ї за годину відзначають у 50% хворих при виписці із стаціонару, 2-річна смертність становить близько 5%. При більшій частоті шлуночкових екстрасистол (1–10 за год), що виявляється у 20% хворих, смертність досягає 20%. Короткі пароксизми шлуночкової тахікардії відзначають у 12% хворих, а смертність від всіх причин становить до 30% протягом 1-го року після перенесеного ІМ. Поява загрозливих для життя аритмій серця після ІМ зумовлена об’єднанням рецидивної ішемії з метаболічними та електролітними порушеннями. Важливі фактори, що спричиняють аритмогенез, — СН і стенозивний коронарний атеросклероз.
Парні й політопні шлуночкові екстрасистоли відзначають у 70–90% хворих на СН, а короткі пароксизми шлуночкової тахікардії — у 40–80%. У цьому разі шлуночкові порушення серцевого ритму є несприятливим прогностичним фактором, причому 33–47% всіх випадків летального кінця у пацієнтів із СН становить раптова серцева смерть. Аритмогенні фактори при СН такі: дисфункція ЛШ (ФВ ЛШ <45%), ішемія міокарда, гіпоксія, електролітні порушення, а також аритмогенні ефекти прийнятих терапевтичних засобів, особливо серцевих глікозидів, діуретиків і периферичних вазодилататорів.
Дуже висока частота шлуночкових екстрасистол у хворих із ДКМП. Так, часті й політопні шлуночкові екстрасистоли відзначають у 80–90% хворих, короткі епізоди шлуночкової тахікардії — у 20–60%. Частота раптової серцевої смерті досягає 10% на рік; на неї доводиться половина всіх випадків смерті. Приблизно у 50% хворих виявляють передсердні екстрасистоли. Формування аритмій пов’язане з наявністю вираженої дисфункції ЛШ і СН.
Шлуночкові екстрасистоли реєструють у 50–65% хворих із ГКМП і з обструкцією виносного тракту ЛШ, в тому числі парні шлуночкові екстрасистоли — у 32%, а пароксизми шлуночкової тахікардії — у 14–25%. Частота раптової серцевої смерті у цих пацієнтів становить 2,5–9% на рік. Передсердну екстрасистолію виявляють рідше, ніж шлуночкові порушення ритму. Причини й фактори, що спричиняють аритмогенез,— клітинна дезорганізація в різних ділянках міокарда, гіпоксія, гіпокаліємія, обструкція виносного тракту ЛШ, діастолічна дисфункція ЛШ, СН, аритмогенні впливи препаратів, інтенсивне фізичне навантаження.
Ризик раптової серцевої смерті внаслідок шлуночкових порушень ритму особливо зростає у хворих з аритмогенною дисплазією ПШ, вродженим або надбаним синдромом подовженого інтервалу Q–T, клапанними вадами серця (включаючи пролапс мітрального клапана), АГ.
Про ступінь небезпеки, пов’язаної із шлуночковою екстрасистолією, можуть свідчити деякі особливості ЕКГ. Зазвичай безпечні екстрасистоли з конфігурацією блокади лівої ніжки пучка Гіса та вертикальним положенням електричної осі передчасного комплексу QRS (тип Розенбаума), або у разі, якщо комплекс QRS екстрасистоли у всіх грудних відведеннях спрямований вгору і нагадує графіку WPW-синдрому типу А (тип Вольфа). Комплекс QRS таких екстрасистол не має додаткових розщеплень, його амплітуда становить ≥20 мм, тривалість може становити до 0,12 с, а сегмент ST та асиметричний зубець Т спрямовані дискордантно до основного зубця шлуночкового комплексу. Перегородкові шлуночкові екстрасистоли з вузькими комплексами QRS частіше відзначають у пацієнтів молодого віку за відсутності структурного ураження серця, вони рідко мають клінічні симптоми. Потенційно загрозливі шлуночкові екстрасистоли в основному виникають на фоні структурного ураження серця, мають форму блокади правої ніжки пучка Гіса, незначну амплітуду комплексу QRS (часто до 10 мм) з додатковими розщепленнями, а його тривалість перевищує 0,12–0,14 с. Можуть відзначати аномалії реполяризації: горизонтальну депресію сегмента ST і конкордантний напрямок симетричного загостреного зубця Т.
Клінічне значення парасистолії, як і екстрасистолії, переважно визначається клінічним перебігом основного захворювання серця. Парасистолію можуть виявляти у хворих зі структурним ураженням міокарда та у практично здорових осіб, а її поява не завжди погіршує перебіг основного захворювання і загальний прогноз. Залишається нез’ясованим питання, чи можуть шлуночкові парасистолії провокувати фібриляцію шлуночків у хворих з гострим ІМ.
КЛАСИФІКАЦІЇ ШЛУНОЧКОВОЇ ЕКСТРАСИСТОЛІЇ
Відповідно до рекомендацій Асоціації кардіологів України, створених на основі МКБ 10-го перегляду, виділяють такі види екстрасистолії: передсердну, атріовентрикулярну, шлуночкову (рідку, в тому числі одиночну — до 30 за годину; часту — ≥30 за годину), алоритмію, поліморфну, парну, ранню — типу R на Т.
В Україні при інтерпретації даних холтерівського моніторування ЕКГ у хворих із шлуночковими порушеннями ритму традиційно використовують класифікацію B. Lown і M. Wolf (1971). Відповідно до цієї класифікації розрізняють 5 класів шлуночкових екстрасистол: 1) рідка мономорфна <30 за годину; 2) часта мономорфна >30 за годину; 3) поліморфна; 4) парна (4а) і пробіжки шлуночкової тахікардії (4b); 5) рання (R на T). Ця класифікація розроблена для систематизації шлуночкових порушень серцевого ритму у хворих із гострим ІМ, але не відповідає потребам стратифікації ризику й вибору тактики диференційованого лікування пацієнтів у постінфарктний період.
Більш детально варіанти шлуночкових порушень серцевого ритму відображені у класифікації R. Myerburg (1984), яку зручно застосовувати при інтерпретації результатів холтерівського моніторування ЕКГ (табл. 1.3). Підкреслимо, що при стратифікації ризику у хворих у постінфарктний період вагомим є вже кількість шлуночкових екстрасистолій >10 за годину. До аритмій високих градацій належать парні шлуночкові екстрасистоли і пароксизми шлуночкової тахікардії будь-якої тривалості. Причому стійку шлуночкову тахікардію, незалежно від клінічних симптомів і характеру структурного захворювання серця, розглядають як злоякісне порушення ритму, тоді як прогностичне значення нестійкої шлуночкової тахікардії у значній мірі залежить від основного захворювання серця й функціонального стану міокарда. Морфологічний тип шлуночкової тахікардії також визначає суттєві відмінності механізмів виникнення й тактики ведення хворих, зокрема застосування антиаритмічних препаратів і катетерних методів лікування.
Добре відома прогностична класифікація шлуночкових аритмій, запропонована J.T. Bigger (1993), що розрізняє шлуночкові аритмії безпечні (доброякісні), небезпечні для життя (злоякісні летальні) й потенційно небезпечні (потенційно летальні).
1. Безпечні (доброякісні) аритмії — будь-які шлуночкові екстрасистолії (рідкі, часті, політопні, парні), а також короткі епізоди шлуночкової тахікардії за відсутності кардіальної патології, які не викликають порушень гемодинаміки. Прогноз таких шлуночкових аритмій такий самий, як і у здоровій популяції. Показань до антиаритмічної терапії немає.
2. Небезпечні для життя (злоякісні) шлуночкові аритмії — епізоди шлуночкової тахікардії, які призводять до порушення гемодинаміки або фібриляції шлуночків. Ці аритмії, як правило, відзначають у хворих з вираженим структурним ураженням серця (ІХС, застійна СН, кардіоміопатії, вади серця) і порушенням скоротності ЛШ. У таких хворих шлуночкові екстрасистолії є лише частиною спектра шлуночкових порушень ритму. Досить часто у них також виявляють нестійку і стійку шлуночкову тахікардію.
3. Потенційно небезпечні (потенційно злоякісні) шлуночкові аритмії — часті, політопні, парні шлуночкові екстрасистолії, короткі епізоди шлуночкової тахікардії у хворих зі структурним ураженням серця (ІХС, СН, кардіоміопатії, вади серця), що не призводять під час порушення ритму до виражених змін гемодинаміки. Маркер більшої імовірності виникнення життєво небезпечних аритмій серця у цих хворих — систолічна дисфункція ЛШ (ФВ ЛШ <45%).
КЛАСИФІКАЦІЇ АНТИАРИТМІЧНИХ ПРЕПАРАТІВ
Найпоширенішою класифікацією антиаритмічних препаратів (які потенційно можуть бути застосовані для лікування екстрасистолії), залишається класифікація Williams (1969) у модифікації D. Harrison (1979), відповідно до якої всі антиаритмічні препарати поділяють на 4 класи:
Клас I. Блокатори швидких натрієвих каналів
А. Препарати, що помірно сповільнюють деполяризацію та реполяризацію (хінідин, прокаїнамід, дизопірамід, аймалін).
В. Препарати, що незначно сповільнюють деполяризацію і прискорюють реполяризацію (лідокаїн, мексилетин, токаїнід, фенітоїн).
С. Препарати, що значно сповільнюють швидкість деполяризації і мінімально впливають на реполяризацію (пропафенон, флекаїнід, енкаїнід, етацизин, алапінін).
Клас II. Блокатори β-адренергічних рецепторів без внутрішньої симпатоміметичної активності (пропранолол, метопролол, атенолол, бетаксолол, бізопролол, небіволол, есмолол).
Клас III. Препарати, що сповільнюють реполяризацію і діють на калієві канали (аміодарон, соталол, ібутилід, дофетилід, азимілід, дронедарон).
Клас IV. Блокатори кальцієвих каналів (верапаміл, дилтіазем).
Новий підхід до класифікації антиаритмічних препаратів було запропоновано експертами Європейського кардіологічного товариства в доповіді «Сицилійський гамбіт» (1991). Авторами виділені провідні механізми аритмогенезу, які спричиняють виникнення та підтримку порушень серцевого ритму, а також електрофізіологічні параметри, усунення яких призведе до відновлення і підтримки синусового ритму (чутливі параметри аритмії). Для кожного із цих параметрів запропоновані препарати, здатні його коригувати. Допускається, що один препарат може мати властивості декількох класів антиаритмічних препаратів. Наприклад, пропафенон, що є блокатором натрієвих каналів, одночасно має β-блокуючі властивості; соталол — не лише блокатор β-адренорецепторів, але й блокатор калієвих каналів; аміодарон має властивості всіх чотирьох класів антиаритмічних препаратів, з огляду на його універсальну дію на іонні канали та рецептори.
Загалом для лікування екстрасистолії потенційно можна використовувати антиаритмічні препарати різних класів (табл. 1.4). Препарати класу ІВ застосовують лише при шлуночкових аритміях, тоді як препарати класу IV — при суправентрикулярних аритміях. Інші антиаритмічні препарати використовують і при шлуночкових, і при суправентрикулярних порушеннях серцевого ритму. Вибір оптимального антиаритмічного препарату у хворих з екстрасистолією має бути індивідуалізованим. Але насамперед варто оцінити доцільність усунення екстрасистолії, порівнявши потенційну користь і ризик призначення антиаритмічних препаратів.
ПРИНЦИПИ ВЕДЕННЯ ХВОРИХ З ЕКСТРАСИСТОЛІЄЮ
Тактика ведення хворих з екстрасистолією залежить від структурного захворювання серця; частоти виникнення екстрасистол, наявності групових екстрасистол або супутніх пароксизмів тахіаритмії; клінічних симптомів, пов’язаних з аритмією. Показаннями для призначення блокаторів β-адренорецепторів та/чи інших антиаритмічних препаратів при екстрасистолічній аритмії є такі клінічні ситуації:
1) прогресуючий перебіг захворювання серця зі значним збільшенням кількості екстрасистол;
2) часті, політопні, парні, групові й ранні (R на T) шлуночкові екстрасистолії, що становлять загрозу щодо виникнення у подальшому пароксизмальної шлуночкової тахікардії та фібриляції шлуночків;
3) алоритмія (бі-, три-, квадригемінія), короткі пробіжки передсердної тахікардії, що супроводжуються ознаками СН;
4) екстрасистолічна аритмія на фоні захворювань, що супроводжуються підвищенням ризику загрозливих для життя аритмій (пролапс мітрального клапана, синдром подовженого інтервалу Q–T тощо);
5) виникнення чи підвищення частоти екстрасистол під час нападів стенокардії або гострого ІМ;
6) збереження шлуночкових екстрасистол після припинення нападу шлуночкової тахікардії та фібриляції шлуночків;
7) екстрасистоли на фоні аномальних шляхів проведення (WPW-синдрому і синдрому Клерка — Леві — Кристеско).
Хворі з доброякісною шлуночковою екстрасистолією не потребують проведення спеціальної антиаритмічної терапії, але необхідне динамічне спостереження, оскільки у частини з них, за даним Фремінгемського дослідження, шлуночкова екстрасистолія може бути дебютом захворювання серця. У разі екстрасистолії особам молодого віку без структурного ураження серця, особливо при екстрасистолії, що зникає під час фізичного навантаження, антиаритмічні препарати зазвичай не призначають. При суб’єктивній непереносимості екстрасистолії показані раціональна психотерапія, седативні засоби, транквілізатори або антидепресанти. Тривалість лікування залежить від медичних показань і коливається від 3 тиж до 2–3 міс. У разі досягнення стійкого седативного й антиаритмічного ефекту добова доза препарату протягом кожних 6–7 днів знижується на 1/3 до повної відміни. Якщо екстрасистолія виникає на фоні вегетативної дисфункції з ознаками симпатоадреналової активації, показані блокатори β-адренорецепторів, а при домінуванні вагоінсулярних симптомів — М-холінолітики (атропін, препарати беладони, іпатропію бромід). Пацієнти із захворюваннями внутрішніх органів і екстрасистолією насамперед потребують адекватного лікування основного захворювання. В кожному разі обстеження має бути спрямоване на виявлення та усунення потенційних провокуючих факторів екстрасистолії (таких як споживання кофеїну, певні життєві ситуації), а також супутніх порушень (АГ).
При безсимптомній надшлуночковій екстрасистолії антиаритмічні препарати призначати недоцільно. Для лікування симптомної, в тому числі групової, надшлуночкової екстрасистолії у хворих зі структурним ураженням серця без ознак СН терапію переважно починають з антагоністів кальцію (верапаміл, дилтіазем) або блокаторів β-адренорецепторів (пропранолол, метопролол, бізопролол, бетаксолол). У разі відсутності ефекту зазначених антиаритмічних препаратів призначають препарати I класу або комбінації антиаритмічних препаратів з різним механізмом дії. Найбільш апробовані такі комбінації антиаритмічних препаратів: дизопірамід + блокатор β-адренорецепторів; пропафенон + блокатор β-адренорецепторів; препарат IА або IВ класу + верапаміл. Аміодарон розглядають як препарат резерву в ситуаціях, коли його призначення виправдане у зв’язку з груповою екстрасистолією та пов’язаних з нею важких клінічних симптомах. Крім того, у певних випадках пригнічення аміодароном передсердної екстрасистолії дозволяє запобігти пароксизмів фібриляції передсердь і суправентрикулярної тахікардії. У гострий період ІМ спеціальне лікування надшлуночкової екстрасистолії, як правило, не показане.
При поодиноких монофокусних шлуночкових екстрасистолах особам із серцево-судинними захворюваннями без порушень гемодинаміки і коронарного кровообігу призначати антиаритмічні препарати не потрібно. Стриманий підхід до призначення антиаритмічних препаратів зумовлений тим, що ризик побічних ефектів при медикаментозному лікуванні доброякісних аритмій вищий, ніж позитивні наслідки лікування. Насамперед ведення цих пацієнтів полягає в терапії основного захворювання, а також застосуванні седативних засобів і методів психотерапії при суб’єктивній непереносимості аритмії.
Потенційно злоякісні шлуночкові аритмії зазвичай виникають на фоні структурного захворювання серця, наприклад ІХС або після перенесеного ІМ. У цих пацієнтів із шлуночковими екстрасистоліями різних градацій існує небезпека виникнення у подальшому пароксизмів шлуночкової тахікардії, тріпотіння чи фібриляції шлуночків. З огляду на це хворі з потенційно злоякісними шлуночковими аритміями насамперед потребують адекватного лікування основного захворювання. З цією метою проводять корекцію стандартних факторів ризику ІХС (АГ, тютюнопаління, гіперхолестеринемія, цукровий діабет), призначають засоби, ефективність яких доведена у пацієнтів із ІХС (ацетилсаліцилова кислота, блокатори β-адренорецепторів, статини) і СН (інгібітори АПФ, блокатори β-адренорецепторів, антагоністи альдостерону). При поєднанні кардіальної патології з частою шлуночковою екстрасистолією високих градацій здійснюють підбір адекватної антиаритмічної терапії. Препаратами вибору найчастіше є блокатори β-адренорецепторів, особливо за наявності додаткових показань: ІХС, АГ, синусова тахікардія. Високу ефективність цих препаратів пов’язують з їх антиангінальною, антиаритмічною і брадикардитичною дією. За необхідності блокатори β-адренорецепторів комбінують з антиаритмічними препаратами I класу (пропафенон, морацизин, етацизин, дизопірамід), з урахуванням доцільності їх подальшого тривалого застосування.
Гіпотезу про профілактичну ефективність антиаритмічних препаратів I класу при шлуночкових екстрасистоліях для запобігання раптової смерті переглянуто після обнародування результатів дослідження CAST (1989). Прийом флекаїніду й енкаїніду у хворих в постінфарктний період із безсимптомними шлуночковими екстрасистоліями високих градацій супроводжувався достовірним підвищенням ризику раптової смерті порівняно з плацебо. Зазначений феномен пов’язують з аритмогенною і негативною інотропною дією антиаритмічних препаратів I класу. Разом з тим негативні результати дослідження CAST та інших досліджень ефективності антиаритмічних препаратів I класу не виключають можливості їх ефективного нетривалого застосування для лікування шлуночкових екстрасистолій у пацієнтів із ІХС, а також шлуночкових аритмій, зумовлених іншими причинами.
У разі недостатньої ефективності блокаторів β-адренорецепторів та антиаритмічних препаратів I класу призначають аміодарон — один із найбільш ефективних антиаритмічних засобів із найбільш низькою імовірністю аритмогенних ефектів. Аміодарон застосовують при резистентності до інших антиаритмічних препаратів; крім того, він препарат вибору у пацієнтів із життєво небезпечними та клінічно вираженими аритміями на фоні тяжкого структурного захворювання серця.
Обнадійливі результати отримано при застосуванні аміодарону у хворих із частою шлуночковою екстрасистолією після перенесеного ІМ у метааналізі АТМА (1997). У групах пацієнтів, які одержували аміодарон, істотно знижувалася імовірність раптової серцевої смерті, але не відзначали достовірного зниження загальної смертності. Аміодарон — препарат вибору для лікування та попередження шлуночкових аритмій у хворих із систолічною дисфункцією міокарда і СН. Застосування аміодарону в низьких дозах (200 мг/добу) дозволяє зменшити до мінімуму кількість некардіальних побічних ефектів. Альтернативним засобом лікування хворих із шлуночковими аритміями на фоні ІХС є соталол — антиаритмічний препарат III класу з властивостями блокатора β-адренорецепторів.
Висока ефективність аміодарону і соталолу при лікуванні пацієнтів зі злоякісними шлуночковими аритміями не свідчить про відсутність проблеми безпеки цих засобів. Антиаритмічні препарати III класу подовжують коригований інтервал Q–T, безпечна границя якого становить 440–460 мс. Якщо показники інтервалу Q–Tс перевищують зазначені границі, діагностують надбаний синдром подовженого інтервалу Q–T. Характерним і специфічним проявом цього стану є поліморфна шлуночкова тахікардія (тахікардія типу пірует), що може трансформуватися у фібриляцію шлуночків. Ризик розвитку аритмогенної дії соталолу найвищий у перші 3 дні прийому препарату. Загалом аритмогенні ефекти соталолу виявляють частіше, ніж при застосуванні аміодарону.
ЛІКУВАННЯ ЕКСТРАСИСТОЛІЇ В ОКРЕМИХ КЛІНІЧНИХ СИТУАЦІЯХ
У хворих із ІМ прогностичне значення і тактика лікування шлуночкових екстрасистолій залежать від терміну їх виникнення. В догоспітальний період ІМ призначають метопролол в дозі 5 мг внутрішньовенно до 3 разів з інтервалом 3–5 хв, далі — per os по 25–50 мг 2 рази на добу. При шлуночкових екстрасистоліях високих градацій в гострий період ІМ на фоні базисної терапії (нітрати, антиагреганти, антикоагулянти, інгібітори АПФ, статини тощо), призначають внутрішньовенне болюсне введення лідокаїну в дозі 1 мг/кг маси тіла, а потім переходять на постійну інфузію препарату зі швидкістю 2 мг/хв. Насичувальну та підтримувальну дози знижують у 2 рази у хворих віком старше 70 років, при кардіогенному шоці та СН. Якщо через 10 хв після першого болюсного введення лідокаїну кількість шлуночкових екстрасистолій не зменшується, додатково струйно вводять 0,5 мг/кг лідокаїну, а швидкість інфузії препарату збільшують до 4мг/хв. За необхідності інфузію лідокаїну продовжують протягом доби. Профілактичне застосування лідокаїну не рекомендується, оскільки є повідомлення, що він може підвищувати смертність хворих з ІМ, насамперед у зв’язку з виникненням асистолії.
При збереженні шлуночкових аритмій високих градацій на фоні терапії лідокаїном і метопрололом застосовують аміодарон, починаючи з дози 600–1200 мг/добу, з подальшим переходом на підтримувальну дозу препарату. Крім того, аміодарон — резервний засіб лікування пароксизмів шлуночкової тахікардії на фоні ІМ.
Для терапії симптоматичних шлуночкових екстрасистолій у хворих із постінфарктним кардіосклерозом найдоцільніше використовувати блокатори β-адренорецепторів, аміодарон або соталол. У пацієнтів із СН застосування інгібіторів АПФ, калійзберігаючих діуретиків, периферичних вазодилататорів забезпечує опосередкований антиаритмічний ефект за рахунок корекції порушень гемодинаміки та нейрогуморального дисбалансу. Разом з тим серцеві глікозиди та петльові діуретики можуть проявляти аритмогенну дію. При поєднанні аміодарону з дигоксином дозу останнього необхідно знизити наполовину у зв’язку з підвищенням загрози глікозидної інтоксикації. Відповідно до рекомендацій Української асоціації кардіологів (2004) при злоякісних шлуночкових порушеннях ритму серця у хворих із низькою ФВ ЛШ і СН показане призначення аміодарону у поєднанні з блокаторами β-адренорецепторів у низьких дозах та інгібіторами АПФ.
Є 4 основні представники класу блокаторів β-адренорецепторів з доведеною здатністю поліпшувати прогноз виживаності та запобігати раптовій смерті у хворих із СН і дисфункцією ЛШ: бізопролол (дослідження CIBIS-II, 1998), метопролол CR/XL (MERIT-HF, 1999), карведилол (COPERNICUS, 2001), небіволол (SENIORS, 2005). Механізм позитивного впливу блокаторів β-адренорецепторів пов’язаний із впливом на РААС і вегетативний баланс, а також з їх антиішемічною дією.
Хворі з прогностично несприятливими аритміями, рефрактерними до антиаритмічної терапії, з вираженими порушеннями гемодинаміки, коронарного кровотоку чи при поєднанні з пароксизмами шлуночкової тахікардії та фібриляції шлуночків мають потребу в хірургічному лікуванні (деструкція ектопічного вогнища, імплантація антитахікардичних пристроїв або використання інших підходів).
Поява екстрасистолічної аритмії у пацієнтів із захворюваннями органів дихання може бути пов’язана із застосуванням β-стимуляторів і гіпертензією малого кола кровообігу. У цьому разі краще застосовувати антагоністи кальцію (верапаміл, дилтіазем), що зменшують вираженість легеневої гіпертензії. Можливе також обережне застосування високоселективних блокаторів β-адренорецепторів і аміодарону.
Принципи лікування парасистолії такі ж, як і екстрасистолії. Проте частіше відзначають рефрактерність до медикаментозної терапії. Застосування антиаритмічних препаратів показане при шлуночковій парасистолічній тахікардії, а також у разі симптоматичної парасистолії. Найбільш ефективний засіб лікування парасистолії — аміодарон.
ВИСНОВКИ
Екстрасистолія — найпоширеніше порушення ритму серця. Суправентрикулярна та шлуночкова екстрасистолія може виникати при багатьох кардіальних і екстракардіальних захворюваннях, її можуть випадково виявити у практично здорових осіб. Комплекс сучасних інструментальних і лабораторних методів обстеження пацієнтів з екстрасистолією спрямований на встановлення її причин і механізмів, кількості та градації, клінічного і прогностичного значення, проведення стратифікації ризику. Загальна стратегія ведення хворих з екстрасистолією й, зокрема, доцільність її усунення за допомогою антиаритмічних препаратів визначають залежно від співвідношення потенційної користі лікування для усунення аритмій, поліпшення прогнозу виживаності й ризику виникнення аритмогенних та інших побічних ефектів терапії.
ЛІТЕРАТУРА
- Голицын С.П. (2000) Грани пользы и риска при лечении желудочковых нарушений ритма сердца. Междунар. журн. мед. практ., 56–64.
- Денисюк В.И., Дзяк Г.В., Мороз В.М. (2005) Лечение аритмий: пути повышения эффективности и безопасности антиаритмических препаратов. ГП ГКФ, Винница, 640 с.
- Дощицин В.Л. (1999) Внезапная аритмическая смерть и угрожающие аритмии. Рос. кардиол. журн., 1: 43–49.
- Кушаковский М.С. (1998) Аритмии сердца. ИКФ Фолиант, Санкт-Петербург, 640 с.
- Мазур Н.А., Абдала А. (1995) Фармакотерапия аритмий. Оверлей, Москва, 224 с.
- Мешков А.П. (1996) Аритмии сердца: диагностика и лечение. Нижний Новгород, 122 с.
- Рейнгардене Д.И., Азаравичене А.П. (2004) Эффективность амиодарона (кордарона) при предсердной экстрасистолии. Терапевт. арх., 87–89.
- Сычев О.С., Епанчинцева О.А., Левчук Е.В. (2005) Исследование эффективности бисопролола для лечения желудочковых аритмий у больных ишемической болезнью сердца с сердечной недостаточностью. Мистецтво лікування, 79–83.
- Сычев О.С., Соловьян А.Н., Шуба О.В. и др. (2005) Применение небиволола у больных с нарушениями ритма сердца при ишемической болезни сердца и эссенциальной артериальной гипертензии. Укр. кардіол. журн., 57–64.
- Фомина И.Г. (2003) Нарушения сердечного ритма. ИД Русский врач, Москва, 192 с.
- Царегородцев Д.А. (2001) Проблема медикаментознорезистентных аритмий. Рос. кадиол. журн., 2: 51–60.