L-Цет® сироп 2,5 мг/5 мл флакон скляний 100 мл №1
L-Цет сироп інструкція із застосування
Склад
Левоцетиризину дигідрохлорид - 2,5 мг/5 мл
Фармакологічні властивості
фармакодинаміка. Левоцетиризин ― це активний стабільний R-енантіомер цетиризину, що належить до групи конкурентних антагоністів периферичних Н1-гістамінових рецепторів. Спорідненість з Н1-гістаміновими рецепторами у левоцетиризину у 2 рази вища, ніж у цетиризину. Впливає на гістамінзалежну стадію розвитку алергічної реакції, зменшує міграцію еозинофілів, судинну проникність, обмежує вивільнення медіаторів запалення. Запобігає розвитку та полегшує перебіг алергічних реакцій, чинить антиексудативну, протисвербіжну, протизапальну дію, майже не чинить антихолінергічної та антисеротонінової дії.
Фармакокінетика. Фармакокінетичні параметри левоцетиризину мають лінійну залежність, не залежать від дози та часу і мають низьку варіабельність у різних пацієнтів. Фармакокінетичний профіль при введенні єдиного енантіомера такий самий, як і при застосуванні цетиризину. У процесі абсорбції або виведення не відмічається хіральна інверсія.
Абсорбція. Левоцетиризин після перорального застосування швидко та інтенсивно всмоктується. Ступінь всмоктування препарату не залежить від дози препарату та не змінюється з прийомом їжі, але Сmах препарату зменшується та досягає свого максимального значення пізніше. Біодоступність становить 100%.
У 50% хворих дія левоцетиризину розвивається через 12 хв після прийому одноразової дози, а у 95% ― через 0,5–1 год. Сmах у сироватці крові досягається через 50 хв після одноразового прийому внутрішньо терапевтичної дози. Рівноважна концентрація у крові досягається після 2 днів прийому препарату. Сmах становить 270 нг/мл після одноразового застосування і 308 нг/мл ― після повторного застосування у дозі 5 мг відповідно.
Розподіл. Відсутня інформація щодо розподілу препарату у тканинах людини, а також щодо проникнення левоцетиризину крізь ГЕБ. У дослідженнях Сmах зафіксована у печінці та нирках, а найнижча ― у тканинах ЦНС. Розподіл левоцетиризину обмежений, тому що об’єм розподілу становить 0,4 л/кг. Зв’язування з білками плазми крові ― 90%.
Біотрансформація. В організмі людини рівень метаболізму становить менше ніж 14% дози левоцетиризину, і тому відмінність у результаті генетичного поліморфізму або одночасного прийому ферментних інгібіторів, як очікується, буде незначною. Процес метаболізму включає ароматичну оксидацію, N- та О-деалкілування і сполучення з таурином. Деалкілування у першу чергу відбувається за участю цитохрому CYP 3А4, тоді як у процесі ароматичної оксидації беруть участь чисельні та (або) невизначені ізоформи CYP. Левоцетиризин не впливав на активність цитохромних ізоферментів 1А2, 2С9, 2С19, 2D6, 2Е1, 3А4 у концентраціях, що значно перевищували максимальні після прийому дози 5 мг перорально. Враховуючи низький ступінь метаболізму та відсутність здатності до пригнічення метаболізму, взаємодія левоцетиризину з іншими речовинами (і навпаки) малоймовірна.
Виведення. Екскреція препарату відбувається в основному за рахунок клубочкової фільтрації та активної канальцевої секреції. Т½ левоцетиризину з плазми крові у дорослих становить 7,9±1,9 год. Т½ препарату коротший у маленьких дітей. Середній очевидний загальний кліренс у дорослих ― 0,63 мл/хв/кг. В основному виведення левоцетиризину та його метаболітів з організму відбувається із сечею (виводиться у середньому 85,4% застосованої дози препарату). З калом виводиться лише 12,9% застосованої дози левоцетиризину.
Особливі популяції. Порушення функцій нирок. Очевидний кліренс левоцетиризину для організму корелює з кліренсом креатиніну. Тому у пацієнтів із помірними та тяжкими порушеннями функції нирок рекомендується підбирати інтервали між прийомами левоцетиризину з урахуванням кліренсу креатиніну. При анурії при кінцевій термінальній стадії захворювання нирок загальний кліренс організму пацієнтів порівняно з загальним кліренсом організму в осіб без таких порушень зменшується приблизно на 80%. Кількість левоцетиризину, що виводиться під час стандартної 4-годинної процедури гемодіалізу, становила <10%.
Показання L-Цет сироп
Симптоматичне лікування алергічного риніту (у тому числі цілорічного алергічного риніту) та кропив’янки.
Застосування L-Цет сироп
Препарат призначати дорослим та дітям віком від 2 років внутрішньо, незалежно від прийому їжі.
Рекомендовані дози:
| Категорія пацієнтів | Вік | Добова доза | Разова доза | Кількість прийомів |
| Діти | Від 2 років до 6 років | 2,5 мг (5 мл) | 1,25 мг (2,5 мл) | 2 рази на добу |
| Від 6 років до 12 років | 5 мг (10 мл) | 5 мг (10 мл) | 1 раз на добу | |
| Підлітки | Від 12 років до 18 років | 5 мг (10 мл) | 5 мг (10 мл) | 1 раз на добу |
| Дорослі | Від 18 років | 5 мг (10 мл) | 5 мг (10 мл) | 1 раз на добу |
Хворим літнього віку із нормальною функцією нирок корекція дози препарату не потрібна.
Хворим із порушеною функцією нирок розрахунок дози необхідно проводити з урахуванням кліренсу креатиніну відповідно до таблиці.
Для застосування цієї таблиці дозування необхідно оцінити кліренс креатиніну (КЛкр) пацієнта у мл/хв. КЛкр (мл/хв) має бути оцінений за вмістом креатиніну у плазмі крові (мг/дл) за допомогою наступної формули: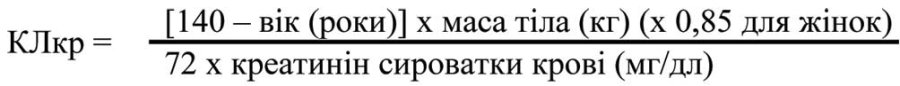
Корекція дози препарату хворим із порушеною функцією нирок:
| Функція нирок | Кліренс креатиніну, мл/хв | Добова доза | Кількість прийомів |
| Нормальна функція нирок | ≥80 | 5 мг (10 мл) | 1 раз на добу |
| Порушення легкого ступеня | 50-79 | 5 мг (10 мл) | 1 раз на добу |
| Порушення помірного ступеня | 30–49 | 5 мг (10 мл) | 1 раз на 2 доби |
| Порушення тяжкого ступеня | <30 | 5 мг (10 мл) | 1 раз на 3 доби |
| Кінцева стадія захворювання нирок. Пацієнти, які перебувають на діалізі | <10 | Протипоказано | |
Дітям із порушеннями функції нирок дозу препарату необхідно скоригувати індивідуально з урахуванням ниркового кліренсу пацієнта та його маси тіла.
Специфічних даних щодо застосування дітям з порушенням функцій нирок немає.
Пацієнти з порушенням функцій печінки. Хворим із винятково печінковою недостатністю корекція режиму дозування не потрібна. Хворим із печінковою та нирковою недостатністю необхідно коригувати режим дозування відповідно до наведеної вище таблиці.
Тривалість застосування. Пацієнтів із періодичним алергічним ринітом (тривалість прояву симптомів захворювання становить менш ніж 4 доби на тиждень або менш ніж 4 тижні на рік) слід лікувати відповідно до перебігу захворювання та анамнезу: лікування можна припинити, якщо симптоми зникнуть, та можна відновити знову при повторному виникненні симптомів. У разі стійкого алергічного риніту (тривалість прояву симптомів захворювання становить більш ніж 4 доби на тиждень або більш ніж 4 тижні на рік) у період контакту з алергенами пацієнту можна запропонувати постійну терапію. Існує клінічний досвід застосування левоцетиризину протягом щонайменше 6-місячного періоду лікування. При хронічних захворюваннях (хронічний алергічний риніт, хронічна кропив’янка) тривалість лікування становить до 1 року (дані доступні з клінічних досліджень при застосуванні рацемату).
Діти. Застосування дітям віком до 2 років не рекомендується через обмеженість даних у цій віковій категорії.
Препарат застосовувати дітям віком від 2 років.
Протипоказання
Підвищена чутливість до левоцетиризину, цетиризину, гідроксизину, до будь-яких інших похідних піперазину або до будь-якої іншої допоміжної речовини препарату.
Тяжка форма хронічної ниркової недостатності (кліренс креатиніну <10 мл/хв).
Побічна дія
З боку нервової системи: сонливість, головний біль, підвищена втомлюваність, слабкість, астенія, судоми, парестезія, запаморочення, непритомність, тремор, дисгевзія.
З боку психіки: порушення сну, збудження, галюцинації, депресія, агресія, безсоння, суїцидальні думки.
З боку серця: посилене серцебиття, тахікардія.
З боку органів зору: порушення зору, нечіткість зору.
З боку органів слуху та рівноваги: вертиго.
З боку печінки та жовчовивідних шляхів: гепатит.
З боку нирок та сечовидільної системи: дизурія, затримка сечі.
З боку імунної системи: гіперчутливість, включаючи анафілаксію та ангіоневротичний набряк.
З боку дихальної системи, органів грудної клітки та середостіння: задишка.
З боку травного тракту: діарея, блювання, запор, сухість у роті, нудота, біль у животі.
З боку шкіри та підшкірних тканин: стійкі медикаментозні висипання, свербіж, висипання, кропив’янка.
З боку кістково-м’язової системи: міальгія, артралгія.
Результати досліджень: збільшення маси тіла, відхилення функціональних печінкових проб від норми.
Порушення харчування та обміну речовин: підвищений апетит.
Загальні порушення та стан у місці введення: набряк.
Особливості застосування
З обережністю застосовувати пацієнтам із хронічною нирковою недостатністю (необхідна корекція режиму дозування) та пацієнтам літнього віку (можливе зниження клубочкової фільтрації). Слід з обережністю застосовувати препарат при одночасному прийомі з алкоголем (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Призначаючи препарат за наявності у пацієнтів певних факторів, що провокують затримку сечі (наприклад, травми спинного мозку, гіперплазія передміхурової залози), необхідно брати до уваги, що левоцетиризин збільшує ризик затримки сечі.
Немає даних щодо посилення ефекту седативних засобів при застосуванні у терапевтичних дозах. Але слід уникати застосування седативних засобів під час прийому препарату.
Оскільки антигістамінні препарати можуть пригнічувати відповідь на шкірні алергічні проби, то перед їх проведенням необхідним є період вимивання (від 3-х днів).
Можливим є виникнення свербежу при припиненні застосування левоцетиризину, навіть якщо ці симптоми не були присутні до початку лікування. Свербіж може зникнути самостійно. У деяких випадках свербіж може бути інтенсивним, що може стати причиною поновлення лікування. Після повторного застосування левоцетиризину свербіж, як правило, проходить.
Допоміжні речовини.
Препарат містить сахарозу, тому якщо у Вас встановлена непереносимість деяких цукрів, проконсультуйтеся з лікарем, перш ніж приймати цей лікарський засіб.
Препарат містить натрію метилпарагідроксибензоат та натрію пропілпарагідроксибензоат, які можуть спричиняти алергічні реакції (можливо, уповільнені).
Застосування у період вагітності і годування груддю.
Вагітність. Левоцетиризин протипоказаний для застосування у період вагітності.
Годування груддю. Цетиризин проникає у грудне молоко, тому при необхідності застосування препарату годування груддю слід припинити.
Фертильність. Немає клінічних даних (включаючи дослідження на тваринах) щодо впливу левоцетиризину на фертильність.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Слід утримуватися від керування автотранспортом або роботи з іншими потенційно небезпечними механізмами під час лікування препаратом.
Взаємодія з іншими лікарськими засобами
Дослідження з левоцетиризином щодо взаємодії (включаючи дослідження з індукторами CYP3A4) не проводилися. Дослідження з цетиризином (з’єднання рацемату) показали, що одночасне застосування з антипірином, азитроміцином, циметидином, діазепамом, еритроміцином, гліпізидом, кетоконазолом або псевдоефедрином не чинить клінічно значущих несприятливих взаємодій. При сумісному застосуванні з теофіліном (400 мг/добу) спостерігалося невелике зниження (на 16%) загального кліренсу левоцетиризину (розподіл теофіліну не змінювався). При дослідженні багаторазового застосування ритонавіру (600 мг 2 рази на добу) та цетиризину (10 мг на добу) ступінь експозиції цетиризину збільшувався приблизно на 40%, тоді як розподіл ритонавіру дещо змінювався (—11%) до паралельного застосування цетиризину.
Прийом їжі не впливає на ступінь всмоктування препарату, але знижує швидкість його абсорбції.
Одночасне застосування цетиризину або левоцетиризину і алкоголю або інших депресантів ЦНС у вразливих пацієнтів може спричинити додаткове зниження пильності та здатності до виконання роботи.
Передозування
Симптоми: симптоми передозування можуть включати сонливість у дорослих та початкове збудження і підвищену дратівливість з наступною сонливістю у дітей.
Лікування. Специфічного антидоту до левоцетиризину немає. У випадку появи симптомів передозування рекомендується симптоматична та підтримуюча терапія. Слід розглянути необхідність промивання шлунка через короткий час після прийому препарату. Гемодіаліз для виведення левоцетиризину з організму не ефективний.
Умови зберігання
при температурі не вище 25 °С в оригінальній упаковці.
Після першого відкриття флакона препарат зберігати не більше 4 тижнів.




