Онівайд® пегильований ліпосомальний (Onivyde® pegylated liposomal)
Онівайд пегильований ліпосомальний інструкція із застосування
Склад
діючі речовини: іринотекан (іrinotecan);
Один флакон концентрату ємністю 10 мл містить 43 мг іринотекану безводного (у вигляді пегильованої ліпосомальної форми іринотекану солі сахарози-октасульфату).
1 мл концентрату містить 4,3 мг іринотекану безводного (у вигляді пегильованої ліпосомальної форми іринотекану солі сахарози-октасульфату);
допоміжні речовини: сахарози октасульфат, 1,2-дістеароїл-sn-гліцеро-3-фосфохолін (DSPC), холестерин, N-(карбоніл-метоксиполіетиленгліколь-2000)-1,2-дістеароїл-sn-гліцеро-3-фосфоетаноламін (MPEG-2000-DSPE), 2-[4-(2-гідроксиетил)піперазин-1-іл] етансульфонова кислота (буфер HEPES), натрію хлорид, вода для ін’єкцій.
Іринотекан - 4,3 мг/мл
Фармакологічні властивості
Фармакодинаміка.
Механізм дії. Діючою речовиною ОНІВАЙД® пегильований ліпосомальний є іринотекан (інгібітор топоізомерази I), інкапсульований у ліпідному двошаровому пухирці або ліпосомі.
Іринотекан являє собою похідне камптотецину. Камптотецин діє як специфічний інгібітор ферменту ДНК-топоізомерази I. Іринотекан та його активний метаболіт SN 38 оборотно зв’язується з комплексом ДНК-топоізомерази I та індукують пошкодження одного ланцюга ДНК, що блокує реплікаційну вилку ДНК та обумовлює цитотоксичність. Іринотекан метаболізується карбоксилестеразою до сполуки SN 38. SN 38 приблизно в 1 000 разів активніший за іринотекан як інгібітор топоізомерази I, виділеної з пухлинних клітинних ліній людини та гризунів.
Фармакодинамічні ефекти. В експериментальних моделях на тваринах ОНІВАЙД® пегильований ліпосомальний показав тривалу концентрацію іринотекану в плазмі крові та SN 38 в місці пухлини.
Клінічна ефективність і безпека. Безпека та ефективність ОНІВАЙД® пегильований ліпосомальний вивчалися у міжнародному рандомізованому відкритому контрольованому клінічному дослідженні (NAPOLI–1), в якому досліджували два режими терапії пацієнтів з метастатичною аденокарциномою підшлункової залози із задокументованим прогресуванням захворювання після проведення терапії гемцитабіном або на базі гемцитабіну. Дослідження проводили з метою оцінки клінічної ефективності та безпеки монотерапії препаратом ОНІВАЙД® пегильований ліпосомальний або комбінації ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ порівняно з групою активного контролю, що застосовувала 5-ФУ/ЛВ. Основними критеріями відбору пацієнтів із метастатичною аденокарциномою підшлункової залози в дослідженні NAPOLI-1 були оцінка загального стану пацієнта за шкалою Карновського (KPS) ≥ 70, нормальний рівень білірубіну, вміст трансаміназ в ≤ 2,5 рази вище за верхню межу норми (ВМН) або у ≤ 5 разів вищий за ВМН для пацієнтів з печінковими метастазами та рівень альбуміну ≥ 3,0 г/дл. Загалом 417 пацієнтів було рандомізовано до груп застосування препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ (n = 117), монотерапії ОНІВАЙД® пегильований ліпосомальний (n=151) та 5-ФУ/ЛВ (n=149). Демографічні дані пацієнтів та вихідні характеристики захворювання були збалансовані між досліджуваними групами. Пацієнти отримували лікування до прогресування захворювання або розвитку неприйнятної токсичності. Первинним критерієм ефективності була загальна виживаність (ЗВ), див. рис 1. Додаткові критерії ефективності включали виживаність без прогресування захворювання (ВБП) та частоту об’єктивної відповіді (ЧОВ). Результати наведені в табл. 1.
Таблиця 1: Результати клінічного дослідження NAPOLI-1
| ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ (n= 117) | 5-ФУ/ЛВ (n= 119) | |
| Загальна виживаність1 | ||
| Кількість летальних випадків, n (%) | 75 (64) | 80 (67) |
| Медіана ЗВ (місяців) | 6,1 | 4,2 |
| (95% ДІ) | (4,8; 8,9) | (3,3; 5,3) |
| Відносний ризик (95% ДІ)3 | 0,67 (0,49–0,92) | |
| р-значення4 | 0,0122 | |
| Виживаність без прогресування захворювання1,2 | ||
| Смерть або прогресування, n (%) | 83 (71) | 92 (77) |
| Медіана ВБП (місяців) | 3,1 | 1,5 |
| (95% ДІ) | (2,7; 4,2) | (1,4; 1,8) |
| Відносний ризик (95% ДІ)3 | 0,56 (0,41–0,75) | |
| р-значення4 | 0,0001 | |
| Частота об’єктивної відповіді2 | ||
| n | 19 | 1 |
| ЧОВ (%) | 16,2 | 0,8 |
| 95% ДІ частоти5 | 9,6; 22,9 | 0,0; 2,5 |
| Різниця частоти (95% ДІ)5 | 15,4 (8,5; 22,3) | |
| р-значення6 | <0,0001 | |
1 Медіана — оцінка середнього часу виживаності за методом Каплана-Мейєра.
2 Згідно з настановами Критеріїв оцінки відповіді при солідних пухлинах (RECIST) в ред. 1.1.
3 Аналіз моделі Кокса.
4 Нестратифікований логранговий критерій.
5 На основі нормальної апроксимації.
6 Точний критерій Фішера.
Скорочення: 5-ФУ/ЛВ = 5-фторурацил/лейковорин; ДІ = довірчий інтервал.
Рисунок 1: Загальна виживаність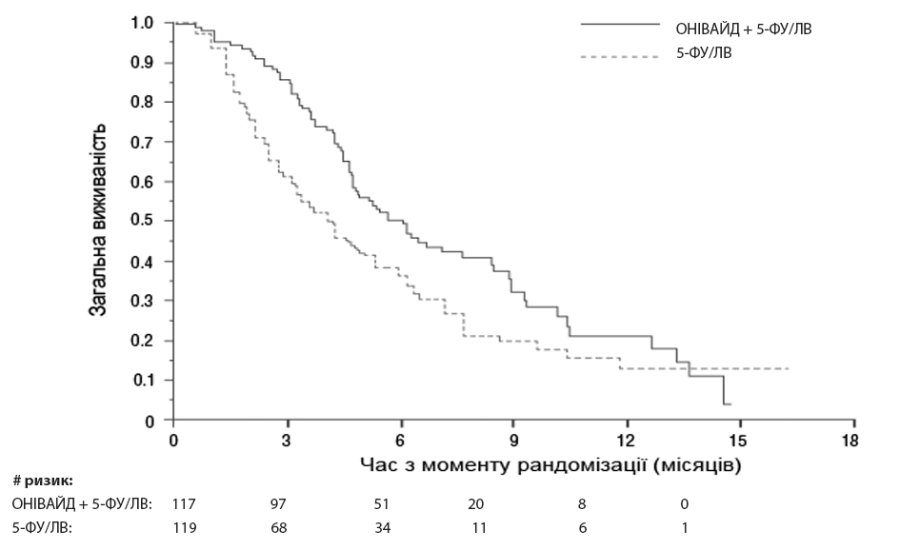
У незначної кількості пацієнтів, які попередньо застосовували неліпосомальні форми іринотекану, не було продемонстровано переваг препарату ОНІВАЙД® пегильований ліпосомальний.
Фармакокінетика.
Абсорбція. Ліпосомальна інкапсуляція іринотекану подовжує його циркуляцію та обмежує розподіл порівняно з неліпосомальними формами іринотекану. Плазмову фармакокінетику загального іринотекану та загального SN-38 оцінювали у хворих на рак, які отримували ОНІВАЙД® пегильований ліпосомальний як монотерапію або як частину комбінованої хіміотерапії, в дозах від 50 до 155 мг/м2. Фармакокінетичні параметри загального іринотекану та SN-38 після застосування ОНІВАЙД® пегильований ліпосомальний у дозі 70 мг/м2 представлені в табл. 2.
Таблиця 2: Зведенні середні значення (± стандартне відхилення) загального іринотекану та загального SN-38
| Показник | ФК параметри | Одиниця вимірювання | Геометричне середнє ОНІВАЙД® пегильований ліпосомальний (95% ДІ)а 70 мг/м2 (n=353)b | Середнє неліпосомальної форми іринотекану (СВ) 125 мг/м2 (n=99)с |
| Загальний іринотекан | AUC | год×нг/мл | 919 228 (845 653–999 204) | 10 529 (3 786) |
| Cmax | нг/мл | 28 353 (27 761–28 958) | 1 492 (452) | |
| Кліренс (CL) | л/год/м2 | 0,087 (0,080–0,094) | 13,0 (5,6) | |
| Об'єм (V) | л/м2 | 2,6 (2,6–2,7) | 138 (60,9) | |
| t½ ефективний | год | 20,8 (19,4–22,3) | 6,07 (1,19) | |
| Загальний SN-38 | AUC | год×нг/мл | 341 (326–358) | 267 (115) |
| Cmax | нг/мл | 3,0 (2,9–3,1) | 27,8 (11,6) | |
| t½ ефективний | год | 40,9 (39,8–42,0) | 11,7 (4,29) | |
СВ = стандартне відхилення.
AUC = площа під кривою концентрації в плазмі (екстрапольована до безкінечності для ОНІВАЙД® пегильований ліпосомальний та AUC24год для неліпосомальної форми іринотекану).
Cmax = максимальна концентрація в плазмі.
t½ ефективний = ефективний період напіввиведення.
а Значення розраховані з популяційного ФК аналізу.
b n = 353 стосується всіх суб’єктів, включених у популяційний ФК аналіз.
c Значення отримані з опублікованих даних [Schaaf LJ et al. Clin Cancer Res. 2006 Jun 15; 12:3782-91]
Розподіл. Пряме вимірювання ліпосомального іринотекану показує, що 95% іринотекану залишається інкапсульованим у ліпосоми під час циркуляції. Неліпосомальна форма іринотекану демонструє великий об’єм розподілу (138 л/м2). Об’єм розподілу ОНІВАЙД® пегильований ліпосомальний у дозі 70 мг/м2 становив 2,6 л/м2, що вказує на те, що ОНІВАЙД® пегильований ліпосомальний в основному обмежений судинною рідиною.
Зв’язування препарату ОНІВАЙД® пегильований ліпосомальний з білками плазми є незначним (< 0,44% загального іринотекану в даному препараті). Зв’язування неліпосомальної форми іринотекану з білками плазми є помірним (від 30% до 68%), а SN-38 має високий ступінь зв’язування з білками плазми людини (приблизно 95%).
Біотрансформація. Іринотекан, вивільнений із ліпосомальної інкапсуляції, проходить шлях метаболізму, аналогічний тому, який описано для неліпосомальної форми іринотекану. Метаболічне перетворення іринотекану до активного метаболіту SN-38 здійснюється під дією ферменту карбоксилестераза. Дослідження in vitro показали, що іринотекан, SN-38 та ще один метаболіт – амінопентанкарбонова кислота (АПК) – не інгібують ізоферменти цитохрому P-450. Надалі SN-38 кон’югується переважно за допомогою ферменту УДФ-глюкуронозилтрансфераза 1A1 (UGT1A1) та утворює глюкуронідний метаболіт. Активність UGT1A1 зменшується в осіб із генетичним поліморфізмом, що призводить до зменшення ферментної активності, наприклад, поліморфізм UGT1A1*28. За даними популяційного фармакокінетичного аналізу у пацієнтів, які застосовували ОНІВАЙД® пегильований ліпосомальний (для підгрупи з генотипічним тестуванням UGT1A1*28 аналіз було адаптовано для нижчої дози, яку вводили гомозиготним пацієнтам за алелем UGT1A1*28), середня рівноважна концентрація загального SN-38 була 1,06 та 0,95 нг/мл відповідно у гомозиготних пацієнтів (n = 14) та негомозиготних (n=244) за цим алелем пацієнтів.
Виведення. Екскреція ОНІВАЙД® пегильований ліпосомальний і неліпосомальних форм іринотекану у людини до кінця не вивчена. Екскреція неліпосомальних форм іринотекану із сечею становить 11% – 20%; SN-38 < 1%, а глюкуроніду SN-38 ‒ 3%. Загальна біліарна та ниркова екскреція іринотекану та його метаболітів (SN-38 та глюкуроніду SN-38) протягом 48 годин після введення неліпосомальних форм іринотекану у двох пацієнтів становила приблизно від 25% (100 мг/м2) до 50% (300 мг/м2).
Порушення функції нирок. Спеціальних фармакокінетичних досліджень у пацієнтів з порушенням функції нирок не проводили. За даними популяційного фармакокінетичного аналізу, порушення функції нирок від легкого до помірного ступеня тяжкості не впливало на концентрацію загального SN-38 після коригування на площу поверхні тіла (BSA). Недостатньо даних для оцінки впливу порушення функції нирок тяжкого ступеня (CLcr < 30 мл/хв) на фармакокінетику (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Порушення функції печінки. Спеціальних фармакокінетичних досліджень у пацієнтів з порушенням функції печінки не проводили. У популяційному фармакокінетичному аналізі пацієнти з вихідним рівнем загального білірубіну 1‒2 мг/дл (n=19) продемонстрували підвищення середньої рівноважної концентрації загального SN-38 на 37% (0,98 [95% ДІ: 0,94‒1,02] та 1,29 [95% ДІ: 1,11‒1,5] нг/мл відповідно) порівняно з тими, в кого вихідний показник білірубіну становив < 1 мг/дл (n=329); однак, впливу підвищеного вмісту АЛТ/АСТ на концентрацію загального SN-38 не спостерігалося. Дані для пацієнтів із рівнем загального білірубіну більш ніж удвічі вищим за ВМН відсутні.
Інші особливі категорії пацієнтів
Вік і стать. Популяційний фармакокінетичний аналіз у пацієнтів віком від 28 до 87 років, 11% з яких були ≥ 75 років, дозволяє припустити, що вік не має клінічно значущого впливу на концентрацію іринотекану та SN-38.
Популяційний фармакокінетичний аналіз у 196 пацієнтів чоловічої статі та 157 ‒ жіночої дозволяє припустити, що стать не має клінічно значущого впливу на концентрацію іринотекану та SN-38 після коригування на BSA.
Раса. Популяційний фармакокінетичний аналіз дозволяє припустити, що азіатські пацієнти мають на 56% нижчу середню рівноважну концентрацію загального іринотекану (3,93 [95% ДІ: 3,68‒4,2] та 1,74 [95% ДІ: 1,58‒1,93] мг/л відповідно) та на 8% вищу середню рівноважну концентрацію загального SN-38 (0,97 [95% ДІ: 0,92‒1,03] та 1,05 [95% ДІ: 0,98‒1,11] нг/мл відповідно), ніж пацієнти європеоїдної раси.
Зв’язок між фармакокінетикою та фармакодинамікою. В аналізі сукупних даних 353 пацієнтів вищий рівень Cmax SN-38 у плазмі асоціювався з підвищеною ймовірністю виникнення нейтропенії, а вищий рівень Cmax загального іринотекану ‒ діареї.
У клінічному дослідженні щодо ефективності ОНІВАЙД® пегильований ліпосомальний вищі концентрації загального іринотекану та SN-38 у плазмі у пацієнтів групи лікування препаратами ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ були пов’язані з довшим періодом ЗВ та ВБП, а також більшою ЧОВ.
Показання Онівайд пегильований ліпосомальний
Лікування метастатичної аденокарциноми підшлункової залози в комбінації з 5-фторурацилом (5-ФУ) та лейковорином (ЛВ) у дорослих пацієнтів із прогресуванням захворювання після терапії на основі гемцитабіну.
Застосування Онівайд пегильований ліпосомальний
Призначення та введення пацієнтам лікарського засобу ОНІВАЙД® пегильований ліпосомальний повинно здійснюватися виключно медичними спеціалістами, які мають досвід проведення протипухлинної терапії.
ОНІВАЙД® пегильований ліпосомальний не є еквівалентним неліпосомальним формам іринотекану і не повинен замінюватись.
Дозування
ОНІВАЙД® пегильований ліпосомальний, лейковорин і 5-фторурацил вводяться послідовно. Рекомендована доза та схема застосування препарату ОНІВАЙД® пегильований ліпосомальний: 70 мг/м2 внутрішньовенно впродовж 90 хвилин із наступним введенням лейковорину в дозі 400 мг/м2 внутрішньовенно протягом 30 хвилин та 5-ФУ по 2 400 мг/м2 внутрішньовенно впродовж 46 годин — через кожні 2 тижні. ОНІВАЙД® пегильований ліпосомальний не застосовується як монотерапія.
У пацієнтів, гомозиготних за алелями UGT1A1*28, слід розпочинати лікування зі зниженої початкової дози препарату ОНІВАЙД® пегильований ліпосомальний до 50 мг/м2 (див. розділи «Побічні реакції» та «Фармакодинаміка») з можливим наступним підвищенням дози до 70 мг/м2, за умови доброї переносимості лікування.
Премедикація. Щонайменше за 30 хвилин до початку інфузії препарату ОНІВАЙД® пегильований ліпосомальний пацієнтам рекомендована премедикація стандартними дозами дексаметазону (або еквівалентного кортикостероїду) разом з антагоністом 5-HT3 (або іншим протиблювотним засобом).
Корекція дози. Всі коригування дози слід здійснювати з огляду на попередній найвищий ступінь токсичності. Доза лейковорину не потребує коригування. Для 1-го та 2-го ступеня токсичності коригування дози не рекомендується. Рекомендації щодо корекції дози для 3-го та 4-го ступеня токсичності, пов’язаного із ОНІВАЙД® пегильований ліпосомальний, наведені у табл. 3 і 4. Пацієнтам, які починають лікування із дози ОНІВАЙД® пегильований ліпосомальний 50 мг/м2 та не підвищують до 70 мг/м2, рекомендоване перше зниження дози до 43 мг/м2 та друге — до 35 мг/м2. Хворим, які потребують наступного зниження дози, рекомендовано припинити лікування. Пацієнтам гомозиготним за алелями UGT1A1*28, в яких протягом першого циклу терапії відсутні токсичні прояви, пов’язані з ОНІВАЙД® пегильований ліпосомальний (знижена доза – 50 мг/м2), можливе збільшення дози до загальної 70 мг/м2 у наступних циклах залежно від індивідуальної переносимості.
Таблиця 3: Рекомендації щодо корекції дози препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ для 3 – 4-го ступеня токсичності у негомозиготних пацієнтів за алелем UGT1A1*28
| Ступінь токсичності (значення) за NCI СТСАЕ ред. 4.01 | Коригування дози препаратів ОНІВАЙД® пегильований ліпосомальний/5-ФУ (для негомозиготних пацієнтів за алелем UGT1A1*28) | |
| Гематологічні симптоми токсичності | ||
| Нейтропенія | Не починати новий цикл терапії до досягнення абсолютної кількості нейтрофілів ≥1 500 клітин/мм3 | |
| Ступінь 3 або 4 (< 1 000 клітин/мм3) або фебрильна нейтропенія | Перший випадок | Знизити дозу ОНІВАЙД® пегильованийліпосомальний до 50 мг/м2 Знизити дозу 5-ФУ на 25% (1 800 мг/м2) |
| Другий випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 43 мг/м2 Знизити дозу 5-ФУ додатково на 25% (1 350 мг/м2) | |
| Третій випадок | Припинити лікування | |
| Тромбоцитопенія Лейкопенія | Не починати новий цикл терапії до досягнення кількості тромбоцитів ≥ 100 тис./мм3 Коригування дози при лейкопенії та тромбоцитопенії базуються на класифікації токсичності NCI СТСАЕ та аналогічні рекомендованим вище при нейтропенії | |
| Негематологічні симптоми токсичності2 | ||
| Діарея | Не починати новий цикл терапії до зменшення тяжкості діареї до ≤ 1-го ступеня (на 2–3 випорожнення за добу більше, ніж до початку лікування) | |
| Ступінь 2 | Не починати новий цикл терапії до зменшення тяжкості діареї до ≤ 1-го ступеня (на 2–3 випорожнення за добу більше, ніж до початку лікування) | |
| Ступінь 3 або 4 | Перший випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 50 мг/м2 Знизити дозу 5-ФУ на 25% (1 800 мг/м2) |
| Другий випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 43 мг/м2 Знизити дозу 5-ФУ додатково на 25% (1 350 мг/м2) | |
| Третій випадок | Припинити лікування | |
| Нудота/блювання | Не починати новий цикл терапії до зменшення тяжкості нудоти/блювання до ≤ 1-го ступеня або до вихідного показника | |
| Ступінь 3 або 4 (незважаючи на терапію протиблювотним препаратом) | Перший випадок | Оптимізувати терапію протиблювотним препаратом Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 50 мг/м2 |
| Другий випадок | Оптимізувати терапію протиблювотним препаратом Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 43 мг/м2 | |
| Третій випадок | Припинити лікування | |
| Токсичні прояви з боку печінки, нирок, органів дихання або інших органів2 ступеня 3 або 4 | Не починати повий цикл терапії до зменшення тяжкості побічних реакцій до ≤ 1-го ступеня | |
| Перший випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 50 мг/м2 Знизити дозу 5-ФУ на 25% (1 800 мг/м2) | |
| Другий випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 43 мг/м2 Знизити дозу 5-ФУ додатково на 25% (1 350 мг/м2) | |
| Третій випадок | Припинити лікування | |
| Анафілактична реакція | Перший випадок | Припинити лікування |
1 NCI СТСАЕ ред. 4.0 = Загальні термінологічні критерії небажаних явищ Національного інституту раку США в редакції 4.0.
2 За винятком астенії та анорексії; астенія та 3-го ступеня анорексія не потребують коригування дози.
Таблиця 4: Рекомендації щодо корекції дози препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ для 3 – 4-го ступеня токсичності у гомозиготних пацієнтів за алелем UGT1A1*28
| Ступінь токсичності (значення) за NCI СТСАЕ ред. 4.01 | Коригування дози ОНІВАЙД® пегильований ліпосомальний/5-ФУ (для гомозиготних пацієнтів за алелем UGT1A1*28 без попереднього збільшення дози3 до 70 мг/м2) | |
| Побічні реакції2 ступеня 3 або 4 | Не починати новий цикл терапії до зменшення тяжкості небажаних явищ до ≤1-го ступеня | |
| Перший випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 43 мг/м2 Коригування дози 5-ФУ згідно з табл. 3 | |
| Другий випадок | Знизити дозу ОНІВАЙД® пегильований ліпосомальний до 35 мг/м2 Коригування дози 5-ФУ згідно з табл. 3 | |
| Третій випадок | Припинити лікування | |
1 NCI СТСАЕ ред. 4.0 = Загальні термінологічні критерії небажаних явищ Національного інституту раку США в ред. 4.0.
2 За винятком астенії та анорексії; астенія та 3-го ступеня анорексія не потребують коригування дози.
3 У разі підвищення дози ОНІВАЙД® пегильований ліпосомальний до 70 мг/м2 та хорошої переносимості у наступних циклах лікування, рекомендоване коригування дози згідно з табл. 3.
Особливі категорії пацієнтів
Порушення функції печінки. Спеціальні дослідження з оцінки ОНІВАЙД® пегильований ліпосомальний при порушенні функції печінки не проводили. Застосування даного лікарського засобу слід уникати у пацієнтів із рівнем білірубіну > 2,0 мг/дл, або рівнем аспартатамінотрансферази (AСT) та аланінамінотрансферази (AЛT) у > 2,5 рази вищим за ВМН або у > 5 разів вищим ВМН у разі наявності печінкових метастаз (див. розділ «Особливості застосування»).
Порушення функції нирок. Спеціальні дослідження з оцінки ОНІВАЙД® пегильований ліпосомальний при порушенні функції нирок не проводили. У пацієнтів із порушенням функції нирок від легкого до помірного ступеня тяжкості коригування дози не потрібне (див. розділи «Особливості застосування» та «Фармакокінетика»). Не рекомендовано застосовувати ОНІВАЙД® пегильований ліпосомальний у пацієнтів із порушенням функції нирок тяжкого ступеня (CLcr < 30 мл/хв).
Пацієнти літнього віку. Програма клінічних досліджень з оцінки ОНІВАЙД® пегильований ліпосомальний включала 41% пацієнтів літнього віку ≥ 65 років. Коригування дози не рекомендоване.
Спосіб застосування
ОНІВАЙД® пегильований ліпосомальний призначений для внутрішньовенного застосування. Концентрат перед введенням слід розвести та використовувати у вигляді однократної внутрішньовенної інфузії впродовж 90 хвилин. Більше інформації наведено в підрозділі «Приготування та введення дисперсії».
Приготування та введення дисперсії. ОНІВАЙД® пегильований ліпосомальний постачається у вигляді стерильної ліпосомальної дисперсії в концентрації 4,3 мг/мл і його необхідно розводити перед введенням за допомогою голки калібром не більше 21. Препарат розводять 5%-им розчином глюкози для ін’єкцій або розчином натрію хлориду 9 мг/мл (0,9%) для ін’єкцій для приготування дисперсії відповідної дози препарату ОНІВАЙД® пегильований ліпосомальний, розведеного до кінцевого об’єму 500 мл. Розведену дисперсію перемішують, обережно перевертаючи флакон. Розведена дисперсія повинна бути від прозорого до злегка білого кольору, або злегка опалесцентною та не містити видимих часток. ОНІВАЙД® пегильований ліпосомальний застосовують перед введенням ЛВ, після чого вводять 5-ФУ. ОНІВАЙД® пегильований ліпосомальний не слід вводити у вигляді болюсної ін’єкції чи нерозведеної дисперсії.
Під час приготування інфузії необхідно дотримуватися асептичних методик. ОНІВАЙД® пегильований ліпосомальний призначений тільки для одноразового застосування.
Слід дотримуватися обережності для уникнення екстравазації та перевіряти місце ін’єкції на наявність ознак запалення. У випадку екстравазації рекомендується промити уражене місце розчином натрію хлориду 9 мг/мл (0,9%) для ін’єкцій та/або стерильною водою та прикласти лід.
Для ознайомлення з умовами зберігання після розведення лікарського засобу див. розділ «Термін придатності».
Невикористаний лікарський засіб або витратні матеріали необхідно утилізувати відповідно до місцевого законодавства.
Запобіжні заходи при поводженні з лікарським засобом або при його застосуванні
ОНІВАЙД® пегильований ліпосомальний – цитотоксичний лікарський засіб. При поводженні з препаратом або при його застосуванні рекомендовано використовувати рукавички, захисні окуляри та захисний одяг. Вагітні медичні спеціалісти не повинні розводити чи вводити ОНІВАЙД® пегильований ліпосомальний.
ДІТИ.
Безпека та ефективність препарату ОНІВАЙД® пегильований ліпосомальний у дітей та підлітків віком ≤ 18 років наразі не встановлено. Дані відсутні.
Протипоказання
Тяжка гіперчутливість в анамнезі до іринотекану або до будь-якої допоміжної речовини.
Годування грудьми (див. розділ «Застосування у період вагітності або годування груддю»).
ОСОБЛИВІ ЗАСТЕРЕЖЕННЯ ТА ЗАПОБІЖНІ ЗАХОДИ ПРИ ЗАСТОСУВАННІ.
ОНІВАЙД® пегильований ліпосомальний є цитотоксичним лікарським засобом і при поводженні з ним слід дотримуватися обережності. При поводженні з препаратом ОНІВАЙД® пегильований ліпосомальний або при його введенні рекомендовано застосовувати захисні рукавички, захисні окуляри та захисний одяг. При потраплянні дисперсії на шкіру, шкіру слід негайно та ретельно промити водою з милом. У разі потрапляння дисперсії на слизові оболонки, слід ретельно промити їх водою. Враховуючи цитотоксичну природу лікарського засобу ОНІВАЙД® пегильований ліпосомальний, вагітні медичні спеціалісти не повинні з ним контактувати.
Побічна дія
Резюме профілю безпеки
Профіль безпеки за даними клінічного дослідження NAPOLI-1. Наведені нижче побічні реакції, які можуть бути пов’язаними із застосуванням ОНІВАЙД® пегильований ліпосомальний, спостерігалися у 264 пацієнтів з метастатичною аденокарциномою підшлункової залози, 147 з яких отримували монотерапію даним препаратом (100 мг/м2), а 117 – ОНІВАЙД® пегильований ліпосомальний (70 мг/м2) у комбінації з 5-ФУ/ЛВ.
Найбільш частими побічними реакціями (частота ≥ 20%) при застосуванні комбінації препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ були: діарея, нудота, блювання, зниження апетиту, нейтропенія, втома, астенія, анемія, стоматит і пірексія. Найбільш частими серйозними побічними реакціями (≥ 2%) при терапії препаратом ОНІВАЙД® пегильований ліпосомальний були: діарея, блювання, фебрильна нейтропенія, нудота, пірексія, сепсис, дегідратація, септичний шок, пневмонія, гостра ниркова недостатність і тромбоцитопенія.
Побічні реакції, які призвели до відміни лікування, складали 11% при застосовуванні комбінації лікарських засобів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ та 12% – монотерапії препаратом ОНІВАЙД® пегильований ліпосомальний.
Найчастіше повідомлялося про наступні побічні реакції, які спричинили відміну лікування: інфекція та діарея – при застосуванні препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ та блювання і діарея – при монотерапії препаратом ОНІВАЙД® пегильований ліпосомальний.
Перелік побічних реакцій
Побічні реакції на основі даних досліджень та досвіду постмаркетингового застосування. Побічні реакції, які можуть виникати під час лікування препаратом ОНІВАЙД® пегильований ліпосомальний, наведено нижче та класифіковано за класами систем органів згідно з MedDRA і частотою їх виникнення*. В межах кожного класу систем органів та частоти виникнення побічні реакції представлені в порядку зниження серйозності. Частота визначається таким чином: дуже часто (≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1 000 до < 1/100), рідко (від ≥ 1/10 000 до < 1/1 000)* та частота невідома (не можна визначити за наявними даними).
Побічні реакції, про які повідомлялося при застосуванні терапії препаратом ОНІВАЙД® пегильований ліпосомальний
Інфекції та інвазії: часто: септичний шок, сепсис, пневмонія, фебрильна нейтропенія, гастроентерит, оральний кандидоз; нечасто: біліарний сепсис.
З боку системи крові та лімфатичної системи: дуже часто: нейтропенія, лейкопенія, анемія, тромбоцитопенія; часто: лімфопенія.
З боку імунної системи: нечасто: гіперчутливість; частота невідома: анафілактичні/анафілактоїдні реакції, ангіоневротичний набряк.
З боку метаболізму та обміну речовин: дуже часто: гіпокаліємія, гіпомагніємія, дегідратація, зниження апетиту; часто: гіпоглікемія, гіпонатріємія, гіпофосфатемія.
З боку психіки: часто: безсоння.
З боку нервової системи: дуже часто: запаморочення; часто: холінергічний синдром, дисгевзія.
З боку серця: часто: гіпотензія.
З боку судинної системи: часто: легенева емболія, емболія, тромбоз глибоких вен; нечасто: тромбоз.
З боку респіраторної системи, органів грудної клітки та середостіння: часто: задишка, дисфонія; нечасто: гіпоксія.
З боку шлунково-кишкового тракту: дуже часто: діарея, блювання, нудота, біль в абдомінальній ділянці, стоматит; часто: коліт, геморой; нечасто: езофагіт, проктит.
З боку гепатобіліарної системи: часто: гіпоальбумінемія.
З боку шкіри та підшкірної клітковини: дуже часто: алопеція; часто: свербіж; нечасто: кропив’янка, висипання, макулопапульозний висип, зміна забарвлення нігтів; частота невідома: еритема.
З боку нирок та сечовивідних шляхів: часто: гостра ниркова недостатність.
Загальні розлади та реакції в місці введення: дуже часто: пірексія, периферичний набряк, запалення слизових оболонок, втома, астенія; часто: реакція, пов’язана з інфузією, набряк.
Результати лабораторних та інструментальних досліджень: дуже часто: зниження маси тіла; часто: підвищення рівня білірубіну, підвищення рівня аланінамінотрансферази, підвищення рівня аспартатамінотрансферази, збільшення міжнародного нормалізованого коефіцієнта.
* У дослідженні NAPOLI-1 рідкі випадки не можуть бути визначені через невеликий розмір вибірки
Опис деяких побічних реакцій
Побічні реакції, які спостерігалися у клінічному дослідженні NAPOLI-1, наведені нижче.
Мієлосупресія. Мієлосупресія (нейтропенія/лейкопенія, тромбоцитопенія та анемія) була більш частою в групі пацієнтів, які застосовувала ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ порівняно з контрольною групою, що отримувала 5-ФУ/ЛВ.
Нейтропенія/лейкопенія. Нейтропенія/лейкопенія була найбільш помітним важливим проявом гематологічної токсичності. Нейтропенія ≥ 3-го ступеня тяжкості частіше спостерігалася у пацієнтів, які отримували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ (27,4%), порівняно з тими, які лікувалися 5-ФУ/ЛВ (1,5%). Нейтропенічна лихоманка/сепсис частіше спостерігалися у хворих, які застосовували комбінацію препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ (у 4 пацієнтів; 3,4%), порівняно з контрольною групою, що застосовувала 5-ФУ/ЛВ (у 1 пацієнта; 0,7%).
Тромбоцитопенія. Тромбоцитопенія ≥ 3-го ступеня тяжкості виникала у 2,6% пацієнтів, які отримували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, та 0% тих, що лікувалися 5-ФУ/ЛВ.
Анемія. Анемія ≥ 3-го ступеня тяжкості виникала у 10,3% пацієнтів, які застосовували ОНІВАЙД®пегильований ліпосомальний + 5-ФУ/ЛВ, та у 6,7% пацієнтів, які отримували лікування 5-ФУ/ЛВ.
Гостра ниркова недостатність. Порушення функції нирок та гостра ниркова недостатність зазвичай спостерігалися у пацієнтів зі зменшенням об’єму міжклітинної рідини через нудоту/блювання та/або діарею. Гостра ниркова недостатність мала місце у 6 зі 117 пацієнтів (5,1%), які застосовували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, у 10 зі 147 (6,8%) на монотерапії препаратом ОНІВАЙД® пегильований ліпосомальний та у 6 зі 134 (4,5%) у групі 5-ФУ/ЛВ.
Діарея та пов’язані з нею побічні реакції. Діарея – це дуже часта побічна реакція, що призводить до розвитку коліту, непрохідності кишечника, гастроентериту, втоми, дегідратації, втрати маси тіла, нефротоксичності, гіпонатріємії та гіпокаліємії. Порушення функції нирок і гостру ниркову недостатність зазвичай спостерігали у пацієнтів зі зменшенням об’єму міжклітинної рідини через нудоту/блювання та/або діарею тяжкого ступеня. У клінічному дослідженні діарея 3-го або 4-го ступеня тяжкості мала місце у 15 зі 117 пацієнтів (12,8%) які отримували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ. Для пацієнтів, у яких виникала відстрочена діарея, середній час до її початку складав 8 днів з моменту застосування попередньої дози препарату ОНІВАЙД® пегильований ліпосомальний. Рання діарея розвивалася переважно протягом ≤ 24 годин після введення дози та зазвичай минала. Рання діарея може супроводжуватися холінергічними симптомами, які можуть включати риніт, підвищене слиновиділення, приливи, підвищене потовиділення, брадикардію, міоз і гіперперистальтику, що може спричинити абдомінальні спазми. У клінічному дослідженні рання діарея виникала у 35 пацієнтів (29,9%), а холінергічні події — у 4 пацієнтів (3,4%), які отримували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ.
При діареї 2‒4-го ступеня тяжкості слід відкласти застосування препарату ОНІВАЙД® пегильований ліпосомальний та почати лікування діареї. Після зменшення тяжкості діареї до 1-го ступеня застосування препарату ОНІВАЙД® пегильований ліпосомальний відновлюють у зниженій дозі (див. розділ «Спосіб застосування та дози»).
Реакція, пов’язана з інфузією. Про гострі інфузійні реакції повідомлялося у 8 зі 117 пацієнтів (6,8%), які застосовували ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, у 3 зі 147 (2,0%) на монотерапії препаратом ОНІВАЙД® пегильований ліпосомальний та у 8 зі 134 (6,0%) у групі 5-ФУ/ЛВ.
Інші особливі групи пацієнтів
Пацієнти літнього віку. Загалом не повідомлялося про значущі клінічні відмінності безпеки та ефективності між пацієнтами віком ≥ 65 років та < 65 років. Проте у дослідженні NAPOLI-1 спостерігалася більша частота припинення лікування (14,8% та 7,9% відповідно) в групі, яка отримувала ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, і в деяких випадках побічні реакції не минали. Побічні реакції 3-го ступеня або вище та серйозні побічні реакції, пов’язані з лікуванням, були частішими у пацієнтів віком < 65 років (84,1% та 50,8% відповідно) порівняно з пацієнтами віком ≥ 65 років (68,5% та 44,4% відповідно). І навпаки, у дослідженні аденокарциноми підшлункової залози, у пацієнтів віком > 75 років (n=12) частіше спостерігалися серйозні побічні реакції, відстрочення застосування, зменшення дози та припинення лікування порівняно з пацієнтами віком ≤ 75 років (n=105) під час лікування препаратами ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ.
Азіатська популяція. Порівняно з пацієнтами європеоїдної раси, у пацієнтів азійського походження спостерігалося менше випадків діареї [у 14 (19,2%) із 73 пацієнтів європеоїдної раси та у 1 з 33 (3,3%) пацієнтів азійського походження спостерігалася діарея ≥ 3-го ступеня], але більше випадків та більш тяжкий ступінь тяжкості нейтропенії. У пацієнтів, які отримували препарати ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, частота нейтропенії ≥ 3-го ступеня тяжкості була вищою серед пацієнтів азійського походження (18 із 33; 55%) порівняно з пацієнтами європеоїдної раси (13 із 73; 18%). Нейтропенічна лихоманка/нейтропенічний сепсис спостерігалися у 6% пацієнтів азійського походження порівняно з 1% таких європеоїдної раси. Це узгоджується з популяційним фармакокінетичним аналізом, який продемонстрував нижчу концентрацію іринотекану та вищу концентрацію його активного метаболіту SN-38 у пацієнтів азійського походження, ніж у пацієнтів європеоїдної раси.
Пацієнти з порушенням функції печінки. В ході клінічних досліджень по вивченню неліпосомальних форм іринотекану при застосуванні за тижневою схемою застосування, у пацієнтів із помірно підвищеним вихідним рівнем загального білірубіну сироватки крові (1,0 – 2,0 мг/дл) ймовірність виникнення нейтропенії першого циклу 3-го або 4-го ступеня тяжкості була значно більшою порівняно з пацієнтами, у яких вихідний рівень білірубіну був менше 1,0 мг/дл.
Пацієнти з операцією Віппла в анамнезі. У клінічному дослідженні з оцінки застосування препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ у пацієнтів з операцією Віппла в анамнезі був вищий ризик виникнення серйозних інфекцій після лікування даною комбінацією [9 з 29 (30%)] порівняно з 11 із 88 (12,5%) пацієнтами, яким попередньо не проводили операцію Віппла.
Пацієнти гомозиготні за алелем UGT1A1. Особи з гомозиготністю 7/7 за алелем UGT1A1*28 мають підвищений ризик розвитку нейтропенії через застосування неліпосомальних форм іринотекану. В клінічному дослідженні оцінки ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ, частота нейтропенії ≥ 3-го ступеня тяжкості у таких пацієнтів (2 із 7; 28,6%) була аналогічною показнику у негомозиготних пацієнтів за алелем UGT1A1*28, які отримували початкову дозу препарату ОНІВАЙД® пегильований ліпосомальний 70 мг/м2 (30 зі 110; 27,3%) (див. розділ «Фармакодинаміка»).
Пацієнти зі зниженою масою тіла (індекс маси тіла < 18,5 мг/м2). У клінічному дослідженні оцінки ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ у 5 з 8 пацієнтів зі зниженою вагою спостерігалися побічні реакції 3-го або 4-го ступеня, переважно мієлосупресія. У 7 із 8 випадків була потрібна корекція дози (відстрочення, зменшення дози чи припинення застосування препарату (див. розділ «Особливості застосування»)).
Повідомлення про підозрювані побічні реакції. Повідомляти про підозрювані побічні реакції після реєстрації лікарського засобу важливо. Це дасть змогу продовжувати моніторинг співвідношення користь/ризик лікарського засобу. Спеціалісти у галузі охорони здоров’я зобов’язані повідомляти про будь-які випадки підозрюваних побічних реакцій через національну систему повідомлень.
Особливості застосування
Загальні. ОНІВАЙД® пегильований ліпосомальний — це ліпосомальна форма іринотекану з іншими фармакокінетичними властивостями порівняно з неліпосомальною формою іринотекану. Концентрація дози та сила дії відрізняються порівняно з неліпосомальними формами іринотекану.
ОНІВАЙД® пегильований ліпосомальний не є еквівалентним іншим неліпосомальним формам іринотекану і не повинен замінюватись.
В обмеженої кількості пацієнтів, у яких попередньо застосовували неліпосомальні форми іринотекану, не було продемонстровано переваг препарату ОНІВАЙД® пегильований ліпосомальний.
Мієлосупресія/нейтропенія. Під час лікування ОНІВАЙД® пегильований ліпосомальний рекомендовано проводити моніторинг розгорнутого аналізу крові. Пацієнтів слід попередити про ризик нейтропенії та серйозність лихоманки. Середній час максимального зниження рівня нейтрофілів нейтропенії ≥ 3-го ступеня становить 23 дні (діапазон — від 8 до 104) після застосування першої дози ОНІВАЙД® пегильований ліпосомальний. Фебрильну нейтропенію (температура тіла > 38°C та кількості нейтрофілів ≤ 1 тис. клітин/мм3) слід негайно лікувати в умовах стаціонару за допомогою внутрішньовенних антибіотиків широкого спектра дії. Потрібно відкласти застосування ОНІВАЙД® пегильований ліпосомальний при виникненні нейтропенічної лихоманки чи зменшенні абсолютної кількості нейтрофілів < 1 500 клітин/мм3. У пацієнтів із метастатичною аденокарциномою підшлункової залози, які отримували терапію препаратом ОНІВАЙД® пегильований ліпосомальний, спостерігалися випадки сепсису з нейтропенічною лихоманкою та наступним септичним шоком із летальним наслідком.
Пацієнтам, у яких виникали тяжкі гематологічні явища, рекомендовано знизити дозу чи припинити лікування (див. розділ «Спосіб застосування та дози»). Пацієнтам із тяжкою недостатністю кісткового мозку не слід застосовувати ОНІВАЙД® пегильований ліпосомальний.
Опромінення черевної порожнини в анамнезі підвищує ризик тяжкої та фебрильної нейтропенії при лікуванні препаратом ОНІВАЙД® пегильований ліпосомальний. Рекомендовано провести ретельний моніторинг кількості клітин крові та розглянути можливість застосування мієлоїдних факторів росту у пацієнтів з опроміненням черевної порожнини в анамнезі. У пацієнтів, які проходять курс опромінення з одночасним застосуванням препарату ОНІВАЙД® пегильований ліпосомальний, необхідно дотримуватися обережності.
Пацієнти з недостатньою глюкуронідацією білірубіну, наприклад, із синдромом Жильбера, можуть знаходитись в групі вищого ризику мієлосупресії під час застосування препарату ОНІВАЙД® пегильований ліпосомальний.
Азіатські пацієнти, порівняно з пацієнтами європеоїдної раси, мають підвищений ризик тяжкої та фебрильної нейтропенії після лікування препаратами ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ (див. розділи «Побічні реакції» та «Фармакокінетика»).
Імуносупресивний ефект і вакцини. Застосування живих або живих ослаблених вакцин у пацієнтів з імунодефіцитом внаслідок застосування хіміотерапевтичних лікарських засобів, включно з ОНІВАЙД® пегильований ліпосомальний, може призвести до розвитку серйозних або летальних інфекцій; отже, вакцинації живими вакцинами слід уникати. Дозволено вводити «вбиті» або інактивовані вакцини, однак відповідь на такі засоби може бути послаблена.
Взаємодія з індукторами CYP3A4 сильної дії. ОНІВАЙД® пегильований ліпосомальний не слід застосовувати одночасно з індукторами ферменту CYP3A4 сильної дії, такими як протисудомні препарати (фенітоїн, фенобарбітал або карбамазепін), рифампін, рифабутин та звіробій, за винятком відсутності терапевтичних альтернатив. Відповідну початкову дозу для пацієнтів, які приймають такі протисудомні препарати або інші індуктори сильної дії, не встановлено. Необхідно розглянути можливість заміни цих лікарських засобів на такі, що не індукують фермент, щонайменше за два тижні до початку терапії ОНІВАЙД® пегильований ліпосомальний (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Взаємодія з інгібіторами CYP3A4 сильної дії чи інгібіторами UGT1A1 сильної дії. ОНІВАЙД® пегильований ліпосомальний не слід застосовувати одночасно з інгібіторами ферменту CYP3A4 сильної дії (наприклад грейпфрутовий сік, кларитроміцин, індинавір, ітраконазол, лопінавір, нефазодон, нелфінавір, ритонавір, саквінавір, телапревір, вориконазол). Використання інгібіторів CYP3A4 сильної дії потрібно припинити щонайменше за один тиждень до початку терапії препаратом ОНІВАЙД® пегильований ліпосомальний.
ОНІВАЙД® пегильований ліпосомальний не слід застосовувати одночасно з інгібіторами UGT1A сильної дії (наприклад атазанавір, гемфіброзил, індинавір), за винятком відсутності терапевтичних альтернатив.
Діарея. При застосуванні ОНІВАЙД® пегильований ліпосомальний може виникати рання (через ≤ 24 годин після початку використання) або відстрочена діарея (> 24 годин) (див. розділ «Побічні реакції»). Якщо виникає рання діарея, слід розглянути можливість терапевтичного та профілактичного застосування атропіну за відсутності протипоказань. Пацієнтів слід попередити про ризик відстроченої діареї, яка може бути виснажливою та, в рідкісних випадках, небезпечною для життя, оскільки постійні рідкі чи водянисті випорожнення можуть призвести до дегідратації, порушення електролітного балансу, коліту, виразок шлунково-кишкового тракту (ШКТ), інфекції чи сепсису.
Щойно виникають перші рідкі випорожнення, пацієнту слід почати пити велику кількість рідини, що містить електроліти. Пацієнти повинні мати в наявності лоперамід (або аналогічний препарат) для початку лікування відстроченої діареї. Застосування лопераміду слід розпочинати при першій появі недостатньо сформованих чи рідких випорожнень або ж частіших випорожнень, ніж зазвичай. Лоперамід слід застосовувати доки у пацієнта буде відсутня діарея протягом щонайменше 12 годин. Якщо при застосуванні лопераміду діарея триває понад 24 години, слід розглянути можливість застосування додаткового перорального антибіотика (наприклад фторхінолону протягом 7 днів). Лоперамід не слід застосовувати понад 48 годин поспіль через ризик паралітичної непрохідності кишечника. Якщо діарея триває більш ніж 48 годин, необхідно припинити застосування лопераміду, контролювати й підтримувати рівень електролітів за допомогою рідини та продовжувати застосування антибіотика до зникнення супутніх симптомів.
Лікування препаратом ОНІВАЙД® пегильований ліпосомальний слід відкласти до зменшення тяжкості діареї до ≤ 1-го ступеня (на 2‒3 випорожнення за добу більше, ніж до початку терапії). ОНІВАЙД® пегильований ліпосомальний не рекомендовано застосовувати у пацієнтів із непрохідністю кишечника та хронічним запальним захворюванням кишечника, поки вони не будуть вилікувані. При появі діареї 3-го або 4-го ступеня тяжкості наступну дозу препарату ОНІВАЙД® пегильований ліпосомальний необхідно зменшити (див. розділ «Спосіб застосування та дози»).
Холінергічні реакції. Рання діарея може супроводжуватися холінергічними симптомами, такими як риніт, підвищене слиновиділення, приливи, підвищене потовиділення, брадикардія, міоз і гіперперистальтика. У разі виникнення холінергічних симптомів слід застосовувати атропін.
Гострі інфузійні та пов’язані реакції. У пацієнтів, які застосовували ОНІВАЙД® пегильований ліпосомальний, повідомлялося про інфузійні реакції, переважно такі як висипання, кропив’янка, періорбітальний набряк або свербіж. Вперше виявлені явища (всі 1-го або 2-го ступеня) виникали переважно на початку лікування препаратом ОНІВАЙД® пегильований ліпосомальний, при цьому лише 2 з 10 пацієнтів повідомляли про такі явища після п’ятої дози. Можуть виникати реакції гіперчутливості, включаючи гостру інфузійну реакцію, анафілактичні/анафілактоїдні реакції та ангіоневротичний набряк. У випадку тяжких реакцій гіперчутливості застосування препарату ОНІВАЙД® пегильований ліпосомальний необхідно припинити.
Попередня операція Віппла. Пацієнти з операцією Віппла в анамнезі мають підвищений ризик розвитку серйозних інфекцій після застосування ОНІВАЙД® пегильований ліпосомальний у комбінації з 5-ФУ та ЛВ (див. розділ «Побічні реакції»). Пацієнтів слід контролювати на наявність ознак інфекції.
Порушення з боку судин. Застосування ОНІВАЙД® пегильований ліпосомальний було пов’язано з тромбоемболічними епізодами, такими як легенева емболія, венозний тромбоз та артеріальна тромбоемболія. Слід ретельно зібрати медичний анамнез для виявлення осіб із численними факторами ризику на додаток до основної пухлини. Пацієнтів потрібно попередити про ознаки й симптоми тромбоемболії та порекомендувати негайно звернутися до лікаря чи медсестри при появі таких ознак або симптомів.
Легенева токсичність. У пацієнтів, які отримували неліпосомальні форми іринотекану, виникали епізоди, подібні до інтерстиціального захворювання легень (ІЗЛ), що призводили до летальних наслідків. Під час клінічних досліджень при застосуванні ОНІВАЙД® пегильований ліпосомальний не повідомлялося про жодні випадки ІЗЛ-подібних епізодів. До факторів ризику належать захворювання легень в анамнезі, використання пневмотоксичних лікарських засобів, колонієстимулюючі фактори або попередня радіотерапія. У хворих із факторами ризику слід ретельно пильнувати наявність респіраторних симптомів до та під час терапії препаратом ОНІВАЙД® пегильований ліпосомальний. Ретикулонодулярна картина на рентгенограмі грудної клітки спостерігалася у невеликого відсотка пацієнтів, які брали участь у клінічному дослідженні з іринотеканом. Вперше виявлена або прогресуюча задишка, кашель та лихоманка повинні стати підставою для переривання лікування препаратом ОНІВАЙД® пегильований ліпосомальний до отримання діагностичної оцінки. У пацієнтів з підтвердженим діагнозом ІЗЛ необхідно припинити застосування ОНІВАЙД® пегильований ліпосомальний.
Порушення функції печінки. У пацієнтів із гіпербілірубінемією спостерігалося більш високі концентрації загального SN-38 (див. розділ «Фармакокінетика») та, отже, підвищений ризик нейтропенії. У пацієнтів із показником загального білірубіну 1,0–2,0 мг/дл слід здійснювати регулярний контроль результатів розгорнутого аналізу крові. Необхідно дотримуватися обережності у пацієнтів із порушенням функції печінки (рівень білірубіну в > 2 рази вище за ВМН; рівень трансаміназ у > 5 разів вище за ВМН). ОНІВАЙД® пегильований ліпосомальний у комбінації з іншими гепатотоксичними лікарськими засобами, особливо за наявності порушення функції печінки, слід застосовувати під пильною увагою.
Порушення функції нирок. Застосування ОНІВАЙД® пегильований ліпосомальний у пацієнтів із порушенням функції нирок тяжкого ступеня не вивчали (див. розділ «Фармакокінетика»).
Пацієнти з недостатньою масою тіла (індекс маси тіла < 18,5 кг/м2). У клінічному дослідженні з оцінки препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ у 5 з 8 пацієнтів з недостатньою масою тіла спостерігалися побічні реакції 3-го або 4-го ступеня, переважно мієлосупресія, тоді як у 7 із 8 випадків було потрібне коригування дози, таке як відстрочення, зменшення дози чи припинення застосування препарату. ОНІВАЙД® пегильований ліпосомальний у пацієнтів з індексом маси тіла < 18,5 кг/м2 слід застосовувати з обережністю.
Допоміжні речовини. В одному флаконі даного лікарського засобу міститься 33,1 мг натрію, що еквівалентно 1,65% рекомендованої ВООЗ максимальної добової норми споживання 2 г натрію у дорослих.
ЗАСТОСУВАННЯ У ПЕРІОД ВАГІТНОСТІ АБО ГОДУВАННЯ ГРУДДЮ.
Жінки репродуктивного віку/контрацепція для жінок та чоловіків. Жінки репродуктивного віку повинні застосовувати ефективні методи контрацепції під час лікування препаратом ОНІВАЙД® пегильований ліпосомальний та протягом 7 місяців після його завершення. Чоловіки мають користуватися презервативами під час терапії препаратом ОНІВАЙД® пегильований ліпосомальний та впродовж 4 місяців після її завершення.
Вагітність. Даних щодо застосування ОНІВАЙД® пегильований ліпосомальний у вагітних жінок недостатньо. В дослідженнях на тваринах іринотекан продемонстрував ембріотоксичність і тератогенність, тому можна припустити, що при застосуванні препарату ОНІВАЙД® пегильований ліпосомальний під час вагітності ймовірна шкідлива дія на плід. Отже, з огляду на результати досліджень на тваринах та механізму дії іринотекану, ОНІВАЙД® пегильований ліпосомальний не слід застосовувати під час вагітності, за винятком випадків крайньої необхідності. При застосуванні ОНІВАЙД® пегильований ліпосомальний під час вагітності або якщо пацієнтка завагітніла під час терапії, її слід проінформувати про потенційний ризик для плода.
Годування груддю. Невідомо, чи проникає ОНІВАЙД® пегильований ліпосомальний або його метаболіти у грудне молоко людини. Через потенційний ризик розвитку серйозних побічних реакцій у немовлят, які перебувають на грудному вигодовуванні, лікування препаратом ОНІВАЙД® пегильований ліпосомальний під час годування груддю протипоказане (див. розділ «Протипоказання»). Пацієнткам не слід годувати груддю протягом одного місяця після застосування останньої дози.
Фертильність. Немає даних щодо впливу препарату ОНІВАЙД® пегильований ліпосомальний на фертильність людини. Дослідження на тваринах продемонстровали, що неліпосомальні форми іринотекану спричиняли атрофію чоловічих та жіночих репродуктивних органів після застосування багатократних добових доз іринотекану. Перед початком застосування препарату ОНІВАЙД® пегильований ліпосомальний доцільно надати поради пацієнту щодо збереження гамет.
ЗДАТНІСТЬ ВПЛИВАТИ НА ШВИДКІСТЬ РЕАКЦІЇ ПРИ КЕРУВАННІ АВТОТРАНСПОРТОМ АБО ІНШИМИ МЕХАНІЗМАМИ.
ОНІВАЙД® пегильований ліпосомальний має помірний вплив на швидкість реакції при керуванні автотранспортом або іншими механізмами. Під час лікування пацієнти мають дотримуватися обережності при керуванні автотранспортом або іншими механізмами.
Взаємодія з іншими лікарськими засобами
Інформація про лікарські взаємодії з ОНІВАЙД® пегильований ліпосомальний ґрунтується на даних наукової літератури щодо неліпосомальних форм іринотекану.
Взаємодії, що впливають на застосування препарату ОНІВАЙД® пегильований ліпосомальний
Індуктори CYP3A4 сильної дії. У пацієнтів, які одночасно отримують неліпосомальну форму іринотекану та протисудомні засоби, що індукують фермент CYP3A4 (фенітоїн, фенобарбітал або карбамазепін), спостерігається значне зниження концентрації іринотекану (зниження показника AUC на 12% при застосуванні звіробою, на 57%‒79% при застосуванні фенітоїну, фенобарбіталу або карбамазепіну) та SN-38 (зниження показника AUC на 42% при застосуванні звіробою, на 36%‒92% при застосуванні фенітоїну, фенобарбіталу або карбамазепіну). Тому, одночасне застосування ОНІВАЙД® пегильований ліпосомальний з індукторами CYP3A4 може знизити його системну концентрацію.
Інгібітори CYP3A4 та інгібітори UGT1A1 сильної дії. У пацієнтів, які одночасно отримують неліпосомальну форму іринотекану та кетоконазол, інгібітори CYP3A4 та UGT1A1, спостерігається підвищена концентрація SN-38 на 109%. Тому, одночасне застосування препарату ОНІВАЙД® пегильований ліпосомальний з іншими інгібіторами CYP3A4 (наприклад грейпфрутовий сік, кларитроміцин, індинавір, ітраконазол, лопінавір, нефазодон, нелфінавір, ритонавір, саквінавір, телапревір, вориконазол) може підвищити його системну концентрацію. З огляду на лікарську взаємодію неліпосомальної форми іринотекану та кетоконазолу, одночасне застосування ОНІВАЙД® пегильований ліпосомальний з іншими інгібіторами UGT1A1 (наприклад азатанавір, гемфіброзил, індинавір) також може підвищувати його системну концентрацію.
Ґрунтуючись на результатах популяційного фармакокінетичного аналізу, одночасне застосування препаратів ОНІВАЙД® пегильований ліпосомальний + 5-ФУ/ЛВ не змінює фармакокінетики препарату ОНІВАЙД® пегильований ліпосомальний.
Антинеопластичні засоби (включаючи флуцитозин як похідне 5-ФУ). Побічні реакції іринотекану, такі як мієлосупресія, можуть посилюватись іншими антинеопластичними засобами, що мають подібний профіль побічних реакцій.
Взаємодії ОНІВАЙД® пегильований ліпосомальний з іншими лікарськими засобами не встановлені.
Передозування
У клінічних дослідженнях ОНІВАЙД® пегильований ліпосомальний застосовувався в дозах до 210 мг/м2 у пацієнтів із різними видами злоякісних пухлин. Побічні реакції у таких пацієнтів були аналогічні тим, про які повідомлялося при застосуванні рекомендованих доз та режимів дозування.
Повідомлялося про передозування неліпосомальними формами іринотекану в дозах, які приблизно вдвічі перевищують рекомендовану терапевтичну дозу іринотекану, що може мати летальні наслідки. Найбільш значні побічні реакції, про які повідомлялося, включали тяжку нейтропенію та тяжку діарею.
Не існує відомого антидоту на випадок передозування препаратом ОНІВАЙД® пегильований ліпосомальний. Необхідно розпочати максимально ефективну підтримуючу терапію для попередження дегідратації через діарею та розпочати лікування будь-яких інфекційних ускладнень.
ТЕРМІН ПРИДАТНОСТІ.
Невідкупорений флакон. 3 роки.
Після розведення. Хімічну та фізичну стабільність розведеної дисперсії для інфузій було продемонстровано при температурі 15°C ‒ 25°C протягом періоду до 6 годин або в холодильнику (2°C ‒ 8°C) впродовж не більше ніж 24 годин. Із мікробіологічного погляду препарат слід використати негайно. Якщо препарат не було застосовано негайно, відповідальність за умови та тривалість зберігання несе користувач.
Умови зберігання
Зберігати в холодильнику (2°C ‒ 8°C). Не заморожувати. Зберігати флакон у зовнішній картонній упаковці для захисту від світла. Зберігати у недоступному для дітей місці.
Умови зберігання препарату після розведення див. розділ «Термін придатності».
НЕСУМІСНІСТЬ.
ОНІВАЙД® пегильований ліпосомальний не слід змішувати одночасно з іншими лікарськими засобами, окрім тих що зазначено у «Приготування та введення дисперсії».
