Вендіол таблетки, вкриті плівковою оболонкою 0,06 мг + 0,015 мг блістер №28
Вендіол інструкція із застосування
Склад
Допоміжні речовини: лактози моногідрат, целюлоза мікрокристалічна (тип 102), калію полакрилін, магнію стеарат;
плівкова оболонка: опадрай ІІ жовтий 31К32378, лактози моногідрат, гіпромелоза (тип 2910), титану діоксид (Е 171), триацетин, барвник хіноліновий жовтий (Е 104).
Гестоден - 0,06 мг
Етинілестрадіол - 0,015 мг
Фармакологічні властивості
фармакодинаміка. Монофазний комбінований пероральний контрацептив (КПК).
Індекс Перля з урахуванням некоректного застосування: 0,24 (21521 цикл), 95% довірчий інтервал 0,04–0,57.
Контрацептивний ефект препарату Вендіол забезпечується трьома взаємодоповнюючими механізмами:
— вплив на гіпоталамо-гіпофізарну систему шляхом пригнічення овуляції;
— вплив на цервікальний слиз робить його непроникним для сперматозоїдів;
— вплив на ендометрій погіршує умови для імплантації плідного яйця.
Фармакокінетика
Етинілестрадіол
Всмоктування. Перорально прийнятий етинілестрадіол швидко і повністю всмоктується. Після прийому 15 мкг максимальна сироваткова концентрація 30 пг/мл досягається в інтервалі 1–1,5 год. Етинілестрадіол зазнає ефекту першого проходження через печінку з великою індивідуальною варіабельністю. Абсолютна біодоступність становить приблизно 45%.
Розподіл. Уявний обʼєм розподілу етинілестрадіолу становить 15 л/кг, причому зв’язування з білками плазми крові становить приблизно 98%. Етинілестрадіол індукує синтез глобуліну, що звʼязує статеві гормони (ГЗСГ), і кортикостероїдзвʼязуючого глобуліну (КЗГ) у печінці. У процесі лікування із застосуванням 15 мкг етинілестрадіолу концентрація ГЗСГ у плазмі крові збільшується з 86 до приблизно 200 нмоль/л.
Метаболізм. Етинілестрадіол повністю метаболізується (плазмовий кліренс метаболітів становить приблизно 10 мл/хв/кг). Метаболіти виводяться із сечею (40%) і калом (60%).
Виведення. Т½ етинілестрадіолу становить приблизно 15 год. Лише невелика частина етинілестрадіолу виводиться у незміненому вигляді. Метаболіти етинілестрадіолу виводяться з організму з сечею і жовчю у співвідношенні 4/6.
Рівноважний стан. Рівноважний стан досягається у другій половині циклу, коли сироваткові концентрації етинілестрадіолу підвищуються в 1,4–2,1 раза.
Гестоден
Всмоктування. Перорально прийнятий гестоден швидко і повністю всмоктується. Абсолютна біодоступність становить приблизно 100%. Після прийому одноразової дози 60 мкг максимальна сироваткова концентрація 2 нг/мл досягається приблизно через 1 год. Концентрація у плазмі крові сильно залежить від рівня ГЗСГ.
Розподіл. Уявний обʼєм розподілу становить 1,4 л/кг після прийому одноразової дози 60 мкг. 30% гестодену звʼязується з альбуміном плазми крові, 50–70% звʼязується з ГЗСГ.
Метаболізм. Гестоден повністю метаболізується. Метаболічний кліренс становить приблизно 0,8 мл/хв/кг після одноразового прийому 60 мкг. Неактивні метаболіти виділяються з сечею (60%) і калом (40%).
Виведення. Очікуваний Т½ становить приблизно 13 год. Т½ збільшується до 20 год, якщо гестоден застосовувати разом з етинілестрадіолом.
Рівноважний стан. Після повторного прийому комбінації гестоден/етинілестрадіол сироваткові концентрації підвищуються у 2–4 рази.
Показання Вендіол
гормональна пероральна контрацепція.
Приймаючи рішення про призначення Вендіолу, необхідно враховувати поточні фактори ризику для окремої жінки, особливо фактори ризику венозної тромбоемболії (ВТЕ), і те, наскільки високим є ризик ВТЕ при застосуванні Вендіолу порівняно з іншими комбінованими гормональними контрацептивами (див. ПРОТИПОКАЗАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Застосування Вендіол
для перорального застосування.
Як приймати Вендіол. Таблетки необхідно ковтати цілими, не розжовуючи, при необхідності запиваючи невеликою кількістю рідини щодня приблизно в один і той самий час у порядку, зазначеному на блістерній упаковці. Слід приймати одну таблетку на добу (бажано в один і той самий час доби) протягом 28 днів поспіль (по 1 жовтій таблетці на добу протягом 24 днів, потім — по 1 зеленій таблетці плацебо на добу наступні 4 дні) без перерви між прийняттям таблеток з наступної упаковки. Кровотеча відміни зазвичай починається через 2–3 дні після прийому останньої таблетки, що містить активну речовину і може тривати до початку прийому таблеток з нової упаковки.
Як почати прийом препарату Вендіол.
Якщо у попередній місяць гормональну контрацепцію не проводили. Прийом таблеток слід розпочинати в 1-й день природного менструального циклу (тобто в 1-й день менструальної кровотечі).
Перехід з іншого КПК, вагінального кільця або трансдермального пластиру. Прийом препарату Вендіол найкраще починати одразу на наступний день після прийому останньої активної таблетки (останньої таблетки, що містить активну речовину) попереднього контрацептивного препарату, але ні в якому разі не пізніше наступного дня після звичайної перерви у прийомі таблеток чи після прийому плацебо-таблеток попереднього контрацептивного препарату. У разі застосування трансдермального пластиру або вагінального кільця жінка повинна розпочати прийом препарату у день видалення, але ні в якому разі не пізніше дня, коли необхідно вводити нове кільце або наклеювати наступний пластир.
Перехід із контрацептивів, що містять лише прогестагени (міні-пілі, інʼєкції, імплантат), або внутрішньоматкової системи (ВМС), що вивільняє прогестаген. Перехід із міні-пілі можливий у будь-який час, з імплантата чи внутрішньоматкової системи — у день їх видалення, з інʼєкцій — у день, коли необхідно зробити наступну інʼєкцію, але в усіх цих випадках необхідно використовувати додатково барʼєрний метод контрацепції протягом перших 7 днів прийому препарату Вендіол.
Застосування після аборту у I триместр вагітності. Жінка може розпочати приймати препарат негайно. У цьому випадку використання додаткових контрацептивних методів не потрібно.
Застосування після пологів або аборту у II триместр вагітності. Прийом препарату Вендіол слід розпочати між 21-м і 28-м днем після пологів або аборту під час II триместру. Якщо жінка розпочне прийом пізніше, то необхідно застосовувати додатково барʼєрний метод контрацепції протягом перших 7 днів прийому таблеток. Однак якщо статевий контакт відбувся до початку прийому препарату, необхідно виключити вагітність перед початком застосування контрацептивного препарату, або жінка повинна дочекатися своєї першої менструації.
Пропуск прийому таблеток.
Ефективність контрацепції може бути знижена, якщо жовта таблетка не була прийнята, особливо на початку упаковки.
При запізненні у прийомі таблетки на менше ніж 12 год контрацептивний захист не порушується. Таблетку необхідно прийняти негайно, як тільки жінка згадає про пропущену таблетку, наступну таблетку слід прийняти у звичайний час.
При запізненні у прийомі таблетки жовтого кольору на більше ніж 12 год контрацептивний захист не гарантується.
У цьому випадку необхідно керуватися такими двома основними правилами.
1. Прийом таблеток ніколи не слід переривати на більше ніж 4 дні.
2. Для досягнення необхідного пригнічення системи гіпоталамус — гіпофіз — яєчники потрібний 7-денний період безперервного прийому таблеток.
Відповідно до зазначених вище правил рекомендується наступне.
1–7-й дні прийому препарату. Жінка повинна прийняти останню пропущену таблетку одразу, як тільки вона згадає про це, навіть якщо це буде означати прийом одночасно двох таблеток. Після цього таблетки слід приймати у звичний час. Додатково протягом наступних 7 днів слід використовувати барʼєрний метод контрацепції, наприклад презерватив. Якщо жінка жила статевим життям у попередні 7 днів, необхідно враховувати можливість виникнення вагітності. Чим більша кількість пропущених таблеток і чим ближче пропуск до перерви у прийомі препарату, тим вищий ризик настання вагітності.
8–14-й дні прийому препарату. Жінка повинна прийняти останню пропущену таблетку одразу ж, як тільки вона згадає про це, навіть якщо це означатиме прийом одночасно двох таблеток. Після цього таблетки слід приймати у звичний час. Якщо таблетки приймали регулярно протягом 7 днів перед першою пропущеною таблеткою, додаткових контрацептивних заходів не потрібно. Якщо жінка приймала таблетки нерегулярно або пропустила більше однієї таблетки, необхідні додаткові контрацептивні заходи протягом 7 днів.
15–24-й дні прийому препарату. Через майбутню перерву у прийомі таблеток існує високий ризик зниження надійності контрацепції. Однак, незважаючи на це, коригуючи схему прийому препарату, зниженню контрацептивного захисту можна запобігти. Відповідно до вищезгаданих правил необхідність в інших контрацептивних заходах відсутня за умови, якщо жінка правильно приймала таблетки протягом 7 днів до першої пропущеної таблетки. В іншому разі жінка повинна дотримуватися першої рекомендації та застосовувати інші додаткові контрацептивні заходи протягом 7 днів.
1. Жінка повинна прийняти останню пропущену таблетку одразу, як тільки вона згадає про це, навіть якщо це означатиме прийом одночасно двох таблеток. Після цього таблетки слід приймати у звичний час, поки таблетки з активною речовиною не закінчаться. Усі 4 таблетки плацебо останнього ряду не приймаються. Жінка повинна розпочати прийом з наступної упаковки відразу після завершення прийому таблеток з попередньої упаковки. Кровотеча відміни малоймовірна, поки не закінчиться друга упаковка, але можуть відзначатися незначні кровʼянисті виділення або проривні кровотечі у дні прийому препарату.
2. Жінка може також припинити прийом таблеток з поточної упаковки. У цьому випадку необхідно приймати по 1 таблетці плацебо останнього ряду протягом 4 днів, включаючи дні пропуску, потім почати прийом таблеток з нової упаковки.
Якщо жінка забувала приймати таблетки і в період прийому таблеток плацебо та у неї відсутня кровотеча відміни, необхідно виключити вагітність.
Прийом у разі шлунково-кишкових порушень. Якщо у жінки було блювання або діарея, всмоктування може бути неповним, і мають бути застосовані додаткові заходи контрацепції. Якщо блювання виникло протягом 3–4 год після прийому препарату, необхідно прийняти додаткову таблетку якомога раніше, але не пізніше ніж через 12 год від звичайного часу прийому. Якщо пройшло більше 12 год, слід орієнтуватися на рекомендації при пропуску таблетки (див. ЗАСТОСУВАННЯ Прийом пропущених таблеток). Якщо жінка не бажає змінювати звичайний графік прийому препарату, вона повинна прийняти додаткову таблетку, починаючи нову упаковку.
Зміна дня початку менструального циклу. Якщо жінка хоче відстрочити день початку менструальної кровотечі, вона повинна розпочати прийом препарату Вендіол з наступної упаковки, пропустивши прийом плацебо-таблеток. Продовжувати прийом препарату з наступної упаковки можливо так довго, як бажає жінка (аж до закінчення таблеток в упаковці). У цей період можуть виникати проривні кровотечі або мажучі виділення. Після прийому плацебо-таблеток жінка повинна відновити регулярний прийом препарату Вендіол.
Якщо жінка хоче перенести початок кровотечі на інший день тижня, то слід скоротити період прийому плацебо-таблеток на стільки днів, на скільки вона хоче. Чим коротший цей інтервал, тим вищий ризик відсутності кровотечі відміни і появи проривних кровотеч і мажучих виділень під час прийому другої упаковки (так само, як і в разі перенесення початку кровотечі).
Інформація щодо особливих груп пацієнтів.
Пацієнтки літнього віку. Препарат Вендіол не показаний після менопаузи.
Пацієнтки з печінковою недостатністю. Препарат Вендіол протипоказаний для застосування жінкам із печінковою недостатністю тяжкого ступеня (див. ПРОТИПОКАЗАННЯ).
Пацієнти з нирковою недостатністю. Препарат Вендіол не досліджували у пацієнтів із нирковою недостатністю.
Діти. Препарат не призначений для застосування дітям.
Протипоказання
КПК не слід застосовувати в нижченаведених випадках. При появі будь-якого з цих станів під час застосування КПК слід негайно припинити його прийом:
— підвищена чутливість до діючих речовин або будь-якої з допоміжних речовин (див. СКЛАД);
— наявність або ризик венозної тромбоемболії (ВТЕ);
• венозна тромбоемболія — наявна ВТЕ (застосування антикоагулянтів) або ВТЕ в анамнезі (наприклад тромбоз глибоких вен (ТГВ) або тромбоемболія легеневої артерії (ТЕЛА));
• відома спадкова або набута схильність до венозної тромбоемболії, наприклад, резистентність до активованого протеїну С (АПС, у тому числі фактор V Лейдена), недостатність антитромбіну III, недостатність протеїну C, недостатність протеїну S;
• значне хірургічне втручання з тривалою іммобілізацією (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ);
• високий ризик ВТЕ внаслідок наявності множинних факторів ризику (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ);
— наявність або ризик артеріальної тромбоемболії (АТЕ);
• АТЕ — наявна АТЕ, АТЕ в анамнезі (наприклад інфаркт міокарда) або продромальний стан (наприклад стенокардія);
• цереброваскулярна хвороба — наявний інсульт, інсульт в анамнезі, продромальний стан (наприклад транзиторна ішемічна атака (ТІА);
• відома спадкова або набута схильність до АТЕ, наприклад, гіпергомоцистеїнемія та антифосфоліпідні антитіла (антикардіоліпінові антитіла, вовчаковий антикоагулянт);
• мігрень з вогнищевими неврологічними симптомами в анамнезі;
• високий ризик АТЕ внаслідок множинних факторів ризику (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ) або наявності будь-якого із зазначених нижче серйозних факторів ризику:
– цукровий діабет із судинними ускладненнями;
– тяжка АГ;
– тяжка дисліпідемія;
— встановлена або можлива вагітність;
— наявність злоякісного новоутворення молочних залоз або підозра на нього;
— карцинома ендометрія або наявність будь-якої іншої естрогензалежної пухлини чи підозра на неї;
— наявність пухлин печінки (доброякісних або злоякісних) або такі пухлини в анамнезі, тяжкі захворювання печінки (поки функція печінки не відновиться);
— тяжка ниркова недостатність або ГНН;
— кровотеча з піхви нез’ясованої етіології;
— наявність панкреатиту або панкреатит в анамнезі, якщо він пов’язаний з тяжкою гіпертригліцеридемією.
Протипоказано одночасне застосування препарату Вендіол і лікарських засобів, що містять омбітасвір/паритапревір/ритонавір і дасабувір, та лікарських засобів, що містять глекапревір/пібрентасвір або софосбувір/велпатасвір/воксилапревір (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Побічна дія
при застосуванні КПК були виявлені наступні побічні реакції.
Серйозні побічні реакції — див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Застосування будь-яких КПК підвищує ризик ВТЕ. Інформацію про ризики відповідно до типу КПК і ризику артеріальних тромбозів — див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
У клінічних дослідженнях аменорея була виявлена у 15% пацієнток (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Найчастішими побічними реакціями, про які повідомляли пацієнтки у III фазі клінічних досліджень і в постмаркетинговому періоді, були головний біль, мігрень, кровотечі та мажучі кровʼянисті виділення.
Також такі побічні реакції були виявлені при застосуванні КПК (таблиця 1):
| Клас системи органів | Часто (≥1/100–<1/10) | Нечасто(≥1/1 000–<1/100) | Поодинокі (≥1/10 000–<1/1000) | Рідко (<1/10 000) | Частота невідома (частоту неможливо оцінити за наявними даними) |
| Інфекційні та паразитарні захворювання | Вагініт, у тому числі вагінальний кандидоз | ||||
| Доброякісні, злоякісні та неуточнені новоутворення (у тому числі кісти та поліпи) | Доброякісні пухлини печінки і гепатоцелюлярна карцинома | ||||
| З боку імунної системи | Анафілактичні/ анафілактоїдні реакції, рідко — кропивʼянка, ангіоневротичний набряк, недостатність кровообігу, дихальна недостатність | Погіршення перебігу системного червоного вовчака | Загострення симптомів спадкового та набутого ангіоневротичного набряку | ||
| Розлади метаболізму та харчування | Зниження або підвищення апетиту, дисліпідемія (у тому числі гіпертригліцеридемія) | Порушення толерантності до глюкози | Погіршення перебігу порфірії | ||
| Психічні розлади | Перепади настрою, у тому числі депресія, порушення лібідо | ||||
| З боку нервової системи | Тривожність, запаморочення, головний біль | Погіршення перебігу хореї | |||
| З боку органів зору | Непереносимість контактних лінз | Неврит зорового нерва, тромбоз судин сітківки | |||
| З боку судинної системи | АГ, мігрень | ВТЕ/АТЕ | |||
| З боку ШКТ | Нудота, блювання, біль у животі | Спазми, здуття живота | Панкреатит | ||
| З боку гепатобіліарної системи | Холестатична жовтяниця | Жовчнокамʼяна хвороба, холестаз* | |||
| З боку шкіри та підшкірної клітковини | Акне | Висип, хлоазма (мелазма) з імовірністю персистенції, гірсутизм, алопеція | Вузликова еритема | Мультиформна еритема | |
| З боку нирок та сечовивідних шляхів | Гемолітико-уремічний синдром | ||||
| З боку репродуктивної системи і молочних залоз | Болісність молочних залоз, підвищена чутливість молочних залоз, галакторея, дисменорея, виділення з піхви, порушення менструального циклу, ектропіон | ||||
| Загальні розлади та реакції у місці введення | Затримка рідини/набряки | ||||
| Дослідження | Збільшення/зменшення маси тіла | ||||
*КПК можуть погіршити перебіг жовчнокам’яної хвороби та посилити холестаз.
Опис окремих побічних реакцій. Підвищений ризик артеріальних/венозних тромботичних і тромбоемболічних захворювань, включно з інфарктом міокарда, інсультом, ТІА, ТЕЛА відзначають у жінок, які приймають КПК, детальніше — див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Особливості застосування
з обережністю. У разі наявності у жінки будь-якого зі станів або факторів ризику, вказаних нижче, слід обговорити з пацієнткою доцільність застосування препарату Вендіол. У разі погіршання стану або появи будь-яких із вказаних нижче симптомів або факторів ризику жінці рекомендується порадитися зі своїм лікарем, який прийме рішення щодо того, чи потрібно перервати прийом препарату Вендіол.
Порушення кровообігу. Ризик ВТЕ. Застосування будь-якого КПК підвищує ризик ВТЕ порівняно з відсутністю застосування. Препарати, що містять левоноргестрел, норгестимат або норетистерон, пов’язані з нижчим ризиком ВТЕ. Інші препарати, такі як Вендіол, можуть бути пов’язані з удвічі більшим рівнем такого ризику. Рішення про застосування будь-якого препарату замість лікарського засобу з більш низьким ризиком розвитку ВТЕ слід приймати тільки після обговорення з пацієнткою, щоб переконатися, що вона розуміє ризик ВТЕ при застосуванні КПК, усвідомлює вплив існуючих факторів ризику на ймовірність виникнення ВТЕ, а також те, що ризик ВТЕ є найвищим протягом першого року застосування препарату. Існують також деякі свідчення того, що цей ризик збільшується при повторному призначенні КПК після перерви у застосуванні протягом ≥4 тиж.
Приблизно у 2 із 10 тис. жінок, які не застосовують КПК і не є вагітними, розвивається ВТЕ протягом одного року. Однак у будь-якої окремої жінки ризик може бути набагато вищим залежно від існуючих факторів ризику (див. інформацію нижче).
За оцінками1, у 9–12 жінок з 10 тис., які застосовують КПК, що містять гестоден, розвивається ВТЕ протягом одного року; це можна порівняти із приблизно 6 випадками2 у жінок, які застосовують КПК, що містять левоноргестрел.
В обох випадках частота ВТЕ на рік є нижчою, ніж частота ВТЕ, очікувана у період вагітності або післяпологовий.
ВТЕ може призводити до летального наслідку у 1–2% випадків.
1Ці випадки були виявлені у результаті загальновживаного епідеміологічного дослідження, проведеного з використанням різних КПК, що містять левоноргестрел (використані відносні ризики).
2Середній показник у діапазоні 5–7 на 10 тис. жінок для КПК, що містять левоноргестрел, порівняно з контрольною групою 2,3–3,6.
Кількість випадків ВТЕ у 10 тис. жінок на рік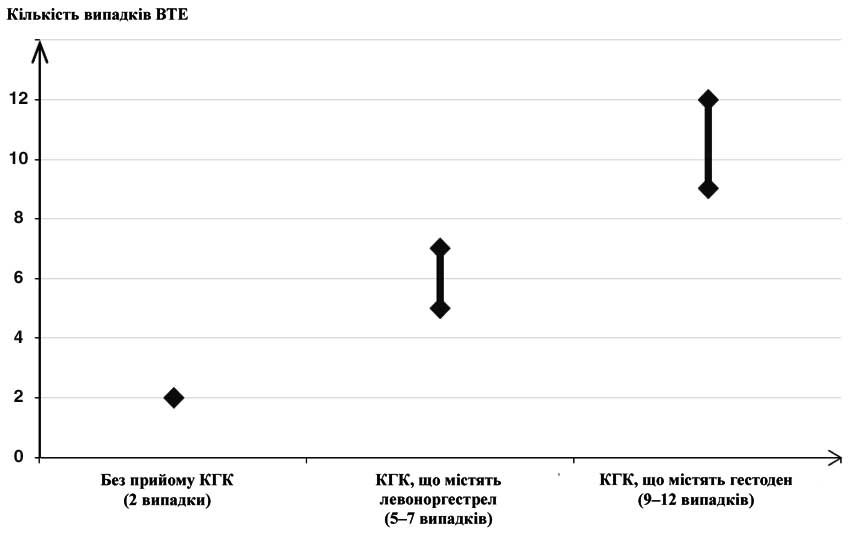
Серед жінок, які застосовують КПК, дуже рідко спостерігався тромбоз інших кровоносних судин, наприклад печінкових, мезентеріальних, ниркових вен сітківки та артерій.
Фактори ризику ВТЕ. Ризик венозних тромбоемболічних ускладнень серед тих, хто застосовує КПК, може бути істотно вищим при наявності додаткових факторів ризику, особливо якщо є множинні фактори ризику (табл. 2).
Вендіол протипоказаний жінкам із множинними факторами ризику, їх наявність говорить про високу імовірність ВТЕ (див. ПРОТИПОКАЗАННЯ). Наявність більше одного фактора ризику може збільшувати імовірність ВТЕ більш значущо, ніж сума деяких індивідуальних чинників, у такому випадку імовірність ВТЕ повинна бути ретельно розрахована. Якщо ризик розвитку ускладнень перевищує користь від застосування, то КПК не слід призначати (див. ПРОТИПОКАЗАННЯ).
Таблиця 2. Фактори ризику для ВТЕ
| Фактор ризику | Коментар |
| Ожиріння (індекс маси тіла (ІМТ) >30 кг/м2). | Ризик зростає зі збільшенням ІМТ. Особливо істотно для жінок, які мають додаткові фактори ризику |
| Тривала іммобілізація, серйозні хірургічні втручання, операції на нижніх кінцівках і тазу, нейрохірургічні операції або значна травма. Примітка: тимчасова іммобілізація, в тому числі авіаперельоти тривалістю більше 4 год, також є фактором ризику ВТЕ, особливо при наявності інших факторів ризику | У даних випадках рекомендується припинити застосування пластиру/таблетки/кільця (у разі планової операції не менше ніж за 4 тиж) і не відновлювати раніше, ніж через 2 тиж після повного відновлення рухового режиму. Необхідно використовувати інший метод контрацепції з метою запобігання небажаної вагітності. Повинна бути розглянута можливість антитромботичної терапії, якщо використання Вендіолу не було припинено раніше |
| Обтяжений сімейний анамнез (випадки ВТЕ у братів, сестер або батьків, особливо у відносно ранньому віці, до 50 років) | При підозрі на спадкову схильність необхідно проконсультуватися з лікарем перед застосуванням будь-якого КПК |
| Інші стани, що призводять до ВТЕ | Рак, системний червоний вовчак, гемолітико-уремічний синдром, хронічні запальні захворювання кишечнику (хвороба Крона або виразковий коліт) та серпоподібно-клітинна анемія |
| Збільшення віку | Особливо вік від 35 років |
Немає єдиної думки щодо можливого впливу варикозного розширення вен та поверхневого тромбофлебіту на початок або прогресування венозного тромбозу.
Слід враховувати ризик тромбоемболії у період вагітності, зокрема протягом 6-тижневого періоду після пологів (інформація щодо застосування у період вагітності або годування грудьми наведена в розділі Застосування у період вагітності або годування грудьми).
Симптоми ВТЕ (ТГВ і ТЕЛА). У разі появи симптомів жінці рекомендується негайно звернутися за медичною допомогою та повідомити лікарю, що вона приймає КПК.
Симптоми ТГВ можуть включати:
– однобічний набряк ноги та/або стопи чи ділянки уздовж вени на нозі;
– біль або підвищена чутливість у нозі, що може відчуватися тільки при стоянні або ходьбі;
– відчуття жару в ураженій нозі; почервоніння або зміна кольору шкіри на нозі.
Симптоми ТЕЛА можуть включати:
– раптову задишку з нез’ясованої причини або прискорене дихання;
– раптовий кашель, можливо, з кровохарканням;
– гострий біль у грудях;
– тяжку сплутаність або запаморочення;
– швидке або нерегулярне серцебиття.
Деякі з цих симптомів (наприклад задишка, кашель) є неспецифічними та можуть бути неправильно інтерпретовані як більш поширені або менш тяжкі явища (наприклад інфекції дихальних шляхів).
Інші ознаки оклюзії судин можуть включати раптовий біль, набряк і появу синюватого кольору кінцівки.
Симптоми оклюзії судини ока можуть варіювати від безболісної розмитості зору, яка може прогресувати до втрати зору. Іноді втрата зору може виникати майже миттєво.
Ризик АТЕ. Епідеміологічні дослідження пов’язують застосування КПК із підвищеним ризиком АТЕ (інфаркту міокарда) або порушенням мозкового кровообігу (наприклад ТІА, інсульту). Артеріальні тромбоемболічні ускладнення можуть мати летальні наслідки.
Фактори ризику для АТЕ. Ризик артеріальних тромбоемболічних ускладнень або порушення мозкового кровообігу серед пацієнток, які приймають КПК, зростає у жінок, які мають фактори ризику (табл. 3). Вендіол протипоказаний, якщо пацієнтка має один серйозний фактор ризику або декілька факторів ризику АТЕ, які призводять до високого ризику розвитку артеріального тромбозу (див. ПРОТИПОКАЗАННЯ). Якщо у жінки наявний більше ніж один фактор ризику, можливо, що підвищення ризику буде більшим, ніж сума окремих факторів — у цьому випадку слід зважити загальний ризик АТЕ для пацієнтки. Якщо співвідношення користі та ризику вважається негативним, не слід призначати КПК (див. ПРОТИПОКАЗАННЯ).
Таблиця 3. Фактори ризику для АТЕ
| Фактор ризику | Коментар |
| Вік | У віці 35 років ризик істотно зростає |
| Паління | Жінкам слід порадити не палити, якщо планують використовувати КПК. Жінкам віком від 35 років, які продовжують палити, наполегливо рекомендується використовувати інші методи контрацепції |
| АГ | |
| Ожиріння (ІМТ >30 кг/м²) | Ризик зростає зі збільшенням ІМТ. Особливо істотно для жінок, які мають додаткові фактори ризику |
| Обтяжений сімейний анамнез (випадки артеріального тромбозу у братів, сестер або батьків, особливо у відносно ранньому віці, до 50 років) | При підозрі на спадкову схильність необхідно проконсультуватися з лікарем перед застосуванням будь-якого КПК |
| Мігрень | Збільшення частоти і тяжкості нападів мігрені при застосуванні КПК (може передувати цереброваскулярним порушенням) є підставою для негайного припинення застосування |
| Інші стани, пов’язані з пов’язані з несприятливими судинними захворюваннями | Цукровий діабет, гіпергомоцистеїнемія, захворювання серцевих клапанів і миготлива аритмія, дисліпопротеїнемія, системний червоний вовчак |
Симптоми АТЕ. У разі появи симптомів жінці рекомендується негайно звернутися за медичною допомогою та повідомити лікарю, що вона приймає КПК.
Симптоми порушення мозкового кровообігу можуть включати:
– раптове оніміння або слабкість обличчя, руки чи ноги, особливо однобічні;
– раптове порушення ходьби, запаморочення, втрату рівноваги або координації;
– раптову сплутаність свідомості, порушення мовлення чи сприйняття;
– раптове погіршання зору одного або обох очей;
– раптовий тяжкий або тривалий головний біль без визначеної причини;
– непритомність або зомління із судомами або без них.
Минущі симптоми вказують на ТІА.
Симптоми інфаркту міокарда можуть включати:
– біль, дискомфорт, відчуття стиснення, важкості, відчуття стиснення або важкості у грудях, руці або нижче груднини;
– відчуття дискомфорту, що віддає у спину, щелепу, горло, руку, шлунок;
– відчуття переповнення шлунка, порушення травлення або задуха;
– підвищене потовиділення, нудота, блювання або запаморочення;
– надзвичайна слабкість, тривожність або задишка;
– швидке або нерегулярне серцебиття.
Рак у гінекології. У деяких епідеміологічних дослідженнях вказується на збільшення ризику раку шийки матки у жінок, які тривалий час приймають КПК (більше 5 років), проте як і раніше, є суперечливі дані про залежність раку шийки матки від сексуальної поведінки та інших чинників, таких як вірус папіломи людини (ВПЛ).
Метааналіз 54 епідеміологічних досліджень свідчить про незначне підвищення відносного ризику (ВР 1,24) розвитку раку молочної залози у жінок, які застосовують КПК. Цей підвищений ризик поступово зникає протягом 10 років після припинення застосування КПК. Оскільки рак молочної залози рідко виникає у жінок віком до 40 років, збільшення кількості випадків діагностування раку молочної залози у жінок, які застосовують або нещодавно застосовували пероральні контрацептиви, є незначним відносно рівня загального ризику раку молочної залози протягом життя. Результати цих досліджень не надають доказів існування причинно-наслідкового зв’язку. Картина підвищеного ризику може пояснюватися як більш ранньою діагностикою раку молочної залози у жінок, які застосовують КПК, так і біологічною дією КПК або обома факторами. Зафіксовано, що рак молочної залози, виявлений у жінок, які будь-коли приймали КПК, клінічно менш виражений, ніж у тих, які ніколи не застосовували КПК.
При застосуванні високодозних КПК (0,05 мг етинілестрадіолу) знижується ймовірність раку ендометрія і яєчників. Чи стосується це твердження низькодозних КПК, ще належить зʼясувати.
Новоутворення печінки. Є повідомлення про поодинокі випадки доброякісних пухлин і ще більш рідкісні випадки злоякісних пухлин печінки серед жінок, які застосовують КПК. В окремих випадках ці пухлини призводили до внутрішньочеревних кровотеч, що загрожували життю.
Головний біль. Виникнення або загострення мігрені, виникнення незвичайного, повторюваного, тривалого або сильного головного болю вимагає негайного припинення лікування та з’ясування причини.
Інше. Депресивний настрій і депресія є частими побічними реакціями при застосуванні гормональних контрацептивів (див. ПОБІЧНА ДІЯ). Депресія може бути тяжкою і є відомим фактором ризику суїцидальної поведінки та самогубства. Жінок слід інформувати про необхідність звернутися до лікаря у разі перепадів настрою і симптомів депресії, навіть якщо вони виникають невдовзі після початку лікування.
Жінки з гіпертригліцеридемією або обтяженим сімейним анамнезом щодо гіпертригліцеридемії, які застосовують КПК, можуть бути схильні до високого ризику виникнення панкреатиту.
Хоча і повідомлялося про невелике підвищення АТ у жінок, які приймають КПК, клінічно важливі зміни рідкісні. Тільки у таких рідкісних випадках негайне припинення прийому КПК виправдано. Якщо КПК використовують на тлі АГ і спостерігається постійне або значне підвищення АТ, що не піддається адекватній антигіпертензивній терапії, застосування КПК необхідно припинити. Якщо це доцільно, застосування КПК може бути відновлене, якщо за допомогою антигіпертензивної терапії досягнуті нормальні значення АТ.
Такі стани як жовтяниця та/або свербіж, пов’язаний із холестазом, формування каменів у жовчному міхурі, порфірія, системний червоний вовчак, гемолітико-уремічний синдром, хорея Сиденгама, герпес вагітних, втрата слуху, пов’язана з отосклерозом, можуть розвиватися або погіршуватися як при вагітності, так і під час прийому КПК, але причинний зв’язок з їх прийомом доведено не було.
Екзогенні естрогени можуть індукувати або посилювати симптоми спадкового та набутого ангіоневротичного набряку.
Гострі захворювання або загострення хронічних захворювань печінки можуть вимагати припинення застосування КПК, поки показники функції печінки не повернуться до норми. Рецидивуюча холестатична жовтяниця, яка розвинулася вперше під час попередньої вагітності або попереднього прийому статевих гормонів, вимагає припинення прийому КПК.
Хоча КПК можуть впливати на інсулінорезистентність і толерантність до глюкози, немає потреби змінювати терапевтичний режим у хворих на цукровий діабет, які використовують низькодозовані КПК (<0,05 мг етинілестрадіолу). Проте за жінками з цукровим діабетом необхідно ретельно спостерігати під час прийому КПК..
Повідомляється про посилення ендогенної депресії, епілепсії, хвороби Крона і виразкового коліту при застосуванні КПК.
Іноді може виникати хлоазма, особливо у жінок із хлоазмою вагітних в анамнезі. Жінки, схильні до виникнення хлоазми, повинні уникати дії прямих сонячних променів або ультрафіолетового опромінювання під час застосування КПК.
Цей лікарський засіб містить 40,118 мг лактози моногідрату у таблетках з активною речовиною і 37,26 мг лактози безводної у плацебо-таблетках. Пацієнтам із рідкісними спадковими проблемами непереносимості галактози, повним дефіцитом лактази або мальабсорбцією глюкози-галактози не слід приймати цей препарат.
Таблетки плацебо містять барвник жовтий захід (Е110), що може спричиняти алергічні реакції.
Медичний огляд. Перед початком або відновленням застосування препарату Вендіол необхідно ретельно зібрати анамнез (включаючи сімейний анамнез), має бути виключена вагітність. Необхідно виконати вимірювання АТ і провести повне медичне обстеження з урахуванням протипоказань (див. ПРОТИПОКАЗАННЯ) і застережень (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Слід звернути увагу жінки на інформацію про венозний і артеріальний тромбоз, включаючи ризик прийому препарату Вендіол порівняно з іншими КПК, на симптоми ВТЕ і АТЕ, на відомі фактори ризику та дії при підозрі на тромбоз.
Жінка також повинна уважно прочитати інструкцію і дотримуватися даних рекомендацій. Частота і характер таких обстежень повинні ґрунтуватися на існуючих нормах медичної практики, з урахуванням індивідуальних особливостей кожної пацієнтки.
Жінка повинна бути попереджена, що гормональні контрацептиви не захищають від ВІЛ-інфекції (СНІД) та інших інфекцій, що передаються статевим шляхом.
Зниження ефективності. Ефективність КПК може знижуватися у таких випадках: пропущені таблетки (див. ЗАСТОСУВАННЯ), шлунково-кишкові розлади (див. ЗАСТОСУВАННЯ) або одночасне застосування інших препаратів (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Порушення менструального циклу. При застосуванні будь-яких пероральних контрацептивів можуть спостерігатися міжменструальні кровотечі (кровомазання або проривні кровотечі), особливо протягом перших кількох місяців. Зважаючи на це, оцінку нерегулярних міжменструальних кровотеч можна проводити лише після періоду адаптації організму до препарату після трьох циклів застосування таблеток.
Якщо нерегулярні кров’янисті виділення зберігаються після періоду адаптації або з’являються після періоду регулярних циклів, слід розглянути негормональні причини кровотеч та відповідні діагностичні заходи з метою виключення наявності пухлин та вагітності. До діагностичних заходів можна включити кюретаж.
У деяких жінок може не настати менструальна кровотеча під час перерви у прийомі препарату.
У випадку застосування КПК відповідно до інструкцій у розділі ЗАСТОСУВАННЯ вагітність малоймовірна. Проте якщо прийом препарату відбувався нерегулярно або якщо менструальних кровотеч немає протягом двох циклів, то перед продовженням застосування КПК необхідно виключити вагітність.
Застосування у період вагітності або годування грудьми
Вагітність. Вендіол протипоказаний до застосування у період вагітності.
Клінічно, на відміну від діетилстильбестролу, у результаті чисельних епідеміологічних досліджень не було встановлено залежності між ризиком вад розвитку та використанням естрогенів окремо або у комбінації на початку вагітності.
Крім того, ризики для статевого диференціювання плода (особливо жіночої статі), описані для старіших високоандрогенних прогестагенів, не мають бути екстрапольовані на сучасні прогестагени (такі як у цьому лікарському засобі), які мають значно менш виражені андрогенні властивості або не мають їх зовсім.
Таким чином, виявлення вагітності під час прийому препарату, що містить естроген і прогестаген, не потребує переривання вагітності.
Підвищений ризик ВТЕ у післяпологовому періоді має бути враховано при поновленні застосування препарату Вендіол (див. ЗАСТОСУВАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Годування грудьми. КПК можуть впливати на лактацію, зменшуючи кількість і змінюючи склад грудного молока. Застосування цього препарату не рекомендується у період годування грудьми, оскільки естроген і прогестаген проникають у грудне молоко, що може негативно вплинути на дитину.
При бажанні пацієнтки продовжувати грудне вигодовування необхідно рекомендувати інший метод контрацепції.
Здатність впливати на швидкість реакції при керуванні транспортними засобами чи роботі з іншими механізмами. Вендіол не впливає або має незначний вплив на здатність керування транспортними засобами та роботи з механізмами.
Взаємодія з іншими лікарськими засобами
примітка: Слід ознайомитися з інформацією щодо лікарського засобу, що застосовується одночасно, для виявлення потенційних взаємодій.
Фармакодинамічні взаємодії. Під час клінічних досліджень з пацієнтами, які отримували лікарські засоби для лікування інфекцій вірусного гепатиту С (HCV), що містять омбітасвір/паритапревір/ритонавір і дасабувір з рибавірином або без нього, було виявлено підвищення трансамінази (АлАТ) більше ніж у 5 разів вище верхньої межі норми (ВМН). Це відбувалося зі значно більшою частотою у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, зокрема і КПК. Крім того, також у пацієнток, які отримували лікування глекапревіром/пібрентасвіром або софосбувіром/велпатасвіром/воксилапревіром, спостерігалося підвищення АлАТ при прийомі лікарських засобів, що містять етинілестрадіол, таких як КПК (див. ПРОТИПОКАЗАННЯ). Тому пацієнтки, які приймають лікарський засіб Вендіол, повинні перейти на альтернативний метод контрацепції (наприклад, на контрацепцію, що містить тільки прогестаген, або негормональні методи) до початку терапії цими комбінованими лікарськими засобами. Застосування лікарського засобу Вендіол можна відновити через 2 тиж після завершення терапії цими комбінованими схемами лікування.
Фармакокінетичні взаємодії
Вплив інших лікарських засобів на препарат Вендіол. Взаємодії можливі з лікарськими засобами, що індукують мікросомальні ферменти. Це може призвести до збільшення кліренсу статевих гормонів, що може викликати виникнення проривної кровотечі та/або спричиняє втрату ефективності контрацептиву.
Терапія. Індукція ферментів може бути виявлена вже через декілька днів лікування. Максимальна індукція ферментів загалом спостерігається через декілька тижнів. Після відміни лікування індукція ферментів може тривати приблизно 4 тиж.
Короткострокове лікування. Жінки, які приймають лікарські засоби, що індукують ферменти, повинні тимчасово використовувати бар’єрний метод або інший метод контрацепції додатково до КПК. Бар’єрний метод слід використовувати протягом усього терміну лікування відповідним препаратом і ще протягом 28 днів після припинення його застосування.
Якщо терапія препаратом-індуктором розпочинається у період застосування останніх активних таблеток КПК з поточної упаковки, то таблетки плацебо слід викинути, а прийом таблеток з наступної упаковки КПК розпочати одразу після закінчення таблеток у попередній упаковці.
Довгострокове лікування. Жінкам при довгостроковій терапії діючими речовинами, що індукують ферменти печінки, рекомендується інший надійний негормональний метод контрацепції.
Наступні взаємодії були описані в літературі.
Діючі речовини, що збільшують кліренс КПК (зниження ефективності КПК через індукцію ферментів), наприклад барбітурати, бозентан, карбамазепін, фенітоїн, примідон, рифампіцин, і препарати для лікування ВІЛ ритонавір, невірапін і ефавіренз, можливо, також фелбамат, гризеофульвін, окскарбазепін, топірамат та препарати, що містять звіробій продирявлений (Hypericum perforatum).
Існує ризик зниження ефективності контрацепції під час лікування та протягом одного циклу після припинення лікування модафінілом.
Діючі речовини з непостійним впливом на кліренс КПК. При одночасному застосуванні з КПК велика кількість комбінацій інгібіторів ВІЛ-протеази та ненуклеозидних інгібіторів зворотної транскриптази, у тому числі комбінації з інгібіторами ВГС, можуть підвищувати або знижувати концентрації естрогену або прогестинів у плазмі крові. Сукупний вплив таких змін може бути клінічно значущим у деяких випадках.
Тому для виявлення потенційних взаємодій слід ознайомитися з інформацією щодо медичного застосування лікарського засобу для лікування ВІЛ/ВГС, що приймається одночасно, і будь-якими пов’язаними рекомендаціями. За наявності будь-яких сумнівів жінкам додатково слід використовувати бар’єрний метод контрацепції при терапії інгібіторами протеази або інгібіторами ненуклеозидної зворотної транскриптази.
Діючі речовини, що знижують кліренс КПК (інгібітори ферментів). Клінічна значущість потенційної взаємодії з інгібіторами ферментів залишається нез’ясованою.
Одночасне застосування сильних інгібіторів CYP 3A4 може підвищити плазмові концентрації естрогену, прогестину або обох компонентів.
Еторикоксиб у дозах 60–120 мг/добу продемонстрував підвищення плазмових концентрацій етинілестрадіолу у 1,4–1,6 раза відповідно при одночасному застосуванні з комбінованим гормональним контрацептивом, що містить 0,035 мг етинілестрадіолу.
Вплив препарату Вендіол на інші лікарські засоби. КПК можуть впливати на метаболізм деяких інших лікарських засобів. Відповідно, концентрація у плазмі крові та тканинах може збільшуватися (наприклад циклоспорин) або зменшуватися (наприклад ламотриджин).
Клінічні дані свідчать про те, що етинілестрадіол пригнічує кліренс субстратів CYP 1A2, що, зі свого боку, викликає слабке (наприклад при застосуванні теофіліну) або помірне (наприклад при застосуванні тизанідину) підвищення їх плазмових концентрацій.
Лабораторні дослідження. Прийом контрацептивних стероїдів може впливати на результати деяких лабораторних досліджень, включно з біохімічними показниками функції печінки, нирок, щитовидної залози, надниркових залоз, рівнем (транспортних) білків у плазмі крові, таких як кортикостероїдзв’язуючий глобулін, ліпідними/ліпопротеїновими фракціями, показниками вуглеводного обміну і параметрами системи згортання крові та фібринолізу. Зміни зазвичай не виходять за межі норми.
Передозування
ніяких серйозних небажаних ефектів у результаті прийому великих доз КПК не спостерігалося. Загальний досвід застосування КПК свідчить, що такі випадки можуть супроводжуватися наступними симптомами: нудота, блювання, і у молодих дівчат — незначні вагінальні кровотечі.
Не існує специфічного антидоту, тому лікування має бути винятково симптоматичним.
Умови зберігання
при температурі не вище 30 °C в оригінальній упаковці для захисту від впливу світла та вологи.
Препарат зберігати у недоступному для дітей місці.
