Клексан® (Clexane®)
Клексан інструкція із застосування
Склад
діюча речовина: еноксапарин;
1 мл розчину містить еноксапарину натрію* 10 000 анти-Ха МО, що еквівалентно 100 мг еноксапарину натрію*;
1 шприц-доза містить 4000 анти-Ха МО, що еквівалентно 40 мг еноксапарину натрію*;
допоміжна речовина: вода для ін’єкцій.
Еноксапарин натрій - 1000 анти-Ха МО/0,1 мл
Фармакологічні властивості
фармакодинаміка. Еноксапарин — це низькомолекулярний гепарин (НМГ) із середньою молекулярною масою приблизно 4500 дальтон, у якому антитромботична та антикоагулянтна активності стандартного гепарину не пов’язані між собою. Діюча речовина представлена у вигляді натрієвої солі.
В очищеній системі in vitro еноксапарин натрію виявляє високу анти-Xa активність (приблизно 100 МО/мг) та низьку анти-IIa (або антитромбінову) активність (приблизно 28 МО/мг), співвідношення яких становить 3,6. Ці антикоагулянтні активності опосередковуються антитромбіном III (ATIII), що обумовлює антитромботичні ефекти у людей.
Окрім анти-Xa/IIa активності, було виявлено додаткові антитромботичні та протизапальні властивості еноксапарину у здорових добровольців та у пацієнтів, а також в експериментальних моделях у рамках доклінічних досліджень. До них належать ATIII-залежне інгібування інших факторів зсідання крові, таких як фактор VIIa, індукування ендогенного вивільнення інгібітора шляху тканинного фактора (TFPI), а також зменшення вивільнення фактора фон Віллебранда (vWF) з судинного ендотелію у циркуляторне русло. Ці фактори роблять свій внесок у загальний антитромботичний ефект еноксапарину натрію.
При застосуванні з метою профілактики еноксапарин натрію суттєво не впливає на показник активованого часткового тромбопластинового часу (АЧТЧ). При застосуванні з метою лікування АЧТЧ може подовжуватися у 1,5–2,2 раза порівняно з контрольним часом на фоні максимальної активності препарату.
Клінічна ефективність та безпека.
Профілактика венозних тромбоемболічних ускладнень, пов’язаних з хірургічними втручаннями.
Тривала профілактика венозної тромбоемболії (ВТЕ) після ортопедичних оперативних втручань. У подвійно сліпому дослідженні тривалої профілактики після оперативного втручання з приводу протезування кульшового суглоба 179 пацієнтів без будь-яких венозних тромбоемболічних ускладнень, які початково отримували під час стаціонарного лікування еноксапарин натрію у дозі 4000 МО (40 мг) підшкірно (п/ш), були рандомізовані для отримання після виписки зі стаціонару або еноксапарин натрію у дозі 4000 МО (40 мг) (n = 90) 1 раз на добу п/ш, або плацебо (n = 89) протягом 3 тижнів. Частота виникнення тромбозу глибоких вен (ТГВ) на фоні тривалої профілактики була статистично значущо нижчою в групі застосування еноксапарину натрію у порівнянні з такою у групі плацебо; при цьому не було зареєстровано жодного випадку тромбоемболії легеневої артерії (ТЕЛА). Випадків виникнення великих кровотеч не спостерігалося.
Дані щодо ефективності представлено у таблиці 1.
Таблиця 1
| Показник | Еноксапарин натрію 4000 МО (40 мг) 1 раз на добу п/ш, n (%) | Плацебо 1 раз на добу п/ш, n (%) |
| Усі пацієнти, які отримували досліджуване лікування з метою тривалої профілактики | 90 (100) | 89 (100) |
| Загальна кількість випадків ВТЕ (%) | 6 (6,6) | 18 (20,2) |
| Загальна кількість випадків ТГВ (%) | 6 (6,6)* | 18 (20,2) |
| Кількість ТГВ проксимальної локалізації (%) | 5 (5,6)# | 7 (8,8) |
| * Значення p у порівнянні з плацебо становить 0,008. # Значення p у порівнянні з плацебо становить 0,537. | ||
У іншому подвійно сліпому дослідженні 262 пацієнти без будь-яких венозних тромбоемболій, яким виконували оперативне втручання з приводу протезування кульшового суглоба та які початково отримували під час стаціонарного лікування еноксапарин натрію у дозі 4000 МО (40 мг) п/ш, були рандомізовані для отримання після виписки зі стаціонару або еноксапарин натрію у дозі 4000 МО (40 мг) (n = 131) 1 раз на добу п/ш, або плацебо (n = 131) протягом 3 тижнів. Подібно до результатів першого дослідження, частота ВТЕ на фоні тривалої профілактики була статистично значущо нижчою в групі застосування еноксапарин натрію у порівнянні з плацебо як за показником загальної кількості ВТЕ (еноксапарин натрію м 21 [16%] порівняно з плацебо — 45 [34,4%]; p =0,001), так і за показником кількості проксимального ТГВ (еноксапарин натрію — 8 [6,1%] порівняно з плацебо — 28 [21,4%]; p = <0,001). Не спостерігалося ніяких відмінностей за частотою розвитку великих кровотеч між групами застосування еноксапарину натрію і плацебо.
Тривала профілактика ТГВ після оперативних втручань з приводу онкологічних захворювань. У подвійно сліпому багатоцентровому дослідженні порівнювалися за безпекою та ефективністю 4-тижневий і 1-тижневий режими профілактичного застосування еноксапарину натрію 332 пацієнтам, яким виконували планові оперативні втручання з приводу онкологічних захворювань органів черевної порожнини або таза. Пацієнти отримували еноксапарин натрію (4000 МО (40 мг) п/ш) щодня протягом 6–10 днів, після чого були рандомізовані для отримання або еноксапарину натрію, або плацебо протягом ще 21 доби. У проміжку між 25-м і 31-м днями або раніше, якщо виникали симптоми ВТЕ, виконувалася двобічна венографія. Спостереження за пацієнтами здійснювалося протягом 3 місяців. Профілактичне застосування еноксапарину натрію протягом 4 тижнів після оперативних втручань з приводу онкологічних захворювань органів черевної порожнини або таза статистично значущо знижувало частоту підтверджених результатами венографії тромбозів у порівнянні із профілактичним застосуванням еноксапарину натрію протягом 1 тижня. Частота ВТЕ в кінці подвійно сліпої фази становила 12,0% (n = 20) в групі плацебо і 4,8% (n = 8) в групі еноксапарину натрію; p = 0,02. Ця різниця зберігалася протягом 3 місяців [13,8% vs. 5,5% (n = 23 vs. 9), p = 0,01]. Не було виявлено ніяких відмінностей між групами за частотою кровотеч або інших ускладнень протягом подвійно сліпого періоду та періоду подальшого спостереження.
Профілактика венозних тромбоемболічних ускладнень у терапевтичних пацієнтів з гострими захворюваннями, які очікувано спричиняють обмеження рухливості.
У подвійно сліпому багатоцентровому дослідженні в паралельних групах еноксапарин натрію у дозі 2000 МО (20 мг) або 4000 МО (40 мг) 1 раз на добу п/ш порівнювався з плацебо у рамках профілактики ТГВ у терапевтичних пацієнтів з дуже обмеженою рухливістю (що визначається дистанцією <10 метрів у межах ≤3 днів) у зв’язку з гострим захворюванням. У цьому дослідженні брали участь пацієнти з серцевою недостатністю (функціональний клас III або IV за NYHA), гострою дихальною недостатністю або ускладненою хронічною дихальною недостатністю, або гострою інфекцією, або гострим ревматичним захворюванням за умови наявності принаймні одного фактора ризику ВТЕ (вік ≥75 років, онкологічне захворювання, раніше перенесена ВТЕ, ожиріння, варикозне розширення вен, гормональна терапія, хронічна серцева або дихальна недостатність).
В цілому у дослідження було включено 1102 пацієнти, а досліджуване лікування отримували 1073 пацієнти. Лікування тривало протягом 6-14 днів (медіана тривалості становила 7 днів). При застосуванні у дозі 4000 МО (40 мг) 1 раз на добу п/ш еноксапарин натрію статистично значущо знижував частоту виникнення ВТЕ у порівнянні з плацебо. Дані щодо ефективності представлено у таблиці 2.
Таблиця 2
| Показник | Еноксапарин натрію 2000 МО (20 мг) 1 раз на добу п/ш, n (%) | Еноксапарин натрію 4000 МО (40 мг) 1 раз на добу п/ш, n (%) | Плацебо n (%) |
| Усі терапевтичні пацієнти, які отримували досліджуване профілактичне лікування на фоні гострого захворювання | 287 (100) | 291 (100) | 288 (100) |
| Загальна кількість ВТЕ (%) | 43 (15,0) | 16 (5,5)* | 43 (14,9) |
| Загальна кількість ТГВ (%) | 43 (15,0) | 16 (5,5) | 40 (13,9) |
| Кількість проксимального ТГВ (%) | 13 (4,5) | 5 (1,7) | 14 (4,9) |
| ВТЕ — венозні тромбоемболічні події, що включали випадки ТГВ, ТЕЛА та смерті, яка була розцінена як обумовлена тромбоемболічним явищем. * Значення p у порівнянні з плацебо становить 0,0002. | |||
Через приблизно 3 місяці після включення пацієнтів у дослідження частота виникнення ВТЕ в групі застосування еноксапарину натрію у дозі 4000 МО (40 мг) залишалася статистично значущо нижчою у порівнянні з групою плацебо.
Загальна частота виникнення кровотеч та частота великих кровотеч становили відповідно 8,6% і 1,1% в групі плацебо, 11,7% і 0,3% в групі застосування еноксапарину натрію у дозі 2000 МО (20 мг) та 12,6% і 1,7% в групі застосування еноксапарину натрію у дозі 4000 МО (40 мг).
Лікування тромбозу глибоких вен, із тромбоемболією легеневої артерії чи без неї.
У багатоцентровому дослідженні в паралельних групах 900 пацієнтів з гострим ТГВ нижніх кінцівок, з ТЕЛА або без неї, були рандомізовані для стаціонарного лікування або еноксапарином натрію у дозі 150 МО/кг (1,5 мг/кг) 1 раз на добу п/ш; або еноксапарином натрію у дозі 100 МО/кг (1 мг/кг) кожні 12 годин п/ш; або гепарином у вигляді в/в болюсу (5000 МО) з подальшим безперервним інфузійним введенням (для досягнення АЧТЧ від 55 до 85 секунд). В цілому у дослідженні було рандомізовано 900 пацієнтів, усі вони отримували досліджуване лікування. Усі пацієнти також отримували варфарин натрію (доза коригувалася відповідно до показника протромбінового часу з метою досягнення значення МНВ від 2,0 до 3,0), лікування яким розпочиналося у межах 72 годин після початку застосування еноксапарину натрію або стандартної терапії гепарином та продовжувалося протягом 90 днів. Еноксапарин натрію або стандартна терапія гепарином призначалися протягом щонайменше 5 днів та до досягнення цільового МНВ на фоні застосування варфарину натрію. Обидві схеми застосування еноксапарину натрію були еквівалентними стандартній терапії гепарином за зниженням ризику рецидивних венозних тромбоемболій (ТГВ та/або ТЕЛА). Дані щодо ефективності представлено у таблиці 3.
Таблиця 3
| Показник | Еноксапарин натрію 150 МО/кг (1,5 мг/кг) 1 раз на добу п/ш, n (%) | Еноксапарин натрію 100 МО/кг (1 мг/кг) 2 рази на добу п/ш, n (%) | Гепарин в/в введення з коригуванням дози залежно від рівня АЧТЧ, n (%) |
| Усі пацієнти з ТГВ з ТЕЛА або без неї, які отримували досліджуване лікування | 298 (100) | 312 (100) | 290 (100) |
| Загальна кількість ВТЕ (%) | 13 (4,4)* | 9 (2,9)* | 12 (4,1) |
| Кількість лише ТГВ (%) | 11 (3,7) | 7 (2,2) | 8 (2,8) |
| Кількість проксимального ТГВ (%) | 9 (3,0) | 6 (1,9) | 7 (2,4) |
| Кількість ТЕЛА (%) | 2 (0,7) | 2 (0,6) | 4 (1,4) |
| ВТЕ — венозна тромбоемболія (ТГВ та/або ТЕЛА). * 95% довірчі інтервали для різниці між групами лікування за загальною частотою ВТЕ становили: - для еноксапарину натрію 1 раз на добу у порівнянні з гепарином — від -3,0 до 3,5. - для еноксапарину натрію кожні 12 годин у порівнянні з гепарином — від -4,2 до 1,7. | |||
Частота великих кровотеч становила відповідно 1,7% в групі застосування еноксапарину натрію 150 МО/кг (1,5 мг/кг) 1 раз на добу, 1,3% в групі застосування еноксапарину натрію 100 МО/кг (1 мг/кг) 2 рази на добу і 2,1% в групі застосування гепарину.
Лікування нестабільної стенокардії та інфаркту міокарда без підйому сегмента ST.
У масштабному багатоцентровому дослідженні 3171 пацієнт, включений під час гострої фази нестабільної стенокардії та інфаркту міокарда без зубця Q, був рандомізований для отримання у комбінації з ацетилсаліциловою кислотою (100-325 мг 1 раз на добу) або еноксапарину натрію у дозі 100 МО/кг (1 мг/кг) кожні 12 годин, або нефракціонованого гепарину (НФГ) в/в з коригуванням дози залежно від рівня АЧТЧ. Пацієнти отримували стаціонарне лікування протягом мінімум 2 днів та максимум 8 днів до клінічної стабілізації, проведення процедур реваскуляризації або виписки зі стаціонару. За пацієнтами здійснювали спостереження до 30 днів. У порівнянні з гепарином еноксапарин натрію статистично значущо знижував сукупну частоту виникнення стенокардії, інфаркту міокарда та смерті з 19,8 до 16,6% (відносне зниження ризику становило 16,2%) на 14-й день. Це зниження сукупної частоти утримувалося і через 30 днів (з 23,3 до 19,8%; відносне зниження ризику становило 15%).
Не спостерігалося статистично значущих відмінностей за частотою розвитку великих кровотеч, хоча крововиливи у місці п/ш ін’єкції виникали частіше.
Лікування гострого інфаркту міокарда з підйомом сегмента ST (STEMI).
У масштабному багатоцентровому дослідженні 20 479 пацієнтів зі STEMI, придатні для отримання фібринолітичної терапії, були рандомізовані для отримання або еноксапарину натрію у вигляді єдиного в/в болюсу 3000 МО (30 мг) з подальшим введенням у дозі 100 МО/кг (1 мг/кг) п/ш і подальшим застосуванням у дозі 100 МО/кг (1 мг/кг) п/ш кожні 12 годин, або НФГ протягом 48 годин з коригуванням дози залежно від рівня АЧТЧ. Усі пацієнти також отримували ацетилсаліцилову кислоту протягом принаймні 30 днів. Схема дозування еноксапарину натрію коригувалася для пацієнтів з тяжким порушенням функції нирок та для пацієнтів літнього віку (≥75 років). П/ш ін’єкції еноксапарину натрію застосовувалися до виписки пацієнта зі стаціонару або протягом максимум 8 днів (залежно від того, що було раніше).
4716 пацієнтам виконували черезшкірне коронарне втручання (ЧКВ) зі здійсненням антитромботичної підтримки досліджуваними препаратами у сліпому режимі. Таким чином, пацієнтам, які отримували еноксапарин натрію, ЧКВ виконували на фоні прийому еноксапарину натрію (без переведення на препарат порівняння) з використанням схеми, вивченої у раніше проведених дослідженнях, тобто без додаткового введення еноксапарину натрію, якщо останнє п/ш введення препарату проводили менш ніж за 8 годин до роздування балона, та із застосуванням в/в болюсу еноксапарину натрію у дозі 30 МО/кг (0,3 мг/кг), якщо останнє п/ш введення препарату проводили більш ніж за 8 годин до роздування балона.
У порівнянні з НФГ еноксапарин натрію статистично значущо знижував частоту первинної кінцевої точки, яка була комбінацією випадків смерті з будь-якої причини та повторного інфаркту міокарда, протягом перших 30 днів після рандомізації [9,9% в групі застосування еноксапарину натрію у порівнянні з 12,0% в групі застосування НФГ] з відносним зниженням ризику на 17% (p <0,001).
Переваги лікування еноксапарином натрію, очевидні для цілого ряду показників ефективності, проявлялися через 48 годин, коли спостерігалося відносне зниження ризику повторного інфаркту міокарда на 35% у порівнянні з лікуванням НФГ (p <0,001).
Позитивний вплив лікування еноксапарином натрію на первинну кінцеву точку був подібним в усіх ключових підгрупах, включаючи підгрупи за віком, статтю, локалізацією інфаркту, анамнезом цукрового діабету, анамнезом раніше перенесеного інфаркту міокарда, типом призначеного фібринолітичного препарату та часом до початку лікування досліджуваним препаратом.
Спостерігалися статистично значущі переваги лікування еноксапарином натрію у порівнянні з НФГ у пацієнтів, які перенесли ЧКВ протягом 30 днів після рандомізації (відносне зниження ризику на 23%) або яким застосовували медикаментозне лікування (відносне зниження ризику на 15%, p = 0,27 для взаємодії).
Частота подій комбінованої кінцевої точки, яка включала смерть, повторний інфаркт міокарда або внутрішньочерепний крововилив (показник сукупної клінічної користі), через 30 днів була статистично значущо нижчою (p <0,0001) в групі застосування еноксапарину натрію (10,1%) у порівнянні з групою застосування НФГ (12,2%), що відповідає відносному зниженню ризику на 17% на користь лікування еноксапарином натрію.
Частота виникнення великих кровотеч через 30 днів була статистично значущо вищою (p <0,0001) в групі застосування еноксапарину натрію (2,1%) у порівнянні з групою застосування гепарину (1,4%). У групі застосування еноксапарину натрію була вища частота шлунково-кишкових кровотеч (0,5%) у порівнянні з групою застосування гепарину (0,1%), тоді як частота внутрішньочерепних крововиливів в обох групах була подібною (0,8% на фоні прийому еноксапарину натрію у порівнянні із 0,7% на фоні прийому гепарину).
Позитивний вплив лікування еноксапарином натрію на первинну кінцеву точку, який спостерігався протягом перших 30 днів, утримувався протягом 12-місячного періоду подальшого спостереження.
Порушення функції печінки. За опублікованими даними, застосування еноксапарину натрію 4000 МО (40 мг) для пацієнтів з цирозом печінки (класи B–C за класифікацією Чайлда – П’ю) є безпечним та ефективним для запобігання тромбозу ворітної вени. При цьому слід відмітити, щоопубліковані дослідження, можуть мати певні обмеження. Необхідно дотримуватися обережності щодо пацієнтів з порушенням функції печінки, оскільки вони більш схильні до виникнення кровотеч (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ) і наразі не виконувалося жодних формальних досліджень з дозування препарату для пацієнтів з цирозом печінки (клас A, B або C за класифікацією Чайлда – П’ю).
Фармакокінетика.
Загальні характеристики.
Фармакокінетичні показники еноксапарину натрію досліджувалися переважно з огляду на динаміку анти-Xa активності в плазмі крові, а також за впливом на анти-IIa активність у рекомендованому діапазоні доз після однократного і багатократного п/ш введення та після однократного в/в введення. Кількісне визначення фармакокінетичної анти-Xa і анти-IIa активності виконувалося за допомогою валідованих амідолітичних методів.
Всмоктування. Абсолютна біодоступність еноксапарину натрію після п/ш ін’єкції за результатами оцінки анти-Xa активності наближається до 100%.
Можуть використовуватися різні дози, лікарські форми та схеми введення препарату.
Середній максимальний рівень анти-Xa активності в плазмі крові спостерігається протягом 3–5 годин після п/ш ін’єкції і досягає приблизно 0,2, 0,4, 1,0 і 1,3 МО анти-Xa активності на 1 мл після однократного п/ш введення препарату у дозах 2000 МО, 4000 МО, 100 МО/кг і 150 МО/кг (20 мг, 40 мг, 1 мг/кг і 1,5 мг/кг) відповідно.
Після введення 3000 МО (30 мг) в/в болюсно з подальшим негайним введенням 100 МО/кг (1 мг/кг) п/ш кожні 12 годин початковий максимальний рівень анти-Xa активності в плазмі крові становив 1,16 МО/мл (n = 16) і середня експозиція відповідала при цьому 88% рівноважних рівнів. Рівноважний стан досягався на другу добу застосування препарату.
Після багатократного п/ш введення препарату за схемами 4000 МО (40 мг) 1 раз на добу та 150 МО/кг (1,5 мг/кг) 1 раз на добу у здорових добровольців рівноважний стан досягався на другу добу застосування препарату, при цьому середнє відношення експозиції було приблизно на 15% вищим у порівнянні із однократним введенням дози препарату. Після багатократного п/ш введення препарату за схемою 100 МО/кг (1 мг/кг) 2 рази на добу рівноважний стан досягався у період між 3 та 4 добою, при цьому середня експозиція була приблизно на 65% вищою у порівнянні із однократним введенням дози препарату, а середні максимальний та мінімальний рівні анти-Ха активності становили приблизно 1,2 та 0,52 МО/мл відповідно.
Об’єм ін’єкції та концентрація дози у межах діапазону 100–200 мг/мл не впливали на фармакокінетичні показники у здорових добровольців.
У рекомендованому діапазоні доз фармакокінетика еноксапарину натрію є лінійною.
Внутрішньо- та міжіндивідуальна варіабельність низька. Після багатократного п/ш введення препарату кумуляції не спостерігається.
Анти-ІІа активність у плазмі крові після п/ш введення приблизно у 10 разів нижча, ніж анти-Ха активність. Середній максимальний рівень анти-ІІа активності спостерігається приблизно через 3–4 години після п/ш ін’єкції, досягаючи 0,13 МО/мл і 0,19 МО/мл після багатократного введення препарату за схемами 100 МО/кг (1 мг/кг) 2 рази на добу і 150 МО/кг (1,5 мг/кг) 1 раз на добу відповідно.
Розподіл. Об’єм розподілу анти-Ха активності еноксапарину натрію становить приблизно 4,3 літра і наближається до об’єму циркулюючої крові.
Біотрансформація. Еноксапарин натрію метаболізується головним чином у печінці шляхом десульфатування та/або деполімеризації з утворенням сполук з меншою молекулярною масою та значно нижчою біологічною активністю.
Виведення. Еноксапарин натрію є лікарським засобом з низьким кліренсом, у якого середній кліренс анти-Ха активності з плазми крові становить 0,74 л/год після 6-годинної інфузії у дозі 150 МО/кг (1,5 мг/кг).
Елімінація має монофазний характер, при цьому період напіввиведення становить від близько 5 годин після однократного п/ш введення до близько 7 годин після багатократного введення.
Нирковий кліренс активних фрагментів охоплює приблизно 10% введеної дози, а загальна ниркова екскреція активних та неактивних фрагментів — 40% дози.
Особливі групи пацієнтів.
Пацієнти літнього віку. За результатами популяційного фармакокінетичного аналізу профіль кінетики еноксапарину натрію у пацієнтів літнього віку не відрізняється від такого у більш молодих пацієнтів, якщо функція нирок не порушена.
Проте з огляду на те, що функція нирок може знижуватися з віком, у літніх пацієнтів можуть спостерігатися нижчі рівні елімінації еноксапарину натрію (див. ЗАСТОСУВАННЯ).
Порушення функції печінки. У дослідженні за участю пацієнтів з вираженим цирозом печінки, які отримували еноксапарин натрію у дозі 4000 МО (40 мг) 1 раз на добу, зниження максимального рівня анти-Ха активності асоціювалося зі збільшенням тяжкості порушення функції печінки (яка оцінювалася за класифікацією Чайлда-П’ю). Це зниження пояснювалося головним чином зниженням рівня ATIII, яке було вторинним по відношенню до зменшення синтезу ATIII у пацієнтів з порушенням функції печінки.
Порушення функції нирок. Спостерігалася лінійна залежність між кліренсом анти-Ха активності з плазми крові та кліренсом креатиніну у рівноважному стані, що свідчить про зменшення кліренсу еноксапарину натрію у пацієнтів з порушенням функції нирок. Експозиція анти-Xa активності, виражена через показник AUC (площа під кривою концентрація/час), у рівноважному стані граничною мірою зростала при легкому порушенні функції нирок (кліренс креатиніну 50–80 мл/хв) та при помірному порушенні функції нирок (кліренс креатиніну 30–50 мл/хв) після багатократного п/ш введення препарату у дозах 4000 МО (40 мг) 1 раз на добу. У пацієнтів з тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв) рівень AUC у рівноважному стані значущо зростав в середньому на 65% після багатократного п/ш введення препарату у дозі 4000 МО (40 мг) 1 раз на добу (див. ЗАСТОСУВАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Гемодіаліз. Фармакокінетика еноксапарину натрію при гемодіалізі була подібною до такої в контрольній групі після однократного в/в введення препарату у дозах 25 МО, 50 МО або 100 МО/кг (0,25, 0,50 або 1,0 мг/кг), проте рівень AUC при цьому був удвічі вищим у порівнянні з контрольною групою.
Маса тіла. Після багатократного п/ш введення препарату у дозі 150 МО/кг (1,5 мг/кг) 1 раз на добу середній рівень AUC анти-Xa активності був граничною мірою вищий у рівноважному стані у здорових добровольців з ожирінням (ІМТ 30–48 кг/м2) у порівнянні з контрольною групою осіб без ожиріння, тоді як максимальний рівень анти-Xa активності в плазмі крові не збільшувався. У осіб з ожирінням при п/ш застосуванні препарату спостерігався нижчий кліренс після внесення поправки на масу тіла.
При застосуванні препарату у дозах без поправки на масу тіла було виявлено, що після однократного п/ш введення препарату у дозі 4000 МО (40 мг) експозиція анти-Xa активності була на 52% вищою у жінок з низькою масою тіла (<45 кг) і на 27% вищою у чоловіків з низькою масою тіла (<57 кг) у порівнянні з контрольними особами з нормальною масою тіла (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Фармакокінетичні взаємодії. При одночасному застосуванні еноксапарину натрію та тромболітиків не спостерігалося ніякої фармакокінетичної взаємодії між ними.
Доклінічні дані з безпеки. Окрім антикоагулянтних ефектів еноксапарину натрію, не спостерігалося ніяких ознак небажаного впливу при застосуванні препарату у дозі 15 мг/кг/добу у 13-тижневих дослідженнях токсичності препарату після п/ш введення у щурів та собак та у дозі 10 мг/кг/добу у 26-тижневих дослідженнях токсичності препарату після п/ш і в/в введення у щурів та мавп.
Еноксапарин натрію не продемонстрував ніякої мутагенної активності за результатами досліджень in vitro, в тому числі тесту Еймса, аналізу прямих мутацій у клітинах лімфоми мишей, а також ніякої кластогенної активності за результатами аналізу аберації хромосом у лімфоцитах людини in vitro та аналізу аберації хромосом у кістковому мозку щурів in vivo.
Дослідження, проведені на вагітних самках щурів та кролів з п/ш введенням еноксапарину у дозах до 30 мг/кг/добу, не виявили ніяких доказів тератогенного впливу або фетотоксичності препарату. Було показано, що еноксапарин натрію не виявляє ніякого впливу на фертильність або репродуктивну функцію самців та самок щурів при п/ш введенні у дозах до 20 мг/кг/добу.
Показання Клексан
препарат показаний для застосування дорослим для:
– Профілактики венозних тромбоемболічних ускладнень у хірургічних пацієнтів з помірним та високим ризиком, особливо у пацієнтів, які підлягають ортопедичним або загально хірургічним оперативним втручанням, в тому числі оперативним втручання з приводу онкологічних захворювань.
– Профілактики венозних тромбоемболічних ускладнень у терапевтичних пацієнтів з гострими захворюваннями (такими як гостра серцева недостатність, дихальна недостатність, тяжкі інфекції або ревматичні захворювання) та зниженою рухливістю, які мають підвищений ризик виникнення венозної тромбоемболії.
– Лікування тромбозу глибоких вен (ТГВ) та тромбоемболії легеневої артерії (ТЕЛА), за винятком випадків ТЕЛА, при яких може бути необхідним проведення тромболітичної терапії або хірургічного втручання.
– Профілактики утворення тромбів у екстракорпоральному кровообігу під час гемодіалізу.
– При гострому коронарному синдромі:
• для лікування нестабільної стенокардії та інфаркту міокарда без підйому сегмента ST (NSTEMI), у комбінації з пероральним прийомом ацетилсаліцилової кислоти;
• для лікування гострого інфаркту міокарда з підйомом сегмента ST (STEMI), в тому числі у пацієнтів, яким планується медикаментозне лікування або подальше черезшкірне коронарне втручання (ЧКВ).
Застосування Клексан
дозування
Профілактика венозних тромбоемболічних ускладнень у хірургічних пацієнтів з помірним та високим ризиком. Індивідуальний тромбоемболічний ризик у пацієнтів може бути оцінений за допомогою валідованої моделі (шкали) стратифікації ризиків.
– Пацієнтам з помірним ризиком тромбоемболічних подій рекомендована доза еноксапарину натрію становить 2000 МО (20 мг) 1 раз на добу, яку вводять шляхом підшкірної (п/ш) ін’єкції. Було показано, що передопераційне початкове введення (за 2 години до оперативного втручання) еноксапарину натрію у дозі 2000 МО (20 мг) є ефективним та безпечним при оперативних втручаннях з помірним ризиком.
У пацієнтів групи помірного ризику профілактичне лікування еноксапарином натрію слід продовжувати протягом періоду тривалістю щонайменше 7–10 днів, незалежно від стану відновлення (наприклад рухливості). Профілактику потрібно продовжувати доти, доки у пацієнта більше не буде відмічатися суттєво знижена рухливість.
– Пацієнтам з високим ризиком тромбоемболічних подій рекомендована доза еноксапарину натрію становить 4000 МО (40 мг) 1 раз на добу, яку бажано вводити за 12 годин до оперативного втручання шляхом підшкірної (п/ш) ін’єкції. Якщо є потреба у початку профілактичного застосування еноксапарину натрію за більш ніж 12 годин до оперативного втручання (наприклад, пацієнт високого ризику, який очікує на відстрочене ортопедичне хірургічне втручання), останню ін’єкцію слід застосовувати не пізніше ніж за 12 годин до оперативного втручання і відновити профілактичне застосування через 12 годин після оперативного втручання.
– Для пацієнтів, які підлягають великому ортопедичному хірургічному втручанню, рекомендується тривала тромбопрофілактика − до 5 тижнів.
– Для пацієнтів з високим ризиком венозних тромбоемболій (ВТЕ), яким виконують оперативні втручання на органах черевної порожнини або таза з приводу онкологічних захворювань, рекомендується тривала тромбопрофілактика − до 4 тижнів.
Профілактика венозних тромбоемболій у терапевтичних пацієнтів. Рекомендована доза еноксапарину натрію становить 4000 МО (40 мг) 1 раз на добу, яку вводять шляхом п/ш ін’єкції.
Профілактичне лікування еноксапарином натрію необхідно здійснювати протягом періоду тривалістю щонайменше 6–14 днів, незалежно від стану відновлення (наприклад рухливості). Користь такого лікування протягом періоду тривалістю більше 14 днів наразі не визначена.
Лікування тромбозу глибоких вен (ТГВ) та тромбоемболії легеневої артерії (ТЕЛА). Еноксапарин натрію необхідно вводити п/ш у вигляді ін’єкції 150 МО/кг (1,5 мг/кг) 1 раз на добу або у вигляді ін’єкцій 100 МО/кг (1 мг/кг) 2 рази на добу.
Схему дозування обирає лікар з огляду на результати індивідуальної оцінки, яка має включати оцінку ризику тромбоемболічних подій та ризику геморагічних подій. Схему дозування по 150 МО/кг (1,5 мг/кг) 1 раз на добу слід використовувати пацієнтам без ускладнень з низьким ризиком рецидиву ВТЕ. Схему дозування по 100 МО/кг (1 мг/кг) 2 рази на добу слід призначати усім іншим пацієнтам, таких як пацієнти з ожирінням, симптомною ТЕЛА, онкологічними захворюваннями, рецидивними ВТЕ або тромбозом проксимальних вен (клубової вени).
Еноксапарин натрію застосовують в середньому протягом 10 днів. За необхідності слід розпочати прийом пероральних антикоагулянтів (див. Перехід із еноксапарину натрію на прямі пероральні антикоагулянти і навпаки» у кінці цього розділу).
Профілактика утворення тромбів під час гемодіалізу. Рекомендована доза еноксапарину натрію становить 100 МО/кг (1 мг/кг). Пацієнтам з високим ризиком геморагічних подій дозу слід знизити до 50 МО/кг (0,5 мг/кг) при наявності подвійного судинного доступу або до 75 МО/кг (0,75 мг/кг) при наявності єдиного судинного доступу.
Під час гемодіалізу еноксапарин натрію слід вводити в артеріальну частину контуру на початку сеансу діалізу. Цієї дози, як правило, вистачає для проведення діалізу впродовж 4 годин. Однак при виникненні фібринових кілець, наприклад, коли сеанс триває довше, ніж звичайно, можна ввести додаткову дозу від 50 МО до 100 МО/кг (від 0,5 до 1 мг/кг).
Даних щодо застосування еноксапарину натрію пацієнтам для профілактики або лікування та під час сеансів гемодіалізу немає.
Гострий коронарний синдром: лікування нестабільної стенокардії та інфаркту міокарда без підйому сегмента ST (NSTEMI) і гострого інфаркту міокарда з підйомом сегмента ST (STEMI).
– Для лікування нестабільної стенокардії та NSTEMI рекомендована доза еноксапарину натрію становить 100 МО/кг (1 мг/кг), яку вводять кожні 12 годин шляхом п/ш ін’єкції та призначають у комбінації з антитромбоцитарною терапією. Лікування слід застосовувати протягом принаймні 2 днів та продовжувати до клінічної стабілізації пацієнта. Звичайна тривалість лікування становить від 2 до 8 днів.
– Для усіх пацієнтів, які не мають ускладнень, рекомендується застосування ацетилсаліцилової кислоти перорально у початковій навантажувальній дозі 150–300 мг (пацієнти, які ще не отримували ацетилсаліцилову кислоту) та підтримуючій дозі 75–325 мг/добу довгостроково незалежно від стратегії лікування.
– Для лікування гострого STEMI рекомендована доза еноксапарину натрію — однократне в/в введення болюсно 3000 МО (30 мг) плюс доза 100 МО/кг (1 мг/кг) п/ш з наступним введенням препарату у дозі 100 МО/кг (1 мг/кг) п/ш кожні 12 годин (максимум 10000 МО (100 мг) для кожної з перших двох доз, що вводяться п/ш). Слід одночасно призначати відповідну антитромбоцитарну терапію, наприклад ацетилсаліцилову кислоту перорально (75–325 мг 1 раз на добу), за відсутності протипоказань. Рекомендована тривалість лікування становить 8 днів або до виписки пацієнта зі стаціонару, залежно від того, що відбудеться раніше. При застосуванні разом із тромболітичною терапією (фібринспецифічною або нефібринспецифічною) еноксапарин натрію слід вводити у проміжку від 15 хвилин до початку фібринолітичної терапії та до 30 хвилин після початку фібринолітичної терапії.
– Особливості дозування препарату пацієнтам віком ≥75 років наводяться нижче (Пацієнти літнього віку).
– Пацієнтам, яким виконують ЧКВ, у разі введення останньої дози еноксапарину натрію п/ш менш ніж за 8 годин до роздування балона додаткові дози препарату більше не потрібні. Якщо останнє п/ш введення препарату було більш ніж за 8 годин до роздування балона, необхідно ввести в/в болюсно 30 МО/кг (0,3 мг/кг) еноксапарину натрію.
Пацієнти дитячого віку. Безпека та ефективність застосування еноксапарину натрію педіатричним пацієнтам наразі не встановлені.
Пацієнти літнього віку. При усіх показаннях, окрім інфаркту міокарда з підйомом сегмента ST (STEMI), пацієнтам літнього віку зниження дози не потрібне, за винятком випадків порушення функції нирок (див. нижче Порушення функції нирок і розділ ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Для лікування інфаркту міокарда з підйомом сегмента ST (STEMI) пацієнтам літнього віку (≥75 років) не можна вводити початковий в/в болюс препарату. Застосування препарату починають з дози 75 МО/кг (0,75 мг/кг) п/ш кожні 12 годин (максимум 7500 МО (75 мг) для кожної з перших двох п/ш доз з подальшим застосуванням препарату в дозі 75 МО/кг (0,75 мг/кг) п/ш для решти доз). Особливості дозування препарату для літніх пацієнтів з порушенням функцій нирок див. нижче у підрозділі Порушення функції нирок та розділі ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Порушення функції печінки. Наразі доступні лише обмежені дані щодо застосування препарату пацієнтам з порушенням функції печінки (див. Фармакодинаміка і Фармакокінетика), тому щодо цієї категорії пацієнтів слід дотримуватися обережності (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Порушення функції нирок (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ і Фармакокінетика).
Тяжке порушення функції нирок. Еноксапарин натрію не рекомендований до застосування пацієнтам з термінальною стадією захворювання нирок (кліренс креатиніну <15 мл/хв) з огляду на відсутність належних даних щодо цієї популяції, за винятком профілактики утворення тромбів у екстракорпоральному кровообігу під час гемодіалізу.
Таблиця 4
Дозування для пацієнтів з тяжким порушенням функції нирок (кліренс креатиніну 15–30 мл/хв)
| Показання | Схема дозування |
| Профілактика венозних тромбоемболічних ускладнень | 2000 МО (20 мг) п/ш 1 раз на добу |
| Лікування ТГВ та ТЕЛА | 100 МО/кг (1 мг/кг) маси тіла п/ш 1 раз на добу |
| Лікування нестабільної стенокардії та NSTEMI | 100 МО/кг (1 мг/кг) маси тіла п/ш 1 раз на добу |
| Лікування гострого STEMI (у пацієнтів віком до 75 років) | 1 × 3000 МО (30 мг) в/в болюсно плюс 100 МО/кг (1 мг/кг) маси тіла п/ш і у подальшому 100 МО/кг (1 мг/кг) маси тіла п/ш кожні 24 години |
| Лікування гострого STEMI (у пацієнтів віком понад 75 років) | Без початкового в/в болюсу 100 МО/кг (1 мг/кг) маси тіла п/ш і у подальшому 100 МО/кг (1 мг/кг) маси тіла п/ш кожні 24 години |
Рекомендована корекція дози не стосується застосування препарату для гемодіалізу.
– Порушення функції нирок помірного та легкого ступеня тяжкості. Хоча для пацієнтів з порушенням функції нирок помірного (кліренс креатиніну 30–50 мл/хв) та легкого (кліренс креатиніну 50–80 мл/хв) ступеня тяжкості коригування дози не рекомендується, за станом таких пацієнтів необхідно здійснювати ретельне клінічне спостереження.
Спосіб застосування. Препарат Клексан не можна вводити внутрішньом’язово.
Для профілактики венозних тромбоемболічних ускладнень після оперативних втручань, лікування ТГВ і ТЕЛА, лікування нестабільної стенокардії та NSTEMI еноксапарин натрію слід вводити шляхом п/ш ін’єкцій.
– Для лікування гострого STEMI застосування препарату слід розпочинати з однократної в/в болюсної ін’єкції з подальшим негайним п/ш введенням.
– Для профілактики утворення тромбів у екстракорпоральному кровообігу під час гемодіалізу препарат вводиться у артеріальну лінію діалізного контуру.
Техніка виконання п/ш ін’єкції.
Введення препарату бажано здійснювати у положенні пацієнта лежачи. Еноксапарин натрію вводиться шляхом глибокої п/ш ін’єкції.
З метою уникнення втрати препарату при використанні шприц-дози не слід видаляти зі шприца пухирці повітря перед ін’єкцією. Якщо необхідно відкоригувати кількість препарату, показану для введення, з огляду на масу тіла пацієнта, потрібно використовувати градуйовані шприц-дози, які дають змогу отримати необхідний об’єм шляхом видалення надлишку перед ін’єкцією. Будь ласка, майте на увазі, що у деяких випадках неможливо отримати точну дозу через характер градуювання на шприці і тоді необхідно округлити величину об’єму до найближчого показника градуювання.
Введення препарату необхідно виконувати поперемінно у ліву та праву передньобічні або задньобічні стінки живота.
Голку необхідно вводити на повну довжину вертикально у складку шкіри, яка м’яко утримується між великим та вказівним пальцями. Складку шкіри потрібно утримувати, поки ін’єкція не буде завершена. Не слід розтирати місце ін’єкції після введення препарату.
Система безпеки попередньо наповнених шприців із захисною системою голки активується у кінці ін’єкції.
Якщо пацієнт виконує введення препарату собі самостійно, йому слід порадити дотримуватися інструкції щодо самостійного ведення препарату Клексан у шприц-дозі з захисною системою голки.
В/в (болюсна) ін’єкція (лише при застосуванні препарату за показанням гострий інфаркт міокарда з підйомом сегмента ST (STEMI)).
Для лікування гострого STEMI застосування препарату слід розпочинати з однократної в/в болюсної ін’єкції з подальшим негайним п/ш введенням.
Для в/в ін’єкції можна використовувати препарат в іншій упаковці: багатодозовий флакон, або шприц-доза.
Еноксапарин натрію слід вводити через систему для в/в інфузій. Його не можна змішувати або призначати одночасно з іншими лікарськими засобами. Для уникнення можливого змішування еноксапарину натрію з іншими лікарськими засобами обраний в/в доступ необхідно промити достатньою кількістю фізіологічного розчину хлориду натрію або глюкози до введення в/в болюсу еноксапарину натрію та після нього, щоб очистити порт введення від лікарських засобів. Еноксапарин натрію можна безпечно вводити з фізіологічним розчином хлориду натрію (0,9 %) або з 5% розчином глюкози.
Початковий болюс 3 000 МО (30 мг). Для введення початкового болюсу 3 000 МО (30 мг) за допомогою шприц-дози необхідно видалити зі шприца надлишковий об’єм так, щоб у шприці залишилося лише 3 000 МО (30 мг). Після цього дозу 3 000 МО (30 мг) можна безпосередньо вводити у систему для в/в інфузій.
Додатковий болюс при ЧКВ у разі, коли останнє п/ш введення препарату виконували більш ніж за 8 годин до роздування балона. Для пацієнтів, яким виконують ЧКВ, необхідне введення додаткового в/в болюсу 30 МО/кг (0,3 мг/кг), якщо останнє п/ш введення препарату виконували більш ніж за 8 годин до роздування балона.
Щоб забезпечити точність введення такого невеликого об’єму, рекомендується розвести препарат до концентрації 300 МО/мл (3 мг/мл).
Відібрати необхідний об’єм розведеного розчину шприцом для введення в систему для в/в інфузій.
Після виконання розведення об’єм для введення можна розрахувати за допомогою такої формули: [Об’єм розведеного розчину (мл) = Маса тіла пацієнта (кг) × 0,1] або використовуючи таблицю 5. Рекомендується виконувати розведення безпосередньо перед застосуванням препарату.
Таблиця 5
Об’єм, який має бути введений через систему для в/в інфузій після розведення препарату до концентрації 300 МО (3 мг)/мл.
| Маса тіла | Необхідна доза з розрахунку 30 МО/кг (0,3 мг/кг) | Об'єм, який має бути введений після розведення препарату до кінцевої концентрації 300 МО (3 мг)/мл | |
| кг | МО | мг | мл |
| 45 | 1350 | 13,5 | 4,5 |
| 50 | 1500 | 15 | 5 |
| 55 | 1650 | 16,5 | 5,5 |
| 60 | 1800 | 18 | 6 |
| 65 | 1950 | 19,5 | 6,5 |
| 70 | 2100 | 21 | 7 |
| 75 | 2250 | 22,5 | 7,5 |
| 80 | 2400 | 24 | 8 |
| 85 | 2550 | 25,5 | 8,5 |
| 90 | 2700 | 27 | 9 |
| 95 | 2850 | 28,5 | 9,5 |
| 100 | 3000 | 30 | 10 |
| 105 | 3150 | 31,5 | 10,5 |
| 110 | 3300 | 33 | 11 |
| 115 | 3450 | 34,5 | 11,5 |
| 120 | 3600 | 36 | 12 |
| 125 | 3750 | 37,5 | 12,5 |
| 130 | 3900 | 39 | 13 |
| 135 | 4050 | 40,5 | 13,5 |
| 140 | 4200 | 42 | 14 |
| 145 | 4350 | 43,5 | 14,5 |
| 150 | 4500 | 45 | 15 |
Введення в артеріальну частину діалізного контуру. Препарат вводять в артеріальну лінію діалізного контуру з метою профілактики утворення тромбів у екстракорпоральному кровообігу під час гемодіалізу.
Перехід із еноксапарину натрію на пероральні антикоагулянти.
Перехід із еноксапарину натрію на антагоністи вітаміну К (АВК) і навпаки. Слід посилити клінічний моніторинг та контроль лабораторних показників [протромбіновий час, виражений через міжнародне нормалізоване відношення (МНВ)] для моніторингу ефекту АВК.
Оскільки існує певний проміжок часу, поки АВК досягне максимуму свого ефекту, слід продовжувати введення еноксапарину натрію у постійній дозі стільки, скільки потрібно для підтримання МНВ у цільовому терапевтичному діапазоні для відповідного показання за результатами двох послідовних аналізів.
Пацієнтам, які отримують на даний час АВК, АВК потрібно відмінити і першу дозу еноксапарину натрію вводити тоді, коли МНВ зменшиться до рівня нижче терапевтичного діапазону.
Перехід із еноксапарину натрію на прямі пероральні антикоагулянти (ППОА) і навпаки. Пацієнтам, які отримують на даний час еноксапарин натрію, еноксапарин натрію потрібно відмінити і розпочати застосування ППОА за 0–2 години (див. інструкцію для медичного застосування конкретного ППОА) до того часу, коли потрібно було вводити наступну заплановану дозу еноксапарину натрію.
Пацієнтам, які отримують на даний час ППОА, першу дозу еноксапарину натрію потрібно вводити тоді, коли потрібно було вводити наступну дозу ППОА.
Застосування препарату при спінальній/епідуральній анестезії або при люмбальній пункції. Якщо лікар прийме рішення про необхідність застосування антикоагулянтів при спінальній/епідуральній анестезії або при люмбальній пункції, рекомендується здійснювати ретельне неврологічне спостереження з огляду на ризик розвитку нейроаксіальної гематоми (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Застосування профілактичних доз. Необхідно витримати інтервал без проведення пункцій тривалістю принаймні 12 годин між останньою ін’єкцією еноксапарину натрію у профілактичній дозі та введенням голки або катетера.
При виконанні процедури з пролонгованим доступом необхідно витримати аналогічний інтервал тривалістю принаймні 12 годин до моменту видалення катетера.
Для пацієнтів з кліренсом креатиніну 15–30 мл/хв слід зважити доцільність подвоєння часу до виконання пункції/ встановлення або видалення катетера до принаймні 24 годин.
Початкове введення еноксапарину натрію 2 000 МО (20 мг) за дві години до оперативного втручання не застосовується при виконанні нейроаксіальної анестезії.
Застосування лікувальних доз. Необхідно витримати інтервал без проведення пункцій тривалістю принаймні 24 години між останньою ін’єкцією еноксапарину натрію у лікувальній дозі та введенням голки або катетера (див. ПРОТИПОКАЗАННЯ).
При виконанні процедури з пролонгованим доступом необхідно витримати аналогічний інтервал тривалістю принаймні 24 години до моменту видалення катетера.
Для пацієнтів з кліренсом креатиніну 15–30 мл/хв слід зважити доцільність подвоєння часу до виконання пункції/встановлення або видалення катетера до принаймні 48 годин.
Пацієнти, які отримують препарат за схемою з введенням 2 рази на добу (тобто 75 МО/кг (0,75 мг/кг) 2 рази на добу або 100 МО/кг (1 мг/кг) 2 рази на добу), повинні пропустити другу дозу еноксапарину натрію, щоб забезпечити достатній проміжок часу до встановлення або видалення катетера.
У цих часових точках все ще виявляються анти-Xa рівні препарату, і дотримання цих інтервалів часу не гарантує, що вони можуть запобігти розвитку нейроаксіальної гематоми.
Відповідно, не слід застосовувати еноксапарин натрію протягом принаймні 4 годин після спінальної/епідуральної пункції та після видалення катетера. Такий інтервал часу повинен ґрунтуватися на результатах оцінки співвідношення користь/ризик, яка має враховувати як ризик тромбозу, так і ризик кровотечі для цієї процедури з огляду на фактори ризику, наявні у цього пацієнта.
Інструкція щодо самостійного введення препарату Клексан у шприц-дозі із захисною системою голки ERIS або PREVENTIS
Автоматична захисна система голки дозволяє зменшити ризик виникнення болю та утворення синців в місті ін’єкції.
Препарат Клексан є розчином для ін’єкцій у попередньо заповнених шприцах із захисною системою голки для запобігання випадковому уколу голкою після ін’єкції.
1. Вимити руки водою з милом. Висушити їх.
2. Обрати ділянку у правій або лівій частині живота. Ця ділянка має бути віддалена (у напрямку до боків) від пупка щонайменше на 5 сантиметрів.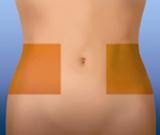
3. Змінювати місце ін’єкції, виконуючи її поперемінно у праву та ліву сторони живота, залежно від того, в яку сторону було зроблено ін’єкцію минулого разу. Очистити місце ін’єкції тампоном зі спиртом.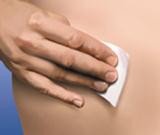
4. Обережно зняти ковпачок з голки, приєднаної до шприца з препаратом Клексан. Викинути цей ковпачок. Шприц є попередньо наповненим і готовим до використання. НЕ натискати на поршень до виконання ін’єкції, щоб позбутися бульбашок повітря. Це може призвести до втрати лікарського засобу. Після того, як знято ковпачок, не допускати, щоб голка торкалася чогось. Це необхідно для забезпечення того, що голка буде залишатися чистою (стерильною).
5. Тримати шприц у руці так, як олівець при письмі, та іншою рукою злегка взяти очищену ділянку живота вказівним і великим пальцями, щоб утворилася складка шкіри. Обов’язково утримувати шкірну складку протягом усієї ін’єкції.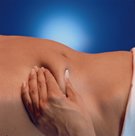
6. Тримати шприц таким чином, щоб голка була спрямована донизу (вертикально під кутом 90°). Ввести голку у шкірну складку на повну довжину.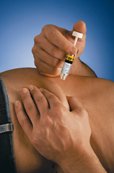
7. Натиснути на поршень шприца великим пальцем. Обов’язково утримувати шкірну складку протягом усієї ін’єкції.
8. Витягнути голку прямо у зворотному напрямку і відпустити складку шкіри.
9. При застосуванні препарату Клексан у шприц-дозі з захисною системою голки ERIS голка автоматично накриється захисним чохлом.
10. При застосуванні препарату Клексан у шприц-дозі з захисною системою голки PREVENTIS після витягання голки з місця ін’єкції продовжуйте тримати палець на поршні. Необхідно направити голку вниз та в бік від себе та інших, а потім натиснути на поршень до упору, щоб активувати захисну систему. Захисний чохол автоматично накриє голку і буде чутно звук клацання, який підтверджує активацію захисту.
11. Одразу ж викинути шприц у відповідний контейнер для гострих предметів.
Примітка: захисні системи голок ERIS або PREVENTIS можуть бути активовані лише у разі спорожнення шприца.
Для уникнення утворення синця не слід розтирати місце ін’єкції після введення препарату.
Діти. Безпека та ефективність застосування еноксапарину натрію педіатричним пацієнтам наразі не встановлені.
Протипоказання
еноксапарин натрію протипоказаний до застосування пацієнтам з такими станами:
– Підвищена чутливість до еноксапарину натрію, гепарину або його похідних, в тому числі інших низькомолекулярних гепаринів, або до будь-якої з допоміжних речовин (див. СКЛАД).
– Наявність в анамнезі імуноопосередкованої гепариніндукованої тромбоцитопенії (ГІТ) у межах останніх 100 днів або за наявності циркулюючих антитіл (див. також ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
– Активна клінічно значуща кровотеча і стани з високим ризиком виникнення кровотечі, в тому числі нещодавно перенесений геморагічний інсульт, виразка ШКТ, присутність злоякісного новоутворення з високим ризиком кровотечі, нещодавно перенесене оперативне втручання на головному мозку, спинному мозку або очах, відоме або підозрюване варикозне розширення вен стравоходу, артеріовенозні мальформації, судинні аневризми або серйозні вади розвитку інтраспінальних або інтрацеребральних судин.
– Спінальна або епідуральна анестезія або локорегіонарна анестезія, якщо еноксапарин натрію використовувався для лікування у межах попередніх 24 годин (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Побічна дія
загальний опис профілю безпеки препарату. Еноксапарин натрію вивчався у більш ніж 15 000 пацієнтів, які отримували еноксапарин натрію у рамках клінічних досліджень. Зокрема було 1776 випадків застосування препарату для профілактики тромбозу глибоких вен після ортопедичних оперативних втручань або оперативних втручань на органах черевної порожнини у пацієнтів з підвищеним ризиком тромбоемболічних ускладнень, 1169 випадків застосування препарату для профілактики тромбозу глибоких вен у пацієнтів з гострими терапевтичними захворюваннями та дуже обмеженою рухливістю, 559 випадків застосування препарату для лікування тромбозу глибоких вен з тромбоемболією легеневої артерії або без неї, 1578 випадків застосування препарату для лікування нестабільної стенокардії та інфаркту міокарда без зубця Q і 10 176 випадків застосування препарату для лікування гострого інфаркту міокарда з підйомом сегмента ST.
Схеми застосування еноксапарину натрію у цих клінічних дослідженнях були різними залежно від показань. Доза еноксапарину натрію для профілактики тромбозу глибоких вен після оперативних втручань або для пацієнтів з гострими терапевтичними захворюваннями та дуже обмеженою рухливістю становила 4000 МО (40 мг) п/ш 1 раз на добу. Для лікування тромбозу глибоких вен з тромбоемболією легеневої артерії або без неї пацієнти отримували еноксапарин натрію або у дозі 100 МО/кг (1 мг/кг) п/ш кожні 12 годин, або у дозі 150 МО/кг (1,5 мг/кг) п/ш 1 раз на добу. У клінічних дослідженнях, в яких препарат застосовувався для лікування нестабільної стенокардії та інфаркту міокарда без зубця Q, дози становили 100 МО/кг (1 мг/кг) п/ш кожні 12 годин, а у клінічному дослідженні, в якому препарат застосовувався для лікування гострого інфаркту міокарда з підйомом сегмента ST, схема застосування еноксапарину натрію включала введення 3000 МО (30 мг) в/в болюсно з наступним введенням препарату у дозі 100 МО/кг (1 мг/кг) п/ш кожні 12 годин.
У клінічних дослідженнях небажаними реакціями, про які повідомлялося найчастіше, були геморагічні явища, тромбоцитопенія та тромбоцитоз (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Опис окремих небажаних реакцій нижче).
Табличний перелік побічних реакцій. Інші побічні реакції, що спостерігались в клінічних дослідженнях і про які повідомлялось в період післяреєстраційного застосування препарату (* вказує на побічні реакції в період післяреєстраційного застосування препарату), докладно описані нижче.
Частота визначалася таким чином: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1 000 до <1/100), рідко (від ≥1/10 000 до <1/1 000), дуже рідко (<1/10 000); частота невідома (не можна оцінити, виходячи із наявних даних). В межах кожної категорії «Система-Орган-Клас» побічні реакції представлені в порядку зменшення ступеня їхньої тяжкості.
Розлади з боку крові та лімфатичної системи.
Часто: геморагічні явища, геморагічна анемія*, тромбоцитопенія, тромбоцитоз.
Рідко: еозинофілія*.
Рідко: випадки імуноалергічної тромбоцитопенії з тромбозом; у деяких з цих випадків тромбоз був ускладнений інфарктом органів або ішемією кінцівок (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Розлади з боку імунної системи.
Часто: алергічна реакція.
Рідко: анафілактичні/анафілактоїдні реакції, в тому числі шок*.
Розлади з боку нервової системи.
Часто: головний біль*.
Розлади з боку судин.
Рідко: спінальна гематома* (або нейроаксіальна гематома). Ці реакції призводили до неврологічних розладів різного ступеня тяжкості, в тому числі до тривалого або необоротного паралічу (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Гепатобіліарні розлади.
Дуже часто: підвищення рівнів печінкових ферментів (головним чином рівнів трансаміназ більш ніж у 3 рази від верхньої межі норми).
Нечасто: гепатоцелюлярне ураження печінки*.
Рідко: холестатичне ураження печінки*.
Розлади з боку шкіри та підшкірної клітковини.
Часто: кропив’янка, свербіж, еритема.
Нечасто: бульозний дерматит.
Рідко: алопеція*, шкірний васкуліт*, некроз шкіри*, який виникає, як правило, у місці ін’єкції (цим явищам зазвичай передує пурпура або еритематозні бляшки, інфільтровані та болісні). Вузлики у місці ін’єкції* (запальні вузлики, які являли собою некістозні «кишені» еноксапарину). Вони розсмоктуються через кілька днів та не вимагають відміни препарату.
Розлади з боку опорно-рухового апарату, сполучної тканини та кісток.
Рідко: остеопороз* після тривалої терапії (протягом більш ніж 3 місяців)
Загальні розлади та реакції в місці введення препарату.
Часто: гематома у місці ін’єкції, біль у місці ін’єкції, інша реакція у місці ін’єкції (наприклад набряк, крововилив, гіперчутливість, запалення, об’ємне утворення, біль або інші реакції).
Нечасто: місцеве подразнення, некроз шкіри у місці ін’єкції.
Зміни за результатами обстежень.
Рідко: гіперкаліємія* (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Опис окремих небажаних реакцій.
Геморагічні явища. Спостерігалися серйозні геморагічні явища, які були зареєстровані не більш ніж у 4,2% пацієнтів (хірургічних пацієнтів). Деякі з цих випадків були летальними. У хірургічних пацієнтів геморагічні ускладнення розцінювалися серйозними у таких випадках: якщо геморагічне явище обумовлювало значущу клінічну подію або якщо воно супроводжувалося зниженням рівня гемоглобіну ≥2 г/дл або вимагало переливання 2 або більше стандартних одиниць препаратів крові. Ретроперитонеальні та внутрішньочерепні крововиливи завжди розцінювались як серйозні.
Як і при застосуванні інших антикоагулянтів, можуть виникати геморагічні явища при наявності супутніх факторів ризику, таких як: органічні ураження, для яких існує імовірність виникнення кровотечі, інвазивні процедури або супутнє застосування лікарських засобів, що впливають на гемостаз (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Таблиця 6
| Система-Орган-Клас | Профілактика у хірургічних пацієнтів | Профілактика у терапевтичних пацієнтів | Лікування у пацієнтів з ТГВ з ТЕЛА або без неї | Лікування у пацієнтів з нестабільною стенокардією та ІМ без зубця Q | Лікування у пацієнтів з гострим STEMI |
| Розлади з боку крові та лімфатичної системи | Дуже часто: геморагічні явищаα Рідко: ретроперитонеальний крововилив | Часто: геморагічні явищаα | Дуже часто: геморагічні явищаα Нечасто: внутрішньо-черепний крововилив, ретроперито-неальний крововилив | Часто: геморагічні явищаα Рідко: ретроперитонеальний крововилив | Часто: геморагічні явищаα Нечасто: внутрішньо-черепний крововилив, ретроперитонеальний крововилив |
αТакі як гематома, екхімоз (окрім того, який спостерігається у місці ін’єкції), гематома рани, гематурія, носова кровотеча і шлунково-кишкова кровотеча.
Тромбоцитопенія та тромбоцитоз.
Таблиця 7
| Система-Орган-Клас | Профілактика у хірургічних пацієнтів | Профілактика у терапевтичних пацієнтів | Лікування у пацієнтів з ТГВ з ТЕЛА або без неї | Лікування у пацієнтів з нестабільною стенокардією та ІМ без зубця Q | Лікування у пацієнтів з гострим STEMI |
| Розлади з боку крові та лімфатичної системи | Дуже часто: тромбоцитозβ Часто: тромбоцитопенія | Нечасто: тромбоцитопенія | Дуже часто: тромбоцитозβ Часто: тромбоцитопенія | Нечасто: тромбоцитопенія | Часто: тромбоцитозβ, тромбоцитопенія Дуже рідко: імуноалергічна тромбоцитопенія |
β Збільшення вмісту тромбоцитів >400 г/л
Пацієнти дитячого віку. Безпека та ефективність застосування еноксапарину натрію дітям на сьогодні не вивчені (див. ЗАСТОСУВАННЯ).
Особливості застосування
загальні застереження. Еноксапарин натрію не можна призначати як взаємозамінний (одиниця за одиницю) замість інших низькомолекулярних гепаринів (НМГ). Ці лікарські засоби відрізняються своїми процесами виробництва, молекулярними масами, специфічними анти-Xa і анти-IIa активностями, одиницями активності, дозуванням та клінічною ефективністю і безпекою. Це обумовлює відмінності у фармакокінетиці та біологічні активності (наприклад антитромбіновій активності, взаємодії з тромбоцитами).
У зв’язку з цим необхідно приділяти особливу увагу інструкціям для медичного застосування, специфічним для кожного патентованого лікарського засобу, та дотримуватися їх.
Наявність гепариніндукованої тромбоцитопенії (ГІТ) в анамнезі (>100 днів).
Застосування еноксапарину натрію пацієнтам, в анамнезі яких є імуноопосередкована ГІТ у межах останніх 100 днів або у яких наявні циркулюючі антитіла, протипоказане (див. ПРОТИПОКАЗАННЯ). Циркулюючі антитіла можуть залишатися протягом кількох років.
Еноксапарин натрію слід застосовувати з надзвичайною обережністю пацієнтам, в анамнезі яких (>100 днів) є імуноопосередкована ГІТ без циркулюючих антитіл. Рішення щодо застосування еноксапарину натрію у такому випадку необхідно приймати лише після ретельної оцінки співвідношення користь/ризик та після того, як було розглянуто можливість застосування альтернативних негепаринових засобів лікування (наприклад данапароїду натрію або лепірудину).
Моніторинг вмісту тромбоцитів. Також при застосуванні НМГ існує ризик розвитку ГІТ, опосередкованої антитілами, яка, як правило, розвивається у проміжку між 5-м та 21-м днями після початку лікування еноксапарином натрію.
Ризик ГІТ вищий у пацієнтів, які перенесли оперативне втручання, і спостерігається переважно після кардіохірургічних втручань та у пацієнтів з онкологічними захворюваннями.
У зв’язку з цим рекомендується визначати вміст тромбоцитів перед початком лікування еноксапарином натрію, а також регулярно у подальшому під час такого лікування.
За наявності клінічної симптоматики, що може вказувати на ГІТ (будь-який новий епізод артеріальної та/або венозної тромбоемболії, будь-яке болісне ураження шкіри у місці ін’єкції, будь-які алергічні або анафілактоїдні реакції на фоні лікування), необхідно визначити вміст тромбоцитів. Пацієнти повинні знати, що такі симптоми можуть у них виникнути і що про їх виникнення слід повідомити свого лікаря.
У клінічній практиці у разі наявності підтвердженого значного зниження рівня тромбоцитів (30–50% від початкового значення) необхідно негайно відмінити еноксапарин натрію і перевести пацієнта на альтернативний негепариновий засіб лікування.
Геморагічні явища. Як і при застосуванні інших антикоагулянтів, може виникнути кровотеча/крововилив будь-якої локалізації. При виникненні кровотечі слід дослідити її походження та розпочати відповідне лікування.
Еноксапарин натрію, які і будь-який інший антикоагулянтний препарат, необхідно застосовувати з обережністю при станах, які обумовлюють підвищення вірогідності кровотечі, таких як:
– порушення гемостазу;
– наявність в анамнезі пептичної виразки;
– нещодавно перенесений ішемічний інсульт;
– тяжка артеріальна гіпертензія;
– нещодавній розвиток діабетичної ретинопатії;
– оперативне втручання на нервовій системі або очах;
– одночасне застосування лікарських засобів, які впливають на гемостаз (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Лабораторні аналізи. Еноксапарин натрію у дозах, що застосовуються для профілактики венозної тромбоемболії, не має суттєвого впливу на час кровотечі, загальні коагуляційні показники, а також не впливає на агрегацію тромбоцитів та зв’язування фібриногену з тромбоцитами.
При застосуванні препарату у вищих дозах може зростати показник активованого часткового тромбопластинового часу (АЧТЧ) та активованого часу згортання (АЧЗ). Оскільки не існує лінійної залежності між зростанням АЧТЧ та АЧЗ і збільшенням антитромботичної активності еноксапарину натрію, то ці показники є ненадійними і не можуть застосовуватися для моніторингу активності еноксапарину натрію.
Застосування препарату при спінальній/епідуральній анестезії або при люмбальній пункції.
Спінальна/епідуральна анестезія або люмбальна пункція не повинні виконуватися у межах 24 годин після застосування еноксапарину натрію у терапевтичних дозах (див. також ПРОТИПОКАЗАННЯ).
Повідомлялося про випадки нейроаксіальних гематом при одночасному застосуванні еноксапарину натрію та проведенні процедур спінальної/епідуральної анестезії або спінальної пункції, що призводило до довгострокового або необоротного паралічу. Ці випадки є рідкісними при застосуванні еноксапарину натрію за схемою 4000 МО (40 мг) 1 раз на добу або у нижчих дозах. Ризик виникнення таких подій є вищим при застосуванні післяопераційних постійних епідуральних катетерів, при одночасному застосуванні інших препаратів, які впливають на гемостаз, таких як нестероїдні протизапальні препарати, при виконанні травматичних або повторних епідуральних або спінальних процедур або у пацієнтів, в анамнезі яких є оперативні втручання на хребті або деформації хребта.
Для зниження потенційного ризику розвитку кровотеч, пов’язаних із одночасним застосуванням еноксапарину натрію та проведенням процедур епідуральної чи спінальної анестезії/аналгезії або спінальної пункції, слід брати до уваги фармакокінетичний профіль еноксапарину натрію (див. Фармакокінетика). Встановлення або видалення епідурального катетера або виконання люмбальної пункції найкраще виконувати тоді, коли антикоагулянтний ефект еноксапарину натрію є низьким, проте точний час досягнення достатньо низького антикоагулянтного ефекту у кожного окремого пацієнта невідомий. Слід додатково брати до уваги те, що виведення еноксапарину натрію є більш тривалим у пацієнтів з кліренсом креатиніну 15–30 мл/хв (див. ЗАСТОСУВАННЯ).
Якщо лікар прийме рішення застосовувати антикоагулянтну терапію при виконанні епідуральної чи спінальної анестезії/аналгезії або люмбальної пункції, необхідно здійснювати частий моніторинг з метою виявлення будь-яких симптомів неврологічних розладів, таких як біль по серединній лінії спини, сенсорні та моторні розлади (відчуття оніміння або слабкості у нижніх кінцівках), порушення функції кишечнику та/або сечового міхура. Слід проінструктувати пацієнтів про необхідність негайно повідомляти лікарю про виникнення будь-яких із зазначених вище симптомів. Якщо підозрюється утворення спінальної гематоми, потрібно негайно розпочати належні заходи із діагностики та лікування, в тому числі розглянути питання щодо проведення декомпресії спинного мозку, навіть якщо таке лікування може не запобігти несприятливим неврологічним наслідкам.
Некроз шкіри/шкірний васкуліт. Повідомлялося про випадки розвитку некрозу шкіри та шкірного васкуліту на фоні застосування низькомолекулярних гепаринів; у таких випадках необхідно негайно відмінити препарат.
Процедури черезшкірної коронарної реваскуляризації. Для зведення до мінімуму ризику кровотечі після інструментальних процедур на судинах у рамках лікування нестабільної стенокардії, інфаркту міокарда без підйому сегмента ST (NSTEMI) і гострого інфаркту міокарда з підйомом сегмента ST (STEMI) необхідно чітко дотримуватися рекомендованих інтервалів між введенням доз еноксапарину натрію. Важливо досягти гемостазу у місці пункції після черезшкірного коронарного втручання (ЧКВ). У разі використання пристрою для закриття місця пункції судини інтродьюсер можна видалити одразу ж після процедури. Якщо використовується метод ручного притискання судини, інтродьюсер має бути видалений через 6 годин після останньої в/в або п/ш ін’єкції еноксапарину натрію. Якщо лікування еноксапарином натрію потрібно продовжити, наступну заплановану дозу слід ввести не раніше ніж через 6–8 годин після видалення інтродьюсера. За місцем введення катетера слід спостерігати для своєчасного виявлення ознак кровотечі або утворення гематоми.
Гострий інфекційний ендокардит. Застосування гепарину пацієнтам з гострим інфекційним ендокардитом, як правило, не рекомендується з огляду на ризик церебральних крововиливів. Якщо таке застосування розцінено як абсолютно необхідне, рішення слід приймати лише після ретельної індивідуальної оцінки співвідношення користь/ризик.
Механічні штучні клапани серця. Застосування еноксапарину натрію з метою тромбопрофілактики у пацієнтів з механічними штучними клапанами серця належним чином не вивчене. Повідомлялося про окремі випадки тромбозу штучних клапанів серця у пацієнтів з механічними штучними клапанами серця, які отримували еноксапарин натрію з метою тромбопрофілактики. Наявність факторів, які можуть обумовлювати додатковий ризик, в тому числі основне захворювання та недостатні клінічні дані, обмежують оцінку таких випадків. Деякі з таких випадків спостерігалися у вагітних жінок, у яких тромбоз призводив до смерті матері і плода.
Вагітні жінки з механічними штучними клапанами серця. Застосування еноксапарину натрію з метою тромбопрофілактики у вагітних жінок з механічними штучними клапанами серця належним чином не вивчено. У клінічному дослідженні, в якому вагітні жінки з механічними штучними клапанами серця отримували еноксапарин натрію (100 МО/кг (1 мг/кг) 2 рази на добу) з метою зменшення ризику тромбоемболій, у 2 з 8 жінок утворилися згустки крові, які призвели до блокування клапану та до смерті матері і плода. У післяреєстраційний період надходили окремі повідомлення про тромбоз клапанів у вагітних жінок з механічними штучними клапанами серця, які отримували еноксапарин натрію з метою тромбопрофілактики. У вагітних жінок з механічними штучними клапанами серця можливий підвищений ризик тромбоемболій.
Пацієнти літнього віку. При застосуванні препарату у профілактичному діапазоні доз у пацієнтів літнього віку не спостерігалося зростання схильності до кровотеч. Для пацієнтів літнього віку (особливо віком від 80 років) можливе підвищення ризику геморагічних ускладнень при застосуванні препарату у терапевтичних дозах. Для пацієнтів віком понад 75 років, які отримують лікування препаратом з приводу інфаркту міокарда з підйомом сегмента ST (STEMI), рекомендується ретельний клінічний моніторинг та може бути розглянута доцільність зниження дози (див. ЗАСТОСУВАННЯ та Фармакокінетика).
Порушення функції нирок. У пацієнтів з порушенням функції нирок спостерігається збільшення експозиції еноксапарину натрію, що підвищує ризик виникнення кровотечі. Для таких пацієнтів рекомендований ретельний клінічний моніторинг, а також може бути розглянута доцільність біологічного моніторингу шляхом визначення анти-Xa активності (див. ЗАСТОСУВАННЯ та Фармакокінетика).
Еноксапарин натрію не рекомендований до застосування пацієнтам з термінальною стадією захворювання нирок (кліренс креатиніну <15 мл/хв) з огляду на відсутність належних даних щодо цієї популяції, за винятком профілактики утворення тромбів у екстракорпоральному кровообігу під час гемодіалізу.
Для пацієнтів з тяжким порушенням функції нирок (кліренс креатиніну 15–30 мл/хв) з огляду на суттєве зростання експозиції еноксапарину натрію рекомендується коригування дози препарату як при терапевтичному, так і при профілактичному застосуванні (див. ЗАСТОСУВАННЯ).
Пацієнтам з порушенням функції нирок помірного (кліренс креатиніну 30–50 мл/хв) та легкого (кліренс креатиніну 50–80 мл/хв) ступеня коригування дози не рекомендується.
Порушення функції печінки. Еноксапарин натрію слід застосовувати з обережністю пацієнтам з порушенням функції печінки через підвищення ризик кровотеч. Коригування дози за результатами моніторингу рівнів анти-Xa активності є ненадійним для пацієнтів з цирозом печінки і не рекомендується (див. Фармакокінетика).
Низька маса тіла. У жінок з низькою масою тіла (<45 кг) та у чоловіків з низькою масою тіла (<57 кг) спостерігалося збільшення експозиції еноксапарину натрію, який застосовувався у профілактичних дозах (без поправки на масу тіла), що може призводити до підвищеного ризику кровотеч. У зв’язку з цим таким пацієнтам рекомендується ретельний клінічний моніторинг (див. Фармакокінетика).
Пацієнти з ожирінням. У пацієнтів з ожирінням відмічається підвищений ризик виникнення тромбоемболій. Безпека та ефективність застосування профілактичних доз препарату пацієнтам з ожирінням (ІМТ (індекс маси тіла) >30 кг/м2) не вивчені у достатній мірі, і наразі немає консенсусу щодо доцільності коригування дози для цієї категорії пацієнтів. За цими пацієнтами необхідно здійснювати ретельне спостереження щодо можливих симптомів тромбоемболій.
Гіперкаліємія. Гепарини можуть пригнічувати секрецію альдостерону у надниркових залозах, що призводить до гіперкаліємії (див. ПОБІЧНА ДІЯ), особливо у пацієнтів з цукровим діабетом, хронічною нирковою недостатністю, вже існуючим метаболічним ацидозом та у пацієнтів, які отримують лікарські засоби з відомою здатністю підвищувати рівні калію (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ). Необхідно періодично контролювати вміст калію в плазмі крові, особливо у пацієнтів з підвищеним ризиком.
Відстежуваність. Низькомолекулярні гепарини є біологічними лікарськими засобами. З метою покращення їх відстежуваності рекомендується, щоб медичні працівники записували торгову назву та номер серії введеного препарату у документацію пацієнта.
Застосування у період вагітності або годування груддю.
Вагітність. У людей відсутні докази того, що еноксапарин проникає через плацентарний бар’єр під час другого та третього триместрів вагітності. Інформація стосовно першого триместру наразі відсутня.
Під час досліджень на тваринах жодних ознак фетотоксичності або тератогенності препарату виявлено не було (див. Доклінічні дані з безпеки). Дані, отримані для експериментальних тварин, показали, що проникнення еноксапарину через плаценту є мінімальним.
Еноксапарин натрію слід призначати вагітним лише у разі встановлення лікарем чіткої потреби у такому лікуванні.
За вагітними жінками, які отримують еноксапарин натрію, необхідно здійснювати ретельне спостереження щодо виникнення ознак кровотечі або надмірної антикоагулянтної дії, а також потрібно застерегти таких пацієнток про ризик геморагічних явищ. В цілому наявні дані вказують на відсутність будь-яких доказів підвищеного ризику кровотеч, тромбоцитопенії або остеопорозу у таких пацієнток у порівнянні з цим ризиком у не вагітних жінок, окрім ризику, який спостерігається у вагітних зі штучними клапанами серця (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Якщо планується епідуральна анестезія, рекомендується перед її виконанням відмінити лікування еноксапарином натрію (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Годування груддю. Невідомо, чи екскретується еноксапарин у грудне молоко людини. У щурів в період лактації проникнення еноксапарину або його метаболітів у грудне молоко є дуже низьким.
Всмоктування еноксапарину натрію при пероральному прийомі є малоймовірним, тому його можна застосовувати під час годування груддю.
Фертильність. Клінічні дані щодо впливу еноксапарину натрію на фертильність наразі відсутні. Дослідження на тваринах не продемонстрували ніякого впливу препарату на фертильність (див. Доклінічні дані з безпеки).
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Вплив еноксапарину натрію на здатність керувати транспортними засобами та працювати з іншими механізмами відсутній або незначний.
Взаємодія з іншими лікарськими засобами
не рекомендується одночасне застосування з нижчезазначеними препаратами.
Лікарські засоби, які впливають на гемостаз (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Деякі засоби, що впливають на гемостаз, рекомендується відміняти до призначення лікування еноксапарином натрію, за винятком випадків, коли такі засоби абсолютно показані. Якщо така комбінація показана, еноксапарин натрію необхідно застосовувати при ретельному клінічному та лабораторному моніторингу за необхідності.
До таких препаратів належать:
– саліцилати для системного застосування, ацетилсаліцилова кислота у протизапальних дозах і нестероїдні протизапальні препарати (НПЗП), в тому числі кеторолак;
– інші тромболітики (наприклад альтеплаза, ретеплаза, стрептокіназа, тенектеплаза, урокіназа) та антикоагулянти (див. ЗАСТОСУВАННЯ).
Препарати, з якими одночасне застосування необхідно здійснювати з обережністю.
Зазначені нижче лікарські засоби можна застосовувати одночасно з еноксапарином натрію з обережністю:
– Інші лікарські засоби, які впливають на гемостаз, такі як:
– інгібітори агрегації тромбоцитів, включаючи ацетилсаліцилову кислоту, що застосовується в антиагрегантній дозі (кардіопротекція), клопідогрель, тиклопідин та антагоністи глікопротеїну IIb/IIIa, що показані при гострому коронарному синдромі, через ризик виникнення кровотечі.
– декстран 40.
– глюкокортикоїди для системного застосування.
– Лікарські засоби, які збільшують рівні калію. Лікарські засоби, які збільшують рівні калію в сироватці крові, можуть призначатися одночасно з еноксапарином натрію при ретельному клінічному та лабораторному моніторингу (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ПОБІЧНА ДІЯ).
Несумісність.
П/ш ін’єкція. Не змішувати з іншими лікарськими засобами.
В/в (болюсна) ін’єкція (виключно для лікування гострого інфаркту міокарда з підйомом сегмента S–T). Еноксапарин натрію можна безпечно вводити з фізіологічним р-ном хлориду натрію (0,9%) або з 5% р-ном глюкози (див. ЗАСТОСУВАННЯ).
Передозування
симптоми. Ненавмисне передозування еноксапарину натрію після в/в, екстракорпорального або п/ш застосування, може призводити до геморагічних ускладнень. Після перорального прийому навіть досить високих доз всмоктування еноксапарину натрію є малоймовірним.
Лікування. Антикоагулянтні ефекти препарату можуть бути значною мірою нейтралізовані повільним в/в введенням протаміну. Доза протаміну залежить від введеної дози еноксапарину натрію:
– 1 мг протаміну нейтралізує антикоагулянтний ефект 100 МО (1 мг) еноксапарину натрію, якщо еноксапарин натрію був введений у межах попередніх 8 годин.
– Можна використовувати інфузійне введення протаміну у дозі 0,5 мг на кожні 100 МО (1 мг) еноксапарину натрію, якщо еноксапарин натрію був введений за більш ніж 8 годин до застосування протаміну або якщо було визначено необхідність призначення другої дози протаміну.
– Через 12 годин після введення еноксапарину натрію застосування протаміну може бути не потрібним.
Проте навіть при застосуванні високих доз протаміну анти-Xa активність еноксапарину натрію ніколи не нейтралізується повною мірою (максимум приблизно на 60%) (див. Інструкції для медичного застосування протамінових солей).
Умови зберігання
зберігати у недоступному для дітей місці. Зберігати в оригінальній упаковці при температурі не вище 25 °C. Не заморожувати.





