Ишемическая болезнь сердца — одна из главных причин высокой смертности и утраты трудоспособности населения в Украине и во многих индустриально развитых странах мира, что представляет серьезную медико-экономическую проблему. Успешное ее решение зависит от понимания механизмов развития заболевания, возможности прогнозирования осложнений и исходов, определяющих врачебную тактику, выбор и эффективность проводимой терапии.
Одной из наиболее распространенных клинических форм ИБС является стенокардия. Своевременная ее диагностика и адекватность лечения определяют не только качество жизни пациентов, но и возможность снижения частоты коронарных осложнений, а в итоге и судьбу больного.
За последние два десятилетия накоплены экспериментальные и клинические данные, изменившие представление кардиологов о механизмах развития ишемии, формировании и прогрессировании атеросклероза и коронарной недостаточности. Концепция динамического коронарного стеноза, разработанная A. Maseri (1980), K.L. Gould (1980), W. Rafflenbeul, P. Lichtlen (1982), позволила с новых позиций объяснить нарушения коронарной гемодинамики в местах атеросклеротического сужения сосудов сердца. Установлена важная роль эндотелия в регуляции тонуса венечных артерий, его взаимодействия с форменными элементами крови, липидами, биологически активными гуморальными факторами, участие в процессах воспаления, прогрессирования атеросклероза и дестабилизации атеромы.
Более глубоким становится само определение ишемии. P.A. Poole-Wilson (1984) полагает, что ишемия — результат нарушения энергообеспечения миокарда и дисбаланс равновесия между потреблением АТФ и кровоснабжением, а не только между поставкой и потребностью сердечной мышцы в кислороде, как считали ранее.
Накопленные экспериментальные и клинические данные позволили понять механизмы, направленные на повышение устойчивости миокарда к ишемическому повреждению, выдвинуть концепцию о существовании динамических изменений миокарда, возникающих вследствие транзиторной или продолжительной ишемии — так называемых состояний оглушенного или гибернированного миокарда. Эти понятия подразумевают существование хронической (в течение нескольких дней или месяцев) сократительной дисфункции миокарда ЛЖ являющейся следствием продолжительной гипоперфузии миокарда и адаптационного снижения метаболизма сердечной мышцы. Такой миокард сохраняет свою жизнеспособность, а его выявление имеет важное практическое значение, поскольку хирургическая реваскуляризация приводит к полному восстановлению его функции.
Установлено, что стенокардия как одна из форм ИБС проявляется клинически не только болевым синдромом. В момент ишемии миокарда удается зарегистрировать нарушения перфузии, метаболизма, диастолической и систолической функции миокарда, изменения ЭКГ, которые могут и не сопровождаться ангинозной болью. По образному сравнению P.F. Cohn (1978) «немые» эпизоды ишемии, как подводная часть айсберга, наряду с болевыми приступами, составляют единое «бремя» ишемии, которое определяет течение и исход заболевания у конкретного больного ИБС.
Своеобразной формой заболевания является стенокардия напряжения на фоне непораженных по данным ангиографии венечных артерий или кардиальный синдром Х.
Факт отсутствия атеросклеротического поражения венечных артерий у этих больных следует понимать весьма условно, имея в виду ограничения, связанные с разрешающей способностью ангиографического исследования, что не исключает наличия атеросклеротического поражения стенки артерии, без уменьшения ее просвета, что устанавливают методом внутрикоронарного УЗИ (IVUS), а также более тонких морфологических и функциональных изменений сосудистой стенки.
Данная глава руководства посвящена хроническим формам ИБС. Согласно принятой в Украине классификации к ним относятся: стабильная стенокардия напряжения (соответствует коду I20.8 по МКБ-10), вазоспастическая стенокардия (ангиоспастическая, спонтанная, вариантная, стенокардия Принцметала — код I20.1 по МКБ-10), стабильная стенокардия напряжения при ангиографически непораженных венечных артериях (кардиальный или коронарный синдром Х — код I20.8 по МКБ-10), безболевая форма ишемической болезни сердца (код I25.6 по МКБ-10), а также постинфарктный кардиосклероз (код I25.2 по МКБ-10) и хроническая аневризма сердца (код I25.3 по МКБ-10).
СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ
Определение
Стенокардия — клинический синдром, проявляющийся болью или ощущением дискомфорта в грудной клетке сжимающего, давящего характера, которая локализуется чаще всего за грудиной и может иррадиировать в левую руку, шею, нижнюю челюсть, эпигастральную область. Боль провоцируется физической нагрузкой, выходом на холод, обильным приемом пищи, эмоциональным стрессом; проходит в покое, устраняется приемом нитроглицерина в течение одной или нескольких минут.
Стенокардия обусловлена преходящей ишемией миокарда, развивается при несоответствии между потребностью миокарда в кислороде и его доставкой коронарным кровотоком.
Эпидемиология
Информация о заболеваемости стенокардией основана на данных эпидемиологических исследований. По результатам 10-летнего проспективного исследования Seven Countries Studies средняя ежегодная заболеваемость стенокардией у мужчин в возрасте 40–59 лет составляет 0,1% в Японии, Греции и Хорватии, 0,2–0,4% — в Италии, Сербии, Нидерландах и США, 0,6–1,1% — в Финляндии. В 5-летнем проспективном исследовании Israel Ischaemic Heart Disease Study в группе мужчин в возрасте старше 40 лет средняя ежегодная заболеваемость стабильной стенокардией составила 0,7%. Эти данные положительно коррелируют с показателем смертности от ИБС в этих регионах. В течение 20-летнего периода Фремингемского исследования ежегодная заболеваемость стенокардией среди мужчин в возрасте 45 лет–54 года составляла 0,3%, 55 лет–64 года — 0,8%, 65 лет–74 года — 0,6%. Среди женщин соответственно возрасту уровни заболеваемости составили 0,2; 0,6 и 0,6%. У половины пациентов после первого ИМ появляются приступы стенокардии, в то время как до инфаркта такие приступы отмечали только у ¼ из них.
По данным эпидемиологического исследования, проведенного сотрудниками Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины (Киев), распространенность стенокардии напряжения в популяции по опроснику Роуза составляет 5,5%, в том числе среди городских жителей у мужчин — 5,3%, у женщин — 9,5%; среди сельского населения у мужчин — 2,8%, у женщин — 4,7%.
Распространенность ИБС в Украине согласно статистическим данным за 2006 г. составила у мужчин 18 814 (на 100 тыс. населения), у женщин — 23 448 (на 100 тыс. населения). Ежегодно от ИБС в Украине умирают около 350 тыс. человек.
Этиология и патогенез
Морфологическим субстратом стенокардии практически всегда являются атеросклеротические сужения коронарных артерий. Стенокардия появляется во время физических нагрузок или стрессовых ситуаций, при сужении просвета коронарной артерии не менее чем на 50–70%. Тяжесть стенокардии зависит от степени, локализации и протяженности стенозов, их количества и числа пораженных артерий. Степень стеноза, особенно эксцентрического, может варьировать в зависимости от тонуса гладких мышц в области атеросклеротической бляшки, что проявляется различиями переносимости физической нагрузки.
В редких случаях стенокардия может развиваться при отсутствии видимого стеноза коронарных артерий как вторичный синдром у пациентов с клапанными пороками сердца, выраженной гипертрофией миокарда (например, у больных с гипертрофической кардиомиопатией), неконтролируемой АГ, являясь следствием относительной коронарной недостаточности. У лиц с неизмененными коронарными артериями ишемия миокарда возникает вследствие ангиоспазма или нарушения регулирующей функции эндотелия.
Похожая на стенокардию боль может быть симптомом некардиальных заболеваний, например пищевода (при этом следует помнить, что нитроглицерин может устранять спазм пищевода и связанные с ним симптомы), грудной клетки или легких. Среди них состояния, повышающие потребление кислорода: гипертермия, гипертиреоз, интоксикация симпатомиметиками (например кокаином) или снижающие поступление кислорода — анемия, гипоксемия, пневмония, БА, ХОБЛ, легочная гипертензия, синдром ночного апноэ, гиперкоагуляция, полицитемия, лейкемия, тромбоцитоз.
Механизмы, направленные на повышение устойчивости миокарда к ишемическому повреждению
В сердечной мышце реализуются внутренние компенсаторные механизмы, направленные на повышение устойчивости миокарда к потенциально летальному ишемическому повреждению — повреждению, приводящему к некрозу. Одним из таких механизмов является ишемическое прекондиционирование — повышение резистентности миокарда к потенциально летальной ишемии, которое достигается предшествующими повторными кратковременными эпизодами менее выраженной (сублетальной) ишемии. Таким образом, происходит своеобразная «тренировка» миокарда допороговой ишемией. Прекондиционирование — понятие патофизиологическое, однако клинической моделью, при которой реализуется этот механизм, может быть многократное повторение эпизодов болевой (стенокардия) и безболевой ишемии.
Другим защитным механизмом является ишемическое посткондиционирование, которое состоит в кратковременном повышении тонуса (вазоконстрикция) коронарных артерий, возникающем после тяжелого ишемического повреждения, и защищающее миокард от реперфузионного повреждения.
Механизмами адаптации к длительной гипоперфузии являются процессы гибернации и оглушения миокарда. По определению Rahimtoola (1989) гибернированным является «миокард с нарушенной сократимостью в состоянии покоя вследствие ограничения коронарного кровотока, способный к частичному или полному восстановлению сократительной функции при увеличении доставки кислорода».
Ранее, в 1975 г., G.R. Heyndrickx и соавторы предложили концепцию «оглушенного» миокарда, получившую дальнейшее развитие в работе E. Braunwald и R.A. Kloner (1982), в соответствии с которой после короткого эпизода выраженной ишемии, повлекшей нарушение сократительной функции миокарда, возможно ее дальнейшее полное восстановление. Чаще всего причиной нарушения сократительной функции сердца является ИМ, реже — хроническая гипоперфузия, связанная с выраженным атеросклеротическим сужением просвета венечной артерии.
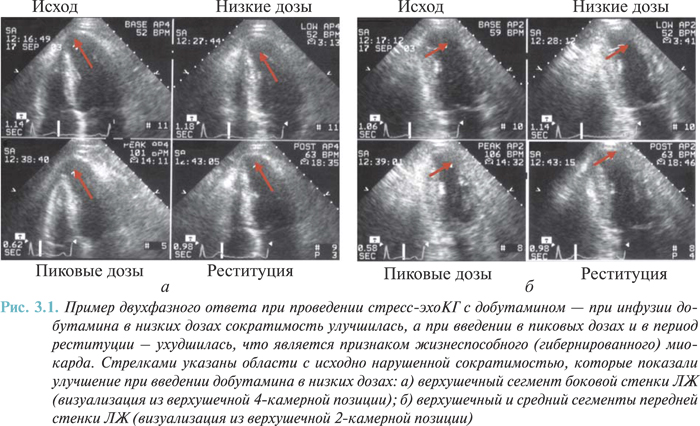
Клиническими состояниями, при которых в сердечной мышце отмечают гибернацию, являются стабильная и нестабильная стенокардия, перенесенный ИМ, «немая» ишемия. К оглушению миокарда приводят нестабильная и вазоспастическая стенокардия, «немая» ишемия, ранняя реперфузия при остром ИМ, выполнение интервенционных и хирургических вмешательств (ЧТКА, АКШ). Различия между гибернированным и оглушенным миокардом представлены в табл. 3.1. Жизнеспособный миокард можно выявить методом стресс-эхоКГ с добутамином (рис. 3.1).
Таблица 3.1
Различия между «оглушенным» и гибернированным миокардом
| Показатель | «Оглушение» | Гибернация |
| Условие | Реперфузия после выраженной ишемии | Хроническая гипоперфузия |
| Перфузия миокарда | ++↓ | ↓↓↓ |
| Биохимические маркеры ишемии | +++ | +(–) |
| Дисфункция ЛЖ | Периодическая | Постоянная |
| Обратимость дисфункции | Спонтанная | После реваскуляризации |
| Клиническое состояние | Нестабильная, вазоспастическая стенокардия, «немая» ишемия, ранняя реперфузия при остром ИМ, ЧТКА, АКШ | Стабильная, нестабильная стенокардия, перенесенный ИМ, «немая» ишемия |
Отметим, что гибернацию не следует отождествлять с хронической ишемией, это качественно другое персистирующее состояние адаптации миокарда к хронической гипоперфузии, обеспечивающее его выживание. В отличие от ишемии при гибернации практически не меняется содержание АТФ и КФК в кардиомиоцитах, сохраняется функция митохондрий, отмечается более активное поглощение глюкозы миокардом, отсутствуют дегенеративные изменения в клетках (вакуолизация, отек, набухание митохондрий, разрыв мембран).
«Оглушенный» и «гибернированный» миокард принято называть жизнеспособным, о чем свидетельствует улучшение или полное восстановление его исходно сниженной сократимости при восстановлении коронарного кровотока у больных ИБС. В ряде исследований установлено, что у более чем 50% пациентов со сниженной глобальной систолической функцией ЛЖ возможно клинически значимое ее улучшение после эндоваскулярной или хирургической реваскуляризации. Причем 22–60% сегментов ЛЖ с исходно нарушенной сократимостью являются жизнеспособными и полностью восстанавливают функцию в условиях адекватного кровоснабжения.
Еще одним механизмом адаптации миокарда к ишемии может быть развитие коллатеральных сосудов. Они обеспечивают кровоток в зонах миокарда между выраженными стенозами в системе одной артерии или связывают территорию кровоснабжения одной эпикардиальной артерии с другой. Коллатерали обеспечивают альтернативный источник кровоснабжения миокарда, пораженного вследствие окклюзирующей коронарной болезни сердца, и могут сохранить функцию миокарда при наличии хронической коронарной окклюзии. Различают два класса коллатералей — капиллярные, без гладкомышечных клеток, они могут располагаться в любом слое миокарда, чаще субэндокардиально; и крупные «мышечные» коллатерали, развивающиеся из существующих артериол и обычно располагающиеся субэпикардиально.
Диагностика
Клинические методы исследования — наиболее важный этап в диагностике заболевания у пациентов с болью в грудной клетке, позволяющие врачу оценить вероятность ИБС с высокой точностью. Клинически значимую коронарную болезнь сердца определяют при выявлении методом коронароангиографии стеноза >70% просвета в одной или более крупных эпикардиальных артериях или >50% стеноза ствола левой коронарной артерии. Наличие участков венечных артерий с менее выраженным стенозом может также вызвать стенокардию, но в этом случае она, как правило, менее выражена и имеет лучший прогноз.
Характеристика болевого синдрома
Первым и важнейшим этапом в диагностике ИБС является подробное описание болевого синдрома. Обычно оценивают 5 характеристик боли: ее характер, локализация, длительность, факторы, провоцирующие и купирующие боль.
Для описания характера ангинозной боли пациентами используют разнообразные определения: «сжимающая», «давящая», «пекущая», «удушающая», часто боль описывают как тяжесть или «кол» за грудиной. Нередко пациенты описывают свои ощущения как «дискомфорт», «но не боль». Боль при стенокардии почти никогда не бывает точечной, острой или колющей и обычно не меняется в зависимости от перемены положения тела и фазы дыхания. Боль обычно локализуется за грудиной, но отмечают также ее распространение на шею, нижнюю челюсть, эпигастральную область, руки, пальцы. Боль, появляющаяся выше нижней челюсти, ниже эпигастрия или локализующаяся на небольшом участке в левой половине грудной клетки в точке проекции верхушки сердца, для стенокардии не характерна. Иногда стенокардия может сопровождаться менее специфическими симптомами — одышкой, усталостью, слабостью, тошнотой, повышенной возбудимостью, ощущением тревоги.
Ангинозная боль обычно непродолжительная, не более 5 мин в большинстве случаев, а иногда даже меньше 1 мин. Дискомфорт или тупая боль, длящаяся часами, вряд ли могут быть симптомом стенокардии. Стенокардия обычно провоцируется физическим или эмоциональным стрессом и проходит во время отдыха. Боль в утренние часы после подъема пациента с постели, а также после приема пищи — классические признаки тяжелой стенокардии. Боль, появляющаяся не во время, а после физического или психоэмоционального напряжения, менее характерна для ИБС.
Сублингвальный прием нитроглицерина полностью купирует или уменьшает выраженность ангинозной боли в течение 30 с — нескольких минут.
Следует помнить, что стенокардию могут имитировать другие заболевания, которые сопровождаются болью или неприятными ощущениями в груди. Подробные данные анамнеза, клиническое и инструментальное исследование помогают в этих случаях избежать диагностических ошибок.
Состояния, при которых возникает боль в грудной клетке, представлены в табл. 3.2.
Таблица 3.2
Причины возникновения боли в грудной клетке
| Сердечно-сосудистые неишемические | Легочные | Желудочно-кишечные | Психические | Другие |
|
|
Заболевания пищевода:
Желудочно-кишечные и билиарные заболевания:
|
Состояния беспокойства:
Аффективные состояния:
|
Грудная клетка:
|
Часто используется такая классификация боли в грудной клетке: типичная стенокардия, атипичная стенокардия и некардиальная боль в грудной клетке. Боль расценивают как типичную стенокардию, когда она соответствует всем вышеперечисленным характеристикам; атипичная стенокардия — когда соответствует двум из вышеуказанных характеристик, боль в грудной клетке некардиального генеза определяют в случаях наличия одной из типичных характеристик или при их отсутствии (табл. 3.3).
Таблица 3.3
Клиническая классификация боли в грудной клетке
| Типичная стенокардия (определенная) |
|
| Атипичная стенокардия (вероятная) | Наличие 2 из вышеперечисленных характеристик |
| Некардиальная боль в грудной клетке | Наличие 1 или отсутствие типичных для стенокардии характеристик |
Стенокардию также классифицируют как стабильную и нестабильную. Нестабильная стенокардия, которая чаще ассоциируется с разрывом атеросклеротической бляшки, имеет значительно более высокий риск развития коронарных событий в ближайшее время. Нестабильная стенокардия определяется как стенокардия, для которой характерна как минимум 1 из 3 характеристик: ангинальная боль в покое, выраженная впервые возникшая стенокардия, прогрессирующая стенокардия.
Стенокардия покоя имеет следующие признаки — ангинозная боль появляется в покое на фоне предшествующей стенокардии напряжения или без таковой, обычно более длительная (до 20 мин). Впервые возникшая стенокардия — стенокардия не менее III ФК, впервые появившаяся в течение 1 мес. Прогрессирующая (усиливающаяся) стенокардия — ранее диагностированная стенокардия, достоверно более частая, продолжительная или с меньшим порогом физической активности ее провоцирующим (то есть повышение ФК стенокардии как минимум на один класс, появившееся в течение 2 мес).
Для классификации стабильной стенокардии используют классификацию Канадского общества по изучению сердечно-сосудистых заболеваний (табл. 3.4).
Таблица 3.4
Классификация стабильной стенокардии Канадского общества по изучению сердечно-сосудистых заболеваний
| ФК стенокардии | Характеристика стенокардии |
| I | Обычная физическая активность (такая как ходьба, подъем по лестнице) не вызывает стенокардию. Боль появляется во время интенсивной или длительной нагрузки |
| II | Умеренное ограничение обычной физической активности. Стенокардия появляется во время быстрой ходьбы, при подъеме в гору, по лестнице, после приема пищи, на холоде, во время эмоционального стресса или в течение нескольких часов после сна. Стенокардия появляется при ходьбе на расстояние более чем 200–400 м или при подъеме более чем на один пролет стандартной лестницы обычным шагом в нормальных условиях |
| III | Заметное ограничение обычной физической активности. Стенокардия появляется при ходьбе на расстояние 100–200 м или при подъеме на один пролет стандартной лестницы обычным шагом в нормальных условиях |
| IV | Невозможность выполнения любой физической активности без появления симптомов дискомфорта, последние могут возникать в покое |
Методы физикального обследования
При физикальном обследовании у больных со стабильной стенокардией обычно не выявляют патологических изменений. Однако может быть полезным обследование во время болевого приступа. При ИБС могут определять 4-й или 3-й тон сердца, ритм галопа, шум митральной регургитации, парадоксальное расщепление 2-го тона, пульсацию грудной клетки, застойные хрипы в легких. При детальном обследовании сердечно-сосудистой системы может быть выявлена другая патология, сопровождающаяся стенокардией, например клапанный порок сердца или ГКМП. Признаки атеросклеротического поражения сосудов внесердечной локализации — шум над сонной артерией, ослабленный пульс на стопе или аневризма брюшной аорты — повышают вероятность наличия ИБС. Повышенное АД или экссудат в сетчатке глаза также характерны для факторов риска возникновения ИБС. Болезненные участки при пальпации грудной клетки можно выявить у пациентов, у которых боль в грудной клетке является следствием скелетно-мышечного синдрома. Однако боль в грудной клетке вследствие повышенного АД или скелетно-мышечного генеза возможна и у пациентов со стенокардией. Наличие шума трения характерно для перикардита или плеврита. Осмотр также должен включать оценку ИМТ и окружности талии с целью диагностики метаболического синдрома. Следует обращать внимание на признаки нарушения липидного обмена: ксантомы, ксантелазмы, краевое помутнение роговицы в виде «старческой дуги».
Лабораторные методы исследования
Диагностические лабораторные исследования выбирают индивидуально с целью получения информации о возможных причинах ишемии, факторах сердечно-сосудистого риска и для оценки прогноза.
Определение уровня гемоглобина, гормонов щитовидной железы в крови и лейкоцитарной формулы информативны для определения возможных причин ишемии. При подозрении на нестабильность определяют биохимические маркеры миокардиального повреждения, такие как уровень тропонина или активность КФК. Однако эти показатели не используют как рутинные исследования при обследовании всех пациентов.
Уровни общего ХС, ХС ЛПНП, ХС ЛПВП и ТГ необходимо оценивать у всех больных с подозрением на ИБС (стабильную стенокардию), чтобы установить степень риска и определить потребность в гиполипидемическом лечении. Липидный профиль крови и гликемический статус необходимо периодически определять повторно, чтобы оценить эффективность лечения, а у пациентов без сахарного диабета выявить возможное его развитие. Рекомендуется ежегодный контроль вышеуказанных показателей. Пациентам с высоким уровнем липидов в сыворотке крови, больным сахарным диабетом и пациентам, которым планируется проведение интервенционных вмешательств, обследование следует проводить по показаниям.
Определение уровня креатинина в сыворотке крови необходимо всем больным с подозрением на стенокардию с целью выявления у них почечной дисфункции, которая присоединяется к таким заболеваниям, как АГ, сахарный диабет, заболевания сосудов почек, и оказывает негативное влияние на прогноз у больных ИБС. Для расчета клиренса креатинина можно использовать формулу Кокрофта — Голта:
(140 — возраст пациента (лет) х масса тела (кг) / 72 х уровень креатинина в сыворотке крови (мг/дл)).
У женщин при расчете используют корректировочный коэффициент 0,85.
Дальнейшее лабораторное обследование, включающее определение субфракций ХС — (аполипопротеин A и аполипопротеин B), гомоцистеина, липопротеина (а), реологических нарушений и маркеров воспаления, таких как СРБ, гликозилированного гемоголобина у пациентов с сопутствующим сахарным диабетом, представляет интерес для объективного прогнозирования риска у больных ИБС.
Совокупность необходимых лабораторных исследований определяют в зависимости от анамнеза заболевания, факторов риска, семейного анамнеза.
Рекомендации по лабораторному обследованию при диагностике стабильной стенокардии.
Всем пациентам:
- Липидный профиль сыворотки крови (натощак), включая определение уровня ХС, ХС ЛПНП, ХС ЛПВП, ТГ.
- Уровень глюкозы в крови (натощак).
- Общий анализ крови, включая гемоглобин и лейкоцитарную формулу.
- Уровень креатинина в крови.
При выявлении отклонений в результатах клинического обследования:
- Определение маркеров повреждения, миокарда при наличии клиники нестабильной стенокардии или острого коронарного синдрома.
- Уровень гормонов щитовидной железы.
- Тест толерантности к глюкозе.
- СРБ.
- Липопротеин (а), аполипопротеин A, аполипопротеин B.
- Гомоцистеин.
- Гликозилированный гемоглобин (HbA1c).
- Мозговой натрийуретический пептид (NT-BNP).
Для рутинного лабораторного обследования пациентов с хронической стабильной стенокардией рекомендовано ежегодное определение уровня глюкозы и липидного профиля крови (натощак).
Неинвазивные инструментальные методы исследования
Для диагностики ишемии миокарда могут быть использованы различные методики: регистрация ЭКГ в покое, холтеровское ЭКГ-мониторирование, нагрузочные тесты (тредмил-тест, ВЭМ), фармакологические пробы, стрессовая эхоКГ, радионуклидные методы исследования.
Выбор методики выявления ишемии миокарда должен определяться прежде всего клинической картиной и конкретными задачами, стоящими перед врачом. Кроме того, необходимо учитывать особенности каждого диагностического метода: показания и противопоказания к его применению, преимущества и недостатки, ограничения в использовании, зависящие как от характеристик самого метода, так и от состояния больного, возможности метода в оценке характера и тяжести поражения коронарного русла и миокарда, его прогностические возможности.
Рентгенография органов грудной клетки
Рентгенографию органов грудной клетки часто используют при обследовании пациентов с подозрением на заболевание сердца. Рентгенография в стандартных проекциях позволяет оценить размеры контуров сердца — общие и отдельных камер, состояние крупных сосудов (аорты, ЛA, верхней полой вены), выявить наличие кальцинатов в миокарде, перикарде, коронарных артериях, крупных сосудах. С помощью этого метода можно выявить признаки левожелудочковой недостаточности — венозный застой, отек легких, легочную патологию, а также изменения костного аппарата грудной клетки.
Однако при стабильной стенокардии рентгенография не несет специфической информации ни для диагностики, ни для стратификации риска. Рентгенограмма чаще бывает патологической у пациентов с ранее перенесенным или острым ИМ, а также у больных с болью некоронарного генеза или дискомфортом в грудной клетке, вызванным некардиальными причинами. Увеличение сердца может быть следствием ранее перенесенного ИМ, острой левожелудочковой недостаточности, перикардиального выпота или хронической перегрузки объемом ЛЖ, например при митральной или аортальной недостаточности. Выявление кальцификации коронарных артерий повышает вероятность симптоматичной ИБС. Флюороскопически определяемая коронарная кальцификация коррелирует с окклюзией основного сосуда у 94% у пациентов с болью в грудной клетке, хотя чувствительность метода всего 40%.
При диагностике стабильной стенокардии рентгенографию рекомендуется проводить:
- у пациентов с подозрением на СН;
- у пациентов с клиническими проявлениями выраженной легочной патологии.
Регистрация ЭКГ в состоянии покоя
У всех больных с подозрением на стенокардию следует зарегистрировать ЭКГ в 12 отведениях в состоянии покоя. Результаты этого исследования не позволяют с полной уверенностью утверждать о наличии или отсутствии ИБС; нормальная ЭКГ в покое не является редкостью даже у больных с очень тяжелой стенокардией. Однако на ЭКГ в покое могут отмечаться такие признаки ИБС, как рубцовые изменения после перенесенного в прошлом ИМ, или патологический характер реполяризации миокарда. Во время ишемии миокарда на ЭКГ фиксируются изменения конечной части желудочкового комплекса — сегмента ST и зубца Т. Острая ишемия обычно приводит к транзиторному горизонтальному или косонисходящему снижению сегмента ST и уплощению или инверсии зубца Т. Иногда отмечают подъем сегмента ST, что свидетельствует о более тяжелой трансмуральной ишемии миокарда. В отличие от острого ИМ, при стенокардии все отклонения сегмента ST быстро нормализуются после купирования симптомов. Кроме того, на ЭКГ могут быть выявлены другие нарушения, такие как признаки ГЛЖ, блокады ножек пучка Гиса, предвозбуждение желудочков, нарушения ритма или проводимости. Такая информация может быть полезной в определении механизмов, ответственных за возникновение боли в грудной клетке, или при выделении подгрупп больных с повышенным риском смерти или ИМ.
При диагностике стабильной стенокардии ЭКГ покоя рекомендуется регистрировать вне болевого приступа, а также (по возможности) во время болевого эпизода.
При рутинном обследовании пациентов с хронической стабильной стенокардией рекомендуется периодическая регистрация ЭКГ в покое даже при отсутствии клинических изменений.
Нагрузочные пробы
Для идентификации ишемии у большинства больных с подозрением на стабильную стенокардию регистрация ЭКГ во время нагрузочных проб — более чувствительный и специфичный метод, чем в покое. Нагрузочные, а также фармакологические тесты провоцируют ишемию миокарда посредством повышения потребности миокарда в кислороде (тредмил-тест, ВЭМ, добутаминовая проба) или снижения доставки кислорода к миокарду (пробы с дипиридамолом и аденозином). При этом выявить ишемию можно различными методами на уровне специфических нарушений перфузии и метаболизма миокарда (плоскостная томография и ОФЭКТ, МРТ), региональной сократимости (стрессовая эхоКГ, вентрикулография) или с учетом ЭКГ-изменений (ВЭМ, тредмил-тест) и клинических симптомов. Более ранней и точной следует считать неинвазивную диагностику, основанную на индикации региональных нарушений перфузии, метаболизма и сократимости миокарда (рис. 3.2).

Как правило, в Украине диагностика ограничивается методами оценки ЭКГ-показателей ишемии и значительно реже анализом параметров систоло-диастолической функции миокарда методом стрессовой эхоКГ.
Тем не менее такие нагрузочные пробы, как тредмил-тест или ВЭМ, до сих пор являются наиболее распространенными методами диагностики ИБС. Это относительно простые и недорогие методы выявления преходящей ишемии миокарда у больных с подозрением на ИБС или с установленным ее диагнозом.
Пробы с дозированной физической нагрузкой
ЭКГ, зарегистрированная в покое, вне болевого приступа, у пациента без ИМ в анамнезе, может оказаться в норме. Во время пробы с дозированной физической нагрузкой пациент выполняет возрастающую нагрузку на тредмиле или ВЭМ, при этом постоянно регистрируют ЧСС и ЭКГ, через регулярные промежутки времени (1–3 мин) контролируют АД. Тредмил-тест по сравнению с ВЭМ имеет как преимущества, так и недостатки. Преимущество заключается, прежде всего, в том, что нагрузка является более физиологичной и воспринимается больными как более привычная. Кроме того, при использовании стандартного протокола Брюса возможно выполнение большей нагрузки, чем при ВЭМ, и более быстрое достижение желаемого результата.
При проведении пробы на тредмиле или велоэргометре можно использовать как протокол Брюса, так и одну из его модификаций. Величина рабочей нагрузки на велоэргометре выражается в ваттах (Вт). Нагрузку начинают с 25–50 Вт, каждые 2–3 мин повышая ее на 25 Вт (одна ступень). При необходимости (у пациентов с СН, тяжелой стенокардией) ступень нагрузки может быть уменьшена до 10 Вт. Следует применять стандартный протокол, поскольку он может быть использован для получения данных об одном и том же больном в дальнейшем. В дополнение к диагностическому значению ЭКГ при физической нагрузке стресс-тест играет важную роль в выявлении немой ишемии и оценке прогноза у больных с хронической стабильной стенокардией, а также в изучении дальнейшего развития заболевания или эффективности лечения. Проведение нагрузочного теста рекомендуется после детального клинического обследования пациента. Осложнениями нагрузочной пробы могут быть как возникновение серьезной аритмии, так и внезапная смерть (1 на 2500 тестов). Врач обязан присутствовать при проведении пробы. Регистрация ЭКГ должна быть беспрерывной с распечаткой на каждой 1-й или 3-й минуте в течение нагрузки и 2–10 мин реституции.
Основные показания к проведению нагрузочных проб:
- дифференциальная диагностика ИБС и отдельных ее форм;
- определение индивидуальной толерантности к физической нагрузке у больных с установленным диагнозом ИБС и уточнение ФК стенокардии;
- оценка эффективности лечебных, в том числе медикаментозных, хирургических и реабилитационных мероприятий;
- экспертиза трудоспособности больных с сердечно-сосудистыми заболеваниями;
- оценка прогноза.
Абсолютными противопоказаниями к проведению теста с физической нагрузкой являются острая фаза ИМ (в течение 2–7 дней от начала), нестабильная стенокардия, нарушение мозгового кровообращения, острый тромбофлебит, ТЭЛА, СН III–IV ФК по классификации NYHA, выраженная легочная недостаточность, лихорадка.
Нецелесообразно выполнять этот диагностический тест при тахиаритмии, полной блокаде левой ножки пучка Гиса, высокой степени синоатриальной и AV-блокад, критическом аортальном стенозе или ГКМП.
Критериями прекращения пробы с физической нагрузкой являются развитие приступа стенокардии, появление признаков ишемии миокарда на ЭКГ, достижение целевой ЧСС, развитие выраженного утомления, делающего невозможным продолжение физической нагрузки, и отказ пациента от проведения пробы. Пробу с физической нагрузкой следует прекратить при:
- развитии типичного приступа стенокардии;
- появлении угрожающих жизни нарушений сердечного ритма: частая, или политопная, или залповая желудочковая экстрасистолия, пароксизмальная тахикардия или пароксизмальная фибрилляция предсердий; появлении систолического шума митральной регургитации;
- возникновении выраженной одышки (частота дыхания более 30 в минуту) или приступа удушья;
- развитии нарушений проводимости — блокады ножек пучка Гиса, AV-блокады II степени и более;
- ишемическом смещении сегмента ST вверх >1 мм в любом из отведений (кроме аVR и V1); или вниз от изоэлектрической линии ≥2 мм (горизонтальная или косонисходящая депрессия) через 60–80 мс после окончания комплекса QRS (особенно если изменения сопровождаются ангинозной болью и сохраняются более 3 мин после окончания теста; депрессия сегмента ST ≥4 мм — абсолютное показание к прекращению теста);
- повышении уровня САД >250 мм рт. ст., ДАД >115 мм рт. ст., снижении САД на 20 мм рт. ст.;
- появлении неврологической симптоматики — головокружения, нарушения координации движений, сильной головной боли;
- возникновении интенсивной боли в нижних конечностях;
- развитии резкого утомления пациента, его отказе от дальнейшего выполнения пробы;
- решении врача как мера предосторожности;
- достижении 75–100% максимальной возрастной ЧСС.
У пациентов с положительными результатами теста при низкой толерантности к физической нагрузке чаще выявляют тяжелое поражение нескольких коронарных артерий. Пробу с физической нагрузкой считают положительной в отношении диагностики ИБС, если во время ее проведения воспроизводится типичная для пациента боль в груди и возникают характерные для ишемии изменения на ЭКГ. Не всегда боль сопровождает снижение сегмента ST. Пробу считают положительной, если ЭКГ-изменения появляются без боли либо типичный приступ стенокардии развивается без снижения сегмента ST, либо боль сопровождается депрессией ST.
Информативность теста с физической нагрузкой может уменьшаться при приеме некоторых препаратов. Блокаторы β-адренорецепторов или некоторые антагонисты кальция (урежающие ЧСС) могут не позволить достичь целевой ЧСС. В этих случаях следует учитывать, с какой целью выполняется нагрузочная проба. Если ее проводят для определения наличия у пациента ИБС — эти препараты следует отменить за 24–48 ч перед тестом с физической нагрузкой. У пациентов с диагностированной ИБС при необходимости оценить эффективность подобранной схемы лечения пробу проводят на фоне приема лекарственных средств.
Учитывая большую важность информации, получаемой при данном исследовании, необходимо во всех случаях (при отсутствии противопоказаний) стремиться к выполнению нагрузочных проб у больных со стабильной стенокардией.
Чувствительность и специфичность пробы с физической нагрузкой. В метаанализе 147 опубликованных результатов исследований, описывающих 24 074 пациента, которым была проведена как коронарная ангиография, так и нагрузочная проба, выявили широкий диапазон чувствительности и специфичности нагрузочных проб. Чувствительность составляла 23–100% (в среднем — 68%), а специфичность — 17–100% (в среднем — 77%). При анализе только 58 исследований, из которых исключали пациентов с ранее перенесенным ИМ, средняя чувствительность составила 67%, а специфичность — 72%. Когда анализ был сужен до нескольких исследований, в которых исключалась рабочая ошибка путем включения пациентов, до начала обследования согласившихся на проведение коронароангиографии и нагрузочной пробы, чувствительность метода составила 50%, а специфичность — 90%.
В одном из последних исследований, проведенном с участием 814 пациентов и тщательно выполненном с целью снижения рабочей ошибки, чувствительность составила 45%, а специфичность — 85%. Таким образом, истинная диагностическая ценность нагрузочной ЭКГ-пробы базируется в основном на ее относительно высокой специфичности, в то время как чувствительность нагрузочной пробы оказывается ниже чувствительности визуализирующих методов исследования.
Хотя чувствительность и специфичность диагностических тестов часто рассматривают как полноценные характеристики, не зависящие от индивидуальных особенностей пациентов, это не всегда так. Например, нагрузочные пробы имеют более высокую чувствительность у лиц пожилого возраста и пациентов с трехсосудистым поражением, чем у лиц молодого возраста и больных с однососудистым поражением. Тест также имеет более низкую специфичность у пациентов с болезнями клапанов сердца, ГЛЖ и депрессией сегмента ST в покое, у пациентов, принимающих дигоксин.
Предтестовая вероятность. Предтестовая вероятность ИБС в зависимости от возраста, пола и характера болевого синдрома рассчитана в табл. 3.5а.
Функциональная оценка, многоступенчатый подход к оценке вероятности ИБС. У больных с ранее не диагностированной ИБС можно использовать ступенчатый подход для оценки вероятности значимого поражения коронарных артерий, основанный на комплексном анализе таких факторов, как возраст, пол и характер боли в грудной клетке, а также наличия и выраженности изменений сегмента ST при выполнении физической нагрузки (табл. 3.5a, б).
Вероятность значимого поражения коронарных артерий можно уточнить путем изучения изменений сегмента ST во время физической нагрузки. Очевидно (см. табл. 3.5б), что нагрузочная проба не будет очень полезной для подтверждения диагноза ИБС у 64-летнего мужчины с типичной стенокардией. Даже при отсутствии изменений на ЭКГ при выполнении пробы вероятность ИБС будет все же составлять 79%. Она повысилась бы до 99%, если бы произошло снижение сегмента ST на 0,2 мВ. Тем не менее, данная проба может оказать помощь в определении степени функциональных ограничений у этого больного (толерантность к физической нагрузке), измерении реакции со стороны АД (как индикатора функции ЛЖ), а также оценке прогноза заболевания. Точно также диагностическая ценность ЭКГ при физической нагрузке является низкой у мужчин и женщин без симптомов заболевания.
Таблица 3.5а
Вероятность наличия ИБС до проведения теста с дозированной физической нагрузкой (%) у больных с симптомами заболевания в зависимости от возpаста и пола
| Возраст, лет | Типичная стенокардия | Нетипичная стенокардия | Неангинозная боль в грудной клетке | |||
| муж. | жен. | муж. | жен. | муж. | жен. | |
| 30–39 | 69,7±3,2 | 25,8±6,6 | 21,8±2,4 | 4,2±1,3 | 5,2±0,8 | 0,8±0,3 |
| 40–49 | 87,3±1,0 | 55,2±6,5 | 46,1±1,8 | 13,3±2,9 | 14,1±1,3 | 2,8±0,7 |
| 50–59 | 92,0±0,6 | 79,4±2,4 | 58,9±1,5 | 32,4±3,0 | 21,5±1,7 | 8,4±1,2 |
| 60–69 | 94,3±0,4 | 90,1±1,0 | 67,1±1,3 | 54,4±2,4 | 28,1±1,9 | 18,6±1,9 |
Таблица 3.5б
Вероятность наличия ИБС после проведения пробы с дозированной физической нагрузкой (%) в соответствии с полом, возpастом, классификацией симптомов и снижением сегмента ST на ЭКГ, вызванным физической нагрузкой
| Возраст, лет | Снижение сегмента ST, мВ | Типичная стенокардия | Нетипичная стенокардия | Неангинозная боль в грудной клетке | Отсутствие симптомов | ||||
| муж. | жен. | муж. | жен. | муж. | жен. | муж. | жен. | ||
| 30–39 | 0,00–0,04 | 25 | 7 | 6 | 1 | 1 | <1 | <1 | <1 |
| 0,05–0,09 | 68 | 24 | 21 | 4 | 5 | 1 | 2 | 4 | |
| 0,10–0,14 | 83 | 42 | 38 | 9 | 10 | 2 | 4 | <1 | |
| 0,15–0,19 | 91 | 59 | 55 | 15 | 19 | 3 | 7 | 1 | |
| 0,20–0,24 | 96 | 79 | 76 | 33 | 39 | 8 | 18 | 3 | |
| >0,25 | 99 | 93 | 92 | 63 | 68 | 24 | 43 | 11 | |
| 40–49 | 0,00–0,04 | 61 | 22 | 16 | 3 | 4 | 1 | 1 | <1 |
| 0,05–0,09 | 86 | 53 | 44 | 12 | 13 | 3 | 5 | 1 | |
| 0,10–0,14 | 94 | 72 | 64 | 25 | 26 | 6 | 11 | 2 | |
| 0,15–0,19 | 97 | 84 | 78 | 39 | 41 | 11 | 20 | 4 | |
| 0,20–0,24 | 99 | 93 | 91 | 63 | 65 | 24 | 39 | 10 | |
| >0,25 | >99 | 98 | 97 | 86 | 87 | 53 | 69 | 28 | |
| 50–59 | 0,00–0,04 | 73 | 47 | 25 | 10 | 6 | 2 | 2 | 1 |
| 0,05–0,09 | 91 | 78 | 57 | 31 | 20 | 8 | 9 | 3 | |
| 0,10–0,14 | 96 | 89 | 75 | 50 | 37 | 16 | 19 | 7 | |
| 0,15–0,19 | 98 | 94 | 86 | 67 | 53 | 28 | 31 | 12 | |
| 0,20–0,24 | 99 | 98 | 94 | 84 | 75 | 50 | 54 | 27 | |
| >0,25 | >99 | 99 | 98 | 9-5 | 91 | 78 | 81 | 56 | |
| 60–69 | 0,00–0,04 | 79 | 69 | 32 | 21 | 8 | 5 | 3 | 2 |
| 0,05–0,09 | 94 | 90 | 65 | 52 | 26 | 17 | 11 | 7 | |
| 0,10–0,14 | 97 | 95 | 81 | 72 | 45 | 33 | 23 | 15 | |
| 0,15–0,19 | 99 | 98 | 89 | 83 | 62 | 49 | 37 | 25 | |
| 0,20–0,24 | 99 | 99 | 96 | 93 | 81 | 72 | 61 | 47 | |
| >0,25 | >99 | 99 | 99 | 98 | 94 | 90 | 85 | 76 | |
Наибольшей диагностической ценности можно достичь у пациентов со средней степенью вероятности заболевания до нагрузочной пробы, например от 20 до 80%. Дополнительное уточнение диагноза возможно при многофакторном анализе результатов стресс-теста, во время которого вероятность наличия заболевания оценивается на основании комбинации ЧСС на высоте физической нагрузки, снижения сегмента ST, наличия или отсутствия стенокардии во время пробы, достигнутой рабочей нагрузки и степени наклона сегмента ST. Такая оценка вероятности ИБС позволяет лучше понять реальное состояние больного, чем произвольная классификация нормы или патологии.
У лиц с низкой вероятностью ИБС (например <20%) и адекватной переносимостью физической нагрузки проведения дополнительных исследований обычно не требуется, даже если у них нельзя исключить наличие ИБС. Диагноз является установленным у больных с высокой вероятностью наличия ИБС после выполнения нагрузочной пробы (например >80%). При умеренно или резко выраженных симптомах, которые неадекватно контролируются медикаментозным лечением, показана коронарная ангиография для определения необходимости инвазивного вмешательства. Больным со средней вероятностью наличия заболевания после выполнения стресс-теста (20–80%) желательно провести второй неинвазивный тест для выделения подгрупп больных с более или менее высокой вероятностью ИБС после диагностического исследования. В зависимости от средств и опыта в данной ситуации можно выбрать в качестве второго теста либо перфузионную сцинтиграфию миокарда, либо стрессовую эхоЕГ.
Факторы, влияющие на результаты тестов с физической нагрузкой
Дигоксин. Дигоксин вызывает индуцированную нагрузкой депрессию сегмента ST у 25–40% практически здоровых лиц. С возрастом патологический ответ превалирует.
Блокаторы β-адренорецепторов. По возможности рекомендуется отмена блокаторов β-адренорецепторов (и других антиишемических препаратов) в срок, в 4–5 раз превышающий период полувыведения препарата (обычно около 48 ч), перед нагрузкой с целью диагностики или первичного определения риска у пациентов с предполагаемой ИБС. Эти препараты следует отменять постепенно для предотвращения развития синдрома отмены, который может помешать проведению исследования. В случае если блокаторы β-адренорецепторов не могут быть отменены, снижается возможность выявления ишемии миокарда, однако у пациентов с высоким риском обычно тест оказывается позитивным.
Другие препараты. Антигипертензивные препараты и вазодилататоры могут повлиять на результаты нагрузочной пробы в основном за счет влияния на уровень АД.
Kратковременное применение нитратов может ослаблять такие проявления ишемии миокарда, как стенокардия и депрессия сегмента ST.
При применении флекаинида описаны случаи возникновения желудочковой тахикардии при физической нагрузке.
Блокада левой ножки пучка Гиса. Вызванная нагрузкой депрессия сегмента ST в отведениях (V5–V6) обычно связана с блокадой, а не с ишемией.
Блокада правой ножки пучка Гиса. Обусловленная нагрузкой депрессия сегмента ST в передних грудных отведениях (V1-V3) также обычно связана с блокадой, а не с ишемией. Однако при ее появлении в левых грудных отведениях (V5–V6) или нижних отведениях (III, aVF) она имеет диагностическое значение при условии ее отсутствия в покое.
ГЛЖ с аномалиями реполяризации на ЭКГ, зарегистрированная в покое, ассоциируется с большинством ложноположительных результатов, которые приводят к снижению специфичности метода.
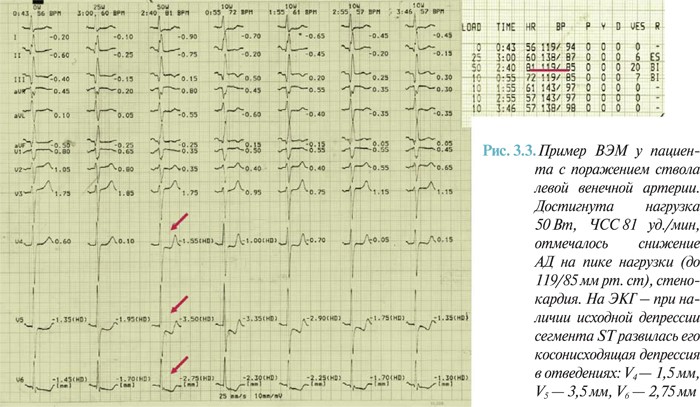
Депрессия сегмента ST в покое является маркером неблагоприятных кардиальных событий у пациентов с ИБС или без нее. Дальнейшая депрессия сегмента ST, индуцированная физической нагрузкой, у пациентов с исходной депрессией в покое <1 мм является высокочувствительным индикатором наличия ИБС (рис. 3.3).
Интерпретация изменений сегмента ST
Выбор отведения. Наиболее высокое качество результатов при проведении пробы с нагрузкой достигается при использовании 12-канальной регистрации ЭКГ. Отведение V5 является наиболее информативным. У пациентов без предшествующего ИМ с нормальной ЭКГ в покое депрессия сегмента ST, индуцированная нагрузкой, ограничивающаяся нижними отведениями (III, aVF) , имеет небольшую диагностическую значимость.
Косовосходящая депрессия ST. Пациенты с косовосходящей депрессией сегмента ST со скоростью подъема менее 1 мВ/с имеют высокую вероятность ИБС. Однако основным критерием положительного теста является горизонтальная или косонисходящая депрессия или элевация сегмента ST на 1 мм в течение >60–80 мс после конечной части комплекса QRS; большинство опубликованных исследований основываются именно на этих критериях.
Реполяризация предсердий. Волны реполяризации предсердий направлены противоположно зубцу Р и могут наслаиваться на сегмент ST и зубец T. Усиленная реполяризация предсердий может привести к косовосходящей депрессии сегмента ST при отсутствии ишемии. У пациентов с ложноположительным результатом теста имеют место: высокий порог нагрузки и высокая пороговая ЧСС, отсутствие боли при физической нагрузке, заметная косонисходящая депрессия сегмента PR в нижних отведениях. Эти данные о реполяризации предсердий впервые были представлены в 1999 г. в рекомендациях по проведению нагрузочных проб ACC/AHA.
Элевация сегмента ST. На ЭКГ покоя в норме элевация сегмента ST (кроме отведений aVR и V1) — редкое явление, может быть следствием трансмуральной ишемии вследствие спазма или критического повреждения венечных артерий, значительно повышает вероятность возникновения аритмии и свидетельствует о локализации ишемии. При наличии на ЭКГ в покое зубца Q у пациента, перенесшего ИМ, клиническое значение элевации сегмента ST неоднозначно. Одни исследования показывают, что это возникает при нарушениях движения стенок миокарда; другие это оценивают как маркер остаточной жизнеспособности миокарда в инфарцированной зоне.
Изменения зубца R. Существует множество факторов, способных повлиять на изменения зубца R в ответ на физическую нагрузку, поэтому его изменения не имеют диагностической ценности.
Компьютерная обработка ЭКГ. Хотя компьютерная обработка может оказаться полезной, в некоторых случаях она приводит к ложноположительной оценке депрессии сегмента ST. Чтобы избежать этого, врач должен сравнивать необработанную ЭКГ со всеми усредненными компьютером данными.
Особые группы пациентов
Женщины
Диагностика стенокардии у женщин представляет определенные трудности. Чем более типична картина болевого приступа для стенокардии, тем выше вероятность наличия коронарного атеросклероза. Однако даже при типичном болевом синдроме у значительной части женщин при ангиографии выявляют нормальные коронарные артерии. В настоящее время нет ни одного неинвазивного скринингового теста, позволяющего надежно диагностировать ИБС у женщин без симптомов ИБС. Тест с физической нагрузкой у женщин значительно чаще, чем у мужчин, бывает ложноположительным. Особенно высока частота ложноположительных результатов у женщин с нетипичным для стенокардии болевым синдромом. Специфичность повышается, если ЭКГ-критерием положительного теста считать депрессию ST не на 1 мм, а на 2 мм.
Хотя ИБС является одной из основных причин смерти у женщин, чаще она возникает, а следовательно, имеет большую предтестовую вероятность у мужчин. Особенно при сравнении с женщинами в пременопаузный период. Низкая по сравнению с мужчинами предтестовая вероятность ИБС у женщин означает, что у них отмечается большее число ложноположительных результатов.
В исследовании CASS почти у половины женщин с клиническими проявлениями стенокардии, у многих из которых была положительная нагрузочная проба, коронарные артерии оказались нормальными.
Чувствительность нагрузочного теста у женщин выше, чем у мужчин, а некоторые исследования показали также и меньшую его специфичность. Среди причин, объясняющих такие расхождения, наиболее вероятными являются: использование разных критериев для определения ИБС, различия в преобладании многососудистых поражений и ранее перенесенного ИМ, различия в критериях оценки сегмента ST, различия переносимости нагрузки (невозможность для многих женщин выполнить нагрузку с максимальным потреблением кислорода), большая распространенность среди женщин пролапса митрального клапана и синдрома Х, различия в функции микрососудов (возможно приводящие к коронарному спазму) и, вероятно, гормональные различия. Чтобы компенсировать ограниченное использование нагрузочной пробы у женщин, некоторые исследователи разработали прогностические модели, которые используют больший объем информации, полученной при проведении пробы, чем только данные об изменении сегмента ST.
Трудности использования нагрузочной пробы у женщин для диагностики ИБС привели к распространенному мнению о том, что визуализирующие стресс-тесты имеют преимущество перед стандартной нагрузочной пробой. Хотя оптимальная стратегия диагностики ИБС у женщин еще окончательно не разработана, мы считаем, что в настоящее время недостаточно данных, чтобы утверждать о большей диагностической ценности у пациенток визуализирующих стресс-тестов по сравнению со стандартной нагрузочной ЭКГ-пробой. У многих женщин с низкой предтестовой вероятностью ИБС отрицательный результат пробы будет достаточным и не будет требовать дальнейшего проведения визуализирующих методов исследования.
Пациенты пожилого возраста
Имеются немногочисленные данные об использовании нагрузочной пробы у лиц в возрасте старше 70 лет. В результатах Национального скринингового исследования США (1989) указывалось, что диагноз ИБС был выявлен у 1,8% мужчин и 1,5% женщин в возрасте старше 75 лет. «Мягкая» ишемия миокарда была установлена у 15% 80-летних пациентов.
При проведении нагрузочного теста у пациентов пожилого возраста исследователи сталкиваются с дополнительными проблемами. Способность выполнения нагрузки зачастую ограничена мышечной слабостью и детренированностью. Большее внимание должно быть уделено опасности механических повреждений, а протокол проведения пробы должен быть менее агрессивным. Пациенты пожилого возраста обычно крепко держатся за поручни во время нагрузки, что также ограничивает время проведения теста, необходимое для достижения максимального поглощения кислорода. С возрастом также повышается вероятность аритмии. Для некоторых пациентов с нарушениями походки и координации более приемлемым методом может оказаться ВЭМ, однако многие люди пожилого возраста не имели опыта езды на велосипеде, что тоже ограничивает возможность проведения пробы.
Интерпретация результатов нагрузочной пробы у пациентов пожилого возраста также имеет некоторые особенности. Большая выраженность поражения коронарных артерий с возрастом повышает чувствительность метода (84%), однако снижает специфичность (70%). Высокая распространенность заболевания приводит к увеличению количества ложноотрицательных результатов теста. Ложноположительные результаты могут отражать наличие сопутствующей ГЛЖ вследствие болезней клапанов сердца и АГ. Также чаще отмечают изменения на ЭКГ в покое, включая последствия перенесенного ИМ, которые затрудняют интерпретацию результатов пробы.
Нагрузочная проба у лиц пожилого возраста трудна как в проведении, так и в интерпретации, в связи с чем необходимость проведения в дальнейшем коронароангиографии и реваскуляризации с возрастом увеличивается. Однако, несмотря на вышеперечисленные особенности, нагрузочная проба не утрачивает своего значения у этих пациентов.
Рекомендации по выполнению нагрузочных ЭКГ-проб для начальной диагностической оценки класса стенокардии:
Класс I
- Пациенты с симптомами стенокардии и средней предтестовой вероятностью ИБС с учетом возраста, пола и симптоматики. Исключением являются неспособность пациента к выполнению нагрузки или выявление изменений на ЭКГ, затрудняющих интерпретацию результатов пробы.
Класс IIb
- Пациенты с депрессией сегмента ST >1 мм на ЭКГ покоя или принимающие дигоксин.
- Пациенты с низкой предтестовой вероятностью ИБС (<10%) с учетом возраста, пола и симптоматики.
Фармакологические ЭКГ-пробы
Для диагностики стабильной стенокардии в амбулаторных условиях могут быть использованы дипиридамоловая и изопротереноловая пробы с регистрацией ЭКГ.
Проба с дипиридамолом
Дипиридамол оказывает сосудорасширяющее действие на уровне артериол. Дилатация артериол ведет к возрастанию кровотока в зонах, снабжаемых непораженными коронарными артериями, а в зонах кровоснабжения стенозированными коронарными артериями дилатация артериол без изменения просвета крупных коронарных артерий обусловливает снижение перфузионного давления дистальнее места стеноза, перераспределение коронарного кровотока (феномен «межкоронарного обкрадывания») и развитие ишемии миокарда.
Проба с дипиридамолом и регистрация ЭКГ может быть проведена с диагностической целью, особенно в тех случаях, когда проведение пробы с дозированной физической нагрузкой по каким-либо причинам невозможно или она недостаточно информативна (не доведена до субмаксимальной ЧСС при отсутствии ишемических изменений на ЭКГ, отрицательной пробе с физической нагрузкой у больного с клинической картиной ИБС). Дипиридамол вводят из расчета 0,75 мг/кг массы тела. Расчетную дозу препарата набирают в 20-миллилитровый шприц и добавляют раствор хлорида натрия до объема 20 мл, приготовленный раствор вводят внутривенно в течение 5 мин. Введение дипиридамола прекращают на любом этапе исследования, если появляются признаки положительного результата пробы на ЭКГ, приступ стенокардии, выраженные нарушения ритма и проводимости сердца, а также побочные реакции (сильная головная боль, тошнота, резкая общая слабость).
При проведении пробы с дипиридамолом отмечают умеренную тахикардию и незначительные изменения АД. Возможны одышка, ощущение тяжести, прилива крови к конечностям, грудной клетке, животу, головная боль и редко — тошнота. Эти побочные реакции проходят в течение 3–5 мин после введения эуфиллина, который является антагонистом дипиридамола. Наряду с общими реакциями иногда развиваются переходящие нарушения ритма сердца (не чаще, чем при ВЭМ), такие как желудочковые и наджелудочковые экстрасистолы.
Чувствительность пробы выше у женщин, а специфичность — у мужчин. Чувствительность пробы с дипиридамолом зависит от тяжести и распространенности коронарного атеросклероза и в среднем составляет 50–70%, а специфичность — 70–80%.
Проба с изопротеренолом
При коронарной недостаточности повышение ЧСС и сократимости, вызванное изопротеренолом, может приводить к несоответствию между потребностью миокарда в кислороде и его доставкой, что обусловливает возникновение преходящей ишемии миокарда в участках, перфузируемых стенозированными коронарными артериями.
При проведении пробы с изопротеренолом обычно отмечают повышение САД и снижение ДАД в среднем на 8–10 мм рт. ст., общее периферическое сосудистое сопротивление снижается.
Изопротеренол в дозе 0,5 мг разводят в 200 мл изотонического раствора хлорида натрия. Полученный раствор вводят внутривенно капельно с начальной скоростью 10–20 капель/мин, при этом в течение 1 мин оценивают индивидуальную реакцию на препарат. Затем путем повышения скорости введения изопротеренола доводят ЧСС за 2–3 мин до 130–150 уд./мин и поддерживают достигнутую ЧСС в течение 3 мин, после чего введение препарата прекращают. Проведение пробы облегчается при использовании инфузионного насоса, позволяющего с большей точностью дозировать препарат.
Критерии оценки пробы и преждевременного ее прекращения такие же, как и при пробе с дипиридамолом.
У 10–20% больных на фоне введения изопротеренола отмечают нарушения ритма сердца: предсердная или желудочковая экстрасистолия, ускоренный узловой ритм, АУ-диссоциация.
Однако это не сопровождается ухудшением состояния обследуемого и, как правило, не требует введения антиаритмических средств. Все указанные аритмии проходят в течение 5–10 мин после прекращения введения изопротеренола. Большинство пациентов при проведении пробы ощущают сердцебиение, ощущение прилива в грудной клетке, голове, иногда — одышку, озноб, нервную дрожь. В редких случаях отмечают значительное повышение АД, как правило, у больных с АГ. Чувствительность и специфичность пробы при оценке по критериям ЭКГ составляет (в зависимости от пола, возраста, исходной ЭКГ) 60–70%.
Изопротереноловую пробу используют в клинической практике редко.
В настоящее время фармакологические пробы (добутаминовая, аденозиновая, дипиридамоловая) чаще используют для провокации ишемии с последующей ее регистрацией визуализирующими методами (эхоКГ, радионуклидные методы исследования).
Холтеровское мониторирование
У больных ИБС холтеровское мониторирование ЭКГ наиболее обосновано для диагностики безболевой ишемии миокарда. В настоящее время это единственный метод, позволяющий определить реальную тяжесть безболевой ишемии, оценить болевые и безболевые ишемические изменения ЭКГ, возникающие в разное время суток в амбулаторных условиях («тотальное бремя ишемии» по определению P. Cohn). С помощью холтеровского мониторирования у больных ИБС возможна регистрация суточных ритмов ишемической активности. Использование холтеровского мониторирования позволяет выявить ишемию миокарда у больных, которые не в состоянии выполнять тесты с физической нагрузкой (физический статус, заболевания периферических сосудов, выраженная легочная патология и т.д.), а также в некоторых особых условиях, например во время психоэмоционального стресса. Вместе с тем, необходимо отметить, что изменения ЭКГ, зарегистрированные во время холтеровского мониторирования, имеют реальное значение только у больных с верифицированной ИБС и только при условии их соответствия критериям, принятым для холтеровского мониторирования. Кроме того, холтеровское мониторирование не может выступать как самостоятельный метод для установления диагноза ИБС.
Особое место занимает холтеровское мониторирование ЭКГ в диагностике вазоспастической стенокардии (стенокардии Принцметала). Как правило, болевые приступы, вызванные коронароспазмом, кратковременные, имеют спонтанный характер, на ЭКГ проявляются элевациями сегмента ST и возникают в состоянии покоя, чаще ночью. В связи с указанными особенностями вазоспастической стенокардии для визуализации изменений на ЭКГ и документального подтверждения диагноза наиболее целесообразно использовать холтеровское мониторирование.
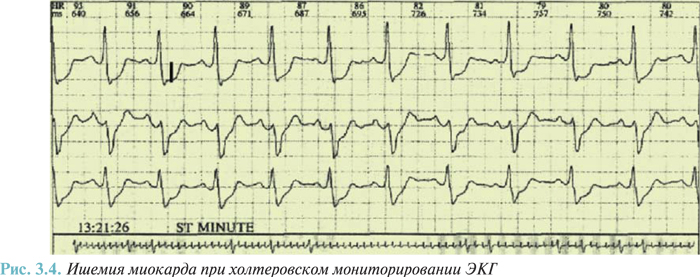
Метод холтеровского мониторирования играет важную роль для контроля эффективности и коррекции терапии ИБС. Динамика показателей при мониторировании ЭКГ дает возможность оценить эффективность и безопасность лекарственных препаратов, позволяет фиксировать некоторые побочные эффекты. Данные холтеровского мониторирования могут быть использованы для оценки результатов хирургического лечения коронарной недостаточности (рис. 3.4).
Показания к проведению холтеровского мониторирования
При необходимости стратификации риска у больных ИБС (со стабильной, нестабильной стенокардией, ИМ) показано проведение холтеровского мониторирования для объективизации клинического состояния — определение «тотального бремени ишемии». Для диагностики ишемии миокарда у больных ИБС использование метода холтеровского мониторирования ЭКГ наиболее обосновано и показано в следующих случаях:
- Больным с наличием бессимптомных транзиторных депрессий сегмента ST во время нагрузочных проб и на ЭКГ покоя — для объективизации клинического статуса.
- Больным, перенесшим безболевую форму ИМ.
- Больным с верифицированной безболевой формой ИБС.
- Для уточнения диагноза «вазоспастическая стенокардия» (стенокардия Принцметала).
- Для оценки результатов лечения и коррекции терапии.
Критерии ишемии миокарда по результатам холтеровского мониторирования. Чувствительность и специфичность метода
Учитывая особенности метода холтеровского мониторирования, с его помощью можно диагностировать транзиторные ишемические изменения, сопровождающиеся стенокардией или ее эквивалентами, а также бессимптомные изменения, возникающие у больных с документированной ИБС. Диагностика эпизодов ишемии миокарда по результатам холтеровского мониторирования ЭКГ возможна только при наличии нормального синусового ритма и при отсутствии исходных изменений графики конечной части желудочковых комплексов.
Как критерии ишемии миокарда приняты изменения на ЭКГ в виде смещений сегмента ST относительно изолинии.
Характеристики ишемической депрессии сегмента ST у больных ИБС (формула 1х1х1) следующие:
- Горизонтальная или косонисходящая депрессия сегмента ST не менее 0,1 мВ в точке, отстоящей на 80 мс от точки J.
- Продолжительность эпизода депрессии сегмента ST не менее 1 мин.
- Временной интервал между двумя подобными эпизодами не менее 1 мин.
Диагностическая ценность метода определяется его чувствительностью и специфичностью. Для холтеровского мониторирования эти показатели значительно варьируют и во многом зависят от контингента обследуемых пациентов. В одном из первых исследований, посвященных этому вопросу, чувствительность метода, основанная на оценке депрессии сегмента ST, составила 62%, специфичность — 61%. Известны работы, в которых указанные показатели были значительно выше — >80% (Kodama Y.). По результатам холтеровского мониторирования у 12 тыс. пациентов чувствительность и специфичность депрессии сегмента ST определены как 93,3 и 55,6% соответственно для мужчин, 66,7 и 37,5% — для женщин.
Вопрос относительно количественных и качественных характеристик элевации сегмента ST как критериев ишемии миокарда при холтеровском мониторировании в настоящее время окончательно не решен. Учитывая параметры ЭКГ, элевация сегмента ST отражает трансмуральную ишемию миокарда, связанную, как правило, с окклюзией коронарной артерии за счет атеротромбоза или вазоспазма. Продолжительность элевации, ее форма, амплитуда и динамика зависят от причины, ее вызвавшей. Однако элевация сегмента ST не является абсолютно специфическим признаком ишемии миокарда и может быть обусловлена целым рядом других причин. Следует отметить, что в настоящее время отсутствуют общепринятые количественные критерии оценки ишемической элевации сегмента ST. Предлагалось считать значимой элевацию с амплитудой сдвига ST над изолинией 0,1–0,3 мВ. В одном из наиболее масштабных исследований Y. Kodama оценивал диагностическую значимость элевации сегмента ST в сочетании с такими показателями, как чередование во время холтеровского мониторирования эпизодов элевации с эпизодами депрессии ST и значение индекса ST/ЧСС — 1,4 мкв/уд./мин. Значимой считалась элевация сегмента ST на 0,1 мВ продолжительностью 80 мс от точки J. В результате авторы получили довольно высокие показатели чувствительности и специфичности метода — 80 и 64,7% соответственно.
Для интерпретации изменений сегмента ST во время холтеровского мониторирования ЭКГ некоторые исследователи предлагают использовать критерии, принятые для проведения нагрузочных проб.
Методика проведения холтеровского мониторирования
Для диагностики ишемических изменений холтеровское мониторирование ЭКГ проводят по стандартным методикам. Как правило, используют системы, регистрирующие ЭКГ в 2 или 3 отведениях. Считается, что с помощью 2 отведений, расположенных на передней поверхности грудной клетки, удается зарегистрировать более 40% изменений на ЭКГ. Увеличение количества отведений способствует повышению информативности метода по выявлению ишемии миокарда. Перспективным техническим решением считается применение ортогональных отведений ЭКГ по Франко. Варианты расположения электродов зависят от типа аппарата для мониторирования, однако наиболее часто используют пары модифицированных отведений V5–V1, V5–AVF. Продолжительность холтеровского мониторирования определяется задачами исследования. Для оценки изменений сегмента ST считается достаточным 24-часовое мониторирование ЭКГ, для оценки эффективности терапевтических мероприятий — 48-часовое. Некоторые исследователи для повышения достоверности результатов предполагали увеличить продолжительность мониторирования до 72 ч. Адекватная оценка результатов холтеровского мониторирования невозможна без дневника пациента, в котором отражена физическая активность больного в течение суток, зафиксированы приступы стенокардии, другие жалобы, обозначено время приема лекарственных средств и т.п.
Крайне важно тесное сотрудничество врача и пациента при проведении холтеровского мониторирования для диагностики безболевых форм ишемии миокарда. Пациента следует четко проинструктировать относительно внимательной регистрации в дневнике приступов стенокардии, поскольку неотмеченные в дневнике приступы могут неправильно трактоваться как эпизоды безболевой ишемии миокарда.
Для оценки ишемии миокарда у больных ИБС определяют следующие показатели:
- Суммарное количество ишемических эпизодов на ЭКГ (выделяют эпизоды ишемии, которые сопровождались ангинозным синдромом, и безболевые изменения — депрессии и элевации сегмента ST).
- Суммарную (за весь период холтеровского мониторирования) продолжительность ишемии миокарда, в том числе и для бессимптомных изменений.
Последний показатель имеет важное прогностическое значение. Считают, что ишемия, продолжительность которой превышает 60 мин/сут, независимо от наличия стенокардии, повышает риск развития сердечно-сосудистых осложнений, в частности ИМ. Среди дополнительных показателей, которые характеризуют тяжесть состояния больного, можно назвать амплитуду сдвига сегмента ST и среднюю продолжительность ишемического эпизода. Необходимо также отмечать появление во время ишемии миокарда нарушений ритма сердца, что не только имеет важное диагностическое значение, но и позволяет дифференцировать аритмогенные изменения сегмента ST.
Повторное проведение холтеровского мониторирования позволяет контролировать эффективность терапии ИБС на основании динамики ЭКГ-показателей. Как правило, учитывают их статистически достоверные различия.
Особенности интерпретации изменений ЭКГ, зарегистрированных при проведении холтеровского мониторирования
Клиническая интерпретация изменений сегмента ST, зарегистрированных во время холтеровского мониторирования, должна учитывать их неспецифический характер. В частности, смещение сегмента ST ниже изолинии возможно при гипервентиляции, гипертрофии желудочков сердца, пролапсе митрального клапана, вегетативной дисфункции, блокадах ножек пучка Гиса, WPW-синдроме, нарушениях электролитного и гормонального баланса. Динамика конечной части желудочкового комплекса на ЭКГ может быть обусловлена различными заболеваниями сердечно-сосудистой системы, включая АГ, миокардит и перикардит, СН, кардиомиопатии. По результатам холтеровского мониторирования диагностически значимую депрессию сегмента ST отмечали у 1–50% лиц без кардиологической патологии. У практически здоровых обследуемых изменения ST–T зависят от многих факторов, среди которых наиболее значимыми являются: влияние на позицию сердца изменений положения тела, психоэмоциональный статус, ваготония, курение.
Изменять график конечной части желудочкового комплекса на ЭКГ могут некоторые лекарственные средства: сердечные гликозиды, блокаторы β-адренорецепторов, антиаритмические препараты, трициклические антидепрессанты, некоторые цитостатики. Косовосходящая депрессия сегмента ST характерна при тахикардии. Выраженная брадикардия может сопровождаться некоторым подъемом сегмента ST над изолинией. Кроме того установлено, что сдвиги сегмента ST зависят от циркадных изменений тонуса вегетативной нервной системы на протяжении суток. Так, утром и днем за счет естественного повышения симпатического влияния сегмент ST может иметь вид косовосходящей депрессии со сдвигом точки J. В ночное время регистрируют седловидный подъем сегмента ST в результате вагусного влияния. Циркадные изменения сегмента ST могут сочетаться с изменениями агрегационных свойств крови и вариабельностью сосудистого тонуса.
Анализ изменений зубца Т при оценке результатов холтеровского мониторирования
Анализ изменений зубца Т при холтеровском мониторировании имеет меньшее значение, чем сегмента ST. Его изменения носят неспецифический характер, значительно варьируют и часто связаны с позиционными изменениями сердца, что подтверждают результаты функциональных проб. Поэтому оценка динамики зубца Т может быть использована только как дополнительный показатель в случае бессимптомных изменений или в качестве ЭКГ-характеристики ангинозного синдрома.
Связь изменений интервала ST–T с болью
Как правило, болевой синдром развивается спустя некоторое время после появления изменений на ЭКГ. В некоторых случаях стенокардия может возникнуть одновременно с изменениями на ЭКГ или даже предшествовать им. Боль обычно проходит быстрее, чем исчезают изменения сегмента ST на ЭКГ, хотя бывают исключения, которые следует учитывать при анализе и интерпретации результатов холтеровского мониторирования.
«Немая» ишемия миокарда
Доказано, что «немая» ишемия миокарда является самостоятельным прогностически неблагоприятным фактором, связанным с увеличением количества коронарных осложнений и повышением частоты случаев сердечной смерти. Существует довольно высокая степень корреляции между количественными показателями холтеровского мониторирования и тяжестью поражения коронарного русла. Результаты холтеровского мониторирования существенным образом дополняют результаты нагрузочных тестов при оценке суммарного риска. Общепризнано, что динамика ЭКГ-показателей, характеризующих безболевую ишемию, отражает эффективность терапии ИБС.
ЭКГ-критерии для безболевой ишемии миокарда не отличаются от общепринятых и соответствуют формуле 1x1x1. Определенные вопросы возникают при определении по ЭКГ начала и окончания ишемического эпизода. Многие исследователи определяют продолжительность депрессии как общее время от ее начала до момента возвращения к изоэлектрической линии. Методически более оправдано за начало эпизода принимать депрессию, достигающую 1 мм, а за его окончание — уменьшение депрессии до уровня меньше 1 мм.
Несмотря на продолжительный период использования холтеровского мониторирования ЭКГ для диагностики ИБС в клинической практике, вопрос относительно надежности определения «немой» ишемии по депрессии сегмента ST остается актуальным. Вместе с тем, необходимо отметить, что достоверность результатов холтеровского мониторирования зависит и от методологии проведения исследования. Адекватный подбор больных, учет показаний к проведению холтеровского мониторирования, которые соответствуют реальным возможностям метода, квалифицированная интерпретация полученных данных в значительной степени повышают достоверность результатов исследования. Анализ результатов холтеровского мониторирования с учетом данных других клинических и инструментальных исследовательских приемов также способствует повышению его информативности. В первую очередь это относится к результатам нагрузочных проб. Многочисленные наблюдения свидетельствуют о высокой степени соответствия результатов холтеровского мониторирования и нагрузочных проб.
Элевация сегмента ST
При проведении холтеровского мониторирования как проявление ишемии может рассматриваться дугообразная элевация сегмента ST y больных острым ИМ. Диагностические сложности возможны при наличии хронической аневризмы сердца, когда сдвиг сегмента ST носит постоянный характер — «застывшая кривая». Продолжительная дугообразная или седловидная элевация сегмента ST возможна при перикардите. Как правило, она сочетается с наличием отрицательного зубца Т. Иногда, при наличии плевроперикардиальных сращений, элевация сегмента ST может носить транзиторный характер и появляться при определенных положениях тела, например в положении лежа на правом боку. Для оценки сдвига точки J используют описанные ранее критерии. Седловидная элевация сегмента ST характерна также для синдрома ранней реполяризации и особой формы стенокардии — вазоспастической стенокардии Принцметала. В первом случае форма седловидной элевации имеет циркадный характер, больше выражена в ночные часы во время сна. Очень часто эту элевацию сегмента ST принимают за проявление спастической реакции коронарных сосудов. При проведении дифференциальной диагностики следует помнить, что приступ стенокардии Принцметала — явление кратковременное, проходящее через несколько минут, часто сопровождается желудочковыми нарушениями ритма, в некоторых случаях тахикардией. Для синдрома ранней реполяризации и вагусных изменений сегмента ST характерна значительная продолжительность (на протяжении нескольких часов), причем последние появляются во время сна, сопровождают весь период сна и нормализуются или имеют тенденцию к снижению сегмента во время пробуждения. Кроме того, при вагусных реакциях отмечают замедленную ЧСС.
Нестабильная стенокардия
Независимо от наличия или отсутствия болевого синдрома количество эпизодов ишемии, регистрируемых во время холтеровского мониторирования, может оказаться решающим для определения прогноза при нестабильной стенокардии.
Депрессия сегмента ST и аритмии
Депрессия сегмента ST на ЭКГ может появляться в связи с нарушениями ритма: до, после или во время аритмических событий. Наиболее часто депрессию сегмента ST регистрируют в связи с пароксизмами любой тахикардии. Морфологические характеристики сегмента ST (как правило, косовосходящая депрессия), а также временная связь с аритмией позволяют довольно легко дифференцировать ритмозависимые изменения ЭКГ.
Ошибки в автоматическом измерении сдвигов сегмента ST
Приведенные ранее критерии ишемии миокарда определены для визуальной оценки ЭКГ. Однако при автоматическом анализе ЭКГ во время холтеровского мониторирования ошибки при измерении сдвигов сегмента ST неизбежны. Поэтому для повышения качества диагностики ишемии миокарда по результатам холтеровского мониторирования необходим обязательный визуальный контроль ЭКГ-изменений, в том числе при использовании аппаратов с автоматическим анализом записи. Наиболее часты ошибки, связанные с плохим качеством записи. Эти ошибки возникают как при автоматическом компьютерном, так и при визуальном анализе ЭКГ. Их отмечают, в частности, в тех случаях, когда каждый следующий комплекс записывается на новом уровне и вся ЭКГ приобретает вид волнообразной кривой. При этом нет отчетливой связи с дыханием. Такие ошибки возникают при выполнении физической нагрузки во время холтеровского мониторирования. ЭКГ низкого качества, с большим количеством дополнительных осцилляций и артефактов часто регистрируют при отрыве электрода или пользовании радиотелефоном.
Визуализирующие методы диагностики ИБС и оценки риска
Эхокардиография (эхоКГ)
ЭхоКГ имеет определенную ценность при диагностике ИБС. Ее проведение целесообразно при подозрении на поражение клапанов или ГКМП, которые могут вызывать симптомы, сходные с ИБС, а также для определения функции ЛЖ. ЭхоКГ-исследование может выявить последствия ИБС у пациентов с хронической ИБС, такие как нарушения региональной сократимости, митральная регургитация. В большинстве случаев эхоКГ не является необходимым исследованием для установления диагноза ИБС. Также нет необходимости в проведении повторных эхоКГ-исследований у пациентов со стенокардией при отсутствии осложнений или изменений клинического состояния.
Рекомендации по проведению эхоКГ для выявления причины боли в грудной клетке у пациентов с предполагаемой стенокардией напряжения:
Класс I
- Пациенты с систолическим шумом, при подозрении на аортальный стеноз или ГКМП.
- Оценка выраженности ишемии (например сегментарные нарушения сократимости ЛЖ), если эхоКГ может быть проведена во время болевого приступа или в течение 30 мин после его прекращения.
- Пациенты с признаками СН.
- Пациенты с ранее перенесенным ИМ.
- Пациенты с полной блокадой левой ножки пучка Гиса, патологическим зубцом Q, другими значительными изменениями ЭКГ, включая признаки ГЛЖ.
Класс IIb
Пациенты с характерными щелчком или шумом с целью диагностики пролапса митрального клапана.
Класс III
Пациенты с нормальной ЭКГ, без ИМ в анамнезе и без признаков или симптомов СН, болезней клапанов сердца, ГКМП.
Трансторакальная эхоКГ и допплеровская эхоКГ имеют диагностическую ценность при наличии шума или других признаков аортального стеноза или ГКМП, сопутствующих ИБС. Данные допплеровского эхоКГ-исследования обычно предоставляют точную количественную информацию о наличии и степени сопутствующих поражений. Например, если речь идет о гипертрофии миокарда, можно установить, является ли она концентрической или асимметричной, гипертрофией межжелудочковой перегородки, верхушки ЛЖ или свободной стенки. Можно определить величину аортального клапанного или подклапанного градиента, а также функцию ЛЖ в целом.
ЭхоКГ может помочь при установлении или исключении диагноза пролапса митрального клапана и определиться в необходимости лечения.
Определение систолической и диастолической функции ЛЖ
Хроническая ИБС (сопровождается она стенокардией или нет) может привести к ухудшению систолической функции ЛЖ. Оценка степени нарушения региональной или общей сократимости является важным мотивом для выбора в дальнейшем медикаментозного или хирургического лечения. Рутинное определение параметров функции ЛЖ в целом, например ФВ ЛЖ, не является необходимым для диагностики стабильной стенокардии. Например, пациентам с подозреваемой стенокардией и нормальной ЭКГ, без ИМ в анамнезе и симптомов СН эхоКГ и радионуклидное исследование не показаны. Многие исследования показали взаимосвязь ИБС с наличием диастолической дисфункции ЛЖ. У пациентов со стабильной стенокардией напряжения без признаков СН эхоКГ в состоянии покоя может выявить диастолическую дисфункцию. Новые возможности допплерографического исследования значительно повысили вероятность выявления диастолической дисфункции, однако ее клиническое значение для прогноза и лечения пока не определены.
Сегментарные нарушения сократимости ЛЖ. ЭхоКГ-данными, способными оказать помощь в диагностике хронической ИБС, могут быть региональные нарушения сократимости, например гипокинез (сниженная сократимость), акинез (отсутствие сократимости) и дискинез (парадоксальное движение стенок). Необходимо с особым вниманием отнестись к нарушениям движения межжелудочковой перегородки, поскольку причиной может быть не только хроническая ИБС, но и такие состояния, как блокада левой ножки пучка Гиса, наличие внутрижелудочковых водителей ритма, перегрузка правых отделов объемом и ранее перенесенное оперативное вмешательство на сердце.
Степень региональной дисфункции ЛЖ может быть описана для каждого сегмента отдельно (гипокинез, акинез, дискинез) или с использованием специальных методов расчета, которые отражают сократимость в целом, а также отдельных сегментов. Нарушения сегментарной сократимости, часто определяемые у пациентов с ранее перенесенным ИМ, хорошо коррелируют с локализацией поражения коронарных артерий или ИМ. Патологическая сегментарная сократимость может наблюдаться у пациентов с преходящей ишемией миокарда, хронической гипоперфузией (гибернированный миокард) или рубцовыми изменениями миокарда, а также при миокардите или других условиях, не связанных с окклюзией коронарных артерий. Если при использовании стандартного трансторакального исследования визуализация эндокарда ЛЖ оказывается недостаточной, рекомендуется применение режима второй гармоники эхоКГ-исследования с контрастированием.
У пациентов со стабильной стенокардией без предшествующего ИМ при проведении эхоКГ-исследования в покое при отсутствии ишемии сократимость стенок ЛЖ обычно нормальная. Нарушения сегментарной сократимости, выявленные при проведении эхоКГ во время ишемии или в течение 30 мин после нее у пациентов без установленной ИБС, повышают вероятность наличия у них клинически значимой ИБС.
Согласно имеющейся информации положительная прогностическая точность таких данных для острой ишемии или ИМ составляла около 50%. Отсутствие нарушений региональной сократимости характерно для группы пациентов с низким риском развития острого ИМ, с негативной прогностической точностью около 95%.
Ишемическая митральная регургитация. ИБС может осложниться другими структурными и функциональными изменениями. Так, возможно появление митральной регургитации, причиной которой могут стать: глобальная систолическая дисфункция ЛЖ, локальная дисфункция папиллярных мышц, склероз и укорочение субмитральных хорд, разрыв папиллярной мышцы и другие причины. Наличие, выраженность и механизмы развития митральной регургитации, а также возможность ее хирургического лечения могут быть достаточно точно определены при помощи трансторакальной допплеровской эхоКГ.
Неинвазивные методы определения анатомии коронарных артерий и выявления их кальциноза
КТ
Усовершенствование техники в течение последних лет позволило расширить применение КТ, которое было ограничено в связи с низкой разрешающей способностью и артефактами при регистрации изображения. Также появилось новое программное обеспечение для анализа и интерпретации полученных изображений, что облегчило и унифицировало метод. Существуют два метода КТ — сверхскоростная или электронно-лучевая КТ и мультиспиральная (многослойная) КТ. Применение обоих методов КТ достоверно подтвердило возможности оценки степени и протяженности коронарной кальцификации. Наиболее часто используют шкалу Агатстона для количественной оценки кальцификации коронарных артерий, которая основана на площади и плотности кальцифицированных бляшек и требует специального программного обеспечения. Чувствительность КТ для диагностики ИБС составляет 85–100%, а специфичность — только 41–76%; положительное прогностическое значение колеблется в пределах 55–84%, а отрицательное — 84–100%.
Кальций депонируется в атеросклеротических бляшках, в том числе расположенных и в коронарных артериях. Коронарная кальцификация увеличивается с возрастом. Для облегчения интерпретации количества кальция в артериях существуют специальные номограммы с учетом возраста и пола. Протяженность коронарной кальцификации больше коррелирует с общим количеством бляшек, чем со степенью стенозирования или локализацией стенозов. Однако в нескольких исследованиях установлено заметное различие при повторных измерениях уровня кальцификации коронарных сосудов методом КТ. Таким образом, выявление кальциноза коронарных артерий может быть полезным для определения пациентов с более высоким риском развития коронарной болезни сердца, но не может быть рекомендовано как метод рутинной диагностики ИБС. Использование серийных КТ у отдельных пациентов для определения и последующего анализа регрессии или прогрессии кальцификации остается проблематичным.
Качество изображения при КТ может быть значительно улучшено при использовании внутривенных контрастных агентов. При этом КТ оказалась наиболее многообещающим неинвазивным методом визуализации коронарных артерий с отличными способностями для выявления и характеристики атеросклеротических бляшек. Так, чувствительность и специфичность КТ-ангиографии для выявления ИБС составляют 95 и 98% соответственно при использовании 16-слойного сканера. Исследования с использованием 64-слойных сканеров показали 90–94% чувствительность и 95–97% специфичность, а отрицательное прогностическое значение 93–99%.
Рекомендации по использованию КТ с контрастированием у пациентов со стабильной стенокардией:
Класс IIb
1. Пациенты с низкой предтестовой вероятностью заболевания, с неинформативными результатами ЭКГ или визуализирующих стресс-тестов.
В настоящее время, несмотря на высокую диагностическую ценность метода КТ, ее прогностическое значение и место в иерархии исследований при ИБС полностью не определено. Наиболее целесообразно ее использование у пациентов с низкой предтестовой вероятностью заболевания (<10%), с сомнительными результатами функциональных тестов — ЭКГ-проб с физической нагрузкой или визуализирующих стрессовых тестов.
МРТ с контрастированием коронарных артерий
Как и в случае с КТ, использование МРТ нашло применение при дополнительном внутривенном введении контрастных средств. В настоящее время МРТ — предмет научного изучения и не рекомендуется для рутинного использования в клинике с целью диагностики ИБС.
Визуализирующие стрессовые методы
Рекомендации по проведению визуализирующих стрессовых исследований как первичного диагностического теста у пациентов с хронической стабильной стенокардией, способных к выполнению физической нагрузки:
Класс I
1. Нагрузочное визуализирующее исследование перфузии миокарда или нагрузочное эхоКГ-исследование у пациентов со средней предтестовой вероятностью ИБС и одним из следующих изменений на ЭКГ в исходе:
а) преэкзитация (WPW-синдром);
б) депрессия сегмента ST в покое более 1 мм.
2. Нагрузочное визуализирующее исследование перфузии миокарда или нагрузочное эхоКГ-исследование у пациентов с ранее проведенным реваскуляризирующим вмешательством (ЧТКА или АКШ).
3. Визуализирующее исследование перфузии миокарда с использованием аденозина или дипиридамола у пациентов со средней предтестовой вероятностью ИБС и одним из следующих изменений на ЭКГ в исходе:
а) электростимулированный желудочковый ритм;
б) блокада левой ножки пучка Гиса.
Класс IIb
1. Нагрузочное визуализирующее исследование перфузии миокарда или нагрузочное эхоКГ-исследование у пациентов с низкой или высокой вероятностью развития ИБС и одним из следующих изменений на ЭКГ в исходе:
а) преэкзитация (WPW-синдром);
б) депрессия сегмента ST в покое более 1 мм.
2. Визуализирующее исследование перфузии миокарда с применением аденозина или дипиридамола у пациентов с низкой или высокой предтестовой вероятностью развития ИБС и одним из следующих изменений на ЭКГ в исходе:
а) электростимулированный желудочковый ритм;
б) блокада левой ножки пучка Гиса.
3. Нагрузочное визуализирующее исследование перфузии миокарда или нагрузочное эхоКГ-исследование у пациентов со средней предтестовой вероятностью развития ИБС и одним из следующих состояний:
а) применение дигоксина с депрессией сегмента ST <1 мм на исходной ЭКГ;
б) ГЛЖ с депрессией сегмента ST <1 мм на исходной ЭКГ.
4. Нагрузочное визуализирующее исследование перфузии миокарда, нагрузочное эхоКГ-исследование, визуализирующее исследование перфузии миокарда с применением аденозина или дипиридамола или эхоКГ с добутамином как первичное стрессовое исследование у пациентов, принимающих дигоксин, с нормальной ЭКГ в покое.
5. ЭхоКГ с нагрузкой или введением добутамина у пациентов с блокадой левой ножки пучка Гиса.
Рекомендации по проведению визуализирующих стрессовых исследований как первичного диагностического теста у пациентов с хронической стабильной стенокардией, не способных к выполнению физической нагрузки:
Класс I
1. Визуализирующее исследование перфузии миокарда с использованием аденозина или дипи-ридамола, или эхоКГ с введением добутамина у пациентов со средней предтестовой вероятностью ИБС.
2. Визуализирующее исследование перфузии миокарда с использованием аденозина или дипиридамола, или эхоКГ с введением добутамина у пациентов с ранее перенесенным реваскуляризирующим вмешательством (ЧТКА или АКШ).
Класс IIb
1. Визуализирующее исследование перфузии миокарда с применением аденозина или дипиридамола, или эхоКГ с введением добутамина у пациентов с высокой или низкой предтестовой вероятностью развития ИБС и отсутствием электростимулированного желудочкового ритма или блокады левой ножки пучка Гиса.
2. Визуализирующее исследование перфузии миокарда с применением аденозина или дипиридамола у пациентов с высокой или низкой предтестовой вероятностью развития ИБС и одним из следующих изменений на исходной ЭКГ:
а) электростимулированный желудочковый ритм;
б) блокада левой ножки пучка Гиса.
3. ЭхоКГ с введением добутамина у пациентов с блокадой левой ножки пучка Гиса.
Когда следует проводить визуализирующее стрессовое исследование?
Пациентами, которым следует проводить в первую очередь кардиологические стрессовые исследования с визуализацией, а не ЭКГ с нагрузкой, могут быть:
1) лица с полной блокадой левой ножки пучка Гиса, электростимулированным желудочковым ритмом, синдромом преэкзитации (WPW-синдром) и другими подобными нарушениями проводимости на ЭКГ;
2) пациенты с депрессией сегмента ST в покое >1 мм, включая лиц с ГЛЖ или тех, кто принимает сердечные гликозиды;
3) пациенты, которые не могут выполнить физическую нагрузку, необходимую для получения значимого результата при рутинной нагрузочной ЭКГ-пробе;
4) пациенты со стенокардией и ранее проведенной реваскуляризацией, для которых важное значение имеет выявление локализации и выраженности ишемии, а также определение жизнеспособности миокарда.
Для индуцирования стресса могут быть использованы следующие методы:
1) физическая нагрузка (тредмил, ВЭМ в вертикальном или горизонтальном положении);
2) фармакологические пробы (с использованием добутамина или вазодилататоров).
Если пациент способен выполнить физическую нагрузку, достаточную для достижения сердечно-сосудистого стресса (6–12 мин), нагрузочные стрессовые тесты (в основном на тредмиле) имеют преимущество перед фармакологическими стрессовыми тестами. Однако если пациент не может выполнить требуемую физическую нагрузку или существуют другие причины (например, необходимость оценить жизнеспособность миокарда), более приемлемым может стать фармакологическая проба. Чаще всего для замены физической нагрузки используют фармакологические пробы с тремя препаратами: дипиридамолом, аденозина фосфатом и добутамином.
Вазодилататоры дипиридамол и аденозина фосфат чаще применяют при исследовании перфузии миокарда с помощью сцинтиграфии, а добутамин как инотропное (и хронотропное) средство получил большее распространение при проведении эхоКГ-исследования.
Дипиридамол вызывает вазодилатацию коронарных сосудов опосредованно — путем ингибирования потребления клетками аденозина, повышая таким образом его уровень в крови и тканях; последний обладает коронародилатирующим действием и значительно повышает коронарный кровоток. Усиление кровотока, вызванное дипиридамолом или аденозином, менее выражено в стенозированных артериях, что определяется при исследовании перфузии миокарда. Дипиридамол и аденозина фосфат вызывают ишемию миокарда вследствие синдрома «коронарного обкрадывания».
Дипиридамол и аденозина фосфат относительно безопасны и хорошо переносятся, несмотря на часто возникающие незначительные побочные эффекты. Наиболее характерные побочные эффекты, связанные с инфузией дипиридамола, включают головную боль (5–23%), головокружение (5–21%), тошноту (8–12%), гиперемию кожи (3%) и аритмии ( <2%). При введении аденозина фосфата зарегистрированы следующие побочные эффекты: боль в грудной клетке (57%), головная боль (35%), гиперемия (25%), диспноэ (15%), AV-блокада I степени (18%). Серьезные побочные эффекты развиваются редко, однако при применении как аденозина фосфата, так и дипиридамола возможно развитие выраженного бронхоспазма у пациентов с БА или ХОБЛ. Поэтому применять указанные препараты у этих пациентов следует с особой осторожностью. Побочные эффекты дипиридамола и аденозина могут быть устранены применением их фармакологического антагониста — теофиллина.
Добутамин в высоких дозах (20–40 мг/кг·мин) за счет повышения ЧСС, САД, усиления сократимости миокарда и увеличения потребности миокарда в кислороде может провоцировать ишемию. Повышение кровотока при этом в 2–3 раза менее выражено, чем при применении аденозина фосфата или дипиридамола, однако также достаточное для определения гетерогенности перфузии методом радионуклидной визуализации. Хотя при инфузии добутамина часто отмечают побочные эффекты, проба является относительно безопасной, даже при проведении у лиц пожилого возраста. Наиболее частыми некардиальными осложнениями (отмечаемыми в 20% случаев) в исследовании с участием 1118 пациентов были: тошнота (8%), тревожность (6%), головная боль (4%) и тремор (4%). Выявляли также развитие аритмий сердца — желудочковых (15%) и суправентрикулярных экстрасистол и нестойкой желудочковой тахикардии (3–4%). Атипичную боль в грудной клетке зарегистрировали примерно у 20% обследованных.
Факторы, снижающие точность неинвазивных методов исследования
Как уже отмечено для нагрузочной ЭКГ-пробы, на результаты проведения исследования может повлиять предтестовая вероятность ИБС. Позитивное прогностическое значение теста снижается вместе со снижением распространенности заболевания в популяции, тогда как отрицательная прогностическая ценность повышается. Визуализирующие стрессовые исследования не следует использовать как рутинный метод для диагностики пациентов с низкой или высокой вероятностью наличия ИБС. Хотя эти исследования имеют меньшую ценность при высокой предтестовой вероятности заболевания, они могут быть полезны для определения степени риска и прогноза у этих пациентов.
Так же, как и для ЭКГ с нагрузкой, на чувствительность, специфичность и прогностическую ценность визуализирующего исследования перфузии миокарда и стрессовой эхоКГ могут влиять различные факторы. Эффект послетестовой систематической ошибки оказался сходным для визуализирующего исследования перфузии миокарда и стрессовой эхоКГ. Коррекция этой ошибки приводит к снижению чувствительности и повышению специфичности обоих методов. В результате изменений чувствительности и специфичности у пациентов со средней предтестовой вероятностью ИБС коррекция верификационной ошибки обычно улучшает диагностическую ценность положительных результатов теста и снижает отрицательных.
1. Стрессовая эхоКГ
Метод стрессовой эхоКГ основывается на оценке изменений сегментарной сократимости ЛЖ при воздействии стрессорного агента по сравнению с исходными данными. Подтверждением наличия ишемии миокарда во время проведения стресс-эхоКГ является развитие новых или усугубление имеющихся нарушений сократимости в >1 сегменте, а также отсутствие улучшения сократимости в ответ на стрессорный агент.
Появление цифровых методов обработки изображения и сохранения информации позволяет оценивать состояние ЛЖ на разных стадиях стрессового исследования, что значительно повышает эффективность и точность интерпретации результатов стрессовой эхоКГ.
Чувствительность и специфичность стрессовой эхоКГ в диагностике ИБС находятся примерно на одном уровне с этими показателями для других стрессовых методов визуализации миокарда. Во многочисленных исследованиях чувствительность отмечали в пределах 70–97%, с усредненными показателями чувствительности для нагрузочной эхоКГ около 80–85% и для стрессовой эхоКГ с добутамином — 82%. Как и ожидалось, чувствительность нагрузочной эхоКГ при многососудистом поражении была выше (73–100%, в среднем — 87%), чем при однососудистом (63–93%, в среднем — 78%). В этих же исследованиях специфичность составила 84–86% для эхоКГ с физической нагрузкой и 62–100% для эхоКГ с добутамином (рис. 3.5).
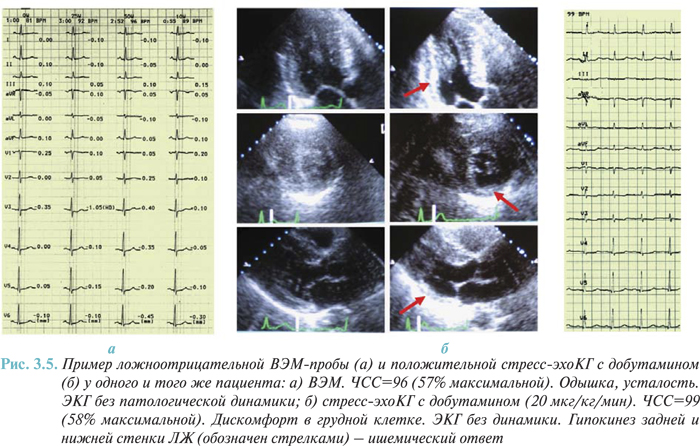
Наиболее часто для нагрузочной стрессовой эхоКГ используют ВЭМ с полулежачим положением пациента, а изображения регистрируют при возможности в конце каждой ступени нагрузки и на пике нагрузки. Ограничениями метода является низкое качество эхоКГ-изображений в связи с гипервентиляцией. Для улучшения визуализации возможно применение метода цветового картирования эндокарда — колорокинез (рис. 3.6).
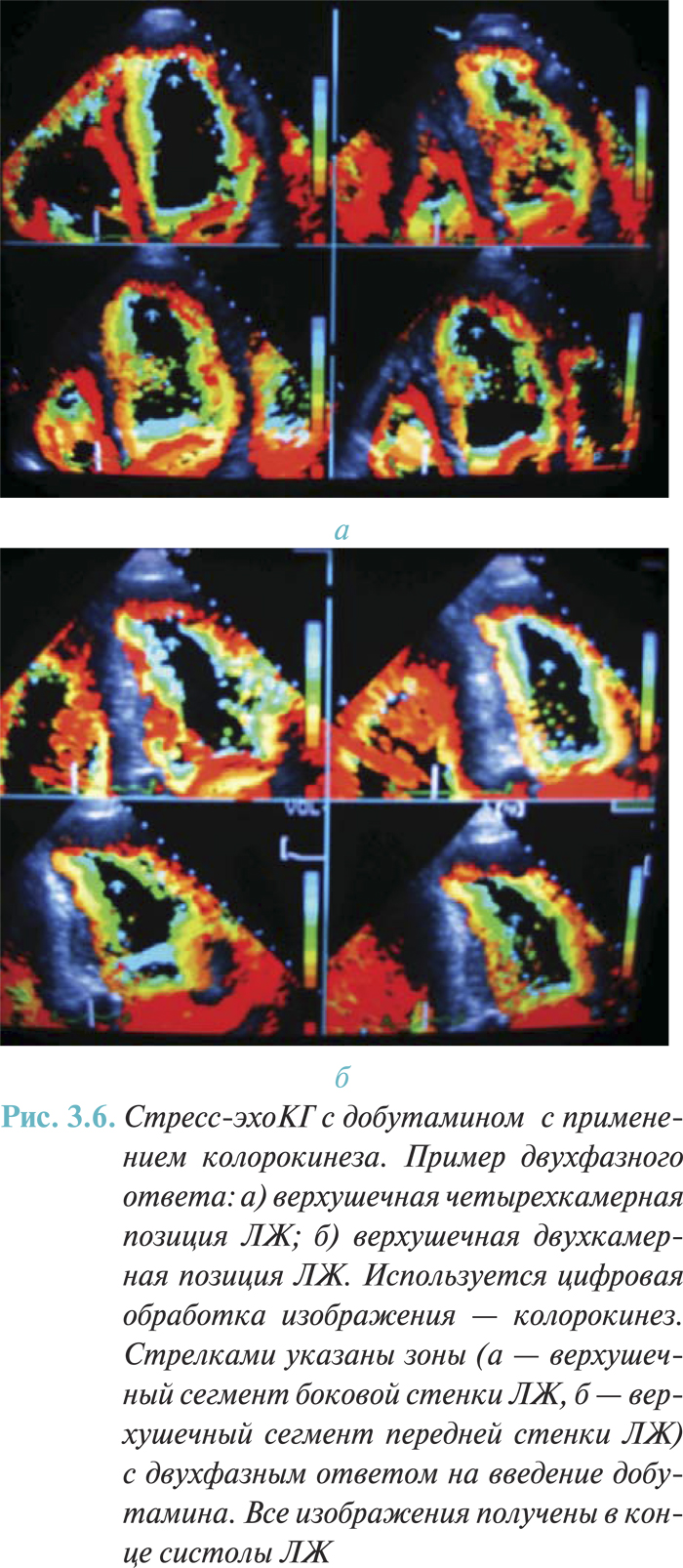
Оптимальным препаратом для проведения фармакологической стрессовой эхоКГ является добутамин. Стрессовая эхоКГ с добутамином имеет большую чувствительность для определения стенозов коронарных артерий, чем при применении вазодилататоров (дипиридамола или аденозина). В недавно опубликованном обзоре 36 исследований чувствительность и специфичность стрессовой эхоКГ с добутамином для диагностики ИБС в среднем составляли соответственно 82% (86% для многососудистых поражений).
2. Радионуклидное исследование
В 1995 г. ACC/AHA был опубликован детальный обзор по использованию радионуклидной визуализации для диагностики ИБС и локализации поражений миокарда. Наибольшее распространение у пациентов с подозреваемой ИБС с целью визуализации миокардиальной перфузии получило использование радиоизотопа 201Tl, однако показано, что новые изотопы — 99mTс-сестамиби и 99mTc-тетрофосмин — обладают подобной диагностической точностью. Таким образом, в большинстве случаев могут быть с одинаковой степенью диагностической ценности использованы все три изотопа — 201Tl, 99mTс-сестамиби и 99mTс-тетрофосмин.
Для визуализации перфузии миокарда может быть использована как плоскостная перфузионная сцинтиграфия, так и ОФЭКТ с визуальным анализом или использованием технических количественных расчетов.
Вычисления (например, произведенные с использованием горизонтальных или периферических контуров) могут улучшить чувствительность теста, особенно у пациентов с однососудистым поражением. Для плоскостной сцинтиграфии с 201Tl средние опубликованные значения чувствительности и специфичности находились в пределах 83 и 88% соответственно при визуальном анализе, а при количественном анализе — 90 и 80% соответственно. ОФЭКТ с 201Tl, в общем, более чувствительна, чем плоскостная визуализация, для диагностики ИБС, локализации гипоперфузируемых участков миокарда, определения стенозов передней межжелудочковой ветви и огибающей ветви левой коронарной артерии, а также с большей вероятностью выявляет наличие многососудистых поражений при ИБС. Усредненные показатели чувствительности и специфичности нагрузочной ОФЭКТ с 201Tl находились в пределах 89 и 76% соответственно при качественном анализе, а при количественном — 90 и 70% соответственно.
Некоторая недостаточность уровней чувствительности и специфичности частично может быть обусловлена тем, что выявленная ангиографически степень стеноза не всегда точно коррелирует с выраженностью функциональных изменений. Меньшая, чем ожидалось, специфичность ОФЭКТ, по сравнению с плоскостным исследованием, связана, вероятно, с послетестовой систематической ошибкой. Кроме того, несомненно, играет роль в снижении специфичности ОФЭКТ по сравнению с плоскостной визуализацией отбор пациентов, а также такие факторы, как фотонная аттенуация и артефакты, возникающие при томографической реконструкции изображения.
После внедрения дипиридамол-индуцированной вазодилатации для исследования миокардиальной перфузии с 201Tl эта фармакологическая проба стала одним из важных методов неинвазивной диагностики ИБС. Плоскостная сцинтиграфия с дипиридамолом имеет высокую чувствительность (90%) и достаточно высокую специфичность (около 70%) в диагностике ИБС. Дипиридамоловая ОФЭКТ с 210Tl или 99mTc-сестамиби оказалась столь же точна, как и плоскостная визуализация. Результаты исследования перфузии миокарда с использованием аденозина подобны результатам, полученным при визуализации на фоне введения дипиридамола или при физической нагрузке. Использование добутамина для визуализации перфузии миокарда имеет значительные ограничения по сравнению с вазодилататорами (дипиридамол или аденозин), так как он не столь выраженно повышает коронарный кровоток, но информативно у пациентов с наличием противопоказаний к назначению дипиридамола или аденозина фосфата.
Особенности при проведении стрессовых методов визуализации
Сопутствующее применение лекарственных препаратов. Чувствительность эхоКГ-исследования с физической нагрузкой для диагностики ИБС снижается у пациентов, принимающих блокаторы β-адренорецепторов. По возможности следует отменить блокаторы β-адренорецепторов за 48 ч до планируемого исследования. Однако даже в том случае, когда нагрузка остается на субмаксимальном уровне вследствие применения препаратов, визуализирующие методы (сцинтиграфия или эхоКГ) имеют большую специфичность, чем ЭКГ-проба с физической нагрузкой.
Блокада ножки пучка Гиса
Во многих исследованиях при нагрузочных методах визуализации отмечали повышенную распространенность нарушения перфузии миокарда у пациентов с блокадой левой ножки пучка Гиса при отсутствии ангиографических признаков ИБС. Эти нарушения чаще всего распространялись на область межжелудочковой перегородки, могли быть стойкими или обратимыми, но большей частью отсутствовали при проведении фармакологической стрессовой пробы. Механизм развития этих изменений полностью не изучен. По данным нескольких исследований (включивших более 200 пациентов) определили, что изучение перфузии с использованием фармакологической вазодилатации является более точным методом для выявления ИБС у пациентов с блокадой левой ножки пучка Гиса и только в 1 небольшом исследовании с участием 24 пациентов получены данные о диагностической бесполезности стрессовой эхоКГ при наличии блокады левой ножки пучка Гиса. Считаем, что исследование сократимости миокарда методом эхоКГ с применением дипиридамола и аденозина рекомендовано таким пациентам. Блокада правой ножки пучка Гиса или блокада верхней или нижней ветви левой ножки пучка Гиса обычно не связаны с подобными изменениями перфузии.
Проведение стрессового исследования у пациентов особых групп (женщины, лица пожилого возраста, пациенты с ожирением, представители некоторых профессий). Нагрузочная ЭКГ-проба (на тредмиле) имеет недостаточную диагностическую ценность у женщин, так как у большинства из них более низкая предтестовая вероятность развития ИБС, чем у мужчин. В этом случае радиоизотопное исследование миокардиальной перфузии или эхоКГ могут быть логическим дополнением к ЭКГ-пробе с физической нагрузкой на тредмиле. Однако чувствительность радиоизотопного сканирования с изотопами таллия у женщин может быть ниже, чем у мужчин. На изображении передней стенки ЛЖ у женщин часто возникают артефакты из-за молочной железы, особенно при сканировании с изотопом 201Tl. В недавних исследованиях установлено, что при использовании изотопа 99mTс-сестамиби эти артефакты уменьшались. В одном из последних проспективных исследований, включившем 115 женщин как с подозреваемой ИБС, так и с низкой ее вероятностью, ОФЭКТ, проведенные с 201T1 и 99mTс-сестамиби, имели одинаковую чувствительность (84,3 и 80,4% для степени коронарного стеноза более 70%). Однако при использовании изотопа 99mTс-сестамиби специфичность метода была выше (84,4% по сравнению с 67,2%) и повышалась до 92,2% с учетом результатов ЭКГ-исследования. Как ЭКГ-проба с дозированной физической нагрузкой, так и стрессовая эхоКГ не приводят к появлению специфичных артефактов, связанных с молочной железой у женщин. Однако эхоКГ-исследование у лиц с ожирением может оказаться технически трудновыполнимым, а полученное изображение часто бывает низкого качества. Некачественное изображение также нередко бывает у лиц с деформациями грудной клетки или заболеваниями легких. Таким образом, в настоящее время недостаточно данных для рекомендаций относительно замены стандартной ЭКГ-пробы с физической нагрузкой визуализирующими стресс-методами для первичной диагностики ИБС у женщин.
Хотя некоторые пациенты пожилого возраста могут адекватно выполнить ЭКГ-пробу с дозированной физической нагрузкой, зачастую ее проведение не представляется возможным из-за физической несостоятельности этих больных. Поэтому при проведении исследования у пациентов пожилого возраста более приемлемы фармакологические визуализирующие методы.
Для пациентов с избыточной массой тела также возникают сложности в использовании ОФЭКТ, поскольку для этого метода существуют определенные ограничения по массе тела (обычно <135 кг). Этим пациентам может быть проведена плоскостная сцинтиграфия. У пациентов с избыточной массой тела трудно достичь оптимального изображения, особенно при использовании изотопа 201Tl, вследствие значительного связывания фотонов мягкими тканями. Лучшие результаты можно получить при проведении сканирования с изотопом 99mTс-сестамиби, а также при использовании позитронной эмиссионной томографии.
Некоторым группам лиц, чья профессия связана с общественной безопасностью (пилоты самолетов, водители автобусов, пожарные, работники правоохранительных служб и т.п.), или спортсменам чаще других проводят нагрузочное тестирование для определения толерантности к физической нагрузке и вероятности наличия ИБС. Для пациентов этих групп со средней и высокой вероятностью ИБС назначение визуализирующих исследований в дополнение к стандартной ЭКГ-пробе с физической нагрузкой должно быть шире, чем у среднестатистического пациента. Некоторые исследователи считают первичным диагностическим стрессовым исследованием для этих групп пациентов стресс-эхоКГ или радионуклидное исследование (табл. 3.6 и 3.7).
Таблица 3.6
Сравнительная оценка стрессовой эхоКГ и стрессового исследования перфузии миокарда
| Преимущества стресс-эхоКГ |
|
| Преимущества радиоизотопного стресс-исследования миокардиальной перфузии |
|
Таблица 3.7
Сравнение диагностической точности различных стрессовых методов для выявления ИБС
| Метод | Чувств.,% | Специф.,% |
| Нагрузочная ЭКГ | 68 | 77 |
| Нагрузочная стресс-эхоКГ | 80–85 | 8–86 |
| Нагрузочное исследование миокардиальной перфузии | 85–90 | 70–75 |
| Стресс-эхоКГ с добутамином | 40–100 | 62–100 |
| Стресс-эхоКГ с вазодилататорами | 56–92 | 87–100 |
| Исследование миокардиальной перфузии с вазодилататорами | 83–94 | 64–90 |
Инвазивная диагностика
1. Коронарная ангиография
Коронарная ангиография используется как одна из методик обследования, которая помогает установить точный диагноз и выбрать оптимальное лечение. Неинвазивные исследования могут выявить наличие стенозирующего коронарного атеросклероза с определенной долей вероятности и используются для определения необходимости проведения коронарной ангиографии и последующей стратификации риска (табл. 3.8). Но они могут быть противопоказаны при наличии определенных сопутствующих заболеваний или невозможности их проведения. Неинвазивные методики также не позволяют оценить возможность реваскуляризации миоарда.
Таблица 3.8
Рекомендации по неинвазивному обследованию пациентов со стабильной стенокардией
| Исследование | Для диагностики | Для прогноза | ||
| Класс | Уровень доказательности | Класс | Уровень доказательности | |
| Лабораторные тесты | ||||
| Уровень глюкозы натощак | I | B | I | B |
| Липидный профиль крови натощак | I | B | I | B |
| Общий анализ крови, креатинин | I | C | I | B |
| СРБ, гомоцистеин, липопротеин (а), аполипопротеин А, аполипопротеин В | IIb | B | IIb | B |
| ЭКГ | ||||
| ЭКГ в покое | I | C | I | B |
| ЭКГ во время эпизода стенокардии | I | B | ||
| ЭКГ при последующих визитах | IIb | C | IIb | C |
| Рентгенография органов грудной клетки | ||||
| Хроническая сердечная недостаточность или данные аускультации сердца | I | B | I | B |
| Подозрение на заболевание легких | I | B | ||
| ЭхоКГ | ||||
| Подозрение на СН, данные аускультации, изменения на ЭКГ (наличие зубца Q, блокада ножек пучка Гиса, значимые изменения сегмента ST) | I | B | I | B |
| Перенесенный ИМ | I | B | ||
| АГ или сахарный диабет | I | C | I | B/C |
| Пациенты промежуточного или низкого риска без оценки функции ЛЖ | IIa | C | ||
| Проба с физической нагрузкой | ||||
| Начальная оценка, за исключением случаев, когда проба неинформативна | I | B | I | B |
| Пациенты с установленной ИБС и значимыми симптомами ухудшения | I | B | ||
| Периодический контроль стенокардии | IIb | C | IIb | C |
| Амбулаторное мониторирование ЭКГ | ||||
| Подозрение на аритмию | I | B | I | B |
| Подозрение на вазоспастическую стенокардию | IIa | C | ||
| Подозрение на стенокардию при нормальной пробе с физической нагрузкой | IIa | C | ||
| Идентификация локализации ишемии при плановой реваскуляризации | IIa | B | ||
| Оценка функционального состояния коронарной артерии со стенозом средней степени | IIa | C | ||
| Фармакологические стрессовые тесты с визуализацией | ||||
| Пациенты, не способные выполнять физическую нагрузку | I | B | I | B |
| Пациенты с незавершенной пробой с физической нагрузкой из-за низкой толерантности | I | B | I | B |
| Оценка жизнеспособности миокарда | IIa | B | ||
| Другие показания как для проб с визуализацией (фармакологическая проба предпочтительнее пробы с нагрузкой) | IIa | B | IIa | B |
| Неинвазивная КТ артериография | ||||
| Пациенты с низкой вероятностью заболевания и незавершенным или положительным стрессовым тестом | IIb | C | ||
Коронароангиография для визуализации коронарных артерий остается наиболее точным диагностическим тестом для определения клинически значимого обструктивного коронарного атеросклероза и менее распространенных неатеросклеротических причин хронической стабильной стенокардии, таких как коронарный спазм, аномалии коронарных артерий, болезнь Кавасаки, первичная артериальная диссекция, васкулопатия. Результаты ранних исследований корреляции симптомов с ангиографическими данными свидетельствуют, что у 26–65% пациентов с дискомфортом в грудной клетке, не являющимся классической стенокардией, выявляли значительные коронарные стенозы как следствие атеросклероза. У многих пациентов с симптомами, похожими, однако, не типичными для хронической стабильной стенокардии (с предтестовой вероятностью около 50%), ценность неинвазивных диагностических тестов (в сопоставлении с другими клиническими данными) может быть достаточной для установления правильного диагноза и решения о дальнейшей клинической стратегии. Обязанностью врача является определение вероятности того, что симптомы пациента связаны с ишемией миокарда. Все решения, связанные с выбором методов диагностики ИБС, должны учитывать желание пациента и сопутствующие заболевания. Необходимо еще раз подчеркнуть значение анамнеза типичной стенокардии у людей среднего и пожилого возраста, примерно у 90% которых диагностируют выраженную коронарную болезнь, многососудистые поражения. У половины женщин при клинике классической стенокардии выявлено значительное стенозирование коронарных артерий.
Показания к проведению коронарной ангиографии
Диагностическая коронарная ангиография может быть назначена пациентам с болью в грудной клетке, возможно, связанной с ишемией миокарда, когда неинвазивные методы исследования противопоказаны или их проведение нежелательно из-за каких-либо сопутствующих заболеваний, инвалидности или других причин. Например, коронарная ангиография может быть рекомендована с минимальным риском пациенту с болью в грудной клетке, характерной для стенокардии и сопутствующей ХОБЛ, который не сможет выполнить нагрузку из-за одышки, исследование с дипиридамолом или аденозином может вызвать бронхоспазм и необходимость введения теофиллина, а при стресс-эхоКГ у этого пациента будет получено некачественное изображение из-за наличия эмфиземы легких.
Пациентам, у которых результаты неинвазивных методов исследования были патологически изменены, однако не внесли достаточной ясности в установление правильного диагноза, может быть назначено проведение коронарной ангиографии. Повторное проведение неинвазивных исследований может быть рекомендовано лицам с низкой вероятностью ИБС, у которых по результатам функциональной ЭКГ-пробы с нагрузкой на тредмиле вероятность ИБС повысилась до средней. Коронароангиография может быть наиболее подходящим тестом для пациентов с высоким риском после проведенной нагрузочной ЭКГ-пробы на тредмиле.
Пациентам с симптомами, возможно, указывающими на стабильную стенокардию, однако не характерными для нее, коронарная ангиография может быть назначена, если их профессиональная или другая деятельность может составлять риск для них самих или окружающих (пилоты, пожарные, спортсмены). Некоторым пациентам с типичными симптомами стабильной стенокардии или нетипичной болью в грудной клетке, но высокой клинической вероятностью развития ИБС экономически оправдано проведение коронарной ангиографии без предшествующего неинвазивного обследования. Диагностика стенокардии у лиц с сахарным диабетом может быть осложнена в результате ослабления выраженности симптомов ишемии миокарда вследствие наличия сенсорной и автономной нейропатии, следовательно, частота назначения коронароангиографии у них должна быть выше. Проведение коронарной ангиографии у пациентов с высокой предтестовой вероятностью заболевания может иметь значение как для определения степени риска, так и установления диагноза.
Риск при проведении диагностической коронарной ангиографии незначительно выше у лиц пожилого возраста по сравнению с более молодыми пациентами; во многих кардиологических центрах большинство пациентов, которым проводят это исследование, старше 65 лет.
Спазм коронарных артерий
Некоторые исследователи предлагают для выявления спазма коронарных артерий применение неинвазивных провокационных проб, хотя при этом всегда есть риск развития необратимого коронароспазма. Поэтому проведение проб, провоцирующих коронароспазм в условиях катетеризации сердца, рекомендовано в тех случаях, когда возможно интракоронарное введение нитроглицерина или других вазодилататоров, а также проведение других интенсивных терапевтических мероприятий.
Аномалии коронарных артерий
Аномальное ответвление или локализация артерии — нечастая причина стенокардии и чаще всего оказывается неожиданной находкой во время проведения коронароангиографии. Однако эта патология может быть заподозрена у пациентов молодого возраста с симптомами ишемии миокарда и распознана с помощью неинвазивных визуализирующих методов исследования (например, трансэзофагальной эхоКГ, КТ, МРТ). Постоянный шум при аускультации сердца возможен при аномальном отхождении передней межжелудочковой или огибающей ветви левой коронарной артерии от ЛА или при наличии коронарного артериовенозного анастомоза, что также может быть подтверждено при проведении коронароангиографии.
Больные после реанимации при фибрилляции желудочков или стойкой желудочковой тахикардии
У большинства пациентов, перенесших внезапную остановку сердца или аритмию с проведением реанимационных мероприятий, выявляют выраженную ИБС. Этим пациентам проведение коронароангиографии показано как для установления диагноза, так и для определения необходимости и возможности реваскуляризационного вмешательства.
Частота таких осложнений, как смерть, ИМ или инсульт, при проведении коронароангиографии составляет 0,1–0,2%.
Рекомендации по проведению коронарной ангиографии с целью установления диагноза «стабильная стенокардия»:
Класс I
1. Тяжелая стенокардия (III ФК и выше по классификации Канадского общества кардиологов) с высокой предтестовой вероятностью заболевания, особенно если симптомы заболевания неадекватно поддаются медикаментозной коррекции.
2. Выжившие после остановки сердца.
3. Пациенты с серьезной желудочковой аритмией.
4. Пациенты после реваскуляризации миокарда (ЧТКА, АКШ) при появлении возвратной умеренной или тяжелой стенокардии.
Класс IIa
1. Пациенты с сомнительным диагнозом при проведении неинвазивного теста или противоречивыми результатами разных неинвазивных тестов при наличии среднего или высокого риска развития ИБС.
2. Пациенты с высоким риском рестенозов после ЧТКА, если ЧТКА была проведена на прогностически важном участке.
2. Внутрисосудистое УЗИ
Внутрисосудистое УЗИ позволяет получить ультразвуковое изображение изнутри коронарной артерии, значительно улучшает качественную и количественную оценку анатомии венечных сосудов: точное измерение диаметра коронарной артерии, оценку эксцентрических атеросклеротических повреждений и ремоделирования артерий, состояние атеросклеротической бляшки; играет важную роль в определении объема интервенционного вмешательства, помогает точнее произвести установку внутрикоронарного стента. В Украине это обследование проводят в высокоспециализированных клинических отделениях и в научных целях. Оно является методикой первого порядка при диагностике ИБС.
Прогноз больных стабильной стенокардией
Течение ИБС весьма разнообразно: у одних больных стенокардия протекает годами без существенного ухудшения клинической картины, у других — быстро прогрессирует, приводя к ИМ, СН и летальному исходу, у третьих — сразу начинается с острого коронарного синдрома. В значительной мере клиническая симптоматика и дальнейшая судьба больного определяется, с одной стороны, соотношением морфологических и функциональных компонентов патогенеза заболевания, с другой — адекватностью подобранного медикаментозного, интервенционного или хирургического лечения. Выбор тактики лечения конкретного больного с коронарной недостаточностью является важнейшей повседневной задачей практикующего кардиолога. Учитывая, что различные клинические синдромы хронической ИБС, по сути, являются проявлением одного и того же патологического процесса, разделение стенокардии на различные формы оправдано лишь с клинических позиций, а оценка тяжести и долгосрочный прогноз ИБС представляют собой весьма сложную проблему. Как известно, течение и долгосрочный прогноз заболевания у пациентов с хроническими формами ИБС в значительной мере коррелируют с данными коронарографии и показателями, характеризующими функцию миокарда, прежде всего с такими как ФВ ЛЖ. Установлена обратная зависимость между выраженностью коронарного атеросклероза и выживанием больных ИБС. В 80-е годы ХХ ст. ежегодная смертность больных ИБС в среднем составляла 3–6%. При поражении одной венечной артерии — 2%, трех — 7–10%, при стенозе ствола левой коронарной артерии прогноз был особенно неблагоприятный.
Представленные нами данные 5-летнего наблюдения пациентов с ИБС, которые не были подвергнуты операции реваскуляризации, опубликованы еще в 1989 г., когда в Украине широко не применялись препараты, оказывающие влияние на прогноз заболевания. Тогда мы не использовали статины, ингибиторы АПФ, несистематически назначали ацетилсалициловую кислоту, а из препаратов, влияющих на прогноз ИБС, применяли только блокаторы β-адренорецепторов. Практически речь шла о «естественном» течении болезни. Результаты наблюдения пациентов с ИБС и поражением двух и более коронарных артерий, получавшими только антиангинальное лечение, свидетельствовали о том, что у 51% из них в течение 5 лет развивался повторный ИМ или коронарная смерть. У пациентов с поражением одной венечной артерии смертность за 5 лет составила — 7%, двух — 16%, трех — 29%. То есть речь идет о тяжелой категории больных, требующих комплексного воздействия, включающего изменение стиля жизни, медикаментозное, интервенционное и хирургическое лечение. В настоящее время к пациентам с ИБС высокого риска относят больных с ежегодным риском смерти более 2%.
Результаты первых эпидемиологических исследований свидетельствовали о высокой вариабельности ежегодной смертности пациентов с ИБС — в пределах от 2,5 до 9%. Эти данные отчетливо указывали на взаимосвязь некоторых изменений ЭКГ покоя, АГ, кардиомегалии и застойной СН со смертностью лиц с ИБС. В многочисленных исследованиях, учитывающих данные коронароангиографии, подчеркивается высокая степень корреляции между выраженностью атеросклеротического поражения коронарного русла и смертностью этих больных.
Резюмируя данные первых исследований, посвященных изучению зависимости между атеросклеротическим поражением венечных артерий и смертностью лиц с ИБС, можно прийти к заключению, что при стенозировании одной из трех главных венечных артерий (передняя межжелудочковая ветвь левой коронарной артерии (ЛКА), огибающая ветвь ЛКА, правая коронарная артерия) ежегодная смертность составляет приблизительно 2%. Если поражены 2 из 3 главных артерий, смертность составляет приблизительно 7%, а если поражены все 3 артерии — приблизительно 11%. Подчеркивается, что эти данные основаны на анализе выраженности атеросклеротических поражений и существенно ухудшаются при развитии и прогрессировании застойной СН.
Reeves и соавторы первыми сделали несколько важных наблюдений. Первое из них состояло в том, что выживаемость пациентов со стенокардией отчетливо улучшалась на протяжении XX в. В их обзоре показано, что длительность жизни от возникновения симптомокомплекса стенокардии до смерти возросла в 1956 г. по сравнению с 1918-м. В первом исследовании Herrick и Nuzum, проведенном в 1918 г., сообщалось, что от момента возникновения стенокардии до смерти в среднем проходило около 3 лет, а в 1956 г. Richards и соавторы установили, что эти больные жили уже в среднем 9,7 года. Также у женщин отмечено более благоприятный прогноз по сравнению с мужчинами. Но независимо от пола наблюдали следующую закономерность: смертность у пациентов с АГ, кардиомегалией, застойной СН и патологическими изменениями на ЭКГ была выше. У женщин, предъявляющих жалобы на боль в прекардиальной области, чаще выявляли нормальные ангиограммы. Reeves и соавторы подчеркивают, что у женщин более высокий процент ложноположительных диагнозов «стенокардия». Авторы предположили, что, возможно, этим и объясняется разница в смертности между пациентами разных полов. В этом обзоре также выделены несколько простых факторов, имеющих особое влияние на выживаемость пациентов со стенокардией. Авторы отметили, что использование простых, неинвазивных методов исследования (например ЭКГ) помогает дифференцировать пациентов с высоким и низким риском смерти. Например, 5-летняя выживаемость пациентов с нормальной ЭКГ составляла 73,1% по отношению к 29,1% у таковых с патологической.
Friesinger и соавторы одними из первых проанализированы результаты коронароангиографии у пациентов с прекардиальной болью. Средний период наблюдения составил 50 мес. Выраженность поражений в каждой из 3 главных артерий оценивали в баллах:
- 0 — поражений нет;
- 1 — поражения несущественны;
- 2 — выраженность стеноза варьирует между 50 и 90%;
- 3 — множественные поражения —50–90% в 1 артерии;
- 4 — стеноз более чем 90%, но не окклюзия;
- 5 — окклюзия.
По данным этого исследования у пациентов с количеством баллов выше 10 смертность в течение 50 мес составила 53%. В то же время у пациентов с количеством баллов выше 3, но ниже 10, смертность составила 5%. Только 1 пациент из 32 с поражением 1 венечной артерии умер за время 50-месячного наблюдения (и то в автокатастрофе).
Данные многочисленных исследователей показывают, что смертность пациентов со стабильной стенокардией строго зависит от количества пораженных артерий. Установлено, что поражение проксимальной части передней межжелудочковой ветви ЛКА связано с относительно серьезным прогнозом и ежегодной смертностью в пределах 4–7,4%. У больных с поражением огибающей ветви ЛКА или правой коронарной артерии прогноз лучше — от 2 до 7 лет. У пациентов с поражением 3 сосудов отмечают высокую смертность — 10–15% в год. В любом случае кардиомегалия и СН серьезно ухудшают прогноз. В заключение подчеркивается значение коронаровентрикулографии для определения прогноза. Friesinger и соавторы оценили связь между ЭКГ-признаками постинфарктного кардиосклероза, длительностью анамнеза СН и прогнозом. У пациентов с ЭКГ-признаками постинфарктного кардиосклероза смертность в течение 22 мес составила 31%, в отличие от 7% смертности больных, не имевших подобных изменений на ЭКГ. Наличие СН в анамнезе было также тесно связано с прогнозом. Смертность на протяжении 22 мес у 45 пациентов с признаками легочной гипертензии составила 40% по сравнению с 8% у 201 пациента без таковой. Смертность у 30 пациентов с поражением 2-3 сосудов в сочетании с СН составила 50%. У больных с аналогичным поражением коронарных артерий, но без СН смертность составила 16%. У пациентов с признаками кардиомегалии (по данным рентгенографии) смертность при наличии поражения 2 сосудов составила 41% в течение 22 мес, у больных без кардиомегалии — 7%.
В настоящее время у пациентов с ИБС хорошо изучена связь между клиническими данными, показателями неинвазивных методов исследования сердечно-сосудистой системы и прогнозом заболевания. Особенно это касается пациентов, перенесших ИМ. Наиболее простые и информативные предикторы прогноза представлены ниже.
Клинические параметры, связанные с прогнозом больных ИБС, перенесших ИМ:
- Возраст
- Стенокардия до ИМ (косвенно указывает на высокую вероятность поражения 3 сосудов)
- ЭКГ- и эхоКГ-признаки ранее перенесенного ИМ (повышают риск неблагоприятного исхода в 2 раза)
- Пол — отдаленный прогноз у женщин, перенесших ИМ, хуже
- Наличие АГ
- Наличие сахарного диабета (3–4-кратное повышение риска)
- Продолжение курения
- Признаки передней локализации ИМ по сравнению с нижней локализацией
- Признаки СН
- Повышенный уровень мочевины, креатинина
- Ранняя постинфарктная стенокардия
- Желудочковые нарушения ритма
- Повышенная ЧСС
Параметры нагрузочного теста, ассоциированные с плохим прогнозом ИБС:
- Продолжительность теста:
-
- невозможность выполнить II ступень по протоколу Bruce (<6,5 METS);
- низкая пороговая ЧСС <120 уд./мин.
- Время появления, амплитуда и продолжительность депрессии сегмента ST:
-
- начало при ЧСС <120 уд./мин или нагрузке < 6,5 METS;
- амплитуда >2 мм;
- продолжительность восстановления >6 мин;
- депрессия сегмента ST в нескольких отведениях.
- Реакция САД во время или по окончанию теста:
-
- снижение АД более чем на 10 мм рт. ст. или отсутствие прироста в ответ на нагрузку (не выше 130 мм рт. ст. при пороговой нагрузке).
- Прочие потенциально неблагоприятные показатели:
-
- подъем сегмента ST (кроме отведения aVR);
- приступ стенокардии, резкая слабость.
ВАЗОСПАСТИЧЕСКАЯ СТЕНОКАРДИЯ
Определение
Вазоспастическая стенокардия является формой стенокардии, обусловленной спазмом коронарных артерий, возникающего внезапно в сегменте крупной эпикардиальной артерии, в результате чего резко снижается коронарный кровоток и возникает, как правило, трансмуральная ишемия миокарда, проявляющаяся элевацией сегмента ST на ЭКГ. C. Conti (1985) дает рабочее определение коронароспазму как транзиторному уменьшению просвета эпикардиальной артерии, достигающему степени, достаточной для провоцирования ишемии миокарда при отсутствии повышения ЧСС и АД.
В 1959 г. Принцметал впервые описал заболевание, при котором в состоянии полного покоя внезапно, без действия видимых провоцирующих факторов, ночью или в ранние утренние часы возникает циклически повторяющаяся ангинозная боль, вызванная спазмом коронарных артерий и в большинстве случаев сопровождающаяся выраженным преходящим подъемом сегмента ST на ЭКГ.
По патогенетическому принципу A. Maseri (1980) классифицировал стенокардию как первичную (вазоспастическая стенокардия), связанную с преходящими нарушениями коронарной перфузии вследствие изменения тонуса коронарных артерий и реологических свойств крови, и вторичную (стенокардия напряжения), возникающую вследствие повышения потребления кислорода миокардом при ограничении его поставки в результате коронарного атеросклероза.
Терминология
Термин «вазоспастическая стенокардия» используется нами для определения категории больных ИБС с преобладанием в клинической картине заболевания симптомов и инструментальных признаков, характерных для ишемии, развившейся вследствие спазма венечных артерий. Термин применяется как синоним «спонтанной», «вариантной», «ангиоспастической», «особой» формы стенокардии или стенокардии Принцметала и выбран не случайно, поскольку наиболее часто используется в зарубежной литературе и, с нашей точки зрения, наилучшим образом отражает механизмы, ответственные за развитие ишемии.
Эпидемиология
Вазоспастическую стенокардию выявляют у 2% пациентов, госпитализированных с клиническими проявлениями нестабильной стенокардии. Чаще это лица в возрасте 50–60 лет, мужчины и женщины в соотношении 5:1. Курение — доказанный фактор риска вазоспастической стенокардии. Употребление алкоголя, кокаина, флуороурацила, суматриптана может вызывать вазоспастическую стенокардию. В некоторых случаях вазоспастическая стенокардия может ассоциироваться с такими вазомоторными нарушениями, как мигрень и синдром Рейно.
Патогенез
Механизмы развития вазоспастической стенокардии до конца не выяснены, хотя предполагают, что в их основе лежат гиперреактивность гладкомышечных клеток и дисфункция эндотелия сосудов, что приводит к выраженному спазму коронарных артерий и их кратковременному динамическому стенозу. Рассматривается влияние нескольких предрасполагающих факторов, таких как повышение внутриклеточной рокиназной активности, нарушение АТФ-чувствительности калиевых каналов, транспорта Na+ и H+, дисбаланс вегетативной нервной системы, повышение концентрации эндотелина. Прекращение или резкое уменьшение коронарного кровообращения приводит к глубокой, чаще трансмуральной ишемии миокарда, снижению локальной сократимости ЛЖ и электрической нестабильности миокарда, проявляющейся нарушением ритма и проводимости.
Морфологические изменения коронарных сосудов у больных с вазоспастической стенокардией весьма вариабельны. В одних случаях выявляют более или менее выраженный фиксированный стеноз проксимальной коронарной артерии, иногда с признаками нестабильной атеромы. В других — атеросклеротическое сужение крупных коронарных артерий может быть минимальным или даже отсутствовать совсем. В последнем случае можно предположить спазм коронарных артерий на уровне мелких интрамуральных коронарных сосудов, морфологические изменения которых обычно не выявляют при коронароангиографии. Иногда в процесс вазоспазма может вовлекаться несколько коронарных сегментов (мультикоронарный спазм).
Клинические проявления
Характеристика ангинозной боли
Интенсивные болевые приступы возникают в покое, часто ночью во время сна или в ранние утренние часы (4–6 часов утра). Болевым приступам, как правило, не предшествуют какие-либо провоцирующие факторы, повышающие потребность миокарда в кислороде (повышение ЧСС и АД, др.) (рис. 3.7).
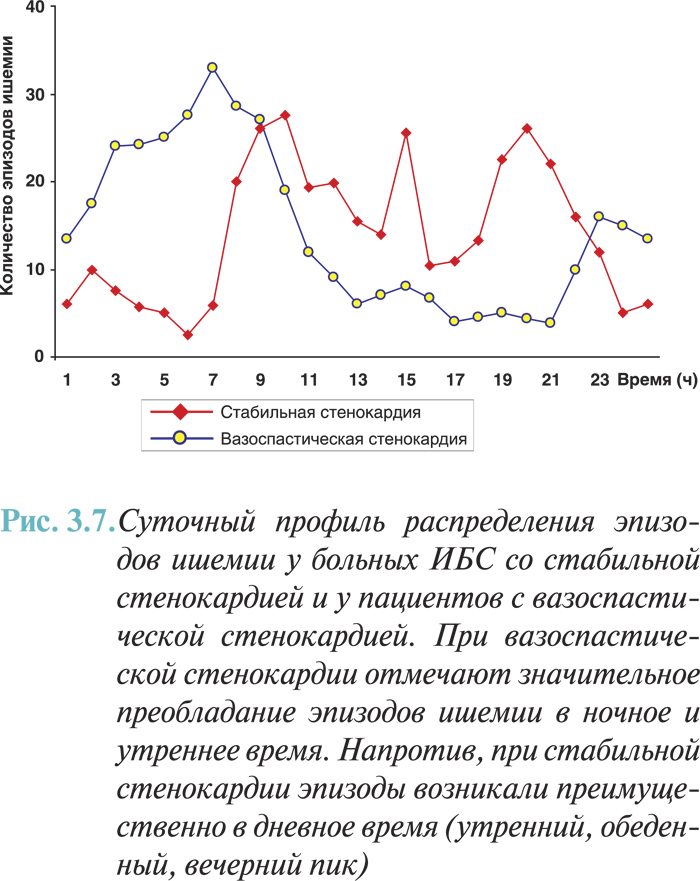
Боль локализуется за грудиной и иррадиирует в левую руку, плечо и лопатку. Продолжительность боли — от 3–10 мин, реже — до 20–30 мин. Нередко на фоне болевого приступа возникает брадикардия. Тахикардия может появиться на высоте приступа или в конце его, но лишь как следствие рефлекторной симпатической активации. Боль может сопровождаться одышкой, слабостью, потливостью, головокружением, что связано с дисфункцией ЛЖ и выраженными вегетативными нарушениями. Во время приступа вариантной стенокардии могут развиться преходящие внутрижелудочковые и АУ-блокады, частая желудочковая экстрасистолия высоких градаций, пароксизмальная тахикардия и даже фибрилляция желудочков, внезапное формирование АУ-блокады II или III степени, остановка синусного узла, что нередко сопровождается синкопальным состоянием.
Клинические варианты вазоспастической стенокардии
Очевидным является и тот факт, что Принцметал впервые описал лишь особую, наиболее тяжелую форму вазоспастической стенокардии и, по-видимому, термин «стенокардия Принцметала» не может охватить весь широкий спектр клинических проявлений вазоспастической стенокардии.
A. Maseri и S. Chierchia (1985), основываясь на патогенетическом подходе, предложили выделять следующие формы стенокардии: стенокардию напряжения, вазоспастическую и смешанную. В патогенезе двух последних вариантов течения ИБС вазоспазм играет ведущую роль. Следует также помнить, что у пациентов с исходно стабильной стенокардией или редкими приступами вазоспастической стенокардии при дестабилизации атеромы усиливаются механизмы динамической коронарной обструкции, что может привести к преобладанию в клинической картине заболевания симптомов коронарного вазоспазма. В этих случаях вазоспазм является характерным проявлением нестабильной стенокардии.
Смешанная стенокардия — форма ИБС, для которой характерно сочетание клинических признаков как стабильной, так и вазоспастической стенокардии.
У ряда больных с наличием диагностированного стеноза коронарных артерий типичные приступы стабильной стенокардии напряжения сочетаются с ночными приступами спонтанной стенокардии. В данном случае приступы стенокардии напряжения возникают в дневные часы и обычно провоцируются физической нагрузкой, психоэмоциональным напряжением, повышением АД. Приступы вазоспастической стенокардии, обусловленные спазмом коронарных артерий, развиваются спонтанно ночью или под утро (рис. 3.8). Толерантность к физической нагрузке у этих больных может быть существенно снижена из-за наличия стеноза коронарных артерий.
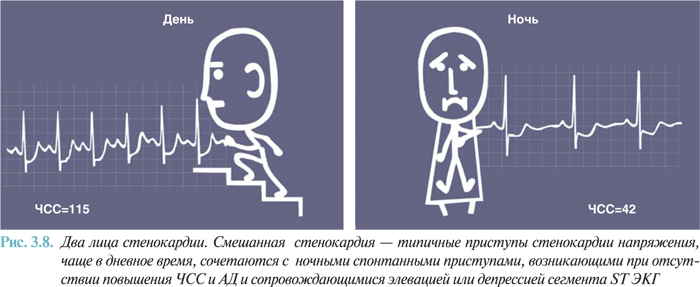
Особого внимания требует ситуация, когда у пациента со стенокардией напряжения впервые появляются приступы спонтанной стенокардии, что обычно свидетельствует об обострении ИБС, вызванном дестабилизацией атеромы.
Второй вариант — собственно вазоспастическая стенокардия, описанная Принцметалом. Выявляют преимущественно у лиц молодого возраста, у которых отсутствует гемодинамически значимая окклюзия коронарных артерий. Спонтанная стенокардия может быть единственным клиническим проявлением ИБС, а стенокардия напряжения отсутствует. Для этих больных, как правило, характерна высокая толерантность к физической нагрузке.
Диагностика
Классическим ЭКГ-признаком вазоспастической стенокардии является элевация сегмента ST, свидетельствующая о наличии трансмуральной ишемии миокарда, обусловленной преходящей динамической окклюзией коронарных артерий. (рис. 3.9) Реже отмечают ишемическую депрессию сегмента ST, что свидетельствует об отсутствии полной окклюзии крупной коронарной артерии или наличии спазма более мелких артерий и артериол при хорошем развитии коллатералей.
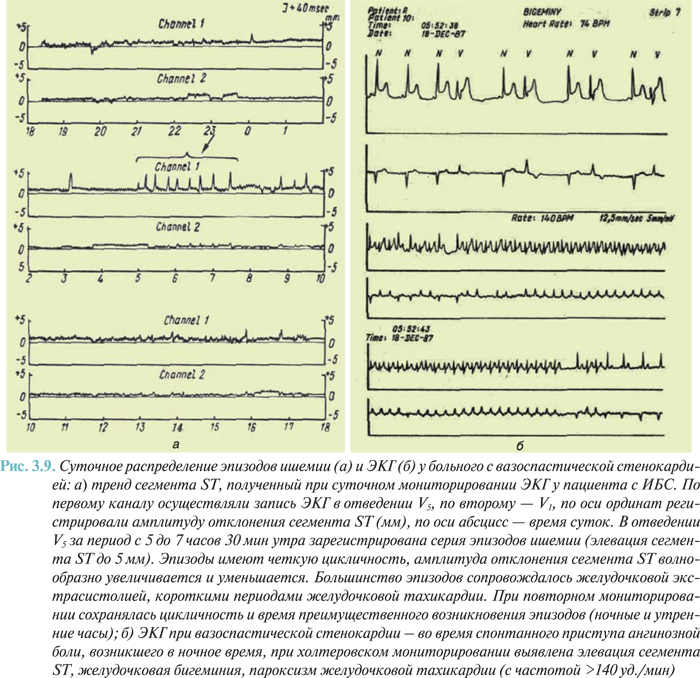
С помощью суточного мониторирования ЭКГ можно диагностировать важный отличительный признак вазоспастической стенокардии — быстрое, скачкообразное смещение сегмента ST и быструю его нормализацию после окончания спастической реакции. Для стенокардии напряжения, наоборот, характерно плавное постепенное смещение сегмента ST на фоне повышения ЧСС и столь же медленное возвращение его к исходному уровню после купирования приступа.
Зафиксировать коронароспазм при вазоспастической стенокардии довольно сложно. В связи с этим для верификации диагноза целесообразно применение функциональных проб, провоцирующих спазм коронарных артерий. Гипервентиляция и холодовая проба отличаются низкой чувствительностью, поскольку ишемические изменения сегмента ST выявляют примерно у 1520% больных вазоспастической стенокардией.
В ангиографических центрах с целью провокации спазма венечных артерий применяют внутрикоронарное введение ацетилхолина и эргометрина. Данные методы считаются золотым стандартом в диагностике вазоспастической стенокардии. Внутривенная эргометриновая проба, с регистрацией ишемии с помощью ЭКГ или сцинтиграфии, по уровню чувствительности и специфичности считается наиболее адекватной в клинических условиях для выявления вазоспастических реакций у больных ИБС. Однако проведение провокационных тестов без предшествующей коронароангиографии или у пациентов со стенозом коронарных артерий высокой степени не рекомендуется.
Прогноз
Прогноз при вариантной стенокардии определяют двумя основными факторами: уровнем коронарной обструкции и развитием дестабилизации ИБС, вследствие чего повышается риск развития ИМ и внезапной коронарной смерти. У пациентов с вазоспастической стенокардией без ангиографических признаков выраженного поражения венечных артерий или дестабилизации атеромы случаи ИМ или коронарной смерти нечасты — до 0,5% случаев в год. Если у больного отмечают тяжелые, длительные или впервые возникшие и повторяющиеся приступы стенокардии Принцметала, которые могут быть отнесены к нестабильной стенокардии, прогноз достаточно серьезен: у 20–25% больных в течение 3 мес развивается ИМ или наступает внезапная сердечная смерть. При стабильном характере вариантной стенокардии редкие и легко купирующиеся под влиянием лечения болевые приступы прекращаются, иногда на многие годы, и прогноз определяется степенью коронарной обструкции и количеством пораженных коронарных артерий. 7-летняя выживаемость этих больных достигает 97%.
КAРДИAЛЬHЫЙ СИНДРОМ Х
Хотя у большинства пациентов с типичной ангинозной болью в грудной клетке при нагрузке и положительным стресс-тестом обычно выявляют выраженную обструктивную коронарную болезнь сердца, приблизительно у 10–15% из них — коронароангиограмма в норме. Этих пациентов относят к кардиальному синдрому Х, для которого нет универсального определения.
Кардиальный синдром Х имеет три характерных признака; наличие каждого из них возможно и при другой кардиологической патологии:
- стенокардия или похожая на нее боль в грудной клетке;
- депрессия сегмента ST на ЭКГ во время нагрузочного теста;
- интактные коронарные артерии по данным коронарографии с ненарушенной функцией ЛЖ.
Кардиальный синдром Х, прежде всего, требует дифференциальной диагностики со стенокардией напряжения — типичным проявлением
ИБС, в основе которой лежит обструктивное атеросклеротическое поражение венечных артерий. Группа больных с диагнозом синдрома Х — гетерогенна. У большинства пациентов, предъявляющих жалобы на боль в области сердца при нагрузке с интактными венечными артериями, отмечают неишемический механизм боли и часто повышение болевой чувствительности. Поэтому диагноз «кардиальный синдром Х» не следует устанавливать при отсутствии объективных признаков ишемии миокарда. К этой категории больных не следует относить пациентов с мышечными мостиками, АГ, клапанными пороками сердца, ГЛЖ, сахарным диабетом, поскольку в этих случаях вероятные причины стенокардии известны. У пациентов с документированным спазмом субэпикардиальных коронарных артерий и типичными клиническими признаками вазоспастической стенокардии также следует исключить рассматриваемый синдром.
Изменения тонуса венечных артерий — прежде всего неадекватный расширительный резерв резистивных артерий в ответ на стресс или аномальная их вазоконстрикция — играют важную роль в формировании ишемии у этих больных, однако в отличие от вазоспастической стенокардии только на микроваскулярном уровне. Поэтому кардиальный синдром Х иногда называют «микроваскулярная стенокардия».
К указанной категории больных не следует также относить пациентов, перенесших ИМ (часто Q-ИМ, иногда с исходом в аневризму), как правило, в молодом возрасте, который был первым проявлением ИБС, а при последующем проведении коронарографии у них не выявляют гемодинамически значимо пораженных венечных артерий. В этих случаях ИМ, как правило, развивается вследствие спазма крупной субэндокардиальной артерии и ее тромбоза с последующей спонтанной или медикаментозной реканализацией сосуда.
Необходимо отличать кардиальный синдром Х от метаболического синдрома, также имеющего название синдрома Х, но характеризующегося инсулинорезистентностью, ожирением, гипертензией и дислипидемией. Следует учитывать, что оба указанных синдрома Х могут сочетаться у одного пациента.
Патогенез
Патогенез кардиального синдрома X до конца не изучен. Для объяснения этого феномена предлагаются два принципиально разных механизма:
1) миокардиальная ишемия возникает вследствие микроваскулярной коронарной дисфункции (патологическая недостаточная дилатация сосудов в ответ на стресс и/или повышенная вазоконстрикция);
2) наличие у пациента повышенной чувствительности к интракардиальной боли или синдром «чувствительного сердца».
Очевидно, что последний механизм не объясняет возникновение у пациентов депрессии сегмента ST на ЭКГ при стресс-тесте. Возможно, что синдром Х может быть результатом различных комбинаций коронарной микроваскулярной дисфункции и повышенной чувствительности к болевым стимулам. Как болевой порог, так и микроваскулярная дисфункция имеют градации по тяжести и модулируются различными факторами, такими как дисфункция эндотелия, воспаление, автономные нервные влияния и психологические механизмы. Среди указанных причин дисфункция эндотелия при кардиальном синдроме Х, по-видимому, является самой важной. Эндотелиальная дисфункция — самое раннее звено в развитии атеросклероза, она определяется уже в период, предшествующий формированию атеросклеротической бляшки, до клинических проявлений болезни. Повреждение эндотелия вызывает дисбаланс в синтезе вазоконстрикторных и вазорелаксирующих веществ, вызывает активацию воспалительного процесса, ведет к тромбообразованию и пролифирации гладкомышечных клеток в артериальной стенке.
У больных со множественными факторами риска часто отмечают начальную коронарную атерому, невыявляемую на коронарограмме, которая может ухудшать эндотелиальную функцию.
Среди пациентов с кардиальным синдромом Х следует отметить преобладание (приблизительно 70%) женщин в постменопаузный период. У них часто отмечают атипичную боль в грудной клетке, которая длится дольше, чем при типичной стенокардии, и может быть резистентной к нитроглицерину. Иногда у этих женщин диагностируют психические заболевания. Дефицит эстрогенов является патогномоничным фактором, воздействующим на сосуды через эндотелийзависимые и эндотелийнезависимые механизмы. Установлено улучшение эндотелиальной функции у женщин в постменопаузный период при приеме 17-β-эстрадиола.
Диагностика
Большинство кардиологов считают, что дополнительно к типичной боли в грудной клетке и ишемическим изменениям ЭКГ либо другим доказательствам ишемии миокарда (выявление преходящего дефекта миокардиальной перфузии при сцинтиграфии с 201Tl) субэпикардиальные коронарные артерии должны быть ангиографически полностью неизмененными. Однако даже эти строгие ангиографические критерии имеют свои ограничения, так как известно, что коронарография может оказаться недостаточно информативной. Метод не выявляет ранние атеросклеротические изменения, когда бляшка развивается в пределах артериальной стенки, не вызывая сужения просвета сосуда, недостаточно чувствителен при диагностике интракоронарного тромбоза, не помогает определить внутреннюю структуру бляшек и идентифицировать бляшки, склонные к разрыву и изъязвлению. При кардиальном синдроме Х преходящие дефекты перфузии часто выявляют в областях, кровоснабжающихся малопораженными венечными артериями. Использование современных диагностических методов позволяет диагностировать ишемию у этих пациентов на уровне изучения локальных нарушений сократимости, перфузии и метаболизма миокарда. У некоторых больных выявляют локальные нарушения подвижности стенки сердца при стресс-эхоКГ, МРТ, либо нарушения метаболизма миокарда при позитронно-эмиссионной томографии. Внутрисосудистое УЗИ коронарных артерий имеет наибольшее значение как раз в тех случаях, когда при коронарографии выявляют нормальные или малоизмененные коронарные артерии. Эта методика позволяет изучить поверхность и внутреннюю структуру атеросклеротических бляшек, определить раннее атеросклеротическое поражение, когда оно находится в пределах стенки артерии, верифицировать бляшки сложной конфигурации, дать им количественную оценку, исследовать состояние сосудистой стенки вокруг бляшки, выявить тромбоз коронарной артерии. Однако сложность, высокая стоимость, необходимость в высокой квалификации персонала препятствуют широкому применению этого ценного метода.
Прогноз
При исключении больных с блокадой левой ножки пучка Гиса и пациентов со вторичной микроваскулярной стенокардией вследствие серьезных системных заболеваний (таких как амилоидоз или миеломная болезнь) прогноз больных с кардиальным синдромом Х благоприятен как в отношении выживаемости, так и сохранения функции ЛЖ. Однако у некоторых пациентов клинические проявления заболевания сохраняются достаточно долго, поэтому качество жизни у большинства пациентов с кардиальным синдромом Х неудовлетворительное.
БЕЗБОЛЕВАЯ ИШЕМИЯ МИОКАРДА
Определение
Безболевая, или «немая», ишемия миокарда — эпизоды транзиторной ишемии сердечной мышцы, объективно выявляемые с помощью некоторых инструментальных методов исследования, но не сопровождающиеся приступами стенокардии или ее эквивалентами.
Феномен безболевой ишемии миокарда фактически является одним из частных проявлений коронарной болезни сердца. В соответствии с классификацией P. Cohn (1993) различают следующие типы безболевой ишемии миокарда:
- I тип — у лиц с доказанным с помощью коронарографии гемодинамически значимым стенозом коронарных артерий, не имеющих в анамнезе приступов стенокардии, ИМ, нарушений сердечного ритма или застойной СН;
- II тип — у больных с ИМ в анамнезе без приступов стенокардии;
- III тип — у больных с типичными приступами стенокардии или ее эквивалентами.
Следует подчеркнуть, что в МКБ-10 и классификации Украинской ассоциации кардиологов безболевая ишемия миокарда, если она является единственным проявлением заболевания (I тип по P. Cohn ), выделяется в отдельную форму безболевой ИБС и кодируется под рубрикой 125.6. Целесообразность выделения данной формы определяется необходимостью ее своевременной диагностики в связи с высокой вероятностью возникновения коронарных осложнений. Следует подчеркнуть, что изменения сегмента ST по ишемическому типу у лиц без клинических проявлений ИБС можно рассматривать как безболевую ишемию миокарда только в случаях, когда установлены характерные перфузионные, биохимические, гемодинамические и функциональные отклонения, указывающие на дисбаланс между потребностью миокарда в кислороде и его поставкой, а также в случаях выявления методом коронарографии гемодинамически значимого стеноза коронарной артерии.
Эпидемиология
Первые клинические проявления заболевания, такие как ИМ и внезапная коронарная смерть, возникают примерно у ⅓ больных на фоне, казалось бы, полного благополучия, являясь первыми клиническими проявлениями заболевания. Однако в этих случаях зачастую выявляется выраженный атеросклероз коронарных артерий (сужение просвета венечных артерий на 50–70% и более), который существовал латентно и до определенного момента клинически не проявлялся. В связи с этим сформировалось понятие «безболевая (бессимптомная, скрытая, латентная) ишемия миокарда», или «безболевая ИБС».
Кроме того, у некоторых пациентов с доказанной ИБС заболевание в течение определенного времени (и не обязательно в его начале) может протекать бессимптомно, когда приступы стенокардии отсутствуют и эпизоды безболевой ишемии миокарда являются практически единственным проявлением патологии.
Феномен безболевой ишемии миокарда выявляют не менее чем у ⅔ больных ИБС со стабильной и нестабильной стенокардией и у ⅓ — с постинфарктным кардиосклерозом. В большинстве случаев у одного и того же больного наблюдается сочетание как безболевой ишемии миокарда, так и ангинозных приступов. Причем лишь небольшая часть эпизодов преходящей ишемии сопровождается приступами стенокардии (не более чем 20–25% общего числа), тогда как доля безболевой ишемии миокарда составляет около 40–80%.
Суточное мониторирование ЭКГ выявляет эпизоды депрессии сегмента ST ишемического типа в среднем у 2–10% «здоровых» мужчин (I тип безболевой ишемии миокарда).
II тип безболевой ишемии регистрируют в среднем у 38% больных, перенесших ИМ и не получающих антиангинальной терапии.
У пациентов со стабильной стенокардией эпизоды ишемического снижения сегмента ST, по данным суточного мониторирования ЭКГ, выявляют в среднем в 82% случаев (III тип). При этом безболевая ишемия может быть у них в 1,5–3 раза чаще, чем болевые эпизоды.
Существенные различия в частоте выявления безболевой ишемии миокарда в разных исследованиях в значительной мере объясняются методами, которыми ее регистрируют, а также клиническими формами заболевания.
Таким образом, безболевая ишемия миокарда относится к числу не менее распространенных, чем стенокардия, проявлений коронарной недостаточности. Эпизоды безболевой ишемии миокарда выявляют у большинства больных ИБС, причем, как правило, их частота и продолжительность превышают частоту и длительность болевых приступов (стенокардии).
Патогенез
Механизмы возникновения недостаточности коронарного кровообращения во время доказанных эпизодов безболевой ишемии миокарда аналогичны таковым у пациентов со стабильной или вазоспастической стенокардией.
Причины отсутствия болевого синдрома во время преходящей ишемии миокарда до сих пор не полностью изучены. У пациентов с эпизодами безболевой ишемии миокарда, вероятнее всего, имеет значение повышенное содержание опиоидных субстанций, снижение чувствительности болевых рецепторов (ноцицепторов) и повышение порога болевой чувствительности.
В основе болевого синдрома при преходящей ишемии миокарда, вызванной абсолютным или относительным уменьшением коронарного кровотока и/или увеличением потребности миокарда в кислороде, лежит высвобождение в очаге ишемии ряда химических субстанций, обладающих свойствами медиаторов боли. Главными из них являются серотонин, гистамин, брадикинин, источником которых служат тромбоциты, базофильные лейкоциты и тканевые тучные клетки.
Если медиаторы боли выделяются в достаточном количестве, происходит возбуждение специфических болевых рецепторов — ноцицепторов. Причем их чувствительность во многом зависит от концентрации в окружающей рецепторы среде ионов К+ и Н+, а также от содержания простагландинов, образующихся в процессе активации метаболизма арахидоновой кислоты. Считают, что простагландины являются своеобразными модуляторами освобождения и функционирования медиаторов боли в ноцицепторах.
Из очага ишемии болевые импульсы переносятся по афферентным волокнам сердечных нервов к паравертебральной цепочке шейных и грудных ганглиев, затем по спиноталамическому тракту спинного мозга к заднебоковым и передним ядрам таламуса и к коре головного мозга, где и формируется болевое ощущение.
В передаче болевого возбуждения на уровне спинного мозга и таламуса важное место отводится так называемой субстанции Р, которая является физиологическим медиатором для волокон чувствительных нейронов задних корешков спинного мозга. Степень высвобождения субстанции Р из нервных окончаний чувствительных волокон регулируется опиоидными нейропептидами — энкефалинами и эндорфинами. Они препятствуют высвобождению субстанции Р и, следовательно, могут регулировать поступление болевых импульсов в таламус и кору головного мозга.
Эти факторы оказывают существенное влияние на характер и интенсивность болевого приступа и в некоторых случаях могут вообще препятствовать его возникновению, несмотря на наличие в миокарде очага ишемии.
Вторым важным фактором, ответственным за отсутствие болевых ощущений при ишемии, может быть недостаточная выраженность собственно ишемии и допороговых в отношении восприятия боли метаболических нарушений, вызванных ею. В соответствии с концепцией «ишемического каскада» наиболее ранним проявлением ишемии является нарушение перфузии, метаболизма и сократимости миокарда, и только позже возникают болевые ощущения.
Мы располагаем собственными данными, подтверждающими эту гипотезу. У большинства пациентов со стабильной стенокардией появление безболевой ишемии миокарда можно объяснить меньшей выраженностью и длительностью ишемии. Так, амплитуда депрессии сегмента ST и ее продолжительность были достоверно меньшими при отсутствии болевого синдрома. Особенно демонстративными были различия в длительности эпизодов ишемии миокарда с наибольшей глубиной депрессии сегмента ST (>3 мм). Безболевые эпизоды ишемии миокарда были в 2 раза короче болевых, 6,5+0,6 против 13,7+1,9 мин соответственно (р<0,001).
У части пациентов со стабильной стенокардией, с преимущественно безболевыми эпизодами ишемии миокарда, по результатам холтеровского мониторирования за появление боли, вероятно, отвечают механизмы восприятия боли. В нашем исследовании было 15% таких пациентов. Они характеризовались безболевой депрессией сегмента ST во время проведения ВЭМ и более высокими базальными уровнями эндогенных опиатов (бета-эндорфин и лей-энкефалин) Во время холтеровского мониторирования у них регистрировали редкие приступы стенокардии (0–3 в сутки) и частые безболевые эпизоды ишемии миокарда (до 6–8 в сутки). Причем амплитуда безболевых депрессий сегмента ST была большей, чем болевых. Не исключено, что у этих пациентов возникновение безболевой ишемии миокарда связано с особенностями восприятия боли, обусловленными периферическими и центральными механизмами. Например, полученные данные предполагают, что у части больных со стабильной стенокардией формирование болевых ощущений во время ишемии миокарда зависит от базального состояния системы эндогенных опиатов.
Диагностика
Безболевую ишемию миокарда выявляют с помощью инструментальных методов исследования во время тестов, провоцирующих ишемию. Главным признаком безболевой ишемии миокарда считают объективно выявляемое преходящее нарушение перфузии, метаболизма и региональной сократительной функции миокарда или электрической активности сердечной мышцы, не сопровождающееся приступом стенокардии или его эквивалентами.
Для выявления безболевой ишемии могут быть использованы: холтеровское мониторирование ЭКГ, пробы с физической нагрузкой (ВЭМ, тредмил), чреспищеводная электрокардиостимуляция, фармакологические пробы (с дипиридамолом, добутамином), стресс-эхоКГ, радионуклидные методы исследования.
У пациентов с доказанной ИБС методом выбора для диагностики безболевой ишемии миокарда может быть 24-часовое мониторирование ЭКГ, поскольку оно необременительно и дает возможность проанализировать полный суточный цикл сердечной деятельности.
По результатам холтеровского мониторирования безболевую ишемию миокарда определяют правилом «трех 1», что включает депрессию сегмента ST горизонтального или нисходящего типа не менее 1 мм, длительностью не менее 1 мин с интервалами между двумя подобными эпизодами не менее 1 мин. Иногда перед возникновением депрессии сегмента ST отмечают повышение ЧСС и АД как свидетельство повышения работы сердца.
При обследовании практически здоровых лиц с целью выявления безболевой ишемии миокарда выбор должен быть сделан в пользу нагрузочных проб (ВЭМ, тредмил-тест), поскольку с помощью этих методов испытуемому можно дать большую нагрузку, чем он обычно выполняет в быту, и тем самым повысить частоту выявления безболевой ишемии миокарда. Изменения сегмента ST ЭКГ, выявленные у практически здоровых лиц без симптомов ИБС (особенно у женщин), нередко могут быть ложноположительными, для верификации диагноза «безболевая ИБС» рекомендуется проводить коронароангиографию.
В настоящее время выделяют вариант безболевой ишемии миокарда без изменений на ЭКГ. Это «скрытая» или «тайная» (clandestine) ишемия, которую выявляют только с помощью сцинтиграфии миокарда, выполненной во время нагрузочного теста, провоцирующего ишемию.
Однако клиническое значение этой «тайной» ишемии миокарда пока не определено.
Лечение
Поскольку патогенетические механизмы возникновения болевой и безболевой ишемии миокарда едины, основные принципы лечения пациентов с безболевой ишемией миокарда не отличаются от таковых при стабильной стенокардии напряжения. Необходимо предусмотреть весь комплекс немедикаментозного и медикаментозного лечения, включающего коррекцию факторов риска развития ИБС, применение антиагрегантов, липидоснижающих и антиангинальных средств. В реальных клинических условиях у пациентов с безболевой ишемией миокарда оценить эффект лечения гораздо сложнее, поскольку отсутствует естественный и простой критерий эффективности терапии — уменьшение количества и выраженности приступов стенокардии. Это существенно повышает роль дополнительных методов диагностики (нагрузочных тестов, холтеровского мониторирования ЭКГ и др.) в осуществлении контроля за лечением.
Прогноз
Безболевая ишемия миокарда — прогностически неблагоприятный фактор, перспектива пациентов с этим феноменом мало отличается от лиц с клиническими проявлениями ИБС. Так, по данным трех 15-летних наблюдений 4229 мужчин в возрасте 35–65 лет установлено, что среди лиц с безболевой ишемией миокарда, выявленной с помощью тестов с физической нагрузкой, вероятность смерти от ИБС, внезапной сердечной смерти, фатального ИМ и развитие нефатального ИМ соответственно в 2; 12; 1,6 и 13,4 раза выше, чем в группе обследованных без изменений ЭКГ при максимальной нагрузке. Согласно данным литературы, по меньшей мере у И больных с безболевой ИБС в дальнейшем развивается типичная стенокардия, ИМ или наступает внезапная кардиальная смерть.
Наличие безболевой ишемии миокарда у пациентов с клинически явной ИБС также отягощает прогноз заболевания по сравнению с пациентами, у которых ее не регистрируют. При этом отмечено, что с увеличением длительности безболевой ишемии миокарда и нарастанием глубины снижения сегмента ST, выявляемых при холтеровском мониторировании ЭКГ, у пациентов с ИБС отчетливо прогрессирует риск развития серьезных осложнений уже в ближайшее время.
Неблагоприятный прогноз отмечен у пациентов с суммарной продолжительностью безболевой ишемии миокарда более 60 мин/сут. В этих случаях в 3–7 раз чаще выявляют признаки поражения трех сосудов или главного ствола ЛКА.
Расхождения по данным литературы в оценке прогноза у пациентов с безболевой ишемией миокарда можно объяснить различиями в критериях и методах ее регистрации, а также контингентом обследуемых. Поскольку безболевую ишемию миокарда выявляют при всех хронических и острых формах ИБС у большинства пациентов, исход заболевания конкретного больного связан не столько с наличием безболевой ишемии миокарда, сколько с тяжестью патологии и общим риском развития сердечно-сосудистых осложнений. Следует также учитывать, что соотношение болевых и безболевых эпизодов ишемии, как впрочем, и их общая продолжительность, являются динамичными характеристиками тяжести течения заболевания и в основном коррелируют с краткосрочным прогнозом.
ИШЕМИЧЕСКАЯ КАРДИОМИОПАТИЯ
Концепция ишемической кардиомиопатии была предложена в 1969 г., когда Raftery и соавторы выявили причинно-следственную связь между ИБС и застойной кардиомиопатией. Иными словами, в описанных случаях отмечали выраженную кардиомегалию с проявлениями застойной СН, как это бывает при типичной ДКМП, и только атеросклеротическое поражение венечных артерий указывало на ее ишемический генез.
Термин «ишемическая кардиомиопатия» был предложен несколько позже, в 1970 г. G. Bursh и соавторами, в то время он был весьма революционным и противоречивым. Авторы настаивали на том, что ишемическая кардиомиопатия «по сути имеет множество сходных черт с другими кардиомиопатиями», и подчеркивали, что «ишемическая кардиомиопатия — истинная кардиомиопатия» с присущими ей признаками.
В настоящее время некоторые кардиологи этот термин используют значительно в более широком смысле, включая в него любые случаи СН и даже просто дисфункции миокарда, развившиеся вследствие ИБС. Так, G. Michael и соавторы (2002) предложили к указанной категории относить:
- больных, перенесших ИМ или реваскуляризацию (АКШ, ЧТКА);
- лиц со стенозами >75% ствола ЛКА или проксимального участка передней межжелудочковой ветви ЛКА;
- пациентов со стенозами >75% двух и более эпикардиальных сосудов.
Некоторые авторы распространяют указанный термин на случаи развития СН вследствие относительной ишемии миокарда, например при таких состояниях, как анемия, ночное апноэ, тиреотоксикоз. Ни с первым, ни со вторым мнением нельзя согласиться. Если подобный подход и можно оправдать с точки зрения синдромального медикаментозного лечения терминальной застойной СН, то он неприемлем с позиций понимания механизмов ее развития и прогрессирования, особенно у пациентов с ИБС без кардиомегалии с наличием, скажем, только региональной дисфункции ЛЖ (гибернация, хроническая аневризма). В этих случаях тактика лечения будет направлена, прежде всего, на скорейшую хирургическую реваскуляризацию, спасение жизнеспособного миокарда, аневризмэктомию.
В наше время в связи с упрощением понятия патогенез ишемической кардиомиопатии описан как осложнение одного или нескольких ИМ, которое сопровождается потерей функции миоцитов, развитием фиброза с последующим нарушением функции миокарда и ремоделированием ЛЖ. Противоположное мнение было высказано исследователями, стоявшими у истоков изучения этой патологии. Так, Atkinson и Virmani (1989) описали застойную СН, обусловленную тяжелой ИБС без предшествующего ИМ. Патогенез этой кардиомиопатии при отсутствии ИМ был неизвестен в то время. Исследователи предположили, что этот тип кардиомиопатии может являться собственно ишемической кардиомиопатией, развившейся вследствие ишемии, или представляет собой идиопатическую ДКМП в сочетании со случайной ИБС. Иными словами, подчеркивали общие схожие признаки ишемической и дилатацинной кардиомиопатий, и две эти патологии различались только в зависимости от морфологического состояния коронарных артерий. Нам в большей мере импонирует эта точка зрения.
В соответствии с мнением членов Ассоциации кардиологов Украины под клиническим термином «ишемическая кардиомиопатия» следует понимать ИБС с установленными с помощью методов коронаро- и вентрикулографии диффузным поражением коронарных артерий, выраженной дилатацией ЛЖ, тотальным снижением сократимости миокарда, сопровождающимися клиническими признаками СН (Национальный конгресс кардиологов Украины, 18–21 сентября, 2000, Киев).
Исторически сложилось так, что в Украине диагноз «кардиомиопатия дилатационная или гипертрофическая» устанавливали путем исключения в процессе дифференциальной диагностики прежде всего таких заболеваний, как ИБС и АГ. Чтобы избежать путаницы в настоящее время, вышесказанное является еще одним аргументом в нецелесообразности использования термина «ишемическая кардиомиопатия» в качестве диагноза. Термин может быть использован в клинической практике, но не рекомендуется в качестве диагноза.
ЛЕЧЕНИЕ СТАБИЛЬНОЙ СТЕНОКАРДИИ
Лечение стабильной стенокардии преследует две основные цели: во-первых, улучшение прогноза и предупреждение осложнений ИБС, таких как ИМ и внезапная смерть; во-вторых, снижение частоты и интенсивности приступов стенокардии и тем самым улучшение качества жизни пациентов. Достижение указанных целей возможно за счет сочетания немедикаментозных, медикаментозных и хирургических (реваскуляризация миокарда) методов лечения.
Выбор метода лечения определяется его влиянием на прогноз пациента. Поэтому из терапевтических мероприятий с одинаковой клинической эффективностью преимущество следует отдавать тем, которые имеют доказанное и/или наиболее выраженное благоприятное влияние на выживаемость и предотвращение сердечно-сосудистых осложнений.
Общие рекомендации
Лечение ИБС, учитывая хроническое течение заболевания, предусматривает тесное сотрудничество врача, пациента и его ближайшего окружения. Выбор метода терапии, медикаментозного или хирургического, зависит от клинического состояния больного и результатов использования лекарственных средств. Решение о терапевтической тактике следует принимать совместно с пациентом, поэтому ему необходимо предоставить детальную информацию о заболевании, степени риска основных осложнений и современных возможностях лечения. Необходимо учитывать соотношение эффективности и стоимости планируемой терапии.
Особое внимание необходимо уделить факторам риска, осложняющим течение заболевания, которые связаны с образом жизни больного, оказывают влияние на общий прогноз и могут быть устранены. К ним относят, прежде всего, нерациональное питание и избыточную массу тела, гиподинамию или неадекватные физические нагрузки, курение.
Рекомендации по рациональному питанию
Соблюдение диеты является эффективным методом вторичной профилактики у больных ИБС. Основу рационального питания этих пациентов составляет средиземноморская диета с достаточным количеством свежих овощей, фруктов, зерновых продуктов с большим содержанием клетчатки, морской рыбы наряду с ограничением в рационе животных жиров. В суточном рационе рекомендуемое количество жира не должно превышать 30%, для насыщенных жиров — не более И общего количества. Количество поступающего с пищей ХС не должно превышать 300 мг/сут. При низкокалорийной диете насыщенные жиры рекомендуется частично заменять сложными углеводами, а также моно- и полиненасыщенными жирами, которые содержатся в растительной пище и морепродуктах.
Омега-3-полиненасыщенные жирные кислоты (ПНЖК). Рыбий жир, содержащий большое количество омега-3 ПНЖК (эйкозапентаеновая, докозагексаеновая кислоты), полезен для коррекции нарушений липидного обмена. Кроме того, этот продукт оказывал положительное влияние на прогноз больных, перенесших ИМ. По данным исследования GISSI-Prevenzione, в котором участвовали более 11 тыс. таких пациентов, продолжительное применение омега-3 ПНЖК в дозе 1 г/сут дополнительно к базовой терапии приводило к снижению общей смертности на 21%. Наиболее существенные различия отмечали для показателя частоты внезапной смерти (45%). Причем положительное влияние препарата на этот показатель выявлено уже на ранних этапах исследования, в течение первых 3 мес. Количество летальных исходов у больных, которые принимали ПНЖК, было меньше, чем в контрольной группе, — 1,1% по сравнению с 1,6% соответственно (р=0,037).
Организаторы GISSI не исключают, что положительное влияние омега-3 ПНЖК связано с антиаритмогенным действием.
В настоящее время считают, что клиническая эффективность омега-3 ПНЖК у больных, перенесших ИМ, в основном связана с профилактикой развития аритмии. Встраиваясь в трансмембранные ионные каналы, омега-3 ПНЖК способствуют электрической стабилизации кардиомиоцитов и препятствуют возникновению аритмии.
Структурные и физико-химические особенности омега-3 ПНЖК позволяют им встраиваться либо в участки двойного слоя фосфолипидов, расположенных рядом с ионными каналами, либо непосредственно в гидрофобные структуры белков ионных каналов. При таком расположении отрицательный заряд карбоксильной группы омега-3 ПНЖК может взаимодействовать с положительным зарядом белков ионных каналов (рис. 3.10).

В экспериментальных исследованиях повышение концентрации омега-3 ПНЖК в мембранах гранулоцитов сопровождалось нормализацией/повышением вариабельности сердечного ритма. Известно, что низкая вариабельность сердечного ритма ассоциирована с риском внезапной смерти. У животных с экспериментальным ИМ омега-3 ПНЖК повышали порог фибрилляции желудочков сердца. Были выявлены свойства ПНЖК, которые могут иметь значение для предупреждения развития атеросклероза, в частности активация синтеза противовоспалительных простагландинов, увеличение продукции простациклина, снижение уровня лейкотриена В4, блокирование миграции нейтрофильных гранулоцитов и моноцитов, антиагрегантное действие. По результатам GISSI ПНЖК оказывали положительное влияние на выживаемость больных независимо от особенностей их питания и наличия других факторов риска, таких как курение, сопутствующая АГ и сахарный диабет. Тем не менее у лиц, которые придерживались рекомендованной диеты, отмечали достоверно (р<0,0001) более высокий показатель выживаемости в течение 3,5 года наблюдения. В настоящее время назначение препаратов омега-3 ПНЖК считают целесообразным дополнением к базовой терапии с целью вторичной профилактики сердечно-сосудистых осложнений, в частности внезапной смерти, у пациентов после перенесенного ИМ.
Витамины
Результаты масштабных клинических исследований не подтвердили положительного влияния витаминов-антиоксидантов (витамины А, Е и С) на уровень сердечно-сосудистого риска у больных ИБС, что ставит под сомнение целесообразность их назначения этим пациентам.
Физическая активность
Адекватная физическая активность оказывает положительное влияние на общее состояние пациентов с ИБС, способствует повышению толерантности к физическим нагрузкам и контролю массы тела, а также нормализации липидного и углеводного обмена, уровня АД. Вместе с тем, следует учитывать индивидуальную переносимость физических нагрузок больными стенокардией. Этот показатель определяется с помощью тестов с дозированными нагрузками и составляет основу индивидуальных программ для проведения тренировок больных ИБС.
Табакокурение
Отказ от курения является обязательной составляющей терапевтических мероприятий при ИБС. Это важная мера способствует улучшению клинического состояния и прогноза пациентов. При необходимости назначают специальную никотинзамещающую терапию.
АГ, сахарный диабет и другие сопутствующие заболевания
Такие сопутствующие заболевания, как АГ, сахарный диабет и метаболический синдром, у пациентов с ИБС требуют адекватной коррекции, поскольку их наличие повышает риск прогрессирования коронарной болезни. Международные рекомендации по предупреждению сердечно-сосудистых заболеваний у пациентов с подтвержденным диагнозом ИБС предполагают более низкий, чем в популяции в целом, уровень АД — 130/85 мм рт. ст. Наличие сопутствующего сахарного диабета и/или заболевания почек также требует соблюдения более жестких целевых показателей АД — <130/80 мм рт. ст. Кроме того, пациенты с сахарным диабетом, который по степени риска сердечно-сосудистых осложнений рассматривают как состояние, эквивалентное ИБС, нуждаются в адекватном контроле уровня гликемии и обязательной коррекции других имеющихся факторов сердечно-сосудистого риска. Терапия при сахарном диабете с учетом указанных факторов достоверно снижает частоту как сердечно-сосудистых, так и сугубо диабетических осложнений.
Психологические факторы
Роль стресса в генезе ИБС остается неопределенной. Известно, что психологические факторы способны провоцировать приступы стенокардии. Диагноз хронического серьезного заболевания, каким является ИБС, может формировать у больного состояние стойкого психологического дискомфорта, а в некоторых случаях — невротические тревожные расстройства. Поэтому обучение пациентов методикам стресс-контроля и релаксации является важным терапевтическим мероприятием. Имеются данные о положительных результатах применения таких методик.
Гормональная заместительная терапия
В настоящее время нет доказательств положительного влияния гормональной заместительной терапии на риск развития сердечно-сосудистых осложнений у женщин с ИБС. Применение гормональных средств для первичной профилактики сопровождалось ростом сердечно-сосудистых заболеваний и рака молочной железы. Поэтому в обычной клинической практике использование гормональной заместительной терапии не показано.
Помощь при остром приступе стенокардии
Пациента следует проинформировать о том, что появление приступа стенокардии требует немедленного прекращения нагрузки, которая его спровоцировала. Чаще всего, когда приступ развивается во время ходьбы, рекомендуется немедленно остановиться и оставаться в состоянии покоя до полного прекращения боли.
Для купирования приступов стенокардии показаны препараты нитроглицерина в форме сублингвальных таблеток, раствора в желатиновых капсулах или аэрозольных упаковках. Можно применять изосорбида динитрат в специальных лекарственных формах быстрого действия — сублингвальные/жевательные таблетки, раствор в аэрозольных упаковках. Целесообразно информировать больного о наиболее частых побочных реакциях на прием нитратов, таких как головная боль и резкое снижение АД. Учитывая возможность выраженных колебаний АД, нитропрепараты рекомендуется применять в положении сидя, особенно в начале лечения. Продолжительность приступа стенокардии более 10–20 мин после отдыха и/или приема нитратов требует немедленной специализированной медицинской помощи.
В некоторых случаях может быть полезным применение быстродействующих нитратов с профилактической целью непосредственно перед нагрузками, которые обычно вызывают приступы стенокардии.
Фармакотерапия стабильной стенокардии
Цель фармакотерапии стабильной стенокардии — улучшение прогноза и качества жизни пациентов за счет устранения симптомов заболевания. Приоритет имеют лекарственные средства с доказанным положительным влиянием на прогноз. Для большинства пациентов со стабильной стенокардией фармакотерапия остается альтернативой хирургическим вмешательствам. Причем, по данным исследования MASS-II, фармакотерапия сопровождается меньшим количеством осложнений, как минимум в течение годичного наблюдения, по сравнению с хирургическими методами лечения. Инвазивные вмешательства остаются методом выбора для больных с очень высоким риском развития сердечно-сосудистых осложнений или в случаях, когда адекватная медикаментозная терапия не позволяет устранить симптомы заболевания.
Фармакотерапия для улучшения прогноза у больных стабильной стенокардией
Антитромботические препараты
Применение антитромбоцитарной терапии предупреждает развитие тромботических осложнений и является обязательным для всех больных стабильной стенокардией при отсутствии противопоказаний.
Ацетилсалициловая кислота (АСК)
АСК остается препаратом выбора для большинства пациентов с ИБС. Положительный терапевтический эффект АСК и относительно низкий риск развития побочных эффектов на сегодня подтверждены целым рядом исследований. В рандомизированных испытаниях установлено безоговорочное преимущество АСК перед плацебо у больных стабильной стенокардией. Например, результаты шведского исследования SAPAT свидетельствуют о снижении под влиянием АСК в суточной дозе 75 мг частоты развития ИМ и внезапной смерти на 34%; р=0,003. Классический метаанализ Antithrombotic Trialists’ Collaboration (АТС) 11 клинических исследований эффективности АСК, в который были включены результаты терапии 2920 больных стабильной стенокардией, подтвердил 33% снижение частоты серьезных сосудистых осложнений (инфаркт, инсульт, кардиальная смерть) по сравнению с плацебо и группой нелеченых больных (9,9% против 14,1% соответственно; р<0,001). Аналогичные результаты антитромботической терапии отмечали у пациентов, перенесших ИМ. По данным того же АТС, с участием почти 19 тыс. больных с ИМ в анамнезе, прием АСК снижал смертность и частоту повторного нефатального ИМ на 31%. Механизм действия АСК заключается в необратимой блокаде тромбоцитарной ЦОГ-1, которая сопровождается уменьшением продукции тромбоксана А2 и снижением агрегационной активности тромбоцитов. АСК инактивирует ЦОГ на весь период жизни тромбоцита — 7–10 дней. Оптимальными антитромботическими дозами АСК считают 75–150 мг/сут. Превышение или снижение указанных доз может влиять на эффективность АСК, как это было показано в исследовании CURE у пациентов с ОКС. Наиболее эффективными для снижения риска сердечно-сосудистых осложнений оказались невысокие дозы препарата — 100 мг и ниже. В исследовании USPHS в небольшой подгруппе больных стенокардией существенное снижение частоты нефатального ИМ отмечали при применении АСК в дозе 325 мг/сут. Вопрос о режиме дозирования АСК у больных стабильной стенокардией остается открытым, поскольку контролируемых сравнительных исследований эффективности различных доз АСК в настоящее время недостаточно.
Среди побочных эффектов, связанных с приемом АСК, наибольшее практическое значение имеют желудочно-кишечные расстройства (ульцерогенное действие и геморрагические осложнения). Следует отметить, что риск развития желудочно-кишечных кровотечений возрастает при применении любых антитромботических средств, причем точных сведений о частоте этого побочного эффекта при назначении, например, клопидогрела на сегодня нет. Возможным механизмом развития кровотечений при применении антитромботических средств считают нарушение нормального процесса восстановления слизистой оболочки ЖКТ, которое в свою очередь обусловлено блокадой высвобождения тромбоцитарных факторов роста. Не исключено, что АСК вызывает дозозависимое повреждение слизистой оболочки желудка, которого можно в значительной степени избежать при применении препарата в низких дозах. Противодействовать желудочно-кишечным эффектам АСК в определенной степени могут средства, блокирующие секрецию соляной кислоты, в частности ингибиторы протонного насоса. Положительные результаты отмечали при сочетанном применении АСК и ланзопразола, эзомепразола. Эрадикация Helicobacter pylory также снижает риск развития желудочно-кишечных кровотечений, в том числе и при использовании АСК.
Безопасность применения антитромботических препаратов затрагивает важный вопрос о риске развития внутричерепной геморрагии. Следует отметить, что абсолютный риск развития подобных осложнений для АСК в дозе >75 мг/сут низкий и составляет менее 1 случая на 1000 пациенто-лет. Нет доказательств и дозозависимого повышения риска возникновения внутричерепных кровоизлияний при применении АСК в обычных терапевтических дозах. Вместе с тем у пациентов с атеросклерозом мозговых сосудов отмечали положительный системный эффект при назначении АСК с целью профилактики ишемического инсульта. К примеру, по результатам уже упоминавшегося метаанализа АТС, применение АСК снижало частоту нефатального инсульта на 42%, что подтверждает целесообразность применения препарата у этих больных.
Резистентность к АСК. Феномен резистентности к АСК определяют при развитии сердечно-сосудистых осложнений, несмотря на прием препарата, а также с помощью лабораторных методов, подтверждающих снижение или отсутствие фармакологического эффекта АСК. Тем не менее, на сегодня нет общепринятых стандартных подходов как для выявления резистентности к АСК, так и для ее преодоления. Подобная проблема существует и для клопидогрела.
Взаимодействие с селективными ингибиторами ЦОГ-2 и прочими НПВП
Обсуждение указанной группы лекарственных средств в контексте лечения стабильной стенокардии обусловлено их вероятным отрицательным влиянием на риск развития сердечно-сосудистых осложнений и возможностью взаимодействия с АСК. Предпосылкой отрицательного действия на сердечно-сосудистую систему является уменьшение под влиянием селективных ингибиторов ЦОГ-2 синтеза простациклина, вещества, обладающего вазодилататорным и антитромботическим эффектами. Снижение активности простациклина создает условия для повышения уровня АД, прогрессирования атеросклероза и тромбообразования.
Существенный рост риска развития серьезных коронарных осложнений, таких как фатальный и нефатальный ИМ, выявлен при проведении ряда клинических исследований с применением рофекоксиба. Повышение частоты сердечно-сосудистых осложнений на фоне применения рофекоксиба носило дозозависимый характер. В частности, этот показатель составлял 2,3 и 3,4% для суточных доз рофекоксиба 400 и 800 мг соответственно.
В плацебо-контролируемом исследовании с применением парекоксиба/вальдекоксиба для лечения пациентов с послеоперационным болевым синдромом после АКШ отмечали увеличение количества сердечно-сосудистых осложнений уже после 10 дней терапии.
По результатам клинических исследований с применением ряда селективных ингибиторов ЦОГ-2 был сделан вывод, что указанные лекарственные средства способны повышать риск развития коронарных осложнений в общей популяции больных. Кроме того, применение ингибиторов ЦОГ-2 было связано с риском развития инсульта, СН и АГ. Поэтому назначение ингибиторов ЦОГ-2 (без одновременного обеспечения эффективной блокады тромбоцитарной ЦОГ-1) больным со стабильной стенокардией противопоказано.
Неселективные ингибиторы ЦОГ (НПВП), например напроксен, способны обратимо блокировать продукцию тромбоксана и агрегацию тромбоцитов. Тем не менее, эффективность НПВП в отношении синтеза тромбоксана значительно уступает АСК. Кроме того, процесс блокирования ЦОГ-1/тромбоксана под влиянием НПВП имеет обратимый характер. Наряду с этим, известны свидетельства того, что неселективные НПВП также могут повышать риск развития сердечно-сосудистых осложнений. Поэтому при необходимости больным ИБС рекомендуется назначение НПВП в минимальных эффективных дозах, по возможности максимально короткими курсами. Препаратом выбора для начала терапии остается парацетамол. Назначение НПВП больным стабильной стенокардией необходимо сочетать с АСК в низких дозах (75 мг) для обеспечения адекватного антитромботического эффекта.
Ибупрофен и, возможно, напроксен способны уменьшать антиагрегантный эффект АСК за счет конкурентной блокады процесса ацетилирования ЦОГ-1. Комбинации указанных НПВП с АСК не рекомендуются.
Диклофенак является относительно селективным блокатором ЦОГ-2. Он практически не влияет на функцию тромбоцитов и не взаимодействует с АСК, поэтому при необходимости такое сочетание препаратов может быть использовано у пациентов с ИБС.
Клопидогрел и тиклопидин относятся к группе тиенопиридинов, по механизму действия являются неконкурентными антагонистами рецепторов АДФ. Их фармакодинамический эффект подобен эффекту АСК. Несмотря на достаточно продолжительное использование тиклопидина в клинической практике, его роль в лечении как хронических форм ИБС, так и ИМ окончательно не определена. По сравнению с клопидогрелом, тиклопидин характеризуется несколько худшей переносимостью и большим количеством побочных эффектов, в частности негативным влиянием на кроветворную функцию костного мозга (нейтропения, тромбоцитопения). Терапевтический эффект препарата развивается медленно.
Основным клиническим исследованием по изучению действия клопидогрела у пациентов с хронической ИБС было исследование CAPRIE. В нем приняли участие больные с перенесенным ИМ, инсультом, атеросклерозом периферических артерий. По результатам исследования в группе пациентов высокого риска клопидогрел в дозе 75 мг/сут оказался несколько эффективнее в отношении предупреждения сердечно-сосудистых осложнений, чем АСК в дозе 325 мг/сут (р=0,043). Тем не менее, анализ результатов CAPRIE в разных подгруппах больных свидетельствует, что возможные преимущества клопидогрела перед АСК по снижению количества сердечно-сосудистых осложнений были выявлены только в подгруппе пациентов с атеросклерозом периферических артерий. Очень незначительными были преимущества клопидогрела относительно частоты развития желудочно-кишечных кровотечений, несмотря на достаточно высокую дозу АСК. Следует также отметить несколько завышенную по данным литературы оценку преимуществ клопидогрела, учитывая, что доза АСК, которую назначали в исследовании (325 мг/сут), была не самой оптимальной. В исследование CAPRIE не включали больных с непереносимостью АСК; нет сравнительных данных по частоте развития желудочно-кишечных кровотечений при применении клопидогрела и плацебо. Если к этому прибавить еще и значительную стоимость клопидогрела, то назначение этого препарата целесообразно лишь при непереносимости АСК и у пациентов с высоким риском возникновения артериального тромбоза. Вопрос относительно риска развития желудочно-кишечных кровотечений на фоне антитромбоцитарной терапии следует рассматривать отдельно для каждого конкретного клинического случая. После коронарного стентирования, при наличии острого коронарного синдрома, при ИМ с элевацией сегмента ST клопидогрел рекомендуется применять в сочетании с АСК, но в течение ограниченного промежутка времени (до 12 мес). Эффективность указанной комбинации при стабильной стенокардии не доказана. Клопидогрел повышает риск развития серьезных кровотечений после АКШ.
Нерешенным остается вопрос относительно потенциального взаимодействия клопидогрела с другими лекарственными средствами, которые влияют или имеют общий путь метаболизма в системе печеночных трансаминаз СУР 3А4. Например, Lau и соавторы показали, что аторвастатин дозозависимо блокирует влияние клопидогрела на АДФ-индуцированную активацию тромбоцитов. Подобное взаимодействие не отмечено для правастатина, метаболизирующегося другим путем. В этой же работе была показана возможность взаимодействия между клопидогрелом и антибиотиками (эритромицин, тролеандомицин), которые ингибируют или индуцируют (рифампицин) систему СУР 3А4. С другой стороны, при применении аторвастатина в невысокой дозе (10 мг/сут) взаимодействия между ним и клопидогрелом не выявлено. Определенные противоречия имеются в оценках вероятности взаимодействия клопидогрела (в нагрузочной дозе 300 мг) и липофильных статинов (аторвастатин, симвастатин, ловастатин) у пациентов после транслюминальных вмешательств. Возможно, что взаимодействия статинов и клопидогрела зависят от дозы последнего. Так, применение аторвастатина или симвастатина и клопидогрела в высокой дозе (600 мг/сут) не влияло на его антиагрегантную активность.
Следует отметить, что специальных проспективных рандомизированных исследований, посвященных вопросу влияния на конечные результаты комбинированной терапии с использованием клопидогрела и липофильных статинов, не проводили. Во всяком случае, по имеющимся данным продолжительное применение таких комбинаций не сказывалось на конечных результатах клинических исследований, включая показатели смертности и морбидности. По результатам регистра GRACE присоединение статинов к терапии клопидогрелом сопровождалось дополнительным положительным влиянием на прогноз. Таким образом, на сегодня данные относительно возможного взаимодействия клопидогрела и статинов довольно противоречивы, объективная значимость такого взаимодействия остается предметом дискуссии.
Дипиридамол и антикоагулянты
В настоящее время дипиридамол не рассматривают в качестве антитромботического средства для лечения при стабильной стенокардии. Считают, что он характеризуется относительно низкой антитромбоцитарной активностью и высоким риском развития синдрома «коронарного обкрадывания» с возможным ухудшением клинической симптоматики стенокардии. Антикоагулянты (варфарин, ингибиторы тромбина) при стабильной стенокардии не показаны, исключая особые обстоятельства, например наличие фибрилляции предсердий.
Гиполипидемические средства
Гиполипидемические средства — важнейшая составляющая лечения больных ИБС. Гиполипидемические препараты назначают в дополнение к диете и мероприятиям по модификации стиля жизни (отказ от курения, адекватная физическая активность и т.д.). Основной фармакологической группой лекарственных средств для коррекции нарушений липидного обмена являются статины. Кроме них в некоторых особых случаях используют эзетимиб, секвестранты желчных кислот (колестирамин, колестипол), никотиновую кислоту, фибраты (гемфиброзил, фенофибрат), а также препараты омега-3 ПНЖК (рыбьего жира).
Ингибиторы ГМГ-КоА-редуктазы (статины)
В Украине зарегистрированы следующие препараты-статины: ловастатин, симвастатин, аторвастатин, розувастатин, флувастатин. Статины снижают риск развития атеросклеротических сердечно-сосудистых осложнений в среднем на 30%. Положительные прогностические возможности статиновой терапии продемонстрированы в целом ряде клинических исследований по первичной (AFCAPS/TexCAPS, ASCOT-LLA) и вторичной (4S, LIPID, CARE, HPS) профилактике атеросклероза и его осложнений (рис. 3.11).

Первым масштабным исследованием, которое радикально изменило отношение клиницистов к терапии дислипидемий, было скандинавское исследование 4S. В нем приняли участие 4444 больных ИБС с гиперхолестеринемией. Пациентов рандомизировали в две группы: плацебо и симвастатина. Начальная доза препарата составляла 20 мг/сут; у части больных под контролем показателей липидного обмена ее повышали до 40 мг/сут. Наблюдение больных осуществляли в среднем до 5,4 года. Основным результатом исследования стало снижение под влиянием терапии симвастатином показателя общей смертности на 30% и сердечно-сосудистой смертности на 42% (рис. 3.12).
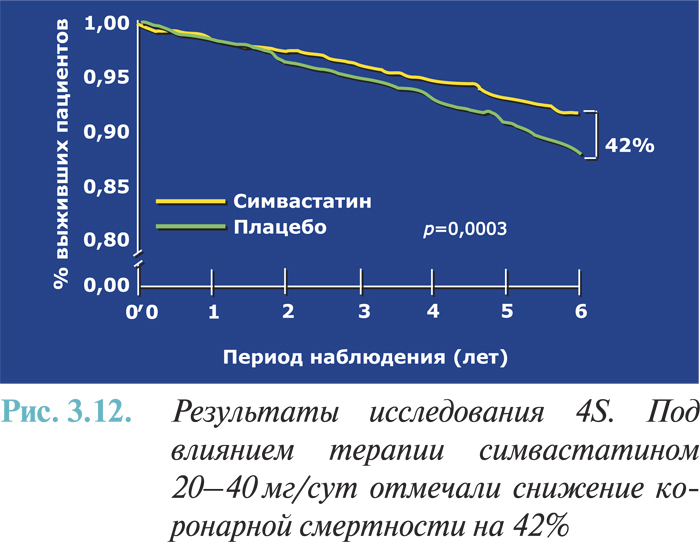
Через 10 лет после завершения скандинавского исследования его авторы представили дополнительные результаты дальнейшего наблюдения больных, принявших в нем участие. Дополнительный период после завершения основного исследования составил в среднем 2 года. Оказалось, что 82,2% больных, которые начали прием симвастатина во время 4S, в дальнейшем его продолжили. Свыше 70% пациентов группы плацебо после завершения основного исследования начали принимать симвастатин. Вместе с тем, показатель смертности у больных, изначально принимавших симвастатин, остался достоверно ниже по сравнению с группой плацебо: 3,6% против 4,9%, соответственно.
Несомненным достижением в изучении терапевтических свойств статинов стало исследование HPS (Heart Protection Study). Его результаты, кроме расширения доказательной базы для применения статинов в целом и симвастатина в частности и масштабности самого исследования (в нем участвовали 20 536 пациентов), дали основания к пересмотру современных стандартов лечения пациентов с высоким риском развития сердечно-сосудистых осложнений. Существенной особенностью HPS было то, что данное исследование выполнялось под руководством Совета медицинских научных исследований Великобритании (MCR) и Британского кардиологического фонда (BHF) и имело независимые источники финансирования. В исследование привлекали больных в возрасте 40–80 лет с высоким риском осложнений ИБС: после перенесенного ИМ, с другими проявлениями ИБС или признаками атеросклеротического поражения некоронарных артерий, с сахарным диабетом II типа и АГ. Основным показанием для назначения симвастатина в HPS был высокий риск развития сердечно-сосудистых осложнений, а не гиперхолестеринемия, как в большинстве предыдущих исследований. Таким образом, среди участников HPS оказалось достаточно пациентов с относительно низким уровнем ХС — до 33%. Симвастатин назначали в дозе 40 мг/сут. Пациенты контрольной группы получали плацебо. Продолжительность терапии составила в среднем 5,5 года. Исследование продемонстрировало достоверную эффективность симвастатина в предупреждении основных осложнений (ИМ, инсульт, потребность в проведении операций по реваскуляризации). Интегральный показатель частоты сердечно-сосудистых осложнений под влиянием терапии снизился на 24%. Причем положительные результаты отмечали в разных подгруппах больных, независимо от пола, возраста, а также, что чрезвычайно важно, — от начальных показателей ХС и ХС ЛПНП (рис. 3.13).
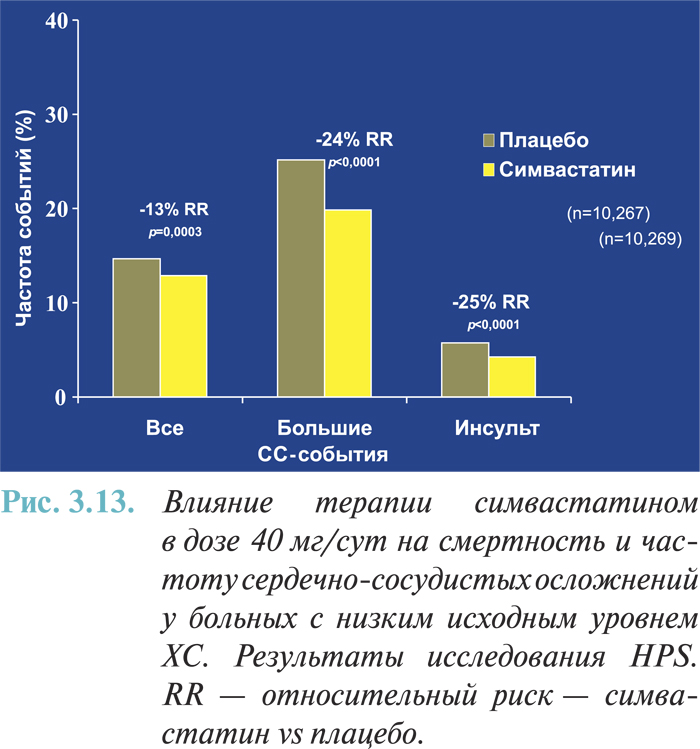
Нашла подтверждение гипотеза относительно положительного прогностического влияния симвастатина у больных с эквивалентами ИБС, включая сахарный диабет и заболевания некоронарных сосудов. Показательны результаты лечения больных сахарным диабетом, у которых в начале исследования не было симптомов ИБС. В этой подгруппе риск развития сердечно-сосудистых осложнений под влиянием терапии уменьшался на 1/3. На фоне приема симвастатина на 27% снижался риск развития ишемического инсульта. Под влиянием лечения выявляли статистически достоверную динамику показателей липидного обмена. Уровень ХС снижался в среднем на 1,2 ммоль/л, ЛПНП — на 1,0 ммоль/л. Вместе с тем, снижение количества сердечно-сосудистых осложнений не зависело как от начальных уровней ХС и ЛПНП, так и от чувствительности этих показателей к терапии статином. Различия в частоте осложнений стали статистически значимыми уже в течение 2-го года исследования и продолжали увеличиваться на продолжении всего периода исследования.
Исследования CARE и LIPID были посвящены изучению эффективности статинов (препарат правастатин) у больных, которые перенесли ИМ или имели в анамнезе нестабильную стенокардию. В первом из них (CARE) приняли участие 4159 больных в возрасте до 75 лет с постинфарктным кардиосклерозом. У всех пациентов отмечали умеренно выраженное повышение уровня общего ХС в крови — до 6,2 ммоль/л. В группе активного лечения больным назначали правастатин 40 мг/сут, в контрольной группе — плацебо, период наблюдения составил 5 лет. Основная конечная точка исследования — смерть от ИБС или нефатальный ИМ — отмечена у 13,2% больных в группе плацебо и у 10,2% — в группе, получавшей правастатин. То есть риск основных сердечно-сосудистых осложнений в группе активного лечения снизился на 24% (р<0,003), в основном за счет количества повторных инфарктов (25%; р<0,006). Пациенты основной группы реже нуждались в оперативном лечении, в частности в АКШ (разница составила 26%; р<0,005) и баллонной ангиопластике коронарных артерий (разница — 23%; р<0,03).
Цель LIPID — изучение прогностического влияния правастатина в суточной дозе 40 мг у больных, перенесших нестабильную стенокардию или ИМ и имеющих умеренное повышение уровня ХС в крови (в среднем — 5,6 ммоль/л). В исследование были включены 9014 пациентов, запланированная продолжительность наблюдения — 5 лет. Тем не менее, исследование было досрочно прекращено по этическим соображениям, поскольку в группе пациентов, которые принимали статин, уже в течение первых 2 лет отмечали снижение риска общей и коронарной смертности на 23 и 24% соответственно. Количество инфарктов, фатальных и нефатальных, достоверно сократилась на 29%.
Важным фактором, определяющим эффект статиновой терапии, является влияние на прогрессирование атеросклероза. По данным исследований разных статинов предупреждение прогрессирования атеросклероза требовало существенного снижения ХС ЛПНП, не менее чем на 45% от начального уровня. Например, «агрессивная» гиполипидемическая терапия с применением аторвастатина в максимальной суточной дозе (80 мг) оказалась более эффективной для предупреждения атеросклеротических изменений коронарных сосудов по сравнению с «мягким» снижением уровня липидов с помощью правастатина в дозе 40 мг/сут. Увеличение объема атеросклеротических бляшек было приостановлено у больных, которые принимали аторвастатин (—0,4%), в отличие от группы правастатина, в которой отмечали их прирост (+2,7%; р=0,02).
Положительное влияние на течение заболевания и преимущества применения аторвастатина в высоких дозах по сравнению с правастатином в стандартных дозах выявлено и у пациентов с острым коронарным синдромом в исследовании PROVE IT.
Прогностическое влияние аторвастатина у больных со стабильной стенокардией и гиперхолестеринемией изучали в исследовании AVERT. В исследование был включен 341 пациент. По данным коронарографии у всех больных были атеросклеротические поражения как минимум одной коронарной артерии (стеноз >50%). При этом клинические проявления заболевания (количество и интенсивность приступов стенокардии) были умеренными или отсутствовали. Половине больных назначали аторвастатин в дозе 80 мг/сут в течение 18 мес. В параллельной группе пациентам проводили ангиопластику с дальнейшим назначением обычного лечения. Результаты AVERT выявили преимущества активной гиполипидемической терапии у этих больных и четкую тенденцию к снижению количества сердечно-сосудистых осложнений в группе, принимавшей аторвастатин. Суммарное количество таких осложнений, как кардиальная смерть, нефатальный ИМ, цереброваскулярные осложнения, потребность в проведении повторной реваскуляризации, было зарегистрировано у 13% пациентов, которые принимали аторвастатин, и у 21% больных, получавших обычную терапию.
Розувастатин в максимальной дозе 40 мг/сут вызывал достоверную регрессию коронарного атеросклероза в исследовании ASTEROID. С помощью внутрисосудистого ультразвукового датчика у 349 пациентов определяли динамику объема атеромы до и после 24-месячного лечения розувастатином. Уменьшение объема атеросклеротической бляшки под влиянием терапии составило 3,15%; р<0,001, а разность объемов в максимально стенозированных сегментах артерий — 9,1%. Интегральный показатель уменьшения объема атеросклеротической бляшки под влиянием розувастатина составил 6,8%. Следует отметить, что розувастатин, один из наиболее мощных гиполипидемических препаратов, особенно по воздействию на уровень ХС ЛПНП. Кроме того, препарат вызывает повышение уровня ХС ЛПВП в среднем на 14,7%. По сравнению с другими статинами розувастатин оказывал на этот показатель наиболее значительное влияние. Однако розувастатин относительно новый препарат, и в настоящее время в рамках программы GALAXY, состоящей из 22 многоцентровых рандомизированных контролируемых исследований, продолжается изучение его эффективности и безопасности, а также влияния на прогноз ИБС.
Снижение риска развития основных сердечно-сосудистых осложнений отмечали в плацебо-контролируемом англо-скандинавском исследовании (ASCOT-LLA), в котором изучали результаты первичной профилактики ИБС у пациентов с АГ и умеренно выраженным повышением уровня ХС в крови (до 6,5 ммоль/л). В исследование включили >10 тыс. больных. Кроме АГ, у них было не менее 3 дополнительных факторов сердечно-сосудистого риска. Такими факторами считали ГЛЖ сердца, изменения ЭКГ, сахарный диабет II типа, инсульт или транзиторную ишемическую атаку (ТИА) в анамнезе, микроальбуминурию, протеинурию, курение. Пациенты получали адекватную антигипертензивную терапию и дополнительно — аторвастатин в дозе 10 мг/сут или плацебо. По результатам исследования относительный риск всех коронарных осложнений на фоне назначения аторвастатина снизился на 36%.
Общий показатель сердечно-сосудистых осложнений и потребность в проведении хирургических вмешательств по реваскуляризации миокарда составил 7,5% в группе атрорвастатина и 9,5% — в группе плацебо. По этическим соображениям комитет по надзору ASCOT-LLA принял решение о досрочном прекращении исследования уже через 1 год после его начала, считая недопустимым отказ от активного лечения больных, учитывая его явные преимущества.
Основной механизм действия статинов связан с обратимой блокадой фермента ГМГ-КоА-редуктазы, который обеспечивает синтез ХС. Снижение внутриклеточной концентрации ХС стимулирует функцию клеточных рецепторов и повышает плазменный клиренс ХС ЛПНП. Терапия статинами сопровождается существенным снижением уровня ХС ЛПНП (в среднем на 25–40%), умеренно выраженным повышением уровня ХС ЛПВП (на 5–15%) и снижением уровня ТГ на 15–50%. Основные фармакологические свойства препаратов группы статинов представлены в табл. 3.9.
Таблица 3.9
Фармакологические свойства препаратов группы статинов
| Показатель | Препарат | |||||
| Аторвастатин | Ловастатин | Правастатин | Розувастатин | Симвастатин | Флувастатин | |
| Тmах, ч | 2–3 | 2–4 | 0,9–1,6 | 3–5 | 1,3–2,4 | 4 |
| Сmах, нг/мл | 27–66 | 10–20 | 45–55 | 37 | 10–34 | 55 |
| Биодоступность, % | 12 | 5 | 18 | 20 | 5 | 6 |
| Связывание с белками плазмы крови, % | 80–90 | >95 | 43–55 | 88–90 | 94–98 | >99 |
| Метаболиты | Активные | Активные | Неактивные | Активные (минимально) | Активные | Неактивные |
| Метаболизм при участии Р450 (СYР) | Да | Да | Нет | Да | Да | Да |
| Липофильность | + | + | — | — | + | + |
| Т½, ч | 15–30 | 2,9 | 1,3–2,8 | 20,8 | 2–3 | 4,7 |
| Экскреция с мочой, % | 2 | 10 | 20 | 10 | 13 | 6 |
| Экскреция с калом, % | 70 | 83 | 71 | 90 | 58 | 90 |
Тmах — время достижению максимальной концентрации в плазме крови; Сmах — максимальная концентрация в плазме крови; Т½ — период полувыведения.
Существуют расчеты, по которым риск развития осложнений (смерть и количество случаев нефатального ИМ) уменьшается на 7% при снижении уровня общего ХС на каждые 0,6 ммоль/л в течение первых 2 лет терапии статинами и еще на 22% — в течение следующих 3–5 лет. Вместе с тем, результаты масштабных клинических исследований (4S, WOSCOPS, CARE, HPS) свидетельствуют о расхождениях между гиполипидемической составляющей действия статинов и характером их влияния на прогноз. Например, в исследовании 4S снижение частоты сердечно-сосудистых осложнений отмечали раньше, чем этого можно было ожидать с учетом только гиполипидемического действия симвастатина.
В исследовании MAAS (381 пациент, получавший симвастатин в дозе 20 мг/сут) отмечали не только достоверное снижение уровней ХС и ХС ЛПНП в крови, но и существенное влияние препарата на процесс прогрессирования атеросклероза по данным ангиографии. Так, у пациентов группы плацебо до конца 4-летнего периода наблюдения выявляли прогрессирование окклюзии коронарных артерий, а терапия симвастатином сопровождалась стабилизацией атеросклеротического процесса.
В исследовании HPS снижение риска развития сердечно-сосудистых осложнений под влиянием продолжительного лечения симвастатином отмечали у всех пациентов независимо от начального уровня ХС в крови, включая больных с практически нормальными показателями липидограммы.
По данным большинства клинических исследований применение статинов позволяет предупредить развитие ишемических инсультов; это действие, по-видимому, не связано непосредственно с влиянием на уровень ХС в сыворотке крови. Определенным доказательством существования нелипидных механизмов действия статинов является их эффективность у больных с острым коронарным синдромом, когда положительное действие статинов, в частности аторвастатина, выявляли уже в течение первых недель после начала лечения. То есть в течение времени, которого явно недостаточно для оптимальной реализации гиполипидемического эффекта (PROVE IT). Даже короткий курс применения аторвастатина (7 дней по 40 мг/сут) перед проведением транслюминальной ангиопластики обеспечивал больным стабильной стенокардией в ходе хирургического вмешательства меньшие повреждения миокарда. Степень повреждения оценивали по биохимическим показателям. Считают, что в основе такого кардиопротекторного действия статинов лежат нелипидные механизмы. Эти дополнительные нелипидные механизмы действия статинов получили название плеотропных. Они связаны с нормализацией функции эндотелия, торможением пролиферации гладкомышечных клеток сосудов, влиянием на апоптоз, противовоспалительной, антитромботической и антиоксидантной активностью препаратов, стабилизацией атероматозных бляшек. Существование плеотропных эффектов объясняют сложным механизмом блокады ГМГ-КоА-редуктазы. Биохимическим субстратом для них являются отличные от ХС продукты метаболизма мевалоната. Эти вещества получили название изопреноидов. Считают, что они участвуют в регуляторных процессах пролиферации, дифференциации, миграции, функционирования (экспрессия эндотелиальной NO-синтазы) и апоптоза клеток крови и сосудистой стенки. Существуют данные относительно противодействия статинов эффектам ангиотензина II. Под влиянием статинов наблюдали снижение концентрации фибриногена и ингибитора активатора плазминогена I, а также вязкости крови. Частично антиагрегантные свойства статинов связаны с уменьшением содержания ХС в фосфолипидах мембран тромбоцитов. В экспериментах отмечали медиаторную активность статинов в процессах ангиогенеза, в первую очередь коронарного. Среди дополнительных эффектов статинов следует указать повышение чувствительности тканей к инсулину, что имеет важное значение для пациентов с сопутствующим сахарным диабетом.
Клинические исследования последних лет подтвердили, что наряду с динамикой липидных показателей терапия статинами сопровождается снижением концентрации СРБ и противовоспалительных цитокинов, что достоверно коррелирует с прогнозом заболевния. Эти факты дают основания считать, что снижение уровня общего ХС, ХС ЛПНП и СРБ являются взаимодополняющими маркерами эффективности лечения, и подтверждают гипотезу о клиническом значении нелипидных механизмов действия статинов. Таким образом, определение только показателей липидограммы не полностью отражает спектр действия статинов. Поэтому их назначение должно базироваться на общей оценке сердечно-сосудистого риска, даже при условии нормального уровня ХС. С учетом этого необходимость в назначении статинов определяется в большей степени величиной сердечно-сосудистого риска, чем уровнем ХС в крови (если речь идет о нормальных или умеренно повышенных показателях).
Лечение статинами должно быть длительным, поскольку улучшение прогноза возможно только при условии продолжительной терапии. Отказ от приема гиполипидемических средств сопровождается возвращением показателей липидограммы к исходу уже в течение 1 мес. Современная концепция гиполипидемической терапии предполагает своеобразный «каскад» эффектов статинов при условии их длительного применения. В течение первых недель/месяцев терапии наблюдается стабилизация атероматозных бляшек за счет восстановления функции эндотелия, уменьшения системного воспаления. Результаты указанного этапа сопровождаются стабилизацией клинического состояния пациентов, уменьшением проявлений ишемии. Важной характеристикой начала действия статинов является положительное прогностическое влияние, которое реализуется после 1-го года лечения, в частности относительно показателя выживаемости.
Следующий этап статинового каскада касается влияния на прогрессирование атеросклероза после 2–4-годичной постоянной терапии. Примером антиатеросклеротического действия статинов могут служить результаты исследований, в которых активное лечение сопровождалось не только отсутствием прогрессирования окклюзии пораженных сегментов коронарных артерий (MARS, 1993; CCAIT, 1994; MAAS, 1994; A-PLUS, 2004), но и регрессом существующих атеросклеротических бляшек (REVERSAL, 2004; ASTEROID, 2006).
Третий этап действия статинов требует продолжительного лечения (>4 лет). Это этап достижения основной стратегической цели терапии: снижение частоты кардиальной и общей смертности, предупреждение развития сердечно-сосудистых осложнений.
Наконец, имеются сведения о положительном влиянии статинов на некардиальную патологию. Так, в ходе лечения пациентов с сахарным диабетом II типа отмечено благоприятное действие симвастатина не только на развитие сердечно-сосудистых осложнений, но и на течение основного заболевания. У больных, принимавших статины, отмечено снижение частоты развития сахарного диабета. Перспективной выглядит информация о применении статинов для лечения и профилактики болезни Альцгеймера и сосудистой деменции. У пациентов пожилого возраста использование статинов приводило к уменьшению выраженности остеопороза и частоты переломов костей. Есть данные об использовании иммуномодулирующего действия статинов в трасплантологии. Описаны положительные результаты применения симвастатина при билиарном циррозе печени, а также для растворения конкрементов ХС в желчном пузыре.
В настоящее время определены «целевые» уровни показателей общего ХС и ХС ЛПНП, достижение которых в процессе лечения достоверно сопровождается снижением частоты сердечно-сосудистых осложнений и улучшением прогноза. Для больных ИБС эти уровни составляют <4,5 ммоль/л (175 мг/дл) для общего ХС и <2,5 ммоль/л (96 мг/дл) для ХС ЛПНП. Согласно Европейским рекомендациям по профилактике сердечно-сосудистых заболеваний аналогичные уровни общего ХС и ХС ЛПНП целесообразно поддерживать у пациентов, которые имеют эквиваленты ИБС и высокий многофакторный риск развития сердечно-сосудистых осложнений — >5% в течение 10 лет.
По данным метаанализа Cholesterol Treatment Trialists’ Collaborators (CTT) снижение ХС ЛПНП на 1 ммоль/л под влиянием статиновой терапии позволяет снизить смертность от ИБС на 19%, частоту нефатального ИМ на 26%, потребность в хирургических вмешательствах >20% (рис. 3.14).
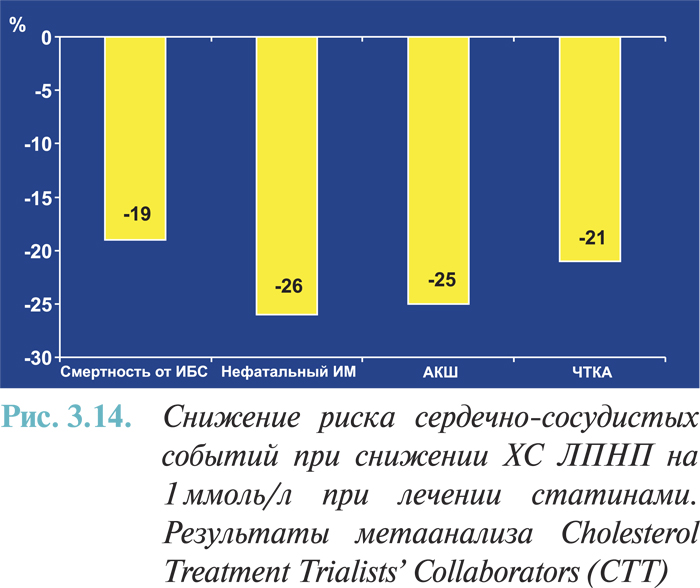
Дозы статинов, рекомендуемые для лечения больных стабильной стенокардией, установлены на основании результатов клинических исследований, в которых доказана эффективность препаратов по снижению смертности и нефатальных осложнений. Для больных стенокардией такие суточные дозы составляют: симвастатин — 20–40 мг; правастатин — 40 мг; аторвастатин — 10–20–80 мг.
В ряде клинических исследований выявлены преимущества аторвастатина в высоких дозах (80 мг/сут) по сравнению с низкими (10 мг/сут) в отношении риска сердечно-сосудистых осложнений. Так, в исследовании TNT частота основных осложнений (коронарная смерть, фатальный и нефатальный ИМ, фатальный и нефатальный инсульт) составляла 8,7% у больных, принимавших аторвастатин в дозе 80 мг, и 10,9% — у пациентов, принимавших препарат в дозе 10 мг. Таким образом, назначение аторвастатина в высоких дозах по сравнению с низкими приводило к снижению относительного риска основных сердечно-сосудистых осложнений на 22% (р<0,001). Повышение дозы аторвастатина до максимальной (80 мг/сут) не сопровождалось учащением таких побочных реакций, как миопатия, миалгия. Вместе с тем, применение аторвастатина в высоких дозах повышало частоту печеночных реакций с повышением активности сывороточных трансаминаз (с 0,2 до 1,2%; р<0,001). Поэтому применение аторвастатина в высоких дозах считается целесообразным у пациентов высокого риска, а также при условии значительного повышения уровня ХС, главным образом при тяжелых наследственных формах дислипидемии.
Терапия статинами характеризуется достаточно высокой безопасностью и хорошей переносимостью. Наиболее частыми побочными эффектами при приеме статинов были диспептические расстройства (метеоризм, дискомфорт и боль в области желудка, тошнота, запор, диарея). Как правило, указанные явления усиливались при повышении дозы лекарственного препарата. Редкой (0,01–0,03%), но наиболее серьезной побочной реакцией, связанной с действием статинов, является миопатия. Ее клинические проявления — миалгия, мышечная слабость, судороги, повышение уровня креатинкиназы крови, редко — лихорадка, очень редко — рабдомиолиз, миоглобинемия и почечная недостаточность. Тяжелые травмы и оперативные вмешательства, выраженная артериальная гипотензия, тяжелые инфекционные заболевания и метаболические расстройства, неконтролируемые судороги и существующая почечная недостаточность относятся к факторам, повышающим риск развития миопатии при применении статинов. Риск развития миопатии возрастает также при одновременном использовании статинов с некоторыми другими лекарственными средствами. Среди них наибольшее значение имеют фибраты, в частности гемфиброзил, препараты никотиновой кислоты, антибиотики группы макролидов (эритромицин), антивирусные средства — ингибиторы протеаз (нефазодон), иммунодепрессанты, циклоспорин.
Статины метаболизируются с участием системы печеночных цитохромов Р450. Ряд лекарственных средств (амиодарон, верапамил, лидокаин, тарфенадин, лоратадин, диазепам, барбитураты, циметидин, рифампицин и др.) и некоторые пищевые продукты (грейпфрутовый сок) влияют на активность печеночных цитохромов, в частности изоферментов CYP 3А4 и CYP 2С9. Они могут в значительной степени изменять фармакологические свойства статинов, их биодоступность и продолжительность действия, что следует принимать во внимание при назначении комбинированной, часто многокомпонентной терапии.
Гепатотоксическое действие с повышением активности печеночных трансаминаз регистрировали в различных клинических исследованиях с применением статинов с частотой 1–2%. Эти нарушения чаще были бессимптомными и развивались в течение первых месяцев лечения, при повышении дозы препарата, в случае имеющейся хронической патологии печени. Для предупреждения возможного гепатотоксического действия статины противопоказаны пациентам с активными заболеваниями печени, лицам, злоупотребляющим алкоголем, а также при стойком бессимптомном повышении активности печеночных трансаминаз. До начала и в период лечения рекомендуется контролировать лабораторные показатели — уровень печеночных ферментов и креатинкиназы. Повышение активности печеночных ферментов более чем в 3 раза, а креатинкиназы более чем в 10 раз по сравнению с верхней границей нормы требует отмены статинов, проведения соответствующих лечебных мероприятий и контроля лабораторных показателей до их полной нормализации.
Среди других побочных эффектов при применении статинов отмечены нарушение сна, головокружение, головная боль, аллергические реакции.
В заключение следует отметить, что на сегодня существуют доказательства положительного влияния терапии статинами и омега-ПНЖК на прогноз при ИБС. Другие гиполипидемические средства по результатам клинических исследований не оказывают достаточного, достоверного влияния на прогностические показатели.
Производные фиброевой кислоты или фибраты характеризуются положительным воздействием на липидный обмен, особенно при гипертриглицеридемии, снижении показателей ХС ЛПВП, у больных с метаболическим синдромом и сахарным диабетом II типа. Они имеют сложный механизм действия с влиянием на синтез и катаболизм липидов, обогащенных ТГ. Он заключается в стимуляции ядерных рецепторов, активируемых пролифератором пероксисом (РАПП). Фибраты — прямые лиганды подтипа а РАПП. Активированные РАПП регулируют генную экспрессию синтеза апоА1 и апоАП основных белков ЛПВП. За счет активации синтеза энзима липопротеинлипазы РАПП повышают катаболизм липидных частиц, обогащенных ТГ. Влияние фибратов на обмен ХС ЛПНП многогранно и зависит от функциональной активности ЛПНП-рецепторов и концентрации ТГ. В частности, при дислипидемии IIB типа по классификации Фредриксона у пациентов с гипертриглицеридемией нередко отмечают умеренно повышенный или даже нормальный уровень ЛПНП, тем не менее возрастает субпопуляция частиц малого размера, повышенной плотности, обогащенных апо В и имеющих повышенную атерогенность. В экспериментальных и клинических исследованиях фибраты способствовали снижению концентрации таких атерогенных частиц, а также повышали аффинность клеточных рецепторов к ЛПНП. Фибраты нормализуют метаболизм жирных кислот путем экспрессии комплекса генов, обеспечивающих их естественное митохондриальное окисление. В результате в крови снижается концентрация свободных жирных кислот, которые являются субстратом для синтеза ТГ.
Вместе с тем, для фибратов выявлены противоречивые данные относительно влияния на кардиальную смертность и возможное повышение некардиальной смертности, которые требуют дальнейшего изучения и уточнения. В связи с этим использование фибратов, как и других гиполипидемических препаратов и их комбинаций со статинами, рекомендовано для лечения выраженных нарушений липидного обмена, а также для достижения целевого уровня ХС у больных очень высокого риска, определенного как смертность >2% в год. Для фибратов и препаратов никотиновой кислоты в качестве показаний рассматриваются особые варианты дислипидемий со снижением ХС ЛПВП и повышением ТГ. Фибраты имеют определенные преимущества перед никотиновой кислотой при лечении дислипидемий такого типа у пациентов с сахарным диабетом, что обусловлено отсутствием у них влияния на уровень глюкозы крови.
Фибраты значительно снижают уровень ТГ (на 40–50%) и способны повысить ХС ЛПВП на 10–20%, по некоторым данным — на 30%.
В классическом исследовании VA-HIT с использованием гемфиброзила продемонстрировано достоверное уменьшение количества кардиальных осложнений у мужчин с практически нормальным уровнем ХС ЛПНП и низким — ХС ЛПВП. Считается, что положительные результаты терапии гемфиброзилом связаны с повышением уровня ХС ЛПВП.
Для монотерапии фибратами развитие миопатии не характерно, но как уже упоминалось, комбинированное применение фибратов и статинов может повышать риск развития этого серьезного осложнения, вероятно, в результате взаимодействия препаратов на общем этапе метаболизма (глюкуронизация). Для фенофибрата, одного из наиболее используемых препаратов-фибратов, подобное взаимодействие не характерно. Поэтому при сочетанном применении статинов в средних терапевтических дозах с фенофибратом возникновение миопатии представляется маловероятным.
Противопоказаниями к назначению фибратов являются нарушения функции печени и почек, а также желчнокаменная болезнь.
Наиболее частым побочным эффектом фибратов является диспепсия, частота которой в разных исследованиях достигала 5%. К более тяжелым нежелательным реакциям при приеме фибратов относятся холестаз, повышение активности печеночных трансаминаз в сыворотке крови, нарушение функции печени, описаны случаи панкреатита.
В случаях когда адекватный контроль показателей липидного спектра крови невозможен из-за непереносимости статинов в высоких дозах, представляется перспективным применение статинов с эзетимибом, новым препаратом, блокирующим всасывание ХС в кишечнике. К настоящему времени получены обнадеживающие результаты использования этой комбинации. При назначении статина и эзитимиба в средних дозах дополнительное снижение уровня ХС и ХС ЛПНП составляет 10–15%. Влияние подобных комбинаций лекарственных препаратов на смертность и течение заболевания в настоящее время изучаются.
Ингибиторы АПФ
До недавнего времени основными показаниями к назначению ингибиторов АПФ были СН, АГ и сахарный диабет, в первую очередь при наличии сопутствующей АГ или микроальбуминурии. Назначение ингибиторов АПФ больным стабильной стенокардией с целью вторичной профилактики изучали в трех больших исследованиях.
В исследовании HOPE приняли участие пациенты с ИБС или сахарным диабетом и высоким риском развития сердечно-сосудистых осложнений, но без СН. Исследуемый препарат — рамиприл в дозе 10 мг/сут, продолжительность исследования — 5 лет.
В исследование EUROPA включали разных по степени риска больных стабильной стенокардией без клинических признаков СН. Исследуемый препарат — периндоприл в дозе 8 мг/сут, продолжительность исследования — 4,2 года.
В исследование PEACE включали пациентов со стабильной стенокардией без СН. Исследуемый препарат — трандолаприл в дозе 2–4 мг/сут, продолжительность наблюдения — 4,8 года.
Исследования НОРЕ и EUROPA продемонстрировали снижение сердечно-сосудистого риска (кардиальная смерть, нефатальный ИМ) под влиянием терапии ингибиторами АПФ на 26 и 20% соответственно (рис. 3.15).
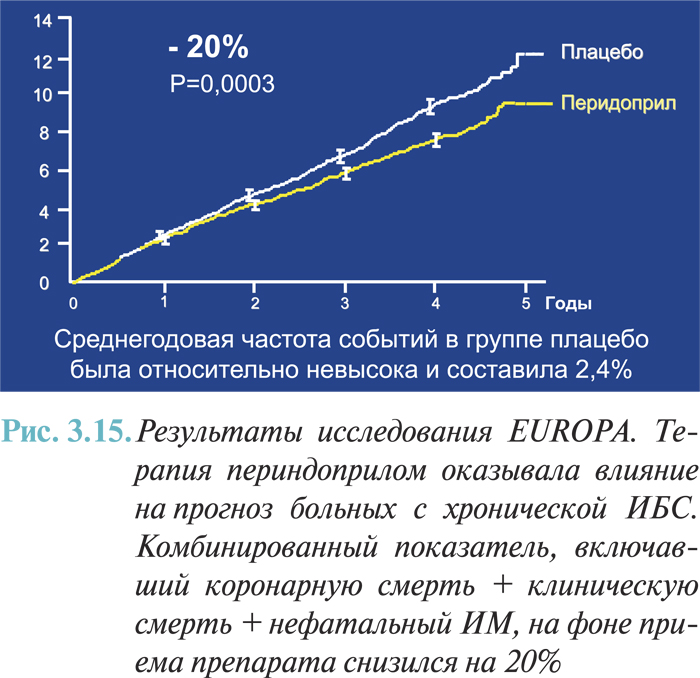
По результатам РЕАСЕ снижение риска было недостоверным и незначительным (на 5%). Существенные различия, выявленные в указанных исследованиях, вероятно, отражают не столько прогностические влияния разных ингибиторов АПФ, сколько различия между их участниками. Так, в исследовании PEACE показатель годовой смертности был низким и составлял 0,8%, а исследовании НОРЕ — 1,6%. Предшествующие реваскуляризационные вмешательства проведены у 72% пациентов в РЕАСЕ и у 44% — в исследовании НОРЕ. Средний уровень АД был также ниже у пациентов в исследовании РЕАСЕ, чем в двух других. Во всех трех исследованиях значительно отличалась базовая терапия. Например, гиполипидемические средства получали 70% пациентов в РЕАСЕ и только 29% — в НОРЕ. Антитромботические препараты — 96 и 76% соответственно. Таким образом, вероятно, что более низкий изначальный риск сердечно-сосудистых осложнений и высокое качество базовой терапии участников РЕАСЕ обусловили результаты исследования. Тем не менее, не исключено, что влияние на показатели сердечно-сосудистого риска зависит и от фармакологических особенностей каждого препарата.
Важным итогом всех трех указанных исследований стало значительное снижение частоты развития застойной СН на фоне терапии ингибиторами АПФ. Кроме того, применение рамиприла сопровождалось существенным (до 32%) уменьшением количества случаев развития инсульта. Подобную тенденцию отмечали в исследовании РЕАСЕ, разница между группой трандолаприла и плацебо составила 24%. Важным компонентом терапевтического действия ингибиторов АПФ у пациентов со стабильной стенокардией исследователи считают влияние на уровень АД.
Назначение ингибиторов АПФ показано всем больным стабильной стенокардией с АГ, сахарным диабетом, СН, бессимптомной дисфункцией ЛЖ.
При отсутствии указанной сопутствующей патологии назначения ингибиторов АПФ пациентам со стабильной стенокардией рекомендовано с учетом оценки соотношения потенциальной пользы, с одной стороны, и риска побочных реакций, стоимости лечения — с другой. Препаратами выбора для лечения больных стабильной стенокардией являются ингибиторы АПФ с доказанной эффективностью в отношении данного показания и в соответствующих дозах (рамиприл 10 мг/сут; периндоприл 10 мг/сут).
Блокаторы β-адренорецепторов
У пациентов, перенесших ИМ, применение блокаторов β-адренорецепторов снижает риск кардиальной смерти и повторного инфаркта на 30%. Причем использование блокаторов β-адренорецепторов в острый период ИМ оказывает незначительное влияние на смертность, тогда как продолжительное применение этих препаратов снижает смертность больных в среднем на 24%. Влияние на прогноз ИБС зависит и от фармакологических свойств блокаторов β-адренорецепторов. Так, лекарственные средства с внутренней симпатомиметической активностью (ацебутолол) оказались в этом плане малоэффективными. Отсутствуют достаточные доказательства воздействия на смертность и для препарата атенолол, одного из наиболее часто назначаемых в настоящее время блокаторов β-адренорецепторов.
Прогностическое влияние блокаторов β-адренорецепторов у больных стабильной стенокардией не изучали в специальных плацебо-контролируемых исследованиях. Но учитывая результаты, полученные у пациентов, перенесших ИМ, блокаторы β-адренорецепторов были внесены в схему лечения стабильной стенокардии. Это произошло потому, что исследования блокаторов β-адренорецепторов у больных с постинфарктным кардиосклерозом предшествовали их применению при стабильной стенокардии. В дальнейшем в наиболее масштабных исследованиях блокаторов β-адренорецепторов с участием больных стабильной стенокардией — APSIS и ТIВЕТ — сравнения активного лечения с плацебо уже не проводили, исходя из интересов пациентов и неэтичности отказа от симптоматической терапии в течение продолжительного времени. В исследование APSIS было включено 809 участников с клинически подтвержденной стабильной стенокардией, период наблюдения составил 3,4 года. По результатам исследования верапамил в лекарственной форме с модифицированным высвобождением активного вещества (SR) 240–480 мг/сут и метопролол SR 100–200 мг/сут оказывали одинаковую эффективность по предупреждению сердечно-сосудистых осложнений. Причем дальнейшее, до 9 лет, наблюдение больных APSIS подтвердило положительное влияние лечения на прогноз, особенно у женщин без сопутствующего сахарного диабета. В исследовании ТIВЕТ приняли участие 682 пациента со стенокардией напряжения, период наблюдения составил 2 года. Результаты лечения нифедипином в лекарственной форме с замедленным высвобождением (SR), 20–40 мг 2 раза в сутки, и атенололом, 50 мг 2 раза в сутки, не отличались. Преимущества имела комбинированная терапия с применением обоих препаратов, в частности отмечали снижение частоты внезапной смерти, нефатального инфаркта и нестабильной стенокардии. Подобные результаты были получены в исследовании IMAGE, в котором сравнивали эффективность метопролола 200 мг/сут и нифедипина 40 мг/сут у 280 больных стабильной стенокардией. У всех пациентов были положительные пробы с дозированной физической нагрузкой. Оба препарата повышали толерантность к физической нагрузке и продолжительность ее выполнения, хотя метопролол — в большей степени. Комбинированная терапия оказалась более эффективной, чем лечение каждым препаратом в отдельности. В небольшом исследовании ASIST принимали участие больные ИБС с редкими приступами стенокардии. Атенолол 100 мг/сут в отличие от плацебо оказывал у этих больных положительное терапевтическое действие. По данным суточного мониторирования ЭКГ препарат уменьшал количество как болевых, так и безболевых эпизодов ишемии миокарда. В исследовании TIBBS сравнивали эффективность бизопролола и нифедипина (лекарственная форма с замедленным высвобождением активного вещества) у 330 больных стабильной стенокардией. У всех участников исследования были ЭКГ-положительные результаты проб с дозированной физической нагрузкой и >2 эпизодов ишемии миокарда в течение 48-часового холтеровского мониторирования. Бизопролол назначали по 10 мг/сут в течение первых 4 нед и по 20 мг — в 4 последующих. Нифедипин назначали по 20 и 40 мг 2 раза в сутки. Продолжительность общего наблюдения составила 1 год. Бизопролол оказался более эффективным в отношении предупреждения сердечно-сосудистых осложнений, таких как кардиальная смерть, острый ИМ и госпитализация по поводу нестабильной стенокардии. Частота осложнений составила 22,1% в группе бизопролола и 33,1% — в группе нифедипина (р=0,033). Все эти данные подтверждают антиангинальную эффективность блокаторов β-адренорецепторов, хотя и не предоставляют достаточных доказательств улучшения прогноза у больных стабильной стенокардией.
Три препарата группы блокаторов β-адренорецепторов — метопролола сукцинат, бизопролол и карведилол — продемонстрировали положительное влияние на показатели выживания и течения заболевания у пациентов с ХСН. Применение небиволола способствовало улучшению прогноза при ХСН у больных пожилого возраста (старше 70 лет).
Блокаторы кальциевых каналов
Препараты фармакологической группы блокаторов кальциевых каналов, снижающие ЧСС, способны улучшать прогноз пациентов после перенесенного ИМ, как установлено в исследовании DAVIT II с верапамилом и в подгруппе больных без признаков СН в исследовании MDPIT с дилтиаземом. В исследовании INTERCEPT наблюдали тенденцию к снижению сердечной смертности, нефатального повторного инфаркта и рефракторной ишемии миокарда, а также существенное снижение потребности в проведении реваскуляризационных вмешательств у больных после ИМ при применении дилтиазема по сравнению с плацебо. Блокаторы кальциевых каналов являются эффективными антигипертензивными средствами, тем не менее они могут повышать риск развития СН. У больных стабильной стенокардией не подтверждена прогностическая эффективность дигидропиридиновых блокаторов кальциевых каналов. Исследования короткодействующих дигидропиридиновых блокаторов кальциевых каналов не только не предупреждали осложнения ИБС, но, наоборот, при применении в высоких дозах (нифедипин >40 мг/сут) способствовали их появлению. Это вызвало в середине 90-х годов ХХ ст. активную дискуссию, закончившуюся признанием, что систематическое применение вазодилататоров с короткой продолжительностью действия, включая дигидропиридиновые блокаторы кальциевых каналов, может оказывать негативное влияние на прогноз пациентов с ИБС и противопоказано при этой патологии. Вместе с тем, для симптоматического лечения стабильной стенокардии при необходимости можно назначать дигидропиридиновые блокаторы кальциевых каналов в виде препаратов и лекарственных форм продолжительного действия, включая лекарственные формы нифедипина. Причем их назначение по данным некоторых исследований приводило не только к улучшению клинических показателей, но и сопровождалось положительными тенденциями относительно снижения риска развития серьезных сердечно-сосудистых осложнений, как, например, применение амлодипина в 2-летнем исследовании CAMELOT, включавшем 1991 больного стабильной стенокардией. Но результаты, полученные в CAMELOT, не были статистически достоверными. Таким образом, убедительных доказательств в пользу применения блокаторов кальциевых каналов для улучшения прогноза больных стабильной стенокардией на сегодня нет. Блокаторы кальциевых каналов, снижающие ЧСС, можно рассматривать в качестве альтернативы блокаторам β-адренорецепторов при непереносимости или наличии противопоказаний к применению последних у больных с постинфарктным кардиосклерозом, но без СН. У некоторых пациентов блокаторы кальциевых каналов могут ухудшать течение заболевания.
Рекомендации по фармакотерапии с целью улучшения прогноза больных стабильной стенокардией
В настоящее время для улучшения прогноза больных стабильной стенокардией (снижение смертности и частоты нефатальных сердечно-сосудистых осложнений) рекомендуется назначение следующих лекарственных средств (класс I, уровень доказательности А):
- АСК 75–100 мг 1 раз в сутки — всем пациентам без противопоказаний к ее назначению.
- Статины — всем пациентам с установленной ИБС, при отсутствии противопоказаний.
- Ингибиторы АПФ — пациентам со следующими сопутствующими заболеваниями (при отсутствии противопоказаний): АГ, застойная СН, бессимптомная дисфункция ЛЖ, предшествующий ИМ с дисфункцией ЛЖ, сахарный диабет.
- Блокаторы β-адренорецепторов — всем пациентам, особенно с постинфарктным кардиосклерозом или СН, при отсутствии противопоказаний.
Общая концепция ведения больных со стабильной стенокардией представлена в виде мнемонической схемы на рис. 3.16.

У больных стабильной стенокардией без сопутствующей патологии ингибиторы АПФ имеют более низкий уровень доказательности относительно влияния на прогноз (класс IIа, уровень В). Применение клопидогрела можно рассматривать как альтернативную антитромботическую терапию у пациентов с непереносимостью АСК. Статины в высоких дозах могут быть рекомендованы пациентам с подтвержденным диагнозом ИБС и очень высоким риском сердечно-сосудистых осложнений (риск сердечно-сосудистой смертности >2% в год).
По особым показаниям (класс 11в — уровни доказательности В и С) можно назначать фибраты — больным с низким уровнем ХС ЛПВП и гипертриглицеридемией при наличии сахарного диабета или метаболического синдрома, а также фибраты или никотиновую кислоту в комбинации со статинами больным очень высокого риска с низким уровнем ХС ЛПВП и гипертриглицеридемией.
Антиангинальная терапия
Симптомы стенокардии и признаки ишемии миокарда, в том числе ее безболевой формы, могут быть устранены с помощью лекарственных средств, уменьшающих потребность миокарда в кислороде и/или увеличивающих кровоток в ишемизированной области. К антиангинальным препаратам относятся блокаторы β-адренорецепторов, блокаторы кальциевых каналов и органические нитраты.
Органические нитраты
Нитраты используют в клинической практике более 100 лет. Назначение нитроглицерина для купирования приступов стенокардии практикуется с 1879 г. Основными представителями группы органических нитратов являются глицерола тринитрат (нитроглицерин), изосорбида динитрат и изосорбида мононитрат. Последний является естественным активным метаболитом изосорбида динитрата. У всех препаратов группы органических нитратов одинаковый механизм действия, они относятся к эндотелийнезависимым вазодилататорам. Антиангинальный эффект нитратов реализуется за счет снижения потребности миокарда в кислороде и улучшения перфузии миокарда. Органические нитраты действуют путем высвобождения оксида азота (NO) — вещества, которое является аналогом эндотелийзависимого релаксирующего фактора. NO активирует гуанилатциклазу, в результате чего образуется цГМФ, который обладает свойством расслаблять гладомышечные клетки сосудов.
Вазодилатация, основной гемодинамический эффект нитратов, имеет дозозависимый характер. При назначении в низких дозах нитропрепараты вызывают расширение преимущественно венозных сосудов. Это приводит к депонированию крови в венозном русле и снижению преднагрузки на сердце (перегрузки объемом). Уменьшение притока крови к сердцу за счет указанного механизма ведет к снижению давления в камерах сердца, в частности конечно-диастолического давления в полости ЛЖ и снижению систолического напряжения его стенок. Вследствие этого потребность миокарда в кислороде снижается, а его перфузия улучшается, особенно в субэндокардиальных областях, что играет важную роль у пациентов с ИБС. При применении в высоких дозах препараты этой группы влияют преимущественно на крупные артерии, включая коронарные сосуды сердца. Нитраты способны предотвращать и купировать ангиоспазм коронарных артерий. Они перераспределяют коронарный кровоток в ишемизированных участках миокарда. Селективная дилатация именно крупных коронарных сосудов является важнейшим фактором оптимизации миокардиального кровотока в ишемизированных зонах. Следует отметить, что малые/резистивные сосуды в этих регионах и так максимально расширены благодаря аденозинопосредованным компенсаторным механизмам ауторегуляции. Указанное влияние нитратов на коронарное русло отличается от действия некоторых других вазодилататоров, например дипиридамола. Последний расслабляет артерии как крупного, так и малого калибра, вызывая перераспределение коронарного кровотока в неишемизированные области миокарда и противодействуя ауторегуляторным механизмам устранения ишемии, за счет чего возможно развитие феномена «коронарного обкрадывания». Органические нитраты снижают уровень АД.
Несмотря на универсальность фармакологического механизма действия органических нитратов, между представителями этой группы имеются существенные отличия. Фармакологические особенности характерны не только для отдельных нитратов, но и для различных лекарственных форм этих препаратов. Важнейшими фармакологическими характеристиками препаратов являются их биодоступность (% активного вещества, поступающего в системный кровоток) и период полувыведения. Нитроглицерин, липофильное вещество, имеет очень короткий период полувыведения (1,0–4,4 мин) и характеризуется широким диапазоном индивидуальной биодоступности при абсорбции в ЖЮГ, поскольку подвергается активному метаболизму при первичном прохождении через печень. Поэтому чаще всего используют сублингвальные/буккальные лекарственные формы нитроглицерина, в которых активное вещество быстро и практически полностью абсорбируется со слизистой оболочки полости рта и поступает в системный кровоток, минуя печень. Отсутствие пресистемного печеночного метаболизма обеспечивает быстрое достижение эффективной концентрации препарата в плазме крови. Нитроглицерин назначают в форме сублингвальных таблеток, желатиновых капсул или аэрозолей. Препарат разрушается при контакте с воздухом, поэтому открытую упаковку с таблетками нельзя хранить более 30 дней. Срок хранения нитроглицерина в форме аэрозоля более продолжительный. Существует лекарственные формы нитроглицерина для трансдермального применения (пластыри, диски). Использование подобных лекарственных форм позволяет пациенту самому регулировать время действия препарата. Изосорбида динитрат после абсорбции в ЖЮГ подвергается активному метаболизму в печени. Его основными метаболитами являются изосорбид-2-мононитрат и изосорбид-5-мононитрат, последний обладает более высокой фармакологической активностью. Период полувыведения изосорбида динитрата составляет 1,1–1,3 ч, биодоступность — 20–25% при приеме внутрь и до 59% — при сублингвальном приеме. Как правило, изосорбида динитрат назначают 2–4 раза/сут. Гидрофильный изосорбид-5-мононитрат имеет наиболее продолжительное среди нитратов время действия (период полувыведения — 4,1–4,9 ч) и высокую биодоступность (до 90–100%) при пероральном приеме. Препарат выпускают в нескольких лекарственных формах, некоторые из них рассчитаны на прием 1 раз/сут.
В зависимости от указанных фармакологических характеристик короткодействующие нитраты показаны для купирования приступов стенокардии, тогда как препараты продолжительного действия используют для профилактики их возникновения. Kоличественные показатели потребности в приеме нитроглицерина могут служить простым и надежным критерием эффективности антиангинальной терапии с применением других лекарственных средств.
Органические нитраты применяют для лечения практически всех форм ИБС, в том числе стабильной и вазоспастической стенокардии. Наличие клинического синдрома стенокардии остается основным показанием для включения нитратов в схему лечения таких пациентов. Высокая антиангинальная эффективность позволяет использовать нитраты для профилактики и устранения ангинальных приступов у больных стабильной стенокардией напряжения. После приема нитропрепаратов значительно сокращается количество приступов стенокардии и повышается толерантность к физической нагрузке, включая продолжительность выполнения нагрузки до появления боли и/или ишемических изменений на ЭКГ. Только 10% больных стабильной стенокардией не отвечают на прием нитратов и еще у 10% развиваются побочные эффекты, требующие их отмены. В целом, антиангинальная эффективность органических нитратов соответствует эффективности блокаторов β-адренорецепторов и блокаторов кальциевых каналов. Позиция относительно применения нитратов в качестве симптоматической терапии приступов стенокардии отражена в отечественных и международных рекомендациях по лечению ИБС. Прогностическое значение нитратов, их влияние на смертность и течение ИБС в настоящее время не доказаны. Это связано не только с противоречивыми результатами имеющихся клинических исследований, но и с тем, что на сегодня не проведены рандомизированные проспективные исследования по объективизации такого влияния, в частности для больных стабильной стенокардией. Вместе с тем, NO, основной эффекторный субстрат нитратов, обеспечивает такие важные физиологические функции, как регуляция сосудистого тонуса и антикоагулянтных свойств крови, влияние на адгезию лейкоцитов, пролиферацию гладкомышечных клеток сосудов и апоптоз. Существуют экспериментальные доказательства антиатеросклеротического действия NO. В экспериментах нитраты нормализовали эндотелиальную функцию, уменьшали повреждение интимы сосудов и препятствовали оксидации ЛПНП.
Противопоказаниями к назначению нитратов являются повышенная чувствительность к ним, шок, острый ИМ с низким давлением наполнения ЛЖ, артериальная гипотензия (САД <90 мм рт. ст.), токсический отек легких, кровоизлияние в мозг или недавно перенесенная черепно-мозговая травма (из-за возможности повышения давления спинномозговой жидкости), закрытоугольная форма глаукомы, тяжелая анемия.
Относительными противопоказаниями к назначению нитратов являются обструктивная форма ГКМП и выраженный аортальный стеноз. Вместе с тем, при появлении у таких больных синдрома стенокардии нитроглицерин можно применять для его устранения.
Отсутствие доказательств положительного влияния на прогноз и течение ИБС делает нецелесообразным применение нитратов у больных без стенокардии. По этой же причине нет оснований назначать нитраты больным с подозрением или факторами риска ИБС.
Взаимодействие нитратов с другими лекарственными средствами
Принципиальное значение имеет взаимодействие органических нитратов с ингибиторами ФДЭ, в частности с сильденафилом, поскольку использование подобной комбинации чревато развитием потенциально опасной артериальной гипотензии. Использование сильденафила возможно только при условии, как минимум, 24-часового перерыва после приема нитратов, включая нитроглицерин. Усиление гипотензивного действия отмечают при сочетанном применении нитратов с барбитуратами, опиоидными анальгетиками, трициклическими антидепрессантами, алкоголем, а также другими средствами, снижающими АД.
Ослабление вазодилататорного эффекта возможно при одновременном применении органических нитратов с карбахолином, норэпинефрином, фенилэфрином, гистамином, ангиотензином, ГКС, стимуляторами ЦНС, М-холиноблокаторами (атропином). Фенобарбитал активирует печеночный метаболизм нитратов, что может значительно уменьшить их биодоступность в лекарственных формах для перорального применения.
Одной из основных проблем, связанных с продолжительным применением нитратов, является развитие толерантности. Толерантностью к нитратам считают снижение клинической эффективности лекарственного средства при регулярном его применении. Сведения о том, что эффективность нитратов может со временем снижаться, появились еще в конце XIX в., когда нитраты только начали использовать в клинической практике. Продолжительное время высказывали сомнения относительно клинического значения этого феномена. Вместе с тем, регулярная терапия нитратами в ряде случаев сопровождается ослаблением или полным исчезновением их клинического действия и гемодинамических эффектов. Механизм этого явления до конца не выяснен. Существующие гипотезы объясняют развитие толерантности снижением концентрации сульфгидрильных (SH-) радикалов, активацией РААС, повышением внутрисосудистого объема в связи с нарушением трансваскулярного градиента Старлинга, образованием свободных радикалов, повышением деградации оксида азота.
Развитие толерантности к нитратам в значительной степени варьирует у разных пациентов. Например, постоянный прием обычных таблеток изосорбида динитрата по 10–20 мг 4 раза в сутки в течение 1 мес сопровождается полной потерей антиангинального эффекта у 10–15% больных стабильной стенокардией, у 60–70% пациентов эффективность лекарственного средства существенно снижается и у остальных 10–15% больных эффективность препарата остается стабильной.
Для предотвращения развития толерантности рекомендуется режим назначения нитратов с обязательным наличием свободного от действия препаратов времени в течение суток. Считается, что для предупреждения развития толерантности вполне достаточно «безнитратного» периода продолжительностью 8–12 ч/сут.
Для нитратов характерны дозозависимые побочные эффекты, связанные с вазодилатацией. Чаще всего это головная боль, гиперемия кожи лица, головокружение. У некоторых больных головная боль носит выраженный характер и является основной причиной отказа от приема препаратов. В отдельных случаях головная боль имеет преходящий характер и исчезает, несмотря на продолжение терапии. Антиангинальний эффект при этом сохраняется. Возможны ортостатическая гипотензия и рефлекторная активация симпатического отдела вегетативной нервной системы с развитием тахикардии и появлением парадоксальной стенокардии. Редко прием нитратов сопровождался развитием синкопальных состояний.
Блокаторы β-адренорецепторов
Блокаторы β-адренорецепторов обладают высокой антиангинальной эффективностью. Механизм действия блокаторов β-адренорецепторов заключается в конкурентном взаимодействии с соответствующим рецепторным аппаратом (β1-и β2-адренорецепторами). Блокада β1-адренорецепторов приводит к снижению ЧСС и уменьшению сократимости миокарда. Оба эти эффекта уменьшают потребность миокарда в кислороде и выраженность ишемии. Препараты этой группы снижают ЧСС как в состоянии покоя, так и при физической нагрузке. Исключение составляют блокаторы β-адренорецепторов с частичной агонистической активностью, для которых характерно снижение ЧСС преимущественно во время физических нагрузок. Положительное влияние блокаторов β-адренорецепторов на перфузию ишемизированного миокарда связано с удлинением диастолы (то есть периода перфузии) за счет снижения ЧСС, а также с перераспределением коронарного кровотока из-за увеличения сосудистого сопротивления в неишемизированных областях. Блокаторы β-адренорецепторов являются препаратами первого ряда в лечении пациентов с АГ. Они уменьшают возбудимость миокарда, повышают порог фибрилляции желудочков сердца во время ишемии, препятствуют развитию аритмии. Известно, что блокаторы β-адренорецепторов имеют универсальное антиишемическое действие и предупреждают возникновение как болевых, так и бессимптомных эпизодов ишемии. Доказана эффективность блокаторов β-адренорецепторов в предотвращении приступов стенокардии/ишемии, вызванной физическими нагрузками.
Блокаторы β-адренорецепторов различают по селективности взаимодействия с β1-адренорецепторами, по продолжительности действия, по наличию внутренней симпатомиметической активности и дополнительных свойств (например способности вызвать вазодилатацию). Несмотря на практически равную антиангинальную эффективность различных блокаторов β-адренорецепторов, в современной клинической практике преимущество отдают кардиоселективным препаратам. Это обусловлено тем, что именно блокада β1-адренорецепторов препятствует системному влиянию симпатического нейротрансмиттера норадреналина, что обеспечивает основной антиагинальный эффект. Кардиоселективность способствует снижению частоты побочных эффектов, обеспечивает лучшую переносимость и безопасность продолжительного лечения, особенно при сопутствующей патологии. Чаще всего используют метопролол, атенолол, бизопролол. При необходимости возможно применение других блокаторов β-адренорецепторов — бетаксолола, карведилола, небиволола. Для эффективной терапии имеет значение длительность действия препарата. Бизопролол и бетаксолол благодаря особенностям фармакокинетики имеют продолжительный период полувыведения и их можно назначать 1 раз в сутки, как и некоторые лекарственные формы метопролола с замедленным высвобождением активного вещества. Атенолол с учетом его периода полувыведения (6–9 ч) целесообразно применять 2 раза в сутки. При повышении дозы может возрастать продолжительность действия препарата, что необходимо учитывать при выборе режима дозирования. Стандартными антиангинальными дозами блокаторов β-адренорецепторов считают:
- для атенолола — 100 мг 1 раз в сутки или 50 мг 2 раза в сутки;
- для бетаксолола — 20 мг 1 раз в сутки;
- для бизопролола — 10 мг 1 раз в сутки;
- для метопролола (лекарственные формы продолжительного действия) — 200 мг 1 раз в сутки.
Основные фармакологические особенности блокаторов β-адренорецепторов представлены в табл. 3.10.
Таблица 3.10
Фармакологические свойства блокаторов β-адренорецепторов
| Препарат | Селективность | Биодоступность, % | Период полувыведения, ч | Печеночная битрансформация | Печеночнокишечная элиминация, % | Почечный клиренс, % |
| Атенолол | Да | 45–50 | 6–7 | Минимальная | 10 | 90 |
| Ацебутолол | Да | 20–60 | 3–4 | Да | 80 | 20 |
| Бетаксолол | Да | 90 | 14–22 | Да | 20–25 | 75–80 |
| Бизопролол | Да | 90 | 10–12 | Да | 50 | 50 |
| Карведилол | Да | 25 | 6–12 | Да | Преимущественно | — |
| Метопролол | Да | 50 | 3–4 | Да | Преимущественно | — |
| Надолол | Нет | 30–40 | 12 | Нет | — | Преимущественно |
| Пропранолол | Нет | 30 | 2–5 | Да | Преимущественно | — |
| Небиволол | Да | 12–100 | 10–50 | Да | Преимущественно | — |
Доза блокаторов β-адренорецепторов определяется отрицательным хронотропным эффектом препарата. При лечении стабильной стенокардии простейшим клиническим критерием оптимального фармакологического действия лекарственного вещества является снижение ЧСС в состоянии покоя до 55–60 уд./мин. Блокаторы β-адренорецепторов ограничивают повышение ЧСС и во время физических нагрузок. В связи с этим оптимальная доза препарата должна способствовать поддержанию ЧСС при физической активности на уровне до 75% пороговой, то есть той, которая связана с появлением стенокардии. Выраженность блокады β-адренорецепторов могут оценивать по результатам тестов с дозированной физической нагрузкой. Эффективность антиангинальной терапии с использованием блокаторов β-адренорецепторов считается достаточной при условии повышения толерантности к физической нагрузке и уменьшения количества приступов стенокардии и потребности в приеме нитратов короткого действия для их купирования (нитроглицерин).
Ухудшение клинической симптоматики под влиянием блокаторов β-адренорецепторов возможно у больных вазоспастической стенокардией (рис. 3.17а–в).
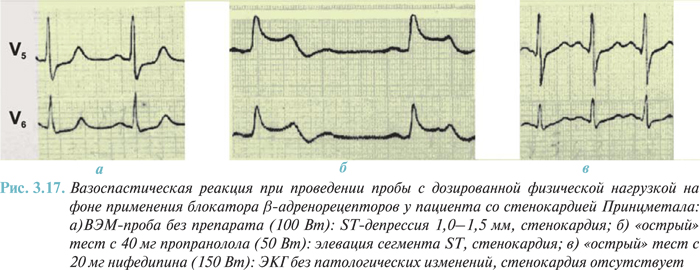
К побочным эффектам, характерным для блокаторов β-адренорецепторов, относятся похолодание конечностей и симптоматическая брадикардия, которая может сопровождаться головокружением, реже — артериальная гипотензия. Возможно появление или усиление респираторных симптомов (одышка), особенно у пациентов с БА/ХОБЛ. Кардиоселективные средства в этих случаях имеют определенные преимущества. Тем не менее, кардиоселективность является относительной характеристикой и прямо пропорционально зависит от дозы препарата, то есть уменьшается или исчезает при ее повышении. Блокаторы β-адренорецепторов могут вызвать слабость и повышенную утомляемость, тем не менее по результатам клинических исследований только 0,4% больных были вынуждены прекратить лечение по этой причине. Среди других побочных реакций регистрировали нарушения AV-проводимости, появление/усиление симптомов СН, головную боль, редко — ощущение тревоги, дистимию, нарушения сна, спутанность сознания (особенно у пациентов пожилого возраста). В литературе обсуждается вопрос о риске депрессий при назначении блокаторов β-адренорецепторов. Однако убедительных доказательств такого риска в настоящее время нет. Описаны случаи влияния блокаторов β-адренорецепторов на показатели липидного обмена, в частности повышение уровня ТГ, но говорить о клиническом значении подобных изменений нет оснований. Блокаторы β-адренорецепторов могут провоцировать появление или обострение псориаза, аллергических реакций. Нарушения сексуальной функции при применении блокаторов β-адренорецепторов регистрировали с частотой 5/1000 пациенто-лет.
В целом, учитывая профиль побочный реакций, блокаторы β-адренорецепторов отличаются хорошей переносимостью, а по влиянию на качество жизни не отличаются от других антиангинальных средств. Например, в исследовании APSIS оценки качества жизни, учитывая побочные реакции, при приеме метопролола и верапамила были аналогичными.
Противопоказаниями к назначению блокаторов β-адренорецепторов являются: повышенная чувствительность к этим препаратам, предсердно-желудочковая блокада II–III степени, синдром слабости синусного узла, брадикардия (ЧСС в покое менее 50 уд./мин до начала лечения), артериальная гипотензия (САД <90 мм рт. ст.), БА, расстройства периферического кровообращения поздних стадий, одновременное применение ингибиторов МАО.
При наличии хронических заболеваний легких и бронхов применение блокаторов β-адренорецепторов требует осторожности, необходимо использовать кардиоселективные средства. Сахарный диабет не является противопоказанием для назначения блокаторов β-адренорецепторов, но следует учитывать, что препараты способны модифицировать действие сахароснижающих средств (особенно инсулина) и маскировать признаки гипогликемии (тремор, тахикардию).
При внезапном прекращении терапии блокаторами β-адренорецепторов возможно развитие синдрома отмены, который проявляется тахикардией, появлением или усилением симптомов стенокардии/ишемии, отрицательной динамикой ЭКГ, повышением уровня АД. В крайних случаях возможные такие серьезные сердечно-сосудистые осложнения, как ИМ и даже внезапная смерть. Развитие синдрома отмены тем вероятнее, чем продолжительнее был период лечения и выше доза препарата. Как правило, синдром отмены возникает в течение 1-й недели после прекращения лечения, но возможно его развитие и в более поздние сроки, до 21 дня. Вероятным механизмом, ответственным за развитие синдрома отмены, считают увеличение плотности β-адренорецепторов и активизацию высвобождения катехоламинов на фоне приема блокаторов β-адренорецепторов. Еще один механизм может быть связан с тем, что блокаторы β-адренорецепторов угнетают секрецию ренина посредством влияния на β-адренорецепторы почек. Их повышенная регуляция во время приема блокаторов β-адренорецепторов в случае отмены может вызвать гиперренинемию с последующим подъемом АД. При синдроме отмены наблюдается повышение агрегации тромбоцитов и усиление высвобождения тромбоксана А2, что может провоцировать ишемические реакции. Поэтому отмену блокаторов β-адренорецепторов следует проводить постепенно под врачебным контролем и с учетом индивидуальных реакций пациента. Для безопасной отмены в среднем считается достаточным 2-недельный период, в течение которого постепенно снижают дозу препарата, но эти сроки могут значительно варьировать в зависимости от индивидуальных особенностей больного.
Взаимодействие с другими лекарственными средствами. Не рекомендуются и требуют особой осторожности комбинации блокаторов β-адренорецепторов с недигидропиридиновыми блокаторами кальциевых каналов (верапамилом, дилтиаземом, бепридилом) в связи с усилением отрицательного влияния на сократительную функцию миокарда, AV-проводимость и уровень АД. Препараты, содержащие клонидин, резерпин, альфа-метилдопу, не следует назначать одновременно с блокаторами β-адренорецепторов, учитывая возможность значительного снижения ЧСС. Требует тщательного медицинского контроля одновременное применение блокаторов β-адренорецепторов и антиаритмических препаратов, сердечных гликозидов. Применение рентгенконтрастных йодсодержащих средств на фоне приема блокаторов β-адренорецепторов повышает риск развития рефрактерных анафилактических реакций. Циметидин может снизить клиренс блокаторов β-адренорецепторов, метаболизирующихся в печени, и соответственно повысить их концентрацию в крови. Терапевтические эффекты блокаторов β-адренорецепторов могут снижаться при сочетанном применении с ксантинами (аминофиллином и теофиллином).
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов — неоднородная группа препаратов, оказывающих антигипертензивное и антиангинальное действие. Основой фармакологической активности блокаторов кальциевых каналов является способность блокировать транспорт ионов кальция в клетку через потенциалзависимые (медленные) L-каналы мембраны. Ионы кальция обеспечивают взаимодействие электрических и механических процессов в кардиомиоцитах, гладкомышечных клетках и скелетных мышцах. В этих процессах участвует внутриклеточный кальций и кальций, поступающий извне. Для мышечного сокращения расходуется 85–90% внутриклеточного и 10–15% кальция, поступившего в клетку через L-каналы. Мышечные клетки разных тканей имеют различную потребность во внеклеточном кальции. Наиболее зависимы от него кардиомиоциты и гладкомышечные клетки сосудистой стенки. Этим объясняется отсутствие существенного влияния препаратов группы блокаторов кальциевых каналов на скелетные мышцы и незначительное воздействие на гладкие мышцы бронхов и ЖКТ. Все блокаторы кальциевых каналов обладают достаточно выраженным вазодилатирующим эффектом, включая непосредственное влияние на коронарные артерии сердца. Блокаторы кальциевых каналов, снижающие ЧСС (верапамил и дилтиазем), оказывают отрицательный инотропный эффект и замедляют AV-проводимость.
Основные фармакодинамические свойства дигидропиридиновых производных (нифедипин, амлодипин, фелодипин) связаны с системным вазодилатирующим эффектом. В терапевтических дозах их влияние на сократимость и проводящую систему миокарда невелико. Кроме того, влияние этих препаратов на сократимость миокарда уравновешивается рефлекторной активацией симпатического отдела вегетативной нервной системы, что проявляется повышением ЧСС. Выраженность этого эффекта определяется фармакологическими свойствами дигидропиридинового блокатора кальциевых каналов. Со временем, несмотря на прием дигидропиридиновых блокаторов кальциевых каналов, ЧСС может возвращаться к исходным показателям. Тем не менее, признаки симпатоадреналовой активации в некоторых случаях сохраняются в процессе лечения и создают предпосылки для возникновения нежелательных побочных реакций.
Aнтагонисты кальция продолжительного действия (такие как амлодипин) или лекарственные формы с замедленным высвобождением активного вещества (такие формы существуют для нифедипина, фелодипина, верапамила, дилтиазема) обладают определенными преимуществами, поскольку создают стабильную концентрацию действующего вещества в плазме крови и обеспечивают постоянный терапевтический эффект. Основные фармакологические особенности различных антагонистов кальция представлены в табл. 3.11.
Таблица 3.11
Антагонисты кальция: основные параметры фармакокинетики и режим дозирования
| Препарат | Дозирование | Биодоступность, % | Период полувыведения, ч | Печеночная биотрансформация | Элиминация |
Верапамил:
|
120–480 мг 1 раз в сутки
80–160 мг 3 раза в сутки |
20–35 | 4,5–12 | Да | Преимущественно почечная (>70%) |
Дилтиазем:
|
120–320 мг 1 раз в сутки
60–80 мг 3 раза в сутки |
40 | 5–7 | Да | Почечная и с желчью |
Нифедипин:
|
30–60 мг 1-2 раза в сутки | 45–50 | 2 | Да | Преимущественно почечная (>80%) |
| Aмлодипин | 5–10 мг 1 раз в сутки | 60–80 | 35–50 | Да | Преимущественно почечная |
| Фелодипин | 5–10 мг 1 раз в сутки | 20 | 11–16 | Да | Преимущественно почечная (>70%) |
| Лерканидипин | 10 мг 1 раз в сутки | Да | |||
| Лацидипин | 4 мг 1 раз в сутки | Да |
Механизм антиангинального действия блокаторов кальциевых каналов связан с разгрузкой сердца за счет системной вазодилатации, а также с непосредственным влиянием на венечные артерии сердца и предупреждением коронароспазма. Среди дополнительных положительных эффектов блокаторов кальциевых каналов следует назвать улучшение диастолической функции ЛЖ. В экспериментах были продемонстрированы антитромботические и антиатерогенные свойства антагонистов кальция. Особым показанием для назначения антагонистов кальция является вазоспастическая или вариантная стенокардия (стенокардия Принцметала). Для нифедипина вазоспастическая стенокардия была первым зарегистрированным показанием к применению. Верапамил и дилтиазем оказывают антиаритмическое действие при суправентрикулярных аритмиях. При синдроме слабости синусного узла, нарушениях AV-проводимости их назначать не следует. Препаратами выбора в таких случаях могут быть дигидропиридины. Антиангинальная эффективность блокаторов кальциевых каналов была продемонстрирована в клинических исследованиях. Например, амлодипин в дозе 10 мг/сут назначали участникам исследования CAMELOT. По сравнению с плацебо амлодипин существенно уменьшал потребность в госпитализации по поводу стенокардии и потребность в проведении реваскуляризации в течение 2-летнего периода наблюдения.
В исследовании САРЕ амлодипин (10 мг/сут) эффективно уменьшал количество эпизодов ишемии во время холтеровского мониторирования ЭКГ после 7 нед лечения. Отмечали уменьшение количества приступов стенокардии и потребности в нитроглицерине.
По сравнению с изосорбида мононитратом (25–50 мг/сут) амлодипин (5–10 мг/сут) оказался более эффективным у больных стабильной стенокардией пожилого возраста в двойном слепом параллельном 28-недельном исследовании.
Исследование CASIS было небольшим по объему — в нем участвовали 315 больных стабильной стенокрадией. Сравнивали антиишемическую эффективность амлодипина в дозе 10 мг/сут и атенолола 100 мг/сут. Амлодипин оказывал большее влияние на толерантность к физической нагрузке (тест на тредмиле). Атенолол имел преимущества по уменьшению количества эпизодов ишемии миокарда во время холтеровского мониторирования. Антиангинальная эффективность комбинации дигидропиридина с атенололом значительно превышала эффективность каждого препарата в отдельности.
Подобные результаты, когда комбинированная терапия была более эффективной, получены в исследованиях с нифедипином. В частности, в исследовании IMAGE метопролол оказался эффективнее нифедипина по показателям толерантности к физической нагрузке. Но результаты комбинированного назначения исследуемых препаратов превышали эффективность монотерапии каждым из них. В испытании TIBET динамика клинических показателей (толерантность к физической нагрузке) и частота осложнений ИБС (нестабильная стенокардия, ИМ и внезапная смерть) достоверно не отличались в группах больных, которые получали нифедипин или атенолол. При этом количество осложнений несколько уменьшалось под влиянием комбинированной терапии.
Рандомизированное плацебо-контролируемое исследование ACTION, цель которого — оценить влияние терапии нифедипином на течение заболевания у пациентов со стабильной стенокардией, продемонстрировало неоднозначные результаты. В исследовании приняли участие 7665 больных стабильной стенокардией без признаков СН (ФВ >40%). Нифедипин назначали в дозе 30–60 мг 1 раз/сут. Период наблюдения составил в среднем 4,9 года. Несмотря на антиангинальный эффект нифедипина, комбинированные показатели, включающие смертность от всех причин, острый ИМ, рефрактерную стенокардию, появление СН и инсульт, в группах активного лечения и плацебо достоверно не отличались. Единственный показатель, по которому выявлены положительные изменения, — потребность в проведении АКШ.
Побочные реакции при применении блокаторов кальциевых каналов дозозависимые и в основном обусловлены вазодилатацией. Чаще всего отмечают головную боль, гиперемию кожи, тахикардию, головокружение, отеки голеней. Последние не связаны с задержкой жидкости в организме, носят доброкачественный характер и, как правило, выраженность их уменьшается или они исчезают после коррекции дозы препарата. Эти реакции наиболее выражены при использовании блокаторов кальциевых каналов, производных дигидропиридина. Верапамил может вызвать констипацию. Редко при применении блокаторов кальциевых каналов возникали аритмия, усиление стенокардии, АГ, нарушения со стороны ЖКТ. Применение дигидропиридинов может сопровождаться незначительным увеличением суточного диуреза. При склонности к артериальной гипотензии, риске развития СН, гемодинамически значимом аортальном или митральном стенозе, обструктивной форме ГКМП применение блокаторов кальциевых каналов не рекомендуется. В случае необходимости их назначения требуется особая осторожность и постоянный клинический контроль.
Поскольку все блокаторы кальциевых каналов метаболизируются в печени, при нарушениях ее функции увеличивается период полувыведения и повышается биодоступность лекарственных средств, что требует коррекции режима дозирования и постоянного клинического наблюдения. В таких случаях следует избегать назначения блокаторов кальциевых каналов в максимальных дозах. Верапамил накапливается в организме при регулярном приеме, что может привести к усилению как терапевтического эффекта, так и побочных реакций. Для дилтиазема также характерна кумуляция, хотя и в незначительной степени. Дилтиазем и амлодипин можно применять у больных с нарушениями функции почек. Амлодипин признан достаточно безопасным лекарственным средством, которое при необходимости можно применять у больных СН.
Следует иметь в виду возможность взаимодействия блокаторов кальциевых каналов с другими лекарственными средствами. Так, верапамил существенно (до 40%) повышает концентрацию дигоксина в плазме крови. Дилтиазем и нифедипин также взаимодействуют с дигоксином, но в меньшей степени. Недигидропиридиновые блокаторы кальциевых каналов не рекомендуется комбинировать с блокаторами β-адренорецепторов, учитывая возможность потенцирования кардиодепрессивного действия. Применение блокаторов β-адренорецепторов с дигидропиридиновыми блокаторами кальциевых каналов является рациональной комбинацией с точки зрения оптимизации терапевтического эффекта и предупреждения побочных реакций, в частности рефлекторной активации симпатической нервной системы. Тем не менее, такая комбинация повышает риск развития СН, особенно у пациентов с имеющимися нарушениями сократимости миокарда.
Все три группы антиангинальных препаратов (блокаторы β-адренорецепторов, органические нитраты, блокаторы кальциевых каналов), рекомендованные для симптоматической терапии стабильной стенокардии, имеют достаточно высокую эффективность, что отражают результаты проведенных клинических исследований. Более высокая терапевтическая эффективность отмечена в сравнительных клинических исследованиях для блокаторов β-адренорецепторов и некоторых блокаторов кальциевых каналов. Так, в уже упоминавшемся исследовании IMAGE, 280 больных стабильной стенокардией принимали метопролол CR 200 мг/сут или нифедипин SR 20 мг 2 раза в сутки в течение 6 нед. Оба препарата повышали толерантность к физическим нагрузкам, однако метопролол в большей степени (р<0,05). В исследовании APSIS верапамил SR в дозе 240–480 мг/сут несколько эффективнее, чем метопролол CR в дозе 100–200 мг/сут, повышал толерантность к физической нагрузке. Но показатели влияния на риск сердечно-сосудистых осложнений для обоих препаратов не отличались. В исследовании TIBBS (514) сравнивали антиангинальные и антиишемические эффекты бизопролола и нифедипина. Бизопролол оказался более эффективным. Атенолол, нифедипин и их комбинацию изучали в исследовании TIBET по показателям толерантности к физической нагрузке и результатам холтеровского мониторирования ЭКГ. Оба препарата (в качестве монотерапии и в комбинации) улучшали параметры переносимости нагрузки и уменьшали выраженность ишемических проявлений по данным суточного мониторирования ЭКГ по сравнению с плацебо. Причем ни один вариант активного лечения не имел статистически достоверных преимуществ перед другим. Вместе с тем, монотерапия нифедипином сопровождалась большим количеством побочных реакций, в том числе и требующих отмены препарата.
Анализ сравнительных исследований блокаторов β-адренорецепторов и блокаторов кальциевых каналов у больных стабильной стенокардией свидетельствует, что первые более эффективны в предупреждении ангинальних приступов, тогда как влияние обеих групп препаратов на переносимость дозированных физических нагрузок не отличалось.
Проведено несколько сравнительных исследований антиангинальных и антиишемических эффектов нитратов пролонгированного действия с блокаторами β-адренорецепторов и блокаторами кальциевых каналов. Ни в одном из них не выявлено влияния нитратов на смертность у больных стабильной стенокардией. Блокаторы β-адренорецепторов и блокаторы кальциевых каналов по сравнению с нитратами пролонгированного действия имели незначительные преимущества относительно антиишемического действия.
Несмотря на положительную динамику клинических параметров во всех указанных исследованиях, их результаты были получены в условиях краткосрочного наблюдения и поэтому не могут рассматриваться в связи с влиянием на долговременный прогноз. То есть необходимо различать симптоматическое лечение стенокардии и терапию, обеспечивающую положительные изменения основных прогностических показателей. Прогноз пациента с ИБС зависит от многочисленных факторов, включая скорость прогрессирования атеросклероза, стабильность или дестабилизацию атеросклеротических бляшек, развитие тромботических осложнений. Возможности традиционной антиангинальной терапии в отношении указанных факторов остаются неопределенными и в целом ограниченными. Учитывая известную прогностическую эффективность блокаторов β-адренорецепторов после перенесенного ИМ, эти препараты у больных стабильной стенокардией считаются антиангинальными средствами первого ряда. При условии противопоказаний для их назначения или наличии других индивидуальных потребностей рекомендуется назначение блокаторов кальциевых каналов или нитратов. При недостаточной эффективности монотерапии возможно использование комбинаций, например блокаторов β-адренорецепторов с дигидропиридиновыми блокаторами кальциевых каналов или нитратами пролонгированного действия.
Активаторы калиевых каналов
Основной представитель этой группы — никорандил. Имеет двойной механизм действия: 1) активирует АТФ-зависимые калиевые каналы, 2) оказывает нитратоподобный эффект. Благодаря системной и коронарной вазодилатации обеспечивает уменьшение пред- и постнагрузки. В экспериментальных исследованиях в условиях ишемии и реперфузии активация К+АТФ-зависимых каналов сопровождалась кардиопротекторным эффектом. Суточная доза никорандила для предупреждения приступов стенокардии составляет 20 мг 2 раза в сутки. При продолжительном приеме может развиваться толерантность к препарату подобно тому, как это происходит при применении нитратов. Перекрестная толерантность с нитратами не отмечена. В небольших рандомизированных плацебо-контролируемых исследованиях с участием больных стабильной стенокардией никорандил улучшал результаты проб с дозированной физической нагрузкой. В исследовании IONA никорандил добавляли к традиционной терапии пациентам, госпитализированным в связи с ангинозной болью. По сравнению с плацебо препарат оказывал выраженный клинический эффект. Тем не менее, продолжение терапии в течение 1,6 года не оказывало достоверного влияния на кардиальную смертность и частоту нефатального ИМ.
Наиболее частым побочным эффектом при применении никорандила была головная боль. Очень редко сообщали о развитии язв слизистой оболочки полости рта на фоне приема никорандила. Европейским кардиологическим обществом препарат рекомендован как дополнительное средство для симптоматического лечения стабильной стенокардии. В Украине никорандил не зарегистрирован.
Ивабрадин
Препарат блокирует f-каналы синусного узла, снижая его пейсмекерную активность и обеспечивая отрицательный хронотропный эффект (рис. 3.18).
Снижение ЧСС под влиянием ивабрадина наблюдается как в состоянии покоя, так и при физических нагрузках. Антиангинальная эффективность препарата установлена в диапазоне доз 10–20 мг/сут. В отличие от других антиангинальных средств, ивабрадин не влияет на тонус сосудов, включая коронарные артерии сердца. Несмотря на то, что ЧСС признана одной из важнейших детерминант потребности миокарда в кислороде и современная тактика лечения стенокардии предусматривает ее снижение до 55–60 уд./мин, в реальной клинической практике возникают трудности с реализацией этих рекомендаций. По данным Европейского реестра за 2006 г. 33% больных стабильной стенокардией не получали блокаторов β-адренорецепторов, в 20% случаев были прямые противопоказания к приему указанных препаратов. В Украине в 2006 г. проведено эпидемиологическое исследование REALITY с участием почти 1500 пациентов. Основная задача исследования — изучение вопроса о ведении больных стабильной стенокардией в амбулаторных условиях и мониторирование у них ЧСС. 84% пациентов принимали блокаторы β-адренорецепторов, но только у 5% из них была достигнута целевая ЧСС <60 уд./мин. У 40% больных, участвовавших в исследовании, указанный показатель превышал 80 уд./мин. Препарат ивабрадин показан для лечения стенокардии с целью снижения ЧСС у пациентов, которые не могут принимать блокаторы β-адренорецепторов из-за противопоказаний или непереносимости (при гиперчувствительности, БА и др.). Снижая ЧСС, одну из основных детерминант потребности миокарда в кислороде, ивабрадин теоретически может оказывать влияние на прогноз при стабильной стенокардии. Реальное значение подобного влияния требует дальнейшего изучения.
Триметазидин и ранолазин
Относятся к антиангинальным препаратам метаболического действия. Их механизм действия непосредственно связан с энергообеспечением миокарда. Триметазидин является первым представителем нового фармакологического класса — ингибиторов фермента 3-КАТ. Блокада фермента 3-КАТ в условиях ишемии оптимизирует энергетическое обеспечение миокарда, переключая клеточный метаболизм с окисления жирных кислот на окисление глюкозы. Это позволяет сохранить в кардиомиоцитах необходимый уровень АТФ, предупредить развитие внутриклеточного ацидоза и накопления ионов кальция. Ранолазин дополнительно блокирует натриевые каналы, которые активируются в условиях ишемии, предупреждает перегрузку миокарда ионами кальция. Триметазидин и ранолазин не оказывают значимого влияния на ЧСС и АД. Учитывая механизм действия и фармакодинамические свойства, их можно комбинировать с традиционными антиангинальными «гемодинамическими» средствами (блокаторами β-адренорецепторов, блокаторами кальциевых каналов, органическими нитратами). Подобные лекарственные сочетания способны повысить эффективность терапии при сохранении ее переносимости. Следует отметить, что ранолазин менее изучен, чем триметазидин. В Украине рано-лазин не зарегистрирован. Влияние метаболических препаратов на прогноз больных стабильной стенокардией не определено.
Молсидомин
Вазодилататор с гемодинамическим профилем, подобным нитратам. В соответствующем режиме дозирования (2–8 мг/сут) препарат применяют как антиангинальное средство. Влияние препарата на прогноз стабильной стенокардии не изучали.
Общие рекомендации по фармакотерапии стабильной стенокардии
Назначение антиангинальной терапии должно учитывать индивидуальные особенности и потребности каждого пациента. Необходим регулярный контроль результатов терапии. Применение нитратов короткого действия (нитроглицерин) рекомендовано всем больным для неотложного купирования приступов стенокардии.
Современные антиангинальные препараты в клинических исследованиях выявили высокую эффективность. Но это не означает, что они будут в такой же степени эффективны у каждого конкретного больного. Перед принятием решения о сочетанном назначении антиангинальных препаратов необходимо использовать их оптимальные дозы в качества монотерапии. Целесообразно попробовать разные комбинации двух антиангинальных препаратов перед назначением третьего. По данным ряда исследований применение трех антиангинальных препаратов не имело преимуществ перед двухкомпонентной терапией. Вместе с тем применение интенсивного лечения, состоящего из нескольких препаратов в высоких дозах, может создать больному дополнительные проблемы, вызвав побочные реакции. Важными составляющими успешной терапии являются дисциплинированность пациента и готовность к сотрудничеству с врачом. Поэтому пациент должен располагать достаточной информацией о своем заболевании и проводимом лечении. Алгоритм ведения больного стабильной стенокардией включает обязательное определение и возможную модификацию факторов риска, назначение лекарственных средств, которые оказывают положительное влияние на прогноз и максимально устраняют клинические симптомы заболевания. Неэффективность медикаментозной терапии и желание больного предполагают возможность хирургического лечения.
Рекомендации по фармакотерапии с целью устранения симптомов и предупреждение ишемии у пациентов стабильной стенокардией:
- Учитывая доказательную базу, для купирования приступов стенокардии и их ситуативной профилактики всем больным показано назначение нитратов короткого действия (нитроглицерина) с соответствующими инструкциями по их применению (класс I, уровень доказательности В).
- Назначение блокаторов β-адренорецепторов рекомендовано всем больным стабильной стенокардией при отсутствии противопоказаний с учетом их эффективности у каждого конкретного пациента. Дозу выбранного препарата необходимо титровать до оптимальной, учитывая ЧСС и переносимость терапии. Для успешного лечения важно обеспечить постоянное в течение суток действие препарата, что позволяет максимально предупредить появление ишемии (класс I, уровень доказательности А).
- В случаях когда назначение блокаторов β-адренорецепторов противопоказано или применение их неэффективно, рекомендована монотерапия блокаторами кальциевых каналов (класс I, уровень доказательности А) или нитратами длительного действия (класс I, уровень доказательности С).
- В случаях недостаточной эффективности монотерапии блокаторами β-адренорецепторов целесообразно присоединение к ним дигидропиридиновых блокаторов кальциевых каналов (класс I, уровень доказательности В). Общая схема антиангинальной терапии представлена на рис. 3.19.

В некоторых случаях при непереносимости блокаторов β-адренорецепторов альтернативой могут стать блокаторы f-каналов синусного узла — препарат ивабрадин (класс IIа, уровень доказательности В).
При неэффективности монотерапии блокаторами кальциевых каналов или комбинированной терапии блокаторы кальциевых каналов + блокаторы β-адренорецепторов возможна замена блокатора кальциевого канала на препарат группы нитратов пролонгированного действия. Регулярное применение нитратов пролонгированного действия требует контроля режима их приема для предупреждения толерантности (класс IIа, уровень доказательности С).
Препараты метаболического действия применяют как вспомогательные или альтернативные средства при наличии противопоказаний или непереносимости традиционных антиангинальных препаратов (класс 11в, уровень доказательности В).
Неэффективность двухкомпонентной терапии с применением препаратов в оптимальных дозах ставит вопрос о назначении третьего антиангинального средства или проведении хирургического вмешательства по реваскуляризации миокарда. Применение многокомпонентной терапии требует регулярного врачебного контроля в связи с риском развития побочных реакций. Обоснованием для хирургического лечения может быть и желание пациента. Проведение вмешательства по реваскуляризации миокарда не исключает продолжения приема препаратов, оказывающих положительное влияние на прогноз при ИБС, в первую очередь антитромботических препаратов и статинов.
Терапия синдрома Х
Основная цель терапии синдрома Х — устранение клинических проявлений заболевания. Нитраты эффективно купируют болевой синдром приблизительно у половины этих больных, поэтому лечение рекомендуется начинать с назначения препаратов этой группы. В случаях когда симптоматика сохраняется несмотря на прием нитратов, возможно применение блокаторов кальциевых каналов или блокаторов β-адренорецепторов. Есть сообщения об эффективности при синдроме Х других антиангинальных средств, таких как никорандил и триметазидин. Полезными для пациентов с синдромом Х могут быть ингибиторы АПФ и статины, поскольку есть данные, что их назначение сопровождается уменьшением выраженности ишемии, индуцированной физической нагрузкой, а также с учетом способности указанных препаратов препятствовать эндотелиальной дисфункции. Вместе с тем, применение ингибиторов АПФ и статинов рассматривают при синдроме Х скорее как часть лечения, модифицирующего факторы риска. Статины показаны больным с дислипидемией. Ингибиторы АПФ рекомендуются при наличии АГ. Для достижения стойких положительных результатов у некоторых пациентов с синдромом Х необходимо комплексное лечение, включающее анальгетические средства, имипрамин или аминофиллин, проведение психотерапии, электростимуляции, физических тренировок. В некоторых случаях у пациенток в постменопаузальный период оказалась полезной гормональная заместительная терапия. Но учитывая возможные отрицательные последствия такой терапии относительно сердечно-сосудистых и онкологических осложнений, необходима взвешенная оценка соотношения пользы и риска в каждом конкретном случае.
Лечение вазоспастической стенокардии
Основными препаратами для лечения вазоспастической стенокардии являются нитраты и блокаторы кальциевых каналов. Причем нитраты в большей степени эффективны для купирования приступов вазоспастической стенокардии, чем для их профилактики. Блокаторы кальциевых каналов более эффективны для предупреждения коронароспазма, однако лечение требует назначения препаратов в высоких дозах. Например, рекомендуемая суточная доза верапамила составляет до 480 мг, дилтиазема — до 240 мг, нифедипина — до 120 мг. В некоторых исследованиях эффективность нифедипина и амлодипина составляла 70%, включая воздействие на ЭКГ-признаки ишемии миокарда, частоту и интенсивность ангинозных приступов. Вместе с тем, обобщенный анализ результатов монотерапии блокаторами кальциевых каналов при вазоспастической стенокардии свидетельствует, что полное устранение симптомов заболевания отмечают в среднем у 38% пациентов. Применение блокаторов кальциевых каналов в комбинации с нитратами пролонгированного действия улучшает состояние большинства пациентов. В случае резистентной к лечению вазоспастической стенокардии возможно использование двух блокаторов кальциевых каналов, например препарата группы производных дигидропиридина и верапамила. Медикаментозная терапия была более эффективной у женщин и пациентов с элевацией сегмента ST, возникающей в условиях провокационных тестов. Целесообразность назначения блокаторов α-адренорецепторов больным вазоспастической стенокардией остается сомнительной, хотя есть сообщения о положительных результатах такой терапии. Описаны случаи успешного лечения вазоспастической стенокардии никорандилом. У некоторых пациентов с резистентной к медикаментозной терапии вазоспастической стенокардией отмечали положительные результаты стентирования пораженной коронарной артерии. АКШ в таких случаях не показано, поскольку сохраняется угроза спазма участков артерии, находящихся дистальнее анастомоза. Под влиянием продолжительной, не менее 1 года, медикаментозной терапии приблизительно у половины больных с вазоспастической стенокардией отмечают стойкую ремиссию. Через 6–12 мес после исчезновения стенокардии считается возможным постепенное сокращение объема лечения и даже полная отмена медикаментов. Появление вазоспазма у больных с гемодинамически значимыми стенозами коронарных артерий требует проведения всех обычных для лечения ИБС мероприятий, включая терапию, направленную на улучшение прогноза и устранение симптомов заболевания. Обязательным для оптимизации лечения вазоспастической стенокардии является устранение таких провоцирующих факторов, как табакокурение.
Принципы лечения больных после оперативных вмешательств по реваскуляризации миокарда
Все пациенты после оперативного лечения ИБС нуждаются в постоянном применении препаратов для предупреждения прогрессирования атеросклероза и развития тромботических осложнений (статинов и антитромбоцитарных средств). Обязательным условием является коррекция образа жизни, соблюдение гиполипидемической диеты, нормализация массы тела, отказ от табакокурения и физические тренировки с учетом индивидуальных возможностей пациента. Поскольку морфологической основой стенокардии является атеросклероз коронарных артерий, даже успешная реваскуляризация не гарантирует полного устранения симптомов коронарной недостаточности, особенно в условиях физической и психологической перегрузки. Возобновление стенокардии у больных после оперативных вмешательств по реваскуляризации миокарда требует проведения дополнительного обследования для дифференциальной диагностики болевого синдрома и уточнения характера поражения коронарного русла. Основные принципы симптоматического лечения стенокардии являются общими для всей популяции больных ИБС, в том числе и после оперативных вмешательств.
ЛИТЕРАТУРА
- Аронов Д.М. (2004) Каскад терапевтических эффектов статинов. Кардиология, 10: 85-94.
- Марцевич С.Ю. (2003) Современные взгляды на терапию нитратами больных ишемической болезнью сердца. Сердце, 2: 88-90.
- Метелица В.И. (2002) Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. Бином, М., с. 551-619.
- Преображенский Д.В. (1993) Клиническое применение антагонистов кальция. М., с. 61.
- Чазов Е.И., Беленков Ю.Н. (2004) Рациональная фармакотерапия сердечно-сосудистых заболеваний. Руководство для практикующих врачей. Литтерра, М.. т. 4.
- Antitrombotic Trialists’ Collaboration (2002) Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patient. BMJ, 324: 71-86.
- Bellosta S., Ferri N., Paoletti R., Corsini A. (2000) Non-lipid-related effects of statins. Ann. Med., 32: 164-176.
- Benowitz N.L., Gourlay S.G. (1997) Cardiovascular toxicity of nicotine: implications for nicotine replacement therapy. J. Am. Call. Cardiol., 29: 1422-1431.
- Blankenhorn D.H. and MARS Research Droup: Coronary angiographic changes with lovastatin therapy: The Monitored Atherosclerosis Study (MARS) (1993) Ann Intern Med, 119: 969-976.
- Boden W.E., van Gilst W.H., Starkey I.R. et al. (2000) Diltiazem in acute myocardial infarction treated with thrombolytic agents: a randomised placebo-controlled 36. trial. Incomplete Infarction Trial of European Research Collaborators Evaluating Prognosis post-Thrombolysis (INTERCEPT). Lancet, 355: 1751-1756.
- CAPRIE Steering Committee (1996) A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischemic events (CAPRIE). Lancet, 348: 1329-1339. 38.
- Dargie H.J., Ford I., Fox K.M. (1996) Total Ischemic Burden Europian Trial (TIBET). Effects of ischemia and treatment with atenolol, nifedipine SR and their combination on outcome in patients with chronic stable angina . The TIBET Study Group. Eur. Heart J., 17: 104-112.
- Deanfield J.E., Detry J.M., Lichtlen P.R. et al. (1994) Amlodipine reduses transient myocardial ischemia in patients with coronary artery disease: double-blind Circadian Anti-Ischemia Program in Europe (CAPE Trial). JAC, 24: 1460-1467.
- DeBacker G., Ambrosioni E., Borch-Johnsen et al. (2003) European guidelines on cardiovascular disease prevention in clinical practice. Third Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur. Heart J., 24: 1601-1610.
- Deedwania P., Barter P., Carmena R. et al. (2006) Treating to New Targets Investigators. Reduction of low-dencity lipoproptein cholesterol in patients with coronary heart disease and metabolic syndrome: analysis of the Treating to New Targets Study. Lancet, 368: 919-928.
- Effect of simvastatin on coronary atheroma: the Multicentre Anti-Atheroma Study (MAAS) (1994) Lancet, 344: 633-338.
- Effect of verapamil on mortality and major events after acute myocardial infarction (the Danish Verapamil Infarction Trial II — DAVIT II) (1990) Am. J. Cardiol., 66: 779-785.
- ESC Guidelines for the Management of Stable Angina Pectoris (2006) Eur. Heart J., 27: 1341-1381.
- Fox K.M. (2003) Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, doubleblind, placebo-controlled, multicentre trial (the EUROPE study). Lancet; 362: 782-788.
- Freemantle N., Urdahl H., Eastaugh J. et al. (2002) What is the place of beta-blockade in patients who have experienced a miocardial infarction with preserved left ventricular function. Evidence and mis(interpretation). Prog. Cardiovasc. Dis., 44: 243-250.
- Fung H.L., Bauer J.A. (1994) Mechanisms of nitric tolerance. Cardiovasc. Drug. Ther., 8: 489-499.
- Gotto A.M. (2003) Dyslipidemia and Coronary Heart Disease, 242 p.
- Graboys T.B., Blatt Ch.M. (1997) Angina Pectoris: Management Strategies and Guide to Interventions. USA, Professional Communications, Inc, p. 240.
- Guasti L., Marina F., Cosentino M. et al. (2008) Prolonged statin-associated reduction in neutrophil reactive oxygen species and angiotensin II type 1 receptor expression: 1-year follow-up. Eur Heart J; 9, 1118-1126. Guidelines for the Management of Patients with Chronic Stable Angina (1999) J. Amer. Coll. Cardiology, 33: 2092-2197.
- Han S.H., Bae J.H., Holmes D.R. et al. (2008) Sex differences in atheroma burden and endothelial function in patients with early coronary atherosclerosis. Eur Heart J; 29, 1359-1369.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebocontrolled trial (2002) Lancet, 360: 7-22.
- Holdaas H. (2008) Statin therapy for prevention of coronary artery disease. The earlier the better or the longer the better? Eur Heart J; 29; 4, 425-426.
- Holubarsch C., Kojda G. (2003) Nitrates in combination therapy: From angina to myocardial infarction and heart failure. Schwarz Pharma. Germany, 104 p.
- Hueb W., Soares P.R., Gersh B.J. et al. (2004) The medicine, angioplasty, or surgery study (MASS-II): a randomised controlled clinical trial of three therapeutic strategies for multivessel coronary artery disease: 1 year results. J. Am. Call. Cardiol., 43: 1743-1751.
- Kastelein J., de Groot E. (2008) Ultrasonic imaging techniques for the evaluation of cardiovascular therapies. Eur Heart J; 29; 7, 849-858.
- Kris-Etherton P.M., Lichtenstein A.H., Howard B.V. et al. (2004) Antioxidant vitamin supplements and cardiovascular disease. Circulation, 110: 637-641.
- Marcassa C., Bax J.J., Bengel F. et al. (2008) Clinical value, cost-effectiveness and safety of myocardial perfusion scintigraphy: a position statement. Eur Heart J; 29; 4, 557-563.
- Marchioli R., Barzi E., Bomba E. et al. (2002) Early protection against sudden death by 3-polyunsaturated fatty acids after miocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico (GISSI)-Prevenzione. Circulation, 105: 1897-1903.
- Markham A., Plosker G.L., Goa K.L. (2000) Nicorandil. An update review of its use in ischemic heart disease with emphasis on its cardioprotective effects. Drugs, 60: 955-974.
- McCormic L.S., Black D., Waters D. et al. (1999) «Aggressive lipid lowering therapy compared with angioplasty in stable coronary disease (AVERT)». N. Engl. J. Med., 341: 70-76.
- Michelson A.D., Cataneo M., Eikelbloom J.W. et al. (2005) Aspirin resistance: position paper of Working Group on Aspirin Resistance. J. Thromb. Haemost., 3: 1309-1311.
- Nayler W. (1993) Amlodipine. Springer-Verlag. Berlin Heidelberg.
- Nissen S.E., Nicholls S.J., Sipahi I. et al. (2006) Effect of very high-intensity statin therapy on regression of coronary atherosclerosis (ASTEROID). JAMA, 295: 1556-1565.
- Nissen S.E., Tuzcu E.M., Libby P. et al. (2004) Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomised controlled trial. JAMA, 292: 2217-2225.
- Nissen S.E., Tuzcu E.M., Schoenhagen P. et al. (2004) Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis (REVERSAL) trial. JAMA, 211: 1071-1080.
- Parker J.D., Parker J.O. (1998) Nitrate therapy for stable angina pectoris. N. Engl. J. Med., 338: 520-531.
- Pepine C.J., Cohn P.N., Deedwania P.C. et al. (1994) Effects of treatment on outcome in mildly symptomatic patients with ischemia during daily life. The Atenolol Silent Ischemia Study (ASIST). Circulation, 90, 762-768.
- Rehnqvist N., Hjemdahl P., Billing E. et al. (1996) Effects of metoprolol vs verapamil in patients with stable angina pectoris. The Angina Prognosis Study in Stockholm (APSIS). Eur. Heart. J., 17: 76-81.
- Robins S.J., Collins D., Wittes J.T. et al. (2001) Relations of gemfibrozil treatment and lipid levels with major coronary events: VA-HIT: a randomized controlled trial. JAMA, 285(12): 1585-1591.
- Schroeder S., Achenbach S., Bengel F. et al. (2008) Cardiac computed tomography: indications, applications, limitations, requirements. Eur Heart J; 29; 4, 531-556.
- Sever P., Dahlof B., Poulter N. et al. (2003) Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-then-average cholesterol concentration in the Anglo-Scandinavian cardiac outcomes trial — Lipid lowering arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet, 361: 1149-1158.
- Sueda S., Kohno H., Fucuda H. et al. (2003) Limitations of medical therapy in patients with pure coronary spastic angina. Chest, 123: 380-386.
- The Scandinavian Simvastatin Survival Study group (1994) Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet, 344: 1383-1389.
- Yusuf S., Slight P., Pogue J. et al. (2000) Effects of an angiotensin-converting-enzime inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcames Prevention Evaluation (HOPE study). N. Engl. J. Med., 342:145-153.