Диагностика и лечение экстрасистолии и парасистолии
Содержание
- ЭТИОЛОГИЯ
- ПАТОГЕНЕЗ
- ОБСЛЕДОВАНИЕ БОЛЬНЫХ
- Инструментальные методы — ЭКГ-диагностика экстрасистолии
- Инструментальные методы — ЭКГ-диагностика парасистолии
- Другие методы инструментальной диагностики
- КЛИНИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
- КЛАССИФИКАЦИИ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ
- КЛАССИФИКАЦИИ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
- ПРИНЦИПЫ ВЕДЕНИЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ
- ЛЕЧЕНИЕ ЭКСТРАСИСТОЛИИ В ОТДЕЛЬНЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
- ВЫВОДЫ
- ЛИТЕРАТУРА
Экстрасистолия — наиболее распространенное нарушение сердечного ритма, которое может значительно влиять на качество жизни больных, быть маркером структурно-функциональных изменений миокарда и свидетельствовать о вероятности возникновения опасных для жизни аритмий сердца. Усовершенствование стратегии ведения больных с экстрасистолической аритмией прежде всего связано с развитием концепции стратификации риска, то есть распределения пациентов на группы в зависимости от степени риска смерти от всех причин и, в частности, внезапной сердечной смерти. Кроме того, активно внедряются современные инструментальные методы диагностики аритмий сердца, прежде всего — амбулаторное мониторирование ЭКГ. В клинической практике существует очевидная потребность в создании согласованных рекомендаций по ведению больных с экстрасистолией, обобщении диагностических и терапевтических подходов. В этих рекомендациях рассматривают принципы ЭКГ-диагностики экстрасистолии и парасистолии, изложены основные методы обследования больных, а также пути выбора тактики лечения. Публикация подготовлена на основе современных руководств по ЭКГ-диагностике, современных согласованных рекомендаций по диагностике и лечению аритмий сердца и стратификации риска.
ЭТИОЛОГИЯ
Появление экстрасистолии могут вызвать какие-либо структурные заболевания сердца.
Особенно часто ее выявляют у больных с острым ИМ и хронической ИБС. Впрочем, экстрасистолия может возникать также при других поражениях миокарда, в том числе субклинических. У многих больных с экстрасистолией доступными инструментальными исследовательскими приемами не находят каких-либо признаков поражения сердца.
Наиболее частые причины и факторы, ассоциированные с экстрасистолией:
- Болезни миокарда, эндокарда и коронарных артерий сердца: ИБС, миокардиты, миокардиофиброз, кардиомиопатии, пороки сердца. АГ или гипотензия, СН, а также нарушение коронарного кровообращения также способствуют появлению экстрасистолии.
- Электролитный дисбаланс (гипокалиемия, гиперкалиемия, гипомагниемия, гипокальциемия), нарушение кислотно-щелочного равновесия.
- Гипоксия: заболевания легких, легочная гиповентиляция (например во время проведения операции).
- Травматические влияния: травма грудной клетки, операция на сердце, катетеризация полостей сердца, травмы головного и спинного мозга.
- Нарушение вегетативной регуляции: НЦД, неврозы, диэнцефалит, симпатический ганглионит и трунцит, психоэмоциональное напряжение.
- Патологические рефлексы, обусловленные заболеваниями органов пищеварения (пептическая язва, желчекаменная болезнь, панкреатит, диафрагмальная грыжа, колит и энтероколит, особенно если они сопровождаются метеоризмом, запором или нарушениями электролитного баланса); дистрофические изменения в шейном и грудном отделах позвоночника (остеохондроз, спондилоартроз); болезни бронхов и легких, особенно сопровождающиеся изнурительным кашлем; аденома простаты.
- Диагностические процедуры: эндоскопия (бронхоскопия, гастроскопия, лапароскопия, цистоскопия, кольпоскопия, ректоскопия), пункция, массаж каротидного синуса, надавливание на глазные яблоки, задержка дыхания на глубоком вдохе.
- Аллергия: пищевая, медикаментозная, микробная, профессиональная, бытовая.
- Фармакодинамическое и токсическое действие лекарственных средств, таких как сердечные гликозиды, хинидин, прокаинамид, средства для наркоза (особенно циклопропан, фторотан, эфир), морфин, глюкокортикоиды, препараты калия, кальция, трициклические антидепрессанты (амитриптиллин), производные фенотиазина, дифрил, фенилбутазон, салицилаты, гидразид изоникотиновой кислоты, атропин, эфедрин, эпинефрин, эдепиран, орципреналин.
ПАТОГЕНЕЗ
Электрофизиологические механизмы. Основные электрофизиологические механизмы экстрасистолии — re-entry (обратный вход возбуждения) и постдеполяризация. В основе возникновения экстрасистол могут лежать также механизмы асинхронного восстановления возбудимости миокарда и патологического автоматизма.
Условия формирования механизма re-entry:
а) наличие стойкой замкнутой петли, длина которой зависит от периметра невозбудимого анатомического препятствия, вокруг которого двигается импульс;
б) однонаправленная блокада проведения в одном из сегментов петли re-entry;
в) ретроградное возвращение возбуждения по ранее заблокированному сегменту к точке исходящей деполяризации, вышедшей к этому времени из состояния рефрактерности.
Ранняя постдеполяризация возникает при остановке или замедлении реполяризации ПД, который начинается при потенциале покоя 75–90 мВ. Существует два подвида ранней постдеполяризации. При первом она формируется при задержке реполяризации в фазе 2-го ПД, то есть на уровне мембранных потенциалов от —3 мВ до —30 мВ; при втором подвиде реполяризация задерживается в фазе 3-го ПД, то есть на уровне мембранных потенциалов от —50 до —70 мВ. ПД может изменяться под влиянием таких факторов, как гиперкатехоламинемия, гипокалиемия, ацидоз, гипокальциемия, ишемия, действие аконитина, метаболита прокаинамида, соталола, и т.п. Под влиянием этих факторов усиливается деполяризующий поток ионов, входящих в клетку (так называемый поток Nа+-окна) в фазе плато с удлинением ПД и одновременным торможением реполяризации в фазе 3. Установлена также связь ранней постдеполяризации с электрогенным кальций-ионообменным механизмом и, возможно, с увеличением входа ионов кальция, что подтверждается возможностью угнетения верапамилом колебаний потенциала в фазах 2 и 3 ПД.
Поздняя постдеполяризация — электрические осцилляции в фазе 4 ПД, которым обычно предшествует гиперполяризация клеточной мембраны. Если амплитуда этих осцилляций увеличивается и достигает порога возбуждения, возникает наведенный импульс — новый преждевременный ПД. Увеличение амплитуды задержанной постдеполяризации возникает при повышении концентрации ионов кальция в клетках. Задержанная постдеполяризация стимулируется ускорением сердечного ритма. Такой феномен можно выявить при синусовой тахикардии у больных с ИБС, ГЛЖ, кардиомиопатией.
ОБСЛЕДОВАНИЕ БОЛЬНЫХ
Обследование больных с экстрасистолической аритмией должно включать методы, обеспечивающие диагностику нарушений сердечного ритма, определение клинического и прогностического значения аритмии, выбор лечения и оценку его эффективности.
Анамнез. При опросе больного выясняют такую информацию:
- Субъективные проявления аритмии (сердцебиение, перебои в работе сердца, толчки или «замирание» сердца, дискомфорт в груди, ощущение нехватки воздуха, одышка, головокружение, синкопальные состояния), длительность существования нарушений ритма;
- Наличие факторов, провоцирующих аритмию (физическая нагрузка, психоэмоциональный стресс, определенное время суток, положение тела, прием пищи, алкоголь, курение);
- Перенесенные за последнее время заболевания;
- Фоновая кардиальная патология;
- Предшествующий прием антиаритмических препаратов (каких именно, их разовые и суточные дозы, длительность приема, эффективность, побочные явления).
Клиническое обследование. Выявление аритмий при аускультации сердца или при пальпации периферических артерий. Наличие клинических признаков СН.
Лабораторные методы исследования. Определение содержания калия, натрия, креатинина в сыворотке крови, активности тиреотропного гормона.
Инструментальные методы — ЭКГ-диагностика экстрасистолии
Экстрасистолы — преждевременные комплексы, обычно имеющие фиксированный интервал сцепления с предшествующим импульсом базисного ритма. По локализации различают суправентрикулярные (синусовые, предсердные, из AV-соединения) и желудочковые экстрасистолы.
Синусовые экстрасистолы и экстрасистолы из AV-соединения выявляют редко, соответственно в 0,2 и 2% случаев. Значительно чаще, по данным М.С. Кушаковского (1992), регистрируют предсердные (25%) и желудочковые (62,6%) экстрасистолы. Синусовые экстрасистолы характеризуются неизменной формой зубца Р и отсутствием компенсаторной паузы. Точно диагностировать синусовую экстрасистолию можно только с помощью инвазивного ЭКГ-исследования.
Предсердные экстрасистолы идентифицируют по двум основным признакам: преждевременным (относительно основного ритма), измененным по форме и/или полярности зубцом Р, а также несколько увеличенной по сравнению с обычным сердечным циклом постэкстрасистолической паузой. Чаще отмечают нижнепредсердные экстрасистолы с отрицательным зубцом Р перед комплексом QRS в отведениях II, III, аVF (рис. 1.1). При левонижнепредсердных экстрасистолах отрицательный зубец Р регистрируют также в отведениях I, aVL, V5–V6, а в отведении V1 иногда экстрасистолический зубец Р имеет двугорбую форму («щит и меч» или «купол и шпиль»). Интервал P–Q предсердных экстрасистол может быть укороченный — до 0,09 с, нормальной длительности или удлиненный (больше 0,20 с), что зависит от места возникновения и условий AV-проведения эктопического импульса.
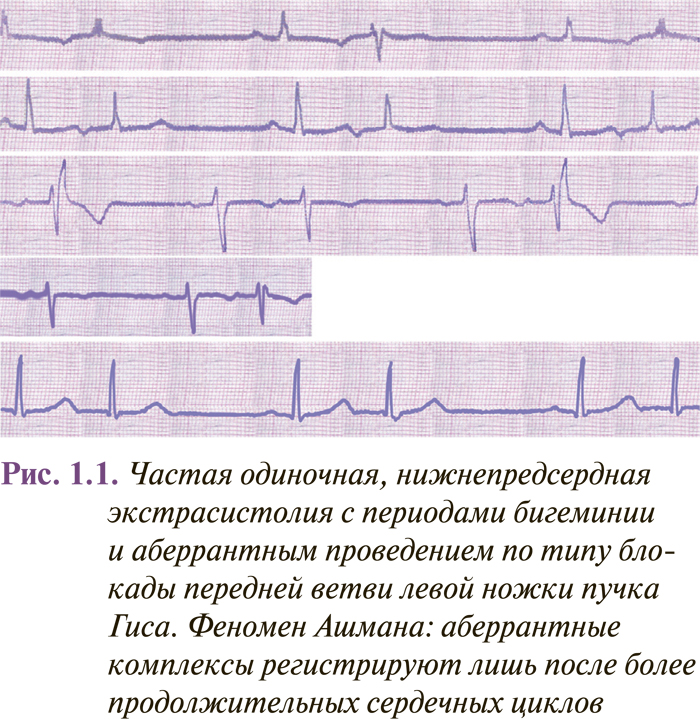
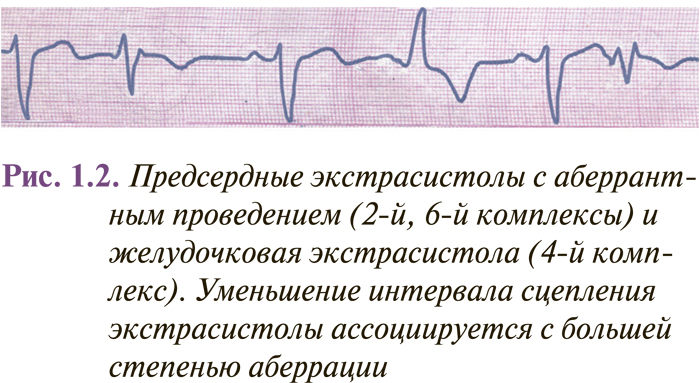
Комплекс QRS предсердной экстрасистолы иногда имеет аберрантную (измененную) форму вследствие функциональной внутрижелудочковой блокады, возникающей при проведении преждевременного импульса (рис. 1.1–1.2). Такие экстрасистолы следует дифференцировать с желудочковыми экстрасистолами, особенно если эктопический зубец Р наслаивается на зубец Т предыдущего комплекса, который при этом несколько деформируется. Аберрантные комплексы QRS суправентрикулярных экстрасистол наиболее часто имеют вид неполной или полной блокады правой ножки пучка Гиса и трехфазную форму в отведениях V1 (rSr’ или rSR’) и V6 (QRS). Иногда они могут иметь форму других нарушений внутрижелудочковой проводимости (см. рис. 1.1). Вероятность возникновения аберрантного желудочкового комплекса повышается при ранних предсердных экстрасистолах (при интервале сцепления меньше 44% предыдущего Р–Р) и экстрасистолах, возникающих при низкой частоте базисного ритма или когда предэктопическому интервалу предшествует удлиненный R–R (феномен Ашмана) (см. рис. 1.1).
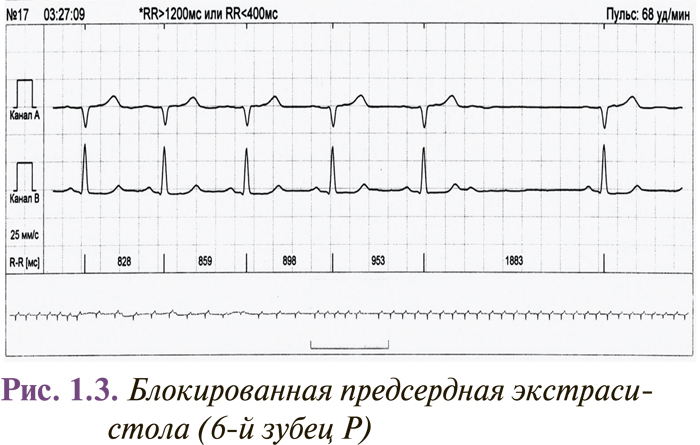
Блокированная предсердная экстрасистола (преждевременное возбуждение предсердий без последующего возбуждения желудочков) возникает вследствие блокады эктопического импульса в AV-соединении, которое находится в состоянии абсолютной рефрактерности. Глубокое проникновение экстрасистолического импульса в участок AV-соединения может приводить к удлинению интервала P–Q в следующих комплексах, появлению периодики Венкебаха и даже возникновению кратковременной субтотальной или полной AV-блокады (рис. 1.3). Блокированная предсердная экстрасистолия может имитировать синоатриальную блокаду или синусовую брадикардию (блокированная предсердная бигеминия) в тех случаях, когда экстрасистолический зубец Р наслаивается на зубец Т предыдущего комплекса.
Экстрасистолы из AV-соединения разделяют на такие ЭКГ-варианты:
а) с одновременным возбуждением предсердий и желудочков;
б) с предварительным возбуждением желудочков;
в) с вентрикуло-атриальной блокадой I степени;
г) скрытые экстрасистолы.
При экстрасистолии из АV-соединения импульс одновременно распространяется вверх к предсердиям (ретроградно) и вниз (антероградно) к желудочкам. Соотношение скорости ретроградного и антероградного проведения определяет ЭКГ-картину АV-экстрасистолии. При АV-экстрасистолии с одновременным возбуждением предсердий и желудочков на ЭКГ обычно регистрируют преждевременный комплекс QRS суправентрикулярной формы; зубец Р’ на поверхностной ЭКГ незаметен, но его можно идентифицировать другими методами (усиленная, чреспищеводная или внутрипредсердная электрограммы). Для экстрасистол из АV-соединения с предварительным возбуждением желудочков характерна регистрация на ЭКГ преждевременного комплекса QRS, чаще суправентрикулярной формы, на сегменте ST или зубце Т которого расположен отрицательный (в отведениях II, III, аVF) зубец Р’.
Если у АV-экстрасистолы интервал R–Р’ длится больше 0,20 с, то говорят о замедлении ретроградного проведения, что может быть предвестником возникновения реципрокных импульсов и ритмов. В случае полной ретроградной блокады экстрасистолического импульса возможно появление вставной экстрасистолы из АV-соединения или регистрация экстрасистолы с полной компенсаторной паузой (узловые экстрасистолы). Для экстрасистол из АV-соединения считается типичной суправентрикулярная форма комплекса QRS, но он может иметь также аберрантный вид, чаще по типу блокады правой ножки пучка Гиса (полной или неполной), что усложняет дифференциальную диагностику аберрантных АV-экстрасистол с желудочковыми. Импульс АV-экстрасистолы может блокироваться одновременно в антеро- и ретроградном направлении — скрытые АV-экстрасистолы. Эти экстрасистолы не регистрируют на ЭКГ, но они имитируют различные формы нарушения АV-проводимости: АV-блокаду I степени, появляющуюся периодически; чередование нормальных и удлиненных интервалов P–Q при скрытой АV-тригеминии; АV-блокаду II степени 1-го типа, II степени 2-го типа (блокада псевдо-Мобитц I) или II степени с проведением 2:1. Наличие скрытой АV-экстрасистолии можно предположить в случаях чередования на ЭКГ нарушений АV-проводимости и реализованных в антероградном направлении АV-экстрасистол. В этих случаях внутрисердечное электрофизиологическое исследование позволяет выявить скрытые АV-экстрасистолы или выявить другую причину нарушения проводимости.
Основные ЭКГ-признаки желудочковых экстрасистол:
1) преждевременное появление расширенного и деформированного по отношению к основному ритму комплекса QRS без предшествующего ему зубца Р, исключая поздние экстрасистолы, перед которыми регистрируются зубцы Р, не имеющие электрофизиологической связи с желудочковыми экстрасистолами;
2) наиболее часто — наличие полной компенсаторной паузы.
Форма желудочковых экстрасистол зависит не только от локализации источника экстрасистолии, но и от скорости и пути распространения импульса в желудочках. Поэтому ЭКГ дает возможность ориентировочно установить расположение эктопического очага по морфологии экстрасистолического комплекса. Если желудочковая экстрасистола имеет вид блокады правой ножки и левой передней ветви пучка Гиса, источник ее находится в системе левой задней ветви пучка Гиса, то есть в задней стенке ЛЖ; если желудочковая экстрасистола имеет вид блокады правой ножки и задней нижней ветви пучка Гиса, источник ее находится в левой передней ветви пучка Гиса; если желудочковая экстрасистола имеет вид полной блокады левой ножки пучка Гиса, источник ее находится в правой ножке пучка Гиса.
Комплекс QRS левожелудочковой экстрасистолы в правых грудных отведениях имеет моно- или бифазную форму: R, qR, RR’, RS, Rs, а в левых — rS или QS. Комплекс QRS правожелудочковой экстрасистолы в правых грудных отведениях имеет форму rS или QS, а в левых — R (табл. 1.1). Если желудочковая экстрасистола возникает в участке межжелудочковой перегородки, обычно длительность и форма ее незначительно отличаются от комплекса QRS основного ритма. Форма QRS типа rSR’ в отведении V1 характерна для экстрасистолы из левой половины межжелудочковой перегородки, а тип R или qR в отведении V6 — для экстрасистол из правой половины перегородки. Направленность комплекса QRS экстрасистолического комплекса во всех грудных отведениях вверх позволяет предположить локализацию источника желудочковой экстрасистолы в базальных отделах сердца, а направленность комплекса QRS вниз — в участке верхушки (см. табл. 1.1). В сложных для топической диагностики случаях точный источник экстрасистолы не указывают, ограничившись выводом о наличии желудочковых экстрасистол.
Таблица 1.1
Характерные формы комплексов желудочковых экстраситол в грудных отведениях ЭКГ при базальной, промежуточной и верхушечной их локализации
| Локализация экстрасистол | Формы комплексов ЖЭ в отведениях ЭКГ | ||||||
| V1 | V2 | V3 | V4 | V5 | V6 | ||
| Правожелудочковые | Базальные | Rs, RS | RS | R | R | R | R |
| Промежуточные | rS, QS | rS | rS | rS, RS | R | R | |
| Верхушечные | rS, QS | rS, QS | rS | rS | rS, RS | Rs, RS | |
| Левожелудочковые | Базальные | R | R | R | R | Rs | RS, Rs |
| Промежуточные | R, qR, RR’, RS, Rs | R, Rs | RS | RS, rS | rS | rS, QS | |
| Верхушечные | RS, Rs | rS, RS | rS | rS | rS | rS | |
| Базальные | R | R | R | R | R | R | |
| Верхушечные | rS | rS | rS | rS | rS | rS | |
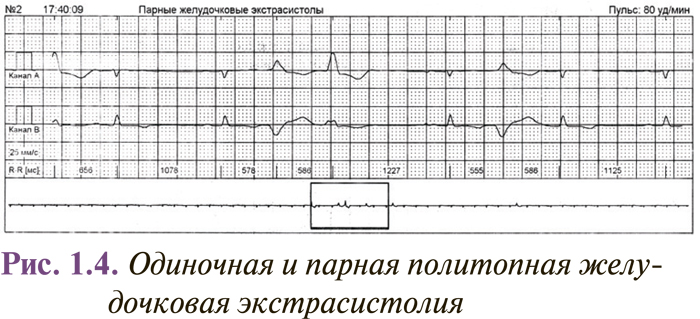
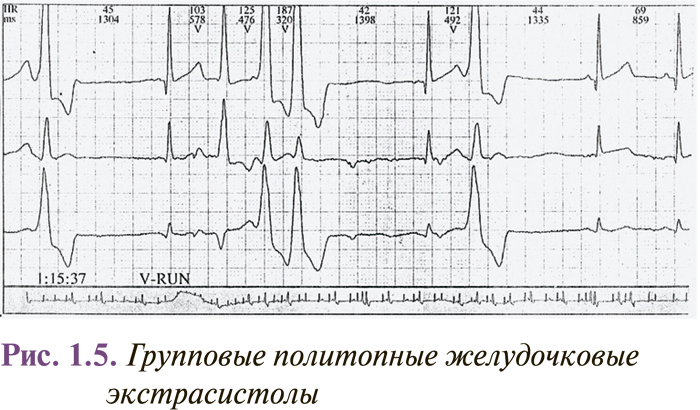
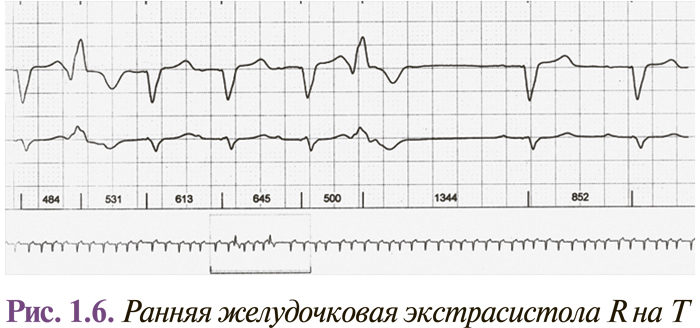
Интервалы сцепления монотопных желудочковых экстрасистол одинаковы, несмотря на то что форма их может быть разной (в этом случае они являются полиморфными). Колебание интервалов сцепления монотопных экстрасистол обычно не превышает 0,06–0,10 с. Политопные желудочковые экстрасистолы имеют разные по длительности интервалы сцепления и, как правило, разную форму комплексов QRS. Две экстрасистолы подряд называются парными (рис. 1.4), а 3–5 — групповыми, «залповыми» (рис. 1.5), или пробежками желудочковой тахикардии. Выделяют также ранние и очень ранние желудочковые экстрасистолы (R на Т) (рис. 1.6). Экстрасистолия может быть нерегулярной (монотопная или политопная), а появление ее с определенной закономерностью определяется как аллоритмия (бигеминия, тригеминия, квадригеминия, и т.п.).
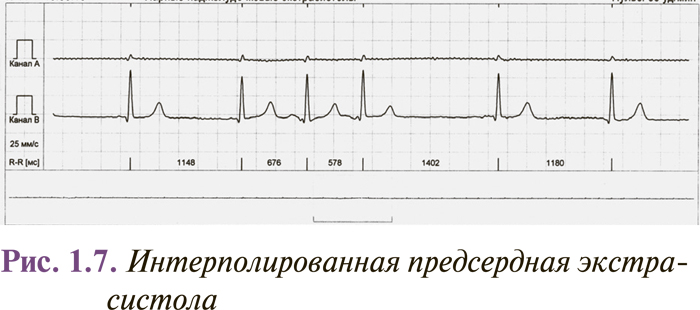
Интерполированные предсердные или желудочковые экстрасистолы регистрируют между двумя нормальными комплексами QRS, обычно на фоне брадикардии (рис. 1.7).
Желудочковую экстрасистолию на фоне фибрилляции предсердий необходимо дифференцировать с аберрантными желудочковыми комплексами. Укороченный кардиоцикл при фибрилляции предсердий, заканчивающийся аберрантным желудочковым комплексом, в отличие от предэкстрасистолического интервала, не сопровождается компенсаторной паузой и ему предшествует удлиненный интервал R–R. Аберрантные комплексы QRS, как правило, имеют форму блокады правой ножки пучка Гиса разной степени выраженности в отведении V1 (rSR’, rSr’), а левожелудочковые экстрасистолы — форму R, RS, Rs, qR, RR’ или Rr’ (табл. 1.2).
Таблица 1.2
Дифференциальная диагностика суправентрикулярных экстрасистол с аберрацией внутрижелудочковой проводимости и желудочковых экстрасистол
| Признаки | Суправентрикулярная экстрасистолия с аберрацией | Желудочковая экстрасистолия |
| Морфология QRS в отведении V1: | ||
| rSR‘, rsR‘ | Характерно | Не характерно |
| qR, R, rR‘ с расщеплением на восходящем колене | Очень редко | Не характерно |
| qR, R, RS, Rsr‘, RR‘ с расщеплением на нисходящем колене | Не характерно | Характерно |
| rS, QS | Не характерно | Характерно |
| Морфология QRS в отведении V6: | ||
| qRS | Характерно | Не характерно |
| rS, QS | Не характерно | Характерно |
| Превалирование положительных или отрицательных зубцов комплекса QRS во всех грудных отведениях | Не характерно | Характерно |
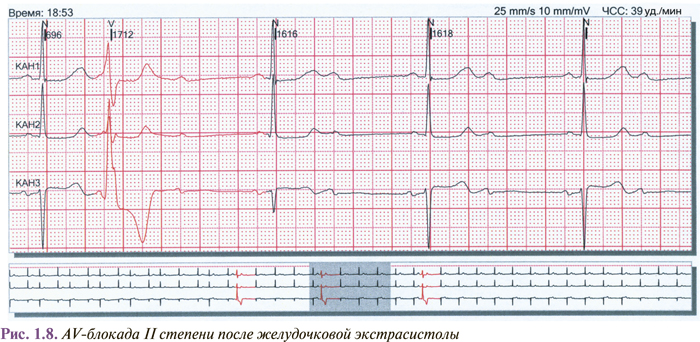
Экстрасистолия нередко сопровождается различными изменениями хроно- и дромотропной функций сердца (постэкстрасистолические феномены). Среди них чаще всего встречаются неспецифические изменения зубца Т, обратные (реципрокные) импульсы, увеличение продолжительности сердечного цикла более чем на 0,3 с, а также AV-блокада I степени. Не чаще чем в 1% случаев отмечают постэкстрасистолическую АV-диссоциацию, AV-блокаду II степени (рис. 1.8), активацию предсердного или AV-ритма, исчезновение блокады ножки пучка Гиса, исчезновение или появление феномена преэкзитации, исчезновение или появление пароксизмальной AV-узловой реципрокной тахикардии, изменения сегмента ST.
Инструментальные методы — ЭКГ-диагностика парасистолии
Парасистолия — автономная активность эктопического центра, которая не зависит от основного сердечного ритма и сосуществует с ним. Двойное ритмообразование становится возможным благодаря защите парацентра от разрядки более частыми импульсами основного ритма, обычно — синоатриального узла (так называемая блокада входа или защитная блокада). Тем не менее вследствие блокады выхода не все импульсы парацентра вызывают возбуждение миокарда. Парацентр — это группа пораженных клеток, способных к спонтанной диастолической деполяризации. Клетки, размещенные вокруг ядра парацентра, настолько гипополяризованы, что создают условия для возникновения одно- или двунаправленной блокады.
По локализации парацентра различают парасистолии: желудочковые, из AV-соединения, предсердные, синусовые, из дополнительных предсердно-желудочковых путей, объединенные (из разных отделов проводящей системы сердца) и дублированные или множественные (из той же камеры сердца). Выделяют такие ЭКГ-варианты парасистолических ритмов: брадикардическая парасистолия с блокадой входа, тахикардическая парасистолия с блокадой выхода, интермиттирующая парасистолия, переходная между экстра- и парасистолией (атипичная) форма множественной парасистолии (из нескольких камер сердца), искусственная парасистолия (на фоне искусственного водителя ритма).
Характерные признаки парасистолии (рис. 1.9):
- Колебание предэктопических интервалов мономорфных комплексов QRST или PQRST, не превышающих в покое 80–100 мс.
- Правило кратности: длина межэктопических интервалов кратна наиболее короткому интервалу между двумя последовательными парасистолами, что отображает автоматизм парацентра. Впрочем, нередко отмечают отклонения от этого правила, обусловленные умеренными колебаниями автоматизма парацентра и нарушениями проводимости в миокарде, окружающем парацентр.
- Сливные комплексы, указывающие на то, что часть миокарда возбуждается синусовым, а другая его часть — парасистолическим импульсом. При желудочковой парасистолии регистрируют сливные комплексы QRS, а при суправентрикулярной — сливные зубцы Р.
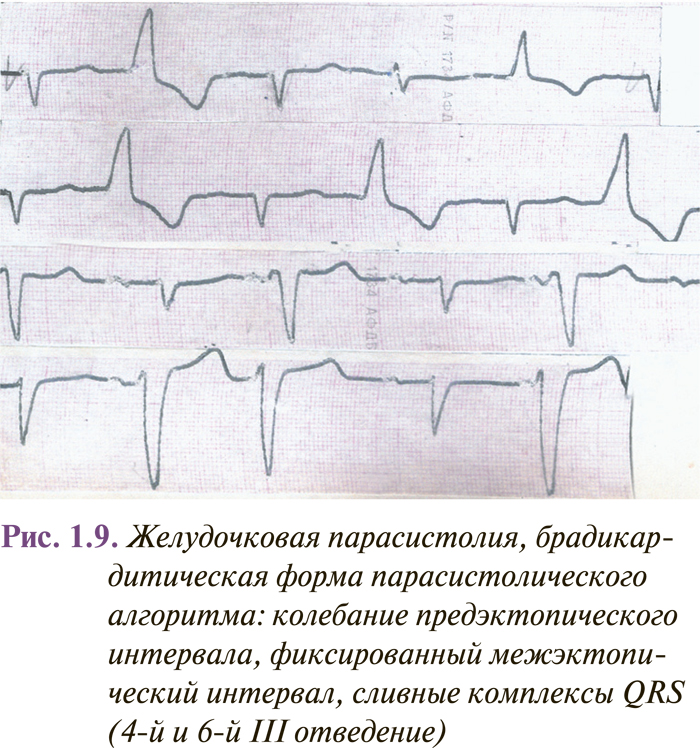
Чаще всего выявляют непрерывную брадикардитическую (меньше 60 импульсов/мин) желудочковую парасистолию. Обычно автоматизм парацентра ниже автоматизма синусного узла. Импульсы из парацентра вызывают возбуждение миокарда желудочков в случае, если они попадают во внерефрактерную фазу. При отсутствии разрядки синусного узла после желудочковой парасистолии, как правило, отмечают компенсаторную паузу. Если парасистола проводится ретроградно на предсердие, то за парасистолическим комплексом QRS выявляют отрицательный зубец Р во II, III, аVF отведениях и неполную компенсаторную паузу.
Непрерывная тахикардитическая желудочковая парасистолия с блокадой выхода — более редкий вариант парасистолии, при котором парацентр генерирует импульсы чаще, чем основной водитель ритма. Блокада выхода II степени 1-го типа проявляется периодикой Венкебаха межэктопических интервалов. Они прогрессивно укорачиваются и заканчиваются продолжительной паузой, которая меньше удвоенного кратчайшего интервала между парасистолами.
Для блокады выхода II степени 2-го типа характерно отсутствие очередной парасистолы или нескольких подряд, причем интервал между парасистолами кратен кратчайшему интервалу между ними. При исчезновении блокады выхода возникает парасистолическая тахикардия (с частотой больше 100 импульсов/мин) или ускоренный парасистолический ритм (с частотой до 100 импульсов/мин).
Интермиттирующую желудочковую парасистолию отмечают при непостоянной активности парацентра. В основе этой формы парасистолии лежит истинная, более или менее продолжительная остановка парацентра с дальнейшим восстановлением его активности. Интермиттирование возникает при временном исчезновении блокады входа и разрядке парацентра.
Парасистолию из участка AV-соединения чаще отмечают в двух вариантах: с одновременным возбуждением предсердий и желудочков или с предварительным возбуждением желудочков. В последнем случае зубцы Р’ инвертированы в отведениях II, III, aVF и могут формироваться сливные зубцы Р. Предсердную парасистолию наиболее часто выявляют в брадикардитической форме. Эктопические зубцы Р отличаются формой, а иногда полярностью от синусовых. При предсердной парасистолии также могут формироваться сливные зубцы Р. Парасистолия с фиксированным предэктопическим интервалом является атипичной формой парасистолии. Эта ситуация возникает при совпадении автоматизма независимых водителей ритма или вследствие барорецепторного рефлекса из синокаротидных зон. При выполнении больным физической нагрузки или после атропиновой пробы происходит восстановление измененного предэктопического интервала.
Другие методы инструментальной диагностики
Ритмография — регистрация длительности интервалов R–R в виде вертикальных штрихов на бумажной ленте при скорости ее движения 10 мм/с, что позволяет провести количественную характеристику экстрасистолии в покое и при функциональных пробах; выявить имеющуюся и скрытую аллоритмию, пароксизмальный характер экстрасистолии, определить колебание интервалов сцепления; четко распознать парасистолию; оценить состояние вегетативной регуляции сердечного ритма. Доминирование на ритмограмме дыхательных волн (колебание длительности сердечных циклов с периодом 3–7 с) свидетельствует о преимуществе парасимпатического тонического влияния на сердце. Отсутствие дыхательной аритмии и доминирование медленных волн сердечного ритма (колебание длительности сердечных циклов с периодами более 10 с) указывает на усиление симпатического тонуса на фоне снижения парасимпатических влияний.
Определение исходного вегетативного тонуса целесообразно проводить у больных с экстрасистолией по двум причинам: во-первых, у многих пациентов отмечают разные варианты нарушений вегетативной регуляции, во-вторых, большинство известных антиаритмических препаратов могут целенаправленно изменять функциональное состояние симпатического и парасимпатического отделов вегетативной нервной системы, что может потенцировать или снижать антиаритмическое действие лекарственных средств. Более точное представление о состоянии вегетативной регуляции можно получить при оценке вариабельности ритма сердца методом суточного мониторирования ЭКГ.
Холтеровское мониторирование ЭКГ позволяет регистрировать ЭКГ без ограничения двигательного режима больного на протяжении 24 ч и более с последующим автоматизированным анализом записи. Оценивают общее количество экстрасистол за время наблюдения, их распределение в течение суток, связь с физическими или эмоциональными нагрузками, ЧСС, приемом пищи, изменением положения тела, преходящими эпизодами ишемии миокарда.
Холтеровское мониторирование ЭКГ — эталонный метод диагностики относительно нечастой экстрасистолии, а также оценки тяжести преждевременных желудочковых или наджелудочковых сокращений, выявленных во время регистрации ЭКГ. Холтеровское мониторирование ЭКГ разрешает точнее, чем кратковременная регистрация ЭКГ, осуществлять качественную и количественную оценку нарушений сердечного ритма вследствие значительно большего количества оцениваемых эктопических комплексов. Одиночные суправентрикулярные или желудочковые экстрасистолы являются довольно частой находкой при холтеровском мониторировании ЭКГ у практически здоровых лиц.
Для выявления экстрасистол при автоматической обработке сигнала ЭКГ используют коэффициент преждевременности — отношение разности между базовым интервалом R–R (RRn) и предэкстрасистолическим интервалом R–R (RRex) к базовому интервалу R–R (рис. 1.10).
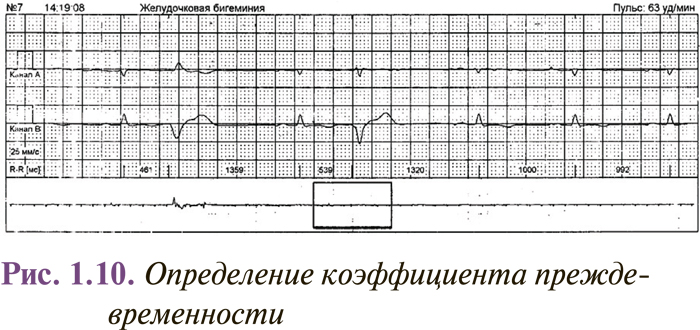
Сокращение расценивается как преждевременное, если этот показатель превышает 20%.
Сравнение циркадных изменений количества экстрасистол и ЧСС позволяет отличать тахи- и брадизависимые формы экстрасистолии. Одним из наиболее распространенных суточных типов распределения экстрасистолии является вагусный (вагозависимый или ночной), когда преждевременные комплексы регистрируют более чем в 1,5 раза чаще в пассивный период суток на фоне замедления синусового ритма. Вагозависимую желудочковую экстрасистолию чаще выявляют у молодых людей без признаков патологии сердца, нередко случайно, больными она не ощущается. Такая форма экстрасистолии преимущественно не нуждается в антиаритмической терапии. При адренергическом (симпатозависимом или дневном типе) среднее количество экстрасистол в час в 1,5 раза больше в активный период суток, а экстрасистолы часто связаны с ускорением синусового ритма. Адренергический тип желудочковой экстрасистолии более характерен для пожилых людей, особенно с ИБС, АГ, пороками сердца, ДКМП и ГКМП, миокардиофиброзом. В отличие от вагусного типа такая экстрасистолия не является доброкачественной, нередко при этом заболевании необходимо назначение антиаритмических препаратов. Очень часто отсутствует связь количества экстрасистол с периодом суток и ЧСС. Могут также отмечать гектический тип распределения экстрасистол со значительным колебанием их количества в разное время. Такая высокая эктопическая активность на протяжении короткого периода иногда может быть связана с рецидивирующей ишемией миокарда. В общем, применение холтеровского мониторирования ЭКГ существенно повышает возможность выявления экстрасистолии и парасистолии, зависимость от времени суток, уточнение ее форм и вариантов.
Метод холтеровского мониторирования ЭКГ позволяет оценивать изменения вариабельности сердечного ритма в течение суток. В частности, снижение стандартного показателя вариабельности сердечного ритма — стандартного отклонения интервалов R–R в течение суток (SDNN) ниже 50 мс свидетельствует о дисбалансе вегетативной регуляции сердечного ритма и является одним из предикторов возникновения внезапной сосудистой смерти у больных с постинфарктным кардиосклерозом, систолической дисфункцией ЛЖ и СН и сохраненным синусовым ритмом. Наиболее мощным предвестником риска возникновения жизненно опасной аритмии было сочетание низкой вариабельности сердечного ритма со сниженной ФВ ЛЖ и нарушенной чувствительностью барорефлекса (исследование ATRAMI, 1998). Подчеркнем, что частая желудочковая экстрасистолия является ограничением для оценки временных и спектральных показателей вариабельности сердечного ритма.
При холтеровском мониторировании ЭКГ обращают внимание также на длительность и вариабельность интервала сцепления, а также длительность интервала Q–T. Важна оценка суточных колебаний корригированного интервала Q–T, даже при его незначительном увеличении может увеличиваться продолжительность чувствительного периода сердечного цикла и склонность к возникновению пароксизмов пируэт-тахикардии.
Повторное холтеровское мониторирование ЭКГ на фоне лечения позволяет оценить эффективность назначенной терапии. С учетом выраженных спонтанных колебаний частоты возникновения аритмий сердца разработаны критерии эффективности антиаритмической терапии у больных с желудочковыми аритмиями:
а) уменьшение общего количества желудочковых экстрасистол за 1 сут более чем на 50–75%;
б) уменьшение количества парных и ранних желудочковых экстрасистол на 90% и более;
в) полное устранение эпизодов желудочковой тахикардии;
г) при полиморфной желудочковой экстрасистолии — уменьшение количества морфологических типов экстрасистол до 1–2.
Об аритмогенном действии антиаритмического препарата свидетельствуют:
- увеличение общего количества экстрасистол в 3–4 раза;
- увеличение количества парных желудочковых экстрасистол и эпизодов нестойкой желудочковой тахикардии на протяжении 1 сут в 10 раз;
- появление раньше не документированной стойкой желудочковой тахикардии.
Оценивая адекватность лечения антиаритмическим препаратом, кроме перечисленных критериев необходимо также учитывать особенности его влияния на синусовый ритм, проводимость, частоту ишемических эпизодов.
Интерпретация данных холтеровского мониторирования ЭКГ при оценке эффективности антиаритмической терапии имеет определенные ограничения. При применении антиаритмических препаратов 1-го класса по классификации V. Williams оценка эффективности по указанным количественным критериям не позволяет предвидеть улучшение прогноза выживаемости больных при длительном лечении. Более того, использование некоторых препаратов (флекаинида, энкаинида) в контролируемых исследованиях ассоциировалось со значительным повышением вероятности внезапной сосудистой смерти. Учитывая это, у пациентов с тяжелым структурным поражением миокарда (дисфункция ЛЖ после перенесенного ИМ или при ДКМП, с/без СН) лечение начинают с проведения терапии этиопатогенетической направленности: корригируют ишемию и гемодинамические нарушения. При наличии дисфункции ЛЖ и частых симптомных желудочковых экстрасистолий к базисной превентивной терапии (ингибиторы АПФ, блокаторы β-адренорецепторов, ацетилсалициловая кислота, статины) добавляют амиодарон или соталол — средства с доказанной эффективностью в профилактике злокачественных желудочковых аритмий. Следует отметить, что блокаторы β-адренорецепторов и амиодарон могут назначать эмпирически, с учетом доказанной способности этих препаратов улучшать прогноз выживания больных и независимо от изменения количества нарушений сердечного ритма. В этих ситуациях холтеровское мониторирование ЭКГ целесообразно проводить в динамике для оценки течения нарушений сердечного ритма на фоне антиаритмической терапии. А в ситуациях, когда применение антиаритмических препаратов вызвано, в первую очередь, клинической значимостью нарушений ритма, а не их прогностическим значением, определяющим критерием эффективности препарата, является уменьшение выраженности симптомов, обусловленных аритмией. Отметим также, что наиболее эффективным средством профилактики внезапной сердечной смерти у пациентов с критериями ее высокого риска является имплантация внутреннего кардиовертера-дефибриллятора.
Пробы с физической нагрузкой (проба Мастера, степ-тест, ВЭМ, тредмил-тест) могут провоцировать появление экстрасистолической аритмии во время нагрузки и в ранний восстановительный период вследствие повышения активности САС, увеличения выброса катехоламинов, развития тканевой гипоксии, ацидоза. У больных с хронической ИБС во время проведения ВЭМ желудочковые экстрасистолы выявляют у 60% обследованных, а их частота нередко коррелирует со смещением сегмента ST. Под влиянием физической нагрузки могут измениться количество и градация экстрасистолии: увеличение количества экстрасистол во время нагрузки при высокой ЧСС или в первую минуту после ее прекращения свидетельствует о возможной ее связи с ИБС; доброкачественные экстрасистолы, как правило, исчезают во время нагрузки и восстанавливаются через 3–5 мин после ее окончания. Необходимо учитывать диагностическое ограничение пробы с нагрузкой: у части больных не удается спровоцировать экстрасистолию, диагностированную ранее; у 11–40% пациентов со здоровым сердцем при физической нагрузке может появиться одиночная экстрасистолия, а у 5% — парная; у некоторых больных при физической нагрузке могут исчезать даже групповые и ранние экстрасистолы.
Ортостатическая проба позволяет уточнить характер экстрасистолической аритмии: стабильная экстрасистолия существует в покое и при функциональных пробах; лабильная экстрасистолия напряжения появляется или усиливается при ортостатической пробе и стандартной нагрузке мощностью 50 Вт; лабильная экстрасистолия покоя исчезает при ортостатической пробе и физической нагрузке мощностью 50 Вт и появляется после перехода в горизонтальное положение. Считается, что лабильная экстрасистолия напряжения и стабильная экстрасистолия наиболее вероятно связаны с наличием заболевания сердца и/или стойкого субстрата аритмии, а лабильная экстрасистолия покоя, как правило, — функциональная (вагусная).
Для уточнения связи экстрасистолической аритмии с влиянием симпатического и парасимпатического отделов вегетативной нервной системы проводят также некоторые фармакологические пробы.
Проба с атропином позволяет выявить влияние вагуса на характер экстрасистолии. После записи исходной ЭКГ внутривенно вводят атропина сульфат в дозе 0,02 мг/кг с постоянной регистрацией ЭКГ на фоне действия препарата. В первые 15–30 с после введения препарата проявляется холиномиметическая фаза действия, а затем начинается холинолитическая. При выраженной ваготонии ЧСС возрастает до 40% и более, а количество экстрасистол уменьшается, или они исчезают.
Пробу с пропранололом проводят для уточнения влияния симпатического отдела вегетативной нервной системы на характер экстрасистолии. После записи исходной ЭКГ препарат вводят внутривенно в дозе 0,1 мг/кг (но не более 10 мг) с постоянной регистрацией ЭКГ на фоне действия препарата. Изменение характера экстрасистолии может быть оценено также после перорального приема пропранолола в дозе 1 мг/кг и регистрации ЭКГ через 60, 90 и 120 мин.
Пробу с изопреналином применяют для провокации эктопической активности миокарда желудочков и/или предсердий. Больному под ЭКГ-контролем внутривенно капельно вводят изопреналин 0,5 мг в 200,0 мл физиологического раствора со скоростью 30–40 капель/мин до возникновения эктопической активности миокарда или достижения субмаксимальной ЧСС. Пробу используют также для оценки индивидуальной эффективности антиаритмических препаратов. С этой целью на ожидаемом максимуме действия антиаритмического препарата повторно внутривенно в той же дозе вводят изопреналин. Препарат, на ожидаемом максимуме действия которого не удается спровоцировать эктопическую активность миокарда, считается эффективным. При отсутствии антиаритмического эффекта пробу повторяют с другим препаратом. Необходимо учитывать то, что повышение ЧСС при введении изопреналина может приводить к угнетению эктопической активности миокарда. В этом случае не удается выявить источник аритмии. Кроме того, действие изопреналина прекращается только через 30–40 мин после окончания введения, что может приводить к стойким желудочковым тахиаритмиям, а также к нестабильности гемодинамики пациента. Учитывая это, для провокации аритмии лучше использовать добутаминовую пробу.
Добутаминовая проба. Добутамин — селективный стимулятор β1-адренорецепторов, действие которого прекращается через 3 мин после окончания введения. Больному под контролем ЭКГ и АД вводят внутривенно капельно добутамин в дозе 250 мг в 250 мл 5% раствора глюкозы до возникновения эктопической активности миокарда. В случае провоцирования аритмии введение добутамина прекращают. Пробу используют также для подбора эффективного антиаритмического препарата, аналогично пробе с изопреналином. В современной кардиологической клинике распространен метод стресс-эхоКГ с добутамином, который позволяет оценить жизнеспособность миокарда у больных с ИБС при решении вопроса о хирургической или эндоваскулярной реваскуляризации коронарных артерий.
Регистрация ППЖ направлена на выявление элементов электрокардиосигнала, возникающего во время систолы желудочков, — проявления их триггерной активности. Для регистрации ППЖ используют биполярные ортогональные отведения X, Y, Z по Франку с усилением, усреднением и фильтрацией комплекса QRS и дальнейшей компьютерной обработкой данных. ППЖ по методике M.B. Simson (1981) определяют в диапазоне 40–250 Гц при амплитуде сигнала до 40 мкВ за 40–60 мс до окончания комплекса QRS.
Прогностически неблагоприятно выявление ППЖ у больных с низкой ФВ ЛЖ и пароксизмами желудочковой тахикардии. Вероятность возникновения эпизодов аритмии у этих пациентов в 10 раз выше, чем у больных с низкой ФВ без ППЖ.
ЭхоКГ проводят для уточнения влияния как экстрасистолии, так и антиаритмических препаратов на состояние гемодинамики. Метод позволяет оценить размеры камер сердца в систолу и диастолу, ФВ, толщину стенок сердца, массу миокарда ЛЖ, соотношение КДО и массы миокарда ЛЖ, выявить зоны гипо- и акинезии, локальной гипертрофии, клапанные дефекты, феномен постэкстрасистолического усиления, дисплазию миокарда ПЖ. Уменьшение ФВ ЛЖ меньше 40% у больных с коронарной недостаточностью ассоциируется с повышением риска внезапной сосудистой смерти. Сердечный выброс можно точнее определить с помощью радиоизотопной вентрикулографии или коронаровентрикулографии.
Чреспищеводную электрограмму (электрофизиологическое исследование) регистрируют с целью определения характера возбуждения предсердий, что позволяет дифференцировать желудочковую и предсердную аберрантную экстрасистолию, выявить блокированные предсердные экстрасистолы, не идентифицированные на ЭКГ, а также вентрикулоатриальное проведение импульсов. Учитывая важную роль дисфункции синусного узла и проводящей системы сердца в возникновении аритмий, может появиться необходимость в проведении электрофизиологического исследования. При проведении чреспищеводного электрофизиологического исследования у больных с экстрасистолией оценивают функцию синусного узла, состояние AV-проведения, наличие дополнительных путей проведения, точку экстрасистолии (минимальная частота стимуляции, при которой экстрасистолия прекращается).
Внутрисердечное электрофизиологическое исследование — современный метод диагностики нарушений ритма и проводимости сердца, определения показаний для кардиостимуляции, радиочастотной катетерной абляции и имплантации кардиовертера-дефибриллятора. Исследование выполняют в специально оборудованных лабораториях. У больных с экстрасистолией абсолютных показаний для проведения внутрисердечного электрофизиологического исследования нет. Данное исследование может быть осуществлено только при необходимости установления связи нарушений ритма сердца с синкопальными и предсинкопальными состояниями. Больным с бессимптомным течением экстрасистолии электрофизиологическое исследование не показано.
КЛИНИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
Экстрасистолии и парасистолии
Клиническое значение экстрасистолии в основном определяется ее типом и градацией, наличием симптомов, характером основного заболевания, степенью поражения сердца и функциональным состоянием миокарда. Частая политопная суправентрикулярная экстрасистолия на фоне синусовой тахикардии, как правило, обусловлена структурным поражением сердца и может провоцировать возникновение тахиаритмии. Частая предсердная экстрасистолия является предвестником возникновения в дальнейшем фибрилляции предсердий. Наличие нечастой наджелудочковой экстрасистолии у лиц без патологии сердца считается вариантом нормы, за исключением тех случаев, когда она провоцирует суправентрикулярные тахиаритмии.
Желудочковые экстрасистолы у лиц без структурного поражения сердца не представляют угрозы для жизни. Их выявляют при холтеровском мониторировании ЭКГ у большинства практически здоровых лиц всех возрастных групп, причем у 10% они политопные и редко — групповые. Таким образом, желудочковая экстрасистолия не обязательно указывает на сопутствующую кардиальную патологию, а при отсутствии заболевания сердца не является предвестником повышения заболеваемости и смертности. С другой стороны, у больных с выраженным структурным поражением сердца и дисфункцией миокарда, особенно на фоне постинфарктного кардиосклероза или СН, выявление частой желудочковой экстрасистолии — дополнительный прогностически неблагоприятный фактор.
Эктопическую активность желудочков отмечают у 75–90% больных с острым ИМ в первые 72 ч заболевания, она предопределяет высокую частоту внезапной сердечной смерти в настоящее время, но не коррелирует с уровнем смерти на протяжении года. Наличие желудочковой экстрасистолии в более поздний период заболевания свидетельствует о неблагоприятном долгосрочном прогнозе. Так, частоту желудочковых экстрасистол меньше 1 в час отмечают у 50% больных при выписке из стационара, двухлетняя смертность составляет около 5%. При большей частоте желудочковых экстрасистол (1–10 в час), выявляемой у 20% больных, смертность достигает 20%. Короткие пароксизмы желудочковой тахикардии отмечают у 12% больных, а смертность от всех причин составляет до 30% на протяжении первого года после перенесенного ИМ. Появление угрожающих жизни аритмий сердца после ИМ обусловлено объединением рецидивирующей ишемии с метаболическими и электролитными нарушениями. Важные факторы, способствующие аритмогенезу, — СН и стенозирующий коронарный атеросклероз.
Парные и политопные желудочковые экстрасистолы отмечают у 70–90% больных СН, а короткие пароксизмы желудочковой тахикардии — у 40–80%. В этом случае желудочковые нарушения сердечного ритма являются неблагоприятным прогностическим фактором, причем 33–47% всех случаев смерти больных СН приходится на внезапную сердечную смерть. Аритмогенные факторы при СН таковы: дисфункция ЛЖ (ФВ ЛЖ <45%), ишемия миокарда, гипоксия, электролитные нарушения, а также аритмогенные эффекты принимаемых терапевтических средств, особенно сердечных гликозидов, диуретиков и периферических вазодилататоров.
Очень высока частота желудочковых экстрасистол у больных с ДКМП. Так, частые и политопные желудочковые экстрасистолы отмечают у 80–90% больных, короткие эпизоды желудочковой тахикардии — у 20–60%. Частота внезапной сердечной смерти достигает 10% в год; на нее приходится половина всех случаев смерти. Приблизительно у 50% больных выявляют предсердные экстрасистолы. Формирование аритмий связано с наличием выраженной дисфункции ЛЖ и СН.
Желудочковые экстрасистолы регистрируют у 50–65% больных с ГКМП с обструкцией выносящего тракта ЛЖ, в том числе парные желудочковые экстрасистолы — у 32%, а пароксизмы желудочковой тахикардии — у 14–25%. Частота внезапной сердечной смерти у этих пациентов составляет 2,5–9% в год. Предсердную экстрасистолию выявляют реже, чем желудочковые нарушения ритма. Причины и факторы, способствующие аритмогенезу, — клеточная дезорганизация в разных участках миокарда, гипоксия, гипокалиемия, обструкция выносящего тракта ЛЖ, диастолическая дисфункция ЛЖ, СН, аритмогенные влияния препаратов, интенсивная физическая нагрузка.
Риск внезапной сердечной смерти вследствие желудочковых нарушений ритма особенно возрастает у больных с аритмогенной дисплазией ПЖ, врожденным или приобретенным синдромом удлиненного интервала Q–T, клапанными пороками сердца (включая пролапс митрального клапана), АГ.
О степени опасности, связанной с желудочковой экстрасистолией, могут свидетельствовать некоторые особенности ЭКГ. Обычно неопасны экстрасистолы с конфигурацией блокады левой ножки пучка Гиса и вертикальным положением электрической оси преждевременного комплекса QRS (тип Розенбаума), или в случае, если комплекс QRS экстрасистолы во всех грудных отведениях направлен вверх и напоминает графику WPW-синдрома типа А (тип Вольфа). Комплекс QRS таких экстрасистол не имеет дополнительных расщеплений, его амплитуда составляет 20 мм и больше, длительность может быть до 0,12 с, а сегмент ST и асимметричный зубец Т направлены дискордантно к основному зубцу желудочкового комплекса. Перегородочные желудочковые экстрасистолы с узкими комплексами QRS чаще отмечают у пациентов молодого возраста при отсутствии структурного поражения сердца, они редко имеют клинические симптомы. Потенциально угрожающие желудочковые экстрасистолы в основном возникают на фоне структурного поражения сердца, имеют форму блокады правой ножки пучка Гиса, незначительную амплитуду комплекса QRS (часто до 10 мм) с дополнительными расщеплениями, а его длительность — более 0,12–0,14 с. Могут отмечать аномалии реполяризации: горизонтальную депрессию сегмента ST и конкордантное направление симметричного заостренного зубца Т.
Клиническое значение парасистолии, как и экстрасистолии, преимущественно определяется клиническим течением основного заболевания сердца. Парасистолию могут выявлять у больных со структурным поражением миокарда и у практически здоровых лиц, а ее появление не всегда ухудшает течение основного заболевания и общий прогноз. Остается неустановленным вопрос, могут ли желудочковые парасистолии провоцировать фибрилляцию желудочков у больных с острым ИМ.
КЛАССИФИКАЦИИ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ
Согласно рекомендациям Ассоциации кардиологов Украины, созданным на основе МКБ 10-го пересмотра, выделяют такие виды экстрасистолии: предсердную, атриовентрикулярную, желудочковую (редкую, в том числе одиночную — до 30 в час; частую — 30 и более в час), аллоритмию, полиморфную, парную, раннюю — типа R на Т.
В Украине при интерпретации данных холтеровского мониторирования ЭКГ у больных с желудочковыми нарушениями ритма традиционно используют классификацию B. Lown и M. Wolf (1971). Согласно этой классификации различают 5 классов желудочковых экстрасистол: 1) редкая мономорфная <30 в час; 2) частая мономорфная >30 в час; 3) полиморфная; 4) парная (4а) и пробежки желудочковой тахикардии (4b); 5) ранняя (R на T). Эта классификация была разработана для систематизации желудочковых нарушений сердечного ритма у больных с острым ИМ, но не соответствует потребностям стратификации риска и выбора тактики дифференцированного лечения пациентов в постинфарктный период.
Более детально варианты желудочковых нарушений сердечного ритма отражены в классификации R. Myerburg (1984), которую удобно применять при интерпретации результатов холтеровского мониторирования ЭКГ (табл. 1.3). Подчеркнем, что при стратификации риска у больных в постинфарктный период весомым является уже количество желудочковых экстрасистолий свыше 10 в час. К аритмиям высоких градаций относят парные желудочковые экстрасистолы и пароксизмы желудочковой тахикардии любой продолжительности. Причем стойкую желудочковую тахикардию, независимо от клинических симптомов и характера структурного заболевания сердца, рассматривают как злокачественное нарушение ритма, тогда как прогностическое значение нестойкой желудочковой тахикардии в большой степени зависит от основного заболевания сердца и функционального состояния миокарда. Морфологический тип желудочковой тахикардии также определяет значительные различия механизмов возникновения и тактики ведения больных, в частности, применение антиаритмических препаратов и катетерных методов лечения.
Таблица 1.3
Систематизация желудочковых нарушений сердечного ритма по R. Myerburg (1984)
| Экстрасистолы | Формы желудочковых аритмий | Морфология желудочковых тахикардий | ||
| Степень тяжести | Количество | Степень тяжести | Характеристики | |
| 0 | Нет | 0 | Нет |
|
| 1 | Редкая (<1 в час) | 1 | Одиночные, мономорфные | |
| 2 | Нечастая (2–9 в час) | 2 | Одиночные, полиморфные | |
| 3 | Промежуточная (10–29 в час) | 3 | Парные, пробежки (2 или 3–5 комплексов) | |
| 4 | Частая (30–59 в час) | 4 | Нестойкая желудочковая тахикардия (от 6 комплексов до 29 с) | |
| 5 | Очень частая (≥60 в ч) | 5 | Стойкая желудочковая тахикардия (≥30 с) | |
Хорошо известна прогностическая классификация желудочковых аритмий, предложенная J.T. Bigger (1993), которая различает желудочковые аритмии безопасные (доброкачественные), опасные для жизни (злокачественные летальные) и потенциально опасные (потенциально летальные).
- Безопасные (доброкачественные) аритмии — любые желудочковые экстрасистолии (редкие, частые, политопные, парные), а также короткие эпизоды желудочковой тахикардии при отсутствии кардиальной патологии, которые не вызывают нарушений гемодинамики. Прогноз таких желудочковых аритмий такой же, как и в здоровой популяции. Показаний к антиаритмической терапии нет.
- Опасные для жизни (злокачественные) желудочковые аритмии — эпизоды желудочковой тахикардии, которые приводят к нарушению гемодинамики или фибрилляции желудочков. Эти аритмии, как правило, отмечают у больных с выраженным структурным поражением сердца (ИБС, застойная СН, кардиомиопатии, пороки сердца) и нарушением сократимости ЛЖ. У таких больных желудочковые экстрасистолии являются лишь частью спектра желудочковых нарушений ритма. Довольно часто у них также выявляют нестойкую и стойкую желудочковую тахикардию.
- Потенциально опасные (потенциально злокачественные) желудочковые аритмии — частые, политопные, парные желудочковые экстрасистолии, короткие эпизоды желудочковой тахикардии у больных со структурным поражением сердца (ИБС, СН, кардиомиопатии, пороки сердца), не приводящие во время нарушения ритма к выраженным изменениям гемодинамики. Маркер большей вероятности возникновения жизненно опасных аритмий сердца у этих больных — систолическая дисфункция ЛЖ (ФВ ЛЖ <45%).
КЛАССИФИКАЦИИ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
Наиболее распространенной классификацией антиаритмических препаратов (которые потенциально могут быть применены для лечения экстрасистолии), остается классификация Williams (1969) в модификации D. Harrison (1979), согласно которой все антиаритмические препараты разделяют на 4 класса:
Класс I. Блокаторы быстрых натриевых каналов:
A. Препараты, умеренно замедляющие деполяризацию и реполяризацию (хинидин, прокаинамид, дизопирамид, аймалин).
B. Препараты, незначительно замедляющие деполяризацию и ускоряющие реполяризацию (лидокаин, мексилетин, токаинид, фенитоин).
C. Препараты, значительно замедляющие скорость деполяризации и минимально влияющие на реполяризацию (пропафенон, флекаинид, энкаинид, этацизин, алапинин).
Класс II. Блокаторы β-адренергических рецепторов без внутренней симпатомиметической активности (пропранолол, метопролол, атенолол, бетаксолол, бизопролол, невиболол, эсмолол).
Класс III. Препараты, замедляющие реполяризацию и действующие на калиевые каналы (амиодарон, соталол, ибутилид, дофетилид, азимилид, дронедарон).
Класс IV. Блокаторы кальциевых каналов (верапамил, дилтиазем).
Новый подход к классификации антиаритмических препаратов был предложен экспертами Европейского кардиологического общества в докладе «Сицилийский гамбит» (1991). Авторами выделены ведущие механизмы аритмогенеза, которые способствуют возникновению и поддержанию нарушений сердечного ритма, а также электрофизиологические параметры, устранение которых приводит к восстановлению и поддержанию синусового ритма (чувствительные параметры аритмии). Для каждого из этих параметров предложены препараты, способные его корригировать. Допускается, что один препарат может иметь свойства нескольких классов антиаритмических препаратов. Например, пропафенон, являющийся блокатором натриевых каналов, одновременно имеет β-блокирующие свойства; соталол — не только блокатор β-адренорецепторов, но и блокатор калиевых каналов; амиодарон имеет свойства всех четырех классов антиаритмических препаратов, учитывая его универсальное действие на ионные каналы и рецепторы.
В целом, для лечения экстрасистолии потенциально можно использовать антиаритмические препараты разных классов (табл. 1.4). Препараты класса IВ применяют только при желудочковых аритмиях, тогда как препараты класса IV — при суправентрикулярных аритмиях. Другие антиаритмические препараты используют и при желудочковых, и при суправентрикулярных нарушениях сердечного ритма. Выбор оптимального антиаритмического препарата у больных с экстрасистолией должен быть индивидуализированным. Но прежде всего следует оценить целесообразность устранения экстрасистолии, сравнив потенциальную пользу и риск назначения антиаритмических препаратов.
Таблица 1.4
Антиаритмические средства, которые применяют для лечения экстрасистолии, и их дозы
| Препарат | Средняя разовая доза per os, мг | Средняя суточная доза per os, мг | Максимальная суточная доза per os, мг |
| Дизопирамид | 100–300 | 400–800 | 2000 |
| Хинидин сульфат в лекарственной форме ретард | 250–500 | 750–1500 | 2000 |
| Аймалин | 50 | 200–300 | 400 |
| Мексилетин | 200–400 | 600–900 | 1200 |
| Фенитоин | 100–200 | 1000 в 1-е сутки, далее по 300–500 | 1000 |
| Пропафенон | 150–300 | 450–900 | 1200 |
| Флекаинид | 50–100 | 200 | 400 |
| Морацизин | 200 | 600–800 | 1200 |
| Этацизин | 50–100 | 150–200 | 250 |
| Аллапинин | 25 | 75–125 | 150 |
| Пропранолол | 40–80 | 120–200 | 400–500 |
| Атенолол | 25–50 | 100–200 | 200 |
| Метопролол | 25–50 | 100–200 | 300 |
| Бетаксолол | 10 | 20 | 40 |
| Бизопролол | 5 | 10 | 20 |
| Небиволол | 5 | 10 | 10 |
| Амиодарон | 100–200 | 600–1200 | 2000 в период насыщения |
| Соталол | 40–80 | 80–160 | 240 |
| Верапамил | 40–120 | 200–320 | 600–720 |
ПРИНЦИПЫ ВЕДЕНИЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ
Тактика ведения больных с экстрасистолией зависит от: структурного заболевания сердца; частоты возникновения экстрасистол, наличия групповых экстрасистол или сопутствующих пароксизмов тахиаритмии; клинических симптомов, связанных с аритмией. Показаниями для назначения блокаторов β-адренорецепторов и/или других антиаритмических препаратов при экстрасистолической аритмии являются такие клинические ситуации:
1) прогрессирующее течение заболевания сердца со значительным увеличением количества экстрасистол;
2) частые, политопные, парные, групповые и ранние (R на T) желудочковые экстрасистолии, представляющие угрозу относительно возникновения в дальнейшем пароксизмальной желудочковой тахикардии и фибрилляции желудочков;
3) аллоритмия (би-, три-, квадригеминия), короткие пробежки предсердной тахикардии, сопровождающиеся признаками СН;
4) экстрасистолическая аритмия на фоне заболеваний, сопровождающихся повышением риска угрожающих жизни аритмий (пролапс митрального клапана, синдром удлиненного интервала Q–T и т.п.);
5) возникновение или повышение частоты экстрасистол во время приступов стенокардии или острого ИМ;
6) сохранение желудочковых экстрасистол после прекращения приступа желудочковой тахикардии и фибрилляции желудочков;
7) экстрасистолы на фоне аномальных путей проведения (WPW-синдрома и синдрома Клерка — Леви — Кристеско).
Больные с доброкачественной желудочковой экстрасистолией в проведении специальной антиаритмической терапии не нуждаются, но требуется проведение динамического наблюдения, так как у части из них, по данным Фремингемского исследования, желудочковая экстрасистолия может быть дебютом заболевания сердца. При экстрасистолии лицам молодого возраста без структурного поражения сердца, особенно при экстрасистолии, исчезающей во время физической нагрузки, антиаритмические препараты обычно не назначают. При субъективной непереносимости экстрасистолии показаны рациональная психотерапия, седативные средства, транквилизаторы или антидепрессанты. Длительность лечения зависит от медицинских показаний и колеблется от 3 нед до 2–3 мес. В случае достижения стойкого седативного и антиаритмического эффекта суточная доза препарата на протяжении каждых 6–7 дней снижается на 1/3 до полной отмены. Если экстрасистолия возникает на фоне вегетативной дисфункции с признаками симпатоадреналовой активации, показаны блокаторы β-адренорецепторов, а при доминировании вагоинсулярных симптомов — М-холинолитики (атропин, препараты белладонны, ипатропия бромид). Пациенты с заболеваниями внутренних органов и экстрасистолией прежде всего нуждаются в адекватном лечении основного заболевания. В любом случае обследование должно быть направлено на выявление и устранение потенциальных провоцирующих факторов экстрасистолии (таких как потребление кофеина, определенные жизненные ситуации), а также сопутствующих нарушений (АГ).
При бессимптомной наджелудочковой экстрасистолии антиаритмические препараты применять нецелесообразно. Для лечения симптомной, в том числе групповой, наджелудочковой экстрасистолии у больных со структурным поражением сердца без признаков СН лечение преимущественно начинают антагонистами кальция (верапамил, дилтиазем) или блокаторами β-адренорецепторов (пропранолол, метопролол, бизопролол, бетаксолол). При отсутствии эффекта указанных антиаритмических препаратов назначают препараты I класса или комбинации антиаритмических препаратов с разным механизмом действия. Наиболее апробированы такие комбинации антиаритмических препаратов: дизопирамид + блокатор β-адренорецепторов; пропафенон + блокатор β-адренорецепторов; препарат IA или IB класса + верапамил. Амиодарон рассматривают как препарат резерва в ситуациях, когда его назначение оправдано из-за групповой экстрасистолии и связанных с ней тяжелых клинических симптомов. Кроме того, в определенных случаях угнетение амиодароном предсердной экстрасистолии позволяет предотвратить пароксизмы фибрилляции предсердий и суправентрикулярной тахикардии. В острый период ИМ специальное лечение наджелудочковой экстрасистолии, как правило, не показано.
При одиночных монофокусных желудочковых экстрасистолах у больных с сердечно-сосудистыми заболеваниями без нарушений гемодинамики и коронарного кровообращения назначать антиаритмические препараты не нужно. Сдержанный подход к назначению антиаритмических препаратов обусловлен тем, что риск побочных эффектов при медикаментозном лечении доброкачественных аритмий выше, чем положительные последствия лечения. Прежде всего ведение таких больных заключается в терапии основного заболевания, а также использовании седативных средств и методов психотерапии при субъективной непереносимости аритмии.
Потенциально злокачественные желудочковые аритмии обычно возникают на фоне структурного заболевания сердца, например ИБС или после перенесенного ИМ. У таких больных с желудочковыми экстрасистолиями различных градаций существует опасность возникновения в дальнейшем пароксизмов желудочковой тахикардии, трепетания или фибрилляции желудочков. Учитывая это, больные с потенциально злокачественными желудочковыми аритмиями прежде всего нуждаются в адекватном лечении основного заболевания. С этой целью проводят коррекцию стандартных факторов риска ИБС (АГ, курение, гиперхолестеринемия, сахарный диабет), назначают средства, эффективность которых доказана у больных ИБС (ацетилсалициловая кислота, блокаторы β-адренорецепторов, статины) и СН (ингибиторы АПФ, блокаторы β-адренорецепторов, антагонисты альдостерона). При сочетании кардиальной патологии с частой желудочковой экстрасистолией высоких градаций осуществляют подбор адекватной антиаритмической терапии. Препаратами выбора чаще всего являются блокаторы β-адренорецепторов, особенно при наличии дополнительных показаний: ИБС, АГ, синусовая тахикардия. Высокую эффективность этих препаратов связывают с их антиангинальным, антиаритмическим и брадикардитическим действием. При необходимости блокаторы β-адренорецепторов комбинируют с антиаритмическими препаратами I класса (пропафенон, морацизин, этацизин, дизопирамид), с учетом целесообразности их дальнейшего длительного применения.
Гипотеза о профилактической эффективности антиаритмических препаратов I класса при желудочковых экстрасистолиях для предотвращения внезапной смерти была пересмотрена после обнародования результатов исследования CAST (1989). Прием флекаинида и энкаинида у больных в постинфарктный период с бессимптомными желудочковыми экстрасистолиями высоких градаций сопровождался достоверным повышением риска внезапной смерти по сравнению с плацебо. Указанный феномен связывают с аритмогенным и отрицательным инотропным действием антиаритмических препаратов I класса. Вместе с тем отрицательные результаты исследования CAST и других исследований эффективности антиаритмических препаратов I класса не исключают возможности их эффективного непродолжительного использования для лечения желудочковых экстрасистолий у больных ИБС, а также желудочковых аритмий, обусловленных другими причинами.
При недостаточной эффективности блокаторов β-адренорецепторов и антиаритмических препаратов I класса назначают амиодарон — одно из наиболее эффективных антиаритмических средств с наиболее низкой вероятностью аритмогенных эффектов. Амиодарон применяют при резистентности к другим антиаритмическим препаратам; кроме того, он является препаратом выбора у больных с жизненно опасными и клинически выраженными аритмиями на фоне тяжелого структурного заболевания сердца.
Обнадеживающие результаты получены при применении амиодарона у больных с частой желудочковой экстрасистолией после перенесенного ИМ в метаанализе АТМА (1997). В группах пациентов, получавших амиодарон, существенно снижалась вероятность внезапной сердечной смерти, но не отмечали достоверного снижения общей смертности. Амиодарон — препарат выбора для лечения и предупреждения желудочковых аритмий у больных с систолической дисфункцией миокарда и СН. Использование амиодарона в низких дозах (200 мг/сут) позволяет уменьшить до минимума количество некардиальных побочных эффектов. Альтернативным средством лечения больных с желудочковыми аритмиями на фоне ИБС является соталол — антиаритмический препарат III класса со свойствами блокатора β-адренорецепторов.
Высокая эффективность амиодарона и соталола при лечении пациентов со злокачественными желудочковыми аритмиями не свидетельствует об отсутствии проблемы безопасности этих средств. Антиаритмические препараты III класса удлиняют корригированный интервал Q–T, безопасная граница которого составляет 440–460 мс. Если показатели интервала Q–Тс превышают указанные границы, диагностируют приобретенный синдром удлиненного интервала Q–T. Характерным и специфическим проявлением этого состояния является полиморфная желудочковая тахикардия (тахикардия типа пируэт), которая может трансформироваться в фибрилляцию желудочков. Риск развития аритмогенного действия соталола наибольший в первые 3 дня приема препарата. В общем, аритмогенные эффекты соталола выявляют чаще, чем при применении амиодарона.
ЛЕЧЕНИЕ ЭКСТРАСИСТОЛИИ В ОТДЕЛЬНЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
У больных с ИМ прогностическое значение и тактика лечения желудочковых экстрасистолий зависят от срока их возникновения. В догоспитальный период ИМ назначают метопролол в дозе 5 мг внутривенно до 3 раз с интервалом 3–5 мин, далее per os по 25–50 мг 2 раза в сутки. При желудочковых экстрасистолиях высоких градаций в острый период ИМ на фоне базисной терапии (нитраты, антиагреганты, антикоагулянты, ингибиторы АПФ, статины и т.п.), назначают внутривенное болюсное введение лидокаина в дозе 1 мг/кг, а затем переходят на постоянную инфузию препарата со скоростью 2 мг/мин. Насыщающую и поддерживающую дозы снижают в 2 раза у больных в возрасте старше 70 лет, при кардиогенном шоке и СН. Если через 10 мин после первого болюсного введения лидокаина количество желудочковых экстрасистолий не уменьшается, дополнительно струйно вводят 0,5 мг/кг лидокаина, а скорость инфузии препарата увеличивают до 4 мг/мин. При необходимости инфузию лидокаина продолжают на протяжении суток. Профилактическое применение лидокаина не рекомендуется, поскольку имеются сообщения, что он может повышать смертность больных ИМ, прежде всего в связи с возникновением асистолии.
При сохранении желудочковых аритмий высоких градаций на фоне терапии лидокаином и метопрололом применяют амиодарон, начиная с дозы 600–1200 мг/сут, с дальнейшим переходом на поддерживающую дозу препарата. Кроме того, амиодарон является резервным средством лечения пароксизмов желудочковой тахикардии на фоне ИМ.
Для терапии симптоматических желудочковых экстрасистолий у больных с постинфарктным кардиосклерозом наиболее целесообразно использовать блокаторы β-адренорецепторов, амиодарон или соталол. У больных СН использование ингибиторов АПФ, калийсберегающих диуретиков, периферических вазодилататоров обеспечивает опосредованный антиаритмический эффект за счет коррекции нарушений гемодинамики и нейрогуморального дисбаланса. Вместе с тем сердечные гликозиды и петлевые диуретики могут оказывать аритмогенное действие. При сочетании амиодарона с дигоксином дозу последнего необходимо снизить наполовину в связи с увеличением угрозы гликозидной интоксикации. Согласно рекомендациям Украинской ассоциации кардиологов (2004), при злокачественных желудочковых нарушениях ритма сердца у больных с низкой ФВ ЛЖ и СН показано назначение амиодарона в сочетании с блокаторами β-адренорецепторов в низких дозах и ингибиторами АПФ.
Есть 4 основных представителя класса блокаторов β-адренорецепторов с доказанной способностью улучшать прогноз выживания и предотвращать внезапную смерть у больных СН и дисфункцией ЛЖ: бисопролол (исследование CIBIS-II, 1998), метопролол CR/XL (MERIT-HF, 1999), карведилол (COPERNICUS, 2001), небиволол (SENIORS, 2005). Механизм положительного влияния блокаторов β-адренорецепторов связан с влиянием на РААС и вегетативный баланс, а также с их антиишемическим действием.
Больные с прогностически неблагоприятными аритмиями, рефрактерными к антиаритмической терапии, с выраженными нарушениями гемодинамики, коронарного кровотока или при сочетании с пароксизмами желудочковой тахикардии и фибрилляции желудочков нуждаются в хирургическом лечении (деструкция эктопического очага, имплантация противотахикардических приспособлений или использование других подходов).
Появление экстрасистолической аритмии у больных с заболеваниями органов дыхания может быть связано с применением в-стимуляторов и гипертензией малого круга кровообращения. В таких случаях лучше применять антагонисты кальция (верапамил, дилтиазем), уменьшающие выраженность легочной гипертензии. Возможно также осторожное применение высокоселективных блокаторов β-адренорецепторов и амиодарона.
Принципы лечения парасистолии такие же, как и экстрасистолии. Однако чаще отмечают рефрактерность к медикаментозной терапии. Применение антиаритмических препаратов показано при желудочковой парасистолической тахикардии, а также в случае симптоматической парасистолии. Наиболее эффективное средство лечения парасистолии — амиодарон.
ВЫВОДЫ
Экстрасистолия — наиболее распространенное нарушение ритма сердца. Суправентрикулярная и желудочковая экстрасистолия может возникать при многих кардиальных и экстракардиальных заболеваниях, ее могут случайно выявить у практически здоровых лиц. Комплекс современных инструментальных и лабораторных методов обследования пациентов с экстрасистолией направлен на установление ее причин и механизмов, количества и градации, клинического и прогностического значения, осуществление стратификации риска. Общая стратегия ведения больных с экстрасистолией и, в частности, целесообразность ее устранения с помощью антиаритмических препаратов определяют в зависимости от соотношения потенциальной пользы лечения для устранения аритмий, улучшения прогноза выживания и риска возникновения аритмогенных и других побочных эффектов терапии.
ЛИТЕРАТУРА
- Голицын С.П. (2000) Грани пользы и риска при лечении желудочковых нарушений ритма сердца. Международный журнал медицинской практики: 56-64.
- Денисюк В.И., Дзяк Г.В., Мороз В.М. (2005) Лечение аритмий: пути повышения эффективности и безопасности антиаритмических препаратов. Винница: ГП ГКФ: 640.
- Дощицин В.Л. (1999) Внезапная аритмическая смерть и угрожающие аритмии. Рос. кардиол. журн., № 1: 43-49.
- Кушаковский М.С. (1998) Аритмии сердца. СПб., ИКФ Фолиант: 640.
- Мазур Н.А., Абдала А. (1995) Фармакотерапия аритмий. М., Оверлей: 224.
- Мешков А.П. (1996) Аритмии сердца: диагностика и лечение. Нижний Новгород: 122 .
- Рейнгардене Д.И., Азаравичене А.П. (2004) Эффективность амиодарона (кордарона) при предсердной экстрасистолии. Терапевт. арх.: 87-89.
- Сычев О.С., Епанчинцева О.А., Левчук Е.В. (2005) Исследование эффективности бисопролола для лечения желудочковых аритмий у больных ишемической болезнью сердца с сердечной недостаточностью. Мистецтво лікування: 79-83.
- Сычев О.С., Соловьян А.Н., Шуба О.В. и др. (2005) Применение небиволола у больных с нарушениями ритма сердца при ишемической болезни сердца и эссенциальной артериальной гипертензии. Укр. кардіол. журн.: 57-64.
- Фомина И.Г. (2003) Нарушения сердечного ритма. М., ИД Русский врач: 192 .
- Царегородцев Д.А. (2001) Проблема медикаментозно-резистентных аритмий. Рос. кадиол. журн., № 2: 51-60.