ВСТУП
Ішемічна хвороба серця (ІХС) — одна з головних причин високої смертності та втрати працездатності населення в Україні та у багатьох індустріально розвинених країнах світу, що становить серйозну медико-економічну проблему. Успішне її вирішення залежить від розуміння механізмів розвитку захворювання, можливості прогнозування ускладнень та результатів, що визначає лікарську тактику, вибір і ефективність проведеної терапії.
Одна з найпоширеніших клінічних форм ІХС — стенокардія. Своєчасна її діагностика та адекватність лікування визначають не лише якість життя пацієнтів, але й можливість зниження частоти коронарних ускладнень, а, загалом, і долю хворого.
За останні два десятиріччя накопичені експериментальні й клінічні дані, що змінили уяву кардіологів про механізми розвитку ішемії, формування і прогресування атеросклерозу та коронарної недостатності. Концепція динамічного коронарного стенозу, розроблена A. Maseri (1980), K.L. Gould (1980), W. Rafflenbeul, P. Lichtlen (1982), дозволила з нових позицій пояснити порушення коронарної гемодинаміки в місцях атеросклеротичного звуження судин серця. Виявлено важливу роль ендотелію в регуляції тонусу вінцевих артерій, його взаємодії з форменими елементами крові, ліпідами, біологічно активними гуморальними факторами, участь у процесах запалення, прогресування атеросклерозу і дестабілізації атероми.
Більш глибоким стає саме визначення ішемії. P.A. Poole-Wilson (1984) вважає, що ішемія — це результат порушення енергозабезпечення міокарда та дисбаланс рівноваги між споживанням АТФ і кровопостачанням, а не лише між постачанням і потребою серцевого м’яза в кисні, як вважали раніше.
Накопичені експериментальні й клінічні дані дозволили зрозуміти механізми, спрямовані на підвищення стійкості міокарда до ішемічного ураження, висунути концепцію про існування динамічних змін міокарда, що виникають внаслідок транзиторної чи тривалої ішемії — так званих станів оглушеного або гібернованого міокарда. Ці поняття включають існування хронічного порушення (протягом декількох днів або місяців) скоротної функції міокарда ЛШ, яке є наслідком тривалої гіпоперфузії міокарда і адаптаційного зниження метаболізму серцевого м’яза. Такий міокард зберігає свою життєздатність, а його виявлення має важливе практичне значення, оскільки хірургічна реваскуляризація зумовлює повне відновлення його функції.
Встановлено, що стенокардія як одна з форм ІХС проявляється клінічно не лише больовим синдромом. У момент ішемії міокарда реєструються порушення перфузії, метаболізму, діастолічної та систолічної функцій міокарда, зміни ЕКГ, які можуть і не супроводжуватися ангінозним болем. За образним порівнянням P.F. Cohn (1978) «німі» епізоди ішемії, як підводна частина айсберга, поряд з больовими нападами, становлять єдиний «тягар» ішемії, що визначає перебіг і результат захворювання у конкретного пацієнта з ІХС.
Своєрідною формою захворювання є стенокардія напруження на фоні неуражених за даними ангіографії коронарних артерій або кардіальний синдром Х.
Факт відсутності атеросклеротичного ураження коронарних артерій у таких хворих слід розуміти досить умовно, враховуючи обмеження, пов’язані з розрізняльною здатністю ангіографічного дослідження. Це не виключає наявності атеросклеротичного ураження стінки артерії, без зменшення її просвіту, що встановлюють методом внутрішньокоронарного УЗД (IVUS), а також більш тонких морфологічних і функціональних змін судинної стінки.
Ця глава настанови присвячена хронічним формам ІХС. Відповідно до прийнятої в Україні класифікації до них належать: стабільна стенокардія напруження (відповідає коду I20.8 за МКХ-10), вазоспастична стенокардія (ангіоспастична, спонтанна, варіантна, стенокардія Принцметала — код I20.1 за МКХ-10), стабільна стенокардія напруження при ангіографічно неуражених коронарних артеріях (кардіальний або коронарний синдром Х — код I20.8 за МКХ-10), безбольова форма ІХС (код I25.6 за МКХ-10), а також постінфарктний кардіосклероз (код I25.2 за МКХ-10) і хронічна аневризма серця (код I25.3 за МКХ-10).
СТАБІЛЬНА СТЕНОКАРДІЯ НАПРУЖЕННЯ
Стенокардія — клінічний синдром, що проявляється болем або відчуттям дискомфорту в грудній клітці стискаючого, давлячого характеру, який найчастіше локалізується за грудиною й може іррадіювати в ліву руку, шию, нижню щелепу, епігастральну ділянку. Біль провокується фізичним навантаженням, виходом на холод, прийомом значної кількості їжі, емоційним стресом; зменшується і зникає у стані спокою, усувається прийомом нітрогліцерину протягом однієї або кількох хвилин.
Стенокардія зумовлена транзиторною ішемією міокарда, розвивається при невідповідності між потребою міокарда в кисні та його доставкою коронарним кровотоком.
Епідеміологія
Інформація про захворюваність на стенокардію ґрунтується на даних епідеміологічних досліджень. За результатами 10-річного проспективного дослідження Seven Countries Studies середня щорічна захворюваність на стенокардію у чоловіків віком 40–59 років становить 0,1% у Японії, Греції та Хорватії; 0,2–0,4% — в Італії, Сербії, Нідерландах і США; 0,6–1,1% — у Фінляндії. У 5-річному проспективному дослідженні Israel Ischaemic Heart Disease Study у групі чоловіків віком старших 40 років середня щорічна захворюваність на стабільну стенокардію становила 0,7%. Ці дані позитивно корелюють із показником смертності від ІХС у цих регіонах. Протягом 20-річного періоду Фремінгемського дослідження щорічна захворюваність на стенокардію серед чоловіків віком 45–54 роки становила 0,3%, 55–64 роки — 0,8%, 65–74 роки — 0,6%. Серед жінок відповідного віку рівні захворюваності становили 0,2; 0,6 і 0,6%. У половини пацієнтів після першого ІМ з’являються напади стенокардії, в той час як до інфаркту такі напади відзначали лише у ¼ з них.
За даними епідеміологічного дослідження, проведеного співробітниками Національного наукового центру «Інститут кардіології ім. акад. М.Д. Стражеска» АМН України (Київ), поширеність стенокардії напруження в популяції за опитувальником Роуза становить 5,5%, в тому числі серед міських жителів у чоловіків — 5,3%, у жінок — 9,5%; серед сільського населення у чоловіків — 2,8%, у жінок — 4,7%.
Поширеність ІХС в Україні згідно зі статистичними даними за 2006 р. становила у чоловіків 18 814 (на 100 тис. населення), у жінок — 23 448 (на 100 тис. населення). Щорічно від ІХС в Україні вмирають приблизно 350 тис. осіб.
Етіологія та патогенез
Морфологічним субстратом стенокардії практично завжди є атеросклеротичне звуження коронарних артерій. Стенокардія з’являється під час фізичних навантажень або стресових ситуацій, при звуженні просвіту коронарної артерії не менше ніж на 50–70%. Тяжкість стенокардії залежить від ступеня, локалізації та довжини стенозів, їх кількості й числа уражених артерій. Ступінь стенозу, особливо ексцентричного, може варіювати залежно від тонусу гладких м’язів у ділянці атеросклеротичної бляшки, що проявляється різною переносимістю фізичного навантаження.
В окремих випадках стенокардія може розвиватися за відсутності видимого стенозу коронарних артерій як вторинний синдром у пацієнтів із клапанними вадами серця, вираженою гіпертрофією міокарда (наприклад у хворих з гіпертрофічною кардіоміопатією), неконтрольованою АГ, будучи наслідком відносної коронарної недостатності. У осіб з незміненими коронарними артеріями ішемія міокарда виникає внаслідок ангіоспазму чи порушення регулюючої функції ендотелію.
Схожий на стенокардію біль може бути симптомом некардіальних захворювань, наприклад захворювань стравоходу (при цьому слід пам’ятати, що нітрогліцерин може усувати спазм стравоходу і пов’язані з ним симптоми), грудної клітки або легень. Серед них стани, що підвищують споживання кисню: гіпертермія, гіпертиреоз, інтоксикація симпатоміметиками (наприклад кокаїном) або ті, що знижують надходження кисню — анемія, гіпоксемія, пневмонія, БА, ХОХЛ, легенева гіпертензія, синдром нічного апное, гіперкоагуляція, поліцитемія, лейкемія, тромбоцитоз.
Чітка залежність роботи серця від метаболізму кисню при збільшенні навантаження та обмеженні перфузії робить міокард вкрай вразливим до ішемії. Так оклюзія великої коронарної артерії у експериментальної таврини призводить до погіршення показників, що характеризують глобальну функцію ЛШ через 3–5 скорочень серця та повної втрати регіональної скоротливої функції через 1 хв. Проте клітини гинуть не відразу та некроз настає приблизно після 15 хв ішемії. Реакція адаптації до ішемії складна і залежить від ступеня та тривалості гіпоперфузії.
Механізми, спрямовані на підвищення стійкості міокарда до ішемічного ураження
У серцевому м’язі реалізуються внутрішні компенсаторні механізми, спрямовані на підвищення стійкості міокарда до потенційно летального ішемічного ураження — ураження, що призводить до некрозу. Одним із таких механізмів є ішемічне прекондиціонування — підвищення резистентності міокарда до потенційно летальної ішемії, що досягається попередніми повторними короткочасними епізодами менш вираженої (сублетальної) ішемії. Таким чином, відбувається своєрідне «тренування» міокарда допороговою ішемією.
Ступінь кардіопротекції внаслідок прекондиціонування досить суттєва і в експериментальних умовах, як правило, розмір інфаркту зменшується на 75%. Одним з перших ідентифікованих стимулів прекондиціонування вважали аденозин, що звільняється з ішемізованої тканини. Наступні дослідження показали, що така реакція, можливо, ініціюється рецепторами, зв’язаними з протеїном G, фізичними стимулами (розтягнення серцевого м’яза), мітогенами, факторами росту фібробластів, вільними радикалами, кальцієм. Зменшення розміру інфаркту не єдина ознака кардіопротекції, що забезпечується прекондиціонуванням, так під час реперфузії в прекондиціонованому серці виникає менше аритмій, швидше відновлюється скоротливість. Прекондиціонування — двофазна реакція. Класичне прекондиціонування захищає серце негайно і продовжується від 2 до 4 год. Відстрочене прекондиціонування, що інколи називають «другим вікном» захисту міокарда, спостерігається після стимулу прекондиціонування через день і може зберігатися до 3–4 діб. Клінічне значення цього механізму захисту міокарда полягає в тому, що серце людини зазнає прекондиціонування під час повторення епізодів больової (стенокардія) та безбольової ішемії, зокрема при передінфарктній стенокардії, а також під час проведення коронарної ангіопластики.
Іншим захисним механізмом є ішемічне посткондиціонування, яке проявляється короткочасним підвищенням тонусу (вазоконстрикція) коронарних артерій, що виникає після важкого ішемічного ураження, і захищає міокард від реперфузійного пошкодження.
Механізми адаптації до тривалої гіпоперфузії — процеси гібернації та оглушення міокарда. За визначенням Rahimtoola (1989) гібернованим є «міокард із порушеною скоротністю в стані спокою внаслідок обмеження коронарного кровотоку, здатний до часткового чи повного відновлення скоротної функції при збільшенні доставки кисню».
Гібернація міокарда швидше наслідок дисбалансу між доставкою та потребою міокарда в кисні, ніж первинного зниження коронарного кровотоку.
Імуногістологічні дослідження показали, що гіберновані кардіоміоцити екскретують скоротливі протеїни, специфічні для фатального серця, такі як актин-α гладких м’язів та цитоселективні протеїни, такі як титин і кардіотин. Відновлення скоротливої функції гібернованого міокарду може тривати від декількох тижнів до місяців, залежно від вираженості гістологічних змін. Важливість гібернації полягає в тому, що вона зворотна при виконанні реваскуляризації.
Для виявлення гібернованого міокарда використовують такі методи, як стрес-ехоКГ з добутаміном, радіонуклідні методи визначення захоплення міокардом 201ТІ, 99mTc-сестамібі, виміряні за допомогою SPECT, а також захоплення [11C]ацетату або [18F]2-фтордеоксилглюкози, виявлені за допомогою позитронної емісійної томографії (ПЕТ). На наявність гібернованого міокарда вказує збільшення захоплення [18F]2-фтордеоксилглюкози при виявленні зниженої перфузії міокарда, тобто визначається невідповідність між метаболізмом та кровотоком. Відповідність зниженого рівня кровотоку зниженому метаболізму при порушеній скоротливій функції міокарда вказує на наявність рубцевої тканини.
У 1975 р. G.R. Heyndrickx та співавторами вперше була запропонована концепція «оглушеного» міокарда, ще один із станів пристосування міокарда до зниженої перфузії, що отримала подальший розвиток в роботі E. Braunwald та R.A. Kloner (1982 р.). Згідно з цією концепцією оглушення міокарда — це систолічна та діастолічна його дисфункція, що зберігається від декількох годин до тижнів і виникає після оклюзії коронарних артерій за умови наступного відновлення перфузії та відсутності незворотного пошкодження міокарда. Ключову роль в патогенезі оглушення відіграють моноцити, поліморфно-ядерні лейкоцити та ендотеліальні клітини, в яких ішемія індукує продукцію та вивільнення вільних радикалів, прозапальних цитокінів, молекул клітинної адгезії. На сьогодні феномен оглушення міокарда пояснюють дві взаємодоповнюючі гіпотези: оксирадикальна та кальцієва. Відповідно до першої агресивні гідроксильні радикали викликають денатурацію протеїнів, інактивацію ферментів, зв’язуються з ліпідами та врешті призводять до апоптозу міокардіоцитів. Кальцієва гіпотеза пояснює оглушення міокарда перевантаженням міоцитів кальцієм, внаслідок чого знижуються реакції скоротливих протеїнів на кальцій та виникає роз’єднання процесів збудження та скорочення міокардіальних клітин.
Широкий спектр варіантів оглушення міокарда включає стани від транзиторної регіональної гіпокінезії без інфаркту міокарда, що виникає після короткочасної оклюзії коронарної артерії, до зони дисфункції міокарда, що оточує ділянку субендокардіального інфаркту. Оглушений міокард може також виникнути як прояв функціонального ішемічно-реперфузійного пошкодження після коронарної реперфузії внаслідок проведеної тромболітичної терапії чи коронарної ангіопластики.
Отже, клінічними станами, при яких у серцевому м’язі виявляють гібернацію, є стабільна та нестабільна стенокардія, перенесений ІМ, «німа» ішемія міокарда. До оглушення міокарда призводять нестабільна і вазоспастична стенокардія, «німа» ішемія, рання реперфузія при гострому ІМ, проведення інтервенційних і хірургічних втручань (ПКВ, АКШ). Відмінності між гібернованим і оглушеним міокардом наведено у табл. 3.1.
Відзначимо, що гібернацію не слід ототожнювати з хронічною ішемією, це якісно інший персистувальний стан адаптації міокарда до хронічної гіпоперфузії, що забезпечує його виживання. На відміну від ішемії, при гібернації практично не змінюється вміст АТФ і КФК у кардіоміоцитах, зберігається функція мітохондрій, спостерігається більш активне поглинання глюкози міокардом, відсутні дегенеративні зміни у клітинах (вакуолізація, набряк, набрякання мітохондрій, розрив мембран).
Таблиця 3.1
Відмінності між «оглушеним» та гібернованим міокардом
| Показник | «Оглушення» | Гібернація |
| Умова | Реперфузія після вираженої ішемії | Хронічна гіпоперфузія |
| Перфузія міокарда | ++↓ | ↓↓↓ |
| Біохімічні маркери ішемії | +++ | +(–) |
| Дисфункция ЛШ | Періодична | Постійна |
| Зворотність дисфункції | Спонтанна | Після васкуляризації |
| Клінічний стан | Нестабільна, вазоспастична стенокардія, «німа» ішемія, рання реперфузія при гострому ІМ, ПКВ, АКШ | Стабільна, нестабільна стенокардія, перенесений ІМ, «німа» ішемія |
«Оглушений» та «гібернований» міокард прийнято називати життєздатним, про що свідчить поліпшення чи повне відновлення його вихідної зниженої скоротності при відновленні коронарного кровотоку у осіб з ІХС. У ряді досліджень встановлено, що більше ніж у 50% пацієнтів зі зниженою глобальною систолічною функцією ЛШ можливе клінічно значиме її поліпшення після ендоваскулярної чи хірургічної реваскуляризації. Причому 22–60% сегментів ЛШ із початково порушеною скоротністю є життєздатними та повністю відновлюють функцію в умовах адекватного кровопостачання. Життєздатний міокард можна виявити методом стресової ехоКГ з добутаміном (рис. 3.1).
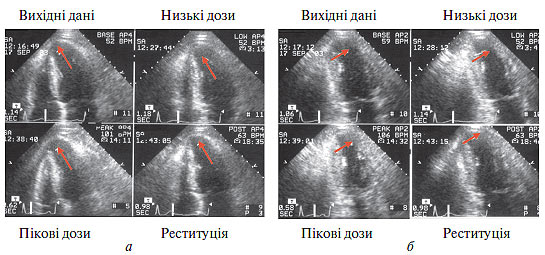
Рис. 3.1. Приклад двофазної відповіді при проведенні стрес-ехоКГ з добутаміном — при инфузії добутаміну в низьких дозах скоротність поліпшилась, а при введенні в максимальних дозах і в період відновлення – погіршилася, що є ознакою життєздатного (гібернованого) міокарда. Стрілками позначені ділянки з попередньо порушеною скоротністю, які продемонстрували поліпшення при введенні добутаміну в низьких дозах: а) верхівковий сегмент бокової стінки ЛШ (візуалізація з верхівкової 4-камерної позиції); б) верхівковий
Ще одним механізмом адаптації міокарда до ішемії може бути розвиток колатеральних судин. Ішемія — міцний стимул для формування колатералей через ангіогенез та артеріогенез.
Ангіогенез — процес збільшення та розгалуження капілярів з існуючої раніше судинної сітки чи ендотеліальних трубочок розміром з капіляр. Цей процес проходить по всій глибині стінки шлуночка, але особливо — в субендокардіальній зоні.
Артеріогенез — збільшення існуючих епікардіальних колатеральних артеріол після тотальної чи субтотальної оклюзії великої коронарної артерії.
У такому разі колатеральні артерії проходять від однієї епікардіальної артерії до іншої. Формування колатералей проходить під впливом деяких фізичних факторів, таких як напруження зсуву, градієнт тиску вздовж колатеральної судини, а також запальних реакцій, при яких виробляються хімічні стимули, такі як судинний ендотеліальний фактор росту, трансформуючий фактор росту-α і -β та ін. Колатералі забезпечують альтернативне джерело кровопостачання міокарда, ураженого внаслідок оклюзивної коронарної хвороби серця, і можуть зберегти функцію міокарда за наявності хронічної коронарної оклюзії.
Діагностика
Клінічні методи дослідження — найбільш важливий етап у діагностиці захворювання у пацієнтів з болем у грудній клітці, що дозволяють лікареві оцінити ймовірність ІХС з високою точністю. Клінічно значиму коронарну хворобу серця визначають при виявленні методом коронароангіографії стенозу 70% просвіту в ≥1 епікардіальних артерій або 50% стенозу стовбура лівої коронарної артерії. Наявність ділянок коронарних артерій з менш вираженим стенозом може також викликати стенокардію, але в цьому разі вона, як правило, менш виражена і має кращий прогноз.
Характеристика больового синдрому
Першим і найважливішим етапом у діагностиці ІХС є докладний опис больового синдрому. Зазвичай оцінюють 5 характеристик болю: його характер, локалізацію, тривалість, фактори, що провокують та купірують біль.
Для опису характеру ангінозного болю пацієнтами використовують різноманітні визначення: «стискаючий», «давлячий», «пекучий», «задушливий», часто біль описують як тяжкість або «кіл» за грудиною. Нерідко пацієнти описують свої відчуття як «дискомфорт», «але не біль». Біль при стенокардії майже ніколи не буває точковим, гострим або колючим і зазвичай не змінюється залежно від зміни положення тіла та фази дихання. Біль, як правило, локалізується за грудиною, але може також поширюватися на шию, нижню щелепу, епігастральну ділянку, руки, пальці. Біль, що з’являється вище нижньої щелепи, нижче епігастрію чи локалізується на невеликій ділянці в лівій половині грудної клітки в точці проекції верхівки серця, для стенокардії не характерний. Іноді стенокардія може супроводжуватися менш специфічними симптомами — задишкою, втомою, слабкістю, нудотою, підвищеною збудливістю, відчуттям тривоги.
Ангінозний біль зазвичай нетривалий, не довше 5 хв у більшості випадків, а іноді навіть менше 1 хв. Дискомфорт або тупий біль, що триває годинами, навряд чи може бути симптомом стенокардії. Стенокардія зазвичай провокується фізичним або емоційним стресом і усувається під час відпочинку. Біль у ранкові години після підйому пацієнта з ліжка, а також після прийому їжі — класичні ознаки тяжкої стенокардії. Біль, що з’являється не під час, а після фізичного чи психоемоційного напруження, менш характерний для ІХС.
Сублінгвальний прийом нітрогліцерину повністю купірує чи зменшує вираженість ангінозного болю протягом 30 с — декількох хвилин.
Слід пам’ятати, що стенокардію можуть імітувати інші захворювання, які супроводжуються болем або неприємним відчуттям у грудях. Докладні дані анамнезу, клінічне та інструментальне дослідження допомагають у цих випадках уникнути діагностичних помилок.
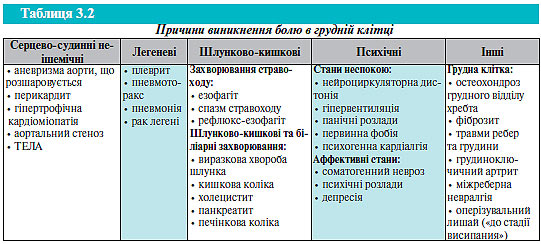
Стани, при яких виникає біль у грудній клітці, наведено в табл. 3.2.
Часто застосовують таку класифікацію болю в грудній клітці: типова стенокардія, атипова стенокардія та некардіальний біль у грудній клітці. Біль розцінюють як типову стенокардію, якщо він відповідає всім вищезазначеним характеристикам; атипова стенокардія — якщо відповідає двом з вищенаведених характеристик; біль у грудній клітці некардіального генезу визначають у разі наявності однієї з типових характеристик або за їх відсутності (табл. 3.3).
Таблиця 3.3
Клінічна класифікація болю в грудній клітці
| Типова стенокардія (певна) | 1) дискомфорт або характерний біль за грудиною достатньої тривалості
2) провокується фізичним або емоційним стресом 3) купірується відпочинком чи прийомом нітрогліцерину |
| Атипова стенокардія (ймовірна) | Наявність 2 з вищезазначених характеристик |
| Некардіальний біль у грудній клітці | Наявність 1 або відсутність типових для стенокардії характеристик |
Стенокардію також класифікують як стабільну та нестабільну. Нестабільна стенокардія, що частіше асоціюється з розривом атеросклеротичної бляшки, має значно більш високий ризик розвитку коронарних подій у найближчий час. Нестабільна стенокардія визначається як стенокардія, для якої характерна як мінімум 1 з 3 характеристик: ангінальний біль у спокої, виражена стенокардія, що виникла вперше, прогресуюча стенокардія.
Стенокардія спокою має такі ознаки — ангінозний біль з’являється у стані спокою на фоні попередньої стенокардії напруження або без такої, звичайно більш тривалий (до 20 хв). Стенокардія, що виникла вперше — стенокардія не менше III ФК, що вперше з’явилася протягом 1 міс. Прогресуюча (що посилюється) стенокардія — раніше діагностована стенокардія, вірогідно з більшою частотою, тривалістю або з меншим порогом фізичної активності, що її провокує (тобто підвищення ФК стенокардії як мінімум на один клас, що з’явилося протягом 2 міс).
Для класифікації стабільної стенокардії використовують класифікацію Канадського товариства з вивчення серцево-судинних захворювань (табл. 3.4).

Методи фізикального обстеження
При фізикальному обстеженні у хворих зі стабільною стенокардією зазвичай не виявляють патологічних змін. Однак може бути корисним обстеження під час больового нападу. При ІХС може визначатися 4-й або 3-й тон серця, ритм галопу, шум мітральної регургітації, парадоксальне розщеплення 2-го тону, пульсація грудної клітки, застійні хрипи в легенях. При детальному обстеженні серцево-судинної системи може бути виявлена інша патологія, що супроводжується стенокардією, наприклад клапанна вада серця або ГКМП. Ознаки атеросклеротичного ураження судин позасерцевої локалізації — шум над сонною артерією, ослаблений пульс на стопі чи аневризма черевної частини аорти — підвищують імовірність наявності ІХС. Підвищений АТ або наявність ексудату в сітківці ока також характерні для факторів ризику виникнення ІХС. Болючі ділянки при пальпації грудної клітки можна виявити у пацієнтів, у яких біль у грудній клітці є наслідком скелетно-м’язового синдрому. Проте біль у грудній клітці внаслідок підвищеного АТ або скелетно-м’язового генезу можливий і у пацієнтів із стенокардією. Наявність шуму тертя характерна для перикардиту або плевриту. Огляд також має включати оцінку ІМТ та окружності талії з метою діагностики метаболічного синдрому. Слід звертати увагу на ознаки порушення ліпідного обміну: ксантоми, ксантелазми, крайове помутніння рогівки у вигляді «старечої дуги».
Лабораторні методи дослідження
Діагностичні лабораторні дослідження вибирають індивідуально з метою одержання інформації про можливі причини ішемії, фактори серцево-судинного ризику та для оцінки прогнозу.
Визначення рівня гемоглобіну, гормонів щитовидної залози в крові та лейкоцитарної формули інформативні для виявлення можливих причин ішемії. При підозрі на нестабільність визначають біохімічні маркери міокардіального ураження, такі як рівень тропоніну чи активність КФК. Проте ці показники не використовують як рутинні дослідження при обстеженні всіх пацієнтів.
Рівні загального ХС, ХС ЛПНЩ, ХС ЛПВЩ і ТГ необхідно оцінювати у всіх пацієнтів з підозрою на ІХС (стабільну стенокардію), щоб встановити ступінь ризику і визначити потребу в проведенні гіполіпідемічного лікування. Ліпідний профіль крові та глікемічний статус необхідно періодично визначати повторно, з метою оцінки ефективності лікування, а у пацієнтів без цукрового діабету виявити можливе його виникнення. Рекомендується щорічний контроль вищезазначених показників. Пацієнтам з високим рівнем ліпідів у сироватці крові, хворим на цукровий діабет і особам, яким планується проведення інтервенційних втручань, обстеження слід проводити за показаннями.
Визначення рівня креатиніну в сироватці крові необхідне всім хворим з підозрою на стенокардію з метою виявлення у них ниркової дисфункції, що приєднується до таких захворювань, як АГ, цукровий діабет, захворювання судин нирок і впливає на прогноз у осіб з ІХС. Для розрахунку кліренсу креатиніну можна використати формулу Кокрофта — Голта:
(140 — вік пацієнта (років) • маса тіла (кг)/72 • рівень креатиніну у сироватці крові (мг/дл)).
У жінок при розрахунку використовують коригувальний коефіцієнт 0,85.
Подальше лабораторне обстеження, що включає визначення субфракцій ХС (аполіпопротеїн A й аполіпопротеїн B), гомоцистеїну, ліпопротеїну (а), реологічних порушень і маркерів запалення, таких як СРБ, глікозильованого гемоголобіну у пацієнтів із супутнім цукровим діабетом, становить інтерес для об’єктивного прогнозування ризику у осіб з ІХС.
Сукупність необхідних лабораторних досліджень визначають залежно від анамнезу захворювання, факторів ризику, сімейного анамнезу.
Нижче наведено рекомендації з лабораторного обстеження при діагностуванні стабільної стенокардії.
Усім пацієнтам:
- Ліпідний профіль сироватки крові (натще), включаючи визначення рівня загального ХС, ХС ЛПНЩ, ХС ЛПВЩ, ТГ.
- Рівень глюкози в крові (натще).
- Загальний аналіз крові, включаючи гемоглобін і лейкоцитарну формулу.
- Рівень креатиніну в крові.
При виявленні відхилень у результатах клінічного обстеження:
- Визначення маркерів ураження міокарда за наявності клініки нестабільної стенокардії чи гострого коронарного синдрому.
- Рівень гормонів щитовидної залози.
- Тест толерантності до глюкози.
- СРБ.
- Ліпопротеїн (а), аполіпопротеїн A, аполіпопротеїн B.
- Гомоцистеїн.
- Глікозильований гемоглобін (HbА1c).
- Мозковий натрійуретичний пептид (NT-BNP).
Для рутинного лабораторного обстеження пацієнтів із хронічною стабільною стенокардією рекомендоване щорічне визначення рівня глюкози і ліпідного профілю крові (натще).
Неінвазивні інструментальні методи дослідження
Для діагностики ішемії міокарда можуть бути використані різні методики: реєстрація ЕКГ у стані спокою, холтерівське ЕКГ-моніторування, навантажувальні тести (тредміл-тест, ВЕМ), фармакологічні проби, стресова ехоКГ, радіонуклідні методи дослідження.
Вибір методики виявлення ішемії міокарда має визначатися насамперед клінічною картиною і конкретними завданнями, які ставить перед собою лікар. Крім того, необхідно враховувати особливості кожного діагностичного методу: показання та протипоказання до його застосування, переваги і недоліки, обмеження у використанні, що залежать як від характеристик самого методу, так і від стану хворого, можливості методу в оцінці характеру і тяжкості ураження коронарного русла та міокарда, його прогностичні можливості.
Рентгенографія органів грудної клітки
Рентгенографію органів грудної клітки часто використовують при обстеженні пацієнтів з підозрою на захворювання серця. Рентгенографія у стандартних проекціях дозволяє оцінити розміри контурів серця — загальні й окремі камери, стан великих судин (аорти, ЛА, верхньої порожнистої вени), виявити наявність кальцинатів у міокарді, перикарді, коронарних артеріях, великих судинах. За допомогою цього методу можна виявити ознаки лівошлуночкової недостатності — венозний застій, набряк легень, легеневу патологію, а також зміни кісткового апарата грудної клітки.
Проте при стабільній стенокардії рентгенографія не несе специфічної інформації ні для діагностики, ні для стратифікації ризику. Рентгенограма частіше буває патологічною у пацієнтів із раніше перенесеним або гострим ІМ, а також у хворих з болем некоронарного генезу або дискомфортом у грудній клітці, викликаним некардіальними причинами. Збільшення серця може бути наслідком раніше перенесеного ІМ, гострої лівошлуночкової недостатності, перикардіального випоту чи хронічного перевантаження об’ємом ЛШ, наприклад при мітральній чи аортальній недостатності. Виявлення кальцинатів коронарних артерій підвищує ймовірність симптоматичної ІХС. Флюороскопічно виявлена коронарна кальцинація корелює з оклюзією основної судини у 94% у пацієнтів з болем у грудній клітці, хоча чутливість методу — всього 40%.
При діагностиці стабільної стенокардії рентгенографію рекомендується проводити:
1) у пацієнтів із підозрою на СН;
2) у пацієнтів із клінічними проявами вираженої легеневої патології.
Реєстрація ЕКГ у стані спокою
У всіх хворих з підозрою на стенокардію слід зареєструвати ЕКГ у 12 відведеннях у стані спокою. Результати цього дослідження не дозволяють з повною впевненістю стверджувати про наявність або відсутність ІХС; нормальна картина ЕКГ у стані спокою не є рідкістю навіть у хворих з дуже тяжкою стенокардією. Проте на ЕКГ у спокої можуть визначатися такі ознаки ІХС, як вогнищеві зміни після перенесеного у минулому ІМ, або патологічний характер реполяризації міокарда. Під час ішемії міокарда на ЕКГ фіксуються зміни кінцевої частини шлуночкового комплексу — сегмента ST і зубця Т. Гостра ішемія зазвичай призводить до транзиторного горизонтального чи косонизхідного зниження сегмента ST та сплощення чи інверсії зубця Т. Іноді визначають підйом сегмента ST, що свідчить про більш тяжку трансмуральну ішемію міокарда. На відміну від гострого ІМ, при стенокардії всі відхилення сегмента ST швидко нормалізуються після купірування симптомів. Крім того, на ЕКГ можуть бути виявлені інші порушення, такі як ознаки ГЛШ, блокади ніжок пучка Гіса, передзбудження шлуночків, порушення ритму чи провідності. Така інформація може бути корисною у визначенні механізмів, відповідальних за виникнення болю у грудній клітці, або при виділенні підгруп хворих із підвищеним ризиком смерті або ІМ.
При діагностиці стабільної стенокардії ЕКГ спокою рекомендується реєструвати поза нападом болю, а також, по можливості, під час епізоду болю.
При рутинному обстеженні пацієнтів із хронічною стабільною стенокардією рекомендується періодична реєстрація ЕКГ у спокої навіть у разі відсутності клінічних змін.
Навантажувальні проби
Для ідентифікації ішемії у більшості хворих з підозрою на стабільну стенокардію реєстрація ЕКГ під час навантажувальних проб — більш чутливий і специфічний метод, ніж у стані спокою. Навантажувальні, а також фармакологічні тести провокують ішемію міокарда за допомогою підвищення потреби міокарда в кисні (тредміл-тест, ВЕМ, добутамінова проба) або зниження транспорту кисню до міокарда (проби з дипіридамолом і аденозином). При цьому виявити ішемію можна різними методами на рівні специфічних порушень перфузії та метаболізму міокарда (площинна томографія й ОФЕКТ, МРТ), регіональної скоротності (стрес-ехоКГ, вентрикулографія) або з урахуванням ЕКГ-змін (ВЕМ, тредміл-тест) і клінічних симптомів. Більш ранньою і точною слід вважати неінвазивну діагностику, що ґрунтується на індикації регіональних порушень перфузії, метаболізму і скоротності міокарда (рис. 3.2).
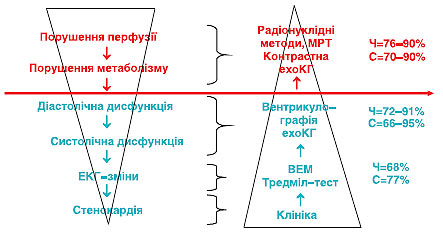
Рис. 3.2. Схематичне зображення патофізіології ішемічного каскаду і методів індикації ішемії. Ч — чутливість, С — специфічність методу для виявлення ішемії
Як правило, в Україні діагностика обмежується методами оцінки ЕКГ-показників ішемії і значно рідше аналізом параметрів систоло-діастолічної функції міокарда методом стресової ехоКГ.
Проте такі навантажувальні проби, як тредміл-тест або ВЕМ, дотепер є найпоширенішими методами діагностики ІХС. Це відносно прості й недорогі методи виявлення транзиторної ішемії міокарда у хворих з підозрою на ІХС або з встановленим її діагнозом.
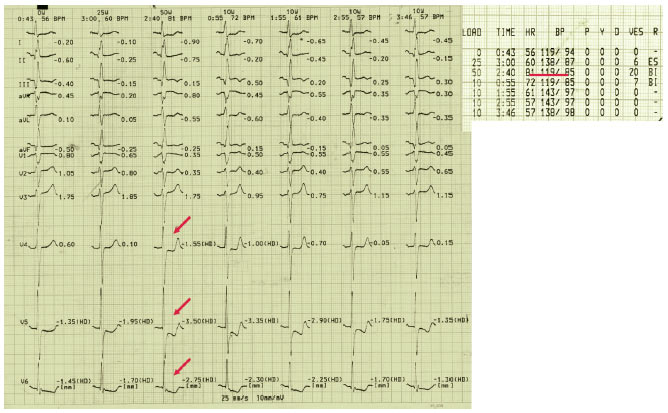
Проби з дозованим фізичним навантаженням
ЕКГ, зареєстрована у стані спокою, поза нападом болю, у пацієнта без ІМ в анамнезі, може виявитися у межах норми. Під час проби з дозованим фізичним навантаженням пацієнт виконує зростаючу за інтенсивністю роботу на тредмілі або велоергометрі, при цьому постійно реєструють ЧСС і ЕКГ, через однакові проміжки часу (1–3 хв) контролюють АТ. Тредміл-тест порівняно з ВЕМ має як переваги, так і недоліки. Перевага полягає, насамперед, у тому, що на тредмілі навантаження є більш фізіологічним і сприймається хворим як більш звичне. Крім того, при використанні стандартного протоколу Брюса можливе виконання більшого навантаження, ніж при ВЕМ, і більш швидке досягнення бажаного результату.
При проведенні проби на тредмілі або велоергометрі можна використати як протокол Брюса, так і одну з його модифікацій. Величина робочого навантаження на велоергометрі виражається у ватах (Вт). Навантаження починають з 25–50 Вт, кожні 2–3 хв підвищуючи його на 25 Вт (один рівень). За необхідності (у пацієнтів з СН, тяжкою стенокардією) рівень навантаження може бути зменшений до 10 Вт. Слід застосовувати стандартний протокол, оскільки він може бути використаний для одержання даних про одного і того самого хворого надалі. На додаток до діагностичного значення ЕКГ при фізичному навантаженні стрес-тест відіграє важливу роль у виявленні «німої» ішемії та оцінці прогнозу у пацієнтів із хронічною стабільною стенокардією, а також у вивченні подальшого розвитку захворювання чи ефективності лікування. Проведення навантажувального тесту рекомендується після детального клінічного обстеження пацієнта. Ускладненням навантажувальної проби можуть бути як виникнення серйозної аритмії, так і раптова смерть (1 на 2500 тестів). Лікар зобов’язаний бути присутнім при проведенні проби. Реєстрація ЕКГ має бути безперервною з роздруківкою на кожній 1-й або 3-й хвилині впродовж навантаження і 2–10 хв реституції.
Основні показання до проведення навантажувальних проб:
- диференційна діагностика ІХС та окремих її форм;
- визначення індивідуальної толерантності до фізичного навантаження у хворих із встановленим діагнозом ІХС та уточнення ФК стенокардії;
- оцінка ефективності лікувальних, у тому числі медикаментозних, хірургічних і реабілітаційних заходів;
- експертиза працездатності осіб із серцево-судинними захворюваннями;
- оцінка прогнозу.
Абсолютними протипоказаннями до проведення тесту з фізичним навантаженням є гостра фаза ІМ (протягом 2–7 днів від початку), нестабільна стенокардія, порушення мозкового кровообігу, гострий тромбофлебіт, ТЕЛА, СН III–IV ФК за класифікацією NYHA, виражена легенева недостатність, лихоманка.
Недоцільно виконувати цей діагностичний тест при тахіаритмії, повній блокаді лівої ніжки пучка Гіса, синоатриальній і АV-блокаді високого ступеня, критичному аортальному стенозі чи ГКМП.
Критеріями припинення проби з фізичним навантаженням є розвиток нападу стенокардії, поява ознак ішемії міокарда на ЕКГ, досягнення цільової ЧСС, розвиток вираженого стомлення, що робить неможливим продовження фізичного навантаження, і відмова пацієнта від проведення проби. Пробу з фізичним навантаженням слід припинити при:
- розвитку типового нападу стенокардії;
- появі загрозливих для життя порушень серцевого ритму: часта або політопна, або залпова шлуночкова екстрасистолія, пароксизмальна тахікардія чи пароксизм фібриляції передсердь;
- появі систолічного шуму мітральної регургітації;
- виникненні вираженої задишки (частота дихання більше 30 за хвилину) або нападу ядухи;
- розвитку порушень провідності — блокади ніжок пучка Гіса, АV-блокади ІІ ступеня і більше;
- ішемічному зсуві сегмента ST вгору ≥1 мм у кожному з відведень (крім аVR і V1); або вниз від ізоелектричної лінії ≥2 мм (горизонтальна або косонизхідна депресія) через 60–80 мс після закінчення комплексу QRS (особливо якщо зміни супроводжуються ангінозним болем і зберігаються >3 хв після закінчення тесту; депресія сегмента ST ≥4 мм — абсолютне показання для припинення тесту);
- підвищенні рівня САТ >250 мм рт. ст., ДАТ >115 мм рт. ст., зниженні САТ на 20 мм рт. ст.;
- появі неврологічної симптоматики — запаморочення, порушення координації рухів, сильного головного болю;
- виникнення інтенсивного болю в нижніх кінцівках;
- розвитку різкого стомлення пацієнта, його відмови від подальшого виконання проби;
- рішенні лікаря як запобіжного заходу;
- досягненні 75–100% максимальної вікової ЧСС.
У пацієнтів із позитивними результатами тесту при низькій толерантності до фізичного навантаження частіше виявляють тяжке ураження декількох коронарних артерій. Пробу з фізичним навантаженням вважають позитивною відносно діагностики ІХС, якщо під час її проведення відтворюється типова для пацієнта біль у грудній клітці та виникають характерні для ішемії зміни на ЕКГ. Не завжди біль супроводжує зниження сегмента ST. Пробу також вважають позитивною, якщо ЕКГ-зміни з’являються без болю чи типовий напад стенокардії розвивається без зниження сегмента ST, або біль супроводжується депресією сегмента ST.
Інформативність тесту з фізичним навантаженням може зменшуватися при прийомі деяких препаратів. Блокатори β-адренорецепторів або деякі антагоністи кальцію (такі, що уповільнюють ЧСС) можуть не дозволити досягти цільової ЧСС. У цих випадках необхідно враховувати, з якою метою виконується навантажувальна проба. Якщо її проводять для визначення наявності у пацієнта ІХС — прийом таких препаратів слід відмінити за 24–48 год перед тестом з фізичним навантаженням. У пацієнтів із діагностованою ІХС при необхідності оцінити ефективність підібраної схеми лікування пробу проводять на фоні прийому лікарських засобів.
З огляду на велику важливість інформації, одержуваної при цьому дослідженні, необхідно у всіх випадках (при відсутності протипоказань) прагнути до виконання навантажувальних проб у хворих зі стабільною стенокардією.
Чутливість і специфічність проби з фізичним навантаженням. У метааналізі 147 опублікованих результатів досліджень, що описують 24 074 пацієнти, яким було проведено як коронарну ангіографію, так і навантажувальну пробу, виявили широкий діапазон чутливості й специфічності навантажувальних проб. Чутливість становила 23–100% (в середньому — 68%), а специфічність — 17–100% (в середньому — 77%). При аналізі лише 58 досліджень, з яких виключали пацієнтів з раніше перенесеним ІМ, середня чутливість становила 67%, а специфічність — 72%. Коли аналіз було звужено до декількох досліджень, в яких була виключена робоча помилка шляхом включення пацієнтів, які до початку обстеження дали згоду на проведення коронароангіографії та навантажувальної проби, чутливість методу становила 50%, а специфічність — 90%.
В одному з останніх досліджень, проведеному за участю 814 пацієнтів і ретельно виконаному з метою зменшення вірогідності робочої помилки, чутливість становила 45%, а специфічність — 85%. Таким чином, справжня діагностична цінність навантажувальної ЕКГ-проби базується в основному на її відносно високій специфічності, в той час як чутливість навантажувальної проби виявляється нижче чутливості візуалізуючих методів дослідження.
Хоча чутливість і специфічність діагностичних тестів часто розглядають як повноцінні характеристики, що не залежать від індивідуальних особливостей пацієнтів, це не завжди так. Наприклад, навантажувальні проби мають більш високу чутливість у осіб похилого віку і пацієнтів з трисудинним ураженням, ніж у осіб молодого віку і хворих з односудинним ураженням. Тест також має більш низьку специфічність у осіб із хворобами клапанів серця, ГЛШ і депресією сегмента ST у стані спокою, у пацієнтів, які приймають дигоксин.
Передтестова ймовірність. Передтестова ймовірність ІХС залежно від віку, статі та характеру синдрому болю розрахована в табл. 3.5а.
Функціональна оцінка, багатоступінчастий підхід до оцінки ймовірності ІХС. У осіб із раніше не діагностованою ІХС можна використати ступінчастий підхід для оцінки ймовірності значимого ураження коронарних артерій, який ґрунтується на комплексному аналізі таких факторів, як вік, стать і характер болю у грудній клітці, а також наявності й вираженості змін сегмента ST при виконанні фізичного навантаження (табл. 3.5a, б).
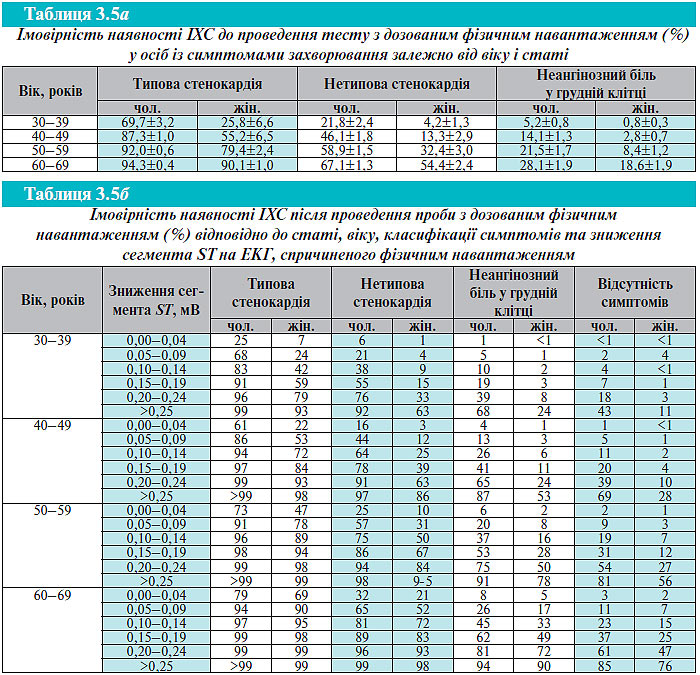
Імовірність значимого ураження коронарних артерій можна уточнити шляхом вивчення змін сегмента ST під час фізичного навантаження. Очевидно (див. табл. 3.5б), що навантажувальна проба не буде дуже корисною для підтвердження діагнозу ІХС у 64-літнього чоловіка з типовою стенокардією. Навіть у разі відсутності змін на ЕКГ при виконанні проби ймовірність ІХС все-таки становитиме 79%. Вона підвищилася б до 99%, якби відбулося зниження сегмента ST на 0,2 мВ. Проте ця проба може допомогти у визначенні ступеня функціональних обмежень у цього хворого (толерантність до фізичного навантаження), визначенні реакції з боку АТ (як індикатора функції ЛШ), а також проведенні оцінки прогнозу захворювання. Так само діагностична цінність ЕКГ при фізичному навантаженні низька у чоловіків і жінок без симптомів захворювання.
Найбільшої діагностичної цінності можна досягти у пацієнтів з середнім ступенем ймовірності захворювання до навантажувальної проби, наприклад від 20 до 80%. Додаткове уточнення діагнозу можливе при багатофакторному аналізі результатів стрес-тесту, під час якого ймовірність наявності захворювання оцінюється на підставі комбінації ЧСС на висоті фізичного навантаження, зниження сегмента ST, наявності чи відсутності стенокардії під час проби, досягнутого робочого навантаження та ступеня нахилу сегмента ST. Така оцінка ймовірності ІХС дозволяє краще зрозуміти реальний стан хворого, ніж довільна класифікація норми чи патології.
У осіб з низькою ймовірністю ІХС (наприклад <20%) і при адекватній переносимості фізичного навантаження проведення додаткових досліджень, зазвичай, не потрібне, навіть якщо у них не можна виключити наявність ІХС. Діагноз вважають встановленим у хворих з високою імовірністю наявності ІХС після виконання навантажувальної проби (наприклад >80%). При помірно чи різко виражених симптомах, які неадекватно контролюються медикаментозним лікуванням, показана коронарна ангіографія для визначення необхідності інвазивного втручання. Особам із середньою ймовірністю захворювання після виконання стрес-тесту (20–80%) бажано провести другий неінвазивний тест для виділення підгрупи хворих з більш-менш високою імовірністю ІХС після діагностичного дослідження. Залежно від засобів і досвіду в цій ситуації можна вибрати як другий тест або перфузійну сцинтиграфію міокарда, або стресову ехоКГ.
Фактори, що впливають на результати тестів з фізичним навантаженням
Дигоксин. Дигоксин викликає індуковану навантаженням депресію сегмента ST у 25–40% практично здорових осіб. З віком патологічна відповідь превалює.
Блокатори β-адренорецепторів. За можливістю рекомендується відміна блокаторів β-адренорецепторів (та інших антиішемічних препаратів) у термін, що в 4–5 разів перевищує період напіввиведення препарату (зазвичай близько 48 г), перед проведенням навантаження з метою діагностики чи первинного визначення ризику у пацієнтів з передбачуваною ІХС. Ці препарати слід відміняти поступово для запобігання розвитку синдрому відміни, що може перешкодити проведенню дослідження. У разі неможливості відміни блокаторів β-адренорецепторів знижується вірогідність виявлення ішемії міокарда, проте у пацієнтів з високим ризиком зазвичай тест виявляється позитивним.
Інші препарати. Антигіпертензивні препарати і вазодилататори можуть вплинути на результати навантажувальної проби в основному за рахунок впливу на рівень АТ.
Застосування нітратів може послабити такі прояви ішемії міокарда, як стенокардія і депресія сегмента ST.
При застосуванні флекаїніду описано випадки виникнення шлуночкової тахікардії у разі фізичного навантаження.
Блокада лівої ніжки пучка Гіса. Спричинена навантаженням депресія сегмента ST у відведеннях (V5–V6) звичайно пов’язана з блокадою, а не з ішемією.
Блокада правої ніжки пучка Гіса. Зумовлена навантаженням депресія сегмента ST у передніх грудних відведеннях (V1–V3) також звичайно пов’язана з блокадою, а не з ішемією. Проте при її появі в лівих грудних відведеннях (V5–V6) або нижніх відведеннях (III, aVF) вона має діагностичне значення за умови її відсутності у стані спокою.
ГЛШ з аномаліями реполяризації на ЕКГ, зареєстрована в стані спокою, асоціюється з більшістю псевдопозитивних результатів, які призводять до зниження специфічності методу.
Депресія сегмента ST у стані спокою — маркер несприятливих кардіальних подій у пацієнтів з ІХС або без неї. Подальша депресія сегмента ST, індукована фізичним навантаженням, у пацієнтів з вихідною депресією у стані спокою ≤1 мм є високочутливим індикатором наявності ІХС (рис. 3.3).
Інтерпретація змін сегмента ST
Вибір відведення. Найбільш висока якість результатів при проведенні проби з навантаженням досягається при використанні 12-канальної реєстрації ЕКГ. Відведення V5 — найбільш інформативне. У пацієнтів без попереднього ІМ з нормальною ЕКГ у стані спокою депресія сегмента ST, індукована навантаженням, що обмежується нижніми відведеннями (III, aVF), має незначну діагностичну значимість.
Косовисхідна депресія ST. Пацієнти з косовисхідною депресією сегмента ST зі швидкістю підйому <1 мВ/с мають високу ймовірність ІХС. Проте основним критерієм позитивного тесту є горизонтальна чи косонизхідна депресія чи елевація сегмента ST на 1 мм протягом ≥60–80 мс після кінцевої частини комплексу QRS; більшість опублікованих досліджень ґрунтуються саме на цих критеріях.
Реполяризація передсердь. Хвилі реполяризації передсердь спрямовані протилежно зубцю Р і можуть нашаровуватися на сегмент ST і зубець T. Посилена реполяризація передсердь може призвести до косовисхідної депресії сегмента ST при відсутності ішемії. У пацієнтів із псевдопозитивним результатом тесту характерні високий поріг навантаження і висока гранична ЧСС, відсутність болю при фізичному навантаженні, помітна косонизхідна депресія сегмента PR у нижніх відведеннях. Ці дані щодо реполяризації передсердь вперше було наведено у 1999 р. у рекомендаціях щодо проведення навантажувальних проб ACC/AHA.
Елевація сегмента ST. На ЕКГ спокою в нормі елевація сегмента ST (крім відведень aVR та V1) — явище нечасте, і може бути наслідком трансмуральної ішемії внаслідок спазму чи критичного пошкодження коронарних артерій, значно підвищує імовірність виникнення аритмії та свідчить про локалізацію ішемії. При наявності на ЕКГ у спокої зубця Q у пацієнта, який переніс ІМ, клінічне значення елевації сегмента ST неоднозначне. Одні дослідження показують, що це виникає при порушеннях руху стінок міокарда; інші це оцінюють як маркер залишкової життєздатності міокарда в зоні інфаркту.
Зміни зубця R. Існує безліч факторів, здатних вплинути на зміни зубця R у відповідь на фізичне навантаження, тому вони не мають діагностичної цінності.
Комп’ютерна обробка ЕКГ. Хоча комп’ютерна обробка може виявитися корисною, в деяких випадках вона призводить до псевдопозитивної оцінки депресії сегмента ST. Щоб уникнути цього, лікар має порівнювати неопрацьовану ЕКГ з усіма усередненими комп’ютером даними.
Особливі групи пацієнтів
Жінки
Діагностика стенокардії у жінок становить певні труднощі. Чим більш типова картина нападу болю для стенокардії, тим вища ймовірність наявності коронарного атеросклерозу. Проте навіть при типовому больовому синдромі у значної частини жінок при ангіографії виявляють інтактні коронарні артерії. На сьогодні немає жодного неінвазивного скринінгового тесту, що дозволяє надійно діагностувати ІХС у жінок без симптомів цього захворювання. Тест із фізичним навантаженням у жінок значно частіше, ніж у чоловіків, буває псевдопозитивним. Особливо висока частота псевдопозитивних результатів у жінок з нетиповим для стенокардії больовим синдромом. Специфічність підвищується, якщо ЕКГ-критерієм позитивного тесту вважати депресію ST не на 1 мм, а на 2 мм.
Хоча ІХС — одна з основних причин смерті у жінок, частіше вона виникає, а отже, має більшу передтестову ймовірність у чоловіків. Особливо при порівнянні з жінками в пременопаузальний період. Низька порівняно з чоловіками передтестова ймовірність ІХС у жінок означає, що у них визначається більша кількість псевдопозитивних результатів.
У дослідженні CASS майже у половини жінок із клінічними проявами стенокардії з позитивною навантажувальною пробою, коронарні артерії виявилися незміненими.
Чутливість навантажувального тесту у жінок вища, ніж у чоловіків, а деякі дослідження показали також і меншу його специфічність. Серед причин, що пояснюють такі відмінності, найбільш імовірними є: використання різних критеріїв для визначення ІХС, розбіжності в перевазі багатосудинних уражень і раніше перенесеного ІМ, в критеріях оцінки сегмента ST, переносимості навантаження (неможливість для багатьох жінок виконати навантаження з максимальним споживанням кисню), більше поширення серед жінок пролапсу мітрального клапана та синдрому Х, відмінності у функції мікросудин (можливо, призводять до коронарного спазму) і, ймовірно, гормональні відмінності. Щоб компенсувати обмежене використання навантажувальної проби у жінок, деякі дослідники розробили прогностичні моделі, які використовують більший обсяг інформації, отриманої при проведенні проби, ніж лише дані про зміну сегмента ST.
Труднощі використання навантажувальної проби у жінок для діагностики ІХС призвели до поширеної думки про те, що візуалізуючі стрес-тести мають перевагу перед стандартною навантажувальною пробою. Хоча оптимальна стратегія діагностики ІХС у жінок ще остаточно не розроблена, ми вважаємо, що на сьогодні недостатньо даних, щоб стверджувати про більшу діагностичну цінність у пацієнток візуалізуючих стрес-тестів порівняно зі стандартною навантажувальною ЕКГ-пробою. У багатьох жінок з низькою передтестовою імовірністю ІХС негативний результат проби буде достатнім і не потребуватиме подальшого проведення візуалізуючих методів дослідження.
Пацієнти похилого віку
Відомі нечисленні дані про використання навантажувальної проби у осіб віком старше 70 років. Результати Національного скринінгового дослідження США (1989) свідчать, що діагноз ІХС виявлено у 1,8% чоловіків та 1,5% жінок віком старше 75 років. «М’яку» ішемію міокарда виявлено у 15% 80-річних пацієнтів.
При проведенні навантажувального тесту у пацієнтів похилого віку дослідники стикаються з додатковими проблемами. Здатність виконання навантаження найчастіше обмежена м’язовою слабкістю і детренованістю. Більшу увагу слід надавати небезпеці механічних ушкоджень, а протокол проведення проби має бути менш агресивним. Пацієнти похилого віку зазвичай міцно тримаються за поручні під час навантаження, що також обмежує час проведення тесту, необхідний для досягнення максимального поглинання кисню. З віком також підвищується імовірність аритмії. Для деяких пацієнтів із порушеннями ходи та координації більш прийнятним методом може виявитися ВЕМ, проте багато людей похилого віку не мали досвіду їзди на велосипеді, що теж обмежує можливість проведення проби.
Інтерпретація результатів навантажувальної проби у пацієнтів похилого віку також має деякі особливості. Більша вираженість ураження коронарних артерій з віком підвищує чутливість методу (84%), проте знижує специфічність (70%). Висока поширеність захворювання призводить до збільшення кількості псевдонегативних результатів тесту. Псевдонегативні результати можуть відображати наявність супутньої ГЛШ внаслідок хвороб клапанів серця і АГ. Також частіше визначають зміни на ЕКГ у спокої, включаючи наслідки перенесеного ІМ, які викликають труднощі в інтерпретації результатів проби.
Навантажувальна проба у осіб похилого віку важка як у проведенні, так і в інтерпретації, у зв’язку з чим необхідність проведення в подальшому коронароангіографії та реваскуляризації з віком збільшується. Проте, незважаючи на вищенаведені особливості, навантажувальна проба не втрачає свого значення у цих пацієнтів.
Рекомендації з виконання навантажувальних ЕКГ-проб для початкової діагностичної оцінки класу стенокардії
Клас I
1. Пацієнти із симптомами стенокардії та середньою передтестовою вірогідністю ІХС з урахуванням віку, статі й симптоматики. Виключенням є нездатність пацієнта до виконання навантаження чи виявлення змін на ЕКГ, що утруднюють інтерпретацію результатів проби.
Клас IIb
1. Пацієнти з депресією сегмента ST >1 мм на ЕКГ спокою чи ті, які приймають дигоксин.
2. Пацієнти з низькою передтестовою імовірністю ІХС (<10%) з урахуванням віку, статі і симптоматики.
Фармакологічні ЕКГ-проби
Для діагностики стабільної стенокардії в амбулаторних умовах можуть бути використані дипіридамолова й ізопротеренолова проби з реєстрацією ЕКГ.
Проба з дипіридамолом
Дилатація артеріол, зумовлена дипіридамолом, веде до зростання кровотоку в зонах, що постачаються неураженими коронарними артеріями, а в зонах кровопостачання стенозованими коронарними артеріями дилатація артеріол без зміни просвіту великих коронарних артерій зумовлює зниження перфузійного тиску дистальніше місця стенозу, перерозподіл коронарного кровотоку (феномен «міжкоронарного обкрадання») і розвиток ішемії міокарда.
Проба з дипіридамолом і реєстрація ЕКГ може бути проведена з діагностичною метою, особливо в тих випадках, коли проведення проби з дозованим фізичним навантаженням за якихось причин неможливе або вона недостатньо інформативна (не доведена до субмаксимальної ЧСС при відсутності ішемічних змін на ЕКГ, негативній пробі з фізичним навантаженням у хворого із клінічною картиною ІХС). Дипіридамол вводять із розрахунку 0,75 мг/кг маси тіла. Розрахункову дозу препарату набирають у 20-мілілітровий шприц і додають розчин хлориду натрію до об’єму 20 мл, приготовлений розчин вводять внутрішньовенно протягом 5 хв. Введення дипіридамолу припиняють на будь-якому етапі дослідження, якщо з’являються ознаки позитивного результату проби на ЕКГ, напад стенокардії, виражені порушення ритму і провідності серця, а також побічні реакції (сильний головний біль, нудота, різка загальна слабкість).
При проведенні проби з дипіридамолом виявляють помірну тахікардію та незначні зміни АТ. Можлива задишка, відчуття тяжкості, припливу крові до кінцівок, грудної клітки, живота, головний біль і рідко — нудота. Ці побічні реакції проходять протягом 3–5 хв після введення еуфіліну, який є антагоністом дипіридамолу. Поряд із загальними реакціями іноді розвиваються перехідні порушення ритму серця (не частіше ніж при ВЕМ), такі як шлуночкові та надшлуночкові екстрасистоли.
Чутливість проби вища у жінок, а специфічність — у чоловіків. Чутливість проби з дипіридамолом залежить від тяжкості й поширеності коронарного атеросклерозу і в середньому становить 50–70%, а специфічність — 70–80%.
Проба з ізопротеренолом
При коронарній недостатності підвищення ЧСС і скоротності, зумовлене ізопротеренолом, може призводити до невідповідності між потребою міокарда в кисні та його доставкою, що зумовлює виникнення минущої ішемії міокарда в ділянках, перфузія яких відбувається стенозованими коронарними артеріями.
При проведенні проби з ізопротеренолом зазвичай визначають підвищення САТ і зниження ДАТ в середньому на 8–10 мм рт. ст., при цьому загальний периферичний судинний опір знижується.
Ізопротеренол в дозі 0,5 мг розводять у 200 мл ізотонічного розчину хлориду натрію. Отриманий розчин вводять внутрішньовенно крапельно з початковою швидкістю 10–20 крапель/хв, при цьому протягом 1 хв оцінюють індивідуальну реакцію на препарат. Потім шляхом підвищення швидкості введення ізопротеренолу доводять ЧСС за 2–3 хв до 130–150 уд./хв і підтримують досягнуту ЧСС протягом 3 хв, після чого введення препарату припиняють. Проведення проби полегшується при використанні інфузійного насоса, що дозволяє з більшою точністю дозувати препарат.
Критерії оцінки проби і передчасного її припинення такі ж, як і при пробі з дипіридамолом.
У 10–20% хворих на фоні введення ізопротеренолу відзначають порушення ритму серця: передсердна чи шлуночкова екстрасистолія, прискорений вузловий ритм, АV-дисоціація.
Проте це не супроводжується погіршенням стану обстежуваного і, як правило, не потребує введення антиаритмічних засобів. Всі зазначені аритмії усуваються протягом 5–10 хв після припинення введення ізопротеренолу. Більшість пацієнтів при проведенні проби відчувають серцебиття, приплив у грудній клітці, голові, іноді — задишку, озноб, нервове тремтіння. Зрідка виявляють значне підвищення АТ, як правило, у хворих на АГ. Чутливість і специфічність проби при оцінці за критеріями ЕКГ становить (залежно від статі, віку, вихідної ЕКГ) 60–70%.
Ізопротеренолову пробу використовують у клінічній практиці рідко.
На сьогодні фармакологічні проби (добутамінова, аденозинова, дипіридамолова) частіше використовують з метою провокації ішемії з подальшою її реєстрацією візуалізуючими методами (ехоКГ, радіонуклідні методи дослідження).
Холтерівське моніторування
У осіб із ІХС холтерівське моніторування ЕКГ найбільш обґрунтоване для діагностики безбольової ішемії міокарда. На сьогодні це єдиний метод, що дозволяє визначити реальну тяжкість безбольової ішемії, оцінити больові й безбольові ішемічні зміни ЕКГ, що виникають у різний час доби в амбулаторних умовах («тотальний тягар ішемії» за визначенням P. Cohn). За допомогою холтерівського моніторування у осіб із ІХС можлива реєстрація добових ритмів ішемічної активності. Використання холтерівського моніторування дозволяє виявити ішемію міокарда у хворих, які не в змозі виконувати тести з фізичним навантаженням (фізичний статус, захворювання периферичних судин, виражена легенева патологія тощо), а також у деяких особливих умовах, наприклад під час психоемоційного стресу. Разом з тим, необхідно відзначити, що зміни ЕКГ, зареєстровані під час холтерівського моніторування, мають реальне значення лише у пацієнтів із верифікованою ІХС і тільки за умови їх відповідності критеріям, прийнятим для холтерівського моніторування. Крім того, холтерівське моніторування не може виступати як самостійний метод для встановлення діагнозу ІХС.
Особливе місце займає холтерівське моніторування ЕКГ у діагностиці вазоспастичної стенокардії (стенокардії Принцметала). Як правило, напади болю, викликані коронароспазмом, короткочасні, мають спонтанний характер, на ЕКГ проявляються елеваціями сегмента SТ і виникають у стані спокою, частіше вночі. У зв’язку із зазначеними особливостями вазоспастичної стенокардії для візуалізації змін на ЕКГ і документального підтвердження діагнозу найбільш доцільно використати холтерівське моніторування.
Метод холтерівського моніторування має важливу роль для контролю ефективності та корекції терапії ІХС. Динаміка показників при моніторуванні ЕКГ дає можливість оцінити ефективність і безпеку лікарських препаратів, дозволяє фіксувати деякі побічні ефекти. Дані холтерівського моніторування можуть бути використані для оцінки результатів хірургічного лікування коронарної недостатності (рис. 3.4).
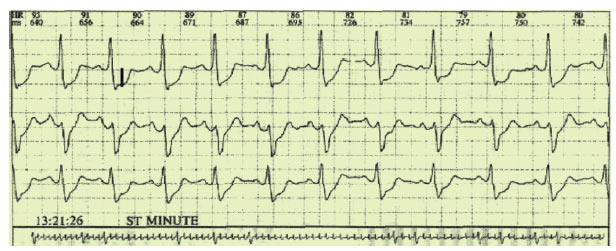
Рис. 3.4. Ішемія міокарда при холтерівському моніторуванні ЕКГ
Показання до проведення холтерівського моніторування
У разі необхідності стратифікації ризику у осіб із ІХС (зі стабільною, нестабільною стенокардією, ІМ) показане проведення холтерівського моніторування для об’єктивізації клінічного стану — визначення «тотального тягаря ішемії». Для діагностики ішемії міокарда у пацієнтів із ІХС використання методу холтерівського моніторування ЕКГ найбільш обґрунтоване і показане в таких випадках:
- Хворим з наявністю безсимптомних транзиторних депресій сегмента SТ під час навантажувальних проб і на ЕКГ спокою — для об’єктивізації клінічного статусу.
- Хворим, які перенесли безбольову форму ІМ.
- Пацієнтам з верифікованою безбольовою формою ІХС.
- Для уточнення діагнозу «вазоспастична стенокардія» (стенокардія Принцметала).
- Для оцінки результатів лікування та корекції терапії.
Критерії ішемії міокарда за результатами холтерівського моніторування. Чутливість і специфічність методу
З огляду на особливості методу холтерівського моніторування з його допомогою можна діагностувати транзиторні ішемічні зміни, що супроводжуються стенокардією чи її еквівалентами, а також безсимптомні зміни, що виникають у пацієнтів із документованою ІХС. Діагностика епізодів ішемії міокарда за результатами холтерівського моніторування ЕКГ можлива лише за наявності нормального синусового ритму і за відсутності вихідних змін графіки кінцевої частини шлуночкових комплексів.
Як критерії ішемії міокарда прийняті зміни на ЕКГ у вигляді зміщення сегмента SТ щодо ізолінії.
Характеристики ішемічної депресії сегмента SТ у осіб із ІХС (формула 1×1×1) такі:
- Горизонтальна або косонизхідна депресія сегмента SТ не менше 0,1 мВ в точці, що відстоїть на 80 мс від точки J.
- Тривалість епізоду депресії сегмента SТ не менше 1 хв.
- Інтервал часу між двома подібними епізодами не менше 1 хв.
Діагностична цінність методу визначається його чутливістю та специфічністю. Для холтерівського моніторування ці показники мають значні розбіжності й багато в чому залежать від контингенту пацієнтів, що обстежуються. В одному з перших досліджень, присвячених цьому питанню, чутливість методу, що ґрунтується на оцінці депресії сегмента SТ, становила 62%, специфічність — 61%. Відомі роботи, у яких зазначені показники були значно вищі — ≥80% (Y. Kodama). За результатами холтерівського моніторування у 12 тис. пацієнтів чутливість і специфічність депресії сегмента SТ визначені як 93,3 і 55,6% відповідно для чоловіків, 66,7 і 37,5% — для жінок.
Питання щодо кількісних та якісних характеристик елевації сегмента SТ як критеріїв ішемії міокарда при холтерівському моніторуванні на сьогодні остаточно не вирішене. З огляду на параметри ЕКГ елевація сегмента SТ відображає трансмуральну ішемію міокарда, пов’язану, як правило, з оклюзією коронарної артерії за рахунок атеротромбозу чи вазоспазму. Тривалість елевації, її форма, амплітуда і динаміка залежать від причини, що її викликала. Проте елевація сегмента SТ не є абсолютно специфічною ознакою ішемії міокарда і може бути зумовлена цілим рядом інших причин. Слід зазначити, що на сьогодні відсутні загальноприйняті кількісні критерії оцінки ішемічної елевації сегмента SТ. Пропонувалося вважати значимою елевацію з амплітудою зміщення SТ над ізолінією 0,1–0,3 мВ. В одному з найбільш масштабних досліджень Y. Kodama оцінював діагностичну значимість елевації сегмента SТ у поєднанні з такими показниками, як чергування під час холтерівського моніторування епізодів елевації з епізодами депресії SТ і значення індексу SТ/ЧСС — 1,4 мкв/уд./хв. Значимою вважалася елевація сегмента SТ на 0,1 мВ тривалістю 80 мс від точки J. У результаті автори одержали досить високі показники чутливості й специфічності методу — 80 і 64,7% відповідно.
Для інтерпретації змін сегмента SТ під час холтерівського моніторування ЕКГ деякі дослідники пропонують використовувати критерії, прийняті для проведення навантажувальних проб.
Методика проведення холтерівського моніторування
Для діагностики ішемічних змін холтерівське моніторування ЕКГ проводять за стандартними методиками. Як правило, використовують системи, що реєструють ЕКГ в 2 або 3 відведеннях. Вважається, що за допомогою 2 відведень, розташованих на передній поверхні грудної клітки, вдається зареєструвати >40% змін на ЕКГ. Збільшення кількості відведень сприяє підвищенню інформативності методу з виявлення ішемії міокарда. Перспективним технічним рішенням вважається застосування ортогональних відведень ЕКГ за Франко. Варіанти розташування електродів залежать від типу апарата для моніторування, проте найчастіше використовують пари модифікованих відведень V5–V1, V5–AVF. Тривалість холтерівського моніторування визначається завданнями дослідження. Для оцінки змін сегмента SТ вважається достатнім 24-годинне моніторування ЕКГ, для оцінки ефективності терапевтичних заходів — 48-годинне. Деякі дослідники для підвищення вірогідності результатів пропонували збільшити тривалість моніторування до 72 год. Адекватна оцінка результатів холтерівського моніторування неможлива без щоденника пацієнта, в якому відображена фізична активність хворого протягом доби, зафіксовані напади стенокардії, інші скарги, позначений час прийому лікарських засобів тощо.
Надзвичайно важливе тісне співробітництво лікаря і пацієнта при проведенні холтерівського моніторування для діагностики безбольових форм ішемії міокарда. Пацієнта слід чітко інструктувати щодо необхідності уважної реєстрації у щоденнику нападів стенокардії, оскільки невідмічені в щоденнику напади можуть бути неправильно розцінені як епізоди безбольової ішемії міокарда.
Для оцінки ішемії міокарда у хворих ІХС визначають такі показники:
- Сумарна кількість ішемічних епізодів на ЕКГ (виділяють епізоди ішемії, які супроводжувалися ангінозним синдромом, і безбольові зміни — депресії та елевації сегмента SТ).
- Сумарну (за весь період холтерівського моніторування) тривалість ішемії міокарда, в тому числі й для безсимптомних змін.
Останній показник має важливе прогностичне значення. Вважають, що ішемія, тривалість якої перевищує 60 хв/добу, незалежно від наявності стенокардії, підвищує ризик розвитку серцево-судинних ускладнень, зокрема ІМ. Серед додаткових показників, які характеризують тяжкість стану хворого, можна назвати амплітуду зміщення сегмента SТ і середню тривалість ішемічного епізоду. Необхідно також відзначати появу під час ішемії міокарда порушень ритму серця, що не лише має важливе діагностичне значення, але й дозволяє диференціювати аритмогенні зміни сегмента SТ.
Повторне проведення холтерівського моніторування дозволяє контролювати ефективність терапії ІХС на підставі динаміки ЕКГ-показників. Як правило, враховують їх статистично достовірні відмінності.
Особливості інтерпретації змін ЕКГ, зареєстрованих при проведенні холтерівського моніторування
При клінічній інтерпретації змін сегмента ST, зареєстрованих під час холтерівського моніторування, необхідно враховувати їх неспецифічний характер. Зокрема, зміщення сегмента ST нижче ізолінії можливе при гіпервентиляції, гіпертрофії шлуночків серця, пролапсі мітрального клапана, вегетативній дисфункції, блокадах ніжок пучка Гіса, WPW-синдромі, порушеннях електролітного і гормонального балансу. Динаміка кінцевої частини шлуночкового комплексу на ЕКГ може бути зумовлена різними захворюваннями серцево-судинної системи, включаючи АГ, міокардит і перикардит, СН, кардіоміопатії. За результатами холтерівського моніторування діагностично значиму депресію сегмента ST визначали у 1–50% осіб без кардіологічної патології. У практично здорових осіб, які обстежувалися, зміни ST–T залежать від багатьох факторів, серед яких найбільш значимими є: вплив на позицію серця зміни положення тіла, психоемоційний статус, ваготонія, тютюнопаління.
Змінювати графік кінцевої частини шлуночкового комплексу на ЕКГ можуть деякі лікарські засоби: серцеві глікозиди, блокатори β- адренорецепторів, антиаритмічні препарати, трициклічні антидепресанти, деякі цитостатики. Косовисхідна депресія сегмента ST характерна при тахікардії. Виражена брадикардія може супроводжуватися деяким підйомом сегмента ST над ізолінією. Крім того, встановлено, що зміщення сегмента ST залежать від циркадних змін тонуса вегетативної нервової системи протягом доби. Так, вранці та вдень за рахунок природного підвищення симпатичного впливу сегмент ST може мати вигляд косовисхідної депресії зі зміщенням точки J. У нічний час реєструють сідлоподібний підйом сегмента ST як результат вагусного впливу. Циркадні зміни сегмента ST можуть поєднуватися зі змінами агрегаційних властивостей крові та варіабельністю судинного тонусу.
Аналіз змін зубця Т при оцінці результатів холтерівського моніторування
Аналіз змін зубця Т при холтерівському моніторуванні має менше значення, ніж сегмента ST. Його зміни носять неспецифічний характер, значно варіюють і часто пов’язані з позиційними змінами серця, що підтверджують результати функціональних проб. Тому оцінка динаміки зубця Т може бути використана лише як додатковий показник у разі безсимптомних змін або як ЕКГ-характеристики ангінозного синдрому.
Зв’язок змін інтервалу ST–T з болем
Як правило, больовий синдром розвивається через деякий час після появи змін на ЕКГ. У деяких випадках стенокардія може виникнути одночасно зі змінами на ЕКГ або навіть передувати їм. Біль зазвичай проходить швидше, ніж зникають зміни сегмента ST на ЕКГ, хоча бувають винятки, які варто враховувати при аналізі та інтерпретації результатів холтерівського моніторування.
«Німа» ішемія міокарда
Доведено, що «німа» ішемія міокарда — самостійний прогностично несприятливий фактор, пов’язаний зі збільшенням кількості коронарних ускладнень і підвищенням частоти випадків серцевої смерті. Існує досить високий ступінь кореляції між кількісними показниками холтерівського моніторування і тяжкістю ураження коронарного русла. Результати холтерівського моніторування істотно доповнюють результати навантажувальних тестів при оцінці сумарного ризику. Загальновизнано, що динаміка ЕКГ-показників, що характеризують безбольову ішемію, відображає ефективність терапії ІХС.
ЕКГ-критерії для безбольової ішемії міокарда не відрізняються від загальноприйнятих і відповідають формулі 1×1×1. Певні питання виникають при визначенні за даними ЕКГ початку і закінчення ішемічного епізоду. Багато дослідників визначають тривалість депресії як загальний час від її початку до момента повернення до ізоелектричної лінії. Методично більш виправдано початком епізоду вважати депресію, що досягає 1 мм, а його закінченням — зменшення депресії до рівня <1 мм.
Незважаючи на тривалий період використання холтерівського моніторування ЕКГ для діагностики ІХС у клінічній практиці, питання щодо надійності визначення «німої» ішемії за депресією сегмента ST залишається актуальним. Разом з тим, необхідно відзначити, що вірогідність результатів холтерівського моніторування залежить і від методології проведення дослідження. Адекватний підбір хворих, врахування показань до проведення холтерівського моніторування, які відповідають реальним можливостям методу, кваліфікована інтерпретація отриманих даних значною мірою підвищують вірогідність результатів дослідження. Аналіз результатів холтерівського моніторування з урахуванням даних інших клінічних та інструментальних методів дослідження також сприяє підвищенню його інформативності. Перш за все це стосується результатів навантажувальних проб. Численні спостереження свідчать про високий ступінь відповідності результатів холтерівського моніторування і навантажувальних проб.
Елевація сегмента ST
При проведенні холтерівського моніторування як прояв ішемії можна розглядати дугоподібну елевацію сегмента ST y хворих з гострим ІМ. Діагностичні складнощі можливі за наявності хронічної аневризми серця, коли зміщення сегмента ST носить постійний характер — «застигла крива». Тривала дугоподібна чи сідлоподібна елевація сегмента ST можлива при перикардиті. Як правило, вона поєднується з наявністю негативного зубця Т. Іноді, за наявності плевроперикардіальних зрощень, елевація сегмента ST може бути транзиторного характеру і з’являтися при певному положенні тіла, наприклад у положенні лежачи на правому боці. Для оцінки зміщення точки J використовують описані раніше критерії. Сідлоподібна елевація сегмента ST характерна також для синдрому ранньої реполяризації та особливої форми стенокардії — вазоспастичної стенокардії Принцметала. У першому випадку форма сідлоподібної елевації має циркадний характер, більше виражена у нічні години під час сну. Дуже часто цю елевацію сегмента ST приймають за прояв спастичної реакції коронарних судин. При проведенні диференційної діагностики слід пам’ятати, що напад стенокардії Принцметала — явище короткочасне, минуче через кілька хвилин, часто супроводжується шлуночковими порушеннями ритму, у деяких випадках тахікардією. Для синдрому ранньої реполяризації та вагусних змін сегмента ST характерна значна тривалість (протягом декількох годин), причому останні з’являються під час сну, супроводжують весь період сну і нормалізуються чи мають тенденцію до зниження сегмента під час пробудження. Крім того, при вагусних реакціях відзначають знижену ЧСС.
Нестабільна стенокардія
Незалежно від наявності чи відсутності больового синдрому кількість епізодів ішемії, які реєструються під час холтерівського моніторування, може виявитися вирішальною для визначення прогнозу при нестабільній стенокардії.
Депресія сегмента ST і аритмії
Депресія сегмента ST на ЕКГ може з’являтися у зв’язку з порушеннями ритму: до, після чи під час аритмічних подій. Найчастіше депресію сегмента ST реєструють у зв’язку з пароксизмами будь-якої тахікардії. Морфологічні характеристики сегмента ST (як правило, косовисхідна депресія), а також тимчасовий зв’язок з аритмією дозволяють досить легко диференціювати ритмозалежні зміни ЕКГ.
Помилки в автоматичному вимірі зміщень сегмента ST
Наведені раніше критерії ішемії міокарда визначені для візуальної оцінки ЕКГ. Проте при автоматичному аналізі ЕКГ під час холтерівського моніторування помилки при вимірі зміщень сегмента ST неминучі. Тому для підвищення якості діагностики ішемії міокарда за результатами холтерівського моніторування необхідно проводити обов’язковий візуальний контроль ЕКГ-змін, у тому числі при використанні апаратів з автоматичним аналізом запису. Найбільш часті помилки пов’язані з поганою якістю запису. Ці помилки виникають як при автоматичному комп’ютерному, так і при візуальному аналізі ЕКГ. Їх відзначають, зокрема, у тих випадках, коли кожен наступний комплекс записується на новому рівні і вся ЕКГ має вид хвилеподібної кривої. При цьому немає чіткого зв’язку з диханням. Такі помилки виникають при виконанні фізичного навантаження під час холтерівського моніторування. ЕКГ низької якості, з великою кількістю додаткових осциляцій і артефактів часто реєструють при відриві електрода чи користуванні радіотелефоном.
Візуалізуючі методи діагностики ІХС і оцінки ризику
Ехокардіографія (ехоКГ)
ЕхоКГ має певну цінність при діагностиці ІХС. Її проведення доцільно проводити при підозрі на ураження клапанів або ГКМП, які можуть викликати симптоми, подібні до ІХС, а також для визначення функції ЛШ. ЕхоКГ-дослідження може виявити наслідки ІХС у пацієнтів з хронічною ІХС, такі як порушення регіональної скоротності, мітральна регургітація. У більшості випадків ехоКГ не є необхідним дослідженням для встановлення діагнозу ІХС. Також немає необхідності у проведенні повторних ехоКГ-досліджень у пацієнтів із стенокардією за відсутності ускладнень чи змін клінічного стану.
Рекомендації з проведення ехоКГ для виявлення причини болю у грудній клітці у пацієнтів з підозрюваною стенокардією напруження
Клас I
- Пацієнти з систолічним шумом при підозрі на аортальний стеноз або ГКМП.
- Оцінка вираженості ішемії (наприклад сегментарні порушення скоротності ЛШ), якщо ехоКГ може бути проведена під час больового нападу або протягом 30 хв після його припинення.
- Пацієнти з ознаками СН.
- Пацієнти з раніше перенесеним ІМ.
- Пацієнти з повною блокадою лівої ніжки пучка Гіса, патологічним зубцем Q, іншими значними змінами ЕКГ, включаючи ознаки ГЛШ.
Клас IIb
Пацієнти з характерним клацанням або шумом з метою діагностики пролапса мітрального клапана.
Клас III
Пацієнти з нормальною ЕКГ, без ІМ в анамнезі і без ознак або симптомів СН, хвороб клапанів серця, ГКМП.
Трансторакальна ехоКГ і допплєрівська ехоКГ мають діагностичну цінність за наявності шуму чи інших ознак аортального стенозу або ГКМП, що супроводжують ІХС. Дані допплєрівського ехоКГ-дослідження зазвичай надають точну кількісну інформацію про наявність і ступінь супутніх уражень. Наприклад, якщо йдеться про гіпертрофію міокарда, можна визначити, чи є вона концентричною чи асиметричною, гіпертрофією міжшлуночкової перегородки, верхівки ЛШ або вільної стінки. Можна визначити величину аортального клапанного чи підклапанного градієнта, а також функцію ЛШ в цілому.
ЕхоКГ може допомогти при встановленні або виключенні діагнозу пролапса мітрального клапана, а також визначитись щодо необхідності лікування.
Визначення систолічної та діастолічної функції ЛШ
Хронічна ІХС (супроводжується вона стенокардією чи ні) може призвести до погіршення систолічної функції ЛШ. Оцінка ступеня порушення регіональної чи загальної скоротності є важливим моментом для подальшого вибору медикаментозного чи хірургічного лікування. Рутинне визначення параметрів функції ЛШ в цілому, наприклад ФВ ЛШ, не є необхідним для діагностики стабільної стенокардії. Наприклад, пацієнтам із підозрюваною стенокардією і нормальною ЕКГ, без ІМ в анамнезі та симптомів СН ехоКГ і радіонуклідне дослідження не показані. У багатьох дослідженнях виявлено взаємозв’язок ІХС з наявністю діастолічної дисфункції ЛШ. У пацієнтів зі стабільною стенокардією напруження без ознак СН на ехоКГ у стані спокою можна виявити діастолічну дисфункцію. Нові можливості допплєрографічного дослідження значно підвищили ймовірність виявлення діастолічної дисфункції, проте її клінічне значення для прогнозу і лікування поки не визначені.
Сегментарні порушення скоротності ЛШ. ЕхоКГ-даними, що допомагають у діагностиці хронічної ІХС, можуть бути регіональні порушення скоротності, наприклад гіпокінез (знижена скоротність), акінез (відсутність скоротності) та дискінез (парадоксальний рух стінок). Слід з особливою увагою ставитися до виявлених порушень руху міжшлуночкової перегородки, оскільки причиною цього може бути не лише хронічна ІХС, але й такі стани, як блокада лівої ніжки пучка Гіса, наявність внутрішньошлуночкових водіїв ритму, перевантаження правих відділів обсягом і раніше перенесене оперативне втручання на серці.
Ступінь регіональної дисфункції ЛШ може бути описаний для кожного сегмента окремо (гіпокінез, акінез, дискінез) або з використанням спеціальних методів розрахунку, які відображають скоротність в цілому, а також окремих сегментів. Порушення сегментарної скоротності, які часто виявляють у пацієнтів з раніше перенесеним ІМ, добре корелюють з локалізацією ураження коронарних артерій або ІМ. Патологічна сегментарна скоротність можлива у пацієнтів з минущою ішемією міокарда, хронічною гіпоперфузією (гібернований міокард) або рубцевими змінами міокарда, а також при міокардиті чи інших станах, не пов’язаних з оклюзією коронарних артерій. Якщо при використанні стандартного трансторакального дослідження візуалізація ендокарда ЛШ виявляється недостатньою, рекомендується застосування режиму другої гармоніки ехоКГ-дослідження з контрастуванням.
У пацієнтів зі стабільною стенокардією без попереднього ІМ при проведенні ехоКГ-дослідження у стані спокою при відсутності ішемії скоротність стінок ЛШ зазвичай нормальна. Порушення сегментарної скоротності, виявлені при проведенні ехоКГ під час ішемії чи протягом 30 хв після неї у пацієнтів без діагностованої ІХС, підвищують імовірність наявності у них клінічно значимої ІХС.
Згідно з наявною інформацією позитивна прогностична точність таких даних для гострої ішемії чи ІМ становила близько 50%. Відсутність порушень регіональної скоротності характерна для групи пацієнтів із низьким ризиком розвитку гострого ІМ, з негативною прогностичною точністю приблизно 95%.
Ішемічна мітральна регургітація. ІХС може ускладнитися іншими структурними та функціональними змінами. Отже, можлива поява мітральної регургітації, причиною якої можуть стати глобальна систолічна дисфункція ЛШ, локальна дисфункція папілярних м’язів, склероз та вкорочення субмітральних хорд, розрив папілярного м’яза та інші причини. Наявність, вираженість і механізми розвитку мітральної регургітації, а також можливість її хірургічного лікування можуть бути досить точно визначені за допомогою трансторакальної допплєрівської ехоКГ.
Неінвазивні методи визначення анатомії коронарних артерій та виявлення їх кальцинозу
Комп’ютерна томографія (КТ)
Удосконалення техніки протягом останніх років дозволило розширити застосування КТ, яке було обмежене у зв’язку з низькою розрізняльною здатністю і артефактами при реєстрації зображення. Також з’явилося нове програмне забезпечення для аналізу та інтерпретації отриманих зображень, що полегшило та уніфікувало метод. Існують два методи КТ — надшвидкісна (електронно-променева) КТ і мультиспіральна (багатошарова) КТ. Застосування обох методів КТ вірогідно підтвердило можливості оцінки ступеня і протяжності коронарної кальцифікації. Найчастіше використовують шкалу Агатстона для кількісної оцінки кальцифікації коронарних артерій, що ґрунтується на площі та щільності кальцифікованих бляшок і потребує спеціального програмного забезпечення. Чутливість КТ для діагностики ІХС становить 85–100%, а специфічність — лише 41–76%; позитивне прогностичне значення коливається в межах 55–84%, а негативне — 84–100%.
Кальцій депонується в атеросклеротичних бляшках, в тому числі розташованих і в коронарних артеріях. Коронарна кальцифікація збільшується з віком. Для полегшення інтерпретації кількості кальцію в артеріях існують спеціальні номограми з урахуванням віку і статі. Розмір зони коронарної кальцифікації більш корелює із загальною кількістю бляшок, ніж зі ступенем стенозування чи локалізацією стенозів. Проте у декількох дослідженнях виявлені помітні відмінності при повторних вимірах рівня кальцифікації коронарних судин методом КТ. Таким чином, виявлення кальцинозу коронарних артерій може бути корисним для визначення пацієнтів з більш високим ризиком розвитку коронарної хвороби серця, але не може бути рекомендоване як метод рутинної діагностики ІХС. Використання серійних КТ у окремих пацієнтів для визначення та подальшого аналізу регресії чи прогресії кальцифікації залишається проблематичним.
Якість зображення при КТ може бути значно поліпшена при використанні внутрішньовенних контрастних агентів. При цьому КТ виявилася найбільш перспективним неінвазивним методом візуалізації коронарних артерій з відмінними здатностями для виявлення і характеристики атеросклеротичних бляшок. Так, чутливість і специфічність КТ-ангіографії для виявлення ІХС становлять 95 і 98% відповідно при використанні 16-шарового сканера. Результати дослідження з використанням 64-шарових сканерів свідчать, що чутливість становить 90–94%, специфічність — 95–97%, а негативне прогностичне значення — 93–99%.
Рекомендації щодо використання КТ з контрастуванням у пацієнтів зі стабільною стенокардією
Клас IIb
1. Пацієнти з низькою передтестовою імовірністю захворювання, з неінформативними результатами ЕКГ або візуалізуючих стрес-тестів.
На сьогодні, незважаючи на високу діагностичну цінність методу КТ, її прогностичне значення і місце серед інших методів дослідження при ІХС повністю не визначене. Найбільш доцільне її використання у пацієнтів з низькою передтестовою імовірністю захворювання (<10%), із сумнівними результатами функціональних тестів — ЕКГ-проб з фізичним навантаженням або візуалізуючих стресових тестів.
МРТ з контрастуванням коронарних артерій
Як і у разі з КТ, використання МРТ знайшло застосування при додатковому внутрішньовенному введенні контрастних засобів. На сьогодні МРТ — предмет наукового вивчення і не рекомендується для рутинного використання в клініці з метою діагностики ІХС.
Візуалізуючі стресові методи
Рекомендації щодо проведення візуалізуючих стресових досліджень як первинного діагностичного тесту у пацієнтів із хронічною стабільною стенокардією, здатних виконувати фізичне навантаження
Клас I
1. Навантажувальне візуалізуюче дослідження перфузії міокарда чи навантажувальне ехоКГ-дослідження у пацієнтів із середньою передтестовою імовірністю ІХС та однією з нижченаведених змін на ЕКГ:
a) преекзитація (WPW-синдром);
б) депресія сегмента ST у спокої >1 мм.
2. Навантажувальне візуалізуюче дослідження перфузії міокарда чи навантажувальне ехоКГ-дослідження у пацієнтів із раніше проведеним реваскуляризуючим втручанням (ПКВ або АКШ).
3. Візуалізуюче дослідження перфузії міокарда з використанням аденозину чи дипіридамолу у пацієнтів із середньою передтестовою імовірністю ІХС та однією з нижченаведених змін на ЕКГ:
a) електростимульований шлуночковий ритм;
б) блокада лівої ніжки пучка Гіса.
Клас IIb
1. Навантажувальне візуалізуюче дослідження перфузії міокарда чи навантажувальне ехоКГ-дослідження у пацієнтів із низькою чи високою імовірністю розвитку ІХС та однією із нижченаведених змін на ЕКГ:
a) преекзитація (WPW-синдром);
б) депресія сегмента ST у спокої >1 мм.
2. Візуалізуючі дослідження перфузії міокарда із застосуванням аденозину чи дипіридамолу у пацієнтів із низькою чи високою передтестовою імовірністю розвитку ІХС та однією із нижченаведених змін на ЕКГ:
a) електростимульований шлуночковий ритм;
б) блокада лівої ніжки пучка Гіса.
3. Навантажувальне візуалізуюче дослідження перфузії міокарда чи навантажувальне ехоКГ-дослідження пацієнтів із середньою передтестовою імовірністю розвитку ІХС та одним із нижченаведених станів:
a) застосування дигоксину з депресією сегмента ST <1 мм на вихідній ЕКГ;
б) ГЛШ з депресією сегмента ST <1 мм на вихідній ЕКГ.
4. Навантажувальне візуалізуюче дослідження перфузії міокарда, навантажувальне ехоКГ-дослідження, візуалізуюче дослідження перфузії міокарда із застосуванням аденозину чи дипіридамолу або ехоКГ з добутаміном як первинне стресове дослідження у пацієнтів, які приймають дигоксин, з нормальною ЕКГ у спокої.
5. ЕхоКГ з навантаженням або введенням добутаміну у пацієнтів із блокадою лівої ніжки пучка Гіса.
Рекомендації щодо проведення візуалізуючих стресових досліджень як первинного діагностичного тесту у пацієнтів із хронічною стабільною стенокардією, не здатних виконувати фізичне навантаження
Клас I
1. Візуалізуюче дослідження перфузії міокарда з використанням аденозину чи дипіридамолу, або ехоКГ із введенням добутаміну у пацієнтів із середньою передтестовою імовірністю ІХС.
2. Візуалізуюче дослідження перфузії міокарда з використанням аденозину чи дипіридамолу, або ехоКГ із введенням добутаміну у пацієнтів із раніше перенесеним реваскуляризуючим втручанням (ПКВ чи АКШ).
Клас IIb
1. Візуалізуюче дослідження перфузії міокарда із застосуванням аденозину чи дипіридамолу, або ехоКГ із введенням добутаміну у пацієнтів із високою чи низькою передтестовою імовірністю розвитку ІХС та відсутністю електростимульованого шлуночкового ритму або блокади лівої ніжки пучка Гіса.
2. Візуалізуюче дослідження перфузії міокарда із застосуванням аденозину чи дипіридамолу у пацієнтів із високою або низькою передтестовою імовірністю розвитку ІХС та однією з нижченаведених змін на вихідній ЕКГ:
a) електростимульований шлуночковий ритм;
б) блокада лівої ніжки пучка Гіса.
3. ЕхоКГ із введенням добутаміну у пацієнтів із блокадою лівої ніжки пучка Гіса.
Коли необхідне проведення візуалізуючого стресового дослідження
Пацієнтами, яким слід проводити в першу чергу кардіологічні стресові дослідження з візуалізацією, а не ЕКГ з навантаженням, можуть бути:
- особи з повною блокадою лівої ніжки пучка Гіса, електростимульованим шлуночковим ритмом, синдромом преекзитації (WPW-синдром) та іншими подібними порушеннями провідності на ЕКГ;
- пацієнти з депресією сегмента ST у спокої >1 мм, включаючи осіб із ГЛШ або тих, хто приймає серцеві глікозиди;
- пацієнти, які не можуть виконати фізичне навантаження, необхідне для одержання значимого результату при рутинній навантажувальній ЕКГ-пробі;
- пацієнти із стенокардією та раніше проведеною реваскуляризацією, для яких важливе значення має виявлення локалізації та вираженості ішемії, а також визначення життєздатності міокарда.
Для індукування стресу можуть бути використані такі методи:
- фізичне навантаження (тредміл, ВЕМ у вертикальному чи горизонтальному положенні);
- фармакологічні проби (з використанням добутаміну чи вазодилататорів).
Якщо пацієнт здатний виконати фізичне навантаження, достатнє для досягнення серцево-судинного стресу (6–12 хв), навантажувальні стресові тести (в основному на тредмілі), мають перевагу перед фармакологічними стресовими тестами. Проте, якщо пацієнт не може виконати необхідне фізичне навантаження або існують інші причини (наприклад необхідність оцінити життєздатність міокарда), більш прийнятним може стати фармакологічна проба. Найчастіше для заміни фізичного навантаження використовують фармакологічні проби з трьома речовинами: дипіридамолом, аденозину фосфатом і добутаміном.
Вазодилататори дипіридамол і аденозину фосфат частіше застосовують при дослідженні перфузії міокарда за допомогою сцинтиграфії, а добутамін як інотропний (і хронотропний) засіб одержав більше поширення при проведенні ехоКГ-дослідження.
Дипіридамол викликає вазодилатацію коронарних судин опосередковано — шляхом інгібування споживання клітинами аденозину, підвищуючи у такий спосіб його рівень у крові й тканинах; останній має коронародилатуючу дію і значно підвищує коронарний кровоток. Посилення кровотоку, викликане дипіридамолом або аденозином, менш виражене у стенозованих артеріях, що визначається при дослідженні перфузії міокарда. Дипіридамол та аденозину фосфат викликають ішемію міокарда внаслідок синдрому «коронарного обкрадання».
Дипіридамол та аденозину фосфат відносно безпечні й добре переносяться, незважаючи на часто виникаючі незначні побічні ефекти. Найбільш характерні побічні ефекти, пов’язані з інфузією дипіридамолу, включають: головний біль (5–23%), запаморочення (5–21%), нудоту (8–12%), гіперемію шкіри (3%) й аритмії (<2%). При введенні аденозину фосфату зареєстровані такі побічні ефекти: біль у грудній клітці (57%), головний біль (35%), гіперемія (25%), диспное (15%), AV-блокада I ступеня (18%). Серйозні побічні ефекти розвиваються рідко, проте при застосуванні як аденозину фосфату, так і дипіридамолу можливий розвиток вираженого бронхоспазму у пацієнтів із БА чи ХОХЛ. Тому застосування зазначених препаратів у цих пацієнтів потребує особливої обережності. Побічні ефекти дипіридамолу й аденозину можуть бути усунуті шляхом застосування їх фармакологічного антагоніста — теофіліну.
Добутамін у високих дозах (20–40 мкг/кг/хв) за рахунок підвищення ЧСС, САТ, посилення скоротності міокарда і збільшення потреби міокарда в кисні може провокувати ішемію. Підвищення кровотоку при цьому в 2–3 рази менше виражене, ніж при застосуванні аденозину фосфату або дипіридамолу, проте також достатнє для визначення гетерогенності перфузії методом радіонуклідної візуалізації. Хоча при інфузії добутаміну часто відзначають побічні ефекти, проба є відносно безпечною, навіть при проведенні у осіб похилого віку. Найбільш частими некардіальними ускладненнями (які відзначали у 20% випадків) у дослідженні за участю 1118 пацієнтів були: нудота (8%), тривожність (6%), головний біль (4%) і тремор (4%). Виявляли також розвиток аритмій серця — шлуночкових (15%) і суправентрикулярних екстрасистол і нестійкої шлуночкової тахікардії (3–4%). Атиповий біль у грудній клітці зареєстрували приблизно у 20% обстежених.
Фактори, що знижують точність неінвазивних методів дослідження
Як відзначено для навантажувальної ЕКГ-проби, на результати проведення дослідження може вплинути передтестова імовірність ІХС. Позитивне прогностичне значення тесту знижується разом зі зниженням поширеності захворювання в популяції, тоді як негативна прогностична цінність підвищується. Візуалізуючі стресові дослідження не слід використовувати як рутинний метод діагностики у пацієнтів із низькою чи високою імовірністю наявності ІХС. Хоча ці дослідження мають меншу цінність при високій передтестовій імовірності захворювання, вони можуть бути корисні для визначення ступеня ризику і прогнозу у цих пацієнтів.
Так само, як і для ЕКГ з навантаженням, на чутливість, специфічність і прогностичну цінність візуалізуючого дослідження перфузії міокарда і стресової ехоКГ можуть впливати різні фактори. Ефект післятестової систематичної помилки виявився подібним для візуалізуючого дослідження перфузії міокарда і стресової ехоКГ. Корекція цієї помилки призводить до зниження чутливості та підвищення специфічності обох методів. Внаслідок змін чутливості та специфічності у пацієнтів із середньою передтестовою імовірністю ІХС корекція верифікаційної помилки зазвичай поліпшує діагностичну цінність позитивних результатів тесту і знижує негативних.
Стресова ехоКГ
Метод стресової ехоКГ ґрунтується на оцінці змін сегментарної скоротності ЛШ при впливі стресорного агента порівняно з вихідними даними. Підтвердженням наявності ішемії міокарда під час проведення стрес-ехоКГ є розвиток нових або збільшення наявних порушень скоротності в 1 сегменті, а також відсутність поліпшення скоротності у відповідь на стресорний агент.
Поява цифрових методів обробки зображення та збереження інформації дозволяє оцінювати стан ЛШ на різних стадіях стресового дослідження, що значно підвищує ефективність і точність інтерпретації результатів стресової ехоКГ.
Чутливість і специфічність стресової ехоКГ у діагностиці ІХС перебувають приблизно на одному рівні з цими показниками для інших стресових методів візуалізації міокарда. У численних дослідженнях чутливість відзначали в межах 70–97%, з усередненими показниками чутливості для навантажувальної ехоКГ близько 80–85% і для стресової ехоКГ з добутаміном — 82%. Як і очікувалося, чутливість навантажувальної ехоКГ при багатосудинному ураженні була вищою (73–100%, в середньому — 87%), ніж при односудинному (63–93%, в середньому — 78%). У цих же дослідженнях специфічність становила 84–86% для ехоКГ з фізичним навантаженням і 62–100% для ехоКГ з добутаміном (рис. 3.5).
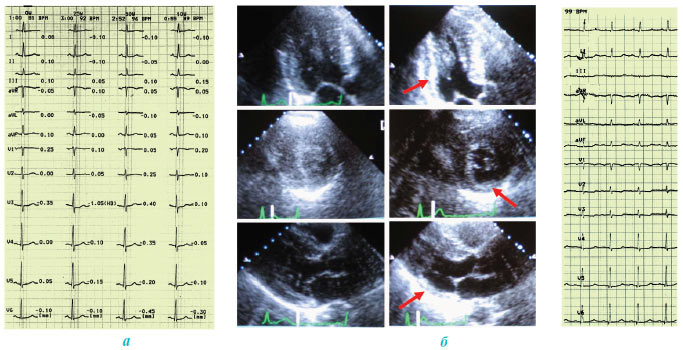
Рис. 3.5. Приклад псевдонегативної ВЕМ-проби (а) та позитивної стрес-ехоКГ з добутаміном (б) у одного й того ж пацієнта: а) ВЕМ. ЧСС=96 (57% максимальної). Задишка, втомленість. ЕКГ без патологічної динамики; б) стрес-ехоКГ з добутаміном (20 мкг/кг/хв). ЧСС=99 (58% максимальної). Дискомфорт у грудній клітці. ЕКГ без динаміки. Гіпокінез задньої та нижньої стінки ЛШ (позначено стрілками) — ішемічна відповідь
Найчастіше для навантажувальної стресової ехоКГ використовують ВЕМ з напівлежачим положенням пацієнта, а зображення реєструють по можливості наприкінці кожного ступеня навантаження і на піку навантаження. Обмеженням методу є низька якість ехоКГ-зображень у зв’язку з гіпервентиляцією. Для поліпшення візуалізації можливе застосування методу колірного картування ендокарда — колорокінезу (рис. 3.6).
Рис. 3.6. Стрес-ехоКГ з добутаміном із застосуванням колорокінезу. Приклад двофазної відповіді: а) верхівкова чотирикамерна позиція ЛШ; б) верхівкова двокамерна позиція ЛШ. Використовується цифрова обробка зображення — колорокінез. Стрілками позначено зони (а — верхівковий сегмент бокової стінки ЛШ, б — верхівковий сегмент передньої стінки ЛШ) із двофазною відповіддю на введення добутаміну. Всі зображення отримано в кінці систоли ЛШ
Оптимальний препарат для проведення фармакологічної стресової ехоКГ — добутамін. Стресова ехоКГ з добутаміном має більшу чутливість для визначення стенозів коронарних артерій, ніж при застосуванні вазодилататорів (дипіридамолу чи аденозину). У нещодавно опублікованому огляді 36 досліджень чутливість і специфічність стресової ехоКГ з добутаміном для діагностики ІХС в середньому становили 82% (86% для багатососудинних уражень).
Радіонуклідне дослідження
У 1995 р. ACC/AHA опубліковано детальний огляд щодо використання радіонуклідної візуалізації для діагностики ІХС і локалізації уражень міокарда. Найбільше поширення у пацієнтів з підозрюваною ІХС з метою візуалізації міокардіальної перфузії одержало використання радіоізотопу 201Tl, проте показано, що нові ізотопи — 99mTc-сестамібі і 99mTc-тетрофосмін — мають подібну діагностичну точність. Таким чином, у більшості випадків можуть бути з однаковим ступенем діагностичної цінності використані всі три ізотопи — 201Tl, 99mTc-сестамібі і 99mTc-тетрофосмін.
Для візуалізації перфузії міокарда може бути використана як площинна перфузійна сцинтиграфія, так і ОФЕКТ з візуальним аналізом або використанням технічних кількісних розрахунків.
Обчислення (наприклад зроблені з використанням горизонтальних або периферичних контурів) можуть поліпшити чутливість тесту, особливо у пацієнтів з односудинним ураженням. Для площинної сцинтиграфії з 201Tl опубліковані середні значення чутливості й специфічності перебували в межах 83 і 88% відповідно при візуальному аналізі, а при кількісному аналізі — 90 і 80% відповідно. ОФЕКТ з 201Tl загалом більш чутлива, ніж площинна візуалізація для діагностики ІХС, локалізації ділянок міокарда з гіпоперфузією, визначення стенозів передньої міжшлуночкової гілки та гілки лівої коронарної артерії, що обгинає, а також з вищою імовірністю виявляє наявність багатосудинних уражень при ІХС. Усереднені показники чутливості й специфічності навантажувальної ОФЕКТ з 201Tl перебували в межах 89 і 76% відповідно при якісному аналізі, а при кількісному — 90 і 70% відповідно.
Деяка недостатність рівнів чутливості й специфічності частково може бути зумовлена тим, що виявлений ангіографічно ступінь стенозу не завжди точно корелює з вираженістю функціональних змін. Менше, ніж очікувалося, специфічність ОФЕКТ, порівняно з площинним дослідженням, пов’язана, імовірно, з післятестовою систематичною помилкою. Крім того, безсумнівно, відіграє роль у зниженні специфічності ОФЕКТ порівняно з площинною візуалізацією відбір пацієнтів, а також такі фактори, як фотонна атенуація та артефакти, що виникають при томографічній реконструкції зображення.
Після впровадження дипіридамол-індукованої вазодилатації для дослідження міокардіальної перфузії з 201Tl ця фармакологічна проба стала одним із важливих методів неінвазивної діагностики ІХС. Площинна сцинтиграфія з дипіридамолом має високу чутливість (90%) і досить високу специфічність (близько 70%) у діагностиці ІХС. Дипіридамолова ОФЕКТ з 201Tl або 99mTc- сестамібі виявилася настільки ж точною, як і площинна візуалізація. Результати дослідження перфузії міокарда з використанням аденозину подібні до результатів, отриманих при візуалізації на фоні введення дипіридамолу чи при фізичному навантаженні. Застосування добутаміну для візуалізації перфузії міокарда має значні обмеження порівняно з вазодилататорами (дипіридамол або аденозин) у зв’язку з менш вираженим підвищенням коронарного кровотоку, проте інформативне у пацієнтів із наявністю протипоказань до призначення дипіридамолу або аденозину фосфату.
Особливості при проведенні стресових методів візуалізації
Супутнє застосування лікарських препаратів. Чутливість ехоКГ-дослідження з фізичним навантаженням для діагностики ІХС знижується у пацієнтів, які приймають блокатори β-адренорецепторів. По можливості необхідно відмінити блокатори β-адренорецепторів за 48 год до планованого дослідження. Проте навіть у тому разі, якщо навантаження залишається на субмаксимальному рівні внаслідок застосування препаратів, візуалізуючі методи (сцинтиграфія чи ехоКГ) мають більшу специфічність, ніж ЕКГ-проба з фізичним навантаженням.
Блокада ніжки пучка Гіса
У багатьох дослідженнях при навантажувальних методах візуалізації відзначали підвищену поширеність порушення перфузії міокарда у пацієнтів із блокадою лівої ніжки пучка Гіса при відсутності ангіографічних ознак ІХС. Ці порушення найчастіше поширювалися на ділянку міжшлуночкової перегородки, могли бути стійкими або оборотними, але здебільшого були відсутні при проведенні фармакологічної стресової проби. Механізм розвитку цих змін повністю не вивчений. За даними декількох досліджень (що включали понад 200 пацієнтів) визначили, що вивчення перфузії з використанням фармакологічної вазодилатації — більш точний метод для виявлення ІХС у пацієнтів із блокадою лівої ніжки пучка Гіса і лише в одному невеликому дослідженні за участю 24 пацієнтів отримано дані про діагностичну недоцільність стресової ехоКГ при наявності блокади лівої ніжки пучка Гіса. Вважаємо, що дослідження скоротності міокарда методом ехоКГ із застосуванням дипіридамолу і аденозину рекомендовано таким пацієнтам. Блокада правої ніжки пучка Гіса чи блокада верхньої або нижньої гілки лівої ніжки пучка Гіса зазвичай не пов’язані з подібними змінами перфузії.
Проведення стресового дослідження у пацієнтів особливих груп (жінки, особи похилого віку, пацієнти з ожирінням, представники деяких професій). Навантажувальна ЕКГ-проба (на тредмілі) має недостатню діагностичну цінність у жінок, тому що у більшості з них більш низька передтестова імовірність розвитку ІХС, ніж у чоловіків. У цьому разі радіоізотопне дослідження міокардіальної перфузії чи ехоКГ можуть бути логічним доповненням до ЕКГ-проби з фізичним навантаженням на тредмілі. Проте чутливість радіоізотопного сканування з ізотопами талію у жінок може бути нижчою, ніж у чоловіків. На зображенні передньої стінки ЛШ у жінок часто виникають артефакти через молочну залозу, особливо при скануванні з ізотопом 201Tl. Нещодавно проведені дослідження показали, що при використанні ізотопу 99mTc-сестамібі ці артефакти зменшувалися. В одному з останніх проспективних досліджень, що включало 115 жінок як з підозрюваною ІХС, так і з низькою її імовірністю, ОФЕКТ, проведені з 201Tl і 99mTc-сестамібі, мали однакову чутливість (84,3 і 80,4% для ступеня коронарного стенозу >70%). Проте при використанні ізотопу 99mTc-сестамібі специфічність методу була вищою (84,4% порівняно з 67,2%) і підвищувалася до 92,2% з урахуванням результатів ЕКГ-дослідження. Як ЕКГ-проба з дозованим фізичним навантаженням, так і стресова ехоКГ не призводять до появи специфічних артефактів, пов’язаних з молочною залозою у жінок. ЕхоКГ-дослідження у осіб з ожирінням важко провести технічно, а отримане зображення часто буває низької якості. Неякісне зображення також нерідко буває у осіб з деформаціями грудної клітки або захворюваннями легень. Таким чином, на сьогодні недостатньо даних для рекомендацій щодо заміни стандартної ЕКГ-проби з фізичним навантаженням візуалізуючими стрес-методами для первинної діагностики ІХС у жінок.
Хоча деякі пацієнти похилого віку можуть адекватно виконати ЕКГ-пробу з дозованим фізичним навантаженням, найчастіше її проведення неможливе у зв’язку з фізичною неспроможністю цих хворих. Тому при проведенні дослідження у пацієнтів похилого віку більше прийнятні фармакологічні візуалізуючі методи.
Для пацієнтів з надмірною масою тіла також виникають труднощі у використанні ОФЕКТ, оскільки для проведення цього методу існують певні обмеження щодо маси тіла (зазвичай <135 кг). Цим хворим може бути проведена площинна сцинтиграфія. У осіб із надмірною масою тіла важко досягти оптимального зображення, особливо при використанні ізотопу 201Tl, внаслідок значного зв’язування фотонів м’якими тканинами. Кращі результати можна одержати при проведенні сканування з ізотопом 99mTc-сестамібі, а також при використанні позитронної емісійної томографії.
Деяким групам осіб, чия професія пов’язана з суспільною безпекою (пілоти, водії, пожежники, працівники правоохоронних служб тощо), або спортсменам частіше, ніж іншим, проводять навантажувальне тестування для визначення толерантності до фізичного навантаження та імовірності наявності ІХС. Для пацієнтів цих груп із середньою та високою імовірністю ІХС призначати візуалізуючі дослідження на додаток до стандартної ЕКГ-проби з фізичним навантаженням необхідно ширше, ніж у середньостатистичного пацієнта. Деякі дослідники вважають первинним діагностичним стресовим дослідженням для цих груп пацієнтів стрес-ехоКГ або радіонуклідне дослідження (табл. 3.6 і 3.7).
Таблиця 3.6
Порівняльна оцінка стресової ехоКГ і стресового дослідження перфузії міокарда
| Переваги стрес-ехоКГ | 1. Вища специфічність
2. Ширші можливості визначення анатомії та функції серцевого м’яза 3. Більша зручність та ефективність проведення 4. Низька вартість |
| Переваги радіоізотопного стрес-дослідження міокардіальної перфузії | 1. Кращі технічні можливості
2. Вища чутливість, особливо для односудинного ураження із залученням огинаючої гілки лівої коронарної артерії 3. Вища точність виявлення ішемії при патологічній скоротності декількох сегментів ЛШ у спокої 4. Більша кількість опублікованих даних, особливо щодо прогнозу |
Таблиця 3.7
Порівняння діагностичної точності різних стресових методів для виявлення ІХС
| Метод | Чутливість,% | Специфічність, % |
| Навантажувальна ЕКГ | 68 | 77 |
| Навантажувальна стрес-ехоКГ | 80–85 | 80–86 |
| Навантажувальне дослідження міокардіальної перфузії | 85–90 | 70–75 |
| Стрес-ехоКГ з добутаміном | 40–100 | 62–100 |
| Стрес-ехоКГ з вазодилататорами | 56–92 | 87–100 |
| Дослідження міокардіальної перфузії з вазодилататорами | 83–94 | 64–90 |
Інвазивна діагностика
Коронарна ангіографія
Коронарну ангіографію використовують як одну з методик обстеження, що допомагає встановити точний діагноз і вибрати оптимальне лікування. Неінвазивні дослідження можуть виявити наявність стенозуючого коронарного атеросклерозу з певною долею імовірності й використовуються для визначення необхідності проведення коронарної ангіографії та подальшої стратифікації ризику (табл. 3.8). Але вони можуть бути протипоказані при наявності певних супутніх захворювань або неможливості їх проведення. Неінвазивні методики також не дозволяють оцінити можливість реваскуляризації міокарда.
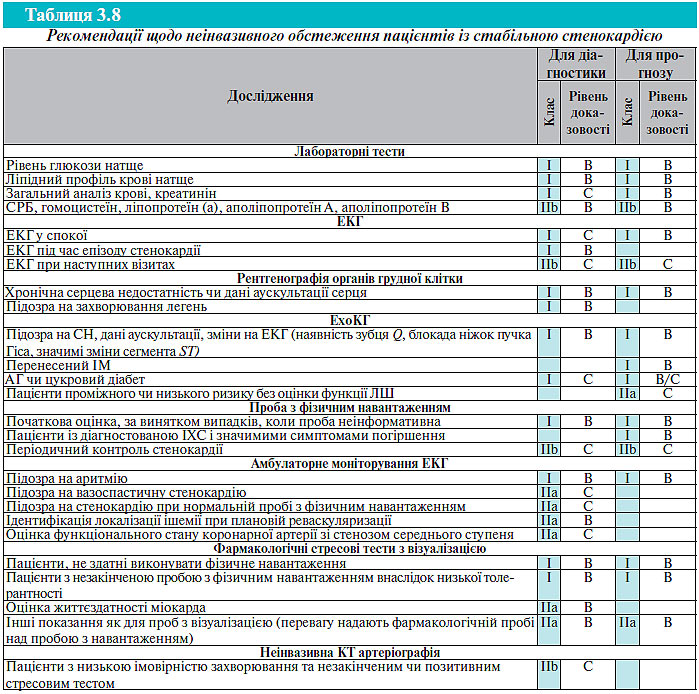
Коронароангіографія для візуалізації коронарних артерій залишається найбільш точним діагностичним тестом для визначення клінічно значимого обструктивного коронарного атеросклерозу та менш поширених неатеросклеротичних причин хронічної стабільної стенокардії, таких як коронарний спазм, аномалії коронарних артерій, хвороба Кавасакі, первинна артеріальна дисекція, васкулопатія. Результати ранніх досліджень кореляції симптомів з ангіографічними даними свідчать, що у 26–65% пацієнтів із дискомфортом у грудній клітці, що не є класичною стенокардією, виявляли значні коронарні стенози як наслідок атеросклерозу. У багатьох пацієнтів із схожими симптомами, проте не типовими для хронічної стабільної стенокардії (з передтестовою імовірністю близько 50%), цінність неінвазивних діагностичних тестів (у зіставленні з іншими клінічними даними) може бути достатньою для встановлення правильного діагнозу і рішення про подальшу клінічну стратегію. Обов’язок лікаря — визначення імовірності того, що симптоми пацієнта пов’язані з ішемією міокарда. Всі рішення, пов’язані з вибором методів діагностики ІХС, мають враховувати бажання пацієнта і його супутні захворювання. Необхідно ще раз підкреслити значення анамнезу типової стенокардії у людей середнього і похилого віку, приблизно у 90% яких діагностують виражену коронарну хворобу, багатосудинні ураження. У половини жінок при клініці класичної стенокардії виявлене значне стенозування коронарних артерій.
Показання до проведення коронарної ангіографії
Діагностична коронарна ангіографія може бути призначена пацієнтам з больовими відчуттями у грудній клітці, можливо, пов’язаними з ішемією міокарда, коли неінвазивні методи дослідження протипоказані чи їх проведення небажане у зв’язку з будь-якими супутніми захворюваннями, інвалідністю чи іншими причинами. Так, коронарна ангіографія може бути рекомендована з мінімальним ризиком пацієнту з болем у грудній клітці, характерним для стенокардії та супутній ХОХЛ, який не зможе виконати навантаження у зв’язку із задишкою, дослідження з дипіридамолом чи аденозином може викликати бронхоспазм і необхідність введення теофіліну, а при стрес-ехоКГ у цього пацієнта буде отримане неякісне зображення у зв’язку з наявністю емфіземи легень.
Пацієнтам, у яких результати неінвазивних методів дослідження були сумнівними і не дали достатньої інформативності для встановлення правильного діагнозу, може бути призначене проведення коронарної ангіографії. Повторне проведення неінвазивних досліджень може бути рекомендоване особам з низькою імовірністю ІХС, у яких за результатами функціональної ЕКГ-проби з навантаженням на тредмілі ймовірність ІХС підвищилася до середньої. Коронароангіографія може бути найбільш оптимальним тестом для пацієнтів із високим ризиком після проведеної навантажувальної ЕКГ- проби на тредмілі.
Пацієнтам із симптомами, що вірогідно вказують на стабільну стенокардію, проте не є характерними для неї, коронарна ангіографія може бути призначена, якщо їх професійна чи інша діяльність може становити ризик для них самих або оточуючих (пілоти, пожежники, спортсмени). Деяким пацієнтам із типовими симптомами стабільної стенокардії чи нетиповим болем у грудній клітці, але високою клінічною імовірністю розвитку ІХС економічно виправдане проведення коронарної ангіографії без попереднього неінвазивного обстеження. Діагностика стенокардії у осіб з цукровим діабетом може бути ускладнена в результаті ослаблення вираженості симптомів ішемії міокарда внаслідок наявності сенсорної та автономної нейропатії, отже, частота призначення коронароангіографії у цих пацієнтів має бути вищою. Проведення коронарної ангіографії у пацієнтів з високою передтестовою імовірністю захворювання може мати значення як для визначення ступеня ризику, так і для встановлення діагнозу.
Ризик при проведенні діагностичної коронарної ангіографії незначно вищий у осіб похилого віку порівняно з молодшими пацієнтами; у багатьох кардіологічних центрах більшість пацієнтів, яким проводять це дослідження, старші 65 років.
Спазм коронарних артерій
Деякі дослідники пропонують для виявлення спазму коронарних артерій застосування неінвазивних провокаційних проб, хоча при цьому завжди є ризик розвитку необоротного коронароспазму. Тому проведення проб, що провокують коронароспазм в умовах катетеризації серця, рекомендовано у тих випадках, коли можливе інтракоронарне введення нітрогліцерину чи інших вазодилататорів, а також проведення інших інтенсивних терапевтичних заходів.
Аномалії коронарних артерій
Аномальне відгалуження чи локалізація артерії — нечаста причина стенокардії — найчастіше несподівана «знахідка» під час проведення коронароангіографії. Проте ця патологія може бути запідозрена у пацієнтів молодого віку із симптомами ішемії міокарда і розпізнана за допомогою неінвазивних візуалізуючих методів дослідження (наприклад трансезофагеальної ехоКГ, КТ, МРТ). Постійний шум при аускультації серця можливий при аномальному відходженні передньої міжшлуночкової чи огинаючої гілки лівої коронарної артерії від ЛА або при наявності коронарного артеріовенозного анастомозу, наявність якого також може бути підтверджена при проведенні коронароангіографії.
Хворі після реанімації з фібриляцією шлуночків або стійкою шлуночковою тахікардією
У більшості пацієнтів, які перенесли раптову зупинку серця чи аритмію з проведенням реанімаційних заходів, виявляють виражену ІХС. Цим пацієнтам проведення коронароангіографії показане як для встановлення діагнозу, так і для визначення необхідності та можливості проведення втручання з метою реваскуляризації.
Частота таких ускладнень, як смерть, ІМ або інсульт при проведенні коронароангіографії становить 0,1–0,2%.
Рекомендації з проведення коронарної ангіографії з метою встановлення діагнозу «стабільна стенокардія»
Клас I
- Тяжка стенокардія (III ФК і вище за класифікацією Канадського товариства кардіологів) з високою передтестовою імовірністю захворювання, особливо якщо симптоми захворювання неадекватно піддаються медикаментозній корекції.
- Пацієнти, які вижили після зупинки серця.
- Пацієнти із серйозною шлуночковою аритмією.
- Пацієнти після реваскуляризації міокарда (ПКВ, АКШ) з появою поворотної помірної чи тяжкої стенокардії.
Клас IIa
- Пацієнти із сумнівним діагнозом при проведенні неінвазивного тесту або суперечливих результатів різних неінвазивних тестів при наявності середнього чи високого ризику розвитку ІХС.
- Пацієнти з високим ризиком рестенозів після ПКВ, якщо ПКВ була проведена на прогностично важливій ділянці.
Внутрішньосудинне УЗД
Внутрішньосудинне УЗД дозволяє одержати ультразвукове зображення зсередини коронарної артерії, значно поліпшує якісну і кількісну оцінку анатомії коронарних судин: точний вимір діаметра коронарної артерії, оцінку ексцентричних атеросклеротичних уражень і ремоделювання артерій, стан атеросклеротичної бляшки; відіграє важливу роль у визначенні обсягу інтервенційного втручання, допомагає точніше провести встановлення внутрішньокоронарного стента. В Україні це обстеження проводять у високоспеціалізованих клінічних відділеннях та в наукових цілях. Воно є методикою першого порядку при діагностиці ІХС.
Прогноз хворих на стабільну стенокардію
Перебіг ІХС досить різний: у одних хворих стенокардія має перебіг роками без істотного погіршення клінічної картини, у інших — швидко прогресує, приводячи до ІМ, CН і летального кінця, у третіх — відразу починається з гострого коронарного синдрому. Значною мірою клінічна симптоматика і подальша доля хворого визначається, з одного боку, співвідношенням морфологічних та функціональних компонентів патогенезу захворювання, з іншого — адекватністю підібраного медикаментозного, інтервенційного чи хірургічного лікування. Вибір тактики лікування конкретного хворого з коронарною недостатністю — найважливіше повсякденне завдання кардіолога-практика. З огляду на те, що різні клінічні синдроми хронічної ІХС по суті є проявом одного патологічного процесу, поділ стенокардії на різні форми виправданий лише з клінічних позицій, а оцінка тяжкості й довготривалий прогноз ІХС становлять досить складну проблему. Як відомо, перебіг і довготривалий прогноз захворювання у пацієнтів із хронічними формами ІХС у значному ступені корелюють із даними коронарографії та показниками, що характеризують функцію міокарда, насамперед з такими, як ФВ ЛШ. Встановлено зворотну залежність між вираженістю коронарного атеросклерозу і виживанням пацієнтів із ІХС. У 80-ті роки ХХ ст. щорічна смертність осіб із ІХС в середньому становила 3–6%. При ураженні однієї коронарної артерії — 2%, трьох — 7–10%, при стенозі стовбура лівої коронарної артерії прогноз був особливо несприятливим.
Наведені нами дані 5-річного спостереження пацієнтів і ІХС, яким не проводили операції реваскуляризації, опубліковані ще у 1989 р., коли в Україні широко не застосовували препарати, що мають вплив на прогноз захворювання. Тоді ми не застосовували статини, інгібітори АПФ, несистематично призначали ацетилсаліцилову кислоту, а з препаратів, що впливають на прогноз ІХС, застосовували тільки блокатори β-адренорецепторів. Практично йшлося про «природний» перебіг хвороби. Результати спостереження пацієнтів із ІХС та ураженням ≥2 коронарних артерій, які одержували тільки антиангінальну терапію, свідчили про те, що у 51% з них протягом 5 років розвивався повторний ІМ або коронарна смерть. У пацієнтів з ураженням однієї коронарної артерії смертність за 5 років становила — 7%, двох — 16%, трьох — 29%. Тобто йдеться про тяжку категорію хворих, яким необхідно проводити комплексний вплив, що включає зміну способу життя, медикаментозне, інтервенційне та хірургічне лікування. На сьогодні до пацієнтів з ІХС високого ризику відносять хворих із щорічним ризиком смерті >2%.
Результати перших епідеміологічних досліджень свідчили про високу варіабельність щорічної смертності пацієнтів із ІХС — у межах від 2,5 до 9%. Ці дані чітко вказували на взаємозв’язок деяких змін ЕКГ спокою, АГ, кардіомегалії та застійної СН зі смертністю осіб з ІХС. У численних дослідженнях, що враховують дані коронароангіографії, підкреслюється високий ступінь кореляції між вираженістю атеросклеротичного ураження коронарного русла та смертністю цих хворих.
На основі даних перших досліджень, присвячених вивченню залежності між атеросклеротичним ураженням коронарних артерій і смертністю осіб з ІХС, можна зробити висновок, що при стенозуванні однієї з трьох головних коронарних артерій (передня міжшлуночкова гілка лівої коронарної артерії, огинаюча гілка лівої коронарної артерії, права коронарна артерія) щорічна смертність становить приблизно 2%. Якщо уражені 2 із 3 головних артерій, смертність становить приблизно 7%, а якщо уражені всі 3 артерії — приблизно 11%. Підкреслюється, що ці дані ґрунтуються на аналізі вираженості атеросклеротичного ураження й істотно погіршуються при розвитку та прогресуванні застійної СН.
Reeves і співавтори першими зробили кілька важливих спостережень. Перше з них полягало в тому, що виживаність пацієнтів зі стенокардією чітко поліпшувалася протягом XX ст. У їх огляді показано, що тривалість життя від виникнення симптомокомплексу стенокардії до смерті зросла у 1956 р. порівняно з 1918-м. У першому дослідженні Herrickі Nuzum, проведеному у 1918 р., повідомлялося, що від моменту виникнення стенокардії до смерті в середньому проходило приблизно 3 роки, а в 1956 р. Richards і співавтори встановили, що такі хворі жили вже в середньому 9,7 року. Також у жінок відзначений більш сприятливий прогноз порівняно з чоловіками. Але незалежно від статі спостерігали таку закономірність: смертність у пацієнтів з АГ, кардіомегалією, застійною СН і патологічними змінами на ЕКГ була вищою. У жінок із скаргами на біль у прекардіальній ділянці частіше виявляли нормальну ангіограму. Reeves і співавтори підкреслюють, що у жінок вища частка псевдопозитивних діагнозів «стенокардія». Автори припустили, що, можливо, цим і пояснюється різниця у смертності між пацієнтами різних статей. У цьому огляді також виділені кілька простих факторів, що мають особливий вплив на виживаність пацієнтів зі стенокардією. Автори відзначили, що використання простих, неінвазивних методів дослідження (наприклад ЕКГ) допомагає диференціювати пацієнтів із високим і низьким ризиком смерті. Наприклад, 5-річна виживаність пацієнтів із нормальною ЕКГ становила 73,1% стосовно 29,1% у таких із патологічними змінами на ЕКГ.
Friesinger і співавтори одними з перших проаналізували результати коронароангіографії у пацієнтів із прекардіальним болем. Середній період спостереження становив 50 міс. Вираженість ураження кожної з 3 головних коронарних артерій оцінювали в балах:
- 0 — уражень немає;
- 1 — ураження несуттєві;
- 2 — вираженість стенозу варіює між 50 і 90%;
- 3 — множинні ураження — 50–90% в 1 артерії;
- 4 — стеноз >90%, але не оклюзія;
- 5 — оклюзія.
За даним цього дослідження у пацієнтів із кількістю балів >10 смертність протягом 50 міс становила 53%. Водночас у пацієнтів із кількістю балів >3, але <10, смертність становила 5%. Лише 1 пацієнт із 32 з ураженням 1 коронарної артерії вмер за період 50-місячного спостереження (проте в автокатастрофі).
Дані численних дослідників свідчать, що смертність пацієнтів зі стабільною стенокардією прямо залежить від кількості уражених артерій. Встановлено, що ураження проксимальної частини передньої міжшлуночкової гілки лівої коронарної артерії пов’язане з відносно серйозним прогнозом і щорічною смертністю в межах 4–7,4%. У хворих з ураженням огинаючої гілки або правої коронарної артерії прогноз кращий — від 2 до 7 років. У пацієнтів з ураженням 3 судин відзначають високу смертність — 10–15% на рік. У кожному разі кардіомегалія та СН серйозно погіршують прогноз. Як підсумок підкреслюється значення коронаровентрикулографії для визначення прогнозу. Friesinger і співавтори оцінили зв’язок між ЕКГ-ознаками постінфарктного кардіосклерозу, тривалістю анамнезу СН і прогнозом. У пацієнтів з ЕКГ-ознаками постінфарктного кардіосклерозу смертність протягом 22 міс становила 31%, на відміну від 7% смертності хворих, які не мали подібних змін на ЕКГ. Наявність СН в анамнезі була також тісно пов’язана з прогнозом. Смертність протягом 22 міс у 45 пацієнтів з ознаками легеневої гіпертензії становила 40% порівняно з 8% у 201 пацієнта без такої. Смертність у 30 пацієнтів з ураженням 2–3 судин у поєднанні з СН становила 50%. У хворих з аналогічним ураженням коронарних артерій, але без СН смертність становила 16%. У пацієнтів з ознаками кардіомегалії (за даними рентгенографії) смертність при наявності ураження 2 судин становила 41% протягом 22 міс, у хворих без кардіомегалії — 7%.
На сьогодні у пацієнтів з ІХС добре вивчено зв’язок між клінічними даними, показниками неінвазивних методів дослідження серцево-судинної системи і прогнозом захворювання. Особливо це стосується пацієнтів, які перенесли ІМ. Найбільш прості та інформативні предиктори прогнозу наведені нижче.
Клінічні параметри, пов’язані із прогнозом хворих ІХС, які перенесли ІМ:
• Вік
• Стенокардія, наявна до ІМ (опосередковано вказує на високу імовірність ураження 3 судин)
• ЕКГ- і ехоКГ-ознаки раніше перенесеного ІМ (підвищують ризик несприятливого результату в 2 рази)
• Стать — віддалений прогноз у жінок, які перенесли ІМ, гірший
• Наявність АГ
• Наявність цукрового діабету (3–4-кратне підвищення ризику)
• Продовження тютюнопаління
• Ознаки передньої локалізації ІМ порівняно з нижньою локалізацією
• Ознаки СН
• Підвищений рівень сечовини, креатиніну
• Рання постінфарктна стенокардія
• Шлуночкові порушення ритму
• Підвищена ЧСС
Параметри навантажувального тесту, асоційовані з поганим прогнозом ІХС:
• Тривалість тесту:
- неможливість виконати II ступінь за протоколом Bruce (<6,5 METS);
- низька порогова ЧСС <120 уд./хв.
• Час появи, амплітуда і тривалість депресії сегмента ST:
- початок при ЧСС <120 уд./хв або навантаження <6,5 METS;
- амплітуда >2 мм;
- тривалість відновлення >6 хв;
- депресія сегмента ST у декількох відведеннях.
• Реакція САТ під час або по закінченні тесту:
- зниження АТ більше ніж на 10 мм рт. ст. або відсутність приросту у відповідь на навантаження (не вище 130 мм рт. ст. при граничному навантаженні).
• Інші потенційно несприятливі показники:
- підйом сегмента ST (крім відведення aVR);
- напад стенокардії, різка слабкість.
ВАЗОСПАСТИЧНА СТЕНОКАРДІЯ
Вазоспастична стенокардія — форма стенокардії, зумовленої спазмом коронарних артерій, що виникає раптово у сегменті великої епікардіальної артерії, внаслідок чого різко знижується коронарний кровотік і виникає, як правило, трансмуральна ішемія міокарда, що проявляється елевацією сегмента ST на ЕКГ. C. Conti (1985) дає робоче визначення коронароспазму як транзиторному зменшенню просвіту епікардіальної артерії, що досягає ступеня, достатнього для провокування ішемії міокарда при відсутності підвищення ЧСС і АТ.
У 1959 р. Принцметал вперше описав захворювання, при якому в стані повного спокою раптово, без дії видимих провокуючих факторів, вночі або в ранні ранкові години виникає ангінозний біль, що циклічно повторюється, викликаний спазмом коронарних артерій і який у більшості випадків супроводжується вираженим минущим підйомом сегмента ST на ЕКГ.
За патогенетичним принципом A. Maseri (1980) класифікував стенокардію як первинну (вазоспастична стенокардія), пов’язану з минущими порушеннями коронарної перфузії внаслідок зміни тонусу коронарних артерій і реологічних властивостей крові, та вторинну (стенокардія напруження), що виникає внаслідок підвищення споживання кисню міокардом при обмеженні його поставки внаслідок коронарного атеросклерозу.
Термінологія
Термін «вазоспастична стенокардія» використовується нами для визначення категорії пацієнтів із ІХС з перевагою у клінічній картині захворювання симптомів та інструментальних ознак, характерних для ішемії, що розвилася внаслідок спазму коронарних артерій. Термін застосовується як синонім «спонтанної», «варіантної», «ангіоспастичної», «особливої» форми стенокардії чи стенокардії Принцметала і вибраний не випадково, оскільки найчастіше використовується в закордонній літературі і, на наш погляд, якнайкраще відображає механізми, відповідальні за розвиток ішемії.
Епідеміологія
Вазоспастичну стенокардію виявляють у 2% пацієнтів, госпіталізованих із клінічними проявами нестабільної стенокардії. Частіше це особи віком 50–60 років, чоловіки і жінки у співвідношенні 5:1. Тютюнопаління — доведений фактор ризику розвитку вазоспастичної стенокардії. Вживання алкоголю, кокаїну, флуороурацилу, суматриптану може викликати вазоспастичну стенокардію. У деяких випадках вазоспастична стенокардія може асоціюватися з такими вазомоторними порушеннями, як мігрень і синдром Рейно.
Патогенез
Механізми розвитку вазоспастичної стенокардії до кінця не з’ясовані, хоча припускають, що в їх основі лежать гіперреактивність гладком’язових клітин і дисфункція ендотелію судин, що призводить до вираженого спазму коронарних артерій та їх короткочасного динамічного стенозу. Розглядається вплив декількох факторів, які призводять до виникнення захворювання, таких як підвищення внутрішньоклітинної ро-кіназної активності, порушення АТФ-чутливості калієвих каналів, транспорту Na+ і H+, дисбаланс вегетативної нервової системи, підвищення концентрації ендотеліну. Припинення чи різке зменшення коронарного кровообігу призводить до глибокої, частіше трансмуральної ішемії міокарда, зниження локальної скоротності ЛШ і електричної нестабільності міокарда, що проявляється порушенням ритму та провідності.
Морфологічні зміни коронарних судин у хворих з вазоспастичною стенокардією досить варіабельні. В одних випадках виявляють більш або менш виражений фіксований стеноз проксимальної коронарної артерії, іноді з ознаками нестабільної атероми. В інших — атеросклеротичне звуження великих коронарних артерій може бути мінімальним або навіть зовсім відсутнім. В останньому випадку можна припустити спазм коронарних артерій на рівні дрібних інтрамуральних коронарних судин, морфологічні зміни яких зазвичай не виявляють при коронароангіографії. Іноді процес вазоспазму може поширюватися на кілька коронарних сегментів (мультикоронарний спазм).
Клінічні прояви
Характеристика ангінозного болю
Інтенсивні напади болю виникають у спокої, часто вночі під час сну або в ранні ранкові години (4–6 годин ранку). Больовим нападам, як правило, не передують будь-які провокуючі фактори, що підвищують потребу міокарда в кисні (підвищення ЧСС і АТ, тощо) (рис. 3.7).
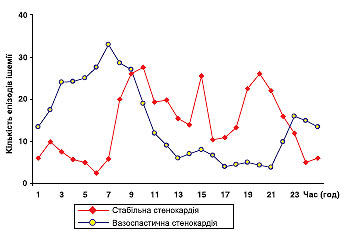
Рис. 3.7. Добовий профіль розподілу епізодів ішемії у хворих з ІХС зі стабільною стенокардією та у пацієнтів із вазоспастичною стенокардією. При вазоспастичній стенокардії виявляють значну перевагу епізодів ішемії в нічний і ранковий час. Навпаки, при стабільній стенокардії епізоди виникали переважно в денний час (ранковий, обідній, вечірній пік)
Біль локалізується за грудиною та іррадіює в ліву руку, плече і лопатку. Тривалість болю — від 3–10 хв, рідко — до 20–30 хв. Часто на фоні больового нападу виникає брадикардія. Тахікардія може з’явитися на висоті нападу або наприкінці його, але лише як наслідок рефлекторної симпатичної активації. Біль може супроводжуватися задишкою, слабістю, пітливістю, запамороченням, що пов’язане з дисфункцією ЛШ і вираженими вегетативними порушеннями. Під час нападу варіантної стенокардії можуть розвинутися минущі внутрішньошлуночкові і АV-блокади, часто — шлуночкова екстрасистолія високих градацій, пароксизмальна тахікардія і навіть фібриляція шлуночків, раптове формування АV-блокади II або III ступеня, зупинка синусного вузла, що нерідко супроводжується синкопальним станом.
Клінічні варіанти вазоспастичної стенокардії
Очевидним є й той факт, що Принцметал вперше описав лише особливу, найбільш тяжку форму вазоспастичної стенокардії і, очевидно, термін «стенокардія Принцметала» не може охопити весь широкий спектр клінічних проявів вазоспастичної стенокардії.
A. Maseri і S. Chierchia (1985), ґрунтуючись на патогенетичному підході, запропонували виділяти такі форми стенокардії: стенокардію напруження, вазоспастичну і змішану. У патогенезі двох останніх варіантів перебігу ІХС вазоспазм відіграє провідну роль. Слід також пам’ятати, що у пацієнтів зі стабільною стенокардією або нечастими нападами вазоспастичної стенокардії при дестабілізації атероми посилюються механізми динамічної коронарної обструкції, що може призвести до переважання у клінічній картині захворювання симптомів коронарного вазоспазму. У цих випадках вазоспазм є характерним проявом нестабільної стенокардії.
Змішана стенокардія — форма ІХС, для якої характерне поєднання клінічних ознак як стабільної, так і вазоспастичної стенокардії.
У цілого ряду хворих із наявністю діагностованого стенозу коронарних артерій типові напади стабільної стенокардії напруження поєднуються з нічними нападами спонтанної стенокардії. У цьому разі напади стенокардії напруження виникають у денні години і зазвичай провокуються фізичним навантаженням, психоемоційним напруженням, підвищенням АТ. Напади вазоспастичної стенокардії, зумовлені спазмом коронарних артерій, розвиваються спонтанно вночі або під ранок (рис. 3.8). Толерантність до фізичного навантаження у цих хворих може бути істотно знижена внаслідок наявності стенозу коронарних артерій.

Рис. 3.8. Два обличчя стенокардії. Змішана стенокардія — типові напади стенокардії напруження, частіше в денний час, поєднуються з нічними спонтанними нападами, що виникають при відсутності підвищення ЧСС і АТ та супутніми елевацією чи депресією сегмента ST ЕКГ
Особливої уваги потребує ситуація, коли у пацієнта зі стенокардією напруження вперше з’являються напади спонтанної стенокардії, що зазвичай свідчить про загострення ІХС, яке зумовлене дестабілізацією атероми.
Другий варіант — власне вазоспастична стенокардія, описана Принцметалом. Виявляють переважно у осіб молодого віку, у яких відсутня гемодинамічно значима оклюзія коронарних артерій. Спонтанна стенокардія може бути єдиним клінічним проявом ІХС, а стенокардія напруження відсутньою. Для цих хворих, як правило, характерна висока толерантність до фізичного навантаження.
Діагностика
Класична ЕКГ-ознака вазоспастичної стенокардії — елевація сегмента ST, що свідчить про наявність трансмуральної ішемії міокарда, зумовлену минущою динамічною оклюзією коронарних артерій. (рис. 3.9) Рідше виявляють ішемічну депресію сегмента ST, що свідчить про відсутність повної оклюзії великої коронарної артерії чи наявність спазму більш дрібних артерій і артеріол при хорошому розвитку колатералей.
Рис. 3.9. Добовий розподіл епізодів ішемії (а) та ЕКГ (б) у хворого з вазоспастичною стенокардією: а) тренд сегмента ST, отриманий при добовому моніторуванню ЕКГ у пацієнта з ІХС. По першому каналу здійснювали запис ЕКГ у відведенні V5, по другому — V1, по осі ординат реєстрували амплітуду відхилення сегмента ST (мм), по осі абсцис — час доби. У відведенні V5 за період з 5 до 7 години 30 хв ранку зареєстровано серію епізодів ішемії (елевація сегмента ST до 5 мм). Епізоди мають чітку циклічність, амплітуда відхилення сегмента ST хвилеподібно збільшується і зменшується. Більшість епізодів супроводжувалася шлуночковою екстрасистолією, короткими періодами шлуночкової тахікардії. При повторному моніторуванні зберігалася циклічність і час переважного виникнення епізодів (нічний та ранковий час); б) ЕКГ при вазоспастичній стенокардії — під час спонтанного нападу ангінозного болю, що виник у нічний час, при холтерівському моніторуванні виявлено елевацію сегмента ST, шлуночкова бігемінія, пароксизм шлуночкової тахікардії (з частотою >140 уд./хв)
За допомогою добового моніторування ЕКГ можна діагностувати важливу відмінну ознаку вазоспастичної стенокардії — швидке, стрибкоподібне зміщення сегмента ST і швидку його нормалізацію після закінчення спастичної реакції. Для стенокардії напруження, навпаки, характерні плавне поступове зміщення сегмента ST на фоні підвищення ЧСС і настільки ж повільне повернення його до вихідного рівня після купірування нападу. Зафіксувати коронароспазм при вазоспастичній стенокардії досить складно. У зв’язку з цим для верифікації діагнозу доцільне застосування функціональних проб, що провокують спазм коронарних артерій. Гіпервентиляція та холодова проба відрізняються низькою чутливістю, оскільки ішемічні зміни сегмента ST виявляють приблизно у 15–20% хворих вазоспастичною стенокардією.
В ангіографічних центрах з метою провокації спазму коронарних артерій застосовують внутрішньокоронарне введення ацетилхоліну та ергометрину. Ці методи вважаються золотим стандартом у діагностиці вазоспастичної стенокардії. Внутрішньовенна ергометринова проба з реєстрацією ішемії за допомогою ЕКГ або сцинтиграфії, за рівнем чутливості й специфічності вважається найбільш адекватною у клінічних умовах для виявлення вазоспастичних реакцій у пацієнтів з ІХС. Проте проведення провокаційних тестів без попередньої коронароангіографії чи у пацієнтів зі стенозом коронарних артерій високого ступеня не рекомендується.
Прогноз
Прогноз при варіантній стенокардії визначають двома основними факторами: рівнем коронарної обструкції та розвитком дестабілізації ІХС, внаслідок чого підвищується ризик розвитку ІМ і раптової коронарної смерті. У пацієнтів із вазоспастичною стенокардією без ангіографічних ознак вираженого ураження коронарних артерій або дестабілізації атероми випадки ІМ або коронарної смерті нечасті — до 0,5% випадків на рік. Якщо у хворого відзначають тяжкі, тривалі або вперше виниклі напади стенокардії Принцметала, що повторюються, які можуть бути віднесені до нестабільної стенокардії, прогноз досить серйозний: у 20–25% хворих протягом 3 міс розвивається ІМ або настає раптова серцева смерть. При стабільному характері варіантної стенокардії больові напади, що виникають рідко і легко купіруються під впливом лікування, припиняються іноді на багато років, і прогноз визначається ступенем коронарної обструкції та кількістю уражених коронарних артерій. 7-річна виживаність цих хворих досягає 97%.
КАРДІАЛЬНИЙ СИНДРОМ Х
Хоча у більшості пацієнтів із типовим ангінозним болем у грудній клітці при навантаженні та позитивному стрес-тесті зазвичай виявляють виражену обструктивну коронарну хворобу серця, приблизно у 10–15% з них — коронароангіограма в нормі. Цих пацієнтів відносять до кардіального синдрому Х, який не має універсального визначення.
Кардіальний синдром Х має три характерні ознаки; наявність кожної з них можлива і при іншій кардіологічній патології:
- стенокардія чи схожий на неї біль у ділянці грудної клітки;
- депресія сегмента ST на ЕКГ під час навантажувального тесту;
- інтактні коронарні артерії за даними коронарографії з не порушеною функцією ЛШ.
Кардіальний синдром Х, насамперед, потребує диференційної діагностики зі стенокардією напруження — типовим проявом ІХС, в основі якої лежить обструктивне атеросклеротичне ураження коронарних артерій. Група хворих із діагнозом синдрому Х гетерогенна. У більшості пацієнтів, які пред’являють скарги на біль у ділянці серця при навантаженні з інтактними коронарними артеріями, відзначають неішемічний механізм болю і часте підвищення больової чутливості. Тому діагноз «кардіальний синдром Х» не слід встановлювати при відсутності об’єктивних ознак ішемії міокарда. До цієї категорії хворих не слід відносити пацієнтів із м’язовими містками, АГ, клапанними вадами серця, ГЛШ, цукровим діабетом, оскільки в цих випадках імовірні причини стенокардії відомі. У пацієнтів із документованим спазмом субепікардіальних коронарних артерій і типових клінічних ознак вазоспастичної стенокардії також варто виключити розглянутий синдром.
Зміни тонусу коронарних артерій — насамперед неадекватний розширювальний резерв резистивних артерій у відповідь на стрес чи аномальна їх вазоконстрикція — відіграють важливу роль у формуванні ішемії у цих хворих, проте, на відміну від вазоспастичної стенокардії, лише на мікроваскулярному рівні. Тому кардіальний синдром Х іноді називають «мікроваскулярна стенокардія».
До зазначеної категорії хворих не слід також відносити пацієнтів, які перенесли ІМ (часто Q–ІМ, іноді з розвитком аневризми), як правило, у осіб молодого віку, що був першим проявом ІХС, а при подальшому проведенні коронарографії у них не виявляють гемодинамічно значимо уражених коронарних артерій. У таких випадках ІМ, як правило, розвивається внаслідок спазму великої субендокардіальної артерії та її тромбозу з подальшою спонтанною чи медикаментозною реканалізацією судини.
Необхідно відрізняти кардіальний синдром Х від метаболічного синдрому, що також має назву синдрому Х, але який характеризується інсулінорезистентністю, ожирінням, гіпертензією та дисліпідемією. Слід враховувати, що обидва зазначені синдроми Х можуть поєднуватися у одного пацієнта.
Патогенез
Патогенез кардіального синдрому X повністю не вивчений. Для пояснення цього феномену пропонуються два принципово різних механізми:
1) міокардіальна ішемія виникає внаслідок мікроваскулярної коронарної дисфункції (патологічно недостатня дилатація судин у відповідь на стрес і/чи підвищена вазоконстрикція);
2) наявність у пацієнта підвищеної чутливості до інтракардіального болю чи синдром «чутливого серця».
Очевидно, що останній механізм не пояснює виникнення у пацієнтів депресії сегмента ST на ЕКГ при стрес-тесті. Можливо, що синдром Х може бути результатом різних комбінацій коронарної мікроваскулярної дисфункції та підвищеної чутливості до больових стимулів. Як больовий поріг, так і мікроваскулярна дисфункція мають градації за тяжкістю і модулюються різними факторами, такими як дисфункція ендотелія, запалення, автономні нервові впливи та психогенні механізми. Серед зазначених причин дисфункція ендотелію при кардіальному синдромі Х, очевидно, є найважливішою. Ендотеліальна дисфункція — найбільш рання ланка в розвитку атеросклерозу, вона визначається вже в період, що передує формуванню атеросклеротичної бляшки, до клінічних проявів хвороби. Ураження ендотелію викликає дисбаланс у синтезі вазоконстрикторних і вазорелаксуючих речовин, викликає активацію запального процесу, веде до тромбоутворення і проліферації гладком’язових клітин в артеріальній стінці.
У хворих із множинними факторами ризику часто відзначають початкову коронарну атерому, яка не виявляється на коронарограмі й може погіршувати ендотеліальну функцію.
Серед пацієнтів з кардіальним синдромом Х переважаючу кількість (приблизно 70%) складають жінки у постменопаузальний період. У них часто відзначають атиповий біль у грудній клітці, що триває довше, ніж при типовій стенокардії, і може бути резистентним до нітрогліцерину. Іноді у цих жінок діагностують психічні захворювання. Дефіцит естрогенів — патогномонічний фактор, що впливає на судини через ендотелійзалежні і ендотелійнезалежні механізми. Встановлено поліпшення ендотеліальної функції у жінок в постменопаузальний період при прийомі 17-β-естрадіолу.
Діагностика
Більшість кардіологів вважають, що додатково до типового болю у грудній клітці та ішемічних змін на ЕКГ або інших доказів ішемії міокарда (виявлення минущого дефекту міокардіальної перфузії при сцинтиграфії з 201Tl) субепікардіальні коронарні артерії мають бути ангіографічно повністю незміненими. Проте навіть ці жорсткі ангіографічні критерії мають обмеження, оскільки відомо, що коронарографія може виявитися недостатньо інформативною. Метод не виявляє ранніх атеросклеротичних змін, коли бляшка розвивається в межах артеріальної стінки, не викликаючи звуження просвіту судини, недостатньо чутливий при діагностиці інтракоронарного тромбозу, не допомагає визначати внутрішню структуру бляшок та ідентифікувати бляшки, схильні до розриву й виразки. При кардіальному синдромі Х минущі дефекти перфузії часто виявляють у ділянках, кровопостачання яких відбувається малоураженими коронарними артеріями. Використання сучасних діагностичних методів дозволяє діагностувати ішемію у цих пацієнтів на рівні вивчення локальних порушень скоротності, перфузії та метаболізму міокарда. У деяких хворих виявляють локальні порушення рухливості стінки серця при стрес-ехоКГ, МРТ, або порушення метаболізму міокарда при позитронно-емісійній томографії. Внутрішньосудинне УЗД коронарних артерій має найбільше значення саме в тих випадках, коли при коронарографії виявляють нормальні чи малозмінені коронарні артерії. Ця методика дозволяє вивчити поверхню і внутрішню структуру атеросклеротичних бляшок, визначити раннє атеросклеротичне ураження, коли воно перебуває в межах стінки артерії, верифікувати бляшки складної конфігурації, дати їм кількісну оцінку, дослідити стан судинної стінки навколо бляшки, виявити тромбоз коронарної артерії. Проте складність, висока вартість, потреба у високій кваліфікації персоналу перешкоджають широкому застосуванню цього цінного методу.
Прогноз
При виключенні хворих із блокадою лівої ніжки пучка Гіса і пацієнтів із вторинною мікроваскулярною стенокардією внаслідок серйозних системних захворювань (таких як амілоїдоз або мієломна хвороба) прогноз хворих із кардіальним синдромом Х сприятливий щодо як виживаності, так і збереження функції ЛШ. Проте у деяких пацієнтів клінічні прояви захворювання зберігаються досить довго, тому якість життя більшості осіб із кардіальним синдромом Х незадовільна.
БЕЗБОЛЬОВА ІШЕМІЯ МІОКАРДА
Безбольова, чи «німа», ішемія міокарда — це епізоди транзиторної ішемії серцевого м’яза, які виявляються об’єктивно за допомогою деяких інструментальних методів дослідження, але не супроводжуються нападами стенокардії чи її еквівалентів.
Феномен безбольової ішемії міокарда фактично є одним із проявів коронарної хвороби серця. Згідно з класифікацією P. Cohn (1993) розрізняють такі типи безбольової ішемії міокарда:
- I тип — у осіб із доведеним за допомогою коронарографії гемодинамічно значимим стенозом коронарних артерій, що не мають в анамнезі нападів стенокардії, ІМ, порушень серцевого ритму чи застійної СН;
- II тип — у хворих з ІМ в анамнезі без нападів стенокардії;
- III тип — у хворих із типовими нападами стенокардії чи її еквівалентами.
Слід підкреслити, що в МКХ-10 і класифікації Української асоціації кардіологів безбольова ішемія міокарда, якщо вона є єдиним проявом захворювання (I тип за P. Cohn), виділяється в окрему форму безбольової ІХС і кодується під рубрикою І25.6. Доцільність виділення цієї форми визначається необхідністю її своєчасної діагностики у зв’язку з високою імовірністю виникнення коронарних ускладнень. Необхідно підкреслити, що зміни сегмента ST за ішемічним типом у осіб без клінічних проявів ІХС можна розглядати як безбольову ішемію міокарда лише у випадках, коли виявлено характерні перфузійні, біохімічні, гемодинамічні та функціональні відхилення, що вказують на дисбаланс між потребою міокарда в кисні та його доставкою, а також у разі виявлення методом коронарографії гемодинамічно значимого стенозу коронарної артерії.
Епідеміологія
Перші клінічні прояви захворювання, такі як ІМ і раптова коронарна смерть, виникають приблизно у ⅓ хворих на фоні, здавалося б, повного благополуччя, і є першими клінічними проявами захворювання. Проте у таких випадках найчастіше виявляється виражений атеросклероз коронарних артерій (звуження просвіту коронарних артерій на ≥50–70%), що існував латентно і до певного моменту клінічно не проявлявся. У зв’язку з цим сформувалося поняття «безбольова (безсимптомна, прихована, латентна) ішемія міокарда», або «безбольова ІХС».
Крім того, у деяких пацієнтів із доведеною ІХС захворювання протягом певного часу (і не обов’язково на його початку) може мати безсимптомний перебіг, коли напади стенокардії відсутні й епізоди безбольової ішемії міокарда є практично єдиним проявом патології.
Феномен безбольової ішемії міокарда виявляють не менше ніж у ⅔ хворих ІХС зі стабільною і нестабільною стенокардією і у ⅓ — з постінфарктним кардіосклерозом. У більшості випадків у одного й того ж хворого спостерігається поєднання як безбольової ішемії міокарда, так і ангінозних нападів. Причому лише невелика частина епізодів транзиторної ішемії супроводжується нападами стенокардії (не більш ніж 20–25% загальної кількості), тоді як частка безбольової ішемії міокарда становить близько 40–80%.
Добове моніторування ЕКГ виявляє епізоди депресії сегмента ST ішемічного типу в середньому у 2–10% «здорових» чоловіків (I тип безбольової ішемії міокарда).
II тип безбольової ішемії реєструють у середньому у 38% хворих, які перенесли ІМ і не одержують антиангінальної терапії.
У пацієнтів зі стабільною стенокардією епізоди ішемічного зниження сегмента ST, за даними добового моніторування ЕКГ, виявляють у середньому в 82% випадків (III тип). При цьому безбольова ішемія може бути у них в 1,5–3 рази частіше, ніж больові епізоди.
У різних дослідженнях істотні відмінності за частотою виявлення безбольової ішемії міокарда значною мірою пояснюються тими методами, якими її реєструють, а також клінічними формами захворювання.
Таким чином, безбольова ішемія міокарда належить до числа не менш поширених, ніж стенокардія, проявів коронарної недостатності. Епізоди безбольової ішемії міокарда виявляють у більшості пацієнтів із ІХС, причому, як правило, їх частота і тривалість перевищують частоту і тривалість больових нападів (стенокардії).
Патогенез
Механізми виникнення недостатності коронарного кровообігу під час доведених епізодів безбольової ішемії міокарда аналогічні таким у пацієнтів зі стабільною або вазоспастичною стенокардією.
Причини відсутності больового синдрому під час транзиторної ішемії міокарда дотепер не повністю вивчені. У пацієнтів з епізодами безбольової ішемії міокарда, найімовірніше, має значення підвищений вміст опіоїдних субстанцій, зниження чутливості больових рецепторів (ноцицепторів) і підвищення порога больової чутливості.
В основі больового синдрому при минущій ішемії міокарда, викликаній абсолютним або відносним зменшенням коронарного кровотоку і/або збільшенням потреби міокарда в кисні, лежить вивільнення у вогнищі ішемії ряду хімічних субстанцій, що мають властивості медіаторів болю. Головні з них — серотонін, гістамін, брадикінін, джерелом яких є тромбоцити, базофільні лейкоцити і тканьові гладкі клітини.
Якщо медіатори болю виділяються у достатній кількості, відбувається збудження специфічних больових рецепторів — ноцицепторів. Причому їх чутливість багато в чому залежить від концентрації іонів К+ і Н+ в середовищі навколо рецепторів, а також від вмісту простагландинів, що утворюються внаслідок активації метаболізму арахідонової кислоти. Вважають, що простагландини є своєрідними модуляторами вивільнення і функціонування медіаторів болю в ноцицепторах.
З вогнища ішемії больові імпульси переносяться по аферентних волокнах серцевих нервів до паравертебрального ланцюжка шийних і грудних гангліїв, потім по спіноталамічному тракту спинного мозку до задньобокових і передніх ядер таламуса і до кори головного мозку, де й формується больове відчуття.
У передачі больового порушення на рівні спинного мозку і таламуса важливе місце приділяється так званій субстанції Р, що є фізіологічним медіатором для волокон чутливих нейронів задніх корінців спинного мозку. Ступінь вивільнення субстанції Р із нервових закінчень чутливих волокон регулюється опіоїдними нейропептидами — енкефалінами та ендорфінами. Вони перешкоджають вивільненню субстанції Р і, отже, можуть регулювати надходження больових імпульсів у таламус і кору головного мозку.
Ці фактори впливають на характер та інтенсивність больового нападу і у деяких випадках можуть взагалі перешкоджати його виникненню, незважаючи на наявність у міокарді вогнища ішемії.
Іншим важливим фактором, відповідальним за відсутність больових відчуттів при ішемії, може бути недостатня вираженість власне ішемії та допорогових, відносно сприйняття болю, метаболічних порушень, викликаних нею. Відповідно до концепції «ішемічного каскаду» найбільш раннім проявом ішемії є порушення перфузії, метаболізму та скоротності міокарда, і лише пізніше виникають больові відчуття.
Ми маємо у своєму розпорядженні власні дані, що підтверджують цю гіпотезу. У більшості пацієнтів зі стабільною стенокардією появу безбольової ішемії міокарда можна пояснити меншою вираженістю і тривалістю ішемії. Так, амплітуда депресії сегмента SТ та її тривалість були вірогідно меншими при відсутності больового синдрому. Особливо демонстративними були відмінності у тривалості епізодів ішемії міокарда з найбільшою глибиною депресії сегмента SТ (>3 мм). Безбольові епізоди ішемії міокарда були в 2 рази коротші больових, 6,5±0,6 проти 13,7±1,9 хв відповідно (р<0,001).
У частини пацієнтів зі стабільною стенокардією, з переважно безбольовими епізодами ішемії міокарда, за результатами холтерівського моніторування за появу болю, вірогідно, відповідають механізми сприйняття болю. У нашому дослідженні було 15% таких пацієнтів. Вони характеризувалися безбольовою депресією сегмента SТ під час проведення ВЕМ і більш високим базальним рівнем ендогенних опіатів (бета-ендорфін і лей-енкефалін) Під час холтерівського моніторування у них зрідка реєстрували напади стенокардії (0–3 на добу) і часті безбольові епізоди ішемії міокарда (до 6–8 на добу). Причому амплітуда безбольових депресій сегмента SТ була більшою, ніж больових. Не виключено, що у цих пацієнтів виникнення безбольової ішемії міокарда пов’язане з особливостями сприйняття болю, що зумовлене периферичними та центральними механізмами. Наприклад, отримані дані дозволяють припустити, що у частини хворих зі стабільною стенокардією формування больових відчуттів під час ішемії міокарда залежить від базального стану системи ендогенних опіатів.
Діагностика
Безбольову ішемію міокарда виявляють за допомогою інструментальних методів дослідження під час тестів, що провокують ішемію. Головною ознакою безбольової ішемії міокарда вважають транзиторне порушення перфузії, метаболізму і регіональної скоротної функції міокарда чи електричної активності серцевого м’яза, яке виявляють об’єктивно, що не супроводжується нападом стенокардії чи його еквівалентів.
Для виявлення безбольової ішемії можуть бути використані: холтерівське моніторування ЕКГ, проби з фізичним навантаженням (ВЕМ, тредміл), черезстравохідна електрокардіостимуляція, фармакологічні проби (з дипіридамолом, добутаміном), стрес-ехоКГ, радіонуклідні методи дослідження.
У пацієнтів з доведеною ІХС методом вибору для діагностики безбольової ішемії міокарда може бути 24-годинне моніторування ЕКГ, оскільки воно необтяжливе для пацієнта і дає можливість проаналізувати повний добовий цикл серцевої діяльності.
За результатами холтерівського моніторування безбольову ішемію міокарда визначають правилом «трьох 1», що включає депресію сегмента ST горизонтального чи спадного типу не менше 1 мм, тривалістю не менше 1 хв з інтервалами між двома подібними епізодами не менше 1 хв. Іноді перед виникненням депресії сегмента ST відзначають підвищення ЧСС і АТ як свідчення посилення роботи серця.
При обстеженні практично здорових осіб з метою виявлення безбольової ішемії міокарда вибір має бути зроблений на користь навантажувальних проб (ВЕМ, тредміл-тест), оскільки за допомогою цих методів пацієнту, який проходить випробування, можна дати більше навантаження, ніж він зазвичай виконує в побуті, і тим самим підвищити частоту виявлення безбольової ішемії міокарда. Зміни сегмента ST ЕКГ, виявлені у практично здорових осіб без симптомів ІХС (особливо у жінок), нерідко можуть бути псевдопозитивними, для верифікації діагнозу «безбольова ІХС» рекомендується проводити коронароангіографію.
На сьогодні виділяють варіант безбольової ішемії міокарда без змін на ЕКГ. Це «прихована», чи «таємна» (clandestine), ішемія, яку виявляють лише за допомогою сцинтиграфії міокарда, виконаної під час навантажувального тесту, що провокує ішемію. Проте клінічне значення цієї «таємної» ішемії міокарда поки не визначене.
Лікування
Оскільки патогенетичні механізми виникнення больової та безбольової ішемії міокарда єдині, основні принципи лікування пацієнтів із безбольовою ішемією міокарда не відрізняються від таких при стабільній стенокардії напруження. Необхідно застосувати весь комплекс немедикаментозного і медикаментозного лікування, що включає корекцію факторів ризику розвитку ІХС, застосування антиагрегантів, ліпідознижувальних і антиангінальних засобів. У реальних клінічних умовах у пацієнтів із безбольовою ішемією міокарда оцінити ефект лікування набагато складніше, оскільки відсутній природний і простий критерій ефективності терапії — зменшення кількості і вираженості нападів стенокардії. Це істотно підвищує роль додаткових методів діагностики (навантажувальних тестів, холтерівського моніторування ЕКГ тощо) у здійсненні контролю за лікуванням.
Прогноз
Безбольова ішемія міокарда — прогностично несприятливий фактор, перспектива пацієнтів із цим феноменом мало відрізняється від осіб із клінічними проявами ІХС. Так, за даними трьох 15-річних спостережень 4229 чоловіків віком 35–65 років встановлено, що серед осіб із безбольовою ішемією міокарда, виявленої за допомогою тестів із фізичним навантаженням, імовірність смерті від ІХС, раптової серцевої смерті, фатального ІМ і розвиток нефатального ІМ відповідно в 2; 12; 1,6 і 13,4 раза вища, ніж у групі пацієнтів без змін ЕКГ при максимальному навантаженні. Згідно з даними літератури щонайменше у ⅓ пацієнтів із безбольовою ІХС у подальшому розвивається типова стенокардія, ІМ або настає раптова кардіальна смерть.
Наявність безбольової ішемії міокарда у пацієнтів із клінічно явною ІХС також обтяжує прогноз захворювання порівняно із пацієнтами, у яких її не реєструють. При цьому відзначено, що зі збільшенням тривалості безбольової ішемії міокарда і наростанням глибини зниження сегмента ST, що виявляють при холтерівському моніторуванні ЕКГ, у пацієнтів із ІХС чітко прогресує ризик розвитку серйозних ускладнень уже найближчим часом.
Несприятливий прогноз відзначено у пацієнтів із сумарною тривалістю безбольової ішемії міокарда >60 хв/добу. У цих випадках у 3–7 разів частіше виявляють ознаки ураження 3 судин або головного стовбура лівої коронарної артерії.
Відмінності за даними літератури в оцінці прогнозу у пацієнтів із безбольовою ішемією міокарда можна пояснити розходженнями у критеріях і методах її реєстрації, а також контингентом обстежуваних. Оскільки безбольову ішемію міокарда виявляють при всіх хронічних і гострих формах ІХС у більшості пацієнтів, результат захворювання конкретної особи пов’язаний не стільки з наявністю безбольової ішемії міокарда, скільки з тяжкістю патології та загальним ризиком розвитку серцево-судинних ускладнень. Слід також враховувати, що співвідношення больових і безбольових епізодів ішемії, як втім, і їх загальна тривалість, є динамічними характеристиками тяжкості перебігу захворювання і, в основному, корелюють з короткотривалим прогнозом.
ІШЕМІЧНА КАРДІОМІОПАТІЯ
Концепцію ішемічної кардіоміопатії запропоновано у 1969 р., коли Raftery і співавтори виявили причинно-наслідковий зв’язок між ІХС і застійною кардіоміопатією. Іншими словами, в описаних випадках відзначали виражену кардіомегалію з проявами застійної СН, як це буває при типовій ДКМП, і лише атеросклеротичне ураження коронарних артерій вказувало на її ішемічний генез.
Термін «ішемічна кардіоміопатія» було запропоновано дещо пізніше, в 1970 р. G. Bursh і співавторами, на той час він був досить революційним і суперечливим. Автори наполягали на тому, що ішемічна кардіоміопатія «по суті, має безліч подібних рис із іншими кардіоміопатіями», і підкреслювали, що «ішемічна кардіоміопатія — справжня кардіоміопатія» з властивими їй ознаками.
На сьогодні деякі кардіологи цей термін використовують більш широко, включаючи до нього будь-які випадки СН і навіть просто дисфункції міокарда, що розвилися внаслідок ІХС. Так, G. Michael і співавтори (2002) запропонували відносити до зазначеної категорії:
- хворих, які перенесли ІМ чи реваскуляризацію (АКШ, ПКВ);
- осіб зі стенозами 75% стовбура лівої коронарної артерії чи проксимальної ділянки передньої міжшлуночкової гілки лівої коронарної артерії;
- пацієнтів зі стенозами 75% двох і більше епікардіальних судин.
Деякі автори поширюють зазначений термін на випадки розвитку СН внаслідок відносної ішемії міокарда, наприклад при таких станах, як анемія, нічне апное, тиреотоксикоз. Ні з першою, ні з другою думкою не можна погодитися. Якщо подібний підхід і може бути виправданий з погляду синдромального медикаментозного лікування термінальної застійної СН, проте він неприйнятний з позицій розуміння механізмів розвитку і прогресування, особливо у пацієнтів із ІХС без кардіомегалії з наявністю, наприклад лише регіональної дисфункції ЛШ (гібернація, хронічна аневризма). У цих випадках тактика лікування буде спрямована, насамперед, на якнайшвидшу хірургічну реваскуляризацію, на врятування життєздатного міокарда, аневризмектомію.
У наш час у зв’язку зі спрощенням поняття патогенез ішемічної кардіоміопатії описаний як ускладнення одного чи кількох ІМ, що супроводжується втратою функції міоцитів, розвитком фіброзу з подальшим порушенням функції міокарда та ремоделюванням ЛШ. Протилежну думку висловлено дослідниками, що стояли біля джерел вивчення цієї патології. Так, Atkinson і Virmani (1989) описали застійну СН, зумовлену тяжкою ІХС без попереднього ІМ. Патогенез цієї кардіоміопатії при відсутності ІМ був невідомий на той час. Дослідники припустили, що цей тип кардіоміопатії може бути власне ішемічною кардіоміопатією, що розвинулася внаслідок ішемії, або становить собою ідіопатичну ДКМП у поєднанні з випадковою ІХС. Іншими словами, підкреслювали загальні схожі ознаки ішемічної та дилатаційної кардіоміопатії, і розрізняли ці обидві патології лише залежно від морфологічного стану коронарних артерій. Нам більше імпонує ця точка зору.
Відповідно до думки членів Асоціації кардіологів України під клінічним терміном «ішемічна кардіоміопатія» слід розуміти ІХС з виявленою за допомогою методів коронаро- та вентрикулографії дифузним ураженням коронарних артерій, вираженою дилатацією ЛШ, тотальним зниженням скоротності міокарда, що супроводжуються клінічними ознаками СН (Національний конгрес кардіологів України, 18–21 вересня, 2000, Київ).
Історично склалося так, що в Україні діагноз «кардіоміопатія дилатаційна чи гіпертрофічна» встановлювали шляхом виключення у процесі диференційної діагностики насамперед таких захворювань, як ІХС і АГ. На сьогодні з метою уникнення плутанини, вищесказане є ще одним аргументом у недоцільності використання терміну «ішемічна кардіоміопатія» як діагноз. Термін може бути використаний у клінічній практиці, але не рекомендується як діагноз.
ЛІКУВАННЯ СТАБІЛЬНОЇ СТЕНОКАРДІЇ
Лікування стабільної стенокардії має дві основні мети: по-перше, поліпшення прогнозу та запобігання ускладненням ІХС, таким як ІМ і раптова смерть; по-друге, зниження частоти та інтенсивності нападів стенокардії і тим самим поліпшення якості життя пацієнтів. Досягнення зазначених цілей можливе за рахунок поєднання немедикаментозних, медикаментозних і хірургічних (реваскуляризація міокарда) методів лікування.
Вибір методу лікування визначається його впливом на прогноз пацієнта. Тому серед терапевтичних заходів з однаковою клінічною ефективністю перевагу слід надавати тим, які мають доведений і/чи найбільш виражений сприятливий вплив на виживаність і запобігання серцево-судинних ускладнень.
Загальні рекомендації
Лікування ІХС з урахуванням хронічного перебігу захворювання передбачає тісну співпрацю лікаря, пацієнта і його найближчого оточення. Вибір методу терапії, медикаментозного чи хірургічного, залежить від клінічного стану хворого і результатів використання лікарських засобів. Рішення щодо терапевтичної тактики слід приймати разом із пацієнтом, тому йому необхідно надати детальну інформацію про захворювання, ступінь ризику основних ускладнень і сучасні можливості лікування. Слід враховувати співвідношення ефективності та вартості планованої терапії.
Особливу увагу слід приділити факторам ризику, які пов’язані зі способом життя хворого, впливають на загальний прогноз, ускладнюють перебіг захворювання та можуть бути усунені. До них відносять, насамперед, нераціональне харчування та надмірну масу тіла, гіподинамію чи неадекватні фізичні навантаження, тютюнопаління.
Рекомендації з раціонального харчування
Дотримання дієти — ефективний метод вторинної профілактики у пацієнтів з ІХС. Основу раціонального харчування цих хворих становить так звана «середземноморська» дієта з достатньою кількістю свіжих овочів, фруктів, зернових продуктів з великим вмістом клітковини, морської риби, разом з обмеженням у раціоні тваринних жирів. У добовому раціоні рекомендована кількість жиру не повинна перевищувати 30%, для насичених жирів — не більше ⅓ загальної кількості. Кількість ХС, що потрапляє в організм разом з їжею, не має перевищувати 300 мг/добу. При низькокалорійній дієті насичені жири рекомендується частково заміняти складними вуглеводами, а також моно- і поліненасиченими жирами, які містяться в рослинній їжі та морепродуктах.
Омега-3-поліненасичені жирні кислоти (ПНЖК). Риб’ячий жир, що містить велику кількість омега-3 ПНЖК (ейкозапентаєнова, докозагексаєнова кислоти), корисний для корекції порушень ліпідного обміну. Крім того, цей продукт впливає на прогноз хворих, які перенесли ІМ. За даними дослідження GISSI-Prevenzione, в якому взяли участь понад 11 тис. таких пацієнтів, тривале застосування омега-3 ПНЖК у дозі 1 г/добу додатково до базової терапії призводило до зниження загальної смертності на 21%. Найбільш істотні відмінності відзначали для показника частоти раптової смерті (45%). Причому позитивний вплив препарату на цей показник виявлено вже на ранніх етапах дослідження, протягом перших 3 міс. Смертність хворих, які приймали ПНЖК, була нижчою, ніж у контрольній групі, — 1,1% порівняно з 1,6% відповідно (р=0,037).
На сьогодні вважають, що клінічна ефективність омега-3 ПНЖК у хворих, які перенесли ІМ, в основному пов’язана з профілактикою розвитку аритмій. Вбудовуючись у трансмембранні іонні канали, омега-3 ПНЖК сприяють електричній стабілізації кардіоміоцитів і перешкоджають виникненню аритмії.
Структурні та фізико-хімічні особливості омега-3 ПНЖК дозволяють їм вбудовуватися або в ділянки подвійного шару фосфоліпідів, розташованих поруч з іонними каналами, або безпосередньо в гідрофобні структури білків іонних каналів. При такому розташуванні негативний заряд карбоксильної групи омега-3 ПНЖК може взаємодіяти з позитивним зарядом білків іонних каналів (рис. 3.10), регулюючи транспорт К+, Na+, Ca2+.

Рис. 3.10. Робоча гіпотеза, що пояснює антиаритмогену дію омега-3 ПНЖК за допомогою зміни активності калієвих, натрієвих і кальцієвих каналів L-типу. 1 і 2 — молекули ПНЖК
В експериментальних дослідженнях підвищення концентрації омега-3 ПНЖК у мембранах гранулоцитів супроводжувалося нормалізацією/підвищенням варіабельності серцевого ритму. Відомо, що низька варіабельність серцевого ритму асоційована з ризиком раптової смерті. У тварин з експериментальним ІМ омега-3 ПНЖК підвищували поріг фибриляції шлуночків серця. Було виявлено властивості ПНЖК, які можуть мати значення для запобігання розвитку атеросклерозу, зокрема активація синтезу протизапальних простагландинів, підвищення продукції простацикліну, зниження рівня лейкотрієну В4, блокування міграції нейтрофільних гранулоцитів і моноцитів, антиагрегантна дія. За результатами GISSI ПНЖК впливали на виживаність хворих незалежно від особливостей їх харчування та наявності інших факторів ризику, таких як тютюнопаління, супутня АГ і цукровий діабет. Проте у осіб, які дотримувалися рекомендованої дієти, відзначали вірогідно (р<0,0001) більш високий показник виживаності протягом 3,5 року спостереження. На сьогодні застосування препаратів омега-3 ПНЖК вважають доцільним доповненням до базової терапії з метою вторинної профілактики серцево-судинних ускладнень, зокрема раптової смерті, у пацієнтів після перенесеного ІМ.
Вітаміни
Результати масштабних клінічних досліджень не підтвердили позитивного впливу вітамінів-антиоксидантів (вітаміни А, Е та С) на рівень серцево-судинного ризику у осіб з ІХС, що ставить під сумнів доцільність їх призначення в таких випадках.
Фізична активність
Адекватна фізична активність впливає на загальний стан пацієнтів з ІХС, сприяє підвищенню толерантності до фізичних навантажень і контролю маси тіла, а також нормалізації ліпідного і вуглеводного обміну, рівня АТ. Разом з тим, необхідно враховувати індивідуальну переносимість фізичних навантажень хворими зі стенокардією. Цей показник визначається за допомогою тестів з дозованими навантаженнями і становить основу індивідуальних програм для проведення тренувань пацієнтів з ІХС.
Тютюнопаління
Відмова від тютюнопаління — обов’язкова складова терапевтичних заходів при ІХС. Цей важливий захід сприяє поліпшенню клінічного стану і прогнозу пацієнтів. При необхідності призначають спеціальну нікотинзамісну терапію.
АГ, цукровий діабет та інші супутні захворювання
Такі супутні захворювання, як АГ, цукровий діабет і метаболічний синдром, у пацієнтів з ІХС потребують адекватної корекції, оскільки їх наявність підвищує ризик прогресування коронарної хвороби. Міжнародні рекомендації щодо запобігання серцево-судинним захворюванням у пацієнтів з підтвердженим діагнозом ІХС передбачають більш низький, ніж у популяції в цілому, рівень АТ — 130/85 мм рт. ст. Наявність супутнього цукрового діабету і/або захворювання нирок також потребує дотримання більш низьких цільових показників АТ — <130/80 мм рт. ст. Крім того, пацієнти з цукровим діабетом, який за ступенем ризику серцево-судинних ускладнень розглядають як стан, еквівалентний ІХС, потребують адекватного контролю рівня глікемії та обов’язкової корекції інших наявних факторів серцево-судинного ризику. Терапія при цукровому діабеті з урахуванням зазначених факторів вірогідно знижує частоту як серцево-судинних, так і суто діабетичних ускладнень.
Психологічні фактори
Роль стресу в генезі ІХС залишається невизначеною. Відомо, що психологічні фактори здатні провокувати напади стенокардії. Діагноз хронічного серйозного захворювання, яким є ІХС, може формувати у пацієнта стан стійкого психологічного дискомфорту, а в деяких випадках — невротичні тривожні розлади. Тому навчання пацієнтів методикам стрес-контролю і релаксації — важливий терапевтичний захід. Існують дані про позитивні результати застосування цих методик.
Гормональна замісна терапія
Досі немає доказів позитивного впливу гормональної замісної терапії на ризик розвитку серцево-судинних ускладнень у жінок з ІХС. Застосування гормональних засобів для первинної профілактики супроводжувалося зростанням серцево-судинних захворювань і раку молочної залози. Тому у звичайній клінічній практиці використання гормональної замісної терапії не показане.
Допомога при гострому нападі стенокардії
Пацієнта слід проінформувати про те, що поява нападу стенокардії потребує негайного припинення навантаження, яке його спровокувало. Найчастіше, коли напад розвивається під час ходи, рекомендується негайно зупинитися і залишатися у стані спокою до повного припинення болю.
Для купірування нападів стенокардії показані препарати нітрогліцерину у формі сублінгвальних таблеток та розчину в желатинових капсулах або аерозольних упаковках. Можна застосовувати ізосорбіду динітрат у спеціальних лікарських формах швидкої дії — сублінгвальні/жувальні таблетки, розчин в аерозольних упаковках. Доцільно інформувати хворого про найчастіші побічні реакції на прийом нітратів, такі як головний біль і різке зниження АТ. З огляду на можливість виражених коливань АТ нітропрепарати рекомендується застосовувати у положенні сидячи, особливо на початку лікування. Тривалість нападу стенокардії понад 10–20 хв після відпочинку і/чи прийому нітратів потребує негайної спеціалізованої медичної допомоги.
У деяких випадках може бути корисним застосування швидкодіючих нітратів з профілактичною метою безпосередньо перед навантаженнями, які звичайно викликають напади стенокардії.
Фармакотерапія стабільної стенокардії
Мета фармакотерапії стабільної стенокардії — поліпшення прогнозу та якості життя пацієнтів за рахунок усунення симптомів захворювання. Пріоритет мають лікарські засоби з доведеним позитивним впливом на прогноз. Для більшості хворих на стабільну стенокардію фармакотерапія залишається альтернативою хірургічним втручанням. Причому, за даними дослідження MASS-II, фармакотерапія супроводжується меншою кількістю ускладнень, як мінімум протягом 1-річного спостереження, порівняно з хірургічними методами лікування. Інвазивні втручання залишаються методом вибору для хворих із дуже високим ризиком розвитку серцево-судинних ускладнень або у разі, якщо адекватна медикаментозна терапія не дозволяє усунути симптоми захворювання.
Фармакотерапія для поліпшення прогнозу у хворих на стабільну стенокардію
Антитромботичні препарати
Застосування антитромботичної терапії запобігає розвитку тромботичних ускладнень і є обов’язковим для всіх хворих на стабільну стенокардію при відсутності протипоказань.
Ацетилсаліцилова кислота (АСК)
АСК залишається препаратом вибору для більшості пацієнтів з ІХС. Позитивний терапевтичний ефект АСК і відносно низький ризик розвитку побічних ефектів на сьогодні підтверджені цілим рядом досліджень. У рандомізованих випробуваннях встановлена беззастережна перевага АСК перед плацебо у хворих на стабільну стенокардію. Наприклад, результати шведського дослідження SAPAT свідчать про зниження під впливом АСК у дозі 75 мг/добу частоти розвитку ІМ і раптової смерті на 34%; р=0,003. Класичний метааналіз Antithrombotic Trialists’Collaboration (АТС) 11 клінічних досліджень ефективності АСК, у який було включено результати терапії 2920 хворих на стабільну стенокардію, підтвердив 33% зниження частоти серйозних судинних ускладнень (інфаркт, інсульт, кардіальна смерть) порівняно з плацебо і групою хворих, які не одержували лікування (9,9% проти 14,1% відповідно; р<0,001). Аналогічні результати антитромботичної терапії були у пацієнтів, які перенесли ІМ. За даним того ж АТС, за участю майже 19 тис. хворих з ІМ в анамнезі, прийом АСК знижував смертність і частоту повторного нефатального ІМ на 31%. Механізм дії АСК полягає в необоротній блокаді тромбоцитарної ЦОГ-1, що супроводжується зменшенням продукції тромбоксану А2 і зниженням агрегаційної активності тромбоцитів. АСК інактивує ЦОГ на весь період життя тромбоцита — 7–10 днів. Оптимальними антитромботичними дозами АСК вважають 75–150 мг добу. Перевищення чи зниження зазначених доз може впливати на ефективність АСК, як це показано у дослідженні CURE у пацієнтів із ГКС. Найбільш ефективними для зниження ризику серцево-судинних ускладнень виявилися невисокі дози препарату — ≤100 мг. У дослідженні USPHS в невеликій підгрупі хворих на стенокардію істотне зниження частоти нефатального ІМ відзначали при застосуванні АСК в дозі 325 мг добу. Питання про режим дозування АСК у пацієнтів із стабільною стенокардією залишається відкритим, оскільки контрольованих порівняльних досліджень ефективності різних доз АСК на сьогодні недостатньо.
Серед побічних ефектів, пов’язаних із прийомом АСК, найбільше практичне значення мають шлунково-кишкові розлади (ульцерогенна дія та геморагічні ускладнення). Слід зазначити, що ризик розвитку шлунково-кишкових кровотеч зростає при застосуванні будь-яких антитромботичних засобів, причому точних відомостей про частоту цього побічного ефекту при застосуванні, наприклад клопідогрелу, на сьогодні немає. Можливим механізмом розвитку кровотеч при застосуванні антитромботичних засобів вважають порушення нормального процесу відновлення слизової оболонки ШКТ, що у свою чергу зумовлено блокадою вивільнення тромбоцитарних факторів росту. Не виключено, що АСК викликає дозозалежне ураження слизової оболонки шлунка, якого можна значною мірою уникнути при застосуванні препарату в низьких дозах. Протидіяти шлунково-кишковим ефектам АСК до певного ступеня можуть засоби, що блокують секрецію соляної кислоти, зокрема інгібітори протонного насоса. Позитивні результати відзначали при поєднаному застосуванні АСК і ланзопразолу, езомепразолу. Ерадикація Helicobacter pylori також знижує ризик розвитку шлунково-кишкових кровотеч, зокрема і при застосуванні АСК.
Безпека застосування антитромботичних препаратів стосується важливого питання про ризик розвитку внутрішньочерепної геморагії. Слід зазначити, що абсолютний ризик розвитку подібних ускладнень для АСК в дозі 75 мг/добу низький і становить <1 випадку на 1000 пацієнто-років. Немає доказів і дозозалежного підвищення ризику виникнення внутрішньочерепних крововиливів при застосуванні АСК у звичайних терапевтичних дозах. Разом з тим у пацієнтів з атеросклерозом мозкових судин спостерігали позитивний системний ефект при призначенні АСК з метою профілактики ішемічного інсульту. Наприклад, за результатами метааналізу АТС (про який вже йшлося вище), застосування АСК знижувало частоту нефатального інсульту на 42%, що підтверджує доцільність застосування препарату в цих хворих.
Резистентність до АСК. Феномен резистентності до АСК визначають при розвитку серцево-судинних ускладнень, незважаючи на прийом препарату, а також за допомогою лабораторних методів, що підтверджують зниження чи відсутність фармакологічного ефекту АСК. Проте на сьогодні немає загальноприйнятих стандартних підходів як для виявлення резистентності до АСК, так і для її подолання. Подібна проблема існує і для клопідогрелу.
Взаємодія з селективними інгібіторами ЦОГ-2 та іншими НПЗП. Обговорення зазначеної групи лікарських засобів у контексті лікування стабільної стенокардії зумовлено їх імовірним негативним впливом на ризик розвитку серцево-судинних ускладнень і можливістю взаємодії з АСК. Передумовою негативної дії на серцево-судинну систему є зменшення під впливом селективних інгібіторів ЦОГ-2 синтезу простацикліну, речовини з вазодилататорним і антитромботичним ефектами. Зниження активності простацикліну створює умови для підвищення рівня АТ, прогресування атеросклерозу і тромбоутворення.
Істотне зростання ризику серйозних коронарних ускладнень, таких як фатальний і нефатальний ІМ, було виявлено при проведенні ряду клінічних досліджень із застосуванням рофекоксибу. Підвищення частоти серцево-судинних ускладнень на фоні застосування рофекоксибу мало дозозадежний характер; цей показник становив 2,3 і 3,4% для добових доз рофекоксибу 400 і 800 мг, відповідно.
У плацебо-контрольованому дослідженні із застосуванням парекоксибу/вальдекоксибу для лікування пацієнтів з післяопераційним больовим синдромом після АКШ відзначали збільшення кількості серцево-судинних ускладнень вже після 10 днів терапії.
За результатами клінічних досліджень із застосуванням ряду селективних інгібіторів ЦОГ-2 зроблено висновок, що зазначені лікарські засоби здатні підвищувати ризик розвитку коронарних ускладнень у загальній популяції хворих. Крім того, застосування інгібіторів ЦОГ-2 було пов’язане з ризиком розвитку інсульту, СН і АГ. Тому призначення інгібіторів ЦОГ-2 (без одночасного забезпечення ефективної блокади тромбоцитарної ЦОГ-1) хворим зі стабільною стенокардією протипоказане.
Неселективні інгібітори ЦОГ (НПЗП), наприклад напроксен, здатні оборотно блокувати продукцію тромбоксану і агрегацію тромбоцитів. Проте ефективність НПЗП щодо синтезу тромбоксану значно поступається АСК. Крім того, процес блокування ЦОГ-1/тромбоксану під впливом НПЗП має оборотний характер. Поряд з цим, існують свідчення того, що неселективні НПЗП також можуть підвищувати ризик розвитку серцево-судинних ускладнень. Тому при необхідності пацієнтам з ІХС рекомендується призначення НПЗП у мінімальних ефективних дозах, по можливості максимально короткими курсами. Препаратом вибору для початку терапії залишається парацетамол. Призначення НПЗП хворим на стабільну стенокардію необхідно поєднувати з прийомом АСК у низьких дозах (75 мг) для забезпечення адекватного антитромботичного ефекту.
Ібупрофен і, можливо, напроксен здатні знижувати антиагрегантний ефект АСК за рахунок конкурентної блокади процесу ацетилування ЦОГ-1. Комбінації зазначених НПЗП з АСК не рекомендуються.
Диклофенак — відносно селективний блокатор ЦОГ-2. Він практично не впливає на функцію тромбоцитів і не взаємодіє з АСК, тому за необхідності таке поєднання препаратів може бути використане у пацієнтів з ІХС.
Клопідогрел і тиклопідин
Належать до групи тієнопіридинів, за механізмом дії є неконкурентними антагоністами рецепторів АДФ. Їх фармакодинамічний ефект подібний до ефекту АСК. Незважаючи на досить тривале застосування тиклопідину в клінічній практиці, його роль у лікуванні як хронічних форм ІХС, так і ІМ остаточно не визначена. Порівняно з клопідогрелом, тиклопідин характеризується дещо гіршою переносимістю і більшою кількістю побічних ефектів, зокрема негативним впливом на кровотворну функцію кісткового мозку (нейтропенія, тромбоцитопенія). Терапевтичний ефект препарату розвивається повільно.
Основним клінічним дослідженням з метою вивчення дії клопідогрелу у пацієнтів з хронічною ІХС було дослідження CAPRIE. У ньому взяли участь хворі з перенесеним ІМ, інсультом, атеросклерозом периферичних артерій. За результатами дослідження в групі пацієнтів високого ризику клопідогрел у дозі 75 мг/добу виявився дещо ефективнішим щодо запобігання серцево-судинним ускладненням, ніж АСК в дозі 325 мг/добу (р=0,043). Проте аналіз результатів CAPRIE у різних підгрупах хворих свідчить, що можливі переваги клопідогрелу перед АСК щодо зниження кількості серцево-судинних ускладнень були виявлені лише у підгрупі пацієнтів з атеросклерозом периферичних артерій. Дуже незначними були переваги клопідогрелу щодо частоти розвитку шлунково-кишкових кровотеч, незважаючи на досить високу дозу АСК. Слід також зазначити трохи завищену, за даними літератури, оцінку переваг клопідогрелу, з огляду на те, що доза АСК, яку призначали в дослідженні (325 мг/добу), була не найбільш оптимальною. У дослідження CAPRIE не включали хворих з непереносимістю АСК; немає порівняльних даних щодо частоти розвитку шлунково-кишкових кровотеч при застосуванні клопідогрелу та плацебо. Якщо до цього додати ще й значну вартість клопідогрелу, то призначення цього препарату доцільно лише при непереносимості АСК, у пацієнтів з високим ризиком виникнення артеріального тромбозу та після стентування коронарних артерій з використанням елютинг-стентів. Питання щодо ризику розвитку шлунково-кишкових кровотеч на фоні антитромбоцитарної терапії слід розглядати окремо для кожного конкретного клінічного випадку. Після коронарного стентування, за наявності гострого коронарного синдрому, при ІМ з елевацією сегмента ST клопідогрел рекомендується застосовувати у комбінації з АСК, але протягом обмеженого проміжку часу (до 12 міс). Ефективність зазначеної комбінації при стабільній стенокардії не доведена. Клопідогрел підвищує ризик серйозних кровотеч після АКШ.
Не вирішеним залишається питання щодо потенційної взаємодії клопідогрелу з іншими лікарськими засобами, які впливають або мають спільний шлях метаболізму в системі печінкових трансаміназ СYР 3А4. Наприклад, Lau і співавтори показали, що аторвастатин дозозалежно блокує вплив клопідогрелу на АДФ-індуковану активацію тромбоцитів. Подібна взаємодія не характерна для правастатину, який метаболізується іншим шляхом. У цій же роботі показана можливість взаємодії між клопідогрелом та антибіотиками (еритроміцин, тролеандоміцин), які інгібують або індукують (рифампіцин) систему СYР 3А4. З іншого боку, при застосуванні аторвастатину в невисокій дозі (10 мг/добу) взаємодії між ним і клопідогрелом не виявлено. Певні протиріччя існують в оцінках імовірності взаємодії клопідогрелу (в навантажувальній дозі 300 мг) і ліпофільних статинів (аторвастатин, симвастатин, ловастатин) у пацієнтів після транслюмінальних втручань. Можливо, що взаємодія статинів і клопідогрелу залежать від дози останнього. Так, застосування аторвастатину або симвастатину і клопідогрелу у високій дозі (600 мг/добу) не впливало на його антиагрегантну активність.
Слід зазначити, що спеціальних проспективних рандомізованих досліджень, присвячених питанню впливу на кінцеві результати комбінованої терапії з використанням клопідогрелу і ліпофільних статинів, не проводили. В усякому разі, за наявними даними, тривале застосування таких комбінацій не позначалося на кінцевих результатах клінічних досліджень, включаючи показники смертності й захворюваності. За результатами реєстру GRACE приєднання статинів до терапії клопідогрелом супроводжувалося додатковим позитивним впливом на прогноз. Таким чином, на сьогодні дані щодо можливої взаємодії клопідогрелу та статинів досить суперечливі, об’єктивна значимість такої взаємодії залишається предметом дискусії.
Дипіридамол і антикоагулянти
На даний час дипіридамол не розглядають як антитромботичний засіб для лікування стабільної стенокардії. Вважають, що він характеризується відносно низькою антитромбоцитарною активністю та високим ризиком розвитку синдрому «коронарного обкрадання» з можливим погіршенням клінічної симптоматики стенокардії. Антикоагулянти (варфарин, інгібітори тромбіну) при стабільній стенокардії не показані, крім особливих обставин, наприклад наявність фібриляції передсердь.
Гіполіпідемічні засоби
Гіполіпідемічні засоби — найважливіша складова лікування пацієнтів із ІХС. Гіполіпідемічні препарати призначають на додаток до дієти і заходів щодо модифікації способу життя (відмова від тютюнопаління, адекватна фізична активність тощо). Основною фармакологічною групою лікарських засобів для корекції порушень ліпідного обміну є статини. Крім них, у деяких особливих випадках використовують езетиміб, секвестранти жовчних кислот (колестирамін, колестипол), нікотинову кислоту, фібрати (гемфіброзил, фенофібрат), а також препарати омега-3 ПНЖК (риб’ячого жиру).
Інгібітори ГМГ-КoA-редуктази (статини)
В Україні зареєстровані такі препарати-статини: ловастатин, симвастатин, аторвастатин, розувастатин, флувастатин. Статини знижують ризик розвитку атеросклеротичних серцево-судинних ускладнень в середньому на 30%. Позитивні прогностичні можливості статинової терапії продемонстровані в цілому ряді клінічних досліджень щодо первинної (AFCAPS/TexCAPS, ASCOT-LLA) та вторинної (4S, LIPID, CARE, HPS) профілактики атеросклерозу і його ускладнень (рис. 3.11).

Рис. 3.11. Клінічні дослідження статинів та коронарний ризик. ЦД — цукровий діабет; ФР — фактор ризику. Статини поліпшували виживаність і зменшували кількість серцево-судинних ускладнень у пацієнтів з ІХС незалежно від статі та віку, початкового рівня ХС, ступеня серцево-судинного ризику, супутніх АГ, цукрового діабету, інших еквівалентів ІХС
Першим масштабним дослідженням, що радикально змінило ставлення клініцистів до терапії дисліпідемії, було скандинавське дослідження 4S. У ньому взяли участь 4444 пацієнтів з ІХС та гіперхолестеринемією. Учасників рандомізували у дві групи: плацебо та симвастатину. Початкова доза препарату становила 20 мг/добу; у частини хворих під контролем показників ліпідного обміну її підвищували до 40 мг/добу. Спостереження пацієнтів проводили в середньому до 5,4 року. Основним результатом дослідження стало зниження під впливом терапії симвастатином загальної смертності на 30% і серцево-судинної смертності — на 42% (рис. 3.12).
Рис. 3.12. Результати дослідження 4S. Під впливом терапії симвастатином 20–40 мг/добу відзначали зниження коронарної смертності на 42%
Через 10 років після завершення скандинавського дослідження його автори надали додаткові результати подальшого спостереження хворих, які взяли в ньому участь. Додатковий період після завершення основного дослідження становив в середньому 2 роки. Виявилося, що 82,2% хворих, які почали прийом симвастатину під час 4S, надалі його продовжили. Понад 70% пацієнтів групи плацебо після завершення основного дослідження почали приймати симвастатин. Разом з тим, показник смертності у хворих, що спочатку приймали симвастатин, залишився вірогідно нижчим порівняно з групою плацебо: 3,6% проти 4,9%, відповідно.
Безсумнівним досягненням у вивченні терапевтичних властивостей статинів стало дослідження НРS (Heart Protection Study). Його результати, крім розширення доказової бази для застосування статинів в цілому і симвастатину зокрема та масштабності самого дослідження (у ньому брали участь 20 536 пацієнтів), дали підстави для перегляду сучасних стандартів лікування пацієнтів високого ризику щодо серцево-судинних ускладнень. Істотною особливістю НРS було те, що це дослідження виконувалося під керівництвом Ради медичних наукових досліджень Великобританії (MCR) і Британського кардіологічного фонду (BHF) і мало незалежні джерела фінансування. У дослідження залучали хворих віком 40–80 років з високим ризиком ускладнень ІХС: після перенесеного ІМ, з іншими проявами ІХС або ознаками атеросклеротичного ураження некоронарних артерій, з цукровим діабетом II типу і АГ. Основним показанням для призначення симвастатину в НРS був високий ризик розвитку серцево-судинних ускладнень, а не гіперхолестеринемія, як у більшості попередніх досліджень. Таким чином, серед учасників НРS виявилося достатньо пацієнтів з відносно низьким рівнем ХС — до 33%. Симвастатин призначали в дозі 40 мг/добу. Пацієнти контрольної групи одержували плацебо. Тривалість терапії становила в середньому 5,5 року. Дослідження продемонструвало достовірну ефективність симвастатину в запобіганні основних ускладнень (ІМ, інсульт, потреба у проведенні операцій по реваскуляризації). Інтегральний показник частоти серцево-судинних ускладнень під впливом терапії знизився на 24%. Причому позитивні результати відзначали в різних підгрупах хворих, незалежно від статі, віку, а також, що надзвичайно важливо, — від початкових показників ХС і ХС ЛПНЩ (рис. 3.13).
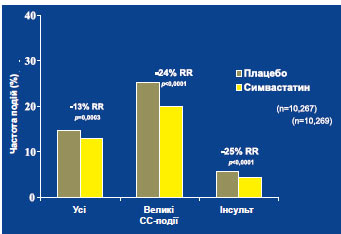
Рис. 3.13. Вплив терапії симвастатином в дозі 40 мг/добу на смертність і частоту серцево-судинних ускладнень у хворих із низьким вихідним рівнем ХС. Результати дослідження НРS. RR — відносний ризик — симвастатин vs плацебо
Знайшла підтвердження гіпотеза щодо позитивного прогностичного впливу симвастатину у пацієнтів з еквівалентами ІХС, включаючи цукровий діабет і захворювання некоронарних судин. Показовими є результати лікування хворих на цукровий діабет, у яких на початку дослідження не було симптомів ІХС. У цій підгрупі ризик розвитку серцево-судинних ускладнень під впливом терапії знижувався на ⅓. На фоні прийому симвастатину на 27% знижувався ризик розвитку ішемічного інсульту. Під впливом лікування виявляли статистично достовірну динаміку показників ліпідного обміну. Рівень ХС знижувався в середньому на 1,2 ммоль/л, ХС ЛПНЩ — на 1,0 ммоль/л. Разом з тим, зменшення кількості серцево-судинних ускладнень не залежало як від початкових рівнів ХС і ЛПНЩ, так і від чутливості цих показників до терапії статином. Відмінності в частоті ускладнень стали статистично значимими вже протягом 2-го року дослідження і продовжували збільшуватися протягом усього періоду дослідження.
Дослідження CARE і LIPID були присвячені вивченню ефективності статинів (препарат правастатин) у хворих, які перенесли ІМ або мали в анамнезі нестабільну стенокардію. У першому з них (CARE) взяли участь 4159 хворих віком до 75 років з постінфарктним кардіосклерозом. У всіх пацієнтів відзначали помірно виражене підвищення рівня загального ХС у крові — до 6,2 ммоль/л. У групі активного лікування хворим призначали правастатин 40 мг/добу, в контрольній групі — плацебо, період спостереження становив 5 років. Основна кінцева точка дослідження — смерть від ІХС або нефатальний ІМ — відзначена у 13,2% хворих у групі плацебо і у 10,2% — у групі пацієнтів, які одержувала правастатин. Тобто ризик основних серцево-судинних ускладнень у групі активного лікування знизився на 24% (р<0,003), в основному за рахунок кількості повторних інфарктів (25%; р<0,006). У пацієнтів основної групи рідше виникала потреба в оперативному лікуванні, зокрема в АКШ (різниця становила 26%; р<0,005) і балонній ангіопластиці коронарних артерій (різниця — 23%; р<0,03).
Метою LIPID було вивчення прогностичного впливу правастатину в дозі 40 мг/добу у хворих з помірно підвищеним рівнем ХС у крові (в середньому — 5,6 ммоль/л), які перенесли нестабільну стенокардію або ІМ. У дослідження були включені 9014 пацієнтів, запланована тривалість спостереження — 5 років. Проте дослідження було достроково припинене з етичних міркувань, оскільки в групі пацієнтів, які приймали статини, вже протягом перших 2 років відзначали зниження ризику загальної та коронарної смертності на 23 і 24% відповідно. Кількість інфарктів, фатальних і нефатальних, вірогідно зменшилася на 29%.
Важливим фактором, що визначає ефект статинової терапії, є вплив на прогресування атеросклерозу. За даними досліджень різних статинів запобігання прогресуванню атеросклерозу потребувало істотного зниження ХС ЛПНЩ, не менше ніж на 45% від початкового рівня. Наприклад, «агресивна» гіполіпідемічна терапія із застосуванням аторвастатину в максимальній дозі (80 мг/добу) виявилася більш ефективною для запобігання атеросклеротичним змінам коронарних судин порівняно з «м’яким» зниженням рівня ліпідів за допомогою правастатину в дозі 40 мг/добу. Збільшення об’єму атеросклеротичних бляшок було зупинено у хворих, які приймали аторвастатин (–0,4%), на відміну від групи правастатину, у якій відзначали їх приріст (+2,7%; р=0,02).
Позитивний вплив на перебіг захворювання та переваги застосування аторвастатину у високих дозах порівняно з правастатином у стандартних дозах виявлено і у пацієнтів з гострим коронарним синдромом у дослідженні PROVE IT.
Прогностичний вплив аторвастатину у хворих на стабільну стенокардію та гіперхолестеринемію вивчали в дослідженні AVERT. У дослідження був включений 341 пацієнт. За даним коронарографії у всіх хворих були атеросклеротичні ураження як мінімум однієї коронарної артерії (стеноз >50%). При цьому клінічні прояви захворювання (кількість та інтенсивність нападів стенокардії) були помірними чи відсутніми. Половині хворих призначали аторвастатин в дозі 80 мг/добу протягом 18 міс. У паралельній групі пацієнтам проводили ангіопластику з подальшим призначенням звичайного лікування. Результати AVERT виявили переваги активної гіполіпідемічної терапії у цих хворих і чітку тенденцію до зменшення кількості серцево-судинних ускладнень в групі пацієнтів, які приймали аторвастатин. Сумарну кількість таких ускладнень, як кардіальна смерть, нефатальний ІМ, цереброваскулярні ускладнення, потреба у проведенні повторної реваскуляризації, було зареєстровано у 13% пацієнтів, які приймали аторвастатин, і у 21% хворих, які одержували звичайну терапію.
Розувастатин у максимальній дозі 40 мг/добу викликав достовірну регресію коронарного атеросклерозу в дослідженні ASTEROID. За допомогою внутрішньосудинного ультразвукового датчика у 349 пацієнтів визначали динаміку об’єму атероми до і після 24-місячного лікування розувастатином. Зменшення об’єму атеросклеротичної бляшки під впливом терапії становило 3,15%; р<0,001, а різниця об’ємів у максимально стенозованих сегментах артерій — 9,1%. Інтегральний показник зменшення об’єму атеросклеротичної бляшки під впливом розувастатину становив 6,8%. Слід зазначити, що розувастатин, один із найбільш потужних гіполіпідемічних препаратів, особливо за впливом на рівень ХС ЛПНЩ. Крім того, препарат викликає підвищення рівня ХС ЛПВЩ в середньому на 14,7%. Порівняно з іншими статинами розувастатин виявив найбільш значний вплив на цей показник. Позитивні результати щодо застосування розувастатину були отримані в масштабному багатоцентровому рандомізованому дослідженні JUPITER. В зазначеному дослідженні взяли участь понад 17 000 осіб. Це були відносно здорові чоловіки віком старше 55 та жінки віком старше 65 років без серцево-судинних ускладнень в анамнезі, з низьким рівнем ХС ЛПНЩ (<3,36 ммоль/л), але з підвищеними показниками СРБ. Терапія — розувастатин 20 мг/добу чи плацебо — проводилась в середньому 1,9 року. Дослідження було припинено достроково після обрахування попередніх даних і встановлення беззаперечних доказів щодо зменшення серцево-судинних ускладнень та смертності під впливом активного лікування порівняно з плацебо. Застосування розувастатину сприяло 44-відсотковому зниженню відносного ризику щодо основних кінцевих точок, включаючи нефатальні ІМ та інсульт, потребу в госпіталізації у зв’язку з ОКС чи реваскуляризацією, а також смертність від серцево-судинних причин. Суттєво нижчим був абсолютний ризик щодо таких жорстких кінцевих точок, як кардіоваскулярна смерть, ІМ, інсульт. Показник становив 1,8% в групі плацебо та 0,9% — в групі розувастатину. Проте розувастатин відносно новий препарат, і на сьогодні у рамках програми GALAXY, що включає 22 багатоцентрових рандомізованих контрольованих дослідження, триває вивчення його ефективності та безпеки, а також впливу на прогноз розвитку ІХС.
Зниження ризику розвитку основних серцево-судинних ускладнень відзначали у плацебо-контрольованому англо-скандинавському дослідженні (ASCOT-LLA), в якому вивчали результати первинної профілактики ІХС у пацієнтів з АГ і помірно вираженим підвищенням рівня ХС у крові (до 6,5 ммоль/л). У дослідження було включено >10 тис. хворих. Крім АГ, вони мали не менше 3 додаткових факторів серцево-судинного ризику. Такими факторами вважали ГЛШ серця, зміни ЕКГ, цукровий діабет II типу, інсульт або транзиторну ішемічну атаку (ТІА) в анамнезі, мікроальбумінурію, протеїнурію, тютюнопаління. Пацієнти одержували адекватну антигіпертензивну терапію і додатково — аторвастатин в дозі 10 мг/добу чи плацебо. За результатами дослідження відносний ризик розвитку всіх коронарних ускладнень на фоні застосування аторвастатину знизився на 36%.
Загальний показник серцево-судинних ускладнень і потреба у проведенні хірургічних втручань щодо реваскуляризації міокарда становили 7,5% у групі аторвастатину і 9,5% — у групі плацебо. За етичними міркуваннями комітет з нагляду ASCOT-LLA ухвалив рішення щодо дострокового припинення дослідження вже через 1 рік після його початку, вважаючи неприпустимим відмову від активного лікування хворих з огляду на його очевидні переваги.
Основний механізм дії статинів пов’язаний з оборотною блокадою ферменту ГМГ-КоА-редуктази, що забезпечує синтез ХС. Зниження внутрішньоклітинної концентрації ХС стимулює функцію клітинних рецепторів і підвищує плазмовий кліренс ХС ЛПНЩ. Терапія статинами супроводжується істотним зниженням рівня ХС ЛПНЩ (в середньому на 25–40%), помірно вираженим підвищенням рівня ХС ЛПВЩ (на 5–15%) і зниженням рівня ТГ на 15–50%. Основні фармакологічні властивості препаратів групи статинів наведені в табл. 3.9.

Існують розрахунки, за якими ризик розвитку ускладнень (смерть і кількість випадків нефатального ІМ) зменшується на 7% при зниженні рівня загального ХС на кожні 0,6 ммоль/л протягом перших 2 років терапії статинами і ще на 22% — протягом наступних 3–5 років. Разом з тим результати масштабних клінічних досліджень (4S, WOSCOPS, CARE, HPS) свідчать про відмінності між гіполіпідемічною складовою дії статинів і характером їх впливу на прогноз. Наприклад, у дослідженні 4S зниження частоти серцево-судинних ускладнень відзначали раніше, ніж цього можна було очікувати з урахуванням лише гіполіпідемічної дії симвастатину.
У дослідженні MAAS (381 пацієнт, який одержував симвастатин в дозі 20 мг/добу) відзначали не лише достовірне зниження рівнів ХС і ХС ЛПНЩ в крові, але й істотний вплив препарату на процес прогресування атеросклерозу за даними ангіографії. Так, у пацієнтів групи плацебо до кінця 4-річного періоду спостереження виявляли прогресування оклюзії коронарних артерій, а терапія симвастатином супроводжувалася стабілізацією атеросклеротичного процесу.
У дослідженні HPS зниження ризику розвитку серцево-судинних ускладнень під впливом тривалого лікування симвастатином відзначали у всіх пацієнтів незалежно від початкового рівня ХС крові, включаючи хворих з практично нормальними показниками ліпідограми.
За даними більшості клінічних досліджень застосування статинів дозволяє попередити розвиток ішемічних інсультів; ця дія, очевидно, не зв’язана безпосередньо з впливом на рівень ХС сироватки крові. Певним доказом існування неліпідних механізмів дії статинів є їх ефективність у хворих із гострим коронарним синдромом, коли позитивну дію статинів, зокрема аторвастатину, виявляли вже протягом перших тижнів після початку лікування, тобто протягом часу, якого явно недостатньо для оптимальної реалізації гіполіпідемічного ефекту (PROVE IT). Навіть короткий курс застосування аторвастатину (7 днів по 40 мг/добу) перед проведенням транслюмінальної ангіопластики забезпечував хворим на стабільну стенокардію в ході хірургічного втручання менші ураження міокарда. Ступінь ураження оцінювали за біохімічними показниками. Вважають, що в основі такої кардіопротекторної дії статинів лежать неліпідні механізми. Ці додаткові неліпідні механізми дії статинів одержали назву плеотропних. Вони пов’язані з нормалізацією функції ендотелію, гальмуванням проліферації гладком’язових клітин судин, впливом на апоптоз, протизапальною, антитромботичною й антиоксидантною активністю препаратів, стабілізацією атероматозних бляшок. Існування плеотропних ефектів пояснюють складним механізмом блокади ГМГ-КоА-редуктази. Біохімічним субстратом для них є відмінні від ХС продукти метаболізму мевалоната. Ці речовини одержали назву ізопреноїдів. Вважають, що вони беруть участь у регуляції процесів проліферації, диференціації, міграції, функціонування (експресія ендотеліальної NO-синтази) і апоптозу клітин крові й судинної стінки. Існують дані щодо протидії статинів ефектам ангіотензину II. Під впливом статинів спостерігали зниження концентрації фібриногену та інгібітора активатора плазміногену I, а також в’язкості крові. Частково антиагрегантні властивості статинів пов’язані зі зниженням вмісту ХС у фосфоліпідах мембран тромбоцитів. У експериментах відзначали медіаторну активність статинів у процесах ангіогенезу, перш за все коронарного. Серед додаткових ефектів статинів слід зазначити підвищення чутливості тканин до інсуліну, що має важливе значення для пацієнтів із супутнім цукровим діабетом.
Клінічні дослідження останніх років підтвердили, що поряд із динамікою ліпідних показників терапія статинами супроводжується зниженням концентрації СРБ і протизапальних цитокінів, що вірогідно корелює з прогнозом захворювання. Ці факти дають підстави вважати, що зниження рівня загального ХС, ХС ЛПНЩ і СРБ — взаємодоповнюючі маркери ефективності лікування, які підтверджують гіпотезу про клінічне значення неліпідних механізмів дії статинів. Таким чином, визначення тільки показників ліпідограми не повністю відображає спектр дії статинів. Тому їх призначення має базуватися на загальній оцінці серцево-судинного ризику, навіть за умови нормального рівня ХС. Враховуючи наведені дані, необхідність у призначенні статинів визначається більшою мірою величиною серцево-судинного ризику, ніж рівнем ХС у крові (якщо йдеться про нормальні чи помірно підвищені показники).
Лікування статинами має бути тривалим, оскільки поліпшення прогнозу можливе тільки за умови тривалої терапії. Відмова від прийому гіполіпідемічних засобів супроводжується поверненням показників ліпідограми до початкового рівня вже протягом 1 міс. Сучасна концепція гіполіпідемічної терапії передбачає своєрідний «каскад» ефектів статинів за умови їх тривалого застосування. Протягом перших тижнів/місяців терапії спостерігається стабілізація атероматозних бляшок за рахунок відновлення функції ендотелію, зменшення системного запалення. Результати зазначеного етапу супроводжуються стабілізацією клінічного стану пацієнтів, зменшенням проявів ішемії. Важливою характеристикою початку дії статинів є позитивний прогностичний вплив, що реалізується після 1-го року лікування, зокрема щодо показника виживаності.
Наступний етап статинового каскаду стосується впливу на прогресування атеросклерозу після 2–4-річної постійної терапії. Прикладом антиатеросклеротичної дії статинів можуть служити результати досліджень, у яких активне лікування супроводжувалось не лише відсутністю прогресування атеросклерозу в уражених сегментах коронарних артерій (MARS, 1993; CCAIT, 1994; MAAS, 1994; A-PLUS, 2004), але й регресом існуючих атеросклеротичних бляшок (REVERSAL, 2004; ASTEROID, 2006).
Третій етап дії статинів потребує тривалого лікування (≥4 років). Це етап досягнення основної стратегічної мети терапії: зниження частоти кардіальної та загальної смертності, запобігання розвитку серцево-судинних ускладнень.
Нарешті, є відомості про позитивний вплив статинів на некардіальну патологію. Так, у процесі лікування пацієнтів із цукровим діабетом II типу відзначено сприятливу дію симвастатину не лише на розвиток серцево-судинних ускладнень, але й на перебіг основного захворювання. У хворих, які приймали статини, відзначене зниження частоти розвитку цукрового діабету. Перспективно виглядає інформація про застосування статинів для лікування та профілактики хвороби Альцгеймера і судинної деменції. У пацієнтів похилого віку застосування статинів призводило до зменшення вираженості остеопорозу і частоти переломів кісток. Є дані про використання імуномодулюючої дії статинів у трасплантології. Описані позитивні результати застосування симвастатину при біліарному цирозі печінки, а також для розчинення конкрементів ХС у жовчному міхурі.
На сьогодні визначені цільові рівні показників загального ХС і ХС ЛПНЩ, досягнення яких у процесі лікування вірогідно супроводжується зниженням частоти серцево-судинних ускладнень і поліпшенням прогнозу. Для пацієнтів з ІХС ці рівні становлять <4,5 ммоль/л (175 мг/дл) для загального ХС і <2,5 ммоль/л (96 мг/дл) для ХС ЛПНЩ. Відповідно до Європейських рекомендацій з профілактики серцево-судинних захворювань аналогічні рівні загального ХС і ХС ЛПНЩ доцільно підтримувати у пацієнтів, які мають еквіваленти ІХС і високий багатофакторний ризик розвитку серцево-судинних ускладнень — >5% протягом 10 років.
За даними метааналізу Cholesterol Treatment Trialists’ Collaborators (CTT) зниження ХС ЛПНЩ на 1 ммоль/л під впливом терапії статинами дозволяє знизити смертність від ІХС на 19%, частоту нефатального ІМ на 26%, потребу в хірургічних втручаннях >20% (рис. 3.14).
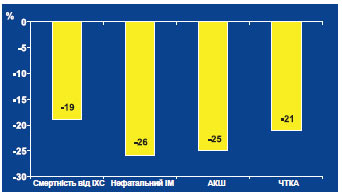
Рис. 3.14. Зниження ризику серцево-судинних подій при зниженні ХС ЛПНЩ на 1 ммоль/л при лікуванні статинами. Результати метааналізу Cholesterol Treatment Trialists’ Collaborators (CTT)
Дози статинів, рекомендовані для лікування хворих на стабільну стенокардію, встановлені на підставі результатів клінічних досліджень, у яких доведена ефективність препаратів щодо зниження смертності та нефатальних ускладнень. Для хворих на стенокардію добові дози становлять: симвастатин — 20–40 мг; правастатин — 40 мг; аторвастатин — 10–20–80 мг.
У ряді клінічних досліджень виявлені переваги аторвастатину у високих дозах (80 мг/добу) порівняно з низькими (10 мг/добу) відносно ризику серцево-судинних ускладнень. Так, у дослідженні TNT частота основних ускладнень (коронарна смерть, фатальний і нефатальний ІМ, фатальний і нефатальний інсульт) становила 8,7% у хворих, які приймали аторвастатин в дозі 80 мг, і 10,9% — у пацієнтів, що приймали препарат в дозі 10 мг. Таким чином, призначення аторвастатину у високих дозах порівняно з низькими приводило до зниження відносного ризику розвитку основних серцево-судинних ускладнень на 22% (р<0,001). Підвищення дози аторвастатину до максимальної (80 мг/добу) не супроводжувалося підвищенням частоти таких побічних реакцій, як міопатія, міалгія. Разом з тим застосування аторвастатину у високих дозах підвищувало частоту печінкових реакцій з підвищенням активності сироваткових трансаміназ (з 0,2 до 1,2%; р<0,001). Тому застосування аторвастатину у високих дозах вважається доцільним у пацієнтів із високим ризиком, а також за умови значного підвищення рівня ХС, головним чином при тяжких спадкових формах дисліпідемії.
Терапія статинами характеризується досить високою безпекою і хорошою переносимістю. Найбільш частими побічними ефектами при прийомі статинів були диспептичні розлади (метеоризм, дискомфорт і біль у ділянці шлунка, нудота, запор, діарея). Як правило, зазначені явища посилювалися при підвищенні дози лікарського препарату. Досить рідкою (0,01–0,03%), але найбільш серйозною побічною реакцією, пов’язаною з дією статинів, є міопатія. Її клінічні прояви — міалгія, м’язова слабкість, судоми, підвищення рівня креатинкінази крові, рідше — лихоманка, дуже рідко — рабдоміоліз, міоглобінемія та ниркова недостатність. Тяжкі травми й оперативні втручання, виражена артеріальна гіпотензія, тяжкі інфекційні захворювання і метаболічні розлади, неконтрольовані судоми та існуюча ниркова недостатність належать до факторів, що підвищують ризик розвитку міопатії при застосуванні статинів. Ризик розвитку міопатії зростає також при одночасному застосуванні статинів з деякими іншими лікарськими засобами. Серед них найбільше значення мають фібрати, (наприклад гемфіброзил), препарати нікотинової кислоти, антибіотики групи макролідів (еритроміцин), антивірусні засоби — інгібітори протеаз (нефазодон), імунодепресанти, циклоспорин.
Статини метаболізуються за участю системи печінкових цитохромів Р450. Ряд лікарських засобів (аміодарон, верапаміл, лідокаїн, тарфенадин, лоратадин, діазепам, барбітурати, циметидин, рифампіцин та ін.) і деякі харчові продукти (грейпфрутовий сік) впливають на активність печінкових цитохромів, зокрема ізоферментів СYР 3А4 і СYР 2С9. Вони можуть значною мірою змінювати фармакологічні властивості статинів, їх біодоступність і тривалість дії, що слід враховувати при призначенні комбінованої, часто багатокомпонентної терапії.
Гепатотоксичну дію з підвищенням активності печінкових трансаміназ реєстрували у різних клінічних дослідженнях із застосуванням статинів з частотою 1–2%. Ці порушення частіше були безсимптомні й розвивалися протягом перших місяців лікування, при підвищенні дози препарату, у разі наявної хронічної патології печінки. Для запобігання можливій гепатотоксичній дії статини протипоказані пацієнтам з активними захворюваннями печінки, особам, які зловживають алкоголем, а також при стійкому безсимптомному підвищенні активності печінкових трансаміназ. До початку і в період лікування рекомендується контролювати лабораторні показники — рівень печінкових ферментів і креатинкінази. Підвищення активності печінкових ферментів більше ніж у 3 рази, а креатинкінази більше ніж в 10 разів порівняно з верхньою межею норми потребує відміни статинів, проведення відповідних лікувальних заходів і контролю лабораторних показників до їх повної нормалізації.
Серед інших побічних ефектів при застосуванні статинів відзначають:
- порушення сну;
- запаморочення;
- головний біль;
- алергічні реакції.
Таким чином, на сьогодні існують докази позитивного впливу статинів і омега-ПНЖК на прогноз ІХС. Інші гіполіпідемічні засоби за результатами клінічних досліджень не мають вірогідного впливу на прогностичні показники.
Похідні фіброєвої кислоти чи фібрати характеризуються позитивним впливом на ліпідний обмін, особливо при гіпертригліцеридемії, зниженні показників ХС ЛПВЩ, у пацієнтів з метаболічним синдромом і цукровим діабетом II типу. Вони мають складний механізм дії з впливом на синтез і катаболізм ліпідів, збагачених ТГ. Він полягає у стимуляції ядерних рецепторів, які активуються проліфератором пероксисом (PАПП). Фібрати — прямі ліганди підтипу α РАПП. Активовані РАПП регулюють генну експресію синтезу апо АІ і апо АII, основних білків ЛПВЩ. За рахунок активації синтезу ензиму ліпопротеїнліпази РАПП підвищують катаболізм ліпідних комплексів, збагачених ТГ. Вплив фібратів на обмін ХС ЛПНЩ багатогранний і залежить від функціональної активності ЛПНЩ-рецепторів і концентрації ТГ. Зокрема, при дисліпідемії IIВ типу за класифікацією Фредриксона у пацієнтів з гіпертригліцеридемією нерідко відзначають помірно підвищений або навіть нормальний рівень ЛПНЩ, проте зростає субпопуляція частинок малого розміру, підвищеної щільності, збагачених апо В, тобто тих, які мають підвищену атерогенність. В експериментальних і клінічних дослідженнях фібрати сприяли зниженню концентрації таких атерогенних частинок, а також підвищували афінність клітинних рецепторів до ЛПНЩ. Фібрати нормалізують метаболізм жирних кислот шляхом експресії комплексу генів, що забезпечують їх природне мітохондріальне окиснення. Внаслідок цього в крові знижується концентрація вільних жирних кислот, які є субстратом для синтезу ТГ.
Разом з тим, для фібратів виявлені суперечливі дані щодо впливу на кардіальну смертність і можливе підвищення некардіальної смертності, які потребують подальшого вивчення та уточнення. У зв’язку з цим застосування фібратів, як і інших гіполіпідемічних препаратів та їх комбінацій зі статинами, рекомендовано для лікування виражених порушень ліпідного обміну, а також для досягнення цільового рівня ХС у хворих з дуже високим ризиком, визначеним як щорічна смертність >2%. Як показання для фібратів і препаратів нікотинової кислоти розглядаються особливі варіанти дисліпідемій зі зниженням ХС ЛПВЩ і підвищенням ТГ. Фібрати мають певні переваги перед нікотиновою кислотою при лікуванні дисліпідемії такого типу у пацієнтів з цукровим діабетом, що зумовлено відсутністю впливу на рівень глюкози крові.
Фібрати значно знижують рівень ТГ (на 40–50%) і здатні підвищити ХС ЛПВЩ на 10–20%, за деяким даними — до 30%. У класичному дослідженні VA-HIT з використанням гемфіброзилу продемонстроване достовірне зменшення кількості кардіальних ускладнень у чоловіків з практично нормальним рівнем ХС ЛПНЩ і низьким — ХС ЛПВЩ. Вважається, що позитивні результати терапії гемфіброзилом пов’язані з підвищенням рівня ХС ЛПВЩ.
Для монотерапії фібратами розвиток міопатії не характерний, але як вище зазначалось, комбіноване застосування фібратів і статинів може підвищувати ризик розвитку цього серйозного ускладнення, ймовірно, в результаті взаємодії препаратів на спільному етапі метаболізму (глюкуронізація). Для фенофібрату, одного з найпоширеніших препаратів-фібратів, подібна взаємодія не характерна, і при одночасному застосуванні статинів в середніх терапевтичних дозах з фенофібратом виникнення міопатії є малоймовірним.
Протипоказання до призначення фібратів — порушення функції печінки та нирок, а також жовчнокам’яна хвороба.
Найбільш частим побічним ефектом фібратів є диспепсії, частота яких у різних дослідженнях досягала 5%. До більш тяжких небажаних реакцій при прийомі фібратів належить холестаз, підвищення активності печінкових трансаміназ у сироватці крові, порушення функції печінки, описані окремі випадки панкреатиту.
Якщо адекватний контроль показників ліпідного спектра крові неможливий внаслідок непереносимості статинів у високих дозах, перспективним вважають застосування статинів з езетимібом, новим препаратом, що блокує всмоктування ХС у кишечнику. Дотепер одержані обнадійливі результати застосування цієї комбінації. При призначенні статину і езитимібу в середніх дозах додаткове зниження рівня ХС і ХС ЛПНЩ становить 10–15%. Вплив подібних комбінацій лікарських препаратів на смертність і перебіг захворювання вивчаються.
Інгібітори ангіотензинперетворюючого ферменту (АПФ)
Донедавна основними показаннями для призначення інгібіторів АПФ були СН, АГ і цукровий діабет, перш за все при наявності супутньої АГ або мікроальбумінурії. Призначення інгібіторів АПФ хворим стабільною стенокардією з метою вторинної профілактики вивчали у трьох великих дослідженнях.
У дослідженні HOPE взяли участь пацієнти з ІХС, цукровим діабетом і високим ризиком серцево-судинних ускладнень, але без СН. Досліджуваний препарат — раміприл в дозі 10 мг/ добу, тривалість дослідження — 5 років.
У дослідження EUROPA були включені різні за ступенем ризику хворі на стабільну стенокардію без клінічних ознак СН. Досліджуваний препарат — периндоприл в дозі 8 мг/добу, тривалість дослідження — 4,2 року.
У дослідження PEACE включали пацієнтів зі стабільною стенокардією без СН. Досліджуваний препарат — трандолаприл в дозі 2–4 мг добу, тривалість спостереження — 4,8 року.
Дослідження НОРE і EUROPA продемонстрували зниження серцево-судинного ризику (кардіальна смерть, нефатальний ІМ) під впливом терапії інгібіторами АПФ на 26 і 20% відповідно (рис. 3.15).

Рис. 3.15. Результати дослідження EUROPA. Терапія периндоприлом впливала на прогноз пацієнтів з хронічною ІХС. Комбінований показник, що включав коронарну смерть + некардіальну смерть + нефатальний ІМ, на фоні прийому препарата знизився на 20%
За результатами РЕАСЕ зниження ризику було недостовірним і незначним (на 5%). Істотні відмінності, виявлені в зазначених дослідженнях, імовірно, відображають не стільки прогностичні впливи різних інгібіторів АПФ, скільки відмінності між їх учасниками. Так, у дослідженні PEACE показник річної смертності був низьким і становив 0,8%, а в дослідженні НОРE — 1,6%. Попередні реваскуляризаційні втручання проведені у 72% пацієнтів у РЕАСЕ і у 44% — у дослідженні НОРE. Середній рівень АТ був також нижчим у пацієнтів у дослідженні РЕАСЕ, ніж у двох інших. У всіх трьох дослідженнях значно відрізнялася базова терапія. Наприклад, гіполіпідемічні засоби одержували 70% пацієнтів у РЕАСЕ і лише 29% — у НОРE. Антитромботичні препарати — 96 і 76% відповідно. Таким чином, імовірно, що більш низький вихідний ризик серцево-судинних ускладнень і висока якість базової терапії учасників РЕАСЕ зумовили результати дослідження. Проте не виключено, що вплив на показники серцево-судинного ризику залежить і від фармакологічних особливостей кожного препарату.
Важливим підсумком усіх трьох наведених досліджень стало значне зниження частоти розвитку застійної СН на фоні терапії інгібіторами АПФ. Крім того, застосування раміприлу супроводжувалося істотним (до 32%) зменшенням кількості інсультів. Подібну тенденцію відзначали у дослідженні РЕАСЕ, різниця між групою трандолаприлу і плацебо становила 24%. Важливим компонентом терапевтичної дії інгібіторів АПФ у пацієнтів зі стабільною стенокардією дослідники вважають вплив на рівень АТ.
Призначення інгібіторів АПФ показано всім хворим на стабільну стенокардію з АГ, цукровим діабетом, СН, безсимптомною дисфункцією ЛШ.
При відсутності зазначеної супутньої патології призначення інгібіторів АПФ пацієнтам зі стабільною стенокардією рекомендовано з урахуванням оцінки співвідношення потенційної користі, з одного боку, і ризику побічних реакцій, вартості лікування — з іншої. Препаратами вибору для лікування хворих на стабільну стенокардію є інгібітори АПФ з доведеною ефективністю щодо даного показання і у відповідних дозах (раміприл 10 мг/добу; периндоприл 10 мг/ добу).
Блокатори β-адренорецепторів
У пацієнтів, які перенесли ІМ, застосування блокаторів β-адренорецепторів знижує ризик кардіальної смерті й повторного інфаркту на 30%. Призначення блокаторів β-адренорецепторів в гострий період ІМ має незначний вплив на показник смертності, тоді як тривале застосування цих препаратів знижує смертність хворих у середньому на 24%. Причому блокатори β-адренорецепторів, які мають внутрішню симпатоміметичну активність (ацебутолол) виявилися в цьому плані низькоефективними. Відсутні достатні докази впливу на смертність і для препарату атенолол, одного з найпоширеніших препаратів блокаторів β-адренорецепторів. Слід зазначити, що спеціально спланованих контрольованих досліджень щодо вивчення прогностичного впливу блокаторів β-адренорецепторів у хворих зі стабільною стенокардією не проводили.
Але з огляду на результати, одержані у пацієнтів, які перенесли ІМ, блокатори β-адренорецепторів були внесені у схему лікування стабільної стенокардії. Це відбулося тому, що дослідження блокаторів β-адренорецепторів у хворих з постінфарктним кардіосклерозом передували їх застосуванню при стабільній стенокардії. Надалі в найбільш масштабних дослідженнях блокаторів β-адренорецепторів за участю хворих на стабільну стенокардію — APSIS і ТIВЕТ — плацебо не використовували, виходячи з інтересів пацієнтів і неетичності відмови від активної терапії протягом тривалого часу. У дослідження APSIS було включено 809 учасників з клінічно підтвердженою стабільною стенокардією, період спостереження становив 3,4 року. За результатами дослідження верапаміл у лікарській формі з модифікованим вивільненням активної речовини (SR) 240–480 мг/добу і метопролол SR 100–200 мг/добу мали однакову ефективність щодо запобігання серцево-судинним ускладненням. Причому подальше, до 9 років, спостереження хворих APSIS підтвердило позитивний вплив лікування на прогноз, особливо у жінок без супутнього цукрового діабету. У дослідженні ТIВЕТ взяли участь 682 пацієнти зі стенокардією напруження, період спостереження — 2 роки. Результати лікування ніфедипіном у лікарській формі з уповільненим вивільненням (SR), 20–40 мг 2 рази на добу, і атенололом 50 мг 2 рази на добу, не відрізнялися. Переваги мала комбінована терапія із застосуванням обох препаратів, відзначали тенденцію до зниження частоти раптової смерті, нефатального інфаркту і нестабільної стенокардії. Подібні результати отримані в дослідженні IMAGE, в якому порівнювали ефективність метопрололу 200 мг/добу і ніфедипіну 40 мг/добу у 280 хворих на стабільну стенокардію. У всіх пацієнтів були позитивні проби з дозованим фізичним навантаженням. Обидва препарати підвищували толерантність до фізичного навантаження і тривалість його виконання, хоча метопролол — більшою мірою. Комбінована терапія виявилась більш ефективною, ніж лікування кожним препаратом окремо. У невеликому випробуванні ASIST брали участь пацієнти з ІХС, які на етапі до лікування мали незначну кількість або й зовсім не мали нападів стенокардії. Застосування у цих пацієнтів атенололу (100 мг/добу), на відміну від плацебо, продемонструвало позитивний вплив на комбіновані кінцеві точки, включаючи зменшення кількості нападів чи появу стенокардії. За даними добового моніторування ЕКГ атенолол зменшував кількість як больових, так і безбольових ішемічних епізодів. У дослідженні TIBBS порівнювали ефективність бізопрололу і ніфедипіну (лікарська форма з уповільненим вивільненням активної речовини) у 330 хворих на стабільну стенокардію. У всіх учасників дослідження були ЕКГ-позитивні результати проб з дозованим фізичним навантаженням і більше 2 епізодів ішемії міокарда протягом 48-годинного холтерівського моніторування. Бізопролол призначали в дозі 10 мг/добу протягом перших 4 тиж і по 20 мг — в наступні 4 тиж. Ніфедипін призначали по 20 і 40 мг 2 рази на добу. Тривалість загального спостереження становила 1 рік. Бізопролол виявився більш ефективним щодо запобігання серцево-судинним ускладненням, таким як кардіальна смерть, гострий ІМ та госпіталізація з приводу нестабільної стенокардії. Частота ускладнень становила 22,1% у групі бізопрололу і 33,1% — у групі ніфедипіну (р=0,033). Всі ці дані підтверджують антиангінальну ефективність блокаторів β-адренорецепторів, хоча й не надають достатніх доказів щодо покращання прогнозу у хворих на стабільну стенокардію.
Три препарати групи блокаторів β-адренорецепторів — метопролола сукцинат, бізопролол і карведилол — продемонстрували позитивний вплив на показники виживаності й перебігу захворювання у пацієнтів із ХСН. Застосування небівололу сприяло поліпшенню прогнозу при ХСН у хворих похилого віку (старше 70 років).
Блокатори кальцієвих каналів
Препарати фармакологічної групи блокаторів кальцієвих каналів, які знижують ЧCC, здатні поліпшувати прогноз пацієнтів після перенесеного ІМ, що виявлено в дослідженні DAVIT II з верапамілом, а також у підгрупі хворих без ознак СН у дослідженні MDPIT з дилтіаземом. У дослідженні INTERCEPT відзначали тенденцію до зниження серцевої смертності, нефатального повторного інфаркту та рефрактерної ішемії міокарда, а також істотне зниження потреби у проведенні реваскуляризаційних втручань у хворих після ІМ при застосуванні дилтіазему порівняно з плацебо. Блокатори кальцієвих каналів — ефективні антигіпертензивні засоби, проте вони можуть підвищувати ризик розвитку СН. У хворих на стабільну стенокардію не підтверджена прогностична ефективність дигідропіридинових блокаторів кальцієвих каналів. Застосування дигідропіридинових блокаторів кальцієвих каналів короткої дії не лише не запобігало ускладненню ІХС, але, навпаки, при використанні у високих дозах (ніфедипін >40 мг/добу) спричиняло їх появу. Це викликало в середині 90-х років ХХ ст. активну дискусію, що закінчилася визнанням, що систематичне застосування вазодилататорів з короткою тривалістю дії, включаючи дигідропіридинові блокатори кальцієвих каналів, може негативно впливати на прогноз пацієнтів з ІХС і протипоказано при цій патології. Разом з тим, для симптоматичного лікування стабільної стенокардії за необхідності можна призначати дигідропіридинові блокатори кальцієвих каналів у вигляді препаратів і лікарських форм тривалої дії, включаючи лікарські форми ніфедипіну. Причому їх застосування за даними деяких досліджень не тільки поліпшувало клінічні показники, але й супроводжувалося позитивними тенденціями щодо зниження ризику розвитку серйозних серцево-судинних ускладнень, як, наприклад застосування амлодипіну в 2-річному дослідженні CAMELOT, що включало 1991 хворого на стабільну стенокардію. Проте результати, отримані в CAMELOT, не були статистично достовірними.
Таким чином, переконливих доказів на користь застосування блокаторів кальцієвих каналів для поліпшення прогнозу хворих на стабільну стенокардію на сьогодні немає. Блокатори кальцієвих каналів, які знижують ЧСС, можна розглядати як альтернативу блокаторам β-адренорецепторів при непереносимості чи наявності протипоказань до застосування останніх у хворих з постінфарктним кардіосклерозом, але без СН. У деяких пацієнтів блокатори кальцієвих каналів можуть погіршувати перебіг захворювання.
Рекомендації щодо фармакотерапії з метою поліпшення прогнозу у хворих на стабільну стенокардію
Для поліпшення прогнозу хворих на стабільну стенокардію (зниження смертності й частоти нефатальних серцево-судинних ускладнень) рекомендується призначення таких лікарських засобів (клас I, рівень доказовості А):
- АCК 75–100 мг 1 раз на добу — всім пацієнтам без протипоказань до її призначення.
- Статини — всім пацієнтам із підтвердженою ІХС, при відсутності протипоказань.
- Інгібітори АПФ (за відсутності протипоказань) — пацієнтам з такими супутніми захворюваннями: АГ, застійна СН, безсимптомна дисфункція ЛШ, перенесений ІМ з дисфункцією ЛШ, цукровий діабет.
- Блокатори β-адренорецепторів — всім пацієнтам, особливо з постінфарктним кардіосклерозом або СН, при відсутності протипоказань.
У хворих на стабільну стенокардію без супутньої патології інгібітори АПФ мають більш низький рівень доказовості щодо впливу на прогноз (клас IIа, рівень В). Застосування клопідогрелу можна розглядати як альтернативну антитромботичну терапію у пацієнтів з непереносимістю ацетилсаліцилової кислоти. Статини у високих дозах можуть бути рекомендовані пацієнтам з підтвердженим діагнозом ІХС і дуже високим ризиком серцево-судинних ускладнень (ризик серцево-судинної смертності >2% на рік).
Загальна концепція ведення хворих зі стабільною стенокардією представлена у вигляді мнемонічної схеми на рис. 3.16.

Рис. 3.16. Препарати, які поліпшують прогноз у пацієнтів з атеросклерозом (А) та ІХС, — мнемонічна схема АІБС: А — аспірин, І — інгібітори АПФ, Б — блокатори β-адренорецепторів, С — статини. ЦД — цукровий діабет, ДФН — дозоване фізичне навантаження. У % зазначено зниження ризику серцево-судинних ускладнень
За особливими показаннями (клас II в — рівні доказовості В і С) можна призначати фібрати — хворим із низьким рівнем ХС ЛПВЩ і гіпертригліцеридемією за наявності цукрового діабету чи метаболічного синдрому, а також фібрати чи нікотинову кислоту в комбінації зі статинами хворим дуже високого ризику з низьким рівнем ХС ЛПВЩ і гіпертригліцеридемією.
Антиангінальна терапія
Симптоми стенокардії та ознаки ішемії міокарда, в тому числі її безбольової форми, можуть бути усунуті за допомогою лікарських засобів, що зменшують потребу міокарда в кисні і/або збільшують кровотік в ішемізованій ділянці. До антиангінальних препаратів належать блокатори β-адренорецепторів, блокатори кальцієвих каналів та органічні нітрати.
Органічні нітрати
Нітрати використовують у клінічній практиці понад 100 років. Призначення нітрогліцерину для купірування нападів стенокардії практикується з 1879 р. Основними представниками групи органічних нітратів є гліцеролу тринітрат (нітрогліцерин), ізосорбіду динітрат й ізосорбіду мононітрат. Останній є природним активним метаболітом ізосорбіду динітрату. У всіх препаратів групи органічних нітратів однаковий механізм дії, вони належать до ендотелійнезалежних вазодилататорів. Антиангінальний ефект нітратів реалізується за рахунок зниження потреби міокарда у кисні та поліпшення перфузії міокарда. Органічні нітрати діють шляхом вивільнення оксиду азоту (NO) — речовини, що є аналогом ендотелійзалежного релаксуючого фактора. NO активує гуанілатциклазу, в результаті чого утворюється цГМФ, що має властивість розслабляти гладком’язові клітини судин.
Вазодилатація, основний гемодинамічний ефект нітратів, має дозозалежний характер. При призначенні у низьких дозах нітропрепарати викликають розширення переважно венозних судин. Це призводить до депонування крові у венозному руслі та зниження переднавантаження на серце (перевантаження об’ємом). Зменшення притоку крові до серця за рахунок зазначеного механізму веде до зниження тиску в камерах серця, зокрема кінцево-діастолічного тиску в порожнині ЛШ і зниження систолічного напруження його стінок. Внаслідок цього потреба міокарда в кисні зменшується, а його перфузія покращується, особливо в субендокардіальних ділянках, що має важливе значення у пацієнтів з ІХС. При застосуванні високих доз препарати цієї групи впливають переважно на великі артерії, включаючи коронарні судини серця. Нітрати здатні запобігати і купірувати ангіоспазм коронарних артерій. Вони перерозподіляють коронарний кровоток до ішемізованих ділянок міокарда. Селективна дилатація саме великих коронарних судин — важливий чинник оптимізації міокардіального кровотоку в зонах ішемії. Слід зазначити, що малі/резистивні судини в цих ділянках і так максимально розширені завдяки аденозинопосередкованим компенсаторним механізмам ауторегуляції. Зазначений вплив нітратів на коронарне русло відрізняється від дії деяких інших вазодилататорів, наприклад дипіридамолу. Останній розслабляє артерії як великого, так і малого калібру, викликаючи перерозподіл коронарного кровотоку в ділянки міокарда, що не зазнали ішемії, і протидіє ауторегуляторним механізмам усунення ішемії, за рахунок чого можливий розвиток феномена «коронарного обкрадання». Органічні нітрати знижують рівень АТ.
Незважаючи на універсальність фармакологічного механізму дії органічних нітратів, між представниками цієї групи є істотні відмінності. Фармакологічні особливості характерні не лише для окремих нітратів, але й для різних лікарських форм цих препаратів. Найважливіші фармакологічні характеристики нітратів — біодоступність (% активної речовини, що надходить у системний кровообіг) і період напіввиведення. Нітрогліцерин — ліпофільна речовина, має дуже короткий період напіввиведення (1,0–4,4 хв) і характеризується широким діапазоном індивідуальної біодоступності при абсорбції в ШКТ, оскільки піддається активному метаболізму при первинному проходженні через печінку. Тому найчастіше використовують сублінгвальні/букальні лікарські форми нітрогліцерину, у яких активна речовина швидко і практично повністю абсорбується зі слизової оболонки порожнини рота і надходить у системний кровотік, минаючи печінку. Відсутність пресистемного печінкового метаболізму забезпечує швидке досягнення ефективної концентрації препарату в плазмі крові. Нітрогліцерин призначають у формі сублінгвальних таблеток, желатинових капсул або аерозолів. Препарат руйнується при контакті з повітрям, тому відкриту упаковку з таблетками не можна зберігати понад 30 днів. Термін зберігання нітрогліцерину у формі аерозолю більш тривалий. Існують лікарські форми нітрогліцерину для трансдермального застосування (пластири, диски). Використання подібних лікарських форм дозволяє пацієнтові самому регулювати час дії препарату. Ізосорбіду динітрат після абсорбції в ШКТ піддається активному метаболізму в печінці. Його основними метаболітами є ізосорбід-2-мононітрат та ізосорбід-5-мононітрат, останній має більш високу фармакологічну активність. Період напіввиведення ізосорбіду динітрату становить 1,1–1,3 г, біодоступність — 20–25% при прийомі всередину і до 59% — при сублінгвальному прийомі. Як правило, ізосорбіду динітрат призначають 2–4 рази на добу. Гідрофільний ізосорбід-5-мононітрат має найбільш тривалий серед нітратів час дії (період напіввиведення — 4,1–4,9 г) і високу біодоступність (до 90–100%) при пероральному прийомі. Препарат випускають у кількох лікарських формах, деякі з них розраховані на прийом 1 раз на добу.
Залежно від зазначених фармакологічних характеристик короткодіючі нітрати показані для купірування нападів стенокардії, тоді як препарати тривалої дії використовують для профілактики їх виникнення. Кількісні показники потреби у прийомі нітрогліцерину можуть служити простим і надійним критерієм ефективності антиангінальної терапії із застосуванням інших лікарських засобів.
Органічні нітрати застосовують для лікування практично всіх форм ІХС, в тому числі стабільної та вазоспастичної стенокардії. Наявність клінічного синдрому стенокардії залишається основним показанням для включення нітратів у схему лікування цих пацієнтів. Висока антиангінальна ефективність дозволяє використовувати нітрати для профілактики та усунення ангінальних нападів у хворих на стабільну стенокардію напруження. Після прийому нітропрепаратів значно зменшується кількість нападів стенокардії та підвищується толерантність до фізичного навантаження, включаючи тривалість виконання навантаження до появи болю і/або ішемічних змін на ЕКГ. Лише 10% хворих на стабільну стенокардію не відповідають на прийом нітратів і ще у 10% розвиваються побічні ефекти, що потребують їх відміни. Загалом антиангінальна ефективність органічних нітратів відповідає ефективності блокаторів β-адренорецепторів і блокаторів кальцієвих каналів. Позиція щодо застосування нітратів як симптоматичної терапії нападів стенокардії відображена у вітчизняних і міжнародних рекомендаціях щодо лікування ІХС. Прогностичне значення нітратів, їх вплив на смертність і перебіг ІХС досі не доведені. Це пов’язано не тільки з суперечливими результатами наявних клінічних досліджень, але і з тим, що на сьогодні не проведені рандомізовані проспективні дослідження з об’єктивізації такого впливу, зокрема для хворих на стабільну стенокардію. Разом з тим, NO, основний ефекторний субстрат нітратів, забезпечує такі важливі фізіологічні функції, як регуляція судинного тонусу і антикоагулянтних властивостей крові, вплив на адгезію лейкоцитів, проліферацію гладком’язових клітин судин та апоптоз. Існують експериментальні докази антиатеросклеротичної дії NO. В експериментах нітрати нормалізували ендотеліальную функцію, зменшували ураження інтими судин і перешкоджали оксидації ЛПНЩ.
Протипоказання до призначення нітратів — підвищена чутливість до них, шок, гострий ІМ з низьким тиском наповнення ЛШ, артеріальна гіпотензія (САТ <90 мм рт. ст.), токсичний набряк легень, крововилив у мозок або недавно перенесена черепно-мозкова травма (у зв’язку з можливістю підвищення тиску спинномозкової рідини), закритокутова форма глаукоми, тяжка анемія.
Відносні протипоказання до призначення нітратів — обструктивна форма ГКМП і виражений аортальний стеноз. Разом з тим з появою у цих хворих синдрому стенокардії нітрогліцерин може бути корисним для його усунення.
Відсутність доказів позитивного впливу на прогноз і перебіг ІХС робить недоцільним застосування нітратів у хворих без стенокардії. За цією ж причиною немає підстав призначати нітрати пацієнтам з підозрою чи факторами ризику ІХС.
Взаємодія нітратів з іншими лікарськими засобами. Принципове значення має взаємодія органічних нітратів з інгібіторами ФДЕ, зокрема із сильденафілом, оскільки використання подібної комбінації може викликати потенційно небезпечну артеріальну гіпотензію. Застосування сильденафілу можливе лише за умови, як мінімум, 24-годинної перерви після прийому нітратів, включаючи нітрогліцерин. Посилення гіпотензивної дії відзначають при поєднані нітратів з барбітуратами, опіоїдними анальгетиками, трициклічними антидепресантами, алкоголем, а також іншими засобами, що знижують АТ.
Ослаблення вазодилататорного ефекту можливо при одночасному застосуванні органічних нітратів з карбахоліном, норепінефрином, фенілефрином, гістаміном, ангіотензином, ГКС, стимуляторами ЦНС, М-холіноблокаторами (атропіном). Фенобарбітал активує печінковий метаболізм нітратів, що може значно зменшити їх біодоступність в лікарських формах для перорального застосування.
Однією з основних проблем, пов’язаних з тривалим застосуванням нітратів, є розвиток толерантності. Толерантністю до нітратів вважають зниження клінічної ефективності лікарського засобу при регулярному його застосуванні. Дані про те, що ефективність нітратів може знижуватися, з’явилися ще наприкінці ХIХ ст., коли нітрати лише почали використовувати у клінічній практиці. Тривалий час висловлювали сумніви щодо клінічного значення цього феномену. Разом з тим регулярна терапія нітратами у ряді випадків супроводжується послабленням або повним зникненням їх клінічної дії та гемодинамічних ефектів. Механізм цього явища повністю не з’ясований. Існуючі гіпотези пояснюють розвиток толерантності зниженням концентрації сульфгідрильних (SH-) радикалів, активацією РААС, підвищенням внутрішньосудинного об’єму у зв’язку з порушенням трансваскулярного градієнта Старлінга, утворенням вільних радикалів, підвищенням деградації оксиду азоту.
Розвиток толерантності до нітратів значною мірою варіює у різних пацієнтів. Наприклад, постійний прийом звичайних таблеток ізосорбіду динітрату по 10–20 мг 4 рази на добу протягом 1 міс супроводжується повною втратою антиангінального ефекту у 10–15% хворих на стабільну стенокардію; у 60–70% пацієнтів ефективність лікарського засобу істотно знижується і у інших 10–15% хворих ефективність препарату залишається стабільною.
Для запобігання розвитку толерантності рекомендується режим призначення нітратів з обов’язковим «вільним від нітратів» проміжком часу протягом доби. Вважається, що для запобігання розвитку толерантності цілком достатньо «безнітратного» періоду тривалістю 8–12 год на добу.
Для нітратів характерні дозозалежні побічні ефекти, пов’язані з вазодилатацією. Найчастіше це головний біль, гіперемія шкіри обличчя, запаморочення. У деяких хворих головний біль носить виражений характер і є основною причиною відмови від прийому препаратів. В окремих випадках головний біль має минущий характер і зникає, незважаючи на продовження терапії. Антиангінальний ефект при цьому зберігається. Можливі ортостатична гіпотензія та рефлекторна активація симпатичного відділу вегетативної нервової системи з розвитком тахікардії та появою парадоксальної стенокардії. Дуже рідко прийом нітратів супроводжувався розвитком синкопальних станів.
Блокатори β-адренорецепторів
Блокатори β-адренорецепторів мають високу антиангінальну ефективність. Механізм дії блокаторів β-адренорецепторів полягає в конкурентній взаємодії з відповідним рецепторним апаратом (β1- і β2-адренорецепторами). Блокада β1-адренорецепторів призводить до зниження ЧСС і зменшення скоротності міокарда. Обидва ці ефекти зменшують потребу міокарда в кисні та сприяють попередженню ішемії. Препарати цієї групи знижують ЧСС як у стані спокою, так і при фізичному навантаженні. Виняток становлять блокатори β-адренорецепторів з частковою агоністичною активністю, для яких характерне зниження ЧСС переважно під час фізичних навантажень. Позитивний вплив блокаторів β-адренорецепторів на перфузію ішемізованого міокарда пов’язаний з подовженням діастоли тобто періоду перфузії) за рахунок зниження ЧСС, а також з перерозподілом коронарного кровотоку внаслідок підвищення судинного опору в неішемізованих ділянках. Блокатори β-адренорецепторів — препарати першого ряду для лікування пацієнтів з АГ. Вони зменшують збудливість міокарда, підвищують поріг фібриляції шлуночків серця під час ішемії, перешкоджають розвитку аритмії. Відомо, що блокатори β-адренорецепторів мають універсальну антиішемічну дію і запобігають виникненню як больових, так і безсимптомних епізодів ішемії. Доведена ефективність блокаторів β-адренорецепторів у запобіганні нападів стенокардії/ішемії, викликаної фізичними навантаженнями.
Блокатори β-адренорецепторів розрізняють за селективністю взаємодії з β1-адренорецепторами, за тривалістю дії, за наявністю внутрішньої симпатоміметичної активності та додаткових властивостей (наприклад здатності викликати вазодилатацію). Незважаючи на практично однакову антиангінальну ефективність різних блокаторів β-адренорецепторів, у сучасній клінічній практиці перевагу віддають кардіоселективним препаратам. Це зумовлено тим, що саме блокада β1-адренорецепторів перешкоджає системному впливу симпатичного нейротрансмітера норадреналіну, що забезпечує основний антиангінальний ефект. Кардіоселективність сприяє зниженню частоти побічних ефектів, забезпечує кращу переносимість і безпеку тривалого лікування, особливо при супутній патології. Найчастіше використовують метопролол, атенолол, бізопролол. За необхідності можливе застосування інших блокаторів β-адренорецепторів — бетаксололу, карведилолу, небівололу. Для ефективної терапії має значення тривалість дії препарату. Бізопролол і бетаксолол завдяки особливостям фармакокінетики мають тривалий період напіввиведення, їх можна призначати 1 раз на добу, як і деякі лікарські форми метопрололу з уповільненим вивільненням активної речовини. Атенолол, з урахуванням його періоду напіввиведення (6–9 год) доцільно застосовувати 2 рази на добу. При підвищенні дози може зростати тривалість дії препарату, що необхідно враховувати при виборі режиму дозування. Стандартними антиангінальними дозами блокаторів β-адренорецепторів вважають:
- для атенололу — 100 мг 1 раз на добу або 50 мг 2 рази на добу;
- для бетаксололу — 20 мг 1 раз на добу;
- для бізопрололу — 10 мг 1 раз на добу;
- для метопрололу (лікарські форми тривалої дії) — 100–200 мг 1 раз на добу.
Основні фармакологічні особливості блокаторів β-адренорецепторів наведені в табл. 3.10.
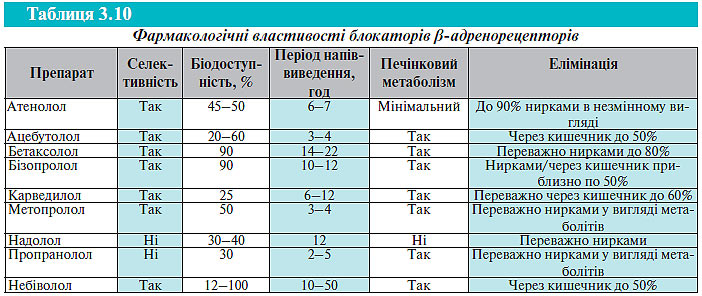
Доза блокаторів β-адренорецепторів визначається негативним хронотропним ефектом препарату. При лікуванні стабільної стенокардії найпростішим клінічним критерієм оптимальної фармакологічної дії лікарського засобу є зниження ЧСС в стані спокою до 55–60 уд./хв. Блокатори β-адренорецепторів обмежують підвищення ЧСС і під час фізичних навантажень. У зв’язку з цим оптимальна доза препарату має сприяти підтримці ЧСС при фізичній активності на рівні до 75% порогової, тобто тієї, яка пов’язана з появою стенокардії. Вираженість блокади β-адренорецепторів можна оцінювати за результатами тестів з дозованим фізичним навантаженням. Ефективність антиангінальної терапії з використанням блокаторів β-адренорецепторів вважається достатньою при умові підвищення толерантності до фізичного навантаження і зменшення кількості нападів стенокардії та потреби в прийомі нітратів короткої дії (нітрогліцерин) для їх купірування.
Погіршення клінічної симптоматики під впливом блокаторів β-адренорецепторів можливе у осіб із вазоспастичною стенокардією (рис. 3.17а–в).

Рис. 3.17. Вазоспастична реакція при проведенні проби з дозованим фізичним навантаженням на фоні застосування блокатора β-адренорецепторів у пацієнта зі стенокардією Принцметала: а)ВЕМ-проба без препарата (100 Вт): ST-депресія 1,0–1,5 мм, стенокардія; б) «гострий» тест з 40 мг пропранололу (50 Вт): елевація сегмента ST, стенокардія; в) «гострий» тест з 20 мг ніфедипіну (150 Вт): ЕКГ без патологічних змін, стенокардія відсутня
Побічні ефекти, характерні для блокаторів β-адренорецепторів — похолодіння кінцівок і симптоматична брадикардія, що може супроводжуватися запамороченням, рідше — артеріальна гіпотензія. Можлива поява чи посилення респіраторних симптомів (задишка), особливо у пацієнтів із БА/ХОХЛ. Кардіоселективні засоби в цих випадках мають певні переваги. Проте кардіоселективність — відносна характеристика — залежить від дози препарату, тобто зменшується або зникає при її підвищенні. Блокатори β-адренорецепторів можуть викликати слабкість і підвищену стомлюваність, проте, за результатами клінічних досліджень лише 0,4% хворих були змушені припинити лікування з цієї причини. Серед інших побічних реакцій реєстрували порушення AV-провідності, появу/посилення симптомів СН, головний біль, рідко — відчуття тривоги, дистимію, порушення сну, сплутаність свідомості (особливо у пацієнтів похилого віку). В літературі обговорюється питання про ризик виникнення депресій при призначенні блокаторів β-адренорецепторів. Проте переконливих доказів такого ризику на сьогодні немає. Описані випадки впливу блокаторів β-адренорецепторів на показники ліпідного обміну, зокрема підвищення рівня ТГ, але говорити про клінічне значення подібних змін немає підстав. Блокатори β-адренорецепторів можуть провокувати появу чи загострення псоріазу, алергічних реакцій. Порушення сексуальної функції при застосуванні блокаторів β-адренорецепторів реєстрували з частотою 5/1000 пацієнто-років.
Загалом з урахуванням профілю побічних реакцій блокатори β-адренорецепторів відрізняються хорошою переносимістю, а за впливом на якість життя не відрізняються від інших антиангінальних засобів. Наприклад, у дослідженні APSIS оцінки якості життя, з огляду на побічні реакції, при прийомі метопрололу і верапамілу були аналогічними.
Протипоказаннями до призначення блокаторів β-адренорецепторів є: підвищена чутливість до цих препаратів, передсердно-шлуночкова блокада II–III ступеня, синдром слабкості синусного вузла, брадикардія (ЧСС у спокої до початку лікування <50 уд./хв), артеріальна гіпотензія (САТ <90 мм рт. ст.), БА, розлади периферичного кровообігу пізніх стадій, одночасне застосування інгібіторів МАО.
При наявності хронічних захворювань легень і бронхів застосування блокаторів β-адренорецепторів потребує обережності, необхідно використовувати кардіоселективні засоби. Цукровий діабет не є протипоказанням для призначення блокаторів β-адренорецепторів, але слід враховувати, що препарати здатні модифікувати дію гіпоглікемізуючих засобів (особливо інсуліну) і маскувати ознаки гіпоглікемії (тремор, тахікардію).
При раптовому припиненні терапії блокаторами β-адренорецепторів можливий розвиток синдрому відміни, що проявляється тахікардією, появою чи посиленням симптомів стенокардії/ішемії, негативною динамікою ЕКГ, підвищенням рівня АТ. В крайніх випадках можливі такі серйозні серцево-судинні ускладнення, як ІМ і навіть раптова смерть. Розвиток синдрому відміни тим імовірніший, чим тривалішим був період лікування і вищою доза препарату. Як правило, синдром відміни виникає протягом 1-го тижня після припинення лікування, але можливий його розвиток у більш пізні строки, до 21-го дня. Імовірним механізмом, відповідальним за розвиток синдрому відміни, вважають підвищення щільності β-адренорецепторів і активацію вивільнення катехоламінів на фоні прийому блокаторів β-адренорецепторів. Ще один механізм може бути пов’язаний з тим, що блокатори β-адренорецепторів пригнічують секрецію реніну шляхом впливу на β-адренорецептори нирок. Тому раптова відміна блокаторів β-адренорецепторів може викликати гіперренінемію з подальшим підвищенням АТ. При синдромі відміни відзначають підвищення агрегації тромбоцитів і посилення вивільнення тромбоксану А2, що може провокувати ішемічні реакції. Тому відміну блокаторів β-адренорецепторів слід проводити поступово, під лікарським контролем, з урахуванням індивідуальних реакцій пацієнта. Для безпечної відміни в середньому вважається достатнім 2-тижневий період, протягом якого поступово знижують дозу препарату, але цей період може значно варіювати залежно від індивідуальних особливостей хворого.
Взаємодія з іншими лікарськими засобами. Не рекомендуються та потребують особливої обережності комбінації блокаторів β-адренорецепторів з недигідропіридиновими блокаторами кальцієвих каналів (верапамілом, дилтіаземом, бепрідилом) у зв’язку з посиленням негативного впливу на скоротність міокарда, АV-провідність і рівень АТ. Препарати, що містять клонідин, резерпін, альфа-метилдопу, не слід призначати одночасно з блокаторами β-адренорецепторів, з огляду на можливість значного зниження ЧСС. Потребує ретельного медичного контролю одночасне застосування блокаторів β-адренорецепторів і антиаритмічних препаратів, серцевих глікозидів. Застосування рентгенконтрастних йодовмісних засобів на фоні прийому блокаторів β-адренорецепторів підвищує ризик розвитку рефрактерних анафілактичних реакцій. Циметидин може знизити кліренс блокаторів β-адренорецепторів, які метаболізуються в печінці, і, відповідно, підвищити їх концентрацію у крові. Терапевтичні ефекти блокаторів β-адренорецепторів можуть знижуватися при одночасному застосуванні з ксантинами (амінофіліном і теофіліном).
Блокатори кальцієвих каналів
Блокатори кальцієвих каналів — неоднорідна група препаратів, що виявляють антигіпертензивну й антиангінальну дію. Основа фармакологічної активності блокаторів кальцієвих каналів — здатність блокувати транспорт іонів кальцію в клітину через потенціалзалежні (повільні) L-канали мембрани. Іони кальцію забезпечують взаємодію електричних і механічних процесів у кардіоміоцитах, гладком’язових клітинах і скелетних м’язах. У цих процесах бере участь внутрішньоклітинний кальцій і кальцій, що надходить ззовні. Для м’язового скорочення витрачається 85–90% внутрішньоклітинного і 10–15% кальцію, що надійшов у клітину через L-канали. М’язові клітини різних тканин мають різну потребу в позаклітинному кальції. Найбільш залежні від нього кардіоміоцити і гладком’язові клітини судинної стінки. Цим пояснюється відсутність істотного впливу препаратів групи блокаторів кальцієвих каналів на скелетні м’язи та незначний вплив на гладкі м’язи бронхів і ШКТ. Всі блокатори кальцієвих каналів виявляють досить виражений вазодилатуючий ефект, включаючи безпосередній вплив на коронарні артерії серця. Блокатори кальцієвих каналів, які знижують ЧСС (верапаміл і дилтіазем), спричиняють негативний інотропний ефект і уповільнюють АV-провідність. Основні фармакодинамічні властивості дигідропіридинових похідних (ніфедипін, амлодипін, фелодипін) пов’язані з системним вазодилатуючим ефектом. В терапевтичних дозах їх вплив на скоротність і провідну систему міокарда незначний. Крім того, вплив цих препаратів на скоротність міокарда врівноважується рефлекторною активацією симпатичного відділу вегетативної нервової системи, що проявляється підвищенням ЧСС. Вираженість цього ефекту визначається фармакологічними властивостями дигідропіридинового блокатора кальцієвих каналів. Згодом, незважаючи на прийом дигідропіридинових блокаторів кальцієвих каналів, ЧСС може повертатися до початкових значень. Проте ознаки симпатоадреналової активації в деяких випадках зберігаються у процесі лікування і створюють передумови для виникнення небажаних побічних реакцій.
Антагоністи кальцію тривалої дії (амлодипін) або лікарські форми з уповільненим вивільненням активної речовини (такі форми існують для ніфедипіну, фелодипіну, верапамілу, дилтіазему) мають певні переваги, оскільки створюють стабільну концентрацію діючої речовини у плазмі крові і забезпечують постійний терапевтичний ефект. Основні фармакологічні особливості різних антагоністів кальцію наведено в табл. 3.11.

Механізм антиангінальної дії блокаторів кальцієвих каналів пов’язаний із розвантаженням серця за рахунок системної вазодилатації, а також з безпосереднім впливом на коронарні артерії серця і запобіганням коронароспазму. Серед додаткових позитивних ефектів блокаторів кальцієвих каналів слід назвати поліпшення діастолічної функції ЛШ. В експериментах були продемонстровані антитромботичні та антиатерогенні властивості антагоністів кальцію. Особливим показанням для призначення антагоністів кальцію є вазоспастична чи варіантна стенокардія (стенокардія Принцметала). Для ніфедипіну вазоспастична стенокардія була першим зареєстрованим показанням до застосування. Верапаміл і дилтіазем мають антиаритмічну дію при суправентрикулярних аритміях. При синдромі слабкості синусного вузла, порушеннях AV-провідності їх призначати не слід. Препаратами вибору у цьому разі можуть бути дигідропіридини. Антиангінальну ефективність блокаторів кальцієвих каналів було продемонстровано у клінічних дослідженнях. Наприклад, амлодипін в дозі 10 мг/добу призначали учасникам дослідження САMЕLOT. Порівняно з плацебо амлодипін істотно зменшував потребу в госпіталізації з приводу стенокардії та потребу в проведенні реваскуляризації впродовж 2-річного періоду спостереження.
У дослідженні САРЕ амлодипін (10 мг/добу) ефективно зменшував кількість епізодів ішемії під час холтерівського моніторування ЕКГ після 7 тиж лікування. Відзначали зменшення кількості нападів стенокардії та потреби в нітрогліцерині.
Порівняно з ізосорбіду мононітратом (25–50 мг/добу) амлодипін (5–10 мг/добу) виявився більш ефективним у хворих похилого віку зі стабільною стенокардією у подвійному сліпому паралельному 28-тижневому дослідженні.
Дослідження CASIS було невеликим за обсягом — у ньому брали участь 315 хворих зі стабільною стенокардією. Порівнювали антиішемічну ефективність амлодипіну в дозі 10 мг/добу і атенололу 100 мг/добу. Амлодипін впливав на толерантність до фізичного навантаження (тест на тредмілі). Атенолол мав переваги за зменшенням кількості епізодів ішемії міокарда під час холтерівського моніторування. Антиангінальна ефективність комбінації дигідропіридину з атенололом значно перевищувала ефективність кожного препарату окремо.
Подібні результати, коли комбінована терапія була більш ефективною, отримані в дослідженнях з ніфедипіном. Зокрема, в дослідженні IMAGE метопролол виявився ефективнішим від ніфедипіну за показниками толерантності до фізичного навантаження. Але результати комбінованого застосування досліджуваних препаратів перевищували ефективність монотерапії кожним із них. У випробуванні TIBET динаміка клінічних показників (толерантність до фізичного навантаження) і частота ускладнень ІХС (нестабільна стенокардія, ІМ і раптова смерть) вірогідно не відрізнялися в групах хворих, які одержували ніфедипін та атенолол. При цьому кількість ускладнень дещо зменшувалася під впливом комбінованої терапії.
Рандомізоване плацебо-контрольоване дослідження ACTION, мета якого — оцінити вплив терапії ніфедипіном на перебіг захворювання у пацієнтів зі стабільною стенокардією, продемонструвало неоднозначні результати. У дослідженні взяли участь 7665 хворих на стабільну стенокардію без ознак СН (ФВ >40%). Ніфедипін призначали в дозі 30–60 мг 1 раз на добу. Період спостереження становив в середньому 4,9 року. Незважаючи на антиангінальний ефект ніфедипіну, комбіновані показники, що включають смертність від усіх причин, гострий ІМ, рефрактерну стенокардію, появу СН та інсульт, у групах активного лікування та плацебо вірогідно не відрізнялися. Єдиний показник, за яким виявлені позитивні зміни, — потреба у проведенні АКШ.
Побічні реакції при застосуванні блокаторів кальцієвих каналів дозозалежні й в основному зумовлені вазодилатацією. Найчастіше відзначають головний біль, гіперемію шкіри, тахікардію, запаморочення, набряки гомілок. Останні не пов’язані з затримкою рідини в організмі, мають доброякісний характер і, як правило, вираженість їх зменшується чи вони зникають після корекції дози препарату. Ці реакції найбільш виражені при використанні блокаторів кальцієвих каналів, похідних дигідропіридину. Верапаміл може викликати констипацію. Рідко при застосуванні блокаторів кальцієвих каналів виникали аритмія, посилення стенокардії, АГ, порушення з боку ШКТ. Застосування дигідропіридинів може супроводжуватися незначним збільшенням добового діурезу. При схильності до артеріальної гіпотензії, ризику розвитку СН, гемодинамічно значимому аортальному чи мітральному стенозі, обструктивній формі ГКМП застосування блокаторів кальцієвих каналів не рекомендується. У разі необхідності їх призначення необхідні особлива обережність і постійний клінічний контроль.
Оскільки всі блокатори кальцієвих каналів метаболізуються в печінці, при порушенні її функції збільшується період напіввиведення і підвищується біодоступність лікарських засобів, що потребує корекції режиму дозування та постійного клінічного спостереження. У такому разі слід уникати призначення блокаторів кальцієвих каналів в максимальних дозах. Верапаміл накопичується в організмі при регулярному прийомі, що може привести до посилення як терапевтичного ефекту, так і побічних реакцій. Для дилтіазему також характерна кумуляція, хоча і незначна. Дилтіазем і амлодипін можна застосовувати у хворих з порушеннями функції нирок. Амлодипін за показаннями при необхідності можна застосовувати у осіб з СН.
Слід враховувати можливість взаємодії блокаторів кальцієвих каналів з іншими лікарськими засобами. Так, верапаміл істотно (до 40%) підвищує концентрацію дигоксину в плазмі крові. Дилтіазем і ніфедипін також взаємодіють із дигоксином, але меншою мірою. Недигідропіридинові блокатори кальцієвих каналів не рекомендується комбінувати з блокаторами β-адренорецепторів з огляду на можливість потенціонування кардіодепресивної дії. Застосування блокаторів β-адренорецепторів з дигідропіридиновими блокаторами кальцієвих каналів є раціональною комбінацією щодо оптимізації терапевтичного ефекту та запобігання побічним реакціям, зокрема рефлекторній активації симпатичної нервової системи. Проте ця комбінація підвищує ризик розвитку СН, особливо у пацієнтів з наявними порушеннями скоротності міокарда.
Всі три групи антиангінальних препаратів (блокатори β-адренорецепторів, органічні нітрати, блокатори кальцієвих каналів), рекомендовані для симптоматичної терапії стабільної стенокардії, мають досить високу ефективність, що відображено у результатах проведених клінічних досліджень. Більш високу терапевтичну ефективність відзначено в порівняльних клінічних дослідженнях для блокаторів β-адренорецепторів і деяких блокаторів кальцієвих каналів. Так, у вищенаведеному дослідженні IMAGE 280 хворих на стабільну стенокардію приймали метопролол CR 200 мг/добу або ніфедипін SR 20 мг 2 рази на добу протягом 6 тиж. Обидва препарати підвищували толерантність до фізичних навантажень, проте метопролол — більшою мірою (р<0,05). У дослідженні APSIS верапаміл SR в дозі 240–480 мг/добу дещо ефективніше, ніж метопролол CR в дозі 100–200 мг/добу підвищував толерантність до фізичного навантаження. Але показники впливу на ризик серцево-судинних ускладнень для обох препаратів не відрізнялись. У дослідженні TIBBS (514) порівнювали антиангінальні й антиішемічні ефекти бізопрололу і ніфедипіну. Бізопролол виявився більш ефективним. Атенолол, ніфедипін та їх комбінацію вивчали в дослідженні TIBET за показниками толерантності до фізичного навантаження і результатами холтерівського моніторування ЕКГ. Обидва препарати (як при монотерапії, так і в комбінації) покращували показники переносимости навантаження та зменшували вираженість ішемічних проявів за даними добового моніторування ЕКГ порівняно з плацебо. Причому жоден варіант активного лікування не мав статистично достовірних переваг перед іншим. Водночас монотерапія ніфедипіном супроводжувалася більшою кількістю побічних реакцій, зокрема і таких, що потребували відміни препарату.
Аналіз порівняльних досліджень блокаторів β-адренорецепторів і блокаторів кальцієвих каналів у хворих на стабільну стенокардію свідчить, що перші більш ефективні у запобіганні ангінальним нападам, тоді як вплив обох груп препаратів на переносимость дозованих фізичних навантажень не відрізнявся.
Проведено кілька порівняльних досліджень антиангінальних та антиішемічних ефектів нітратів пролонгованої дії з блокаторами β- адренорецепторів і блокаторами кальцієвих каналів. У жодному з них не виявлено впливу нітратів на смертність хворих на стабільну стенокардію. Блокатори β-адренорецепторів і блокатори кальцієвих каналів порівняно з нітратами пролонгованої дії мали незначні переваги щодо антиішемічної дії.
Незважаючи на позитивну динаміку клінічних параметрів у всіх зазначених дослідженнях, їх результати були отримані в умовах короткотривалого спостереження і тому не можуть розглядатися у зв’язку з впливом на довготривалий прогноз. Тобто необхідно розрізняти симптоматичне лікування стенокардії й терапію, що забезпечує позитивні зміни основних прогностичних показників. Прогноз пацієнта з ІХС залежить від численних факторів, включаючи швидкість прогресування атеросклерозу, стабільність або дестабілізацію атеросклеротичних бляшок, розвиток тромботичних ускладнень. Можливості традиційної антиангінальної терапії щодо зазначених факторів залишаються невизначеними і в цілому обмеженими. З урахуванням відомої прогностичної ефективності блокаторів β-адренорецепторів після перенесеного ІМ ці препарати вважаються антиангінальними засобами першого ряду і у хворих на стабільну стенокардію. За наявності протипоказань для їх застосування чи інших індивідуальних особливостей рекомендується призначення блокаторів кальцієвих каналів або нітратів. При недостатній ефективності монотерапії можливе використання комбінацій, наприклад блокаторів β-адренорецепторів з дигідропіридиновими блокаторами кальцієвих каналів або нітратами пролонгованої дії.
Активатори калієвих каналів
Основний представник цієї групи — нікорандил.
Має подвійний механізм дії:
1) активує АТФ-залежні калієві канали;
2) проявляє нітратоподібний ефект.
Завдяки системній і коронарній вазодилатації забезпечує зменшення перед- і постнавантаження. В експериментальних дослідженнях в умовах ішемії і реперфузії активація К+-АТФ-залежних каналів супроводжувалася кардіопротекторним ефектом. Добова доза нікорандилу для запобіання нападам стенокардії становить 20 мг 2 рази на добу. При тривалому прийомі може розвинутися толерантність до препарату подібно тому, як це відбувається при застосуванні нітратів. Перехресна толерантність з нітратами не спостерігалась. У невеликих рандомізованих плацебо-контрольованих дослідженнях за участю хворих на стабільну стенокардію нікорандил поліпшував результати проб з дозованим фізичним навантаженням. У дослідженні IONA нікорандил включали до традиційної терапії пацієнтів, госпіталізованих у зв’язку з ангінозним болем. Порівняно з плацебо препарат проявив виражений клінічний ефект. Проте продовження терапії протягом 1,6 року не виявило достовірного впливу на кардіальну смертність і частоту нефатального ІМ.
Найчастішим побічним ефектом при застосуванні нікорандилу був головний біль. Дуже рідко повідомляли про розвиток виразок слизової оболонки порожнини рота. Європейським кардіологічним товариством препарат рекомендований як додатковий засіб для симптоматичного лікування стабільної стенокардії. В Україні нікорандил не зареєстрований.
Івабрадин
Препарат блокує If-канали синусного вузла, знижуючи його пейсмейкерну активність і забезпечуючи негативний хронотропний ефект (рис. 3.18).
Рис. 3.18. Вплив івабрадину на синусний вузол. If- струм визначає параметри діастолічної деполяризації, частоту виникнення потенціалу дії та ЧСС. Селективне і специфічне інгібування If-каналів синусного вузла івабрадином призводить до уповільнення діастолічної деполяризації та ізольованої негативної хронотропної дії
Зниження ЧСС під впливом івабрадину спостерігається як у стані спокою, так і при фізичних навантаженнях. Антиангінальна ефективність препарату встановлена в діапазоні доз 10–15 мг/добу. На відміну від інших антиангінальних засобів, івабрадин не впливає на тонус судин, включаючи коронарні артерії серця. Незважаючи на те що ЧСС визнано однією з найважливіших детермінант потреби міокарда в кисні й сучасна тактика лікування стенокардії передбачає її зниження до 55–60 уд./хв, у реальній клінічній практиці виникають труднощі з реалізацією цих рекомендацій. За даними Європейського реєстру за 2006 р. 33% хворих на стабільну стенокардію не одержували блокаторів β-адренорецепторів, у 20% випадків були прямі протипоказання до прийому зазначених препаратів. В Україні у 2006 р. проведене епідеміологічне дослідження REALITY за участю майже 1500 пацієнтів. Основне завдання дослідження — вивчення питання про нагляд за хворими на стабільну стенокардію в амбулаторних умовах і моніторування у них ЧСС. 84% пацієнтів приймали блокатори β-адренорецепторів, але лише у 5% з них було досягнуто цільової ЧСС <60 уд./хв. У 40% хворих, які брали участь у дослідженні, зазначений показник перевищував 80 уд./хв. Препарат івабрадин показаний для лікування стенокардії з метою зниження ЧСС у пацієнтів, які не можуть приймати блокатори β-адренорецепторів у зв’язку з протипоказаннями або непереносимістю (при гіперчутливості, БА тощо). Знижуючи ЧСС, одну з основних детермінант, потреби міокарда в кисні, івабрадин імовірно може впливати на прогноз при стабільній стенокардії. Так, у осіб зі стабільною ІХС та систолічною дисфункцією ЛШ, за даними дослідження BEAUTIFUL, прийом івабрадину супроводжується зниженням ризику серцево-судинних ускладнень (кількість випадків фатального і нефатального ІМ — на 36% (р=0,001), потреба в реваскуляризації — на 30% (р=0,016)). Ці результати стосувались підгрупи пацієнтів з достатньо високою початковою ЧСС >70 уд./хв. Позитивні результати спостерігали як за умови монотерапії івабрадином, так і при застосуванні в комбінації з блокатором β-адренорецепторів. У вітчизняному багатоцентровому відкритому дослідженні CROSS підтверджено високу антиангінальну ефективність івабрадину. У хворих зі стабільною стенокардією під впливом 3-місячного лікування івабрадином ЧСС знизилася з 77,71+0,74 до 60,92+0,75 за 1 хв (р=0,001), а кількість ангінозних нападів скоротилася з 7,98+0,91 до 0,92+0,20 за 1 тиж (р=0,001).
Триметазидин і ранолазин
Належать до метаболічних антиангінальних препаратів. Механізм їх дії безпосередньо пов’язаний з енергозабезпеченням міокарда. Триметазидин — перший представник нового фармакологічного класу — інгібіторів ферменту 3-КАТ. Блокада ферменту 3-КАТ в умовах ішемії оптимізує енергетичне забезпечення міокарда, перемикаючи клітинний метаболізм з окиснення жирних кислот на окиснення глюкози. Це дозволяє зберегти в кардіоміоцитах необхідний рівень АТФ, запобігти розвитку внутрішньоклітинного ацидозу та накопиченню іонів кальцію. Ранолазин додатково блокує натрієві канали, які активуються в умовах ішемії, запобігає перевантаженню міокарда іонами кальцію. Триметазидин і ранолазин не мають суттєвого впливу на ЧСС і АТ. З огляду на механізм дії та фармакодинамічні властивості їх можна комбінувати з традиційними антиангінальними «гемодинамічними» засобами (блокаторами β-адренорецепторів, блокаторами кальцієвих каналів, органічними нітратами). Подібні поєднання здатні підвищити ефективність терапії при збереженні її переносимості. Слід зазначити, що ранолазин менш вивчено, ніж триметазидин. В Україні ранолазин не зареєстрований. Вплив метаболічних препаратів на прогноз хворих зі стабільною стенокардією не визначений.
Молсидомін
Вазодилататор з гемодинамічним профілем, подібним до нітратів. У відповідному режимі дозування (2–8 мг/добу) препарат застосовують як антиангінальний засіб. Вплив препарату на прогноз стабільної стенокардії не вивчали.
Загальні рекомендації з фармакотерапії стабільної стенокардії
Призначення антиангінальної терапії має враховувати індивідуальні особливості й потреби кожного пацієнта. Необхідний регулярний контроль результатів терапії. Застосування нітратів короткої дії (нітрогліцерин) рекомендовано всім хворим для невідкладного купірування нападів стенокардії.
Сучасні антиангінальні препарати у клінічних дослідженнях виявили високу ефективність. Але це не означає, що вони будуть так само ефективні у кожного конкретного хворого. Перед прийняттям рішення про призначення двох антиангінальних препаратів необхідно використати їх оптимальні дози у монотерапії. Доцільно спробувати різні комбінації двох антиангінальних препаратів перед призначенням третього. За даними ряду досліджень застосування трьох антиангінальних препаратів не мало переваг перед двокомпонентною терапією. Разом з тим призначення інтенсивного лікування, що складається з кількох препаратів у високих дозах, може створити хворому додаткові проблеми, викликавши побічні реакції. Важливою складовою успішної терапії є дисциплінованість пацієнта і готовність до співпраці з лікарем. Тому пацієнт повинен мати достатню інформацію про своє захворювання і плановане лікування. Алгоритм ведення пацієнта зі стабільною стенокардією включає обов’язкове визначення та можливу модифікацію факторів ризику, призначення лікарських засобів, які впливають на прогноз і максимально усувають клінічні симптоми захворювання. Неефективність медикаментозної терапії та бажання хворого передбачають можливість хірургічного лікування.
Рекомендації з фармакотерапії з метою усунення симптомів і запобігання ішемії у пацієнтів із стабільною стенокардією:
- З огляду на доказову базу для купірування нападів стенокардії та їх ситуативної профілактики всім хворим показано призначення нітратів короткої дії (нітрогліцерину) з відповідними інструкціями щодо їх застосування (клас I, рівень доказовості В).
- Призначення блокаторів β-адренорецепторів рекомендовано всім хворим на стабільну стенокардію за відсутності протипоказань з урахуванням їх ефективності у кожного конкретного пацієнта. Дозу вибраного препарату необхідно титрувати до оптимальної з урахуванням ЧСС і переносимості терапії. Для успішного лікування важливе забезпечення постійної, протягом доби, дії препарату, що дозволяє максимально попередити появу ішемії (клас I, рівень доказовості А).
- Якщо призначення блокаторів β-адренорецепторів протипоказане чи їх застосування неефективне, рекомендована монотерапія блокаторами кальцієвих каналів (клас I, рівень доказовості А) або нітратами тривалої дії (клас I, рівень доказовості С).
- У разі недостатньої ефективності монотерапії блокаторами β-адренорецепторів доцільне приєднання до них дигідропіридинових блокаторів кальцієвих каналів (клас I, рівень доказовості В). Загальну схему антиангінальної терапії наведено на рис. 3.19.
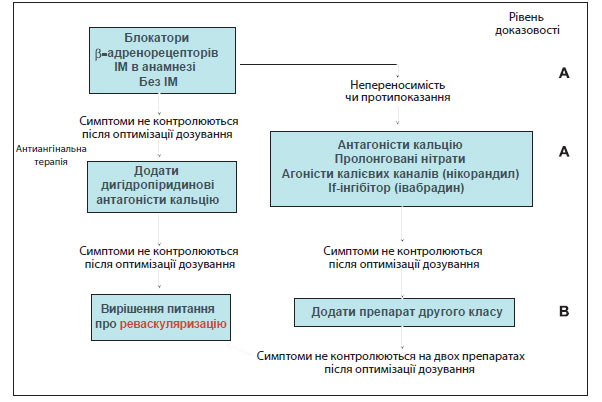
Рис. 3.19. Симптоматичне лікування стабільної стенокардії
У випадках непереносимості блокаторів β-адренорецепторів альтернативою можуть стати блокатори If-каналів синусного вузла — препарат івабрадин (клас IIа, рівень доказовості В).
При неефективності монотерапії блокаторами кальцієвих каналів або комбінованої терапії — блокатори кальцієвих каналів + блокатори β-адренорецепторів — можлива заміна блокатора кальцієвого каналу на препарат групи нітратів пролонгованої дії. Регулярне застосування нітратів пролонгованої дії потребує контролю режиму їх прийому для запобігання толерантності (клас IIа, рівень доказовості С).
Препарати метаболічної дії застосовують як допоміжні чи альтернативні засоби за наявності протипоказань або непереносимості традиційних антиангінальних препаратів (клас IIв, рівень доказовості В).
Неефективність двокомпонентної терапії із застосуванням препаратів в оптимальних дозах порушує питання про призначення третього антиангінального засобу чи хірургічного втручання з метою проведення реваскуляризації міокарда. Застосування багатокомпонентної терапії потребує регулярного лікарського контролю у зв’язку з ризиком розвитку побічних реакцій. Підставою для хірургічного лікування може бути і бажання пацієнта. Проведення втручання з реваскуляризації міокарда не виключає продовження прийому препаратів, що позитивно впливають на прогноз ІХС, антитромботичних препаратів і статинів.
Терапія синдрому Х
Основна мета терапії синдрому Х — усунення клінічних проявів захворювання. Нітрати ефективно усувають больовий синдром приблизно у половини таких хворих, тому лікування рекомендується починати з призначення препаратів цієї групи. У разі, якщо симптоматика зберігається, незважаючи на прийом нітратів, можливе застосування блокаторів кальцієвих каналів або блокаторів β-адренорецепторів. Є повідомлення про ефективність при синдромі Х інших антиангінальних засобів, таких як нікорандил і триметазидин. Корисними для пацієнтів з синдромом Х можуть бути інгібітори АПФ та статини, оскільки є дані, що їх застосування супроводжується зменшенням вираженості ішемії, індукованої фізичним навантаженням, а також з урахуванням здатності зазначених препаратів протидіяти ендотеліальній дисфункції. Разом з тим застосування інгібіторів АПФ і статинів розглядають при синдромі Х скоріше як частину лікування, що модифікує фактори ризику. Статини показані хворим з дисліпідемією. Інгібітори АПФ рекомендуються при АГ. Для досягнення стійких позитивних результатів у деяких пацієнтів з синдромом Х необхідна комплексна терапія, що включає анальгетичні засоби, іміпрамін або амінофілін, проведення психотерапії, електростимуляції, фізичних тренувань. У деяких випадках хворі в постменопаузальний період потребують замісної гормональної терапії. Але з огляду на можливі негативні наслідки такої терапії щодо серцево-судинних і онкологічних ускладнень, необхідна зважена оцінка співвідношення користі та ризику в кожному конкретному випадку.
Лікування вазоспастичної стенокардії
Основні препарати для лікування вазоспастичної стенокардії — нітрати і блокатори кальцієвих каналів. Причому нітрати більш ефективні для усунення нападів вазоспастичної стенокардії, ніж для їх профілактики. Блокатори кальцієвих каналів більш ефективні для запобігання коронароспазму, причому лікування потребує призначення препаратів у високих дозах. Наприклад, рекомендована добова доза верапамілу становить до 480 мг, дилтіазему — до 240 мг, ніфедипіну — до 120 мг. У деяких дослідженнях ефективність ніфедипіну і амлодипіну становила 70%, включаючи вплив на ЕКГ-ознаки ішемії міокарда, частоту та інтенсивність ангінозних нападів. Разом з тим, узагальнений аналіз результатів монотерапії блокаторами кальцієвих каналів при вазоспастичній стенокардії свідчить, що повне усунення симптомів захворювання відзначають в середньому 38% пацієнтів. Застосування блокаторів кальцієвих каналів у комбінації з нітратами пролонгованої дії поліпшує стан більшості пацієнтів. У разі резистентної до лікування вазоспастичної стенокардії можливе використання двох блокаторів кальцієвих каналів різних груп, наприклад дигідропіридину і верапамілу. Імовірно, що пацієнти жіночої статі та особи з елевацією сегмента ST, що виникає в умовах провокаційних тестів, краще піддаються медикаментозному лікуванню. Доцільність призначення блокаторів α-адренорецепторів хворим із вазоспастичною стенокардією залишається сумнівною, хоча є повідомлення про позитивні результати такої терапії. Описано випадки успішного лікування вазоспастичної стенокардії нікорандилом. У деяких пацієнтів з резистентною до медикаментозної терапії вазоспастичною стенокардією відзначали позитивні результати стентування ураженої коронарної артерії. АКШ в цих випадках не показане, оскільки зберігається загроза спазму ділянок артерії, що знаходяться дистальніше анастомозу. Під впливом тривалої, не менше 1 року, медикаментозної терапії приблизно у половини хворих з вазоспастичною стенокардією можна досягти стійкої ремісії. Через 6–12 міс після зникнення стенокардії вважається можливим поступове скорочення обсягу лікування і навіть повна відміна медикаментів. Поява вазоспазму у хворих з гемодинамічно значущими стенозами коронарних артерій потребує проведення всіх звичайних для лікування ІХС заходів, включаючи терапію, спрямовану на поліпшення прогнозу та усунення симптомів захворювання. Обов’язковим для оптимізації лікування вазоспастичної стенокардії є усунення таких провокуючих факторів, як тютюнопаління.
Принципи лікування хворих після оперативних втручань по реваскуляризації міокарда
Всі пацієнти після оперативного лікування ІХС мають потребу в постійному застосуванні препаратів для запобігання прогресування атеросклерозу і розвитку тромботичних ускладнень (статини і антитромботичні засоби). Обов’язкові умови — корекція способу життя, дотримання гіполіпідемічної дієти, нормалізація маси тіла, відмова від тютюнопаління та фізичні тренування з урахуванням індивідуальних можливостей пацієнта. Оскільки морфологічною основою стенокардії є атеросклероз коронарних артерій, навіть успішна реваскуляризація не гарантує повного усунення симптомів коронарної недостатності, особливо в умовах фізичного і психологічного перевантаження. Поява стенокардії у хворих після оперативних втручань з реваскуляризації міокарда потребує проведення додаткового обстеження для диференційної діагностики больового синдрому і уточнення характеру ураження коронарного русла. Основні принципи симптоматичного лікування стенокардії — загальні для всієї популяції пацієнтів з ІХС, в тому числі після оперативних втручань.
ЛІТЕРАТУРА
- Аронов Д.М. (2004) Каскад терапевтических эффектов статинов. Кардиология, 10: 85–94.
- Марцевич С.Ю. (2003) Современные взгляды на терапию нитратами больных ишемической болезнью сердца. Сердце, 2: 88–90.
- Метелица В.И. (2002) Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. Бином, М., с. 551–619.
- Преображенский Д.В. (1993) Клиническое применение антагонистов кальция. М., с. 61.
- Чазов Е.И., Беленков Ю.Н. (2004) Рациональная фармакотерапия сердечно-сосудистых заболеваний. Руководство для практикующих врачей. Литтерра, М., т. 4.
- Antitrombotic Trialists’ Collaboration (2002) Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patient. BMJ, 324: 71–86.
- Bellosta S., Ferri N., Paoletti R., Corsini A. (2000) Non-lipid-related effects of sta-tins. Ann. Med., 32: 164–176.
- Benowitz N.L., Gourlay S.G. (1997) Cardiovascular toxicity of nicotine: implications for nicotine replacement therapy. J. Am. Call. Cardiol., 29: 1422–1431.
- Blankenhorn D.H. and MARS Research Droup: Coronary angiographic changes with lovastatin therapy: The Monitored Atherosclerosis Study (MARS) (1993) Ann. Intern. Med., 119: 969–976.
- Boden W.E., van Gilst W.H., Starkey I.R. et al. (2000) Diltiazem in acute myocardial infarction treated with thrombolytic agents: a randomised placebo-controlled trial. Incomplete Infarction Trial of European Research Collaborators Evaluating Prognosis post-Thrombolysis (INTERCEPT). Lancet, 355: 1751–1756.
- CAPRIE Steering Committee (1996) A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischemic events (CAPRIE). Lancet, 348: 1329–1339.
- Dargie H.J., Ford I., Fox K.M. (1996) Total Ischemic Burden Europian Trial (TIBET). Effects of ischemia and treatment with atenolol, nifedipine SR and their combination on outcome in patients with chronic stable angina. The TIBET Study Group. Eur. Heart J., 17: 104–112.
- Deanfield J.E., Detry J.M., Lichtlen P.R. et al. (1994) Amlodipine reduses transient myocardial ischemia in patients with coronary artery disease: double-blind Circadian Anti-Ischemia Program in Europe (CAPE Trial). JAC, 24: 1460–1467.
- DeBacker G., Ambrosioni E., Borch-Johnsen et al. (2003) European guidelines on cardiovascular disease prevention in clinical practice. Third Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur. Heart J., 24: 1601–1610.
- Deedwania P., Barter P., Carmena R. et al. (2006) Treating to New Targets Investigators. Reduction of low-dencity lipoproptein cholesterol in patients with coronary heart disease and metabolic syndrome: analysis of the Treating to New Targets Study. Lancet, 368: 919–928.
- Effect of simvastatin on coronary atheroma: the Multicentre Anti-Atheroma Study (MAAS) (1994) Lancet, 344: 633–338.
- Effect of verapamil on mortality and major events after acute myocardial infarction (the Danish Verapamil Infarction Trial II — DAVIT II) (1990) Am. J. Cardiol., 66: 779–785.
- ESC Guidelines for the Management of Stable Angina Pectoris (2006) Eur. Heart J., 27: 1341–1381.
- Fox K.M. (2003) Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPE study). Lancet; 362: 782–788.
- Freemantle N., Urdahl H., Eastaugh J. et al. (2002) What is the place of beta-blockade in patients who have experienced a miocardial infarction with preserved left ventricular function. Evidence and mis(interpretation). Prog. Cardiovasc. Dis., 44: 243–250.
- Fung H.L., Bauer J.A. (1994) Mechanisms of nitric tolerance. Cardiovasc. Drug. Ther., 8: 489–499.
- Gotto A.M. (2003) Dyslipidemia and Coronary Heart Disease, 242 p.
- Graboys T.B., Blatt Ch.M. (1997) Angina Pectoris: Management Strategies and Guide to Interventions. USA, Professional Communications, Inc, p. 240.
- Guasti L., Marina F., Cosentino M. et al. (2008) Prolonged statin-associated reduction in neutrophil reactive oxygen species and angiotensin II type 1 receptor expression: 1-year follow-up. Eur. Heart J., 9, 1118–1126. Guidelines for the Management of Patients with Chronic Stable Angina (1999) J. Amer. Coll. Cardiology, 33: 2092–2197.
- Han S.H., Bae J.H., Holmes D.R. et al. (2008) Sex differences in atheroma burden and endothelial function in patients with early coronary atherosclerosis. Eur. Heart J., 29: 1359–1369.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial (2002) Lancet, 360: 7–22.
- Holdaas H. (2008) Statin therapy for prevention of coronary artery disease. The earlier the better or the longer the better? Eur. Heart J., 29(4): 425–426.
- Holubarsch C., Kojda G. (2003) Nitrates in combination therapy: From angina to myocardial infarction and heart failure. Schwarz Pharma. Germany, 104 p.
- Hueb W., Soares P.R., Gersh B.J. et al. (2004) The medicine, angioplasty, or surgery study (MASS-II): a randomised controlled clinical trial of three therapeutic strategies for multivessel coronary artery disease: 1 year results. J. Am. Call. Cardiol., 43: 1743–1751.
- Kastelein J., de Groot E. (2008) Ultrasonic imaging techniques for the evaluation of cardiovascular therapies. Eur. Heart J., 29(7): 849–858.
- Kris-Etherton P.M., Lichtenstein A.H., Howard B.V. et al. (2004) Antioxidant vitamin supplements and cardiovascular disease. Circulation, 110: 637–641.
- Marcassa C., Bax J.J., Bengel F. еt al. (2008) Clinical value, cost-effectiveness and safety of myocardial perfusion scintigraphy: a position statement. Eur. Heart J., 29(4): 557–563.
- Marchioli R., Barzi E., Bomba E. et al. (2002) Early protection against sudden death by 3-polyunsaturated fatty acids after miocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravviveza nell’Infarto Miocardico (GISSI)-Prevenzione. Circulation, 105: 1897–1903.
- Markham A., Plosker G.L., Goa K.L. (2000) Nicorandil. An update review of its use in ischemic heart disease with emphasis on its cardioprotective effects. Drugs, 60: 955–974.
- McCormic L.S., Black D., Waters D. et al. (1999) Aggressive lipid lowering therapy compared with angioplasty in stable coronary disease (AVERT). N. Engl. J. Med., 341: 70–76.
- Michelson A.D., Cataneo M., Eikelbloom J.W. et al. (2005) Aspirin resistance: position paper of Working Group on Aspirin Resistance. J. Thromb. Haemost., 3: 1309–1311.
- Nayler W. (1993) Amlodipine. Springer-Verlag. Berlin Heidelberg.
- Nissen S.E., Nicholls S.J., Sipahi I. et al. (2006) Effect of very high-intensity statin therapy on regression of coronary atherosclerosis (ASTEROID). JAMA, 295: 1556–1565.
- Nissen S.E., Tuzcu E.M., Libby P. et al. (2004) Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomised controlled trial. JAMA, 292: 2217–2225.
- Nissen S.E., Tuzcu E.M., Schoenhagen P. et al. (2004) Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis (REVERSAL) trial. JAMA, 211: 1071–1080.
- Parker J.D., Parker J.O. (1998) Nitrate therapy for stable angina pectoris. N. Engl. J. Med., 338: 520–531.
- Pepine C.J., Cohn P.N., Deedwania P.C. et al. (1994) Effects of treatment on outcome in midly symptomatic patients with ischemia during daily life. The Atenolol Silent Ischemia Study (ASIST). Circulation, 90: 762–768.
- Rehnqvist N., Hjemdahl P., Billing E. et al. (1996) Effects of metoprolol vs verapamil in patients with stable angina pectoris. The Angina Prognosis Study in Stockholm (APSIS). Eur. Heart. J., 17: 76–81.
- Robins S.J., Collins D., Wittes J.T. et al. (2001) Relations of gemfibrozil treatment and lipid levels with major coronary events: VA-HIT: a randomized controlled trial. JAMA, 285(12): 1585–1591.
- Schroeder S., Achenbach S., Bengel F. et al. (2008) Cardiac computed tomography: indications, applications, limitations, requirements. Eur. Heart J., 29(4): 531–556.
- Sever P., Dahlof B., Poulter N. et al. (2003) Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-then-average cholesterol concentration in the Anglo-Scandinavian cardiac outcomes trial — Lipid lowering arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet, 361: 1149–1158.
- Sueda S., Kohno H., Fucuda H. et al. (2003) Limitations of medical therapy in patients with pure coronary spastic angina. Chest, 123: 380–386.
- The Scandinavian Simvastatin Survival Study group (1994) Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet, 344: 1383–1389.
- Yusuf S., Slight P., Pogue J. et al. (2000) Effects of an angiotensin-converting-enzime inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcames Prevention Evaluation (HOPE study). N. Engl. J. Med., 342:145–153.