Острая сердечная недостаточность (ОСН) — это клинический синдром, который характеризуется быстрым возникновением симптомов и жалоб, характерных для нарушения работы сердца со снижением сердечного выброса, легочным и/или системным застоем. ОСН часто развивается без связи с наличием кардиологической патологии в прошлом. Нарушение функции сердца может иметь характер систолической или диастолической дисфункции, нарушений сердечного ритма, нарушений преднагрузки и постнагрузки. Эти нарушения часто носят угрожающий жизни характер и требуют проведения экстренных мер. ОСН может развиваться как острое заболевание de novo (то есть у пациента без имеющейся ранее дисфункции сердца) или как острая декомпенсация хронической ХСН. При быстром развитии ОСН, по сравнению с постепенным развитием симптоматики при декомпенсации ХСН, часто отсутствуют признаки задержки жидкости в организме. Таким образом, ОСН нужно рассматривать не как болезнь, а скорее как синдром, причиной которого являются разные механизмы.
ЭПИДЕМИОЛОГИЯ, ЭТИОЛОГИЯ И ПРОГНОЗ СИНДРОМА ОСН
Рост удельного веса лиц пожилого возраста в популяции, повышение выживания после перенесенного острого ИМ привело к значительному увеличению числа пациентов с ХСН и значительного количества госпитализаций в связи с декомпенсацией СН. ИБС является этиологической причиной ОСН в 60–70% случаев, особенно у пациентов пожилого возраста. У лиц более молодого возраста ОСН развивается вследствие ДКМП, аритмий, врожденных и приобретенных пороков сердца, миокардитов.
Каждый год в США при выписке из стационара диагноз ОСН является основным приблизительно в 1 млн случаев, сопутствующим — еще в 2 млн. Частота ранних повторных госпитализаций по поводу СН довольно высокая и составляет около 20% на протяжении 30 дней после выписки и 50% на протяжении 6 мес. Средняя продолжительность пребывания в стационаре составляет 10 дней. Также следует отметить, что на протяжении последних двух десятилетий 30-дневная смертность при ОСН остается неизменной и составляет >10%.
Учитывая это, госпитализацию по поводу ОСН нужно рассматривать как серьезное неотложное состояние, поскольку госпитальная смертность составляет 8%, а на протяжении 6 мес — 25–30%. Смертность особенно высокая при остром ИМ, в результате которого развивается СН. Так, 12-месячная смертность составляет 30%. При развитии отека легких внутригоспитальная смертность — 12%, годовая смертность — 40%. Эти данные подтверждаются большими регистрами, такими как Acute Decompensated Heart Failure National Registry (Национальный регистр острой декомпенсированной сердечной недостаточности, ADHERE) (2005), Euro Heart Survey Programme (Европейская программа кардиологического обследования) (2006) и др.
Затраты на лечение пациентов с СН составляют 1–2% от общих затрат на здравоохранение, приблизительно 75% затрат связаны с лечением в стационаре. Тяжелая СН и острая декомпенсация являются наиболее затратными неотложными состояниями в кардиологии.
Лучшее понимание патофизиологических процессов, которые приводят к ОСН, и четкое определение следствий заболевания должны стать ключом к изучению новых методов лечения и улучшения прогноза у этих больных. Причины и осложнения ОСН приведены ниже в табл. 1.1.
Таблица 1.1
Причины и фоновые состояния развития ОСН
| 1. Декомпенсация имеющейся СН (например при кардиомиопатии) |
2. Острый коронарный синдром:
|
| 3. Гипертензивный криз |
| 4. Острые нарушения ритма сердца (желудочковая тахикардия, фибрилляция или трепетание предсердий, другие суправентрикулярные тахикардии, брадиаритмии различной этиологии) |
| 5. Клапанная регургитация (эндокардит, отмечавшейся разрыв сухожильных хорд, усиление регургитации, отмечавшейся ранее) |
| 6. Тяжелый аортальный стеноз |
| 7. Тяжелый острый миокардит |
| 8. Тампонада сердца |
| 9. Разрыв аневризмы аорты |
| 10. Послеродовая кардиомиопатия |
11. Фоновые заболевания, которые не относятся к сердечно-сосудистой системе:
|
12. Синдром высокого выброс:
|
| 13. Влияние лекарственных средств и других химических веществ (отравление блокаторами β-адренорецепторов, гликозидами и т.п.) |
Исторически ОСН рассматривалась только как следствие ХСН у пациентов с тяжелыми формами систолической дисфункции ЛЖ. Однако недавно проведенные исследования показали (табл. 1.2), что характеристика пациентов с ОСН значительно отличается от таковой пациентов с ХСН. На протяжении последних 2 лет было опубликовано несколько больших исследований, в которых изучены фундаментальные характеристики больных, госпитализированных с ОСН. Эти исследования показывают, что средний возраст пациентов составляет 71–76 лет, половина пациентов — женщины и половина имеет сохраненную ФВ ЛЖ (>40%). Эти характеристики значительно отличаются от пациентов с ХСН, где пациенты более молодого возраста, преимущественно мужчины и имеющие ФВ ниже 40%.
Таблица 1.2
Клиническая характеристика пациентов с ОСН (AHF)
| Показатель | Canada AHF | EuroHeart AHF | ADHERE AHF (n>100 000) | CHARM CHF (7599) | OPTIMIZE-HF AHF (n=34 059) | IMPACT-HF CHF (n=567) | OPTIME-CHF ADHF (n=951) |
| Возраст, лет | 76±11 | 71 | 72,5 | 71 | 73±15 | 71±12 | 66±14 |
| Женщины, % | 50 | 50 | 52 | 50 | 52 | 48 | 33,9 |
| ФВ >40% | 50 | 50 | 40 | 50 | 50 | 25 | 0 |
| ПН, % | — | 17 | 14 | 17 | 19 | 23,5 | >50 |
| СД, % | 34 | 27 | 44 | 27 | 42 | 45,1 | 44 |
| АГ, % | — | — | 72 | — | 71 | 64,7 | 68 |
| ИБС, % | 37 | 31 | 37 | 61 | 50 | 48,7 | 52 |
| ФП, % | 30 | 42 | 30 | 42 | 30 | 35,4 | 34 |
CHARM — (Candesartan in Heart Failure — Assessment of Mortality and Morbidity); CHF — ХСН; OPTIMIZE-HF (Organized Program To Initiate life-saving treatMent In HospitaliZEd patients with Heart Failure); IMPACT-HF (The Initiation Management Predischarge process for Assessment of Carvedilol Therapy for Heart Failure); OPTIME-CHF (Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure) ADHF — острая декомпенсированная СН; ПН — почечная недостаточность; СД — сахарный диабет; ФП — фибрилляция предсердий.
КЛИНИЧЕСКИЕ КЛАССИФИКАЦИИ ОСН
У пациента с ОСН может определяться одно из нижеприведенных состояний (табл. 1.3):
I. Острая декомпенсированная СН (de novo или как декомпенсация ХСН) с характерными жалобами и симптомами ОСН, которая является умеренной и не отвечает критериям кардиогенного шока, отека легких или гипертонического криза.
II. Гипертензивная ОСН: жалобы и симптомы СН сопровождают высокое АД с относительно сохраненной функцией ЛЖ. При этом на рентгенографии органов грудной клетки нет признаков отека легких.
III. Отек легких (подтвержденный при рентгенографии органов грудной клетки) сопровождается тяжелым нарушением дыхания, ортопноэ, хрипами в легких, при этом степень насыщения крови кислородом до лечения, как правило, менее 90%.
IV. Кардиогенным шоком называют недостаточную перфузию жизненно важных органов и тканей, вызванную снижением насосной функции сердца после коррекции преднагрузки. Относительно параметров гемодинамики на сегодня нет четких определений данного состояния, которое отображает расхождение в распространенности и клинических исходах при данном состоянии (см. табл. 1.3). Однако кардиогенный шок обычно характеризуется снижением АД (САД <90 мм рт. ст. или же снижением среднего АД >30 мм рт. ст.) и/или низким объемом экскреции мочи (<0,5 мл/кг/ч) с ЧСС >60 уд./мин независимо от наличия застойных явлений в органах. Кардиогенный шок является крайним проявлением синдрома малого выброса.
V. СН при высоком сердечном выбросе характеризуется повышенным МОК при обычно повышенной ЧСС (вследствие аритмий, тиреотоксикоза, анемии, болезни Педжета, ятрогенных и других механизмов), теплыми конечностями, застоем в легких и иногда сниженным АД (как при септическом шоке).
VI. Правожелудочковая СН характеризуется синдромом малого сердечного выброса вследствие насосной несостоятельности ПЖ (поражение миокарда или высокая нагрузка — ТЭЛА и т.п.) с повышением венозного давления в яремных венах, гепатомегалией и артериальной гипотензией.
Таблица 1.3
Терминология и общепринятые клинические и гемодинамические параметры
| Клинический статус | ЧСС, уд./мин | САД, мм рт. ст. | Сердечный индекс, л/мин/м2 | ДЗЛК*, мм рт. ст. | Застой по Киллипу | Диурез | Гипоперфузия | Гипоперфузия органов-мишеней |
| I. Острая декомпенсированная ХСН | +/– | Нижняя граница нормы/высокое | Нижняя граница нормы/высокий | Незначительно повышенное | II | + | +/– | |
| II. ОСН с АГ/гипертоническим кризом | Обычно повышенная | Высокое | +/– | >18 | II–IV | +/– | +/– | +, с симптомами со стороны
ЦНС |
| III. ОСН с отеком легких | + | Нижняя граница нормы | Низкий | Повышенное | III | + | +/– | |
| IVa. Кардиогенный шок**/синдром малого выброса | + | Нижняя граница нормы | Низкий, <2,2 | >16 | III–IV | Низкий | + | + |
| IVб. Тяжелый кардиогенный шок | >90 | <90 | <1,8 | >18 | IV | Очень низкий | ++ | + |
| V. СН с высоким выбросом | + | +/– | + | +/– | II | + | – | – |
| VI. Острая правожелудочковая СН | Обычно низкая | Низкое | Низкий | Низкое | +/– | +/–, острое начало | +/– |
*Давление заклинивания легочных капилляров; **дифференциальный диагноз между кардиогенным шоком и синдромом малого выброса основывается на субъективной оценке и клинической симптоматике этих двух синдромов, которые могут сочетаться.
Существует много других классификаций синдрома ОСН, которые широко используются наравне с вышеприведенной в отделениях коронарной патологии и блоках интенсивной терапии.
Классификация по Киллипу основана на клинической симптоматике и результатах рентгенографии органов грудной клетки. Классификация применяется преимущественно для СН при остром ИМ, но может применяться при СН de novo. Классификация по «клинической тяжести» используется у больных с кардиомиопатиями и основана на клинических признаках. Она чаще всего используется при декомпенсации ХСН.
Классификация по Киллипу (на основе Killip T. & Kimball J., 1967)
Классификация по Киллипу была разработана для клинической оценки степени тяжести дисфункции миокарда при остром ИМ (табл. 1.4).
Класс I — СН нет. Отсутствуют клинические признаки декомпенсации.
Класс II — СН. К числу диагностических критериев относят хрипы в легких, ритм галопа, легочная гипертензия. Застой в легких с наличием влажных хрипов в нижних отделах легких (ниже угла лопатки) с одной или двух сторон.
Класс III — Тяжелая СН. Отек легких с влажными хрипами над всей поверхностью.
Класс IV — Кардиогенный шок. Артериальная гипотензия — САД <90 мм рт. ст., признаки периферической вазоконстрикции — олигурия, цианоз, чрезмерное потоотделение.
Классификация по клинической степени тяжести
Классификация клинической степени тяжести базируется на оценке периферического кровообращения (перфузии тканей) и аускультации легких (застой в легких) (табл. 1.4). Пациентов разделяют на такие группы:
- класс I (группа A) (теплый и сухой);
- класс II (группа B) (теплый и влажный);
- класс III (группа L) (холодный и сухой);
- класс IV (группа C) (холодный и влажный).
Прогностическая ценность данной классификации доказана у больных с кардиомиопатией, и потому она может применяться для оценки состояния больных с декомпенсацией ХСН как в стационарных, так и в амбулаторных условиях.
Таблица 1.4
Классификация ОСН при ИМ
| Класс | Клинические признаки недостаточности | Частота, % | Смертность, % | Принципы фармакологического лечения |
| I | Хрипов в легких и третьего дополнительного тона нет | 33 | 8 | Не нуждается |
| II | Хрипы не более чем над 50% поверхности легких или третий тон | 38 | 30 | Уменьшение преднагрузки, в первую очередь с помощью диуретиков |
| III | Хрипы более чем над 50% поверхности легких (часто клиническая картина отека легких) | 10 | 44 | Уменьшение преднагрузки диуретиками и нитратами, а при отсутствии эффекта — повышение сердечного выброса негликозидными инотропными средствами |
| IV | Кардиогенный шок | 19 | 80–100 | В зависимости от клинического варианта, тяжести и типа гемодинамики разное сочетание инфузионной и инотропной терапии |
КЛИНИЧЕСКИЙ СИНДРОМ ОСН
ОСН является клиническим синдромом, который проявляется снижением сердечного выброса, тканевой гипоперфузией, повышением ДЗЛК при левожелудочковой недостаточности, застойными явлениями в тканях. Сердечная дисфункция может быть связана с систолической или диастолической миокардиальной дисфункцией, острой клапанной дисфункцией, перикардиальной тампонадой, нарушениями сердечного ритма и проводимости, изменениями в системе преднагрузки и постнагрузки. Множественная экстракардиальная патология также может привести к ОСН вследствие изменения нагрузки на сердце, например:
а) повышение постнагрузки в результате системной или легочной гипертензии или массивной ТЭЛА;
б) повышение преднагрузки через повышение объема крови и/или уменьшение выделения жидкости при патологии почек или эндокринной системы;
в) увеличение сердечного выброса при инфекционных процессах, тиреотоксикозе, анемии, болезни Педжета. СН может осложнять имеющуюся недостаточность других органов и систем. Тяжелая СН также индуцирует полиорганную недостаточность, которая является потенциально терминальным состоянием.
Адекватное продолжительное лечение, по возможности хирургическая коррекция патологии, лежащей в основе синдрома, могут предотвратить дальнейшее развитие ОСН и улучшить отдаленный неблагоприятный прогноз.
ПАТОФИЗИОЛОГИЯ ОСН
Конечным следствием синдрома ОСН является критическая неспособность миокарда поддерживать сердечный выброс, необходимый для поддержания адекватной периферической циркуляции. Для благоприятного клинического результата при ОСН необходимо, чтобы дисфункция миокарда была обратимой. Это особенно важно при ишемической ОСН, оглушении миокарда или его гибернации, поэтому этиологически правильное лечение приводит к обратному развитию миокардиальной дисфункции.
Оглушением миокарда называют миокардиальную дисфункцию (снижение сократительной способности миокарда) вследствие острой ишемии, которая может сохраняться даже при полном восстановлении коронарного кровотока. Интенсивность и продолжительность оглушения зависят от тяжести и продолжительности предыдущего ишемического эпизода.
Гибернацией («спящее состояние миокарда») называют нарушение функции миокарда, которое развивается в результате резкого снижения коронарного кровотока, несмотря на то что кардиомиоциты продолжают оставаться интактными. При улучшении кровотока и доставки кислорода к тканям сниженная сократительность миокарда в зоне нарушенного кровотока может восстановиться. Гибернация и оглушение миокарда могут сочетаться. При гибернации состояние со временем улучшается после восстановления кровотока и оксигенации ткани, тогда как в случае оглушения миокард сохраняет свой инотропный резерв и может реагировать на инотропную стимуляцию. Поскольку эти механизмы зависят от продолжительности ишемии миокарда, скорости восстановления кровотока и оксигенации, реваскуляризация является необходимым условием обратимости указанных патофизиологических изменений.
Таким образом ОСН включает комбинацию гемодинамических механизмов, а именно: снижение сердечной сократимости, увеличение диастолической дисфункции, периферическую вазоконстрикцию, задержку жидкости и/или Na+, что снижает перфузию и приводит к застою в легких.
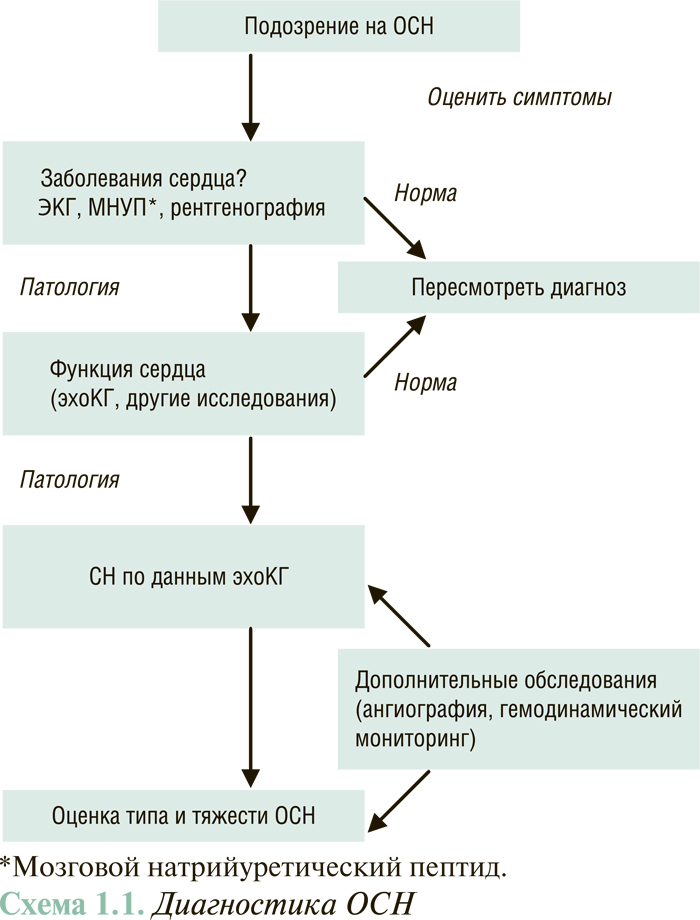
ДИАГНОСТИКА ОСН
Диагноз ОСН устанавливается на основе комплексного клинического обследования, которое включает данные анамнеза, результаты физикального обследования, инструментальных исследований (рентгенография грудной клетки, эхоКГ) и лабораторных анализов (схема 1.1).
По результатам регистров ADHERE, Euro Heart Survey и ряда небольших исследований наиболее часто отмечаемые симптомы представлены в табл. 1.5.
Таблица 1.5
Симптомы ОСН
| Одышка (при нагрузке, пароксизмальная ночная одышка, ортопноэ, одышка в состоянии покоя или отек легких) |
| Кашель |
| Тяжелое дыхание |
| Ощущение дискомфорта в ступнях и ногах |
| Ощущение дискомфорта в брюшной полости |
| Увеличение окружности живота |
| Вздутие живота пищей |
| Раннее насыщение пищей или анорексия |
| Боль или дискомфорт в правом подреберье |
| Увеличение массы тела |
| Повышенная утомляемость |
| Депрессия |
| Изменение интеллектуальных способностей, снижение концентрации внимания |
| Засыпание в течении дня |
| Расстройства сна |
| Ощущение сердцебиения |
| Головокружение, обморок или потеря сознания |
На схеме 1.2 представлена почасовая последовательность установления диагноза ОСН, начала терапии, оценки адекватности реакции на назначенную медикаментозную терапию и принятие решения о дальнейшем местопребывании больного. Диагноз ОСН должен быть установлен через 2 ч с момента госпитализации в БРИТ. Внутривенное применение лечебных средств следует начинать на протяжении также 2 ч после установления диагноза, а еще через 2 ч внутривенной терапии — оценить ее эффективность и при необходимости применить дополнительные меры. На протяжении последующих 6–8 ч необходимо продолжить оценку эффективности лечения.

ОСН следует классифицировать в соответствии с описанными далее критериями на систолическую и/или диастолическую дисфункцию (табл. 1.6), а также на лево/правожелудочковую недостаточность с застоем выше/ниже места повреждения.
Таблица 1.6
Оценка функции ЛЖ при ОСН
| Оценка функции ЛЖ — определение ФВ ЛЖ |
| Систолическая дисфункция ЛЖ |
| Транзиторная систолическая дисфункция |
| Диастолическая дисфункция |
Физикальное обследование
Общее состояние больного оценивается уже при сборе анамнеза. Обращают внимание на массу тела, которая может быть сниженной, вплоть до кахексии. При ожирении часто отмечают синдром апноэ во сне. Анасарка, иктеричность склер также часто сопровождают декомпенсированную СН.
Измерение АД является очень простым, но важным методом обследования пациентов с ОСН. Необходимо помнить о таких аспектах, как измерение АД в состоянии покоя, в положении сидя и горизонтальном положении, применении ортостатической пробы. Известно, что САД является важным предиктором прогноза у больных с ОСН. Нужно четко измерять и ДАД, поскольку по пульсовому давлению косвенно можно судить о сердечном выбросе.
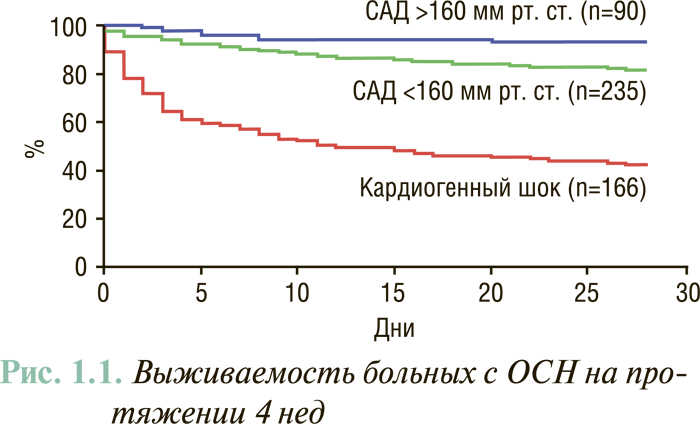
Определение ЧСС является очень важным при первичном обследовании больных с ОСН. Декомпенсация может быть результатом дигоксининдуцированной брадикардии, особенно у пациентов с почечной недостаточностью, передозировки блокаторов β-рецепторов, гипотиреоидизма или нарушения функции проводящей системы сердца. Наличие тахикардии может свидетельствовать о латентной инфекции, гипертиреоидизме (особенно при применении амиодарона), ТЭЛА, анемии, суправентрикулярной или желудочковой тахикардии или служить простым маркером тяжести декомпенсации СН, от чего также зависит прогноз (рис. 1.1).
Для определения ЧСС проводится мониторирование, поскольку часто отмечают дефицит пульса (разность между ЧСС и частотой пульсовых волн на периферических артериях); при пальпаторном методе можно получить недостоверные результаты. С целью определения адекватности сердечного выброса проводят пальпаторное исследование свойств пульса. Определение давления в яремных венах является наиболее часто употребляемым физикальным обследованием у пациентов с ОСН. Иногда с целью обоснования медикаментозной терапии проводят ежедневное измерение давления в яремных венах. Помимо того, что давление в яремных венах отражает давление в правом предсердии, оно ассоциируется с диастолическим наполнением, которое можно определить путем катетеризации правых отделов сердца, а именно давления заклинивания в легочных капиллярах. Изменение давления в яремных венах в ответ на нажатие в область середины живота от 10 до 15 с (правый верхний квадрант живота), так называемый гепатоюгулярный феномен, также довольно информативно, поскольку коррелирует с повышением давления в правых отделах сердца.
При аускультации легких часто выслушиваются влажные хрипы или крепитация на вдохе. В случае отсутствия хрипов при явной симптоматике декомпенсации сердечной деятельности застой в легких можно подтвердить рентгенологически.
Аускультация сердца дает возможность выявить больных с пороками клапанов сердца. У пациентов с ишемической или идиопатической ДКМП часто выявляют митральную регургитацию, которая может быть связана с перегрузкой объемом. В случаях, когда после интенсивной медикаментозной терапии сохраняется значительная регургитация, такие пациенты должны направляться на кардиохирургическое лечение.
Наличие дополнительного третьего тона отмечают у пациентов с низкой податливостью желудочков (жесткость миокарда), повышенным давлением наполнения желудочков или повышенным ранним диастолическим наполнением. Для оптимального выслушивания третьего тона пациента необходимо уложить на левый бок, найти точку максимальной пульсации верхушечного толчка, при выслушивании не прижимать головку фонендоскопа.
Выслушивание этого тона является важным у пациентов с ОСН, особенно для дальнейшего прогноза. Доказана его корреляция с уровнем МНУП — основного прогностического фактора СН. Наличие третьего тона у пациентов с выраженной дисфункцией ЛЖ ассоциируется с прогрессированием симптомов СН и является независимым предиктором осложнений, таких как госпитализация по поводу дестабилизации СН и смерть в результате насосной несостоятельности.
При обследовании больных с ОСН обращают внимание на конечности по двум причинам: для определения температуры и отеков. В зависимости от того, конечности теплые или холодные, судят об адекватности перфузии. Отеки являются классическим признаком декомпенсации ХСН, однако следует помнить, что отсутствие отеков не исключает диагноз ОСН.
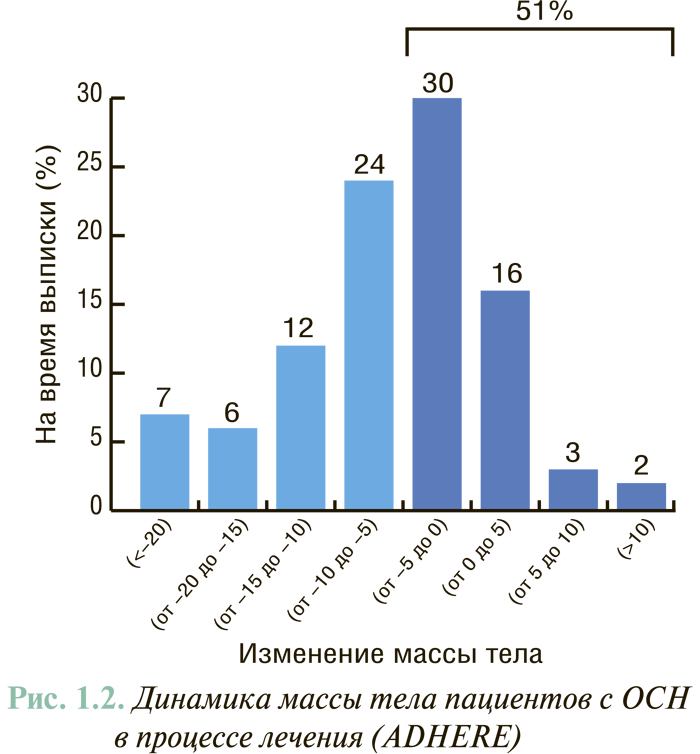
Определение массы тела пациента также является важным показателем, особенно в динамике лечения, так, по результатам регистра ADHERE (рис. 1.2), у половины пациентов не достигается снижение этого показателя.
ЭКГ
Общей целью применения ЭКГ-обследования у больных с ОСН является определение этиологии дисфункции ЛЖ (ишемическая или неишемическая кардиомиопатия). Как правило, у пациентов с систолической дисфункцией ЛЖ ЭКГ довольно редко бывает неизмененной. Поэтому нормальные показатели ЭКГ в состоянии покоя приблизительно у 95% свидетельствуют о сохраненной ФВ ЛЖ. Исторически считают наличие патологического зубца Q на стандартной ЭКГ в 12 отведениях как свидетельство перенесенного ранее ИМ вследствие коронарного атеросклероза. Однако такую картину могут часто отмечать у больных с неишемическими заболеваниями сердца. В таких случаях необходимо основываться на комплексе исследований. Присутствие патологического зубца Q не всегда коррелирует с ФВ ЛЖ. При подозрении на острый коронарный синдром регистрация ЭКГ обязательна. Для выявления этиологии ОСН помогает определение ритма и признаков перегрузки сердца. На ЭКГ определяются признаки увеличения нагрузки на ЛЖ или ПЖ, предсердие, признаки перикардита, гипертрофии желудочков. Наилучшим методом выявления нарушений ритма сердца является непрерывное мониторирование ЭКГ.
Рентгенография органов грудной клетки и другие визуализирующие методики
Рентгенография органов грудной клетки является наиболее простым и доступным методом исследования, который следует проводить у всех пациентов. Это исследование позволяет оценить признаки венозного застоя крови в малом кругу кровообращения, причем до появления выраженных клинических проявлений этого осложнения. Рентгенологически венозный застой крови в легких проявляется интенсивным затемнением корней и периферических отделов легких, а также значительным расширением легочных вен (рис. 1.3).
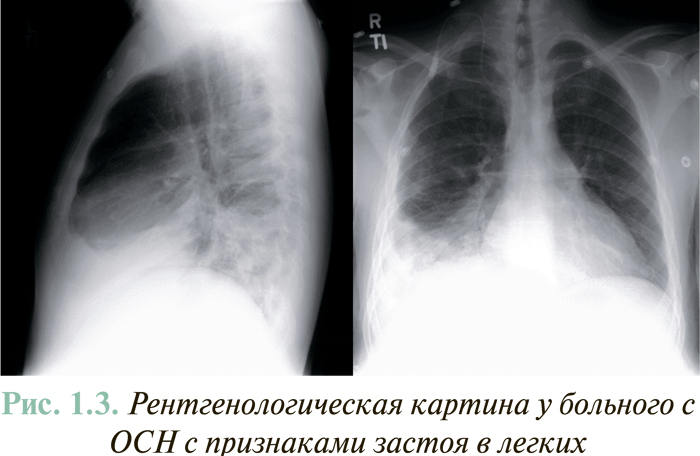
У пациентов с ХСН, даже при наличии повышенного давления заклинивания легочной артерии (ДЗЛА), как правило, отсутствуют рентгенологические признаки застоя в легких.
Также рентгенографию органов грудной клетки у больных с ОСН необходимо применять для выявления других потенциальных симптомов, прямо не связанных с СН, прежде всего пневмонии или ТЭЛА. Рентгенография используется как для подтверждения диагноза, так и для контроля лечения.
Другие визуализирующие методики, такие как КТ, ядерный магнитный резонанс, позитронная эмиссионная томография, радионуклидные исследования органов грудной клетки, контрастная ангиография, применяются для более точной диагностики легочной патологии и диагностики ТЭЛА.
Лабораторные исследования
Лабораторные исследования, которые необходимо выполнить при ОСН, приведены в табл. 1.7. Исследование газового состава артериальной крови (с помощью аппарата типа «Astrup») позволяет оценить степень оксигенации (рО2), адекватность дыхательной системы (рСО2), кислотно-основное состояние (pH), его нарушение. Таким образом, применение его рекомендовано всем пациентам с тяжелой СН. Неинвазивные методы исследования: пульсоксиметрия и определение CО2 в конце спокойного выдоха часто могут заменить применение «Astrup», но только не при патологических шоковых состояниях, а в случае сужения сосудов и очень низкого сердечного выброса.
Таблица 1.7
Лабораторное обследование пациентов с ОСН
| Общий анализ крови | Всегда |
| Содержание тромбоцитов | Всегда |
| Международное нормализованное отношение (МНО) | Если пациент получает антикоагулянты или при тяжелой СН |
| С-реактивный белок (СРБ) | Желательно |
| D-димер | При подозрении на ТЭЛА (может дать ложнопозитивный результат при повышении СРБ или при продолжительной госпитализации) |
| Мочевина, креатинин и электролиты (Na+, K+) | Всегда |
| Глюкоза крови | Всегда |
| МВ-КФК* или сердечные тропонины Т/I | Всегда при подозрении на острый коронарный синдром |
| Газовый состав артериальной крови | При тяжелой СН |
| Трансаминазы | Желательно |
| Общий анализ мочи | Желательно |
| МНУП или NT-проМНУП** в плазме крови | Желательно |
*МВ-фракция (сердечная) КФК; **фрагмент МНУП.
МНО = международное нормализованное отношение протромбинового времени.
Другие специфические исследования проводятся при дифференциальной диагностике или наличии недостаточности другого органа.
Активация физиологических компенсаторных механизмов вследствие повреждения миокарда, включающая РААС, симпатическую нервную систему (СНС), эндотелины и другие нейрогуморальные факторы, на сегодня довольно хорошо изучена. Развитие СН характеризуется комплексным балансом между вазодилататорными и вазоконстрикторными влияниями. Натрийурез, диурез и вазодилататорные механизмы уменьшают стрессорные влияния на сердце, но вместе с тем угнетают РААС, СНС, эндотелины, что ведет к периферической вазоконстрикции и гемодинамическим изменениям. Конечным результатом прогрессивного ухудшения функции сердца является нарастание симптомов СН. Значительную роль в этом звене играют НУП: А тип — атриальный (предсердный) натрийуретический пептид (ANP, ПНУП), В тип — мозговой (BNP, МНУП), которые имеют прямое отношение к миокардиоцитам, и С тип (CNP) — НУП эндотелиального происхождения. Базируясь на многих экспериментальных и клинических исследованиях, МНУП считается более чувствительным и специфическим индикатором миокардиального стресса.
Определение в плазме крови МНУП (вещества, которое образуется в желудочках сердца при механическом растяжении его стенок и перегрузке объемом) используется для исключения или подтверждения наличия СН у пациентов, госпитализированных в стационар с жалобами на одышку. Предельные значения составляют 300 пг/мл для NT-проМНУП и 100 пг/мл для МНУП, однако при определении этих предельных величин в исследования практически не были включены пациенты пожилого возраста. Во время развития отека легких значение МНУП до момента госпитализации пациента может быть нормальным. С другой стороны, МНУП имеет высокое отрицательное прогностическое значение при исключении СН. Различные клинические состояния могут влиять на концентрацию МНУП, например почечная недостаточность и септицемия. При определении повышенной концентрации МНУП необходимо проведение дальнейших диагностических тестов. Если диагноз ОСН подтвержден, повышенное содержание в плазме крови МНУП и NT-проМНУП имеет важное прогностическое значение.
Тропонины. Тропонины — это комплекс трех белковых субстанций: тропонин I, тропонин Т и тропонин С. Эти протеины играют ключевую роль в регуляции Са2+-опосредованного сокращения мышц. Большинство исследований, оценивающих повышение тропонинов, проводили по поводу острого коронарного синдрома и ХСН. Относительно ОСН диагностическое значение имеют Т- и I-тропонины, которые отмечают у 23–84% пациентов; отсутствие этих пептидов ассоциируется со значительно лучшим прогнозом у таких больных. Также существует тесная корреляция между повышением уровня тропонинов и гемодинамическими маркерами, такими как повышение ДЗЛА, повышенным уровнем ПНУП, снижением сердечного индекса.
Повышение уровня тропонинов ассоциируется с повреждением кардиомиоцитов, на которое обычно не влияет стандартное лечение СН. Поэтому будущая цель терапии должна включать определение уровня тропонинов как индикатора тяжести и продолжения повреждения кардиомиоцитов и как важный прогностический маркер ОСН.
На протяжении последнего десятилетия накоплено много данных о важной роли воспаления в патогенезе СН. Концепция, впервые предложенная в 1990 г. Levine и соавторами, заключалась в том, что декомпенсация СН сопровождается повышением уровня провоспалительных цитокинов, в первую очередь ФНО (TNF-α). С того времени значительно расширилось понимание многофакторного патогенеза и механизмов дестабилизации ХСН и роли активации воспаления в этом процессе. Известно, что уровень TNF-α повышается при состояниях, ассоциированных с дисфункцией ЛЖ, включая миокардит, сепсис, реакцию отторжения трансплантата. С физиологической точки зрения значительное повышение уровня TNF-a стимулирует апоптоз, угнетает сократительную способность миокарда. В ряде проведенных исследований показано, что повышение TNF-α является независимым маркером плохого прогноза у пациентов с тяжелой СН. Наравне с TNF-α важное значение имеют другие маркеры воспаления, а именно провоспалительный цитокин интерлейкина-6 (IL-6), который повышается у пациентов с острым ИМ, СН средней и тяжелой степени. Как показано в ряде исследований, повышение IL-6 является независимым предиктором смертности у пациентов с ХСН.
Наиболее исследованным реактантом острой фазы воспаления считается СРБ, который продуцируется в печени в ответ на повышение IL-6 и других воспалительных цитокинов и используется как показатель системной воспалительной активности. На сегодня в ряде исследований четко показана взаимосвязь между повышенным уровнем СРБ и кардиоваскулярными осложнениями, такими как нестабильная стенокардия и острый ИМ. Отдельное значение в патофизиологии СН имеет высокочувствительный CPБ (high-sensitive CRP — hsCRP), который считается идеальным биомаркером воспаления именно у пациентов с острой декомпенсированной СН. Повышение уровня (hsCRP) при госпитализации ассоциируется с тяжелым течением ОСН на протяжении госпитального периода и является независимым предиктором регоспитализации и смертности.
Существует еще одна гипотеза о том, что воспаление выступает основным фактором дестабилизации СН или по крайней мере ускоряет декомпенсацию СН. Хотя на сегодня она клинически не доказана, но имеет основания для существования. В первую очередь повышенный уровень циркулирующих провоспалительных маркеров может указывать на больных с высоким риском, что может использоваться с целью стратификации риска пациентов, у которых возможна декомпенсация СН, особенно в сочетании с другими клиническими данными. С другой стороны, недостаточное снижение маркеров воспаления при неотложной терапии ОСН может выявить больных с потенциально высоким риском отрицательного прогноза, которым возможно понадобится более агрессивное вмешательство или более тщательное наблюдение в динамике. Наконец, доказательства связи воспаления и декомпенсации СН следует использовать для разработки новых методов терапевтических вмешательств у пациентов с декомпенсированной СН и повышенным уровнем маркеров воспаления.
Эхокардиография
Проведение эхоКГ является важным методом выявления структурных и функциональных изменений, которые вызвали или возникли вследствие ОСН, а также при остром коронарном синдроме. ЭхоКГ с допплеровским исследованием следует использовать для изучения и мониторинга систолической и диастолической функций ЛЖ и ПЖ, структуры и функции клапанов сердца, выявления возможной патологии перикарда, механических осложнений острого ИМ и места повреждения. Сердечный выброс определяется с использованием соответствующих параметров допплеровского исследования на аорте и ЛА. Кроме того, при этом виде исследования можно определить давление в системе ЛА (по степени трикуспидальной регургитации) и с его помощью проводить мониторинг преднагрузки ЛЖ.
Часто у пациентов с тяжелым острым легочным застоем (отеком легких) или декомпенсированной СН определяют нормальную ФВ ЛЖ, так как у них преимущественно нарушена диастолическая функция. Рабочей группой Европейского общества кардиологов разработаны три критерия диагностики диастолической СН:
1 — признаки и симптомы СН;
2 — наличие нормальной левожелудочковой систолической функции;
3 — подтверждение аномального расслабления, наполнения или диастолической жесткости ЛЖ.
Другие методы исследования
Исследование инвазивных гемодинамических параметров — катетеризация правых отделов сердца и катетеры Swan-Ganz используются не очень часто вследствие инвазивности процедуры и необеспеченности терапевтических клиник необходимым оборудованием. Это базируется на результатах исследования Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness Study (ESCAPE), которое демонстрирует отсутствие краткосрочной или длительной пользы катетеризации правых отделов сердца у пациентов с тяжелой декомпенсированной СН. Соответственно на сегодня эффективность применения этой методики окончательно не определена. С другой стороны, ДЗЛА рассматривается как очень важный гемодинамический параметр у пациентов с ОСН. Тем более в исследовании ESCAPE ДЗЛА был сильным независимым предиктором летального исхода и регоспитализации.
При наличии патологии коронарных артерий, например нестабильной стенокардии или ИМ, важным является проведения ангиографии и определение необходимости реваскуляризационных процедур, значительно улучшающих прогноз.
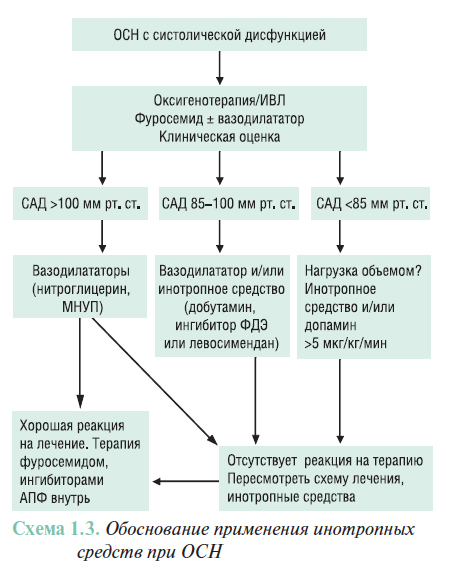
ЛЕЧЕНИЕ ПРИ ОСН
Цели лечения ОСН
Главная цель лечения — уменьшение выраженности клинических симптомов и стабилизация гемодинамики (табл. 1.8). Улучшение только гемодинамических параметров может привести к неправильным выводам, поэтому одновременно необходимо устранять одышку и/или слабость. Указанные положительные эффекты, которых можно достичь за короткое время, должны также сопровождаться благоприятными эффектами относительно отдаленных результатов. Этого можно достичь путем предотвращения или ограничения повреждения миокарда.
Таблица 1.8
Цель лечения пациентов с ОСН
| Клинические симптомы |
| ↓ жалобы (одышка и/или слабость)
↓ симптоматика ↓ масса тела ↑ диурез ↑ оксигенация крови |
| Лабораторные показатели |
| Нормализация электролитов сыворотки крови
↓ азота мочевины и/или креатинина ↓ билирубина ↓ МНУП в плазме крови Нормализация глюкозы крови |
| Гемодинамические показатели |
| ↓ ДЗЛК <18 мм рт. ст.
↑ сердечного выброса и/или ударного объема |
| Клинические результаты |
| ↓ продолжительность пребывания в отделении интенсивной терапии
↓ продолжительность госпитализации ↑ время до повторной госпитализации ↓ летальность |
| Переносимость |
| Высокая комплаентность
Низкая частота побочных эффектов |
Очень важным является также устранение других клинических симптомов, имеющихся у пациента: снижение массы тела, усиление диуреза — при застойных явлениях и олигурии на фоне ОСН. Повышение оксигенации крови, улучшение функции печени и почек, нормализация электролитного состава сыворотки крови также важны при лечении ОСН. Концентрация МНУП в плазме крови может отражать гемодинамическое улучшение, поэтому следует стремиться к снижению данного показателя.
Относительно клинических исходов важными являются показатели продолжительности внутривенной инфузии вазоактивных компонентов, продолжительность пребывания в стационаре, время до повторной госпитализации. Главная цель лечения — снижение как внутригоспитальной, так и отдаленной смертности.
Больные с ОСН нуждаются в неотложной медпомощи, наилучшие результаты при лечении таких пациентов достигаются с помощью привлечения специально обученного персонала в специализированных отделениях — БРИТ кардиологического профиля, где должен быть обеспечен доступ к максимальному количеству диагностических обследований — эхоКГ, коронарная ангиография, при необходимости инвазивное мониторирование гемодинамики.
Очень важным фактором является то, насколько быстро пациент получает догоспитальную помощь, когда поступает в специализированное отделение и как быстро начинается внутривенная терапия. Имеющиеся данные свидетельствуют о том, что раннее внутривенное введение вазоактивных препаратов снижает продолжительность пребывания в стационаре. Анализ данных 1414 больных, включенных в исследование ADHERE, показал, что этот показатель был на 3,1 сут меньше при внутривенном введении вазодилататоров, незиритида или инотропных препаратов в БРИТ, чем при начале такой терапии в профильном отделении (6,3±6,5 и 9,4±10,9 сут соответственно, р<0,05).
Мониторинг состояния пациента с ОСН следует начинать как можно раньше после поступления пациента в стационар, одновременно с необходимыми диагностическими и лечебными мероприятиями. Тип и степень мониторинга определяется индивидуально в каждом конкретном случае и зависит от степени декомпенсации и ответа на начальную терапию.
У всех пациентов, которые находятся в критическом состоянии, необходимо проводить мониторинг АД, ЧСС, температуры тела, частоты дыхания, параметров ЭКГ. Ряд лабораторных исследований время от времени необходимо повторять, например определение электролитов, креатинина, глюкозы, маркеров воспаления и других метаболических нарушений. Обязательно необходимо контролировать уровень калия. Использование современного автоматического оборудования позволяет проводить это быстро и четко. Если состояние больного ухудшается, необходимо увеличить частоту обследований. Мониторинг ЭКГ (ЧСС, аритмии и сегмент ST) необходим в фазе декомпенсации, особенно если ишемия и аритмия являются следствием острого события.
Поддержка нормального АД необходима в начале лечения, и в дальнейшем определение этого параметра следует проводить регулярно (например каждые 5 мин) до тех пор, пока терапия вазодилататорами, диуретиками или инотропными средствами не стабилизирует данный показатель. Надежность неинвазивного автоматического определения АД с помощью плетизмографии высокая при отсутствии выраженной вазоконстрикции и высокой ЧСС.
Пульсоксиметр — простое неинвазивное устройство, которое определяет сатурацию гемоглобина в артериальной крови (SaO2). Пульсоксиметрию необходимо проводить непрерывно любому пациенту, который находится в нестабильном состоянии, или при респираторной поддержке с концентрацией кислорода во вдыхаемом воздухе (FiO2) больше, чем в окружающей среде. Также необходимо проводить измерение данного показателя через определенные промежутки времени (каждый час) любому пациенту, который получает оксигенотерапию в связи с острой декомпенсацией. Сердечный выброс и параметры преднагрузки мониторируются неинвазивным способом с применением допплеровских методик. Не существует доказательства преимуществ какой-нибудь из этих методик при мониторировании пациента, а также сведений об ограничении их использования.
Часть пациентов для мониторирования необходимых жизненно важных параметров или контроля адекватности терапии нуждается в инвазивных вмешательствах: артериальный катетер, центральный венозный катетер, катетеризация ЛА.
Показанием к введению артериального катетера является необходимость непрерывного анализа АД вследствие гемодинамической нестабильности или повторного лабораторного исследования артериальной крови.
Центральный венозный катетер позволяет получить доступ к венозной крови и таким образом его установление полезно при объемной инфузионной терапии, введении различных лекарственных средств, мониторинге ЦВД и определении венозной сатурации кислорода (SvO2) в верхней полой вене или правом предсердии, что дает важные сведения о транспорте кислорода.
Как было указано ранее, необходимо с осторожностью относиться к интерпретации результатов определения давления в правом предсердии, так как этот показатель у пациентов с ОСН очень слабо коррелирует с давлением в левом предсердии и давлением наполнения ЛЖ. Измерение ЦВД будет неинформативным при трикуспидальной регургитации и вентиляции легких в режиме положительного давления в конце выдоха (ПДКВ).
Катетер в ЛА (КЛА) является флотирующим баллонным катетером, с помощью которого можно измерить давление в верхней полой вене, правом предсердии, ПЖ, ЛА, а также определить сердечный выброс. Современные катетеры позволяют определять сердечный выброс в полунепрерывный способ, оценивать насыщение кислородом смешанной венозной крови, конечное диастолическое давление и ФВ ПЖ.
Хотя установка КЛА для диагностики ОСН обычно не является необходимой, ее можно использовать для дифференциации кардиогенных и некардиогенных причин у пациентов с сопутствующей патологией или заболеваниями легких. КЛА также используется для определения ДЗЛА, сердечного выброса и других гемодинамических параметров как проводник для терапии при диффузных заболеваниях легких и гемодинамической нестабильности, несмотря на лечение, которое проводится. ДЗЛА не отображает конечное диастолическое давление в ЛЖ у пациентов с митральным стенозом, аортальной регургитацией, межжелудочковым шунтом, высоким давлением в дыхательных путях или избыточной жесткостью ЛЖ при его гипертрофии, сахарном диабете, фиброзе эндокарда, введении инотропных средств, ожирении, ишемии. Значительная трикуспидальная регургитация, часто выявляющаяся у пациентов с ОСН, также может влиять на определение сердечного выброса методом термодилюции.
Использование КЛА рекомендуется пациентам с гемодинамической нестабильностью и неудовлетворительным ответом на классическую терапию, а также у пациентов с комбинацией застоя и гипоперфузии. В этих случаях установление катетера является необходимым для принятия решения относительно оптимальной инфузионной терапии и для контроля введения вазоактивных и инотропных средств (табл. 1.9).
Таблица 1.9
Общие терапевтические подходы при использовании инвазивного мониторинга при ОСН
| Гемодинамическая характеристика | Терапевтический подход | ||||
| Сердечный индекс | Сниженный | Сниженный | Сниженный | Сниженный | Сохраненный |
| ДЗЛА | Низкое | Высокое или нормальное | Высокое | Высокое | Высокое |
| САД, мм рт. ст. | >85 | <85 | >85 | ||
| Тип лечения | Объемная инфузия | Вазодилататоры (нитроглицерин), при необходимости — нагрузка жидкостью | Инотропные средства (добутамин, допамин) и диуретики внутривенно | Вазодилататоры (нитроглицерин), диуретики, инотропные средства (добутамин, левосимендан) | Внутривенно диуретики. Если САД низкое — инотропные средства с вазоконстрикторным действием |
При ОСН: снижение сердечного индекса — <2,2 л/мин/м2, ДЗЛА — низкое, если <14 мм рт. ст., высокое — если >18–20 мм рт. ст.
Оксигенотерапия и вспомогательное дыхание
Оксигенотерапия
Поддержание SaO2 в нормальных границах (95–98%) очень важно для обеспечения нормального транспорта кислорода к тканям и их оксигенации, что предотвращает дисфункцию органов и полиорганную недостаточность.
Вначале следует обеспечить проходимость дыхательных путей и назначить оксигенотерапию с возрастающей концентрацией кислорода НО2. Эндотрахеальная интубация необходима, если эти мероприятия не обеспечивают надлежащей оксигенации тканей.
Ингаляция высоких концентраций кислорода пациенту с СН и гипоксемией безусловно необходима, но ее использование у больных без признаков гипоксемии может наносить ущерб и ее следует избегать.
Вспомогательное дыхание
Для респираторной поддержки без эндотрахеальной интубации (неинвазивная вентиляция легких (НВЛ)) используются две основные методики: режим непрерывного положительного давления (НПД) при адекватном спонтанном дыхании и неинвазивная масочная вентиляция легких (НИМВЛ). НИМВЛ позволяет проводить механическую вентиляцию без эндотрахеальной интубации. Существует бесспорное мнение о том, что одну из этих методик всегда необходимо использовать перед интубацией трахеи и проведением ИВЛ. Использование неинвазивных методик позволило значительно снизить необходимость в интубации трахеи и проведении ИВЛ.
Использование НПД способно восстановить функцию легких и приводит к повышению функционального остаточного объема. Уменьшается жесткость легких, снижается градиент трансдиафрагмального давления, снижается активность диафрагмы. Это обусловливает уменьшение работы, связанной с дыханием, и приводит к общему уменьшению метаболических потребностей организма.
Респираторная поддержка в режиме НПД у пациентов с левожелудочковой недостаточностью (кардиогенный отек легких) улучшает оксигенацию, уменьшает выраженность симптоматики ОСН, а также приводит к уменьшению потребности в эндотрахеальной интубации.
Инвазивную респираторную поддержку (ИВЛ с эндотрахеальной интубацией) не следует использовать для уменьшения гипоксемии, так как этого можно достичь, используя НВЛ или оксигенотерапию. Такую методику необходимо применять при ОСН-индуцированной слабости дыхательных мышц. Слабость дыхательных мышц проявляется снижением частоты дыхания, ассоциированным с гиперкапнией и нарушением сознания. ИВЛ могут применять лишь в том случае, когда острая дыхательная недостаточность не устраняется при введении вазодилататоров, оксигенотерапией и/ или НВЛ в режимах НПД и НИМВЛ. Кроме того, иногда существует необходимость в немедленной инвазивной вентиляции при отеке легких вследствие ИМ с элевацией сегмента ST.
Медикаментозная терапия
Морфин и его аналоги
Применение морфина или его аналогов рекомендовано на ранних стадиях лечения пациентов с тяжелой ОСН, особенно при наличии возбуждения и выраженной одышки. Морфин вызывает венозную и умеренную артериальную дилатацию, а также снижает ЧСС. В большинстве исследований морфин вводили внутривенно болюсно сразу же после введения внутривенного катетера. При необходимости возможно повторное введение.
Диуретики
Сердечная декомпенсация характеризуется снижением систолической функции ЛЖ, а во многих случаях аномальной диастолической функцией. В результате снижения сердечного выброса и повышения конечного диастолического давления в ЛЖ появляется субстрат для задержки Na+ в организме. Снижение сердечного выброса и повышение ОПСС приводит к снижению почечного кровотока, что в свою очередь активирует нейрогуморальную систему (медиаторы, вызывающие вазоконстрикцию) и повышает секрецию альдостерона. Поэтому увеличивается общий объем жидкости в организме, в частности объем плазмы крови, то есть гемодинамическая реакция является основой для задержки Na+ в организме.
Снижение скорости клубочковой фильтрации (СКФ) при СН обладает высокой степенью корреляции с гемодинамическими параметрами. Значительное снижение сердечного выброса и почечного кровотока ассоциируется со значительным снижением СКФ. Нейрогуморальные факторы, способствующие задержке Na+ и жидкости, включают альдостерон, вазопресин, ангиотензин II, норэпинефрин и вазоконстрикторные простагландины. Наоборот, простациклин, допамин и предсердный натрийуретический гормон оказывают содействие экскреции Na+.
Внутривенное введение диуретиков уменьшает выраженность симптомов ОСН, поэтому их следует применять в качестве препаратов первого ряда при наличии признаков застоя в легких и периферических отеках, обусловленных задержкой жидкости в организме. Однако в настоящее время ограничены данные о способности такой терапии улучшать прогноз у этих больных. Доказано, что применение диуретиков в высоких дозах приводит к нейрогормональной активации и способствует системному сосудосуживающему эффекту. Соответственно на фоне их применения улучшение гемодинамики может быть недостаточно выраженным, а устранение симптомов — неполным (толерантность к действию диуретиков).
Диуретики увеличивают объем отделяемой мочи вследствие усиления выделения жидкости, натрия и других ионов. Это приводит к уменьшению объема плазмы крови и внутрисосудистого объема, снижению общего содержания воды и натрия в организме, давления наполнения ПЖ и ЛЖ сердца, уменьшению выраженности застоя и отека легких. Внутривенное введение петлевых диуретиков также оказывает вазодилатирующий эффект, который проявляется ранним (через 5–30 мин) снижением давления в правом предсердии и ДЗЛА, а также снижением легочного сопротивления. При болюсном введении фуросемида в высоких дозах (>1 мг/кг) существует риск развития рефлекторной вазоконстрикции. При остром коронарном синдроме диуретики необходимо использовать в низких дозах, преимущественно внутривенно.
Внутривенное введение петлевых диуретиков (фуросемида, торасемида) вызывает выраженный диуретический эффект и является методом выбора у пациентов с ОСН. Введение ударной дозы с последующей инфузией фуросемида или торасемида более эффективно по сравнению только с болюсным введением. Такую терапию можно безопасно начинать перед госпитализацией пациента, а дозу препарата необходимо титровать до достижения диуретического эффекта и уменьшения выраженности симптомов застоя. В табл. 1.10 приведена фармакокинетика диуретиков при внутривенном введении.
Таблица 1.10
Фармакокинетика диуретиков при внутривенном введении
| Препарат | Доза, мг | Время начала действия, мин | Время достижения максимального эффекта, мин | Продолжительность действия, ч |
| Петлевые диуретики | ||||
| Этакриновая кислота | 50–100 | 5 | 15–30 | 2 |
| Фуросемид | 20–120 | 5 | 30 | 2 |
| Торасемид | 20–100 | 5 | 15–30 | 4–6 |
| Буметанид | 0,5–1,0 | 5 | 30–45 | 2 |
| Тиазидные диуретики | ||||
| Хлоротиазид | 250–500 | 15 | 30 | 2 |
Тиазидные диуретики, спиронолактон и эплеренон (у больных с ИМ и после него) могут использовать в комбинации с петлевыми диуретиками. Комбинация диуретиков в низких дозах более эффективна и реже вызывает побочные эффекты по сравнению с применением одного диуретика в высоких дозах. Использование петлевых диуретиков одновременно с добутамином, допамином или органическими нитратами также способствует повышению эффективности фармакотерапии. При уменьшении выраженности симптомов задержки жидкости в организме необходимо снижение дозы.
Контроль уровня ионов K+ и Na+ в сыворотке крови, а также оценку функции почек необходимо проводить регулярно с короткими интервалами (через каждые 1–2 дня) в зависимости от реакции на лечение. В табл. 1.11 приведены рекомендуемые дозы диуретиков, наиболее часто применяемых при СН.
Таблица 1.11
Дозирование и способ введения диуретиков
| Степень задержки жидкости в организме | Препарат | Доза, мг | Комментарии |
| Умеренно выраженная | Фуросемид | 20–40 | Внутрь или внутривенно в зависимости от клинической симптоматики |
| Буметанид | 0,5–1,0 | Титрование дозы в зависимости от клинической реакции | |
| Торасемид | 10–20 | Регулярный контроль уровня K+, Na+ и креатинина в сыворотке крови и АД | |
| Тяжелая | Фуросемид | 40–100 | Внутривенно |
| Фуросемид (инфузия) | 5–40/ч | Предпочтительнее, чем болюсное введение в высокой дозе | |
| Буметанид | 1–4 | Внутрь или внутривенно | |
| Торасемид | 20–100 |
Внутрь |
|
| Рефрактерная к петлевым диуретикам | Добавить гидрохлоротиазид | 25–50 2 раза в сутки | Комбинация с петлевыми диуретиками предпочтительнее, чем монотерапия петлевыми диуретиками в высоких дозах |
| или | |||
| Спиронолактон | 25–50 1 раз в сутки | ||
| или | Спиронолактон является средством выбора при отсутствии у пациента почечной недостаточности и гиперкалиемии у больных с ИМ и после него | ||
| Эплеренон | 50 1 раз в сутки | ||
| В случае алкалоза | Ацетазоламид | 500 мг | Внутривенно |
| Рефрактерная к петлевым и тиазидным диуретикам | Добавить допамин для дилатации почечных сосудов или добутамин как инотропное средство | При почечной недостаточности рекомендуется проведение ультрафильтрации или гемодиализа |
Резистентность к диуретикам определяется как клиническое состояние, при котором реакция организма на диуретики снижена или утрачена до того, как достигнута терапевтическая цель — устранение отека. Такая толерантность ассоциируется с плохим прогнозом. Чаще отмечают у пациентов с тяжелой ХСН при продолжительной диуретической терапии, хотя также отмечается и при острой гиповолемии после внутривенного введения петлевых диуретиков. Резистентность к диуретикам может быть вызвана влиянием ряда факторов (табл. 1.12).
Таблица 1.12
Причины развития рефрактерности к диуретикам
| Уменьшение внутрисосудистого объема (гиповолемия)
Нейрогормональная активация Обратная реабсорбция ионов Na+ после уменьшения объема циркулирующей крови Гипертрофия дистальных отделов нефрона Снижение канальцевой секреции (почечная недостаточность, применение НПВП) Снижение перфузии почек (низкий сердечный выброс) Нарушение всасывания пероральных форм диуретиков Несоблюдение схемы лечения или диеты (потребление большого количества натрия) |
Терапевтические подходы к преодолению резистентности к диуретикам представлены в табл 1.13. В клинической практике может быть целесообразным применение разных стратегий с учетом индивидуального подхода к каждому пациенту.
Таблица 1.13
Преодоление рефрактерности к диуретикам
| Ограничение потребления натрия и воды, контроль электролитного баланса крови
Восполнение дефицита жидкости при гиповолемии Повышение дозы и/или частоты применения диуретиков Использование внутривенной инфузии (более эффективна, чем болюсное введение или прием внутрь) Комбинированная диуретическая терапия:
Комбинация диуретика с допамином или добутамином Снижение дозы ингибитора АПФ или применение ингибиторов АПФ в очень низких дозах Если вышеприведенные способы неэффективны, следует решить вопрос о проведении ультрафильтрации или гемодиализа |
Хотя диуретики можно безопасно применять у большинства пациентов, в ряде случаев возможно развитие побочных эффектов, которые иногда могут представлять угрозу для жизни. К ним относятся: активация нейрогормональных систем (ангиотензин-альдостероновой, симпатической); гипокалиемия, гипомагниемия и гипохлоремический алкалоз, который может привести к развитию опасной аритмии; нефротоксическое действие и прогрессирование почечной недостаточности. Чрезмерно повышенный диурез может привести к значительному снижению венозного давления, ДЗЛА и диастолического наполнения, что вызывает уменьшение ударного объема и сердечного выброса, особенно у пациентов с тяжелой СН и преимущественно диастолической недостаточностью или ишемической дисфункцией ПЖ.
Вазодилататоры в лечении ОСН
Вазодилататоры показаны больным с ОСН как терапия первой линии. Внутривенное введение вазодилататоров дает возможность быстро вывести больного из состояния декомпенсации за счет улучшения гемодинамики. Применение вазодилататоров статистически значимо уменьшает давление наполнения желудочков сердца — давление заклинивания в легочных капиллярах, то есть преднагрузку, на протяжении 24–48 ч и уменьшает потребность миокарда в кислороде. Такая терапия позволяет снизить ОПСС (или постнагрузку) и объем нагрузки ЛЖ, увеличить УОК и МОК. Вазодилататоры также рекомендуют большинству пациентов с ОСН в том случае, если гипоперфузия сочетается с нормальным АД, явлениями застоя в легких и сниженным диурезом. В этих случаях применение вазодилататоров увеличивает периферическую циркуляцию и уменьшает преднагрузку (табл. 1.14).
Таблица 1.14
Показания к назначению вазодилататоров при ОСН и их дозирование
| Вазодилататор | Показания | Дозирование | Побочные эффекты | Комментарий |
| Нитроглицерин | ОСН при нормальном АД | Начальная скорость инфузии — 20 мкг/мин с постепенным повышением до 200 мкг/мин | Артериальная гипотензия, головная боль | Безопасен, при постоянном применении развивается толерантность |
| Изосорбида динитрат | ОСН при нормальном АД | Начальная скорость инфузии — 1 мг/ч c постепенным повышением до 10 мг/ч | Гипотензия, головная боль | Безопасен, при постоянном применении развивается толерантность |
| Нитропруссид натрия | Гипертензивный криз, кардиогенный шок (в сочетании с инотропными средствами) | 0,3–5 мкг/кг/мин | Артериальная гипотензия, токсическое действие, обусловленное изоцианатом | Чувствителен к воздействию света |
| Незиритид | Острая декомпенсированная СН | Внутривенно болюсно в дозе 2 мкг/кг + внутривенно капельно со скоростью 0,015–0,03 мкг/кг/мин | Артериальная гипотензия |
Органические нитраты. Нитраты уменьшают застой в легких без неблагоприятного влияния на ударный объем сердца и потребность миокарда в кислороде, что особенно важно при остром коронарном синдроме. В низких дозах они вызывают дилатацию только венозных сосудов, при увеличении дозы — также и артерий, в том числе коронарных. При назначении в адекватных дозах нитраты позволяют сохранить баланс между дилатацией артериального и венозного русла, что ведет к уменьшению преднагрузки и постнагрузки на сердце без ухудшения тканевой перфузии. Титрование дозы нитрата до максимальной гемодинамически переносимой дозы в сочетании с применением фуросемида в низкой дозе более эффективно, чем монотерапия диуретиком в высокой дозе.
По результатам одного рандомизированного исследования применения фуросемида и болюсного парентерального введения изосорбида динитрата было показано, что внутривенное введение нитратов в высоких дозах было эффективнее терапии фуросемидом относительно устранения тяжелого отека легких.
При применении в субоптимальних дозах вазодилататоры могут оказывать ограниченный эффект в отношении предотвращения рецидивов ОСН. Однако введение нитратов в высоких дозах также может привести к снижению их эффективности. Главным недостатком нитратов является быстрое развитие толерантности к ним, особенно при внутривенном введении в высоких дозах, которое ограничивает их эффективность только 16–24 ч, когда дальнейшее введение требует применения более высоких доз. Вместе с тем неадекватная вазодилатация может вызвать резкое снижение АД, приводящее к нестабильности гемодинамики.
Нитроглицерин выпускается в формах для приема внутрь/сублингвально и для ингаляционного введения (спрей нитроглицерина в дозе 400 мкг (2 нажатия) каждые 5–10 мин под контролем АД). Внутривенное введение нитратов (нитроглицерин со скоростью 20 мкг/мин с постепенным повышением дозы до 200 мкг/мин или изосорбида динитрата со скоростью 1–10 мг/ч) следует применять чрезвычайно осторожно, при постоянном контроле уровня АД, титруя дозу препарата для предотвращения артериальной гипотензии. Особой осторожности необходимо придерживаться при применении нитратов у пациентов с аортальным стенозом, их назначают только по строгим показаниям.
Дозу нитратов следует снизить, если уровень САД снижается ниже 90—100 мм рт. ст. и полностью отменить при дальнейшем снижении АД.
Нитропруссид натрия. Применять нитропруссид натрия рекомендуют у пациентов с тяжелой СН, а также у больных с преобладающим повышением постнагрузки, прежде всего при АГ с СН или при митральной регургитации. Дозу нитропруссида натрия необходимо титровать с осторожностью при обязательном условии мониторинга АД и постоянном наблюдении за состоянием пациента. Продолжительное введение препарата может сопровождаться проявлениями токсического действия его метаболитов — тиоцианида и цианида, поэтому с особенной осторожностью его следует применять у пациентов с тяжелой печеночной или почечной недостаточностью. Дозу нитропруссида натрия необходимо снижать постепенно для предотвращения развития синдрома отмены. При ОСН, обусловленной острым коронарным синдромом, предпочтительнее применять нитраты, чем нитропруссид натрия, поскольку последний может вызвать развитие синдрома коронарного обкрадывания.
Незиритид — представитель нового класса вазодилататоров, препарат рекомбинантного МНУП человека, который относительно недавно включен в арсенал средств, применяемых при ОСН (рис. 1.4). МНУП вырабатывается в желудочках сердца в ответ на повышение напряжения его стенок при перегрузке объемом, обусловленным ОСН.
При внутривенном введении незиритид расширяет венозные, артериальные, в том числе коронарные сосуды, что приводит к снижению пред- и постнагрузки и повышению сердечного выброса без прямого инотропного эффекта. Этим уменьшается выраженность симптомов ОСН, прежде всего одышки, и улучшается клиническое состояние. Поскольку в рекомендуемых дозах незиритид оказывает предсказуемое и продолжительное действие, его применение обычно не требует подбора скорости инфузии и инвазивного контроля гемодинамики. Соответственно при терапии незиритидом не требуется столь тщательный контроль, как при использовании других вазодилататоров (нитроглицерина или нитропруссида натрия), и пребывание больного в БРИТ.
В клинических исследованиях при участии более чем 1000 больных с ОСН его внутривенное введение значительно снижало системное сосудистое сопротивление, давление в правом предсердии, а также ДЗЛК, увеличивало сердечный выброс, натрийурез и диурез, что способствовало быстрому улучшению клинического состояния больных. Незиритид у этих больных снижал повышенный уровень нейрогормонов в крови.
Препарат не влияет на ЧСС, не повышает потребления кислорода миокардом, в отличие от добутамина не обладает проаритмическим действием, а в отличие от нитроглицерина не вызывает развития тахифилаксии. Основным его эффектом является дозозависимое снижение АД.
Следует отметить, что наряду с преимуществами препарат имеет ряд недостатков. Так, по данным исследования, опубликованного в 2000 г., незиритид увеличивает 30-дневную смертность, которая при его применении составила 7,1%, по сравнению с 4,8% в группе плацебо (р=0,62). В эти же сроки в группе, получавшей незиритид, отмечали большую частоту случаев существенного ухудшения функции почек (р=0,04).
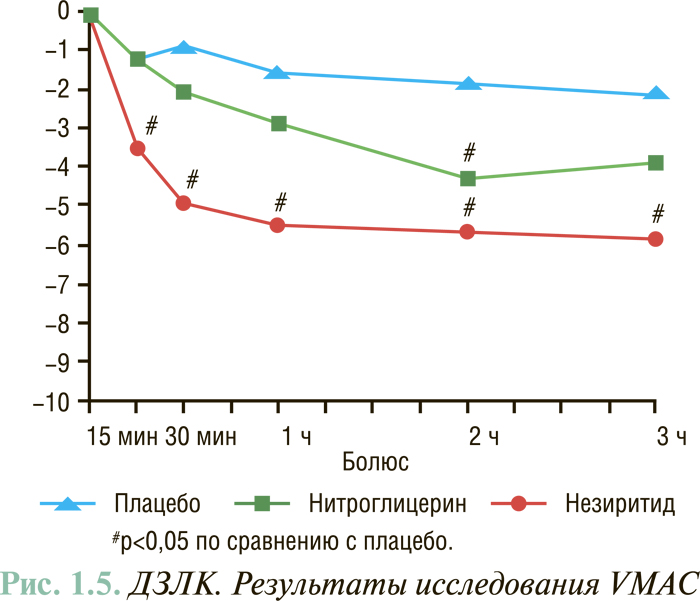
В более масштабном исследовании VMAC (Vasodilatation in the Management of Acute Congestive Heart Failure) принимали участие 498 пациентов с одышкой в состоянии покоя. Терапию незиритидом сравнивали с внутривенным введением нитроглицерина или плацебо. Результаты исследования представлены в табл. 1.15.
Таблица 1.15
Средние геодинамические изменения по сравнению с исходными данными
| Эффект через 3 ч | Плацебо (n=62) | Нитроглицерин (n=62) | Незиритид (n=62) |
| Давление заклинивания в легочных капиллярах, мм рт. ст. | –2,0 | –3,8 | –5,8* |
| Давление в правом предсердии, мм рт. ст. | 0 | –2,6 | –3,1* |
| Сердечный индекс, л/мин/м2 | 0 | 0,2 | 0,1 |
| Среднее давление в ЛА, мм рт. ст. | –1,1 | –2,5 | –5,4* |
| Системное сосудистое сопротивление, дин·с-1·см-5) | –44 | –105 | –144 |
| САД, мм рт. ст. | –2,5 | –5,7* | –5,6* |
*р<0,05 по сравнению с группой плацебо.
Исследование не продемонстрировало преимуществ незиритида перед нитроглицерином относительно влияния на частоту летальных исходов или повторных госпитализаций на протяжении 30 дней. Продолжительность пребывания в стационаре была большей в группе пациентов, получавших незиритид, по сравнению с группой, получавшей нитроглицерин (10 и 8,1 дня соответственно, р=0,008). Повышение уровня креатинина в плазме крови более чем на 44,2 ммоль/л было отмечено у 27% пациентов группы, получавшей незиритид, и у 21% пациентов контрольной группы (р=0,11). Смертность на протяжении 30 дней при применении незиритида составила 8,6%, а в группе контроля — 5,5% (относительный риск 1,56 при 95% доверительном интервале 0,75–3,24; р=0,2).
В исследовании VMAC (Vasodilatation in the Management of Acute Congestive Heart Failure study) показано, что внутривенное введение незиритида по сравнению с нитроглицерином приводило к статистически более выраженному снижению ДЗЛК на протяжении первых 15 мин, которое сохранялось в течение 24 ч (рис. 1.5). Через 48 ч в группе незиритида ДЗЛК также было ниже, чем в группе нитроглицерина. Степень уменьшения выраженности симптомов через 3 и 24 ч в обеих группах была одинаковой. В целом, применение незиритида по сравнению с нитроглицерином реже сопровождалось развитием побочных эффектов, хотя частота возникновения артериальной гипотензии в обеих группах была одинаковой.
Кроме того, результаты клинических исследований указывают на то, что применение незиритида может снижать частоту повторных госпитализаций по поводу ОСН. Так, в исследовании VMAC частота повторных госпитализаций по поводу ОСН на протяжении 30 дней в группах незиритида и плацебо составила 7 и 13% соответственно. Во втором исследовании были получены подобные данные, частота повторных госпитализаций по поводу СН в группах незиритида и добутамина составила 4 и 13% соответственно (р=0,081). В исследовании PROACTION (Prospective Randomized Outcomes Study of Acutely Decompensated Congestive Heart Failure Treated Initially in Outpatients with Natrecor) применение незиритида по сравнению со стандартной терапией снижало частоту повторных госпитализаций на протяжении 30 дней на 57% (р=0,058). Хотя во всех указанных исследованиях положительный эффект незиритида не достигал уровня статистической значимости, полученные данные свидетельствуют о целесообразности проведения дальнейших исследований этого препарата.
Учитывая это, можно сделать вывод, что незиритид эффективен относительно улучшения гемодинамических параметров, но его применение не способствует улучшению клинических результатов. На сегодня препарат может быть рекомендован только для кратковременного применения. В общем, окончательная оценка будет зависеть от результатов недавно начатого исследования. Кроме того, препарат пока не зарегистрирован в Украине.
Поскольку внутривенное введение вазодилататоров приводит к быстрому улучшению гемодинамики и уменьшению выраженности симптомов, эти препараты следует применять на ранних этапах лечения ОСН. Такая терапия показана при недостаточной эффективности внутривенного введения диуретиков или при наличии умеренных или выраженных проявлений застоя, но лишь в тех случаях, когда уровень САД превышает 90 мм рт. ст.
Инотропные средства
Создание новых негликозидных инотропных препаратов, таких как дериваты катехоламинов (допамин, добутамин), агонисты β-адренорецепторов (преналтерол, ксамотерол), несколько поколений ингибиторов ФДЭ (амринон, мильринон, эноксимон, веснаринон), сенситизаторы кальция (пимобендан, левосимендан), позволило достичь более значительного повышения сократимости миокарда, чем при использовании гликозидов, не вызывая побочных реакций, присущих последним. Тем не менее, результаты многочисленных исследований показали, что использование мощных положительных инотропных препаратов в лечении СН возможно лишь в виде коротких курсов, когда резкое повышение сердечного выброса позволяет добиться повышения диуреза и выведения пациента из состояния тяжелой декомпенсации. Однако чем сильнее инотропный эффект этих препаратов, тем больше они повышают смертность больных с СН при длительном лечении. Отрицательное влияние длительного применения негликозидных инотропных стимуляторов на прогноз больных с СН был доказан во многих многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследованиях.
В связи с вышесказанным были сформулированы представления об идеальном инотропном средстве, согласно которому оно должно:
- повышать сократимость миокарда;
- повышать сердечный выброс;
- оптимизировать периферическое кровообращение;
- уменьшать застой в легких;
- не вызывать аритмогенного эффекта;
- не вызывать тахикардию;
- устранять или снижать клинические проявления СН;
- предотвращать развитие СН;
- повышать выживаемость и качество жизни.
Исторически препараты с положительным инотропным действием составляли основу дополнительной терапии ОСН, поскольку они улучшают гемодинамические показатели, в первую очередь повышают МОК (схема 1.3).
В качестве резервных для лечения больных с низким и очень низким МОК следует рассматривать инотропные лекарственные средства, поскольку убедительных данных о целесообразности их применения нет, а использование повышает частоту развития побочных эффектов. Так, применение милринона часто приводит к артериальной гипотонии, поэтому при САД <90 мм рт. ст. целесообразнее использовать добутамин. При достаточном уровне АД выбор инотропного препарата должен определяться
наличием или отсутствием сопутствующей терапии блокаторами β-адренорецепторов. Поскольку действие добутамина обусловлено стимулированием активности β-адренорецепторов, на фоне продолжительной терапии блокаторами β-адренорецепторов для достижения клинически значимого повышения МОК необходимо применять более высокие дозы добутамина. Напротив, сопутствующая терапия блокаторами β-адренорецепторов не снижает эффективность применения милринона при ОСН, а для левосимендана — улучшает результаты лечения. Соответственно у больных, которые принимают блокаторы β-адренорецепторов на протяжении длительного времени, лучше использовать препараты милринона (не зарегистрированы в Украине) или левосимендана (зарегистрированы в Украине). Если терапию блокаторами β-адренорецепторов не проводили, допускается применение любого инотропного средства.
Эффективность применения милринона при ОСН оценивалась лишь в 1 большом контролируемом исследовании, при этом между группами милринона и плацебо не было выявлено статистически значимых расхождений относительно продолжительности пребывания в стационаре, выраженности симптомов или смертности. Более того, в группе милринона чаще фиксировали побочные эффекты, особенно стойкую артериальную гипотензию и тахиаритмии. АНА и АСС не рекомендуют использовать прерывистую терапию инотропными препаратами при амбулаторном лечении больных с выраженной ХСН, поскольку такая терапия может повышать смертность и частоту развития других отрицательных клинических исходов.
Инотропные средства рекомендованы при наличии периферической гипоперфузии (артериальная гипотензия, ухудшение функции почек) независимо от наличия застоя в легких и отека легких, рефрактерных к терапии диуретиками и вазодилататорами в оптимальных дозах.
Допамин
Допамин является естественным предшественником норадреналина. Дозозависимо влияет на α- и β-адренорецепторы за счет высвобождения норадреналина из гранулярных депо пресинаптических нервных окончаний, то есть имеет косвенное адреномиметическое действие.
В низких дозах (<2 мкг/кг/мин внутривенно) допамин преимущественно действует на периферические допаминергические рецепторы и снижает периферическое сопротивление. Вазодилатацию отмечают в почках, органах брюшной полости, сосудах коронарного и церебрального русла, сопровождается улучшением почечного кровотока, скорости клубочковой фильтрации, повышением диуреза и выделения натрия, усилением ответа на диуретики.
В дозах 2–5 мкг/кг/мин допамин проявляет себя как агонист β-адренорецепторов — повышает ЧСС, сердечный выброс и УОК; при этом незначительно влияет на ОПСС. Тем не менее при повышении дозы более 5 мкг/кг/мин повышает ЧСС, сердечный выброс и УОК; при этом частично влияет на ОПСС. Однако при повышении дозы более 5 мкг/кг/мин начинает доминировать α-миметический эффект допамина, что проявляется в виде повышения АД и венозного давления, вазоспазма, повышения преднагрузки ЛЖ, снижения мезентериального и почечного кровотока. Коронарный кровоток при инфузии допамина может повышаться как в ответ на увеличение работы миокарда, так и вследствие прямого дилатационного действия (стимуляция допаминовых DA1-рецепторов) на венечные артерии.
Благодаря способности допамина оказывать положительное инотропное действие на миокард и при этом повышать АД, его часто используют для терапии критических состояний, связанных с гипотензией, а также для стабилизации гемодинамики сразу после восстановления работы сердца при сердечно-легочной реанимации.
Таким образом допамин могут использовать как инотропное средство (>2 мкг/кг/мин внутривенно) при ОСН, которая сопровождается гипотензией. Инфузия низких доз допамина (<2–3 мкг/кг/мин) способна улучшить почечный кровоток и усилить диурез при ХСН с гипотензией и олигурией.
Добутамин
Добутамин — синтетический катехоламин, специально разработанный для лечения больных СН. В настоящее время благодаря таким его эффектам, как повышение сердечного выброса, снижение ОПСС, умеренное повышение ЧСС, умеренное снижение давления в легочных капиллярах, снижение конечного диастолического давления ЛЖ, показание для назначения добутамина значительно расширились и включают:
- состояния, сопровождающиеся низким сердечным выбросом;
- впервые возникшую ОСН;
- обострение ХСН;
- необходимость применения препарата с меньшей вазопрессорной активностью, чем у норэпинефрина или допамина;
- снижение перфузии органов и тканей;
- повышенное давление наполнения желудочков;
- необходимость увеличения транспорта кислорода к тканям;
- нарушение кровообращения при агрессивных режимах ИВЛ.
Добутамин имеет прямое стимулирующее действие на β1— и β2-адренорецепторы. Вазоконстрикторный эффект добутамина, обусловленный стимуляцией α-рецепторов, нейтрализуется сосудорасширяющим эффектом, связанным со стимуляцией β2-адренорецепторов. В результате суммарный сосудистый эффект добутамина сводится к незначительным изменениям ОПСС.
Контрактильность ЛЖ на фоне применения добутамина увеличивается благодаря стимуляции β1— и α-рецепторов, тогда как повышение ЧСС в основном обусловлено действием препарата на β1-рецепторы. Поэтому положительное инотропное действие препарата более выражено, чем хронотропное. В дозах, которые вызывают подобное эпинефрину и норэпинефрину повышение сердечного выброса, добутамин в значительно меньшей степени, чем эти препараты, повышает ЧСС и ОПСС. Эта особенность действия обеспечивает определенные клинические преимущества добутамина перед другими катехоламинами.
Добутамин оказывает прямое действие на β-адренорецепторы, что выгодно отличает его от допамина, действие которого на эти рецепторы опосредовано высвобождением норадреналина из нервных окончаний. Положительный инотропный эффект проявляется улучшением функционирования желудочков сердца и повышением продуктивности их работы, что сопровождается снижением давления в малом круге кровообращения, ЦВД, давления в правом и левом предсердии. Это свойство добутамина позволяет применять его как средство монотерапии у больных с выраженной левожелудочковой СН, когда преднагрузка увеличена и давление в легочных капиллярах превышает 18 мм рт. ст.
Внутривенное введение добутамина в дозах 2–15 мкг/кг/мин сопровождается повышением сердечного выброса, главным образом за счет увеличения ударного объема сердца, что происходит вследствие усиления сократимости миокарда. Ударный объем и сердечный выброс повышаются при относительно небольшом повышении АД и ЧСС. ОПСС у больных СН снижается при применении добутамина как за счет рефлекторного уменьшения симпатомиметического действия, так и вследствие прямого вазодилататорного эффекта. Снижение постнагрузки, обусловленной добутамином, в совокупности с его положительным инотропным действием облегчает выброс крови из ЛЖ, способствуя тем самым повышению сердечного выброса. Повышение ударного объема и ФВ, что отображает повышение эффективности работы ЛЖ, приводит к уменьшению его КСО. При инфузии добутамина в дозе 5 мкг/кг/мин происходит повышение сердечного выброса на 35%, коронарного кровотока — на 37%, а потребление миокардом кислорода — лишь на 20%. В дозе 10 мкг/кг/мин препарат повышает эти показатели на 65, 51 и 40% соответственно.
Большинство медикаментозных средств с сосудорасширяющими и инотропными свойствами вызывает повышение внутрилегочного шунтирования при легочных заболеваниях. Добутамин не является исключением и за счет ослабления гипоксической вазоконстрикции (рефлекс Эйлера — Лильестранда) улучшает перфузию плохо вентилируемых участков, повышая тем самым венозное «примешивание» в легких. Тем не менее, оксигенация артериальной крови при этом чаще всего не снижается и даже возрастает благодаря повышению сердечного выброса и содержанию кислорода в венозной крови.
При инфузии добутамина функция почек обычно улучшается, что приводит к повышению диуреза, клиренса креатинина и экскреции натрия. Улучшение функции почек происходит вследствие повышения сердечного выброса и вторичного повышения перфузии почек, а не в результате прямого дилатирующего действия на почечные сосуды, как при применении допамина. Недавно было показано, что инфузия добутамина улучшает перфузию органов брюшной полости.
Длительная инфузия добутамина (более 24–48 ч) может приводить к развитию толерантности и частичной потере гемодинамического эффекта. Завершение терапии добутамином — к развитию обратной артериальной гипотензии, застойных явлений, дисфункции почек. Этого можно избежать благодаря постепенной отмене добутамина (ступенчатое снижение дозы на 2 мкг/кг/мин каждый день) и оптимизации пероральной вазодилатирующей терапии, например использования ингибиторов АПФ.
Целесообразность применения добутамина при ОСН подтверждается результатами ряда небольших исследований, в которых на фоне его применения отмечалось улучшение гемодинамических показателей. Однако результаты более весомых исследований, в которых оценивали показатели смертности и заболеваемости, не выявили существенных преимуществ.
В исследовании PRECEDENT (Prospective Randomized Evaluation of Cardiac Ectopy with Dobutamine or Nesiritide Therapy) было показано, что применение добутамина по сравнению с незиритидом повышает частоту возникновения желудочковой экстрасистолии и пароксизмов желудочковой терапии, но реже сопровождается развитием артериальной гипотонии.
Ингибиторы ФДЭ (амринон, мильринон, эноксимон, веснаринон)
Мильринон и эноксимон являются ингибиторами ФДЭ III типа, которые применяют в клинической практике. После введения этих лекарственных средств пациентам с прогрессирующей СН отмечают значительно выраженный инотропный, лузитропный и сосудорасширяющий эффекты, повышение сердечного выброса и ударного объема при одновременном снижении давления в ЛА, ДЗЛК, а также системного и легочного сосудистого сопротивления. Препараты этой группы в Украине не зарегистрированы.
Левосимендан
Новый представитель класса инотропных препаратов, негликозидное кардиотоническое лекарственное средство со свойствами вазодилататора, которое применяют для лечения острой декомпенсированной СН более чем в 40 странах, включая Украину. Выявляет два основных механизма действия: повышение чувствительности к Ca++ контрактильных протеинов-кардиомиоцитов, что предопределяет положительное инотропное действие, а также активацию мышечных К+-каналов, что приводит к периферической вазодилатации. Левосимендан обладает также умеренной ингибирующей активностью к ФДЭ. Кроме того, активный метаболит левосимендана проявляет подобный механизм действия и имеет продолжительный период полувыведения, что обеспечивает сохранение эффекта на протяжении нескольких суток после прекращения введения препарата.
Результаты клинического изучения в исследованиях LIDO (Longitudinal Investigation of Depression Outcomes, 203 больных) и RUSSLAN (Randomised study on Safety and effectiveness of Levosimendan in patients with left ventricular failure due to an Acute myocardial infarction, 504 больных) дали основания предположить, что вместе с благоприятным действием на симптомы заболевания и параметры гемодинамики, кратковременная внутривенная инфузия левосимендана у больных ОСН и значительно нарушенной сократительной способностью ЛЖ может иметь преимущество как перед добутамином, так и перед плацебо относительно влияния на смертность в ближайшие 6 мес. Аналогичная закономерность была выявлена в исследовании CASINO (the Calcium Sensitizer or Inotrope or None in Low-Output Heart Failure study, 291 больной). Тем не менее, количество исследованных больных было незначительным, чтобы с уверенностью говорить о преимуществах такой терапии.
Новые данные об эффективности и безопасности левосимендана при ОСН получены в другом исследовании REVIVE II (The second Randomized Multicenter Evaluation of Intravenous Levosimendan Efficacy) и исследовании SURVIVE (Survival of Patients With Acute Heart Failure in Need of Intravenous Inotropic Support).
В рандомизированном плацебо-контролируемом исследовании REVIVE II проводили сравнение эффективности и безопасности левосимендана и плацебо. Набор пациентов осуществлялся в 103 центрах, было включено 600 больных старше 18 лет с ФВ ЛЖ <35%, определенной в ближайшие 12 мес, госпитализированных в предшествующие 24 ч с декомпенсацией СН. Обязательным условием было сохранение одышки в покое после внутривенного введения мочегонных средств. Вначале внутривенно вводили нагрузочную дозу левосимендана 6–12 мкг/кг с дальнейшей инфузией 0,1 мкг/кг/мин на протяжении 1 ч и с повышением дозы до 0,2 мкг/кг/мин при хорошей переносимости. Продолжительность введения левосимендана или плацебо составляла 24 ч. Средний возраст больных, включенных в исследование, — 63 года, ФВ — в среднем 22%, ингибиторы АПФ получали 76–78% пациентов, блокаторы β-адренорецепторов — 68–69%, спиронолактон — 37%, внутривенное введение вазодилататоров или положительных инотропных препаратов проводили у 26–27%.
Первичной конечной точкой было изменение симптомов, смерть или утяжеление СН в первые 5 сут после рандомизации. Это первое исследование, в котором оценивалось влияние вмешательства на клиническое течение заболевания в целом за период, соответствующий длительности срока типичной госпитализации в США. Такой подход представляется более значимым, чем изучение отдельных симптомов или одной конечной точки.
В группе левосимендана улучшение симптомов отмечали достоверно чаще, а ухудшение — реже, чем в группе плацебо (р=0,015). При этом наличие клинического ухудшения констатировали при наличии одного из следующих событий: смерть; сохранение или ухудшение СН, несмотря на лечение вазодилататорами, мочегонными или инотропными препаратами; умеренное или выраженное ухудшение общей оценки своего состояния больным через 6 ч, 24 ч и 5 сут. Клиническое состояние не изменилось приблизительно у равного количества больных в обеих группах. Эффект левосимендана проявлялся уже через 6 ч после начала введения препарата. Аналогичную закономерность отмечали при оценке выраженности одышки (табл. 1.16).
Таблица 1.16
Состояние больных (улучшение) в исследовании REVIVE II
| Время оценки | Левосимендан, % (n=299) | Плацебо, % (n=301) | Р |
| 24 ч (на конец инфузии) | 60 | 46 | 0,026 |
| 48 ч | 63 | 58 | 0,053 |
| 5 сут | 76 | 65 | 0,001 |
Смертность в течение 90 дней была вторичной конечной точкой. В этот период среди получающих левосимендан умерло 15,1% больных, плацебо — 11,6% (разность не достоверна). Тем не менее число умерших в группе, получавшей левосимендан, на 5-е сутки лечения было достоверно меньшим, чем в группе сравнения.
Таким образом, исследование REVIVE II продемонстрировало положительное влияние левосимендана на клинические проявления ОСН, которое появляется во время его 24-часовой инфузии и сохраняется как минимум 4 сут после ее окончания. Однако при дальнейшей интерпретации результатов этого исследования необходимо учитывать, что оно не было спланировано с целью оценки влияния терапии на смертность.
При объединении результатов плацебо-контролируемых исследований левосимендана при ОСН (CASINO, REVIVE I, REVIVE II и RUSSLAN) по совокупным данным риск смерти в течение 6 мес в группах, получавших левосимендан и плацебо, существенно не отличался.
Основные побочные эффекты левосимендана соответствуют особенностям его фармакологического действия: головная боль и артериальная гипотония связаны с вазодилатирующими свойствами, аритмии — с положительным инотропным действием. Поэтому можно ожидать их более частое возникновение по сравнению с использованием плацебо.
Рандомизированное проспективное двойное слепое исследование с двойной маскировкой SURVIVE по сравнению эффективности и безопасности левосимендана и добутамина проводили в 75 центрах 8 стран Европы, в него было включено 1327 больных. В настоящее время это самое большое клиническое исследование внутривенного применения инотропных лечебных средств при ОСН, в котором оценивали влияние краткосрочного введения препаратов на выживаемость в отдаленные периоды заболевания. Включали больных с ФВ <30%, определенной в ближайшие 12 мес, госпитализированных с острой декомпенсацией СН и недостаточной эффективностью терапии при внутривенном введении мочегонных и/или вазодилататоров. Левосимендан вводили в течение 24 ч (нагрузочная доза 12 мкг/кг за 10 мин с дальнейшей инфузией 0,1 мкг/кг/мин и увеличением через 1 ч до 0,2 мкг/кг/мин при хорошей переносимости); одновременно использовали плацебо добутамина. Добутамин вводили в дозе 5–40 мкг/кг/мин на протяжении 24 ч и более; одновременно использовали плацебо левосимендана. Кроме того, при клинической необходимости на протяжении 6-месячного периода наблюдения была возможность повторного слепого введения того лечебного средства, к которому больной был рандомизирован в начале исследования.
Средний возраст больных, включенных в исследование, составлял 66–67 лет, ХСН была у 88% больных (в остальных случаях причиной госпитализации была впервые возникшая ОСН), в 76% случаев СН была ишемического генеза, ФВ — в среднем 24%. Продолжительность введения левосимендана — в среднем 23 ч, добутамина — 39 ч (средняя доза — 6 мкг/кг/мин).
Первичной конечной точкой была общая смертность на протяжении 6 мес. Количество больных в исследовании позволяло с достаточной надежностью продемонстрировать снижение смертности в группе левосимендана в этот период на 25% по сравнению с группой, получающей добутамин.
Хотя отмечена тенденция преимущества левосимендана в ранние сроки после начала введения исследуемых препаратов, общая смертность больных ни на одном из этапов исследования в группах левосимендана и добутамина достоверно не отличалась (табл. 1.17).
Таблица 1.17
Общая смертность в исследовании SURVIVE
| Время оценки | Левосимендан, % (n=664) | Добутамин, % (n=663) | Относительный риск (95% доверительный интервал) |
| 180-е сутки (первичная конечная точка) | 26,1 | 27,9 | 0,91 (0,74–1,13) |
| 31-е сутки (вторичная конечная точка) | 11,9 | 13,7 | 0,85 (0,63–1,15) |
| 5-е сутки (ретроспективный анализ) | 4,4 | 6,0 | 0,72 (0,44–1,16) |
По вторичным точкам, характеризующим клиническую эффективность (число дней, проведенных больными, которые выжили, вне стационара, оценка выраженности одышки и изменение общей оценки своего состояния через 24 ч после начала лечения, сердечно-сосудистая смертность через 6 мес), группы достоверно не отличались. Вместе с тем содержание МНУП после начала введения левосимендана снижалось приблизительно наполовину и оставалось таким как минимум 5 сут, тогда как снижение в группе добутамина было менее выраженным (p<0,0001 для отличий между группами через 1, 3 и 5 сут). Через 5 сут от начала терапии степень снижения содержания этого маркера тяжести СН составила 46% в группе левосимендана и 13% в группе добутамина, это наиболее значимое снижение уровня МНУП в клинических испытаниях при ОСН.
Таким образом, полученные факты свидетельствуют о более выраженном влиянии левосимендана на отдельные проявления заболевания по сравнению с добутамином. Единственным отрицательным моментом является более частое возникновение мерцательной аритмии. При объединении результатов трех исследований по сравнению левосимендана и добутамина с похожим протоколом введения левосимендана (CASINO, LIDO и SURVIVE) общее количество больных составило 1730, а смертность через 6 мес от начала лечения оказалась достоверно ниже в группе получающих левосимендан (р=0,032).
Подытоживая результаты исследований REVIVE II и SURVIVE, левосимендан уменьшает симптомы, улучшает клиническое течение острой декомпенсации СН по сравнению с плацебо и обладает преимуществом перед добутамином по влиянию на отдельные проявления заболевания. Вместе с тем при использовании левосимендана можно ожидать более частого возникновения мерцательной аритмии и данный эффект заметен как при сравнении с плацебо, так и сравнительно с добутамином. Насколько это связано со способностью левосимендана несколько снижать уровень калия в крови, пока не понятно. Частота возникновения желудочковой тахикардии при использовании левосимендана тоже повышается, тем не менее заметных отличий в данном случае по сравнению с добутамином не выявлено.
Согласно данным о влиянии на смертность в течение длительного времени левосимендан достоверно не отличается от плацебо и не имеет выраженного преимущества перед добутамином. Однако в связи с небольшим количеством наблюдаемых больных с уверенностью судить об этом аспекте действия препарата не представляется возможным.
Возможно, продолжающиеся исследования помогут подтвердить полученные результаты, а также определить перспективные направления дальнейшего изучения левосимендана. Данные проводимых исследований не меняют представлений о месте этого лечебного средства в лечении ОСН: в настоящее время инфузию левосимендана рассматривают как дополнительное вмешательство у больных с низким сердечным выбросом в связи со значительным нарушением сократимости миокарда, без признаков гиповолемии, выраженной артериальной гипотонии и не отвечающих на стандартную терапию (внутривенное введение мочегонных и вазодилататоров в оптимальных дозах). С появлением левосимендана в распоряжении врачей, по сравнению с добутамином, появился другой эффективный кардиотонический препарат. С учетом накопленных фактов, добутамин имеет преимущества при наличии артериальной гипотонии и ряда других противопоказаний к левосимендану (тяжелое нарушение функции печени и почек, гиперчувствительность), тогда как в остальных случаях более выраженное действие следует ожидать от левосимендана. В случаях, когда клинической стабилизации при декомпенсированной СН добиться не удается, несмотря на присоединение к лечению более доступного по цене добутамина, следует назначать левосимендан.
Левосимендан используют в виде продолжительной внутривенной инфузии в течение 6–24 ч, но гемодинамические эффекты сохраняются более 48 ч после окончания инфузии. Тахикардия и артериальная гипотензия описаны при инфузии высоких доз левосимендана, что не позволяет применять его при САД ниже 85 мм рт. ст. Важной чертой левосимендана является возможность реализации его положительных гемодинамических эффектов (повышение ударного выброса, снижение давления наполнения ЛЖ, ОПСС и сопротивления в легочных сосудах при незначительном снижении АД) на фоне сопутствующего использования блокаторов β-адренорецепторов.
Сердечные гликозиды
Сердечные гликозиды ингибируют миокардиальную Na+/K+-АТФазу, таким образом повышая обмен Ca++/Na+, что проявляется положительным инотропным эффектом. При ОСН сердечные гликозиды незначительно повышают сердечный выброс и снижают давление наполнения. У пациентов с тяжелой ХСН с эпизодами острой декомпенсации применение сердечных гликозидов является эффективным способом их предотвращения. В то же время доказано, что у пациентов, получающих сердечные гликозиды после ИМ, повышенную активность КФК в крови отмечают более длительное время, а при наличии острого ИМ и ОСН использование производных наперстянки может способствовать возникновению угрожающих для жизни аритмий. Таким образом, инотропное поддержание с использованием сердечных гликозидов при ОСН не рекомендуется, особенно при наличии острого коронарного синдрома.
В табл. 1.18 приведена характеристика инотропных препаратов, применяющихся при ОСН.
Таблица 1. 18
Препараты с положительным инотропным действием
| Препарат | Доза при болюсном введении | Доза при инфузионном введении |
| Добутамин | Нет | 2–20 мкг/кг/мин (β+) |
| Допамин | Нет | Менее чем 3 мкг/кг/мин: почечный эффект (δ+) 3–5 мкг/кг/мин: инотропное действие (β+)
Более 5 мкг/кг/мин: (β+), вазопрессорное действие (α+) |
| Левосимендан | 12–24 мкг/кг на протяжении 10 мин* | 0,1 мкг/кг/мин, может быть повышена до 0,2 или снижена до 0,05 мкг/кг/мин |
| Норэпинефрин | Нет | 0,2–1,0 мкг/кг/мин |
| Эпинефрин | 1 мг можно вводить внутривенно при реанимационных мероприятиях | 0,05–0,5 мкг/кг/мин |
*Рекомендованное дозирование. При наличии артериальной гипотензии терапию следует начинать с инфузии, минуя болюсное введение.
Ингибиторы АПФ при ОСН
На сегодня исследований эффективности ингибиторов АПФ у больных ОСН не проводили, за исключением СН после ИМ, где изучали отдаленный эффект.
Вероятно, ингибиторы АПФ не показаны на раннем этапе стабилизации состояния пациентов с ОСН. Однако поскольку указанные пациенты принадлежат к группе высокого риска, ингибиторы АПФ играют большое значение в лечении ОСН и острого ИМ. Поэтому сегодня обсуждается вопрос — когда следует начинать терапию ингибиторами АПФ и кому они наиболее показаны.
Гемодинамические эффекты ингибиторов АПФ обусловлены снижением образования ангиотензина II и повышением содержания брадикинина, что приводит к снижению ОПСС и усилению натрийуреза. Кратковременная терапия ассоциируется со снижением содержания в плазме крови ангиотензина II и альдостерона с одновременным повышением ангиотензина I и активности ренина.
С целью предотвращения артериальной гипотензии следует избегать внутривенного введения ингибиторов АПФ. Начальная доза должна быть невысокой и прогрессивно титроваться после стабилизации при условии мониторинга АД и функции почек.
Ингибиторы АПФ необходимо с осторожностью применять у пациентов с минимальным сердечным выбросом, поскольку они могут значительно снизить скорость клубочковой фильтрации. Риск непереносимости ингибиторов АПФ повышается при одновременном применении НПВП и при наличии двустороннего стеноза почечных артерий.
Блокаторы β-адренорецепторов
В настоящее время нет данных о проведении исследований эффективности блокаторов β-адренорецепторов при ОСН, направленных на изучение улучшения клинического состояния пациентов. Наоборот, считалось, что ОСН является противопоказанием для терапии препаратами данной группы. Пациентов с ОСН при наличии влажных хрипов в нижних отделах легких или артериальной гипотензии исключали из испытаний на ранней стадии после развития острого ИМ. Применение блокаторов β-адренорецепторов у пациентов без выраженной СН или артериальной гипотензии ограничивало размер повреждения миокарда, устраняло сложные нарушения ритма сердца и уменьшало выраженность боли. Внутривенное введение блокаторов β-адренорецепторов может быть целесообразным у больных с ангинозной болью, которая не устраняется наркотическими средствами, с повторными приступами ишемии миокарда, АГ, тахикардией или аритмией.
У пациентов с острым ИМ, состояние которых на фоне ОСН быстро стабилизируется, блокаторы β-адренорецепторов следует назначать как можно раньше. У пациентов с признаками ОСН на фоне ХСН блокаторы β-адренорецепторов необходимо назначать сразу после стабилизации состояния (обычно в течение 3–4 дней).
Первая доза метопролола, карведилола, бизопролола и небиволола для перорального приема должна быть небольшой с последующим постепенным повышением до целевого уровня. Титрование дозы необходимо проводить в зависимости от индивидуальной реакции организма на лечение. Блокаторы β-адренорецепторов могут чрезмерно снижать АД и ЧСС. Пациенты, принимавшие блокаторы β-адренорецепторов перед госпитализацией в связи с декомпенсацией СН, должны продолжать их прием; исключением является необходимость проведения больному инотропной терапии (в случае применения левосимендана возможно его сочетание с блокаторами β-адренорецепторов).
Терапия антикоагулянтами
Антикоагулянты широко применяют в лечении острого коронарного синдрома независимо от наличия СН. Это также касается и фибрилляции предсердий. Доказательств эффективности назначения нефракционированного гепарина (НФГ) или низкомолекулярных гепаринов (НМГ) в комплексе стартовой терапии ОСН очень мало. В большом плацебо-контролируемом исследовании с применением подкожной инъекций 40 мг эноксапарина у пациентов, госпитализированных по неотложным показаниям, включая большое количество больных СН, выявлено снижение частоты венозных тромбозов при отсутствии влияния на клиническую симптоматику. Следует отметить, что возникновение признаков острой декомпенсации на фоне ХСН требует тщательного мониторинга свертывающей системы крови, в связи с часто имеющейся у таких больных дисфункции печени. НМГ противопоказаны в случае значительного нарушения функции почек (клиренс креатинина <30 мл/мин) и тромбоцитопении (<100 000/мм3 или снижении в 2 раза и более во время лечения гепарином).
Вазопрессорная терапия при кардиогенном шоке
В комбинации с инотропными средствами и инфузией жидкости на фоне отсутствия оптимальной перфузии при улучшенном сердечном выбросе необходимо назначать терапию вазопрессорами. Вазопрессоры также могут использовать при реанимационных мероприятиях, а также для поддержания адекватной перфузии при угрожающей для жизни артериальной гипотензии.
Эпинефрин
Эпинефрин — катехоламин с высоким аффинитетом (прочность связи) относительно β1-, β2— и α-адренергических рецепторов. Эпинефрин используют для инфузионного введения в дозах 0,05–0,5 мкг/кг/мин в случае, когда добутамин не вызывает клинического эффекта и АД остается низким. При этом рекомендуется прямое мониторирование АД, а также мониторинг параметров гемодинамики с использованием катетеризации ЛА.
Норэпинефрин
Норэпинефрин — катехоламин с высоким аффинитетом относительно α-адренорецепторов, который следует использовать для повышения ОПСС. Норэпинефрин-индуцированное повышение ЧСС развивается меньше, чем на фоне действия эпинефрина. Рекомендованные дозы норэпинефрина не отличаются от таковых эпинефрина. Норэпинефрин (0,2–1 мкг/кг/мин) обладает преимуществом при низком АД на фоне сниженного ОПСС, например при септическом шоке. Норэпинефрин очень часто комбинируют с добутамином для улучшения параметров гемодинамики.
Общие вопросы лечения ОСН
Инфекции
Пациенты с выраженной ОСН подвержены различным инфекционным осложнениям, особенно часто со стороны дыхательной и мочевыделительной системы, септицемии, внутригоспитальным (нозокомиальным) инфекциям, вызванным грамположительными возбудителями. Повышение содержания СРБ и ухудшение общего состояния могут быть единственными проявлениями инфекции — температурная реакция часто отсутствует. Тщательная профилактика инфекционных заболеваний, поддержание целостности слизистых и кожных покровов являются важными задачами лечения ОСН. При необходимости следует назначать адекватную антибиотикотерапию.
Сахарный диабет
Развитие ОСН часто связано с ухудшением метаболического контроля и развитием гипергликемии. Прием гипогликемических препаратов следует прекратить, а гликемический контроль осуществлять с помощью препаратов инсулина короткого действия, в зависимости от содержания глюкозы в крови. Нормогликемия повышает выживаемость пациентов с сахарным диабетом, находящихся в критическом состоянии.
Катаболизм
Отрицательный энергетический баланс — серьезная проблема при наличии ОСН. Это является следствием снижения поступления калорий с пищей в связи с ухудшением кишечного всасывания. Следует поддерживать оптимальный баланс калорий и аминокислот. Определение концентрации альбумина в сыворотке крови и состояние азотистого баланса позволяют мониторировать метаболический статус пациента.
Почечная недостаточность
ОСН может вызвать или спровоцировать ухудшение уже существующей почечной недостаточности. Необходим тщательный мониторинг функции почек. Сохранение функции почек следует рассматривать как одну из целей при выборе терапевтической стратегии у таких пациентов.
Существует ряд заболеваний, при которых ОСН развивается de novo или которые служат пусковым механизмом для развития декомпенсации ХСН. ИБС и острый коронарный синдром являются наиболее частыми причинами ОСН. Заболевания других органов и систем могут значительно осложнять лечение ОСН.
ИБС
При остром коронарном синдроме (нестабильная стенокардия или ИМ), осложненном развитием ОСН, показано проведение коронарной ангиографии. При остром ИМ проведение реперфузионной терапии достоверно снижает частоту развития ОСН. Чрескожное коронарное вмешательство (ЧКВ) или оперативное вмешательство (АКШ) возможны уже на ранних стадиях заболевания. Если ни ЧКВ, ни АКШ не могут быть проведены в короткий срок, рекомендуется проведение ранней тромболитической терапии.
Всем пациентам с острым ИМ и признаками СН показано проведение эхоКГ для оценки общей и локальной сократительной способности миокарда, выявления клапанной дисфункции (особенно митральной регургитации) и исключения ряда других состояний (например перикардита, кардиомиопатии, ТЭЛА).
При кардиогенном шоке у пациентов с острым коронарным синдромом как можно быстрее необходимо провести коронарную ангиографию и процедуру реваскуляризации. Временная стабилизация пациента может быть достигнута инфузионной терапией, внутриаортальной баллонной контрпульсацией, применением фармакологических инотропных препаратов.
Патология клапанного аппарата сердца
ОСН может быть следствием патологии клапанного аппарата сердца (при острой митральной и аортальной недостаточности, эндокардите, аортальном или митральном стенозе, тромбозе искусственного клапана, расслаивающей аневризме аорты).
При наличии инфекционного эндокардита в начале лечения обязательно назначение антибактериальной терапии на фоне применения других фармакологических средств терапии ОСН. Дисфункция сердца также может усиливаться при наличии миокардита. Однако при инфекционном эндокардите ведущей причиной развития ОСН является недостаточность клапана сердца. Лечение следует начинать немедленно. При тяжелой острой митральной или аортальной регургитации необходимо оперативное вмешательство. Проведение неотложного хирургического вмешательства требуется при аортальной недостаточности.
Лечение ОСН при тромбозе искусственного клапана сердца (ТИКС)
ОСН вследствие ТИКС ассоциирована с высокой смертностью. У всех пациентов с СН и подозрением на ТИКС необходимо провести рентгенографию органов грудной клетки и эхоКГ.
Тромболитическая терапия используется при ТИКС правых отделов сердца, а также у кандидатов на оперативное вмешательство из групп высокого риска. При ТИКС левых отделов сердца показано оперативное вмешательство.
Необходимо использовать следующие препараты: ингибитор тканевого активатора плазминогена 10 мг внутривенно болюсно с инфузией 90 мг на протяжении 90 мин; стрептокиназа 250 000–500 000 МЕ на протяжении 20 мин с последующей инфузией 1–1,5 млн МЕ на протяжении 10 ч. После тромболизиса всем пациентам следует назначить нефракционированный гепарин в виде внутривенной инфузии (увеличение АЧТВ в 1,5–2 раза по сравнению с нормальными величинами).
Расслаивающая аневризма аорты
Острая расслаивающая аневризма аорты может быть причиной развития ОСН как с развитием болевого синдрома, так и без него. Обычно ОСН развивается на фоне гипертензивного состояния или острой аортальной недостаточности. Необходимо немедленно установить диагноз, оперативное вмешательство проводить по жизненным показаниям.
ОСН и АГ
ОСН является одним из наиболее распространенных осложнений гипертензивных кризов. Клиническим признаком ОСН при АГ является застой в легких, в связи с быстротой развития его называют вспышкой отека легких. У пациентов, госпитализированных с признаками отека легких на фоне гипертонического криза, часто не выявляют изменений систолической функции сердца, а определяют ухудшение процессов расслабления ЛЖ. Целью лечения являются уменьшение пред- и постнагрузки ЛЖ, уменьшение ишемии миокарда (при ее наличии), адекватная вентиляция легких.
Лечение следует проводить немедленно: оксигенотерапия; неинвазивная вентиляция с положительным давлением, а при необходимости — ИВЛ, внутривенное введение гипотензивных средств.
Гипотензивная терапия должна вызвать достаточно быстрое (в течение 30–60 мин) снижение САД и ДАД на 30 мм рт. ст. Не следует стараться восстановить АД до нормальных значений, это может привести к снижению перфузии органов. Поэтому дальнейшее снижение АД следует проводить под контролем функций этих органов. Снижение АД может быть достигнуто назначением:
- внутривенного введения петлевых диуретиков, особенно при наличии признаков перегрузки жидкостью, а также при указании в анамнезе на имеющуюся ранее ХСН;
- внутривенного введения нитроглицерина или нитропруссида натрия для снижения пред- и постнагрузки, а также повышения коронарного кровотока;
- блокаторы кальциевых каналов (например никардипин, верапамил) можно применять пациентам с диастолической дисфункцией и увеличенной постнагрузкой.
Блокаторы β-адренорецепторов не следует использовать при наличии отека легких. Однако для купирования гипертонического криза при феохромоцитоме эффективным является внутривенное введение комбинированных блокаторов α- и β-адренорецепторов, например лабеталола — болюсное введение 10 мг с последующей инфузией 50–200 мг/ч.
Почечная недостаточность
СН вызывает гипоперфузию почек как прямо, так и посредством активации нейрогуморальных механизмов. Неконтролируемая комбинированная терапия диуретиками, ингибиторами АПФ, НПВП также может способствовать развитию почечной недостаточности. Почечная недостаточность влияет на эффективность терапии СН, особенно при использовании дигоксина, ингибиторов АПФ, блокаторов рецепторов ангиотензина II, спиронолактона. Преренальный стеноз артерий и постренальная обструкция (как причины возникновения почечной недостаточности) должны быть исключены.
Повышение содержания креатинина в сыворотке крови более чем на 25–30% и/или достижение концентрации более 3,5 мг/дл (>266 мкмоль/л) является относительным противопоказанием к продолжению терапии ингибиторами АПФ. Комбинация с инотропными средствами с положительным действием усиливает почечный кровоток, позволяет улучшить функцию почек, восстановить эффективность диуретиков. При снижении функции почек может потребоваться проведение диализа, особенно при наличии гипонатриемии, ацидоза и неконтролируемой задержки жидкости. Выбор между перитонеальным диализом, гемодиализом и ультрафильтрацией зависит от технической оснащенности лечебного учреждения.
Заболевание легких и бронхообструкция
При наличии у пациентов с ОСН бронхообструктивного синдрома необходимо использовать бронходилататоры. Бронходилататоры могут улучшать функцию сердца, но не входят в схему терапии ОСН. К терапии обычно добавляют назначение 2,5 мг сальбутамола (0,5 мл 0,5% раствора в 2,5 мл 0,9% раствора натрия хлорида) через небулайзер на протяжении 20 мин. Ингаляцию можно повторять каждый час в течение нескольких часов.
Нарушение ритма сердца и ОСН
Брадиаритмии. Брадикардия у пациентов с ОСН чаще всего является следствием острого ИМ, особенно при окклюзии правой коронарной артерии.
Лечение брадиаритмий обычно начинается с введения атропина 0,25–0,5 мг внутривенно, при необходимости введения можно повторить.
Изопреналин — 2–20 мкг/мин в виде инфузий могут использовать при AV-диссоциации или низком желудочковом ответе. При наличии ишемии миокарда использовать данное лекарственное средство не следует. Медленный желудочковый ритм при фибрилляции предсердий можно ускорить путем внутривенного введения теофиллина со скоростью 0,2–0,4 мг/кг/ч, вначале — болюсное введение, затем в виде инфузии. При отсутствии ответа на фармакотерапию необходимо использовать искусственный водитель ритма.
Суправентрикулярные тахиаритмии (СВТ). СВТ могут осложнять течение ОСН или быть причиной ее развития. Фибрилляция предсердий с частым желудочковым ответом также может вызывать ОСН. Контроль ЧСС у пациента с СВТ и ОСН является первоочередной задачей.
У пациентов с рестриктивной кардиомиопатией или тампонадой сердца снижение ЧСС следует проводить безотлагательно. Необходимо проводить соответствующую фармако- или электроимпульсную терапию (кардиоверсию).
Лечение фибрилляции предсердий зависит от продолжительности заболевания.
Пациенты с ОСН и фибрилляцией предсердий должны получать антикоагулянтные препараты. Если нарушение ритма имеет пароксизмальный характер, после стабилизации состояния необходимо проводить кардиоверсию. Если фибрилляция предсердий длится более 48 ч, следует назначить антикоагулянты (вначале возможно применение низкомолекулярных гепаринов) и проводить фармакотерапию, направленную на поддержание оптимальной ЧСС. Если отмечают гемодинамическую нестабильность, абсолютно показана срочная кардиоверсия. Следует избегать назначения верапамила и дилтиазема при пароксизме фибрилляции предсердий, так как эти средства ухудшают течение СН и могут вызвать AV-блокаду III степени. Амиодарон и блокаторы β-адренорецепторов используют при фибрилляции предсердий как для снижения ЧСС, так и для предотвращения рецидива (табл. 1.19).
Таблица 1.19
Лечение аритмий при ОСН
| Фибрилляция или тахисистолия желудочков | Дефибрилляция разрядами 200–300–360 Дж (преимущество нужно отдать двухфазной дефибрилляции с максимальной мощностью 200 Дж). При отсутствии эффекта ввести 1 мг эпинефрина и/или 150–300 мг амиодарона |
| Желудочковая тахикардия | При нестабильном состоянии пациента — электроимпульсная терапия, при стабильном — внутривенное введение амиодарона |
| Синусовая тахикардия или суправентрикулярная тахикардия | Использование блокаторов β-адренорецепторов при клинической и гемодинамической переносимости:
Метопролол 5 мг внутривенно медленно (при необходимости можно повторить) Аденозин используется для замедления AV-проводимости или для медикаментозной кардиоверсии тахикардии по типу re-entry Иногда используют: Эсмолол 0,5–1,0 мг/кг на протяжении 1 мин, потом инфузия со скоростью 50–300 мкг/кг/мин или Лабеталол 1–2 мг струйно, потом инфузия со скоростью 1–2 мг/мин (всего 50–200 мг) Лабеталол также применяют при ОСН на фоне гипертонического криза или феохромоцитомы в виде болюсного введения 10 мг (всего 300 мг) |
| Фибрилляция или трепетание предсердий | По возможности — электроимпульсная терапия.
Дигоксин 0,125–0,25 мг внутривенно или блокаторы β-адренорецепторов или амиодарон используют для замедления AV-проводимости. Амиодарон может индуцировать медикаментозную кардиоверсию без ухудшения функции ЛЖ. Пациенту следует назначить гепарин |
| Брадикардия | Атропин 0,25–0,5 мг внутривенно, всего 1–2 мг. Как временное мероприятие — инфузия изопреналина (1 мг в 100 мл 0,9% р-ра натрия хлорида, максимальная скорость 75 мл/ч, то есть 2–12 мкг/мин). Если брадикардия стойкая к введению атропина, нужно начать чрескожную или трансвенозную кардиостимуляцию. При остром ИМ в случае резистентной брадикардии можно использовать теофиллин: болюсно 0,25–0,5 мг/кг и в дальнейшем инфузия со скоростью 0,2–0,4 мг/кг/ч |
Не следует использовать антиаритмические препараты I класса.
В случае хорошей переносимости блокаторов β-адренорецепторов их необходимо назначать всем пациентам с СВТ. Электроимпульсную терапию с седативными средствами при СВТ следует использовать у пациентов с ОСН и артериальной гипотензией.
Лечение угрожающих жизни аритмий
Фибрилляция желудочков и желудочковая тахикардия требуют проведения сердечно-легочной реанимации, в том числе немедленной кардиоверсии, при необходимости — вентиляционной поддержки дыхания, а также применения седативных средств (в случае моторного возбуждения или сохранения сознания), стойкого восстановления коронарного кровообращения при остром коронарном синдроме. Амиодарон и блокаторы β-адренорецепторов позволяют снизить частоту повторного возникновения данных событий.
ОСН во время оперативного вмешательства
ОСН во время оперативного вмешательства обычно является следствием ишемии миокарда, обычно безболевой, то есть не ассоциированной с болевым синдромом.
Немедикаментозное лечение ОСН
ОСН является серьезным осложнением большинства заболеваний сердца. В ряде случаев срочное или экстренное хирургическое вмешательство значительно улучшает прогноз. К немедикаментозным вмешательствам относятся коронарная реваскуляризация, коррекция анатомических нарушений, замена или реконструкция клапана сердца, а также временная циркуляторная поддержка с использованием аппаратов вспомогательного кровообращения. ЭхоКГ является наилучшим способом диагностики состояний, при которых необходим нефармакологический подход (алгоритм ведения больных при остром ИМ с применением данных эхоКГ представлен в табл. 1.20).
Таблица 1.20
Алгоритм ведения больных с ОСН при остром ИМ: применение эхоКГ
| Алгоритм А эхоКГ |
|
| ДИАГНОЗ: Разрыв внешней стенки желудочка |
| Перикардиоцентез. Объемная инфузия. Инотропные средства. Решить вопрос о ВАБК |
| Немедленное оперативное вмешательство |
| Алгоритм Б эхоКГ |
| ДИАГНОЗ: Разрыв МЖП: локализация; размер; Qp:Qc |
| Фармакотерапия |
| Нестабильное состояние пациента — ВАБК, ИВЛ, КЛА |
| Коронарная ангиография |
| Немедленное оперативное вмешательство |
| Алгоритм В эхоКГ |
| Эхо-признаки острой тяжелой митральной регургитации
+/– визуализация разрыва сосочковой мышцы |
| Если диагноз неясен — провести Чп-эхоКГ
Если Чп-эхоКГ не дает результата — установить КЛА для исключения разрыва МЖП |
| ДИАГНОЗ: Острая митральная регургитация |
| Фармакотерапия |
| Нестабильное состояние пациента — ВАБК, ИВЛ, КЛА |
| Коронарная ангиография |
| Немедленное оперативное вмешательство |
| Алгоритм Г эхоКГ |
|
| Отменить: препараты с положительным инотропным действием, нитраты, ВАБК
Назначить: блокаторы β-адренорецепторов, стимуляторы α-адренорецепторов |
| ЭхоКГ: низкая ФВ без механических осложнений |
| Кардиогенный шок вследствие «потери» большого количества миокарда |
Фармакотерапия. Назначить:
|
Qp:Qs — отношение легочного кровотока к системному, КЛА — катетер в легочной артерии, Чп-эхоКГ — чреспищеводная эхоКГ, ПСД — переднее систолическое движение, АВК — аппарат вспомогательного кровообращения.
Заболевания сердца, являющиеся причиной ОСН и требующие оперативного вмешательства:
- Кардиогенный шок после остром ИМ при поражении нескольких коронарных сосудов.
- Постинфарктный дефект межжелудочковой перегородки (МЖП).
- Разрыв стенки желудочка.
- Острая декомпенсация имеющейся патологии клапанного аппарата.
- Недостаточность или тромбоз искусственного клапана сердца.
- Аневризма аорты или расслаивающая аневризма аорты в полость перикарда.
- Острая митральная недостаточность вследствие:
-
- ишемического разрыва сосочковых мышц;
- ишемической дисфункции сосочковых мышц;
- миксоматозного разрыва сухожильных хорд;
- эндокардита;
- травмы.
- Острая аортальная регургитация вследствие:
-
- эндокардита;
- расслаивающей аневризмы аорты;
- закрытой травмы грудной клетки;
- разрыва аневризмы синуса Вальсальвы.
- Острая декомпенсация хронической кардиомиопатии.
Внутриаортальная баллонная контрпульсация
Контрпульсация является стандартным компонентом лечения пациентов с кардиогенным шоком или тяжелой левожелудочковой недостаточностью при соблюдении следующих условий:
I. Улучшение не наступает, несмотря на объемную инфузию, инотропную поддержку.
II. Наличие выраженной митральной регургитации или разрыва МЖП — с целью гемодинамической стабилизации.
III. Наличие тяжелой ишемии миокарда, препятствующей стабилизации состояния, — базис для проведения коронарографии и реваскуляризации.
Внутриаортальная баллонная контрпульсация противопоказана при расслаивающей аневризме аорты или клинически значимой аортальной недостаточности. Ее также не следует применять при тяжелых поражениях периферических сосудов, полиорганной недостаточности, некорригируемых причинах ОСН.
Аппарат вспомогательного кровообращения
Аппарат вспомогательного кровообращения — это механический насос, который частично замещает механическую работу желудочка. Аппарат позволяет разгрузить желудочек, снизить нагрузку на миокард и усилить периферический кровоток. Некоторые из этих устройств имеют блок экстракорпоральной оксигенации. Если течение ОСН затягивается, а трансплантацию сердца провести невозможно, дальнейшее использование аппарата вспомогательного кровообращения нецелесообразно.
Наиболее частыми осложнениями при применении АИК являются тромбоэмболия, кровотечение, инфекции.
Трансплантация сердца
Трансплантацию сердца могут рассматривать как лечебное мероприятие при тяжелой ОСН с заранее известным неблагоприятным прогнозом. Примером может служить тяжелый острый миокардит, послеродовая кардиомиопатия или острый ИМ с неблагоприятным прогнозом после реваскуляризации. Тем не менее трансплантация сердца невозможна до тех пор, пока не достигнута стабилизация состояния — естественным способом или с помощью аппарата вспомогательного кровообращения.
ЗАКЛЮЧЕНИЕ
Современные представления относительно диагностики и лечения ОСН за последние 10 лет существенно обогатились. Проведенные недавно регистры позволили охарактеризовать большинство диагнозов больных как декомпенсацию ХСН, а новые случаи ОСН объяснить обострением ИБС или АГ. Очень важным является разработанный и согласованный объем обязательного обследования для всех больных с ОСН, что позволяет своевременно проводить дифференциальную диагностику и стратификацию риска возможных осложнений (это и лабораторные исследования, и инструментальные методы оценки структурно-функциональных особенностей сердечно-сосудистой системы у больных с ОСН). Врачи-терапевты и кардиологи должны не только назначать рекомендованное лекарственное средство больным с декомпенсацией сердечной деятельности, но и определять природу этой декомпенсации. Важным является более активное привлечение в процесс лечения кардиохирургов и интервенционных кардиологов, электрофизиологов для проведения реваскуляризации жизнеспособного миокарда, коррекции приобретенных клапанных поражений миокарда (включая коррекцию выраженной митральной регургитации), проведение стимуляции сердца для ресинхронизации его работы (в случае наличия блокады ножек и расширения комплекса QRS) и др. Следует помнить, что положительные кратковременные результаты лечения ОСН следует трансформировать в длительные положительные результаты. На этом пути перспективным является применение патогенетического базисного лечения основного заболевания, защита миокарда и функции почек.
ЛИТЕРАТУРА
- Abraham W.T., Adams K.F., Fonarov G.C. et al. (2005) In-Hospital Mortality in Patients With Acute Decompensated Heart Failure Requiring Intravenous Vasoactive Medications: An Analysis From the Acute Decompensated Heart Failure National Registry (ADHERE). JACC, 46: 57-64.
- Cleland J.G., Swedberg K., Follath F. et al. (2003) Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The EuroHeart Failure survey programme — a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur. Heart J., 24(5): 442-463.
- Colucci W.S. (2001) Nesiritide for the treatment of decompensated heart failure. J. Card. Fail., 7(1): 92-100.
- DiDomenico R.J. et al. (2004) Guidelines for Acute Decompensated Heart Failure Treatment. Ann. Pharmacother., 38: 649-660.
- Earl G.L., Fitzpatrick J.T. (2005) Levosimendan: A Novel Inotropic Agent for Treatment of Acute Decompensated Heart Failure. Ann. Pharmacother., 39: 1888-1896.
- Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: The Task Force on Acute Heart Failure of the European Society of Cardiology. Endorsed by the European Society of Intensive Care et al. (2005) Eur. Heart J., 26: 384-416.
- Felker G.M., Adams K.F. Jr., Konstam M.A., et al. (2003) The problem of decompensated heart failure: nomenclature, classification, and risk stratification. Am. Heart J., 145 (2 suppl): S18-S25.
- Gheorghiade M. et al. (2005). Acute Heart Failure Syndromes: Current State and Framework for Future Research. Circulation, 112: 3958-3968.
- Gheorghiade M., Zannad F. (2005) Modern management of acute heart failure syndromes. Eur. Heart. J. Suppl., 7: B3-B7.
- Jain P., Massie B.M., Gattis W.A. et al. (2003) Current medical treatment for the exacerbation of chronic heart failure resulting in hospitalization. Am. Heart J., 145 (2 Suppl.): S3-S17.
- Philip A., Poole-Wilson (2002) Treatment of Acute Heart Failure: Out With the Old, In With the New. JAMA, 287: 1578-1580.