Пухлини голови та шиї
Содержание
- ПУХЛИНИ ПОВІКИ
- ПУХЛИНИ ЗОВНІШНЬОГО ВУХА
- ПУХЛИНИ СЛИЗОВОЇ ОБОЛОНКИ ПОРОЖНИНИ РОТА
- РАК ЯЗИКА
- РАК СЛИЗОВОЇ ОБОЛОНКИ ЩОКИ
- РАК СЛИЗОВОЇ ОБОЛОНКИ ТВЕРДОГО ТА М’ЯКОГО ПІДНЕБІННЯ
- РАК СЛИЗОВОЇ ОБОЛОНКИ АЛЬВЕОЛЯРНОГО КРАЮ ВЕРХНЬОЇ ТА НИЖНЬОЇ ЩЕЛЕПИ
- РАК ГУБИ
- ПУХЛИНИ ЩЕЛЕП
- ПУХЛИНИ СЛИННИХ ЗАЛОЗ
- ПУХЛИНИ ШИЇ
- НЕЙРОЕНДОКРИННІ ПУХЛИНИ
- НЕОРГАННІ ПУХЛИНИ
- ПУХЛИНИ ПАРАГАНГЛІОНАРНИХ СТРУКТУР — ХЕМОДЕКТОМИ
- ДІАГНОСТИКА ЕНДОКРИННИХ ПУХЛИН ШЛУНКОВО-КИШКОВОГО ТРАКТУ
- ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
ПУХЛИНИ ПОВІКИ
Серед новоутворень органа зору пухлини повіки за частотою займають 1-ше місце.
ДОБРОЯКІСНІ ПУХЛИНИ ПОВІКИ
Найчастіше відмічають папіломи повіки. Розташовуються папіломи здебільшого на шкірі поблизу війчастого краю, мають широку основу або вузьку ніжку, вкриті малозміненою шкірою або товстим роговим шаром. Консистенція щільна. Ростуть папіломи поволі, без виразки. Виразка існуючих папілом, схильність до більш швидкого їх росту є ознаками злоякісного переродження.
Лікування — хірургічне висічення, електрокоагуляція.
Кісти. Розрізняють дермоїдні та епідермоїдні, ретенційні кісти потових, сальних та інших залоз повік, атероматозні кісти (або атероми повік).
Дермоїдні кісти — округлої або овальної форми утворення еластичної консистенції, зовні гладкі. Розташовуються під шкірою, найчастіше у зовнішньої спайки повіки. Шкіра над кістою не змінена, рухома. Кіста малорухома, фіксована, капсула її зрощена з окістям краю орбіти, вміст дермоїдних кіст — суміш зроговілих епітеліальних клітин, жиру, волосся та інших утворень.
Лікування — тільки хірургічне (видалення кісти разом з капсулою).
Ретенційні кісти локалізуються на війчастому краю повік і мають вигляд прозорих кульок невеликих розмірів, вміст яких — водяниста прозора рідина світлого або солом’яно-жовтого кольору. Кіста легко спустошується проколом стерильної голки. Рецидиви бувають рідко.
Атероматозні кісти повіки бувають нерідко численними. Вміст їх — густі атероматозні маси.
Лікування — хірургічне видалення разом із капсулою.
Гемангіоми повіки відмічають частіше у дітей, здебільшого у дівчаток. Розрізняють капілярну, кавернозну форми гемангіом. Кавернозні гемангіоми частіше виявляють у дорослих. Вони виступають над поверхнею шкіри або розповсюджуються в глибину. Капілярну гемангіому відмічають частіше ніж інші форми; це плоска пляма червоного кольору з чіткими межами. При невеликих гемангіомах зазвичай проводять коагуляцію. При більших гемангіомах здійснюють діатермокоагуляцію голковим електродом, проколюючи тканину пухлини в різноманітних напрямках.
Нейрофіброми повіки. Новоутворення локалізуються частіше на верхній повіці. Пальпується один великий або декілька більш дрібних щільних вузликів, що займають майже всю повіку та викликають птоз.
Лікування — хірургічне висічення пухлини. Характерні часті рецидиви.
Лімфангіоми повіки ростуть дифузно та уражують більшу частину або всю повіку, викликаючи птоз. Пухлина м’яка, поверхня її гладка, шкіра над нею не змінена. Виявляють лімфангіому рідко.
Лікування — хірургічне висічення пухлини.
ПЕРЕДРАКОВІ ПУХЛИНИ ПОВІКИ
Пігментна ксеродерма. Належить до облігатних передракових дерматозів. На шкірі повіки виникають червоного кольору плями, після чого шкіра на цих ділянках стає сухою, вкритою кірками. З’являються телеангіектазії, осередки атрофії та гіперкератозу. Необхідний захист шкіри від сонячних променів.
Лікування — хірургічне, електрохірургічне, кріохірургічне видалення; ПТ.
Шкірний ріг — факультативна форма передракових пухлин повіки. На повіці виникає тверда, у вигляді шипа, пухлина, що виступає над рівнем шкіри, конічної форми. Основа її м’яка. Верхня частина рогу щільна, суха, являє собою розростання рогового епітеліального шару.
Лікування — висічення шкірного рогу під основою електроножем.
ЗЛОЯКІСНІ ПУХЛИНИ ПОВІКИ
До місцево-деструктивних пухлин належить базальноклітинний рак. При тривалому існуванні може розповсюджуватися на глибокі відділи повіки, кон’юнктиву, очне яблуко, орбіту. Розвивається базальноклітинний рак частіше на нижній повіці та у внутрішньому куті ока.
Не дає метастазів, але має інфільтративний ріст.
Клінічний перебіг базальноклітинного раку повік різноманітний, однак найчастіше виділяють наступні форми: вузлову, виразкову, руйнуючу та поверхнево-склеротичну.
Специфічний «восковий» або «стеариновий» відтінок пухлини, який виявляють при дослідженні щілинною лампою, а також дрібно горбкувата її поверхня з вираженим судинним малюнком характерні для всіх клінічних форм базальноклітинного раку.
Лікування — таке саме, як і при плоскоклітинному раку повіки.
Від базальноклітинного раку повіки плоскоклітинний відрізняється більш швидким ростом та здатністю метастазувати в регіонарні лімфатичні вузли (привушні та глибокі яремні), що зумовлює гірший прогноз. Плоскоклітинний рак повіки може тривалий час існувати без помітних зовнішніх ознак; розвивається він значно повільніше, ніж рак інших локалізацій, тому довго залишається нерозпізнаним.
Локалізується найчастіше (в половині випадків) на нижній повіці, рідше — в ділянці внутрішнього кута очної щілини, значно рідше — в ділянці верхньої повіки, зовнішнього кута очної щілини та інших відділів повіки.
Плоскоклітинний рак повіки виявляють у вигляді одинокого вузлового ущільнення або плоского бородавчастого утворення, що виступає над поверхнею шкіри, з жорсткою щільною поверхнею. Інколи може початися з появи на шкірі ерозії з незначним серозним виділенням, яке засихає в кірку. Потім під кіркою формується виразка з щільними краями та горбистим дном. При подальшому рості пухлини відбувається часткове руйнування повіки. В занедбаних випадках ракова пухлина розповсюджується на очне яблуко, м’які тканини орбіти та приносові пазухи носа.
Лікування. Місцево-деструктивні та злоякісні пухлини повіки (базальноклітинний та плоскоклітинний рак) лікують майже однаково. Добрих результатів можна досягнути на ранніх стадіях, використовуючи хірургічний метод, ПТ, а також кріотерапію.
ПТ, зокрема, близькофокусну рентгенотерапію та її різні методики, використовують диференційовано залежно від поширення злоякісної пухлини, локалізації та гістологічної будови. При опроміненні необхідно захистити очне яблуко. Для цього може бути використаний напівсферичний свинцевий очний протез. Сумарна доза при базальноклітинному раку становить близько 60 Гр, при плоскоклітинному — 75–80 Гр.
При невеликих за площею та неглибоких ракових пухлинах методом вибору може бути хірургічне висічення їх в межах здорових тканин. При розповсюджених, в тому числі рецидивних, пухлинах проводять комбіноване лікування, спочатку — дистанційну гамма-терапію, після цього — широке висічення пухлини майже до екзентерації орбіти.
Прогноз лікування доброякісних пухлин повік зазвичай добрий, при невеликих ЗН (I–II стадія) — сприятливий, при розповсюдженому базальноклітинному та плоскоклітинному раку (III стадія) — 5-річне виліковування відмічають у 60–70% випадків.
ПУХЛИНИ ЗОВНІШНЬОГО ВУХА
Вухо поділяється на зовнішнє (вушна раковина і зовнішній слуховий прохід), середнє та внутрішнє. За клінічним перебігом новоутворення зовнішнього вуха поділяють на доброякісні, місцево-деструктивні та злоякісні.
Доброякісні новоутворення зовнішнього вуха, тобто вушної раковини та зовнішнього слухового проходу, не є рідкісними.
З епітеліальних доброякісних пухлин виділяють папілому та церуміному.
Папіломи частіше виникають на шкірі вушної раковини; можуть також розташовуватися в зовнішньому слуховому проході, нерідко заповнюючи його просвіт.
Церумінома (атенома) зовнішнього слухового проходу відмічається дуже рідко, виникає з овальних (сірчаних) залоз. Церуміному виявляють частіше в осіб віком старше 20 років. Хворі скаржаться на закладеність вух. При розповсюдженій пухлині мають скарги на зниження слуху, біль та виділення з вуха. Спочатку пухлина розташовується на стінці зовнішнього слухового проходу і має рожевий колір, у міру росту та збільшення вона заповнює прохід та ззовні нагадує поліп. Рентгенологічно в цей період визначають добру пневматизацію соскоподібного відростка. Поступово пухлина розповсюджується на середнє вухо та його стінки, руйнуючи їх. Ці зміни визначають рентгенологічно.
М’якотканинні доброякісні пухлини зовнішнього вуха виникають з різних тканин: фіброзної, жирової, м’язової, судинної та інших (фіброма, ліпома, гемангіома тощо).
Фіброма розташовується частіше на вушній раковині, на місцях проколу голкою для носіння сережок, має розміри 0,5–4 см. Рідше вона локалізується біля входу в зовнішній слуховий прохід та навколо завитка вушної раковини. Нерідко молоді жінки звертаються до хірурга поліклініки з проханням прооперувати їх та усунути наявний косметичний недолік на місці проколу вушної раковини, де утворилися фіброми.
Гемангіоми становлять близько 7% серед всіх доброякісних пухлин вуха. Вони можуть розвиватися в усіх відділах вуха. Частіше виявляють капілярні та кавернозні гемангіоми. Капілярні гемангіоми в дитячому віці часто зникають. Кавернозні гемангіоми зазвичай розташовуються в товщі вушної раковини. Частіше вони м’якої консистенції і мають синюшний відтінок. Гемангіоми вушної раковини можуть розповсюджуватися в бік зовнішнього слухового проходу, просвіт якого може бути повністю закритий. При травмі нерідко відмічають кровоточивість гемангіоми.
Хондрому виявляють дуже рідко; розвивається з хрящової тканини. Локалізуючись в зовнішньому слуховому проході, поступово може закрити його просвіт.
Остеобластокластоми також відмічають рідко. З’являються вони зазвичай у хворих віком 8–45 років у вигляді безболісного набряку, кам’янистої щільності позаду вушної раковини. Рентгенографічне дослідження виявляє кісткові зміни у вигляді круглих затемнень, навколо яких формується щільний вал. При деструктивній формі остеобластокластоми рентгенологічно можуть проявлятися руйнуванням піраміди скроневої кістки.
Остеома частіше розвивається в кортикальному шарі соскоподібного відростка або зовнішнього слухового проходу. Зростання остеоми повільне. В зовнішньому слуховому проході остеоми характеризуються своєрідним перебігом та нагадують кісткові потовщення. Виявляють латеральні остеоми зовнішнього слухового проходу і медіальні, розташовані біля барабанної перетинки в медіальній частині зовнішнього слухового проходу. Останні зазвичай множинні, двобічні, на широкій основі та некомпактні (мають спонгіозну будову). Остеоми вкриті дещо потовщеним епітелієм сірувато-білого або сірувато-жовтого кольору. У разі, коли остеоми закривають просвіт проходу, розвивається зниження слуху. Хворі інколи скаржаться на шум у вухах. У ділянці соскоподібного відростка остеоми виявляють у вигляді поодиноких вузлів, що розпізнаються частіше випадково при рентгенографії.
У ділянці вушної раковини можуть бути кісти та справжні холестеатоми. Розрізняють кісти серозні (частіше після перенесених травм) та епідермоїдні. Справжні холестеатоми розвиваються з ембріональних тканин. Локалізуються вони у скроневій кістці та нагадують дермоїдну кісту, досягаючи інколи великих розмірів.
ЗЛОЯКІСНІ ПУХЛИНИ ЗОВНІШНЬОГО ВУХА
До місцево-деструктивних новоутворень відносять базальноклітинний рак, до злоякісних — плоскоклітинний рак, меланому, саркому. Найчастіше відмічають базальноклітинний та плоскоклітинний рак, значно рідше — меланому, дуже рідко — саркому.
Базальноклітинний та плоскоклітинний рак шкіри мають різний прогноз і це необхідно враховувати.
За даними багатьох авторів, базальноклітинний та плоскоклітинний рак частіше розвиваються у вушній раковині (85%), рідше — у зовнішньому слуховому проході (10%) та ще рідше — у середньому вусі (5%). Базальноклітинний рак зазвичай виникає на шкірі вушної раковини та хрящового відділу зовнішнього слухового проходу. Плоскоклітинний рак виявляють в усіх відділах зовнішнього вуха. Виникають пухлини частіше в осіб віком 50–70 років, однаково часто у чоловіків і жінок. Рак зовнішнього вуха нерідко виникає на місці тривалих запальних процесів, травм і вікових змін шкіри. Чинниками його розвитку можуть бути опіки, відмороження, побутові та професійні шкідливості. Рак зовнішнього вуха може бути екзофітним (бородавчасті вузлики з широкою основою) або ендофітним (плоска виразка з інфільтрованими краями). Ракова пухлина, що виникла в тій або іншій частині вушної раковини, інфільтрує та руйнує поступово всю раковину, а після цього розповсюджується на прилеглі тканини та органи. Рак зовнішнього слухового проходу на ранніх стадіях розвитку зазвичай не розпізнається, бо хворі не скаржаться, а зовні процес нагадує інше захворювання, наприклад, екзему або хронічний запальний процес. У цей період часто відзначають характерні симптоми раку слухового проходу — зуд у вусі, до якого приєднується біль. Зростання пухлини може відбуватися в бік вушної раковини аж до повного її руйнування або в напрямку середнього вуха, або у всі боки одночасно.
З розповсюдженням на середнє вухо, навколишні тканини та кістки приєднується нестерпний біль, розвиваються параліч мімічної мускулатури, зниження слуху, виникають метастази в привушні та шийні лімфатичні вузли.
Діагностика базальноклітинного та плоскоклітинного раку шкіри зовнішнього вуха на початкових стадіях складна через схожість процесу з іншими захворюваннями та доброякісними новоутвореннями. Однак у більшості випадків запідозрити рак зовнішнього вуха можна на підставі макроскопічного вигляду новоутворення.
Диференціювати пухлини зовнішнього вуха необхідно з вовчаком, туберкульозом, сифілісом.
Підтверджується діагноз цитологічним дослідженням відбитків зскрібків або пунктатів з пухлини, біопсією.
Лікування при доброякісних пухлинах зовнішнього вуха хірургічне (висічення скальпелем, електроексцизія та електрокоагуляція, кріогенний вплив). Остеоми та остеобластокластоми видаляють у тих випадках, коли вони викликають функціональні порушення або косметичні дефекти.
Лікування базальноклітинного та плоскоклітинного раку шкіри зовнішнього вуха може бути променевим, хірургічним або комбінованим. Хірургічне лікування показане при обмежених пухлинах і полягає у висіченні частини або всієї вушної раковини.
При розповсюдженому процесі застосовують комбіноване лікування: передопераційна ПТ, після цього (через 2 тиж) електроексцизія пухлини або всієї вушної раковини, або кріохірургія (у пацієнтів похилого віку). Нерідко потрібно висікати зовнішній слуховий прохід. Дефект закривають місцевими тканинами або шляхом вільної шкірної пластики.
При підозрі на метастази або наявність їх у шийних лімфатичних вузлах виконують фасціально-футлярне висічення шийної клітковини. При проростанні метастазів у внутрішню яремну вену або за наявності численних метастазів в шийні лімфатичні вузли проводять операцію Крайля.
Комбіноване лікування раку зовнішнього слухового проходу II та III стадії із застосуванням радикальних оперативних втручань та післяопераційної ПТ дає можливість досягнути 5-річної виживаності у 20–22% хворих.
ПУХЛИНИ СЛИЗОВОЇ ОБОЛОНКИ ПОРОЖНИНИ РОТА
Пухлини слизової оболонки порожнини рота відмічають здебільшого в осіб віком старше 40 років, декілька частіше у чоловіків, ніж у жінок.
Розрізняють доброякісні та злоякісні пухлини. До доброякісних пухлин відносять папіломи, фіброми, невриноми, гемангіоми, лімфангіоми, ретенційні кісти, дермоїди.
З доброякісних пухлин частіше виявляють епітеліальні — плоскоклітинні папіломи (з багатошарового плоского епітелію). Це поодинокі або множинні утворення на ніжці або широкій основі. Зовні папілома вкрита епітелієм, який знаходиться на різних стадіях проліферації. Основа ніжки папіломи переходить в нормальну слизову оболонку. Найчастіше локалізується на слизовій оболонці піднебіння, щік, спинки язика, передніх відділів дна порожнини рота. Виразкування папіломи може бути ознакою малігнізації.
Лікування папілом — хірургічне або електрохірургічне. У підозрілих випадках необхідно заздалегідь виконати біопсію.
ПЕРЕДРАКОВІ ЗАХВОРЮВАННЯ
До передракових захворювань належать лейкоплакія, плоскі (прості декубітальні) виразки, хронічні виразки, які розвинулися внаслідок травми гострими краями каріозних зубів, протезів, туберкульозні та сифілітичні виразки, тріщини, бородавчасті розростання, тривало існуючі папіломи на широкій основі.
Серед пацієнтів із передраковими захворюваннями основну масу складають особи, що палять, жують бетель, тютюн, вживають алкоголь. Визначну роль в етіології передраку слизової оболонки порожнини рота відіграють неповноцінне харчування, неправильний його режим, вживання занадто гарячої їжі.
Діагностика передракових захворювань слизової оболонки порожнини рота ґрунтується на огляді, пальпації, дослідженні мазків-відбитків або зскрібків з осередку утворення. У ряді випадків слід проводити пункційну або ексцизійну біопсію. Ретельному обстеженню підлягає регіонарний лімфатичний апарат.
Лейкоплакії — білуваті або сіруваті плями, що розташовуються найчастіше на слизовій оболонці щік, рідше на язиці, а також в ділянці дна порожнини рота. Розрізняють обмежені (у вигляді окремих плям) та дифузні форми, що охоплюють інколи значні ділянки слизової оболонки. Плями — з нечіткими контурами. На початкових стадіях поверхня вогнищ лейкоплакії гладка блискуча, консистенція м’яка. В подальшому (через зроговіння поверхневих шарів епітелію) поверхня стає шорсткою, на ній з’являються тріщини, брудно-сірий наліт, інколи бородавчасті розростання (лейкокератоз). Ущільнення в ділянці лейкоплакії, наявність інфільтрату з великою ймовірністю можуть вказувати на малігнізацію.
Плоскі (прості декубітальні) виразки виникають відповідно до місця травми слизової оболонки каріозним або зламаним зубом, неякісним протезом. Форма виразки нерівна, дно плоске, нерідко вкрите сіруватим нальотом, краї тонкі, м’які. Якщо край виразки потовщується та з’являється інфільтрат, то це свідчить про малігнізацію виразки.
Бородавчасті розростання — щільні бляшки з дрібногорбистою нерівною поверхнею, що злегка виступають над рівнем слизової оболонки.
Лікування передракових захворювань повинно бути активним і полягає у використанні хірургічного методу — висічення, кріодеструкція, електрокоагуляція. Втручання виконують на відстані 5 мм від краю утворення. Якщо процес охоплює значну частину органу, можна здійснити поетапну кріодеструкцію або електрокоагуляцію окремих ділянок утворення.
Прості декубітальні виразки або тріщини лікують медикаментозно після заздалегідь проведеного лікування або видалення хворих зубів, усунення дефектів протезування. Якщо ефекту в результаті проведеного консервативного лікування протягом 10–15 днів немає, застосовують висічення виразки в межах здорових тканин.
РАК СЛИЗОВОЇ ОБОЛОНКИ ПОРОЖНИНИ РОТА
Рак слизової оболонки порожнини рота виявляють здебільшого в осіб віком старше 40 років, частіше у чоловіків, ніж у жінок. Займає 1-ше місце серед злоякісних пухлин голови та шиї. Приблизно в 55–60% випадків рак органів порожнини рота локалізується на язиці. Рак язика розвивається частіше на бокових поверхнях і в середній його третині. Далі йдуть слизові оболонки щік, дна порожнини рота, твердого та м’якого піднебіння, альвеолярних країв верхньої та нижньої щелепи.
Розрізняють 3 основні форми раку порожнини рота: виразкову, папілярну, інфільтративну.
Виразковий рак характеризується наявністю виразки з інфільтратом навколо. Дно ракової виразки дрібногорбисте, вкрите фіброзним нальотом. В основі виразки пальпується щільний інфільтрат. Далі виразка збільшується та набуває вигляду кратера.
Папілярна форма раку являє собою пухлину грибовидної форми на слизовій оболонці з пляшкоподібними або папілярними виростами. Такі пухлини мають чіткі межі, розташовуються поверхнево та відмічаються у чверті всіх хворих. Пухлина буває щільною та кровоточивою.
Інфільтративна форма раку характеризується дифузним ураженням, твердим, нерідко болісним інфільтратом у товщі тканин. Інфільтрат не має чітких меж, слизова оболонка над ним здається нормальною, інколи з’являється тонка виразка в центрі пухлини.
За гістологічною будовою рак порожнини рота в 90–95% випадків — плоскоклітинний зроговілий, рідко — незроговілий та недиференційований. Можуть виявляти аденокарциноми з малих слинних залоз.
Клінічні прояви. Скарги хворого залежать від локалізації пухлини, стадії захворювання, форми раку. На початкових стадіях у хворих відмічають печію в ділянці утворення при прийомі їжі, відчуття стороннього тіла в роті, біль при ковтанні. У міру розвитку захворювання біль в ділянці пухлини посилюється. При розташуванні пухлини в ділянці щелепи відзначають зубний біль, хитання та випадіння зубів. Ускладнюється відкриття рота, ковтання, виникає слинотеча, розлад вимови, з’являється гнилий запах з рота — супутник розпаду та інфікування пухлини.
Розпад ракової пухлини може призвести до сильної кровотечі.
Пухлинний процес слизової оболонки рота вирізняється швидким місцевим прогресуванням та розповсюдженням на навколишні тканини. Розвиваються інтоксикація та виснаження.
Однією з особливостей пухлин слизової оболонки порожнини рота є також часте (в 40–86%) метастазування в підщелепні та глибокі шийні лімфатичні вузли. Слід відзначити, що рак слизової оболонки задньої половини порожнини рота має більш злоякісний перебіг, ніж передньої, тому лікувати рак органів задньої половини порожнини рота також значно складніше.
Діагноз встановлюють на підставі огляду (в тому числі інструментального), рентгенологічного та цитологічного досліджень. Інколи бувають необхідні пункція пухлини або біопсія з краю новоутворення.
Діагностика та лікування раку слизової оболонки порожнини рота залежать від локалізації пухлини, ступеня розповсюдження процесу, гістологічної форми, загального стану хворого.
Диференційну діагностику слід проводити із запальними процесами, доброякісними пухлинами малих слинних залоз, первинним сифілісом, туберкульозом, зобом кореня язика.
Лікування. Лікування раку слизової оболонки порожнини рота має бути комбінованим. Спочатку слід провести санацію порожнини рота. Лікування первинного раку порожнини рота починають з дистанційної ПТ до сумарної дози 50–60 Гр. За наявності регіонарних метастазів проводять їх опромінення одночасно з первинним вогнищем.
Через 3–4 тиж після опромінення ставиться питання про хірургічне втручання. При місцево-поширених пухлинах виконують комбіновані хірургічні втручання з видаленням в єдиному блоці з первинною пухлиною вмісту піднижньощелепного трикутника, клітковини та лімфатичних вузлів шиї, у разі наявності регіонарних метастазів — в обсязі операції Крайля. Видаляти регіонарні лімфатичні вузли можна до променевого лікування або через 3–4 тиж після нього. При поширених метастазах перед операцією на шиї треба провести передопераційне опромінення в дозі 40–45 Гр. Перша умова виконання операції — це лікування первинної пухлини. Другою умовою для радикального виконання операції є можливість висічення регіонарних лімфатичних вузлів. При рухомих та обмежено рухомих вузлах радикальна лімфаденектомія можлива. Видалення ж спаяних з навколишніми тканинами вузлів (загальна або внутрішня сонні артерії, гортань, трахея, нижня щелепа) часто неможливе. Тому висічення нерухомих метастазів не завжди виправдане через загрозу небезпечних ускладнень. Шийна лімфаденектомія протипоказана при різко послабленому загальному стані хворого, віддалених метастазах, тяжких супутніх захворюваннях, особливо при порушенні мозкового кровообігу (навіть в анамнезі). Межі втручання й об’єм тканин, що видаляються при операції Крайля, базуються на топографо-анатомічних даних. У блок тканин, що видаляються, включають підщелепну та нижній полюс привушної слинної залози. Межами тканин, що видаляються, є ключиця, передній край трапецієподібного м’яза, соскоподібний відросток, нижній полюс привушної слинної залози, нижній край нижньої щелепи і середня лінія шиї.
Фасціально-футлярне висічення клітковини шиї ґрунтується на тих же принципах анатомічної зональної футлярності, що й операція Крайля, але відрізняється від неї декілька меншим обсягом. При цій операції зберігаються внутрішня яремна вена, груднино-ключично-соскоподібний м’яз і додатковий нерв. Операція показана у разі наявності одиничних або декількох рухомих метастатичних лімфатичних вузлів. Ця операція не викликає таких серйозних порушень і деформацій, як операція Крайля. Вона може бути проведена відразу з обох боків, що необхідно в ряді випадків. При дотриманні показань до операцій віддалені результати лікування при фасціально-футлярному висіченні клітковини шиї і операції Крайля однакові.
Верхнє фасціально-футлярне висічення шийної клітковини (операція Ванаха) складається не тільки з видалення підпідборідних і піднижньощелепних лімфатичних вузлів, але й глибоких шийних лімфовузлів в зоні від заднього черевця двочеревцевого м’яза до верхнього краю сухожилка лопатково-під’язикового м’яза, а також обох піднижньощелепних залоз і резекції нижнього полюса привушних залоз. Однобічна операція Ванаха виконується тільки при підозрі на метастаз в підпідборідній чи піднижньощелепній ділянці, її слід використовувати як метод розширеної біопсії.
При проведенні оперативних втручань з приводу видалення регіонарних метастазів можуть виникнути ускладнення як в ранній, так і в пізній післяопераційний період. До цих ускладнень належать: пошкодження нервів (лицьового, під’язикового, язикового, блукаючого, діафрагмального); пошкодження грудної лімфатичної протоки, емфізема середостіння; повітряна емболія при пошкодженні крупних вен; масивна кровотеча (з внутрішньої та загальної сонної артерії) як первинна, так і вторинна; порушення дихання (ларингоспазм, набряк гортані); пневмонія.
З метою підвищення ефективності лікування розповсюджених та радіорезистентних пухлин слизової оболонки порожнини рота застосовують терморадіотерапію.
При неоперабельних пухлинах застосовують паліативну ПТ, внутрішньоартеріальну хіміотерапію та ПХТ.
Основні схеми ПХТ, що застосовуються при пухлинах голови та шиї:
1. циклофосфамід — 400 мг/м2 внутрішньовенно (в/в) в 1-й день,
доксорубіцин — 40 мг/м2 в/в в 1-й день,
цисплатин — 40 мг/м2 в/в в 1-й день,
кожні 4 тиж.
2. цисплатин — 50 мг/м2 в/в в 1-й день,
доксорубіцин — 30 мг/м2 в/в в 1-й день,
5-флуороурацил — 500 мг/м2 в/в в 1-й та 2-й дні,
кожні 4 тиж.
3. цисплатин — 20 мг/м2 в/в в 1–4-й дні,
доксорубіцин — 20 мг/м2 в/в в 1–3-й дні,
блеоміцин — 10 мг/м2 в/в в 1–4-й дні,
кожні 3–4 тиж.
4. циклофосфамід — 500 мг/м2 в/в в 1-й день,
доксорубіцин — 50 мг/м2 в/в в 1-й день,
цисплатин — 40 мг/м2 в/в в 2-й та 3-й дні,
5-флуороурацил — 500 мг/м2 в/в в 1-й та 2-й дні,
кожні 4 тиж.
5. циклофосфамід — 300 мг/м2 в/в в 1-й день,
доксорубіцин — 30 мг/м2 в/в в 1-й день,
цисплатин — 30 мг/м2 в/в в 1-й день,
блеоміцин — 30 мг в/в в 1-й день,
кожні 3 тиж.
6. 5-флуороурацил — 600 мг/м2 в/в в 1-й день,
епірубіцин — 50 мг/м2 в/в в 1-й день,
цисплатин — 100 мг/м2 в/в в 1-й день,
кожні 3 тиж.
7. іфосфамід — 1500 мг/м2 в/в протягом 1 год в 1–3-й дні,
+ месна
мітоксантрон — 12 мг/м2 в/в протягом 30 хв в 1-й день,
кожні 3 тиж.
8. паклітаксел — 250 мг/м2 в/в протягом 24 год в 1-й день,
кожні 3 тиж.
9. паклітаксел — 135 мг/м2 в/в протягом 24 год в 1-й день,
цисплатин — 75 мг/м2 в/в в 1-й день,
кожні 3 тиж.
10. паклітаксел — 90 мг/м2 в/в в 1-й день,
цисплатин — 60 мг/м2 в/в в 1-й день,
кожні 2 тиж.
11. паклітаксел — 250 мг/м2 в/в протягом 3 год в 1-й день,
карбоплатин — AUC=7,5 в/в в 1-й день,
кожні 3 тиж.
12. паклітаксел — 200 мг/м2 в/в протягом 3 год в 1-й день,
карбоплатин — AUC=7 в/в в 1-й день,
кожні 3 тиж.
13. паклітаксел — 175 мг/м2 в/в протягом 3 год в 1-й день,
іфосфамід — 1000 мг/м2 в/в протягом 2 год в 1–3-й дні,
+ месна
цисплатин — 60 мг/м2 в/в в 1-й день,
кожні 3–4 тиж.
Кріогенний метод можна використовувати з успіхом при раку органів порожнини рота I–II стадії, залишках пухлин і обмежених рецидивах, а також при раку передніх відділів порожнини рота III стадії, коли є протипоказання до хірургічного лікування. За наявності регіонарних метастазів кріогенний вплив на первинне вогнище проводиться одномоментно з розтином шийної клітковини.
Ефективність лікування хворих на рак слизової оболонки порожнини рота значною мірою залежить від стадії процесу, а також ступеня злоякісності плоскоклітинного раку.
За даними літератури, 5-річна виживаність при раку органів порожнини рота I стадії (після використання хірургічного методу або ПТ) становить 75–80%, II стадії — 50–60%, при використанні комбінованого лікування при раку III стадії — 30–40%.
Залежно від локалізації раку порожнини рота 5-річна виживаність при використанні різних сучасних методів становить для раку: язика — 30%, щоки — 47%, ясна — 40%, дна порожнини рота — 36%, твердого піднебіння — 25%, м’якого піднебіння — 20–25%. Встановлено, що при проростанні раку органів порожнини рота в кістки 5-річна виживаність становить 32%, а за відсутності проростання — 47%.
Поліпшення результатів лікування раку органів порожнини рота залежить від багатьох обставин, але передусім повинна покращуватися діагностика ранніх форм раку.
РАК ЯЗИКА
Частка раку язика становить 60% всіх ракових пухлин слизової оболонки порожнини рота. Рак язика частіше розвивається в середній третині його бокової поверхні (62–70%) та в корені. Значно рідше виникає на нижній поверхні язика, рідко — на дорсальній поверхні та кінчику язика.
Класифiкацiя за системою TNM (коди МКХ-0-С02–06)
T — первинна пухлина, оцінюється за розміром пухлини у найбільшому вимірі
Тx — недостатньо даних для оцінки первинної пухлини
Т0 — первинна пухлина не визначається
Tis — преінвазивна карцинома
Т1 — пухлина до 2 см у найбільшому вимірі
Т2 — пухлина до 4 см у найбільшому вимірі
Т3 — пухлина більше 4 см у найбільшому вимірі, але не виходить за межі губи
Т4а — (резектабельні): пухлина розповсюджується на оточуючі структури (кортикальний шар кістки, глибокі м’язи язика, верхньощелепний синус, шкіра обличчя)
Т4b — (нерезектабельні): пухлина розповсюджується на жувальні м’язи, крилоподібну пластинку чи основу черепа та/або охоплює внутрішню сонну артерію
N — регіонарні лімфатичні вузли
Nx — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів
N0 — немає ознак ураження регіонарних лімфатичних вузлів
N1 — метастази в один гомолатеральний лімфатичний вузол до 3 см у найбільшому вимірі
N2 — метастази в один гомолатеральний лімфатичний вузол діаметром до 6 см у найбільшому вимірі чи множинні метастази в гомолатеральні лімфатичні вузли, ні один з яких не перевищує 6 см у найбільшому вимірі, чи білатеральні, чи контралатеральні метастатичні лімфатичні вузли, ні один з яких не перевищує 6 см у найбільшому вимірі
N2а — метастаз в гомолатеральний лімфовузол більше 3 см, але не більше 6 см у найбільшому вимірі
N2b — множинні метастази в гомолатеральні лімфовузли,жоден з яких не перевищує 6 см у найбільшому вимірі
N2c — білатеральні чи контралатеральні метастатичні лімфовузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N3 — метастази в лімфатичні вузли більше 6 см у найбільшому вимірі
Примітка: лімфовузли по середній лінії тіла вважаються гомолатеральними.
М — віддалені метастази
Мх — немає даних для визначення віддалених метастазів
М0 — немає ознак віддалених метастазів
М1 — є віддалені метастази
Патоморфологічна класифікація рТNМ: категорії рТ, рN, рМ відповідають категоріям Т, N та М.
рN0 — матеріал для гістологічного дослідження після селективної шийної регіонарної лімфаденектомії повинен включати не менше 6 лімфатичних вузлів. Матеріал для гістологічного дослідження після радикальної чи модифікованої радикальної шийної лімфаденектомії повинен включати не менше 10 лімфатичних вузлів.
Гістопатологічна градація:
Gх — ступінь диференціації пухлини неможливо визначити
G1 — високий ступінь диференціації
G2 — проміжний ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями при раку язика представлено у табл. 15.1.
Таблиця 15.1
Групування за стадiями
|
Стадія 0 |
Tis N0M0 |
|
Стадія I |
T1N0M0 |
|
Стадія II |
T2N0M0 |
|
Стадія III |
T3N0M0 T1–3N1M0 |
|
Стадія IVА |
T4аN0–1M0T1–4аN2M0 |
|
Стадія IVB |
T4b, будь-яке NM0, будь-яке TN3M0 |
|
Стадія IVC |
Будь-яке T, будь-яке NM1 |
Розрізняють пухлини передньої, середньої, задньої третини та ділянки кореня язика. Рак передньої та середньої третини (близько 75% випадків) буває плоскоклітинним зроговілим, дає метастази передусім у підщелепні лімфатичні вузли. В задній третині та в ділянці кореня язика нерідко виявляють низькодиференційований незроговілий рак та лімфоепітеліоми. Рак цих відділів язика метастазує в глибокі шийні лімфатичні вузли, що розташовуються вздовж внутрішньої яремної вени, в навкологлотковій клітковині.
Наявність зв’язків кровоносних та лімфатичних судин обох половин язика зумовлює можливість виникнення двобічних і перехресних метастазів (у 20% випадків). Середня частота метастазування раку язика в регіонарні лімфовузли становить 70%. Інфільтративні форми метастазують частіше та раніше, ніж екзофітні.
У поширеній формі рак язика має виразково-інфільтративний характер і розповсюджується на сусідні відділи порожнини рота. Гематогенні метастази у віддалені органи при раку язика надто рідкісні.
Диференційну діагностику раку язика необхідно проводити з наступними захворюваннями: неспецифічні запальні процеси, через травму або потрапляння стороннього тіла, туберкульозна виразка, актиномікотичні інфільтрати, сифілітична гума, папіліт, зоб кореня язика, що утворився з дистопійованої тканини щитоподібної залози, змішані пухлини кореня язика, які виникли з малих слинних залоз, міобластома (або пухлина Абрикосова), лімфангіоми.
Лікування раку язика. Сьогодні найбільше розповсюдження отримав комбінований метод лікування. Він включає такі етапи: І етап — ПТ первинного пухлинного вогнища. ІІ етап лікування (хірургічний) починають через 3–4 тиж після зменшення вираженості променевих реакцій. Хірургічне втручання виконують під ендотрахеальним наркозом, воно полягає в електроексцизії ураженої частини язика або розширеній операції. ІІІ етап лікування включає хірургічне висічення підщелепного та шийного лімфатичного апарату.
При раку язика IV стадії найбільш доцільна паліативна ПТ. Певний паліативний ефект може бути досягнутий завдяки регіонарній хіміотерапії шляхом внутрішньоартеріального введення метотрексату, 5-флуороурацилу у язикову артерію. Можливо також застосування блеоміцину, цисплатину.
Для лікування раку кореня язика найчастіше необхідна ПТ. Зазвичай застосовують дистанційну гамма-терапію в сумарній вогнищевій дозі 50–70 Гр в комплексі з внутрішньоротовою близькофокусною рентгенотерапією.
Складним завданням є лікування рецидивів раку язика. При цьому застосовують за можливості комбіноване лікування.
Рак слизової оболонки дна порожнини рота становить близько 20% усіх видів плоскоклітинного раку порожнини рота.
Пухлина найчастіше розташовується в бокових відділах, нерідко переходить на нижню поверхню язика, нижню щелепу та на м’язи дна порожнини рота. При локалізації пухлини в передніх відділах відмічають двобічні регіонарні метастази.
Характерна швидка прогресія.
Класифiкацiя за системою TNM та групування за стадiями — див. табл. 15.1.
Лікування. При раку дна порожнини рота в силу анатомічних особливостей найчастіше для лікування первинної пухлини потрібно призначати теле-гамма-терапію у поєднанні з одночасною близькофокусною рентгенотерапією та електрокоагуляцією залишків пухлини. Для деяких хворих може бути застосований комбінований метод, який включає ІІ етап — електроексцизію пухлини з резекцією язика. Через 3–4 тиж вдаються до двобічної регіонарної лімфаденектомії на шиї в обсязі фасціально-футлярної лімфаденектомії.
РАК СЛИЗОВОЇ ОБОЛОНКИ ЩОКИ
На частку цієї локалізації припадає близько 12% злоякісних пухлин слизової оболонки порожнини рота. Пухлина найчастіше розвивається на фоні лейкоплакії. Вирізняють виразкову, інфільтративну та папілярну форми. На початкових стадіях виразкову форму раку важко відрізнити від простої виразки. У занедбаних випадках пухлинний процес може переходити навіть на шкіру щоки. Розповсюдження пухлини на ділянку жувальних м’язів призводить до обмеження відкриття рота. Регіонарні метастази раку слизової оболонки щоки в основному бувають однобічними.
Лікування. Перший етап лікування раку слизової оболонки щоки включає теле-гамма-терапію та близькофокусну рентгенотерапію, якщо остання можлива через тризм. Електроексцизія пухлини при I та II стадіях припускає збереження підшкірної клітковини та шкіри. Електрохірургічний розтин тканин при III стадії раку сприяє утворенню наскрізного дефекту щоки, що закривається шкірними клаптиками, переміщеними з шиї. Інколи в цих випадках використовують філатовське стебло. При локалізації пухлини в задніх відділах щоки необхідно видаляти задні ділянки альвеолярних відростків і частину гребня висхідної гілки нижньої щелепи. Регіонарну лімфаденектомію на шиї виконують, як правило, тільки на боці процесу.шиї
РАК СЛИЗОВОЇ ОБОЛОНКИ ТВЕРДОГО ТА М’ЯКОГО ПІДНЕБІННЯ
У ділянці м’якого піднебіння частіше відмічають плоскоклітинний рак, а в ділянці твердого — аденокарциному, циліндрому. Біль та виразкування з’являються рано у зв’язку з ураженням кісткових структур верхньої щелепи. Регіонарні метастази виявляють у 15–20% випадків в глибокі шийні лімфатичні вузли.
РАК СЛИЗОВОЇ ОБОЛОНКИ АЛЬВЕОЛЯРНОГО КРАЮ ВЕРХНЬОЇ ТА НИЖНЬОЇ ЩЕЛЕПИ
Гістологічно представлений плоскоклітинним раком. Рано залучає в процес кісткову тканину альвеолярного відростка щелепи, що викликає рухливість зубів та біль. Метастазує в 20–25% випадків.
Лікування. Тільки при I стадії раку слизової оболонки альвеолярного відростка нижньої щелепи можлива його резекція на рівні верхівок коренів, в інших випадках показане видалення фрагмента чи половини нижньої щелепи одночасно з фасціально-футлярним висіченням шийної клітковини чи операцією Крайля за наявності уражених метастатичних лімфатичних вузлів. При раку слизової оболонки верхньої щелепи виконують резекцію верхньої щелепи. Післяопераційні дефекти заміщують обтураційними протезами.
РАК ГУБИ
Рак губи — під цією назвою зазвичай мають на увазі новоутворення, що виникають в ділянці слизової оболонки червоної облямівки губи. Частіше уражується нижня губа. По відношенню до всіх ЗН рак нижньої губи займає 6-те–7-ме місце та становить 3–7% всіх злоякісних пухлин. Рак верхньої губи відмічають значно рідше, він становить 2–5% стосовно раку нижньої губи. До 90% хворих на рак нижньої губи — це чоловіки віком 40–60 років.
ПЕРЕДРАКОВІ СТАНИ
До шкідливих факторів відносять вітер, сонячну радіацію. Важливе значення надають таким шкідливим звичкам, як паління, вживання алкоголю.
Передраковими станами нижньої губи є еритроплакія та лейкоплакія, дифузний та обмежений гіперкератоз, тріщини, що не загоюються, папіломи, хронічний хейліт (залозистий чи екзематозний).
Факультативні передпухлинні стани — шкірний ріг, папілома, кератоакантома, лейкоплакія, гіперкератотична та виразкова форми червоного плоского лишаю та червоного вовчака, післяпроменевий стоматит, хейліт.
До облігатних передпухлинних процесів відносять хейліт Манганотті, обмежений гіперкератоз, бородавчастий передрак.
Хейліт Манганотті проявляється однією чи декількома ерозіями яскраво-червоного кольору. Ерозії самостійно епітелізуються, але протягом деякого часу з’являються знову. Іноді ерозії зберігаються протягом багатьох місяців, без схильності до кровоточивості. Оточуючі тканини червоної облямівки запалені.
Обмежений (локалізований) дискератоз виявляють в продуктивній та деструктивній формах.
Продуктивно-вогнищевий дискератоз виглядає як біла пляма. Рогові нарости (лейкоплакія, гіперкератоз) можуть приховувати ріст епітелію в глибину.
Деструктивна форма дискератозу: на червоній облямівці губи виникають обмежені дефекти епітеліального покриву — ерозія, виразки, тріщини. Паралельно з деструктивними відбуваються й проліферативні процеси: по краях дефекту епітеліальні вирости. Тільки за допомогою гістологічного дослідження шматочка, взятого з краю новоутворення, можна виявити справжній характер процесу.
Папілома — чітко відокремлене утворення, нерідко вдається в товщу губи. Поверхня її шорстка, інколи вкрита роговими масами — папілома з ороговінням. При папіломі особливо активний проліферативний процес. Папілому губи слід розглядати як прогресивне передпухлинне захворювання, яке схильне до переходу в рак.
Бородавчастий передрак виглядає як безболісний вузлик напівкільцеподібної форми з бородавчастою поверхнею, діаметром 4–10 мм. Колір вогнища від блідо-рожевого до застійно-червоного. Зверху вузлик вкритий сірими лусочками, що важко видаляються, та розташований на незміненій червоній облямівці.
Кератоакантома являє собою пухлину напівкільцеподібної, округлої форми, що виступає над поверхнею нижньої губи. У центрі є заглиблення, що заповнене роговими масами. Під роговими масами є виразка з ворсинчастим дном, яка ніколи не кровоточить та не має виділень. Вузол жовто-коричневого чи рожевого кольору, щільний, росте дуже швидко. Самостійно розсмоктується через 3–6 міс.
Лікування передракових станів. При хейліті, дифузному дискератозі показані санація слизової оболонки порожнини рота, припинення паління та вживання спиртних напоїв, вітамінотерапія. Особи, які працюють на відкритому повітрі, повинні систематично змащувати червону облямівку губ маслом. При постійному перебігу процесу хворі підлягають переведенню на роботу в закриті приміщення.
При прогресуванні процесу показане висічення червоної облямівки з наступною пластикою слизової оболонки нижньої губи.
При вогнищевому дискератозі застосовують електрокоагуляцію, кріогенний вплив, висічення вогнища або ПТ. Перед початком лікування вогнищевого дискератозу необхідна біопсія. Якщо ж є підозра на злоякісне переродження, показані прямокутна резекція губи або ПТ в тих же дозах, що і при раку. Лікування папіломи полягає в її хірургічному видаленні або кріодеструкції.
РАК НИЖНЬОЇ ГУБИ
Порівняно зі злоякісними пухлинами слизової оболонки порожнини рота рак губи відрізняється меншою злоякісністю.
Розрізняють дві форми раку нижньої губи — ендофітну та екзофітну; між ними існують перехідні форми.
До екзофітного раку нижньої губи відносять папілярну та бородавчасту форми.
Папілярна форма розвивається частіше з папіломи. Основа папіломи стає інфільтрованою, щільною та безболісною. Коли верхівка відпадає, на губі утворюється виразка.
Бородавчаста (фунгозна) форма розвивається на ґрунті дифузного продуктивного дискератозу, коли виникають множинні дрібні вирости на губі. В подальшому вони зливаються між собою та уражують всю губу, нагадуючи цвітну капусту. Поступово збільшується інфільтрація прилеглих тканин і розпад пухлини.
До ендофітного раку нижньої губи, що має більш злоякісний перебіг, відносять виразкову та виразково-інфільтративну форму.
Виразкова форма раку губи розвивається часто на фоні деструктивного дискератозу. Виразка поступово поглиблюється, приймає форму з нерівним дном. Виразка безболісна, краї її щільні, піднесені, вивернуті, інфільтровані. Межі інфільтрації втрачаються в навколишніх тканинах. Болісність виникає при приєднанні запальних явищ.
Якщо пухлинна інфільтрація переважає над процесами деструкції, встановлюють виразково-інфільтративну форму рака губи. При цій формі пухлинний інфільтрат має значно більші, ніж виразка, розміри та дерев’янисту консистенцію.
На пізніх стадіях розвитку процесу між різноманітними формами раку нижньої губи є багато загальних рис. В занедбаних випадках ракова виразка розповсюджується на м’язовий шар, нижню щелепу, щоку, шкіру.
Рак нижньої губи має мікроскопічну будову плоскоклітинного, найчастіше зроговілого (80,5%) раку. Росте він порівняно довго, інколи розповсюджується більше по поверхні і мало інфільтрує прилеглі тканини. Метастази з’являються відносно пізно. Незроговілий плоскоклітинний рак характеризується швидким виразкуванням, інфільтративним ростом і раннім розвитком метастазів в регіонарні лімфатичні вузли.
Метастазування раку нижньої губи відбувається здебільшого лімфогенним шляхом (в підпідборідні, підщелепні, лицьові, привушні, поверхневі та глибокі шийні лімфатичні вузли).
Класифiкацiя за системою TNM (код МКХ-0-С00)
T — первинна пухлина, оцінюється за розміром пухлини у найбільшому вимірі
Тx — недостатньо даних для оцінки первинної пухлини
Т0 — первинна пухлина не визначається
Tis — преінвазивна карцинома
Т1 — пухлина до 2 см у найбільшому вимірі
Т2 — пухлина до 4 см у найбільшому вимірі
Т3 — пухлина більше 4 см у найбільшому вимірі, але не виходить за межі губи
Т4 — пухлина розповсюджується на оточуючі структури (кістку, язик, шкіру шиї)
N — регіонарні лімфатичні вузли (регіонарними вважаються лімфовузли шиї)
Nx — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів
N0 — немає ознак ураження регіонарних лімфатичних вузлів
N1 — метастази в один гомолатеральний лімфатичний вузол до 3 см у найбільшому вимірі
N2 — метастази в один гомолатеральний лімфатичний вузол діаметром до 6 см у найбільшому вимірі чи множинні метастази в гомолатеральні лімфатичні вузли, жоден з яких не перевищує 6 см у найбільшому вимірі, чи білатеральні, чи контралатеральні метастатичні лімфатичні вузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N2а — метастаз в гомолатеральний лімфовузол більше 3 см, але не більше 6 см у найбільшому вимірі
N2b — множинні метастази в гомолатеральні лімфовузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N2c — білатеральні чи контралатеральні метастатичні лімфовузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N3 — метастази в лімфатичні вузли більше 6 см у найбільшому вимірі
Примітка: лімфовузли по середній лінії тіла вважаються гомолатеральними.
М — віддалені метастази
Мх — немає даних для визначення віддалених метастазів
М0 — немає ознак віддалених метастазів
М1 — є віддалені метастази
Патоморфологічна класифікація рТNМ: категорії рТ, рN, рМ відповідають категоріям Т, N та М.
рN0 — матеріал для гістологічного дослідження після селективної шийної регіонарної лімфаденектомії повинен включати не менше 6 лімфатичних вузлів. Матеріал для гістологічного дослідження після радикальної чи модифікованої радикальної шийної лімфаденектомії повинен включати не менше 10 лімфатичних вузлів.
Гістопатологічна градація:
Gх — ступінь диференціації пухлини неможливо визначити
G1 — високий ступінь диференціації
G2 — проміжний ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями при раку нижньої губи представлено в табл. 15.2.
Таблиця 15.2
Групування за стадiями
|
Стадія 0 |
Tis N0M0 |
|
Стадія І |
T1N0M0 |
|
Стадія ІІ |
T2N0M0 |
|
Стадія ІІІ |
T3N0M0 T1–3N1M0 |
|
Стадія ІVА |
T4N0–1M0, T1–4N2M0 |
|
Стадія IVB |
Будь-яке TN3M0 |
|
Стадія IVC |
Будь-яке T, будь-яке NM1 |
Діагноз ґрунтується на ретельно зібраному анамнезі, огляді, пальпації (з боку слизової оболонки губи та шкіри, в тому числі в ділянці підщелепної ямки), даних цитологічного дослідження, рентгенографії, біопсії. Для визначення розповсюдженості пухлини виконують рентгенографію нижньої щелепи, органів грудної клітки. Проводять УЗД лімфатичних вузлів шиї, органів черевної порожнини. При огляді рекомендовано використовувати лупу. Пальпувати необхідно як саму пухлину, так і лімфатичні вузли шиї. Виконують цитологічне дослідження мазків-відбитків чи зскрібка з пухлинної виразки, а також пункційного матеріалу з метастатичних лімфатичних вузлів. При негативній відповіді цитологічного дослідження проводять біопсію пухлини. Біопсію (в сумнівних випадках) проводять після знеболювання наміченої ділянки губи 0,5% розчином новокаїну. З краю пухлини або виразки висікають клапоть тканини розміром 5–8 мм, захоплюючи ділянки здорового покриву. Інколи з метою гемостазу проводять електрокоагуляцію.
Диференційний діагноз необхідно проводити з доброякісними захворюваннями, туберкульозною гранульомою та сифілітичною виразкою.
Лікування. При раку губи лікування повинно враховувати стадію процесу та клінічну форму. Спочатку слід провести санацію порожнини рота, кинути палити. Найбільш ефективним виявився комбінований метод лікування, що складається з двох етапів: висічення первинної пухлини на губі та видалення регіонарних лімфатичних вузлів та шийної клітковини.
Лікування раку губи I стадії можна здійснити хірургічним або променевим методами.
Частіше використовують опромінення — близькофокусну рентгенотерапію. Цей метод лікування, завдяки добрим віддаленим та косметичним результатам, став методом вибору. За даними деяких авторів, при лікуванні раку губи I стадії променевим методом можна досягти майже 100% вилікування. Сумарна вогнищева доза становить 60–70 Гр.
Хірургічне втручання показане за наявності залишкової пухлини після ПТ, полягає в прямокутному або більш радикальному трапецієподібному висіченні ділянки губи з пухлиною (з первинною пластикою дефекту за М.М. Блохіним).
При підозрі на наявність метастазів в регіонарні лімфатичні вузли (при I стадії раку нижньої губи) виникає необхідність у виконанні типової операції Ванаха (підщелепної лімфаденектомії). У класичному виглядi ця операцiя складалася з видалення пiдщелепних та пiдпідборiдних лiмфовузлiв разом з жировою клітковиною, привушною слинною залозою та пiдщелепними м’язами шиї. Л.I. Пачес (1971) назвав цю операцiю «фасцiально-футлярним видаленням» жирової клітковини шиї одномоментно з обох боків.
За наявностi метастазiв в шийні лiмфатичні вузли проводять операцiю Крайля, що складається з видалення жирової клітковини вiдповiдного боку шиї разом з лiмфатичними вузлами, груднино-ключичним м’язом та внутрiшньою яремною веною. Останнiм часом операцiю Крайля в класичному виглядi не застосовують, проводять шийну фасцiально-футлярну лiмфаденектомiю. Остання передбачає видалення клiтковини з лiмфовузлами в межах I–IV фасцiй шиї зі збереженням груднино-ключичного м’яза та внутрiшньої яремної вени. Операцiю не рекомендується проводити в осіб похилого віку та у разі наявностi у хворих тяжких супутнiх хвороб серця, нирок, легенi, печiнки. В такому разі рекомендується проводити ПТ.
Лікування раку губи II стадії в більшості випадків здійснюється променевим методом — глибока рентгенотерапія до сумарної вогнищевої дози 60–70 Гр. Через 2–3 тиж після опромінення виконують підщелепну двобічну фасціально-футлярну лімфаденектомію. Якщо абластичність операції сумнівна, виконують післяопераційне опромінення зони регіонарного лімфатичного апарату до сумарної вогнищевої дози 55–60 Гр.
При раку губи III стадії застосовується комбіноване лікування: попередня дистанційна гамма-терапія; широке висічення залишків пухлини (з пластикою ранового дефекту за М.М. Блохіним, Диффенбахом, стеблом Філатова, лобно-тім’яно-потиличним клаптем); видалення регіонарного лімфатичного апарату, що виконується через 3–4 тиж після лікування первинного осередку. Внутрішньоартеріальна хіміотерапія (катетеризація a. facialis) флуороурацилом, метотрексатом, препаратами платини проводиться як при комбінованому, так і при комплексному лікуванні гамма-терапією.
Кращі результати відмічають при комбінації ПТ з локальною гіпертермією.
Рецидиви раку нижньої губи і так звані регіонарні рецидиви (вторинні метастази) підлягають комбінованому лікуванню.
При розповсюджених неоперабельних первинних чи рецидивних пухлинах губи рекомендують проведення курсів ПХТ.
Прогноз. Стійке вилікування раку нижньої губи I–II стадій досягається в 60–70% випадків. При раку III стадії віддалені результати значно гірші — 5-річна виживаність становить 30–40%.
При множинних та двобічних регіонарних метастазах стійке вилікування відмічають рідко.
Працездатність після вилікування в більшості випадків відновлюється, але часто хворому потрібно змінювати колишню роботу на відкритому повітрі на роботу в приміщенні.
РАК ВЕРХНЬОЇ ГУБИ
У структурi захворюваностi на ЗН рак верхньої губи займає 11–12-те мiсце та становить не бiльше 3–5% вiд усiх пухлин людини. Але цi данi вiдповiдають лише анатомiчнiй локалізації, тому що, по сутi, цi пухлини є новоутвореннями шкiри верхньої губи.
На рак верхньої губи хворiють частiше жiнки віком 40–60 рокiв. Рак в куточках рота (комiсуральний рак) виникає рiдко.
Патологiчна анатомiя. За макроскопiчною структурою рак верхньої губи можна роздiлити на двi форми: 1) екзофiтну, яка виглядає, наче бородавка, що розвивається дуже повiльно, але насамкінець на її поверхнi з’являється виразка, яка швидко збiльшується i по периферiї i в глибину та дном своїм доходить до верхньої щелепи; 2) ендофiтну, яка спочатку має вигляд трiщини, що поступово поширюється у всi боки — по периферiї та в глибину i також при занедбаних формах доходить до верхньої щелепи. Незабаром до такої пухлини — виразки приєднується iнфекцiя, внаслiдок чого вона стає болiсною, швидко збiльшується так, що iнфiльтрацiя стає значно бiльшою, ніж виразка. У цей перiод проходить дуже iнтенсивне метастазування, переважно лiмфогенним шляхом в пiдщелепнi лiмфатичнi вузли, потiм в поверхневi та глибокi шийнi з одного боку, але бувають метастази з обох боків. Рiдше бувають метастази гематогеннi в легенi та кiстки.
Мiкроскопiчно визначають, що рак верхньої губи розвивається iз багатошарового плоского епiтелiю червоної облямiвки губи i тому виникає будова плоскоклiтинного раку з/без ороговiння. Базальноклiтинний рак відмічають дуже рiдко.
Передраковi захворювання як для нижньої, так i для верхньої губи загальнi. До них належать дифузний дискератоз, вогнищевий дискератоз, папiлома. Дискератоз розподiляється на двi форми: продуктивну та деструктивну. Iз продуктивної форми виникає екзофiтна форма раку, iз деструктивної — ендофiтна. Iз папiломи розвивається екзофiтний плоскоклiтинний рак у виглядi бородавки, яка потiм стає виразкою.
Клiнiка раку верхньої губи має такий самий перебіг, як i нижньої, що описано у вiдповiдному роздiлi.
Класифiкацiя раку верхньої губи така сама, як i раку нижньої.
Лiкування раку верхньої губи слід проводити з урахуванням стадiй процесу, клiнiчної форми, гiстологiчної структури пухлини. Але при раку I стадiї рекомендується проводити близькофокусну ПТ, досягаючи дози 60–70 Гр на первинне вогнище.
За наявностi метастазiв, або при пiдозрi на їх наявнiсть необхідне оперативне втручання — видалення лiмфатичних вузлiв разом з жировою клітковиною в пiдщелепнiй зонi, у тому числі й пiдшкiрний м’яз.
При рентгеностiйких формах раку застосовують комбiновану хiмiопроменеву терапiю iз проведенням внутрiшньоартерiальної хiмiотерапiї в басейн гiлок лицьової артерiї. Для виконання операцiї застосовують рiзнi види хейлопластики з обов’язковим видаленням метастатичних лiмфовузлiв.
Прогноз при раку верхньої губи залежить вiд стадiї захворювання, макроскопiчної та гiстологiчної форми пухлини, характеру та своєчасностi лiкування. На сьогодні недостатньо матерiалу для визначення точних даних вiдносно 3–5-річних результатiв одужання хворих при раку верхньої губи.
ПУХЛИНИ ЩЕЛЕП
Пухлини щелеп відносно рідкiсні захворювання, частiше виявляють у молодих людей, бiльше у жiнок, нiж у чоловiкiв. Розрізняють як доброякiснi, так i злоякiснi пухлини. Серед доброякiсних пухлин частiше відмічають фiброми, остеоми, хондроми, остеобластокластоми, змiшанi пухлини, остеодистрофiю, гiперостоз, адамантиному, епулiди та iншi новоутворення. Злоякiсних пухлин значно менше. Одні з них походять зі сполучної тканини — саркоми, iншi — з епiтелiальної тканини — рак.
Остеоми — пухлини, якi походять iз самої кiстки i становлять 2,7–6% всiх доброякiсних пухлин щелеп. Клiнiчно та гiстологiчно вони розподiляються на губчастi та компактнi. На рентгенограмi вони схожi на остеодистрофiю з наявнiстю часто великих кiстково-мозкових порожнин.
Остеоми ростуть дуже повiльно, без клiнiчних проявів. Збiльшуючись, остеома починає спричинювати неврологiчний біль, а далi викликає асиметрiю нижньої половини обличчя. Якщо вона локалiзується близько до суглоба, то викликає тугорухомiсть щелепи. Оскiльки остеома рiдко буває великих розмiрiв, то клiнiка практично не буває рiзко вираженою.
Дiагностика остеом може бути простою, якщо вона компактна, та дуже складною при губчастiй формi. Диференцiювання слід проводити з деякими формами остеодисплазiй, остеобластокластомами, адамантиномами, екзостозами та iншими захворюваннями.
Лiкування тiльки хiрургiчне. Проводиться резекцiя щелепи в межах здорової тканини. Залишення на мiсцi шматочків пухлини веде до рецидиву захворювання, малiгнiзацiї процесу.
Прогноз при правильному лiкуваннi цiлком сприятливий.
Остеоїдна остеома — це м’яка остеома, розмiром до 2 см, відмічають рiдко як в твердiй частинi кiстки, так i в губчастiй субстанцiї, однаково часто у чоловiкiв та жiнок, як правило, в молодому вiцi, до 40 рокiв.
Клiнiчно проявляється невеликим болем, який перiодично загострюється, особливо вночi. Росте повiльно, довго, викликаючи асиметрiю обличчя. Дiагноз встановлюють на основi клiнiко-рентгенологiчного дослiдження, але далеко не завжди. Тому найчастiше дiагностується на основi патогiстологiчного дослiдження.
Лiкування радикальне оперативне, яке складається з резекцiї кiстки в здорових межах. В іншому разi виникають рецидиви, особливо при зскрiбуваннi.
Остеобластокластома — це захворювання, яке ще має назву фiброзної остеодистрофiї, або гiгантоклiтинної пухлини. Часто локалiзується в нижнiй щелепi, уражує переважно молодих жінок (в основному до 20 рокiв), розвивається повiльно та часто призводить до перелому щелепи та остеомiєлiту. Вони становлять 20% неодонтогенних доброякiсних пухлин.
Ця пухлина, яка ще має назву гiгантоклiтинного епулiду, має два види: периферичний та центральний. Останній вид може бути комірчастої, кiстозної або лiтичної структури.
Клiнiка залежить вiд локалiзацiї пухлини та стадiї розвитку. Початок захворювання характеризується невеликим болем в зубах, вираженість якого поступово збільшується. Розвивається асиметрiя обличчя, запалення в пухлинi з пiдвищенням температури тіла та появою норицi, болем при жуваннi, незвичайною рухомiстю зубiв, особливо в зонi пухлини. Залежно вiд давностi захворювання на яснах у хворого з’являється пухлина блiдо-рожевого кольору, яка поступово збiльшується та розповсюджується як по довжинi кiстки, так i впоперек. Тканини над пухлиною швидко вкриваються виразками, вираженість болю збiльшується, пiдвищується температура тіла. Лiмфатичнi вузли збiльшуються, стають болiсними. При пальпацiї виявляють пухлину твердої еластичної консистенцiї, нерухому без чiтких контурiв, яка поступово переходить в здорову тканину. Зуби, що знаходяться в пухлинi, легко рухаються, болять. З’являються норицi. Пальпаторно iнколи (при великих пухлинах), можна виявити симптом «фетрової шляпи» або симптом «пластмасової iграшки». Шкiра над пухлиною не змiнена, але при великих пухлинах розтягнута та блищить.
Дiагноз встановлюють на основi клiнiко-рентгенологiчних дослiджень. Рентгенологiчно при остеобластокластомi виявляють гiперостоз кiстки з наявнiстю великої кiлькостi рiзної величини порожнин, роздiлених мiж собою кiстковими перетинками. Цi порожнини наповненi рiзного кольору рiдиною вiд буро-червоного до жовто-коричневого, iнколи кров’янистого.
Лiкування має бути радикальним, виконуватися на межi здорових тканин, що гарантує вiдсутність рецидивiв та малiгнiзацiї. ПТ можна застосовувати з палiативною метою.
Адамантинома — це одонтогенна епiтелiальна пухлина, яка розмiщується переважно в нижнiй щелепi, виявляється однаково часто у чоловiкiв та жiнок в молодому вiцi (20–40 рокiв), але може бути i у дiтей та в осіб похилого вiку. Захворювання може мати перебіг у двох варiантах: кiстозному та солiдному. При цьому кiстозну форму виявляють значно частiше. Обидвi форми можуть викликати злоякiсний варiант — остеогенну саркому.
Клiнiка адамантиноми розвивається поступово. При цьому нижня щелепа потовщується, викликаючи деформацiю обличчя. Поступово збiльшуючись, пухлина заважає рухомостi щелепи, наступає утруднення жування та ковтання їжi, виникає спершу невеликий, а потiм сильний біль.
При пальпацiї виявляють тверду, з гладкою поверхнею пухлину, яка поступово переходить на здорову кiстку. Шкiра над пухлиною не змiнена, але слизова оболонка часто вкрита виразками, якi iнколи зливаються мiж собою. Саме тому часто з’являється кровотеча. Рiдко відмічають переломи щелепи. Iнколи виявляють малiгнiзацiю пухлини через швидке її збiльшення.
Дiагноз завжди буває складним, хоча, на перший погляд, повинен встановлюватися легко на базi клiнiко-рентгенологiчного дослiдження. При рентгенологiчному дослiдженнi видно багатокамерну тiнь з порожнинами та перекладинами, гiперостоз кiстки без реакцiї з боку окiстя.
Адамантиному необхiдно диференцiювати з кiстками нижної щелепи, якi часто викликають симптом «пергаметного хрусту». У деяких випадках необхідно робити бiопсiю.
Лiкування тiльки хiрургiчне радикальне, що полягає в резекцiї кiстки в здорових межах. Це попереджує розвиток рецидивiв та малiгнiзацiю пухлини.
Епулід — грибоподібне утворення на ніжці, що виникає на яснах з періодонту. Розрізняють фіброзний, ангіоматозний, гігантоклітинний епулід. Виникає на фоні хронічних травм. Диференціація проводиться за допомогою біопсії. Лікування хірургічне — видалення утворення з вискрібуванням чи коагуляцією періодонтального ложа при фіброзному та ангіоматозному епуліді. При рецидивах та гігантоклітинному епуліді — резекція альвеолярного відростка в межах 1–2-го зубів. Малігнізації не виявлено.
Хондроми відмічають у будь-якому вiцi, частiше у жiнок. Вони розподiляються на енхондроми та екхондроми. Мiкроскопiчно хондрома має округлу форму у виглядi кулі, вкритої фiброзною капсулою, перламутрового кольору. Мiкроскопiчно вона складається з гiалiнового хряща з прошарками сполучної тканини. Iнколи в нiй виявляють шматочки кiсткоутворення.
Клiнiка хондроми передбачає наявність круглої пухлини твердо-еластичної консистенцiї, нерухомої, з гладкою поверхнею. Локалiзується вона в дiлянцi суглобового та альвеолярного відростків нижньої щелепи. Росте поволi й довгий час не викликає нiяких симптомів, крiм наявностi круглої невеликої пухлини.
Дiагностика екхондроми та енхондроми нескладна. В основi її — рентгенодiагностика та клiнiка. Рентгенологiчно екхондрома має на переднiй стiнцi круглу тiнь пухлини, в серединi якої видно дiлянки кiсткоутворення рiзної форми та величини. Енхондрома на рентгенограмi виглядає як кiста кiстки, в якiй видно корiнцi зубiв.
Диференцiювати необхідно з фiброзною остеодистрофiєю, кiстою, фiброзною дисплазiєю кiстки.
Лiкування — тiльки операцiя за типом радикальної — резекцiя щелепи в межах здорових тканин, а в деяких випадках — видалення половини щелепи. Залишки пухлини призводять не тiльки до рецидиву, але й до виникнення хондросаркоми.
ПТ неефективна, тому що ця пухлина нечутлива до опромiнення.
Іншi доброякiснi пухлини, такi як фiброма, мiксома, гемангiома, відмічають рiдко. Їх можна дiагностувати за допомогою рентгенологiчного дослiдження, вивчення видаленої пухлини, біоптатів.
Лiкування тiльки радикальне оперативне з резекцiєю кiстки в межах здорових тканин.
ЗЛОЯКІСНІ ПУХЛИНИ НИЖНЬОЇ ЩЕЛЕПИ
Злоякiснi захворювання нижньої щелепи виявляють значно рiдше, нiж верхньої, приблизно в 3–4 рази, найчастiше в осіб віком 40–60 років, хворiють переважно чоловiки.
САРКОМА НИЖНЬОЇ ЩЕЛЕПИ
Саркома нижньої щелепи виникає значно частiше порiвняно з раком i походить iз сполучної або хрящової тканини щелепи. Причинами її виникнення дуже часто є одномоментна або хронiчна травма, iнколи запальнi процеси кiстки — остеомiєлiт. Розрiзняють два види сарком: центральнi та перiостальнi. Першi розвива-ються зі спонгiозних частин кiстки та кiсткового мозку, інші — iз перiосту або поверхневих частин кiстки. Обидвi форми саркоми розвиваються у молодих людей віком 20–40 рокiв, але нерiдко виникають у дiтей та осіб похилого вiку.
Метастазують саркоми переважно гематогенним шляхом.
Клiнiка. Центральнi саркоми, якi ростуть iз середини кiстки, швидко заповнюють губчасту речовину. Кiстка поступово потовщується, внаслiдок чого з’являються мiсця її руйнування. Саркоми, що ростуть ззовнi iз перiосту, спочатку розсувають тканини та вiдштовхують їх так, що відбувається змiщення зубiв, язика та iнших м’яких тканин. Саркоми розвиваються значно швидше, ніж рак, i тривалий час їх перебіг характеризується відсутністю виразок. Внаслiдок цього можна пальпувати продовгувату безболісну пухлину без чiтких контурiв з гладкою поверхнею. Але у мiру росту пухлини з’являється біль, вираженість якого весь час збiльшується та стає нестерпним. У цей час з’являється симптом «пергаментного хрусту» (симптом «фетрової шляпи»), що свiдчить про руйнування мозкової речовини при збереженнi кортикальної речовини. Виникають деформацiя обличчя та iнфiльтрацiя м’ягких тканин порожнини рота та пiдщелепної ділянки. Обмежується вiдкривання рота. Розхитування зубiв відмічають дуже рано.
Диференцiйний дiагноз буває дуже складним через подібність клiнiчної картини з фiброматозом десни, кiстки та остеомiєлiтом. Основнi ознаки фiброми, на вiдмiну вiд саркоми, — це локалiзацiя пухлини одразу на обох щелепах у виглядi валикоподiбних потовщень блiдого або iнтенсивно червоного кольору. На вiдмiну вiд раку перебіг саркоми значно швидший, але значно довше не з’являються виразки. На рентгенограмi при саркомi видно спiкули — розростання надкiсткового шару у виглядi променiв свiчки. При дуже швидкому ростi саркоми можна думати про наявнiсть остеомiєлiту, але його перебіг при гострому процесi характеризується високою температурою тіла та iнтоксикацiєю з характерними змiнами в кровi.
Лiкування саркоми нижньої щелепи досить складне та включає хiрургiчне втручання — резекцiю щелепи в межах здорових тканин або видалення щелепи з наступним опромiненням на рентгенотерапевтичних установках, або за допомогою введення в рану радiоактивних препаратiв. Проте можна використати i передоперацiйну регiонарну хiмiотерепiю, яка проводиться за допомогою катетеризацiї підщелепної артерiї. Таке комбiноване лiкування покращує вiддаленi результати. Але вибір раціонального методу лікування визначається морфологічною структурою пухлини.
Прогноз при саркомах нижньої щелепи завжди серйозний i незадовiльний тому, що до 5 рокiв живими залишаються лише 20% хворих.
Рак нижньої щелепи розподiляється на первинний, який виникає з рiзних тканин нижньої щелепи — з епiтелiальних елементiв чертвiгової мембрани, з елементiв стiнки кiстки, з епiтелiю десни, та вторинний, який розвивається як метастаз раку iнших органiв — молочної, щитоподібної залози, нирки, передміхурової залози, внаслiдок контактного поширення раку язика та порожнини рота.
Причиною виникнення первинного раку нижньої щелепи є постiйне подразнення фiзичними факторами (радiоактивнi елементи, механiчна травма), термiчне та часте подразнення хiмiчними речовинами (палiння), хронiчнi запальнi процеси (остеомiєлiт, актиномiкоз та iншi хвороби) та багато iнших факторiв.
Передраковими захворюваннями нижньої щелепи є лейкоплакiя, папiломи, лейкокератози тощо.
Найчастіше рак нижньої шелепи належить до пухлин, що мають будову плоскоклітинної з ороговінням та рідше — без ороговіння карциноми. Пухлина може бути з ендофітним або екзофітним ростом.
Метастази раку нижньої щелепи відмічають значно частіше, ніж при ураженні верхньої щелепи. Метастазування переважно лімфогенне — в піднижньощелепні та шийні лімфовузли.
Клiнiка раку нижньої щелепи дуже рiзна. Початок захворювання має прихований та досить тривалий перебіг. Потiм з’являється невеликий біль, схожий як при епулiдi, або безпричинний біль з iррадiацiєю у вухо. Iнколи першим симптомом є розшатування зубiв. Бувають випадки патологiчного перелому щелепи. З боку слизової оболонки альвеолярного краю можна виявити виразку, яка довго не загоюється, але процес дуже швидко розповсюджується по кiстцi. Незабаром пухлина збiльшується, викликаючи деформацiю обличчя, внаслiдок чого пухлинний iнфiльтрат розповсюджується на підборідну чи пiдщелепну ділянки та дно порожнини рота. Лiмфатичнi вузли збiльшуються, але вони ще м’якi та рухомi, а потiм стають твердими. Невдовзi вони зростаються мiж собою та з щелепою, створюючи дуже болючий iнфiльтрат, який охоплює практично половину обличчя.
Класифікація та діагностика раку нижньої щелепи такі ж, як і для раку слизової оболонки порожнини рота.
Диференцiйний дiагноз. На початковiй стадiї правильний дiагноз встановити на основi клiнiко-рентгенологiчних даних практично неможливо без біопсії, тому що всi симптоми зовсiм мало вираженi та схожi мiж собою при iнших хворобах. Тому перед лiкуванням слід виконати бiопсiю. Диференцiацiю необхiдно провести з остеомієлiтом, хронiчним перiоститом, який завжди супроводжує рак нижньої щелепи з самого початку захворювання. На цiй стадiї хвороби на рентгенограмi видно зону деструкцiї з нерiвними та нечiткими контурами та з дiлянками лiзису кiстки.
Для лікування раку нижньої щелепи використовують комбінований метод: дистанційна гамма-терапія на вогнище та регіонарні піднижньощелепні лімфатичні вузли сумарною вогнищевою дозою 45–60 Гр з наступним хірургічним лікуванням через 3–4 тиж після закінчення ПТ — резекція або екзартикуляція половини нижньої щелепи з фасціально-футлярною лімфаденектомією або операцією Крайля. Хворим із занедбаними стадіями призначають паліативну ПТ (до 70 Гр); регіонарну внутрішньоартеріальну хіміотерапію цитостатиками (метотрексат, блеоміцин, цисплатин та ін.).
Видаленню пухлини нижньої щелепи повинен передувати комплекс заходів, спрямованих на виготовлення ортопедичних конструкцій, що використовуються для утримання в правильному положенні залишків нижньої щелепи (шина Ванкевича). Інколи з цією ж метою застосовують назубні дротяні шини з міжщелепною еластичною тягою. Від комплексу ортопедичних заходів значною мірою залежать швидкість загоєння рани та естетичний аспект післяопераційних рубців.
У післяопераційний період, особливо після резекції значної частини нижньої щелепи і жувальних м’язів, годування хворого впродовж кількох тижнів здійснюють через носостравохідний зонд. Реконструктивні операції з метою заміщення дефектів нижньої щелепи — кісткову пластику, виконують одразу.
Прогноз при раку нижньої щелепи дуже несприятливий. 5-річна виживаність хворих пiсля комбiнованого лiкування ледве досягає 20%.
Реабiлiтацiя хворих включає застосування спецiальних щелепно-лицьових протезiв, призначених для вiдновлення функцiї органа. Вибiр та виготовлення протезу залежать вiд локалiзацiї процесу, величини пухлини, характеру та обсягу оперативного втручання, термiну, який минув пiсля операцiї, ступеня порушення функцiї мови, жування, ковтання та косметичних дефектiв. При цьому можна широко застосовувати безпосереднiй та вториннi протези. Безпосереднiй (резекцiйний) протез виготовляється перед операцiєю. У пiсляоперацiйний перiод проводиться протезування пiсля загоєння рани.
Основною вимогою, вiд якої залежить ефективнiсть протезування, є його етапнiсть.
I етап — виговлення протезу перед операцiєю — захисної пластинки, який повинен забезпечити самостiйний прийом їжi, збереження мови, утримання тампонів в пiсляоперацiйнiй порожнинi.
II етап — створення формуючого протезу та застосування його через 10–15 дiб пiсля операцiї. Завданням цього протезування є вiдновлення втрачених функцiй жування, ковтання, мови, попередження розвитку рубцiв та деформацiї обличчя, створення ложа для постiйного протезу.
III етап — створення постiйного протезу та встановлення його через 30 днiв пiсля операцiї. Цей етап протезування передбачає вiдновлення функцiї жування та ковтання їжi, мови, збереження, за можливостi, нормального зовнiшнього вигляду хворого.
Питання про встановлення iнвалiдностi має вирiшуватися iндивiдуально залежно вiд обсягу та характеру операцiї, специфiки роботи, можливостi переквалiфiкацiї, вiку та статi хворого, iнших показникiв.
ПУХЛИНИ СЛИННИХ ЗАЛОЗ
Пухлини слинних залоз виявляють в різному віці, але найчастіше — в осіб віком 30–60 років, приблизно однаково часто у чоловіків та жінок, вони становлять 1–3% всіх новоутворень. У більшості випадків новоутворення локалізуються в привушних слинних залозах.
Клініко-морфологічна класифікація пухлин слинних залоз передбачає розподіл на епітеліальні та неепітеліальні. Серед них розрізняють також доброякісні та злоякісні пухлини.
ДОБРОЯКІСНІ ПУХЛИНИ
Серед доброякісних пухлин найчастіше відмічають плеоморфні аденоми, змішані мукоепідермоїдні пухлини.
Характеризуються вони повільним ростом, повною або обмеженою рухомістю при пальпації, гладкою або горбистою поверхнею, щільною або тугопластичною консистенцією, незв’язаністю зі шкірою над пухлиною.
Ураження лицьового нерва, як правило, не виявляють.
Частіше відмічають плеоморфні аденоми (змішані пухлини). Серед усіх пухлин слинних залоз їх частка становить понад 47%. Змішані пухлини макроскопічно характеризуються різноманітністю. Капсула пухлини в більшості випадків тонка та легко рветься. Щільну капсулу виявляють рідко.
Гістологічна класифікація пухлин слинних залоз:
I. Епітеліальні пухлини
А. Аденоми
1. Плеоморфна аденома (змішана пухлина)
2. Мономорфні аденоми:
а) аденолімфома;
б) оксифільна аденома;
в) інші типи.
Б. Мукоепідермоїдна пухлина
В. Ациноклітинна пухлина
Г. Злоякісні пухлини
1. Аденокістозна карцинома (циліндрома)
2. Аденокарцинома
3. Епідермоїдна карцинома (плоскоклітинний рак)
4. Недиференційована карцинома
5. Карцинома в плеоморфній аденомі (злоякісна змішана пухлина)
ІІ. Неепітеліальні пухлини
ІІІ. Некласифіковані пухлини
IV. Споріднені стани
ЗЛОЯКІСНІ ПУХЛИНИ
До злоякісних пухлин відносять мукоепідермоїдні пухлини, циліндроми, аденокарциноми, карциному в плеоморфній аденомі. Вони мають щільну консистенцію, болісні, рухомі, інфільтрують шкіру, нерідко метастазують в легені, кістки. Інколи відмічають нориці з виділенням густого гною.
Аденокістозні карциноми (циліндроми) виявляють у 13% хворих на злоякісні пухлини слинних залоз, частіше в малих слинних залозах (50%), однаково часто у чоловіків та жінок. Інколи мають перебіг, подібний до такого змішаних пухлин. Слід зауважити, що плеоморфну аденому, циліндрому та мукоепідермоїдну пухлину макроскопічно практично неможливо відрізнити. Ця обставина спричиняє значні складності для хірургів, призводить до діагностичних помилок і неадекватного лікування хворих. Аденокістозні карциноми мають схильність до переважного гематогенного метастазування (40–45%) в легені, кістки.
Аденокарциноми відмічають дуже часто серед ЗН слинних залоз. Вже на початкових стадіях розвитку пухлина має щільну консистенцію, вона безболісна, не має чітких меж, рухомість її обмежена. З ростом пухлини з’являється біль, інфільтруються прилеглі тканини, жирова клітковина, вушна раковина, нижня щелепа. Розвиваються контрактура жувальних м’язів, парез лицьового нерва, гіперемія шкіри. Пухлина метастазує в регіонарні шийні лімфатичні вузли, інколи в легені, кістки.
Плоскоклітинний рак (епідермоїдна карцинома) за клінічною картиною схожий на аденокарциному слинних залоз. Характеризується раннім ураженням жувальних м’язів, нижньої щелепи, лицьового нерва, швидким метастазуванням у регіонарні лімфатичні вузли.
Карцинома в плеоморфній аденомі виникає на фоні тривалого захворювання на змішану пухлину слинної залози. При цьому клінічний перебіг пухлини набуває злоякісного характеру.
Злоякісні пухлини відмічають дещо частіше у жінок. Приблизно ⅔ цих пухлин локалізується у привушній та підщелепній слинних залозах. Анамнез захворювання короткий. Із самого початку пухлина щільна та цілком безболісна. З розвитком пухлини майже водночас з’являються гіперемія шкіри та інфільтрація підшкірної клітковини, вушної раковини, рухомість пухлини обмежується. Інфільтрація шкіри, ураження лицьового нерва свідчать про злоякісність новоутворення. Інколи виразкування шкіри над пухлиною може симулювати рак шкіри.
Метастазування карцином в регіонарні шийні лімфатичні вузли виявляють у 48–50% хворих, частіше на боці ураження, та надто рідко воно буває двобічним. Регіонарними є поверхневі та глибокі яремні лімфатичні вузли шиї.
TNM класифікація раку слинних залоз (коди МКХ-0-С07, С08)
T — первинна пухлина, оцінюється за розміром пухлини у найбільшому вимірі
Тx — недостатньо даних для оцінки первинної пухлини
Т0 — первинна пухлина не визначається
Tis — преінвазивна карцинома (carcinoma in situ)
Т1 — пухлина до 2 см у найбільшому вимірі без екстрапаренхімального розповсюдження*
Т2 — пухлина більше 2 см, але до 4 см у найбільшому вимірі без екстрапаренхімального розповсюдження*
Т3 — пухлина з екстрапаренхімальним розповсюдженням та/чи більше 4 см*
Т4а — пухлина розповсюджується на шкіру, нижню щелепу, слуховий канал, та/чи лицьовий нерв
Т4b — пухлина розповсюджується на основу черепа та/чи крилоподібну пластину та/чи охоплює сонну артерію
Примітка: *екстрапаренхімальним розповсюдженням є клінічні чи макроскопічні дані інвазії шкіри, м’яких тканин, кістки чи нерва
N — регіонарні лімфатичні вузли (регіонарними вважаються лімфовузли шиї)
Nx — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів
N0 — немає ознак ураження регіонарних лімфатичних вузлів
N1 — метастази в один гомолатеральний лімфатичний вузол до 3 см у найбільшому вимірі
N2 — метастази в один гомолатеральний лімфатичний вузол, діаметром до 6 см у найбільшому вимірі чи множинні метастази в гомолатеральні лімфатичні вузли, жоден з яких не перевищує 6 см у найбільшому вимірі, чи білатеральні, чи контралатеральні метастатичні лімфатичні вузли, жоден з яких не більше 6 см у найбільшому вимірі
N2а — метастаз в гомолатеральний лімфовузол більше 3 см, але не більше 6 см у найбільшому вимірі
N2b — множинні метастази в гомолатеральні лімфовузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N2c — білатеральні чи контралатеральні метастатичні лімфовузли, жоден з яких не перевищує 6 см у найбільшому вимірі
N3 — метастази в лімфатичні вузли більше 6 см у найбільшому вимірі
Примітка: лімфовузли по середній лінії тіла вважаються гомолатеральними.
М — віддалені метастази
МХ — недостатньо даних для визначення віддалених метастазів
М0 — немає ознак віддалених метастазів
М1 — є віддалені метастази
Патоморфологічна класифікація рТNМ: категорії рТ, рN, рМ відповідають категоріям Т, N та М.
рN0 — матеріал для гістологічного дослідження після селективної шийної регіонарної лімфаденектомії повинен включати не менше 6 лімфатичних вузлів. Матеріал для гістологічного дослідження після радикальної чи модифікованої радикальної шийної лімфаденектомії повинен включати не менше 10 лімфатичних вузлів.
Гістопатологічна градація:
Gх — ступінь диференціації пухлини неможливо визначити
G1 — високий ступінь диференціації
G2 — проміжний ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями при раку слинних залоз представлено в табл. 15.3.
Таблиця 15.3
Групування за стадіями
|
Стадія I |
Т1 Т2 |
N0 N0 |
М0 М0 |
|
Стадія II |
Т3 |
N0 |
М0 |
|
Стадія III |
Т1 Т2 Т3 |
N1 N1 N1 |
М0 М0 М0 |
|
Стадія IVА |
Т4а Т1, Т2, Т3, Т4а |
N0, N1 N2 |
М0 М0 |
|
Стадія IVВ |
Т4b Будь-яке Т |
Будь-яке N N3 |
М0 М0 |
|
Стадія IVС |
Будь-яке Т |
Будь-яке N |
М1 |
Діагностика. Основна проблема — це вирішення питання про гістологічний варіант пухлини. З’ясування скарг, анамнезу захворювання, огляд і пальпація часто допомагають правильно вирішити питання про характер новоутворення.
Особливо широке розповсюдження отримав метод цитологічної діагностики, пунктатів пухлин слинних залоз.
Рентгенологічне дослідження черепа та контрастну рентгенографію слинних протоків (сіалографія) використовують здебільшого для визначення поширеності пухлинного процесу та лікувальної тактики. Можна використати також подвійне контрастування: сіалографію та пневмографію, сіалографію та томографію.
Новоутворення на знімках виявляють у вигляді дефекту наповнення проток і тканини залози. При злоякісних пухлинах визначають дефекти наповнення проток. Метод сіалографії дозволяє в більшості випадків (особливо для привушної залози) мати уяву не тільки про характер новоутворення, але й про топографію пухлини.
Незважаючи на застосування самих сучасних радіометричних, сканографічних та ангіографічних досліджень, дані цитологічного дослідження мазків-відбитків, пункційної та ексцизійної біопсії є найбільш інформативними у встановленні остаточного діагнозу та виборі методу лікування.
Диференційну діагностику слід проводити між різноманітними пухлинами слинних залоз та іншими захворюваннями (кісти, запальні процеси, туберкульоз, хронічний лімфаденіт та пухлини шиї).
Лікування. Доброякісні новоутворення слинних залоз (окрім змішаних пухлин привушної залози) вимагають видалення без пошкодження капсули.
При змішаних пухлинах розміром до 2 см, розташованих в полюсах або задній частині залози, показана резекція привушної залози. Субтотальну резекцію залози виконують при розташуванні змішаної пухлини в товщі залози. Паротидектомія зі збереженням гілок лицьового нерва показана при змішаних пухлинах більших розмірів, рецидивах, в тому числі багатовузлових, а також локалізації пухлини в ділянці глоткового відростка слинної залози.
Лікування злоякісних пухлин слинних залоз, як правило, комбіноване. В передопераційний період проводять дистанційну гамма-терапію (сумарна вогнищева доза 55–60 Гр). Під впливом опромінення пухлина нерідко значно зменшується в розмірах. Регіонарні лімфатичні вузли необхідно опромінювати в тому випадку, якщо в них виявляють або є підозра на метастази. Приблизно через 3 тиж після закінчення опромінення виконують операцію.
Лікування раку привушної слинної залози полягає в проведенні паротидектомії (без збереження гілок лицьового нерва) з фасціально-футлярним висіченням клітковини шиї з боку ураження в одному блоці із слинною залозою. У разі наявності множинних або незміщуваних шийних метастазів виконують операцію Крайля.
При локалізації пухлини в піднижньощелепній слинній залозі виконують фасціально-футлярне висічення клітковини шиї разом з ураженою залозою (операція Ванаха) або операцію Крайля за показаннями.
При занедбаних формах злоякісних пухлин слинних залоз показана паліативна ПТ (до 70 Гр на курс), хіміотерапія (в окремих випадках внутрішньоартеріальна) метотрексатом, блеоміцином, адріаміцином, комплексними сполуками платини.
Внаслідок пересічення стовбура лицьового нерва виникає парез мімічних м’язів відповідного боку, що призводить до інвалідизації хворих. Ушкодження навіть окремих гілочок лицьового нерва при хірургічному лікуванні доброякісних пухлин привушної залози вимагає тривалого відновного лікування.
Прогноз. Віддалені результати лікування при доброякісних пухлинах слинних залоз, в тому числі змішаних, сприятливі, рецидиви після лікування змішаних пухлин привушної слинної залози виявляють, за даними різних авторів, в 1,5–35% випадків, вони виникають частіше протягом перших 2 років. Віддалені результати лікування злоякісних пухлин слинних залоз в основному несприятливі. Місцеві рецидиви виникають приблизно у 40% оперованих. Вилікування відмічають лише у 20–25% хворих.
ПУХЛИНИ ШИЇ
У ділянці шиї виявляють доброякісні та ЗН м’яких тканин та щитоподібної залози.
Відносно часто відмічають атерому — кісту сальної залози. Виникає атерома внаслідок закупорювання вивідної протоки сальної залози та переповнення її секретом. Локалізується частіше в ділянці верхньої бокової поверхні шиї, де міститься велика кількість сальних залоз. Закупорка вивідної протоки залози виникає зазвичай на ґрунті запального процесу.
У шкірі пальпується щільне овальної форми безболісне утворення, що зміщується разом зі шкірою. Збільшується атерома поволі, інколи досягаючи великих розмірів. Шкіра над нею тоншає, інколи виникають запалення і самостійний прорив атероми з подальшим утворенням нориці.
Лікування — хірургічне (висічення атероми разом з капсулою). При нагноєнні атероми виконують висічення гнійника. При запаленні та нагноєнні атером невеликих розмірів можливо висічення атероми разом з оточуючими тканинами в єдиному блоці з наступним накладенням швів на рану. Видалення атероми роблять зазвичай амбулаторно. Результати лікування задовільні.
ДОБРОЯКІСНІ ПУХЛИНИ ШИЇ
Папілома — доброякісне невеликих розмірів утворення на шиї, яке виникає з епітелію шкіри, блідого або коричнево-чорного кольору. Може бути на тонкій ніжці або на широкій основі. Папіломам властиве зроговіння, особливо в осіб літнього та похилого віку. Росте вона поволі. Зазвичай жодних загальних розладів папіломи не викликають. Біль виникає при запаленні папіломи або механічному пошкодженні. Виразкування папіломи викликає підозру на її малігнізацію. В таких випадках (а також з косметичних міркувань) папіломи підлягають видаленню шляхом висічення в межах здорових тканин або кріодеструкції, діатермокоагуляції. Малігнізації папілом сприяють механічне, хімічне, променеве подразнення.
На шиї виявляють здебільшого прості папіломи, невус (вроджений), множинні старечі кератопапіломи і akanthosis nigricans.
Базальноклітинний рак на шиї виникає дуже рідко.
Пігментовані папіломи при травмі можуть бути джерелом розвитку меланоми.
Ліпоми утворюються з жирової тканини. Це найчастіші пухлини, що виявляють на шиї; здебільшого локалізуються на задній поверхні (на межі з волосистою частиною голови). Інколи ліпоми в нижньому відділі шиї над яремною ямкою можуть імітувати зоб. На задній поверхні шиї та в ділянці верхньої частини спини ліпоми можуть бути великих розмірів та займати широку площу. Такі ліпоми являють собою скупчення жирової тканини, позбавлені капсули. Видалення їх супроводжується певними технічними складнощами внаслідок відсутності чітких меж між тканиною ліпоми і навколишньою підшкірно-жировою клітковиною. Ліпоми мають м’яку, щільно-еластичну або щільну консистенцію, гладку або часточкову поверхню; вони безболісні та рухомі.
Лікування ліпом шиї — оперативне, висічення пухлини в межах здорових тканин.
За наявності численних ліпом говорять про ліпоматоз. Особливою формою цього захворювання є так звана жирна шия, або хвороба Мателунга. При даній патології відзначають надлишковий розвиток жирової тканини вздовж передньобічної поверхні шиї (від ділянки привушної залози вздовж краю нижньої щелепи і до груднини). У поперечному напрямку пухлини поширюються в защелепні та надключичні ямки. Рідше ліпоми розповсюджуються по задній поверхні шиї.
При хворобі Мателунга жирові розростання розповсюджуються також вглиб — під м’язи шиї і в середостіння, викликаючи атрофію м’язів і компресію тканин.
Ліпоматозні маси зазвичай не мають чіткої капсули.
Лікування — тільки хірургічне. За можливості широко і повністю висікають ліпоматозні маси, однак повністю видалити всі жирові маси зазвичай неможливо, що і є причиною частих рецидивів.
Фіброма — доброякісна пухлина, яка виходить зі сполучної тканини. Фіброми можуть розвиватися зі сполучнотканинних елементів шкіри, м’язів, сухожилків та інших тканин, але найбільш часто зі шкіри — фіброма molluscum.
Локалізуються фіброми здебільшого в бокових трикутниках шиї. Розрізняють вузлову та дифузну фіброму. Вузлові фіброми, що розташовуються під шкірою, являють собою частіше овоїдні, щільні, з гладкою або горбистою поверхнею рухомі утворення. Розміри їх коливаються в широких межах.
Щільні фіброми містять більше, ніж м’які, колагенових волокон і менше — клітин і судин. На розрізі фіброми мають сіро-рожевий колір і гомогенну консистенцію. Фіброліпоми (через домішок жирової тканини) мають жовтуватий колір.
Дифузні фіброми не мають капсули, щільні, ростуть інфільтративно, проростаючи в навколишні тканини (за типом злоякісних пухлин), тому їх називають ще фіброзною інвазією, або фіброзною агресією, або агресивним фіброматозом. Вони можуть виникати як в органах шиї, так і в м’язах. Ці фіброми мають щільну консистенцію, нечіткі контури, часто розповсюджуються в середостіння, викликаючи компресію трахеї, судин, обмежуючи рухомість шиї. При видаленні швидко виникають рецидиви. За клінічним перебігом нагадують фібросаркоми. Діагностика фібром ґрунтується на даних клініки, а також пункційної біопсії.
Лікування підшкірних і більш глибоких локалізацій фібром тільки оперативне. Множинні дрібні фіброми видаляють при їх виразкуванні або підозрі на малігнізацію.
Лікування дифузних фібром — оперативне в поєднанні з рентгенотерапією.
Невриному (шванному, неврилемому) виявляють порівняно рідко. Пухлина виходить з плечового сплетення блукаючого, симпатичного та інших нервів. Інколи в невриномі міститься багато фіброзної тканини (неврофіброма). Локалізується у верхньому відділі шиї, над ключицею, відмічають здебільшого в зрілому віці.
Невриноми, які виходять з блукаючого нерва, поволі ростуть, мають овальну форму, розташовуються у фасціальному просторі судинного пучка під переднім краєм кивального м’яза. Невринома має щільну консистенцію, гладку поверхню, може інколи передавати пульсацію, як артеріальна аневризма. При пальпації — слабко болісна або безболісна, але не може бути стиснена (на відміну від аневризми артерії). Тиск на пухлину може викликати інколи уповільнення пульсу.
Невриному диференціюють із хемодектомою, хронічним лімфаденітом і метастазами раку в лімфовузли.
Остаточний діагноз встановлюється після пункційної біопсії або гістологічного дослідження видаленої пухлини.
Невриноми, які розвиваються з плечового сплетення, розташовуються в надключичній ямці, малорухомі, мають щільну консистенцію, чіткі контури та гладку або часточкову поверхню. При пальпації виникає біль стріляючого характеру, що іррадіює у верхні кінцівки.
Диференціювати невриному плечового сплетення необхідно з метастазами раку в лімфовузли надключичної ділянки та лімфосаркомою. Злоякісне переродження неврином відбувається дуже рідко.
Лікування неврином оперативне. Якщо видалити пухлину без значного пошкодження нервових пучків неможливо, від операції потрібно відмовитися, або вирішити питання про подальшу пластику.
Із симпатичних вузлів або симпатичного нервового стовбура розвиваються гангліоневроми — ростуть поволі, невеликих розмірів, майже нерухомі щільноеластичної консистенції. Частіше виявляють у дітей та юнаків. Розташовуються у верхньому відділі шиї. При подразненні симпатичного стовбура розвивається симптом Горнера. Малігнізацію гангліоневром відзначають дуже рідко.
Лікування — оперативне.
Хемодектома. Пухлина розвивається з нервових клітин каротидного та аортальних тілець венозного вузла, рідко — блукаючого нерва. Виявляють хемодектому рідко, але її злоякісну будову відмічають у 50% хворих. Розвивається частіше у жінок. Росте поволі, періодично. Має чіткі контури, овальну форму, щільноеластичну консистенцію. Розташовується в куті нижньої щелепи в розгалуженні сонної артерії. Хемодектома може розсувати судини або муфтоподібно охоплювати їх (особливо внутрішню сонну артерію), викликаючи стенозування. Пухлина не зміщується при ковтанні, часто передає пульсацію сонної артерії і може давати систолічний аневризмоподібний шум, однак, на відміну від аневризми, вона не стискується. У діагностиці хемодектом велике значення має ангіографія.
Лікування хемодектом — оперативне (повне видалення пухлини). За неможливості видалення пухлини через муфтоподібне охоплення нею артерії та інтимного зрощення з судинами виникає необхідність видалення пухлини разом з резекцією судин і подальшою пластикою внутрішньої сонної артерії або перев’язки її (при розвитку колатералей vilisii мозкового кровотоку).
Слід відзначити, що пластика внутрішньої сонної артерії через складнощі доступу технічно інколи неможлива. У таких випадках від видалення пухлини відмовляються і призначають ПТ.
Хемодектоми блукаючого нерва клінічно майже не відрізняються від неврином цього нерва і хемодектом каротидного вузла. Діагностують зазвичай лише при гістологічному дослідженні.
Лікування — хірургічне видалення разом з сегментом нерва.
ЗЛОЯКІСНІ ПУХЛИНИ ШИЇ
РАК ЩИТОПОДІБНОЇ ЗАЛОЗИ
Щитоподібна залоза (glandula thyroidea) починає функціонувати у плода з 3 міс антенатального розвитку; у новонароджених її маса становить 1 г, у дорослих — 40–60 г, складається з правої і лівої часток та перешийка. Перешийок залози розміщується на рівні 2–3-го кільця трахеї. Частки прилягають до відповідних відділів трахеї, гортані, глотки, стравоходу, а також прикривають загальні сонні артерії в середній їх третині. Додаткову частку залози — пірамідальну (lobus pyramidalis) відмічають у 30–40% населення. Це найчастіше виріст лівої частки залози або її перешийка, спрямований проксимально, довжиною 2 см.
Щитоподібна залоза має власну тонку (внутрішню) сполучнотканинну капсулу, від якої вглиб відходять перетинки, що розділяють її на дрібні часточки. Поверх власної капсули розміщується фасціальна (зовнішня) капсула, яка походить від внутрішньошийної фасції. Вона охоплює залозу разом з гортанню, а в місцях переходу із залози на суміжні органи ущільнюється, утворюючи зв’язки: серединну — між перешийком залози і перснеподібним хрящем, а також першим хрящем трахеї; латеральні — від залози до перснеподібного та щитоподібного хрящів. Між зовнішньою і внутрішньою капсулами залози є наповнений пухкою клітковиною щілиноподібний простір, в якому розташовані судини щитоподібної залози, лімфатичні вузли та паращитоподібні залози. У місцях переходу передньолатеральних поверхонь залози в задньомедіальні до щитоподібної залози прилягають компоненти основного судинно-нервового пучка шиї — a. carotis communis, n. vagus, v. jugularis interna. Біля задньомедіального краю часток залози проходить n. laringeus recurrens.
Кровопостачання залози здійснюється двома верхніми і двома нижніми щитоподібними артеріями (відповідно від a. carotis externa і a. subclavia). У 10% осіб буває ще й п’ята артерія, яка бере початок від дуги аорти або від плечоголовного стовбура, — a. thyroidea ima. Ця артерія підходить до перешийка залози і віддає гілки до медіальних відділів правої та лівої часток.
Венозна сітка залози розвинена краще, ніж артеріальна. Дрібні вени зливаються на поверхні залози, утворюючи сітку великих судин. З них формуються парні верхні, середні та нижні щитоподібні вени, які впадають у внутрішні яремні і плечоголовні вени. Біля нижнього краю перешийка залози міститься непарне венозне щитоподібне сплетення — plexus venosus thyroideus impar, з якого кров через vv. thyroideae inferiores відводиться в плечеголовні вени.
Іннервація щитоподібної залози здійснюється симпатичними стовбурами і гортанними нервами. Біля нижнього краю щитоподібної залози нижню щитоподібну артерію перетинає нижній гортанний нерв, пошкодження якого під час перев’язки артерії призводить до порушення фонації.
Клітковину шиї з лімфатичними колекторами поділяють на 7 рівнів:
1. Підщелепна та підпідборідна групи лімфатичних вузлів.
2. Верхньо-яремні, яремно-двочеревцеві та група лімфатичних вузлів в ділянці додаткового нерва.
3. Середньо-яремні лімфатичні вузли.
4. Нижньо-яремні, яремно-лопатково-під’язикові лімфатичні вузли.
5. Лімфатичні вузли в ділянці заднього трикутника шиї (нижня група вузлів в ділянці додаткового нерва).
6. Претрахеальні і паратрахеальні вузли.
7. Лімфатичні вузли надключичної групи та переднього середостіння (тимічні).
До 1962 р. щитоподібну залозу розглядали як орган із мономорфною клітинною структурою, що представлена тільки фолікулярними клітинами (пізніше отримали назву А-клітин), функція яких пов’язана із синтезом тироксину. У період з 1962 по 1968 р. в щитоподібній залозі виявлені й описані парафолікулярні клітини, що продукують поліпептидний гормон — кальцитонін (С-клітини). Ці клітини є нейроектодермальними за своєю природою. Вони виробляють поліпептидні гормони, що здатні до активного накопичення попередників моноамінів та їх декарбоксилювання (amine precursos uptake and dekarboxylation), у зв’язку з чим їх відносять до APUD-системи. У 1970–1972 рр. у щитоподібній залозі була відкрита потужна клітинна система, що накопичує біогенний моноамін — серотонін, на даний час цю систему називають системою В-клітин (табл. 15.4).
Таблиця 15.4
Гістогенетична класифікація пухлин щитоподібної залози
|
Джерело розвитку |
Гістологічна структура пухлин |
|
|
Доброякісні |
Злоякісні |
|
|
А-клітини |
Папілярна аденома, фолікулярна аденома, трабекулярна аденома |
Папілярна аденокарцинома, фолікулярна аденокарцинома, недиференційований рак |
|
В-клітини |
Папілярна аденома, фолікулярна аденома, трабекулярна аденома |
Папілярна аденокарцинома, фолікулярна аденокарцинома, недиференційований рак |
|
С-клітини |
Солідна аденома |
Солідний рак з амілоїдозом строми (медулярний рак) |
|
Метаплазований епітелій |
– |
Плоскоклітинний рак |
|
Неепітеліальні клітини |
Фіброма, лейоміома, гемангіома, тератома та ін. |
Фібросаркома, лейоміосаркома, гемангіоендотеліома, гемангіосаркома, лімфосаркома, лімфогранулематоз та ін. |
|
Епітеліальні та неепітеліальні клітини |
Некласифіковані пухлини |
|
Основною функцією щитоподібної залози є участь в йодному обміні: поглинання йодидів з крові, синтез основних тиреоїдних гормонів — трийодтироніну (Т3) та тироксину (Т4), їх збереження, викид у кров, доставка до клітин різноманітних органів та тканин, участь у різноманітних метаболічних процесах. Всього в обміні щитоподібної залози і формуванні її патології бере участь 10 гормонів (вміст яких із метою диференціації патології і визначення підходів до лікування визначають у крові людини): загальний тироксин (Т4), вільний тироксин (ВТ4), загальний трийодтиронін (Т3), вільний трийодтиронін (ВТ3), зворотний трийодтиронін (ЗТ3), ТТГ, тироксинзв’язувальний глобулін (ТЗГ), тиреоглобулін (ТГ), антитіла до тиреоглобуліну (АТГ), антитіла до макросомальної фракції (АМС), кальцитонін.
У здорових людей вміст Т4 в крові становить 60–140 нмоль/л. При тиреотоксикозі його рівень у крові зростає від 141 до 400 нмоль/л. При гіпотиреозі вміст Т4 в крові знижено. При еутиреоїдному дифузному та вузловому зобі вміст Т4 в крові не відрізняється від такого у здорових людей. Майже весь тироксин циркулює в крові у зв’язаному з білками стані. Невеличка частина циркулює в крові у вільному, не зв’язаному з білками стані. Ця фракція і визначає фізіологічну активність гормону. Середній вміст ВТ4 в крові у здорових людей 10–27 нмоль/л. Вміст ВТ4 у крові змінюється аналогічно до загального тироксину, і визначення вільної форми гормону не має істотних переваг, за винятком випадків зміни ТЗГ.
Трийодтиронін — гормон щитоподібної залози, синтезований у її фолікулах. Більше 80% Т3 є продуктом екстратиреоїдного утворення внаслідок дейодування Т4 у периферичних тканинах. Вміст Т4 у крові здорових людей 1,1–2,7 нмоль/л. Фізіологічна активність Т3 у 5 разів вище, ніж Т4, і навпаки, Т3 метаболізується в організмі значно швидше, ніж Т4. Період напіврозпаду Т3 становить в середньому 45 год, Т4 — 4 доби. Поряд із Т3 при периферичному дейодуванні тироксину утворюється також зворотний (резервний) Т3. Концентрація Т3 у крові підвищується у хворих на тиреотоксикоз (до 12,3 нмоль/л) і знижується при гіпотиреозі (до 0,3–1,0 нмоль/л).
Вміст вільного триойдтироніну в крові становить 3,5–7,0 нмоль/л.
ЗТЗ не є біологічно активним гормоном. Його концентрація в крові здорових людей становить 130–150 нмоль/л.
ТЗГ — основний транспортний білок тиреоїдних гормонів. ТЗГ здійснює зв’язування і транспортування тиреоїдних гормонів до органів і тканин, де відбувається периферичний метаболізм цих гормонів. Вміст ТЗГ у крові здорових людей становить 0,24–0,4 мкмоль/л. При тиреотоксикозі вміст зменшується, а при гіпотиреозі — збільшується.
ТГ — специфічний білок щитоподібної залози — виконує функцію акцепторної молекули, на якій синтезується тиреоїдний гормон. У здорових людей концентрація тиреоглобуліну в крові становить 2–60 нг/моль. ТГ секретується щитоподібною залозою разом з іншими гормонами і виявляється в крові як при доброякісних, так і при злоякісних її новоутвореннях. Після тиреоїдектомії з приводу раку щитоподібної залози (РЩЗ) підвищення вмісту в крові ТГ може бути показником рецидиву або метастазування.
Основним регулятором функції щитоподібної залози є ТТГ гіпофіза. Його секреція регулюється двома чинниками — тиреотропін-рилізинг-гормоном гіпоталамуса і тиреоїдними гормонами щитоподібної залози. Збільшення фракції тиреоїдних гормонів, що вільно циркулюють в крові, за принципом негативного зворотного зв’язку призводить до зниження секреції ТТГ. Вміст ТТГ у крові здорових людей — 1,2–2,8 мОД/л. При тиреотоксикозі вміст ТТГ у крові знижується, а при гіпотиреозі — підвищується.
На функцію щитоподібної залози впливають також симпатична (шийні ганглії) і парасимпатична (верхній гортанний і зворотний нерви) частини вегетативної нервової системи.
Головним елементом для синтезу тиреоїдних гормонів є йод, який у вигляді йодиду надходить до організму з водою, їжею, повітрям, всмоктується в кров і накопичується в щитоподібній залозі. Крім щитоподібної залози, йод концентрується в легенях, слинних залозах, печінці, плаценті. Хоча концентрація в них йоду в декілька тисяч разів нижча, ніж у щитоподібній залозі, цей факт необхідно враховувати при потраплянні великих доз радіонуклідів йоду в організм.
Гормонам щитоподібної залози відводиться головна роль у діяльності нервової, серцево-судинної, шлунково-кишкової систем, інших залоз ендокринної системи, у тому числі статевих, у регуляції найважливіших метаболічних процесів. Тиреоїдні гормони підвищують потребу тканин у кисні, беруть участь в утворенні високоенергетичних хімічних сполук, що містять фосфор, підвищують синтез білків, стимулюють процеси росту. Під їх контролем відбувається фізичний і психічний розвиток плода, диференціація його тканин, зокрема кістково-м’язової, нервової системи та ін.
В останні роки відмічають тенденцію до підвищення захворюваності на РЩЗ, особливо у дітей. В Україні захворюваність на РЩЗ становить 4 випадки на 100 тис. населення, але захворюваність на РЩЗ у різних регіонах неоднорідна.
На частку раку припадає 3–5% від усіх захворювань залози. У районах поширення ендемічного зобу РЩЗ виявляють в 3–10 разів частіше, ніж у тих районах, де зоб відмічають рідко. В етіології цього захворювання відіграють роль такі чинники, як зниження функції щитоподібної залози та підвищення тиреотропної функції гіпофіза. Сприяють розвитку РЩЗ опромінення шиї (залози), особливо в дитячому віці, вплив канцерогенних речовин і ряд інших чинників. Важливим є питання взаємовідношення РЩЗ до різноманітних форм зобу та аденоми.
Іонізуюче випромінювання впливає на злоякісне переродження щитоподібної залози двома шляхами: первинне порушення ДНК, що призводить до злоякісного росту тканин; зниження функціональної активності залози, виникнення її недостатності, тривала стимуляція виділення тиреотропіну й автономна гіперплазія тиреоїдної тканини з утворенням вузла і його трансформації в рак. Більшість радіаційно-індукованих пухлин щитоподібної залози становить папілярний рак. Він характеризується низькою швидкістю росту, відсутністю клінічних проявів протягом тривалого часу. Однотипність гістологічної структури РЩЗ у раніше опромінених осіб є доказом ролі радіогенного чинника в тиреоїдному канцерогенезі. Період між опроміненням і виникненням перших ознак пухлини становить 5–10 років. Тривалість періоду, протягом якого високий ризик виникнення радіогенного РЩЗ, може становити до 50 років. Найбільш високий ризик відмічають через 10–15 років після опромінення.
РЩЗ, що утворився з парафолікулярних С-клітин (медулярний рак), може передаватися спадково за аутосомно-домінантним типом з високим рівнем пенетрації і виникати при синдромі множинної ендокринної неоплазії (МЕН) та без інших ендокринних захворювань. Майже в 70% спостережень медулярний рак має сімейну форму. Ген сімейної форми медулярного раку відкритий у 1987 р., локалізується в центромірі 10-ї хромосоми і визначається DNA-маркером. Встановлено участь онкогенів і пухлиносупресорних генів у виникненні раку. Онкогени є частиною генома, але, як правило, вони знаходяться в «репресованому», неактивному стані. Активуються під впливом мутації, делеції або хромосомної транслокації, при цьому клітини трансформуються в стан «неконтрольованого» росту.
При папілярному раку відбувається мутація RET і NTRKI проонкогенів, що беруть участь у кодуванні рецептора тирозинкінази. Активація зазначених генів вірогідно вища в осіб віком 4–30 років, що зумовлює частоту виникнення папілярного раку в дітей Чорнобильської зони, та раніше виявлена в 60% із них активація онкогена RET. В онкогенезі щитоподібної залози одночасно беруть участь декілька проонкогенів (С-тус, C-fos, Ras, RET, NTRKI) і пухлиносупресорний ген р53.
У виникненні РЩЗ мають значення й інші чинники: EGFR та інсуліноподібний фактор росту (IGFR). У клітинах раку виявлена більша кількість EGFR-рецепторів, ніж у нормальних клітинах щитоподібної залози.
РЩЗ уражує в основному жінок середнього і похилого віку, хоча може розвиватися в будь-якому віці в осіб обох статей. Вузли в щитоподібній залозі у дітей до статевого дозрівання майже завжди ракові.
Мiжнародна морфологiчна класифiкацiя
I. Епiтелiальнi пухлини.
1. Фолiкулярний рак.
2. Папiлярний рак.
3. Плоскоклiтинний рак.
4. Недиференцiйований рак (анапластичний):
а) веретеноклiтинна форма;
б) дрiбноклiтинна форма;
в) гігантоклітинна форма.
5. Медулярний рак.
II. Неепiтелiальнi пухлини.
1. Фiбросаркома та iншi.
III. Змiшанi пухлини.
1. Карциносаркома.
2. Злоякiсна гемангiоендотелiома.
3. Лiмфома.
4. Тератома.
IV. Вториннi (метастатичні) пухлини.
За гістологічною будовою РЩЗ поділяють на високодиференційований та недиференційований (анапластичний), що походить з епітелію фолікулів; проміжне положення займає медулярний (С-клітинний) рак, що походить з парафолікулярних клітин. Диференційований РЩЗ виявляють у вигляді папілярної та фолікулярної аденокарцином, характеризується повільним перебігом та відносно сприятливим прогнозом. Частка диференційованого РЩЗ становить близько 5% випадків серед всієї вузлової патології щитоподібної залози. Вузлові ураження щитоподібної залози відмічають досить часто, і, залежно від методу виявлення та віку досліджуваних, захворюваність може становити 20–50% у загальній популяції, що включає великий потік звернень до ендокринологів. Окрім цього, захворюваність на РЩЗ, найчастіше диференційований, є однією з найбільш швидкозростаючих, папілярний гістологічний тип становить близько 80% усіх випадків раку.
В останні роки покращилися діагностичні та терапевтичні можливості (чутливі методики визначення рівня ТГ в сироватці крові, УЗД шиї, рекомбінантний людський ТТГ (рлТТГ)), що дозволяє виконувати менш інвазивні та комфортні для пацієнтів процедури.
Папілярна аденокарцинома є найбільш поширеним РЩЗ (25–80%). Мікроскопічно дана форма характеризується будовою тканини пухлини у вигляді сосочків. Крім сосочкових структур, характерними ознаками папілярного раку вважають псамомні тільця і кальцифікати. Важливою особливістю папілярного раку є часто багатофокусний ріст — до 20–80% випадків. Виділяють кілька гістологічних варіантів папілярної аденокарциноми.
За даними деяких авторів, класифікація диференційованого РЩЗ повинна враховувати не тільки морфологію, а й біологічну «поведінку» пухлини: «чисті» або солідні (50% випадків), папілярно-фолікулярні або змішані (11,4% випадків) та мікрокарциноми (окультні склерозуючі) — 6% випадків. Також папілярний рак поділяють на варіанти низького та високого ступеня злоякісності, останні становлять близько 16–27% випадків. Для високозлоякісних форм папілярного раку характерні атипія ядер (плеоморфізм, гіперхромазія), ангіоінвазія, поля некрозу.
Описано «висококлітинний» варіант папілярного РЩЗ (tаll-сеll). Цю форму відрізняють клітини, висота яких приблизно вдвічі більша, ніж ширина, характерні також еозинофілія цитоплазми, гіперхромазія ядер. Висококлітинний варіант папілярного раку, за даними більшості авторів, відрізняється агресивним перебігом, питома вага його серед папілярних пухлин становить 3,0–10,4%.
Виділяють колонно-клітинний (columnar cell) варіант папілярного РЩЗ. Колонно-клітинна карцинома має такі морфологічні особливості: ділянки папілярної будови чергуються із солідними, мікрофолікулярними і кріброзними полями; фолікули довгої форми, утворюють паралельні ряди; клітини також мають видовжену форму; позитивна імуногістохімічна реакція на цитокератин. Ця форма РЩЗ, за даними більшості дослідників, вирізняється ще більш агресивним перебігом, частота її становить близько 0,1%.
Описаний ще один рідкісний різновид новоутворень щитоподібної залози — гіалінізуючі трабекулярні пухлини (доброякісні та злоякісні). Злоякісні гіалінізуючі трабекулярні пухлини вважаються варіантом папілярного раку, оскільки в них часто виявляють пошкодження протоонкогена RЕТ/РТС1 — цей генетичний дефект часто розглядається як основна причина папілярного раку. Питома вага «звичайного» варіанта папілярного раку становить 70%, інкапсульований варіант виявляють у 10% випадків, частота фолікулярного (папілярно-фолікулярного або змішаного) варіанта становить 10%, tall cell (висококлітинної) форми — 4%, дифузного склерозуючого варіанта — 3%, оксифільних (В-клітинного) — 2%, інших (columnar cell — колонно-клітинний, світлоклітинний, острівковий, трабекулярний, ліпоматозний) — 1% випадків.
Фолікулярна аденокарцинома займає 2-ге місце за частотою серед злоякісних пухлин щитоподібної залози (13–40%). Ця пухлина складається зі структур, подібних до нормального тиреоїдного епітелію, а також аденоми щитоподібної залози, що нерідко утруднює диференційну діагностику доброякісних і злоякісних фолікулярних новоутворень. Відмінними гістологічними ознаками фолікулярного раку вважають інвазію капсули пухлини і судин, вогнища некрозів, атипію ядер, деякі особливості гістоархітектоніки — трабекулярну і солідну будову. Фолікулярний рак поділяють на інкапсульований, інвазивний та ангіоінвазивний варіанти. Існує також поділ фолікулярного раку за ступенем диференціювання. Крім того, диференційовані форми РЩЗ поділяють за походженням на А-клітинні і В-клітинні (або Гюртля-клітинні, оксифільноклітинні). В-клітини (онкоцити, клітини Ашкеназі — Гюртля) мають полігональну форму, великі розміри й оксифільну цитоплазму. Часто їх розглядають як змінені фолікулярні клітини, що підтверджується продукцією тиреоглобуліну В-клітинними новоутвореннями. РЩЗ з клітин Ашкеназі — Гюртля (В-клітинний) за своєю будовою та клінічним перебігом близький до фолікулярного раку, але більш агресивний. Гістологічною ознакою В-клітинного раку, що відрізняє його від фолікулярної форми, вважається висока (75% і вище) питома вага оксифільних клітин у пухлині. Частота Гюртля-клітинного раку становить 0,1–11,0% серед епітеліальних злоякісних пухлин щитоподібної залози і близько ⅓ серед фолікулярного раку. Середній вік хворих на момент виявлення пухлини становить близько 55,5 року, співвідношення чоловіків і жінок дорівнює 1: 2–2,5 відповідно.
Описана острівкова карцинома (insular carcinoma), яку відносять до низькодиференційованих варіантів РЩЗ. Острівкова карцинома характеризується особливою будовою: дрібні й однорідні пухлинні клітини формують скупчення (острівці, гнізда), оточені фіброзною тканиною, полями некрозу і мікрофолікулами. За своєю гістоархітектонікою дана форма РЩЗ нагадує острівці підшлункової залози. Ця пухлина відрізняється агресивним перебігом і несприятливим прогнозом порівняно з диференційованими формами РЩЗ. Характерні ангіоінвазія і вихід за межі залози, виникнення на тлі інших форм РЩЗ. Питома вага острівкової карциноми серед видів РЩЗ становить 1,8%, середній вік хворих — 32 роки. Метастази виявляють не менше ніж у половини хворих. Одні автори відносять острівкову карциному до папілярного раку, інші — до фолікулярного.
Виділяють спадкові синдроми, до складу яких входять високодиференційовані форми РЩЗ. Одним з таких захворювань є синдром Гарднера. До його складу входять різні пухлини сполучнотканинного походження (фіброми, остеоми, десмоїд), поліпоз товстої кишки, папілярний РЩЗ, рак панкреатодуоденальної зони, пухлини надниркової залози, атероми. Дуже рідко РЩЗ у складі синдрому Гарднера має фолікулярну будову. Шлях передачі — аутосомно-домінантний, етіологія захворювання, за даними досліджень, пов’язана з мутацією АРС-гена (adenomatosis polyposis coli — аденоматозний поліпоз кишечнику) в 5-й хромосомі. Синдром Турко (Turcot’s syndrome) включає поліпи товстої кишки, пухлини головного мозку, папілярний РЩЗ, також пов’язаний з мутацією АРС-гена. Хвороба Каудена (Cowden ’s disease), або множинні гамартоми, — також спадковий синдром, до складу якого можуть входити фолікулярні пухлини щитоподібної залози. При цьому захворюванні відмічають різні пухлини — рак і фіброаденоматоз молочної залози, рак товстої кишки, аденоми і РЩЗ, а також папіломатоз губ і слизової оболонки рота, кісти печінки і кісток, ліпоми, поліпи і менінгеоми. Шлях передачі — аутосомно-домінантний, можливою причиною вважають мутації гена-супресора пухлин PTEN. Синдром МЕН І типу (синдром Вермера) включає наявність фолікулярних аденом щитоподібної залози, аденом паращитоподібних залоз і гіпофіза, пухлини острівкового апарату підшлункової залози. Характеризується дефектом у 11-й (11q13) хромосомі. У 1985 р. описано комплекс Карні (Сarney’s complex), який включає пухлини кори надниркової залози із синдромом Кушинга, лентіго й ефеліди, блакитні невуси шкіри і слизових оболонок, міксоми шкіри і серця, шванноми, СТГ-продукуючі аденоми гіпофіза, сертоліоми тестикул, пухлини щитоподібної залози, протокові аденоми та фіброаденоми молочних залоз. Шлях передачі — аутосомно-домінантний, дефект при цьому синдромі ймовірно локалізується в 2-й (2р16) хромосомі. Описано папілярний РЩЗ у складі синдрому Аллагілє (Allagile syndrome), до складу якого входять холестаз новонароджених, вади розвитку легені і дужок хребців, очні аномалії і гепатоцелюлярний рак.
Медулярний рак (0,8–10% серед РЩЗ) — цей різновид карциноми щитоподібної залози розвивається з С-клітин (парафолікулярних), що виробляють кальцитонін, що було вперше встановлено Е. Williams у 1966 р. С-клітини є похідними нейроектодерми і, мабуть, мігрують в ембріогенезі в щитоподібну залозу з нервового гребінця. Основна маса парафолікулярних клітин розташована у верхніх половинах часток щитоподібної залози. Для медулярного раку характерна солідна будова з наявністю амілоїдозу строми і внутрішньоклітинних включень амілоїду, секреторних гранул. Ця пухлина належить до групи нейроектодермальних пухлин АРUD-системи, які можна виявити за допомогою забарвлення із сріблом за Грімеліусом. Медулярний рак може мати перебіг у вигляді двох форм — спорадичної і сімейної. У свою чергу, сімейні форми можуть бути представлені трьома варіантами — медулярними карциномами у складі синдромів МЕН ІІа і ІІb типів і власне сімейним медулярним раком (FМТС — familian medullary thyroid carcinoma).
Сімейні форми захворювання відзначають приблизно у 10–50% хворих на медулярний РЩЗ. З урахуванням того, що ця пухлина може бути одним з компонентів синдромів МЕН, при виявленні медулярного РЩЗ завжди необхідно проводити цілеспрямований пошук інших новоутворень нейроендокринного походження. Найбільш сприятливий прогноз має медулярний РЩЗ у складі синдрому Сіппла (МЕН ІІа типу), найгірший прогноз у хворих з синдромом МЕН ІІb типу, проміжне положення займає спорадичний медулярний рак.
С-клітинні пухлини виробляють тиреокальцитонін і безліч різних біологічно активних субстанцій. Незважаючи на особливості гістогенезу, клітини медулярного РЩЗ здатні, за деякими даними, продукувати ТГ. Існування доброякісних С-клітинних пухлин на даний час заперечується, а при виявленні іноді С-клітинної гіперплазії її розглядають як медулярний рак.
Синдром МЕН ІІа типу (синдром Сіппла) представлений поєднанням медулярного РЩЗ, феохромоцитоми і гіперпаратиреозу. Середній вік розвитку медулярного РЩЗ при МЕН ІІа типу варіює залежно від методу, який використовували для діагностики. Визначення рівня кальцитоніну в тесті стимуляції з пентагастрином є найчутливішим методом діагностики патології С-клітин. При клінічному обстеженні пацієнтів, у яких при генетичному скринінгу виявлена мутація RET-протоонкогена, у віці до 10 років медулярний РЩЗ виявляють рідко. Захворюваність збільшується з віком і до 13 років становить 25%, а до 70 років — 70%. Тест з пентагастрином при обстеженні осіб, відібраних при генетичному скринінгу, виявляється позитивним приблизно в 20% випадків у віці 10 років, в 50% — 13 років, в 65% — 20 років і в 95% — у віці 30 років. На даний час генетичне тестування проводиться до 6-річного віку всім особам, що входять до групи ризику.
Феохромоцитому відмічають приблизно у 10–60% носіїв гена МЕН ІІа типу з частотою, яка залежить від варіанта мутації, і, як правило, діагностується у віці старше 10 років. Якщо феохромоцитому виявляють у члена сім’ї, в якій відмічена мутація RET-протоонкогена, захворювання класифікується як синдром МЕН ІІа типу. При проспективному обстеженні членів цих сімей діагноз феохромоцитоми незмінно встановлюється після виявлення С-клітинної патології.
Практично всі феохромоцитоми розташовані в наднирковій залозі і лише в окремих випадках їх виявляють ретроперитонеально (походять з екстраадреналової хромафінної тканини: симпатичні та парааортальні ганглії, орган Цукеркандля і т.д.). У 50% випадків — феохромоцитоми двобічні, але ураження другої надниркової залози часто розвивається лише через декілька років. При гістологічному дослідженні може бути виявлена пухлинна прогресія від гіперплазії клітин мозкової речовини до феохромоцитоми, яка практично завжди є доброякісною.
Клінічна симптоматика (психічна нестійкість, головний біль, підвищене потовиділення, відчуття страху) може значно варіювати. Артеріальна гіпертензія на ранній стадії, як правило, відсутня. Проте, необхідне активне скринінгове обстеження з метою виявлення феохромоцитоми, яке передбачає визначення добової екскреції метанефринів та норметанефринів із сечею. Якщо це дослідження свідчить про гіперпродукцію катехоламінів, при сцинтиграфії з 123I-мета-йодбензилгуанідином (MIBG) можна виявити посилене захоплення РФП однією або обома частинами надниркової залози. На ранній стадії процесу УЗД, КТ або МРТ в наднирковій залозі не дуже інформативні.
Гіперпаратиреоз відмічають в 10–25% випадків синдрому МЕН ІІа типу, асоційований з мутацією в локусі 634, як правило, розвивається в третій декаді життя. Часто йдеться про гіперплазію паращитоподібних залоз і одній або двох аденомах в осіб старшого віку. Гіперпаратиреоз розвивається поволі, частіше має відносно м’який перебіг. Скринінгове дослідження для виявлення гіперпаратиреозу має на увазі визначення рівня іонізованого кальцію і паратгормону-1–84 (інтактний паратгормон) один раз на рік.
У деяких сім’ях з МЕН ІІа типу відмічають папульозні елементи на шкірі верхньої ділянки спини, що зудять, пігментуються і болючі. Ці зміни є однією з форм шкірного ліхеноїдного амілоїдозу. В декількох сім’ях з МЕН ІІа типу описана хвороба Гіршпрунга.
Синдром МЕН ІІb типу (синдром Горліна) представлений поєднанням медулярного РЩЗ, феохромоцитоми, гангліонейроматозу, марфаноїдних змін і патології скелета. Гіперпаратиреоз при цьому синдромі практично ніколи не виявляють. Медулярний РЩЗ при МЕН ІІb типу має значно агресивніший перебіг, ніж при МЕН ІІа типу. Він розвивається в молодшому віці, як правило, до 10 років, при цьому часто виявляється проростання капсули щитоподібної залози, а також регіонарні і віддалені метастази.
Феохромоцитома розвивається відносно рано, приблизно у половини пацієнтів з МЕН ІІb типу, і часто є двобічною. Гангліонейроматоз проявляється невриномами слизових оболонок, які з’являються на дистальній частині язика, на потовщених губах, впродовж травного й урогенітального тракту. Можуть виникати шлунково-кишкові розлади, такі як кишкові спазми, запори і діарея. Часто розвивається гіпертрофія роговичних нервів.
Марфаноїдні зміни включають довгі тонкі кінцівки, змінене відношення довжини верхньої і нижньої частин тулуба, а також слабкість зв’язкового апарату. Патологію скелета відмічають часто, вона проявляється вивихом тазостегнових суглобів, деформацією грудної клітки і характерними рисами обличчя.
Сімейна форма медулярного РЩЗ. У багатьох сім’ях єдиним проявом мутації RET-протоонкогена є медулярний РЩЗ. Клінічно сімейна форма медулярного РЩЗ маніфестує в старшому віці і при мутаціях в екзонах 13 і 14 має відносно сприятливіший прогноз порівняно з медулярним РЩЗ при МЕН ІІа типу.
Залишається остаточно не визначеним, чи є медулярний РЩЗ самостійним захворюванням, чи йдеться про варіант синдрому МЕН ІІа типу, при якому особливості генотипу зумовлюють затримку маніфестації інших його компонентів.
Недиференційований рак (3,7–26% серед РЩЗ) поділяється на великоклітинний (гіганто- і веретеноклітинний), дрібно-, поліморфноклітинний варіанти. Недиференційований РЩЗ, на відміну від інших форм, частіше виявляють в осіб похилого віку — 60–70 років і старше. Крупноклітинні варіанти відмічають частіше в старшій віковій групі й у чоловіків, а дрібноклітинні — у молодому віці й у жінок. У багатьох хворих (до 30–76% і більше) анапластичний рак виникає на тлі тривало існуючого зобу. Недиференційований РЩЗ вважається самою злоякісною пухлиною у людини і вирізняється вкрай агресивним перебігом з несприятливим прогнозом.
Плоскоклітинний РЩЗ виявляють дуже рідко. Частота його не перевищує 1% серед РЩЗ. Походження плоскоклітинного РЩЗ не цілком зрозуміло. Прийнято вважати, що він з’являється в результаті метаплазії фолікулярного епітелію — про це свідчать випадки виявлення осередків плоскоклітинного раку на тлі диференційованих аденокарцином щитоподібної залози. За клінічним перебігом плоскоклітинний РЩЗ наближається до анапластичної карциноми, тобто має вкрай агресивний перебіг. При виявленні даної форми РЩЗ завжди необхідно довести первинність її походження,оскільки в ряді випадків це можуть бути метастази інших пухлин або бранхіогенний рак.
Ще рідше (близько 0,1–0,2%) виявляють злоякісні пухлини щитоподібної залози сполучнотканинного походження. Клінічний перебіг і прогноз при цих захворюваннях також близькі до таких при анапластичному раку. Серед сполучнотканинних і змішаних пухлин найчастіше відмічають фібросаркому й гемангіоендотеліому.
Надзвичайно рідко виявляють світлоклітинний РЩЗ, який за будовою нагадує аденокарциному нирки. Частота світлоклітинного раку серед злоякісних пухлин щитоподібної залози становить близько 0,18%. Гістогенетичне походження цієї пухлини залишається не зовсім зрозумілим — світлоклітинний РЩЗ включають в групи як фолікулярних, так і папілярних пухлин, а іноді розглядають як похідне плюрипотентної ектодерми.
Лімфоми щитоподібної залози в основному розглядають як обмежене ураження при системному процесі, хоча не виключається і первинне ураження щитоподібної залози. Їх питома вага серед злоякісних пухлин щитоподібної залози становить 0,1–5,0%. Ці пухлини досі мало вивчені. Абсолютну більшість лімфом становлять дифузні крупноклітинні та гістіоцитарні, В-клітинні форми. Середній вік хворих на момент діагностики становить 58–70 років, співвідношення чоловіків і жінок 1:1,8–6. Лімфоми вирізняються агресивним перебігом, що наближається до дрібноклітинного недиференційованого і плоскоклітинного РЩЗ.
Мiжнародна класифiкацiя за системою TNM (коди МКХ-0-С73)
Т — первинна пухлина
Примітка: кожна Т-категорія може бути поділена так: а) солітарна пухлина, b) множинні пухлини (класифікується найбільша)
Тх — недостатньо даних для оцінки первинної пухлини
Т0 — первинна пухлина не визначається
Т1 — пухлина 2 см або менше у найбільшому вимірі, обмежена тканиною щитоподібної залози
Т2 — пухлина розміром більше 2 см, але до 4 см у найбільшому вимірі, обмежена тканиною щитоподібної залози
Т3 — пухлина більше 4 см у найбільшому вимірі, обмежена тканиною щитоподібної залози, чи пухлина будь-якого розміру з мінімальним розповсюдженням за межі залози (наприклад груднино-щитоподібний м’яз чи м’які тканини навколо щитоподібної залози)
Т4а — пухлина будь-яких розмірів із розповсюдженням за межі капсули щитоподібної залози, проростає в підшкірні м’які тканини, гортань, трахею, стравохід чи зворотний нерв гортані
Т4b — пухлина розповсюджується на передвертебральний простір, охоплює сонну артерію чи розповсюджується на структури середостіння
Всі анапластичні карциноми оцінюють як пухлини Т4.
Т4а — анапластична карцинома в середині щитоподібної залози, яку можна хірургічно видалити
Т4b — анапластична карцинома, що розповсюджується за межі щитоподібної залози, яку неможливо оперативно видалити
N — регiонарнi лiмфатичнi вузли (центральні та латеральні шийні, також лімфовузли верхнього середостіння)
Nх — недостатньо даних для оцінки стану регіонарних лімфовузлів
N0 — немає ознак ураження регіонарних лімфовузлів
N1 — метастази в регіонарні лімфатичні вузли
N1а — метастази в лімфатичні вузли до рівня IV (претрахеальні, паратрахеальні та передгортанні)
N1b — однобічні, двобічні чи контралатеральні метастази в шийні чи лімфатичні вузли верхнього середостіння
М — віддалені метастази
Мх — недостатньо даних для визначення віддалених метастазів
М0 — немає ознак віддалених метастазів
М1 — є віддалені метастази
Патоморфологічна класифікація рТNМ: категорії рТ, рN, рМ відповідають категоріям Т, N та М.
рN0 — матеріал для гістологічного дослідження після селективної шийної регіонарної лімфаденектомії повинен включати не менше 6 лімфатичних вузлів.
Гістопатологічна градація:
Gх — ступінь диференціації пухлини не може бути визначений
G1 — високий ступінь диференціації
G2 — проміжний ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями при РЩЗ представлено в табл. 15.5–15.7.
Таблиця 15.5
Групування за стадіями (папілярний чи фолікулярний рак)
|
Вік до 45 років |
|||
|
Стадія I |
Будь-яке Т |
Будь-яке N |
М0 |
|
Стадія II |
Будь-яке Т |
Будь-яке N |
М1 |
|
Вік 45 років і старше |
|||
|
Стадія I |
Т1 |
N0 |
М0 |
|
Стадія II |
Т2 |
N0 |
М0 |
|
Стадія III |
Т3 Т1, Т2, Т3 |
N0 N1а |
М0 М0 |
|
Стадія IVА |
Т4а Т1, Т2, Т3 |
N0, N1a, N1b |
М0 M0 |
|
Стадія IVB |
T4b |
Будь-яке N |
M0 |
|
Стадія IVC |
Будь-яке T |
Будь-яке N |
M1 |
Таблиця 15.6
Групування за стадіями (медулярний рак)
|
Стадія I |
Т1 |
N0 |
М0 |
|
Стадія II |
Т2 |
N0 |
М0 |
|
Стадія III |
Т3 Т1, Т2, Т3 |
N0 N1а |
М0 М0 |
|
Стадія IVА |
Т4а Т1, Т2, Т3 |
N0, N1a, N1b |
М0 М0 |
|
Стадія IVB |
T4b |
Будь-яке N |
М0 |
|
Стадія IVC |
Будь-яке T |
Будь-яке N |
М1 |
Таблиця 15.7
Групування за стадіями (недиференційований рак)*
|
Стадія IVА |
Т4а |
Будь-яке N |
М0 |
|
Стадія IVB |
T4b |
Будь-яке N |
М0 |
|
Стадія IVC |
Будь-яке T |
Будь-яке N |
М1 |
*Всі випадки належать до стадії IV.
Клінічна картина РЩЗ визначається станом залози, характером росту й розповсюдженістю пухлини, залежить від гістологічної структури пухлини, загального стану та віку хворих, наявності метастазів.
Основний місцевий симптом — збільшення залози або поява в ній більш щільної ділянки, іноді у вигляді пухлинного вузла. Одні вузли мають чіткі межі, гладку поверхню, інші — неправильну форму, нечіткі межі. При дифузній формі майже завжди змінюється конфігурація щитоподібної залози, що відрізняє раковий процес від тиреоїдиту Хашимото, при якому залоза зберігає свою форму. Темп росту пухлини має вирішальне значення в перебігу хвороби. При бурхливому темпі росту пухлини хворі, як правило, гинуть незалежно від методу лікування.
Функція залози порушується рідко; у 3–5% хворих вона підвищується різною мірою, аж до тяжкого тиреотоксикозу в поодиноких випадках.
Осиплість голосу, зумовлена проростанням пухлини в зворотні нерви, дисфагія та кровохаркання є пізніми ознаками РЩЗ, що свідчить зазвичай про неможливість радикального видалення пухлини.
Метастазування тиреоїдного раку відбувається лімфатичним, гематогенним та лімфогематогенним шляхами. Найчастіше відзначають лімфогенне метастазування в лімфатичні вузли шиї, середостіння, надключичні та підключичні. Іноді метастази РЩЗ виявляють в лімфатичних вузлах пахвової ділянки.
Для РЩЗ характерне регіонарне метастазування в лімфовузли по ходу глибокої яремної вени (верхні, середні, нижні), загруднинні, паратрахеальні, а також у лімфатичні вузли по ходу додаткового нерва та гілок поверхневої артерії шиї. Врахування цих даних має важливе значення при виконанні радикальної операції.
Гематогенні метастази найчастіше виявляються у легенях, кістках, печінці, проте можливо й в інших органах (нирках, серці, шкірі). Метастази в легені й кістки можуть з’являтися через декілька років після видалення основного пухлинного вогнища.
Через особливості клінічного перебігу РЩЗ виділяють 4 форми: струмоподібну, тиреоїдитоподібну, приховану та псевдозапальну.
При струмоподібній формі раку щитоподібна залоза збільшена, щільна, характеризується нерівномірним збільшенням. Метастази в регіонарні лімфовузли з’являються значно пізніше зазначених ознак.
Тиреоїдитоподібна форма за клінічним перебігом дуже схожа на хронічний тиреоїдит Хашимото та Ріделя. Нерідко проявляється обтураційним синдромом.
При прихованій формі раку ріст первинної пухлини не виражений. Метастази в регіонарні лімфатичні вузли виявляють раніше, ніж первинну пухлину.
Псевдозапальну форму виявляють рідко.
У результаті розпаду пухлини порушується загальний стан хворого, підвищується температура тіла, виникають гіперемія шкіри, ущільнення тканин на передній поверхні шиї в ділянці щитоподібної залози, біль.
При цій формі РЩЗ нагадує клініку гострого тиреоїдиту.
Діагностика РЩЗ є складною внаслідок різноманітної клінічної картини, наявності прихованих форм, розвитку раку на фоні попереднього довгостроково існуючого зоба, а також відсутності патогномонічних ознак у початкових стадіях захворювання.
Розпізнавання раку, що розвинувся в незміненій щитоподібній залозі, особливо в осіб віком старше 40 років, дещо легше. І все ж, незважаючи на відсутність патогномонічних клінічних ознак для своєчасної діагностики РЩЗ, сукупність клінічних симптомів дає достатньо інформації для передбачуваного діагнозу й у той же час зумовлює необхідність широкого використання додаткових методів дослідження, серед яких найбільш важливі — цитологічне, ультрасонографічне, радіоізотопне та рентгенологічне.
Важливе значення при розпізнаванні прихованої форми РЩЗ має також цитологічний метод шляхом дослідження пунктатів зі збільшених лімфатичних вузлів на шиї.
ВУЗЛОВІ УТВОРЕННЯ ЩИТОПОДІБНОЇ ЗАЛОЗИ
Обстеження пацієнтів із вузловим зобом
Вузли щитоподібної залози є не якимось одним захворюванням, а клінічною маніфестацією різної патології цього органу. Вони можуть з’являтися в незміненій щитоподібній залозі або на тлі дифузного зобу, можуть бути поодинокими або множинними. Кожен із вузлів у багатовузловому зобі може стати клінічно значущим за показниками зростання, розміру та функціональних характеристик. Ризик наявності раку однаковий для солітарних «холодних» вузлів і багатовузлового зобу. Вузли непухлинної природи можна виявити у пацієнтів із зобом, а також при запальних та аутоімунних захворюваннях. Метою діагностики при вузловому зобі є диференціювання доброякісної та злоякісної патології (рис. 15.1).
УЗД ТА СЦИНТИГРАФІЯ ШИЇ
На сьогодні УЗД є найбільш точним методом візуалізації вузлів щитоподібної залози, тому воно показане при будь-якому виявленому при пальпації вузловому новоутворенні. УЗД дозволяє точно визначити розміри і структуру як найбільшого вузла, так і інших вузлів, які не пальпуються, що особливо важливо при багатовузловому зобі. УЗД необхідно для прицільної тонкоголкової аспіраційної біопсії (ТАБ). Крім того, при УЗД шиї можуть бути виявлені підозрілі на метастатичні лімфатичні вузли. До ехографічних ознак злоякісних пухлин щитоподібної залози можна віднести гіпоехогенність, мікрокальцинати, відсутність периферичного хало-сигналу, нечіткі межі, внутрішньоінодулярну гіперваскуляризацію і регіонарну лімфаденопатію. Поєднання цих ехографічних ознак підвищує ймовірність злоякісного характеру вузлового новоутворення. Хоча широке застосування УЗД й обмежило використання тиреоїдної сцинтиграфії, але ця методика корисна для підтвердження функціональної природи вузла щитоподібної залози при низьких або невизначених значеннях ТТГ у сироватці крові, оскільки вона часто демонструє наявність вузлів, що функціонують автономно.
ТОНКОГОЛКОВА АСПІРАЦІЙНА БІОПСІЯ
Будь-який солітарний вузол щитоподібної залози (≥1 см) повинен бути досліджений цитологічно за винятком «гарячих» вузлів на тлі пригніченого рівня ТТГ. Утворення меншого розміру (<1 см) з дуже низькою ймовірністю набувають клінічного значення, навіть якщо вони злоякісні. Тому їх пункція показана тільки за наявності підозрілих ехографічних ознак (солідні гіпоехогенні з мікрокальцинатами) або несприятливих даних анамнезу. У разі багатовузлового зоба ТАБ під контролем УЗД слід піддавати вузли найбільшого розміру. ТАБ є золотим стандартом диференційної діагностики при вузловому зобі, хоча має ряд обмежень, а саме — неінформативні мазки і фолікулярна неоплазія. У цих випадках необхідним є термінове інтраопераційне гістологічне дослідження із вирішенням питання про обсяг оперативного втручання.
ЛІКУВАННЯ ДИФЕРЕНЦІЙОВАНОГО РАКУ ЩИТОПОДІБНОЇ ЗАЛОЗИ
Хірургічне лікування. Мінімальним обсягом хірургічного втручання є тотальна (або субтотальна) тиреоїдектомія із дисекцією центральної клітковини шиї. Подібний обсяг операції знижує ризик місцевого рецидиву захворювання і пов’язаний із мінімальним ризиком ускладнень. Крім того, це робить можливим виконання (після хірургічного втручання) абляції радіоактивним йодом і подальшого адекватного моніторингу. Інвазію в трахею та стравохід у хворих на диференційований РЩЗ відмічають рідко. Проте, з урахуванням можливості виникнення загрозливих для життя ускладнень й обмежених можливостей нехірургічних методів лікування, в даному разі за відсутності ознак віддалених метастазів необхідно виконувати хірургічну резекцію. Показання до операції має враховувати не тільки технічну можливість резекції пухлини, а й загальний стан пацієнта. Залежно від поширеності інвазії хірургічна стратегія може варіювати від «вікончатої» резекції трахеї до комплексних ларинготрахеальних і ехофагеальних резекцій.
За наявності місцево-поширеного РЩЗ виділяють кілька підходів:
1. Максимально радикальна операція з резекцією і видаленням оточуючих пухлину тканин, верхніх відділів шлунково-кишкового тракту і дихальних шляхів.
2. Обмежені резекції зі збереженням найважливіших анатомічних структур шиї та середостіння і проведення в подальшому терапії радіоактивним йодом.
3. Паліативні резекції, при яких залишається значна частина пухлинної тканини і виконується трахеостомія, в ряді випадків — гастростомія.
У дітей і підлітків вибір обсягу хірургічного втручання повинен бути таким самим, як і у дорослих.
Виділяють кілька класифікацій варіантів лімфаденектомії при раку голови та шиї (Martin H., 1951):
1. Радикальна (операція Крайля) — видалення лімфатичної тканини від краю нижньої щелепи до ключиці, від середньої лінії шиї до краю m. trapezius. У блок тканин, що видаляються, включають m. sternocleidomastoideus і m. omohyoideus, внутрішню яремну вену, підщелепну залозу.
2. Часткова (парціальна) — видалення лімфатичної тканини на будь-якій обмеженій ділянці шиї.
3. Білатеральна (двобічна).
4. Шийна дисекція з видаленням первинного вогнища пухлини.
5. Профілактична.
Spiro R. (1994) класифікує шийні лімфаденектомії за кількістю груп (рівнів) лімфатичних вузлів, що видаляються:
1. Радикальна — видалення вузлів IV–V рівнів. У даному варіанті дисекція може бути традиційною (операція Крайля), модифікованою, розширеною, модифікованою та розширеною.
2. Селективна — видалення III рівнів лімфатичних вузлів. Цей варіант включає наступні різновиди дисекції: надлопатково-під’язикова, югулярна та інші.
3. Обмежена — видалення до II рівнів лімфатичних вузлів. Можливі медіастинальні, паратрахеальні й інші варіанти із видаленням однієї групи вузлів.
Е. Восса (1984), S. Аrуаn (1986), R. Вуеrs (1991) виділяють чотири варіанти шийної дисекції при раку голови та шиї:
1. Радикальна (стандартна) — крім клітковини з лімфатичними вузлами видаляють кивальний м’яз, внутрішню яремну вену, підщелепну залозу і додатковий нерв.
2. Модифікована — разом з лімфатичними вузлами видаляють кивальний м’яз і внутрішню яремну вену.
3. Функціональна — видалення лише клітковини з лімфатичними вузлами.
4. Селективна — видалення окремих груп лімфатичних вузлів.
Класифікація А. Ваllantyne (1991) включає такі види лімфаденектомій при РЩЗ:
1. Центральна — видалення лімфатичних вузлів навколо щитоподібної залози по ходу внутрішньої яремної вени.
2. Селективна — видалення окремих латеральних груп лімфатичних вузлів.
3. Модифікована — видалення всіх груп лімфатичних вузлів з відповідного боку шиї зі збереженням додаткового нерва.
4. Радикальна — видалення всіх груп лімфатичних вузлів разом з кивальним м’язом, внутрішньою яремною веною і додатковим нервом.
J. Моlеу (1999) видалення латеральної групи лімфатичних вузлів, розташованих по ходу судинно-нервового пучка (II–V рівні), називає функціональною дисекцією; висічення VI рівня (пре- і паратрахеальних) — центральною, а видалення VII рівня — медіастинальною центральною дисекцією.
М. Giammanco (2001) виділяє наступні види футлярно-фасціальних дисекцій при РЩЗ:
1. Селективна: а) підщелепна; б) вище рівня під’язикової кістки; в) задньолатеральна шийна; г) латеральна, д) передня (центральна).
2. Функціональна.
3. Радикальна.
4. Модифікована: а) зі збереженням додаткового нерва, б) зі збереженням внутрішньої яремної вени; в) зі збереженням кивального м’яза.
5. Радикальна розширена.
На сьогодні в більшості випадків при РЩЗ виконується модифікована шийна лімфаденектомія зі збереженням м’язів, нервів, слинних залоз і внутрішньої яремної вени. Видалення вищевказаних анатомічних утворень здійснюється зазвичай у разі поширення на них метастазів, що мають значні розміри.
Хірургічні ускладнення: параліч зворотного гортанного нерва
Залежно від розміру первинної пухлини післяопераційний параліч зворотного гортанного нерва відмічають рідко (<2% випадків). Минущу дисфункцію голосу виявляють набагато частіше, минає спонтанно у більшості хворих протягом 1–6 міс. Після операції, навіть якщо голос не змінений, усіх пацієнтів необхідно направляти на ларингоскопію. Навіть якщо виник однобічний параліч зворотного гортанного нерва, він найчастіше добре переноситься хворими, але іноді можливий розвиток аспіраційної пневмонії із загрозою для життя. Стійкий параліч зворотного гортанного нерва може знизити якість життя через зміну голосу та підвищення зусиль для фонації. Розроблена проста хірургічна техніка для лікування небезпечних випадків паралічу зворотного гортанного нерва шляхом розведення (латералізації) паралізованих голосових зв’язок. Ці методики мають високу ефективність при малому числі ускладнень.
Методами профілактики інтраопераційного пошкодження зворотного гортанного і додаткового нервів є: інтраопераційне виділення нерва із постійним візуальним контролем за його станом, для контролю стану нерва можна використовувати інтраопераційний електрофізіологічний нейромоніторинг. Застосування профілактичних заходів дозволяє знизити ризик порушення функції гортанних нервів до досить низьких значень — <1%.
Хірургічні ускладнення: гіпопаратиреоз
Після тиреоїдектомії, як при трансплантації паращитоподібних залоз, так і без неї, гіпокальціємія виникає у ⅓ випадків і триває більше 3 міс менше ніж у 2% хворих. Необхідно звертати увагу на симптоми гіпокальціємії, а рівень загального кальцію, поряд з іонізованим кальцієм, необхідно оцінювати на наступний день після операції і далі щодня до його стабілізації. У післяопераційний період у таких хворих необхідно визначати рівень іонізованого кальцію. Вимірювання рівня паратгормону в сироватці крові може допомогти в приграничних випадках і передбачити можливість нормалізації рівня кальцію в крові. Якщо відмічають гіпокальціємію або її симптоматику, необхідно починати лікування препаратами кальцію у поєднанні з альфакальцидолом або іншими похідними вітаміну D3. Для запобігання гіперкальціємії необхідний ретельний моніторинг рівня кальцію в сироватці крові.
Методами профілактики гіпопаратиреозу є: інтраопераційне дослідження рівня кальцитоніну в крові; застосування щадних оперативних технік відносно паращитоподібних залоз; застосування інтраопераційної гетеротопічної комплексної аутотрансплантації тканини паращитоподібної залози. Найбільш поширений метод аутотрансплантації «свіжої» паращитоподібної залози при її випадковому видаленні під час оперативних втручань на щитоподібній залозі. Розрізняють метод алотрансплантації паратиреоїдної тканини з наступною тривалою імуносупресивної терапією і метод алотрансплантації мікроінкапсульованої паратиреоїдної тканини, що дозволяє уникнути антигенного конфлікту без імуносупресії. На даний час метод застосований в експерименті і, безумовно, буде виправданий в клінічній практиці. Описані дані про застосування фотодинамічної візуалізації паращитоподібних залоз, що дозволяє зберегти їх функцію в післяопераційний період.
ПІСЛЯОПЕРАЦІЙНЕ ПРИЗНАЧЕННЯ РАДІОАКТИВНОГО ЙОДУ. ТИРЕОЇДНА АБЛЯЦІЯ
Післяопераційна тиреоїдна абляція полягає в призначенні хворому 131I, метою її є руйнування залишків тиреоїдної тканини в ложі щитоподібної залози. Доцільність її використання визначається наступним:
- руйнування при терапії 131I мікроскопічних фокусів пухлини, що залишилися після операції, може знизити вірогідність рецидиву і рівень смертності;
- абляція 131I резидуальної нормальної тиреоїдної тканини полегшує ранню діагностику рецидиву, яка базується на моніторингу рівня ТГ в сироватці крові та періодичному виконанні сцинтиграфії всього тіла з 131I (131I СВТ);
- висока активність 131I дозволяє проводити високочутливу післяопераційну СВТ, через 2–5 днів після його призначення,а також виявляти раніше не діагностовані вогнища пухлини.
На основі висновків хірурга та патологоанатома пацієнти можуть бути розподілені на три групи (табл. 15.8).
Таблиця 15.8
Показання до проведення післяопераційної тиреоїдної абляції (стратифікація ризику)
|
Немає показань (низький ризик рецидиву або летальності внаслідок РЩЗ) |
Абсолютні показання (із використанням високої активності ≥3,7 ГБк (100 мКі) після відміни тиреоїдних гормонів) |
Відносні показання (із використанням високої або низької активності (3,7 або 1,1 ГБк (100 або 30 мКі)) |
|
Повноцінна операція Сприятливий гістологічний варіант Однофокусна пухлина ≤1 см, N0, M0 Відсутність екстратиреоїдної інвазії |
Віддалені метастази або неповне видалення пухлини, або повне видалення пухлини, але високий ризик рецидиву або смертності: пухлина проростає капсулу щитоподібної залози (стадія Т3 або Т4) або метастази в лімфовузли шиї |
Обсяг операції менший, ніж тиреоїдектомія, або відсутність регіонарної лімфодисекції, або вік <18 років, або розмір пухлини >1 см і T2, N0, M0, чи несприятливий гістологічний варіант РЩЗ: папілярний — висококлітинний, колоноподібний; дифузно-склеротичний варіант; фолікулярний — широкоінвазивний або низькодиференційований |
Група дуже низького ризику. Пацієнти з одним фокусом мікрокарциноми (≤1 см), без ознак проростання капсули щитоподібної залози і за відсутності метастазів у лімфатичні вузли. Консенсус: переваг і показань для призначення 131I після операції немає.
Група високого ризику. Пацієнти із високим ризиком продовження хвороби. Консенсус: післяопераційне призначення 131I знижує вірогідність рецидиву і, ймовірно, покращує виживаність, до того ж дозволяє проводити ранню діагностику рецидиву. Показане призначення високої активності радіоактивного йоду після відміни препаратів тиреоїдних гормонів, тому що використання рлТТГ ще не схвалено для використання з цією метою.
Група низького ризику. Включає всіх інших пацієнтів. Немає консенсусу: переваги спірні, тому не визначено, чи слід призначати її всім пацієнтам, чи тільки вибірково.
Ефективна тиреоїдна абляція вимагає адекватної стимуляції ТТГ. Існують два методи підготовки: відміна тиреоїдних гормонів із розвитком гіпотиреозу і призначення рлТТГ на фоні продовження пацієнтом терапії L-Т4, не знижуючи, таким чином, якість життя хворого.
Вагітність повинна бути виключена перед призначенням терапії 131I.
Необхідно дотримуватися дієти з низьким вмістом йоду на період 3 тиж до призначення 131I. Надлишок надходження йоду має бути виключений.
Призначувана активність 131I варіює в різних центрах від 1,1 ГБК (30 мКі) (низька активність) і 3,7 ГБК або 100 мКі та навіть більше (висока активність).
СВТ після тиреоїдної абляції виконується через 3–5 днів після введення 131I. Вона має високу інформативність, якщо захоплення ізотопу залишками тиреоїдної тканини становить менше 2% призначеної активності.
СУПРЕСИВНА ТЕРАПІЯ
ТТГ-супресивна терапія після операції має дві мети:
- корекція гіпотиреозу шляхом призначення дози для досягнення нормальних рівнів тиреоїдних гормонів у крові;
- пригнічення ТТГ-залежного росту резидуальних ракових клітин шляхом пригнічення секреції ТТГ до рівня ≤0,1 мОД/л. У пацієнтів з повною ремісією будь-який час протягом спостереження немає необхідності далі супресувати ендогенну секрецію ТТГ. Тому режим лікування може бути змінений із супресивного на замісний.
Побічні ефекти у вигляді субклінічного тиреотоксикозу найчастіше проявляються кардіальними симптомами й остеопенією.
ДИНАМІЧНЕ СПОСТЕРЕЖЕННЯ ПІСЛЯ ПЕРВИННОГО ЛІКУВАННЯ
Фізикальне обстеження та УЗД шиї. УЗД має значно більшу чутливість, ніж пальпація шиї, і використовується рутинно для оцінки зон регіонарних лімфатичних вузлів і стану ложа щитоподібної залози. При УЗД можуть бути виявлені лімфовузли малих розмірів — 2–3 мм у діаметрі. Доброякісну гіперплазію шийних лімфатичних вузлів відмічають рідко. У разі наявності лімфатичного вузла більше 5 мм в діаметрі, збільшення якого зберігається декілька місяців, специфічність УЗД можна підвищити шляхом вивчення ехохарактеристик цього лімфатичного вузла, виконуючи ТАБ під контролем УЗД з наступним цитологічним дослідженням і визначенням вмісту ТГ у змивах з пункційної голки.
Визначення ТГ в сироватці крові. ТГ є специфічним і надзвичайно важливим пухлинним маркером для динамічного спостереження хворих на папілярний і фолікулярний РЩЗ. Його слід визначати за допомогою чутливого імунорадіометричного аналізу (функціональна чутливість <1,0 нг/мл), стандартизованого за Європейським референс-стандартом (CRM 457). Після тотальної тиреоїдної абляції за допомогою операції та радіоактивного йоду рівень ТГ повинен стати таким, що не визначається, а будь-яке визначення його рівня повинно насторожувати клініциста.
Інші процедури. Додаткові діагностичні методи включають КТ шиї і легень, МРТ кісток і головного мозку. Сканування кісток має низьку чутливість. 18ФДГ-ПЕТ рідко показана для таких пацієнтів. Це дослідження застосовують для визначення неопластичних вогнищ в задній частині шиї або середостінні у пацієнтів з підвищеним рівнем ТГ у сироватці крові, у яких не виявлено патологічне накопичення радіоактивного йоду. Його можна також проводити перед будь-яким агресивним видом лікування, щоб переконатися у відсутності інших неопластичних вогнищ. Чутливість методу може бути підвищена шляхом стимуляції ТТГ (рис. 15.2).
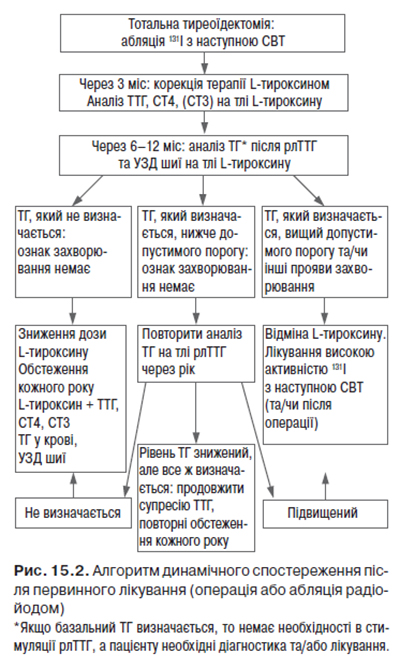
ВЕДЕННЯ ПАЦІЄНТІВ ІЗ РЕЦИДИВОМ АБО ПРОГРЕСУВАННЯМ ЗАХВОРЮВАННЯ
Ремісії вдається досягти приблизно у ⅔ пацієнтів із рецидивом пухлини в ділянці шиї і в ⅓ хворих з віддаленими метастазами. Ремісія найчастіше настає у хворих з обмеженою розповсюдженістю пухлини.
Місцевий і регіонарний рецидиви. Лікування базується на комбінації хірургічного втручання і терапії 131I у хворих, у яких виявлено накопичення ізотопу. Операції, що виконують із використанням інтраопераційного датчика радіоактивності, можуть покращувати результати лікування.
Коли повне хірургічне видалення неможливе, можна провести дистанційну ПТ — у разі незначного накопичення радіоактивного йоду в осередках пухлини.
Віддалені метастази. Метастази в легені. У разі накопичення метастазами радіоактивного йоду лікування являє собою призначення 131I після відміни на тривалий час ГТ.
Метастази в кістки. Метастази в кістки слід лікувати за допомогою комбінації хірургічного методу, терапії 131I (за умови накопичення ізотопу в метастазах) і дистанційної ПТ як з метою лікування, так і задля зменшення вираженості болю. Можуть виявитися ефективними й інші локальні методи, такі як емболізація і цементуючі ін’єкції.
Метастази в головний мозок. Метастази в головний мозок відносно рідкісні. У тому випадку, коли це можливо, їх слід піддавати резекції. Якщо вони нерезектабельні і не здатні накопичувати йод, то як паліатив може проводитися дистанційна ПТ. Зазвичай метастази в головний мозок свідчать про несприятливий прогноз.
НЕБАЖАНІ ЕФЕКТИ РАДІОАКТИВНОГО ЙОДУ
Можливі ранні ефекти: радіаційні тиреоїдити, порушення відчуттів смаку і запаху, нудота і блювання, сіалоаденіт, ксеростомія, сухість очей, опромінення сечового міхура (або гонад), прямої кишки, гіпозооспермія.
Можливі пізні ефекти: підвищення ризику лейкемії та вторинного раку, променевий фіброз.
РОЛЬ ДИСТАНЦІЙНОЇ ПТ
Дистанційну ПТ використовують нечасто. Її слід ретельно планувати, переважно із використанням тривимірних технологій з відповідною пересторогою для запобігання променевій мієлопатії. При мікроскопічних осередках пухлини необхідно створити сумарну вогнищеву дозу 50–60 Гр на ділянку шиї та верхнього середостіння, що підводиться за 25–30 сеансів по 5 разів на тиждень. Показано як початкове лікування рецидиву нерезектабельної пухлини або місцевої інвазії, яка передбачає наявність макро- і мікровогнищ пухлини, які не здатні накопичувати 131I. Дистанційна ПТ може бути також показана при метастазах в кістки і головний мозок.
РОЛЬ ЦИТОТОКСИЧНОЇ ХІМІОТЕРАПІЇ ТА ЕКСПЕРИМЕНТАЛЬНИХ МЕТОДІВ ЛІКУВАННЯ
Цитотоксична хіміотерапія не застосовується в рутинному веденні хворих на папілярний або фолікулярний РЩЗ. Її використання обмежене прогресуванням захворювання, де неможливо застосувати хірургічне втручання, радіойодотерапію або інші лікувальні методи. Відповідь на хіміотерапію слабка, ефект в кращому разі досягається в 10–20% випадків при використанні доксорубіцину або комбінації доксорубіцину з цисплатином. У будь-якому випадку не вдається досягти хороших результатів. До того ж вони не позначаються на виживаності хворих. Відповідь на хіміотерапію низькодиференційованих форм РЩЗ на тлі високого ТТГ (ендогенного чи екзогенного) краща. Молекулярно-орієнтовані види терапії та антиангіогенні препарати перебувають на етапі проспективних контрольованих досліджень і можуть бути перспективними в лікуванні даної категорії хворих.
Хіміотерапія. Хіміотерапевтичне лікування застосовують при поширеному РЩЗ. Для системної хіміотерапії використовують такі схеми ПХТ:
- адріаміцин — по 60 мг/м2 в/в в 1-й день, вінкристин — по 1 мг/м2 в/ в 1-й день, блеоміцин — по 30 мг/м2 в/ в 1-й день, кожні 3 тиж.
- адріаміцин — по 75 мг/м2 в/в в 1-й день, блеоміцин — по 30 мг/м2 в/ в 1, 8, 15, 22-й день, кожні 4 тиж.
- адріаміцин — по 60 мг/м2 в/в в 1-й день, вінкристин — по 1,4 мг/м2 в/ в 1-й день, циклофосфан — по 1000 мг/м2 в/ в 1-й день, кожні 3–4 тиж.
- доксорубіцин — по 60 мг/м2 в/в в 1-й день, цисплатин — по 40 мг/м2 в/ в 1-й день, кожні 3–4 тиж.
- доксорубіцин — по 60 мг/м2 в/в в 1-й день, вінкристин — по 1 мг/м2 в/ в 1-й день, блеоміцин — по 10–20 мг/м2 в/ в 1-й день, кожні 3–4 тиж.
Лікування медулярного РЩЗ. У хірургічному лікуванні медулярного РЩЗ застосовують тотальну тиреоїдектомію з двобічним видаленням шийних лімфовузлів. Тотальна тиреоїдектомія показана як при спадкових, так і при спорадичних формах медулярного РЩЗ. У пацієнтів із гіперпаратиреозом за наявності вираженої аденоми паращитоподібної залози проводиться видалення пухлини. При дифузній гіперплазії паращитоподібних залоз здійснюється субтотальна паратиреоїдектомія з видаленням 3 та ½ паращитоподібних залоз. У хворих із доведеною феохромоцитомою надниркової залози перед тиреоїдектомією необхідно провести адреналектомію, щоб уникнути гіпертонічного кризу під час операції. При двобічній феохромоцитомі показана двобічна адреналектомія.
ПТ. На даний час використання ПТ в лікуванні медулярного РЩЗ не є загальновизнаним. Більшість авторів вважають невиправданим призначення ПТ при всіх формах та стадіях медулярного РЩЗ, коли можливе здійснення широкого адекватного хірургічного втручання. Аналіз виживаності хворих на медулярний РЩЗ у двох групах хворих з післяопераційноюПТ і без неї показав відсутність статистично значущої різниці між цими показниками. У самостійному варіанті ПТ у вигляді теле-гамма-терапії на ділянку шиї та середостіння може бути використана тільки як паліативний метод лікування.
Останнім часом розширюються можливості радіонуклідної діагностики та лікування медулярних карцином. Проблема ранньої діагностики медулярного РЩЗ вирішується за допомогою таких методів, як сцинтиграфія з 131I-метайодбензилгуанідином, 111In-октреотидом, 99mTc (V)-димеркаптобурштиновою кислотою. Описана терапевтична ефективність 131I-метайодбензилгуанідину в лікуванні медулярного РЩЗ і його метастазів.
Замісна гормональна і ад’ювантна протипухлинна терапія. Після хірургічного втручання всім пацієнтам з медулярною карциномою щитоподібної залози проводиться замісна терапія тиреоїдними препаратами під контролем рівня ТТГ у крові в межах 0,5–1,5 мОД/л.
Медулярний РЩЗ належить до категорії новоутворень, на які існуючі протипухлинні препарати не чинять вираженої терапевтичної дії. В останні роки в літературі з’явилися повідомлення про застосування при цій патології біотерапії. Зокрема, для цих цілей використовуються інтерлейкін-2 і -4, а також рекомбінантний інтерферон. Підсилює протипухлинний хіміотерапевтичний ефект дакарбазину його поєднання з радіоімунотерапією і застосуванням моноклональних антитіл MN-14. Однак зазначені роботи мають пошуковий характер і переконливих даних про поліпшення результатів лікування не містять.
СКРИНІНГ МЕДУЛЯРНОГО РАКУ ЩИТОПОДІБНОЇ ЗАЛОЗИ
У 1985 р. ідентифікований та клонований протоонкоген REТ (rеarranged during transfection), що є етіологічним чинником розвитку спадкових форм медулярного РЩЗ. Визначено, що протоонкоген REТ складається з 20 екзонів, а причиною розвитку карциноми є мутації в 10-й хромосомі. Встановлено, що мутації, асоційовані з синдромами МЕН II типу, перетворюють нормальний протоонкоген RET в домінантний трансформуючий онкоген.
В організмі людини ген RET експресується в нормальних і пухлинних тканинах нейроендокринного диференціювання, включаючи парафолікулярні С-клітини і медулярний РЩЗ, мозковому шарі надниркової залози, феохромоцитомі, нейробластомі, периферичних нервах та їх пухлинах.
Виявлення гермінальної мутації гена RET в лімфоцитах периферичної крові пацієнтів — найбільш точний критерій діагностики спадкових форм медулярного РЩЗ.
Згідно з рекомендаціями Американського товариства клінічної онкології, пацієнтам з МЕН II типу генетичне тестування пропонується в якості стандартної допомоги. При виявленні мутації необхідне цілеспрямоване обстеження всіх родичів першого ступеня спорідненості для виявлення носія патологічного гена. Ідентифіковані безсимптомні носії RЕТ-мутацій необхідно перевіряти на наявність медулярного РЩЗ, феохромоцитоми і гіперплазії паращитоподібних залоз.
Оскільки практично для всіх хворих на медулярний РЩЗ характерний підвищений рівень кальцитоніну в сироватці крові, його дослідження у хворих та їх найближчих родичів є цінним діагностичним тестом. Біохімічне дослідження вихідного індивідуального рівня кальцитоніну (базального і комбінованого з навантаженням пентагастрином) дозволяє виявляти схильність до розвитку цього захворювання у родичів хворих із сімей зі спадковим медулярним РЩЗ.
Згідно із сучасним уявленням у безсимптомних носіїв патологічних мутацій гена RET виправдано профілактичне видалення щитоподібної залози. У носіїв мутацій гена RET із сімей з синдромом МЕН ІІа типу рекомендується проведення тотальної тиреоїдектомії з 5-річного віку. У сім’ях з синдромом МЕН ІІb типу рекомендують проводити тиреоїдектомію у ще більш молодшому віці, оскільки у дітей з цією формою захворювання метастази можуть розвиватися дуже рано. При проведенні тотальної тиреоїдектомії у дітей існує такий самий ризик розвитку операційних ускладнень, як і в дорослих, проте замісна терапія гіпотиреозу тиреоїдними препаратами проста і не має віддалених несприятливих наслідків.
При сімейному медулярному РЩЗ питання про оперативне втручання вирішується індивідуально, оскільки перебіг захворювання при цьому синдромі менш агресивний, клінічні прояви виникають у віці 30–40 років. Високочутлива рання молекулярна діагностика МЕН-II-синдромів дозволяє виявити пацієнтів з групи ризику до появи у них клінічних та біохімічних ознак розвитку медулярного РЩЗ.
ЛІКУВАННЯ НЕДИФЕРЕНЦІЙОВАНОГО РАКУ ЩИТОПОДІБНОЇ ЗАЛОЗИ
При недиференційованому РЩЗ радикальну операцію в більшості випадків не можна здійснити технічно, тому виконується можливе втручання паліативного характеру, пов’язане в основному з декомпресією трахеї. Дистанційну ПТ ділянки шиї і середостіння широко застосовують при недиференційованому РЩЗ. Дистанційне опромінення в складі комбінованого або комплексного лікування дозволяє трохи збільшити тривалість життя хворих на недиференційований рак. Курс ПТ використовують найчастіше в складі комбінованого лікування, до або після операції. Тактика лікування пухлин сполучнотканинного походження і плоскоклітинного РЩЗ мало відрізняється від такої при анапластичному раку. Сумарна вогнищева доза при лікуванні недиференційованого раку становить 30–60 Гр, фракціями 1–2 Гр, 5 днів на тиждень. Також використовують комбінації невеликих сумарних доз (17,5 Гр) з хіміотерапією; високодозову ПТ (сумарна вогнищева доза не менше 60 Гр) і гіперфракціонування (фракції до 4 Гр за сеанс, 4–5 разів на тиждень). Хіміотерапію у пацієнтів з недиференційованим РЩЗ застосовують у комплексі з хірургічним та променевим лікуванням. Серед препаратів частіше призначають антрациклінові антибіотики, блеоміцин або цисплатин.
Прогноз. Найкращий прогноз відмічають у разі лікування диференційованих форм РЩЗ папілярної та фолікулярної будови. 5-річна виживаність становить 80–97,5%, 10-річна — 75–94,2%, 20-річна — 61–92,9%. Найбільше число рецидивів і метастазів виявляють у перші 5–10 років спостереження після лікування. Медулярний РЩЗ за своїм клінічним перебігом агресивніший порівняно з папілярними і фолікулярними карциномами. Пухлина має більш виражені локальні інвазивні властивості, характеризується раннім регіонарним (до 70%) і віддаленим (до 35%) метастазуванням з переважним ураженням середостіння, легень, печінки, рідше — кісток скелета, головного мозку. При медулярному раку 5-річна виживаність становить 70–90%, 10-річна — 48–86%, 20-річна — 33–44%. За умови недиференційованого РЩЗ прогноз несприятливий — за даними більшості авторів, незалежно від лікування протягом 6–12 міс помирають 100% хворих.
АПУД-СИНДРОМИ
На даний час відомо 4 основні синдроми, клінічні прояви яких зумовлені апудомами: карциноїдний синдром (при виникненні пухлин з клітин — природних кілерів шлунково-кишкового тракту, ендокринних клітин органів дихання та ін.), синдром Золлінгера — Еллісона (при гіперпродукції гастрину апудомами з D-клітин підшлункової залози або з G-клітин шлунку), синдром Іценко — Кушинга (при аденомах гіпофіза) і синдром Вернера — Моррісона, інакше водна діарея (при апудомах з I-клітин кишечнику). Рідкісні об’єднання пухлин гіпофізу, острівців підшлункової залози і С-клітинних аденом паращитоподібних залоз визначають при синдромі Вермера, а одночасне виникнення пухлин із С-клітин щитоподібної залози, феохромоцитоми і парагангліоми зумовлює розвиток синдрому Сіппла.
Аналіз даних наукової літератури свідчить про прямий зв’язок ряду паранеопластичних синдромів зі зміною вмісту серотоніну, мелатоніну, катехоламінів і їх метаболітів, а також інших продуктів АПУД-системи в організмі онкологічних хворих. Порушенням в них обміну серотоніну, мелатоніну й їх аналогів значною мірою можуть пояснювати неспецифічне посилення обміну речовин, температурні реакції, зміни складу крові, порушення згортання крові, абактеріальний фібринозний ендокардит, карциноїдний синдром, гіперкортицизм, периферичні поліневрити, невропатії та міопатії, психічні порушення, зміни з боку шкіри тощо.
Важливе значення має участь АПУД-системи в ендогенних механізмах пухлинного росту. Серед речовин, які синтезуються апудоцитами, в онкологічному плані викликають інтерес серотонін, мелатонін, гістамін, адреналін, інсулін, глюкагон і гастрин — як речовини, здатні впливати на рівень і швидкість проліферації клітин.
НЕЙРОЕНДОКРИННІ ПУХЛИНИ
В останні роки виділена розсіяна по організму функціонально-активна система нейроендокринних клітин нейроектодермального походження. Характерними її властивостями є накопичення попередників біогенних амінів, подальше їх декарбоксилювання і вироблення біологічно активних похідних (адреналін, серотонін, мелатонін і т.д.), а також поліпептидних гормонів. Їх поділяють на наступні основні групи.
Аденоми ендокринних залоз (гіпофіз, епіфіз, підшлункова залоза і т.д.).
Карциноїди:
а) гормонально-активні;
б) гормонально-неактивні.
Парагангліоми:
а) хромафінні (феохромоцитома);
б) нехромафінні (хемодектома).
Дрібноклітинний рак легені, медулярний РЩЗ.
Тимоми.
Меланома.
Характерною особливістю цих новоутворень є наявність нейросекреторних гранул в цитоплазмі клітин. Нейроендокринні пухлини можуть бути гормонально-активними. У цьому випадку пухлина проявляє себе паранеопластичними синдромами.
Паранеопластичні синдроми — комплекс таких симптомів онкологічних захворювань, які викликані секрецією пухлиною гормонів та інших активних речовин, а також характерні порушення невідомої природи, не пов’язані з прямим механічним впливом новоутворення або його метастазів. На даний час відомо більше 40 таких синдромів. Вони характерні не тільки для апудом і проявляються ендокринними, гематологічними, неврологічними, дерматологічними порушеннями. Найчастіше відмічають підвищення рівня АКТГ, статевих гормонів (у тому числі ХГТ), кортикостероїдів, порушення електролітного балансу. Сюди ж можна віднести деякі випадки пухлинної інтоксикації, вегетоневрозів і кахексії. Гормонально-активні карциноїди викликають карциноїдний синдром (нападоподібне почервоніння шкірних покривів, бронхоспазм, абдомінальний дискомфорт, діарея), аденоми ендокринних залоз — відповідний гормональний синдром, феохромоцитоми — підвищення артеріального тиску і т.д. Можливі найрізноманітніші ендокринні порушення.
Про паранеопластичні синдроми слід завжди пам’ятати в широкій лікарській практиці, оскільки їх можна виявляти на ранніх стадіях розвитку пухлини, яка себе ще нічим не проявила. З другого боку, за допомогою гормональних досліджень можна контролювати радикальність лікування і рано діагностувати рецидиви захворювання.
Ступінь злоякісності апудом часто не корелює із вираженістю паранеопластичних проявів. При гістологічному дослідженні далеко не завжди можна визначити ступінь агресивності пухлини і прогнозувати клінічний перебіг захворювання. Хоча більшість нейроендокринних пухлин — доброякісні, в окремих випадках вони можуть давати метастази, що поволі ростуть (карциноїди, парагангліоми).
НЕОРГАННІ ПУХЛИНИ
Неорганні пухлини шиї походять з м’яких тканин, тому їх доцільно класифікувати за гістогенетичним принципом, на якому ґрунтуються сучасні класифікації м’якотканинних пухлин.
Пухлини нейроектодермального генезу:
- новоутворення периферичних нервів (невриноми, нейрофіброми, неврогенні саркоми);
- власне нервової тканини (гліоми);
- симпатичних гангліїв (гангліоневроми, нейробластоми);
- парагангліонарних структур (нехромафінні парагангліоми, хемодектоми).
Ці ураження в практиці прийнято називати неврогенними пухлинами шиї.
Серед неорганних пухлин шиї частіше діагностують доброякісні. Проте слід відмітити, що серед доброякісних новоутворень є такі форми, при яких поняття доброякісності хоча і справедливе з точки зору загальноонкологічних і морфологічних позицій, але складність топографоанатомічних особливостей локалізації і росту створює серйозні загрози при хірургічних втручаннях і робить умовним уявлення про їх доброякісність. Так, при операціях з приводу каротидних хемодектом або хемодектом блукаючого нерва, інтимно пов’язаних із сонними артеріями, створюються загрозливі ситуації.
КОРОТКА ХАРАКТЕРИСТИКА НЕОРГАННИХ ПУХЛИН ШИЇ
Неврогенні пухлини шиї становлять 45% всіх неорганних пухлин шиї. Найчастіше виявляють невриноми, рідше — нейрофіброми і гангліоневроми. В 40% випадків відмічають пухлини парагангліонарних структур — хемодектоми і парагангліоми. Хворіють переважно жінки віком 20–40 років, але можуть розвиватися також у дітей та осіб літнього віку. Можна встановити зв’язок пухлини з нервом, з якого пухлина виходить (шийний приграничний стовбур, спинномозкові корінці, стовбур шийного і плечового сплетень, рідкісні — блукаючий, під’язиковий або лицьовий нерви).
Клінічні групи симптомів при пухлинах шиї, що виникають з периферичних нервів:
- І група — загальні симптоми: характерна куляста або овоїдна форма пухлини, одиночність пухлинного вузла, гладка поверхня і щільна консистенція, достатня зміщуваність пухлини в поперечному напрямі (відносно осі нерва) і обмеження по довжині нерва (особливо при парафарингеальному розташуванні).
- ІІ група — симптоми компресійного характеру, ступінь яких залежить від локалізації і розмірів пухлини. Це зсув гортані, бічної стінки глотки, мигдаликів, м’якого піднебіння, сонних артерій. Ця група симптомів виразніше проявляється при парафарингеальній локалізації пухлин.
- ІІІ група — неврологічні симптоми. Їх виявляють рідко, залежать від ступеня стискування нервових волокон.
Особливістю клінічного перебігу неврогенних пухлин шиї є повільний ріст, особливо це стосується неврином. При нейрофібромах темп росту швидший. Нейрофіброми шиї можуть поєднуватися з окремими проявами загального нейрофіброматозу (хвороба Реклінгаузена). Разом із множинними нейрофіброматозними вузлами відмічають наявність пігментних плям на шкірі.
Злоякісні неврогенні пухлини шиї (злоякісні невриноми, симпатогоніоми, гангліобластоми) становлять близько 10% неврогенних пухлин шиї (в це число не включені хемодектоми). Особливість їх перебігу—дещо швидкий ріст, інфільтрація навколишніх тканин, метастазування в регіонарні лімфатичні вузли (рідко) і віддалені органи — легені, хребет.
ПУХЛИНИ ПАРАГАНГЛІОНАРНИХ СТРУКТУР — ХЕМОДЕКТОМИ
Хемодектоми сонного (каротидного) гломуса і блукаючого нерва — пухлини нейроектодермального генезу.
Сонний (каротидний) гломус розташовується в судинній піхві біфуркації сонної артерії, позаду або в краю внутрішньої сонної артерії. Тільце 3–7 мм в довжину і 2–4 мм в ширину нагадує формою рисове зерно. Нехромафінні параганглії за гістологічною будовою і гістогенезом схожі зі структурами хромафінної тканини і в ембріональний період синтезують адреналоподібні речовини. Окрім каротидного тільця, нехромафінні параганглії виявляють в ділянці ganglion nodosum блукаючого нерва, в цибулині яремної вени, в клітковині орбіти, в ділянці дуги аорти, біфуркації черевної аорти (орган Цуккеркандля) й інших анатомічних зонах. Нехромафінні параганглії виконують хеморецепторну функцію: клітини каротидних тілець мають низький поріг збудження до кисневого дефіциту і є джерелом рефлексів, реалізація яких приводить до збудження дихання, збільшення числа циркулюючих еритроцитів, підвищення артеріального тиску і секреції АКТГ, глюкокортикоїдів, адреналіну й інсуліну.
Пухлини розвиваються з рецепторних клітин парагангліїв, становлять до 40% всіх неврогенних пухлин шиї.
а) Каротидні хемодектоми:
- доброякісний варіант;
- злоякісний варіант виявляють рідко, в 5–6% випадків. Критерієм злоякісності є рецидиви і метастази (лімфогенно — в регіонарні лімфатичні вузли і гематогенно — в хребет).
Клініка. Пухлина локалізується на бічній поверхні шиї, нижче кута нижньої щелепи, в зоні сонного трикутника, відповідно до біфуркації загальної сонної артерії. Пухлина безболісна, щільної консистенції, з гладкою поверхнею. При пальпації визначають пульсацію, при аускультації над пухлиною прослуховують судинний шум. Пухлина зміщується в горизонтальному напрямку й обмежено рухома у вертикальному напрямку. Відвести пухлину від пульсуючої судини неможливо. Суб’єктивних скарг немає.
б) Хемодектоми блукаючого нерва:
- доброякісний перебіг;
- злоякісний перебіг — відмічають швидке зростання пухлини, метастази в хребет і легені.
Пухлини розвиваються з парагангліонарної (хеморецепторної) тканини нодозного ганглія блукаючого нерва, що є потовщенням нерва поблизу яремного отвору. Пухлини локалізуються на бічній поверхні шиї під кутом нижньої щелепи, йдучи верхнім полюсом в защелепну ямку. Зазвичай верхній полюс пухлини доходить до черепа, а нижній може досягати розвилки загальної сонної артерії. Пульсацію сонної артерії над пухлиною визначають рідко. Суб’єктивні симптоми: відчуття чужорідного тіла в глотці, зміна тембру голосу, утруднення при ковтанні. Визначають тріаду Горнера, можливі симптоми випадання функції блукаючого, під’язикового і язикоглоткового нервів. При ангіографії — зсув внутрішньої сонної артерії до середини і наперед.
ДІАГНОСТИКА ЕНДОКРИННИХ ПУХЛИН ШЛУНКОВО-КИШКОВОГО ТРАКТУ
Свого часу група Lamberts запропонувала використовувати радіоактивні маркери для візуалізації зон, насичених рецепторами соматостатину. Як маркер був запропонований мічений 111In октреотид, оскільки 123I має деякі недоліки: виводиться з жовчю, накопичується в шлунково-кишковому тракті і приводить до появи артефактів, що утруднюють інтерпретацію зображень у верхній половині живота. Період напіврозпаду 111In — 2,8 доби (123I — 13,2 год), зображення можна одержати і через 48 год; 111In виділяється нирками, тим самим усуваються артефакти, пов’язані з накопиченням контрастної речовини в шлунково-кишковому тракті, не вимагається систематичного застосування проносних засобів, загальний радіоактивний фон нижчий, зображення виходять кращої якості. Рекомендується вводити 111 Мбк октреотиду (іноді 222 Мбк, якщо слід виконати SPECT-томосцинтиграфію; доза опромінення така ж, як і при ангіографії та КТ); за 3 дні до дослідження слід припинити лікування аналогами соматостатину (щоб уникнути насичення рецепторів). Зображення одержують через 4 і 24 год після введення; за показаннями (акумуляція в будь-якому місці або для уточнення локалізації) проводять повторне дослідження через 30 год. Якщо є подвійна камера, весь період обстеження займає 2 год. У здорових людей радіоактивна речовина в незначній кількості накопичується в щитоподібній залозі, печінці, нирках, сечових шляхах і селезінці, іноді візуалізується жовчний міхур; нормальний тимус не візуалізується ніколи. Пухлину виявляють як вогнище гіперфіксації всередині «холодної зони». Визначення анатомічної локалізації стає можливим завдяки фізіологічній фіксації маркера на сусідніх органах. При складнощах в інтерпретації єдине вогнище накопичення вважають патологічним.
Діагностика нейроендокринних пухлин. Сцинтиграфія дозволяє не тільки підтвердити діагноз, але й виявити патологію, що не визначається за допомогою іншої діагностичної апаратури. Виявлення примітивних пухлин (гастрином і глюкагоном карциноїдів, а також апудом, що не функціонують) становить 70–100%. Деякі труднощі викликає тільки діагностика інсуліном через недостатню гомогенність у зображеннях різних серій. Чутливість методу оцінюють від 47% (Zimmer, половина пухлин, що вивчаються, — інсуліноми, які візуалізуються за допомогою сцинтиграфії тільки в 1 випадку з 8; діагностуються при використанні сцинтиграфії в поєднанні з іншими методами дослідження) до 78% (Lamberts, ендокринні пухлини pancreas). Сцинтиграфія дозволяє виявити 50% дуоденопанкреатичних пухлин у хворих із синдромом Золлінгера — Еллісона, не визначених за допомогою ендоскопії, ехографії і КТ (ефективність ехо- й ендоскопії 25%). Сукупна ефективність всіх методик при виявленні дуоденопанкреатичних пухлин становить 92%.
Діагностика метастазів ендокринних пухлин — друга сфера використання сцинтиграфії, результати дослідження часто визначають лікувальну тактику. Чутливість у виявленні метастазів у печінку оцінена в 93%. У даному дослідженні всі відомі метастази в печінку в хворих із синдромом Золлінгера — Еллісона підтверджені сцинтиграфією і в 11% випадків виявлені вперше в ході сцинтиграфії після того, як за допомогою КТ не виявлено патології. За всю історію проведення сцинтиграфії тільки в 1 випадку пропущена пухлина печінки. Як правило, сцинтиграфія дозволяє виявити додаткові вогнища гіперфіксації (54% випадків), особливо в кістковій тканині та середостінні, причому в 20% випадків їх визначають тільки за допомогою сцинтиграфії. Найбільш вірогідне виявлення рецидивуючої пухлини або метастазу після операції шляхом проведення сцинтиграфії. Виявлення множинних метастазів (вогнищ гіперфіксації) може стати протипоказанням до хірургічного втручання, оскільки воно не буде радикальним. У разі ендокринних пухлин pancreas і карциноїдних пухлин передопераційна сцинтиграфія допоможе виявити несподівані вогнища локалізації (протипоказання до операції), визначити необхідність в додаткових методах дослідження або специфічного лікування і встановити в початковій пухлині рецептори соматостатину. Результати сцинтиграфії визначають лікувальну тактику більше ніж у 25% випадків. Контрольні дослідження після курсів хіміо- і радіотерапії — менш популярна сфера застосування сцинтиграфії, оскільки візуалізація пухлин залежить не стільки від їх розмірів, скільки від кількості рецепторів соматостатину, а вплив хіміотерапії на стан рецепторів соматостатину поки невідомий. Зате сцинтиграфія рецепторів соматостатитну завжди виявляє печінкові і кісткові метастази гастрином, що не визначаються після курсів хіміотерапії за допомогою КТ і кісткової сцинтиграфії.
Таким чином, основними методами діагностики ендокринних пухлин pancreas, дванадцятипалої кишки і шлунка є ехо- й ендоскопія і сцинтиграфія рецепторів соматостатину (найчутливіший метод діагностики дуоденопанкреатичних гастрином при синдромі Золлінгера — Еллісона). Візуалізація декількох вогнищ в ендокринних залозах дозволяє припустити множинну ендокринну неоплазію і розширити дослідження. Сцинтиграфію використовують для підтвердження ефективності лікування аналогами соматостатину (при цьому знижується продукція гормонів). Про вплив октреотиду на продукцію гормону, що інгібує, наголошували тільки в пухлинах, що містять ARNm-рецептори типу 2.
Обмеження. Чутливість сцинтиграфії визначається розмірами пухлини і кількістю рецепторів на ній. Пухлини розміром 2 см і більше визначають в 87% випадків, до 2 см — в 35% (за досвідом авторів даного дослідження візуалізуються пухлини розміром 5 мм, невидимі за допомогою інших інструментальних методів дослідження, і це не межа). Розмір пухлини, що визначається за допомогою сцинтиграфії (не співпадає з реальним), залежить від кількості рецепторів соматостатину, тому багата на рецептори пухлина може показатися об’ємнішою, і навпаки, величезна пухлина може бути частково некротизованою або давати гетерогенну фіксацію і тому здаватися меншою. Коли пухлина не містить рецепторів соматостатину, можна одержати хибнонегативний результат сцинтиграфії (якщо не виражені патологічна і фізіологічна фіксація); іноді пухлини візуалізуються в косих проекціях або за допомогою КТ. Застосування неміченого октреотиду покращує діагностику печінкових метастазів карциноїдів, оскільки при цьому знижується фізіологічне поглинання трейсера печінкою. При множинних, близько розташованих вогнищах можливе нашарування вогнищ гіперфіксації. Метод найбільш придатний для діагностики пухлин, багатих на рецептори соматостатину. Іноді радіоактивний маркер накопичується у вогнищі хронічного запалення, в зоні недавнього хірургічного втручання, в будь-якому вогнищі попереднього подразнення в легенях. Метод не дозволяє диференціювати гістологічний тип пухлини, але все-таки виявлення вогнищ гіперфіксації в характерних для певного вигляду пухлин місцях, як правило, зумовлює й гістологічний тип. Деякі види пухлин не мають октреотидчутливих рецепторів, отже, їх візуалізація за допомогою сцинтиграфії неможлива.
Перспективи сцинтиграфії з використанням радіомічених аналогів соматостатину. Основне призначення — діагностика дуоденопанкреатичних пухлин шлунково-кишкового тракту, що не візуалізуються іншими методами, і виявлення віддалених метастазів. Більшість нейроендокринних пухлин (окрім інсуліном) багата на рецептори соматостатину, які мають високу спорідненість з октреотидом, аналогом цих рецепторів. Мічений радіоактивним індієм октреотид дозволяє одержати їх сцинтиграфічне зображення. Сцинтиграфія виявляє до 80% гастрином і карциноїдів, а в поєднанні з традиційними методами (ехо- й ендоскопія) — до 90% дуоденопанкреатичних пухлин в печінці. Пухлини, що виявляються за допомогою сцинтиграфії, чутливі до лікування аналогами соматостатину, внаслідок чого пригнічується синтез гормонів.
На даний час вивчаються такі маркери, як VIP, субстанція P, білки запалення і тромбозу, з якими пов’язують нові можливості клінічної сцинтиграфії.
Лімфосаркома (ретикулосаркома) — злоякісна пухлина, що розвивається із лімфатичних вузлів та складається з елементів лімфоїдної та ретикулярної тканини. Виявляють пухлину порівняно рідко, переважно в дитячому та молодому віці. Шийні вузли уражуються найчастіше (у 35% випадків). Частіше уражуються окремі лімфовузли або групи лімфовузлів (нодозна форма), рідше процес має поширений характер (дифузна форма) — лімфосаркоматоз або ретикулосаркоматоз.
Лімфосаркома шиї виникає непомітно та швидко збільшується в розмірах, зростається із судинним пучком, м’язами та іншими оточуючими тканинами, з інвазією та стискуванням їх. Локалізується найчастіше в боковому трикутнику шиї над ключицею.
Шкіра над пухлиною поступово стоншується, змінює колір, з’являються ерозії, внаслідок чого пухлинні розростання виходять назовні. У початковий період лімфосаркома має круглу або вузлувату форму, нерівномірно щільну консистенцію, горбисту поверхню, нечіткі контури. За нетривалий період часу утворення може досягати великих розмірів. У міру прогресування процесу уражуються лімфовузли шиї, середостіння.
Лікування лімфосарком — комплексне. Обмежені пухлини на ранніх стадіях розвитку підлягають хірургічному видаленню, в післяопераційний період призначають променеву та хіміотерапію. При поширених формах і в занедбаних випадках лімфосарком застосовують рентгенотерапію. Тривалість життя хворих — декілька місяців, при ремісії — 1–2 роки.
Бранхіогенний рак розвивається з лімфоепітеліальних клітин зябрових кишень, відмічається рідко. За локалізацією відповідає бічній кісті шиї, розташовується в межах від підщелепної ділянки до ключиці. Являє собою щільне, горбисте, малорухоме утворення, спаяне з м’язами та судинним пучком. В занедбаних випадках пухлина зазвичай проростає в судинний пучок, м’які тканини шиї, а також глотку і гортань.
Лікування: хірургічне та променеве.
Пухлину видаляють разом з кивальним м’язом, яремною веною та лімфовузлами вздовж неї. У ряді випадків (особливо при сумніві в операбельності хворих) проводять ПТ, що обов’язкова в післяопераційний період. У занедбаних випадках теле-гамма-терапія є єдиним методом лікування. Прогноз сприятливий при радикальному видаленні пухлини.
Метастази в лімфатичні вузли шиї. Виявляють при пухлинах, що локалізуються частіше в інших органах. Нерідко такі метастази клінічно проявляються раніше, ніж сама пухлина. В окремих випадках при метастазуванні у лімфовузли шиї первинна пухлина може зовсім не проявлятися. При патогістологічному дослідженні метастазу за допомогою імуногістохімічних методів визначають первинну пухлину, що є джерелом цих метастазів. Найчастіше в лімфовузли шиї метастазує рак губи, язика, щитоподібної залози, легені, шлунка, молочної залози, рідше — стравоходу та гортані. Відзначають деяку різницю в локалізації метастазів залежно від джерела первинного вогнища. Так, наприклад, рак шлунка метастазує переважно в надключичні лімфатичні вузли зліва, рак молочної залози — у підключичні та надключичні лімфатичні вузли по ходу заднього краю кивального м’яза шиї, РЩЗ — у верхні яремні та надгортанні лімфовузли шиї, рідше — у нижні яремні вузли та вузли переднього середостіння, рак язика, нижньої губи дає метастази в підщелепні лімфовузли.
Метастази мають округлу форму, щільну консистенцію, у занедбаних випадках — спаяні зі шкірою, частіше бувають множинні, нерідко відмічають і поодинокі.
Діагностика: пункційна або ексцизійна біопсія.
Видаленню підлягають найбільші лімфатичні вузли.
Лікування. При радикальному видаленні первинної пухлини одночасно видаляють регіонарні метастази та проводять ПТ.
Якщо метастази в лімфовузли шиї розвинулися після видалення первинної пухлини і значно розповсюджені, то оперативне лікування їх зазвичай не проводять. Обмежуються в таких випадках променевою та хіміотерапією.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Які доброякісні пухлини повік виявляють найчастіше:
А. Кісти
В. Папіломи
С. Гемангіоми
D. Нейрофіброми
2. Яка локалізація раку органів порожнини рота найбільш розповсюджена:
А. Слизова оболонка щік
В. Слизова оболонка дна порожнини рота
С. Слизова оболонка альвеолярних країв верхньої та нижньої щелепи
D. Язик
3. При лікуванні раку нижньої губи І стадії застосовують:
А. Хірургічне втручання
В. Внутрішньоартеріальну хіміотерапію
С. Близькофокусну рентгенотерапію
D. Дистанційну рентгенотерапію
4. Пухлина Шмінке є різновидом:
А. Аденокарциноми
В. Плоскоклітинного раку
С. Апудом
D. Сарком
5. При метастатичному ураженні шийних лімфатичних вузлів виконують операцію:
А. Крайля
В. Дюкена
С. Мельникова
D. Гартмана
6. Епулід належить до доброякісних пухлин:
А. Слинних залоз
В. Щелеп
С. Носоглотки
D. Гортаноглотки
7. До злоякісних пухлин слинних залоз належать усі, крім:
А. Плеоморфних аденом
В. Циліндром
С. Мукоепідермоїдних пухлин
D. Плоскоклітинного раку
8. Парафолікулярні С-клітини щитоподібної залози виробляють:
А. Трийодтиронін
В. Серотонін
С. Тироксин
D. Кальцитонін
9. При медулярній формі РЩЗ в післяопераційний період з лікувальною метою застосовують:
А. Радіойодотерапію
В. Імунотерапію
С. Дистанційну рентгенотерапію
D. Внутрішньоартеріальну хіміотерапію
10. Прогноз та перебіг захворювання при якій формі РЩЗ найбільш сприятливий:
А. Медулярній
В. Папілярній
С. Недиференційованій
D. Анапластичній
Шаблон відповідей
|
1 |
B |
6 |
B |
|
2 |
D |
7 |
A |
|
3 |
C |
8 |
D |
|
4 |
B |
9 |
C |
|
5 |
A |
10 |
B |