Вивчення зв’язку між остеопорозом і ревматичними захворюваннями суглобів (РЗС) викликає великий інтерес не лише у ревматологів, але й у фахівців інших галузей медицини. Поряд із запаленням і терапією ГК, які є найбільш універсальними факторами, що ведуть до розвитку вторинного остеопорозу при РЗС (Насонов Е.Л. и соавт., 1997; 1998), існує багато інших факторів, що впливають на формування остеопенічного синдрому у цієї групи хворих, — іммобілізація, супутня патологія, тощо.
Існує цілий ряд загальних факторів, що призводять до розвитку як ОА, так і остеопорозу — жіноча стать, похилий вік, генетична схильність (сімейна агрегація гена колагену I типу та ін.), дефіцит естрогенів і вітаміну D тощо. Остеопороз діагностують у кожної 5-ї жінки віком 75 років, а ОА — у 1 з 10 осіб віком старше 50 років і у кожного 2-го віком старше 75 років. Обидва захворювання відіграють значну роль у порушенні стану здоров’я населення, призводячи до ранньої інвалідизації та зниження тривалості життя.
Остеопороз — системне захворювання скелета, що характеризується зменшенням кісткової маси, порушеннями мікроархітектоніки кісткової тканини, що призводить до підвищення крихкості кістки й ризику переломів (Конференція з остеопорозу, Копенгаген, 1990).
На думку експертів ВООЗ, у рейтингу основних медико-соціальних проблем сучасності (Kleerekoper M., 1985; Meunier P.J., 1997) остеопороз посідає третє місце після захворювань серцево-судинної системи і цукрового діабету і, за даними деяких дослідників (Родионова С.С., 1994), є найпоширенішим і серйозним захворюванням обміну речовин скелета людини. Перш за все це зумовлене частим розвитком і тяжкістю ускладнень остеопорозу, серед яких найважливіше значення мають патологічні переломи кісток, зокрема компресійні переломи тіл хребців, переломи дистального відділу кісток передпліччя, шийки стегнової кістки та ін. (Melton L.J., 1993; Подрушняк Е.П., 1997). Ці ускладнення призводять до інвалідизації і часто до передчасної смерті хворих від супутніх порушень із боку серцево-судинної та дихальної систем (Поворознюк В.В. и соавт., 1998). Так, ризик перелому шийки стегнової кістки у жінок віком 50 років становить 15,6%, тобто перевищує ризик виникнення раку молочної залози (9%) (Cummings S.R. et al., 1989). При цьому ризик смерті приблизно однаковий (2,8%) (Melton L.J., 1993; Kanis J.A., 1994). За даними ВООЗ майже у 25% жінок віком молодше 65 років в анамнезі є компресійні переломи хребців, а у 20% — переломи кісток передпліччя (WHO Techn Rep., 1994; Поворознюк В.В., 1997). Крім того, у хворих на остеопороз підвищується ризик нетравматичних (спонтанних) переломів хребта і променевої кістки (32 і 15,6% відповідно) (Kanis J.A., 1994). В останні десятиріччя проблема остеопорозу набула особливого медико-соціального значення у зв’язку зі значним постарінням населення високорозвинених країн світу і відповідним збільшенням кількості жінок у клімактеричний період (Cummings S.R. et al., 1989; Geusens P., Dequeker J., 1991; Франке Ю., Рунге Г., 1995).
Проблема остеопорозу актуальна і в Україні у зв’язку зі значним постарінням населення — 13,2 млн (25,6%) становлять люди віком 55 років і старше, а також високою часткою осіб, які проживають на радіоактивно забруднених територіях і мають незбалансований раціон (Поворознюк В.В. и соавт., 1995; Корж А.А. и соавт., 1997). Результати досліджень, проведених в Інституті геронтології АМН України (Поворознюк В.В., 1996; 1997; 1998; Поворознюк В.В. и соавт., 1995; 1997; 1998), показали, що у віці від 30 до 80 років мінеральна щільність компактної кісткової тканини знижується у жінок на 27%, у чоловіків — на 22%, а губчатої кісткової тканини — на 33 і 25% відповідно. Це призводить до значного підвищення ризику переломів і реального збільшення їх кількості. З урахуванням даних епідеміологічних і демографічних досліджень в Україні можна прогнозувати, що ризик переломів є у 4,4 млн жінок і у 235 тис. чоловіків; всього 4,7 млн, або 10,7% загальної чисельності населення (Поворознюк В.В. и соавт., 1995).
За кордоном проблема остеопорозу активно розробляється з 60-х років ХХ ст. і належить до однієї з найбільш вартісних медичних програм: лікування пацієнтів із остеопорозом і його ускладненнями — процес тривалий, не завжди ефективний і потребує значних матеріальних затрат (Riggs B.L., Melton L.G., 1995). У 1994 р. фінансування такої програми в США становило 10 млрд дол., то в 2020 р., за підрахунками фахівців, її вартість може зрости до 62 млрд. Таким чином, необхідність профілактики та лікування остеопорозу і його ускладнень не викликає сумнівів, а успішність профілактики залежить від термінів діагностики остеопорозу.
Механізми розвитку остеопорозу
Порушення в системі ремоделювання кісткової тканини як причина остеопорозу
З позицій сучасної остеології кістка вивчається як орган опорно-рухового апарату, форма й структура якого зумовлена функціями, для виконання яких і пристосована макро- і мікроскопічна структура (Спузяк М.И., 1988). До складу кістки входять коркова (компактна) і губчата речовина (у скелеті відповідно складові 80 і 20% маси), вміст яких залежить від форми кісток. Кісткова тканина — рухливий резерв мінеральних солей, причому в метаболізмі кісткової тканини на частку компактної речовини доводиться приблизно 20%, а губчатої — близько 80% (Kanis J.A., 1994).
Клітинними елементами кісткової тканини, що беруть участь у постійному обміні мінеральних і органічних компонентів між кістковим матриксом і тканинною рідиною з перицелюлярною резорбцією кісткової речовини як неодмінним компонентом такого обміну, є остеобласти (формують кістку), остеокласти (руйнують кістку) і остеоцити (Ach P. et al., 1980; Kalender W.A., 1992).
Протягом життя людини відбувається постійне відновлення кістки, яке полягає в резорбції окремих ділянок скелета з майже одночасним формуванням нової кісткової тканини (ремоделювання). Щорічно від 2 до 10% маси скелета перебудовується (Canalis E., 1993), причому ця внутрішня перебудова є локальною й не змінює геометрії чи розмірів кісток. Вона характерна для дорослого організму, тоді як кістка, що росте, характеризується формоутворенням — ростом у довжину й ширину.
Ремоделювання відбувається в дискретно розташованих ділянках кістки — так званих одиницях ремоделювання, кількість яких одномоментно досягає 1 млн (Поворознюк В.В., 1997). Для резорбції 100 мк кістки необхідно близько 30 днів, заміщення цієї маси кістки новою кісткою відбувається протягом 90 днів, тобто повний цикл ремоделювання становить 120 днів (Корж А.А. и соавт., 1995). На тканинному рівні метаболічні процеси у скелеті визначаються загальною кількістю активних одиниць ремоделювання (у нормі — близько 1 млн) і балансом ремоделювання — відношенням кількості резорбованої і знову сформованої кістки в кожній одиниці. Процес ремоделювання кісткової тканини має значно більш активний перебіг у трабекулярних кістках, ніж у кортикальних.
У практично здорових людей молодого віку швидкість перебудови кістки в одиницях ремоделювання залишається постійною: кількість кісткової тканини, що піддається резорбції остеокластами, практично відповідає кількості сформованої остеобластами (Eriksen E., 1986). Порушення ремоделювання в бік переваги процесів резорбції над процесами формування кістки призводить до зменшення маси і порушення структури кісткової тканини (Kanis J.A., 1994). Для інволютивного ж остеопорозу характерне знижене кісткоутворення, в той час як при ряді захворювань, що є причиною вторинних остеопеній, спостерігається підвищена резорбція кістки.
Таким чином, остеопороз розглядається як результат порушення процесів ремоделювання кісткової тканини і зазвичай виникає спочатку в метаболічно більш активній трабекулярній тканині, де зменшується кількість і товщина пластинок, порожнини між ними збільшуються внаслідок перфорації трабекул. Ці зміни зумовлені порушенням балансу між глибиною резорбованих порожнин і товщиною знову утворених пластинок.
Процес перебудови кісткової тканини перебуває під контролем цілого ряду системних і локальних факторів, що в сукупності становлять багаторазово дубльовану на різних рівнях систему взаємодії (табл. 10.1). Фактори системної дії впливають на вивільнення та активацію факторів місцевої дії, які, у свою чергу, виявляють аутокринний або паракринний вплив на кісткову тканину.
Таблиця 10.1
Фактори, що впливають на перебудову кісткової тканини
| Фактори системної дії | Фактори місцевої дії |
1. Гормони:
2. Інші фактори:
|
|
Гормональні механізми. Більшість дослідників визнають роль гормонів у контролі метаболізму і гомеостазу кісткової тканини. Відомо, що гормони анаболічної дії (естрогени, андрогени) стимулюють кісткоутворення, а антианаболічні гормони (наприклад ГК) посилюють резорбцію кості. На думку ряду дослідників, такі гормони, як ПТГ, кальцитонін і вітамін D, більше беруть участь у регуляції кальцієвого гомеостазу, ніж безпосередньо впливають на функціональну активність остеобластів і остеокластів.
Вплив естрогенів на кісткову тканину:
- Сприяють абсорбції кальцію в кишечнику, підвищуючи чутливість до вітаміну D;
- Cтимулюють клітинні й гуморальні ланки імунітету;
- виявляють антирезорбтивну дію (впливають на процеси активування остеокластів);
- Cтимулюють ендохондральну осифікацію хрящової тканини, діючи безпосередньо на рецептори хондроцитів;
- Cтимулюють виділення остеобластами остеокластпригнічувальних факторів;
- Знижують активність ПТГ і чутливість до нього клітин кісткової тканини;
- Стимулюють синтез і секрецію кальцитоніну;
- Модулюють активність і синтез цитокінів (особливо ІЛ-6), стимулюють синтез ІФР і ТФР-β.
Виявлення на остеобластоподібних клітинах специфічних високоафінних рецепторів свідчить про пряму дію естрогенів на скелет. Секреція остеобластами факторів росту й регуляція естрогенами продукції ІЛ-6 і кальцитоніну свідчать про можливість паракринного впливу естрогенів на кісткову тканину.
Важливе значення мають і опосередковані ефекти естрогенів, зокрема їх вплив на гемостаз. Так, відомо, що високі дози цих препаратів знижують активність антитромбіну III, а низькі дози (особливо трансдермальних форм) прискорюють запуск фібринолітичної системи приблизно у 8 разів. Це має важливе значення при ряді РЗС, коли система гемостазу має схильність до гіперкоагуляції. Крім того, естрогени знижують ризик виникнення ішемічної хвороби серця і рецидиву інфаркту міокарда (на 50–80%), клімактеричних порушень (у 90–95% жінок), покращують стан м’язового тонусу, шкіри, знижують імовірність виникнення гіперпластичних процесів у матці й молочних залозах, урогенітальних порушень та ін.
Факти, що свідчать про вплив естрогенів на кісткову тканину:
- Більш значна втрата кісткової маси у жінок в постменопаузальний період.
- Секреція анаболічних стероїдів у жінок в постменопаузальний період зменшується на 80% (у чоловіків — на 50%), в той час як продукція кортикостероїдів — лише на 10%.
- Серед хворих на пресенільний остеопороз жінок у 6–7 раз більше, ніж чоловіків.
- Жінки з ранньою (у тому числі штучно викликаною) менопаузою втрачають кісткову масу швидше, ніж жінки того ж віку з фізіологічною менопаузою.
- Остеопороз або гіпостоз — ознаки гіпогонадизму, що часто відзначаються.
- ЗГТ естрогенами за останні 10 років зумовила зменшення постменопаузальної втрати кісткової тканини і як наслідок — зменшення кількості переломів (Lindsay R. et al., 1977; Lindsay R., 1983).
- Оскільки дефіцит естрогенів призводить до місцевого дисбалансу в одиницях ремоделювання, то метаболічні зміни, що підвищують швидкість ремоделювання кістки, будуть і надалі сприяти прискоренню втрати кісткової маси (Kanis J.A., 1994).
Зважаючи на те що одним із основних патогенетичних механізмів розвитку первинного остеопорозу є дефіцит естрогенів, до досить ефективних методів профілактики і лікування захворювання належить ЗГТ (Rizzoli R., Bonjour J.-P., 1997), що на сьогодні є засобом другої лінії терапії, наприклад постменопаузального остеопорозу. Ще на початку 20-х років ХХ ст. R. Cecil і B. Archer (1926) виявили, що протягом перших 2 років після менопаузи у 25% випадків у жінок розвиваються симптоми дегенеративного артриту. Пізніше встановлено, що у чоловіків і жінок віком молодше 50 років ОА (як і остеопороз) реєструють приблизно з однаковою частотою, проте після 50 років частота розвитку ОА (так званий менопаузальний артрит) різко зростає у жінок, але не у чоловіків. Більше того, за останніми даними, ЗГТ сприяє зниженню частоти розвитку коксартрозу й гонартрозу, причому тривала ЗГТ впливає на прогресування дегенеративних змін у суглобах більшою мірою, ніж короткий курс ЗГТ. Усе зазначене свідчить про те, що дефіцит естрогенів відіграє важливу роль у розвитку не лише остеопорозу, але й ОА, ЗГТ виявляє сприятливий ефект щодо прогресування обох захворювань (Zhang Y. et al., 1998).
До гормонів, що виявляють позитивний вплив на кісткову тканину, відносять андрогени, особливо у жінок відразу після настання менопаузи, коли відбувається різке (у середньому на 80%) зниження вироблення анаболічних стероїдів (у чоловіків тих самих вікових груп — у середньому на 50%). Вони збільшують мінеральну масу кістки, діючи безпосередньо на рецептори кісткових клітин, і стимулюють біосинтез білка в остеобластах, сприяють включенню кальцію, фосфору. Аналогічну дію на кісткову тканину мають і гестагени. Оскільки в кістковій тканині є рецептори лише до естрадіолу, дія гестагенів на кісткову тканину більш потужна, ніж естрогенів.
Важливою властивістю вищезазначених гормонів є їх вплив на кортикостероїдні рецептори в кістковій тканині, що становить конкуренцію екзогенним кортикостероїдам (див. нижче). Вони також стимулюють синтез білка в остеобластах та інтрамембранну осифікацію.
Вплив ГК на стан кісткової тканини
ГК — на сьогодні найбільш потужні з наявних протизапальних препаратів, застосовуються для лікування широкого спектра захворювань вже понад 40 років (Axelrod L., 1993). При ОА йдеться перш за все про місцеве (внутрішньосуглобове чи периартикулярне) застосування цих гормонів. Проте не слід зменшувати й системний ефект ГК на організм, що проявляється навіть при локальному їх застосуванні, досить виражений у деяких випадках.
Скелет, будучи органом — мішенню для ГК, уражається найчастіше. Клінічно ГК-індуковане порушення обміну кальцію проявляється остеопенією, остеопорозом, асептичним некрозом кісток, гіперпаратиреозом, міопатією, кальцифікацією тканин та іншими порушеннями.
Розділяючи процеси кісткоутворення й резорбції, ГК викликають швидку втрату кісткової маси, прямо інгібуючи формування кістки й тим самим знижуючи синтез основних компонентів матриксу, включаючи колаген і протеоглікани (Canalis E., 1983). Порушення гомеостазу кальцію й фосфору належить до найпоширеніших наслідків терапії ГК. Індуковане останніми порушення фосфорно-кальцієвого обміну пов’язане як із прямою дією препаратів на тканини і органи, так і з розладом функцій кальцієрегулювальних гормонів. Провідною ланкою в цьому патологічному процесі є пригнічення всмоктування кальцію і фосфору в кишечнику, пов’язане з порушенням метаболізму чи фізіологічною дією вітаміну D. Зниження абсорбції кальцію в кишечнику внаслідок інгібування синтезу кальцієзв’язувального протеїну, відповідального за активний транспорт кальцію в стінку кишечнику, призводить до підвищення екскреції кальцію із сечею, негативного кальцієвого балансу і підвищення резорбції кістки (Adashi J.D. et al., 1993).
Вторинна кальцієва недостатність спричиняє розвиток гіперпаратиреозу, що збільшує демінералізацію скелета, а це, в свою чергу, призводить до змін в органічному матриксі кісткової тканини і підвищення втрат кальцію та фосфору із сечею. Крім того, ГК знижують секрецію статевих гормонів шляхом інгібування секреції пітуїтарного гонадотропіну, а також шляхом прямої негативної дії на продукцію естрогенів і тестостерону.
На думку S. Benvenuti, M.L. Brandi (1999), вплив ГК на процеси диференціювання клітин кісткової тканини залежить від доз, типу ГК, тривалості застосування препарату (експозиції), специфічності. Так, виявлено, що після внутрішньосуглобового введення ГК знижувався рівень піридиноліну і деоксипіридиноліну (MacDonald A. et al., 1994).
Метаболізм вітаміну D. Метаболіти вітаміну D специфічно зв’язуються з рецепторами із високою спорідненістю в рецепторних ділянках і з’являються в ядрах клітин тканин і органів-мішеней (кістка, кишечник, залози внутрішньої секреції тощо) (Lawson D.E.M., Wilson P.W., 1979; Stumpf W.E. et al., 1979). Експерименти in vivo (Mellow A.M. et al., 1978) показали, що 1,25-(ОН)2D і 25-(ОН)D зв’язуються з ізольованими кістковими клітинами і гомогенатами кістки. Дослідження за допомогою міченого радіоактивної міткою вітаміну D (Deluca H.F., 1979) показали, що останній локалізується в остеобластах, остеоцитах і хондроцитах. Вітамін D індукує як мінералізацію, так і резорбцію кісткової тканини, тому на сьогодні за своєю дією на кістку він розглядається як стероїдний гормон системної дії (Сорока Н.Ф., 1997). Крім того, доведений вплив вітаміну D на синтез колагену і протеогліканів (Stern P.H., 1980), що зумовлює його додаткову дію на процес формування кістки. Механізм дії вітаміну D пов’язаний також із посиленням транспорту кальцію й фосфору в кишечнику, реабсорбції кальцію в нирках, тому гіповітаміноз D супроводжується істотною демінералізацією кісткової тканини (Deluca H.F., 1978; 1979). У біоптатах при цьому виявляють широкі остеоїдні прошарки внаслідок недостатньої кальцинації. Хронічний дефіцит вітаміну D призводить до остеомаляції, яка може ускладнювати перебіг остеопорозу. Прогресуюча гіпомінералізація кістки погіршує біомеханічні властивості останньої й підвищує ризик виникнення переломів. Надлишок вітаміну D призводить до посилення резорбції кісткової тканини. Відомо, що отруєння вітаміном D супроводжується гіперкальціємією, гіперфосфатемією, гіперкальціурією і гіперфосфатурією.
Вітамін D діє на резорбцію кісткової тканини разом із ПТГ, причому в експериментах на тваринах та у клінічних спостереженнях (Stern P.H., 1980) виявлено існування реципрокного зв’язку між ними: 1,25-(ОН)2D3 здійснює контроль секреції й синтезу ПТГ (стимулом до посилення його секреції є зниження рівня кальцію в крові), а ПТГ є основним гормональним фактором, що регулює синтез ниркової α1-гідроксилази. Цією взаємодією можна пояснити виникнення вторинного гіперпаратиреоїдизму при наявності дефіциту вітаміну D.
Синтез і метаболізм вітаміну D в організмі піддається інволютивному впливу за рахунок нижченаведених факторів:
- Дефіцит естрогенів (за рахунок зниження рівня кальцитоніну, що має здатність непрямої стимуляції утворення 1,25-(ОН)2D3, а також рівня активності α1-гідроксилази в нирках).
- Зниження з віком здатності шкіри до утворення вітаміну D (молодше 70 років — більше ніж у 2 рази).
- Інволюційні зміни в нирках (нефросклероз) призводять до зниження активності ферментних систем, що беруть участь у метаболізмі вітаміну D.
- Зменшення з віком кількості рецепторів до кальцитріолу в кишечнику.
Вікове зниження утворення кальцитріолу за принципом зворотного зв’язку призводить до підвищення синтезу ПТГ. У свою чергу, надлишок останнього посилює резорбцію кісткової тканини й веде до її рарефікації.
Таким чином, дефіцит вітаміну D — один із провідних факторів у розвитку практично всіх форм остеопорозу.
В останні роки з’явилися дані про те, що вітамін D бере участь у метаболізмі не лише кісткової, але й хрящової тканини (Насонов Е.Л., 1998; 1999). Він стимулює синтез протеоглікану хондроцитами, модулює активність металопротеїназ, що беруть участь у руйнуванні хряща. Так, зниження рівня 24-, 25- і 1,25-вітаміну D асоціюється з підвищенням активності металопротеїназ, а його нормальний рівень знижує активність цих ферментів in vitro. Таким чином, зниження рівня вітаміну D може посилювати продукцію деструктивних ферментів і знижувати синтез матричних протеогліканів, що, в свою чергу, призводить до втрати хрящової тканини. Слід також підкреслити, що на ранній стадії ОА вітамін D-залежне порушення метаболізму хряща може супроводжуватися ремоделюванням і потовщенням субхондральної кісткової тканини. Це викликає зниження амортизаційної здатності субхондральної кістки й прискорення дегенеративних змін у хрящі.
У дослідженнях показано, що у пацієнтів із гонартрозом зниження споживання вітаміну D з їжею і низький рівень 25-вітаміну D у сироватці крові асоціюється із 3-разовим підвищенням ризику прогресування рентгенологічних змін у колінних суглобах, 3-разовим підвищенням ризику утворення остеофітів і 2-разовим — втрати хрящової тканини (судячи зі звуження міжсуглобової щілини) (Mcalidon T.E. et al., 1996). У жінок похилого віку з низьким рівнем 25-вітаміну D у сироватці крові спостерігається 3-разове підвищення частоти розвитку коксартрозу (судячи зі звуження міжсуглобового простору, але не за утворенням остеофітів) порівняно із жінками, у яких нормальний рівень вітаміну D (Lane N.E. et al., 1999). Більше того, нещодавно висловлене припущення про те, що втрата кісткової маси й дегенеративні зміни в хребті — патогенетично взаємозалежні процеси, що мають загальну тенденцію до прогресування з віком. Вважається, що дефіцит кальцію і вітаміну D призводить до збільшення синтезу ПТГ, що, у свою чергу, викликає надлишкове відкладання кальцію в суглобовому хрящі (Fujita T., 1997).
Рекомендації Американської академії наук, щодо норми адекватного споживання вітаміну D у різних вікових групах (табл. 10.2), необхідності збільшення добового споживання вітаміну D до 400 МО (у чоловіків) і 600 МО (у жінок) у вікових групах 51–70 років і старше (Holick M.F., 1998), важливі для профілактики не лише остеопорозу, але й ОА.
Таблиця 10.2
Рекомендації зі споживання вітаміну D (Holick M.F., 1998)
| Вік | Cередня доза, МО (мкг/добу) | Максимальна доза, МО (мкг/добу) |
| 0–6 міс | 200 (5) | 1000 (25) |
| 6–12 міс | 200 (5) | 1000 (25) |
| 1–18 років | 200 (5) | 2000 (50) |
| 19–50 років | 200 (5) | 2000 (50) |
| 51–70 років | 400 (10) | 2000 (50) |
| >71 року | 600 (15) | 2000 (50) |
| Період вагітності | 200 (5) | 2000 (50) |
| Період лактації | 200 (5) | 2000 (50) |
У клінічній практиці на сьогодні застосовують переважно синтетичні похідні вітаміну D — кальцитріол і альфакальцидол, що з’явився на ринку України, причому останній вважається найбільш перспективним препаратом цієї групи (добре переноситься хворими, рідко відмічаються випадки гіперкальціємії та гіперкальціурії).
Кальцитріол безпосередньо зв’язується з рецепторами кишечнику до вітаміну D, отже виявляє в більшій мірі місцеву дію, сприяючи абсорбції кальцію в кишечнику, і суттєво не впливає на синтез ПТГ.
Альфакальцидол, на відміну від кальцитріолу, спочатку зазнає трансформації в печінці з утворенням активного метаболіту 1,25-(OH)2D3, тому його ефекти на синтез ПТГ і абсорбцію кальцію можна порівняти, що свідчить про більш фізіологічну його дію. Добові дози препарату становлять 0,25–0,5 мкг — з метою профілактики ГК-індукованого остеопорозу і 0,75–1 мкг — при достовірно встановленому остеопорозі.
Імунологічні аспекти виникнення вторинного остеопенічного синдрому при ОА
На сьогодні суттєва роль медіаторів системи імунітету (цитокінів і факторів росту) у локальній регуляції процесів ремоделювання кісткової тканини не викликає сумнівів. Вважається, що порушення в системі імунних медіаторів відіграють важливу роль у патогенезі вторинного остеопорозу на фоні РЗС (Насонов Е.Л. и соавт., 1996; 1997).
Остеобласти, які мають подібні морфологічні властивості з деякими лініями кістковомозкових стромальних клітин, здатні синтезувати цитокіни колонієстимулювальні фактори (КСФ, ІЛ). Останнє припускає участь остеобластів як у процесі ремоделювання кісткової тканини, так і в мієлопоезі. Оскільки остеокласти походять із гемопоетичних гранулоцитарно-макрофагальних колонієутворювальних одиниць (КУО) моноцитів, що є попередниками моноцитів/макрофагів, то ранні етапи гемопоезу і остеокластогенезу регулюються подібним чином. У розвитку остеокластів беруть участь цитокіни, які одночасно відіграють провідну роль у регуляції локальних і системних запальних реакцій при різних захворюваннях людини: ІЛ-1, -3, -6, -11, ФНП, гранулоцитарно-макрофагальні колонієстимулювальні фактори (ГМ-КСФ). Важливим також є і той факт, що дія цитокінів з остеокластогенними (ІЛ-6 і -11) і остеобластогенними (ЛІФ) властивостями опосередкована подібними молекулярними механізмами, а саме модуляцією глікопротеїну-130 (ГП-130), що бере участь у передачі цитокін-опосередкованого активаційного сигналу клітинам-мішеням. Слід відмітити, що естрогени пригнічують, а 1,25-(ОН)2D3 і ПТГ посилюють експресію ГП-130 у клітинах кісткового мозку. Отже, зміна рівня гормонів (у тому числі й на фоні гострофазової відповіді, пов’язаного з аутоімунним запаленням при РЗС) може впливати на чутливість попередників остеокластів і остеобластів до впливу цитокінів, що беруть участь у процесі ремоделювання кісткової тканини.
Докладна характеристика імунологічних аспектів розвитку остеопорозу в хворих ревматологічного профілю наведена нами раніше в книзі «Ревматоидный артрит. Диагностика и лечение» (К.: Морион, 2001).
Аліментарні причини остеопорозу
Відомо багато аліментарних факторів, що є причиною остеопорозу. Наводимо найважливіші з них.
Деякі аліментарні фактори, що викликають підвищення ризику розвитку остеопорозу:
- Різноманітні порушення дієти
- Недостатнє надходження кальцію з їжею
- Недостатнє надходження в організм вітаміну D
- Дієта з високим вмістом протеїнів або фосфатів
- Кофеїн
- Дієта з високим вмістом натрію
- Алкоголь
- Низьке надходження в організм флюоридів
- Цинга
- Дефіцит вітамінів В6, В12, К
- Дефіцит мікроелементів (бору, цинку тощо)
Порушення гомеостазу кальцію чи його дефіцит
Більшість учених на сьогодні визнають, що остеопороз — кальцієзалежне захворювання (Nordin B.E.C., Morris H.A., 1989). Із 1–1,7 кг кальцію, що міститься в організмі дорослої людини, 99% входить до складу скелета і 1% циркулює в міжклітинній рідині (Корж А.А. и соавт., 1997). Добова потреба в елементарному кальцію становить не менше 1100–1500 мг, що необхідно для нормального функціонування органів і систем, які беруть участь у метаболізмі мінералів кісткової тканини, травного тракту, печінки, нирок, сироватки крові та міжтканинної рідини.
Дефіцит кальцію виникає внаслідок його аліментарної недостатності, порушення всмоктування в кишечнику або посиленого виділення. Важливими факторами є знижена абсорбція кальцію, низькі концентрації кальцитріолу і резистентність до нього тканин-мішеней. Внаслідок цього підвищується резорбція кісткової тканини для вирівнювання кальцієвого балансу. Однак відмінності у споживанні кальцію в різних регіонах світу не можуть пояснити різниці в ризику переломів між популяціями. Так, переломи стегнової кістки відзначають досить часто у країнах із високим споживанням кальцію, наприклад у Скандинавських країнах і Нідерландах, і навпаки, їх кількість менша у країнах із низьким споживанням кальцію. Цей факт підтверджує складний патогенез остеопорозу, складовою частиною якого є кальцієзалежний механізм. Імовірно, прискорена втрата кісткової маси відбувається внаслідок підвищення чутливості кісткової тканини до ПТГ (Heaney R.P., 1970; Riggs B.L., Melton L.J., 1995) і в ряді випадків у зв’язку зі зниженою чутливістю до нього ниркової α1-гідроксилази. Внаслідок прискорення ремоделювання кістки кістковий баланс стає негативним; крім того, через недостатнє утворення 1,25-(OH)2D3 знижується абсорбція кальцію в кишечнику.
Зміна чутливості до ПТГ органів-мішеней може бути зумовлена дефіцитом естрогенів, особливо в постменопаузальний період.
Вікові аспекти розвитку остеопенічного синдрому при ОА
На сьогодні більшість дослідників вказують на важливе значення закладеної в період активного формування скелета кісткової маси й досягнення так званого піка кісткової маси (у зарубіжній літературі — peak bone mass) (Kanis J.A., Pitt F., 1992; Kanis J.A., 1994; Broll H., 1996). Проведений на підставі даних ультразвукової денситометрії (Поворознюк В.В., 1998) і однофотонної абсорбціометрії (ОФА) (Дедух Н.В. и соавт., 1998) аналіз структурно-функціонального стану кісткової тканини у дітей і підлітків України показав, що основне збільшення кісткової маси відбувається у дітей обох статей у віці від 10 до 14 років. Пік кісткової маси, що залежить від багатьох факторів, є важливою детермінантою структурно-функціонального стану кісткової системи у людей більш старших вікових груп, розвитку інволюційного остеопорозу (постменопаузального й сенільного) та його ускладнень (Kroger H. et al., 1993). Згідно з даними P.I. Meunier та співавторів (1997) невелика вихідна кісткова маса служить причиною виникнення остеопорозу в 57% випадків. На користь цієї теорії свідчить більш рідке виникнення остеопорозу в популяціях, що мають більшу кісткову масу, наприклад у представників негроїдної раси.
За кордоном вивчення показників мінеральної насиченості й МЩКТ у осіб різних вікових груп із метою встановлення закономірностей формування й резорбції кісткової тканини проводиться вже більше 20 років (Clochon P. et al., 1988). В Україні подібні дослідження проводяться в Інституті геронтології АМН України (В.В. Поворознюк, Є.П. Подрушняк та ін.), в Українському ревматологічному центрі (УРЦ) (В.М. Коваленко та ін.), в Інституті патології хребта й суглобів АМН України (Харків) (О.О. Корж, Н.В. Дєдух та ін.). Дані, отримані при використанні ОФА на базі УРЦ (Коваленко В.Н. и соавт., 1995–1997) та Інституту патології хребта й суглобів АМН України (Харків) (Дедух Н.В. и соавт., 1998), наведені в табл. 10.3.
Таблиця 10.3
Середні показники МНКТ і МЩКТ променевої кістки (випадкова вибірка; дані ОФА)
| Вік, років (жін./чол.) | Дистальний відділ | Проксимальний відділ | ||||||
| МНКТ, г/см | МЩКТ, г/см2 | МНКТ, г/см | МЩКТ, г/см2 | |||||
| Чол. | Жін. | Чол. | Жін. | Чол. | Жін. | Чол. | Жін. | |
| 4–5 | 0,270 | 0,217 | 0,231 | 0,202 | 0,301 | 0,281 | 0,341 | 0,336 |
| 6–7 | 0,328 | 0,305 | 0,273 | 0,254 | 0,351 | 0,326 | 0,381 | 0,376 |
| 8–11/ 8–9 | 0,389 | 0,415 | 0,249 | 0,257 | 0,419 | 0,475 | 0,429 | 0,463 |
| 12–15/13–15 | 0,795 | 0,623 | 0,396 | 0,341 | 0,829 | 0,665 | 0,589 | 0,544 |
| 16–18 | 0,945 | 0,823 | 0,453 | 0,420 | 0,954 | 0,757 | 0,644 | 0,601 |
| 19–25 | 1,203 | 0,846 | 0,575 | 0,445 | 1,380 | 0,851 | 0,800 | 0,640 |
| 26–30 | 1,243 | 0,871 | 0,588 | 0,480 | 1,352 | 0,950 | 0,810 | 0,702 |
| 31–40 | 1,260 | 0,850 | 0,590 | 0,472 | 1,341 | 0,939 | 0,821 | 0,700 |
| 41–45 | 1,255 | 0,825 | 0,578 | 0,436 | 1,339 | 0,940 | 0,811 | 0,656 |
| 46–50 | 1,248 | 0,817 | 0,571 | 0,419 | 1,311 | 0,832 | 0,792 | 0,613 |
| 51–60 | 1,236 | 0,780 | 0,552 | 0,400 | 1,269 | 0,799 | 0,780 | 0,582 |
| 61–70 | 1,210 | 0,710 | 0,500 | 0,321 | 1,227 | 0,748 | 0,730 | 0,518 |
| >70 | <1,210 | <0,710 | <0,500 | <0,310 | <1,227 | <0,748 | <0,730 | <0,518 |
На сьогодні наявні літературні дані про співвідношення остеопорозу і ОА суперечливі. За даними деяких дослідників остеопороз і ОА рідко розвиваються у тих самих хворих (Healey J. et al., 1985; Hordon L. et al., 1993). Співвідношення між первинними ОА і остеопорозом наведені в табл. 10.4.
Таблиця 10.4
Первинний остеопороз і ОА: подібності й відмінності (за: Насонов Е.Л., 2000)
| Ознака | Остеопороз | ОА |
| Визначення | Метаболічне захворювання кісток | Метаболічне (дегенеративне) захворювання хряща |
| Основний патогенетичний механізм | Порушення ремоделювання (балансу остеокластопосередкованої резорбції та остеобластопосередкованого формування) кісткової тканини | Порушення анаболізму і катаболізму (балансу між хондроцитопосередкованим синтезом і деградацією) хрящової тканини |
| Стать | Жіноча | Жіноча |
| Частота в популяції | Близько 30% (>50 років) | Близько 10–30% (>65 років) |
| Ускладнення | Переломи | Порушення функції суглобів |
| Вплив на тривалість життя | ++ (переломи шийки стегна); підвищення ризику розвитку інфаркту міокарда та інсульту | + (зменшення на 8–10 років у жінок, але не у чоловіків, у міру збільшення кількості уражених суглобів); хвороби легень і травного тракту |
| Фактори ризику: | ||
| Жіноча стать | + | + |
| Похилий вік | + | + |
| Генетична схильність | + | + |
| Маса тіла надмірна/недостатня | +/– | +/– |
| Дефіцит естрогенів | + | +/– |
| Дефіцит вітаміну D | + | + |
| Надмірне фізичне навантаження | + | + |
| МПК | Знижена | Підвищена або нормальна |
| БМ кісткової резорбції (Пір, Д-Пір) | Підвищені | Підвищені |
| Ризик переломів кісток скелета | Підвищений | Вірогідно підвищений щодо коксартрозу |
Пір — піридинолін, Д-Пір — деоксипіридинолін.
Нами проведене обстеження методом ОФА (прилад NK-364A з ізотопом 125I у ролі джерела іонізуючого випромінювання) осіб без патології з боку опорно-рухового апарату (контрольна група) і хворих на ОА (основна група). Сканували стандартні ділянки кісткової тканини дистального й проксимального відділів передпліччя, що відображають мінералізацію переважно губчатої та компактної речовини кісткової тканини. МЩКТ визначали відповідно до сучасної класифікації остеопеній та остеопорозу (Techn. Rep. of a WHO study group, 1994):
- Норма: зміна МЩКТ у межах 1 стандартного відхилення (SD) від референтного значення, одержаного в результаті виміру МЩКТ у осіб не старше 30 років — Т-індекс
- Зменшення кісткової маси (остеопенія): зниження МЩКТ >1 SD і <2,5 SD від референтного значення
- Остеопороз: зниження МЩКТ >2,5 SD від референтного значення
- Тяжкий остеопороз: зниження МЩКТ >2,5 SD від референтного значення в комбінації з одним або більше переломами кісток.
Для динамічного аналізу використовували Z-показник — стандартне відхилення МЩКТ від средньовікових норм, отриманих нами шляхом обстеження 2500 осіб без патології опорно-рухового апарату, які проживають у різних регіонах України.
За нашим даними, зменшення МЩКТ у всіх досліджених ділянках скелета корелює з віком як в осіб контрольної групи, так і у хворих на ОА (рис. 10.1). Нами відзначено також істотне прискорення втрати кісткової тканини мінерального компонента у пацієнтів з ОА в ранній постменопаузальний період (p<0,05).
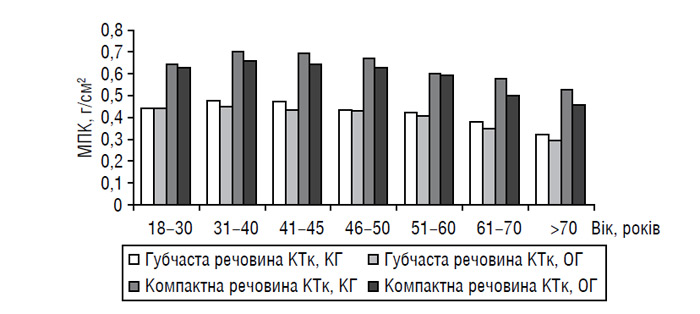
Рис. 10.1. Показники МЩКТ у хворих на ОА (основна група — ОГ) і у практично здорових осіб (контрольна група — КГ) залежно від віку. КТк — кісткова тканина
В.І. Алякна та співавтори (1988) проводили біопсію клубової кістки з подальшим гістоморфометричним аналізом недекальцінованих зрізів, вимірювали швидкість поширення ультразвуку у кістках, визначали деякі БМ кісткового метаболізму (кальцій загальний та іонізований, неорганічний фосфат, оксипролін у сечі) у 89 хворих на ОА і у 344 практично здорових осіб. Виявлено, що у хворих на ОА більш старших вікових груп (70 років і старше) швидкість поширення ультразвуку на 4,2% менше, ніж у контролі, що служить відображенням більш низької МЩКТ у цих пацієнтів. Залежність розвитку остеопорозу від віку пацієнтів із ОА й тривалості захворювання підтверджували зниження рівня оксипроліну в сечі й тенденцію до зниження рівня іонізованого кальцію в крові. Дані біопсії показали при ОА зниження синтезу остеоїду, порушення його мінералізації та деяке зменшення загальної поверхні резорбції кістки.
Клініка і діагностика системного остеопорозу при ОА
Системний остеопороз — складне багатофакторне захворювання, що зазвичай характеризується повільним безсимптомним прогресуванням до моменту появи переломів кісток, що в більшості випадків є першими достовірними ознаками остеопорозу (Melton L.J., 1993), причому характерне виникнення спонтанних нетравматичних або неадекватних тяжкості травми переломів.
Нами проведено порівняльну оцінку стану кісткової тканини у хворих на ОА, РА й практично здорових осіб. Обстежено 348 осіб із РЗС: 149 пацієнтів з діагнозом ОА, встановленим відповідно до критеріїв, запропонованих ACR (1994), і 199 — з достовірним діагнозом РА за критеріями ARA (табл. 10.5). Пацієнтів обстежено клінічно, включаючи визначення ІМТ, та інструментальними методами. У 310 хворих проводили ОФА; 38 пацієнтів обстежили методом ультразвукової денситометрії п’яткової кістки (ультразвуковий денситометр Achilles, «LUNAR»). Усім хворим проводили рентгенографію хребта з подальшим розрахунком морфометричних індексів рентгенограм — центрального індексу Barnett, Nordin (Спузяк М.І., 1988) з метою оцінки стану кісткової тканини. Проводили кореляційний аналіз (r<0,35 кваліфікували як слабкий зв’язок).
Таблиця 10.5
Характеристика обстежених пацієнтів із РЗС (n=348)
| Показник | Нозологічна форма | |
| РА | ОА | |
| Загальна кількість хворих | 199 | 149 |
| Вік (у середньому років) | 18–76 (48,14±1,23) | 29–82 (54,36±6,23) |
| Стать | Чоловіки — 42
Жінки — 157 |
Чоловіки — 44
Жінки — 105 |
| Тривалість захворювання (у середньому років) | 0,17–37 (5,85±1,27) | 0,5–34 (7,60±2,24) |
| Рентгенологічна стадія | 0–I — 42
II — 116 III–IV — 41 |
0–I — 41
II — 68 III — 40 |
| Клінічний варіант | Моно-/олігоартрит — 35
Поліартрит — 164 |
Моно-/олігоартроз — 90
Поліостеоартроз — 59 |
| Функціональна недостатність суглобів | 0–I — 41
II — 119 III–IV — 39 |
0–I — 30
II — 69 III — 50 |
| Системна терапія ГК (n)/середня тривалість терапії (років) | 62/6,44±1,12 | — |
Як основні симптоми, що супроводжують генералізовану рарефікацію кісткової тканини при РЗС, виділяємо анатомічні зміни й больовий синдром.
Анатомічні зміни у вигляді зменшення росту (у середньому на 4,8±0,31 см) за час захворювання відзначили 46 обстежених, або 23,11% їх загальної кількості, а порушення постави зареєстровані у 76% хворих. Зменшення росту визначали, вимірявши відстані голова — симфіз (1) і симфіз — стопи (2): зменшення співвідношення (1) до (2) більше ніж на 5 см свідчило про остеопороз. При проведенні кореляційного аналізу виявлено дуже слабкий кореляційний зв’язок анатомічних змін із вираженістю остеопорозу (r=0,09).
Больовий синдром, зумовлений патологічними процесами у кістковій тканині, що супроводжуються її розрідженням, відзначали у 72% хворих, у яких денситометрично виявлені порушення МЩКТ (табл. 10.6).
Таблиця 10.6
Характеристика больового синдрому в обстежених хворих (n=348)
| Характеристика болю | Частка від загальної кількості хворих,% | Кореляційний зв’язок між вираженістю больового синдрому і ступенем остеопенічних змін, r | |
| РА (n=199) | ОА (n=149) | ||
| Локалізований | 12 | 13 | 0,12 |
| Генералізований біль у хребті | 26 | 30 | 0,62 |
| Осалгія | 14 | 11 | 0,28 |
| Змішані варіанти | 24 | 14 | 0,41 |
| Усього | 76 | 68 | 0,36 |
Больовий синдром включав:
1. Локалізований біль, який ми розділяли на «надкістковий», що характеризується гострим початком і досить чіткою локалізацією, «псевдорадикулярний» (типу люмбаго), малодиференційований і такий, що має тенденцію до хронізації, з ригідністю м’язів (м’язовим спазмом) як рефлекторною реакцією на біль і, як правило, з відсутністю компресійного болю, і «радикулярний» — як гострий, так і хронічний.
2. Генералізований біль у хребті, що досягає найбільшої інтенсивності переважно в його «перехідних» ділянках (шийно-грудній, попереково-грудній, попереково-крижовій).
Клінічні варіанти перебігу остеопорозу хребців були такими: а) гострий больовий синдром, пов’язаний зазвичай зі свіжим компресійним переломом хребця чи декількох хребців, що характеризувався гострим інтенсивним болем в ураженому відділі хребта, подальшим гострим реактивним м’язовим напруженням в ураженій зоні, часто у вигляді оперізувального, іррадіювального, псевдорадикулярного болю у грудній клітці, черевній порожнині або стегнових кістках; б) хронічний: скарги на тупий біль у спині протягом тривалого часу, постійний або виникаючий періодично, що супроводжується вищеописаними анатомічними змінами — зменшенням росту, деформацією хребта (сутулість спостерігалася у 60% із усіх обстежених пацієнтів). Симптоматика у цих хворих повільно наростала при збільшенні тривалості захворювання і характеризувалася чергуванням періодів загострення та ремісії, коли больовий синдром ставав менш вираженим або практично був відсутнім (Насонов Е.Л. и соавт., 1997; Подрушняк Е.П., 1997). Ймовірно, причина подібного перебігу остеопорозу — повзуча деформація тіл хребців (множинні мікропереломи трабекул) із прогресуючим зменшенням висоти хребців, деформацією хребта — збільшенням кіфозу грудного відділу (Орлова Е.В., 1980).
3. Біль у різних кістках скелета (осалгія). Раніше вважалося, що оскільки в кістці немає больових рецепторів, то больовий синдром при остеопорозі не може виникнути без деформації тіла хребця, проте на сьогодні це припущення спростоване. Так, дифузний біль у кістках, чутливість при постукуванні ребер і тазових кісток і загальна чутливість до струсу відзначені у пацієнтів за умови реєстрації на рентгенограмах розрідження трабекулярної структури кісткової тканини і відсутності деформації тіл хребців (Франку Ю., Рунге Г., 1995). Подібний біль може бути зумовлений кістковими мікропереломами або подразненням періосту випнутою порозною кісткою. Існування залежності інтенсивності болю від вираженості остеопорозу у пацієнтів із РЗС підтверджено й іншими дослідниками (Kocian J. еt al., 1987). Дані кореляційного аналізу між вираженістю болю і ступенем остеопенічних змін див. табл. 10.6. Найбільш сильний позитивний корелятивний зв’язок відзначено між генералізованим болем у хребті й остеопенічним синдромом (r=0,62).
Таким чином, анатомічні зміни хребта й больовий синдром (локалізований біль, генералізований біль у хребті, осалгія) — основні клінічні прояви, що супроводжують генералізовану рарефікацію кісткової тканини при РЗС. Виявлення відповідних клінічних ознак на ранній (до переломів) стадії розвитку остеопенії у цієї категорії хворих дозволить практичному лікареві цілеспрямовано проводити диференційну діагностику подібних порушень і вчасно призначати адекватну терапію з урахуванням факторів ризику розвитку спонтанних (патологічних) переломів — віку хворих (особливо у жінок в ранній постменопаузальний період), системних проявів, а також специфічної терапії (системне введення ГК та ін.).
Підкреслимо, що встановлення діагнозу остеопорозу тільки на підставі клініко-анамнестичних даних не можливе і потребує підтвердження за допомогою лабораторних та інструментальних методів дослідження.
Наш досвід (Коваленко В.Н. и соавт., 2000) підтверджує, що в симптоматичній терапії больового синдрому при остеопорозі добре зарекомендували себе прокаїнові, тримекаїнові блокади, а також ненаркотичні анальгетики. Особливо ефективний у хворих ревматологічного профілю трамадол, що дозволяє значно зменшити вираженість (або усунути повністю) больового синдрому, зумовленого як остеопорозом, так і ураженням суглобів (артрити, артралгії) (Коваленко В.Н., Головков Ю.Ж., 1995).
Патологічні переломи
Відомо, що для клінічної стадії розвитку остеопорозу характерні патологічні (спонтанні, крихкокісткові остеопоротичні) переломи, що виникають при відсутності травматичного фактора чи при невідповідності тяжкості травми (Поворознюк В.В., 1997). Наявні в сучасній літературі дані свідчать про тісну кореляцію між схильністю до переломів і остеопорозу.
До параметрів, що впливають на стан кісткової тканини і відповідно на частоту розвитку остеопоротичних переломів, належать: маса або МЩКТ (в іноземній літературі — BMD (bone mineral density), г/см2)), схильність до втрати рівноваги, геометрія кісток (особливо шийки стегнової кістки), якість кістки, мікроархітектоніка кісткової тканини.
Особливо важливе значення для виникнення переломів у осіб віком молодше 65 років більшість дослідників (Войташшак Й., Швець А., 1997; Корж А.А. и соавт., 1997) надають МЩКТ, яка незалежно від інших причин тісно корелює з міцністю кістки й ризиком переломів. Зниження МЩКТ у будь-якій ділянці скелета на 1 SD від норми призводить до разового підвищення ризику переломів у 1,5 раза (Cummings S.R. et al., 1989).
У проспективних і ретроспективних дослідженнях встановлено прямий корелятивний зв’язок між наявністю переломів в анамнезі та/чи підвищеним ризиком виникнення перелому і низькою кістковою масою (Ross P.D. et al., 1987; Gardsell P. et al., 1989; Cummings S.R. et al., 1993). S.R. Cummings та співавтори (1993) виявили, що у жінок, показник МЩКТ шийки стегнової кістки яких становить (<–2 SD), ризик перелому стегна в 8,5 раза вищий, ніж у тих, чия МЩКТ >2 SD. Зниження МЩКТ шийки стегнової кістки на 1 SD підвищує ризик перелому в 2,6 раза, що свідчить про достовірний зв’язок МЩКТ з імовірністю перелому.
У групі пацієнтів із РЗС, обстежених нами, переломи в анамнезі відзначено у 69 (19,8%) осіб. Найбільша кількість переломів припадала на вік 52–56 років у жінок і близько 60 років — у чоловіків. Слід зазначити, що у 76,7% випадків переломи відбувалися внаслідок дії лише мінімального навантаження, тобто відзначена невідповідність тяжкості травми і сили провокуючого моменту.
Незважаючи на те що при остеопорозі усі відділи скелета мають підвищену крихкість, деякі з них є типовими ділянками локалізації остеопоротичних переломів, а саме тіла нижніх грудних і верхніх поперекових хребців (так звані перехідні зони хребта), проксимальний кінець стегнової кістки (підголовчаста, міжвертлюжна, підвертлюжна ділянка), проксимальний кінець плечової та дистальний відділ променевої кістки (перелом Colles) (табл. 10.7).
Таблиця 10.7
Ризик переломів (95% ДІ) у осіб віком 50 років (за: Melton L.J. et al., 1991)
| Місце перелому | Жінки | Чоловіки |
| Проксимальна ділянка стегна | 17,5 (16,8–18,2) | 6,0 (5,6–6,5) |
| Хребет* | 15,6 (14,8–16,3) | 5,0 (4,6–5,4) |
| Дистальна ділянка передпліччя | 16,0 (15,7–16,7) | 2,5 (2,2–3,1) |
| Усього | 39,7 (38,7–40,6) | 13,1 (12,4–13,7) |
*Клінічно діагностовані переломи.
Переломи довгих трубчастих кісток, найбільш характерні для стегнової кістки, виникають приблизно на 15 років пізніше, ніж компресійні переломи хребців; середній вік хворого з переломом зап’ястя — 65 років, а з переломом стегнової кістки — 80 (Delmas P.D., Woolf A.D., 1997). Це, очевидно, пов’язано з тим, що у стегновій кістці, у тому числі у її шийці, утримується більша кількість компактної кістки, ніж у тілі хребця. Переважна локалізація переломів у обстеженій нами вибірці пацієнтів із РЗС наведена в табл. 10.8.
Таблиця 10.8
Локалізація переломів у пацієнтів із РЗС та діагностованим остеопорозом
| Локалізація переломів (% від загальної кількості переломів) | Нозологічна форма | |
| РА, n (%) | ОА, n (%) | |
| Шийка стегнової кістки | 7 (3,52) | 6 (21,40) |
| Тіло хребця | 13 (6,53) | 16 (57,10) |
| Ключиця | 4 (2,00) | — |
| Ребро | 4 (2,00) | 2 (7,14) |
| Кістки передпліччя або променева кістка | 2 (1,00) | 4 (14,30) |
| Щиколотка | 1 (0,50) | — |
| П’яткова кістка | 1 (0,50) | — |
| Множинні повторні переломи | 5 (2,51) | 7 (4,70) |
| Всього від загального числа хворих, n (%) | 41 (20,60) | 28 (18,80) |
| Спонтанні переломи,% від загальної кількості переломів | 82,00% | 71,40% |
Наявність компресійних переломів тіл хребців (включаючи клиноподібну деформацію й лінзоподібну форму тіл хребців зі зменшенням їх висоти) підтверджувалося даними центрального індексу Barnett — Nordin (Спузяк М.И., 1988). Показники стану кісткової тканини у цій групі хворих, одержані при проведенні ОФА, наведені в табл. 10.9.
Таблиця 10.9
Показники МЩКТ (Z-показник, SD) у пацієнтів із РЗС та переломами (за даними ОФА)
| Z-показник, SD | Вид кісткової тканини | |||
| Губчата речовина | Компактна речовина | |||
| ОА (n=131) | РА (n=179) | ОА (n=131) | РА (n=179) | |
| Чоловіки | –2,07±0,89 | –2,36±0,75 | –1,49±0,62 | –1,76±0,79 |
| Жінки | –2,34±0,27 | –2,85±0,37 | –1,54±0,38 | –2,00±0,41 |
| Уся група | –2,21±0,36 | –2,48±0,41 | –1,52±0,60 | –1,93±0,44 |
У групі хворих із переломами ІМТ становив 17,15–33 ум. од. (в середньому — 24,91±4,36 ум. од.) і вірогідно не відрізнявся від ІМТ в основній групі в цілому (p>0,1). Припускаємо, що ізольовані загальнотрофічні порушення не є важливим прогностичним фактором патологічних переломів.
Хоча зниження МЩКТ є провідним чинником, що визначає ризик остеопоротичних переломів, за даними клінічних і епідеміологічних досліджень ризик переломів кісток скелета не завжди корелює зі зниженням МЩКТ за даними денситометрії, тобто важливі не «кількісні», а «якісні» зміни у кістковій тканині (Dempster D.W., 2000).
Це добре ілюструють наявні на сьогодні суперечливі дані, одержані різними дослідниками. Так, S. Вoonen та співавтори (1996) у популяційних дослідженнях встановили, що у хворих на ОА (і навіть у їх кровних родичів) спостерігається зниження ризику переломів кісток скелета (ОR=0,33–0,64), особливо шийки стегнової кістки. Водночас результати проспективних досліджень свідчать про те, що у хворих на ОА, незважаючи на підвищення МЩКТ, не спостерігається зниження ризику «нехребетних» переломів порівняно із пацієнтами без ОА (Arden N.K. et al., 1999). Більше того, у хворих на коксартроз спостерігається 2-разове підвищення ризику переломів стегнової кістки. Ці дані мають винятково важливе значення, тому що свідчать про необхідність проведення заходів щодо профілактики остеопоротичних переломів кісток скелета не лише у хворих на ОА зі зниженою, але й нормальною і навіть підвищеною МЩКТ. Слід також враховувати, що висока МЩКТ за даними денситометрії часто є артефактом, зумовленим дегенеративними змінами у осіб похилого віку (остеофіти, сколіоз та ін.) (Belmont-Serrano М.A. et al., 1993; Jones G. et al., 1995; Nevitt М.C. et al., 1995). Нарешті, у хворих на ОА, як і при РА, виявлено розвиток периартикулярного остеопорозу кісток, що прилягають до ураженого суглоба (Karvonen R.L. et al., 1998). Вважається, що схильність до остеопоротичних переломів при ОА, незважаючи на відсутність вираженого зниження МЩКТ, пов’язана з порушенням якості кісткової тканини (Stewart A., 1999) і порушенням м’язової маси, що створюють передумови для випадкових втрат рівноваги (Jones G. et al., 1995; Arden N.K. et al., 1999).
У ретроспективному (post-hoc) аналізі досліджень SOTI та TROPOS оцінено застосування стронція ранелату у хворих на остеопороз та супутній спінальний ОА (n=1105) (Bruyère O. et al., 2008). Обґрунтуванням такого дослідження стали дані P. Alexandersen та співавторів (2007) щодо зниження маркерів деградації не лише кісткової, а й хрящової тканини при застосуванні стронцію ранелату. За 3 роки терапії оцінено індекс рентгенологічного прогресування ОА (за сумарним балом шкали Лейна: звуження міжхребцевих просторів, передні та задні остеофіти, склероз). У групі лікування стронція ранелатом за 3 роки прогресування спінального ОА було на 42% менше пацієнтів із прогресуванням спінального ОА за сумарним балом, ніж у групі плацебо, на 33% менше пацієнтів зі звуженням міжхребцевих просторів та на 34% менше пацієнтів із наявністю вертебрального больового синдрому.
Окремо слід зазначити деструкцію кісткової тканини у відділах, що є мішенями для асептичних (безсудинних) некрозів — змертвіння ділянки кістки внаслідок недостатнього живлення чи повного його припинення при збереженій життєдіяльності суміжних зон кістки, перш за все голівок стегнових кісток. Це ускладнення спостерігалося нами у 7 (3,52%) хворих на РА і у 2 (1,34%) — на ОА. Загибель кісткових клітин при збереженні проміжної речовини — характерна риса цього процесу (мінеральний склад мертвої кістки не змінюється). Змертвіла ділянка кістки втрачає рідкі елементи крові, лімфи і тканинної рідини, внаслідок чого на одиницю маси змертвілої кістки доводиться більше неорганічних речовин, ніж на одиницю маси живої. У навколишній живій кістковій тканині посилюються васкуляризація та резорбція кістки, тому на рентгенограмі ділянка остеонекрозу виглядає більш інтенсивною, ніж навколишня кісткова тканина.
Можна припустити, що безсудинні некрози становлять крайній ступінь вираженості рарефікації кісткової тканини із втратою як мінерального, так і органічного її компонента.
Вплив тривалості захворювання ОА на МЩКТ
Залежність МЩКТ від тривалості захворювання — недостатньо вивчене питання. За нашими даними (рис. 10.2) найнижчі денситометричні показники реєстрували у тих, хто хворіє на ОА протягом 6–10 років.
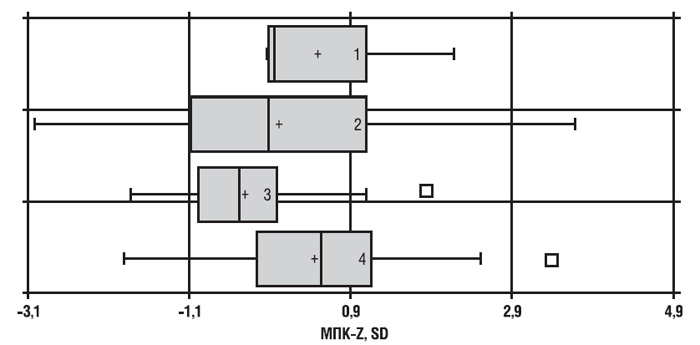
Рис. 10.2. Залежність показника МЩКТ від тривалості ОА (1 — тривалість захворювання <1 року, 2 — 1–5 років, 3 — 6–10 років, 4 — >10 років)
У групі хворих із тривалістю ОА 1–5 років і понад 10 років кісткова маса дещо більша, хоча загалом у групі не досягає показників осіб того ж віку без ураження опорно-рухового апарату, а також осіб, які хворіють менше 1 року. Виявлена також тенденція до підвищення МЩКТ у пацієнтів з ОА, які хворіють більше 10 років. На нашу думку, це пояснюється розвитком компенсаторних процесів у кістковій тканині, що знижують її метаболізм і сповільнюють темпи втрати скелетом мінерального компонента.
Особливості розвитку остеопорозу у хворих на ОА
За даними клінічних досліджень (Malavolta L. et al., 2000) встановлено, що МЩКТ хребта і шийки стегнової кістки, а також маса тіла більші у пацієнтів з ОА тазостегнового суглоба порівняно із хворими з переважним ураженням дрібних суглобів кистей і особами групи контролю (без патології опорно-рухового апарату). Дані аналізу МЩКТ в обстежених нами хворих залежно від кількості уражених суглобів наведені на рис. 10.3.
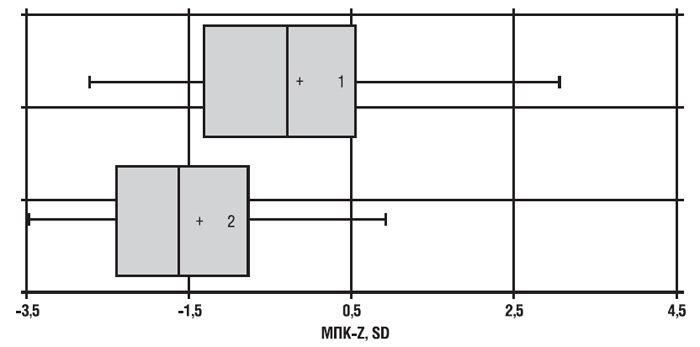
Рис. 10.3. Показники відхилення МЩКТ від середньовікових норм (МЩК-Z, SD) у хворих на ОА (1-ша група — моно-/олігоостеоартроз, 2-га група — поліостеоартроз)
За нашими даними, особи з ураженням багатьох суглобів (поліостеоартроз) мали вірогідно більш низьку МЩКТ. Показник МЩКТ-Z становив у хворих з полі-/оліго-/моноостеоартрозом у губчатій речовині кісткової тканини (–1,39±0,22) і (–0,15±0,29) (p<0,01), a у компактному (–1,13±0,47) і (+0,12±0,52) відповідно. Слід зазначити, що у 69 (76,7%) пацієнтів з моно-/олігоартрозом МЩКТ була значно вища вікової норми. Ймовірно, у цьому разі дегенеративно-дистрофічний процес, зумовлений ОА, виявляв протекторну дію щодо втрати кісткової маси.
Роль іммобілізації в розвитку остеопенічного синдрому
Гіпокінезія, або недостатність рухової активності, що зумовлюється ОА, супроводжується розвитком серцево-судинних захворювань, ожиріння, атрофії скелетних м’язів, остеопенії тощо. Практичним лікарям часто доводиться мати справу із крайнім проявом гіпокінетичного режиму — кліностатичною гіпокінезією (при тривалому перебуванні хворого у ліжку). Вплив постільного режиму на кісткову тканину було відзначено ще у 50-х роках XX ст. Зміна вектора земної сили тяжіння щодо вертикальної осі тіла веде до зменшення вагового навантаження на опорно-руховий апарат і внутрішні органи, зниження рухової активності, в основному у великих суглобах, і динамічного силового навантаження на скелет (локомоція, підтримка вертикальної пози і т.д.) (Оганов В.С., 1998).
Встановлено, що гіпокінезія супроводжується надлишковою екскрецією (негативним балансом) кальцію (Григорьева А.И. и соавт., 1994), причому величина кальцієвих втрат значно варіює у обстежених осіб залежно від рухового режиму і прийому антиостеопоротичних препаратів. Залишаються, однак, невирішеними питання, щодо топографії, ступеня вираженості й оборотності змін у КТ в умовах гіпокінезії.
В.С. Оганов, В.С. Шнайдер (1996), застосовуючи метод ОФА, вивчали зміни МПК діафізів великогомілкової і стегнової кісток у здорових осіб (25–44 роки) в умовах постільного режиму протягом 120 діб (МЩКТ сумарно великогомілкової та малогомілкової кісток визначали на межі середньої та дистальної третини гомілки), а також в умовах антиортостатичної гіпокінезії (АНОГ — 6°) протягом 370 діб (причому одна група випробуваних виконувала фізичні вправи і приймала кислоту етидронову протягом усього періоду постільного режиму, а інша — фізичні вправи, починаючи з 121-го дня і до періоду закінчення постільного режиму). В останньому експерименті, більш показовому, виявлено зниження МЩКТ в середньому на 10% у ¾ осіб, які тренувалися в постійному режимі, і на 5–12% — у всіх обстежених у групі «відстроченої» профілактики в різний термін експерименту. Автори зробили висновок, що частота випадків зміни МЩКТ зростає зі збільшенням тривалості експозиції (МЩКТ поперекових хребців знижується протягом 120 діб на 1,7% на місяць (кількісна комп’ютерна томографія) або на 0,91% на місяць (абсорбціометрія, DEXA).
Особливої уваги заслуговують дані про зниження вмісту мінералів у кістках таза у відновний період після гіпокінезії. Аналіз БМ (14-та і 30-та доба відновного періоду після 120 добової АНОГ (–5°), а також гістоморфометричних показників біопсії (30-та доба) гребеня клубової кістки (Оганов В.С. и соавт., 1997) дозволив авторам припустити, що в цей період відбувається паралельна активація процесів формування й резорбції кісткової тканини. Отже, цим можна пояснити і втрату кісткової маси через відносну ригідність процесів формування кісткової тканини.
Результати вищенаведених досліджень узгоджуються з існуючим на сьогодні поглядом на механізм адаптації кісткової тканини до зовнішнього механічного середовища. Встановлено, що адаптивні процеси у кістковій тканині запускаються перш за все внаслідок деформації кісткового матеріалу і лише потім механічним навантаженням або напруженням як такими. Більш значимим параметром є не пікові значення відносної деформації, а якась нижня границя фізіологічної деформації (тобто мінімально ефективна деформація, при перевищенні якої процеси формації кісткової тканини починають переважати над резорбцією кістки) (Burr D.B., Martin B., 1992; Оганов В.С., 1998).
Величина втрат кісткової маси в найбільш критичних із біомеханічної точки зору регіонах скелета (поперекові хребці, проксимальний епіфіз стегна) має виражений позитивний зв’язок із тривалістю гіпокінезії. Так, при гіпокінезії до 120 діб зниження МЩКТ у частини пацієнтів можна було розцінювати як норму або остеопенію за критеріями ВООЗ (1994), а при збільшенні тривалості гіпокінезії частина обстежуваних осіб переходила у групу з остеопорозом.
Виявлено також не менш значимий феномен вибіркового підвищення МЩКТ губчатої кістки (тіла поперекових хребців) в умовах клінортостатичної гіпокінезії в результаті постільного режиму внаслідок спинномозкової травми (Woodard D. et al., 1988), терапії сколіозу (Hansson T.H. et al., 1985) або в умовах космічного польоту (Оганов В.С., Шнайдер В.С., 1996). Однією з найбільш прийнятних версій для пояснення феномена вважається гіпотеза про сповільнення процесів ремоделювання кісткової тканини при дефіциті фізичного навантаження (Оганов В.С., Шнайдер В.С., 1996) і нагромадженні внаслідок цього високомінералізованої фракції мінерального компонента кісткової тканини (Burr D.B., Martin B., 1992).
Причини втрати кісткової маси при гіпокінезії залишаються предметом дискусій, але найбільш імовірне припущення про те, що зменшення механічної стимуляції знижує рівень ефективного «деформаційного потенціалу», що в результаті призводить до сповільнення адаптивного ремоделювання кісткової тканини як системи (Burr D.B., Martin B., 1992). Відзначимо також, що у хворих, які тривалий час перебували на постільному режимі при гемі- або квадриплегії (Woodard D. et al., 1988), спостерігали зменшення об’єму кістки в середньому на 33% і подальшу стабілізацію процесу демінералізації після 25 тиж, причому відзначено також загальне сповільнення процесів резорбції та формації кістки, що позначається в літературі як «ледача кістка» (Родіонова С.С., 1993).
Знання механізмів формування «ледачої кістки» необхідне для розуміння патогенезу остеопенічних станів при ОА, однак безперечно те, що остеопенія при дефіциті механічного навантаження (в неускладненому варіанті) зумовлена вихідним гальмуванням остеобластичного гістогенезу й, можливо, має характер тканинної адаптації чи адаптивного ремоделювання (Оганов В.С., 1998). Феномен «гіпермінералізації» губчатої кістки тіл поперекових хребців, який спостерігається при гіпокінезії як у здорових людей, так і у пацієнтів, які дотримуються тривалого постільного режиму, слід вважати прогностично несприятливим.
Наведені дані підтверджують важливу роль фактора іммобілізації в розвитку остеопенічних станів при ОА.
БМ кісткового метаболізму
Удосконалення за останні роки специфічних і чутливих БМ, що відображують загальну швидкість формування і резорбції кістки, значно поліпшило неінвазивну оцінку кісткового метаболізму при різних метаболічних захворюваннях кістки. Як відомо, БМ поділяються на маркери кісткоутворення і кісткової резорбції. Оскільки наявні на сьогодні маркери кісткового метаболізму детально описані в сучасній літературі в книгах «Ревматоидный артрит. Диагностика и лечение» (под ред. Коваленко В.Н., 2001), «Остеопороз: эпидемиология, клиника, диагностика, профилактика и лечение» (под ред. Коржа Н.А. и др., 2002), коротко зупинимося лише на деяких із них.
До найбільш перспективних маркерів кісткової резорбції відносяться піридинолін (Пір) і деоксипіридинолін (Д-Пір) — дві неподільні піридинові сполуки, що утворюються в результаті посттрансляційної модифікації молекул колагену, присутні в нативному колагені і не беруть участі у його ресинтезі (Fujimoto D. et al., 1978). При РЗС ці маркери розглядаються як чутливі й специфічні лабораторні індикатори не тільки кісткової резорбції, але й суглобової деструкції (Greenwald R., 1996). Так, за даними експериментальних досліджень, у щурів з ад’ювантним артритом вже протягом перших 2 тиж після індукування захворювання спостерігається підвищення екскреції Пір із сечею, що корелює з клінічними ознаками запалення (Tordjman С. et al., 1994). Рівень Д-Пір у сечі підвищується пізніше й більш тісно пов’язаний зі зниженням МЩКТ. Характерно, що введення інгібіторів колагеназ асоціюється зі зниженням екскреції Пір і Д-Пір (Ganu V. et al., 1994; Greenwald R., 1994).
Рівні Пір і Д-Пір у сечі значно вищі у дітей, ніж у дорослих; характерне їх підвищення на 50–100% під час менопаузи (Beardsworth L.J. et al., 1990). У хворих на остеопороз їх концентрації в сечі (особливо Д-Пір) корелюють зі швидкістю кісткового метаболізму, що вимірюється за кінетикою кальцію, і даними гістоморфометрії кісткової тканини (Delmas P.D. et al., 1991).
У хворих на ОА підвищення екскреції із сечею Пір і Д-Пір виражене менше, ніж при РА, і значно менше корелює з вираженістю клінічних проявів (Thompson P. et al., 1992; Astbury С. et al., 1994; MacDonald A. et al., 1994; Takahashi М. et al., 1995). He визначено зв’язку між тяжкістю рентгенологічних змін (за шкалою Kellgren — Lawrence) і рівнями цих маркерів (Thompson P. et al., 1992).
Із маркерів кісткоутворення слід зазначити остеокальцин. R. Еmkey та співавтори (1996) встановили, що внутрішньосуглобове введення ГК призводить до істотного зниження концентрації остеокальцину в крові наступного дня після ін’єкції з поступовою нормалізацією протягом 2 тиж (клінічний ефект зберігається протягом 4 тиж), причому істотних змін концентрації Пір у сечі не відзначено. Ці результати свідчать про те, що внутрішньосуглобове введення ГК викликає тільки транзиторну інгібіцію утворення кісткової тканини і не впливає на процес резорбції.
Визначення лабораторних маркерів кісткового метаболізму підвищує ефективність інструментальної оцінки ризику розвитку остеопорозу (перш за все денситометричних методів). Повторні визначення кісткових маркерів у період лікування можуть покращувати якість моніторингу хворих на остеопороз.
Практичні рекомендації з використання БМ кісткового метаболізму для діагностики остеопенічних станів:
- Сиворотковий остеокальцин і кістковий ізофермент лужної фосфатази на сьогодні — найбільш чутливі маркери кісткоутворення при остеопорозі.
- Найбільш чутливі маркери кісткової резорбції — екскреція із сечею піридинолінових з’єднань і термінальних фрагментів колагену I типу за допомогою імунологічного аналізу чи рідинної хроматографії під високим тиском.
- Для проведення висновку про клінічну значимість досліджуваних лабораторних маркерів кісткового метаболізму необхідна ретельна оцінка кожної клінічної ситуації та особливостей проведеної терапії.
- Підвищений рівень кісткового метаболізму асоційований із високою швидкістю втрати кісткової маси. Лабораторні маркери кісткоутворення і/або резорбції можуть допомогти виявити серед хворих на ОА осіб із вихідною нормальною кістковою масою, що мають підвищений ризик розвитку остеопенії (особливо на ранніх стадіях розвитку захворювання).
- Підвищені рівні маркерів кісткової резорбції асоційовані з підвищеним ризиком переломів хребта й стегнової кістки, незалежно від кісткової маси. Таким чином, комбінована оцінка кісткової маси і маркерів кісткового метаболізму корисна для вибору «мішеней» для лікування хворих на ОА з найвищим ризиком переломів (з урахуванням інших факторів ризику).
- Кісткові маркери зручні для оцінки ефективності антирезорбтивної терапії для швидкого (3–6 міс) скринінгу хворих, які не реагують на лікування, оскільки вплив терапії на кістковий метаболізм виявляється раніше, ніж зміни кісткової маси, що виявлені денситометрично.
Основним недоліком лабораторних методик, які використовують на сьогодні, є те, що вони відображають лише стан метаболізму кісткової тканини на момент дослідження, не даючи безпосередньої інформації про кількісні параметри стану кісткової тканини (тобто на підставі використання тільки показників лабораторних досліджень неможливо встановити діагноз остеопорозу або остеопенії). Слід також зазначити, що на відміну від деяких метаболічних захворювань кісток (хвороба Педжета, ниркова остеодистрофія), які характеризуються значною зміною кісткового метаболізму, при остеопорозі на фоні ОА часто незначні зміни швидкості ремоделювання кістки за тривалий період можуть призводити до істотної втрати кісткової маси. Це може пояснювати те, що дані, отримані за допомогою стандартних маркерів (активність загальної лужної фосфатази, рівень гідроксипроліну тощо), у хворих на остеопороз у більшості проміжків часу перебувають у межах норми. Отже, необхідна розробка більш специфічних і чутливих маркерів кісткового метаболізму. Так, вимоги до ідеального маркера кісткової резорбції такі: це повинен бути продукт деградації компонентів кісткового матриксу, який не виявляється в інших тканинах, не засвоюється організмом у процесі нового формування кістки, а також не підпадає під вплив ендокринних факторів при визначенні його рівня в крові.
Остеопороз: сучасні підходи до профілактики і лікування
У відомих на сьогодні даних про причини, закономірності й механізми формування остеопенічних станів закладений потужний потенціал, що дозволяє створювати методи й визначати тактику лікування на різних етапах розвитку остеопеній.
Стратегія профілактики й лікування остеопорозу ґрунтується на різних підходах і «мішенях». Загальна мета стратегії — зменшення кількості випадків переломів у популяції чи поліпшення прогнозу для осіб, які вже перенесли перелом (популяційний підхід до профілактики та лікування). Прикладом вдалого популяційного підходу до профілактики може слугувати вакцинація при ряді інфекційних захворювань (віспа, поліомієліт тощо). На жаль, ефективний популяційний підхід до антиостеопоротичних заходів на сьогодні не розроблений. Інший підхід — індивідуальний, спрямований на пацієнтів, які належать до будь-якої групи ризику (первинна профілактика), які мають низьку кісткову масу, але ще не перенесли перелом (вторинна профілактика) або вже перенесли його (третинна профілактика).
Первинна профілактика
Первинну профілактику можна застосовувати на всіх етапах життя. Вона має базуватися на виявленні груп ризику розвитку остеопорозу і переломів із використанням деяких методів скринінгу (визначення факторів ризику з подальшим проведенням денситометрії за допомогою наявних методик або БМ кісткоутворення і/або резорбції). Слід підкреслити, що рівень кісткового метаболізму може бути незалежним фактором ризику втрати кісткової маси.
Зважаючи на те що більшість переломів виникає в осіб старших вікових категорій, однією з методик зниження індивідуального ризику переломів протягом життя в популяції є перш за все підвищення кісткової маси у більш ранньому віці з метою впливу на довгостроковий прогноз. Для досягнення ефекту застосування подібних заходів має бути тривалим і задовольняти вимоги про співвідношення ризик/безпека на користь безпеки. На жаль, більшість досліджень ризику/безпеки антиостеопоротичних заходів, проведених і досі, є не проспективними рандомізованими контрольованими, а обсерваційними, що знижує їх цінність щодо довготривалого прогнозування. Практично відсутні роботи, у яких би оцінювалася роль комплексу факторів як позитивних, так і негативних, що впливають на кісткову систему індивідуума, а також висвітлювалися економічні аспекти питання, перш за все співвідношення реальної вартості програм первинної профілактики остеопорозу і потенційної користі від неї в майбутньому (зниження ризику розвитку переломів, непрацездатності та інвалідизації). Безсумнівно, що позитивно можуть впливати зміна стилю життя, зокрема відмова від тютюнопаління та зловживання алкоголем, регулярні заняття фізкультурою, включення в дієту продуктів, багатих на кальцій, вітаміни, корекція дисгормональних порушень.
Вторинна і третинна профілактика
Вторинна профілактика заснована на виявленні доклінічних випадків, тобто пацієнтів із низькою кістковою масою або незалежним ризиком переломів. Тактика визначення аналогічна до такої для первинної профілактики. Третинна профілактика включає перш за все уважність лікарів першої ланки, ревматологів, ортопедів-травматологів і суміжних фахівців щодо ризику повторних переломів у осіб із низькою кістковою масою.
Запобігання падінням — обов’язкова частина профілактичних заходів, оскільки при підвищеній ламкості скелета будь-яке падіння може ускладнитися переломом. Шляхи профілактики падінь активно розробляються: це фізичні вправи, тренування вестибулярного апарату, модуляція зовнішніх і внутрішніх факторів ризику, а в деяких випадках — застосування спеціальних протекторів для стегна, різних корсетів і т.д.
При лікуванні хворого на остеопороз слід насамперед знизити швидкість втрати скелетом мінерального компонента і стабілізувати кісткову масу. Антиостеопоротична терапія має бути ефективною протягом тривалого періоду, мати мінімум побічних ефектів. Залежно від характеру клінічної маніфестації та вираженості остеопорозу лікар може вибрати оптимальну тактику профілактики й лікування чи комбінацію того й іншого.
Велику увагу лікарям-ревматологам слід приділяти взаємодії антиостеопоротичних препаратів із засобами, що найчастіше застосовують у лікуванні ОА й остеопорозу — НПЗП і ГК.
Терапія остеопенії та остеопорозу має базуватися на таких принципах:
- Етіологічний (лікування основного захворювання, на фоні якого виникла остеопенія чи остеопороз);
- Патогенетичний (медикаментозна терапія остеопорозу);
- Симптоматичний (перш за все зменшення вираженості больового синдрому);
- Додаткові методи — дієта, фізіотерапевтичні процедури, лікувальна фізкультура, масаж, бальнеотерапія.
На сьогодні для патогенетично обґрунтованих профілактики і лікування остеопорозу використовують дві основні групи препаратів: які стимулюють кісткоутворення та інгібують резорбцію кістки (антирезорбенти).
Групи препаратів, що застосовуються у лікуванні ГК-індукованого остеопорозу:
1. Препарати, що стимулюють кісткоутворення
- Стронцію ранелат
- Фториди (натрію фторид, монофлуорофосфат)
- Анаболічні стероїди
- Осеїн-гідроксиапатитний комплекс (на сьогодні відносять до дієтичної підтримки)
- Пептид (1–34) ПТГ
- ПГЕ2
- Соматотропний гормон
2. Препарати, що інгібують резорбцію кістки (антирезорбенти):
- Кальцій + Вітамін D і його активні метаболіти (на сьогодні відносять до дієтичної підтримки)
- Тіазидні діуретики
- Осеїн-гідроксиапатитний комплекс (на сьогодні відносять до дієтичної підтримки)
- Кальцитонін
- Бісфосфонати (кислота етидронова, клодронова, памідронова, алендронова, тилудронова, золендронова тощо)
- Анаболічні стероїди (нандролон, станозолол, оксандролон та ін.)
- ЗГТ (естрогени, прогестагени, комбіновані препарати та ін.)
3. Комбінована терапія.
4. Експериментальні препарати (антагоністи інтегрину, інгібітори протонного насосу, амілін).
Оптимальним можна вважати препарат, що відповідає таким вимогам:
- Підвищує МЩКТ різних ділянок скелета незалежно від віку хворих (як чоловіків, так і жінок);
- Знижує ризик розвитку й частоту переломів кісток скелета (перш за все шийки стегнової кістки і компресійних переломів тіл хребців);
- Не порушує нормальної структури кісток;
- Не викликає серйозних побічних явищ;
- Добре переноситься хворими;
- Має зручний спосіб застосування й дозування;
- Економічно вигідний;
- Добре комбінується з іншими лікарськими препаратами;
- Позитивно впливає на супутню патологію (атеросклероз та ін.).
На наш погляд, стандартна оцінка ефективності кожного антиостеопоротичного препарату в хворого ревматологічного профілю (на фоні комплексної терапії НПЗП, базисних засобів, ГК та ін.) має включати
- Ефективність препарату в усуненні больового синдрому (характеризувалася динамікою больового синдрому, що виражається больовим індексом)
- Ефективність препарату у відновленні функціонального статусу хворих (динаміка показників суглобового індексу, Стенфордської анкети стану здоров’я, індексів сили кисті, швидкості проходження відстані 15 м)
- Вірогідність виникнення нових переломів (що виражається у %)
- Вірогідність виникнення побічних ефектів з аналізом їх впливу на органи і системи, показаннями для припинення лікування (%), а також негативним впливом на стандартні схеми терапії РЗС
Універсальним підходом до профілактики остеопорозу є відновлення порушеного кальцієвого балансу у бік підвищення всмоктування в кишечнику й зменшення виведення з організму. Дієта з підвищеним вмістом кальцію — необхідний компонент комплексного лікування. Джерелами кальцію є молочні продукти (особливо твердий сир, що містить від 600 до 1000 мг кальцію на 100 г продукту, а також плавлений сир, меншою мірою сир, молоко, сметана), мигдаль, лісові та волоські горіхи і т.д.
Найчастіше застосовують такі препарати кальцію (табл. 10.10).
Таблиця 10.10
Вміст елементарного кальцію у деяких солях кальцію
| Сіль кальцію | Вміст елементарного кальцію, мг/1000 мг солі |
| Гліцерофосфат | 191 |
| Глюконат | 90 |
| Карбонат | 400 |
| Лактат | 130 |
| Хлорид | 270 |
| Цитрат | 211 |
Одночасно з дієтою при наявності факторів ризику розвитку остеопорозу необхідний додатковий прийом препаратів кальцію, які зможуть компенсувати його дефіцит. У осіб із діагностованим остеопорозом добові дози кальцію, які приймають додатково до їжі, мають становити 1500–2000 мг; для профілактики остеопенії у хворих, які приймали ГК, — 1000–1500 мг, причому дози можуть варіювати залежно від ряду факторів (табл. 10.11).
Ефективність кальцієвих препаратів залежить від їх біологічного засвоєння (найнижча — у хлориду і глюконату кальцію, вища — у карбонату і фосфату, найвища — у лактату і цитрату кальцію).
Оскільки в нічний час втрата мінеральних компонентів кісткою прискорена (циркадне прискорення резорбтивних процесів у кістці — див. вище), доцільно приймати препарати кальцію ввечері, що буде запобігати цьому процесу в другій половині ночі.
Таблиця 10.11
Добові дози кальцію, рекомендовані хворим, які приймали ГК, при загрозі розвитку остеопенії
| Пацієнти | Доза, мг |
| Діти | |
| 1–10 років | 600–800 |
| 11–18 років | 1200–1500 |
| Дорослі | |
| чоловіки | 1000–1500 |
| жінки | 1500–2000 |
| ті, хто застосовують естрогени | 1000–1200 |
| ті, хто застосовують вітамін D | 800–1200 |
Необхідно пам’ятати, що при підвищеному споживанні кальцію існує певний ризик розвитку сечокам’яної хвороби, що корелює із підвищенням дози препарату (особливо при застосуванні доз вище 2000 мг/добу). Практичним лікарям слід рекомендувати цим пацієнтам збільшити прийом рідини (1,2–1,5 л/добу).
Засвоєнню кальцію сприяють лактоза, лимонна кислота, білковий раціон, фосфор, магній. Погіршують засвоєння кальцію надмірна кількість жирів, недостатня кількість білків, голодування, суворе вегетаріанство, недостатня кількість магнію, фосфору і вітаміну D, продукти з високим вмістом щавелевої кислоти (щавель, ревінь, шпинат, буряк, шоколад), захворювання органів травлення (гастрит, ентерит, коліт, пептична виразка), захворювання підшлункової залози (цукровий діабет, панкреатит), жовчного міхура й жовчних шляхів, щитовидної залози (зоб, тиреотоксикоз, тиреоїдит), гінекологічні захворювання, особливо пов’язані з ендокринною патологією, деякі препарати, особливо ГК (преднізолон, бетаметазон, дексаметазон), левотироксин та ін.
Важливу роль в оптимізації ведення хворих на ОА із загрозою розвитку або вже розвиненим остеопенічним синдромом відіграють вітаміни.
Роль вітамінів в оптимізації терапії пацієнтів із ОА та остеопенічним синдромом:
1. Кислота аскорбінова:
- посилює синтез ГК в організмі;
- зменшує проникність судин;
- бере участь в утворенні основної речовини сполучної тканини;
- підвищує антигіалуронідазну активність.
2. Біофлавоноїди:
- ущільнюють і зменшують проникність стінки судин, зокрема капілярів.
3. Вітамін В5:
- бере участь у клітинних окисно-відновних реакціях;
- покращує капілярний кровотік;
- нормалізує секреторну функцію шлунка.
4. Токоферол (вітамін Е):
- попереджує окиснення ненасичених жирних кислот у ліпідах;
- впливає на біосинтез ферментів;
- покращує функції судинної та нервової систем.
5. Вітамін D і його активні метаболіти.
Одним із напрямків медикаментозного лікування вторинного остеопорозу є застосування ЗГТ (естрогени, гестагени або комбіновані препарати, а також андрогени).
Серед естрогенів найчастіше використовують естрадіол або у вигляді етерифікованих форм (естрадіолу валерат 20 мг, естрадіолу сульфат), або кон’югованих форм, що містять естрон, який в організмі перетворюється в естрадіол і естріол (ефект зберігається ще протягом 1–2 міс). У монотерапії використовуються і трансдермальні форми, наприклад естрадіол у формі 0,1% гелю, разова доза якого становить 0,05 або 0,1, що відповідає 1 мг естрадіолу (добова доза). Як і інші трансдермальні естрогени, він виявляє позитивний ефект у жінок із гіперкоагуляційним синдромом, що часто виникає на фоні РА, системного червоного вовчака та інших ревматичних захворювань.
Крім того, ЗГТ естрогенами дозволяє знизити ризик виникнення ішемічної хвороби серця і рецидивів інфаркту міокарда (на 50–80%), клімактеричних порушень (у 90–95% жінок), поліпшити стан м’язового тонусу, шкіри, знизити ймовірність гіперпластичних процесів у матці й молочних залозах, урогенітальних порушень та ін.
При призначенні ЗГТ естрогенами необхідно пам’ятати про протипоказання: вказівки в анамнезі на рак молочної залози, рак ендометрія, гострі захворювання печінки, порфирії, естрогензалежні пухлини. Слід пам’ятати, що підвищення рівня тригліцеридів крові є протипоказанням до перорального застосування препаратів ЗГТ, навіть на фоні нормального рівня холестерину; тоді як для трансдермальної форми цього немає. До ЗГТ-нейтральних станів належать варикозне розширення вен, флебіти, епілепсія, бронхіальна астма, системні захворювання сполучної тканини, системний атеросклероз.
Фахівці вважають, що всі жінки, які в постменопаузальний період приймають ГК, повинні одержувати ЗГТ при відсутності протипоказань, причому курс (для профілактики і лікування остеопорозу) становить 5–7 років.
Чоловікам із недостатністю гонад (а в ряді випадків і жінкам) може бути рекомендована ЗГТ андрогенами — тестостерону пропіонат 100–200 мг внутрішньом’язово 1 раз на 2–4 тиж, тестостерону енантат та ін.
До препаратів гестагенів належать лікарські засоби, що містять різні комбінації естрадіолу валерату, норгестрелу, левоноргестрелу, похідні 17-OH-прогестерону (ципротерону ацетат, медроксипрогестерон), а також імплантаційні лікарські форми. Протипоказанням до призначення препаратів цієї групи є менінгіома.
Денситометричний контроль при проведенні ЗГТ необхідний кожні 3 міс.
Кальцитонін (ендогенний поліпептид, що містить 32 амінокислотні залишки) також має здатність запобігати втраті кісткової маси, а у високих дозах підвищує вміст мінеральних речовин у скелеті. Антирезорбтивний ефект препарату зумовлений специфічним зв’язуванням із рецепторами для кальцитоніну, що експресуються на остеокластах. Однак характер впливу кальцитоніну на трабекулярну і кортикальну кістку, а також його ефективність при остеопенічних станах у пацієнтів із РЗС (особливо на фоні прийому ГК) у вітчизняній та закордонній літературі до останнього часу були мало досліджені.
У клінічній практиці на сьогодні використовують чотири види кальцитоніну: природний свинячий кальцитонін, синтетичні кальцитоніни людини, вугра й лосося. Останній знайшов широке застосування в Україні у різних галузях медицини, в тому числі й у ревматології.
Досить висока ефективність кальцитоніну лосося у лікуванні остеопорозу в комбінації з препаратами кальцію, вітамінами групи D і дієтою у пацієнтів із РЗС і остеопорозом підтверджена результатами досліджень, проведених на базі Інституту кардіології ім. М.Д. Стражеска, УРЦ (Коваленко В.Н. и соавт., 1995–1999).
В останній час широко розповсюджена концепція про те, що в основі дії антиостеопоротичних препаратів лежить їх здатність позитивно впливати не лише на кількість, але й на якість кісткової тканини (Dempster D.W., 2000).
Поліпшенням якості кістки вважають покращання її мікроархітектури на кортикальному і трабекулярному рівнях. Для оцінки мікроархітектури кісткової тканини раніше використовували гістоморфометрію кісткового біоптата. В останній час науковці широко застосовують нові неінвазивні методики вимірювання мікроархітектури кісткової тканини. До них відносять кількісну комп’ютерну томографію та мікрокомп’ютерну томографію. Ці методики не є інвазивними та дозволяють оцінити тривимірну структуру трабекулярної та кортикальної кістки. При вивченні структури трабекулярної кістки оцінюють кількість і товщину трабекул, розділення трабекул, відношення об’єму кісткової тканини до загального об’єму кістки, що вивчається, а також тип структури кістки («plate-like» або «rod-like»). Параметрами кортикальної кістки, що вимірюються, є товщина кортикального шару та ступінь порозивності.
Ця концепція виявилася особливо важливою для пояснення механізмів дії та високої клінічної ефективності синтетичного кальцитоніну лосося, який належить до ефективних засобів другої лінії для лікування оостеопорозу, в тому числі гомонально зумовленого, антиостеопоретична активність якого пов’язана із пригніченням кісткової резорбції (Насонов Е.Л. и соавт., 1997; Беневоленская Л.И., 1999). Крім того, поряд із високою антиостеопоротичною активністю кальцитонін лосося має широкий спектр системних ефектів, що робить його застосування особливо доцільним при остеопорозі, який розвивається на фоні інших захворювань, зокрема ОА. У дослідженні H.E. Gruber (2000) виявлено позитивний вплив кальцитоніну на мікроархітектуру, але лише на трабекулярну кістку.
Згідно з новими Європейськими рекомендаціями (Kanis J., 2008), кальцитонін віднесено до другої лінії терапії внаслідок сумнівного впливу на ризик невертебральних переломів.
Особливий інтерес становить вивчення анальгезивних ефектів кальцитоніну. Імунореактивний кальцитонін був ідентифікований у головному мозку, спиномозковій рідини, гіпофізі та ін. Мічений 125I кальцитонін необоротно зв’язується зі специфічними рецепторами, що локалізуються у різних структурах мозку, особливо в тих зонах гіпоталамуса, які беруть участь у передачі й сприйнятті больових відчуттів. Слід зазначити, що центральні анальгезивні ефекти кальцитоніну нагадують такі опіоїдних анальгетиків. Анальгезивний потенціал кальцитоніну може бути пов’язаний зі стимуляцією вивільнення ендогенного агоніста опіоїдних рецепторів — β-ендорфіну. На фоні інтраназального введення кальцитоніну спостерігається підвищення рівня β-ендорфіну в плазмі крові. Анальгезивна дія кальцитоніну продемонстрована у клінічних дослідженнях при больовому синдромі різної етіології, зокрема ревматичної. Більше того, дані недавно проведених експериментальних досліджень свідчать про те, що при експериментальному ОА собак in vivo кальцитонін ефективно пригнічує продукцію Пір і Д-Пір, гальмує прогресування морфологічних змін у хрящі та стимулює синтез протеоглікану in vitro (Framington P. et al., 1989; Manicourt D.H. et al., 1999). Ці дані свідчать не лише про симптоматичний, але й, можливо, модифікуючий вплив міакальцику на прогресування ОА. Таким чином, кальцитонін — препарат вибору при остеопорозі, що супроводжується болем різного генезу, у тому числі остеоартритичним, а також при комбінації остеопорозу та ОА. Крім того, здатність кальцитоніну інгібувати шлункову секрецію, на наш погляд, важлива властивість препарату щодо запобігання та лікування «медикаментозних» виразок (НПЗП-гастропатія) у хворих на ОА, які тривалий час застосовують НПЗП.
До одного з перспективних класів антиостеопоротичних лікарських препаратів належать бісфосфонати — аналоги неорганічного пірофосфату, ендогенного регулятора кісткового метаболізму (Chesnut С.H., III, 1995; Fleish H., 1995). Препарати цієї групи стабільні, не метаболізуються, але мають високу афінність до фосфату кальцію й, отже, до кістки, що сприяє їх швидкому виведенню із крові й дає можливість включатися в кальцифіковані тканини (Lin J.H. et al., 1991). Розподіл їх у кістках негомогенний: вони відкладаються переважно в місцях формування нової кістки.
У фармакотерапії остеопорозу, пов’язаного із запаленням, бісфосфонатам приділяється значна роль як препаратам, що мають певні протизапальні властивості, пригнічують розвиток суглобового запалення і деструкцію суглобів у різних експериментальних моделях артритів (Barbier A. et al., 1986). Для деяких бісфосфонатів показано, що вони можуть знижувати синтез ФНП-α, ІЛ-1 та -6 (Matsuda Т. et al., 1991; Passeri G. et al., 1994; Richards P.J. et al., 1996).
Доведені ефективність і безпека цих препаратів у підтримці кісткової маси скелета і запобіганні переломів (Black D.M. et al., 1996). Проте різна структура препаратів цього класу зумовлює їх різні антирезорбтивні можливості та співвідношення ефективності й токсичності (Fleish H., 1995). Встановлено, що вони мають інгібуючі властивості щодо остеокластопосередкованої резорбції кістки. Однак значне й тривале інгібування резорбції, що досягається тривалим застосуванням бісфосфонатів, може викликати порушення формування кістки й, отже, підвищення її крихкості, підвищити ризик переломів (що доведено для етидронату та ін.). Останнім часом все більше досліджень свідчать про тривалу кумуляцію бісфосфонатів у кістковій тканині (десятки років) і тривале пригнічення маркерів формування кісткової тканини. Дослідження з біопсією кісткової тканини продемонстрували пригнічення кістковоутворюючих поверхонь на 40–80% при застосуванні бісфосфонатів у звичайних дозах. (Chavassieux P.M. et al., 1997).
До більш потужних бісфосфонатів із значним терапевтичним проміжком між дозами, інгібуючими резорбцію кістки, і дозами, потенційно здатними порушувати мінералізацію, належить кислота алендронова і тилудронова — бісфосфонати нової генерації, що виявляють значну інгібуючу активність на резорбцію кістки й позитивну дію на формування кістки (Chesnut C.H., III, 1995; Liberman U.A. et al., 1995).
Найпоширеніші побічні ефекти бісфосфонатів — незначні порушення функції травного тракту, які не потребують відміни препаратів. Крім того, при застосуванні бісфосфонатів першого покоління можуть відзначатися явища дефектів мінералізації та остеомаляція, тобто порушення якості кістки.
Новим сучасним підходом до лікування остеопорозу є застосування препаратів, здатних як пригнічувати резорбцію кістки, так і стимулювати її формування, що спрямовує метаболізм кісткової тканини у бік регенерації нової міцної кістки. На сьогодні таким препаратом є стронцію ранелат.
Стронцію ранелат стимулює кальцієчутливі рецептори пре-остеобластів та остеобластів, що призводить до збільшення кількості активних остеобластів і синтезу колагену (Canalis E. et al., 1996; Chattopadhyay N. et al., 2007) з одного боку, а з іншого підвищує синтез остеопротегерину, що призводить через RANK-RANKL-механізм до зменшення диференціювання остеокластів із клітин-попередників (Brennan T.C. et al., 2006). Крім того, через стимуляцію кальцієчутливих рецепторів остеобластів стронцію ранелат прискорює апоптоз зрілих остеокластів та сповільнює резорбцію кістки. (Buchler J. et al, 2001; Marie P.J. et al., 1993).
За даними мікрокомп’ютерної томографії кісткової тканини (MRpQT, Xtrem CT, Scanco Medical) вже за 1 рік лікування стронція ранелатом товщина кортикальної кістки збільшилася на 5,3% (p<0,05), що у 4 рази перевищувало цей показник у хворих, які лікувалися референтним бісфосфонатом алендронатом, а об’єм трабекулярної кістки — 2%(p<0,05), що у 3,4 раза перевищувало об’єм трабекулярної кістки у хворих, які застосовували алендронат. Слід відзначити, що вірогідних змін мікроархітектури кістки у групі бісфосфонату у цьому дослідженні не виявлено. (Rizzoli R., 2009).
Щодо взаємодії антиостеопоротичних препаратів із НПЗП, що найбільш часто застосовують у лікуванні, доведена відсутність взаємовпливу на фармакокінетику бісфосфонатів і НПЗП, за винятком індометацину. Дуже важливим є оптимальний вибір НПЗП. На базі УРЦ (Шуба Н.М. и соавт., 2000) проведене порівняльне дослідження ефективності й безпеки застосування в комплексній терапії пацієнтів із РЗС (ОА і РА) НПЗП — мелоксикаму, диклофенаку натрію та флурбіпрофену, яке включало обстеження хворих методом ОФА на початку лікування і через 12 міс.
З даних табл. 10.12 видно, що у пацієнтів, які одержували мелоксикам або диклофенак, швидкість втрати кісткової тканини мінерального компонента (як у губчатій, так і в компактній речовині) була меншою, ніж у тих, які одержували флурбіпрофен, що корелювало із більш вираженою позитивною динамікою лабораторних показників активності запального процесу.
Таблиця 10.12
Динаміка МЩКТ за даними ОФА (Δ%) у пацієнтів із РЗС
| НПЗП | Губчата кісткова тканина | Компактна кісткова тканина |
| Мелоксикам (15 мг/добу) | –6,2% | –2,5% |
| Диклофенак (150 мг/добу) | –4,7% | –2,7% |
| Флурбіпрофен (200 мг/добу) | –8,0% | –5,1% |
Таким чином, протекторну дію НПЗП на кісткову тканину при РЗС можна пояснити зниженням ними активності запального процесу, що супроводжується аутоімунним компонентом (Насонов Е.Л.и соавт., 1997; Шуба Н.М. та співавт., 2000), тобто їх протизапальні властивості можуть додатково забезпечувати протекторну дію щодо демінералізації кісткової тканини, особливо на фоні застосування ГК.
На закінчення сформулюємо деякі принципи профілактичних і лікувальних заходів при вторинному остеопорозі у хворих на ОА
1. Зниження негативного впливу таких факторів розвитку остеопорозу, як тютюнопаління, зловживання алкоголем, малорухливий спосіб життя, тривале голодування та ін.
2. Своєчасне лікування супутньої патології, що впливає на кістковий метаболізм, — гіпертиреоїдизму, гіперпаратиреоїдизму і т.д.
3. Збереження і підтримка позитивного кальцієвого балансу (дієта, додатковий прийом препаратів кальцію в комбінації з вітаміном D або його активними метаболітами).
4. При відсутності протипоказань призначення жінкам у постменопаузальний період препаратів ЗГТ; у пременопаузальний період при порушеннях оваріально-менструального циклу — контроль 17β-естрадіолу і при необхідності — ЗГТ (у тому числі андрогени з урахуванням гормонального профілю).
5. У чоловіків — контроль рівня тестостерону; при необхідності — ЗГТ андрогенами.
6. Проведення контрольного денситометричного обстеження хворих на ОА, які належать до групи ризику.
7. Щорічний денситометричний контроль показників МНКТ і МЩКТ у пацієнтів із ОА та виявленим остеопорозом.
Моніторинг антиостеопоротичної терапії остеопорозу: роль БМ кісткового метаболізму
R. Civitelly та співавтори (1988) відзначили суттєве підвищення МЩКТ хребта після терапії кальцитоніном протягом 1 року, в той час як у осіб із низьким кістковим метаболізмом аналогічна терапія не приводила до підвищення кісткової маси. Автори припустили, що хворі з підвищеним кістковим метаболізмом, який характеризується, підвищенням рівнів остеокальцину і гідроксипроліну, мають більш сприятливий прогноз щодо терапії кальцитоніном. Більша ефективність інших антирезорбтивних засобів (ЗГТ естрогенами, бісфосфонати) в терапії остеопорозу у пацієнтів із підвищеним метаболізмом кісткової тканини залишається не доведеною.
Антирезорбтивні агенти типу ЗГТ естрогенами та бісфосфонатів індукують значне, але оборотне зниження маркерів резорбції та формування кістки. Спираючись на точне вимірювання кісткової маси денситометричним методом і очікуваний рівень зміни кісткової маси, індукований антирезорбтивною терапією, лише через 2 роки можна визначити, чи ефективне лікування у конкретного хворого, тобто чи зростає вірогідно кісткова маса. У багатьох дослідженнях показана значна кореляція між ранніми змінами (після 3–6 міс) показників маркерів формування і/чи резорбції кістки й відстроченими (понад 1–2 років) змінами кісткової маси за даними денситометричних досліджень (у променевій кістці, хребті чи всьому скелеті) у хворих, які одержували лікування антирезорбтивними агентами типу естрогенів або бісфосфонатів (Delmas P.D. et al., 1985; 1991; Delmas P.D., Woolf A.D., 1997). Коефіцієнти кореляції у цих дослідженнях постійно становили близько 0,5. Це дозволило авторам припустити, що на індивідуальному рівні маркери кісткового метаболізму можуть бути не здатні точно прогнозувати відстрочені зміни кісткової маси. Проте шляхом введення лімітуючого порогу достовірного зниження кісткових маркерів після 6 міс (30–60% або більше залежно від точності виміру), можна ідентифікувати відразу після початку лікування більшість хворих, які будуть реагувати підвищенням кісткової маси через 2 роки з дуже низькою частотою псевдопозитивних і псевдонегативних результатів (Delmas P.D., Woolf A.D., 1997).
При застосуванні стронцію ранелату протягом перших 3 міс рівень маркерів формування кісткової тканини (кістковий ізофермент лужної фосфатази, N-термінальний пептид проколагену І типу) зростає, а рівень маркерів резорбції (С-телопептид колагену І типу) знижується, що в подальшому стабільно підтримується протягом 3 та більше років терапії. (Kanis J.A. et al., 2008).
Таким чином, повторні визначення чутливих і специфічних маркерів (формування чи резорбції) через 3–6 міс після початку антиостеопоротичної терапії, ймовірно, прийнятні для моніторингу хворих ревматологічного профілю на остеопороз, тим більше, що ефекти подібного лікування можуть бути виявлені ще до появи змін МЩКТ.
Наведені вище дані літератури, а також результати наших досліджень підтверджують актуальність проблеми остеопенічного синдрому при ОА. Поєднаний розвиток остеопорозу та ОА суттєво погіршує якість життя, і, ймовірно, тривалість життя хворих, особливо похилого і старечого віку.
Підкреслимо важливість проведення денситометричного і біохімічного моніторингу стану кісткової тканини для оцінки динаміки, а також ефективності застосовуваних препаратів, перш за все НПЗП.
Рекомендації з діагностики, профілактики та лікування системного остеопорозу у жінок в постменопаузальний період (затверджено президією Асоціації ревматологів України 10.06.2009 р.)
Установи-розробники:
- ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» АМН України
- ДУ «Інститут геронтології» АМН України
- Український науково-медичний центр проблем остеопорозу
- Національна медична академія післядипломної освіти ім. П.Л. Шупика
Підготовлено за пропозицією:
- Асоціації ревматологів України
- Української асоціації остеопорозу
- Української асоціації менопаузи, андропаузи та захворювань кістково-м’язової системи
Автори:
- Президент Асоціації ревматологів України, член-кореспондент АМН України, директор ННЦ «Інститут кардіології імені академіка М.Д. Стражеска», заслужений діяч науки та техніки України, головний ревматолог МЗ України, професор В.М. Коваленко (тел. (044) 275-66-22)
- Президент Української асоціації остеопорозу, Української асоціації менопаузи, андропаузи та захворювань кістково-м’язової системи, директор Українського науково-медичного центру проблем остеопорозу, заслужений діяч науки та техніки України, професор В.В. Поворознюк (тел. (044) 431-05-50)
- О.П. Борткевич, доктор медичних наук, професор
- Н.В. Григор’єва, доктор медичних наук
- Н.М. Шуба, доктор медичних наук, професор
- Т.В. Орлик, кандидат медичних наук
- Г.О. Проценко, кандидат медичних наук
- В.М. Вайда, кандидат медичних наук
- Н.І. Дзерович
Вступ
Остеопороз — найпоширеніше системне захворювання скелета, яке характеризується зниженням міцності кісткової тканини та подальшим зростанням ризику переломів. Проблема остеопорозу набула особливого значення в останні роки, що зумовлено суттєвим постарінням населення та збільшенням кількості жінок у постменопаузальний період. З 2000 по 2010 р. проводиться Міжнародна декада, присвячена патології кістково-м’язової системи (The Bone and Joint Decade). Проведення Декади — результат міжнародної ініціативи, спрямованої на покращання якості життя населення планети, що страждає на захворювання опорно-рухового апарату, та активізацію досліджень щодо розробки ефективних профілактичних, лікувальних та діагностичних заходів при цій патології.
У розвинених країнах остеопороз — одна з основних проблем охорони здоров’я. Зарубіжні фахівці вважають, що захворювання вже набуло характеру епідемії. Головне, що відрізняє його від інших захворювань опорно-рухового апарату, — це майже повна відсутність клінічних проявів аж до виникнення перелому. Остеопороз розвивається в будь-якому віці, як у чоловіків, так і в жінок. Захворювання уражає переважно жінок старшого віку, що значною мірою зумовлено втратою кісткової маси внаслідок дефіциту естрогенів у цей віковий період. Остеопороз уражає від третини до половини всіх жінок у постменопаузальний період. Втрата кісткової маси розпочинається у жінок приблизно із 35–40 років і становить 0,5–1% на рік; з настанням менопаузи, а також у перші 3–5 років постменопаузи цей показник зростає до 3–7% на рік. Отже, в перші роки постменопаузи жінка може втратити до 9–35% кісткової маси. У 4 із 10 жінок розвивається 1 або більше остеопоротичних переломів протягом життя. Летальність внаслідок ускладнень, зумовлених остеопоротичними переломами, в популяції жінок європеоїдної раси віком 50 років і старше становить 2,8%, що відповідає показнику летальності від злоякісних пухлин молочної залози. Разом з тим, ризик перелому стегнової кістки дорівнює об’єднаному ризику раку молочної залози, раку матки та раку яєчників. Тільки у США остеопороз призводить до 250 тис. переломів стегнової кістки, 250 тис. переломів передпліччя й 700 тис.–750 тис. вертебральних переломів щорічно. Остеопоротичні переломи істотно впливають на захворюваність та летальність. Сумарний ризик остеопоротичних переломів у жінок віком 50 років становить 39,7%, у чоловіків — 13,1%. Ця оцінка є не зовсім точною, оскільки включає лише переломи хребців, які діагностуються. Насправді ж істинний ризик переломів вищий. Для порівняння: ризик розвитку в жінок віком 50 років таких поширених захворювань, як рак молочної залози, становить 9%, серцево-судинна патологія — 40%. Внаслідок переломів стегнової кістки середня тривалість життя зменшується на 12–15%. За даними ВООЗ кількість ліжко-днів на рік для жінок у постменопаузальний період з остеопоротичними переломами проксимального відділу стегнової кістки перевищує цей показник для таких захворювань, як рак молочної залози, гострий інфаркт міокарда, хронічні захворювання легень, цукровий діабет тощо. Наведені дані свідчать про значну поширеність остеопорозу.
Характерною локалізацією остеопоротичних переломів є хребет, стегнова кістка, дистальний відділ кісток передпліччя та проксимальна ділянка плечової кістки. У жінок після настання менопаузи ризик виникнення переломів у характерних відділах скелета за період життя, що залишився, перевищує відповідний для раку молочної залози (12%) і становить у розвинених країнах 40% та більше, що наближається до ризику виникнення ішемічної хвороби серця. За оцінками у 2000 р. в Європі у чоловіків та жінок віком 50 років і старше очікувалося 620 тис. нових переломів стегнової кістки, 574 тис. — передпліччя, 250 тис. — проксимальної ділянки плечової кістки та 620 тис. — клінічно значущих переломів хребців, що становить 34,8% таких переломів у світі. Остеопоротичні переломи розвиваються й в інших ділянках скелета (кістки таза, ребра, дистальні ділянки стегнової та великогомілкової кісток).
Поширеність остеопорозу
Загальна кількість остеопоротичних переломів у Європі в чоловіків та жінок становить 2,7 млн, а прямі витрати на їх лікування — 36 млрд євро. Остеопороз виявляється приблизно у 6% чоловіків і 21% жінок віком 50–84 роки. Його поширеність у чоловіків віком 50 років у 3 рази нижча порівняно з відповідним показником у жінок, що зіставне з різницею ризику виникнення остеопоротичних переломів за період життя, що залишився.
Остеопоротичні переломи — основна причина захворюваності в популяції. Переломи стегнової кістки пов’язані із втратою функції кінцівки, вираженим больовим синдромом і майже завжди потребують госпіталізації. Видужання настає повільно, а реабілітація часто буває неповною, більшість хворих не можуть повністю обслуговувати себе й потребують перебування у спеціалізованих установах чи будинках-інтернатах. Після перелому стегнової кістки до 20% хворих помирають протягом перших 6 міс, близько 50% пацієнтів не можуть пересуватися без сторонньої допомоги, а ⅓ — втрачають здатність до самообслуговування. Проведені нами дослідження показали, що летальність серед пацієнтів з остеопоротичними переломами проксимального відділу стегнової кістки становила протягом 2 років — 18,6%; 47% хворих із зазначеної групи померли протягом перших 6 міс після виникнення перелому (Поворознюк В.В., Форосенко В.С., 2004).
Переломи тіл хребців можуть сприяти виникненню гострого болю в хребті та втраті функції, проте часто бувають і малосимптомними. Переломи хребців часто рецидивують, а ступінь подальшої інвалідизації підвищується зі збільшенням їх кількості. Переломи дистального відділу променевої кістки також викликають гострий біль і втрату функції, проте функціональне відновлення, як правило, хороше.
Широковідомо, що остеопороз та пов’язані з ним переломи є чинниками підвищення смертності (за винятком переломів кісток передпліччя). При переломах стегнової кістки більшість випадків смерті припадає на перші 3–6 міс після перелому, серед яких 20–30% виникають внаслідок перелому як такого. За даними аналізу причин смерті в європейських країнах понад 1% становить смертність внаслідок переломів стегнової кістки, що дещо вище за смертність від раку підшлункової залози й дещо нижче від раку молочної залози.
Загальним підходом до розрахунку тяжкості хвороби, рекомендованим ВООЗ та Всесвітнім банком, є оцінка спричиненої хворобою інвалідності, що включає смертні випадки внаслідок хвороби та кількість інвалідів, які вижили. Підхід, що базується на кількості інвалідів та кількості втрачених ними років здорового життя (DALYs — Disability And Life-Years lost), дає можливість порівняти наслідки остеопорозу з наслідками інших захворювань.
На рис. 10.4 наведено порівняння тяжкості остеопорозу з іншими хронічними хворобами в Європі. Остеопороз за цим показником перевищує РА, але нижчий за остеоартрит (остеоартроз (ОА) за прийнятою термінологією в Україні). При порівнянні онкологічної патології остеопороз перевищує рак всіх локалізацій, за винятком раку легені. Високі медико-соціальні та особисті витрати на лікування остепорозу стають проблемою для охорони здоров’я та лікарів, зокрема тому, що більшість хворих на остеопороз не отримують терапії.
Рис. 10.4. Тяжкість захворювань, розрахована за кількістю інвалідів та кількістю втрачених ними років здорового життя (DALYs — Disability And Life-Years lost). ІХС — ішемічна хвороба серця; ХОЗЛ — хронічне обструктивне захворювання легень; РА — ревматоїдний артрит
За даними DXA у 11% жінок української популяції виявляється остеопороз на рівні шийки стегнової кістки, у 20 та 24% відповідно — в ділянці хребта та передпліччя (табл. 10.13). При цьому МЩКТ на рівні хребта в жінок віком 50–59 років української популяції є нижчою порівняно з референтними вибірками жінок США, що можна пояснити недостатньою профілактикою втрати кісткової тканини в українських жінок в пре- та постменопаузальний період (Povoroznyuk V.V. et al., 2007).
Таблиця 10.13
Частка остеопорозу та остеопенії в жінок української популяції за даними двохенергетичної рентгенівської денситометрії (Поворознюк В.В. та співавт., 2008)
| Показник | Референтна вибірка США, % | Референтна вибірка (українська популяція), % |
| Поперековий відділ хребта (LІ–LІV) | ||
| Остеопороз
Остеопенія |
31
49 |
20
43,9 |
| Шийка стегнової кістки | ||
| Остеопороз
Остеопенія |
13
54 |
11
55 |
| Передпліччя | ||
| Остеопороз
Остеопенія |
22
46 |
24
42 |
За результатами досліджень в Україні структурно-функціонального стану кісткової тканини у жінок віком 20–89 років остеопороз виявлено: у 13% жінок — у віковій групі 50–59 років, у 25% — у групі 60–69 років, у 50% — у групі 70–79 років та у 53% — у групі 80–89 років (рис. 10.5) (Поворознюк В.В., 1998).
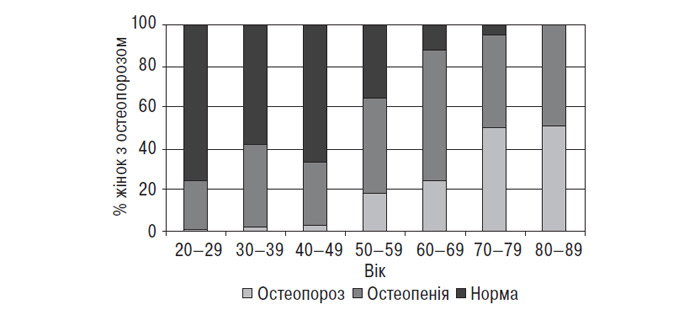
Рис. 10.5. Частка остеопорозу й остеопенії залежно від віку в жіночого населення України
Населення України старіє. Так, на 1 січня 2004 р. 15,6 млн (32,8%) становили люди віком 50 років і старше, 9,9 млн (21,0%) — 60 років і старше, з яких 6,4 млн (13,5%) — жінки. 70-річного віку досягли 4,7 млн (9,8%) жителів, з яких 3,2 млн — жінки, тобто 6,8% загальної кількості населення (Міністерство статистики України, 2004). Зважаючи на отримані дані щодо поширеності системного остеопорозу в населення України та демографічні показники, нами підраховано ймовірну кількість жіночого населення, в якого показники міцності кісткової тканини перебувають за межею переломів (Т-показник <–2,5 SD) (Поворознюк В.В., Григорьева Н.В., 2004).
Загальна передбачувана кількість жінок України, які страждають на остеопороз, становить 3005 тис., або 11,8% усього жіночого населення. Згідно з отриманими даними суттєве збільшення кількості жінок з остеопорозом спостерігається у віковій групі 50–59 років — 387,0 тис.; у старших вікових групах цей показник зростає (60–69 років — 754,2 тис.; 70–79 років — 1235,0 тис.) аж до вікової групи 80 років і старше (рис. 10.6). Зниження показника в останній групі зумовлене зменшенням її кількісного складу.
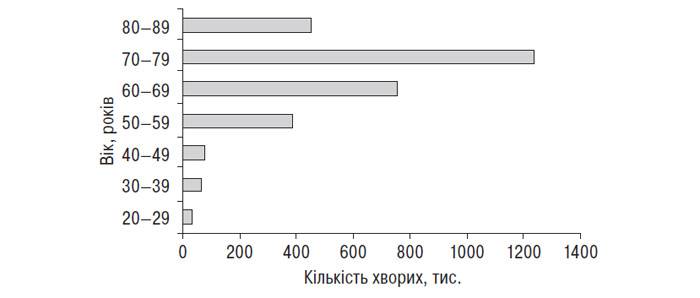
Рис. 10.6. Передбачувана кількість хворих на остеопороз за віковими групами серед жіночого населення України (Поворознюк В.В., Григорьева Н.В., 2004)
Отримані результати свідчать про те, що остеопороз у нашій державі набуває характеру непередбачуваної за своїми масштабами епідемії, запобігти якій можна за умови створення загальнодержавної програми діагностики, профілактики й лікування цього захворювання та його загрозливих ускладнень.
Наведені дані свідчать про значну поширеність остеопорозу в усьому світі. Проте постаріння населення, збільшення кількості людей літнього й старечого віку, зміна способу життя свідчать про те, що соціально-економічні наслідки остеопорозу будуть збільшуватися. Кількість остеопоротичних переломів практично подвоїлася за останнє десятиріччя; вже в 1990 р. число переломів шийки стегнової кістки серед жителів нашої планети, за оцінками спеціалістів у галузі математичного моделювання, становило 1,7 млн, у наш час — 2,5 млн, а до 2050 р. ця цифра може сягнути 6 млн.
Методи визначення МЩКТ та діагностики остеопорозу
Мета визначення МЩКТ — визначення діагностичних критеріїв, прогностичної інформації про ймовірність розвитку переломів у майбутньому, а також вихідних даних для подальшого моніторингу стану хворого, який отримував або не отримував лікування. МЩКТ — це значення маси кістки, що віднесена до одиниці об’єму (об’ємна щільність) або до одиниці площі (поверхнева щільність). Ці показники можна визначити in vivo за допомогою методу денситометрії. На сьогодні поряд із рентгенографією кісток скелета використовуються більш сучасні методи, що дозволяють оцінити МЩКТ. Ці методи відрізняються між собою за можливістю виміру МЩКТ, разом або окремо трабекулярних та кортикальних кісток, а також за точністю, дозою опромінення, часом, необхідним для проведення дослідження. Вибір методу дослідження й оцінка його результатів базується на знанні будови кісткової тканини, її фізіології, особливостей патогенезу конкретного варіанта остеопорозу й можливостей застосовуваних методів та методик. У діагностиці остеопорозу провідне місце займають інструментальні променеві дослідження. За останні три-чотири десятиріччя розроблено ряд нових технологій для кількісної оцінки зниження МЩКТ, що поєднуються під загальною назвою «кісткова денситометрія». Для кількісної оцінки МЩКТ використовують рентгенівську абсорбціометрію, одно- та двофотонну рентгенівську денситометрію, кількісну комп’ютерну томографію, ультразвукову денситометрію. Зусиллями дослідників з різних країн світу під егідою ВООЗ затверджені денситометричні критерії щодо МЩКТ (WHO, 1994). В Україні розроблені норми для жінок у постменопаузальний період (Поворознюк В.В., 1998 — при використанні ультразвукової денситометрії; Поворознюк В.В., Дзерович Н.І., Карасевська Т.А., 2007 — при використанні рентгенівської денситометрії).
Радіограмометрія — метод виміру розмірів кісток із використанням скелетних радіографів. Вимірюючи ширину кортикального шару метакарпальної ділянки визначають загальну ширину та ширину серединного шару п’ястка з вичисленням метакарпального індексу, ширину кортикального шару, відсоток кортикальної площі, кортикальну площу й відношення кортикальної площі до площі поверхні. В Україні розроблені та запропоновані нормативні дані щодо зазначеного методу для жителів нашої країни (Поворознюк В.В., Дмитренко О.П., 2004).
Однофотонна абсорбціометрія (ОФА). Cameron і Sorenson у 1963 р. описали новий метод визначення МЩКТ, що полягає в реєстрації проходження монохроматичного потоку фотонів однієї енергії через кістку й м’які тканини. Проте запропонований авторами алгоритм для визначення МЩКТ за допомогою ОФА, справедливий тільки тоді, коли в зоні сканування товщина кісткової та м’якої тканин постійні, що обмежує сферу застосування ОФА виміром дистальних відділів скелета, таких як променева й п’яткова кістки. Погрішність виміру щільності п’яткової кістки за цією методикою становить <3%. ОФА променевої кістки вірогідно відображає ризик переломів периферичних кісток скелета. Виміряна зазначеним методом щільність променевої кістки є також хорошим критерієм для визначення ризику переломів хребта й загального ризику переломів.
При проведенні двофотонної абсорбціометрії (ДФА) використовуються радіонукліди, що випромінюють фотони двох різних енергій. Перевагою цього методу є можливість кількісної оцінки МЩКТ у тих ділянках скелета, що оточені великими й нерівномірними масами м’яких тканин. Найкращим об’єктом для проведення дослідження є поперековий відділ хребта та проксимальні ділянки стегнових кісток. Похибка вимірювання методом ДФА щодо поперекового відділу хребта й проксимальних ділянок стегнових кісток, яка становить 2–4%, дещо обмежує його застосування для оцінки динаміки МЩКТ.
Рентгенівська абсорбціометрія використовується переважно для виміру щільності дистальних відділів променевої, плечової та п’яткової кісток, хребта. Двохенергетична (ДРА) та одноенергетична (ОРА) рентгенівська абсорбціометрія не пов’язані з використанням радіоактивних ізотопів.
ДРА — найсучасніший метод оцінки МЩКТ. Для методу ДРА доступна більшість відділів скелета. Дослідження хребта можуть виконуватися як у передньозадній, так і в латеральній проекціях, що дає можливість виявити деформації й компресійні переломи тіл хребців. За допомогою ДРА оцінюють МЩКТ проксимальних відділів стегнових кісток, кісток передпліччя й всього скелета. Результати дослідження хребта за допомогою ДРА мають хорошу кореляцію з даними ДФА. Найбільш важливою перевагою методу ДРА є висока точність. Коефіцієнт варіації при дослідженні проксимальних ділянок стегнових кісток становить 0,9%, тому на основі отриманих даних можна виконати максимально точну оцінку ризику переломів.
Кількісна комп’ютерна томографія (ККТ) є фотонною абсорбціометричною методикою, подібною до ОФА, ДФА і ДРА. Її унікальність полягає в можливості отримання тривимірного зображення, завдяки чому можна здійснити пряме визначення МЩКТ і виконувати просторовий поділ сигналів від трабекулярної та кортикальної кістки. У 1976 р. Ruegsegger та співавтори розробили спеціальний периферичний КТ-сканер для виміру променевої кістки. Genant та співавтори використовували наявні КТ-сканери для кількісної оцінки щільності хребців. Цей метод отримав широке клінічне застосування в США та Європі.
Таким чином, денситометрія кісткової тканини на сьогодні широко використовується для оцінки ризику переломів, підтвердження або спростування діагнозу остеопорозу й моніторингу лікування, але залежно від вибраної методики необхідно враховувати специфіку пріоритетності дослідження периферичного чи аксіального скелета. Денситометричні методи визначають лише проекційну мінеральну щільність і, таким чином, точність істотно залежить від товщини кістки. Крім того, кісткова тканина неоднорідна, збільшення з віком вмісту жирової тканини в кістковому мозку знижує коефіцієнт поглинання в ділянці виміру, що, у свою чергу, веде до погіршення точності показника МЩКТ. Досі немає універсального апаратного методу, який задовольняв би всі потреби наукової та клінічної медицини.
Визначені точні характеристики різних методів вимірювання (WHO, 1994; Marshall D., Johnell O., Wedel H., 1996; Gluer C.C., 1997). Для оцінки ступеня ризику й діагностики велике значення має характеристика спроможності методу передбачати ймовірність виникнення остеопоротичних переломів. Вона традиційно визначається як підвищення відносного ризику перелому при зменшенні МЩКТ на кожне одне стандартне відхилення (1 SD) від середнього значення для цього віку й має назву коефіцієнт ризику виникнення переломів (табл. 10.14).
Таблиця 10.14
Підвищення ризику переломів (95% ДІ) з віком у жінок при зменшенні МЩКТ на кожне 1 SD (МЩКТ; абсорбціометрія) нижче середнього значення для цього віку
| Місце вимірювання | Перелом передпліччя | Перелом стегнової кістки | Перелом хребця | Усі переломи |
| Дистальна ділянка променевої кістки | 1,7 (1,4–2,0) | 1,8 (1,4–2,2) | 1,7 (1,4–2,1) | 1,4 (1,3–1,6) |
| Шийка стегнової кістки | 1,4 (1,4–1,6) | 2,6 (2,0–3,5) | 1,8 (1,1–2,7) | 1,6 (1,4–1,8) |
| Поперековий хребець | 1,5 (1,3–1,8) | 1,6 (1,2–2,2) | 2,3 (1,9–2,8) | 1,5 (1,4–1,7) |
Точність вимірювання різними методами різних ділянок скелета істотно відрізняється. Крім того, точність залежить ще й від типу та локалізації перелому, ймовірність якого має бути визначена. Наприклад, для передбачення ймовірності перелому стегнової кістки більш інформативне визначення МЩКТ методом DXA, виконане на рівні стегнової кістки, а не в ділянці передпліччя чи поперекового відділу хребта. Для прогнозу ймовірності перелому стегнової кістки коефіцієнт ризику, виходячи зі значень МЩКТ цієї ділянки скелета, становить 2,6. Інакше кажучи, ризик перелому підвищується в 2,6 раза при зниженні МЩКТ на кожне SD. Отже, у хворого, в якого значення Z-показника* стегнової кістки становить — 3 SD, рівень ризику буде 2,63, тобто у 15 разів вищий, ніж у особи того ж віку, в якої значення Z-показника дорівнює 0. Для прогнозу остеопоротичних переломів будь-якої локалізації зазвичай користуються таким методом: ризик перелому підвищується в 1,5 раза при зниженні значень МЩКТ на 1 SD. Так, у хворого, в якого значення МЩКТ на 3 SD менше за середні значення для його віку, ризик перелому становитиме 1,53, тобто у 3 рази вищий, ніж у хворого, в якого значення МЩКТ відповідають середнім цифрам норми. Слід відзначити, що ризик переломів у осіб, у яких значення МЩКТ співпадають із середніми для їх віку, менший за середній рівень ризику в популяції, тому що значення МЩКТ у популяції мають нормальний розподіл, тоді як ризик виникнення переломів зі зниженням МЩКТ підвищується експоненціально.
*Z-показник (Z-score) — число стандартних відхилень (SD), на яке встановлене значення вище чи нижче середнього для осіб даного віку, статі, маси тіла, етнічної або расової групи.
Серед денситометричних методів найпоширенішим є двохенергетична рентгенівська абсорбціометрія — DXA (dual-energy X-ray absorptiometry). Зручність цього методу полягає в можливості визначення МЩКТ як усього скелета, так і окремих його відділів, зокрема тих, що найбільш вразливі до переломів. Під поняттям МЩКТ розуміють МЩКТ у тому відділі, що сканується. Цей показник використовують для розрахунку МЩКТ — ділять мінеральний вміст на площу сканування. Оскільки сканування є двомірним, то цей показник вірогідно характеризує поверхневу щільність (г/см2), а не об’ємну щільність (г/см3). Поверхнева щільність становить ⅔ дисперсії значень міцності кістки, яку визначали in vitro на ізольованих кістках (тіла хребців, проксимальна ділянка стегнової кістки). DXA також використовують для отримання бічних (латеральних) зображень хребта від ТIV до LIV з метою діагностики деформацій тіл хребців. Визначення наявності переломів тіл хребців покращує оцінку ризику переломів хребців, що має безсумнівну користь у хворих із переломами тіл хребців, значення Т-показника в яких може ще не відповідати остеопорозу. Ця процедура потребує меншого опромінення, ніж звичайне рентгенологічне обстеження. Метод чутливий і специфічний, за його допомогою визначають до 90% переломів ІІ та ІІІ ступеня (за даними напівкількісного методу Genant). Методом DXA визначають також жирову й нежирову масу, що більшою мірою має значення для наукових досліджень.
Використання методу DXA знайшло значне поширення в усьому світі в клінічній практиці, зокрема дослідження стегнової кістки й поперекового відділу хребта (аксіальна DXA) після багатьох проспективних досліджень, в яких було показане велике значення коефіцієнта ризику для прогнозування виникнення переломів. Наприклад, у метааналізі було відзначено збільшення в 2,6 раза ризику переломів стегнової кістки при зменшенні МЩКТ шийки стегнової кістки на кожне значення 1 SD. Коефіцієнт ризику вищий у жінок при або одразу ж після настання менопаузи.
Ці коефіцієнти ризику вищі за ті, що розраховують при використанні інших методів діагностики остеопорозу. При застосуванні аксіальної DXA можна прогнозувати інші типи переломів із такими ж високими значеннями коефіцієнтів ризику, як і отримані іншими методами. Великий обсяг інформації щодо аксіальної DXA став підставою розглядати цей метод як референтний стандарт. Визнання DXA стандартним референтним методом створює основу для можливості порівняння експлуатаційних характеристик інших менш визнаних методів.
Діагностичні критерії
Наведені нижче чотири категорії стану кісткової тканини у дорослих осіб жіночої статі отримані на підставі визначення МЩКТ шийки стегнової кістки.
1. Нормальний: значення МЩКТ відрізняється від стандартних (референтних) середніх значень цього показника в молодих жінок на одне (або більше) стандартне відхилення (Т-показник* ≥–1 SD).
2. Знижена кісткова маса (остеопенія): значення МЩКТ нижче стандартних (референтних) середніх значень цього показника в молодих жінок більше ніж на 1 SD, але менше –2,5 SD (Т-показник <–1 SD, але >–2,5 SD).
3. Остеопороз: значення МЩКТ нижче стандартних (референтних) середніх значень цього показника в молодих жінок на –2,5 SD (або більше) (Т-показник ≤–2,5 SD).
4. Тяжка форма остеопорозу: значення МЩКТ нижче стандартних (референтних) середніх значень цього показника в молодих дорослих жінок на –2,5 SD (або більше) при наявності одного чи більше переломів.
*Т-показник (Т-score) — число стандартних відхилень (SD), на яке встановлене значення вище чи нижче середнього для осіб молодого віку.
Наведені категорії базуються на даних показників МЩКТ шийки стегнової кістки у жінок віком 20–29 років, отриманих у дослідженні NHANES III і рекомендованих Міжнародним фондом остеопорозу.
Ці діагностичні критерії остеопорозу подібні до запропонованих ВООЗ у 1994 р. і відрізняються специфікацією місця визначення (шийка стегнової кістки), нормальними референтними значеннями для осіб молодого віку, крім того, вони адаптовані для чоловіків.
Визначення МЩКТ у різних відділах скелета
Критерії ВООЗ 1994 р. були розроблені для діагностики остеопорозу стегнової кістки, поперекової ділянки хребта та передпліччя. Дані, отримані завдяки впровадженню нових технологій, свідчать, що одні й ті ж самі значення Т-показника, визначені різними методами в різних відділах скелета, мають різну інформаційну цінність для прогнозу ризику переломів. Кореляційний аналіз показників МЩКТ, отриманих у різних відділах скелета, також малопридатний для прогнозування ризику переломів. Саме тому впроваджено вимірювання в референтній зоні. Це не забороняє використання інших технологій та зон вимірювання, проте слід враховувати, що отримані значення Т-показника будуть відрізнятися від МЩКТ шийки стегнової кістки.
Значення поширеності остеопорозу в жінок за показниками МЩКТ всієї стегнової кістки або шийки стегнової кістки майже однакові, це є підставою вважати, що із часом, коли результатами метааналізу буде доведена інформативність значень МЩКТ всієї стегнової кістки для оцінки ризику переломів, цей показник може замінити визначення МЩКТ шийки стегнової кістки.
У ряді методичних рекомендацій для оцінки стану кісткової тканини у хворих з остеопорозом віддається перевага визначенню МЩКТ проксимальної ділянки стегнової кістки та поперекової ділянки хребта. За умови використання такого способу діагностики, підставою для встановлення у хворого діагнозу остеопорозу є низькі значення двох Т-показників. Наприклад, Міжнародне товариство з клінічної денситометрії рекомендує визначення МЩКТ поперекового відділу хребта й стегнової кістки. Хворому діагностують остеопороз, коли значення Т-показника хребта, шийки стегнової кістки або усього стегна становить ≤–2,5 SD. Але при використанні декількох зон діагностики прогнозування ризику виникнення переломів істотно не покращується. Визначення остеопорозу на підставі мінімальних значень 2 показників або більше збільшує кількість виявлення хворих. Аналогічний результат можна отримати при застосуванні менш жорсткого критерію, наприклад змінити значення Т-показника з ≤–2,5 SD на ≤–2,0 SD. Однак це знижує інформативність окремого діагностичного критерію.
Діагностичні критерії відрізняються від критеріїв щодо надання медичної допомоги. Так, ризик виникнення переломів істотно відрізняється в різних популяціях. Наприклад, при Т-показнику ≤–2,5 SD ймовірність виникнення переломів у жінки віком 80 років буде у 5 разів вища, ніж у жінки віком 50 років. Інші чинники, що визначають обсяг медичної допомоги, включають наявність клінічних факторів ризику, високі значення маркерів метаболізму кісткової тканини, а також витрати й користь від лікування.
Ультразвукова денситометрія
Ультразвукова денситометрія вперше розроблена C.M. Langton та співавторами у 1984 р. Висловлена гіпотеза, що широкосмугове ослаблення ультразвукової хвилі (broadband ultrasound attenuation, BUA) п’яткової кістки є потенційним індикатором переломів стегнової кістки. Концепція базувалася на тому, що швидкість ультразвуку та ослаблення звукової хвилі залежать від щільності, еластичності й структури тканини, через яку проходить ультразвукова хвиля. BUA залежить від макроскопічної структури кістки — числа й товщини кісткових трабекул.
Метод ультразвукової денситометрії дозволяє отримати дані щодо швидкості ультразвукових коливань, що є основою для висновку про щільність кісткової тканини. Перевагами методу ультразвукової денситометрії є неінвазивність, висока точність, швидкість сканування, легкість в обслуговуванні, неіонізуюче випромінювання, компактність і портативність апаратури. Сучасні апарати дозволяють вимірювати швидкість ультразвукової хвилі у кістковій тканині дистальної ділянки променевої кістки, п’яткової кістки, фаланги пальців та великогомілкової кістки.
Робочі характеристики ультразвукового методу дослідження подібні до методу DXA. У більшості досліджень показано, що широкосмугове ослаблення ультразвуку або швидкість поширення ультразвуку в п’ятковій кістці пов’язані з підвищенням у 1,5–2 рази ризику переломів зі зменшенням МЩКТ на 1 SD. Результати порівняльних досліджень свідчать, що значення цих коефіцієнтів ризику для прогнозу остеопоротичних переломів близькі до отриманих при визначенні МЩКТ на периферичних ділянках абсорбціометричними методами. Дані світових досліджень, а також досліджень, проведених в Україні (Поворознюк В.В. и соавт., 2004), свідчать, що метод ультразвукової денситометрії може бути використаний для скринінгу стану кісткової тканини, особливо при проведенні епідеміологічних досліджень.
Стандартна рентгенографія
Це низьковартісний і доступний метод дослідження стану кісткової тканини.
Рентгенологічні ознаки остеопорозу:
- Атрофія кісткового малюнка:
- стоншення кортикального шару;
- редукування трабекулярних структур (витончення поперечних трабекул до їх повного зникнення та потовщення поздовжніх трабекул, що орієнтовані за лініями навантаження: «смугаста кістка»);
- підкресленість контурів кортикального шару всієї кістки («рамкова» структура хребця).
- Великопетлиста кісткова структура.
- Розширення кістковомозкового каналу.
- Спонгіозування кортикального шару довгих і коротких трубчастих кісток.
Проте при використанні рентгенологічного методу для оцінки стану кісткової тканини слід брати до уваги, що до 30–50% втрати губчатої кістки можуть не визначатися на стандартній рентгенографії.
Оцінка стану тіл хребців за бічними рентгенограмами. Внаслідок втрати кісткової тканини тіла хребців втрачають свою міцність, що призводить до типових остеопоротичних деформацій:
- Двояковвігнутої, що характеризується зменшенням середньої висоти тіла хребця.
- Клиноподібної, що характеризується зменшенням передньої висоти тіла хребця.
- Компресійного перелому, що характеризується зниженням усіх трьох висот тіла хребця: передньої, середньої та задньої.
Розрізняють такі ступені зниження висоти тіл хребців (за H.K. Genant):
0 — немає зниження висоти тіла хребця
1 — зниження висоти тіла хребця на 20–25%
2 — зниження висоти тіла хребця на 25–40%
3 — зниження висоти тіла хребця на >40%
Найчастіше остеопоротичні деформації локалізуються в «перехідних зонах», тобто в місцях переходу більш рухливого відділу хребта в менш рухливий, та навпаки. Двояковвігнуті деформації частіше виявляють у сегментах ThIV–ThVIII та LIII–LIV, клиноподібні — у сегментах ThV–ThVII, ThXI–LI; компресійні переломи — у сегментах ThXII–LI.
Остеопенія
На сьогодні у деяких рекомендаціях пропонується застосовувати вищенаведені критерії лише для діагностики остеопорозу, а остеопенію не відносити до критеріїв хвороби. Тим часом, важливим є виділення терміну «остеопенія», хоча він більшою мірою використовується при епідеміологічній оцінці остеопорозу, ніж як його діагностичний критерій. Проте за даними проведених досліджень у більшості осіб, у яких визначено остеопенію, протягом наступних 10 років розвивається остеопороз.
Оцінка ризику виникнення переломів
Збільшення поширення остеопорозу, поглиблення знань механізмів його розвитку та перебігу, а також розробка ефективних методів лікування зумовили необхідність підвищення вимог до моніторингу хворих із цією патологією. Це, у свою чергу, потребує широкого використання устаткування для оцінки ступеня тяжкості остеопорозу. Визначення МЩКТ є основним компонентом діагностики остеопорозу, тому що ступінь вираженості цієї патології встановлюється за показниками МЩКТ та порушенням мікроархітектоніки кісткової тканини. Досі ще відсутні клінічні прилади визначення якості кістки за допомогою показників, які не залежать від щільності кістки, тому на практиці оцінка ступеня тяжкості остеопорозу базується на визначенні маси скелета, яку вимірюють за даними МЩКТ.
Клінічне значення остеопорозу полягає у збільшенні кількості переломів та підвищенні показників захворюваності та смертності, пов’язаних із ним. Саме тому основну увагу зосереджують на виявленні хворих із високим ризиком виникнення переломів, а не чоловіків та жінок з остеопорозом. Хоч маса кістки є важливою складовою ризику переломів, інші порушення скелета також мають певний вплив на ламкість кістки. Крім того, схильність до падінь, сила удару також впливають на величину ризику переломів. Оскільки МЩКТ є лише однією зі складових ризику переломів, при оцінці ризику слід враховувати також значення інших показників ризику переломів, які є додатковою інформацією до МЩКТ.
МЩКТ
Використання значень маси кістки для прогнозу ризику переломів залежить від точності її визначення. На сьогодні усі абсорбційні методики мають високу специфічність, проте низьку чутливість, яка залежить від вибору величини значення МЩКТ, що приймається за показник високого ризику. За даними багатьох перехресних проспективних популяційних досліджень ризик виникнення переломів зростає від 1,5 до 3,0 разів при зниженні значення МЩКТ на кожне стандартне відхилення. Ступінь інформативності показника МЩКТ у прогнозуванні переломів приблизно такий самий, як і інформативності рівня артеріального тиску для прогнозування ризику виникнення інсульту, й значно вищий за відповідний щодо концентрації холестерину в сироватці крові у прогнозуванні інфаркту міокарда.
Незважаючи на технічні характеристики, слід визнати, що нормальні значення МЩКТ зовсім не гарантують того, що не станеться перелому, вони лише інформують про знижений ризик можливості його виникнення. Навпаки, характерні для остеопорозу значення МЩКТ свідчать лише про високий ризик переломів, а не про неминучість їх виникнення. У віці 50 років частка жінок з остеопорозом, у яких в наступні 10 років виникнуть переломи стегнової кістки, хребта, передпліччя або проксимальної ділянки плечової кістки, становить приблизно 45% (тобто позитивні прогнозовані значення). Ступінь точності (чутливість) прогнозу дуже низький — 96% переломів стегнової кістки, хребта, передпліччя або проксимальної ділянки плечової кістки виникнуть у жінок, в яких немає остеопорозу. Низька чутливість є однією із причин, чому при проведенні популяційного скринінгу показники МЩКТ у жінок у постменопаузальний період широко не використовують.
Вік
Інформативність прогнозу остеопорозу може бути підвищена одночасним урахуванням інших, незалежних від МЩКТ, факторів ризику. Можливо, найкращим прикладом є вік. Однакові значення Т-критерію, які визначені одним і тим самим методом на одній і тій самій ділянці, мають різне інформативне значення у хворих різного віку, а при будь-якому показнику МЩКТ ризик виникнення переломів у людей літнього віку набагато вищий, ніж у молодих. Це є наслідком того, що важливий внесок віку в розвиток переломів не залежить від показників МЩКТ. При значенні Т-показника –2,5 SD ймовірність виникнення переломів у європейській популяції населення залежно від віку коливається від 1,4 до 10,5%. Таким чином, одночасне врахування віку й даних МЩКТ підвищує ступінь ризику, який визначається. Крім того, існує значна кількість додаткових незалежних від віку та МЩКТ факторів ризику виникнення переломів.
Інші клінічні фактори ризику
На сьогодні визначена значна кількість додаткових факторів ризику виникнення переломів. Для оцінки їх ризику інтерес викликають ті фактори, внесок яких у ризик переломів перевищує МЩКТ або вік. Деякі фактори ризику взагалі не мають відношення до певного виду лікування, у зв’язку із чим так важливо встановити зв’язок між абсолютною ймовірністю переломів та даним фактором ризику. Наприклад, схильність до падіння — фактор високого ризику виникнення переломів, проте лікування препаратами, які впливають на активність процесів ремоделювання кісткової тканини мало або зовсім не впливає на ступінь вираженості цього фактора.
За останні кілька років у ряді метааналізів показано, що визначення клінічних факторів ризику розвитку остеопорозу можна використовувати з або без даних МЩКТ.
Низький індекс маси тіла (ІМТ). Низький ІМТ — істотний фактор ризику переломів стегнової кістки. Так, ризик переломів у особи з ІМТ 20 кг/м² майже у 2 рази вищий, ніж відповідний при ІМТ 25 кг/м². Важливо відзначити, що при порівнянні осіб з ІМТ 25 і 30 кг/м² значення ризику не знижуються наполовину, тобто недостатня маса тіла є фактором ризику остеопорозу, тоді як надмірна маса тіла є протекторним фактором. Також слід відзначити, що інформативність ІМТ у прогнозуванні переломів значно знижується при зіставленні його з показником МЩКТ.
Дані численних досліджень свідчать про те, що наявність в анамнезі переломів, спричинених остеопорозом, є важливим фактором ризику виникнення наступних переломів, при цьому за наявності в анамнезі переломів ризик їх подальшого виникнення збільшується майже в 2 рази. Підвищення ризику переломів хребців стає ще більш значущим при наявності в минулому переломів тіл хребців, при цьому ступінь ризику частково не залежить від значень МЩКТ. Взагалі, зіставлення фактора ризику з МЩКТ знижує значення відносного ризику на 10–20%.
Наявність у сімейному анамнезі переломів, зумовлених остеопорозом, є важливим фактором ризику, який значною мірою не залежить від МЩКТ. Наявність переломів стегнової кістки є більш вагомим фактором ризику, ніж наявність у сімейному анамнезі остеопоротичних переломів іншої локалізації.
Тютюнопаління — фактор ризику, що частково залежить від МЩКТ.
Глюкокортикоїди — одна з важливих причин остеопорозу та переломів. Ризик виникнення переломів, спричинений прийомом ГК, не пов’язаний виключно із втратою кісткової маси, а із впливом на гормональний гомеостаз організму та ін.
Вживання алкоголю. Між застосуванням алкоголю та ступенем ризику переломів встановлено дозозалежний зв’язок. Вживання щодня 2 одиниць алкоголю або менше (1 одиниця алкоголю=10 мл, або 8 г абсолютного етилового спирту) його не підвищує. У деяких дослідженнях навіть відзначено при цьому зниження ризику переломів, проте вживання 3 одиниць та більше алкоголю дозозалежно підвищує ризик розвитку остеопоротичних переломів.
РА. Підвищення ризику виникнення переломів може бути наслідком впливу багатьох вторинних причин остеопорозу (наприклад запальні захворювання кишечнику, ендокринні розлади тощо), проте в більшості випадків залишається нез’ясованим, до якої міри високий ризик переломів залежить від низької МЩКТ або інших факторів ризику (наприклад прийому ГК). На противагу цьому, РА спричиняє підвищення ризику виникнення переломів незалежно від значень МЩКТ та застосування ГК.
БМ обміну кісткової тканини. Після настання менопаузи значення БМ ремоделювання кісткової тканини підвищуються; за даними деяких досліджень інтенсивність втрати кісткової маси корелює з динамікою їх значень. Це свідчить про доцільність використання біохімічних показників метаболізму кісткової тканини при оцінці ступеня ризику виникнення переломів. У кількох проспективних дослідженнях показано, що в жінок у постменопаузальний період рівень маркерів, які характеризують обмін кістки, в сироватці крові та їх екскреція із сечею корелюють із рівнем ризику переломів. У деяких дослідженнях продемонстровано, що у жінок в постменопаузальний період, в яких значення цих маркерів вищі за відповідні у пременопаузі (25–40% жінок у постменопаузальний період), приблизно в 2 рази вищий ризик переломів хребців і невертебральних переломів (зокрема переломів стегнової кістки) незалежно від віку та середніх значень МЩКТ.
Виявлення хворих на остеопороз
На сьогодні немає єдиних рекомендацій щодо скринінгу населення з метою виявлення хворих на остеопороз або пацієнтів із високим ризиком виникнення переломів. Зі збільшенням можливостей медикаментозного лікування остеопорозу, збільшенням кількості антиостеопоротичних препаратів та зниженням їх вартості підхід до вирішення проблеми змінюється, зокрема, це стосується людей літнього та старечого віку. За відсутності дотримання цих рекомендацій хворих виявляють при періодичних оглядах за наявністю в анамнезі низькоенергетичних переломів або істотних факторів ризику. Перелік факторів ризику, на які необхідно звернути увагу при клінічній оцінці стану хворого, наведений у табл. 10.15. У нього не внесені показники МЩКТ, оскільки вони не пройшли апробації на великих когортах хворих у всьому світі для того, щоб впровадити їх до алгоритму обстеження.
Таблиця 10.15
Клінічні фактори ризику, які використовуються при оцінці ризику виникнення переломів
Фактори ризику:
Вторинні причини остеопорозу:
|
На сьогодні лікування остеопорозу значною мірою спрямоване на жінок із клінічними факторами ризику. Дані про те, що останні модулюють ймовірність виникнення переломів (і, відповідно, рентабельність лікування), стали підставою для спрямування терапії на зниження ймовірності виникнення переломів, а не лише на корекцію МЩКТ.
Міжнародна асоціація остеопорозу (IOF, 2006) для скринінгу пацієнтів пропонує використовувати 1-хвилинний тест для оцінки факторів ризику остеопорозу (табл. 10.16).
Таблиця 10.16
Хвилинний тест оцінки факторів ризику остеопорозу (one-minute osteoporosis risk test)
| № з/п | Запитання | Відповідь |
| 1 | Чи мав хтось із Ваших родичів діагноз остеопороз чи перелом стегнової кістки (шийки стегнової кістки) після мінімального (незначного) удару чи падіння? | Так
Ні |
| 2 | Чи був у Вас перелом кісток після мінімального (незначного удару чи падіння?) | Так
Ні |
| 3 | Чи приймаєте Ви кортикостероїди (кортизон, преднізолон та ін.) понад 3 місяці? | Так
Ні |
| 4 | Чи зменшився Ваш зріст більше ніж на 3 см? | Так
Ні |
| 5 | Чи приймаєте Ви регулярно алкоголь у дозі, яка б перевищувала небезпечну? | Так
Ні |
| 6 | Чи палите Ви більше 20 цигарок на день? | Так
Ні |
| 7 | Чи страждаєте Ви на часту діарею, зумовлену такими захворюваннями, як целіакія, хвороба Крона? | Так
Ні |
| 8 | Чи настала у Вас менопауза до 45 років? | Так
Ні |
| 9 | Чи були у Вас періоди аменореї (відсутність менструації) протягом 12 місяців та більше (не пов’язані з вагітністю чи менопаузою)? | Так
Ні |
| 10 | Чи страждали Ви коли-небудь від імпотенції, зниження лібідо та інших симптомів, які пов’язані з низьким рівнем тестостерону? | Так
Ні |
Згідно з результатами досліджень, проведених в Україні, використання 1-хвилинного тесту дає можливість виявляти пацієнтів зі структурно-функціональними порушеннями кісткової тканини (Поворознюк В.В., Дзерович Н.І., 2008). Серед питань тесту найвищу вірогідну інформативність мають: 1 (Чи мав хтось із Ваших родичів діагноз остеопороз чи перелом стегнової кістки (шийки стегнової кістки) після мінімального (незначного) удару чи падіння?); 2 (Чи був у Вас перелом кісток після мінімального (незначного удару чи падіння?); 3 (Чи приймаєте Ви кортикостероїди (кортизон, преднізолон та ін.) понад 3 місяці?); 4 (Чи зменшився Ваш зріст більше ніж на 3 см?).
У 2008 р. Міжнародна асоціація остеопорозу (IOF) запропонувала розширений 1-хвилинний тест для оцінки факторів ризику остеопорозу (табл. 10.17). Зазначені тести було переведено українською мовою та адаптовано (Поворознюк В.В., Дзерович Н.І., Карасевська Т.А., Поворознюк Р.В., 2007; 2009); український варіант розміщений на сайті IOF (Міжнародної асоціації остеопорозу).
Таблиця 10.17
Розширений хвилинний тест оцінки факторів ризику остеопорозу (one-minute osteoporosis risk test)
| № з/п | Запитання | Відповідь |
| Сімейний анамнез | ||
| 1 | Хтось із Ваших батьків страждав на остеопороз або в когось із них був перелом внаслідок незначного удару? | Так
Ні |
| 2 | У когось із Ваших батьків було порушення постави в літньому віці («горб вдови»)? | Так
Ні |
| Анамнез життя | ||
| 3 | Вам 40 років або більше? | Так
Ні |
| 4 | У Вас були переломи кісток після незначних ударів або падінь у зрілому віці? | Так
Ні |
| 6 | Ви часто падаєте (більше 1 разу за минулий рік) або Ви боїтеся падінь через слабкість? | Так
Ні |
| 7 | Ваш ріст зменшився більше ніж на 3 см (після 40 років)? | Так
Ні |
| 8 | У Вас низька маса тіла (ІМТ <19 кг/м2)? | Так
Ні |
| 9 | Ви коли-небудь приймали препарати кортикостероїдів (кортизон, преднізолон) більше 3 місяців? | Так
Ні |
| 10 | Ви хворієте на ревматоїдний артрит? | Так
Ні |
| 11 | У Вас підвищена функція щитоподібної або паращитоподібної залози? | Так
Ні |
| Для жінок | ||
| 12 | У Вас настала менопауза у віці до 45 років? | Так
Ні |
| 13 | У Вас були відсутні менструації 12 місяців і більше, що не було пов’язано з вагітністю, менопаузою або видаленням матки? | Так
Ні |
| 14 | Ви перенесли операцію видалення яєчників до 50 років без наступного прийому замісної гормональної терапії? | Так
Ні |
| Для чоловіків | ||
| 15 | Ви колись страждали від імпотенції, зниження лібідо чи інших симптомів, пов’язаних зі зниженням рівня тестостерону? | Так
Ні |
| Cпосіб життя | ||
| 16 | Ви вживаєте алкоголь у дозі, що перевищує безпечну кількість (більше ніж еквівалент 20 мл спирту на день)? | Так
Ні |
| 17 | Ви палите або палили колись? | Так
Ні |
| 18 | Ви приділяєте менше 30 хв на день фізичним вправам (роботі у садку тощо)? | Так
Ні |
| 19 | Ви споживаєте мало молочних продуктів (внаслідок алергії або з інших причин) без замісного прийому препаратів кальцію? | Так
Ні |
| 20 | Ви мало часу проводите на свіжому повітрі й сонці (менше 10 хв на день) без замісного прийому вітаміну D? | Так
Ні |
Один з алгоритмів виявлення та лікування хворих на остеопороз наведений на рис. 10.7.
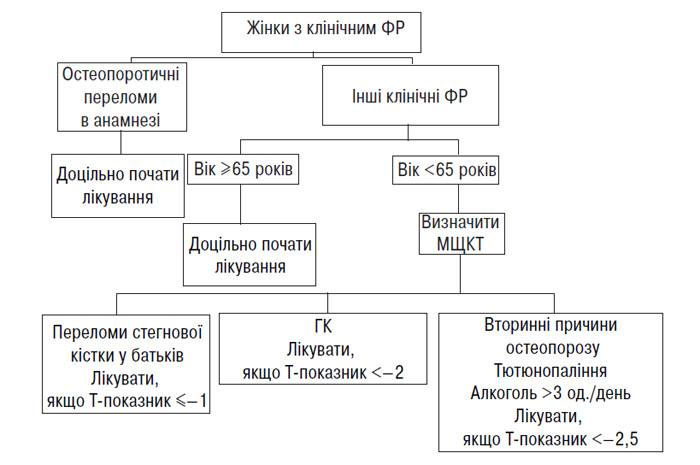
Рис. 10.7. Алгоритм виявлення та лікування жінок з остеопорозом у постменопаузальний період, що базується на економічному аналізі витрат у системі охорони здоров’я Великобританії. ФР — фактор ризику
Він базується на даних про взаємодію клінічних факторів ризику, віку та значень МЩКТ і впроваджений у Великобританії. Алгоритм ведення хворих на остеопороз дає можливість проводити лікування без визначення МЩКТ, оскільки наявність переломів в анамнезі є одним із найвагоміших факторів ризику, що значною мірою не залежить від МЩКТ. При наявності інших факторів ризику є можливість проводити економічно рентабельне лікування жінок віком понад 65 років, проте молодшим жінкам слід додатково визначати МЩКТ. Лікування жінок, у батьків яких були переломи стегнової кістки, буде ефективним, коли значення Т-показника шийки або всієї стегнової кістки буде ≤–1 SD. Для жінок, які тривалий час застосовують ГК, мінімальний Т-показник має становити –2,0 SD, тоді як при наявності більш слабких факторів ризику (вторинні причини остеопорозу, тютюнопаління, вживання 3 одиниць і більше алкоголю на день) Т-показник становить –2,5 SD. Перевагою цього алгоритму є можливість призначення лікування без визначення Т-показника, що цілком рентабельно.
Ця схема із врахуванням економічних підстав може бути широко впроваджена в клінічну практику.
Обстеження хворих на остеопороз та встановлення діагнозу
При діагностиці остеопорозу в усіх хворих незалежно від наявності переломів, зумовлених втратою кісткової тканини, використовують один підхід. Обсяг клінічного та лабораторного обстеження залежить від тяжкості захворювання, віку хворого та наявності чи відсутності переломів хребців. Мета збору анамнезу, об’єктивного обстеження та лабораторних аналізів:
- виключити наявність захворювань та патологічних станів, що нагадують остеопороз (остеомаляція, мієломна хвороба);
- виявити всі випадки остеопорозу та фактори, що призвели до нього;
- оцінити ступінь тяжкості остеопорозу для визначення прогнозу, тобто визначити ризик зумовлених ним переломів;
- вибрати найбільш доцільне лікування;
- визначити показники, необхідні для подальшого моніторингу.
Процедури, що виконують при діагностиці остеопорозу, наведені у табл. 10.18.
Таблиця 10.18
Процедури, рекомендовані при діагностиці остеопорозу
| Процедури | |
| Типові |
|
| Інші |
|
На підставі цих обстежень має бути:
1. Встановлено діагноз остеопорозу (методами DXA або рентгенографічним).
2. Виявлено причину (наприклад тестування функціонального стану щитоподібної залози для визначення гіпертиреозу, визначення вільного кортизолу в сечі для діагностики синдрому Кушинга).
3. Проведено диференційну діагностику (наприклад електрофорез білків для визначення мієломної хвороби, визначення рівня кальцію та активність лужної фосфатази для діагностики остеомаляції).
Обстеження, що зазвичай проводяться у спеціалізованих центрах, включають визначення БМ метаболізму кістки, рівень ПТГ в сироватці крові, рівень 25-гідроксивітаміну D, електрофорез білків у сироватці крові або сечі, рівень кальцію в сечі натще або його добову екскрецію, рівень вільного кортизолу в сечі, тестування функціонального стану щитоподібної залози та біопсію клубової кістки.
У чоловіків доцільно визначати вільний тестостерон, гонадотропіни та пролактин. Оцінка базується на даних клінічного обстеження; так, у хворих із явним остеопорозом одночасно можуть виявляти легкий гіперпаратиреоз або гіпертиреоз, системний мастоцитоз, пізні прояви недосконалого остеогенезу або остеомаляцію.
Диференційна діагностика остеопорозу
Специфічні чинники втрати кісткової маси виявляють у чоловіків частіше, ніж у жінок. У значної кількості чоловіків із симптоматичними переломами тіл хребців виявляють такі чинники розвитку остеопорозу, як гіпогонадизм, лікування пероральними стероїдами або алкоголізм. У контрольованих дослідженнях виявлено істотне підвищення ризику переломів тіл хребців, що пов’язане з тютюнопалінням, вживанням алкоголю, лікуванням пероральними ГК, антиконвульсантами, а також із гіпогонадизмом та іншими чинниками, що призводять до остеопорозу. Фактори ризику виникнення переломів стегнової кістки у чоловіків і жінок однакові.
Остеомаляція та злоякісні пухлини часто спричиняють втрату кісткової маси та переломи. Остеомаляція характеризується дефектом мінералізації кісткового матриксу, що найчастіше є наслідком недостатнього надходження, утворення або порушення обміну вітаміну D. Іншими причинами є порушення транспорту фосфатів або тривале застосування деяких препаратів, наприклад солей алюмінію (та інших антацидів, що зв’язують фосфор), фтору або етидронату у високих дозах, а також тривале лікування антиконвульсантами. У переважній більшості випадків остеомаляцію діагностують на підставі даних анамнезу та патологічних значень біохімічних аналізів (низькі рівні кальцію в сироватці крові та сечі, фосфатів і вітаміну D у сироватці крові та високі значення показників активності лужної фосфатази й концентрації ПТГ). Для однозначного підтвердження дефекту мінералізації слід виконувати транcклубову біопсію кісткової тканини після введення тетрацикліну в якості мітки (тетрациклінова мітка).
Системний остеопороз із або без патологічних переломів часто розвивається у пацієнтів із мієломною хворобою, станом, для якого характерні виражений біль у кістках, підвищення ШОЕ та протеїнурія Бенс-Джонса; що виявляється при дослідженні аспірату кісткового мозку, та за даними (імуно)електрофорезу білків у сироватці крові та сечі. Остеопороз можуть імітувати патологічні переломи, спричинені метастазами злоякісних пухлин, які можна виявити при клінічному та рентгенологічному обстеженні, при визначенні маркерів пухлин та за допомогою сцинтиграфії або інших візуалізаційних технологій. Остеопоротичні переломи хребців слід диференціювати з іншими деформаціями хребта, такими, як сколіоз, ОА та хвороба Шеєрмана — May.
Принципи ведення хворих на остеопороз
Рухова активність і падіння
Обмеження рухової активності є важливим чинником втрати кісткової маси. Прикуті до ліжка хворі за 1 тиж втрачають стільки ж кісткової маси, скільки за звичайних умов вони втрачають за рік. Тому слід уникати будь-якого обмеження рухливості. Обсяг вправ із підняття ваги, що оптимально впливає на стан скелета у хворих на остеопороз, досі невідомий, проте фізичні вправи є невід’ємним компонентом ведення хворих. Фізіотерапія — важливий лікувальний чинник при реабілітації хворих після переломів. Підвищення фізичної сили хворого сприяє профілактиці падінь завдяки підвищенню впевненості у своїх силах та координації рухів, а також підтримання кісткової маси за рахунок стимуляції процесів утворення кістки та гальмування її резорбції. Ці заходи можуть бути поєднані із програмою зменшення імовірності падінь у осіб, які належать до груп високого ризику. Фактори ризику падінь наведено у табл. 10.19.
Таблиця 10.19
Фактори ризику падінь
| 1 | Порушення рухової активності, безпорадність |
| 2 | Порушення ходи й рівноваги |
| 3 | Розлади нервово-м’язової та кістково-м’язової систем |
| 4 | Вік |
| 5 | Порушення гостроти зору |
| 6 | Захворювання серцево-судинної та нервової систем |
| 7 | Падіння в анамнезі |
| 8 | Прийом лікарських засобів |
| 9 | Когнітивні розлади |
Вплив на фактори ризику, а саме порушення зору, зменшення застосування лікарських засобів, які порушують пильність та здатність підтримувати рівновагу, оптимізація домашнього середовища (неслизька підлога, звільнення від перешкод, покращання освітлення, встановлення поручнів у ванній кімнаті та туалеті) є важливими заходами попередження падінь. Хоча в численних дослідженнях і показано, що ці заходи зменшують імовірність падінь, у рандомізованих дослідженнях не підтверджено істотного зниження ризику виникнення переломів. У деяких рандомізованих дослідженнях продемонстровано зниження ризику переломів стегнової кістки при використанні пристосувань, що захищають стегно, особливо в людей літнього віку, які мешкають у будинках-інтернатах. Проте результати проведеного нещодавно метааналізу рандомізованих досліджень ставлять під сумнів протипереломну ефективність таких попереджувальних заходів.
Харчування
Серед людей старших вікових груп поширений дефіцит кальцію, білків та вітаміну D. За даними наших досліджень встановлено, що у жінок старших вікових груп існує виражений дефіцит кальцію (42% від рекомендованих величин). Рівні застосування основних макронутрієнтів, які впливають на ремоделювання кісткової тканини (кальцію, магнію, фосфору), у добовому раціоні жінок усіх вікових груп були достовірно нижчими за рекомендовані. Лише у 3,2% жінок вміст кальцію в харчовому раціоні перевищував 1000 мг/добу, більше ніж у половини пацієнток був меншим 200 мг/добу (рис. 10.8).
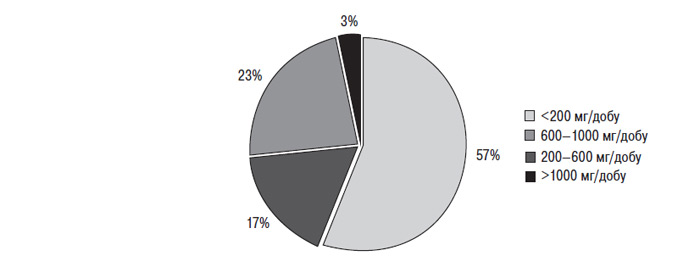
Рис. 10.8. Розподіл обстеженого жіночого населення України залежно від добового рівня вживання кальцію (Поворознюк В.В., Григорьева Н.В., 2004)
Кальцій — основний негормональний засіб, що застосовується для профілактики остеопорозу. Доведено, що додаткове його введення (500–1500 мг/добу) вірогідно зменшує втрату кісткової маси в постменопаузальний період. Застосування кальцію сприяє зниженню частоти переломів хребців та стегнової кістки у осіб літнього та старечого віку. Результати проведених досліджень свідчать про зниження на 60% числа переломів стегнової кістки серед чоловіків та жінок, у яких вміст кальцію у фактичному раціоні харчування становив понад 700 мг/добу порівняно з тими, хто приймав його менше 500–700 мг/добу.
Споживання вітаміну D понад 700 МО/добу може сприяти зниженню ризику падінь. Якщо поступове зменшення споживання калорій з віком можна розглядати як певне пристосування до зниження енергетичних витрат, то паралельне зменшення вживання білків може згубно впливати на підтримання цілісності та функції низки органів і систем, у тому числі скелетних м’язів і кісток. Споживання кальцію та вітаміну D знижує вторинний гіперпаратиреоз та ризик переломів проксимальної ділянки стегнової кістки, зокрема, у людей літнього віку, які проживають у будинках-інтернатах.
Хворим на остеопороз рекомендується вживати щонайменше 1000 мг/добу кальцію, 800 МО вітаміну D та 1 г/кг маси тіла білка на добу.
Достатнє вживання білка необхідне не лише для підтримання функції кістково-м’язової системи, але й для зниження імовірності розвитку ускладнень після остеопоротичних переломів. Корекція недостатності білків у дієті хворих, які нещодавно перенесли перелом стегнової кістки, значно знижує частоту випадків розвитку таких ускладнень, як пролежні, тяжка анемія та супутні інфекційні захворювання легень і нирок. Окрім того, зменшується середня тривалість перебування в стаціонарі осіб літнього віку після переломів стегнової кістки.
Фармакологічне лікування остеопорозу
Фармакологічне лікування остеопорозу довготривале, спрямоване на ефективне зниження ризику переломів. Недотримання режиму лікування може призвести до погіршення перебігу захворювання. В Україні на сьогодні зареєстровані стронцію ранелат та бісфосфонати (алендронат, ібандронат, ризендронат, золендронат), які в Європі належать до основної групи, та кальцитонін і ЗГТ, які класифікуються, як інші. Усі ці препарати знижують ризик переломів хребців. Деякі з них також знижують ризик невертебральних переломів та переломів стегнової кістки. Ефективність впливу основних фармакологічних препаратів на ризик виникнення переломів хребців та стегнової кістки наведена у табл. 10.20.
Таблиця 10.20
Ефективність препаратів основної групи для лікування остеопорозу в постменопаузальний період у запобіганні переломам (адаптовано за даними рандомізованих контрольованих досліджень)
| Препарат | Вплив на ризик переломів хребців | Вплив на ризик невертебральних переломів | ||
| Остеопороз | Остеопороз з переломома | Остеопороз | Остеопороз з переломома | |
| Стронцію ранелат | + | + | + (у т.ч. стегнової кістки) | + (у т.ч. стегнової кістки) |
| Алендронат | + | + | ДВ | + (у т.ч. стегнової кістки) |
| Ризендронат | + | + | ДВ | + (у т.ч. стегнової кістки) |
| Ібандронат | ДВ | + | ДВ | +б |
| Золендронат | + | + | ДВ | ДВ (+в) |
ДВ — дані відсутні; + препарат ефективний; ажінки з переломами хребців в анамнезі; бза даними тільки підгрупи хворих (ретроспективний аналіз); взмішана група хворих з/без множинних переломів тіл хребців. Усі препарати використовували в комплексі з кальцієм та вітаміном D.
Основні фармакологічні препарати
Стронцію ранелат
Стронцію ранелат складається з двох атомів стабільного стронцію й молекули ранелової кислоти та застосовується для лікування при постменопаузальному остеопорозі та для зниження ризику переломів хребців та стегнової кістки. Він зменшує інтенсивність резорбції кісткової тканини й одночасно стимулює її формування, впливаючи на обидва процеси ремоделювання.
Проведені 8-річні дослідження довели ефективність стронцію ранелату в запобіганні виникнення як переломів хребців, так і невертебральних переломів. Дослідження проводили на великій когорті хворих, а саме пацієнтів з остеопенією, жінок віком старше 80 років, пацієнтів з/без остеопорозу та перелому хребців в анамнезі. Зниження частоти виникнення переломів стегнової кістки також продемонстровано у жінок віком старше 74 роки з низькою МЩКТ. У рандомізованих контрольованих дослідженнях отримані дані про те, що через 3 роки лікування стронцію ранелатом відносний ризик переломів тіл хребців знижується на 41% (ВР=0,59; 95% ДІ), абсолютний ризик переломів хребців — на 12%, NNT=9 (number needed to treat (NNT) — кількість хворих, яких необхідно пролікувати для досягнення одного хорошого результату (або запобігання небажаному)) (Meunier P.J. et al., 2004); відносний ризик переломів стегнової кістки знижується на 36% (ВР=0,64; 95% ДІ), а абсолютний ризик переломів стегнової кістки — на 2,1% (NNT=48) (Reginster J.Y. et al., 2005).
Рекомендується приймати по 2 г (1 саше) стронцію ранелату 1 раз на добу. Його всмоктування сповільнюють їжа, молоко та молочні продукти, тому цей препарат слід приймати у проміжках між прийомом їжі, найкраще — перед сном, принаймні через 2 год після їди. При цьому немає потреби підбирати дозу відповідно до віку або хворим із порушеннями функції нирок легкого та помірного ступеня (кліренс креатиніну — 30–70 мл/хв). Стронцію ранелат не слід призначати хворим із тяжкою нирковою недостатністю (кліренс креатиніну — <30 мл/хв).
Побічні реакції при лікуванні стронцію ранелатом зазвичай незначні й швидко усуваються. Найчастіше відзначають нудоту та пронос, які виникають на початку лікування й зникають після 3 міс прийому препарату.
При об’єднанні всіх даних ІІІ фази досліджень остеопорозу відзначене підвищення частоти виникнення венозної тромбоемболії (ВТЕ; ВР — 1,42; ДІ 1,02–1,98). Причинно-наслідкового зв’язку між ризиком ВТЕ та лікуванням стронцію ранелатом не виявлено, й офіційні органи не вважають наявність у анамнезі ВТЕ протипоказанням для його призначення. Проте стронцію ранелат слід використовувати з обережністю у хворих із підвищеним ризиком виникнення ВТЕ, у тому числі тих, хто мав ВТЕ в анамнезі. При лікуванні осіб із підвищеним ризиком розвитку ВТЕ слід приділяти увагу скаргам і симптомам ВТЕ та можливим профілактичним заходам.
Згідно з дослідженнями, проведеними в Україні на базі Українського науково-медичного центру проблем остеопорозу (Поворознюк В.В., Дзерович Н.І., Орлик Т.В., Вайда В.М., 2008) стронцію ранелат через 6 міс лікування істотно (на 45%) знижував вертебральний больовий синдром (р=0,005) та на 33% покращував якість життя (р=0,0001) у жінок з остеопорозом у постменопаузальний період. Терапія стронцію ранелатом вірогідно підвищувала МЩКТ поперекового відділу хребта на 3,4% через 6 міс (p=0,03), на 5,1% — через 9 міс (p=0,02) та на 7,7% — через 12 міс лікування (p=0,004) та МЩКТ стегнової кістки — на 1,9% через 6 міс, на 3,7% — через 9 міс та на 4,1% — через 12 міс лікування (р=0,01).
Бісфосфонати
Бісфосфонати — стабільні аналоги пірофосфату — характеризуються наявністю зв’язків Р-С-Р. На сьогодні синтезовано низку бісфосфонатів, активність яких залежить від довжини та структури бічного ланцюга. Бісфосфонати мають велику спорідненість до апатиту кісток як in vitro, так і in vivo, що є основою для їх клінічного застосування. Вони є сильними інгібіторами резорбції кісткової тканини за рахунок зменшення кількості остеокластів шляхом підвищення їх апоптозу. Здатність бісфосфонатів пригнічувати резорбцію кісткової тканини in vitro широко варіює в різних сполуках (до 10 тис. разів), що зумовлює застосування у клініці різних доз. Механізм впливу на остеокласти полягає у пригніченні активності аденозинтрифосфатази, порушенні цитоскелета й гофрованої облямівки. Амінобісфосфонати також пригнічують кілька етапів мевалонового шляху, що модифікує ізопренілювання зв’язувального білка.
Біодоступність бісфосфонатів при прийомі всередину достатньо низька й становить від 1 до 3% прийнятої дози, й ще більше знижується під впливом їжі, кальцію, заліза, кави, чаю та апельсинового соку. Бісфосфонати швидко виводяться із плазми крові, приблизно 50% потрапляє в кісткову тканину, а решта виводиться із сечею. Період їх напіввиведення з кісток досить тривалий.
Найбільш поширеними бісфосфонатами у світі є алендронат (70 мг) та ризедронат (35 мг). У дослідженні FIT (Fracture Intervention Trial — дослідження щодо лікування переломів) показано, що терапія алендронатом знижує майже наполовину частоту виникнення переломів хребців, зап’ястка та стегнової кістки у жінок, які в минулому мали переломи тіл хребців. У жінок без таких переломів не відзначено істотного зменшення клінічно значущих переломів порівняно із загальною популяцією, проте в ⅓ хворих, у яких до лікування T-показник МЩКТ стегнової кістки був <–2,5 SD, кількість таких переломів вірогідно зменшилася. За 3 роки лікування алендронат знижував відносний ризик переломів хребців на 47% (ВР=0,53; 95% ДІ), абсолютний ризик переломів хребців — на 7% (NNT=14); відносний ризик переломів стегнової кістки — на 51% (ВР=0,49; 95% ДІ), абсолютний ризик переломів стегнової кістки — на 1,1% (NNT=91) (Black D.M. et al., 1996).
Застосування ризедронату у жінок, які в минулому мали переломи тіл хребців, знижує частоту подальших переломів хребців на 40–49%, а невертебральних переломів — на 30–36%. На великій популяції жінок літнього та старечого віку продемонстровано, що використання ризедронату вірогідно знижує ризик переломів стегнової кістки (на 30%), цей ефект був більш вираженим у жінок віком 70–79 років (на 40%), але не спостерігався у жінок віком 80 років без остеопорозу. Дослідження S.T. Harris та співавторів (1999) продемонструвало, що лікування ризендронатом дозволяє за 3 роки знизити відносний ризик переломів хребців на 41% (ВР=0,59; 95% ДІ), та абсолютний ризик переломів хребців — на 5% (NNT=20). M.R. MacClung та співавтори (2001) показали, що лікування ризендронатом за 3 роки знижує відносний ризик переломів стегна на 40% (ВР=0,6; 95% ДІ), а абсолютний ризик переломів стегна — на 1,1% (NNT=91).
Застосувння 2,5 мг ібандронату щоденно знижувало на 50–60% ризик виникнення переломів хребців, проте вплив препарату на рівень ризику невертебральних переломів продемонстровано лише у жінок, у яких до лікування T-показник МЩКТ був <–3 SD. C.H. Chesnut III та співавтори (2004) показали, що лікування ібандронатом за 3 роки знижує відносний ризик переломів хребців на 62% (ВР=0,38; 95% ДІ), а абсолютний ризик переломів хребців — на 5% (NNT=20). Результати досліджень у паралельних групах показали, що прийом всередину 1 раз на місяць 150 мг ібандронату підвищує МЩКТ і знижує рівень БМ ремоделювання кісткової тканини так само ефективно (або й краще), як і щоденний прийом препарату, що стало підставою для затвердження цієї дози для лікування остеопорозу у жінок в постменопаузальний період. Аналогічні дані досліджень у паралельних групах, у яких порівнювали ефективність внутрішньовенного введення й щоденного прийому всередину ібандронату, стали підставою для затвердження застосування внутрішньовенного введення 3 мг ібандронату кожні 3 міс для лікування при постменопаузальному остеопорозі.
Нещодавно завершено ІІІ фазу досліджень, проведену за участю 7500 жінок із постменопаузальним остеопорозом, у якій протягом 3 років оцінювали ефективність щорічного введення 5 мг золедронату. Порівняно із групою плацебо лікування золедронатом знижувало на 70% відносний ризик виникнення переломів хребців (ВР=0,3; 95% ДІ), а абсолютний ризик переломів хребців — на 8% (NNT=13), відносний ризик переломів стегна — на 41% (ВР=0,59; 95% ДІ), та абсолютний ризик переломів стегна — на 1,1% (NNT =91) (Black D.M. et al., 2007).
На сьогодні цей препарат широко використовують для лікування при постменопаузальному остеопорозі. Внутрішньовенне введення золедронату через короткий проміжок часу після першого перелому стегнової кістки знижує ризик виникнення подальших переломів та рівень пов’язаної з ними смертності.
Загалом лікування бісфосфонатами достатньо безпечне. При прийомі їх per os можуть виникати шлунково-кишкові розлади, деякі амінобісфосфонати (алендронат) рідко спричиняють розвиток езофагіту. Внутрішньовенне введення бісфосфонатів може індукувати тимчасові фазні реакції з лихоманкою, болем у кістках і м’язах, які послаблюються і зникають при подальших курсах лікування. У хворих на рак, яким вводили внутрішньовенно памідронат або золедронат у високих дозах, описано розвиток остеонекрозу щелепи. Частота його виникнення у хворих на остеопороз винятково низька (порядку 1/100 тис. випадків), а причинно-наслідковий зв’язок його з лікуванням бісфосфонатами не доведений.
Інші фармакологічні препарати
Кальцитонін
Кальцитонін — ендогенний поліпептидний гормон, який пригнічує резорбцію кісткової тканини остеокластами. Кальцитонін, виділений з риб родини лососевих, у 40–50 разів активніший за людський, у зв’язку з чим у більшості досліджень використовують кальцитонін лосося. Для лікування застосовують ін’єкції препарату або спрей для інтраназального введення, біологічний ефект якого становить 20–50% порівняно з ін’єкцією (200 МО назального препарату еквівалентні 50 МО ін’єкційного).
Кальцитонін помірно підвищує МЩКТ поперекових хребців та кісток передпліччя, знижує ризик виникнення переломів хребців, проте вираженість цього впливу залишається сумнівною. Його вплив на ризик невертебральних переломів також залишається невизначеним. Крім того, кальцитонін має виражену анальгезивну дію в жінок при гострих переломах хребців, що (як вважається) не залежить від його впливу на остеокластичну резорбцію. Проте необхідність повторних ін’єкцій та висока вартість назальної форми препарату стають на заваді тривалому застосуванню кальцитоніну як лікарського засобу першої лінії для лікування остеопорозу, а його анальгезивний вплив слід враховувати при гострому болю після переломів тіл хребців.
ЗГТ
Естрогени гальмують підвищення метаболізму кісткової тканини, яке було спричинене менопаузою, та запобігають втраті кісткової маси всього скелета незалежно від віку і тривалості лікування. Результати рандомізованих плацебо-контрольованих досліджень свідчать про те, що естрогени знижують ризик розвитку вертебральних та невертебральних переломів (у тому числі переломів стегнової кістки) приблизно на 30% незалежно від вихідних значень МЩКТ. Після припинення ЗГТ інтенсивність втрати кісткової маси підвищується до постменопаузального рівня, але зниження ризику розвитку переломів може (що має бути доведеним) тривати ще кілька років.
Проте за результатами дослідження Національного інституту здоров’я США (Women’s Health Initiative — WHI) показано, що ризики, які виникають при тривалій ЗГТ, перевищують користь від неї. У великому дослідженні, проведеному за участю жінок у постменопаузальний період, показано, що під час комбінованого прийому кон’югованих естрогенів і медроксипрогестерону ацетату підвищується на 30% ризик розвитку ішемічної хвороби серця та раку молочної залози і на 40% — інсульту. При цьому незначно підвищився ризик розвитку деменції, але не виявлено клінічно значущого впливу на залежну від стану здоров’я якість життя (розлади сну, вазомоторні реакції). Подальшим аналізом показано, що рівень ризику раку молочної залози підвищувався значно менше у жінок, які раніше не проходили курсів ЗГТ. У жінок, у яких видалено матку, лікування кон’югованими естрогенами також приводило до істотного підвищення кількості випадків інсульту, але не впливало на ризик розвитку ішемічної хвороби серця і раку молочної залози, що свідчило про шкідливу дію медроксипрогестерону ацетату. Обговорюється питання, якою мірою користь ЗГТ іншими естрогенами й прогестинами у жінок у постменопаузальний період більш молодшого віку перевищує її ризик; але досі не проведено плацебо-контрольованих досліджень щодо безпеки такого тривалого лікування. Тому ЗГТ більше не рекомендують використовувати як засіб першої лінії для профілактики та лікування остеопорозу.
Комбіноване та етапне лікування
Режими лікування остеопорозу включають комбіноване або послідовне застосування препаратів з однаковою дією (наприклад ≥2 інгібітори резорбції кістки) або з різною дією (наприклад інгібітор резорбції та препарат, який впливає на формування кісткової тканини). Сподівання, що комбіноване лікування має бути більш ефективним, поки що не виправдалися.
Більшість сучасних даних свідчить, що комбіноване застосування двох інгібіторів сприяє більш вираженому зниженню резорбції кістки та, відповідно, більшому підвищенню значень МЩКТ, ніж використання кожного препарату окремо. Проте дані про більш виражений вплив на зниження ризику виникнення переломів не були достовірно доведені. Результати досліджень жодної з опублікованих робіт не спроможні довести відмінностей у ризику виникнення переломів між групами лікування.
Оцінка ефективності фармакологічних препаратів для лікування остеопорозу та його ускладнень щодо зниження ризику розвитку остеопоротичних переломів
Оцінка ризику виникнення переломів на тлі фармакологічного лікування проводиться за показниками зниження відносного, абсолютного ризику та кількості пацієнтів, яких необхідно пролікувати для запобігання одному перелому (Number Needed to Treat — NNT).
Зниження відносного ризику демонструє зниження ризику виникнення переломів у пацієнтів на тлі лікувальної інтервенції. Відносний ризик вимірюється у відсотках або коефіцієнті ризику. Відносний ризик вказує на здатність лікування знижувати ризик у вибраній популяції хворих. При цьому популяції можуть відрізнятися за вихідним ступенем ризику (наявність переломів у анамнезі, вік, МЩКТ тощо). Навіть при високих показниках зниження відносного ризику зменшення абсолютного ризику переломів може бути незначним.
Зниження абсолютного ризику дозволяє отримати об’єктивні дані про результати терапії щодо зменшення ризику виникнення переломів. Зниження абсолютного ризику — це різниця між кількістю переломів у групі активного лікування та кількістю переломів у групі плацебо, яка вказує на вірогідність того, що індивідуум отримає певний результат за певний час лікування.
Показник NNT також є наглядним щодо ефективності різних втручань. Він дорівнює кількості пацієнтів, яких необхідно пролікувати для запобігання одному перелому. Показник NNT дорівнює 1/зниження абсолютного ризику. Чим нижчий показник NNT, тим ефективніше втручання щодо запобігання переломам.
Згідно з вимогами Консолідованих стандартів представлення досліджень (CONSORT) інформація щодо результатів рандомізованих контрольованих досліджень має включати як показники зниження відносного ризику, так і зниження абсолютного ризику та кількості пацієнтів, яких необхідно лікувати для запобігання одній події.
Моніторинг лікування
Використання денситометрії для моніторингу лікування
Мета медикаментозної терапії хворих на остеопороз — підвищення міцності кісткової тканини для зниження ризику виникнення переломів.
У чоловіків та жінок, які не отримують контрольованого лікування, одним із основних чинників міцності кісткової тканини є рівень її мінеральної щільності, а низькі значення показників МЩКТ є важливим предиктором переломів. Дані щодо залежності довготривалої ефективності антиостеопоротичних препаратів від рівня підвищення і підтримання МЩКТ суперечливі. За результатами метарегресійного аналізу продемонстрована більш сильна кореляційна залежність між динамікою значень МЩКТ та зниженням ризику переломів порівняно з даними при аналізі результатів окремого хворого.
Лише 16% зниження ризику переломів тіл хребців після лікування алендронатом пояснювалося підвищенням МЩКТ на рівні поперекових хребців, але більш значуще підвищення МЩКТ на рівні хребта і стегнової кістки після лікування алендронатом більшою мірою знижувало ризик виникнення невертебральних переломів. Між тим у хворих, які лікувалися ризедронатом, зміни МЩКТ погано прогнозували ступінь зниження ризику виникнення невертебральних переломів. Зниження ризику виникнення невертебральних переломів при лікуванні ризедронатом на 12 і 7% пов’язане зі змінами МЩКТ хребта й шийки стегнової кістки відповідно.
За попередніми даними значна частка (до 74%) протипереломної ефективності стронцію ранелату корелює з підвищенням МЩКТ усієї стегнової кістки або її шийки. Вимірювання МЩКТ для хворих, яких лікують стронція ранелатом, є чітким прогностичним критерієм зниження ризику переломів і має бути використане для моніторінгу клінічної ефективності.
Моніторинг лікування за допомогою БМ обміну кісткової тканини
За останні 20 років виявлено лабораторні маркери, які відображають інтенсивність формування і/або резорбції кісткової тканини. Більшість із них імунологічні, в яких використовують антитіла, що розпізнають специфічні компоненти кісткового матриксу (наприклад колаген І типу або неколагенові білки), які виділяються у кровотік під час формування кісткової тканини остеобластами чи її резорбції остеокластами. За допомогою інших методів визначають активність ферментів, які відображають активність остеобластів (кісткова лужна фосфатаза) або остеокластів (тартрат-резистентна кисла фосфатаза). Найбільш інформативними маркерами при дослідженнях остеопорозу для оцінки формування кістки є остеокальцин та N-кінцевий пропептид проколагену I типу, для оцінки резорбції кістки — С-телопептид колагену I типу, який є продуктом деградації колагену I типу.
Лікування антирезорбентами (кальцитонін, естрогени, бісфосфонати) веде до зниження до пременопаузального рівня значень БМ резорбції кістки за 3–6 міс, а формування кістки — за 6–9 міс. Зниження значень маркерів ремоделювання кісткової тканини при лікуванні алендронатом або естрогенами є дозозалежним і корелює з довготривалим (2–3 роки) підвищенням МЩКТ хребта та стегнової кістки. Важливим є те, що встановлено достовірний зв’язок між швидким зниженням абсолютних значень маркерів ремоделювання кісткової тканини при застосуванні антирезорбентів (бісфосфонатів) та величиною зниження ризику вертебральних і невертебральних переломів. Крім того, у великому проспективному дослідженні встановлено, що використання маркерів ремоделювання кісткової тканини для моніторингу при терапії бісфосфонатами сприяє більш ретельному дотриманню режиму лікування хворими порівняно з тими, в кого не визначали рівень цих маркерів. Таким чином, визначення маркерів ремоделювання кісткової тканини після кількох місяців терапії бісфосфонатами не лише дає важливу інформацію, але й підвищує схильність хворих до лікування.
При застосуванні стронцію ранелату протягом перших 3 міс рівень маркерів формування кісткової тканини (кістковий ізофермент лужної фосфатази, N-термінальний пептид проколагену I типу) зростає, а рівень маркерів резорбції (С-телопептид колагену I типу) знижується, що в подальшому стабільно підтримується протягом 3 та більше років терапії.
Висновки
Зазначені рекомендації включають основні настанови щодо діагностики остеопорозу та виявлення факторів ризику переломів, а також його лікування та запобігання переломам у жінок в постменопаузальний період, обґрунтовані на базі доказової медицини та рекомендовані до впровадження у практику лікарів-ревматологів, терапевтів, травматологів, геріатрів, гінекологів і ендокринологів.
У зв’язку з відчутним постарінням населення України, збільшенням питомої ваги жіночого населення віком старше 50 років, нагальними екологічними та соціальними проблемами, остеопороз у жінок в постменопаузальний період та його ускладнення можуть призвести до епідемії цього захворювання в нашій державі з непередбачуваними медико-соціальними наслідками. Тому колектив авторів висловлює надію, що наведені рекомендації допоможуть спільноті лікарів України у діагностиці та лікуванні остеопорозу та його ускладнень у жінок у постменопаузальний період і покращать якість життя жінок у цей період.