Фактори ризику та їх взаємозв’язок із серцево-судинними захворюваннями
Содержание
Наявність розбіжностей в частоті серцево-судинних захворювань (ССЗ) різних популяцій зумовлює необхідність вивчення етіології та патогенезу цих хвороб шляхом ретельного аналізу зовнішніх і внутрішніх умов їх виникнення в окремих групах населення.
На підставі результатів суцільного обстеження значних контингентів, об’єднаних територіально, виявлено зв’язок між клінічними проявами ССЗ, біохімічними порушеннями в організмі, особливостями фізіологічних величин та умовами зовнішнього середовища. Найбільш значущі фактори, вираженість яких асоціюється з найбільшою поширеністю клінічних проявів ССЗ, були названі факторами ризику. Кількість їх постійно зростає; найбільш характерні для багатьох країн (АГ, гіперхолестеринемія, тютюнопаління, ожиріння тощо) називають основними.
Фактори ризику — частіше умови виникнення і лише іноді — причина захворювання. Однак їх розподіл на ті, які є причиною хвороби, та ті, що сприяють її розвитку, не завжди вдається, оскільки існує дуже тонкий перехід від групи «норма» до поняття «патологія» як для всієї популяції, так і для кожного її члена. Те, що з найбільшою вірогідністю є патологічним для значної групи людей, може бути малозначущим для одного з її представників. Перешкоджає визначенню факторів ризику як причини ССЗ і те, що далеко не всі з них можуть бути вимірені та виражені в абсолютних значеннях. Це психоемоційне навантаження, спадковість, недостатня фізична активність тощо.
J. Stamler (1973) запропонував класифікацію основних факторів ризику, розділивши їх на біологічні, що не підлягають впливу екзогенних умов (вік, стать); ендогенні, що підлягають впливу екзогенних причин (АГ, підвищений вміст ХС у крові, рівень сечової кислоти, ЧСС); фактори навколишнього середовища і спосіб життя (тютюнопаління, харчування, фізична активність) і патологічні зміни у внутрішній системі самого організму (зміни на ЕКГ). Пізніше було запропоновано поділяти фактори на ті, що спричиняють захворювання (психоемоційні, генетичні, аліментарні), що сприяють захворюванню (особливості конституції, вік, професійні шкідливості), і ті, що посилюють чи прискорюють процес його розвитку (АГ, інфекція, інтоксикація).
P. Houpkins (1981) зробив висновок про те, що серед досліджуваних факторів ризику (а їх >240) можна виділити ініціатори, тобто ті, що дають початок хворобі; активатори — ті, що сприяють її поширенню; потенціатори — ті, що посилюють її прогресування, і преципітатори — ті, що прискорюють розвиток патології.
Доведено, що виникнення ССЗ значною мірою залежить від способу життя людей (табл. 1.1). Усю різноманітність факторів, що впливають на здоров’я, розділяють на 2 основні групи: внутрішні (біологічні) й зовнішні (природні та соціальні). До першої групи факторів відносять стать, вік, конституціональні особливості, спадковість, тип вищої нервової діяльності. До другої групи належать спосіб життя і соціальні умови (географічні, кліматичні, екологічні, професійні фактори, особливості способу життя тощо).
Таблиця 1.1
Фактори ризику
|
Спосіб життя |
Біохімічні та фізіологічні параметри |
Параметри, що не модифікуються |
|
• Висококалорійне харчування з підвищеним вмістом жиру та ХС • Тютюнопаління • Надмірне вживання алкоголю • Недостатня фізична активність |
• Підвищений рівень загального ХС у крові за рахунок ЛПНЩ • Підвищений АТ • Високий рівень ТГ • Гіперглікемія, цукровий діабет • Ожиріння • Тромбогенні фактори |
• Вік • Стать • Спадковість • Наявність у родині гіперхолестеринемії |
На підставі багаторічних досліджень встановлено, що здоров’я населення на 49–53% залежить від способу життя, на 17–20% — від зовнішнього середовища (екологія, клімат), на 18–22% — від спадкових причин (генотип, біологія людини) і на 8–10% — від стану системи охорони здоров’я.
Оскільки для розробки конкретних профілактичних заходів найважливіше значення мають фактори, на які можна впливати, найбільший інтерес із них викликають АГ, порушення обміну ліпідів, тютюнопаління, надлишкова маса тіла та ін.
Фактори ризику можна розділити на категорії залежно від доведеності їх впливу на виникнення і перебіг захворювання.
До факторів ризику I категорії, при зменшенні вираженості яких доведено достовірний позитивний профілактичний вплив на перебіг ІХС, відносять АГ, тютюнопаління, підвищений рівень ХС ЛПНЩ у крові, тромбогенні фактори.
До факторів ризику II категорії, при зменшенні вираженості яких доведена ймовірність позитивного впливу на перебіг ІХС, відносять цукровий діабет, ожиріння, недостатню фізичну активність, низький рівень ХС ЛПВЩ у крові.
До факторів ризику III категорії, зменшення вираженості яких, ймовірно, позитивно впливає на перебіг ІХС, відносять підвищений рівень ТГ у крові, зловживання алкоголем, психосоціальні фактори.
До IV категорії відносять фактори ризику, які не модифікуються: вік, стать, спадковість.
Пошук і визначення факторів, частота і рівні яких корелюють із захворюваністю і смертністю, — предмет епідеміологічних досліджень, що проводилися останнім часом. У результаті була сформульована концепція про фактори ризику, тобто звички, риси та відхилення від норми, які пов’язані зі значним збільшенням схильності до розвитку ССЗ, що найчастіше реєструють у поки ще здорових людей.
Епідеміологічні дослідження з тривалим проспективним спостереженням за захворюваністю та смертністю населення показали, що у класичному варіанті фактор ризику відповідає трьом вимогам:
- з підвищенням його рівня зростає захворюваність і смертність від певної хвороби;
- пацієнти з клінічними проявами захворювання мають більш високий рівень факторів ризику порівняно зі здоровими;
- при немедикаментозному і медикаментозному зниженні рівня фактора ризику зменшується частота ускладнень і смертність від захворювання.
Численні епідеміологічні дослідження довели, що трьома найбільш значимими факторами ризику розвитку захворювань, пов’язаними з атеросклерозом, є гіперхолестеринемія, підвищений рівень АТ і тютюнопаління. Надто небезпечна комбінація цих факторів, навіть помірно виражених, у однієї людини, оскільки їх дія значно підсилюється.
Все більше поширення набуває оцінка сумарного ризику розвитку ІХС у конкретного пацієнта. За результатами проведених проспективних епідеміологічних досліджень розроблені таблиці й моделі ризику ІХС.
Система оцінки ризику SCORE враховує всі варіанти фатальних серцево-судинних подій за 10-річний період і дозволяє визначити прогнозований загальний серцево-судинний ризик та шляхи його зниження.
Показниками високого загального ризику розвитку ССЗ є наявність, кількість та вираженість факторів ризику. Чим вище сумарний ризик розвитку ІХС, тим гірший прогноз захворювання, тим більш рішучою має бути тактика лікаря щодо медикаментозної корекції факторів ризику з метою зниження їх до найнижчого рівня.
Порушення обміну ліпідів. За сучасними уявленнями морфологічні прояви атеросклерозу пов’язані з відкладанням ліпідів на стінці судин. Тому епідеміологічні дослідження базувалися, в першу чергу, на визначенні вмісту ліпідів у крові обстежених і вивченні їх взаємозв’язку з клінічними проявами атеросклерозу.
Перші точні відомості про підвищений рівень ХС як фактор, що спричиняє розвиток ІХС, отримані в популяційному дослідженні у Фремінгемі; встановлено, що при високому вмісті ХС у крові ІХС розвивається у 4 рази частіше, ніж при низькому.
За результатами кооперативного дослідження в 7 країнах серед чоловіків віком 40–59 років поширеність гіперхолестеринемії (≥250 мг/дл) в Японії та Югославії становила 7%, в Італії — 13%, у Греції — 14%, в Нідерландах — 32%, у США — 39%, у Фінляндії — 56%. За 4 роки проспективного спостереження за особами з низьким рівнем ХС ІХС розвилася в 13% обстежених, а при його вмісті ≥260 мг/дл — у 80%.
В кооперативному дослідженні з багатофакторної профілактики встановлено, що поширеність гіперхолестеринемії (≥260 мг/дл) становить у Москві 21,1%, в Бішкеку — 20,0%, в Мінську — 23,6%, в Каунасі — 24,2%, в Ташкенті — 26,8%, в Києві — 16,9%, в Харкові — 14,0%.
Коливання поширеності гіперхолестеринемії зумовлені генетичними особливостями, відмінностями в характері харчування, способі життя тощо.
Вважають, що вживання їжі, багатої на ХС, підтримує його високий вміст у крові і сприяє прогресуванню атеросклеротичних змін у судинах. Саме завдяки додаванню його в їжу тваринам можна моделювати атеросклеротичні зміни в судинах. У вегетаріанців найнижчий рівень ХС у крові, що не перевищує 3,9 ммоль/л. Сприятлива антисклеротична дія рослинної їжі пояснюється наявністю в ній бета-ситостерину, який сповільнює всмоктування ХС в кишечнику. Крім того, харчова клітковина, адсорбуючи жовчні кислоти і ХС, виводить їх з організму.
Значна кількість епідеміологічних досліджень продемонструвала наявність вираженої кореляції між вмістом насичених жирів у раціоні, рівнем ХС у крові та частотою ІХС.
Загальний вміст ХС у крові корелює з ризиком розвитку ІХС більшою мірою у молодих людей, ніж у осіб літнього віку.
За рівнем ХС у крові можна певною мірою судити про вираженість атеросклеротичних уражень коронарних артерій. При гіперхолестеринемії частота раптової смерті підвищується в кілька разів, зростає і смертність від ІХС в цілому.
Оскільки причетність ХС до розвитку ІХС підтверджена даними багатьох досліджень, в подальшому його вміст був використаний як прогностичний тест розвитку нових випадків цього захворювання.
Залишається відкритим питання, при якому рівні ХС починається його значний вплив на судинну стінку. Поширеною є думка, що при значенні ХС менше 4,2–4,8 ммоль/л ІХС виникає рідко.
Визначення вмісту ХС у різних вікових групах показало, що в немовляти його загальний рівень у 2,0–2,5 раза нижчий, ніж у дорослих, і становить 1,3–2,6 ммоль/л. До 14 років цей показник повільно зростає, трохи знижуючись у період статевого дозрівання. Середній вміст ХС у крові підлітків — 4,5 ммоль/л.
З віком його рівень підвищується, становлячи до 40 років в середньому 5,2 ммоль/л. Значення цього показника різко підвищується до 50 років і протягом наступних 10 років майже не змінюється.
Однак у віці старше 65 років спостерігається зниження ХС у зв’язку з тим, що особи з високим його рівнем не доживають до глибокої старості. Для довгожителів характерний низький рівень ХС. У чоловіків його рівень найвищий у 45–54 роки, у жінок він досягає найвищого значення в 65–74 роки.
Отже, при оцінці рівня ХС як фактора, що спричиняє розвиток атеросклерозу та ІХС, необхідно обов’язково враховувати вік.
Збільшення кількості цього показника у крові при старінні зумовлено посиленням його синтезу й утилізації, зміною інтенсивності перетворення в інші речовини (жовчні кислоти, стероїдні гормони тощо). При цьому певне значення може мати розвиток гіпоксії, що приводить до накопичення недоокислених продуктів обміну, з яких за допомогою ацетил-КоА може відбуватися синтез ХС в організмі. З віком знижується надійність систем, що регулюють його постійний рівень у крові, зокрема жовчновидільної функції печінки, тому ХС накопичується у тканинах печінки. Змінюється чутливість клітин і тканин до хімічних речовин, у зв’язку з чим навіть незначне підвищення рівня ХС може спричиняти значні метаболічні зміни.
Вміст ХС залежить від способу життя людини, насамперед від особливостей її харчування і рівня фізичної активності. Його рівень підвищується при ожирінні, АГ, гіпотиреозі.
Якщо всі дослідники одностайні щодо вікових змін загального ХС, то відносно статевих відмінностей його рівня результати проведених досліджень досить суперечливі: одні свідчать, що його вміст вищий в чоловічій популяції, другі стверджують — в жіночій, треті не знаходять статевих відмінностей.
Немає єдності в поглядах дослідників і щодо поширення гіперхолестеринемії серед міського та сільського населення. Так, в Канаді незалежно від статі мешканці сільської місцевості мають більш високі рівні загального ХС, ХС ЛПНЩ, ТГ і нижчі ХС ЛПВЩ, ніж мешканці міст. В Японії різниця в концентрації ХС у плазмі крові серед представників сільських та міських регіонів незначна, а в Білорусі, Казахстані, Узбекистані, Китаї та Венесуелі гіперхолестеринемія більш поширена серед міського населення.
Наведені дані свідчать про необхідність регіонального вивчення ліпідного профілю окремих популяцій з метою його подальшого врахування при розробці профілактичних програм.
Таким чином, дослідники, які займаються проблемою атеросклерозу, приходять до висновку, що саме ХС має відношення до процесів, які врешті стають причиною змін у судинній стінці.
Загальний ХС плазми крові розділяють на 3 класи: ХС, що входить до ЛПНЩ, ЛПДНЩ та ЛПВЩ. ЛПНЩ та ЛПДНЩ транспортують ХС до тканин, зумовлюючи його накопичення в судинах, і сприяють розвитку атеросклерозу. ЛПВЩ відповідають за зворотне транспортування ХС із тканин у печінку, де ХС катаболізується до жовчних кислот, що виводяться через кишечник. Отже, ЛПВЩ мають антиатерогенні властивості.
Підвищений рівень ХС ЛПНЩ — фактор ризику розвитку ІХС, а зворотний зв’язок між вмістом ЛПВЩ та ІХС свідчить про їх захисні властивості. Підвищений рівень ХС у крові — основний показник ризику розвитку ІХС.
З моменту одержання даних про наявність зв’язку між рівнем ХС і частотою виникнення ІХС з’явилося прагнення ідентифікувати інші ліпідні фракції щодо ризику розвитку ІХС. Зіставлення показників смертності від ІХС та ліпідних фракцій у 19 країнах продемонструвало, що 32% смертей зумовлені рівнем ХС ЛПВЩ і 55% — співвідношенням загального ХС і ХС ЛПВЩ. Виявлено негативний кореляційний зв’язок між вмістом ХС ЛПВЩ і показником сумарного атеросклеротичного ураження коронарних артерій за результатами коронарографії. За даними 10-річного проспективного спостереження пацієнтів з ІХС, смертність від цього захворювання підвищується в 5,9 раза при рівні ХС ЛПНЩ >4,13 ммоль/л порівняно з хворими, рівень ХС ЛПНЩ яких становить 3,35 ммоль/л.
У пацієнтів з ІХС з порушеним обміном ліпідів відзначали прогресування стенозів: через 2 роки у 39% випадків, через 3 — у 48%. При підвищенні вмісту загального ХС у крові на 10 мг/дл стеноз збільшувався на 1%. Інтенсивність процесу корелює із зростанням вмісту ХС ЛПНЩ та зниженням рівня ХС ЛПВЩ.
Згідно з методичними рекомендаціями Українського товариства кардіологів (2007) запропоновані такі рівні ХС:
- бажаний (<5,2 ммоль/л) або нормальний;
- погранично підвищений (5,2–6,1 ммоль/л);
- високий (>6,2 ммоль/л).
Цільовим рівнем ХС для загальної популяції є стійка його концентрація <5,2 ммоль/л.
Підвищений рівень ХС у крові — один із найпотужніших факторів ризику розвитку ІХС. В епідеміологічних дослідженнях, що базуються на тривалих спостереженнях популяцій, доведено, що частота нових випадків ІМ та смерті від ІХС вища у осіб з більш високим рівнем ХС в крові. Смертність від ІХС зростає у 2 рази з підвищенням рівня ХС від 5,2 до 6,5 ммоль/л і в 3 — при рівні ХС ≥7,8 ммоль/л. У осіб з ІХС та іншими захворюваннями, зумовленими атеросклерозом, підвищений рівень ХС виявляють частіше, ніж в загальній популяції. ІХС відзначають рідше в тих країнах, де середньопопуляційний рівень ХС у крові низький, і частіше там, де середній рівень ХС >5,2 ммоль/л.
Загальний ризик розвитку ІХС значно зростає, якщо підвищений рівень ХС поєднується з іншими факторами ризику: АГ, тютюнопалінням, ожирінням, цукровим діабетом, порушеною толерантністю до глюкози.
Зниження рівня ХС у крові сприяє зниженню ризику розвитку ССЗ.
Після робіт G. Wigand (1960), якому вдалося відтворити атеросклероз, вводячи кролям не ХС, а ТГ, велику увагу в механізмі атеросклеротичних уражень судин стали приділяти і гіпертригліцеридемії.
За даними клінічних спостережень та популяційних досліджень доведено, що вміст ТГ у сироватці крові >2,1 ммоль/л спричиняє швидкий розвиток атеросклерозу.
У проспективному дослідженні, проведеному у Стокгольмі (Швеція), виявлено, що саме ТГ плазми крові, а не ХС, — значимий і незалежний фактор ризику розвитку ІХС. З підвищенням їх рівня зростає показник смертності від ІХС.
Майже всі ретроспективні дослідження свідчать, що пацієнти з ІХС мають більш високий рівень ТГ порівняно з особами без її проявів.
Однак виникає питання — чи зумовлені атеросклероз та ІХС підвищеним вмістом ТГ незалежно від рівня ХС? З практичної точки зору ця проблема не має великого значення, оскільки ізольовану гіпертригліцеридемію виявляють рідко, в більшості випадків відбувається одночасне підвищення цих двох показників. Крім того, гіпертригліцеридемія часто поєднується з надлишковою масою тіла чи цукровим діабетом.
У 14 із 15 досліджень, присвячених вивченню взаємозв’язку між підвищеним рівнем ТГ крові у чоловіків і виникненням ІМ або стенокардії, підтверджена лінійна залежність між рівнем ТГ і частотою розвитку ІХС. Результати покрокового логістичного аналізу свідчать, що рівні ТГ у крові є предикторами розповсюдженості уражень коронарних судин.
Для вивчення поширеності дисліпопротеїнемії в українській популяції при проведенні епідеміологічних обстежень міських і сільських жителів визначали частоту гіперхолестеринемії та гіпертригліцеридемії в кожній статево-віковій групі.
Результати свідчать, що 36,8% чоловіків віком 18–64 років мають підвищений (≥5,2 ммоль/л) рівень ХС у плазмі крові.
Найнижчу поширеність гіперхолестеринемії визначають у віці 18–24 років, а в 55–64 роки її реєструють у кожного другого. Аналогічна динаміка виявлена і у поширеності гіпертригліцеридемії (табл. 1.2).
В жіночій популяції у кожної другої відзначено підвищений рівень ХС у крові. З віком підвищується частота гіперхолестеринемії, причому найбільший її приріст (на 21,7%) відбувається між 25–34 та 35–44 роками. Зміни розповсюдженості гіпертригліцеридемії за віком майже аналогічні.
Серед сільських чоловіків віком 18–64 років підвищений рівень ХС виявлено у 33,6%, а підвищений вміст ТГ в плазмі крові — у 37,5%. Найнижчу поширеність гіперхолестеринемії та гіпертригліцеридемії відзначено у осіб віком 18–24 років. З віком вона поступово підвищується.
Частота гіперхолестеринемії серед сільських жінок становить 45,3%, а поширеність гіпертригліцеридемії — 43,9%. Динаміка поширеності цих показників за віком аналогічна.
Серед чоловіків, які проживають у сільській місцевості, гіпертригліцеридемію реєструють в 1,4 раза, а серед жінок, що мешкають у сільській місцевості, — в 2,5 раза частіше, ніж серед обстежених міських жителів. Такі відмінності певною мірою зумовлені особливостями характеру харчування населення. Адже основу харчового раціону сільських жителів становлять молоко, м’ясо, яйця, картопля і хліб. Питома вага овочів та фруктів не перевищує 15,0%. Калорійність раціону жителів села значно перевищує відповідні показники жителів міста за рахунок достовірно більшого споживання жирів та цукру.
АГ — один з провідних факторів ризику розвитку хвороб системи кровообігу.
Чим вищий АТ, тим вищий ризик розвитку мозкового інсульту та ІХС. У пацієнтів з АГ в 3–4 рази вищий ризик виникнення ІХС та в 7 разів — мозкового інсульту порівняно з особами з нормальними показниками АТ.
Прогностичне значення АГ щодо виникнення ССЗ підвищується з віком. Серед осіб з АГ ІІ ступеня ризик їх виникнення коливається від 1% у віці 25–34 років до 30% — у 65–74 роки.
В економічно розвинених країнах майже у кожного третього виявляють підвищений АТ, частіше — в осіб негроїдної раси та у жителів Скандинавських країн.
В Україні стандартизований за віком показник поширеності АГ в міській популяції становить 29,3%, в тому числі 32,5% серед чоловіків і 25,3% серед жінок (рис. 1.1).
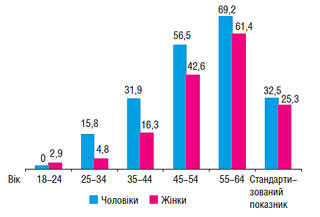
Рис. 1.1. Статево-вікова поширеність АГ в міській популяції, %
У сільській популяції поширеність АГ вища — 36,3%, зокрема серед чоловіків — 37,9%, серед жінок — 35,1% (рис. 1.2).
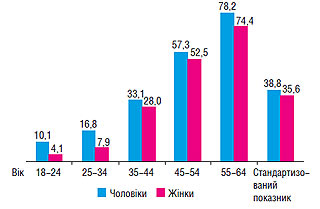
Рис. 1.2. Статево-вікова поширеність АГ в сільській популяції, %
У структурі за рівнем АТ домінує АГ I ступеня, її реєструють у половини осіб з підвищеним рівнем АТ (рис. 1.3).
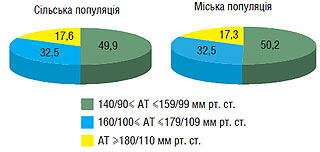
Рис. 1.3. Структура АГ за рівнем АТ, %
У кожного третього хворого виявляють АГ II ступеня, а у кожного шостого — АГ III ступеня. Відмінностей щодо питомої ваги АГ різного ступеня в міський та сільській популяціях не виявлено.
Результат аналізу структури АГ за її окремими формами свідчить, що в обох популяціях найпоширеніша форма — змішана АГ, яку відзначають у 2/3 осіб з підвищеним АТ (рис. 1.4).
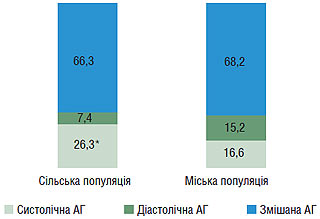
Рис. 1.4. Структура АГ залежно від форми, %
У міській популяції майже однаково часто виявляють ізольовану систолічну (16,6%) та діастолічну (15,2%) форми АГ. У сільській популяції питома вага ізольованої систолічної АГ, наявність якої сприяє розвитку ускладнень та зумовлює високий рівень індивідуального ризику смерті внаслідок ССЗ, в 3,6 раза перевищує частоту ізольованої діастолічної АГ та виявляється в 1,6 раза частіше, ніж у міській популяції.
Нині не викликає сумніву той факт, що АГ — патологічний стан, який підлягає корекції, інакше можливий розвиток серйозних ускладнень у вигляді порушення мозкового кровообігу, серцевої чи ниркової недостатності. Крім того, дослідження підтверджують провідну роль АГ у виникненні та прогресуванні атеросклерозу, а значить і ІХС.
Результати Фремінгемського дослідження продемонстрували чітку залежність між рівнем АТ і частотою виникнення нових випадків мозкового інсульту, СН, всіх форм ІХС та атеросклерозу судин нижніх кінцівок. Незалежно від того, супроводжується АГ суб’єктивними скаргами чи її перебіг безсимптомний, — прогноз, як правило, однаковий.
На підставі аналізу смертності чоловіків віком 40–59 років у 6 країнах доведено пріоритетне значення АГ у формуванні рівня смертності від ІХС. На підставі даних 9 проспективних досліджень, які сумарно включали 42 тис. осіб з середнім періодом спостереження 10 років, виявлена наявність лінійного зв’язку між рівнем ДАТ у межах 90–110 мм рт. ст. і частотою виникнення ІХС. При стійкому підвищенні середнього ДАТ на 5 мм рт. ст. ризик розвитку ІМ підвищується на 21%, а при підвищенні ДАТ на 10 мм рт. ст. — відповідно на 37%. У дослідженні MRFIT встановлено, що відносний ризик виникнення ІХС зростає від 1,0 при САД <120 мм рт. ст. і ДАТ <80 мм рт. ст. до 3,23 при підвищенні САТ і ДАТ >160 та 110 мм рт. ст. відповідно.
За даними проведених нами епідеміологічних досліджень, поширеність ІХС зростає з підвищенням АТ. Її частота серед осіб з АГ в 3,5 раза вища, ніж у обстежених без АГ. Серед пацієнтів з ІХС у кожного другого реєструють підвищений АТ.
Найчастіше ІХС асоціюється з систолічною та змішаною АГ. Для характеристики вираженості факторів ризику розвитку ІХС використовують поняття відносного ризику, який визначають як відношення частоти ІХС при високому рівні фактора (верхня дециль) до її частоти при низькому його рівні (нижня дециль). Імовірність розвитку ІХС при високому САТ у чоловіків віком 40–49 років в 4,0 рази, а 50–59 років — в 6,0 разів вища, ніж при низьких його значеннях. Аналогічно для ДАТ ризик розвитку ІХС при високих значеннях в 40–49 років в 3,0 рази, а в 50–59 років — у 5 разів вищий, ніж при низьких його значеннях. Для жінок відносний ризик для САТ становить 2,7 і 5,0; для ДАТ — 2,0 і 3,0 відповідно.
Отже, відносний ризик розвитку ІХС підвищується з віком та є більше високим для САТ, ніж для ДАТ.
У пацієнтів з ІХС середній рівень АТ значно вищий, ніж у осіб без ІХС. Наведені дані переконливо свідчать, що АГ, безумовно, впливає на ризик розвитку ІХС.
Аналіз смертності серед осіб з різними формами АГ показує, що наявність ізольованої АГ підвищує ризик загальної смертності у чоловіків в 4,5 раза, у жінок — у 2,0 рази.
Незалежно від статі, найбільш несприятливий віддалений прогноз спостерігається для хворих зі змішаною формою АГ. Так, серед чоловіків з цією формою АГ показники смертності від усіх причин та від ССЗ відповідно в 2,4 і 1,9 раза вищі, ніж серед осіб з діастолічною АГ, та в 1,2 і 1,3 раза вищі, ніж серед пацієнтів з систолічною АГ. У жінок за наявності змішаної форми АГ загальний ризик смерті від хвороб системи кровообігу в 1,6 раза вищий, ніж у осіб з систолічною формою АГ.
Поєднання підвищеного САТ та ДАТ не лише підвищує ризик загальної смерті, але й значно впливає на середню тривалість життя. Серед померлих зі змішаною формою АГ середня тривалість періоду від обстеження до смерті становила у чоловіків 11,9±4,1 року, у жінок — 12,7±3,8 року, тоді як для осіб з діастолічною АГ — відповідно 14,3±3,4 та 15,4±2,7 року, а з систолічною АГ — 15,7±1,4 і 16,0±2,4 року.
Показник загальної смертності мультиплікативно зростає відповідно з кількістю супутніх АГ факторів ризику. Відносний ризик серцево-судинної смерті підвищується у чоловіків від 1,0 при ізольованій АГ до 7,9 у тому разі, якщо АГ поєднується з трьома факторами ризику; у жінок — від 1,0 до 3,4 відповідно.
Виникнення та перебіг АГ тісно пов’язані з наявністю наступних факторів ризику:
Вік. Існує позитивна залежність між АТ та віком. Загалом рівень ДАТ підвищується до 55 років, потім змінюється мало. САТ з віком постійно підвищується.
Стать. Середній рівень АТ і поширеність АГ у жінок молодого та середнього віку трохи нижчі, ніж у чоловіків. Пізніше ця залежність змінюється аж до реверсії.
Расові та етнічні особливості. У осіб негроїдної раси частота АГ трохи вища, ніж у інших рас. Відмінності в рівнях АТ у американців негроїдної і європеоїдної раси та африканців становлять близько 5 мм рт. ст. у 2-й віковій декаді та близько 20 мм рт. ст. — у 6-й, тобто має місце більший повіковий приріст АТ у осіб негроїдної раси. У них же спостерігають вищий ризик ускладнень з боку нирок.
Спадковість — один із найбільш значимих факторів для майбутнього розвитку АГ. Виявлено тісну кореляцію між АТ у найближчих родичів (батьки, брати і сестри).
Генетичні аспекти. Експериментальні дослідження підтвердили генетичну основу високого АТ і хоча описані деякі моногенні гіпертензивні порушення у людини, в основному АГ є полігенним захворюванням. Сьогодні вивчається цілий ряд генів, які, можливо, відповідають за виникнення АГ. Ймовірно, в майбутньому за допомогою методів молекулярної біології стане можливим виявлення осіб, схильних до розвитку АГ.
Особливості неонатального періоду. Несприятливе навколишнє середовище у критичні періоди внутрішньоутробного розвитку та передчасні пологи є факторами ризику виникнення ССЗ, зокрема високого АТ. Наявність зворотної залежності між рівнем АТ і масою тіла при народженні доведена у проспективних дослідженнях, проведених серед дітей та дорослих.
Центральне ожиріння та метаболічний синдром. Ожиріння позитивно корелює з рівнем АТ. Поєднання ожиріння, резистентності до інсуліну, гіперінсулінемії, зниженої толерантності до глюкози, порушень ліпідного обміну і АГ — предмет пильної уваги дослідників. Встановлено зв’язок між підвищенням рівня інсуліну та ростом АТ.
Маса тіла. Кореляція між масою тіла і рівнем АТ пряма, сильна і стійка. Надлишкова маса асоціюється з 2–6-кратним підвищенням ризику виникнення АГ.
Аліментарні фактори:
- NaCl — кухонна сіль. Її вживання вище фізіологічної норми позитивно корелює з АГ.
- Інші макроелементи. Існує зворотний зв’язок між споживанням К+, Са2+, Mg2+ та рівнем АТ.
- Інші компоненти: білки, жири, вуглеводи, харчові волокна. Переважання в раціоні овочів та фруктів, риби, курячого м’яса, обмеження вживання насичених жирів, ХС і солодощів сприяє зниженню АТ.
- Кава. Відновлення пресорного ефекту кофеїну відбувається через кілька годин після вживання кави. АГ виникає у 3 рази частіше серед тих, хто вживає від 1 до 5 чашок кави в день порівняно з тими, хто не вживає кави взагалі. Кофеїн, який міститься в міцній каві, підвищує ДАТ у чоловіків з підвищеним АТ на 8 мм рт. ст., а у осіб з нормальним АТ — на 3 мм рт. ст.
- Алкоголь. Вживання алкоголю прямо корелює з рівнем АТ, причому як епізодичне, так і хронічне. Залежність між вживанням алкоголю та поширеністю АГ має вигляд J-подібної кривої. Частота АГ мінімальна серед осіб, які вживають алкоголь епізодично в невисоких дозах, і поступово зростає залежно від частоти і щоденної кількості вживаних алкогольних напоїв.
Тютюнопаління. Нікотин при палінні різко підвищує АТ навіть у затятих курців. Гіпертензивний ефект кожної сигарети триває близько 30 хв. Уже на 1-й хвилині після викурювання сигарети САТ підвищується на 15 мм рт. ст., а на 4-й — на 25 мм рт. ст. При однакових рівнях АТ мозковий інсульт та ІХС серед курців виникають у 2–3 рази частіше, ніж у тих, хто не палить.
Психосоціальні фактори. Стрес спричиняє підвищення АТ, хоча досі не відомо, чи приводить тривалий стрес до тривалого підвищення АТ.
Соціально-економічний статус. У країнах постперехідного періоду відзначають зворотний зв’язок між рівнем АТ і освітою, доходами та професійним статусом. Водночас у країнах перехідного і доперехідного періоду виявляють значну поширеність АГ серед забезпечених верств населення. Досвід більшості країн свідчить, що по мірі зростання економіки в суспільстві реєструється неухильне підвищення рівня АТ та розповсюдженості АГ серед малозабезпечених верств населення.
Фізична активність. У осіб, які ведуть малорухомий спосіб життя, ризик виникнення АГ на 20–50% вищий, ніж у фізично активних. Фізичні навантаження під час виконання професійних обов’язків сприяють підвищенню АТ, а фізична активність під час дозвілля — навпаки. Регулярні аеробні фізичні навантаження — досить ефективний засіб немедикаментозного лікування АГ.
Фактори навколишнього середовища. Шум, забруднення повітря, погана якість питної води — фактори ризику виникнення АГ.
Таким чином, на рівень АТ впливає безліч факторів: вік, стать, ступінь фізичного навантаження, емоційний стан, температура навколишнього середовища, атмосферний тиск. Значення АТ коливаються під час сну і активності, в робочі та вихідні дні, при зміні положення тіла, залежно від методів та умов його вимірювання. З урахуванням цього стає зрозумілим, що критерії нормального і підвищеного АТ певною мірою є умовними.
Встановлення критеріїв АТ базується на результатах обстеження великих груп населення і співвідношенні рівня АТ з ризиком виникнення серцевих, мозкових ускладнень, а також ризиком передчасної смерті.
Для визначення ступеня епідеміологічного неблагополуччя в популяції необхідно оцінити частоту поєднання АГ з іншими факторами ризику. З цією метою нами проаналізована якісна і кількісна асоціативність АГ залежно від віку. Отримані дані свідчать, що в обстеженій популяції АГ має високий рівень поєднання з іншими факторами ризику. Уже в 20–29 років у кожного другого обстеженого АГ поєднується з одним або двома факторами ризику. В 30–39 років ізольовану АГ реєструють лише у 21,7% пацієнтів. Більше половини (55,6%) осіб цієї вікової категорії курять, у 33,3% АГ поєднується з дисліпопротеїнемією, 27,8% мають надлишкову масу тіла і 16,7% ведуть малорухомий спосіб життя. Поєднання АГ з 2 і більше факторами ризику виявляють у 39,2% обстежених. В наступному віковому десятилітті кількість осіб з ізольованою АГ зменшується до 10,7%. Питома вага чоловіків з АГ, які курять, становить 46,4%; поєднання АГ та дисліпопротеїнемії реєструють у 39,3%, АГ і надлишкової маси тіла — у 42,9%; АГ і низької фізичної активності — у 35,7%. У віці 50–59 років поєднання АГ і вищезазначених факторів ризику визначають у 88,9% осіб з підвищеним АТ: АГ з тютюнопалінням — у 50,0%; АГ з дисліпопротеїнемією — у 48,9%; АГ з надлишковою масою тіла — у 36,4%; АГ з низькою фізичною активністю — у 36,4%. У віковій групі 60–64 років найчастіше реєструють поєднання АГ з низькою фізичною активністю — 34,2%; серед осіб з підвищеним АТ курять 21,1%, у 18,4% відзначають порушення обміну ліпідів (табл. 1.3).
Таблиця 1.3
Розподіл поєднань АГ з іншими факторами ризику (ФР), %
|
Вік, років |
Ізольована АГ |
АГ + 1 ФР |
АГ + 2 ФР |
АГ + ≥3 ФР |
| 20–29 | 50,0 | 37,5 | 12,5 | – |
| 30–39 | 21,7 | 39,1 | 30,5 | 8,7 |
| 40–49 | 10,7 | 30,4 | 41,1 | 17,8 |
| 50–59 | 11,1 | 28,7 | 38,9 | 21,3 |
| 60–64 | 26,3 | 44,8 | 18,4 | 10,5 |
| 20–64 | 15,9 | 33,0 | 34,3 | 16,8 |
Поєднання АГ + дисліпопротеїнемія + тютюнопаління, що за даними численних проспективних досліджень має найбільш несприятливий прогноз для життя, реєструють у кожного п’ятого пацієнта.
Загалом серед усіх обстежених з АГ поширеність цієї тріади в 30–39 років становить 1,1%, в 40–49 років — 12,5%, в 50–59 років — 14,8%.
Зазначимо, що висока частота факторів ризику серед осіб з АГ, більшість з яких пов’язана із способом життя і може змінюватися, — свідчення незадовільної роботи лікарів первинних структур охорони здоров’я щодо вторинної профілактики АГ.
Відомо, що незбалансоване харчування, надмірне вживання кухонної солі, недостатня фізична активність, зловживання алкоголем сприяють розвитку АГ. Поінформованість населення про значення цих факторів значною мірою визначає успіх її первинної профілактики. Однак 74% опитаних осіб не можуть назвати жодного фактора ризику розвитку АГ. Найчастіше причинами її розвитку вважають вживання алкоголю і стреси. Вживання кухонної солі та переїдання відзначають відповідно 8,3 та 7,6% респондентів; 14,3% опитуваних вважають, що фізична культура знижує АТ, і майже стільки ж (12,9%) вважають фізкультуру фактором, що сприяє розвитку АГ, решта взагалі не змогли відповісти, як впливає фізкультура на рівень АТ.
У літературі є повідомлення про ефективність санітарно-профілактичної роботи при АГ. Американські дослідники відзначають підвищення поінформованості населення країни внаслідок проведення Національної освітньої програми боротьби з АГ. Так, за 9 років кількість осіб, які знають про гіпертензивну дію кухонної солі, збільшилася від 5 до 31%, а обізнаних про значення незбалансованого харчування і переїдання — від 9 до 35%. У Молдові внаслідок проведення освітніх заходів серед населення за 4 роки обізнаність про гіпертензивну дію кухонної солі зросла від 8,0 до 32,3%, а про надлишкову масу тіла — від 2,6 до 18,1%. Ступінь ефективності освітніх заходів залежить від інтенсивності та форм їх проведення, від соціальних та культурологічних характеристик популяції, що визначають її готовність сприйняти таке втручання, але, безсумнівно, існує принципова можливість підвищення рівня знань про АГ і поліпшення ставлення хворих до її лікування.
Світовий досвід щодо контролю АГ в популяції переконливо доводить, що населення має знати свій АТ, розуміти, підвищений він чи ні, а за наявності АГ — лікувати її. Проведені нами дослідження показали, що знають про наявність у себе АГ 80,8% міських жителів нашої країни і 67,8% — жителів сільської місцевості. Приймають які-небудь антигіпертензивні препарати відповідно 48,4 та 38,3% хворих, а ефективність лікування становить лише 18,7% у міській та 8,1% — у сільській популяціях (табл. 1.4).
Відомо, що жінки більше уваги приділяють своєму здоров’ю, більш сумлінно ставляться до рекомендацій лікаря, ретельніше виконують його призначення. Тому серед них порівняно з чоловіками достовірно більше осіб, які знають про підвищений АТ, значно більший відсоток охоплення медикаментозним лікуванням і вищий показник його ефективності.
Інформованість населення про підвищений АТ, а також поширеність АГ залежать від освітнього рівня обстежених: з підвищенням рівня освіти знижується частота АГ і зростає обізнаність населення про захворювання.
Поінформованість хворих про наявність АГ та кількість осіб, які лікуються, незалежно від статі збільшується з віком, в той час як ефективність лікування у всіх вікових групах змінюється мало.
Для зниження ризику розвитку тяжких ускладнень АГ важливим є своєчасне призначення антигіпертензивної терапії, яка обов’язково має включати і заходи щодо зміни способу життя. Результати проведених досліджень свідчать, що на рівні первинних структур охорони здоров’я майже повністю ігноруються випадки АГ І ступеня, в лікуванні відзначається явна недооцінка важливості застосування немедикаментозних методів корекції підвищеного АТ, акцент робиться на призначенні лікарських засобів.
Відповідно до сучасних уявлень у терапії АГ перевагу слід віддавати медикаментозним препаратам першого ряду, до яких відносять діуретики, блокатори β-адренорецепторів, інгібітори АПФ, антагоністи кальцію тривалої дії та антагоністи рецепторів ангіотензину ІІ. Блокатори α-адренорецепторів, алкалоїди раувольфії, агоністи центральних α2-адренорецепторів, вазодилататори, становлячи групу препаратів другого ряду, не розглядаються як препарати вибору, оскільки вони часто не відповідають вимогам тривалої терапії і можуть призначатися лише в окремих випадках.
Проведені дослідження свідчать, що стереотипи медикаментозної терапії АГ не відповідають сучасним концепціям: 16,6% міських і 29,1% — сільських жителів з підвищеним АТ як монотерапію застосовують препарати другого ряду.
Адекватне антигіпертензивне лікування сприяє збільшенню середньої тривалості життя хворих на 8 років та істотній зміні структури летальності, насамперед за рахунок зменшення кількості фатальних мозкових інсультів та ІМ майже в 2 рази.
Таким чином, на сучасному етапі необхідно продовжувати підвищення інформаційного рівня населення про АГ і мотивацію хворих до контролю та лікування АГ спільними зусиллями медичних працівників і засобів масової інформації.
Установлені факти зумовили необхідність проведення національних програм щодо виявлення та боротьби з АГ. В наш час такі програми активно розробляють та успішно впроваджують у багатьох країнах світу, зокрема в Україні.
Указом Президента України від 4 лютого 1999 р. № 117/99 затверджена Програма профілактики та лікування артеріальної гіпертензії в Україні. Мета програми — зниження захворюваності населення на АГ, ІХС, судинні ураження мозку, смертності від ускладнень АГ, збільшення тривалості й підвищення якості життя хворих серцево-судинними захворюваннями.
Завдання програми:
- пропаганда здорового способу життя;
- зміцнення охорони здоров’я кадрами та ресурсами, необхідними для здійснення медико-санітарної освіти населення, виявлення хворих на АГ, профілактика АГ та її ускладнень;
- створення стандартів діагностики і лікування на підставі наукових даних, забезпечення ефективної діагностичної, лікувальної, реабілітаційної допомоги при АГ та її ускладненнях;
- забезпечення населення ефективними антигіпертензивними засобами та приладами для вимірювання АТ.
Виконання програми розраховане на 1999–2010 рр.
Реалізація заходів, передбачених програмою, дозволить домогтися підвищення показників громадського здоров’я та економічного ефекту, а саме:
- підвищення обізнаності населення про наявність АГ до 90%;
- збільшення до 70–75% кількості хворих на АГ, які регулярно приймають антигіпертензивні препарати;
- зниження захворюваності на цереброваскулярні хвороби при АГ на 20–30%, а при ІХС — на 10%;
- зниження смертності від мозкового інсульту на 20–30%, від ІХС — на 10%;
- зменшення втрати працездатності внаслідок зниження тимчасової і стійкої непрацездатності та передчасної смерті.
З огляду на поширеність АГ та її ускладнень, ефективне проведення профілактичних і лікувальних заходів сприятиме підвищенню загальної тривалості життя населення.
Реалізація програми передбачає не лише постійне розширення знань лікарів про нові найбільш ефективні антигіпертензивні лікарські засоби, але й навчання індивідуальному підходу до їх призначення хворому з урахуванням їх вартості та фінансових можливостей пацієнта, а також активному контролю ефективності призначеного лікування та коригуванню супутніх факторів ризику.
Це потребує значних зусиль з боку медичних працівників первинних структур охорони здоров’я, оскільки переважна більшість хворих все ще лікуються неефективно і, таким чином, залишаються у групі підвищеного ризику розвитку ускладнень АГ.
Тютюнопаління. Зв’язок тютюнопаління з розвитком хвороб системи кровообігу сильний, стійкий і доведений результатами великих епідеміологічних, клінічних і експериментальних досліджень. Найпоширенішими захворюваннями і патологічними станами серцево-судинної системи, спричиненими тютюнопалінням, є ІХС, зокрема ІМ, раптова коронарна смерть, церебральні судинні порушення тощо.
Серед можливих зв’язків тютюнопаління з атеросклерозом виділяють 4 основні механізми ураження серцево-судинної системи: гіперкоагуляція, порушення транспорту кисню монооксидом вуглецю, звуження коронарних судин, несприятливі гемодинамічні ефекти нікотину. Біологічні ефекти тютюнопаління залежать від компенсаторних можливостей серцево-судинної системи та піддаються індивідуальним коливанням.
Численні епідеміологічні обстеження населення різних країн не тільки встановили зв’язок тютюнопаління з розвитком ІХС, виникненням ІМ або раптової коронарної смерті, але й продемонстрували значне зниження ризику коронарної смерті у осіб, які відмовилися від куріння.
За даними Фремінгемського дослідження, тютюнопаління в 2 рази підвищує ризик розвитку стенокардії та ІМ і в 4,9 раза — раптової смерті. Результати 5 проспективних досліджень у США показали, що серед чоловіків віком 40–64 років, що викурюють не менше 20 сигарет на добу, в 2,5 раза частіше реєструють ІХС та в 3,2 раза — напади її загострення.
Встановлено, що тютюнопаління зумовлює понад 80% всіх випадків смерті від ІХС у чоловіків віком 35–44 років і 27% в 45–64 роки. Загалом близько 1/3 випадків смерті від цього захворювання серед осіб середнього віку пов’язане з тютюнопалінням.
Відносний ризик розвитку ІХС особливо високий в молодих вікових групах чоловіків та жінок, які курять. Так, нефатальний ІМ у чоловіків віком 30–49 років, які курять, виникає у 5 разів, в 50–59 років — у 3 рази, в 60–79 років — у 2 рази частіше, ніж у їх однолітків, які не курять. Результати міжнародного дослідження MONICA свідчать, що 65% випадків нефатального ІМ серед чоловіків та 55% серед жінок віком 35–39 років спричинені тютюнопалінням. Серед чоловіків молодого віку, які курять, фатальний ІМ реєструють в 4 рази частіше, ніж серед тих, хто не курить.
За допомогою численних епідеміологічних і клінічних досліджень, проведених протягом останніх 30 років, доведено, що всі форми споживання тютюну (куріння цагарок, сигарет, сигар, трубок, вживання жувального чи нюхального тютюну), а також продукти його згоряння, впливаючи на тих осіб, які самі не курять (пасивне чи змушене тютюнопаління), значно підвищують їх захворюваність і передчасну смертність.
Ризик виникнення захворювань залежить як від кількості сигарет, що викурюється, так і від тривалості тютюнопаління. В наш час не існує поняття безпечної сигарети або безпечного рівня куріння.
Споживання тютюну значно впливає на стан здоров’я людини, оскільки в тютюновому димі міститься багато хімічних компонентів (нікотин, смоли, монооксид вуглецю) і подразнюючих речовин.
Тютюнопаління впливає на організм людини негайно та спричиняє тривалі ефекти. Негайний вплив — наслідок прямої нікотиніндукованої вазоконстрикції та підвищення рівня адреналіну в крові; проявляється у підвищенні ЧСС на 30%, АТ — на 5–10 мм рт. ст., уповільненні периферичного кровообігу, що спричиняє зниження температури верхніх і нижніх кінцівок. Тривалі ефекти пов’язані зі смолами, що містять понад 40 канцерогенних речовин і є причиною злоякісних захворювань; окисом вуглецю і газами, що сприяють розвитку ССЗ; подразнюючими речовинами та ціаністим воднем, що зумовлюють виникнення бронхіту й емфіземи ленень. Нікотин як такий не грає провідної ролі в розвитку захворювань, однак, з ним пов’язане виникнення залежності, яка підтримує споживання тютюну і перешкоджає відмові від тютюнопаління.
Відомо, що найнебезпечнішими наслідками тютюнопаління щодо розвитку гострої серцево-судинної патології є нікотиніндукована пряма вазоконстрикція, прискорення згортання крові (підвищення концентрації фібриногену, в’язкості крові, здатності тромбоцитів до агрегації) і зниження транспорту кисню еритроцитами. Нікотин як м’який симпатоміметик активує симпатичну нервову систему. В поєднанні з вазоконстрикторною дією це може послужити причиною маніфестації ішемії.
Нині вважають, що основну ушкоджувальну дію на серцево-судинну систему зумовлює окис вуглецю і окисні гази. Окис вуглецю зменшує транспорт кисню кров’ю та його доставку до міокарда, внаслідок чого настає компенсаторне збільшення коронарного кровотоку, спрямоване на адекватне забезпечення потреби в кисні. При хронічному впливі окису вуглецю розвивається поліцитемія, підвищується в’язкість крові, що сприяє розвитку гострого тромбозу. Гази-окислювачі модифікують ЛПНЩ, підвищуючи їх атерогенність, спричиняють ушкодження ендотелію та порушують вивільнення окису азоту з амінокислоти α-аргініну. Вони також змінюють функцію тромбоцитів і сприяють розвитку тромбозів.
Компоненти тютюнового диму можуть впливати на метаболізм серцево-судинних препаратів, рецепторний апарат, активувати речовини-антагоністи, підсилювати несприятливі ефекти лікарських засобів або створювати додаткові умови, що провокують виникнення побічних ефектів медикаментозного лікування. Тютюнопаління служить причиною несприятливого впливу на ефективність і безпеку лікування пацієнтів з серцево-судинною патологією.
Результати експериментальних досліджень показали, що компоненти тютюнового диму послаблюють гіпотензивний ефект блокаторів β-адренорецепторів. Хворим з підвищеним АТ, які курять, потрібні препарати для його корекції у більш високих дозах.
У пацієнтів з ІХС, які курять, спостерігають зниження антиангінального ефекту атенололу, пропранололу і ніфедипіну; застосування блокаторів β-адренорецепторів на 30% частіше супроводжується різноманітними побічними ефектами, серед яких — порушення ритму серця, біль у нижніх кінцівках і задишка.
Смертність від ССЗ серед курців в 2 рази вища, ніж серед тих, хто не курить. Тютюнопаління на 30–40% зумовлює смертність від ІХС. Її ризик підвищується на 1,9% у тих, хто викурює щодня 10 сигарет і на 3,4% — при щоденному викурюванні більше 20 сигарет. У курців зменшується тривалість життя, а раптова серцева смерть настає в 2 рази частіше. Після припинення куріння знижується ризик захворювань, однак, він все одно вищий, ніж у осіб, які ніколи не курили.
Чим раніше людина відмовляється від тютюнопаління, тим більш сприятливий для неї прогноз. Вже через рік після припинення куріння ризик розвитку ІХС знижується на 50%, а ймовірність ІМ або смерті від нього у пацієнтів з діагностованою ІХС знижується на 30–36%. Найкращі результати реєструють через 10–14 років після відмови від куріння.
За даними R. Doll та співавторів (2004), особи, які регулярно курять, в середньому втрачають 10 років життя, тобто вмирають на 10 років раніше, ніж їх однолітки, які не курять. Найбільший внесок в роки втраченого життя належить ІХС та інсульту. Встановлено, що ті, хто кидає курити у віці до 60; 50 і 40 років, зберігають у середньому 3; 6 або 9 років життя порівняно з тими, хто продовжує курити. Особи, які припинили курити до 30 років, мають практично таку ж тривалість життя, як і ті, які не курять.
Спостереження за курцями протягом 10 років продемонструвало значно вищу частоту стенокардії серед чоловіків, які регулярно курять.
Епідеміологічні дослідження показали, що при щоденному викурюванні 20 сигарет у віці 50; 60 і 70 років частота коронарної патології становить 11,9; 18,3 та 19,0 на 1 тис. населення; показники для тих, які не курять, становлять 3,6; 5,7 і 15,3 відповідно.
У осіб, які викурюють щодня 15 сигарет, ризик захворіти на ІХС у 2 рази, а у тих, хто викурює 40 сигарет — в 12,5 раза вищий, ніж у тих, які не курять. Поширеність ІХС серед курців становить 15,8%, серед тих, хто ніколи не курив, — 14,2%, а серед тих, хто курив у минулому, вона значно вища — 21,7%. Така ситуація пояснюється тим, що відмова від куріння в переважній більшості випадків пов’язана з погіршенням стану здоров’я.
Кумулятивним впливом хронічної тютюнової інтоксикації є зменшення очікуваної тривалості життя: 35-річна жінка, яка курить, проживе на 5 років, а 35-річний чоловік, який курить, — на 7 років менше, ніж їх однолітки, які не курять.
Існують значні відмінності в поширеності тютюнопаління як у різних країнах, так і серед різних груп населення. Активні заходи щодо боротьби з тютюнопалінням, здійснювані у країнах Західної Європи і США протягом останніх 50 років, сприяли значному зниженню розповсюдженості тютюнопаління. Так, у США серед чоловіків вона знизилася від 52,0 до 20,9%, а серед жінок — від 34,0 до 21,3%, однак рівень поширеності тютюнопаління там залишається досить високим, кількість курців збільшується щорічно на 1 млн чоловік. У Фінляндії реалізація національної програми по інтегральній профілактиці сприяла зниженню частоти тютюнопаління серед населення на 24%. Відзначено зниження на 19% поширеності тютюнопаління у Великобританії і на 22% — у Франції.
Незважаючи на це, поширеність тютюнопаління у світі залишається високою і коливається у різних вікових групах від 20 до 65% серед чоловіків та від 2 до 42% серед жінок. Більш високі показники серед чоловічого населення відзначають у країнах Південно-Східної Азії (62–64%), Росії (58%), Греції (53%), а серед жінок — у Сербії та Чорногорії (42%), Греції (39%) та Словаччині (32%).
Перші систематизовані й достовірні відомості про поширеність тютюнопаління серед дорослого населення України отримані нами в епідеміологічних дослідженнях наприкінці 70-х років ХХ ст. Тоді в популяції віком 20–59 років вона становила 51,1% серед чоловіків і 5,4% серед жінок. Найвищу частоту тютюнопаління реєстрували у віці 20–29 років: 65,1% у чоловіків і 7,9% — у жінок. З віком кількість курців зменшувалася до 37,2% серед чоловіків і до 2,6% — серед жінок.
Відмінною рисою епідеміології тютюнопаління в Україні є істотні розбіжності в поширеності цієї звички серед міських та сільських жителів. За нашими даними щоденно курять серед чоловіків віком 18–64 років у сільській місцевості 61,1% осіб, а в міській — 42,4%. Максимально тютюнопаління поширене серед осіб віком 18–39 років, його частота істотно знижується у 50–59 років, а серед осіб старше 60 років співвідношення кількості чоловіків-курців, які проживають у міській та сільській місцевості, вирівнюється (рис. 1.5).
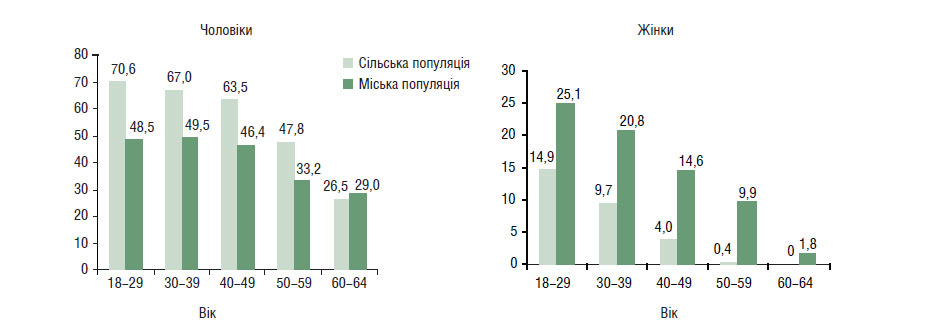
Рис. 1.5. Поширеність тютюнопаління серед населення України, %
У багатьох популяційних дослідженнях виявлено, що ризик розвитку ССЗ залежить від інтенсивності тютюнопаління. Так, збільшення щоденно викурюваних сигарет на 10 штук супроводжується ростом смерті від всіх ССЗ на 16%. Частота фатального і нефатального ІМ та інсульту у осіб, які викурюють 40 сигарет на день, в 4 рази вища, ніж у чоловіків, які курять до 10 сигарет в день.
Серед жінок ці відмінності ще більш виражені. Ризик розвитку ІМ у молодих жінок віком 16–44 років підвищується від 2,5% при викурюванні 1–5 сигарет до 74,6% при інтенсивності тютюнопаління більше 40 сигарет в день.
Серед чоловіків, які курять, основну частину складають особи, що викурюють щодня по 10–20 сигарет (40,0–45,3%). Вікова динаміка інтенсивності тютюнопаління має вигляд параболічної кривої: середня кількість сигарет, що викурюють щодня, однакова у віці 20–29 і 60–64 років — відповідно 14,2 і 15,8, а максимальна — у 40–49 років, становлячи 18,2 сигарет. Для жінок характерний лінійний ріст інтенсивності тютюнопаління: середня кількість сигарет, що викурюють щодня, збільшується від 6,9 в 20–29 років до 10 в 50–59 років.
Як свідчить анамнез, кожен четвертий (24,5%) починає палити у віці до 15 років, 67% — до 24 років. З віком початку тютюнопаління тісно пов’язані його стаж та розвиток нікотинової залежності.
Більш висока поширеність тютюнопаління в сільській місцевості супроводжується більшою його інтенсивністю. Так, серед жителів села переважають злісні (які викурюють щодня понад 20 сигарет) курці — 59,3%, тоді як серед міських чоловіків — особи, які викурюють до 10 сигарет на день (43,3%).
Низька поширеність тютюнопаління серед жінок зберігалася до середини 80-х років ХХ ст. На сьогодні кожна 5-та жінка, яка проживає в місті, активно курить, в той час як наприкінці 1970-х років курила лише кожна 20-та. Негативна тенденція росту цього показника серед жінок супроводжується підвищенням інтенсивності тютюнопаління. Середня кількість сигарет, які щодня викурюють, збільшилася від 6,4 до 7,2.
Поширеність тютюнопаління серед міських жінок приблизно в 2 рази вища, ніж серед сільських (14,6 та 6,3%). Ця ситуація характерна для всіх вікових груп, проте з віком розбіжності стають більш вираженими. Переважають особи, які викурюють щодня до 10 сигарет (92% в селі й 81% — у місті); 4–5% жінок, незалежно від місця проживання, викурюють 10–19 сигарет. Злісних курців серед жінок значно менше, ніж серед чоловіків, проте серед міських мешканок майже 15% щодня викурюють пачку сигарет та більше.
Добре відомо, що жінки до початку менопаузи захищені від розвитку ІХС гормональним естрогенним фоном. Тютюнопаління спричиняє руйнівну дію на естрогени. Останні дослідження показують, що викурювання однієї сигарети знижує позитивну дію естрогенів навіть у тих фазах менструального циклу, коли їх концентрація максимальна. Таким чином, жінки, які курять, самі руйнують свій захист, тому проблеми з серцем та судинами виникають у них раніше і частіше, ніж у їх одноліток, які не курять.
Одним із вкрай несприятливих факторів тютюнопаління жінок репродуктивного віку є куріння в період вагітності. Анкетування показало, що 29,7% жінок, які курять, зменшивши кількість сигарет, продовжували курити в першу половину вагітності, а 5% — до пологів.
Характерною рисою популяції жінок є більш пізній вік початку тютюнопаління порівняно з чоловіками. Лише 8,2% жінок починають курити до 15 років, а у 31,4% звичка до тютюнопаління формується після 24 років. У жінок вона зумовлена бажанням активно і свідомо залучитися до куріння. Результати анкетування свідчать, що 32,5% опитаних почали курити, намагаючись перебороти стресові ситуації, пов’язані зі страхом втратити роботу чи робоче місце; 28% — внаслідок конфліктів в особистому житті; 15,3% вважають, що тютюнопаління допомагає їм у створенні іміджу сучасної жінки; 12% розглядають його як фактор, що допомагає перебороти самітність і сприяє комунікабельності; 12,2% опитаних не змогли сформулювати конкретної причини.
На жаль, у країні відсутня державна система моніторування тютюнопаління серед населення. Ґрунтуючись на даних епідеміологічних обстежень населення, виконаних нами з інтервалом у 25 років, можна констатувати, що поширеність тютюнопаління серед чоловіків сільської місцевості залишається стабільною, тоді як у місті спостерігається стійка тенденція до зниження як частоти, так і інтенсивності тютюнопаління. Виявлено значне зростання розповсюдженості тютюнопаління серед жінок. При цьому темп приросту жінок-курців у сільській місцевості значніший, ніж у міський: за чверть сторіччя кількість таких жінок у місті збільшилася майже у 3 рази, а в селі — в 10 разів. Відзначимо зміщення віку початку тютюнопаління до молодшого. Внаслідок цього тютюнопаління серед жінок може набути характеру, схожого з чоловічим, тобто тютюнопаління з вираженою нікотиновою залежністю, високою інтенсивністю та відповідними наслідками для здоров’я.
Інформованість тих, хто курить, про зв’язок тютюнопаління з онкологічними та ССЗ досить висока і становить 78,2% серед чоловіків та 80,5% серед жінок. Згодні з цим 72,0% чоловіків і 66,5% жінок.
Проте лише кожен 4-й чоловік і кожна 5-та жінка, які курять, стурбовані шкідливим впливом тютюнопаління на здоров’я. Водночас за даними поштового опитування, проведеного нами в рамках програми ВООЗ щодо профілактики хронічних неінфекційних захворювань (програма CINDI), саме наявність серйозних захворювань або особисте усвідомлення загрозливої небезпеки, пов’язаної з тютюнопалінням, є провідною причиною відмови від цієї шкідливої звички як серед чоловіків (53,6%), так і серед жінок (40,7%). Кожен 3-й респондент віком старше 45 років, який курить, знає про наявність у нього ССЗ (27,0%); у кожного 5-го відзначається високий АТ, у кожного 10-го (13,5%) — гастрит або виразкова хвороба; у 17,6% жінок і майже у 40% чоловіків — хронічний бронхіт або БА. Лише третина тих, хто палить, оцінюють своє здоров’я як добре. Тільки 22% чоловіків і 17% жінок одержують рекомендації медичних працівників щодо відмови від тютюнопаління.
Відомо, що одним із факторів, які перешкоджають пропаганді відмови від тютюнопаління з боку лікаря чи медичної сестри, є тютюнопаління медичного працівника. Проведене в Італії дослідження показало, що лікарі, які не курять самі, у 2 рази частіше консультують своїх пацієнтів щодо відмови від тютюнопаління порівняно з тими, хто палить. У країнах, де поширеність тютюнопаління серед медичних працівників знижується, боротьба з цією шкідливою звичкою проходить значно легше і ефективніше. За даними ВООЗ (2005) у таких країнах, як Швейцарія, Норвегія, Словенія, Ізраїль, Швеція, Фінляндія, Люксембург, Ісландія та Ірландія питома вага лікарів, які не курять, не перевищує 10%. Серед англійських лікарів ця звичка поширена у 2 рази менше, ніж в популяції загалом (6,8%).
За нашим даними курять 38–45% лікарів-чоловіків та 8,5–15% лікарів-жінок. Опитування медиків Києва показало, що курять 38% терапевтів-чоловіків і 10% жінок, серед інших медичних фахівців — 44% чоловіків і 12% жінок.
Більшість із тих, хто курить (40–80% у різних країнах), бажає позбавитися цієї звички. За нашими даними 60% чоловіків і 40% жінок, які беруть участь у міжнародній антитютюновій компанії «Quit and Win», здійснювали більше 3 спроб відмови від тютюнопаління.
На жаль, більшість людей, які намагаються самостійно відмовитися від тютюнопаління, незабаром поновлюють його. Так, за даними різних досліджень лише 3–10% з тих, хто кинув курити, утримуються від тютюнопаління протягом наступних 6 міс. Основна причина низької ефективності самостійної відмови від тютюнопаління — нікотинова (тютюнова) залежність.
У МКХ-10 тютюнова залежність разом з алкогольною і наркотичною віднесена до категорії «Розумові й поведінкові порушення, зумовлені використанням психоактивних сполук», тобто тютюнопаління класифікується як захворювання.
В нікотиноманії виділяють елементи психологічної та фармакологічної (фізіологічної) залежності. Остання зумовлена тривалим надходженням в організм нікотину і залежить від віку початку, стажу та інтенсивності тютюнопаління. У більшості курців спостерігають такі ознаки залежності — толерантність, абстинентний синдром і нездатність самостійно припинити надходження нікотину в організм.
В Україні налічується майже 9 млн активних курців. Вони становлять 1/3 всього працездатного населення країни.
Ситуація щодо тютюнопаління в Україні певною мірою зумовлена нижчезазначеними факторами:
- низький рівень громадського усвідомлення значення і небезпеки тютюнопаління для окремих громадян і суспільства в цілому;
- проникнення на український ринок транснаціональних тютюнових компаній з їх масштабною і витонченою рекламою тютюнових виробів;
- недостатнє виконання Закону України «Про заходи щодо попередження та зменшення вживання тютюнових виробів та їх шкідливого впливу на здоров’я населення»;
- низька участь медичних працівників в антитютюновій пропаганді і наданні допомоги тим, хто бажає відмовитися від тютюнопаління.
Слід підкреслити, що хоча тютюнопаління є незалежним чинником ризику, його дія підсилюється у 5–8 разів при поєднанні з високим рівнем АТ, порушеним обміном ліпідів, надлишковою масою тіла чи ожирінням та низькою фізичною активністю.
При поєднанні тютюнопаління з професійно-виробничими факторами воно чинить потенціюючий вплив, частіше за мультиплікативним типом.
У ряді досліджень встановлено, що тютюнопаління спричиняє підвищення АТ. У курців рівень САТ на 3–7 мм рт. ст., а ДАТ — на 2–6 мм рт. ст. вищий, ніж у некурців. Дані двох проспективних досліджень свідчать, що ризик розвитку систолічної АГ у курців вищий, ніж у осіб, які не вживають тютюн.
Не викликає сумніву той факт, що загальний серцево-судинний ризик значно зростає у курців з високим АТ. Тому в рекомендаціях Європейського товариства кардіологів підкреслюється, що хворим на АГ, які курять, необхідно обов’язково відмовитися від цієї шкідливої звички.
Надлишкова маса тіла і ожиріння. Жирова тканина у здорових людей становить 15–20% маси тіла. Її кількість визначається двома протилежними процесами — ліпогенезом та ліполізом. Провідне значення у регуляції цих процесів належить системі гіпоталамус — гіпофіз, яка контролює харчову поведінку, апетит і кількість спожитої їжі, тобто аліментарні фактори.
Збільшення маси тіла порівняно з ідеальною реєструється дослідниками з початку 1960-х років у різних країнах, причому як серед дорослого, так і серед дитячого населення.
Це достовірно пов’язане з переїданням, поліпшенням матеріально-побутових умов і гіподинамією, зумовленою науково-технічним прогресом.
Діти і підлітки з надлишковою масою тіла, як правило, залишаються повними і в дорослому віці, хоча у більшості дорослих з надлишковою масою тіла в дитинстві вона була нормальною. Збереження набутого в молодості ожиріння до самої старості становить більш високий ризик для здоров’я, ніж ожиріння, набуте в дорослому віці.
Для діагностики надлишкової маси тіла і ожиріння використовують ІМТ, який є показником не кількості жиру, а пропорційності маси, і розраховується за формулою:
| ІМТ = | маса тіла, кг | . |
| (зріст, м)2 |
Ідеальна маса тіла дорослої людини коливається в межах 20–24,9 кг/м2 (рис. 1.6).
Відносний ризик для здоров’я, пов’язаний з ожирінням, можна визначити за шкалою ВООЗ (табл. 1.5).
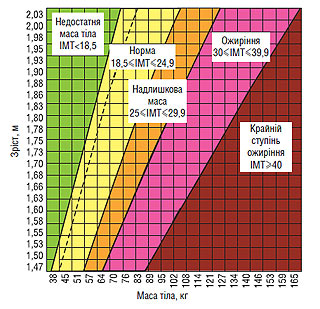
Рис. 1.6. Карта ІМТ
Надлишкова маса тіла — серйозна проблема в багатьох країнах світу. Це досить розповсюджений фактор ризику серед всіх вікових груп, частота якого коливається в межах 13,6–50,4% в різних популяціях.
Таблиця 1.5
Ризик розвитку захворювань залежно від маси тіла
|
Маса тіла |
ІМТ, кг/м2 |
Ризик розвитку захворювань |
|
Недостатня |
<18,5 |
Низький |
|
Нормальна |
18,5–24,9 |
Низький |
|
Надлишкова |
25,0–29,9 |
Підвищений |
|
Ожиріння I ступеня |
30,0–34,9 |
Високий |
|
Ожиріння II ступеня |
35,0–39,9 |
Дуже високий |
|
Ожиріння III ступеня |
≥40 |
Надзвичайно високий |
Переважна більшість досліджень свідчить, що надлишкову масу тіла в 1,5–5,0 разів частіше відзначають серед жінок, ніж серед чоловіків, хоча деякі дослідники не знаходять різниці в поширеності надлишкової маси тіла серед чоловіків і жінок.
За результатами проведених нами епідеміологічних досліджень в Україні надлишкову масу тіла виявляють у 37,5% чоловіків та у 29,5% жінок, які проживають в містах, і відповідно у 37,6 та 33,1% жителів сільської місцевості (табл. 1.6).
Таблиця 1.6
Поширеність надлишкової маси тіла та ожиріння серед населення України, %
|
Показник |
Чоловіки |
Жінки |
||
|
Місто |
Село |
Місто |
Село |
|
|
Надлишкова маса тіла |
37,5 |
37,6 |
29,5* |
33,1* |
|
Ожиріння |
14,6 |
18,0 |
23,6** |
36,5** |
*р<0,05; **р<0,0001.
Крім того, у 14,6% міських та 18,0% сільських чоловіків і відповідно у 23,6 та 36,5% жінок відзначають ожиріння. Таким чином, проблеми з надмірною масою тіла мають більше половини обстежених незалежно від статі, причому поширеність ожиріння серед міських жінок в 1,6 раза, а серед сільських — в 2 рази вища, ніж серед чоловіків.
Протягом 25-річного періоду спостереження міського населення поширеність надлишкової маси тіла в чоловічій популяції знизилася від 45,9 до 37,5%, а частота ожиріння майже не змінилася. У жіночій популяції реєструють достовірно позитивні зміни обох показників: частота надлишкової маси тіла знизилася від 40,0 до 29,5%, а поширеність ожиріння — від 33,1 до 23,6%.
Середньопопуляційний рівень ІМТ не змінився серед чоловіків і достовірно знизився серед жінок.
Результати наших досліджень свідчать, що за останні десятиріччя значно змінилися звички харчування населення: знизилася калорійність добових раціонів за рахунок зменшення споживання тваринних білків (м’яса, риби) і жирів, свіжих овочів та фруктів тощо. Це, безумовно, вплинуло на вищезазначені зміни.
Аналіз поширеності надлишкової маси тіла залежно від рівня освіти показав, що чоловіків з нормальною масою тіла найменше серед осіб з вищою освітою. У жінок відзначена протилежна тенденція — з підвищенням освітнього рівня збільшується кількість жінок з нормальною масою тіла.
Надлишкова маса тіла позитивно корелює з малорухомим способом життя, цукровим діабетом, рівнем АТ, вмістом ХС і ТГ у плазмі крові та негативно — з рівнем ХС ЛПВЩ. Підвищений рівень ХС спостерігається у людей молодого віку з надлишковою масою тіла в 2 рази частіше, ніж у людей того ж віку з нормальним ІМТ. Ризик розвитку АГ у осіб з надлишковою масою тіла підвищується в 8 разів порівняно з худорлявими.
У осіб з надлишковою масою тіла частіше виявляють цукровий діабет. Якщо маса тіла перевищує норму на 15%, він розвивається у 2 рази частіше, а якщо на 25% — у 10 разів частіше, ніж у людей з нормальною масою.
Зв’язок надлишкової маси тіла із захворюваністю ІХС більше виражений у молодому віці, причому найчіткіша асоціація простежується при раптовій смерті.
Патогенетична дія надлишкової маси тіла на серцево-судинну систему проявляється в підвищенні гемодинамічного навантаження на серце за рахунок подовження судинної системи, збільшення ОЦК, підвищення периферичного опору, погіршення метаболічних процесів у міокарді за рахунок жирової дистрофії, зниження напруження кисню в артеріальній крові внаслідок недостатньої легеневої вентиляції.
Основною ознакою ожиріння вважають накопичення в організмі жирової тканини: у чоловіків — понад 10–15%, у жінок — понад 20–25% норми, що служить причиною значних порушень стану здоров’я.
Ризик розвитку супутніх ожирінню захворювань значною мірою залежить від того, як жир розподіляється на тулубі. Для встановлення характеру розподілу жиру в організмі використовують відношення об’єму талії та стегон (ОТ/ОС). Ожиріння вважається абдомінальним, якщо цей показник >0,85 у жінок і >1,0 — у чоловіків. Цей тип ожиріння — найбільш несприятливий і, як правило, сполучається з комплексом гормональних та метаболічних змін. Абдомінальне ожиріння розглядається як самостійний фактор ризику розвитку цукрового діабету, ІХС, АГ і як один із компонентів метаболічного синдрому.
Дослідження останніх років показали, що надійною ознакою надлишкового накопичення жирової тканини є показник ОТ. Високий ризик супутніх захворювань відзначають при ОТ>102 см у чоловіків та >88 см у жінок.
Значно більшого ризику розвитку захворювань зазнають пацієнти, які мають надлишки жиру у верхній частині тулуба, нагадуючи форму яблука, на відміну від тих, у кого надлишки жиру розміщені в нижній частині тулуба, що нагадує форму груші.
Існує три основних типи ожиріння, а саме:
- аліментарне, зумовлене незбалансованістю між надходженням в організм калорій та енерговитратами. Цей тип ожиріння найпоширеніший і тісно пов’язаний з харчуванням, більшою мірою з переїданням, яке визначають як споживання більшої кількості калорій, ніж це потрібно організму для основного обміну речовин та підтримання необхідного рівня фізичної активності (80–85% всіх випадків);
- ендокринне, обумовлене недостатньою активністю залоз внутрішньої секреції (10–13% всіх випадків ожиріння);
- церебральне, зумовлене порушенням регуляції центрів голоду і апетиту (2–3% випадків ожиріння).
Фактори, що впливають на масу тіла:
- демографічні: вік, стать, етнічне походження;
- соціальні: рівень доходів, освіти, сімейний статус, якість споживаних продуктів;
- біологічні: стан метаболізму й ендокринної системи;
- поведінкові: характер харчування, тютюнопаління, вживання алкоголю, низька фізична активність.
Ожиріння часто супроводжується супутньою патологією: цукровим діабетом, АГ, атеросклерозом, ІХС, СН, деякими формами раку, порушенням репродуктивної функції, захворюваннями опорно-рухового апарату. За даними досліджень цукровий діабет і АГ у осіб з ожирінням спостерігають в 2,9 раза, а гіперліпідемію — в 1,5 раза частіше, ніж серед населення загалом. Ризик розвитку цих захворювань значно підвищується при збільшенні ІМТ.
Результати епідеміологічних досліджень свідчать про наявність зв’язку між поширеністю ССЗ і ожирінням. Так, за даними проспективного дослідження в Чикаго частота ІХС у 2 рази вища у осіб з надлишковою масою тіла. В кооперативному дослідженні в 7 країнах у пацієнтів з ІХС виявлено відносно більшу масу тіла порівняно з особами без ознак ІХС, поширеність останньої була в 2 рази вища у групі осіб з ожирінням. У Фремінгемському дослідженні надлишкова маса тіла — фактор ризику розвитку стенокардії та раптової смерті.
З підвищенням ІМТ статистично зростає частота ІХС: при його високому рівні патологію виявляють у 2 рази частіше, ніж при низькому. За нашими даними, ІХС реєструють у кожної 4-ї особи з надлишковою масою тіла віком 50–59 років і у кожної 3-ї в 60–69 років. У пацієнтів з ІХС ожиріння відзначають у 3 рази частіше, ніж у осіб без її ознак.
У пацієнтів з ожирінням виявляють збільшення серцевого викиду, пов’язаного з необхідністю забезпечення зростаючих метаболічних потреб, яке досягається не за рахунок ЧСС, а за рахунок росту ударного об’єму. Високий серцевий викид — причина розвитку ексцентричної ГЛШ та діастолічної дисфункції. Якщо ж потовщення стінки шлуночка відбувається несинхронно з дилатацією його порожнини, створюються умови для формування систолічної дисфункції з подальшим розвитком кардіопатії ожиріння та застійної СН на фоні збільшення внутрішньосудинного об’єму. Приєднання АГ до клінічної картини посилює прогресування структурно-функціональних порушень у міокарді. Формування ГЛШ є самостійним предиктором розвитку раптової смерті, причому за даними Фремінгемського дослідження половина чоловіків віком старше 45 років з ознаками ГЛШ, зафіксованими на ЕКГ, помирали протягом наступних 8 років.
Дані Фремінгемського дослідження свідчать, що збільшення маси тіла на 10% супроводжується підвищенням концентрації ХС у плазмі крові на 0,3 ммоль/л, а кожні зайві 4,5 кг маси тіла підвищують САТ на 4,4 мм рт. ст. Ризик розвитку ХСН зростає на 5% при підвищенні ІМТ на 1 кг/м2.
Інсулінорезистентність, що виникає внаслідок ожиріння, є сполучною ланкою між ожирінням, порушенням толерантності до глюкози, АГ і дисліпідемією.
Розвиток атеросклерозу при ожирінні зумовлений високим вмістом ХС внаслідок підвищення швидкості його добової продукції у осіб з цією патологією (20 мг/кг жирової маси) порівняно з особами з нормальною масою тіла (12 мг/кг відповідно), а також іншими порушеннями в ліпідному обміні (підвищення рівня ТГ, ЛПНЩ, зниження рівня ЛПВЩ), що є причиною зміни трофіки й ураження судинної стінки. Крім того, постійна гіперінсулінемія, яка супроводжує ожиріння, спричиняючи підвищення рівня ТГ у крові, сприяє відкладенню ліпідів у судинній стінці.
Підвищення АТ при ожирінні відзначають у 2,0–4,6 раза частіше, ніж при нормальній масі тіла. За виразом Д.Я. Шуригіна, «гіпертонія йде за ожирінням, як тінь за людиною».
Зі збільшенням маси тіла зростає смертність, скорочується тривалість життя. При надлишку маси тіла на 10% смертність підвищується на 8%, якщо маса тіла перевищує норму на 50% — смертність зростає на 56%.
Проведені нами дослідження показали, що чим більше маса тіла, тим значніші відмінності між смертністю осіб з надлишковою та нормальною масою тіла за наявності у них інших факторів ризику. Так, АГ у осіб з нормальною масою тіла підвищує ризик смерті від ССЗ у 3,5 раза, в осіб з надлишковою масою тіла — у 3,7 раза, а в осіб з ожирінням — у 4,7 раза. Поєднання АГ та дисліпопротеїнемії — одне з найбільш несприятливих: смертність від ССЗ при такій комбінації серед осіб з надлишковою масою тіла в 3 рази, а з ожирінням в 3,5 раза вища, ніж у групі з аналогічним поєднанням факторів ризику і нормальною масою тіла. Високий АТ, порушений обмін ліпідів і тютюнопаління підвищують ризик смерті у людей з нормальною масою тіла в 5,5 раза, у осіб з надлишковою масою тіла — в 6,2 раза, а в осіб з ожирінням — майже у 8 разів.
Графік відносного ризику смерті залежно від ІМТ має вигляд прямої лінії для серцево-судинних захворювань, J-подібної кривої — для онкологічних захворювань і U-подібної кривої — для всіх захворювань.
Групи осіб з різними значеннями ІМТ відрізняються не лише за показниками смертності, але й за термінами її настання. Так, серед людей з надлишковою масою тіла, які вмерли від ССЗ, середній період від моменту обстеження до настання смерті становить 14,8±0,8 року, а з ожирінням III ступеня — 5,4±1,2 року. Таким чином, надлишок маси тіла впливає не тільки на рівень смертності, але й на тривалість життя.
Маса тіла на 27,4% визначає смертність від ССЗ, на 22,5% — від ІХС та на 12,3% — від мозкового інсульту.
Надлишкова маса є результатом дисбалансу між надходженням та витратами енергії і в 60–90% випадків зумовлена переїданням. Про переважне значення аліментарно-конституціонального фактора у розвитку ожиріння свідчить той факт, що лише 38,3% осіб з надлишковою масою тіла ведуть малорухомий спосіб життя, а раціони більшості обстежених характеризуються надмірною калорійністю.
Сьогодні існує безліч клініко-епідеміологічних і експериментальних даних про зв’язок харчування зі станом здоров’я та розвитком різних захворювань. Провідним фактором, що визначає нижчу серцево-судинну захворюваність в Японії та її лідерство в довголітті серед інших країн, вважають особливості харчування в цій країні.
У Китаї ріст споживання м’яса, птахів, риби, яєць, молока, жирів, овочів, фруктів та алкогольних напоїв супроводжується підвищенням ІМТ серед жителів, особливо серед чоловіків. Дослідники вважають, що зазначені зміни в харчуванні населення спричиняють підвищення ризику ССЗ.
Надмірне вживання вуглеводів спричиняє розвиток АГ. Рафіновані вуглеводи активують САС, підсилюючи екскрецію відповідних гормонів. Крім того, всмоктування натрію в кишечнику підсилюється у присутності глюкози, а вуглеводна дієта може викликати затримку води і натрію в організмі. Більше того, вживання вуглеводів прискорює розвиток нейрогенної гіпертензії. Таким чином, вуглеводна дієта у відповідних умовах може стати додатковим фактором ризику розвитку АГ.
Високий рівень ССЗ реєструють у Скандинавських країнах, де їжа багата жирами та жирними молочними продуктами, але містить мало овочів.
Низька захворюваність населення Середземномор’я певною мірою зумовлена дієтою з високим вмістом поліненасичених жирних кислот.
Таким чином, можна виділити принаймні три обставини, що визначають підвищений інтерес до ожиріння:
- значна кількість людей мають надлишкову масу тіла чи ожиріння найчастіше за рахунок переїдання;
- існує тісний зв’язок цих факторів ризику з рядом патологічних процесів — атеросклерозом, ІХС, АГ, цукровим діабетом;
- наявність надлишкової маси тіла та ожиріння скорочує тривалість життя людей.
Як свідчать результати проведених нами досліджень, надлишкова маса тіла і ожиріння відіграють провідну роль у формуванні здоров’я населення. Поєднання надлишкової маси тіла з АГ, тютюнопалінням та/чи порушеним обміном ліпідів в 3–4 рази підвищує ризик розвитку ССЗ з летальним кінцем, а тому зменшення маси тіла при її надлишку є важливою складовою профілактики на популяційному та індивідуальному рівні.
Недостатня фізична активність. Фізична активність — це сукупність різних моделей поведінки, що визначається як рух тіла з допомогою м’язової сили і витрат енергії. Вона вимірюється ступенем перевищення витрат енергії над основним обміном речовин. Регулярна фізична активність підвищує фізичну працездатність або тренованість — здатність здійснювати фізичні дії, не відчуваючи втоми, і можливість підтримки такої здатності протягом життя. Фізична тренованість — об’єктивний показник регулярної фізичної активності.
На сьогодні обговорюється питання: чим визначається рівень рухової активності людини? Його спадкоємними і генетичними ознаками чи умовами життя і тренуванням? Результати досліджень свідчать, що фізична активність значною мірою залежить від функціональних можливостей індивіда, рівня його фізичного виховання, побутових, природних умов, способу життя і роду занять.
При фізичному навантаженні закономірно поглиблюється дихання, що збільшує життєвий обсяг легень, забезпечує підвищення рівня поглинання кисню та насичення ним крові на 15–30%. Якщо в стані спокою тканини використовують 30% кисню крові, то при фізичному навантаженні у нетренованих осіб — 47%, а у тренованих — 73%. При недостатній руховій активності знижується ефективність окисного фосфорилювання, що приводить до накопичення продуктів неповного окиснення вуглеводів, а це в свою чергу ушкоджує ендотелій судин і спричиняє розвиток атеросклерозу. І навпаки, під впливом регулярних дозованих фізичних навантажень підвищується еластичність судин і зменшується ЗПСО.
Позитивний вплив фізичних вправ реалізується також за допомогою ЦНС. Фізична активність сприяє створенню домінанти рухового аналізатора і функціонуючих нервових центрів. При цьому відбувається врівноваження процесів збудження та гальмування, з’являються нові кортико-вісцеральні та кортико-судинні зв’язки, що зумовлює рівновагу нервової діяльності.
Рухова активність сприяє поліпшенню реологічних властивостей крові й стану мікроциркуляторного русла. У процесі м’язового скорочення зі стінки судин вивільняються простацикліни — гуморальні фактори з вазодилативним ефектом, підвищується концентрація антикоагулянтів крові та її фібринолітична активність.
Завдяки активізації обмінних процесів при фізичній активності забезпечуються нормалізація ліпідного обміну та зменшення маси тіла.
Регулярні фізичні навантаження сприяють зміцненню не лише скелетних, але й серцевого м’яза, підвищуючи його працездатність. Треноване серце більш адекватно реагує на зростаюче навантаження внаслідок здатності до економізації роботи міокарда. Ударний об’єм нетренованого серця становить близько 50–60 см3, а тренованого — 80–100 см3.
Фізичні тренування мають велике значення у неспецифічній профілактиці багатьох захворювань серцево-судинної, нервової, дихальної систем та опорно-рухового апарату. Разом з іншими факторами недостатня фізична активність є вагомим та значно поширеним фактором ризику розвитку ССЗ.
Так, у країнах Євросоюзу відсоток осіб, фізична активність яких не перевищує 3,5 год/тиж, варіює від 15% у Фінляндії до 70% у Португалії. Чверть дорослого населення Америки взагалі не мають ніяких фізичних навантажень і лише 23% осіб регулярно займаються фізичними тренуваннями.
Результати проведених нами епідеміологічних досліджень свідчать про значну поширеність недостатньої фізичної активності серед населення України — 43,6%. Цей показник в жіночій популяції перевищує аналогічний у чоловіків: 48,3 та 39,1% відповідно (табл. 1.7).
Таблиця 1.7
Поширеність недостатньої фізичної активності серед міського населення України, %
| Вік | Чоловіки | Жінки |
| 20–29 | 29,3 | 49,7 |
| 30–39 | 44,1 | 49,7 |
| 40–49 | 45,2 | 40,2 |
| 50–59 | 33,6 | 50,2 |
| 60–64 | 43,5 | 56,9 |
| Стандартизований показник | 39,1 | 48,3 |
Розповсюдженість недостатньої фізичної активності не залежить від віку, залишаючись однаково високою у всіх вікових категоріях.
Виявлено, що 40,8% чоловіків та 43,5% жінок понад 5 год робочого часу проводять в положенні сидячи; компенсувати недостатню фізичну активність обстежені намагаються, головним чином, за рахунок ходьби. Лише 19,3% чоловіків та 14,0% жінок займаються ранковою гімнастикою і тільки відповідно 16,5 та 7,6% — яким-небудь видом спорту.
Особи, професійна діяльність яких пов’язана з фізичним навантаженням, значно менше зацікавлені у фізичній активності в години дозвілля. Однак найбільшу профілактичну дію зумовлює фізична активність в години дозвілля, а не під час виконання професійних обов’язків.
Останнім часом фізична активність у вільний від роботи час здобуває все більшу популярність. Дослідження свідчать про достовірне збільшення питомої ваги дорослого населення, яке регулярно займається фізичною культурою і спортом. Проте не більше 20% осіб мають той рівень фізичної активності, що рекомендується для поліпшення стану серцево-судинної системи.
Аналіз 25-літньої динаміки поширеності недостатньої фізичної активності свідчить про достовірне збільшення в українській популяції кількості чоловіків, які ведуть малорухомий спосіб життя, від 18,7 до 39,1%, а жінок — від 35,7 до 48,3%, причому це стосується всіх вікових груп.
Недостатня фізична активність асоціюється з такими патологічними станами, як ІХС, АГ, мозковий інсульт, ожиріння, інсуліннезалежний цукровий діабет, остеопороз. Фізичні навантаження ефективні в комплексі немедикаментозної терапії та реабілітації хворих із серцево-судинною патологією. За допомогою використання адекватної стану хворого системи фізичних навантажень можна досягти певного зниження АТ.
Найбільше (>200) досліджень з метою вивчення впливу фізичної активності на розвиток різних захворювань проведено в США, де кількість смертей, пов’язаних з малорухомим способом життя, що становить близько 250 тис. на рік, співвідноситься з рівнем смертності внаслідок таких факторів ризику, як АГ, дисліпопротеїнемія та ожиріння.
Ризик розвитку серцево-судинної патології у осіб з низьким рівнем фізичної активності у 2 рази вищий, ніж у таких з достатнім її рівнем. За результатами досліджень, у фізично активних жінок ризик ІХС на 60–75% нижчий, ніж у малорухомих. В епідеміологічному обстеженні 6 тис. осіб протягом 6 років встановлено, що у пацієнтів з ІХС з найвищим рівнем фізичної тренованості в 4 рази нижча смертність, ніж у пацієнтів з низькою фізичною працездатністю.
Зниження загальної смертності та смертності від ІХС на 27–31% можна досягти лише шляхом підвищення інтенсивності фізичних навантажень, причому цей ефект значно превалює над іншими у зміні способу життя.
Таким чином, потенційними перевагами фізичної активності для здоров’я є:
- зниження ризику загальної смерті у осіб, які ведуть здоровий спосіб життя;
- зниження ризику розвитку ІХС і мозкового інсульту;
- зниження ризику розвитку АГ на 35–53% та позитивний вплив аеробної активності у пацієнтів з підвищеним АТ;
- поліпшення співвідношення ліпопротеїнів, зниження рівня загального ХС, ТГ, підвищення вмісту ЛПВЩ у ліпідному спектрі крові;
- нормалізація балансу надходження та витрат енергії, зменшення маси тіла і профілактика ожиріння;
- відновлення психологічної рівноваги (боротьба з депресією та стресом);
- зниження рівня глюкози у крові й підвищення толерантності до глюкози, зниження ризику інсуліннезалежного цукрового діабету;
- зниження активності фібриногену і ХІІ фактора згортання крові, підвищення фібринолітичної активності.
В останні роки доведено, що поряд з класичними факторами ризику важливу роль у патогенезі ССЗ відіграє запалення. Встановлено, що фізична активність (прогулянки протягом 60 хв 3 рази на тиждень) позитивно впливає на його показники.
Нераціональне харчування. Харчування — важлива складова здорового способу життя, що, відповідно до оцінки експертів ВООЗ, на 68–74% визначає рівень здоров’я населення. Існують докази наявності зв’язку між АГ і вживанням насичених жирів, кухонної солі, алкоголю.
Наукові дослідження свідчать, що раціон з великою кількістю жирів і малою кількістю овочів та фруктів, риби певною мірою сприяє розвитку хвороб системи кровообігу.
Нераціональне харчування є визначальним у виникненні й розвитку надлишкової маси тіла та ожиріння, порушень ліпідного обміну і толерантності до вуглеводів, АГ.
Харчування має численні складові, пов’язані з ризиком для здоров’я, але найбільш важливими є їх пропорції. Ступінь ризику підвищується при високому вмісті жиру в раціоні, особливо насичених жирних кислот, надмірній калорійності та підвищеному вживанні солі; зниження ризику пов’язане з достатнім споживанням складних вуглеводів та харчової клітковини.
У проведених дослідженнях споживання великої кількості фруктів та овочів сприяло зниженню частоти розвитку стенокардії, ІМ та мозкового інсульту. Так, у осіб, рівень споживання фруктів і овочів яких вище 90-го процентиля, сумарний ризик розвитку ІХС на 15% нижчий, ніж у тих, чиї показники нижче 10-го процентиля. Показано, що збільшення споживання фруктів і овочів приблизно на 150 г/добу супроводжується зниженням на 20–40% ризику розвитку ІХС, а мозкового інсульту — на 10–25%.
Зменшення споживання жирів і кухонної солі при збільшенні кількості споживаних фруктів і овочів супроводжується помірним зниженням АТ.
Проте інформація про інші компоненти харчування, зокрема з ліпотропною і антиоксидантною дією, нечисленна, непереконлива і має потребу в подальшому вивченні.
Порушення в харчуванні, що сприяють розвитку захворювань, наведені в табл. 1.8.
В оптимальному варіанті харчування забезпечує організм енергією та основними нутрієнтами залежно від трудової діяльності людини, віку, статі, конституції, способу життя, національних традицій, а також клімато-географічних умов проживання.
У медичній практиці для визначення якості харчування населення використовують показник процентного споживання енергії, отриманої від вживання жиру. Згідно з даними FAО (Food and Agricultural Organization), більшість населення Європи живе в країнах, де цей показник дуже високий і становить >35%. Протягом останніх 20 років майже у всіх країнах відзначають стабільний ріст споживання жирів. Поряд з цим незначна кількість клітковини в харчуванні населення і надмірне споживання цукру та солі становлять загальну проблему для більшості країн.
Здорове харчування спрямоване на:
- зниження споживання жирів до 30% калорійності добового раціону, але не менше 15%, в тому числі насичених — до 10%, поліненасичених — понад 7%;обмеження споживання ХС їжі до 300 мг/добу;
- збільшення споживання складних вуглеводів до 50–70% загальної калорійності їжі і клітковини до 27–40 г/добу за рахунок овочів й фруктів (не менше 400 г щодня);
- зменшення споживання цукру до 10% або 60 г/добу;
- зменшення кількості вживання кухонної солі до 6 г/добу;
- обмеження вживання алкогольних напоїв.
Результати проведених нами епідеміологічних досліджень щодо вивчення фактичного харчування українського населення свідчать, що 30,5% чоловіків і 23,9% жінок порушують режим харчування, приймаючи їжу 2 рази на добу, і лише 5,6% харчуються частіше 4 разів на добу. Ця негативна риса в режимі харчування найпоширеніша у віці 25–34 років.
Не дотримуються будь-яких обмежень у харчуванні 79,4% чоловіків і 57,9% жінок; дотримуються спеціальних дієт відповідно 20,6 і 42,1%, з них 6,3 і 18,5% — з метою зменшення маси тіла; 7,4 і 13,2% — внаслідок шлунково-кишкових захворювань; 1,5 і 2,1% — у зв’язку з цукровим діабетом, а 1,8 та 3,9% перебувають на гіпохолестериновій дієті. При цьому поширеність надлишкової маси тіла та ожиріння в чоловічій популяції становить 46,3%, а в жіночій — 49,3%, а гіперхолестеринемії — відповідно 36,8 та 50,1%.
З віком кількість осіб, які дотримуються дієти, майже не змінюється, в той час як частота патологічних станів, що потребують корекції харчування, підвищується.
Молоді жінки дотримуються дієти для зменшення маси тіла в 2,5 раза частіше, ніж жінки віком 55–64 років, хоча поширеність надлишкової маси тіла та ожиріння серед останніх в 3,4 раза вища.
Важливим фактором здорового харчування є якість і кількість вживаних жирів. Порушення співвідношення тваринних і рослинних жирів у раціоні (в нормі 1,0:1,0 в молодому віці та 0,8:1,0 в старших вікових групах) може спричиняти виникнення дисліпідемії, АГ, підвищення ІМТ. Аналіз показав, що для приготування їжі переважна більшість населення використовує рослинне масло, а для бутербродів — вершкове. Смалець та інші тваринні жири найчастіше використовують особи старших вікових груп.
Досолюють їжу 80,2% чоловіків та 74,9% жінок, причому відповідно 8,5 і 4,5% завжди додають у страви сіль, навіть не куштуючи їх.
Відзначимо недостатнє споживання населенням свіжих овочів та фруктів. Вони щодня наявні в раціоні лише у 16,5% чоловіків та 23,1% жінок, а кожен третій чоловік і кожна четверта жінка споживають їх лише в сезон.
Харчування населення в цілому характеризується:
а) достатнім вмістом білків у раціоні, більша частина з яких — тваринного походження;
б) надмірним вживанням жирів;
в) незбалансованістю жирних кислот у складі жирового компоненту раціону внаслідок надмірного споживання жирів тваринного походження: їх співвідношення становить 0,5 у раціоні чоловіків і 0,7 — у раціоні жінок;
г) недостатньою кількістю вуглеводів, переважну більшість яких становлять прості вуглеводи, а саме цукор і цукромісткі продукти, а також крохмаль;
д) недостатньою кількістю вітамінів А, В2, В6, РР у раціоні осіб обох статей та вітаміну С у раціоні жінок;
е) недостатньою кількістю кальцію в раціоні осіб обох статей, магнію, фосфору і цинку в раціоні жінок;
є) порушеннями в режимі харчування, а саме: дворазовий прийом їжі з тривалими (>6 год) інтервалами між ними, висока енергетична цінність вечірнього прийому (до 50–60% добової калорійності) у 30,2% обстежених.
Співвідношення білків, жирів і вуглеводів у фактичному харчуванні становить 1:1,5:3,5, що істотно відрізняється від рекомендованого — 1:1:4 (рис. 1.7).
Рис. 1.7. Співвідношення основних компонентів раціону харчування населення України (% загальної калорійності)
Вживання алкоголю. Останнім часом зростає споживання алкогольних напоїв і кількість пов’язаних з цим проблем у країнах Центральної та Східної Європи, де значну частину населення можна віднести до групи ризику.
Вживання алкоголю пов’язане з соціально-демографічними, економічними та культурними факторами. Чоловіки вживають більше алкоголю, ніж жінки. Проте в деяких країнах відзначають ріст вживання алкогольних напоїв серед жінок і наближення його до рівня споживання чоловіками. Серед представників обох статей вживання алкоголю знижується з віком.
Сукупний медико-соціальний ефект вживання алкоголю виражається у підвищенні загальної смертності.
Вживання алкоголю і проблеми, пов’язані з цим, існують дуже давно. Виділяють поняття небезпечного та шкідливого для здоров’я вживання алкоголю.
Небезпечне вживання — заподіяння шкоди у разі зловживання: ≥350 г етанолу протягом тижня для чоловіків та ≥210 г — для жінок.
Шкідливе вживання — будь-яке вживання, що може завдати шкоди психологічному чи фізичному стану людини.
Існує певна залежність між дозою вживаного алкоголю і різними фізичними, психологічними та психічними порушеннями, а також соціальною шкодою.
Вживання алкоголю підвищує ризик розвитку мозкового інсульту, підвищує АТ та спричиняє розвиток застійної кардіоміопатії. Зв’язок між вживанням алкогольних напоїв і АТ встановлено у багатьох популяційних дослідженнях. Загалом він має лінійну залежність, хоча в деяких дослідженнях відзначено пороговий ефект на рівні 50–100 мл міцних спиртних напоїв на добу. Разом з тим виявлено позитивний вплив вживання алкоголю в помірних дозах на ризик виникнення ІХС.
Встановлено, що серед осіб, які часто вживають алкоголь, достовірно вища смертність від хвороб системи кровообігу порівняно з тими, хто помірно та рідко вживає алкогольні напої. Смертність від ІХС на 35,5% вища серед частопитущих; у них же на 40,0% частіше виникає мозковий інсульт.
Основний механізм впливу алкоголю — його дія на судинний тонус через вегетативну нервову систему та ендокринний апарат, центри головного мозку, що беруть участь у регуляції серцево-судинної діяльності, підвищення судинної проникності. Алкоголь здатний збільшувати згортання крові, впливаючи на її антитромбінову активність, підвищуючи концентрацію фібриногену та показник гематокриту, змінюючи структуру і активність кров’яних пластинок.
Психоемоційні фактори ризику. Нарівні з традиційними факторами ризику — АГ, дисліпідемією, тютюнопалінням, надлишковою масою тіла і недостатньою фізичною активністю, важливу роль у розвитку хвороб системи кровообігу відіграють психоемоційні та соціальні фактори. Взаємозв’язок цих факторів ризику та ССЗ здавна є предметом уваги вчених, але лише в останні роки після завершення тривалих проспективних досліджень отримано докази того, що порушення емоційної сфери людини є незалежними факторами ризику розвитку ІХС та АГ.
Серед таких порушень — дія гострої психічної травми, хронічне психоемоційне перенапруження, несприятливі життєві події та зміни, психологічні характеристики людей (тип поведінки, темперамент, риси характеру). У медичній літературі психоемоційні й соціальні фактори узагальнені під терміном «стрес» або «психоемоційне напруження», до яких відносять депресію, тривогу або їх поєднання, що отримало назву тривожно-депресивних станів.
Серед основних джерел стресу виділяють соціальну і правову незахищеність населення, незадоволеність матеріальним становищем та умовами проживання, невпевненість у майбутньому. До груп населення з найбільш високим рівнем психоемоційного напруження відносять жінок, осіб віком старше 40 років, людей з вищою освітою, розлучених, пенсіонерів, безробітних, а також осіб з низькою самооцінкою. Представники цих груп потребують підвищеної уваги в наданні психологічної допомоги.
Вивчення психосоціальних факторів ризику має тривалу історію. Ще в 1868 г. німецький лікар Von Busch відзначив, що особи, які голосно розмовляють, надмірно заглиблені в свою роботу, мають схильність до серцевих нападів. На початку ХХ ст. W. Osler охарактеризував хворих з грудною жабою як сильних, енергійних, впевнених в собі осіб, що мають напружену й емоційно насичену роботу.
У 50-ті роки ХХ ст. M. Friedman та R. Rosenman описали психологічний тип А, що відповідає «портрету коронарного хворого», який згодом уточнювався та доповнювався: це люди з прискореним темпом життя, амбіційні, здатні енергійно просуватися по службі, агресивні, постійно зайняті на роботі та вдома, незадоволені завершеною роботою, з відчуттям браку часу, невмінням та небажанням відпочивати.
У проспективному дослідженні за участю 3,5 тис. практично здорових осіб встановлено, що особи з поведінковим типом А віком 30–49 років хворіють на ІХС у 6,5 раза, а віком 50–59 років — в 1,9 раза частіше, ніж особи з типом Б. На сьогодні в дослідженнях з використанням методу коронарографії доведено взаємозв’язок типу поведінки А з розвитком атеросклеротичних змін коронарних судин.
Поведінка типу А, навіть за відсутності клінічних ознак ІХС, асоціюється з гіперактивністю симпатичної нервової системи, підвищенням АТ, рівня ліпідів крові, атеросклеротичною облітерацією коронарного русла, підвищенням коагуляційного потенціалу, тобто з багатьма ланками патогенезу ІХС.
У багатьох дослідженнях встановлено, що ворожість — незалежний чинник ризику ІХС та впливає на смертність від неї.
Зростання серцево-судинної захворюваності в багатьох країнах протягом останніх десятиліть певною мірою пов’язане з психосоціальним неблагополуччям у сучасному суспільстві. Соціальне неблагополуччя неодмінно асоціюється з підвищенням рівня емоційного стресу, що, в свою чергу, приводить до збільшення кількості депресивних і тривожних порушень у населення. За останні 30 років кількість хворих з депресивними порушеннями збільшилася більше ніж у 17 разів і за прогнозами ВООЗ до 2020 р. серед 10 провідних причин інвалідності й смертності депресія займе 2-ге місце, поступаючись лише ІХС. Поширеність депресії в популяціях різних країн становить 3–6% залежно від використовуваних дослідниками критеріїв.
Наявність взаємозв’язку між депресією та розвитком ІХС доведена скандинавським проспективним дослідженням, в якому протягом 27 років спостереження встановлено, що захворюваність на ІХС, в тому числі ІМ, в 1,7 раза вища у людей з депресією порівняно з особами без неї. Результати тривалих епідеміологічних досліджень у США та Японії переконливо довели, що наявність депресії в 2 рази підвищує ризик розвитку мозкового інсульту, особливо ішемічного.
У пацієнтів з ІХС депресію виявляють значно частіше, ніж в середньому в популяції: поширеність її серед цих пацієнтів становить близько 20%. Після перенесеного ІМ або операції АКШ психоемоційні порушення виявляють у кожного третього, а після інсульту — у кожного другого хворого.
Рівень смертності хворих, які перенесли ІМ, з супутньою депресією, в 3–6 разів вищий, ніж у хворих без неї. Депресія — незалежний предиктор смерті у пацієнтів з ІХС. Психоемоційні порушення підвищують ризик раптової коронарної смерті не лише у хворих, але й у здорових осіб.
Незважаючи на клінічне значення, в більшості випадків депресія вчасно не діагностується і не лікується. Труднощі у виявленні депресії зумовлені тим, що такі депресивні симптоми, як астенія, зниження настрою, апатія, порушення апетиту та сну часто розцінюють як природну психологічну реакцію пацієнта на основне захворювання.
Депресія майже завжди супроводжується тривожними симптомами, які значно підвищують ризик розвитку ІХС і зумовлюють її тяжкість. Про зв’язок традиційних факторів ризику і тривожно-депресивних станів свідчить той факт, що серед хворих з АГ поширеність останніх достовірно вище, ніж у осіб з нормальним рівнем АТ; у пацієнтів з тривожно-депресивними станами частота АГ, абдомінального ожиріння та інших факторів ризику вища. Проведене в США дослідження за участю 3 тис. осіб з нормальним АТ показало, що високий рівень тривоги і депресії у людей віком 45–64 років є незалежним чинником ризику розвитку АГ незалежно від раси.
Відомо, що жінки порівняно з чоловіками характеризуються більшим рівнем стресу і підвищеною реакцією на нього, у них в 1,5–2,0 рази частіше виникають різні депресивні порушення.
Встановлено, що депресивний епізод хоча б 1 раз протягом життя відзначають у 20% жінок і лише у 10% чоловіків. Це співвідношення 2:1 у захворюваності депресією не залежить від расової та етнічної належності, економічного статусу та віку.
Більша поширеність психоемоційних порушень у жінок зумовлена біологічними особливостями жіночого організму, а також психологічними і соціальними факторами.
Серед механізмів підвищеної схильності осіб з емоційними порушеннями до розвитку ССЗ виділяють поведінкові (тютюнопаління, вживання алкоголю, недотримання рекомендацій лікаря, недисциплінованість у лікуванні) і патофізіологічні. Серед останніх, по-перше — гіперактивність гіпоталамо-гіпофізарно-наднирникової системи індукує АГ, гіперхолестеринемію, гіпертригліцеридемію, гіперглікемію, інсулінорезистентність та ожиріння. Другий патофізіологічний механізм, пов’язаний з системою згортання крові — у хворих з депресією підвищені реактивність тромбоцитів, рівень внутрішньоклітинного вільного кальцію, фібриногену і фактора VII, що сприяють тромбоутворенню. Третій механізм — порушення ендотеліальної функції і внаслідок цього наявність підвищеного ризику розвитку атеросклеротичного процесу.
Проведене нами дослідження серед жінок віком 20–64 роки з використанням госпітальної шкали тривоги і депресії (HADS), розробленої A.S. Zigmond і R.P. Snaith для скринінгового виявлення цих станів, визначило ознаки тривожно-депресивних станів у 53,9% обстежених, причому у 31,7% осіб вони мали субклінічний характер, а у 22,2% — клінічно виражений (табл. 1.9).
Тривожно-депресивні стани достовірно більше поширені серед жінок з низьким рівнем освіти (62,1%) та у вдов (72,2%).
Поширеність тривожно-депресивних станів підвищується з віком від 38,8% у віці 20–24 років до 67,1% — в 55–64 роки.
Нами встановлено, що у жінок з ознаками тривожно-депресивних станів достовірно частіше реєструється АГ, надлишкова маса тіла і порушення ліпідного обміну (рис. 1.8).
Рис. 1.8. Поширеність факторів ризику у жінок з тривожно-депресивними станами та без них (%)
Серед осіб з клінічно вираженими станами, тобто з максимальними значеннями даних HADS (13–21 бал), відносний ризик виникнення гіпертригліцеридемії в 2,7 раза, ожиріння в 2,2 раза, АГ в 1,7 раза, гіперхолестеринемії в 1,6 раза вищий, ніж у осіб з мінімальними значеннями HADS (0–4 бала). Відносний ризик виникнення ІХС у жінок з клінічними тривожно-депресивними станами становить 2,1; ІМ — 2,0.
Таким чином, поширеність тривожно-депресивних станів у неорганізованій жіночій популяції не поступається за частотою традиційним факторам ризику ССЗ. Результати досліджень свідчать про наявність у осіб з ознаками тривожно-депресивних станів АГ, надлишкової маси тіла і порушень ліпідного обміну.
Для підвищення ефективності профілактичних заходів необхідно контролювати не лише добре відомі фактори ризику, але й виявляти та коригувати психоемоційні порушення.
ЛІТЕРАТУРА
- Борьба с артериальной гипертонией (1996) Пример комитета экспертов ВОЗ, Женева.
- Всемирная декларация и план действий в области питания (1992) Продовольственные и сельскохозяйственные организации ООН (ФАД), WHO, Geneva, с. 19.
- Давиденко Н.В., Смирнова І.П., Горбась І.М., Кваша О.О. (2002) Нераціональне харчування — ризик для здоров’я. Укр. терапевт. журн, 4(3): 26–29.
- Дисліпідемії: діагностика, профілактика та лікування (2007) Метод. рекомендації, Київ.
- Калинина А.М., Чазова Л.Ц., Павлова Л.И. (1996) Влияние многофакторной профилактики ишемической болезни сердца на прогноз жизни. Кардиология, с. 22–27.
- Кваша О.О., Малацківська О.В. (2005) До проблеми вторинної профілактики артеріальної гіпертензії. Охорона здоров’я України, 3–4: 36–40.
- Кулага Э.А. (2005) Распространенность избыточной массы тела и показатели смертности у мужчин в возрасте 40–59 лет, проживающих в Киеве (по данным проспективного исследования). Укр. кардиол. журн., 6: 106–111.
- Малацківська О.В., Горбась І.М. (2005) Зв’язок між традиційними факторами ризику розвитку серцево-судинних захворювань та тривожно-депресивними станами у жінок. Укр. кардіол. журн., 2: 97–100.
- Оганов Р.Г., Ольбинская Л.И., Смулевич А.Б. и соавт. (2004) Депрессии и расстройства депрессивного спектра в общемедицинской практике. Результаты программы КОМПАС. Кардиология; 1: 48–54.
- Рацион питания и предупреждение хронических заболеваний (2003) Пример совместного консультативного совещания экспертов ВОЗ/ФАД. Женева, с. 108–126.
- Смулевич А.Б. (2003) Депрессии при соматических и психических заболеваниях.
- Федоров Б.М. (1990) Стресс и система кровообращения. Медицина, Москва.
- 1999 Word Health Organization — International Society of Hypertension Guidelines for the management of hypertension (1999) J. Hypertens, 17: 151–183.
- Anderson P. et al. (1993) The risk of alcohol. Addiction, 88: 1493–1508.
- Bobak M. (2003) Relative and absolute gender gap in allcause mortality in Europe and the contribution of smoking. Eur. J. Epidemiol., 18: 15–18.
- CINDI dietary guide (2000) WHO, p. 32.
- Critchley J.A., Capewell S. (2003) Mortality risk reduction associated with smoking cessation in patients with coronary heart disease: a systematic review. JAMA, 290: 86–97.
- Diet, nutrition and prevention of chronic diseases: report of WHO study Group (1990) WHO Technical Report Series, № 724, Geneva, p. 203.
- Doll R., Peto R., Boreham J., Sutherland J. (2004) Mortality in relation to smoking: 50 year’ observations on male British doctors. BMJ, 328: 1519–1528.
- European Guidelines on Cardiovascular Disease Prevention in Clinical Practice (2003) Eur. H. J., 24 (17): 1601–1610.
- Еzatti M., Henley S.J., Thun M.J., Lopez A.D. (2005) Role of smoking in global and regional Cardiovascular mortality. Circulation, 115: 489–497.
- Ezatti M., Lopez A.D. (2004) Regional, disease specific patterns of smoking-attributable mortality in 2000. Tobacco Control., 13: 388–395.
- Fletcher G.F., Balady G.J., Vogel R.A. (2002) 33rd Bethesda Conference: Preventive Cardiology: How Can We Do Better? JACC, 40(4): 579–651.
- Frasure-Smith N., Lesperance F., Talajic M. (1995) Depression and 18-month prognosis after myocardial infarction. Circulation, 91: 999–1005.
- Gidron Y., Davidson K. (1996) Development and preliminary testing of a brief intervention for modifying CHD-predictive hostility components. J. Behav. Med., 3: 203–220.
- Houpkins P.H., Williams R.R. (1981) A survey of 246 suggested coronary risk factors. Atherosclerosis, 40(1): 52.
- Jolliffe J.A., Rees K., Taylor R.S. et al. (2003) Exercise-based rehabilitation for coronary heart disease (Cochrane Review). The Cochrane Library; Issue I (Oxford: Update Software).
- Libby P., Ridker P.M., Maseri A. (2002) Inflammation and atherosclerosis. Circulation, 105: 1135–1143.
- Massie B.M. (2002) Obesity and heat failure-risk factor or mechanism? N. Engl. J. Med., 347(5): 358–359.
- McGinnis M.J., Foege W.H. (1993) Actual causes of death in the United States. J. Am. Med. Assoc., 270: 2207–2212.
- Myers J., Prakash M., Froelicher V. et al. (2002) Exercise capacity and mortality among men referred for exercise testing. New Engl. J. Med., 346: 893–801.
- Physical Activity and Health (1996) A Report of the Surgeon General. U.S. Department of Health and Human Services. Centres for Disease Control and Prevention. National Centre for Chronic Disease Prevention and Health Promotion. The President’s Council on Physical Fitness and Sport.
- Radke P.W., Schunkert H. (2006) Public smoking ban: Europe on the move. Eur Heart J., 27(20): 2385–2386.
- Scragg R., Stewart A., Jackson R. et al. (1987) Alcohol and exercise in myocardial infarction and sudden coronary death in men and women. Am. J. Epidemiol., 126: 77–85.
- The ICD — 10 classification of mental and behavioural disorder: clinical descriptions and diagnostic guidelines (1992) Geneva. WHO.
- Thompson G.R. (1989) A Handbook of hyperlipidaemia London, p. 236.
- Wood D., De Backer G., Faergeman O. et al. (1998) Prevention of CHD in clinical practice. Recommendations of the second Joint Task Force of European and other Societies on coronary Prevention. Eur. Heart J., 19: 1434–1503.