Гостра серцева недостатність
Содержание
- ВИЗНАЧЕННЯ
- ЕПІДЕМІОЛОГІЯ, ЕТІОЛОГІЯ І ПРОГНОЗ СИНДРОМУ ГСН
- КЛІНІЧНІ КЛАСИФІКАЦІЇ ГСН
- КЛІНІЧНИЙ СИНДРОМ ГСН
- ПАТОФІЗІОЛОГІЯ ГСН
- ДІАГНОСТИКА ГСН
- Фізикальне обстеження
- ЕКГ
- Рентгенографія органів грудної клітки та інші візуалізуючі методики
- Лабораторні дослідження
- Ехокардіографія
- Інші методи дослідження
- ЛІКУВАННЯ ГСН
- Мета лікування ГСН
- Оксигенотерапія і допоміжне дихання
- Медикаментозна терапія
- Загальні питання лікування ГСН
- ІХС
- ВИСНОВОК
- ЛІТЕРАТУРА
ВИЗНАЧЕННЯ
Гостра серцева недостатність (ГСН) — це клінічний синдром, що характеризується швидким виникненням симптомів і скарг, характерних для порушення роботи серця зі зниженням серцевого викиду, легеневим і/або системним застоєм. ГСН часто розвивається без зв’язку з наявністю кардіологічної патології в минулому. Порушення функції серця може мати характер систолічної або діастолічної дисфункції, порушень серцевого ритму, порушень перед- і постнавантаження. Ці порушення часто носять загрозливий для життя характер і вимагають проведення екстрених заходів. ГСН може розвиватися як гостре захворювання de novo (тобто у пацієнта без наявної раніше дисфункції серця) або як гостра декомпенсація ХСН. При швидкому розвитку ГСН, порівняно з поступовим розвитком симптоматики при декомпенсації ХСН, часто відсутні ознаки затримки рідини в організмі. Таким чином, ГСН потрібно розглядати не як хворобу, а скоріше як синдром, причиною якого є різні механізми.
ЕПІДЕМІОЛОГІЯ, ЕТІОЛОГІЯ І ПРОГНОЗ СИНДРОМУ ГСН
Ріст питомої ваги осіб похилого віку в популяції, підвищення виживаності після перенесеного гострого ІМ призвело до значного збільшення кількості пацієнтів з ХСН і значної кількості госпіталізацій у зв’язку з декомпенсацією СН. ІХС є етіологічною причиною ГСН в 60–70% випадків, особливо у пацієнтів похилого віку. У осіб молодшого віку ГСН розвивається внаслідок ДКМП, аритмій, вроджених і набутих вад серця, міокардитів.
Щороку в США при виписці зі стаціонару діагноз ГСН є основним приблизно в 1 млн випадків, супутнім — ще в 2 млн. Частота ранніх повторних госпіталізацій з приводу СН досить висока і становить близько 20% протягом 30 днів після виписки і 50% протягом 6 міс. Середня тривалість перебування в стаціонарі становить 10 днів. Також слід зазначити, що протягом останніх двох десятиліть 30-денна смертність при ГСН залишається незмінною і становить >10%.
З огляду на це госпіталізацію з приводу ГСН потрібно розглядати як серйозний невідкладний стан, оскільки госпітальна смертність становить 8%, а протягом 6 міс — 25–30%. Смертність особливо висока при гострому ІМ, у результаті якого розвивається СН. Так, 12-місячна смертність становить 30%. При розвитку набряку легень внутрішньогоспітальна смертність — 12%, річна смертність — 40%. Ці дані підтверджуються великими реєстрами, такими як Acute Decompensated Heart Failure National Registry (Національний реєстр гострої декомпенсованої серцевої недостатності, ADHERE) (2005), Euro Heart Survey Programme (Європейська програма кардіологічного обстеження) (2006) та ін.
Витрати на лікування пацієнтів з СН становлять 1–2% від загальних витрат на охорону здоров’я, приблизно 75% витрат пов’язані з лікуванням у стаціонарі. Тяжка СН і гостра декомпенсація є найбільш витратними невідкладними станами в кардіології.
Краще розуміння патофізіологічних процесів, які призводять до ГСН, і чітке визначення наслідків захворювання повинні стати ключем до вивчення нових методів лікування та покращання прогнозу у таких хворих. Причини і ускладнення ГСН наведені нижче в табл. 1.1.
Таблиця 1.1
Причини і фонові стани розвитку ГСН
|
1. Декомпенсація наявної СН (наприклад при кардіоміопатії) |
|
2. Гострий коронарний синдром
|
|
3. Гіпертензивний криз |
|
4. Гострі порушення ритму серця (шлуночкова тахікардія, фібриляція або тріпотіння передсердь, інші суправентрикулярні тахікардії, брадиаритмії різної етіології) |
|
5. Клапанна регургітація (ендокардит, розрив сухожильних хорд; посилення регургітації, яка відзначалась раніше) |
|
6. Тяжкий аортальний стеноз |
|
7. Тяжкий гострий міокардит |
|
8. Тампонада серця |
|
9. Розрив аневризми аорти |
|
10. Післяпологова кардіоміопатія |
|
11. Фонові захворювання, які не належать до серцево-судинної системи:
|
|
12. Синдром високого викиду
|
|
13. Вплив лікарських засобів та інших хімічних речовин (отруєння блокаторами β-адренорецепторів, глікозидами і т.п.) |
Історично ГСН розглядалася тільки як наслідок ХСН у пацієнтів з тяжкими формами систолічної дисфункції ЛШ. Проте нещодавно проведені дослідження показали (табл. 1.2), що характеристика пацієнтів із ГСН значно відрізняється від такої пацієнтів з ХСН. Протягом останніх 2 років було опубліковано кілька великих досліджень, у яких вивчені фундаментальні характеристики хворих, госпіталізованих із ГСН. Ці дослідження показують, що середній вік пацієнтів становить 71–76 років, половина пацієнтів — жінки і половина має збережену ФВ ЛШ (>40%). Ці характеристики значно відрізняються від пацієнтів з ХСН, де пацієнти більш молодого віку, переважно чоловіки, які мають ФВ <40%.
Таблиця 1.2
Клінічна характеристика пацієнтів із ГСН (AHF)
| Показник | Canada AHF |
EuroHeart AHF |
ADHERE AHF (n>100 000) |
CHARM CHF (7599) |
OPTIMI-ZE-HF AHF (n=34 059) |
IMPACT-HF CHF (n=567) |
OPTIME-CHF ADHF (n=951) |
| Вік, років | 76±11 | 71 | 72,5 | 71 | 73±15 | 71±12 | 66±14 |
| Жінки, % | 50 | 50 | 52 | 50 | 52 | 48 | 33,9 |
| ФВ >40% | 50 | 50 | 40 | 50 | 50 | 25 | 0 |
| НН, % | — | 17 | 14 | 17 | 19 | 23,5 | >50 |
| ЦД, % | 34 | 27 | 44 | 27 | 42 | 45,1 | 44 |
| АГ, % | — | — | 72 | — | 71 | 64,7 | 68 |
| ІХС, % | 37 | 31 | 37 | 61 | 50 | 48,7 | 52 |
| ФП, % | 30 | 42 | 30 | 42 | 30 | 35,4 | 34 |
КЛІНІЧНІ КЛАСИФІКАЦІЇ ГСН
У пацієнта з ГСН може визначатися один із нижченаведених станів (табл. 1.3):
Таблиця 1.3
Термінологія та загальні клінічні і гемодинамічні параметри
| Клінічний статус |
ЧСС, уд./хв | САТ, мм рт. ст. |
Серцевий індекс, л/хв/м2 |
ТЗЛК*, мм рт. ст. | Застій за Кілліпом |
Діурез | Гіпоперфузія | Гіпоперфузія органів-мішеней |
| I. Гостра декомпенсована ХСН | +/– | Нижня межа норми/високий | Нижня межа норми/високий | Незначно підвищений | II | + | +/– | – |
| II. ГСН з АГ/ гіпертонічним кризом |
Звичайно підвищена | Високий | +/– | >18 | II–IV | +/– | +/– | +, із симптомами з боку ЦНС |
| II. ГСН з АГ/ гіпертонічним кризом |
+ | Нижня межа норми | Низький | Підвищений | III | + | +/– | – |
| IVa. Кардіогенний шок**/синдром малого викиду |
+ | Нижня межа норми | Низький, <2,2 | >16 | III–IV | Низький | + | + |
| IVб. Тяжкий кардіогенний шок | >90 | <90 | <1,8 | >18 | IV | Дуже низький | ++ | + |
| V. СН з великим викидом | + | +/– | + | +/– | II | + | – | – |
| VI. Гостра правошлуночкова СН | Звичайно низька | Низький | Низький | Низький | – | +/– | +/–, гострий початок |
+/– |
I. Гостра декомпенсована СН (de novo або як декомпенсація ХСН) із характерними скаргами і симптомами ГСН, що є помірною і не відповідає критеріям кардіогенного шоку, набряку легень або гіпертонічного кризу.
II. Гіпертензивна ГСН: скарги та симптоми СН супроводжуються високим АТ з відносно збереженою функцією ЛШ. При цьому на рентгенографії органів грудної клітки немає ознак набряку легень.
III. Набряк легень (підтверджений при рентгенографії органів грудної клітки) супроводжується тяжким порушенням дихання, ортопное, хрипами в легенях, при цьому ступінь насичення крові киснем до лікування, як правило, <90%.
IV. Кардіогенним шоком називають недостатню перфузію життєво важливих органів і тканин, викликану зниженням насосної функції серця після корекції переднавантаження. Щодо параметрів гемодинаміки на сьогодні не існує чітких визначень такого стану, що відображає розбіжність у поширеності та клінічних наслідках при цьому стані (див. табл. 1.3). Проте кардіогенний шок звичайно характеризується зниженням АТ (САТ <90 мм рт. ст. або зниженням середнього АТ >30 мм рт. ст.) і/або малим об’ємом екскреції сечі (<0,5 мл/кг/год) із ЧСС >60 уд./хв незалежно від наявності застійних явищ в органах. Кардіогенний шок є крайнім проявом синдрому малого викиду.
V. СН при високому серцевому викиді характеризується підвищеним ХОК при звичайно підвищеній ЧСС (внаслідок аритмій, тиреотоксикозу, анемії, хвороби Педжета, ятрогенних та інших механізмів), теплими кінцівками, застоєм у легенях та іноді зниженим АТ (як при септичному шоці).
VI. Правошлуночкова СН характеризується синдромом малого серцевого викиду внаслідок насосної неспроможності ПШ (ураження міокарда або велике навантаження — ТЕЛА і т.п.) з підвищенням венозного тиску в яремних венах, гепатомегалією і артеріальною гіпотензією.
Існує багато інших класифікацій синдрому ГСН, які широко використовуються нарівні з вищенаведеною у відділеннях коронарної патології і блоках інтенсивної терапії.
Класифікація за Кілліпом ґрунтується на клінічній симптоматиці та результатах рентгенографії органів грудної клітки. Класифікація застосовується переважно для СН при гострому ІМ, але може застосовуватися при СН de novo. Класифікація за «клінічною тяжкістю» використовується у хворих із кардіоміопатіями і базується на клінічних ознаках. Вона найчастіше використовується при декомпенсації ХСН.
Класифікація за Кілліпом (на основі Killip T. & Kimball J., 1967)
Класифікація за Кілліпом розроблена для клінічної оцінки ступеня тяжкості дисфункції міокарда при гострому ІМ (табл. 1.4).
Таблиця 1.4
Класифікація ГСН при ІМ
| Клас | Клінічні ознаки недостатності |
Частота, % | Смертність, % | Принципи фармакологічного лікування |
| I | Хрипів у легенях та третього додаткового тону немає |
33 | 8 | Немає потреби |
| II | Хрипи не більше ніж над 50% поверхні легень або третій тон |
38 | 30 | Зменшення переднавантаження, в першу чергу за допомогою діуретиків |
| III | Хрипи більш ніж над 50% поверхні легень (часто клінічна картина набряку легень) |
10 | 44 | Зменшення переднавантаження діуретиками і нітратами, а при відсутності ефекту — підвищення серцевого викиду неглікозидними інотропними засобами |
| IV | Кардіогенний шок | 19 | 80–100 | Залежно від клінічного варіанта, тяжкості і типу гемодинаміки різне поєднання інфузійної та інотропної терапії |
Клас I — СН немає. Відсутні клінічні ознаки декомпенсації.
Клас II — СН. До числа діагностичних критеріїв належать хрипи в легенях, ритм галопу, легенева гіпертензія. Застій у легенях з наявністю вологих хрипів у нижніх відділах легень (нижче кута лопатки) з однієї або обох сторін.
Клас III — Тяжка СН. Набряк легень з вологими хрипами над всією поверхнею.
Клас IV — Кардіогенний шок. Артеріальна гіпотензія — САТ <90 мм рт. ст., ознаки периферичної вазоконстрикції — олігурія, ціаноз, надмірне потовиділення.
Класифікація за клінічним ступенем тяжкості
Класифікація за клінічним ступенем тяжкості базується на оцінці периферичного кровообігу (перфузії тканин) і аускультації легень (застій у легенях) (табл. 1.4).
Пацієнтів розділяють на такі групи:
клас I (група A) (теплий і сухий);
клас II (група B) (теплий і вологий);
клас III (група L) (холодний і сухий);
клас IV (група C) (холодний і вологий).
Прогностична цінність цієї класифікації доведена у хворих з кардіоміопатією, і тому вона може застосовуватися для оцінки стану хворих з декомпенсацією ХСН як у стаціонарних, так і в амбулаторних умовах.
КЛІНІЧНИЙ СИНДРОМ ГСН
ГСН є клінічним синдромом, що проявляється зниженням серцевого викиду, тканинною гіпоперфузією, підвищенням ТЗЛК при лівошлуночковій недостатності, застійними явищами в тканинах. Серцева дисфункція може бути пов՚язана з систолічною або діастолічною міокардіальною дисфункцією, гострою клапанною дисфункцією, перикардіальною тампонадою, порушеннями серцевого ритму і провідності, змінами в системі перед- та постнавантаження. Множинна екстракардіальна патологія також може призвести до ГСН внаслідок зміни навантаження на серце, наприклад:
а) підвищення постнавантаження в результаті системної або легеневої гіпертензії або масивної ТЕЛА;
б) підвищення переднавантаження у зв’язку з підвищенням об’єму крові та/або зменшення виділення рідини при патології нирок або ендокринної системи;
в) збільшення серцевого викиду при інфекційних процесах, тиреотоксикозі, анемії, хворобі Педжета. СН може ускладнювати наявну недостатність інших органів і систем. Тяжка СН також індукує поліорганну недостатність, що є потенційно термінальним станом.
Адекватне тривале лікування, по можливості хірургічна корекція патології, що лежить в основі синдрому, можуть запобігти подальшому розвитку ГСН і поліпшити віддалений несприятливий прогноз.
ПАТОФІЗІОЛОГІЯ ГСН
Кінцевим наслідком синдрому ГСН є критична нездатність міокарда підтримувати серцевий викид, необхідний для підтримки адекватної периферичної циркуляції. Для сприятливого клінічного результату при ГСН необхідно, щоб дисфункція міокарда була оборотною. Це особливо важливо при ішемічній ГСН, оглушенні міокарда або його гібернації, тому етіологічно правильне лікування призводить до зворотного розвитку міокардіальної дисфункції.
Оглушенням міокарда називають міокардіальну дисфункцію (зниження скорочувальної здатності міокарда) внаслідок гострої ішемії, що може зберігатися навіть при повному відновленні коронарного кровотоку. Інтенсивність і тривалість оглушення залежать від тяжкості і тривалості попереднього ішемічного епізоду.
Гібернацією («сплячий стан міокарда») називають порушення функції міокарда, що розвивається в результаті різкого зниження коронарного кровотоку, незважаючи на те, що кардіоміоцити продовжують залишатися інтактними. При покращанні кровотоку і доставки кисню до тканин знижена скорочуваність міокарда в зоні порушеного кровотоку може відновитися. Гібернація і оглушення міокарда можуть поєднуватися. При гібернації стан у подальшому поліпшується після відновлення кровотоку та оксигенації тканини, тоді як у випадку оглушення міокард зберігає свій інотропний резерв і може реагувати на інотропну стимуляцію. Оскільки ці механізми залежать від тривалості ішемії міокарда, швидкості відновлення кровотоку і оксигенації, реваскуляризація є необхідною умовою оборотності зазначених патофізіологічних змін.
Таким чином, ГСН включає комбінацію гемодинамічних механізмів, а саме: зниження серцевої скорочуваності, збільшення діастолічної дисфункції, периферичну вазоконстрикцію, затримку рідини і/або Na+, що знижує перфузію і призводить до застою в легенях.
ДІАГНОСТИКА ГСН
Діагноз ГСН встановлюється на основі комплексного клінічного обстеження, що включає дані анамнезу, результати фізикального обстеження, інструментальних досліджень (рентгенографія грудної клітки, ехоКГ) і лабораторних аналізів (схема 1.1).
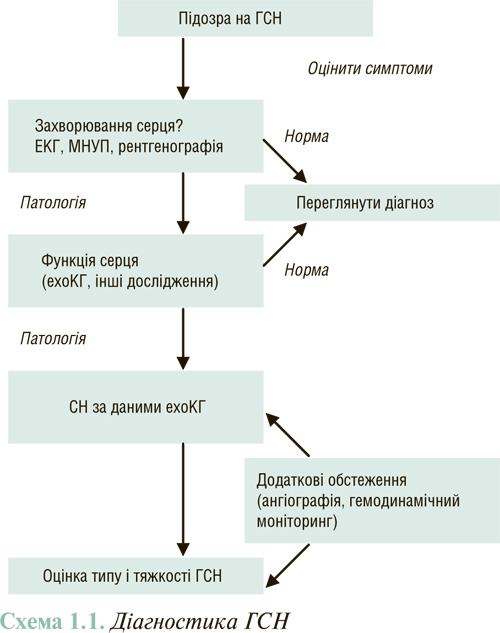
За результатами реєстрів ADHERE, Euro Heart Survey і ряду невеликих досліджень симптоми, які найчастіше відзначають, представлені в табл.1.5.
Таблиця 1.5
Симптоми ГСН
| Задишка (при навантаженні, пароксизмальна нічна задишка, ортопное, задишка в стані спокою або набряк легень) |
| Кашель |
| Тяжке дихання |
| Відчуття дискомфорту в ступнях і ногах |
| Відчуття дискомфорту в черевній порожнині |
| Збільшення об՚єму живота |
| Здуття живота після прийому їжі |
| Раннє насичення їжею або анорексія |
| Біль або дискомфорт у правому підребер’ї |
| Збільшення маси тіла |
| Підвищена втомлюваність |
| Депресія |
| Зміни інтелектуальних здібностей, зниження концентрації уваги |
| Засинання протягом дня |
| Порушення сну |
| Відчуття серцебиття |
| Запаморочення голови, непритомність або втрата свідомості |
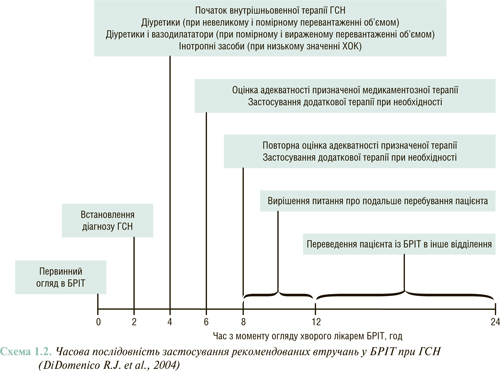
На схемі 1.2 представлено погодинну послідовність встановлення діагнозу ГСН, початку терапії, оцінки адекватності реакції на призначену медикаментозну терапію та прийняття рішення про подальше місцеперебування хворого. Діагноз ГСН повинен бути встановлений через 2 год з моменту госпіталізації в блок реанімації та інтенсивної терапії (БРІТ). Внутрішньовенне застосування лікувальних засобів слід починати також протягом 2 год після встановлення діагнозу, а ще через 2 год внутрішньовенної терапії — оцінити її ефективність і при необхідності застосувати додаткові заходи. Протягом наступних 6–8 год слід продовжити оцінку ефективності лікування.
ГСН необхідно класифікувати відповідно описаним далі критеріям на систолічну і/або діастолічну дисфункцію (табл. 1.6), а також на ліво-/правошлуночкову недостатність із застоєм вище/нижче місця ураження.
Таблиця 1.6
Оцінка функції ЛШ при ГСН
|
Оцінка функції ЛШ — визначення ФВ ЛШ |
|
Систолічна дисфункція ЛШ |
|
Транзиторна систолічна дисфункція |
|
Діастолічна дисфункція |
Фізикальне обстеження
Загальний стан хворого оцінюється вже під час збору анамнезу. Звертають увагу на масу тіла, яка може бути зниженою аж до кахексії. При ожирінні часто відзначають синдром апное під час сну. Анасарка, іктеричність склер також часто супроводжують декомпенсовану СН.
Вимірювання АТ є дуже простим, але важливим методом обстеження пацієнтів з ГСН. Необхідно пам՚ятати про такі аспекти, як вимір АТ у стані спокою, у положенні сидячи та горизонтально, застосування ортостатичної проби. Відомо, що САТ є важливим предиктором прогнозу у хворих із ГСН. Потрібно чітко вимірювати і ДАТ, оскільки по пульсовому тиску опосередковано можна оцінити серцевий викид.
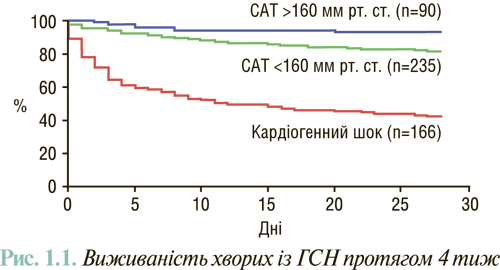
Визначення ЧСС є дуже важливим при первинному обстеженні хворих із ГСН. Декомпенсація може бути результатом дигоксиніндукованої брадикардії, особливо у пацієнтів з нирковою недостатністю, передозування блокаторів β-адренорецепторів, гіпотиреоїдизму або порушення функції провідної системи серця. Наявність тахікардії може свідчити про латентну інфекцію, гіпертиреоїдизм (особливо при застосуванні аміодарону), ТЕЛА, анемію, суправентрикулярну або шлуночкову тахікардію або бути простим маркером тяжкості декомпенсації СН, від чого також залежить прогноз (рис. 1.1).
Для визначення ЧСС проводиться моніторування, оскільки часто визначають дефіцит пульсу (різниця між ЧСС і частотою пульсових хвиль на периферичних артеріях); при пальпаторному методі можна отримати недостовірні результати. З метою визначення адекватності серцевого викиду проводять пальпаторне дослідження властивостей пульсу. Визначення тиску в яремних венах є найчастіше вживаним фізикальним обстеженням пацієнтів із ГСН. Іноді з метою обґрунтування медикаментозної терапії проводять щоденне вимірювання тиску в яремних венах. Окрім того, що тиск у яремних венах відображає тиск у правому передсерді, він асоціюється з діастолічним наповненням, яке можна визначити шляхом катетеризації правих відділів серця, а саме ТЗЛК. Зміна тиску в яремних венах у відповідь на натискання в ділянці середини живота від 10 до 15 с (правий верхній квадрант живота), так званий гепатоюгулярний феномен, також досить інформативно, оскільки корелює з підвищенням тиску в правих відділах серця.
При аускультації легень часто вислуховуються вологі хрипи або крепітація на вдиху. У випадку відсутності хрипів при явній симптоматиці декомпенсації серцевої діяльності застій у легенях можна підтвердити рентгенологічно.
Аускультація серця дає можливість виявити хворих із вадами клапанів серця. У пацієнтів із ішемічною або ідіопатичною ДКМП часто виявляють мітральну регургітацію, що може бути пов՚язано з перевантаженням об’ємом. У випадках, коли після інтенсивної медикаментозної терапії зберігається значна регургітація, пацієнти повинні направлятися на кардіохірургічне лікування.
Наявність додаткового третього тону відзначають у пацієнтів з низькою піддатливістю шлуночків (жорсткість міокарда), підвищеним тиском наповнення шлуночків або підвищеним раннім діастолічним наповненням. Для оптимального вислуховування третього тону пацієнта необхідно покласти на лівий бік, знайти точку максимальної пульсації верхівкового поштовху, при вислуховуванні не притискати голівку фонендоскопа.
Вислуховування цього тону є важливим у пацієнтів із ГСН, особливо для подальшого прогнозу. Доведена його кореляція з рівнем МНУП — основного прогностичного фактора СН. Наявність третього тону у пацієнтів із вираженою дисфункцією ЛШ асоціюється з прогресуванням симптомів СН і є незалежним предиктором ускладнень, таких як дестабілізація СН і смерть у результаті насосної недостатності.
При обстеженні хворих із ГСН звертають увагу на кінцівки з двох причин: для визначення температури та набряків. Залежно від того, кінцівки теплі чи холодні, роблять висновок про адекватність перфузії. Набряки є класичною ознакою декомпенсації ХСН, проте слід пам՚ятати, що відсутність набряків не виключає діагноз ГСН.
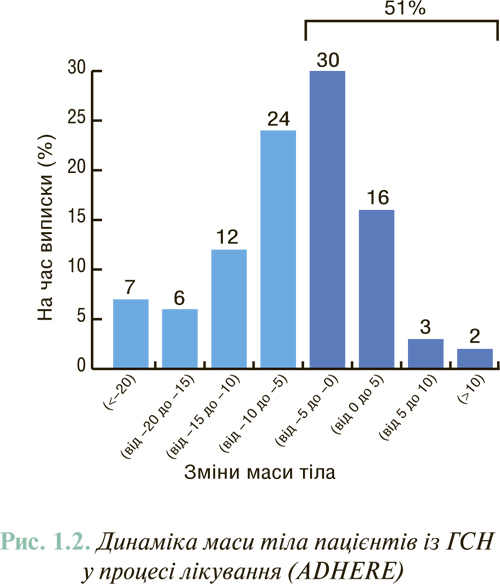
Визначення маси тіла пацієнта також є важливим показником, особливо в динаміці лікування; так, за результатами реєстра ADHERE (рис. 1.2), у половини пацієнтів не досягається зниження цього показника.
ЕКГ
Загальною метою застосування ЕКГ-обстеження у хворих із ГСН є визначення етіології дисфункції ЛШ (ішемічна або неішемічна кардіоміопатія). Як правило, у пацієнтів із систолічною дисфункцією ЛШ ЕКГ досить рідко буває без змін. Тому нормальні показники ЕКГ у стані спокою приблизно у 95% свідчать про збережену ФВ ЛШ. Історично вважають наявність патологічного зубця Q на стандартній ЕКГ у 12 відведеннях свідченням перенесеного раніше ІМ внаслідок коронарного атеросклерозу. Проте таку картину можуть часто відзначати у хворих з неішемічними захворюваннями серця. У таких випадках необхідно базуватися на комплексі досліджень. Наявність патологічного зубця Q не завжди корелює з ФВ ЛШ. При підозрі на гострий коронарний синдром реєстрація ЕКГ обов՚язкова. Виявленню етіології ГСН допомагає визначення ритму і ознак перевантаження серця. На ЕКГ визначаються ознаки збільшення навантаження на ЛШ або ПШ, передсердя, ознаки перикардиту, гіпертрофії шлуночків. Найкращим методом виявлення порушень ритму серця є безперервне моніторування ЕКГ.
Рентгенографія органів грудної клітки та інші візуалізуючі методики
Рентгенографія органів грудної клітки є найбільш простим та доступним методом дослідження, яке слід проводити всім пацієнтам. Це дослідження дозволяє оцінити ознаки венозного застою крові в малому колі кровообігу, причому до появи виражених клінічних проявів цього ускладнення. Рентгенологічно венозний застій крові в легенях проявляється інтенсивним затемненням кореня і периферичних відділів легень, а також значним розширенням легеневих вен (рис. 1.3).
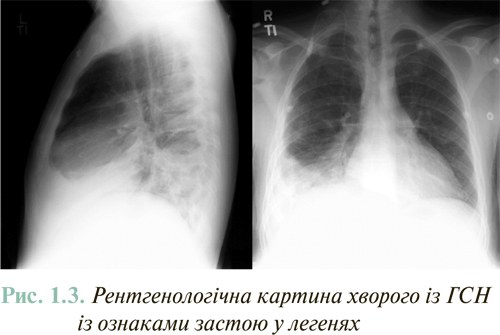
У пацієнтів з ХСН, навіть при наявності підвищеного тиску заклинювання легеневої артерії (ТЗЛА), як правило, відсутні рентгенологічні ознаки застою у легенях.
Також рентгенографію органів грудної клітки у хворих з ГСН необхідно проводити для виявлення інших потенційних симптомів, безпосередньо не пов՚язаних з СН, насамперед пневмонії або ТЕЛА. Рентгенографія використовується як для підтвердження діагнозу, так і для контролю лікування.
Інші візуалізуючі методики, такі як КТ, ядерний магнітний резонанс, позитронна емісійна томографія, радіонуклідні дослідження органів грудної клітки, контрастна ангіографія, застосовуються для більш точної діагностики легеневої патології та діагностики ТЕЛА.
Лабораторні дослідження
Лабораторні дослідження, які необхідно виконати при ГСН, наведені в табл. 1.7. Дослідження газового складу артеріальної крові (за допомогою апарата типу «Astrup») дозволяє оцінити ступінь оксигенації (pО2), адекватність дихальної системи (pСО2), кислотно-основний стан (pН), його порушення. Таким чином, застосування його рекомендоване всім пацієнтам із тяжкою СН. Неінвазивні методи дослідження: пульсоксиметрія і визначення CО2 наприкінці спокійного видиху часто можуть замінити застосування «Astrup», але тільки не при патологічних шокових станах, а у випадку звуження судин і дуже низького серцевого викиду.
Таблиця 1.7
Лабораторне обстеження пацієнтів із ГСН
| Загальний аналіз крові | Завжди |
| Вміст тромбоцитів | Завжди |
| МНВ | Якщо пацієнт отримує антикоагулянти або при тяжкій СН |
| СРБ | Бажано |
| D-димер | При підозрі на ТЕЛА (може дати псевдопозитивний результат при підвищенні СРБ або при тривалій госпіталізації) |
| Сечовина, креатинін та електроліти (Na+, K+) | Завжди |
| Глюкоза крові | Завжди |
| МВ-КФК* або серцеві тропоніни Т/I | Завжди при підозрі на гострий коронарний синдром |
| Газовий склад артеріальної крові | При тяжкій СН |
| Трансамінази | Бажано |
| Загальний аналіз сечі | Бажано |
| МНУП або NT‑проМНУП** у плазмі крові | Бажано |
Активація фізіологічних компенсаторних механізмів внаслідок ураження міокарда, що включає РААС, симпатичну нервову систему (СНС), ендотеліни та інші нейрогуморальні фактори, на сьогодні досить добре вивчена. Розвиток СН характеризується комплексним балансом між вазодилататорними і вазоконстрикторними впливами. Натрійурез, діурез і вазодилататорні механізми зменшують стресорний вплив на серце, але разом з тим пригнічують РААС, СНС, ендотеліни, що призводить до периферичної вазоконстрикції і гемодинамічних змін. Кінцевим результатом прогресивного погіршення функції серця є наростання симптомів СН. Значну роль у цій ланці відіграють НУП: А тип — атріальний (передсердний) натрійуретичний пептид (АNP, ПНУП), В тип — мозковий (BNP, МНУП), які мають пряме відношення до міокардіоцитів, і С тип (CNP) — НУП ендотеліального походження. Базуючись на багатьох експериментальних і клінічних дослідженнях, МНУП вважається найбільш чутливим і специфічним індикатором міокардіального стресу.
Визначення в плазмі крові МНУП (речовини, що утворюється в шлуночках серця при механічному розтягненні його стінок і перевантаженню об’ємом) використовується для виключення або підтвердження наявності СН у пацієнтів, госпіталізованих у стаціонар зі скаргами на задишку. Граничні значення становлять 300 пг/мл для NT-проМНУП і 100 пг/мл для МНУП, проте при визначенні цих граничних величин у дослідження практично не були включені пацієнти похилого віку. Під час розвитку набряку легень значення МНУП до моменту госпіталізації пацієнта може бути нормальним. З іншого боку, МНУП має високе негативне прогностичне значення при виключенні СН. Різні клінічні стани можуть впливати на концентрацію МНУП, наприклад ниркова недостатність і септицемія. При визначенні підвищеної концентрації МНУП необхідне проведення подальших діагностичних тестів. Якщо діагноз ГСН підтверджений, підвищений вміст у плазмі крові МНУП і NT-проМНУП має важливе прогностичне значення.
Тропоніни. Тропоніни — це комплекс трьох білкових субстанцій: тропонін I, тропонін Т і тропонін С. Ці протеїни відіграють ключову роль у регуляції Са2+-опосередкованого скорочення м՚язів. Більшість досліджень, що оцінюють підвищення тропонінів, проводили з приводу гострого коронарного синдрому і ХСН. Відносно ГСН діагностичне значення маютьТ- і I-тропоніни, які відзначають у 23–84% пацієнтів; відсутність цих пептидів асоціюється зі значно кращим прогнозом у таких хворих. Також існує тісна кореляція між підвищенням рівня тропонінів і гемодинамічними маркерами, такими як підвищення ТЗЛА, підвищеним рівнем ПНУП, зниженням серцевого індексу.
Підвищення рівня тропонінів асоціюється з ураженням кардіоміоцитів, на яке звичайно не впливає стандартне лікування СН. Тому майбутня мета терапії повинна включати визначення рівня тропонінів як індикатора тяжкості і продовження ураження кардіоміоцитів і як важливий прогностичний маркер ГСН.
Протягом останнього десятиріччя накопичено багато даних про важливу роль запалення в патогенезі СН. Концепція, вперше запропонована в 1990 р. Levine і співавторами, полягала в тому, що декомпенсація СН супроводжується підвищенням рівня прозапальних цитокінів, у першу чергу ФНП (TNF-α). З того часу значно розширилося розуміння багатофакторного патогенезу та механізмів дестабілізації ХСН і ролі активації запалення в цьому процесі. Відомо, що рівень TNF-α підвищується при станах, асоційованих із дисфункцією ЛШ, включаючи міокардит, сепсис, реакцію відторгнення трансплантата. З фізіологічної точки зору значне підвищення рівня TNF-α стимулює апоптоз, пригнічує скорочувальну здатність міокарда. У ряді проведених досліджень показано, що підвищення TNF-α є незалежним маркером несприятливого прогнозу у пацієнтів з тяжкою СН. На рівні з TNF-α важливе значення мають інші маркери запалення, а саме прозапальний цитокін інтерлейкіна-6 (IL-6), рівень якого підвищується у пацієнтів із гострим ІМ, СН середнього і тяжкого ступеня. Як показано у ряді досліджень, підвищення IL-6 є незалежним предиктором смертності пацієнтів із ХСН.
Найбільш дослідженим реактантом гострої фази запалення вважається CРБ, що продукується в печінці у відповідь на підвищення IL-6 та інших запальних цитокінів і використовується як показник системної запальної активності. На сьогодні в ряді досліджень чітко показаний взаємозв՚язок між підвищеним рівнем CPБ і кардіоваскулярними ускладненнями, такими як нестабільна стенокардія та гострий ІМ. Окреме значення в патофізіології СН має високочутливий CPБ (high-sensitive CRP, hsCRP), що вважається ідеальним біомаркером запалення саме у пацієнтів із гострою декомпенсованою СН. Підвищення рівня hsCRP при госпіталізації асоціюється із тяжким перебігом ГСН протягом госпітального періоду і є незалежним предиктором регоспіталізації і смертності.
Існує ще одна гіпотеза про те, що запалення виступає основним фактором дестабілізації СН або принаймні прискорює декомпенсацію СН. Хоча на сьогодні вона клінічно не доведена, але має підстави для існування. У першу чергу підвищений рівень циркулюючих прозапальних маркерів може вказувати на хворих з високим ризиком, що можна використати з метою стратифікації ризику пацієнтів, у яких можлива декомпенсація СН, особливо у поєднанні з іншими клінічними даними. З іншого боку, недостатнє зниження маркерів запалення при невідкладній терапії ГСН може виявити хворих із потенційно високим ризиком негативного прогнозу, яким можливо знадобиться більш агресивне втручання або більш ретельне спостереження в динаміці. Нарешті, докази зв՚язку запалення і декомпенсації СН слід використати для розробки нових методів терапевтичних втручань у пацієнтів із декомпенсованою СН і підвищеним рівнем маркерів запалення.
Ехокардіографія
Проведення ехоКГ є важливим методом виявлення структурних і функціональних змін, які викликали або виникли внаслідок ГСН, а також при гострому коронарному синдромі. ЕхоКГ з допплєрівським дослідженням слід використати для вивчення і моніторингу систолічної і діастолічної функцій ЛШ і ПШ, структури і функції клапанів серця, виявлення можливої патології перикарда, механічних ускладнень гострого ІМ і місця ураження. Серцевий викид визначається з використанням відповідних параметрів допплєрівського дослідження на аорті і ЛА. Крім того, при цьому виді дослідження можна визначити тиск у системі ЛА (за ступенем трикуспідальної регургітації) і з його допомогою проводити моніторинг переднавантаження ЛШ.
Часто у пацієнтів із тяжким гострим легеневим застоєм (набряком легень) або декомпенсованою СН визначають нормальну ФВ ЛШ, тому що у них переважно порушена діастолічна функція. Робочою групою Європейського товариства кардіологів розроблені три критерії діагностики діастолічної СН:
1 — ознаки і симптоми СН;
2 — наявність нормальної лівошлуночкової систолічної функції;
3 — підтвердження аномального розслаблення, наповнення або діастолічної жорсткості ЛШ.
Інші методи дослідження
Дослідження інвазивних гемодинамічних параметрів — катетеризація правих відділів серця і катетери Swan-Ganz використовуються не дуже часто внаслідок інвазивності процедури і незабезпеченості терапевтичних клінік необхідним устаткуванням. Це базується на результатах дослідження Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness Study (ESCAPE), що демонструє відсутність короткострокової або тривалої користі катетеризації правих відділів серця у пацієнтів із тяжкою декомпенсованою СН. З урахуванням цього на сьогодні ефективність застосування цієї методики остаточно не визначена. З іншого боку, ТЗЛА розглядається як дуже важливий гемодинамічний параметр у пацієнтів із ГСН. Слід відзначити, що в дослідженні ESCAPE ТЗЛА був сильним незалежним предиктором летальності і регоспіталізації.
При наявності патології коронарних артерій, наприклад нестабільної стенокардії або ІМ, важливим є проведення ангіографії та визначення необхідності реваскуляризаційних процедур, що значно поліпшують прогноз.
ЛІКУВАННЯ ГСН
Мета лікування ГСН
Головна мета лікування — зменшення вираженості клінічних симптомів і стабілізація гемодинаміки (табл. 1.8). Поліпшення тільки гемодинамічних параметрів може призвести до неправильних висновків, тому одночасно необхідно усувати задишку і слабкість. Зазначені позитивні ефекти, яких можна досягти за короткий час, повинні також супроводжуватися сприятливими ефектами щодо віддалених результатів. Цього можна досягти шляхом запобігання або обмеження ураження міокарда.
Таблиця 1.8
Мета лікування пацієнтів із ГСН
|
Клінічні симптоми |
|
↓ скарги (задишка і/або слабкість) ↓ симптоматика ↓ маса тіла ↑ діурез ↑ оксигенація крові |
|
Лабораторні показники |
|
Нормалізація електролітів сироватки крові ↓ азоту сечовини і/або креатиніну ↓ білірубіну ↓ МНУП у плазмі крові нормалізація глюкози крові |
|
Гемодинамічні показники |
|
↓ ТЗЛК <18 мм рт. ст. ↑ серцевого викиду і/або ударного об’єму |
|
Клінічні результати |
|
↓ тривалість перебування у відділенні інтенсивної терапії ↓ тривалість госпіталізації ↑ час до повторної госпіталізації ↓ летальність |
|
Переносимість |
|
Висока комплаєнтність Низька частота побічних ефектів |
Дуже важливим є також усунення інших клінічних симптомів, що є у пацієнта: зниження маси тіла, посилення діурезу — при застійних явищах та олігурії на фоні ГСН. Підвищення оксигенації крові, покращання функції печінки і нирок, нормалізація електролітного складу сироватки крові також важливі при лікуванні ГСН. Концентрація МНУП у плазмі крові може відображати гемодинамічне покращання, тому необхідно прагнути до зниження цього показника.
Щодо клінічних результатів важливими є показники тривалості внутрішньовенної інфузії вазоактивних компонентів, тривалість перебування в стаціонарі, час до повторної госпіталізації. Головна мета лікування — зниження як внутрішньогоспітальної, так і віддаленої смертності.
Хворі з ГСН мають потребу в невідкладній медичній допомозі, найкращі результати при лікуванні таких пацієнтів досягаються за допомогою залучення спеціально навченого персоналу в спеціалізованих відділеннях — БРІТ кардіологічного профілю, де повинен бути забезпечений доступ до максимальної кількості діагностичних обстежень — ехоКГ, коронарна ангіографія, при необхідності інвазивне моніторування гемодинаміки.
Дуже важливим фактором є те, наскільки швидко пацієнт отримав догоспітальну допомогу, коли надійшов у спеціалізоване відділення і як швидко почалася внутрішньовенна терапія. Наявні дані свідчать про те, що раннє внутрішньовенне введення вазоактивних препаратів знижує тривалість перебування в стаціонарі. Аналіз даних 1414 хворих, включених у дослідження ADHERE, показав, що цей показник був на 3,1 доби менше при внутрішньовенному введенні вазодилататорів, незиритиду або інотропних препаратів у БРІТ, ніж у випадку початку такої терапії в профільному відділенні (6,3±6,5 і 9,4±10,9 доби відповідно, р<0,05).
Моніторинг стану пацієнта з ГСН слід починати якомога раніше після надходження пацієнта в стаціонар, одночасно з необхідними діагностичними та лікувальними заходами. Тип і ступінь моніторингу визначаються індивідуально в кожному конкретному випадку і залежать від ступеня декомпенсації та відповіді на початкову терапію.
У всіх пацієнтів, які перебувають у критичному стані, необхідно проводити моніторинг АТ, ЧСС, температури тіла, частоти дихання, параметрів ЕКГ. Ряд лабораторних досліджень необхідно періодично повторювати, наприклад визначення електролітів, креатиніну, глюкози, маркерів запалення та інших метаболічних порушень. Обов՚язково необхідно контролювати рівень калію. Використання сучасного автоматичного устаткування дозволяє проводити це швидко та чітко. Якщо стан хворого погіршується, необхідно підвищити частоту обстежень. Моніторинг ЕКГ (ЧСС, аритмії і сегмент ST) необхідний у фазі декомпенсації, особливо якщо ішемія і аритмія є наслідком гострої події.
Підтримка нормального АТ необхідна на початку лікування, і в подальшому визначення цього параметра слід проводити регулярно (наприклад кожні 5 хв) до того часу, поки терапія вазодилататорами, діуретиками або інотропними засобами не стабілізує цей показник. Надійність неінвазивного автоматичного визначення АТ за допомогою плетизмографії є високою при відсутності вираженої вазоконстрикції та підвищеної ЧСС.
Пульсоксиметр — простий неінвазивний пристрій, що визначає сатурацію гемоглобіну в артеріальній крові (SaО2). Пульсоксиметрію необхідно проводити безперервно будь-якому пацієнтові, що перебуває в нестабільному стані, або при респіраторній підтримці з концентрацією кисню у повітрі, що вдихається (FiО2) більше, ніж у навколишньому середовищі. Необхідно проводити визначення цього показника через певні проміжки часу (щогодини) будь-якому пацієнтові, що отримує оксигенотерапію у зв՚язку з гострою декомпенсацією. Серцевий викид і параметри переднавантаження моніторуються неінвазивним способом із застосуванням допплєрівських методик. Не існує доказів переваги будь-якої з цих методик при моніторуванні пацієнта, а також відомостей про обмеження їх використання.
Частина пацієнтів для моніторування необхідних життєво важливих параметрів або контролю адекватності терапії має потребу в інвазивних втручаннях: артеріальний катетер, центральний венозний катетер, катетеризація ЛА.
Показанням до введення артеріального катетера є необхідність безперервного аналізу АТ внаслідок гемодинамічної нестабільності або повторного лабораторного дослідження артеріальної крові.
Центральний венозний катетер дозволяє отримати доступ до венозної крові і тому його встановлення необхідно при масивній інфузійній терапії, введенні різних лікарських засобів, моніторингу ЦВТ і визначенні венозної сатурації кисню (SvО2) у верхній порожнистій вені або правому передсерді, що дає важливі дані про транспорт кисню.
Як зазначалося, необхідно з обережністю ставитися до інтерпретації результатів визначення тиску в правому передсерді, тому що цей показник у пацієнтів із ГСН дуже слабко корелює з тиском у лівому передсерді і тиском наповнення ЛШ. Вимірювання ЦВТ буде неінформативним при трикуспідальній регургітації та вентиляції легень у режимі позитивного тиску наприкінці видиху.
Катетер у ЛА (КЛА) є флотуючим балонним катетером, за допомогою якого можна виміряти тиск у верхній порожнистій вені, правому передсерді, ПШ, ЛА, а також визначити серцевий викид. Сучасні катетери дозволяють визначати серцевий викид у напівбезперервний спосіб, оцінювати насичення киснем змішаної венозної крові, кінцевий діастолічний тиск і ФВ ПШ.
Хоча установка КЛА для діагностики ГСН звичайно не є необхідною, її можна використати для диференціації кардіогенних і некардіогенних причин у пацієнтів із супутньою патологією або захворюваннями легень. КЛА також використовується для визначення ТЗЛА, серцевого викиду та інших гемодинамічних параметрів як провідник для терапії при дифузних захворюваннях легень і гемодинамічній нестабільності, незважаючи на лікування, що проводиться. ТЗЛА не відображає кінцевий діастолічний тиск ЛШ у пацієнтів із мітральним стенозом, аортальною регургітацією, міжшлуночковим шунтом, високим тиском у дихальних шляхах або надлишковій жорсткості ЛШ при його гіпертрофії, цукровому діабеті, фіброзі ендокарда, введенні інотропних засобів, ожирінні, ішемії. Значна трикуспідальна регургітація, що часто виявляється у пацієнтів з ГСН, також може впливати на визначення серцевого викиду методом термодилюції.
Використання КЛА рекомендується пацієнтам з гемодинамічною нестабільністю та незадовільною відповіддю на класичну терапію, а також у пацієнтів з комбінацією застою та гіпоперфузії. У цих випадках встановлення катетера є необхідним для прийняття рішення щодо оптимальної інфузійної терапії і для контролю введення вазоактивних та інотропних засобів (табл. 1.9).
Таблиця 1.9
Загальні терапевтичні підходи при використанні інвазивного моніторингу при ГСН
| Гемодинамічна характеристика | Терапевтичний підхід | ||||
| Серцевий індекс | Знижений | Знижений | Знижений | Знижений | Збережений |
| ТЗЛА | Низький | Високий або нормальний | Високий | Високий | Високий |
| САТ, мм рт. ст. | >85 | <85 | >85 | ||
| Тип лікування | Об’ємна інфузія | Вазодилататори (нітрогліцерин) при необхідності — навантаження рідиною |
Інотропні засоби (добутамін, допамін) і діуретики внутрішньовенно |
Вазодилататори (нітрогліцерин) діуретики, інотропні засоби (добутамін, левосимендан) | Внутрішньовенно діуретики. При низькому САТ — інотропні засоби з вазоконстрикторною дією |
Оксигенотерапія і допоміжне дихання
Оксигенотерапія
Підтримка SaО2 у межах норми (95–98%) дуже важлива для забезпечення нормального транспорту кисню до тканин та їх оксигенації, що запобігає дисфункції органів та поліорганній недостатності.
Спочатку слід забезпечити прохідність дихальних шляхів і призначити оксигенотерапію із зростаючою концентрацією кисню FiО2. Ендотрахеальна інтубація необхідна, якщо ці заходи не забезпечують належної оксигенації тканин.
Інгаляція високих концентрацій кисню пацієнтові з СН та гіпоксемією безумовно необхідна, але її використання у хворих без ознак гіпоксемії може нашкодити і тому її слід уникати.
Допоміжне дихання
Для респіраторної підтримки без ендотрахеальної інтубації (неінвазивна вентиляція легень (НВЛ)) використовуються дві основні методики: режим безперервного позитивного тиску (БПТ) при адекватному спонтанному диханні та неінвазивна масочна вентиляція легень (НІМВЛ). НІМВЛ дозволяє проводити механічну вентиляцію без ендотрахеальної інтубації. Існує безперечна думка про те, що одну з цих методик завжди необхідно використовувати перед інтубацією трахеї та проведенням штучної вентиляції легень (ШВЛ). Використання неінвазивних методик дозволило значно знизити необхідність в інтубації трахеї та проведенні ШВЛ.
Використання БПТ здатно відновити функцію легень і призводить до підвищення функціонального залишкового об’єму. Зменшується жорсткість легень, знижується градієнт трансдіафрагмального тиску, знижується активність діафрагми. Це зумовлює зменшення роботи, пов՚язаної з диханням, і призводить до загального зменшення метаболічних потреб організму.
Респіраторна підтримка в режимі БПТ у пацієнтів з лівошлуночковою недостатністю (кардіогенний набряк легень) покращує оксигенацію, зменшує вираженість симптоматики ГСН, а також призводить до зменшення потреби в ендотрахеальній інтубації.
Інвазивну респіраторну підтримку (ШВЛ з ендотрахеальною інтубацією) не слід використовувати для зменшення гіпоксемії, тому що цього можна досягти, використовуючи НВЛ або оксигенотерапію. Таку методику необхідно застосовувати при ГСН-індукованій слабкості дихальних м՚язів. Слабкість дихальних м՚язів проявляється зниженням частоти дихання, асоційованим з гіперкапнією і порушенням свідомості. ШВЛ можуть застосовувати лише в тому випадку, коли гостру дихальну недостатність не вдається подолати шляхом введення вазодилататорів, оксигенотерапією і/або НВЛ у режимах БПТ і НІМВЛ. Крім того, іноді існує необхідність у негайній інвазивній вентиляції при набряку легень внаслідок ІМ з елевацією сегмента ST.
Медикаментозна терапія
Морфін і його аналоги
Застосування морфіну або його аналогів рекомендовано на ранніх стадіях лікування пацієнтів із тяжкою ГСН, особливо при наявності збудження та вираженої задишки. Морфін викликає венозну і помірну артеріальну дилатацію, а також знижує ЧСС. У більшості досліджень морфін вводили внутрішньовенно болюсно відразу ж після встановлення внутрішньовенного катетера. При необхідності можливе повторне введення.
Діуретики
Серцева декомпенсація характеризується зниженням систолічної функції ЛШ, а в багатьох випадках аномальною діастолічною функцією. У результаті зниження серцевого викиду і підвищення кінцевого діастолічного тиску в ЛШ з՚являється субстрат для затримки Na+ в організмі. Зниження серцевого викиду та підвищення ЗПСО призводить до зниження ниркового кровотоку, що в свою чергу активує нейрогуморальну систему (медіатори, що викликають вазоконстрикцію) і підвищує секрецію альдостерону. Тому збільшується загальний об’єм рідини в організмі, зокрема об’єм плазми крові, тобто гемодинамічна реакція є основою для затримки Na+ в організмі.
Зниження швидкості клубочкової фільтрації (ШКФ) при СН має високу ступінь кореляції з гемодинамічними параметрами. Значне зниження серцевого викиду і ниркового кровотоку асоціюється зі значним зниженням ШКФ. Нейрогуморальні фактори, що сприяють затримці Na+ та рідини, включають альдостерон, вазопресин, ангіотензин II, норепінефрин і вазоконстрикторні простагландини. Навпаки, простациклін, допамін і передсердний натрійуретичний гормон сприяють екскреції Na+.
Внутрішньовенне введення діуретиків зменшує вираженість симптомів ГСН, тому їх слід застосовувати як препарати першого ряду при наявності ознак застою в легенях і периферичних набряках, зумовлених затримкою рідини в організмі. Проте на сьогодні дані про вплив діуретичної терапії на поліпшення прогнозу у таких хворих обмежені. Доведено, що застосування діуретиків у високих дозах призводить до нейрогормональної активації і сприяє системному судинозвужувальному ефекту. Відповідно на фоні їх застосування поліпшення гемодинаміки може бути недостатньо вираженим, а усунення симптомів — неповним (толерантність до дії діуретиків).
Діуретики збільшують об’єм сечі, що виділяється, внаслідок посилення виділення рідини, натрію та інших іонів. Це призводить до зменшення об’єму плазми крові і внутрішньосудинного об’єму, зниженню загального вмісту води і натрію в організмі, тиску наповнення ПШ і ЛШ серця, зменшенню вираженості застою та набряку легень. Внутрішньовенне введення петльових діуретиків також здійснює вазодилатуючий ефект, що проявляється раннім (через 5–30 хв) зниженням тиску в правому передсерді і ТЗЛА, а також зниженням легеневого опору. При болюсному введенні фуросеміду у високих дозах (>1 мг/кг) існує ризик розвитку рефлекторної вазоконстрикції. При гострому коронарному синдромі діуретики необхідно використовувати в низьких дозах, переважно внутрішньовенно.
Внутрішньовенне введення петльових діуретиків (фуросеміду, торасеміду) викликає виражений діуретичний ефект і є методом вибору у пацієнтів із ГСН. Введення ударної дози з наступною інфузією фуросеміду або торасеміду більш ефективно порівняно тільки з болюсним введенням. Таку терапію можна безпечно починати перед госпіталізацією пацієнта, а дозу препарату необхідно титрувати до досягнення діуретичного ефекту і зменшення вираженості симптомів застою. У табл. 1.10 наведено фармакокінетику діуретиків при внутрішньовенному введенні.
Таблиця 1.10
Фармакокінетика діуретиків при внутрішньовенному введенні
Тіазидні діуретики, спіронолактон і еплеренон (у хворих із гострим ІМ і після нього) можуть бути використані в комбінації з петльовими діуретиками. Комбінація діуретиків у низьких дозах більш ефективна і рідше викликає побічні ефекти порівняно із застосуванням одного діуретика у високих дозах. Використання петльових діуретиків одночасно з добутаміном, допаміном або органічними нітратами також сприяє підвищенню ефективності фармакотерапії. При зменшенні вираженості симптомів затримки рідини в організмі необхідне зниження дози.
Контроль рівня іонів K+ і Na+ у сироватці крові, а також оцінку функції нирок необхідно проводити регулярно з короткими інтервалами (через кожні 1–2 дні) залежно від реакції на лікування. У табл. 1.11 наведено рекомендовані дози діуретиків, які найчастіше застосовуються при СН.
Таблиця 1.11
Дозування та спосіб введення діуретиків
| Ступінь затримки рідини в організмі | Препарат | Доза, мг | Коментарі |
| Помірно виражена | Фуросемід Буметанід Торасемід |
20–40 0,5–1,0 10–20 |
Внутрішньо або внутрішньовенно залежно від клінічної симптоматики Титрування дози залежно від клінічної реакції Регулярний контроль рівня K+, Na+ та креатиніну в сироватці крові, АТ |
| Тяжка | Фуросемід Фуросемід (інфузія) Буметанід Торасемід |
40–100 5–40 мг/год 1–4 20–100 |
Внутрішньовенно Перевага надається внутрішньовенному, а не болюсному введенню у високій дозі Внутрішньо або внутрішньовенно Внутрішньо |
| Рефрактерна до петльових діуретиків | Приєднати гідрохлоротіазид або Спіронолактон або Еплеренон |
25–50 мг 2 рази на добу 25–50 мг 1 раз на добу 50 мг 1 раз на добу |
Перевага надається комбінації з петльовими діуретиками, а не монотерапії петльовими діуретиками у високих дозах Спіронолактон є засобом вибору при відсутності у пацієнта ниркової недостатності і гіперкаліємії У хворих з ІМ та після нього |
| У випадку алкалозу | Ацетазоламід | 500 мг | Внутрішньовенно |
| Рефрактерна до петльових і тіазидних діуретиків | Додати допамін для дилатації ниркових судин або добутамін в якості інотропного засобу | При нирковій недостатності рекомендується проведення ультрафільтрації або гемодіалізу |
Резистентність до діуретиків визначається як клінічний стан, при якому реакція організму на діуретики знижена або втрачена до того, як досягнута терапевтична мета — усунення набряку. Така толерантність асоціюється з поганим прогнозом. Частіше відзначають у пацієнтів із тяжкою ХСН при тривалій діуретичній терапії, хоча також визначається і при гострій гіповолемії після внутрішньовенного введення петльових діуретиків. Резистентність до діуретиків може бути викликана впливом ряду факторів (табл. 1.12).
Таблиця 1.12
Причини розвитку рефрактерності до діуретиків
|
Зменшення внутрішньосудинного об’єму (гіповолемія) Нейрогормональна активація Зворотна реабсорбція іонів Na+ після зменшення об’єму циркулюючої крові Гіпертрофія дистальних відділів нефрону Зниження канальцевої секреції (ниркова недостатність, застосування НПЗП) Зниження перфузії нирок (низький серцевий викид) Порушення всмоктування пероральних форм діуретиків Недотримування схеми лікування або дієти (вживання великої кількості натрію) |
Терапевтичні підходи до подолання резистентності до діуретиків наведені в табл. 1.13. У клінічній практиці може бути доцільним застосування різних стратегій з урахуванням індивідуального підхода до кожного пацієнта.
Таблиця 1.13
Подолання рефрактерності до діуретиків
|
Обмеження вживання натрія і води, контроль електролітного балансу крові Поповнення дефіциту рідини при гіповолемії Підвищення дози і/або частоти застосування діуретиків Застосування внутрішньовенної інфузії (більш ефективна, ніж болюсне введення або прийом внутрішньо) Комбінована діуретична терапія:
Комбінація діуретика з допаміном або добутаміном Зниження дози інгібітору АПФ або застосування інгібіторів АПФ у дуже низьких дозах Якщо засоби, що приведені вище, неефективні, слід вирішити питання про проведення ультрафільтрації або гемодіалізу |
Хоча діуретики можна безпечно застосовувати у більшості пацієнтів, у ряді випадків можливий розвиток побічних ефектів, які іноді можуть становити загрозу для життя. До них відносяться: активація нейрогормональних систем (ангіотензин-альдостеронової, симпатичної); гіпокаліємія, гіпомагніємія і гіпохлоремічний алкалоз, що може призвести до розвитку небезпечної аритмії; нефротоксична дія і прогресування ниркової недостатності. Надмірно підвищений діурез може призвести до значного зниження венозного тиску, ТЗЛА та діастолічного наповнення, що викликає зменшення ударного об’єму і серцевого викиду, особливо у пацієнтів із тяжкою СН і переважно діастолічною недостатністю або ішемічною дисфункцією ПШ.
Вазодилататори в лікуванні ГСН
Вазодилататори показані хворим із ГСН як терапія першої лінії. Внутрішньовенне введення вазодилататорів дає можливість швидко вивести хворого із стану декомпенсації за рахунок покращання гемодинаміки. Застосування вазодилататорів статистично значимо зменшує тиск наповнення шлуночків серця — тиск заклинювання в легеневих капілярах, тобто переднавантаження, протягом 24–48 год і зменшує потребу міокарда в кисні. Така терапія дозволяє знизити ЗПСО (або постнавантаження) і об’єм навантаження ЛШ, збільшити УОК і ХОК. Вазодилататори також рекомендують більшості пацієнтів із ГСН у тому випадку, якщо гіпоперфузія поєднується з нормальним АТ, явищами застою в легенях і зниженим діурезом. У цих випадках застосування вазодилататорів збільшує периферичну циркуляцію та зменшує переднавантаження (табл. 1.14).
Таблиця 1.14
Показання до призначення вазодилататорів при ГСН та їх дозування
| Вазодилататор | Показання | Дозування | Побічні ефекти |
Коментарі |
| Нітрогліцерин | ГСН при нормальному АТ | Початкова швидкість інфузії — 20 мкг/хв з поступовим підвищенням до 200 мкг/хв |
Артеріальна гіпотензія, головний біль |
Безпечний, при постійному прийомі розвивається толерантність |
| Ізосорбіду динітрат | ГСН при нормальному АТ | Початкова швидкість інфузії — 1 мг/год з поступовим підвищенням до 10 мг/год | Гіпотензія, головний біль | Безпечний, при постійному прийомі розвивається толерантність |
| Нітропрусид натрія | Гіпертензивний криз, кардіогенний шок (у поєднанні з інотропними засобами) | 0,3–5 мкг/кг/хв | Артеріальна гіпотензія, токсична дія, зумовлена ізоціанатом | Чутливий до дії світла |
| Незиритид | Гостра декомпенсована СН | Внутрішньовенно болюсно в дозі 2 мкг/ кг + внутрішньовенно крапельно зі швидкістю 0,015–0,03 мкг/кг/хв |
Артеріальна гіпотензія |
Органічні нітрати. Нітрати зменшують застій у легенях без несприятливого впливу на ударний об’єм серця і потребу міокарда в кисні, що особливо важливо при гострому коронарному синдромі. У низьких дозах вони викликають дилатацію тільки венозних судин, при збільшенні дози — також і артерій, у тому числі коронарних. При призначенні в адекватних дозах нітрати дозволяють зберегти баланс між дилатацією артеріального та венозного русла, що веде до зменшення перед- і постнавантаження на серце без погіршення тканинної перфузії. Титрування дози нітратів до максимальної гемодинамічно переносимої дози у поєднанні із застосуванням фуросеміду в низькій дозі більш ефективно, ніж монотерапія діуретиком у високій дозі.
За результатами одного рандомізованого дослідження прийом фуросеміду і болюсного парентерального введення ізосорбіду динітрату довели, що внутрішньовенне введення нітратів у високих дозах було більш ефективним, ніж терапія фуросемідом щодо усунення тяжкого набряку легень.
При застосуванні в субоптимальних дозах вазодилататори можуть виявляти обмежений ефект відносно запобігання рецидивів ГСН. Проте введення нітратів у високих дозах також може призвести до зниження їх ефективності. Головним недоліком нітратів є швидкий розвиток толерантності, особливо при внутрішньовенному введенні у високих дозах, що обмежує їх ефективність тільки 16–24 год; продовження подальшого введення вимагає застосування більш високих доз. Разом з тим неадекватна вазодилатація може викликати різке зниження АТ, що призводить до нестабільності гемодинаміки.
Нітрогліцерин випускається у формах для прийому всередину/сублінгвально та для інгаляційного введення (спрей нітрогліцерину в дозі 400 мкг (2 натискання) кожні 5–10 хв під контролем АТ). Внутрішньовенне введення нітратів (нітрогліцерин зі швидкістю 20 мкг/хв із поступовим підвищенням дози до 200 мкг/хв або ізосорбіду динітрату зі швидкістю 1–10 мг/год) слід застосовувати надзвичайно обережно, при постійному контролі рівня АТ, титруючи дозу препарату для попередження артеріальної гіпотензії. Особливої обережності необхідно дотримуватися при застосуванні нітратів у пацієнтів із аортальним стенозом, їх призначають тільки за суворими показаннями.
Дозу нітратів слід знизити, якщо рівень САТ знижується <90–100 мм рт. ст. і повністю відмінити при подальшому зниженні АТ.
Нітропрусид натрію. Застосовувати нітропрусид натрію рекомендують у пацієнтів із тяжкою СН, а також у хворих з переважним підвищенням постнавантаження, насамперед при АГ із СН або при мітральній регургітації. Дозу нітропрусиду натрію необхідно титрувати з обережністю при обов՚язковій умові моніторингу АТ та постійного спостереження стану пацієнта. Тривале введення препарату може супроводжуватися проявами токсичної дії його метаболітів — тіоціаніду й ціаніду, тому з особливою обережністю його слід застосовувати у пацієнтів із тяжкою печінковою або нирковою недостатністю. Дозу нітропрусиду натрію необхідно знижувати поступово для запобігання розвитку синдрому відміни. При ГСН, зумовленій гострим коронарним синдромом, доцільніше застосовувати нітрати, ніж нітропрусид натрію, оскільки останній може викликати розвиток синдрому коронарного обкрадання.
Незиритид — представник нового класу вазодилататорів, препарат рекомбінантного МНУП людини, що відносно недавно включений до арсеналу засобів, які застосовуються при ГСН (рис. 1.4). МНУП виробляється у шлуночках серця у відповідь на підвищення напруження його стінок при перевантаженні об’ємом, зумовленим ГСН.
При внутрішньовенному введенні незиритид розширює венозні, артеріальні, в тому числі коронарні судини, що призводить до зниження перед- і постнавантаження та підвищення серцевого викиду без прямого інотропного ефекту. Цим самим зменшується вираженість симптомів ГСН, насамперед задишки, і поліпшується клінічний стан. Оскільки в рекомендованих дозах незиритид виявляє передбачувану та тривалу дію, при його застосуванні немає необхідності підбирати швидкість інфузії та інвазивного контролю гемодинаміки. Відповідно при терапії незиритидом не потрібне проведення дуже ретельного контролю, як при використанні інших вазодилататорів (нітрогліцерину або нітропрусиду натрію), і перебування хворого в БРІТ.
У клінічних дослідженнях при участі більш ніж 1000 хворих із ГСН його внутрішньовенне введення значно знижувало системний судинний опір, тиск у правому передсерді, а також ТЗЛК, збільшувало серцевий викид, натрійурез і діурез, що сприяло швидкому поліпшенню клінічного стану хворих. Незиритид у цих хворих знижував підвищений рівень нейрогормонів у крові.
Препарат не впливає на ЧСС, не підвищує споживання кисню міокардом, на відміну від добутаміну не проявляє проаритмогенну дію, а на відміну від нітрогліцерину не викликає розвитку тахіфілаксії. Основним його ефектом є дозозалежне зниження АТ.
Слід зазначити, що поряд із перевагами препарат має ряд недоліків. Так, за даними дослідження, опублікованого у 2000 р., незиритид збільшує 30-денну смертність, що при його застосуванні становила 7,1%, порівняно з 4,8% у групі плацебо (р=0,62). У цей же час у групі, що отримувала незиритид, відзначали вищу частоту випадків істотного погіршення функції нирок (р=0,04).
У більш масштабному дослідженні VMAC (Vasodilatation in the Management of Acute Congestive Heart Failure) брали участь 498 пацієнтів із задишкою в стані спокою. Терапію незиритидом порівнювали з внутрішньовенним введенням нітрогліцерину або плацебо. Результати дослідження наведені в табл. 1.15.
Таблиця 1.15
Середні гемодинамічні зміни порівняно з вихідними даними
| Ефект через 3 год | Плацебо (n=62) |
Нітрогліцерин (n=62) | Незиритид (n=62) |
| Тиск заклинювання в легеневих капілярах, мм рт. ст. |
–2,0 | –3,8 | –5,8* |
| Тиск в правому передсерді, мм рт. ст. | 0 | –2,6 | –3,1* |
| Серцевий індекс, л/хв/м2 | 0 | 0,2 | 0,1 |
| Середній тиск в ЛА, мм рт. ст. | –1,1 | –2,5 | –5,4* |
| Системний судинний опір, дин•с-1•см-5) | –44 | –105 | –144 |
| САТ, мм рт. ст. | –2,5 | –5,7* | –5,6* |
Дослідження не продемонструвало перевагу незиритиду перед нітрогліцерином щодо впливу на частоту летальних наслідків або повторних госпіталізацій протягом 30 днів. Тривалість перебування в стаціонарі була більшою в групі пацієнтів, що отримували незиритид, порівняно з групою, що отримувала нітрогліцерин (10 і 8,1 дня відповідно, р=0,008). Підвищення рівня креатиніну в плазмі крові більш ніж на 44,2 ммоль/л було відзначено у 27% пацієнтів групи, що отримувала незиритид, і у 21% пацієнтів контрольної групи (р=0,11). Смертність протягом 30 днів при застосуванні незиритиду склала 8,6%, а в групі контролю — 5,5% (відносний ризик 1,56 при 95% довірчому інтервалі 0,75–3,24; р=0,2).
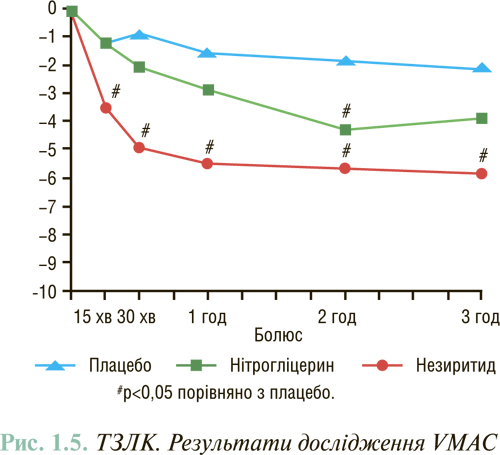
У дослідженні VMAC показано, що внутрішньовенне введення незиритиду порівняно з нітрогліцерином призводило до статистично більш вираженого зниження ТЗЛК протягом перших 15 хв, яке зберігалося протягом 24 год (рис. 1.5). Через 48 год у групі незиритиду ТЗЛК також був нижчий, ніж у групі нітрогліцерину. Ступінь зменшення вираженості симптомів через 3 і 24 год в обох групах була однаковою. У цілому застосування незиритиду порівняно з нітрогліцерином більш рідко супроводжувалося розвитком побічних ефектів, проте частота виникнення артеріальної гіпотензії в обох групах була однаковою.
Крім того, результати клінічних досліджень вказують на те, що застосування незиритиду може знижувати частоту повторних госпіталізацій з приводу ГСН. Так, у дослідженні VMAC частота повторних госпіталізацій з приводу ГСН протягом 30 днів у групах незиритиду і плацебо становила 7 і 13% відповідно. В іншому дослідженні були отримані подібні дані, частота повторних госпіталізацій з приводу СН у групах незиритиду і добутаміну склала 4 і 13% відповідно (р=0,081). У дослідженні PROACTION (Prospective Randomized Outcomes Study of Acutely Decompensated Congestive Heart Failure Treated Initially in Outpatients with Natrecor) застосування незиритиду порівняно із стандартною терапією знижувало частоту повторних госпіталізацій протягом 30 днів на 57% (р=0,058). Хоча у всіх зазначених дослідженнях позитивний ефект незиритиду не досягав рівня статистичної значимості, отримані дані свідчать про доцільність проведення подальшого дослідження цього препарату.
З огляду на це можна зробити висновок, що незиритид ефективний щодо поліпшення гемодинамічних параметрів, але його застосування не сприяє покращанню клінічних результатів. На сьогодні препарат може бути рекомендований тільки для короткочасного застосування. Загалом остаточна оцінка буде залежати від результатів нещодавно розпочатого дослідження. Крім того, препарат поки що не зареєстрований в Україні.
Оскільки внутрішньовенне введення вазодилататорів призводить до швидкого покращання гемодинаміки і зменшення вираженості симптомів, ці препарати слід застосовувати на ранніх етапах лікування ГСН. Така терапія показана при недостатній ефективності внутрішньовенного введення діуретиків або при наявності помірних або виражених проявів застою, але лише в тих випадках, коли рівень САТ >90 мм рт. ст.
Інотропні засоби
Створення нових неглікозидних інотропних препаратів, таких як деривати катехоламінів (допамін, добутамін), агоністи β-адренорецепторів (преналтерол, ксамотерол), кілька поколінь інгібіторів ФДЕ (амринон, мільринон, еноксимон, веснаринон), сенситизатори кальцію (пимобендан, левосимендан), дозволило досягти більш значного підвищення скоротливості міокарда, ніж при використанні глікозидів, не викликаючи побічних реакцій, властивих останнім. Проте результати численних досліджень показали, що використання потужних позитивних інотропних препаратів у лікуванні СН можливо лише шляхом застосування коротких курсів, коли різке підвищення серцевого викиду дозволяє досягти підвищення діурезу і виведення пацієнта зі стану тяжкої декомпенсації. Проте чим сильніший інотропний ефект цих препаратів, тим більше вони підвищують смертність хворих із СН при тривалому лікуванні. Негативний вплив тривалого застосування неглікозидних інотропних стимуляторів на прогноз хворих із СН був доведений у багатьох багатоцентрових подвійних сліпих рандомізованих плацебо-контрольованих дослідженнях.
Враховуючи вищевказане, були сформульовані уявлення про ідеальний інотропний засіб, відповідно до яких він повинен:
- підвищувати скоротливість міокарда;
- підвищувати серцевий викид;
- оптимізувати периферичний кровообіг;
- зменшувати застій у легенях;
- не викликати аритмогенного ефекту;
- не викликати тахікардію;
- усувати або знижувати клінічні прояви СН;
- запобігати розвитку СН;
- підвищувати виживаність та якість життя.
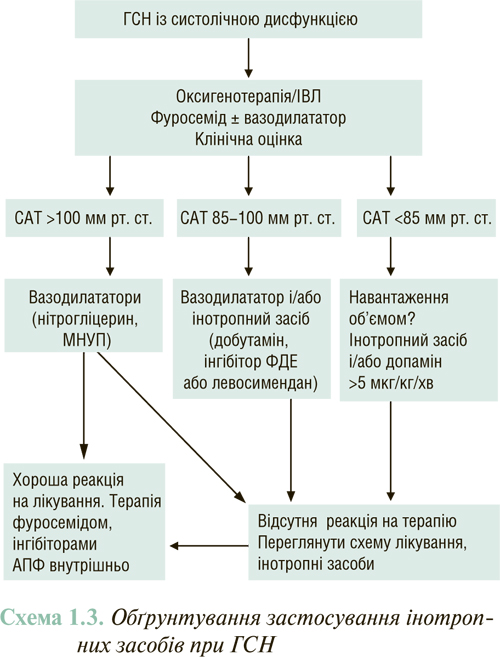
Історично препарати з позитивною інотропною дією становили основу додаткової терапії ГСН, оскільки вони поліпшують гемодинамічні показники, в першу чергу підвищують ХОК (схема 1.3).
В якості резервних для лікування хворих із низьким і дуже низьким ХОК слід розглядати інотропні лікарські засоби, оскільки переконливих даних про доцільність їх застосування немає, проте їх використання підвищує частоту розвитку побічних ефектів. Так, застосування мільринону часто призводить до артеріальної гіпотензії, тому при САТ <90 мм рт. ст. доцільніше використати добутамін. При достатньому рівні АТ вибір інотропного препарату повинен визначатися наявністю або відсутністю супутньої терапії блокаторами β-адренорецепторів. Оскільки дія добутаміну зумовлена стимулюванням активності β-адренорецепторів, на фоні тривалої терапії блокаторами β-адренорецепторів для досягнення клінічно значимого підвищення ХОК необхідно застосовувати більш високі дози добутаміну. Навпаки, супутня терапія блокаторами β-адренорецепторів не знижує ефективність застосування мільринону при ГСН, а для левосимендану — покращує результати лікування. Відповідно у хворих, які приймають блокатори β-адренорецепторів протягом тривалого часу, краще використовувати препарати мільринону (не зареєстровані в Україні) або левосимендану (зареєстровані в Україні). Якщо терапію блокаторами β-адренорецепторів не проводили, допускається застосування будь-якого інотропного засобу.
Ефективність застосування мільринону при ГСН оцінювалася лише в одному великому контрольованому дослідженні, при цьому між групами мільринону і плацебо не було виявлено статистично значимих розбіжностей щодо тривалості перебування в стаціонарі, вираженості симптомів або смертності. Більше того, в групі мільринону частіше фіксували побічні ефекти, особливо стійку артеріальну гіпотензію і тахіаритмії. АНА й АСС не рекомендують використовувати переривчасту терапію інотропними препаратами при амбулаторному лікуванні хворих із вираженою ХСН, оскільки така терапія може підвищувати смертність та частоту розвитку інших негативних клінічних наслідків.
Інотропні засоби рекомендовані при наявності периферичної гіпоперфузії (артеріальна гіпотензія, погіршення функції нирок) незалежно від наявності явищ застою або набряку легень, рефрактерних до терапії діуретиками і вазодилататорами в оптимальних дозах.
Допамін
Допамін є природним попередником норадреналіну. Дозозалежно впливає на α- і β-адренорецептори за рахунок вивільнення норадреналіну з гранулярних депо пресинаптичних нервових закінчень, тобто має непряму адреноміметичну дію.
У низьких дозах (<2 мкг/кг/хв внутрішньовенно) допамін переважно діє на периферичні допамінергічні рецептори і знижує периферичний опір. Вазодилатацію виявляють у нирках, органах черевної порожнини, судинах коронарного і церебрального русла, супроводжується покращанням ниркового кровотоку, ШКФ, підвищенням діурезу і виділенням натрію, посиленням відповіді на діуретики.
У дозах 2–5 мкг/кг/хв допамін проявляє себе як агоніст β-адренорецепторів — підвищує ЧСС, серцевий викид і УОК; при цьому незначно впливає на ЗПСО. При підвищенні дози >5 мкг/кг/хв підвищує ЧСС, серцевий викид і УОК; при цьому частково впливає на ЗПСО. Проте при підвищенні дози >5 мкг/кг/хв починає домінувати α-міметичний ефект допаміну, що проявляється у вигляді підвищення АТ і венозного тиску, вазоспазму, підвищення переднавантаження ЛШ, зниження мезентеріального та ниркового кровотоку. Коронарний кровоток при інфузії допаміну може підвищуватися як у відповідь на збільшення роботи міокарда, так і внаслідок прямої дилатаційної дії (стимуляція допамінових DA 1-рецепторів) на коронарні артерії.
Внаслідок здатності допаміну виявляти позитивну інотропну дію на міокард і при цьому підвищувати АТ, його часто використовують для терапії критичних станів, пов՚язаних з гіпотензією, а також для стабілізації гемодинаміки відразу після відновлення роботи серця при серцево-легеневій реанімації.
У такий спосіб допамін можна використати як інотропний засіб (>2 мкг/кг/хв внутрішньовенно) при ГСН, що супроводжується гіпотензією. Інфузія низьких доз допаміну (<2–3 мкг/кг/хв) здатна покращити нирковий кровотік і посилити діурез при ХСН з гіпотензією і олігурією.
Добутамін
Добутамін — синтетичний катехоламін, спеціально розроблений для лікування хворих із СН. На сьогодні завдяки таким його ефектам, як підвищення серцевого викиду, зниження ЗПСО, помірне підвищення ЧСС, помірне зниження тиску в легеневих капілярах, зниження кінцевого діастолічного тиску ЛШ, показання для призначення добутаміну значно розширилися і включають:
- стани, що супроводжуються низьким серцевим викидом;
- ГСН, яка вперше виникла;
- загострення ХСН;
- необхідність застосування препарату з меншою вазопресорною активністю, ніж у норепінефрину або допаміну;
- зниження перфузії органів і тканин;
- підвищений тиск наповнення шлуночків;
- необхідність збільшення транспорту кисню до тканин;
- порушення кровообігу при агресивних режимах ШВЛ.
Добутамін здійснює пряму стимулюючу дію на β1— і β2-адренорецептори. Вазоконстрикторний ефект добутаміну, зумовлений стимуляцією α-рецепторів, нейтралізується судинорозширювальним ефектом, пов՚язаним із стимуляцією β2-адренорецепторів. У результаті сумарний судинний ефект добутаміну зводиться до незначних змін ЗПСО.
Контрактильність ЛШ на фоні застосування добутаміну збільшується завдяки стимуляції β1— і α-рецепторів, тоді як підвищення ЧСС в основному зумовлено дією препарату на β1-рецептори. Тому позитивна інотропна дія препарату більш виражена, ніж хронотропна. У дозах, які викликають подібно епінефрину і норепінефрину підвищення серцевого викиду, добутамін у значно нижчому ступені, ніж ці препарати, підвищує ЧСС і ЗПСО. Ця особливість дії забезпечує певні клінічні переваги добутаміну перед іншими катехоламінами.
Добутамін здійснює пряму дію на β-адренорецептори, що вигідно відрізняє його від допаміну, дія якого на ці рецептори опосередкована вивільненням норадреналіну в нервових закінченнях. Позитивний інотропний ефект проявляється покращанням функціонування шлуночків серця та підвищенням продуктивності їх роботи, що супроводжується зниженням тиску в малому колі кровообігу, ЦВТ, тиску в правому і лівому передсерді. Ця властивість добутаміну дозволяє застосовувати його як засіб монотерапії у хворих із вираженою лівошлуночковою СН, коли переднавантаження збільшене і тиск у легеневих капілярах перевищує 18 мм рт. ст.
Внутрішньовенне введення добутаміну в дозах 2–15 мкг/кг/хв супроводжується підвищенням серцевого викиду, головним чином за рахунок збільшення ударного об’єму серця, внаслідок посилення скоротливості міокарда. Ударний об’єм і серцевий викид підвищуються при відносно невеликому підвищенні АТ і ЧСС. ЗПСО у хворих СН знижується при застосуванні добутаміну як за рахунок рефлекторного зменшення симпатоміметичної дії, так і внаслідок прямого вазодилататорного ефекту. Зниження постнавантаження, зумовлене добутаміном, у сукупності з його позитивною інотропною дією полегшує викид крові з ЛШ, сприяючи тим самим підвищенню серцевого викиду. Підвищення ударного об’єму і ФВ, що відображає підвищення ефективності роботи ЛШ, призводить до зменшення його КСО. При інфузії добутаміну в дозі 5 мкг/кг/хв відбувається підвищення серцевого викиду на 35%, коронарного кровотоку — на 37%, а споживання міокардом кисню — лише на 20%. У дозі 10 мкг/кг/хв препарат підвищує ці показники на 65, 51 і 40% відповідно.
Більшість медикаментозних засобів із судинорозширювальними та інотропними властивостями викликає підвищення внутрішньолегеневого шунтування при легеневих захворюваннях. Добутамін не є виключенням і за рахунок послаблення гіпоксичної вазоконстрикції (рефлекс Ейлера — Лільєстранда) покращує перфузію погано вентильованих ділянок, підвищуючи тим самим венозне «домішування» в легенях. Проте оксигенація артеріальної крові при цьому найчастіше не знижується і навіть зростає завдяки збільшенню серцевого викиду і вмісту кисню у венозній крові.
При інфузії добутаміну функція нирок зазвичай покращується, що призводить до підвищення діурезу, кліренсу креатиніну та екскреції натрію. Покращання функції нирок відбувається внаслідок підвищення серцевого викиду і вторинного підвищення перфузії нирок, а не в результаті прямої дилатуючої дії на ниркові судини, як при застосуванні допаміну. Нещодавно було показано, що інфузія добутаміну покращує перфузію органів черевної порожнини.
Тривала інфузія добутаміну (>24–48 год) може призводити до розвитку толерантності і часткової втрати гемодинамічного ефекту; завершення терапії добутаміном — до розвитку зворотної артеріальної гіпотензії, застійних явищ, дисфункції нирок. Цього можна уникнути, якщо відміну добутаміну проводити поступово (ступінчасте зниження дози на 2 мкг/кг/хв щодня) і оптимізації пероральної вазодилатуючої терапії, наприклад використання інгібіторів АПФ.
Доцільність застосування добутаміну при ГСН підтверджується результатами ряду невеликих досліджень, у яких на фоні його застосування відзначали покращання гемодинамічних показників. Проте результати більш вагомих досліджень, у яких оцінювали показники смертності і захворюваності, не виявили його істотних переваг.
У дослідженні PRECEDENT (Prospective Randomized Evaluation of Cardiac Ectopy with Dobutamine or Nesiritide Therapy) було показано, що застосування добутаміну порівняно з незиритидом підвищує частоту виникнення шлуночкової екстрасистолії і пароксизмів шлуночкової аритмії, але рідше супроводжується розвитком артеріальної гіпотензії.
Інгібітори ФДЕ (амринон, мільринон, еноксимон, веснаринон)
Мільринон і еноксимон є інгібіторами ФДЕ III типу, які застосовують у клінічній практиці. Після введення цих лікарських засобів пацієнтам із прогресуючою СН відзначають значно виражений інотропний, лузітропний і судинорозширювальний ефекти, підвищення серцевого викиду і ударного об’єму при одночасному зниженні тиску в ЛА, ТЗЛК, а також системного і легеневого судинного опору. Препарати цієї групи в Україні не зареєстровані.
Левосимендан
Новий представник класу інотропних препаратів, неглікозидний кардіотонічний лікарський засіб із властивостями вазодилататора, що застосовують для лікування гострої декомпенсованої СН більш ніж у 40 країнах, включаючи Україну. Виявляє два основних механізми дії: підвищення чутливості до Ca2+ контрактильних протеїнів-кардіоміоцитів, що визначає позитивну інотропну дію, а також активацію м՚язових K+-каналів, що призводить до периферичної вазодилатації. Левосимендан виявляє також помірну інгібуючу активність до ФДЕ. Крім того, активний метаболіт левосимендану проявляє подібний механізм дії і має тривалий період напіввиведення, що забезпечує збереження ефекту протягом декількох діб після припинення введення препарату.
Результати клінічного вивчення в дослідженнях LIDO (Longitudinal Investigation of Depression Outcomes, 203 хворих) і RUSSLAN (Randomised study on Safety and effectiveness of Levosimendan in patients with left ventricular failure due to an Acute myocardial infarction, 504 хворих) дозволили припустити, що разом із сприятливою дією на симптоми захворювання та параметри гемодинаміки, короткочасна внутрішньовенна інфузія левосимендану у хворих з ГСН і значно порушеною скорочувальною здатністю ЛШ може мати перевагу як над добутаміном, так і плацебо щодо впливу на смертність у найближчі 6 міс. Аналогічна закономірність була виявлена у дослідженні CASINO (the Calcium Sensitizer or Inotrope or None in Low-Output Heart Failure study, 291 хворий). Проте кількість досліджених хворих була незначною, щоб з впевненістю говорити про переваги такої терапії.
Нові дані про ефективність і безпеку левосимендану при ГСН були отримані в інших дослідженнях REVIVE II (The second Randomized Multicenter Evaluation of Intravenous Levosimendan Efficacy) і дослідженні SURVIVE (Survival of Patients With Acute Heart Failure in Need of Intravenous Inotropic Support). У рандомізованому плацебо-контрольованому дослідженні REVIVE II проводили порівняння ефективності та безпеки левосимендану і плацебо. Набір пацієнтів здійснювався в 103 центрах, було включено 600 хворих віком старше 18 років із ФВ ЛШ ≤35%, яка була визначена в найближчі 12 міс, госпіталізованих у попередні 24 год із декомпенсацією СН. Обов՚язковою умовою було збереження задишки в стані спокою після внутрішньовенного введення сечогінних засобів. Спочатку внутрішньовенно вводили навантажувальну дозу левосимендану 6–12 мкг/кг із подальшою інфузією 0,1 мкг/кг/хв протягом 1 год і підвищенням дози до 0,2 мкг/кг/хв у випадку хорошої переносимості. Тривалість введення левосимендану або плацебо становила 24 год. Середній вік хворих, включених у дослідження, — 63 роки, ФВ — у середньому 22%, інгібітори АПФ отримували 76–78% пацієнтів, блокатори β-адренорецепторів — 68–69%, спіронолактон — 37%, внутрішньовенне введення вазодилататорів або позитивних інотропних препаратів проводили у 26–27%.
Первинною кінцевою точкою була зміна симптомів, смерть або збільшення ступеня тяжкості СН у перші 5 діб після рандомізації. Це перше дослідження, в якому оцінювався вплив втручання на клінічний перебіг захворювання в цілому за період, що відповідає тривалості строку типової госпіталізації в США. Такий підхід представляється більш вагомим, ніж вивчення окремих симптомів або однієї кінцевої точки.
У групі левосимендану поліпшення симптомів відзначали вірогідно частіше, а погіршення — рідше, ніж у групі плацебо (р=0,015). При цьому наявність клінічного погіршення констатували при наявності однієї з наступних подій: смерть; збереження або погіршення симптомів СН, незважаючи на лікування вазодилататорами, сечогінними або інотропними препаратами; помірне або виражене погіршення загальної оцінки свого стану хворим через 6 год, 24 год і 5 діб. Клінічний стан не змінився приблизно у рівної кількості хворих в обох групах. Ефект левосимендану проявлявся вже через 6 год після початку введення препарату. Аналогічну закономірність відзначали при оцінці вираженості задишки (табл. 1.16).
Таблиця 1.16
Стан хворих (покращання) у дослідженні REVIVE II
|
Час оцінки |
Левосимендан, % (n=299) |
Плацебо, % (n=301) |
р |
|
24 год (на кінець інфузії) |
60 |
46 |
0,026 |
|
48 год |
63 |
58 |
0,053 |
|
5 діб |
76 |
65 |
0,001 |
Смертність протягом 90 діб була вторинною кінцевою точкою. У цей період серед хворих, що отримували левосимендан, померло 15,1% хворих, плацебо — 11,6% (різниця не достовірна). Проте кількість померлих у групі, що отримувала левосимендан, на 5-ту добу лікування була вірогідно менша, ніж у групі порівняння.
Таким чином, дослідження REVIVE II продемонструвало позитивний вплив левосимендану на клінічні прояви ГСН, що проявляється під час 24-годинної інфузії і зберігається як мінімум 4 доби після її закінчення. Проте при подальшій інтерпретації результатів цього дослідження необхідно враховувати, що воно не було сплановане з метою оцінки впливу терапії на смертність.
При об՚єднанні результатів плацебо-контрольованих досліджень левосимендану при ГСН (CASINO, REVIVE I, REVIVE II і RUSSLAN) за загальними даними ризик смерті протягом 6 міс у групах, що отримували левосимендан і плацебо, істотно не відрізнявся.
Основні побічні ефекти левосимендану відповідають особливостям його фармакологічної дії: головний біль і артеріальна гіпотензія пов՚язані з вазодилатуючими властивостями, аритмії — з позитивною інотропною дією. Тому можна чекати їх частішого виникнення порівняно з використанням плацебо.
Рандомізоване проспективне подвійне сліпе дослідження з подвійним маскуванням SURVIVE щодо порівняння ефективності і безпеки левосимендану та добутаміну проводили в 75 центрах 8 країн Європи, до нього було включено 1327 хворих. На сьогодні це найбільше клінічне дослідження внутрішньовенного застосування інотропних лікувальних засобів при ГСН, у якому оцінювали вплив короткотривалого введення препаратів на виживаність у віддалені періоди захворювання. Включали хворих із ФВ <30%, що визначалася в найближчі 12 міс, госпіталізованих із гострою декомпенсацією СН і недостатньою ефективністю терапії при внутрішньовенному введенні сечогінних і/або вазодилататорів. Левосимендан вводили протягом 24 год (навантажувальна доза 12 мкг/кг за 10 хв із подальшою інфузією 0,1 мкг/кг/хв і збільшенням через 1 год до 0,2 мкг/кг/хв при хорошій переносимості); одночасно використали плацебо добутаміну. Добутамін вводили в дозі 5–40 мкг/кг/хв протягом 24 год і більше; одночасно використовували плацебо левосимендану. Крім того, у випадку клінічної необхідності протягом 6-місячного періоду спостереження була можливість повторного сліпого введення того лікувального засобу, до якого хворий був рандомізований на початку дослідження.
Середній вік хворих, включених у дослідження, становив 66–67 років, ХСН була у 88% хворих (в інших випадках причиною госпіталізації була ГСН, що вперше виникла), у 76% випадків СН була ішемічного генезу, ФВ — у середньому 24%. Тривалість введення левосимендану — у середньому 23 год, добутаміну — 39 год (середня доза — 6 мкг/кг/хв).
Первинною кінцевою точкою була загальна смертність протягом 6 міс. Кількість хворих у дослідженні дозволяло з достатньою вірогідністю продемонструвати зниження смертності в групі левосимендану в цей період на 25% порівняно з групою, що отримувала добутамін.
Хоча і відзначена тенденція до переваги левосимендану в ранній період після початку введення досліджуваних препаратів, загальна смертність хворих на жодному з етапів дослідження в групах левосимендану і добутаміну вірогідно не відрізнялася (табл. 1.17).
Таблиця 1.17
Загальна смертність у дослідженні SURVIVE
|
Час оцінки |
Левосимендан, % (n=664) |
Добутамін, % (n=663) |
Відносний ризик (95% довірчий інтервал) |
|
180-та доба (первинна кінцева точка) |
26,1 |
27,9 |
0,91 (0,74–1,13) |
|
31-ша доба (вторинна кінцева точка) |
11,9 |
13,7 |
0,85 (0,63–1,15) |
|
5-та доба (ретроспективний аналіз) |
4,4 |
6,0 |
0,72 (0,44–1,16) |
По вторинним точкам, які характеризують клінічну ефективність (кількість днів, проведених хворими, що вижили, поза стаціонаром, оцінка вираженості задишки і зміна загальної оцінки свого стану через 24 год після початку лікування, серцево-судинна смертність через 6 міс), групи вірогідно не відрізнялися. Разом із тим вміст МНУП після початку введення левосимендану знижувався приблизно вдвічі і залишався таким, як мінімум, протягом 5 діб, тоді як зниження в групі добутаміну було менш вираженим (p<0,0001 для відмінностей між групами через 1, 3 і 5 діб). Через 5 діб від початку терапії ступінь зниження вмісту цього маркера тяжкості СН склав 46% у групі левосимендану і 13% у групі добутаміну; це найбільш вагоме зниження рівня МНУП у клінічних випробуваннях при ГСН.
Таким чином, отримані факти свідчать про більш виражений вплив левосимендану на окремі прояви захворювання порівняно з добутаміном. Єдиним негативним моментом є більш часте виникнення миготливої аритмії. При об՚єднанні результатів трьох досліджень щодо порівняння левосимендану і добутаміну з подібним протоколом введення левосимендану (CASINO, LIDO і SURVIVE) загальна кількість хворих склала 1730, а смертність через 6 міс від початку лікування виявилася вірогідно нижче в групі осіб, що отримували левосимендан (р=0,032).
Підводячи підсумки результатів досліджень REVIVE II і SURVIVE, левосимендан зменшує симптоми, покращує клінічний перебіг гострої декомпенсації СН порівняно з плацебо і має перевагу над добутаміном щодо впливу на окремі прояви захворювання. Разом з тим при використанні левосимендану можна чекати більш частого виникнення миготливої аритмії і цей ефект помітний як при порівнянні з плацебо, так і з добутаміном. Наскільки це пов՚язано зі здатністю левосимендану дещо знижувати рівень калію в крові, поки не зрозуміло. Частота виникнення шлуночкової тахікардії при використанні левосимендану теж підвищується, проте помітних відмінностей у цьому випадку порівняно з добутаміном не виявлено.
Згідно з даними про вплив на смертність протягом тривалого часу, левосимендан вірогідно не відрізняється від плацебо і не має вираженої переваги над добутаміном. Проте у зв՚язку із невеликою кількістю хворих, які брали участь у дослідженні, з упевненістю робити висновок про цей аспект дії препарату неможливо.
Вірогідно, дослідження, що тривають, допоможуть підтвердити отримані результати, а також визначити перспективні напрямки подальшого вивчення левосимендану. Дані проведених досліджень не змінили уявлень про місце цього лікарського засобу в лікуванні ГСН: у цей час інфузію левосимендану розглядають як додаткове втручання у хворих з низьким серцевим викидом у зв՚язку із значним порушенням скоротності міокарда без ознак гіповолемії, вираженої артеріальної гіпотензії і при відсутності відповіді на стандартну терапію (внутрішньовенне введення сечогінних і вазодилататорів в оптимальних дозах). З появою левосимендану в розпорядженні лікарів, порівняно з добутаміном, з՚явився інший ефективний кардіотонічний препарат. З урахуванням накопичених фактів, добутамін має переваги при наявності артеріальної гіпотензії та при ряді інших протипоказань до призначення левосимендану (тяжке порушення функції печінки і нирок, гіперчутливість), тоді як в інших випадках більш вираженої дії слід очікувати від левосимендану. У випадках, коли клінічної стабілізації при декомпенсованій СН домогтися не вдається, незважаючи на приєднання до лікування більш доступного за ціною добутаміну, варто призначати левосимендан.
Левосимендан використовують у вигляді тривалої внутрішньовенної інфузії протягом 6–24 год, проте гемодинамічні ефекти зберігаються >48 год після закінчення інфузії. Тахікардія і артеріальна гіпотензія, які описані при інфузії високих доз левосимендану, не дозволяє застосовувати його при САТ <85 мм рт. ст. Важливою рисою левосимендану є можливість реалізації його позитивних гемодинамічних ефектів (підвищення ударного викиду, зниження тиску наповнення ЛШ, ЗПСО і опору в легеневих судинах при незначному зниженні АТ) на фоні супутнього використання блокаторів β-адренорецепторів.
Серцеві глікозиди
Серцеві глікозиди інгібують міокардіальну Na+/K+-АТФазу, у такий спосіб підвищуючи обмін Ca2+/Na+, що проявляється позитивним інотропним ефектом. При ГСН серцеві глікозиди незначною мірою підвищують серцевий викид і знижують тиск наповнення. У пацієнтів із тяжкою ХСН і епізодами гострої декомпенсації прийом серцевих глікозидів є ефективним способом їх запобігання. У той же час доведено, що у пацієнтів, які отримують серцеві глікозиди після ІМ, підвищена активність КФК у крові відзначається більш тривалий час, а при наявності гострого ІМ і ГСН використання похідних наперстянки може сприяти виникненню загрозливих для життя аритмій. Таким чином, інотропна підтримка з використанням серцевих глікозидів при ГСН не рекомендується, особливо при наявності гострого коронарного синдрому.
У табл. 1.18 наведена характеристика інотропних препаратів, що застосовуються при ГСН.
Таблиця 1.18
|
Препарат |
Доза при болюсному введенні |
Доза при інфузійному введенні |
|
Добутамін |
Немає |
2–20 мкг/кг/хв (β+) |
|
Немає |
Менше ніж 3 мкг/кг/хв: нирковий ефект (δ+) 3–5 мкг/кг/хв: інотропна дія (β+) Більше 5 мкг/кг/хв: (β+), вазопресорна дія (α+) |
|
|
12–24 мкг/кг протягом 10 хв* |
0,1 мкг/кг/хв, може бути підвищена до 0,2 або знижена до 0,05 мкг/кг/хв |
|
|
Немає |
0,2–1,0 мкг/кг/хв |
|
|
1 мг можна вводити внутрішньовенно при реанімаційних заходах |
0,05–0,5 мкг/кг/хв |
*Рекомендоване дозування. При наявності артеріальної гіпотензії терапію слід починати з інфузії, виключаючи болюсне введення.
Інгібітори АПФ при ГСН
На сьогодні дослідження ефективності інгібіторів АПФ у хворих з ГСН не проводили, за винятком СН після ІМ, де вивчали віддалений ефект.
Імовірно, інгібітори АПФ не показані на ранньому етапі стабілізації стану пацієнтів із ГСН. Проте оскільки зазначені пацієнти належать до групи високого ризику, інгібітори АПФ мають велике значення в лікуванні ГСН і гострого ІМ. Тому сьогодні обговорюється питання — коли слід починати терапію інгібіторами АПФ і кому вони найбільш показані.
Гемодинамічні ефекти інгібіторів АПФ зумовлені зниженням утворення ангіотензину II і підвищенням вмісту брадикініну, що призводить до зниження ЗПСО і посилення натрійурезу. Короткочасна терапія асоціюється зі зниженням вмісту в плазмі крові ангіотензину II і альдостерону з одночасним підвищенням ангіотензину I і активності реніну.
З метою запобігання артеріальної гіпотензії слід уникати внутрішньовенного введення інгібіторів АПФ. Початкова доза повинна бути невисокою і прогресивно титруватися після стабілізації за умови моніторингу АТ та функції нирок.
Інгібітори АПФ необхідно з обережністю застосовувати у пацієнтів з мінімальним серцевим викидом, оскільки вони можуть значно знизити ШКФ. Ризик непереносимості інгібіторів АПФ підвищується при одночасному застосуванні НПЗП і при наявності двобічного стенозу ниркових артерій.
Блокатори β-адренорецепторів
На сьогодні немає даних про проведення досліджень ефективності блокаторів β-адренорецепторів при ГСН, спрямованих на вивчення покращання клінічного стану пацієнтів. Навпаки, вважали, що ГСН є протипоказанням для терапії препаратами цієї групи. Пацієнтів з ГСН при наявності вологих хрипів у нижніх відділах легень або артеріальної гіпотензії виключали з випробувань на ранній стадії після розвитку гострого ІМ. Застосування блокаторів β-адренорецепторів у пацієнтів без вираженої СН або артеріальної гіпотензії призводило до обмеження розмірів ушкодження міокарда, усунення складних порушень ритму серця і зменшення вираженості болю. Внутрішньовенне введення блокаторів β-адренорецепторів може бути доцільним у хворих з ангінозним болем, що не усувається наркотичними засобами, з повторними нападами ішемії міокарда, АГ, тахікардією або аритмією.
У пацієнтів з гострим ІМ, стан яких на фоні ГСН швидко стабілізується, блокатори β-адренорецепторів слід починати тестувати якомога раніше. У пацієнтів з ознаками ГСН на фоні ХСН блокатори β-адренорецепторів необхідно призначати відразу після стабілізації стану (звичайно протягом 3–4 діб).
Перша доза метопрололу, карведилолу, бізопрололу і небівололу для перорального прийому повинна бути невеликою з наступним поступовим підвищенням до цільового рівня. Титрування дози необхідно проводити залежно від індивідуальної реакції організму на лікування. Блокатори β-адренорецепторів можуть надмірно знижувати АТ та ЧСС. Пацієнти, що приймали блокатори β-адренорецепторів перед госпіталізацією у зв՚язку з декомпенсацією СН, повинні продовжувати їх прийом; виключенням є необхідність проведення хворому інотропної терапії (у випадку застосування левосимендану можливо його поєднання з блокаторами β-адренорецепторів).
Терапія антикоагулянтами
Антикоагулянти широко застосовують в лікуванні гострого коронарного синдрому незалежно від наявності СН. Це також стосується і фібриляції передсердь. Доказів ефективності призначення нефракціонованого гепарину або низькомолекулярних гепаринів у комплексі стартової терапії ГСН дуже мало. У великому плацебо-контрольованому дослідженні із застосуванням підшкірної ін՚єкції 40 мг еноксапарину у пацієнтів, госпіталізованих за невідкладними показаннями, включаючи велику кількість хворих СН, виявлено зниження частоти венозних тромбозів при відсутності впливу на клінічну симптоматику. Слід зазначити, що виникнення ознак гострої декомпенсації на фоні ХСН вимагає ретельного моніторингу згортальної системи крові, у зв՚язку з частою наявністю у таких хворих дисфункції печінки. Низьмолекулярні гепарини протипоказані у випадку значного порушення функції нирок (кліренс креатиніну <30 мл/хв) і тромбоцитопенії (<100 000/мм3 або зниженні в 2 рази і більше під час лікування гепарином).
Вазопресорна терапія у разі кардіогенного шоку
У комбінації з інотропними засобами та інфузією рідини на фоні відсутності оптимальної перфузії при поліпшеному серцевому викиді необхідно призначати терапію вазопресорами. Вазопресори також можна використовувати при реанімаційних заходах, а також для підтримки адекватної перфузії при загрозливій для життя артеріальній гіпотензії.
Епінефрин
Епінефрин — катехоламін із високим афінітетом (міцність зв՚язку) відносно β1-, β2— і α-адренергічних рецепторів. Епінефрин використовують для інфузійного введення в дозах 0,05–0,5 мкг/кг/хв у випадку, коли добутамін не викликає клінічного ефекту і АТ залишається низьким. При цьому рекомендується пряме моніторування АТ, а також моніторинг параметрів гемодинаміки з використанням катетеризації ЛА.
Норепінефрин
Норепінефрин — катехоламін з високим афінітетом відносно α-адренорецепторів, який слід використовувати для підвищення ЗПСО. Норепінефрин-індуковане підвищення ЧСС розвивається менше, ніж на фоні дії епінефрину. Рекомендовані дози норепінефрину не відрізняються від таких епінефрину. Норепінефрин (0,2–1 мкг/кг/хв) має перевагу при низькому АТ на фоні зниженого ЗПСО, наприклад у випадку септичного шоку. Норепінефрин дуже часто комбінують з добутаміном для покращання параметрів гемодинаміки.
Загальні питання лікування ГСН
Інфекції
Пацієнти з вираженою ГСН схильні до різних інфекційних ускладнень, особливо часто з боку дихальної та сечовивідної системи, септицемії, внутрішньогоспітальним (нозокоміальним) інфекціям, викликаними грампозитивними збудниками. Підвищення вмісту СРБ і погіршення загального стану можуть бути єдиними проявами інфекції — температурна реакція часто відсутня. Ретельна профілактика інфекційних захворювань, підтримка цілісності слизових оболонок і шкірних покривів є важливими завданнями лікування ГСН. При необхідності слід призначати адекватну антибіотикотерапію.
Цукровий діабет
Розвиток ГСН часто пов՚язаний з погіршенням метаболічного контролю і розвитком гіперглікемії. Застосування гіпоглікемізуючих препаратів слід припинити, а глікемічний контроль здійснювати за допомогою препаратів інсуліну короткої дії, залежно від вмісту глюкози в крові. Нормоглікемія підвищує виживаність пацієнтів із цукровим діабетом, що перебувають у критичному стані.
Катаболізм
Негативний енергетичний баланс — серйозна проблема при наявності ГСН. Це є наслідком зниження надходження калорій з їжею у зв՚язку з погіршенням кишкового всмоктування. Слід підтримувати оптимальний баланс калорій та амінокислот. Визначення концентрації альбуміну в сироватці крові та стан азотистого балансу дозволяють моніторувати метаболічний статус пацієнта.
Ниркова недостатність
ГСН може викликати або спровокувати погіршення вже існуючої ниркової недостатності. Необхідний ретельний моніторинг функції нирок. Збереження функції нирок слід розглядати як одну із цілей при виборі терапевтичної стратегії у таких пацієнтів.
Існує ряд захворювань, при яких ГСН розвивається de novo або які є пусковим механізмом для розвитку декомпенсації ХСН. ІХС і гострий коронарний синдром є найчастішими причинами ГСН. Захворювання інших органів і систем можуть значно ускладнювати лікування ГСН.
ІХС
При гострому коронарному синдромі (нестабільна стенокардія або ІМ), ускладненому розвитком ГСН, показане проведення коронарної ангіографії. При гострому ІМ проведення реперфузійної терапії вірогідно знижує частоту розвитку ГСН. Черезшкірне коронарне втручання (ПКВ) або оперативне втручання (АКШ) можливі вже на ранніх стадіях захворювання. Якщо ні ПКВ, ні АКШ не можуть бути проведені в короткий термін, рекомендується проведення ранньої тромболітичної терапії.
Усім пацієнтам із гострим ІМ та ознаками СН показане проведення ехоКГ для оцінки загальної і локальної скорочувальної здатності міокарда, виявлення клапанної дисфункції (особливо мітральної регургітації) і виключення ряду інших станів (наприклад перикардиту, кардіоміопатії, ТЕЛА).
У випадку кардіогенного шоку у пацієнтів з гострим коронарним синдромом якнайшвидше необхідно провести коронарну ангіографію і процедуру реваскуляризації. Тимчасова стабілізація пацієнта може бути досягнута інфузійною терапією, внутрішньоаортальною балонною контрпульсацією, застосуванням фармакологічних інотропних препаратів.
Патологія клапанного апарату серця
ГСН може бути наслідком патології клапанного апарату серця (при гострій мітральній і аортальній недостатності, ендокардиті, аортальному або мітральному стенозі, тромбозі штучного клапана, розшаровуючій аневризмі аорти).
При наявності інфекційного ендокардиту на початку лікування обов՚язкове призначення антибактеріальної терапії на фоні застосування інших фармакологічних засобів терапії ГСН. Дисфункція серця також може посилюватися при наявності міокардиту. Проте при інфекційному ендокардиті основною причиною розвитку ГСН є недостатність клапанів серця. Лікування слід починати негайно. При тяжкій гострій мітральній або аортальній регургітації необхідне оперативне втручання; проведення невідкладного хірургічного втручання потрібно і при аортальній недостатності.
Лікування ГСН при тромбозі штучного клапану серця (ТШКС)
ГСН внаслідок ТШКС асоційована з високою смертністю. У всіх пацієнтів із СН і підозрою на ТШКС необхідно провести рентгенографію органів грудної клітки і ехоКГ.
Тромболітична терапія використовується при ТШКС правих відділів серця, а також у кандидатів на оперативне втручання з групи високого ризику. При ТШКС лівих відділів серця показане оперативне втручання.
Необхідно використовувати наступні препарати: інгібітор тканинного активатора плазміногену 10 мг внутрішньовенно болюсно з інфузією 90 мг протягом 90 хв; стрептокіназу 250 000–500 000 МО протягом 20 хв з наступною інфузією 1–1,5 млн МО протягом 10 год. Після тромболізису всім пацієнтам слід призначати нефракціонований гепарин у вигляді внутрішньовенної інфузії (збільшення АЧТЧ в 1,5–2 рази порівняно з нормальними величинами).
Розшаровуюча аневризма аорти
Гостра розшаровуюча аневризма аорти може бути причиною розвитку ГСН як з розвитком больового синдрому, так і без нього. Зазвичай ГСН розвивається на фоні гіпертензивного стану або гострої аортальної недостатності. Необхідно негайно встановити діагноз, оперативне втручання проводити за життєвими показаннями.
ГСН і АГ
ГСН є одним із найпоширеніших ускладнень гіпертензивних кризів. Клінічною ознакою ГСН при АГ є застій у легенях; у зв՚язку зі швидкістю розвитку його називають спалахом набряку легень. У пацієнтів, госпіталізованих з ознаками набряку легень на фоні гіпертонічного кризу, часто не виявляють змін систолічної функції серця, а визначають погіршення процесів розслаблення ЛШ. Метою лікування є зменшення перед- і постнавантаження ЛШ, зменшення ішемії міокарда (при її наявності), адекватна вентиляція легень.
Лікування необхідно проводити негайно: оксигенотерапія, неінвазивна вентиляція з позитивним тиском, а при необхідності — ШВЛ, внутрішньовенне введення гіпотензивних засобів. Гіпотензивна терапія повинна викликати досить швидке (протягом 30–60 хв) зниження САТ і ДАТ на 30 мм рт. ст. Не слід намагатися відновити АТ до нормальних значень, це може призвести до зниження перфузії органів. Тому подальше зниження АТ слід проводити під контролем функції цих органів. Зниження АТ може бути досягнуто призначенням:
- внутрішньовенного введення петльових діуретиків, особливо при наявності ознак перевантаження рідиною, а також при наявній раніше ХСН в анамнезі;
- внутрішньовенного введення нітрогліцерину або нітропрусиду натрію для зниження перед- і постнавантаження, а також підвищення коронарного кровотоку;
- блокатори кальцієвих каналів (наприклад нікардипін, верапаміл) можна застосовувати пацієнтам з діастолічною дисфункцією і збільшеним постнавантаженням.
Блокатори β-адренорецепторів не слід використовувати при наявності набряку легень. Проте для купірування гіпертонічного кризу при феохромоцитомі ефективним є внутрішньовенне введення комбінованих блокаторів α- і β-адренорецепторів, наприклад лабеталолу — болюсне введення 10 мг з наступною інфузією 50–200 мг/год.
Ниркова недостатність
СН викликає гіпоперфузію нирок як безпосередньо, так і за допомогою активації нейрогуморальних механізмів. Неконтрольована комбінована терапія діуретиками, інгібіторами АПФ, НПЗП також може сприяти розвитку ниркової недостатності. Ниркова недостатність впливає на ефективність терапії СН, особливо при використанні дигоксину, інгібіторів АПФ, блокаторів рецепторів ангіотензину II, спіронолактону. Преренальний стеноз артерій і постренальна обструкція (як причини виникнення ниркової недостатності) повинні бути виключені.
Підвищення вмісту креатиніну в сироватці крові більш ніж на 25–30% і/або досягнення концентрації >3,5 мг/дл (>266 мкмоль/л) є відносним протипоказанням для продовження терапії інгібіторами АПФ. Комбінація з інотропними засобами з позитивною дією посилює нирковий кровотік, дозволяє покращити функцію нирок, відновити ефективність діуретиків. При зниженні функції нирок може бути необхідним проведення діалізу, особливо при наявності гіпонатріємії, ацидозу та неконтрольованої затримки рідини. Вибір між перитонеальним діалізом, гемодіалізом та ультрафільтрацією залежить від технічного оснащення лікувальної установи.
Захворювання легень і бронхообструкція
При наявності у пацієнтів із ГСН бронхообструктивного синдрому необхідно використовувати бронходилататори. Бронходилататори можуть покращувати функцію серця, але не входять у схему терапії ГСН. Додатково до терапії зазвичай призначають 2,5 мг сальбутамолу (0,5 мл 0,5% розчину в 2,5 мл 0,9% розчину натрію хлориду) через небулайзер протягом 20 хв. Інгаляцію можна повторювати щогодини протягом декількох годин.
Порушення ритму серця і ГСН
Брадиаритмії. Брадикардія у пацієнтів із ГСН найчастіше є наслідком гострого ІМ, особливо при оклюзії правої коронарної артерії. Лікування брадиаритмій зазвичай починається з введення атропіну 0,25–0,5 мг внутрішньовенно, при необхідності введення можна повторити.
Ізопреналін — 2–20 мкг/хв у вигляді інфузій можна використати при AV-дисоціації або низькій шлуночковій відповіді. При наявності ішемії міокарда використовувати цей лікарський засіб не слід. Повільний шлуночковий ритм при фібриляції передсердь можна прискорити шляхом внутрішньовенного введення теофіліну зі швидкістю 0,2–0,4 мг/кг/год; на початку — болюсне введення, далі — у вигляді інфузії. При відсутності відповіді на фармакотерапію необхідно використовувати штучний водій ритму.
Суправентрикулярні тахіаритмії (СВТ). СВТ можуть ускладнювати перебіг ГСН або бути причиною її розвитку. Фібриляція передсердь з частою шлуночковою відповіддю також може викликати ГСН. Контроль ЧСС у пацієнта з СВТ і ГСН є першочерговим завданням.
У пацієнтів із рестриктивною кардіоміопатією або тампонадою серця зниження ЧСС слід проводити невідкладно, шляхом проведення відповідної фармако- або електроімпульсної терапії (кардіоверсія). Лікування фібриляції передсердь залежить від тривалості захворювання.
Пацієнти з ГСН і фібриляцією передсердь повинні отримувати антикоагулянтні препарати. Якщо порушення ритму має пароксизмальний характер, після стабілізації стану необхідно проводити кардіоверсію. Якщо фібриляція передсердь триває >48 год, необхідно призначити антикоагулянти (спочатку можливе застосування низькомолекулярних гепаринів) і проводити фармакотерапію, спрямовану на підтримку оптимальної ЧСС. При визначенні гемодинамічної нестабільності, абсолютно показана термінова кардіоверсія. Слід уникати призначення верапамілу і дилтіазему при пароксизмі фібриляції передсердь, тому що ці засоби погіршують перебіг СН і можуть викликати AV-блокаду III ступеня. Аміодарон і блокатори β-адренорецепторів використовують при фібриляції передсердь як для зниження ЧСС, так і для запобігання рецидиву (табл. 1.19).
Таблиця 1.19
Лікування аритмії при ГСН
|
Фібриляція або тахісистолія шлуночків |
Дефібриляція розрядами 200–300–360 Дж (перевага надається двофазній дефібриляції з максимальною потужністю 200 Дж). При відсутності ефекту ввести 1 мг епінефрину та/або 150–300 мг аміодарону |
|
Шлуночкова тахікардія |
При нестабільному стані пацієнта — електроімпульсна терапія, при стабільному — внутрішньовенне введення аміодарону |
|
Синусова тахікардія або суправентрикулярна тахікардія |
Застосування блокаторів β-адренорецепторів при клінічній та гемодинамічній переносимості: Метопролол 5 мг внутрішньовенно повільно (при необхідності можна повторити) Аденозин застосовується для уповільнення AV-провідності або для медикаментозної кардіоверсії тахікардії за типом re-entry Іноді застосовують: Есмолол 0,5–1,0 мг/кг протягом 1 хв, потім інфузія зі швидкістю 50–300 мкг/кг/хв або Лабеталол 1–2 мг болюсно, потім інфузія зі швидкістю 1–2 мг/хв (усього 50–200 мг) Лабеталол також застосовують при ГСН на фоні гіпертонічного кризу або феохромоцитомі у вигляді болюсного введення 10 мг (усього 300 мг) |
|
Фібриляція або тріпотіння передсердь |
По можливості — електроімпульсна терапія. Дигоксин 0,125–0,25 мг внутрішньовенно або блокатори β-адренорецепторів або аміодарон використовують для уповільнення AV-провідності. Аміодарон може індукувати медикаментозну кардіоверсію без погіршення функції ЛШ. Пацієнту слід призначити гепарин |
|
Брадикардія |
Атропін 0,25–0,5 мг внутрішньовенно, всього 1–2 мг. Як тимчасовий засіб — інфузія ізопреналіну (1 мг в 100 мл 0,9% розчину натрію хлориду, максимальна швидкість 75 мл/год, тобто 2–12 мкг/хв). |
Не слід використовувати антиаритмічні препарати I класу.
У випадку хорошої переносимості блокаторів β-адренорецепторів їх необхідно призначати всім пацієнтам із СВТ. Електроімпульсну терапію з седативними засобами при СВТ слід використовувати у пацієнтів із ГСН та артеріальною гіпотензією.
Лікування загрозливих для життя аритмій
Фібриляція шлуночків і шлуночкова тахікардія вимагають проведення серцево-легеневої реанімації, у тому числі негайної кардіоверсії, при необхідності — вентиляційної підтримки дихання, а також застосування седативних засобів (у випадку моторного збудження або збереження свідомості), стійкого відновлення коронарного кровообігу при гострому коронарному синдромі. Аміодарон і блокатори β-адренорецепторів дозволяють знизити частоту повторного виникнення цих подій.
ГСН під час оперативного втручання
ГСН під час оперативного втручання зазвичай є наслідком ішемії міокарда, як правило, безбольової, тобто не асоційованої з больовим синдромом.
Немедикаментозне лікування ГСН
ГСН є серйозним ускладненням більшості захворювань серця. У ряді випадків термінове або екстрене хірургічне втручання значно покращує прогноз. До немедикаментозних втручань належать коронарна реваскуляризація, корекція анатомічних порушень, заміна або реконструкція клапана серця, а також тимчасова циркуляторна підтримка з використанням апаратів допоміжного кровообігу. ЕхоКГ є найкращим способом діагностики станів, при яких необхідний нефармакологічний підхід (алгоритм ведення хворих при гострому ІМ із застосуванням даних ехоКГ наведений у табл. 1.20).
Таблиця 1.20
Алгоритм ведення хворих із ГСН при гострому ІМ: застосування ехоКГ
| Алгоритм А ехоКГ |
| Рідина в порожнині перикарда (особливо при товщині шару >10 мм) Ехоущільнення в рідині Ехоознаки тампонади серця |
| ДІАГНОЗ: Розрив зовнішньої стінки шлуночка |
| Перикардіоцентез. Об’ємна інфузія. Інотропні засоби. Вирішити питання про ВАБК |
| Негайне оперативне втручання |
| Алгоритм Б ехоКГ |
| ДІАГНОЗ: Розрив МШП: локалізація; розмір; Qр:Qс |
| Фармакотерапія |
| Нестабільний стан пацієнта — ВАБК, ШВЛ, КЛА |
| Коронарна ангіографія |
| Негайне оперативне втручання |
| Алгоритм В ехоКГ |
| Ехоознаки гострої тяжкої мітральної регургітації +/– візуалізація розриву сосочкового м’яза |
| Якщо діагноз не встановлений — провести Чc-ехоКГ Якщо Чc-ехоКГ не дає результату — встановити КЛА для виключення розриву МШП |
| ДІАГНОЗ: Гостра мітральна регургітація |
| Фармакотерапія |
| Нестабільний стан пацієнта — ВАБК, ШВЛ, КЛА |
| Коронарна ангіографія |
| Негайне оперативне втручання |
| Алгоритм Г ехоКГ |
| Акінезія верхівки Гіперкінез базальних відділів МШП, ПСР |
| Відмінити: препарати з позитивною інотропною дією, нітрати, ВАБК
Призначити: блокатори β-адренорецепторів, стимулятори α-адренорецепторів |
| ЕхоКГ: низька ФВ без механічних ускладнень |
| Кардіогенний шок внаслідок «втрати» великої кількості міокарда |
| Фармакотерапія |
| Призначити: ВАБК, ШВЛ, ПКВ або АКШ, АДК; трансплантація серця |
Захворювання серця, що є причиною ГСН і вимагають оперативного втручання:
1. Кардіогенний шок після гострого ІМ при ураженні кількох коронарних судин.
2. Постінфарктний дефект міжшлуночкової перегородки.
3. Розрив стінки шлуночка.
4. Гостра декомпенсація наявної патології клапанного апарату.
5. Недостатність або тромбоз штучного клапана серця.
6. Аневризма аорти або розшаровуюча аневризма аорти в порожнину перикарда.
7. Гостра мітральна недостатність внаслідок:
- ішемічного розриву сосочкових м՚язів;
- ішемічної дисфункції сосочкових м՚язів;
- міксоматозного розриву сухожильних хорд;
- ендокардиту;
- травми.
8. Гостра аортальна регургітація внаслідок:
- ендокардиту;
- розшаровуючої аневризми аорти;
- закритої травми грудної клітки;
- розриву аневризми синуса Вальсальви.
9. Гостра декомпенсація хронічної кардіоміопатії.
Внутрішньоаортальна балонна контрпульсація
Контрпульсація є стандартним компонентом лікування пацієнтів із кардіогенним шоком або тяжкою лівошлуночковою недостатністю при дотриманні наступних умов:
I. Покращання не настає, незважаючи на об՚ємну інфузію, інотропну підтримку.
II. Наявність вираженої мітральної регургітації або розриву міжшлуночкової перегородки — з метою гемодинамічної стабілізації.
III. Наявність тяжкої ішемії міокарда, що перешкоджає стабілізації стану, — базис для проведення коронарографії і реваскуляризації.
Внутрішньоаортальна балонна контрпульсація протипоказана при розшаровуючій аневризмі аорти або клінічно значимій аортальній недостатності. Її також не слід застосовувати при тяжких пошкодженнях периферичних судин, поліорганній недостатності, причинах ГСН, що не коригуються.
Апарат допоміжного кровообігу
Апарат допоміжного кровообігу — це механічний насос, що частково заміщає механічну роботу ЛШ. Апарат дозволяє розвантажити шлуночок, знизити навантаження на міокард і посилити периферичний кровотік. Деякі з таких пристроїв мають блок екстракорпоральної оксигенації. Якщо перебіг ГСН затягується, а трансплантацію серця провести неможливо, подальше використання апарата допоміжного кровообігу недоцільно.
Найчастішими ускладненнями при застосуванні апарата допоміжного кровообігу є тромбоемболія, кровотеча, інфекції.
Трансплантація серця
Трансплантацію серця необхідно розглядати як лікувальний захід при тяжкій ГСН із заздалегідь відомим несприятливим прогнозом. Прикладом може бути тяжкий гострий міокардит, післяпологова кардіоміопатія або гострий ІМ з несприятливим прогнозом після реваскуляризації. Проте трансплантація серця неможлива до того часу, поки не досягнута стабілізація стану — природним способом або за допомогою апарата допоміжного кровообігу.
ВИСНОВОК
Сучасні дані щодо діагностики та лікування ГСН за останні 10 років істотно збагатилися. Проведені нещодавно реєстри дозволили охарактеризувати більшість діагнозів хворих як декомпенсацію ХСН, а нові випадки ГСН пояснити загостренням ІХС або АГ. Дуже важливим є розроблений і погоджений об’єм обов՚язкового обстеження для всіх хворих із ГСН, що дозволяє вчасно проводити диференціальну діагностику і стратифікацію ризику можливих ускладнень (це і лабораторні дослідження, й інструментальні методи оцінки структурно-функціональних особливостей серцево-судинної системи у хворих із ГСН). Лікарі-терапевти і кардіологи повинні не тільки призначати рекомендовані лікарські засоби хворим з декомпенсацією серцевої діяльності, але й визначати природу цієї декомпенсації. Важливим є більш активне залучення в процес лікування кардіохірургів та інтервенційних кардіологів, електрофізіологів для проведення реваскуляризації життєздатного міокарда, корекції набутих клапанних уражень міокарда (включаючи корекцію вираженої мітральної регургітації), проведення стимуляції серця для ресинхронізації його роботи (у випадку наявності блокади ніжок і розширення комплексу QRS) та ін. Слід пам՚ятати, що позитивні короткочасні результати лікування ГСН необхідно трансформувати в тривалі позитивні результати. На цьому шляху перспективним є застосування патогенетичного базисного лікування основного захворювання, захист міокарда та функції нирок.
ЛІТЕРАТУРА
- Abraham W.T., Adams K.F., Fonarov G.C. et al. (2005) In-Hospital Mortality in Patients With Acute Decompensated Heart Failure Requiring Intravenous Vasoactive Medications: An Analysis From the Acute Decompensated Heart Failure National Registry (ADHERE). JACC, 46: 57–64.
- Cleland J.G., Swedberg K., Follath F. et al. (2003) Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The EuroHeart Failure survey programme — a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur. Heart J., 24(5): 442–463.
- Colucci W.S. (2001) Nesiritide for the treatment of decompensated heart failure. J. Card. Fail., 7(1): 92–100.
- DiDomenico R.J. et al. (2004) Guidelines for Acute Decompensated Heart Failure Treatment. Ann. Pharmacother., 38: 649–660.
- Earl G.L., Fitzpatrick J.T. (2005) Levosimendan: A Novel Inotropic Agent for Treatment of Acute Decompensated Heart Failure. Ann. Pharmacother., 39: 1888–1896.
- Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: The Task Force on Acute Heart Failure of the European Society of Cardiology. Endorsed by the European Society of Intensive Care et al. (2005) Eur. Heart J., 26: 384–416.
- Felker G.M., Adams K.F. Jr., Konstam M.A., et al. (2003) The problem of decompensated heart failure: nomenclature, classification, and risk stratification. Am. Heart J., 145 (2 suppl): S18–S25.
- Gheorghiade M. et al. (2005). Acute Heart Failure Syndromes: Current State and Framework for Future Research. Circulation, 112: 3958–3968.
- Gheorghiade M., Zannad F. (2005) Modern management of acute heart failure syndromes. Eur. Heart. J. Suppl., 7: B3–B7.
- Jain P., Massie B.M., Gattis W.A. et al. (2003) Current medical treatment for the exacerbation of chronic heart failure resulting in hospitalization. Am. Heart J., 145(2 Suppl.): S3–S17.
- Philip A., Poole-Wilson (2002) Treatment of Acute Heart Failure: Out With the Old, In With the New. JAMA, 287: 1578–1580.