Визначення
Інфекційний ендокардит — запальне захворювання ендокарда інфекційної етіології, зумовлене інвазією збудника з його локалізацією на клапанних структурах, ендокарді, ендотелію в зоні магістральних судин, що прилягають до серця, яке супроводжується, як правило, бактеріємією і ураженням різних органів і систем організму.
Епідеміологія
Протягом останніх 10–15 років відзначають підвищення захворюваності інфекційним ендокардитом, що може бути зумовлено кількома чинниками:
- поширенням операцій, що виконуються на серці, — появою інфекційного ендокардиту протезованого клапана;
- підвищеною схильністю до захворювання при наявності:
- вроджених вад серця (10–20%), у тому числі двостулкового аортального клапана (12–30%);
- пролапса мітрального клапана (22–29%);
- набутих вад серця (37–76%);
- обструктивної ГКМП;
- операції на серці без заміни клапанів;
- постін’єкційними абсцесами після введення різних лікарських засобів;
- появою нової форми — нозокоміального інфекційного ендокардиту, пов’язаного з широким використанням інвазивної інструментальної техніки (катетерів, штучних водіїв ритму серця, шунтів), які вводять у серце і судини;
- появою інфекційного ендокардиту наркоманів.
Інфекційний ендокардит може виникати в будь-якому віці. До епохи антибіотиків найчастіше захворювання визначалось у осіб середнього віку, в останні десятиріччя пік захворюваності змістився до 50-річного віку, в 5 разів збільшилася кількість тих, які захворіли у віці старше 60 років. Чоловіки хворіють в 2 рази частіше, ніж жінки. У більшості пацієнтів інфекція уражає аортальний (28–45%), мітральний (5–36%) або обидва клапани (до 35%). Ендокардит правих відділів серця виявляють рідше (ураження тристулкового клапана <6%, клапана ЛА <1%). У чоловіків переважає ураження аортального клапана, у жінок — мітрального.
Етіологія
Інфекційний ендокардит — поліетіологічне захворювання, потенційними збудниками якого можуть бути до 128 різновидів мікроорганізмів. Основними серед них є стафілококи (30–50%) і стрептококи (20–30%).
Підвищення етіологічної ролі стафілокока (частіше золотавого) за останні 10–15 років пояснюється широким впровадженням у клінічну практику антибіотиків, а також поширенням оперативних втручань на серці, імплантації ендокардіального електрода штучного водія ритму серця, інвазивних інструментальних досліджень.
Із усіх штамів стрептокока найчастіше висівають зеленкуватий стрептокок, вдається виділити й інші штами стрептокока, насамперед ентерокок, що викликає інфекційний ендокардит у 10–15% випадків.
Пневмококовий ендокардит особливо часто діагностують у хворих після кардіохірургічного втручання з імплантацією штучних матеріалів, а також у пацієнтів, що перенесли в післяопераційний період пневмонію.
Спостереження останніх років свідчать про збільшення в етіології інфекційного ендокардиту питомої ваги грамнегативної мікрофлори: ешерихії, протея, сальмонел, синьогнійної палички, клебсієл, які є причиною захворювання у 3–8% випадків. У ін’єкційних наркоманів грамнегативні бактерії викликають захворювання у 5–64% випадків.
Зросла частота ендокардиту, викликаного грибами (1,5–6%); серед збудників цієї групи переважають дріжджеподібні гриби. Ендокардит грибкової етіології в 5–14% випадків виникає в ін’єкційних наркоманів.
Останнім часом у появі інфекційного ендокардиту також підвищилася етіологічна роль анаеробної флори. Існує припущення, що анаеробні бактерії реалізують свою ушкоджуючу роль тільки в асоціації з аеробними мікроорганізмами.
У хворих зі штучним клапаном серця в 50% випадків раннього ендокардиту висівається золотавий і епідермальний стафілокок, у 21% — грамнегативна мікрофлора, в 10% — гриби. Збудниками пізнього ендокардиту протезованого клапана є епідермальний стафілокок і стрептокок (50%), золотавий стафілокок (16%), ентерокок (11%), грамнегативна мікрофлора (12%).
Нині співвідношення між первинним і вторинним ендокардитом, пов’язаним із вадою клапана ревматичної або іншої етіології, істотно змінилося на користь першого, частота якого становить >30%.
Патогенез
Питання патогенезу інфекційного ендокардиту складне і остаточно не з’ясоване. Інфекційний ендокардит виникає в результаті взаємодії трьох складових: стану організму (сприятливих факторів), бактеріємії з урахуванням тропності та ступеня вірулентності бактерій. У більшості випадків в анамнезі є вказівки на ваду серця, атеросклероз, операції на серці, які сприяють вибірній адгезії мікроорганізмів на ендокарді. Виникнення ендокардиту, вірогідно, слід розглядати як результат мікроструктурних змін в ендокарді під впливом функціональних гемодинамічних перевантажень. Ці причини в тій чи іншій мірі пояснюють появу найбільш вразливого місця в ендокарді як місцевого фактора, що зумовлює цю локалізацію інвазії збудника.
Можливість розвитку інфекційного ендокардиту залежить від вираженості, частоти та видової специфічності бактеріємії. Під впливом етіологічних факторів на фоні зміненої реактивності всього організму і клапанного апарата серця виникає інтерстиціальний вальвуліт, небактеріальний ендокардит, у подальшому приєднується інфекція, розвивається інфекційне ураження клапанів з бактеріємією і тромбоемболічними ускладненнями.
Чинники, що полегшують адгезію мікроорганізмів на ендотеліальній поверхні та сприяють розвитку інфекційного ендокардиту, розподіляються на місцеві й загальні. До загальних відносяться виражені зміни імунного статусу організму, які часто відзначаються у наркоманів, хворих на алкоголізм, осіб похилого віку, пацієнтів із певними порушеннями в HLA-системі гістосумісності, а також у пацієнтів, що отримують імуносупресивну терапію.
У патогенезі інфекційного ендокардиту виділяють три фази: інфекційно-токсичну, імунозапальну (імунної генералізації процесу) і дистрофічну (з дистрофічними змінами внутрішніх органів). Від співвідношення інфекційно-токсичних та імунозапальних проявів частково залежить різноманіття клінічної картини хвороби.
Патологічна анатомія
При ендокардиті серце збільшене, звичайно переважає гіпертрофія лівих відділів у зв’язку з недостатністю клапана аорти. У міокарді, крім ознак запалення, виявляють такі виражені дистрофічні і некробіотичні ураження, як базофільна і паренхіматозна дистрофія, а також мікромаляції і мікроділянки фрагментів розпаду м’язових волокон.
Для всіх варіантів інфекційного ендокардиту характерна наявність вегетацій, які переважно розташовуються на стулках клапанів, рідше — на ендокарді шлуночків або лівого передсердя, а також на легеневій або іншій артеріях. Вегетації звичайно виявляються через 2 тиж від початку інфекційного ендокардиту при гострій (стафілококовій) формі і через 6–8 тиж при підгострому його перебігу. Свіжі вегетації складаються із тонких ниток фібрину, серед яких виявляють еритроцити і у меншій кількості — змішано-клітинні лейкоцити, тромбоцити та майже завжди колонії бактерій. Свіжі вегетації мають рожевий, червоний, жовтий або зелений кольори, але поступово набувають сірого забарвлення. При підгострому процесі поряд зі свіжими є вегетації, покриті фіброзною капсулою, частково або повністю кальциновані, часто на ніжці; відзначаються організовані вегетації, що повністю кальциновані. У неактивній стадії інфекційного ендокардиту вегетації являють собою фіброзні або повністю кальциновані горбики.
При первинному ендокардиті стулки клапанів тонкі, вільний край клапана часто потовщений, що викликано гемодинамічними порушеннями або запальною інфільтрацією, вегетації розташовуються по вільному краю клапанів, внутрішній оболонці висхідної частини аорти. При вторинному ендокардиті, коли інфекційний процес вражає вже змінений клапан, свіжі вегетації розташовуються на фіброзно-змінених або кальцинованих стулках, можливий відрив хорд.
Класифікація
В Україні користуються класифікацією інфекційного ендокардиту, прийнятою на VI Конгресі кардіологів України (Київ, 2000):
I. Активність процесу: активний, неактивний
II. Ендокардит нативних клапанів:
1) первинний
2) вторинний (набута вада серця, вроджена вада серця, травма, сторонні предмети)
III. Ендокардит протезованого клапана
Локалізація:
- аортальний клапан
- мітральний клапан
- тристулковий клапан
- клапан ЛА
- ендокард передсердь або шлуночків
IV. Збудник (грампозитивні, грамнегативні мікроорганізми, L-форми бактерій, рікетсії, гриби)
V. Ускладнення
VI. СН (0–III стадія, I–IV ФК)
За перебігом захворювання розрізняють гострий, підгострий або затяжний, хронічний рецидивуючий і латентний інфекційний ендокардит. До гострого відносять випадки захворювання тривалістю до 2 міс, >2 міс — до підгострого.
Клінічна картина
При інфекційному ендокардиті вона відрізняється значним різноманіттям симптомів, що зумовлює труднощі діагностики. Хвороба може маніфестувати раптово або тривати латентно, мати швидкий або затяжний перебіг. Клінічна картина захворювання, його перебіг і результат у кожному конкретному випадку залежать як від стану захисних сил організму, його неспецифічної резистентності і реактивності, так і від виду інфекційного збудника. Важливе значення має постійна бактеріємія, місцева реакція навколо клапана, емболізація судин різних органів, циркуляція імунних комплексів із накопиченням їх у тканинах.
Клінічні прояви звичайно розвиваються протягом 2 тиж з моменту інфікування. Одним із основних симптомів є лихоманка, що може супроводжуватися ознобом, пітливістю. Температурна реакція варіює від високої стійкої лихоманки протягом декількох місяців до незначного підвищення температури тіла протягом декількох днів з наступною стійкою її нормалізацією.
Спостереження за станом хворих дозволили виявити основні типи температурних кривих:
а) транзиторний тип характеризується нетривалим субфебрилітетом, відзначається у 40% хворих у початковій стадії ендокардиту;
б) інтермітуюча 1–2-тижнева або 1–2-денна висока лихоманка чергується з 1–2-тижневими періодами нормальної або субфебрильної температури тіла;
в) стійке помірне підвищення температури тіла зберігається тривалий час на фоні лікування і після ліквідації вогнищ хронічної інфекції;
г) при гектичній температурі добовий градієнт досягає 2–3 °C, відзначають озноб і підвищену пітливість;
д) при гіпотермічному типі температура тіла нижче норми, що характерно для хворих, які різко ослаблені з клінічно вираженою недостатністю кровообігу.
Потовиділення не полегшує стану пацієнта, буває профузним, іноді потом вкриваються тільки окремі ділянки тіла (голова, чоло, верхня половина тулуба).
Клінічні симптоми зумовлені появою вегетацій, частини яких можуть відриватися та емболізувати судини серця, мозку, нирок, селезінки, печінки, кінцівок і легень (при правосторонньому ендокардиті).
При розгорнутій клінічній картині відзначають наступні симптоми:
- виражена інтоксикація: слабкість, анорексія, головний біль, міалгія, артралгія, схуднення;
- зміни шкірних покривів: блідо-жовтуватий колір шкіри, петехії (дрібнокрапчасті геморагії) на шкірі та слизових оболонках, кон’юнктиві нижньої повіки (симптом Лукіна — Лібмана), плями Джейнуея — плями червоно-фіолетового кольору до 5 мм у діаметрі на долонях, ступнях, тулубі; вузлики Ослера — болючі, завбільшки з горошину, вузлики червонуватого кольору на долонних поверхнях пальців рук і підошовних поверхнях пальців ніг;
- зміни кінцевих фаланг («барабанні палички») і нігтів («годинникове скло»);
- моно- або олігоартрит великих суглобів верхніх і нижніх кінцівок;
- ураження аортального/мітрального клапана, ураження міокарда;
- тромбоемболії селезінкової, ниркових, легеневої, коронарних, мозкових артерій із розвитком інфарктів відповідних органів, судин сітківки ока;
- ознаки сухого або ексудативного перикардиту;
- ураження судин: мікотичні аневризми артерій, генералізований васкуліт;
- гепатомегалія, спленомегалія, збільшення лімфатичних вузлів;
- ураження нирок (дифузний гломерулонефрит, вогнищевий нефрит, інфаркт нирки);
- ураження ЦНС: менінгоенцефаліт, субарахноїдальний крововилив, тромбоемболія судин мозку, психоз;
- прогресуюча СН.
Зміни показників лабораторних досліджень при інфекційному ендокардиті неспецифічні, у периферичній крові часто виявляють ознаки гіпо- або нормохромної анемії. У більшості випадків визначається лейкопенія, але при ускладненнях можливий лейкоцитоз із зсувом лейкоцитарної формули вліво, моноцитоз, тромбоцитопенія. Типовим є підвищення ШОЕ, проте слід враховувати, що внаслідок диспротеїнемії цей симптом не може вчасно відобразити позитивну динаміку при лікуванні захворювання.
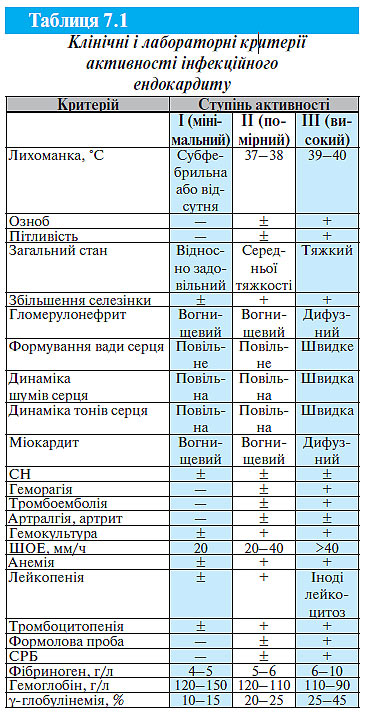
Для оцінки тяжкості інфекційного ендокардиту запропоновано виділяти три ступені активності процесу. Основні критерії активності процесу, доповнені даними дослідження гуморального імунітету, наведені в табл. 7.1 (Дьомін А.А., 2006).
Діагностика
У типових випадках діагностика інфекційного ендокардиту нескладна і ґрунтується на наступних ознаках: лихоманка з ознобом, наявність клапанних дефектів із появою шумів серця при первинному ендокардиті або вираженій зміні їх характеру при вторинному, тромбоемболічні ускладнення та позитивні результати бактеріологічного дослідження. Значні труднощі представляє діагностика захворювання при стертій формі або атиповому перебігу.
На ЕКГ визначають ознаки гіпертрофії ЛШ (при ураженні аортального або мітрального клапана) або ПШ (при ураженні тристулкового клапана або клапана ЛА), можливі порушення AV- провідності, передсердна і шлуночкова екстрасистолія. У 25% випадків виявляють фібриляцію або тріпотіння передсердь.
ЕхоКГ дозволяє верифікувати діагноз, її рекомендується проводити всім хворим з підозрою на інфекційний ендокардит. ЕхоКГ дозволяє у значній мірі об’єктивно оцінити стан клапанного апарату серця, вчасно виявити вегетації клапанів, кальциноз, розрив хорд або стулки клапана, абсцес клапанного кільця та міокардіальний абсцес, уточнити характер вади серця, а також визначити необхідність термінового оперативного лікування хворих із недостатністю аортального/мітрального клапана, що гостро розвинулась і вираженим перевантаженням об’ємом ЛШ.
При одновимірному дослідженні ознаками вегетацій є нерівномірне потовщення однієї зі стулок клапана, густо розташовані «кошлаті» мілкохвильові її осциляції, рухливість стулки при цьому не обмежується. Метод дозволяє візуалізувати вегетації розміром 2–3 мм.
При двовимірній ехоКГ вегетації визначаються у вигляді додаткових ехотіней, тісно зв’язаних зі стулками, які виходять поза звичайні межі їх локації (рис. 7.1). Частота виявлення вегетацій при ехоКГ-дослідженні залежить від їх величини, структури, локалізації, клапанної вади, що передує, тривалості захворювання. Виділяють три типи вегетацій: «сидячі», «на ніжці», «нитчасті» (рис. 7.2).
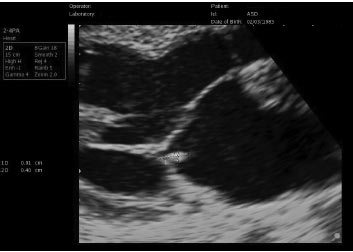
Рис. 7.1. Інфекційний ендокардит, вегетація на задній стулці мітрального клапана. В-режим, парастернальна позиція, довга вісь, ZOOM

Рис. 7.2. Інфекційний ендокардит, вегетації на стулках мітрального клапана. В-режим, апікальна чотирикамерна позиція
За допомогою допплєрівської ехоКГ визначають регургітацію на аортальному та мітральному клапанах у відповідну фазу серцевого циклу.
Тяжкість перебігу інфекційного ендокардиту на підставі даних ехоКГ-дослідження оцінюється за ступенем руйнування стулок, їх деформацією, утворенням абсцесів стулок, основи аорти, розривом хорд мітрального клапана, відривом стулки аортального клапана, результатом чого є зростання недостатності клапанів з перевантаженням відповідних камер серця. Збереження або зникнення вегетацій на фоні лікування (за даними ехоКГ) є ненадійним критерієм ефективності або неефективності антибіотикотерапії.
Черезстравохідна ехоКГ має значно більш високу чутливість відносно виявлення внутрішньосерцевих вегетацій (95–100% порівняно з 60–65% при проведенні трансторакальної ехоКГ).
Розроблені критерії, що дозволяють більш впевнено запідозрити діагноз інфекційного ендокардиту і які є показанням для проведення невідкладного ехоКГ-скринінгу і можливої госпіталізації (Horskotte D. et al., 2004):
- нове ушкодження клапана (шум регургітації);
- емболія неясної етіології (інсульт, інфаркт нирки);
- сепсис неясної етіології;
- гематурія, гломерулонефрит і підозра на інфаркт нирки;
- лихоманка у поєднанні з іншими факторами ризику інфекційного ендокардиту.
Катетеризація серця дозволяє виявити вади клапанів, вроджені дефекти, ураження коронарних артерій, оцінити ступінь вираженості гемодинамічних порушень у хворих з інфекційним ендокардитом. У ряді випадків проводити це дослідження небезпечно з огляду на ризик відриву вегетацій від клапана з наступною емболією судин великого кола кровообігу.
Посіви крові на стерильність — один із основних методів верифікації діагнозу інфекційного ендокардиту. Успішне виділення мікроорганізмів із крові залежить від дотримання ряду умов. У 50–55% випадків у гострий період та в 80–85% випадків у підгострий період посів крові виявляється стерильним. Причинами, що ускладнюють ідентифікацію збудника захворювання, є антибактеріальна терапія, що передує забору крові, недосконале бактеріологічне устаткування для проведення посіву, наявність у крові бактерій, що потребують застосування спеціальних середовищ (анаероби, сателіти і штами стрептокока зі зміненими властивостями (тіол- або вітамін В6-залежні), L-форми бактерій, бруцели). Для виділення вірусів, рикетсій, хламідій, грибів потрібні спеціальні методи. Якщо посіви крові взяті у пацієнта, який не отримував лікування в попередні 2 тиж, то вид збудника вдається ідентифікувати у 96% випадків. Кращі перспективи по ідентифікації збудника інфекційного ендокардиту відкриває бактеріологічне дослідження артеріальної крові, частота виявлення позитивної гемокультури при цьому зростає.
Відповідно до модифікованих діагностичних критеріїв інфекційного ендокардиту діагноз може бути достовірним, імовірним та таким, що виключається, при наявності альтернативного (Bayer A.S., 1996).
Діагноз достовірного інфекційного ендокардиту встановлюють за наявності 2 основних критеріїв або 1 основного і 3 або 5 допоміжних критеріїв.
Діагноз можливого інфекційного ендокардиту встановлюють за наявності 1 основного та 1 або 3 допоміжних критеріїв.
Діагноз інфекційного ендокардиту виключається:
- при наявності альтернативного діагнозу, що пояснює наявні ознаки захворювання;
- при зникненні проявів, що нагадують ендокардит, після 4 днів антибактеріальної терапії;
- при відсутності морфологічних ознак інфекційного ендокардиту під час операції або при аутопсії.
Основні діагностичні критерії інфекційного ендокардиту
1. Позитивна гемокультура, характерна для інфекційного ендокардиту:
- типовий мікроорганізм, виділений із двох флаконів: Streptococcus viridans, Streptococcus bovis, бактерії групи НАСЕК; позагоспітальний штам Staphylococcus aureus або ентерококи при відсутності первинного вогнища; одноразова позитивна культура крові Coxiella burneti або IgG >1:800;
- повторні позитивні гемокультури, що характерні для інфекційного ендокардиту:
-
- у зразках крові, взятих з інтервалом >12 год;
- у всіх 3, в 3 з 4 або в більшості іншої кількості зразків крові, взятих на посів з інтервалом між першим і останнім забором крові >1 год.
2. ЕхоКГ-ознаки інфекційного ендокардиту:
- наявність характерних ехоКГ-ознак:
- вегетації на клапанах серця або інших структурах;
- внутрішньокардіальні абсцеси;
- дисфункція протезованих клапанів;
- поява нових ознак регургітації крові через клапани.
Допоміжні діагностичні критерії інфекційного ендокардиту
1. Попередні захворювання серця або внутрішньовенне вживання наркотиків.
2. Лихоманка >38 °С.
3. Судинні ускладнення: артеріальна емболія, інфаркт легені, мікотичні аневризми, внутрішньочерепний крововилив, симптом Лукіна, плями Жанев’є.
4. Імунні порушення: гломерулонефрит, вузлики Ослера, плями Рота, ревматоїдний фактор.
5. Позитивна гемокультура, що не відповідає основним критеріям, або серологічні ознаки активної інфекції, викликаної потенційним збудником інфекційного ендокардиту.
Діагностичні критерії інфекційного ендокардиту у пацієнтів літнього і похилого віку включають:
- лихоманку з ознаками СН неясного генезу;
- лихоманку з цереброваскулярними порушеннями;
- лихоманку з нирковою недостатністю неясного генезу;
- лихоманку і біль в ділянці спини;
- анемію неясного походження та зменшення маси тіла;
- шум, що знову з’явився над ділянкою серця;
- внутрішньолікарняну інфекцію з лихоманкою у хворих із встановленим внутрішньовенним катетером.
На жаль, середній термін встановлення діагнозу «інфекційний ендокардит» від перших скарг до звернення до лікаря становить не менше 2–3 міс, а при ураженні правих відділів серця і більше; до 87% хворих госпіталізують з неправильним діагнозом. Діагностика інфекційного ендокардиту у хворих літнього віку особливо складна, кількість діагностичних помилок досягає 50%.
Для встановлення правильного діагнозу необхідно враховувати весь комплекс проявів патологічного процесу.
Можливі «маски» інфекційного ендокардиту
1. Загальні: нездужання, анорексія, зниження маси тіла, блідість шкірних покривів, нічна пітливість.
2. Із боку серця: міокардит, перикардит, ураження клапанів, ІМ (шуми, аритмія, СН).
3. Із боку легень: частіше визначаються при поразці клапанів правих відділів серця і зумовлені розвитком повторних інфаркт-пневмоній, інфаркту легені (плеврит, кровохаркання, набряк легень).
4. Із боку органа зору: раптова сліпота, петехії на повіках, на очному дні — петехіальні крововиливи і плями Рота (білі округлі плями діаметром 1–2 мм, розташовані поверхнево, які іноді закривають судини сітківки, і складаються зі скупчень клітин, що утворилися внаслідок інфарктів сітківки), набряк і неврит зорового нерва.
5. Церебральні: ті, що мають перебіг під виглядом гострого порушення мозкового кровообігу, рідше — менінгіту або менінгоенцефаліту (геміплегія, афазія, атаксія, головний біль, психічні порушення).
6. Ниркові: проявляються симптомами дифузного гломерулонефриту або інфаркту нирки (протеїнурія, гематурія, гіпертензивний криз).
7. Гематологічні: проявляються анемією.
8. Із боку опорно-рухового апарата: артрит, остеомієліт.
9. Судинні: які відтворюють клініку системного васкуліту, тромбангіїту (геморагічний синдром, тромбоемболічні ускладнення).
Лікування
Терапія інфекційного ендокардиту базується на декількох принципах:
1. Терапія повинна бути по можливості етіотропною, тобто спрямована на ерадикацію конкретного збудника.
2. Необхідно застосовувати комбінацію декількох антибактеріальних препаратів для досягнення високих бактерицидних концентрацій і попередження розвитку резистентності.
3. Терапія повинна бути тривалою: при захворюванні стрептококової етіології — не менше 4 тиж, стафілококової — 6 тиж, при захворюванні, викликаному грамнегативними збудниками — не менше 8 тиж.
4. При наростанні ознак імунного конфлікту у формі гломерулонефриту, васкуліту, міокардиту та ін., а також прояві інфекційно-токсичного шоку розглядають питання про призначення ГКС.
5. При гострих формах інфекційного ендокардиту, викликаного переважно стафілококами і грамнегативними мікроорганізмами, доцільно проведення імунотерапії (антистафілококова плазма, антистафілококовий γ-глобулін) і дезінтоксикації.
6. При відсутності ефекту протягом 2 тиж після застосування адекватної антибіотикотерапії необхідна консультація кардіохірурга. Хірургічне лікування слід проводити за суворими показаннями і своєчасно.
Відповідно до наказу МОЗ України № 436 від 03.07.2006 р. «Стандарти надання допомоги кардіологічним хворим» програма лікування інфекційного ендокардиту передбачає наступний перелік медичних послуг:
Обов’язковий асортимент
- оперативне лікування;
- етіотропна терапія: антибіотикотерапія під контролем чутливості збудника, застосування ГКС та ін.
- симптоматичне лікування СН та ускладнень.
Додатковий асортимент
- застосування аміодарону у хворих із симптомними або тяжкими шлуночковими аритміями;
- внутрішньовенне введення симпатоміметичних засобів (допаміну і/або добутаміну);
- непрямі антикоагулянти у хворих із постійною формою фібриляції передсердь, наявністю тромбів у порожнинах серця, тромбоемболій в анамнезі.
При виборі антибіотика слід враховувати результати мікробіологічного дослідження, чутливість виділеного збудника.
Труднощі лікування насамперед зумовлені значним поширенням нетипових збудників захворювання з високою резистентністю багатьох мікроорганізмів до існуючих антибіотиків. Велике значення має і той факт, що антибіотики погано проникають у клапани серця та міокард і у багатьох випадках (наприклад при наявності штучних клапанів серця, шунтів, кардіостимуляторів) перебіг ендокардиту не завжди прогнозований. При виявленні інфекційного ендокардиту антибактеріальне лікування необхідно починати якомога раніше, не чекаючи ідентифікації збудника, оскільки процес швидко дисемінує. У випадках із невстановленим збудником інфекційного ендокардиту рекомендують починати терапію бета-лактамними антибіотиками та аміноглікозидами (схема 7.1). Відсутність ефекту через 3–5 днів і негативні результати бактеріологічного дослідження дозволяють припустити наявність стафілококового ендокардиту, що найімовірніше зумовлений пеніциліно- і метіцилінорезистентними стафілококами, що потребує заміни антибіотика.
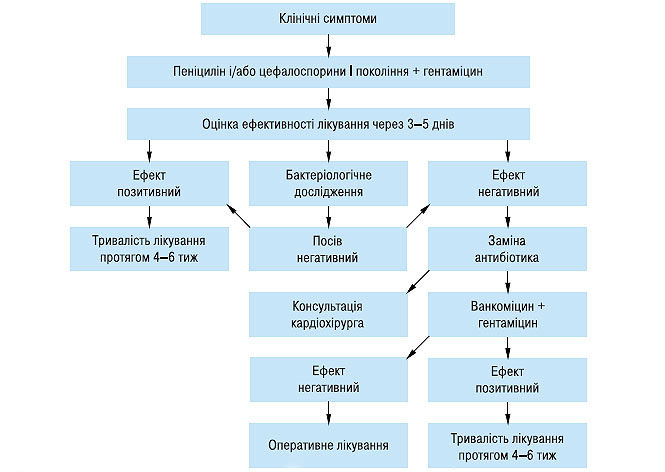
Схема 7.1. Алгоритм емпіричного лікування інфекційного ендокардиту
Найефективнішими вважаються бензил-пеніцилін, цефалоспорини і аміноглікозиди. Антибіотиком вибору для початкової терапії, як правило, є бензилпеніцилін у добовій дозі 12–24 млн ОД. Вибір цього антибіотика (при дотриманні дози, що рекомендується) пояснюється його доступністю, вираженою бактерицидною дією на широкий спектр мікроорганізмів і широким терапевтичним діапазоном.
Сучасна етіотропна хіміотерапія інфекційного ендокардиту у хворих з нормальною функцією нирок наведена в табл. 7.2.

Для лікування інфекційного ендокардиту, викликаного стрептококом, призначають бензилпеніцилін протягом 4 тиж або бензилпеніцилін у комбінації з аміноглікозидом (гентаміцин, тобраміцин протягом 2 тиж). Ці режими вимагають тривалої госпіталізації пацієнтів і використання внутрішньовенних катетерів, що часто призводить до розвитку флебіту. AHA опублікувала результати двох досліджень по лікуванню цефтриаксоном пацієнтів зі стрептококовим ендокардитом. Висока ступінь вилікування (98%) після 4-тижневої терапії препаратом виправдовує застосування цефтриаксону з урахуванням спектру його активності та фармакокінетичних особливостей, що дозволяє призначати його 1 раз на добу і використовувати для амбулаторного лікування неускладненого інфекційного ендокардиту. При алергічних реакціях на пеніциліни і цефалоспорини рекомендовані глікопептидні антибіотики.
Сучасна антибіотикотерапія ентерококового ендокардиту з урахуванням того, що ентерококи значно менш чутливі до бензилпеніциліну і гентаміцину, включає комбінацію антибіотиків, що мають синергічну дію: амінопеніцилін (ампіцилін) або глікопептидний антибіотик (ванкоміцин, тейкопланін) з аміноглікозидами (гентаміцин, стрептоміцин). Серйозною проблемою є інфекційний ендокардит, викликаний ентерококами з високим рівнем резистентності до аміноглікозидів. У цих випадках призначають тривалу (8–12 тиж) терапію бензилпеніциліном або ампіциліном у високих дозах. При алергії до бета-лактамних антибіотиків слід призначати ванкоміцин у комбінації з аміноглікозидами внутрішньовенно, тейкопланін. Частота рецидивів при цьому становить 50%. При рецидиві показано кардіохірургічне лікування з імплантацією клапана. Якщо ентерококи резистентні до пеніцилінів, аміноглікозидів і ванкоміцину, ефективної антибактеріальної терапії немає. Можливе застосування лінезоліду в дозі 600 мг кожні 12 год.
Цефалоспорини не слід застосовувати для лікування ентерококового ендокардиту в зв’язку з первинною резистентністю до них цих мікроорганізмів.
При стафілококовому ендокардиті доведено, що бактерицидний ефект, стерилізація клапанів і профілактика їх тяжких ушкоджень забезпечуються вірогідніше при використанні комбінації пеніцилінів або цефалоспоринів, стійких до дії бета- лактамаз, і аміногликозидів. При неефективності терапії, виділенні пеніциліно- і метіцилінорезистентних штамів золотавого або епідермального стафілокока або при алергії до бета-лактамних антибіотиків застосовують глікопептиди (ванкоміцин, тейкопланін) у поєднанні з аміноглікозидами. У випадку алергії до бета- лактамних антибіотиків при стафілококовому ендокардиті застосовують також лінкозаміди (лінкоміцин, кліндаміцин). Високу протистафілококову активність має цефепім.
Ендокардити, викликані грамнегативними мікроорганізмами, майже завжди розвиваються в результаті внутрішньогоспітального інфікування і лікувати їх складно через наявність у збудників різних механізмів резистентності. Сучасна антибіотикотерапія припускає застосування аміноглікозидів (тобраміцин, нетилміцин, амікацин) одночасно з цефалоспоринами III–IV покоління (цефтриаксон, цефепім) або карбапенемів (іміпенем, меропенем) протягом 4–6 тиж.
При грибкових ендокардитах проводять комбіновану хіміотерапію амфотерицином В і флуконазолом у поєднанні з хірургічним лікуванням. Навіть при оптимальному лікуванні відзначають високу смертність і пізні рецидиви захворювання (через 2 роки і більше).
Для лікування пацієнтів із ендокардитом протезованих клапанів можна використати комбінацію цефалоспоринів з гентаміцином або тобраміцином, ефективне також застосування ванкоміцину. При захворюванні, викликаному епідермальним стафілококом, найчастіше застосовують ванкоміцин/тейкопланін із рифампіцином і гентаміцин. Недоцільно проводити монотерапію рифампіцином.
При тривалому проведенні антибактеріальної терапії внутрішньовенно рекомендують додавати гепарин із розрахунку 1 ОД/мл розчину антибіотика для запобігання утворення тромбів і 1 раз на тиждень вводити амфотерицин В (50 000 ОД внутрішньовенно крапельно) для попередження грибкової інфекції. Протигрибкові препарати доцільно застосовувати приблизно із середини курсу антибіотикотерапії, коли можна чекати розвитку грибкової інфекції. Для діагностики останньої і оцінки ефективності терапії необхідно періодично проводити посів із кореня язика та посів сечі для виявлення грибкової флори.
Дискусійним залишається питання про застосування ГКС, багато дослідників зверталися до цієї проблеми, але вона дотепер не вирішена. Нині можна стверджувати, що застосування ГКС не запобігає руйнуванню клапанного апарата: пригнічуючи запальну реакцію навколо вогнища інфекції, вони, навпаки, зумовлюють більш швидке руйнування клапана. Гормональна терапія веде до пригнічення клітинного і гуморального імунітету, необхідного для боротьби з інфекцією, призводить до зниження фагоцитарної активності лейкоцитів і рівня утворення антитіл, що може сприяти генералізації септичного процесу. Призначати ГКС небажано до досягнення належного ефекту від застосування антибіотикотерапії (нормалізація температури тіла, тенденція до зниження ШОЕ). ГКС небезпечно застосовувати у випадках захворювання з негативними результатами гемокультури, коли лікарі змушені проводити емпіричну антибактеріальну терапію, а гормони, усуваючи лихоманку, анемію і нормалізуючи ШОЕ, позбавляють критеріїв оцінки ефективності цієї терапії. Неприпустиме застосування ГКС при рецидивах захворювання, особливо ранніх (протягом перших 2–3 міс), якщо немає можливості провести повну ерадикацію збудника. У випадках захворювання зі встановленим збудником і відомою його чутливістю до антибіотиків у застосуванні гормонів, як правило, немає необхідності.
Таким чином, ГКС не є препаратами першого ряду, їх застосування протипоказано при гострому септичному ендокардиті, наявності септичного синдрому при підгострому септичному ендокардиті, невизначеному виді збудника, відсутності ерадикації збудника, при інфекційному ендокардиті, що рецидивує. Несприятливий вплив ГСК на перебіг інфекційного ендокардиту, особливо в дозі 30 мг/добу, роблять їх застосування небажаним.
Показанням до призначення ГКС є інфекційно- токсичний шок, при якому короткочасне застосування ГКС у високих дозах (≥100–200 мг у перерахуванні на преднізолон) життєво необхідно. Безсумнівним показанням до їх призначення є медикаментозна алергія. Відносним показанням до їх застосування є тяжке ураження нирок імунозапального характеру (протеїнурія >1 г/л) або міокарда.
При інфекційному ендокардиті, особливо гострому, проводять пасивну імунізацію готовими антитоксичними сироватками з метою нейтралізації циркулюючих у крові мікробних токсинів. Найбільш ефективним є застосування гіперімунної плазми (залежно від виду збудника — антистафілококова, антисиньогнійна та ін.). Антистафілококову плазму вводять внутрішньовенно крапельно по 125–250 мл щодня або через день (4–6 вливань на курс). Антисиньогнійну плазму вводять внутрішньовенно із розрахунку 4–6 мл/кг маси (в середньому 250 мл) з інтервалами між введенням 1–3 дні (4–6 вливань на курс). Антистафілококовий гаммаглобулін не тільки є джерелом антитіл, але також стимулює фактори неспецифічного імунітету, застосовується у вигляді внутрішньом’язових ін’єкцій по 5–10 мл щодня протягом 10 днів. Імуноглобулін людини вводять внутрішньовенно по 50 мл зі швидкістю 20–40 крапель/хв щодня протягом 3–5 днів.
Оперативне лікування проводиться як у ранній термін захворювання при лихоманці, що утримується, і бактеріємії, так і по закінченні як мінімум 4–6-тижневого курсу антибактеріальної терапії. Проведення хірургічного лікування необхідне приблизно у 20% хворих інфекційним ендокардитом.
Показаннями до оперативного втручання на нативних клапанах є:
- СН внаслідок недостатності аортального або мітрального клапана, що гостро виникла;
- персистуюча лихоманка і бактеріємія >8 днів, незважаючи на антибактеріальну терапію;
- абсцеси, псевдоаневризми, порушення провідності, міокардит;
- виявлення збудників, які часто не піддаються антибактеріальній терапії (гриби, Brucella, Coxiella);
- виявлення мікроорганізмів з високим потенціалом до швидкої деструкції структур серця (S. lugdunensis);
- ураження міокарда і фіброзного кільця.
До відносних показань до хірургічного лікування інфекційного ендокардиту нативних клапанів відносять наявність масивних вегетацій на внутрішньосерцевих структурах (за даними ехоКГ), емболії периферичних судин, виділення в гемокультурі грамнегативної палички або стафілокока.
Хірургічний метод полягає у видаленні уражених клапанних структур з вегетаціями та імплантації штучного механічного або біологічного протеза. Останнім часом повідомляється про нові підходи до хірургічної тактики: висічення вегетацій, ушивання перфорації стулки клапана, ізольоване протезування однієї зі стулок мітрального або аортального клапана ксеноперикардом і санація камер серця, закриття порожнини абсцесу. Загальна 5-річна виживаність з урахуванням госпітальної летальності становить 70–75%.
Показаннями для проведення невідкладного хірургічного втручання при інфекційному ендокардиті протезованих клапанів серця є встановлена грибкова етіологія інфекційного ендокардиту, поява симптомів СН, ознак порушення функції протеза, внутрішньосерцевих абсцесів, прогресування порушень провідності серця, рецидивуючі емболічні ускладнення. Хірургічне лікування інфекційного ендокардиту протезованих клапанів супроводжується високим операційним ризиком. Операція може бути необхідною також для лікування пацієнтів з тяжкими системними емболічними ускладненнями, для видалення абсцесу селезінки або лікування мікотичних аневризм.
Прогноз
Без лікування інфекційний ендокардит практично завжди призводить до летального кінця, при медикаментозному лікуванні смертність досягає 80%, при хірургічному — 30%, що пояснюється перш за все несвоєчасністю встановлення діагнозу.
Для прогнозування результату захворювання важливе значення мають збудник, його вірулентність і стійкість до антибактеріальних засобів, а також локалізація клапанного ураження.
Пацієнт вважається вилікуваним, якщо протягом 2 міс після закінчення адекватної антимікробної терапії не виявляються симптоми інфекційного ендокардиту, немає підвищення температури тіла, ШОЕ, результати посівів крові негативні. Поновлення хвороби протягом перших 12 міс після виписки зі стаціонару розцінюється як рецидив, поновлення хвороби пізніше ніж через 1 рік — як повторне виникнення інфекційного ендокардиту. Раннім рецидивом вважається поява симптомів інфекційного ендокардиту протягом перших 3 міс.
Факторами, що погіршують прогноз хвороби, є наявність застійної СН, похилий вік, залучення в процес клапана аорти або декількох клапанів серця, полімікробна бактеріємія, неможливість ідентифікації етіологічного агента внаслідок негативних результатів посівів крові, резистентність збудника до бактерицидних препаратів першого ряду, пізній початок терапії. Особливо несприятливий прогноз — при наявності протезованих клапанів, розвитку абсцесів клапанного кільця або міокарда, виявленні грамнегативних збудників. При наявності грибкового ендокардиту внаслідок складності виділення збудника з гемокультури, низької ефективності лікування, генералізації процесу по судинній системі за рахунок частих емболій помирає 80–90% хворих.
Найбільш частою причиною смерті навіть у випадках адекватного лікування є СН, що розвивається внаслідок деструкції клапана або ушкодження міокарда. Крім того, до летального кінця можуть призвести емболія судин життєво важливих органів, розвиток ниркової недостатності або мікотичної аневризми, ускладнень після хірургічного втручання.
Профілактика
Профілактика розвитку інфекційного ендокардиту в хворих із підвищеним ризиком зводиться до попередження бактеріємії, що виникає після різних втручань і маніпуляцій. Антибіотикопрофілактику необхідно проводити пацієнтам із патологією серця при ризику розвитку інфекційного ендокардиту перед проведенням інвазивних процедур.
Показання до антимікробної профілактики у хворих високого ризику:
- наявність штучних клапанів серця або протезних матеріалів, що використані для пластики клапана (як біо-, так і механічних ендопротезів);
- перенесений раніше інфекційний ендокардит;
- вроджені вади серця:
- некоригована синя вада, включаючи паліативні шунти та анастомози;
- повністю скоригований вроджений дефект за допомогою протезного матеріалу або пристрою, що введений хірургічним або катетерним методом протягом перших 6 міс після процедури;
- коригована вада з резидуальним дефектом у місці протезованого фрагменту або протезний пристрій;
- реципієнт серцевого трансплантата з клапанною регургітацією внаслідок структурно аномального клапана.
ЛІТЕРАТУРА
- Бешляга В.М., Кнышов Г.В., Руденко А.В. и др. (2003) Роль эхокардиографии в диагностике инфекционного эндокардита. Серце і судини, 4: 58–64.
- Буткевич О.М., Виноградова Т.Л. (2000) Некоторые вопросы современной терапии инфекционного эндокардита. Терапевт. арх., 9: 54–57.
- Демин А.А., Дробышева В.П. (2000) Антибактериальная химиотерапия инфекционного эндокардита. Клин. антимикробная химиотерапия, 1: 25–27.
- Кнышов Г.В., Коваленко В.Н. (ред.) (2004) Инфекционный эндокардит. Морион, Киев, 256 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 122 с.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07. 2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006). Укр. кардіол. журн., 6: 89–115.
- Никонов В.В. (2007) Инфекционный эндокардит. Медиц. неотлож. сост., 5: 44–47.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва, 1328 с.
- Ребров А.П., Пономарева Е.Ю., Белова А.А. и др. (2000) Инфекционный эндокардит: качество диагностики и клинические особенности. Терапевт. арх., 9: 50–53.
- Руденко А.В., Крикунов А.А. (2004) Клинические проявления и диагностика инфекционного эндокардита. Серце і судини, 1: 96–104.
- Шиллер Н., Осипов М.А.(2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Anderson D.J., Goldstein L.B., Wilkinson W.E. et al. (2003) Stroke location, characterization, severity, and outcome in mitral vs aortic valve endocarditis. Neurology, 61: 1341–1346.
- Bayer A.S. (1996) Revised diagnostic criteria for infective endocarditis. Cardiol. Clin., 14: 345–350.
- Baddour L.M., Wilson W.R., Bayer A.R. et al. (2005) Infective endocarditis, diagnosis, antimicrobial therapy, and management of complications. A statement for healthcare professionals from the Committee on rheumatic fever, endocarditis, and Kawasaki disease, Council on cardiovascular disease in the young, and the Councils on clinical cardiology, stroke, and cardiovascular surgery and anesthesia, American Heart Association — executive summary. Circulation, 111: 3167–3184.
- Cabell C.H., Jollis J.G., Peterson G.E. et al.(2002) Changing patient characteristics and the effect on mortality in endocarditis. Arch. Intern. Med.,162: 90–94.
- Durack D.T., Bright D.K., Lukes A.S.(1994) Duke Endocarditis Service. New criteria for diagnosis of infective endocarditis. Amer. J. Med., 96: 200–209.
- Evangelista A., Gonzalez-Alujas M.T. (2004) Echocardiography in infective endocarditis. Heart, 90: 614–617.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Greub G., Lepidi H., Rovery C. et al. (2005) Diagnosis of infectious endocarditis in patients undergoing valve surgery. Amer. J. Med., 118: 230–238.
- Horskotte D., Follath F., Gutchik E. et al. (2004) Guidelines on prevention, diagnosis and treatment of infective endocarditis. Executive summary. The task force on infective endocarditis of the European society of cardiology. Eur. Heart J., 25: 267–276.
- Kuruppu J.C., Corretti M., Mackowiak P. et al. (2002) Overuse of transthoracic echocardiography in the diagnosis of native valve endocarditis. Arch. Intern. Med., 162: 1715–1720.
- Le T., Bayer A.S. (2003) Combination antibiotic therapy for infective endocarditis. Clin. Infect. Dis., 36: 615–621.
- Li J.S., Sexton D.J., Mick N. et al. (2000) Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin. Infect. Dis., 30: 633–638.
- Nishimura R.A., Carabello B.A., Faxon D.P et al. (2008) ACC/AHA 2008 guideline update on valvular heart disease: focused update on infective endocarditis. Circulation, 118: 887–896.
- Petti C.A., Fowler V.G. Jr (2003) Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin., 21: 219–233.
- Prendergast B.D. (2004) Diagnostic criteria and problems in infective endocarditis. Heart, 90: 611–613.
- Sachdev M., Peterson G.E., Jollis J.G. (2002) Imaging techniques for diagnosis of infective endocarditis. Infect. Dis. Clin. North. Amer., 16: 319–337.
- Sekido M., Takano T., Takayama M. et al. (1999) Survey of infective endocarditis in the last 10 years: analysis of clinical, microbiological and therapeutic features. J. Cardiol., 33: 209–215.
- Stryjewski M.E., Corey G.E. (2005) Treatment protocols for bacterial endocarditis and infection of electrophysiologic cardiac devices Biofilms, Infection, and antimicrobial therapy, eds. Pace, Rupp, and Finch. Boca Raton: CRC Press, P. 428–449.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Thuny F., Disalvo G., Belliard O. et al. (2005) Risk of embolism and death in infective endocarditis: prognostic value of echocardiography: a prospective multicenter study. Circulation., 112: 69–75.
- Valente A.M., Jain R., Scheurer M. et al. (2005) Staphylococcus aureus bacteremia in childhood: who is at risk for endocarditis? Pediatrics.,115: 15–19.
- Wilson W., Taubert K.A., Gewitz M. et al. (2007) Prevention of infective endocarditis: guidelines from the American Heart Association. Circulation, 116: 1736–1754.