Вроджені вади серця
Содержание
- АНОМАЛІЇ ПОЛОЖЕННЯ СЕРЦЯ
- АНОМАЛІЇ МІЖПЕРЕДСЕРДНОЇ ПЕРЕГОРОДКИ
- Дефект міжпередсердної перегородки
- АНОМАЛІЇ МІЖШЛУНОЧКОВОЇ ПЕРЕГОРОДКИ
- Дефект міжшлуночкової перегородки
- Комплекс Ейзенменгера
- ІЗОЛЬОВАНИЙ СТЕНОЗ ЛЕГЕНЕВОЇ АРТЕРІЇ
- ТЕТРАДА ФАЛЛО
- ВІДКРИТА АРТЕРІАЛЬНА ПРОТОКА
- КОАРКТАЦІЯ АОРТИ
- АНОМАЛІЯ ЕБШТЕЙНА
- ЛІТЕРАТУРА
Вроджені вади серця являють собою структурні аномалії та деформації клапанів, отворів або перегородок між камерами серця або судин, що відходять від нього, що порушують внутрішньосерцеву та системну гемодинаміку, що призводить до розвитку гострої або хронічної недостатності кровообігу.
Епідеміологія
Частота вроджених вад серця становить до 1% всіх захворювань серця.
Етіологія
Виникнення вад ембріонального розвитку може бути зумовлене генними мутаціями, різними інфекційними процесами та інтоксикаціями (ендогенними і екзогенними) у період вагітності.
Із вродженими вадами серця пов’язані певні хромосомні порушення, найбільш часто — трисомія 21 (синдром Дауна), а також трисомії 13, 14, 15 і 18. У більш ніж 50% пацієнтів із синдромом Дауна відзначають вроджені вади серця (найбільш часто атріовентрикулярні або шлуночкові септальні дефекти).
Мутації в декількох специфічних генах ідентифіковані в деяких випадках вроджених вад серця. Мутації в TBX5 виявляють у більшості пацієнтів з синдромом Хольта — Орама, аутосомним захворюванням із септальними дефектами. Мутації в гені еластину були ідентифіковані як причина надклапанного аортального стенозу, мутації в NKX2.5 пов’язані з аутосомним домінантним фенотипом дефекту передсердної перегородки при тетраді Фалло.
Патогенез
Вроджена вада серця є наслідком порушення нормального процесу розвитку первинної та вторинної міжпередсердних перегородок та ендокардіальних подушок у період його ембріонального формування. При порушенні розвитку м’язової частини міжшлуночкової перегородки в ній утворюються поодинокі або множинні отвори, частіше в мембранозній її частині, при цьому можуть утворитися високі або низькі її дефекти, які нерідко захоплюють розташовані нижче частини м’язової перегородки. Порушення розвитку аортолегеневої перегородки може бути локальним, на невеликій ділянці, тоді формується вада по типу аортолегеневої нориці. Іноді поділу артеріального стовбура на аорту й ЛА взагалі не відбувається та формується вада, яка називається загальним артеріальним стовбуром. У процесі формування цієї перегородки напрямок її росту може порушитися і йти не по спіралі, як звичайно, а прямо — у таких випадках формується вада, яка називається транспозицією аорти й ЛА. У ряді випадків порушення розвитку перегородки артеріального конуса призводять до її відхилення в той чи інший бік, внаслідок чого виникає звуження аорти або ЛА. До звуження останньої часто приєднується порушення розвитку складок конуса в місці, де вони беруть участь у формуванні мембранозної частини перегородки, — в ній утворюється дефект, розширена аорта зміщується вправо та розташовується прямо над дефектом — розвивається вада, яка отримала назву «тетрада Фалло».
Виникнення ряду вроджених вад серця та магістральних судин пов’язане з порушеннями в постнатальний період. Порушення в процесі нормального закриття артеріальної протоки призводить до формування відкритої артеріальної протоки. При поєднанні незарощення овального отвору з недорозвиненням вторинної перегородки формується дефект міжпередсердної перегородки в ділянці овального вікна.
Класифікація
За етіологією вроджені вади поділяються на дві групи:
- Вади, зумовлені порушенням формоутворення, що є патологією ембріонального розвитку серцево-судинної системи;
- Вади, що розвинулися внаслідок захворювань ендокарда, перенесених у внутрішньоутробний період.
Із урахуванням морфології ураження серед вроджених вад серця виділяють:
- аномалії розташування серця;
- аномалії передсердної, міжшлуночкової перегородки;
- аномалії ЛА, артеріальної протоки, аорти;
- переміщення великих судин;
- аномалії клапанного апарата серця.
Систематизація вроджених вад серця
Загальні:
- вроджена коригована транспозиція магістральних артерій;
- аномалії розташування серця;
- уроджена повна блокада серця.
Вади серця «білі» з шунтуванням крові зліва направо:
1. Шунт крові на рівні передсердь:
1) дефект міжпередсердної перегородки;
2) дефект міжпередсердної перегородки в сполученні з мітральним стенозом (синдром Лютамбаше);
3) часткове аномальне приєднання легеневих вен.
2. Шунт крові на рівні шлуночків:
1) дефект міжшлуночкової перегородки;
2) дефект міжшлуночкової перегородки в сполученні з недостатністю клапана аорти;
3) дефект міжшлуночкової перегородки зі скиданням крові з ЛШ у праве передсердя.
3. Шунт крові з устя аорти в праву частину серця:
1) розрив аневризми синуса Вальсальви;
2) коронарна артеріовенозна фістула;
3) аномальне відгалуження виходу лівої коронарної артерії зі стовбура ЛА.
4. Шунт крові між аортою та ЛА:
1) аортопульмональне вікно;
2) відкрита артеріальна протока.
5. Багаторівневі шунти крові:
1) повний загальний передсердно-шлуночковий канал;
2) поєднання дефекту міжшлуночкової перегородки з дефектом міжпередсердної перегородки;
3) поєднання дефекту міжшлуночкової перегородки з відкритою артеріальною протокою.
Вади серця «білі» без шунтування крові:
1. Вади лівих відділів серця:
1) вроджена обструкція притоку крові в ліве передсердя;
2) мітральна недостатність;
3) первинний дилатуючий фіброеластоз ендокарда;
4) стеноз устя аорти;
5) недостатність аортального клапана;
6) коарктація аорти.
2. Вади правих відділів серця:
1) аномалія тристулкового клапана (Ебштейна) без ціанозу;
2) стеноз ЛА;
3) уроджена недостатність клапана ЛА;
4) ідіопатичне розширення стовбура ЛА.
Вади серця «сині»:
Із посиленим легеневим кровотоком:
1. Повна транспозиція магістральних артерій.
2. Синдром Тауссіг — Бінга.
3. Артеріальний стовбур.
4. Повна аномалія приєднання легеневих вен.
5. Єдиний шлуночок без стенозу легеневого стовбура.
6. Загальне передсердя.
7. Тетрада Фалло з атрезією легеневого стовбура з посиленням колатерального артеріального кровотоку.
8. Атрезія тристулкового клапана з великим дефектом міжшлуночкової перегородки без стенозу легеневого стовбура.
9. Гіпоплазія лівих відділів серця (атрезія аорти й мітрального клапана).
З нормальним або зменшеним легеневим кровотоком:
1. Атрезія тристулкового клапана.
2. Аномалія Ебштейна з шунтуванням крові з правого передсердя в ліве.
3. Атрезія легеневого стовбура з інтактною міжшлуночковою перегородкою.
4. Стеноз або атрезія легеневого стовбура з дефектом міжшлуночкової перегородки (тетрада Фалло).
5. Стеноз легеневого стовбура із шунтуванням крові з правого передсердя в ліве.
6. Повна транспозиція магістральних судин у поєднанні зі стенозом легеневого стовбура.
7. Відходження обох судин, які виносяться з ПШ у сполученні зі стенозом легеневого стовбура.
8. Єдиний шлуночок зі стенозом легеневого стовбура.
9. Артеріовенозні нориці легень.
10. Сполучення між порожнистими венами та лівим передсердям.
Лікування
Відповідно до протоколу надання медичної допомоги пацієнтам із вродженими вадами серця лікувальна програма передбачає перелік та обсяг обов’язкових медичних послуг, в які включене оперативне лікування вад серця й лікування СН та її ускладнень (наказ МОЗ України № 436 від 03.07.2006 р.).
АНОМАЛІЇ ПОЛОЖЕННЯ СЕРЦЯ
До аномалій внутрішьогрудного положення серця відносять порушення розташування верхівки серця, її відповідності характеру положення органів черевної порожнини та випадки неправильного формування серця, такі як зворотнє або невизначене розташування ембріональних закладок правого й лівого передсердь.
Епідеміологія
Частота цих аномалій становить 1,5% серед усіх вроджених вад серця, найбільш частими серед них є правосформоване праворозташоване серце — ізольована декстрокардія (рис. 3.1) і лівосформоване праворозташоване серце (рис. 3.2) — «дзеркальна декстрокардія» (відповідно в 54 і 33% хворих із правобічним положенням серця). У першому випадку розташування інших органів грудної клітки та топографія органів черевної порожнини відповідають фізіологічній нормі, у другому випадку відзначають повне зворотне розташування внутрішніх органів.

Рис. 3.1. Правосформоване праворозташоване серце. Тут і далі на рисунках: ПП — праве передсердя; ЛП — ліве передсердя
Рис. 3.2. Лівосформоване праворозташоване серце
Клінічна картина й діагностика
Якщо будову серця і судин не порушено, воно в цілому функціонує нормально, порушення кровообігу не відбувається.
При пальпації серцевий поштовх розташовується в п̓ятому міжребер’ї праворуч по середньоключичній лінії. Аускультативно тони серця найкраще прослуховуються праворуч відповідно до загальноприйнятих аускультативних точок, симетрично зміщеним на праву половину грудної клітини.
На ЕКГ при ізольованій декстрокардії характерний позитивний зубець Р у I, aVL, aVF, V1–4- відведеннях. У грудних відведеннях вольтаж комплексів QRS прогресивно підвищується від V6R до V1–2 і далі знижується до V6, вказуючи на правобічне положення серця. При цьому потенціали ПШ у формі комплексів r або RS реєструють у відведеннях від V6R до V2–3, лівого — у вигляді q або qRS — у V3–6.
На ЕКГ при істинній декстрокардії характерний негативний зубець Р у I, aVL, V5–6- відведеннях, позитивний Р у II, III, V1- відведеннях, негативні комплекси QRS у I, aVR, підвищення їхнього вольтажу від V1 до V6R і зниження — від V1 до V6, негативні Т у I, aVL, V5–6. У I стандартному відведенні реєструють зубці, що мають протилежний зазвичай напрямок: II стандартне відведення відповідає нормальному III і, навпаки, III стандартне відведення — II, відведення aVL відбиває відведення aVR й, навпаки, aVR–aVL, відведення V1 рівноцінно V2R, V3–V3R, V4–V4R, V5–V5R, V6–V6R. Відведення aVF не змінюється. Якщо поміняти місцями електроди правої й лівої руки й накласти грудні електроди дзеркально до нормального серця, то ЕКГ можна аналізувати як при нормальному положенні серця.
Рентгенологічне дослідження виявляє тінь серця переважно в правій половині грудної клітки, верхівка серця орієнтована вправо.
Аномальне положення серця підтверджується при ехоКГ-обстеженні.
Лікування
Аномальне розташування серця саме по собі не супроводжується розладами гемодинаміки. Хірургічному лікуванню підлягають лише хворі із супутніми вадами серця.
АНОМАЛІЇ МІЖПЕРЕДСЕРДНОЇ ПЕРЕГОРОДКИ
Дефект міжпередсердної перегородки
Визначення
Дефект міжпередсердної перегородки — вроджена вада серця, при якій є сполучення між двома передсердями, що розвивається в результаті аномального розвитку первинної й вторинної міжпередсердних перегородок та ендокардіальних подушок.
Дефект міжпередсердної перегородки в сполученні зі стенозом лівого атріовентрикулярного отвору називається синдромом Лютамбаше.
Епідеміологія
Поширеність дефекту міжпередсердної перегородки становить 5–10% усіх вроджених вад, є найбільш частою вадою серця у дорослих (30%), у жінок відзначають частіше, ніж у чоловіків (2:1).
Патологічна анатомія
Існує кілька морфологічних типів дефекту міжпередсердної перегородки. Найбільш частий варіант — високий дефект міжпередсердної перегородки типу ostium secundum (75% випадків), що виникає внаслідок порушення розвитку вторинної перегородки, локалізується в центральній частині міжпередсердної перегородки в ділянці овальної ямки (рис. 3.3).

Рис. 3.3. Анатомічні варіанти дефекту міжпередсердної перегородки
Дефект типу ostium primum (15%) являє собою варіант дефекту ендокарда, виникає внаслідок неповного розвитку первинної перегородки, розташовується в нижньому відділі перегородки безпосередньо над рівнем передсердно-шлуночкових отворів, поєднується з розщепленням стулок мітрального й рідше тристулкового клапанів.
Поєднання порушення розвитку перегородок передсердя з неправильним розташуванням венозного синуса призводить до утворення складних дефектів.
Дефекти венозного синуса (10%) частіше відзначають високо в міжпередсердній перегородці поблизу від впадання верхньої порожнистої вени, пов’язані з атиповим впаданням легеневих вен у праве передсердя або верхню порожнисту вену. Набагато рідше дефекти венозного синуса можуть локалізуватися в нижній частині перегородки над устям нижньої порожнистої вени.
У деяких випадках відзначають загальне передсердя — відсутність більшої частини міжпередсердної перегородки або наявність тільки рудиментарних її елементів, часто поєднується з розщепленням атріовентрикулярних клапанів.
Відкритий овальний отвір, що не закривається в 20% дорослих, не слід розглядати як різновид дефекту міжпередсердної перегородки, оскільки при істинному дефекті є недостатність тканини, а при відкритому овальному вікні сполучення здійснюється за рахунок клапана, що відкривається при особливих обставинах.
Синдром Лютамбаше морфологічно характеризується наявністю дефекту міжпередсердної перегородки (частіше вторинного) і звуженням лівого атріовентрикулярного отвору (вродженого або набутого). Характерним є розширення ЛА, що іноді вдвічі перевищує розмір аорти.
Порушення гемодинаміки
Наявність дефекту міжпередсердної перегородки призводить до скидання артеріальної крові з лівого передсердя в праве внаслідок наявності градієнта тиску між ними. У результаті виникає перевантаження об’ємом правої половини серця, дилатація ПШ і збільшення ОЦК у малому колі. При більших дефектах це може призводити до легеневої гіпертензії, однак виражена гіпертензія в малому колі в перші 20 років виникає у близько 2% хворих.
Основну роль у компенсації порушення кровообігу грає ПШ, робота якого збільшується в кілька разів. Недостатність ПШ розвивається після 10 років існування вади, у більш старшому віці приєднується недостатність ЛШ. Остання, викликаючи зменшення його піддатливості, може призводити до збільшення обсягу шунта зліва направо.
При синдромі Лютамбаше величина шунта збільшується пропорційно зростанню стенозуючого дефекту мітрального отвору, крім цього відбувається порушення відтоку крові з малого кола та виникнення легеневої гіпертензії.
Клінічна картина
Клінічні прояви вади залежать від ступеня порушення гемодинаміки та змінюються з віком. При відносно невеликому дефекті в молодому віці хворі можуть не мати скарг і ваду виявляють при випадковому обстеженні. Скарги на задишку та напади серцебиття при фізичному навантаженні виникають у віці старше 40 років, потім наростають слабкість і стомлюваність, з’являються різні аритмії, СН, що зумовлена вираженою легеневою гіпертензією.
При більших дефектах міжпередсердної перегородки задишка є одним із симптомів захворювання вже у молодому віці. У хворих часто виникають напади серцебиття.
При перкусії відзначають розширення границь серця переважно вправо, а при більших дефектах — вліво. В окремих випадках описано наявність серцевого горба (за рахунок збільшення правих відділів серця), а також систолічне тремтіння з лівого краю грудини.
Характерна аускультативна картина: над ЛА ліворуч біля грудини вислуховується систолічний шум помірної інтенсивності, що виникає внаслідок збільшеного кровотоку через клапан ЛА. Другий тон над ЛА посилений та роздвоєний. Рідше визначають діастолічний шум над нижньою частиною грудини, пов’язаний із відносним стенозом отвору тристулкового клапана при збільшеній кількості крові, що проходить через нього. Після того як збільшений легеневий судинний опір призводить до зниження величини скидання крові зліва направо, інтенсивність шумів знижується, з’являється діастолічний шум, викликаний недостатністю клапана ЛА.
Діагностика
На ЕКГ електрична вісь серця у хворих із вторинним дефектом відхилена вправо, з первинним — вліво. При кожному з дефектів виявляють різний ступінь перевантаження і гіпертрофії ПШ і правого передсердя, вираженість якої залежить від величини тиску в легеневому стовбурі. Виявляють ознаки часткової блокади правої ніжки пучка Гіса (феномен rSR՛՛ або rsR՛ у правих грудних відведеннях), можуть визначати передсердну екстрасистолічну аритмію, пароксизмальну суправентрикулярну тахікардію. У хворих із синдромом Лютамбаше нерідко виявляють фібриляцію передсердь.
На рентгенограмі серце збільшене в поперечнику, в косих проекціях визначається збільшення правих відділів серця. Дуга ЛА вибухає, дуга аорти зменшена, посилений судинний малюнок легень, корені легень розширені, характерна їхня пульсація.
Діагноз встановлюють методом трансторакальної та допплєрівської ехоКГ, за допомогою якої можна встановити локалізацію, розмір дефекту (добре візуалізується оstium secundum та primum), а також напрямок скидання крові. При ехоКГ-обстеженні виявляють наступні ознаки:
- збільшення порожнини правого передсердя й ПШ;
- парадоксальний рух міжшлуночкової перегородки;
- гіпердинамічний рух стінок лівого передсердя;
- ознаки легеневої гіпертензії;
- ознаки розщеплення мітрального та тристулкового клапанів з проявами їхньої недостатності при первинному дефекті (рис. 3.4);
- пролапс мітрального клапана при вторинному дефекті;
- стеноз мітрального отвору при синдромі Лютамбаше;
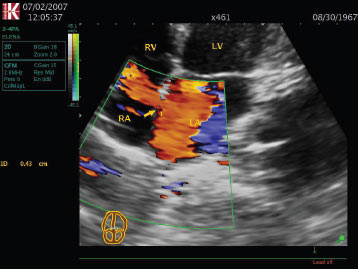
- шунтування крові між передсердями зліва направо або cправа наліво (рис. 3.5а, б).
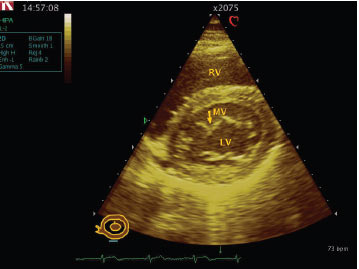
Рис. 3.4. Розщеплення передньої стулки мітрального клапана. В-режим, парастернальна позиція, коротка вісь

а
б
Рис. 3.5. Дефект міжпередсердної перегородки. В-режим: а) субкостальна позиція, довга вісь; б) апкальна чотирикамерна позиція, шунт зліва направо (ліве передсердя — праве передсердя)
Дефекти венозного синуса вимагають додаткових діагностичних підходів — черезстравохідне ехоКГ забезпечує найкращу візуалізацію міжпередсердної перегородки, легеневих вен, особливо в дорослих пацієнтів з недостатніми «акустичними вікнами».
Катетеризації порожнин серця зазвичай не потрібно, крім випадків супутньої легеневої гіпертензії або коли неінвазивне дослідження неповноцінне. Наявність дефекту міжпередсердної перегородки підтверджується проведенням катетера із правого передсердя через перегородку в ліве й підвищенням насичення крові киснем у порожнині правого передсердя порівняно із пробами крові, взятої біля устя порожнистих вен. Різниця в 2 об. % і більше (або 8–10%) розглядається як абсолютна ознака шунтування крові.
Коронароангіографію звичайно проводять пацієнтам у віці старше 40 років перед планованою хірургічною корекцією вади.
Дефект міжпередсердної перегородки також може бути діагностовано за допомогою КТ (рис. 3.6) або МРТ, що є методом вибору для оцінки позасерцевої анатомії, у тому числі великих судин, гілок ЛА, а також системних та легеневих венозних з’єднань.

Рис. 3.6. Дефект міжпередсердної перегородки. Мультиспіральна КТ, апікальний зріз
Лікування
Хірургічне закриття дефекту рекомендоване, якщо співвідношення легеневого до системного кровотоку більш ніж 1,5:1 і відношення легеневого до системного судинного опору менше 0,7. Немає єдиної думки щодо хірургічного лікування асимптомних хворих у віці 25–40 років, однак воно виправдано для попередження прогресування симптомів. Унаслідок можливості збільшення скидання крові зліва направо, появи фібриляції передсердь і розвитку легеневої гіпертензії з віком бажане виконання хірургічної корекції вади до появи ознак погіршення функції серця. У симптомних хворих у віці старше 40 років хірургічне закриття дефекту поліпшує толерантність до фізичного навантаження й виживаність порівняно з медикаментозною терапією та запобігає подальшому погіршенню функціонального стану, хоча не знижує ризик розвитку суправентрикулярної аритмії, СН і цереброваскулярних подій. Хірургічне втручання в 80% хворих віком старше 60 років зі значним скиданням крові приводить до поліпшення симптомів. У 70% хворих старшого віку після операції зберігаються порушення ритму, в 10–25% вони виникають уперше, підвищується ризик системної АГ невідомої етіології.
Показання до хірургічного лікування:
- неефективна медикаментозна терапія СН;
- значне артеріовенозне скидання;
- відставання у фізичному розвитку;
- підвищення тиску в малому колі кровообігу.
Протипоказання до оперативного втручання:
- Веноартеріальне (справа наліво) скидання, оскільки це ознака вираженої гіпертензії й часто незворотніх змін у малому колі кровообігу.
- Виражена лівошлуночкова недостатність.
Хірургічне лікування полягає в ушиванні або пластиці латкою дефекту міжпередсердної перегородки. Незначні дефекти зашивають, більші закривають гомотрансплантатами або протезами з пластмасової губки. При первинному дефекті зі значною мітральною недостатністю додатково ушивають розщеплену стулку або проводять протезування мітрального клапана. У результаті хірургічного лікування поліпшується стан хворого: зменшуються задишка, серцебиття, розміри серця.
В останні роки зростає роль пристроїв для закриття дефекту (вперше застосовані в 1976 р.), вибір типу пристрою залежить від локалізації дефекту. На сьогодні немає порівняльних досліджень щодо впровадження пристроїв і хірургічних методів операції, не існує консенсусу відносно тривалого спостереження після установки пристроїв і довгострокові результати невідомі, включаючи ризик розвитку передсердної аритмії, СН та інсульту; передбачається, що їх результати будуть порівняними.
При синдромі Лютамбаше хірургічне лікування полягає в одномоментній корекції — усуненні дефекту міжпередсердної перегородки та мітральної комісуротомії. Протипоказаннями до операції є лише тяжка стадія легеневої гіпертензії та різко виражена дистрофія міокарда, що зумовлює термінальну стадію СН.
Медикаментозна терапія включає симптоматичні засоби: антиаритмічні препарати при фібриляції передсердь і пароксизмальній суправентрикулярній тахікардії, лікування СН.
Прогноз
Вторинний дефект має сприятливий природний перебіг у перші 20–30 років життя. Причиною смерті при відсутності оперативної корекції є правошлуночкова СН, рідше — тромбоз ЛА, аритмія. При первинному дефекті перебіг менш сприятливий, прогноз гірше, раніше виникають клінічна симптоматика та ускладнення, основним обтяжувальним чинником є легенева гіпертензія.
АНОМАЛІЇ МІЖШЛУНОЧКОВОЇ ПЕРЕГОРОДКИ
Дефект міжшлуночкової перегородки
Визначення
Дефект міжшлуночкової перегородки — вроджена вада серця, при якій є патологічне сполучення між ПШ та ЛШ серця.
Епідеміологія
Виявляється в 25–30% випадків усіх вроджених вад серця, однаково часто в чоловіків і жінок.
Патологічна анатомія
Дефекти можуть розташовуватися вище або нижче надшлуночкового гребеня, в мембранозній або м’язовій частині міжшлуночкової перегородки, найбільш часті перимембранозні дефекти (75–80%). М’язові дефекти або дефекти трабекулярної перегородки відзначають у 20% усіх дефектів міжшлуночкової перегородки.
Приблизно половина дефектів невеликого розміру, але вони можуть варіювати від 1 до 30 мм і більше, мати різну форму: круглу, еліпсовидну, з м’якими або фіброзно зміненими краями. При ваді також виявляють гіпертрофію міокарда і дилатацію порожнин обох шлуночків, передсердь, розширення стовбура ЛА, іноді значне.
Порушення гемодинаміки
Функціональні розлади залежать насамперед від розмірів отвору та від стану легеневого судинного русла. При невеликих дефектах (до 10 мм) виникає значний градієнт тиску в ПШ і ЛШ, а в систолу відбувається незначне артеріовенозне скидання крові через дефект. Через низький опір крові в малому колі кровообігу тиск у ПШ і ЛА або незначно підвищується, або залишається нормальним. У діастолу в результаті підвищення кінцевого діастолічного тиску в ПШ частина крові з його порожнини може повертатися в ліві відділи, викликаючи об’ємне перевантаження лівого передсердя, а особливо ЛШ.
Помірні або великі дефекти викликають застій в легенях та перевантаження об’ємом ЛШ, що може призводити до виникнення легеневої гіпертензії.
Великі дефекти міжшлуночкової перегородки не створюють перешкоди скиданню крові зліва направо, обидва шлуночка функціонують як єдина насосна камера з двома виходами, призводячи до вирівнювання тиску в системному і легеневому колі кровообігу. Величина скидання крові зворотньо пропорційна відношенню легеневого та системного судинного опору. Якщо загальнолегеневий опір нормальний або підвищений, але становить менше половини від опору у великому колі кровообігу, відбувається велике скидання крові, легеневий кровотік у 2 рази і більше перевищує системний, відзначаються значне підвищення тиску в малому колі кровообігу, об’ємні та систолічні перевантаження ЛШ і ПШ, що зумовлює розвиток вираженої декомпенсації кровообігу. У цих хворих дуже рано відзначають розвиток структурних змін у легенях, а також вторинної легеневої гіпертензії. Якщо загальнолегеневий опір становить половину та більше ЗПСО, то обсяг скидання зменшується.
Клінічна картина
Клінічна картина залежить від віку хворого, розмірів дефекту, величини судинного опору легень. При невеликих дефектах клінічні прояви вади відсутні, задишка при фізичному напруженні найчастіше є першим проявом декомпенсації.
При дефектах більших розмірів (діаметром >10 мм або більше половини діаметра устя аорти) хворі скаржаться на задишку по типу тахіпное за участю допоміжних м’язів, відчуття серцебиття, біль в ділянці серця, стійкий кашель, що підсилюється при зміні положення тіла.
При пальпації грудної клітки часто визначають систолічне тремтіння в четвертому міжребер’ї ліворуч та в ділянці мечоподібного відростка.
Основною клінічною ознакою вади є характерний гучний, пов’язаний з I тоном, голосистолічний шум Роже, який вислуховується у третьому–четвертому міжребер’ї ліворуч від грудини, та проводиться до верхівки серця.
Діагностика
При невеликих дефектах ЕКГ у межах фізіологічної норми. При більших дефектах виявляють неспецифічні ознаки комбінованої гіпертрофії обох шлуночків та передсердь, зміни ST–T, фібриляцію передсердь, порушення внутрішньошлуночкової провідності.
На рентгенограмі при невеликих дефектах серце нормальних розмірів, при більших — кардіомегалія, посилення легеневого малюнка за рахунок переповнення артеріального русла. При вираженій легеневій гіпертензії посилені прикореневі зони, а судинний малюнок периферичних відділів легень виглядає «збідненим». Дуга легеневого стовбура вибухає по лівому контуру, при рентгеноскопії відзначають посилення її пульсації.
ЕхоКГ-обстеження з колірним допплєрівським картуванням дозволяє верифікувати діагноз — безпосередньо визначити розміри й розташування дефекту, наявність і напрямок скидання крові. Градієнт тиску між ЛШ і ПШ можна оцінити за допомогою постійнохвильової допплєрографії. При ехоКГ-обстеженні можна виявити:
- збільшення розмірів усіх камер серця;
- гіперкінез стінок ЛШ;
- візуалізуючий дефект міжшлуночкової перегородки (>10 мм);
- турбулентний потік через перегородку зліва направо (рис. 3.7).
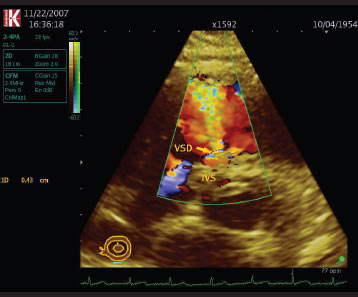
Рис. 3.7. Дефект міжшлуночкової перегородки. В-режим, апікальна чотирикамерна позиція
При катетеризації правих відділів серця відзначають значне підвищення тиску в ПШ та ЛА, а також підвищення насичення крові киснем, що починається на рівні ПШ і збільшується в легеневому стовбурі.
Селективну ангіокардіографію зазвичай проводять у пацієнтів віком старше 40 років при планованому хірургічному втручанні, метод дозволяє визначати локалізацію дефекту, його розміри, а також виключити супутню патологію.
Лікування
Хворим із симптомами СН призначають медикаментозну терапію для стабілізації стану перед проведенням хірургічної корекції.
Абсолютними показаннями до операції є критичний стан або СН, що не піддається консервативній терапії, а також підозра на необоротні зміни, що розвиваються в судинах легень.
Відносними показаннями для хірургічного втручання є великий дефект з ознаками значного скидання крові, часті респіраторні захворювання, відставання у фізичному розвитку.
Хірургічне лікування протипоказане, якщо систолічний тиск у ЛА дорівнює системному й артеріовенозне скидання крові становить менше 40% хвилинного обсягу малого кола кровообігу і є шунт справа наліво.
Прогноз
Спонтанне закриття дефекту відбувається у 15–60% випадків. Потрібне диспансерне спостереження хворих через можливість виникнення надалі різних ускладнень (ураження провідної системи серця, недостатність тристулкового клапана, фібриляція передсердь). У цілому 25-річна виживаність для всіх пацієнтів становить 87%, смертність підвищується з розміром дефекту.
У неоперованих хворих з ізольованим невеликим дефектом і нормальним тиском у ПШ прогноз сприятливий, хоча в них зберігається високий ризик розвитку інфекційного ендокардиту. При помірних і більших дефектах високий ризик розвитку різних ускладнень, включаючи інфекційний ендокардит, аортальну недостатність, порушення ритму й провідності, дисфункцію ЛШ, раптову смерть.
Комплекс Ейзенменгера
Визначення
Комплекс Ейзенменгера — високий дефект міжшлуночкової перегородки, зсув аорти вправо та відходження її одночасно від обох шлуночків серця («сидяча верхи аорта»), розширення ЛА.
Епідеміологія
Поширеність вади становить 4% серед вроджених вад серця у дорослих і визначається в 10% хворих з дефектами міжшлуночкової перегородки.
Порушення гемодинаміки
При цій ваді відбувається скидання крові з ЛШ у правий (через дефект міжшлуночкової перегородки) і викид крові із ПШ одночасно в аорту та ЛА. Патологічні зміни в легеневому судинному басейні корелюють зі станом гемодинаміки і можуть бути розділені по ступеню тяжкості. Перший ступінь характеризується збільшенням легеневого кровотоку з нормальним середнім тиском у ЛА. Другий ступінь характеризується збільшенням середнього тиску в ЛА, помірну гіпертрофію виявляють у проксимальних судинах як результат гіпертрофії та проліферації гладких м’язів, а також збільшення елементів сполучної тканини. Третій ступінь характеризується підвищенням легеневого судинного опору, що корелює зі зменшеною кількістю дистальних легеневих судин.
Клінічна картина
Клінічна картина багато в чому подібна з дефектом міжшлуночкової перегородки, однак більш чітко проявляються порушення гемодинаміки. Найбільш частими клінічними симптомами є синюшність шкірних покривів внаслідок змішування артеріальної й венозної крові, задишка, серцебиття при фізичному навантаженні, кровохаркання.
Аускультативно ліворуч біля грудини в місці прикріплення III–IV ребра, а також у проекції аорти вислуховується грубий систолічний шум. Діастолічний шум зумовлений аортальною недостатністю.
Діагностика
На ЕКГ нерідко відзначають ознаки внутрішньошлуночкової блокади, гіпертрофії ПШ, фібриляцію та тріпотіння передсердь. При холтерівському моніторингу ЕКГ в 36% хворих виявляють суправентрикулярну аритмію, що є провісником клінічного погіршення та смерті.
ЕхоКГ та допплєрівська ехоКГ у режимі колірного картування та постійнохвильовому режимі дозволяють визначити наявність дефекту, напрямок скидання крові, підвищення тиску в ПШ і ЛА.
На рентгенограмі в передньозадній проекції різко виступає дуга ЛА. Судинний пучок посилений, корінь легень сильно пульсує («танець коренів»). Розміри серця збільшені за рахунок обох шлуночків.
При катетеризації серця відзначають підвищення тиску в ПШ і ЛА. Насичення венозної крові киснем може бути рівномірно знижене в правих відділах серця та ЛА або незначно підвищене в ПШ. При введенні контрастної речовини в порожнину ЛШ виявляють її перехід у порожнину ПШ у систолу та подальше одночасне надходження в аорту і ЛА.
Лікування
Медикаментозне лікування симптоматичне, включаючи лікування СН. Терапія не повинна зменшувати післянавантаження через збільшення скидання крові справа наліво. Варто призначати антигіпертензивні препарати, оскільки некоригована АГ може підвищувати ризик розвитку легеневих кровотеч. Зазвичай пацієнти добре переносять блокатори β- адренорецепторів.
Призначення антагоністів ендотеліну зменшує функціональний клас СН і поліпшує переносимість фізичних навантажень. Попередні результати рандомізованого плацебо-контрольованого дослідження BREATHE-5 свідчать, що бозентан у пацієнтів з комплексом Ейзенменгера, крім поліпшення переносимості фізичних навантажень, знижує легеневий судинний опір без погіршення насичення киснем крові.
На відміну від первинної легеневої гіпертензії, де доведена ефективність антикоагулянтів для запобігання тромбозу ЛА, немає аргументів для їхнього застосування в хворих з комплексом Ейзенменгера і їх не слід призначати через підвищений ризик виникнення кровотеч. Антикоагулянти показані при наявності фібриляції та тріпотінні передсердь, рецидивуючих тромбоемболіях, механічних протезах клапанів.
Необхідно виключити потенційно нефротоксичні препарати (включаючи НПЗП).
Хірургічне лікування — операція накладення анастомозу – протипоказано, оскільки підвищений тиск у системі ЛА зробило б неможливим правильне функціонування штучної протоки. Немає єдиної думки про роль трансплантації серця у цих хворих.
Прогноз
Пацієнти можуть доживати до середнього віку. До ускладнень комплексу Ейзенменгера відносять легеневі кровотечі й емболії, зумовлені аневризматичними розширеннями ЛА в їх дрібніших відгалуженнях.
ІЗОЛЬОВАНИЙ СТЕНОЗ ЛЕГЕНЕВОЇ АРТЕРІЇ
Визначення
Ізольований стеноз ЛА характеризується наявністю перешкоди на шляху надходження крові на рівні клапана легеневого стовбура.
Епідеміологія
Досить розповсюджений (9% усіх уроджених вад серця).
Патологічна анатомія
Морфологічно вада неоднорідна, обструкція викиду крові з ПШ може локалізуватися на надклапанному, клапанному та/або підклапанному рівнях, виділяють декілька її форм:
- клапанний стеноз ЛА — найбільш часта форма, вада утворюється в результаті зрощення стулок по комісурам, і клапан отримує вид діафрагми з отвором округлої або злегка овальної форми діаметром від 1 до 10 мм і більше (рис. 3.8);
- інфундибулярний (підклапанний) стеноз утворюється за рахунок фіброзно-м’язової смуги у місця з’єднання порожнини ПШ та артеріального конуса або за рахунок гіпертрофованих м’язів, що формують звужений вихід з ПШ та розташовуються під клапанами ЛА або нижче у вивідному тракті;
- найрідша форма — звуження просвіту ЛА, зумовлене нерівномірним розподілом артеріального стовбура.
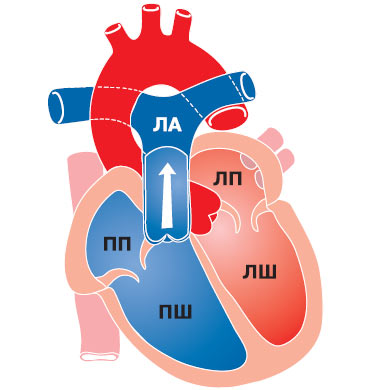
Рис. 3.8. Клапанний стеноз ЛА
Морфологічно визначають концентричну гіпертрофію м’язів вихідного відділу, ендокард товщає і у вихідному відділі нерідко відзначають формування вираженого фіброзу. У стінці ЛА відбуваються дегенеративні зміни, вона стає тоншою, виникає характерне постстенотичне розширення ЛА, що нерідко поширюється на ліву гілку. Тристулковий клапан часто має ознаки дисплазії.
Порушення гемодинаміки
Перешкода відтоку крові створює перевантаження ПШ, систолічний тиск у ньому значно зростає (до 200 мм рт. ст. і більше), у результаті чого утворюється систолічний градієнт тиску між ПШ і ЛА, виникає гіпертрофія ПШ. Систолічний тиск у ЛА в більшості випадків у межах норми або незначно знижений. При розвитку гіпертрофії міокарда зростає діастолічний тиск у ПШ, що призводить до підвищення тиску в правому передсерді, його гіпертрофії та дилатації. Ступінь стенозу з віком підвищується, оскільки змінений потік крові через звужений отвір збільшує клапанну деформацію.
Клінічна картина
Клінічні ознаки цілком залежать від ступеня стенозу, часто виявляють фізичну недорозвиненість. Скарги на виражену задишку, особливо після фізичного напруження в зв’язку з недостатньою артеріалізацією легень, біль в серці, перебої в роботі серця, запаморочення, непритомність.
При огляді виявляють наявність серцевого горба, посилення серцевого поштовху, систолічне тремтіння передньої частини грудної стінки в другому–третьому міжребер’ї ліворуч від грудини, перкуторно розширення границь серця вправо.
Аускультативно визначається інтенсивний грубий систолічний шум над ЛА, що добре проводиться до верхньої частини лівої половини грудної клітки та на ділянку спини, підсилюється на вдиху, II тон над ЛА при клапанному та підклапанному (інфундибулярному) стенозі ослаблений або відсутній, при надклапанному стенозі може бути посилений.
Діагностика
На ЕКГ електрична вісь відхилена вправо, часто визначають ознаки гіпертрофії та перевантаження ПШ і правого передсердя, які корелюють зі ступенем стенозу. Зсув сегмента SТ униз і негативний зубець Т у правих грудних відведеннях свідчать про крайній ступінь перевантаження.
На рентгенограмі в передньозадньому положенні виявляється розширення контуру ПШ. ЛА при підклапанному ураженні зменшена, при надклапанному звуженні — розширена з виступаючою дугою. Характерне розходження між пульсуючим основним стовбуром ЛА і нерухомими артеріями середнього калібру в ділянці коренів легень. Аорта часто буває недорозвинена, ЛШ невеликих розмірів, легені підвищеної прозорості внаслідок зниженого кровопостачання.
ЕхоКГ-обстеження дозволяє виявити ваду і деталізувати її анатомічну будову, хоча іноді можуть виникати ускладнення з візуалізацією клапана ЛА. Визначають потовщення стулок клапана з неповним відкриттям їх у систолу, зменшенням отвору через зрощення стулок по комісурам, а також гіпоплазію клапанного кільця. За допомогою допплєрівського дослідження виявляють турбулентний систолічний потік у легеневому стовбурі, можна розрахувати градієнт тиску в місці перешкоди між ПШ і стовбуром ЛА.
Катетеризація є верифікуючим методом діагностики в незрозумілих випадках: патогномонічною ознакою служить градієнт САТ між ПШ та ЛА. Тиск у порожнинах серця характерно змінений: у ПШ підвищується до 100–200 мм рт. ст. і вище, у ЛА залишається нормальним або трохи зниженим, при вираженому стенозі це зниження значне (<8 мм рт. ст.). По характеру зміни тиску від ЛА до ПШ можна судити про локалізацію стенозу, що важливо для вибору тактики хірургічного лікування: при клапанному стенозі (сприятливому для операції) перепад тиску відбувається різко, у момент проходження клапана може реєструватися негативний тиск — ефект Вентури; при інфундибулярному (підклапанному) стенозі тиск змінюється більш поступово, в порожнині ЛШ тиск незмінений.
Лікування
Єдиним ефективним методом лікування є хірургічна корекція вади, показаннями до якої є виражена клінічна картина вади й наявність градієнта тиску між ПШ і ЛА >40 мм рт. ст.
Хірургічне лікування протипоказане при вираженій правошлуночковій недостатності.
Летальність після хірургічного усунення вади не перевищує 3%, однак різко підвищується при вираженій кардіомегалії, зумовленій гіпертрофією та дилатацією правих відділів серця. Віддалені результати лікування хороші і прямо залежать від віку хворого, якому зроблена операція, і початкової тяжкості стенозу.
Прогноз
Залежить від ступеня стенозу та вираженості клінічних проявів. При незначному стенозі ЛА пацієнти доживають до старості. При більш вираженому стенозі і прогресуванні захворювання може розвиватися недостатність ПШ, що є основною причиною раптової смерті в молодому віці. Частими ускладненнями вади є туберкульоз легень та інфекційний ендокардит.
ТЕТРАДА ФАЛЛО
Визначення
У комплекс тетради Фалло входять чотири аномалії: високий дефект міжшлуночкової перегородки, декстрапозиція аорти (одночасне відходження аорти від ПШ і ЛШ), стеноз або атрезія ЛА з обструкцією виносного тракту ПШ, гіпертрофія ПШ.
Епідеміологія
Тетрада Фалло відноситься до найпоширенішої «синьої» вади серця, частота її становить у старшому віці 12–14% усіх уроджених вад серця, трохи частіше в чоловіків.
У 15% хворих з тетрадою Фалло виявляють делецію хромосоми 22q11.
Патологічна анатомія
Основу вади становить недорозвиненість вихідного відділу ПШ і зміщення конусної перегородки вперед та вліво, що зумовлює стеноз вихідного відділу ПШ, як правило, з порушенням розвитку фіброзного кільця легеневого стовбура, клапанного апарата та дуже часто стовбура і гілок (рис. 3.9). Нерідко відзначають двостулковий клапан ЛА.
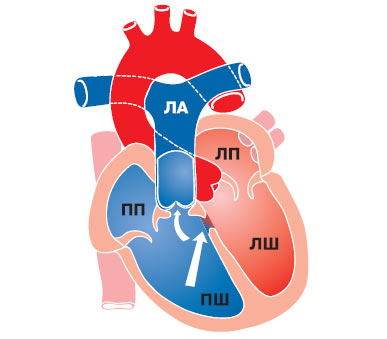
Рис. 3.9. Тетрада Фалло
Характерний розвиток колатерального кровообігу в судинах малого кола кровообігу, зміни в судинах легень, які піддаються значній перебудові: деякі судини склерозуються, облітеруються, у просвіті іноді утворюються багатостовбурові судини.
Порушення гемодинаміки
Звуження ЛА приводить до перевантаження ПШ тиском, крім того, збільшення повернення крові до ПШ викликає одночасно і перевантаження об’ємом. Скидання крові з ЛШ в ПШ не має великого значення внаслідок значного підвищення тиску в ПШ, тому градієнт тиску між шлуночками виявляється незначним.
У випадках помірного стенозу ЛА, коли опір викиду крові в легені нижче, ніж в аорту, скидання крові через дефект міжшлуночкової перегородки відбувається зліва направо і легеневий кровотік виявляється збільшеним, що клінічно проявляється так званою блідою (аціанотичною) формою тетради Фалло. При збільшення вираженості стенозу виникає перехресне, а потім стабільне скидання крові справа наліво (веноартеріальне), що клінічно позначається переходом у ціанотичну («синю») форму вади.
Клінічна картина
Клінічні прояви залежать від ступеня звуження вихідного відділу ПШ і ЛА та ступеня гіпоксемії. Уже з раннього дитинства у хворих відзначають дифузійний ціаноз (в аорту одночасно надходить кров з ПШ і ЛШ, відбувається змішування артеріальної й венозної крові, що викликає синюшність шкірних покривів), поліцитемію та згущення крові. Можуть виникати часті легеневі кровотечі.
Найбільш характерним симптомом є напади задишки з появою ціанозу, які виникають внаслідок спазму м’язів у вихідному відділі ПШ, у результаті чого кров з нього надходить в аорту, при цьому збільшується кисневе голодування та може наступити втрата свідомості (гіпоксична кома). Напад починається раптово, з посилення задишки, ціанозу, можливі апное, судоми з наступною появою геміпарезу, може закінчитися летально.
Хворі не в змозі переносити фізичне навантаження, оскільки при навантаженні збільшується скидання венозної крові, підсилюється гіпоксемія, що веде до збільшення гіпоксії тканин. Типова задишка при невеликому навантаженні, різка слабкість після навантаження, запаморочення, тахікардія, посилення ціанозу.
Найбільш частими клінічними симптомами є:
- зміна форми нігтів («годинникове скло»);
- деформація пальців у вигляді барабанних паличок (як реакція на тривалу гіпоксемію);
- відставання у фізичному розвитку;
- діти віддають перевагу положенню «навпочіпках», при якому створюються особливо сприятливі умови для кровообігу в легенях (зменшується обсяг венозного скидання крові в аорту);
- судомний синдром внаслідок гіпоксії мозку;
- видимі слизові оболонки та шкірні покриви ціанотичні;
- АТ зазвичай знижений;
- систолічне тремтіння в другому–третьому міжребер’ї, викликане стенозом устя ЛА.
При аускультації характерними ознаками є ослаблення II тону над ЛА, грубий «сухий» систолічний шум у другому–третьому міжребер’ї ліворуч біля грудини.
Діагностика
На ЕКГ виявляють значне відхилення електричної осі вправо, ознаки вираженої гіпертрофії ПШ і правого передсердя, може реєструватися порушення провідності по правій ніжці пучка Гіса.
На рентгенограмі в передньозадній проекції в більшості випадків відзначається нерізке випинання нижньої частини правого контуру за рахунок гіпертрофії ПШ. Аорта частіше зміщена вправо, стравохід відхилений вліво. Легеневі поля підвищеної прозорості, у більш пізніх стадіях може бути посилення малюнка коренів легень внаслідок розвинених колатералей.
При ехоКГ-обстеженні добре виявляються всі ознаки вади, можливе безпосереднє визначення величини зсуву аорти, дефекту міжшлуночкової перегородки, ступеня легеневого стенозу і гіпертрофії ПШ. Найбільш характерними ехоКГ-ознаками є:
- розрив між міжшлуночковою перегородкою та передньою стінкою аорти;
- локалізація аорти над міжшлуночковою перегородкою;
- розширення устя аорти;
- гіпертрофія ПШ;
- клапанний і субклапанний стеноз ЛА;
- гіпоплазія кільця клапана ЛА, легеневого стовбура та проксимальних відділів ЛА;
- закидування контрастної речовини з ПШ у вихідний відділ ЛШ та аорту;
- при допплєрівському дослідженні турбулентний систолічний потік у ПШ (шунт зліва направо), можливий турбулентний потік у вихідний відділ ЛШ (шунт справа наліво);
- додатковий турбулентний діастолічний потік у випадку функціонуючого аортолегеневого анастомозу в легеневому стовбурі;
- наявність градієнта тиску між ПШ і ЛА.
Катетеризація порожнин серця і ангіокардіографія — найбільш інформативні методи діагностики тетради Фалло. При катетеризації порожнин виявляють значне підвищення тиску в ПШ, рівне системному градієнту тиску між ПШ і ЛА. Характерною гемодинамічною ознакою вади є однаковий систолічний тиск у ПШ та аорті, куди нерідко вдається провести катетер через дефект міжшлуночкової перегородки. Тиск у правому передсерді частіше нормальний, у ЛА помірно знижений. При введенні контрастної речовини в порожнину ПШ відзначається одночасне його надходження в ЛА і аорту. Визначається також дефект наповнення інфундибулярної частини ПШ або клапана ЛА, що дозволяє визначити ступінь її стенозу.
Лікування
Консервативна терапія неефективна. Хірургічне лікування показане всім хворим із тетрадою Фалло і може бути радикальним або паліативним. Радикальна корекція вади включає усунення легеневого стенозу та закриття дефекту міжшлуночкової перегородки в умовах штучного кровообігу. При тяжких формах ціанотичні напади, високий рівень гемоглобіну (>200 г/л), стан хворого, який швидко погіршується, можуть бути показанням до проведення паліативної операції — накладання аортолегеневих анастомозів з метою збільшення легеневого кровотоку та зменшення гіпоксії. Ці операції дозволяють пацієнтам дожити до 5–6-літнього віку, коли можливе проведення радикальної корекції вади з меншим ступенем ризику.
Прогноз
Віддалені результати радикального хірургічного лікування неускладнених форм тетради Фалло, як правило, хороші. Погіршення стану у віддалений термін може бути зумовлене в тій чи іншій мірі стенозом ЛА, що залишився, легеневою недостатністю, реканалізацією міжшлуночкової перегородки, порушеннями ритму серця. Останні звичайно зумовлені травмуванням провідних шляхів під час оперативного втручання, залишковим високим тиском у ПШ, вираженою кардіомегалією через реканалізацію міжшлуночкової перегородки або розвиток аневризми ПШ. Саме аритмія є причиною раптової смерті хворих у різний термін після оперативної корекції вади.
ВІДКРИТА АРТЕРІАЛЬНА ПРОТОКА
Визначення
Відкрита артеріальна протока (ductus arteriosus, боталова протока) — незарощення артеріальної протоки плода, що з’єднує аорту й ЛА.
Епідеміологія
Відзначають у 5–10% уроджених вад серця. У жінок ваду виявляють частіше, ніж у чоловіків (3:1).
Патологічна анатомія
Залежно від форми протоки існують різні анатомічні його типи: циліндричний, воронкоподібний, вікончатий, аневризматичний. При тривалому існуванні протоки виникає її кальциноз, що захоплює і аорту. Стовбур і розгалуження ЛА розширені. У дрібних ЛА та артеріолах по мірі розвитку легеневої гіпертензії відбуваються характерні морфологічні зміни — м’язово-фіброзне переродження стінок і зменшення їх просвіту.
Порушення гемодинаміки
При незарощенні артеріальної протоки внаслідок різниці тиску між аортою та ЛА відбувається скидання оксигенованої крові в ЛА й далі в легені, потім через судини малого кола кровообігу вона повертається назад у ліву половину серця і аорту, тобто збільшується кровотік у малому колі кровообігу та гіпертензія в системі ЛА, кровонаповнення лівого передсердя і ЛШ збільшене. При малих розмірах протоки обсяг шунта невеликий і тиск в ЛА залишається нормальним. При великому діаметрі протоки значна кількість крові надходить у ЛА, потім у ліві відділи, викликаючи їхнє об’ємне перевантаження. Тиск в аорті передається безпосередньо через протоку в ЛА, що зумовлює ранній розвиток легеневої гіпертензії, при цьому ступінь останньої може бути досить високою.
Клінічна картина
Клінічна симптоматика і перебіг захворювання варіюють залежно від ступеня порушення гемодинаміки. При невеликих і середніх розмірах протоки перебіг вади довгостроково може бути безсимптомним і ваду виявляють випадково. У більшості випадків протягом тривалого часу хворі не пред’являють скарг; у фазі декомпенсації на перший план виступають задишка та серцебиття. Зазвичай відзначається блідість шкірних покривів. Ціаноз, що з’являється, не є прямим наслідком вади, а виникає тільки при значному підвищенні тиску в ЛА, зумовленому застоєм в легенях. Пізньому ціанозу, як правило, передує ціаноз при навантаженні (збільшення споживання кисню периферичними тканинами). При більшій вираженості шунтів у хворих виявляють відставання у фізичному розвитку, швидку стомлюваність, задишку та серцебиття при фізичному навантаженні.
САТ нормальний або незначно підвищений, ДАТ — різко знижений і при фізичному навантаженні може знижуватися до нуля, що зумовлює типовий високий пульсовий тиск.
При пальпації визначається посилення верхівкового поштовху, парастернальний серцевий горб, збільшення печінки й селезінки.
Важливою діагностичною ознакою є шум над ЛА — грубий протяжливий систолодіастолічний «машинний шум», «шум поїзда в тунелі», що супроводжується систолодіастолічним або систолічним тремтінням («котяче муркотання») у проекції основи серця. Із розвитком легеневої гіпертензії діастолічний компонент шуму зменшується, а потім зовсім зникає. При вирівнюванні тиску у великому й малому колі кровообігу, коли тиск крові в ЛА стає вищим, ніж в аорті, напрямок кровотока через шунт змінюється і вада стає практично «афонічною».
Діагностика
На ЕКГ при вираженій ваді виявляється відхилення електричної осі вправо (при вираженій легеневій гіпертензії) або вліво, ознаки гіпертрофії обох шлуночків, іноді реєструється неповна блокада лівої ніжки пучка Гіса, передсердні аритмії.
При рентгенологічному дослідженні відзначається посилення судинного малюнка, що відповідає величині артеріовенозного скидання крові, розширення або вибухання стовбура ЛА зі збільшенням діаметра часткових та сегментарних судин легень (кардіоторакальний індекс становить 55–60%) за рахунок спочатку лівого, а потім обох шлуночків і лівого передсердя. З віком відзначається розширення висхідної частини аорти. При відсутності легеневої гіпертензії зміни на рентгенограмі можуть бути відсутні.
На ехоКГ специфічних ознак немає, однак характерне збільшення порожнини ЛШ і зміна відношення розміру лівого передсердя до діаметра аорти (1:2 і більше). Як прояв об’ємного перевантаження ЛШ є збільшення швидкості руху передньої стулки мітрального клапана в діастолу. При проведенні допплєрівського дослідження часто вдається візуалізувати протоку, визначити постійний потік крові з аорти в ЛА та виміряти градієнт тиску. При контрастній ехоКГ визначається закидання контрастної речовини з ЛА в аорту.
Діагноз може бути встановлений та/або підтверджений катетеризацією порожнин серця при наявності сатурації кисню на рівні ЛА і візуалізацією протоки при аортографії. При катетеризації правих відділів серця виявляється підвищення тиску в ПШ (близько 45 мм рт. ст.) і в ЛА (до 100 мм рт. ст). При введенні контрастної речовини в порожнину шлуночка визначають його подальше надходження не тільки в аорту, але й в систему ЛА. Найбільш достовірною ознакою є проведення катетера з ЛА в аорту, коли він описує своєрідну характерну криву. Під час видалення катетера реєструється крива аортального, потім легеневого тиску.
Лікування
Показання до хірургічного лікування залежать від розмірів протоки, ступеня легеневої гіпертензії та клінічної картини серцевої декомпенсації.
Віддалені результати хірургічної корекції вади показують, що своєчасне оперативне втручання дозволяє досягти повного видужання. У хворих із вираженою легеневою гіпертензією результат оперативного втручання залежить від вихідного стану й оборотності структурних і функціональних змін легеневих судин і міокарда. Найбільш частими ускладненнями після оперативного втручання є виникнення легеневої гіпертензії, дисфункції ЛШ, аритмії.
Найбільш складним є питання про оперативне втручання у хворих з високою легеневою гіпертензією, оскільки відомо, що в них протока часто склерозована, спроби її перев’язки можуть призвести до тяжкої кровотечі внаслідок розриву протоки, прорізування лігатури і т.д. Абсолютно протипоказане хірургічне лікування хворим зі скиданням крові справа наліво.
Прогноз
Відкрита артеріальна протока навіть невеликих розмірів веде до передчасної смерті, що зумовлено зниженням компенсаторних можливостей міокарда та судин малого кола кровообігу, приєднанням різних ускладнень (пневмонія, легенева гіпертензія, інфекційний ендокардит, СН, розрив аневризми та ін.) частіше у осіб віком старше 40 років. При великому діаметрі протоки розвивається типова картина з ціанозом і задишкою. При неускладненому перебігу середня тривалість життя — 50–60 років, хоча описані одиничні випадки, коли хворі доживали до 70–79 років (діаметр протоки у них не перевищував 3 мм).
КОАРКТАЦІЯ АОРТИ
Визначення
Коарктація аорти — вроджене сегментарне звуження аорти, що розташовується в ділянці її перешийка.
Епідеміологія
Є одним з найпоширеніших — до 15% усіх вроджених вад серця, у чоловіків виявляють в 2–2,5 раза частіше, ніж у жінок.
Патологічна анатомія
Коарктація частіше локалізується в ділянці дуги аорти дистально місця відхождення лівої підключичної артерії поблизу від артеріальної протоки або відповідної їй зв’язки.
По анатомічних особливостях виділяють три варіанти вади:
1) ізольована коарктація аорти;
2) коарктація в поєднанні з відкритою артеріальною протокою:
- постдуктальна (розташована нижче відгалуження відкритої артеріальної протоки) (рис. 3.10а);
- юкстадуктальна (протока відкривається на рівні звуження);
- предуктальна (артеріальна протока відходить нижче рівня коарктації) (рис. 3.10б, в);
3) коарктація аорти в поєднанні з іншими вродженими вадами серця (дефектом міжшлуночкової, міжпередсердної перегородки, стенозом аорти, аневризмою синуса Вальсальви, транспозицією магістральних судин).
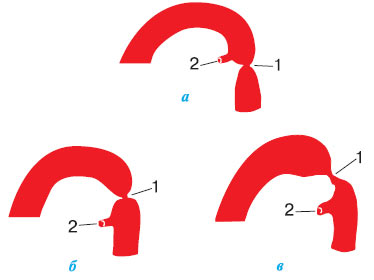
Рис. 3.10. Варіанти коарктації аорти: а) постдуктальна; б) предуктальна з локальним звуженням; в) предуктальна зі звуженням на протяжності. 1 — коарктація аорти; 2 — відкрита артеріальна протока
У стінці аорти в ділянці коарктації наростає склеротичний процес, що призводить до потовщення інтими, її значних змін. Дистально від коарктації стінка тоншає, просвіт аорти розширюється, іноді аневризматично (внаслідок впливу турбулентного потоку крові після проходу місця звуження). Характерні склеротичні зміни в судинах верхньої половини тіла, посилений розвиток колатералей, по яких кров переходить з верхньої частини аорти в постстенотичну її ділянку, дистрофічні зміни міокарда. Особливо значно розширені підключичні артерії, гілки пахвової артерії. ЛШ серця значно гіпертрофований, у тому числі його м’язовий і трабекулярний апарат, що може викликати звуження шляху відтоку.
Порушення гемодинаміки
Механічна перешкода на шляху кровотоку в аорті викликає перевантаження ЛШ і веде до розвитку двох режимів кровообігу: гіпертонічного (верхня половина тулуба) і гіпотонічного (черевна порожнина, нижні кінцівки). Проксимальніше місця звуження АТ підвищений, що супроводжується збільшенням ХОК і роботи ЛШ. Дистальніше перешкоди АТ (особливо пульсовий) знижений, кровопостачання частково, а іноді й повністю здійснюється за рахунок колатералей.
При постдуктальній коарктації кров з аорти під високим тиском скидається через відкриту артеріальну протоку в ЛА, при цьому може рано розвинутися легенева гіпертензія. При предуктальному варіанті напрямок скидання через артеріальну протоку буде визначатися різницею тисків між ЛА та низхідною аортою нижче місця коарктації, скидання може бути артеріовенозним і веноартеріальним. Останній пояснює диференційований ціаноз (є на ногах і відсутній на руках) як клінічну ознаку предуктальної коарктації.
Патогенез АГ при коарктації аорти складний і до кінця не з’ясований. Передбачається, що механічна обструкція, активація РААС на фоні недостатньої перфузії нирок та органічні зміни в судинній стінці призводять до збільшення ЗПСО.
Клінічна картина
Клінічна картина вади визначається віком, анатомічними змінами, рівнем АТ. У дітей старшого віку та дорослих при відсутності скарг підвищений АТ виявляють випадково. Пацієнти скаржаться на головний біль, запаморочення, підвищену стомлюваність, слабкість і біль у ногах, судороги м’язів ніг, мерзлякуватість стоп, носові кровотечі.
При огляді відзначають:
- диспропорційний розвиток скелетних м’язів: м’язи верхньої половини тіла гіпертрофовані при відносній гіпотрофії м’язів таза та нижніх кінцівок;
- підвищену пульсацію при пальпації міжреберних артерій (при нахилі вперед з опущеними руками);
- посилену пульсацію сонних і підключичних артерій, артерій верхніх кінцівок;
- пульсацію аорти в яремній ямці;
- пульсацію в міжлопатковому просторі, у пахвовій западині;
- різко ослаблену пульсацію на стегновій артерії та судинах нижніх кінцівок, АТ на останній нерідко знижений або взагалі не визначається;
- виражену АГ (переважно систолічну — до 220 мм рт. ст.);
- невеликий пульсовий тиск на ногах: САТ на ногах на 50–60 мм рт. ст. нижчий, ніж на руках, при нормальному ДАТ;
- верхівковий поштовх посилений;
- границі серцевої тупості зазвичай розширені вліво, аорта розширена;
- шкіра верхньої половини тіла тепла, нижньої — більш холодна, бліда.
Дані аускультації неспецифічні, I тон приглушений, акцент II тону на аорті внаслідок підвищення АТ у початковому відділі аорти, систолічний шум середньої інтенсивності в другому міжребер’ї ліворуч, добре проводиться в міжлопатковий простір.
Діагностика
На ЕКГ часто виявляють відхилення електричної осі вліво, визначають ознаки вираженої гіпертрофії міокарда ЛШ.
При рентгенографічному дослідженні в передньозадній проекції визначається збільшення ЛШ, розширення висхідної аорти. Визначається узурація нижніх країв ребер внаслідок тиску різко розширених та звитих міжреберних артерій. У передній косій проекції чітко помітна різниця в діаметрі висхідної та низхідної частин аорти (тінь аорти має вигляд числа «3»). Легеневий малюнок зазвичай виражений, судинний пучок вибухає праворуч за рахунок розширення висхідної частини аорти, лівий контур його згладжений. Посилено пульсацію ЛШ висхідної частини аорти та плечоголовних судин.
За допомогою ехоКГ можлива візуалізація місця звуження аорти, його діаметр і довжина, а також співвідношення з гілками дуги аорти та відкритою артеріальною протокою. За допомогою допплєрівської ехоКГ можна визначити систолічний турбулентний потік та градієнт тиску в місці коарктації (рис. 3.11), точно оцінити ступінь обструкції.
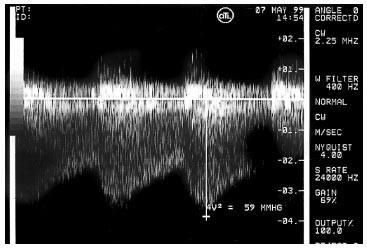
Рис. 3.11. Коарктація аорти. Режим постійнохвильового допплєра, супрастернальний доступ, довга вісь
Проведення МРТ має переваги в дорослій популяції для візуалізації анатомічних особливостей аорти, а особливо показано в тому випадку, якщо ехоКГ неможливе.
При катетеризації аорти діагноз вади підтверджується при визначенні величини градієнта систолічного тиску між висхідною та низхідною аортою, місця звуження, вираженості аневризматичних змін аорти. У порожнині ЛШ і аорті виявляється значне підвищення систолічного тиску. При предуктальному варіанті катетер з ЛА безперешкодно проходить через відкриту артеріальну протоку в низхідну аорту, де визначається зниження насичення крові киснем.
Лікування
Наявність коарктації аорти є абсолютним показанням до хірургічного втручання, ризик якого неоднаковий у різні вікові періоди та залежить від тяжкості стану хворих, анатомії вади та порушень кровообігу. Показання для оперативної корекції вади у дорослих включають застійну СН, гіпертензію в судинах верхніх кінцівок та/або градієнт >20 мм рт. ст. Консервативне лікування ускладнень (СН, АГ), як правило, малоефективне.
У хворих віком старше 20 років питання про показання до оперативного втручання варто вирішувати індивідуально: операція необхідна пацієнтам, у яких відсутня склеротична форма легеневої гіпертензії та тяжкий кальциноз аорти. При наявності вираженої декомпенсації кровообігу хірургічне лікування пов’язане з високим ризиком, тому показання до операції визначають із обережністю, оцінивши скорочувальну здатність міокарда та причину СН.
У дорослих хворих відновлення прохідності аорти звичайно легко здійснюється шляхом резекції звуженої ділянки аорти та накладення анастомозу кінець у кінець або ж заміщення звуженої ділянки судинним протезом. Рідше використовують операцію прямої або непрямої істмопластики аорти.
Із постопераційних ускладнень слід зазначити артеріальну гіпотензію, що може розвинутися відразу ж після відновлення кровотоку по аорті, абдомінальний синдром і кровотечу, що виникають у найближчий післяопераційний період. Специфічним ускладненням після успішного усунення коарктації аорти є розвиток післяопераційної або так званої парадоксальної гіпертензії, що відзначають у 50–80% хворих, частіше в осіб старшого віку. Наявність АГ є ризиком передчасного розвитку ІХС, дисфункції ЛШ, розриву аневризм аорти або мозкових судин, раптової смерті. Незважаючи на відсутність рандомізованих досліджень, блокатори β- адренорецепторів звичайно рекомендуються як препарати першого вибору.
Прогноз
Вада при відсутності лікування характеризується вкрай несприятливим перебігом, середня тривалість життя без хірургічного лікування — 35 років. Більшість пацієнтів помирають від прогресуючої СН, інфекційного ендокардиту, іноді від розриву аорти або її аневризми, інсульту.
Летальність у віддалений термін у хворих, прооперованих у віці старше 25 років, досягає 35%, в 20% хворих нормалізації рівня АТ не відбувається, можливе утворення аневризми аорти та рестеноза. Загальна 30-річна виживаність після хірургічної корекції вади становить усього 72%. Основні причини смерті у віддалений післяопераційний період — СН та ІМ.
АНОМАЛІЯ ЕБШТЕЙНА
Визначення
Аномалія розвитку тристулкового клапана, що характеризується різним ступенем дисплазії та зміщенням стулок клапана в порожнину ПШ.
Епідеміологія
Поширеність вади становить менше 1% всіх вроджених вад серця, в 1,5 раза частіше у дівчаток.
Патологічна анатомія
Основна анатомічна особливість вади полягає у зсуві тристулкового клапана в порожнину ПШ у напрямку до верхівки серця, зазвичай до місця з’єднання припливної і трабекулярної його частин (рис. 3.12). Ступінь дисплазії, деформації стулок, їхніх структур варіюють в широких межах. У всіх випадках в порожнину шлуночка зміщені задня стулка та досить часто — перегородкова, місцем найбільшого зсуву є комісура між ними. Зміщені стулки часто різко деформовані, стоншені, хорди їх укорочені, сосочкові м’язи гіпоплазовані. До фіброзного кільця прикріплюється тільки малозмінена передня стулка, що є найчастіше єдиною функціонуючою стулкою тристулкового клапана, вона значно збільшена в розмірах, нерідко є парусевидною, іноді вільний її край прикріплюється у вивідному відділі ПШ і викликає стенозування шляхів відтоку. Патологія тристулкового клапана супроводжується розширенням фіброзного кільця, що призводить до вираженої недостатності клапана.
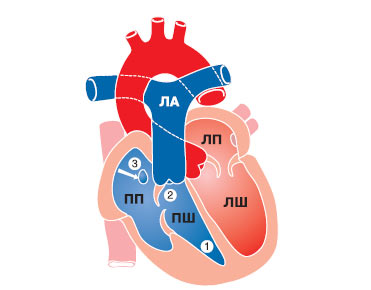
Рис. 3.12. Схема аномалії Ебштейна: 1 — ПШ (зменшений); 2 — «атріалізована» частина ПШ; 3 — дефект міжпередсердної перегородки
Зміщені стулки ділять порожнину ПШ на дві функціональні частини: велика (верхня) частина, розташована над зміщеним клапаном, є «атріалізованою» частиною ПШ та утворює з правим передсердям загальну, велику за об’ємом порожнину. Менша (нижня) частина розташовується під зміщеним клапаном і разом із трабекулярним та вихідним відділом функціонує як ПШ. Стінка правого передсердя гіпертрофована, у той час як стінка передсердної частини ПШ стоншена, аневризматично вибухає, товщина її становить 1–3 мм, міокард дистальної камери нормальний або трохи стовщений.
Порушення гемодинаміки
Зміни гемодинаміки визначаються ступенем зсуву і дисплазії тристулкового клапана, наявністю або відсутністю міжпередсердного сполучення. Анатомічні зміни призводять до дефіциту легеневого кровотоку, недостатності тристулкового клапана, скидання крові справа наліво через міжпередсердне сполучення. Зменшення легеневого кровотоку зумовлене меншим, ніж у нормі, УОК ПШ. Крім цього, відзначають обмеження припливу крові в дистальний відділ ПШ і в діастолу: у систолу правого передсердя «атріалізована» камера ПШ перебуває у фазі діастоли, через що просування крові в дистальну камеру ПШ затримується, а ефективність систоли передсердя знижується. У результаті тиск у правому передсерді підвищується, що зумовлює його дилатацію й гіпертрофію. При виражених змінах виникає нездатність правого передсердя до подальшого розширення, що створює перешкоду відтоку крові з порожнистих вен.
Клінічна картина
Клінічні симптоми різноманітні і залежать від вираженості анатомічних порушень, серед них найбільше часто відзначають задишку, низьку толерантність до фізичних навантажень, напади пароксизмальної тахікардії, що призводять до втрати свідомості.
При огляді виявляють різний ступінь ціанозу, набухання шийних вен, границі серцевої тупості значно розширені вліво і вправо, визначається «серцевий горб», зумовлений гігантськими розмірами правого передсердя та верхньою частиною ПШ.
Аускультативно тони серця ослаблені, роздвоєння I тону, розщеплення, ослаблення II тону, наявність III і IV тонів, що створюють ритм галопу, систолічний шум недостатності тристулкового клапана і діастолічний шум трикуспідального стенозу в проекції мечоподібного відростка справа біля грудини.
Діагностика
На ЕКГ електрична вісь частіше відхилена вправо. Зубці Р у I, II і в правих грудних відведеннях високі та гострі (гіпертрофія і дилатація правого передсердя), амплітуда шлуночкових зубців низька. Нерідко відзначають WPW-синдром (25%) із проявами пароксизмальної шлуночкової і передсердної тахікардії, екстрасистолію, тріпотіння та фібриляцію передсердь. Часто виявляють повну або неповну блокаду правої ніжки пучка Гіса, перший ступінь атріовентрикулярної блокади (40–50%), збільшення інтервалу P–Q.
На рентгенограмі в передньозадній проекції відзначають підвищену прозорість легеневих полів (за рахунок збідніння легеневого малюнка), різке збільшення розмірів серця за рахунок розширених правих відділів. Тінь серця може мати форму кулі, судинний пучок залишається вузьким. Ліві відділи не змінені.
ЕхоКГ дозволяє встановити правильний діагноз у більшості пацієнтів. При ехоКГ-обстеженні виявляють наступні найбільш характерні ознаки:
- зсув нижче фіброзного кільця однієї, двох або всіх стулок тристулкового клапана (більш ніж на 8 мм);
- запізнювання закриття тристулкового клапана порівняно з мітральним (0,065 с);
- збільшення амплітуди відкриття та зниження швидкості раннього діастолічного закриття передньої стулки тристулкового клапана;
- деформація ехосигнала від стулок;
- об’ємне збільшення розмірів правого передсердя, ідентифікація «атріалізованої» частини ПШ (рис. 3.13).
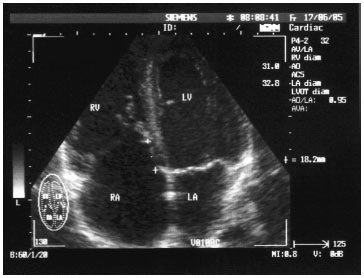
Рис. 3.13. Аномалія Ебштейна. В-режим, апікальна чотирикамерна позиція
За допомогою допплєрівської ехоКГ можлива оцінка ступеня недостатності тристулкового клапана, шунтуючого потоку справа наліво через дефект міжпередсердної перегородки.
Катетеризацію порожнин серця необхідно проводити з великою обережністю, оскільки нерідко розвиваються небезпечні для життя порушення серцевого ритму. При катетеризації визначається підвищення тиску в правому передсерді, при проведенні катетера у вихідний відділ ПШ нерідко реєструють діастолічний градієнт, що зв’язаний зі зсувом і дисплазією тристулкового клапана або зумовлений відносним стенозуванням правого атріовентрикулярного отвору порівняно з різко розширеним правим передсердям. Систолічний тиск в ПШ і ЛА зазвичай нормальний або трохи знижений. Введення контрастної речовини в порожнину ПШ допомагає виявити різке розширення шляху припливу та зниження шляху відтоку. Важливі діагностичні ознаки можна отримати при одночасній реєстрації тиску та проведенні внутрішньопорожнинної ЕКГ.
Лікування
При безсимптомному перебігу захворювання хірургічне лікування не проводять. Оперативне втручання показане при наявності ціанозу, ознак недостатності кровообігу та тяжких порушень ритму серця, рефрактерних до медикаментозного лікування. Радикальна операція полягає в пластичній реконструкції тристулкового клапана, при неможливості її виконання роблять протезування клапана.
При поєднанні аномалії Ебштейна з WPW-синдромом одномоментно виконують пластику тристулкового клапана і деструкцію додаткових шляхів проведення імпульсу. Абляція додаткових шляхів часто супроводжується ускладненнями та менш результативна (75%), чим у хворих без вад (95%).
Не встановлено впливів оперативного лікування на виникнення раптової смерті.
Медикаментозна терапія спрямована на лікування СН та усунення порушень ритму серця.
Прогноз
Захворювання характеризується прогресуючим перебігом. У неоперованих хворих старшого віку прогностично несприятливими факторами та причиною смерті зазвичай є прогресуюча кардіомегалія, СН і порушення ритму, які призводять до раптової смерті (3–4%).
ЛІТЕРАТУРА
- Бабаджанов К.Б., Джуманиязов Ат.А., Джуманиязов Ах.А. (2008) Ближайшие результаты радикальной коррекции тетрады Фалло у взрослых. Укр. кардіол. журн., 7: 90–93.
- Белоконь Н.А., Подзолков В.П. (1991) Врожденные пороки сердца. Медицина, Москва, 352 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. МОРИОН, Киев, 480 с.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Наказ № 436 Міністерства охорони здоровʼя України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006). Укр. кардіол. журн., 6: 89–115.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца. Руководство для врачей. Литтерра, Москва, 1328 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Apostolopoulou S.C., Magninas A., Cokkinos D.V. et al. (2005) Effect of the oral endothelin antagonist bosentan on the clinical, exercise, and haemodynamic status of patients with pulmonary arterial hypertension related to congenital heart disease. Heart, 91: 1447–1452.
- Book W.M. (2005) Heart failure in the adult patient with congenital heart disease. J. Card. Fail., 11: 306–312.
- Brickner M.E., Hillis L.D., Lange R.A. (2000) Congenital Heart Disease in Adults. N. Engl. J. Med., 342: 256–263.
- Carr J.A., Amaato J.J., Higgins R.S. (2005) Long-term results of surgical coarctectomy in the adolescent and adult with 18-year follow-up. Ann. Thorac. Surg., 79: 1950–1955.
- Celermajer D.S., Greaves K. (2002) Survivors of coarctation repair: fixed but not cured. Heart, 88: 113–114.
- Cho J.M., Puga F.J., Danielson G.K. et al. (2002) Early and long-term results of the surgical treatment of tetralogy of Fallot with pulmonary atresia, with or without major aortopulmonary collaterals. J. Thorac. Cardiovasc. Surg., 124: 70–81.
- Christensen D.D., McConnel M.E., Book W.M. et al. (2005) Initial experience with bosentan therapy in patients with Eisenmenger syndrome. Amer. J. Cardiol., 95: 435–436.
- de Divitis M., Pilla C., Kattenhorn M. et al. (2003) Ambulatory blood pressure, left ventricular mass, and conduit artery function late after successful repair of coarctation of the aorta. J. Amer. Coll. Cardiol., 41: 2259–2265.
- Gatzoulis M.A., Freeman M.A., Siu S.C. et al. (1999) Atrial arrhythmia after surgical closure of atrial septal defects in adults. N. Engl. J. Med., 340: 839–846.
- Gatzoulis M.A., Rogers P., Li W. et al. (2005) Safety and tolerability of bosentan in adults with Eisenmenger physiology. Int. J. Cardiol., 98: 147–151.
- Geva T., Sahn D.J., Powell A.J. (2003) Magnetic resonance imaging of congenital heart disease in adults. Prog. Pediatr. Cardiol., 17: 21–39.
- Goon H.W., Park I.S., Ko J.K. et al. (2005) Computed tomography for the diagnosis of congenital heart disease in pediatric and adult patients. Int. J. Cardiovasc. Imaging., 21: 347–365.
- Ho S.Y., McCarthy K.P., Josen M. et al. (2001) Anatomic-echocardiographic correlates: an introduction to normal and congenitally malformed hearts. Heart, 86(II): 3–11.
- Hoffman J.E., Kaplan S. (2002) The incidence of congenital heart disease. J. Amer. Coll. Cardiol., 39: 1890–1900.
- Holzer R., Cao Q.L., Hijazi Z.M. (2004) State of the art catheter interventions in adults with congenital heart disease. Expert. Rev. Cardiovasc. Ther., 2: 699–711.
- Kreutzer C., DeVive J., Oppido G. et al. (2000) Twenty-five year experience with Rastelli repair foe the transposition of great arteries. J. Thorac. Cardiovasc. Surg., 120: 211–223.
- Metcalfe K., .Rucka A.K., Smoot L. et al. (2000) Elastin: mutational spectrum in supravalvular aortic stenosis. Eur. J. Hum. Genet., 8: 955–963.
- Moore J.D., Doyle T.P. (2003) Interventional catheter therapy in adults with congenital heart disease. Progr. Pediatr. Cardiol, 17: 61–71.
- Niwa K., Perfloff J.K., Kaplan S. et al. (1999) Eisenmenger syndrome in adults: ventricular septal defect, truncus arteriosus, univentricular heart. J. Amer. Coll. Cardiol., 34: 223–232.
- Perloff J.K. (2003) Clinical recognition of congenital heart disease. 5th ed. W.B. Saunders, Philadelphia, p. 1–5.
- Rigby M. (1999) The era of transcatheter closure of atrial septal defects. Heart, 81: 227–228.
- Therrien J., Dore A., Gersony W. et al. (2001) CCS Consensus conference 2001 update: recommendations for the management of adults with congenital heart disease. Part I. Can. J. Cardiol., 17: 940–959.
- Therrien J., Warnes C., Daliento L. et al. (2001) CCS Consensus conference 2001 update: recommendations for the management of adults with congenital heart disease. Part III. Can. J. Cardiol., 17: 1138–1158.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams&Wilkins, Lippincott, 1628 p.
- Warnes C.A. (2003) Bicuspid aortic valve and coarctation: two villains part of a diffuse problem. Heart, 89: 965–966.
- Warnes C.A. (2005) The adult with congenital heart disease: born to be bad? J. Amer. Coll. Cardiol., 46: 18.