Легенева гіпертензія
Содержание
Легенева (артеріальна) гіпертензія (ЛГ) — синдром, пов’язаний з групою різних за своєю природою захворювань, при якому відзначають складні порушення функції ендотелію легеневих судин, його проліферацію та ремоделювання легеневих судин. Перебіг захворювання характеризується прогресуючим підвищенням легеневого судинного опору (ЛСО), що призводить до порушення функції ПШ, СН і передчасної смерті. Основною клінічною ознакою ЛГ є рівень середнього АТ в ЛА >25 мм рт. ст. у спокої і 30 — під час навантаження. ПШ — насос системи низького тиску, що добре адаптується до навантаження об’ємом, але дуже погано — до навантаження тиском, що призводить до його гіпертрофії та дисфункції. Легеневе серце (сor pulmonale) визначають при розвитку дисфункції ПШ внаслідок ЛГ, асоційованої з хронічними захворюваннями паренхіми легень.
КЛАСИФІКАЦІЯ
ЛГ включає ідіопатичну або первинну форму ЛГ, утому числі так звану сімейну форму, ЛГ при ураженні судин при системних захворюваннях сполучної тканини, при вроджених вадах серця внаслідок шунтування крові з великого кола кровообігу в малий, портальній гіпертензії, ВІЛ-інфекції, хронічній рецидивуючій ТЕЛА, ураженні лівої половини серця і захворювань легень. Всі ці хвороби мають загальні патофізіологічні механізми, що включають прогресуючі зміни легеневої мікроциркуляції.
Сучасна клінічна класифікація ЛГ (Venice expert meeting, 2003) наведена в табл. 1.1.

Згідно з МКХ-10 первинна ЛГ кодується I.27.0, інші уточнені форми ЛГ — I.27.8, неуточнені форми ЛГ — I.27.9, а ЛГ після ТЕЛА — I.26.
ЕПІДЕМІОЛОГІЯ
Дані щодо поширення ЛГ мають різнорідний характер практично внаслідок відсутності чітких реєстрів і значної кількості нозологічних форм, віднесених до цього синдрому. В Україні офіційних статистичних даних щодо поширення ЛГ немає. За даними американських реєстрів, ідіопатичну ЛГ виявляють в 1–4 випадках на 1 млн населення. Водночас експерти відзначають, що ця частота може бути більшою прибільш агресивному використанні діагностичних інструментальних методик. Співвідношення чоловіки/жінки серед хворих з ЛГ становить 1:2. Середній вік при встановленні діагнозу— 36 років. Середня тривалість симптомів захворювання до встановлення діагнозу становить приблизно 2 роки, виживаність протягом 1 року — 68%, протягом 3 років — 48%, 5 років — 34%. Середня тривалість життя після встановлення діагнозу 2,8 року.
ЕТІОЛОГІЯ
Сімейна форма ЛГ становить 6–10% усіх випадків цього захворювання. Розвиток сімейних форм ЛГ пов’язують з мутаціями рецепторів сімейства факторів росту TGF-β. Понад 50% випадків сімейної форми ЛГ і до 20% спорадичних — рідкісні мутації рецепторів морфогенетичного протеїну кісткового мозку. Цей цитокін — потужний регулятор та індуктор росту гладком’язових клітин судинної стінки та апоптозу.
Нечасто відзначають такий вроджений варіант ЛГ, як спадкова геморагічна телеангіектазія. Це захворювання зумовлене мутацією іншого гена — ALK 1. Знання про генетичні мутації, асоційовані з ЛГ, постійно розширюються, можливо, будуть виявлені ще й інші гени, які відіграють роль у розвитку цього захворювання.
При системних захворюваннях сполучної тканини можлива ЛГ як з ураженням паренхіми легень, так і без нього. За даними різних реєстрів лише приблизно 40% пацієнтів із системними захворюваннями сполучної тканини не мають ураження паренхіми або судин легень. Серед інших 60% хворих 19% мають ізольовану ЛГ, 22% — ураження паренхіми легень і 19% — поєднану патологію. ЛГ виявляють у 37% пацієнтів із системною склеродермією, у 14% — із системним червоним вовчаком і у 5% — із ревматоїдним артритом. За цими даними ще близько 13% пацієнтів із системними захворюваннями сполучної тканини мають недіагностовану ЛГ.
Поширеність ЛГ внаслідок вроджених вад серця із шунтуванням крові зліва направо точно невстановлене, але з урахуванням того, що частота вроджених вад серця становить близько 0,8% від всіх живонароджених, в Україні це означає появу 5 тис. випадків вроджених вад серця щорічно. Кількість таких хворих продовжує збільшуватися, зокрема внаслідок поліпшення надання їм допомоги, удосконалення хірургічного лікування. Розмір і локалізація шунта, а також генетичні фактори та реакція системи нейроендокринної регуляції визначають швидкість і ступінь розвитку ЛГ. За даними американських дослідників, виживаність цих хворих дещо краща, ніж пацієнтів з іншими типами ЛГ; за умов хірургічної корекції 1-річна виживаність становить 92%, 2-річна — 89%, 3-річна — 77% і 5-річна — 77%.
Легенево-печінкові судинні порушення на пізніх стадіях ураження печінки включають гепатопульмональний синдром і портопульмональну АГ. Гепатопульмональний синдром, який відзначають у 20% пацієнтів з хворобами печінки, характеризується прогресуючою гіпоксемією внаслідок вазодилатації внутрішньолегеневих судин. Цей стан не викликає ЛГ і проходить після трансплантації печінки. Портопульмональний тип ЛГ характеризується підвищенням тиску в ЛА без зниження оксигенації крові, його виявляють приблизно у 20% хворих на пізніх стадіях ураження печінки.
Виділяють три гемодинамічні типи: (а) гіпердинамічний тип, при якому відзначають помірне підвищення тиску вЛА (при цьому значно збільшується серцевий викид), нормальний легеневий капілярний тиск (тиск заклинювання) і знижений ЛСО; (б) гіперволемічний тип, при якому збільшується ОЦК, помірно зростає тиск у ЛА, збільшується серцевий викид, підвищується тиск у легеневих капілярах при нормальному ЛСО; (в) вазопроліферативний тип — найбільш рідкий і пов’язаний зі значним підвищенням тиску в ЛА та ЛСО, помірним початковим зниженням легеневого капілярного тиску і помірним збільшенням з подальшим зменшенням у динаміці серцевого викиду. Взагалі після трансплантації печінки ЛГ зменшується або зникає, але в ряді випадків проведення операції пов’язане з високим ризиком.
ЛГ, асоційована з ВІЛ-інфекцією, становить 0,5% всіх випадків. Деякі експерти вбачають асоціацію ЛГ зі змішаним інфікуванням людини ВІЛ та вірусом герпесу 8-го типу, при якому розвивається саркома Капоші. Виживаність становить 58% на 1-му році, 39%— за 2 роки і 21% — протягом 3 років.
Препарати і токсини, пов’язані з розвитком ЛГ, включають анорексигенні препарати, які використовувалися раніше — амінорекс, амфетаміни, а також кокаїн. Застосування цих засобів протягом >3 міс підвищує ризик розвитку ЛГ у 30 разів порівняно зі здоровим населенням. Вважають, що розвиток ЛГ може бути опосередкований порушенням функціонування транспортера серотоніну, який локалізується в гладких м’язах судин легеневого басейну.
Встановлено, що 20–40% пацієнтів із β-таласемією і серповидно-клітинною анемією схильні до розвитку ЛГ. Розвиток ЛГ погіршує прогноз захворювання: смертність при серповидно-клітинній анемії з ЛГ значно вища, ніж при серповидно-клітинній анемії без ЛГ.
Розвиток ЛГ часто відзначають у пацієнтів з тяжкими захворюваннями бронхів і легень. Відповідно досучасних уявлень ХОХЛ — стан, який характеризується прогресуючою необоротною обструкцією дихальних шляхів з патологічною запальною відповіддю і фіброзом легень внаслідок впливу шкідливих часточок і газів. Прогресування обструкції дихальних шляхів настає внаслідок як запалення бронхіол, так і зниження еластичності паренхіми легень через її запальну деструкцію, еластолізис і втрату відповідних альвеол. Морфологічно це проявляється хронічним бронхітом, бронхіолітом та емфіземою. Збуджені ділянки легеневої та бронхіальної тканини виділяють реактивні продукти перекисного окиснення, які усвою чергу вивільняють прозапальні цитокіни. При ХОХЛ у легеневій судинній мережі також підвищена експресія ендотеліну-1, особливо в період загострення захворювання.
Ураження паренхіми легень може бути наслідком системних захворювань сполучної тканини, описаних вище, або наслідком ідіопатичного легеневого фіброзу (фіброзивний альвеоліт) і дуже рідко — саркоїдозу легень.
Залежно від етіології поширеність ЛГ при ХОХЛ може варіювати. Так, ЛГ виявляють у 31% хворих з ідіопатичним легеневим фіброзом. Наявність ЛГ призводить до більш значного функціонального обмеження і супроводжується більш високою смертністю. Відзначають лінійну зворотну кореляцію між тиском у ЛА та клінічним прогнозом. Смертність за наявності симптомів ЛГ в 3 рази вища, ніж без ЛГ.
Синдром нічного апное — найнебезпечніша форма порушення сну: його виявляють у 5–15% дорослого населення. Наслідком синдрому нічного апное є АГ, інсульт, аритмії та блокади серця, а також ЛГ, особливо у пацієнтів з ХОХЛ. Точного патогенетичного зв’язку між синдромом нічного апное та ЛГ не виявлено. Можливо, що розвитку ЛГ сприяють ті ж самі фактори, що характерні при інших зазначених патологічних станах: гіпоксемії, порушенні вегетативної регуляції, гіперсимпатикотонії, дисфункції ендотелію, гіперагрегації тромбоцитів, активації прозапальних і протромботичних факторів тощо. На думку більшості експертів, провідний фактор для формування ЛГ при синдромі нічного апное — порушення функції ендотелію та гіперсекреція ендотеліну-1. Зазвичай пацієнти із синдромом нічного апное та ЛГ — це особи старшого віку зі зниженою функцією легень. При синдромі нічного апное ЛГ має помірний характер і, як правило, спостерігається позитивна відповідь на застосування специфічного лікування синдрому нічного апное — використання дихання з позитивним тиском наприкінці видиху (СРАР-терапія).
ЛГ внаслідок хронічного тромбозу чи емболії розвивається в 0,1–4% хворих, які перенесли гостру легеневу емболію. Проте, на думку багатьох авторів, її поширення недооцінене. Тромбоемболічні події відзначають в анамнезі у 60% хворих з ЛГ, а порушення коагуляції (найчастіше позитивний титр вовчакового антикоагулянта) — у 30% пацієнтів. Поліморфізм гена транспортера серотоніну виявляють у 30% хворих з хронічною тромбоемболічною ЛГ. Наявність цього генетичного поліморфізму, можливо, несприятливо модулює клінічний перебіг хвороби. Правильний діагноз цієї форми ЛГ вкрай важливий, оскільки деякі пацієнти можуть бути вилікувані методом хірургічної тромбектомії.
Хронічна ЛГ може бути наслідком ураження лівої половини серця — СН внаслідок набутих вад серця та/чи порушення його скоротної здатності (ІХС, ДКМП і міокардит) або наповнення (АГ, ГКМП і рестриктивна кардіоміопатія). Близько ⅔ хворих із лівосторонньою СН мають порушення систолічної функції ЛШ і ⅓ — діастолічної функції. Хронічну СН із систолічною дисфункцією ЛШ відзначають приблизно в 1% населення, що в Україні становить близько 500 тис. Кількість цих хворих збільшується щороку. Це пов’язане як з природним процесом старіння населення, так і підвищенням ефективності лікування і виживаності хворих з хронічною СН. Частіше при цих станах ЛГ має м’який характер, але приблизно в ⅓ хворих може бути тяжкою. Прогноз цілком залежить від прогнозу основного захворювання. Відповідно слід проводити більш ретельне обстеження всіх хворих з хронічною СН з метою виявлення ЛГ.
ПАТОГЕНЕЗ
Патогенез ЛГ досі недостатньо досліджений. Участь основних патогенетических механізмів у формуванні ЛГ наведена на рис. 1.1. У процес формування ЛГ різною мірою нарізних стадіях процесу втягуються системи регуляції кровообігу, вазоактивні субстанції, фактори росту, медіатори запалення, тромбоцитарні фактори, компоненти системи згортання крові.
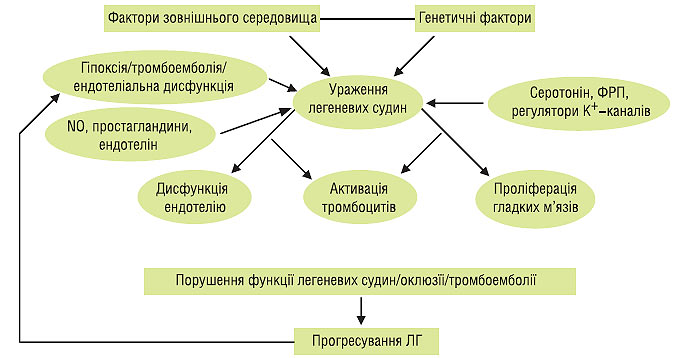
Рис. 1.1. Сучасні уявлення про патогенез ЛГ (адаптовано за S. Stewart, 2005). ФРП — фактори росту пухлин
Ключовий момент патогенезу ЛГ — дисфункція ендотелію легеневих судин. Остання може виникнути внаслідок спадкових механізмів та під впливом факторів зовнішнього середовища, що змінюють природний баланс метаболізму оксиду азоту, з одного боку, та ендотеліну і тромбоксану — з іншого. Це призводить до порушення вазореактивності легеневих судин та їх вазоконстрикції. Внаслідок цього дисбалансу активуються внутрішньоклітинні механізми, що запускають гіперплазію та гіпертрофію гладком’язових елементів, апоптоз, проліферацію фібробластів, запалення й ангіогенез.
Важливою ланкою патогенезу ЛГ є активація рецепторів ендотеліну. Ця активація може мати гострі й хронічні наслідки. До гострих відносять вазоконстрикцію і запалення, до хронічних — проліферацію фібробластів, надмірний синтез компонентів екстрацелюлярного матриксу, ремоделювання легеневих судин, підвищення секреції реніну й альдостерону, утворення ангіотензину II, гіпертрофію кардіоміоцитів. Причиною росту концентрації ендотеліну може бути як збільшення його продукції, так і зменшення його утилізації в легенях. Значне підвищення вмісту ендотеліну відзначають при ідіопатичній формі ЛГ, вроджених вадах серця, захворюваннях сполучної тканини. Ефекти ендотеліну реалізуються за допомогою ендотелінових рецепторів А- і В-типів. А-тип локалізується на клітинах гладких м’язів, а В-тип — на клітинах ендотелію. Блокада ефектів ендотеліну може включати як зменшення його утворення (інгібірування ендотелін-конвертуючого ферменту), так і блокаду його рецепторів (селективну чи неселективну).
Іншим важливим механізмом у патогенезі є порушення синтезу та/або доступності NO. Прояв порушення функції ендотелію при ЛГ — зниження синтезу оксиду азоту. З однієї сторони, це є наслідком зниження активності ендотеліальної NO-синтази. З іншої — відзначають зниження біодоступності оксиду азоту у зв’язку з гіпоксією, оксидантним стресом і зниженням вмісту L-аргініну внаслідок зростання активності аргінази у клітинах ендотелію та еритроцитах. У хворих з ЛГ інгаляції NO приводять до зниження тиску в ЛА та клінічного поліпшення. Іншим клінічно значущим механізмом підвищення концентрації оксиду азоту в легеневих судинах є зниження його розпаду під впливом ФДЕ, особливо її ізоензиму-5. У легеневому судинному басейні виявляють значну кількість цього типу ФДЕ і відповідно вплив на неї є важливим терапевтичним механізмом.
Вагомий елемент у патогенезі захворювання — порушення або зниження нормальної функції вольтажзалежних калієвих каналів гладком’язових клітин легеневих судин. Внаслідок цих порушень додатково виводиться калій і збільшується внутрішньоклітинний зміст кальцію, що призводить до вазоконстрикції. Активація тромбоцитів супроводжується звільненням цілого ряду біологічно активних субстанцій: тромбоцитарного фактора росту, серотоніну, факторів згортання крові та проагрегації. Наслідком цього є прокоагулянтний стан у системі ЛА і виникнення тромботичних ускладнень. Зазначені зміни призводять до того, що дисфункція ендотелію легеневих судин прогресує.
Ще один важливий компонент у патогенезі ЛГ — зниження синтезу простацикліну. При ЛГ відзначають зниження експресії простациклінсинтетази в ЛА малого і середнього діаметра. Відповідно підвищується концентрація антагоніста простацикліну — тромбоксану. Описані порушення частіше виявляють у хворих з ідіопатичною ЛГ і з ЛГ при захворюваннях сполучної тканини.
Ураження міокарда ЛШ і його структурно-функціональна перебудова (ремоделювання) — основні компоненти розвитку СН. Провідну участь у формуванні СН беруть нейрогуморальні системи регуляції кровообігу: РААС, альдостерон, симпатоадреналова система, ендотелінова, кінінова, оксиду азоту, простагландинова та ін. Взаємодія систем нейрогуморальної регуляції запускає певні механізми, які призводять до додаткового порушення регуляції судинного тонусу в системі ЛА. Наслідок цього каскаду реакцій — формування стійкої ЛГ з ремоделюванням легеневих судин, гіпертрофією та ремоделюванням ПШ: порочне коло замикається. При вроджених вадах серця ремоделювання легеневих судин — наслідок впливу сил стресу розтягнення (shear-stress) під дією високого тиску в ЛА. На пізніх стадіях процесу з його хронізацією ЛГ ідіопатичного генезу патофізіологічно не буде відрізнятися від ЛГ внаслідок колагенових хвороб, вроджених вад серця чи лівошлуночкової СН.
КЛІНІКА ТА ДІАГНОСТИКА
Без належного лікування при ЛГ спостерігається швидкий розвиток і прогресування гіпертрофії ПШ, його дилатації та правошлуночкової СН. Це основна причина смерті. При проведенні патогенетичної терапії швидкість прогресування захворювання значно уповільнюється, як і розвиток правошлуночкової СН та відповідно знижується смертність.
Діагностичний підхід при ЛГ потребує проведення серії досліджень з метою підтвердження ЛГ, визначення функціональних змін (клінічний клас), з’ясування причини виникнення ЛГ та оцінки реакції на призначене лікування. Цей послідовний підхід використовують, навіть якщо деякі дослідження надають суперечливу інформацію.
Для практичних цілей можуть бути рекомендовані такі 4 етапи встановлення діагнозу ЛГ:
1) підозра на наявність захворювання;
2) виявлення;
3) визначення ФК;
4) оцінка гемодинамічних змін і реакції на призначене лікування.
1. Підозра на наявність ЛГ
Специфічних симптомів для ЛГ немає. Початкові прояви ЛГ можуть бути мінімальними, що може призвести до запізнення діагностики на ранній стадії захворювання. Найчастіше при підозрі на ЛГ використовують скринінговий метод. Підозра на ЛГ має виникнути з появою таких загальних симптомів, як задишка, втома, слабкість, біль у грудях (за типом стенокардії), серцебиття, синкопальні стани, кашель (іноді кровохаркання), відчуття тяжкості у правому підребер’ї та збільшення об’єму живота. Симптоми у стані спокою відзначають, як правило, у гострих або запущених випадках, а також при дуже швидкому прогресуванні ЛГ. В інших випадках симптоми розмиті й неспецифічні та часто призводять до неправильної діагностики інших захворювань серця і легень.
ЛГ може бути виявлена в пацієнтів без будь-яких симптомів при скринінгових дослідженнях, особливо серед хворих групи ризику або зі схильністю до розвитку ЛГ: системні захворювання сполучної тканини, портальна гіпертензія, ВІЛ-інфекція, вроджені вади серця, ХОХЛ, лівошлуночкова СН.
Іноді підозра на наявність ЛГ виникає при випадковому обстеженні: рентгенографії, ЕКГ, ехоКГ.
2. Виявлення ЛГ
Діагностика ЛГ потребує проведення кількох рутинних досліджень, таких як загальне клінічне обстеження, ЕКГ, рентгенологічне дослідження органів грудної клітки і трансторакальної ехоКГ з допплєром.
При загальному клінічному обстеженні у хворих з розвиненою ЛГ визначають розширення границь серця вправо, прослуховують акцент II тону на ЛА, пан систолічний шум регургітації на трикуспідальному клапані, діастолічний шум недостатності клапана ЛА, а також III тон. Виявляють розширення шийних вен, гепатомегалію, периферичні набряки, асцит і похолодіння кінцівок. Зазначені симптоми характерні для хворого з уже розвиненими симптомами правошлуночкової недостатності. Часто це супроводжується центральним і периферичним ціанозом. При перкусії та аускультації легень всі звукові феномени зазвичай нормальні.
ЕКГ. Рутинне ЕКГ-дослідження може свідчити про підозру чи додатково підтвердити діагноз ЛГ: виявляють гіпертрофію ПШ, ознаки його розтягнення чи перенавантаження (найчастіше повна блокада правої ніжки пучка Гіса). Подібні феномени можуть бути виявлені і для правого передсердя. Проте відсутність змін на звичайній ЕКГ у спокої не виключає наявності ЛГ.
Рентгенологічне дослідження органів грудної клітки дозволяє виявити патологічні зміни у 90% випадків. Серед найчастіших симптомів: розширення кореня ЛА, що контрастує з втратою малюнка периферичних кровоносних судин у легенях. Можливе виявлення розширення тіней, що належать до правого передсердя і ПШ. При рентгенографії чітко визначають супутні захворювання легень — ХОХЛ або застійні явища в легеневих венах внаслідок лівошлуночкової недостатності, що відповідають зміні тіні серця за наявності вроджених вад та ін.
Трансторакальна ехоКГ з допплєром — найбільш інформативне неінвазивне скринінгове дослідження хворих з підозрою на ЛГ. Метод дозволяє досліджувати швидкість потоку регургітації на трикуспідальному клапані та обчислити САТ у ЛА та ПШ. Згідно з даними у здорових осіб м’яку ЛГ можна визначити при САТ у ЛА близько 36–50 мм рт. ст. або швидкості потоку регургітації на трикуспідальному клапані 2,8–3,4 м/с (при припущенні, що нормальний тиск у правому передсерді становить 5 мм рт. ст.). Незважаючи на високу інформативність методу, слід зазначити, що існують категорії хворих з хибно-позитивним діагнозом за даними ехоКГ: особи похилого і старечого віку за наявності симптомної СН високого ФК. У цьому разі рекомендують проводити верифікацію діагнозу методом катетеризації правих відділів серця і ЛА.
Метод ехоКГ дає можливість оцінити розміри порожнин серця і порожнистої вени, функціональний стан шлуночків, наявність випоту в перикарді, наявність вад серця із шунтуванням крові, ступінь дисфункції клапанів серця. Для ЛГ характерне збільшення порожнини ПЖ, передсердя і порожнистої вени, зниження функціональної здатності ПШ, зменшення розміру ЛШ. Дослідження може бути доповнене внутрішньовенним введенням контрастного для ультразвуку речовини з метою кращого виявлення потоків крові за наявності вади серця.
Обстеження хворих з підозрою на ЛГ має включати проведення функціональних досліджень легень: дослідження функції зовнішнього дихання і газового складу крові (втому числі для визначення ХОХЛ). Ухворих з ЛГ зазвичай виявляють зниження легеневої дифузії CO2 (на 40–80% належного рівня) і помірне зниження дихального об’єму легень. Парціальний тиск кисню в артеріальній крові (PaO2) при диханні атмосферним повітрям, як правило, нормальний, парціальний тиск вуглекислоти в артеріальній крові (PaCO2) — нормальний або трохи знижений внаслідок гіпервентиляції.
Важливий метод обстеження для виявлення хворих з хронічною ТЕЛА — вентиляційно-перфузійне сканування легень. У хворих з ідіопатичною ЛГ показники вентиляційно-перфузійного сканування, як правило, у нормі. Можливі невеликі периферичні дефекти перфузії, що анатомічно не відповідають легеневим сегментам. При хронічній ТЕЛА типовим є визначення дефектів перфузії, які відповідають сегментарним або частковим ділянкам при нормальних показниках вентиляції. При ХОХЛ, навпаки, — типове виявлення дефектів перфузії, що супроводжуються відповідними дефектами вентиляції.
КТ легень може більш точно виявити захворювання паренхіми легень, наявність стовщень плеври (особливо міждольової), локального випоту та патології лімфовузлів. Також за допомогою цього методу дослідження можна краще діагностувати тип ураження легень за наявності ознак посилення інтерстиціального малюнка на звичайній рентгенограмі легень та відсутності ознак лівошлуночкової СН. Проведення КТ з контрастуванням судин допомагає діагностувати хронічну ТЕЛА. У таких випадках визначають оклюзії та стенози, ознаки реканалізації тромбу, дефекти перфузії. Остаточне показання для проведення ендартеректомії визначають при прямій ангіографії ЛА.
3. Визначення ФК
Об’єктивна оцінка функціонального стану хворих неможлива без проведення навантажувальних тестів. Найпростіший для практичного використання тест з 6-хвилинною ходьбою. Для проведення тесту необхідно провести оцінку дистанції, яку хворий зможе пройти протягом зазначеного проміжку часу. Складніший метод ергоспірометрії, при якому можна оцінити не лише здатність хворого до виконання фізичного навантаження, але й показники газообміну, і головне — споживання кисню. Метод набагато складніший і його використання обмежене спеціалізованими стаціонарами. Дані про відповідність результатів навантажувальних тестів функціональному стану наведено в табл. 1.2.
Таблиця 1.2
Об’єктивізація ФК за даними навантажувальних тестів
| ФК | Дистанція ходьби, яку здатний подолати хворий за 6 хв, м |
Максимальне споживання кисню, мол/м2 за 1 хв |
| I
II III IV |
426–550
300–425 150–300 <150 |
18,1–22,0
14,1–18,1 10,1–14,0 <10 |
4. Оцінка гемодинамічних змін і реакції на лікування
Золотий стандарт у встановленні діагнозу ЛГ— катетеризація правих відділів серця і ЛА. При цьому підтверджується діагноз і безпосередньо встановлюється ступінь ЛГ, а також з’являється можливість визначити вазореактивність легеневих судин у відповідь на застосування лікарських засобів. При катетеризації визначають тиск у ЛА, серцевий викид, ЛСО, тиск у правому передсерді, тиск заклинювання в легеневих капілярах. ЛГ визначають при підвищенні АТ в ЛА >25 мм рт. ст. у стані спокою або >30 мм рт. ст. при навантаженні, при рівні тиску заклинювання в легеневих капілярах ≤15 мм рт. ст. і рівні ЛСО >3 мм рт. ст./л/хв. При катетеризації беруть кров з різних порожнин серця і ЛА для визначення газового складу і насичення крові киснем. Це може допомогти у визначенні локалізації шунтів. Крім того, показники гемодинаміки мають прогностичне значення: низька величина серцевого викиду, високий тиск у ЛА і правому передсерді, низьке насичення центральної венозної крові киснем асоціюється з дуже поганим прогнозом. Уразі необхідності при катетеризації можливе проведення ангіопульмонографії. При катетеризації ЛА слід проводити тести з вазодилататорами. На жаль, таке тестування можна проводити лише з препаратами короткої дії. Для цих цілей використовують внутрішньовенне введення простацикліну чи аденозину фосфату та інгаляції оксиду азоту. Позитивною вважають відповідь, коли відзначають зниження САТ у ЛА на 10 мм рт. ст., досягнення абсолютного значення тиску <40 мм рт. ст. при збільшенні чи незмінній величині серцевого викиду. У хворих з позитивним результатом тесту встановлено стійку тривалу відповідь при лікуванні вазодилататорами, перш за все антагоністами кальцію. Саме в цих хворих тривала монотерапія антагоністами кальцію супроводжується поліпшенням ФК і, можливо, підвищенням виживаності. Зазвичай позитивну відповідь виявляють лише у 10–15% хворих з ідіопатичною ЛГ. Емпіричне призначення антагоністів кальцію у високих дозах без визначення вазореактивності часто супроводжується погіршенням стану чи тяжкими побічними ефектами цієї терапії.
Відповідно до рекомендацій Американської колегії фахівців з торакальної медицини в узгоджених рекомендаціях по АГ вважається, що цей тест необхідно рутинно використовувати в усіх хворих з ЛГ. Водночас його не слід застосовувати у осіб, яким непоказана терапія антагоністами кальцію, як правило, це пацієнти з IV ФК.
Використання неінвазивного визначення реакції тиску в ЛА на вазодилататори методом ехо-КГ може призводити до значних помилок і не може замінити катетеризацію.
Останній крок при діагностиці ЛГ — визначення її типу та асоційованих захворювань або станів. Як ми вже відзначали, дані ехоКГ дозволяють визначити наявність вроджених вад серця із шунтуванням крові, дисфункції ЛШ, ступінь порушення функції ПЖ. Біохімічне та імунологічне дослідження сироватки крові дозволяє виявити системні захворювання сполучної тканини та СНІД; рентгенологічне дослідження (рутинне, а за необхідності КТ) — підтвердити наявність ХОБЛ. Біохімічне дослідження сироватки крові у поєднанні з УЗД органів черевної порожнини дозволяє виявити хворих з ураженням печінки та портальною гіпертензією. КТ із контрастуванням, вентиляційно-перфузійним скануванням і ангіопульмонографією дають можливість виявити пацієнтів з хронічною ТЕЛА.
Згідно з рекомендаціями експертів ВООЗ (1998) для хворих з ЛГ адаптована функціональна класифікація NYHA, яка початково була запропонована для осіб з ХСН (табл. 1.3).
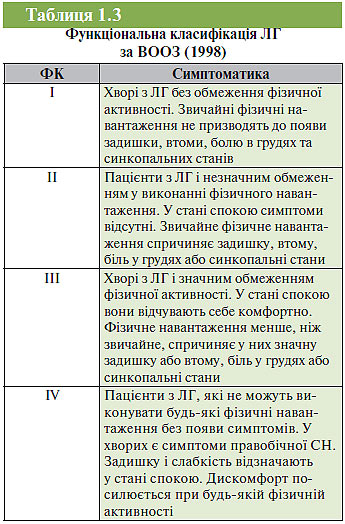
Як правило, у хворих з IV ФК відзначають симптоми розвиненої правобічної СН. Цілком зрозуміло, що прогресування ФК від I до IV відображає еволюцію/прогресування правошлункової СН.
ЛІКУВАННЯ ЛЕГЕНЕВОЇ ГІПЕРТЕНЗІЇ
Мета лікування легеневої гіпертензії — зменшення вираженості симптомів, уповільнення прогресування захворювання, поліпшення якості життя хворих і збільшення його тривалості. Лікування необхідно починати одразу ж після встановлення діагнозу.
Хворі з ЛГ мають уникати надмірних фізичних навантажень, різких змін пози тіла (ризик ортостатичних реакцій і синкопе), тютюнопаління, надмірного споживання кухонної солі. Не слід використовувати протизаплідні засоби, що містять естрогени, необхідно також запобігати вагітності у зв’язку з високим ризиком материнської смертності (50%). Рекомендується уникати прийому препаратів (втому числі рослинного походження), що містять потенційні вазоконстрикторні речовини. Бажано запобігати простудним захворюванням, проводити вакцинацію проти грипу. Хворим з ЛГ слід виключити підйом угори (>1 тис. м над рівнем моря), а при перельотах у літаку бути готовими до користування кисневими масками.
При тривалій подорожі рекомендується робити короткі перерви для нетривалих прогулянок кожні 2 год. У літаках рекомендується вставати з крісла і ходити по салону.
При проведенні хірургічного лікування необхідно пам’ятати, що загальна анестезія та інтубація трахеї пов’язані з дуже високим ризиком розвитку вагусних ускладнень.
Основний алгоритм лікування включений у заключний документ Всесвітнього симпозіуму щодо ЛГ (Венеція, 2003). У 2007 р. провідні експерти США його дещо доповнили відповідно до нових даних доказової медицини (рис. 1.2).
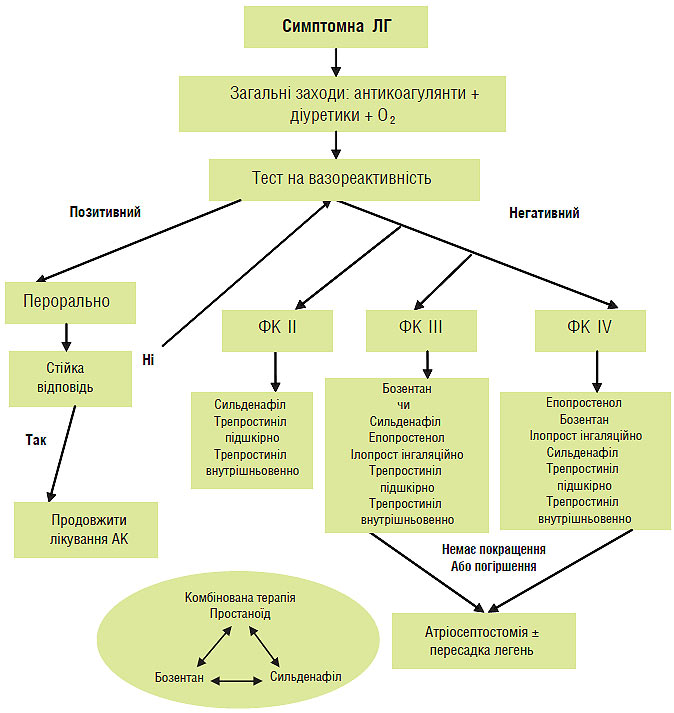
Рис. 1.2. Алгоритм лікування ЛГ (адаптовано з Updated ACCP Clinical Practice Guidelines, 2007). АК – антагоністи кальцію
Загальна терапія хворих з ЛГ включає прийом антикоагулянтів, діуретиків та дигоксину, а також інгаляції кисню. Результати короткочасних досліджень свідчать про зменшення вираженості симптомів і зниження вмісту катехоламінів у крові при застосуванні дигоксину в терапії ЛГ. Дигоксин також показаний з метою поліпшення контролю ЧСС при фібриляції передсердь.
Діуретики рекомендовані як для лікування, так і профілактики застійних явищ. Відповідь на прийом діуретиків може значно змінюватися, тому дози препаратів підбирають індивідуально. Слід ретельно моніторувати функцію нирок і показники електролітного обміну для запобігання розвитку ускладнень хронічної діуретичної терапії. Антагоністи альдостерону (спіронолактон) можна використовувати при розвитку хронічної СН III–IV ФК.
Застосування кисню сприяє поліпшенню оксигенації крові. Мета лікування — підтримка насичення гемоглобіну киснем нарівні не менше 90%. У деяких випадках тривале застосування кисню, особливо у високих дозах, може спричинити легеневу вазоконстрикцію і привести до погіршення стану хворого. Використання кисню особливо ефективне у пацієнтів з ХОХЛ, Водночас при вроджених вадах серця його застосування буде практично неефективним.
Застосування непрямих антикоагулянтів (варфарину) при ЛГ, за даними ретроспективних аналізів, привело до поліпшення результатів лікування хворих з ідіопатичною ЛГ. Результатів проспективних досліджень ефективності варфарину при цій патології немає. Також є певні докази ефективності кумаринових похідних у хворих з ЛГ внаслідок ТЕЛА. Рутинне застосування варфарину при ЛГ, пов’язаній з колагенозами чи вродженими вадами серця, може значно підвищувати ризик розвитку шлунково-кишкових кровотеч і гемоптозу. Цільовим рівнем при призначенні кумаринів є МНВ 1,5–2,5.
Огляд основних медикаментозних засобів для терапії ЛГ та їх ефективність за даними доказової медицини наведені в табл. 1.4.
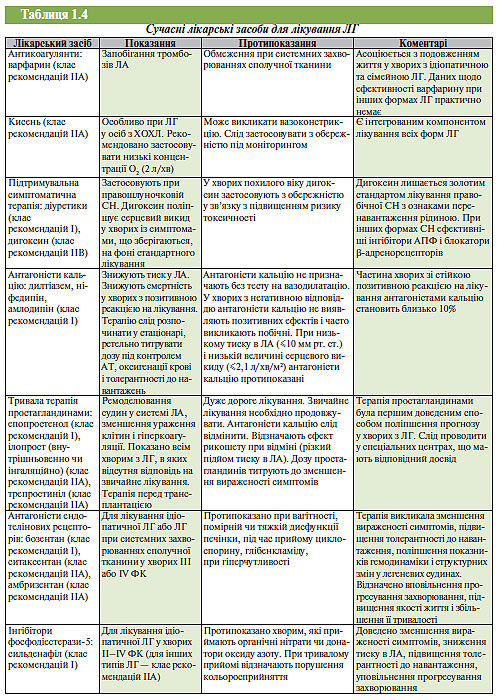
Антагоністи кальцію показали високу ефективність щодо зниження тиску вЛА, поліпшення симптомів і якості життя, а також підвищення виживаності у хворих з ідіопатичною ЛГ. Цей ефект лікування проявляється лише у хворих з позитивною відповіддю тесту на вазодилатацію. Частка цих пацієнтів становить близько 10% усіх хворих з ідіопатичною ЛГ. В осіб без позитивної відповіді при проведенні функціонального тесту призначення антагоністів кальцію може спричинити погіршення, зниження оксигенації крові, тяжку системну гіпотензію. Вважають, що достовірний результат тесту можна одержати лише при інвазивному дослідженні, дані УЗД в цьому разі неінформативні. Антагоністи кальцію слід використовувати у високих дозах. Вважають, що ефективність антагоністів кальцію підвищується при одночасному застосуванні з варфарином. У хворих із СН перевагу слід віддати амлодипіну. Водночас вважається, що при IV ФК антагоністи кальцію непоказані. Терапію потрібно починати у стаціонарі, ретельно титрувати дозу під контролем АТ, контролювати показники оксигенації крові й толерантність до навантажень.
Антагоністи рецепторів ендотеліну-1. Як зазначено вище, ендотелін-1 відіграє одну із провідних ролей у формуванні та прогресуванні ЛГ при її ідіопатичній формі, захворюваннях сполучної тканини і вроджених вадах серця. Це визначає важливу роль блокаторів рецепторів ендотеліну-1 в терапії ЛГ. Бозентан став першим блокатором рецепторів ендотеліну-1 А- і В-типів для перорального прийому. У проспективних рандомізованих дослідженнях встановлена його здатність знижувати тиск у ЛА, ЛСО і поліпшувати серцевий викид у хворих III–IV ФК. Це супроводжувалося значним поліпшенням ФК, зменшенням вираженості симптомів і підвищенням толерантності до навантаження та якості життя. Також відзначали уповільнення прогресування захворювання, зниження ступеня ремоделювання ПШ. Основним результатом терапії бозентаном стало підвищення виживаності протягом 1року (96%) і 2 років (89%) порівняно з контрольною групою (69 і 57% відповідно). Таким чином, бозентан показаний для лікування ЛГ ідіопатичного генезу, при системних захворюваннях сполучної тканини, вроджених вадах серця, дії токсичних речовин, а також при ВІЛ-інфекції. Доза бозентану на початку лікування становить 62,5 мг 2 рази на добу, через 4 тиж терапії за умов хорошої переносимості дозу подвоюють. При погіршенні стану хворих бозентан відміняють і призначають альтернативну терапію. Дослідження ефективності бозентану при ЛГ IIФК на момент написання настанови ще не закінчено. Протягом останніх років отримано позитивні результати клінічних досліджень щодо інших блокаторов рецепторів ендотеліну-1 — ситаксентану та амбризентану.
Простагландини (простаноїди). Як відзначено вище, простаноїди беруть активну участь у регуляції функції ендотелію, адгезії та агрегації, запаленні та проліферації клітин у легеневих судинах. Відповідно недостатність простацикліну (абсолютна чи відносна) може відігравати значну роль у патогенезі ЛГ. Отже, призначення екзогенного простацикліну (парентерально чи інгаляційно) при ЛГ патогенетично обґрунтоване.
Найбільш досліджений препарат, який відповідно має найбільшу доказову базу серед простаноїдів — це епіпростенол (синтетичний аналог простацикліну). Внутрішньовенна терапія епіпростенолом протягом 12 тиж поліпшувала гемодинаміку, симптоми захворювання, якість життя та сприяла покращанню результатів тесту 6-хвилинної ходьби. Прогресуюче ремоделювання ПШ зменшувалося, і цей позитивний результат зберігався у віддалений період. У деяких дослідженнях встановлене підвищення виживаності хворих, які одержували цю терапію, порівняно зі стандартною терапією ЛГ. Внутрішньовенна терапія епіпростенолом ефективна у пацієнтів з ідіопатичною ЛГ, придифузних захворюваннях сполучної тканини, дії токсинів, вроджених вадах серця із шунтуванням крові справа наліво III–IV ФК. Початкова доза становить 2 нг/кг/хв з подальшим її підвищенням за умови хорошої переносимості до 30 нг/кг/хв. Можна застосовувати і більш високі дози, але при цьому підвищується ймовірність розвитку побічних ефектів. Побічні ефекти терапії епіпростенолом включають гіперемію з припливами крові, нудоту, блювання, діарею, біль у ділянці щелепи, скелетно-м’язовий біль, шкірні висипання еритематозного характеру, а також ускладнення, пов’язані з тривалим застосуванням центрального катетера. З огляду на складність проведення цю терапію необхідно призначати лише в центрах, що мають відповідний досвід.
Інший препарат простаноїдів з доведеною ефективністю — ілопрост, який можна використовувати як для інфузій, так і в інгаляційній формі. Інгаляційна терапія ілопростом для хворого є більш простою у порівнянні з інфузією, також поліпшує гемодинаміку, сприяє збільшенню дистанції ходьби за 6 хв, знижує ФК захворювання, симптоми і якість життя після 12 тиж її застосування. Побічні ефекти включають кашель, припливи крові з почервонінням, головний біль, біль у щелепі, нудоту й гіпотензію. Ця терапія ефективна в осіб з ідіопатичною ЛГ, при дифузних захворюваннях сполучної тканини, дії токсинів, вроджених вадах серця із шунтуванням крові справа наліво, тромбоемболічній хворобі та III–IV ФК ЛГ. Рекомендована доза — 6–9 інгаляцій 2,5 мкг ілопросту щодня з використанням портативного розпилювача. Дозу можна підвищувати до 5 мкг за умов хорошої переносимості. Цей спосіб терапії простагландинами має певні переваги, але віддалена ефективність (вплив на смертність) її недоведена. Внутрішньовенна терапія ілопростом мало відрізняється від застосування епіпротенолу.
Ще один препарат простаноїдів — трепростиніл — бензидиновий аналог простацикліну, який можна вводити внутрішньовенно чи підшкірно. Профіль побічних ефектів внутрішньовенної терапії трепростинілом подібний до такого у епіпростенолу. Початкова доза становить 5 нг/кг/хв з поступовим підвищенням до 60 нг/кг/хв.
Безперервне підшкірне введення трепростинілу протягом 12 тиж викликало клінічне поліпшення зі збільшенням дистанції 6-хвилинної ходьби. Це супроводжувалося позитивною динамікою симптомів, показників гемодинаміки та якості життя. Підшкірне введення трепростинілу показане пацієнтам з ідіопатичною ЛГ, при захворюваннях сполучної тканини, вроджених вадах серця при II–IV ФК. Побічні ефекти цієї терапії включають біль у місці ін’єкції, діарею, біль у щелепі та набряки. Початкова доза становить 1,25 нг/кг/хв із поступовим підвищенням до 22,5 нг/кг/хв. Технологія введення включає використання спеціального інфузійного мікронасосу, який створює додатковий тиск для постійного введення. Цей лікарський засіб також слід застосовувати лише в центрах із достатнім досвідом застосування цієї терапії.
Інгібітори фосфодіестерази (ФДЕ)-5. З огляду на важливу роль дисфункції ендотелію в патогенезі ЛГ застосування препаратів, що спричиняють безпосередній вплив на продукцію оксиду азоту, стало ще одним перспективним напрямком у лікуванні цього захворювання. Перший з них — сильденафіл — специфічний інгібітор ФДЕ-5. Цей фермент відповідає за розпад цГМФ, за допомогою якого реалізуються ефекти оксиду азоту. Широко представлений у легеневому судинному руслі. Основним показанням для призначення сильденафілу до останнього часу була еректильна дисфункція. Також встановлено, що цей препарат після 12 тиж прийому здатний знижувати тиск і судинний опір у ЛА, збільшувати серцевий викид у пацієнтів з ЛГ. У цей період відзначали зменшення вираженості симптомів, збільшення дистанції 6-хвилинної ходьби і зниження ФК, крім цього відзначене збільшення періоду клінічного поліпшення стану хворих. Ефект препарату не залежить від дози. Засіб добре переноситься, найчастіші побічні явища — носова кровотеча, головний біль і закладеність носа. Ефективність сильденафілу доведена у пацієнтів II–IV ФК з ідіопатичною ЛГ, при дифузних захворюваннях сполучної тканини, вроджених вадах серця із шунтуванням крові справа ліворуч. Припускають, що препарат може бути ефективним у хворих з ЛГ тромбоемболічного походження. Рекомендована доза становить 20 мг 3 рази на добу. Препарат протипоказаний хворим, які приймають органічні нітрати чи донатори оксиду азоту.
У прямих порівняльних дослідженнях ефективності щодо сурогатних точок з бозентаном (дистанція 6-хвилинної ходьби, маса міокарда ПШ) встановлена практично однакова ефективність протягом 12-тижневого курсу лікування. Ефективність інших блокаторов ФДЕ-5 (у тому числі тадалафілу) при ЛГ на момент написання настанови проходить етап дослідження.
Комбінована медикаментозна терапія. У клінічній практиці для досягнення більшого ефекту раціонально застосовувати лікарські засоби з різними механізмами дії, які можуть впливати нарізні ланки патогенезу і таким чином потенціювати ефекти один одного. Однак у терапії ЛГ при виборі комбінації препаратів різних класів спираються більш на інтуїцію, ніж на дані доказової медицини
Існують одиничні пілотні дослідження, в яких вивчали ефективність і безпеку різних комбінацій: епопростенолу і бозентану, ілопросту та бозентану. Кілька невеликих досліджень проведено для оцінки ефективності та безпеки комбінованої терапії простаноїдами та інгібіторами ФДЕ-5. Встановлено більш значний гемодинамічний ефект комбінованого лікування порівняно з монотерапією. Але досі віддалені результати такої терапії залишаються невизначеними: є відомості як пропозитивний, так і про негативні наслідки. Не виявлено клінічно значущих взаємодій між наведеними лікарськими засобами при їх одночасному призначенні.
Комбінована терапія бозентаном і сильденафілом приводить до більш значного, ніж монотерапія, збільшення дистанції 6-хвилинної ходьби, цей ефект зберігається протягом 6–12 міс. Це супроводжувалося також позитивною динамікою показника максимального споживання кисню. Проспективних досліджень ефективності такої терапії на момент написання настанови немає. Водночас відомо, що бозентан значно знижує концентрацію сильденафілу в плазмі крові, але клінічні наслідки такої взаємодії залишаються невивченими.
Можливо, у найближчому майбутньому комбіноване лікування пероральними та інгаляційними препаратами зможе відмінити необхідність застосування тривалої парентеральной терапії у хворих з ЛГ. Для цього необхідно провести ретельно сплановані клінічні випробування. Однак слід враховувати фармакоекономічні фактори. Усі сучасні препарати для лікування ЛГ дорогі, і необхідно визначити непросто ефективність, ареальне співвідношення вартість/ефективність для перспективних стратегій комбінованої терапії ЛГ.
Інтервенційне та хірургічне лікування ЛГ. Існує кілька типів інтервенційного та хірургічного лікування ЛГ. Огляд основних типів втручань і їх ефективність за даними доказової медицини наведені в табл. 1.5.
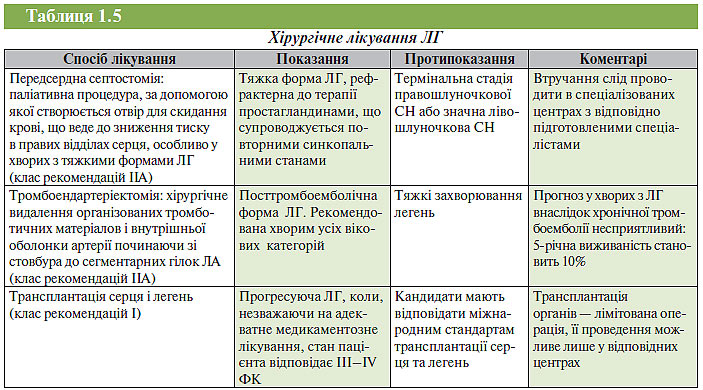
Передсердна септостомія (паліативна процедура) — створення отвору в міжпередсердній перегородці для скидання крові, яке призводить до зниження тиску в правих відділах серця, особливо у хворих з тяжкими формами ЛГ (IV ФК). У деяких пацієнтів спостерігається спонтанне відкриття овального отвору з відповідним клінічним ефектом. Процедуру проводять за допомогою спеціального балонного катетера. Показана хворим з рефрактерними формами ЛГ, коли тривала патогенетична терапія (бозентан або простагландини) не приводить до поліпшення їх клінічного стану. Непоказана хворим з термінальними стадіями правошлуночкової СН або зі значною лівошлуночковою СН. Ризик летального кінця при проведенні цієї процедури становить 5–6%, виконувати її слід лише у відповідних центрах. Віддалені результати балонної передсердної септостомії невідомі.
Легенева тромбоендартеріектомія — ефективний метод лікування ЛГ, яка виникла внаслідок хронічного тромбозу та/чи емболії ЛА. Важливий елемент успішного проведення оперативного втручання — відбір пацієнтів. Важливо, щоб саме тяжкість тромботичної оклюзії визначала тяжкість ЛГ. При цьому сама величина тиску вЛА немає значення для проведення оперативного втручання, оскільки у пацієнтів з найвищим рівнем тиску буде досягнуто найвищого ефекту від такого втручання. Для відбору хворих слід використовувати дані катетеризації правих відділів серця та ангіопульмонографії. Периопераційна смертність у кращих медичних центрах варіює від 5 до 11%. Хоча на сьогодні непроведені контрольовані дослідження ефективності такого оперативного лікування, користь від нього виявляють майже відразу: у більшості хворих регресують симптоми, підвищується переносимість фізичного навантаження, поліпшуються гемодинамічні показники та якість життя. За даними ретроспективного аналізу 5-річна виживаність після вдало проведеного оперативного лікування досягає 75%.
Трансплантація легень або комплексу легень і серця — радикальний хірургічний метод лікування хворих з ЛГ. Операція показана при прогресуючій ЛГ, коли, незважаючи на адекватне медикаментозне лікування, стан пацієнта відповідає III–IV ФК. Усі хворі за результатами тесту 6-хвилинної ходьби <400 м можуть розглядатися як кандидати для проведення трансплантації. При трансплантації лише легень рекомендують проводити пересадження обох легень, а за наявності значних структурно-функціональних змін ПШ операцією вибору є трансплантація серця і легень. Трансплантація органів — лімітована операція, її проведення можливе лише у відповідних центрах. Хворі після операції мають отримувати імуносупресивну терапію. Виживаність після трансплантації серця і легень у хворих з ідіопатичною ЛГ у кращих центрах становить: через 1 рік — 64% (в останні роки — до 74%), через 3 роки — 54%, через 5 років — 44%. У пацієнтів з вродженими вадами серця результати операції, як правило, гірші. Відбір кандидатів для трансплантації серця і легень значно варіює врізних центрах. Водночас бажано, щоб пацієнти були молодшими 50 років, без наявних системних захворювань, таких як неконтрольований цукровий діабет з ураженням органів, виражений атеросклероз, злоякісні новоутворення.
Лікування інших форм ЛГ. На сьогодні з погляду доказової медицини невизначена пріоритетна терапія лікування ЛГ у осіб з ХОХЛ. Мета терапії цих пацієнтів — максимальне збереження функції легень і попередження прогресування бронхообструкції. Стандартна терапія може включати похідні еуфіліну, стимулятори β-адренорецепторів, антигістамінні препарати і стероїдні гормони. Слід запобігати розвитку фібриляції передсердь. При її розвитку можливе призначення дигоксину для контролю ЧСС. Є дані пропозитивний вплив статинів, які попереджають деструкцію легеневої тканини.
Пацієнтам з ідіопатичним легеневим фіброзом показана терапія імунодепресантами і цитостатиками відповідно до стандартів лікування цього захворювання. Особи з лівошлуночковою СН мають отримувати стандартну терапію діуретиками, інгібіторами АПФ і блокаторами β-адренорецепторів, антагоністами альдостерону та за необхідності дигоксином. Можливо, у цих хворих буде позитивною відповідь на призначення антагоністів рецепторів ендотеліну-1.
Спостереження хворих з ЛГ
Після встановлення діагнозу і призначення патогенетичної терапії хворим з ЛГ рекомендовано перебувати на диспансерному обліку за місцем проживання. Терапію ЛГ призначають довічно. Мета спостереження — визначення ефекту призначеного лікування і його своєчасна корекція, формулювання прогнозу щодо життя і працездатності. Слід максимально використовувати неінвазивні процедури в динаміці спостереження: тест із 6-хвилинною ходьбою (1 раз на 3 міс) і ехоКГ (1 раз на 6 міс). Погіршення стану і відсутність ефекту від проведеної терапії — показання для госпіталізації та проведення катетеризації серця з визначенням подальшої тактики лікування.
Прогноз
Прогноз при ЛГ значно відрізняється залежно від її етіології. Прогноз ідіопатичної ЛГ несприятливий, у середньому тривалість життя хворого становить 2,8 року. Для ЛГ при системній склеродермії тривалість життя становить лише 1рік. Прогноз залежить від строків приєднання СН. За її наявності прогноз вкрай несприятливий. Вважається, що сучасне раціональне лікування здатне продовжити період життя цих пацієнтів; проведена терапія в окремих випадках дає час для підготовки до трансплантації серця й легень. Це положення відображене в заключному документі Всесвітнього симпозіуму щодо ЛГ (Venice expert meeting, 2003).
ЛІТЕРАТУРА
- Рекомендации Украинской ассоциации кардиологов по профилактике и лечению артериальной гипертензии (2004) Киев, 84 с.
- Abman S.H. (2007) Recent advances in the pathogenesis and treatment of persistent pulmonary hypertension of the newborn. Neonatology, 91: 283–290.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007) Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest, 131: 1917–1928.
- Barst R.J., McGoon M., Torbicki A. et al. (2004) Diagnosis and differential assessment of pulmonary arterial hypertension (World Symposium on Pulmonary Arterial Hypertension in Venice, 2003). J. Am. Coll. Cardiol., 43, Suppl. S.: 40S–47S.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007). Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest., 131: 1917–1928.
- Benza R.L., Park M.H., Keogh A.et al. (2007) Management of pulmonary arterial hypertension with a focus on combination therapies. J. Heart Lung Transplant., 26: 437–446.
- Gaine S.P., Rubin L.J. (1998) Primary pulmonary hypertension. Lancet, 352: 719–725.
- Galie N., Torbicki A., Barst R. et al. (2004) Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur. Heart. J., 25: 2243–2278.
- Gaynor S.L., Maniar H.S., Bloch J.B. et al. (2005) Right atrial and ventricular adaptation to chronic right ventricular pressure overload. Circulation., 112: I212–I218.
- Gibbs J.S.R., Higenbottam T.W. for British Cardiac Society Guidelines and Medical Practice Committee (2001) Recommendation on the management of pulmonary hypertension in clinical practice. Heart, 86, Suppl. 1: i1–i13.
- Ishida K., Masuda M. (2007) Thromboendarterectomy for severe chronic thromboembolic pulmonary hypertension. Asian Cardiovasc. Thorac. Ann., 3: 229–233.
- Keogh A.M., McNeil K.D., Williams T. et al. (2003) Pulmonary artery hypertension: a new era in management. Med. J. Aust., 178: 564–567.
- Law M.A., Grifka R.G., Mullins C.E. et al. (2007) Atrial septostomy improves survival in select patients with pulmonary hypertension. Am. Heart J., 153: 779–784.
- Macchia A., Marchioli R., Marfisi R. et al. (2007) Meta-analysis of trials of pulmonary hypertension: a clinical condition looking for drugs and research methodology. Am. Heart J., 153: 1037–1047.
- McGoon M., Gutterman D., Steen V. et al. (2004) Screening, early detection, and diagnosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest., 126: 14S–34S.
- McLaughlin V.V., Presberg K.W., Doyle R.L. et al. (2004) Prognosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest., 126: 78S–92S.
- Rubin L.J. (2004) Diagnosis and management of pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest., 126: 7S–10S.
- Simonneau G., Galie N., Rubin L.J. et al. (2004) Clinical classification of pulmonary hypertension. J. Am. Coll. Cardiol., 43, Suppl S.: 5S–12S.
- Stewart S. (2005) Pulmonary arterial hypertension. London and New York: Taylor&Francis, 56 p.
- The American Society for Transplant Physicians/The American Thoracic Society/European respiratory Society/International Society for Heart Lung Transplantation (1997) International guidelines for the selection of lung transplantation. Am. J. Resp. Crit. Care. Med., 158: 335–339.
- World Health Organisation: Primary Pulmonary Hypertension — executive summary (ed. S. Rich) (1998).
- Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.