Тромбоемболія легеневої артерії (ТЕЛА) — це оклюзія основного стовбура чи гілок ЛА частинами тромбу, які формуються у венах великого кола кровообігу чи порожнинах правих відділів серця і переносяться в мале коло кровообігу із плином крові. Тромбоз ЛА — локальне тромбоутворення в системі легеневих артерій. Іноді дуже складно відрізнити локальне тромбоутворення в малому колі кровообігу (у хворих із СН, пухлинами тощо) від емболізації з інших судинних регіонів, тому найчастіше їх розглядають разом як єдиний симптомокомплекс.
Легенева емболія, код за МКХ-10: I26.
ТЕЛА не є самостійним захворюванням, а становить поширене і прогностично досить несприятливе ускладнення різних хвороб, травм та оперативних втручань.
ЕПІДЕМІОЛОГІЯ
ТЕЛА — одне з найпоширеніших ускладнень багатьох захворювань, що становить загрозу для життя хворого. У світі ТЕЛА вважається третьою за частотою причиною смерті. Щорічно від ТЕЛА помирає 0,1% населення земної кулі. За даними Європейського товариства кардіологів у Франції щорічно реєструють до 100 тис. випадків ТЕЛА, в Англії та Шотландії — 65 тис., в Італії — 60 тис., а в США — близько 650 тис. Більшість випадків ТЕЛА розвивається у стаціонарах, причому 70–80% становлять хворі терапевтичного профілю. Серед пацієнтів терапевтичного профілю найчастіше ТЕЛА розвивається при інсульті (56%), ІМ (22%), гострих терапевтичних захворюваннях (16%), новоутвореннях (>15% випадків), а також у осіб похилого віку (9%). При загальній хірургічній патології частота ТГВ становить 32%, при переломах голівки стегнової кістки — 45%, множинних травмах — 50%, при гінекологічних операціях із приводу злоякісних новоутворень — 22%, при гінекологічних операціях з приводу доброякісних новоутворень — 14%.
За даними Фремінгемського дослідження смертність від ТЕЛА становить 15,6% всієї госпітальної смертності (18% — хворі хірургічного профілю, 82% — з терапевтичною патологією). Суттєві відмінності епідеміологічних даних пояснюються відсутністю точної статистики поширеності ТЕЛА, що зумовлено об’єктивними причинами: в більшості випадків епізоди ТЕЛА залишаються не поміченими, оскільки її клінічні симптоми подібні з іншими захворюваннями легеневої та серцево-судинної системи, а при аутопсії часто лише ретельне дослідження ЛА дозволяє виявити тромби чи залишкові ознаки перенесеної ТЕЛА.
Точні статистичні дані щодо частоти випадків ТЕЛА в Україні відсутні, а ймовірна частота захворювання становить близько 50 тис. випадків на рік, в тому числі з летальним результатом — більше 10 тис. В Україні розвиток ТЕЛА ускладнює 0,1–0,3% оперативних втручань і є причиною 20–40% смерті в післяопераційний період. Не рідше ТЕЛА виявляють і у хворих терапевтичного профілю.
За даними Європейського товариства кардіологів прижиттєво ТЕЛА діагностують приблизно у 25% випадків. Рівень смертності при нелікованій ТЕЛА досягає 30%, проте проведення адекватної антикоагулянтної терапії дозволяє знизити його до 2–8%. Імовірність рецидивів ТЕЛА в нелікованих хворих становить близько 50%, у половини з яких також несприятливий прогноз.
ЕТІОЛОГІЯ
Венозний тромбоз будь-якої локалізації може ускладнитися розвитком ТЕЛА. Найбільшу загрозу становить басейн нижньої порожнистої вени, з тромбоутворенням у якому пов’язано близько 90% всіх епізодів ТЕЛА. Часта причина ТЕЛА (70%) — гострий ТГВ ілеофеморального сегмента і проксимальних відділів вен нижніх кінцівок (підколінно-стегновий сегмент).
Венозний тромбоз із локалізацією в дистальних відділах глибоких вен нижніх кінцівок (гомілка) ускладнюється ТЕЛА із частотою 1–5%, а тромбоз поверхневих вен майже ніколи не приводить до розвитку ТЕЛА. Часто відзначають тромбоз одночасно глибоких і поверхневих вен гомілки (рис. 1.1). Найбільшу загрозу становлять так звані флотуючі тромби. Вони мають єдину точку фіксації в дистальному відділі, а довжина їх іноді досягає 15–20 см. Виникнення флотуючих тромбів часто зумовлено поширенням процесу з вен невеликого калібру у великі венозні судини. При оклюзивному флеботромбозі флотуюча верхівка тромбу може стати потенційним емболом (рис. 1.2). Слід зазначити, що при флотуючому тромбі не відзначають будь-яких клінічних проявів, оскільки кровотік в ураженій вені зберігається.
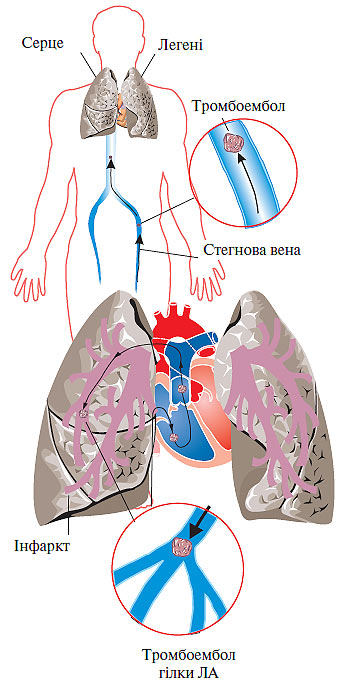
Рис. 1.1. Схема міграції тромбоембола із стегнової вени в легеню
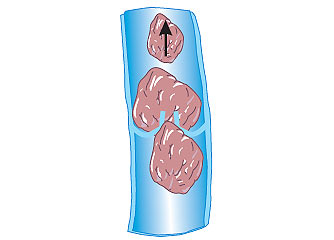
Рис. 1.2. Утворення ембола
При тромбах, які повністю закривають просвіт судини, ТЕЛА не розвивається. Є повідомлення про випадки ТЕЛА з басейну верхньої порожнистої вени (до 3,5%) внаслідок введення венозних катетерів у відділеннях реанімації та блоках інтенсивної терапії. Значно рідше до розвитку ТЕЛА призводять тромби із локалізацією у правому передсерді за умови його дилатації чи фібриляції передсердь.
Відриваючись від венозної стінки в місці утворення, тромби з потоком крові потрапляють у ЛА. Локалізація тромбоемболів у судинному руслі легень багато в чому залежить від їх розмірів. Зазвичай емболи затримуються в місцях розгалуження артерій, викликаючи часткову або, що трапляється рідше, повну оклюзію дистальних гілок. У 65% випадків уражується ЛА обох легень, у 20% — лише правої легені, у 10% — лише лівої легені, причому нижні сегменти уражуються в 4 рази частіше, ніж верхні. У хворих з відкритим овальним вікном за наявності високої легеневої гіпертензії тромбоемболи можуть потрапити в артерії великого кола кровообігу (парадоксальна тромбоемболія) і призвести до емболії артерій мозку, черевного відділу аорти, магістральних артерій нижніх кінцівок та ін.
За даними Французького реєстру в 50% ТЕЛА джерело емболії та фактори ризику встановити не вдається. Імовірно, у багатьох випадках має місце локальне тромбоутворення в системі ЛА. Первинний тромбоз ЛА частіше розвивається при застійних явищах у малому колі кровообігу при тяжких захворюваннях серця та легень, а також при вродженій схильності до тромбозу. Важливе значення мають зміни в системі гемостазу, спонтанного фібринолізу, ретракції та організації венозних тромбів.
ФАКТОРИ РИЗИКУ
Оскільки тромбоз магістральних вен і ТЕЛА — прояви однієї патології, вони мають загальні фактори ризику. Виокремлюють первинні (спадкові) та вторинні (набуті) фактори ризику тромбозу глибоких вен нижніх кінцівок і ТЕЛА (табл. 1.1). Багато пацієнтів мають спадкову схильність до тромбозу, що розвивається під впливом провокуючих факторів. Різні фактори ризику можуть поєднуватися один із одним, хоча у значної частини хворих класичні сприятливі фактори відсутні.
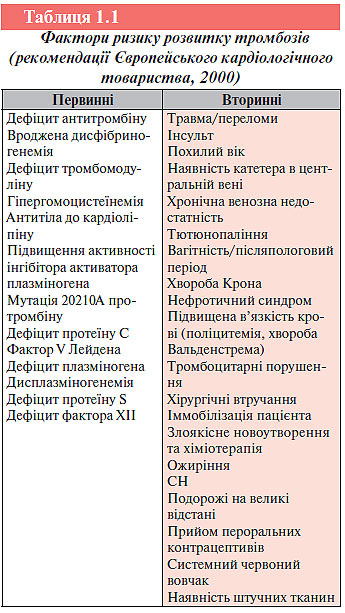
Вроджена схильність до тромбозу як самостійний фактор ризику вважають надзвичайно рідкісним явищем, хоча реальне її поширення невідоме. Припустити наявність генетичних дефектів слід у разі розвитку тромбозу неясного генезу у осіб віком до 40 років, рецидивного тромбозу глибоких вен і ТЕЛА чи обтяженого анамнезу. Частота тромбоемболічних ускладнень підвищується з віком, хоча ця тенденція може відображати розвиток захворювань, що є об’єктивними факторами ризику розвитку тромбозу.
Одним із провідних факторів, що спричиняє тромбоутворення у глибоких венах нижніх кінцівок, — гіподинамія. Значне зменшення роботи м’язів нижніх кінцівок призводить до сповільнення кровотоку у венах, що спричиняє утворення тромбів. Тромбоемболії часто виявляють при серцево-судинних захворюваннях, у тому числі у 30–60% пацієнтів із інсультом, 5–35% — із гострим ІМ і у 12% — із хронічною СН. Розвиток тромбозу глибоких вен і ТЕЛА спричиняє іммобілізація пацієнта, навіть нетривала (на 1 тиж), і хірургічні втручання (наприклад після оперативних втручань із приводу перелому стегнової кістки частота тромбоемболії за відсутності профілактичної терапії становить 50–75%).
Вагомий фактор ризику розвитку ТЕЛА — подорожі на великі відстані. Так, при тривалих перельотах, починаючи з 2500 км, імовірність розвитку ТЕЛА підвищується зі збільшенням відстані (рис. 1.3).
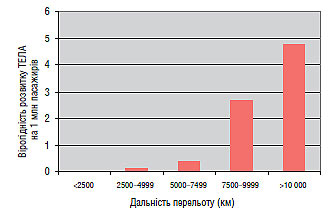
Рис. 1.3. Імовірність розвитку ТЕЛА залежно від дальності перельоту (Lapostolle F. et al., 2001)
Тому при тривалості польоту >6 год пасажирам рекомендується не перетискати одягом нижні кінцівки та запобігати розвитку дегідратації, а за наявності додаткових факторів ризику ТЕЛА — проводити профілактичну компресію ніг за допомогою медичних трикотажних виробів або еластичного бинта. Альтернативний метод — одноразове введення перед польотом низькомолекулярного гепарину (НМГ) у профілактичній дозі. Профілактичне застосування ацетилсаліцилової кислоти не рекомендується.
До важливих факторів ризику ТЕЛА (близько 30%) належать злоякісні новоутворення, які супроводжуються синдромом гіперкоагуляції і пригнічення системи фібринолізу. Часто ТЕЛА ускладнює перебіг післяопераційного періоду (оперативні втручання на матці, яєчниках, передміхуровій залозі, сечовому міхурі, шлунку, товстій кишці тощо), особливо за наявності гнійно-септичних ускладнень.
У період вагітності ризик розвитку тромбоемболії підвищується у 5 разів. Замісна гормональна терапія в період менопаузи призводить до підвищення ризику тромбозів та емболії у 3 рази. До самостійних факторів ризику належать також тютюнопаління та ожиріння. У клінічних дослідженнях і під час аутопсій виявити джерело тромбу при ТЕЛА вдавалося у 50–70% випадків. Із них у 70–90% джерелом ТЕЛА був тромбоз судин, що впадають у нижню порожнисту вену, а у 10–20% — у верхню порожнисту вену.
ПАТОГЕНЕЗ
Більше сторіччя тому, в 1856 г., Рудольф Вірхов установив, що до розвитку венозного тромбозу призводять три фактори:
- локальне ураження ендотелію;
- підвищення згортальної здатності крові;
- локальне сповільнення кровотоку (стаз).
Початковим етапом тромбогенезу в більшості випадків є пошкодження ендотелію судинної стінки. Відомо, що ендотелій має потужний вплив на стан коагуляційного гемостазу. В нормі клітини ендотелію синтезують ендотелін, простациклін, оксид азоту — речовини, які попереджують спазм судин і тромбоутворення, гальмують адгезію та агрегацію тромбоцитів. Крім цього, ендотеліальні клітини виділяють тканинний активатор плазміногена, що ініціює фібриноліз у відповідь на тромбоутворення. При пошкодженні поряд із пригніченням захисного впливу ендотелію на згортальні властивості крові відбувається вивільнення у кровотік прокоагулянтних речовин, зокрема фактора Віллебранда і тканниного фактора. Крім того, оголений субендотеліальний шар судин сам стає потужним стимулятором адгезії та агрегації тромбоцитів, із яких вивільняється ряд біологічно активних речовин (АДФ, серотонін, фактор ІІІ, тромбопластин та ін.). Активація тромбоцитів стимулює запуск коагуляційного каскаду за участю всіх факторів згортання крові з утворенням тромбіну, що перетворює фібриноген у фібрин і призводить до формування фібрин-тромбоцитарного тромбу.
Тромб від місця утворення переноситься із плином крові в ПШ, де частково руйнується і у вигляді окремих фрагментів потрапляє в мале коло кровообігу. Тому в більшості випадків відзначають множинну оклюзію декількох гілок ЛА різного калібру, часто двосторонню — немасивну ТЕЛА. Значно рідше відбувається масивна тромбоемболія головних гілок або стовбура ЛА, що супроводжується гострим розвитком клінічної картини тяжкої тромбоемболії, що закінчується швидкою раптовою серцевою смертю. При субмасивній ТЕЛА емболізуються дольові й сегментарні гілки ЛА.
Механічна обструкція артеріального русла легень тромбоемболом, у якій значну роль відіграє спазм ЛА у відповідь на механічне подразнення, і нейрогуморальна реакція, що виникає у відповідь, мають провідне значення в генезі респіраторних і гемодинамічних розладів, вираженості клінічних проявів і ступеня тяжкості ТЕЛА. Дія гуморальних факторів не залежить від розмірів тромбу, тому емболія навіть дрібної гілки ЛА може призвести до значних порушень гемодинаміки. Це пояснює часту невідповідність між обсягом емболічної оклюзії легеневих судин і тяжкістю клінічної картини ТЕЛА.
Гемодинамічні розлади
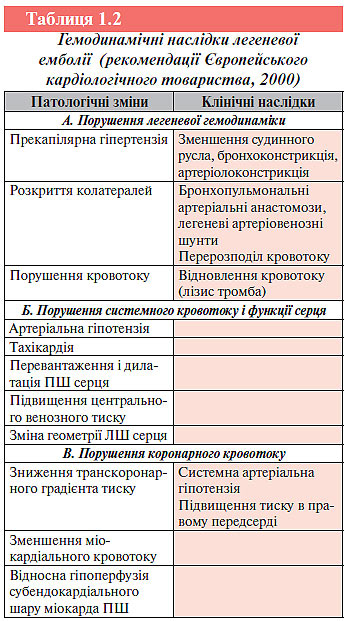
Внаслідок часткової чи повної механічної обструкції легенево-артеріального русла тромбоемболом відбувається різко виражений генералізований спазм артеріол малого кола (прекапілярна гіпертензія), переважно за рахунок барорефлексу та вивільнення вазоконстрикторних субстанцій (тромбоксану А2, серотоніну, гістаміну тощо) із тромбоцитів, які осідають на поверхні тромбоембола. В результаті цього легеневий судинний опір значно зростає і розвивається легенева гіпертензія. У осіб без супутніх захворювань серця та легень гостра гіпертензія малого кола кровообігу виникає при обструкції близько 40–50% легеневого артеріального русла. Оклюзія 60–75% легеневої циркуляції є критичною і призводить до розвитку гострої правошлуночкової недостатності і різкого зменшення об’єму циркулюючої крові. Необхідно відзначити, що при ТЕЛА ступінь оклюзії просвіту судини згодом може збільшуватися за рахунок приєднання вторинного місцевого тромбозу, що збільшує розміри тромбоембола щодо об’єму кровотоку. Нерідко це призводить до трансформації немасивної ТЕЛА в масивну (табл. 1.2).
При першому епізоді субмасивної і навіть масивної ТЕЛА, що не призводить до раптової смерті, систолічний тиск у ЛА найчастіше залишається відносно невисоким (40–50 мм рт. ст.). Негіпертрофований ПШ не може забезпечити систолічний тиск >70 мм рт. ст. Високі значення цього показника, як правило, свідчать про поступове формування легеневої гіпертензії в результаті декількох епізодів ТЕЛА чи про наявність хронічної легеневої гіпертензії іншого генезу.
Підвищення легеневого судинного опору супроводжується зростанням напруження у стінці ПШ серця і його дилатацією, внаслідок цього міжшлуночкова перегородка випинається в порожнину ЛШ і звужує його просвіт, а стиснення правої коронарної артерії викликає ішемію, а іноді й ІМ ПШ серця.
Підвищення легеневого судинного опору і надмірне навантаження на ПШ серця (підвищення постнавантаження) на фоні значного зменшення ємкості артеріального русла (зниження переднавантаження) призводить до значного обмеження венозного припливу крові в ліві відділи серця і розвитку синдрому малого серцевого викиду: зменшуються хвилинний об’єм, серцевий індекс, знижується рівень АТ, порушується кровопостачання життєво важливих органів (головного мозку, серця, нирок). Порушення центральної гемодинаміки при ТЕЛА можуть бути різного ступеня вираженості: від помірно вираженої дилатації ПШ серця з компенсаторною гіперфункцією і без істотного зменшення серцевого викиду в стані спокою до обструктивного кардіогенного шоку з високим центральним венозним тиском і зниженим АТ внаслідок порушення наповнення ЛШ серця в діастолу. Це може призвести до зменшення коронарного кровотоку і погіршити перфузію міокарда, переважно ПШ серця. У деяких випадках можливий розвиток гострого набряку легень, що має складний патофізіологічний механізм. Велике значення має рефлекторний викид норадреналіну у відповідь на ураження великого обсягу легеневої тканини, що викликає спазм легеневих артеріол і перевантаження ЛШ серця. Крім того, різка дилатація ПШ серця призводить до здавлювання ЛШ і підвищення тиску в лівому передсерді і, таким чином, збільшує легеневу гіпертензію. У патогенезі набряку легень при емболіях дрібних гілок ЛА істотну роль відіграє підвищення проникності альвеолярно-капілярної мембрани у поєднанні зі збільшенням легеневого кровотоку по гілках ЛА, в яких оклюзія відсутня (схема 1.1).

Схема 1.1. Патогенез ТЕЛА (зі змінами за Г.Є. Ройтверг, А.В. Струтинським)
Респіраторні розлади
Повне або часткове припинення легеневого кровотоку в результаті ТЕЛА призводить до вираженого порушення вентиляційно-перфузійного співвідношення, внаслідок чого розвивається дихальна недостатність і артеріальна гіпоксемія. В результаті припинення кровотоку в добре вентильованих альвеолах відбувається збільшення внутрішньолегеневого «мертвого простору» і погіршення газообміну. Порушення вентиляційно-перфузійного співвідношення посилюється вираженим бронхоспазмом, пов’язаним із дією на гладкі м’язи дрібних бронхів біологічно активних речовин, які виділяються із тромбоцитів (тромбоксан А2, серотонін та ін.). Крім того, внаслідок ішемії альвеол, зумовленої їх недостатньою перфузією, порушується не лише вентиляція, але й продукція сурфактанта, що може призвести до розвитку ателектазів на 1–2-й добі після тромбоемболії.
Внаслідок недостатності кровопостачання альвеол може розвинутися інфаркт легені. Крім того, зниження вентиляції альвеол зі збереженою перфузією ще більше порушує газообмін у легенях і призводить до посилення артеріальної гіпоксемії. Нарешті, в результаті підвищення тиску проксимальніше місця оклюзії відкриваються артеріоло-венозні анастомози і відбувається шунтування крові з артеріол у вени, що також збільшує артеріальну гіпоксемію.
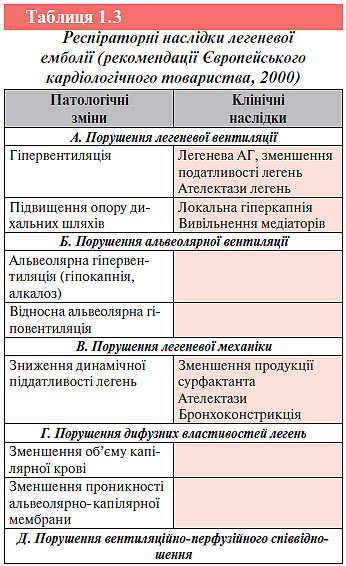
При альвеолярно-інтерстиціальному набряку легень відбувається стимуляція юкстакапілярних рецепторів в альвеолярно-капілярній мембрані. Це призводить до підвищення вагусної аферентної активності з подальшою стимуляцією респіраторних нейронів довгастого мозку, в результаті чого виникає гіпервентиляція та гіперкапнія (табл. 1.3).
Слід підкреслити, що далеко не завжди при ТЕЛА відзначають всі порушення гемодинаміки та альвеолярної вентиляції. Це залежить, насамперед, від масивності тромбоемболії, локалізації тромбоембола і вихідного кардіопульмонального статусу хворого. Рецидивна оклюзія великих ЛА викликає розвиток тяжкої гіпертензії малого кола кровообігу і розвиток хронічного легеневого серця. Ступінь вираженості хронічної легеневої гіпертензії залежить від багатьох факторів: повноти спонтанного чи медикаментозного лізису тромбу, рецидивів ТЕЛА, утворення тромбів навколо ділянки первинної тромбоемболії, процесів організації та внутрішньосудинного ремоделювання тромбів, перебудови мікроциркуляторного русла легень.
КЛАСИФІКАЦІЯ ТРОМБОЕМБОЛІЙ ЛЕГЕНЕВОЇ АРТЕРІЇ
Згідно з МКХ-10-го перегляду ТЕЛА належить до захворювань серцево-судинної системи.
Міжнародна класифікація передбачає виокремлення 2 основних груп ТЕЛА — масивну і немасивну.
ТЕЛА вважають масивною, якщо у пацієнтів розвиваються явища кардіогенного шоку та/ чи артеріальна гіпотензія (зниження САТ <90 мм рт. ст., або зниження на ≥40 мм рт. ст. від початкового рівня, що триває >15хв і не пов’язане з гіповолемією, сепсисом, аритмією). Масивна ТЕЛА розвивається при обструкції >50% судинного русла легень.
Немасивну ТЕЛА діагностують у пацієнтів зі стабільною гемодинамікою без виражених ознак правошлуночкової недостатності. Немасивна ТЕЛА розвивається при обструкції <50% судинного русла легень.
Серед пацієнтів із немасивною ТЕЛА, за умови виявлення ознак гіпокінезії ПШ (при проведенні ехоКГ) і стабільної гемодинаміки, виокремлюють підгрупу субмасивної ТЕЛА. Субмасивна ТЕЛА розвивається при обструкції ≥30% судинного русла легень.
По гостроті розвитку патологічного процесу виокремлюють такі форми ТЕЛА:
- гостра — характеризується раптовим початком, болем за грудиною, задишкою, зниженням АТ, ознаками гострого легеневого серця, можливим розвитком обструктивного шоку;
- підгостра — характерні прогресування дихальної та правошлуночкової недостатності, ознаки тромбоінфарктної пневмонії;
- хронічна рецидивна — характерні повторні епізоди задишки, симптоми тромбоінфарктної пневмонії, поява та прогресування ХСН із періодами загострення, поява та прогресування ознак хронічного легеневого серця.
КЛІНІКА
Клінічна картина захворювання неспецифічна і характеризується поліморфізмом симптомів — від виражених гемодинамічних порушень і розвитку гострої правошлуночкової недостатності до безсимптомного перебігу захворювання. Вираженість клінічних проявів визначається обсягом емболізації легеневого судинного русла, локалізацією тромбоембола, рівнем легеневої гіпертензії, ступенем гемодинамічних розладів, вихідним кардіопульмональним статусом хворого, наявністю інфаркту легень, тромбоінфарктної пневмонії та іншими факторами. У 90% випадків ТЕЛА можна запідозрити на підставі наявності таких клінічних симптомів: задишка, біль у грудній клітці та втрата свідомості. Сукупність задишки, тахіпное та болю в грудній клітці виявляють у 97% хворих.
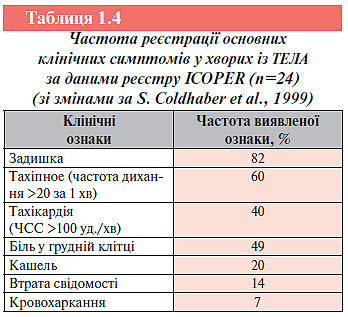
При аналізі даних міжнародного реєстру ICOPER встановлено, що з 2454 пацієнтів у більшості (89%) відзначали клінічні ознаки ТЕЛА при збереженні стабільної гемодинаміки, в 4% — нестабільну гемодинаміку (САТ <90 мм рт. ст.), а у 7% — безсимптомний перебіг захворювання. Частота реєстрації основних клінічних ознак ТЕЛА наведена в табл.1.4.
ОСНОВНІ КЛІНІЧНІ СИНДРОМИ
Кардіальний синдром
Гостра недостатність кровообігу (переважно правошлуночкова) проявляється артеріальною гіпотензією. Артеріальна гіпотензія (транзиторна чи стійка) — характерна ознака ТЕЛА, зумовлена різким зниженням серцевого викиду, що розвивається внаслідок гострого перевантаження правих відділів серця і різкого зменшення припливу крові до лівих відділів серця. Виражена артеріальна гіпотензія, як правило, свідчить про наявність масивної ТЕЛА.
Обструктивний шок розвивається приблизно у 20% хворих.
Синдром гострого легеневого серця виникає при масивній ТЕЛА. При об’єктивному обстеженні визначається набрякання шийних вен, патологічна пульсація в епігастральній ділянці, розширення правої межі серця, акцент і роздвоєння II тону над ЛА, систолічний шум над мечоподібним відростком або в четвертому міжребер’ї по лівому краю грудини; в п’ятому міжребер’ї по лівому краю грудини прослуховується патологічний III тон (правошлуночковий протодіастолічний ритм галопу). Майже завжди відзначають підвищення центрального венозного тиску, збільшення печінки і абдомінально-югулярний рефлюкс.
Ангінозний біль за грудиною, що нагадує стенокардію, пов’язаний з дилатацією виносного тракту ПШ, легеневого конуса та різким зменшенням коронарного кровотоку внаслідок зниження УОК і ХОК.
Тахікардія зазвичай буває синусовою, можливе виникнення тахісистолічної форми фібриляції чи тріпотіння передсердь, суправентрикулярної тахікардії. Часто розвивається гостра блокада правої ніжки пучка Гіса. Можуть виникати загрозливі для життя порушення ритму: шлуночкова тахікардія та фібриляція шлуночків.
Гострий набряк легень при ТЕЛА виникає рідко, переважно за наявності супутньої патології серцево-судинної системи.
Легенево-плевральний синдром
Задишка — основний і найбільш характерний симптом ТЕЛА, що є проявом дихальної недостатності. Задишка виникає раптово у стані спокою, має інспіраторний характер і буває різного ступеня вираженості. Ізольована задишка, яка виникає гостро, зазвичай є результатом масивної ТЕЛА, що нерідко супроводжується болем за грудиною та вираженими гемодинамічними порушеннями. Іноді, при немасивній ТЕЛА, задишка розвивається поступово протягом декількох тижнів. За відсутності хронічних бронхолегеневих і серцево-судинних захворювань задишка не супроводжується дистанційними хрипами, диханням, що клекоче, і не залежить від локалізації ТЕЛА, ортопное не відзначають. Зазвичай задишка супроводжується тахіпное і тахікардією, ступінь вираженості яких залежить від масивності ТЕЛА та вихідного кардіопульмонального статусу хворого. Підвищення показників частоти дихання >40 за 1 хв і ЧСС >120 уд./хв має несприятливе прогностичне значення.
Біль у грудній клітці плеврального характеру, що посилюється при диханні, кашлі, зумовлений розвитком інфаркту легені, інфарктної пневмонії чи сухого плевриту (легенево-плевральний синдром) і не є провідним діагностичним критерієм. Кашель непродуктивний. У 10–30% хворих виявляють кровохаркання, зумовлене розвитком інфаркту легень, часто у вигляді прожилок крові в мокротинні, можлива легенева кровотеча. Характерна блідість шкірних покривів, які набувають попелястого відтінку. При масивній ТЕЛА з’являється виражений «чавунний» ціаноз ділянки шиї та верхньої половини тулуба.
Притуплення перкуторного звуку, посилення голосового тремтіння, вологі хрипи і крепітацію відзначають при інфаркті легені та інфарктній пневмонії. У період формування інфаркту легені з’являється шум тертя плеври, що прослуховується протягом декількох годин або днів і зникає при зменшенні вираженості явищ фібринозного плевриту або накопиченні ексудату в плевральній порожнині. Ексудативний плеврит розвивається у 50% хворих з інфарктом легені. Іноді виявляють стійкий ексудативний плеврит, що сприяє затяжному перебігу захворювання. Можуть також відзначати помірно виражений бронхообструктивний синдром.
Температура тіла підвищується, як правило, з 1–2-го дня хвороби, зберігається кілька днів (рідше — 1–3 тиж), зазвичай субфебрильна, а при розвитку інфарктної пневмонії підвищується до 38,5–39 °С.
Церебральний синдром
При масивній ТЕЛА можуть відзначати порушення з боку ЦНС (втрата свідомості, судоми, блювання, кома), в основі яких лежить гіпоксія головного мозку.
Нирковий синдром
Іноді перебіг ТЕЛА ускладнюється розвитком ГНН, в патогенезі якої провідна роль належить різкому зниженню рівня АТ у поєднанні з констрикцією юкстагломерулярних судин, що призводить до зниження фільтраційного тиску в клубочках нирок.
Абдомінальний синдром
Можуть відзначати різкий біль у правому підребер’ї, що супроводжується парезом кишечнику, гикавкою, симптомами подразнення очеревини. Це пов’язане з гострим збільшенням печінки при правошлуночковій недостатності або із розвитком великого інфаркту правої легені.
Масивна ТЕЛА розвивається при обструкції >50% легеневого артеріального русла. Перебіг захворювання характеризується бурхливою симптоматикою і часто закінчується раптовою смертю. Клінічна картина тромбоемболії стовбура чи великих гілок ЛА в більшості випадків характеризується гострим початком захворювання, бурхливим прогресуванням симптомів емболії, розвитком дихальної правошлуночкової недостатності, зниженням АТ та порушенням перфузії внутрішніх органів.
Виокремлюють три форми масивної тромбоемболії легеневої артерії:
- миттєва — закінчується раптовою смертю;
- циркуляторна — характеризується розвитком кардіогенного шоку з вираженою картиною правошлуночкової недостатності;
- респіраторна — характеризується вираженою задишкою, тахіпное, дифузним ціанозом.
Субмасивна ТЕЛА розвивається при обструкції >30% легеневого артеріального русла. Характеризується дисфункцією ПШ і стабільною гемодинамікою. Проте ці хворі мають високий ризик розвитку ускладнень, в тому числі фатальних (гостре легеневе серце, кардіогенний шок). Має перебіг із вираженими клінічними симптомами.
Немасивна ТЕЛА зазвичай розвивається при обструкції <30% легеневого артеріального русла. Часто має перебіг із менш вираженими симптомами чи безсимптомно і залишається нерозпізнаною. У більшості випадків немасивна ТЕЛА має перебіг під маскою інших захворювань і синдромів. У клінічній картині на перший план виступають явища тромбоінфарктної пневмонії. Маніфестує задишкою, що виникає гостро і посилюється при переході пацієнта у вертикальне положення, кровохарканням, тахікардією, болем у грудній клітці в місці ураження легені (внаслідок залучення в патологічний процес плеври).
Слід підкреслити, що часто тяжкість клінічної картини захворювання не відповідає обсягу тромбоемболічної оклюзії. Так, емболія дрібних гілок ЛА може мати перебіг із чітко вираженими симптомами інфаркту легені, інтенсивним плевральним болем, ознаками дихальної недостатності та артеріальною гіпотензією, тоді як деякі випадки масивної ТЕЛА можуть проявлятися лише помірно вираженою задишкою і тахікардією.
Інфаркт легені
У 10–30% випадків перебіг ТЕЛА ускладнюється розвитком інфаркту легені. Інфаркт легені розвивається переважно при тромбоемболії дольових і сегментарних гілок ЛА. Велике значення в поширенні інфаркту легені має пригнічення ендогенного фібринолізу. Необхідною умовою його розвитку, поряд із оклюзією гілок ЛА, є зниження кровотоку в бронхіальних артеріях, розвиток колатералей і порушення прохідності бронхів. Тому найчастіше інфаркт легені розвивається при ТЕЛА, що ускладнює перебіг застійної СН, мітрального стенозу, пневмонії, ХОХЛ. Зазвичай інфаркт легені має геморагічний характер за рахунок крововиливу з бронхіальних артерій у легеневу тканину і зворотного потоку крові з легеневих вен. Формування інфаркту легені починається через 24 год після початку захворювання, а повний його розвиток відбувається через 5–6 діб. Інфікування інфаркту легені призводить до розвитку перифокальної пневмонії.
Клінічні ознаки інфаркту легені — раптовість виникнення, гострий біль у грудній клітці, кровохаркання, задишка, тахікардія, крепітація та вологі хрипи при аускультації над відповідною ділянкою легені, підвищення температури тіла.
Біль, зумовлений реактивним плевритом над ураженою ділянкою легені, з’являється у відповідній половині грудної клітки і характеризується посиленням при глибокому диханні, кашлі, іноді при натисканні на відповідні міжреберні проміжки. При накопиченні ексудату в плевральній порожнині біль зникає. У разі залучення в патологічний процес діафрагмальної плеври можуть відзначати псевдосимптоми гострого живота. Кровохаркання при інфаркті легені виникає у 10–56% хворих, у більшості випадків незначне. Підвищення температури тіла, як правило, відзначають з 1–2-го дня хвороби. Температура тіла субфебрильна, при розвитку інфарктної пневмонії підвищується до 38,5–39 °С. Притуплення перкуторного звуку, посилення голосового тремтіння, вологі хрипи і крепітацію визначають лише при великих інфарктах легені та інфарктних пневмоніях. У період формування інфаркту легені з’являється шум тертя плеври. Ексудативний плеврит розвивається у половини хворих інфарктом легені при його субплевральній локалізації. Серозний або геморагічний ексудат має невеликий об’єм. Іноді розвивається стійкий ексудативний плеврит, що спричиняє затяжний перебіг захворювання. Зрідка інфаркт легені може ускладнюватися розвитком абсцедивної пневмонії, емпіеми плеври і спонтанного пневмотораксу.
Рецидивна ТЕЛА
У осіб, які перенесли перший епізод ТЕЛА, відзначають високий ризик рецидиву у найближчі роки. Рецидивний перебіг захворювання відзначають у 9,4–34,6% пацієнтів із ТЕЛА. У третини хворих із масивною ТЕЛА її розвитку передують емболії дрібних гілок ЛА, а впродовж 4–6 тиж після першого епізоду існує високий ризик повторної ТЕЛА. Цей ризик приблизно в 2,5 раза вищий у чоловіків, ніж у жінок. Крім того, ризик рецидиву ТЕЛА у 2 рази вищий у жінок, які приймають гормональні контрацептиви, і у пацієнтів з ідіопатичною формою захворювання. Рецидивна ТЕЛА найчастіше виникає на фоні серцево-судинних захворювань, що мають перебіг із порушеннями ритму і СН, злоякісних новоутворень, а також після оперативних втручань на органах черевної порожнини. У більшості випадків рецидивна ТЕЛА не має яскравих клінічних проявів, має латентний перебіг, під маскою інших захворювань, що створює значні труднощі при діагностиці, особливо якщо не вдається виявити фактори ризику тромбозу.
Рецидиви ТЕЛА можуть проявлятися:
- немотивованою задишкою (епізоди, які раптово виникають і швидко проходять);
- повторними пневмоніями, частина яких має перебіг як плевропневмонія;
- швидкоминучим сухим плевритом, ексудативним плевритом, особливо з геморагічним випотом;
- повторними «немотивованими» непритомностями, колапсом, які нерідко поєднуються із відчуттям нестачі повітря і тахікардією;
- почуттям стиснення у грудній клітці, що виникає раптово;
- лихоманкою невстановленого походження, стійкою до терапії антибактеріальними препаратами;
- пароксизмальною задишкою із відчуттям нестачі повітря і тахікардією;
- появою чи прогресуванням СН, резистентної до терапії;
- появою та прогресуванням симптомів підгострого чи хронічного легеневого серця за відсутності даних в анамнезі щодо хронічних захворювань бронхолегеневого апарату.
Рецидивний перебіг ТЕЛА призводить до розвитку пневмосклерозу, емфіземи легень, легеневої гіпертензії, прогресуючої правошлуночкової недостатності. Черговий рецидив захворювання може призвести до раптової смерті хворого від масивної емболії.
ДІАГНОСТИКА
Своєчасна діагностика ТЕЛА дотепер представляє значні труднощі у зв’язку з неспецифічністю та поліморфізмом клінічних синдромів, що розвиваються, раптовістю розвитку, катастрофічною швидкістю перебігу захворювання і неможливістю використання в багатьох лікувальних закладах високоінформативних методів дослідження (сцинтиграфія легень, ангіопульмонографія, КТ). При житті захворювання діагностують у 50–70% випадків, гіпердіагностика — у 65%. Величезне значення у своєчасній діагностиці ТЕЛА має настороженість лікаря, що ґрунтується на оцінці факторів ризику та клінічних симптомів захворювання.
Визначення клінічної імовірності ТЕЛА
Визначення клінічної імовірності — важливий компонент ведення пацієнтів із підозрою на ТЕЛА. У клінічній практиці найчастіше використовують правило (шкалу) P.S. Wells і женевський рахунок. Так, у 2000 р. P.S. Wells і M. Rodger запропонували шкалу оцінки виявлених клінічних ознак у балах (табл. 1.5).
Таблиця 1.5
Шкала оцінки ймовірності ТЕЛА на підставі клінічних ознак (Wells P.S., Rodger M., 2000)
| Ознака | Бали* |
| Клінічні симптоми тромбозу глибоких вен нижніх кінцівок (як мінімум — їх набряк і болючість при пальпації по ходу глибоких вен) | +3 |
| При проведенні диференційного діагнозу ТЕЛА більш вірогідна, ніж альтернативний діагноз | +3 |
| Тахікардія (ЧСС >100 уд./хв) | +1,5 |
| Іммобілізація чи хірургічне втручання протягом останніх 4 тиж | +1,5 |
| ТГВ нижніх кінцівок або ТЕЛА в анамнезі | +1,5 |
| Кровохаркання | +1 |
| Онкологічні захворювання на сьогодні або давністю ≤6 міс | +1 |
*Якщо сума балів за шкалою ≤2, імовірність ТЕЛА низька; при 2–6 — помірна; >6 балів — імовірність висока.
Недолік використання цього тесту — введення в рахунок нестандартизованого клінічного судження про більш імовірний альтернативний діагноз. У свою чергу, шкала женевського рахунку (табл. 1.6) дуже складна. У ній передбачено визначення газового складу артеріальної крові, що часто недоступно в реальній клінічній практиці і не рекомендовано Європейським товариством кардіологів у зв’язку з незначною інформативністю та неспецифічністю змін при ТЕЛА.
З огляду на вищезазначене швейцарські і французькі вчені, які брали участь у розробці женевського рахунку, створили нове прогностичне правило для оцінки клінічної імовірності ТЕЛА, що базується винятково на доступних клінічних даних (табл. 1.7). Шкала переглянутого женевського рахунку ґрунтується на ретроспективному аналізі даних 965 пацієнтів, госпіталізованих із підозрою на ТЕЛА.

Інформативність цього правила була перевірена на незалежній когорті учасників (n=749) проспективного дослідження. Період спостереження становив 3 міс. Точність прогнозу виявилася подібною до ретроспективних даних первісної когорти хворих, на яких розробляли правило. Переглянутий женевський рахунок має велике клінічне значення і рекомендований для використання Європейським товариством кардіологів як перший етап діагностики ТЕЛА.
Лабораторна діагностика
На сьогодні існують різні маркери тромбоутворення: тромбін-антитромбіновий комплекс, фібринопептид А, розчинні фібрин-мономірні комплекси, проте, найбільше значення має визначення D-димера у плазмі крові.
D-димер
У більшості пацієнтів із венозним тромбозом відзначають ендогенний фібриноліз, що недостатньо ефективний для відкриття судини, але викликає руйнування певної кількості фібрину з утворенням продукту розпаду перехреснозв’язаного фібрину — D-димера. Підвищення концентрації D-димера, визначеного методом імуноферментного аналізу (ELISA), >500 мкг/л свідчить про спонтанну активацію фібринолітичної системи крові у відповідь на тромбоутворення у венозній системі. Метод характеризується високою чутливістю (96–99%) і негативною передбачувальною цінністю (99,6%), проте низькою специфічністю (приблизно 50%). Це пов’язане з тим, що концентрація продуктів розпаду фібрину підвищується при багатьох станах, зокрема при сепсисі, гострому ІМ, злоякісних новоутвореннях, запаленні, після оперативних втручань, при деяких системних захворюваннях тощо. Необхідно підкреслити, що у багатьох пацієнтів після перенесеної ТЕЛА рівень D-димера у периферичній крові залишається підвищеним протягом декількох місяців, незважаючи на антикоагулянтну терапію. Тому при рецидивній ТЕЛА підвищення рівня D-димера не є маркером повторного тромбоутворення, хоча нормальні значення показника дозволяють виключити рецидив захворювання (чутливість приблизно 100%).
Таким чином, нормальний рівень D-димера у периферичній крові хворого з високою імовірністю дозволяє виключити ТЕЛА, а підвищений — потребує продовження обстеження пацієнта з використанням інструментальних методів діагностики.
Дослідження газового складу крові
При масивній ТЕЛА можуть виявляти розвиток гіпоксемії, гіпокапнії та дихального алкалозу. Проте проспективне вивчення методів діагностики ТЕЛА (дослідження PIOPED) показало, що всупереч класичній точці зору, аналіз дослідження газового складу крові не має діагностичної цінності. У ході випробування не виявлено кореляції між змінами РаО2, РаСО2 і результатами ангіопульмонографії.
Інструментальна діагностика
Електрокардіографія
Найчастіше відзначають і коригують з тяжкістю ТЕЛА зміни на ЕКГ, що гостро виникли, які відображають гостре перевантаження правих відділів серця і легеневу гіпертензію:
– поява зубця Q у III відведенні, одночасне збільшення амплітуди зубця S у I відведенні і негативного зубця Т у III відведенні (синдром МакДжина — Уайта, або синдром SI–QIII);
– поява негативних симетричних зубців Т у відведеннях V1–V3;
– підйом сегмента ST у відведеннях III, aVF, aVR й V1–V3;
– блокада правої ніжки пучка Гіса;
– Р-pulmonale;
– зміщення перехідної зони вліво до відведень V5–V6;
– синусова тахікардія та/чи інші порушення ритму (фібриляція/тріпотіння передсердь, екстрасистолія тощо) (рис. 1.4).
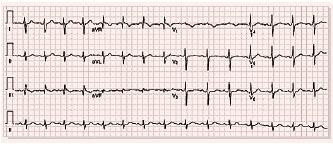
Рис. 1.4. Синдром SI–QIII, негативний зубець T у відведеннях III і V1, згладжений зубець Т у відведенні V2 і двофазний у V3, неповна блокада правої ніжки пучка Гіса при ТЕЛА
Після ефективного лікування ТЕЛА та нормалізації тиску в ЛА вираженість цих явищ швидко зменшується і вони зникають.
Ознаки гострого перевантаження ПШ частіше спостерігають при емболії стовбура та головних гілок ЛА, ніж при ураженні дольових і сегментарних гілок. Слід зазначити, що у 20–25% хворих із ТЕЛА зміни на ЕКГ взагалі можуть бути відсутніми. Крім того, всі зазначені ЕКГ-ознаки не є специфічними для ТЕЛА, оскільки можуть реєструватися при інших захворюваннях, що супроводжуються явищами гострого гемодинамічного перевантаження ПШ.
Рентгенографія органів грудної клітки
У більшості випадків ТЕЛА супроводжується появою на рентгенограмі непостійних і малоспецифічних рентгенологічних ознак. Найбільш специфічними є симптоми гострого легеневого серця: збільшення правих відділів серця, розширення верхньої порожнистої вени, вибухання легеневого конуса по лівому контуру серцевої тіні. Часта ознака — збільшення розміру центральних ЛА. Збіднення легеневого малюнка (симптом Вестермарка) — специфічна, але відносно рідкісна ознака ТЕЛА (виявляють не більш ніж в 5% випадків), що свідчить про масивну емболію ЛА. Високий і малорухомий стан купола діафрагми в ділянці ураження легені відзначають в 40% випадків, найбільш імовірно, це зумовлено рефлекторним зморщуванням легені у відповідь на емболію. У розвитку цього синдрому можлива також участь й інших факторів: ураження діафрагмальної плеври, зменшене кровонаповнення ураженого сегмента або долі, збільшення об’єму печінки, рефлекторний вплив на діафрагмальний і поворотний нерви, зменшення легеневого об’єму в результаті появи ателектазів і запальних інфільтратів.
Дископодібні ателектази легень, зазвичай, передують розвитку інфаркту легені. Інфільтрати легеневої тканини — часто двосторонні, характерні для інфарктної пневмонії і можуть супроводжуватися плевральним випотом. Досить рідко можна виявити класичні ознаки інфаркту легені — клиноподібну тінь в легеневому полі, що звернена основою до плеври (симптом Хемптона) (рис. 1.5).Проте у зв’язку з інфільтрацією легеневої тканини навколо зони інфаркту затемнення частіше приймає округлу або неправильну форму. У деяких хворих можна виявити ознаки застою в малому колі кровообігу. Корні легень можуть бути розширені внаслідок підвищення тиску в ЛА проксимальніше місця її оклюзії.
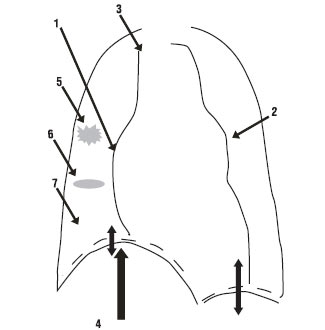
Рис. 1.5. Рентгенографічні ознаки ТЕЛА, описані F.G. Fleichner (1965): 1 — розширення правої межі серця; 2 — вибухання легеневого конуса по лівому контуру серцевої тіні; 3 — розширення тіні верхньої порожнистої вени; 4 — високе і малорухоме стояння купола діафрагми; 5 — інфільтрати легеневої тканини; 6 — дископодібні ателектази; 7 — збіднення легеневого малюнка (симптом Вестермарка)
Всі описані рентгенологічні ознаки лише з певним ступенем імовірності можуть бути асоційовані з виникненням ТЕЛА, причому тільки в тих випадках, коли вони поєднуються з клінічними симптомами захворювання. Слід підкреслити, що відсутність змін на рентгенограмі органів грудної клітки не виключає діагнозу ТЕЛА. Так, в дослідженні ICOPER, при аналізі рентгенограм 2322 пацієнтів із доведеною ТЕЛА, у 24% із них рентгенологічних змін не виявлено. Найбільш частими патологічними змінами на оглядовій рентгенограмі органів грудної клітки були: розширення тіні серця (27%), плевральний випіт (23%), високе стояння купола діафрагми (20%), розширення ЛА (19%), ателектази (18%) й інфільтрати легеневої тканини (17%), симптоми застою в легенях (14%). Збіднення легеневого малюнка виявлене у 8% випадків, інфаркт легені — в 5% (рис. 1.6).
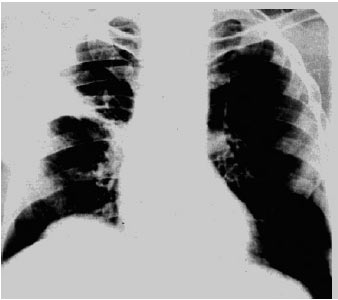
Рис. 1.6. Рентгенограма легень у прямій проекції при інфаркті легені. Клиноподібна тінь у середній долі правої легені
Ехокардіографія
Тривалий час катетеризація правих відділів серця була єдиним методом, що дозволяв оцінювати стан правих відділів серця, одержувати характеристики внутрішньосерцевого кровотоку, визначати тиск у правих відділах серця і ЛА. Проте інвазивність цієї методики визначає ряд обмежень і труднощів у її використанні. ЕхоКГ-дослідження дозволяє неінвазивним способом у режимі реального часу оцінити розміри і рух серцевих структур, одержати характеристики внутрішньосерцевої гемодинаміки, визначити тиск у камерах серця та ЛА, при цьому доведена хороша порівняність результатів ехоКГ з даними, отриманими при катетеризації порожнин серця.
ЕхоКГ-дослідження при ТЕЛА дозволяє також виключити ряд захворювань, які мають подібні клінічні симптоми і можуть бути причиною гострої легеневої гіпертензії: ІМ, гостра декомпенсована СН, гострий міокардит, перикардит, розшаровуюча аневризма аорти і т.д.
Основні зміни при ехоКГ-дослідженні при ТЕЛА відносяться до правих відділів серця.
ЕхоКГ-ознаками ТЕЛА є:
- гіпокінезія і дилатація ПШ (рис. 1.7);
- парадоксальний рух міжшлуночкової перегородки (рис. 1.8);
- трикуспідальна регургітація (рис. 1.9);
- відсутність/зменшення інспіраторного спадіння нижньої порожнистої вени;
- дилатація ЛА;
- ознаки легеневої гіпертензії;
- тромб у порожнині правого передсердя і шлуночка;
- можуть визначати перикардіальний випіт, шунтування крові справа наліво через відкрите овальне вікно.
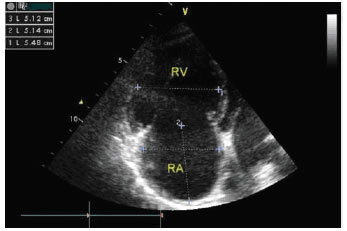
Рис. 1.7. Розширення правих відділів серця, апікальна чотирикамерна позиція, діастола, двомірне дослідження. ПШ значно більше ЛШ і займає верхівку серця. Міжшлуночкова перегородка вибухає в бік ЛШ (ознака перевантаження об’ємом ПШ), міжпередсердна перегородка вибухає в бік лівого передсердя
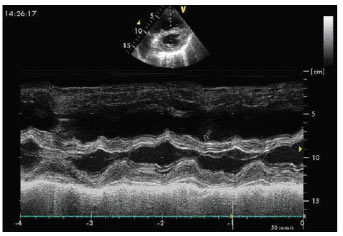
Рис. 1.8. ПШ, парастернальна коротка вісь ЛШ, двомірне і М-модальне дослідження. Парадоксальний рух міжшлуночкової перегородки (стрілка)
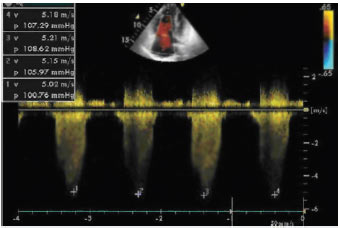
Рис. 1.9. Трикуспідальна регургітація у хворої з легеневою гіпертензією, апікальна чотирикамерна позиція, кольорове допплєрівське дослідження. Постійно-хвильове дослідження струменя трикуспідальної регургітації
Структурна перебудова серця та зміни внутрішньосерцевої гемодинаміки, що виявляють при ТЕЛА, можуть викликати порушення систолічної функції як ПШ, так і ЛШ серця. Виражене перевантаження ПШ тиском приводить до зниження серцевого викиду, що клінічно проявляється гемодинамічною нестабільністю.
Імовірність виявлення дисфункції ПШ при ехоКГ-дослідженні пов’язана зі ступенем обтурації легеневих судин. Так, її визначають більш ніж в 90% випадків при закритті емболом >1/3 загальної площі легеневих судин. Водночас дисфункція ПШ у хворих із нормальною перфузією >70% легеневих сегментів малоймовірна (<15% хворих). Особливістю дисфункції ПШ при ТЕЛА є виражене порушення скоротності вільної стінки ПШ (базальні та середні сегменти) при збереженій або незначно порушеній скоротності верхівки ПШ (ознака МакКоннелла). Ця ознака має високу специфічність щодо ТЕЛА і дозволяє проводити диференційну діагностику з первинною легеневою гіпертензією, при якій визначають рівномірне зниження скоротності ПШ серця (табл. 1.8).
Таблиця 1.8
Діагностична значимість трьох груп ехоКГ- критеріїв для визначення ТЕЛА у хворих з попередньою серцево-легеневою патологією та без такої
| Ознака | Перенавантаження ПШ | 60/60 | МакКоннелла |
| Пацієнти з попередньою серцево-легеневою патологією | |||
| Специфічність, % | 21 | 89 | 100 |
| Чутливість, % | 80 | 26 | 20 |
| ППЗ, % | 65 | 82 | 100 |
| НПЗ, % | 36 | 40 | 40 |
| Пацієнти без попередньої серцево-легеневої патології | |||
| Специфічність, % | 78 | 100 | 100 |
| Чутливість, % | 81 | 25 | 19 |
| ППЗ, % | 90 | 100 | 100 |
| НПЗ, % | 64 | 37 | 35 |
Застосування допплєрівських режимів дослідження підвищило діагностичні можливості ехоКГ, що особливо інформативно щодо визначення ступеня легеневої гіпертензії. Допплєрівська реєстрація швидкості потоку в ЛА дозволяє не лише якісно, але й кількісно оцінити вираженість легеневої гіпертензії, визначити середній тиск у ЛА. Проте найбільше значення для виявлення легеневої гіпертензії має вираженість трикуспідальної регургітації. Використання струменя трикуспідальної регургітації лежить в основі неінвазивного визначення систолічного тиску в ЛА. Для розрахунку тиску необхідно до градієнта тиску на трикуспідальному клапані додати значення величини тиску в правому передсерді. Цей метод оцінки тиску в ЛА найбільш точний серед неінвазивних.
Слід відзначити, що в деяких випадках тиск у ЛА, визначений відповідно до потоку трикуспідальної регургітації, може бути недооціненим, оскільки систолічний тиск у ЛА залежить від ударного об’єму ПШ серця.
За величиною систолічного тиску в ЛА виокремлюють такі ступені легеневої гіпертензії:
- помірній гіпертензії відповідає систолічний тиск у ЛА, що становить 30–50 мм рт. ст.;
- значній гіпертензії — 50–80 мм рт. ст.;
- вираженій гіпертензії — >80 мм рт. ст.
За швидкістю струменя регургітації на стулках клапана ЛА можна розрахувати кінцево-діастолічний тиск у ЛА. Він складається із градієнта тиску між ЛА і ПШ серця наприкінці діастоли, розрахований за швидкістю струменя легеневої регургітації та діастолічного тиску у правому передсерді.
Критерії перевантаження ПШ — наявність ≥1 з чотирьох ознак: 1) тромб в правих порожнинах серця; 2) діаметр ПШ >30 мм (парастернальна позиція) чи ПШ/ЛШ >1; 3) систолічне згладження міжшлуночкової перетинки; 4) час прискорення <90 мс або градієнт тиску недостатності тристулкового клапана >30 мм рт. ст. за відсутності гіпертрофії ЛШ.
Ознака 60/60 — час прискорення на ЛА <60 мс та градієнт тиску недостатності тристулкового клапана ≤60 мм рт ст.
Ознака МакКоннела — нормо- чи гіперкінезія апікального сегмента за наявності гіпо- та акінезії інших сегментів вільної стінки ПШ (Kurzyna M. et al., 2002).
Останнім часом все більше поширення одержує проведення черезстравохідного ехоКГ-дослідження (рис. 1.10). Метою цього діагностичного методу, перш за все, є виявлення тромбу в основних гілках ЛА, а також визначення побічних ознак легеневої гіпертензії. У проведених дослідженнях показана позитивна роль черезстравохідного ехоКГ-дослідження у хворих із незʼясованою зупинкою кровообігу чи з ознаками електромеханічної дисоціації. Це дослідження також допомагає виявити тромби-наїзники та відбирати пацієнтів для проведення тромболітичної терапії, катетерної чи хірургічної емболектомії.
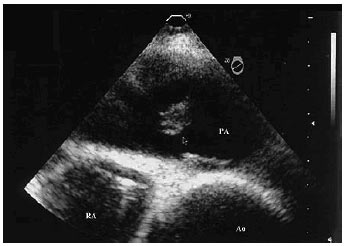
Рис. 1.10. Черезстравохідне ехоКГ-дослідження. Тромб у стволі ЛА
Велике значення надають також використанню ехоКГ-дослідження для стратифікації ризику, вибору оптимальної тактики лікування та контролю проведеної терапії у хворих із ТЕЛА. Виявлення дисфункції ПШ серця при ТЕЛА за даними ехоКГ у різних дослідженнях асоціювалося із 6-разовим підвищенням госпітальної смертності та 2-разовим підвищенням ризику смерті протягом 90 днів спостереження. Несприятливе прогностичне значення щодо 5-річної виживаності у хворих із ТЕЛА мало також вихідне підвищення рівня систолічного тиску в системі ЛА >50 мм рт. ст. (за даними допплєрівського ехоКГ-дослідження).
Таким чином, ехоКГ — зручний і безпечний метод дослідження, що дозволяє в найкоротший термін одержати дані про вплив емболії ЛА на функцію ПШ, а також визначити ступінь ризику розвитку ускладнень і здійснити диференційований підхід до лікування цієї категорії хворих. Успіх або невдача того чи іншого методу лікування також можуть бути оцінені за допомогою ехоКГ-дослідження. Проте ехоКГ має цілий ряд обмежень і її роль у діагностиці та визначенні ризику хворих із ТЕЛА не слід переоцінювати (чутливість методу становить 60–70%).
Катетеризація правих відділів серця
Катетеризація ЛА дозволяє одержати найбільш точну і повну інформацію про порушення гемодинаміки у правих відділах серця. Метод дозволяє виміряти тиск у ЛА, правому передсерді, ПШ, оцінити тиск в лівому передсерді за тиском заклинювання в ЛА (ТЗЛА), визначити легеневий судинний опір, серцевий викид (методом термодилюції) і насичення змішаної венозної крові киснем.
Для катетеризації ЛА використовують катетер Свана — Ганца, який має балончик і термістор. Катетер вводять через одну із центральних вен у порожнисту вену і праве передсердя. Тут балончик роздувають і катетер проводять в ПШ, а потім у ЛА, де просувають до точки заклинювання. Положення катетера визначають за формою кривої тиску, а якщо це не вдається, то рентгенологічно (рис. 1.11).

Рис. 1.11. а — схема введення плаваючого катетера Свана — Ганца для виміру тиску в порожнині ПП, ПШ і у ЛА; б — криві тиску (Р) у ПП, ПШ, ЛА та ТЗЛА
Катетеризація ЛА дозволяє виявити гемодинамічні порушення і визначити ступінь їх вираженості при ТЕЛА (табл. 1.9). У типових випадках виявляють підвищення тиску в правому передсерді, середнього тиску в ЛА, зниження серцевого індексу, нормальний ТЗЛА, підвищення легеневого судинного опору.
Таблиця 1.9
Характер гемодинамічних розладів при ТЕЛА за даними катетеризації правих відділів серця (Савельєв В.С., 1985)
| Параметр гемодинаміки | Вираженість гемодинамічних розладів | ||
| Помірні | Виражені | Різко виражені | |
| Тиск в аорті, мм рт. ст. | >100 | >100 | <100 |
| САТ у ПШ, мм рт. ст. | <40 | 40–59 | ≥60 |
| Кінцево-діастолічний тиск у ПШ, мм рт. ст. | <10 | 10–14 | ≥15 |
| Середній тиск у ПШ, мм рт. ст. | <19 | 19–24 | ≥25 |
| САТ у стволі ЛА, мм рт. ст. | <25 | 25–34 | ≥35 |
| ДЗЛА, мм рт. ст. | 6–12 | 6–12 | 6–12 |
| Серцевий індекс, л/(хв·м2) | ≥2,5 | ≥2,5 | <2,5 |
Вентиляційно-перфузійна сцинтиграфія легень
Ключову роль у діагностиці ТЕЛА має вентиляційно-перфузійна сцинтиграфія легень (ВПСЛ) — поєднання радіонуклідного дослідження регіональних порушень легеневої вентиляції (пневмосцинтиграфії) та перфузії легень (пульмоносцинтиграфії).
Найбільше значення має методика перфузійної пульмоносцинтиграфії із внутрішньовенним введенням мікросфер альбуміну, мічених 99mTc. При оклюзії гілок ЛА порушується заповнення капілярного русла радіоактивним препаратом нижче ділянки звуження (рис. 1.12). Метод перфузійної сцинтиграфії відрізняється високою чутливістю, проте недостатньо специфічний, оскільки багато патологічних процесів у легенях супроводжуються регіональним зниженням перфузії (пухлини легені, пневмонії, обструктивні захворювання легень, пневмосклероз тощо). Одночасна оцінка вентиляції легень шляхом інгаляції ізотопу інертного радіоактивного газу (зазвичай ксенону чи криптону) підвищує специфічність методу. В свою чергу, інформативність ВПСЛ значно зростає при зіставленні її результатів із даними рентгенографії.
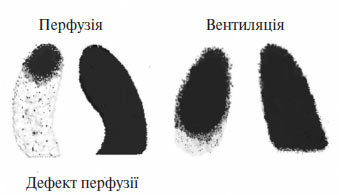
Рис. 1.12. Перфузійна і вентиляційна сцинтиграми при ТЕЛА
Високоймовірний критерій ТЕЛА — сегментарна відсутність кровотоку в легенях, що не супроводжується змінами вентиляції в цьому сегменті та змінами на оглядовій рентгенограмі грудної клітки (рис. 1.13). За відсутності суворої сегментарності та множинності перфузійних дефектів на сцинтиграмах імовірність діагнозу ТЕЛА середня. У цьому разі необхідне проведення диференційного діагнозу між пневмонією, ателектазом, пухлиною, туберкульозом та іншими захворюваннями легень. Як правило, для встановлення діагнозу необхідне проведення ангіопульмонографії. Якщо результати перфузійної сцинтиграфії легень відповідають нормі, то ймовірність ТЕЛА низька і проведення вентиляційної сцинтиграфії недоцільне.
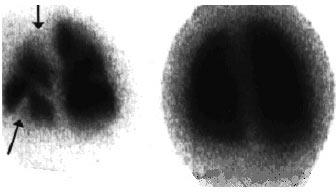
Рис. 1.13. Перфузійна і вентиляційна сцинтиграми. Численні розсіяні сегментарні й підсегментарні (стрілки) дефекти перфузії при нормальній вентиляції
Труднощі діагностики ТЕЛА методом ВПСЛ виникають, якщо тромбоемболія ускладнюється розвитком інфаркту легені. У таких випадках разом зі зменшенням перфузії, як правило, відбувається і локальне зниження вентиляції, а на рентгенограмі з’являються ознаки ущільнення легеневої тканини. За наявності порушень вентиляції в зоні перфузійних дефектів підтвердити чи виключити діагноз ТЕЛА важко, у зв’язку з чим необхідне проведення ангіопульмонографії.
У результаті проведення ВПСЛ можна визначити перфузійний дефіцит. Так, легкий ступінь порушення перфузії характеризується перфузійним дефіцитом до 29%, середній — 30–40%, тяжкий — 45–59%, дуже тяжкий — ≥60%.
Зауважимо, що діагностика ТЕЛА, за даними ВПСЛ, можлива лише при зіставленні її результатів із клінічною картиною захворювання. Якщо результати аналізу даних ВПСЛ суперечать клінічним (низька клінічна ймовірність ТЕЛА і висока — за даними ВПСЛ, або висока клінічна ймовірність при нормі за даним ВПСЛ), то обов’язковим є подальше обстеження пацієнта.
У проспективному дослідженні з вивчення методів діагностики ТЕЛА (PIOPED) проведена спроба розробити сцинтиграфічні критерії ТЕЛА. У результаті їх використання при високій імовірності ТЕЛА діагноз підтверджували ангіопульмонографією у 87% випадків, при середній — у 30%, при низькій — у 14%, при нормальній сцинтиграмі — лише у 4% випадків. Згодом у дослідженні PISAPED діагностичні критерії ВПСЛ було переглянуто, що дозволило підвищити чутливість і специфічність методу в діагностиці ТЕЛА (до 92 і 87% відповідно). Проте у осіб із хронічними легеневими захворюваннями значимість ВПСЛ у діагностиці ТЕЛА істотно нижча, що зумовлено вихідними порушеннями вентиляції легень. Так, у дослідженні COPD у осіб із хронічними захворюваннями легень проведення сцинтиграфії легенів дозволило підтвердити діагноз ТЕЛА у 25% пацієнтів, а у 25% — виключити. У інших 50% хворих результати були визнані сумнівними. У цих пацієнтів необхідне проведення ангіопульмонографії.
Ангіопульмонографія
Селективна ангіопульмонографія — це рентгенологічний метод дослідження судин легень і легеневого кровотоку, при якому контрастна речовина вводиться безпосередньо в легеневе судинне русло. Метод дає можливість одержати максимальну інформацію про анатомічний і функціональний стан судин легень. Селективна ангіопульмонографія на сьогодні залишається еталонним методом діагностики ТЕЛА.
Виділяють специфічні та неспецифічні ангіографічні критерії ТЕЛА.
Специфічні ангіографічні критерії:
- Дефект наповнення у просвіті судини — найбільш характерна ангіографічна ознака ТЕЛА;
- Повна обструкція судини (ампутація судини, обрив її контрастування). При масивній ТЕЛА цей симптом на рівні дольових артерій відзначають у 5% випадків, частіше (у 45%) його виявляють на рівні дольових артерій, дистальніше тромбоембола, розташованого в головній ЛА.
Неспецифічні ангіографічні критерії:
- Розширення головних ЛА;
- Зменшення кількості контрастованих периферичних гілок (симптом мертвого чи підрізаного дерева);
- Деформація легеневого малюнка;
- Відсутність або затримка венозної фази контрастування.
Інформативність неспецифічних ознак не встановлена. Діагноз ТЕЛА вважається підтвердженим лише за наявності специфічних критеріїв (рис. 1.14).
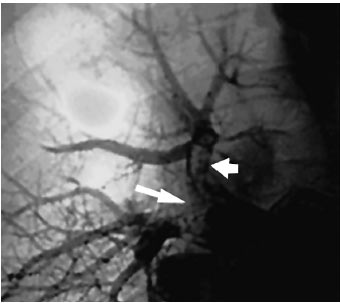
Рис. 1.14. Ангіопульмонограма легень при тромбоемболії гілки ЛА. Стрілками показаний артеріальний дефект наповнення в ділянці локалізації ембола у правій верхній дольовій артерії та обрив наповнення у правій середній дольовій артерії
Слід зазначити, що локальна відсутність контрастування дистальних розгалужень ЛА (зони відсутності васкуляризації) та формування кукси артерії виявляють не лише при ТЕЛА, але й при інших патологічних станах (рак легені, абсцес, велика повітряна порожнина тощо). У цих випадках для встановлення правильного діагнозу необхідно враховувати дані інших методів дослідження (рентгенологічного, ВПСЛ, спіральної КТ), у зіставленні з клінічною картиною захворювання. Ангіопульмонографія дозволяє не лише підтвердити діагноз ТЕЛА та встановити її локалізацію, але також оцінити обсяг ураження судинного русла легень за допомогою ангіографічного індексу.
Доцільність проведення ангіографії визначається доступністю неінвазивних методів, станом хворого та необхідністю встановлення точного діагнозу.
Проведення ангіопульмонографії показане у разі:
- невизначених даних, отриманих при сцинтиграфії легень, і відсутності ознак флеботромбозу за результатами УЗД, флебографії або плетизмографії; при підозрі на розвиток ТЕЛА, що базується на клінічних даних;
- вирішення питання про проведення тромбоемболектомії у хворих із гострим легеневим серцем та/чи кардіогенним шоком (зокрема за наявності протипоказань до тромболітичної та/чи антикоагулянтної терапії);
- рецидивної ТЕЛА (результати ВПСЛ у цих випадках можуть не відображати гостроти процесу і обсягу ураження судин легень);
Слід враховувати, що, хоча безпека ангіопульмонографії ЛА значно підвищилася за останні роки, проте при проведенні дослідження можливі серйозні ускладнення:
- алергічна реакція на контрастну речовину (можливе проведення дослідження під прикриттям кортикостероїдних і антигістамінних препаратів);
- прогресування ниркової недостатності як реакція на контрастну речовину;
- перфорація серця (у 0,3% випадків);
- порушення ритму серця;
- розвиток СН у хворих із дисфункцією ЛШ (при введенні великого об’єму контрастної речовини);
- наростання легеневої гіпертензії під час проведення процедури;
- підвищення тяжкості стану хворого (у 2–4% випадків);
- летальний кінець (<0,2%).
Чутливість ангіопульмонографії в діагностиці ТЕЛА становить близько 98%, а специфічність — 95–98%. Слід зазначити, що надійність діагностики ТЕЛА при проведенні ангіопульмонографії знижується при зменшенні калібру судин. При ТЕЛА нижче субсегментарних артерій інтерпретація одержаних результатів ускладнена. Знижується чутливість методу і у хворих із хронічними легеневими і серцево-судинними захворюваннями.
Комп’ютерна томографія (КТ)
В останні роки в діагностиці ТЕЛА все частіше використовують спіральну КТ із внутрішньовенним введенням рентгеноконтрастного препарату, що дозволяє одержувати високоякісне зображення легеневих судин і визначати точну локалізацію тромбоемболів. При зіставленні результатів спіральної КТ і ангіопульмонографії у хворих із ТЕЛА, чутливість КТ становила 100%, специфічність — 96%, а негативна передбачувальна цінність — 99%. Метод дозволяє не лише підтвердити діагноз ТЕЛА, але й отримати інформацію про альтернативні захворювання. Крім того, КТ дає цінну інформацію про розміри і функцію ПШ серця. Якщо раніше вважали, що КТ корисна лише для діагностики тромбоемболії центральних і дольових артерій, то за допомогою мультидатчиків останніх поколінь можна виявляти структури розміром від 0,5 мм, тим самим значно підвищуючи можливість виявлення тромбоемболів у сегментарних, субсегментарних і більш дрібних судинах легеневого судинного русла (рис. 1.15). КТ все ширше використовують у клінічній практиці як метод скринінгу ТЕЛА чи в комбінації з сцинтиграфією легень і ехоКГ.
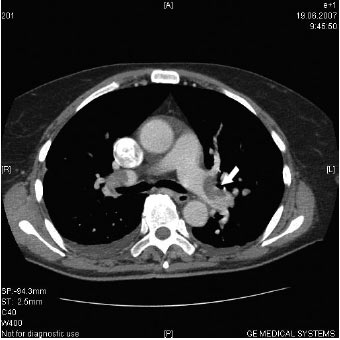
Рис. 1.15. Спіральна КТ з контрастуванням ЛА. Тромбоз правої та лівої ЛА
Магнітно-резонансна ангіографія (МРА)
Значення МРА легень у діагностиці ТЕЛА на сьогодні не визначене. Проте порівняно з ангіографією та КТ метод має ряд переваг: забезпечує кращу візуалізацію судин, проводиться без опромінення пацієнта і введення контрастної речовини, практично не викликає ускладнень, дозволяє оцінити розміри і функцію шлуночків серця. МРА можна використати у пацієнтів із порушеною функцією нирок, у разі непереносимості рентгеноконтрастних речовин. Крім того, можливе одночасне проведення магнітно-резонансної венографії (МРВ), що підвищує значимість методу. На сьогодні (з квітня 2006 р.) проводиться багатоцентрове дослідження PIOPED 3, метою якого є вивчення діагностичної цінності проведення МРА самостійно та у поєднанні з МРВ із метою виявлення пацієнтів із ТЕЛА.
ДІАГНОСТИКА ТРОМБОЗУ ГЛИБОКИХ ВЕН НИЖНІХ КІНЦІВОК (ТГВ)
За даними аутопсій джерелом ТЕЛА у 90% випадків є тромби в глибоких венах нижніх кінцівок. Діагностика ТГВ при підозрі на ТЕЛА має важливе значення, оскільки наявність тромбу в венах нижніх кінцівок сама по собі обґрунтовує застосування антикоагулянтної терапії і знижує необхідність у проведенні додаткових (зокрема інвазивних) досліджень.
До ранніх клінічних ознак ТГВ належать:
- спонтанний біль у ділянці стопи і гомілки, що посилюється під час ходи;
- поява болю в литкових м’язах при тильному згинанні стопи (симптом Хоманса);
- локальна болючість при пальпації по ходу вен;
- однобічний набряк гомілки, стопи і стегна, що виявляють при огляді в горизонтальному та вертикальному положенні пацієнта.
Існує шкала оцінки ймовірності наявності ТГВ (Wells P.S., 1995) на підставі основних і додаткових прогностичних ознак, зокрема клініко-анамнестичних даних та результатів об’єктивного огляду.
Прогностичні ознаки, що дозволяють визначити передтестову ймовірність наявності ТГВ
Основні прогностичні ознаки:
- рак (лікування, проведене в цей час; протягом попередніх 6 міс; паліативна терапія);
- параліч, парез, нещодавня іммобілізація нижніх кінцівок за допомогою гіпсової пов’язки;
- недавнє захворювання із дотриманням постільного режиму протягом >3 днів і/або велике оперативне втручання в попередні 4 тиж;
- локальна болючість по ходу глибоких вен;
- набряклість стегна і гомілки (слід виміряти їх окружність);
- окружність набряклої гомілки, що обмірювалась на 10 см нижче виростка великогомілкової кістки, на 3 см більша окружності неураженої гомілки;
- виражена сімейна схильність до ТГВ (наявність ТГВ в анамнезі у ≥2 найближчих родичів).
Додаткові прогностичні ознаки:
- недавня (<60 днів) травма набряклої кінцівки;
- набряк, при натисненні на який утворюється ямка, виявляють лише на ураженій кінцівці;
- неварикозне розширення поверхневих вен відзначають лише на ураженій кінцівці;
- перебування в стаціонарі попередні 6 міс;
- еритема.
Передтестова ймовірність наявності ТГВ
Висока (≥80%):
- наявність ≥3 основних ознак та відсутність альтернативного діагнозу;
- наявність ≥2 основних ознак, ≥2 додаткових ознак, відсутність альтернативного діагнозу.
Низька (≤19%):
- наявність 1 основної, 1–2 додаткових ознак і альтернативного діагнозу;
- наявність 1 основної, 1 додаткової ознаки і відсутність альтернативного діагнозу;
- відсутність основних ознак, наявність 1–3 додаткових ознак і альтернативного діагнозу;
- відсутність основних ознак і альтернативного діагнозу, наявність 1–2 додаткових ознак.
Помірна (20–79%):
- всі інші поєднання.
Слід зазначити, що виражені клінічні ознаки ТГВ нижніх кінцівок виявляють лише у 20% хворих із підтвердженими результатами флебографії і радіонуклідних досліджень. У 80% випадків ТГВ характеризується безсимптомним перебігом. Відсутність клінічних проявів ТГВ може бути зумовлена неоклюзивним характером тромбозу чи збереженням відтоку крові по інших венах. Тому проведення інструментальних досліджень вен нижніх кінцівок обов’язкове для всіх хворих із підозрою на ТЕЛА.
У минулому для діагностики тромбозу використовували імпендансну плетизмографію, проте чутливість цього методу виявилася низькою (приблизно 60%), тому на сьогодні основним методом діагностики ТГВ є УЗД з допплєрографією вен нижніх кінцівок.
УЗД вен нижніх кінцівок
Ультразвукове дуплексне ангіосканування із кольоровим картуванням кровотоку дозволяє оцінити стан стінок і просвіту вен, наявність у них тромботичних мас, характер тромбу (оклюзивний, пристінковий, флотуючий), його дистальну і проксимальну границі, прохідність глибоких і перфорантних вен, і навіть орієнтовно оцінити давність процесу за ступенем організації тромбу та вираженістю запальної інфільтрації підшкірної клітковини (рис. 1.16, 1.17).

Рис. 1.16. Флотуючий тромб у підколінній вені (ультразвукова ангіосканограма)

Рис. 1.17. Флотуючий тромб у підколінній вені (ультразвукова ангіосканограма з кольоровим картуванням кровотоку)
Ознаками тромбозу при УЗД вен нижніх кінцівок вважають непіддатливість стінок вени при стисненні та підвищену ехогенність порівняно з кров’ю, що рухається. Критеріями ТГВ при ультразвуковій допплєрографії є: відсутність або зниження швидкості кровотоку, відсутність або послаблення кровотоку при дихальних пробах, збільшення кровотоку при стисненні ноги дистальніше досліджуваного сегмента, поява ретроградного кровотоку при стисненні ноги проксимальніше досліджуваного сегмента.
УЗД дозволяє надійно діагностувати проксимальний ТГВ за наявності клінічних симптомів (специфічність 97%), але має низьку чутливість при виявленні безсимптомного тромбозу. Нормальний результат УЗД не виключає наявності ТЕЛА, оскільки ТГВ вдається виявити лише у 30–50% пацієнтів із підтвердженою ТЕЛА. Проте, з огляду на простоту, доступність і відсутність побічних ефектів, УЗД є обов’язковим методом дослідження у хворих із підозрою на ТЕЛА.
Рентгеноконтрастна флебографія
При діагностиці флеботромбозу нижніх кінцівок використовують також радіонуклідну флебографію із застосуванням макроагрегату альбуміну, міченого 99mТс, що вводять у поверхневі вени стоп. На сьогодні рентгеноконтрастна флебографія є еталоном діагностики венозного тромбозу і рідко викликає ускладнення. Її використовують при сумнівних результатах неінвазивних досліджень вен нижніх кінцівок, а також при поширенні тромбозу вище проекції пахвинної зв’язки, коли точному визначенню локалізації верхівки тромбу за допомогою ультразвукового ангіосканування перешкоджає наявність газу в кишечнику. Чутливість і специфічність методу наближаються до 100%.
Альтернативними методами виявлення ТГВ можуть бути КТ нижньої кінцівки або МРТ.
ДИФЕРЕНЦІЙНА ДІАГНОСТИКА
Виражений поліморфізм клінічних симптомів, відсутність специфічних ознак захворювання при загальнодоступних дослідженнях (ЕКГ, рентгенографія, лабораторні показники) визначають складність діагностики ТЕЛА і необхідність проведення диференційної діагностики з багатьма захворюваннями.
Захворювання, із якими доводиться диференціювати ТЕЛА:
- ІМ, нестабільна стенокардія;
- пневмонія, бронхіт, ХОХЛ у фазі загострення;
- СН;
- БА;
- перикардит;
- первинна легенева гіпертензія;
- пневмоторакс, перелом ребра;
- синдром Тітце, артралгія та міалгія.
ДІАГНОСТИЧНІ СТРАТЕГІЇ
Жоден із лабораторних та інструментальних методів, що застосовується окремо, не має досить високої чутливості та специфічності при діагностиці ТЕЛА. Тому крім клінічних проявів, які можуть свідчити про низьку, помірну чи високу ймовірність наявності ТЕЛА, у більшості випадків для підтвердження чи виключення цього діагнозу необхідно провести ряд досліджень.
Ангіопульмонографія поки залишається еталоном діагностики ТЕЛА. Проте це дорогий метод дослідження, пов’язаний із ризиком розвитку ускладнень, а його результати іноді важко інтерпретувати, особливо при ураженні дрібних гілок ЛА. Тому необхідно провести комплекс лабораторних і неінвазивних інструментальних досліджень, що дозволить зменшити кількість показань для проведення ангіографії; водночас буде досить надійним у діагностиці цього тяжкого захворювання.
У клінічній практиці необхідно визначити, яким пацієнтам які дослідження і в якій послідовності слід проводити. Від одержаних результатів залежить обсяг невідкладних лікувальних заходів і подальша тактика ведення хворих.
Сучасний алгоритм діагностики ТЕЛА базується переважно на використанні КТ. Цей алгоритм складається з послідовності дій, кожна з яких дозволяє чітко і швидко сортувати пацієнтів, уникаючи використання зайвих та високовартісних методів дослідження. Він допомагає точно і в найкоротший термін встановити діагноз та своєчасно розпочати лікування. Водночас результати останніх досліджень свідчать, що недотримання визначеного алгоритму діагностики призводить до затримки призначення антикоагулянтної терапії та підвищення ризику раптової серцевої смерті.
Стратегія діагностики ТЕЛА визначається ступенем ризику розвитку ускладнень і відрізняється у гемодинамічно стабільних і нестабільних пацієнтів (схеми 1.2 та 1.3).
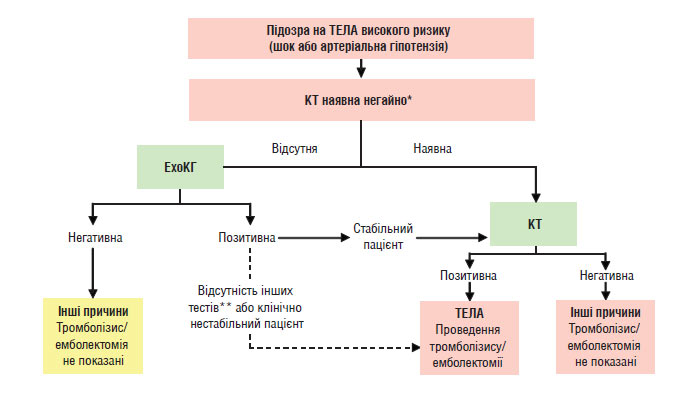
Схема 1.2. Алгоритм діагностики та лікувальної тактики при ТЕЛА з високим ризиком розвитку ускладнень (рекомендації Європейського товариства кардіологів, 2008):
*Можливість проведення КТ визначається як її наявністю, так і відносною стабільністю стану пацієнта для її проведення;
**трансезофагеальна ехоКГ, венозна компресійна ультрасонографія (виявлення ТГВ).
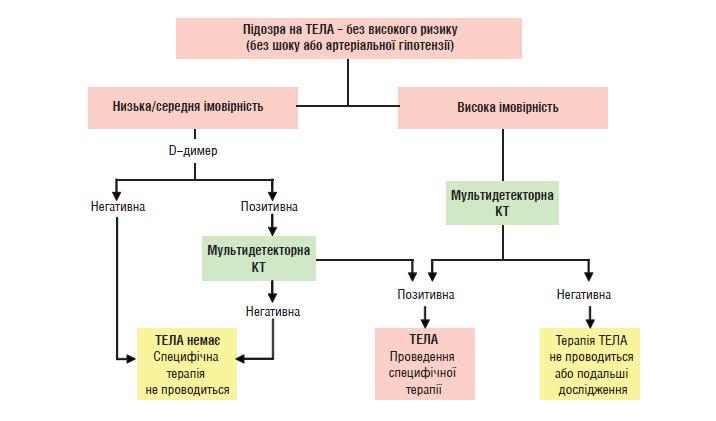
Схема 1.3. Алгоритм діагностики та лікування гемодинамічно стабільних пацієнтів з підозрою на ТЕЛА (рекомендації Європейського товариства кардіологів, 2008)
У гемодинамічно нестабільних хворих з підозрою на ТЕЛА найбільш оптимальним методом для початку діагностики є ехоКГ, яка у більшості випадків дозволяє виявити непрямі ознаки легеневої гіпертензії та перенавантаження правого шлуночка, а також виключити інші причини нестабільності (гострий ІМ, розшаровуюча аневризма аорти, перикардит). ЕхоКГ може бути підставою для встановлення діагнозу ТЕЛА і початку тромболітичної терапії за відсутності інших методів діагностики чи неможливості швидкої стабілізації стану пацієнта. У всіх інших випадках необхідне проведення КТ. Ангіографія не рекомендована у зв’язку з підвищенням летальності у гемодинамічно нестабільних хворих та ризику кровотеч при проведенні тромболітичної терапії.
Діагностична стратегія у гемодинамічно стабільних пацієнтів з підозрою на ТЕЛА починається з визначення імовірності цього захворювання на підставі клінічних даних. З цією метою доцільно використовувати правило (шкалу) P.S. Wells і женевський рахунок (див. табл. 1.5 та 1.7). Такий підхід у комбінації з визначенням рівня D-димера дозволяє виключити діагноз ТЕЛА приблизно у 30% хворих. У пацієнтів із позитивним рівнем D-димера рекомендоване проведення мультидетекторної КТ, на підставі даних якої роблять висновок щодо доцільності проведення специфічної терапії. У хворих з високою клінічною ймовірністю ТЕЛА, а також у пацієнтів, госпіталізованих на момент розвитку симптоматики захворювання, КТ має бути першим кроком діагностичного алгоритму. У разі негативного результату мультидетекторної КТ діагноз ТЕЛА може бути виключений, але якщо використовується однодетекторна КТ для остаточного виключення ТЕЛА, необхідне також проведення ультразвукового сканування вен нижніх кінцівок.
Стратифікація ризику
Прояви ТЕЛА можуть варіювати від незначно вираженої задишки до шоку, проте у більшості пацієнтів середній ступінь вираженості симптомів. Швидка і точна стратифікація ризику має дуже важливе значення, оскільки пацієнтам із високим ризиком потрібна більш агресивна лікувальна тактика. Тому в обстеження хворих зі стабільною гемодинамікою необхідно включати оцінку ризику несприятливого результату.
Прогноз захворювання залежить від поширення емболії, вихідного стану серцево-судинної та дихальної систем, багатьох інших факторів.
Безсумнівно, що визначаючим значенням для перебігу і результату захворювання має обсяг ураження і вираженість гемодинамічних порушень. Закономірно, що у пацієнтів із масивною ТЕЛА прогноз значно гірший порівняно з немасивною. За даними реєстру ICOPER у хворих із масивною ТЕЛА 90-денна летальність становила 52,4%, а у хворих з немасивною — 14,7%. Крім того, при масивній ТЕЛА частіше відзначають тромбоз ПШ і виражену супутню патологію. Вік старше 70 років, виражена СН, злоякісні новоутворення, хронічні захворювання легень в анамнезі були незалежними предикторами несприятливого 3-місячного прогнозу як у хворих із масивною, так і немасивною ТЕЛА.
Багато клінічних ознак має велике значення для прогнозу захворювання. Виражена задишка, втрата свідомості, зниження рівня АТ, тахікардія, набрякання шийних вен, збільшення розмірів печінки є клінічними проявами систолічної дисфункції ПШ і, відповідно, свідчать про несприятливий прогноз. У хворих із вираженими проявами гемодинамічних порушень вірогідно частіше розвиваються госпітальні кровотечі, рецидив ТЕЛА. При цьому повторний епізод емболії є незалежним предиктором 90-добової смертності. Крім того, в результаті вивчення даних реєстру RIETE (3391 пацієнт з ТЕЛА без супутньої патології) встановлено, що у хворих із гемодинамічним колапсом або ізольованою задишкою (без болю плеврального характеру і кровохаркання) летальність була в 2 рази вищою, ніж у хворих з інфарктом легені і супутньою задишкою, болем у грудній клітці та кровохарканням. Більше того, тяжкість подальших рецидивів ТЕЛА у хворих із епізодом гемодинамічного колапсу чи наявністю ізольованої задишки також виявилася більш серйозною.
Традиційно для оцінки прогнозу у хворих із ТЕЛА використовують шкалу переглянутого женевського рахунку (табл. 1.10). Ця шкала визначає ризик настання смерті, повторної емболізації ЛА або клінічно значимої кровотечі у хворих із ТЕЛА. Враховують 6 показників, причому наявність супутнього злоякісного новоутворення і артеріальної гіпотензії мають найбільше значення. Ця модель розроблена для виявлення хворих із низьким ризиком.
Таблиця 1.10
Розрахункова шкала для оцінки прогнозу у хворих із ТЕЛА (Wicki S. et al., 2000)
| Показник | Бали |
| Злоякісне новоутворення | +2 |
| СН | +1 |
| Попередній ТГВ | +1 |
| Артерільна гіпотензія | +2 |
| Гіпоксемія | +1 |
| ТГВ при УЗД | +1 |
Якщо сума не перевищує 2 балів, то імовірність розвитку ускладнень низька; при сумі 2–6 балів — помірна; >6 балів — висока.
ЕКГ у 12 відведеннях також допомагає виявити хворих із високим ризиком несприятливих подій при ТЕЛА. Так, інверсія зубця T у відведеннях V2 і V3 і псевдоінфарктний зубець Qr у V1, як правило, з’являються при дисфункції та дилатації ПШ серця і є маркерами несприятливого прогнозу, включаючи летальний результат.
Дилатація і дисфункція ПШ серця, виявлені при ехоКГ, є незалежними предикторами подальших тромбоемболічних подій і смерті. Навіть у пацієнтів зі стабільною гемодинамікою (САТ ≥90 мм рт. ст.) гіпокінезія ПШ — незалежний фактор розвитку ранньої смерті (в 2 рази підвищується ризик летального результату в 30-денний період). Цей факт має важливе клінічне значення, оскільки дозволяє виявити пацієнтів із високим ризиком (смертність 17%), що здаються гемодинамічно стабільними у зв’язку з відсутністю артеріальної гіпотензії.
Несприятливим фактором є розвиток легеневої гіпертензії. Так, систолічний тиск у ЛА >50 мм рт. ст. у гострий період ТЕЛА в 3 рази підвищує ризик персистувальної легеневої гіпертензії та дисфункції ПШ серця, легеневої гіпертензії протягом року після розвитку захворювання. У цих осіб може бути подальше погіршення захворювання із розвитком хронічної легеневої гіпертензії.
В обстеження хворих ТЕЛА з метою виявлення групи високого ризику необхідно включати визначення рівня тропоніну (Тn) і мозкового натрійуретичного пептиду (МНУП — ВNP). Внаслідок ішемії міокарда ПШ у крові виявляють підвищення рівня ТnІ і Т, які є чутливими маркерами необоротно ушкоджених кардіоміоцитів. Необхідно відзначити, що при ТЕЛА, порівняно з гострим ІМ, рівень тропонінів у периферичній крові значно нижчий і визначається протягом коротшого проміжку часу. Підвищення рівня Тn тісно корелює з вираженістю дисфункції ПШ, підвищенням летальності, ускладнень і рецидивів ТЕЛА. Так, негативна передбачувальна цінність розвитку внутрішньогоспітальної смерті при виявленні ТnТ становить від 97 до 100%, при рівні показника від ≥0,04 до 0,09 нг/мл за даними різних авторів.
Із багатьох проведених досліджень найбільш переконливими є дані К. Janata та співавторів (2003), де рівень ТnТ ≥0,09 нг/мл передбачав госпітальну смерть із чутливістю 80%, специфічністю 92%, причому негативна передбачувальна цінність досягла 99%, а позитивна — 34%.
Інший важливий маркер несприятливого прогнозу — рівень МНУП (ВNP) у крові. У відповідь на перерозтягнення кардіоміоцитів ПШ серця внаслідок його перевантаження і дилатації вже через кілька годин в міокарді ПШ починає вироблятись прогормон ВNP (проВNP), що індукує появу біологічно активного ВNP і кінцевої частини проВNP (NТ-проВNP). Підвищення у крові рівня цих біомаркерів є предиктором дисфункції ПШ серця, розвитку правошлуночкової недостатності та підвищення смертності. Так, рівень ВNP <50 пкг/мл, визначений у периферичній крові хворого, свідчить про низький ризик розвитку СН у хворих із ТЕЛА (негативна передбачувальна цінність — близько 100%), тоді як рівень ≥90 пкг/мл — про високий ризик. Рівень тропоніну та МНУП слід визначати через 6–12 год з моменту розвитку захворювання. Результати використовують в основному для розмежування груп низького та середнього ризику серед гемодинамічно стабільних пацієнтів. Хворі з нормальним рівнем біомаркерів Тn і ВNP належать до групи низького ризику за госпітальною смертністю (негативна передбачувальна цінність — 97–100%). Підвищені рівні Тn і ВNP — незалежні маркери несприятливого госпітального і віддаленого прогнозу. Цим пацієнтам обов’язково слід проводити ехоКГ. При виявленні дисфункції ПШ таких хворих відносять до групи високого ризику розвитку госпітальної смерті. Їм необхідне проведення більш агресивної терапії.
ЛІКУВАННЯ ХВОРИХ ІЗ ТЕЛА
Терапію хворих із ТЕЛА слід проводити відповідно до клінічного статусу пацієнта, обсягу емболізації, наявністю супутньої серцево-легеневої патології, рівнем маркерів некрозу міокарда (тропонін), а також зі ступенем дисфункції правих відділів серця, що оцінюють на підставі фізикального обстеження, ЕКГ і ехоКГ. Пацієнтам із високим ризиком розвитку несприятливих подій необхідно проводити тромболітичну терапію чи емболектомію для відновлення прохідності магістральних ЛА на фоні введення гепарину для профілактики повторної емболізації. Водночас пацієнти з низьким ризиком мають необхідність лише у проведенні адекватної антикоагулянтної терапії. Черезшкірні катетерні втручання (інтервенційні процедури) можуть стати альтернативою хірургічній емболектомії у пацієнтів із високим ризиком розвитку ускладнень або у хворих із протипоказаннями для проведення тромболітичної терапії.
Тромболітична терапія
Тромболітична терапія дозволяє врятувати життя хворим із кардіогенним шоком на фоні ТЕЛА. Фізичне розчинення тромбу, що закриває просвіт магістральної ЛА, приводить до запобігання швидкопрогресуючого розвитку правошлуночкової недостатності та зменшення вивільнення серотоніну та інших нейрогуморальних факторів, що сприяють посиленню легеневої гіпертензії. У хворих із легеневою гіпертензією та низьким серцевим викидом на фоні ТЕЛА проведення тромболітичної терапії супроводжується зниженням середнього тиску в ЛА на 30% і підвищенням серцевого індексу на 15% вже через 2 год від її початку. Через 72 год підвищення серцевого індексу досягає вже 80%, а зниження середнього тиску в ЛА — 40%. Відзначено також значне зменшення кінцево-діастолічного розміру ПШ через 3 год від початку тромболітичної терапії. Водночас застосування лише гепарину не зумовлює зміни вищезазначених параметрів. Системна тромболітична терапія також сприяє розчиненню тромбів у малому тазу та/чи глибоких венах нижніх кінцівок, які можуть бути джерелом рецидивування ТЕЛА.
Ідеальний лікарський засіб, насамперед, має забезпечувати максимальну клінічну ефективність при мінімальному ризику побічних ефектів. Ідеальний фібринолітичний препарат для застосування у хворих із ТЕЛА повинен мати чіткі певні показання для застосування, відрізнятися швидкістю розвитку терапевтичного ефекту у поєднанні з низькою частотою побічних реакцій, серед яких найбільш значимими є кровотечі, а також впливати на подальший прогноз захворювання. Крім того, важливо, щоб препарат був зручним і простим у застосуванні, в тому числі при підборі режиму дозування, а також забезпечував розумне співвідношення ефективність/вартість. Такого фібринолітичного агента в нашому арсеналі на сьогодні немає. У клінічних дослідженнях проведено тестування декількох фібринолітичних препаратів (альтеплаза, стрептокіназа, урокіназа) для лікування хворих із ТЕЛА. Незважаючи на деякі відмінності між різними препаратами і режимами їх введення щодо впливу на показники центральної гемодинаміки в ранні строки, не встановлено достовірних розходжень між окремими режимами за впливом на смертність (табл. 1.11).
Таблиця 1.11
Рекомендовані режими тромболітичної терапії при ТЕЛА
| Діюча речовина | Звичайна схема |
Прискорена схема |
| Стрептокіназа | 250 тис. МО за 30 хв, потім 100 тис. МО/год протягом 12–24 год | 1,5 млн МО протягом 2 год |
| Урокіназа | 4400 МО/кг за 10 хв, потім 4400 МО/кг/год протягом 12–24 год | 3 млн МО протягом 2 год |
| Альтеплаза | 100 мг протягом 2 год | 0,6 мг/кг протягом 15 хв (макс. доза — 50 мг) |
За даними останніх досліджень, введення альтеплази (100 мг протягом 2 год) дозволяє швидше досягти тромболітичного і гемодинамічного ефекту, ніж введення урокінази (4400 МО/кг/год протягом 12–24 год), стрептокінази (1,5 млн МО протягом 2 год) або альтеплази (0,6 мг/кг маси тіла протягом 15 хв). При цьому розходження між режимами достовірні лише протягом 1-ї години після початку терапії.
На відміну від ІМ, терапевтичне вікно для ефективного проведення тромболітичної терапії у хворих із ТЕЛА набагато ширше і становить до 14 днів від розвитку симптомів захворювання. Така ефективність, імовірно, зумовлена існуванням колатерального бронхіального кровообігу. Таким чином, хворих із підозрою на ТЕЛА варто розглядати як потенційних кандидатів для проведення тромболітичної терапії при розвитку нових симптомів захворювання протягом 2 тиж, що передували госпіталізації.
Проведено декілька рандомізованих контрольованих клінічних досліджень, у яких оцінювали ефективність і безпеку тромболітичної терапії на фоні застосування гепарину порівняно із введенням гепарину в режимі монотерапії у хворих із гострою ТЕЛА. Метааналіз 9 із них (сумарно включений 461 хворий) не виявив достовірного зниження смертності (рис. 1.18) або повторної емболізації ЛА при застосуванні фібринолітичних засобів. Проте зниження частоти розвитку кожної з несприятливих подій практично на 40% при застосуванні тромболітичної терапії припускає необхідність включення більшої кількості хворих для досягнення статистично достовірних відмінностей. Хоча показання до проведення тромболітичної терапії при ТЕЛА досі чітко не визначені, пацієнти з масивною ТЕЛА (гемодинамічна нестабільність і дисфункція ПШ) теоретично повинні мати максимальну перевагу від її проведення.
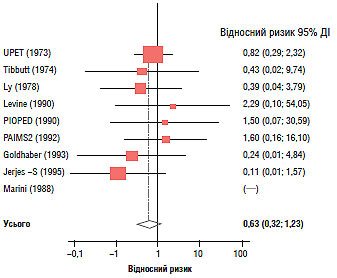
Рис. 1.18. Відносний ризик смерті при проведенні тромболітичної терапії порівняно з гепарином (за даними метааналізу G. Thabut і співавторів, 2002)
Невелике дослідження, в яке було включено 8 хворих із масивною ТЕЛА та шоком, на сьогодні єдине, у якому продемонстровано достовірне зниження смертності внаслідок застосування фібринолітичних препаратів при цій патології. Це дослідження було припинене з етичних міркувань після того, як 4 хворих, яким проводили тромболітичну терапію (стрептокіназа в дозі 1,5 млн МО внутрішньовенно протягом 1 год на фоні антикоагулянтної терапії гепарином), залишилися живі, а 4 пацієнти, які одержували лише гепарин, померли. У 2004 р. опублікований аналіз 5 досліджень, що включали хворих із масивною ТЕЛА. Застосування тромболітичної терапії у цієї категорії пацієнтів супроводжувалося зниженням ризику смерті або розвитку повторної емболізації на 55% (табл. 1.12).
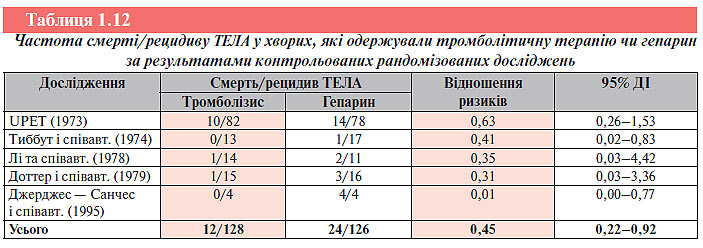
У 1997 р. S. Konstantinides і співавтори при аналізі даних неконтрольованого обсерваційного дослідження встановили зниження смертності при застосуванні тромболітичних препаратів у групі гемодинамічно стабільних хворих із ТЕЛА та перевантаженням ПШ (субмасивна ТЕЛА). У більш пізньому контрольованому дослідженні ці дані не підтвердилися, проте відзначене зменшення потреби у проведенні ургентних інвазивних втручань у цієї категорії хворих після тромболітичної терапії. За даними українських авторів (Полівінок І.В. та співавт., 2002), проведення тромболітичної терапії стрептокіназою (в дозі 1,5 млн МО протягом 60–90 хв) дозволяло вірогідно знизити смертність хворих із субмасивною ТЕЛА (на 21,3%). Проте підвищення частоти великих кровотеч ставить під сумнів переваги фібринолітичної терапії у цих хворих.
Наприкінці 2007 р. розпочалося проспективне рандомізоване подвійне сліпе плацебо-контрольоване багатоцентрове дослідження PEITHO (Pulmonary Embolism International Thrombolysis Study), в якому досліджується ефективність терапії тенектеплазою у пацієнтів із субмасивною ТЕЛА. Тенектеплаза — відносно новий тромболітичний препарат — має ряд істотних переваг перед своїми попередниками, що полягають у більшій фібриноспецифічності, резистентності до інактивації, а також можливості внутрішньовенного болюсного введення (5–10 с) і дозуванні залежно від маси тіла пацієнта. Результати цього дослідження дозволять вирішити питання доцільності тромболітичної терапії у нормотензивних хворих з доведеною ТЕЛА.
Застосування тромболітичних засобів у хворих зі стабільною гемодинамікою без ознак перевантаження ПШ серця не приводить до поліпшення клінічного перебігу захворювання і тому вважається необґрунтованим. За даними окремих досліджень і проведених метааналізів, застосування тромболітичних препаратів призводить до збільшення кількості великих кровотеч (внутрішньочерепні, ретроперитонеальні чи зовнішні кровотечі, що потребували переливання крові) приблизно у 2 рази (рис. 1.19). Ризик розвитку кровотеч після фібринолізу для хворих, після проведення ангіографії становить близько 14%. При цьому у приблизно 40% загальної їх кількості відзначають кровотечі з місця пункції, а внутрішньочерепні крововиливи становлять 1,9% загальної кількості геморагічних ускладнень. Імовірність розвитку геморагій у осіб із неінвазивною діагностикою ТЕЛА вивчена недостатньо, хоча у двох проведених дослідженнях великих кровотеч у цих хворих не відзначено. Таким чином, у кожного пацієнта перед проведенням тромболітичної терапії слід оцінити ступінь ризику розвитку геморагічних ускладнень. Це також зумовлено тим, що більшість хворих із ТЕЛА мають цілий ряд супутніх захворювань.
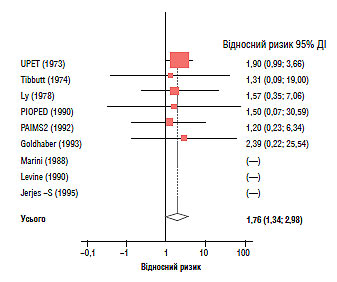
Рис. 1.19. Відносний ризик великих кровотеч при проведенні тромболітичної терапії порівняно з гепарином (за даними метааналізу G. Thabut і співавторів, 2002)
Загалом ймовірність кровотечі у хворих із масивною ТЕЛА висока, незалежно від того, чи проводиться лише антикоагулянтна терапія, а чи спільно антикоагулянтна і тромболітична терапія. Імовірність кровотеч підвищується з віком хворого. Так, середній вік хворих, у яких відзначали розвиток великої кровотечі після проведення тромболітичної терапії, становить 63 роки, тоді як середній вік хворих без геморагічних ускладнень — 56 років (p=0,005). Встановлено, що кожен наступний рік життя підвищує імовірність кровотечі приблизно на 4%. Підвищення ІМТ (>30 кг/м2) або недостатня (<70 кг) маса тіла, жіноча стать, АГ і проведення ангіографії також є незалежними факторами ризику розвитку геморагії. Абсолютні й відносні протипоказання до проведення тромболітичної терапії у хворих із ТЕЛА наведені в табл. 1.13.
Таблиця 1.13
Протипоказання до проведення тромболітичної терапії у хворих із ТЕЛА
| Абсолютні протипоказання |
| Активна внутрішньочерепна кровотеча |
| Внутрішньочерепний крововилив |
| Відносні протипоказання |
| Значне хірургічне втручання, розродження, органна біопсія чи пункція судини, яку неможливо притиснути, протягом найближчих 10 днів |
| Геморагічний інсульт, перенесений у попередні 2 міс |
| Перенесена в попередні 10 днів шлунково-кишкова кровотеча |
| Травма, перенесена в попередні 15 днів |
| Нейро- чи офтальмологічне хірургічне втручання протягом найближчого місяця |
| Неконтрольована АГ (САТ >180 мм рт. ст.; ДАТ >110 мм рт. ст.) |
| Проведення серцево-легеневої реанімації |
| Кількість тромбоцитів <100 000/мм3, протромбіновий час <50% |
| Період вагітності |
| Бактеріальний ендокардит |
| Діабетична геморагічна ретинопатія |
Досі жоден із тромболітичних препаратів не продемонстрував переваг перед іншими щодо ефективності лікування хворих із ТЕЛА. Проте ризик прогресування артеріальної гіпотензії при застосуванні стрептокінази у хворих із масивною ТЕЛА робить призначення альтеплази і урокінази більш оптимальним. При застосуванні урокінази (4400 МО/кг/год протягом 12–24 год) ризик розвитку великих кровотеч становить приблизно 28%, при введенні альтеплази в дозі 100 мг протягом 2 год — 21–24%, а в дозі 0,6 мг/кг маси тіла протягом 15 хв — 11%. Введення альтеплази (100 мг протягом 2 год) дозволяє швидше досягти тромболітичного і гемодинамічного ефекту, ніж проведення інших режимів тромболітичної терапії. У зв’язку з цим єдиним фібринолітичним режимом, схваленим Управлінням щодо контролю за харчовими продуктами та лікарськими засобами США (FDA) для застосування у хворих із масивною ТЕЛА, є введення альтеплази (тканинний активатор плазміногена) в дозі 100 мг протягом 2 год. Відповідно до існуючих рекомендацій перед введенням альтеплази інфузію гепарину необхідно припинити. Після закінчення тромболітичної терапії визначають АЧТЧ. При його значенні <80 с відновлюється інфузія гепарину без попереднього болюсного введення, а при значенні АЧТЧ >80 с — антикоагулянтна терапія не проводиться. При цьому АЧТЧ повторно визначають через 4 год. У переважній більшості випадків повторний аналіз дозволяє відновити терапію гепарином (АЧТЧ <80 с).
Таким чином:
- Терапевтичне «вікно» для проведення тромболітичної терапії у хворих із ТЕЛА становить до 14 днів від розвитку симптомів;
- Тромболітична терапія показана всім хворим із масивною ТЕЛА;
- Більшість протипоказань для проведення тромболітичної терапії при масивній ТЕЛА — відносні;
- З урахуванням ефективності та безпеки кращим режимом тромболітичної терапії при ТЕЛА є системне введення 100 мг альтеплази протягом 2 год;
- Ефективність тромболітичних препаратів у хворих із субмасивною ТЕЛА (гіпокінезія ПШ) не доведена, проте у зв’язку із клінічною доцільністю терапія може проводитися на розсуд лікаря;
- Тромболітична терапія не показана гемодинамічно стабільним хворим без ознак перевантаження/дисфункції ПШ.
Хірургічна емболектомія
Незважаючи на відсутність великих рандомізованих клінічних досліджень, які продемонстрували б зниження летальності при проведенні тромболітичної терапії у хворих із ТЕЛА, згідно з існуючими рекомендаціями ця методика проведення реперфузії залишається кращою. Водночас за даними ряду міжнародних реєстрів у реальній клінічній практиці кількість хворих із протипоказаннями для проведення фібринолітичної терапії більша і частота її ускладнень істотно вища, ніж у ретельно контрольованих клінічних дослідженнях. Так, за даними реєстру MAPPET (Management Strategies and Prognosis in Patients with Pulmonary Embolism), у 40% хворих із ТЕЛА, яким проводили фібринолітичну терапію, було хоч одне відносне протипоказання. При цьому в близько 1/3 пацієнтів із масивною ТЕЛА — абсолютні протипоказання для фібринолітичної терапії. У реєстрі ICOPER із 304 хворих, яким проводили тромболітичну терапію, у 66 (21,7%) відзначали великі, а у 9 (3%) — внутрішньочерепні кровотечі. Такі невтішні дані привели до пошуку нових методів лікування ТЕЛА і відродження методів хірургічної корекції.
Висока частота периопераційних ускладнень і висока смертність хворих при проведенні хірургічної емболектомії протягом ряду років обмежували використання цього методу лікування. Проте вдосконалення техніки оперативного втручання і методів анестезіологічної підтримки дозволило дещо поліпшити результати хірургічного лікування. На сьогодні хірургічна емболектомія — метод лікування хворих із масивною ТЕЛА, пацієнтів із протипоказаннями до проведення тромболітичної терапії, а також у разі неефективності останньої. Наявність тромбу в правих відділах серця чи незакриття овального отвору в міжпередсердній перегородці — додаткові критерії на користь хірургічного втручання. Результати оперативного лікування значно кращі при можливості його проведення до розвитку стійкого зниження АТ і/чи кардіогенного шоку.
На сьогодні використовують кілька методик емболектомії з ЛА. Емболектомія в умовах тимчасової оклюзії порожнистих вен не потребує складного технічного забезпечення, і у разі екстреної необхідності її може успішно виконати досвідчений хірург загального профілю. Одним із найнебезпечніших етапів подібного втручання є вступний наркоз, коли може виникнути брадикардія, гіпотензія й асистолія. Посилення гемодинамічних розладів пов’язане з тим, що різко дилатовані праві відділи серця надзвичайно чутливі до значних коливань внутрішньоплеврального тиску, які виникають під час штучної вентиляції легень. Всі маніпуляції щодо видалення емболів після пережимання порожнистих вен мають тривати не довше 3 хв, оскільки цей інтервал критичний для хворих, операцію яким проводять в умовах тяжкої вихідної гіпоксії. На жаль, подібна операція супроводжується дуже високою смертністю.
Проводиться також емболектомія в умовах штучного кровообігу з використанням черезстернального доступу. Допоміжну веноартеріальну перфузію проводять на першому етапі оперативного втручання (до вступного наркозу) шляхом канюлювання стегнових судин. Штучний кровообіг дозволяє значною мірою зробити більш безпечним проведення емболектомії у хворих із дуже тяжкими гемодинамічними розладами. І все ж смертність після подібних втручань досягає 20–50%.
Проведення оперативного втручання на працюючому серці без пережаття аорти з екстракцією лише видимого тромбу з основних гілок ЛА дозволило знизити смертність до 11%.
За відносними показаннями при однобічному ураженні можливе проведення хірургічної дезобструкції судинного русла з бічного торакотомного доступу в умовах пережаття відповідної ЛА.
Черезшкірна емболектомія, катетерна фрагметація і тромбектомія
У хворих із ТЕЛА найчастіше виявляють цілий ряд супутніх захворювань, які не дозволяють провести їм тромболітичну терапію чи хірургічне видалення тромбу. Доступність цілодобової хірургічної допомоги цим хворим в Україні, як і у світі в цілому, також обмежена. Єдиним альтернативним методом лікування у цьому разі є черезшкірна катетерна тромбектомія.
Ідеальний катетер для проведення черезшкірної тромбектомії при ТЕЛА характеризується такими властивостями:
1) висока маневреність, що дозволяє здійснити його швидкий пасаж по правих відділах серця з подальшою установкою в магістральні ЛА;
2) висока ефективність у видаленні обтурувального тромбу з магістральних ЛА, що дозволяє швидко поліпшити гемодинаміку, усунути недостатність ПШ і кардіогенний шок;
3) висока безпека, що полягає у відсутності ушкоджувальної дії на структури серця чи ЛА.
На сьогодні розроблено цілий ряд різних катетерів для лікування ТЕЛА. Деякі призначені для витягування, інші — для фрагментації, ще інші — для аспірації тромбу.
Більшість доступних на сьогодні катетерів не усувають тромб повністю, а розбивають його на фрагменти, які мігрують у більш дрібні розгалуження ЛА (рис. 1.20). Поперечний зріз периферичних судин малого кола кровообігу приблизно у 2 рази більший, ніж магістральних ЛА. Таким чином, перерозподіл великого центрального тромбу по дистальних судинах може швидко поліпшити гемодинаміку з істотним збільшенням загального легеневого кровотоку та поліпшенням функції ПШ.
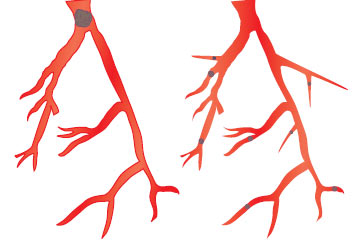
Рис. 1.20. Принцип катетерної терапії ТЕЛА. Тромб не усувається повністю, а розбивається на фрагменти, які мігрують у більш дрібні розгалуження ЛА
Успіх тромболітичної терапії, механічної тромбектомії чи катетерної фрагментації тромбу тим вищий, чим більш свіжим і пухким є тромб, що викликав оклюзію. Тромбектомію можна застосовувати у пацієнтів із давністю тромбу до 3 тиж.
На підставі анамнезу захворювання та даних ангіографії виокремлюють три групи хворих із різною ефективністю катетеризаційних втручань:
Тип 1 — пацієнти із «свіжим» тромбом, що призвів до недавньої емболізації ЛА — хороший результат втручання з відновленням периферичного легеневого кровотоку та оксигенації крові.
Тип 2 — пацієнти зі старим організованим тромбом, що призвів до недавньої емболізації ЛА — нижча ефективність тромбектомії, але незважаючи на високу ймовірність наявності резидуальних тромбів, шанси на поліпшення легеневого кровотоку хороші.
Тип 3 — пацієнти з ТЕЛА в анамнезі та повторному погіршенні самопочуття у зв’язку з рецидивною емболізацією — поганий результат механічної тромбектомії.
Першим катетером, розробленим для лікування масивної ТЕЛА, який використовують у клініці вже протягом 3 десятиліть, є катетер Greenfield. Пристрій призначений для видалення неорганізованих «свіжих» тромбів ручним способом за допомогою великого шприца. У більшості випадків процедура проводиться шляхом багаторазового повторного витягування частин тромбу для відновлення адекватного кровотоку в ЛА. Ефективність тромбектомії за допомогою цього катетера становить 76% за даними його винахідника і значно нижча за даними інших авторів.
Інші механічні чи реолітичні пристрої для тромбектомії в дольових і сегментарних гілках ЛА вивчали в невеликих клінічних дослідженнях.
Високоефективним пристроєм для механічної катетерної тромбектомії при масивній ТЕЛА є пристрій Aspirex. Основною частиною катетера є захищений змійовик, що обертається з великою швидкістю, через L-подібний отвір у наконечнику якого відбувається аспірація, мацерація та видалення тромбу (рис. 1.21).

Рис. 1.21. Пристрій Aspirex для катетерної тромбектомії при масивній ТЕЛА
На сьогодні використовують також фрагментацію тромбу без емболектомії шляхом балонної ангіопластики чи з використанням ротаційного катетера. Механічна фрагментація тромбу за допомогою балонної ангіопластики, проведена одночасно з фармакологічним тромболізисом (введення урокінази в дозі 80–100 тис. МО/год протягом 8–24 год) у хворих із масивною ТЕЛА, виявилася досить ефективною. В окремих випадках застосовують також стентування ЛА.
У деяких випадках катетери використовують для спрямованого введення фібринолітичного препарату, що дозволяє прискорити лізис тромбу і швидше відновити легеневий кровоток. Дані останніх років свідчать, що системна інфузія тромболітичних препаратів іноді не призводить до необхідного ефекту у зв’язку з недостатнім контактом лікарського засобу із тромбом у гілці ЛА, що піддалася оклюзії (рис. 1.22). Тромболітичну терапію у разі катетеризації проводять шляхом внутрішньовенного болюсного введення препарату з подальшою його інфузією протягом 12–24 год на фоні системної антикоагулянтної терапії.

Рис. 1.22. Схематичне зображення кровообігу в ЛА при ТЕЛА
Режими катетерної тромболітичної терапії:
- урокіназа: внутрішньовенна інфузія зі швидкістю 250 тис. МО/год одночасно з 2000 МО гепарину протягом 2 год з подальшим введенням урокінази зі швидкістю 100 тис. МО/год протягом 12–24 год;
- альтеплаза:
1) болюсне внутрішньовенне введення в дозі 10 мг із подальшою інфузією в дозі 40 мг протягом 2 год;
2) внутрішньовенна інфузія в дозі 100 мг протягом 7 год;
3) болюсне внутрішньовенне введення в дозі 20 мг з катетерною фрагментацією тромбу і подальшою інфузією в дозі 80 мг протягом 2 год.
При проведенні катетерних процедур, зокрема катетерної тромбектомії, можливий розвиток ряду ускладнень, які включають перфорацію чи дисекцію центральних судин і стінок серця, гемотампонаду, легеневу кровотечу і емболізацію судин великого кола кровообігу. Можливий також розвиток порушень ритму і блокад серця, втрати крові, контраст-індукованої нефропатії, анафілактичних реакцій та цілого ряду ускладнень у місці пункції судини (гематома, фістула, псевдоаневризма тощо). Для зниження ризику перфорації чи диссекції тромбектомію необхідно проводити лише в основних і дольових ЛА і не застосовувати цю методику в сегментарних артеріях. Процедуру слід припиняти при досягненні адекватного гемодинамічного ефекту незалежно від результатів ангіографії.
Антикоагулянтна терапія
Антикоагулянтна терапія — основний метод лікування хворих із ТЕЛА вже >40 років, з часу опублікування результатів дослідження Barrit і Jordan (1960). Нефракціонований гепарин зв’язується з антитромбіном III і підвищує активність останнього, що запобігає тромбоутворенню та сприяє розчиненню тромбів, що вже сформувалися, шляхом активації ендогенних фібринолітичних механізмів. Таким чином, гепаринотерапія в основному спрямована на джерело тромбоемболії, а не на тромб-ембол у ЛА, а основною її метою є профілактика повторних тромбозів та емболізації. Актуальність такої профілактики пояснюється тим, що за відсутності антикоагулянтної терапії у хворих, які перенесли епізод ТЕЛА, ймовірність повторної емболії з летальним результатом коливається від 18 до 30%.
Гепарин необхідно призначати всім хворим з підозрою на ТЕЛА (за відсутності протипоказань) ще на етапі діагностики. Після підтвердження діагнозу більшість протипоказань для гепаринотерапії, таких як активна кровотеча, вроджені чи набуті порушення гемостазу, неконтрольована АГ чи недавно перенесене хірургічне втручання слід розглядати як відносні. Починати антикоагулянтну терапію при ТЕЛА із самостійного призначення пероральних антикоагулянтів без попереднього введення гепарину менш ефективно, а в деяких випадках це може призвести до погіршення клінічного стану хворого (початковий протромбогенний ефект непрямих антикоагулянтів).
У рекомендаціях Європейського товариства кардіологів міститься нижченаведена схема введення нефракціонованого гепарину при ТЕЛА. Спочатку внутрішньовенно струйно (болюсно) вводять 5–10 тис. МО гепарину. Потім починають внутрішньовенне краплинне введення препарату. Початкова швидкість інфузії залежить від маси тіла хворого і розраховується за номограмою, проте не має бути нижчою 1250 МО/год. Гепаринотерапію виконують під обов’язковим контролем показника АЧТЧ. Перше визначення АЧТЧ проводять через 4–6 год від початку терапії, а швидкість наступної інфузії коригується залежно від досягнутого антикоагулянтного ефекту. Рекомендоване підтримання показника АЧТЧ на рівні в 1,5–2,5 раза вище, ніж контрольне значення для даної лабораторії (табл. 1.14).
Приводом до призначення гепарину в таких високих дозах є емпіричне спостереження недостатньої антикоагулянтної ефективності стандартних доз, при цьому відсутність адекватної антикоагуляції може стати фатальною для хворого. У пацієнтів із масивною ТЕЛА тактика гепаринотерапії має бути ще більш агресивною. При цьому рекомендують для болюсного введення застосовувати дозу не нижче 10 тис. МО, а цільовий рівень АЧТЧ при інфузійній терапії має становити не менше 80 с. Гепаринотерапію необхідно проводити протягом 7–10 днів, оскільки саме в ці строки відбувається лізис та/чи організація тромбу.
Таблиця 1.14
Номограма для проведення гепаринотерапії при ТЕЛА (Raschke et al., 1993)
| Показник | 80 МО/кг внутрішньовенно болюсно, далі зі швидкістю 18 МО/кг/год |
| АЧТЧ <35 с (<1,2 × контроль)
АЧТЧ 35–45 с (1,2–1,5 × контроль) АЧТЧ 36–70 с (1,5–2,3 × контроль) АЧТЧ 71–90 с (2,3–3,0 × контроль) АЧТЧ >90 c (>3,0 × контроль) |
80 МО/кг болюсно, підвищення швидкості інфузії на 4 МО/ кг/год
40 МО/кг болюсно, підвищення швидкості інфузії на 2 МО/кг/год Без змін Зниження швидкості інфузії на 2 МО/кг/год Припинення введення на 1 год, зниження швидкості інфузії на 3 МО/кг/год |
Застосування гепарину пов’язується із підвищеним ризиком розвитку кровотеч. Проведення інвазивних втручань, тромболітичної терапії, наявність супутніх місцевих уражень вроджених або набутих порушень гемостазу, в свою чергу, також підвищують імовірність кровотеч. Тому ретельний контроль АЧТЧ — обов’язкова умова адекватності й безпеки антикоагулянтної терапії гепарином.
Другим за частотою ускладненням гепаринотерапії є гепарин-індукована тромбоцитопенія (ГІТ). Описано два типи ГІТ, які характеризуються різними проявами і підходами до терапії. ГІТ I типу відзначається частіше і має сприятливий перебіг. Механізм її розвитку зумовлений неімунною взаємодією між гепарином і тромбоцитами, що викликає появу тромбоцитопенії з перших днів гепаринотерапії. При цьому кількість тромбоцитів рідко зменшується нижче 100 тис. у 1 мкл і часто повертається до норми, незважаючи на продовження застосування гепарину. Пацієнтам із ГІТ I типу не потрібне призначення специфічного лікування. ГІТ II типу відзначають у 1–5% всіх хворих, які одержують гепарин. Критерієм її діагностики є зменшення кількості тромбоцитів <100 · 109/л, або >50% їх вихідного рівня. У середньому кількість тромбоцитів при цьому типі тромбоцитопенії зменшується до 40–60 тис./мкл. Патогенез ГІТ II типу пов’язаний з імунними механізмами і тому вона розвивається на 5-й добі після початку гепаринотерапії. Імунну реакцію в більшості випадків запускає комплекс гепарину з IV фактором тромбоцитів (IV ФТ), що стимулює утворення антитіл, переважно Ig. Імунні комплекси (гепаринів/IV ФТ/Ig) адсорбуються на поверхні тромбоцитів. Ig взаємодіють із тромбоцитарними Fc-рецепторами (FcγRIIA) і призводять до активації, агрегації і подальшої деструкції тромбоцитів із вивільненням великої кількості біологічно активних речовин. У результаті утворюються тромбоцитарні мікрочастинки, багаті фосфоліпідами з вираженою прокоагулянтною активністю. Ig також активують клітини ендотелію, зв’язуючись із IV ФТ/гепаринсульфатним комплексом на їх поверхні, внаслідок чого синтезується велика кількість тканинного фактора (тканинний тромбопластин), що ініціює зовнішній шлях згортальної системи крові. Тому найчастішими та клінічно значимими проявами ГІТ II типу є тромбози і тромбоемболії, які відзначають у 30–55% випадків. Особливо часто при ГІТ виявляють тромбози глибоких вен нижніх кінцівок і рецидиви ТЕЛА. Тромбози артеріальних судин частіше проявляються у вигляді ішемії нижніх кінцівок, порушень мозкового кровообігу, ІМ. При цьому застосування непрямих антикоагулянтів (аценокумарол, варфарин тощо) у хворих з ГІТ II парадоксально підвищує ризик розвитку тромботичних ускладнень. На сьогодні немає оптимального лабораторного методу діагностики ГІТ, а більшість існуючих методик мають обмежене використання у клінічній практиці (табл. 1.15).
При ГІТ II типу необхідна негайна відміна гепарину, а в більшості випадків — призначення альтернативної антикоагулянтної та антитромбоцитарної терапії. Для профілактики та лікування тромбозів використовують прямі інгібітори тромбіну (гірудин, бівалірудин) і антитромбоцитарні препарати, за необхідності — хірургічні втручання (тромбектомія, фрагментація тощо). Із метою профілактики ГІТ при проведенні гепаринотерапії необхідно проводити контроль кількості тромбоцитів крові через день. Значного зниження імовірності ГІТ досягають також при застосуванні НМГ і пентасахариду (фондапаринукс натрій).
Таблиця 1.15
Лабораторі методи діагностики ГІТ (за T.E. Warkentin, 1997)
| 1. Визначення кількості тромбоцитів |
| 2. Функціональні тести:
– тест агрегації тромбоцитів для визначення ГІТ-IgG; – тест секреції серотоніну для визначення ГІТ-IgG |
| 3. Антигенні тести:
– визначення титру ГІТ-IgG методом імуноферментного аналізу (ELISA) |
В останні роки для лікування хворих із ТЕЛА успішно використовують НМГ. Вони мають ряд переваг перед нефракціонованим гепарином. Для НМГ характерні підвищена біодоступність при підшкірному введенні, більш тривалий період напіввиведення, низька частота розвитку тромбоцитопенії та остеопорозу. НМГ мають також більш передбачуваний антикоагулянтний ефект, оскільки в меншій мірі, ніж нефракціоновані гепарини, зв’язуються з білками плазми крові. Це дозволяє призначати їх із урахуванням маси тіла хворого. Необхідність у спеціальному лабораторному контролі при їх застосуванні в більшості випадків відсутня.
У 2004 р. проведено метааналіз усіх рандомізованих досліджень, в якому порівнювали безпеку та ефективність застосування нефракціонованого гепарину і НМГ у хворих із симптомною і безсимптомною (ТГВ) ТЕЛА. Не виявлено істотних відмінностей між двома видами терапії за частотою розвитку повторних симптомних венозних тромбоемболічних ускладнень і смерті як на момент припинення лікування, так і за результатами 3-місячного спостереження (табл. 1.16).
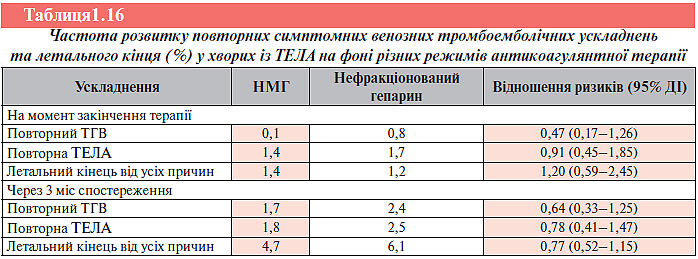
У пацієнтів із симптомною ТЕЛА розвиток повторних венозних тромбоемболій та смерті також не відрізнялися і становили для нефракціонованого гепарину і НМГ — 2,3% проти 1,7% на момент закінчення лікування і 4,3% проти 3,3% через 3 міс спостереження (p>0,05) відповідно. Ймовірність розвитку великих і малих кровотеч на фоні застосування різних видів гепаринотерапії була однаковою. Таким чином, застосування НМГ, як мінімум, настільки ж ефективне і безпечне для лікування гострої немасивної ТЕЛА, як і нефракціонованого гепарину. Зручність застосування, низька ймовірність розвитку алергічних реакцій і ГІТ, у свою чергу, роблять НМГ більш привабливими для лікування цієї категорії пацієнтів. Водночас застосування нефракціонованого гепарину залишається єдиним методом антикоагулянтної терапії, рекомендованим для застосування у хворих із масивною ТЕЛА. При застосуванні НМГ слід пам’ятати, що основний шлях їх виведення —через нирки, в той час як нефракціонований гепарин в основному метаболізується в печінці. У пацієнтів із хронічними захворюваннями нирок, вираженим ожирінням, непередбаченими кровотечами, а також повторними ТЕЛА (незважаючи на проведену терапію НМГ в адекватних дозах), і в період вагітності слід проводити лабораторне моніторування при терапії НМГ.
Цілий ряд НМГ тестували для лікування та профілактики тромбозу глибоких вен і ТЕЛА (еноксапарин натрій, дальтепарин натрій, надропарин кальцій, тинзапарин, ревіпарин, цертопарин, ардепарин тощо). Згідно з даними вищеописаного метааналізу, не було відзначено переваг того чи іншого НМГ для лікування ТЕЛА. Із зареєстрованих на сьогодні в Україні НМГ найбільш вивченим для терапії хворих із тромбозом глибоких вен і ТЕЛА є еноксапарин натрій (зареєстрований FDA для лікування ТЕЛА). Його застосовують у дозі 1 мг/кг маси тіла через 12 год або 1,5 мг/кг 1 раз на добу. Тривалість лікування хворих із ТЕЛА із застосуванням НМГ становить 5–10 днів.
Альтернативним методом антикоагулянтної терапії при ТЕЛА є використання селективного інгібітора Х фактора згортання крові — фондапаринукса. Його підшкірне введення у фіксованій дозі (5 мг для хворих з масою тіла <50 кг, 75 мг — 50–100 кг, 10 мг — >100 кг) один раз на добу у дослідженні H.R. Baller та співавторів було настільки ж ефективним, як введення нефракціонованого гепарину. Але фондапаринукс не рекомендований для застосування у хворих з масивною ТЕЛА, а також для пацієнтів із супутньою нирковою недостатністю (кліренс креатиніну <20 мл/хв).
Одночасно із застосуванням гепарину хворим із ТЕЛА призначають непрямі антикоагулянти, механізм дії яких полягає в порушенні нормального метаболізму вітаміну К в печінці. Вітамін К необхідний для синтезу цілого ряду факторів згортальної системи крові (II, VII, IX, Х). Вітамін К також відіграє роль в активації протеїнів С і S, що мають антикоагулянтні властивості. Оскільки період напіввиведення протеїнів С і S менший, ніж факторів згортальної системи крові, то протягом перших кількох днів прийому пероральні антикоагулянти можуть викликати тимчасовий парадоксальний стан гіперкоагуляції. У зв’язку з цим, а також виходячи з необхідності 4–5-денного періоду для досягнення адекватного антикоагулянтного ефекту, прийом непрямих антикоагулянтів необхідно починати вже з перших днів гепаринотерапії.
Із препаратів цієї групи в Україні зареєстровані варфарин, аценокумарол, феніндіон. Ці препарати добре абсорбуються в кишечнику і при потраплянні у кров зв’язуються з білками плазми крові (на 97–99%), метаболізуються в печінці і потім екскретуються з сечею. Період напіввиведення варфарину становить 42 год, аценокумаролу — 9 год, феніндіону — 5 год. Встановлено, що зі збільшенням періоду напіввиведення знижуються коливання антикоагулянтного ефекту та кратність прийому препарату, водночас збільшується тривалість дії препарату після його відміни, що стає актуальним у разі розвитку геморагічних ускладнень. Період напіввиведення варфарину дозволяє призначати препарат 1 раз на добу і забезпечує незначні коливання його антикоагулянтного ефекту. Тому саме варфарин одержав найбільше поширення у світовій клінічній практиці й успішно застосовується протягом >50 років.
Початкова доза варфарину у хворих із ТЕЛА зазвичай становить 5 мг. Існують різні схеми насичення варфарином, при цьому найбільше поширення одержала схема, наведена в табл. 1.17.
Таблиця 1.17
Схема насичувальної терапії варфарином (Kovacs M.J. et al., 2003)
| День | Показник МНВ (INR) | Доза варфарину, мг/добу |
| 1-й | – | 5 |
| 2-й | – | 5 |
| 3-й | <1,5
1,5–1,9 2,0–2,9 >3,0 |
10
5 2,5 0 |
| 4-й | <1,5
1,5–1,9 2,0–2,9 >3,0 |
10
7,5 5 0 |
| 5-й | <2,0
2,0–2,9 >3,0 |
10
5 0 |
| 6-й | <1,5
1,5–1,9 2,0–2,9 >3,0 |
10
7,5 5 0 |
Час появи протитромботичного ефекту однаковий для всіх непрямих антикоагулянтів і в середньому становить 3–5 днів. Це пов’язане з тим, що повноцінна протитромботична дія настає лише тоді, коли знижується концентрація всіх чотирьох вітамін К-залежних факторів. При цьому фактор VII, що має найбільш короткий період напіввиведення, починає зникати з плазми крові вже через кілька годин після початку прийому препаратів. Саме ці спостереження дозволили відмовитися від застосування непрямих антикоагулянтів в ударних дозах для насичення, які не дають додаткових переваг, а можуть призвести до різкого зниження рівня фактора VII у перші 48 год, викликаючи геморагічні ускладнення та некрози шкіри.
Похідні індандіону (феніндіон) мають подібну до кумаринів антикоагулянтну дію, але їх не рекомендують застосовувати як препарати першого ряду у зв’язку з високою частотою їх побічних ефектів (різноманітні шкірні прояви і гепатотоксична дія). Виняток становлять хворі з гіперчутливістю до похідних кумарину і ті, які добре переносять тривалий прийом індандіонів.
Протягом усього періоду клінічного застосування непрямих антикоагулянтів основним методом контролю є визначення протромбінового часу (ПЧ). Цей метод заснований на активації згортання крові тканинним екстрактом — тромбопластином. У цю реакцію залучаються фактори «зовнішнього» каскаду фібриноутворення, вміст яких головним чином знижується під дією препаратів цього ряду.
На сьогодні для активації згортання крові або плазми крові при виконанні цього тесту використовують близько 30 тромбопластинів. Їх одержують із різних джерел (трупний мозок людини, мозок кролика чи бика та ін.). Вони розрізняються за чутливістю до змін згортання крові під дією антикоагулянтів, у неоднаковому ступені інгібуються PIVKA (білками, що утворюються за відсутності вітаміну К). Це зумовлює значні розбіжності в результатах досліджень ПЧ, що проводяться різними лабораторіями, і утруднює розробку єдиного оптимального рівня гіпокоагуляції. На підставі пропозиції ВООЗ були відкалібровані найпоширеніші у світі тромбопластини і створено єдину стандартну шкалу визначення інтенсивності гіпокоагуляції (відносно Британського порівняльного тромбопластина). Єдиний показник результатів визначення ПЧ одержав назву Міжнародного нормалізованого відношення (МНВ). Для перевірки рівня гіпокоагуляції стали застосовувати референтні плазми крові, приготовлені як штучно, так і одержані з крові хворих, які приймають непрямі антикоагулянти. Встановлені у процесі стандартизації тромбопластинів калібровані константи, так званий міжнародний індекс чутливості (МІЧ), дозволили порівнювати результати ПЧ незалежно від тромбопластина, який використовується. На сьогодні, як правило, в інструкції до тромбопластину зазначають МІЧ, за допомогою якого за формулою можна визначити МНВ:
МНВ = (ПЧ хворого/ПЧ донора)МІЧ.
Після насичення варфарином подальшу корекцію дози здійснюють залежно від МНВ, що має залишатися на рівні 2,0–3,0.
Слід пам’ятати, що цілий ряд продуктів харчування та лікарських засобів можуть впливати на антикоагулянтний ефект варфарину, оскільки є джерелом надходження вітаміну К або впливають на метаболізм варфарину. Продукти, що містять вітамін К у великій кількості, і тим самим знижують ефективність кумаринових похідних, а також препарати, які знижують/підвищують їх ефективність, наведені в табл. 1.18.
Таблиця 1.18
Продукти харчування та лікарські засоби, що впливають на ефективність пероральної антикоагулянтної терапії варфарином
| Продукти, що містять велику кількість вітаміну К | Лікарські засоби, які змінюють ефективність терапії варфарином | |
| Знижують | Підвищують | |
| Брюсcельська капуста
Білокачанна капуста Зелений чай Шпинат Авокадо Броколі Кольорова капуста Салат Печінка Соя, олія сої Зелена цибуля |
Гризеофульвін
Естрогени Барбітурати Пероральні контрацептиви Колестирамін Колестипол |
Саліцилати
Сульфаніламіди Хлоралгідрат Етакринова кислота Клофібрат Гемфіброзил Кетоконазол Анаболічні стероїди Циметидин Пероральні антибіотики Суліндак |
Загальна тривалість лікування непрямими антикоагулянтами має становити не менше 3 міс. У деяких випадках, наприклад у хворих з чітко вираженим гіперкоагуляційним синдромом, непрямі антикоагулянти застосовують протягом ≥1 року. Схема проведення антикоагулянтної терапії у хворих із ТЕЛА наведена на рис. 1.23.
Рис. 1.23. Алгоритм проведення антикоагулянтної терапії у хворих із ТЕЛА
До найчастіших ускладнень терапії непрямими антикоагулянтами належать кровотечі, тому їх застосування протипоказане пацієнтам із пептичною виразкою шлунка і дванадцятипалої кишки, неспецифічним виразковим колітом, геморагічними діатезами та іншими захворюваннями, що характеризуються підвищеним ризиком розвитку геморагії. При виникненні кровотечі на фоні прийому непрямих антикоагулянтів необхідно відмінити прийом цих препаратів. Внутрішньовенно вводять антагоніст непрямих антикоагулянтів — вітамін К в дозі 5–10 мг щоденно. Слід пам’ятати, що максимальну ефективність препарату відзначають лише через 20–24 год після введення. Тому за необхідності термінової зупинки кровотечі необхідно провести трансфузію свіжозамороженої плазми крові в дозі 10–20 мл/кг маси тіла, одночасно розпочавши терапію вітаміном К.
Профілактика тромбоемболічних ускладнень у хворих, які перебувають на лікуванні у стаціонарі
Профілактика ТЕЛА і тромбозу глибоких вен нижніх кінцівок — одне з основних завдань тактики ведення пацієнтів, які перебувають на лікуванні у стаціонарі. Саме цей пункт займає 1-ше місце серед 79 основних профілактичних заходів, які можуть підвищити безпеку хворого, відповідно до останнього звіту Агентства з вивчення якості охорони здоров’я США (The Agency for Healthcare Research and Quality, США). Проте, незважаючи на наявність ефективних і безпечних методів профілактики, використання їх у повсякденній клінічній практиці залишається не на належному рівні. Парадоксально, але сьогодні у хворих терапевтичного, а не хірургічного профілю частіше виявляють розвиток ТГВ нижніх кінцівок, що пояснюється, імовірно, більш адекватною його профілактикою в хірургічних клініках. За даним Goldhaber і співавторів, у 33 із 100 хворих, які перебували у відділенні інтенсивної терапії терапевтичного профілю >48 год, за допомогою УЗД виявлено ТГВ нижніх кінцівок.
Питання про необхідність профілактики та вибору її методу ґрунтується на класифікації хворих за ступенем ризику розвитку цих ускладнень, а основні її принципи полягають в наступному:
- у кожного хворого необхідно оцінити ступінь ризику розвитку тромбоемболічних ускладнень;
- при встановленні ризику у всіх пацієнтів слід проводити профілактику залежно від його ступеня;
- профілактику потрібно здійснювати доти, доки є ризик розвитку тромбоемболічних ускладнень (табл. 1.19).
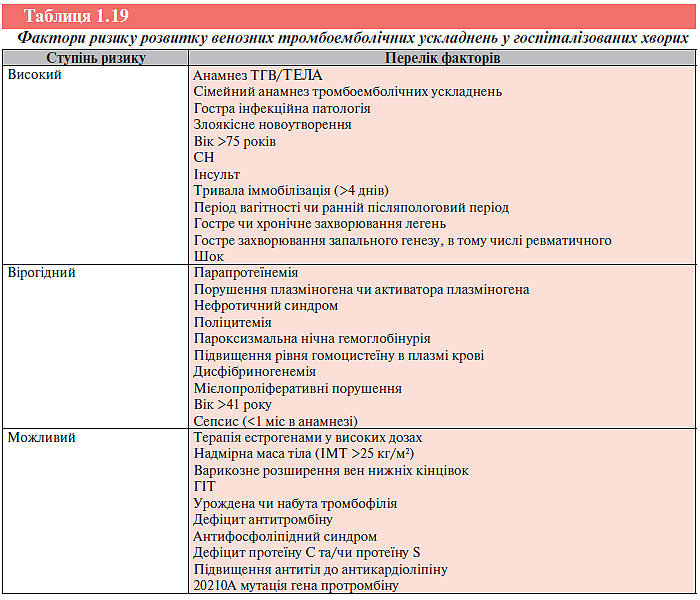
Пацієнтам, у яких виявлені фактори ризику розвитку ТГВ, потрібно щодня проводити огляд нижніх кінцівок із визначенням симптомів Хоманса і Мозеса, а за необхідності — УЗД вен нижніх кінцівок. Із метою профілактики ТГВ/ТЕЛА проводять немедикаментозні (механічні), медикаментозні заходи; у пацієнтів із високим ризиком можлива також їх комбінація.
Немедикаментозні засоби профілактики включають ранню активізацію хворих у післяопераційний період, при ІМ, інсульті головного мозку; еластичну компресію ніг (еластичні бинти, протитромбозні панчохи та гольфи, переривчаста пневматична компресія).
Накладання еластичних бинтів проводять вже при госпіталізації хворого, оскільки перебування у стаціонарі завжди пов’язане з обмеженням рухової активності. Бинт розтягують з початку кожного туру і накладають від рівня плюснефалангових суглобів у положенні стопи під прямим кутом до гомілки та її супінації, захоплюючи половину ширини попереднього туру бинта і поступово знижуючи компресію від щиколотки до верхньої третини стегна. Необхідно прагнути, щоб тиск, який чинить бинт, становив у нижньо-середній третині гомілки — 15–20 мм рт. ст., на рівні нижньої третини стегна — 8–10 мм рт. ст. Простіші та ефективніші у використанні спеціальні панчохи дозованої компресії, що самостійно забезпечують необхідний градієнт тиску. Проте потрібно провести їх попередній підбор, і вони не завжди забезпечують адекватний ступінь компресії в найближчий післяопераційний період. Панчохи дозованої компресії створюють градієнт тиску до 30–40 мм рт. ст. з максимальним тиском у ділянці носка та мінімальним — в ділянці стегна, що супроводжується зменшенням (приблизно на 70%) обсягу венозного судинного русла та підвищенням швидкості венозного кровотоку в нижніх кінцівках. Застосування панчіх дозованої компресії після порожнинних, гінекологічних і нейрохірургічних втручань дозволяє знизити ризик розвитку тромбозу глибоких вен більше ніж у 3 рази, а також поряд із використанням НМГ є найбільш ефективним методом профілактики у хворих після операцій на тазостегновому суглобі. Можливе застосування перемежованої пневматичної компресії ніг, для проведення якої використовують спеціальний пристрій. Еластична компресія нижніх кінцівок, крім прискорення венозного кровотоку та зменшення стазу крові, приводить до стимуляції ендогенних фібринолітичних механізмів за рахунок незначного ушкодження клітин ендотелію, а також зміни реологічних характеристик та перфузійного тиску в судинах нижніх кінцівок. Проводити еластичну компресію слід до відновлення звичайного рухового режиму хворого, продовжуючи її в амбулаторних умовах.
Важливу роль відіграє лікувальна фізкультура (ЛФК), заняття якою також проводять для всіх без винятку хворих. ЛФК приводить до збільшення об’ємної швидкості кровотоку і венозного відтоку і є важливим чинником профілактики розвитку тромбозів. Крім того, регулярна фізична активність — один зі стимуляторів синтезу і вивільнення в кровоток простацикліну, що знижує імовірність пристінкового тромбоутворення. Застосовують також інші засоби неспецифічної профілактики, спрямовані на активізацію кровотоку в нижніх кінцівках. Певний ефект може дати горизонтальне положення хворого з піднятими гомілками (кут згинання в колінних і тазостегнових суглобах має становити 20–30°). Ефективна також інтраопераційна електроміостимуляція, для проведення якої необхідна наявність спеціальної апаратури, тому вона поки не набула великого поширення.
Методи фармакологічної профілактики
Із метою медикаментозної профілактики застосовують антикоагулянтну (нефракціонований гепарин/НМГ, фондапаринукс натрій, непрямі антикоагулянти) і антиагрегантну терапію.
Великий крок вперед щодо попердження ТГВ/ТЕЛА зроблений після появи НМГ, а згодом і фондапаринуксу натрію. У трьох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях у хворих нехірургічного профілю встановлено, що застосування НМГ (еноксапарину натрію чи дальтепарину натрію) чи синтетичного пентасахариду (фондапаринуксу натрію) 1 раз на добу є безпечним і дозволяє практично наполовину знизити ризик розвитку тромбозу глибоких вен порівняно з плацебо. Основні дані цих досліджень наведені в табл. 1.20.
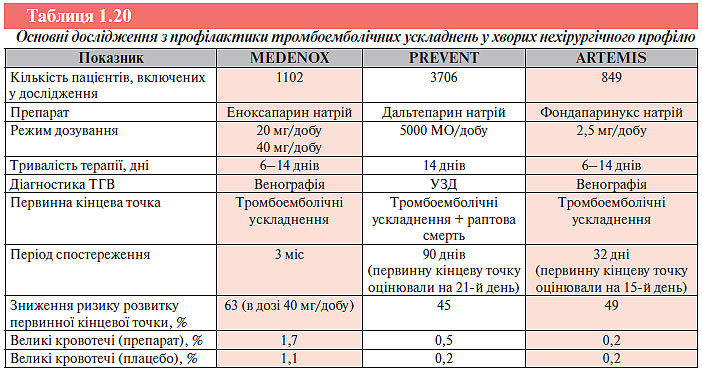
При цьому в дослідженні ARTEMIS терапія фондапаринуксом натрію зумовлювала достовірне зниження частоти фатальної ТЕЛА (р=0,029), а також відзначена тенденція до зниження загальної смертності у групі, яка отримувала фондапаринукс натрій через 32 дні спостереження (табл. 1.21).
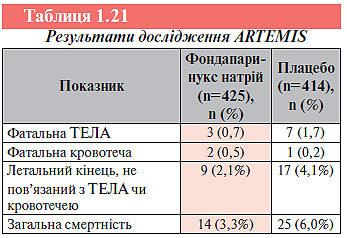
Протягом тривалого часу з метою профілактики тромбоемболічних ускладнень застосовували нефракціонований гепарин в дозі 5000 МО 2–3 рази на добу. Проте дані різних досліджень щодо ефективності та безпеки нефракціонованого гепарину суперечливі. У 2003 р. обнародувані результати дослідження THE-PRINCE, в якому встановлено, що введення нефракціонованого гепарину в дозі 5000 МО 3 рази на добу за ефективністю та безпекою еквівалентно 40 мг еноксапарина натрію 1 раз на добу.
Хворим хірургічного профілю антикоагулянтну терапію та механічну профілактику тромбозу глибоких вен необхідно проводити залежно від виду хірургічного втручання (табл. 1.22).
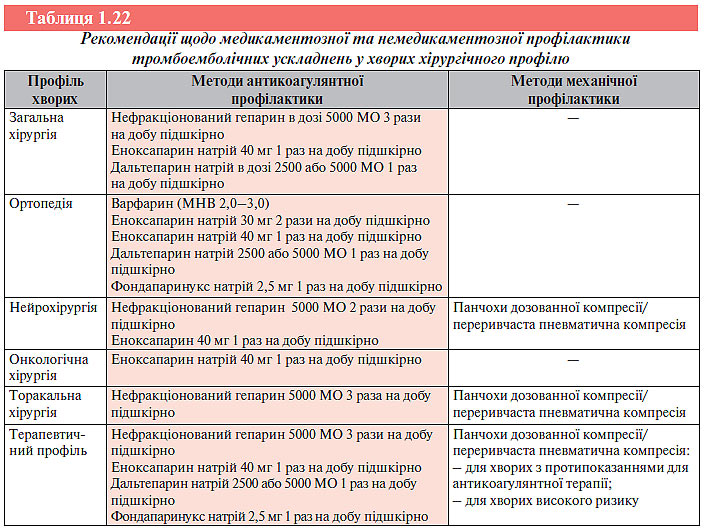
Тривалість лікування нефракціонованим гепарином/НМГ — не менше 7–10 днів (до повної мобілізації пацієнта). При ургентних операціях, а також у разі небезпеки виникнення інтраопераційної кровотечі гепаринотерапію починають після завершення втручання, але не пізніше, ніж через 12 год. Під час операції застосовують засоби прискорення венозного кровотоку. У разі застосування спінальної чи епідуральної анестезії при призначенні НМГ дотримуються таких правил (рекомендації FDA США):
1) спінальну пункцію можна проводити лише через 10–12 год після введення початкової профілактичної дози НМГ;
2) перед початком введення гепарину, якщо можливо, слід видалити спінальний катетер;
3) якщо катетер залишається на місці, його видаляють через 10–12 год після останньої ін’єкції НМГ і за 2 год до наступної;
4) необхідно відкласти застосування антикоагулянтів при травматичній спінальній/епідуральній пункції;
5) слід дотримуватися обережності при застосуванні НПЗП.
Введення нефракціонованого гепарину/НМГ із профілактичною метою відміняють, як правило, без подальшого призначення непрямих антикоагулянтів.
Вторинна профілактика ТГВ/ТЕЛА. Усім пацієнтам, які перенесли ТГВ/ТЕЛА, показане лікування непрямими антикоагулянтами:
- при первинному епізоді ТГВ/ТЕЛА, причина розвитку яких встановлена, тривалість лікування має становити 3 міс;
- при первинному епізоді ідіопатичного ТГВ тривалість терапії — 3–6 міс (у хворих віком молодше 50 років необхідно виключити наявність тромбофілії);
- при первинному епізоді ТГВ/ТЕЛА у осіб із тромбофілією лікування слід проводити довічно;
- при повторному розвитку ТГВ/ТЕЛА, за винятком випадків транзиторного існування їх явної причини, лікування проводять довічно;
- при терапевтичному значенні МНВ 2,0–3,0 основними методами хірургічної профілактики є тромбектомія, в тому числі з використанням ендоваскулярних методів, перев’язка магістральних вен (стегнової вени нижче устя глибокої вени стегна), плікація нижньої порожнистої вени та імплантація кава-фільтра (КФ). На сьогодні найширше застосовують черезшкірну імплантацію КФ, показаннями до якої є:
- наявність протипоказань до антикоагулянтної терапії чи тяжкі геморагічні ускладнення при її застосуванні;
- рецидив ТЕЛА чи проксимальне поширення флеботромбозу на фоні адекватної антикоагулянтної терапії;
- тромбоемболектомія з ЛА;
- протяжний флотуючий тромб в ілеокавальному венозному сегменті;
- ТГВ/ТЕЛА у хворих із низьким кардіопульмональним резервом і тяжкою легеневою гіпертензією;
- високий ризик розвитку ТГВ/ТЕЛА (великі оперативні втручання, переломи кісток і хребта) у хворих, які перенесли ТЕЛА;
- ТЕЛА у вагітних (як доповнення до терапії гепарином або за наявності протипоказань до застосування антикоагулянтів);
- безуспішність раніше використаних методів лікування ТГВ/ТЕЛА;
- тромбендартеректомія, проведена хворим із постемболічною легеневою гіпертензією;
- ТГВ/ТЕЛА у хворих, які перенесли трансплантацію нирки чи серця.
Протипоказання до імплантації КФ — тяжка коагулопатія за наявності ризику виникнення кровотечі; обструктивний тромбоз тієї частини вени, у яку має бути імплантований КФ; септична емболізація та септикопіємія. При септичній тромбоемболії КФ не перешкоджає проходженню дрібних бактеріальних емболів, тому в таких випадках проводиться перев’язка нижньої порожнистої вени. При септичному тромбофлебіті малого таза, крім того, перев’язують ліву яєчникову вену. Техніка виконання черезшкірної імплантації КФ різних конструкцій (зонтичний Мобіна — Уддіна, Грінфільда, Амплатца, «пташине гніздо», «тюльпан Гюнтера», РЕПТЕЛА, «піскові годинники») має багато спільного. Імплантацію КФ роблять у рентгенопераційному кабінеті. Для оцінки стану нижньої порожнистої вени та одержання інформації про ембологенність тромбу спочатку здійснюють ретроградну чи антеградну ілеокаваграфію. Вибір доступу (ретроградний — яремний, підключичний; антеградний — стегновий) залежить від імовірної локалізації тромбу: проведення катетера через тромбовані вени може призвести до фрагментації тромбу з розвитком ТЕЛА.
КФ імплантують безпосередньо нижче устя ниркових вен. При низькому положенні фільтра внаслідок утворення між ним та устями ниркових вен мертвого простору підвищується ризик тромбоутворення і розвитку ТЕЛА. Після імплантації КФ проводять контрольну рентгенографію для визначення місця його розташування. Протягом 2 діб хворому показаний постільний режим; призначають антибіотики на 5–6 днів, проводять лікування гепарином. Протиемболічні КФ надійно запобігають ТЕЛА: частота розвитку післяопераційної емболії не перевищує 1,2%. Результати рандомізованого клінічного дослідження PREPIC, у ході якого оцінювали ранні та віддалені наслідки застосування КФ з метою профілактики розвитку ТЕЛА у хворих із проксимальним ТГВ, свідчать, що імплантація КФ попереджає розвиток ТЕЛА протягом перших 12 діб, але підвищує ризик виникнення ТГВ протягом наступних 2 років. За час спостереження смертність в обох групах була однаковою. З урахуванням результатів цього дослідження перспективними слід визнати застосування таких конструкцій КФ, які можна витягати з нижньої порожнистої вени по мірі усунення загрози розвитку ТЕЛА. На сьогодні у клінічній практиці з успіхом використовують знімний КФ «Парасолька».
ЛІТЕРАТУРА
- Adapted from Goldhaber S.Z., Visani L., De Rosa M., for ICOPER (1999) Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet, 353: 1386.
- Fleischner F.G. (1965) Observations on the radiologic changes in pulmonary embolism. In Sasahara A.A., and Stein M. (Eds.): Pulmonary Embolic Disease. New York, Grune & Stratton, p. 312.
- Greenspan R.H. (1994) Pulmonary angiography and the diagnosis of pulmonary embolism. Prog. cardiovasc. dis, Vol. 37(2): 93–106.
- Gregory Elliott C., Goldhaber Samuel Z., Luigi Visani and Marisa DeRosa Chest Radiographs in Acute Pulmonary Embolism (2000) Results From the International Cooperative Pulmonary Embolism Registry. Chest, 118: 33–38.
- Grifoni S., Vanni S., Magazzini S. et al. (2006) Association of Persistent Right Ventricular Dysfunction at Hospital Discharge After Acute Pulmonary Embolism With Recurrent Thromboembolic Events. Arch Intern Med., 166: 2151–2156.
- Kearon C., Kahn S.R., Agnelli G., Goldhaber S., Raskob G.E., Comerota A.J. (2008) Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest, 133(Supp. l): 454S–545S. [Erratum, Chest (2008) 134: 892].
- Kovacs M.J., Rodger M., Anderson D.R. et al. (2003) Comparison of 10-mg and 5-mg warfarin initiation nomograms together with low-molecular-weight heparin for outpatient treatment of acute venous thromboembolism. A randomized, double-blind, controlled trial. Ann Intern Med; 138: 715.
- Kucher N., Goldhaber S.Z. (2003) Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism. Circulation, 108: 2191–2194.
- Kucher N., Rossi E., De Rosa M., Goldhaber S.Z. (2005) Prognostic Role of Echocardiography Among Patients With Acute Pulmonary Embolism and a Systolic Arterial Pressure of 90 mm Hg or Higher. Arch. Intern. Med., 165: 1777–1781.
- Kucher N., Rossi E., De Rosa M. et al. (2006) Massive Pulmonary Embolism. Circulation, 113: 577–582.
- Kurzyna M., Torbicki A., Pruszczyk P. et al. (2002) Disturbed right ventricular ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism. Am. J. Cardiol., 90(5): 507–511.
- Le Gal G., Righini M., Roy P.-M. et al. (2006) Prediction of Pulmonary Embolism in the Emergency Department: The Revised Geneva Score. Ann. Intern. Med., 144: 165–171.
- Le Gal G., Righini M., Roy P.-M. et al. (2006) Value of D-Dimer Testing for the Exclusion of Pulmonary Embolism in Patients With Previous Venous Thromboembolism. Arch Intern Med., 166: 176–180.
- Lesser B.A., Leeper K.V., Stein P.D. et al. (1992) The diagnosis of acute pulmonary embolism in patients with chronic obstructive pulmonary disease. Chest, 102: 17–22.
- Lobo J.L., Zorrilla V., Aizpuru F. et al. (2006) Clinical Syndromes and Clinical Outcome in Patients With Pulmonary Embolism. Findings From the RIETE Registry. Chest, 130: 1817–1822.
- Ribeiro A., Lindmarker P., Johnsson H. et al. (1999) Pulmonary embolism: one-year follow-up with echocardiography doppler and five-year survival analysis. Circulation, 99: 1325–1330.
- Snow V,, Quaseem A., Barry P. et al. (2007) Management of Venous Thromboembolism: A Clinical Practice Guideline from the American College of Physicians and the American Academy of Family Physicians. Ann. Fam. Med, J., 5: 74–80.
- Stein P., Athanasoulis C., Alavi A. et al. (1992) Complications and Validity of Pulmonary Angiography in Acute Pulmonary Embolism. Circulation, 85: 462–468.
- Tapson VF. Acute pulmonary embolism. (2008) N Engl J Med, 358: 1037–1052.
- Task Force Report (2000) Guidelines on diagnosis and management of acute pulmonary embolism. European Society of Cardiology. Europ. Heart J., Vol. 21: 1301–1336.
- Thabut G., et al. (2002) Thrombolytic therapy of pulmonary embolism: A meta-analysis. J. Am. Coll. Cardiol., 40: 1660–1667.
- The PIOPED investigators: value of the ventilation/per/fusion scan in acute pulmonary embolism (1990) JAMA, 263: 2753–2755.
- The PISA-PED Investigators (1996) Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the prospective study of acute pulmonary embolism diagnosis (PISA-PED). Am. J. Respir Crit. Care Med., 154: 1387–1393.
- Torbicki A., Perrier A., Konstantinides SV., et al. (2008)Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J, 29: 2276–2315.
- van Strijen M.J., de Monye W., Schiereck J. et al. (2003) Single-detector helical computed tomography as the primary diagnostic test in suspected pulmonary embolism: a multicenter clinical management study of 510 patients. Ann. Intern. Med., 138: 307–314.
- Wells P.S., Anderson D.R., Rodger M. et al. (2000) Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: Increasing the models utility with the SimpliRED D-dimer. Thromb Haemost, 83: 416.
- Wells P.S., Hirsh J., Anderson D.R. et al. (1995) Accuracy of clinical assessment of deep/vein thrombosis. Lancet, 345: 1326–1330.
- Wicki J., Perrier A., Perneger T.V. et al. (2000) Predicting adverse outcome in patients with acute pulmonary embolism: A risk score. Thromb. Haemost, 84: 548.