Тібсово таблетки, вкриті плівковою оболонкою 250 мг пляшка №60
Тібсово інструкція із застосування
Склад
діючі речовини: івосиденіб (ivosidenib)1;
1 таблетка, вкрита плівковою оболонкою, містить 250 мг івосиденібу;
допоміжні речовини:
інтрагранулярні: гіпромелози (гідроксипропілметил-целюлози) ацетату сукцинат, клас M (HPMCAS-M)1, метанол1, 2, целюлоза мікрокристалічна PH-103, натрію кроскармелоза, лаурилсульфат натрію, кремнію діоксид колоїдний безводний, магнію стеарат;
екстрагранулярні: целюлоза мікрокристалічна PH-103, натрію кроскармелоза, кремнію діоксид колоїдний безводний, магнію стеарат;
плівкова оболонка: вода очищена2, Opadry® II Blue 33K105003: HPMC 2910/гіпромелоза (E 464), титану діоксид (E 171), лактози моногідрат, триацетин (E 1518), FD&C Blue #2/індигокарміну алюмінієвий лак (E 132).
1 Діюча речовина івосиденіб та гіпромелози (гідроксипропілметил-целюлози) ацетату сукцинат, клас M (HPMCAS-M) висушені розпиленням у композиції 1:1 для отримання твердодисперсного проміжного продукту івосиденібу. Метанол використовується в якості розчинника в процесі вироблення твердодисперсного проміжного продукту.
2 Видаляється в процесі виробництва.
Івосіденіб - 250 мг
Фармакологічні властивості
Фармакодинаміка.
Механізм дії. Івосиденіб є інгібітором мутантного ферменту ізоцитратдегідрогенази-1 (IDH-1). Мутантний IDH-1 перетворює альфа-кетоглутарат (α-KG) у 2-гідроксиглутарат (2-HG), який блокує клітинну диференціацію і сприяє онкогенезу як у гематологічних, так і в негематологічних злоякісних пухлинах. Механізм дії івосиденібу, окрім його здатності знижувати рівень 2-HG і відновлювати клітинну диференціацію, повністю не вивчений за різними показаннями.
Фармакодинамічні ефекти. У пацієнтів із гематологічними злоякісними пухлинами та холангіокарциномою з мутованою IDH-1 застосування багаторазового режиму дозування івосиденібу 500 мг на добу знизило концентрацію 2-HG у плазмі крові до рівнів, наближених до тих, що спостерігалися у здорових осіб. У кістковому мозку пацієнтів із гематологічними злоякісними пухлинами та в біопсії пухлини пацієнтів із холангіокарциномою середнє зниження [% коефіцієнта варіації (% КВ)] концентрації 2-HG становило 93,1% (11,1%) і 82,2% (32,4%) відповідно.
За даними аналізу 173 пацієнтів з гострим мієлоїдним лейкозом (ГМЛ), які отримували 500 мг івосиденібу один раз на добу, при використанні моделі концентрації івосиденібу–QTc, було передбачено залежне від концентрації подовження інтервалу QTc приблизно на 17,2 мсек (90% ДІ: 14,7; 19,7) при рівноважному Cmax. За даними аналізу 101 пацієнта з холангіокарциномою, які отримували івосиденіб у дозі 500 мг на добу, спостерігалося залежне від концентрації подовження інтервалу QTc приблизно на 17,2 мсек (90% ДІ: 14,3; 20,2) при рівноважному Cmax після застосування дози 500 мг на добу (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Клінічна ефективність
Вперше виявлений гострий мієлоїдний лейкоз (ГМЛ) у комбінації з азацитидином
Ефективність і безпеку Тібсово оцінювали в рандомізованому, багатоцентровому, подвійному сліпому, плацебо-контрольованому клінічному дослідженні (AG120-C-009) за участю 146 дорослих пацієнтів з ГМЛ з мутацією IDH-1, які раніше не отримували лікування та яким інтенсивна індукційна хіміотерапія не підходила через наявність щонайменше одного з таких критеріїв: вік ≥75 років, функціональний статус 2 за шкалою Східної об’єднаної онкологічної групи (ECOG), серцеве чи легеневе захворювання тяжкого ступеня, порушення функції печінки з рівнем білірубіну більш ніж у 1,5 рази вище верхньої межі норми, кліренс креатиніну <45 мл/хв або інше супутнє захворювання.
Аналіз генних мутацій для центрального підтвердження мутації IDH-1 у кістковому мозку та/або периферичній крові виконували для всіх учасників за допомогою аналізу Abbott RealTime™ IDH1 Assay. Пацієнти були рандомізовані для отримання Тібсово в дозі 500 мг або відповідного плацебо перорально один раз на добу разом з азацитидином у дозі 75 мг/м2/доба підшкірно або внутрішньовенно протягом 1 тижня кожні 4 тижні до кінця дослідження, прогресування захворювання або розвитку неприйнятної токсичності.
Середній вік пацієнтів, які отримували Тібсово, становив 76 років (від 58 до 84 років); 58% були чоловіками, 21% — азіати, 17% — європеоїдної раси, 61% — дані про расу відсутні, значення функціонального статусу за шкалою ECOG становило 0 (19%), 1 (44%) або 2 (36%). 75% пацієнтів були з вперше виявленим ГМЛ. Загалом пацієнти мали підтверджений сприятливий (4%), проміжний (67%) або низький/інший (26%) цитогенетичний ризик за оцінкою дослідників на основі клінічного практичного керівництва в онкології Національна загальна онкологічна мережа (NCCN) (2017).
Оцінка ефективності базувалася на досягненні первинної кінцевої точки виживаності без подій (ВБП), вимірюваної від дати рандомізації до неефективності лікування, рецидиву після ремісії або смерті з будь-якої причини. Неефективність лікування визначали як неможливість досягнення повної ремісії (ПР) до 24-го тижня. Загальна виживаність (ЗВ), частота ПР, частота ПР + ПР з частковим гематологічним відновленням (ПР + ПРч) і частота об’єктивної відповіді (ЧОВ) були ключовими вторинними кінцевими точками (Таблиця 1 та рис. 1).
Таблиця 1 – Оцінка ефективності у пацієнтів з вперше виявленим ГМЛ у комбінації з азацитидином
| Кінцева точка | Івосиденіб (500 мг один раз на добу) + азацитидин (N = 72) | Плацебо + азацитидин (N = 74) |
|---|---|---|
| Виживаність без подій, випадки (%) Неефективність лікування Рецидив Смерть | 46 (63,9) 42 (58,3) 3 (4,2) 1 (1,4) | 62 (83,8) 59 (79,7) 2 (2,7) 1 (1,4) |
| Відносний ризик1 (95% ДІ) | 0,33 (0,16; 0,69) | |
| Загальна виживаність (ЗВ), випадки (%) | 28 (38,9) | 46 (62,2) |
| Медіана ЗВ (95% ДІ), місяці | 24,0 (11,3; 34,1) | 7,9 (4,1; 11,3) |
| Відносний ризик1 (95% ДІ) | 0,44 (0,27; 0,73) | |
| ПР, n (%) | 34 (47,2) | 11 (14,9) |
| 95% ДІ2 | (35,3; 59,3) | (7,7; 25,0) |
| Відношення шансів3 (95% ДІ) | 4,76 (2,15; 10,50) | |
| ПР + ПРч показник, n (%) | 38 (52,8) | 13 (17,6) |
| 95% ДІ2 | (40,7; 64,7) | (9,7; 28,2) |
| Відношення шансів3 (95% ДІ) | 5,01 (2,32; 10,81) | |
| ПР + ПРн показник, n (%) | 39 (54,2) | 12 (16,2) |
| 95% ДІ2 | (42,0; 66,0) | (8,7; 26,6) |
| Відношення шансів3 (95% ДІ) | 5,90 (2,69; 12,97) | |
ДІ – довірчий інтервал; ПР – повна ремісія; ПРч – повна ремісія з частковим гематологічним відновленням; ПРн – повна ремісія з неповним гематологічним відновленням; ЗВ – загальна виживаність; ЧВ – часткова відповідь.
1Відносний ризик оцінюють за допомогою моделі пропорційних ризиків Кокса, стратифікованої за факторами стратифікації при рандомізації (статус ГМЛ і географічний регіон), при цьому схема плацебо+азацитидин використовується як знаменник.
2ДІ у відсотках розраховується за методом Клоппера–Пірсона (точний біноміальний метод).
3Оцінка Кохрана—Мантеля—Генселя для відношення шансів розраховується з використанням схеми плацебо+азацитидин як знаменника.
Рисунок 1: Графік Каплана–Мейєра для загальної виживаності (ЗВ)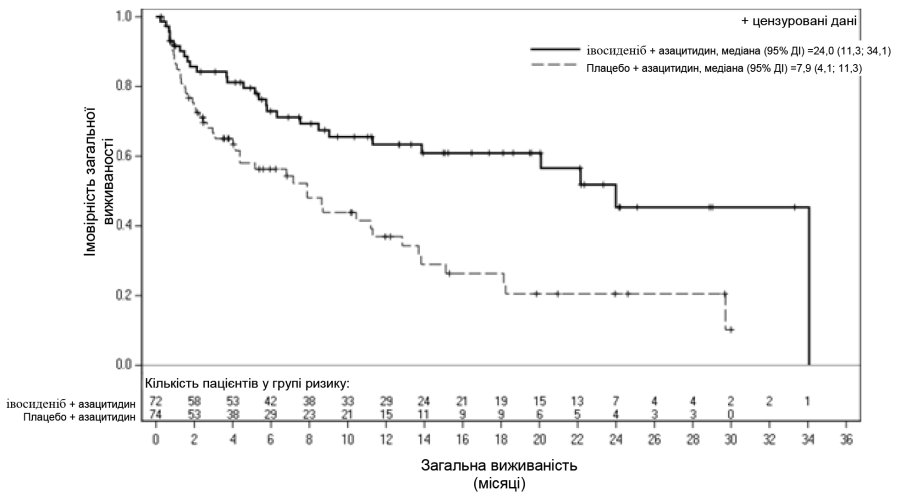
Результати оновленого аналізу ЗВ, проведеного за даними 64,2% (N = 95) випадків, підтвердили перевагу Тібсово в комбінації з азацитидином щодо загальної виживаності порівняно до плацебо в комбінації з азацитидином та медіана ЗВ становила 29,3 місяця порівняно з 7,9 місяця відповідно (ВР = 0,42; 95% ДІ: від 0,27 до 0,65).
Попередньо лікована, місцевопоширена або метастатична холангіокарцинома
Ефективність Тібсово оцінювалась у ході рандомізованого (2:1), багатоцентрового, подвійно сліпого, плацебо-контрольованого дослідження III фази (дослідженні AG120-C-005) за участю 185 дорослих пацієнтів із місцевопоширеною або метастатичною холангіокарциномою з мутацією IDH-1 R132 і прогресією захворювання принаймні після 1, але не більше 2 попередніх режимів терапії, включаючи щонайменше 1 схему лікування на основі гемцитабіну або 5-ФУ та очікувана виживаність яких становила ≥3 місяців.
Пацієнти були рандомізовані для отримання Тібсово перорально в дозі 500 мг один раз на добу або відповідного плацебо до прогресування захворювання або розвитку неприйнятної токсичності. Рандомізацію було стратифіковано за кількістю попередніх режимів терапії (1 або 2). Пацієнтам, які були рандомізовані для отримання плацебо, мали можливість перейти на препарат Тібсово після задокументованого рентгенологічного прогресування захворювання за оцінкою дослідника. Аналіз генних мутацій для центрального підтвердження мутації IDH-1 з біопсії пухлинної тканини виконували для всіх учасників за допомогою аналізу OncomineTM Dx Target Test.
Середній вік пацієнтів становив 62 роки (від 33 до 83 років). Більшість пацієнтів (63%) були жінками, 57% — європеоїдної раси, значення функціонального статусу за шкалою ECOG становило 0 (37%) або 1 (62%). Усі пацієнти отримали щонайменше 1 попередню схему системної терапії, а 47% — дві попередні схеми. На момент встановлення діагнозу в більшості пацієнтів була внутрішньопечінкова холангіокарцинома (91%), а у 92% були виявлені метастази. В обох групах, 70% пацієнтів мали мутацію R132C, 15% — мутацію R132L, 12% — мутацію R132G, 1,6% — мутацію R132S і 1,1% — мутацію R132H. Первинною кінцевою точкою була виживаність без прогресування захворювання (ВБПЗ), визначена Незалежним радіологічним комітетом (IRC) відповідно до Критеріїв оцінки відповіді солідних пухлинах (RECIST) версія 1.1, яку вимірювали як час від рандомізації до прогресування захворювання або смерті з будь-якої причини.
Загальна виживаність (ЗВ) була вторинною кінцевою точкою. Згідно з протоколом значна частина пацієнтів (70,5%) групи плацебо перейшла на препарат Тібсово після рентгенологічно підтвердженого прогресування захворювання за оцінкою дослідника.
Оцінку ефективності наведено в таблиці 2.
Таблиця 2. Оцінка ефективності в пацієнтів з місцевопоширеною або метастатичною холангіокарциномою
| Кінцева точка | Івосиденіб (500 мг один раз на добу) | Плацебо |
|---|---|---|
| Виживаність без прогресування захворювання (ВБПЗ) за оцінкою IRC | N = 124 | N = 61 |
| Випадки, n (%) Прогресування захворювання Смерть | 76 (61) 64 (52) 12 (10) | 50 (82) 44 (72) 6 (10) |
| Медіана ВБПЗ, місяці (95% ДІ) | 2,7 (1,6; 4,2) | 1,4 (1,4; 1,6) |
| Відносний ризик (95% ДІ)1 P-значення2 | 0,37 (0,25; 0,54) <0,0001 | |
| Показник ВБПЗ (%)3 6 місяців 12 місяців | 32,0 21,9 | НО НО |
| Івосиденіб (500 мг один раз на добу) | Плацебо | |
| Загальна виживаність4 | N = 126 | N = 61 |
| Смерті, n (%) | 100 (79) | 50 (82) |
| Медіана ЗВ (місяці, 95% ДІ) | 10,3 (7,8; 12,4) | 7,5 (4,8; 11,1) |
| Відносний ризик (95% ДІ)1 P-значення2 | 0,79 (0,56; 1,12) 0,093 | |
IRC — Незалежний радіологічний комітет, ДІ — довірчий інтервал, НО — не підлягає оцінюванню.
1Відносний ризик розраховують на основі стратифікованої регресійної моделі Кокса. Коефіцієнт стратифікації — це кількість попередніх ліній терапії під час рандомізації.
2P-значення розраховують із використанням одностороннього стратифікованого лог-рангового тесту без коригування на перехресний дизайн. Коефіцієнт стратифікації — це кількість попередніх ліній терапії під час рандомізації.
3На підставі оцінки за методом Каплана–Мейєра. Жоден пацієнт, рандомізований для отримання плацебо, не досяг ВБПЗ протягом 6 місяців або довше.
4Показники ЗВ базуються на даних підсумкового аналізу ЗВ (на основі 150 випадків смерті; дата припинення збору даних: 30 травня 2020 р.), який було виконано через 16 місяців після підсумкового аналізу ВБПЗ (дата припинення збору даних: 31 січня 2019 р.).
Рисунок 2: Графік Каплана–Мейєра для виживаності без прогресування захворювання (ВБПЗ) за оцінкою IRC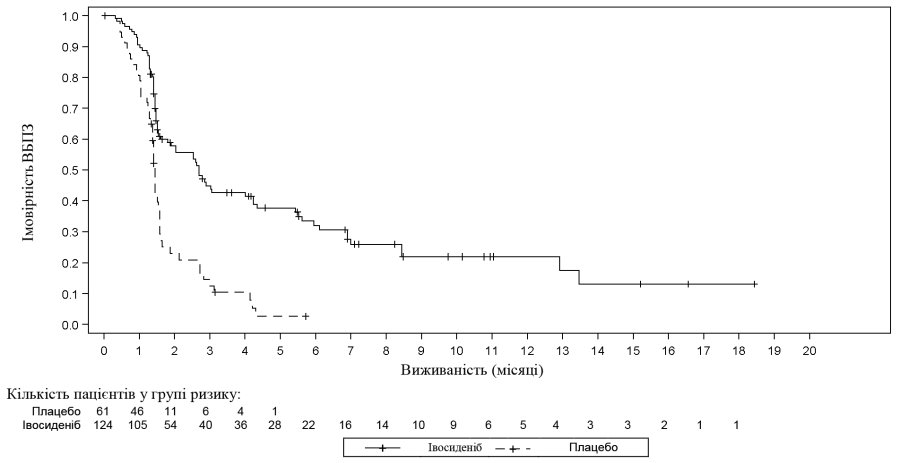
Рисунок 3: Графік Каплана–Мейєра для загальної виживаності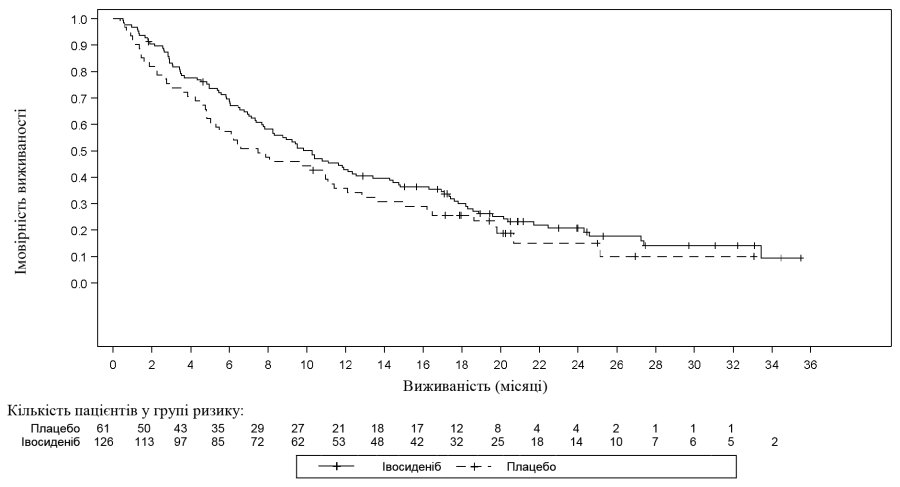
Педіатрична популяція. Європейська Агенція з лікарських засобів відмінила зобов’язання надати результати досліджень препарату Тібсово в усіх підгрупах педіатричної популяції при лікуванні всіх захворювань, що належать до категорії злоякісних новоутворень (за винятком пухлин центральної нервової системи, новоутворень кровотворної та лімфоїдної тканин), а також при лікуванні злоякісних новоутворень центральної нервової системи.
Європейське агентство з лікарських засобів відкликало зобов’язання надати результати досліджень препарату Тібсово в одній або декількох підгрупах педіатричної популяції при лікуванні гострого мієлоїдного лейкозу (інформація про застосування в пацієнтів дитячого віку міститься в розділі «Діти»).
Фармакокінетика.
Клінічна фармакологія івосиденібу ґрунтується на результатах 10 клінічних досліджень. Було проведено 5 досліджень за участю здорових добровольців і 3 дослідження за участю пацієнтів із злоякісними новоутвореннями на пізній стадії, включно із 2 дослідженнями за участю пацієнтів із холангіокарциномою. Було проведено два дослідження за участю пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином. Фармакокінетичні кінцеві точки оцінювали в плазмі та сечі. Фармакодинамічні кінцеві точки оцінювали в плазмі, сечі, біопсії пухлини та кістковому мозку (лише для досліджень за участю пацієнтів із злоякісними новоутвореннями на пізній стадії).
У пацієнтів із вперше виявленим ГМЛ та холангіокарциномою параметри фармакокінетики івосиденібу в дозі 500 мг у рівноважному стані були зіставними.
Абсорбція. Після перорального застосування однократної дози 500 мг у пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином, та в пацієнтів із холангіокарциномою медіана часу до досягнення Cmax (Tmax) приблизно становила 2 години.
У пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб (у добовій дозі 500 мг) у комбінації з азацитидином, середня рівноважна Cmax становила 6 145 нг/мл (КВ %: 34), а середня рівноважна AUC — 106 326 нг/год/мл (КВ %: 41).
У пацієнтів із холангіокарциномою середнє Cmax становило 4 060 нг/мл (КВ %: 45) після застосування однократної дози 500 мг та 4 799 нг/мл (КВ %: 33) у рівноважному стані після застосування дози 500 мг на добу. Значення AUC становило 86 382 нг·год/мл (КВ %: 34).
Протягом одного місяця коефіцієнти накопичення становили приблизно 1,6 для AUC та 1,2 для Cmax у пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином, та приблизно 1,5 для AUC та 1,2 для Cmax у пацієнтів із холангіокарциномою, які отримували івосиденіб у дозі 500 мг на добу. Рівноважна концентрація в плазмі досягалася протягом 14 днів застосування один раз на добу.
Після застосування однократної дози здоровими добровольцями, яке супроводжувалось споживанням їжі багатої на жири (приблизно 900–1 000 калорій, вміст жирів 56–60%), спостерігалось значне підвищення значення Cmax івосиденібу (приблизно на 98%; 90% ДІ: 79%, 119%) і AUCinf (приблизно на 25%) (див. розділ «Спосіб застосування та дози»).
Розподіл. За даними популяційного фармакокінетичного аналізу середній теоретичний об’єм розподілу івосиденібу в рівноважному стані (Vc/F) становить 3,20 л/кг (КВ %: 47,8) у пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином, та 2,97 л/кг (КВ %: 25,9) у пацієнтів із холангіокарциномою, які отримували івосиденібом у монотерапії.
Біотрансформація. Івосиденіб був переважаючим компонентом (>92%) загальної радіоактивності в плазмі здорових добровольців. Він в основному метаболізується окислювальними шляхами, переважно за участю CYP3A4 та з незначною участю N-деалкілування та гідролітичних шляхів.
Івосиденіб індукує CYP3A4 (у тому числі власний метаболізм), CYP2B6, CYP2C8, CYP2C9 і може індукувати CYP2C19 та UGT. Тому, може зменшитися системна концентрація субстратів цих ферментів (див. «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Застосування у період вагітності або годування груддю»).
В умовах in vitro івосиденіб інгібує P-gp і має потенціал індукувати P-gp. Тому, може змінитися системна концентрація активних речовин, які переважно транспортуються P-gp (див. розділи «Протипоказання» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
За даними дослідження in vitro івосиденіб у клінічно значущих концентраціях здатний інгібувати OAT3, OATP1B1 та OATP1B3, і, отже, може збільшуватися системна концентрація субстратів OAT3, OATP1B1 або OATP1B3 (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Виведення. У пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином, середній теоретичний кліренс івосиденібу в рівноважному стані становив 4,6 л/год (35%) із середнім кінцевим періодом напіввведення 98 годин (42%).
У пацієнтів із холангіокарциномою середній теоретичний кліренс івосиденібу в рівноважному стані становив 6,1 л/год (31%) із середнім кінцевим періодом напіввиведення 129 годин (102%).
У здорових добровольців, 77% однократної пероральної дози івосиденібу було виявлено у фекаліях, при цьому 67% — у незміненому вигляді. Приблизно 17% одноразової пероральної дози було виявлено в сечі, з яких 10% — у незміненому вигляді.
Лінійність/нелінійність. При застосуванні доз від 200 мг до 1 200 мг на добу (в 0,4–2,4 рази вище рекомендованої дози) AUC та Cmax івосиденібу зростають менш ніж пропорційно дозі.
Особливі категорії пацієнтів
Пацієнти літнього віку. У пацієнтів віком до 84 років не було виявлено клінічно значущого впливу на фармакокінетику івосиденібу. Параметри фармакокінетики івосиденібу в пацієнтів віком ≥85 років невідомі (див. розділ «Спосіб застосування та дози»).
Порушення функції нирок. У пацієнтів із порушенням функції нирок легкого чи помірного ступеня (розрахована швидкість клубочкової фільтрації (рШКФ) ≥30 мл/хв/1,73 м2) не було виявлено клінічно значущого впливу на фармакокінетику івосиденібу. Параметри фармакокінетики івосиденібу в пацієнтів із порушенням функції нирок тяжкого ступеня (рШКФ <30 мл/хв/1,73 м2) або з порушенням функції нирок, що потребує діалізу, невідомі (див. розділ «Спосіб застосування та дози»).
Порушення функції печінки. Згідно з класифікацією Національного інституту раку [NCI], у пацієнтів із порушенням функції печінки легкого ступеня не було виявлено клінічно значущого впливу на фармакокінетику івосиденібу. У пацієнтів із вперше виявленим ГМЛ та з холангіокарциномою параметри фармакокінетики івосиденібу при порушенні функції печінки помірного та тяжкого ступеня невідомі (див. розділ «Спосіб застосування та дози»). Фармакокінетичні дані для пацієнтів із порушенням функції печінки, стратифікованих за класифікацією Чайлда–П’ю, відсутні.
Інше. Не було виявлено клінічно значущого впливу на фармакокінетику івосиденібу залежно від статі, раси, маси тіла чи функціонального статусу за ECOG.
Показання Тібсово
Тібсово у комбінації з азацитидином призначений для лікування дорослих пацієнтів із вперше виявленим гострим мієлоїдним лейкозом (ГМЛ) з мутацією ізоцитратдегідрогенази-1 (IDH-1) R132, яким не може бути призначена стандартна індукційна хіміотерапія.
Тібсово у монотерапії призначений для лікування дорослих пацієнтів з місцевопоширеною або метастатичною холангіокарциномою з мутацією IDH-1 R132, які попередньо пройшли щонайменше одну лінію системної терапії.
Застосування Тібсово
Лікування повинен призначати лікар з досвідом проведення протипухлинної терапії. Перед застосуванням Тібсово, пацієнти повинні отримати підтвердження щодо наявності IDH1 R132 мутації за допомогою відповідного діагностичного тесту.
Спосіб застосування
Тібсово призначений для перорального застосування.
Таблетки слід приймати один раз на добу приблизно в один і той самий час. Не вживати їжу протягом 2 годин до і протягом 1 години після застосування препарату (див. розділ «Фармакокінетика»). Таблетки слід ковтати цілими, запиваючи водою.
Пацієнтам слід порекомендувати уникати споживання грейпфрута та грейпфрутового соку під час лікування (див. «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Не слід ковтати силікагелевий водопоглинач, який міститься в контейнері для таблеток.
Дозування
Гострий мієлоїдний лейкоз (ГМЛ)
Рекомендована доза становить 500 мг івосиденібу (2 таблетки по 250 мг) перорально один раз на добу. Застосування івосиденібу слід розпочинати з 1-го дня циклу 1 у комбінації з азацитидином у дозі 75 мг/м2 площі поверхні тіла, внутрішньовенно або підшкірно, один раз на добу, з 1-го по 7-ий дні кожного 28-денного циклу. Під час першого циклу лікування азацитидин слід застосовувати у 100%-ній дозі. Рекомендується проведення щонайменше 6 циклів лікування пацієнтів.
Слід ознайомитись з інструкцією для медичного застосування азацитидину для отримання інформації щодо способу застосування та дози.
Лікування слід продовжувати до прогресування захворювання або розвитку непереносимості.
Холангіокарцинома
Рекомендована доза становить 500 мг івосиденібу (2 таблетки по 250 мг) перорально один раз на добу. Лікування слід продовжувати до прогресування захворювання або розвитку непереносимості.
Пропущення або затримка прийому призначеної дози
Якщо прийом призначеної дози було пропущено або не прийнято у звичайний час, призначену дозу слід прийняти якомога швидше протягом 12 годин після пропущеної. Протягом цих 12 годин не можна приймати 2 призначені дози препарату. Наступного дня слід продовжити курс лікування згідно з раніше призначеною схемою.
Якщо після застосування призначеної дози препарату стався епізод блювання, не слід приймати замінну дозу препарату. Наступного дня приймати ліки як завжди.
Запобіжні заходи, яких необхідно дотримуватися перед призначенням та моніторинг
Перед початком лікування слід зробити електрокардіограму (ЕКГ). Перед початком лікування скоригований по частоті серцевих скорочень інтервал QT (QTc) повинен бути меншим за 450 мсек. За наявності порушень QT-інтервалу лікар повинен повторно провести оцінку співвідношення користь/ризик ініціації терапії івосиденібом. Якщо подовження інтервалу QTc становить 480–500 мсек, івосиденіб слід призначати лише у виняткових випадках під ретельним медичним спостереженням.
Слід проводити моніторинг ЕКГ до початку лікування, щонайменше раз на тиждень протягом перших 3 тижнів, а далі щомісяця, якщо QTc-інтервал залишається ≤480 мсек. Слід негайно вжити відповідних заходів при виявлені будь-яких відхилень QTc-інтервалу (див. таблицю 3 та розділ «Особливості застосування»). У разі появи симптоматики подовження QT-інтервалу слід зробити ЕКГ за клінічними показаннями.
Одночасне застосування з лікарськими засобами, які подовжують QTc-інтервал, або інгібіторами CYP3A4 помірної або сильної дії, може збільшити ризик подовження QTc-інтервалу і тому одночасне застосування з Тібсово слід уникати. У разі неможливості призначення альтернативної терапії, пацієнтів слід лікувати з обережністю й ретельно контролювати на наявність подовження QTc-інтервалу. Слід провести моніторинг ЕКГ до початку одночасного застосування, щотижня протягом щонайменше 3 тижнів, а далі за клінічними показаннями (див. інформацію нижче та розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції»).
Слід провести повний аналіз крові та хімічний аналіз крові перед початком лікування препаратом Тібсово, щонайменше один раз на тиждень протягом першого місяця лікування, один раз на два тижні протягом другого місяця лікування, а також під час кожного візиту до лікаря протягом усього періоду лікування за клінічними показаннями.
Коригування дози при одночасному застосуванні з інгібіторами CYP3A4 помірної або сильної дії
Якщо застосування інгібіторів CYP3A4 помірної або сильної дії уникнути не можна, рекомендовану дозу івосиденібу слід знизити до 250 мг (1 таблетка по 250 мг) один раз на добу. Після припинення застосування інгібітору CYP3A4 помірної або сильної дії, дозу івосиденібу слід збільшити до 500 мг після щонайменше 5 періодів напіввиведення інгібітору CYP3A4 (див. інформацію вище та розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Коригування дози та рекомендації щодо лікування побічних реакцій
Таблиця 3: Рекомендовані коригування дози при виникненні побічних реакцій
| Побічні реакції | Рекомендовані заходи |
| Диференціювальний синдром (див. розділи «Особливості застосування» та «Побічні реакції») | • При підозрі розвитку диференціювального синдрому, розпочати лікування системними кортикостероїдами впродовж щонайменше 3 днів і поступово знижувати дозу лише після зникнення симптомів. Передчасне припинення лікування може призвести до рецидиву симптомів. • Розпочати моніторинг гемодинамічних показників до зникнення симптомів та впродовж щонайменше 3 днів. • Припинити застосування препарату Тібсово, якщо серйозні ознаки/симптоми зберігаються понад 48 годин після початку застосування системних кортикостероїдів. • Відновити лікування івосиденібу в дозі 500 мг один раз на добу, коли тяжкість ознак/симптомів зменшиться до помірного чи легкого ступеня та після покращення клінічного стану. |
| Лейкоцитоз (кількість лейкоцитів >25 × 109/л або абсолютне збільшення загальної кількості лейкоцитів >15 × 109/л від вихідного рівня, див. розділи «Особливості застосування» та «Побічні реакції») | • Розпочати лікування гідроксикарбамідом відповідно до стандартної практики закладу, а також лейкаферез за клінічними показаннями. • Дозу гідроксикарбаміду знижувати поступово тільки після послаблення чи зникнення лейкоцитозу. Передчасне припинення лікування може призвести до рецидиву. • Припинити застосування Тібсово, якщо застосування гідроксикарбаміду не призвело до послаблення лейкоцитозу. • Після зникнення лейкоцитозу відновіть лікування івосиденібом у дозі 500 мг один раз на добу. |
| Подовження QTc-інтервалу >480–500 мсек (2-ий ступінь, див. розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції») | • Моніторинг та відновлення рівня електролітів за клінічними показаннями. • Переглянути та відкоригувати супутні лікарські засоби, які подовжують QTc-інтервал (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). • Припиніть застосування Тібсово доки не буде досягнуто QTc-інтервал ≤480 мсек. • Відновіть лікування івосиденібом у дозі 500 мг один раз на добу після відновлення QTc-інтервалу ≤480 мсек. • Після відновлення QTc-інтервалу ≤480 мсек проводити моніторинг ЕКГ щонайменше раз на тиждень протягом 3 тижнів та за клінічними показаннями. |
| Подовження QTc-інтервалу >500 мсек (3-ий ступінь, див. розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції») | • Моніторинг та відновлення рівня електролітів за клінічними показаннями. • Переглянути та відкоригувати супутні лікарські засоби, які подовжують QTc-інтервал (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). • Припинити застосування Тібсово та проводити моніторинг ЕКГ кожні 24 години до досягнення QTc-інтервалу в межах 30 мсек від вихідного рівня або ≤480 мсек. • У разі подовження QTc-інтервалу >550 мсек, на додаток до вже запланованого припинення застосування івосиденібу, слід розглянути можливість безперервного електрокардіографічного моніторингу пацієнта, доки значення QTc не повернеться до <500 мсек. • Відновити лікування івосиденібом у дозі 250 мг один раз на добу після відновлення QTc-інтервалу в межах 30 мсек від вихідного рівня або ≤480 мсек. • Після відновлення QTc-інтервалу в межах 30 мсек від вихідного рівня або ≤480 мсек проводити моніторинг ЕКГ щонайменше раз на тиждень протягом 3 тижнів та за клінічними показаннями. • У разі виявлення альтернативної етіології подовження QTc-інтервалу слід розглянути можливість підвищення дози івосиденібу до 500 мг один раз на добу. |
| Подовження QTc-інтервалу з ознаками/симптомами небезпечної для життя шлуночкової аритмії (4-ий ступінь, див. розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції») | • Остаточно припинити застосування препарату |
| Інші побічні реакції ≥3-го ступеня тяжкості | • Припинити застосування Тібсово до зменшення токсичності до ≤1-го ступеня або до вихідного рівня, потім відновити лікування в дозі 500 мг один раз на добу (токсичність 3-го ступеня) або 250 мг один раз на добу (токсичність 4-го ступеня). • При виникненні токсичності 3-го ступеня (другий випадок), знизити дозу препарату Тібсово до 250 мг один раз на добу до зникнення токсичності, потім відновити лікування в дозі 500 мг один раз на добу. • При виникненні токсичності 3-го ступеня (третій випадок) або 4-го ступеня, припинити застосування Тібсово. |
1-й ступінь – легкий ступінь тяжкості, 2-й ступінь – помірний, 3-й ступінь – тяжкий, 4-й ступінь – загроза для життя.
Особливі категорії пацієнтів
Пацієнти літнього віку
Пацієнтам віком від 65 років немає потреби в коригуванні дози препарату (див. розділи Побічні реакції» та «Фармакокінетика»). Нема даних щодо застосування в пацієнтів віком від 85 років.
Порушення функції нирок
Пацієнти з порушенням функції нирок легкого (рШКФ ≥60 – ˂<90 мл/хв/1,73 м2) або помірного ступеня (рШКФ ≥30 – <˂60 мл/хв/1,73 м2) коригування дози не потребують. Для пацієнтів із порушенням функції нирок тяжкого ступеня (рШКФ <30 мл/хв/1,73 м2) рекомендовану дозу не встановлено. Слід з обережністю застосовувати Тібсово в пацієнтів із порушенням функції нирок тяжкого ступеня та встановити ретельний медичний нагляд за станом пацієнта (див. розділи «Особливості застосування» та «Фармакокінетика»).
Порушення функції печінки
Пацієнти з порушенням функції печінки легкого ступеня (категорія А за класифікацією Чайлда–П’ю) не потребують коригування дози. Для пацієнтів із порушенням функції печінки помірного та тяжкого ступеню (категорія В та С за класифікацією Чайлда–П’ю) рекомендовану дозу не встановлено. Слід з обережністю застосовувати Тібсово в пацієнтів із порушенням функції печінки помірного та тяжкого ступеню та встановити ретельний медичний нагляд за станом пацієнта (див. розділи «Особливості застосування» та «Фармакокінетика»).
Невикористаний лікарський засіб або витратні матеріали необхідно утилізувати відповідно до місцевого законодавства.
Діти.
Безпеку та ефективність препарату Тібсово в дітей та підлітків віком до 18 років не встановлено. Дані відсутні.
Протипоказання
Гіперчутливість до діючої речовини або до будь-якої допоміжної речовини препарату.
Одночасне застосування з індукторами CYP3A4 сильної дії або дабігатраном (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Вроджений синдром подовженого QT-інтервалу.
Раптова смерть або поліморфна шлуночкова аритмія в сімейному анамнезі.
Інтервал QT/QTc >500 мсек незалежно від методу коригування (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Побічна дія
Вперше виявлений ГМЛ у комбінації з азацитидином. Найбільш частими побічними реакціями були блювання (40%), нейтропенія (31%), тромбоцитопенія (28%), подовження QT-інтервалу на ЕКГ (21%), безсоння (19%).
Найбільш частими серйозними побічними реакціями були диференціювальний синдром (8%) і тромбоцитопенія (3%).
У пацієнтів, які отримували івосиденіб у комбінації з азацитидином, частота припинення лікування івосиденібом через побічні реакції становила 6%. Побічними реакціями, що призвели до припинення лікування, були подовження QT-інтервалу на ЕКГ (1%), безсоння (1%), нейтропенія (1%) та тромбоцитопенія (1%).
Частота переривання застосування призначеної дози івосиденібу через побічні реакції становила 35%. Найбільш частими побічними реакціями, що призвели до переривання застосування призначеної дози, були нейтропенія (24%), подовження QT-інтервалу на ЕКГ (7%), тромбоцитопенія (7%), лейкопенія (4%) та диференціювальний синдром (3%).
Частота зниження дози івосиденібу через побічні реакції становила 19%. Побічними реакціями, що призвели до зниження дози, були подовження QT-інтервалу на ЕКГ (10%), нейтропенія (8%) та тромбоцитопенія (1%).
Інформація про частоту побічних реакцій ґрунтується на даних дослідження AG120-C-009, за участю 72 рандомізованих пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб (500 мг на добу) у комбінації з азацитидином. Медіанна тривалості лікування препаратом Тібсово становила 8 місяців (діапазон 0,1–40,0 місяців). Частота побічних реакцій ґрунтується на частоті побічних реакцій з будь-якої причини, де частина випадків побічних реакцій може мати інші причини, ніж застосування івосиденібу, наприклад, захворювання, інші лікарські засоби або непов’язані причини.
Частота визначається таким чином: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100); рідко (від ≥1/10000 до <1/1000); дуже рідко (<1/10000). У межах кожної групи побічні реакції представлено в порядку зменшення їхньої серйозності.
Таблиця 4 – Побічні реакції про які повідомлялося в клінічному досліджені AG120-C-009 (N = 72) у пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином
| Системи органів | Частота | Побічні реакції |
| З боку системи крові та лімфатичної системи | дуже часто | диференціювальний синдром, лейкоцитоз, тромбоцитопенія, нейтропенія |
| часто | лейкопенія | |
| З боку психіки | дуже часто | безсоння |
| З боку нервової системи | дуже часто | головний біль, запаморочення |
| часто | периферична нейропатія | |
| З боку шлунково-кишкового тракту | дуже часто | блювання1 |
| часто | орофарінгеальний біль | |
| З боку опорно-рухової системи та сполучної тканини | дуже часто | біль у кінцівках, артралгія, біль у спині |
| Результати лабораторних досліджень | дуже часто | подовження QT-інтервалу на ЕКГ |
1Груповий термін включає блювання та поклик до блювання
Попередньо лікована, місцевопоширена або метастатична холангіокарцинома. Найбільш частими побічними реакціями були втома (43%), нудота (42%), біль в абдомінальній ділянці (35%), діарея (35%), зниження апетиту (24%), асцит (23%), блювання (23%), анемія (19%) та висипання (15%).
Найбільш частими серйозними побічними реакціями були асцит (2%), гіпербілірубінемія (2%) та жовтяниця холестатична (2%).
У пацієнтів, які отримували івосиденіб, частота припинення лікування через побічні реакції становила 2%. Побічними реакціями, що призвели до припинення лікування, були асцит (2%) та гіпербілірубінемія (1%).
Частота переривання застосування призначеної дози івосиденібу через побічні реакції становила 16%. Найбільш поширеними побічними реакціями, що призвели до переривання застосування призначеної дози, були гіпербілірубінемія (3%), збільшення рівня аланінамінотрансферази (3%), збільшення рівня аспартатамінотрансферази (3%), асцит (2%) і втома (2%).
Частота зниження дози івосиденібу через побічні реакції становила 4%. Побічними реакціями, що призвели до зниження дози, були подовження QT-інтервалу на ЕКГ (3%) та периферична нейропатія (1%).
Інформація про частоту побічних реакції ґрунтується на даних дослідження AG120-C-005, за участю 123 рандомізованих пацієнтів з попередньо лікованою, місцевопоширеною або метастатичною холангіокарциномою, які отримували івосиденіб 500 мг один раз на добу. Медіанна тривалості лікування препаратом Тібсово становила 2,8 місяців (діапазон 0,1–45,1 місяців; середнє значення (стандартне відхилення [SD]) 6,7 (8,2) місяців).
Частота побічних реакцій ґрунтується на частоті побічних реакцій з будь-якої причини, де частина випадків побічних реакцій може мати інші причини, ніж застосування івосиденібу, наприклад, захворювання, інші лікарські засоби або непов’язані причини.
Частота визначається таким чином: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100); рідко (від ≥1/10000 до <1/1000); дуже рідко (<1/10000). В межах кожної групи побічні реакції представлено в порядку зменшення їхньої серйозності.
Таблиця 5 – Побічні реакції про які повідомлялося в клінічному досліджені AG120-C-005 (N = 123) у пацієнтів із місцевопоширеною або метастатичною холангіокарцинома, які отримували івосиденіб
| Системи органів | Частота | Побічні реакції |
| З боку системи крові та лімфатичної системи | дуже часто | анемія |
| З боку обміну речовин і метаболізму | дуже часто | зниження апетиту |
| З боку нервової системи | дуже часто | периферична нейропатія, головний біль |
| З боку шлунково-кишкового тракту | дуже часто | асцит, діарея, блювання, нудота, біль в абдомінальній ділянці |
| З боку гепатобіліарної системи | часто | жовтяниця холестатична, гіпербілірубінемія |
| З боку шкіри і підшкірної клітковини | дуже часто | висипання1 |
| Загальні розлади та реакції в місці введення | дуже часто | втома |
| часто | падіння | |
| Результати лабораторних досліджень | дуже часто | збільшення рівня аспартатамінотрансферази, збільшення рівня білірубіну в крові |
| часто | подовження QT-інтервалу на ЕКГ, збільшення рівня аланінамінотрансферази, зниження рівня лейкоцитів, зниження рівня тромбоцитів | |
1Груповий термін включає висипання, макулопапульозний висип, еритему, макулярний висип, генералізований ексфоліативний дерматит, медикаментозний дерматит і гіперчутливість до лікарських засобів.
Опис деяких побічних реакцій
Диференціювальний синдром у пацієнтів з ГМЛ (див. розділи «Спосіб застосування та дози» та «Особливості застосування»)
У дослідженні AG120-C-009 за участю 72 пацієнтів із вперше виявленим ГМЛ, які отримували Тібсово в комбінації з азацитидином, у 14% спостерігався диференціювальний синдром. Жоден пацієнт не припинив лікування івосиденібом із причини диференціювального синдрому, а переривання прийому препарату (3%) для корекції ознак/симптомів потребувала меншість пацієнтів. Усі 10 пацієнтів, у яких спостерігався диференціювальний синдром, одужали після лікування або після переривання прийому Тібсово. Медіана часу до виникнення диференціювального синдрому становила 20 днів. Диференціювальний синдром виникав від 3 до 46 днів після початку терапії під час комбінованої терапії.
Подовження QTс-інтервалу (див. розділи «Спосіб застосування та дози», «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
У дослідженні AG120-C-009 за участю 72 пацієнтів із вперше виявленим ГМЛ, які отримували івосиденіб у комбінації з азацитидином, подовження QT-інтервалу на ЕКГ спостерігалося у 21%, в 11% відмічалися реакції ≥3-го ступеня. За даними аналізу ЕКГ, у 15% пацієнтів, які отримували івосиденіб у комбінації з азацитидином і які пройшли щонайменше одну оцінку ЕКГ після початку лікування, значення інтервалу QTc становило ˃>500 мсек, у 24% спостерігалося збільшення QTc >60 мсек від вихідного рівня. 1% пацієнтів припинив лікування івосиденібом через подовження QT-інтервалу на ЕКГ, 7% та 10% пацієнтів потребували відповідно переривання лікування та зниження дози. Медіана часу до виникнення подовження QT-інтервалу в пацієнтів, які отримували івосиденіб, становила 29 днів. Подовження QT-інтервалу на ЕКГ спостерігалося від 1 дня і до 18 місяців після початку лікування.
У дослідженні AG120-C-005 за участю 123 пацієнтів з місцевопоширеною або метастатичною холангіокарциномою, які отримували івосиденіб у монотерапії, подовження QT-інтервалу на ЕКГ спостерігалося в 10%; у 2% відмічалися реакції ≥3-го ступеня. За результатами аналізу ЕКГ у 2% пацієнтів QTс-інтервал становив >500 мсек, а в 5% пацієнтів подовження QTc-інтервалу становило >60 мсек від вихідного рівня. Зниження дози для корекції ознак/симптомів потребували 3% пацієнтів. Медіана часу до виникнення подовження QT-інтервалу в пацієнтів, які отримували івосиденіб у монотерапії, становила 28 днів. Подовження QT-інтервалу на ЕКГ спостерігалося від 1 дня і до 23 місяців після початку лікування.
Особливі категорії пацієнтів
Порушення функції печінки. Безпека та ефективність івосиденібу не встановлені для пацієнтів із порушенням функції печінки помірного та тяжкого ступеню (категорія В та С за класифікацією Чайлда–П’ю). У пацієнтів із порушенням функції печінки легкого ступеня (категорія А за класифікацією Чайлда–П’ю) відзначалася тенденція до збільшення частоти побічних реакцій (див. розділи «Спосіб застосування та дози» та «Фармакокінетика»).
Звіт про підозрювані побічні реакції. Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
У разі виникнення запитань, переходьте на сайт ТОВ «Серв’є Україна» https://servier.ua/ або звертайтесь за тел. (044) 490 3441.
Особливості застосування
Диференціювальний синдром у пацієнтів з ГМЛ. Упродовж лікування івосиденібом повідомлялося про випадки виникнення диференціювального синдрому (див. розділ «Побічні реакції»). Якщо не проводити лікування диференціювального синдрому, він може бути небезпечним для життя або може призвести до летального наслідку (див. інформацію нижче та розділ «Спосіб застосування та дози»). Диференціювальний синдром пов’язаний зі швидкою проліферацією та диференціюванням мієлоїдних клітин. Симптоми включають: неінфекційний лейкоцитоз, периферичний набряк, пірексію, задишку, плевральний випіт, артеріальну гіпотензію, гіпоксію, набряк легень, пневмоніт, перикардіальний випіт, висипання, гіперволемію, синдром лізису пухлини та підвищення рівня креатиніну.
Слід повідомити пацієнта про ознаки та симптоми диференціювального синдрому та про необхідність негайно звернутися до лікаря в разі їх виникнення, а також нагадати про необхідність постійно носити з собою пам’ятку для пацієнта.
Якщо виникає підозра на розвиток диференціювального синдрому, слід розпочати лікування системними кортикостероїдами та моніторинг гемодинамічних показників до зникнення симптомів та ще протягом мінімум 3 днів.
Якщо спостерігається лейкоцитоз, необхідно розпочати лікування гідроксикарбамідом відповідно до стандартної практики закладу, а також лейкаферез за клінічними показаннями (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Поступово знижувати дозу кортикостероїдів чи гідроксикарбаміду тільки після зникнення симптомів. У випадку передчасного припинення лікування кортикостероїдами та/або гідроксикарбамідом симптоми диференціювального синдрому можуть повторитися. Якщо серйозні ознаки/симптоми зберігаються понад 48 годин після початку застосування системних кортикостероїдів, необхідно припинити лікування препаратом Тібсово та відновити лікування в дозі 500 мг івосиденібу один раз на добу, коли тяжкість ознак/симптомів зменшиться до помірного чи легкого ступеня, а клінічний стан пацієнта покращиться.
Подовження QTc-інтервалу. Під час лікування івосиденібом повідомлялося про випадки подовження QTc-інтервалу (див. розділ «Побічні реакції»). Слід проводити моніторинг ЕКГ до початку лікування, щонайменше раз на тиждень протягом перших 3 тижнів лікування, а далі щомісяця, якщо QTc-інтервал залишається ≤480 мсек (див. розділ «Спосіб застосування та дози»). Слід негайно вжити відповідних заходів при виявлені будь-яких відхилень (див. розділ «Спосіб застосування та дози»). У разі появи симптоматики подовження QT-інтервалу, слід зробити ЕКГ за клінічними показаннями. У разі блювання та/або діареї тяжкого ступеня, необхідно провести оцінку порушення балансу електролітів у сироватці крові, особливо калію та магнію.
Пацієнтів слід повідомити про ризик подовження QT-інтервалу, його ознаки та симптоми (пальпітація, запаморочення, непритомність або навіть зупинка серця), а також порадити негайно звернутися до лікаря в разі їх виникнення.
Одночасне застосування лікарських засобів, які подовжують QTc-інтервал, або інгібіторами CYP3A4 помірної або сильної дії, може збільшити ризик подовження QTc-інтервалу і тому одночасне застосування з Тібсово слід уникати. У разі неможливості призначення альтернативної терапії, пацієнтів слід лікувати з обережністю й ретельно контролювати на наявність подовження QTc-інтервалу. Слід провести моніторинг ЕКГ до початку одночасного застосування, щотижня протягом щонайменше 3 тижнів, а далі за клінічними показаннями. Якщо застосування інгібіторів CYP3A4 помірної або сильної дії уникнути не можна, рекомендовану дозу івосиденібу слід знизити до 250 мг один раз на добу (див. розділи «Спосіб застосування та дози» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Якщо для лікування ознак/симптомів диференціювального синдрому клінічно показане призначення фуросеміду (субстрату OAT3), слід ретельно спостерігати за станом пацієнтів із метою виявлення порушення електролітного балансу та подовження QTc-інтервалу.
Під час лікування івосиденібом пацієнти із застійною серцевою недостатністю або порушенням електролітного балансу мають перебувати під ретельним медичним наглядом із періодичним проведенням моніторингу ЕКГ та рівня електролітів. Лікування препаратом Тібсово слід остаточно припинити, якщо в пацієнтів розвивається подовження QTc-інтервалу з ознаками чи симптомами небезпечної для життя аритмії (див. розділ «Спосіб застосування та дози»).
Слід з обережністю застосовувати івосиденіб у пацієнтів із рівнем альбуміну нижче норми або недостатньою масою тіла.
Порушення функції нирок тяжкого ступеня. Безпеку та ефективність івосиденібу не встановлено для пацієнтів із порушенням функції нирок тяжкого ступеня (рШКФ <30 мл/хв/1,73 м2). Слід з обережністю застосовувати Тібсово в пацієнтів із порушенням функції нирок тяжкого ступеня та встановити ретельний медичний нагляд за станом пацієнта (див. розділи «Спосіб застосування та дози» та «Фармакокінетика»).
Порушення функції печінки. Безпеку та ефективність івосиденібу не встановлено для пацієнтів із порушенням функції печінки помірного та тяжкого ступеню (категорія В та С за класифікацією Чайлда–П’ю). Слід з обережністю застосовувати Тібсово в пацієнтів із порушенням функції печінки помірного та тяжкого ступеню та встановити ретельний медичний нагляд за станом пацієнта (див. розділи «Спосіб застосування та дози» та «Фармакокінетика»). Слід з обережністю застосовувати Тібсово в пацієнтів з порушенням функції печінки легкого ступеня (категорія А за класифікацією Чайлда–П’ю) (див. розділ «Побічні реакції»).
Субстрати CYP3A4. Івосиденіб індукує CYP3A4, тому може знижуватися системна концентрація субстратів CYP3A4. Якщо застосування ітраконазолу чи кетоконазолу уникнути не можна, слід спостерігати за станом пацієнта з метою виявлення втрати протигрибкової ефективності (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Жінки репродуктивного віку/контрацепція. Жінки репродуктивного віку повинні пройти тест на вагітність перед початком лікування препаратом Тібсово та їм слід запобігати вагітності протягом терапії (див. розділ «Застосування у період вагітності або годування груддю»).
Жінки репродуктивного віку й чоловіки, які мають партнерок дітородного віку, повинні застосовувати ефективні методи контрацепції під час лікування препаратом Тібсово та протягом щонайменше 1 місяця після застосування останньої дози.
Івосиденіб може знижувати системну концентрацію гормональних контрацептивів. Тому, рекомендується одночасне застосування бар’єрних методів контрацепції. (див. розділи «Особливості застосування» та «Застосування у період вагітності або годування груддю»).
Непереносимість лактози. Тібсово містить лактозу. Пацієнтам із рідкісною спадковою непереносимістю галактози, загальної недостатністю лактази або мальабсорбцією глюкози-галактози не слід застосовувати цей препарат.
Вміст натрію. Даний лікарський засіб містить менше 1 ммоль натрію (23 мг) на таблетку, тобто майже вільний від натрію.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку/контрацепція. Жінки репродуктивного віку повинні пройти тест на вагітність перед початком лікування препаратом Тібсово та їм слід запобігати вагітності протягом терапії (див. розділ «Особливості застосування»).
Жінки репродуктивного віку й чоловіки, які мають партнерок дітородного віку, повинні застосовувати ефективні методи контрацепції під час лікування препаратом Тібсово та протягом щонайменше 1 місяця після застосування останньої дози.
Івосиденіб може знижувати системну концентрацію гормональних контрацептивів, тому рекомендується одночасне застосування альтернативних методів контрацепції, таких, як бар’єрна контрацепція (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Вагітність. Недостатньо даних щодо застосування івосиденібу вагітними жінками. Дослідження на тваринах продемонстрували репродуктивну токсичність.
Тібсово не рекомендується застосовувати під час вагітності та жінкам репродуктивного віку, які не використовують ефективні методи контрацепції. Пацієнтів слід проінформувати про потенційний ризик для плода, якщо препарат застосовується під час вагітності або якщо пацієнтка (або партнерка пацієнта, який отримує лікування) завагітніла під час терапії або протягом 1 місяця після застосування останньої дози.
Годування груддю. Невідомо, чи проникає івосиденіб або його метаболіти в грудне молоко. Дослідження на тваринах щодо оцінки проникнення івосиденібу або його метаболітів у грудне молоко не проводились. Ризик для новонароджених/немовлят виключати не можна.
Під час лікування препаратом Тібсово годування груддю слід припинити та щонайменше протягом одного місяця після застосування останньої дози.
Фертильність. Дані щодо впливу івосиденібу на фертильність людини відсутні. Досліджень оцінки івосиденібу на фертильність тварин не проводились. Під час 28-денного дослідження на тваринах вивчення токсичності багатократних доз, відзначався небажаний вплив на репродуктивні органи. Клінічна значущість цього впливу невідома.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Івосиденіб має незначний вплив на здатність керувати транспортними засобами та працювати з іншими механізмами. У деяких пацієнтів, які застосовували івосиденіб, повідомлялося про випадки втоми та запаморочення (див. розділ «Побічні реакції»), що слід враховувати під час оцінки здатності пацієнта керувати автотранспортом або працювати з іншими механізмами.
Взаємодія з іншими лікарськими засобами
Вплив інших лікарських засобів на івосиденіб
Індуктори CYP3A4 сильної дії. Івосиденіб є субстратом CYP3A4. Одночасне застосування індукторів CYP3A4 сильної дії (наприклад карбамазепіну, фенобарбіталу, фенітоїну, рифампіцину, препарати звіробою (hypericum perforatum)) може спричинити зниження плазмової концентрації івосиденібу, тому одночасне застосування з препаратом Тібсово протипоказане (див. розділ «Протипоказання»). Клінічні дослідження оцінки фармакокінетики івосиденібу за наявності індуктора CYP3A4, не проводили.
Інгібітори CYP3A4 помірної або сильної дії. У здорових добровольців, застосування однократної дози 250 мг івосиденібу та 200 мг ітраконазолу один раз на добу протягом 18 днів, призвело до збільшення AUC івосиденібу на 169% (90% ДІ: 145, 195) без зміни Cmax. Одночасне застосування інгібіторів CYP3A4 помірної або сильної дії підвищує плазмову концентрацію івосиденібу. Це може призвести до підвищення ризику подовження QTc-інтервалу, тому під час лікування препаратом Тібсово слід розглянути можливість призначення альтернативних препаратів, які не є інгібіторами CYP3A4 помірної або сильної дії. У разі неможливості призначення альтернативної терапії, пацієнтів слід лікувати з обережністю й ретельно контролювати на наявність подовження QTc-інтервалу. Якщо застосування інгібіторів CYP3A4 помірної або сильної дії уникнути не можна, рекомендовану дозу івосиденібу слід знизити до 250 мг один раз на добу (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
• інгібітори CYP3A4 помірні дії: апрепітант, циклоспорин, дилтіазем, еритроміцин, флуконазол, грейпфрут і грейпфрутовий сік, ізавуконазол, верапаміл;
• інгібітори CYP3A4 сильної дії: кларитроміцин, ітраконазол, кетоконазол, позаконазол, ритонавір, вориконазол.
Лікарські засоби, які подовжують QTc-інтервал. Одночасне застосування з лікарськими засобами, які подовжують QTc-інтервал (такі як протиаритмічні препарати, фторхінолони, антагоністи 5-HT3 рецепторів, триазолові протигрибкові засоби) може призвести до підвищення ризику подовження QTc-інтервалу, тому одночасне застосування з Тібсово слід за можливості уникати. У разі неможливості призначення альтернативної терапії, пацієнтів слід лікувати з обережністю й ретельно контролювати на наявність подовження QTc-інтервалу (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Вплив івосиденібу на інші лікарські засоби
Взаємодії з транспортерами. Івосиденіб інгібує P-gp і має потенціал індукувати P-gp. Тому може змінитися системна концентрація активних речовин, які переважно транспортуються P-gp (наприклад дабігатран). Одночасне застосування з дабігатраном протипоказане (див. розділ «Протипоказання»).
Івосиденіб інгібує OAT3, транспортний поліпептид органічних аніонів 1B1 (OATP1B1) та 1B3 (OATP1B3). Тому може збільшитися системна концентрація субстратів OAT3 або OATP1B1/1B3. Якщо можливо, слід уникати одночасного застосування Тібсово з субстратами OAT3 (наприклад, бензилпеніциліном, фуросемідом) або чутливими субстратами OATP1B1/1B3 (наприклад, аторвастатином, правастатином, розувастатином) (див. розділ «Фармакокінетика»). У разі неможливості призначення альтернативної терапії, пацієнтів слід лікувати з обережністю. Якщо для лікування ознак/симптомів диференціювального синдрому клінічно показане призначення фуросеміду, слід ретельно спостерігати за станом пацієнтів із метою виявлення порушення електролітного балансу та подовження QTc-інтервалу.
Індукція ферментів
Ферменти цитохрому CYP450 (CYP)
Івосиденіб індукує CYP3A4, CYP2B6, CYP2C8, CYP2C9 і може індукувати CYP2C19. Тому, може зменшитися системна концентрація субстратів цих ферментів. Під час лікування Тібсово слід розглянути можливість застосування альтернативних препаратів, які не є субстратами CYP3A4, CYP2B6, CYP2C8 чи CYP2C9 з вузьким терапевтичним індексом або субстратами CYP2C19. Якщо застосування цих лікарських засобів уникнути не можна, слід спостерігати за станом пацієнтів з метою виявлення втрати ефективності субстрату (див. розділ «Фармакокінетика»).
• субстрати CYP3A4 з вузьким терапевтичним індексом: алфентаніл, циклоспорин, еверолімус, фентаніл, пімозид, хінідин, сиролімус, такролімус;
• субстрати CYP2B6 з вузьким терапевтичним індексом: циклофосфамід, іфосфамід, метадон;
• субстрати CYP2C8 з вузьким терапевтичним індексом: паклітаксел, піоглітазон, репаглінід;
• субстрати CYP2C9 з вузьким терапевтичним індексом: фенітоїн, варфарин;
• субстрати CYP2C19: омепразол.
Ітраконазол або кетоконазол не слід застосовувати одночасно з Тібсово через ймовірну втрату протигрибкової ефективності.
Івосиденіб може знижувати системну концентрацію гормональних контрацептивів, тому одночасне застосування бар’єрних методів контрацепції рекомендується протягом щонайменше 1 місяця після застосування останньої дози (див. розділи «Особливості застосування» та «Застосування у період вагітності або годування груддю»).
Уридиндифосфат-глюкуронозил-трансферази (UGT). Івосиденіб здатний індукувати UGT і тому може зменшитися системна концентрація субстратів цих ферментів (наприклад, ламотриджину, ралтегравіру). Під час лікування Тібсово слід розглянути можливість застосування альтернативних препаратів, які не є субстратами UGT. Якщо застосування таких лікарських засобів уникнути не можна, слід спостерігати за станом пацієнтів із метою виявлення втрати ефективності субстрату UGT (див. розділ «Фармакокінетика»).
Передозування
У випадку передозування, токсичність може проявлятися у вигляді загострення побічних реакцій, пов’язаних з івосиденібом (див. розділ «Побічні реакції»). Необхідно ретельно слідкувати за станом пацієнтів та забезпечити підтримуючу терапію (див. розділи «Спосіб застосування та дози» та «Особливості застосування»). Не існує відомого антидоту на випадок передозування івосиденібом.
Умови зберігання
Не потребує особливих температурних умов зберігання. Зберігати таблетки у щільно закритому контейнері для захисту від вологи. Зберігати у недоступному для дітей місці.
