Ковіфлу (Coviflu)
Ковіфлу інструкція із застосування
Склад
допоміжні речовини: L-гідроксипропілцелюлоза, кросповідон, кремнію діоксид колоїдний, повідон, натрію стеарилфумарат.
Склад плівкової оболонки: опадрі жовтий 03A520072, гіпромелоза HPMC 2910 (E 464), тальк, титану діоксид (E171), оксид заліза жовтий (Е172).
Фавіпіравір - 200 мг
Фармакологічні властивості
фармакодинаміка. Противірусна активність in vitro
Фавіпіравір продемонстрував противірусну активність щодо лабораторних штамів вірусу грипу типу А та типу В з ЕС50 0,014–0,55 мкг/мл.
ЕС50 проти сезонних вірусів грипу типу А та типу В, включаючи штами, стійкі до адамантану (амантадин та римантадин), осельтамівіру або занамівіру, становив 0,03–0,94 мкг/мл і 0,09–0,83 мкг/мл відповідно.
ЕС50 проти вірусів грипу типу А та типу В, стійких до адамантану, осельтамівіру та занамівіру, становив 0,09–0,47 мкг/мл, і перехресної стійкості не спостерігалося.
ЕС50 проти вірусів грипу типу А (включаючи штами, стійкі до адамантану, осельтамівіру або занамівіру), таких як свинячий тип А та пташиний тип А, включаючи високопатогенні штами (у тому числі H5N1 та H7N9), становив 0,06–3,53 мкг/мл.
Механізм дії. Вважається, що фавіпіравір метаболізується в клітинах до рибозилтрифосфатної форми (фавіпіравір РТФ). Фавіпіравір РТФ селективно пригнічує РНК-полімеразу, яка бере участь у реплікації вірусу грипу. Фавіпіравір РТФ проявляє різну активність щодо ДНК-полімераз людини α, β та γ: фавіпіравір РТФ (1000 мкмоль/л) не виявляв інгібуючого впливу на α-полімеразу; на 9,1–13,5% інгібував β-полімеразу та на 11,7–41,2% інгібував γ-полімеразу. Інгібуюча концентрація (IC50) фавіпіравіру РТФ на РНК-полімерази II людини становила 905 мкмоль/л.
Резистентність. Не спостерігалося змін чутливості вірусу грипу типу А до фавіпіравіру і не було виявлено резистентних вірусів. У клінічних дослідженнях, включаючи міжнародне дослідження III фази, інформації про появу резистентності до фавіпіравіру вірусів грипу не отримано.
Фармакокінетика. Абсорбція
Концентрація в крові. У наведеній нижче таблиці представлено фармакокінетичні параметри фавіпіравіру, який застосовували перорально 8 здорових дорослих у дозі 1600 мг двічі на добу в перший день, потім по 600 мг двічі на добу протягом 4 днів (1600 мг/600 мг два рази на добу) з наступним однократним застосуванням дози 600 мг один раз на добу.
Таблиця 1
Фармакокінетичні параметри фавіпіравіру
| Дозування | День | Cmax (мкг/мл) | AUC (мкг·год/мл) | Tmax (год) | T½ (год) |
| 1600 мг 2 рази на добу у день 1-й 600 мг 2 рази на добу у 2–5-й дні | Дні 1–5-й | 64,56 (17,2) | 446,09 (28,1) | 1,5 (0,75, 4) | 4,8±1,1 |
| 600 мг 1 раз на добу на 6-й день | День 6-й | 64,69 (24,1) | 553,98 (31,2) | 1,5 (0,75, 2) | 5,6±2,3 |
Зміни середньої концентрації фавіпіравіру у плазмі крові (середнє ± стандартне відхилення)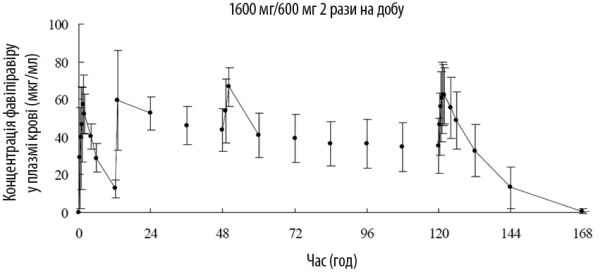
Після багаторазового перорального застосування фавіпіравіру протягом 7 днів у здорових добровольців, у яких виявлено незначну активність альдегідоксидази, розрахункове значення AUC незміненого препарату становило 1452,73 мкг·год/мл в 1-й день та 1324,09 мкг·год/мл на 7-й день.
Розподіл. Коли 20 здорових дорослих чоловіків застосовували перорально фавіпіравір у дозах 1200 мг 2 рази на добу протягом першого дня, а потім 800 мг 2 рази на добу протягом 4 днів, середнє геометричне концентрації препарату в спермі становило 18,341 мкг/мл на 3-й день застосування препарату та 0,053 мкг/мл — на 2-й день після припинення застосування препарату. Через 7 днів після припинення прийому лікарського засобу його рівні у спермі були нижче межі кількісного визначення (0,02 мкг/мл) у всіх учасників дослідження. Середнє співвідношення концентрації препарату у спермі та його концентрації у плазмі крові становило 0,53 на 3-й день застосування препарату та 0,45 — на 2-й день після припинення застосування препарату. Коефіцієнт зв’язування з білками в сироватці крові становив 53,4–54,4% (in vitro, центрифужна ультрафільтрація) при концентрації препарату в крові 0,3–30 мкг/мл.
Метаболізм. Фавіпіравір не метаболізується ізоферментами системи цитохрому Р450 (CYP): він метаболізується переважно альдегідоксидазою та частково метаболізується до гідроксильованої форми ксантиноксидази. У дослідженнях із використанням мікросом печінки людини утворення гідроксилату становило від 3,98 до 47,6 пмоль/мг білка/хв, при цьому у зв’язку з міжіндивідуальною варіабельністю значення активності альдегідоксидази відрізнялися максимум у 12 разів. Кон’югат глюкуронату спостерігався в плазмі крові та сечі людини як метаболіт, відмінний від гідроксильованої форми.
Виведення. Фавіпіравір виводився переважно у гідроксильованій формі із сечею, а також невелика кількість препарату виводиться в незміненому вигляді. У 7-денному дослідженні з багатократним пероральним застосуванням у 6 здорових дорослих осіб сукупний коефіцієнт виведення із сечею препарату в незміненій та гідроксильованій формі становив 0,8% та 53,1% відповідно протягом 48 год після прийому останньої дози.
Під час фармакокінетичного дослідження, проведеного за межами Японії, повідомлялося про підвищення рівня фавіпіравіру в плазмі крові у пацієнтів з порушенням функції печінки.
Показання Ковіфлу
для лікування нових або повторних пандемічних інфекцій, спричинених вірусом грипу, при яких лікування іншими противірусними засобами було неефективним або недостатньо ефективним.
Застосування Ковіфлу
застосування препарату слід розпочати негайно після появи грипоподібних симптомів.
Загальний період лікування має становити 5 днів. Звичайна доза фавіпіравіру для дорослих становить 1600 мг (8 таблеток) перорально двічі на добу у 1-й день лікування, після чого застосовують по 600 мг (3 таблетки) перорально двічі на добу протягом 4 днів.
Особливі групи пацієнтів. Пацієнти літнього віку (>65 років). Оскільки у осіб літнього віку фізіологічні функції часто бувають зниженими, застосовувати у них Ковіфлу слід з обережністю, контролюючи загальний стан пацієнта.
Пацієнти дитячого віку (<18 років). Лікарський засіб не призначений для застосування у дітей.
Порушення функції печінки. У пацієнтів з легким та помірним порушенням функції печінки (класи A і B за шкалою Чайлда — П’ю, по 6 осіб для кожного класу) при застосуванні Ковіфлу перорально у дозах 1200 мг двічі на добу протягом 1-го дня, а потім 800 мг двічі на добу протягом 4 днів порівняно зі здоровими дорослими добровольцями значення Cmax та AUC на 5-й день були відповідно приблизно в 1,6 раза та 1,7 раза вищими у пацієнтів з легкими порушеннями функції печінки та в 1,4 раза та 1,8 раза вищими у пацієнтів з помірними порушеннями функції печінки.
У пацієнтів з тяжкими порушеннями функції печінки (клас C за шкалою Чайлда — П’ю, 4 особи) при застосуванні фавіпіравіру перорально у дозі 800 мг двічі на добу протягом 1-го дня, а потім 400 мг двічі на добу протягом 2 днів порівняно зі здоровими дорослими добровольцями значення Cmax та AUC на 3-й день були відповідно приблизно у 2,1 та 6,3 раза вищими.
Ситуації, коли застосування препарату потребує обережності. Лікарський засіб слід з обережністю застосовувати у пацієнтів з активною подагрою або подагрою в анамнезі, а також у хворих з гіперурикемією (у таких пацієнтів може підвищитися рівень сечової кислоти в крові, а отже, симптоми можуть посилитися).
Діти. Лікарський засіб не призначений для застосування у дітей.
Протипоказання
вагітність або підозра на вагітність: у дослідженнях на тваринах спостерігалися смерть ембріона на ранніх термінах та тератогенні ефекти (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Застосування у період вагітності або годування грудьми);
Реакції підвищеної чутливості до будь-якого компоненту препарату в анамнезі.
Побічна дія
побічні реакції в осіб, які брали участь у дослідженні застосування препарату для лікування грипу. У клінічних дослідженнях, проведених у Японії, та в міжнародному дослідженні ІІІ фази (дослідження, що проводилися із рівнями доз, нижчими від затвердженої дози) побічні реакції спостерігалися у 100 з 501 учасника (19,96%), у яких оцінювали безпеку застосування препарату (включаючи відхилення від норми результатів лабораторних аналізів).
Найбільш поширені побічні реакції включали підвищення рівня сечової кислоти в крові у 24 осіб (4,79%), діарею —у 24 осіб (4,79%), зменшення кількості нейтрофілів у 9 осіб (1,80%), підвищення рівня АсАТ (глутамат-оксалоацетаттрансамінази) у 9 осіб (1,80 %), підвищення рівня АлАТ (глутамат-піруваттрансамінази) у 8 осіб (1,60 %).
Клінічно значущі побічні реакції (на аналогічні лікарські засоби). Повідомлялося про нижчезазначені клінічно значущі побічні реакції при застосуванні інших протигрипозних лікарських засобів. Слід ретельно спостерігати за станом пацієнта і в разі виявлення будь-яких розладів терапію варто припинити та вжити відповідних заходів.
– Шок, анафілаксія.
– Пневмонія.
– Фульмінантний гепатит, дисфункція печінки, жовтяниця.
– Токсичний епідермальний некроліз, синдром Стівенса — Джонсона.
– Гостре ураження нирок.
– Зменшення кількості лейкоцитів, нейтрофілів та тромбоцитів.
– Неврологічні та психіатричні симптоми (порушення свідомості, делірій, галюцинації, марення, судоми тощо).
– Хоча причинно-наслідковий зв’язок не встановлено, повідомлялося про психоневротичні симптоми, такі як аномальна поведінка, після застосування препаратів проти вірусу грипу, включаючи лікарський засіб Ковіфлу (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
– Геморагічний коліт.
Інші побічні реакції. Якщо виникають побічні реакції, перелічені нижче, слід провести симптоматичне лікування.
Таблиця 2
| Клас системи органів | ≥1% | Від 0,5 до 1% | <0,5% |
| Гіперчутливість | Висипання | Екзема, свербіж | |
| Розлади з боку печінки | Підвищення рівня АсАТ (глутамат-оксалоацетаттрансамінази) та АлАТ (глутамат-піруваттрансамінази), підвищення рівня гамма-глутамілтрансферази | Підвищення рівня ЛФ у крові, підвищення рівня білірубіну в крові | |
| Розлади з боку ШКТ | Діарея (4,79%) | Нудота, блювання, біль у животі | Дискомфорт у животі, виразка дванадцятипалої кишки, наявність незміненої крові в калі, гастрит |
| Розлади з боку крові | Зменшення кількості нейтрофілів, зменшення кількості лейкоцитів | Збільшення кількості лейкоцитів, зменшення кількості ретикулоцитів, збільшення кількості моноцитів | |
| Метаболічні розлади | Підвищення рівня сечової кислоти в крові (4,79%), підвищення рівня ТГ у крові | Наявність глюкози в сечі | Зниження рівня калію в крові |
| Розлади з боку дихальної системи | БА, біль у ротоглотці, риніт, назофарингіт | ||
| Інші розлади | Підвищення рівня креатинкінази (КФК) в крові, наявність крові в сечі, поліп у мигдаликах, пігментація, дисгевзія (порушення сприйняття смаку), гематоми, нечіткість зору, біль в очах, вертиго, надшлуночкові екстрасистоли | ||
Особливості застосування
застереження
1. Оскільки в дослідженнях на тваринах спостерігалися випадки смерті ембріона на ранніх термінах розвитку та тератогенні ефекти, не слід застосовувати Ковіфлу у жінок зі встановленою або підозрюваною вагітністю (див. ПРОТИПОКАЗАННЯ та Застосування у період вагітності або годування грудьми).
2. При застосуванні лікарського засобу у жінок репродуктивного віку перед початком лікування має бути отримано негативний результат тесту на вагітність. Слід детально пояснити жінкам, якими ризиками супроводжується застосування цього препарату, і настійно рекомендувати використовувати найефективніші методи контрацепції жінці та її партнеру під час лікування цим препаратом та протягом 7 днів після закінчення його застосування (див. Застосування у період вагітності або годування грудьми). Якщо під час лікування виникає підозра на вагітність, жінці слід рекомендувати негайно припинити прийом цього препарату та проконсультуватися з лікарем.
3. Фавіпіравір проникає у сперму. При застосуванні препарату у пацієнтів чоловічої статі слід детально пояснити їм, якими ризиками супроводжується лікування цим препаратом, та настійно рекомендувати використовувати найефективніші методи контрацепції під час статевих актів у період лікування та протягом 7 днів після його закінчення (чоловіки мають використовувати презервативи). Крім того, пацієнтам чоловічої статі слід повідомити, що вони не повинні вступати в статеві контакти з вагітними (див. Застосування у період вагітності або годування грудьми та Фармакокінетика).
4. Перед початком лікування слід детально пояснити інформацію про ефективність препарату та ризики (включаючи ризик впливу на плід).
5. Перед початком лікування препаратом слід ретельно зважити доцільність його застосування.
Запобіжні заходи
1. Ковіфлу — це препарат, застосування якого слід розглядати лише у разі спалаху нових або таких, що виникли повторно, інфекцій, спричинених вірусом грипу, за яких інші противірусні лікарські засоби є неефективними або недостатньо ефективними. При проведенні терапії цим препаратом слід ознайомлюватися з найсвіжішою інформацією та призначати препарат лише відповідним пацієнтам.
2. Фавіпіравір не є ефективним проти бактеріальних інфекцій.
3. Фавіпіравір не призначений для застосування у дітей (див. Діти).
4. Незалежно від способу введення або типу протигрипозних вірусних засобів у пацієнтів з інфекцією, спричиненою вірусом грипу, були зареєстровані випадки аномальної поведінки (див. ПОБІЧНІ РЕАКЦІЇ). Для уникнення нещасних випадків, таких як падіння через незвичайну поведінку, як превентивний захід пацієнтів або їхніх опікунів потрібно проінструктувати про те, що:
- може виникнути аномальна поведінка
,
- коли пацієнти проходять лікування вдома, опікуни або інші особи повинні вживати превентивних заходів щодо нещасних випадків, таких як падіння, протягом як мінімум 2 днів після початку лихоманки
.
Тяжкі форми аномальної поведінки, що призводили до нещасних випадків при падінні, частіше спостерігалися у хлопчиків шкільного віку та неповнолітніх. Відомо, що такі симптоми з більшою ймовірністю виявляли протягом 2 днів після початку лихоманки.
Слід ретельно спостерігати за пацієнтами, і якщо спостерігаються будь-які відхилення, лікування слід припинити та вжити відповідних заходів.
5. Інфекція, спричинена вірусом грипу, може ускладнитися бактеріальними інфекціями або супроводжуватися симптомами, які легко сплутати з грипоподібними симптомами. У разі бактеріальної інфекції або підозри на бактеріальну інфекцію слід вжити відповідних заходів, таких як застосування антибактеріальних препаратів.
Застосування у період вагітності або годування грудьми
Вагітність. Протипоказано застосовувати лікарський засіб Ковіфлу у жінок з відомою чи підозрюваною вагітністю. У дослідженнях на тваринах із рівнями експозиції, аналогічними або нижчими за клінічну експозицію, спостерігалися смерть ембріона на ранніх термінах (у щурів) і тератогенні ефекти (у мавп, мишей, щурів і кроликів).
Годування грудьми. При застосуванні лікарського засобу Ковіфлу у жінок, які годують грудьми, слід припинити грудне вигодовування. Під час досліджень було встановлено, що основний метаболіт фавіпіравіру — гідроксильована форма — проникає в грудне молоко.
Оскільки в дослідженнях на тваринах спостерігалися випадки смерті ембріона на ранніх термінах розвитку та тератогенні ефекти, не слід застосовувати фавіпіравір у жінок із встановленою або підозрюваною вагітністю (див. ПРОТИПОКАЗАННЯ).
При застосуванні фавіпіравіру у жінок репродуктивного віку перед початком лікування має бути підтверджено негативний результат тесту на вагітність. Слід детально пояснити жінкам, якими ризиками супроводжується застосування цього препарату, і настійно рекомендувати використовувати найефективніші методи контрацепції жінці та її партнеру під час лікування цим препаратом та протягом 7 днів після закінчення його застосування. Якщо під час лікування виникає підозра на вагітність, жінці слід рекомендувати негайно припинити прийом цього препарату та проконсультуватися з лікарем.
Фавіпіравір проникає у сперму. При застосуванні препарату у пацієнтів чоловічої статі слід детально пояснити їм, якими ризиками супроводжується лікування цим препаратом, та настійно рекомендувати використовувати найефективніші методи контрацепції під час статевих актів у період лікування та протягом 7 днів після закінчення його застосування (чоловіки мають використовувати презервативи). Крім того, пацієнтам чоловічої статі слід повідомити, що вони не повинні вступати в статеві контакти з вагітними (див. Фармакокінетика).
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Відсутні дані щодо впливу фавіпіравіру на здатність керувати транспортними засобами та працювати з іншими механізмами.
Взаємодія з іншими лікарськими засобами
лікарський засіб Ковіфлу не метаболізується ізоферментами системи цитохрому Р450 (CYP): він метаболізується переважно альдегідоксидазою та частково ксантиноксидазою. Цей препарат інгібує альдегідоксидазу і CYP 2C8, але не індукує ізоферменти системи CYP (див. Фармакокінетика).
Запобіжні заходи при одночасному застосуванні з іншими лікарськими засобами
Таблиця 3
Лікарські засоби, одночасно з якими фавіпіравір слід застосовувати з обережністю
| Препарат | Ознаки, симптоми та лікування | Механізм взаємодії та фактори ризику |
| Піразинамід | Підвищується рівень сечової кислоти в крові. При застосуванні піразинаміду в дозі 1,5 г один раз на добу і фавіпіравіру в дозі 1200 мг/400 мг два рази на добу рівень сечової кислоти в крові становив 11,6 мг/дл, коли піразинамід застосовували окремо, і 13,9 мг/дл, коли піразинамід застосовували в комбінації з фавіпіравіром | Посилення реабсорбції сечової кислоти в ниркових канальцях внаслідок адитивного ефекту |
| Репаглінід | Рівень репаглініду в крові може підвищуватися, а також можуть виникати побічні реакції на репаглінід | Інгібування CYP 2C8 підвищує рівень репаглініду в крові |
| Теофілін | Рівень фавіпіравіру в крові може підвищуватися, також можуть виникати побічні реакції на фавіпіравір | Взаємодія з ксантиноксидазою може підвищувати рівень фавіпіравіру в крові |
| Фамцикловір | Ефективність цих препаратів може знижуватися | Інгібування альдегідоксидази фавіпіравіром може знизити рівень активних форм цих препаратів у крові |
| Суліндак | ||
In vitro фавіпіравір необоротно інгібував альдегідоксидазу залежно від дози та часу та інгібував CYP 2C8 залежно від дози. Не спостерігалося інгібуючої активності щодо ксантиноксидази і слабкої інгібуючої активності відносно CYP 1A2, 2C9, 2C19, 2D6, 2E1 та 3A4. Гідроксильований метаболіт виявляв слабку інгібуючу активність щодо CYP 1A2, 2C8, 2C9, 2C19, 2D6, 2E1 та 3A4.
Індуктивного впливу фавіпіравіру на CYP не спостерігалося.
Таблиця 4
Вплив супутніх лікарських засобів на фармакокінетику фавіпіравіру
| Супутній лікарський засіб і дозування | Доза фавіпіравіру | N | Час застосування дози | Співвідношення параметрів для фавіпіравіру (90% довірчий інтервал) (при застосуванні в комбінації/окремо) | |
| Cmax | AUC | ||||
| Теофілін 200 мг двічі на добу у дні з 1-го до 9-го; 200 мг один раз на добу на день 10-й | 600 мг 2 рази на добу у день 6-й; 600 мг один раз на добу у дні з 7-го до 10-го | 10 | День 6-й | 1,33 (1,19; 1,48) | 1,27 (1,15; 1,40) |
| День 7-й | 1,03 (0,92; 1,15) | 1,17 (1,04; 1,31) | |||
| Озельтамівір 75 мг двічі на добу у дні з 1-го до 5-го; 75 мг один раз на добу на день 6-й | 600 мг двічі на добу на день 5-й; 600 мг один раз на добу на день 6-й | 10 | День 6-й | 0,98 (0,87; 1,10) | 1,01 (0,91; 1,11) |
| Ралоксифен 60 мг один раз на добу у дні з 1-го до 3-го | 1200 мг двічі на добу у день 1-й; 800 мг двічі на добу на день 2-й; 800 мг 1 раз на добу на день 3-й | 17 | День 1-й | 1,00 (0,90; 1,10) | 1,03 (0,95; 1,12) |
| День 3-й | 0,90 (0,81; 0,99) | 0,85 (0,79; 0,93) | |||
| Гідралазин 5 мг один раз на добу у дні 1 та 5 | 1200 мг (перша доза)/400 мг (друга доза) у день 1-й; 400 мг двічі на добу у дні з 2-го до 4-го; 400 мг один раз на добу на день 5-й | 14 | День 1-й | 0,99 (0,92; 1,06) | 0,99 (0,92; 1,07) |
| День 5-й | 0,96 (0,89; 1,04) | 1,04 (0,96; 1,12) | |||
Таблиця 5
Вплив фавіпіравіру на фармакокінетику супутніх лікарських засобів
| Супутній лікарський засіб і дозування | Доза фавіпіравіру | N | Час застосування дози | Співвідношення параметрів для фавіпіравіру (90% довірчий інтервал) (при застосуванні в комбінації/окремо) | |
| Cmax | AUC | ||||
| Теофілін 200 мг двічі на добу у дні з 1-го до 9-го; 200 мг один раз на добу на день 10-й | 600 мг двічі на добу на день 6-й; 600 мг один раз на добу у дні з 7-го до 10-го | 10 | День 7-й | 0,93 (0,85; 1,01) | 0,92 (0,87; 0,97) |
| День 10-й | 0,99 (0,94; 1,04) | 0,97 (0,91; 1,03) | |||
| Озельтамівір 75 мг двічі на добу у дні з 1-го до 5-го; 75 мг один раз на добу на день 5-й | 600 мг двічі на добу на день 5-й; 600 мг один раз на добу на день 6-й | 10 | День 6-й | 1,10 (1,06; 1,15) | 1,14 (1,10; 1,18) |
| Ацетамінофен 650 мг один раз на добу у дні 1-й та 5-й | 1200 мг двічі на добу у день 1-й; 800 мг двічі на добу у дні з 2-го до 4-го; 800 мг один раз на добу на день 5-й | 28 | День 1-й | 1,03 (0,93; 1,14) | 1,16 (1,08; 1,25) |
| День 5-й | 1,08 (0,96; 1,22) | 1,14 (1,04; 1,26) | |||
| Комбінація норетиндрон/етинілестрадіол 1 мг/0,035 мг один раз на добу у дні з 1-го до 5-го | 1200 мг двічі на добу у день 1-й; 800 мг двічі на добу у дні з 2-го до 4-го; 800 мг один раз на добу на день 5-й | 25 | День 12-й (норетиндрон) | 1,23 (1,16; 1,30) | 1.47 (1,42, 1,52) |
| День 12-й (норетиндрон) | 1,48 (1,42; 1,54) | 1.43 (1,39; 1,47) | |||
| Репаглінід 0,5 мг один раз на добу у день 13-й | 1200 мг двічі на добу у день 1-й; 800 мг двічі на добу у дні з 2 по 4; 800 мг один раз на добу на день 5-й | 17 | День 13-й | 1,28 (1,16; 1,41) | 1,52 (1,37; 1,68) |
| Гідралазин 5 мг один раз на добу у дні 1 та 5 | 1200 мг (перша доза)/400 мг (друга доза) у день 1-й; 400 мг двічі на добу у дні з 2-го до 4-го; 400 мг один раз на добу на день 5-й | 14 | День 1-й | 0,73 (0,67; 0,81) | 0,87 (0,78; 0,97) |
| День 5-й | 0,79 (0,71; 0,88) | 0,91 (0,82; 1,01) | |||
Передозування
відсутні дані про передозування фавіпіравіру.
Умови зберігання
в оригінальній упаковці за температури не вище 30 °C. Зберігати в недоступному для дітей місці.