Епайдра® (Apidra)
Епайдра інструкція із застосування
Склад
1 мл розчину містить інсуліну глюлізину (продукту рекомбінантної ДНК-технології із застосуванням Escherichia coli) 100 ОД, що еквівалентно 3,49 мг;
1 шприц-ручка СолоСтар® містить 3 мл розчину для ін’єкцій, що еквівалентно 300 ОД інсуліну глюлізину;
допоміжні речовини: м-крезол, натрію хлорид, трометамін, полісорбат 20, кислота хлористоводнева концентрована, натрію гідроксид, вода для ін’єкцій.
Інсулін глюлізин - 100 ОД/мл
Фармакологічні властивості
фармакодинаміка. Інсулін глюлізин є рекомбінантним аналогом інсуліну людини, що за своєю силою дії подібний до інсуліну людини. Інсулін глюлізин діє швидше та має меншу тривалість дії, ніж простий інсулін людини.
Основна дія інсулінів та їх аналогів, включаючи інсулін глюлізин, спрямована на регулювання метаболізму глюкози. Інсуліни знижують рівень глюкози в крові шляхом стимуляції периферійної утилізації глюкози, особливо у скелетних м’язах і жировій тканині, та пригнічення синтезу глюкози в печінці. Інсулін запобігає ліполізу в адипоцитах, протеолізу та посилює синтез протеїну.
Дослідження за участю здорових добровольців і хворих на цукровий діабет продемонстрували, що при п/ш введенні інсулін глюлізин діє швидше та має меншу тривалість дії, ніж простий інсулін людини. Якщо інсулін глюлізин застосовується у вигляді п/ш ін’єкції, зниження рівня глюкози починається протягом 10–20 хв. Після в/в введення дія препарату починалася раніше та тривала менше, а пік активності був більш вираженим, ніж при п/ш введенні. При в/в введенні цукрознижувальні ефекти інсуліну глюлізину або простого людського інсуліну є однаково сильними.
Одна одиниця інсуліну глюлізину виявляє таку саму цукрознижувальну активність, що й одна одиниця простого людського інсуліну.
Дозозалежність. У дослідженні, у якому взяли участь 18 чоловіків, хворих на цукровий діабет 1-го типу, віком 21–50 років, цукрознижувальний ефект інсуліну глюлізину був дозозалежним при застосуванні в терапевтично значущих дозах 0,075–0,15 ОД/кг маси тіла, але менш ніж пропорційним при застосуванні доз 0,3 ОД/кг маси тіла або вищих, як і при застосуванні людського інсуліну.
Ефект інсуліну глюлізину настає приблизно вдвічі швидше і припиняється приблизно на 2 год раніше, ніж ефект простого людського інсуліну.
У дослідженні І фази за участю пацієнтів з цукровим діабетом 1-го типу оцінювали профілі цукрознижувального ефекту інсуліну глюлізину та простого інсуліну людини, які вводили п/ш у дозі 0,15 ОД/кг у різний час відносно 15-хвилинного стандартного прийому їжі. Встановлено, що при введенні інсуліну глюлізину за 2 хв до прийому їжі спостерігається постпрандіальний глікемічний контроль, подібний до такого при введенні простого інсуліну людини, що застосовувався за 30 хв до прийому їжі. При порівнянні цукрознижувальних ефектів інсуліну глюлізину та простого інсуліну людини при введенні за 2 хв до прийому їжі інсулін глюлізин забезпечував кращий постпрандіальний контроль, ніж простий інсулін людини. Застосування інсуліну глюлізину через 15 хв після початку прийому їжі забезпечує глікемічний контроль, подібний до такого при застосуванні простого інсуліну людини, що введений за 2 хв до початку прийому їжі (рис. 1).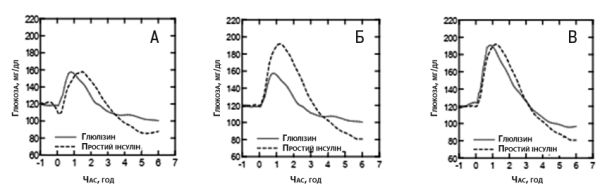
Рис. 1. Середній цукрознижувальний ефект через 6 год у 20 пацієнтів з цукровим діабетом 1-го типу. Інсулін глюлізин, який вводили за 2 хв до початку прийому їжі («глюлізин — перед їдою»), порівняно з простим людським інсуліном, який вводили за 30 хв до початку прийому їжі («простий інсулін — за 30 хв до їди») (рис. 1А), і порівняно з простим людським інсуліном, який вводили за 2 хв до початку прийому їжі («простий інсулін — перед їдою») (рис. 1В). Інсулін глюлізин, який вводили через 15 хв після початку прийому їжі («глюлізин — після їди»), порівняно з простим людським інсуліном, який вводили за 2 хв до початку прийому їжі («простий інсулін — перед їдою») (рис. 1С). На осі x нуль (позначений стрілкою) відповідає початку 15-хвилинного прийому їжі.
Ожиріння. Дослідження І фази, у якому застосовували інсулін глюлізин, інсулін лізпро та простий людський інсулін у пацієнтів з ожирінням, продемонструвало, що у цих пацієнтів інсулін глюлізин зберігає свою здатність діяти швидко. У цьому дослідженні час до досягнення 20% загальної АUС та значення АUС0–2 год, що є показниками ранньої дії інсулінів щодо зниження рівня глюкози, дорівнювали відповідно 114 хв і 427 мг/кг для інсуліну глюлізину, 121 хв і 354 мг/кг для інсуліну лізпро, 150 хв і 197 мг/кг для простого інсуліну людини (рис. 2).
Рис. 2. Швидкість інфузії глюкози після п/ш введення 0,3 ОД/кг маси тіла інсуліну глюлізину (глюлізин) або інсуліну лізпро (лізпро) або простого людського інсуліну (простий інсулін) у пацієнтів з ожирінням.
Інше дослідження І фази з оцінки інсуліну глюлізину та інсуліну лізпро, проведене за участю 80 осіб без цукрового діабету з широким діапазоном індексів маси тіла (18–46 кг/м2), продемонструвало, що швидка дія загалом зберігається у широкому діапазоні індексів маси тіла (ІМТ), тоді як загальний цукрознижувальний ефект знижується при зростанні ступеня ожиріння.
Середня загальна AUC швидкості інфузії глюкози у період 0–1 год становила відповідно 102±75 і 158±100 мг/кг при застосуванні інсуліну глюлізину у дозах 0,2 і 0,4 ОД/кг маси тіла та відповідно 83,1±72,8 і 112,3±70,8 мг/кг при застосуванні інсуліну лізпро у дозах 0,2 і 0,4 ОД/кг маси тіла. Дослідження I фази за участю 18 пацієнтів з ожирінням та цукровим діабетом 2-го типу (ІМТ 35–40 кг/м2), яким вводили інсулін глюлізин та інсулін лізпро (90% ДІ 0,81–0,95 (p≤0,01)), показало, що інсулін глюлізин ефективно контролює денні постпрандіальні коливання рівня глюкози в крові.
Клінічна ефективність та безпека. Цукровий діабет 1-го типу — дорослі пацієнти. У 26-тижневому клінічному дослідженні ІІІ фази, в якому порівнювався інсулін глюлізин з інсуліном лізпро, які вводили п/ш незадовго (за 0–15 хв) до прийому їжі пацієнтам з цукровим діабетом 1-го типу, що отримували інсулін гларгін як базальний інсулін, інсулін глюлізин забезпечував порівнянний з інсуліном лізпро контроль глікемії, про що свідчили зміни рівня глікозильованого гемоглобіну (вираженого як еквівалент HbA1c) на момент кінцевої точки дослідження порівняно з вихідним значенням. Спостерігалися порівнянні значення рівнів глюкози в крові, визначені шляхом самоконтролю. На відміну від інсуліну лізпро, при застосуванні інсуліну глюлізину не було потреби у підвищенні дози базального інсуліну.
12-тижневе клінічне дослідження III фази за участю пацієнтів з цукровим діабетом 1-го типу, які отримували інсулін гларгін як базальний інсулін, свідчить про те, що ефективність інсуліну глюлізину, введеного одразу після прийому їжі, є порівнянною з ефективністю введених незадовго до прийому їжі інсуліну глюлізину (за 0–15 хв) або простого інсуліну (за 30–45 хв).
Із популяції пацієнтів, які виконали умови протоколу дослідження, у групі пацієнтів, які отримали інсулін глюлізин до прийому їжі, виявлено статистично значущо більш виражене зниження рівня глікозильованого гемоглобіну порівняно з групою пацієнтів, які отримували простий інсулін.
Цукровий діабет 1-го типу — педіатричні пацієнти. У 26-тижневому клінічному дослідженні III фази порівнювалися інсулін глюлізин та інсулін лізпро, які вводили шляхом п/ш ін’єкцій незадовго (за 0–15 хв) до прийому їжі дітям (віком 4–5 років: n=9; віком 6–7 років: n=32 і віком 8–11 років: n=149) та підліткам (віком 12–7 років: n=382) з цукровим діабетом 1-го типу, що отримували інсулін гларгін або НПХ-інсулін у якості базального інсуліну. Інсулін глюлізин забезпечував порівнянний з інсуліном лізпро контроль глікемії, про що свідчили зміни рівня глікозильованого гемоглобіну (вираженого як еквівалент HbA1c) на момент кінцевої точки дослідження порівняно з вихідним значенням та рівнів глюкози при самостійному моніторуванні пацієнтами.
Інформація стосовно клінічного застосування препарату Епайдра у дітей віком до 6 років є недостатньою.
Цукровий діабет 2 типу — дорослі пацієнти.
26-тижневе клінічне дослідження III фази з наступним 26-тижневим дослідженням подальшого спостереження для оцінки безпеки проводили з метою порівняння інсуліну глюлізину (який вводили за 0–15 хв до прийому їжі) з простим людським інсуліном (який вводили за 30–45 хв до прийому їжі), що застосовували шляхом п/ш ін’єкцій у пацієнтів з цукровим діабетом 2-го типу, що також отримували НПХ-інсулін як базальний інсулін. Середній індекс маси тіла (ІМТ) пацієнтів становив 34,55 кг/м2. Було показано, що інсулін глюлізин є порівнянним з простим людським інсуліном за змінами рівня глікозильованого гемоглобіну (вираженого як еквівалент HbA1c) на момент кінцевої точки дослідження через 6 міс від початку дослідження порівняно з вихідним значенням (–0,46% для інсуліну глюлізину і –0,30% для простого людського інсуліну, p=0,0029), на момент кінцевої точки дослідження через 12 міс від початку дослідження порівняно з вихідним значенням (–0,23% для інсуліну глюлізину і –0,13% для простого людського інсуліну, різниця була статистично незначущою). У цьому дослідженні більшість пацієнтів (79%) змішували свій інсулін короткої тривалості дії з нейтральним протаміном Хагедорна (НПХ)-інсуліном безпосередньо перед виконанням ін’єкції, а 58% пацієнтів приймали пероральні цукрознижувальні препарати на момент рандомізації та були проінструктовані про необхідність продовжувати їх приймати у тій же дозі.
Раса та стать. У ході контрольованих клінічних досліджень за участю дорослих пацієнтів інсулін глюлізин не продемонстрував різниці у безпеці та ефективності в підгрупах, що відрізнялися за расою та статтю.
Фармакокінетика. Більш швидка абсорбція інсуліну глюлізину забезпечується заміною амінокислоти аспарагіну у позиції В3 інсуліну людини лізином і лізину в позиції В29 глутаміновою кислотою.
У дослідженні за участю 18 чоловіків віком 21–50 років, хворих на цукровий діабет 1-го типу, дія інсуліну глюлізину була дозозалежною при ранній, максимальній і загальній експозиції в діапазоні доз 0,075–0,4 ОД/кг.
Абсорбція та біодоступність. Фармакокінетичні профілі у здорових добровольців і хворих на цукровий діабет (1-го або 2-го типу) продемонстрували, що швидкість абсорбції інсуліну глюлізину була приблизно у 2 рази вищою і Cmax приблизно у 2 рази вищою порівняно з такими у простого інсуліну людини.
У дослідженні за участю пацієнтів з цукровим діабетом 1-го типу після п/ш ін’єкції у дозі 0,15 ОД/кг показники Тmax для інсуліну глюлізину дорівнювали 55 хв і Сmax була 82±1,3 мкОД/мл порівняно з Тmax 82 хв і Сmax 46±1,3 мкОд/мл для простого інсуліну людини. Середній час утримання в системному кровотоці інсуліну глюлізину був коротшим (98 хв), ніж простого інсуліну людини (161 хв) (рис. 3).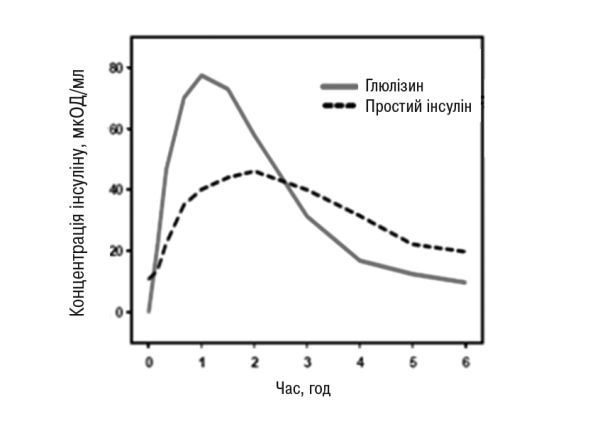
Рис. 3. Фармакокінетичний профіль інсуліну глюлізину і простого людського інсуліну у пацієнтів з цукровим діабетом 1-го типу після введення дози 0,15 ОД/кг.
У дослідженні за участю пацієнтів з цукровим діабетом 2-го типу після п/ш застосування інсуліну глюлізину у дозі 0,2 ОД/кг Сmax становить 91 мкОД/мл з міжквартильним діапазоном 78–104 мкОД/мл.
При п/ш ін’єкції інсуліну глюлізину в черевну стінку, стегно або ділянку дельтоподібного м’яза профілі «концентрація/час» були подібними, при цьому абсорбція препарату є дещо більш швидкою при застосуванні в ділянку стінки живота, ніж у стегно. Абсорбція у місці ін’єкції в ділянці дельтоподібного м’яза була середньою між вищезазначеними показниками (див. ЗАСТОСУВАННЯ). Абсолютна біодоступність (70%) інсуліну глюлізину була подібною у вищезазначених місцях ін’єкцій та мала низьку міжіндивідуальну варіабельність (коефіцієнт варіабельності — 11%). В/в болюсне застосування інсуліну глюлізину забезпечувало більш високу системну експозицію порівняно з такою при п/ш ін’єкції, причому значення Сmax було приблизно в 40 разів більшим.
Ожиріння. Інше дослідження І фази інсуліну глюлізину та інсуліну лізпро, проведене за участю 80 осіб без цукрового діабету з широким діапазоном індексів маси тіла (18–46 кг/м2), продемонструвало, що швидка абсорбція і загальна експозиція в цілому зберігаються у широкому діапазоні індексів маси тіла.
Час до досягнення 10% від загальної експозиції інсуліну при застосуванні інсуліну глюлізину був приблизно на 5–6 хв коротшим.
Розподіл і виведення інсуліну глюлізину і простого людського інсуліну після в/в введення є подібними, при цьому об’єми розподілу становлять 13 і 22 л, а Т½ — 13 і 18 хв відповідно.
Після п/ш застосування інсулін глюлізин виводиться швидше, ніж простий інсулін людини, з уявним Т½ 42 хв для інсуліну глюлізину порівняно з 86 хв для простого інсуліну. При аналізі даних різних досліджень із застосуванням інсуліну глюлізину за участю здорових добровольців або хворих на цукровий діабет 1-го або 2-го типу уявний Т½ був у межах 37–75 хв (міжквартильний діапазон).
Інсулін глюлізин, як і людський інсулін, погано зв’язується з білками плазми крові.
Особливості застосування препарату в окремих групах пацієнтів. Пацієнти з порушеннями функції нирок. У клінічному дослідженні за участю осіб без цукрового діабету та з функцією нирок у широкому діапазоні (кліренс креатиніну >80 мл/хв, 30–50 мл/хв, <30 мл/хв) здатність інсуліну глюлізину до швидкої дії в цілому зберігалася. Однак при порушенні функції нирок потреба в інсуліні може знижуватися.
Пацієнти з порушеннями функції печінки. Фармакокінетичні властивості інсуліну глюлізину не досліджувалися у пацієнтів з порушенням функції печінки.
Пацієнти літнього віку. Стосовно пацієнтів літнього віку з цукровим діабетом існує дуже обмежена база даних щодо фармакокінетики препарату.
Діти та підлітки. Фармакокінетичні та фармакодинамічні властивості інсуліну глюлізину у дітей (віком 7–11 років) і підлітків (віком 12–16 років), хворих на цукровий діабет 1-го типу, такі: інсулін глюлізин швидко всмоктується у хворих обох вікових груп і має такі ж показники Тmax та Сmax, як і у дорослих (див. ЗАСТОСУВАННЯ). Введення інсуліну глюлізину безпосередньо перед прийомом їжі дітям та підліткам забезпечує кращий постпрандіальний глікемічний контроль порівняно з простим інсуліном людини, як і у дорослих хворих (див. Фармакодинаміка). Відхилення рівня глюкози (AUC0–6 год) становить 641 мг/(год∙дл) для інсуліну глюлізину та 801 мг/(год∙дл) для простого інсуліну людини.
Доклінічні дані щодо безпеки застосування. Доклінічні дані не вказують на наявність токсичності (крім тієї, що пов’язана з гіпоглікемією), яка б відрізнялася від показників звичайного інсуліну людини або була клінічно значущою для людей.
Показання Епайдра
цукровий діабет, коли необхідне застосування інсуліну у дорослих, підлітків і дітей віком від 6 років.
Застосування Епайдра
сила дії цього препарату виражається в одиницях, які застосовуються виключно для препарату Епайдра і відрізняються від МО чи одиниць, у яких виражається сила дії інших аналогів інсуліну (див. Фармакодинаміка).
Препарат Епайдра застосовують у режимах інсулінотерапії, що включають інсулін середньої або довготривалої дії або аналог базального інсуліну. Цей лікарський засіб можна призначати одночасно з пероральними протидіабетичними засобами.
Дозу препарату Епайдра підбирають та регулюють індивідуально.
Особливі категорії пацієнтів. Пацієнти з порушеннями функції нирок. Фармакокінетичні властивості інсуліну глюлізину в цілому зберігаються у пацієнтів з порушенням функції нирок. Однак у разі порушення функції нирок потреба в інсуліні може знижуватися (див. Фармакокінетика).
Пацієнти з порушеннями функції печінки. Фармакокінетичні властивості інсуліну глюлізину не вивчалися у пацієнтів зі зниженою функцією печінки. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути меншою через зниження глюконеогенезу та здатності інсуліну метаболізуватися.
Пацієнти літнього віку. Наявні дані з фармакокінетики інсуліну у пацієнтів літнього віку з цукровим діабетом є недостатніми. Погіршення функції нирок може призвести до зниження потреби в інсуліні.
Діти та підлітки. Не існує достовірної клінічної інформації щодо застосування препарату Епайдра у дітей віком до 6 років.
Застосування. Препарат Епайдра у попередньо наповненій шприц-ручці СолоСтар можна застосовувати лише для п/ш ін’єкцій. Якщо необхідне введення препарату за допомогою шприца, в/в ін’єкції або інфузійного насоса, слід використовувати флакон (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Препарат Епайдра слід вводити шляхом п/ш ін’єкції незадовго (за 0–15 хв) до чи одразу після прийому їжі.
Препарат Епайдра застосовують п/ш у ділянку черевної стінки, стегна або дельтоподібного м’яза. Місця для ін’єкцій або інфузій у зоні ін’єкції (передня стінка черевної порожнини, стегно або дельтоподібний м’яз) слід по черзі змінювати, щоб знизити ризик розвитку ліподистрофії та амілоїдозу шкіри (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ПОБІЧНА ДІЯ). Швидкість абсорбції і, відповідно, початок та термін дії можуть залежати від певного місця ін’єкції, техніки її виконання та інших змінних показників. П/ш ін’єкція у черевну стінку забезпечує трохи швидшу абсорбцію, ніж введення препарату в інші місця для ін’єкцій (див. Фармакокінетика).
Необхідно слідкувати за тим, щоб не допустити введення препарату безпосередньо у кровоносну судину. Після введення препарату не слід масажувати місце ін’єкції. Пацієнтів слід навчати дотримуватися правильної процедури виконання ін’єкцій.
Змішування з іншими інсулінами. Інсулін глюлізин не слід змішувати з іншими лікарськими засобами, крім людського НПХ-інсуліну.
Інструкція для використання шприц-ручки СолоСтар. Перед першим застосуванням шприц-ручку слід витримати при кімнатній температурі протягом 1–2 год.
Перевірити картридж перед його використанням. Його можна застосовувати лише тоді, коли р-н у ньому є прозорим, безбарвним, без видимих твердих часточок та має таку ж консистенцію, як і вода. Оскільки Епайдра є р-ном, вона не потребує ресуспендування перед застосуванням.
Порожні шприц-ручки не можна використовувати знову, їх потрібно належним чином знищити.
Щоб запобігти будь-якій контамінації, кожна попередньо наповнена шприц-ручка повинна використовуватися лише однією особою. Перед кожною ін’єкцією слід перевіряти інформацію на етикетці, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Схематичне зображення шприц-ручки СолоСтар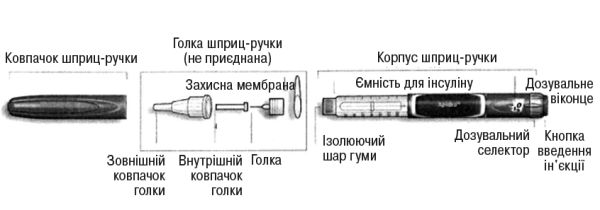
Важлива інформація щодо використання шприц-ручки СолоСтар
• Для кожної ін’єкції слід використовувати нову голку, сумісну тільки зі шприц-ручкою СолоСтар. Не слід обирати дозу та натискати кнопку введення, якщо голка не приєднана до шприц-ручки.
• Тест на безпеку слід виконувати перед кожною ін’єкцією.
• Шприц-ручка призначена особисто, і не слід передавати її іншим особам.
• Якщо ін’єкцію пацієнту вводить інша особа, ця особа має вживати спеціальних заходів безпеки для запобігання нещасним випадкам, пов’язаним із застосуванням голки та перенесенням інфекції.
• Не слід використовувати шприц-ручку СолоСтар у разі пошкодження або при наявності сумнівів щодо правильності її функціонування.
• Завжди необхідно мати запасну шприц-ручку СолоСтар на випадок втрати або пошкодження поточної шприц-ручки СолоСтар.
Інструкції щодо зберігання. Слід уважно ознайомитися з інформацією щодо зберігання шприц-ручки СолоСтар.
Якщо шприц-ручка СолоСтар зберігається в холодильнику, слід витягнути її звідти за 1–2 год до введення препарату, щоб вона нагрілася до кімнатної температури. Ін’єкційне введення охолодженого інсуліну є більш болісним.
Використана шприц-ручка СолоСтар підлягає утилізації згідно із встановленими правилами.
Експлуатація. Слід оберігати шприц-ручку СолоСтар від пилу та бруду.
Очистити зовні шприц-ручку СолоСтар можна, протираючи її вологою тканиною.
Не слід занурювати в рідину, промивати і змащувати шприц-ручку, оскільки цим можна пошкодити її.
Шприц-ручка СолоСтар призначена для точної і безпечної роботи.
Її необхідно використовувати з обережністю. Слід уникати ситуацій, при яких можливе пошкодження шприц-ручки СолоСтар. Якщо є підозра, що шприц-ручка СолоСтар пошкоджена, слід використати нову шприц-ручку.
Стадія 1. Контроль інсуліну.
A. Уважно прочитати інформацію на етикетці шприц-ручки СолоСтар для того, щоб переконатися у введенні відповідного інсуліну. Шприц-ручка СолоСтар з Епайдрою — синього кольору, кнопка для введення препарату — темно-синього кольору з рельєфним кільцем у верхній частині.
B. Зняти ковпачок шприц-ручки.
C. Проконтролювати зовнішній вигляд інсуліну. Епайдра є прозорим, безбарвним р-ном, без видимих твердих часточок і має таку ж консистенцію, як вода з інсуліном. Не можна використовувати шприц-ручку СолоСтар, якщо інсулін мутний, забарвлений або має сторонні частки.
Стадія 2. Приєднання голки.
Для кожної ін’єкції слід завжди застосовувати нову стерильну голку. Це дасть змогу запобігти забрудненню, а також можливому засміченню голки. Необхідно використовувати лише ті голки, які є сумісними зі шприц-ручкою СолоСтар.
A. Зняти захисну етикетку з контейнера голки.
B. Встановити голку на одній лінії зі шприц-ручкою, а потім утримувати на одній прямій до її приєднання (накручують або насаджують залежно від типу голки).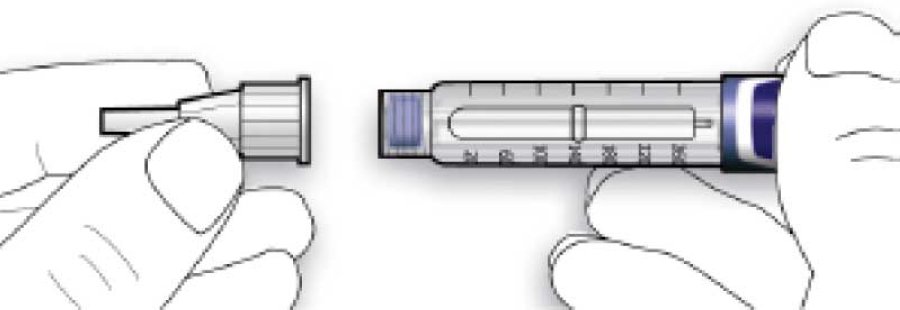
• Якщо голка не знаходиться на одній лінії зі шприц-ручкою в момент приєднання, це може призвести до порушення ізолюючого шару гуми і спричинити витікання рідини або перелом голки.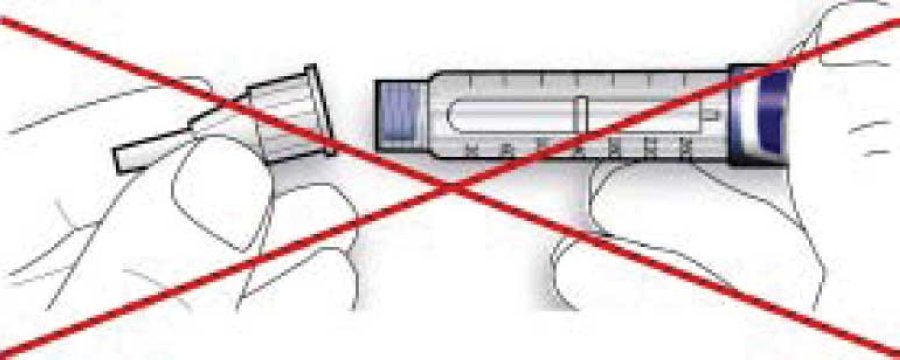
Стадія 3. Тест на безпеку.
У всіх випадках слід виконувати тест на безпеку перед кожною ін’єкцією. Цим забезпечується одержання точної дози завдяки:
• перевірці того, що шприц-ручка і голка функціонують нормально;
• видаленню пухирців повітря.
A. Відміряти дозу, що дорівнює 2 ОД, повертаючи дозувальний селектор.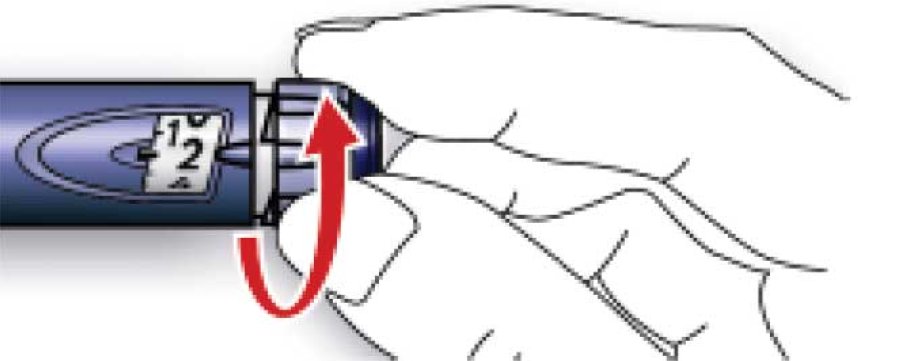
B. Зняти зовнішній ковпачок з голки і зберігати його, щоб потім помістити в нього використану після введення ін’єкції голку. Зняти внутрішній ковпачок з голки і викинути його.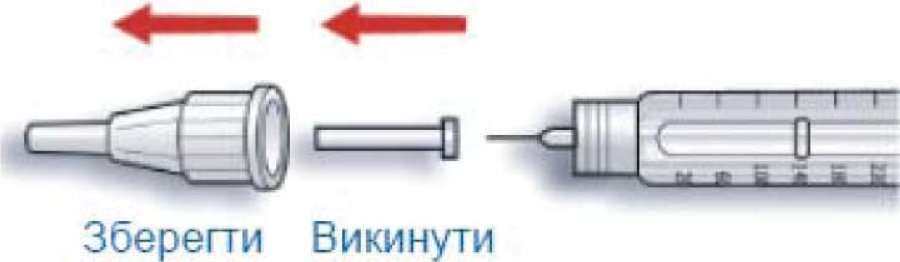
C. Розмістити шприц-ручку голкою вгору.
D. Кінчиками пальців постукати обережно по ємності для інсуліну, щоб усі пухирці повітря піднялися вгору в напрямку голки.
E. Натиснути на кнопку введення ін’єкції до упору. Перевірити, чи з’являється інсулін на кінчику голки.
Якщо при цьому з кінчика голки виходить інсулін, шприц-ручка і голка працюють належним чином. Можна провести випробування на безпеку кілька разів, поки не з’явиться інсулін.
• Якщо інсулін не з’явився, слід провести контроль наявності пухирців повітря і повторно провести випробування на безпеку більше 2 разів до їх видалення.
• Якщо появи інсуліну не спостерігається, це може бути спричинено блокуванням голки. Слід зняти голку і повторити випробування.
• Якщо появи інсуліну не спостерігається після заміни голки, шприц-ручку СолоСтар може бути зіпсовано. Не слід використовувати її.
Стадія 4. Вибір дози.
Можна встановити дозу з точністю до 1 ОД (від мінімальної дози 1 ОД до максимальної дози 80 ОД). Якщо необхідно ввести дозу, що перевищує 80 ОД, потрібно ввести 2 або більше ін’єкцій.
A. Перевірити, щоб дозувальне віконце показувало «0» після завершення випробування тесту на безпеку.
B. Вибрати необхідну дозу (на нижченаведеному прикладі обрана доза становить 30 ОД). Якщо встановлено дозу, що перевищує необхідну, слід повернути дозувальний селектор у початкове положення.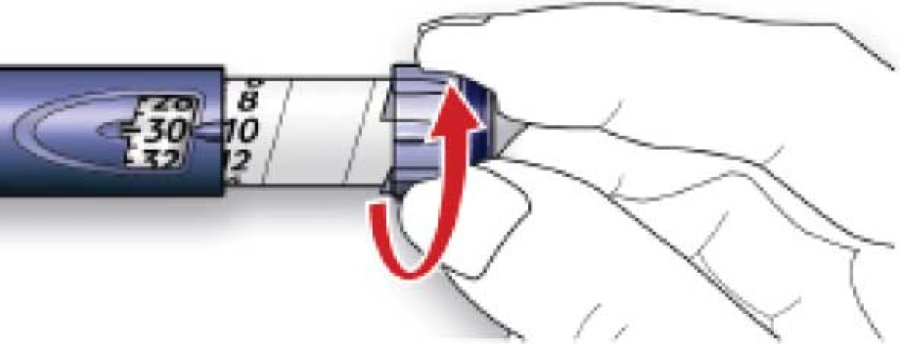
· Не натискати на кнопку введення ін’єкції під час обертання селектора, інакше інсулін витече.
· Не можна повернути дозувальний селектор до числа одиниць, що перевищує кількість, яка залишилася у шприц-ручці. Не слід намагатися силою повернути дозувальний селектор. У цьому випадку слід або ввести залишок інсуліну і доповнити необхідну дозу за допомогою нової шприц-ручки СолоСтар, або використати нову шприц-ручку СолоСтар для введення повної дози.
Стадія 5. Техніка введення ін’єкції.
A. Дотримуватися техніки введення ін’єкції, з якою ознайомив лікар.
B. Ввести голку у шкіру.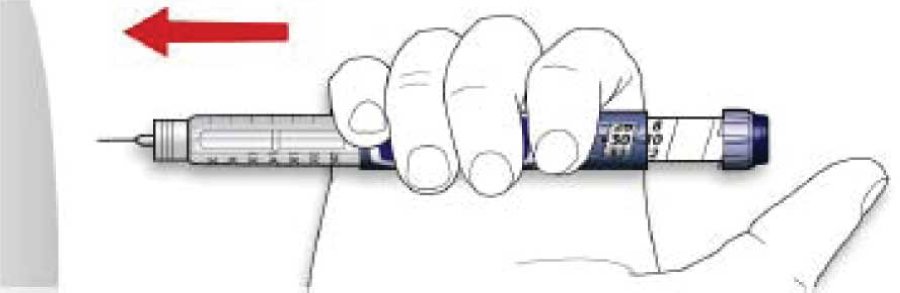
C. Ввести дозу за допомогою натискання на кнопку введення ін’єкції до упору в одному напрямку. Після введення ін’єкції у дозувальному віконці має встановитися «0».
D. Залишити кнопку введення ін’єкції в натиснутому положенні. Повільно рахувати до 10 перед витяганням голки зі шкіри. При цьому забезпечується введення повної дози.
Стадія 6. Видалення та утилізація голки.
У всіх випадках видаляти голку після кожної ін’єкції та зберігати шприц-ручку без прикріпленої голки. Цим забезпечується профілактика:
• забруднення та/або потрапляння інфекції;
• потрапляння повітря в ємність для інсуліну та витікання інсуліну, що може призвести до неправильного дозування.
A. Насадити зовнішній ковпачок голки назад на голку і використовувати його для скручування голки зі шприц-ручки. Необхідно дотримуватися особливої обережності при зніманні та викиданні голки. Для зниження ризику нещасних випадків, пов’язаних із використанням голки, ніколи не насаджувати назад внутрішній ковпачок голки.
• Якщо введення препарату було здійснено іншою особою, спеціальні заходи безпеки при видаленні та утилізації голки вживаються цією ж особою. Слід дотримуватися рекомендованих заходів безпеки для видалення та утилізації голок (наприклад техніки насаджування ковпачка однією рукою) для зниження ризику нещасних випадків, пов’язаних із застосуванням голки, а також перенесення інфекційних захворювань.
B. Обережно викинути голку (згідно з інструкціями лікаря).
C. У всіх випадках слід поміщати ковпачок назад на шприц-ручку та зберігати шприц-ручку до наступної ін’єкції.
Діти. Даних щодо клінічного застосування препарату Епайдра у дітей віком до 6 років недостатньо.
Протипоказання
гіперчутливість до інсуліну глюлізину або будь-якого компонента препарату. Гіпоглікемія.
Побічна дія
найпоширенішою побічною дією інсулінотерапії є гіпоглікемія, що виникає як наслідок застосування вищої дози інсуліну, ніж це потрібно.
Відповідні побічні реакції, продемонстровані під час проведення клінічних досліджень, наводяться нижче за класами систем органів та у порядку зниження частоти виникнення: дуже часто (≥1/10); часто (≥1/100–<1/10); нечасто (≥1/1000–<1/100); рідко (≥1/10 000–<1/1000); дуже рідко (<1/10 000), частота невідома (неможливо розрахувати за наявними даними).
У кожній з груп побічні явища представлено в порядку зниження ступеня їх серйозності.
| Клас органів та систем MedDRA | Дуже часто | Часто | Нечасто | Рідко | Невідомо |
| Метаболічні та аліментарні розлади | Гіпоглікемія | ||||
| Розлади з боку шкіри та підшкірних тканин | Реакції у місці ін’єкції, місцеві реакції гіперчутливості | Ліподистрофія | Амілоїдоз шкіри | ||
| Порушення загального стану та реакції у місці введення | Системні реакції гіперчутливості | ||||
Метаболічні та аліментарні розлади. Симптоми гіпоглікемії, як правило, виникають раптово. Вони включають холодний піт, холодну бліду шкіру, втомлюваність, нервозність або тремор, відчуття неспокою, незвичну втому або слабкість, сплутаність свідомості, порушення концентрації уваги, сонливість, сильне відчуття голоду, порушення зору, головний біль, нудоту та сильне серцебиття. Гіпоглікемія може стати тяжкою і призвести до втрати свідомості та/або судом і спричинити тимчасове або стійке порушення функції головного мозку або навіть стати причиною летального наслідку.
Розлади з боку шкіри та підшкірних тканин. Місцеві реакції гіперчутливості (почервоніння, набряк і свербіж у місці ін’єкції) можливі під час лікування із застосуванням інсуліну. Такі реакції, як правило, є минущими та зазвичай зникають у разі продовження лікування. Розлади шкіри та підшкірної клітковини — ліподистрофія та амілоїдоз шкіри — можуть виникнути на місці ін’єкції та затримувати місцеве всмоктування інсуліну.
Розлади шкіри та підшкірної клітковини можуть виникати у місці ін’єкції як наслідок недотримання рекомендації щодо постійного чергування місць ін’єкції. Постійне чергування місця ін’єкції в межах даної ділянки ін’єкції може допомогти зменшити вираженість або запобігти цим реакціям (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Порушення загального стану та реакції у місці введення. Системні реакції гіперчутливості можуть включати кропив’янку, стиснення у грудях, задишку, алергічний дерматит і свербіж. Тяжкі випадки включають генералізовану алергічну реакцію разом з анафілактичною реакцією, що може загрожувати життю.
Повідомлення про підозрювані побічні реакції після реєстрації лікарського засобу є важливою процедурою. Це дозволяє продовжувати моніторинг співвідношення «користь/ризик» для цього лікарського засобу. Медичних працівників просять повідомляти про всі підозрювані побічні реакції у Державний експертний центр МОЗ України.
Особливості застосування
перехід пацієнта на застосування нового типу або торгової марки повинен відбуватися під ретельним наглядом лікаря. Зміни концентрації, торгової марки препарату (виробника), типу препарату (простий, НПХ, ленте, тривалої дії тощо), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва можуть потребувати зміни дози. Також може виникати необхідність у регулюванні схеми одночасного застосування пероральних антидіабетичних препаратів.
Пацієнтів необхідно попередити про необхідність постійно змінювати місце ін’єкції, щоб знизити ризик розвитку ліподистрофії та амілоїдозу шкіри. Існує потенційний ризик затримки абсорбції інсуліну та погіршення глікемічного контролю після ін’єкцій інсуліну в місцях цих реакцій. Повідомляється, що зміна місця ін’єкції на неуражену ділянку шкіри призводить до гіпоглікемії. Рекомендується проводити моніторинг рівня глюкози в крові після зміни місця введення, і можна врахувати коригування дози антидіабетичних препаратів.
Гіперглікемія. Застосування невідповідних доз або припинення лікування, особливо у хворих на інсулінозалежний діабет, може призвести до розвитку гіперглікемії та діабетичного кетоацидозу − станів, що є потенційно летальними.
Гіпоглікемія. Гіпоглікемія виникає залежно від профілю дії інсулінів, що застосовуються, та може, таким чином, змінюватися при переході на новий режим лікування.
Умови, які можуть зробити ранні попереджувальні симптоми гіпоглікемії нетиповими або менш вираженими, включають значну тривалість захворювання на цукровий діабет, інтенсифікацію інсулінотерапії, діабетичну нейропатію, застосування лікарських препаратів, таких як блокатори β-адренорецепторів, або перехід з інсуліну тваринного походження на інсулін людини. Потреба у корекції дози також може виникнути, якщо пацієнти підвищують режим фізичної активності або змінюють свою звичайну дієту. Фізичні навантаження одразу після їди підвищують ризик розвитку гіпоглікемії. Гіпоглікемія після ін’єкції швидкодіючих аналогів інсуліну, як правило, виникає раніше, ніж при застосуванні розчинного інсуліну людини. Гіпоглікемічні або гіперглікемічні реакції, якщо не надати пацієнту відповідної допомоги, можуть призвести до втрати свідомості, коми або летального наслідку.
Потреба в інсуліні може змінюватися за наявності іншої хвороби або емоційних порушень.
Помилкове введення інших лікарських засобів. Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну глюлізину випадково вводилися інші інсуліни, зокрема інсуліни тривалої дії. Перед кожною ін’єкцією слід перевіряти інформацію на етикетці, щоб уникнути помилкового введення замість інсуліну глюлізину інших інсулінів.
Допоміжні речовини. Одна доза цього лікарського засобу містить менше ніж 1 ммоль (23 мг) натрію, тобто він практично не містить натрію.
Епайдра містить м-крезол, який може спричинити алергічні реакції.
Комбінація препарату Епайдра з піоглітазоном. Про випадки серцевої недостатності повідомлялося при застосуванні піоглітазону в поєднанні з інсуліном, особливо в пацієнтів з ризиком розвитку серцевої недостатності. Це потрібно враховувати при розгляді можливості проведення лікування комбінацією піоглітазону і препарату Епайдра. При застосуванні цієї комбінації пацієнтів потрібно спостерігати щодо появи ознак і симптомів серцевої недостатності, збільшення маси тіла і набряку. При будь-якому погіршенні кардіологічних симптомів застосування піоглітазону потрібно припинити.
Поводження із попередньо наповненою шприц-ручкою СолоСтар. Препарат Епайдра у попередньо наповненій шприц-ручці СолоСтар можна використовувати лише для п/ш ін’єкцій. Якщо необхідне введення препарату за допомогою шприца, в/в ін’єкції або інфузійного насоса, слід використовувати флакон. Перед використанням шприц-ручки СолоСтар слід уважно прочитати інструкцію для застосування. Шприц-ручку СолоСтар потрібно використовувати відповідно до рекомендацій, що містяться у цій інструкції (див. ЗАСТОСУВАННЯ).
Застосування у період вагітності або годування грудьми
Вагітність. Дані щодо застосування інсуліну глюлізину у вагітних відсутні або обмежені (менше ніж 300 результатів вагітності).
У ході досліджень впливу на репродуктивну функцію, проведених на тваринах, не виявлено жодних відмінностей між застосуванням інсуліну глюлізину та інсуліну людини стосовно впливу на вагітність, розвиток ембріона/плода, пологи або постнатальний розвиток.
У вагітних цей препарат слід застосовувати з обережністю. Необхідно ретельно контролювати рівень глюкози.
Пацієнткам з діагностованим або гестаційним цукровим діабетом у період вагітності слід підтримувати належний метаболічний контроль. Потреба організму в інсуліні може зменшуватися в І триместр вагітності та, як правило, збільшуватися в ІІ та ІІІ триместр. Одразу після пологів потреба організму в інсуліні швидко зменшується.
Годування грудьми. Невідомо, чи екскретується інсулін глюлізин у грудне молоко людини, проте зазвичай інсулін не проникає у грудне молоко та не абсорбується після перорального застосування.
Жінкам, які годують грудьми, може бути необхідно скоригувати дозу інсуліну та раціон харчування.
Фертильність. У ході досліджень впливу інсуліну глюлізину на репродуктивну функцію, проведених на тваринах, не виявлено жодних небажаних впливів на фертильність.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Здатність пацієнта концентрувати увагу та його реакція можуть порушуватися унаслідок розвитку гіпоглікемії або гіперглікемії або, наприклад, у результаті порушення зору. Це може становити ризик у ситуаціях, коли наявність таких симптомів є особливо важливою (зокрема, під час керування автомобілем або іншими механізмами).
Пацієнтам слід рекомендувати дотримуватися обережності та запобігати розвитку гіпоглікемії під час керування транспортними засобами. Це особливо важливо для тих пацієнтів, у яких симптоми — провісники гіпоглікемії є слабко вираженими або взагалі відсутні, і для тих хворих, у кого часто виникають епізоди гіпоглікемії. За цих обставин слід розглянути доцільність керування транспортними засобами.
Взаємодія з іншими лікарськими засобами
дослідження щодо типів фармакокінетичних взаємодій не проводилися. З огляду на емпіричні знання стосовно інших подібних лікарських засобів, прояв клінічно релевантних фармакокінетичних взаємодій є малоймовірним.
На метаболізм глюкози впливає цілий ряд речовин і лікарських препаратів. Отже, це може потребувати корекції дози інсуліну глюлізину та особливо ретельного нагляду за станом хворого.
До речовин, що можуть посилити глюкозознижувальну активність та збільшити схильність до виникнення гіпоглікемії, належать пероральні антидіабетичні засоби, інгібітори АПФ, дизопірамід, фібрати, флуоксетин, інгібітори МАО, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні антибіотики.
Речовини, що можуть знижувати цукрознижувальний ефект інсуліну: кортикостероїди, даназол, діазоксид, діуретики, глюкагон, ізоніазид, похідні фенотіазину, соматропін, симпатоміметичні засоби (такі як епінефрин (адреналін), сальбутамол, тербуталін), тиреоїдні гормони, естрогени, прогестини (наприклад у складі пероральних контрацептивів), інгібітори протеаз та атипові антипсихотичні лікарські засоби (зокрема оланзапін і клозапін).
Блокатори β-адренорецепторів, клонідин, солі літію або алкоголь можуть призвести як до підвищення, так і до зниження властивості інсуліну знижувати рівень глюкози в крові. Пентамідин може спричинювати розвиток гіпоглікемії, що іноді супроводжується гіперглікемією.
Крім того, під впливом симпатолітичних лікарських засобів, таких як клонідин, гуанетидин, резерпін, і блокаторів β-адренорецепторів ознаки адренергічного зворотного регулювання можуть бути ослаблені або навіть відсутні.
Передозування
гіпоглікемія може виникати як наслідок надмірної дії інсуліну відносно об’єму прийнятої їжі та витрат енергії.
Специфічні дані щодо передозування інсуліну глюлізину відсутні. Проте гіпоглікемія може розвинутися поступово.
Легкі гіпоглікемічні епізоди можна усувати шляхом перорального застосування глюкози або продуктів харчування з високим вмістом цукру. Тому хворому на цукровий діабет рекомендується постійно мати при собі кілька шматочків цукру, цукерок, печиво або фруктовий сік з цукром.
Цукрозамінники не можна застосовувати для лікування гіпоглікемічних станів.
Тяжкі гіпоглікемічні епізоди, при яких пацієнт втрачає свідомість, можна усунути за допомогою введення глюкагону (0,5–1 мг) в/м або п/ш, що може зробити відповідним чином проінструктована особа, або за допомогою в/в введення глюкози, що повинен виконати медичний працівник. Глюкозу вводять в/в також у разі, якщо стан пацієнта не покращується протягом 10–15 хв після введення глюкагону.
Коли хворий опритомніє, рекомендується застосування вуглеводів перорально з метою запобігання рецидиву гіпоглікемії.
Після ін’єкції глюкагону пацієнта слід обстежити в лікарні для виявлення причини виникнення тяжкої гіпоглікемії та запобігання виникненню подібних нападів.
Умови зберігання
зберігати у недоступному для дітей місці.
Зберігати у холодильнику при температурі від 2–8 °С. Не заморожувати. Зберігати шприц-ручку у зовнішній картонній упаковці з метою захисту від дії світла.
Не допускати контакту зі стінками холодильника.
Умови зберігання під час користування. Після початку застосування шприц-ручку (з насадженим ковпачком) необхідно використати протягом 4 тиж. Шприц-ручку, яка знаходиться у використанні, не слід зберігати в холодильнику. Зберігати при температурі не вище 25 °С у зовнішній картонній упаковці з метою захисту від дії світла. Після кожної ін’єкції на шприц-ручку слід знову надівати ковпачок з метою захисту від світла. Перед першим використанням шприц-ручку необхідно зберігати при кімнатній температурі протягом 1–2 год. Термін придатності після першого застосування — 4 тиж.