Ферменты — специфические белки, ускоряющие множество взаимосвязанных химических реакций, протекающих в организме. Эти биологические катализаторы проявляют свое действие в ничтожно малых концентрациях. Скорость ферментативных реакций в миллионы раз быстрее, чем в присутствии лучших неорганических катализаторов. Ферментам присущ ряд характерных свойств. Первое — это мощное каталитическое действие, о силе которого свидетельствует такой пример: 1 г фермента пепсина желудочного сока переваривает за 2 ч около 50 кг денатурированного белка. Такое расщепление белка могло бы произойти и под действием неорганического катализатора — хлористоводородной (соляной) кислоты, но эта реакция протекала бы во много раз медленнее, чем в присутствии фермента. Второе важное свойство ферментов — специфичность действия в соответствии с типом химической реакции и происхождением субстрата. Например, протеолитические ферменты гидролизируют только белки, точнее, пептидные связи в их молекулах, но не действуют на углеводы и жиры. Липазы — ферменты, расщепляющие жиры, но не белки и углеводы. Этот тип специфичности получил название относительной. Абсолютная специфичность проявляется в способности фермента действовать только на одно вещество, примером может служить уреаза, которая катализирует гидролиз мочевины с образованием аммиака и углекислоты.
Ферменты весьма чувствительны к изменению концентрации водородных ионов. Имеется определенное оптимальное значение рН, при котором они наиболее активны. Кроме того, скорость ферментативной реакции зависит от температуры: она ускоряется при повышении температуры на 10 °С примерно в два раза (в пределах 10–37 °С). При 50 °С и выше скорость реакции замедляется вследствие денатурации белка фермента. На активность ферментов большое влияние оказывают также их ингибиторы как неорганические, так и органические, присутствующие в тканях и крови. Для деятельности некоторых ферментов необходимы активаторы (сульфгидрильные соединения, ионы металлов и др.).
Не останавливаясь на существующих теориях механизма действия ферментов, укажем лишь, что биокатализаторы снижают энергию активации реакции, в которой они участвуют, т.е. ферментативная реакция происходит на более низком энергетическом уровне. Ферменты не являются источником энергии и поэтому вызывают лишь те превращения, которые могли бы осуществляться самопроизвольно.
Международной комиссией по ферментам разработаны классификация и номенклатура ферментов, которые были утверждены на V Международном биохимическом конгрессе (Москва, 1961 г.). Согласно этой классификации ферменты подразделяются на 6 главных классов, каждый из которых в свою очередь делится на подклассы и подподклассы. Фермент имеет номер, состоящий из 4 цифр, разделенных точками. Первая цифра указывает на номер одного из 6 классов ферментов, вторая — на подкласс, третья — на подподкласс, четвертая — на порядковый номер фермента. В основу принятой классификации положен тип катализируемой реакции, специфической для данного фермента.
Основные классы ферментов: оксидоредуктазы — катализируют окислительно-восстановительные реакции; трансферазы — катализируют реакции переноса различных химических групп; гидролазы — катализируют реакции гидролиза субстратов при участии молекул воды; лиазы — катализируют негидролитическое отщепление от молекул групп атомов с образованием двойных связей; изомеразы — катализируют реакции изомеризации разных типов; лигазы (синтетазы) — катализируют синтез органических веществ с использованием энергии распада АТФ или аналогичного трифосфата.
Протеолитические ферменты — основные составные части вобэнзимных препаратов, согласно номенклатуре ферментов, относятся к классу гидролаз (3), подклассу пептидгидролаз (3.4), подподклассу пептидил-пептидгидролаз (3.4.21). Они расщепляют в белках преимущественно внутренние пептидные связи.
Биохимия протеолитических ферментов, входящих в состав препаратов СЭТ (К.Н. Веремеенко)
Кратко рассмотрим биохимию ферментов протеолитического действия животного и растительного происхождения, входящих в состав препаратов СЭТ. В табл. 1 приведены сведения о составе препаратов вобэнзим, флогэнзим, вобэ-мугос Е.
В состав препарата вобэнзим входят протеолитические ферменты животного происхождения — химотрипсин, трипсин, панкреатин (смесь трипсина и амилазы), амилаза и липаза, а также растительного — папаин и бромелаин. Флогэнзим содержит трипсин и бромелаин, а вобэ-мугос Е — трипсин, химотрипсин и папаин.
Трипсин и химотрипсин относят к сериновым протеиназам, поскольку в активном центре их молекул содержится серин, а папаин и бромелаин — к тиоловым (цистеиновым) протеиназам, так как в их активном центре имеется сульфгидрильная группа.
Протеиназы животного происхождения
Секрет панкреатического сока содержит гидролитические ферменты, расщепляющие различные субстраты — белки, углеводы, жиры. 72% общего количества белков панкреатического сока составляют протеолитические ферменты и их предшественники. Среди них большой удельный вес имеют неактивные предшественники трипсина и химотрипсина — трипсиноген и химотрипсиногены А, В, С [24].
Трипсиноген и трипсин. Трипсин (КФ 3.4.21.4)* синтезируется ацинозными клетками поджелудочной железы в форме предшественника — трипсиногена (зимогена), лишенного ферментативной активности. Активация зимогена в естественных условиях происходит в двенадцатиперстной кишке под действием энтерокиназы кишечного сока. Превращение трипсиногена в активный фермент может осуществляться аутокаталитически под действием трипсина или других протеолитических ферментов (аспергиллопептидазы А). Во время активации посредством ограниченного протеолиза в N-конце молекулы зимогена расщепляется единственная пептидная связь Лиз-Изолей с освобождением гексапептида. Такая высокая избирательность гидролиза объясняется наличием в N-терминальном конце 4 рядом расположенных остатков аспарагиновой кислоты с отрицательным зарядом, которые имеются в структуре до первого дисульфидного моста. Благодаря электростатическому отталкиванию 4 основных анионных групп этот отрезок полипептидной цепи может находиться в растянутом (неспирализованном) состоянии. Развернутая конфигурация в конце полипептидной цепи молекулы профермента может быть причиной высокой чувствительности связи Лиз-Изолей к триптическому гидролизу во время активации зимогена. В спиральной структуре пептидные связи резистентны к действию протеолитических ферментов. После освобождения гексапептида из трипсиногена вначале образуется нестойкая открытая структура, которая затем принимает спиральную конфигурацию. В процессе превращения трипсиногена в трипсин существенную роль играют ионы кальция. В их отсутствие примерно половина потенциально активного белка превращается в инертный и образовывается только половина гексапептида, выявленного в пробах с ионами кальция. Имеющиеся данные свидетельствуют о том, что кальций оказывает специфическое действие, ускоряя гидролиз связи Лиз-Изолей в молекуле трипсиногена и подавляя расщепление других пептидных связей, приводящее к необратимым изменениям и образованию инертного белка. Следует указать на ключевую роль трипсина в активации других зимогенов поджелудочной железы — химотрипсиногенов А, В, С, проэластазы, профосфолипазы А, прокарбоксипептидаз А и В.
*Здесь и далее цифры в скобках обозначают порядковый номер (шифр) фермента в соответствии с предложенной в 1961 г. номенклатурой.
Для медицинских целей применяют трипсин, получаемый из поджелудочной железы крупного рогатого скота и свиней, которая является наиболее богатым источником фермента. По классической прописи Д. Нортропа и соавторов [25], метод получения кристаллического трипсина основан на предварительном выделении из железы неактивного зимогена, который затем подвергается активации. Выход активного трипсина составляет около 50% его общего количества. Повышения количества активного фермента можно добиться добавлением ионов кальция. Более перспективной является методика выделения трипсиногена с помощью хроматографии на Км-целлюлозе. Получаемые препараты превосходят кристаллический трипсин (по методу Кунитца), по потенциальной активности, гомогенности, стабильности и отсутствию примесей химотрипсиногена.
Трипсин представляет собой низкомолекулярный однокомпонентный белок, не содержащий простетической группы. Молекулярная масса трипсина и трипсиногена практически одинакова и составляет 23 800 дальтон. Их изоэлектрическая точка находится при рН 10,5, т.е. фермент является катионом. Наряду с катионным трипсином в поджелудочной железе выявлены анионные формы белка с изоэлектрическими точками, находящимися при более низких значениях рН.
Установлены первичная и третичная структуры трипсина. Его молекула состоит из одной полипептидной цепи, включающей 223 аминокислотных остатка и 6 дисульфидных связей. Трипсиноген и трипсин в кислой среде (рН 2–4) обладают высокой стабильностью. Растворы трипсина сохраняют активность даже при кратковременном кипячении в 0,01 М растворе кислоты. С повышением рН фермент подвергается инактивации, а в щелочной среде необратимо денатурируется. Аутокаталитическая активация трипсиногена предотвращается ингибитором трипсина, присутствующим в поджелудочной железе и поступающим в двенадцатиперстную кишку вместе с проферментом. Ингибитор может также блокировать следовые количества активного трипсина, образующегося во время спонтанной активации, что препятствует преждевременной активации.
Характерной особенностью трипсина является тенденция при физиологическом рН среды подвергаться аутолизу (самоперевариванию) с потерей биологических свойств. Этот процесс, проявляющийся при рН > 5,0, объясняется равновесием между нативной и денатурированной формами трипсина, причем активный фермент переваривает денатурированный. По нашим данным, трипсин в концентрации 1 мг/мл при температуре 35 °С в течение 2 ч теряет около 80% своей исходной активности. Ионы кальция в концентрации 4•10-3 М в значительной степени предохраняют фермент от инактивации. Полагают, что Са++ связывается с нативной формой молекулы фермента, в результате чего равновесие нативный — денатурированный трипсин сдвигается в сторону первого. Не исключено, что стабилизирующий эффект ионов кальция объясняется уменьшением взаимного сродства молекул трипсина, меньшей вероятностью соединения, при котором одна молекула играет роль субстрата, другая — фермента.
Активность трипсина угнетается фосфорорганическими ядами, диизопропилфторфосфатом (ДПФФ), фенилметилсульфонилфторидом (ФМСФ) и др. Инактивация фермента сопровождается блокированием гидроксильной группы серина, что указывает на существенную роль серинового остатка в каталитической функции трипсина. Согласно имеющимся данным, активный центр трипсина включает остатки молекул серина и гистидина, расположенные на различных витках полипептидной спирали в молекуле зимогенов, которые сближаются во время активации. Наличие 6 дисульфидных связей в молекуле трипсина позволяет остаткам молекул серина и гистидина пространственно сблизиться и взаимодействовать. Полагают, что активный центр фермента формируется за счет образования водородной связи между гидроксильной группой серина и азотом неионизированного имидазольного ядра гистидина. Являясь донатором электронов, имидазол облегчает эстерификацию серинового остатка фермента. Промежуточное соединение — ацилфермент — содержит протон в имидазольном ядре и стабилизируется водородной связью. Реакция дезацилирования сопровождается освобождением протона с помощью нуклеофильного агента (последним может быть и азот имидазольной группы). При этом образуется ацилимидазол, который затем гидролизуется в водной среде с освобождением свободного фермента. Наличие рядом с активным серином ионизированного карбоксила аспарагиновой кислоты благодаря их электростатическому действию может снизить стабильность промежуточного комплекса и способствовать отделению продуктов реакции от поверхности фермента. Повышенное сродство трипсина к субстратам, имеющим положительно заряженную группу (производные аргинина и лизина), связано с наличием остатка аспарагиновой кислоты (положение 177), которая входит в состав субстратсвязывающего участка активного центра фермента. Таким образом, в состав активного центра трипсина входят остатки серина, гистидина и аспарагиновой кислоты.
Специфичность трипсина характеризуется преимущественным расщеплением пептидных связей, образованных карбоксильными группами аргинина и лизина, т.е. условием быстрого гидролиза молекулы субстрата является наличие положительного электрического заряда в боковой цепи, причем на определенном расстоянии от расщепляемой связи. Наряду с пептидными фермент расщепляет сложноэфирные и амидные связи, однако при этом гидролизуемая связь также должна быть образована аргинином или лизином со свободными остатками гуанидиновой группы или ε-аминогруппами. Скорость гидролиза сложных эфиров значительно выше, чем таковая соответствующих амидов. Кроме того, трипсин может расщеплять также соединения других аминокислот основного характера — гомоаргинина, орнитина. Присутствие остатков с боковыми цепями кислого характера в непосредственном окружении чувствительной связи снижает скорость триптического гидролиза. По имеющимся данным, трипсин имеет более широкую субстратную специфичность, проявляющуюся расщеплением яичного альбумина, тиреоглобулина. Так, в тиосульфатном производном β-цепи инсулина трипсин гидролизует не только связи аргинина и лизина, но и цистеина. Вместе с тем следует отметить, что из всех пептидил-пептидгидролаз трипсину присуща наиболее узкая специфичность.
Для определения активности трипсина используют белковые и синтетические субстраты. В качестве белковых широко применяют казеин и гемоглобин. О скорости их расщепления судят по количеству продуктов гидролиза белков в трихлоруксусных фильтратах путем измерения оптической плотности растворов при 280 нм. Обычно белки-субстраты подвергают денатурации температурным воздействием, поскольку денатурированный белок легче расщепляется трипсином. Некоторые авторы ранее считали, что трипсин и другие протеиназы вовсе не расщепляют нативный белок, а наблюдаемый гидролиз происходит за счет гидролиза части белка, находящегося в денатурированном состоянии. Они полагали, что первичной реакцией протеиназ является денатурация белка-субстрата, после которой происходит собственно протеолиз.
Впоследствии это мнение оказалось ошибочным и не соответствующим ряду установленных фактов, в частности, факту превращения зимогенов поджелудочной железы в активный фермент. Как уже отмечалось, в основе превращения трипсиногена в трипсин, химотрипсиногенов в химотрипсины лежит процесс ограниченного протеолиза специфических связей в молекуле проферментов, находящихся в нативном состоянии. При этом никакой денатурации не происходит. Из других белков, которые легко гидролизуются трипсином, следует назвать фибриноген. Постденатурационные изменения обычно приводят к уменьшению скорости расщепления белков-субстратов. Таким образом, природные нативные белки, как и денатурированные, в принципе способны расщепляться трипсином. Нативная конфигурация белка более устойчива, чем развернутая структура ее денатурированной формы.
В качестве синтетических субстратов для трипсина наиболее часто применяют N-бензоил-DL-аргинин этиловый эфир (БАЭЭ), метиловый эфир N-тозил-аргинина (ТАМЭ), N-бензоил-DL-аргининамид (БАА), N-бензоил-DL-аргинин-пара-нитроанилид (БАПНА). В последние годы для определения активности трипсина используют более специфические хромогенные субстраты — H-D-глу-глу-арг-пара-нитроанилид (S-2444), бензоил-лей-гли-глу-арг-пара-нитроанилид (S-2222). Из этих субстратов под действием фермента расщепляется паранитроанилидная связь и освобождается хромофор — паранитроанилин желтого цвета, количество которого определяется спектрофотометрически при 405 нм.
Химотрипсин (КФ 3.4.21.1) — протеолитический фермент, продуцируемый клетками экзокринной части поджелудочной железы в виде неактивного предшественника — химотрипсиногена, который активируется в двенадцатиперстной кишке трипсином. В 1933 г. Д. Нортроп и М. Кунитц выделили из кислого экстракта поджелудочной железы быка кристаллический белок химотрипсиноген А, который под действием небольших концентраций трипсина превращался в активный протеолитический фермент — α-химотрипсин. В процессе кристаллизации α-химотрипсина при длительной активации были получены другие формы химотрипсина — β и γ, которые отличались друг от друга формой кристаллов.
В 1947 г. С. Кeith и соавторы [78] из поджелудочной железы крупного рогатого скота выделили новую анионную форму химотрипсиногена, получившую название химотрипсиноген В. Последний отличался от химотрипсиногена А изоэлектрической точкой, находившейся в пределах рН 5,1–5,2. Активация осуществлялась путем добавления 1 части трипсина к 1500 частям химотрипсиногена В. Позднее препараты химотрипсина были получены из поджелудочной железы других животных, в частности свиньи, причем были выделены две анионные формы химотрипсиногена — В и С, которые характеризовались различными физико-химическими свойствами.
Наиболее изученным и широко используемым в медицинской практике в качестве лекарственного средства является α-химотрипсин. Его молекулярная масса составляет около 25 000 дальтон, изоэлектрическая точка находится при рН 9,1–9,5. Фермент наиболее устойчив при рН 3,0. Расшифрована его аминокислотная последовательность и трехмерная структура. Химотрипсин состоит из 245 аминокислотных остатков и 3 полипептидных цепей, соединенных дисульфидными связями. Как и трипсин, химотрипсин в слабощелочной среде подвергается аутолитической инактивации, скорость которой резко возрастает с повышением температуры: при 30 °С она в 30 раз больше, чем при 0–5 °С. Исследование аутолиза при различных рН (7–11) показало, что максимальная инактивация наблюдается при рН 9,1–9,2. Кальция хлорид оказывает стабилизирующее действие на активность химотрипсина. α-Химотрипсин является примером типичного белка, который подвергается обратимой денатурации. Кратковременное нагревание фермента до 100 °С в 0,0025 N HCl приводит к появлению обратимо денатурированного белка. Его выдерживание при температуре 20 °С в течение 10 мин способствует полному восстановлению активности химотрипсина. Однако более длительное нагревание (15–20 мин) сопровождается необратимыми изменениями в молекуле фермента.
Превращение химотрипсиногенов в химотрипсины осуществляется путем расщепления пептидной связи Арг-Изолей (15–16) в молекуле зимогена трипсином, в результате чего образуется активный фермент. Отщепляющийся при этом N-концевой 15-членный пептид остается связанным с остальной частью молекулы дисульфидным мостиком. Расщепляемые связи, по-видимому, расположены в развернутом участке молекулы белка и поэтому могут легко «атаковаться» активирующим ферментом. В условиях активации химотрипсиногена (метод Кунитца) небольшими количествами трипсина (10 000:1) α-химотрипсин образуется в течение 48 ч. Описана активация химотрипсиногена более высокими концентрациями трипсина (70:1), которая завершалась за 1–2 ч. Изучение кинетики активации показало, что вначале химотрипсиноген вследствие гидролиза одной пептидной связи трипсином превращается в π-химотрипсин, который затем в зависимости от добавленного трипсина может превратиться в две формы фермента. При быстрой активации расщепляется еще одна пептидная связь и образуется δ-химотрипсин. В условиях медленной активации расщепляются 2–4 пептидные связи в молекуле π-химотрипсина и образуется α-химотрипсин.
Итак, расщепление трипсином одной «стратегической» связи в химотрипсиногене, как и в трипсиногене, приводит к образованию биологически активных ферментов с более выраженной спирализованной конфигурацией белка. По-видимому, из-за стерических препятствий в макроструктуре белка не могут гидролизоваться другие потенциально чувствительные пептидные связи.
В настоящее время расшифровано строение активного центра в молекуле химотрипсина. Этому во многом способствовало применение специфических ингибиторов, избирательно блокирующих определенные группы в активном центре ферментов. Среди них наиболее эффективны фосфорорганические соединения, такие, как ДПФФ, диэтил-пара-нитрофенилфосфат (ДПНФФ) и др. Ингибиторы образуют с ферментом прочное соединение, которое содержит один остаток связанного ингибитора на молекулу химотрипсина. Неактивный зимоген — химотрипсиноген А — не образует комплекса с ДПФФ, что свидетельствует о том, что ингибитор взаимодействует лишь с активным центром фермента. Последний содержит имидазольные группы гистидина, гидроксильные группы серина и аспарагиновую кислоту. Следует отметить гомологию первичной структуры трипсина и -химотрипсина в участках активного центра, а также наличие большого количества одинаковых или сходных ди- и тетрапептидных структур.
Опыты с синтетическими субстратами показали, что в течении каталитических реакций различают несколько стадий. Вначале образуется ферментсубстратный комплекс, затем субстрат расщепляется с одновременным ацилированием фермента, далее ацилфермент гидролизуется, происходят регенерация фермента и освобождение ацильной группы (дезацилирование).
Химотрипсин в отличие от трипсина характеризуется широкой субстратной специфичностью, расщепляя пептидные связи, образованные различными аминокислотными остатками. С максимальной скоростью фермент гидролизует связи, образованные карбоксильными группами ароматических аминокислот — тирозина, фенилаланина, триптофана, а также лейцина и метионина. Аналогично трипсину химотрипсин обладает амидазной и эстеразной активностью, причем сложные эфиры гидролизуются им значительно быстрее, чем амиды. Химотрипсины В и С имеют такую же специфичность при расщеплении синтетических субстратов, как и химотрипсин А, но ее диапазон несколько шире при действии на белки.
Представление о специфичности протеиназ поджелудочной железы, сложившееся в результате изучения их действия на синтетические субстраты, не может объяснить более широкую специфичность химотрипсина и трипсина, которая проявляется при гидролизе ими естественных белковых субстратов. Это свидетельствует о том, что гидролиз пептидных связей в белках зависит не только от специфических аминокислотных остатков, но и от их последовательности на протяжении более значительного участка цепи, включающего расщепляемую связь.
Для определения активности химотрипсина используют методы с применением белковых и синтетических субстратов. В качестве белковых наиболее часто применяют гемоглобин, казеин, сывороточный и яичный альбумины, которые предварительно подвергают денатурации путем прогревания или обработки мочевиной. Наиболее широкое распространение получил гемоглобиновый метод Ансона и казеиновый Кунитца. С помощью этих методов обычно определяют удельную активность фермента (в расчете на 1 мг белка). Методы определения активности химотрипсина с использованием синтетических субстратов отличаются специфичностью и поэтому находят все более широкое применение. В качестве субстратов используют амиды и сложные эфиры: этиловый эфир ацетил-L-тирозина, этиловый эфир бензоил-L-тирозина, пара-нитрофенильный эфир N-карбобензокси-L-тирозин, ацетил-L-фенил-аланин-оксамид и др. Необходимо отметить, что химотрипсин в отличие от трипсина свертывает молоко. Нами предложена простая качественная проба, позволяющая отличить трипсин от химотрипсина с использованием щелочного белка протамина сульфата [8]. Этот субстрат в определенных условиях практически не расщепляется кристаллическим химотрипсином и быстро гидролизуется небольшими концентрациями трипсина.
Протеиназы растительного происхождения
Богатыми источниками протеолитических ферментов являются соки плодов тропических растений, таких, как дынное дерево, представители семейства тутовых, бромелиевых и др. Так, жидкая часть млечного сока растения Ficus carica содержит 10–17,5% белков, 90% которых обладают протеолитической активностью. Поэтому они могут служить сырьем для получения из них очищенных ферментных препаратов.
Для получения коммерческих препаратов папаина используют латекс из дынного дерева (Carica papaya), а протеиназы под названием «бромелаин» выделяют из сока ананаса (Ananas comosus). Эти две группы ферментов, составляющие семейство папаиноподобных протеиназ, входят в состав полиэнзимных препаратов, используемых для перорального введения.
Приводим краткие сведения о биохимических свойствах папаина и бромелаина. Более подробно они описаны в монографии В.В. Мосолова [24].
Папаин (КФ 3.4.22.2) — протеолитический фермент, присутствующий в соке дынного дерева. Такое название дали протеиназе в конце XIX века Вюртц и Бошут. Оно сохранилось и сейчас для обозначения препаратов, полученных из латекса. Папаин содержится во всех частях дынного дерева, но наиболее богатым источником являются зеленые плоды, под кожурой которых расположены млечные сосуды, заполненные латексом. При разрезе плодов млечный сок выделяется и коагулирует. Высушенный и измельченный концентрат латекса поступает в продажу под названием «папаин».
В дальнейшем было установлено, что коммерческие препараты папаина представляют собой протеолитический комплекс, содержащий кроме папаина, выделенного в 1937 г. в кристаллическом виде, и другие протеолитические ферменты, обозначенные как химопапаин А и В, а также пептидазы А и В. Позднее эти формы фермента были получены в очищенном виде, показаны различия в их специфичности. Недавно из высушенного латекса с помощью метода хроматографии на СН-сефарозе выделена новая цистеиновая протеиназа — протеиназа IV, отличающаяся от химопапаина иммунологическими свойствами [50]. В 1986 г. в Институте биохимии Российской АН получен комплексный препарат протеолитических ферментов из млечного сока дынного дерева, выращенного в условиях Черноморского побережья Кавказа [22]. Препарат стабилен в зоне рН 4,0–9,0 и сохраняет около 60% активности при его инкубации при 70 °С в течение 30 мин. По своим свойствам он близок к препаратам, полученным из дынного дерева, выращенного в других регионах мира. Устойчивость к высоким температурам, глубина гидролиза белков указывают на возможность использования этого сырья для получения из него лекарственных препаратов папаина.
Молекула папаина состоит из одной полипептидной цепи, включающей 212 аминокислотных остатков с N-концевым изолейцином и С-концевым аспарагином [6]. Единственная сульфгидрильная группа цистеина, от которой зависит активность фермента, находится в положении 25. С помощью рентгеноструктурного анализа установлена трехмерная структура белка. Молекулярная масса его составляет 20 700 дальтон, изоэлектрическая точка находится в щелочной зоне рН 9,0. Папаин обладает высокой устойчивостью к денатурирующим воздействиям: он сохраняет активность в нейтральной и слабощелочной средах, но необратимо инактивируется при кислых значениях рН. Быстрая потеря активности отмечена при рН < 4,5. Папаин стабилен к воздействию температуры и мочевины. Его активность сохраняется в 9 М растворе мочевины. Как и другие протеиназы, папаин теряет активность в процессе самопереваривания в присутствии инактиваторов. Кристаллический папаин обладает слабой активностью в отсутствие активаторов.
В качестве активатора используют вещества, обладающие восстановительными свойствами, — цистеин, глютатион, тиогликолевую кислоту. Максимальная активность фермента проявляется в присутствии восстановителей и веществ, способных связывать ионы металлов, и обычно достигается через 5–10 мин. С этой целью применяют смесь цистеина (0,005 М) с этилендиаминтетрауксусной кислотой (0,002 М). Обработка окислителями вызывает инактивацию фермента. К ним относятся йодацетат, йодацетамид, пара-хлормеркурибензоат, цистин, специфически реагирующие с сульфгидрильными группами. Эти данные свидетельствуют о том, что папаин является SH-ферментом. Активированный папаин содержит от 0,5 до 1,0 моля SH-групп. Отмечена корреляция между содержанием тиоловых групп в молекуле папаина и активностью фермента.
Механизм действия папаина включает образование промежуточных продуктов — тиоловых эфиров. Полагают, что цистеин в положении 25 образует в активном ферменте водородную связь с основной формой гистидина в положении 159, причем эти остатки аминокислот находятся в кислой форме. Гистидин в процессе ферментативной реакции протонирует карбонильный кислород гидролизуемой связи, а цистеин отдает протон отщепляемой группе молекулы субстрата, «атакуя» карбонильный углерод субстрата с образованием тиолового эфира.
Папаин обладает широкой специфичностью по отношению к белковым субстратам; он может использоваться для расщепления пептидов, которые образуются в результате триптического и химотриптического гидролиза. В белках фермент гидролизует практически любые пептидные связи, за исключением пролина и глютаминовой кислоты с диссоциированной карбонильной группой. Предпочтительнее папаин гидролизует пептидные связи, образованные глицином, лейцином, изолейцином, тирозином, фенилаланином и др. [24]. В синтетических субстратах быстрее гидролизуются пептидные связи, образованные карбоксильными группами аргинина, лизина с замещенными α-аминными группами. Медленнее расщепляются производные кислых и нейтральных аминокислот с алифатическими и ароматическими боковыми цепями. Дипептиды с незамещенными α-аминными или карбоксильными группами слабо гидролизуются или совсем не гидролизуются папаином. Кроме пептидных связей фермент способен расщеплять амиды и сложные эфиры. Из этих субстратов наиболее чувствительными являются эфиры и амиды N-бензоил-L-аргинина. Этиловые эфиры N-ацетил-L-тирозина, N-бензоил-L-тирозина устойчивы к действию папаина.
Следует отметить, что специфичность папаина при гидролизе белков и высокомолекулярных пептидов может отличаться от таковой в опытах с низкомолекулярными субстратами. Эти различия обусловлены действием аминокислотных остатков, расположенных в молекуле субстрата на определенном расстоянии от гидролизуемой связи, а также конформационным состоянием молекулы субстрата. Папаин, как и другие пептидгидролазы, расщепляет денатурированные белки с большей скоростью, чем нативные.
Характерным свойством папаина является его способность свертывать молоко и переваривать кишечных гельминтов, устойчивых к действию протеиназ пищеварительного тракта.
Папаин обладает высокой протеолитической активностью в широком интервале рН. Оптимальное значение рН для гидролиза им гемоглобина, казеина, бычьего и сывороточного альбумина находится в пределах 7,2–10,0. При значении рН 5,0–7,5 происходит оптимальное расщепление папаином одного из лучших синтетических субстратов — N-бензоил-L-аргинин амида.
Недавно предложены высокочувствительные субстраты, которые позволяют определить активность папаина и бромелаина не только в свободном виде, но и в присутствии избытка ингибиторов сыворотки крови [63].
Бромелаин. Такое название было предложено в 1957 г. Heinike, Gortner [24] для протеолитических ферментов семейства бромелиевых, выделенных из сока плодов ананаса. Как оказалось, активный фермент содержался не только в плодах, но и в других частях растения. Коммерческие препараты бромелаина гетерогенны и содержат по крайней мере четыре различные цистеиновые протеиназы, которые очищены методом аффинной хроматографии [100].
Наиболее изученная протеиназа, выделенная из сока стеблей ананаса, была названа бромелаином из стеблей (stem bromelain), а фермент, полученный из плодов, — бромелаином из плодов ананаса (fruit bromelain). Согласно номенклатуре, оба фермента имеют одинаковый шифр — КФ 3.4.22.4. Кроме того, из стеблей получены еще две протеиназы — ананаин и комосаин, отличающиеся друг от друга иммунологическими свойствами. Из Bromelia pinguin выделена протеиназа пингвинанин, который во многом похож на бромелаин.
Обычно бромелаин для изготовления лекарственных препаратов получают из стеблей ананаса, что обусловлено трудностью хранения плодов — источника фермента.
В Институте биохимии Российской АН проведены исследования, показавшие наличие активного протеолитического фермента в пролиферирующих верхушках плода ананаса [130]. Выделенный фермент расщеплял как белковые субстраты — казеин, азоказеин, азокол, так и синтетические — БАПНА. Методом изоэлектрического фокусирования обнаружены две активные формы протеиназы, отличающиеся изоэлектрической точкой. Одна из них обладает кислыми свойствами, ее изоэлектрическая точка равна 4,15, другая — представляет собой катионную форму с изоэлектрической точкой 9,7, которая является основным компонентом бромелаина и по своим свойствам напоминает бромелаин из стеблей ананаса. Охарактеризованы физико-химические и биохимические свойства щелочной протеиназы. Фермент входит в группу цистеиновых протеиназ с молекулярной массой 21 000 дальтон. Его молекула содержит одну SH-группу в составе активного центра. Фермент проявляет высокую активность при наличии активаторов — цистеина, дитиотрейтола и инактивируется веществами, связывающими SH-группы — йодацетамидом, пара-хлормеркурибензоатом. Оптимальная ферментативная активность при гидролизе казеина отмечается при рН 8,0, при расщеплении синтетического хромогенного субстрата БАПНА — при рН 9,0. Фермент, как и препараты бромелаина из стеблей и плодов ананаса, стабилен при комнатной температуре в течение 4 ч и при рН 5,0–10,0. Подобно папаину выделенная протеиназа обладает высокой молокосвертывающей активностью, что может иметь практическое значение при замене сычужного фермента ренина в производстве сыра. Все полученные до сих пор бромелаины являются сульфгидрильными протеиназами, активируются в присутствии цистеина и угнетаются агентами, специфически блокирующими группы цистеина.
Бромелаины представляют собой гликопротеины, молекула которых состоит из одной полипептидной цепи, соединенной пятью дисульфидными связями. Энзимы, полученные из стеблей или плодов ананаса, отличаются содержанием основных аминокислот. Бромелаин, полученный из плодов, обладает кислыми свойствами, его изоэлектрическая точка находится при рН 4,6. Бромелаин, полученный из стеблей, обладает щелочными свойствами, его изоэлектрическая точка находится при рН 9,55. Он характеризуется меньшей активностью (по сравнению с ферментом, полученным из плодов), по отношению как к белковым, так и синтетическим субстратам. Очищенный бромелаин из стеблей ананаса гидролизует ряд синтетических низкомолекулярных субстратов, причем с наибольшей скоростью производные аргинина. Однако в отличие от папаина фермент активнее расщепляет БАЭЭ, чем соответствующий амид. Согласно нашим данным, низкомолекулярный аргининсодержащий белок — протамина сульфат — является весьма чувствительным субстратом для бромелаина: скорость расщепления его ферментом на один порядок выше, чем казеина [17].
Таким образом, тропические растения — папайя и ананас — являются богатыми источниками протеолитических ферментов с широкой субстратной специфичностью, что обусловило их использование для получения лекарственных препаратов и включения в полиэнзимные комбинации, применяемые для СЭТ.
Белковые ингибиторы плазмы крови — регуляторы активности протеолитических ферментов (К.Н. Веремеенко)
Широкий спектр биологического действия протеолитических ферментов, высокая активность последних по отношению к белковым субстратам требуют сложных механизмов их регуляции в организме. Важнейшим звеном контроля протеолиза является наличие в крови и тканях специфических белков — ингибиторов, обладающих способностью образовывать с протеиназами комплексы, в составе которых фермент полностью или частично утрачивает каталитическую функцию. Ингибиторы можно рассматривать как компоненты универсальной системы, предохраняющие организм от избыточного протеолиза.
Наиболее полно изучены ингибиторы протеиназ плазмы крови, которые по количеству составляют третью группу функционально активных белков после альбуминов и иммуноглобулинов — примерно 10% общего содержания белков плазмы крови.
В настоящее время известно свыше 10 белковых ингибиторов, содержащихся в плазме крови [113]. Они охарактеризованы, выяснены механизмы их взаимодействия с протеиназами, разработаны методы определения их активности. К данной группе регуляторных белков проявили большой интерес врачи, биохимики, иммунологи, патофизиологи.
В табл. 2 представлены некоторые данные об основных ингибиторах плазмы крови. Относительная молекулярная масса ингибиторов варьирует от 55 000 до 720 000 дальтон, содержание в плазме (сыворотке) крови колеблется от 0,07 до 2 г/л, а молярное — от 1 до 36 мкмоль/л. В состав всех ингибиторов входят углеводы (7,7–34%).
В опытах in vitro каждый из ингибиторов подавляет активность нескольких протеиназ, однако в организме человека большинство из них проявляет более высокую избирательность действия в отношении определенного фермента. Эффективность ингибиторов зависит от ряда факторов: а) относительной концентрации ингибитора и фермента; б) скорости взаимодействия фермента с ингибитором (константа ассоциации); в) стабильности образовавшегося комплекса протеиназы с ингибитором; г) скорости удаления комплекса фермент — ингибитор из организма.
Наибольшую группу ингибиторов плазмы крови составляет семейство серпинов — ингибиторов сериновых протеиназ, в активном центре которых находится серин (α1ИП, АТІІІ, α2АП, α1АХ). Механизм их действия заключается в том, что ингибитор является высокоспецифическим субстратом — мишенью для фермента, подвергаясь ограниченному протеолизу. Поверхность молекул серпинов имеет специфическую структуру — «петлю связывания», в которой находится расщепляемая пептидная связь, образующая активный центр ингибитора. Структура этой петли комплементарна участку активного центра фермента. В процессе образования комплекса активные центры протеиназы и ингибитора взаимодействуют.
Особое положение среди ингибиторов протеолитических ферментов занимает высокомолекулярный гликопротеин — α2М. В реакции взаимодействия с этим белком каталитический центр ферментов не принимает непосредственного участия, оставаясь свободным, но из-за стерических препятствий он недоступен для многих высокомолекулярных белков. Уникальное взаимодействие α2М с протеиназами широкого спектра действия обеспечивает образование стабильного комплекса с ограниченными ферментативными функциями (подробнее см. с. 43).
Рассмотрим биохимические свойства 4 основных плазменных (сывороточных) ингибиторов — α1ИП, α2АП, АТIII, α2М, участвующих в регуляции активности основных протеиназ, определение которых может быть использовано в качестве критериев эффективности СЭТ.
α1-Ингибитор протеиназ (α1ИП) является важной составной частью антипротеолитического потенциала плазмы крови. Это наиболее изученный белок семейства серпинов, угнетающих активность сериновых протеиназ. Его концентрация в плазме крови (36 мкмоль/л) выше суммы всех остальных антипротеиназ плазмы крови.
α1ИП представляет собой гликопротеид, относящийся к α1-глобулинам плазмы, составляет основную часть этой фракции. Он имеет небольшую молекулярную массу (55 000 дальтон), благодаря чему может легко проникать в кровь и распределяться во внесосудистом пространстве. Ранее он был известен под названием «α1-антитрипсин», так как на его долю приходится 90% суммарной антитрипсиновой активности плазмы крови. Как выяснилось позднее, этот ингибитор обладает широким спектром действия, тормозя активность многих сериновых протеолитических ферментов, поэтому его стали называть α1-ингибитором протеиназ. Основной мишенью его действия в организме является нейтрофильная эластаза. Физиологическая роль α1ИП заключается в контроле активности этого фермента — высокоактивной сериновой протеиназы, локализованной в азурофильных гранулах нейтрофильных полиморфноядерных гранулоцитов. При дегрануляции или гибели нейтрофильных гранулоцитов освобождается эластаза, которая расщепляет большинство компонентов соединительнотканного матрикса, в том числе компоненты межклеточного вещества соединительной ткани — коллаген, эластин и протеогликаны, а также белки плазмы крови: факторы свертывания крови, фибринолиза, компоненты комплемента, транспортные белки, иммуноглобулины. Высокая концентрация эластазы в гранулах нейтрофильных гранулоцитов требует эффективного механизма ее контроля, который достигается в основном с помощью α1ИП.
Полностью расшифрована первичная структура α1ИП [52]. Его молекула состоит из 394 аминокислотных остатков и содержит 12% углеводов. Ингибитор представляет собой одноцепочечный белок, в N-конце которого находится глутаминовая кислота, а в С-конце — лизин. В молекуле 1ИП имеется 30% спиральных и 40% β-структур. α1ИП синтезируется клетками печени, а также моноцитами крови и альвеолярными макрофагами. Его синтез контролируется геном, локализованным в 14-й хромосоме, состоящей из 7 эксонов и 6 интронов [71]. В активном центре молекулы ингибитора находится метионин, что доказано его чувствительностью к окислителям. Белок кодируется двумя независимыми аллелями в одном локусе, и наследование происходит кодоминантным путем.
α1ИП — лабильный белок: при температуре 70 °С в течение 10 мин его активность снижается на 90%, а при pH < 5 и рН > 10,5 он полностью инактивируется.
α1ИП взаимодействует со многими сериновыми протеиназами, но с различной скоростью, которая уменьшается в таком порядке: лейкоцитарная эластаза > химотрипсин > катепсин G > трипсин > плазмин > тромбин. Таким образом, наиболее высокая константа ассоциации α1ИП с нейтральной эластазой и первичная функция ингибитора в организме заключаются в торможении активности именно этого фермента.
Связывание α1ИП с сериновыми протеиназами осуществляется путем протеолитической атаки фермента на ингибитор как на субстрат. Образование комплекса ингибитора с эластазой сопровождается расщеплением в молекуле α1ИП пептидной связи Мет358 — Сер359.
α1ИП — гетерогенен, он представлен системой белков, которые обозначены как Рi. Описано более 70 фенотипов, которые отличаются изоэлектрической точкой и идентифицируются методом изоэлектрофокусирования и анализа последовательности ДНК-кодирующих эксонов [94]. Варианты α1ИП при изоэлектрофокусировании в градиенте рН (4,4–4,9), равном 0,5, занимают в полиакриламидном геле строго определенное положение по отношению к аллелю М и обозначены буквами латинского алфавита в направлении их движения от катода к аноду: РiF — быстрый, РiS — медленный, РiZ — очень медленный. Среди населения Европы семейство аллеля М встречается наиболее часто — у 86–99% от общего количества населения, т.е. составляет основную часть генофонда. Аллель М разделяется на субаллели — М1, М2, М3, М4. Другие разновидности встречаются реже, их частота варьирует среди населения Европы и США.
Для клиники важное значение имеет выявление редких аллелей РiZ и РiS, при которых синтезируется пониженное количество ингибитора [52]. Так, при наличии аллеля Z в гомозиготной форме — РiZZ — в сыворотке крови его содержание снижается до 15–20%, а при фенотипе РiS — до 60% по сравнению с таковыми варианта М1М1, условно принятого за 100%. Редкие аллели чаще встречаются у населения Скандинавских стран и белого населения США (1:1600 и 1:5000 соответственно). Показаны географические различия и в частоте генов. Так, среди 200 000 новорожденных в Швеции частота фенотипа α1ИПZZ составляет 1:1600, а в США среди 107 000 обследованных — 1:4100 [99]. По сравнению с другими наследственными заболеваниями это очень высокие показатели: фенилкетонурия встречается в одном случае на 10 000 населения, а галактоземия — в одном случае на 100 000 населения. Отмечены также различия в частоте выявления этого фенотипа ингибитора в разных регионах одной и той же страны.
У людей, достигших преклонного возраста, чаще обнаруживают гомозиготные формы α1ИП — М1М1, чем гетерозиготные — М1М2; М1М3 [91]. Семьи с аллелями Z имеют больше детей, чем семьи с аллелями М. Этот факт объясняется снижением угнетения ингибитором протеолитического фермента сперматозоидов — акрозина, способствующего внедрению мужских половых клеток в яйцеклетку.
Микрогетерогенность α1ИП связана с точечными мутациями в первичной структуре белка и составом углеводов. В молекуле ингибитора аллеля Z глутаминовая кислота замещена лизином в положении 342, что приводит к изменению электрофоретической подвижности, повышению изоэлектрической точки белка по сравнению с таковой нормального аллеля [113]. Такая замена в аминокислотной последовательности сопровождается изменением функциональных свойств ингибитора: резким снижением его концентрации в плазме крови и нарушением секреции, что способствует его накоплению в гепатоцитах. Морфологический анализ биоптата печени больного, гомозиготного по аллелю Z, позволил выявить изменения: умеренный фиброз, внутриклеточное накопление α1ИП в шероховатом эндоплазматическом ретикулуме [58]. В основе ухудшения транспорта ингибитора лежит нарушение процессов сиалирования в гепатоцитах вследствие дефицита сиаловой кислоты в клетках печени.
Первичная структура аллеля S отличается от таковой нормального белка тем, что глутаминовая кислота замещена валином в положении 264 [94]. Такая мутация приводит к внутриклеточному распаду α1ИП, а не к накоплению его в печени, что сопровождается умеренным дефицитом ингибитора в крови. Недавно описан новый вариант ингибитора, названный α1ИП Питсбурга. Он представляет собой изоформу ингибитора, образованную в результате точечной мутации — замены в положении 388 метионина на аргинин.
Для изучения точечных мутаций в изоингибиторах α1ИП в настоящее время используют методы анализа нуклеотидной последовательности ДНК в гене, кодирующем этот белок (ДНК-зондовые методы) [103]. Они позволяют установить причину наследственного дефекта на уровне ДНК еще при отсутствии симптомов заболевания, что имеет важное значение для прогнозирования наследственных дефектов обмена и разработки методов заместительной терапии.
Существенная роль 1ИП в регуляции протеолиза обусловила большой интерес к исследованию его фенотипов и количественному определению их в сыворотке крови и других биологических жидкостях. Первое сообщение по данному вопросу принадлежит С. Laurell и S. Eriksson [81], которые обнаружили связь между врожденной недостаточностью ингибитора и первичной эмфиземой легких. Это явление они назвали α1-антитрипсиновой недостаточностью и установили, что заболевание является наследственным и возникает в результате резкого дефицита α1ИП. Авторы предположили, что недостаток ингибитора приводит к растормаживанию протеиназ (в основном нейтрофильной эластазы), разрушающих альвеолярные перегородки, вследствие чего происходит слияние альвеол в более крупные эмфизематозные полости, ткани легких теряют эластичность и постепенно уменьшается их дыхательная поверхность.
Позднее появились работы, подтвердившие связь между врожденным дефицитом 1ИП и другими деструктивными поражениями легких, что привело к возникновению гипотезы дисбаланса системы протеиназы — ингибиторы в генезе заболеваний бронхолегочной системы (эмфизема легких, хронический бронхит, пневмония) [70]. Согласно этой гипотезе, в основе указанных заболеваний лежит единый пусковой механизм, связанный с нарушением равновесия между протеиназами и их ингибиторами, которые защищают ткани от воздействия протеолитических ферментов. Оно сдвигается в сторону неконтролируемого протеолиза и повреждения свободным ферментом тканей бронхолегочного дерева.
В последующие годы была подробно изучена связь между фенотипами α1ИП и развитием заболеваний бронхолегочной системы. Оказалось, что у больных с обструктивными заболеваниями легких встречается более высокая частота вариантов ZZ, MZ, SZ, MS по сравнению с контрольной группой. Редкие фенотипы α1ИП, а также М3М3 выявлены у 14% больных с хроническим бронхитом; у здоровых лиц они составили 3,7%. У больных с распространенными формами туберкулеза, раком легких и хронической пневмонией чаще, чем у здоровых лиц, встречались как редкие варианты ингибитора, так и вариант М3М3. Результаты этих исследований позволили предположить, что аллель M3 в гомозиготной форме является таким же существенным фактором риска указанных заболеваний, как и аллели PiS и РiZ — в гетерозиготной [11].
По статистическим данным Национального центра здоровья США, основанным на анализе историй болезни 26 866 600 умерших за 12 лет (1979–1991 гг.), частота смертности больных с обструктивным заболеванием легких, у которых обнаружена недостаточность α1ИП, составила 2,79% у взрослых (в вoзpacте 36–47 лет) и 1,2% у детей (в возрасте 1 год — 14 лет) от общего количества умерших [49].
С учетом тесной биохимической и функциональной связи между верхними дыхательными путями и бронхолегочным деревом особенно важным представлялось изучение полиморфизма α1ИП при заболеваниях ЛОР-органов. С помощью метода изоэлектрофокусирования в полиакриламидном геле исследованы фенотипы α1ИП в сыворотке крови 404 больных с воспалительными, аллергическими и онкологическими заболеваниями верхних дыхательных путей [11]. Полученные данные свидетельствуют о том, что при злокачественном поражении верхних дыхательных путей снижалась частота аллеля М1 и повышалась частота аллеля М2. В 2 и 6% случаев соответственно выявлены варианты M1S и М1Z, при этом функциональная активность α1ИП по отношению к трипсину и эластазе была значительно сниженной. У больных с аллергическими и воспалительными заболеваниями ЛОР-органов (гайморит, аллергический ринит) частота аллеля М2 превышала таковую в контрольной группе, причем его гомозиготная форма встречалась в 6 раз чаще у больных с тяжелым течением заболевания. На основании полученных результатов можно сделать вывод: у носителей аллелей ингибитора S и Z, а также М2 повышается риск развития ЛОР-заболеваний, что обусловливает необходимость проведения у них генетического скрининга сывороточного α1ИП.
Важным является изучение гетерогенности ингибитора при заболеваниях печени. По имеющимся данным, у детей с гомозиготным фенотипом РiZ наблюдаются клинические признаки заболеваний печени — цирроза и неонатального гепатита (17–25% случаев). Часть пациентов с резким дефицитом α1ИП погибает еще в детском возрасте, а у взрослых вероятность развития цирроза печени достаточно высока (примерно у 20% больных старше 50 лет). Первыми признаками врожденного дефицита α1ИП являются холестатическая желтуха и увеличение печени. Поэтому у новорожденных с гипербилирубинемией неясной этиологии и длительной желтухой необходимо провести исследование функциональной активности ингибитора и его фенотипирование. Для наследственной недостаточности α1ИП характерны внутрицитоплазматические включения в виде гранул, которые были идентифицированы как α1ИП при помощи специфической антисыворотки.
Исследования последних лет показали, что даже при наследственном дефиците α1ИП не всегда наблюдается заболевание дыхательных путей, в частности эмфизема легких. У носителей гетерозиготного аллеля Z вероятность развития этих заболеваний зависит от различных факторов: курения, загрязненности воздуха, продуктов перекисного окисления липидов.
Остановимся на курении. Компоненты табачного дыма парализуют защитную функцию α1ИП, а также способствуют активации протеолиза. Уровень нейтрофильной эластазы в бронхоальвеолярных смывах у курящих повышается вследствие усиления проницаемости эпителия и увеличения притока нейтрофильных гранулоцитов и макрофагов в легочную межуточную ткань. Их количество возрастает примерно в 10 раз и зависит от числа выкуренных сигарет. Компоненты табачного дыма (пероксид- и супероксидные анионы) окисляют в активном центре ингибитора метионин в положении 358, способствуя образованию модифицированного ингибитора. Скорость взаимодействия последнего с нейтрофильной эластазой более чем в 1000 раз меньше, чем эластазы с нативным ингибитором [114].
Таким образом, вдыхание табачного дыма изменяет в легочной ткани соотношение между протеиназами, в частности эластазой, и ингибиторами в сторону преобладания первых, что приводит к повреждению эластических волокон бронхов и легких. Курение является фактором риска развития ряда заболеваний дыхательного тракта и поэтому абсолютно противопоказано лицам с гомозиготной недостаточностью α1ИП по аллелю Z. Носители фенотипа α1ИПZZ, злоупотребляющие курением, живут на 20 лет меньше по сравнению с некурящими лицами того же фенотипа. При наличии у курящих дефицита α1ИП риск возникновения бронхолегочных заболеваний резко возрастает (они могут заболеть в возрасте до 40 лет). Наиболее уязвимыми являются дети — пассивные курильщики. Известно, что бронхолегочными заболеваниями чаще болеют дети в возрасте до 5 лет, у которых курят родители. Антиникотиновая пропаганда должна быть более активной.
Наряду с изучением генетического полиморфизма α1ИП перспективным является определение его суммарного содержания в биологических жидкостях с диагностической целью. Определение α1ИП проводят с помощью энзиматических и иммунологических методов исследования.
Большой интерес вызвало изучение α1ИП как белка острой фазы в сыворотке крови при воспалительных, деструктивных процессах, злокачественных новообразованиях [1, 11]. Определение количества ингибитора служит объективным критерием течения патологического процесса, эффективности применяемой терапии. Оно является облигатным при первичной эмфиземе легких и других деструктивных заболеваниях органов дыхания, при гипербилирубинемии неясной этиологии и длительной желтухе новорожденных. Снижение уровня этого белка должно прежде всего ассоциироваться с генетически детерминированной количественной или функциональной недостаточностью и служит абсолютным показанием к более углубленному изучению фенотипических вариантов α1ИП.
При острых воспалительных процессах различного генеза после хирургических вмешательств содержание сывороточного α1ИП повышается, а затем по мере стихания процесса нормализуется. Показатель этого высокореактивного белка может быть использован как весьма надежный критерий верификации воспаления, степени его выраженности и прогноза.
Изучение уровня α1ИП оказалось информативным биохимическим показателем при злокачественных новообразованиях различной локализации — молочной железы, легких, толстого кишечника, ЛОР-органов [13]. Согласно нашим данным, у больных раком гортани концентрация α1ИП повышается, причем наиболее выраженные изменения отмечены при III–IV стадиях заболевания. Определение ингибитора в отдаленный период после хирургического и комбинированного лечения показало, что возникновение рецидива и метастазов сопровождается повышением уровня этого белка. Опасность рецидива опухоли была выше у больных с высоким исходным содержанием ингибитора. Поэтому данный биохимический показатель может быть использован в качестве маркера метастазов и рецидивов злокачественных опухолей на раннем этапе их развития.
Содержание сывороточного α1ИП является объективным показателем течения ишемической болезни сердца. По имеющимся данным, уровень ингибитора повышается в первые дни инфаркта миокарда, достигая максимума к 5-м суткам, и при благоприятном исходе нормализуется к концу 3-й недели [69]. У больных с нестабильной стенокардией также наблюдается повышение количества сывороточного α1ИП, однако в значительно меньшей степени, чем при остром инфаркте миокарда.
Имеются сообщения о важности определения α1ИП при инфекционных заболеваниях (гепатит А), а также при циррозе печени, коллагенозах для прогноза течения болезни [1].
Ценную информацию дает определение ингибитора не только в сыворотке крови, но и в других биологических жидкостях (спинномозговой, синовиальной и др.). При черепно-мозговой травме уровень ингибитора в ликворе увеличивается в 8–10 раз, а при улучшении состояния больного снижается. В амниотической жидкости концентрация ингибитора повышается с увеличением срока беременности [11]. При осложненной беременности уровень 1ИП снижается, что является предпосылкой для проведения фенотипирования ингибитора. При наличии врожденных пороков развития плода выявляется низкая концентрация α1ИП, которая становится еще меньшей при удлинении гестации.
В последние годы больным с наследственным и приобретенным дефицитом α1ИП в качестве заместительной терапии вводят препараты ингибиторов. Они получены из крови доноров и оказались эффективными при лечении больных эмфиземой легких. Для лечения одного больного необходимы высокие дозы препарата (около 4 г в неделю), поэтому в настоящее время препараты ингибиторов, в частности их мутанты, менее чувствительные к окислительной инактивации, получают методом генной инженерии [52]. Их рекомендуют вводить больным с гомозиготной недостаточностью α1ИП при экстремальных состояниях (шок, обширные оперативные вмешательства, инфекционные болезни). Cледует еще раз подчеркнуть, что профилактичеcкой мерой при наследственном дефиците α1ИП является отказ от курения.
В заключение следует отметить, что α1ИП — важнейший белок сыворотки крови — предохраняет организм от избыточного протеолиза в крови и тканях. Изучение генетической гетерогенности этого белка-регулятора расширяет наши представления о молекулярной патологии наследственных болезней, способствует раннему выявлению носителей патологических генов как факторов риска развития ряда заболеваний, что важно для своевременного включения в комплексную терапию ингибиторов протеаз. Кроме того, изучение функциональной активности этого высокореактивного белка в крови и других биологических жидкостях является ценным информативным критерием для характеристики течения заболевания, его прогноза и эффективности лечения полиэнзимными препаратами протеиназ, вводимыми перорально.
α2-Антиплазмин (α2АП) является важнейшим ингибитором плазмина — основного фермента фибринолиза. Этот ингибитор был открыт в 1979 г. одновременно учеными трех стран: Соlmаn (Бельгия), Моrоi, Aoki (Япония), Mullertz, Сlemensen (Дания). Он стал известен под разными названиями: «первый плазминовый ингибитор», «α2-ингибитор плазмина», «антиплазмин», «первичный ингибитор фибринолиза». В 1979 г. Международный комитет по тромбозу и гемостазу предложил термин «α2-антиплазмин», который впоследствии стал общепринятым.
Важным доказательством физиологической роли α2АП как основного ингибитора фибринолиза послужили данные N. Аокi и соавторов [42] о наследственном дефиците этого ингибитора у мужчины с выраженной склонностью к кровотечениям. В его крови был обнаружен низкий уровень α2АП, который составлял менее 1 мг/л, что примерно в 60 раз меньше, чем в плазме крови здоровых лиц. Содержание других ингибиторов — α2М, α1ИП, АТIII, титров факторов свертывания крови, а также протромбиновое и тромбопластиновое время были в пределах нормы. In vitro сгусток цельной крови больного быстро лизировал. Добавление очищенного препарата α2АП в кровь больного нормализовало скорость лизиса, причем эффект был прямо пропорционален количеству добавленного ингибитора. Несмотря на повышенный фибринолиз in vitro концентрация фибриногена не отличалась от таковой здоровых лиц, но отмечалось увеличение скорости превращения глу-плазминогена в его модифицированную форму — лиз-плазминоген, очевидно, под действием спонтанно образующихся следовых количеств плазмина. Внутривенное или пероральное введение больному синтетического ингибитора фибринолиза — транс-4-аминометил-цикло-гексакарбоновой кислоты — нормализовало фибринолиз и ослабило геморрагические проявления.
Связь наследственного дефицита α2АП с нарушениями фибринолиза была подтверждена данными других исследователей [57, 129]. В Японии описан врожденный дефицит α2АП у трех сестер (возраст от 3 мес до 5 лет), у которых после небольших травм возникали длительные кровотечения [129]. У них выявлено значительное уменьшение уровня α2АП, а также ускорение лизиса сгустков плазмы и разбавленной цельной крови. Ни родители сестер, ни их брат не страдали кровоточивостью, хотя содержание ингибитора у них было вдвое меньше нормального. Сделано заключение: родители больных сестер (не состоящие в кровном родстве) и брат являются гетерозиготными, а сестры — гомозиготными по недостаточности α2АП.
Описан случай наследственного дефицита α2АП у гетерозиготного больного, у которого концентрация ингибитора, определяемая функциональными методами, составляла 50% нормы. α2АП имел пониженное сродство к фибрину: 8,3% при норме 32,4%. Время полураспада аномального ингибитора равно 72,9 ч, а нормального — 6,1 ч. Повышенная кровоточивость у больного объясняется снижением синтеза 2АП и ослаблением его способности связываться с фибрином.
α2АП получен в очищенном состоянии, что позволило изучить его первичную и третичную структуры. Методы выделения этого ингибитора различны, они включают аффинную хроматографию на сефарозе 4В, конканавалин-А-сефарозе или ДЭАЭ-целлюлозе. Предложен и простой одностадийный метод его получения из плазмы крови с использованием аффинной хроматографии на сефарозе, к которой присоединена тяжелая цепь плазминогена [125].
α2АП представляет собой гликопротеин, который состоит из одной полипептидной цепи и содержит 14% углеводов [45]. Его молекулярная масса равна 70 000 дальтон. Расшифрована первичная структура ингибитора, которая отличается от таковой ATIII и α1ИП. Молекула α2АП стабилизирована тремя дисульфидными связями, две из которых легко восстанавливаются и S-карбоксиметилируются без потери активности. Изучение пространственной организации α2АП показало, что белок содержит 16% спиралей, 19% β-структур, 65% беспорядочных спиральных структур. N-концевой аминокислотой является аспарагин, С-концевой — лейцин. При хранении ингибитора в растворе, а также повторном замораживании и оттаивании его активность быстро теряется, но сохраняется в лиофилизированном виде.
α2АП кроме активности плазмина тормозит таковую других протеиназ в опытах in vitro — трипсина, химотрипсина, плазменного калликреина, тромбина, фактора XIа свертывания крови, кининогеназную активность калликреина и прекалликреинактивирующую активность фактора Хагемана [101]. Однако скорость связывания ингибитора с указанными протеиназами, за исключением трипсина, значительно ниже, чем с плазмином, поэтому физиологическое значение α2АП в контроле их активности вряд ли имеет существенное значение. С трипсином α2АП взаимодействует относительно быстро с образованием эквимолярного устойчивого комплекса. Ингибитор не действует на папаин и нейтрофильную эластазу, освобождающуюся при воспалительном процессе.
α2АП — основной быстродействующий ингибитор плазмина, локализуется в α2-глобулиновой фракции плазмы крови и относится к группе серпинов. Его содержание в плазме крови здоровых лиц колеблется от 50 до 70 мг/л. Хотя оно и низкое, но ингибитор практически мгновенно подавляет активность плазмина даже при температуре 0 °С, в отличие от α2М, инактивирующее действие которого усиливается с удлинением времени взаимодействия с ферментом. Большое сродство α2АП к плазмину определяет его главную роль в регуляции фибринолиза в организме. Ингибитор быстро стехиометрически реагирует с плазмином с образованием стабильного комплекса, не диссоциирующего в присутствии восстанавливающих и денатурирующих агентов.
Расшифрована природа взаимодействия плазмина с α2АП [45]. Реакция происходит в два этапа. На первом (быстром) образуется обратимый комплекс фермент — ингибитор, на втором (более медленном) — стабильный необратимый комплекс. Это пример одного из самых быстрых белок-белковых взаимодействий. Скорость реакции на порядок выше таковой трипсина с α2АП.
Высокая скорость связывания на первом этапе зависит от наличия в тяжелой цепи плазмина (плазминогена) специфических структур — лизин-связывающих участков (ЛСУ), которые соединяются с α2АП [13]. Непосредственно в акте катализа они не участвуют, но являются главным фактором избирательного связывания с α2АП и фибрином. ЛСУ обладают также большим сродством к таким карбонильным кислотам, как -аминокапроновая кислота, 6-аминогексановая кислота (6-АГК), и лизину. В присутствии 6-АГК или лизина реакция плазмина с α2АП замедляется примерно в 50 раз, что, вероятно, объясняется наличием общего специфического участка в молекуле фермента, связывающего как α2АП, так и 6-АГК, а также лизин. На участие ЛСУ в реакции плазмин — α2АП указывает тот факт, что на взаимодействие α2АП с трипсином (не содержащим ЛСУ) 6-АГК не влияет. Однако ЛСУ лишь ускоряют связывание плазмина с ингибитором, а решающую роль в этом процессе играет активный центр фермента. Доказательством этого являются данные о том, что мини-плазмин — продукт протеолитического расщепления нативного плазмина, состоящего только из легкой цепи с активным центром фермента, — связывается с ингибитором необратимо с потерей энзиматической активности. Однако скорость реакции α2АП и мини-плазмина в 60 раз медленнее, чем таковая с нативным плазмином и α2АП. При образовании комплекса плазмин расщепляет специфическую Лей-Мет-связь в N-концевом участке молекулы α2АП, затем образуется ковалентная связь между активным остатком серина плазмина и карбонильной группой лейцина ингибитора. Комплексообразование приводит к конформационным изменениям в молекуле ингибитора, что сопровождается и изменением некоторых его антигенных детерминант.
На основании имеющихся данных можно сделать вывод, что α2АП контролирует фибринолиз несколькими путями. Прежде всего этот ингибитор в физиологических концентрациях препятствует адсорбции плазминогена на фибрине, конкурируя за ЛСУ. Последние комплементарно связываются со специфическими лизиновыми участками (ЛУ) молекулы фибрина. Известно, что волокна фибрина избирательно соединяют и прочно удерживают плазминоген и его активаторы, которые превращают связанный с фибрином плазминоген в плазмин. Тканевый активатор плазминогена обладает повышенной аффинностью к фибрину и активирует профермент на поверхности фибринового сгустка. Существенно, что образовавшийся плазмин не подвергается инактивации антиплазминами плазмы, но избирательно локально лизирует фибрин, а не количественно преобладающий фибриноген. Уменьшая способность плазминогена соединяться с участками молекулы фибрина, α2АП снижает количество образовавшегося плазмина на поверхности сгустка и замедляет фибринолиз.
Второй путь регуляции фибринолиза α2АП заключается в том, что ингибитор присоединяется к волокнам фибрина поперечными связями; это приводит к большей устойчивости сгустка к лизису плазмином. α2АП связывается в основном с А-α-цепью фибрина, наиболее чувствительной к действию плазмина, ковалентно. Для специфического связывания плазмина с α2АП требуется присутствие фактора ХIIIа, тромбина и ионов кальция. При дефиците в плазме крови фактора ХIIIа связывание ингибитора с волокнами фибрина резко снижается.
С учетом важнейшей физиологической роли α2АП исследование его содержания в плазме крови широко используется в клинике в качестве показателя, позволяющего судить о состоянии фибринолитической системы крови. С этой целью, как и при исследовании ATIII, применяют иммунологические и функциональные методы. Получены моноклональные антитела, специфические для α2АП, не дающие перекрестной реакции с α2М и α1ИП. Они позволяют получить информацию об антигенной структуре α2АП и имеют большое значение при определении этого ингибитора в биологических жидкостях с диагностической целью. После разработки методов синтеза специфических синтетических пептидов последние стали использоваться в клинико-диагностической практике. Наиболее широкое распространение получили хромогенные субстраты, в особенности Н-Д-Вал-Лей-Лиз-пара-нитроанилид (S-2251) [13]. Методы с применением этого субстрата характеризуются воспроизводимостью, высокой точностью, быстротой исполнения и допускают возможность автоматизации определения.
Опубликованы данные о диагностической значимости определения α2АП [43, 98]. У больных циррозом печени концентрация этого белка, определяемая иммунохимическим методом, резко снижена, причем степень снижения коррелирует с изменениями других функциональных показателей печени — концентрацией альбумина, активностью холинэстеразы, аминотрансфераз [43]. На основании изучения α2АП у пациентов с заболеваниями печени сделан вывод о том, что его определение в плазме крови является весьма информативным показателем состояния функции данного органа. Эти данные подтверждают сведения о синтезе α2АП паренхиматозными клетками печени: присутствие его в цитоплазме гепатоцитов обнаружено с помощью метода антителофлуоресцентного анализа. Концентрация α2M и α1ИП в плазме крови пациентов с заболеваниями печени, напротив, значительно повышена.
Низкая концентрация α2АП выявлена при многих патологических состояниях, сопровождающихся усилением фибринолиза, причем ее снижение наступает быстрее и выражено в большей степени, чем других ингибиторов плазмы крови.
Важным представляется изучение α2АП при диссеминированном внутрисосудистом свертывании крови [41]. Установлено существенное уменьшение содержания α2АП в плазме крови животных с ДВС-синдромом, вызванным введением тканевого тромбопластина. Уже через 10 мин в плазме крови животных определяли комплекс плазмин — α2АП, который затем быстро исчезал из циркуляции. В плазме крови пациентов с подострым и хроническим течением ДВС-синдрома иммунологическими методами комплекс не обнаруживается вследствие его быстрого выведения из кровообращения. Период полураспада циркулирующего комплекса плазмин — α2АП составляет 0,52 дня, а свободного ингибитора — 2,6 дня.
Немаловажное значение имеет определение α2АП и его комплексов с плазмином при лечении больных фибринолитическими препаратами. Показано, что тромболитическая терапия приводит к истощению ингибитора в результате образования комплексов с плазмином, вследствие чего больные, страдающие наследственным дефицитом α2АП, подвержены кровотечениям. Выявление в плазме крови комплекса α2АП — плазмин служит показателем активации системы фибринолиза. Введение активаторов фибринолиза — стрептокиназы, урокиназы — сопровождается образованием плазмина, который быстро связывается и инактивируется α2АП. Титр комплекса α2АП — плазмин нарастает в течение первых 3 ч после внутривенного введения активаторов плазминогена, уровень же свободного α2АП при этом снижается. При введении умеренных доз урокиназы в крови определяется комплекс плазмин — α2АП, высоких доз — и комплекс плазмин — α2М. Для определения комплекса α2АП — плазмин используют простой тест латексной агглютинации с применением специфических антисывороток. Неактивный комплекс содержит новые детерминанты, иммунологически отличающиеся от нативной молекулы ингибитора.
Таким образом, α2АП является основным быстродействующим ингибитором плазмина. Определение его уровня в плазме крови позволяет судить о состоянии фибринолитической системы крови при различных патологических состояниях, а также служит важным биохимическим критерием активности фибринолиза, что необходимо учитывать при назначении тромболитической терапии.
Антитромбин ІІІ (АТІІІ) является основным физиологическим ингибитором фермента свертывания крови — тромбина. Как известно, последний участвует не только в процессе превращения фибриногена в фибрин, но и в активации V, VIII, XII факторов свертывания, антикоагулянтной протеазы протеина С, а также служит индуктором агрегации тромбоцитов.
АТІІІ кроме тромбина угнетает также активность других сериновых протеиназ, в частности факторов Xa, XIa, XIIa, участвующих в каскадном механизме свертывания крови. Таким образом, АТІІІ не только ингибирует действие тромбина. Этот ингибитор играет существенную роль в поддержании жидкого состояния крови, являясь составной частью противосвертывающей системы организма.
Характерная особенность АТІІІ заключается в том, что он действует в присутствии своего активатора — гепарина. Физиологически это очень важно, так как для остановки кровотечения тромбин синтезируется в избытке, что создает угрозу возникновения тромбоза. Для его предотвращения необходима быстрая инактивация лишнего тромбина. Эту жизненно важную функцию и выполняет система АТІІІ — гепарин.
АТІІІ взаимодействует также с такими сериновыми протеазами, как плазмин, химотрипсин, калликреин плазмы, урокиназой, тромбиноподобными ферментами, выделенными из яда змей. Их инактивация АТІІІ происходит так же медленно, как и тромбина, но ускоряется гепарином. Однако для достижения одинакового ингибирующего эффекта АТІІІ на тромбин и плазмин для первого фермента требуется гораздо меньшая концентрация гепарина (0,005 ЕД/мл), чем для второго (2 ЕД/мл).
При изучении антикоагулянтов плазмы уже давно было замечено, что гепарин сам по себе не влияет на свертывание фибриногена тромбином, но действует как сильный ингибитор в присутствии плазмы или определенного белкового компонента. Этот белок, получивший первоначально название «кофактор гепарина», позднее был идентифицирован как АТІІІ. Термин «кофактор гепарина» указывает на то, что белок рассматривается как кофактор, а его небелковый активатор (гепарин) — как основной фактор. Последующие результаты исследований показали, что при инактивации тромбина АТІІІ с гепарином всегда образуется неактивный комплекс АТІІІ — тромбин в соотношении 1:1, причем свойства и строение этого комплекса не зависят от того, получен он при наличии или отсутствии гепарина. При низких концентрациях последнего количество молей инактивированного тромбина может значительно превосходить таковое добавленного гепарина. Эти данные указывают на то, что одна молекула гепарина способна вызвать превращение нескольких молекул тромбина, т.е. гепарин функционирует как ускоритель реакции. После образования стабильного комплекса тромбин — АТІІІ молекула гепарина освобождается и вновь связывается со свободным ингибитором для ускорения образования нового комплекса. Следовательно, АТІІІ можно считать основным фактором, а гепарин — кофактором. Имеющиеся в литературе утверждения о том, что АТІІІ активирует гепарин, т.е. является его кофактором, ошибочны, так как решающую роль в инактивации тромбина играет АТІІІ, а гепарин является вспомогательным ускоряющим фактором подобно тому, как в системе фермент — кофермент основной фактор — специфический белок.
Быстрая инактивация тромбина, по-видимому, является результатом промежуточных реакций, в которых участвуют АТІІІ, гепарин и тромбин. Ускоряющий эффект гепарина на процесс комплексообразования АТІІІ и тромбина очень велик. Скорость реакции при этом повышается более чем в 1800 раз. Между молекулами фермента и ингибитором имеется сродство, но в отсутствие гепарина реакция их связывания протекает медленно, что, вероятно, объясняется структурными особенностями этих белков.
Гепарин, представляющий собой полисахарид класса глюкозаминогликанов, благодаря наличию в молекуле сульфатных и карбоксильных групп при физиологических значениях рН несет большое количество отрицательных зарядов, что обеспечивает электростатическое взаимодействие с белками, содержащими основные группы.
В настоящее время гепарин рассматривают как аллостерический фактор, который взаимодействует как с АТІІІ, так и с тромбином. С помощью спектроскопических методов исследования показано, что гепарин соединяется с пептидным фрагментом ингибитора, который содержит остаток триптофана, расположенный в N-конце полипептидной цепи. Он не только активирует АТІІІ, но и, реагируя с тромбином, делает его более чувствительным к связыванию с АТІІІ. Для этого необходимы определенные структуры в молекуле гепарина: N-сульфатные группы для взаимодействия с АТІІІ и свободные карбоксильные группы для соединения с тромбином.
Имеющие данные позволяют сделать вывод, что быстрая инактивация тромбина осуществляется в результате промежуточных реакций, причем основой является реакция в тройном комплексе тромбин — АТІІІ — гепарин. Она может реализоваться с одинаковой вероятностью двумя путями: через комплекс АТІІІ — гепарин или гепарин — тромбин, к которому присоединяются тромбин и АТІІІ соответственно. Далее тройной комплекс претерпевает конформационные изменения, при этом образуются комплекс тромбин — АТІІІ и свободный гепарин. Можно предположить, что на поверхности молекул, образующих комплекс, имеются определенные комплементарные участки, обеспечивающие образование промежуточных соединений. Взаимодействие двух белков осуществляется при помощи межмолекулярных нековалентных связей, в основном электростатических, в данном случае анионных зарядов молекулы гепарина. На стадии тройного комплекса или после ее завершения в активном центре тромбина ацилируется серин при разрыве пептидной связи, содержащей остаток карбоксильной группы аргинина в молекуле АТІІІ. Образуется стабильное ацильное производное, и каталитическая функция тромбина блокируется. Первоначально полагали, что образовавшийся комплекс тромбин — АТІІІ необратим, позднее появились данные о том, что он спонтанно, хотя и очень медленно, распадается с высвобождением активного тромбина и неактивного АТІІІ. Время полураспада составляет 3,5 сут. Нейтрофильная эластаза и некоторые протеиназы, выделенные из яда змей, постепенно инактивируют ингибитор путем ограниченного протеолиза. Комплекс тромбин — АТІІІ удаляется из крови клетками ретикулоэндотелиальной системы, причем время его распада не зависит от того, получен он в присутствии или при отсутствии гепарина. Электронно-микроскопические и радиографические исследования показали, что захват и выведение комплекса, как и комплекса трипсин — α1ИП, осуществляется гепатоцитами. Приведенные данные позволяют предположить, что эти два гомологичных ингибитора имеют общий рецепторный участок узнавания, когда протеиназы присоединяются к ингибиторам.
АТІІІ является гликопротеином с молекулярной массой 60 000 дальтон и изоэлектрической точкой, находящейся при рН 5,1. Молекула белка содержит 13% углеводов — гексозу, глюкозамин, нейраминовую кислоту. Концентрация АТІІІ в плазме крови человека составляет в среднем 0,3 г/л. Расшифрована первичная структура ингибитора, показана гомология с таковой α1ИП и овальбумина. Его биосинтез происходит в печени, почках, сосудистой стенке и легких. Последний факт, вероятно, играет роль в поддержании текучести крови в микроциркуляторном русле. АТІІІ выделен из плазмы крови человека и животных методом аффинной хроматографии на гепарин-сефарозе. Ингибитор образует стехиометрический комплекс с тромбином, серин активного центра которого соединяется с аргинином.
Связывание тромбина с АТІІІ зависит от рН среды, оно тормозится при смещении рН в кислую сторону. При ацидозе реакция комплексообразования резко замедляется. Это имеет важное значение, поскольку при некоторых патологических состояниях наблюдается ацидоз, что приводит к выраженному замедлению реакции взаимодействия фермента с ингибитором.
АТІІІ — гетерогенный белок. При помощи изоэлектрофокусирования показано, что при рН 4,9–5,2 он разделяется на ряд фракций. Эта гетерогенность может зависеть либо от различий в гликозилировании белка, либо от мутационных изменений, приводящих к появлению изоингибитора. Известны несколько мутантов, у которых в активном центре АТІІІ серин замещен лейцином.
Определение АТІІІ в плазме крови стало одним из важных лабораторных диагностических тестов, позволяющих судить о состоянии противосвертывающей системы крови. Методы определения этого высокореактивного ингибитора подразделяются на функциональные и иммунологические. Первые основаны на снижении под действием АТІІІ свертывающей активности тромбина, добавленного к исследуемому образцу плазмы крови. Активность АТІІІ выражают в процентах, принимая за 100% антитромбиновое время нормальной плазмы (стандартная смешанная плазма 10–20 здоровых лиц). У здоровых этот показатель колеблется от 85 до 115%. При помощи иммунологических методов определяют количество белка, прореагировавшего со специфическими для АТІІІ антителами. В норме оно равно 0,3 г/л. Результаты, полученные при использовании этих методов, в основном совпадают, но могут и отличаться. Функциональные методы дают иногда заниженные данные, а иммунологические — нормальные или немного завышенные. В этих случаях белковая молекула ингибитора, вероятно, сохраняет свои антигенные детерминанты, но оказывается неполноценной в функциональном отношении.
Наиболее широко в отечественных клиниках применяют функциональные методы, в которых для определения АТІІІ используют естественный субстрат тромбина — фибриноген и низкомолекулярные синтетические субстраты — пептиды с хромогенными или флюорогенными свойствами. В молекуле первых — Н-Д-Фен-Пип-Арг-пара-нитроанилид, (S2238), N-бензоил-Фен-Вал-Арг-пара-нитроанилид (S-2160), Тоз-Гли-Про-Арг-пара-нитроанилид (хромозим ТН) — под действием тромбина от этих субстратов отщепляется окрашенный в желтый цвет пара-нитроанилин, количество которого регистрируется спектрофотометрически при 405 нм. От флюорогенных субстратов тромбин высвобождает диметиловый эфир 5-аминоизофталевой кислоты, количество которого измеряют на флуориметре.
В клинических лабораториях Украины содержание АТІІІ определяют также с использованием фибриногена в качестве субстрата. Существуют два варианта метода. Первый из них заключается в том, что к плазме крови добавляют избыток тромбина по сравнению с имеющимся в ней АТІІІ, а для ускорения реакции — гепарин. Количество связанного тромбина определяют по разнице между содержанием внесенного в опытную пробирку фермента и оставшегося несвязанным тромбина, что соответствует уровню АТІІІ, поскольку ингибитор и фермент взаимодействуют в молярном соотношении 1:1, а АТІІІ израсходован полностью. Во втором варианте не используют гепарин и поэтому определяют медленные антитромбины, при этом в инактивации тромбина участвуют кроме АТІІІ другие ингибиторы плазмы крови, в основном α2М, на долю которого приходится 25% антитромбинового потенциала плазмы. Так как молярные концентрации обоих ингибиторов близки, тромбин вначале быстрее связывается с АТІІІ, а с увеличением времени — с α2М. Поэтому при коротком времени инкубации плазмы с тромбином (не более 2–3 мин) инактивирующим действием 2М можно пренебречь, поскольку тромбин практически связывается с АТІІІ. Недостатком этого варианта метода является то, что он не пригоден для определения АТІІІ у больных, получающих с лечебной целью гепарин.
Исходя из важной физиологической роли АТІІІ в организме исследование его уровня нашло широкое применение в клинике. Большим стимулом к этому послужило обнаружение наследственного дефицита АТІІІ в 1965 г. в крови членов одной норвежской семьи, что проявилось в склонности к тромбозу вен. Позднее были описаны аналогичные случаи наследственной недостаточности ингибитора у больных с тяжелыми тромбоэмболическими осложнениями. Частота выявления наследственного дефицита АТІІІ составляет 1:3000. Его клиническими признаками являются рецидивирующий тромбоз глубоких вен, легочная эмболия, ДВС-синдром, окклюзия сосудов головного мозга. К факторам риска при наследственном дефиците АТІІІ относятся шок различного генеза, инфекционные заболевания, обширные хирургические вмешательства. Дефицит ингибитора наследуется по аутосомно-доминантному типу. Не описаны случаи полного отсутствия АТІІІ. Вероятно, потеря способности синтезировать этот белок приводит к летальному исходу.
Последующие исследования внесли некоторую ясность в выяснение природы наследственного дефекта, ответственного за функциональную неполноценность белка АТІІІ. Одна из разновидностей недостаточности ингибитора заключается в аномальной низкой чувствительности АТІІІ к гепарину. У таких людей содержание ингибитора, определяемое в тесте без гепарина, не отличается от нормального. Однако при концентрациях гепарина, необходимых для анализа на торможение тромбина, АТІІІ проявляет низкую активность. Лишь при высоких концентрациях гепарина, не способных повышать активность нормального АТІІІ, аномальный ингибитор начинает эффективно тормозить тромбин. По-видимому, снижение чувствительности к гепарину связано с уменьшением сродства к нему в результате изменения нативной структуры белка.
Вышеизложенные научные предпосылки в известной степени послужили основой для клинических наблюдений, в которых гепарин при некоторых патологических состояниях теряет противосвертывающее свойство. Причиной слабой эффективности гепарина, вероятно, является нарушение скорости взаимодействия фермента с АТІІІ. Как уже упоминалось, специфическое сродство АТІІІ к гепарину обусловлено образованием нековалентных связей между ними, в частности, между анионными группами гепарина и протонированными группами лизина ингибитора. При контакте таких групп создаются оптимальные молекулярные взаимодействия на поверхности молекул. Изменение фиксированной топографии групп, участвующих в образовании комплекса, приводит к снижению прочности сродства гепарина к АТІІІ. Нарушения могут возникнуть в результате как мутационных изменений первичной структуры белка, так и некоторых заболеваний.
В клинической практике чаще встречается не врожденный, а приобретенный дефицит АТІІІ. В развитии приобретенной недостаточности важная роль отводится нарушению синтеза ингибитора при заболеваниях печени, так как его синтез происходит в этом органе. Определение уровня АТІІІ рассматривается как информативный тест, характеризующий белково-синтетическую функцию печени, а также как показатель контроля за течением заболевания и эффективности терапии.
У больных вирусным гепатитом, особенно с тяжелым течением заболевания, уровень АТІІІ в плазме крови снижается. При хронических болезнях печени также наблюдается снижение уровня АТІІІ, которое наиболее выражено при декомпенсированном циррозе. У больных с алкогольным циррозом (а не первичным билиарным) выявляют снижение количества как АТІІІ, так и α2АП, хотя при этом не отмечены тромбоэмболические осложнения. Для клинической картины данного состояния характерны кровотечения, в возникновении которых кроме пониженного уровня АТІІІ существенную роль могут играть и другие факторы, в частности система прокоагулянтов. При гепатите, осложненном массивными тромбозами, концентрация АТІІІ снижается в такой же мере, как и факторов протромбинового комплекса. Низкий уровень АТІІІ обнаружен у больных с тромбозом вен и тромбоэмболией легочной артерии, а также после операции по поводу тромбоза глубоких вен; он коррелировал с частотой развития легочных тромбоэмболий в послеоперационный период.
Снижение уровня АТІІІ наблюдается при нефротическом синдроме, особенно в фазе хронической почечной недостаточности и при обострении нефрита. Полагают, что этот факт связан с процессами локальной и диссеминированной внутрисосудистой коагуляции, при которых ингибитор связывается с активирующимися при свертывании крови протеиназами. Кроме того, при данном синдроме АТІІІ как низкомолекулярный белок легко переходит из крови в мочу. Если за 1 сут организм теряет с мочой более 5 г белка, то концентрация АТІІІ в крови резко падает и возникает опасность тромбоэмболических осложнений.
Согласно данным литературы [13], определение уровня ATIII является важным биохимическим тестом для ранней диагностики острого ДВС-синдрома, при котором в крови активируются протеолитические ферменты — тромбин и другие, а АТІІІ расходуется на их нейтрализацию, вследствие чего его концентрация снижается, что приводит к ослаблению эффективности терапии гепарином. Исследование в АТІІІ в динамике заболевания позволяет судить о потреблении ингибитора активированными факторами свертывания крови и эффективности терапии гепарином. После лечения низкими дозами гепарина (5000 ЕД подкожно каждые 8–12 ч) уровень АТІІІ нормализуется.
Имеются сведения об изменении содержания АТІІІ при ишемической болезни сердца. При остром инфаркте миокарда уровень АТІІІ резко снижается в первые 10 дней заболевания, при нестабильной стенокардии — изменяется незначительно.
У больных сахарным диабетом, особенно при сосудистых ретинопатиях, концентрация ингибитора снижается; при этом параллельно повышается содержание продуктов распада фибриногена. Снижение концентрации ингибитора объясняется усиленным его потреблением факторами свертывания крови и может свидетельствовать о латентно протекающем ДВС-синдроме. Кроме того, снижение содержания АТІІІ может быть связано с его выходом из циркулирующей крови вследствие повышенной проницаемости эндотелия сосудов и повреждения гепатоцитов.
Показана целесообразность определения АТІІІ для диагностики предтромботических состояний в акушерской практике. Снижение уровня АТІІІ оказалось важным биохимическим показателем состояния антикоагулянтной системы крови беременных до и после операционного лечения.
Разработка методов промышленного производства концентратов АТІІІ способствовала их применению с лечебной целью при наследственном дефиците. Введение человеческого АТІІІ больным (5 раз по 300 ЕД в течение 2 сут) повышало количество ингибитора в 2 раза. Препараты АТІІІ оказались эффективными при ДВС-синдроме, при обширных хирургических вмешательствах, а также при некоторых патологических состояниях, связанных с наследственной или приобретенной недостаточностью этого важнейшего регулятора противосвертывающей системы.
α2-Макроглобулин (α2М) — высокомолекулярный гликопротеин плазмы крови, принимающий участие в контроле активности протеиназ широкого спектра действия путем специфического комплексообразования. Наряду с регуляцией функции 4 классов протеиназ α2М, как показано в последние годы, играет важную роль в клеточном росте, дифференциации, метаболизме соединительной ткани, модуляции активности различных цитокинов — интерлейкинов, факторов роста, регуляции синтеза NO макрофагами и др. [18, 48, 106].
Уникальный ингибитор сериновых протеиназ 2М был открыт независимо друг от друга В. Haverback с соавторами [67] и К.Н. Веремеенко, В.А. Белицером [12] с использованием разных методических подходов. В. Haverback и соавторы установили, что трипсин при добавлении к сыворотке крови сохраняет способность расщеплять некоторые синтетические эфиры аргинина, и предположили существование в сыворотке крови наряду с ингибитором особого белка, предохраняющего трипсин от потери эстеразной активности.
К.Н. Веремеенко и В.А. Белицер показали, что трипсин в присутствии более чем 100-кратного избытка сывороточных ингибиторов расщепляет низкомолекулярный аргининсодержащий белок — протамина сульфат, будучи неактивным в отношении обычных белковых субстратов. Кроме того, фермент приобретает необычную устойчивость к тепловой инактивации. Результаты кинетических исследований позволили предположить наличие в α2-глобулиновой фракции специфического белка, образующего комплекс с трипсином, который интенсивно гидролизует протамина сульфат. Его назвали ингибитором I в отличие от ингибитора II, после взаимодействия с которым фермент полностью инактивируется [14]. Существенно, что ингибитор, находящийся во фракции 2-глобулинов, имеет более высокое сродство к трипсину, чем ингибитор II, мигрирующий с α1-глобулинами. Выделение ингибитора I из плазмы крови человека, изучение его свойств дало возможность заключить, что он идентичен α2М [37]. Предположение B. Haverback [67] о существовании в α2-глобулиновой фракции особого белка — трипсинпротеинэстеразы, предохраняющей фермент от инактивации, не подтвердилось.
α2М имеет молекулярную массу 720 000 дальтон. Его молекула состоит из 4 идентичных субъединиц с молекулярной массой 185 000 дальтон каждая. Субъединицы соединяются в пары ковалентными связями (дисульфидными мостиками), а димеры (полумолекулы) стабилизированы нековалентными связями [62].
В 1984 г. полностью расшифрована первичная структура белка, которая имеет много общего с таковой белков системы комплемента С3, С4 [107]. Каждая субъединица содержит 1451 аминокислотный остаток с С-концевым аланином и N-терминальным серином. В присутствии 1 М мочевины молекула α2М диссоциирует на две половины с образованием фрагментов с молекулярной массой 360 000 дальтон. Эти полумолекулы можно расщепить путем обработки тиоловыми соединениями, при этом образуются фрагменты с молекулярной массой 180 000 дальтон, которые и являются субъединицами белка. Выявлена локализация 11 дисульфидных мостиков. В количественном отношении в молекуле α2М преобладают аминокислоты — валин, лейцин, серин, глутаминовая кислота и треонин, что составляет около 41% от всех остатков аминокислот. Молекула α2М содержит углеводы (8–10%) — маннозу, ацетилглюкозамин, галактозу. Глюкозаминные основные группы присоединены к 8 остаткам аспарагина.
Изучение пространственной организации α2М показало, что белок содержит 8,6% β-спиралей и 35–60% β-структур. Моделью третичной структуры выбрана конформация -бочонка преальбумина.
α2М обладает высокой специфичностью, являясь ингибитором сериновых, тиоловых, кислых и металлопротеиназ. Отличительная черта α2М состоит в том, что активный центр ферментов после взаимодействия с ним остается свободным. В результате этого протеиназы в связанном состоянии с α2М реагируют с низкомолекулярными субстратами и защищены от связывания с высокомолекулярными субстратами и ингибиторами. Поэтому α2М предпочтительнее называть не ингибитором, а рестриктором (ограничителем) ферментативной функции протеиназ [37].
В настоящее время в основном выяснены механизмы взаимодействия α2М с протеиназами. Комплексообразование протеиназ с α2М представляет собой многоступенчатую реакцию. На первом этапе активная протеиназа (П) реагирует с определенным участком α2М, при этом образуется непрочный комплекс (α2М — П); на втором — фермент расщепляет специфическую пептидную связь в молекуле α2М, что приводит к конформационным изменениям последней (α2М*). На третьем этапе протеиназа ковалентно присоединяется к определенному участку молекулы α2М, что сопровождается образованием более компактной структуры α2М по сравнению с его исходной структурой. Захват протеиназы приводит к вызванному стерически блокированию ряда свойств, ограничению ее специфичности, в частности, к потере способности расщеплять высокомолекулярные субстраты. Кинетику реакций протеиназ с α2М можно представить в виде такой схемы:
![]()
Расшифрована последовательность аминокислот на участке α2М, подвергающегося расщеплению протеиназами (участок приманки). Он расположен в зоне локализации аминокислотных остатков 666–706 субъединиц молекулы α2М, служит субстратом для протеиназ и в основном соответствует субстратной специфичности фермента [62]. Наиболее быстро реагируют с α2М такие сериновые протеиназы, как трипсин, химотрипсин, панкреатическая и нейтрофильная эластаза (константы скорости первого порядка > 107 М–1•с–1), в то время как тромбин, фактор Ха и активаторы плазминогена взаимодействуют медленно (константы скорости второго порядка < 104 М–1•с–1). Участки приманки, вероятно, являются несимметричными, выставленными на поверхность гибкими структурами, в которых даже относительно гидрофобные сегменты доступны действию протеиназ. Последние расщепляют пептидные связи, локализованные вблизи середины полипептидных цепей субъединицы α2М. Так, трипсин гидролизует связи Арг681-Вал682; Арг696-Лей697; химотрипсин — Тир685-Глу686; плазмин, тромбин расщепляют Арг696-Лей697; эластаза — Вал682-Гли683; папаин — Гли683-Фен684; Гис699-Вал700. В результате гидролиза образуются две половины цепи α2М с молекулярной массой 85 000 дальтон. Расщепление специфической пептидной связи в зоне «приманки» 2М приводит к структурным изменениям молекулы белка, что подтверждено электронно-микроскопическими, спектроскопическими и другими исследованиями, а также увеличением скорости передвижения α2М в полиакриламидном геле, что связано с образованием более компактной структуры белка по сравнению с нативной. Электрофоретически медленная форма исходного (нативного) белка S превращается в быструю форму F. Вследствие гидролиза пептидного участка «приманки» молекула протеиназ входит в связывающие полости и соединяется ковалентно с молекулой α2М (рис. 1).
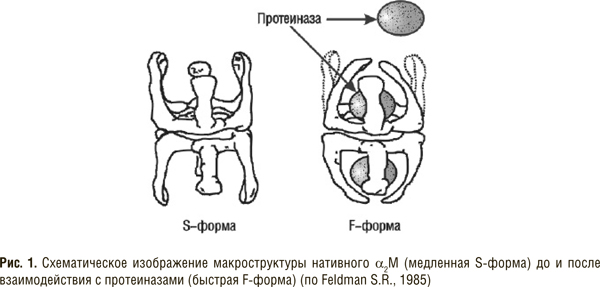
Химическая природа связывающих участков в молекуле α2М была установлена с помощью низкомолекулярных нуклеофильных агентов — первичных аминов, в частности метиламина [117]. При обработке метиламином α2М из медленной формы превращается в быструю — F, как и после взаимодействия с протеиназой. Кроме того, метиламин, включаясь в α2М, лишает его способности присоединяться к протеиназам, т.е. конкурирует за специфические связывающие участки в молекуле α2М. Позднее было установлено, что метиламин связывается с глутаминовым остатком α2М с образованием γ-глутамиламида и одновременным высвобождением 4 тиоловых эфиров цистеина (ни один из них не содержится в нативной форме α2М). Эти результаты позволили предположить, что нативный α2М содержит внутренний тиоэфир, который раскрывается после протеолитического расщепления участка «ловушки» или нуклефильного ацилирования тиоэфира. Последний, вероятно, локализован в малом гидрофобном кармане, защищенном частично от растворителя. Его активность значительно возрастает после гидролиза зоны «приманки». В молекуле α2М внутренний тиоловый эфир образуется между β-SH Цис949 и γ-карбонильной группой Глн952, который реагирует с метиламином. Показано, что присоединение протеиназ к α2М происходит через аминогруппы лизиновых остатков основных аминокислот. При комплексообразовании тиоэфирные связи разрушаются с освобождением SН-групп и образуется изопептидная связь между ε-лизином протеиназы и глутамиловым остатком α2М:
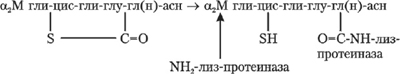
Коэффициент связывания протеиназ зависит от скорости их вовлечения в «ловушку» α2М и варьирует в зависимости от ряда факторов: величины молекулярной массы фермента, его субстратной специфичности, концентрации реагирующих веществ, температуры. Скорость взаимодействия α2М и относительно специфических протеиназ с большой молекулярной массой — тромбином, плазмином — значительно меньше, чем α2М и ферментов с более широкой специфичностью и небольшой молекулярной массой — трипсином, химотрипсином, катепсинами.
Процесс присоединения протеиназ к участку тиолового эфира детально прослежен на примере трипсина. Ход реакции изучали в присутствии конкурентного ингибитора фермента — бензамидина и оценивали по накоплению образовавшихся тиоловых групп, концентрации расщепленных субъединиц. Оказалось, что взаимодействие α2М с трипсином происходит быстро: за 10–15 с образуется примерно 90–95% тиоловых групп. В присутствии бензамидина сульфгидрильные группы освобождались медленно, но их количество было таким же, как и при отсутствии ингибитора.
Согласно имеющимся данным, реакция взаимодействия протеиназ с α2М двухэтапная, схематически ее можно представить так [55]:
На 1-м (быстром) этапе в результате расщепления внутренних β-цистеинил-γ-глутамиловых тиоловых эфиров образуется половина тиоловых групп, а другая половина выявляется на медленном (2-м) этапе. При взаимодействии α2М с трипсином в небольших концентрациях образуется комплекс в молярном соотношении 1:1 и освобождается одна пара SН-групп. При относительно высокой концентрации этого фермента молярное соотношение реагирующих компонентов составляет 1:2 и образуется 4 тиоловые группы. Хотя α2М содержит 4 идентичные субъединицы, он может связывать лишь 2 моля трипсина. Независимо от концентрации последнего степень максимального ковалентного связывания составляет 60–70%. Остальная часть фермента удерживается в комплексе с α2М за счет нековалентных связей.
Итак, последовательность образования комплекса α2М — протеиназа следующая: протеолитический фермент реагирует с участком (участками) «приманки», гидролизует в нем специфические пептидные связи, что приводит к конформационным изменениям молекулы α2М и образованию более компактной структуры. В результате этого происходят активация -цистеинил- -глутамил-тиоловых эфиров и ковалентное связывание фермента.
Наиболее детально изучено действие α2М на активность протеиназ животного происхождения — трипсина и химотрипсина. Оказалось, что большинство белков (альбумин, миозин, казеин, гемоглобин) практически не расщепляются трипсином, связанным с α2М [37]. Согласно нашим данным, аргининсодержащий белок (протамина сульфат) и некоторые синтетические субстраты (ТАМЭ, БАПНА) гидролизуются комплексом трипсин — α2М со скоростью, близкой к таковой свободного фермента. Важно, что после взаимодействия с α2М трипсин приобретает устойчивость к аутолизу и влиянию белковых ингибиторов (α1ИП, ингибитору трипсина из соевых бобов), что положено в основу его количественного определения [13]. Константа скорости реакции трипсина с α2М в 6 раз выше, чем таковая с α1ИП [37].
α2М принимает участие в регуляции протеолитических ферментов системы свертывания крови, фибринолиза, кининовой системы [106]. Он является одним из важных ингибиторов тромбина, катализирующего превращение фибриногена в фибрин и неактивного фактора ХIII в ХIIIа. В отличие от основного ингибитора тромбина — АТIII — α2М взаимодействует с ферментом медленно: потеря свертывающей активности тромбина нарастает во времени, достигая 95% от исходной. Другие сериновые протеиназы свертывания крови (факторы ХIIа, IХа, VIIа) не подавляются α2М, что связано, по-видимому, с их неспособностью гидролизовать пептидные связи в зоне «приманки» молекулы α2М [13].
Существенная роль принадлежит α2М в регуляции фибринолиза, которая осуществляется путем взаимодействия с основным ферментом фибринолитической системы крови — плазмином. По имеющимся данным, комплекс плазмин — α2М слабо гидролизует фибриноген, но сохраняет способность расщеплять специфические синтетические субстраты. Согласно данным К.Н. Веремеенко и А.И. Кизим [15], плазмин, связанный с α2М, лизировал фибрин и проявлял слабую активность в отношении фибриногена. В опытах in vivo с экспериментально вызванным тромбозом наружной яремной вены комплекс плазмин — α2М расщеплял фибриновую основу тромба, что подтверждено гистологическими исследованиями [21]. Избирательное действие плазмина, связанного с α2М, на фибрин объясняется, вероятно, особенностями структуры фермента и субстрата. Как известно, особенностью плазмина является наличие в его молекуле ЛСУ, а в молекуле фибрина ЛУ, которые комплементарны ЛСУ фермента. Можно полагать, что для ЛУ фибрина возможен контакт с ЛСУ плазмина, входящего в комплекс с α2М. Не исключено, что при комплексообразовании молекула α2М может подвергаться конформационным изменениям, способствующим более эффективному действию плазмина.
α2М участвует в регуляции кининовой системы, являясь ингибитором основного кининобразующего фермента — калликреина [10]. Подобно плазмину, связанному с α2М, комплекс калликреин — α2М полностью угнетает биологическую активность калликреина: сокращение гладких мышц, сосудистую проницаемость, но сохраняет эстеразное действие. На секреторный калликреин α2М не оказывает влияния. В комплексе с α2М калликреин становится не чувствительным к инактивирующему действию своего основного ингибитора С1-эстеразы и ингибитора трипсина из соевых бобов. Приведенные данные свидетельствуют о том, что α2М не полностью блокирует каталитическое действие протеиназ, а лишь сужает субстратную специфичность.
Кроме уникальной регуляторной функции в отношении протеиназ широкого спектра действия α2М выполняет функцию переноса различных биосоединений и их удаления из кровотока путем рецепторного взаимодействия с мононуклеарными фагоцитами — моноцитами и макрофагами [84]. Последняя функция связана с наличием специальной структуры в молекуле α2М («участка узнавания»), которая распознается клеточными рецепторами. Она существует самостоятельно и не имеет прямого отношения ни к участку «приманки», ни к внутреннему тиоэфиру. «Участок узнавания» расположен в 138 аминокислотном СООН-концевом домене, который можно легко выделить с помощью ограниченного расщепления метиламином. Как уже упоминалось, при взаимодействии тетрамерного α2М с протеиназами или аминами белок подвергается конформационным изменениям, переходя из медленной формы (S) в быструю (F). Первая из них проявляет способность угнетать протеиназы, не связываясь с клеточными рецепторами, вторая — модифицированная форма α2М — распознается клеточными рецепторами. Уровень циркулирующих комплексов протеиназа — α2М очень низок вследствие их быстрого выведения с помощью рецепторов, расположенных на гепатоцитах: время полужизни комплексов составляет 2–5 мин. Этот факт важен в отношении связывания и последующего удаления протеолитических ферментов из кровотока [123].
В условиях патологии в крови и тканях может накапливаться избыточное количество протеиназ не только эндогенного, но и экзогенного (бактериального) происхождения, которые оказывают деструктивное воздействие на белковые структуры, а также способствуют образованию вазоактивных веществ. По имеющимся данным [116], α2М угнетает протеиназы из Staphylococcus aureus, Proteus vulgaris, Bacillus и металлопротеиназы, выделенные из яда змей (Crotalus atrox venom). В этих случаях α2М обеспечивает контроль за активностью протеолитических ферментов путем их быстрого связывания и выведения из организма. Так, при диссеминированном внутрисосудистом свертывании крови α2М выполняет функцию нейтрализации активированных протеиназ крови, а также играет роль поддерживающего ингибитора в тех случаях, когда активность других ингибиторов (АТIII, α2М, α1ИП) исчерпывается, выполняя их основную функцию инактивации протеиназ [106]. Кроме того, α2М может связывать протеолитические ферменты, диссоциирующие из обратимых комплексов, с ингибиторами и выводить их из циркуляции.
Защитное действие α2М не ограничивается сосудистым руслом. Этот высокомолекулярный глобулин, как уже отмечалось, присутствует и в других биологических жидкостях — плевральной, амниотической, синовиальной, что может указывать на его роль в регуляции протеолитических систем во внесосудистых пространствах. Следует указать на то, что мононуклеарные фагоциты, с одной стороны, вовлекаются в процесс регулируемого рецепторами эндоцитоза, а с другой — они участвуют в синтезе и секреции α2М, обеспечивая независимо от плазмы крови источник этого белка.
В последние годы расшифрованы рецепторные механизмы связывания комплекса протеиназа — α2М клетками, имеющими на мембранах специфические рецепторы белковой природы. Обнаружено два их типа. Первый — одновременно является рецептором липопротеинов низкой плотности (ЛПНП) — рецептор эндоцитозного типа, экспрессированный на макрофагах, фибробластах, гепатоцитах, гладкомышечных и других клетках. Этот рецептор, впервые описанный F. Van Leuven и соавторами [116], взаимодействует также с аполипопротеином Е, тканевым и урокиназным активатором плазминогена и липопротеинлипазой (ЛПЛ) — ферментом, участвующим в катаболизме липопротеинов, богатых триглицеридами. Эффект возбуждения рецептора сопровождается модификацией связывания и катаболизма ЛПНП макрофагами, угнетением пролиферации фибробластов, индуцированных трансформирующим фактором роста. Второй рецептор, обозначенный как сигнальный, связан с протеином G моноцитов и распознается лишь активированной формой 2М. Активация этого рецептора активной формой α2М способствует мобилизации кальция из эндоплазматического ретикулума и увеличению его концентрации в цитоплазме, ускорению синтеза фактора активации тромбоцитов, а также индукции синтеза цАМФ и др. [88а, 88б].
Наиболее подробно изучена структура рецептора к ЛПНП. Он представляет собой сложный высокомолекулярный белок — гетеродимер, состоящий из 3 субъединиц с молекулярном массой, равной соответственно 500, 85 и 40 кДа [84]. Первые две субъединицы связаны с мембраной клетки. Клонирована мДНК рецептора α2М, которая состоит из 14 849 оснований. В ее кодировании участвуют 4545 кодонов. Ген рецептора находится в 12 хромосоме (12q13-q14).
Большой интерес представляют данные о роли α2М в регуляции роста и тканевой дифференциации. Она реализуется путем специфического комплексообразования с различными цитокинами: факторами роста, интерлейкинами, эозинофильными катионными белками и др. Молекулярные механизмы этих сложных взаимодействий мало изучены. Установлено, что нативный α2М является одним из переносчиков факторов роста, cреди них — трансформирующий фактор роста (ТGF) 1 и 2, тромбоцитарный фактор роста (PDGF), фактор роста нервов , фактор некроза опухолей (TNF ), интерлейкин IL-1 и IL6, сосудистый эндотелиальный фактор роста (VEGF). По имеющимся данным [48], α2М, активированный метиламином, в 3 раза интенсивнее связывается с PDGF по сравнению с нативным α2М. Полагают, что α2М может регулировать рост клетки двумя механизмами. Первый основан на активном переносе ряда цитокинов, которые обладают большим сродством к активной форме α2М. Второй механизм заключается в прямом связывании α2М с сигнальным рецептором макрофагов, обладающим высокой аффинностью по отношению к активированной конформации α2М, и не зависит от функции переноса цитокинов [84].
Имеются сообщения о влиянии α2М (медленной и быстрой формы) на активность фактора роста тромбоцитарного происхождения (PDGF-BB) [48]. Изучалось влияние свободного и связанного с плазмином α2М на пролиферацию клеток легочных фибробластов. Комплекс плазмин — α2М угнетал клеточную пролиферацию, вызываемую PDGF, на 80–90%, а нативная форма α2М таким эффектом не обладала. Авторы высказали предположение о том, что нативный α2М во внесосудистых тканях служит резервуаром для PDGF, который освобождается при снижении pH, а активированный протеиназой α2М способствует выведению и инактивации указанного фактора PDGF-BB посредством рецептора ЛПНП. Кроме того, при воспалении высвобождаются протеиназы, секретируемые макрофагами и нейтрофильными гранулоцитами, и соединяющиеся с α2М, который превращается при этом в быструю форму, тем самым инициируя выведение фактора роста посредством указанного рецепторного механизма.
Особый интерес вызвало свойство медленной и быстрой формы α2М взаимодействовать с TGF , который играет существенную роль в процессах дифференциации и роста клеток, ангиогенезе, подавлении иммунных реакций [108]. Он также контролирует синтез внеклеточных матричных белков (фибрина, коллагенов, протеогликанов), угнетает фагоцитоз и цитотоксичность Т-клеток, макрофагов. Повышение образования этого фактора приводит к увеличению экспрессии адгезивных молекул и гликопротеидов межклеточного матрикса, что может быть причиной фиброза в различных органах — почках, легких, печени. Гиперпродукция этого цитокина наблюдается при коронарном артериосклерозе.
Согласно представлению К. Ransberger (1999), перорально применяемые полиферментные препараты уменьшают гиперпродукцию TGF макрофагами и другими клетками, а также экспрессию мРНК этого фактора. В основе этого действия лежит способность всосавшихся в кровь протеиназ взаимодействовать с α2М с образованием активной формы последнего, которая способна необратимо связывать TGF с потерей его биологической активности и последующим удалением из циркуляции посредством фагоцитоза. Медленная форма α2М может служить лишь переносчиком этого цитокина, который не теряет активности и не элиминируется из организма.
Таким образом, α2М выполняет ряд регуляторных функций: а) инактивирует и выводит факторы роста; б) усиливает их активность; в) защищает факторы роста от инактивации протеиназами; г) служит внеклеточным резервуаром факторов роста.
Кроме цитокинов α2М взаимодействует с другими биосоединениями и, в частности ЛПЛ — одним из ключевых ферментов обмена липопротеидов [120]. Гепарин (кофактор фермента) частично препятствует образованию комплекса α2М с ЛПЛ.
Новые данные свидетельствуют об участии α2М в синтезе NO — важнейшего фактора цитотоксической активности макрофагов [84]. В культуре клеток Raw-264.7 нативная форма α2М повышает как синтез NO макрофагами мышей, так и их функциональный эффект без связывания со специальными рецепторами плазменных мембран. В основе этого лежит способность нативного и обработанного метиламином α2М повышать активность фермента NО-синтазы, катализирующей синтез NO из L-аргинина при участии O2 и НАДФН. В результате этого повышается NО-зависимая цитотоксичность макрофагов и наблюдается запрограммированная гибель этих клеток — апоптоз. Полагают, что этот эффект обусловлен способностью α2М инактивировать TGF .
Таким образом, можно полагать, что α2М — важный компонент макрофагальной аутокринной регуляции, в том числе и образования клеточного NO. С NO связаны многие физиологические и патологические процессы, поэтому изучение механизмов регуляции его синтеза имеет большое теоретическое и практическое значение. Считают, что α2М, синтезирующийся макрофагами и фибробластами, действует в межуточной ткани, в частности, в зоне воспаления, инфицированных очагах, в интиме поврежденных сосудов, васкуляризованных опухолях. α2М может регулировать синтез NO макрофагами и повышать клеточную активность даже без проникновения внутрь клеток и без связывания со специфическими рецепторами плазменных мембран.
В связи с важной ролью α2М в регуляции ферментов протеолиза, иммунологических реакциях проводят исследование этого белка и его молекулярных форм. Для количественного определения его в биологических жидкостях применяют иммунохимические и энзиматические методы. Первые основаны на определении количества белка с использованием специфических антисывороток, вторые — на способности α2М образовывать с протеиназами активный комплекс, не чувствительный к ингибитору трипсина из соевых бобов [13]. Энзимологические методы отличаются быстротой выполнения, доступностью, воспроизводимостью и могут быть выполнены в любой клинико-диагностической лаборатории. Они нашли широкое применение в клиниках Украины и стран СНГ.
Особый интерес представляет изучение α2М при заболеваниях, в патогенезе которых важную роль играет усиление активации протеолитических ферментов в пораженной ткани и крови, что вызывает нарушение динамического равновесия между активностью протеиназ и их ингибиторами (острый панкреатит, ожоговая болезнь, злокачественные новообразования, диссеминированное внутрисосудистое свертывание крови). Данные по этому вопросу обобщены в монографии К.Н. Веремеенко и соавторов [13].
В литературе имеются указания на возможность применения препаратов 2М в качестве терапевтического средства для повышения интенсивности репарационных процессов, стимуляции лейко- и эритропоэза, при лучевой болезни и др. [18].
Таким образом, α2М выполняет различные биологические функции. Углубленное изучение этого белка в последние годы, расшифровка первичной и третичной структуры способствовали лучшему пониманию его физиологической роли. α2М играет существенную роль не только в регуляции различных протеолитических систем крови и тканей. Результаты исследований показали, что этот высокомолекулярный гликопротеид участвует в процессах роста, дифференциации тканей, многих иммунологических реакциях, воспалительных, аллергических процессах. Такие многообразные функции α2М объясняются его необычной макроструктурой, которая обеспечивает, с одной стороны, стерическое угнетение протеолитических ферментов широкого спектра действия, не затрагивая их активных центров, с другой — узнавание комплексов ферментов, связанных с α2М, клеточными рецепторами. Эти структурные особенности α2М важны для понимания молекулярных механизмов многих биохимических и иммунологических процессов. Исследование этого важнейшего глобулина крови и его молекулярных форм имеет не только теоретическое значение, но и расширяет возможности использования белка в медицинской практике в качестве диагностического и прогностического критерия течения ряда заболеваний и эффективности терапии.
Взаимодействие плазменных ингибиторов крови с протеиназами, используемыми для СЭТ (К.Н. Веремеенко, А.И. Кизим)
СЭТ, основанная на использовании комбинаций гидролитических энзимов, нашла широкое применение в лечении многих заболеваний [28–30, 111, 126]. В состав базового препарата вобэнзим входят ферменты протеолитического, амилолитического и липолитического действия. Препараты нового поколения (флогэнзим, вобэ-мугос Е) содержат лишь протеолитические ферменты растительного и животного происхождения, однако они по эффективности не уступают вобэнзиму, что свидетельствует о том, что именно протеиназы являются основой лечебного действия СЭТ, обусловленного их ключевой ролью в обмене веществ [113]. Для понимания терапевтических эффектов ведутся разноплановые исследования, направленные на выяснение действия протеиназ СЭТ на различные биохимические и иммунологические процессы.
Одной из центральных проблем теоретических основ СЭТ является выяснение возможности каталитического действия перорально вводимых ферментов в крови. Наличие мощной системы белковых ингибиторов плазмы, которые быстро связывают ферменты с полной или частичной потерей их активности, затрудняет понимание лечебных эффектов протеиназ. Между тем СЭТ предусматривает осуществление терапевтического действия после всасывания интактных каталитически активных форм энзимов.
Молекулярные механизмы взаимодействия применяемых перорально протеиназ с белковыми ингибиторами крови остаются недостаточно изученными. В связи с этим нами предпринято подробное исследование комплексообразования протеиназ, входящих в состав полиэнзимных препаратов, с ингибиторами плазмы крови. Для осуществления этого исследования требовалась разработка высокочувствительного метода определения активности протеиназ в циркулирующей крови.
Методы определения активности протеиназ
Прежде чем приступить к выполнению основной задачи была изучена субстратная специфичность протеиназ, входящих в состав полиэнзимных препаратов, с помощью некоторых белковых и синтетических субстратов. Эти сведения необходимы для отбора наиболее чувствительных методов определения активности коммерческих препаратов протеиназ животного (трипсин, химотрипсин) и растительного (папаин, бромелаин) происхождения. В качестве белкового субстрата был избран казеин, наиболее часто применяемый для определения активности высокоочищенных препаратов протеолитических ферментов. Нами был использован также низкомолекулярный белок — протамина сульфат. Из синтетических субстратов были выбраны БАПНА, БАЭЭ, N-Сукц-Лей-Лей-Цис-(Бенз)-пара-нитроанилид.
Коммерческие препараты протеиназ — трипсин, химотрипсин, бромелаин и папаин, а также полиэнзимные — таблетки вобэ-мугос Е, флогэнзим и ампулированная форма вобэ-мугос Е — были любезно предоставлены нам доктором З. Масиновски (Чехия).
Активность протеолитических ферментов по гидролизу казеина определяли с помощью модифицированного нами метода Кунитца [25]. Для получения линейной зависимости между количеством фермента и величиной оптической плотности (Е280) мы увеличили концентрацию казеина с 1 до 2%. Казеинрасщепляющую активность протеиназ выражали в мкмоль тирозина за 1 мин •10–2. Об эстеразной активности судили по количеству отщепившегося от БАЭЭ бензоил-L-аргинина (БА), которое выражали в мкмоль за 5 мин. Амидазную активность протеиназ оценивали по способности гидролизовать БАПНА и выражали в мкмоль пара-нитроанилина за 1 мин •10–3. Активность протеолитических ферментов по расщеплению протамина сульфата определяли с помощью разработанного нами метода [13] и выражали в мкмоль аргинина •10–3, образовавшегося из протамина сульфата за 1 мин. Активность цистеиновых протеиназ (бромелаина и папаина) определяли с помощью хромогенного субстрата — N-Сукц-Лей-Лей-Цис(Бенз)-пара-нитроанилида по методу Fukai и Kasafirec [63]. Содержание белка в препаратах ферментов определяли по методу Lowry [83].
Так как в состав полиэнзимных смесей входят коммерческие препараты протеиназ различной степени очистки, а также наполнители, для характеристики удельной активности ферментов в них определяли содержание белка.
Из табл. 3 видно, что наибольшее количество белка содержит химотрипсин и бромелаин.
Результаты опытов расщепления казеина трипсином, химотрипсином, папаином, бромелаином как в отдельности, так и в составе полиэнзимных смесей представлены на рис. 2.
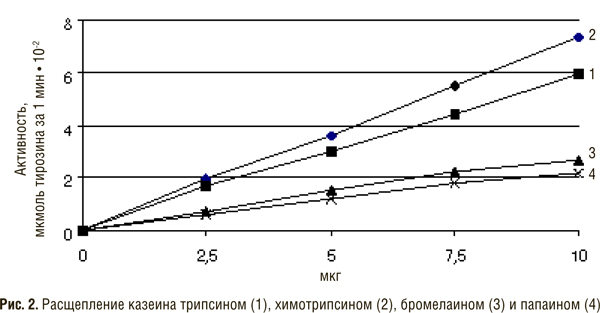
Видно, что все исследуемые препараты протеиназ интенсивно расщепляют казеин, причем наблюдается прямо пропорциональная зависимость между концентрацией фермента (2,5–10 мкг) и его активностью.
Протеиназы животного происхождения (трипсин, химотрипсин) расщепляют субстрат с большей скоростью, чем протеолитические ферменты растительного происхождения (папаин, бромелаин). Так, казеинрасщепляющая активность химотрипсина в 2 раза превышает таковую бромелаина и почти в 2,6 раза папаина.
В составе полиэнзимных смесей все исследуемые препараты сохраняют способность гидролизовать казеин. Наибольшую активность по отношению к этому субстрату проявлял вобэ-мугос Е, выпускаемый в виде таблеток. Наименее активен был флогэнзим (рис. 3).
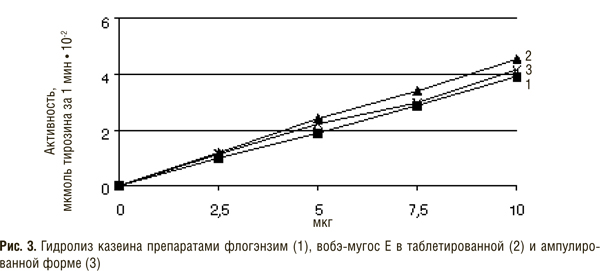
Изучение действия протеиназ на синтетический субстрат БАПНА показало, что наиболее интенсивно его расщепляет трипсин, а химотрипсин обладает почти 10% активностью от таковой трипсина, что, вероятно, объясняется наличием в коммерческих препаратах химотрипсина примесей трипсина. Папаин и бромелаин в концентрациях от 2 до 8 мкг практически не проявляют амидазной активности, она обнаруживается лишь при наличии в пробах 100–400 мкг этих протеиназ. Притом скорость расщепления БАПНА папаином (400 мкг) была более чем в 3 раза выше, чем бромелаином (400 мкг) (рис. 4). Комбинированные препараты флогэнзим и вобэ-мугос Е (таблетки) гидролизовали этот субстрат с одинаковой скоростью, а вобэ-мугос Е в ампулированной форме — гораздо слабее (рис. 5).
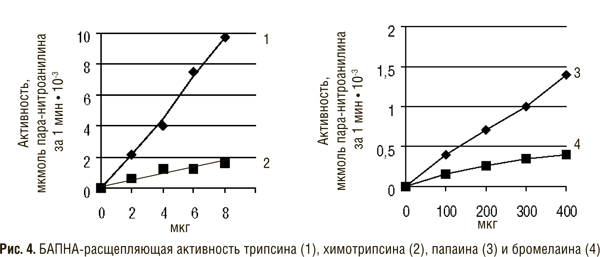

На рис. 6 изображено расщепление БАЭЭ полиэнзимными препаратами. За 5 мин реакции субстрата с 10 мкг препаратов вобэ-мугос Е и флогэнзим образовывалось соответственно 0,16 и 0,21 мкмоль БА. Более высокая эстеразная активность флогэнзима по сравнению с вобэ-мугосом Е, вероятно, объясняется тем, что в состав первого входит больше трипсина (35 против 22%), который и определяет активность полиэнзимной смеси. Следует отметить, что наибольшая БАЭЭ-эстеразная активность присуща трипсину, в несколько раз меньшая химотрипсину и папаину, очень низкая бромелаину. Так, эстеразная активность 10 мкг трипсина и химотрипсина составляет соответственно 0,075 и 0,018 мкмоль БА за 1 мин, 25 мкг папаина — 0,045 мкмоль и 200 мкг бромелаина — 0,009 мкмоль БА за 1 мин.
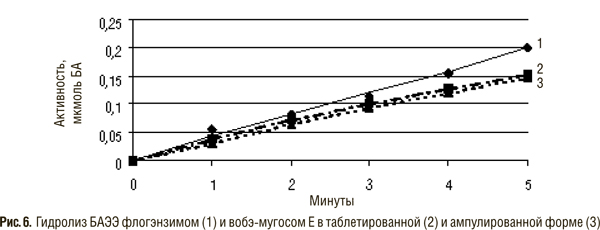
Таким образом, протеиназы растительного происхождения (папаин и бромелаин) по сравнению с протеолитическими ферментами животного происхождения обладают значительно меньшей способностью гидролизовать казеин и проявляют слабую активность по отношению к синтетическим субстратам — БАПНА и БАЭЭ. Это послужило основанием для поиска более чувствительных субстратов для указанных цистеиновых протеиназ растительного происхождения. Мы остановились на щелочном белке протамина сульфата, в молекуле которого преобладают остатки аргинина, а трипсин и тиоловые протеиназы расщепляют в субстратах предпочтительнее пептидные связи, образованные карбоксильными группами аргинина и лизина. Ранее было установлено, что протамина сульфат является высокочувствительным субстратом для трипсина [12]. Разработаны условия определения активности исследуемых протеолитических ферментов: их концентрация, рН среды, время инкубации с субстратом. Показано, что пригодны лишь препараты протамина сульфата с минимальным количеством аргининсодержащих пептидов. Коммерческие препараты трипсина, как и высокоочищенные кристаллические, с большой скоростью расщепляли этот субстрат (рис. 7). Химотрипсин проявлял слабую протаминрасщепляющую активность (ПРА), обусловленную, вероятно, наличием в его составе небольших количеств трипсина. Высокоочищенный кристаллический химотрипсин в исследуемых концентрациях лишен способности гидролизовать протамина сульфат.

Как показали эксперименты, папаин и бромелаин в концентрации 0,25–2 мкг интенсивно расщепляли этот субстрат, причем активность бромелаина превышала таковую папаина (рис. 8).
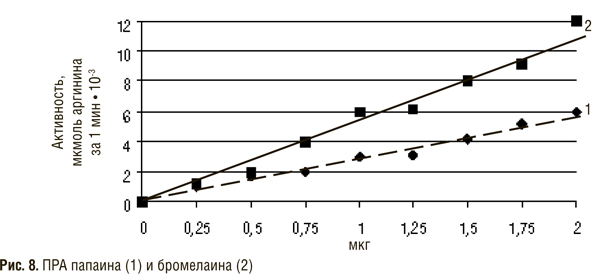
Существенно, что чувствительность теста с протамина сульфатом была на порядок выше, чем с казеином, и на 2 порядка, чем с БАПНА.
Полиэнзимные смеси обладают высокой ПРА: она определяется, как и в случае со свободным трипсином, при концентрации в пробе 0,01 мкг (рис. 9). При сравнительном анализе ПРА полиэнзимных препаратов и отдельных протеиназ, входящих в их состав, оказалось, что у первых она вдвое выше, чем у вторых. Установленный факт усиления активности протеиназ в составе комбинированных препаратов можно объяснить тем, что из-за различия специфичности протеиназы животного и растительного происхождения могут взаимно облегчать гидролиз пептидных связей в белковом субстрате.
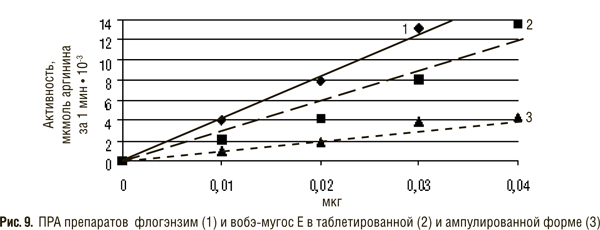
В последующих опытах для изучения взаимодействия протеиназ с плазменными ингибиторами мы использовали два субстрата: высокомолекулярный белок — казеин и низкомолекулярный аргининсодержащий — протамина сульфат, который, согласно нашим данным, является наиболее чувствительным к гидролизу исследуемыми протеиназами.
Влияние ингибиторов плазмы крови на активность протеиназ, используемых для СЭТ
Расшифровка механизмов действия применяемых перорально энзимных комбинаций требует детального исследования их взаимодействия с плазменными (сывороточными) ингибиторами, поскольку системный эффект связан с наличием активного фермента в кровеносном русле после его всасывания из кишечника. Как известно, плазма крови содержит мощную систему ингибиторов, связывающую протеолитические ферменты животного и растительного происхождения, благодаря чему контролируется их активность. В литературе имеются данные изучения взаимодействия очищенных препаратов протеиназ (трипсина, химотрипсина, плазмина, тромбина и др.) с сывороточными ингибиторами [14–16, 21]. Эти данные не относятся к коммерческим препаратам бромелаина, папаина, трипсина, химотрипсина, которые представляют собой комплексы, состоящие из нескольких протеиназ с различной специфичностью и отношением к ингибиторам.
Учитывая вышеизложенное, мы изучали влияние ингибиторов плазмы крови на активность указанных протеиназ и их комбинаций, которые предложены для СЭТ.
В опытах in vitro исследовалось действие плазменных ингибиторов протеиназ на активность энзимов животного (трипсина и химотрипсина) и растительного (папаина и бромелаина) происхождения, а также их смесей, которые входят в состав коммерческих препаратов флогэнзим и вобэ-мугос Е. Эффективность ингибиторов оценивали по степени торможения расщепления протеиназами казеина и низкомолекулярного аргининсодержащего белка протамина сульфата.
В первой серии опытов было изучено влияние различных количеств плазмы крови (разбавленной в 100 раз) на активность отдельных протеиназ и их смесей. Определяли скорость гидролиза казеина при увеличении количеств плазмы и постоянной концентрации фермента (10 мкг трипсина, химотрипсина и 20 мкг папаина, бромелаина). Суммарное содержание ингибиторов, определяемое в тесте с казеином, варьировало от 2 до 8 мкг инактивированного трипсина, т.е. в пробе находился избыток фермента. Смесь фермента с ингибитором выдерживали 15 мин при температуре 22 °С для образования комплекса, после чего определяли активность не связавшегося с ингибитором фермента (ее выражали в процентах от исходной активности, принятой за 100). На рисунках приведены средние результаты 5 опытов.
Как видно на рис. 10, разбавленная в 100 раз плазма крови подавляет активность всех исследуемых протеиназ, но в разной степени, что зависит от природы используемого фермента. Так, активность трипсина и химотрипсина практически полностью угнетается 0,8 мл плазмы крови. Эти результаты согласуются с полученными нами ранее: при избытке трипсина по отношению к ингибиторам плазмы крови распределение фермента между двумя основными ингибиторами — α1ИП и α2М — происходит соответственно их молярному содержанию: преобладающее количество связывается с α1ИП (~ 90%), полностью блокируя трипсин, и лишь небольшая часть фермента — с α2М (~ 10%), в комплексе с которым сохраняется незначительная казеинолитическая активность (5–7% от исходной) [37].

Казеинрасщепляющая активность протеиназ растительного происхождения (папаина и бромелаина) в условиях опытов (избыток ферментов над суммой ингибиторов протеиназ) снижается лишь на 20%, что указывает на меньшую чувствительность тиоловых протеолитических ферментов, по сравнению с сериновыми, к инактивирующему действию плазмы крови.
В последующих опытах исследовали влияние плазмы крови (1:100) на способность комплексных протеолитических препаратов флогэнзим и вобэ-мугос Е расщеплять казеин. При этом в реакционных смесях содержались различные количества плазмы крови (общее содержание ингибиторов в тесте с казеином составляло 3–15 мкг/мл) и постоянная концентрация фермента (20 мкг).
На рис. 11 видно, что в присутствии 0,1–0,6 мл плазмы крови, разбавленной в 100 раз, расщепление казеина полиэнзимными препаратами снижается почти линейно. Степень торможения активности флогэнзима ингибиторами плазмы была несколько меньшей, чем таковая вобэ-мугоса Е (77 и 85% соответственно). Этот факт можно объяснить различием в составе полиферментных смесей: флогэнзим содержит одну сериновую протеиназу (трипсин), а вобэ-мугос Е — две (трипсин и химотрипсин), которые в большей степени инактивируются плазменными ингибиторами.
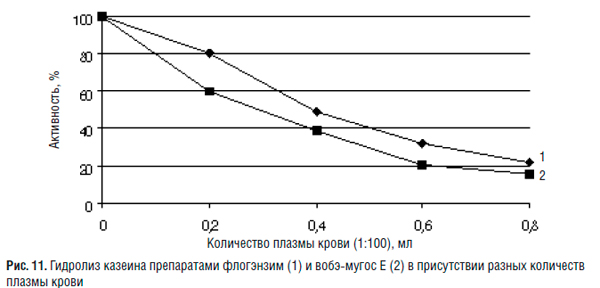
Мы исследовали гидролиз протамина сульфата как отдельными протеиназами, так и ферментными смесями при разных концентрациях плазмы крови. Использование более чувствительного протаминового теста по сравнению с казеиновым позволило брать для пробы меньшие концентрации ферментов (1 мкг бромелаина, 2 мкг папаина и 0,03–0,04 мкг комбинированных препаратов).
На рис. 12 показано расщепление протамина сульфата папаином и бромелаином при разных количествах плазмы крови человека. Видно, что активность папаина резко тормозится малым количеством плазмы (0,1 мл); прибавление же больших количеств — не приводит к дальнейшему заметному угнетению активности фермента. Аналогичная закономерность наблюдается и в отношении бромелаина. Характерно, что оба фермента полностью не угнетаются даже избыточными количествами плазмы крови. Остаточная активность для папаина и бромелаина составляла соответственно 52 и 32%.
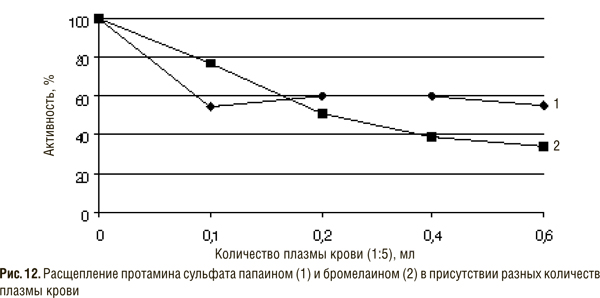
Мы предположили, что остаточная активность указанных тиоловых протеиназ растительного происхождения присуща энзимам, связанным с α2М, который ограничивает субстратный спектр действия ферментов, позволяя им расщеплять низкомолекулярные субстраты.
В целях подтверждения этого предположения было изучено действие выделенного из плазмы крови человека α2М на ПРА папаина. На рис. 13 видно, что низкие концентрации α2М (2,5–5 мкг) оказывают выраженный тормозящий эффект на активность фермента, а при повышении концентрации α2М скорость инактивации замедляется. При насыщении α2М папаином (зона эквивалентности составляет 28 мкг ингибитора), вероятно, образуется комплекс, в котором фермент становится малочувствительным к избытку α2М. Остаточная активность фермента — около 30%. В комплексе с α2М трипсин, как было показано ранее, сохраняет 68–75% от исходной активности [13, 37].

Эти и предыдущие результаты согласуются с предположением о том, что тиоловые протеиназы, как и трипсин, осуществляют свою каталитическую функцию не в свободном состоянии, а в связанном с α2М виде: ферментативная реакция происходит в тройном комплексе: α2М — фермент — субстрат, в котором активный центр способен контактировать с молекулой протамина.
α1ИП, вероятно, не играет существенной роли в инактивации исследуемых тиоловых протеиназ, поскольку при избытке ферментов по сравнению с плазменными ингибиторами активность энзима в тесте с казеином угнетается лишь на 20%, т.е. на величину, близкую к доле 2М в антипротеиназном потенциале плазмы крови (трипсин и химотрипсин в этих условиях практически полностью инактивируются).
Следующая серия опытов посвящена выяснению вопроса о действии ингибиторов плазмы крови (1:5) на ПРА протеиназ, включенных в состав полиэнзимных смесей (препараты флогэнзим и вобэ-мугос Е). Установлено (рис. 14), что ингибиторы плазмы крови вызывают торможение активности флогэнзима, которое наиболее выражено при наличии в пробе 0,1 мл плазмы крови. В присутствии 0,2–0,6 мл плазмы крови ПРА этого ферментного препарата несколько увеличивается. При наличии в пробе 0,6 мл плазмы крови выявляется примерно 40% от исходной активности флогэнзима. Аналогичная закономерность отмечена при изучении влияния разных количеств плазмы крови на активность препарата вобэ-мугос Е (ПРА при максимальном количестве плазмы составляет 48%).

Полученные данные показывают, что плазма крови при любых концентрациях блокирует активность ферментных препаратов флогэнзим и вобэ-мугос Е лишь частично, но полного торможения не наблюдается. Можно полагать, что остаточная (неингибируемая) активность присуща комплексу протеиназа — α2М, в котором связанные ферменты активны по отношению к протамина сульфату, но не расщепляют высокомолекулярные белки (казеин).
Исследовали гидролиз протамина сульфата в смесях, содержащих различные концентрации комплексных ферментных препаратов (0,01–0,04 мкг) при постоянном количестве цельной плазмы крови, содержащей 250 мкг ингибиторов (в тесте с казеином). Результаты проведенных опытов (рис. 15) показывают, что с повышением концентрации ферментов ПРА повышается почти линейно при использовании как флогэнзима, так и вобэ-мугоса Е. (В этих опытах гидролитическое действие ферментных смесей на казеин отсутствует). Факт повышения протеолитической активности в условиях большого избытка ингибиторов плазмы крови можно объяснить тем, что вследствие высокого сродства α2М к протеиназам последние в основном связываются с ним с образованием активного комплекса. По нашим данным, константа скорости реакции трипсина с α2М в 6 раз больше константы реакции с α1ИП. Из всего количества связанного фермента только часть, прореагировавшая с α2М, обнаруживается по расщеплению протамина сульфата. Интенсивность этого гидролитического действия, очевидно, пропорциональна содержанию комплекса фермента с α2М [37].
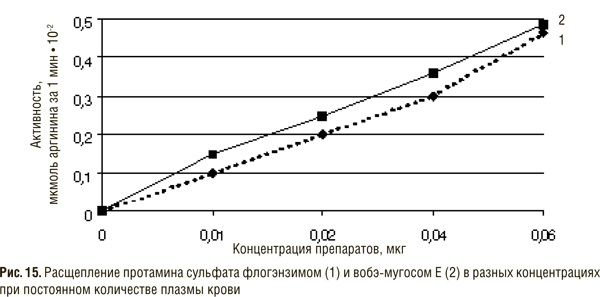
Предложенный метод определения суммарной протеолитической активности сериновых и цистеиновых протеиназ с помощью протамина сульфата характеризуется высокой чувствительностью. Однако он не позволяет дифференцировать активность энзимов растительного происхождения от трипсина, входящего в состав полиэнзимных препаратов. В связи с этим мы попытались разработать специфический метод, позволяющий выявлять активность папаиноподобных протеиназ в сыворотке крови. С этой целью использовали два хромогенных субстрата — N-Сукц-Гли-Лей-Цис(Бенз)-пара-нитроанилид и N-Сукц-Лей-Лей-Цис(Бенз)-пара-нитроанилид, которые были предложены для определения активности очищенных препаратов бромелаина и папаина [63]. Нами подобраны оптимальные условия определения этих ферментов: концентрация субстрата и фермента, время и температура реакции.
Показательно, что пептидные анилиды расщепляются бромелаином и папаином, причем ферменты проявляют высокую активность по отношению к N-Сукц-Лей-Лей-Цис(Бенз)-пара-нитроанилиду. В связи с этим в последующих опытах был использован этот субстрат.
На рис. 16 видно, что наблюдается линейная зависимость между скоростью реакции и концентрацией ферментов. Наибольшей активностью обладает папаин, меньшей — бромелаин. Активность двух полиэнзимных препаратов по отношению к N-Сукц-Лей-Лей-Цис(Бенз)-пара-нитроанилиду практически не отличается. В условиях опыта трипсин и химотрипсин лишены способности гидролизовать этот субстрат.
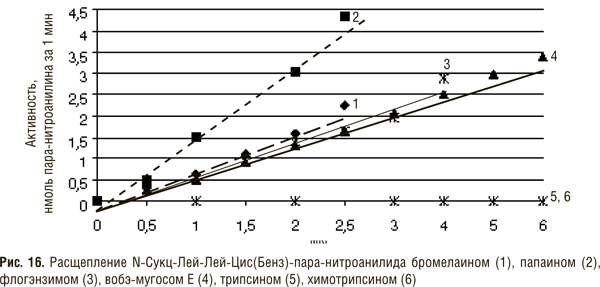
Особый интерес представляло выяснить, расщепляется ли N-Сукц-Лей-Лей-Цис(Бенз)-пара-нитроанилид полиэнзимными препаратами и их компонентами (тиоловыми протеиназами) в присутствии избытка сывороточных ингибиторов.
Согласно полученным результатам, как бромелаин и папаин, так и флогэнзим и вобэ-мугос E при наличии в реакционной смеси избытка сывороточных ингибиторов сохраняют способность гидролизировать указанный хромогенный субстрат (рис. 17). Обращает внимание тот факт, что в присутствии сыворотки крови активность бромелаина значительно выше, чем свободного фермента (сравнить с кривой 1 на рис. 16).
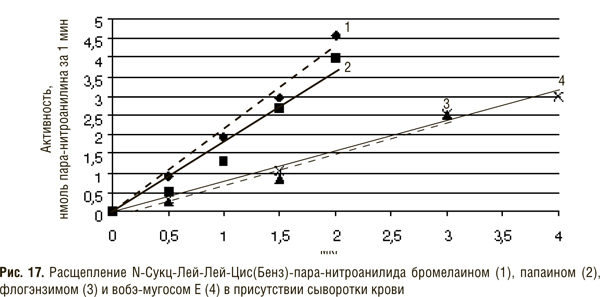
Можно полагать, что добавленный к сыворотке бромелаин активирует эндогенные зимогены протеиназ, близкие по специфичности действия папаиноподобным ферментам. Природа этих неактивных предшественников пока не известна и требует дальнейшего изучения.
Таким образом, в результате проведенных исследований выявлены существенные различия в действии ингибиторов протеиназ плазмы крови на активность протеолитических ферментов растительного (бромелаина и папаина) и животного (трипсина, химотрипсина) происхождения. Первые менее чувствительны к инактивации плазменными ингибиторами, чем вторые. Основным ингибитором растительных энзимов в отличие от сериновых протеиназ животного происхождения является α2М, в комплексе с которым они сохраняют значительную часть протеолитической (протаминрасщепляющей) активности. Можно предположить, что избирательное расщепление протамина сульфата бромелаином, папаином, трипсином в присутствии плазмы крови связано с образованием комплекса фермент — α2М, который сужает диапазон каталитической функции энзима, делая его более специфическим. α2М в отличие от α1ИП характеризуется более высоким сродством к исследуемым протеиназам, поэтому в присутствии большого избытка ингибиторов протеолитические ферменты связываются преимущественно с ним, сохраняя способность гидролизовать протамина сульфат и, по-видимому, другие субстраты. Кроме того, комплексы протеиназ с α2М становятся недоступными для других плазменных ингибиторов.
Разработанный нами протаминовый тест позволяет определять нанограммовые количества ферментов комбинированных препаратов флогэнзим и вобэ-мугос Е (10–40 нг), т.е. количества, которые не удается выявить известными методами с помощью белковых и синтетических субстратов. Чувствительность метода в сотни раз выше, чем при использовании казеина, гемоглобина, БАПНА. Обращает на себя внимание тот факт, что ПРА смеси протеиназ, добавленных к плазме крови, выше суммарной активности отдельных энзимов, входящих в их состав. Это имеет большое значение для применения полиферментных комбинаций с лечебной целью. Чувствительность метода определения специфической протеолитической активности полиэнзимных смесей можно повысить за счет удлинения ферментативной реакции (в предложенном методе она составляла 10 мин).
Разработанный метод определения ПРА был использован для выявления в сыворотке крови животных полиэнзимных смесей после их перорального введения. Он позволяет проследить клиренс всосавшихся из кишечника в кровь ферментов, время их циркуляции и удаления из сосудистого русла, что имеет существенное значение для обоснования методов их применения и определения эффективных доз препаратов.
Влияние полиэнзимных препаратов на фибриноген и фибрин (А.И. Кизим)
О возможности использования комплексных ферментных препаратов в качестве средств, улучшающих реологические свойства крови и действующих на фибринолиз, известно мало. Экспериментальные биохимические работы, направленные на выяснение их действия на фибриноген и фибрин, немногочисленны. Между тем выполнение такого рода исследований представляет несомненный интерес, так как фибриноген и фибрин являются основными белками заключительного этапа свертывания крови и фибринолиза. Основная функция первого заключается в его участии в гемостазе. Фибриноген представляет собой единственный субстрат, из которого под влиянием тромбина образуется сгусток фибрина. Благодаря сложной структуре и высокой реактивности фибриноген взаимодействует со многими клеточными структурами и компонентами крови [60]. Этот асимметричный высокомолекулярный белок определяет вязкость крови. Связываясь с рецепторами на мембранах эпителиальных клеток, тромбоцитов, он стимулирует адгезию последних, а также вызывает обратимую агрегацию эритроцитов. Концентрация фибриногена в плазме крови контролируется уровнем продуктов его распада (ПРФ), которые способствуют его синтезу прямым путем (стимуляция гепатоцитов) или опосредованным — через выработку моноцитами-макрофагами гепатоцитстимулирующего фактора [59, 61].
Фибрин защищает организм от потери крови при повреждении сосудов, взаимодействуя с клеточными структурами, участвует в регенерации тканей. Кроме того, он специфически с помощью лизиновых участков в молекуле связывает плазминоген и его активаторы, способствуя избирательному расщеплению сгустка фибрина в кровеносном русле.
Имеются многочисленные публикации, в которых приведены результаты исследования уровня фибриногена при различных сердечно-сосудистых заболеваниях [26, 60, 61, 66, 76]. На основании анализа данных, полученных при исследовании 156 888 больных учеными из США, Англии, Швеции и Японии, сделано заключение о том, что содержание фибриногена является более значимым фактором риска развития сердечно-сосудистых заболеваний, чем уровень холестерина. Обнаружено, что острый инфаркт миокарда сопровождается гиперфибриногенемией, причем повторные инфаркты чаще возникают у больных с концентрацией фибриногена в острый период более 7,5 г/л [61]. Содержание фибриногена и вязкость крови значительно повышались у больных с кратковременными ишемическими приступами. Отмечено его увеличение и по мере прогрессирования коронарного атеросклероза [66]. Риск развития инфаркта миокарда в 6 раз выше у больных, у которых уровень фибриногена превышает 3,5 г/л.
Повышение концентрации фибриногена выявлено у пациентов с гипертонической болезнью, при этом отмечена положительная корреляция с показателями артериального давления [61]. Гиперфибриногенемия характерна также для больных сахарным диабетом [61]. Имеется тесная связь между уровнем глюкозы в крови и фибриногена. Определение последнего в крови может иметь прогностическое значение в отношении диагностики сосудистых осложнений инсулиннезависимого сахарного диабета II типа.
Проанализирована связь между содержанием фибриногена, курением и развитием сердечно-сосудистых заболеваний [128]. Показано, что концентрация фибриногена у курящих выше, чем у некурящих. У женщин этот показатель превышает таковой у мужчин.
Выявлена зависимость уровня фибриногена от времени года у лиц пожилого возраста: он на 23% выше в зимние месяцы по сравнению с летними, что согласуется с клиническими наблюдениями о возрастании риска развития инфаркта миокарда зимой [109].
Содержание фибриногена повышается у людей, подвергающихся стрессам, у больных со II типом гиперлипопротеинемии и гиперхолестеринемией. Содержание фибриногена положительно коррелирует с уровнем холестерина, триглицеридов и ЛПНП.
Таким образом, имеющие данные позволяют предположить наличие причинной связи между развитием атеросклероза, инфаркта миокарда и уровнем фибриногена. Об этом свидетельствует следующее. Фибриноген определяет реологические свойства крови, способствуя адгезии и агрегации тромбоцитов, вызывает обратимую агрегацию эритроцитов. Именно эти механизмы реализуются как на начальных этапах формирования липидной бляшки, так и на осложненных стадиях развития атеросклероза.
С учетом вышеизложенного нами было изучено расщепление препаратами протеиназ животного и растительного происхождения, а также их смесями вобэ-мугос Е и флогэнзим фибриногена и фибрина при наличии и отсутствии ингибиторов плазмы крови.
Стандартные препараты протеиназ — трипсин, химотрипсин, папаин и их комбинации, входящие в состав вобэ-мугоса Е и флогэнзима, — были предоставлены нам фирмой «Мукос Фарма Лтд». Препарат фибриногена, полученный из I фракции белков плазмы крови по Кону с помощью разработанного нами метода, содержал 75–80% белка, свертываемого тромбином. Тромбин фирмы «Симко» (Львов) обладал активностью 1000 NIH ед/мг белка.
Фибриногенолитическая активность протеиназ определяли по интенсивности расщепления фибриногена. Его содержание определяли методом В.А. Белицера и соавторов [3], основанным на ферментативном превращении фибриногена в фибрин под действием тромбина в присутствии ионов кальция и монойодацетата, предотвращающего стабилизацию фибрина ХIII фактором свертывания крови и устраняющего удерживание сгустком сывороточных белков, что облегчает растворение сгустка. Определение фибриногенолитической активности исследуемых протеиназ проводили следующим образом. В серию пробирок вносили по 0,2 мл 0,5% раствора фибриногена, 0,6 мл 0,05 М мединалового буфера (рН 7,6) и 0,1 мл фермента (1–4 мкг). Смесь помещали в ультратермостат с температурой 37 °С и через различные промежутки времени (от 5 до 120 мин) определяли содержание нерасщепленного фибриногена [3].
При исследовании действия протеиназ и их полиэнзимных смесей на расщепление фибриногена в присутствии ингибиторов плазмы крови в пробирки вносили по 0,2 мл плазмы крови, затем прибавляли 0,1 мл протеиназ (20–50 мкг) и 1,5 мл 0,06 М фосфатного буфера (рН 7,6). Смеси инкубировали при 37 °С и через 60–240 мин определяли уровень нерасщепленного фибриногена. В тех же пробах после удаления фибриногена определяли количество ПРФ иммуноферментным методом [20].
При изучении влияния отдельных протеиназ и входящих в состав флогэнзима и вобэ-мугоса Е на лизис фибрина в серию пробирок вносили 0,2 мл 0,5% раствора фибриногена, 0,7 мл 0,05 М фосфатного буфера (рН 7,6), 0,1 мл тромбина (100 NIH ед) и 0,1 мл раствора фермента или полиэнзимных препаратов (1–60 мкг). После образования сгустка отмечали время его лизиса, которое служило мерой активности фермента.
Результаты опытов по изучению способности трипсина, химотрипсина, бромелаина, папаина и их комбинаций в составе препаратов флогэнзим и вобэ-мугос E расщеплять фибриноген обобщены в табл. 4 и 5.
Из данных табл. 4 следует, что сериновые протеиназы трипсин и химотрипсин интенсивно гидролизуют фибриноген. Так, последний полностью расщепляется 1 мкг трипсина за 30 мин, а 2 мкг — за 3 мин. Химотрипсин гидролизует фибриноген с меньшей скоростью, чем трипсин: при концентрации 1 мкг за 120 мин расщепляется 77% субстрата от исходного, 2 мкг вызывает 100% расщепление фибриногена за 10 мин.
Протеиназы растительного происхождения в концентрации 1–4 мкг гидролизуют фибриноген, но с меньшей интенсивностью, чем трипсин и химотрипсин. Бромелаин обладает более выраженной фибриногенолитической активностью по сравнению с папаином. Так, 2 мкг бромелаина расщепляют фибриноген за 60 мин, 4 мкг — за 30 мин, а 1–2 мкг папаина за 60–120 мин гидролизует этот белок на 10%, а 4 мкг — на 74%.
Данные о фибриногенолитическом действии полиэнзимных препаратов приведены в табл. 5. 2 мкг препарата вобэ-мугос Е полностью переваривают фибриноген за 30 мин. Флогэнзиму свойственна более выраженная фибриногенолитическая активность: при концентрации ферментной смеси 1 мкг субстрат расщепляется за 30 мин, а при концентрации 2 мкг — за 5 мин. Более эффективное действие флогэнзима по сравнению c вобэ-мугосом Е на фибриноген, по-видимому, обусловлено тем, что в состав первого входят трипсин и бромелаин, которые интенсивнее гидролизуют фибриноген (в составе второго препарата имеется папаин, слабо гидролизирующий этот белок). Расчеты показывают, что фибриногенолитическая активность флогэнзима и вобэ-мугоса Е значительно больше, чем сумма активностей отдельных протеиназ, входящих в состав лекарственных препаратов.
Изучали также влияние протеиназ и их смесей, добавленных к плазме крови, на гидролиз фибриногена. Эти результаты приведены в табл. 6.
Показано, что в присутствии плазмы крови фибриноген практически не расщеплялся всеми протеиназами и их полиэнзимными комбинациями (в концентрации 20 мкг). Незначительная фибриногенолитическая активность выявлена лишь через 4 ч инкубации в опытах с трипсином, флогэнзимом и вобэ-мугосом Е. С повышением концентрации протеиназ до 50 мкг расщепление фибриногена наблюдалось, причем наибольшей активностью обладал бромелаин: за 2 ч расщеплялось 94,2% от исходного фибриногена, а с увеличением инкубации до 240 мин субстрат полностью гидролизовался. Химотрипсин, добавленный к плазме крови человека, также проявлял фибриногенолитическое действие, хотя и в меньшей мере, чем бромелаин. Очень слабой способностью гидролизовать фибриноген в присутствии плазмы крови обладал папаин. Трипсин, прибавленный к плазме крови, в концентрации 50 мкг вызывал свертывание фибриногена без добавления тромбина. Согласно имеющимся данным [9], трипсин ускоряет свертывание плазмы крови путем активации протромбина в тромбин.
Комплексные ферментные препараты вобэ-мугос Е и флогэнзим в присутствии плазмы крови обладают выраженной способностью расщеплять фибриноген: уже через 60 мин (концентрация протеиназ 50 мкг) происходит заметное уменьшение уровня фибриногена в плазме, а спустя 240 мин количество расщепленного фибриногена составляло соответственно 54 и 60%, т.е. оба препарата обладают близкой фибриногенолитической активностью (см. табл. 6).
Для получения дополнительных доказательств переваривания фибриногена протеиназами и их полиэнзимными смесями в присутствии плазмы крови определяли ПРФ с помощью иммуноферментного метода (рис. 18 и 19).

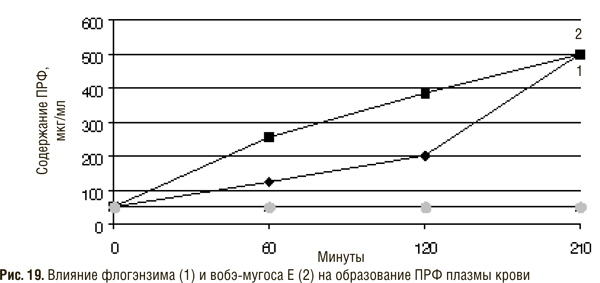
Установлено, что при наличии в реакционной смеси избытка ингибиторов плазмы крови как сериновые, так и тиоловые протеиназы вызывают образование ПРФ из фибриногена, причем их количество увеличивается с удлинением времени воздействия ферментов на субстрат (см. рис. 18).
Наибольшей способностью образовывать ПРФ обладают трипсин, химотрипсин, меньшей — бромелаин. У папаина это свойство проявляется в наименьшей степени, что согласуется с данными о слабой расщепляемости фибриногена этим ферментом (см. табл. 4). Отмечено также накопление ПРФ в присутствии ингибиторов плазмы крови при действии флогэнзима и вобэ-мугоса Е на фибриноген (см. рис. 19).
Таким образом, комплексные ферментные препараты флогэнзим и вобэ-мугос Е и входящие в их состав сериновые и цистеиновые протеиназы расщепляют фибриноген плазмы крови, что доказано уменьшением его содержания и параллельным накоплением ПРФ.
Результаты экспериментов по исследованию действия отдельных протеиназ и их смесей в составе полиэнзимных препаратов на гидролиз фибрина представлены в табл. 7 и 8.
Из табл. 7 видно, что все исследуемые протеиназы гидролизируют фибрин, но со скоростью, гораздо меньшей, чем фибриноген. Наиболее быстро фибрин расщеплял трипсин (2–20 мкг). Химотрипсин гидролизует фибриноген несколько слабее трипсина.
Цистеиновые протеиназы по своему действию на фибрин уступают протеиназам животного происхождения. Лизис фибрина бромелаином проявляется при концентрации фермента 10 мкг, в то время как трипсин и химотрипсин проявляют фибринолитическую активность уже при наличии в пробе 2 мкг фермента, т.е. чувствительность фибрина к сериновым протеиназам в 5 раз выше, чем к бромелаину. Фибринолитическое действие папаина проявляется лишь при его концентрации 20–60 мкг. Время лизиса сгустка фибрина под влиянием 60 мкг папаина составляет 49–56 мин, в то время как бромелаин при такой же концентрации переваривает этот белок за 10 мин.
Комбинированные протеиназные препараты вобэ-мугос Е и флогэнзим (табл. 8) обладают значительной фибринолитической активностью, которая проявляется при наличии в реакционной смеси 2 мкг препаратов (как и в опытах с трипсином). Скорость гидролиза фибрина флогэнзимом несколько ниже, чем вобэ-мугосом Е.
Была изучена фибринолитическая активность препаратов вобэ-мугос Е и флогэнзим и входящих в их состав ферментов в присутствии плазменных ингибиторов крови. Как показали опыты, ни в одном случае лизис фибрина в течение 5 ч инкубации не наблюдался. Эти результаты свидетельствуют о том, что ингибиторы плазмы крови полностью тормозят действие протеиназ и их полиэнзимных смесей на гидролиз фибрина.
Таким образом, проведенные исследования позволили установить, что широко используемые для СЭТ комплексные протеиназные препараты флогэнзим и вобэ-мугос Е обладают способностью интенсивно гидролизовать основные белки свертывающей и фибринолитической системы крови — фибриноген и фибрин, причем первый более чувствителен к расщеплению полиэнзимными смесями. Существенно, что фибриногенолитическая активность полиэнзимных препаратов превышает сумму активностей отдельных протеиназ, включенных в их состав. В присутствии избытка ингибиторов плазмы крови фибриногенолитическая активность полиэнзимных препаратов сохраняется, хотя и выражена в меньшей степени, чем при отсутствии ингибиторов. Способность протеиназ и их комбинаций в составе флогэнзима и вобэ-мугоса Е гидролизовать фибрин при наличии ингибиторов плазмы не выявлена. Установленные отличия в гидролизе фибриногена и фибрина комплексными ферментными препаратами можно, вероятно, объяснить тем, что фибрин как волокнистый нерастворимый белок менее доступен для протеолиза протеиназами, чем фибриноген — асимметричный белок, находящийся в растворенном виде.
Установленный факт высокой фибриногенолитической активности препаратов флогэнзим и вобэ-мугос Е в плазме крови человека представляет несомненный интерес. Снижения содержания фибриногена необходимо добиваться при многих тромботических состояниях, при которых оно повышено — при инфаркте миокарда, венозных тромбозах, обширных хирургических вмешательствах [119]. С этой целью применяют препараты тромбиноподобных ферментов, выделенных из яда змей, — арвин, батроксобин, однако они дорогостоящие и малодоступны [95]. Поэтому безопасное пероральное применение ферментных комбинаций может быть использовано для улучшения реологических свойств крови и кровотока в стенозированных сосудах, а также позволит проводить операции на фоне частичной дефибриногенации с постепенным снижением уровня фибриногена.