ОПРЕДЕЛЕНИЕ ОСТРОГО ИНФАРКТА МИОКАРДА
Острый инфаркт миокарда определяют, пользуясь клиническими, электрокардиографическими, биохимическими и патоморфологическими характеристиками. Признано, что термин «острый инфаркт миокарда» отображает смерть кардиомиоцитов, вызванную длительной ишемией. На ЭКГ можно выявить признаки ишемии миокарда — изменения ST и T, а также признаки некроза миокарда, в частности конфигурации комплекса QRS. Рабочее определение острого прогрессирующего ИМ (с элевацией сегмента ST) сформулировано следующим образом: пациенты с наличием болевого синдрома (боль за грудиной, которая может иррадиировать в руки, под левую лопатку, в нижнюю челюсть, шею, спину, длится более 20 мин, не купируется нитроглицерином), повышением сегмента ST (в точке J) >0,2 мВ в двух или более смежных прекардиальных отведениях и >0,1 мВ в одном или более дистантных отведениях. Также к признакам острого ИМ можно отнести блокаду левой ножки пучка Гиса на ЭКГ при данных, свидетельствующих, что она возникла впервые и в период накануне обследования. Другие варианты острого ИМ будут рассмотрены далее.
Дополнительную информацию для уточнения диагноза острого ИМ на фоне клинических симптомов острой ишемии миокарда (сроки развития, объем поврежденного миокарда) можно получить с помощью анализа биомаркеров, о которых более детально будет сказано далее.
Диагноз устанавливают с указанием даты возникновения (до 28 сут), локализации (передняя стенка, передневерхушечный, переднебоковой, переднеперегородочный, диафрагмальный, нижнебоковой, нижнезадний, нижнебазальный, верхушечно-боковой, базальнолатеральный, верхнебоковой, боковой, задний, заднебазальный, заднебоковой, заднеперегородочный, перегородочный, ПЖ). Следует указать тип острого ИМ: первичный, рецидивирующий или повторный (в этом случае указывать размеры и локализацию необязательно).
При наличии различных осложнений острого ИМ их необходимо включать в формулировку диагноза с указанием даты развития (отдельно не шифруют). Также в диагнозе указывают такие лечебные вмешательства, как АКШ (с указанием количества шунтов), транслюминальная ангиопластика и стентирование с указанием сосудов, баллонная контрапульсация, электроимпульсная терапия, временная (указать сроки) или постоянная электрокардиостимуляция (ЭКС), абляция.
Для каждой лечебной процедуры необходимо указывать дату (сроки) проведения.
Формулировать диагноз следует в такой последовательности: причина развития острого ИМ (например ИБС); внезапная коронарная смерть с оживлением; острый ИМ (с соответствующими уточнениями); осложнения ИМ (с соответствующими уточнениями); наличие различных форм кардиосклероза (при постинфарктном кардиосклерозе по возможности указывать дату, глубину и локализацию всех предшествовавших ИМ); СН (с указанием степени).
КЛАССИФИКАЦИЯ
Согласно МКБ-10 среди разновидностей острого ИМ выделяют:
- острый ИМ с наличием патологического зубца Q (I21.0–I21.3);
- острый ИМ без патологического зубца Q (I21.4);
- острый ИМ (неуточненный — в случае затрудненной диагностики I21.9);
- рецидивирующий ИМ (I22);
- повторный ИМ (I22);
- острую коронарную недостаточность (промежуточный I24.8).
Осложнения острого инфаркта классифицируют следующим образом:
- ОСН (классы I–IV по Killip, I50.1);
- нарушения сердечного ритма и проводимости (желудочковая тахикардия, фибрилляция желудочков, ускоренный идиовентрикулярный ритм, фибрилляция и трепетание предсердий, суправентрикулярная аритмия, суправентрикулярная и желудочковая экстрасистолия, атриовентрикулярная блокада I–III степени, отказ синусового узла, асистолия I44–I49);
- наружный разрыв сердца (острый и подострый — с формированием псевдоаневризмы) с гемоперикардом (I23.0) и без гемоперикарда (I23.3);
- внутренний разрыв сердца (с формированием дефекта межпредсердной перегородки 123.1, дефекта межжелудочковой перегородки 123.2, разрыв сухожильной хорды I23.4, надрыв и отрыв папиллярной мышцы I23.5);
- тромбообразование в полостях сердца (I23.6);
- тромбоэмболия малого и большого круга кровообращения (I23.8);
- ранняя постинфарктная дилатация с формированием острой аневризмы сердца (I23.7);
- эпистенокардитический перикардит (Pericarditis epistenocardica);
- синдром Дресслера (I24.1);
- ранняя (от 72 ч до 28 сут) постинфарктная стенокардия (I20.0).
ЭПИДЕМИОЛОГИЯ
Несмотря на определенные успехи в лечении острого ИМ в большинстве индустриальных стран, эта патология остается в списке лидирующих причин заболеваемости и смертности. Согласно статистическим данным, частота острого ИМ среди мужского населения в возрасте старше 40 лет колеблется в разных регионах мира от 2 до 6 на 1000. Заболеваемость острым ИМ в США составляет 1,5 млн человек/год, дестабилизация ИБС становится причиной ежегодной смерти приблизительно 500 000 человек. Показатель смертности вследствие дестабилизации ИБС в Украине за 2005 г. составляет 707 на 100 000 населения. Среди женщин острый ИМ отмечают приблизительно в 2 раза реже. Согласно официальной статистике, городское население болеет чаще, чем сельские жители, но эти данные следует оценивать осторожно, с учетом возможных различий в выявляемости заболевания. Информация о догоспитальной летальности неоднородна (в частности, в США данный показатель составляет приблизительно 50% всех случаев острого ИМ; по данным регистра MONICA — приблизительно 30%, причем отношение количества случаев догоспитальной смерти к случаям госпитальной снижается с возрастом, составляя от 15,6% у лиц моложе 50 лет до 2,0% у пациентов старше 70 лет). Наибольшее количество случаев догоспитальной смерти у больных с острым ИМ составляет внезапная смерть в первый час заболевания. Более половины пациентов с установленным диагнозом ИБС умирают внезапно. Примерно в 30% случаев внезапная смерть является первым проявлением ИБС и чаще всего связана со злокачественными желудочковыми аритмиями (желудочковая тахикардия или фибрилляция желудочков). Практически все случаи первичной фибрилляции желудочков происходят в первые 4 ч острой ишемии миокарда. Стойкую желудочковую тахикардию с переходом в фибрилляцию желудочков отмечают несколько позже, она достигает максимальной частоты развития через 24 ч и более после развития острого ИМ. Значительно реже первичным нарушением ритма является асистолия. Внутрибольничная летальность в наиболее квалифицированных лечебных учреждениях составляла в 1960 г. 20–25%, а к концу 80-х гг. снизилась до 10–15%. Согласно итальянскому регистру BLITZ, в настоящее время этот показатель составляет 7,4% (7,5% для острого ИМ с элевацией сегмента ST, 5,2% для острого коронарного синдрома (ОКС) без элевации сегмента ST). Частота регистрации острого ИМ с элевацией сегмента ST на момент госпитализации составила 65% всех ОКС. К факторам, определяющим успешность борьбы с данной патологией, можно с уверенностью отнести профилактическую стратегию, поддерживаемую государством, и улучшение стандартов лечения. К социально-профилактическим программам относят профилактику факторов риска ИБС и ее осложнений — рекомендации относительно отказа от курения и чрезмерного употребления алкоголя (более 40 г чистого алкоголя в сутки); борьбу с избыточной массой тела путем рационального питания и физической активности; контроль уровня АД и глюкозы крови; исключение хронических стрессов. Разумеется, данные программы применимы в первую очередь к группам населения, у которых кроме указанных (модифицируемых) факторов риска существуют также немодифицируемые, такие как мужской пол, пожилой возраст, семейный анамнез ИБС. Также большое значение имеет широкое оповещение населения (особенно групп риска острого ИМ) о специфических симптомах заболевания, что позволяет уменьшить временной промежуток от развития симптомов до обращения за квалифицированной медицинской помощью. Значительный вклад в осуществление вышеуказанных программ вносит кардиологическая диспансеризация, при помощи которой также производят отбор пациентов с показаниями к фармакологической и/или хирургической модификации течения ИБС.
КЛИНИКА И КЛИНИЧЕСКИЕ ДЕФИНИЦИИ
Острый ИМ с зубцом Q
В отечественных классификациях данный термин ранее подразделяли на крупноочаговый и трансмуральный острый ИМ, что являлось одним из основных расхождений с международной классификацией. В соответствии с глубиной расположения очага поражения в толще сердечной мышцы крупноочаговый ИМ может преимущественно занимать субэпикардиальный, субэндокардиальный или интрамуральный слои миокарда, что будет отображаться в специфической графике ЭКГ (если в очаг поражения вовлечен субэпикардиальный слой, на ЭКГ превалируют элевации сегмента ST, интрамуральное и субэндокардиальное поражение сопровождаются формированием выраженных депрессий ST с глубокими отрицательными зубцами Т). Общей чертой этих подвариантов является формирование патологического зубца Q и в большинстве случаев — снижение амплитуды зубца R в отведениях, соответствующих локализации поражения, тогда как мелкоочаговые субэпикардиальный, субэндокардиальный или интрамуральный ИМ протекают без формирования зубца Q и выраженного снижения амплитуды зубца R. Дополнительную информацию для уточнения глубины поражения могут дать уровень ферментемии и степень нарушений регионарной сократимости по данным двухмерной эхоКГ. Электрокардиографически острый ИМ с зубцом Q может быть определен при наличии патологического зубца Q в отведениях V1–V3 или при наличии зубца Q длительностью >0,03 с в отведениях I, II, аVL, aVF, V4, V5 или V6. Патологическим считается зубец Q, составляющий 0,25 и более амплитуды зубца R в том же отведении. С осторожностью нужно относиться к трактовке подобных изменений в отведении III (особенно не подтвержденных в отведении aVF), поскольку они могут быть вызваны особенностями расположения сердца в грудной клетке (в этом случае обязательно нужно зарегистрировать отведение III на вдохе, дополнительные отведения). В ряде случаев можно наблюдать комплексы (q)rS, когда «рудиментарный» зубец R не принимают во внимание, а зубец S расценивают как патологический комплекс QS. Особенно затруднена верификация патологических зубцов Q в случае гипертрофии миокарда и/ или нарушений внутрижелудочковой проводимости. В таком случае более информативна электрокардиотопограмма.
Патогенетически острый ИМ с зубцом Q является этапом развития острого ИМ, когда объем пораженного (некротизированного) миокарда уже значителен, причем по амплитуде и длительности зубца Q можно косвенно судить о глубине поражения миокарда, а по количеству отведений с наличием патологического зубца Q — о его распространенности. Чаще всего острый ИМ с зубцом Q диагностируют при переходе острого ИМ из острейшей фазы в острую и затем в подострую. При поздней установке диагноза в случаях, когда к моменту первой записи ЭКГ изменения сегмента ST отсутствуют, следует помнить, что сами по себе зубцы Q могут быть признаком перенесенного ранее инфаркта. В этом случае, при отсутствии архивных ЭКГ и других медицинских записей, данные анамнеза могут быть подтверждены выявлением участков истончения сердечной стенки на эхоКГ.
Острый ИМ без патологического зубца Q
Этот термин соответствует понятию «мелкоочаговый ИМ» и подразумевает ОКС, завершившийся формированием очага поражения (некроза) миокарда, но все же недостаточно большого (по глубине), чтобы привести к формированию патологических зубцов Q на ЭКГ. Неточность данного соответствия заключается в том, что из-за отсутствия патологических зубцов Q можно говорить не о незначительном распространении инфаркта, а только о незначительной глубине поражения миокарда. В качестве примера приводят случаи, когда стойкие изменения на ЭКГ в виде отрицательных зубцов Т отмечены во всех грудных отведениях, и при соответствующей клинике и высоком уровне ферментемии очаг поражения можно расценивать как распространенный интрамуральный, тогда как отсутствие патологических зубцов Q относит его к «острому ИМ без зубца Q».
Топически можно выделить изолированные субэпикардиальный (диагностируют редко ввиду специфической анатомии коронарного дерева), субэндокардиальный и интрамуральный подварианты мелкоочагового ИМ, которые различаются по ЭКГ-графике. В частности, одним из типичных ЭКГ-проявлений интрамурального острого ИМ является наличие стойких отрицательных зубцов Т. Тем не менее этот признак недостаточно специфичен и может выявляться при нестабильной стенокардии, гипертрофии миокарда, метаболических нарушениях и быть следствием ранее перенесенного структурного поражения миокарда (коронарной или некоронарной природы) и перикарда. Субэндокардиальный вариант инфаркта может протекать как по типу «острый ИМ без зубца Q», так и по типу «острый ИМ с зубцом Q» (относительно редко). Он характеризуется поражением преимущественно субэндокардиальных отделов миокарда, тогда как интрамуральные и субэпикардиальные отделы миокарда могут сохранять свою жизнеспособность. Чаще всего является следствием дистального поражения коронарных артерий, микроэмболизации коронарного русла. ЭКГ-картина имеет ряд особенностей: величина вектора возбуждения миокарда не изменяется, так как он берет начало от проводящей системы желудочков, заложенной под эндокардом, и достигает неповрежденного эпикарда. На ЭКГ могут быть отмечены неглубокий патологический зубец Q (необязательно), небольшое снижение зубца R, депрессия сегмента ST, возможна инверсия или двухфазность зубца Т в отведениях I, V1–V4 при передней локализации инфаркта, в отведениях III и aVF — при нижней (задней) и в отведениях aVL, V5–V6 — при боковой локализации. По мере развития ИМ происходит частичная или полная нивелировка депрессии сегмента ST с формированием устойчивых отрицательных зубцов Т. Следует акцентировать внимание на глубину депрессии сегмента ST в отведениях, расположенных над областью инфаркта более 0,2 мВ, поскольку менее выраженные смещения сегмента ST, например 0,1 мВ, свойственны субэндокардиальной ишемии, а не инфаркту. Кроме того, к признакам ишемии следует отнести ее неустойчивость: изменения, как правило, возникают на фоне стресса или физической нагрузки, часто нивелируются спустя несколько минут после устранения провоцирующего фактора, приема нитроглицерина. Депрессию же при субэндокардиальном инфаркте могут отмечать до 3 дней. Так или иначе, для уточнения диагноза необходимы динамическая регистрация ЭКГ по возможности с анализом архивных записей, сопоставление биохимических и других клинических и инструментальных критериев.
Рецидивирующий и повторный ИМ
Данные понятия относят соответственно к тем случаям, когда после первого перенесенного острого ИМ формируется второй и более. Причем сроки развития рецидива острого ИМ — от 3 до 28 сут с момента развития исходного инфаркта, а по истечении этого срока нужно говорить о повторном ИМ. Если ЭКГ-диагностика размеров и локализации очага поражения затруднена, в диагнозе ее указывать не обязательно.
Острая коронарная недостаточность
Данное понятие приблизительно соответствует международному термину «острый коронарный синдром» и используется как промежуточный диагноз в ранние сроки заболевания. Постановка такого диагноза основана на выявлении элевации или депрессии сегмента ST в сочетании с длительной (более 20 мин) ангинозной болью. Характерно, что за рубежом широко используют классификацию, согласно которой все случаи дестабилизации ИБС объединены в понятие «острый коронарный синдром» и в зависимости от наличия или отсутствия элевации сегмента ST в первые часы заболевания подразделены на ОКС с элевацией сегмента ST (к нему относят понятие «инфаркт миокарда с элевацией сегмента ST» — ST elevation miocardial infarction, STEMI, а также случаи, соответствующие часто встречающемуся в отечественной литературе термину «острое нарушение коронарного кровообращения», которые в дальнейшем не заканчиваются формированием некроза миокарда) и на ОКС без элевации сегмента ST (к которому можно отнести случаи нестабильной стенокардии, мелкоочагового острого ИМ с депрессией или без депрессии сегмента ST). Особенность такой классификации состоит в том, что она построена на степени проявления миокардиальной ишемии, в то время как классификация, учитывающая наличие или отсутствие патологического зубца Q, предусматривает градацию по глубине повреждения сердечной мышцы и соответственно относится к более позднему периоду заболевания. Целесообразность такой «ранней», рабочей классификации обусловлена тем, что современные подходы к лечению раннего периода острого ИМ дифференцированы в первую очередь по степени проявления ишемии и существенно влияют на течение подострого периода заболевания. В частности, в эру реперфузионной терапии распространенная тотальная ишемия миокарда с элевацией ST на ЭКГ далеко не во всех случаях приводит к формированию ИМ с зубцом Q. С другой стороны, динамичность процессов, происходящих в рамках дестабилизации ИБС, предполагает возможность перехода заболевания из одного клинического варианта в другой. С учетом вышеизложенного, при использовании термина «острая коронарная недостаточность» целесообразно уточнение характера и степени ишемических изменений на ЭКГ, сопровождающих заболевание (с указанием наличия или отсутствия элевации сегмента ST на ЭКГ), что может в дальнейшем способствовать выбору адекватной тактики лечения.
Этиология и патогенез острого ИМ
В настоящее время является общепризнанным предположение о патофизиологической роли коронаротромбоза в развитии острого ИМ, выдвинутое в 1909 г. Н.Д. Стражеско и В.П. Образцовым, а в 1912 г. J.B. Herrick. Причиной ОИМ, как и других форм ОКС, более чем в 90% случаев является внезапное уменьшение коронарного кровотока, вызванное атеросклерозом в сочетании с тромбозом, с наличием или без сопутствующей вазоконстрикции. Редко отмечают острый ИМ как следствие септической (тромбо-)эмболии коронарной артерии или внутрикоронарный тромбоз как следствие воспалительного процесса в эндотелии сосуда при коронаритах различного генеза. Также описаны случаи острого ИМ, развившиеся на фоне изолированного коронароспазма интактных артерий (чаще интоксикационной природы).
Среди этиологических факторов, способствующих развитию острого ИМ, первое место занимает атеросклероз. Другие факторы риска ИМ являются также факторами риска развития атеросклероза. К «большим» факторам риска относят некоторые формы гипер- и дислипопротеинемии, АГ, курение табака, низкую физическую активность, нарушения углеводного обмена (особенно сахарный диабет II типа), ожирение, возраст пациента старше 50 лет (средний возраст госпитализированных больных с острым ИМ в Италии составляет 67 лет). Действительно, нарушения липидного обмена диагностируют у больных с ИМ значительно чаще, чем у здоровых людей (особенно дислипопротеинемии IIб и III типов). В то время как АГ является доказанным фактором риска ИМ, симптоматические формы АГ не сопряжены с высоким риском ИМ. Это можно объяснить особенностями патогенеза АГ, которая, с одной стороны, способствует развитию атеросклероза, а с другой — предрасполагает к локальным спазмам артерий. Результаты обширных исследований свидетельствуют о повышении частоты ИМ у курящих. Объясняют это тем, что вещества, образующиеся при сгорании табака (в первую очередь никотин), повреждают эндотелий сосудов и способствуют вазоспазму, а высокое содержание карбоксигемоглобина в крови курящих снижает способность крови к переносу кислорода. Избыточная масса тела (ИМТ 30 и более) является фактором риска прогрессирования атеросклероза и ИМ, если протекает по типу абдоминального ожирения. У больных со сниженной физической активностью на фоне развития атеросклероза недостаточно эффективно происходит адаптивное развитие коллатералей в миокарде и толерантности кардиомиоцита к ишемии (феномен прекондиции). Кроме того, вследствие гиподинамии происходит неадекватное повышение тонуса САС в случае нерегулярных значительных физических и психоэмоциональных нагрузок. Хроническое повышение уровня глюкозы и продуктов незавершенного углеводного обмена в крови при сахарном диабете приводит к повреждению эндотелия и развитию полиангиопатии.
При сочетании двух и более указанных факторов степень риска повышается пропорционально. Кроме перечисленных, существует еще множество так называемых «малых» факторов риска (подагра, псориаз, дефицит фолиевой кислоты и др.), удельный вес которых в общей структуре заболевания относительно невелик.
Клинические проявления и исходы зависят от локализации обструкции, степени и длительности ишемии миокарда. В частности, существуют отличия в степени проявления болевого синдрома и стрессовой активации РААС, обусловливающей наличие гипертензии, тахикардии, гипергликемии, лейкоцитоза с анэозинофилией в первые часы заболевания. Характерно, что во время развития острого ИМ со стойкой элевацией сегмента ST формируется так называемый «красный» тромб, который содержит значительно большее количество эритроцитов. Такое отличие от «тромбоцитарного», или «белого», тромба, связанного с развитием ОКС без стойкой элевации сегмента ST, свидетельствует о более глубоком и длительном нарушении реологических и коагуляционных свойств крови и о более значительных стойких тромбогенных изменениях в эндотелии поврежденного участка коронарной артерии. Следовательно, при остром ИМ с элевацией сегмента ST развивается преимущественно окклюзивный и персистирующий тромбоз. Приблизительно в ⅔–¾ случаев формированию коронарного тромба предшествует внезапный разрыв уязвимой бляшки (воспаленной, богатой липидами бляшки, покрытой тонкой фиброзной оболочкой). Другие случаи связывают с механизмами, не определенными до конца, такими как эрозия бляшки. В ¾ случаев бляшки, которые становились базисом для окклюзивного тромбообразования во время острого ИМ, вызывали лишь незначительный или умеренный стеноз, что предшествовало развитию инфаркта (понятно, что именно в этих случаях тромболитическая терапия является максимально эффективной). Впрочем, на фоне выраженного стеноза разрывы бляшек приводят к более частому развитию острого ИМ (по сравнению с незначительными стенозами). ИМ, вызванный полной окклюзией коронарной артерии, развивается через 20–30 мин после начала выраженной ишемии (отсутствие кровотока по артерии или коллатералям) и прогрессирует со временем от субэндокардиального к субэпикардиальному участку (феномен фронта волны). Реперфузия и вовлечение коллатералей могут предотвращать возникновение некроза или способствуют уменьшению его размера (сохраняя в среднем до 70% ишемизированного миокарда периинфарктной зоны). Наличие же длительной стенокардии перед острым ИМ может способствовать формированию развитых коллатералей, что обусловливает сохранение или длительное поддержание жизнеспособности зоны ишемии (при коронарной ангиографии развитые коллатерали определяют в 30% случаев острого ИМ). У таких больных отмечена тенденция к менее выраженному повреждению миокарда, более редкому развитию СН и меньшей летальности; в отдаленном периоде после острого ИМ насосная функция сердца у них сохраняется в большей степени. При длительности коронарной окклюзии более 6 ч лишь небольшая часть (10–15%) ишемизированного миокарда остается жизнеспособной. Наличие субкритического, но стойкого кровотока может расширить временное окно для спасения миокарда путем полной реперфузии (рис. 1.1).
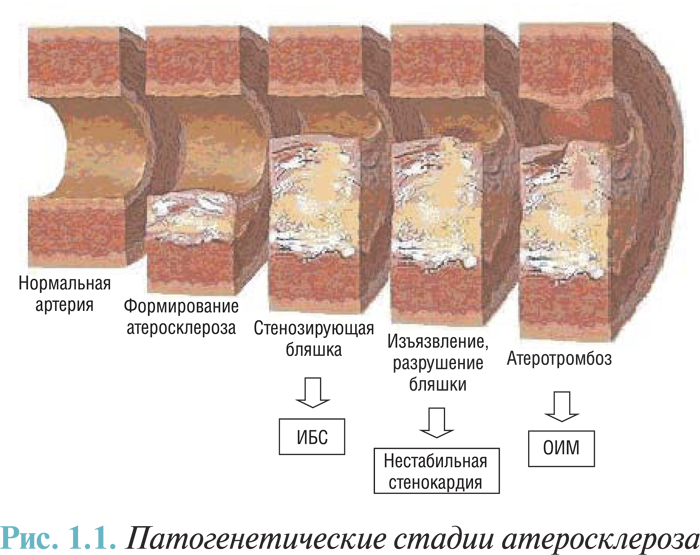
Ответ на разрыв бляшки является динамическим: аутогенные тромбоз и тромболизис, часто ассоциируемые с вазоспазмом, развиваются одновременно, вызывая преходящую обструкцию кровотока. В небольшом проценте случаев тромб, вызвавший развитие острого ИМ, может быть разрушен в первые часы с начала заболевания собственной фибринолитической системой организма при содействии эндогенных вазодилататоров, устраняющих коронароспазм. В таком случае говорят о спонтанном (или аутогенном) лизисе тромба и реканализации инфарктобусловившей коронарной артерии. Клинически данный вариант течения острого ИМ характеризуется ранним (до проведения реперфузионной терапии) регрессом симптоматики и ЭКГ-признаков, уровень ферментемии и объем пораженного миокарда по данным исследований в подострой фазе заболевания оказывается меньше, чем в случае несостоятельности аутогенной фибринолитической системы.
Основными модуляторами активации главного фибринолитического профермента плазминогена и двухцепочечной урокиназы, также принимающей участие в каскаде фибринолиза, являются вырабатываемые эндотелием tPA и его антагонист — быстро реагирующий ингибитор активатора плазминогена PAI-1. Их соотношение в плазме определяет фибринолитический потенциал крови. Нарушение баланса между этими двумя пептидами (повышение уровня PAI-1 при нормальном или сниженном уровне tPA) в плазме крови зафиксировано в острый период ИМ и связано с риском развития повторного инфаркта, 30-дневной смерти после перенесенного ИМ. Также известно, что ангиотензин II и его метаболит ангиотензин IV вызывают повышение выработки PAI-1 клетками эндотелия. С другой стороны, РААС тесно связана с калликреин-кининовой системой таким образом, что АПФ обеспечивает деградацию брадикинина (рис. 1.2).
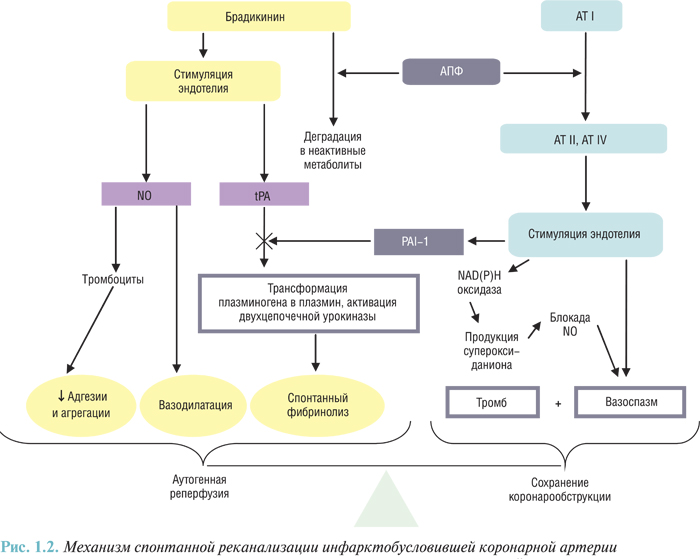
Еще одной причиной неэффективности аутогенной реперфузии является недостаточное действие вазорелаксирующих агентов, и как следствие этого — продолжающийся вазоспазм. Брадикинин является стимулятором выработки эндогенного эндотелиального фактора расслабления (NO). Поскольку продукты деградации брадикинина этими свойствами не обладают, очевидно, что гиперфункция эндокринной, внутрисосудистой или РААС, кроме снижения фибринолитической активности, приводит также к нарушению сосудорасширяющего потенциала крови.
В свою очередь РААС приводит к инактивации NO путем превращения его супероксид-аниона в неактивный пероксинитрит. Супероксид-анион образуется при участии мембранной NAD(P)H оксидазы и эндотелиальной NO-синтетазы. При этом подавляются и другие краткосрочные системные эффекты NO — ингибирование АДФ-зависимой адгезии и агрегации тромбоцитов, ингибирование адгезии тромбоцитов к эндотелию путем блокады дегрануляции тромбоцитов. Вследствие этого возникает повышение проагрегационного потенциала крови, стимулирующее начальные этапы образования коронарного тромбоза и ретромбоза.
При коронарном тромбозе начальная обструкция кровотока, как правило, начинается с агрегации тромбоцитов при участии фибрина (рис. 1.3).
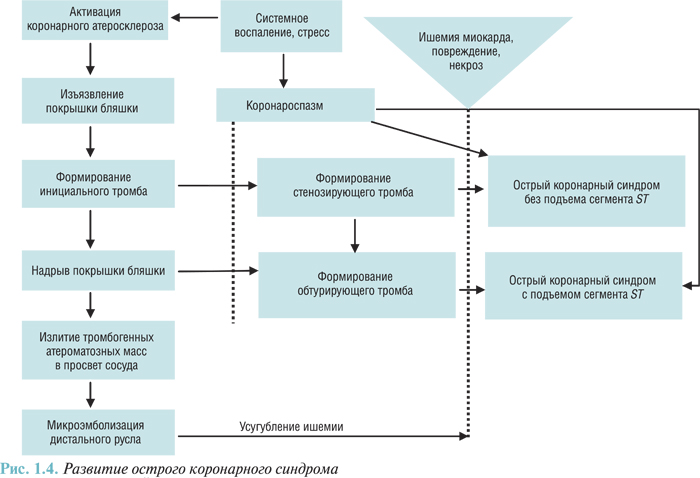
Еще одним неблагоприятным последствием разрушения атеросклеротической бляшки и коронарного тромбоза является дистальная эмболизация тромботическими и атероматозными массами, которая ведет к микрососудистой обструкции и может препятствовать успешной реперфузии миокарда на тканевом уровне, несмотря на восстановление адекватной проходимости инфарктобусловившей артерии (рис. 1.4).
Развитие окклюзии коронарного сосуда ведет к гибели кардиомиоцитов. От уровня и длительности окклюзии сосуда зависит величина очага некроза миокарда. Нарушение коронарного кровотока и развитие некроза миокарда запускают каскад нейрогуморальных реакций, воспалительного и пролиферативного процесса. Все эти структурно-функциональные и метаболические перестройки миокарда ведут к ремоделированию полости ЛЖ: дилатации полости ЛЖ, изменению его геометрии и развитию гипертрофии, что может вести к появлению СН и определяет отдаленный прогноз у пациентов, перенесших острый ИМ (рис. 1.5).
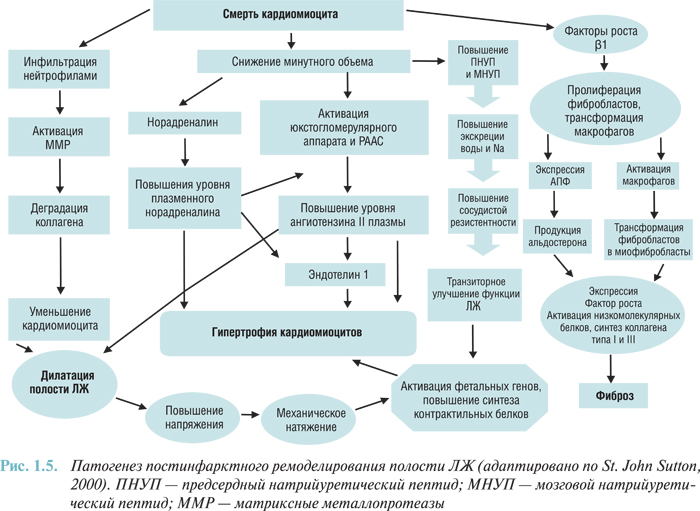
В течении острого ИМ можно выделить несколько патогенетических периодов. Продромальный период, или так называемое прединфарктное состояние, отмечают по разным данным в 30–60% случаев. Средняя длительность этого периода 7 дней, часто его начало сопряжено с физической или психоэмоциональной нагрузкой, причем наиболее неблагоприятными являются «малые», но регулярные стрессы, постоянное стрессовое состояние. Клинически его характеризуют возникновение или значительное учащение и усиление тяжести приступов стенокардии (так называемая нестабильная стенокардия), а также изменения общего состояния (слабость, утомляемость, снижение настроения, тревога, нарушение сна). Действие антиангинальных средств становится, как правило, менее эффективным. Отмечают, что нестабильная стенокардия даже в случае необращения за медицинской помощью может разрешиться самостоятельно без развития острого ИМ, чему способствуют описанные выше механизмы. Однако оценить тяжесть и объем возможного поражения миокарда по клинической картине прединфарктного состояния крайне трудно, поэтому ко всем больным, поступившим в стационар с клиникой нестабильной стенокардии, должна применяться та же лечебно-диагностическая тактика, что и к больным с острым ИМ, исключая проведение тромболизиса (см. ниже). При отсутствии признаков стабилизации состояния больного, которому проводят интенсивную терапию, показана коронарография с решением вопроса о целесообразности и объеме инвазивных вмешательств.
Острейший период (время от возникновения ишемии миокарда до первых проявлений его некроза) продолжается обычно от 30 мин до 2 ч. Начало этого периода, как правило, соответствует моменту максимальной ангинозной боли, к которой может присоединяться характерная иррадиация (в руку, плечо, надплечье, ключицу, шею, нижнюю челюсть, межлопаточное пространство). В ряде случаев боль носит затяжной или волнообразный характер, что при сохранении «острофазовой» графики ЭКГ без формирования отрицательных зубцов Т может свидетельствовать об интермиттирующей коронарной обструкции (флотирующий тромб, активация спонтанного фибринолиза) или присоединении новых участков поражения сердечной мышцы. Безболевую форму острого ИМ диагностируют редко, чаще всего такой диагноз устанавливают post factum. Другие клинические проявления связаны с гиперактивацией вегетативной (как симпатической, так и парасимпатической) нервной системы и в ряде случаев выраженным рефлекторным снижением насосной функции сердца (резкая слабость, ощущение нехватки воздуха, страх смерти, профузный пот, одышка в покое, тошнота и рвота). СН в этот период заболевания развивается прежде всего как левожелудочковая, наиболее ранние ее проявления — одышка и снижение пульсового давления, в тяжелых случаях — сердечная астма или отек легких, который нередко сочетается с развитием кардиогенного шока. Различные нарушения сердечного ритма и проводимости отмечают практически у всех больных.
Острый период наступает по окончании острейшего периода и продолжается около 2 сут — до окончательного отграничения очага некроза. При рецидивирующем течении острого ИМ продолжительность острого периода может увеличиваться до 10 и более дней; часто осложняется выраженным резорбционным синдромом. В течение этого периода происходит вымывание в периферическую кровь кардиоспецифичных ферментов; по динамике их вымывания можно также судить о размерах поражения.
Подострый период, соответствующий интервалу времени от полного отграничения очага некроза до замещения его первичной соединительной тканью, продолжается примерно 28 дней. В это время у некоторых больных проявляются клинические симптомы, связанные с уменьшением массы функционирующего миокарда (СН) и его электрической нестабильностью (аритмии сердца). Проявления резорбционного синдрома постепенно уменьшаются, осложнения острого периода в эти сроки обычно разрешаются; если же выявляют усугубление СН, аритмии сердца, постинфарктной стенокардии, это требует медикаментозной и в ряде случаев инвазивной коррекции. Обычно в этот период больные проходят реабилитационное лечение в стационаре. Особенности ведения больного с инфарктом в реабилитационном отделении определяются размером некроза миокарда, демографическими характеристиками пациента и наличием или отсутствием сопутствующих заболеваний. После исчезновения симптомов и при минимальном повреждении миокарда пациент может быть переведен в реабилитационное отделение уже через несколько дней. В случаях выраженной дисфункции ЛЖ или при высокой степени риска новых событий требуется более длительная госпитализация.
Постинфарктный период завершает течение острого ИМ, поскольку на исходе этого периода предполагается окончательное формирование плотного рубца в зоне инфаркта. Считают, что при типичном течении крупноочагового ИМ послеинфарктный период длится примерно 6 мес. В это время постепенно развивается компенсаторная гипертрофия сохранившегося миокарда, благодаря которой СН, возникшая в более ранний период ИМ, у некоторых больных может быть ликвидирована. Однако при больших размерах поражения миокарда полная компенсация не всегда возможна и признаки СН сохраняются или нарастают. Процессы рубцевания также могут сопровождаться формированием стойкого аритмогенного субстрата и хронической аневризмы сердца, дилатацией полостей сердца с развитием вторичной клапанной недостаточности, что, как и стойкая постинфарктная стенокардия, может потребовать хирургической коррекции.
ФАКТОРЫ РИСКА НЕБЛАГОПРИЯТНОГО ТЕЧЕНИЯ ОСТРОГО ИМ
Ранее к неблагоприятным факторам, усугубляющим течение острого ИМ, помимо размеров и локализации инфаркта, традиционно относили пожилой возраст, женский пол, наличие сопутствующего сахарного диабета, АГ, другие социальные, наследственные факторы и сопутствующие заболевания. Теперь же с появлением новых медицинских технологий структура факторов риска изменилась: значительный вклад как в ранний, так и отдаленный прогноз у больных, перенесших острый ИМ, вносят терапия острой фазы заболевания, сроки обращения за медицинской помощью.
Наибольший положительный эффект на результаты лечения острого ИМ в последние годы оказало совершенствование алгоритмов лечения, направленных на восстановление проходимости инфарктобусловившей коронарной артерии (ИОКА). В обширных рандомизированных исследованиях у больных с острым ИМ с применением тромболитической терапии 30-дневная летальность отмечена в пределах 6–10%, тогда как в исследованиях с применением ЧТКА выявлена летальность 2,5% за тот же период. Однако следует отметить, что в хирургические исследования включали в основном тщательно отобранный контингент больных (в частности, исключали пациентов пожилого возраста или имеющих выраженный системный атеросклероз, который, с одной стороны, создает трудности при проведении пункций крупных артерий, а с другой — является достаточно надежной «гарантией» многососудистого поражения коронарного русла и соответственно фактором, усугубляющим прогноз). Кроме того, анализ реальной ситуации в кардиологической практике свидетельствует, что много пациентов не получают оптимальной (в соответствии с современными алгоритмами) терапии, включающей тромболизис. В частности, серийные наблюдения в Северной Америке и Европе позволяют предполагать, что частота тромболитической терапии при остром ИМ в этих регионах в среднем составляет до 40%. В Италии частота тромболитической терапии составляет 50% общего числа случаев госпитализации больных с ОКС. Кроме того, некоторые из пациентов проходят лечение не в кардиореанимационных отделениях, а в возрастной структуре больных лица пожилого возраста имеют больший удельный вес, чем в когортах многоцентровых исследований. Таким образом, можно ожидать, что госпитальная летальность среди реальных больных с острым ИМ будет выше, чем по результатам исследований с применением тромболизиса и ангиопластики. По результатам наблюдения случаев лечения острого ИМ в реальной клинической практике сформирован список предикторов ранней (30-дневной) смертности у больных с острым ИМ (табл.1.1).
Таблица 1.1
Предикторы 30-дневной смертности после острого ИМ (McGovern P.G., 1996)
| Да, n (%)* | Нет, n (%)* | p | p (мультивариационный) | |
| Мужской пол | 94 (14,8) | 101 (23,9) | <0,001 | НД |
| Тромболизис | 32 (14,0) | 122 (22,4) | <0,05 | НД |
| ОКП | 112 (15,0) | 83 (36,0) | <0,001 | <0,001 (0,4)† |
| Курение | 71 (14,6) | 61 (20,8) | <0,05 | НД |
| Семейный анамнез ИБС | 29 (10,3) | 96 (20,6) | <0,001 | НД |
| ЛЖН | 112 (31,0) | 48 (10,4) | <0,001 | <0,01 (1,7)† |
| Кардиогенный шок | 61 (78,2) | 99 (13,3) | <0,001 | <0,001 (19)† |
| Желудочковая аритмия | 50 (34,3) | 110 (16,3) | <0,001 | <0,001 (3)† |
| AV-блокада | 26 (48,2) | 135 (17,6) | <0,001 | НД |
| Реинфаркт | 26 (60,0) | 132 (17,0) | <0,001 | <0,01 (3,9)† |
| Возраст (среднее) | 73 года (умершие в стационаре) | 67 лет (пережившие стационарный период) | <0,001 | <0,001 (1,05)† |
*n — количество пациентов, умерших в стационаре, с наличием или без наличия признака; % — процент пациентов, умерших в стационаре, среди пациентов с наличием и без наличия признака; † — отношение шансов; ОКП — отделение коронарной патологии; ЛЖН — левожелудочковая недостаточность; НД — недостоверно.
По данным таблицы к независимым предикторам ранней смерти после перенесенного острого ИМ можно отнести лечение острой фазы ИМ вне отделения коронарной патологии (кардиореанимации), наличие острой левожелудочковой недостаточности (ОЛЖН) и кардиогенного шока, развитие желудочковых аритмий и рецидива острого ИМ в течение госпитального периода. Также в данном анализе независимым предиктором раннего летального исхода после острого ИМ являлся пожилой возраст.
При анализе факторов риска неблагоприятного исхода в отдаленный постинфарктный период (5-летнее наблюдение) были выделены такие предикторы, как постинфарктный кардиосклероз (после анализируемого ИМ), отсутствие реперфузионной терапии в острой фазе заболевания, наличие в семейном анамнезе ИБС, сердечная блокада, отсутствие ацетилсалициловой кислоты в терапии постинфарктного периода и пожилой возраст. Тем не менее к независимым предикторам неблагоприятного исхода отнесены пожилой возраст и наличие левожелудочковой недостаточности в стационаре (табл. 1.2).
Таблица 1.2
Предикторы смерти после острого ИМ в течение 5-летнего наблюдения (McGovern P.G., 1996)
| Да, n (%)* | Нет, n (%)* | p | p (мультивариационный) | |
| Мужской пол | 196 (30,9) | 161 (38,2) | <0,05 | НД |
| ИМ в анамнезе | 92 (42,3) | 198 (33,7) | <0,001 | НД |
| Тромболизис | 54 (24,1) | 219 (40,2) | <0,001 | НД |
| Сахарный диабет | 58 (44,6) | 230 (33,8) | <0,05 | НД |
| Курение в анамнезе | 147 (30,1) | 115 (39,1) | <0,05 | НД |
| Семейный анамнез ИБС | 61 (21,5) | 185 (39,9) | <0,001 | НД |
| ОЛЖН | 184 (51,0) | 110 (23,8) | <0,001 | <0,001 (2,7)† |
| Желудочковая аритмия | 64 (43,8) | 229 (33,9) | <0,05 | НД |
| Внутрисердечные блокады | 33 (61,1) | 261 (33,9) | <0,001 | НД |
| Назначение ацетилсалициловой кислоты при выписке | 98 (17,6) | 37 (38,1) | <0,001 | НД |
| Возраст (среднее) | 72,3 года (умершие при отдаленном наблюдении) | 65,6 года (пережившие период наблюдения) | <0,001 | <0,001 (1,05)† |
*n — количество пациентов, умерших в течение отдаленного наблюдения, с наличием или без наличия признака; % — процент пациентов, умерших в течение отдаленного наблюдения, среди пациентов с наличием и без наличия признака; † — отношение шансов; ОЛЖН — острая левожелудочковая недостаточность.
На основании полученных данных построены как общая кривая выживаемости после перенесенного острого ИМ (рис. 1.6), так и кривые выживаемости при наличии и отсутствии левожелудочковой недостаточности в острый период ИМ (рис. 1.7).
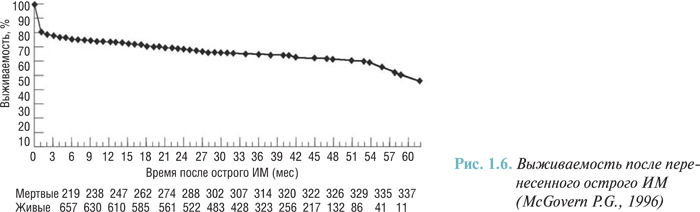
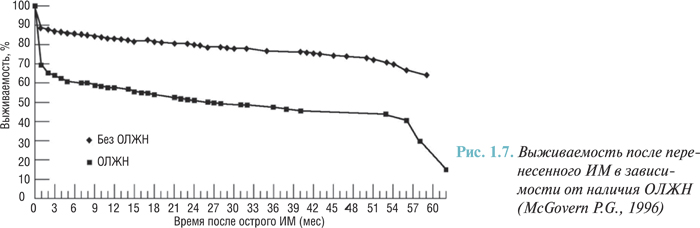
Как видно из рисунков, наибольшее количество больных, перенесших острый ИМ, умирает в раннем (до 2 мес) постинфарктном периоде, наличие признаков ОЛЖН в стационаре оказывает на это существенное влияние.
Другой обширный регистр CENIC (Mattos et al., 2004), включающий данные о 9371 пациенте с острым ИМ и элевацией сегмента ST, прошедших реперфузионную терапию в виде первичной ангиопластики или тромболизиса с последующей «ЧТКА спасения» в течение 24 ч от начала острого ИМ, как основной фактор риска госпитальной летальности также выделил наличие ОЛЖН в стационаре; кроме этого, такими факторами были многососудистое поражение коронарного дерева и неэффективность тромболизиса и/или ЧТКА по данным коронаровентрикулографии.
Анализ данных о более чем 10 тыс. больных с острым ИМ в исследовании GISSI-3 также показал отрицательное прогностическое влияние дилатации полости ЛЖ >60 мл/м2 на летальность и развитие СН после острого ИМ. Анализируя факторы, способствующие развитию дилатации полости ЛЖ, большинство авторов доказали значение величины зоны некроза и передней локализации поражения. Имеются различные данные о взаимосвязи анамнестических характеристик, течении первых суток инфаркта и влиянии лечения.
Еще одним фактором, определяющим отдаленный прогноз у пациентов, перенесших ИМ и развитие застойной СН, является постинфарктное ремоделирование полости ЛЖ. К ремоделированию полости ЛЖ сердца приводят структурно-функциональные повреждения миокарда. Это общеизвестный факт, доказанный во многих исследованиях как на экспериментальной модели, так и в клинической практике.
ПРОФИЛАКТИКА
Первичная профилактика
Первичная профилактика острого ИМ совпадает с мерами первичной профилактики других форм ИБС, а у больных с установленным атеросклерозом венечных артерий сердца включает также устранение или уменьшение влияния факторов риска развития острого ИМ, что актуально и при вторичной профилактике (предупреждение повторного ИМ). К главным факторам риска относят АГ, гипер- и дислипопротеинемию, нарушения углеводного обмена (особенно сахарный диабет), курение, недостаточную физическую активность, ожирение. Больным с ИБС необходимо постоянное активное лечение, предупреждающее приступы стенокардии и способствующее развитию коллатералей в системе венечных артерий.
Больные с АГ подлежат диспансерному наблюдению. Им проводят патогенетическую и антигипертензивную терапию, обеспечивающую оптимальный для каждого пациента уровень АД и направленную на предупреждение гипертонических кризов. При наличии гиперхолестеринемии большое значение имеет диета, применяемая для лечения и профилактики атеросклероза. Целесообразно использовать статины, фибраты, омега-3-полиненасыщенные жирные кислоты, растворимую пищевую клетчатку. Длительное применение витаминов, в частности А, С, Е и никотиновой кислоты, не влияло на риск развития острого ИМ и других сердечных событий. Диета с пониженным содержанием углеводов, а при необходимости и медикаментозная терапия показаны больным с пониженной толерантностью к глюкозе и явным сахарным диабетом, а также больным с ожирением. Кардиологическая диспансеризация должна обязательно включать популяризацию среди населения здорового образа жизни с исключением курения, занятиями физической культурой и спортом. Достаточная физическая активность препятствует возникновению и развитию ИБС, способствует развитию коллатералей в системе венечных артерий сердца, снижает склонность к тромбообразованию и развитию ожирения. Особое значение занятия физкультурой имеют для пациентов, двигательная активность которых недостаточна по условиям трудовой деятельности или иным причинам. Одна из важных составляющих профилактики острого ИМ — квалифицированное лечение больных с установленным диагнозом стенокардии и коронарного атеросклероза. Профилактические меры, применяемые у пациентов этой категории, существенно не отличаются от вторичной профилактики у больных, перенесших ИМ.
Вторичная профилактика
Курение
Опыт длительных наблюдений свидетельствует о том, что прекращение курения позволяет снизить смертность в течение следующих нескольких лет более чем вдвое. Потенциально это наиболее эффективное мероприятие из вторичной профилактики; следует приложить значительные усилия для отказа от курения. В острой фазе заболевания большинство пациентов не курят, в течение периода восстановления им нужно помочь преодолеть вредную привычку. Возобновление курения нередко отмечают по возвращении больного домой, поэтому во время периода реабилитации он нуждается в поддержке и советах.
Диета и пищевые добавки
Лионское исследование влияния диеты на сердце доказало, что средиземноморская диета понижает частоту рецидивов у пациентов, которые перенесли первый ИМ, по крайней мере в течение 4 лет. Всем пациентам следует советовать средиземноморскую диету, которая характеризуется малым количеством насыщенных жиров, богата полиненасыщенными жирами, фруктами и овощами. Считают, что употребление в пищу жирной рыбы по крайней мере дважды в неделю уменьшает риск реинфаркта и смерти. Добавление к диете омега-3-полиненасыщенных жирных кислот из рыбьего жира (1 г в сутки), но не витамина Е ассоциировалось с достоверным снижением смертности от всех причин и вероятности внезапной смерти. Нет доказательств целесообразности применения после перенесенного инфаркта пищевых добавок, которые содержат антиоксиданты, однако добавление в рацион добавок, содержащих пищевую клетчатку (более 4,0 г растворимой клетчатки на 1,735 ккал рациона), снижало сердечно-сосудистую смертность. Назначение фолиевой кислоты целесообразно в случае повышения содержания в крови гомоцистеина.
Антитромбоцитарная и антикоагулянтная терапия
По результатам метаанализа Antiplatelet Trialists Collaboration выявлено снижение приблизительно на 25% вероятности реинфаркта и смерти после перенесенного ИМ. В проанализированных исследованиях доза ацетилсалициловой кислоты колебалась в пределах 75–325 мг/сут. Есть свидетельства того, что более низкие дозы обеспечивают достижение эффекта с меньшим количеством побочных проявлений.
Исследования, выполненные в период до широкого применения ацетилсалициловой кислоты, доказали эффективность пероральных антикоагулянтов в предотвращении реинфаркта и смерти после перенесенного ИМ. В этих исследованиях пациентов рандомизировали не позднее чем через 2 нед после инфаркта. Эффективность рутинного применения пероральных антикоагулянтов в противовес ацетилсалициловой кислоте у больных в постинфарктный период оценивали в исследовании АFTER. При лечении этих пациентов не было получено четких преимуществ по сравнению с применением ацетилсалициловой кислоты. Возможно, пероральное применение антикоагулянтов оказалось бы полезным для отдельных категорий пациентов, в частности для больных с большой зоной акинезии передней локализации, фибрилляцией предсердий или наличием эхокардиографически доказанного тромба в ЛЖ, но больших рандомизированных исследований в этом направлении не проводили. Ацетилсалициловая кислота в сочетании с фиксированной низкой дозой пероральных антикоагулянтов не является более эффективной для предотвращения новых ишемических событий, чем ацетилсалициловая кислота в качестве монотерапии. Умеренно и высокоинтенсивная пероральная терапия антикоагулянтными средствами (МНО>2,0) в сочетании с ацетилсалициловой кислотой обеспечила уменьшение количества реокклюзий после успешного лизиса по сравнению с монотерапией ацетилсалициловой кислотой. В двух исследованиях (ASPECT-2, 2002 и WARIS-2, 2002) такое сочетание препаратов позволило также уменьшить общее количество случаев смерти, реинфаркта и инсульта у пациентов в постинфарктный период, но отмечено достоверное увеличение количества нефатальных осложнений, обусловленных кровотечениями. Результаты исследования CLARITY TIMI 28 показали эффективность комбинированного применения клопидогрела и ацетилсалициловой кислоты у больных с острым ИМ после реперфузионной терапии. И хотя особо отмечают, что преимущество в группе клопидогрела было получено лишь по показателю возобновления кровотока в ИОКА, результаты исследования COMMIT с использованием клопидогрела как дополнительной к ацетилсалициловой кислоте терапии при остром ИМ у 46 000 пациентов продемонстрировали достоверное снижение общей смертности на 7%. Кроме того, уже доказана эффективность клопидогрела для вторичной профилактики после перенесенного ОКС без стойкой элевации сегмента ST (CURE, 2001). Возможность назначения пероральных антикоагулянтов нужно рассматривать у пациентов, которые не переносят ацетилсалициловую кислоту. Так, у таких больных клопидогрел является хорошим альтернативным средством антитромбоцитарной терапии.
Блокаторы β-адренорецепторов
В нескольких исследованиях и метаанализах показано, что средства, блокирующие β-адренорецепторы, уменьшают летальность и вероятность реинфаркта после перенесенного острого ИМ на 20–25%. Положительные результаты получены в исследованиях с пропранололом, метопрололом, тимололом, ацебутололом и карведилолом. Впрочем, в меньших по объему исследованиях с применением других блокаторов β-адренорецепторов получен похожий результат. Метаанализ 82 рандомизированных исследований свидетельствует в пользу длительного применения блокаторов β-адренорецепторов с целью уменьшения заболеваемости и летальности после острого ИМ, даже если были применены фибринолитические средства и одновременно назначены ингибиторы АПФ. Выраженное снижение летальности у больных СН на фоне применения блокаторов β-адренорецепторов дает основания для применения этих препаратов у больных в постинфарктный период. Анализ данных проведенных исследований свидетельствует о том, что блокаторы β-адренорецепторов без внутренней симпатомиметической активности должны быть назначены всем пациентам после перенесенного ИМ при отсутствии противопоказаний.
Антагонисты кальция
Доказательства возможного благоприятного влияния антагонистов кальция значительно более слабые, чем блокаторов β-адренорецепторов. Результаты ранних исследований с применением верапамила и дилтиазема позволили допустить, что эти препараты могут предотвращать реинфаркт и смерть. В исследовании INTERCEPT с участием 874 пациентов с острым ИМ без застойной СН, у которых проводили терапию фибринолитическими средствами, 6-месячное применение дилтиазема в дозе 300 мг/сут уменьшило количество коронарных вмешательств. Использование верапамила и дилтиазема может быть целесообразным при противопоказаниях к назначению блокаторов β-адренорецепторов, особенно при обструктивных заболеваниях дыхательных путей. Следует быть осторожным при назначении этих препаратов пациентам с нарушенной функцией желудочков. Дигидропиридиновые антагонисты кальция в качестве монотерапии приводят к увеличению летальности больных с острым ИМ [7], поэтому такое лечение должны назначать только при наличии четких клинических показаний. И хотя результаты субанализа исследования ASCOT [3] дают основания полагать, что комбинированная терапия аторвастатином, амлодипином и периндоприлом у больных с риском развития ИБС снижает общую смертность на 11% (p<0,025) и частоту всех кардиоваскулярных событий на 16% (p<0,0001), рутинное назначение амлодипина как дополнения к терапии блокаторами β-адренорецепторов и ингибиторами АПФ больным после ИМ требует дополнительных исследований с привлечением большего количества пациентов.
Ингибиторы АПФ
По результатам нескольких исследований установлено, что ингибиторы АПФ уменьшают летальность после перенесенного острого ИМ со сниженной остаточной функцией ЛЖ. В исследования SAVE (1992) включали пациентов в среднем через 11 дней после острого события. У всех их ФВ была менее 40% при радиоизотопной вентрикулографии и не было признаков манифестной ишемии при нагрузочном тесте. В течение первого года не отмечено благоприятного влияния на смертность, но в следующие 3–5 лет смертность уменьшилась на 19% (с 24,6 до 20,4%). В то же время даже в течение первого года замечали уменьшение реинфарктов и случаев возникновения СН.
В исследовании AIRE (1993) пациентов, у которых появились клинические или рентгенологические признаки СН, рандомизировали для терапии рамиприлом в среднем через 5 дней после начала ИМ. Через 15 мес смертность уменьшилась с 22,6 до 16,9% (относительное уменьшение на 27%).
В исследовании TRACE (1995) лечение трандолаприлом или плацебо начиналось в среднем через 4 дня после инфаркта, осложненного дисфункцией ЛЖ. Индекс подвижности стенки у всех пациентов составлял 1,2 и меньше. В среднем через 108 нед наблюдения смертность составляла 34,7% в группе активного лечения и 42,3% в группе плацебо. Авторы этого исследования в дальнейшем наблюдали пациентов в течение минимум 6 лет и доказали увеличение ожидаемой продолжительности жизни на 15,3 мес (27%). С учетом результатов трех исследований целесообразно назначать ингибиторы АПФ пациентам, у которых после острого события возникала СН с ФВ менее 40% или индексом подвижности стенки 1,2 и меньше, при условии отсутствия противопоказаний. Следует отметить, что доказательства эффективности терапии ингибиторами АПФ получены преимущественно у больных с передней локализацией ИМ.
Данные длительного исследования эффективности ингибиторов АПФ у пациентов в постинфарктный период, а также данные исследования HOPE [20] свидетельствуют о пользе назначения этих препаратов по крайней мере в течение 4–5 лет, даже при отсутствии дисфункции ЛЖ. Достигнутый эффект может быть даже большим у пациентов с сахарным диабетом, которые перенесли ИМ. Длительное назначение ингибитора АПФ после перенесенного ИМ, подобно ацетилсалициловой кислоте и блокаторам β-адренорецепторов оправдано, если пациенты хорошо переносят эти препараты. Результаты исследования EUROPA подтвердили эффективность применения периндоприла у больных после перенесенного ИМ [14]. Назначение периндоприла пациентам с низкой степенью риска независимо от наличия СН, АГ, сахарного диабета приводило к снижению вероятности повторных ИМ на 24%, развития СН — на 39%. В другом большом исследовании с рамиприлом отмечена его способность уменьшать частоту кардиоваскулярных событий в качестве профилактической терапии у больных с высоким риском сердечно-сосудистых осложнений (HOPE).
Липидоснижающая терапия
Скандинавское исследование влияния симвастатина на выживание (4S, 1994) доказало пользу снижения уровня липидов в популяции 4444 пациентов со стенокардией и/или после ИМ с уровнями ХС в сыворотке крови 212–308 мг/дл (5,5–8,0 ммоль/л) после применения диетических мероприятий. Пациентов не включали в исследование до 6 мес после острого инфаркта, была отобрана группа больных с относительно низкой степенью риска. В среднем через 5,4 года общая смертность в группе лечения симвастатином снизилась на 30% (12% в группе плацебо и 8% в группе симвастатина), что при пересчете результатов означает 33 спасенные жизни на 1000 леченых пациентов в течение этого периода. Были отмечены существенное снижение смертности вследствие коронарных причин, а также потребности в выполнении шунтирующих хирургических вмешательств. Польза применения симвастатина у пациентов в возрасте старше 60 лет была такой же, как и у больных младшей возрастной группы.
В исследовании CARE (1996) 4159 пациентов после ИМ со «средними» уровнями ХС (в среднем 209 мг/дл) получали правастатин 40 мг или плацебо в течение 3–20 мес после острого события. Правастатин обеспечил относительное снижение риска фатальных коронарных событий или реинфаркта на 24%. Подобные благоприятные эффекты отмечены в подгруппе пациентов, которым выполнили реваскуляризацию миокарда. Исследование LIPID (1998) объединило около 9 тыс. пациентов с перенесенным ранее ИМ или нестабильной стенокардией и уровнем ХС в широком диапазоне: 42% — <213 мг/дл (5,5 ммоль/л), 44% — в пределах 213–250 мг/дл (5,5–6,4 ммоль/л) и 13% — 251 мг/дл (6,5 ммоль/л). Больные были рандомизированы, чтобы получать терапию 40 мг правастатина или плацебо в течение 6 лет. Лечение правастатином позволило снизить вероятность коронарной смерти на 24%, риск (ре-)ИМ — на 29% [8].
Результаты исследования ASCOT подтвердили эффективность терапии аторвастатином у пациентов с нарушением обмена липидов относительно развития коронарных событий (в том числе фатальных).
Вторым препаратом из группы липидоснижающих средств является никотиновая кислота. До недавнего времени применение ее с этой целью было ограничено в связи с коротким периодом действия, необходимостью инъекционного введения и выраженными побочными эффектами (гиперемия). Однако в последние годы появились сообщения, что новая пероральная пролонгированная форма никотиновой кислоты была успешно использована в лечении дислипидемии у пациентов с сахарным диабетом. Более того, сравнение эффективности пролонгированной формы никотиновой кислоты и гемфиброзила доказало преимущество первого средства в лечении дислипидемии. Тем не менее для оценки возможности включения данного препарата в терапию постинфарктных больных необходимо проведение специальных исследований. В целом, влияние липидоснижающей терапии на госпитальную летальность у больных с ОКС оценено в исследовании PURSUIT (рис. 1.8).
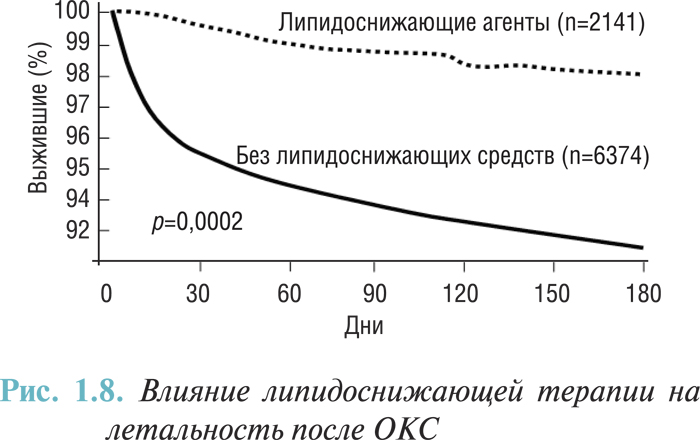
В целом, липидоснижающие средства следует назначать пациентам, которые соответствуют критериям включения в упомянутые выше исследования. Статины назначают, если несмотря на соблюдение диеты на диетические мероприятия, содержание уровня общего ХС >190 мг/дл (4,9 ммоль/л) и/или ХС ЛПНП >115 мг/дл (2,97 ммоль/л). Результаты исследования HPS (2001) позволяют допустить, что рекомендации относительно применения статинов должны распространяться и на пациентов с более низким уровнем липидов, включая больных пожилого возраста (рис. 1.9).
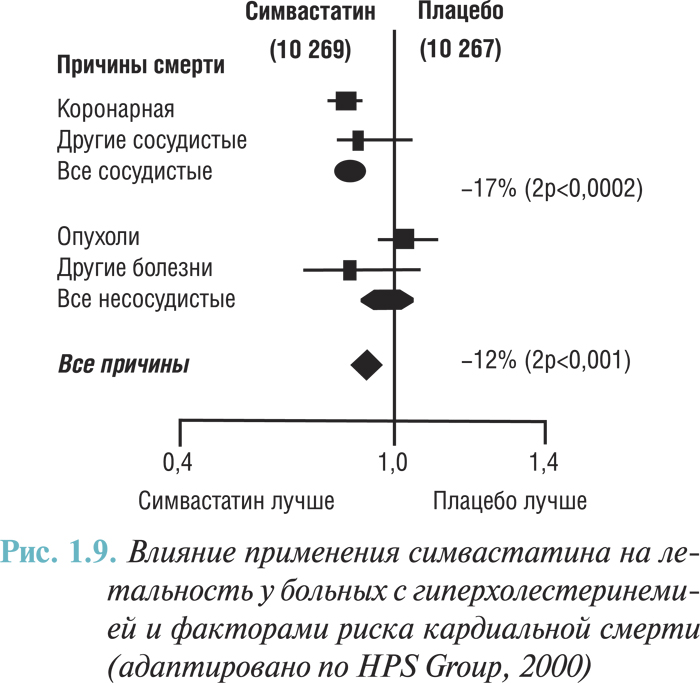
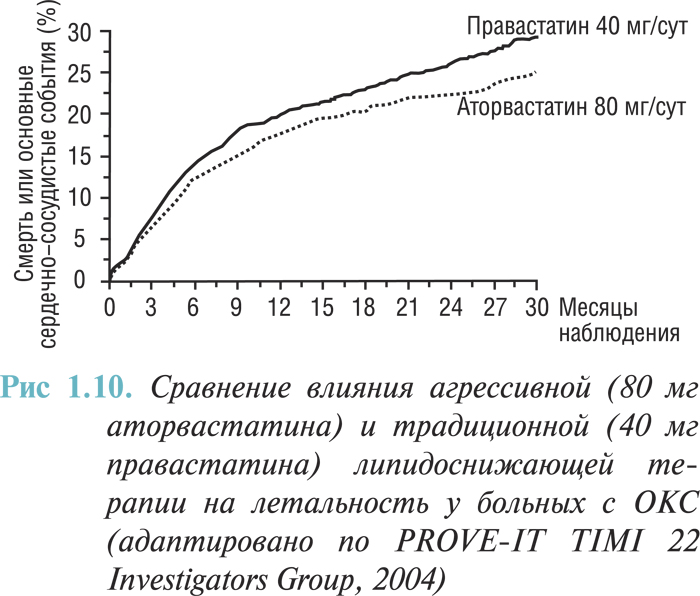
У пациентов с низким уровнем ХС ЛПВП следует оценить необходимость назначения статинов. Сохраняются противоречия относительно сроков начала терапии. Данные недавно опубликованного исследования свидетельствуют, что преимущество может быть у раннего и агрессивного лечения липидоснижающими средствами, независимо от уровня ХС (рис. 1.10).
Итак, подводя итог, представляем перечень профилактических мер, применяемых у пациентов после перенесенного острого ИМ с элевацией сегмента ST (табл. 1.4).
Таблица 1.4
Вторичная профилактика: резюме
| Рекомендации | Класс | Уровень доказательств |
| Прекратить курение | I | С |
| Оптимальный контроль гликемии у пациентов с сахарным диабетом | I | В |
| Контроль АД у пациентов с АГ | I | С |
| Средиземноморская диета | I | В |
| Добавление в пищу 1 г рыбьего жира и омега-3-полиненасыщенных жирных кислот | I | В |
| Ацетилсалициловая кислота 75–160 мг/сут | I | А |
| При непереносимости ацетилсалициловой кислоты: клопидогрел 75 мг/сут | II b | С |
| Пероральный антикоагулянт | II а | В |
| Пероральные блокаторы β-адренорецепторов: всем пациентам без противопоказаний | I | А |
| Продолжение терапии ингибитором АПФ, начатой в первый день | I | А |
| Статины: если общий ХС >190 мг/дл и/или ХС ЛПНП >115 мг/дл | I | А |
| Фибраты: если ХС ЛПВП <45 мг/дл и ТГ >200 мг/дл | II а | А |
| Антагонисты кальция (дилтиазем или верапамил), если есть противопоказания к назначению блокаторов β-адренорецепторов и нет СН |
II b | В |
ДИАГНОСТИКА
Установление диагноза и ранняя стратификация риска
Быстрая постановка диагноза и ранняя стратификация риска у пациентов, которые обращаются с острой болью в грудной клетке, важны для выявления тех больных, у которых раннее вмешательство может улучшить последствия заболевания. С другой стороны, когда диагноз «острый ИМ» исключен, основное внимание может быть уделено выявлению других сердечных или несердечных причин симптомов. Сначала следует установить рабочий диагноз — ОКС с элевацией сегмента ST.
Клиническая картина
Обычно основанием для этого является выраженная боль в грудной клетке длительностью 20 мин и более, которая не уменьшается после приема нитроглицерина. Важными для диагностического поиска являются предшествующий анамнез ИБС, иррадиация боли в шею, нижнюю челюсть или левую руку. Боль может быть не очень интенсивной; у людей пожилого возраста распространены такие симптомы, как усталость, одышка, обморок, синкопе. Не существует специфических физикальных признаков, позволяющих установить диагноз «инфаркт миокарда». Однако у многих пациентов появляются симптомы, характерные для активации вегетативной нервной системы (бледная кожа, потливость), а также развивается гипотензия или снижение пульсового давления.
Могут отмечать нерегулярный пульс, брадикардию или тахикардию, третий тон сердца, влажные хрипы в нижних отделах легких.
Нужно как можно быстрее зарегистрировать ЭКГ.
В случае элеваций сегмента ST или появления новой или вероятно новой блокады левой ножки пучка Гиса назначают специфическую терапию или проводят мероприятия для ее начала (реперфузионная терапия, назначение ацетилсалициловой кислоты или при ее непереносимости или наличии данных о предыдущей неэффективности — тиенопиридины, а также антикоагулянты; в случае передней локализации острого ИМ или сопутствующей АГ — ингибиторы АПФ, блокаторы β-адренорецепторов, нитропрепараты и т.п.). Использование ЭГК при указанных признаках является ключевым при ведении острой фазы острого ИМ (рис. 1.11).
Впрочем, картина ЭКГ часто неоднозначна, и даже при подтвержденном инфаркте могут сразу не проявиться его классические признаки — элевация сегмента ST и новые патологические зубцы Q. Следует получить повторные записи ЭКГ и по возможности проводить сравнение новых ЭКГ с предыдущими записями. Для установления диагноза в отдельных случаях (инфаркт задней стенки) полезно зарегистрировать ЭКГ в дополнительных отведениях, например V7–V8, по Слопаку (S1–S4).
У всех больных нужно как можно быстрее начать мониторирование ЭКГ для выявления жизненно опасных аритмий. В острой фазе заболевания следует проводить анализ крови на сывороточные маркеры, но для решения вопроса о начале реперфузионной терапии в большинстве случаев не нужно ожидать результатов этого анализа.
Полезной методикой обследования больных с острой грудной болью является двухмерная эхоКГ. Региональные нарушения подвижности стенки появляются в течение секунд после возникновения коронарной окклюзии, до формирования некроза. Впрочем, нарушения подвижности стенки не являются специфическими для острого ИМ и могут быть обусловлены ишемией, ранее перенесенным инфарктом (особенно в сочетании с истончением соответствующих участков стенки ЛЖ), выраженными нарушениями внутрижелудочковой проводимости. Двухмерная эхоКГ исключительно важна для постановки диагноза в других случаях боли в груди, в частности острого расслоения аорты, экссудативного перикардита, массивной легочной эмболии. Отсутствие нарушений подвижности стенки позволяет исключить только наличие распространенного ИМ — в ряде случаев мелкоочаговое поражение миокарда может не сопровождаться явным нарушением сегментарной сократимости (особенно в сочетании с гипертрофией миокарда).
Когда анамнез, ЭКГ и маркеры некроза не свидетельствуют о диагнозе «острый инфаркт миокарда», пациенту следует провести стресс-тестирование с целью установления диагноза ИБС.
Лабораторная диагностика
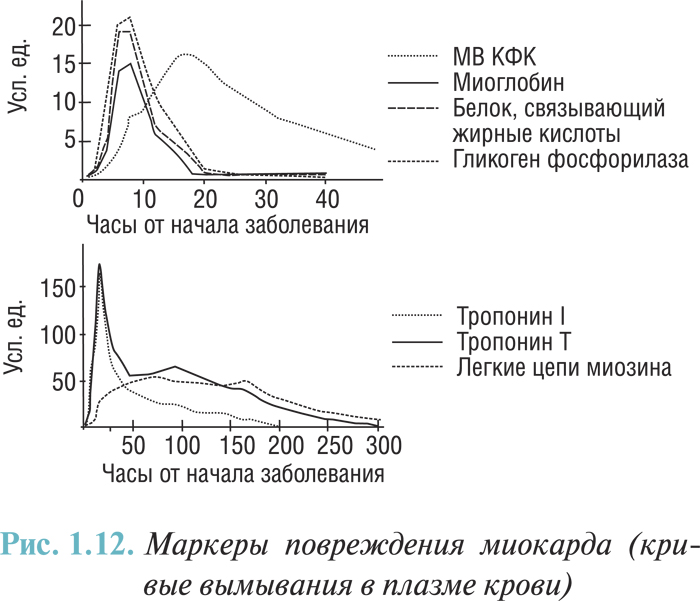
На данном этапе главным маркером повреждения миокарда можно считать МВ-фракцию КФК (КФК-МВ). КФК-МВ имеет высокую клиническую специфичность для диагностики развития ИМ. Как дополнение или альтернатива КФК-МВ могут определяться сердечные тропонины T и I (количественный анализ), миоглобин, которые характеризуются высокой специфичностью к ткани миокарда, а также высокой чувствительностью. Среди наиболее распространенных биомаркеров приоритет в диагностике повреждения миокарда принадлежит определению количества фермента КФК-МВ. Несколько разным является профиль вымывания КФК-МВ и тропонинов в периферическую венозную кровь. Так, диагностически значимые концентрации КФК-МВ определяют в среднем на 30–60 мин раньше, чем у тропонинов, однако гипертропонинемия продолжается приблизительно на неделю дольше повышения КФК-МВ, что, несомненно, очень информативно в случае диагностики острого ИМ post factum (особенно с учетом того факта, что специфичность другого «позднего» маркера поражения миокарда — ЛДГ значительно ниже такой для обоих предыдущих маркеров). В последнее время разработаны новые маркеры повреждения миокарда (белок, связывающий жирные кислоты, гликоген-фосфорилаза ВВ, легкие цепочки миозина), которые пока не нашли широкого применения в клинике (рис. 1.12).
В настоящее время в Украине представлены быстрые иммунохроматографические тесты (Cito test) для определения кардиомаркеров: тропонина I, КК-МВ, миоглобина (табл. 1.5). Они дают возможность:
- на догоспитальном этапе создать максимально быстрый отбор пациентов с острым коронарным синдромом, которые нуждаются в неотложной медицинской помощи, и выбрать оптимальную тактику ведения больных;
- установить дифференциальный диагноз острого ИМ и НС;
- обследовать пациента в любых условиях,
- в том числе вне лечебного учреждения;
- получить результат тестирования через 10 мин.
Таблица 1.5
Характеристики тестов
| Начало повышения, ч | Пик активности, ч | Нормализация | |
| Миоглобин | 2–4 | 9–12 | 24–36 ч |
| КК-МВ | 3–8 | 9–30 | 48–72 ч |
| Тропонин | 4–6 | 12–24 | 1–2 нед |
| КК-МФ | Тропонин I | Миоглобин | |
| Пороговый уровень, нг/мл | 5 | 0,5 | 50 |
| Чувствительность, % | 100 | 98,7 | 100 |
| Специфичность, % | 99,8 | 98,4 | 97,7 |
| Точность, % | 99,8 | 98,5 | 98 |
Дифференциальная диагностика
Типичный клинический случай острого ИМ чаще всего приходится дифференцировать с такими причинами синдрома боли в грудной клетке, как расслоение грудного отдела аорты, тромбоэмболия в системе ЛА, острый (чаще вирусный) перикардит, выраженный корешковый синдром. Во внимание принимают наличие факторов риска коронарного атеросклероза, ангинозный анамнез, характер и динамику болевого приступа, реакцию пациента на вазодилататоры и наркотические анальгетики, динамику АД, в дальнейшем — результаты объективного осмотра, ЭКГ, эхоКГ, лабораторных анализов. В частности, при расслоении аорты боль чаще локализована в межлопаточном пространстве, резистентна к применению нитратов, в анамнезе — неконтролируемая АГ, выраженные изменения на ЭКГ отсутствуют, кардиальные маркеры в пределах нормальных значений, отмечают выраженный лейкоцитоз со сдвигом лейкоцитарной формулы влево; уточнение диагноза возможно при проведении эхоКГ, контрастной аортографии, КТ. При исключении перикардита следует обращать внимание на анамнез перенесенных респираторно-вирусных инфекций, наличие шума трения перикарда, отсутствие динамики кардиальных маркеров, данные эхоКГ, зависимость боли от фаз дыхания и положения тела. При плексите и обострении остеохондроза с корешковым синдромом боль чаще локализована слева или справа от грудины и зависит от положения тела, фазы дыхания. Почти всегда при пальпации удается выявить точки наибольшей болезненности в месте выхода соответствующих нервных корешков при отсутствии других специфичных для острого ИМ клинико-инструментальных признаков. При эмболии ветвей ЛА боль ощущается, как правило, несколько глубже, чем при остром ИМ, часто сопровождается пароксизмальной одышкой или удушьем, отмечают коллапс, гиперемию верхней половины тела. Изменения ЭКГ в ряде случаев напоминают картину острого ИМ нижней локализации, отличаясь от нее признаками острой перегрузки правых отделов сердца; в дальнейшем возможны клинические проявления сегментарной или долевой пневмонии, увеличение печени и другие признаки правожелудочковой недостаточности, кровохарканье; в анамнезе важно обратить внимание на наличие тромбофлебита, геморроя, операций на органах малого таза, костных переломов и обширных травм мягких тканей; гиперферментемия не характерна; данные эхоКГ подтверждают выраженную легочную гипертензию. При гастралгической форме острого ИМ возможна постановка ошибочного диагноза острого живота. Симптомы раздражения брюшины в этом случае отсутствуют, лейкоцитоз не так выражен. В случае нижней локализации острого ИМ без элевации сегмента ST графика ЭКГ бывает сходной с изменениями при остром панкреатите; правильный диагноз позволяет поставить анализ амилазы крови и диастазы мочи. Безболевая форма острого ИМ, протекающая с левожелудочковой недостаточностью, у больных с АГ клинически может напоминать выраженный гипертонический криз. В сомнительных случаях предпочтительно предположить возникновение острого ИМ и срочно госпитализировать больного.
Резюме
Начальная диагностика острого ИМ (рис. 1.13):
- боль/дискомфорт в груди;
- анамнестические и социальные факторы риска ИБС (анамнез ИБС (в том числе семейный), мужской пол, стрессы, зрелый возраст, ИМТ >30, АГ, сахарный диабет, периферический атеросклероз, курение, подагра, регулярный прием ацетилсалициловой кислоты и др.);
- элевация сегмента ST или (подозреваемая) новая блокада левой ножки пучка Гиса, выявленные на ЭКГ при госпитализации. Часто необходимы дополнительные ЭКГ;
- повышенные маркеры некроза миокарда (MB-КФК, тропонины). Для решения вопроса о необходимости реперфузионной терапии не нужно ожидать результатов.

ЛЕЧЕНИЕ ОСТРОГО ИНФАРКТА МИОКАРДА И ЕГО ОСЛОЖНЕНИЙ
Первичная цель лечения заключается в предотвращении смерти. Впрочем, ведение больных с ИМ обязательно направлено на сведение к минимуму дискомфорта пациентов и ограничение степени повреждения миокарда, предотвращение развития СН. Удобно выделение четырех фаз лечения:
- Неотложные мероприятия. Основные задачи этой фазы предоставления помощи заключаются в быстром установлении диагноза, снятии боли, профилактике или лечении осложнений заболевания (гемодинамических и аритмических).
- Ранние мероприятия. Принципиальное задание этой фазы — как можно более быстрое начало реперфузионной терапии для ограничения размеров инфаркта, предупреждения расширения зоны некроза (extension) и раннего ремоделирования (expansion), лечения таких осложнений, как СН, шок, угрожающие жизни аритмии.
- Последующие мероприятия с целью преодоления осложнений, возникающих позже.
- Оценка риска и мероприятия с целью профилактики прогресса ИБС, нового инфаркта, СН и смерти.
Эти фазы осуществляют на этапах догоспитальной помощи, в отделении/блоке неотложной кардиологической помощи, в специализированном отделении для постинфарктних больных или в обычном отделении кардиологического профиля (при отсутствии специализированных отделений).
Догоспитальная или ранняя госпитальная помощь
Мероприятия при остановке кровообращения и дыхания
Базисную поддержку жизни и развернутые мероприятия по поддержке жизни необходимо осуществлять в расширенном объеме в условиях специализированной помощи согласно соответствующим рекомендациям.
Лица, не имеющие надлежащей подготовки или оборудования, должны начать мероприятия по базисной поддержке жизни в соответствии с Европейскими рекомендациями по сердечно-легочной реанимации и неотложной помощи при сердечно-сосудистых заболеваниях и внезапной смерти 2001 г., дополненными в 2005 г. К общим положениям можно отнести следующие:
- интервал времени от первого контакта с пациентом лица (лиц), проводящих реанимационные мероприятия, до начала этих мероприятий, должен быть минимальным (желательно около 10 с). Ни сбор данных о больном, ни оформление документации, ни нюансы транспортировки не должны приводить к увеличению этого интервала (или к возникновению длительных пауз в проведении реанимационных мероприятий);
- первичные реанимационные мероприятия, включающие как минимум непрямой массаж сердца в области нижней трети грудины (100–120 толчков в мин), в ряде случаев способны поддержать жизнеспособность пациента в течение времени, достаточном для начала развернутых реанимационных мероприятий;
- в то время как непрямой массаж сердца больного уже сам по себе помогает поддерживать легочную вентиляцию на минимальном уровне при условии обеспечения проходимости дыхательных путей, искусственная вентиляция легких методами «рот в рот» или «рот в нос» не является адекватной заменой физиологическому акту дыхания, поскольку в получаемой больным газовой смеси процентное содержание СО2 повышено. Кроме того, такие подходы к вентиляции легких сопряжены с риском инфекции. Более рационально использовать дыхательные маски;
- при проведении непрямого массажа сердца и вентиляции легких их соотношение по частоте должно составлять 30:2. Эффективность мероприятий следует оценивать по появлению пульсации магистральных артерий;
- при нарушении сердечной деятельности, сопровождающейся отсутствием пульсации на магистральных сосудах, в первую очередь следует предполагать наличие у больного фибрилляции желудочков или гемодинамически неэффективной желудочковой тахикардии до уточнения причины остановки кровообращения при помощи ЭКГ и других инструментальных методов;
- электрическая дефибрилляция является единственным эффективным методом восстановления сердечной деятельности в большинстве случаев внезапной остановки кровообращения. Каждая минута после наступления остановки сердца снижает вероятность успешного исхода дефибрилляции на 10%;
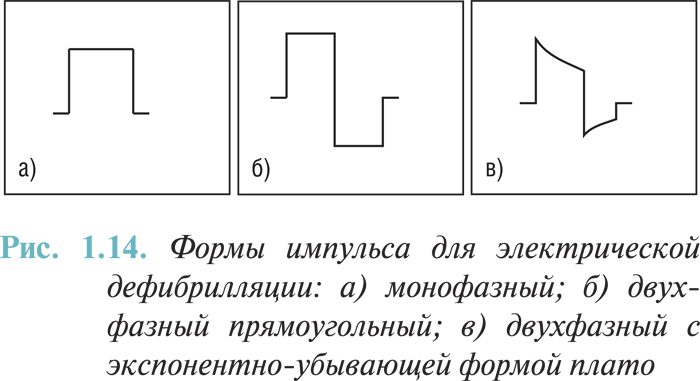
- в настоящее время рекомендуют проводить дефибрилляцию ударами прямого тока с двухфазной формой волны пониженной амплитуды и энергией 200 Дж для первых двух ударов и 360 Дж для последующих. Среди двухфазных наиболее эффективным считают импульс с экспонентно-убывающей формой плато каждой из фаз (рис. 1.14).
- электрод, накладываемый на грудину, помещают на верхнюю часть правой половины грудной клетки под ключицей. Электрод, накладываемый на верхушку сердца, располагают немного латеральнее точки нормальной проекции верхушечного толчка, но не на молочную железу у женщин. Полярность электродов решающего значения не имеет;
- бригады скорой помощи (минимум 3 человека), направляемые на случаи с потерей сознания и/или болью в груди, должны быть оснащены дефибриллятором (желательно — автоматическим внешним дефибриллятором), электрокардиографом и средствами подачи кислорода, а медицинский персонал должен иметь опыт работы с ними и навыки проведения сердечно-легочной реанимации (СЛР);
- во многих случаях СЛР и дефибрилляция сами по себе не позволяют вернуть или сохранить больному жизнь, поэтому для увеличения шансов пациента на выживание необходимо оказывать также специализированную кардиологическую помощь (включающую восстановление коронарного кровотока в случае развития острого ИМ);
- ЭКГ больного с остановкой кровообращения и дыхания должна быть получена в максимально короткие сроки. Интерпретацию ЭКГ должен производить квалифицированный персонал на месте или посредством трансляции. Средний медицинский персонал также может верифицировать жизнеугрожающие аритмии и асистолию при определенном уровне подготовки;
- медикаментозную поддержку следует начать сразу после верификации состояния сердечной деятельности по данным ЭКГ (внутривенное или внутрисердечное введение эпинефрина, атропина при асистолии и мелковолновой фибрилляции, применение амиодарона и лидокаина при желудочковых тахиаритмиях);
- для обеспечения своевременности и адекватности проведения общих, а затем и специализированных, реанимационных мероприятий необходима координация действий бригад скорой помощи и сотрудников кардиореанимационных отделений (в частности извещение стационара о планирующейся доставке пациента);
- длительность реанимационных мероприятий при отсутствии эффекта должна составлять на догоспитальном этапе минимум 30 мин, в стационаре — минимум 15 мин с момента констатации факта остановки кровообращения.
Симптоматическое лечение
Уменьшение боли, одышки и возбуждения
Уменьшение боли имеет первоочередное значение, не только с гуманной точки зрения, но и из-за того, что боль связана с симпатической активацией, которая приводит к вазоконстрикции и увеличению постнагрузки на сердце (хотя нет прямых доказательств того, что симптоматическое снятие болевого синдрома опиоидами улучшает отдаленный прогноз по сравнению с другими антиангинальными средствами). В этом контексте чаще всего применяют внутривенные опиоиды — морфин (например в дозе 4–10 мг морфина с дополнительным введением по 2 мг с интервалами 5 мин до исчезновения боли); следует избегать внутримышечных и подкожных инъекций, учитывая больший промежуток времени до максимального клинического эффекта и его неконтролируемость. Может возникнуть необходимость в повторном введении препарата. Возможны побочные эффекты — тошнота, рвота, гипотензия с брадикардией, затруднение дыхания, у мужчин — задержка мочеотделения спазматического генеза. В случаях когда опиоиды не позволяют снять боль при повторном назначении, иногда эффективным средством являются внутривенное введение блокаторов β-адренорецепторов и/или нитратов. Кислород (2–4 л/мин через маску или носовой катетер) следует назначать пациентам с признаками СН или шока. Неинвазивное мониторирование насыщения крови кислородом (SpO2) существенно помогает в принятии решения о назначении кислорода или в тяжелых случаях вспомогательной вентиляции легких.
Как правило, реакцией на боль и обстоятельства, вследствие которых возникает сердечный приступ, является возбуждение. Очень важно успокоить пациента. При сильном возбуждении полезно назначить препарат группы транквилизаторов (бензодиазепинового ряда), но в большинстве случаев достаточный эффект может быть получен после терапии опиоидами.
Устранение тошноты, рвоты, гипотонии и брадикардии
Эти симптомы часто возникают в начальной фазе ОКС из-за повышенной активности блуждающего нерва и/или побочных эффектов наркотических анальгетиков, нитратов и блокаторов β-адренорецепторов. Для устранения тошноты и рвоты можно использовать противорвотные средства, например метоклопрамид (20 мг внутривенно с последующим введением до достижения общей дозы 60 мг в случае необходимости). Выраженность брадикардии, которую отмечают в сочетании с гипотонией или без нее и которая сохраняется после купирования боли и тошноты, можно уменьшить с помощью атропина. При рефлекторной гипотонии, вызванной снижением чувствительности сосудистой стенки к вазопрессорам, также целесообразно введение ГКС. Стойкая гипотония скорее всего является признаком кардиогенного шока как проявления тяжелого поражения миокарда.
Восстановление и поддержание адекватного коронарного кровотока
У пациентов с клиническими признаками ИМ и стойкой элевацией сегмента ST или предположительно новой блокадой левой ножки пучка Гиса следует осуществить механическую или фармакологическую реперфузию, если отсутствуют очевидные противопоказания.
Фибринолитическая терапия
В настоящее время в рандомизированных исследованиях эффективности тромболитических препаратов по сравнению с плацебо или одного фибринолитического средства по сравнению с другим приняли участие свыше 150 000 пациентов. Убедительно доказано благоприятное влияние фибринолитической терапии на пациентов, у которых от возникновения симптомов инфаркта прошло до 12 ч. Метаанализ этих исследований свидетельствует, что у пациентов, поступающих в течение 6 ч от начала симптомов, с элевацией сегмента ST или блокадой ножки пучка Гиса, введение тромболитических средств позволяет предотвратить приблизительно 30 смертельных случаев на 1000 больных, получавших лечение, а введение в промежуток времени между 7–12 ч от начала симптомов — 20 смертельных случаев на 1000 пациентов.
В 1988 г. был доказан существенный дополнительный эффект применения ацетилсалициловой кислоты в комбинации с фибринолитиками, что привело к предотвращению 50 смертельных случаев на 1000 лечившихся больных. Благоприятный эффект терапии отмечали во всех предварительно определенных подгруппах. Наибольший эффект был отмечен у пациентов с наивысшей степенью риска. У пациентов в возрасте старше 75 лет, лечение которых осуществлялось в течение первых 24 ч, влияние на выживание было незначительным и статистически недостоверным. Впрочем, если тромболитическую терапию осуществляли в течение первых 12 ч от начала симптомов, летальность достоверно снизилась на 26–29,4%. Наиболее эффективна фибринолитическая терапия больных, у которых сохранены зубцы R в сочетании с элевацией сегмента ST (ранние сроки коронарообструкции). На рис. 1.15 показаны результаты анализа эффективности тромболитической терапии (ТЛТ) в зависимости от сроков ее проведения.
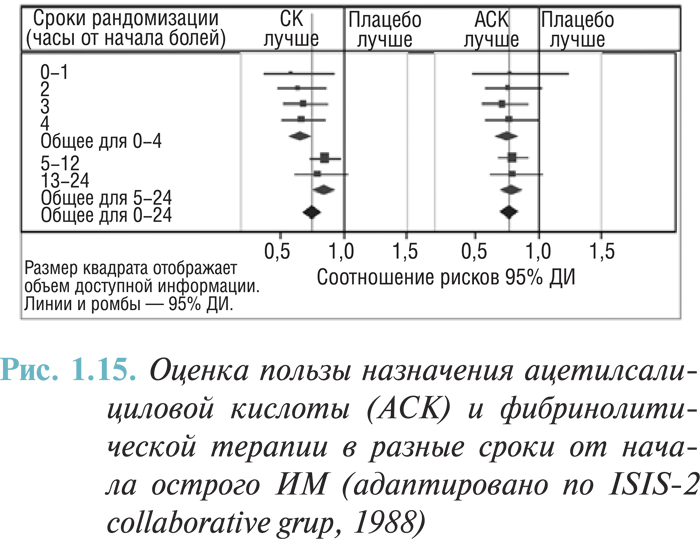
Результатом сравнения разных методов восстановления коронарного кровотока является вывод о необходимости его восстановления как можно раньше любым доступным методом и в наиболее ранние сроки. Положительный эффект тромболитической терапии будет наибольшим, если она осуществляется в самые ранние сроки от начала симптомов. В частности, максимальное снижение летальности наблюдалось в случае, если лечение начиналось в течение первых двух часов заболевания. Анализ исследований с привлечением свыше 6000 пациентов свидетельствует, что при догоспитальном тромболизисе ранняя смертность уменьшалась на 15–20%; есть данные о практически равной эффективности догоспитального тромболизиса и первичной ПТКА. При задержке введения тромболитических средств на каждый час количество смертельных случаев увеличивалось на 1,6 на 1000 лечащихся пациентов. Большое рандомизированное исследование показало, что если тромболитическая терапия (ТЛТ) проводится через 6–24 ч от начала острого ИМ, ее эффективность в среднем равняется таковой для плацебо, хотя частота ангиографически подтвержденного открытия ИОКА при проведении ТЛТ альтеплазой в сроки до 24 ч от начала острого ИМ остается существенно выше, чем у пациентов, которым ТЛТ вообще не проводилась. Учитывая результаты больших исследований, можно говорить, что клиническая эффективность ТЛТ (в частности терапии альтеплазой) превышает таковую для плацебо лишь в сроки до 12 ч от начала острого ИМ.
Осложнения фибринолитической терапии
Тромболитическую терапию ассоциируют с некоторым увеличением количества инсультов (приблизительно на 3,9 из 1000 лечившихся пациентов), причем «избыточные» инсульты преимущественно отмечали в течение первого дня после начала лечения. Ранние инсульты были по большей части обусловлены церебральным кровотечением; более поздние инсульты чаще определяли как тромботические или эмболические. Часть «избыточных» инсультов приходилась на умерших в дальнейшем пациентов, что нужно учитывать при оценке смертности (увеличение на 1,9 на 1000 больных). Тяжелые нецеребральные кровотечения (требующие переливания крови или являющиеся жизненно опасными) могут возникать в 4–13% количества лечившихся больных. Источник кровотечения преимущественно связан с местом процедуры. Независимые предикторы нецеребрального кровотечения — пожилой возраст, низкая масса тела, женский пол. Существенными предикторами возникновения внутричерепных кровотечений считают пожилой возраст, низкую массу тела, женский пол, перенесенное раньше заболевание мозговых сосудов или АГ в анамнезе, систолическую и диастолическую гипертензию на момент госпитализации.
Назначение стрептокиназы может ассоциироваться с гипотензией, но тяжелые аллергические реакции отмечают редко. Польза от рутинного назначения гидрокортизона не доказана. При возникновении гипотензии следует уменьшить скорость введения стрептокиназы, а в случае необходимости — временно прекратить инфузию, придать пациенту горизонтальное положение с приподнятыми нижними конечностями, увеличить объем подачи кислорода. Иногда необходимо ввести атропин или пополнить объем внутрисосудистой жидкости. Прессорные амины не рекомендованы для лечения гипотензии, сопровождающей введение стрептокиназы, если АД может быть нормализовано применением вышеперечисленных средств. В некоторых случаях может понадобиться инфузия допамина со скоростью 5–10 мкг/кг·мин.
Сравнение фибринолитических средств
В настоящее время существует большое количество тромболитических препаратов (стрептокиназа, урокиназа, анистреплаза, тканевый активатор плазминогена альтеплаза, мутантные формы tPA: TNK-тенектеплаза, rPA-ретеплаза, nPA-ланотеплаза). Адекватную реканализацию ИОКА при проведении ТЛТ (по данным коронарографии соответствует градации TIMI-3) регистрируют в 34–50% случаев. Она зависит от вида используемого препарата [5]. Тем не менее в исследованиях ISIS-3 и GISSI-2 не выявили отличий в показателях смертности при применении стрептокиназы и тканевого активатора плазминогена или анистреплазы. Кроме того, дополнительное подкожное введение гепарина не снижало смертность по сравнению с терапией без его применения. Впрочем, в исследовании GUSTO сравнивали ускоренное введение t-PA (тканевого активатора плазминогена) в течение 90 мин с обычной схемой введения в течение 3 ч. Ускоренное введение t-PA и внутривенное введение гепарина, контролируемое по показателю АЧТВ, позволило уменьшить количество смертельных случаев на 10 среди 1000 лечившихся пациентов. В исследовании GUSTO-I смертность за 30-дневный период при применении t-PA была достоверно ниже, чем при использовании стрептокиназы. Риск инсульта по данным исследования GUSTO-I был выше при применении t-PA по сравнению со стрептокиназой (0,7 и 0,5% соответственно, р=0,03).
Последние исследования в области тромболитической терапии при остром ИМ были посвящены сравнению ускоренного режима введения t-PA с одноболюсным (в случае TNK и rPA) или двухболюсным (для rPA) введением мутантных форм тканевого активатора плазминогена. Так, болюсное введение зарегистрированного в Украине TNK-tPA с коррекцией в зависимости от массы тела является эквивалентным ускоренной инфузии t-PA по показателю смертности через 30 дней. Это мероприятие ассоциируют с существенным уменьшением частоты возникновения немозговых кровотечений и уменьшением потребности в переливании крови. Осуществление фибринолитической терапии болюсом позволяет быстро применить ее в госпитале или на догоспитальном этапе и снизить риск ошибок, связанных с введением препарата. Выбор фибринолитического средства будет зависеть от индивидуальной оценки риска и пользы, а также от факторов доступности и стоимости. Для пациентов, которым тромболизис осуществляют после 4 ч с момента развития симптомов, лучшие результаты могут дать препараты с большей степенью фибриноспецифичности.
Клинические последствия ТЛТ
Для уменьшения количества осложнений и летальности у больных с острым ИМ, если у них нет очевидных противопоказаний, следует как можно быстрее применять фибринолитические средства и ацетилсалициловую кислоту, которые создают взаимодополняющий эффект. На данном этапе цель — начать фибринолиз в течение 90 мин с момента обращения пациента за медицинской помощью («от обращения до введения иглы») или в течение 30 мин после поступления в госпиталь («от двери до введения иглы»). У пациентов с ИМ, который формируется медленно или волнообразно (stuttering), следует осуществлять серийную регистрацию ЭКГ или мониторирование сегмента ST, клиническую оценку и повторные анализы сывороточных маркеров для диагностики ИМ.
Фибринолитическую терапию не следует назначать пациентам, у которых ИМ развился более 12 ч назад, если нет признаков сохранения ишемии (с надлежащими ЭКГ-критериями для проведения фибринолиза). Пациенты пожилого возраста при отсутствии противопоказаний также должны получать фибринолитическую терапию, если нет условий для своевременного выполнения механической реперфузии. Следует отметить, что позднее проведение реперфузионной терапии в условиях значительной некротизации с нарушением целостности коронарного русла ниже места обструкции может привести к геморрагической конверсии ИМ со значительным распространением его на неповрежденные участки сердечной мышцы. В этом случае прогноз для пациента может быть даже хуже, чем в случае отказа от проведения реперфузионной терапии.
Имеются данные о том, что фибринолитическая терапия, приводя к открытию ИОКА и тем самым к ограничению зоны некроза миокарда, предотвращает развитие ранней постинфарктной дилатации (РПД) полости ЛЖ и дисфункции ЛЖ, что является одним из основных факторов, улучшающих прогноз при остром ИМ.
Противопоказания к фибринолитической терапии
Абсолютные и относительные противопоказания к фибринолитической терапии приведены в табл. 1.6. Следует отметить, что сахарный диабет и, в частности, диабетическая ретинопатия, не является противопоказанием к фибринолитической терапии. Травматичную реанимацию рассматривают как относительное противопоказание для осуществления тромболизиса.
Таблица 1.6
Противопоказания к фибринолитической терапии
| Абсолютные противопоказания |
|
| Относительные противопоказания |
|
Режимы фибринолитической терапии
Дозирование современных фибринолитических средств и информация относительно потребности в сопутствующем применении антитромбинов приведены в табл. 1.7.
Таблица 1.7
Дозирование современных фибринолитических средств*
| Тромболитические препараты | Начальное лечение | Сопутствующие антитромбины | Специфические противопоказания |
| Стрептокиназа | 1,5 млн МЕ в 100 мл 5% глюкозы или изотонического раствора NaCl в течение 30—60 мин | Гепарин внутривенно болюсно (60 МЕ/кг) с последующей инфузией в течение 48 ч под контролем АЧТВ (в пределах 50–70 мс) или эноксапарин 30 мг болюсно (у пациентов старше 75 лет без болюса), потом подкожно 1 мг/кг (у пациентов старше 75 лет — 0,75 мг/кг) не больше 80 мг дважды (при повышении уровня креатинина >2,5 мг/дл у мужчин или 2 мг/дл у женщин или если клиренс креатинина <30 мл/мин — один раз) в сутки на протяжении 3–8 сут, или фондапаринукс (если уровень сывороточного креатинина <3 мг/дл) 2,5 мг болюсно, потом 2,5 мг подкожно один раз в сутки от 3 до 8 сут | Предыдущее введение стрептокиназы |
| Альтеплаза (t-PA) | 15 мг внутривенно болюсно; 0,75 мг/кг в течение 30 мин, дальше 0,5 мг/кг в течение 60 мин; общая доза не должна превышать 100 мг | ||
| Тенектеплаза | Внутривенно болюсно в дозе 0,5 мг/кг в течение 10 с; общая доза не должна превышать 50 мг (10000 ЕД) |
*Приведена информация относительно препаратов, зарегистрированных в Украине. N.B. Ацетилсалициловую кислоту следует назначать всем пациентам при отсутствии противопоказаний к применению этого препарата.
Повторное назначение фибринолитического средства
Если есть признаки реокклюзии или реинфаркта с возобновлением элевации сегмента ST или блокадой ножки пучка Гиса, следует опять назначать фибринолитическую терапию (если нет условий для осуществления механической реперфузии). Повторно в сроки свыше 3 и более суток от первого введения не следует назначать стрептокиназу, поскольку антитела к стрептокиназе сохраняются в течение по крайней мере 10 лет в концентрациях, которые могут повлиять на ее активность. Альтеплаза (t-PA) и TNK-tPA не ведут к формированию антител. Однако следует помнить, что повторное назначение фибринолитических средств может привести к повышению риска геморрагических осложнений.
Дополнительная антикоагулянтная и антитромбоцитарная терапия
Независимые и дополнительные благоприятные эффекты ацетилсалициловой кислоты описаны выше. Точно неизвестно, способствует ли ацетилсалициловая кислота фибринолизу, предотвращению реокклюзии или ограничению микрососудистых эффектов активации тромбоцитов. В исследованиях поздней реокклюзии ацетилсалициловая кислота была более эффективным средством в предотвращении последующих клинических событий, чем в поддержке проходимости коронарной артерии. Сначала пациент должен разжевать первую дозу 150–325 мг (не применять ацетилсалициловую кислоту в защитной оболочке!), затем ежедневно применять более низкую дозу (125–175 мг) перорально. Если пероральный прием невозможен, ацетилсалициловую кислоту можно ввести внутривенно (250 мг). В случае ее непереносимости показано назначение клопидогрела. При комбинации клопидогрела с ацетилсалициловой кислотой доза последней может составлять 75–100 мг.
Агрегация и адгезия тромбоцитов подавлялась ацетилсалициловой кислотой лишь частично, прогресс был достигнут благодаря разработке ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa, которые блокируют конечный этап агрегации тромбоцитов и их адгезию к участкам поврежденного эндотелия. Ангиографические исследования доказали способность этих препаратов вместе с половинной дозой фибринолитиков и уменьшенной дозой гепарина улучшать коронарный кровоток подобно полной дозе фибринолитиков, но с более полной тканевой реперфузией. Применение этих препаратов в двух больших исследованиях не снижало летальность в течение 30 дней и количество внутричерепных кровотечений, хотя уменьшало количество рецидивов инфарктов. Также на фоне их применения отмечено увеличение количества немозговых кровотечений (преимущественно спонтанных), особенно у пациентов пожилого возраста. Поэтому не рекомендуют рутинное применение уменьшенной дозы фибринолитического средства вместе с абсиксимабом или другими парентеральными ингибиторами гликопротеиновых рецепторов тромбоцитов IIb/IIIa. Необходима дальнейшая оценка возможных благоприятных эффектов такой комбинированной терапии у пациентов отдельных подгрупп, например у больных с наивысшей степенью риска или планируемым выполнением ЧТКА.
В последние годы подтвердили высказанную ранее теорию о том, что фибринолитические агенты (в первую очередь стрептокиназа) обладают собственной прокоагулянтной активностью вследствие активации высвобождения тромбина, глобального повреждения эндотелия с развитием его дисфункции. Было отмечено, что системная ТЛТ стрептокиназой повышает активность тромбина в 3 раза и производит протромбиногенные сдвиги в калликреин-кининовой системе. Это привело к необходимости разработки адъювантной терапии, которая могла бы компенсировать постфибринолитический всплеск тромбиновой активности.
Эффективность применения гепарина изучали во многих исследованиях во время или после фибринолиза, особенно вместе с применением тканевого активатора плазминогена. Гепарин не улучшает результатов лизиса сгустка фибринолитиком, болюсное введение даже больших доз (до 300 МЕ/кг), по данным ангиографии, не приводит к увеличению частоты спонтанного открытия коронарной артерии. Тем не менее проходимость коронарной артерии через часы и дни после тромболитической терапии тканевым активатором плазминогена лучше при одновременном внутривенном применении гепарина. Длительное внутривенное назначение гепарина не позволяло предотвратить реокклюзии после достижения успешного коронарного фибринолиза, подтвержденного ангиографическим методом. Суммируя приведенные факты, можно заключить, что, не обладая собственной тромборазрушающей активностью, гепарин (по крайней мере при контролируемом внутривенном инфузионном введении) обладает профилактическими свойствами в отношении коронарного ретромбоза, особенно в период прокоагулянтного сдвига в системе свертывания, вызванного системным фибринолизом. Во время внутривенной терапии гепарином необходимо тщательное мониторирование показателя АЧТВ (который не должен превышать 70 с, так как сверхвысокие его значения ассоциируются с большей вероятностью смерти, кровотечения и реинфаркта). Следует отметить, что в большинстве исследований по применению внутривенно гепарина у больных в острый период ИМ средние показатели АЧТВ не достигали целевых значений в течение первых 48 ч заболевания, с чем может быть связан ряд негативных результатов, полученных в вышеупомянутых исследованиях. Несмотря на отсутствие прямых доказательств развития клинически значимого синдрома «рикошета» при резкой отмене гепарина у больных с острым ИМ, теоретические предпосылки для использования схемы лечения с постепенным уменьшением дозы препарата (и возможным переходом на подкожное введение) все же достаточно убедительны. Таким образом, инфузию гепарина после терапии фибринолитиком можно прекратить через 48 ч и перейти на подкожное введение низкомолекулярного или обычного гепарина. Продление терапии гепарином внутривенно может быть сопряжено с развитием специфического осложнения — «гепарин-индуцируемой» тромбоцитопении и увеличением количества геморрагий, что следует принимать во внимание. Поводом для принятия такой тактики может быть длительно сохраняющаяся ишемия (особенно при отсутствии возможности осуществить механическую или повторную фармакологическую реперфузию).
Низкомолекулярный гепарин — подфракция стандартного гепарина с молекулярной массой около 4500 Да (молекулярная масса нефракционированного гепарина 12 000–15 000 Да). Характеризуется рядом теоретических преимуществ по сравнению со стандартным гепарином. Среди них — лучшее предотвращение нового образования тромбина в результате большей степени подавления фактора Ха, лучший предполагаемый фармакокинетический профиль, меньшее связывание с протеинами, меньшая активация тромбоцитов, более низкая частота возникновения тромбоцитопении, отсутствие необходимости контроля АЧТВ. Низкомолекулярные гепарины изучены в больших исследованиях у пациентов с острым коронарным синдромом без элевации сегмента ST, но лишь недавно их применение начали исследовать в комбинации с фибринолитическими средствами при остром ИМ. Ранее выполненные клинические исследования позволяют допустить, что низкомолекулярный гепарин по сравнению с нефракционированным гепарином может уменьшить риск возвратной ишемии и формирования тромбов в желудочках, хотя и за счет большей частоты кровотечений. В трех недавно проведенных ангиографических исследованиях применение эноксапарина натрия или дальтепарина натрия ассоциировалось с тенденцией к уменьшению риска реокклюзии и/или более длительным сохранением проходимости инфарктобусловившего сосуда. В ASSENT-3, первом большом исследовании с применением низкомолекулярного гепарина на фоне TNK-tPA, эноксапарин натрия (30 мг внутривенно болюсно и 1 мг/кг подкожно каждые 12 ч) в течение 7 дней уменьшал риск внутригоспитального реинфаркта или внутригоспитальной рефрактерной ишемии по сравнению с гепарином. При этом в исследовании не отмечали увеличения частоты внутричерепных кровотечений (за исключением незначительного увеличения количества немозговых кровотечений по сравнению с гепарином). Тенденция к уменьшению летальности через 30 дней свидетельствовала в пользу эноксапарина натрия, хотя в течение 1 года наблюдения не была выявлена разница в смертности между группами пациентов, получающих нефракционированный и низкомолекулярный гепарины. В исследовании ASSENT-3 PLUS (2002) догоспитальное назначение эноксапарина натрия сопровождалось существенным увеличением риска внутричерепных кровотечений по сравнению с применением гепарина у пациентов в возрасте >75 лет. Результаты исследования ExTRACT TIMI-25 свидетельствуют, что эноксапарин натрия, назначаемый в качестве адъювантной терапии у больных с острым ИМ и элевацией сегмента ST, получавших реперфузионную терапию, уже через 48 ч приводил к снижению частоты развития рецидива ИМ на 36% и случаев проведения ургентной реваскуляризации на 22% по сравнению с инфузионной терапией нефракционированным гепарином. Через месяц от начала лечения данные соотношения сохранялись, тогда как снижение 30-дневной смертности в группе эноксапарина натрия носило лишь характер тенденции. Кроме того, терапия эноксапарином натрием ассоциировалась с существенным (на 50%) повышением частоты больших кровотечений к 30-м суткам лечения, что, безусловно, следует учитывать при выборе антикоагулянта и схемы лечения у больных с острым ИМ и высоким риском кровотечений. В данном исследовании применяли апробированную ранее у больных с острым ИМ схему введения: 30 мг эноксапарина натрия внутривенно болюсно в начале тромболитической терапии, затем подкожные инъекции из расчета 1 мг/кг массы тела (но не более 100 мг) каждые 12 ч в течение 5 дней. Существенное дополнение к схеме терапии касалось уменьшения дозы препарата на 25% и исключения внутривенного болюса у пациентов в возрасте старше 75 лет, что позволило избежать увеличения частоты внутричерепных кровоизлияний во время терапии эноксапарином натрием. С учетом убедительных доказательств пользы от применения приведенной схемы лечения эноксапарином натрием ее можно рекомендовать для применения в лечении острого ИМ. Тем не менее представляется целесообразной ее модификация у пациентов с высоким риском кровотечений (в первую очередь у больных с обострениями гастрита и пептической язвой желудка в анамнезе) с уменьшением дозы препарата на 25% и исключением внутривенного болюса. С целью дополнительного снижения риска геморрагии у таких пациентов оправдано включение в сопутствующую терапию блокаторов протонного насоса (омепразол, ланзопразол и др.).
В ранее проведенных исследованиях в дополнение к фибринолитикам применяли прямые ингибиторы тромбина — бивалирудин, лепирудин, аргатробан, эфегатран. Эти препараты улучшали проходимость коронарных артерий и снижали частоту кровотечений по сравнению с гепарином. Невзирая на это, в двух крупномасштабных исследованиях применение гирудина на фоне фибринолитической терапии не давало четких клинических преимуществ по сравнению с гепарином. В исследовании HERO-2 бивалирудин в комбинации со стрептокиназой не снижал смертность в течение 30 дней по сравнению с применением гепарина внутривенно. При внутривенном введении бивалирудина в течение 48 ч случаи реинфаркта отмечены реже, но при этом недостоверно увеличилось количество нецеребральных кровотечений. Рекомендованные дозы гепарина приведены в табл. 1.8.
Таблица 1.8
А) Сопутствующая терапия антикоагулянтами
| Нефракционированный гепарин:
внутривенно болюсно: 60 МЕ/кг, максимум 4000 МЕ внутривенная инфузия: 12 Ед/кг на протяжении 24–48 ч, максимум 1000 Ед/ч, целевой АЧТВ 50–70 мс1 мониторирование АЧТВ: 3; 6; 12; 24 ч после начала терапии |
| Эноксапарин (если уровень сывороточного креатинина <2,5 мг/дл у мужчин или <2 мг/дл у женщин или клиренс креатинина >30 мл/мин):1
Для пациентов младше 75 лет: внутривенно болюсно 30 мг и через 15 мин — подкожная инъекция 1 мг/кг (повторять каждые 12 ч на протяжении госпитального периода, но не больше 8 сут); Для пациентов старше 75 лет: подкожная инъекция 0,75 мг/кг (повторять каждые 12 ч на протяжении госпитального периода, но не больше 8 сут) |
| Фондапаринукс (если уровень сывороточого креатинина <3 мг/дл):
внутривенно болюсно: 2,5 мг подкожные инъекции: 2,5 мг 1 раз в сутки в течение госпитального периода, но не больше 8 сут |
Б) Сопутствующая терапия антикоагулянтами, если больному требуется проведение коронарных вмешательств
| Нефракционированный гепарин:
внутривенное (болюсное) введение в дозе, необходимой для проведения процедуры (в случае одновременного использования блокаторов IIB/IIIA рецепторов дозу гепарина нужно уменьшить) |
| Эноксапарин (если после последнего введения прошло > 8 ч):
внутривенно болюсно 30 мг независимо от возраста и уровня креатинина |
В) Терапия антикоагулянтами у пациентов, которые не получали реперфузионной терапии
| Эноксапарин (если уровень сывороточного креатинина <2,5 мг/дл у мужчин или <2 мг/дл у женщин или клиренс креатинина >30 мл/мин)2:
Для пациентов младше 75 лет: внутривенно болюсно 30 мг и через 15 мин — подкожная инъекция 1 мг/кг (повторять каждые 12 ч на протяжении госпитального периода, но не больше 8 сут); Для пациентов старше 75 лет: подкожная инъекция 0,75 мг/кг (повторять каждые 12 ч на протяжении госпитального периода, но не больше 8 сут) |
| Фондапаринукс (если уровень сывороточого креатинина <3 мг/дл): внутривенно болюсно: 2,5 мг
подкожные инъекции: 2,5 мг 1 раз в сутки в течение госпитального периода, но не больше 8 сут |
1При необходимости возможен переход на подкожные инъекции низкомолекулярного гепарина или фондапаринукса;
2если клиренс креатинина (по формуле Cockroft — Gault) на протяжении периода лечения составляет 30 мл/мин и менее, единая дозировка эноксапарина составляет 1 мг/кг подкожно 1 раз в сутки.
Относительно проблемы антикоагулянтной терапии при ОКС следует отметить, что в последние годы появилась новая группа препаратов, с которой связаны надежды в отношении оптимизации лечения этих больных. Это селективные ингибиторы Ха-фактора, по химической структуре представляющие собой пентасахаридную последовательность, которая составляет активную в отношении указанного фактора часть молекулы гепарина. Проведено большое рандомизированное исследование MICHELANGELO: OASIS 5, в котором принимали участие свыше 20 тыс. пациентов с ОКС без элевации сегмента ST. В этом исследовании пентасахарид фондапаринукс натрия в дозе 2,5 мг 1 раз в сутки был так же эффективен, как и эноксапарин натрия в предотвращении смерти, нефатального ИМ и рефрактерной ишемии в течение 9 сут после включения в исследование. Но применение пентасахарида на 17% снизило 30-дневную летальность, на 11% — 6-месячную летальность и на 47% — частоту больших геморрагических осложнений. Более того, при применении пентасахарида значительно снизилась частота возникновения гепарининдуцируемой тромбоцитопении. Были получены первые результаты исследования MICHELANGELO: OASIS 6, в котором участвовали более 12 тыс. больных с острым ИМ и элевацией сегмента ST. Данное исследование показало, что пентасахарид, назначаемый в дозе 2,5 мг 1 раз в сутки по 9-е сутки при остром ИМ, позволил снизить частоту развития смерти и реинфаркта к 30-м суткам на 18% у больных, которым не проводили ургентную ангиопластику, а частота геморрагических осложнений при его применении была даже несколько ниже, чем у больных контрольной группы, получавших нефракционированный гепарин. Согласно данным пилотных исследований, у пациентов с острым ИМ и элевацией сегмента ST на фоне введения альтеплазы применение пентасахарида по сравнению с вводимым внутривенно нефракционированным гепарином привело к снижению частоты реокклюзий и реваскуляризаций в течение первой недели заболевания.
Перкутанные коронарные вмешательства
Среди перкутанных коронарных вмешательств, которые осуществляют в первые часы ИМ, различают первичную ЧТКА, ЧТКА в сочетании с фармакологической реперфузионной терапией и «ЧТКА спасения» (rescue PCI) после неудачной попытки фармакологической реперфузии. В последнее время большое внимание уделяют сопоставлению клинической эффективности разных стратегий, которые комбинируют фармакологические и хирургические подходы.
Первичная ЧТКА
Под этим термином понимают ангиопластику и/или стентирование без предыдущей или сопутствующей фибринолитической терапии. Первичной ЧТКА предоставляют преимущество, если ее можно выполнить в течение 90 мин с момента контакта больного с медицинским персоналом.
Наибольшие преимущества первичная ЧТКА имеет по сравнению с тромболитической терапией у больных пожилого возраста (свыше 65 лет) и у молодых пациентов, которые находятся в состоянии кардиогенного шока к моменту начала лечения. Осуществление первичной ЧТКА возможно при наличии опытной бригады, в которую включены не только интервенционные кардиологи, но и вспомогательный персонал с соответствующими навыками. Если пациенты поступают в госпиталь, где нет условий для выполнения катетеризации, следует произвести тщательную индивидуальную оценку потенциальных преимуществ механической реперфузии по сравнению с риском, а также потенциальными расходами времени на транспортировку больного в ближайшую лабораторию катетеризации сердца. Недавно в исследовании DANAMI-2 стратегию рутинной перевозки больных в специализированный госпиталь для выполнения первичной ЧТКА сравнивали со стратегией внутригоспитального тромболизиса. Перевозку больных из территориальных госпиталей в центры инвазивной кардиологии позволяли осуществлять в течение 3 ч. В среднем срок транспортировки каретой скорой помощи составлял менее 32 мин, а время от прибытия в территориальный госпиталь до начала ЧТКА («от двери до ЧТКА») — менее 2 ч. Через 30 дней отмечали достоверное уменьшение общего количества случаев смерти, реинфаркта и инсульта у пациентов, которых перевозили для осуществления первичной ЧТКА (14,2% по сравнению с 8,5%, р<0,002), тогда как уменьшение смертности было недостоверным (8,6% против 6,5%, р = 0,20). Результаты этого исследования подтверждены исследованиями PRAGUE и PRAGUE-2, а также другими большими исследованиями. В реальной же практике, согласно итальянскому регистру BLITZ, среднее время доставки в госпиталь составило 129 мин, время «от двери до иглы» — 45 мин, а «от двери до ЧТКА» — 85 мин. Существенным дополнением к стратегии первичной ЧТКА были полученные в этих исследованиях данные относительно равной эффективности первичной ЧТКА и тромболитической терапии, если лечение начиналось менее, чем через 3 ч от начала развития симптомов острого ИМ. Первичная ЧТКА эффективна для обеспечения и поддержания проходимости коронарной артерии и при этом лишена риска кровотечений, присущего фибринолитической терапии. Рандомизированные клинические исследования по сравнению своевременной первичной ЧТКА и фибринолитической терапии в квалифицированных центрах с большим объемом процедур свидетельствуют о более эффективном восстановлении проходимости, менее частом возникновении реокклюзии, улучшении остаточной функции ЛЖ и более благоприятных клинических исходах после первичной ЧТКА. Рутинная установка коронарного стента у пациента с острым ИМ уменьшает потребность в реваскуляризации целевого сосуда, но ассоциируется лишь с тенденцией к снижению частоты смерти или реинфаркта по сравнению с первичной ангиопластикой. У пациентов с противопоказаниями к фибринолитической терапии уровень заболеваемости и смертности выше, чем у больных без противопоказаний. Первичную ЧТКА могут успешно выполнять у подавляющего большинства этих пациентов.
В современных оптимизированных алгоритмах фибринолизиса используют антикоагулянты и антитромбоцитарные препараты (блокаторы гликопротеиновых рецепторов IIb/IIIa). Так, по данным уже достаточно большого количества исследований (INTRO AMI, AMI-SK, ASSENT-3, TIMI 14, ENTIRE-TIMI, HERO-2, GUSTO V) частота реканализации ИОКА с адекватным тканевым кровотоком TIMI-3 достигает 70%.
ЧТКА в сочетании с фибринолизом
Выполнение ЧТКА немедленно после фибринолитической терапии стрептокиназой с целью содействия реперфузии или уменьшения риска реокклюзии в исследовании PRAGUE не оправдало надежд. Впрочем, эффективность и безопасность ЧТКА после введения тромболитиков повысились в результате накопления опыта выполнения процедур, появления стентов и более мощных антитромбоцитарных средств (антагонистов гликопротеиновых рецепторов тромбоцитов IIb/IIIa и тиенопиридинов), а также догоспитального болюсного тромболизиса половинной дозой со следующим проведением ангиографии в ближайшие сроки и ЧТКА в случае сохраняющейся окклюзии ИОКА.
«ЧТКА спасения»
«ЧТКА спасения» (Rescue PCI) определяют как выполнение ЧТКА на коронарной артерии, которая после фибринолитической терапии остается закрытой. При этом подразумевают, что предшествующая тромболитическая терапия могла быть проведена как на догоспитальном этапе, так и в отделении неотложной кардиологической помощи, не оснащенном катетеризационной лабораторией для проведения коронаровентрикулографии. Ограниченный опыт позволяет допустить тенденцию к благоприятным последствиям реканализаций ИОКА методом ангиопластики в случае неэффективности тромболизиса (табл. 1.9).
Таблица 1.9
Обзор рандомизированных исследований по применению ЧТКА и тромболизиса при остром ИМ
| Исследование | Сравниваемые группы | n | Тромболитик | Передний ОИМ, % | Шок, % | Время до ТЛТ, ч | Время до ЧТКА, ч | Смерть/смерть или СН, % |
| Belenkie et al., 1992 | ТЛТ — >ЧГКA?* | 16 | Стрептокиназа (CK) или tPA | 53,6 | 0 | 4,3±1,0 | 6,3 | |
| ТЛТ | 12 | 33,3 | ||||||
| Rescue I 1994 | ТЛТ — >ЧTKA? | 78 | CK или tPA | 100 | 0 | 4,5±1,9 | 5,1/6 | |
| ТЛТ | 73 | 9,6/17 | ||||||
| TAMI 1** 1994 | Первичная ЧTKA | 49 | СК или tPA | 41 | 0 | 2,9 | 2,8 | 6,1 |
| ТЛТ | 59 | 42 | 4,5 | 1,7 | ||||
| PRAGUE 1999 | ТЛТ — >ЧTKA? | 100 | CK | 12 | ||||
| ТЛТ | 99 | 18 | ||||||
| Первичная ЧTKA | 101 | 13 | ||||||
| Vermeer et al., 1999 | Первичная ЧTKA | 75 | tPA | 48 | 0 | 3,6 | 5 | |
| ТЛТ — >ЧTKA? | 74 | 59 | 2,5 | 4,0 | 6 | |||
| ТЛТ | 75 | 45 | 2,25 | 5 | ||||
| MERLIN 2004 | ТЛТ —>ЧTKA? | 153 | CK 96% (или tPA) | 48,4 | 0 | 3,0 | 5,5 | 9,8/34 |
| ТЛТ | 154 | 40,3 | 2,8 | 11/40,9 |
*«ЧТКА спасения»; ** больные с коронарным кровотоком TIMI 2.
Результаты исследования PACT указывают на безопасность и большую (по сравнению со стандартной тромболитической терапией) эффективность догоспитального болюсного тромболизиса половинной дозой с последующей перевозкой больного в территориальный госпиталь для выполнения ангиографии и в случае необходимости «ЧТКА спасения». Следует отметить, что вторую половину дозы фибринолитика в этом исследовании больные получали лишь после проведения ангиографии, если ИОКА оказывалась полностью (или более чем на 75%) открытой.
Основной проблемой во внедрении алгоритма первичной (догоспитальной) ТЛТ с последующей «ЧТКА спасения» является сложность неинвазивного определения степени эффективности тромболизиса в ближайшие часы от начала ТЛТ. Поскольку проведение коронароангиографии для определения необходимости «ЧТКА спасения» уже является сложной процедурой с определенной степенью риска и требует доставки больного в катетеризационную лабораторию, целесообразно выделение группы больных в острой фазе ИМ, прошедших ТЛТ, которым ангиография показана в первую очередь. Срок для оценки эффективности ТЛТ должен быть 3 ч, критерием эффективности следует считать снижение элевации сегмента ST (в отведениях с наиболее выраженной элевацией) >50% при передней локализации острого ИМ и >70% — в случае задней локализации.
По данным исследования ASSENT-3, коронарное вмешательство у пациентов, которые получили полную дозу фибринолитического средства в сочетании с антагонистом рецепторов гликопротеина IIb/IIIa, может сопровождаться повышенным риском осложнений, обусловленных кровотечениями.
Хирургическое шунтирование коронарных артерий
Количество пациентов, которые нуждаются в хирургическом шунтировании коронарных артерий в острой фазе ИМ, ограничено. Впрочем, это вмешательство может быть показано после неудачной ЧТКА, когда во время катетеризации внезапно возникла окклюзия коронарной артерии или в случаях, когда выполнение ЧТКА по результатам ангиографии не может считаться эффективным решением проблемы. Кроме того, шунтирование коронарных артерий осуществляют у отдельных пациентов с кардиогенным шоком или в сочетании с хирургическим лечением дефекта межжелудочковой перегородки или митральной регургитации, обусловленной дисфункцией или разрывом папиллярной мышцы. Показаниями для хирургического шунтирования коронарных артерий было и есть наличие многососудистого повреждения коронарного дерева в подострый период заболевания. В частности, шведские исследователи доказали позитивное влияние на одногодичную смертность реваскуляризации, которую выполняли через 2 нед после начала острого ИМ. Обобщение рекомендаций по реперфузионной терапии представлено в табл. 1.10.
Таблица 1.10
Реперфузионная терапия: резюме
| Рекомендации |
| Реперфузионная терапия показана всем пациентам с болью/дискомфортом в грудной клетке в первые 12 ч, ассоциируемых с элевацией сегмента ST или (вероятно) новой блокадой ножки пучка Гиса на ЭКГ |
| Первичная ЧТКА |
| Метод выбора при выполнении опытной бригадой в течение менее 90 мин после первого контакта с медицинским персоналом |
| Показана пациентам в состоянии шока и/или с противопоказаниями к фибринолитической терапии |
Антагонисты рецепторов GP IIb/IIIa и первичная ЧТКА:
|
| а) клопидогрел в дозе 75 мг в сутки показан в комбинации с низкой (до 100 мг в сутки) дозой ацетилсалициловой кислоты у всех больных с острыми коронарными синдромами как средство, предупреждающее реокклюзию после реперфузионной терапии (если нет противопоказаний);
б) оптимальная нагрузочная доза клопидогрела составляет 300 мг, однако при наличии риска осложнений (возраст старше 75 лет, тромболитическая терапия у больных даже с умеренным риском геморрагических осложнений, в частности у пациентов, которые получали внутривенный болюс антикоагулянта) клопидогрел желательно назначать без нагрузочной дозы; с) длительность лечения клопидогрелом после перенесенного ИМ у пациентов, которые получали реперфузионную терапию, должна составлять от 1 мес до 1 года (в зависимости от переносимости препарата). |
|
ЧТКА спасения После неудачного тромболизиса у пациентов с распространенным инфарктом, если: а) пациент моложе 75 лет; б) у пациента острая СН или он в состоянии кардиогенного шока (в том числе вследствие гемодинамически значимых аритмий сердца); в) у пациента признаки кардиальной ишемии или электрической нестабильности |
| Фибринолитическая терапия
Если нет противопоказаний (см. табл. 1.5) и если первичная ЧТКА не может быть выполнена в кратчайшее время (в течение 90 мин с момента контакта больного с медицинским персоналом), фармакологическую реперфузию следует начать как можно раньше |
| Выбор фибринолитических средств зависит от индивидуализированной оценки пользы и риска, доступности и стоимости |
| У пациентов, которые поступают в течение ≤6 ч с момента появления симптомов, преимущество отдают более фибриноспецифическим средствам, таким как тенектеплаза или альтеплаза |
| Начало фибринолитической терапии на догоспитальном этапе при наличии соответствующего оснащения и сотрудничества работников скорой помощи с определенным стационаром, причем предпочтение отдают болюсному внутривенному введению фибриноспецифических средств |
| Повторное назначение неиммуногенного литического средства при наличии признаков реокклюзии и невозможности механической реперфузии |
| Если больной раньше не принимал ацетилсалициловую кислоту, разжевать ее в дозе 150–325 мг (таблетки без оболочки!) |
| Вместе с альтеплазой (и другими тромболитиками) — определение дозы гепарина в зависимости от массы тела с частой коррекцией в соответствии с АЧТВ |
Профилактика, диагностика и лечение осложнений острого периода ИМ
Нарушения гемодинамики
В данную группу объединены наиболее типичные нарушения гемодинамики, которые могут возникать при ИМ (табл. 1.11). Кроме того, СН может быть следствием аритмических или механических осложнений.
Таблица 1.11
Клинический спектр состояний гемодинамики при ИМ и их лечение
| Состояние гемодинамики | Показатели гемодинамики, клинические особенности, лечение |
| Нормальное | Нормальные показатели АД, ЧСС и дыхания, адекватное периферическое кровообращение |
| Гипердинамическое | Тахикардия, звучные тона сердца, адекватное периферическое кровообращение. Показаны блокаторы β-адренорецепторов |
| Брадикардия — гипотензия | «Теплая» гипотензия, брадикардия, венодилатация, нормальное давление в яремных венах, сниженная перфузия тканей. Обычно — при нижней локализации ИМ, иногда провоцируется опиатами. Корректируется применением атропина и/или кардиостимуляции |
| Гиповолемия | Веноконстрикция, сниженное давление в яремных венах, сниженная перфузия тканей. Корректируется инфузией жидкости |
| Инфаркт правого желудочка | Высокое давление в яремных венах, сниженная перфузия тканей или шок, брадикардия, гипотензия (см. текст) |
| Насосная недостаточность | Тахикардия, тахипноэ, сниженное пульсовое давление, сниженная перфузия тканей, гипоксемия, отек легких (см. текст) |
| Кардиогенный шок | Резко сниженная перфузия тканей, олигурия, тяжелая гипотензия, сниженное пульсовое давление, тахикардия, отек легких, похолодание конечностей, гипергидроз, нарушения сознания различной степени тяжести (см. текст) |
Наиболее частым вариантом нарушений гемодинамики во время острой фазы ИМ является левожелудочковая недостаточность, ассоциируемая с плохим коротко- и долговременным прогнозом выживания. Ее клинические черты — одышка, синусовая тахикардия, третий тон сердца и влажные хрипы в легких, первоначально в базальных участках, позже — по всем легочным полям. В ряде случаев левожелудочковая недостаточность сопровождается острой недостаточностью митрального клапана (вследствие дисфункции или отрыва папиллярной мышцы, растяжения митрального кольца). В этой ситуации снижение постнагрузки на ЛЖ (часть крови уходит обратно в левое предсердие против низкого градиента давления) может приводить к временному уменьшению проявлений острой ишемии (боль, изменения на ЭКГ) и «улучшению» показателей сегментарной сократимости по данным двухмерной эхоКГ на фоне снижения системного АД, но явления застоя в легких, напротив, прогрессируют и при соответствующей степени митральной недостаточности может развиться кардиогенный шок. Впрочем, даже выраженный застой в легких может не сопровождаться аускультативными признаками. Если же к левожелудочковой недостаточности присоединяется острая правожелудочковая, развивается так называемый синдром малого выброса (low output). К его клиническим проявлениям относят уменьшение или исчезновение застойных явлений в легких при выраженном снижении системного давления, некорригируемые инотропами. Ввиду разгрузки ЛЖ также могут отмечать временное улучшение его сократимости, но снижение проявлений его ишемии и перегрузки носит временный характер. Некорригированный синдром малого выброса часто трансформируется в истинный кардиогенный шок. Повторная аускультация сердца и легких должна осуществляться у всех пациентов в ранний период ИМ вместе с оценкой других жизненно важных признаков.
К общим мероприятиям относят мониторирование нарушений ритма, оценку электролитных нарушений, своевременную диагностику сопутствующих состояний, в частности дисфункцию клапанов или заболевания легких. Степень выраженности застойных явлений в легких можно оценить с помощью рентгенографии. ЭхоКГ необходима для оценки выраженности повреждения миокарда, механической функции желудочков и выявления осложнений, в частности митральной регургитации и дефекта межжелудочковой перегородки, которые могут вызывать нарушение насосной функции сердца. У пациентов с тяжелой СН, шоком и синдромом малого выброса перкутанная или хирургическая реваскуляризация могут улучшить выживание.
Степень левожелудочковой недостаточности классифицируют по Киллипу (Killip): класс 1 — нет влажных хрипов или третьего тона сердца; класс 2 — область хрипов занимает менее 50% аускультативной поверхности легких или наличие третьего тона сердца; класс 3 — область хрипов занимает более 50% аускультативной поверхности легких; класс 4 — кардиогенный шок.
Незначительная и умеренная СН
Следует с самого начала назначать кислород, но быть осторожным при наличии хронического заболевания легких. Рекомендуют мониторирование насыщения крови кислородом. Наиболее удобная и доступная методика оценки эффективности внешнего дыхания — пульсоксиметрия, которая является опцией большинства современных кардиореанимационных систем мониторов. Незначительная СН корригируется нитратами, диуретиками (фуросемид 20–40 мг или торасемид в дозе 5–10 мг медленно внутривенно, при необходимости с повторным введением через 1–4 ч; нитроглицерин внутривенно или нитраты перорально). Дозу нитроглицерина следует титровать под контролем АД, для того чтобы избежать гипотензии. Ингибиторы АПФ должны быть назначены в течение 24 ч при отсутствии гипотензии, гиповолемии или тяжелой почечной недостаточности. В последнее время все большую роль в терапии левожелудочковой недостаточности при остром ИМ отводят антагонистам альдостерона. Наиболее известный и распространенный препарат этой группы — спиронолактон. Результаты рандомизированного исследования с участием 1663 больных с СН III–IV класса по NYHA (ФВ ≤ 35%) при длительном применении спиронолактона в дозе 25 мг/сут показали снижение смертности вследствие любой причины в течение 2 лет на 24% по сравнению с плацебо (p<0,001). К недостаткам спиронолактона следует отнести большое количество побочных эффектов, среди которых основное место занимает гинекомастия. Другой препарат из этой группы — эплеренон — лишен этого побочного действия. В исследовании EPHESUS у больных с острым ИМ, осложненном СН, назначали длительную терапию эплереноном по сравнению с плацебо. Частота смерти вследствие любой причины в группе лечения эплереноном составляла 14,4%, тогда как в группе плацебо этот показатель был 16,7% (p=0,008); комбинированный показатель кардиоваскулярной смертности и регоспитализаций по поводу сердечно-сосудистых заболеваний был 26,7% против 30% в группе плацебо (p=0,002). Наибольший эффект был получен в группе больных со сниженной ФВ ЛЖ.
Выраженная СН
Исследование газового состава артериальной крови (по Аструпу)
Это исследование позволяет оценить степень оксигенации (рО2), дыхательную функцию (pCO2), кислотно-щелочное состояние (pH) и его нарушения. Таким образом, проведение этого исследования показано всем пациентам с тяжелой СН. Неинвазивные методы исследования: пульсоксиметрия и определение CO2 в выдыхаемом воздухе могут заменить исследование по Аструпу (уровень доказательности C), но только не при состояниях, сопровождаемых малым выбросом или вазоконстрикторным шоком. Определение венозной сатурации О2 (например из центральных вен) проводят для общего определения адекватности оксигенации организма.
Пульсоксиметр
Это простое неинвазивное устройство, определяющее артериальную сатурацию гемоглобина кислородом (SaO2, SpO2). Определение SaO2 обычно не имеет погрешности более чем в 2% при определении данного показателя кооксиметром, если только у пациента нет кардиогенного шока. Пульсоксиметрию следует проводить непрерывно любому пациенту, находящемуся в нестабильном состоянии, или при респираторной поддержке с концентрацией кислорода в вдыхаемом воздухе (FiO2) больше, чем в воздухе. Также необходимо проводить измерение данного показателя через определенные промежутки времени (каждый час) любому пациенту, получающему оксигенотерапию в связи с острой декомпенсацией.
Артериальный катетер
Показаниями к введению артериального катетера является необходимость непрерывного анализа АД вследствие гемодинамической нестабильности или при необходимости повторного лабораторного исследования артериальной крови. Частота осложнений после установки радиального катетера диаметром 2 дюйма и размером 20 G невелика.
Центральный венозный катетер
Центральный венозный катетер позволяет получить доступ к венозной крови и, таким образом, его установка полезна при объемной инфузионной терапии, введении различных лекарственных средств, мониторинге ЦВД и определении венозной сатурации кислорода (SvO2) в верхней полой вене или правом предсердии, что дает важные сведения о транспорте кислорода. Следует избегать переоценки результатов определения давления в правом предсердии, так как этот показатель у пациентов с острой СН очень слабо коррелирует с давлением в левом предсердии, давлением наполнения ЛЖ. Измерение ЦВД неинформативно при трикуспидальной регургитации и вентиляции легких в режиме положительного давления в конце выдоха.
Катетер в ЛА
Катетер в ЛА (КЛА) представляет собой флотирующий баллонный катетер, с помощью которого можно измерить давление в верхней полой вене, правом предсердии, ПЖ, ЛА, а также определить сердечный выброс. Современные катетеры позволяют определять сердечный выброс полунепрерывным способом, оценивать смешанную венозную сатурацию, КДО и ФВ ПЖ. Хотя установка КЛА для диагностики острой СН при остром ИМ обычно не нужна, его можно использовать для разграничения кардиогенных и некардиогенных причин у пациентов с сочетанной патологией или заболеванием легких. КЛА также используют для определения давления заклинивания в ЛА, сердечного выброса и других гемодинамических параметров как проводник для терапии при диффузных заболеваниях легких и гемодинамической нестабильности, несмотря на проводимое лечение. Давление заклинивания в ЛА не совсем точно отражает конечно-диастолическое давление ЛЖ у пациентов с митральным стенозом, аортальной регургитацией, межжелудочковом шунте, высоком давлении в дыхательных путях или избыточной жесткости ЛЖ при его гипертрофии, сахарном диабете, фиброзе эндокарда, введении инотропных средств, ожирении, ишемии. Значительная трикуспидальная регургитация, часто выявляемая у пациентов с острой СН, может также влиять на определение сердечного выброса методом термодилюции. Использование КЛА рекомендовано у пациентов с гемодинамической нестабильностью, неудовлетворительным ответом на классическую терапию, а также у пациентов с комбинацией застоя и гипоперфузии. В этих случаях имплантация катетера необходима с целью обеспечения оптимальной инфузионной терапии и для контроля введения вазоактивных и инотропных средств. Так как частота осложнений увеличивается с частотой использования КЛА, необходимо вводить катетер при соответствующей клинической ситуации (обычно после определения водно-электролитного состояния) и удалять его сразу, как только в нем исчезает необходимость (например при оптимизации терапии диуретиками и вазодилататорами).
Кислород, петлевой диуретик и периферический вазодилататор
Эти мероприятия следует назначать при наличии признаков периферической гипоперфузии и выраженного застоя в легких при сохраненном системном давлении. Если нет выраженной гипотензии, стоит начать введение нитроглицерина с дозы 0,25 мкг/кг/мин, с увеличением дозы каждые 5 мин до снижения АД на 15 мм рт. ст. или до снижения САД до не менее 90 мм рт. ст. Как было указано выше, следует оценить целесообразность измерения давления в ЛА и давления заклинивания в легочных капиллярах, а также сердечного выброса с помощью баллонного флотационного катетера (Сван — Ганза). Давление заклинивания должно быть менее 20 мм рт. ст., сердечный индекс — превышать 2 л/мин/м2. Среди диуретиков предпочтение следует отдавать петлевым ввиду выраженности их эффекта по устранению застойных явлений в малом круге кровообращения. Рекомендовано начать терапию с внутривенного введения (возможно капельное введение на изотоническом растворе NaCl) фуросемида в дозе 40–80 мг (суточная доза не должна превышать 120 мг). Хотя введение фуросемида в растворе гидрокарбоната натрия может быть оправдано с точки зрения фармакодинамики, к этой методике следует относиться с осторожностью при отсутствии данных о кислотно-щелочном состоянии крови. При недостаточном диуретическом эффекте целесообразно продолжить диуретическую терапию торасемидом (внутривенное капельное введение в изотоническом растворе NaCl в дозе 5–20 мг). Также дополнительный эффект может быть получен при применении антагонистов альдостерона (спиронолактон, эплеринон). При выраженном ацидозе препаратом выбора может быть этакриновая кислота. При наличии у больного выраженной толерантности к диуретикам (особенно в сочетании со значительными застойными явлениями в легких), в качестве адъювантной терапии в последнее время испытывают рекомбинантный мозговой натрийуретический пептид — несиритид. Согласно данным зарубежных исследователей, внутривенное применение несиритида в нагрузочной дозе 2 мкг/кг с последующей инфузией в дозе 0,01 мкг/кг/мин у больных со значительной СН уменьшало частоту повторных обращений в стационар по поводу СН в течение 30 нед на 13%. Но для широкого применения этого препарата необходимы дополнительные исследования. Если невзирая на вышеуказанные меры и введение 100% кислорода через маску со скоростью 8–10 л/мин (при адекватном применении бронходилататоров) не удается поддерживать парциальное напряжение кислорода свыше 60 мм рт. ст. (при прямом измерении в крови), показана эндотрахеальная интубация с искусственной вентиляцией легких. Причиной острой СН может быть оглушение (реперфузия с задержкой возобновления сократимости) или гибернация (снижение перфузии с сохранением жизнеспособности) миокарда. Реваскуляризация миокарда, перфузия которого снижена, может способствовать улучшению функции желудочков. При выраженной левожелудочковой недостаточности с застойными явлениями в легких и сердечной астмой, рефрактерными к нитратам и мочегонным средствам, препаратом выбора может служить морфин. При внутривенном введении в виде гидрохлорида в дозе 0,51 мл 1% раствора снижает давление в малом круге кровообращения, блокирует симпатическую гиперактивацию, замедляет ЧСС, оказывает выраженное седативное действие.
Респираторная поддержка без эндотрахеальной интубации (неинвазивная вентиляция)
Для респираторной поддержки используют две основные техники: в режиме постоянного повышенного давления и неинвазивную вентиляцию с положительным давлением. Неинвазивная вентиляция с повышенным давлением позволяет проводить механическую вентиляцию без эндотрахеальной интубации. Бесспорно мнение о том, что одну из этих техник всегда необходимо использовать до интубации трахеи и проведения искусственной вентиляции легких. Использование неинвазивных техник позволило значительно снизить необходимость в интубации трахеи и проведении искусственной вентиляции легких. Использование постоянного повышенного давления способно восстановить функцию легких и вызывает повышение функционального остаточного объема. Улучшается податливость легких, уменьшается градиент трансдиафрагмального давления, снижается активность диафрагмы. Все это ведет к уменьшению работы, связанной с дыханием, и общему снижению метаболизма в организме. Неинвазивная вентиляция с повышенным давлением — более сложная методика, требующая использования специального аппарата. Добавление режима положительного давления в конце выдоха позволяет проводить поддержку по типу постоянного повышенного давления (также известно как двухуровневая поддержка положительного давления). Физиологически благотворное действие данного режима вентиляции сходно с постоянным повышенным давлением, однако предоставляет также поддержку вдоха, что еще больше уменьшает энергетические затраты на дыхание и метаболическую потребность организма. Респираторная поддержка в режиме постоянного повышенного давления у пациентов с кардиогенным отеком легких улучшает оксигенацию, уменьшает симптоматику острой СН, а также ведет к снижению потребности в эндотрахеальной интубации. Применение режима неинвазивной вентиляции с повышенным давлением приводит к уменьшению необходимости эндотрахеальной интубации, но это не приводило к снижению смертности и улучшению долговременных функциональных показателей. Таким образом, использование режимов постоянного повышенного давления и неинвазивной вентиляции с повышенным давлением при остром кардиогенном отеке легких ассоциировано с достоверным уменьшением потребности в интубации трахеи и искусственной вентиляции легких.
Инотропные средства
Могут быть использованы при наличии стойкой и выраженной системной гипотензии. Если имеются признаки гипоперфузии почек, рекомендуют допамин внутривенно в дозе 2,5–5,0 мкг/кг/мин. Если доминирует застой в легких, преимущество отдают добутамину, начиная с дозы 2,5 мкг/кг/мин. Дозу можно постепенно увеличивать с 5–10-минутными интервалами до 10 мкг/кг/мин или до улучшения состояния гемодинамики. В отношении применения инотропных агентов для компенсации нарушений системной гемодинамики в настоящее время существует точка зрения, что, невзирая на улучшение качества жизни и показателей гемодинамики (системное АД, скорость клубочковой фильтрации, периферический кровоток, органная функция), эта терапия ассоциируется с увеличением кардиальной смертности в результате более быстрого исчерпания контрактильного ресурса сердечной мышцы, развития толерантности к экзогенным (и эндогенным) вазопрессорам и вызванного их избыточной концентрацией проаритмогенного эффекта. Это утверждение справедливо для таких инотропов, как допамин, добутамин, норэпинефрин, ингибиторы ФДЭ и сердечные гликозиды, что подтверждено результатами больших рандомизированных исследований. Такой эффект связан с тем, что большинство из этих препаратов повышает миокардиальную сократимость за счет повышения внутриклеточной концентрации свободного кальция. Это значительно увеличивает энергозатраты и утилизацию кислорода миокардом, лишенного внешних источников кислорода и макроэргов. Определенное изменение взглядов в этом направлении возможно с появлением нового класса инотропных препаратов, в частности левосимендана. Это вещество стойко соединяется с тропонином С и стабилизирует его состояние, повышая ответ актомиозиновых мостиков на стимуляцию кальцием. При внутривенном применении левосимендана в дозе 8–24 мкг/кг внутриклеточная концентрация кальция остается постоянной, сократительная способность сердечной мышцы повышается, но увеличения использования макроэргов не происходит. Также была выявлена способность этого препарата осуществлять вазодилатацию как артериального, так и венозного русла (допускают, что за счет открытия чувствительных к АТФ калиевых каналов в гладкомышечных клетках). Это подтверждено фактом снижения давления заклинивания в ЛА и общего сосудистого сопротивления у больных с застойной СН. Период полураспада вещества в плазме крови составляет в среднем 80 ч, поэтому эффект одной дозы сохраняется достаточно долго. Результаты сравнения эффективности левосимендана (8–24 мкг/кг нагрузочная доза в течение 10 мин со следующей инфузией 0,1–0,2 мкг/кг/мин на протяжении суток) и добутамина (инфузия 5–10 мкг/кг/мин) у больных с декомпенсированной застойной СН свидетельствуют о более выраженном улучшении кардиогемодинамики, вазодилатирующего эффекта и уменьшении 30-дневной летальности (6,8% по сравнению с 17% в группе добутамина). Об эффективности препарата у больных, у которых тяжелая СН развилась в результате острого ИМ с элевацией сегмента ST, свидетельствуют результаты исследования RUSSLAN, в котором получено достоверное снижение приблизительно на 54% летальности в течение первых суток острого ИМ и на 42% — 14-дневной летальности по сравнению с плацебо. Эти данные подтверждены также результатами отдельных исследователей.
В табл. 1.12 приведена сравнительная характеристика наиболее известных из существующих в настоящее время инотропных агентов.
Таблица 1.12
Сравнительная характеристика инотропных агентов, используемых при остром ИМ, осложненном тяжелой СН
| Левосимендан | Мильринон | Добутамин | Допамин | |
| Класс препарата | Кальциевый сенситайзер | Ингибитор ФДЭ | Катехоламин | Катехоламин |
| ↑ внутриклеточного содержания Са++ | Нет | Да | Да | Да |
| Повышение контрактильности | Да | Да | Да | Да |
| Вазодилатирующий эффект | Коронарный и системный | Периферический | Слабый периферический | Слабый периферический |
| Повышение потребления О2 | Нет | Нет | Да | Да |
| Аритмогенный потенциал | Не отмечали до настоящего времени | Желудочковые (12,1%) и наджелудочковые (3,8%) аритмии | Желудочковая эктопическая активность (5%) | Желудочковая эктопическая активность (5%) |
| Способ введения | Внутривенный | Внутривенный, пероральный | Внутривенный | Внутривенный |
| Взаимодействие с другими лекарственными препаратами | Не выражено | Малое количество взаимодействий | Не выражено | Антагонисты допаминовых рецепторов (метоклопрамид) ослабляют эффект допамина |
| Сочетание с блокаторами β-адренорецепторов | Возможно | Возможно | Возможно | Возможно |
| Побочные эффекты | Головная боль, гипотензия | Желудочковые аритмии, гипотензия, головная боль | Тахикардия, желудочковые тахиаритмии | Тахикардия, же лудочковые тахиаритмии |
Кардиогенный шок
Кардиогенный шок (истинный) — клиническое состояние гипоперфузии, которое характеризуется снижением САД <90 мм рт. ст. и повышением центрального давления наполнения >20 мм рт. ст. или снижением сердечного индекса <1,8 л/мин/м2. Другие характеристики шока — необходимость введения внутривенных инотропных средств и/или внутриаортальной баллонной контрпульсации для поддержания САД на уровне >90 мм рт. ст. и сердечного индекса >1,8 л/мин/м2. Ранняя тромболитическая терапия уменьшает вероятность возникновения кардиогенного шока. Для установления диагноза кардиогенного шока нужно исключить другие причины гипотензии, такие как гиповолемия, вазовагальные реакции, электролитные расстройства, побочные эффекты лекарственных средств или аритмии. Обычно кардиогенный шок ассоциируется с обширным повреждением ЛЖ, но может также возникать при ИМ ПЖ. Функцию ЛЖ и наличие ассоциируемых механических осложнений следует оценивать методом двухмерной допплерэхокардиографии. Оценку состояния гемодинамики обычно осуществляют баллонным флотирующим катетером. Следует стремиться к достижению давления наполнения (заклинивания в легочных капиллярах), по крайней мере 15 мм рт. ст. с сердечным индексом >2 л/кг/мин.
С целью улучшения функции почек можно применить низкие дозы допамина (2,5–5 мкг/кг/мин), а также при необходимости — дополнительное назначение добутамина (5–10 мкг/кг/мин).
В клинической практике обычно предполагают, что кардиогенный шок сопровождается ацидозом. Ввиду того, что катехоламины малоэффективны в кислой среде, коррекция ацидоза имеет важное значение. Как «мостик» к проведению механических вмешательств, рекомендуют поддерживающее лечение с помощью внутриаортальной баллонной контрпульсации.
Контрпульсация является стандартным компонентом лечения пациентов с кардиогенным шоком или тяжелой левожелудочковой недостаточностью при соблюдении следующих условий:
- улучшение не наступает, несмотря на объемную инфузию, инотропную поддержку и введение вазодилататоров;
- имеется выраженная митральная регургитация или разрыв межжелудочковой перегородки — с целью гемодинамической стабилизации для проведения диагностических мероприятий или лечения;
- имеется тяжелая ишемия миокарда — для подготовки к коронарной ангиографии и реваскуляризации.
Синхронизированную внутриаортальную баллонную контрпульсацию производят путем раздувания и сдувания баллона объемом 30–50 мл, размещенного в грудной аорте через бедренный доступ. Раздувание баллона в фазу диастолы увеличивает аортальное диастолическое давление и коронарный кровоток, тогда как сдувание во время систолы уменьшает постнагрузку и облегчает выброс крови из ЛЖ. Внутриаортальная баллонная контрпульсация может значительно улучшить гемодинамику; при наличии определенных состояний ее использование облегчает проведение дальнейших мероприятий (например коронарную реваскуляризацию, замену клапана, пересадку сердца) или помогает добиться полного выздоровления (например раннее оглушение миокарда после острого ИМ или операции на сердце, миокардит). Внутриаортальная баллонная контрпульсация противопоказана при расслаивающей аневризме аорты или клинически значимой аортальной недостаточности. Ее также не следует применять при тяжелых поражениях периферических сосудов, некорригируемых причинах острой СН, полиорганной недостаточности.
На ранних стадиях заболевания следует рассмотреть возможность осуществления безотлагательной ЧТКА или хирургического вмешательства. Если это невозможно или эти вмешательства могут быть выполнены лишь после длительной задержки, следует применить фибринолитическую терапию.
Пересадка сердца может рассматриваться в качестве лечебного мероприятия при тяжелой острой СН с заведомо неблагоприятным прогнозом. Примером может служить циркулярный трансмуральный острый ИМ с неблагоприятным прогнозом после реваскуляризации. Тем не менее пересадка сердца невозможна до тех пор, пока не достигнута стабилизация состояния естественным способом или с помощью вспомогательного кровообращения (баллонной контрпульсации). В общем виде рекомендации по ведению больных с острым ИМ, тяжелой СН и кардиогенным шоком представлены в табл. 1.13.
Таблица 1.13
Резюме: насосная недостаточность и шок
|
Диагностика: рентгенография органов грудной клетки, эхокардиография, катетеризация правых отделов сердца и ЛА
Кислород Фуросемид: 20–40 мг внутривенно, при необходимости повторно с интервалами 1–4 ч Нитроглицерин, если нет гипотензии Ингибиторы АПФ при отсутствии гипотензии, гиповолемии или почечной недостаточности
Кислород Фуросемид Нитроглицерин, если нет гипотензии Инотропные средства: допамин, добутамин и/или левосимендан Оценка состояния гемодинамики баллонным флотирующим катетером Поддержание вентиляции при неадекватном напряжении кислорода Оценка возможности ранней реваскуляризации
Кислород Оценка состояния гемодинамики баллонным флотирующим катетером Инотропные средства: допамин и добутамин Поддержание вентиляции при неадекватном напряжении кислорода Внутриаортальная баллонная контрпульсация Оценка возможности применения ранней реваскуляризации миокарда |
Механические осложнения острого ИМ
Ранняя постинфарктная дилатация и формирование аневризмы ЛЖ
Одним из наиболее типичных последствий обширного острого ИМ является ремоделирование ЛЖ. Полость ЛЖ теряет свою эллипсовидную форму за счет гибели кардиомиоцитов и замещения погибших клеток соединительной тканью, перераспределения объемной нагрузки на неповрежденный миокард. С первых по 14-е сутки острого ИМ в изменении геометрии полости ЛЖ преобладает процесс дилатации, в последующем на первый план выходит компенсаторная гипертрофия непораженного миокарда.
Выделяют от 2 до 4 периодов постинфарктного ремоделирования сердца. Первый период (раннее ремоделирование) регистрируют в первые 24–72 ч; длится до 7–14 сут от начала ИМ. Гистологически этот период соответствует окончанию некротической стадии острого ИМ и формированию «молодого» рубца, состоящего из грануляционной ткани с обильной сетью тонкостенных сосудов, представленной фибробластами и тонкими волокнами коллагена. Процессы ремоделирования в первые 24–72 ч (некротическая фаза острого ИМ) в большей мере зависят от величины поражения миокарда, уровня поражения коронарного русла, проходимости инфарктобусловившей коронарной артерии, состояния тканевой перфузии.
К факторам, влияющим на процессы раннего ремоделирования на 7–14-е сутки, относят наличие и обширность зон резидуальной ишемии и «оглушения» миокарда, выраженность воспалительной реакции в ответ на развитие острого ИМ, степень активации САС и РААС, процесса апоптоза кардиомиоцитов.
Большинство авторов, изучающих проблему постинфарктного ремоделирования полости ЛЖ, отмечают ведущую роль проходимости инфарктобусловившей коронарной артерии, срок ее открытия и уровень поражения сосуда. Наиболее важным фактором, влияющим на активизацию процессов ремоделирования, в настоящее время считают тканевую перфузию миокарда — наличие адекватной микроциркуляции в зоне поражения. Однако вне зависимости от проходимости инфарктобусловившей коронарной артерии при различном уровне поражения сосуда и развитии коллатерального кровотока отмечают различную величину зоны некроза.
Учитывая величину зоны ишемизированного миокарда, кровоснабжаемого пораженным участком коронарного русла, можно предполагать и величину некротического поражения. Уровень окклюзии коронарной артерии, тип коронарного кровообращения в большей мере определяют размер зоны некроза и предполагают возможность развития более или менее выраженного ремоделирования полости ЛЖ.
Наиболее неблагоприятным вариантом постинфарктного ремоделирования является ранняя сегментарная постинфарктная дилатация с формированием аневризмы ЛЖ. Причинами неблагоприятного протекания процессов ремоделирования, помимо обширности поражения миокарда, могут выступать перегрузка ЛЖ (причем в первые часы заболевания преобладает постнагрузка в силу гиперфункции «стрессорных» систем организма, в дальнейшем с развитием застоя в малом круге кровообращения и формированием повышенного диастолического давления в левом предсердии — увеличение преднагрузки), несостоятельность грануляционной ткани при ускоренной резорбции очага некроза. Клинически острая аневризма сердца может проявляться усугублением явлений СН, появлением прекордиальной пульсации. Эхокардиографически отмечен участок выпячивания стенки ЛЖ (при инфаркте перегородочной локализации выпячивание ее происходит в полость ПЖ согласно градиенту давления) с ее истончением, ограниченный по периферии перешейком. Впрочем, на ранних стадиях формирования аневризмы сердца не всегда удается выявить эти эхоКГ-признаки. В этом случае более надежным признаком является наличие стойкого дискинеза (парадоксального движения) стенки в систолу. При обширных поражениях с резким снижением тотальной сократимости ЛЖ дискинез может не отмечаться, тогда следует обратить внимание на участки полного акинеза. Наиболее неблагоприятным последствием острой аневризмы сердца является ее разрыв (см. далее). По локализации разрыв очага поражения бывает периферическим (ранним, возникающим преимущественно в первые 72 ч) и центральным (возникающим в период относительной стабилизации зоны некроза). Неблагоприятным явлением, существенно повышающим риск раннего разрыва, является гиперкинез сегментов, прилегающих к участку некроза. Поздний разрыв происходит на фоне истончения стенки аневризмы и характеризуется несостоятельностью процессов рубцевания. К другим последствиям формирования острой аневризмы следует отнести усугубление на ее фоне явлений СН, турбулентность кровотока в ЛЖ, формирование тромба в полости аневризмы с возможными тромбоэмболическими осложнениями.
Разрыв свободной стенки
Острый разрыв свободной стенки
Клиническая картина характеризуется сердечно-сосудистым коллапсом с электромеханической диссоциацией, то есть сохранением электрической активности при потере сердечного выброса и отсутствии пульса. Стандартные мероприятия сердечно-легочной реанимации неэффективны, поскольку обычно это заканчивается фатальным исходом в течение нескольких минут. Очень редко больного удается прооперировать (рис. 1.16).
Приблизительно в 25% случаев небольшие количества крови попадают в полость перикарда, что вызывает нарастающие нарушения гемодинамики. Клиническая картина может напоминать реинфаркт, учитывая возобновление боли и реэлевацию сегмента ST, но чаще отмечают внезапное ухудшение состояния гемодинамики с преходящей или стойкой гипотензией. Развиваются классические признаки тампонады сердца, которые можно подтвердить эхокардиографическим методом. Хотя во время эхоКГ обычно не устанавливают локализацию разрыва, можно верифицировать наличие жидкости в перикарде с признаками тампонады или без них (рис. 1.17).
Для диагностики подострого разрыва свободной стенки недостаточно выявить лишь жидкость в перикарде, поскольку этот признак отмечают достаточно часто после острого ИМ. Типичной находкой является эхогенная масса в перикардиальном пространстве, которая напоминает сгусток (гемоперикард). Следует рассмотреть необходимость немедленного хирургического вмешательства в зависимости от клинического состояния. Перикардиоцентез может способствовать коррекции тампонады у пациентов в состоянии шока в период ожидания перед хирургическим вмешательством. В определенном проценте случаев прогрессу гемотампонады при подостром разрыве миокарда мешает развитие воспалительного процесса в перикардиальной сумке с формированием фибринозных спаек и тромбообразование в месте разрыва. В этом случае часто формируется так называемая псевдоаневризма сердца с достаточно специфическими ультразвуковыми и рентгенологическими признаками (рис. 1.18).
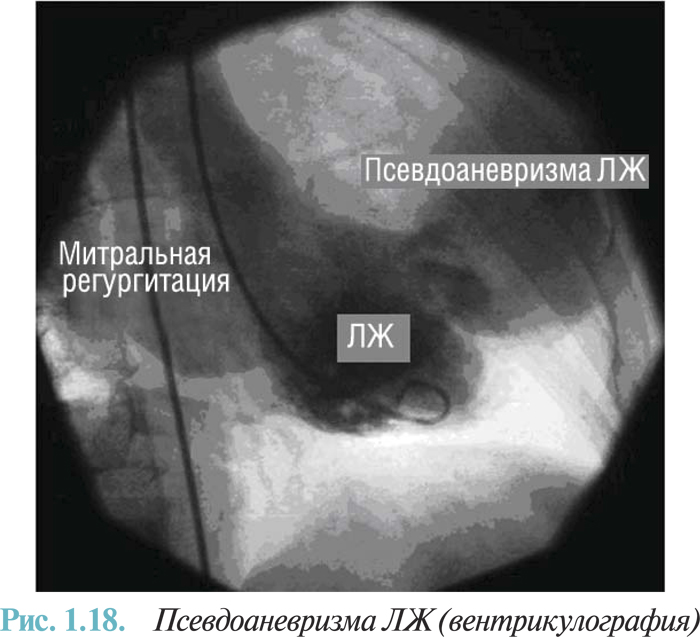
Дефект межжелудочковой перегородки, или синдром Бернгейма, может развиться в ранние сроки ИМ; частота этого осложнения составляет приблизительно 1–2% всех случаев инфаркта. Если не выполнить хирургическую коррекцию, летальность составляет 54% в течение первой недели и 92% в течение первого года. Диагноз можно заподозрить при значительном ухудшении клинических проявлений. Его подтверждают аускультативно (появление громкого систолического шума), методом эхоКГ и/или путем выявления повышения содержания кислорода в крови ПЖ. Впрочем, шум может быть мягким или вообще отсутствовать. ЭхоКГ-исследование позволяет установить локализацию и размер дефекта межжелудочковой перегородки. Шунтирование крови слева направо подтверждают цветным допплеровским методом и количественно оценивают методом пульсовой допплерэхокардиографии. Оценку пиковой скорости потока через место разрыва методом постоянной допплерэхокардиографии используют для измерения систолического давления в ПЖ (ЛА).
Медикаментозное лечение вазодилататорами, например внутривенным нитроглицерином, может обеспечить некоторое улучшение состояния в случае, если нет кардиогенного шока. Но наиболее эффективным методом поддержания кровообращения в период подготовки к хирургической коррекции является внутриаортальная баллонная контрпульсация. Ургентное вмешательство дает единственный шанс для выживания при большом постинфарктном дефекте межжелудочковой перегородки с кардиогенным шоком. Даже если нет гемодинамической нестабильности, раннее хирургическое вмешательство показано также ввиду того, что размер дефекта может увеличиться.
При решении вопроса о проведении хирургического вмешательства следует выполнить дооперационную коронарную ангиографию и при необходимости установить шунты. Предикторами плохих последствий заболевания после хирургического вмешательства являются кардиогенный шок, задняя локализация процесса, дисфункция ПЖ, возраст, значительный временной промежуток между моментом разрыва перегородки и осуществлением вмешательства. Госпитальная смертность после хирургических вмешательств в пределах 25–60%, а среди выживших пациентов функциональное состояние в 95% соответствует СН класса I или II по NYHA.
Митральная регургитация
Митральная регургитация является распространенным осложнением острого ИМ. Существуют три механизма острой митральной регургитации:
- расширение кольца митрального клапана в результате дилатации и дисфункции ЛЖ;
- дисфункция папиллярной мышцы, обычно в результате ИМ нижней локализации;
- разрыв папиллярной мышцы.
Разрыв папиллярной мышцы обычно проявляется внезапным ухудшением состояния гемодинамики. Ввиду внезапности и тяжести повышения давления в левом предсердии шум часто является мягким. Степень митральной регургитации лучше всего оценить методом цветной допплерэхокардиографии.
Наиболее частой причиной частичного или тотального разрыва папиллярной мышцы является малый инфаркт заднемедиальной папиллярной мышцы в бассейне правой или огибающей артерии. У некоторых пациентов для постановки окончательного диагноза необходима чреспищеводная эхоКГ.
Кардиогенный шок и отек легких с тяжелой митральной регургитацией требуют безотлагательного хирургического лечения. Во время подготовки проводят внутриаортальную баллонную контрпульсацию, целесообразно выполнение коронарной ангиографии.
Протезирование клапана является методом выбора при разрыве папиллярной мышцы, хотя в некоторых случаях можно попробовать откорректировать дефект. Если нет разрыва папиллярной мышцы, целесообразно осуществить попытку механической реперфузии инфарктобусловившей артерии.
Внутриполостное тромбообразование
Внутриполостное тромбообразование, как правило, сопровождает распространенный инфаркт передней стенки ЛЖ сердца. Появление данного феномена в первую очередь носит защитный характер. При большом поражении передней стенки ЛЖ происходит истончение стенки, нарушение ее сократительной способности, вплоть до парадоксального движения, что вызывает местные турбулентные движения крови. В месте инфаркта часто отмечают воспалительную реакцию эндокарда. Все эти явления способствуют пристеночному тромбообразованию. При выраженном нарушении сократительной функции, особенно сегментарной, с формированием аневризмы сердца пристеночное тромбообразование может перерастать во внутриполостное. Внутриполостной тромб теряет профилактическое значение, может существенно нарушать кардиогемодинамику и несет угрозу тромбоэмболических осложнений (рис. 1.19).
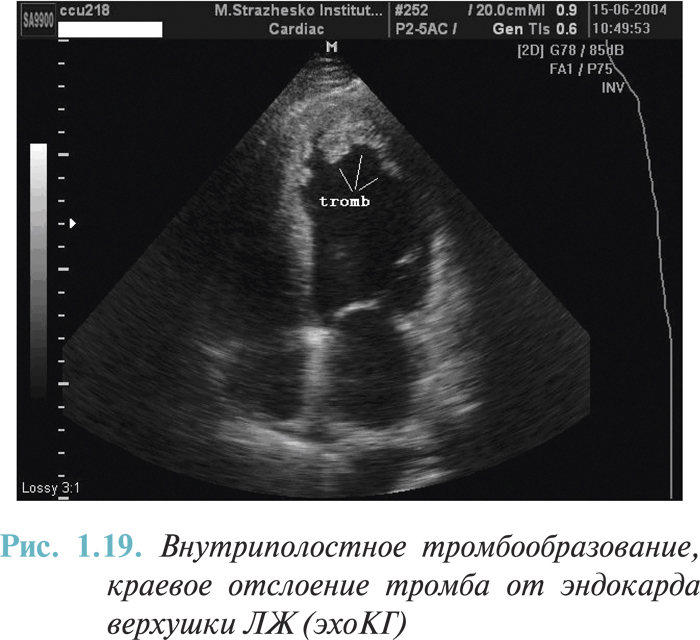
При возникновении внутриполостного тромба необходимо проведение активной антикоагулянтной терапии с включением гепаринов и непрямых антикоагулянтов.
При развитии дилатации полости ЛЖ с наличием постинфарктной аневризмы и внутриполостного тромба возможно проведение оперативного вмешательства, включающего аневризмэктомию, тромбэктомию и АКШ.
Профилактика и лечение аритмий и нарушений проводимости
Аритмии и нарушение проводимости чрезвычайно распространены в первые часы после ИМ. В некоторых случаях, в частности при желудочковой тахикардии, фибрилляции желудочков и полной AV-блокаде, возникает угроза для жизни и требуется проведение немедленной коррекции. Часто аритмии являются проявлением серьезного основного заболевания, например сохраняющейся ишемии, насосной недостаточности, измененного вегетативного тонуса, гипоксии, расстройств электролитного (гипокалиемия) или кислотно-щелочного состояния, требующих внимания и мероприятий по их коррекции. Необходимость лечения и степень его неотложности в основном зависят от гемодинамических последствий нарушения ритма. Индукция стойкой мономорфной желудочковой тахикардии во время проведения программируемой стимуляции желудочков в подострый период острого ИМ является достаточно надежным маркером риска развития желудочковых тахиаритмий в последующем, но в острой фазе ИМ этот метод непригоден для применения. Рутинное применение программируемой стимуляции желудочков в подострый период острого ИМ показано только у больных с высокой степенью риска развития угрожающих жизни желудочковых аритмий, а также для оценки эффективности антиаритмической терапии у таких пациентов. Для выявления больных с высоким аритмическим риском в последнее время используют неинвазивные показатели вариабельности сердечного ритма, нарушений процессов деполяризации и реполяризации миокарда, но проблема еще далека от окончательного решения.
Желудочковые эктопические ритмы
Желудочковые эктопические ритмы почти всегда отмечают в первый день заболевания; распространенными являются сложные экстрасистолические аритмии: полиморфные комплексы, короткие эпизоды тахикардии, феномен R-на-Т. По Лауну (Lown) желудочковые экстрасистолы разделяют на 5 типов:
I — мономорфная с частотой <5 в мин;
II — мономорфная с частотой >5 в мин;
III — полиморфная;
IV — парная желудочковая экстрасистола (а) или группы из 3–5 желудочковых экстрасистол (b);
V — ранняя с феноменом R-на-Т.
Невзирая на удобство использования этой классификации для формулировки диагноза у конкретного больного, значение этих аритмий как предикторов фибрилляции желудочков или стойкой желудочковой тахикардии сомнительное. Если желудочковые аритмии не сочетаются с дисфункцией ЛЖ, то потребности в отдельной терапии нет.
Желудочковая тахикардия
Эпизоды неустойчивой (до 30 с) желудочковой тахикардии (ЖТ) могут быть хорошо переносимы и не обязательно требуют лечения. Более длительные эпизоды могут вызывать гипотензию и СН с возможным переходом в фибрилляцию желудочков. Также выделяют раннюю ЖТ (возникает в первые 48 ч острого ИМ) и позднюю, которую ассоциируют с более плохим прогнозом. По морфологии различают мономорфную и полиморфную ЖТ, по ЧСС — быструю ( >170 комплексов в мин) и медленную (120–170 комплексов в мин).
Препаратами первой линии в случае отсутствия противопоказаний являются блокаторы β-адренорецепторов. При стабильной стойкой мономорфной ЖТ в качестве начального лечения может быть применен прокаинамид и/или лидокаин в случае, если ЖТ носит явно ишемический характер. Сначала применяют нагрузочную дозу лидокаина 1 мг/кг в/в, затем — половину этой дозы каждые 8–10 мин до максимальной дозы — 4 мг/кг или осуществляют длительную инфузию в дозе 1–3 мг/мин. Впрочем, у пациентов с возвратной стойкой желудочковой тахикардией, которая требует кардиоверсии, или в случае фибрилляции желудочков преимущество может быть отдано внутривенному введению амиодарона (5 мг/кг в течение первого часа, затем 900–1200 мг в течение 24 ч). При сохранении гемодинамически значимой желудочковой тахикардии показана электрическая кардиоверсия. При отсутствии или временной недоступности дефибриллятора следует попробовать применить прекардиальный удар. Важно отличить истинную желудочковую тахикардию от ускоренного идиовентрикулярного ритма, который обычно является безвредным следствием реперфузии, когда частота ритма желудочков сохраняется менее 120 уд./мин.
На рис. 1.20 отображен алгоритм лечения стойкой ЖТ согласно объединенным рекомендациям АСС/АНА, Европейского кардиологического общества (ESC) от 2006 г.
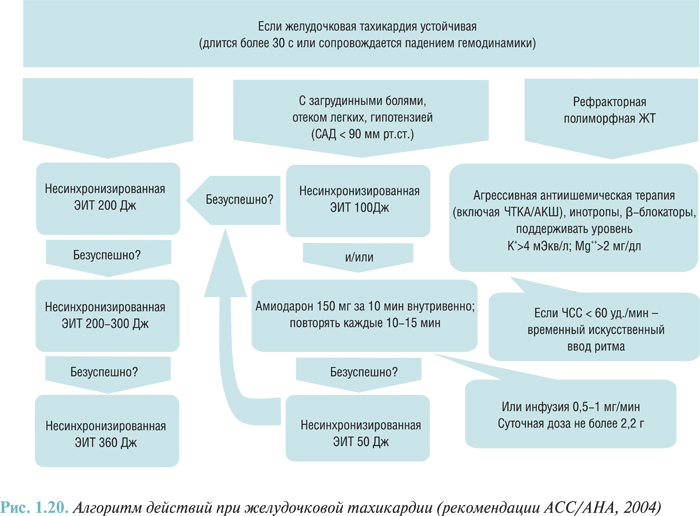
Фибрилляция желудочков
Следует немедленно выполнить дефибрилляцию согласно международным рекомендациям по сердечно-легочной реанимации 2005 г. Более подробный алгоритм представлен на рис. 1.21 и отображает порядок фармакотерапии и электроимпульсной терапии согласно объединенным рекомендациям ААС/АНА/ESC от 2006 г.
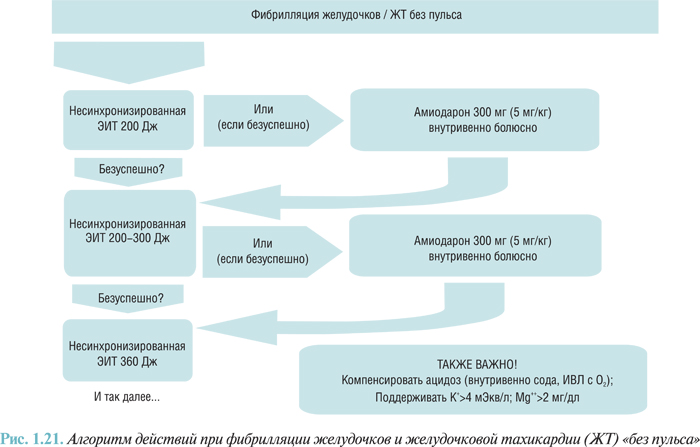
Суправентрикулярные аритмии
Фибрилляция предсердий является осложнением ИМ в 15–20% случаев и часто ассоциируется с тяжелым поврежденим ЛЖ и СН. Также ее причинами могут быть инфаркт предсердий (чаще при тромбозе в правой коронарной артерии), перикардит. Непосредственными причинами начала и сохранения аритмии является растяжение предсердий, избыточная симпатическая активность и электролитный дисбаланс. Обычно аритмия проходит спонтанно. Эпизоды могут продолжаться от минут до часов и часто повторяются. Во многих случаях частота желудочкового ритма не увеличивается, аритмия хорошо переносится и лечение не требуется. В других ситуациях тахикардия способствует возникновению СН и поэтому необходимо немедленное лечение. С целью замедления частоты ритма у многих пациентов эффективны блокаторы β-адренорецепторов, но амиодарон может быть более эффективным для прекращения аритмии. Использование прокаинамида или пропафенона менее приемлемо, учитывая значительный кардиодепрессивный эффект первого и проаритмогенный эффект второго. Возможно также выполнение кардиоверсии. Впрочем, ее применяют лишь при необходимости, принимая во внимание большую частоту рецидивов. В общем виде схема лечения стойкой мерцательной аритмии или трепетания предсердий представлена на рис. 1.22.
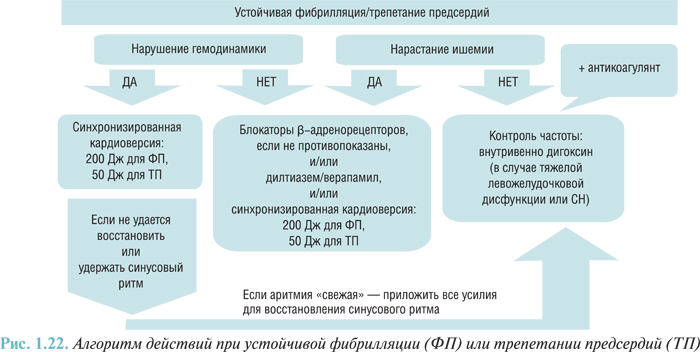
Другие суправентрикулярные тахикардии диагностируют редко; обычно проходят самостоятельно. Они могут также прекращаться при массаже каротидного синуса. Эффективными нередко оказываются блокаторы β-адренорецепторов; не рекомендуют применять верапамил. Если исключено трепетание предсердий и состояние гемодинамики стабильно, одним из возможных средств лечения является аденозин; во время введения препарата необходимо мониторирование ЭКГ. При плохой переносимости аритмии следует осуществить кардиоверсию. Согласно рекомендациям Европейского общества кардиологов, последовательность действий при пароксизмальной суправентрикулярной тахикардии следующая (рис. 1.23).

Синусовая брадикардия и блокады сердца
Синусовую брадикардию могут отмечать в течение первых часов заболевания, особенно при ИМ нижней локализации или применении больших доз опиоидов. Ее может сопровождать достаточно выраженная гипотензия. В этом случае следует применить атропин внутривенно, начиная с дозы 0,3–0,5 мг с повторными введениями через каждые 5 мин до достижения общей дозы 1,5–2,0 мг. Если в этом случае нет реакции на введение атропина, может быть рекомендована временная кардиостимуляция. Следует отметить, что фармакологические стимуляторы сердечной деятельности (аминофиллин) не рекомендованы к применению в этой ситуации.
АУ-блокада возникает в 14% случаев острого ИМ с элевацией сегмента ST, наиболее часто ассоциируется с ИМ нижней локализации и имеет прогностическое значение для внутригоспитальной летальности. AV-блокада первой степени не требует лечения. AV-блокада второй степени типа I (Мобитц I или Венкебаха) обычно редко вызывает негативные гемодинамические эффекты. При нарушениях гемодинамики следует сначала ввести атропин, а при его неэффективности проводить кардиостимуляцию.
AV-блокада второй степени типа II (Мобитц II) и полная AV-блокада являются показаниями для введения стимулирующего электрода, обычно если брадикардия вызывает гипотензию или СН. В случае тяжелых расстройств гемодинамики следует рассмотреть возможность последовательной AV-стимуляции. Развитие новой блокады ножки пучка Гиса или гемиблокады обычно указывает на обширный инфаркт передней локализации. В этом случае высокой является вероятность возникновения полной AV-блокады, а также насосной недостаточности. В профилактическом порядке может быть показано введение временного электрода. После AV-блокады, двух-или трехпучковой блокады, а также электрической кардиоверсии может возникать асистолия. Если был введен электрод, в этой ситуации следует попробовать осуществить кардиостимуляцию. Другой путь — массаж сердца и ИВЛ, а также трансторакальная кардиостимуляция. При наличии AV-блокады высокой степени, а также во многих случаях двух- или трехпучковой блокады следует установить трансвенозный электрод для кардиостимуляции. В общем виде схема лечения AV-блокады представлена на рис. 1.24.
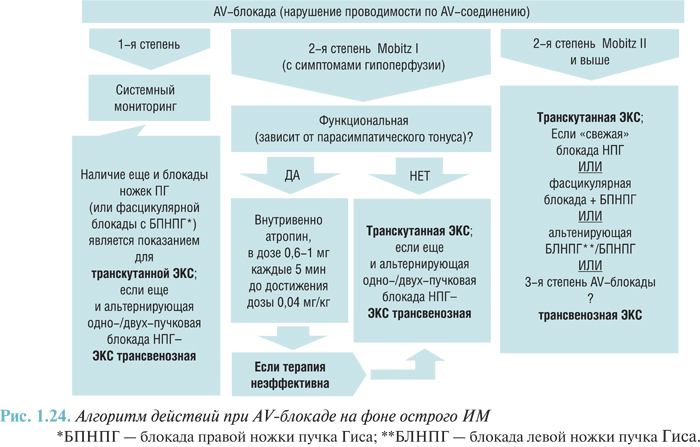
В отношении транскутанной стимуляции можно отметить, что в отечественной клинической практике этот метод практически не используют, преимущество отдают профилактической установке трансвенозного электрода со стимуляцией в режиме «деманд». Некоторые кардиологи предпочитают подключичный подход, но его следует избегать на фоне или вскоре после введения фибринолитиков. В этой ситуации целесообразно избирать альтернативные доступы.
Стандартные средства терапии и профилактики в острой фазе заболевания
Ацетилсалициловая кислота и другие антитромбоцитарные средства
Убедительные доказательства эффективности ацетилсалициловой кислоты получены в исследовании ISIS-2. В этом исследовании доказано дополнительное благоприятное влияние ацетилсалициловой кислоты на результаты лечения стрептокиназой. Существует ограниченный ряд противопоказаний к применению ацетилсалициловой кислоты: ее не следует назначать пациентам с гиперчувствительностью, пептической язвой в стадии обострения, патологическими изменениями крови или тяжелыми заболеваниями печени. Иногда ацетилсалициловая кислота является пусковым фактором бронхоспазма у пациентов с БА. В отличие от фибринолитической терапии, нет четких доказательств связи между эффективностью ацетилсалициловой кислоты и периодом от начала симптомов. Невзирая на это, ацетилсалициловую кислоту нужно как можно раньше назначать всем пациентам с острым ИМ или подозрением на инфаркт. Этот препарат должны получать 85–95% пациентов с ИМ. Следует помнить о необходимости контроля количества тромбоцитов и нейтрофилов. Результаты исследования ESPRIT свидетельствуют о том, что профилактическое действие ацетилсалициловой кислоты может быть усилено комбинацией с ретардной формой дипиридамола, однако для принятия решения о целесообразности рутинного использования этой комбинации данных недостаточно. При наличии противопоказаний к применению ацетилсалициловой кислоты следует рассмотреть возможность назначения тиенопиридинов, которые имеют другой механизм действия и лишены присущих ацетилсалициловой кислоте побочных эффектов. Самый существенный недостаток первых тиенопиридинов (тиклопидин) при применении их у больных с острым ИМ — слишком длительный период достижения максимума их клинической эффективности, в то время как ацетилсалициловая кислота начинает действовать с первых минут после приема под язык или в качестве внутривенной инфузии. Появление тиенопиридинов нового поколения (клопидогрел, празугрел) с разработкой нагрузочных режимов их применения приблизили скорость их клинического эффекта к таковой у ацетилсалициловой кислоты. Относительно комбинированного применения ацетилсалициловой кислоты и тиенопиридинов при ОКС можно сказать следующее: данные проведенного большого рандомизированного исследования CLARITY TIMI 28 продемонстрировали существенное уменьшение частоты 30-суточной комбинированной конечной точки (кровоток 0-й или 1-й степени по TIMI на контрольной ангиограмме, смерть вследствие любой причины или развитие рецидива ИМ). В исследовании COMMIT-CCS у 46 тыс. пациентов с ОИМ было получено снижение частоты смерти, реинфаркта и инсульта на 9% при комбинированной терапии ацетилсалициловой кислотой и клопидогрелом длительностью 14 дней и более. Новый препарат из данной группы — CS-747 или прасугрел в 3 пилотных исследованиях у здоровых добровольцев в нагрузочной (60 мг) и поддерживающей (5–20 мг) дозе продемонстрировал более полное (на 58% по сравнению с клопидогрелом) и стабильное ингибирование агрегации тромбоцитов с меньшей частотой малых кровотечений, чем широко известный аналог клопидогрел в нагрузочной/поддерживающей дозе. Эти данные подтверждены в крупном исследовании TRITON TIMI 38 у больных ИБС (рис. 1.25).
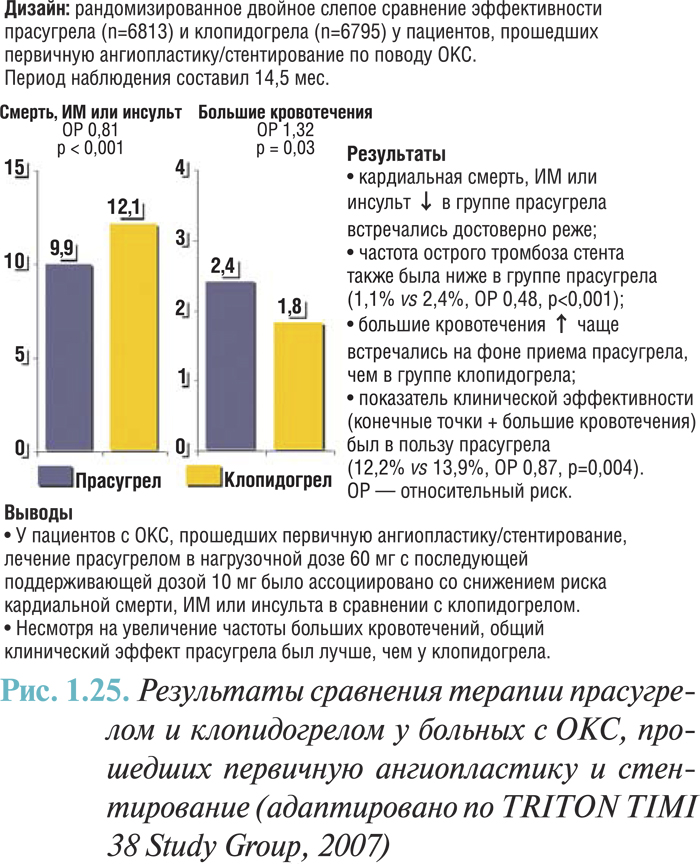
В исследовании применение тиенопиридинов в качестве дополнительного к ацетилсалициловой кислоте препарата оправдано тем фактом, что приблизительно в 50% случаев отмечают так называемую резистентность к ацетилсалициловой кислоте, когда назначение ацетилсалициловой кислоты не вызывает селективной блокады метаболизма арахидоновой кислоты с оптимизацией соотношения продукции простагландинов и тромбоксана А2. В этой ситуации блокада АДФ-зависимых рецепторов адгезии тромбоцитов тиенопиридинами является очень важной для снижения склонности к тромбообразованию. Альтернативными по отношению к производным тиенопиридинов являются такие пероральные препараты, как ривароксабан и субстанция AZD6140, исследования по применению которых у больных с ОКС (TIMI 46 ATLAS, PLATO) еще не завершены.
Еще одной группой антитромбоцитарных препаратов являются блокаторы гликопротеиновых рецепторов IIB/IIIA. На настоящее время несколько инфузионных препаратов из этой группы (абсиксимаб, эптифибатид и тирофибан) являются золотым стандартом антитромбоцитарной терапии при проведении ЧТКА или стентирования с целью подавления тромбообразования в зоне дилатации ИОКА. Имеется информация о позитивном эффекте по снижению частоты последующих ургентных ЧТКА при применении абсиксимаба и половинной дозы тенектеплазы в качестве модификации реперфузионной терапии (исследование ASSENT-3), хотя по показателю 1-летней смертности достоверной разницы между этой тактикой и режимом введения полной дозы тенектеплазы с добавлением прямого антикоагулянта не было. Кроме обязательной внутривенной инфузии в течение не менее одних суток, к отрицательным чертам этих препаратов следует отнести их высокую стоимость и увеличение геморрагических осложнений при их применении (по сравнению с эноксапарин натрием и нефракционированным гепарином).
Антиаритмические средства
Хотя показана способность лидокаина уменьшать частоту возникновения фибрилляции желудочков в острой фазе ИМ, этот препарат существенно увеличивает риск асистолии. Результаты метаанализа 14 исследований выявили недостоверное повышение летальности у пациентов, которые получали лидокаин, по сравнению с плацебо. Рутинное профилактическое применение этого препарата не оправдано.
Как видно на рис. 1.26, в результате проведенного метаанализа исследований эффекта применения антиаритмической терапии у пациентов в разные сроки после перенесенного острого ИМ единственными препаратами, снижающими риск аритмических событий, оказались блокаторы β-адренорецепторов и амиодарон, причем эффективность последнего несколько превышала такую для блокаторов β-адренорецепторов.
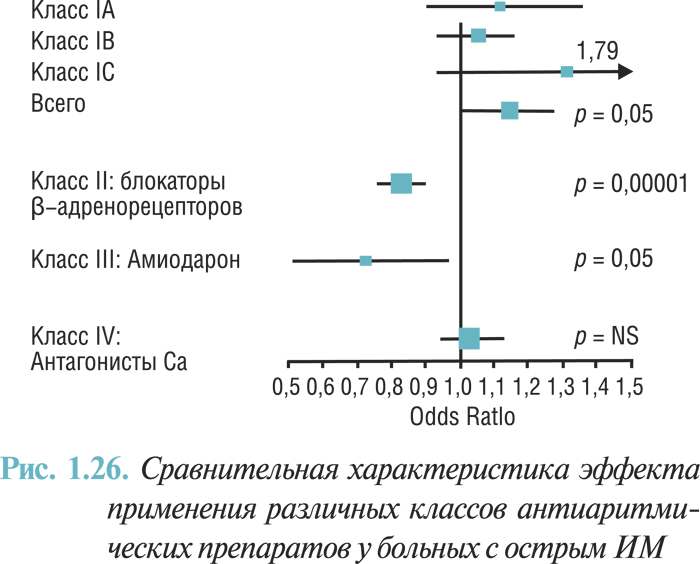
Наиболее вероятным объяснением такой эффективности представителя третьей группы антиаритмиков по сравнению с препаратами первой группы является особенность его механизма действия. В отличие от препаратов первой группы амиодарон приводит к удлинению реполяризации, в первую очередь в неповрежденных ишемией участках миокарда. Учитывая, что в ишемизированной периинфарктной зоне реполяризация удлиняется в силу дисфункции ионных каналов (преимущественно медленных калиевых), при назначении амиодарона разница в длительности реполяризации между «здоровым» и ишемизированным миокардом нивелируется. Следовательно, исчезают предпосылки для развития желудочковых тахиаритмий по типу re-entry. Специально проведенный субанализ исследования CAMIAT установил (рис. 1.27), что эффективность комбинации амиодарона и блокатора β-адренорецепторов превосходит таковую для каждого из этих препаратов в отдельности, причем если исходная ЧСС у пациента была >70 уд./мин, то отмечали дополнительное увеличение эффекта от назначения комбинации этих препаратов, что позволяет рекомендовать такую комбинацию для лечения пациентов после острого ИМ с факторами риска внезапной смерти (особенно с повышением ЧСС в покое >70 уд./мин).
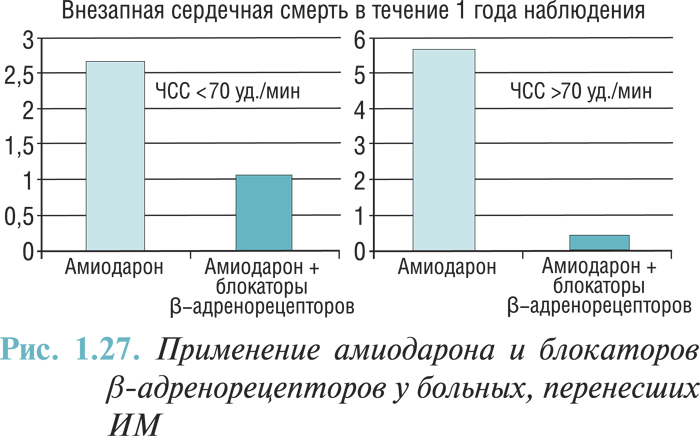
Одним из возможных объяснений этого факта может служить гипотеза, согласно которой антиаритмики третьей группы обладают таким свойством, как обратная частотная зависимость (reverse rate dependency). Суть этого феномена заключается в том, что степень удлинения реполяризации при использовании этих препаратов тем меньше, чем выше ЧСС в определенной точке, (для амиодарона эта точка находится между 70 и 80 уд./мин, тогда как для других антиаритмиков третьей группы она, вероятно, еще ниже), медикаментозное удлинение интервала Q–T в непораженных зонах сердечной мышцы перестает компенсировать электрофизиологические нарушения в периинфарктной зоне. Подтверждением этой гипотезы могут также служить результаты исследований EMIAT (при наличии исходного уровня ЧСС >84 уд./мин частота аритмических событий на фоне лечения амиодароном составляла 54%, тогда как в группе больных с ЧСС <63 уд./мин аритмии возникали лишь в 17% случаев) и ECMA (если в ходе лечения амиодароном не удавалось достигнуть ЧСС <80, аритмии возникали в 59% случаев, тогда как замедление ритма сердца до 63 уд./мин и ниже ассоциировалось с развитием аритмий всего лишь в 12% случаев). Таким образом, можно предположить, что назначение в дополнение к амиодарону блокаторов β-адренорецепторов приводит к снижению ЧСС, «выводя» амиодарон в зону его наибольшей эффективности, что и обусловливает дополнительный эффект их комбинации. К отрицательным качествам амиодарона можно отнести относительно высокий процент таких побочных явлений, как пневмосклероз, фотосенсибилизация, дисфункция щитовидной железы при его длительном применении. Эффективность недавно разработанной модификации амиодарона, лишенной атома йода и многих его побочных эффектов, — дронедарона у больных после острого ИМ пока не доказана.
Блокаторы β-адренорецепторов
В острой фазе ИМ осуществлено немало исследований относительно назначения блокаторов β-адренорецепторов с учетом способности этих препаратов продлевать диастолу, улучшать перфузию миокарда, в особенности субэндокарда, ограничивать зону некроза, уменьшать частоту фатальных аритмий, ослаблять боль и снижать частоту других осложнений, особенно у больных без сопутствующей ТЛТ. Также среди эффектов блокаторов β-адренорецепторов — доказанное уменьшение количества реинфарктов после ТЛТ и снижение ранней летальности. По данным совокупного анализа 28 исследований внутривенное применение блокаторов β-адренорецепторов обеспечивает абсолютное уменьшение летальности через 7 дней с 4,3% до 3,7%, или 6 спасенных жизней на 1000 лечившихся пациентов. Эти исследования осуществлялись до внедрения фибринолитических средств или первичной 4TKA. В проведенных рандомизированных исследованиях осуществляли внутривенную блокаду β-адренорецепторов на фоне применения фибринолитиков, количество событий было слишком малым для того, чтобы сделать определенные выводы. Ретроспективный анализ применения атенолола в исследовании GUSTO-I (1996) и систематический обзор не свидетельствуют в пользу рутинного раннего внутривенного применения блокаторов β-адренорецепторов. Но длительное их применение в постинфарктный период имеет определенные преимущества (рис. 1.28, 1.29).
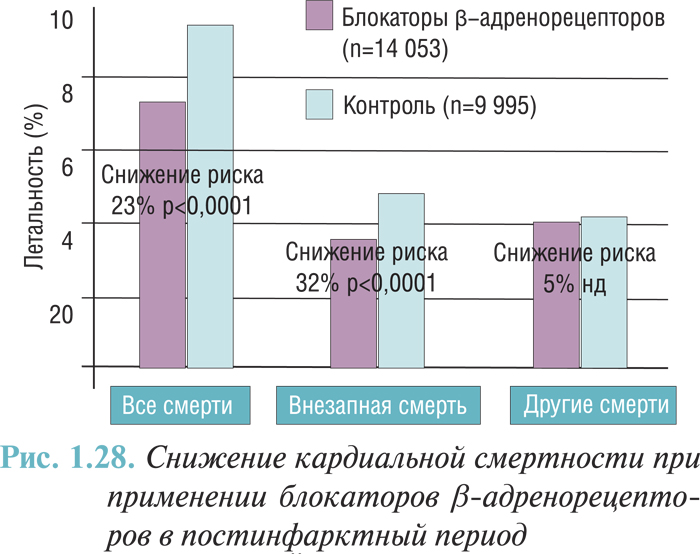

Назначение внутривенных блокаторов β-адренорецепторов особенно показано при тахикардии (когда нет СН), относительной гипертензии или когда боль не проходит после введения опиоидов. Все больные, не имеющие противопоказаний, должны получать перорально блокаторы β-адренорецепторов, однако сначала целесообразно оценить ответ пациента на эту форму терапии путем использования препарата короткого действия (рис. 1.30).

Целесообразность раннего (на 3-и–21-е сутки острого ИМ) назначения блокаторов β-адренорецепторов подтверждена в исследованиях с применением многих блокаторов β-адренорецепторов, в частности пропранолола и карведилола.
Следует отметить, что среди препаратов, ингибирующих хронотропную функцию сердца, появился новый класс — ингибиторы автоматизма клеток — вводителей ритма синусного узла (представитель класса препарат ивабрадин). Данный препарат замедляет частоту генерации импульсов клетками синусного узла путем воздействия на мембранные If каналы, но не влияя при этом на адренергические рецепторы сердца и сосудов. Таким образом, терапия данным препаратом имеет контролируемый изолированный отрицательный хронотропный эффект. В настоящее время проводят рандомизированное клиническое исследование BEAUTYFUL по применению ивабрадина в качестве адъювантной терапии у больных со стабильной ИБС и дисфункцией ЛЖ, однако данные масштабных исследований по применению этого препарата у больных с OKC пока отсутствуют. В течение длительного времени обсуждали вопрос целесообразности применения блокаторов β-адренорецепторов при проведении реваскуляризации. По данным последних исследований улучшение течения острого ИМ при применении блокаторов β-адренорецепторов связано с большим спектром эффектов этого класса препаратов (рис. 1.31).

Нитраты
Метаанализ 10 исследований с ранним внутривенным введением нитратов, выполненным у 2041 пациента, выявил достоверное уменьшение летальности приблизительно на И. Анализ результатов GISSI-3 у 19 394 больных с острым ИМ свидетельствует, что эффективность комбинации нитратов и ингибиторов АПФ относительно снижения случаев смерти и ишемических осложнений превосходит таковую для каждого из этих препаратов в отдельности (рис. 1.32).
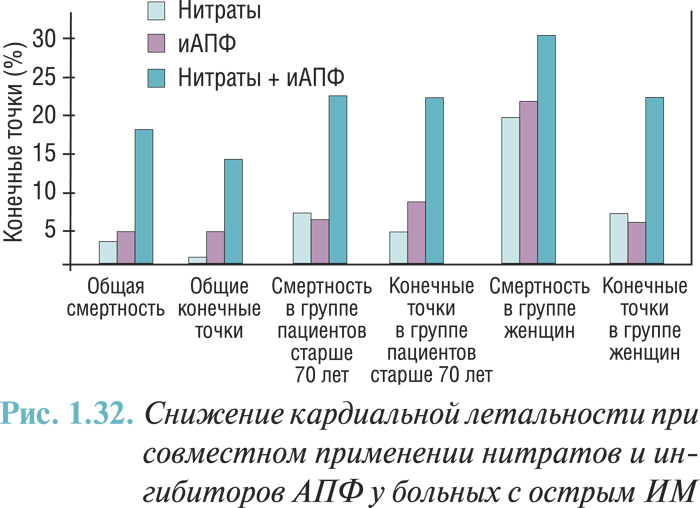
При рутинном назначении нитратов не отмечали достоверного уменьшения летальности. В исследовании ISIS-4 пероральный изосорбида мононитрат назначали с начала заболевания в течение 1 мес, доказательства эффективности препарата не получены. В исследовании ESPRIM (1994) также не доказана польза применения молсидомина, донора оксида азота. Следовательно, внутривенное применение нитратов показано при наличии болевого синдрома, острой СН, в отдельных случаях — для коррекции АГ. Доказано, что внутривенное введение нитратов может способствовать ограничению зоны некроза (рис. 1.33).
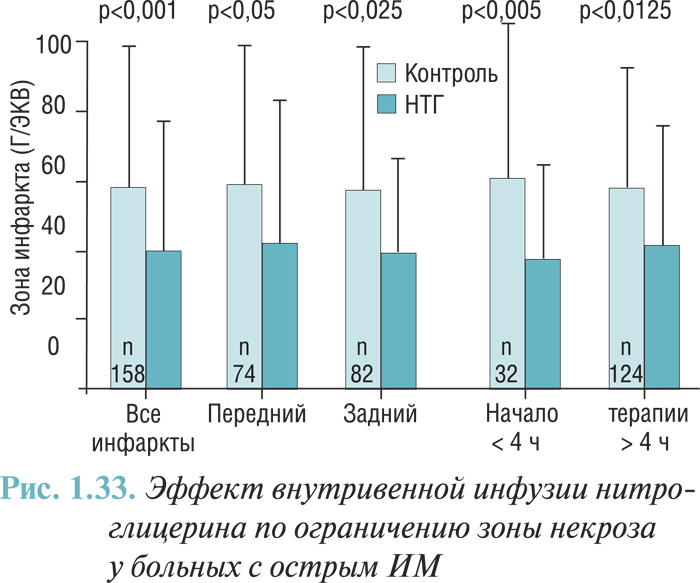
Применение форм нитратов внутривенно позволяет предотвращать дилатацию полости ЛЖ, развитие ишемических осложнений инфаркта и снижать внутригоспитальную летальность (рис.1.34).
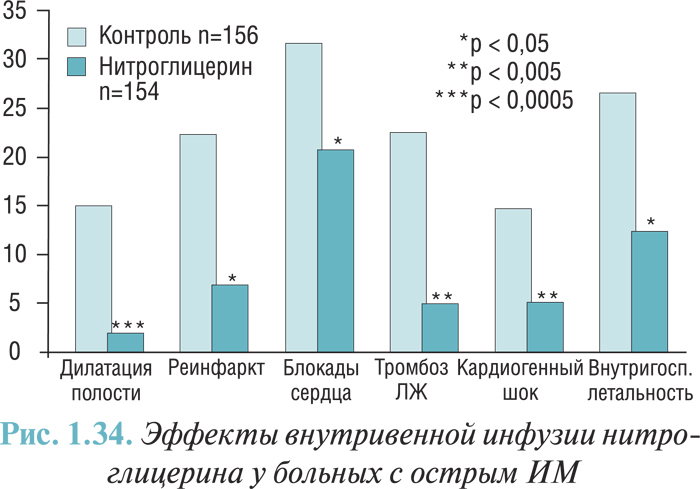
Таким образом, пероральные нитраты следует назначать больным для лечения и профилактики дисфункции ЛЖ в сочетании с ингибиторами АПФ. Кроме того, есть данные, свидетельствующие о том, что нитроглицерин способен подавлять адгезию и агрегацию тромбоцитов.
Аденозин
В настоящее время отсутствуют данные относительно выраженного позитивного эффекта аденозина на клиническое течение острого ИМ. В рандомизированных исследованиях AMISTAD и AMISTAD II получены данные, свидетельствующие об уменьшении размера инфаркта (по данным позитронно-эмиссионной томографии) у больных с острым ИМ, которые в острый период заболевания получали терапию аденозином. Достоверной информации о влиянии такой терапии на прогноз исследователи не получили вследствие недостаточного количества пациентов. Но полученную в исследовании ATTACC тенденцию к снижению кардиоваскулярной смертности в течение 1 года у больных с острым ИМ передней локализации после назначения аденозина в виде инфузии (10 мкг/кг/мин в течение 6 ч в первые часы острого ИМ) следует подтвердить проведением рандомизированных исследований с привлечением большего количества больных для выяснения вопроса относительно возможности рутинного использования аденозина в качестве адъювантной терапии при остром ИМ передней локализации.
Антагонисты кальция
Метаанализ исследований с применением антагонистов кальция при остром ИМ выявил отрицательную тенденцию в плане их влияния на кратко- и долгосрочный прогноз. Для использования антагонистов кальция (особенно короткого действия) с профилактической целью в острой фазе ИМ нет оснований.
Ингибиторы АПФ
Установлено, что ингибиторы АПФ следует назначать пациентам со сниженной ФВ или проявлениями СН в ранней фазе заболевания. В исследованиях GISSI-3, ISIS-4, FAMIS применение ингибиторов АПФ с первого дня заболевания незначительно, но достоверно уменьшало летальность в течение следующих 4–6 недель. Впрочем, в исследовании CONSENSUS II благоприятного влияния эналаприлата на течение острого ИМ не выявлено. Очевидно, это обусловлено либо случайными факторами, либо ранним введением препарата внутривенно в большой дозе, приводящей к артериальной гипотензии.
Систематический анализ исследований эффективности ингибиторов АПФ в ранний период ИМ указывает на безопасность и хорошую переносимость этих препаратов в умеренных дозах (табл. 1.14). Их прием ассоциируют с небольшим, но достоверным уменьшением летальности после 30 дней от начала заболевания, причем в основном благоприятный эффект достигают в течение первой недели. В настоящее время существует общее согласие относительно начала применения ингибиторов АПФ в острый период ИМ больным с дисфункцией ЛЖ, наличием СН, сахарного диабета, АГ, с передней локализацией инфаркта, при отсутствии противопоказаний.
Таблица 1.14
Дозирование ингибиторов АПФ после ИМ в контролируемых исследованиях
| Исследование, препарат | Начальная доза | Целевая доза |
| CONSENSUS II, эналаприл | Эналаприлат 1 мг внутривенно, дальше 2–5 мг 2 раза в сутки с увеличением до 20 мг при хорошей переносимости | До 20 мг |
| GISSI-3, лизиноприл | 5 мг | До 10 мг |
| ISIS-4, каптоприл | 6,25 мг; через 2 ч — 12,5 мг, через 10–12 ч — 25 мг | До 50 мг 2 раза в сутки |
| CHINESE, каптоприл | 6,25 мг; через 2 ч — 12,5 мг | До 12,5 мг 3 раза в сутки |
| SMILE, зофеноприл | 7,5 мг; повторно через 12 ч, при хорошей переносимости — удвоение дозы | До 30 мг 2 раза в сутки |
| AIRE, рамиприл | 2,5 мг 2 раза в сутки, увеличение до 5 мг 2 раза в сутки | До 5 мг 2 раза в сутки |
| SAVE, каптоприл | 6,25 мг; при хорошей переносимости — до 25 мг 3 раза в сутки | До 50 мг 3 раза в сутки |
| TRACE, трандолаприл | 0,5 мг | До 4 мг |
В многоцентровых исследованиях (SAVE, AIRE, TRACE, SMILE, CCS-1, CATS, ISIS-4, GISSI-3) отмечено снижение летальности в госпитальном периоде острого ИМ и увеличение выживаемости в отдаленные сроки заболевания. Ингибиторы АПФ используют с целью профилактики ремоделирования ЛЖ, развития и прогрессирования СН.
В то же время, несмотря на многочисленные исследования, посвященные применению препаратов этой группы у больных с острым ИМ, в данный момент остается открытым вопрос о целесообразности применения ингибиторов АПФ в первые часы развития ИМ, поскольку большинство крупных исследований оценивали эффективность назначения ингибиторов АПФ в сроки между 24–72 ч от начала развития заболевания (рис. 1.35). Следует учесть тот факт, что в первые часы заболевания эти препараты могут вызывать гипотензию с возможным усугублением нарушения коронарной перфузии.

Каптоприл является одним из первых препаратов, разработанных для модификации активности РААС. Исторически роль данного каскада состоит в быстрых адаптивных реакциях, регулирующих взаимоотношения между сердечно-сосудистой системой и жизненно важными органами при внезапных стрессах и повреждении. Однако при хронической стимуляции РААС происходят длительные и малообратимые расстройства ее регуляции. Причем поскольку «разбалансировке» подвергаются как эндокринная (внутрисосудистая), так и тканевые РААС, соответственно и последствия данных нарушений могут быть весьма разнообразны. К таким последствиям можно отнести стойкое увеличение периферического сосудистого сопротивления, фиброз и гипертрофию миокарда, нарушение функции эндотелия и снижение фибринолитических свойств крови.
Терапевтические задачи, которые можно ставить перед ингибиторами АПФ в острейшей фазе ИМ, касаются влияния на функцию эндотелия, фибринолитический баланс, а также на состояние тромбоцитарного звена гемостаза. С учетом указанных выше механизмов регуляции сосудистого тонуса, тромбообразования и аутогенного фибринолиза быстрая блокада эндокринной РААС в острейшей фазе ИМ, препятствующая разрушению брадикинина, способна не только вызвать брадикинин-опосредованную вазодилатацию коронарных артерий, но и облегчить лизис тромба, вызвавшего данный инфаркт, а также способствовать предотвращению ранней тромботической реокклюзии коронарного сосуда, включая реперфузионные микрососудистые тромбоэмболические осложнения. Результаты исследования HEART дали клиническое подтверждение этой гипотезе. В частности, рамиприл, назначенный в первые 24 ч острого ИМ, привел к существенному (p <0,02) снижению активности PAI-1 к концу второй недели инфаркта. Интересно, что как в данном исследовании, так и в исследованиях с лизиноприлом у больных с АГ и у пациентов пожилого возраста этот эффект ингибиторов АПФ не был связан с их гипотензивным действием. Исследование эффекта ингибирования АПФ при помощи инфузии эналаприлата (5 мкг/мин) на вазодилатацию и фибринолитический баланс плазмы проведено Pretorius и соавторами. В данной работе показано значительное увеличение концентрации tPA в плазме крови на фоне инфузии эналаприлата. Эналаприлат потенцировал эффекты экзогенного брадикинина как на вазодилатацию, так и на увеличение концентрации tPA. Примечательно, что в исследовании изучено также влияние специфической блокады брадикининовых рецепторов препаратом HOE 140 на вышеописанные эффекты брадикинина. В результате получено блокирование эффектов как эндогенного, так и экзогенного брадикинина на вазодилатацию и фибринолитический баланс плазмы крови, причем даже терапия эналаприлатом не приводила к сдвигам фибринолитического баланса и вазодилатации.
По поводу лабораторной верификации эффекта ингибиторов АПФ на фибринолиз утверждают, что описанное влияние на концентрацию tPA и PAI-1 отмечено для различных ингибиторов АПФ, что дает основания предполагать наличие «классового» эффекта ингибиторов АПФ на фибринолиз. В указанном аспекте каптоприл является самым быстродействующим ингибитором АПФ, водорастворимость которого предполагает более активное его блокирующее влияние именно на внутрисосудистую РААС. Кроме того, по частоте клинических проявлений повышенного уровня брадикинина в крови («брадикининовый» кашель, гипотензия) каптоприл превосходит практически все известные представители этого класса препаратов.
В отношении дополнительных положительных механизмов блокады АПФ в острейшей фазе ИМ при помощи каптоприла также отмечают следующее: данный препарат является одним из немногих ингибиторов АПФ, содержащих в своей структуре свободную SH-группу. Общеизвестен тот факт, что долговременный вазодилатирующий эффект экзогенных нитратов обеспечивается их превращением в длительноживущие доноры NO–S-нитрозотиолы, устойчивые к оксидативной инактивации супероксид-анионом. Истощение в плазме крови молекул, содержащих вакантные тиоловые (SH) группы (L-аргинин, метионин), приводит к развитию так называемой толерантности к нитратам I типа и, как следствие этого, к снижению их вазодилатирующего и антиангинального эффектов. При этом толерантность развивается как к экзогенному, так и к эндогенному NO, так как механизмы накопления и трансформации нитрозотиолов происходят по одному биохимическому каскаду. Снижение уровня свободного NO в плазме крови происходит путем превращения его супероксид-анионом в неактивный пероксинитрит. В данном случае каптоприл оказывает двоякое действие: во-первых, может выступать в качестве донатора сульфгидрильных групп и стимулировать не только брадикинин-опосредованную, но и нитрат-опосредованную вазодилатацию. Кроме того, каптоприл блокирует опосредованную ангиотензином II активацию мембранной NAD(P)H оксидазы и, следовательно, снижает продукцию супероксид-аниона. Таким образом, стимулируя повышение в крови уровня оксида азота (NO) путем повышения его продукции и снижения его инактивации, каптоприл тем самым потенцирует и другие кратковременные системные эффекты NO — ингибирование АДФ-зависимой адгезии и агрегации тромбоцитов, ингибирование адгезии тромбоцитов к эндотелию путем блокады дегрануляции тромбоцитов. Это положение подтверждено при изучении эффектов каптоприла на агрегацию и адгезию тромбоцитов в ранний постинфарктный период.
Еще один возможный механизм позитивного влияния блокады АПФ на течение острейшей фазы ИМ заключается в следующем. Являясь мембранной кининазой II, АПФ катализирует деградацию многих макромолекул, к которым, в частности, относят энкефалины и бета-неоэндорфин. Предотвращением распада этих веществ также отчасти можно объяснить полученное в некоторых исследованиях снижение частоты рецидивирующего или пролонгированного ангинозного статуса в острой фазе ИМ на фоне лечения каптоприлом.
Тем не менее группа ингибиторов АПФ неоднородна, состоит из препаратов липофильных и гидрофильных, с наличием сульфгидрильных групп короткого и длительного действия. Применение большинства ингибиторов АПФ доказало их клиническую эффективность при остром ИМ по сравнению с плацебо. Однако полномасштабного сравнения эффективности различных ингибиторов АПФ до настоящего времени не проводили. Результаты проведенного исследования (SMILE-2) прямого сравнения лизиноприла и нового представителя липофильных ингибиторов АПФ — зофеноприла свидетельствуют о сопоставимой эффективности обоих препаратов в предотвращении кардиальных событий в постинфарктный период. Это лишний раз доказывает, что данные метаанализов, в которых сравнивают эффективность различных ингибиторов АПФ в разных исследованиях (и у разных категорий пациентов), не могут заменить информации, получаемой при прямом сравнении этих препаратов в одном исследовании.
Блокаторы рецепторов ангиотензина II первого типа
Результаты многочисленных исследований по применению ингибиторов АПФ при остром ИМ показали достоверное снижение летальности в госпитальный период ИМ и увеличение выживаемости в отдаленные сроки заболевания. Однако несмотря на столь высокую эффективность ингибиторов АПФ при остром ИМ, в настоящее время систематизированы сведения о возможных ограничениях при использовании данной группы препаратов. При этом отмечены выраженный сухой кашель (брадикининовый эффект), гипотензия, требующие отмены препарата. У большинства представителей класса ингибиторов АПФ выявлен феномен снижения эффективности действия препарата.
Снижению эффективности ингибиторов АПФ способствует активация АПФ-независимого пути трансформации А1 в А11 через химазы, CAGE (chymostatin — sensitive angiotensin II — generating enzyme), катепсин G. Образование А11 возможно непосредственно из ангиотензиногена, в обход стадии образования А1 (тканевый активатор плазминогена, катепсин G, тонин). Блокаторы рецепторов ангиотензина II (БРА) первого типа, действие которых не зависит от пути превращения ангиотензина II, блокируя его эффекты на уровне рецепторов, одинаково влияют на системные эффекты и тканевые.
Ряд исследователей оценивал эффективность блокаторов рецепторов ангиотензина II при остром ИМ. В пилотных исследованиях блокаторы рецепторов ангиотензина II определены как препараты, не уступающие ингибиторам АПФ. Вместе с тем по результатам исследования OPTIMAAL (The Optimal Therapy in Myocardial Infarction with Angiotensin II Antagonist Losartan), которое оценивало эффективность применения лозартана по сравнению с каптоприлом, не выявлены преимущества блокаторов рецепторов ангиотензина II перед ингибиторами АПФ. В настоящее время проведено другое многоцентровое исследование VALsartan In Acute myocardial iNfarcTion (VALIANT), в котором для лечения 14 500 больных с высокой степенью риска после перенесенного острого ИМ применяли вальзартан, каптоприл и их комбинацию. В данном исследовании доказана равная эффективность вальзартана и каптоприла при отсутствии дополнительного эффекта комбинированного применения этих групп препаратов. Противоречивость результатов исследований как при остром ИМ, так и при СН только поддерживает интерес к изучению эффективности ингибиторов АПФ, блокаторов рецепторов ангиотензина II, а также их комбинаций. Кроме того, нет убедительных данных об одинаковой эффективности всех представителей класса блокаторов рецепторов ангиотензина II у больных с острым ИМ. Показанием к назначению блокаторов рецепторов ангиотензина II остается непереносимость ингибиторов АПФ.
Несмотря на то что во многих проведенных ранее исследованиях как при СН, так и при остром ИМ не было получено данных о преимуществе блокаторов рецепторов ангиотензина II над ингибиторами АПФ, изыскания в данной области не остановлены.
Результаты последних исследований у нормотоников и пациентов с метаболическим синдромом свидетельствуют, что антагонисты рецепторов ангиотензина II первого типа, вызывающие повышение в крови его концентрации по механизму обратной связи, относительно описанных функций эндотелия производят эффект, отличный от эффекта ингибиторов АПФ. Антагонисты рецепторов ангиотензина II первого типа снижают уровень активности tPA, снижая при этом уровень PAI-1 значительно меньше, чем ингибиторы АПФ, причем для этих препаратов отмечена нивелировка эффекта на уровень PAI-1 при длительном назначении. Более того, некоторые исследователи отмечают отсутствие влияния антагонистов рецепторов к ангиотензину II первого типа на уровень PAI-1 или даже некоторое повышение уровня PAI-1 в ответ на блокаду ангиотензиновых рецепторов первого типа. Одним из возможных объяснений того, что, по данным большинства исследований, блокада этих рецепторов не приводит к значительному повышению уровня PAI-1, является неоднозначность воздействия ангиотензина II на уровень антифибринолитического агента. Кроме вышеописанной прямой стимуляции эндотелиальной выработки PAI-1, ангиотензин II стимулирует также ангиотензиновые рецепторы второго типа, что приводит к опосредованному увеличению выработки брадикинина и NO. Исследование Bouchie и соавторов показало, что оксид азота наряду с натрийуретическими факторами блокирует экспрессию PAI-1 в эндотелии. Тем не менее, исходя из результатов вышеприведенных исследований, положительный эффект стимуляции ангиотензином II рецепторов второго типа частично нивелируется его опосредованным блокирующим действием на фибринолиз.
Магний
Метаанализ исследований эффективности препаратов магния при остром ИМ позволял сделать вывод о достоверности их эффекта. Однако осуществленное позднее исследование ISIS-4 не подтвердило этого, хотя существовали разногласия относительно недостаточной дозы магния в этом исследовании. Недавно опубликованные результаты большого исследования MAGIC подтвердили отсутствие благоприятного влияния рутинного назначения солей магния у больных с острым ИМ. Однако внутривенное введение солей магния может быть применено у больных с удлинением интервала Q–T и наличием полиморфных желудочковых тахикардий. Соли магния противопоказаны при сердечных блокадах или ухудшении функционирования почек.
Препараты с мембранопротекторными свойствами
Различные патологические процессы, развивающиеся в сердце при ишемии и реперфузии (как в условиях эксперимента, так и у больных с нестабильной стенокарией или острым ИМ), принимают участие в повреждении мембранных структур кардиомиоцитов. Среди них принципиальное значение имеют увеличение образования свободных радикалов, перекисное окисление липидов, кальциевая перегрузка, воспаление, ацидоз, угнетение антиоксидантной системы организма. Эти процессы не являются взаимоисключающими и действуют синергически, дополняя друг друга. Главная цель мероприятий, направленных на защиту мембранных систем кардиомиоцитов, — снизить степень их повреждения, препятствуя переходу обратимых изменений в необратимые. На этой концепции базируется использование мембранопротекторов.
Мембранопротекторы оказывают комплексное воздействие на миокард, способствующее ограничению ишемического и реперфузионного повреждения. Однако по преимущественному влиянию на одно из звеньев патологического процесса препараты можно условно разделить на несколько групп:
- инактивирующие свободные радикалы и процессы перекисного окисления липидов (природные и синтетические антиоксиданты);
- снижающие образование прооксидантных факторов путем воздействия на источники их образования (блокаторы β-адренорецепторов, ингибиторы липоксигеназ);
- оптимизирующие метаболические процессы кардиомиоцитов (убихинон, триметазидин);
- стабилизирующие мембраны кардиомиоцитов (экзогенный фосфокреатин, фосфатидилхолин, прогестерон, глюкокортикоиды);
- повышающие активность и мощность антиоксидантных ферментов (силимарин, селенит натрия, препараты супероксиддисмутазы).
Триметазидин
В последние годы получены данные об эффективности применения триметазидина, который оказывает прямое защитное действие на клетку без влияния на гемодинамику. В терапевтических концентрациях триметазидин ускоряет восстановление энергетических запасов клетки изолированного сердца крысы во время реперфузии, способствует сохранению нормального уровня АТФ. Защитное действие триметазидина на функцию митохондрий доказано в опытах на изолированном перфузируемом сердце крысы, подвергнутом ишемии и реперфузии. Препарат уменьшал вызванное кальциевой перегрузкой угнетение окислительного фосфорилирования АДФ путем влияния гидролитической формы митохондриальной АТФазы, ингибируя движение ионов водорода через мембрану митохондрий.
Механизм действия триметазидина заключается в ингибировании фермента β-окисления жирных кислот — 3-кетоацил-КоА-тиолазы, что облегчает течение аэробного окисления глюкозы и обеспечивает лучшее использование остаточного кислорода ишемизированной клеткой. Триметазидин способствует внутриклеточному поддержанию синтеза АТФ, улучшению обмена фосфолипидов клеточных мембран, уменьшению тканевого ацидоза, предупреждению кальциевой перегрузки и поддержанию сократительной функции миокарда. Это отражено в результатах экспериментальных и клинических исследований при острой ишемии и реперфузии миокарда. В опытах in vitro триметазидин ингибировал агрегацию тромбоцитов, стимулируемую тромбином, коллагеном, арахидоновой кислотой, кальциевым ионофором и АДФ, а в опытах in vivo препятствовал росту внутрикоронарного тромбоцитарного тромба. Установлено, что триметазидин меняет текучесть наружного слоя плазматической мембраны тромбоцитов и эритроцитов человека. Кроме того, выявлено уменьшение инфильтрации нейтрофилами зоны риска при введении триметазидина за 30 мин до лигирования коронарной артерии, что способствует ограничению окончательной зоны некроза. Данный механизм частично объясняет отмечаемое уменьшение размера зоны некроза при экспериментальной региональной ишемии миокарда под влиянием триметазидина. В экспериментальных исследованиях на сердце кролика отмечено значительное уменьшение выхода КФК из кардиомиоцитов и ограничение размеров ИМ, преимущественно за счет воздействия на «зону риска». На изолированном сердце крысы добавление к перфузируемому раствору триметазидина приводило к уменьшению дисфункции ЛЖ и улучшению постишемического восстановления сократительной способности миокарда, позволяло предотвратить вызываемые ишемией нарушения электрофизиологических свойств кардиомиоцитов.
Вышеизложенные результаты экспериментальных исследований подтверждают теоретические обоснования необходимости применения триметазидина в клинической практике. Препарат широко исследовали при назначении у больных с хронической ИБС (рекомендован Европейским обществом кардиологов). При проведении ЧТКА у больных с острым ИМ внутривенное болюсное введение триметазидина с последующим внутривенным капельным введением препарата в течение 48 ч приводило к более быстрому снижению сегмента ST до изолинии и препятствовало его реэлевации, что связывают с более ранней реперфузией миокарда и уменьшением реперфузионных повреждений.
Получены данные о влиянии триметазидина на вегетативную нервную систему. Birand и соавторы установили, что предварительный прием триметазидина способствует уменьшению тонуса симпатического и увеличению тонуса вагусного отдела вегетативной нервной системы при проведении ЧТКА у больных с ИБС. В то же время обнаружено, что применение триметазидина в ранний период острого ИМ приводит к повышению тонуса парасимпатической нервной системы и не влияет на выявление ППЖ (неинвазивный маркер электрической нестабильности миокарда).
При назначении препарата достоверно увеличивается ФВ ЛЖ у больных с СН, развившейся после ИМ. Нами проведены исследования по раннему назначению таблетированной формы триметазидина у больных с острым ИМ. На фоне терапии триметазидином реже возникали угрожающие жизни аритмии, AV-блокады, выявлено уменьшение массы некротизированного миокарда (по данным неинвазивных маркеров —сокращением времени нормализации активности МБ-КФК в сыворотке крови), что способствовало предупреждению развития ранней дилатации полости ЛЖ.
Несмотря на результаты исследования EMIP-FR, опубликованные в 2000 г., где показано преимущество внутривенного введения триметазидина только у больных без вмешательств по реваскуляризации миокарда, теоретические обоснования и проведенные пилотные исследования дают основания для назначения метаболически активного препарата триметазидина не только при лечении больных со стабильной стенокардией, но и при реваскуляризационных вмешательствах и развитии острого ИМ.
Кверцетин
Научно-исследовательские работы последнего времени показали, что в основе патологических процессов в сердце лежит нарушение функционирования мембран клеток. Это такие мембранные механизмы, как активация фосфолипаз и оксигеназ, образование свободных радикалов, активация перекисного окисления липидов. Особую роль играет активация липоксигеназ и образование ее производных (лейкотриенов LTC4–LTE4, LTB4, липоксинов), которые сужают коронарные сосуды, оказывают аритмогенный эффект, проагрегантное действие. Поэтому торможение активности липоксигеназ является важным направлением в лечении больных с острым ИМ.
В последние годы ведут интенсивные исследования ингибиторов липоксигеназ. Многие препараты этой группы, обладая рядом положительных свойств, имеют множество побочных эффектов, применение их в клинической практике невозможно. Наиболее перспективным представителем ингибиторов липоксигеназ является биофлавоноид кверцетин, воздействующий на активность ферментов, принимающих участие в деградации фосфолипидов (фосфолипаза, липоксигеназа, ЦОГ), ферментов, которые принимают участие в свободнорадикальных процессах, ферментов продукции оксида азота, протеинкиназы и др. Кверцетин предотвращает увеличение внутриклеточного Са++ в тромбоцитах и тормозит их аггрегацию, то есть тормозит процессы тромбогенеза. К основным положительным чертам препарата относят его вазодилататорное действие, которое частично опосредовано улучшением биодоступности оксида азота. Большой интерес представляют исследования по изучению антиоксидантной активности флавоноидных веществ, мембранозащитные свойства которых проявляются в способности инактивировать свободные радикалы, ингибировать образование супероксид-радикала и гидроксильных радикалов, увеличивать эффективность ферментативной антиоксидантной защиты, стабилизировать структуру клеточной мембраны.
Результаты экспериментальных и клинических исследований свидетельствуют, что лекарственные формы кверцетина уменьшают реперфузионные нарушения коллатерального кровообращения в сердце, предупреждают феномен невосстановления кровотока (no-reflow) в коронарных сосудах, улучшают гемодинамику, уменьшают объем некротизированного миокарда и оказывают противоаритмическое действие [1].
Ингибирующее влияние кверцетина на процессы перекисного окисления липидов было экспериментально и клинически подтверждено при изучении его защитного действия на миокард при ишемии. Препарат, ограничивая накопление продуктов перекисного окисления липидов, предохраняет от окисления аскорбиновую кислоту и адреналин, продолжительное окисление которых способно активизировать перекисное окисление липидов.
Существенным недостатком кверцетина была нерастворимость в воде, то есть низкая биологическая доступность. С разработкой первой в мире водорастворимой формы кверцетина принципиально расширились возможности применения его в неотложной кардиологии, а именно при остром ИМ.
Кверцетин — агликон флавоноидного гликозида рутина. При остром ИМ кверцетин может быть применен во всех трех формах: в виде таблеток, гранул кверцетина и раствора для внутривенного введения. Первый опыт касался таблеток кверцетина, которые при остром ИМ назначали с первых суток заболевания на фоне базисного лечения, что приводило к уменьшению размера зоны некроза (по данным серийного определения кардиоспецифического изофермента МБ-КФК), количества эпизодов боли в первые сутки заболевания, применения наркотических анальгетиков с целью обезболивания, AV-блокад, желудочковых экстрасистол и эпизодов желудочковых тахиаритмий (фибрилляция желудочков/желудочковая тахикардия (ФЖ/ЖТ)). Особенностью воздействия таблеток кверцетина на уровень гиперферментемии МБ-КФК было отсутствие влияния на значение пика активности фермента и уменьшение количества повторных пиков МБ-КФК, ускорение времени нормализации уровня фермента в крови. Госпитальный период болезни при лечении кверцетином характеризовался меньшим, по сравнению с группой контроля, количеством осложнений — клинических проявлений СН, послеинфарктной стенокардии, желудочковых и наджелудочковых аритмий. Количество больных с желудочковой экстрасистолией в течение всего времени наблюдения среди больных, получающих кверцетин, было существенно меньше. Положительное влияние препарата на электрическую стабильность сердца подтверждено во время проведения программированной стимуляции желудочков (инвазивного ЭФИ). На фоне лечения кверцетином желудочковую тахикардию (как главную детерминанту риска внезапной смерти в постинфарктный период) отмечали на 60% реже, чем у больных контрольной группы.
Это стало основой разработки нового метода лечения острого ИМ с применением растворимой в воде формы кверцетина. Для быстрого влияния на поврежденный миокард во время развития острого ИМ данную форму препарата вводили внутривенно капельно по специальной схеме. Раннее применение внутривенной формы кверцетина в комплексной терапии острого ИМ улучшает клиническое течение заболевания: уменьшает выраженность аритмического синдрома, острой левожелудочковой недостаточности, рецидивирования болевого синдрома, частоты использования наркотических анальгетиков. Антиаритмическое действие корвитина может быть обусловлено как проявлением мембранопротекторного его действия, так и улучшением внутрисердечной гемодинамики, уменьшением миокардиального стресса под влиянием препарата. С другой стороны, позитивное действие растворимой формы флавоноида кверцетина обусловлено его влиянием на биологически активные регуляторные вещества (оксид азота, лейкотриены), уменьшением прооксидантного стресса.
Препарат улучшает электрофизиологические свойства миокарда и предупреждает появление нарушений ЭКГ высокого разрешения — ППЖ, положительно влияет на тонус и регуляторные способности вегетативной нервной системы.
Наиболее эффективно кверцетин влияет на величину зоны некроза и процессы ремоделирования полости ЛЖ у больных с открытой ИОКА на фоне тромболитической терапии, при дисфункции миокарда ЛЖ и у больных с высоким лейкоцитозом.
Введение кверцетина до начала терапии фибринолитическим агентом позволяет преодолеть тромборезистентность и увеличить частоту реканализации ИОКА.
Кверцетин стабилизирует мембраны кардиомиоцитов путем ингибирования перекисного окисления липидов. Количество диеновых конъюгатов снижается уже через 2 ч после начала введения препарата, а максимальный эффект наступает на 5-е сутки заболевания.
В клинических условиях доказана его способность тормозить активность липоксигеназы, что проявляется в стойком снижении количества лейкотриена С4 на протяжении всего периода наблюдения, что уменьшает патологическое воздействие ишемии и реперфузии на миокард.
Анализ динамики изменений NO2– показал, что под действием кверцетина стационарный уровень циркулирующего метаболита оксида азота по сравнению с контрольной группой значительно снижается. Это может свидетельствовать о влиянии препарата на индукцию синтеза NO2– клетками крови или на изменения метаболизма этого короткоживущего биологически активного вещества.
Таким образом, включение кверцетина в схему лечения больных с острым ИМ улучшает клиническое течение заболевания, приводит к уменьшению размера ИМ, повышает электрическую стабильность сердца, имеет противовоспалительное и антиоксидантное действие.
Фосфокреатинин
В настоящее время в клинической практике уже хорошо себя зарекомендовал и достаточно широко используется экзогенный креатинфосфат — синтетический аналог эндогенного макроэрга, играющего важную роль в энергообеспечении функций кардиомиоцитов. Под влиянием фосфокреатинина показано уменьшение повреждающего воздействия ишемии на клеточную мембрану кардиомиоцитов и отсутствие их гипоксической контрактуры при реперфузии. Внутривенная инфузия препарата уменьшала площадь ишемического повреждения сердечной мышцы, значительно сокращая зону относительной ишемии миокарда, и приводила к ограничению размеров некроза у кроликов с экспериментальным ИМ. Выявлена способность фосфокреатинина оказывать защитное действие на ишемизированный миокард при реперфузии за счет увеличения коллатерального кровотока, улучшения состояния микроциркуляторного русла и реологических свойств эритроцитов, увеличения их пластичности. В кровеносном русле фосфокреатинин способствует быстрому связыванию АДФ-индуктора агрегации тромбоцитов и образованию АТФ, что является мощным антиагрегационным фактором. Это предотвращает агрегацию тромбоцитов на поврежденной сосудистой стенке и в очаге ишемического повреждения. Фосфокреатинин предотвращает быстрое образование малонового диальдегида, уменьшает выход КФК, МБ-КФК, ЛДГ. Препарат может оказывать антипероксидантное действие (косвенным путем), не вызывая активации антиоксидантных ферментов и деградации перекиси водорода, но оказывая влияние на субстрат перекисного окисления липидов — мембранные фосфолипиды. Введение фосфокреатинина перед окклюзией коронарной артерии предотвращает накопление лизофосфоглицеридов и ряда других продуктов деградации фосфолипидов в зоне ишемии. В ряде работ доказано, что экзогенный фосфокреатинин обладает антиаритмической активностью, предотвращает развитие фибрилляции желудочков в условиях экспериментальной острой ишемии миокарда.
Исследования фармакокинетики фосфокреатинина показали, что внутривенное введение препарата сопровождается быстрым исчезновением его из крови. При этом первая фаза введения характеризуется временем полувыведения 5–7 мин, а вторая фаза — около 50 мин. Внеклеточный фосфокреатинин не может поддерживать внутриклеточный энергетический метаболизм ввиду низкой скорости проникновения в клетку, но может иметь значение в сохранении некоторых сарколеммальных пулов фосфокреатинина или АТФ. Экзогенный фосфокреатинин способен стабилизировать мембрану после присоединения к ее внешней поверхности без проникновения в клетки.
Введение фосфокреатинина больным с острым ИМ сопровождалось ингибированием процессов перекисного окисления липидов, снижением кортизолемии, что отражает уменьшение органических повреждений клеточных мембран, вызванных гипоксией и стрессом.
В ряде исследований подтверждена возможность использования фосфокреатинина в качестве эффективного лекарственного средства для лечения острого ИМ с целью ограничения зоны некротизированного миокарда, уменьшения частоты развития угрожающих жизни нарушений ритма, СН, разрывов сердца, с возможной тенденцией к уменьшению летальности. Было показано, что применение фосфокреатинина не позднее 6 ч от начала острого ИМ оказывает мощное антиаритмическое действие как на ишемические, так и на реперфузионные нарушения ритма. Основными проявлениями кардиопротекторного действия экзогенного фосфокреатинина при остром ИМ считалось уменьшение объема ишемического повреждения и повышение сократительной способности сердечной мышцы.
Использование больших доз фосфокреатинина (до 80 г/сут) вызывало значительное улучшение клинического течения острого ИМ, осложненного отеком легких и кардиогенным шоком. Данные многоцентровых итальянских исследований по применению фосфокреатинина при остром ИМ показали быструю нормализацию сегмента ST и значительное уменьшение выраженности желудочковых аритмий в группе больных, получавших фосфокреатинин, уже в течение первого часа после появления симптомов острого ИМ. Эти же авторы отметили уменьшение степени выраженности асинергии ЛЖ по данным двухмерной эхокардиографии, наличие статистически значимого уменьшения вымывания МБ-КФК, суммарной глубины зубца Q на ЭКГ после окончания лечения фосфокреатинином.
По результатам проведенных нами исследований, у больных с острым ИМ при назначении фосфокреатинина достоверно раньше наступала нормализация уровня КФК и МБ-КФК, реже регистрировались затяжные и многопиковые формы кривых активности МБ-КФК, что приводило к уменьшению массы некротизированного повреждения миокарда и свидетельствовало о кардиопротекторном действии препарата. Это позволяло ограничивать процессы раннего ремоделирования полости ЛЖ, поддерживать систолическую функцию миокарда. Ограничение зоны некроза под влиянием фосфокреатинина, по-видимому, обеспечивается улучшением микроциркуляции, стабилизацией мембран жизнеспособных кардиомиоцитов и сохранением внутриклеточного пула АТФ.
Приведенные данные указывают как на перспективность использования фосфокреатинина при остром ИМ, так и на необходимость дальнейших исследований по выявлению места фосфокреатинина среди других кардиоактивных фармакологических препаратов. Защита ишемизированного миокарда с помощью фосфокреатинина может повысить эффективность лечения больных с острым ИМ.
Липин
Основу строения мембраны, отграничивающей клетку и клеточные органеллы от окружающей среды и являющейся матриксом для погруженных в нее белковых молекул, составляет липидный бислой. В условиях ишемии и реперфузии его функции нарушаются. В экспериментальных работах изучено разрушающее мембрану действие фосфолипаз, которые преобразуют нормальные липиды мембраны в детергированные. Поэтому вполне обоснованным является использование фосфолипидов, главных компонентов липидного бислоя, для замещения возникающих дефектов, что приводит к восстановлению нарушенной барьерной функции мембран и стабилизации мембранных белков. Одним из препаратов, способных восстанавливать функциональную активность поврежденных мембран путем введения компонентов липидного слоя, является липин, препарат на основе природного фосфатидилхолина, представляющий собой суспензию однослойных фосфатидилхолиновых липосом в физиологическом растворе.
В работах последних лет показано, что лецитиновые липосомы оказывают антиоксидантное, антигипоксическое действие и способствуют поддержанию энергетического метаболизма тканей, находящихся в состоянии гипоксии. В условиях экспериментального острого ИМ на фоне применения липина отмечали стабилизацию мембран кардиомиоцитов, уменьшение структурных повреждений внутриклеточных органелл и контрактурных сокращений миофибрил. Применение препарата способствовало уменьшению зоны некроза и частоты развития нарушений ритма. Эти эффекты могли бы существенно улучшить клиническое течение острого ИМ, однако на сегодня не существует достаточно убедительных доказательств клинической эффективности использования липина у больных с острым ИМ.
Триметилгидразиния пропионат
Определенный теоретический и клинический интерес представляет препарат триметилгидразиния пропионат — средство, влияющее на метаболическое звено трансформации ишемии клетки в ее некроз.
При ишемии гликолиз и гликогенолиз являются наиболее энергетически выгодными путями синтеза АТФ, но утилизация ограниченного количества кислорода, поступающего в зону ишемии, осуществляется главным образом за счет окисления свободных жирных кислот. Это происходит вследствие увеличения их содержания в плазме в результате усиления липолиза (стресс, использование гепарина).
Таким образом, тесная связь функции миокарда и состояния энергетического обмена при ишемии и реперфузии теоретически может обусловить возможность применения триметилгидразиния пропионата, в основе действия которого лежит стимуляция окисления глюкозы путем угнетения окисления свободных жирных кислот в результате уменьшения их транспорта в митохондриях.
По немногочисленным экспериментальным работам триметилгидразиния пропионат способствует уменьшению массы очага некроза, оказывает вазодилатирующее действие на коронарные и периферические артерии, имеет антиишемический эффект, уменьшает электрическую нестабильность миокарда.
При всем теоретическом обосновании целесообразности его использования при СН и у больных с острым ИМ на сегодня не существует убедительных доказательств (исследований) для его применения в клинической практике кардиолога (в отличие от неврологии). При этом, несмотря на желание ряда клиницистов рекомендовать препарат для назначения больным с СН и острым ИМ, мы считаем это преждевременным.
Рекомендации по профилактической терапии в острой фазе ИМ представлены в табл. 1.15.
Таблица 1.15
Средства базисной терапии в острой фазе ИМ
| Рекомендации |
| Ацетилсалициловая кислота 150–25 мг (форма без оболочки) |
| Пероральный бета-блокатор всем пациентам без противопоказаний |
| Пероральный ингибитор АПФ на первый день заболевания всем пациентам без противопоказаний |
| Нитраты при наличии постинфарктной ишемии или левожелудочковой недостаточности |
| Клопидогрел у пациентов, которым проводилась реперфузионная терапия |
ВЕДЕНИЕ БОЛЬНЫХ С ОСОБЕННЫМИ ТИПАМИ ИНФАРКТА
Инфаркт ПЖ
Диагностика инфаркта ПЖ имеет важное значение, поскольку это заболевание может проявляться кардиогенным шоком, но стратегия лечения отличается от таковой при шоке в результате тяжелой дисфункции ЛЖ. ИМ ПЖ можно заподозрить при наличии специфической клинической триады, когда гипотензию, чистые легочные поля и повышение давления в яремных венах отмечают у пациентов с инфарктом нижней локализации. Элевация сегмента ST в отведении V4R позволяет заподозрить инфаркт ПЖ; регистрацию ЭКГ в этом отведении нужно обязательно осуществлять во всех случаях шока, а возможно, рутинно. Появление зубцов Q и элеваций сегмента ST в отведениях V1–3, отрицательных зубцов Т в этих отведениях также позволяет заподозрить диагноз инфаркта ПЖ. При эхоКГ-исследовании типичными для инфаркта ПЖ являются такие признаки: дилатация, гипокинез или акинез ПЖ, дилатация правого предсердия, появление выраженной трикуспидальной регургитации в результате дилатации трикуспидального кольца (рис. 1.36).
Когда инфаркт ПЖ играет роль в возникновении гипотензии или шока, важно поддерживать преднагрузку ПЖ. Если это возможно, желательно избегать применения средств с вазодилатирующим действием, в частности опиоидов, нитратов, диуретиков и ингибиторов АПФ. Во многих случаях эффективной является внутривенная нагрузка жидкостью. Инфаркт ПЖ часто осложняется фибрилляцией предсердий. Это нарушение ритма нужно быстро устранять кардиоверсией, поскольку предсердие вносит существенный вклад в наполнение ПЖ. Подобным образом в случае возникновения блокады сердца следует осуществить двухкамерную кардиостимуляцию, невзирая на повышение риска индуцируемой катетером фибрилляции желудочков. Некоторому сомнению подвергали эффективность фибринолитической терапии при инфаркте ПЖ, но она бесспорно показана у пациентов с гипотензией. Другой возможный путь — прямая ЧТКА, способная быстро улучшить показатели гемодинамики.
ИМ у больных сахарным диабетом
Приблизительно четвертая часть всех пациентов с ИМ болеет сахарным диабетом, в дальнейшем этот показатель может увеличиться. Следует отметить, что пациенты с сахарным диабетом могут обращаться с атипичными симптомами, достаточно частым осложнением у них является СН. У пациентов с ИМ на фоне сахарного диабета смертность вдвое выше, чем у пациентов без диабета (рис. 1.37).
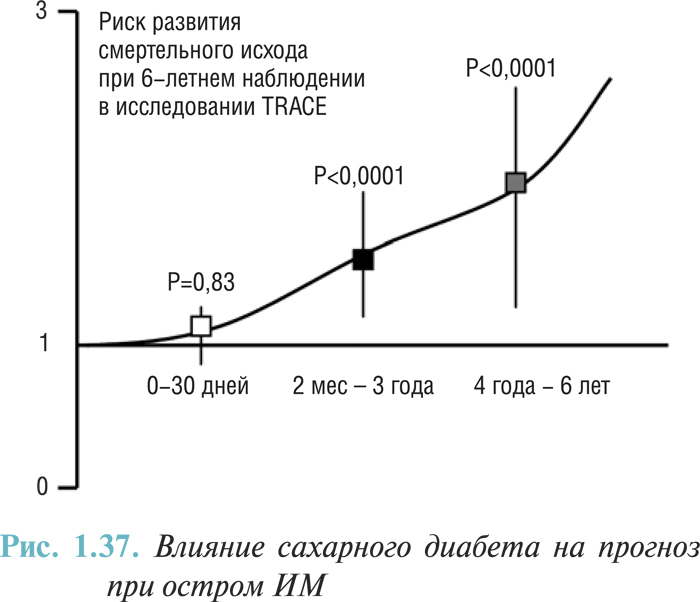
Несмотря на тот факт, что лишь немногие из препаратов, применяемых в острый период ИМ, прямо противопоказаны больным сахарным диабетом, приходится признать, что пациенты с диабетом в реальной практике не получают такого же активного лечения, как другие больные с острым ИМ. Между тем диабет не является противопоказанием для проведения фибринолитической терапии, даже при ретинопатии. Более того, применение блокаторов β-адренорецепторов и ингибиторов АПФ у них может быть даже более эффективным, чем у пациентов без диабета, а риск возникновения осложнений незначителен по сравнению с пользой лечения (рис. 1.38).

Острая фаза заболевания часто характеризуется ухудшением контроля метаболических показателей, а гипергликемия является независимым предиктором смертности. Показано, что строгий контроль уровня гликемии путем внутривенного применения смеси глюкоза-инсулин как у больных с диабетом I, так и II типа с последующей терапией множественными дозами инсулина способен уменьшить летальность при длительном наблюдении.
ВЕДЕНИЕ БОЛЬНЫХ СО СПЕЦИФИЧЕСКИМИ ВНУТРИГОСПИТАЛЬНЫМИ ОСЛОЖНЕНИЯМИ
Тромбоз глубоких вен и эмболия легких
Эти осложнения сейчас диагностируют относительно нечасто, исключая случаи длительного постельного режима из-за возникновения СН. Предотвратить это осложнение можно путем применения профилактических доз низкомолекулярного гепарина. Лечение осуществляют терапевтическими дозами низкомолекулярного гепарина, после чего в течение 3–6 мес продолжают терапию пероральными антикоагулянтами.
Внутрижелудочковый тромб и системная эмболия
При эхоКГ-исследовании в полости желудочков могут выявляться тромбы, особенно у пациентов с обширным инфарктом передней локализации (рис. 1.39). Если тромбы мобильные или выступают в полость желудочков, сначала следует назначить внутривенно нефракционированный гепарин (НМГ) или низкомолекулярный гепарин, позже пероральные антикоагулянты в течение по крайней мере 3–6 мес.
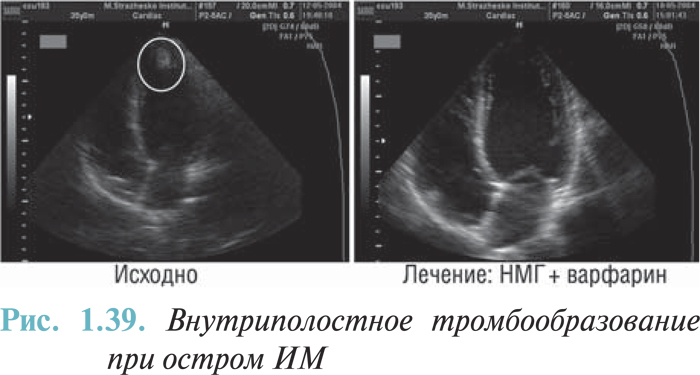
Перикардит
ИМ может осложняться острым перикардитом, что ассоциируется с ухудшением прогноза. Вызывает боль в грудной клетке, которая может быть ошибочно интерпретирована как рецидив инфаркта или ранняя постинфарктная стенокардия. Особенность боли — ее резкий, колющий характер, связь с положением тела и фазами дыхания. Диагноз подтверждают при наличии шума трения перикарда. При выраженном болевом синдроме применяют пероральную или внутривенную форму ацетилсалициловой кислоты в высоких дозах, НПВП или ГКС. Геморрагический выпот в перикард с возникновением тампонады сердца отмечают нечасто; может быть связан с антикоагулянтной терапией. Обычно выявляют методом эхоКГ. При выраженных расстройствах гемодинамики осуществляют перикардиоцентез.
Поздние желудочковые аритмии
Желудочковая тахикардия и фибрилляция желудочков, которые возникают в течение первого дня заболевания, имеют низкую ценность для предвидения возвратных аритмий. При более позднем возникновении аритмии могут возобновляться и ассоциируются с высоким риском смерти. Желудочковая тахикардия или фибрилляция желудочков в течение первой недели после ИМ ассоциируются с более распространенным повреждением миокарда; следует всегда осуществлять тщательную оценку анатомии коронарных артерий и функции желудочков. При высокой вероятности индукции аритмии на фоне ишемии следует рассмотреть возможность реваскуляризации методом ЧТКА или путем хирургического вмешательства. Если это маловероятно, существует возможность применения других терапевтических подходов, в том числе комбинированное назначение блокаторов β-адренорецепторов, амиодарона, ингибиторов АПФ, статинов, или имплантация дефибриллятора (у больных с низкой ФВ).
Постинфарктная стенокардия и ишемия
Стенокардия — возвратная или индуцируемая ишемия в ранней постинфарктной фазе требует последующего обследования.
Рутинная ЧТКА при отсутствии спонтанной или индуцируемой ишемии не улучшает функции ЛЖ и выживания. Впрочем, при лечении стенокардии — возвратной или индуцируемой ишемии, обусловленной реокклюзией или остаточным стенозом, определенное значение имеет реваскуляризация (ЧТКА или хирургическое шунтирование коронарных артерий). Также может быть полезной при лечении аритмий, ассоциируемых со стойкой ишемией (рис. 1.40). Хотя в нескольких исследованиях показано, что проходимость ИОКА является маркером благоприятного длительного прогноза, нет данных о том, что поздняя ЧТКА с единственной целью возобновления проходимости сосуда влияет на поздние события. Этот вопрос изучают сейчас в рандомизированных исследованиях.
Хирургическое шунтирование коронарных артерий может быть показано, если симптомы не корректируются другими средствами или если при коронарной ангиографии выявляют стеноз ствола левой коронарной артерии или трехсосудистое поражение со сниженной функцией ЛЖ, при которых хирургическое лечение улучшает прогноз.
Физическая активность у больных с острым ИМ
Пациенты с повреждением ЛЖ должны оставаться в постели в течение первых 2–3 сут. К этому времени становится ясно, возникнут ли осложнения инфаркта. В неосложненных случаях пациент может начинать садиться на 3-и сутки, ему позволяют самообслуживание и самостоятельный прием пищи. На 5-е сутки больным позволяют стоять, на 7-е — ходить по палате. Расширение физического режима начинают со второй недели, увеличивая ходьбу на 50–75–100 м в день, а с 12-х суток начинают осваивать подъем по ступеням (по 2 ступеньки в день). Если ИМ осложнялся СН, шоком или тяжелыми аритмиями, следует продлевать постельный режим. В этом случае расширение физической активности должно осуществляться медленнее, в зависимости от симптомов и обширности повреждения миокарда.
ОЦЕНКА РИСКА У БОЛЬНЫХ С ОСТРЫМ ИМ
Сроки
Клиническая картина течения острого периода ИМ в значительной степени предопределяет дальнейший прогноз. Одними из наиболее частых причин смерти в постинфарктный период являются желудочковые тахиаритмии и внезапная кардиальная смерть. В 2001 г. Европейское общество кардиологов в сотрудничестве с АНА и АСС выпустило рекомендации по профилактике внезапной смерти. Указанные в этих рекомендациях маркеры риска внезапной смерти (вместе со степенью их доказанности) представлены в табл. 1.16
Таблица 1.16
Маркеры риска развития внезапной смерти после острого ИМ (рекомендации Европейского общества кардиологов, 2006)
| Маркеры риска |
| Анамнестические факторы риска |
| ФВ ЛЖ |
| Снижение вариабельности ритма сердца |
| КДО ЛЖ |
| Желудочковая экстрасистолия |
| Эпизоды желудочковой тахикардии |
| ЧСС в покое (>70 уд./мин) |
| ППЖ |
| Длительность интервала Q–T |
| Результаты ЭФИ |
| Динамика зубца T на ЭКГ |
| Турбулентность сердечного ритма |
| «Открытая» ИОКА |
Кроме того, большое значение в настоящее время уделяют оценке маркеров системного воспаления, поскольку участие воспалительной реакции в патогенезе ОКС в настоящее время не подвергают сомнению. В частности, большое значение придают повышению в крови уровня интерлейкинов (ИЛ)-1β, -6 и -8 и ФНО-α, что ассоциируется с выраженным прогрессированием дисфункции ЛЖ. В экспериментальных работах отмечено прямое негативное инотропное и кардиодепрессивное действие ИЛ-1β, -6 и ФНО-α. Выявлено, что большое влияние на динамику формирования некротического очага и последующей дилатации полости ЛЖ оказывает воспалительная реакция организма, сопутствующая процессу некроза миокарда. Воспалительная реакция при возникновении некроза обусловлена необходимостью замещения погибших кардиомиоцитов соединительной тканью. Вместе с тем воспалительная реакция может усугублять ишемическое и реперфузионное повреждение миокарда и способствовать распространению зоны некроза. Выраженная активация нейтрофилов при остром ИМ оказывает неблагоприятное влияние на функцию миокарда. Удаление нейтрофилов из крови или добавление субстанций, ингибирующих лейкоцитарную инфильтрацию, в исследованиях на животных способствует уменьшению размеров ИМ. В эксперименте доказано прямое повреждающее действие на миокард другого маркера системного воспалительного процесса СРБ. Результаты исследований последних лет показали значение длительного повышения уровня СРБ в острый период ИМ для развития и прогрессирования дилатации полости ЛЖ, дисфункции ЛЖ. По современным данным, СРБ активирует систему комплемента, а конечным продуктом этого является комплекс, атакующий мембрану кардиомиоцитов и вызывающий нарушение ее функции с изменением ионной проницаемости, повышение внутриклеточной концентрации кальция и гибель клеток.
После острого ИМ важно выявить пациентов с высоким риском возникновения отдаленных событий, таких как реинфаркт и смерть. Желательно своевременно осуществить вмешательство для предотвращения этих событий. Поскольку риск возникновения событий уменьшается со временем, желательно осуществлять раннюю оценку риска. Клиническое обследование, оценка размера инфаркта и функции ЛЖ в покое должны осуществляться в течение первых 24–48 ч, но время дальнейшего обследования будет зависеть от особенностей оснащения на месте. Традиционно пробу с максимальной нагрузкой на велоэргометре или тредмиле выполняют в течение 6 нед для выявления индукции ишемии. Более новыми средствами ранней оценки риска является эхоКГ с добутамином. Этот метод позволяет различать ишемию в отдаленных участках, а также в жизнеспособном миокарде, который сохраняется в зоне инфаркта. Стресс-эхокардиография может выполняться на второй неделе заболевания при неосложненном течении инфаркта и использоваться для оценки необходимости в проведении коронарной ангиографии и коррекции медикаментозной терапии. Если первичное коронарное вмешательство (ангиопластика/стентирование) закончилось успешно, ранняя оценка риска имеет меньшее значение. В этом случае можно допустить, что инфарктобусловившее повреждение коронарной артерии удалось устранить и стабилизировать, основная проблема заключается в выявлении индуцируемой ишемии в других бассейнах. Таким пациентам целесообразно осуществить стресс-тестирование в амбулаторных условиях через 6 нед с использованием ЭКГ или методов визуализации сердца. Большое значение в стратификации риска коронарных событий и внезапной смерти придают в последнее время таким неинвазивным методикам, как холтеровское мониторирование ЭКГ, анализ вариабельности сердечного ритма, двумерная эхоКГ в динамике заболевания; исследуют методики анализа нарушений деполяризации и реполяризации.
Клиническая оценка и последующие обследования
На рис. 1.41 показан алгоритм оценки риска после ИМ, а в табл. 1.17 — показания для методов визуализации. Клиническими индикаторами высокого риска в острой фазе является АГ, стойкая СН, злокачественные аритмии, стойкая боль в грудной клетке или ранняя стенокардия при минимальной нагрузке. Пациенты с этими клиническими маркерами преимущественно старшего возраста, чаще имеют несколько факторов риска, перенесенный в прошлом ИМ и являются кандидатами для ранней коронарной ангиографии (см. табл. 1.16).
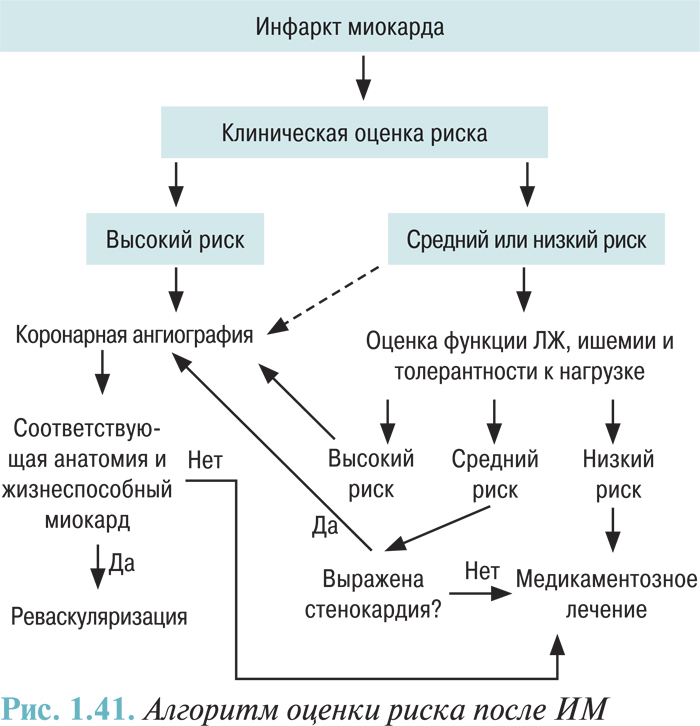
Таблица 1.17
Резюме рекомендаций по визуализации и нагрузочных тестов
| Обследование | При поступлении | В течение 48 ч | Перед выпиской | После выписки1 |
| ЭхоКГ в покое | Если необходимо для установления диагноза | Для оценки функции ЛЖ и наличия тромбов | Для оценки функции ЛЖ, СН или нового шума2 | |
| Стресс-эхоКГ | Для оценки жизнеспособности миокарда и ишемии3 | Если не проведена перед выпиской или после первичной ЧТКА | ||
| Стресс-ЭКГ | Для оценки ишемии миокарда | Если не проведена перед выпиской или после первичной ЧТКА | ||
| Коронарная ангиография | Если необходимо для первичной ЧТКА | Когда есть клинические признаки высокого риска | Когда визуализация позволяет выявить признаки высокого риска, среднего риска с симптомами или когда симптомы не проходят |
1Преимущество предоставляют ранней оценке риска;
2эхокардиография в покое показана при любой стадии СН, шока или появлении нового шума;
3выбор оптимального метода зависит от местных возможностей, но преимущество предоставляют визуализации.
Если во время ангиографии анатомия коронарного русла подходит для вмешательства и есть признаки ишемизированного жизнеспособного миокарда, показана реваскуляризация.
Для пациентов без клинических маркеров высокого риска характерен более низкий уровень риска, но среди них есть те, у которых позже случаются события, поэтому им показана последующая стратификация риска. Хотя этим пациентам часто выполняют коронарную ангиографию, целесообразно начать с неинвазивного обследования. По окончании острой фазы ИМ прогноз тесно связан со степенью дисфункции ЛЖ, обширностью и тяжестью остаточной ишемии. Оба эти параметра можно оценить методами перфузионной сцинтиграфии миокарда или эхоКГ. ФВ и КСО являются выраженными предикторами смертности, а у пациентов с нарушенной функцией ЛЖ перфузионная визуализация особенно полезна, поскольку жизнеспособный, но ишемизированный миокард может стать субстратом для последующих сердечных событий.
Степень риска является высокой у пациентов, у которых ФВ по данным визуализации сердца составляет <35% или у больных с обширной или глубокой индуцируемой ишемией, с поражением свыше 50% остального жизнеспособного миокарда. Этим пациентам нужно выполнять коронарную ангиографию, их ведут так же, как пациентов с высокой степенью риска, оцененной лишь по клиническим критериям.
Степень риска является низкой у пациентов, у которых ФВ по данным визуализации сердца составляет >50% или у пациентов с ограниченной или незначительной индуцируемой ишемией и с поражением менее 20% остального жизнеспособного миокарда, особенно когда ишемия возникает в зоне инфаркта, а не в отдаленной зоне. Этих пациентов можно лечить медикаментозно, кроме случаев, когда вмешательство необходимо для устранения симптомов.
Пациентов, которые по критериям визуализации не относятся к высокому или низкому риску, можно вести в зависимости от клинических симптомов. Например, пациенты со стойкой стенокардией, которая адекватно не контролируется медикаментами, являются кандидатами для проведения коронарной ангиографии и возможного последующего вмешательства. В то же время пациентов с минимальными или контролируемыми симптомами можно начинать лечить медикаментозно.
Всем пациентам нужно осуществить оценку метаболических маркеров риска, включая уровни общего ХС, ХС ЛПНП и ЛПВП, ТГ натощак, а также глюкозы в плазме крови.
Оценка жизнеспособности миокарда, оглушение и гибернация
Оценка жизнеспособности миокарда и поиск ишемии после перенесенного инфаркта являются взаимодополняющими заданиями, поскольку лишь жизнеспособный миокард может быть ишемизированным, а в решении этих заданий используют подобные методы визуализации сердца. Дисфункция ЛЖ после острого ИМ может быть обусловлена некрозом, оглушением жизнеспособного миокарда в зоне инфаркта, гибернацией жизнеспособного миокарда или всеми тремя причинами. Простое оглушение должно проходить в течение 2 нед после острого ишемического повреждения, если исчезает ишемия. При сохранении ишемии затяжное оглушение переходит в гибернацию, когда для возобновления функции нужна реваскуляризация. Эти концепции имеют наибольшее значение у пациентов с тяжелым поражением функции ЛЖ после острого ИМ, когда рассматривают потребность в реваскуляризации для улучшения функции. Их значение уменьшается для пациентов, у которых симптомы дисфункции ЛЖ не доминируют.
Существуют несколько методов оценки жизнеспособности миокарда. Для начального обследования самым распространенным является стресс-эхокардиография с добутамином.
Результаты проведения стресс-эхоКГ после ИМ в настоящее время достаточно точно показали влияние на отдаленный прогноз выявления «оглушенного» и «гибернированного» миокарда. Также при наличии жизнеспособного и отсутствии ишемизированного миокарда после острого ИМ, при пробе с добутамином и атропином, отмечали практически 100% выживаемость больных в течение 12 мес. Тогда как при отсутствии жизнеспособного миокарда любого типа выживаемость снижается до 94%, а при наличии только ишемизированного миокарда — до 90%. У больных с дисфункцией ЛЖ после перенесенного острого ИМ и выявленной при стресс-эхоКГ с добутамином ишемии миокарда как при двухфазной реакции, так и при элевации сегмента ST во время пробы есть возможность восстановления функции и геометрии ЛЖ путем реваскуляризации миокарда.
Оценка риска аритмии
У пациентов с вероятно высоким риском нарушений ритма целесообразно проведение холтеровского мониторирования ЭКГ и неинвазивных ЭФИ. Прогностическое значение у пациентов в постинфарктный период имеют показатели вариабельности сердечного ритма, чувствительности барорефлекса и поздние потенциалы. Впрочем, необходим дополнительный клинический опыт для того, чтобы установить, насколько эти исследования добавляют диагностической информации по сравнению с обычными прогностическими тестами. Предыдущие результаты исследования MADIT II (2002) свидетельствуют об улучшении прогноза выживания при имплантации дефибриллятора у пациентов после перенесенного ранее ИМ с ФВ менее 30%, независимо от результатов ЭФИ.
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИЕ МЕРОПРИЯТИЯ В ПОСТИНФАРКТНЫЙ ПЕРИОД
Цель лечебно-профилактических мероприятий в постинфарктный период — возобновить максимально полноценную жизнь пациента, включая возвращение к труду. Во время проведения реабилитации следует принимать во внимание физические, психологические и социально-экономические факторы. Реабилитация показана пациентам с тяжелой дисфункцией ЛЖ. Процесс нужно начинать как можно раньше после поступления в госпиталь и продолжать в течение последующих недель и месяцев. Детальное рассмотрение принципов и методов реабилитации приведено в специальных докладах соответствующей рабочей группы Европейского общества кардиологов. Медикаментозное ведение постинфарктного периода, или вторичная медикаментозная профилактика ИМ, детально рассмотрено выше.
Психологические и социально-экономические аспекты
У пациентов с острым ИМ почти всегда возникает чувство тревоги. Поэтому больного необходимо успокоить и объяснить суть заболевания. Важно также предотвратить появление депрессии и раздражительности, которые чаще отмечают по возвращении домой. Следует признать распространенность феномена возражения; в острой фазе заболевания это имеет защитный эффект, но в дальнейшем может затруднять восприятие диагноза (рис 1.42 и 1.43).

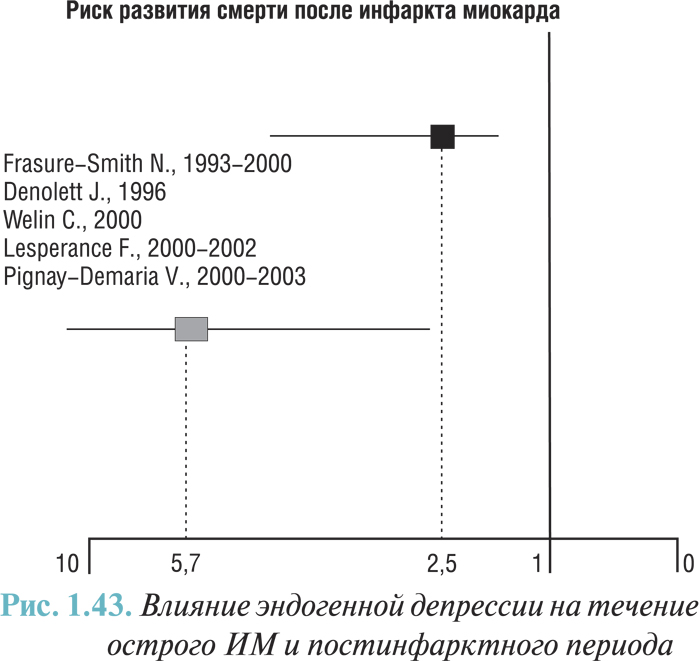
Наличие у больного типа личности «D» может повлиять на клиническое течение у пациентов с нарушенной функцией ЛЖ после ИМ, а уменьшение эмоциональной нагрузки во время осуществления реабилитационной программы — улучшить прогноз. Перед выпиской из госпиталя следует обсудить вопрос возвращения к работе и возобновлению других видов активности. В некоторых случаях развития депрессивного состояния целесообразно назначение лечения антидепрессантами без проаритмогенного эффекта.
Советы относительно образа жизни
Во время госпитализации следует обсудить с пациентами и их партнерами возможные причины ИБС, дать индивидуальные советы относительно образа жизни (режима и характера питания, контроля массы тела, курения и физических нагрузок).
Физическая активность
Всем пациентам следует дать советы относительно физической активности, в зависимости от течения восстановительного периода после сердечного приступа, принимая во внимание возраст, уровень активности перед инфарктом и физические ограничения. Важным элементом принятия решений является нагрузочная проба перед выпиской, которая не только предоставляет полезную клиническую информацию, но и позволяет успокоить слишком тревожного пациента. Метаанализ реабилитационных программ, выполненных в период до внедрения методов реперфузии, которые предусматривали включение нагрузок, позволяет допустить существенное уменьшение летальности. Следует признать, что кроме влияния на летальность, нагрузочная реабилитация может иметь другие благоприятные эффекты, в частности, способствовать развитию коллатералей. Имеются сведения об улучшении толерантности к нагрузке, общего состояния сердечно-сосудистой системы, по крайней мере во время активного периода тренировок, даже у пациентов пожилого возраста. В частности, в исследовании ETICA регулярная физическая тренировка умеренной интенсивности у пациентов с ИБС после проведения коронарной ангиопластики привела к повышению объема переносимой нагрузки и уменьшению частоты кардиальных событий в дальнейшем без существенного влияния на динамику проходимости прооперированного сосуда. Вполне логично, что позитивный эффект от физической тренировки обусловлен постепенным приспособлением метаболизма миокарда к ишемическим условиям, а не прекращением прогрессирования атеросклероза. Рекомендованная частота нагрузок для достижения значимого повышения функционального состояния составляет 3–5 раз в неделю. Каждое повышение физической работоспособности на одну ступеньку ассоциируют с уменьшением риска смерти от всех причин на 8–14%. Следовательно, после оценки риска всем пациентам, перенесшим ИМ с тяжелой дисфункцией ЛЖ, следует посоветовать принять участие в реабилитационной программе.
ЛИТЕРАТУРА
- ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society (2006) Eur. Heart J., 27(17): 2099-2140.
- Antman E.M., Hand M., Armstrong P.W. et al. (2007) Focused update of the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Group to Review New Evidence and Update the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction). Circulation. 2008; 117: 296 -329.
- Bjorn Dahlof, Peter S. Sever, Neil R. et al. (2005) Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet; 366: 895-906.
- Boden W. van Gilst W.H., Scheldewaert R. et al. (2000) Diltiazem in acute myocardial infarction treated with thrombolytic agents: a randomised placebo-controlled trial. Lancet, 355: 1751-1756.
- Cohen M., Antman E.M., Gurfinkel E. et al. (2000) Impact of enoxaparin low molecular weight heparin in patients with Q-wave myocardial infarction. Am. J. Cardiol, 86: 553-56, A9.
- Eric J. Topol. Acute Coronary Syndromes. Marcel Dekker Inc 2005.
- Goldbourt U., Behar S., Reicher-Reiss H. et al. (1993) Early administration of nifedipine in suspected acute myocardial infarction. The Secondary Prevention Reinfarction Israel Nifedipine Trial 2 study. Arch Intern Med,153: 345-353.
- Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels (1998) N.Engl.J.Med., 339:1349-1357.
- Mezilis N.E., Partenakis F.I., Kanakaraki M.K. et al. (2000) Dobutamine vs exercise-induced ST segment elevation early after Q wave myocardial infarction. Prediction of functional recovery after revascularization. Eur. Heart J, 21: 814-822
- Nieminen M.S., Moiseyev V.S., Andrejevs N. et al. (1999) Randomized study on safety and effectiveness of levosimendan in patients with left ventricular failure after an acute myocardial infarction (RUSSLAN Trial). Circulation, 100 (18 Suppl. I): I-646.
- Pfeffer M.A., McMurray J.J.V., Velazques E.J. et al. (2003) Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N.Engl.J.Med., 349: 1893-1906.
- Rubins H.B., Robins S.J., Collins D. et al. (1999) Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N.Engl.J.Med., 341: 410-418.
- Sabatine M.S, Cannon C.P, Gibson C.M. et al. (2005) Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N.Engl.J.Med., 352: 1179-1189.
- Sica D.A. (2004) EUROPA: has anything new been learned with angiotensin converting enzyme inhibitors? J. Clin. Hypertens. (Greenwich), 6(2): 91-95.
- Silber S., Albertsson P., Aviles F.F. et al. (2005) Guidelines for percutaneous coronary interventions: the task force for percutaneous coronary interventions of the European Society of Cardiology. Eur Heart J, 26: 804-847.
- Stenestrand U., Wallentin L. (2002) Early revascularization and 1-year survival in 14-day survivors of acute myocardial infarction: a prospective cohort study. Lancet: 359: 1805-1811.
- Streppel M.T., Arends L.R., van’t Veer P. et al. (2005) Dietary fiber and blood pressure: a meta-analysis of randomized placebo-controlled trials. Arch Intern Med, 165: 150-156.
- Task Force on Acute Heart Failure of the European Society of Cardiology. Guidelines on the diagnosis and treatment of acute heart failure. Sophia Antipolis (FR): European Society of Cardiology, 2005, 36 p.
- The Assessment of the Safety and Efficacy of a New Thrombolytic Agent-3 (ASSENT-3) investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab or unfractionated heparin: the ASSENT — 3 randomised trial in acute myocardial infarction (2001) Lancet, 358: 605-613.
- The Heart Outcomes Prevention Evaluation Study Investigators: Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients (2000) N. Engl. J. Med., 342: 145-153.
- The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology: Frans Van de Werf, Chair, Diego Ardissino, Amadeo Betriu, Dennis V. Cokkinos, Erling Falk, Keith A.A. Fox, Desmond Julian, Maria Lengyel, Franz-Josef Neumann, Witold Ruzyllo, Christian Thygesen, S. Richard Underwood, Alec Vahanian, Freek W.A. Verheugt, William Wijns. Management of acute myocardial infarction in patients presenting with ST-segment elevation(2003) Eur.Heart J., 24: 28-66.
- van Es R.F., Jonker J.J.C., Verheugt F.W.A. et al. (2002) Aspirin and coumadin after acute coronary syndromes (the ASPECT-2 study): a randomised controlled trial. Lancet, 360: 109-113.
- Widimsky P., Budesinsky T., Vorac D. et al. (2003) Long distance transport for primary angioplasty vs immediate thrombolysis in acute myocardial infarction. Final results of the randomized national multicenter trial PRAGUE-2. Eur Heart J, 24: 94-104.
- Yusuf S., Mehta S.R. et al. (2006) Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA, 295(13): 1579-1580.
- Zjlstra F., Hoorntje J.C.A, DeBoer M.-J. et al. (1999) Long-term benefit of primary angioplasty as compared with thrombolytic therapy for acute myocardial infarction. N. Engl. J. Med.,341: 1413-1419