Инфекционный эндокардит — воспалительное заболевание эндокарда инфекционной этиологии, обусловленное инвазией возбудителя с его локализацией на клапанных структурах, эндокарде, эндотелии в зоне прилегающих к сердцу магистральных сосудов, сопровождающееся, как правило, бактериемией и поражением различных органов и систем организма.
Эпидемиология
В течение последних 10–15 лет отмечают повышение заболеваемости инфекционным эндокардитом, что может быть обусловлено несколькими факторами:
- распространением операций, выполняемых на сердце, — появлением инфекционного эндокардита протезированного клапана;
- повышенной предрасположенностью к заболеванию при наличии:
- врожденных пороков сердца (10–20%), в том числе двустворчатого аортального клапана (12–30%);
- пролапса митрального клапана (22–29%);
- приобретенных пороков сердца (37–76%);
- обструктивной ГКМП;
- операции на сердце без замены клапанов;
- постинъекционными абсцессами после введения различных лекарственных средств;
- появлением новой формы — нозокомиального инфекционного эндокардита, связанного с широким использованием инвазивной инструментальной техники (катетеров, искусственных водителей ритма сердца, шунтов), вводимой в сердце и сосуды;
- появлением инфекционного эндокардита наркоманов.
Инфекционный эндокардит может возникать в любом возрасте. До эпохи антибиотиков им наиболее часто заболевали лица среднего возраста, в последние десятилетия пик заболеваемости сместился к 50-летнему возрасту, в 5 раз увеличилось количество заболевших в возрасте старше 60 лет. Мужчины болеют в 2 раза чаще, чем женщины. У большинства пациентов инфекция поражает аортальный (28–45%), митральный (5–36%) или оба клапана (до 35%). Эндокардит правых отделов сердца выявляют реже (поражения трехстворчатого клапана — <6%, клапана ЛА — <1%). У мужчин преобладает поражение аортального клапана, у женщин — митрального.
Этиология
Инфекционный эндокардит — полиэтиологическое заболевание, потенциальными возбудителями которого могут быть до 128 разновидностей микроорганизмов. Основными среди них являются стафилококки (30–50%) и стрептококки (20–30%).
Повышение этиологической роли стафилококка (чаще золотистого) за последние 10–15 лет объясняется широким внедрением в клиническую практику антибиотиков, а также распространением оперативных вмешательств на сердце, имплантации эндокардиального электрода искусственного водителя ритма сердца, инвазивных инструментальных исследований.
Из всех штаммов стрептококка наиболее часто высевают зеленящий стрептококк, удается выделить и другие штаммы стрептококка, прежде всего энтерококк, вызывающий инфекционный эндокардит в 10–15% случаев.
Пневмококковый эндокардит особенно часто диагностируют у больных после кардиохирургического вмешательства с имплантацией искусственных материалов, а также у пациентов, перенесших в послеоперационный период пневмонию.
Наблюдения последних лет свидетельствуют об увеличении в этиологии инфекционного эндокардита удельного веса грамотрицательной микрофлоры: эшерихий, протея, сальмонелл, синегнойной палочки, клебсиелл, которые являются причиной заболевания в 3–8% случаев. У инъекционных наркоманов грамотрицательные бактерии вызывают заболевание в 5–64% случаев.
Возросла частота эндокардита, вызванного грибами (1,5–6%); среди возбудителей этой группы преобладают дрожжеподобные грибы. Эндокардит грибковой этиологии в 5–14% случаев возникает у инъекционных наркоманов.
В последнее время в появлении инфекционного эндокардита также повысилась этиологическая роль анаэробной флоры. Предполагают, что повреждающая роль анаэробных бактерий реализуется только в ассоциации с аэробными микроорганизмами.
У больных с искусственным клапаном сердца в 50% случаев раннего эндокардита высевается золотистый и эпидермальный стафилококк, в 21% — грамотрицательная микрофлора, в 10% — грибы. Возбудителями позднего эндокардита протезированного клапана являются эпидермальный стафилококк и стрептококк (50%), золотистый стафилококк (16%), энтерококк (11%), грамотрицательная микрофлора (12%).
В настоящее время соотношение между первичным и вторичным эндокардитом, связанным с пороками клапана ревматической или иной этиологии, существенно изменилось в пользу первого, частота которого составляет более 30%.
Патогенез
Вопросы патогенеза инфекционного эндокардита сложны и окончательно не выяснены. Инфекционный эндокардит возникает в результате взаимодействия трех составляющих: состояния организма (предрасполагающих факторов), бактериемии с учетом тропности и степени вирулентности бактерий. В большинстве случаев в анамнезе имеются указания на порок сердца, атеросклероз, операции на сердце, которые предрасполагают к избирательной адгезии микроорганизмов на эндокарде. Возникновение эндокардита, по-видимому, следует рассматривать как результат микроструктурных изменений в эндокарде под влиянием функциональных гемодинамических перегрузок. Эти причины в той или иной степени объясняют появление наиболее уязвимого места в эндокарде как местного фактора, обусловливающего данную локализацию инвазии возбудителя.
Возможность развития инфекционного эндокардита зависит от выраженности, частоты и видовой специфичности бактериемии. Под влиянием этиологических факторов на фоне измененной реактивности всего организма и клапанного аппарата сердца возникает интерстициальный вальвулит, небактериальный эндокардит, затем происходит присоединение инфекции, развивается инфекционное поражение клапанов с бактериемией и тромбоэмболическими осложнениями.
Факторы, облегчающие адгезию микроорганизмов на эндотелиальной поверхности и способствующие развитию инфекционного эндокардита, подразделяются на местные и общие. К общим могут быть отнесены выраженные изменения иммунного статуса организма, отмечаемые у наркоманов, больных алкоголизмом, лиц пожилого возраста, пациентов с определенными нарушениями в HLA-системе гистосовместимости, а также у пациентов, получающих иммуносупрессивную терапию.
В патогенезе инфекционного эндокардита выделяют три фазы: инфекционно-токсическую, иммуновоспалительную (иммунной генерализации процесса) и дистрофическую (с дистрофическими изменениями внутренних органов). От соотношения инфекционно-токсических и иммуновоспалительных проявлений отчасти зависит многообразие клинической картины болезни.
Патологическая анатомия
При эндокардите сердце увеличено, обычно преобладает гипертрофия левых отделов в связи с недостаточностью клапана аорты. В миокарде, помимо признаков воспаления, выявляют такие выраженные дистрофические и некробиотические поражения, как базофильная и паренхиматозная дистрофия, а также микромаляции и микроучастки глыбчатого распада мышечных волокон.
Для всех вариантов инфекционного эндокардита характерны вегетации, которые наиболее часто располагаются на створках клапанов и реже — на эндокарде желудочков или левого предсердия, а также на легочной или других артериях. Вегетации обычно выявляются через 2 нед от начала инфекционного эндокардита при острой (стафилококковой) форме и через 6–8 нед при подострой. Свежие вегетации состоят из тонких нитей фибрина, среди которых выявляют эритроциты и в меньшем количестве — смешанно-клеточные лейкоциты, тромбоциты и почти всегда колонии бактерий. Свежие вегетации имеют розовый, красный, желтый или зеленый цвет, но постепенно приобретают серую окраску. При подостром процессе наряду со свежими имеются вегетации, покрытые фиброзной капсулой, частично или полностью обызвествленные, нередко на ножке, часто организованные вегетации полностью кальцинированы. В неактивной стадии инфекционного эндокардита вегетации представлены фиброзными бугорками или полностью кальцинированы.
При первичном эндокардите створки клапанов чаще тонкие, свободный край клапана часто утолщен, что вызвано гемодинамическими нарушениями или воспалительной инфильтрацией, вегетации располагаются по свободному краю клапанов, внутренней оболочке восходящей части аорты. При вторичном эндокардите, когда инфекционный процесс поражает уже измененный клапан, свежие вегетации располагаются на фиброзно-измененных или кальцинированных створках, возможен отрыв хорд.
Классификация
В Украине используют классификацию инфекционного эндокардита, принятую на VI Конгрессе кардиологов Украины (Киев, 2000):
I. Активность процесса: активный, неактивный
II. Эндокардит нативных клапанов:
1) первичный
2) вторичный (приобретенный порок сердца, врожденный порок сердца, травма, инородные тела)
III. Эндокардит протезированного клапана
Локализация:
- аортальный клапан
- митральный клапан
- трехстворчатый клапан
- клапан ЛА
- эндокард предсердий или желудочков
IV. Возбудитель (грамположительные, грамотрицательные микроорганизмы, L-формы бактерий, риккетсии, грибы)
V. Осложнения
VI. СН (0–III стадия, I–IV ФК)
По течению различают острый, подострый или затяжной, хронический рецидивирующий и латентный инфекционный эндокардит. К острому относят случаи заболевания длительностью до 2 мес, более 2 мес — к подострому.
Клиническая картина
При инфекционном эндокардите она отличается значительным многообразием симптомов, что определяет и трудности диагностики. Болезнь может манифестировать внезапно или длительно протекать латентно, иметь быстрое или затяжное течение. Клиническая картина заболевания, его течение и исход в каждом конкретном случае зависят как от состояния защитных сил организма, его неспецифической резистентности и реактивности, так и от вида инфекционного возбудителя. Важное значение имеет постоянная бактериемия, местная реакция вокруг клапана, эмболизация сосудов различных органов, циркуляция иммунных комплексов с накоплением их в тканях.
Клинические проявления обычно развиваются в течение 2 нед с момента инфицирования. Одним из основных симптомов является лихорадка, которая может сопровождаться ознобом, потливостью. Температурная реакция варьирует от высокой упорной лихорадки на протяжении нескольких месяцев до незначительного повышения температуры тела в течение нескольких дней с последующей стойкой ее нормализацией.
Наблюдения за состоянием больных позволили выявить основные типы температурных кривых: а) транзиторный тип характеризуется недлительным субфебрилитетом, отмечается у 40% больных в начальной стадии эндокардита; б) интермиттирующая 1–2-недельная или 1–2-дневная высокая лихорадка чередуется с 1–2-недельными периодами нормальной или субфебрильной температуры тела; в) стойкое умеренное повышение температуры тела сохраняется длительно на фоне лечения и после ликвидации очагов хронической инфекции; г) при гектической температуре суточный градиент достигает 2–3 °C, отмечают озноб и повышенную потливость; д) при гипотермическом типе температура тела ниже нормы, что характерно у резко ослабленных больных с клинически выраженной недостаточностью кровообращения. Потоотделение не облегчает состояния пациента, бывает профузным, иногда испариной покрываются только отдельные участки тела (голова, лоб, верхняя половина туловища).
Клинические симптомы обусловлены появлением вегетаций, части которых могут отрываться и эмболизировать сосуды сердца, мозга, почек, селезенки, печени, конечностей и легких (при правостороннем эндокардите).
При развернутой клинической картине отмечают следующие симптомы:
- выраженная интоксикация: слабость, анорексия, головная боль, миалгия, артралгия, похудение;
- изменения кожных покровов: бледно-желтоватый цвет кожи, петехии (мелкоточечные геморрагии) на коже и слизистых оболочках, конъюнктиве нижнего века (симптом Лукина — Либмана), пятна Джейнуэя — краснофиолетовые до 5 мм в диаметре пятна на ладонях, ступнях, туловище, узелки Ослера — болезненные, величиной с горошину, узелки красноватого цвета на ладонных поверхностях пальцев рук и подошвенных поверхностях пальцев ног;
- изменения концевых фаланг («барабанные палочки») и ногтей («часовые стекла»);
- моно- или олигоартрит крупных суставов верхних и нижних конечностей;
- поражение аортального/митрального клапана, поражение миокарда;
- тромбоэмболии селезеночной, почечных, легочной, коронарных, мозговых артерий с развитием инфарктов соответствующих органов, сосудов сетчатки глаза;
- признаки сухого или экссудативного перикардита;
- поражение сосудов: микотические аневризмы артерий, генерализованный васкулит;
- гепатомегалия, спленомегалия, увеличение лимфатических узлов;
- поражение почек (диффузный гломерулонефрит, очаговый нефрит, инфаркт почки);
- поражение ЦНС: менингоэнцефалит, субарахноидальное кровоизлияние, тромбоэмболия сосудов мозга, психоз;
- прогрессирующая СН.
Изменения показателей лабораторных исследований при инфекционном эндокардите не являются специфичными, в периферической крови часто выявляют признаки гипо- и нормохромной анемии. В большинстве случаев отмечается лейкопения, но при осложнениях возможен лейкоцитоз со сдвигом лейкоцитарной формулы влево, моноцитоз, тромбоцитопения. Типичным является повышение СОЭ, однако следует учитывать, что вследствие диспротеинемии этот симптом не может своевременно отражать положительную динамику при лечении заболевания.
Для оценки тяжести инфекционного эндокардита предложено выделять три степени активности процесса. Основные критерии активности процесса, дополненные данными исследования гуморального иммунитета, представлены в табл. 7.1 (Демин А.А., 2006).
Таблица 7.1
Клинические и лабораторные критерии активности инфекционного эндокардита
| Критерий | Степень активности | ||
| I (минимальная) | II (умеренная) | III (высокая) | |
| Лихорадка, °С | Субфебрильная или отсутствует | 37–38 | 39–40 |
| Озноб | — | ± | + |
| Потливость | — | ± | + |
| Общее состояние | Относительно удовлетворительное | Средней тяжести | Тяжелое |
| Увеличение селезенки | ± | + | + |
| Гломерулонефрит | Очаговый | Очаговый | Диффузный |
| Формирование порока сердца | Медленное | Медленное | Быстрое |
| Динамика сердечных шумов | Медленная | Медленная | Быстрая |
| Динамика тонов сердца | Медленная | Медленная | Быстрая |
| Миокардит | Очаговый | Очаговый | Диффузный |
| СН | ± | ± | ± |
| Геморрагия | — | ± | + |
| Тромбоэмболия | — | ± | + |
| Артралгия, артрит | — | ± | ± |
| Гемокультура | ± | + | + |
| СОЭ, мм/ч | 20 | 20–40 | >40 |
| Анемия | ± | + | + |
| Лейкопения | ± | + | Иногда лейкоцитоз |
| Тромбоцитопения | ± | + | + |
| Формоловая проба | — | ± | + |
| СРБ | — | ± | + |
| Фибриноген, г/л | 4–5 | 5–6 | 6–10 |
| Гемоглобин, г/л | 120–150 | 120–110 | 110–90 |
| γ-глобулинемия, % | 10–15 | 20–25 | 25–45 |
— отсутствие симптома; ± необязательное наличие или меньшая выраженность симптома; + частое наличие или значительная выраженность симптома
Диагностика
В типичных случаях диагностика инфекционного эндокардита несложна и основывается на следующих признаках: лихорадка с ознобом, наличие клапанных дефектов с появлением шумов сердца при первичном эндокардите или выраженном изменении их характера при вторичном, тромбоэмболические осложнения и положительные результаты бактериологического исследования. Значительные трудности представляет диагностика заболевания при стертом или атипичном течении.
На ЭКГ отмечают признаки гипертрофии ЛЖ (при поражении аортального или митрального клапана) или ПЖ (при поражении трехстворчатого клапана или клапана ЛА), возможны нарушения AV-проводимости, предсердная и желудочковая экстрасистолия. В 25% случаев выявляют фибрилляция или трепетание предсердий.
ЭхоКГ позволяет верифицировать диагноз, ее рекомендуется проводить всем больным с подозрением на инфекционный эндокардит. ЭхоКГ позволяет в значительной степени объективно оценить состояние клапанного аппарата сердца, своевременно выявить вегетации клапанов, кальциноз, разрыв хорд или створки клапана, абсцесс клапанного кольца и миокардиальный абсцесс, уточнить характер порока сердца, а также определять необходимость срочного оперативного лечения больных с остро развившейся недостаточностью аортального/митрального клапана и выраженной перегрузкой объемом ЛЖ.
При одномерном исследовании признаками вегетаций являются неравномерное утолщение одной из створок клапана, густо расположенные «лохматые» мелковолновые ее осцилляции, подвижность створки при этом не ограничивается. Метод позволяет визуализировать вегетации размером 2–3 мм.
При двухмерной эхоКГ вегетации определяются в виде дополнительных эхотеней, тесно связанных со створками и выходящих за обычные границы их локации (рис. 7.1). Частота выявления вегетаций при эхоКГ-исследовании зависит от их величины, структуры, локализации, предшествующего клапанного порока, продолжительности заболевания. Выделяют три типа вегетаций: «сидячие», «на ножке», «нитчатые» (рис. 7.2).
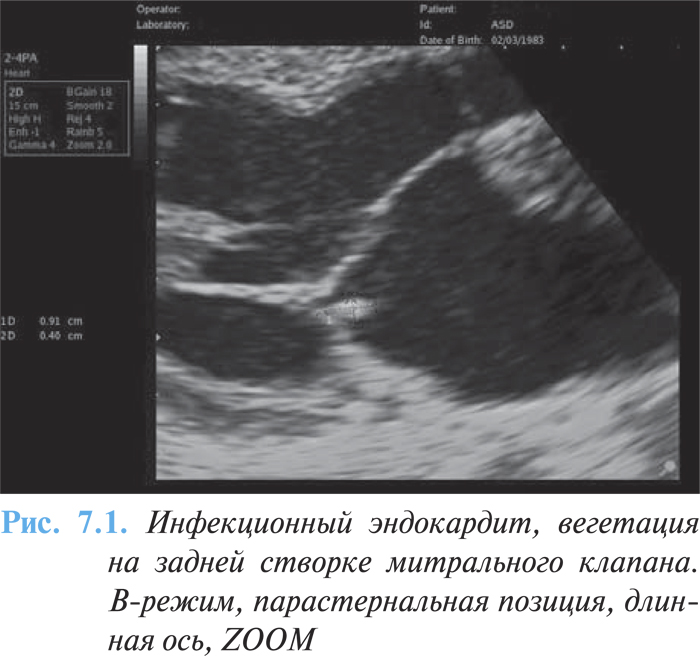
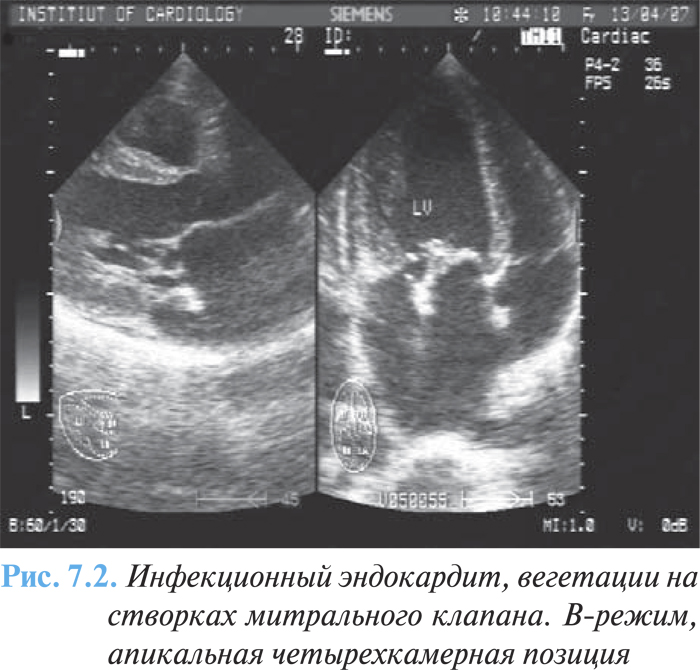
С помощью допплеровской эхоКГ определяют регургитацию на аортальном и митральном клапанах в соответствующую фазу сердечного цикла.
Тяжесть течения инфекционного эндокардита на основании данных эхоКГ-исследования оценивается степенью разрушения створок, их деформацией, образованием абсцессов створок, основания аорты, разрывом хорд митрального клапана, отрывом створки аортального клапана, результатом чего является нарастание недостаточности клапанов с перегрузкой соответствующих камер сердца. Сохранение или исчезновение вегетаций на фоне лечения (по данным эхоКГ) не является надежным критерием эффективности или неэффективности антибиотикотерапии.
Чреспищеводная эхоКГ имеет значительно более высокую чувствительность в отношении выявления внутрисердечных вегетаций (95–100% по сравнению с 60–65% при проведении трансторакальной эхоКГ).
Разработаны критерии, позволяющие более уверенно заподозрить диагноз инфекционного эндокардита и являющиеся показанием для неотложного эхоКГ-скрининга и возможной госпитализации (Horskotte D. et al., 2004):
- новое повреждение клапана (шум регургитации);
- эмболия неизвестной этиологии (инсульт, инфаркт почки);
- сепсис неизвестной этиологии;
- гематурия, гломерулонефрит и подозрение на инфаркт почки;
- лихорадка в сочетании с другими факторами риска инфекционного эндокардита.
Катетеризация сердца позволяет выявить пороки клапанов, врожденные дефекты, поражение коронарных артерий, оценить степень выраженности гемодинамических нарушений у больных с инфекционным эндокардитом. В ряде случаев проводить это исследование опасно, учитывая риск отрыва вегетаций от клапана с последующей эмболией сосудов большого круга кровообращения.
Посевы крови на стерильность — один из основных методов верификации диагноза инфекционного эндокардита. Успешное выделение микроорганизмов из крови зависит от соблюдения ряда условий. В 50–55% случаев в острый период и в 80–85% случаев в подострый период посевы крови оказываются стерильными. Причинами, затрудняющими идентификацию возбудителя заболевания, являются предшествующая забору крови антибактериальная терапия, несовершенное бактериологическое оборудование для проведения посева, наличие в крови бактерий, требующих применения специальных сред (анаэробы, сателлиты и штаммы стрептококка с измененными свойствами (тиол- или витамин В6-зависимые), L-формы бактерий, бруцеллы). Для выделения вирусов, риккетсий, хламидий, грибов требуются специальные методы. Если посевы крови взяты у пациента, не получавшего лечение в предшествующие 2 нед, то возбудителя устанавливают в 96% случаев. Большие перспективы в идентификации возбудителя инфекционного эндокардита открывает бактериологическое исследование артериальной крови, частота выявления положительной гемокультуры при этом возрастает.
Согласно модифицированным диагностическим критериям инфекционного эндокардита диагноз может быть достоверным, вероятным и исключающим при наличии альтернативного (Bayer A.S., 1996).
Диагноз «достоверный инфекционный эндокардит» устанавливают, если представлены 2 основных критерия или 1 основной и 3 дополнительных или 5 дополнительных критериев.
Диагноз «возможный инфекционный эндокардит» устанавливают, если представлены 1 основной и 1 дополнительный или 3 дополнительных критерия.
Диагноз «инфекционный эндокардит» исключается:
- при наличии альтернативного диагноза, объясняющего имеющиеся признаки;
- при исчезновении проявлений, напоминающих эндокардит, после 4 дней антибактериальной терапии;
- при отсутствии морфологических признаков инфекционного эндокардита во время операции или при аутопсии.
Основные диагностические критерии инфекционного эндокардита:
1. Положительная гемокультура, характерная для инфекционного эндокардита:
— типичный микроорганизм, выделенный из двух флаконов: Streptococcus viridans, Streptococcus bovis, бактерии группы НАСЕК; внебольничный штамм Staphylococcus aureus или энтерококки при отсутствии первичного очага; однократная положительная культура крови Coxiella burneti или IgG более 1:800;
— повторные положительные гемокультуры, характерные для инфекционного эндокардита:
- в образцах крови, взятых с интервалом >12 ч;
- во всех 3, в 3 из 4 или в большинстве другого количества образцов крови, взятых на посев с интервалом между первым и последним забором крови более 1 ч.
2. ЭхоКГ-признаки инфекционного эндокардита:
— наличие характерных эхоКГ-признаков:
- вегетации на клапанах сердца или других структурах;
- внутрикардиальные абсцессы;
- дисфункция протезированных клапанов;
— появление новых признаков регургитации крови через клапаны.
Вспомогательные диагностические критерии инфекционного эндокардита:
- Предшествующие заболевания сердца или внутривенное употребление наркотиков.
- Лихорадка >38 °С.
- Сосудистые осложнения: артериальная эмболия, инфаркт легкого, микотические аневризмы, внутричерепное кровоизлияние, симптом Лукина, пятна Жаневье.
- Иммунные нарушения: гломерулонефрит, узелки Ослера, пятна Рота, ревматоидный фактор.
- Положительная гемокультура, не соответствующая основным критериям, или серологические признаки активной инфекции, вызванной потенциальным возбудителем инфекционного эндокардита.
Диагностические критерии инфекционного эндокардита у пациентов пожилого и старческого возраста включают:
- лихорадку с необъяснимой СН;
- лихорадку с цереброваскулярными расстройствами;
- лихорадку с необъяснимой почечной недостаточностью;
- лихорадку и боль в области спины;
- анемию неясного происхождения и уменьшение массы тела;
- вновь появившийся шум над областью сердца;
- внутрибольничную инфекцию с лихорадкой у больных с установленными внутривенными катетерами.
К сожалению, средний срок установления диагноза «инфекционный эндокардит» от первых жалоб и обращений к врачу составляет не менее 2–3 мес, а при поражении правых отделов сердца и того более, до 87% больных поступают в стационар с неправильным диагнозом. Диагностика инфекционного эндокардита у больных пожилого возраста особенно затруднительна, количество диагностических ошибок достигает 50%.
Для установления правильного диагноза необходим учет всего комплекса проявлений патологического процесса.
Возможные «маски» инфекционного эндокардита:
- Общие: недомогание, анорексия, уменьшение массы тела, бледность кожных покровов, ночная потливость.
- Со стороны сердца: миокардит, перикардит, поражение клапанов, ИМ (шумы, аритмия, СН).
- Со стороны легких — чаще отмечаются при поражении клапанов правых отделов сердца и обусловлены развитием повторных инфаркт-пневмоний, инфаркта легкого (плеврит, кровохарканье, отек легких).
- Со стороны органа зрения: внезапная слепота, петехии на веках, на глазном дне — петехиальные кровоизлияния и пятна Рота (белые округлые пятна диаметром 1–2 мм, расположенные поверхностно, иногда закрывающие сосуды сетчатки, состоящие из скоплений клеток, образовавшихся вследствие инфарктов сетчатки), отек и неврит зрительного нерва.
- Церебральные — протекающие под видом острого нарушения мозгового кровообращения, реже — менингита или менингоэнцефалита (гемиплегия, афазия, атаксия, головная боль, психические нарушения).
- Почечные — проявляющиеся симптомами диффузного гломерулонефрита или инфаркта почки (протеинурия, гематурия, гипертензивный криз).
- Гематологические — проявляющиеся анемией.
- Со стороны опорно-двигательного аппарата: артрит, остеомиелит.
- Сосудистые — воспроизводящие клинику системного васкулита, тромбангиита (геморрагический синдром, тромбоэмболические осложнения).
Лечение
Терапия инфекционного эндокардита базируется на нескольких принципах:
- Терапия должна быть по возможности этиотропной, то есть направленной на эрадикацию конкретного возбудителя.
- Необходимо применять комбинацию нескольких антибактериальных препаратов для достижения высоких бактерицидных концентраций и предупреждения развития резистентности.
- Терапия должна быть продолжительной: при заболевании стрептококковой этиологии — не менее 4 нед, стафилококковой — 6 нед, при заболевании, вызванном грамотрицательными возбудителями, — не менее 8 нед.
- При нарастании признаков иммунного конфликта в форме гломерулонефрита, васкулита, миокардита и др., а также проявлений инфекционно-токсического шока рассматривают вопрос о назначении ГКС.
- При острых формах инфекционного эндокардита, вызванного преимущественно стафилококками и грамотрицательными микроорганизмами, целесообразно проведение иммунотерапии (антистафилококковая плазма, антистафилококковый γ-глобулин) и дезинтоксикации.
- При отсутствии эффекта в течение 2 нед после применения адекватной антибиотикотерапии необходима консультация кардиохирурга. Хирургическое лечение следует проводить по строгим показаниям и своевременно.
В соответствии с приказом МЗ Украины № 436 от 03.07.2006 г. «Стандарти надання допомоги кардіологічним хворим» программа лечения инфекционного эндокардита предусматривает следующий перечень медицинских услуг:
Обязательный ассортимент:
- оперативное лечение;
- этиотропная терапия: антибиотикотерапия под контролем чувствительности возбудителя, применение ГКС и др.
- симптоматическое лечение СН и осложнений.
Дополнительный ассортимент:
- применение амиодарона у больных с симптомными или тяжелыми желудочковыми аритмиями;
- внутривенное введение симпатомиметических средств (допамина и/или добутамина);
- непрямые антикоагулянты у больных с постоянной формой фибрилляции предсердий, наличием тромбов в полостях сердца, тромбоэмболий в анамнезе.
При выборе антибиотика следует учитывать результаты микробиологического исследования, чувствительность выделенного возбудителя.
Трудности лечения прежде всего обусловлены широким распространением нетипичных возбудителей заболевания с высокой резистентностью многих микроорганизмов к существующим антибиотикам. Немаловажное значение имеет и тот факт, что антибиотики плохо проникают в клапаны сердца и миокард и во многих случаях (например при наличии искусственных клапанов сердца, шунтов, кардиостимуляторов) течение эндокардита не всегда прогнозируемо. При выявлении инфекционного эндокардита антибактериальное лечение необходимо начинать как можно раньше, не дожидаясь идентификации возбудителя, поскольку процесс быстро диссеминирует. В случаях с неустановленным возбудителем инфекционного эндокардита рекомендуют начинать терапию бета-лактамными антибиотиками и аминогликозидами (схема 7.1). Отсутствие эффекта через 3–5 дней и отрицательные результаты бактериологического исследования позволяют предположить наличие стафилококкового эндокардита, который вероятнее всего обусловлен пенициллино- и метициллинорезистентными стафилококками, что требует замены антибиотика.
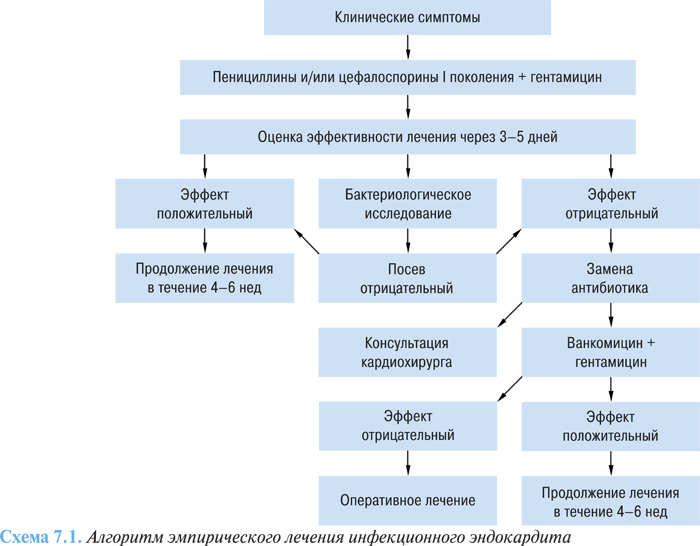
Наиболее эффективными считаются бензилпенициллин, цефалоспорины и аминогликозиды. Антибиотиком выбора для начальной терапии, как правило, является бензилпенициллин в суточной дозе 12–24 млн ЕД. Выбор этого антибиотика (при соблюдении рекомендуемой дозы) объясняется его доступностью, выраженным бактерицидным действием на многие микроорганизмы и широким терапевтическим диапазоном.
Современная этиотропная химиотерапия инфекционного эндокардита у больных с нормальной функцией почек представлена в табл. 7.2.
Таблица 7.2
Этиотропная химиотерапия инфекционного эндокардита
| Антибиотик | Суточная доза препарата (предпочтительно вводить внутривенно) | Длительность терапии, нед |
| Стрептококки (S. bovis, S. pneumonie, S. pyogenes и др.) | ||
| 1. Бензилпенициллин | 12–24 млн ЕД/сут в 4–6 введений | 4 |
| или цефтриаксон + | 2 г/сут однократно внутривенно | 4 |
| гентамицин | 3 мг/кг/сут в 2–3 введения внутривенно | 2 |
| после цефтриаксона | 2 г/сут однократно внутривенно | 2 |
| 2. Ванкомицин | 30 мг/кг/сут в 2 введения внутривенно | 4 |
| 3. Тейкопланин | В начальной дозе 6 мг/кг 2 раза в сутки, | 1–4 дня |
| затем 6 мг/кг/сут | 3–4 | |
| Энтерококки (E. faecalis, E. faecium) | ||
| 1. Бензилпенициллин | 12–24 млн ЕД/сут внутривенно каждые 4 ч | 4–6 |
| или ампициллин + | 175 мг/кг внутривенно каждые 4 ч | 4–6 |
| гентамицин | 3 мг/кг/сут в 2–3 введения внутривенно или внутримышечно | 4–6 |
| 2. Ванкомицин + | 30 мг/кг/сут в 2 введения внутривенно | 4–6 |
| гентамицин | 3 мг/кг/сут в 2–3 введения внутривенно или внутримышечно | 4–6 |
| 3. Тейкопланин | В начальной дозе 6 мг/кг 2 раза в сутки, | 1–4 дня |
| затем 6 мг/кг/сут | 3–4 | |
| Стафилококки (S. aureus, S. epidermidis) | ||
| Оксациллин + | 8–12 г/сут в 3–4 введения | 4 |
| гентамицин | 3 мг/кг/сут в 2–3 введения внутривенно | Первые 3–5 дней |
| При аллергии к пенициллинам | ||
| Ванкомицин + | 30 мг/кг/сут в 2 введения внутривенно | 4–6 |
| гентамицин | 3 мг/кг/сут в 2–3 введения внутривенно | Первые 3–5 дней |
| Грамотрицательные бактерии (E. coli, Proteus spp., Pseudomonas spp., Klebsiella spp., Enterobacter spp., Serratia spp.) | ||
| 1. Цефепим или | 4 г в 2 введения | 4 |
| цефтазидим + | ||
| гентамицин | 5 мг/кг в 3 введения | 2 |
| или тобрамицин | 5–8 мг/кг в 3 введения | 2 |
| 2. Имипенем | 2 г в 4 введения | 4 |
| Грибы Candida spp., Aspergillus spp. | ||
| Амфотерицин В + | 1 мг/кг однократно | 4–6 |
| флуконазол | 400 мг однократно | 4–6 |
Для лечения инфекционного эндокардита, вызванного стрептококком, назначают бензилпенициллин в течение 4 нед или бензилпенициллин в комбинации с аминогликозидом (гентамицин, тобрамицин в течение 2 нед). Эти режимы требуют длительной госпитализации пациентов и использования внутривенных катетеров, что часто приводит к развитию флебитов. AHA опубликовала результаты двух исследований по лечению цефтриаксоном пациентов со стрептококковым эндокардитом. Высокая степень излечения (98%) после 4-недельной терапии препаратом оправдывает применение цефтриаксона с учетом спектра активности и фармакокинетических особенностей, позволяющих назначать его 1 раз в сутки и использовать для амбулаторного лечения неосложненного инфекционного эндокардита. При аллергических реакциях на пенициллины и цефалоспорины рекомендованы гликопептидные антибиотики.
Современная антибиотикотерапия энтерококкового эндокардита с учетом того, что энтерококки значительно менее чувствительны к бензилпенициллину и гентамицину, включает комбинацию антибиотиков, обладающих синергическим действием: аминопенициллин (ампициллин) или гликопептидный антибиотик (ванкомицин, тейкопланин) с аминогликозидами (гентамицин, стрептомицин). Серьезную проблему представляют инфекционный эндокардит, вызванный энтерококками с высоким уровнем резистентности к аминогликозидам. В этих случаях назначают длительную (8–12 нед) терапию бензилпенициллином или ампициллином в высоких дозах. При аллергии к бета-лактамным антибиотикам следует назначать ванкомицин в комбинации с аминогликозидами внутривенно, тейкопланин. Частота рецидивов при этом составляет 50%. При рецидиве показано кардиохирургическое лечение с имплантацией клапана. Если энтерококки резистентны к пенициллинам, аминогликозидам и ванкомицину, эффективной антибактериальной терапии нет. Возможно применение линезолида в дозе 600 мг каждые 12 ч.
Цефалоспорины не следует применять для лечения энтерококкового эндокардита из-за первичной резистентности к ним этих микроорганизмов.
При стафилококковом эндокардите доказано, что бактерицидный эффект, стерилизация клапанов и профилактика их тяжелых повреждений обеспечиваются быстрее при использовании комбинации пенициллинов или цефалоспоринов, устойчивых к действию бета-лактамаз, и аминогликозидов. При неэффективности терапии, выделении пенициллино- и метициллинорезистентных штаммов золотистого или эпидермального стафилококка или при аллергии к бета-лактамным антибиотикам применяют гликопептиды (ванкомицин, тейкопланин) в сочетании с аминогликозидами. В случаях аллергии к бета-лактамным антибиотикам при стафилококковом эндокардите применяют также линкозамиды (линкомицин, клиндамицин). Высокой противостафилококковой активностью отличается цефепим.
Эндокардиты, вызванные грамотрицательными микроорганизмами, почти всегда развиваются в результате внутригоспитального инфицирования и лечить их сложно из-за наличия у возбудителей различных механизмов резистентности. Современная антибиотикотерапия предполагает применение аминогликозидов (тобрамицин, нетилмицин, амикацин) в сочетании с цефалоспоринами III–IV поколения (цефтриаксон, цефепим) или карбапенемов (имипенем, меропенем) в течение 4–6 нед.
При грибковых эндокардитах проводят комбинированную химиотерапию амфотерицином В и флуконазолом в сочетании с хирургическим лечением. Даже при оптимальном лечении отмечают высокую смертность и поздние рецидивы заболевания (через 2 года и более).
Для лечения пациентов с эндокардитом протезированных клапанов можно использовать комбинацию цефалоспоринов с гентамицином или тобрамицином, эффективен ванкомицин. При заболевании, вызванном эпидермальным стафилококком, чаще применяют ванкомицин/тейкопланин с рифампицином и гентамицин. Монотерапия рифампицином нецелесобразна.
При длительном проведении антибактериальной терапии внутривенно рекомендуют добавлять гепарин из расчета 1 ЕД/мл раствора антибиотика для предотвращения образования тромбов и 1 раз в неделю вводить амфотерицин В (50 000 ЕД внутривенно капельно) для предупреждения грибковой инфекции. Противогрибковые препараты целесообразно применять приблизительно с середины курса антибиотикотерапии, когда можно ожидать развития грибковой инфекции. Для диагностики последней и оценки эффективности терапии необходимо проводить посевы соскобов с корня языка и посевы мочи для выявления грибковой флоры.
Дискуссионным остается вопрос о применении ГКС, многие исследователи обращались к этой проблеме, но она до сих пор не решена. В настоящее время можно утверждать, что применение ГКС не предотвращает разрушения клапанного аппарата: подавляя воспалительную реакцию вокруг очага инфекции, они, наоборот, обусловливают более быстрое разрушение клапана. Гормональная терапия ведет к угнетению клеточного и гуморального иммунитета, необходимого для борьбы с инфекцией, вызывает снижение фагоцитарной активности лейкоцитов и уровня образования антител, которые могут способствовать генерализации септического процесса. Назначение ГКС нежелательно до достижения надежного подавления возбудителя антибиотиками (нормализации температуры тела, тенденции к снижению СОЭ). ГКС опасно применять в случаях заболевания с отрицательной гемокультурой, когда врачи вынуждены проводить эмпирическую антибактериальную терапию, а гормоны, устраняя лихорадку, анемию и замедляя СОЭ, лишают их критериев оценки эффективности этой терапии. Недопустимо применение ГКС при рецидивах заболевания, особенно ранних (в течение первых 2–3 мес), когда нет возможности провести полную эрадикацию возбудителя. В случаях заболевания с установленным возбудителем и известной его чувствительностью к антибиотикам в применении гормонов, как правило, нет необходимости.
Таким образом, ГКС не являются препаратами первого ряда, они противопоказаны при остром септическом эндокардите, наличии септического синдрома при подостром септическом эндокардите, неустановленном возбудителе, отсутствии эрадикации возбудителя, при рецидивирующем инфекционном эндокардите. Неблагоприятное влияние ГСК на течение инфекционного эндокардита, особенно в дозе ≥30 мг/сут, делают их применение нежелательным.
Показанием к назначению ГКС является инфекционно-токсический шок, при котором кратковременное применение ГКС в высоких дозах (≥100–200 мг в пересчете на преднизолон) жизненно необходимо. Несомненным показанием к их назначению является медикаментозная аллергия. Относительным показанием к их применению является тяжелое иммуновоспалительное поражение почек (протеинурия >1 г/л) и миокарда.
При инфекционном эндокардите, особенно остром, проводят пассивную иммунизацию готовыми антитоксическими сыворотками с целью нейтрализации циркулирующих в крови микробных токсинов. Наиболее эффективна гипериммунная плазма (в зависимости от вида возбудителя — антистафилококковая, антисинегнойная и др.). Антистафилококковую плазму вводят внутривенно капельно по 125–250 мл ежедневно или через день (4–6 вливаний на курс). Антисинегнойную плазму вводят внутривенно из расчета 4–6 мл/кг (в среднем 250 мл) с интервалами между вливаниями 1–3 дня (4–6 вливаний на курс). Антистафилококковый гаммаглобулин не только является источником антител, но стимулирует также факторы неспецифического иммунитета, применяется в виде внутримышечных инъекций по 5–10 мл ежедневно в течение 10 дней. Иммуноглобулин человека вводят внутривенно по 50 мл со скоростью 20–40 капель/мин ежедневно в течение 3–5 дней.
Оперативное лечение проводится как в ранние сроки заболевания при сохраняющихся лихорадке и бактериемии, так и по завершении как минимум 4–6-недельного курса антибактериальной терапии. В хирургическом лечении нуждаются около 20% больных инфекционным эндокардитом.
Показаниями к оперативному вмешательству на нативных клапанах являются:
- СН вследствие остро возникшей недостаточности аортального или митрального клапана;
- персистирующая лихорадка и бактериемия более 8 дней, несмотря на антибактериальную терапию;
- абсцессы, псевдоаневризмы, нарушения проводимости, миокардит;
- выявление возбудителей, часто не поддающихся антибактериальной терапии (грибы, Brucella, Coxiella);
- выявление микроорганизмов c высоким потенциалом к быстрой деструкции структур сердца (S. lugdunensis);
- поражения миокарда и фиброзного кольца.
К относительным показаниям к хирургическому лечению инфекционного эндокардита нативных клапанов относят наличие массивных вегетаций на внутрисердечных структурах (по данным эхоКГ), эмболии периферических сосудов, выделение в гемокультуре грамотрицательной палочки или стафилококка.
Хирургический метод заключается в удалении пораженных клапанных структур с вегетациями и имплантации вместо него искусственного механического или биологического протеза. Имеются сообщения о новых подходах: иссечении вегетаций, ушивании перфорации створки клапана, изолированном протезировании одной из створок митрального или аортального клапана ксеноперикардом и санации камер сердца, закрытии полости абсцесса. Общая 5-летняя выживаемость с учетом госпитальной летальности составляет 70–75%.
Показаниями для проведения неотложного хирургического вмешательства при инфекционном эндокардите протезированных клапанов сердца являются установление грибковой этиологии инфекционного эндокардита, появление симптомов СН, признаков нарушения функции протеза, внутрисердечных абсцессов, прогрессирование нарушений проводимости сердца, рецидивирующие эмболические осложнения. Хирургическое лечение инфекционного эндокардита протезированных клапанов сопровождается высоким операционным риском. Операция может потребоваться также для лечения пациентов с тяжелыми системными эмболическими осложнениями, для иссечения абсцесса селезенки или лечения микотических аневризм.
Прогноз
Без лечения инфекционный эндокардит практически всегда приводит к летальному исходу, при медикаментозном лечении смертность достигает 80%, при хирургическом — 30%, что объясняется прежде всего несвоевременностью установления диагноза.
Для прогноза исхода заболевания важное значение имеют возбудитель, его вирулентность и устойчивость к антибактериальным средствам, а также локализация клапанного поражения.
Пациент считается излеченным, если в течение 2 мес после окончания адекватной антимикробной терапии не выявляются симптомы инфекционного эндокардита, нет повышения температуры тела, нет повышения СОЭ, отрицательные посевы крови. Возобновление болезни в течение первых 12 мес после выписки из стационара расценивается как рецидив, возобновление болезни позже чем через 1 год — как повторное возникновение инфекционного эндокардита. Ранним рецидивом считается появление симптомов инфекционного эндокардита в течение первых 3 мес.
Факторами, ухудшающими прогноз болезни, являются наличие застойной СН, пожилой возраст, вовлечение в процесс клапана аорты или нескольких клапанов сердца, полимикробная бактериемия, невозможность идентификации этиологического агента вследствие отрицательных результатов посевов крови, резистентность возбудителя к бактерицидным препаратам первого ряда, позднее начало терапии. Особенно неблагоприятный прогноз отмечают при наличии протезированных клапанов, развитии абсцессов клапанного кольца или миокарда, выявлении грамотрицательных микроорганизмов. При наличии грибкового эндокардита вследствие сложности выделения возбудителя из гемокультуры, малоэффективности лечения, генерализации процесса по сосудистой системе за счет частых эмболий умирают 80–90% больных.
Наиболее частой причиной смерти даже в случаях адекватного лечения является СН, развившаяся вследствие деструкции клапана или повреждения миокарда. Кроме того, к летальному исходу могут привести эмболия сосудов жизненно важных органов, развитие почечной недостаточности или микотической аневризмы, осложнений после хирургических вмешательств.
Профилактика
Профилактика развития инфекционного эндокардита у больных с повышенным риском сводится к предупреждению бактериемии, которая возникает после различных вмешательств и манипуляций. Антибиотикопрофилактику следует проводить пациентам с патологией сердца при риске развития инфекционного эндокардита перед проведением инвазивных процедур.
Показания к антимикробной профилактике у больных высокого риска:
- наличие искусственных клапанов сердца (как био-, так и механических эндопротезов);
- сложные врожденные синие пороки сердца;
- предшествующий инфекционный эндокардит;
- хирургические системные или легочные анастомозы.
Показаниями к проведению антимикробной профилактики у больных умеренного риска являются:
- приобретенные пороки сердца;
- пролапс митрального клапана с регургитацией или значимым утолщением клапана;
- нецианотичный врожденный порок сердца (кроме дефекта межпредсердной перегородки типа ostium secundum), включая двустворчатый аортальный клапан;
- ГКМП.
ЛИТЕРАТУРА
- Бешляга В.М., Кнышов Г.В., Руденко А.В. и др. (2003) Роль эхокардиографии в диагностике инфекционного эндокардита. Серце i судини, 4: 58-64.
- Буткевич О.М., Виноградова Т.Л. (2000) Некоторые вопросы современной терапии инфекционного эндокардита. Терапевт. арх., 9: 54-57.
- Демин А.А., Дробышева В.П. (2000) Антибактериальная химиотерапия инфекционного эндокардита. Клин. антимикробная химиотерапия, 1: 25-27.
- Кнышов Г.В., Коваленко В.Н. (ред.) (2004) Инфекционный эндокардит.Морион, Киев, 256 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 122 с
- Наказ № 436 Міністерства охорони здоров’я України від 03.07. 2006 р.«Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006). Укр. кардіол. журн., 6: 89-115.
- Никонов В.В. (2007) Инфекционный эндокардит. Медиц. неотлож. сост., 5: 44-47.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва, 1328 с.
- Ребров А.П., Пономарева Е.Ю., Белова А.А. и др. (2000) Инфекционный эндокардит: качество диагностики и клинические особенности. Терапевт. арх., 9: 50-53.
- Руденко А.В., Крикунов А.А. (2004) Клинические проявления и диагностика инфекционного эндокардита. Серце i судини, 1: 96-104.
- Шиллер Н., Осипов М.А.(2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Anderson D.J., Goldstein L.B., Wilkinson W.E. et al. (2003) Stroke location, characterization, severity, and outcome in mitral vs aortic valve endocarditis. Neurology, 61: 1341-1346.
- Bayer A.S.(1996) Revised diagnostic criteria for infective endocarditis. Cardiol. Clin., 14: 345-350.
- Baddour L.M., Wilson W.R., Bayer A.R. et al. (2005) Infective endocarditis, diagnosis, antimicrobial therapy, and management of complications. A statement for healthcare professionals from the Committee on rheumatic fever, endocarditis, and Kawasaki disease, Council on cardiovascular disease in the young, and the Councils on clinical cardiology, stroke, and cardiovascular surgery and anesthesia, American Heart Association — executive summary. Circulation, 111: 3167-3184.
- Cabell C.H., Jollis J.G., Peterson G.E. et al.(2002) Changing patient characteristics and the effect on mortality in endocarditis. Arch. Intern. Med.,162: 90-94.
- Durack D.T., Bright D.K., Lukes A.S.(1994) Duke Endocarditis Service. New criteria for diagnosis of infective endocarditis. Amer. J. Med., 96: 200-209.
- Evangelista A., Gonzalez-Alujas M.T.(2004) Echocardiography in infective endocarditis. Heart, 90: 614-617.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Greub G., Lepidi H., Rovery C. et al.(2005) Diagnosis of infectious endocarditis in patients undergoing valve surgery. Amer. J. Med., 118: 230-238.
- Horskotte D., Follath F., Gutchik E. et al. (2004) Guidelines on prevention, diagnosis and treatment of infective endocarditis. Executive summary. The task force on infective endocarditis of the European society of cardiology. Eur. Heart J., 25: 267-276.
- Kuruppu J.C., Corretti M., Mackowiak P. et al. (2002) Overuse of transthoracic echocardiography in the diagnosis of native valve endocarditis. Arch. Intern. Med., 162: 1715-1720.
- Le T., Bayer A.S. (2003) Combination antibiotic therapy for infective endocarditis. Clin. Infect. Dis., 36: 615-621.
- Li J.S., Sexton D.J., Mick N. et al. (2000) Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin. Infect. Dis., 30: 633-638.
- Petti C.A., Fowler V.G. Jr (2003) Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin., 21: 219-233.
- Prendergast B. D. (2004) Diagnostic criteria and problems in infective endocarditis. Heart, 90: 611-613.
- Sachdev M., Peterson G.E., Jollis J.G. (2002) Imaging techniques for diagnosis of infective endocarditis. Infect. Dis. Clin. North. Amer., 16: 319-337.
- Sekido M., Takano T., Takayama M. et al. (1999) Survey of infective endocarditis in the last 10 years: analysis of clinical, microbiological and therapeutic features. J. Cardiol., 33: 209-215.
- Stryjewski M.E., Corey G.E. (2005) Treatment protocols for bacterial endocarditis and infection of electrophysiologic cardiac devices Biofilms, Infection, and antimicrobial therapy, eds. Pace, Rupp, and Finch. Boca Raton: CRC Press, P. 428-449.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Thuny F., Disalvo G., Belliard O. et al. (2005) Risk of embolism and death in infective endocarditis: prognostic value of echocardiography: a prospective multicenter study. Circulation., 112: 69-75.
- Valente A.M., Jain R., Scheurer M. et al. (2005) Staphylococcus aureus bacteremia in childhood: who is at risk for endocarditis? Pediatrics.,115: 15-19.