2.7.1. Набуті вади серця
Визначення. Набуті вади серця — це захворювання, в основі яких лежать морфологічні та/чи функціональні порушення клапанного апарату (стулок клапанів, фіброзного кільця, хорд, папілярних м’язів), зумовлені гострими та хронічними захворюваннями і травмами, що порушують функцію клапанів і спричиняють зміни внутрішньосерцевої гемодинаміки.
Набуті вади серця трапляються приблизно у 0,5–1% населення помірного кліматичного поясу, а за секційними даними — у 4–8% населення.
Найчастіше трапляються такі набуті вади серця:
- мітральний стеноз;
- мітральна недостатність (регургітація);
- аортальний стеноз;
- аортальна недостатність;
- трикуспідальний стеноз;
- трикуспідальна недостатність;
- комбінована мітральна вада серця;
- комбінована аортальна вада серця;
- поєднана мітрально-аортальна вада серця.
Розрізняють прості (чисті), комбіновані та поєднані вади серця. Проста вада серця — це одна чиста вада; комбінована — поєднання стенозу та недостатності; поєднана — мітрально-аортальна вада серця. Найпоширенішою причиною набутих вад серця є ревматизм, рідше — атеросклероз, інфекційний ендокардит, сифіліс.
Основний механізм компенсації при тривалому перебігу набутих вад серця — гіпертрофія і дилатація переобтяжених відділів серця. Тоногенна дилатація, що розвивається паралельно з гіпертрофією, має компенсаторний характер і призводить до виникнення механізму Франка – Стерлінга: посилення скорочень серця у відповідь на додаткове розтягнення міокарда (чим більше розтягнення, тим більший викид серця) [7, 25, 44].
Класифікація набутих вад серця [60]
Вади серця вважають комбінованими за наявності стенозу та недостатності одного клапана і поєднаними при ураженні декількох клапанів. З огляду на кожний перебіг та хірургічну тактику ураження кожного з клапанів доцільно розглядати залежно від переважання стенозу або недостатності.
1. Ізольований стеноз або комбінована вада з переважанням стенозу. Хірургічна тактика в цих випадках однакова, а діагностика невеликої супутньої регургітації клапана на тлі стенозу нерідко утруднена.
2. Комбіновані вади без чіткого переважання. У таких випадках за клініко-інструментальними даними визначають як стеноз, так і недостатність клапана, причому питання показань до клапанзберігаючої операції чи протезування клапана вирішують індивідуально.
3. Ізольована недостатність або комбінована вада з перевагою недостатності. За наявності показань до операції у більшості хворих здійснюються протезування клапана, а в певної частини пацієнтів — різні варіанти пластичних операцій.
Загальна характеристика вад серця:
- Етіологія — ревматична, неревматична (з уточненням);
- Локалізація (клапан): мітральний; трикуспідальний; клапан легеневої артерії;
- Характер ураження клапана: стеноз, недостатність, комбінована вада;
- Ступінь вади.
V. СН (0–ІІІ стадія, І–IV ФК).
Мітральний стеноз:
І05.0 — ревматичний;
І34.2 — неревматичний (з уточненням етіології).
Мітральна недостатність:
І05.1 — ревматологічна;
І34.0 — неревматична (з уточненням етіології, у тому числі дегенеративна);
І05.2 — комбінована ревматична мітральна вада:
- з переважанням стенозу;
- з переважанням недостатності;
- без чіткого переважання.
І34.1 — пролапс мітрального клапана.
Аортальний стеноз:
І06.0 — ревматичний;
І35.0 — неревматичний (з уточненням етіології, у тому числі дегенеративний).
Аортальна недостатність:
І06.1 — ревматична;
І35.1 — неревматична (з уточненням етіології, у тому числі дегенеративна).
Комбінована аортальна вада:
І06.2 — ревматична;
І35.2 — неревматична (з уточненням етіології):
- з переважанням стенозу;
- з переважанням недостатності;
- без чіткого переважання.
Трикуспідальний стеноз:
І07.0 — ревматичний;
І36.0 — неревматичний (з уточненням етіології).
Трикуспідальна недостатність:
І07.1 — ревматична;
І36.1 — неревматична (з уточненням етіології).
Комбінована трикуспідальна вада:
І07.2 — ревматична;
І36.2 — неревматична (з уточненням етіології);
І37.0 — клапанний стеноз легеневої артерії;
І37.1 — недостатність клапана легеневої артерії;
І37.2 — комбінована вада клапана легеневої артерії.
Поєднані вади серця:
І08.0 — мітрально-аортальна;
І08.1 — мітрально-трикуспідальна;
І08.2 — аортально-трикуспідальна;
І08.3 — мітрально-аортально-трикуспідальна (з розшифруванням; див. приклади формулювання діагнозу).
Приклади формулювання діагнозу:
1. Хронічна ревматична хвороба серця, комбінована мітральна вада з переважанням стенозу. Постійна форма ФП. СН ІІБ стадії зі зниженою ФВ ЛШ, ІІІ ФК.
2. Хронічна ревматична хвороба серця, поєднана мітрально-аортальна вада серця: аортальний стеноз, мітральна недостатність. Шлуночкова екстрасистолічна аритмія. СН ІІА стадії зі збереженою ФВ ЛШ, ІІ ФК.
3. Кальцинуюча хвороба клапанів серця: дегенеративний аортальний стеноз. СН ІІА стадії зі збереженою ФВ ЛШ, ІІ ФК.
2.7.1.1. Мітральний стеноз
Визначення. Мітральний стеноз — це звуження лівого АV-отвору, яке призводить до утруднення випорожнення ЛП та збільшення градієнта діастолічного тиску між ЛП і ЛШ.
Частота мітрального стенозу у країнах Східної Європи значно вища, ніж у Західній Європі й США. «Чистий» мітральний стеноз трапляється у 83% випадків мітральних і 62% усіх набутих вад. У жінок мітральний стеноз виявляють частіше, ніж у чоловіків.
Поширеність ревматичного мітрального стенозу поступово знижується в розвинутих країнах. Дегенеративне кальцинуюче ураження мітрального клапана часто виявляють у хворих похилого віку. Перкутанна мітральна комісуротомія зробила суттєвий внесок у лікування пацієнтів із ревматичним мітральним стенозом.
Етіологія та патогенез. Мітральний стеноз трапляється переважно при ревматизмі; рідше він супроводжує захворювання сполучної тканини, атеросклероз (рис. 2.10). У нормі площа мітрального отвору становить 4–6 см2. При його звуженні до 2,5 см2 порушення гемодинаміки не спостерігається. Зменшення площі лівого АV-отвору до ≤1–1,5 см2 супроводжується вираженими гемодинамічними порушеннями [7, 25, 44].
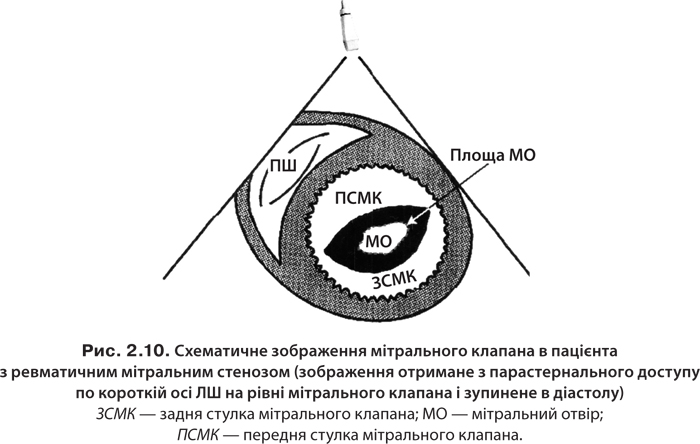
Клініка і діагностика захворювання наведені в алгоритмі 2.31.
|
Алгоритм 2.31. Критерії діагностики мітрального стенозу [17] 1. Скарги хворого залежать від ступеня вади серця, появи таких ускладнень, як СН, аритмії серця. Основною скаргою є задишка; при легеневій гіпертензії може з’являтися біль, який нагадує стенокардію, спричинений підвищенням потреби міокарда ПШ в кисні. Кровохаркання виникає при розриві дрібних, бронхіальних вен внаслідок високого тиску у ЛП, а також проникнення еритроцитів per dіapedesum. Нічні напади гострої лівопередсердної недостатності призводять до набряку легень. 2. Пульс малого наповнення, р. dіfferens, часто аритмічний; визначається дефіцит пульсу при ФП. 3. Межі відносної тупості серця зміщуються доверху за рахунок ЛП і вправо — за рахунок правого передсердя і ПШ. При цьому підвищується тиск у ЛП, легеневих венах і артеріолах, що призводить до легеневої гіпертензії. 4. Аускультативні критерії: І тон на верхівці ляскаючий (посилений), вислуховується ритм «перепілки» (посилений І тон у поєднанні з тоном відкриття мітрального клапана), пресистолічний, протодіастолічний чи мезодіастолічний шум, пресистолічний ритм галопу, акцент ІІ тону над легеневою артерією. 5. ЕКГ-критерії: ознаки гіпертрофії ЛП (P-mіtrale), ПШ, зміщення електричної осі серця вправо, аритмії та блокади серця. 5. ЕКГ-критерії: ознаки гіпертрофії ЛП (P-mіtrale), ПШ, зміщення електричної осі серця вправо, аритмії та блокади серця. 6. ЕхоКГ-критерії: Критерії ехоКГ В-режиму:
Критерії допплер-ехоКГ (найточніший метод визначення площі мітрального отвору):
7. Рентгенологічні критерії: згладжування талії серця, випинання 2-ї і 3-ї дуг (легеневої артерії та ЛП) по лівому контуру серця, відхилення контрастованого стравоходу по дузі малого радіуса (˂6 см). |
Характеристика стадій мітрального стенозу наведена в табл. 2.87.
Таблиця 2.87. Стадії мітрального стенозу
|
Клас тяжкості |
Площа мітрального отвору (в нормі — 4–6 см2) |
Клінічні прояви |
|
Мінімальний |
>2,5 |
Відсутні |
|
Легкий |
1,4–2,5 |
Мінімальна задишка при значному навантаженні |
|
Помірний |
1,0–1,4 |
Задишка, ортопное, пароксизмальна нічна ядуха, застійні зміни в легенях |
|
Тяжкий (критичний) |
<1,0 |
Ті самі, що при тяжкому стенозі, плюс виражена правошлуночкова недостатність |
Площа мітрального отвору зменшується на 0,1–0,3 см2 за рік. При помірному підвищенні тиску в ЛП (не більше 25–30 мм рт. ст.) порушується кровотік у малому колі кровообігу, підвищується тиск у легеневих венах, який передається через капіляри в легеневу артерію, від чого виникає венозна чи пасивна легенева гіпертензія. Підвищення тиску в ЛП >25–30 мм рт. ст. спричиняє розрив капілярів; виникає альвеолярний набряк легень. Щоб зменшити приплив крові до легень, виникає рефлекторний спазм легеневих артеріол (рефлекс Китаєва).
При площі мітрального отвору >1,5 см2 симптоми можуть бути відсутні, однак збільшення трансмітрального кровотоку або зниження часу діастолічного наповнення призводить до різкого підвищення тиску в ЛП і виникнення клінічних симптомів набряку легень. Провокуючі фактори декомпенсації: фізичні навантаження, емоційний стрес, ФП, вагітність.
Лікування. Здійснюють консервативне лікування ускладнень мітрального стенозу (СН, аритмій, блокад серця, тромбоемболій), про що йтиметься у спеціальних розділах [44].
У разі виникнення задишки призначають ББА. Є спостереження, які свідчать про покращення самопочуття, зменшення задишки та підвищення толерантності до фізичного навантаження та тлі прийому ББА (їх використовують навіть при набряку легень у хворих на мітральний стеноз при в/в введенні). ББА зменшують скоротливу здатність ПШ і, відповідно, наповнення легень. Поряд з цим унаслідок сповільнення ЧСС та збільшення тривалості діастоли зменшується застій у легенях і збільшується серцевий викид. Серцевий глікозид дигоксин застосовують дуже обережно тільки у разі розвитку ФП (хворим із синусовим ритмом протипоказаний, оскільки підвищує скоротливу здатність ПШ і сприяє наростанню легеневої гіпертензії).
Медикаментозне лікування (ЄТК, 2017; ВАКУ, 2018)
Діуретики, ББА, дигоксин (при ФП) чи АК, що впливають на ЧСС, можуть тимчасово покращувати стан хворого і зменшувати вираженість симптомів. Антикоагулянтна терапія із цільовим рівнем МНВ 2–3 показана пацієнтам як з першим епізодом ФП, так і при пароксизмальній ФП [7, 35, 44] (табл. 2.88).
Таблиця 2.88. Медикаментозна терапія при мітральному стенозі згідно з рекомендаціями ЄТК (2017)
|
Методи лікування |
Механізм дії |
|
Діуретики і нітрати тривалої дії |
Тимчасово зменшують задишку |
|
ББА та АК (верапаміл, дилтіазем) |
Сповільнюють ЧСС, підвищують толерантність до фізичного навантаження, подовжують діастолу і час наповнення ЛШ |
|
Антикоагулянти |
При пароксизмальній і перманентній ФП МНВ 2,0–3,0 |
|
Антикоагулянти обов’язкові при синусовому ритмі |
Перенесені тромбоемболії, наявний тромб у ЛП (І С). Спонтанний ехоконтраст, встановлений при трансезофагеальній ехоКГ, ЛП (>50 мм) (Іа С) |
|
Профілактика інфекційного ендокардиту |
Починаючи з юного віку і після консервативної інтервенції аж до дорослого віку |
В нових рекомендаціях ESС/EACTS 2017 р. щодо клапанних вад серця є суттєві доповнення та зміни стосовно застосування антикоагулянтів при вадах серця. Експерти дійшли висновку, що на сьогодні отримана достатня кількість даних, щоб рекомендувати НПАК як альтернативу варфарину пацієнтам із вадами аортальних клапанів або мітральною недостатністю. Водночас для хворих із мітральним стенозом та механічними протезами клапанів серця НПАК, як і раніше, залишаються протипоказаними.
В осіб із синусовим ритмом антикоагулянти застосовують за наявності тромбоемболій в анамнезі або тромбів у ЛП (І, С) та рекомендовані, якщо при трансезофагеальній ехоКГ візуалізують щільне контрастування в ЛП або у хворих зі збільшеним ЛП (діаметр у М-режимі >50 мм або індекс об’єму ЛП >60 мл/м2) (ІІа, С).
Пацієнти з помірним чи тяжким мітральним стенозом та постійною формою ФП мають отримувати АВК, а не НПАК.
Кардіоверсія не показана до виконання оперативного втручання у хворих із тяжким мітральним стенозом, оскільки зазвичай з її допомогою не вдається стійке відновлення синусового ритму на тривалий час. Якщо пароксизм ФП нетривалий і ЛП помірно збільшене, кардіоверсію слід застосовувати після вдалого оперативного втручання.
У пацієнтів похилого віку з ревматичним стенозом при високому хірургічному ризику перкутанна мітральна комісуротомія є корисною, навіть коли вона виконується з паліативною метою. У всіх інших осіб похилого віку протезування клапана є методом вибору.
У пацієнтів похилого віку з дегенеративним мітральним стенозом з вираженою кальцифікацією мітрального кільця проведення протезування клапана несе високий хірургічний ризик. Якщо спаяння комісур відсутнє, перкутанна мітральна комісуротомія не може бути виконана при дегенеративному мітральному стенозі.
У хворих із мітральним стенозом при виникненні нападу ФП кращим препаратом є аміодарон, який у дозі 1000–1200 мг (при високій ЧСС рекомендується у дозі 900–2500 мг/добу) відновлює ритм серця у 60–90% випадків. ААП ІІІ С класу пропафенон теж ефективний, але при СН він не показаний за рахунок пригнічення скоротливої здатності шлуночків. ААП новокаїнамід, дилтіазем цим хворим протипоказані (!).
Хворим, які перенесли тромбоемболії великого і малого кола кровообігу, при ФП призначають антикоагулянти — спочатку гепарин, потім препарат непрямої дії варфарин у дозі 2,5–10 мг/добу (МНВ повинно становити 2,0–3,0), або інгібітори Ха-фактора згортання крові — ривароксабан 20 мг/добу чи апіксабан 5 мг 2 рази на добу, або прямий інгібітор тромбіну — дабігатрану етексилат 150 мг 2 рази на добу. Згодом вирішують питання про хірургічне лікування.
Операція мітральної комісуротомії показана хворим з ІІ, ІІІ, ІV ФК СН за класифікацією NYHA. Механічний двостулковий протез, який застосовується при оперативному лікуванні вади, наведений на рис. 10 (див. кольорову вкл.). Можна застосовувати балонну вальвулопластику (ендоваскулярна хірургія). Протезування мітрального клапана показане при мітральному стенозі ІІІ–ІV стадії (з критичною площею отвору ˂1 см2) звуження мітрального отвору [7, 50].

Протипоказання до проведення перкутанної мітральної комісуротомії:
- площа мітрального отвору >1,5 см2;
- тромб у ЛП;
- більша від помірної мітральна недостатність;
- виражена чи двокомісурна кальцифікація;
- відсутність спаяності комісур;
- тяжка супутня аортальна патологія чи тяжкий комбінований трикуспідальний стеноз та регургітація;
- супутнє ураження вінцевих судин, що потребує АКШ.
2.7.1.2. Мітральна недостатність
Мітральна недостатність — друга найчастіша клапанна патологія в Європі щодо необхідності проведення хірургічних втручань. Важливо розрізняти первинну та вторинну мітральну недостатність, особливо стосовно необхідності хірургічних і транскатетерних інтервенційних втручань (ЄТК, 2017; ВАКУ, 2018).
Етіологія. Хронічна мітральна недостатність виникає при ревматизмі, атеросклерозі, інфекційному ендокардиті, захворюваннях сполучної тканини, травмах, розриві хорд, інфаркті папілярних м’язів, дилатації ЛШ, пролапсі мітрального клапана, кальцинозі кільця мітрального клапана. Гостра мітральна недостатність розвивається при перфорації чи відриві стулок мітрального клапана при інфекційному ендокардиті, повному або частковому розриві папілярного м’яза у хворих на ІМ.
Клініка та діагностика мітральної недостатності наведена в алгоритмі 2.32.
|
Алгоритм 2.32. Критерії діагностики мітральної недостатності [17] 1. У фазі декомпенсації мітральної недостатності хворі скаржаться на серцебиття, задишку, кашель, набряки на ногах. 2. Пульс суттєво не відрізняється від норми. 3. Межі відносної тупості серця зміщуються вліво та вверх, а при тривалій легеневій гіпертензії — і вправо. 4. Аускультативно характерна тріада: послаблений І тон, голосний систолічний шум над верхівкою, який проводиться в аксилярну ділянку, акцент ІІ тону над легеневою артерією, часте його розщеплення чи роздвоєння. При тяжкій мітральній недостатності визначається патологічний ІІІ тон. 5. ЕКГ-критерії: ГЛШ та гіпертрофія ЛП (р-mіtrale). У разі високої легеневої гіпертензії приєднується також гіпертрофія ПШ. При тривалому перебігу захворювання виникає екстрасистолія, ФП. 6. ЕхоКГ-критерії двомірного режиму:
Критерії допплер-ехоКГ (констатує наявність тільки мітральної недостатності): пізній турбулентний систолічний потік у ЛП, що свідчить про незначну мітральну недостатність. 7. Рентгенологічні критерії: визначається збільшення ЛП в косих відведеннях. Контрастований стравохід відхиляється по дузі великого радіуса на >6 см. У передній проекції талія згладжена, виникає 3-тя дуга (ЛП і закруглення верхівки серця та збільшення дуги ЛШ). |
Мітральна недостатність — єдина вада серця з частим діастолічним перевантаженням ЛШ. Клінічні симптоми виникають пізно — через ≥20 років, а початкову стадію вади хворі переносять досить спокійно. На пізніх стадіях вади виникає застій крові в легенях. Пацієнти переносять ФП при мітральній недостатності легше, ніж при мітральному стенозі. ФП і ТП при тяжкій мітральній недостатності є показанням до проведення операції.
Первинна мітральна недостатність
При первинній мітральній недостатності один із компонентів клапанного апарату є безпосередньо ураженим. Дегенеративні зміни клапана — найчастіша етіологія мітральної недостатності (пролапс стулок, провалювання стулок).
Оцінка. Дослідження ехоКГ — основний метод, що використовується для оцінки тяжкості та механізму мітральної недостатності, її наслідків для ЛШ (порушення функції та ремоделювання), ЛП, легеневого кровотоку, а також можливості відновлення. Точна анатомічна структура та функціональна характеристика відповідно до класифікації Карпентьє мають бути проведені для оцінки можливості реконструктивних втручань. Трансторакальна ехоКГ також дозволяє оцінити кільце мітрального клапана та наявність кальцифікації клапана. Однак черезстравохідна ехоКГ рекомендована при субоптимальній візуалізації. Визначення функціонального стану та симптомів шляхом проведення кардіопульмонального навантажувального тесту може бути корисним у безсимптомних пацієнтів. Низька концентрація у плазмі крові натрійуретичного пептиду має високе негативне прогностичне значення, що важливо при повторному обстеженні безсимптомних хворих.
Оскільки величини тиску в легеневій артерії, визначені за допомогою ехоКГ, можуть не відповідати таким при інвазивному вимірюванні, катетеризація правих відділів серця має бути обов’язково проведена, якщо єдиним показанням до хірургічного втручання є легенева гіпертензія.
Показання до інтервенційних втручань при первинній хронічній мітральній недостатності наведені в табл. 2.89.
Таблиця 2.89. Показання до хірургічного лікування при тяжкій первинній мітральній недостатності
|
Показання |
Клас |
Рівень доказовості |
|
Реконструктивна операція на мітральному клапані є пріоритетною, якщо очікуються отримати довготривалий сприятливий результат втручання |
І |
С |
|
Симптомні пацієнти з ФВ ЛШ >30%. |
І |
В |
|
Асимптомні пацієнти із систолічною дисфункцією ЛШ (КСР ≥45 мм та/чи ФВ ЛШ ≤60%) |
І |
В |
|
Безсимптомні хворі зі збереженою систолічною функцією ЛШ (КСР <45 мм |
ІІа |
В |
|
Безсимптомні хворі зі збереженою ФВ ЛШ (>60%) і КСР 40–44 мм чи значна дилатація ЛП (індекс об’єму ≥60 мл/м 2 у хворих із синусовим ритмом) |
ІІа |
С |
|
Пацієнти з тяжкою дисфункцією ЛШ (ФВ <30% та/чи КСР >55 мм), рефрактерною до медикаментозної терапії з високою вірогідністю довготривалого ефекту від реконструктивної операції та низькою супутньою захворюваністю |
ІІа |
С |
Медикаментозне лікування. При хронічній мітральній недостатності зі збереженою функцією ЛШ відсутні докази переваги профілактичного застосування вазодилататорів, включаючи іАПФ. Однак ці препарати слід застосовувати при виникненні СН у пацієнтів, яким не можна виконати хірургічне лікування чи при збереженні симптомів після хірургічного втручання. ББА та спіронолактон (чи еплеренон) також слід застосовувати при лікуванні цих пацієнтів.
Вторинна мітральна недостатність
При вторинній мітральній недостатності (раніше відома як «функціональна мітральна недостатність») стулки клапана та хорди структурно нормальні, й мітральна недостатність є результатом дисбалансу між «закриваючими» та «натягуючими» силами, що впливають на клапан внаслідок порушення геометрії ЛШ. Найчастіше це виявляють при ДКМП та ішемічній кардіоміопатії. Дилатація мітрального кільця при хронічній ФП та збільшенні ЛП є також механізмом вторинної мітральної недостатності.
Вторинна мітральна недостатність є динамічним станом. Отримати прогностичну інформацію щодо динамічних характеристик мітральної недостатності дозволяє ехоКГ-оцінка мітральної недостатності під час фізичного навантаження. Може бути корисним виявлення життєздатного міокарда у пацієнтів з ішемічною вторинною мітральною недостатністю, які є кандидатами для реваскуляризації (табл. 2.90).
Таблиця 2.90. Показання до оперативного втручання при хронічній вторинній мітральній недостатності
|
Показання |
Клас |
Рівень доказовості |
|
Пацієнти з тяжкою вторинною мітральною недостатністю і ФВ ЛШ >30%, що підлягають АКШ |
І |
С |
|
Симптомні пацієнти з тяжкою мітральною недостатністю, ФВ ЛШ <30% з можливістю проведення реваскуляризації та життєздатним міокардом |
ІІa |
С |
|
Симптомні пацієнти з тяжкою вторинною мітральною недостатністю, ФВ ЛШ <30% без показань до проведення реваскуляризації, які залишаються симптомними, незважаючи на ОМТ (включаючи ресинхронізацію серця, якщо вона показана), і мають низький хірургічних ризик |
ІІb |
С |
|
Ендоваскулярна пластика мітрального клапана за методикою «від краю до краю» може бути розглянута у пацієнтів із тяжкою вторинною мітральною недостатністю, ФВ ЛШ <30% без показань до проведення реваскуляризації та з низьким хірургічним ризиком, які залишаються симптомними, незважаючи на ОМТ (включаючи ресинхронізацію серця, якщо вона показана), і мають сприятливу морфологію клапана за даними ехоКГ |
ІІb |
С |
Лікування при мітральній недостатності консервативне і ефективніше, ніж при мітральному стенозі. Зменшення регургітації та тривале клінічне покращення може спостерігатися при застосуванні вазодилататорів артеріолярного чи змішаного типу — іАПФ, БРА, АМР. У цих пацієнтів при ФП ефективними є також дигоксин і ББА (останні додають після застосування іАПФ) [3, 4].
У хворих із мітральною недостатністю спостерігається підвищений ризик виникнення інфекційного ендокардиту, тому при лихоманці та у разі втручань, пов’язаних із ризиком бактеріємії, необхідно проводити профілактику інфекційного ендокардиту за допомогою антибіотиків. При гострій мітральній недостатності проводять хірургічне лікування і призначають нітрогліцерин чи нітропрусид натрію, альтернативний препарат — урапідил.
Прогноз. Невелика і навіть помірна безсимптомна мітральна недостатність істотно не впливає на виживаність. Прогноз погіршується після приєднання інфекційного ендокардиту. При мітральній недостатності виділяють перший період — компенсований, другий — пасивної легеневої гіпертензії, третій період — правошлуночкової недостатності зі збільшенням печінки, розвитком набряків. Виражена мітральна недостатність швидко призводить до тяжкої СН.
Протипоказання до проведення перкутанної мітральної комісуротомії:
- площа отвору клапана >1,5 см2*;
- тромб у ЛП;
- більше ніж легка мітральна недостатність;
- тяжка чи бікомісуральна кальцифікація;
- відсутність спаяння комісур;
- супутня тяжка патологія АК чи комбінований трикуспідальний стеноз і регургітація, які потребують хірургічного лікування.
Примітка. *Перкутанна мітральна комісуротомія може бути розглянута у пацієнтів із площею отвору клапана >1,5 см2 і симптомами, які не можна пояснити іншими причинами за умови сприятливих анатомічних характеристик клапана.
2.7.1.3. Пролапс мітрального клапана
Визначення. Пролапс мітрального клапана (синдром Барлоу) — провисання однієї чи обох стулок мітрального клапана у бік ЛП у систолу шлуночків. Чим більше виражений пролапс мітрального клапана, тим значніша мітральна регургітація. У деяких дослідженнях частота виникнення пролапсу мітрального клапана в популяції становить від 1,6–2,5% до 21% випадків. У чоловіків при вираженому пролапсі мітрального клапана частіше виникає мітральна недостатність, яка потребує хірургічного лікування.
Етіологія. Встановлені чи можливі такі причини пролапсу мітрального клапана:
1. Загальні ураження сполучної тканини:
- синдром Марфана;
- синдром Елерса — Данло;
- синдром Холта — Орама;
- синдром Шершевського — Тернера;
- синдром Дауна.
2. Патологія сухожильних хорд.
3. Патологія папілярних м’язів (із надмірним їх натягненням, з розвитком субендокардіальної ішемії).
4. Патологія стулок:
- міксоматозна дегенерація стулки;
- виражений дефект сполучної тканини.
5. Вегетативний дисбаланс із підвищенням рівня циркулюючих катехоламінів.
Можливе виникнення пролапсу мітрального клапана після дегідратації (наприклад після прийому фуросеміду).
Основні ланки патогенезу пролапсу мітрального клапана:
1. Надмірне натягнення папілярних м’язів зі збільшенням локальної потреби кисню з розвитком субендокардіальної ішемії.
2. Вегетативний дисбаланс із активацією симпатичної та зниженням функції парасимпатичної НС зі збільшенням синтезу катехоламінів (адреналін, норепінефрин).
3. Розвиток підвищеної вазомоторної реактивності в басейні КА, схильність до епізодів зниження коронарної перфузії.
4. Порушення ендокарда та ендотелію в зонах міксоматозної трансформації з формуванням тромбоцитарно-фібринних тромбів.
5. Розвиток аритмогенезу в результаті надмірного натягування стулок, сухожильних хорд, папілярних м’язів та дилатації ЛП.
Загальноприйнятої класифікації пролапсу мітрального клапана не існує. Захворювання можна класифікувати за низкою критеріїв:
1. За етіологією:
- первинний (вроджений чи ідіопатичний):
- ізольований,
- поєднаний;
- вторинний (набутий) неуточнений.
2. За локалізацією та кількістю вроджених стулок: передня, задня чи обидві стулки.
3. За ступенем вираженості:
І — незначний — 3–5 мм;
ІІ — помірний — 6–9 мм;
ІІІ — виражений — ≥10 мм.
4. За допплер-ехоКГ-дослідженням виділяють 4 ступені мітральної недостатності:
І ст. — недостатність проникає в порожнину передсердя на ¼ її глибини;
ІІ ст. — недостатність проникає в порожнину передсердя на ½ її глибини;
ІІІ ст. — недостатність на ¾ її глибини;
ІV ст. — недостатність досягає протилежної сторони передсердя.
5. За клінічним перебігом:
- безсимптомний;
- кардіалгічний;
- аритмічний;
- синкопальний;
- розвиток раптової смерті;
- ускладнений (інфекційний ендокардит, ХСН).
Первинний пролапс мітрального клапана характеризується наявністю «міксоматозної дегенерації» клапанних структур, тобто відбувається процес руйнування та втрати нормальної архітектоніки фібриляторних структур сполучної тканини з накопиченням кислих мукополісахаридів без ознак запалення. Вторинний пролапс мітрального клапана є ускладненням будь-якого захворювання (ревматизм та інші системні захворювання сполучної тканини, інфекційний ендокардит, міокардит, ІХС, ГКМП, гіпертиреоз, емфізема легень, травма серця, аномалія Ебштейна тощо).
Клініка і діагностика захворювання наведені в алгоритмі 2.33, табл. 2.91.
|
Алгоритм 2.33. Критерії діагностики пролапсу мітрального клапана [17] 1. Хворі скаржаться на біль у ділянці серця за типом кардіалгії, серцебиття, перебої в роботі серця, задишку, запаморочення, втрату свідомості. 2. Пульс суттєво не змінюється або стає аритмічним. 3. Межі відносної тупості серця зміщуються вліво і доверху при розвитку мітральної недостатності. 4. Аускультативно визначається дзвінкий І тон, пізній систолічний шум систолічний щиголь (клацання), які мають тенденцію змінюватись у динаміці (у 20% випадків патологія з боку серця може не визначатися). 5. ЕКГ-критерії: неспецифічне зміщення сегмента ST від ізолінії; приплюснутий, двофазовий або негативний зубець Т у ІІ, ІІІ, V5–6 відведеннях. Можуть визначатись суправентрикулярні екстрасистоли, ПТ, ФП, подовження інтервалу Q–T. 6. ЕхоКГ-критерії:
За допомогою допплер-ехоКГ можна визначати наявність діастолічного турбулентного потоку у вихідному тракті ЛШ. Ступені пролапсу мітрального клапана за даними ехоКГ:
7. Рентгенологічні критерії: при розвитку мітральної недостатності виникає збільшення ЛШ, ЛП та згладжування талії серця. |
Таблиця 2.91. Великі та малі критерії діагностики пролабування мітрального клапана
|
Великі критерії |
|
|
1. Аускультативні |
|
|
2. ЕхоКГ-критерії |
|
|
3. ЕхоКГ + аускультативні критерії |
|
|
Малі критерії |
|
|
1. Аускультативні критерії |
|
|
2. ЕхоКГ-критерії |
|
|
Клінічні ознаки спадкових захворювань та синдромів, при яких трапляється пролапс мітрального клапана |
|
|
1. Загальні |
Високий зріст, довгі кінцівки відносно величини торса, арахнодактилія, особливості будови черепа та грудної клітки (синдром Марфана); наявність псевдоартрозів, євнухоподібна будова тіла, гінекомастія, подовжені кінцівки при синдромі Клайнфелтера |
|
2. Грудна клітка |
Гострий епігастральний кут, зменшення передньозаднього розміру грудної клітки, вдавлення груднини, кіфоз, сколіоз, синдром прямої спини |
|
3. Форма черепа, обличчя |
Доліхоцефалія, довге і вузьке обличчя, готичне піднебіння у поєднанні з високим голосом при синдромі Марфана, маскоподібне обличчя, опущені повіки, низька лінія росту волосся при mіotonіа dystrophісa (часто поєднується з порушеннями ритму серця та провідності), низько посаджені вуха |
|
4. Очі |
Міопія, косоокість, ектопія кришталика, епікат, блакитні склери |
|
5. Шкіра |
Численні пігментні плями за типом веснянок, стоншення та ранимість шкіри, схильність до мікрогеморагій у місцях стиснення, підвищене розтягнення шкіри, атрофічні борозни, підшкірні вузлики, переважно на передній поверхні гомілок (синдром Елерса — Данло) |
|
6. Венозні судини |
Варикоцеле у юнаків, розширення вен нижніх кінцівок у жінок молодого віку, які не народжували дітей |
|
7. Гіпермобільність суглобів |
Можливість пасивного розгинання V пальця рук перпендикулярно до тильної поверхні кісті, пасивне приведення І пальця до стику з передпліччям, перерозгинання в ліктьових і колінних суглобах, можливість доторкнутися долонями підлоги, коліна, що не згинаються, при синдромі Елерса — Данло |
Пролапс мітрального клапана часто має сприятливий перебіг. Поряд з цим інколи виникають ускладнення.
Ускладнення пролапсу мітрального клапана:
1. Мітральна недостатність трапляється у 70–85% осіб і потребує оперативного лікування у 40% випадків. Численними масштабними дослідженнями доведено, що ризик розвитку гемодинамічно значущої недостатності за 10 років становить до 1%, в той час як при значному потовщенні або збільшенні площин стулок ризик досягає 15%. Постійна регургітація крові призводить до ураження міксоматозної тканини і деформації мітрального клапана, що спричиняє розвиток дисфункції ЛШ.
2. Інфекційний ендокардит інколи (у 10–30% випадків) ускладнює пролапс мітрального клапана, що пов’язано з різними інвазивними втручаннями.
3. Розвиток різних аритмій серця (суправентрикулярної та шлуночкової екстрасистолії, ФП, суправентрикулярної ПТ, брадиаритмії). Вважають, що порушення ритму зумовлені такими чинниками:
- утворенням патологічного підвищеного автоматизму та/чи тригерної активності;
- надшлуночковим натягненням стулок, сухожильних хорд і капілярних м’язів при пролабуванні мітрального клапана;
- дилатацією ЛП;
- активацією симпатичної та пригніченням парасимпатичної НС;
- фіброзними змінами в капілярних м’язах і міокарді ЛП та/чи ЛШ;
- дисплазією артерії, яка кровозабезпечує АV-вузол. ШТ за типом «пірует» та дисперсія інтервалу Q–T можуть спричиняти ФШ і РСС.
4. Гострі церебральні ішемічні катастрофи з розвитком транзиторних атак та ішемічного інсульту (порушення ендотелію в зонах міксоматозної трансформації призводить до утворення тромбоцитарно-фібринних тромбів і церебральних емболізацій).
Лікування. Найефективнішими засобами в терапії при пролапсі мітрального клапана є ББА і препарати магнію при гіпомагніємії.
Нітрати в цьому разі не слід призначати, оскільки вони можуть посилювати пролабування мітрального клапана та призводити до виникнення локальної ішемії. З метою профілактики тромбоутворень застосовують антитромбоцитарні препарати (АСК, клопідогрель).
Лікування при аритміях здійснюють за загальними правилами, однак при тяжких шлуночкових тахіаритміях, резистентних до лікування, розриві хорд і вираженому їх подовженні, а також тяжкій регургітації крові застосовують хірургічне лікування. При тяжкій мітральній недостатності необхідно протезувати мітральний клапан або виконати пластику мітрального клапана. Із ААП застосовують ББА у комбінації з магнієм, а при шлуночкових екстрасистолах високих градацій — аміодарон. Згідно з рекомендаціями АНА/АСС, хворому на пролапс мітрального клапана, що ускладнився ФП, ХСН, показаний варфарин. У разі безсимптомного перебігу захворювання лікування не потрібне.
За наявності вираженої мітральної недостатності, особливо з ознаками лівошлуночкової недостатності, показане хірургічне лікування (пластика мітрального клапана, що дає кращі віддалені результати, ніж його протезування).
2.7.1.4. Комбінована мітральна вада серця
Комбінована мітральна вада серця трапляється часто і, як правило, має ревматичне походження. Недостатність мітрального клапана здебільшого виникає на тлі мітрального стенозу. Порушення гемодинаміки несприятливі, оскільки у систолу ЛШ частина крові, яка повинна знову пройти через звужений мітральний отвір, повертається до ЛП. Це спричиняє тяжкість перебігу комбінованої мітральної вади серця. Клінічно при комбінованій мітральній ваді визначають симптоми мітрального стенозу і недостатності. На пізніх стадіях цієї вади виникають різні ускладнення внаслідок значної дилатації порожнин серця і розширення фіброзних кілець.
Розрізняють три варіанти комбінованої мітральної вади серця:
1) з переважанням мітрального стенозу;
2) з переважанням мітральної недостатності;
3) без чіткого переважання.
У хворих із переважанням стенозу мітрального отвору основними клінічними ознаками є задишка і серцебиття, які виникають рано і прогресивно наростають. Поряд з цим виникає «котяче муркотіння», симптом метелика, межі відносної тупості серця зміщуються переважно доверху і вправо (менше вліво). При аускультації І тон на верхівці посилений (ляскаючий), вислуховуються перш за все прото-, мезодіастолічний або пресистолічний шум і слабший систолічний шум на верхівці, який проводиться в аксилярну ділянку.
При комбінованій мітральній ваді серця з переважанням недостатності спостерігається виражене зміщення відносної тупості серця вліво і доверху (мало вправо). На верхівці серця І тон послаблений, визначається виражений систолічний шум, який проводиться в аксилярну впадину. Діастолічні шуми при цій ваді серця менш виражені. За допомогою ехоКГ і рентгенологічного дослідження визначають переважне розширення ЛШ і ЛП. У хворих із переважанням мітрального стенозу визначають переважне розширення ПШ, ЛП і правого передсердя.
У хворих з комбінованою мітральною вадою серця без чіткого переважання виявляють однаковою мірою симптоми як недостатності, так і стенозу. Для точної діагностики ступеня вираженості кожного з компонентів комбінованої мітральної вади використовують катетеризацію серця та ліву вентрикулографію, які дозволяють визначити величину тиску в порожнинах серця і магістральних судинах, розміри порожнин серця і вираженість регургітації крові в ньому.
Лікування пацієнтів із комбінованою вадою включає такі заходи:
1) профілактику рецидиву гострої ревматичної лихоманки;
2) профілактику інфекційного ендокардиту в усіх хворих;
3) лікування при ФП із застосуванням ББА, дигоксину, варфарину, діуретиків;
4) хірургічне лікування.
2.7.1.5. Аортальний стеноз
Визначення. Аортальний стеноз — це звуження гирла аорти, одна із найпоширеніших вад серця, яка охоплює від 5 до 23% усіх набутих вад серця. Вади аортальних клапанів за частотою займають друге місце після мітральних.
Аортальний стеноз потребує хірургічного лікування чи транскатетерного втручання в Європі та Північній Америці, що пов’язано зі старінням популяції цих країн.
Етіологія. Аортальний стеноз буває ревматичної, дегенеративної та вродженої природи. Ізольований аортальний стеноз свідчить про неревматичну етіологію. В нормі площа гирла аорти становить 2–3 см2; клінічні симптоми вади з’являються при площі гирла аорти 0,75 см2 (площа 0,5 см2 — критична).
Клініка і діагностика аортального стенозу наведені в алгоритмі 2.34.
|
Алгоритм 2.34. Критерії діагностики аортального стенозу [17] 1. Хворі скаржаться на задишку, запаморочення, синкопальні стани (зумовлені діастолічною дисфункцією), появу набряків на ногах при розвитку ХСН, напади стенокардії (у 70% хворих) за рахунок порушення взаємозв’язку між доставкою і потребою міокарда в кисні. 2. Пульс малий (parvus), рідкий (rarus), повільний (tardus); визначається систолічне тремтіння у ІІ міжребер’ї справа від груднини; САТ знижений. 3. Межі відносної тупості серця зміщуються вліво і донизу. 4. Аускультативні критерії: грубий систолічний шум у ІІ міжребер’ї справа, який проводиться на артерії шиї та в міжлопаткову ділянку; ІІ тон над аортою послаблений. 5. ЕКГ-критерії: ГЛШ (пізніше, коли з’являється мітралізація, — гіпертрофія ЛП), БЛНПГ. 6. ЕхоКГ-критерії двомірного режиму:
7. Критерії допплер-ехоКГ:
8. Рентгенологічні критерії: розширення аорти, ГЛШ, звапнення клапана аорти. |
У більшості випадків клінічні симптоми аортального стенозу виникають у пацієнтів віком понад 50 років. Тривала компенсація вади забезпечується ГЛШ. Для хворих з аортальним стенозом характерна класична клінічна тріада: стенокардія напруження, непритомність при фізичному навантаженні та СН. Після появи клінічних симптомів вади тривалість життя хворих рідко перевищує 5 років (після виникнення стенокардії — 5 років, після появи непритомності — приблизно 3 роки, після появи ознак СН — 1,5–2 роки). Тому виникнення будь-якого з цих симптомів є показанням до хірургічного лікування аортального стенозу. Розвиток ГЛШ при цій ваді серця теж є несприятливим фактором. Згідно з рекомендаціями ААС/ЄТК (2016), за даними ехоКГ-дослідження, аортальний стеноз вважають тяжким при площі отвору <1,0 см2 (або <0,6 см2/м2 площі поверхні тіла); помірним — при площі отвору в межах 1,0–1,5 см2 (або в межах 0,6–0,9 см2/м2 площі поверхні тіла).
Лікування. Виникнення клінічних симптомів аортального стенозу є показанням до хірургічного лікування, яке може продовжити тривалість життя на 10–15 років.
Жодне медикаментозне лікування при аортальному стенозі не може покращити прогноз порівняно з природним перебігом захворювання. Результати рандомізованих досліджень свідчать, що статини не впливають на перебіг аортального стенозу. Пацієнтів із симптомами СН, які не підходять для протезування АК, або які чекають на хірургічне чи інтервенційне втручання, слід лікувати відповідно до протоколів надання допомоги хворим із СН. Має проводитися антигіпертензивне лікування за наявності гіпертонічної хвороби. Медикаментозне лікування має бути обережним з метою уникнення гіпотонії. Утримання синусового ритму є важливим фактором. При цьому периферичні вазодилататори та діуретики слід призначати дуже обережно, оскільки відбувається посилення симптомів вади серця, а серцеві глікозиди — тільки при ГЛШ, коли КСО становить >50 мл, а ФВ ЛШ <35%, але вони можуть призводити до підвищення частоти нападів стенокардії (!) [7, 35, 44].
Зазвичай призначають ББА, іАПФ, БРА, антитромбоцитарні препарати та антикоагулянти. Однак ББА при тяжкій стадії ХСН (коли площа аортального клапана <1,0 см2) протипоказані, а іАПФ, БРА малоефективні. При виникненні персистуючої форми ФП препаратом вибору є аміодарон.
Тактика лікування хворих з набутими вадами серця за наявності асоційованої патології
Особливості терапевтичного підходу до пацієнтів із поєднанням ІХС, ФП та набутих вад серця представлено у табл. 2.92.
Таблиця 2.92. Тактика лікування пацієнтів із набутими вадами серця за наявності ФП (ЄТК, 2017; ВАКУ, 2018)
|
Антикоагулянтна терапія |
||
|
У хворих із мітральним стенозом у поєднанні із ФП необхідно розглядати НПАК як альтернативу АВК |
ІІа |
В |
|
НПАК слід розглядати як альтернативу АВК у хворих із ФП із четвертого місяця після хірургічної чи транскатетерної імплантації біопротеза аортального клапана (!) |
ІІа |
С |
|
Не рекомендовано застосовувати НПАК у хворих із ФП та помірним/вираженим мітральним стенозом |
ІІІ |
С |
|
НПАК протипоказані хворим із механічним клапанним протезом (!) |
ІІІ |
В |
|
Хірургічне втручання |
||
|
Перед оперативним втручанням на клапані у хворих із симптомним перебігом ФП необхідно розглядати хірургічну абляцію |
ІІа |
А |
|
Хворим, які підлягають оперативному втручанню на клапані, може бути розглянуте хірургічне видалення чи кліпування вушка ЛП |
ІІb |
В |
Найпоширенішим методом оперативного лікування хворих з аортальним стенозом є балонна дилатація за відсутності звапнення клапана аорти при ФВ ˂20%, яка покращує стан пацієнтів, але не впливає на прогноз захворювання. Однак основним методом корекції стенозу аортального отвору є протезування аортального клапана. Показанням до операції є тяжкий аортальний стеноз (стенокардія, втрата свідомості, задишка) (рівень доказовості В). Експерти США і Європи зазначають, що оперативне лікування цих хворих має здійснюватися практично незалежно від величини ФВ ЛШ. Таке лікування призначають навіть людям похилого віку (старше 80 і навіть 90 років).
2.7.1.6. Аортальна недостатність
Визначення. Аортальна недостатність — це ретроградна течія крові з аорти до ЛШ через змінений аортальний клапан або розширення аортального кільця.
Цю ваду серця діагностують у 3,6–10 разів частіше у чоловіків, ніж у жінок. Причиною цієї вади є ревматизм (у 80% випадків).
Розвиток аортальної недостатності може бути спричиненим як первинним захворюванням клапанних стулок, так і порушенням геометрії кореня та висхідного відділу аорти. У країнах Заходу найпоширенішим етіологічним чинником аортальної недостатності є дегенеративний процес три- чи двостулкового аортального клапана. Серед інших причин — інфекційний та ревматичний ендокардит. Гострий розвиток аортальної недостатності зазвичай спричинений саме інфекційним ендокардитом і рідше — розшаруванням аорти.
Етіологія і патогенез. Розрізняють гостру та хронічну аортальну недостатність, які мають різні механізми розвитку. Гостра аортальна недостатність може виникати при інфекційному ендокардиті, розшаровуючій аневризмі аорти висхідної частини, системному червоному вовчаку тощо. Хронічну аортальну недостатність найчастіше спричиняють ревматизм, інфекційний ендокардит, атеросклероз, дифузні захворювання сполучної тканини, травми грудної клітки, сифіліс, синдром Марфана. Розширення аорти буває ідіопатичним та при АГ.
Клініка і діагностика аортальної недостатності наведені в алгоритмі 2.35.
|
Алгоритм 2.35. Критерії діагностики аортальної недостатності [17, 25] 1. Хворі скаржаться на відчуття поштовхів, пульсацію в шиї, біль у ділянці серця за типом кардіалгії, непритомність; при декомпенсації — задишку, біль у правому підребер’ї. 2. Пульс частий (freguens), швидкий (сeller), високий (altus) і великий (magnus). Визначаються периферичні симптоми (пульсуюча людина, позитивний симптом Мюсе, Квінке тощо). Верхівковий поштовх резистентний, куполоподібний. САТ підвищується, ДАТ — знижується. 3. Межі відносної тупості серця зміщуються вліво і донизу, розширення судинного пучка відбувається вправо за рахунок аорти. 4. Аускультативні критерії: визначається послаблення І тону, дуючий протодіастолічний шум над аортою і в точці Боткіна — Ерба, який слабко проводиться на верхівку. На верхівці серця може вислуховуватись діастолічний шум Флінта. При аускультації стегнової артерії визначається подвійний тон Траубе та подвійний шум Виноградова — Дюроз’є. Наявність високочастотного діастолічного шуму «музичого» характеру дозволяє припустити перфорацію стулки клапана. 5. ЕКГ-критерії: ознаки ГЛШ, при мітралізації вади — ЛП. 6. ЕхоКГ-критерії Критерії двомірного режиму:
Критерії допплер-ехоКГ:
7. Рентгенологічні критерії: визначається ГЛШ, аортальна конфігурація серця, розширення аорти. |
При аортальній недостатності визначають «бичаче серце», УО може досягати 200 мл, а ХОК — 25 л/хв. (приблизно, як у бігуна-марафонця під час бігу) (!). Багато років єдиною скаргою може бути відчуття пульсації та серцебиття, особливо в лежачому положенні. Хворі дуже погано переносять екстрасистолію, оскільки збільшується об’єм ЛШ після паузи за рахунок регургітації крові. Водночас пацієнти добре переносять фізичні навантаження, оскільки вазодилатація у працюючих м’язах і тахікардія знижують ступінь аортальної недостатності.
Набуті вади серця за стадіями наведено в табл. 2.93.
Таблиця 2.93. Стадії набутих вад серця
|
Стадії |
Вади серця |
|||
| Мітральний стеноз |
Мітральна недостатність | Аортальний стеноз | Аортальна недостатність | |
|
І |
Компенсації |
Компенсації |
Повної компенсації |
Повної компенсації |
|
ІІ |
Легеневого застою |
Субкомпенсації |
Прихованої СН |
Прихованої СН |
|
ІІІ |
Правошлуночкової |
Правошлуночкової |
Відносної коронарної недостатності |
Субкомпенсації |
|
IV |
Дистрофічна |
Дистрофічна |
Вираженої лівошлуночкової недостатності |
Декомпенсації |
|
V |
Термінальна |
|||
Зниження ДАТ ˂50 мм рт. ст. є ознакою вираженого ступеня вади. З іншого боку, ДАТ >90 мм рт. ст. свідчить про незначну аортальну недостатність (за відсутності симптомів СН).
Прогноз. Після виникнення стенокардії напруження середня тривалість життя становить близько 4 років, а після проявів ознак СН — приблизно 3 роки.
Лікування, спрямоване на основне захворювання: застосовують сечогінні препарати, АМР, іАПФ, БРА; при ФП — антикоагулянти, антитромбоцитарні препарати, серцеві глікозиди, статини тощо. При аортальній недостатності застосування ніфедипіну, амлодипіну, каптоприлу, празозину сприяє зменшенню недостатності, покращує показники функціонального стану ЛШ і клінічного покращення стану хворих і нормалізації АТ.
Засоби, які знижують ЧСС, внутрішньоаортальна балонна контрапульсація протипоказані, оскільки вони призводять до збільшення об’єму регургітації.
Призначення серцевих глікозидів може бути ефективним у деяких хворих з ознаками СН, але їх застосовують обмежено. Показаннями до оперативного лікування аортальної недостатності є ІІІ–ІV стадія вади, ознаки ХСН ІІІ–ІV ФК (за класифікацією NYHA), непритомність, ангінозний біль у серці, лівошлуночкова недостатність, виражена кардіомегалія. ЕхоКГ-показання до операції: КСР >55 мм, КДР >75 мм, ФВ <50% (рівень доказовості В). При гострій аортальній недостатності призначають вазодилататори (нітропрусид натрію, нітрати, іАПФ) у комбінації з петльовими діуретиками [4]. У більшості пацієнтів тяжка стадія аортальної недостатності коригується імплантацією протеза клапана в умовах штучного кровообігу.
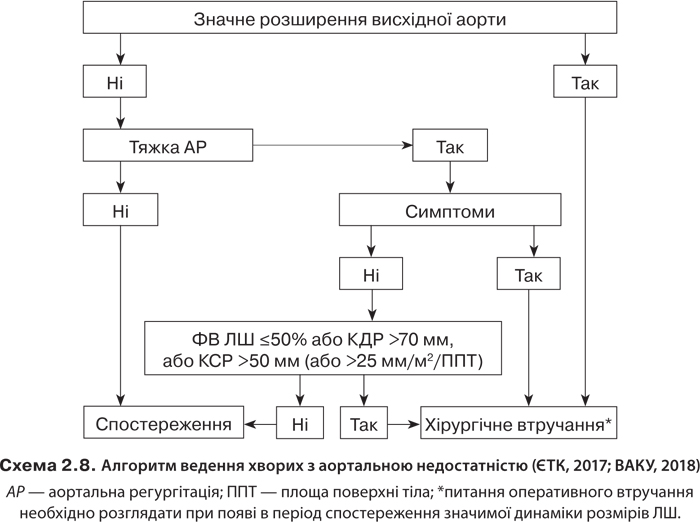
Ведення хворих з аортальною недостатністю — див. на схемі 2.8.
2.7.1.7. Комбінована аортальна вада
Аортальний стеноз у поєднанні з недостатністю становлять комбіновану аортальну ваду серця. У хворих із комбінованою аортальною вадою серця визначаються клінічні та інструментальні ознаки як стенозу, так і недостатності.
Комбінована аортальна вада серця буває: 1) з переважанням стенозу; 2) з переважанням недостатності; 3) без чіткого переважання. При цьому виникають скарги, характерні для обох вад. У другому міжребер’ї праворуч від краю груднини вислуховується як систолічний, так і діастолічний шуми, виникають ознаки гіпертрофії та дилатації ЛШ. Якщо у хворих переважає стеноз, то САД і пульсовий АТ знижені; якщо переважає аортальна недостатність, то вони зростають. Під час ехоКГ і рентгенологічного досліджень при комбінованій ваді визначають критерії як стенозу, так і недостатності. При переважанні аортального стенозу визначають обмежене постстенотичне розширення ділянки висхідної частини аорти. Якщо переважає аортальна недостатність, визначається дифузне розширення аорти.
При комбінованій ваді серця, на відміну від ізольованих, менш виражені задишка й ознаки застою крові в легенях, а також периферичні ознаки аортальної недостатності. Досить надійними ознаками переваги аортальної недостатності є характерні зміни пульсу, виражений ІІІ тон, високий САТ, тоді як при аортальному стенозі властивості пульсу протилежні, САТ низький.
2.7.1.8. Поєднані мітрально-аортальні вади серця
Відомі такі поєднання мітрально-аортальних вад серця:
1. Мітрально-аортальний стеноз.
2. Мітральний стеноз у поєднанні з аортальною недостатністю.
3. Мітрально-аортальна недостатність.
У кожному з цих поєднаних мітрально-аортальних вад серця можливі три варіанти:
1) з переважанням мітральної вади;
2) з переважанням аортальної вади;
3) без суттєвого переважання жодної з цих вад.
Крім цього, мітральна й аортальна вада можуть проявлятися стенозом або недостатністю. Отже, у цих пацієнтів може бути багато різних варіантів поєднаних мітрально-аортальних вад серця.
І. Мітрально-аортальний стеноз
1. У пацієнтів із мітрально-аортальним стенозом із переважанням мітрального стенозу з-поміж клінічних проявів на перший план виступають зміщення відносної тупості серця доверху і вправо (менше вліво), посилений (клацаючий) І тон; прото-, мезодіастолічний або пресистолічний шум, ритм перепілки, пресистолічний ритм галопу. Систолічний шум над аортою, характерний для аортального стенозу, менш виражений.
ЕхоКГ-критерії:
- на ехоКГ спостерігаються ознаки, характерні для мітрального стенозу;
- «П»-подібний рух передньої стулки мітрального клапана;
- на користь аортального стенозу свідчить ущільнення та потовщення стінок аорти і стулок аортального клапана, зменшення систолічного відкриття аортальних стулок;
- такі ознаки аортального стенозу, як постстенотичне розширення аорти внаслідок нормальної швидкості кровотоку через аортальний отвір, як правило, відсутні;
- характерне виражене збільшення ЛП, перевантаження тиском, а пізніше — об’ємом ПШ;
- концентричний тип ремоделювання ЛШ.
2. При поєднаному мітрально-аортальному стенозі з переважанням аортального стенозу спостерігається розширення серця вліво і донизу (менше доверху і вправо), послаблений І тон, грубий систолічний шум над аортою, який проводиться на сонну артерію та в міжлопатковий простір. Діастолічний шум, ритм перепілки маловиражений.
ЕхоКГ-критерії:
- на ехоКГ визначаються ознаки, характерні для аортального стенозу;
- виявляються всі без винятку ознаки помірного мітрального стенозу;
- спостерігається помірне збільшення порожнини ЛП;
- концентричний тип ремоделювання порожнини ЛШ.
3. Клініко-інструментальні особливості мітрально-аортального стенозу, які виражені однаковою мірою:
- межі відносної тупості серця значно розширені вліво, доверху і вправо;
- сила І тону на верхівці збережена, але він не посилений;
- вислуховуються прото-, мезодіастолічний або пресистолічний шум на верхівці на фоні систолічного шуму над аортою.
ЕхоКГ-критерії:
- визначають ознаки як мітрального, так і аортального стенозу;
- спостерігається збільшення ЛП різного ступеня вираженості; вираженість перевантаження правих відділів серця також залежить від ступеня мітрального стенозу;
- концентричне ремоделювання ЛШ, яке супроводжується легким або помірним потовщенням його стінки (1,2–1,6 см).
ІІ. Мітральний стеноз у поєднанні з помірною аортальною недостатністю
Виділяють два варіанти мітрального стенозу в комбінації з аортальною недостатністю: 1) з переважанням мітрального стенозу; 2) з переважанням аортальної недостатності.
1. Мітральний стеноз у поєднанні з помірною аортальною недостатністю з переважанням стенозу характеризується тим, що на перший план виступають клініко-ехоКГ-симптоми мітрального стенозу. При цьому визначається переважне зміщення відносної тупості серця вправо, значне посилення І тону на верхівці, вислуховується переважно діастолічний шум на верхівці (слабкий діастолічний шум над аортою) на тлі маловиражених (або відсутніх) периферичних симптомів аортальної недостатності.
ЕхоКГ-критерії:
- визначаються всі ехоКГ-ознаки вираженого мітрального стенозу;
- характерна наявність «клапанних» ознак аортальної недостатності: «шарованість», підвищення ехогенності стулок і стінок аорти, сепарація та тремтіння стулок у діастолу;
- діастолічне тремтіння передньої мітральної стулки в результаті її фіброзу та ущільнення не визначається;
- знижується об’єм аортальної недостатності, в результаті чого дилатація кореня аорти, гіперкінез її стінок та дилатація порожнини ЛШ будуть відсутніми;
- швидкість турбулентного діастолічного потоку в вихідному тракті ЛШ незначна;
- розміри та об’єм порожнини ЛШ, а також товщина її стінок будуть у межах нормальних величин;
- виражене збільшення ЛП і наявність ознак перевантаження ПШ.
2. У хворих на мітральний стеноз у комбінації з вираженою аортальною недостатністю спостерігаються виражені периферичні симптоми недостатності, зміщення межі відносної тупості серця переважно вліво (менше доверху і вправо), ослаблений І тон, переважає діастолічний шум більше над аортою, ніж на верхівці.
ЕхоКГ-критерії:
- ознаки вираженої аортальної недостатності;
- визначаються ознаки помірного мітрального стенозу;
- дрібноамплітудне діастолічне тремтіння передньої мітральної стулки внаслідок її фіброзу та ущільнення, як правило, не виявляється;
- характерна дилатація ЛШ (ексцентричний тип ремоделювання);
- помірна дилатація ЛП.
ІІІ. Мітрально-аортальна недостатність
Поєднання органічної мітральної недостатності з аортальною недостатністю трапляється рідко. Значно частіше наявне поєднання аортальної недостатності зі вторинною недостатністю мітрального клапана (мітралізація аортальної недостатності).
Клінічно при поєднанні мітральної недостатності з аортальною визначається виражене послаблення І тону на верхівці, наявність систолічного шуму на верхівці та діастолічного шуму над аортою на тлі ознак периферичних симптомів недостатності аортальних клапанів.
ЕхоКГ-критерії:
- виявляються всі ознаки органічної мітральної недостатності;
- про наявність аортальної недостатності свідчить сепарація і тремтіння аортальних стулок у діастолу та турбулентний діастолічний потік у вихідному тракті ЛШ (в результаті аортальної недостатності). При вираженій аортальній та помірній мітральній недостатності може визначатися ретроградний потік у низхідній та черевній аорті як наслідок важкої аортальної недостатності;
- дрібноамплітудне діастолічне тремтіння передньої мітральної стулки за наявності органічної мітральної недостатності та вираженого фіброзу стулок у хворих з аортальною недостатністю не визначається;
- характерна виражена дилатація ЛШ з ознаками її об’ємного перевантаження, а також дилатація ЛП;
- при ревматичному ураженні, коли спостерігається поєднане ураження мітрального клапана, визначаються ознаки помірного мітрального стенозу.
2.7.1.9. Трикуспідальний стеноз
Площа отвору тристулкового клапана становить 7 см2, а окружність клапанного кільця — 10–12,2 см. Стеноз правого АV-отвору трапляється дуже рідко.
Трикуспідальний стеноз зазвичай комбінується із трикуспідальною недостатністю, а його причиною найчастіше є ревматичне ураження трикуспідального клапана. Майже завжди патологія трикуспідального клапана в цьому разі поєднується з ураженням клапанів лівих відділів серця, особливо мітрального клапана, що і зумовлює відповідну клінічну симптоматику. Інші причини трикуспідального стенозу бувають рідко — вроджена вада, медикаментозно-індуковане ураження, хвороба Уїппла, ендокардит, масивна пухлина правого передсердя [17, 58].
Етіологія. Ця вада серця майже завжди має ревматичне походження, при цьому не відбувається звапнення стулок.
Клініка і діагностика трикуспідального стенозу наведені в алгоритмі 2.36.
|
Алгоритм 2.36. Критерії діагностики трикуспідального стенозу [17, 25, 60] 1. Хворі скаржаться на тяжкість і біль у правому підребер’ї, загальну слабкість, серцебиття, набряки, збільшення живота. 2. Властивості пульсу суттєво не змінюються, але визначається позитивний венний пульс на яремних венах. Інколи діагностується діастолічне тремтіння грудної клітки по лівому краю груднини. 3. Межі відносної тупості серця зміщуються вправо за рахунок дилатації правого передсердя і ПШ. 4. Аускультативно визначається характерний діастолічний шум з максимумом під мечоподібним відростком, який посилюється на вдиху і зменшується при натужуванні (симптом Карвалло). Може прослуховуватися тон відкриття тристулкового клапана (теж краще на вдиху). 5. ЕКГ-критерії: ознаки гіпертрофії правого передсердя без гіпертрофії ПШ. Інтервал P–Q може бути дещо подовженим. 6. ЕхоКГ-критерії Критерії двомірного режиму:
Критерії допплер-ехоКГ:
7. Рентгенологічні критерії: гіпертрофія правого передсердя. Катетеризація правих відділів серця — найбільш інформативний метод діагностики трикуспідальних вад серця. |
Відсутність ознак легеневої гіпертензії та гіпертрофії ПШ за наявності венозного застою крові у великому колі кровообігу свідчить про стеноз тристулкового отвору, який виявляється приблизно у 5% пацієнтів із мітральним стенозом.
Найбільш інформативним методом діагностики є ехоКГ. Нерідко трапляються випадки, коли трикуспідальний стеноз залишається непоміченим. Детальне ехоКГ-дослідження анатомії трикуспідального клапана та підклапанного апарату необхідне для оцінки можливостей щодо подальшої тактики лікування. На сьогодні не існує загальноприйнятих підходів для оцінки тяжкості трикуспідального стенозу, однак наявність середнього градієнта на трикуспідальний клапан ≥5 мм рт. ст. при нормальній ЧСС вважається свідченням клінічно значимого трикуспідального стенозу. Катетеризацію серця на сьогодні не використовують для оцінки тяжкості трикуспідального стенозу.
Лікування. Питання оптимальної тактики втручань на трикуспідальному клапані залишається дискусійним, все ж частіше використовується протезування із застосуванням біологічних протезів, основною перевагою яких порівняно із механічними є нижчий ризик тромбозів. Перкутанна балонна дилатація трикуспідального клапана (самостійно чи в поєднанні з мітральною комісуротомією) проводилась у невеликій кількості випадків і нерідко призводила до значної трикуспідальної недостатності. На сьогодні недостатньо даних щодо віддалених результатів.
Специфічних консервативних методів лікування трикуспідального стенозу не існує. При розвитку ХСН застосовують діуретики, ББА, периферичні вазодилататори, антикоагулянти, метаболічні засоби (триметазидин). Лікування спрямоване на зменшення застою крові у великому колі кровообігу.
2.7.1.10. Трикуспідальна недостатність
Розрізняють органічну і відносну (без морфологічних змін клапанів) форми трикуспідальної недостатності. У більшості випадків виявляють вторинну трикуспідальну недостатність.
Етіологія. Причинами цієї вади є ревматизм, інфекційний ендокардит, травма, РКМП, аномалія Ебштейна, інфаркт чи розрив папілярних м’язів. Вторинна трикуспідальна регургітація виникає при мітральному стенозі.
Клініка і діагностика трикуспідальної регургітації наведені в алгоритмі 2.37.
|
Алгоритм 2.37. Критерії діагностики трикуспідальної недостатності [17, 25, 60] 1. Скарги хворого на задишку, серцебиття, біль у правому підребер’ї, набряки, збільшення живота за рахунок асциту. 2. Артеріальний пульс суттєво не змінюється. Вени шиї розширені, позитивний венний пульс. 3. Межі відносної тупості серця зміщуються вправо. 4. Аускультативні критерії: над мечоподібним паростком визначається пансистолічний дуючий шум, який інколи супроводжується систолічним тремтінням грудної клітки. Шум проводиться доверху і вправо, посилюється при глибокому вдиху і послаблюється при видиху (симптом Ріверо — Корвалло). Спостерігається послаблення ІІ тону над легеневою артерією, на вдиху можна вислухати патологічний ІІІ тон. 5. ЕКГ-критерії: часто визначаються ознаки гіпертрофії ПШ на тлі відхилення електричної осі серця вправо, р-pulmonale (високі та загострені зубці Р у ІІ, ІІІ, aVF-, V1-відведеннях), у більшості пацієнтів виникає постійна форма ФП. 6. ЕхоКГ-критерії: Критерії двомірного режиму (немає специфічних ознак):
Критерії допплер-режиму:
7. Рентгенологічні критерії: визначається гіпертрофія ЛП та правого передсердя. |
ЕхоКГ — найбільш зручний та інформативний метод для оцінки трискупідальної недостатності. При первинній трискупідальній недостатності її причину в деяких випадках можна встановити за допомогою вивчення структурних порушень трискупідальної недостатності. У разі вторинної МРТ — найбільш інформативний метод оцінки ПШ, золотий стандарт для дослідження його структури та функції.
Катетеризація серця не є обов’язковим дослідженням для діагностики трикуспідальної недостатності, але може виконуватися у пацієнтів, яким передбачається проведення ізольованого оперативного втручання при вторинній трискупідальній недостатності для дослідження гемодинаміки, зокрема для оцінки резистентності пульмональних судин.
Інструментальну діагностику набутих вад серця систематизовано в алгоритмі 2.38.
|
Алгоритм 2.38. Інструментальна діагностика набутих вад серця [21] ЕКГ-діагностика |
|
|
Мітральний стеноз:
|
Мітральна недостатність:
|
|
Аортальний стеноз:
|
Аортальна недостатність:
|
|
Трикуспідальний стеноз:
|
Трикуспідальна недостатність:
|
Лікування трикуспідальної недостатності
Вибір протеза при набутих вадах серця
Вибір між біологічним та механічним протезом у дорослих в основному ґрунтується на оцінці вірогідності кровотеч на фоні застосування антикоагулянтів та можливості утворення тромбів, що характерно для механічних протезів, та ризику розвитку структурних порушень біопротеза, звичайно, з урахуванням способу життя і бажання самого пацієнта.
Ведення хворих із протезованими клапанами
Основними ускладненнями після трансплантації клапанів є тромбоемболії та кровотечі, пов’язані з прийомом антикоагулянтів. Профілактику ендокардиту і ведення пацієнтів з ендокардитом протезованих клапанів детально викладено у відповідних рекомендаціях.
Планові обстеження необхідно проводити щорічно, а в разі виявлення прогресуючої симптоматики — якнайшвидше. Після транскатетерної імплантації чи хірургічної імплантації біопротеза контрольна ехоКГ з вимірюванням градієнтів на протезованому клапані має проводитися протягом 30 днів з моменту імплантації, потім — через 1 рік і надалі — щороку. Трансезофагеальну ехоКГ необхідно проводити у разі недостатньої візуалізації, при підозрі на дисфункцію протезованого клапана чи ендокардит. Флуороскопія та мультиспіральна КТ дають важливу додаткову інформацію в разі тромбозу клапанів або за наявності пануса, що спричиняє дисфункцію клапана. Особливості призначення антитромботичної та антикоагулянтної терапії після протезування клапанів наведені в табл. 2.94 і 2.95.
Таблиця 2.94. Показання до антитромботичної терапії після протезування клапанів (ЄТК, 2017; ВАКУ, 2018)
|
Механічні протези |
Клас, рівень доказовості |
|
Пожиттєве застосування пероральних антикоагулянтів (АВК) показане всім хворим з механічними протезами (!) |
І, В |
|
Застосування препаратів НФГ або НМГ в терапевтичних дозах показане на період вимушеного переривання прийому пероральних антикоагулянтів |
І, С |
|
Додавання АСК в низьких дозах (75–100 мг/добу) додатково до АВК слід рекомендувати після тромбоемболії, незважаючи на досягнення цільового МНВ |
ІІа, С |
|
Додавання АСК в низьких дозах (75–100 мг/добу) додатково до АВК може бути розглянуто за наявності супутньої атеросклеротичної патології |
ІІb, С |
|
Рекомендується самостійний контроль МНВ пацієнтом після проведення спеціальних тренінгів і контролю якості |
І, В |
|
Пацієнтам після стентування коронарних судин на період 1 міс слід рекомендувати потрійну антитромботичну терапію із застосуванням АСК (75–100 мг/добу), клопідогрелю (75 мг/добу) та АВК варфарину незалежно від типу стента (!) |
IIа, В |
|
Потрійну антитромботичну терапію із застосуванням АСК (75–100 мг/добу), клопідогрелю (75 мг/добу) та АВК на період більше 1 міс, однак не довше 6 міс, слід рекомендувати пацієнтам з високим ризиком ГКС або наявністю анатомічних/процедурних особливостей, які переважають ризик від можливих кровотеч (!) |
IIа, В |
|
Подвійну терапію АВК і клопідогрелем (75 мг/добу) слід рекомендувати як альтернативу потрійній антитромботичній терапії у пацієнтів, в яких ризик кровотеч перевищує ішемічний ризик |
ІІа, А |
|
Пацієнтам, яким виконано перкутанне втручання на коронарних судинах, слід рекомендувати відміну антитромбоцитарної терапії через 12 міс (!) |
IIа, В |
|
Пацієнтам, які потребують прийому АСК і/або клопідогрелю додатково до АВК, слід рекомендувати ретельний контроль МНВ на рівні нижньої межі цільового з перебуванням у терапевтичному вікні >65–70% часу |
IIа, В |
|
Застосування антикоагулянтів, що не відносяться до АВК, після протезування клапанів протипоказане (!) |
ІІІ, В |
|
Пероральні антикоагулянти показані пожиттєво пацієнтам з біологічними протезами, які мають інші показання до антикоагулянтів (!) |
І, С |
|
Пероральні антикоагулянти (АВК) слід рекомендувати протягом перших 3 міс після імплантації протеза мітрального або трикуспідального клапана |
ІІа, С |
|
Пероральні антикоагулянти (АВК) слід рекомендувати протягом перших 3 міс після хірургічної пластики мітрального або трикуспідального клапана |
ІІа, С |
|
АСК в низьких дозах (75–100 мг/добу) слід рекомендувати в перші 3 міс після хірургічної імплантації аортального клапана або органозберігаючої операції на аортальному клапані |
ІІа, С |
|
Подвійну антитромбоцитарну терапію слід рекомендувати на період перших 3–6 міс після ТІАК з подальшим переведенням на монотерапію антитромбоцитарним препаратом |
ІІа, С |
|
Подвійну антитромбоцитарну терапію слід рекомендувати на період перших 3–6 міс після ТІАК з подальшим переведенням на монотерапію антитромбоцитарним препаратом |
ІІа, С |
|
Монотерапія антитромбоцитарним препаратом може бути розглянута після ТІАК при високому ризику кровотеч |
ІІb, С |
|
Терапія пероральними антикоагулянтами може бути розглянута на період перших 3 міс після хірургічної імплантації біопротеза аортального клапана |
ІІb, С |
Примітка. ТІАК — транскатетерна імплантація аортального клапана.
Таблиця 2.95. Цільові рівні МНВ при встановлених механічних протезах
|
Тромбогенність протеза* |
Фактори ризику в конкретного пацієнта** |
|
|
Відсутність |
Наявність одного або більше факторів ризику |
|
|
Низька |
2,5 |
3,0 |
|
Помірна |
3,0 |
3,5 |
|
Висока |
3,5 |
4,0 |
Примітки. *Тромбогенність протеза: низька — Carbomedics, Меdtonіс Наll, АТS, St. Jude Меdiсаl, Оn-Х, Sоrіn Вісаrbon; помірна — інші двостулкові клапани з недостатньо вивченою тромбогенністю; висока — Lillehei — Kaster, Omniscience, Starr — Edwards, Bjork — Shiley та інші клапани з нахиленим диском. **Фактори ризику: трансплантація мітрального чи трикуспідального клапана; тромбоемболія в анамнезі; ФП; мітральний стеноз будь-якого ступеня; ФВ ЛШ <35%.
Переривання терапії антикоагулянтами при проведенні планових інвазивних втручань
Застосування антикоагулянтів при проведенні некардіальних оперативних втручань потребує обережного підходу, заснованого на оцінці ризику згідно з тромбогенними характеристиками протезів та факторів ризику, залежних від пацієнта. У пацієнтів дуже високого ризику за можливості необхідно уникати переривання прийому антикоагулянтів. Незначні хірургічні втручання (включаючи екстракцію зуба, видалення катаракти), а також оперативні втручання, при яких кровотечу легко контролювати, не потребують переривання антикоагулянтної терапії. Великі оперативні втручання потребують зниження МНВ <1,5. У пацієнтів із механічними протезами антикоагулянти необхідно відміняти до проведення хірургічного втручання, а на час їх відміни застосовувати гепарин. Призначення НФГ на період хірургічних втручань залишається єдиним доведеним підходом до антикоагулянтної терапії у хворих із механічними протезами, при цьому бажане в/в введення. Вважається, що альтернативою НФГ є п/ш введення НМГ, однак доцільність такого підходу на сьогодні не доведена, якщо препарати НМГ все ж застосовуються, їх необхідно призначати двічі на добу з урахуванням маси тіла і функції нирок. Фондапаринукс не слід застосовувати у хворих із механічними протезами на період хірургічних втручань (!).
У разі розвитку СН застосовується комплексна терапія з використанням діуретиків, іАПФ, серцевих глікозидів, ББА. При ураженні самого клапана пластика клапана та його кільця має перевагу над протезуванням. Здійснюється лікування, спрямоване на основне захворювання.
Нерідко набуті вади серця виникають у вагітних. Рекомендації ЄТК (2015) щодо лікування цих пацієнтів наведені нижче.
Ведення хворих при набутих вадах серця у період вагітності (ЄТК, 2015; ВАКУ, 2018)
Ведення хворих у період вагітності детально висвітлено у відповідних рекомендаціях ЄТК.
Рішення щодо оптимальної тактики ведення хворих приймається після детального обговорення за участю кардіолога, акушера-гінеколога та анестезіолога. Клапанна патологія має виявлятися та адекватно лікуватися до вагітності. Вагітність не слід планувати при тяжкому мітральному стенозі, тяжкому симптомному аортальному стенозі, синдромі Марфана з дилатацією аорти >45 мм та >27,5 мм/м2 при синдромі Тернера.
Розродження породіль шляхом кесарева розтину рекомендовано при нетяжкому мітральному стенозі або аортальному стенозі, діаметрі висхідної аорти >45 мм, у разі тяжкої легеневої гіпертензії, а також при передчасних пологах у разі застосування пероральних антикоагулянтів.
Вроджена клапанна патологія
Помірний або тяжкий мітральний стеноз із площею отвору <1,5 см2 у вагітних зазвичай переноситься досить тяжко. Мітральну комісуротомію необхідно проводити у пацієнток із тяжкою симптоматикою (СН ІІІ–IV ФК за NYHА) і/або в разі систолічного тиску в легеневій артерії >50 мм рт. ст., незважаючи на оптимально підібрану терапію. Комісуротомію слід проводити після 20-го тижня вагітності в центрах із відповідним досвідом спеціалістів.
Ускладнення тяжкого аортального стенозу трапляються частіше у пацієнток з наявністю симптомів ще до вагітності або за наявності дисфункції ЛШ. Цим хворим рекомендована оцінка толерантності до фізичного навантаження до вагітності.
Мітральна і аортальна недостатність у разі відсутності дисфункції ЛШ зазвичай добре переносяться.
Протезовані клапани
Материнська смертність породіль із протезованими механічними клапанами варіює від 1 до 4%, а частота серйозних ускладнень сягає 40%.
Особливості лікування вагітних із ССЗ [54]:
- Призначаючи терапію, завжди слід враховувати можливість шкоди для плода. ББА безпечні, однак можуть спричиняти брадикардію і затримку розвитку плода. Діуретики можуть бути використані в мінімальних дозах з метою уникнення порушень кровозабезпечення плода. іАПФ та БРА протипоказані.
- Операція на клапанах серця із застосуванням штучного кровообігу пов’язана з можливою внутрішньоутробною загибеллю плода у 20–30% випадків.
- Перкутанну дилатацію отвору при стенозах можна виконувати у період вагітності після 20-го тижня у спеціалізованих центрах.
- Питання про переривання вагітності у ранні терміни обговорюються у таких випадках:
- при тяжкому порушенні систолічної функції ЛШ (ФВ <40%);
- при синдромі Марфана з аневризмою висхідного відділу аорти >40 мм у діаметрі;
- при вираженому стенозі отвору, коли неможливо провести ПКВ.
- При мітральному стенозі з симптомами СН призначають метопролол у комбінації з низькими дозами діуретиків.
- При вираженій задишці та легеневій гіпертензії, незважаючи на медикаментозну терапію, вирішують питання про перкутанну мітральну комісуротерапію.
- У хворих із тяжкими аритміями серця, у яких зберігаються симптоми СН, незважаючи на застосування діуретиків, може бути виконана балонна вальвулопластика (однак досвід проведення цієї процедури наразі недостатній).
- При синдромі Марфана застосовують ББА в низьких дозах протягом усієї вагітності з метою профілактики розвитку розшарування аорти (однак є загроза розвитку плода).
- При протезованих клапанах застосовують варфарин у низьких дозах (≤5 мг/добу) в І–ІІІ триместр, після чого його замінюють на НФГ під контролем визначення АЧТЧ, який повинен збільшуватись в 2–3 рази (норма — 35–70 с).
У разі розвитку СН у жінок із набутими вадами серця (невагітних) застосовується комплексна терапія з використанням діуретиків, іАПФ, серцевих глікозидів, ББА. Перш за все здійснюється лікування, спрямоване на основне захворювання.
2.7.2. Вроджені вади серця
Вроджені вади серця виявляють приблизно в 1% немовлят, а у дорослих їх поширеність становить близько 0,2% [47], тож у практиці ревматолога і терапевта інколи наявна ця патологія. У рекомендаціях ЄТК (2015) з практичних міркувань усі вроджені вади серця поділяються на «білі» та «сині» (табл. 2.96).
Таблиця 2.96. Класифікація вроджених вад серця
|
«Білі» вади |
«Сині» вади |
|
|
з шунтуванням крові зліва направо |
без шунтування |
|
|
А. На рівні передсердь: 1) дефект міжпередсердної перегородки:
2) дефект міжпередсердної перегородки з мітральним стенозом (синдром Лютембаше). Б. На рівні шлуночків: дефект міжшлуночкової перегородки. В. Між коренем аорти і правим серцем: 1) розрив аневризми синуса Вальсальви; 2) коронарна артеріовенозна фістула. Г. Між аортою і легеневою артерією: відкрита артеріальна (боталлова) протока. Д. На кількох рівнях |
А. Вади лівих відділів серця: 1) мітральна недостатність; 2) стеноз гирла аорти; 3) недостатність аортальних клапанів; 4) коарктація аорти тощо. Б. Вади правих відділів серця: 1) аномалія тристулкового клапана Ебштейна; 2) стеноз гирла легеневої артерії; 3) недостатність клапана легеневої артерії; 4) ідіопатичне розширення стовбура легеневої артерії |
А. Зі збільшеним легеневим кровотоком: 1) повна транспозиція великих артерій; 2) єдиний шлуночок тощо. Б. З незміненим або зменшеним легеневим кровотоком: 1) стеноз гирла легеневої артерії з дефектом міжшлуночкової перегородки і декс-трапозицією аорти (тетрада Фалло); 2) стеноз гирла легеневої артерії з дефектом міжпередсердної перегородки (тріада Фалло) |
Критерії діагностики вроджених вад серця наведені в табл. 2.97.
Таблиця 2.97. Критерії діагностики «білих» та «синіх» вад серця
|
Вроджені вади серця |
Клінічні ознаки вад серця |
|
Вади «білого» типу (артеріовенозний скид) |
– зменшується інтенсивність шуму; – з’являється акцент ІІ тону над легеневою артерією; – виникають ЕКГ-ознаки систолічного перевантаження ПШ; – розміри серця можуть навіть зменшуватися; – виникає ціаноз (синдром Ейзенменгера) |
|
Вади «синього» типу (веноартеріальний скид) |
|
|
Вади серця без скиду |
|
2.7.2.1. Дефект міжпередсердної перегородки
Ця вада найпоширеніша у дорослих і становить понад 30% вроджених вад серця. Хворіють частіше жінки. Перебіг захворювання може бути безсимптомним, однак більшість симптомів виникає у віці до 40 років.
При цій ваді серця спостерігається відкрите овальне вікно. Розрізняють первинний і вторинний дефекти міжпередсердної перегородки. Первинний дефект локалізується у нижній частині перегородки, вторинний — в овальному вікні. За відсутності легеневої гіпертензії дефект міжпередсердної перегородки переноситься добре, проте тривале скидання крові з ЛП у праве призводить до підвищення тиску в легеневій артерії. Підвищене об’ємне перевантаження призводить до перерозтягнення, розвитку гіпертрофії правого передсердя, ПШ, а згодом — до дисфункції останнього та виникнення трикуспідальної недостатності. Легеневий кровотік може збільшуватись у декілька разів і перевищувати кровотік у великому колі кровообігу, в результаті чого зменшується надходження крові до лівих відділів серця. Компенсація первинного порушення гемодинаміки забезпечується гіперфункцією та гіпертрофією ПШ [10, 63].
Клініка та діагностика захворювання наведені в алгоритмі 2.39.
|
Алгоритм 2.39. Критерії діагностики дефекту міжпередсердної перегородки [17, 25, 60] 1. Хворі віком 20–30 років скаржаться на задишку при фізичному навантаженні, підвищену втомлюваність, перебої в роботі серця, часті респіраторні захворювання. 2. Пульс звичайних властивостей. Пальпаторно відчувається поштовх ПШ (зліва від нижнього краю груднини). 3. Межі відносної тупості серця зміщуються вправо, можливо, доверху. 4. Аускультативні критерії: визначається систолічний шум (вторинний стеноз гирла легеневої артерії), рідше — діастолічний шум внаслідок вторинного стенозу правого АV-отвору, а також розщеплення ІІ тону над легеневою артерією, яке не залежить від фаз дихання. 5. ЕКГ-критерії: гіпертрофія ПШ, неповна БПНПГ, ФП. 6. ЕхоКГ-критерії: Критерії двомірного режиму:
Критерії контрастної ехоКГ — ефект «негативного контрастування» — потрапляння цівки крові з ЛП до правого. У разі вираженої легеневої гіпертензії може визначатися закид крові із правого в ЛП. 7. Рентгенологічні критерії: знаходять збільшення розмірів правого передсердя і ПШ, розширення легеневої артерії, посилення легеневого судинного малюнка. 8. Вентрикулографія дозволяє встановити напрямок течії крові через дефект. |
Тиск у легеневій артерії залишається нормальним, але при розвитку ТП і ФП підвищується. Тромбоемболічні ускладнення можуть бути пов’язані з ФП, ТП, а також із парадоксальною емболією — надходженням крові з правого передсердя до ЛП за рахунок вираженої легеневої гіпертензії. У деяких хворих визначаються ознаки лівошлуночкової СН, зумовлені «стисненням» ЛШ збільшеним ПШ.
Прогноз при другорядному дефекті міжпередсердної перегородки сприятливий навіть без хірургічного лікування. Незначні дефекти на тривалість життя суттєво не впливають. При первинному дефекті міжпередсердної перегородки прогноз гірший, оскільки виникає виражена легенева гіпертензія.
Лікування дефекту міжпередсердної перегородки. Хірургічне лікування навіть при безсимптомному перебігу захворювання, якщо скид артеріальної крові більший за 50% легеневого кровотоку. За допомогою оперативного втручання (вшивання отвору, накладання латки) запобігають розвитку легеневої гіпертензії та правошлуночкової недостатності, знижують ризик інфекційного ендокардиту. Оптимальним для операції вважають вік 3–6 років; інколи хороші результати отримують у хворих віком понад 40 років, якщо немає високої легеневої гіпертензії.
Медикаментозне лікування спрямоване на запобігання виникненню ФП і суправентрикулярної ПТ шляхом застосування аміодарону та ББА, а ХСН лікують за загальними правилами.
2.7.2.2. Дефект міжшлуночкової перегородки
Дефект міжшлуночкової перегородки — найпоширеніше захворювання з-поміж усіх вроджених вад серця. У 25–40% осіб відбувається спонтанне закриття дефекту міжшлуночкової перегородки.
Клініка та діагностика захворювання наведені в алгоритмі 2.40.
|
Алгоритм 2.40. Критерії діагностики дефекту міжшлуночкової перегородки [17, 25, 60] Першими ознаками захворювання є відставання дітей у фізичному розвитку, часті респіраторні інфекції. При незначному дефекті скид крові малий, скарг немає; при великому скиді крові зліва направо виникають запаморочення, непритомність. У 10–20% пацієнтів виникає кровохаркання, спричинене ТЕЛА дрібних гілок або розривом дрібних гілок легеневої артерії. 1. Пульс без особливостей. При пальпації по лівому краю груднини можна визначити систолічне тремтіння, шийні вени набухлі. 2. Межі відносної тупості серця зміщуються вліво і вправо, верхівковий поштовх посилений. 3. Аускультативні критерії: визначають інтенсивний систолічний шум в ІІІ–ІV міжребер’ї, який не проводиться в аксилярну ділянку, а при скиді крові справа наліво — діастолічний шум, вислуховується розщеплення або роздвоєння ІІ тону над легеневою артерією. При декомпенсації систолічний шум стає слабшим. Може виникати шум легеневої регургітації (діастолічний шум Грехема — Стілла) за рахунок вторинної недостатності клапанів легеневої артерії. 4. ЕКГ-критерії: при невеликому скиданні крові зліва направо визначають перевантаження ПШ (гіпертрофія), справа наліво — ГЛШ, а потім гіпертрофія ЛП. 5. Рентгенологічні критерії: при незначних дефектах міжшлуночкової перегородки суттєвих змін не спостерігається; при великому скиді крові зліва направо спостерігається посилення легеневого малюнку, розширення ПШ; при легеневій гіпертензії — виражене збільшення стовбура легеневої артерії з різким звуженням її дистальних гілок. 6. ЕхоКГ-критерії Критерії двомірного режиму:
Критерії допплер-ехоКГ:
Критерії кольорового допплерівського сканування:
Критерії контрастної ехоКГ:
|
Відбувається ліво-правий скид крові на рівні шлуночка, що призводить до збільшення легеневого кровотоку, об’ємного навантаження ПШ та розвитку його гіпертрофії. Згодом відбувається розвиток склерозу легеневих судин, який супроводжується право-лівим скидом крові та виникненням ціанозу. При незначних дефектах скид крові невеликий; скарги, як правило, не виникають, єдина ознака — грубий систолічний шум в ІІІ–ІV міжребер’ї зліва від груднини. Шум частіше пансистолічний.
Лікування. За відсутності ознак легеневої гіпертензії застосовують консервативну терапію. Якщо до 3–5 років життя не відбулося закриття дефекту міжшлуночкової перегородки, виконують хірургічну корекцію вади. Хірургічне лікування протипоказане при синдромі Ейзенменгера, коли відбувається склерозування гілок легеневої артерії та значно підвищується тиск у ній. У дітей віком до 1 року відкрита артеріальна протока становить 10–12% усіх вроджених вад серця. Якщо не виконується хірургічне лікування, 30% хворих помирає у віці до 40 років. Для зниження тиску в легеневій артерії використовують нітрати, АК групи дигідропіридинів пролонгованої дії (ніфедипін, амлодипін), іАПФ (еналаприл, каптоприл, лізиноприл). З метою профілактики ТЕЛА призначають варфарин, апіксабан, дабігатран, АСК або клопідогрель. Суть операції полягає у проведенні пластики дефекту міжшлуночкової перегородки. Післяопераційна летальність не перевищує 1% випадків. До і впродовж 6 міс після хірургічного лікування вади серця здійснюють профілактику інфекційного ендокардиту. Ендоваскулярне закриття дефекту може бути альтернативою хірургічного лікування [3, 6].
2.7.2.3. Відкрита артеріальна протока
Визначення. Відкрита артеріальна протока — це функціонуюча судина, яка з’єднує легеневу артерію з низхідною частиною аорти.
Патогенез. Високий легеневий судинний опір у плода зумовлює скидання крові справа наліво (з легеневої артерії в аорту через артеріальну боталлову протоку). Тому бідна на кисень кров з ПШ, минаючи нерозправлені легені плода, потрапляє в низхідну частину аорти і до плаценти, де насичується киснем. Однак після народження дитини відбувається зниження судинного опору, в результаті чого кров із аорти через відкриту артеріальну протоку потрапляє до легеневої артерії, проходить через мале коло кровообігу і повертається до ЛП. Тягар артеріовенозного шунтування несе на собі ЛП і ЛШ, оскільки кров, що надходить до аорти, збільшується на ту частину, яка надходить через протоку до легеневої артерії. Об’ємне навантаження на ЛШ, який нагнітає кров у велике і мале коло кровообігу, призводить до лівошлуночкової СН. Зазвичай артеріальна протока після народження дитини закривається і не функціонує, а її незакриття призводить до розвитку захворювання. Порушення гемодинаміки призводить до легеневої гіпертензії, а потім до лівошлуночкової СН.
До факторів ризику відкритої артеріальної протоки належать краснуха у матері, народження на більшій висоті над рівнем моря, недоношеність, жіноча стать, обтяжена спадковість. Протягом перших 15 год артеріальна протока перестає бути гемодинамічно значимою, а протягом 2–3 тиж повністю облітерується. У дорослих від артеріальної протоки залишається тільки фіброзний тяж — артеріальна зв’язка. Якщо артеріальна протока залишається відкритою більше 3 міс у доношених або більше 12 міс у недоношених дітей, то її самостійне закриття малоймовірне.
Клініка та діагностика захворювання наведені в алгоритмі 2.41.
|
Алгоритм 2.41. Критерії діагностики відкритої артеріальної протоки [17, 25] 1. Хворі скаржаться на задишку, набряки на ногах, виникає збільшення печінки, асцит, ціаноз. 2. Пульс швидкий (сeller) і великий (magnus), коли відбувається скидання крові зліва направо. Позитивний венний пульс, вени на шиї набухлі, пальці мають вигляд барабанних паличок. 3. Межі відносної тупості серця зміщуються вліво, інколи доверху. 4. Аускультативні критерії: над легеневою артерією і під лівою ключицею прослуховується систоло-діастолічний (машинний) шум. При зростанні легеневої гіпертензії інтенсивність шуму зменшується, хоч загальний стан хворого погіршується. ІІ тон над аортою послаблений. 5. ЕКГ-критерії: нормальне положення електричної осі серця, іноді спостерігається подовження інтервалу Р–Q. У разі значного скидання крові виникають ознаки перевантаження ЛШ і ЛП. 6. Рентгенологічні критерії: збільшення розмірів ЛШ і ЛП, посилення легеневого судинного малюнку, вибухання висхідної частини аорти, збільшення розмірів ПШ при високій легеневій гіпертензії. 7. ЕхоКГ-критерії: Критерії двомірного режиму:
Критерії допплер-ехоКГ:
Кольорова допплер-ехоКГ (найбільш інформативний метод):
|
При дуже високому тиску в легеневій артерії виникає синдром Ейзенменгера, при якому скид крові змінює свій напрямок, що призводить до ціанозу і симптому барабанних паличок.
Лікування. Хірургічне лікування при відкритій артеріальній протоці (перев’язування відкритої артеріальної протоки) показане всім хворим віком від 1 року. Оптимальний вік для операцій — 3–4 роки, але у разі розвитку легеневої гіпертензії та інших ускладнень оперативне втручання необхідне раніше. До і після операції впродовж 6 міс проводять профілактику інфекційного ендокардиту. Існують поодинокі повідомлення про закриття артеріальної протоки на фоні застосування індометацину. При розвитку склеротичної форми легеневої гіпертензії хірургічне закриття відкритої артеріальної протоки протипоказане.
Операція нескладна, летальність — до 0,5% випадків, але вона підвищується у хворих старшого віку із широкою і короткою протокою зі стоншеними і місцями звапненими стінками у зв’язку з небезпекою розриву [7, 47]. Ендоваскулярне закриття відкритої артеріальної протоки здійснюють амбулаторно.
Вагітність протипоказана пацієнтам зі значною легеневою гіпертензією і синдромом Ейзенменгера.
2.7.2.4. Стеноз гирла легеневої артерії
Стеноз гирла легеневої артерії — вроджена вада серця, яка частіше трапляється у чоловіків, ніж у жінок. У пацієнтів із незначним стенозом легеневої артерії симптоми захворювання відсутні.
Клініка та діагностика захворювання наведені в алгоритмі 2.42.
|
Алгоритм 2.42. Критерії діагностики стенозу гирла легеневої артерії [17, 25, 60] 1. Клінічні критерії: у разі вираженого стенозу гирла легеневої артерії хворі скаржаться на задишку при фізичному навантаженні (ортопное не буває, оскільки у легеневій артерії тиск перебуває на рівні нормальних величин). Ознаки правошлуночкової недостатності розвиваються у віці старше 40–50 років. Інколи визначається серцевий горб, систолічне тремтіння в ІІ–ІІІ міжребер’ї зліва від груднини. 2. Пульс не відрізняється від норми. 3. Межі відносної тупості серця зміщуються вправо. 4. Аускультативні критерії: визначається грубий систолічний шум над легеневою артерією (ліворуч біля краю груднини або в ІІ–ІV міжреберних проміжках), який проводиться на спину і посилюється на вдиху, а також розщеплення та ослаблення ІІ тону над нею. 5. ЕКГ-критерії:
6. Рентгенологічні критерії: визначається постстенотичне розширення легеневої артерії, гіпертрофія правих відділів серця, а легеневий малюнок не змінений. 7. ЕхоКГ-критерії: Критерії двомірного режиму:
Критерії допплер-режиму:
|
Лікування. Хворим із вираженим стенозом гирла легеневої артерії показане хірургічне лікування. Поряд з цим деяким пацієнтів виконують балонну дилатацію стенозу. Показаннями до хірургічного лікування є виражена клінічна картина вади серця, а також градієнт тиску між ПШ і легеневою артерією >40 мм рт. ст. Хірургічне лікування протипоказане при вираженій правошлуночковій недостатності. Оптимальний вік для операції — 5–10 років, однак у разі вираженого стенозу легеневої артерії до хірургічного лікування вдаються раніше. Є два головні методи хірургічного лікування: 1) вальвулотомія (розрізання зрослих комісур і вирізання гіпертрофованих м’язів вихідного каналу ПШ); 2) балонна вальвулопластика. Летальність при операціях із застосуванням штучного кровообігу становить близько 3% випадків; при балонній ангіопластиці вона дещо менша. Віддалені результати після операції задовільні.
2.7.2.5. Тетрада та пентада Фалло
Визначення. Тетрада Фалло — це вроджена вада серця, яка включає: 1) декстрапозицію аорти (або зміщення гирла аорти вправо); 2) наявність дефекту в мембранній частині міжшлуночкової перегородки; 3) звуження легеневої артерії; 4) гіпертрофію ПШ. Тетрада Фалло становить близько 10% усіх вроджених вад серця. Без хірургічної корекції до 40 років доживають тільки 5% хворих. Відомо, що тетрада Фалло — найпоширеніша «синя» вада серця. Якщо приєднується п’ята ознака — дефект міжпередсердної перегородки, — йдеться про пентаду Фалло.
Порушення гемодинаміки при тетраді Фалло спричинене скидом крові справа наліво через дефект міжшлуночкової перегородки. Як правило, з віком стеноз легеневої артерії прогресує. У хворих із тетрадою Фалло при вираженому стенозі легеневий кровотік знижений. При скиді справа наліво значна частина крові надходить з ПШ до аорти, де вона підмішується до артеріальної крові з ЛШ й зумовлює розвиток ціанозу. Викид крові справа наліво особливо збільшується під час фізичного навантаження, коли венозний приплив крові до серця суттєво збільшується, а легеневий кровотік не змінюється за рахунок неможливості збільшення надходження крові через звужений отвір легеневої артерії. Внаслідок цих змін насичення гемоглобіну киснем в артеріальній крові може знижуватися до 60% [4, 6, 47].
Поряд з цим позасерцева компенсація порушень гемодинаміки включає: 1) розвиток поліцитемії зі збільшенням кількості еритроцитів до 8 · 1012/л і гемоглобіну до 250 г/л, що зумовлює підвищення вмісту кисню в крові; 2) утворення анастомозів між бронховими артеріями і системою легеневих артерій. Внаслідок цього до малого кола кровообігу додатково надходить і оксигенується кров з аорти.
Клініка та діагностика захворювання наведені в алгоритмі 2.43.
|
Алгоритм 2.43. Критерії діагностики тетради Фалло [17] 1. Хворі на тетраду Фалло скаржаться на задишку, яка збільшується при фізичному навантаженні (пацієнт раптово стає синім), інколи виникає запаморочення та втрата свідомості, що може призвести до смерті (причина нападу — спазм початкової частини легеневої артерії). Визначається дифузний ціаноз «чорнильного» кольору, барабанні палички на пальцях. 2. Пульс суттєво не змінюється. 3. Межі відносної тупості серця зміщуються вправо, визначається систолічне тремтіння в ІІ–ІІІ міжребер’ї зліва. 4. Аускультативні критерії: визначається грубий систолічний шум у ІІ–ІІІ міжребер’ї по лівому краю груднини в результаті стенозу легеневої артерії; ІІ тон над легеневою артерією послаблений. Чим більший ціаноз, тим менший кровотік і слабший шум. 5. ЕКГ-критерії: відхилення електричної осі серця вправо, високі зубці р-pulmonale, особливо у стандартних відведеннях, БПНПГ або гіпертрофія ПШ. 6. Рентгенологічні критерії: виявляють вузький судинний пучок, дуга легеневої артерії не визначається, нерідко аортальна дуга зміщується вправо, розширення ПШ. 7. При зондуванні серця визначають надходження контрастної маси із ПШ до ЛШ через отвір у міжшлуночковій перегородці. Тиск крові у ПШ та насичення крові киснем підвищені, а тиск у легеневій артерії помірно знижений. 8. ЕхоКГ-критерії Критерії двомірного режиму:
Критерії допплер-режиму:
|
Тривала хронічна гіпоксія призводить до розвитку ускладнення — тромбоемболії судин головного мозку за рахунок поліцитемії, яка підвищує реологічні властивості крові. У 1–6% випадків це ускладнення виникає в результаті розвитку ШТ та ФШ. Інфекційний ендокардит — ускладнення, яке виникає нечасто.
Лікування. Усі пацієнти із тетрадою Фалло піддаються оперативному лікуванню, яке може бути радикальним (усунення легеневого стенозу, закриття дефекту міжшлуночкової перегородки в умовах штучного кровообігу) та паліативне (накладання аортальних анастомозів з метою збільшення легеневого кровообігу та зменшення гіпоксії). Ці операції дозволяють пацієнтам дожити до 5–6-річного віку, коли можна виконувати радикальну операцію [6, 47].
Медикаментозна терапія включає надання хворим колінно-ліктьового положення, інгаляцію киснем, уведення морфіну та ББА. Для профілактики нападів ціанозу обережно з усуненням артеріальної гіпотензії призначають ББА, інгаляції киснем. При поліцитемії проводять кровопускання.
При набутих і вроджених вадах серця з метою профілактики тромбоутворення часто застосовують антикоагулянти. Показання і тривалість їхнього застосування відображено в табл. 2.98.
Таблиця 2.98. Показання до застосування непрямих антикоагулянтів при клапанній хворобі серця (ЄTK, 2013)
|
Постійно |
Протягом 3 міс після операції |
|
Усім пацієнтам із механічними протезами серця; пацієнтам, в яких є ФП або менш «важливі» чинники — СН, дисфункція ЛШ (ФВ <30%) |
Усім пацієнтам з біопротезами показане призначення варфарину (цільове МНВ = 2,5) або інгібіторів Xа-факторів згортання крові: ривароксабану (20 мг/добу) чи апіксабану (10 мг/добу) або прямого інгібітора тромбіну — дабігатрану — 300 мг/добу. Доказова база про безпеку заміни непрямих антикоагулянтів АСК (в дозі 75–100 мг/добу) слабка |