КОРОТКИЙ АНАТОМОФІЗІОЛОГІЧНИЙ НАРИС. АНАТОМІЯ МОЛОЧНОЇ ЗАЛОЗИ
Молочна залоза (лат. — mamma, glandula mammaria; грец. — mastos) — парний орган, функціонально відноситься до жіночої репродуктивної системи. За походженням являє собою видозмінену потову залозу.
Молочні залози розташовані на поверхні великого грудного та частково переднього зубчатого м’язів в ділянці між парастернальною та передньою аксилярною лініями, на рівні від ІІІ до VІ, інколи VІІ ребра. Молочну залозу статево зрілої жінки оточує жирова тканина, що визначає її форму. Крім того, залежно від віку, функціонального стану (період вагітності, годування грудьми) її розміри та форма можуть варіювати.
У центрі залози розташований сосок (papilla mammaria), оточений ареолою (areola mammae) — відносно пласка ділянка пігментованої шкіри, що містить численні ареолярні залози (бугорки Монтгомері), на поверхні яких відкриваються вивідні протоки сальних залоз, що змащують сосок під час грудного вигодовування. Під шкірою ареоли розташований компактний шар циркулярних і поздовжніх м’язових волокон, що забезпечують напруження соска. Вся молочна залоза, особливо сосок, густо забезпечена сенсорними нервами.
Тканина молочної залози може розповсюджуватися за межі її видимих контурів, формуючи «відростки»: пахвовий, ключичний, груднинний, задньобоковий.
У молочній залозі виділяють тіло, жирову та фіброзну тканину. Тіло (паренхіма) молочної залози складається з 15–20 окремо розташованих часток молочної залози (lobi glandulae mammаe). За своєю будовою це складна альвеолярно-трубчаста залоза. Альвеоли складаються із секреторних клітин — лактоцитів, а також з міоепітеліальних клітин, що виконують функцію «витискування» молока із термінальних відділів залоз. Частки розташовані радіарно відносно соска, можуть нашаровуватися одна на іншу. Також частки паренхіми можуть утворювати скупчення, що лежать окремо від основної маси залози (частіше у пахвовому відростку), формуючи додаткові частки.
Кожна частка складається з окремих часточок молочної залози (lobuli glandulae mammаe), що відкриваються у молочний проток (ductus lactiferus), який направляється до соска і в субареолярній ділянці утворює веретеноподібне розширення — молочний синус (sinus lactiferus), що служить резервуаром для накопичення молока.
Кінцева звужена частина протоку пронизує сосок і відкривається на його верхівці воронкоподібним розширеним молочним отвором. Кількість молочних отворів менша, ніж часток — від 8 до 15, бо деякі з протоків зливаються.
Від передньої поверхні грудної стінки до шкіри залози направляються сполучнотканинні тяжі (Куперові зв’язки). Задня поверхня залози гладка, відмежована від грудної фасції грудними зв’язками, що підтримують молочну залозу (ligg. suspensoria mammae).
Кровопостачання молочної залози здійснюється гілками внутрішньої грудної артерії (rr. perforantes), верхньою і латеральною грудними артеріями з басейну пахвової артерії, а також ІІІ–VІІ задніми міжреберними артеріями. Залежно від особливостей ангіоархітектоніки розрізняють магістральний, петльовий і сітчастий типи ділення артеріальних судин.
Глибокі вени супроводжують однойменні артерії, поверхневі вени розташовані під шкірою, утворюючи густу сітку. Підшкірні вени ареоли формують сітку анастомозів, так зване венозне навколососкове коло.
Чутлива та симпатична іннервація молочної залози здійснюється передніми гілками ІІ–VІІ міжреберних нервів, які на задній поверхні залози утворюють сплетення, від якого відходять тонкі гілочки до кровоносних судин, часток і вивідних протоків. Шкіра молочної залози іннервується гілками надключичних нервів (з шийного сплетення), а також боковими гілками ІІ–VІ міжреберних нервів.
ФІЗІОЛОГІЯ МОЛОЧНОЇ ЗАЛОЗИ
Молочна залоза — дзеркало гормонального фону жінки. Вона є органом-мішенню для як мінімум 15 гормонів, змінюється на фоні менструального циклу, періоду вагітності, годування грудьми, вікової інволюції. Ці зміни визначаються функцією гіпоталамічних нейрогормонів, гормонів гіпофізу, яєчників, надниркової і щитоподібної залози.
Кінцевий розвиток молочних залоз (телархе) залежить від часу початку менструальної функції жінки (менархе): чим пізніше менархе, тим пізніше телархе. Молочна залоза починає активно розвиватися у дівчат віком 12–16 років, під час посилення функціональної активності аденогіпофізу у відповідь на підвищення секреції гіпоталамусом гонадотропних рилізинг-гормонів (ГРГ). Під впливом ГРГ клітинами передньої частки гіпофізу починають вироблятися фолікулостимулюючий (ФСГ) і лютеїнізуючий (ЛГ) гормони, які зумовлюють перетворення премордіальних фолікулів яєчників у зрілі фолікули, що секретують естрогени. Приблизно через 18 міс після менархе цикл стає овуляторним, тобто утворюється жовте тіло, що продукує прогестерон. Циклічні зміни рівня статевих гормонів протягом менструального циклу суттєво впливають на морфофункціональний стан молочних залоз. У фолікуліновій фазі циклу під впливом естрогенів відбувається проліферація клітин у термінальних відділах протоків. У лютеїновій фазі за рахунок впливу прогестерону забезпечуються часточково-альвеолярний розвиток і клітинна диференціація. При цьому відмічають збільшення об’єму та щільності тканини залози за рахунок кровонаповнення органа та набряку. Саме цією обставиною пояснюються відчуття нагрубання, ущільнення, розпирання та підвищена чутливість молочних залоз (див. Синдром передменструального напруження). Отже, готуючись до лактації, молочні залози збільшуються за рахунок розростання залозистої тканини. Якщо ж вагітність не наступає, відбувається атрофія сформованих структур шляхом апоптозу.
Максимальний анатомічний та функціональний розвиток молочної залози досягає піку у період вагітності та годування грудьми. Лактогенез — це комплексний морфофізіологічний процес, що включає сукупність змін як протоків, так і альвеол молочної залози протягом вагітності та контролюється ендокринною і вегетативною нервовою системою. Процеси росту і розвитку молочної залози відрізняються у кожний триместр вагітності. Так, у І триместр відмічають епітеліально-канальцеве розростання з утворенням часточково-коміркових структур. У ІІ триместр — морфофункціональна диференціація альвеолярних елементів і поява молочної секреції. У ІІІ — продовжується часточкова гіперплазія й одночасно посилюється секреторна функція. Також фіксують деяке посилення кровопостачання та мікроциркуляції.
Одночасно зі збільшенням молочних залоз виявляють зміни сосків та ареол: гіперпігментація, збільшення діаметру, гіперплазія залоз Монтгомері, більша пружність соска.
Провідну роль у розвитку молочної залози у період вагітності та годування грудьми відіграють стероїдні гормони яєчників і плаценти, пролактин, гонадотропін, плацентарний лактоген.
Естрогени індукують структурні зміни в епітеліальній і сполучній тканині, що характеризуються збільшенням кровопостачання строми, змінюючи проникність капілярів, сприяють росту молочних протоків і їх розгалуженню. Високий рівень естрогенів індукує розвиток альвеол. Також естрогени блокують лактогенну активність пролактину та скорочення міоепітеліальних клітин, що індукуються окситоцином.
Прогестерон сприяє диференціації молочних протоків і альвеол, гальмує процес поділу клітин, який стимулюється естрогенами.
Пролактин бере участь у процесі індукції і підтримання молочної секреції: сприяє розвитку лактоцитів, стимулює синтез протеїнів, ліпідів і вуглеводів молока. Виявлено наявність механізму позитивного зворотного зв’язку між естрогенами і пролактином.
Плацентарний лактоген (хоріонічний соматотропін) — поліпептидний гормон, що синтезується синцитіотрофобластом, виконує соматотропну, лактогенну та лютеотропну дію.
Соматотропний гормон (СТГ) — поліпептидний гормон, діє на тканину молочної залози в основному в комбінації із соматомединами (інсуліноподібні фактори росту). Інтегральна дія полягає у посиленні морфогенетичних та анаболічних процесів, які проявляються у синтезі нуклеїнових кислот і поділі клітин. Дія СТГ доповнюється дією тиреоїдних гормонів та інсуліну.
Гормони щитоподібної залози (тироксин, трийодтиронін) відіграють важливу роль у морфогенезі і функціональній диференціації епітеліальних клітин молочної залози. Вплив тиреоїдних гормонів на молочну залозу може реалізовуватися різними шляхами — безпосередньо, через вплив на рецептори до інших гормонів, у тому числі до пролактину, або шляхом впливу на тиреотропну та лютеїнізуючу функцію гіпофізу.
Доведена опосередкована дія інсуліну на клітини молочної залози певною мірою пояснює підвищення частоти мастопатії при порушеннях метаболізму, але механізми розвитку цієї патології залишаються предметом наукового пошуку.
Лактопоез — це процес підтримання лактації. Її тривалість коливається від 5 до 24 міс. Процес лактопоезу підтримується годуванням грудьми шляхом нейрогормональних рефлексів під час ссання. Рефлекторна дуга починається в чутливих рецепторах сосків і ареол, звідки спинномозковим шляхом сигнал потрапляє в гіпоталамус. У гіпоталамусі запускається продукція октапептидів (в основному окситоцину), адено- і позагіпофізарних гормонів, які підтримують лактацію.
Після закінчення грудного вигодовування епітеліальні клітини залозистого апарату проходять стадію зворотного розвитку, аж до часткового руйнування альвеол. У жінок, які не годували грудьми, частки можуть зберігатися, тому що процес зворотного розвитку залишається незавершеним. Ці обставини підвищують ризик виникнення проліферативних процесів і раку молочної залози (РМЗ).
У клімактеричний період у міру зниження функції яєчників знижується рівень естрогенів. Відповідно до вікової ендокринної перебудови жіночого організму поступово відбувається фіброзно-жирова інволюція молочних залоз. Залозисті частки та протоки спустошуються, атрофуються, заміщуються фіброзною та жировою тканиною, товщина підшкірного жирового шару збільшується, шкіра стоншується.
ЕПІДЕМІОЛОГІЯ
Останні 15 років рак молочної залози посідає 1-ше місце в структурі онкологічної захворюваності жінок України. У 2008 р. його частота становила 61,7 на 100 тис. жіночого населення (з коливанням від 74,3 в Одеській обл.1 до 40,0 — у Закарпатській обл.). Протягом останніх 20 років відмічають тенденцію до неухильного підвищення не тільки рівня захворюваності (1977 р. — 16,1 на 100 тис. жінок), але й показників смертності від РМЗ (1976 р. — 8,4 на 100 тис. жінок; 2008 р. — 30,7 на 100 тис. жінок). Саме тому РМЗ на сьогодні залишається надзвичайно актуальною проблемою сучасної охорони здоров’я.
При аналізі захворюваності на рак молочної залози чітко прослідковуються наступні тенденції:
- рівень захворюваності прямо пропорційний збільшенню віку жінок (закономірність зберігається до 60 років);
- існування двох максимумів захворюваності: вік 45–50 років і після 55 років; період ранньої менопаузи розмежовує їх;
- «омолодження» РМЗ — на сьогодні молоді жінки (до 40 років) хворіють удвічі частіше, ніж 30 років тому;
- жінки, які живуть у містах, хворіють частіше, ніж сільські мешканки;
- захворюваність прямо корелює з кількістю факторів ризику в популяції (раннє менархе, пізня менопауза, пізній вік першої вагітності та пологів, відсутність пологів, відсутність лактації, часте штучне переривання вагітності, надмірна маса тіла, часті важкі стресові стани тощо).
У 2008 р. кількість виявлених хворих на РМЗ у І–ІІ стадіях становила лише 75,1%. При профоглядах діагностовано 49,2% первинних пухлин. Це свідчить про незадовільний стан ранньої діагностики через відсутність належної онкологічної настороженості медичних працівників і низький рівень санітарної культури населення.
ЕТІОПАТОГЕНЕЗ
Розлади системи гормонального гомеостазу є найсуттєвішим фактором виникнення передраку та РМЗ. Порушення різних його ланок призводять до одного й того ж наслідку — гіперестрогенізації організму жінки, яка у поєднанні з дією гонадотропних гормонів гіпофізу є головним фактором, що викликає утворення дисгормональних проліфератів у молочній залозі. Слід зазначити, що гіперестрогенізація може бути наслідком як абсолютного, так і відносного надлишку естрогенів. У генезі дисплазій та РМЗ мають значення патологічні стани як суто в ендокринній системі, так і поза нею. Серед перших варто згадати порушення ієрархічної системи регуляції функції периферичних органів (гіпоталамо-гіпофізарно-яєчникової та/або наднирникової осі), хронічні запальні захворювання придатків. До інших належать деякі екстрагенітальні захворювання, психічні травми, що порушують циклічну діяльність яєчників. Особливо важливе зниження естрогенінактивуючої функції печінки внаслідок її захворювань та авітамінозів.
Сьогодні не викликає сумнівів значення генетичного фактора розвитку РМЗ. У жінок, у сімейному анамнезі яких реєстрували РМЗ у родичів І ступеня (мати, сестра, дочка), ризик захворювання у 3–5 разів вищий, ніж у популяції. За наявності у родичів І ступеня білатерального раку ризик підвищується у 9 разів.
Розрізняють сімейний і спадковий РМЗ. Сімейний рак являє собою скупчення хворих на пухлини молочної залози в межах однієї сім’ї, яке частіше буває випадковим, завдяки впливу вищезгаданих загальних зовнішніх канцерогенних факторів і проживанню в однакових умовах середовища. У той же час близько 10% випадків РМЗ мають справжню спадкову природу.
Завдяки прогресу молекулярної генетики було розшифровано гени, що викликають схильність до РМЗ. У першу чергу, серед них необхідно назвати гени BRCA-1 і BRCA-2 (скорочення від англ. BReast CAncer).
BRCA-1 і BRCA-2 належать до класу генів-супресорів, які кодують білки, що пригнічують клітинний ріст. У жінок — носіїв мутантної форми гена BRCA відмічають до 90% імовірність розвитку РМЗ протягом життя. При цьому ризик захворіти на рак яєчника становить близько 40%. Чоловіки, у геномі яких є мутантні форми генів BRCA-1 або BRCA-2, також можливий підвищений ризик розвитку РМЗ або передміхурової залози.
Відзначено, що пухлини, асоційовані з мутаціями генів BRCA-1 і BRCA-2, мають більш високий ступінь злоякісності (переважно ІІІ) порівняно зі спорадичним РМЗ.
Мутації генів BRCA-1 виявляють у 1,5–2 рази частіше, ніж BRCA-2. Можливо, кількість мутацій BRCA більша, якщо РМЗ виявляють у молодому віці, відмічають двобічне ураження молочних залоз, або ж діагностовано рак яєчника у даної пацієнтки або її найближчих родичів.
Виявлені й інші гени, які можуть призводити до спадкового РМЗ. Одним із них є ген ATM. Мутація цього гена призводить до розвитку синдрому атаксії-телеангіектазії, що характеризується неврологічними розладами, телеангіектазіями, імунодефіцитними станами, гіперчутливістю до іонізуючого випромінювання. Крім того, у носіїв мутантного гена АТМ частіше відмічають пухлини головного мозку, надниркової і молочної залози.
РМЗ може також бути компонентом синдрому Лі — Фраумені, проявами якого є пременопаузальний РМЗ у поєднанні з саркомами м’яких тканин, пухлинами головного мозку, лейкозами, адренокортикальним раком. У виникненні цього синдрому відіграють роль мутації гена-супресора пухлинного росту р53 і гена СНЕК2.
Для синдрому Каудена (Cowden) характерні, окрім РМЗ, множинні гамартоми, рак ендометрія, новоутворення шлунково-кишкового тракту, патологія щитоподібної залози (у тому числі рак). Частота розвитку РМЗ серед жінок з синдромом Каудена становить 25–50%. Серед шкірних проявів синдрому слід звернути увагу на фіброми та папіломи порожнини рота, множинні трихолемоми, гіперкератоз долонь і підошов. Відповідальним за розвиток даного синдрому є мутація гена PTEN.
Одним із найпоширеніших синдромів спадкового раку жіночої репродуктивної системи є синдром Лінча 2-го типу (Lynch 2): синдром сімейного раку молочної залози, ендометрія, яєчника, товстої кишки. Виявлено ряд мутацій генів hMLH1 і hMLH2, пов’язаних із цим синдромом.
Вивчається роль мутації і в інших генах: BRIP1, PALB2, CASP8, TGFB1, які можуть відігравати певну роль у виникненні РМЗ.
Необхідно пам’ятати, що дія генів схильності до РМЗ значною мірою знаходиться під впливом інших генів — генів-модифікаторів, оскільки канцерогенез є результатом взаємодії багатьох генів, у якому онкогенам і генам-супресорам відводиться провідна роль. Інші гени, у тому числі гени детоксикації, відіграють роль модифікаторів функцій головних генів.
Вірусний фактор. Джон Джозеф Біттнер у 1936 р. виявив у молоці самок мишей специфічний «фактор молока», який викликав РМЗ у вигодуваних цим молоком мишенят. Вказаний «фактор молока» був ідентифікований як вірус пухлин молочних залоз мишей, або MMTV (від англ. Mouse Mammary Tumor Virus). За останні 10 років з’явилися докази того, що в організмі людини циркулює MMTV-споріднений провірус людини, або hMTV (від англ. human Mammary Tumor Virus). Його виявлено у геномі лімфоцитів і пухлинних клітин. У нормальних тканинах людини він відсутній, що вказує на зовнішнє джерело інфекції. Запропоновано декілька шляхів потрапляння вірусу в організм людини: із забрудненими мишиними фекаліями продуктів через лімфоїдну тканину шлунково-кишкового тракту; не виключена передача як від миші безпосередньо, так і через проміжних хазяїв (коти, примати); можливий вертикальний шлях передачі (від матері до дітей). Лімфоїдна тканина кишечнику людини може слугувати «воротами» ретровірусної інфекції, а лімфатичні вузли — резервуаром. Остаточних доказів вірусного походження РМЗ у людини досі немає, але прибічники вірусно-генетичної теорії Зільбера застерігають широко застосовувати чуже материнське молоко без попередньої генеалогічної консультації годувальниць.
Застарілими та недостовірними є дані про наявність зв’язку між розвитком РМЗ та післяполового маститу, що лікували консервативно, а також з частим рентгенологічним обстеженням органів грудної порожнини у жінок, хворих на туберкульоз легень.
ПАТОМОРФОЛОГІЯ
Існують численні класифікації раку молочної залози, на базі яких створено гістологічну класифікацію пухлин молочних залоз ВООЗ (1981). Застосовується також класифікація за ступенем злоякісності (ВООЗ, 1968), позаяк доведено, що останні мають певне прогностичне значення.
1. Епітеліальні пухлини2.
- Доброякісні (внутрішньопротокова папілома, аденома тощо).
- Злоякісні:
- неінфільтруючі (внутрішньопротоковий рак, часточковий рак in situ);
- інфільтруючі (інфільтруючий протоковий рак (у тому числі з перевагою внутрішньопротокового компонента, інфільтруючий часточковий рак, слизовий, медулярний, папілярний, тубулярний, аденокістозний, секреторний, апокринний, рак з метаплазією);
- запальний рак3;
- хвороба Педжета соска.
2. Змішані сполучнотканинні й епітеліальні пухлини (фіброаденома, листоподібна фіброаденома, цистосаркома, карциносаркома).
3. Інші види пухлин (пухлини м’яких тканин, шкіри, кровотворної та лімфоїдної тканин).
4. Некласифіковані пухлини.
5. Дисплазії молочної залози (фіброзно-кістозна хвороба).
6. Пухлиноподібні ураження (ектазія протоку (плазмоклітинний мастит, перидуктальний мастит); «запальні» псевдопухлини; гамартоми; гінекомастія та ін.).
ПЕРЕДПУХЛИННІ ЗАХВОРЮВАННЯ
Протягом певного часу цей термін вважався синонімом поняття «дисгормональні дисплазії». Але останнім часом доведено, що дисплазії молочних залоз (а також виділена з них група доброякісних пухлин) є досить неоднорідною групою захворювань, що формуються під впливом різних ендокринних та обмінних порушень і є результатом ненормального, некоординованого росту епітелію та сполучної тканини. Якщо деякі з цих процесів можуть розглядатися як передракові захворювання, то інші досить рідко переходять у новоутворення (аденома, фіброаденома), а окремі типи (листоподібна фіброаденома) можуть започаткувати розвиток своєрідних форм саркоми.
Велика плутанина існує у термінології: наприклад, термін «кістозний фіброаденоматоз» має близько 30 синонімів (фіброзно-кістозна мастопатія (хвороба), хвороба Реклю, хвороба Шимельбуша, хронічний кістозний мастит тощо). Така ж ситуація і в класифікації — існують декілька клінічних та патоморфологічних класифікацій.
Фіброаденома макроскопічно являє собою щільний округлий, добре окреслений вузол, оточений капсулою, сірувато-білого кольору. Пальпаторно вона визначається у вигляді щільного, гладенького утвору, не зв’язаного зі шкірою, що легко зміщується (так званий симптом «плавання» пухлини по залозі). Ні при якому іншому захворюванні молочної залози виявити цей симптом не вдається. Відмічають також позитивний симптом Кьоніга (у горизонтальному положенні вузол не зникає) та симптом «долоні» (при пальпації основою долоні — п’ястком — вузол не зникає). Частіше виявляють у молодих осіб. Аденому відмічають досить рідко, клінічно вона не відрізняється від фіброаденоми.
Листоподібна фіброаденома (філоїдна фіброаденома, цистофібросаркома тощо) досить рідкісна пухлина. Уперше її описав у 1938 р. Müller. Її слід відрізняти від банальних сарком, що виходять з м’яких тканин, наприклад фасцій. Такі первинні саркоми не мають дисгормональних попередників, а також клінічної та гістологічної своєрідності, притаманних малігнізованим філоїдним фіброаденомам. Пухлина чітко відокремлена, має гладеньку або поліциклічну поверхню, щільно-еластичну або неоднорідну консистенцію, за якої щільні ділянки чергуються з осередками розм’якшення (у них визначається симптом флюктуації). Розміри можуть варіювати від невеликих до гігантських (до 20 кг). Макроскопічно пухлина складається з кількох вузлів, що зливаються, оточена псевдокапсулою, поверхня великих пухлин неоднорідна, і в деяких випадках щільні осередки, що виступають над розрізом, нагадують листки закритої книги (через що пухлина і дістала свою назву). У клінічної історії пухлини немає таких ознак (розмір пухлини, темп її росту, вік хворої, біль, втягнений сосок тощо), які б вірогідно свідчили про її малігнізацію. Таким чином, неможливо визначити злоякісний потенціал філоїдної пухлини тільки клінічно.
Мастопатія (фіброаденоматоз) клінічно поділяється на дифузну та вузлову форми. Серед дифузних форм ми вважаємо за доцільне виділити такі:
1) дифузна мастопатія із перевагою залозистого компонента (аденоз) — стан на межі між нормою та патологією, морфологічна основа якого — гіперплазія залозистих часточок. Хворіють молоді жінки (віком до 22–25 років), пальпаторно визначається дифузна зернистість або невеликі вузлики, перед менструацією з’являється біль, набряк, ущільнення залоз. Схильна до спонтанного зворотного розвитку;
2) дифузна мастопатія з перевагою фіброзного компонента. Відмічають переважно в осіб віком 21–35 років астенічної конституції, часто з ознаками вірилізації. Більше ніж у 60% менархе настає після 15–16 років, наявна схильність до мізерних менструацій при короткому циклі (18–21 день) чи зі збільшеним інтервалом (35 і більше днів). Хворі відмічають тимчасову аменорею у стресових станах. Молочні залози нерідко розвинуті погано або атрофічні. Пальпаторно виявляють помірно щільні утворення дископодібної форми, різних розмірів, що нагадують пласкі грудки без чітких контурів. Розташовані вони зазвичай симетрично у центральній частині чи верхньо-зовнішніх квадрантах. У патогенезі мають значення явища дефіциту естрогенів і гіперкортицизму. З метою призначення лікування цих хворих можна поділити за етіологічними ознаками:
- хворі з гіпофункцією яєчників, що розвинулася при їх первинному ураженні (тривалий хронічний аднексит, паротит, ревматизм, туберкульоз). Через розвиток інфільтратів і фіброзу порушується васкуляризація та іннервація органів зі зниженням їх чутливості до ФСГ і ЛГ, утруднюються ріст і дозрівання фолікулів. Лікування за участю гінеколога спрямовано на усунення запалення та корекцію гіпоестрогенемії;
- хворі з явищами гіпертиреозу (тиреотоксична мастопатія, хвороба Вельямінова). Зумовлено тим, що при підвищенні тиреоїдної активності підвищується активність кори надниркової залози і механізмом зворотного зв’язку гальмується діяльність яєчників. Лікування за участю ендокринолога (антитиреоїдні засоби, препарати йоду у другій фазі циклу);
- хворі з нейро- та психогенною естрогенною недостатністю після захворювань ЦНС (енцефаліти, черепно-мозкова травма), реактивних станів чи неврозів. Відмічають високий рівень АКТГ та ТТГ (стресові гормони) з порушенням циклічності виділення гонадотропних гормонів гіпофізу та вторинними порушеннями дозрівання фолікулів. Лікування слід проводити спільно з невропатологом і психіатром (седативні засоби, транквілізатори, мікстура Кватера).
У всіх випадках застосовується вітамінотерапія токоферолом, фолієвою та аскорбіновою кислотами;
3) дифузна мастопатія з перевагою кістозного компонента. Хворі характеризуються жіночністю будови тіла, конституція нормостенічна чи пікнічна. Вік старше 30 років. Менструальний цикл регулярний, але є ознаки недостатності лютеїнової функції — затяжний цикл з тривалою кровотечею (до 7–10 днів), ановуляторні цикли, синдром передменструальної напруги, в анамнезі — викидні. Хворі скаржаться на почуття розпирання, переповнення у залозах, що іррадіюють у плече, лопатку. Пальпаторно визначають помірно виражене дифузне ущільнення, на фоні якого існують гладенькі еластичні утвори, що сплощуються при натисненні, не спаяні з оточуючими тканинами. Часто виявляють і великі кісти 2–5 см у діаметрі, може бути симптом флюктуації, виділення з сосків. У гормональному профілі — підвищена секреція естрогенів при зниженні кортикостероїдів. Аналогічно виділяють такі групи хворих:
- пацієнти із хворобами печінки та жовчовивідних шляхів. Лікування традиційне;
- хворі з недостатністю тиреоїдної функції, викликаною ендемічним зобом або наслідками хірургічного чи фармакологічного впливу. Відмічають персистенцію фолікулів, відсутність овуляції та зниження лютеїнової функції через гіперестрогенемію та дефіцит прогестинів і кортикостероїдів. Лікування тироксином, вітамінами, прогестинами та стимуляторами овуляції;
- хворі з кістоутворенням у яєчниках, за наявності підвищення рівня гонадотропінів у них відмічають збільшення фолікулінової фази та ановуляцію. Лікування проводять за участю гінеколога-ендокринолога. Слід зауважити, що призначення гормонотерапії є дуже серйозним кроком, особливо у молодих жінок, який має бути ретельно обґрунтованим. Останнім часом показання до їх призначення значно звужуються. Перед лікуванням бажано провести обстеження на гормональну насиченість організму (кольпоцитологія, симптом зіниці, натягнення шийкового слизу, екскреція гормонів з сечею та їх концентрація в крові) з постійним контролем цих показників під час лікування.
Вузлові форми характеризуються наявністю вогнищ ущільнення з досить чіткою межею. Їх поверхня може бути зернистою, гладенькою чи нерівною. Як правило, вони безболісні. У лікуванні більшість авторів дотримується активної хірургічної тактики, що зумовлено не стільки принципами терапії вузлової мастопатії, скільки небезпекою діагностичної помилки. Але секторальною резекцією з цього приводу обмежитися не можна, слід провести увесь комплекс терапевтичних заходів, як при відповідній формі дифузного фіброаденоматозу.
Досить часто виражений біль і дискомфорт у молочних залозах транзиторного характеру викликає не наявність мастопатії, а більше чи менше виражений передменструальний синдром (ПМС). Через широку розповсюдженість та значний вплив на здоров’я та працездатність жінок стисло наведемо дані про цю патологію.
ПМС (синдром передменструальної напруги, передменструальна хвороба, циклічна хвороба, оваріальний циклічний синдром) — патологічний симптомокомплекс, що проявляється нейропсихічними, вегетосудинними й обмінноендокринними порушеннями у другій фазі менструального циклу.
Частота ПМС варіабельна і залежить від віку жінки. Так, у віці до 30 років вона становить 20%, у віці старше 30 років ПМС відмічають приблизно у кожної другої жінки. Крім того, ПМС частіше виявляють у емоційно лабільних жінок астенічної тілобудови з дефіцитом маси тіла. Значно вищу частоту ПМС відмічають у жінок інтелектуальної праці.
Ще в ІІ ст. до н.е. Гален висловив ідеї про зв’язок хворобливого стану жінок напередодні циклічних кровотеч з фазами Місяця. Перша публікація, у якій було офіційно визначено цей патологічний стан, відноситься до 1931 р., коли Роберт Франк вперше систематизував, сформулював та пояснив деякі причини таких фізичних і психічних порушень.
Існує багато теорій розвитку ПМС: гормональна, «водної інтоксикації», психосоматичних порушень, алергічна тощо. Історично першою була гормональна теорія (Frank R.T., 1931). Згідно з нею ПМС розвивається на фоні абсолютної або відносної гіперестрогенії та дефіциту секреції прогестерону. Проте, як показали проведені дослідження, ановуляцію та недостатність жовтого тіла при вираженій клініці ПМС відмічають дуже рідко. Крім того, терапія прогестероном виявилася неефективною.
Певну роль у генезі ПМС відіграє пролактин, який є не тільки гормоном, але і модулятором, і цитокіном. Фізіологічне підвищення концентрації пролактину у ІІ фазі менструального циклу поряд з гіперчутливістю до нього тканин-мішеней можуть призводити до натрійзатримувального ефекту через гіперальдостеронемію та антидіуретичного ефекту, що реалізовується вазопресином.
Показана роль простагландинів у патогенезі ПМС. Багато симптомів ПМС можуть бути зумовлені станом гіперпростагландинемії (мігренеподібний головний біль, нудота, блювання, здуття живота, діарея). Простагландини відповідальні також за прояви різних вегетосудинних реакцій.
Не остання роль у патогенезі ПМС відводиться порушенню обміну нейропептидів у ЦНС (опіоїди, серотонін, дофамін, норадреналін тощо) і пов’язаних з ним периферичних нейроендокринних процесів.
Залежно від переважання тих чи інших симптомів у клінічній картині умовно виділяють 5 форм ПМС (Сметник В.П., 1987): нейропсихічна, набрякова, цефалгічна, кризова, атипові форми.
Нейропсихічна форма характеризується наступними симптомами: емоційна лабільність, дратівливість, плаксивість, безсоння, агресивність, апатія до навколишнього світу, депресивний стан, слабкість, швидка втомлюваність, нюхові та слухові галюцинації, послаблення пам’яті, відчуття страху, смутку, безпричинний сміх або плач, сексуальні порушення, суїцидальні думки. Окрім нейропсихічних реакцій, які виступають на перший план, у клінічній картині можуть бути й інші симптоми: головний біль, запаморочення, порушення апетиту, нагрубання та болісність молочних залоз, здуття живота.
Набрякова форма відрізняється переважанням наступних симптомів: набряки обличчя, гомілок, пальців рук, нагрубання та болісність молочних залоз (мастодинія), свербіж шкіри, підвищене потовиділення, спрага, збільшення маси тіла, порушення функції шлунково-кишкового тракту (запор, діарея, метеоризм), біль у суглобах, головний біль, дратівливість тощо. У більшості хворих із набряковою формою у другій фазі менструального циклу відмічають від’ємний діурез із затримкою до 500–700 мл рідини.
Цефалгічна форма характеризується превалюванням у клінічній картині вегетосудинної і неврологічної симптоматики: головний біль за типом мігрені з нудотою, блюванням і діареєю (типові прояви простагландинемії), запаморочення, серцебиття, серцевий біль, безсоння, дратівливість, підвищена чутливість до запахів, агресивність. Головний біль має специфічний характер: смикаючий, пульсуючий в ділянці скроні, з набряком повіки, супроводжується нудотою, блюванням. В анамнезі у цих жінок часто відмічають нейроінфекції, черепно-мозкові травми, психічні стреси. Сімейний анамнез часто обтяжений серцево-судинними захворюваннями, гіпертонічною хворобою і патологією шлунково-кишкового тракту.
При кризовій формі у клінічній картині переважають симпатоадреналові кризи, що супроводжуються підвищенням артеріального тиску, тахікардією, відчуттям страху, серцевим болем без змін на електрокардіограмі (ЕКГ). Напади нерідко закінчуються рясним сечовиділенням. Як правило, кризи виникають після перевтоми, стресових ситуацій. Кризовий перебіг ПМС може бути результатом нелікованої нейропсихічної, набрякової чи цефалічної форми на стадії декомпенсації і проявляється у віці старше 40 років. У більшості хворих на кризову форму ПМС відмічають захворювання нирок, серцево-судинної системи та шлунково-кишкового тракту.
До атипових форм ПМС належать вегетативно-дизоваріальна міокардіопатія, гіпертермічна офтальмоплегічна форма мігрені, гіперсомнічна форма, «циклічні» алергічні реакції (виразковий гінгівіт, стоматит, бронхіальна астма, іридоцикліт тощо).
Залежно від кількості симптомів ПМС, їх тривалості і вираженості виділяють легку та тяжку форми:
- легка форма — поява 3–4 симптомів за 2–10 днів до менструації при значній вираженості 1–2 симптомів;
- тяжка форма — поява 5–12 симптомів за 3–14 днів до менструації, з них 2–5 або всі значно виражені.
Важливо, що порушення працездатності, незалежно від кількості та тривалості симптомів, свідчить про тяжкий перебіг ПМС і часто поєднується з нейропсихічною формою.
Лікування. Через невизначену напевно етіологію та складність патогенезу, загальноприйняті підходи до лікування ПМС відсутні. Обґрунтовані дані з цього питання представлені у збірнику доказової медицини (Evidence Based Medicine) (табл. 7.1).
Таблиця 7.1
Підходи до лікування ПМС
|
Корисна, благотворна дія |
Спіронолактон; піридоксин |
|
Швидше корисна, благотворна дія |
Алпразолам (транквілізатор), буспірон (анксіолітик), гонадорелін (менше 6 міс; синтетичний аналог гонадотропін-вивільняючого гормону), метолазон (тіазидний діуретик), НПЗП, оральні контрацептиви, до складу яких входить дроспіренон (гестаген з антимінералокортикоїдною активністю), сполуки кальцію, гістеректомія окремо або у поєднанні із двобічною оваріоектомією (лапароскопічно) |
|
На межі між користю та шкідливістю |
Кломіпрамін (антидепресант), даназол (антигонадотропний засіб), селективні інгібітори зворотного захоплення серотоніну, прогестогени |
|
Дія невідома |
Естроген, прогестерон, тіболон (селективний регулятор естрогенної активності), магнезія, масло вечірньої примули, акупунктура, фізичні вправи, релаксація, абляція ендометрія |
РІСТ І РОЗПОВСЮДЖЕННЯ
Ріст і розповсюдження ракової пухлини в молочній залозі відбувається зазвичай у таких напрямках:
1) по молочних протоках та ходах шляхом інтраепітеліального росту;
2) лімфогенно — по лімфатичних капілярах паренхіми, шкіри та підшкірної клітковини, лімфатичних судинах часточкових сплетінь, периваскулярних та периневральних лімфатичних щілинах;
3) гематогенно — по кровоносних судинах.
Відтікання лімфи, а відповідно і лімфогенне метастазування, відбувається наступними шляхами:
1. Пахвовий шлях, яким іде відтік 4/5 лімфи, переважно від зовнішньої половини залози. Починається від навколососкового сплетення, далі лімфосудини формують 2–4 великих стовбури, що проходять по великому грудному м’язу та впадають у вузли пахвової ямки. У місці перехрещення нижнього краю великого грудного та третього зубця переднього зубчатого м’яза знаходиться лімфатичний вузол Зоргіуса, де в першу чергу може виникнути метастаз раку. Згадані лімфатичні судини широко анастомозують із судинами, що прямують у над- та підключичні, парастернальні й інші лімфоколектори. Існує декілька класифікацій (близько 5), які поділяють пахвові лімфовузли на групи чи етапи метастазування. Але за вітчизняною традицією (ще за часів СРСР) лімфоколектором I та II рівнів метастазування прийнято називати пахвову зону, а III рівня — підключичну.
2. Підключичний шлях є додатковим шляхом відтоку, анатомічно та функціонально тісно пов’язаний із пахвовим шляхом. Він складається з транспекторального напрямку — 2–5 лімфосудин, що прямують через великий грудний м’яз до лімфовузлів (роттеровських), розташованих між великим і малим грудними м’язами, або безпосередньо до підключичних вузлів медіального краю m. pectoralis minor; інтерпекторального напрямку — 1–2 лімфатичні судини, які огинають грудні м’язи та впадають у підключичні лімфатичні вузли. Інвазія останніх, як правило, пов’язана із масивним метастатичним ураженням пахвового колектора і значно погіршує прогноз.
3. Парастернальний шлях проходить від глибоких відділів паренхіми та медіальних квадрантів до лімфовузлів, розташованих по ходу внутрішніх грудних судин у просторі між міжреберними м’язами та внутрішньогрудною фасцією з I по V міжребер’я. Метастатичне ураження цієї групи при медіальній чи центральній локалізації пухлини відмічають майже у кожної третьої пацієнтки, що оперується.
4. Медіастинальний шлях тісно пов’язаний із попереднім колектором. Але його лімфосудини починаються як від парастернальних лімфовузлів, так і безпосередньо від молочної залози, прямують до перибронхіальних, трахеобронхіальних колекторів, а також до лімфовузлів тимусу.
5. Міжреберний шлях важко враховувати при плануванні лікування, але він набуває певного значення при блокаді головних шляхів відтоку. Деякі дослідники наголошують на наявності лімфатичних та лімфовенозних анастомозів із грудними хребцями та грудним лімфатичним протоком, чим пояснюють часте метастатичне ураження плеври, легень та хребців.
6. Перехресний внутрішньошкірний та підшкірний шлях у напрямку протилежної залози та контралатеральних лімфовузлів.
7. Епігастральний шлях підшкірних та субфасціальних лімфосудин, які широко анастомозують з судинами, що прямують через піхви прямих м’язів черева до лімфомережі передочеревинної клітковини та вінцевої зв’язки печінки. Про існування цього шляху свідчить часте метастатичне ураження печінки (особливо діафрагмальної її поверхні та ділянки біля lig. coronarium hepatis) при розташуванні пухлини у нижніх квадрантах залози та субмамарній складці.
8. Внутрішньошкірний та підшкірний шлях відтоку лімфи вздовж внутрішніх і зовнішніх гілок верхніх та нижніх епігастральних судин у напрямку заочеревинних та пахвинних лімфовузлів, очеревини та яєчників. Про існування цього шляху свідчить часте ураження метастазами останніх.
Шляхи з 4-го по 8-й є додатковими, активно функціонують лише при блокаді головних магістралей лімфовідтоку.
Клінічна класифікація етапів лімфовідтоку (Berg, 1955) зручна для використання на практиці. В основу її покладено принцип етапності метастатичного ураження лімфатичних вузлів.
І рівень — нижні пахвові лімфовузли, розташовані латеральніше зовнішнього краю малого грудного м’яза.
ІІ рівень — середні пахвові лімфовузли, розташовані за малим грудним м’язом. До нього належать міжпекторальні (роттеровські) лімфовузли, розташовані між малим і великим грудними м’язами.
ІІІ рівень — апікальні пахвові лімфовузли, що традиційно називають у нашій країні підключичними. Вони розташовані у проміжку від медіального краю малого грудного м’яза до груднино-ключичного зчленування.
В 6-й редакції класифікації TNM застосовують модифікацію цієї класифікації (див. відповідний розділ).
ДІАГНОСТИКА
Рак молочної залози належить до візуальних локалізацій пухлин, і через це, здається, його діагностика не повинна викликати суттєвих труднощів. Але й дотепер ця проблема не вирішена остаточно, відсоток своєчасно виявлених пухлин залишається в Україні негідно низьким для цивілізованої держави (I–II стадія — 75,1%, III — 15,3%, IV — 7,6% від усіх вперше виявлених у 2008 р.).
Прийнято розрізняти 3 клінічні форми раку молочної залози: вузлову, дифузну та рак Педжета. Дифузний рак, у свою чергу, поділяється на набряково-інфільтративну, бешихоподібну та маститоподібну форми (деякі автори ще окремо виділять панцирну форму). Рак Педжета — своєрідна пухлина, що уражує сосок та ареолу (вирізняють екземоподібну, псоріазоподібну, виразкову та пухлинну форми).
Клінічна діагностика РМЗ ґрунтується на анамнестичних даних, даних огляду, наявності пухлини при пальпації та змінах лімфатичних вузлів.
1) При зборі анамнезу слід звернути увагу на наступні моменти:
- термін виявлення або появи пухлини, наявність подібних пухлин раніше;
- операції на молочних залозах (з приводу маститу, доброякісних пухлин, раку);
- строки заміжжя, родинний стан у теперішній час; сексуальна функція;
- вік появи менструацій, час настання менопаузи, термін останньої менструації;
- гінекологічні захворювання;
- вік першої вагітності та перших пологів, вік при останній вагітності чи пологах, їх кількість;
- повноцінність годування грудьми, кількість молока, виділення з сосків після припинення годування;
- наявність онкологічних захворювань (зокрема РМЗ) і передракових станів у родичів.
2) Під час огляду необхідно звернути увагу на:
- збільшення або зменшення розмірів залоз;
- підтягнення догори чи у боки, рухомість чи фіксація;
- зміни форми залози (вибухання, западення тощо), окремо — ділянки соска;
- локальна чи розлита гіперемія шкіри залози, розповсюдження її на суміжні ділянки;
- локальний чи тотальний набряк залози, що має вигляд «кірки цитрини»;
- вузликові ущільнення, виразки шкіри, кірки, мокнуча поверхня, нориця, розпад тканини.
3) Пальпаторно оцінюють такі характеристики пухлинного вузла:
- розміри (діаметр), зазвичай відмічають — до 2 см; до 5 см; більше 5 см;
- консистенція — щільна, щільно-еластична, неоднорідна. Наявність позитивних симптомів: Кьоніга, «долоні» (див. вище);
- локалізація — центральна, зовнішні квадранти (верхній і нижній), внутрішні квадранти (верхній і нижній). Варто зазначати розташування пухлини у ділянці соска, ареоли, а також у пахвовому, підключичному та груднинному відростках залози, а також у субмамарній складці та по сосковій лінії;
- межі пухлини — чіткі, частково нечіткі, нечіткі;
- зв’язок із прилеглими тканинами — шкірою, соском, м’язом (залежно від локалізації). Симптоми «майданчика» (ригідність шкіри, що інфільтрована пухлиною), умбілікації (втягання шкіри, що нагадує пупок, у місці проростання пухлиною), Прибрама (зміщення пухлини при потягуванні за сосок);
- наявність в залозі інших вузлів чи ущільнень.
4) При пальпації регіонарних лімфовузлів важливо з’ясувати:
- наявність збільшення та ущільнення лімфатичних вузлів в пахвових та надключичних ділянках з обох боків;
- кількість вузлів — один, декілька, ланцюжок чи конгломерат;
- зв’язок вузлів між собою (спаяність), з прилеглими тканинами та шкірою (рухомість);
- наявність набряку верхньої кінцівки.
Дослідження хворої здійснюють у вертикальному та горизонтальному положеннях, з піднятими й опущеними руками.
Інструментальна діагностика базується на променевих та морфологічних методах дослідження.
Мамографія — рентгенологічне дослідження молочних залоз. Безконтрастна мамографія проводиться у двох проекціях (прямій та боковій чи косій) при дозованій компресії органа. Для вивчення окремих ділянок залози, їх структури, візуалізації дрібних вапняних включень, роблять прицільні знімки за допомогою спеціальних тубусів.
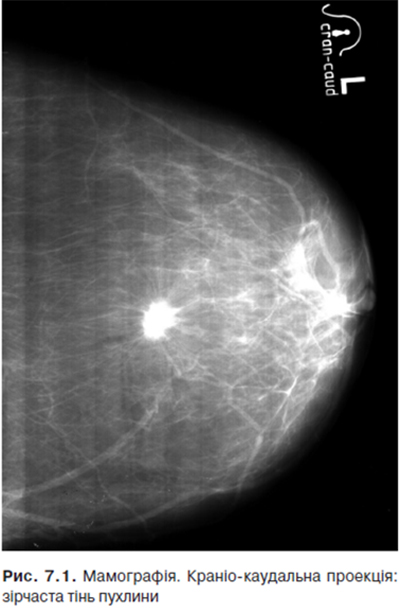
Рентгенологiчно оцінюють прямі та непрямі ознаки вузлової форми РМЗ. Серед прямих — пухлинний вузол і мiкрокальцинати. Рентгенологiчна картина пухлинного вузла певною мірою залежить вiд його гiстологiчної будови. Скирознi пухлини формують осередок ущільнення зірчастої або амебоподібної форми, неоднорідної структури, з нечітким контуром і характерними спiкулоподiбними вiдхвiстями по периферії, перебудовою структури залози. Часто відмічають зону просвітлення навколо пухлини. Приблизно у половині випадків виявляють типові кальциновані включення, так звані мiкрокальцинати. Пухлина медулярної будови виглядає як вузол округлої чи неправильної форми, неоднорідної структури (через нерівномiрнiсть росту пухлини) з нечіткими, подекуди поліциклічними, контурами. У деяких випадках вузол оточує фіброзна капсула, що симулює картину доброякісної пухлини.
Серед непрямих ознак виділяють наступні: зміни шкіри — ущільнення, iнфiльтрацiя, втягнення; зміни судинного малюнка (симптом гiперваскуляризацiї); перебудова тканин, що оточують пухлину, — неправильної форми тiньовi смужки, що формують малюнок «мережi», ракова «стежка» мiж пухлиною та шкiрою; змiни соска. Важливою диференцiйно-дiагностичною ознакою є невiдповiднiсть розмiру пухлини при пальпацiї та рентгенографiї, яка зумовлена особливостями iнфільтративного росту пухлини та перифокальним запаленням, за рахунок якого пухлина пальпаторно здається бiльшою, нiж на знімках.
При дифузних формах відмічають потовщення шкіри, підвищення загальної щільності з дифузним затемненням залози, перебудовою її структурного малюнка з утворенням тіней невизначеної форми, гіперваскуляризації, а за наявності вузла — тінь без чітких меж.
Для підвищення природно низької контрастності органа застосовують методики штучного контрастування. Пневмокістографія: після пункції кісти та аспірації її вмісту у порожнину вводять повітря в обсязі, що дорівнює обсягу аспірату. Метод дозволяє встановити наявність залишкової рідини, інтракістозного раку, вивчити особливості архітектоніки кісти, стан внутрішніх стінок. Дуктографія — метод вибору за наявності патологічної секреції, особливо кров’янистих і серозних виділень. Протипоказання — гострий запальний процес і клінічно діагностований РМЗ через небезпечність дисемінації клітин по протоках. Після масажу залози та видалення секрету у проток за допомогою шприца вводять 0,5 мл уротрасту чи верографіну.
Частота помилкових негативних результатів при мамографії становить 1,8–6,8%, а помилкових позитивних — 9–17%. За даними багатьох дослідників, точність мамографії становить 78,5–90%, знижуючись зі зменшенням розміру пухлини.
УЗД (сканування, ультрасонографія) в В-режимі дозволяє визначити локалізацію, кількість, розміри, ехоструктуру новоутворення та додаткові акустичні ефекти, а також стан лімфатичних вузлів і тканин, що оточують пухлину. Мінімальною вимогою для адекватного дослідження молочних залоз є наявність короткофокусного лінійного датчика частотою 5 МГц. Проте для деталізації виявлених змін необхідними є спеціалізовані високочастотні датчики 7–15 МГц із динамічним фокусуванням.
При вузловій формі раку та експансивному типі росту при УЗД візуалізується гіпоехогенне утворення правильної овальної або круглої форми з чіткими контурами, яке «розсуває» оточуючі тканини. Пухлина з інфільтративним характером росту найчастіше неправильної форми з нерівними поліциклічними контурами, часто дистально виявляють тінь (затухання ультразвукових хвиль). При раку вісь пухлини знаходиться, як правило, в сагітальній площині, на відміну від доброякісних утворень, де вона перебуває у фронтальній площині (рис. 7.1, 7.2).

З додаткових ознак можна оцінити реакцію оточуючих тканин на ріст пухлини:
- зона десмоплазії — ділянка підвищеної щільності оточуючої жирової тканини у вигляді нерівного гіперехогенного обідка. Ультразвукове сканування дозволяє диференціювати зону десмоплазії від меж пухлини (тобто точніше визначити її розмір), чого неможливо досягти при пальпації або мамографії;
- порушення гістоархітектоніки органа, зумовлене пухлинною інфільтрацією та вторинним фіброзом;
- мікрокальцинати погано визначаються при УЗД, у їх виявленні провідна роль належить рентгенівській мамографії.
Окремі типи пухлин (муцинозні, медулярні) можуть візуалізуватися як добре відокремлені від оточуючої тканини комплекси кіст з гіпоехогенним вмістом. З ростом пухлини утворюються анехогенні зони (некроз, крововиливи); ділянки активного росту пухлини лоціюються у вигляді анехогенного обідка.
Особливою формою є папілярний рак, що виникає у порожнині кісти. Диференційна діагностика кіст та кістоподібного раку за допомогою променевих методів ускладнена, тому будь-яке кістоподібне утворення, підозріле на атипове, підлягає проведенню біопсії з цитологічним дослідженням.
Соноеластографія — ультразвукова методика, що полягає в одночасному вимірюванні ехогенності та жорсткості (еластичності) біологічних тканин. Патогенетичним обґрунтуванням методу є ущільнення тканин і втрата ними еластичності при запальних процесах і пухлинних утвореннях.
Допплерографія — ґрунтується на застосуванні ефекту Допплера, суть якого полягає в тому, що від рухомих об’єктів ультразвукові хвилі віддзеркалюються зі зміненою частотою — підвищеною, якщо рух спрямований у бік датчика, і зниженою — при протилежному русі. Найчастіше застосовують нижченаведені методики.
ІСД, що базується на періодичному випромінюванні серій імпульсів ультразвукових хвиль, які, відбиваючись від еритроцитів, послідовно сприймаються тим самим датчиком. При цьому фіксуються сигнали, відображені тільки з певної відстані від датчика, які встановлюються на розсуд лікаря. Місце дослідження кровотоку називають контрольним об’ємом. Перевагою ІСД є можливість оцінки кровотоку у будь-якій заданій точці.
Інформація при ІСД може бути представлена трьома способами: у вигляді кількісних показників швидкості кровотоку, у вигляді спектрограми та тональними звуковими сигналами на звуковому виході. Основним методом діагностичної інформації є спектрограма — графік, на якому по вертикальній осі відкладається швидкість, а по горизонтальній — час. Сигнали, що відображаються вище горизонтальної осі, ідуть від току крові, спрямованого до датчика, нижче цієї осі — від датчика. Крім того, по виду допплерівської спектрограми можна визначити характер току крові: ламінарний тік відображається у вигляді вузької кривої з чіткими контурами, турбулентний — широкої неоднорідної кривої.
Для отримання найкращих даних про швидкість циркуляції крові по судинах у кожному випадку необхідно коригувати напрям допплерівського кута. При малих розмірах судин не завжди можливо підібрати оптимальні умови для оцінки кровотоку. У зв’язку з неможливістю стандартизації умов отримання даних про швидкість току крові по різних судинах, а також через конструктивні відмінності ультразвукових апаратів найбільш об’єктивними є так звані кут-незалежні (A/B, IR, IP, IA) показники кровотоку.
ЕД. Як нормальні судини паренхіми, так і судини, що утворилися в результаті неоангіогенезу в пухлині, мають дуже маленький просвіт і низьку швидкість кровотоку. Дана методика є найбільш ефективною для оцінки таких судин. Після того як судини виявлені, визначають їх кількість і проводять спектральну оцінку. Отримані результати зіставляються з даними в контралатеральній молочній залозі.
Методика ЕД базується на аналізі амплітуд усіх ехосигналів допплерівського спектра, що відображають щільність еритроцитів у заданому об’ємі. Відтінки кольору (від темно-помаранчевого до жовтого) відповідають інтенсивності ехосигналу. До переваг методу слід віднести те, що відображення отримують усі судини, незалежно від їх ходу відносно ультразвукового променя, у тому числі кровоносні судини малого діаметра та з незначною швидкістю кровотоку. Недолік: неможливо зробити висновок про напрямок, характер і швидкість кровотоку.
КДК принципово будується аналогічно зображенню в В-режимі, але у певній (виділеній) ділянці сірошкального зображення виводиться у кольорі інформація про швидкість руху структур у кожному елементі зображення. Червоний колір відповідає потоку, що йде у бік датчика, синій — від датчика. Темні відтінки цих кольорів відповідають низькій швидкості, світлі відтінки — високій. Недоліком КДК є неможливість отримання зображення дрібних кровоносних судин з маленькою швидкістю кровотоку. До переваг слід віднести можливість оцінки як морфологічного стану судин, так і стану кровотоку по них.
Одна з особливостей кровотоку у молочних залозах — наявність судин як з високою, так і з низькою швидкістю кровотоку. У зв’язку з цим для повноцінного дослідження усіх судин молочних залоз необхідно використовувати комплексне УЗД. Застосування кольорокодованих методик як в режимі дуплексного сканування (В-режим+ІСД або ЕД), так і в триплексному (В-режим+ЕД+КДК) режимі дозволяє покращити виявлення судин молочних залоз.
Одним з найвизначніших критеріїв злоякісності є судинна асиметрія молочних залоз. Судини пухлини характеризуються нерівномірністю калібру, покрученістю, лакуноподібними розширеннями. У зв’язку з цим для виявлення цих критеріїв великі надії покладаються на методику просторової тривимірної реконструкції.
У цілому завдяки прогресуючому розвитку діагностичної апаратури, відсутності променевого навантаження на пацієнта, неінвазивному характеру обстеження УЗД конкурує з мамографією.
Чорно-білі та кольорокодовані допплерівські методики, а також тривимірна просторова реконструкція збагатили діагностичну інформацію УЗД. Однак до тих пір, поки не стане можливою стандартизація апаратури та методик дослідження, вирішальним у диференційній діагностиці злоякісної чи доброякісної патології молочних залоз при комплексному УЗД продовжує залишатися сірошкальна ехографія в В-режимі.
Пункційна біопсія із цитологічним дослідженням аспірату є обов’язковим методом дослідження при будь-якій підозрі на РМЗ. При її виконанні слід дотримуватися наступних вимог:
1. Використання голки з мандреном (для уникнення обтурації її прозіру елементами шкіри та клітковини).
2. Суворе дотримання правил асептики.
3. Найкоротший термін початку спеціального лікування після маніпуляції.
Це технічно простий, достатньо надійний та інформативний метод (80% співпадання цитологічного та гістологічного діагнозів). Результативність її знижується зі зменшенням розмірів новоутворення та при деяких видах пухлин, у яких переважає сполучнотканинний компонент (скірозний рак, фіброаденома з гіалінозом тощо). Цитологічному аналізу можуть підлягати виділення з сосків у вигляді мазків-відбитків. У разі необхідності патогістологічної верифікації до початку лікування здійснюють трепан-біопсію за допомогою спеціальної голки, отримуючи стовпчик тканини. Ця маніпуляція виконується для поглибленого вивчення її клітинного складу та гістохімічного дослідження, а також визначення гормональних рецепторів.
Завдяки досягненням променевої діагностики та скринінгу можливе виявлення пухлин, що не визначаються пальпаторно. Це вимагає проведення прицільної стереотаксичної пункційної або трепан-біопсії під рентгенівським контролем або за допомогою ультрасонографічної навігації голки. Для визначення локалізації пухлини при операції цими ж методами проводять її внутрішньотканинне маркування розчином синьки, вугільним пилом або металевим дротом.
Ексцизійна біопсія з терміновим гістологічним дослідженням є остаточним та вирішальним етапом діагностики РМЗ (у 99% дає правильний висновок про природу процесу). Вона виконується під наркозом, з готовністю перейти до радикального втручання (про можливість такої тактики хвора має бути попереджена); у спеціалізованому стаціонарі за наявності умов для експрес-біопсії (кріотом, досвідчений морфолог тощо). Показання:
- виявлення інструментальними методами новоутворення, що не пальпується та підозріле на РМЗ;
- непевні або негативні результати пункційної біопсії за наявності клініко-інструментальних доказів раку;
- атипово розташовані пухлини, не виявлені рентгенологічно.
Найчастіше виконується в обсязі секторальної резекції із додержанням абластики.
Методи, що застосовувалися раніше — трансілюмінація (просвічення вузьким пучком світла), радіонуклідна діагностика 32Р, термографія, не застосовуються як низькочутливі та недостовірні.
Діагностика метастазів РМЗ. Методом вибору для діагностики стану регіонарних лімфатичних колекторів є ультрасонографія ділянок регіонарного лімфовідтоку (аксилярна, над- і підключична). Інші можливі методи визначення стану лімфатичних вузлів — рентгенологічні (пряма та непряма лімфографія верхньої кінцівки) та радіоізотопні (лімфосцинтиграфія) у повсякденній клінічній практиці не застосовують. З метою цитологічної верифікації здійснюється пункційна біопсія лімфовузлів.
Дослідження сторожового (сигнального) лімфовузла (sentinel lymph node). Сигнальним лімфовузлом є перший лімфовузол, до якого потрапляють пухлинні клітини із зони лімфовідтоку. Вважається, що у разі відсутності метастазів у ньому ймовірність їх наявності в інших лімфовузлах украй низька, таким чином, необхідності їх видаляти немає. Ідентифікують сторожовий лімфовузол шляхом введення в оточуючі пухлину тканини спеціальної фарби — лімфозурину (лімфовузол зафарбовується і його видно при операції), або радіоактивного препарату Nanocoll (накопичення якого в лімфовузлах визначається ручним гамма-детектором). Дослідження, присвячені проблемі сторожового лімфатичного вузла, проводять у багатьох світових клініках; до появи кінцевих результатів стандартним є виконання лімфодисекції у повному обсязі.
У діагностиці віддалених метастазів слід застосовувати рентгенологічний метод (кістки, легені), сонографію органів черевної порожнини та малого таза. Найчутливіші методи діагностики метастазів у кістки — остеосцинтиграфія та однофотонна емісійна гамма-томографія із фосфатними сполуками, міченими технецієм. Для уточнювальної топічної діагностики метастатичних уражень можуть бути застосовані рентгенівська та МРТ.
Радіонуклідні методи мають додаткове значення в діагностиці РМЗ. Мамосцинтиграфія — метод візуалізації пухлин молочної залози із використанням туморотропних РФП: 99mTc-MIBI, 201TlCl, 99mTc-тетрафосмін тощо. На сцинтиграмах відмічають осередки гіперфіксації РФП у пухлині та метастатичних лімфатичних вузлах.
ПЕТ дозволяє визначити накопичення в осередках пухлини 18F-фтордезоксиглюкози. Воно відображує швидкість утилізації глюкози, що значно підвищена в пухлинній тканині порівняно з оточуючою нормальною. Метод відрізняється високою чутливістю, зокрема в діагностиці віддалених метастазів.
Визначення у крові хворих радіоімунним чи ферментноімунним методом пухлинних маркерів, таких як РЕА, СА15–3 тощо, через низьку специфічність і невисоку чутливість не застосовують у первинній діагностиці РМЗ, зважаючи на наявність більш цінних та інформативних методів. Проте ці маркери можуть бути застосовані при спостереженні за динамікою дисемінованого процесу як критерії перебігу хвороби (прогресування — при підвищенні титру) та ефективності лікування (зниження чи незмінність концентрації при стабілізації захворювання).
МIЖНАРОДНА КЛАСИФIКАЦIЯ ЗА СИСТЕМОЮ TNM (6-та редакція, 2002)
Класифікація TNM застосовується тільки для раку. У разі одночасного розвитку декількох пухлин у одній залозі категорія Т оцінюється за найбільшою. Білатеральні пухлини, що виникли одночасно, класифікують окремо.
T — первинна пухлина
TX — недостатньо даних для оцінки первинної пухлини
Tis-сarcinoma in situ — преiнвазивна карцинома
Tis (DCIS)-сarcinoma in situ в протоках
Tis (LCIS) — сarcinoma in situ в часточках
Tis (Педжета) — хвороба Педжета соска без наявностi пухлинного вузла
Якщо при хворобі Педжета визначається пухлина, то вона класифікується згідно з її розмірами.
T1 — пухлина до 2 см в найбiльшому вимiрi
Т1mic — мікроінвазія не більше 0,1 см у найбільшому вимірі
T1а — до 0,5 см в найбiльшому вимiрi
T1в — до 1 см в найбiльшому вимiрi
T1с — до 2 см в найбiльшому вимiрi
T2 — пухлина до 5 см в найбiльшому вимiрi
T3 — пухлина понад 5 см в найбiльшому вимiрi
T4 — пухлина будь-якого розмiру з прямим поширенням на грудну стiнку* або шкіру**
T4a — поширення на грудну стінку
T4b — набряк, виразкування шкiри, сателiти в шкiрi молочної залози
T4c — 4ав
T4d — запальна форма раку
*Грудна стінка — це ребра, міжреберні м’язи, передній зубчатий м’яз, за винятком грудних м’язів.
**Втягнення шкіри, ретракція соска та інші шкірні симптоми, крім тих, що стосуються Т4, можуть відмічатися при Т1, Т2, Т3, не впливаючи на класифікацію.
N — регiонарнi лiмфатичнi вузли
Регіонарними лімфатичними вузлами вважають:
1. Пахвові: міжпекторальні лімфатичні вузли (Роттера) і лімфатичні вузли, розміщені вздовж пахвової вени та гілок. Їх поділяють на три рівні.
І — лімфатичні вузли розміщені латерально від зовнішнього краю малого грудного м’яза;
ІІ — лімфатичні вузли розміщені між зовнішнім та внутрішнім краями малого грудного м’яза, а також міжпекторальні вузли;
ІІІ — лімфатичні вузли розміщені медіально від внутрішнього краю малого грудного м’яза, а також підключичні й апікальні лімфатичні вузли.
2. Внутрішні грудні лімфатичні вузли, розміщені в міжреберних проміжках вздовж краю груднини.
3. Надключичні лімфатичні вузли у надключичній ямці, яка є трикутником між лопатково-під’язиковим м’язом і сухожиллям, внутрішньою яремною веною і ключицею з підключичною веною. Лімфатичні вузли поза цим трикутником (trigonum omoclavicularis) вважаються М1.
NX — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів
N0 — немає ознак метастатичного ураження регіонарних лімфатичних вузлів
N1 — метастази в рухомих пахвових лiмфовузлах на боці пухлини
N2 — метастази в фiксованих між собою пахвових лiмфовузлах, гомолатеральних внутрішніх грудних лімфатичних вузлах за відсутності клінічно доведених метастазів у пахвових лімфатичних вузлах
N2а — метастази в фiксованих між собою пахвових лiмфовузлах
N2б — метастази в гомолатеральних внутрішніх грудних лімфатичних вузлах за відсутності клінічно доведених метастазів у пахвових лімфатичних вузлах
N3 — метастази в підключичний гомолатеральний лімфатичний вузол (вузли) із ураженням пахвових лімфатичних вузлів або без них, або клінічно видимі метастази у гомолатеральні внутрішні грудні лімфатичні вузли при клінічно доведених метастазах у пахвових лімфатичних вузлах; або — метастази в надключичний гомолатеральний лімфатичний вузол (вузли) із ураженням пахвових лімфатичних вузлів або без них
N3а — метастази в підключичний гомолатеральний лімфатичний вузол (вузли)
N3б — клінічно видимі метастази у гомолатеральні внутрішні грудні вузли
N3с — метастази в надключичний гомолатеральний лімфатичний вузол (вузли)
M — вiддаленi метастази
Mх — недостатньо даних для визначення вiддалених метастазiв
М0 — немає ознак віддалениих метастазів
M1 — є вiддаленi метастази (враховуючи i метастази у надключичних лiмфовузлах)
Можлива оцiнка символу G — ступiнь диференцiацiї пухлини та R — наявнiсть резидуальних пухлин пiсля лiкування. При необхідності можливе застосування символiв: r — оцiнка рецидивних пухлин, y — при застосуваннi до операцiї iнших спеціальних методiв лiкування та фактора надiйностi — С.
рTNM ПАТОМОРФОЛОГІЧНА КЛАСИФІКАЦІЯ
рТ — первинна пухлина
При класифікації рТ розмір пухлини оцінюють за інвазивним компонентом.
рN — регіонарні лімфатичні вузли
Патоморфологічна класифікація вимагає дослідження видалених аксилярних лімфатичних вузлів. Резекційний матеріал включає зазвичай не менше 6 лімфатичних вузлів.
Класифікація ґрунтується на видаленні пахвових лімфатичних вузлів разом із сторожовим вузлом або без нього. Класифікація, яка ґрунтується лише на висіченні сторожового вузла без подальшого видалення пахвових лімфатичних вузлів, позначається терміном (sn) для «сторожового вузла».
рNХ — недостатньо даних для оцінки стану регіонарних лімфатичних вузлів (не видалені для дослідження, або видалені раніше)
рN0 — відсутні метастази в регіонарні лімфатичні вузли, додаткові обстеження на наявність окремих клітин пухлини не проводили
рN0(і-) — відсутні метастази в регіонарні лімфатичні вузли при звичайному гістологічному дослідженні, негативні дані імуногістохімії
рN0(і+) — відсутні метастази в регіонарні лімфатичні вузли при звичайному гістологічному дослідженні, позитивні дані імуногістохімії, при імуногістохімії немає груп розміром понад 0,2 мм
рN0(mol-) — відсутні метастази в регіонарні лімфатичні вузли при звичайному гістологічному дослідженні, негативні результати молекулярних досліджень (RT-PCR)
рN0(mol+) — відсутні метастази в регіонарні лімфатичні вузли при звичайному гістологічному дослідженні, позитивні результати молекулярних досліджень (RT-PCR)
рN1 — метастази у 1–3 пахвові лімфатичні вузли та/або у внутрішні грудні лімфатичні вузли з мікроскопічними проявами хвороби у висіченому сторожовому вузлі, але останні клінічно не визначаються*
рN1mi — мікрометастази (понад 0,2 мм, жоден не більший ніж 2 мм)
рN1а — метастази у 1–3 пахвові лімфатичні вузли
рN1b — метастази у внутрішні грудні лімфатичні вузли з мікроскопічними проявами хвороби у висіченому сторожовому вузлі, але останні клінічно не визначаються*
рN1c — метастази у 1–3 пахвові лімфатичні вузли та/або у внутрішні грудні лімфатичні вузли з мікроскопічними проявами хвороби у висіченому сторожовому вузлі, але останні клінічно не визначаються*
рN2 — метастази у 4–9 пахвових лімфатичних вузлів, або клінічно визначаються** внутрішні грудні лімфатичні вузли за відсутності метастазів у пахвові лімфатичні вузли
рN2 b — метастази в клінічно видимі внутрішні грудні лімфатичні вузли за відсутності метастазів у пахвові лімфатичні вузли
рN3 — метастази у 10 або більше пахвових лімфатичних вузлів, або в підключичні лімфатичні вузли, або в клінічно видимі гомолатеральні внутрішні грудні лімфатичні вузли у поєднанні з метастазами у 1–3 пахвові лімфатичні вузли; або метастази більше ніж в 3 пахвові лімфатичні вузли з клінічно невидимими мікроскопічними метастазами у внутрішні грудні лімфатичні вузли; або метастази в гомолатеральні надключичні лімфатичні вузли
рN3а — метастази у 10 або більше пахвових лімфатичних вузлів, або в підключичні лімфатичні вузли
рN3b — метастази в клінічно видимі гомолатеральні внутрішні грудні лімфатичні вузли у поєднанні з метастазами у 1–3 пахвові лімфатичні вузли; або метастази більше ніж у 3 пахвові лімфатичні вузли з клінічно невидимими мікроскопічними метастазами у внутрішні грудні лімфатичні вузли
рN3с — метастази в гомолатеральні надключичні лімфатичні вузли
*Клінічно не визначаються за допомогою методів візуалізації.
**Клінічно визначаються за допомогою методів візуалізації або при клінічному огляді.
Групування за стадiями
|
Тis, Т0 |
T1 |
T2 |
T3 |
T4 |
M1 |
|
|
N0 |
0 |
I |
IIA |
IIБ |
IІІВ |
IV |
|
N1 |
IIА |
IIА |
IIБ |
IIIA |
IІІВ |
IV |
|
N2 |
IІІА |
IІІА |
IІІА |
IІІА |
IІІВ |
IV |
|
N3 |
ІІІС |
ІІІС |
ІІІС |
ІІІС |
ІІІС |
IV |
|
M1 |
IV |
IV |
IV |
IV |
IV |
IV |
З 2010 р. є доступною 7-ма редакція класифікації TNM, проте офіційно в нашій країні вона не застосовується.
ЛІКУВАННЯ ПЕРВИННИХ ПУХЛИН
Хірургічне лікування
Перше повідомлення про ампутацію молочної залози, ураженої пухлиною, зроблено Цельсом (І ст. до н.е.). Введення в медичну літературу думки про лімфогенне розповсюдження РМЗ та відповідні хірургічні висновки вперше зроблені видатним французьким хірургом Le Dran (1757). Важливим етапом у хірургічному лікуванні РМЗ були роботи англійського хірурга Moore (1867), німецьких дослідників, зокрема Volkmann (1875).
Радикальна мастектомія за Голстедом — Мейєром, запропонована у 1882 р. W. Halsted, а в 1894 р. незалежно від нього Meyer, на довгий час стала класичною операцією при РМЗ. Вона передбачає моноблочне видалення всієї залози з великим та малим грудними м’язами, пахвовою, підключичною та підлопатковою клітковиною в межах анатомічних футлярів. У післяопераційний період застосовують постійне вакуумне дренування рани (метод запропонований у 1952 р. Raffl саме для цього втручання). Деформація грудної клітки, порушення функції верхньої кінцівки, часте виникнення лімфостазу були недоліками даної операції. Наразі її виконують тільки в окремих випадках — при розповсюдженні пухлини на великий грудний м’яз.
Історично складалися 2 тенденції у хірургії РМЗ: розширення обсягу втручання та його скорочення.
Розширена радикальна мастектомія за Урбаном — Холдіним запропонована у 1951 р. Urban і передбачала на додаток до операції Голстеда резекцію грудної стінки з краєм груднини, хрящами II–IV ребер з перев’язкою a. thoracica interna та видаленням парастернальних лімфовузлів. Операцію здійснювали хворим із центральною та внутрішньою локалізацією пухлини, коли ураження парастернальних лімфовузлів виявляють приблизно у 30%. Втручання модифіковане у 1955 р. С.А. Холдіним, який запропонував не інтраплевральне видалення препарату (як Урбан), а екстраплевральне. Подальші дослідження показали, що ця операція не покращила результати 5-річної виживаності, а відсоток ускладнень у післяопераційний період був достатньо високим. У зв’язку з цим, а також завдяки успіхам комплексного лікування РМЗ ця операція зараз не використовується.
Прогрес у променевій і медикаментозній терапії РМЗ дозволив перейти до розробки менш травматичних втручань без збитку для радикалізму.
Модифікована (обмежена) радикальна мастектомія за Пейті — Дайсоном вперше була застосована Patey у 1932 р. (лікарня у Мідлсексі), а згодом широко пропагувалася його другом Handley. На відміну від операції Голстеда, при цьому втручанні зберігається великий грудний м’яз. Післяопераційні ускладнення відмічають у меншій кількості випадків, рана загоюється швидше, операція дає кращі функціональні результати порівняно з класичною мастектомією, а також надає можливість для подальшої пластики молочної залози.
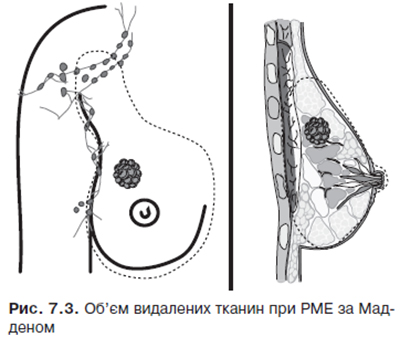
Радикальна мастектомія за Мадденом — операція, при якій виконують видалення молочної залози, пахвових, підлопаткових і підключичних лімфоколекторів зі збереженням обох грудних м’язів (рис. 7.3). Операція описана в літературі J.L. Madden (1970) і використовується як альтернатива операції Пейті.
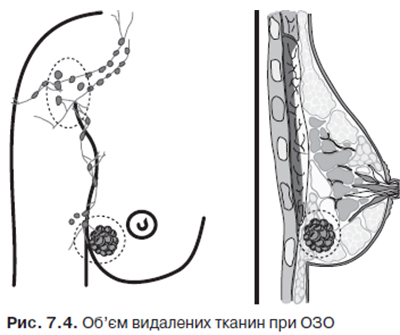
На сьогодні у значної кількості хворих вдається діагностувати РМЗ при невеликих розмірах пухлини. Тому з 70-х років ХХ ст. почали розробляти та активно впроваджувати органозберігаючі операції (ОЗО). Вони є елементом комбінованого лікування і обов’язково доповнюються променевою терапією. На відміну від мастектомій при ОЗО (або консервативних) операціях зберігається орган з наступним формуванням задовільної у косметичному плані молочної залози.
Квадрантектомія з лімфодисекцією I–III рівнів лімфовузлів за Berg передбачає видалення квадранта молочної залози, відступаючи не менше 3 см від краю пухлини. При лампектомії (від англ. lump — вузол, пухлина) відступають від краю пухлини не менше 1 см і видаляють лімфовузли І–ІІ етапів метастазування. Будь-який вид ОЗО вимагає інтраопераційного гістологічного експрес-дослідження відсутності в краях резекції елементів пухлини — дослідження «чистоти країв». Лише за її наявності обсяг втручання може бути розцінений як адекватний (рис. 7.4).
Протипоказаннями до ОЗО є:
- мультицентричний ріст пухлини;
- дифузні форми РМЗ;
- прогноз явних незадовільних косметичних результатів.

Наступний розвиток ідеології та техніки ОЗО, впровадження та поширення в хірургії РМЗ методів пластичної хірургії призвели до появи міждисциплінарного напрямку — онкопластичної хірургії, що передбачає реалізацію високих функціональних і косметичних результатів операцій без збитку для онкологічного радикалізму. Прикладом досягнень сучасної онкопластичної хірургії може бути виконання лампектомії при деяких варіантах центральної локалізації пухлини, що раніше традиційно вважалося показанням до виконання мастектомії. Пластичні методи відновлення видаленої молочної залози викладені у розділі «Реабілітація».
Як паліативне втручання при пухлинах, що розпадаються, з виразкуванням, кровотечею застосовується ампутація молочної залози (інша назва — проста мастектомія).
Променева терапія
ПТ застосовується частіше як елемент комбінованого чи комплексного лікування. Найчастіше застосовують дистанційну гамма-терапію, в окремих центрах доступне лікування електронним чи протонним пучком, що його генерують лінійні чи циклічні прискорювачі елементарних частинок.
Стандартним підходом є післяопераційна ПТ, яка показана при великих розмірах первинної пухлини (рТ3 і більше), медіальній чи центральній локалізації раку, мультицентричному його рості, наявності 4 і більше метастазів у регіонарні лімфовузли, видалені при операції, нерадикальному характерові втручання. Методом звичайного фракціонування з разовою вогнищевою дозою (РВД) у 2 Гр опромінюють післяопераційний рубець (до 50–60 Гр) та зони регіонарного метастазування (до 45 Гр).
Передопераційну ПТ традиційним фракціонуванням (по 2 Гр щодобово до сумарної вогнищевої дози (СВД) у 40 Гр) проводять при місцево-поширених та дифузних формах з метою переведення їх в операбельний стан. Ефектами передопераційного опромінення можуть бути підвищення абластичності втручання, девіталізація пухлинних клітин. Ефективність передопераційної ПТ за інтенсивно-концентраційною методикою, яка передбачає підведення великими разовими дозами (4–5 Гр) щодобово СВД 20 Гр на залозу та шляхи лімфогенного метастазування, остаточно не доведена.
Як самостійний метод лікування ПТ застосовують за наявності протипоказань до оперативного лікування, при неоперабельних та дифузних формах РМЗ, відмові хворої від втручання4. У таких випадках підводять не менше 60–70 Гр на пухлину та 50 Гр на зони метастазування протягом 5–7 тиж з 3-тижневою перервою. Але стійкого видужання ПТ не дає, прогресування настає через відносно короткий термін.
Медикаментозна терапія
З метою індивідуалізації хіміо- та гормонотерапії необхідно визначити молекулярні особливості новоутворення. Для цього здійснюють імуногістохімічне дослідження пухлини. Залежно від наявності у пухлині рецепторів до естрогену, прогестерону, білка HER2/neu, ki-67 розрізняють 5 молекулярних типів РМЗ (табл. 7.2).
Таблиця 7.2
Молекулярні типи РМЗ
|
Молекулярний тип |
Імуногістохімічний портрет |
|||
|
ER* |
PR*, % |
HER2/neu* |
Ki-67*, % |
|
|
Люмінальний A |
+ |
≥20 |
– |
≤20 |
|
Люмінальний Б HER2/neu-негативний |
+ |
<20** |
– |
>20** |
|
Люмінальний Б HER2/neu-позитивний |
+ |
будь-який |
гіперекспресія |
будь-який |
|
HER2/neu-тип |
– |
– |
гіперекспресія |
будь-який |
|
Базальноподібний (тричі негативний) |
– |
– |
– |
будь-який |
*ER — рецептори до естрогенів; PR — рецептори до прогестерону; HER2/neu — епідермальний фактор росту; ki-67 — маркер проліферації клітинної популяції; **наявність хоча б одного з показників.
Хіміотерапія
РМЗ — пухлина, чутлива до великої кількості сучасних протипухлинних засобів, що належать до різних груп цитостатиків. До останнього часу найефективнішими засобами були доксорубіцину гідрохлорид (ефективний у 40% хворих), циклофосфамід і метотрексат (ефективність 35%), 5-флуороурацил (ефективність 25%), алкалоїди рожевого барвінку (вінкристин, вінбластин). З 90-х рр. минулого сторіччя активно застосовують таксани (паклітаксел і доцетаксел), вінорелбін (похідна віналкалоїдів), антиметаболіти капецитабін, томудекс і гемцитабін. Частіше застосовують поліхіміотерапію (ПХТ) — різні поєднання найбільш активних препаратів. Застосовуються наступні методики:
- ад’ювантна (післяопераційна) ПХТ базується на ствердженні того, що у хворих після радикальної операції наявні мікрометастази, тобто проводиться профілактично. Вона починається одразу після операції короткими курсами, що повторюються;
- неоад’ювантна (доопераційна) ПХТ спрямована на досягнення тієї ж мети, що й передопераційна ПТ. Крім того, при патогістологічному дослідженні видаленої пухлини можливо оцінити ступінь її ураження препаратами, що застосовувалися, і за необхідності скоригувати лікування;
- ПХТ як елемент хіміопроменевої терапії місцево-поширеного та дисемінованого РМЗ.
Останнім часом, у зв’язку з вичерпанням можливостей традиційної хіміо- та променевої терапії широко вивчаються модифікатори лікування, які підвищують уразливість пухлини. До них належать штучна короткочасна гіперглікемія, УВЧ-магнітна гіпертермія, гіпербарична оксигенація, застосування радіоакцепторних сполук (метронідазол) і засобів, що полегшують транспортування цитостатику у клітину (верапаміл, лідокаїн).
Досягнення молекулярної онкології дали поштовх для створення протипухлинних засобів з метою впливу на процеси злоякісної трансформації клітин. Їх застосування отримало назву таргетної терапії (від англ. target — ціль, мішень). Даними «цілями» можуть бути неоангіогенез у пухлині, процеси передачі клітинних сигналів, апоптоз, диференціювання пухлинних клітин тощо. Особливістю препаратів таргетної терапії є не цитотоксична, а переважно цитостатична дія; тому доцільне їх поєднання із традиційними засобами хіміотерапії.
Трастузумаб — моноклональне антитіло до HER2/neu — одного з родини тирозинкіназних рецепторів. Блокування HER2/neu може уповільнити або зупинити ріст пухлини, що стимулюється EGFR. Використання трастузумабу передбачає попередню оцінку чутливості до цього виду лікування шляхом імуногістохімічного визначення експресії HER2/neu в тканині пухлини.
Бевацизумаб — моноклональне рекомбінантне гуманізоване химерне антитіло до VEGF. Нейтралізуючи даний фактор, препарат блокує утворення нових кровоносних судин у пухлинній тканині, запобігаючи подальшій прогресії, інвазії та гематогенному метастазуванню. Також знижує проникність пухлинних судин та зменшує інтерстиційний набряк, що покращує кровопостачання та транспортування в пухлинну тканину інших антибластомних засобів.
Різні стадії випробувань проходять також інгібітор циклооксигенази-2 (фермента, який, напевно, є елементом стимуляції ангіогенезу) — целекоксиб; інгібітор матриксної металопротеїнази — маримістат; інгібітори трансферази.
Гормональне лікування
Оскільки РМЗ належить до гормонозалежних пухлин, ГТ є одним з найважливіших методів лікування. Найсуттєвішим питанням ГТ є прогнозування гормоночутливості пухлини, для чого визначають вміст рецепторів естрогенів і прогестерону в пухлині. Ефективність ГТ естрогенрецепторпозитивних (ЕР+) пухлин становить 50–60%, а (ЕР–) — лише 5–10%; наявність на додаток рецепторів прогестерону підвищує ефективність ГТ до 80%.
ГТ поділяється на:
1) аблятивну, яка має на меті видалення ендокринних органів — продуцентів естрогенів, тобто це хірургічна чи променева кастрація. Вона виконується у жінок репродуктивного віку та в перші роки менопаузи та може застосовуватися як ад’ювантний захід, так і компонент паліативного лікування. Хоча збільшення тривалості життя після кастрації немає, але збільшується тривалість безрецидивного періоду та підвищується якість життя у хворих із задавненим РМЗ.
Втручання, що виконували раніше, — адреналектомія та гіпофізектомія або його руйнування радіоактивним випромінюванням — призводили до тяжких ускладнень і тепер не використовуються. Звужуються показання і до оваріоектомії;
2) медикаментозна передбачає застосування декількох груп препаратів:
- золотим стандартом медикаментозної ГТ є застосування синтетичних антиестрогенних препаратів, у першу чергу тамоксифену. Його широко застосовують у клінічний практиці, приймають протягом тривалого часу (як ад’ювантна терапія — 5 років). Остаточно механізм його дії не встановлено, але відомо, що тамоксифен зменшує число активних рецепторів і змінює властивості комплексу естроген — рецептор, блокуючи останній. Проте на деякі тканини, зокрема на ендометрій, тамоксифен діє як агоніст естрогенів, викликаючи бластоматозну трансформацію. Серед інших побічних ефектів — стимуляція новоутворень печінки та тромбоемболічні ускладнення. Пробластоматозних ефектів повністю позбавлений інший антиестроген — тореміфен. Серед нових препаратів слід згадати стероїдний антиестроген фулвестрант та нестероїдний ралоксифен;
- інгібітори ароматази — ферменту, що каталізує один з кінцевих етапів утворення естрогенів з андрогенів; поділяються на стероїдні (форместан, екземестан) та нестероїдні (аміноглутетимід, фадразол, летрозол, анастрозол). У хворих в період менопаузи ця група препаратів вступає в конкуренцію з антиестрогенами;
- агоністи гонадотропін-рилізінг факторів гіпоталамусу при постійному введенні викликають нечутливість гіпофіза до стимулювального впливу, внаслідок чого зменшується виділення гонадотропінів і таким чином майже повністю виключається функція яєчників — настає «фармакологічна кастрація». Представники цієї групи — бусерелін, гозерелін, трипторелін;
- механізм дії прогестинів остаточно не встановлений, але серед них слід згадати такі, як зниження концентрації гонадотропінів і АКТГ; зменшення синтезу естрогенів із андрогенів в печінці, пряма цитотоксична дія, дія на фактори росту тощо. До цієї групи належать медроксипрогестерону ацетат, мегестролу ацетат;
- естрогени й андрогени викликають велику кількість побічних ефектів, тому їх використовують рідко, можуть розглядати як представників IV–V лінії ГТ. Механізми дії точно не встановлені, але передбачається, що вони гальмують секрецію гонадотропних гормонів, а естрогени можуть порушувати синтез стероїдних рецепторів.
Лікування рецидивів та метастазів
Місцево-регіонарні рецидиви у більшості випадків з’являються у перші 2 роки після операції.
Імплантаційні рецидиви виникають у ділянці післяопераційного рубця чи на місці розрізу для дренажної трубки. Вони зазвичай добре відокремлені, рухомі. Оперативного їх видалення з наступною променевою терапією достатньо для вилікування, але не убезпечує від нових рецидивів.
Рест-рецидиви (від англ. rest — залишок, остача) розташовані у клітковині поблизу рубця, у підключичній і пахвовій ділянках. Розміри їх різноманітні, контури нечіткі, рухомість обмежена через інфільтрацію оточуючих тканин і проростання у м’язи. Виникнення їх пов’язане із залишенням у рані частини пухлини чи метастатичних лімфатичних вузлів. Метод вибору — променева терапія з електроексцизією пухлин.
Лімфангітичні рецидиви часто погрожують переходом до панцирних форм. Лікування починають зі спроби променевого впливу 2–3 полями (якщо уражені зони у них вкладаються). У таких випадках проводять дистанційну гамма-терапію з тангенційних полів з РВД у 2 Гр і СВД 20–60 Гр залежно від дози, підведеної при попередньому променевому лікуванні.
Дисемінати по шкірі додатково можна піддавати близькофокусній рентгенотерапії.
У лікуванні метастазів при РМЗ перевага надається медикаментозній терапії. Її почали застосовувати ще на початку 1960-х років, але тільки після публікації результатів лікування п’ятьма протипухлинними засобами з різним механізмом дії (вінкристин (V), метотрексат (М), 5-флуороурацил (F), циклофосфамід (С), преднізолон (Р)), яке призвело до ремісії у 90% хворих (Cooper R.,1969), у світі активно почали застосовувати різні схеми комбінованої хіміотерапії. Більшість фахівців вважають за доцільне починати лікування дисемінованого РМЗ з комбінацій типу CMF, переходячи при резистентності до них на більш агресивні схеми. Курси ПХТ періодично повторюють (кожні 3–4 тиж). Активно використовують ГТ.
Метастази в кістки часто множинні (хребет, малий таз, ребра, стегнові та плечові кістки), супроводжуються вираженим больовим синдромом, контрактурами, патологічними переломами. Основна причина остеодеструкції — активація нормальних остеокластів пухлиною чи продуктами її метаболізму. Застосовують телегамма-терапію з РВД 4 Гр, на курс 5–6 фракцій, що дає анальгезивний ефект і викликає репарацію остеокластичних метастазів. Застосовують кальцитонін, препарати кальцію, вітамін D, а також новий препарат на основі клодронату натрію, що викликає пригнічення функції остеобластів. Досить ефективне лікування радіоактивним ³²Р, що вводиться перорально (тричі із сумарною активністю 296–444 МБк), можливо поєднання з дистанційною гамма-терапією з СВД близько 30 Гр.
Оскільки метастази в шкіру, підшкірну клітковину, лімфовузли і кістки є проявом генералізації процесу, променеві та/чи хірургічні методи впливу в усіх випадках необхідно поєднувати із гормональною та цитотоксичною терапією, яку проводять за загальними принципами лікування розповсюджених форм РМЗ.
За наявності випоту у серозних порожнинах показане внутрішньопорожнинне введення флуороурацилу, тіофосфаміду, блеоміцину. При випітних плевритах можливо внутрішньоплевральне введення 198Au-колоїду (3700–5500 МБк). При метастазах у головний мозок ендолюмбально вводять метотрексат, ломустин, застосовують променеву терапію на фоні активної дегідратації та кортикостероїдної терапії. Лікування слід проводити одночасно із симптоматичними заходами (знеболення, дезінтоксикація тощо).
УСКЛАДНЕННЯ ЛІКУВАННЯ ТА РЕАБІЛІТАЦІЯ
Післяопераційні ускладнення5. Окрім загальнохірургічних (нагноєння, інфільтрати тощо) виявляють такі ускладнення:
- підшкірні сероми: пов’язані з лімфореєю (через видалення лімфоапарату), поганою фіксацією шкірних клаптів та неадекватним дренуванням рани. Налагодження останнього та пункційне видалення рідини усуває проблему;
- тромбофлебіти верхньої кінцівки: зазвичай виникають на фоні лімфореї та запалення, що приєднується. Лікування традиційне;
- ранні набряки кінцівки (у перший місяць після операції): зазвичай зумовлені тромбофлебітом і зникають після його розрішення. Причиною є лімфостаз унаслідок недостатнього колатерального лімфовідтоку, порушення транскапілярного обміну, затримка Na+ та води в позаклітинному просторі, зниження онкотичного тиску крові через втрату білків з рановим транссудатом. Лікування: компресія кінцівки еластичними бинтами чи спеціальними компресійними нарукавнивами, сечогінні засоби, вазопротектори, корекція гіпопротеїнемії. Профілактика: дотримання техніки операції, ретельний гомеостаз, дренування рани й адекватне ведення післяопераційного періоду;
- пізні набряки: викликані склерозом і фіброзом клітковини через стійкий лімфостаз (необхідно впевнитись у відсутності метастатичної його природи). Сприяють їм рецидивуюча бешиха, тромбофлебіт, зміни в стінці судин і нервових елементах (сплетеннях, симпатичних гангліях тощо) у тому числі й пов’язані з опроміненням. Консервативне лікування (див. вище) малоефективне; застосовують мікрохірургічний метод — накладення лімфовенозних анастомозів. Профілактика: лікувальна фізкультура (ЛФК), попередження мікротравм кінцівки, особливо у ділянці кисті, обмеження навантаження на «хвору» кінцівку, щоденні водні процедури. Пацієнт повинен пам’ятати, що через неповноцінність лімфоциркуляції в оперованій кінцівці навіть легкі, непомітні ушкодження можуть призвести до незадовільних наслідків;
- порушення функції кінцівки у ранній післяопераційний період зумовлено переважно больовим синдромом, видаленням м’язів і нервових гілочок, натягненням шкіри. У хворих, які активно займаються ЛФК, через півроку функція відновлюється практично в повному обсязі. Але при неправильно спланованій реабілітаційній програмі або недотриманні пацієнткою вимог формуються контрактура плечового суглоба, артроз і больовий синдром. ЛФК слід починати з 1–2-го дня післяопераційного періоду, далі можна додавати масаж. Фізіотерапевтичні процедури хворим на РМЗ протипоказані!
Косметичний дефект передньої грудної стінки коригують ортопедичним чи хірургічним шляхом. Ортопедична реконструкція молочної залози здійснюється за рахунок екзопротезів з різних пластичних матеріалів. На першому етапі (3–4 міс після операції) застосовують полегшені протези, згодом (після формування рубця) — із щільних матеріалів.
Хірургічну корекцію еластичними імплантами спочатку здійснювали при гіпоплазії, атрофії молочних залоз, фіброзній мастопатії та множинних папіломах. За останні десятиріччя з’явилося чимало досліджень щодо їх застосування після мастектомій з приводу РМЗ. Даний напрям отримав назву «онкопластична хірургія». Публікації останніх років свідчать про доцільність одночасної (так званої первинної) реконструктивної операції. Вибір методу реконструкції залежить, перш за все, від завдань операції: необхідне заміщення лише об’єму (форми) залози чи шкіри, ареоли та соска, або інших дефектів грудної стінки. У першому випадку застосовують методику без використання власних тканин: імпланти фіксованого об’єму, еспандери. Якщо бракує покривної шкіри, застосовують «чисто» аутологічні методики: переміщений клапоть з m. latissimus dorsі, м’язово-шкірний клапоть з m. transversus rectus abdominus (TRAM), DIEP-клапоть (Deep inferior epigastric artery perforator), SGAP-клапоть (Superior gluteal artery perforator). Можлива комбінація методик із використанням чужорідних і власних тканин (неаутологічних і аутологічних) — одночасне використання імплантів і клаптя з m. latissimus dorsi.
Як і будь-яка операція, реконструкція молочної залози має ускладнення: ранні — некрози клаптів, лімфорея, гематома, розвиток інфекції, зміщення та відторгнення протезу; пізні — капсульна контрактура протезу (вторинне зморщування навколопротезної капсули з ущільненням залози), деформація, асиметрія залози, розрив протезу.
Захворювання на РМЗ та інвалідизуюча операція є причинами розвитку тяжкого психоемоційного стресу, пов’язаного із відчуттям втрати жіночої привабливості та неповноцінності. У гострий період застосовують психофармакологічну корекцію (седативні засоби, транквілізатори), згодом акцентуючи увагу на психотерапевтичному підході, спрямованому на формування у хворої адекватного психологічного захисту. Цей компонент реабілітації тісно пов’язаний із соціальною реадаптацією хворої з професійної точки зору та у родині.
РЕЗУЛЬТАТИ ЛІКУВАННЯ
Головним фактором прогнозу при РМЗ є клінічна стадія (розповсюдженість) до початку лікування, а також вік хворої, гістологічна будова пухлини, її гормоночутливість тощо. 5-річна виживаність без урахування стадії становить 40–65%, коливаючись від 90% і вище при І стадії до 40–45% — при ІІІБ стадії у разі радикального лікування. Але приблизно третина хворих, що померли від РМЗ, гинуть через 5 і більше років після завершення лікування. За останні 15–20 років результати лікування РМЗ дещо покращилися через удосконалення ранньої діагностики та розробку нових методів комбінованого та комплексного лікування.
ПРОФІЛАКТИКА
Первинна профілактика РМЗ (гігієнічна, генетична, імунобіологічна) на сьогодні залишається швидше теоретичною.
Пильну увагу зараз звертають на профілактичні заходи, що є складовими протиракової боротьби і дозволяють діагностувати РМЗ у період, коли він є локальною, цілком курабельною хворобою. Первинна профілактика складається з двох етапів:
І етап:
1) щомісячне самообстеження молочних залоз після спеціального навчання. За даними літератури, близько 90% жінок (необізнані у правилах самообстеження!) самотужки виявили в себе пухлину. У 1983 р. Американське протиракове товариство рекомендувало щомісячне самообстеження асимптоматичних жінок віком старше 20 років на 7–10-й день менструального циклу. Але тільки 10% жінок застосовують правильну методику пальпації. У СРСР навчання самообстеженню стикалося зі значними труднощами, зумовленими низькою санітарною культурою більшості населення, а нині ще й соціальними негараздами, неуважним ставленням через них до власного здоров’я;
2) щорічне анкетне опитування жінок віком старше 40 років про стан молочних залоз та фактори підвищеного ризику;
3) обов’язкове клінічне обстеження молочних залоз всіх жінок лікарями загальнолікувальної мережі;
4) у більшості країн, ґрунтуючись на результатах численних досліджень, доведена ефективність мамографії як скринінг-обстеження в ранній діагностиці РМЗ і, відповідно, у зниженні смертності. Найбільш переконливими у цьому відношенні є дані Нью-Йоркської програми, у межах якої половину жінок щорічно обстежували мамографічно, решту — ні. Через 7 років серед жінок, що знаходилися під рентгенологічним контролем, смертність від РМЗ була на 33% нижча, ніж у контрольній групі. Масові обстеження, що проводяться з 1960-х років у США, дозволили знизити летальність серед жінок віком старше 50 років на 50%. Масове застосування мамографії дозволило виявити 35,4% усіх хворих на РМЗ серед жінок 40–49 років. Доцільне поєднання цих методів ранньої діагностики РМЗ: скринінг із застосуванням мамографії та фізикального обстеження дозволяє подовжити життя хворих на РМЗ на 3,5 року та знизити смертність на 25–30%. Але практично для організації такого скринінгу у нашій країні мамографи повинні бути у районних поліклініках, що наразі неможливо.
ІІ етап: поглиблене спеціальне обстеження вибраної групи хворих — огляд онколога, інструментальні обстеження, нарешті — морфологічна верифікація.
До важливих напрямків первинної профілактики РМЗ належать активне виявлення, спостереження, а також тривала патогенетична терапія передракових станів, у першу чергу — мастопатії.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. У патогенезі РМЗ мають значення наступні гормональні розлади:
А. Гіпохолестеринемія
В. Гіперестрогенемія
С. Альгодисменорея
D. Галакторея
Е. Гіпогаммаглобулінемія
2. У структурі онкологічної захворюваності жіночого населення 1-ше місце посідає:
А. Рак шийки матки
В. Рак тіла матки
С. Рак шлунка
D. РМЗ
Е. Лейкози
3. До основних (прямих) ознак РМЗ при мамографії належать:
А. Набряк залози, зміни соска та кальциноз залози
В. Пухлинний вузол та мікрокальцинати
С. Фіброзна капсула та гіперваскуляризація
D. Зміни шкіри, зміни судинного малюнка, перебудова оточуючих пухлину тканин
Е. Дефект наповнення молочної протоки
4. До непрямих ознак РМЗ при мамографії належать:
А. Набряк залози, зміни соска та кальциноз залози
В. Пухлинний вузол та мікрокальцинати
С. Фіброзна капсула та гіперваскуляризація
D. Зміни шкіри, зміни судинного малюнка, перебудова оточуючих пухлину тканин
Е. Дефект наповнення молочної протоки
5. Найчастіша локалізація віддалених метастазів РМЗ:
А. Сечовий міхур, печінка, м’які тканини
В. Головний мозок, трахея, бронхи, легені
С. Лімфатичні вузли, шкіра, геніталії
D. Печінка, легені, кістки
Е. Периферичні нерви, кістки, м’язи, шкіра
6. Розрізняють наступні клінічні форми РМЗ:
А. Рак Панкости, центральний рак, периферичний рак
В.Частковий та часточковий рак
С. Вузлову, дифузну, рак Педжета
D. Маститоподібний, екзематозний та набряковий рак
Е. Операбельний та метастатичний рак
7. Розрізняють наступні види ГТ РМЗ:
А. Радикальна та паліативна
В. Паліативна та симптоматична
С. Ад’ювантна та радикальна
D. Аблятивна та медикаментозна
Е. Інтраопераційна та післяопераційна
8. До ранніх ускладнень операцій з приводу РМЗ належать:
А. Жирова емболія, гостра серцева недостатність, набряк верхньої кінцівки
В. Анафілактичний шок, сепсис, тромбоз плечової артерії
С. Підшкірні сероми, лімфорея, тромбофлебіти верхньої кінцівки, ранні набряки кінцівки
D. Контрактура верхньої кінцівки, індуративний лімфостаз, рецидивуюча бешиха
Е. Астенодепресивний синдром, трофічна виразка, судинна вертебробазилярна недостатність
9. До пізніх ускладнень операцій з приводу РМЗ належать:
А. Жирова емболія, гостра серцева недостатність, набряк верхньої кінцівки
В. Анафілактичний шок, сепсис, тромбоз плечової артерії
С. Підшкірні сероми, лімфорея, тромбофлебіти верхньої кінцівки, ранні набряки кінцівки
D. Контрактура верхньої кінцівки, індуративний лімфостаз, рецидивуюча бешиха
Е. Астенодепресивний синдром, трофічна виразка, судинна вертебробазилярна недостатність
10. Хворій 57 років, 6 років тому проведене комплексне лікування з приводу раку правої молочної залози ст. ІІБ Т2N1M0. Зараз післяопераційний рубець гладенький, без ознак рецидиву. Скаржиться на біль в поперековій ділянці з іррадіацією в ліву нижню кінцівку. Які дослідження є необхідними ?
А. Рентгенографія легень та УЗД печінки
В. Рентгенографія хребта та МРТ головного мозку
С. Остеосцинтиграфія та МРТ хребта
D. КТ хребта та головного мозку
Е. Визначення пухлинних маркерів
11. Хвора віком 40 років поступила зі скаргами на наявність пухлини в лівій молочній залозі. Об’єктивно: у вертикальному положенні виявляється пухлина розмірами 4х3 см щільно-еластичної консистенції. У горизонтальному положенні пухлина менш щільна: представляє собою утворення без чітких контурів. Периферичні лімфовузли не збільшені. Хворій показано:
А. Сонографія молочних залоз та ексцизійна біопсія
В. Рентгенографія органів грудної порожнини та трепанобіопсія
С. Мамографія та пункційна біопсія
D. Сонографія молочних залоз та визначення пухлинних маркерів
Е. МРТ молочних залоз
12. Обов’язковими інструментальними методами дослідження при підозрі на РМЗ є:
А. МРТ молочної залози, біопсія
В. Радіоізотопна лімфосцинтиграфія, рентгенографія кісток, пункційна біопсія
С. Мамографія (рентгенівська або ультразвукова), біопсія, рентгенографія легень, сонографія органів черевної порожнини
D. Рентгенографія легень, сонографія органів малого таза та черевної порожнини
Е. Контрастна непряма мамолімфографія, визначення пухлинних маркерів (РЕА, СА 15–3), рентгенографія легень
13. Позитивний симптом Прибрама полягає у наступному:
А. Наявність набряку шкіри молочної залози у вигляді «шкірки цитрини»
В. У горизонтальному положенні вузол не зникає
С. При пальпації основою долоні — п’ястком вузол не зникає
D. При пальпації залози хвора відчуває біль
Е. Зміщення пухлини при потягуванні за сосок
14. Позитивний симптом Кьоніга полягає у наступному:
А. Наявність набряку шкіри молочної залози у вигляді «кірки цитрини»
В. У горизонтальному положенні вузол не зникає
С. При пальпації основою долоні — п’ястком вузол не зникає
D. При пальпації залози хвора відчуває біль
Е. Зміщення пухлини при потягуванні за сосок
15. Сторожовий (сигнальний) лімфатичний вузол — це:
А. Надключичний лімфовузол
В. Парастернальний лімфовузол
С. Роттеровські лімфовузли
D. Перший лімфовузол, до якого потрапляють пухлинні клітини із зони лімфовідтоку
Е. Вузол Зоргіуса
16. Враховуючи вікову структуру захворюваності в Україні на РМЗ, скринінгову мамографію рекомендують проводити жінкам віком старше:
А. 20 років
В. 30 років
С. 40 років
D. 50 років
Е. Не рекомендують взагалі
17. Рест-рецидиви — це:
А. Рецидиви, розташовані у клітковині поблизу рубця, у підключичній і пахвовій ділянках
В. Десимінати по шкірі
С. Метастази в печінку
D. Рецидиви, розташовані в підключичній ділянці
Е. Рецидиви, розташовані в надключичній ділянці
18. Які з перелічених методів належать до «чисто» аутологічних методик онкопластичної хірургії?
А. Силіконові імпланти фіксованого розміру
В. Реконструкції TRAM-клаптем, DIEP-клаптем, SGAP-клаптем
С. Еспандери
D. Реконструкції TRAM-клаптем, DIEP-клаптем, силіконовими імплантами
Е. Введення в тканину залози силіконового гелю
19. Який молекулярний підтип РМЗ має найбільш несприятливий прогноз?
А. Люмінальний А
В. Люмінальний В
С. Базальноподібний
D. HER2/neu-позитивний
Е. Тричі негативний
20. Чим відрізняється тричі негативний молекулярний підтип РМЗ від базальноподібного?
А. Тричі негативний виявляють в жінок у пременопаузальний період, а базальноподібний — у постменопаузальний
В. Тричі негативний часто пов’язаний з мутацією гена BRCA1, а базальноподібний — BRCA2
С. Відмінностей немає
D. Тричі негативний підтип є цитокератиннегативним, а базальноподібний — цитокератинпозитивним
Е. Тричі негативний підтип має сприятливий прогноз, а базальноподібний — несприятливий.
Шаблон відповідей
|
1 |
B |
11 |
C |
|
2 |
D |
12 |
C |
|
3 |
B |
13 |
E |
|
4 |
D |
14 |
B |
|
5 |
D |
15 |
D |
|
6 |
C |
16 |
C |
|
7 |
D |
17 |
A |
|
8 |
C |
18 |
B |
|
9 |
D |
19 |
E |
|
10 |
C |
20 |
D |
1Найвищу захворюваність відмічають у Севастополі – 93,5‰.
2Класифікація подається у скороченому варіанті.
3Запальний рак в оригінальній класифікації не виділяється
4ПТ як самостійний метод лікування рецидивних і метастатичних пухлин описана нижче.
5Ускладнення променевої та медикаментозної терапії викладені в курсі загальної онкології.