КОРОТКИЙ АНАТОМО-ФІЗІОЛОГІЧНИЙ НАРИС
ХІРУРГІЧНА АНАТОМІЯ ОБОДОВОЇ КИШКИ
Межами товстої кишки (гр. colonos, лат. intestinum crassum) є ілеоцекальна затулка (розташована по задньомедіальному краю сліпої кишки на відстані 6 см від дна її купола) проксимально та шкірний край заднього проходу дистально. Середня її довжина становить 150 см, її діаметр вкрай варіабельний, що залежить від функціонального стану. Сегментом найбільшого діаметра є сліпа кишка, найменшого — сигмоподібна. Середня довжина сліпої кишки — 6 см, висхідної — 15–20 см, поперечної ободової — 30–60 см, низхідної — 20–25 см, сигмоподібної — 40 см.
Анатомічні особливості, які відрізняють товсту кишку від тонкої:
- більший діаметр;
- тенії — стрічкоподібні поздовжні м’язові волокна (виділяють вільну — taenia libera, сальникову — taenia omentalis та брижову тенію — taenia mesocolica);
- гаустри — поперечні розширення кишкової стінки; 4) жирові привіски (appendices epiploicae).
Кровопостачання ободової кишки відбувається за рахунок двох артеріальних систем (верхньої та нижньої брижової артерії), що пов’язано з її ембріональним розвитком.
Верхня брижова артерія відходить на 10–15 см нижче черевного стовбура, пролягає позаду підшлункової залози, виходить з-під гачкоподібного відростка її голівки, від неї відходить середня ободова артерія (a. colica media), яка, пройшовши 5–7 см між листками брижі поперечно-ободової кишки, ділиться на праву та ліву гілки (ramus dexter et sinister). Наступною від верхньої брижової артерії відходить права ободова артерія (a. colica dextra), яка, досягнувши правого краю брижі, розділяється на дві гілки — верхню та нижню (ramus superior et inferior). Верхня гілка анастомозує з лівою гілкою a. colica media, а нижня гілка — з ободовою гілкою здухвинно-ободової артерії (ramus colicus a. ileocolicae). Здухвинно-ободова артерія (a. ileocolica), відійшовши від аорти, дугоподібно прямує до ілеоцекального кута, де розділяється на дві гілки (ramus colicus et iliacus a. ileocolicae).
Нижня брижова артерія відходить від аорти на 3–4 см вище від її біфуркації. Довжина її стовбура приблизно 3 см. Вона ділиться на ліву ободову артерію (a. colica sinistra) та на 3–4 сигмоподібні артерії (aa. sigmoideae), хоча інколи їх може бути і більше. Ліва ободова артерія ділиться на висхідну та низхідну гілки (ramus asendens et descendens), висхідна гілка анастомозує з лівою гілкою середньої ободової артерії, а низхідна — із висхідною гілкою першої сигмоподібної артерії. Перша сигмоподібна артерія починається безпосередньо від низхідної гілки лівої ободової артерії, інші — від нижньої брижової артерії.
Головною особливістю артеріальної системи ободової кишки є наявність міжсистемного анастомозу у вигляді крайової артерії Drummond (Etala E., 2008). Вона утворена артеріальними дугами, починаючи від здухвинно-ободової та закінчуючи сигмоподібними артеріями (ramus colicus a. ileocolicae → ramus dexter et sinister a. colicae mediae → ramus ascendens et descendens a. colicae mediae → ramus ascendens et descendens a. sigmoideae). Завдяки крайовій артерії Drummond частково зберігається життєздатність низхідної та сигмоподібної кишки в разі накладання на нижню брижову артерію лігатури.
Венозний відтік здійснюється в однойменні вени, по яких кров через ворітну вену потрапляє в печінку. Устя ворітної вени утворений верхньою брижовою, лівою шлунковою та селезінковою венами, а нижня брижова вена є притоком останньої.
Регіонарними лімфатичними вузлами для ободової кишки є надободові (розміщені в стінці кишки під серозною оболонкою), навколоободові (розміщені між брижовим краєм ободової кишки та крайовою артерією Drummond), проміжні (розташовані вздовж стовбурів і гілок ободових артерій) та головні (біля основи верхньої та нижньої брижової артерії) (Etala E., 2008).
ХІРУРГІЧНА АНАТОМІЯ ПРЯМОЇ КИШКИ
Чіткої анатомічної межі між прямою та сигмоподібною кишкою немає. Топографічно цією межею вважається рівень тіла III крижового хребця (SIII), але з точки зору хірургічної анатомії межа знаходиться на рівні promontorium (мис). Характерними візуальними відмінностями прямої кишки від сигмоподібної є відсутність теній, гаустр та жирових привісків, а також наявність згинів у фронтальній та сагітальній площині (рис. 12.1).

У прямій кишці розрізняють три відділи: супраампулярний відділ, ампулу прямої кишки та анальний канал.
Межами супраампулярного відділу є рівень promontorium проксимально та рівень SIII дистально. Він помірно рухомий, зв’язаний із передньою стінкою крижової кістки редукованою брижею, яку традиційно прийнято називати mesorectum.
Ампула прямої кишки має вкрай варіабельний об’єм. Її умовно ділять на верхню, середню і нижню третини, що пов’язано з особливостями кровопостачання та є важливим при визначенні обсягу резекції. Рельєф слизової оболонки утворений трьома складками — «затулка Хьюстона (Houston)», — які повторюють її фронтальні згини; топографічними орієнтирами служити не можуть через їх високу варіабельність. Середня і нижня третина ампули прямої кишки не мають очеревинного покриву, розміщуються екстраперитонеально. Верхньоампулярний та ректосигмоїдний відділи розташовані мезоперитонеально. Ампула прямої кишки дистально переходить в анальний канал.
Межею анатомічного анального каналу є зубчаста лінія, тобто межа між слизовою оболонкою та шкірою анального отвору. Довжина анатомічного анального каналу — 1,5–2 см. Межею хірургічного анального каналу є так зване аноректальне кільце — місце прикріплення до прямої кишки mm. levatores ani, тобто межа між порожниною малого таза та клітковиною промежини. Довжина хірургічного анального каналу 3–4 см.
Основними м’язами прямої кишки є m. levator ani, m. sphincter ani internus et externus. Останній відіграє вирішальну роль у забезпеченні функції континенції (утримання вмісту товстої кишки). Кровопостачання отримують від гілок a. pudenda interna, венозний відтік через однойменну вену в систему нижньої порожнистої вени, іннервацію — від n. pudendus із plexus sacralis. Судини та нерв відходять із порожнини малого таза та проходять в fossa ischiorectalis s. canalis Alkok.
Фасції прямої кишки є похідними фасції таза (fascia pelvis). У хірургії прямої кишки найбільше значення мають такі з них:
- власна (периректальна) фасція прямої кишки;
- фасція Denonvillier (Денонвільє) — передня щільна частина фасції таза, що відділяє сечовий міхур, передміхурову залозу та сім’яні пухирці у чоловіків від прямої кишки. Візуалізується при МРТ. У жінок розвинена незначно або відсутня;
- фасція Waldeyer (Вальдеєра, ретросакральна) — щільна фасціальна пластина, листок пресакральної фасції, що покриває передню стінку крижової кістки та пресакральне венозне сплетення, розміщене під нею. Фіксується до прямої кишки на рівні аноректального кільця.
Кровопостачання прямої кишки відбувається за рахунок непарної a. rectalis superior, гілки a. mesenterica inferior (ректосигмоїдний відділ, верхня третина ампули) та двох парних артерій — a. rectalis media, гілки a. iliaca interna (середня третина ампули), a. rectalis inferior — гілка a. pudenda interna із a. iliaca interna (нижньоампулярний відділ та анальний канал).
Венозний відтік здійснюється по однойменних венах, які супроводжують артерії. Від супраампулярного відділу та ампули прямої кишки кров потрапляє у систему ворітної вени, від анального каналу — до нижньої порожнистої вени. Особливістю венозного відтоку є наявність портокавального анастомозу: v. cava inf. ← v. Iliaca int. ← v. rectalis med. →← v. rectalis sup. → v. mesenterica inf. → v. lienalis → v. portae.
Лімфатичний відтік від прямої кишки є багатоступеневим, він може бути як ортоградним, так і ретроградним (хоча на сьогодні доведено, що ретроградне метастазування при раку прямої кишки (РПК) спостерігається менше ніж в 1% випадків) (Moriya A.O. et.al., 1989).
Регіонарними лімфовузлами для прямої кишки є такі (згідно з Японською класифікацією):
- рівень 1 (дистальні лімфовузли) — параректальні лімфатичні вузли (локалізовані в mesorectum); лімфовузли за ходом верхньої прямокишкової артерії (висхідний відтік) та середньої прямокишкової артерії (латеральний відтік);
- рівень 2 (проміжні лімфовузли) — лімфовузли за ходом нижньої брижової артерії (висхідний відтік), внутрішньої здухвинної артерії (латеральний відтік);
- рівень 3 (проксимальні, або апікальні лімфовузли) — парааортальні лімфовузли (висхідний відтік), лімфовузли затульного каналу (латеральний відтік).
Першу концепцію лімфовідтоку від прямої кишки запропонував E. Miles (1908). Згідно з нею існує висхідний, латеральний та низхідний шлях відтоку лімфи від прямої кишки.
- Висхідний — параректальні лімфовузли → верхні ректальні (вздовж a. rectalis superior) → нижньобрижові лімфовузли (за ходом a. mesenterica inferior) → парааортальні лімфовузли.
- Латеральний — середні ректальні (a. rectalis media) → затульні (a. obturatoria, яка проходить в canalis obturatorius) → внутрішні здухвинні (a. iliaca interna) → загальні здухвинні (a. iliaca communis) → парааортальні лімфовузли.
- Низхідний — у пахові лімфатичні вузли.
Концепція E. Miles була розроблена для обґрунтування необхідності проведення черевно-промежинної екстирпації прямої кишки (операція Кеню — Майлса) при пухлинах, локалізованих в середньо- та нижньоампулярному відділі, а також у ділянці анального каналу з метою запобігання рецидивам, які могли виникнути із ретроградних метастазів.
В 60-х роках ХХ ст. R.J. Heald та співавтори на основі численних патоморфологічних досліджень внесли суттєві зміни до концепції E. Miles, а саме: 1) усі лімфатичні вузли першого порядку, до яких надходить лімфа від всіх відділів прямої кишки (зазвичай 4–12), та сторожовий лімфовузол (вузол Герота) розміщені в межах периректального клітковинного простору, обмеженого фасціальним футляром — mesorectum; 2) архітектоніка лімфатичних судин прямої кишки побудована таким чином, що між ділянками анального каналу та ампули практично відсутні сполучення (анастомози), тобто низхідний шлях метастазування пухлин ампули прямої кишки практично відсутній (<1%, див. вище). Ці важливі відомості дали змогу відкрити нову еру сучасної онкопроктологічної хірургії — еру сфінктерозберігаючих операцій.
MESORECTUM
Уперше цей термін був запропонований Maunsell для позначення ділянки редукованої брижі ректосигмоїдного відділу прямої кишки. Однак на сьогодні таке визначення вважається цілком невірним. Підтвердженням цього служить відсутність такого терміну в PNA (Parisiensia Nomina Anatomica) та анатомічних номенклатурах пізнішого перегляду. Mesorectum є ділянкою навколопрямокишкової клітковини, обмеженою краніально — парієтальною очеревиною, латерально — власною фасцією прямої кишки, медіально — стінкою прямої кишки та каудально — леваторами анального отвору та аноректальним кільцем, вентрально — фасцією Denonvillier та дорзально — фасцією Waldeyer. За даними Heald та співавторів, а також Valdoni та співавторів, у клітковині mesorectum містяться регіонарні лімфовузли першого порядку для всіх відділів тазової частини прямої кишки. Сучасне трактування поняття mesorectum у колоректальній хірургії є надзвичайно важливим, оскільки правильно проведена операція тотальної мезоректумектомії дає можливість виконувати ОЗО при ЗН прямої кишки та подовжити безрецидивний період.
ФІЗІОЛОГІЯ ТОВСТОЇ КИШКИ
Головною функцією товстої кишки є всмоктування води та солей натрію. Так, за добу 1000–2000 мл ізотонічного хімусу з клубової кишки перетворюється на 200–250 мл напівтвердих калових мас. Важливі функції виконують товстокишкові бактерії — вони синтезують вітаміни групи В, вітамін К та фолієву кислоту, беруть участь у метаболізмі жовчних кислот та пігментів. Пасаж хімусу по товстій кишці забезпечується трьома механізмами: 1) шлунково-клубовим рефлексом (розслаблення стулок баугінієвої затулки при виході хімусу зі шлунка), 2) сегментарними скороченнями та 3) скороченням внаслідок дії маси (цей тип подразника характерний тільки для товстої кишки). Головними функціями прямої кишки є континенція (довільне утримання кишкового вмісту) та дефекація. Континенція забезпечується завдяки постійному тонічному скороченню м’язів зовнішнього анального сфінктера та діафрагми малого таза. Дефекація — це спінальний рефлекс, що замикається на рівні парасимпатичних ядер крижового відділу спинного мозку (SII–SIV), реалізацію якого людина може свідомо регулювати довільним скороченням зовнішнього анального сфінктера. Виникнення рефлексу дефекації залежить від тиску в ампулі прямої кишки, створеного каловими масами. При досягненні тиску 18–20 мм водного стовпчика виникає позив до дефекації, при 50–60 мм водного стовпчика відбувається рефлекторне розслаблення внутрішнього анального сфінктера, при цьому свідоме розслаблення зовнішнього анального сфінктера та напруження м’язів черева викликає дефекацію.
ЕПІДЕМІОЛОГІЯ
Колоректальний рак (КРР) набуває дедалі більшого значення як медична та соціальна проблема. У світі щорічно діагностують більше 500 тис. випадків КРР, причому менше третини пролікованих хворих живуть більше 5 років. Найвищий рівень захворюваності відзначають в економічно розвинутих країнах (з його незначним підвищенням чи стабілізацією в останні десятиріччя), найнижчі показники відмічено в африканських, південноамериканських та азійських країнах (зі швидким зростанням в умовах зниження дитячої смертності та старіння населення). У США, Великій Британії, Нідерландах та деяких інших державах КРР займає 2-ге місце в структурі смертності від ЗН.
Захворюваність на КРР в Україні зросла в період з 1970 по 1996 р. у 3,4 раза і становить 16,4 на 100 тис. населення для раку ободової (РОК) та 14,7 — для РПК. Ця тенденція зберігається і в останні роки: у 2012 р. «грубий» показник захворюваності на РОК досяг 23,7 на 100 тис. населення, РПК — 20,7.
«Грубі» показники захворюваності та смертності для РОК та РПК, а також місце в структурі найбільш розповсюджених ЗН за період 2011–2012 рр. (дані Національного канцер-реєстру)
У 2012 р. захворюваність на РОК становила 27,4 (чоловіки) і 19,0 (жінки) на 100 тис.; смертність — 16,2 (чоловіки) та 10,3 (жінки) на 100 тис. населення; у структурі захворюваності — 4-те місце серед чоловіків та 3-тє — серед жінок; у структурі смертності — 5-те серед чоловіків і 2-ге — серед жінок.
Захворюваність на РПК — 23,3 (чоловіки) і 18,6 (жінки) на 100 тис.; смертність — 14,0 (чоловіки) та 10,8 (жінки) на 100 тис. населення; у структурі захворюваності — 5-те місце серед чоловіків та жінок; у структурі смертності — 4-те серед чоловіків і жінок.
ЕТІОЛОГІЯ ТА ПАТОГЕНЕЗ
Основні чинники та патогенетичні механізми КРР, як і багатьох інших онкологічних захворювань, досі остаточно не з’ясовані, тому залишається тільки констатувати «поліетіологічність» цієї патології. Безумовною є генетична схильність до розвитку КРР, про що свідчать численні спадкові синдроми, наведені нижче. Серед факторів зовнішнього середовища найбільше значення мають особливості харчування. У країнах, де переважає так званий західний тип дієти (рафіновані продукти з великим вмістом тваринних жирів і протеїнів), відзначають високий рівень захворюваності на КРР. Проте при переважанні східного типу дієти (груба їжа з високим вмістом клітковини та рослинних жирів) у структурі захворюваності домінує рак шлунка, який значно випереджає КРР. Доказом існування зв’язку між характером харчування та розвитком КРР є епідеміологічні дані, що свідчать про підвищення його частоти в окремих груп населення, які історично змінили тип дієти (наприклад у представників негроїдної раси США).
Механізмами реалізації цих факторів є утворення ендоканцерогенів, головним чином із жирів та білків, які надходять з їжею (в основному з консервантів і наповнювачів харчових продуктів). Надлишкове введення тваринного жиру викликає підвищення вмісту жовчних кислот, які є потенційними канцерогенами і збільшують популяцію анаеробів у товстій кишці. Останні за рахунок продукції сполук з високою ферментативною активністю здійснюють хімічну модуляцію жовчних кислот з утворенням речовин з канцерогенними властивостями. Незначна частота раку тонкої кишки, на думку деяких авторів, пояснюється саме бідністю її мікробного пейзажу.
Зрозуміло, що чим довше перебувають канцерогени (у складі калових мас) в організмі, тим вірогідніший розвиток неоплазми. Наявність в їжі клітковини, яка прискорює пасаж кишкового вмісту, є фактором протидії канцерогенезу. Окрім того, клітковина збільшує об’єм калу, що знижує концентрацію канцерогенів.
В окремих дослідженнях наголошується на значенні в етіології КРР нестачі в їжі деяких сполук, зокрема селену, вітаміну А тощо. Неважко помітити, що згадані факти не утворюють стрункої теорії походження раку товстої кишки, розробка якої належить майбутньому. Передчасними є й заходи профілактики КРР, що ґрунтуються лише на гіпотезі типу дієти.
ПАТОМОРФОЛОГІЯ
Макроскопічно розрізняють екзофітну (ріст пухлини у просвіт кишки), ендофітну (проростання вглибину стінки кишки) та перехідну (пухлини зі змішаним ростом) форми.
Серед екзофітних виділяють (за А.М. Ганичкіним, 1970):
- поліпоподібну пухлину, що є малігнізованим поліпом;
- папілярну — пухлину на ніжці, від якої в просвіт кишки відходять грони, що нагадують кольорову капусту;
- вузлувату пухлину, яка розташована на одній зі стінок та виступає в кишковий просвіт; із появою на верхівці виразки поступово переходить у перехідну чи виразкову форму.
Перехідна, або змішана, форма — блюдцеподібна пухлина з піднесеними краями (екзофітного характеру) та кратероподібною частиною з ендофітним ростом.
Ендофітна форма має такі прояви:
- виразкова пухлина походить із вузлуватої; ракові клітини інвазують підслизовий шар та м’язовий шар, стінка кишки ущільнюється, її циркулярно охоплює інфільтрат;
- дифузно-інфільтративна пухлина з самого початку проростає у підслизовий шар, і хоча цілісність слизової оболонки зберігається, її рельєф порушується, складки деформуються з подальшим циркулярним звуженням просвіту кишки.
Наводимо Міжнародну гістологічну класифікацію пухлин товстої кишки (скорочено):
I. Епітеліальні пухлини
А. Доброякісні
1. Аденома: а) тубулярна (залозистий поліп); б) ворсинчаста; в) тубулярно-ворсинчаста.
2. Аденоматоз (аденоматозний поліпоз кишечнику).
Б. Злоякісні
1. Аденокарцинома.
2. Слизова аденокарцинома.
3. Перснеподібноклітинний (мукоцелюлярний) рак.
4. Плоскоклітинний рак.
5. Залозисто-плоскоклітинний рак.
6. Недиференційований (медулярний, трабекулярний) рак.
7. Некласифікований рак.
II. Нейроендокринний рак
III. Неепітеліальні пухлини
А. Доброякісні (лейоміома, неврілемома, ліпома і ліпоматоз, гемангіоми та ін.).
Б. Злоякісні (найчастіше — лейоміосаркома).
До груп IV–VI входять пухлини кровотворної та лімфоїдної тканини, некласифіковані пухлини, вторинні пухлини (метастази та проростаючі з інших органів).
VII. Пухлиноподібні ураження
(гамартоми, гетеротопії шлункового епітелію, гіперпластичний поліп, доброякісний лімфоїдний поліп та поліпоз, запальний поліп, глибокий кістозний поліп, ендометріоз, гранульома).
Для анального каналу та анального отвору існують окремі класифікації. Вони мають такі самі розділи, але злоякісні епітеліальні пухлини анального каналу класифікуються таким чином:
1. Плоскоклітинний рак.
2. Базаліоїдний рак.
3. Мукоепітеліальний рак.
4. Аденокарцинома.
5. Недиференційований рак.
6. Некласифікований рак.
Крім того, у рубрикацію внесено меланому, яка нерідко виникає в цій ділянці.
Класифікація пухлин ануса в цілому збігається з такою пухлин шкіри, але серед пухлиноподібних процесів згадуються шпилясті (гострокінцеві) кондиломи, гігантська кондилома, псевдоепітеліоматозна гіперплазія, фіброзний поліп.
Передракові стани
Серед передпухлинних процесів насамперед варто згадати поліпи. Поліп (від грецького poly — багато та pus — нога, тобто «багатоніжка») — це пухлина (чи пухлиноподібне утворення) на ніжці, яка виступає зі стінки у просвіт порожнистого органа. Клінічні класифікації поліпів не збігаються з патоморфологічними. Найпоширенішою є модифікована класифікація В.Л. Рівкіна та співавторів (1969).
Поодинокі та групові поліпи
Тубулярна аденома — гладеньке рухоме утворення невеликих розмірів із вираженою ніжкою, яке не відрізняється ні за кольором, ні за щільністю від слизової оболонки, що його оточує.
Ворсинчаста аденома складається з кількох часточок, нагадує ягоду малини, забарвлення дещо інтенсивніше, ніж інтактної слизової оболонки.
Тубулярно-ворсинчасті аденоми займають проміжне положення.
Гіперпластичні поліпи являють собою невелике бляшкоподібне ущільнення до 0,5 см в діаметрі, найчастіше діагностуються у прямій та сигмовидній кишці. Деякі дослідники відносять їх до передаденоматозних поліпів.
Ювенільні поліпи найчастіше трапляються у дітей та підлітків, проліферативна активність незначно виражена, малігнізують рідко.
Фіброзні поліпи — сполучнотканинні утворення з великою кількістю судин.
Лімфоїдні поліпи — рідко діагностовані форми розміром 2–3 мм, що утворюються через гіперплазію лімфатичних фолікулів підслизової основи.
Глибокий кістозний поліп виникає при проникненні залоз у підслизовий шар, що може відбуватися при тривалих запальних процесах (неспецифічний виразковий коліт) або при випадінні прямої кишки.
Ворсинчаста пухлина
Це досить своєрідне поліпоподібне утворення, яке найчастіше уражує пряму та сигмоподібну кишку. Гістологічно належить до ворсинчастих аденом, але традиційно у зв’язку з особливостями клінічного перебігу виділяють в окрему групу. Деякі автори вважають їх облігатним передраковим станом, інші — повільно прогресуючим раком. Частота розвитку раку на ґрунті вільозної пухлини становить від 25 до 90%.
Макроскопічно розрізняють дві їх форми:
- вузлову — трапляється частіше, при ній виявляють екзофітний пухлинний вузол із широкою основою, вкритий ворсинками;
- стелючу — розташовується по поверхні слизової оболонки, не утворюючи вузла, іноді займає значну площу. Пальпаторно — м’яка, як пух, контактно кровоточить.
Ці пухлини рожево-червоного, іноді темно-червоного кольору (через значні судинні розростання) діаметром від 1 до 5–8 см і навіть більше. Найважливіший клінічний синдром — це виділення з кишки тягучих прозорих слизових мас (іноді 1,5–2 л/добу), що нагадують яєчний білок та містять велику кількість іонів калію і призводять до гіпокаліємії. Зазвичай із прогресуванням малігнізації кількість слизу зменшується, а виділення крові збільшується.
Клінічні прояви поліпів товстої кишки аналогічні симптомам КРР, але їх вираженість менша. Нерідким є безболісний перебіг.
Принцип лікування єдиний — усі виявлені залозисті поліпи мають бути видалені шляхом трансанального висічення (якщо вони локалізовані на відстані <6 см від ануса) або електрокоагуляцією через колоноскоп. Зрідка при великих поліпах і ворсинчастій пухлині, розташованих на 8–12 см від анального отвору (та при неможливості ендоскопічного втручання), застосовують задню проктотомію: після розтину від крижової кістки до куприка останній резектують; мобілізують та розтинають задню стінку прямої кишки і виділяють поліп; рану зашивають пошарово.
Дифузний поліпоз
Родинний дифузний поліпоз (ДП) — тяжке захворювання з аутосомно-домінантним типом успадкування і частіше майже повною пенетрантністю. Біля 40% випадків виявляються спорадичними. Мутантний ген знаходиться в 5-й хромосомі. Діагностика не викликає труднощів: спадковий анамнез, молодий вік хворого, біль у животі та втрата маси тіла, пронос зі слизом та кров’ю, виражена анемія, інфантилізм, множинні поліпи товстої кишки — дозволяють легко установити правильний діагноз. Малігнізація при «класичному» поліпозі спостерігається практично в 100% випадків.
Відомі численні спадкові синдроми, при яких родинний ДП поєднується з різноманітними позакишковими проявами:
- синдром Гарднера — множинні остеоми лицьових кісток, епідермоїдні кісти та ДП;
- синдром Пейтца — Джигерса — поєднання поліпів (гамартомного типу) та пігментних плям шкіри, переважно обличчя, слизових оболонок губ та щік. Останні коричневого, іноді — буро-жовтого кольору, з чіткими контурами, розмірами від міліарних до плода вишні, на відміну від веснянок, не мають сезонності. Гамартомні поліпи малігнізуються рідко;
- синдром Тюрко — поєднання ДП та ЗН ЦНС;
- синдром Кронкайта — Канада — ДП, алопеція, атрофічні зміни нігтів, пігментація шкіри, анемія, набряки, що виникають у віці >40 років. Патогенез — порушення всмоктування в кишечнику вітамінів А, В6, РР, С. Описано поєднання ДП з іншими новоутвореннями внутрішніх органів.
Лікування родинного ДП — тільки оперативне. Проводять видалення всіх уражених поліпами ділянок товстої кишки зі збереженням тих відділів, які можуть бути сановані та за якими можливо здійснювати постійне ендоскопічне спостереження.
Вторинний псевдополіпоз виникає внаслідок хронічного запалення (неспецифічний виразковий коліт, хронічна дизентерія) або інвазії паразитами (шистосомоз чи хвороба Більгарца). Це досить рідкісна глистна інвазія, яку викликає шистосома Мансоні; самки відкладають яйця в підслизовому шарі товстої кишки з утворенням поліпоподібних гранульом, що можуть відторгатися.
Неполіпозні передракові захворювання
Спадковий неполіпозний КРР (синдром Лінча) — захворювання з аутосомно-домінантним типом успадкування; трапляється в 1–10% хворих на КРР. У пацієнтів із синдромом Лінча 1-го типу у віці >45 років виявляють пухлини проксимального відділу селезінкового кута товстої кишки; а хворі з синдромом Лінча 2-го типу, крім того, мають множинні пухлинні ураження інших органів. Ендоскопічні дослідження необхідно проводити з 25 років щорічно; при першому виявленні раку показана субтотальна колектомія.
Неспецифічний виразковий коліт — у хворих із тривалим перебігом захворювання (8–10 років) ризик розвитку раку зростає у 2–8 разів. Пацієнти з тривалим анамнезом хвороби підлягають колоноскопії з систематичною біопсією кожних 10 см кишки; за відсутності дисплазії наступний контроль — через 1–2 роки. При непевній картині або легкій дисплазії контрольні обстеження виконують кожні 6 міс чи вирішують питання про «профілактичну» колектомію. При макроскопічних ураженнях, тяжкій дисплазії, стенозуванні просвіту, що утруднює огляд, показана рання колектомія.
Гранулематозний коліт (хвороба Крона) — ризик розвитку раку у цих хворих не отримав остаточної оцінки, необхідність регулярного ендоскопічного та гістологічного контролю дискутується.
Зрідка відзначають ракове переродження ректальних нориць (хронічного парапроктиту) та шпилястих кондилом. Надзвичайно рідко відбувається малігнізація актиномікозу параректальної клітковини, кокцидіоїдозу, венеричної лімфогранульоми (четверта венерична хвороба).
Ріст і розповсюдження
Розповсюдження по кишковій стінці по довжині має неабияке практичне значення — від цього залежить рівень резекції кишки. При екзофітних формах раку розповсюдження в проксимальному та дистальному напрямках обмежується визначеним макроскопічно краєм пухлини. При ендофітних формах (особливо низькодиференційованих) поширення відбувається у підслизовому шарі зазвичай не більше ніж на 2–3 см від меж пухлини. Тільки у виняткових випадках ракові клітини розміщуються на більшій відстані. Розповсюдження в товщу стінки кишки та за її межі реалізується у такому напрямі: зі слизової оболонки та підслизового шару у вигляді ракових тяжів по міжклітинних щілинах та лімфатичних капілярах до субсерозного шару, в якому бластомні клітини концентруються в осередках, а згодом проростають серозу й переходять на сусідні тканини та органи. Частіше цей процес розгортається при ендофітних і вузлуватій екзофітній пухлині.
Розповсюдження (метастазування) лімфатичними шляхами є провідним при КРР. Відтік лімфи від товстої кишки здійснюється поетапно у напрямку, який загалом збігається з кровопостачанням відповідних ділянок (рис. 12.2).
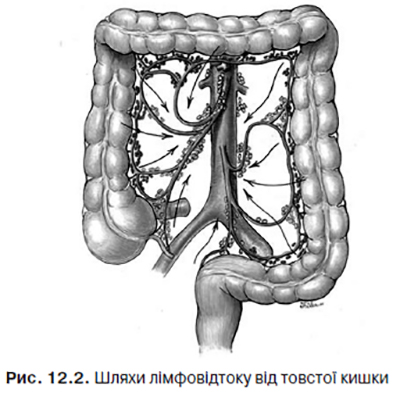
Першим лімфатичним бар’єром є епіколярні (надободові) лімфовузли, розташовані по внутрішньому та брижовому краях кишки. Таких вузлів особливо багато у colon ascendens.
Другий етап — параколярні (навколоободові) лімфатичні вузли розміщуються уздовж артеріальних аркад і гілок брижових артерій (a. ileocolica, a. colica dextra, a. colica media, a. colica sinistra, aa. sigmoideae). Останній регіонарний етап — мезентеріальні лімфовузли — локалізуються біля aa. mesenterica superior et inferior. Звідси лімфатичні судини прямують до вузлів, розташованих на аорті та нижній порожнистій вені.
З прямої кишки лімфа потрапляє в параректальні лімфовузли, що містяться у параректальній клітковині. Далі відтікання може відбуватися у трьох напрямках:
- у лімфовузли вздовж верхньої прямокишкової артерії (регіонарні) і далі — в за очеревинні, пара- та передаортальні (віддалені);
- по лімфатичних шляхах, що супроводжують a. rectalis media до клубових лімфовузлів (уздовж a. iliaca interna), біфуркаційних (у розгалуженні аорти) та аортальних;
- за ходом a. rectalis inferior et a. pudenda interna — в пахвинні лімфатичні вузли.
Метастази в лімфовузли довкола аорти та v. cava inferior (які раніше трактували як юкстарегіонарні) вважають віддаленими.
При блокаді лімфатичних вузлів метастазами можливе колатеральне або ретроградне метастазування у напрямку сусідніх лімфоколекторів та органів. Варіантом лімфогенного метастазування є інвазія ракових клітин в периневральні лімфатичні щілини.
Гематогенне метастазування відбувається за рахунок проникнення бластомних клітин у вени.
Імплантаційне метастазування відзначають при розповсюдженні елементів пухлини по поверхні очеревини (з розвитком карциноматозу і навіть ракового перитоніту) або слизової оболонки. Останньому сприяє перистальтика та оперативне втручання, при якому велика кількість клітин та фрагментів пухлин відторгаються у просвіт кишки.
Віддалені метастази можуть бути наслідком прогресування ракового процесу будь-яким з наведених шляхів. Найчастіше вони виникають у печінці, лімфатичних вузлах, очеревині. Рак нижньоампулярного відділу прямої кишки нерідко гематогенно метастазує у легені (vv. rectales mediales et inferiors, що належать до кавальної системи).
ДІАГНОСТИКА
Незважаючи на те що товста кишка, особливо пряма, є доступною для огляду та дослідження завдяки сучасним методикам, у більшості госпіталізованих діагностують розповсюджені форми захворювання. Серед вперше виявлених у 1995 р. в нашій країні випадків РОК I та II стадію діагностовано лише в 24,4%. РПК, який належить до візуальних локалізацій, у 55% хворих виявляють у III та IV стадії. У 2012 р. РОК у І–ІІ стадії виявлено у 53,5%, у IV — у 19%. РПК у початкових стадіях відзначено у 63,7%, а у IV стадії — у 15,3%. Ці дані свідчать про підвищення якості первинної діагностики КРР в Україні.
У клінічному перебігу КРР виділяють такі синдроми.
СИНДРОМ РОЗЛАДІВ ФУНКЦІЇ КИШЕЧНИКУ
1. Порушення ритму та частоти дефекації
Запори в початкових стадіях розвитку хвороби зумовлені набряком і запаленням слизової оболонки довкола пухлини, порушенням процесів всмоктування, бродінням та гниттям кишкового вмісту, що спричинює функціональне звуження просвіту кишки (рефлекторно — спастичний фактор). Стенози кишки, які при цьому виникають, до певного часу компенсуються гіпертрофією стінки проксимальної ділянки. З прогресуванням процесу внаслідок інфільтрації стінки кишки пухлини (особливо ендофітні) призводять до стійких запорів, які супроводжуються здуттям, урчанням, відчуттям тяжкості у животі (механічний фактор).
Проноси виникають внаслідок рефлексу від подразнення кишки при проходженні калових мас по ураженій ділянці, що призводить до прискорення перистальтики. Характерним для КРР є чергування проносів та запорів. Застій калу над пухлиною спричиняє підвищену секреторну діяльність кишки та запалення слизової оболонки (з утворенням слизу та ексудату). Рідина, що утворилася, сприяє проходженню калу крізь стенозовану ділянку шляхом зміни його консистенції. Запор, таким чином, завершується рясними водянистими смердючими випорожненнями, і знов настає затримка дефекації на декілька діб або навіть тижнів. Отже, йдеться про хибний пронос.
2. Хибні позиви до дефекації, тенезми
Хибні позиви до дефекації є характерними для пухлини прямої та сигмоподібної кишки, вони виникають від 3–5 до 15–20 разів на добу. Часті хибні позиви супроводжуються виділенням незначної кількості крові, слизу, гною. Після такої дефекації хворі не відзначають полегшення, у них зберігається відчуття стороннього тіла в прямій кишці. Тенезми — це болючі хибні позиви до дефекації, що не супроводжуються виділенням калу. Тенезми виникають при подразненні пухлиною інтрамуральних нервових сплетень ампулярного відділу прямої кишки.
3. Зміна форми калу
Цей синдром більш притаманний анальним видам раку. Випорожнення набувають форми олівця, стрічкоподібної форми або вигляду «калу вівці». Причина полягає в сплющенні калових мас внаслідок деформації стінок кишки та гіпертонусу анального сфінктера.
4. Нетримання калу та газів
Настає при руйнуванні сфінктера пухлиною або при раковій інфільтрації його нервового апарату. Порушення функції фекальної континенції настає не відразу: спочатку має місце судомне скорочення сфінктера через біль та запалення, згодом — ослаблення та недієздатність. Варто зауважити, що цей симптом може з’являтися і при стенозуючих пухлинах ободової кишки та ректосигмоїдного кута. Він широко відомий як «симптом Обухівської лікарні» і пояснюється рефлекторним паралічем сфінктера внаслідок виснаження нервово-м’язового апарату через численні тенезми та гіперперистальтику.
БОЛЬОВИЙ СИНДРОМ
Біль у животі може бути викликана:
- прогресуванням кишкової непрохідності;
- місцевим розповсюдженням (на оточуючі тканини та органи) як самої пухлини, так і параканкрозного запального процесу. Характер болю є різноманітним. Іноді біль буває низької інтенсивності, не має певної локалізації. Іноді (при пухлинах правої половини ободової кишки) біль з’являється у вигляді короткочасних нападів, може супроводжуватися напруженням м’язів живота, субфебрильною температурою тіла, появою гострофазових лабораторних показників і таким чином симулювати гострий апендицит чи холецистит. Характеристика болю при кишковій непрохідності читачам відома.
Біль у промежині є раннім симптомом при раку анального каналу: виникає він через проростання нервових елементів і спазм сфінктера та має постійний, інтенсивний характер, посилюється при дефекації, а також після тривалого ходіння. Інколи він стає пекучим, заважає сидіти, перешкоджає випорожненню, викликає негативні емоції. При пухлинах інших відділів прямої кишки біль може бути постійним, ниючим, іррадіювати в анус, куприк, крижі, поперекову, сідничну ділянки, іноді — в низ живота та нижні кінцівки. Потрібно пам’ятати, що часто біль зумовлений супутнім захворюванням (геморой, парапроктит, анальна тріщина тощо), з приводу чого хворий і звертається до лікаря. Обмеження діагностичного пошуку лише констатуванням цих хвороб є неприпустимою помилкою! Нерідко хворих, що скаржаться на біль у крижово-куприковій ділянці чи внизу живота, лікують з приводу остеохондрозу поперекового відділу хребта, хронічного аднекситу, інших хвороб. Усім цим хворим має бути проведене обстеження прямої кишки.
СИНДРОМ ПАТОЛОГІЧНИХ ВИДІЛЕНЬ
Синдром більш характерний для пухлин прямої кишки, проте нерідко розвивається і при ураженні ободової кишки. Виділення з’являються внаслідок утворення виразок, інфікування розпаду пухлини, травматизації її калом, запальних процесів у слизовій оболонці з ексудацією та утворенням екстравазатів.
Виділення крові реєструють у 75–90% хворих на РПК. Кількість крові звичайно невелика. Виділяється у вигляді дрібних краплинок чи тонких смужок, які утворюються на поверхні калу при його проходженні повз ушкоджену ділянку пухлини. Найчастіше кров з’являється при дефекації, в більшості випадків передує каловим масам, позаяк вона стікає по стінках ампули і накопичується перед сфінктером. У цьому полягає одна з причин, яка перешкоджає протягом тривалого часу виявленню крові хворим особисто. Нагадаємо, що при гемороїдальній кровотечі кров спостерігається наприкінці дефекації у вигляді великої плями, що розпливається по фекальних масах. Зрідка кров, сукровична чи сукровично-гнійна рідина можуть просочуватися з газами, забруднювати білизну і викликати свербіння, подразнення, запалення та мацерацію періанальної шкіри. Також рідко крововтрата буває значною; профузні кровотечі практично не виникають. При пухлинах проксимальних відділів товстої кишки кров може візуально не визначатися, але аналіз на приховану кров є позитивним.
У більшості випадків кров буває зміненою, оскільки змішується зі слизом, гноєм, серозною рідиною, набуваючи вигляду «м’ясних помиїв». При тривалому контакті крові й калу (при пухлинах ободової кишки) останній може набувати брудно-чорного кольору. Тривале знаходження рідкої крові в ампулі за відсутності фекалій призводить не тільки до чорного її забарвлення, але й до розкладання з набуттям вигляду кавової гущі та смердючого запаху. Рідше кров виділяється згустками.
Слиз виділяється білуватого кольору чи напівпрозорими невеликими скупченнями та пластівцями, нерідко з домішками крові чи гною. Вигляд його відрізняється від нерясних калових мас, як при гострих ентероколітах, і від довгих стрічкоподібних тяжів чи пластівців, як при деяких формах хронічного коліту.
Гній — рідкий, жовтуватий чи бурий, іхорозний, смердючий, на відміну від білого чи зеленуватого, притаманного банальним колітам та ректитам. Поява гною вказує на розпад та приєднання інфекції, тобто при більш задавненій стадії процесу.
Пронос, наявність слизу й крові в калі, тенезми (які нагадують «ректальний плювок») можуть бути причиною хибної діагностики гострої дизентерії та госпіталізації хворого в інфекційний стаціонар.
Описані нижче два синдроми належать до таких, що виникають при занедбаних випадках КРР.
СИНДРОМ ПОРУШЕННЯ ЗАГАЛЬНОГО СТАНУ
Анемія пов’язана зі щоденними крововтратами, а також порушенням вітаміносинтезуючої функції товстої кишки, частіше виникає при пухлинах правої половини ободової кишки.
Лихоманка спричинена параканкрозним запальним процесом у кишці та оточуючих тканинах, інтоксикацією через всмоктування продуктів розпаду пухлин, зазвичай сягає субфебрильних значень.
Втрата маси тіла пояснюється втратою білків з кров’ю та гноєм, великою пухлинною масою («пастка азоту та глюкози»), порушенням травлення. Проте частина хворих (особливо на РПК) мають збільшену масу тіла і навіть ожиріння.
Різке схуднення, землистий колір та сухість шкіри, іктеричність при КРР трапляються відносно рідко і свідчить про фатальний безпосередній прогноз.
СИНДРОМ ПУХЛИН, ЩО ПАЛЬПУЮТЬСЯ
Пальпація пухлини є важливим об’єктивним симптомом у клінічному перебігу та діагностиці КРР. Але практично в усіх випадках виявленню лікарем чи самим хворим пухлини передували інші клінічні симптоми. Хоча пухлина, що пальпується, не є раннім симптомом КРР, все ж у значної кількості хворих наявність останньої стає головним приводом для встановлення правильного діагнозу. Цей симптом ще не вказує на беззаперечну неоперабельність пухлини. Частота виявлення пухлини залежить і від її локалізації: найлегше пальпуються новоутворення сліпої та висхідної ободової кишки, найскладніше — печінкового та селезінкового кута.
Варто зазначити, що цей синдром залишає широкий простір для диференційної діагностики. Наприклад, при утворенні, що пальпується у правому підребер’ї, її слід проводити з:
- раком печінкового кута ободової кишки;
- паразитарною та непаразитарною кістою печінки;
- раком та гемангіомою печінки;
- водянкою жовчного міхура;
- раком жовчного міхура;
- «відключеним» жовчним міхуром;
- кістою та раком правої нирки;
- пухлиною надниркової залози;
- стороннім тілом у кишці;
- позаорганною заочеревинною пухлиною;
- запальною псевдопухлиною;
- специфічними гранульомами (туберкульоз, актиномікоз, амебіаз кишки);
- каловим камінням;
- пухлинними ураженнями брижі (лімфоми);
- пухлинами (дермоїд) та килами передньої черевної стінки.
Залежно від переважання тих чи інших синдромів у перебігу захворювання деякі автори виділяють клінічні форми раку товстої кишки:
1) токсико-анемічну;
2) ентероколітичну;
3) диспептичну;
4) обтураційну;
5) псевдозапальну (нагадує хронічний запальний процес у черевній порожнині);
6) пухлинну (утворення, що пальпуються).
У правій половині товстої кишки частіше виникають 1, 3, 5 і 6 форми, у лівій — 2 та 4. Дійсно, нерідко у конкретного хворого на КРР можливо визначити 1 та 2 домінуючих синдроми, сукупність яких і становить клінічну форму. Рак лівої половини товстої кишки частіше маніфестує гострою чи хронічною кишковою непрохідністю (через що значній кількості хворих проводять операції в ургентних хірургічних відділеннях). Причинами цього є переважання ендофітних форм, менший діаметр просвіту кишки та більш щільна консистенція калу порівняно з правими відділами. Але взагалі ми дотримуємося скептичного ставлення до розмежування клінічних форм, які мають радше теоретичне, ніж практичне значення.
ДІАГНОСТИКА
Після вивчення скарг та анамнестичних даних, що свідчать про можливість існування пухлини товстої кишки, проводять ретельне фізикальне та лабораторне обстеження хворого, а також спеціальне пальцеве та інструментальне дослідження.
Пальцеве обстеження прямої кишки є обов’язковим методом діагностики, який не може бути нічим замінений і має передувати будь-якому виду ендоскопії. При мінімальному технічному оснащенні воно дозволяє діагностувати близько ⅔ пухлин прямої кишки. Лікар повинен усвідомлювати завдання, які він має вирішити при цьому:
- оцінити тонус анального сфінктера, виключити можливість пухлини анального каналу;
- знайти та локалізувати пухлину, оцінити її розмір та характеристику росту, а також рухомість і ступінь розповсюдження на оточуючі тканини та органи, виявити можливість розпаду та виразкоутворення;
- визначити ступінь прохідності кишки в ділянці пухлини і можливість проведення ректороманоскопії;
- визначити стан параректальної клітковини і лімфовузлів, які в ній містяться;
- оцінити характер виділень за їх залишками на рукавичці.
Ректальне обстеження проводять методично та за певним планом. Починають його в колінно-ліктьовому положенні. Після зовнішнього огляду ануса лікар вводить у нього вказівний палець правої руки і оцінює еластичність, розтяжність і тонічність сфінктера, стан слизової оболонки (її консистенцію та поверхню) та ступінь болісності дослідження. При введенні пальця в ампулу прямої кишки необхідно старанно дослідити її передню стінку. Це особливо важливо у чоловіків, оскільки дозволяє оцінити форму, розміри та консистенцію передміхурової залози й сім’яних міхурців.
Розмір передміхурової залози в нормі становить не більше 4–4,5 см, вона визначається як круглувате утворення з чіткими контурами та неглибокою вертикальною борозною, еластичної консистенції; слизова оболонка прямої кишки над нею зберігає певну рухомість. Сім’яні міхурці пальпуються тільки при їх збільшенні (що може свідчити про інфільтрацію параректальної клітковини і порушення відтоку з них секрету) у вигляді м’якої консистенції вибухань вище та дещо збоку від основи залози.
Згодом лікар обводить пальцем інші стінки ампули; звертає увагу на стан кісток миски (куприк, крижова, сідничні кістки) та м’яких тканин навколо прямої кишки.
Після цього, не витягуючи пальця, хворому пропонують випрямити спину, і немовби сісти навпочіпки. При цьому з’являється можливість обстежити пухлини, що знаходяться на відстані 9–10 см, а іноді й 12–15 см від ануса.
Якщо виявлено пухлину на передній стінці, доцільно провести пальцеве обстеження у положенні хворого на спині з зігнутими в колінах та приведеними до живота ногами, найкраще — на гінекологічному кріслі. У цій позиції передня стінка ніби «звисає» у просвіт кишки, стає більш доступною для обстеження. Іноді при ураженні бокових стінок отримати більше інформації дозволяє дослідження в положенні на боці.
Піхвове дослідження має на меті визначення рухомості прямої кишки з пухлиною відносно геніталій, виявлення метастазів у Дугласовому просторі та клітковині малої миски. Метастатичне ураження при цьому дослідженні діагностують частіше, ніж при ректальному. Обстеження слід проводити одночасним введенням вказівного пальця правої руки в пряму кишку, лівої руки — в піхву, оцінюючи стан ректовагінальної перегородки та бокових клітковинних просторів.
На жаль, піхвовим дослідженням хірург часто нехтує і задовольняється консультацією гінеколога. Проте гінеколог переважно намагається виявити захворювання статевих органів у хворої на КРР, а хірург вирішує (як свідчить наведене вище) інші завдання. Консультація гінеколога, особливо хірурга-гінеколога, має незамінне значення при з’ясуванні питання щодо об’єму оперативного втручання при інвазії пухлини в жіночі статеві органи та для планування операції.
Ендоскопічне дослідження вимагає ретельної підготовки кишечнику за допомогою проносних засобів та клізм. Найчастіше застосовують осмотичні проносні засоби. Останнім часом все більше ректальних хірургів відмовляються від очисної клізми як засобу підготовки ободової кишки до ендоскопічного дослідження та оперативного втручання.
Ректороманоскопія (RRS, від лат. rectum та грецьк. romanum — сигмоподібна кишка) — метод обстеження товстої кишки на протяжності 30–40 см від ануса жорстким тубусом — розроблений та впроваджений у практику С.П. Федоровим (1897). При ректороманоскопії вивчають стан і характер судинного малюнка слизової оболонки, еластичність та рухомість стінок кишки, здійснюють візуальну оцінку виявленого утворення, визначають точний рівень його розташування та довжину ураження (за рисками на тубусі ректоскопа). За допомогою конхотома (щипчиків) можливо визначити консистенцію високо розташованої пухлини та ступінь її рухомості (інструментальна пальпація).
ФКС — метод обстеження товстої кишки за допомогою волоконного ендоскопа, який здійснив переворот в діагностиці захворювань цього органа. Перший волоконний ендоскоп для огляду шлунка та дванадцятипалої кишки був продемонстрований Гиршовичем та співавторами (Hirshowitz et al., 1958); він усував серйозні перешкоди для застосування ендоскопії в клінічній практиці. У 1960 р. прилад був успішно випробуваний Niva для обстеження дистальних відділів товстої кишки. Досконалу модель, що забезпечила широке застосування ФКС, розробили в 1970 р. K. Negasako та співавтори. Основний арсенал ендоскопічної техніки становлять японські ендоскопи, що мають високі діагностичні та експлуатаційні можливості. Їх дистальний кінець згинається в чотирьох напрямках на 90–100°, оптична система забезпечує огляд на 90–100°. Крім того, наявні канали для подавання повітря та води (для промивання лінзового вікна), аспірації кишкового вмісту, додатковий канал для введення інертного газу, який запобігає вибухонебезпечності кишкового метану. Інструментальний канал дозволяє маніпулювати різними інструментами при біопсії, зупинці кровотечі, поліпектомії тощо. Можливе фотографування ендоскопічної картини, демонстрація її на телевізійній приставці та запис на відео.
Дослідження не має обмежуватися виявленням пухлини. За можливості дальшого (за пухлину) просування колоноскопа потрібно продовжити обстеження: у 40–50% таких хворих додатково виявляють поліпи, а у 3–5% — друге синхронне ЗН. При проведенні ФКС також призначають біопсію пухлини для подальшого патогістологічного дослідження.
Лапароскопія має обмежене застосування в діагностиці КРР. За її допомогою можна отримати дані про місцеве розповсюдження пухлини на інші органи і наявність метастазів по очеревині. Лапароскопія на сьогодні у розвинутих країнах світу з діагностичної процедури переходить у розряд основної лікувальної методики.
Ендоскопічні методи дозволяють провести прицільну біопсію і отримати матеріал для патогістологічного і/або цитологічного дослідження. Морфологічна верифікація діагнозу до операції є обов’язковою!
Променеві методи дослідження
Іригоскопія — основний рентгенологічний (променевий) метод дослідження товстої кишки, який полягає в ретроградному заповненні її контрастною масою. Після ретельної підготовки кишки напередодні за допомогою клізми вводять 600–800 мл водної суспензії BaSO4. У цій фазі тугого заповнення оцінюють положення, форму, розмір та рухомість усіх відділів кишки. Далі пацієнту пропонують випорожнити кишку. Внаслідок цього основна маса контрастної суміші видаляється, але на слизовій оболонці залишається тонкий шар барієвої суспензії, яка окреслює її складки — це фаза рельєфу слизової оболонки. Після цього в кишку вводять до 1 л повітря, що дає можливість перевірити еластичність стінок кишки, а також виявити найменші нерівності її поверхні. Описана методика отримала назву подвійного контрастування, при якому контрастна маса й повітря вводяться одночасно.
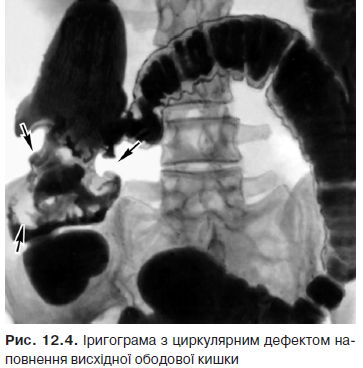
До основних рентгенологічних симптомів КРР належать:
- Дефект наповнення. Може бути крайовим, центральним (при екзофітних пухлинах) або циркулярним (при ендофітних пухлинах) (рис. 12.3, 12.4). Визначається при тугому або напівтугому наповненні, краще виявляється при дозованій компресії органа рентгенологом під час обстеження. При занедбаному КРР можлива повна обтурація просвіту кишки.
- Зміни рельєфу слизової оболонки. У нормі в правій половині товстої кишки напрям складок майже циркулярний; у colon transversum — відносно гаустр чергуються складки уздовж кишки та циркулярні; у лівій половині складки розташовуються переважно вздовж.

При КРР рельєф слизової оболонки зазнає суттєвих змін (так званий злоякісний рельєф): спочатку складки набрякають, стають горбкуватими; у подальшому відзначають обрив та відсутність складок, дефекти слизової оболонки і навіть повне її відторгнення.
Серед непрямих ознак слід згадати такі:
- відсутність гаустр і ригідність стінок на окремій ділянці кишки;
- розширення кишки вище та нижче ураженого пухлиною сегмента;
- сегментарне укорочення кишечнику;
- затримка просування барієвої суміші біля нижнього полюса пухлини при ретроградному заповненні («стоп-симптом»);
- неповне укорочення кишки та залишок контрастної маси у звуженій ділянці при випорожненні кишки;
- додаткові тіні на фоні повітря.
Ультрасонографія дозволяє визначити довжину ураженого відділу кишки при значному її стенозуванні пухлиною (що неможливо виконати іншими методами), глибину проростання кишкової стінки, параректальної клітковини та оточуючих органів, ураження метастазами лімфовузлів та печінки.
При УЗД кишечнику наразі застосовують два методи:
- внутрішньопорожнинне дослідження всієї товстої кишки за допомогою ультразвукового ендоскопа, прямої кишки — із застосуванням ректального датчика (трансректальне УЗД);
- дослідження ободової кишки через передню черевну стінку без/з наповненням (ультразвукова іригоскопія) і обстеження прямої кишки при добре наповненому сечовому міхурі.
При РОК виявляють локальне неоднорідне потовщення її стінки. Сонографічна картина шлунково-кишкового тракту при цих ураженнях нагадує ультразвукову картину нирки, в якій паренхіма є зоною, вільною від відображених сигналів, а чашково-мискова система представлена сигналами підвищеної інтенсивності. Тому цей ультразвуковий симптом в літературі отримав назву «псевдонирки», «мішені», «бичачого ока», «кокарди», або «ураження порожнистого органа».
Цінність методу значно знижується при діаметрі пухлини ≤4 см та неглибокій інфільтрації стінки (до м’язового шару). Для ультразвукової картини РПК характерні зміни товщини, структури, зовнішнього контура стінки.
Незмінену пряму кишку при дослідженні через передню черевну стінку виявляють за розміщенням її переднього півкола справа та зліва від серединної лінії. Товщина її стінки однакова на всій протяжності (0,29±0,01 см), структура представлена 2 шарами: перший (підвищеної інтенсивності) — слизова оболонка, другий (зниженої інтенсивності) — м’язова оболонка.
Визначається локальне потовщення стінки кишки відповідно до довжини пухлини; при товщині стінки 10–11 мм пухлина проростає всі її шари, при товщині >15 мм вростає в параректальну клітковину. Порушується структура стінки, зникає її двошаровість; зовнішній контур стає нерівним через нерівномірне проростання в оточуючу клітковину. Одночасно можна виявити проростання в інші органи, а у жінок — метастази в яєчники.
При ендоректальному дослідженні стінка прямої кишки виглядає як рівномірна стрічка товщиною 2–3 мм, в якій візуалізують 5 шарів. У навколокишковій клітковині незмінені лімфовузли не відзначають.
Трансректальне УЗД при РПК ґрунтується на виявленні утворення стінки з порушенням її п’ятишарової структури. Цей метод дає можливість оцінити відношення пухлини до стінок прямої кишки (глибину інвазії). Змінені лімфатичні вузли виглядають як круглі утворення розміром ≥4 мм в параректальній клітковині. Проте диференційна діагностика їх метастатичного ураження та реактивної гіперплазії можлива тільки зрідка. Більш інформативним методом для оцінки статусу регіонарних лімфатичних вузлів прямої кишки є МРТ із контрастуванням (у деяких країнах Європи в стадії розробки знаходяться нові контрастні речовини з парамагнетичними властивостями, що мають виняткову тропність до лімфоїдної тканини. Завдяки ним можливо відрізнити за допомогою МРТ-реконструкції метастатичне ураження лімфатичного вузла від його гіперплазії).
Слід зауважити, що ендоскопічні та променеві методи не виключають один одного, їх необхідно застосовувати разом.
КТ і МРТ широко застосовують для діагностики РПК та РОК. Сучасні спіральні мультизрізові комп’ютерні томографи дають можливість візуалізувати як саму первинну пухлину, так і її зв’язок із суміжними органами, інвазію в магістральні судини, наявність віддалених метастазів, зокрема в печінку і легені. Цей метод дозволяє винятково точно проводити топічну діагностику локалізації первинної пухлини та метастазів, що в подальшому впливає на тактику оперативного лікування. КТ і МРТ є взаємодоповнюваними методами. За допомогою МРТ можна отримати більше даних щодо розташування дрібних анатомічних структур, наприклад пухлини до мезоректальної фасції тощо. МРТ має особливо важливе значення в діагностиці, визначенні тактики лікування та обсягів хірургічного лікування при РПК.
З метою діагностики рецидивів і метастазів у хворих, що зазнали радикального лікування, доцільне періодичне визначення рівня пухлинних маркерів — РЕА та СА 19–9.
КЛАСИФІКАЦІЯ РАКУ ОБОДОВОЇ КИШКИ
Патоморфологічну та макроскопічну класифікацію КРР наведено вище. У клінічній практиці застосовують міжнародну класифікацію TNM для ободової та прямої кишки.
Міжнародна класифікація РОК за системою TNM (табл. 12.1, 12.2)
Т — первинна пухлина
Тх — первинна пухлина не може бути оцінена
Т0 — немає ознак первинної пухлини
Тis — carcinoma in situ: внутрішньоепітеліальна пухлина або інвазія базальної мембрани*
Т1 — пухлина поширюється на підслизовий шар
Т2 — пухлина поширюється на м’язовий шар
Т3 — пухлина проникає через м’язовий шар у підслизову оболонку або в непокриті очеревиною прилеглі кишкові тканини
Т4 — пухлина проростає вісцеральну очеревину** і/або поширюється на інші органи та тканини***
*Тis включає випадки, коли пухлинні клітини розташовані у залозистій частині базальної мембрани (інтраепітеліально або всередині слизової оболонки) без поширення через м’язовий шар слизової оболонки у підслизовий шар.
**Пухлина, яка макроскопічно прилягає до інших органів чи структур, класифікується як Т4. Однак якщо в місці прилягання під час мікроскопічного дослідження пухлина не визначається, то її рекомендується класифікувати як Т3. Підстадії V та L слід використовувати для визначення наявності ураження кровоносних та лімфатичних судин: V1 та L1 — мікроскопічної інвазії, V2 та L2 — макроскопічної інвазії.
***Пряме поширення у разі Т4 означає поширення на інші сегменти ободової кишки шляхом проростання серозних оболонок, наприклад, зі сліпої кишки в сигмоподібну.
Таблиця 12.1
Ураження регіонарних лімфатичних вузлів при РОК
|
Сегмент |
Регіонарні лімфатичні вузли |
|
Сліпа кишка |
Білякишкові, перед- та засліпокишкові, а також розташовані вздовж клубово-ободової, правої ободової артерії |
|
Висхідна кишка |
Білякишкові, а також розташовані вздовж здухвинно-кишкової, правої та середньої ободової артерії |
|
Печінковий згин |
Білякишкові, а також розташовані вздовж середньої ободової артерії |
|
Поперечна ободова кишка |
Білякишкові, а також розташовані вздовж середньої ободової артерії |
|
Селезінковий згин |
Білякишкові, а також розташовані вздовж середньої та лівої ободової, нижньої брижової артерії |
|
Низхідна кишка |
Білякишкові, а також розташовані вздовж лівої ободової, нижньої брижової і сигмоподібних артерій |
|
Сигмоподібна кишка |
Білякишкові, а також розташовані вздовж нижньої брижової, сигмоподібних артерій |
N — регіонарні лімфатичні вузли
Nх — стан регіонарних лімфатичних вузлів не може бути оцінений;
N0 — метастази в регіонарні лімфатичні вузли відсутні;
N1 — метастази в 1–3 навколокишкових лімфовузлах;
N2 — метастази в ≥4 навколокишкових лімфовузлах.
Примітка: пухлинний вузол розміром >3 мм в діаметрі в навколотовстокишковій клітковині без гістологічних ознак резидуального лімфовузла в пухлинній тканині класифікується як метастаз у регіонарних лімфовузлах. Однак пухлинні вузли розміром <3 мм у діаметрі класифікуються у категорії як безпосереднє поширення пухлини, тобто Т3.
М — віддалені метастази
Мх — наявність віддалених метастазів не може бути оцінена
М0 — віддалені метастази відсутні
М1 — є віддалені метастази
Постхірургічна класифікація рTNM — категорії pT, pN, pM відповідають категоріям T, N, M. Додатково оцінюють показники: р — глибина проростання пухлини в стінку кишки; G — ступінь диференціації пухлини; R — наявність резидуальних пухлин після лікування.
pN0 — матеріал для гістологічного дослідження після регіонарної лімфаденектомії має включати не менше 12 лімфовузлів.
G — гістологічна градація
Gх — ступінь диференціації пухлини не може бути оцінений
G1 — високий ступінь диференціації
G2 — середній ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Таблиця 12.2
Групування за стадіями
|
Стадія |
T |
N |
M |
Дюкс (Dukes) |
MAC (Astler — Culler, 1953) |
|
0 |
Тis |
N0 |
M0 |
– |
– |
|
I |
T1 |
N0 |
M0 |
A |
A |
|
T2 |
N0 |
M0 |
A |
B1 |
|
|
IIA |
T3 |
N0 |
M0 |
B |
B2 |
|
IIB |
T4 |
N0 |
M0 |
B |
B3 |
|
IIIA |
T1, T2 |
N1 |
M0 |
C |
C1 |
|
IIIB |
T3, T4 |
N1 |
M0 |
C |
C2/C3 |
|
IIIC |
Будь-яке Т |
N2 |
M0 |
C |
C1/C2/C3 |
|
IV |
Будь-яке Т |
Будь-яке N |
M1 |
– |
D |
R — резидуальна пухлина
R0 — повна резекція, краї гістологічно негативні, після резекції не залишилося пухлини
R1 — неповна резекція, краї гістологічно уражені, після резекції залишилися мікроскопічні ознаки пухлини
R2 — неповна резекція, краї уражені, після резекції залишилися макроскопічні ознаки пухлини
КЛАСИФІКАЦІЯ РАКУ ПРЯМОЇ КИШКИ
Міжнародна класифікація раку прямої кишки за системою TNM (табл. 12.3, 12.4)
Т — первинна пухлина
Тх — первинна пухлина не може бути оцінена
Т0 — немає ознак первинної пухлини
Тis — carcinoma in situ: внутрішньоепітеліальна пухлина або інвазія базальної мембрани*
Т1 — пухлина поширюється на підслизовий шар
Т2 — пухлина поширюється на м’язовий шар
Т3 — пухлина проникає через м’язовий шар у підслизову оболонку або в непокриті очеревиною навколокишкові тканини
Т4 — пухлина проростає вісцеральну очеревину** і/або поширюється на інші органи та тканини***
*Тis включає випадки, коли пухлинні клітини розташовані у залозистій частині базальної мембрани (інтраепітеліально або всередині слизової оболонки) без поширення через м’язовий шар слизової оболонки у підслизовий шар.
**Пухлина, яка макроскопічно прилягає до інших органів чи структур, класифікується як Т4. Однак якщо в місці прилягання під час мікроскопічного дослідження пухлина не визначається, то її рекомендується класифікувати як Т3. Підстадії V та L слід застосовувати для визначення наявності ураження кровоносних та лімфатичних судин: V1 та L1 — мікроскопічної інвазії, V2 та L2 — макроскопічної інвазії.
***Пряме поширення у разі Т4 означає поширення на інші сегменти ободової кишки шляхом проростання серозних оболонок.
Таблиця 12.3
Ураження регіонарних лімфатичних вузлів при РПК
|
Сегмент |
Регіонарні вузли |
|
Ректосигмоїдний відділ |
Навколокишкові, а також розташовані вздовж лівої ободової, сигмоподібних, нижньої брижової, верхньої прямокишкової, середніх прямокишкових артерій |
|
Пряма кишка |
Навколокишкові, а також розташовані вздовж нижньої брижової, латеральної крижової, внутрішньої клубової, верхньої прямокишкової, середніх і нижніх прямокишкових артерій |
Примітка: пухлинний вузол розміром >3 мм в діаметрі в навколотовстокишковій клітковині без гістологічних ознак резидуального лімфовузла в пухлинній тканині класифікується як метастаз у регіонарних лімфовузлах. Однак пухлинні вузли розміром <3 мм у діаметрі класифікуються у категорії як безпосереднє поширення пухлини, тобто Т3.
N — регіонарні лімфатичні вузли
Nх — стан регіонарних лімфатичних вузлів не може бути оцінений
N0 — метастази в регіонарні лімфатичні вузли відсутні
N1 — метастази в 1–3 навколокишкових лімфовузлах
N2 — метастази в ≥4 навколокишкових лімфовузлах
М — віддалені метастази
Мх — наявність віддалених метастазів не може бути оцінена
М0 — віддалені метастази відсутні
М1 — є віддалені метастази
Постхірургічна класифікація рTNM — категорії pT, pN, pM відповідають категоріям T, N, M. Додатково оцінюють показники: р — глибина проростання пухлини в стінку кишки; G — ступінь диференціації пухлини; R — наявність резидуальних пухлин після лікування.
pN0 — матеріал для гістологічного дослідження після регіонарної лімфаденектомії має включати не менше 12 лімфовузлів.
G — гістологічна градація
Gх — ступінь диференціації пухлини не може бути оцінений
G1 — високий ступінь диференціації
G2 — середній ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Таблиця 12.4
Групування за стадіями
|
Стадія |
T |
N |
M |
Дюкс (Dukes) |
MAC (Astler — Culler, 1953) |
|
0 |
Тis |
N0 |
M0 |
– |
– |
|
I |
T1 |
N0 |
M0 |
A |
A |
|
T2 |
N0 |
M0 |
A |
B1 |
|
|
IIA |
T3 |
N0 |
M0 |
B |
B2 |
|
IIB |
T4 |
N0 |
M0 |
B |
B3 |
|
IIIA |
T1, T2 |
N1 |
M0 |
C |
C1 |
|
IIIB |
T3, T4 |
N1 |
M0 |
C |
C2/C3 |
|
IIIC |
Будь-яке Т |
N2 |
M0 |
C |
C1/C2/C3 |
|
IV |
Будь-яке Т |
Будь-яке N |
M1 |
– |
D |
R — резидуальна пухлина
R0 — повна резекція, краї гістологічно негативні, після резекції не залишилося пухлини
R1 — неповна резекція, краї гістологічно уражені, після резекції залишилися мікроскопічні ознаки пухлини
R2 — неповна резекція, краї уражені, після резекції залишилися макроскопічні ознаки пухлини
Міжнародна класифікація раку анального каналу за системою TNM
Т — первинна пухлина
Тх — первинна пухлина не може бути оцінена
Тis — carcinoma in situ
Т1 — пухлина розміром ≤2 см у найбільшому вимірі
Т2 — пухлина розміром >2 см, але <5 см у найбільшому вимірі
Т3 — пухлина >5 см у найбільшому вимірі
Т4 — пухлина будь-яких розмірів, яка проростає у сусідній орган*
*Проростання тільки у м’язи сфінктера не класифікується як Т4.
N — регіонарні лімфатичні вузли. Регіонарними є периректальні, внутрішні здухвинні й пахові лімфовузли.
Nх — стан лімфатичних вузлів не може бути оцінений
N0 — метастази в лімфатичних вузлах відсутні
N1 — метастази в периректальних лімфатичних вузлах
N2 — однобічні метастази у внутрішніх здухвинних і/ або пахових лімфатичних вузлах
N2 — метастази у навколокишкових та пахових і/або двобічні метастази у внутрішніх здухвинних і/або пахових лімфатичних вузлах
М — віддалені метастази
Мх — наявність віддалених метастазів не може бути оцінена
М0 — віддалені метастази відсутні
М1 — є віддалені метастази
Постхірургічна класифікація рTNM — категорії pT, pN, pM відповідають категоріям T, N, M. Додатково оцінюють показники: р — глибина проростання пухлини в стінку кишки; G — ступінь диференціації пухлини; R — наявність резидуальних пухлин після лікування.
pN0 — матеріал для гістологічного дослідження після регіонарної лімфаденектомії має включати не менше 12 лімфовузлів; після пахвинної лімфаденектомії — не менше ніж 6 лімфовузлів.
G — гістологічна градація
Gх — ступінь диференціації пухлини не може бути оцінений
G1 — високий ступінь диференціації
G2 — середній ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями наведено в табл. 12.5.
Таблиця 12.5
Групування за стадіями
|
Стадія |
T |
N |
M |
|
0 |
Tis |
N0 |
M0 |
|
I |
T1 |
N0 |
M0 |
|
II |
T2, T3 |
N0 |
M0 |
|
IIIA |
T1, T2, T3 |
N1 |
M0 |
|
T4 |
N0 |
M0 |
|
|
IIIB |
T4 |
N1 |
M0 |
|
Будь-яке Т |
N1, N2 |
M0 |
|
|
IV |
Будь-яке T |
Будь-яке N |
M1 |
Класифікація раку прямої кишки за Dukes в модифікації Astler — Culler, 1953
А — пухлина не виходить за межі слизової оболонки
В1 — пухлина проростає м’язову оболонку, але не серозу, відсутні регіонарні метастази
В2 — проростання всіх шарів стінки кишки, але без регіонарних метастазів
B3 — проростання в сусідні органи і тканини, але без регіонарних метастазів
С1 — ураження регіонарних лімфатичних вузлів без проростання у стінки кишки
С2 — проростання серозної оболонки та наявність регіонарних метастазів
D — наявність віддалених метастазів
ЛІКУВАННЯ ПЕРВИННИХ ПУХЛИН
Хірургічне лікування
Уперше резекцію ободової кишки з приводу раку успішно виконав Reybard в 1833 р. Він видалив пухлину сигмоподібної кишки та циркулярно зшив її відрізки (і виконав, таким чином, одномоментну операцію). Намагаючись покращити результати операцій, ряд авторів наприкінці XIX ст. запропонували розділити втручання на декілька етапів. На цьому підґрунті Mikulicz (Мікулич) в 1902 р. розробив та докладно описав двомоментний спосіб резекції (після резекції кишки її відрізки виводили у вигляді двостулкового протиприродного ануса, другим етапом — шляхом його закриття — відновлювали цілісність кишки), що дозволило знизити післяопераційну летальність. Після цього більшість хірургів почали користуватися методикою Мікулича і на досить тривалий період відмовилися від одномоментної резекції. Однак суттєвим недоліком операції Мікулича була складність у подальшій ліквідації стоми, яка могла затягуватися на багато місяців. Для вирішення цієї проблеми І.І. Греков у 1928 р. запропонував формувати міжкишковий анастомоз до виведення в рану петлі ободової кишки з пухлиною та її фіксації. Після формування протиприродного ануса обидві виведені петлі ушивали наглухо. У 1903 р. Schloffer (Шлоффер) запровадив трьохмоментне втручання. Класична операція Шлоффера передбачала попереднє накладання стоми на кишку вище пухлини, другим етапом — резекцію ураженої ділянки, третім — закриття стоми.
Нині хірурги намагаються виконувати одномоментні операції з накладенням міжкишкових анастомозів. За наявності ускладнень пухлини методом вибору є двоетапні операції (Гартмана, Мікулича). До накладення на першому етапі тільки стоми без видалення пухлини вдаються лише у виняткових випадках, при значному місцевому поширенні пухлини чи її абсцедуванні, гострій кишковій непрохідності, коли внаслідок оклюзії діаметр привідної кишки значно перевищує діаметр відвідної, та наявне недостатнє кровопостачання кишкової стінки, що підвищує ризик неспроможності анастомозу; або при загальному виснаженні пацієнта, коли є анестезіологічні протипоказання до одномоментного радикального втручання.
Обсяг резекції залежить головним чином від локалізації пухлини. Для її радикального видалення потрібно відступити не менше 3 см у проксимальному та дистальному напрямках, а також виділити регіонарні лімфовузли, які розташовані уздовж артеріальних судин, останні мають бути перев’язані та пересічені у місці їх відходження, а сегменти кишки, які з них отримують кровопостачання, — видалені. Отже, моноблочно видаляють ділянку кишки з ділянкою брижі, де містяться лімфатичні судини та вузли.
При раку сліпої кишки виконують правобічну геміколектомію з резекцією 15–25 см клубової кишки (перев’язують відповідно a. colica dextra et ileocolica). Дистальна межа резекції — права третина colon transversum.
При раку висхідної ободової кишки радикальною також є правобічна геміколектомія. Цю ж операцію виконують при ураженні пухлиною печінкового кута ободової кишки, але при цьому додатково пересікають праву гілку a. сolica media, розширюючи рівень резекції до середньої третини поперечної ободової кишки.
При пухлинах, локалізованих в середній третині поперечної ободової кишки, виконують її резекцію (із перев’язкою стовбура a. сolica media).
Ураження неопластичним процесом селезінкового кута ободової кишки, низхідної ободової кишки викликає необхідність проведення лівобічної геміколектомії. Межі резекції: проксимально — ліва третина поперечної ободової кишки, дистально — верхня третина сигмоподібної кишки. Лігатури накладають на a. colica sinistra et a. sigmoidea (рис. 12.5).
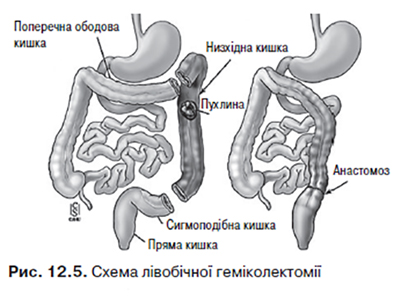
При локалізації пухлини у сигмоподібній кишці операцією вибору є її резекція (перев’язують a. sigmoidea). Якщо пухлина розміщена від ануса на відстані лише на 13–18 см, пересікають також a. rectalis superior.
Здебільшого описані операції завершуються накладанням міжкишкових анастомозів. Але за умов високої вірогідності розвитку неспроможності останніх виконують згадану вище операцію Мікулича чи будь-яку іншу з її модифікацій, запропонованих Грековим (1928), Rankin (1930), Lahey (1939). При множинних пухлинах товстої кишки вдаються до субтотальної колектомії.
Розвиток хірургії РПК відбувався досить складним тривалим шляхом; його й досі не можна вважати завершеним. Першу операцію з приводу РПК (промежинну ампутацію) виконав Лісфранк (Lisfrank) ще в доасептичну еру, в 1828 р. У 1845 р. Діффенбах (Diffenbach) провів резекцію ПК зі збереженням сфінктера, також застосовуючи промежинний доступ. З метою поліпшення доступу до кишки Верней (1873) та Кохер (1874) пропонували видаляти куприк, Краске (1886) — виконувати резекцію крижової кістки. Щоб уникнути післяопераційної неспроможності анастомозу Гохенег (Hochennegg) в 1889 р. запропонував формувати міжкишковий анастомоз поза операційною раною шляхом евагінації дистальної культі через анальний канал з подальшою її демукозацією та протягуванням через її просвіт виведеної проксимальної культі. Анастомоз накладали поза раною, а потім виведену кишку втягували в порожнину малого таза. Крижові резекції призводили до тяжких післяопераційних ускладнень (остеомієліт крижової кістки, травмування нервів крижового сплетення, кишкові нориці та ін.), до того ж вони не давали змогу виконати оптимальний обсяг лімфодисекції та висічення ділянок прямої кишки, особливо при «високому» раку. У 1882 р. Кьоніг після невдалої спроби дістатися до пухлини через промежину додатково виконав лапаротомію (тобто застосував комбінований доступ), висік уражену пряму кишку, проксимальний її відрізок вивів у вигляді колостоми. Абдомінальний доступ дозволив визначити розповсюдження пухлини і підвищити радикалізм операції. Вибір методу оперативного лікування при РПК насамперед залежить від локалізації та поширення пухлини.
Черевно-промежинна екстирпація прямої кишки виконується при підтвердженні інвазії злоякісної пухлини в зовнішній анальний сфінктер, м’язи-леватори або при місцево-поширеній пухлині із розповсюдженням на анальний канал. Значний внесок у розробку цієї операції зробили E. Quenu (1896) та W.E. Miles (1908). У 1934 р. Кіршнер вперше застосував двобригадний спосіб виконання операції Кеню — Майлса, який надалі широко пропагандував O. Lloyd-Davis. Одна бригада хірургів виконує лапаротомію, ревізію органів черевної порожнини, перев’язує та пересікає судини, видаляє пряму кишку до діафрагми миски та пересікає кишку. Синхронно інша бригада мобілізує кишку з боку промежини та видаляє її. Втручання закінчують виведенням сигмостоми та ушиванням промежинної рани.
Черевно-анальна резекція прямої кишки з виведенням сигмоподібної кишки у анальний канал вперше виконана H.W. Maunsell в 1892 р. Показанням до цієї операції була локалізація пухлини на відстані 6–9 см від анального отвору. Мобілізовану пряму кишку відсікають, відступивши 4–5 см від пухлини і залишаючи «манжетку» кишки зі сфінктером. Через останню протягають сигмоподібну кишку, яку пересувають у малу миску. Таким чином зберігається сфінктер і функція фекальної континенції (утримання калу). Проте у 15–30% хворих виведення сигмоподібної кишки неможливе. У цій ситуації є можливість вивести її дистальний відрізок у вигляді сигмостоми (Іноятов І.М., 1968). Також можливо додатково мобілізувати та вивести вниз всю ліву половину ободової кишки (Valdoni P., 1961). Операція Вальдоні доцільна й у якості розширеної при ураженні лімфовузлів біля гирла a. mesenterica inferior. Мобілізація лівої половини ободової кишки є необхідним етапом під час проведення низької передньої резекції прямої кишки. Користується популярністю черевно-анальна резекція в модифікації Parks (1972). Операція полягає у резекції сигмоподібної та прямої кишки разом із внутрішнім анальним сфінктером, пересіченням останньої над зовнішнім анальним сфінктером, демукозації залишеної культі від рівня зубчатої лінії, виведенні низхідної ободової кишки та накладанні міжкишкового анастомозу трансанально. Головними недоліками черевно-анальної резекції є травмування зовнішнього анального сфінктера та неможливість виконувати цю операцію при «низькому» РПК. На сьогодні в провідних клініках колоректальної хірургії черевно-анальні резекції практично не застосовуються, оскільки за функціональними результатами ця операція значно поступається низькій передній резекції прямої кишки та проктектомії.
Передню резекцію прямої кишки виконують при локалізації пухлини на ≥10 см (до 15 см) від ануса. Вперше виконав її в 1843 р. W. Reibard. Остаточно техніка була розроблена у клініці Мейо в 1964 р. Назва операції походить від хірургічного доступу через передню черевну стінку, оскільки на початку ери хірургії нижніх відділів прямої кишки всі втручання виконували через задній (крижовий) доступ. Виконують лапаротомію; після резекції ураженої ділянки кишки накладають міжкишковий анастомоз. При його формуванні в глибині малої миски можливі технічні труднощі, які долають використанням введеного через анус апарата для накладання механічного кишкового шва.
Нині має значення виділення високої та низької передньої резекції прямої кишки. Різниця між описаними операціями полягає у висоті накладання анастомозу та від того, знаходитиметься він у черевній порожнині чи в порожнині малого таза. Низькою передня резекція прямої кишки вважається у випадку, коли колоректоанастомоз сформовано на відстані ≤5 см від ануса.
Низька передня резекція прямої кишки є однією з найсучасніших і найбільш ефективних сфінктерозберігаючих операцій, яка в багатьох випадках може замінити операцію Кеню — Майлса без втрати радикалізму при раку нижніх відділів прямої кишки без інвазії в сфінктерний апарат. Показаннями до її виконання є рак середньо- та нижньоампулярного відділу прямої кишки без проростання у м’язи зовнішнього та внутрішнього сфінктерів, леваторів та без розповсюдження пухлини на анальний канал. Може виконуватися як радикальна чи паліативна операція. Від інших типів передньої резекції прямої кишки низька передня резекція відрізняється необхідністю мобілізації прямої кишки на всій протяжності та одночасним виконанням тотальної мезоректумектомії як обов’язкового етапу, високою перев’язкою нижньої брижової артерії та накладанням міжкишкового анастомозу переважно за допомогою циркулярного зшиваючого апарата (формування ручного анастомозу в такому разі можливо, але з великими технічними труднощами).
Своє теоретичне обґрунтування операція отримала в роботах Heald та співавторів і Valdoni та співавторів (див. вище). Технічно операція розпочинається так само, як і висока передня резекція — ободову кишку перев’язують або перетискають еластичним затискачем на рівні проксимального краю резекції, парієтальну очеревину навколо прямої кишки розсікають циркулярно в напрямку до сечового міхура. Далі проводять мобілізацію сигмоподібної кишки, висока (на 2 см нижче від місця відходження від аорти) перев’язка нижньої брижової артерії. За необхідності на цьому етапі можливо провести мобілізацію селезінкового кута або всієї лівої половини ободової кишки за методом Valdoni. Мобілізація задньої стінки прямої кишки проводиться шляхом розсічення ножицями фасції Waldeyer до рівня аноректального кільця з контролем гемостазу. Після цього хірург вводить під задню стінку прямої кишки руку та пальпує бокові зв’язки (в них проходять великі судини — середні прямокишкові артерії). Мобілізацію передньої стінки проводять шляхом її відсепарування від сечового міхура та сім’яних пухирців у чоловіків ножицями та розсічення фасції Denonvillier. Після виконання цих етапів на бокові зв’язки прямої кишки накладаються лігатури та їх пересікають. Якщо мобілізацію прямої кишки проведено успішно, вона розправляється та стає довшою на 4–5 см.
Після санації анального каналу, відступивши на 2 см від нижнього краю пухлини, на дистальну та проксимальну частини кишки накладають затискачі та ножицями надсікають спочатку передню, а потім задню стінку кишки, накладаючи при цьому на дистальну губу кисетний шов. Ті самі маніпуляції проводять і з проксимального краю. Макропрепарат, до якого входитимуть сигмоподібна, пряма кишка та клітковина mesorectum у фасціальному футлярі, видаляють en block. Проксимальний відділ товстої кишки вищеописаним способом виводять до порожнини малої миски, до місця майбутнього анастомозу. У просвіт проксимальної культі вводять голівку зшиваючого апарата, а в дистальну культю (через анус) — робочу частину апарата. Обидва кисетні шви затягуються. Голівка з’єднується з робочою частиною, після чого при обертанні регуляторного гвинта їх площини зближуються. Коли обидві культі будуть знаходитися достатньо близько, хірург натискає на важіль, що на рукоятці апарата, в результаті чого лезами висікається надлишкова тканина, та за допомогою металевих скоб формується міжкишковий анастомоз. Герметичність його перевіряють або шляхом інтраопераційної ректоскопії, або заповнюють порожнину малого таза фізіологічним розчином і протягом декількох хвилин стежать за появою бульбашок повітря з ділянки анастомозу. Після остаточного зрощення країв анастомозу скоби видаляються самостійно.
Виконання низької передньої резекції завжди пов’язане із загрозою розвитку неспроможності колоректоанастомозу, оскільки останній постійно травмуватиметься каловими масами. Також до неспроможності анастомозу може призводити таке тяжке ускладнення, як некроз привідної кишки, що пов’язане з гіршим кровопостачанням ободової кишки, ніж прямої. Тому для зниження ризику виникнення неспроможності анастомозу до мінімуму низька передня резекція завжди доповнюється формуванням превентивної ентеро- чи колостоми (зазвичай ілео- чи трансверзостома). Як правило, превентивна стома формується у термін до 2 міс, після завершення якого безперервність шлунково-кишкового тракту відновлюється.
Іншим видом ОЗО, що виконують при злоякісних пухлинах прямої кишки, є проктектомія. Показанням до її застосування є локалізація пухлини в нижньо- чи середньоампулярному відділі прямої кишки без інвазії в зовнішній сфінктер, леватори та анальний канал при неможливості виконання низької передньої резекції. Етап мобілізації прямої кишки є аналогічним низькій передній резекції. При досягненні діафрагми малого таза з абдомінального доступу переходять до промежинного етапу операції: перианальну шкіру розтинають еліпсоподібним розрізом, далі шляхом підшкірного введення 0,25% розчину адреналіну виконують гідропрепарування зовнішнього анального сфінктера (цей етап також відомий як демукозація анального каналу, оскільки слизову оболонку кишки разом із внутрішнім анальним сфінктером сепарують від волокон зовнішнього анального сфінктера). Після завершення обох етапів мобілізації пряму кишку видаляють. На відміну від черевно-промежинної екстирпації прямої кишки за Кеню — Майлсом, проктектомія дає можливість зберегти усі м’язи та зв’язки малого таза, відповідальні за континенцію. Реконструктивний етап полягає у виведенні ободової кишки у порожнину малого таза та протягуванні її через анальний канал із фіксацією стінки кишки до періанальної шкіри.
Виконання реконструктивних операцій є радикальним методом лікування функціональних розладів, що виникають після сфінктерозберігаючих резекцій прямої кишки, частіше після низької передньої резекції (синдром низької передньої резекції, див. нижче). Метою цих операцій є створення тазового товстокишкового резервуара із петель ободової кишки, який виконував би функцію ампули прямої кишки. Першою операцією, проведеною з цією метою, було формування «J»-подібного резервуара (1986 р.): проксимальний кінець ушивали наглухо, привідну петлю загинали догори приблизно на 5–6 см та серозно-м’язовими швами підшивали до стінки товстої кишки. Анастомоз накладали між куксою прямої кишки та кутом, утвореним з’єднаними петлями кінець в бік. Іншим, простішим варіантом створення товстокишкового тазового резервуара є поперечна колопластика. Операція полягає у поздовжньому розсіченні стінки привідної петлі ободової кишки, після чого слідує зшивання цього розрізу в поперечному напрямку (за типом пілоропластики за Гейнеке — Мікуличем).
При протипоказаннях до накладання анастомозу вдаються до операції Гартмана. Це двохмоментна операція, при якій після резекції ділянки кишки з пухлиною оральний кінець виводять у вигляді одностулкової колостоми, а дистальний — наглухо ушивають та залишають у черевній порожнині. Через деякий час проводять реконструктивну операцію.
Економні операції. У 1973 р. на симпозіумі американського проктологічного товариства R. Turnbull повідомив, що місцеве висічення РПК відкриває нову еру в лікуванні пацієнтів із цим захворюванням за умови ранньої діагностики. Останнім часом з’явилося чимало повідомлень про економні операції у хворих з невеликими (1–3 см в діаметрі) рухомими пухлинами із задовільними безпосередніми та віддаленими результатами. Ці операції мають суворі показання: пухлина Т1 (зрідка Т2) за відсутності метастазів; обов’язкове додаткове застосування променевої і/або хіміотерапії; ретельне спостереження за пацієнтами після втручання (2–3 рази на рік).
Трансанальна резекція прямої кишки з накладанням анастомозу кінець у кінець. Після дивульсії (розтягнення) сфінктера циркулярно пересікають слизову та м’язову оболонки прямої кишки, виділяють кишку проксимально по всьому периметру, одночасно підтягуючи її нижче ануса. Відсікають пряму кишку на 2–3 см вище від пухлини і формують ректоанальний анастомоз. Трансанальну резекцію прямої кишки слід доповнювати реверсивною мезоректумектомією.
Трансанальне висічення пухлини застосовують при її локалізації до 9 см від анального отвору. Накладають затискач на ніжку пухлини, останню відсікають. Основу утворення прошивають і перев’язують. Слизову оболонку в радіусі 2–3 см від нього також відтинають. Суттєво підвищує абластичність застосування електроножа.
Секторальну резекцію анального каналу та прямої кишки виконують при пухлині Т1–2N0M0, розташованій нижче 5 см.
Розширені операції. Розширення обсягу операції відбувається за рахунок видалення ділянок 2-го та 3-го етапів регіонарного метастазування РПК. З цією метою з 60-х років застосовують аорто-здухвинно-мискову лімфодисекцію, яку у нашій країні вперше виконано в 1971 р. М.О. Зибіною. У світовій онкологічній практиці лімфаденектомії широко застосовували японські хірурги. Так, за обсягом лімфодисекції виділяють: обмежену — відповідає обсягу тотальної мезоректумектомії; стандартну — відповідає тотальній мезоректумектомії + лімфодисекція за ходом здухвинних судин; розширену — обсяг стандартної + лімфодисекція затульних судин та затульного простору + лімфодисекція клубових судин + парааортальна лімфодисекція (Takahashi T. та співавтори). В Європі та США ці операції не знайшли широкого застосування, оскільки суттєво не впливають на частоту рецидивів та 5-річну виживаність (за даними деяких рандомізованих досліджень, 5-річна виживаність у групі пацієнтів, яким була виконана стандартна лімфаденектомія, вища, ніж у групі розширених!), але значно погіршують якість життя пацієнтів (травмування соматичних і вегетативних нервових сплетень малого таза, ступінь якого залежить від обсягу лімфаденектомії, веде до порушення сечовипускання, дефекації та статевої функції у чоловіків).
Комбіновані втручання виконують при розповсюдженні пухлини на інші (не обов’язково суміжні) органи. Окрім резекції оточуючих товсту кишку органів, на які поширилася пухлина, можливе одночасне видалення поодиноких метастазів у печінці та легенях. Варіантом комбінованих є надрадикальні операції:
- евісцерація малої миски — повне видалення всіх органів та клітковини миски з накладанням уретро- та колостоми. Виконується з 1943 р., в СРСР вперше виконана в Києві професором І.П. Дєдковим у 1975 р.;
- гемікорпоректомія — відсічення нижньої половини тулуба. Застосовується в світі з 1960-х років, в СРСР єдина вдала операція проведена в 1987 р. у Москві професором В.Д. Федоровим (докладніше див. «Хірургія». — 1988. — № 10, с. 3–7).
Паліативні та симптоматичні операції виконують у 20–25% хворих, що зазнали хірургічного втручання. До них вдаються переважно у двох випадках: 1) місцево-поширеного процесу без віддалених метастазів; 2) первинної пухлини будь-яких розмірів з віддаленими метастазами. У такій ситуації (при відмові від комбінованої операції) можливі: паліативна резекція чи екстирпація; реканалізація кишки (видалення пухлинних мас, що обтурують просвіт кишки). Ці втручання зменшують пухлинну масу (отже й інтоксикацію), а також прояви кишкової непрохідності, покращують результати паліативної хіміотерапії.
Накладання колостоми — симптоматичне втручання (з метою відключення кишки з пухлиною) — зменшує травмування останньої, а втім і вірогідність кровотечі, попереджує розвиток непрохідності кишки, гальмує перифокальне запалення, що загалом покращує стан хворого. Такі самі наслідки має накладання обхідного міжкишкового анастомозу.
Променеве лікування
Зазвичай застосовують при РПК. Утім аденокарцинома є помірно резистентною до опромінення; відносно високу радіочутливість має плоскоклітинний рак анального каналу.
Передопераційна ПТ. У світі широко застосовують методику дрібнофракційної теле-гамматерапії (разова вогнищева доза 2–2,5 Гр) до сумарної дози від 30 до 54 Гр із подальшим хірургічним лікуванням через 3–4 тиж. Ця методика входить у світові рекомендації щодо лікування РПК, оскільки дозволяє не лише знизити частоту місцевих рецидивів, а й підвищити частоту виконання сфінктерозберігаючих втручань.
Як самостійний метод лікування (за неможливості радикальної операції) ПТ представлена:
- теле-гамма-терапією — здійснюється розщепленим (на 2 етапи) курсом з 3-тижневим інтервалом дрібним фракціонуванням (разова вогнищева доза 2–2,5 Гр) до сумарної вогнищевої дози в 70 Гр;
- внутрішньопорожнинною гамма-терапією —здійснюється у поєднанні з дистанційною у вогнищевій дозі на одну аплікацію 3 Гр, сумарно — 24–30 Гр.
Інтенсифікація ПТ можлива при застосуванні радіомодифікаторів і синхронізаторів клітинного циклу пухлини (флуороурацил).
На сьогодні найбільш прийнятним методом неоад’ювантної ПТ при РПК є подовжений курс із дрібним фракціонуванням сумарної дози (разова вогнищева доза — 2 Гр, сумарна вогнищева доза — 30 Гр, курс — 15 діб). За допомогою цього методу вдається досягти адекватного локального контролю за розповсюдженістю пухлини і звести до мінімуму променеві ускладнення лікування (променевий проктит, цистит, виразки шкіри, утворення нориць та ін.). При додаванні хіміопрепарату можливе проведення хіміопроменевої терапії (у цьому випадку хіміопрепарат виступає в ролі радіомодифікатора — він потенціює дію іонізуючого випромінювання на злоякісні клітини завдяки багатьом механізмам). Зазвичай в якості радіомодифікаторів при лікуванні хворих на РПК застосовують флуороурацил, тегафур та капецитабін.
Хіміотерапія
Перші кроки до хіміотерапії було зроблено C. Heidelberger та співавторами, які в 1957 р. синтезували новий протипухлинний препарат флуороурацил. Уже через 5 років було отримано дані про його ефективність при раку товстої кишки. Цей препарат та його похідне тегафур (який в організмі перетворюється на флуороурацил) й досі залишаються базовими в хіміотерапії КРР. Останнім часом все більшої популярності набувають нові протипухлинні засоби:
- капецитабін у вигляді пероральних таблеток: цей препарат перетворюється на флуороурацил під дією тимідинфосфорилази безпосередньо в пухлинній тканині;
- ралтитрексид — інгібітор тимідилатсинтетази — при розповсюдженому КРР;
- іринотекан — інгібітор топоізомерази і ДНК.
Певну ефективність мають також антрациклінові антибіотики — мітоміцин С, адріаміцин. У схеми першої лінії ПХТ включають також похідні платини (оксаліплатин). Підвищення ефективності ПХТ можливо поєднаним з флуороурацилом призначенням кальцієвої солі фолінової кислоти.
Новим перспективним напрямком медикаментозної терапії КРР є таргетна терапія.
Як правило, ПХТ призначають як:
- ад’ювантну (тобто елемент комплексного лікування) після радикальних оперативних втручань. Досконалої загальноприйнятої схеми не існує; втім в 1990 р. Національний інститут раку США рекомендував одночасне застосування флуороурацилу та імуномодулятора левамізолу протягом 1 року. За даними авторів, така схема хіміотерапії знижує смертність від КРР на третину;
- неоад’ювантну, яка стала можливою з розвитком інтервенційної радіології. Проводять катетеризацію артеріальної судини, що васкуляризує відповідну ділянку кишки; застосовують цитостатики з модифікуючими агентами (наприклад верапамілом);
- паліативну (при неоперабельних пухлинах та на додаток до нерадикальних операцій). Ефективність такої хіміотерапії не перевищує 20–30%, до того ж можливо досягти лише часткової регресії пухлини.
Шляхами введення протипухлинних лікарських засобів є внутрішньовенний, внутрішньоартеріальний, ендолімфатичний. Можлива імплантація в черевну порожнину антибластомних засобів, іммобілізованих на органічних матрицях, що звільняються повільно, протягом тривалого часу.
Флуороурацил — протипухлинний засіб, належить до класу антиметаболітів. Найбільш активний в період S клітинного циклу. Випускається у флаконах по 500 мг (10 мл) та у вигляді 1% та 5% крему для зовнішнього застосування. Механізм дії пов’язаний із впливом на геном його метаболітів — фторуридинтрифосфат (вбудовується в РНК, порушує процесинг і трансляцію), фтордезоксиуридин-5´-монофосфат (пригнічує утворення тимідилатсинтетази, що веде до накопичення в клітині дезоксиуридин-5´-монофосфату, який вбудовується в ДНК та порушує реплікацію і репарацію). У клітинах на активну речовину перетворюється лише 15% засобу, 85% під дією ферменту дигідропіримідиндегідрогенази перетворюються на неактивні сполуки, що виводяться переважно нирками та легенями. При застосуванні розведений препарат необхідно берегти від світла. Флуороурацил протипоказаний при пригніченні кровотворення, вираженій кахексії, інфекційних захворюваннях, стенокардії тяжкого ступеня та при інфаркті міокарда давністю до 6 міс. Найважливіші побічні ефекти — пригнічення кровотворення (панцитопенія, можливий агранулоцитоз), стоматит, нейротоксичність (сонливість, епілептичні напади, атаксія, можлива енцефалопатія), кардіотоксичність (напади стенокардії, особливо за наявності ішемічної хвороби серця в анамнезі), блефарит, дакріоцистит, кон’юнктивіт, металевий присмак у роті.
Фолінат кальцію — антидот протипухлинних засобів — антагоністів синтезу фолієвої кислоти (метотрексат та ін.). При взаємодії з флуороурацилом утворюється потрійний комплекс із фтордезоксиуридин-5´-монофосфатом і тимідилатсинтетазою. У результаті цього посилюється деструктивна дія метаболітів флуороурацилу на ДНК пухлинної клітини. Водночас фолінат кальцію відновлює дигідрофолатредуктазу, збільшуючи кількість фолієвої кислоти. Випускається у таблетках по 5 та 15 мг, також у флаконах по 50; 100 та 350 мг для внутрішньом’язового та внутрішньовенного введення. При комбінації з флуороурацилом фолінат кальцію вводять за 30–60 хв до флуороурацилу, щоб фолінат кальцію встиг метаболізуватися. Одночасне введення обох препаратів неприпустиме, оскільки утворюються преципітати. Побічні реакції спостерігаються рідко (гіперчутливість до препарату).
Капецитабін — протипухлинний засіб, належить до антиметаболітів. Вихідна сполука неактивна, активація препарату проходить за три етапи: в печінці капецитабін перетворюється на 5´-дезокси-5-фторцитидин, із якого в печінці та інших тканинах утворюється 5´-дезокси-5-фторуридин. Останнім етапом метаболізму препарату є його перетворення на флуороурацил під дією тимідинфосфорилази пухлинних клітин. Продукти метаболізму флуороурацилу, в свою чергу, спричиняють всі притаманні йому впливи, до того ж пригнічують активність тимідинфосфорилази. Препарат випускається у таблетках по 150 та 500 мг. Проноси — дозолімітуюча побічна дія препарату. Іншими важливими побічними ефектами є блювання, долонно-підошовна дизестезія, пригнічення кровотворення, кардіо- та нейротоксичність. Слід зазначити, що побічні дії капецитабіну виражені менше, ніж флуороурацилу. При призначенні фолінату кальцію в комбінації з капецитабіном протипухлинні та побічні ефекти останнього підсилюються.
Іринотекан — протипухлинний засіб, інгібітор ДНК-топоізомераз. Напівсинтетична похідна алкалоїду камптотецину, яку отримують із камптотеки гострокінцевої. Вихідна сполука неактивна. Під дією тканинних карбоксилестераз з іринотекану утворюється активний метаболіт SN-38, який пригнічує топоізомеразу I, активність якої в клітинах КРР значно вища, ніж в нормальних клітинах слизової оболонки шлунково-кишкового тракту, що забезпечує вибіркову дію препарату. Коли реплікаційна виделка доходить до того місця, де відбулася інгібіція топоізомерази I, стається дволанцюговий розрив ДНК та запуск апоптозу. Препарат випускається у флаконах по 100 мг (5 мл). Перед вживанням слід розводити фізіологічним розчином або 5% глюкозою. Побічні ефекти: пригнічення кровотворення (частіше нейтропенія, яка розвивається на 7–10-ту або 24–28-му добу), проноси — як ранні (у добу застосування препарату), так і відстрочені (на наступну добу та пізніше). Проноси — дозолімітуюча побічна дія, оскільки можуть призвести до тяжких порушень водно-електролітного балансу. Також відзначають алопецію, нудоту та блювання.
Оксаліплатин — протипухлинний засіб із групи алкілуючих сполук. Препарат ковалентно зв’язується з атомами азоту пуринових нуклеотидів в межах одного (95%) або двох (5%) ланцюгів ДНК, порушуючи її реплікацію та функції. На відміну від інших препаратів платини, комплекси, утворені оксаліплатином, не розпізнаються ферментами репарації ДНК. Дія препарату не залежить від фази клітинного циклу. Препарат випускається у флаконах по 50 та 100 мг. Перед застосуванням розводять у 250 або 500 мл 5% глюкози. Забороняється використовувати для розведення кристалоїдні розчини, що містять іони хлору. Найважливішим побічним ефектом є нейропатія. Розрізняють її гостру (в перші 3 доби) та хронічну форми. Гостра нейропатія включає парестезії стоп та кистей, порушення зору, дизестезію гортані та глотки, що проявляються дисфагією, дисфонією та задишкою. Зазвичай минає через 3–4 доби без специфічного лікування. Хронічна нейропатія, як правило, виникає після отримання сумарної дози більше 1200 мг/м2. На відміну від цисплатину, хронічна нейропатія, викликана оксаліплатином, проходить через 3–4 міс після відміни препарату.
Мітоміцин С — протипухлинний антибіотик. Подібно до алкілуючих сполук викликає утворення зшивок між нуклеотидами ланцюгів ДНК, порушуючи її реплікацію та зчитування генетичної інформації. Крім того, мітоміцин здатен пошкоджувати РНК-полімеразу. Препарат активується в умовах гіпоксії, наявність якої характерна для пухлинної тканини. Випускається у флаконах по 5; 20 та 40 мг. Розводять водою для ін’єкцій. При потраплянні розчину на шкіру та на поверхні інших тканин швидко викликає некрози та виразкування, при швидкому введенні спричиняє тромбофлебіти. Специфічні побічні ефекти — гемолітико-уремічний синдром (при розвитку гострої ниркової недостатності можлива загибель пацієнта) та пневмоніт (проявляється задишкою, непродуктивним кашлем, дифузними затемненнями на легеневому полі на рентгенограмі).
Таргетна (молекулярно-спрямована) терапія
Останніми роками дослідження молекулярної біології КРР послугували підставою для створення протипухлинних засобів, які мають мішенню (англ. target) вплив на процеси злоякісної трансформації клітин. Такими точками впливу можуть бути неоангіогенез у пухлині, процеси передачі клітинних сигналів, апоптоз, диференціювання пухлинних клітин тощо. Особливістю препаратів таргетної терапії є не цитотоксична, а переважно цитостатична дія; тому доцільним є їх поєднання з традиційними засобами хіміотерапії.
Бевацизумаб — моноклональне рекомбінантне гуманізоване химерне антитіло до VEGF. Нейтралізуючи вказаний фактор, препарат блокує утворення нових кровоносних судин у пухлинній тканині, запобігаючи подальшій прогресії, інвазії та гематогенному метастазуванню. Також знижує проникність пухлинних судин та зменшує інтерстиційний набряк, що покращує кровопостачання та транспорт у пухлинну тканину інших антибластомних засобів. З невідомих причин підвищує концентрацію активного метаболіту іринотекану SN-38 на 33%. Фармакологічно несумісний із колоїдними розчинами (гідроксіетилкрохмаль). Абсолютними протипоказаннями до застосування препарату є післяопераційний період менше 28 діб (порушується процес загоєння рани), шлунково-кишкові кровотечі в анамнезі, метастатичні ураження ЦНС, вагітність і період лактації, а також гіперчутливість до препарату. Бевацизумаб застосовують або у вигляді монотерапії, або в комбінації з різними схемами ПХТ (зазвичай поєднано з паліативною ПХТ при метастатичному РПК). Основні побічні ефекти препарату — перфорації шлунково-кишкового тракту, носові кровотечі, нестабільна стенокардія, інфаркт міокарда, інсульт, тяжка артеріальна гіпертензія (у 30% пацієнтів), протеїнурія та нефротоксичність (5% хворих).
Перспективними препаратами при КРР є цетуксимаб — моноклональне антитіло, яке блокує EGFR, а також гефітиніб — інгібітор фосфорилювання EGFR. Зазначені засоби виявилися малотоксичними и наразі проходять II та III фазу клінічних випробувань.
Різні стадії випробувань проходять також інгібітори циклооксигенази-2 (ферменту, який є елементом стимуляції ангіогенезу) целекоксиб та рофекоксиб.
Основні програми поліхіміотерапії при колоректальному раку
Програми ад’ювантної ПХТ:
- FOLFOX-6
- оксаліплатин 85 мг/м2 внутрішньовенно за 2 год в 1-шу добу;
- кальцію фолінат 400 мг/м2 внутрішньовенно за 2 год в 1-шу добу;
- флуороурацил 400 мг/м2 внутрішньовенно болюсно в 1-шу добу, потім 1200 мг/м2 внутрішньовенно за 46 год.
Цикл повторюють кожні 2 тиж упродовж 6 міс.
- 5-FU/LV (sLV5FU2)
- кальцію фолінат 400 мг/м2 внутрішньовенно за 2 год в 1-шу добу;
- флуороурацил 400 мг/м2 внутрішньовенно болюсно в 1-шу добу, потім 1200 мг/м2 внутрішньовенно за 46 год.
Цикл повторюють кожні 2 тиж упродовж 6 міс.
- Capecitabine
- капецитабін 1250 мг/м2 2 рази на добу в 1–14-й дні.
Цикл повторюють кожні 3 тиж упродовж 6 міс.
- CapeOx4
- оксаліплатин 130 мг/м2 внутрішньовенно за 2 год в 1-шу добу;
- капецитабін 1000 мг/м2 2 рази на добу в 1–14-й дні.
Цикл повторюють кожні 3 тиж упродовж 6 міс.
- FOlFIRI
- кальцію фолінат 200 мг/м² внутрішньовенно в 1-шу добу шляхом 2-годинної інфузії перед введенням флуороурацилу;
- флуороурацил 400 мг/м² внутрішньовенно швидко в 1-шу добу, потім 2400 мг/м² внутрішньовенно шляхом безперервної інфузії протягом 46 год;
- іринотекан 180 мг/м² внутрішньовенно в 1-шу добу.
Курси повторюють кожні 14 діб.
При лікуванні метастатичного колоректального раку застосовують класичні схеми ПХТ у поєднанні з таргетними препаратами: FOLFOX + бевацизумаб, FOLFOX + панітумумаб, FOLFIRI + бевацизумаб, FOLFIRI + афліберцепт, FOLFIRI + цетуксимаб або панітумумаб тощо.
Хіміопроменева терапія
- ПТ + інфузії флуороурацилу;
- ПТ + флуороурацил 225 мг/м2 в 5–7-й день тижня;
- ПТ + флуороурацил 400 мг/м2 + кальцію фолінат 20 мг/м2 протягом 4 діб в 1-й та 5-й тиждень;
- ПТ + капецитабін 825 мг/м2 + 2 рази на добу 5 або 7 днів на тиждень протягом 5 тиж.
Залежно від ефективності та переносимості лікування проводять декілька курсів комбінованої терапії. Через 6–8 тиж після проведеного лікування виконують біопсію всієї товщі стінки анального каналу. Якщо в біоптаті будуть виявлені пухлинні клітини, пацієнту буде показана операція Кеню — Майлса. У певних окремих випадках можливе вирішення питання про призначення другої лінії ПХТ (флуороурацил + цисплатин).
Імунотерапія
Активна специфічна імунотерапія полягає в застосуванні аутологічних вакцин (тобто отриманих з певним чином оброблених клітин пухлини). Їх використання доцільно в післяопераційний період, коли пухлинна маса в організмі різко зменшена. За аналогією з інфекційними хворобами, вакцина не здатна вилікувати хворобу, але у змозі попередити її чи пом’якшити перебіг. За окремими повідомленнями в літературі (Vermorken J. et al., 1996) чотирикратне введення такої вакцини дозволило вдвічі (!) зменшити кількість рецидивів і померлих від КРР.
Активна неспецифічна імунотерапія передбачає застосування левамізолу, як згадано вище. Слід зауважити, що частина онкологів беруть під сумнів імуномодулюючий ефект левамізолу і вбачають його дію в біохімічній модуляції флуороурацилу.
Пасивну імунотерапію проводять за допомогою моноклональних антитіл (див. розділ «Таргетна терапія»).
ЛІКУВАННЯ РЕЦИДИВІВ ТА МЕТАСТАЗІВ
Частота місцевих рецидивів становить 18–35%; середня тривалість життя хворих з рецидивом — 10–12 міс. Відповідно до локалізації рецидивної пухлини розрізняють:
- внутрішньокишкові рецидиви (при РПК — після сфінктерозберігаючих операцій). Клінічна картина і діагностика збігаються з такими первинних пухлин;
- позакишкові рецидиви виникають у черевній порожнині, малій мисці або промежині. Можливі імплантаційні рецидиви у місцях, де знаходилися дренажні трубки. Своєчасна діагностика позакишкових рецидивів досить складна через бідність симптоматики та низьку цінність інструментальних процедур.
Вдруге можуть бути радикально прооперованими 20–35% хворих з рецидивом. Рецидивні пухлини характеризуються низькою резектабельністю, а операції з їх приводу — травматичністю, тому більшість втручань виявляються паліативними. При рецидивах РПК, а також нерухомих рецидивних пухлинах ободової кишки можлива паліативна ПТ.
Метастази в печінці становлять близько 60% усіх віддалених метастазів. Поодинокі метастази можуть бути видалені шляхом резекції органа, доцільна також кріодеструкція пухлинних вузлів, руйнування останніх черезшкірною ін’єкцією етанолу, а також високочастотною термоабляцією. Можлива емболізація судин, що їх васкуляризують. Великі західні медичні центри мають досвід гепатектомії з трансплантацією печінки.
Метастази в легенях знаходять у 15% хворих з генералізованими КРР. Хірургічне лікування можливе у випадку солітарних метастазів.
Дисемінацію по очеревині відзначають досить часто.
При множинних метастазах у внутрішніх органах доцільна лише системна ПХТ. Середня тривалість життя таких хворих становить близько 6 міс.
УСКЛАДНЕННЯ ЛІКУВАННЯ
Інтраопераційні ускладнення розвиваються у 5–10% оперованих і є найбільш небезпечними. Насамперед до них належать кровотеча, що виникає при мобілізації кишки. Ризик кровотечі значно підвищується при великих пухлинах, в умовах обмеженої видимості операційного поля. Особливо небезпечними є ушкодження магістральних судин, а також вен, розташованих на передній поверхні крижової кістки та бокових стінках миски. Несприятливі наслідки може мати розкриття просвіту кишки, а також травмування оточуючих кишку органів.
Ранні післяопераційні ускладнення. Найчастіше виникає гнійний перитоніт. Основні причини — неспроможність анастомозів та інфікування черевної порожнини під час операції. Також слід згадати про некроз низхідної кишки при сфінктерозберігаючих операціях і виникнення абсцесів, флегмон в порожнині малої миски та заочеревинному просторі, а також довкола колостоми. Лікування проводять за правилами гнійної хірургії.
Досить часто розвиваються тромбоемболічні ускладнення. Численними дослідженнями, у тому числі і в нашій клініці, доведено, що у хворих на КРР існує латентний гіперкоагуляційний потенціал. Останній при впливі мінімального екзогенного чинника може переходити у ДВЗ-синдром.
Колопроктологічні втручання є вкрай травматичними (особливо операція Кеню — Майлса). Недостатньо гальмована стресова реакція на операційну травму в поєднанні з розладами системи гемокоагуляції спричиняє гострі стресові виразки шлунково-кишкового тракту, що часто ускладнюються кровотечами та перфораціями. Головними заходами у боротьбі зі стресовими ураженнями та коагулопатичними розладами є їх комплексна профілактика та раціональне ведення післяопераційного періоду.
До пізніх післяопераційних ускладнень належать стриктури анастомозу чи колостоми, евентрація (випадіння) ділянки кишки через анус або стому, кишкові нориці. Стриктури здебільшого ліквідують бужуванням, нориці — консервативними заходами, при їх марності вдаються до операції.
Окрім органічних ускладнень, додаткових страждань пацієнтам завдають функціональні розлади, особливо після ОЗО на прямій кишці. Частіше за все виникає симптомокомплекс, відомий під назвою «синдром низької передньої резекції» (low anterior resection syndrome). Для нього характерними є:
- часті (6 разів на добу або частіше) акти дефекації;
- тривалі, багатомоментні, інколи болісні, неповні випорожнення кишечнику;
- імперативні позиви до дефекації (тенезми);
- інконтиненція (нетримання) газів, рідких чи твердих калових мас різного ступеня.
Основною патогенетичною ланкою виникнення функціональних розладів є часткове або повне видалення ампули прямої кишки із втратою її резервуарної функції, явища інконтиненції при цьому виникають вторинно. Фекальні маси не створюють достатнього тиску на стінки кишки, і рефлекс дефекації не відбувається. Також має значення інтраопераційне травмування вегетативних нервів гіпогастрального сплетення. Для запобігання виникненню функціональних розладів застосовують реконструктивні операції (див. вище).
Частота післяопераційних ускладнень становить 20–60%, післяопераційна летальність — 3–15% (за даними різних клінік).
Ускладненнями променевого лікування є променеві ректосигмоїдити. Вони можуть призвести до перфорації променевих виразок, профузної кровотечі, стриктури кишки або сечоводу, нетримання калу. Лікування: безшлакова дієта, проносні засоби, місцеве застосування (мікроклізми, свічки) в’яжучих засобів, репарантів, протизапальних та знеболювальних препаратів. Аналогічне лікування пізніх променевих циститів і вагінітів. При утворенні ректовезикальних або ректовагінальних нориць необхідною є операція.
РЕАБІЛІТАЦІЯ
До найважливіших напрямків реабілітації належать заходи з контролю функціонування протиприродного ануса. Відсутність керованого акту дефекації, вільне відходження всіх компонентів кишкового вмісту, окрім власне фізичних страждань, завдає і психологічної травми, викликаної вимушеною самоізоляцією хворого від оточення. Реабілітація пацієнтів із колостомою відбувається у двох напрямках.
1. Хірургічне створення керованого протиприродного анального отвору. До нього відносять формування з клаптя шкіри «хоботка» над виведеним сегментом кишки, який згодом може бути перетисненим будь-яким зовнішнім пристроєм. Крім того, в літературі налічується близько 200 видів операцій, при яких функцію утримання калу намагаються контролювати за допомогою м’язів (наприклад переміщення m. gracilis зі стегна на промежину). Здійснювалися спроби контролювати відходження калу застосуванням різних обтураторів, зокрема імплантацією магнітних замків. Деякі автори формують з інших видів кишки штучний резервуар для накопичення калу, який хворий мусить регулярно спорожнювати за допомогою клізми. Проте існуючі хірургічні методи реабілітації вважати задовільними не можна.
2. Методи регулювання діяльності стоми, до яких належать:
- природна евакуація у поєднанні з медикаментозною регуляцією функціонування кишечнику та користування калоприймачем;
- регулярне випорожнення товстої кишки через колостому — метод іригації.
Значну допомогу хворим надають у кабінетах стоматерапії при проктологічних закладах, а також громадські асоціації хворих із колостомою. Із 1975 р. діє Всесвітня стомійна організація, до якої належать більше 50 національних організацій.
Після резекцій товстої кишки (особливо великих за обсягом) виникає постколектомічний синдром, який охоплює комплекс порушень специфічних функцій товстої кишки (евакуаторна, калоформуюча, вітаміносинтетична тощо). До коригуючих заходів відносять дієту, калоформуючі засоби, ферментні препарати, адсорбенти. Важливим напрямком є відновлення мікробного біоценозу кишечнику. При недостатності затулкової функції товстої кишки (при сфінктерозберігаючих операціях) доцільна ЛФК. Специфічних реабілітаційних заходів потребує порушення сечовипускання, а також статевої функції після втручань на прямій кишці (частіше у чоловіків).
РЕЗУЛЬТАТИ ЛІКУВАННЯ
Завдяки прогресу хірургічної техніки, розробці ефективних методик анестезіологічного забезпечення та ведення післяопераційного періоду в останні десятиріччя зменшилася кількість післяопераційних ускладнень. Це дозволило покращити безпосередні результати хірургічного лікування пацієнтів із КРР. Проте показники 5-річної виживаності змінилися незначно і становлять 46–60%. Це зумовлено відсутністю на сьогодні надійних засобів попередження рецидивів і метастазів після радикальної операції. Результати радикального лікування залежать від поширеності пухлини, особливо від ураження регіонарних зон метастазуванням.
ПРОФІЛАКТИКА
Первинна профілактика базується на запобіганні дії відомих етіологічних чинників, адекватному лікуванні та диспансерному спостереженні передракових станів (див. відповідний розділ).
Триває пошук профілактичних засобів КРР. Доведено, що тривале застосування ацетилсаліцилової кислоти (4 рази на тиждень у дозі 300 мг більше 20 років) дозволяє знизити ризик виникнення КРР на 50% та смертність від КРР — на 40% (Negri T. et al., 1997). Цей ефект пов’язують із блокадою циклооксигенази-2.
Існують дані, які свідчать про зниження частоти виникнення аденоматозних поліпів товстої кишки при прийомі карбонату кальцію (на 15–20%).
Наслідком замісної ГТ в менопаузу є зниження ризику КРР майже на 20%.
Заходи вторинної профілактики спрямовані на своєчасну діагностику. Важливим напрямком є скринінг цих захворювань, а також ранніх стадій КРР.
Обґрунтуванням дослідження калу на приховану кров (гемокульт-тест, бензидинова проба Грегерсена, реакція з пірамідоном, гваякова проба) є той факт, що пухлини товстої кишки тією чи іншою мірою кровоточать. Серед здорового населення 2–6% обстежених мають позитивний гемокульт-тест. При подальшому обстеженні цієї когорти КРР виявляють у 5–10%, аденоми — у 20–40% осіб. Для позитивних результатів тесту щоденна втрата крові має бути не менше 20 мл (фізіологічна втрата крові з кишечнику 2 мл). Тест передбачає взяття не менше 2 мазків протягом 3 діб, виключення з дієти яловичини та продуктів з високою пероксидазною активністю (хрін, редиска, капуста, томати, гриби, огірки), препаратів заліза й аскорбінової кислоти. Отже, у 50–75% тест є хибнопозитивним; частота хибнонегативних результатів може сягати 50% при КРР і 70% — при аденомах. Проте, за даними численних рандомізованих досліджень, смертність від КРР при проведенні щорічного скринінгу із застосуванням гемокульт-тесту може бути знижена на 30%.
ФКС дозволяє виявити 55% доброякісних і злоякісних пухлин товстої кишки. Проте можливості методу у якості скринінгового сумнівні через його вартість, низьку пропускну спроможність та інвазивність. Більшість фахівців рекомендують обмежитися застосуванням ФКС у осіб, що мають високий ризик розвитку пухлин товстої кишки у віці старше 50 років.
Наразі активно проводять пошук молекулярних та неінвазивних інструментальних методів скринінгу, що можуть стати альтернативою вищезазначеним.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. У пацієнта С., 56 років, при колоноскопії виявлено пухлину низхідного відділу ободової кишки. Виконано біопсію. Патогістологічний висновок — аденокарцинома. Який метод діагностики дасть можливість виявити віддалені метастази злоякісної пухлини цієї локалізації?
А. Спіральна КТ органів грудної і черевної порожнини
В. Іригографія
С. Оглядова рентгенографія органів грудної порожнини
D. Трансректальна ультрасонографія
Е. Тотальна колоноскопія
2. Пацієнт В., 60 років, скаржиться на біль при дефекації протягом 2 міс, відмічає виділення крові та слизу з калом. При колоноскопії виявлено екзофітну пухлину на відстані 16 см від ануса, що циркулярно звужує просвіт. Патогістологічний висновок — аденокарцинома. Віддалених метастазів не виявлено. Яке лікування слід провести хворому?
А. Оперативне — передню резекцію прямої кишки
В. Оперативне — правобічну геміколектомію
С. Хіміотерапію за схемою Мейо
D. Неоад’ювантну ПТ
Е. Оперативне — колостомію
3. Пацієнтка В., 67 років, скаржиться на зменшення маси тіла до 10 кг за останні 2 міс, слабкість, тяжкість в правому підребер’ї, нудоту, втрату апетиту. При пальпації в правому підребер’ї виявлено болісний інфільтрат 12×7 см, рухомий. При проведенні диференційної діагностики, яке захворювання слід виключити в першу чергу?
А. Рак правого кута ободової кишки
В. Хронічний холецистит
С. Ехінококову кісту печінки
D. Хронічний псевдотуморозний панкреатит
Е. Копростаз
4. Пацієнт Т., 65 років, пройшов курс неоад’ювантної ПТ з приводу раку середньоампулярного відділу прямої кишки (нижній край пухлини на відстані 7 см від ануса). Ефект у вигляді стабілізації. Яка подальша тактика лікування хворого?
А. Виконання низької передньої резекції з превентивною ентеростомією
В. Екстирпація прямої кишки за Кеню — Майлсом
С. Симптоматичне лікування
D. Призначення повторного курсу ПТ
Е. Хіміотерапія за схемою FOLFIRI
5. Пацієнт Л., 71 рік, хворий на рак сигмоподібної кишки T4NxM1 (білобарне метастатичне ураження печінки, канцероматоз черевної порожнини). Пацієнту призначено курс паліативної хіміотерапії. Під час прийому одного з хіміопрепаратів пацієнт став скаржитися на біль, похолодіння та парестезії у верхніх та нижніх кінцівках за типом «рукавичок та шкарпеток». Який хіміопрепарат призначено хворому?
А. Блеоміцин
В. Оксаліплатин
С. Флуороурацил
D. Мітоміцин С
Е. Іринотекан
6. Пацієнт В., 62 роки, скаржиться на болісність при дефекації протягом 3 міс, виділення крові та слизу з калом. При пальцевому ректальному дослідженні на 4–5 см пальпується щільне нерухоме пухлиноподібне утворення на 7-му–9-ту годину. Взято біопсію. Патогістологічний висновок — низькодиференційована аденокарцинома. Планується проведення органозберігаючого оперативного лікування. Які з діагностичних методів найбільш точно дозволять виключити пухлинну інвазію зовнішнього анального сфінктера?
A. Спіральна КТ органів черевної порожнини та іригографія
B. ФКС та ПЕТ-КТ
C. МРТ малого таза та трансректальне УЗД
D. Визначення РЕА
E. Віртуальна колоноскопія
7. Ви консультуєте пацієнта віком 54 роки. У пацієнта рак лівого кута ободової кишки, гістологічно підтверджений (помірно диференційована аденокарцинома кишки), без явищ кишкової непрохідності. За даними діагностичної лапароскопії канцероматозу черевної порожнини немає. За даними спіральної КТ візуалізується об’ємне утворення розмірами 35×64 мм, розміщене на межі II та III сегментів печінки. За результатами пункції цього утворення отриманий висновок — помірно диференційована аденокарцинома кишки. Пацієнт без вираженої супутньої патології. Яким з Вашої точки зору буде найбільш адекватний обсяг лікування?
A. Лівобічна геміколектомія
B. Колостомія
C. Хіміотерапія за схемою Мейо
D. Одномоментна комбінована лівобічна геміколектомія та лівобічна гемігепатектомія
Е. Симптоматичне лікування
8. Пацієнт Ш., 63 роки, хворий на рак нижньоампулярного відділу прямої кишки (нижній край пухлини на відстані 4 см від ануса), пройшов курс неоад’ювантної ПТ у сумарній вогнищевій дозі 30 Гр. Пацієнту виконується оперативне лікування в обсязі низької передньої резекції прямої кишки. Під час операції виявилося, що сформувати апаратний колоректоанастомоз вкрай ризиковано. В яку операцію слід провести конверсію низької передньої резекції?
A. Екстирпація прямої кишки за Кеню — Майлсом
B. Сигмостомія
C. Лівобічна геміколектомія
D. Тотальна колопроктектомія
E. Проктектомія
9. Пацієнту Р., 55 років, виконано низьку передню резекцію прямої кишки з приводу раку її середньоампулярного відділу. До операції пацієнт отримав курс неоад’ювантної ПТ у сумарній вогнищевій дозі 30 Гр. Операцію завершено формуванням превентивної ілеостоми. Який найбільш сприятливий період для відновлення безперервності шлунково-кишкового тракту у хворого?
A. 11 міс
B. 1 рік
C. 2 роки
D. 2 міс
Е. Ілеостома пожиттєво
10. Пацієнтка С., 67 років, поступила у хірургічне відділення лікарні з клінічною картиною перитоніту, гострої кишкової непрохідності. Ухвалено рішення виконати екстрене оперативне втручання. Інтраопераційно: у черевній порожнині значна кількість гною, фібрину та кишкового вмісту з різким неприємним каловим запахом; виявлено пухлину сигмоподібної кишки, що повністю обтурує просвіт, по одній зі стінок видно перфорацію пухлини, з якої виділяється кишковий вміст. Яка оперативна тактика в цьому випадку буде найбільш доцільною?
A. Лівобічна геміколектомія
B. Операція Гартмана, санація та дренування черевної порожнини
C. Формування обхідного анастомозу
D. Проктектомія
Е. Ушивання черевної порожнини наглухо
Шаблон відповідей
|
1 |
A |
|
2 |
A |
|
3 |
A |
|
4 |
A |
|
5 |
B |
|
6 |
C |
|
7 |
D |
|
8 |
E |
|
9 |
D |
|
10 |
B |