КОРОТКИЙ АНАТОМО-ФІЗІОЛОГІЧНИЙ НАРИС
Розташування, проекція та скелетотопія. Шлунок розташовується у верхньому поверсі черевної порожнини. Більша його частина знаходиться в лівому підребер’ї (близько 3/4 всієї поверхні), менша — в епігастральній ділянці. Розміри шлунка значно відрізняються залежно від дієтичних уподобань людини. Тому його об’єм варіює від 1 до 5 л. Довжина шлунка при середньому наповненні становить близько 21–25 см.
У шлунка (рис. 10.1) розрізняють передню і задню стінки, які переходять одна в одну по малій (1) і великій кривині (2). Місце переходу стравоходу в шлунок називають входом, ostium cardiacum (3), а початкову частину шлунка, прилеглу до входу, — кардією або кардіальною частиною, pars cardiaca (4). Зліва від входу знаходиться дно шлунка, fundus ventriculi (5), відмежоване від кардіальної частини кардіальною борозною, incisura cardiaca. Вправо від входу розташовані тіло (6) та пілорична частина шлунка (pylorus) (7); остання ділиться на antrum pyloricum та пілоричний канал, canalis pyloricus, який переходить в дванадцятипалу кишку. Вихід шлунка відмежований від дванадцятипалої кишки круговою борозною, якій відповідає ostium pyloricum (8). На малій кривині шлунка, ближче до пілоричної частини, є кутова вирізка, incisura angularis; ділянки малої кривини тут утворюють кут шлунка. За хірургічною класифікацією шлунок умовно поділяється на: верхню (кардіальна частина та дно), середню (тіло) та нижню (пілоричний відділ) третини.
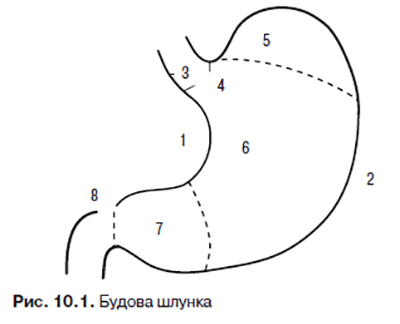
У рентгенології поділ шлунка на відділи інший. Найнижче розташовану частину шлунка, навпроти incisurae angularis, позначають як sinus ventriculi. Дещо дистальніше sinus ventriculi знаходиться фізіологічний сфінктер, sphincter antri, який відділяє тіло шлунка від antrum pylori. Дно, тіло і синус складають травний мішок, saccus digestorius, а pylorus та antrum pyloricum утворюють евакуаторний канал, canalis egestorius.
Вхід шлунка, ostium cardiacum, розташовується зліва від хребта на рівні X грудного хребця, приблизно на 1–2 см донизу від hiatus oesophagei, на глибині 9–15 см від передньої черевної стінки. На передню грудну стінку ostium cardiacum проектуються відповідно до хряща VI–VII ребра на 2–4 см ліворуч від серединної лінії. Кардія шлунка лежить на 3 см нижче за вхід, на рівні XI грудного хребця. Вона найбільш постійна в своєму положенні та фіксована до верхньої стінки черевної порожнини зв’язковим апаратом шлунка, а також черевним відділом стравоходу, який має невелику довжину (1,5–2 см) і сполучений з діафрагмою. Дно шлунка стикається з лівим куполом діафрагми і розташовується на рівні X–XI грудних хребців. При середньому ступені наповнення шлунка велика кривина проектується на середині відстані між мечоподібним відростком і пупком. Мала кривина в ділянці пілоруса може розташовуватися на різних рівнях по відношенню до мечоподібного відростка. Найчастіше вона знаходиться на рівні мечоподібного відростка, рідше — на відстані 5–7 см нижче за нього. Відстань між мечоподібним відростком і великою кривиною коливається в межах від 0 до 15 см, в середньому — 7 см. Місце переходу шлунка в дванадцятипалу кишку розташовується на рівні I поперекового хребця, що відповідає середині відстані між мечовидним відростком і пупком. При наповненні шлунка pylorus зміщується на 3–5 см вправо від середньої лінії тіла. Порівняно велика рухомість пілоричної частини шлунка зумовлена тим, що вона менш фіксована до навколишніх органів, ніж кардіальна частина. У наповненому стані зверху шлунок торкається нижньої поверхні лівої частки печінки та лівого куполу діафрагми, позаду — верхнього полюса лівої нирки та лівої надниркової залози (вкритих очеревиною та жировою клітковиною), селезінки, передньої поверхні підшлункової залози, далі нижче — поперечно-ободової кишки та її брижі, попереду — передньої черевної стінки.
Стінка шлунка складається з 4 шарів:
1. Слизова оболонка (tunica mucosa) виділяє шлунковий сік для хімічної обробки їжі. В ній виділяють два види залоз: а) залози дна шлунка, що розташовані в дні та тілі шлунка та містять головні (продукують пепсиноген) та парієтальні (продукують соляну кислоту) клітини; б) пілоричні залози, що складаються в основному з головних клітин. Більша площа контакту з їжею досягається утворенням складок слизової оболонки. Вздовж малої кривини складки розташовані поздовжньо, утворюючи «шлункову стежку» — канал, по якому при сильній перистальтиці їжа може проходити зі стравоходу до пілоруса. В ділянці ostium pyloricum знаходиться циркулярна складка слизової оболонки, що відмежовує кисле середовище порожнини шлунка від лужного середовища дванадцятипалої кишки.
2. Підслизова оболонка (tela submucosa) — пухка сполучна тканина, яка містить судини та нерви, допомагає слизовій оболонці змінювати рельєф складок.
3. М’язова оболонка (tunica muscularis) складається з гладком’язових волокон, що розташовані у три шари: зовнішній — поздовжній (є продовженням поздовжніх м’язових волокон стінки стравоходу), середній — циркулярний (виражений більше попереднього, є продовженням циркулярних волокон стравоходу, потовщуючись утворює пілоричний сфінктер) та внутрішній — косий.
4. Зовнішній (серозний) шар (tunica serosa) — очеревина, що вкриває шлунок по всій поверхні, за винятком великої та малої кривини (де проходять судини) та невеликої (близько 5 см) ділянки його поверхні, що стикається із діафрагмою.
Зв’язки оточують шлунок суцільним кільцем і відіграють важливу роль в його фіксації. У зв’язках між листками очеревини розташовані жирова клітковина, кровоносні та лімфатичні судини, лімфатичні вузли і нервові гілки. Розрізняють наступні зв’язки шлунка: шлунково-підшлункова зв’язка; пілорично-підшлункова зв’язка; шлунково-діафрагмальна зв’язка; шлунково-селезінкова зв’язка; шлунково-ободова зв’язка; печінково-дванадцятипала зв’язка; печінково-шлункова зв’язка.
Попереду та позаду шлунка розташовуються щілиноподібні простори — передшлункова і сальникова сумки.
Кровопостачання шлунка здійснюється лівою і правою шлунковими артеріями, лівою і правою шлунково-сальниковими артеріями, а також короткими шлунковими артеріями. Всі ці судини відносять до системи черевного стовбура. Черевний стовбур (truncus соеliacus), який відходить від аорти на рівні XII грудного — I поперекового хребця, — невелика артеріальна гілка завдовжки 0,5–3 см (в середньому 1,7 см) та діаметром 0,8–1,2 см. Ділиться на три артерії: ліву шлункову, загальну печінкову і селезінкову. Ліва шлункова артерія (а. gastrica sinistra) — найбільша артерія шлунка: діаметр її досягає 0,3–0,5 см. Вона відхиляється ліворуч від місця свого відходження і спочатку знаходиться в шлунково-підшлунковій зв’язці, потім приблизно на 3–4 см нижче за місце переходу стравоходу в шлунок підходить до малої кривини і розташовується уздовж неї. Тому розрізняють висхідну та низхідну її частини. Такий розподіл артерії зумовлений практичними міркуваннями, оскільки при звичайній резекції шлунка перев’язують низхідну частину а. gastricae sinistrae, а при субтотальній резекції шлунка або гастректомії — її висхідну частину. Нерідко (в 19%) від лівої шлункової артерії відходить додаткова печінкова артерія, яка прямує до печінки в товщі малого сальника. Розташовуючись на малій кривині, ліва шлункова артерія віддає гілки до кардіальної частини шлунка, потім ділиться на дві гілки (передня і задня). Анастомоз лівої шлункової артерії з правою шлунковою в більшості випадків здійснюється за допомогою задньої гілки. Іноді ліва і права шлункові артерії не анастомозують між собою.
Загальна печінкова артерія (а. hepatica communis) відхиляється від місця свого відходження вправо та розташовується біля верхнього краю підшлункової залози. На рівні пілоруса ділиться на власну печінкову і шлунково-дванадцятипалу артерії. Власна печінкова артерія розташовується в печінково-дванадцятипалій зв’язці. Від цієї артерії або від лівої гілки її найчастіше (в 70%) відходить права шлункова артерія (а. gastrica dextra), яка йде до малої кривини з боку пілоруса. Діаметр її в 2–3 рази менший, ніж лівої шлункової артерії. Шлунково-дванадцятипала артерія прямує донизу і перехрещує задню стінку верхньої частини дванадцятипалої кишки поблизу пілоруса. Від початкової частини її відходить задньоверхня підшлунково-дванадцятипала артерія. На рівні нижнього краю пілоруса шлунково-дванадцятипала артерія ділиться на праву шлунково-сальникову і передньоверхню підшлунково-дванадцятипалу артерії. Перша з них, а. gastro-epiploica dextra, віддає гілки до великого сальника і шлунка, а також анастомозує в товщі шлунково-ободової зв’язки з лівою шлунково-сальниковою артерією.
Селезінкова артерія (а. lienalis) проходить за верхнім краєм підшлункової залози. Від основного стовбура а. lienalis або від головних гілок її відходить ліва шлунково-сальникова артерія (а. gastro-epiploica sinistra). Вона знаходиться в нижній частині шлунково-селезінкової зв’язки, віддає гілки до великого сальника та зліва на відстані 3–10 см від воріт селезінки підходить до великої кривини шлунка, розташовуючись потім в шлунково-ободовій зв’язці. Таким чином, уздовж великої кривини ліва і права шлунково-сальникові артерії, які анастомозують між собою, утворюють артеріальну магістраль, від якої відходять 12–15 пар гілок до передньої і задньої стінок шлунка.
Вени шлунка належать до портальної системи. По малій кривині розташовуються ліва і права шлункові вени (vv. gastricaе sinistra et dextra). Ліва шлункова вена анастомозує з венами стравоходу. Права шлункова вена впадає в портальну вену вище підшлункової залози в товщі печінково-дванадцятипалої зв’язки. Уздовж великої кривини розташовуються права і ліва шлунково-сальникові вени (vv. gastroepiploicaе dextra et sinistra), які супроводжують однойменні артерії. Права шлунково-сальникова вена з’єднується в загальний стовбур із середньою ободовою і верхньопередньою підшлунково-дванадцятипалою венами та впадає у верхню брижову вену. Ліва шлунково-сальникова вена впадає в селезінкову вену або її притоки біля воріт селезінки. Короткі шлункові вени (vv. gastricae breves), що супроводжують однойменні артерії, проходять в шлунково-селезінковій зв’язці і впадають в селезінкову вену або ліву шлунково-сальникову вену. На межі шлунка і дванадцятипалої кишки знаходяться пілоричні вени. Вени шлунка в основному супроводжують однойменні артерії; вони багаторазово анастомозують між собою, утворюючи суцільну венозну мережу, що забезпечує відтік крові від стінок шлунка в різних напрямках.
Лімфатична система
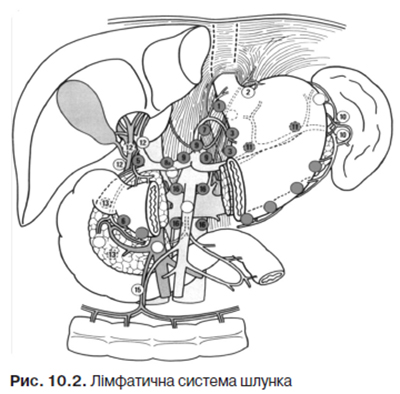
За анатомічною класифікацією лімфатичні вузли, що оточують шлунок, підрозділяються на три групи: І — лімфатичні вузли, розташовані уздовж малої кривини по ходу лівої шлункової артерії; ці лімфатичні вузли приймають лімфу від правих двох третин дна і тіла шлунка; ІІ — лімфатичні вузли, розташовані в ділянці воріт селезінки і хвоста підшлункової залози; до цих вузлів відтікає лімфа з лівої третини дна і тіла шлунка до середини великої кривини; ІІІ — лімфатичні вузли, що лежать по великій кривині шлунка уздовж правої шлунково-сальникової артерії і під пілорусом; вони приймають лімфу від тієї частини шлунка, яка прилягає до правої половини великої кривини.
Японською науково-дослідною спілкою з вивчення раку шлунка (Japanese Gastric Cancer Association — JGCA, 1998) запропонована класифікація лімфатичної системи шлунка, яка на даний час визнана більшістю провідних онкологічних центрів. До I групи належать перигастральні лімфовузли, до II — лімфовузли уздовж лівої шлункової, загальної печінкової, селезінкової артерій і черевного стовбура, до III — лімфовузли в печінково-дванадцятипалій зв’язці, позаду голівки підшлункової залози і в ділянці кореня брижі поперечної ободової кишки. Якщо пухлина розташовується в нижній третині шлунка, лімфовузли уздовж селезінкової артерії також належать до III групи. До IV групи відносяться лімфовузли уздовж верхньої брижової артерії та парааортальні вузли. Крім того, регіонарні лімфовузли мають своє індивідуальне цифрове позначення від 1 до 16: 1 — справа, 2 — зліва від кардіального відділу; 3 — уздовж малої, 4 — великої кривини; 5 — надпілоричні (уздовж правої шлункової артерії); 6 — підпілоричні; 7 — уздовж лівої шлункової артерії; 8 — уздовж загальної печінкової артерії; 9 — в ділянці черевного стовбура; 10 — в ділянці воріт селезінки; 11 — вздовж селезінкової артерії; 12 — в печінково-дванадцятипалій зв’язці; 13 — позаду голівки підшлункової залози; 14 — вздовж верхньої брижової артерії; 15 — вздовж середньої товстокишкової артерії; 16 — парааортальні (рис. 10.2).
Іннервація. Шлунок іннервується симпатичними і парасимпатичними нервами. Симпатичні нерви походять від черевного сплетення, plexus соеliacus, та його похідних (plexus lienalis, plexus mesentericus superior). Парасимпатична іннервація здійснюється гілками блукаючих нервів, які вступають у черевну порожнину разом зі стравоходом звичайно у вигляді двох стовбурів — truncі vagalеs anterior et роsterior. Блукаючі стовбури анастомозують між собою, а також з гілками, що йдуть від черевного сплетення.
Фізіологія шлунка
Шлунок є відділом травного тракту, в якому їжа, змішана зі слиною, вкрита в’язким слизом слинних залоз стравоходу, затримується від 3 до 10 год для її механічної та хімічної обробки. До функцій шлунка відносяться:
1 — депонування їжі;
2 — секреторна — виділення шлункового соку, що забезпечує хімічну обробку їжі;
3 — моторна — перемішування їжі з травними соками та її пересування порціями в дванадцятипалу кишку;
4 — всмоктування в кров невеликої кількості речовин, що поступили з їжею. Речовини, розчинені у спирті, всмоктуються в значно більшій кількості;
5 — екскреторна — виділення разом зі шлунковим соком в порожнину шлунка метаболітів (сечовина, сечова кислота, креатин, креатинін), концентрація яких тут перевищує порогові величини, і речовин екзогенного походження (солі важких металів, йод, лікарські засоби);
6 — інкреторна — утворення активних речовин (гормонів), що беруть участь в регуляції діяльності шлункових і інших травних залоз (гастрин, гістамін, соматостатин, мотилін та ін.);
7 — захисна — бактерицидна і бактеріостатична дія шлункового соку і повернення недоброякісної їжі, перешкоджання її потраплянню в кишечник;
8 — секреторна діяльність шлунка здійснюється шлунковими залозами, що продукують шлунковий сік і представлені трьома видами клітин: головними (головні гландулоцити), що беруть участь у продукції ферментів; парієтальними (парієтальні гландулоцити), що беруть участь у виробленні хлористоводневої кислоти (НСІ) і додатковими (мукоцити), які виділяють мукоїдний секрет (слиз). Клітинний склад залоз змінюється залежно від приналежності їх до того або іншого відділу шлунка, відповідно змінюються склад і властивості секрету, який вони виділяють.
ЕПІДЕМІОЛОГІЯ
Незважаючи на значні успіхи теоретичної та практичної онкології, залишається багато нез’ясованого у проблемі раку шлунка. Наприклад, частота виникнення та біологічні особливості раку шлунка на Сході і Заході суттєво відрізняються. У Японії рак шлунка відмічають часто, значний відсоток захворювань діагностують на ранніх стадіях, а віддалені результати його лікування є одними з найкращих у світі. У Європі рак шлунка виявляють не так часто, діагностують на більш пізніх стадіях, він характеризується значно гіршим прогнозом. Захворюваність на рак шлунка посідає 4-те місце у світі серед ЗН. Щорічно діагностують понад 900 тис. нових випадків цього захворювання. В одному випадку з 50 у пацієнтів, які звертаються зі скаргами на диспепсію, виявляють рак шлунка. Це захворювання має високий показник смертності (понад 700 тис. на рік), що робить його 2-м у структурі онкологічної смертності після раку легені. Найчастіше рак шлунка виникає у чоловіків. Захворюваність на рак шлунка залишається традиційно високою, хоча в останні роки простежується тенденція до зниження показників захворюваності та смертності в усьому світі.
За частотою захворюваності всі країни можна розділити на чотири групи:
1. Країни з найвищою захворюваністю (Японія, Корея, Фінляндія, Ісландія, Великобританія).
2. Країни з високою захворюваністю (Коста-Рика, Швейцарія, Данія, Росія, Україна).
3. Країни з низькою захворюваністю (Парагвай, Таїланд, США).
4. Країни з найнижчою захворюваністю (Індонезія, Нігерія).
У Росії захворюваність на цю патологію становить 41 хворий, у Японії — 59, Фінляндії — 49, США — 7,2 на 100 тис. населення. У Кореї рак шлунка займає 1-ше місце в структурі онкологічної захворюваності (20,8%) та 2-ге місце — за смертністю.
В Україні за період 1999–2007 рр. рівень захворюваності на рак шлунка у чоловіків знизився з 39,9 до 34,0, а показник загальної смертності від раку шлунка — з 33,3 до 26,9 на 100 тис. чоловічого населення. Захворюваність на рак шлунка у жінок за вказаний термін знизилася з 22,9 до 20,3, а смертність — з 17,8 до 15,0 на 100 тис. жіночого населення.
У середньому найкращі показники виживаності хворих на рак шлунка відмічають у Японії — 53% пацієнтів живуть понад 5 років після радикального лікування. В інших країнах цей показник не перевищує 15–20%.
ЕТІОЛОГІЯ ТА ПАТОГЕНЕЗ
У 1926 р. Нобелівська премія була присуджена Йогану А.Г. Фібігеру (Iohannes Аndreas Grib Fibiger) за відкриття інфекційної етіології раку шлунка. Він вважав причиною розвитку хвороби дрібних гельмінтів. І хоча з часом виявилася хибність його теорії, йому неможливо відмовити в науковій далекоглядності. У 1983 р. уперше була описана бактерія Helicobacter pylori, яку пізніше визнали основним етіологічним чинником розвитку хронічного гастриту. У 1994 р. робоча група Міжнародного агентства з вивчення раку прийшла до висновку, що Н. pylori є канцерогеном, який зумовлює рак шлунка людини. Дослідницька група «Єврогаст» прийшла до висновку, що в популяції людей, інфікованих Н. pylori, рак шлунка виникає у 6 разів частіше, ніж у здоровій популяції.
Можна виділити два основних шляхи розвитку захворювання: підвищення кислотності, що призводить до антрального гастриту і виразкової хвороби шлунка чи дванадцятипалої кишки, і зниження кислотності, що викликає пангастрит, атрофічні зміни слизової оболонки та її метаплазію, створюючи умови для виникнення раку.
У разі потрапляння на слизову оболонку шлунка Н. pylori викликає не тільки запальну, але й імунну відповідь. Утворюються специфічні антитіла, які індукують аутоімунний процес, що, в свою чергу, спричиняє незворотні морфологічні зміни слизової оболонки і є провісником розвитку раку шлунка. До того ж у хворих на рак шлунка виробляються антитіла до Н. pylori, які потенціюють ріст пухлини. Ймовірно, канцерогенний ефект даної бактерії залежить не тільки від вірулентності її різних штамів, але й від чинників, що посилюють або, навпаки, захищають організм хворого від розвитку злоякісної пухлини шлунка.
Іншим інфекційним агентом, який виявляють при цьому захворюванні, є вірус Епштейна — Барр (EBV). EBV інфіковано понад 90% населення. Вагомим доказом патогенетичної ролі EBV у виникненні певних морфологічних форм раку шлунка стало виявлення вірусних маркерів (m-РНК EBER-1) у 80–100% пухлинних клітин цих хворих, а також демонстрація моноклональної інтеграції генома в клітинах пухлини. У Японії EBV-асоційовану форму раку шлунка відмічають в 7%, в США — в 16%, у Росії — в 9% випадків.
Різним морфологічним типам раку шлунка властиві різні види генетичних порушень (Tahara, 1993). Виділяють два основних генетичних типи раку шлунка. У країнах Західної Європи та США їх позначають як «кишковий» (або тубулярний) та «дифузний» рак (Lauren P., 1965), тоді як у колишньому СРСР і Японії їх називають високо- та низькодиференційований рак. «Кишковий» тип частіше виникає на тлі кишкової метаплазії, розвивається у популяціях із високим ризиком виникнення раку шлунка та, вірогідно, етіологічно пов’язаний з Н. pylori. «Дифузний» тип виникає в осіб молодого віку та в жінок, що швидше відображає його генетичну природу, а не вплив зовнішніх чинників.
Роль генетичного чинника у розвитку раку шлунка запідозрена у зв’язку з тим, що серед осіб з групою крові A(II) захворюваність вище на 20%, ніж серед осіб з групою O(I) та B(III). Основний внесок у дослідження генетичного фактора вніс аналіз спадкового раку шлунка. У випадках сімейного раку шлунка виявлено мутантний ген Е-кадхерін (CDH-1), пов’язаний із підвищенням ризику розвитку захворювання.
Серед інших чинників ризику виникнення раку шлунка варто назвати канцерогенний вплив нітратів та нітритів. Основним джерелом цих сполук (89%) є овочі. Це капуста, морква, салат, буряк, шпинат тощо. Крім того, нітрозаміни містяться у багатьох алкогольних напоях, в’ялених та копчених продуктах. Вони можуть утворюватися ендогенно внаслідок бактеріального зараження харчових продуктів. Захворюваність на рак шлунка вища в тих регіонах, де переважає багата на крохмаль (картопля, мучні продукти та подібне) їжа та недостатньо тваринних білків, молока, свіжих овочів та фруктів. Збільшення частки свинини у харчовому раціоні підвищує ризик захворювання порівняно зі споживанням баранини в 2,1 раза, а яловичини — в 4,6 раза. У 2,5 раза підвищується ризик захворіти на рак шлунка серед осіб, які щодня вживають тваринні жири, порівняно з особами, які вживають переважно рослинну олію. Ризик захворювання підвищують порушення ритму харчування в 3,7 раза, недостатнє пережовування їжі — в 1,6 раза, переїдання — в 2 рази. У 1,5–3,4 раза вищий ризик захворювань у осіб, які зловживають алкоголем, при тютюнопалінні він значно підвищується. Відносний ризик захворювання серед осіб, які в дитинстві отримували грудне вигодовування менше року, в 3,4 раза вищий, ніж серед тих, кого годували більше року. Встановлено прямий кореляційний зв’язок між частотою розвитку раку шлунка та вмістом у ґрунті міді, молібдену, кобальту та зворотний — із вмістом цинку та марганцю. Наприклад, висока захворюваність зареєстрована в районах Карелії з ґрунтами легкого механічного складу і в районах з торф’яно-глейовими ґрунтами. Отримано епідеміологічні дані, які свідчать про роль підвищеного вмісту солі у виникненні раку шлунка. Підвищене вживання солі призводить до ушкодження слизової оболонки шлунка, що зумовлює хронічне запалення.
Патогенез раку шлунка складний і багато в чому не вивчений. При диференційованих формах раку основні генетичні порушення виявлені в зміні експресії наступних генів: p53 (40%), k-ras (10%), c-erb B2 (20%), c-met (11%), APC, E-cadherin, при низькодиференційованих аденокарциномах — k-sam, E-cadherin. Більшість дослідників визнають, що гістогенез раку шлунка може розвиватися за двома напрямками. Перший шлях схематично можна представити таким чином: тривала дія (більше 20 років) на нормальну слизову оболонку факторів навколишнього середовища, харчування, і перш за все H. pylori, призводить до атрофічного гастриту. Атрофічний гастрит перероджується у кишкову метаплазію, дисплазію чи аденому, диференційовану карциному або неметапластичну атрофію слизової оболонки і низькодиференційовану аденокарциному, що призводить до інвазивного раку. Даний тип гістогенезу частіше відмічають у осіб літнього віку, він не пов’язаний зі спадковим фактором. Другий тип гістогенезу припускає наявність мультипотентних проліферативних клітин. Мультипотентна проліферативна клітина розвивається в карциноїд, диференційовану аденокарциному або низку інших ЗН: муцинозну (слизову) аденокарциному, низькодиференційовану аденокарциному, перснеподібно-клітинний рак, ендокриноклітинну карциному, AFP (α-фетопродукуючий) рак. Даний тип гістогенезу частіше розвивається без попереднього гастриту у молодих пацієнтів.
ПАТОМОРФОЛОГІЯ
Відзначається наступна частота ураження раком різних відділів шлунка: пілоричний — 50%, мала кривина — 27%, кардіальний — 15%, велика кривина — 3%, дно — 2% та тотальне ураження — 3%.
Перша форма раку шлунка, яка діагностується тільки мікроскопічно, — карцинома in situ, що характеризується морфологічними змінами, властивими раку, за винятком проростання базальної мембрани. Друга форма раку шлунка — ранній рак — це невелика пухлина (0,5–3 см), яка не проникає за межі слизової оболонки та підслизової основи, практично не метастазує та становить 10–15% усіх діагностованих випадків цієї пухлини. Відповідно до Макроскопічної класифікації Японського товариства гастроентерологів виділяють три основних типи раннього раку шлунка: I — поліповидний; II — поверхневий (піднесений, плаский, поглиблений); III — виразковий (екскавований). Нерідко виявляють змішані форми пухлини.
Ранній рак частіше має будову тубулярної або папілярної аденокарциноми — до 90%. Відмічають також перснеподібно-клітинний і недиференційований (анапластичний) рак. Внаслідок прогресування ранній рак трансформується у поширений.
Залежно від характеру росту пухлини та вторинних некротичних змін виділено кілька макроскопічних форм раку шлунка, що мають характерну рентгенологічну картину. Це наступні форми:
- рак з переважно екзофітним експансивним ростом: бляшкоподібний, поліпозний (у тому числі, що розвивається з поліпа шлунка); фунгозний (грибоподібний); виразковий (злоякісні виразки), який включає первинно-виразкову форму раку; блюдцеподібний рак (рак-виразка) та рак з хронічної виразки (виразка-рак);
- рак з переважно ендофітним інфільтруючим ростом: інфільтративно-виразковий, дифузний (обмежений або з тотальним ураженням шлунка);
- рак екзо-ендофітний, зі змішаним характером росту — перехідні форми. За даними вивчення операційного матеріалу, рак з переважно екзофітним ростом виявляють значно частіше (71,8%), ніж ендофітну карциному (28,2%).
Відповідно до цієї класифікації форми раку шлунка є також фазами розвитку пухлини зі зміною форм (фаз) при прогресуванні раку. Так, поліпозний рак може трансформуватися в грибоподібний, а останній в результаті приєднання некрозу та розпаду пухлини перетворюється на блюдцеподібний рак. В деяких випадках блюдцеподібний рак переходить в інфільтративно-виразковий, а бляшкоподібний — у дифузний, тобто відмічають зміну характеру росту пухлини — перехід від переважно екзофітного до переважно ендофітного.
Згідно з міжнародною гістологічною класифікацією пухлин шлунка розрізняють аденокарциному (папілярний, тубулярний, слизовий та перснеподібно-клітинний рак), залозисто-плоскоклітинний, плоскоклітинний, недиференційований і некласифікований рак. За ступенем диференціації аденокарциноми поділяють на високо-, помірно- і низькодиференційовані. Найчастіше виявляють аденокарциному, дещо рідше — недиференційований і перснеподібно-клітинний рак, інші форми — дуже рідко. Аденокарцинома характеризується переважно екзофітним, експансивним ростом, а недиференційований і перснеподібно-клітинний рак мають схильність до переважно ендофітного, інфільтруючого росту.
До передракових захворювань, на тлі яких може розвинутися рак шлунка, відносять: хронічний атрофічний і гіпертрофічний гастрит, ригідний антральний гастрит, поліпи й поліпоз шлунка, хворобу Менетріє (складчастий гастрит), перніціозну анемію, атрофічний гастрит кукси шлунка.
У хворих з перніціозною анемією, патогенез якої полягає в продукції антитіл проти клітин протонної помпи, клітин, що продукують пепсиноген та внутрішній фактор Касла, відмічають хронічний атрофічний гастрит. У багатьох випадках його перебіг супроводжується кишковою метаплазією епітелію шлунка. Низка досліджень свідчить, що рак шлунка на тлі перніціозної анемії виявляють у декілька разів частіше, ніж у здорових людей. Інші дослідження не підтвердили це твердження. Та оскільки значна кількість хворих з перніціозною анемією взагалі не мають симптомів і часто не звертаються у медичні заклади, можливість адекватного дослідження цієї гіпотези є сумнівною.
До 90-х років XX ст. панувала гіпотеза, що приблизно в 10% випадків виразка шлунка трансформується у рак. Проте більш пізні дослідження довели, що більшість випадків так званої пухлинної трансформації є раннім раком шлунка з виразкуванням. Однак справжня малігнізація виразки шлунка можлива, проте відмічається менше ніж у 1% випадків.
Значна кількість досліджень присвячена ризику виникнення раку після хірургічних втручань з приводу виразкової хвороби шлунка та дванадцятипалої кишки. Ризик виникнення раку шлунка після його резекції підвищується у 3–4 рази. У такому випадку пухлина зазвичай знаходиться у куксі шлунка та майже ніколи не поширюється на анастомозовану петлю тонкої кишки. Рак кукси шлунка виникає у 2–6% з числа оперованих з приводу захворювань шлунка. Чоловіки хворіють у 4–5 разів частіше, ніж жінки. Захворюваність на рак кукси резектованого шлунка в останні роки зростає. Пухлина частіше виникає через 20 років після операції. Ризик підвищується в осіб, котрим резекція шлунка виконана в молодому віці. З метою ранньої діагностики раку кукси шлунка необхідне ретельне диспансерне спостереження осіб, які перенесли резекцію шлунка. Хворі, які перенесли резекцію шлунка більше 10 років тому, повинні щорічно проходити огляд у терапевта або хірурга з обов’язковим ендоскопічним або рентгенологічним дослідженням.
Рак шлунка, що розвивається на ґрунті хронічного атрофічного гастриту, завжди супроводжується гіпохлоргідрією або ахлоргідрією. Тому пацієнти із хронічним гастритом повинні знаходитися під постійним спостереженням лікаря і проходити не менше 2 разів на рік профілактичні огляди з метою можливого виявлення ранніх форм раку шлунка. Діагностика гастриту включає клінічну картину, ендоскопічне та морфологічне підтвердження. Рекомендовані 6 точок, з яких слід брати біопсію (Yokohama Recommendation at the 10th Asian Pacific Congress of Gastroenterology, Yokohama, 1996):
1. Середина антрального відділу по малій кривині.
2. Кут шлунка.
3. Середина тіла шлунка по малій кривині (посередині між кутом і кардією).
4. Середина антрального відділу по великій кривині.
5. Точка навпроти кута шлунка (по великій кривині в ділянці антрального відділу).
6. Середина тіла по великій кривині (точка посередині між входом в антральний відділ і дном).
Гіперпластичні поліпи — найчастіше діагностована форма шлункових поліпів. За розміром вони рідко перевищують 1,5 см і виявляються у 75–95% випадків. Вірогідність малігнізації цих поліпів невисока (близько 0,5% випадків). Частіше відбувається малігнізація поліпів розміром понад 2 см. Аденоматозні поліпи виявляють рідко, а малігнізація їх відбувається у 40% випадків, особливо якщо розмір поліпів перевищує 2 см.
Хвороба Менетріє (гіпертрофічна гастропатія) — своєрідне та рідкісне захворювання шлунка, що характеризується гіперплазією епітелію слизової оболонки шлунка та різким потовщенням її складок, зниженням кислотоутворювальної функції та ентеропатією із втратою білка. Клінічна картина характеризується болем в епігастральній ділянці, втратою маси тіла і нудотою. Інші скарги відмічають рідше. Захворювання має хронічний перебіг. Виявляють спонтанне видужання або перехід у хронічний атрофічний гастрит. Рак виникає приблизно у 15% хворих.
РІСТ ТА РОЗПОВСЮДЖЕННЯ
По підслизовому шару вздовж стінки шлунка: при екзофітних пухлинах ракові пухлини виявляють на відстані до 2–3 см від видимого краю пухлини; при ендофітних — 8–10 см.
Проростання пухлини:
- у малий та великий сальник; у печінку та діафрагму; у підшлункову залозу; у селезінку; у жовчовивідні шляхи; у поперечну ободову кишку; у передню черевну стінку.
Лімфогенне метастазування:
- у регіонарні лімфовузли від лімфовузлів І до ІV груп (див. Хірургічна анатомія шлунка);
- у віддалені лімфовузли (метастаз Вірхова — в надключичні лімфовузли зліва між ніжками кивального м’яза током лімфи через грудну лімфатичну протоку); ліві пахвові лімфовузли (метастаз Айріша);
- у пупок (метастаз сестер Джозеф), у яєчники (метастаз Крукенберга) — при ретроградному відтіканні лімфи, у разі метастатичної блокади ортоградних лімфатичних шляхів круглої зв’язки печінки).
Гематогенне метастазування:
- у печінку;
- у легені;
- у кістки;
- у головний мозок.
Імплантаційні метастази:
- дисемінація по очеревині локальна або тотальна;
- по очеревині малого таза (метастаз Шніцлера).
ДІАГНОСТИКА
Близько 20–30% хворих на рак шлунка під час первинного звернення не підлягають радикальному лікуванню через поширеність процесу. Приблизно у такої ж кількості хворих це стає зрозумілим під час операції. Тільки 20–30% хворих можуть бути радикально прооперованими, а можливість прожити понад 5 років мають тільки 5–35% хворих.
На етапі діагностики раку шлунка виникають такі завдання: виявлення пухлини та точна оцінка поширення пухлинного процесу з метою вибору адекватного лікування.
Початкові форми раку шлунка можна виявити тільки під час проведення скринінгу всього населення або груп із високим ризиком виникнення даної патології. Найбільший досвід скринінгу з виявлення раку шлунка має Японія. За період 1960–1985 рр. з метою скринінгу було обстежено (рентгенофлюорографією шлунка) 5 161 876 осіб. Рак шлунка виявлено у 0,12% (6240). У 98,1% виконано радикальне оперативне втручання, з них у 47,1% виявлено ранній рак. На даний час триває японське дослідження з вивчення ефективності скринінгової рентгенофлюорографії шлунка в поєднанні з дослідженням сироваткового пепсиногену (PGІ та PGІІ) та скринінгової ендоскопічної гастроскопії в поєднанні із дослідженням PGІ та PGІІ. Втім, на даний час жодним рандомізованим багатоцентровим дослідженням не доведено покращання віддалених результатів лікування у пацієнтів внаслідок скринінгу. Тому для більшості країн проведення скринінгу є недоцільним через низьку захворюваність на рак шлунка або через високу вартість, тобто економічну недоступність.
На жаль, початкові форми раку шлунка не мають будь-яких патогномонічних ознак. Симптоматика відповідає клінічній картині тих захворювань (хронічний гастрит, виразкова хвороба, поліпи шлунка), на тлі яких виникла злоякісна пухлина.
У разі розвитку раку за відсутності фонового захворювання відмічають поступове, іноді з короткими ремісіями збільшення вираженості симптоматики. Якщо пухлина розвивається на тлі попереднього захворювання, хворі скаржаться на збільшення вираженості симптомів, які відмічали раніше. Зміна характеру симптомів, які набули вже звичного для хворого перебігу, є дуже важливим сигналом. За всіма цими явищами нерідко приховується перехід процесу в нову якість — ракове захворювання.
КЛІНІКА
Місцеві ознаки
Біль у животі — характерний симптом раку шлунка, проте він рідко буває початковою ознакою хвороби. Часто тільки через багато місяців після проявів шлункового дискомфорту, як правило в епігастральній ділянці, приєднується біль. У хворих на рак шлунка відмічають ниючий, тупий, різноманітної інтенсивності, частіше всього незначний, не пов’язаний із вживанням їжі, що не має періодичності й сезонності, біль в епігастральній ділянці. Це відрізняє його від виразкової хвороби і хронічного гастриту. У разі раку кардії одним із перших проявів може бути біль у лівій половині грудної клітки, який симулює напади стенокардії, що може бути приводом для помилкової діагностики. У разі залучення у пухлинний процес підшлункової залози та позаочеревинної клітковини біль значно посилюється та іррадіює у спину, має оперізувальний характер. Різноманітність больового синдрому залежить від: 1) розмірів пухлини; 2) наявності або відсутності виразки; 3) явищ перигастриту та поширення пухлини на сусідні органи.
Другим за значенням серед місцевих проявів є диспептичний синдром, який перебуває у прямій залежності від локалізації первинної пухлини. Найчастіше диспептичний синдром виявляють на тлі пухлин нижньої третини шлунка, коли внаслідок стенозу виходу зі шлунка порушується евакуація їжі та з’являється відчуття переповненого шлунка. З ростом пухлини і виникненням стенозу вихідного відділу шлунка відрижка повітрям із неприємним запахом та їжею замінюється блюванням з’їденою їжею, застійним шлунковим вмістом. Пізніше приєднуються загальні симптоми, пов’язані із дисбалансом водно-електролітного і білкового обміну.
Нудота та/або блювання, як правило, пізні прояви хвороби, що пов’язані з розвитком стенозу пілоричного відділу, проте інколи виникають і у відносно ранніх стадіях. Часом блювання супроводжується кровотечею різної інтенсивності. Майже 10–17% випадків гострих шлункових кровотеч мають раковий генез. У кожного шостого померлого в результаті шлунково-кишкової кровотечі на аутопсії виявляють рак шлунка. Автори вказують, що більшість кровотеч відмічають у пізніх стадіях захворювання (у разі розпаду пухлини).
Печію виявляють частіше при кардіальному та кардіоезофагеальному раку, проте можуть відмічати й при інших локалізаціях, виникає через порушення функції кардіального клапану та закиданні шлункового вмісту до стравоходу.
Дисфагія — симптом, найбільш характерний для раку, який локалізується у кардіальному відділі шлунка, але він не може вважатися раннім проявом захворювання. Дисфагія часто супроводжується слинотечею, що в низці випадків може передувати дисфагії.
У деяких випадках першим проявом хвороби є наявність новоутворення в епігастральній ділянці. У 80–87% хворих у таких випадках вдається зробити радикальну операцію, проте, звичайно, мова йде про пухлини, які локалізуються у нижній третині шлунка і зміщуються під час пальпації.
Порівняно тривалий розвиток пухлини без місцевих симптомів належить до так званих німих форм хвороби і відмічається у 2–3% усіх випадків раку шлунка. Прихований рак шлунка іноді проявляється віддаленими метастазами без будь-яких «шлункових» скарг. За наявності ендоскопічної техніки ранні та «німі» форми раку шлунка повністю стають візуальною локалізацією. Відсутність патогномонічних симптомів раннього раку повністю компенсована наявністю патогномонічних симптомів віддалених метастазів. Наявність останніх не пов’язана із розміром первинної пухлини. У цілому поліморфізм клінічних проявів раку шлунка залежить від багатьох причин, головними з яких є: форма і локалізація пухлини у шлунку, будова і швидкість розвитку новоутворення, стадія процесу, розвиток ускладнень, темпи метастазування. Вплив кожного з цих чинників може по-різному позначатися на розвитку симптомів, збільшуючи вираженість одних, зменшуючи або цілком перекриваючи інші. Усе це зрештою змінює клінічну картину захворювання. Тривалість часу від появи перших симптомів до звернення хворих на рак шлунка в поліклініку різноманітна, але близько 65% хворих звертаються за медичною допомогою через 3 міс після появи перших симптомів. Інколи рак шлунка проявляється класичною клінікою ураження печінки та асциту.
Загальна симптоматика
Рак тіла шлунка довгий час може мати перебіг без виражених місцевих ознак. На перший план виступають розлади загального характеру. За умови виразкування пухлин цієї локалізації та приєднання запального процесу можуть відмічати субфебрильну температуру тіла, а в разі пухлин малої кривини одним із перших проявів нерідко буває хронічна шлункова кровотеча, що маніфестує анемію. Рак дна шлунка, досягаючи великих розмірів, довгий час залишається «німим». Біль з’являється у разі поширення пухлини на сусідні органи та структури. За наявності раку шлунка у 20–25% хворих розвивається залізодефіцитна та В12-дефіцитна анемія. Причинами анемії (водночас із можливою хронічною крововтратою) є гемолітичний вплив продуктів розпаду пухлини, пригнічення гемопоезу внаслідок атрофії слизової оболонки шлунка, відсутність соляної кислоти і втрата шлунком здатності виробляти антианемічний фактор Касла. Відома роль шлунка як органа, що бере участь у вуглеводному та електролітному обміні. Шлунок і травний тракт регулюють кислотно-лужну рівновагу, забезпечують засвоєння організмом основних гемопоетичних речовин — вітаміну В12, заліза, міді, кобальту тощо.
Найчастіше рак шлунка проявляється втратою маси тіла, особливо в разі раку, який супроводжується стенозом воротаря. З прогресуванням пухлинного процесу збільшується вираженість клінічних проявів захворювання.
Серед різноманітних клінічних атипових форм раку шлунка відомі такі:
- анемічна форма, що характеризується гіпохромною анемією, відмічається у разі екзофітних пухлин;
- фебрильна форма характеризується немотивованою постійною лихоманкою;
- ентероколітична форма супроводжується діареєю;
- рак кардіального відділу шлунка, що за симптомами нагадує ішемічну хворобу серця.
Метастатична форма раку шлунка виявляється віддаленими метастазами раніше, ніж основною пухлиною:
- асцитична форма;
- печінкова форма (збільшення печінки, жовтяниця);
- інші форми раку шлунка.
Безсимптомний рак шлунка відмічають рідко (1–2%). Тільки детальне обстеження хворого може виявити його ознаки. Ретельне вивчення анамнезу захворювання дозволяє якщо не визначити, то, принаймні, запідозрити рак шлунка. З анамнестичних даних особливу увагу слід звернути на наявність сімейних поліпозу шлунка, гастриту (особливо із вираженою секреторною недостатністю й анемією), хвороби Менетріє, перенесених операцій з приводу виразкової хвороби або раку шлунка, злоякісних захворювань інших локалізацій, особливо шлунково-кишкового тракту. Крім того, мають насторожити зміни характеру звичного для пацієнта із хронічним захворюванням шлунка симптомокомплексу.
Необхідно пам’ятати, що кожного хворого з підозрою на рак шлунка треба ретельно дообстежити на відсутність чи наявність віддалених метастазів. Тому фізикальне обстеження пацієнта з підозрою на рак шлунка включає не тільки пальпацію органів черевної порожнини та заочеревинного простору, а й усіх груп периферичних лімфатичних вузлів. Особливу увагу звертають на надключичні та пахвові лімфовузли зліва, вагінальне та бімануальне обстеження (у жінок) та ректальне обстеження (детально див. Рак прямої кишки). Під час пальпації живота необхідно звертати увагу на наявність або відсутність асциту.
Золотим стандартом інструментального обстеження хворих з підозрою на рак шлунка є поєднання рентгенологічного, ендоскопічного та морфологічного (дослідження біоптату, отриманого при ендоскопічній гастроскопії) методів. Рентгенологічне дослідження має передувати ендоскопічному для уточнення локалізації пухлини, що дозволить ендоскопісту точніше виконати прицільну біопсію пухлини. Після верифікації ЗН шлунка для визначення поширеності процесу необхідно виконати: рентгенологічне обстеження органів грудної клітки, ультрасонографічне обстеження черевної порожнини, КТ органів черевної порожнини, малого таза та заочеревинного простору, ФКС (при неможливості — ректороманоскопію). Виконання наведеного мінімального комплексу діагностичних заходів дозволить зменшити кількість лікарських помилок, а внаслідок цього — покращити результати лікування хворих.
До недавнього часу рентгенологічне дослідження було основним методом діагностики раку шлунка. Сучасна рентгенодіагностика включає:
- туге заповнення шлунка суспензією барію сульфату;
- пасаж суспензії сульфату барію;
- методику подвійного контрастування;
- контрастне рентгенологічне обстеження із застосуванням препаратів, що розслаблюють шлункову стінку.
Найбільш важливі рентгенологічні ознаки раку шлунка:
- наявність пухлини або дефекту наповнення;
- втрата еластичності шлункової стінки в ділянці пухлини, що призводить до зменшення або повного припинення перистальтики;
- зміна рельєфу слизової оболонки в місці локалізації пухлини. У разі розпаду пухлини та утворення кратеру останній виявляється у вигляді депо.
При ендофітному раку визначають плаский дефект наповнення, що має велику протяжність і дуже невелику глибину. Стінка органа на рівні дефекту ригідна, часто без перистальтики. У разі інфільтрації стінки на обмеженій ділянці з тенденцією до циркулярного охоплення шлунка виникає деформація за типом гантелі. У разі інфільтрації малої кривини виявляють укорочення шлунка.
Зміни форми шлунка внаслідок ракової інфільтрації мають різноманітний характер і залежать від локалізації, форми і розмірів пухлини. Схематично різноманітного роду деформації можна згрупувати таким чином: 1) шлунок у формі рогу, якщо пухлина розташована на малій кривині; 2) у разі циркулярної інфільтрації нижньої третини він випрямляється і набуває форми трубки; 3) за умови розташування пухлини у верхній третині може виникнути каскадний шлунок; 4) рак, що локалізується у середній третині шлунка, призводить до деформації за типом вісімки.
Рентгенодіагностика раннього раку шлунка, безумовно, складна. Результати її повинні враховуватися у комплексі з даними, отриманими за допомогою інших клініко-інструментальних методів.
При екзофітних формах раннього раку шлунка рентгенологічно виявляють округлої або овальної форми дефекти наповнення, які мають нерівні контури. Відмічають обрив складок слизової оболонки по краях утворення, перистальтика зберігається. Під час вивчення пневморельєфу і подвійного контрастування чітко визначають ободок контрастної речовини, що обмежує пухлину.
Рентгенологічна картина ендофітної форми раку шлунка залежить від того, у якому відділі локалізується пухлина:
- у разі розташування пухлини в нижній третині шлунок нерівномірно звужений, контури його нерівні, перистальтика відсутня;
- якщо пухлина локалізується на малій кривині, визначається пласке депо контрастної речовини, що трактується як відображення виразки. Перистальтика в цій ділянці відсутня;
- розташована на великій кривині пухлина має вигляд плаского втискування контуру. Перистальтика на цій ділянці відсутня;
- пухлини середньої третини шлунка проявляють себе ригідністю його стінки, що зумовлено вираженим запаленням підлеглих шарів.
У разі виразкової форми первинного раннього раку рентгенологічна картина залежить від розмірів виразки, розмірів пухлинного валу, що супроводжує запалення, стану прилеглої слизової оболонки, локалізації пухлини.
При локалізації виразок на великій або малій кривині в середній третині шлунка визначають пласку нішу, яка не виходить за контур шлунка, із вираженим валом навколо. У половини хворих перистальтика зберігається.
Якщо пухлина локалізується у нижній третині шлунка, остання циркулярно нерівномірно звужена, мала кривина дещо скорочена; якщо ж розташована на малій кривині, визначають пласку нішу, що не виходить за контур шлунка, з конвергенцією складок слизової оболонки до неї. Стінка шлунка в цій ділянці ригідна.
Ендоскопічна діагностика набула широкого розповсюдження у зв’язку з розробкою і впровадженням у клінічну практику ендоскопів на основі волоконної оптики, які дають можливість огляду всіх відділів шлунка та одержання матеріалу для морфологічного (гістологічного, цитологічного) дослідження.
Перші ендоскопи існували ще в античні часи, що підтвердилося при розкопках Помпеї. Пилип Бозіні (Philip Bozzini) у 1805 р. сконструював «Lichtleiter» (інструмент з підсвіткою) для обстеження сечових шляхів, прямої кишки та гортані. Першу ендоскопічну гастроскопію виконав Адольф Кусмауль (Adolph Kussmaul) в 1868 р. у професійного циркового ковтача шпаг, оскільки його апарат був 47 см металевою трубкою діаметром 13 мм. У 1881 р. Іван Андрійович фон Мікулич-Радецький (Johann(es) Freiherr von Mikulicz-Radecki) створив перший гастроскоп, придатний для практичного використання. Перший гнучкий гастроскоп, який являв собою систему трубок та лінз, сконструював у 1932 р. Рудольф Шиндлер (Rudolph Schindler). У 1949 р. японська фірма «Олімпус оптикал» (зараз Olympus Corporation) почала розробку гнучкого апарата для внутрішнього обстеження шлунка та одержання фотографічних зображень його слизової оболонки. Перший працюючий прототип було створено у 1950 р. Сучасний гастродуоденоскоп — це високотехнологічний пристрій, що дозволяє оглядати, фотографувати та записувати весь процес огляду, виконувати різні маніпуляції та навіть отримувати при огляді морфологічну картину новоутворення шлунка та дванадцятипалої кишки.
Ендоскопічна картина раннього раку шлунка представлена практично цілком доброякісними, на вигляд, утвореннями (поліп, зернисте потовщення слизової оболонки шлунка; вогнищева гіперплазія, одинока, нетипово розташована «застигла» складка, ділянки ерозій, виразка).
Діагноз раннього раку часто встановлюють після морфологічного дослідження біопсійного матеріалу із зовнішньо доброякісних змін слизової оболонки шлунка. Цим повинна визначатися основа тактики під час ендоскопічного дослідження: необхідність множинного прицільного збору біоптатів усіх виявлених змін, якими б мінімальними і цілком доброякісними на вигляд вони не здавалися.
У всіх випадках виразки шлунка ретельне дослідження за допомогою прицільної біопсії дозволяє розпізнати злоякісну пухлину. Сьогодні це одне з істотних досягнень в організації протиракових заходів.
Гастроскопія з прицільною біопсією має перевагу перед рентгенологічним дослідженням у виявленні поверхневих, дуже маленьких пухлин. Водночас ендоскопічний метод поступається рентгенологічному дослідженню у виявленні підслизової інфільтрації стінки шлунка, визначенні причин і характеру деформації органа, часто зумовлених злоякісним процесом. Ці звуження і деформації можуть перешкоджати просуванню ендоскопа або просто обмежувати видимість відділів шлунка. Тому поєднане використання рентгенологічного та ендоскопічного методів дослідження є обов’язковим, оскільки дозволяє більш глибоко і точно вивчати стан шлунка.
Не всі відділи шлунка легко досягаються ендоскопом. Складність виникає у разі взяття біоптату з кардіального або антрального відділів. У разі локалізації пухлини в цих відділах щіточкова біопсія інформативна в 72,4%, тоді як щипцева — лише в 66,7%. Матеріал варто направляти як на гістологічне, так і на цитологічне дослідження. Поєднання обох цих методів дозволяє визначити морфологічний діагноз у 98,1% випадків.
У 80-ті роки XX ст. для діагностики захворювань шлунка запропонована ендоскопічна ультрасонографія. Вона дозволяє не тільки виявити стан слизової оболонки, а й вивчити підлеглі шари стінки шлунка. Особливо важлива ендоскопічна ультрасонографія для пацієнтів, яким планується проведення ендоскопічного радикального лікування з приводу раннього раку шлунка.
Діагностична цінність ендоскопічної ультрасонографії збільшується за рахунок одночасної аспіраційної біопсії. У такому разі морфологічне підтвердження можливе у 86% випадків.
Значну цінність у діагностиці поширення пухлин шлунка має КТ. Для цього дослідження шлунок щільно заповнюють контрастом. У деяких випадках виникає необхідність у застосуванні препаратів, що розслаблюють стінку шлунка, щоб виключити спазм шлункової стінки, який імітує її потовщення, оскільки останнє є одним із симптомів, що свідчать про наявність раку.
Місце КТ у діагностиці раку шлунка неоднозначне. Використання даного методу дозволяє у 91% випадків визначити операбельність, а в 90% — неможливість виконання радикальної операції. Проте можливості методу обмежені. У низці випадків результати, отримані під час цього дослідження, зумовлені доброякісними або запальними змінами, не завжди чітко диференціюються шари шлунка та суміжні тканини. Тому остаточне рішення про резектабельність приймають після лапаротомії.
Діагностична цінність МРТ у діагностиці раку шлунка вивчена недостатньо. Проте у значній кількості випадків за її допомогою вдається діагностувати проростання пухлиною шлунка суміжних органів.
Інтраопераційне УЗД дозволяє у 100% випадків визначити проростання раку шлунка в суміжні органи та в 93% випадків — ураження парааортальних лімфовузлів. Це допомагає хірургу визначити можливість та обсяг оперативного втручання хворого під час операції.
Діагностична лапароскопія дозволяє виявити дисемінацію пухлини по очеревині, яку неможливо визначити за допомогою інших досліджень. До того ж сучасні лапароскопи дозволяють виконувати біопсію вказаних дисемінантів та брати змиви з черевної порожнини для цитологічного дослідження. Крім того, лапароскопічно можна діагностувати ураження регіонарних лімфовузлів (за винятком вузлів у ділянці верхньої брижової артерії, верхнього краю підшлункової залози, гепатодуоденальної зв’язки).
Ідеального онкомаркера для виявлення раку шлунка поки не знайдено. CА 72–4 онкомаркер шлунка (вуглеводний антиген 72–4, Cа 72–4, TAG 72) — високомолекулярний глікопротеїн, компонент поверхні епітелію, експресується різними карциномами — товстої кишки, легені, яєчника, ендометрія, підшлункової залози, шлунка, молочної залози. Діагностична чутливість тесту CA 72–4 для раку шлунка становить 28–80%, в середньому 40–46%. Ступінь підвищення рівня CA 72–4 корелює зі стадією хвороби. Після радикальної операції рівень CA 72–4 нормалізується (за 3–4 тиж). Даний маркер має більшу чутливість до рецидивів раку шлунка порівняно з РЕА або СА 19–9. Поєднання усіх цих тестів підвищує діагностичну чутливість та специфічність тестування.
РЕА (в англомовній літературі — Human Carcinoembyronic Antigen (CEA)) ідентифікується у середньому у 32% хворих на рак шлунка. Нормальний рівень РEA у дорослих становить <2,5 нг/мл (для курців — <5,0 нг/мл). Частота його виявлення залежить від морфологічної форми процесу (часто відмічають на тлі високодиференційованих пухлин і значно рідше — низькодиференційованих) та поширення раку (в разі дисемінації — до 85%). Як правило, після радикального оперативного втручання рівень РЕА нормалізується. Повторне підвищення рівня РЕА корелює із продовженням хвороби. Титр РЕА >20 нг/мл, зазвичай, свідчить про дисемінацію (метастазування) процесу.
Онкомаркер Са 19–9 (раковий антиген 19–9, СА 19–9) — у нормі синтезується підшлунковою залозою та печінкою плода. При патологічних станах — клітинами пухлин підшлункової залози, печінки або шлунка. Рівень Са 19–9 — до 37 ОД/мл — норма в крові людини. Підвищення рівня Са 19–9 пов’язане з онкопатологією: раком підшлункової залози, жовчного міхура, жовчних шляхів або первинним раком печінки; раком шлунка; раком молочної залози; раком яєчника та матки. Практично всі пацієнти з показниками Са 19–9 >10 000 ОД/мл мають віддалені метастази.
КЛАСИФІКАЦІЯ РАКУ ШЛУНКА
Міжнародна класифікація раку шлунка за системою ТΝМ
Т — первинна пухлина
Тх — первинну пухлину неможливо оцінити
То — ознаки первинної пухлини відсутні
Тіs — преінвазивний рак (внутрішньоепітеліальний рак без поширення на базальну мембрану)
Т1 — пухлина інфільтрує слизовий та підслизовий шар
Т2a — пухлина проростає м’язовий шар
Т2b — пухлина проростає субсерозний шар
Тз — пухлина проростає серозну оболонку (вісцеральну очеревину) без поширення на прилеглі органи і тканини
Т4 — пухлина поширюється на суміжні структури
Примітка: пухлина може проростати м’язовий шар, проростає шлунково-товстокишкову та шлунково-печінкову зв’язки або великий, або малий сальник без перфорації вісцеральної очеревини, яка покриває ці структури. У такому разі пухлина класифікується як T2. Якщо є проростання вісцеральної очеревини, що вкриває зв’язки шлунка або сальника, то пухлина класифікується як T3.
Сусідніми структурами шлунка є селезінка, поперечна ободова кишка, печінка, діафрагма, підшлункова залоза, черевна стінка, надниркова залоза, нирки, тонка кишка, заочеревинний простір.
Внутрішньостiнкове поширення на дванадцятипалу кишку або стравохід класифікується за найбільшою глибиною інвазії у разі всіх локалізацій включно зі шлунком.
N — регіонарні лімфовузли
Регіонарними лімфатичними вузлами є лімфатичні вузли, розміщені вздовж малої та великої кривини, лівої шлункової, загальної печінкової й селезінкової артерій, черевного стовбура та гепатодуоденальні лімфовузли.
Νх — регіонарні лімфовузли неможливо оцінити
N0 — метастази в регіонарні лімфовузли відсутні
N1 — наявні метастази в 1–6 регіонарних лімфатичних вузлах
N2 — наявні метастази в 7–15 регіонарних лімфатичних вузлах
N3 — наявні метастази у більше ніж 15 регіонарних лімфатичних вузлах.
М — віддалені метастази
Мх — віддалені метастази неможливо оцінити
Мо — віддалені метастази відсутні
М1 — є віддалені метастази
рТΝМ. Патоморфологічна класифікація
Категорії рТ, рΝ, рМ відповідають категоріям Т, N, М.
рТо — матеріал для гістологічного дослідження після регіонарної лімфодисекції повинен включати не менше ніж 15 лімфовузлів
G — гістопатологічна градація
Gх — ступінь диференціації неможливо визначити
G1 — високий ступінь диференціації
G2 — проміжний ступінь диференціації
G3 — низький ступінь диференціації
G4 — недиференційована пухлина
Групування за стадіями представлено в табл. 10.1.
Таблиця 10.1
Класифікація раку шлунка за стадіями
|
Стадія 0 |
Тіs |
N0 |
М0 |
|
Стадія ІА |
Т1 |
N0 |
М0 |
|
Стадія ІБ |
Т1 |
N1 |
М0 |
|
Т2a, Т2b |
N0 |
М0 |
|
|
Стадія II |
Т1 |
N2 |
М0 |
|
Т2а, Т2b |
N1 |
М0 |
|
|
T3 |
N0 |
М0 |
|
|
Стадія ПІА |
Т2а, Т2Ь |
N2 |
М0 |
|
T3 |
N1 |
М0 |
|
|
Т4 |
N0 |
М0 |
|
|
Стадія IIIБ |
T3 |
N2 |
М0 |
|
Стадія IV |
Т4 |
Ν1, N2, N3 |
М0 |
|
Т1, Т2, Тз |
N3 |
М0 |
|
|
Будь-яке Т |
Будь-яке N |
М1 |
Оскільки Японія досягла значних успіхів у профілактиці та лікуванні раку шлунка, вважаємо за доцільне навести Японську класифікацію.
За анатомічною локалізацією прийнято поділяти шлунок на верхню (С), середню (М) та нижню (А) третини. Якщо пухлина охоплює більше ніж один анатомічний відділ, поширення на відділи шлунка позначається двома (або трьома) літерами.
Ступінь проростання шлункової стінки позначається малими латинськими літерами:
ss — інфільтрація субсерозного шару
sе — ракові клітини розташовані на серозній оболонці та контактують із черевною порожниною
sі — ракові пухлини поширюються на сусідні органи та тканини
sеі — комбінація sе та sі
Ступінь дисемінації по очеревині позначається наступним чином:
Р0 — дисемінація відсутня
Р1 — дисемінація на прилеглій очеревині вище від поперечної ободової кишки
Р2 — окремі ділянки дисемінації на віддалених ділянках очеревини
Р3 — множинна дисемінація по очеревині
Наявність метастазів у регіонарні лімфатичні вузли позначається символом N (як і в міжнародній класифікації), проте підхід до класифікації дещо інакший:
Ν0 — метастази відсутні
Ν1 — метастази в лімфовузли І групи (перигастральні лімфовузли)
N2 — метастази в лімфовузли II групи (лімфовузли вздовж лівої шлункової, загальної печінкової, селезінкової артерій та черевного стовбура)
N3 — метастази в лімфовузли ІІІ групи (лімфовузли гепатодуоденальної зв’язки, позаду головки підшлункової залози, біля кореня брижі поперечної ободової кишки (у разі локалізації пухлини в нижній третині вузли вздовж селезінкової артерії належать до ІІІ групи)
N4 — метастази в лімфовузли IV групи (лімфовузли вздовж верхньої брижової артерії та парааортальні вузли)
ДИФЕРЕНЦІЙНА ДІАГНОСТИКА
Захворювання, з якими необхідно диференціювати рак шлунка, можна розділити на дві групи: 1) захворювання шлунка; 2) захворювання, не пов’язані зі шлунком. До першої відносять виразкову хворобу, різноманітні форми гастриту, перигастрит, доброякісні новоутворення (ліпома, міома, фіброма тощо), поліпи, туберкульоз, сифіліс, до другої — пухлини та кісти печінки, підшлункової залози, заочеревинні пухлини та новоутворення поперечної ободової кишки.
Основне значення у диференційній діагностиці раку шлунка і зазначених захворювань, крім анамнезу, даних фізикального і лабораторного обстеження, мають рентгенологічне дослідження (в тому числі КТ), ультразвукове сканування печінки, гастроскопія з прицільною біопсією, цитологічне дослідження промивних вод шлунка та ексфоліативна біопсія, лапароскопія. Ретельний аналіз даних дозволяє уникнути помилкових висновків. Заключним етапом діагностики в незрозумілих випадках повинна бути лапаротомія.
До ускладнень раку шлунка відносять кровотечу, перфорацію, перитоніт, стеноз антрального та кардіального відділів шлунка.
ЛІКУВАННЯ
Головним є хірургічний метод, адекватність обсягу якого, головним чином, впливає на прогноз захворювання. На кінець XX ст. сформувалися дві основні тенденції у лікуванні раку шлунка. У хворих з ранніми стадіями раку шлунка адекватним є ендоскопічне видалення пухлини або ОЗО. У хворих із розповсюдженим раком виконують розширені, комбіновані та суперрозширені операції з(без) перед- і післяопераційними курсами хіміотерапії.
Ендоскопічне видалення пухлин показано лише в разі розташування пухлини в слизовому та підслизовому шарах. І хоча випадки виникнення рецидиву після даного втручання дуже рідкісні, варто сказати, що цей метод є новим і віддалені його результати ще невідомі.
В останні роки з метою зменшення післяопераційних ускладнень після хірургічного лікування при раку шлунка в початкових стадіях (Тis, Т1, Т2) розроблені ОЗО. Це клиноподібна резекція шлунка, антрумектомія, резекція шлунка зі збереженням пілоричного відділу та блукаючих нервів та ін. Проте, оскільки на даний час немає результатів мультицентрових рандомізованих досліджень, вказані методики не можуть бути рекомендованими для використання як стандартні.
Для лікування хворих на рак шлунка виконують такі радикальні оперативні втручання: субтотальна дистальна резекція, субтотальна проксимальна резекція, гастректомія. Показанням до виконання дистальної субтотальної резекції шлунка є екзофітна (або невелика інфільтративна) пухлина, що не виходить за межі нижньої третини шлунка. Проксимальна субтотальна резекція шлунка може бути виконана при екзофітній пухлині верхньої третини шлунка без переходу пухлини на кардіальний жом або стравохід. Це зумовлено тим, що ранній рак, розташований у верхній третині шлунка, не метастазує в над- та підворотарні лімфатичні вузли, які не видаляються під час цієї операції. У разі екзофітної пухлини лінія резекції шлунка в проксимальному напрямку має проходити на відстані 3–5 см, а інфільтративної — 8–10 см від краю пухлини. Дистальна межа резекції має бути на відстані від пухлини не меншій ніж 3 см від краю пухлини, в усіх інших випадках показане виконання (тотальної) гастректомії. Порушення наведених принципів призводить до залишення пухлинної тканини по лінії резекції шлунка, виникнення раннього рецидиву кукси та смерті хворого протягом року після операції.
Засновником шлункової хірургії по праву вважається Теодор К.А. Більрот (Christian Albert Theodor Billroth (1829–1894)). Проте, ще у 1810 р. Д.К.Т. Мерем (Daniel Karl Theodor Merrem) виконав резекцію пілоричної частини шлунка з накладанням гастродуоденоанастомозу на собаці. У хворого на рак шлунка вперше подібні операції були проведені Жюлем Пеаном (Jules E. Pean) у 1879 р. та Людвіком Рібігером (Ludwik Rybygier) у 1880 р., проте операції закінчилися смертю хворих. 29 січня 1881 р. Т. Більротом вперше виконана успішна резекція нижньої третини шлунка з накладанням гастродуоденоанастомозу (зараз метод має назву Більрот-І). Хвора прожила 4 міс після операції та померла від прогресування раку. Інший тип анастомозу, зараз відомий як метод Більрот-ІІ (гастроентероанастомоз із попереднім зашиванням кукси дванадцятипалої кишки) запропонував у 1881 р. Антон Вольфлер (Anton Wölfler). Дуже поширений, проте мало придатний в онкологічній практиці спосіб формування гастроентероанастомозу, названий за Гофмейстером — Фінстерером (Hans Finsterer, Franz von Hofmeister), був, насправді, запропонований А. Айзельбергом (Anton Freiherr von Eiselsberg) у 1888 р. На даний час існує велика кількість модифікацій оперативних втручань. Проте найбільш адекватною для онкологічних хворих залишається модифікація канадського хірурга Дональда Ч. Бальфура (Donald Church Balfour). Вона полягає у накладенні переднього попереду ободового гастроентероанастомозу на довгій петлі з міжкишковим анастомозом. При цьому залишається можливість виконання реконструктивного втручання у разі виникнення рецидиву раку у куксі шлунка.
Радикальність операції при раку шлунка напряму залежить від обсягу лімфодисекції. Проста лімфодисекція (рівень D0) не передбачає проведення останньої, тому a priori не є онкологічною операцією. Стандартна лімфодисекція (D1) передбачає видалення тільки перигастральних лімфовузлів шлунка (№ 1–6), тому її радикалізм більшістю сучасних авторів піддається сумніву. Стандартна радикальна лімфодисекція (D2) передбачає, крім лімфовузлів № 1–6, обов’язкове видалення заочеревинних лімфовузлів по ходу черевного стовбура (№ 9) та його гілок — лівої шлункової (№ 7), загальної печінкової (№ 8), селезінкової артерій (№ 11), лімфовузлів воріт селезінки (№ 10) (див. рис. 10.2). За даними проведених досліджень, при лімфодисекції D2 необхідно видалити та дослідити не менше 26–27 лімфовузлів, інакше втручання відповідатиме обсягу D1. На IV Міжнародному конгресі з раку шлунка та на ХVІІІ Всесвітньому конгресі з хірургії шлунково-кишкового тракту обсяг лімфодисекції D2 визначено як стандартний при радикальному хірургічному лікуванні хворих на рак шлунка, оскільки вірогідно знижує частоту рецидивів та покращує віддалені результати лікування.
Під час розширеної радикальної лімфодисекції (D3), крім видалення груп лімфатичних колекторів № 1–11, видаляють лімфатичні вузли гепатодуоденальної зв’язки (№ 12), ретропанкреатодуоденальні (№ 13), вздовж верхньої брижової артерії (№ 14), по ходу середньої ободової артерії (№ 15), парааортальні лімфовузли на рівні черевного відділу аорти (№ 16). При лімфодисекції D3 кількість видалених (та досліджених) лімфовузлів має становити більше 40 (43–48).
Об’єктивізувати вибір обсягу лімфодисекції дозволяє дослідження сигнального (сторожового) лімфатичного вузла, який першим отримує лімфу від пухлини. Методика його визначення включає введення водного розчину метиленового синього у перитуморальну зону, витримка експозиції (близько 10–15 хв), видалення та термінове морфологічне дослідження зафарбованих лімфовузлів.
У разі дифузно-інфільтративної пухлини розміром понад 8 см в діаметрі, пухлини верхньої та/або середньої третини шлунка, що проростає серозну оболонку, пухлини, що займає задню стінку шлунка, існує значний ризик пухлинної дисемінації по очеревині при розкритті сальникової сумки. Доцільним є виконання евісцерації верхньо-лівого квадранту черевної порожнини, що включає повне видалення сальникової сумки — оментобурсектомія (Щепотін І.Б., 2000). При вростанні або приляганні пухлини шлунка до парієнтальної очеревини необхідне виконання перитонектомії з метою попередження пухлинної дисемінації по черевній порожнині. Обсяг хірургічного втручання слід встановлювати до початку операції на основі детального обстеження и не змінювати в бік його зменшення після ревізії черевної порожнини, оскільки дані пальпації шлунка не завжди співпадають з межами дійсного ураження і можуть вводити в оману навіть досвідчених лікарів.
Виконання паліативних операцій у хворих на рак шлунка дещо продовжує життя хворих, покращує його якість, позбавляючи тяжких відчуттів.
Для відновлення пасажу їжі або профілактики стенозу при раку шлунка виконують два типи симптоматичних операцій: формування обхідних анастомозів і живильних нориць. Проте їх доцільність, враховуючи сучасний розвиток анестезіологічного забезпечення та інтенсивної терапії, а також можливості виконання паліативних або умовно радикальних втручань сумнівна.
Променеве лікування
Враховуючи високу рухомість органа та відносну радіорезистентність аденокарциноми шлунка, променеве лікування при даній патології має дуже обмежене застосування. Променева терапія на даний час не стала стандартним методом лікування раку шлунка (за винятком раку кардіального відділу) через високий рівень ускладнень та відсутність достовірних даних про її ефективність у комбінованому лікуванні. За останні 30 років неодноразово досліджували доцільність проведення променевої терапії як в неоад’ювантному, так і в ад’ювантному режимах при раку шлунка, проте в жодному з них не виявлено достовірного підвищення виживаності. Однак обнадійливі результати її застосування в ряді спеціалізованих клінік диктують необхідність подальшого пошуку більш ефективних схем лікування та проведення рандомізованих досліджень для підтвердження їх клінічної ефективності. Таким чином, поки що проведення променевої терапії при лікуванні раку шлунка вважається недостатньо аргументованим.
Хіміотерапія
Ад’ювантній хіміотерапії раку шлунка присвячена величезна кількість досліджень, проведених в багатьох країнах світу. Проте дотепер питання про її ефективність у комбінованому лікуванні раку шлунка залишається відкритим через значну суперечливість результатів лікування. Це викликано тим, що на результати ад’ювантної хіміотерапії може впливати велике число чинників — правильний вибір препаратів і їх дозування, час початку курсу лікування після оперативного втручання, радикальність оперативного втручання, відмінності у визначенні стадії пухлини і проведенні статистичної обробки результатів.
Однією з основних відмінностей у підходах до ад’ювантної хіміотерапії є різний термін початку проведення лікування після оперативного втручання. В Японії курс ад’ювантної хіміотерапії призначають практично всім хворим з дня оперативного втручання, тоді як в США і Європі — зазвичай через 6–8 тиж. Час початку хіміотерапії є істотним для ефективності лікування і покращання віддалених результатів. Відомо, що час подвоєння об’єму раку шлунка в людському організмі зазвичай становить 40–80 днів. Таким чином, до початку курсу хіміотерапії через 6 тиж після операції кількість резидуальної пухлинної тканини подвоюється, що надалі позначається на результатах лікування. Крім того, в США і Європі проводиться переважно внутрішньовенна системна ад’ювантна хіміотерапія, спрямована в основному на профілактику виникнення гематогенних метастазів в печінку. В Японії більш широко застосовують альтернативні способи введення хіміопрепаратів (внутрішньоочеревинне, внутрішньоартеріальне, пероральне), спрямовані в основному на профілактику лімфогенних метастазів і дисемінації пухлини в черевній порожнині. Істотні відмінності у визначенні стадії раку шлунка ускладнюють порівняння результатів застосування ад’ювантної хіміотерапії раку шлунка в Японії, з одного боку, і в США і європейських країнах — з іншого.
Таким чином, на даний час в США і Європі, як і в Японії, відсутні переконливі дані про ефективність ад’ювантної внутрішньовенної ПХТ. Більш перспективною в лікуванні раку шлунка є передопераційна суперселективна внутрішньоартеріальна хіміотерапія і післяопераційна внутрішньочеревна ПХТ, застосування яких в комбінованому лікуванні дозволило збільшити виживаність хворих порівняно із застосуванням рутинної внутрішньовенної хіміотерапії та хірургічного лікування (Щепотін І.Б., 2000). Проте кожна з цих методик має свої недоліки. Так, при застосуванні передопераційної суперселективної внутрішньоартеріальної хіміотерапії не вдається впливати на вільні ракові клітини, що залишаються в черевній порожнині після оперативного втручання, а також впливати на метастази пухлини по очеревині. Видається логічним в майбутньому провести рандомізоване дослідження з вивчення комбінованого застосування цих двох методів.
Як правило,використовують ПХТ, що призначається в таких режимах:
- неоад’ювантна — можлива як системна, тобто внутрішньовенне введення, так і внутрішньоартеріальна;
- ад’ювантна після радикальних оперативних втручань;
- паліативна (при неоперабельних пухлинах та після нерадикальних операцій).
Враховуючи подібність схем та препаратів, більш детальний опис хіміо- та імунотерапії представлено у розділі «Колоректальний рак».
ЛІКУВАННЯ РЕЦИДИВІВ ТА МЕТАСТАЗІВ
Частота місцевих рецидивів залежить від адекватності оперативного втручання та, залежно від клініки, коливається від 20 до 40%; середня тривалість життя хворих з рецидивом — 14 міс. Повторна радикальна операція можлива приблизно у 25% хворих із рецидивом. Загалом, через рецидив раку шлунка помирають 20–30% хворих із цією патологією.
Метастази в печінку становлять понад 60% всіх віддалених метастазів раку шлунка. Поодинокі та локалізовані множинні метастази можуть бути видалені шляхом сегменторієнтованої (анатомічної) резекції печінки, електрохімічного лізису, а також високочастотної абляції.
Метастази в легені виявляють у 5–7% хворих на рак шлунка. Хірургічне лікування доцільне у випадку солітарних метастазів та полягає у атипових або клиновидних резекціях легені.
Дисемінацію по очеревині відмічають досить часто. В цих випадках методом вибору є внутрішньоочеревинне введення хіміопрепаратів. При множинних метастазах у внутрішні органи доцільна лише системна хіміотерапія. Середня тривалість життя таких хворих не перевищує 6 міс.
УСКЛАДНЕННЯ ЛІКУВАННЯ
Безпосередні результати радикальних хірургічних втручань з приводу раку шлунка не можна вважати задовільними через високу частоту виникнення післяопераційних ускладнень і летальності. У Великобританії післяопераційна летальність після субтотальної резекції становить 13%, а після гастректомії — 29%. При цьому у хірургів, що оперують не більше 10 хворих з раком шлунка на рік, післяопераційна летальність становить 22%.
Загалом післяопераційні ускладнення можна розділити на первинні, тобто викликані оперативним втручанням, і вторинні, що розвинулися в результаті дисфункції органа та/або системи під впливом операції. Найгрізнішими первинними ускладненнями, які часто викликають необхідність виконання повторних оперативних втручань, є неспроможність анастомозів, некроз підшлункової залози, абсцеси черевної порожнини, кровотеча, формування зовнішньої нориці.
Недостатність стравохідного анастомозу, незважаючи на значні успіхи в хірургії, у ряді клінік виявляють у 4–18% випадків (Shchepotin І.В. et al.,1996).
Післяопераційні кровотечі, як правило, виникають внаслідок технічних вад операції. Післяопераційні панкреатит та панкреонекроз розвиваються в результаті дії комплексу причин: інфікування та травмування підшлункової залози при грубих маніпуляціях під час операції, порушення відтоку соку підшлункової залози в результаті післяопераційного набряку або механічного пошкодження протоки підшлункової залози. Гнійно-септичні ускладнення (піддіафрагмальний та підпечінковий абсцеси, первинний перитоніт та ін.) також зумовлюються рядом причин, основні з яких — системного характеру, та порушенням техніки операції.
У разі недостатності стравохідного анастомозу або його перфорації необхідно ушити дефект і провести за анастомоз зонд для ентерального живлення. Зазвичай нориці анастомозу мають тенденцію до самостійного закриття, тому основні заходи під час релапаротомії повинні зводиться до адекватного дренування, недопущення потрапляння кишкового вмісту у вільну черевну порожнину і забезпечення ентерального живлення через зонд. Медикаментозне лікування включає застосування антибактеріальної терапії, інгібіторів протеолізу, поліпшення мікроциркуляції й адекватного знеболення. При виникненні внутрішньочеревної кровотечі необхідно виявити джерело, після чого судину перев’язують. Якщо джерело кровотечі після ретельної ревізії черевної порожнини не виявлено, то крім гемотрансфузії (у разі абсолютних показань) проводять інтенсивне консервативне лікування ДВЗ-синдрому.
Одним зі складних ускладнень хірургічного лікування раку шлунка є розвиток нориць дванадцятипалої кишки, кукси шлунка, підшлункової залози. Прогноз при нориці шлунка або дванадцятипалої кишки залежить від кількості ексудату, що виділяється. Післяопераційна летальність при виділенні з нориці >200 мл вмісту за добу може досягати 38–45%. Лікування гастродуоденальних нориць може бути медикаментозним, ендоскопічним і хірургічним. У 90% випадків нориці закриваються самостійно при адекватному живленні і медикаментозному лікуванні. Доведена висока ефективність застосування соматостатину або його синтетичного аналога октреотиду ацетату в поєднанні з повним парентеральним живленням при норицях дванадцятипалої кишки.
Перший досвід лікування нориць введенням фібринових губок через эндоскоп продемонстрував обнадійливі результати.
Нориці підшлункової залози після операцій з приводу раку шлунка частіше виникають в результаті грубого порушення техніки операції. Існує 3 види лікування нориць підшлункової залози: медикаментозний, ендоскопічний і хірургічний. Більше ніж у 80% хворих нориці підшлункової залози закриваються спонтанно в результаті медикаментозного лікування. При застосуванні соматостатину або його синтетичного аналога октреотиду період закриття нориць вдається скоротити до 7 діб, тоді як при лікуванні без нього тривалість його становить в середньому 32 доби. Можливість застосування ендоскопічного методу для лікування нориць підшлункової залози знаходиться в процесі вивчення. Хірургічне лікування нориць підшлункової залози показане в тих випадках, коли всі методи консервативного лікування виявилися неефективними. Операцією вибору є внутрішнє дренування за допомогою накладення панкреато-єюноанастомозу за Roux.
Своєчасно виконані термінові повторні оперативні втручання дозволяють врятувати близько 40% хворих, у яких розвинулися тяжкі післяопераційні ускладнення. Тому у кращих медичних центрах післяопераційна летальність у хворих з цією патологією не перевищує 3%.
РЕЗУЛЬТАТИ ЛІКУВАННЯ
Загалом 5-річна виживаність хворих на рак шлунка становить 20–30%. При початкових стадіях цей показник сягає понад 70%. На жаль, кількість хворих, у яких рак шлунка виявлено на ранніх стадіях, дуже незначна. Приблизно половина хворих з ІІ стадією раку шлунка живуть 5 і більше років. У хворих із ІІІ стадією раку шлунка показник 5-річної виживаності не перевищує 30%. А при IV стадії раку шлунка тільки 5% хворих переживають 5-річний термін.
ПРОФІЛАКТИКА
Первинна профілактика базується на епідеміологічних дослідженнях. Враховуючи роль Н. руlоrі у виникненні раку шлунка, були зроблені спроби широкого виявлення та лікування носіїв цієї інфекції для запобігання виникненню хвороби. Проте результати проведених досліджень свідчать, що у 80% пацієнтів після ерадикації Н. руlоrі результати лікування були незадовільними, оскільки зберігався диспептичний синдром і жодне конкретне захворювання не виліковувалося. Тому було визнано економічно недоцільним проведення масштабного серологічного тестування та антибактеріального лікування хворих з диспепсією.
На майбутнє вважається перспективним створення людської анти-Н.руlоrі вакцини, яка, вірогідно, буде давати триваліший та надійніший ефект, ніж антибактеріальне лікування.
Значних успіхів у профілактиці раку шлунка можна досягти покращанням соціально-економічної ситуації у країнах, що розвиваються, та шляхом оптимізації характеру і ритму харчування.
Американська протиракова спілка розробила такі рекомендації оптимального харчування для профілактики раку шлунка:
- підтримання оптимальної маси тіла, заняття спортом;
- вживання різних продуктів харчування;
- щоденне вживання овочів та фруктів (5 та більше різновидів);
- вживання продуктів із підвищеним вмістом клітковини;
- зменшення вживання жирів;
- обмеження вживання алкогольних напоїв;
- обмеження вживання в’ялених, копчених та консервованих за допомогою нітратів продуктів.
Дослідження Американського інституту раку визначили зв’язок між дієтою та ризиком виникнення раку шлунка. Встановлено, що рак шлунка рідше відмічають у людей, харчовий раціон яких містить, поряд із м’ясними і молочними продуктами, велику кількість овочів та фруктів, багатих на вітаміни А, С та Е. До них належать морква, обліпиха, шипшина, смородина, цитрусові, шпинат, перець, цибуля, гарбуз, кріп, петрушка, квасок тощо. Вважають, що вітамін А та ретиноїди перешкоджають накопиченню канцерогенів і зменшують їх вплив на клітини. Механізм сприятливого впливу аскорбінової кислоти пояснюють гальмуванням утворення нітрозамінів. Крім характеру харчування, надають значення вмісту мікроелементів. Істотним засобом профілактики раку шлунка є відмова від паління і зловживання алкоголем. На основі даних досліджень розроблені рекомендації щодо профілактичного харчування:
- щоденно вживати не менше ніж 5 різних видів городини та овочів. Рослинна їжа повинна забезпечувати потреби організму в енергії на 45–60%;
- вживання червоного м’яса має бути обмеженим; жири та олії повинні забезпечувати не більше ніж 30% енергетичної потреби організму;
- м’ясо та рибу слід готувати за невисокої температури, значно обмежити вживання смажених страв;
- не допускати як перевищення, так і значного зменшення маси тіла. У середньому віці маса не повинна перевищувати таку в молоді роки більше ніж на 5–6 кг;
- регулярні щоденні 1-годинні прогулянки або щоденні 1-годинні інтенсивні заняття спортом сприяють значному зниженню ризику захворювання на рак, особливо товстої кишки.
Заходи профілактики спрямовані також на своєчасну діагностику, адекватне лікування та диспансерне спостереження передракових станів. Важливим напрямком теоретично міг би стати скринінг цих захворювань, проте ефективність та доцільність останнього на даний час не доведена.
СИТУАЦІЙНІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Хворий віком 47 років скаржиться на збільшення лівих надключичних лімфатичних вузлів протягом 3 міс. Пальпаторно останні до 2,5 см, кам’янистої щільності, практично нерухомі, інші групи вузлів — не змінені. Про яку патологію треба думати в першу чергу:
А. Рак печінки
В. Рак шлунка
С. Рак язика
D. Лімфогранулематоз
Е. Рак щитоподібної залози
2. Хвору на рак шлунка з тотальним ураженням та профузною кровотечею госпіталізовано до хірургічного стаціонару загального профілю. Тактика ведення цієї хворої у відділенні:
А. Переведення до спеціалізованого (онкологічного) лікувального закладу
В. Термінове оперативне втручання (перев’язка лівої шлункової артерії)
С. Термінове оперативне втручання (гастректомія)
D. Консервативне ведення, гемотрансфузія
Е. Динамічне спостереження
3. Хворий віком 37 років скаржиться на значне зменшення маси тіла, шлунковий дискомфорт, слабкість протягом 7 міс. Про яку патологію треба думати в першу чергу:
А. Лімфогранулематоз
В. Рак шлунка
С. Рак товстої кишки
D. Гострий лімфаденіт
Е. Рак слизової оболонки порожнини рота
4. У хворої на рак шлунка на 4-ту добу після гастректомії несподівано відмічено підвищення температури тіла до 39,4 °С, біль в лівій половині живота, мутні виділення по дренажу, лейкоцитоз до 12 Т/л, «зсув лейкоцитарної формули вліво». Тактика ведення цієї хворої у відділенні:
А. Виконання обзорної рентгенографії, сонографії, за можливості — КТ органів черевної порожнини, після чого встановлюють лікувальну тактику В. Термінове оперативне втручання
С. Туалет дренажів
D. Консервативне ведення, гемотрансфузія
Е. Місцево — холод, динамічне спостереження
5. Хворий віком 53 роки після субтотальної дистальної резекції шлунка за Б-ІІ з бурсектомією та лімфодисекцією за Д2, скаржиться на лихоманку до 38 °С, оперізувальний біль у животі. Про яке ускладнення треба думати в першу чергу:
А. Недостатність анастомозу
В. Кровотеча з анастомозу
С. Недостатність кукси дванадцятипалої кишки
D. Гострий панкреатит
Е. Гострий ентерит
6. Хвора віком 77 років звернулася в районну поліклініку зі скаргами на слабкість, шлунковий дискомфорт, біль в епігастрії. При фізикальному обстеженні відмічено істеричність склер, в епігастральній ділянці пальпується щільне малорухоме утворення, печінка виступає з-під краю реберної дуги, неболюча, край її бугристий, ущільнений. Про яку патологію треба думати в першу чергу:
А. Гепатоцелюлярний рак
В. Рак шлунка, метастази в печінку
С. Рак поперечно-ободової кишки
D. Хронічний копростаз
Е. Пухлина заочеревинного простору
7. У хворого віком 37 років під час радикального оперативного втручання з приводу раку шлунка при морфологічному дослідженні виявлені метастази в сигнальні лімфатичні вузли. Який мінімальний обсяг лімфодисекції має бути виконано:
А. Д0
В. Д1
С. Д2
D. Д3
Е. Немає різниці
8. Хворий віком 47 років скаржиться на збільшення лівих надключичних лімфатичних вузлів протягом 3 міс. Пальпаторно останні до 2,5 см, кам’янистої щільності, практично нерухомі, інші групи вузлів — не змінені. Яке обстеження треба виконати першим:
А. Ексцизійну біопсію надключичного лімфовузла
В. Інцизійну біопсію надключичного лімфовузла
С. Сонографічне обстеження лівої надключичної ділянки
D. ФГДС
Е. Рентгенологічне обстеження надключичних ділянок
9. Хворий віком 37 років поступив в спеціалізовану онкологічну клініку з діагнозом «рак нижньої третини шлунка І стадія Т2NхМ0, 2-га клінічна група». При обстеженні в нижній третині шлунка — до 2 см діаметром блюдцеподібне утворення. Який рекомендований обсяг оперативного втручання?
А. Гастректомія
В. Дистальна субтотальна резекція шлунка
С. Проксимальна субтотальна резекція шлунка
D. Розширена гастректомія
Е. Гастропанкреатодуоденальна резекція
10. Хвора віком 77 років звернулася в районну поліклініку зі скаргами на слабкість, шлунковий дискомфорт, біль в епігастрії. При фізикальному обстеженні відмічено істеричність склер, в епігастральній ділянці пальпується щільне малорухоме утворення, печінка виступає з-під краю реберної дуги, неболюча, край її бугристий, ущільнений. Які обстеження необхідні в першу чергу:
А. Ретроградна панкреатохолангіографія
В. ФГДС
С. Радіоізотопне сканування підшлункової залози
D. ФКС
Е. Оглядова рентгенографія органів черевної порожнини
11. Хворий віком 37 років поступив в спеціалізовану онкологічну клініку з діагнозом «рак верхньої третини шлунка І стадія Т2NхМ0, 2-га клінічна група». При обстеженні у верхній третині шлунка — до 2 см діаметром блюдцеподібне утворення. Який рекомендований обсяг оперативного втручання?
А. Гастректомія
В. Дистальна субтотальна резекція шлунка
С. Проксимальна субтотальна резекція шлунка
D. Розширена гастректомія
Е. Гастропанкреатодуоденальна резекція
12. Хвора віком 77 років звернуласся в обласний онкологічний диспансер зі скаргами на слабкість, шлунковий дискомфорт, біль в епігастрії. При фізикальному обстеженні відмічено істеричність склер, в епігастральній ділянці пальпується щільне малорухоме утворення, печінка виступає з-під краю реберної дуги, неболюча, край її бугристий, ущільнений. Встановлено діагноз «рак верхньої та середньої третин шлунка ІV стадія Т4NхМ1(НЕР) 2-га клінічна група». Рекомендоване лікування:
А. Паліативна гастректомія
В. Комбінована гастректомія з гепатектомією та трансплантацією печінки
С. Паліативна хіміотерапія
D. ПТ на шлунок та печінку
Е. Симптоматичне лікування
13. Під час оперативного втручання у хворої віком 46 років з приводу раку шлунка виявлено дисемінацію пухлини по парієтальній та вісцеральній очеревині черевної порожнини та малого таза. Який метод ад’ювантної терапії найбільш доцільний:
А. Внутрішньоартеріальна хіміотерапія
В. Системна хіміотерапія
С. Внутрішньоочеревинна хіміотерапія
D. ПТ
Е. Ад’ювантна терапія недоцільна
14. Через 15 міс після радикального лікування з приводу раку шлунка ІІ стадії рТ3N0М0 хворий відмічає важкість у правому підребер’ї. Про яку патологію треба думати в першу чергу:
А. Післяопераційний гепатит
В. Метастази в печінку при раку шлунка
С. Післяопераційний панкреатит
D. Післяопераційний ентерит
Е. Дисемінація раку шлунка по очеревині
15. Хвора віком 37 років обстежується в обласному онкодиспансері з приводу раку шлунка. Під час обстеження виявлено збільшення обох яєчників, невелику кількість випоту в малому тазу. Яка причина вказаних змін найімовірніша:
А. Рак обох яєчників
В. Рак шлунка, метастази в яєчники
С. Реактивний аднексит
D. Рак тіла матки з переходом на яєчник
Е. Немає вірної відповіді
16. Хворий віком 37 років скаржиться на значні шлунковий дискомфорт, похудіння, слабкість протягом 5 міс. При ректальному обстеженні пальпується щільне утворення, що ззовні стискає пряму кишку. Про яку патологію треба думати в першу чергу:
А. Лімфогранулематоз з ураженням параректальних лімфатичних вузлів
В. Рак шлунка, дисемінація по очеревині малого таза
С. Рак прямої кишки
D. Рак передміхурової залози
Е. Рак сечового міхура
17. Хворий віком 57 років поступив в спеціалізовану онкологічну клініку з діагнозом «рак середньої третини шлунка І стадія Т2NхМ0, 2-га клінічна група». При обстеженні в середній третині шлунка — до 2 см діаметром блюдцеподібне утворення. Який рекомендований обсяг оперативного втручання:
А. Гастректомія
В. Дистальна субтотальна резекція шлунка
С. Проксимальна субтотальна резекція шлунка
D. Розширена гастректомія
Е. Гастропанкреатодуоденальна резекція
18. У хворого віком 37 років після виконання поліпектомії шлунка (множинні аденоматозні поліпи, розмірами від 0,5 до 2 см, розташовані в нижній третині шлунка) отримано гістологічне заключення — малігнізація поліпа. Яка оптимальна тактика ведення хворого:
А. Спостереження
В. Оперативне лікування
С. Хіміотерапевтичне лікування
D. Променеве лікування
Е. Ендоскопічна деструкція ділянок розташування поліпів
19. Хворий віком 67 років, в анамнезі (15 років тому) стовбурова ваготомія з пілоропластикою з приводу виразкової хвороби шлунка, звернувся до районної поліклініки з «рецидивом виразкової хвороби» (зі слів хворого). Про яку патологію треба думати в першу чергу:
А. Рецидив виразкової хвороби
В. Рак шлунка
С. Демпінг-синдром
D. Загострення хронічного панкреатиту
Е. Немає вірної відповіді
20. У хворого віком 44 роки після виконання поліпектомії шлунка (множинні аденоматозні поліпи, розмірами від 0,5 до 2 см, розташовані в нижній третині шлунка) отримано гістологічне заключення — малігнізація поліпа. Які інструментальні методи обстеження необхідні:
А. ФКС
В. Радіоізотопне обстеження печінки
С. Оглядова рентгенографія органів черевної порожнини
D. МРТ шлунка
Е. Повторне ендоскопічне обстеження ділянок розташування поліпів та виконання їх біопсії
Шаблон відповідей
|
1 |
B |
11 |
C |
|
2 |
C |
12 |
E |
|
3 |
B |
13 |
E |
|
4 |
A |
14 |
B |
|
5 |
D |
15 |
B |
|
6 |
B |
16 |
B |
|
7 |
C |
17 |
A |
|
8 |
D |
18 |
E |
|
9 |
B |
19 |
B |
|
10 |
B |
20 |
E |