Глава 5. Дослідження опорно-рухового апарату
Своєчасна діагностика захворювань суглобів — крок до успішного лікування. Нозологічний діагноз у більшості випадків базується на типових щодо певного ревматичного захворювання особливостях суглобового синдрому, екстраартикулярних проявах, лабораторних та інструментальних методах дослідження. Клінічне дослідження суглобів дозволяє виявити об’єктивні ознаки хвороби, здатні допомогти розпізнати нозологічну належність ревматичної хвороби, її локалізацію, стадію розвитку, ступінь порушення функції суглобів, моніторувати й оцінити якість лікування. Від знань лікаря, володіння практичними навичками, ретельності й точності дослідження суглобів значною мірою залежить своєчасність та правильність встановлення діагнозу, ефективність лікування. Так, оцінку прогресування та ефективність лікування РА проводять, ураховуючи динаміку клінічних симптомів за індексом оцінки активності РА (DAS чи DAS28) та Стенфордської анкети оцінки здоров’я (HAQ).
Методика дослідження суглобів включає: огляд, пальпацію, вимірювання кінцівок та суглобів, визначення ступеня рухливості суглобів.
Дослідження суглобів фактично починається з тієї миті, коли лікар вперше бачить хворого. Спостереження за ходою, поставою, рухами хворого дає загальне уявлення про зміни та функціональні можливості опорно-рухового апарату, а іноді допомагає встановити діагноз. Помітне накульгування — «качина хода» з’являється при коксартрозі.
Дослідження суглобів проводять, якщо дозволяє стан опорно-рухового апарату, в положенні хворого стоячи, лежачи та під час руху. Якщо досліджують пацієнта в положенні лежачи, він повинен зручно лежати на твердій кушетці, щоб м’язи його були розслаблені.
Огляд
Під час огляду суглобів звертають увагу на:
1) симетричність тіла;
2) довжину кінцівки та її частин відносно іншої;
3) зміну форми та контурів суглобів, форми кісток кінцівок;
4) зміну контурів у місцях розміщення сухожиль та синовіальних сумок;
5) стан м’язів кінцівок;
6) стан шкіри в ділянці суглоба, стан нігтів.
Огляд зазвичай починають із суглобів верхніх кінцівок, після чого переходять до огляду суглобів нижніх кінцівок, голови і тулуба. Суглоби верхніх кінцівок досліджують у положенні хворого стоячи чи сидячи, суглоби нижніх кінцівок — у положенні стоячи та лежачи.
1. При огляді в положенні стоячи звертають увагу на симетричність положення кінцівок щодо плечового поясу чи таза, передпліччя до плеча, кисті до передпліччя, гомілки до стегна, стопи до гомілки. При цьому визначають положення надпліччя, кутів лопаток, гребенів клубових кісток, підколінних та сідничних складок, наявність фізіологічних згинів хребта (2 у грудному та 2 — у поперековому відділах), наявність патологічних скривлень (кіфоз, сколіоз). Виявляють порушення постави: за наявності змін у поперековому відділі хребта — випинається живіт, у грудному — сутулість. Плоска спина відзначається за відсутності фізіологічного кіфозу у грудному та лордозу — у поперековому відділах хребта, поза прохача.
2. Звертають увагу на довжину кінцівки та її частин щодо іншої, при цьому можна констатувати: норму, вкорочення чи подовження. Слід пам’ятати, що в деяких випадках, частіше при гострому артриті, при значному больовому синдромі хворий приймає вимушене положення (поза розвантаження), при цьому уражений суглоб знаходиться в положенні помірного згинання, що зменшує внутрішньосуглобовий тиск та знижує відчуття болю. Вимушене положення в ураженому суглобі властиве також у хворих із м’язовими контрактурами та анкілозами. Необхідно звернути увагу, що больові відчуття в суглобах, обмеження їх рухомості і розвиток контрактур можуть бути зумовлені патологією скелетних м’язів або нервової системи.
3. Ретельно досліджують стан усіх суглобів: кистей, променезап’ясткових, ліктьових, плечових (ПС), ключично-акроміальних, груднино-ключичних, груднино-реберних, скронево-нижньощелепних, стипни, гомілковостопних, колінних (КС), кульшових (КуС); шийного, грудного, поперекового відділів хребта, крижово-клубових суглобів. Обов’язково потрібно проводити порівняння хворих суглобів із симетричними здоровими.
Велике значення необхідно приділяти дослідженню зміни конфігурації суглобів. Збільшення обсягу суглоба — припухлість — одна з основних ознак його ураження.
Припухлість суглоба може мати дифузний чи обмежений характер. Рівномірна дифузна припухлість характеризується згладженістю контурів суглоба, зокрема, зникненням кісткових виступів, що частіше зумовлено гострим артритом, але можливе також при значному набряку синовіальної оболонки (СО), позасуглобових м’яких тканин чи наявності випоту в порожнині суглоба.
Обмежена припухлість може бути викликана внутрішньосуглобовим випотом, потовщенням та іншими змінами в позасуглобових м’яких тканинах (бурсит, тендінит), зміною форми кістки або позасуглобовими жировими потовщеннями (подушками). М’яка, еластична пухлина, іноді болісна, на обмеженій ділянці навколосуглобових тканин свідчить про наявність бурситу, це переважно запалення в ділянці заворотів капсули суглоба.
Для характеристики змін форми суглобів використовують терміни дефігурація та деформація.
Дефігурація — це згладжування контурів суглоба зі збільшенням його обсягу. Ця зміна форми суглобів, пов’язана з ексудативним процесом у суглобі чи набряком періартикулярної тканини, що проявляється рівномірним набряком суглоба чи нерівномірними змінами його форми за рахунок випоту в заворотах суглобової сумки. Важливо розрізняти, чим спричинена дефігурація суглоба, чи це синовіт із наявністю рідини в суглобі, чи набряк періартикулярних тканин або потовщена СО.
При деформації наявні нерівномірне збільшення суглоба, характерні грубі, стійкі зміни форми суглоба, зумовлені змінами кісткової тканини (Ктк), фіброзними нашаруваннями, ущільненням періартикулярної тканини, із залученням розміщених поблизу сухожиль і розвитком згинальних та розгинальних контрактур та анкілозів.
Лікар у своїй практиці має справу з різними ураженнями суглобів: запальними (артрит), дегенеративними (ОА), мікрокристалічніми (артропатія) та ін. Для встановлення діагнозу велике значення має локалізація патологічного процесу. Ураження дрібних кісток зазвичай частіше трапляється при РА, в той час як ураження великих суглобів (частіше КС та КуС) — при ОА, а при подагрі процес частіше локалізується в ділянці першого плеснофалангового суглоба великого пальця стопи.
4. У патологічний процес може залучатися різна кількість суглобів. Моноартрит — запалення одного суглоба, олігоартрит — декількох, поліартрит — більшості. Ураження може бути симетричним або асиметричним. Наявність симетричного поліартриту суглобів кистів найбільш характерна для РА, моноартрит, асиметричний олігоартрит нижніх кінцівок характерний для серонегативних спондилоартритів (анкілозуючого спондилоартриту, хвороби Рейтера), а запалення I пальця стопи частіше виявляють при подагрі. Слід пам’ятати, що моноартикулярне ураження та ізольоване залучення у процес дистальних частин кінцівок утруднює проведення диференційного діагнозу та потребує залучення додаткової інформації. Для дебюту РА «суглобами виключення» є дистальні міжфалангові суглоби кистей, крижово-клубові суглоби та поперековий відділ хребта.
5. Для верифікації діагнозу має значення стан шкіри, зокрема в ділянці суглоба, стан слизової оболонки, нігтів. Звертають увагу на забарвлення шкіри, наявність вузлів, висипки, виразкувань, телеангіектазій, рубців, стан підшкірних вен тощо, що дозволяє припустити наявність у хворого псоріазу, хвороби Рейтера, ССД, вузлуватої еритеми та інщих хвороб. При запаленні суглоба має місце зміна кольору шкіри в ділянці суглоба. У деяких хворих на РА при пальпації виявляють ревматоїдні вузлики — підшкірні утворення круглої форми, діаметром від 0,5 до 2–3 см, при пальпації не болісні. Вони мають щільну консистенцію, рухливі, частіше локалізуються симетрично на розгинальних поверхнях передпліччя, навколо суглобів, частіше ліктьових, у місцях кріплення сухожиль. При подагрі виявляють тофуси, які мають біло-жовтуватий колір, зернисту поверхню, часто містяться на вушних раковинах та в ділянці суглобів, іноді з них утворюються нориці.
6. Ранньою та постійною позасуглобовою ознакою РА є прогресуюча атрофія м’язів, що поширюється не лише на навколосуглобові м’язи, але й призводить до загального виснаження. При ураженні кистей при РА має місце атрофія міжкісткових м’язів підвищення I та V пальців. Частіше атрофія м’язів розгиначів передпліччя наявна при ураженні променезап’ясткових суглобів, передніх груп м’язів стегна — при ураженні КС.
Пальпація
За допомогою пальпації можна виявити підвищення місцевої температури тіла, встановити характер зміни форми суглоба, наявність випоту в суглобі, суглобові шуми, больові точки та ін. Проводять пальпацію в зручному положенні суглобів, коли м’язи розслаблені. Методика пальпації передбачає такі дії:
1. Тильним боком долоні визначаємо температуру шкіри в ділянці суглоба; місцеве підвищення температури свідчить про запальний процес у суглобі.
2. Виявляємо болісність переважно в ділянці суглобових поверхонь кісток, яка може бути поверхнева та глибока. Для гострого артриту характерний біль при пальпації в усіх відділах суглоба та гіперемія шкіри над ним. Поліартралгія — це біль у суглобі без ознак запалення при повному обсязі рухів.
Виявляємо міофасціальний біль, що проявляється не лише спазмами, а також наявністю у напружених м’язах болісних ущільнень, затвердінь і тригерних точок.
3. З’ясовуємо характер зміни форми суглоба: визначаємо, чим викликана припухлість суглоба, випотом у порожнину суглоба чи кістковими розростаннями.
4. За допомогою пальпації виявляємо флуктуацію в результаті накопичення рідини в порожнині, вона частіше визначається в КС, рідше — в ПС, ще рідше — у променезап’ястковому, та майже ніколи — в КуС.
5. Крепітація в суглобі при натискуванні на сумку, хруст, клацання при рухах, яке можна почути і на відстані, можливий біль (при запальних та дегенеративних захворюваннях суглобів).
6. Чужорідні тіла в порожнині суглоба — «суглобові миші» (частіше в КС, рідко — в ліктьовому, дуже рідко — в ПС). Характерні для ОА.
Крім визначення при пальпації болісності суглобів, флуктуації, при підозрі на РА потрібно використовувати тест бокового стискування дрібних суглобів кисті (проксимальні міжфалангові, плеснофалангові), стопи (плеснофалангові) та променезап’ясткові суглоби.
Вираженість болю при пальпації характеризує індекс Річі за шкалою: 0 — болю немає; 1 — хворий каже, що пальпація болісна; 2 — хворий реагує гримасою; 3 — хворий забирає руку чи не дає пальпувати суглоб.
Вимірювання
Мета вимірювання суглобів та кінцівок — визначити довжину кінцівок, окружність кінцівок та суглобів, що дозволяє виявити патологічні зміни, судити про динаміку хвороби. Для вимірювання використовують сантиметрові стрічки та спеціальні лінійки.
Необхідно розрізняти вкорочення кінцівки функціональне та істинне. Істинне вкорочення нижніх кінцівок виявляють при вимірюванні відстані між передньоверхньою вістю клубової кістки та латеральною щиколоткою. Функціональне вкорочення частіше наявне про сколіозі, контрактурах КуС. Ця різниця помітна при порівнянні відстані від пупка до латеральних кісточок.
Вимірювання окружності проводять частіше на рівні суглоба, а також при потребі на рівні верхньої, середньої та нижньої третини кінцівки. Вимірювання окружності стегна проводять на відстані 10; 15 чи 20 см від верхнього краю колінної чашки, гомілки — на 15–20 см нижче колінної чашки.
Дослідження обсягу та амплітуди рухів у суглобах
При дослідженні ступеня рухомості в суглобі визначають крайні межі активних та пасивних рухів за всіма можливими для цього суглоба напрямками, а також виявляють патологічні форми рухів. Дослідження починається з вивчання обсягу активних, а потім пасивних рухів. Дослідження проводять за допомогою кутоміра (гоніометра). Обмеження рухомості суглобів може бути зворотним та постійним.
Зворотне обмеження може бути зумовлене:
1) м’язовим напруженням;
2) внутрішньосуглобовим випотом;
3) блокадою суглоба у зв’язку з наявністю вільних тіл у суглобі;
4) змінами у періартикулярних тканинах.
При гострому артриті характерне зворотне обмеження та болісність усіх можливих у цьому суглобі активних та пасивних рухів. Загальна ранкова скутість наявна при РА, а місцева — при ОА.
Постійне обмеження може бути викликано як внутрішньосуглобовими, так і зовнішньосуглобовими причинами. Перше включає кістковий анкілоз, руйнування суглобових поверхонь. Зовнішньосуглобовими причинами можуть бути ущільнення суглобової капсули чи м’язові контрактури.
Контрактура — стійка фіксація суглоба в певному положенні. Розрізняють згинальні та розгинальні контрактури. Вони можуть бути зумовлені первинним ураженням опорно-рухового апарату (РА — згинальні контрактури), хворобами нервової системи, м’язів.
Анкілоз — це відсутність рухів у суглобі. Розрізняють фіброзний анкілоз, коли суглобова щілина (СЩ) заповнюється фіброзною тканиною (ПсА), та кістковий — при якому суглобові кінці з’єднуються кістковими балками — РА.
Тугорухомість у суглобах — це функціональне порушення за рахунок обмеження амплітуди та швидкості рухів.
Підвивих — це зміщення у межах суглобової капсули поверхонь головок кісток, які утворюють суглоб, унаслідок руйнування хряща.
Вимірювання м’язової сили, яке має певне значення для встановлення діагнозу, проводять таким чином: хворого просять зробити той чи інший рух із максимальним напруженням м’язів, а дослідник чинить опір і таким способом отримує уяву про м’язову силу. М’язову силу можна визначати також за допомогою динамометрів.
Дослідження суглобів дозволяє оцінити їх функціональну здатність та ступінь її порушення: 1 — життєвоважливі маніпуляції виконуються без труднощів; 2 — із затрудненнями; 3 — зі сторонньою допомогою.
Дослідження окремих суглобів
Плечовий суглоб
Огляд. Огляд ПС, якщо дозволяє стан хворого, виконують у положенні хворого стоячи та сидячи. На початку дослідження порівнюють обидва ПС спереду, збоку та ззаду. При артриті ПС плече частіше приведено та ротовано всередину. Огляд дозволяє виявити припухлість та атрофію грудних, трапецієподібних, дельтоподібних, лопаткових м’язів. Про наявність ексудату свідчить збільшення розміру суглоба, переважно спереду.
Пальпація. До обстеження потрібно попросити хворого вказати здоровою рукою місце найбільшого болю. Лікар, стоячи спереду хворого, пальпує обидва плеча, що дозволяє виявити припухлість, болісність, місцеве підвищення температури тіла, напруження та атрофію м’язів (рис. 5.1).
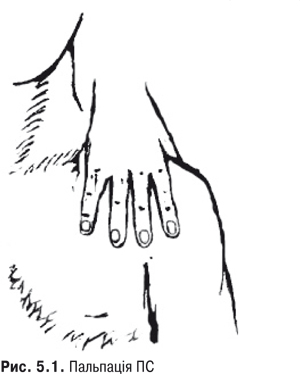
Після чого суглоб досліджують із боків та ззаду. Біль, повзумовлений ураженням самого суглоба, виникає при пальпації та пасивному русі плеча, тому його слід відрізняти від болю, пов’язаного із позасуглобовими захворюваннями. Планомірне дослідження ПС включає пальпацію акроміально-ключичного суглоба, обертової манжети, субакроміальної сумки, міжгорбкової борозни, лопатко-плечового суглоба та суглобової сумки, це дозволяє локалізувати наявний патологічний процес. Насамперед досліджують передній відділ СЩ, латеральний та медіальний горбики на передній поверхні головки плечової кістки, міжгорбкову борозну, де розміщене сухожилля m. biceps. Для дослідження передньої частини обертової манжети плеча хворий закладає руки за спину до протилежної лопатки, а лікар пальпує безпосередньо перед акроміальним відростком. При дослідженні задньої частини обертової манжети плеча хворий розміщує руку на протилежному плечі і лікар досліджує ділянку нижче заднього краю акроміального відростка лопатки.
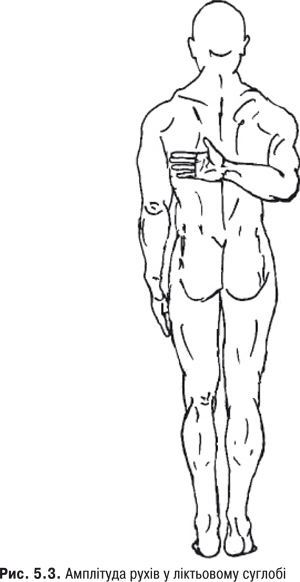
Амплітуда рухів. Для попередньої оцінки амплітуди рухів у ПС використовують нижченаведені чотири прийоми (рис. 5.2, 5.3):

1) пацієнт підіймає витягнуті руки доверху по вертикальній дузі та становить долонями над головою;
2) хворий кистями рук, зігнутими в ліктьовому суглобі, торкається голови (руки за голову);
3) пацієнт підіймає руки, розведені в боки (у фронтальній площині), та з’єднує їх долонями над головою;
4) хворий заводить руки за спину, торкаючись спини тильним боком кисті, максимально високо до лопаток.
ПС властиві такі рухи: згинання, розгинання, відведення, приведення, ротація. Кут рухів у ПС без участі лопатки та хребта характеризує істинний обсяг рухів у ньому, а з їх участю — повний. Щоб дослідити істинний обсяг рухів, лікар фіксує лопатку, натискуючи рукою на ключицю та ость лопатки.
Оцінка згинання здійснюється при підйомі витягнутих рук доверху по дузі в сагітальній площині: кут згинання істинний — 90˚, кут згинання з участю лопатки — до 150˚, а з участю хребта — до 180˚. Кут розгинання становить 30–40˚. Для оцінки відведення хворий має підняти руки у фронтальній площині та з’єднати їх долонями над головою. При істинному відведенні руки розміщуються горизонтально та кут становить 90˚. Для здійснення відведення >90˚ потрібна участь лопаток. Сумарний кут зовнішньої та внутрішньої ротації становить 90–135˚.
Ліктьовий суглоб
Огляд. Ліктьовий суглоб з’єднує плечову з ліктьовою та променевою кістками. Досліджують спереду та ззаду при опущених та прямих руках. Якщо в порожнині суглоба є ексудат, спереду виявляють припухлість, а на задній поверхні — випин суглобової капсули. На розгинальній поверхні передпліччя поблизу ліктьового відростка у хворих на РА виявляють підшкірні ревматоїдні вузлики, у хворих на подагру — тофуси.
Пальпація. При пальпації лікар утримуючи рукою передпліччя хворого досліджує великими пальцями передню та задню суглобові поверхні, головку ліктьової кістки, натискує на медіальний та латеральний надвиростки дистального кінця плечової кістки та ліктьового відростка (рис. 5.4, 5.5).


Амплітуда рухів. У ліктьовому суглобі можливі такі рухи: згинання, розгинання, супінація та пронація. При повному розгинанні плеча вісь плеча та передпліччя утворює пряму лінію, обсяг розгинання дорівнює 0˚. При повному згинанні передні поверхні плеча та передпліччя стикаються і кут згинання становить 150–160˚. Щоб виміряти обсяг супінації та пронації, руку згинають у ліктьовому суглобі під прямим кутом у сагітальній площині.
При повній супінації кисті рук повертають долонями доверху та кут супінації становить 90˚. При повній пронації кисті рук повертають тильним боком доверху, амплітуда пронації досягає 90˚ (рис. 5.6).

Променезап’ястковий, п’ястково-фалангові, проксимальні та дистальні міжфалангові суглоби
Огляд. При дослідженні кисті рук мають лежати на рівній поверхні чи колінах хворого. Оглядають їх долонну і тильну поверхню, п’ястково-фалангові, міжфалангові, променезап’ясткові суглоби. Звертають увагу на форму, стан шкіри, м’язів тенора і гіпотенора, міжкісткових проміжків. Локальна припухлість у ділянці променезап’ясткового суглоба може бути зумовлена кістою, змінами сухожильної піхви чи СО. У разі запалення дистального міжфалангового суглоба палець має форму «редископодібну». За наявності дактиліту (артрит дистального та проксимального міжфалангових суглобів і набряк позасуглобових м’яких тканин) відзначають картину «сосископодібного пальця». Деформація п’ястково-фалангових, міжфалангових суглобів кисті, сухожильні згинальні та розгинальні контрактури, підвивихи у п’ястково-фалангових з’єднаннях, аж до ульнарної девіації, формує «ревматоїдну кисть». До класичного ураження кистей у розгорнутій стадії РА відноситься деформація за типом «ґудзикової петлі» або «бутоньєрки», що зумовлені стійким згинанням у проксимальних міжфалангових суглобах та перерозгинанням у дистальних міжфалангових, «шия лебедя» — за рахунок перерозгинання у проксимальних міжфалангових суглобах та згинання дистальних міжфалангових. Деформація дрібних суглобів, зовні подібних до РА, але неерозивних, наявна при артропатії Жаку. Вузлики Гебердена, характерні для поліостеоартрозу, локалізуються лише в ділянці дистальних міжфалангових суглобів кистей, вузли Бушара — в ділянці проксимальних міжфалангових суглобів.
Контрактура Дюпюїтрена — це потовщення та скорочення долонного апоневрозу та згиначів пальців, що призводить до згинальних контрактур. Найчастіше пошкоджуються IV, а потім V та III пальці, II і I пальці уражуються рідко. Атрофія м’язів підвищення I пальця свідчить про «синдром зап’ясткового каналу», що пов’язаний із порушенням рухової функції серединного нерва.
Пальпація. Пальпацію кистей виконують двома способами:
1. Лікар стоїть обличчям до пацієнта, тримає міцно його кисть обома руками, пальпує зап’ястя хворого, накладає І пальці на тильний бік зап’ястя, а ІІ та ІІІ пальці — на долоні (рис. 5.7).

2. Лікар утримує однією рукою зап’ястя хворого яке розслаблене, та направлене долонею донизу в нульовому положенні (0°); іншою рукою він пальпує зап’ястя, наклавши свій І палець на тильний бік, а ІІ та ІІІ — на долоню (рис. 5.8).

Припухлість зап’ястя може бути зумовлена локалізованим тендосиновітом або суглобовим синовітом, які розпізнати буває важко. Припухлість і біль при пальпації в ділянці шилоподібного відростка свідчать про стенозуючий тендосиновіт (тендосиновіт де Кервена), для якого характерне ураження сухожилля довгого відвідного м’яза та короткого розгинача І пальця. Про тендосиновіт свідчить крепітація та потовщення, що виявляють пальпуючи долоню хворого, який повільно згинає та розгинає пальці. При запаленні променеліктьового суглоба біль виникає під час пронації та супінації кисті.
П’ястково-фалангові суглоби пальпують в положенні згинання. Лікар підтримує кисть обома руками, а великими пальцями пальпує тильну поверхню суглоба. Міжфалангові суглоби досліджують за допомогою великого та вказівного пальців по задньобоковій поверхні. При підозрі на РА слід використовувати тест бокового стискування дрібних суглобів кисті, стоп та променезап’ясткових суглобів, при їх ураженні у хворого виникає біль.
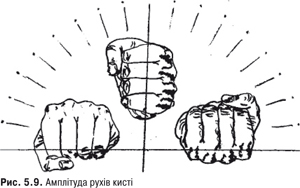
Амплітуда рухів. У променезап’ястковому суглобі можливі такі рухи: згинання та розгинання, а також променеве та ліктьове відведення. Амплітуда рухів визначається при випрямленій кисті стосовно передпліччя (0˚). У нормі кут згинання зап’ястя досягає 80–90˚, кут розгинання — 70˚, відхилення в ліктьовій бік становить 50–60˚, а у променевий — 30–40˚ (рис. 5.9).
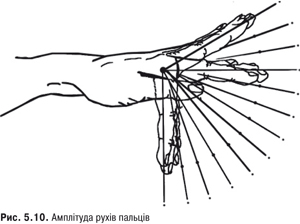
Для визначення рухливості у п’ястково-фалангових суглобах, лівою рукою беремо кисть хворого, а іншою по черзі згинають та розгинають проксимальні фаланги пальців (рис. 5.10, 5.11). Для визначення функції кисті в цілому хворого просять стиснути її в кулак, потиснути руку лікаря. Про можливість робити точні рухи свідчить можливість хворого з’єднувати кінці великих пальців з іншими пальцями тієї ж руки. Допомагають визначити функцію кисті також можливість писати, малювати, розстібати та застібати ґудзики.

Кульшовий суглоб
Огляд. Основні ознаки хворих із кокситом та коксартрозом — кульгання через біль, вкорочення кінцівки і наявність згинальних контрактур. Тому дослідження розпочинають з оцінки ходи. Досліджують співвідношення між положенням стегна та таза, визначають довжину ніг та нахил тазу.
Пальпація. Пальпація КуС проводиться з урахуванням кісткових орієнтирів — гребінь здухвинної кістки з його передньою та задньою верхньою вістю, сідничний горб та великий вертлюг.
Амплітуда рухів. КуС має велику амплітуду рухів. При випрямленій нозі амплітуда згинання становить 90 o, а при зігнутій в КС нозі — 120˚. Амплітуда перерозгинання (гіперекстезії) стегна — 10–15˚. Повний кут відведення становить 40–50˚. У нормі кут внутрішньої ротації — 40˚, а зовнішньої — 45˚. Обмеження внутрішньої ротації — один із найбільш ранніх та найбільш достовірних симптомів ураження КуС. Про ураження КуС свідчить наявність симптома Вебера чи колінно-п’яткової ознаки, яка визначається таким чином: стегно та коліно ноги, яку досліджують, зігнуті, п’ятка її лежить на коліні іншої розігнутої ноги, стегно відведено та ротовано назовні. При ураженні суглоба з’являється біль, напруження м’язів, обмеження рухливості.
КС. Це складний суглоб із наявністю менісків із добре розвинутим апаратом зв’язок. СО тут найбільша й утворює верхній (надпателярний), задній (підколінний) завороти та багато синовіальних сумок.
Огляд. Спостереження за ходою хворого дозволяє виявити кульгання, контрактуру чи надмірну рухливість у КС. При огляді оцінюються контури суглоба, визначається відношення між гомілкою та стегном. Виявляють деформацію: genu valgum із кутом, відкритим назовні (Х-подібні ноги), genu varum із кутом, відкритим всередину (О-подібні ноги). За наявності ексудату в порожнині суглоба з обох боків надколінка виявляють випинання. Кіста Беккера утворюється в підколінній ямці при значній кількості ексудату в порожнині суглоба через підвищення внутрішньосуглобового тиску та протрузію заднього завороту суглобової сумки. Вона має вигляд яйцеподібної пухлини. За наявності бурситу запальний вміст із підколінної ямки може зміщатися донизу по задній поверхні литкового м’яза.
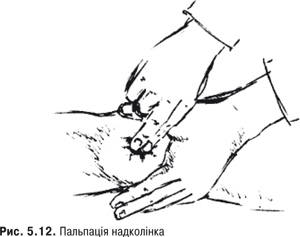
Пальпація. Пальпація дозволяє визначити еластичність суглобової капсули, наявність рідини в порожнині суглоба. Важливою ознакою накопичення рідини в КС є позитивний симптом флуктуації. Флуктуація в КС визначається зазвичай у recessus suprapatellaris. Для виявлення мінімальної кількості випоту долонею виштовхують рідину з медіальної ділянки КС у ділянку вище надколінка, а потім у латеральну ділянку. Якщо медіальна ямка надколінка починає наповнятися та вибухати, симптом вважають позитивним. Про наявність помірного та великого об’єму випоту в КС свідчить симптом «плаваючого надколінка», або симптом «балотування» надколінка (рис. 5.12).
Перевірка наявності симптому виконується таким чином — надколінок фіксують I і II пальцями лівої кисті, а з допомогою правої здійснюють поштовхоподібні натискування на надколінок. Якщо рідина є, надколінок ударяється об виросток стегна і симптом балотування буде позитивним. Ізольовані припухлості у ділянці КС можуть бути пов’язані з локальними запальними процесами (бурсит, киста, гигрома та ін.). Якщо тримати одну руку на надколінку, а іншою згинати та розгинати коліна, можна виявити крепітацію та хрускіт.
Амплітуда рухів. У КС відбуваються згинання, розгинання, ротація. Кут згинання в КС становить 125–135˚. Кут перерозгинання становить до 10–15˚. Повний обсяг рухів становить 135–150˚. При зігнутому суглобі в ньому можлива ротація, амплітуда зовнішньої та внутрішньої ротації становить 45˚.
Гомілковостопний суглоб і суглоби стоп
Огляд. При огляді та пальпації звертають увагу на деформацію, наявність ексудату, болісні точки. Частіше припухлість має місце на передній поверхні, оскільки в цій ділянці СО розміщується на поверхні. Огляд стоп дозволяє виявити сплощення поздовжнього склепіння (плоскостопість), контрактуру п’яткового сухожилля із підйомом п’яти, опущення переднього відділу стопи (кінська стопа), деформацію I пальця стопи із зовнішнім відхиленням пальця.
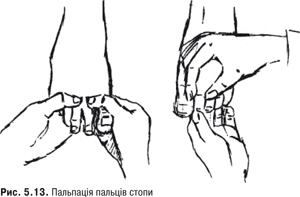
Пальпація. Визначають, чи є болісність у передній тильній частині стопи, ділянці кріплення ахіллова сухожилля, ділянці плеснофалангових та міжфалангових суглобів (рис. 5.13).
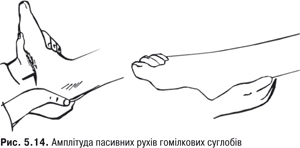
Амплітуда рухів. Для вимірювання обсягу рухів гомілка та стопа знаходяться у вихідному положенні під кутом 90˚. Обсяг тильного згинання — 20–30˚, а підошовного — 30–40˚ (рис. 5.14, 5.15).

Хребет
Огляд. У деяких хворих має місце сутулість, у інших навпаки — випрямлення фізіологічних згинів хребта. Часто лікар виявляє сколіоз — скривлення хребта набік, що частіше відзначають у грудному відділі хребта. При анкілозуючому спондилоартриті характерний кіфозний тип деформації, при якому розвивається кіфоз грудного відділу та гіперлордоз шийного відділу хребта («поза прохача») чи ригідний — зменшення чи зникнення поперекового лордозу та грудного кіфозу(дошкоподібна спина). При хворобі Бехтєрева виявляють напруження та атрофію прямих м’язів спини, симптом віжок.
Під час огляду виявляють зміну форми шийного лордозу — кривошия, що може бути вродженою та набутою (наслідок спазму м’язів шиї). Зміни у хребті визначають за симптомом Форестьє. Якщо здорову людину ставлять спиною до стіни, то її п’яти, лопатки та потилиця торкаються стіни. За наявності кіфозу в грудному та гіперлордозу в шийному відділах хребта потилиця до стіни не торкається.
Пальпація. Для виявлення больового синдрому запропоновано ряд діагностичних проб: виявлення болісності по ходу остистих відростків хребців та у паравертебральних точках.
Біль, що локалізується між ХІІ парою ребер та сідничними складками характеризують як «синдром болю у нижній ділянці спини». Гострий біль продовжується не більше 3 міс, якщо біль триває довше — це хронічний біль. ВООЗ виділяє також додатково підгострий біль — від 4 до 12 тиж. Слід диференціювати біль у спині, який за клінічною характеристикою може бути: локальним, зумовленим різними патологічними змінами м’язово-скелетних структур; проекційним при патології корінців спинного мозку чи нерва; відображений, пов’язаний із патологією внутрішніх органів. Біль у спині може бути спричинений такими потенційно небезпечними станами, як пухлини, метастази злоякісних новоутворень, переломи, аневризма черевної ділянки аорти, синдромом стискання кінського хвоста. Лікар вже при першому огляді має виявити ознаки, які викликають підозру на наявність тяжкої патології. Цьому допомагає розроблена система «червоних прапорців» чи «знаків погрози» при болю у нижній ділянці спини. Основні з них: попередня травма, вік >50 років та <20 років, стійка лихоманка, онкологічне захворювання в анамнезі, метаболічне захворювання, виражена м’язова слабкість, дисфункція сечовивідних шляхів чи кишечнику, випадіння больової чутливості в ділянці промежини, зниження тонусу сфінктерів, біль у спині, що не зменшується вночі та у спокої. Наявність цих ознак потребує проведення лабораторно-інструментального дослідження та направлення хворого до відповідного фахівця.
Амплітуда рухів. Для оцінки рухливості хребта слід враховувати його кривизну. При максимальному нахилі вперед хребет має форму плавної дуги від потилиці до тазових кісток. При максимальному нахилі назад із вертикального положення хребет описує дугу до 30˚, при боковому нахилі — 60˚. Ротація у грудному та поперековому відділах хребта в середньому становить 30˚ від середньої лінії.
Про зменшення рухливості у шийному відділі хребта свідчить збільшення відстані між підборіддям та рукояткою груднини при максимальному згинанні, яке в нормі становить 0–2 см, та зменшення його при максимальному розгинанні <16–22 см. Зміни у шийному відділі хребта дозволяє виявити також такий спосіб: від VII шийного хребця відміряють доверху відстань у 8 см та повторно вимірюють цю відстань при максимальному згинанні шиї, яка у здорової людини збільшується на 3 см, а при ураженні шийного відділу хребта не змінюється чи змінюється мало. При ураженні грудного відділу визначається позитивний симптом Ота: від VII шийного хребця відміряють донизу відстань 30 см та повторно вимірюють цю відстань при максимальному згинанні вперед, яка у здорової людини збільшується на 4–5 см, а при ураженні грудного відділу хребта не змінюється. Зменшення рухливості у поперековому відділі хребта виявляють за допомогою симптому Шобера: від V поперекового хребця відміряють вверх відстань 10 см та повторно вимірюють цю відстань при максимальному згинанні. У здорової людини ця відстань збільшується на 4–5 см, при анкілозуючому спондилоартриті не змінюється.
Крижово-клубовий суглоб
Огляд і пальпація. При ураженні відзначається болісність у місці проекції суглоба, а також позитивні симптоми Кушелевського (рис. 5.16 а, б).
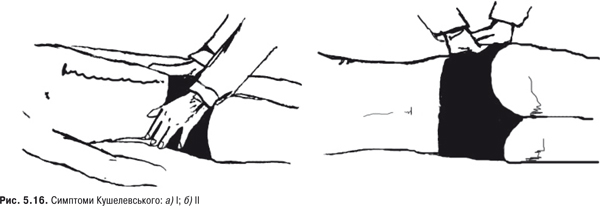
1. Хворий лежить на спині. Лікар кладе руки на гребінці клубових кісток спереду і ривком натискає на них. За наявності запальних змін у цих суглобах виникає біль у ділянці крижів.
2. Хворий лежить на боку. Лікар кладе руки на ділянку клубових кісток і різко натискає на неї. При цьому хворий відчуває біль у ділянці крижів.
3. Хворий лежить на спині. Одна нога зігнута в КС й відведена вбік. Лікар однією рукою опирається на КС, другою натискає на протилежну клубову кістку. У цей час відбувається зміщення в ділянці крижово-клубового суглоба, і хворий відчуває біль.
Методика проведення пункції великих та дрібних суглобів
Показання: неінфекційний артрит (РА у дорослих та дітей, мікрокристалічний, ПсА, хвороба Бехтєрева, хвороба Рейтера, СЧВ та змішане захворювання сполучної тканини (ЗЗСТ), посттравматичний артрит, суглобовий синдром при запаленнях кишечнику) за наявності ознак запалення з вираженим ексудативним компонентом та неефективності НПЗП; реактивний синовіт на тлі ОА; посттравматичний та постопераційний синовіт; періартрит, тендовагініт, бурсит.
Протипоказання: абсолютних немає; відносні: геморагічний діатез на тлі гемофілії, тромбоцитопенія.
Методика: процедура виконується з дотриманням правил асептики.
При пункції суглобів верхніх кінцівок хворий сидить, руки на столі, при пункції нижніх кінцівок — лежить на кушетці.
ПС. Зазвичай пунктують із передньої поверхні, при цьому СЩ визначають між медіальним боком голівки плечової кістки та суглобовою впадиною лопатки — дещо нижче і латеральніше клювовидного відростку.
Ліктьовий суглоб. Зігнутий під прямим кутом суглоб пунктують із зовнішньобокової поверхні у заглибленні, яке визначається пальпаторно між ліктьовим відростком та надвиростком плечової кістки. Або — пункція з боку задньої поверхні через сухожилля триголового м’яза, над верхнім краєм локтьового відростка та суворо по центру.
Променезап’ястковий суглоб. Пальпаторно визначається заглиблення між сухожиллям власного розгинача II пальця та сухожиллям загального розгинача пальців, потім перпендикулярно вводять голку на глибину 1,5–2 см.
П’ястково-фалангові суглоби. Пальпаторно визначають СЩ, для чого просять хворого розслабити кисть руки і проводять можливе зміщення у п’ястково-фаланговому суглобі. Тракцію пальців хворого проводять однією рукою, а другою роблять пункцію по лінії СЩ, під сухожиллям розгинача.
Проксимальні міжфалангові суглоби. Витягнувши та зігнувши палець хворого під кутом приблизно в 45°, визначають СЩ, потім роблять пункцію під сухожиллям розгинача.
КС. Хворий лежить на спині з максимально розігнутими КС. Пальпаторно визначають верхній край надколінка і намічають точку вколювання на 1–1,5 см проксимальніше краю надколінка. Голку вводять перпендикулярно до зовнішньобокової поверхні суглоба та паралельно столу чи кушетці, на якій лежить хворий.
Гомілковостопний суглоб. По тильній поверхні суглоба уявно проводять лінію, яка об’єднує нижні кінці гомілок, ділять на три частини. На границі зовнішньої та середньої третини і на 1 см вище неї проводять пункцію (у напрямку до п’яткової кістки) на глибину 2–3 см. При правильному введенні голки в суглоб лікар відчуває її «провал» .
Таранно-п’ятковий суглоб. Пальпаторно визначають заглиблення нижче латеральної гомілки, голку вводять на глибину 2–3 см у напрямку до медіального боку стопи.
Плеснофалангові та міжфалангові суглоби стоп. Пункцію проводять з дорзальної поверхні по медіальному або латеральному боці, під сухожиллям розгинача пальців, тракція пальців полегшує маніпуляцію.
Ускладнення: інфекція (ризик 1:10 000); гемартроз; вазовагальне запаморочення; біль; пошкодження хряща.
Ускладнення: збільшення вираженості болю в суглобі, збільшення набряку протягом декількох годин (до 2 діб), інфікування суглоба, атрофія підшкірної основи, атрофія м’язів біля місця ін’єкції, депігментація шкіри, гіпертензія, підсилення глікемії у хворих на цукровий діабет, порушення менструального циклу, «стероїдна артропатія», остеонекроз, розриви сухожиль, відчуття «жару», почервоніння обличчя та верхньої ділянки тулуба, панкреатит, субкапсулярна катаракта.
Глава 6. Оцінка вираженості болю та функціонального стану суглобів
Індекс DAS (табл. 6.1) об’єднує окремі параметри (4 або 3) в сумарний індекс, що дозволяє багатократно оцінювати активність РА та може бути використаний для контролю активності в повсякденній практиці.
Таблиця 6.1
Оцінка суглобів при визначенні DAS
|
Суглоби |
Болісність (68 суглобів) |
Індекс Річі (53 суглоби) |
Індекс 28 суглобів (болісність і припухлість) |
|
Скронево-нижньощелепні |
2 |
1 пункт |
– |
|
Груднино-ключичні |
2 |
1 пункт |
– |
|
Акроміально-ключичні |
2 |
1 пункт |
– |
|
ПС |
2 |
2 |
2 |
|
Ліктьові |
2 |
2 |
2 |
|
Променезап’ясткові |
2 |
2 |
2 |
|
Пястково-фалангові |
10 |
1 пункт |
10 |
|
Проксимальні міжфалангові |
10 |
1 пункт |
10 |
|
Дистальні міжфалангові |
8 |
– |
– |
|
КуС |
2 |
2 |
– |
|
КС |
2 |
2 |
2 |
|
Гомілковостопні |
2 |
2 |
– |
|
Таранно-п’яткові |
2 |
2 |
– |
|
Міжплеснові |
6 |
6 |
– |
|
Плеснофалангові |
10 |
2 |
– |
|
Шийний відділ хребта |
1 |
1 |
– |
|
Поперековий відділ хребта |
1 |
– |
– |
|
Крижово-клубові з’єднання |
2 |
– |
– |
Компоненти індексу DAS включають:
- Суглобовий індекс Річі (СІР)
- Рахунок припухлих суглобів із 44 суглобів
- ШОЕ
- Загальну оцінку стану здоров’я за візуальною аналоговою шкалою (ВАШ)
Індекс DAS28. Компоненти індексу DAS28 становлять:
- Число болісних суглобів (ЧБС) із 28 можливих (ЧБС28)
- Число припухлих суглобів (ЧПС) із 28 можливих (ЧПС28)
- ШОЕ
- Загальну оцінку стану здоров’я за ВАШ
Індекс Річі характеризує болісність суглобів при пальпації за такою шкалою:
0 — немає болю;
1 — пацієнт каже, що пальпація болісна;
2 — пацієнт морщиться;
3 — пацієнт видирає руку чи відмовляється від дослідження.
Індекс Річі включає оцінку 53 суглобів, максимально можливе його значення становить 78 балів, оскільки деякі суглоби об’єднуються у групи.
При визначенні кількості припухлих суглобів оцінюють 44 суглоби:
0 — немає припухлості;
1 — є припухлість (можна побачити чи пропальпувати).
Максимальне значення — 44 бали.
Загальна оцінка свого стану пацієнтом проводиться за ВАШ. Запитання може бути сформульоване так: «Наскільки сильно погіршує ваш стан РА?».
Індекс DAS можна розрахувати:
- Із використанням або без використання загальної оцінки стану здоров’я
- Індекс DAS28 аналогічний індексу DAS, однак включає спрощений рахунок із 28 суглобів
- Індекс DAS можна підрахувати, використовуючи СРБ замість ШОЕ
Порядок виконання
- Клінічна оцінка болісних та припухлих суглобів, взяття крові для визначення СРБ та ШОЕ.
- Професійні навички — необхідне навчання для правильної оцінки числа болісних та припухлих суглобів.
- Час заповнення — 5–8 хв для оцінки числа суглобів. Слід врахувати час очікування результатів ШОЕ протягом 1 год.
- Необхідне обладнання — лабораторія для визначення СРБ та ШОЕ. Для розрахунку індексу DAS необхідний програмований калькулятор або комп’ютер із підключенням до інтернету.
Розрахунки
- Індекс Річі може становити від 0 до 78 балів
- Число припухлих суглобів від 0 до 44 (ЧПС44)
- ШОЕ від 0 до 100
- Загальна оцінка здоров’я від 0 до 100
- Рахунок DAS може становити від 0 до 10 балів
- Рахунок DAS28 може становити від 0 до 9,4 бала
Метод розрахунку
Для обчислення DAS використовують програмований калькулятор або комп’ютер (www.das-score.nl).
Використовують такі формули:
DAS – 4 (4 параметри) = 0,53938 • sqrt (СІР) + 0,06465 • (ЧПС44) + 0,330 • ln (ШОЕ) + 0,224.
DAS28 – 4 (4 параметри) = 0,56 • sqrt (ЧБС28) + 0,28 • (ЧПС28) + 0,70 • ln (ШОЕ) + 0,014 • ЗСЗ.
DAS28 – 3 (3 параметри) = 0,56 • sqrt (ЧБС28) + 0,28 • (ЧПС28) + 0,70 • ln (ШОЕ) • 1,08 + 0,16.
Формула для розрахунку DAS28 (виходячи із DAS/DAS28) = (1,072 • DAS) + 0,94,
де: sqrt — корінь квадратний; СІР — суглобовий індекс Річі; ЧПС — число припухлих суглобів; ЧБС — число болісних суглобів; ШОЕ — швидкість осідання еритроцитів (мм/год); ln — натуральний логарифм; ЗСЗ — загальний стан здоров’я чи загальна оцінка активності захворювання, на думку пацієнта (100-мм візуальна аналогова шкала — ВАШ).
Показники норми
Розроблено референтні значення, які також доцільно використовувати для інтерпретації індексу активності в окремих пацієнтів.
Обґрунтованість
- Індекс DAS включає основний набір показників, що використовуються для оцінки ефективності БПЗП. Із індексу DAS спеціально видалені показники непрацездатності та кісткової деструкції.
- Оскільки для оцінки активності РА не існує золотого стандарту, під час розробки індексу DAS у ролі зовнішнього стандарту використовували думку лікаря про високу чи низьку активність захворювання.
Співвідношення з іншими індексами
Із декількох комбінованих індексів DAS найкраще корелював із загальною оцінкою активності захворювання лікарем та пацієнтом та з 12 іншими методами оцінки активності захворювання.
Коментарі
Індекс DAS можна використовувати як метод контролю ефективності БПЗП при РА. Однак, хоча індекс DAS є корисним показником під час прийняття терапевтичних рішень про тактику ведення пацієнтів із РА, він не замінює ретельного опитування та огляду пацієнта. Недоліком індексу DAS для використовування у клінічній практиці є наявність аналізу крові та визначення кількості болісних і припухлих суглобів навченим медичним працівником. Самостійна оцінка активності захворювання пацієнтом може бути менш працемісткою для лікаря, але повністю замінити DAS не може.
Інтерпретація індексу
Активність захворювання розцінюється як: низька — DAS ≤2,4; помірна — 2,4 >DAS ≤3,7; висока — DAS >3,7.
Індекс DAS <1,6 відповідає стану ремісії за критеріями Американської ревматологічної асоціації (ARA).
Активність захворювання розцінюється як: низька — DAS28 ≤3,2; помірна — 3,2 >DAS28 ≤5,1; висока — DAS28 >5,1.
Індекс DAS28 <2,8 відповідає стану ремісії за критеріями ARA.
Анкету для оцінки стану здоров’я (HAQ) наведено у табл. 6.2 та Стенфордську анкету оцінки здоров’я хворого на РА (mHAQ) — у табл. 6.3.
Таблиця 6.2
Опитування для оцінки стану здоров’я (HAQ)
|
Чи здатні Ви |
Вільно |
З деякими труднощами |
З великими труднощами |
Не можу |
|
Одягання та догляд за собою |
||||
|
1. Самостійно одягнутися, включаючи зав’язування шнурків на взутті та застібання гудзиків на одязі? |
||||
|
2. Вимити своє волосся? |
||||
|
Вставання |
||||
|
3. Підвестися зі звичайного стільця без підлокітників? |
||||
|
4. Лягти та підвестися з ліжка? |
||||
|
Прийняття їжі |
||||
|
5. Розрізати шматок м’яса? |
||||
|
6. Піднести до рота повний стакан або чашку? |
||||
|
7. Відкрити нерозпакований пакет молока? |
||||
|
Прогулянки |
||||
|
8. Гуляти по вулиці по рівній поверхні? |
||||
|
9. Піднятися на 5 сходин? |
||||
|
Гігієна |
||||
|
10. Повністю вмитися та витертися? |
||||
|
11. Прийняти ванну? |
||||
|
12. Сісти та підвестися з унітазу? |
||||
|
Досяжний радіус дії |
||||
|
13. Дістати та опустити донизу предмет вагою ≈2 кг, що знаходиться вище рівня Вашої голови? |
||||
|
14. Нахилитися, для того щоб підняти з підлоги одяг, що впав? |
||||
|
Сила кистей |
||||
|
15. Відчинити двері авто? |
||||
|
16. Відкрити банку? |
||||
|
17. Відкрити та закрити водопостачальний кран? |
||||
|
Інші види діяльності |
||||
|
18. Ходити по крамницях, виконувати інші доручення? |
||||
|
19. Сідати та виходити з авто? |
||||
|
20. Виконувати хатню роботу? |
Таблиця 6.3
Стенфордська анкета оцінки здоров’я хворого на РА (mHAQ)
|
Чи здатні Ви |
Вільно |
З деякими труднощами |
З великими труднощами |
Не можу |
|
1. Самостійно одягнутися, включаючи зав’язування шнурків на взутті та застібання гудзиків на одязі? |
||||
|
2. Лягти та підвестися з ліжка? |
||||
|
3. Піднести до рота повний стакан або чашку? |
||||
|
4. Гуляти біля дому? |
||||
|
5. Повністю вимитися та витертися? |
||||
|
6. Нахилитися для того, щоб підняти з підлоги одяг, що впав? |
||||
|
7. Відкрити та закрити водопостачальний кран? |
||||
|
8. Сідати та виходити з авто? |
Кодування відповідей: 0 — без затруднень, 1 — з деякими труднощами 2 — з великими труднощами, 3 — не можу виконати.
Індекс HAQ = сума всіх балів/20.
Індекс mHAQ = сума всіх балів/8 (максимальний HAQ =3 балам).
Оцінка наслідків остеоартриту
Наслідок захворювання та ефективність терапії оцінюють за динамікою болю в суглобах, скутістю, функціональною активністю (індекси Lequesne (Лекена), WOMAC).
Індекс Lequesne (Лекена) включає (табл. 6.4 і 6.5) оцінку болю у спокої та при ходінні (5 запитань), максимальної відстані, що можна пройти (1 запитання), повсякденної активності (4 запитання). Бальна оцінка кожного запитання підсумовується та становить рахунок тяжкості захворювання.
Таблиця 6.4
Сумарний індекс Лекена (індекс тяжкості для коксартрозу)
|
1. Біль чи дискомфорт |
|
|
Біль вночі: |
|
|
0 |
|
1 |
|
2 |
|
Ранкова скутість чи біль після вставання з ліжка: |
|
|
0 |
|
1 |
|
2 |
|
Посилення болю після стояння на ногах упродовж 30 хв: |
|
|
0 |
|
1 |
|
Біль при ходьбі: |
|
|
0 |
|
1 |
|
2 |
|
Біль виникає в положенні сидячи впродовж 2 год, не встаючи |
2 |
|
2. Максимальна дистанція при ходінні без болю: |
|
|
0 |
|
1 |
|
2 |
|
3 |
|
4 |
|
5 |
|
6 |
|
+1 |
|
+2 |
|
3. Функціональна активність: |
|
|
Чи можете Ви, нахилившись вниз, одягнути шкарпетки? |
0–2 |
|
Чи можете Ви підняти предмет із підлоги? |
0–2 |
|
Чи можете Ви піднятися на один прогін по сходах? |
0–2 |
|
Чи можете Ви сісти в машину? |
0–2 |
Таблиця 6.5
Сумарний індекс Лекена (індекс тяжкості для гонартрозу)
|
1. Біль чи дискомфорт: |
|
|
Біль вночі: |
|
|
0 |
|
1 |
|
2 |
|
Ранкова скутість чи біль після вставання з ліжка: |
|
|
0 |
|
1 |
|
2 |
|
Посилення болю після стояння на ногах упродовж 30 хв: |
|
|
1 |
|
2 |
|
Біль при ходьбі: |
|
|
0 |
|
1 |
|
2 |
|
Біль чи дискомфорт при вставанні без допомоги рук з положення сидячи: |
|
|
0 |
|
1 |
|
2. Максимальна дистанція при ходінні без болю: |
|
|
0 |
|
1 |
|
2 |
|
3 |
|
4 |
|
5 |
|
6 |
|
+1 |
|
+2 |
|
3. Функціональна активність: |
|
|
Чи можете Ви пройти вверх один прогін по сходах? |
0–2 |
|
Чи можете Ви пройти вниз один прогін по сходах? |
0–2 |
|
Чи можете Ви прибрати нижню полку шафи, стоячи на колінах? |
0–2 |
|
Чи можете Ви йти по нерівній дорозі? |
0–2 |
|
Чи відчуваєте Ви біль штрикаючого характеру чи раптове відчуття втрати опори в ураженій кінцівці? |
|
|
1 |
|
2 |
Градації відповідей: вільно — 0, з певними затрудненнями — 1, неможливо — 2. Тяжкість ОА: легкий ОА — 1–4, помірний ОА — 5–7, тяжкий ОА — 8–10, дуже тяжкий — 11–12, вкрай тяжкий >12.
Індекс WOMAC (Western Ontario and McMaster University) — анкета для самостійної оцінки пацієнтом ступеня вираженості болю (у спокої та при ходьбі — 5 запитань), скутості (тривалість і вираженість — 2 запитання), функціональної недостатності у повсякденній діяльності (17 запитань).
Оцінка проводиться за ВАШ (в мм). Ця шкала має вигляд лінійки з розміткою від 0 до 100 мм, де 0 означає відсутність болю (скутості чи затруднень), а 100 — це максимальний біль (скутість чи затруднення).
Оцінка болю
Інтенсивність болю в таких ситуаціях:
1. Ходіння по рівній поверхні.
2. Підйом та спуск по сходах.
3. Вночі в ліжку.
4. Сидячи або лежачи.
5. У вертикальному положенні.
Оцінка ранкової скутості
Який ступінь скутості після того, як Ви:
6. Прокинулись вранці?
7. Сиділи, лежали чи відпочивали протягом дня?
Оцінка функціональної недостатності
Наскільки важко для Вас:
8. Спускатися по сходах?
9. Підніматися по сходах?
10. Підвестися, після того як Ви сиділи?
11. Стояти?
12. Нахилятися?
13. Ходити по рівній поверхні?
14. Сідати/виходити з авто?
15. Робити покупки?
16. Одягати шкарпетки/панчохи?
17. Вставати з ліжка?
18. Знімати шкарпетки/панчохи?
19. Лежати в ліжку?
20. Залізти та вилізти з ванни?
21. Сидіти?
22. Сідати ти вставати з унітазу?
23. Робити важку хатню роботу?
24. Робити легку хатню роботу?
Визначення активності та ступеня тяжкості анкілозуючого спондилоартриту
Індекс BASDAI (Bath Ankylosing Spondilitis Disease Activity Index). Опитувальник для визначення індексу BASDAI складається із 6 запитань, на які пацієнт відповідає самостійно.
Для відповіді на кожне запитання пропонується 10-сантиметрова ВАШ (ліва крайня точка відповідає відсутності певної ознаки, права крайня точка відповідає крайньому ступеню вираженості ознаки; для останнього запитання про термін скутості — ≥2). Пацієнт має відповісти на кожне із нижченаведених запитань, свою відповідь відобразити рискою, яка перетинає 10-сантиметрову лінію у вибраному ним місці.
1. Як би Ви розцінили рівень загальної слабкості (стомлюваності) за останній тиждень?
2. Як би Ви розцінили рівень болю в шиї, спині або КуС за останній тиждень?
3. Як би Ви розцінили рівень болю (або ступінь припухлості) в суглобах (окрім шиї, спини чи КуС) за останній тиждень?
4. Як би Ви розцінили ступінь неприємних відчуттів, які виникають при доторкуванні до будь-яких болісних ділянок або тиску на них (за останній тиждень)?
5. Як би Ви розцінили ступінь вираженості ранішньої скутості, яка виникає після прокидання (за останній тиждень)?
6. Як довго продовжується ранішня скутість, яка виникає після прокидання (за останній тиждень)?
Лікар за допомогою лінійки вимірює довжину відмічених відрізків ліній, вираховує суму та середню величину. Величина індексу BASDAI >4 свідчить про високу активність захворювання.
Індекс BASFI (Bath Ankylosing Spondilitis Functional Index) складається з 10 запитань, пов’язаних з оцінкою повсякденної активності, які відображені на аналогових шкалах. Ліва крайня точка відповідає 0 мм — «без утруднень», права крайня точка відповідає 100 мм — «це неможливо зробити».
Запитання (оцінюються за ВАШ за останній тиждень) «Чи можете Ви…»:
- Надіти шкарпетки або колготи без сторонньої допомоги?
- Нагнутися вперед, щоб підняти ручку з підлоги без використання пристосувань?
- Дотягнутися рукою до високо розташованої полиці без сторонньої допомоги?
- Встати зі стільця без допомоги рук і без сторонньої допомоги?
- Встати з підлоги з положення «лежачи на спині» без сторонньої допомоги?
- Стояти без додаткової опори протягом 10 хв і не відчувати дискомфорту?
- Піднятися наверх на 12–15 сходинок, не опиратися на перила чи паличку (наступати одною ногою на кожну сходинку)?
- Повернути голову і подивитися за спину, не повертати тулуб?
- Займатися фізично активними видами діяльності (наприклад фізичними вправами, спортом, роботою в саду)?
- Зберігати активність протягом всього дня (дома чи на роботі)?
Лікар за допомогою лінійки вимірює довжину відмічених відрізків ліній, вираховує суму та середню величину. Величина індексу BASFI >4 свідчить про виражені функціональні порушення.
Глава 7. Лабораторні методи дослідження
Клінічна оцінка імунологічного стану при ревматичних хворобах
Захворювання, в основі розвитку і прогресування яких лежить хронічне запалення, відносяться до числа найбільш поширених і прогностично несприятливих форм патології людини.При деяких із них запалення тісно пов’язане з аутоімунітетом, тобто з імунною відповіддю проти власних тканин, так ніби то вони чужорідні для організму. Ці захворювання визначаються як аутоімунні. Імунна відповідь спрямована проти обмеженого числа (ауто) антигенів, специфічних для певних тканин, призводить до локального («органоспецифічного») запалення, а проти аутоантигенів, наявних у всіх клітинах (наприклад нуклеїнових кислот, нуклеотидів тощо), компонентів клітинних мембран або білків плазми крові, до генералізованого (системного) запалення. Найбільш яскравими прикладами системних аутоімунних захворювань є РА, СЧВ, ССД, ідіопатична запальна міопатія (ІЗМ) (дерматоміозит (ДМ) і поліміозит), синдром Шегрена, системний васкуліт і деякі інші запальні ревматичні захворювання.
Розвиток системного хронічного запалення визначає характерну для аутоімунних ревматичних хвороб надзвичайну різноманітність клінічних проявів та лабораторних змін. Це суттєво затруднює ранню діагностику, а внаслідок цього, проведення адекватної терапії, що особливо ефективна в дебюті захворювання.
В ідеалі лабораторні тести мають відповідати таким критеріям (табл. 7.1), але жоден із них у принципі не може відповідати всім цим вимогам повністю.
Таблиця 7.1
Що означає ідеальний лабораторний тест в ревматології?
|
Підтвердження діагнозу |
|
Виключення інших діагнозів |
|
Оцінка прогнозу |
|
Оцінка активності хвороби |
|
Виявлення ураження певного органа |
|
Оцінка стадії захворювання |
|
Уточнення механізмів захворювання |
|
Вибір методу лікування |
|
Моніторинг ефективності терапії |
|
Моніторинг токсичності терапії |
Потрібно розрізняти діагностичні тести і тести, необхідні для вирішення інших клінічних завдань (активність імунологічного процесу, прогноз, ефективність протизапальної терапії) (табл. 7.2).
Таблиця 7.2
Характеристика лабораторних тестів при ревматичних захворюваннях
|
Показник |
Діагноз |
Активність |
Прогноз |
Ефективність лікування |
|
Аутоантитіла |
||||
|
РФ |
+ |
– |
+ |
– |
|
АНФ |
+ |
– |
– |
– |
|
АФЛ |
+ |
– |
+/– |
– |
|
АНЦА |
+ |
? |
– |
? |
|
Маркери запалення |
||||
|
ШОЕ |
– |
+ |
+/– |
+ |
|
СРБ |
– |
++ |
+ |
+ |
Загальноприйнятими параметрами, які характеризують діагностичне значення лабораторних тестів, є чутливість, специфічність і діагностична цінність (табл. 7.3, 7.4, рис. 7.5).
Таблиця 7.3
Чутливість, специфічність і діагностична цінність
|
|
|
|
|
Для діагностики захворювання можна використовувати лише тести, які виявляють високу чутливість і специфічність |
Таблиця 7.4
Визначення чутливості, специфічності та діагностичної цінності
|
Результат |
Хвороба наявна |
Хвороба відсутня |
|
Позитивний |
Правдиво позитивний (ПП) |
Неправдиво позитивний (НП) |
|
Негативний |
Неправдиво негативний (НН) |
Правдиво негативний (ПН) |
|
Ймовірність захворювання |
||
|
↓ |
↓ |
|
|
Скринінговий тест (для виключення захворювання) |
Підтверджувальний тест (для підтвердження захворювання) |
|
|
↓ |
↓ |
|
|
Негативний |
Позитивний |
|
|
↓ |
↓ |
|
|
Висока чутливість |
Висока специфічність |
|
|
↓ |
↓ |
|
|
Висока негативна достовірна цінність (хвороба малоймовірна) |
Висока позитивна достовірна цінність (хвороба ймовірна) |
|
Рис. 7.5. Необхідні характеристики лабораторних методів
Чутливість = ПП / (ПП+НН).
Специфічність = ПН / (ПН+НП).
Позитивна діагностична цінність = ПП (ПП + НП).
Негативна діагностична цінність = ПН (ПН + НН).
Клінічні дані
Найбільш корисними в ревматології є серологічні тести (визначення аутоантитіл та маркерів запалення), в той час як методи оцінки імунного статусу (субпопуляції лімфоцитів, імуноглобуліни та ін.), як і імуногенетичні маркери (за винятком HLA-B27), поки що мають суттєво менше значення, хоча дослідження в цьому напрямку активно розвиваються.
Ревматоїдний фактор
РФ — аутоантитіла IgM, а також IgA та IgG ізотопів, які реагують із Fc-фрагментом IgG. Підвищення титрів РФ входить в число критеріїв РА, хоча значення позитивного РФ для встановлення діагнозу менше, ніж даних анамнезу та клінічного обстеження. РФ у діагностичних титрах часто виявляється при різних ревматичних (табл. 7.6) та неревматичних (табл. 7.7) захворюваннях, і навіть у здорових людей.
Таблиця 7.6
Чутливість та специфічність РФ при РА
|
Діагноз |
РФ, % |
||
|
>15 од/мл |
>50 од/мл |
>100 од/мл |
|
|
РА |
66 |
46 |
26 |
|
Синдром Шегрена |
62 |
52 |
33 |
|
ЗЗСТ |
23 |
13 |
6 |
|
СЧВ |
27 |
10 |
3 |
|
ССД |
44 |
18 |
2 |
|
Поліміозит |
18 |
0 |
0 |
|
РеА |
0 |
0 |
0 |
|
ОА |
25 |
0 |
0 |
|
Здорові |
13 |
0 |
0 |
|
Чутливість, % |
66 |
48 |
26 |
|
Специфічність, % |
72 |
88 |
95 |
Таблиця 7.7
РФ при неревматичних захворюваннях
|
З ревматоїдноподібним артритом |
Без ревматоїдноподібного артриту |
|
|
Водночас РФ рідко виявляється при захворюваннях суглобів, з якими іноді доводиться проводити диференційну діагностику РА (серонегативна спондилоартропатія, подагра, інші мікрокристалічні артрити). У осіб похилого віку значення РФ (як діагностичного маркера РА) знижується. На сьогодні вважають, що визначення РФ має більш суттєве значення для оцінки прогнозу, ніж діагностики РА, особливо на ранній стадії захворювання. Високі титри РФ асоціюються з тяжчим перебігом РА, несприятливим прогнозом та розвитком «екстраартикулярних» (системних) проявів хвороби. Фактично виявлення високих титрів РФ у дебюті захворювання є умовою для негайного призначення ефективних БПЗП.
Антинуклеарні антитіла
Антинуклеарні антитіла — гетерогенна група антитіл, що реагують із різними компонентами ядра (табл. 7.8), розглядаються як діагностичний маркер системних аутоімунних ревматичних захворювань (табл. 7.9).
Таблиця 7.8
АНФ — гетерогенна популяція антитіл, які реагують із компонентами ядра
|
Потрібно визначати:
|
Гомогенне
|
Периферичні
|
|
Не потрібно визначати:
|
Крапчасте
|
Нуклеолярне
|
|
Слід пам’ятати:
|
Таблиця 7.9
Клінічне значення АНФ
|
Захворювання |
Частота АНФ, % |
|
Визначення дуже корисне СЧВ ССД |
95–100 60–80 |
|
Визначення іноді корисне Запальна міопатія Синдром Шегрена |
30–80 40–70 |
|
Абсолютно необхідно (обов’язковий компонент діагностичних критеріїв) ЗЗСТ Медикаментозний вовчак Аутоімунний («люпоїдний») гепатит |
100 100 100 |
|
Визначення корисне для оцінки прогнозу Ювенільний хронічний олігоартрит з увеїтом Феномен Рейно |
20–50 20–60 |
Основний «скринінговий» тест для визначення антинуклеарних антитіл з будь-якою специфічністю (у цьому разі їх зазвичай позначають як АНФ) — метод непрямої імунофлуоресценції.
Тип імунофлуоресценції (світіння) в певною мірою відображає наявність антитіл з різною специфічністю. Проте оскільки при різних захворюваннях може виявлятись один і той же тип світіння, його «чутливість» і «специфічність» дуже низькі, і йому не слід надавати надто великого значення, особливо якщо можливе визначення специфічних антинуклеарних антитіл.
Важливість визначення АНФ не викликає сумнівів. Але оскільки АНФ з високою частотою виявляють при дуже багатьох неревматичних захворюваннях, на тлі прийому багатьох лікарських препаратів, і навіть у здорових осіб (табл. 7.10), саме по собі виявлення АНФ (особливо у низьких титрах) не має діагностичного значення як у дорослих, так і у дітей.
Таблиця 7.10
Захворювання, при яких виявлення АНФ не має діагностичного значення
|
Захворювання |
Частота АНФ, % |
|
РА |
30–50 |
|
Дискоїдний вовчак |
5–25 |
|
Фіброміалгія |
25 |
|
Родичі пацієнтів з аутоімунними захворюваннями |
5–25 |
|
Захворювання щитовидної залози |
30–50 |
|
Розсіяний склероз |
25 |
|
Інфекції та пухлини |
5–50 |
|
Первинний біліарний цироз |
10–40 |
|
Аутоімунний холангіт |
100 |
|
Первинна легенева гіпертензія |
40 |
|
Тяжкий атеросклероз |
70 |
|
У здорових (титри): 1:40 1:80 1:160 1:320 |
20–30 10–12 5 3 |
За наявності типових клінічних ознак захворювання, наприклад СЧВ, титри АНФ не настільки важливі. Водночас пацієнти, які мають високі титри АНФ за відсутності достовірних клінічних проявів СЧВ, потребують більш детального обстеження та динамічного спостереження, ніж пацієнти з низькими титрами антитіл. Наприклад, виявлення високих (>1:160) титрів АНФ у пацієнтів із симетричними стійкими артралгіями дозволяє запідозрити дебют системного аутоімунного захворювання (спонтанне чи індуковане ліками). У таких пацієнтів слід провести додаткові імунологічні дослідження, які включають визначення ІgМ РФ і типу антинуклеарних антитіл.
Характеристика клінічного значення антитіл до різних ядерних антигенів наведена в табл. 7.11.
Таблиця 7.11
Клінічне значення АНФ
|
Захворювання |
Антитіла |
Чутливість, % |
Специфічність |
|
СЧВ |
АНФ Анти-дсДНК Sm Гістони РНП Ro(SS-A)/La(SS-B) Нуклеосоми |
95 50–70 15 70 30 20–30 Помірна |
Низька Висока Висока Низька Низька Низька Висока |
|
Медикаментозний вовчак |
АНФ Гістони |
90 80 |
Низька Помірна |
|
Синдром Шегрена |
АНФ Ro(SS-A) |
90 70–80 |
Низька Помірна |
|
Склеродермія |
АНФ Центромеру Scl-70 Нуклеолярні |
90 30–40 25 15 |
Низька Висока Висока Низька |
|
Запальні міопатії |
АНФ Jo-1 |
40 20 |
Низька Висока |
Низька чутливість цих тестів (за винятком антитіл до дезоксирибонуклеопротеїну) робить недоцільним їх застосування у пацієнтів із негативними результатами визначення АНФ. Проте оскільки АНФ володіє низькою специфічністю, ці тести (особливо антитіла до двоспіральної ДНК, меншою мірою — анти-Sm) корисні для підтвердження діагнозу СЧВ за наявності позитивних результатів визначення АНФ.
Антитіла до фосфоліпідів
АФЛ-гетерогенна популяція аутоантитіл, яка реагує з аніонними (рідше — нейтральними) фосфоліпідами, та широким спектром фосфоліпідзв’язувальних білків у плазмі крові, більшість з яких бере участь у регуляції згортання крові. Гіперпродукція АФЛ асоціюється з розвитком антифосфоліпідного синдрому (АФС), до клінічних проявів якого належать венозні та артеріальні тромбози, акушерська патологія (первинне невиношування вагітності та ін.), а також тромбоцитопенія та деякі інші, менш характерні прояви. Виділяють дві основні форми АФС: первинний АФС (ПАФС), який розвивається за відсутності ознак СЧВ чи якого-небудь іншого захворювання, і вторинний АФС (ВАФС), пов’язаний із СЧВ, рідше — іншими аутоімунними та інфекційними захворюваннями, злоякісними новоутвореннями чи прийомом деяких лікарських препаратів.
Загальноприйнятими лабораторними маркерами АФС (входять у діагностичні критерії АФС та СЧВ) є IgG- та IgM-антитіла до кардіоліпіну (аКЛ), які виявляються стандартизованим імуноферментним методом (ІФМ), та вовчаковий антикоагулянт (ВА), який визначається за допомогою фосфоліпідзалежних коагуляційних тестів.
При АФС аКЛ найбільш ефективно зв’язуються з кардіоліпіном у присутності білка плазми крові — β2-глікопротеїну І (β2-ГПІ). Фактично аКЛ реагують з антигенними детермінантами не кардіоліпіну, а конформаційними епітопами β2-ГПІ, які експресуються в процесі взаємодії β2-ГПІ та кардіоліпіну. Навпаки, аКЛ, які виявляються в сироватці крові пацієнтів з інфекційними захворюваннями (в яких рідко розвиваються тромботичні ускладнення), взаємодіють із самим кардіоліпіном. Оскільки у фетальній сироватці, яка використовується для визначення аКЛ, міститься β2-ГПІ, припускають, що за допомогою стандартного ІФМ можна виявляти як атитіла до β2-ГПІ (анти-β2-ГПІ), так і антитіла, які реагують власне з кардіоліпіном. Більш специфічний метод визначення анти-β2-ГПІ базується на використанні «іммобілізованого» на твердій фазі β2-ГПІ в ІФМ.
Потенційні показання до визначення АФЛ дуже різноманітні. До них належать розвиток тромботичних порушень (особливо множинних, рецидивуючих, із незвичною локалізацією), тромбоцитопенії та акушерської патології в осіб молодого та середнього віку, а також при тромбозі у новонароджених, який не можна пояснити, у разі некрозу шкіри на тлі лікування непрямими антикоагулянтами у пацієнтів, у яких виявляється подовження активованого часткового тромбопластинового часу.
Загалом для діагностики АФС аКЛ (іВА) виявляють більш високу чутливість, а анти-β2-ГПІ — специфічність (табл. 7.12).
Таблиця 7.12
Чутливість і специфічність АФЛ
|
Показник |
IgG-анти-β2-ГПІ |
IgG-аКЛ |
|
Верхня границя норми
|
=10 GPL 57% 82% |
=10 GPL 57% 43% |
|
Верхня границя норми
|
=20 GPL 22% 94% |
=20 GPL 35% 79% |
|
Власні дані Верхня межа норми
|
=10 GPL 60% 84% |
=20 GPL 57% 74% |
Це пов’язано з тим, що результати визначення аКЛ нерідко можуть бути неправдиво-позитивними, пов’язані з наявністю непатогенних (реагуючих лише з кардіоліпіном) антитіл, або неправдиво-негативними, оскільки виявність патогенних анти-β2-ГПІ може суттєво варіювати залежно від методичних особливостей визначення аКЛ.
Антинейтрофільні цитоплазматичні антитіла
Антинейтрофільні цитоплазматичні антитіла (АНЦА)-гетерогенна популяція аутоантитіл, які реагують із ферментами, локалізованими в цитоплазмі нейтрофілів (табл. 7.13). Основним методом визначення АНЦА є метод непрямої імунофлуоресценції з використанням фіксованих спиртом нейтрофілів, за допомогою якого виявляються два основних типи аутоантитіл: цитоплазматичні АНЦА (цАНЦА) та перинуклеарні (пАНЦА). цАНЦА зазвичай специфічні щодо протеїнази-3, а пАНЦА найбільш часто реагують з мієлопероксидазою.
Таблиця 7.13
АНЦА
|
АНЦА- гетерогенна популяція аутоантитіл, яка реагує з ферментами цитоплазми нейтрофілів |
|
цАНЦА реагують із протеїназою-3, пАНЦА реагують із мієлопероксидазою |
|
Чутливість цАНЦА для діагностики гранулематозу Вегенера — 34–92%, специфічність — 99% |
|
Показання до визначення: нефрит, який не можна пояснити, легенево-нирковий синдром |
|
Підвищення АНЦА — предиктор загострення при гранулематозі Вегенера |
Зазвичай цАНЦА дають гранулярну цитоплазматичну флуоресценцію з більшою інтенсивністю в напрямку до ядра нейтрофілів, ніж до периферії, а пАНЦА — перинуклеарне світіння нейтрофілів та деяких моноцитів. Цей тип світіння часто є ніби артефактом, зумовленим спиртовою фіксацією нейтрофілів. Тому при визначенні пАНЦА необхідне встановлення відповідних контролів із лімфоцитами донора або НЕр-2-клітинами. Про наявність пАНЦА можна говорити тільки в тому випадку, якщо сироватки реагують лише з нейтрофілами (або моноцитами) або титр реагуючих із нейтрофілами антитіл у 2 рази вищий, ніж титр антитіл, які реагують із лімфоцитами.
Маркери запалення
Одним із найчутливіших та специфічних маркерів запалення є СРБ. При хронічному запаленні рівень СРБ корелює з ШОЕ, в’язкістю плазми крові та в більшості випадків — із концентрацією протизапальних цитокінів (ІЛ-6, -1, ФНП-α).
У нормі в сироватці СРБ наявний у невеликих кількостях (≈0,8 мкг/мл). У 90% здорових донорів концентрація СРБ не перевищує 3 мкг/мл, а у 99% — <10 мкг/мл. На фоні запалення його концентрація може підвищуватися в ≥100 разів.
При хронічних запальних захворюваннях, таких як РА, серонегативна спондилоартропатія, системний васкуліт (але не при СЧВ та ІЗМ), рівень СРБ дуже добре корелює з клінічними проявами активності захворювання.
Дослідження концентрації СРБ має прогностичне значення. У хворих на РА стійке підвищення СРБ асоціюється з несприятливим прогнозом, а зниження концентрації відображає ефективність лікування. При ОА підвищення концентрації СРБ корелює з прогресуванням ураження КС.
Висновок
Останнім часом великою популярністю (особливо за кордоном) користується одночасне дослідження кількох лабораторних показників, так звана ревматологічна панель, в яку входить визначення РФ, АНФ, сечової кислоти, а також СРБ, анти-стрептолізину О, імуноглобулінів, антинуклеарних антитіл, АФЛ та АНЦА, HLA-В27. Проте більшість осіб із «позитивними» результатами «ревматичних» лабораторних тестів зовсім не хворіють на ревматичні захворювання. Оскільки не існує імунологічних тестів, результати яких були б специфічними для кожного ревматологічного захворювання, ці дослідження слід проводити лише за суворими показаннями, які базуються на детальному клінічному обстеженні пацієнтів (табл. 7.14 та 7.15).
Таблиця 7.14
Коли слід визначати аутоантитіла?
|
Лише при високій імовірності відповідного ревматологічного захворювання |
|
При низькій імовірності — в більшості випадків — неправдиво-позитивні результати |
|
Визначення аутоантитіл не придатне для скринінгу |
Таблиця 7.15
Клінічна цінність лабораторних тестів після клінічного обстеження (в балах)
|
Клінічний діагноз |
ШОЕ |
СРБ |
РФ |
АНФ |
аФЛ |
АНЦА |
|
РА |
3 |
3 |
3 |
2 |
0 |
0 |
|
Системні захворювання сполучної тканини |
3 |
2 |
2 |
4 |
3 |
0 |
|
Васкуліт |
1–4 |
2 |
0 |
0 |
0 |
3 |
Біохімічні методи дослідження при ревматичних захворюваннях
Лабораторні методи дослідження частіше не несуть інформації щодо нозологічної форми ревматичного захворювання, але вони цінні відносно таких моментів: 1) допомагають виявити наявність запального процесу; 2) оцінити ступінь та динаміку активності запального процесу; 3) оцінити ефективність лікування, стійкість ремісії, підібрати адекватну дозу ліків; 4) допомагають проводити диференційну діагностику запальних та інших хвороб суглобів; 5) виявити порушення в білковому, ліпідному, вуглеводному обмінах тощо.
Патогенез більшості ревматичних хвороб становить запалення. Запалення є одним із найпотужніших індукторів «гострофазової відповіді», що становить фізіологічну захисну реакцію організму, спрямовану на послаблення небажаних наслідків різних стресорних дій та пошкоджень тканин. Основою розвитку запального процесу є каскад біохімічних та імунологічних процесів, спрямованих на елімінацію пошкоджувального фактора, відновлення пошкоджених тканин і порушених функцій. Наслідком «гострофазової відповіді» є — підвищення температури тіла, лейкоцитоз, підвищення ШОЕ, збільшення синтезу деяких білків у плазмі крові та гормонів (адренокортикотропний гормон, кортизол, інсулін, глюкагон, соматотропний гормон, тиреотропний гормон) та ін. Особливе значення має зміна білковосинтезуючої функції печінки, що проявляється посиленням синтезу одних білків та зниженням продукції інших. Білки плазми крові, концентрація яких підвищується у відповідь на запалення >5%, мають назву «гострофазових». Регуляція синтезу цих білків здійснюється за участю прозапальних цитокінів: інтерлейкіну (ІЛ)-1 та -6, ФНП, онкостатину М тощо.
«Гострофазові» білки гетерогенні, їх ділять на три основні групи:
- СРБ, сироватковий амілоїдний білок А;
- альфа1 — кислий глікопротеїд, альфа1 — антитрипсин, альфа1 — антихемотрипсин, гаптоглобін, фібриноген;
- церулоплазмін, С3- та С4-компоненти комплементу.
При запаленні концентрація білків першої групи збільшується у 100–1000 разів, другої — у 2–4, третьої — у 1,5.
Для виявлення та оцінки гостроти запалення у клінічній практиці застосовують визначення таких лабораторних показників: ШОЕ, загальний білок сироватки крові та його фракції, СРБ. Деякі з цих показників визначаються біохімічними, а деякі — імунологічними методами дослідження.
СРБ відносять до імунологічних показників, але виявлення його у сироватці крові — найбільш чутливий метод оцінки гостроти запалення, тому автори зазначають про нього також у цьому розділі. При запаленні СРБ зв’язується з елементами клітинної стінки, С1q-фракцією комплементу та рецепторами, які знаходяться на нейтрофілах та моноцитах, що сприяє запуску та підтримує запальну відповідь. Це високочутливий маркер запалення, підвищення його концентрації відзначається вже через 4–6 год від початку пошкодження тканин, максимальна концентрація досягається через 24–72 год. При запаленні кількість СРБ може підвищитись у ≥100 разів, збільшуючись вдвічі кожні 6 год. Синтез та секреція СРБ здійснюється у печінці та регулюється прозапальними цитокінами. Період напіввиведення СРБ становить 19 год та не залежить від його рівня у плазмі крові. Є кількісні та якісні методи визначення СРБ. Рутинні якісні методи мають низьку чутливість та дозволяють визначити СРБ у концентрації, яка >10 мг/мл. Сучасні кількісні методи добре корелюють із гостротою запалення, дозволяють оцінити динаміку запального процесу. Кількість СРБ у плазмі крові визначають методами ELSA, радіоімунодифузії чи лазерної нефелометрії. У 90% здорових донорів концентрація СРБ не перевищує 3 мг/мл, що при якісному лабораторному дослідженні відповідає негативному результату. Концентрація СРБ при покращанні стану знижується на 50% за 24 год, в той час як ШОЕ знижується повільно (на 50% за 1 тиж).
Білки та білкові фракції (протеїнограма)
Загальний білок у сироватці крові
Концентрація загального білка в сироватці крові в нормі від 65 до 85 г/л — це нормопротеїнемія. Зміна кількості загального білка в сироватці крові залежить здебільшого від синтезу та розпаду двох основних білкових фракцій — альбумінів та глобулінів.
Гіпопротеїнемія частіше виникає за рахунок зменшення кількості альбумінів і відзначається при білковому голодуванні; значних втратах білка організмом при гострих та хронічних кровотечах, опіках, значних ексудатах, захворюваннях нирок із нефротичним синдромом, при цукровому діабеті, тяжкому тиреотоксикозі, раковій кахексії; порушенні утворення білка в організмі при захворюваннях печінки, тривалих запальних процесах, тривалому прийомі ГК, захворюваннях кишечнику.
Гіперпротеїнемія частіше зумовлена гіперглобулінемією і виникає як наслідок дегідратації, при захворюваннях сполучної тканини, системному васкуліті, інфекційних захворюваннях, цирозі печінки, мієломній та інших хворобах.
За допомогою електрофорезу у здорової людини виділяють 5 білкових фракцій: альбуміни, глобуліни, α1-глобуліни, α2-глобуліни, β-глобуліни, γ-глобуліни. Аналіз фореграм білків дозволяє виявити, за рахунок якої фракції у хворого наявне збільшення або дефіцит білка, а також судити про специфічність змін, характерних для різних патологій.
Альбуміни — найбільш легка та гомогенна фракція простих білків, до 40% яких знаходиться в плазмі, а 60% — у міжклітинній рідині. Щоденно в печінці синтезується 12–15 г цього білка. Альбуміни відіграють важливу роль у підтримці нормального онкотичного тиску, а також беруть участь у транспорті великої кількості ендо- та екзогенних речовин. У плазмі крові здорової людини знаходиться 32–55 г/л (52–68%) альбумінів. При запальних ревматичних захворюваннях виявляють зменшення кількості альбумінів.
Глобуліни сироватки крові представлені чотирма фракціями, що теж негомогенні і містять декілька білків, які виконують різні функції. У сироватці крові здорової людини міститься 23–35 г/л глобулінів.
Альбуміно-глобуліновий коефіцієнт — це відношення кількості альбумінів у плазмі крові до кількості глобулінів. У нормі він становить 1,2–2,5, за наявності запалення знижується.
До 90% α1-глобулінів синтезується в печінці. Основними компонентами цієї фракції є α1-антитрипсин, α1-кислий глікопротеїд, α1-ліпопротеїд. У нормі концентрація α1-глобулінів у крові дорівнює 1–4 г/л (4±1 відн%).
Збільшення фракції α1-глобулінів має місце при гострих, підгострих, загостренні хронічних запальних процесів; ураженні печінки; при всіх процесах тканинного розпаду чи клітинної проліферації.
Зменшення α1-глобулінів характерне при дефіциті альфа1-антитрипсину, гіпо-альфа1-протеїнемії.
Фракція α2-глобулінів містить альфа2-макроглобулін, гаптоглобін, аполіпопротеїни А, В, С, церулоплазмін. Глюкопротеїди цієї фракції складаються з фукози, глікозаміну, галактозаміну, нейрамінової кислоти та її ацетильних похідних — сіалових кислот. У нормі їх концентрація у крові становить 5–9 г/л (8±1 відн%).
До α-глобулінів відноситься основна маса білків гострої фази. Збільшення α1- та α2-глобулінів відображає інтенсивність запальних процесів і стресорної реакції при вищезазначеній патології.
Фракція β-глобулінів включає трансферин, гемопексин, компоненти комплементу, імуноглобуліни та ліпопротеїди. Норма 6–10 г/л (10±2 відн%).
Збільшення β-глобулінів виявляють при первинній та вторинній гіперліпопротеїнемії, захворюваннях печінки, нефротичному синдромі, при виразці шлунка з кровотечею, гіпотиреозі.
Зниження β-глобулінів виявляють при гіпо-β-ліпопротеїнемії.
Фракція γ-глобулінів включає імуноглобуліни G, A, M, D, E. У нормі в крові їх міститься 8–17 г/л (16±4 відн%).
Підвищення вмісту цієї фракції наявне при реакції системи імунітету, коли виробляються антитіла та аутоантитіла: при хронічних інфекціях, аутоімунних захворюваннях, у тому числі захворюваннях сполучної тканини, системному васкуліті, хронічних захворюваннях печінки, бронхіальній астмі, рецидивуючій кропивниці, атопічному дерматиті та ін. Такі ж самі зміни виявляють при парапротеїнемії: мієломній хворобі, макроглобулінемії Вальденстрема та ін.
Зниження фракція γ-глобулінів може бути первинним і вторинним. Первинна гіпогаммаглобулінемія можлива у дітей віком 3–5 міс (фізіологічна), може бути вродженою та ідіопатичною. Вторинна — є наслідком захворювань і станів, які призводять до виснаження імунної системи: хронічні інфекції, злоякісні новоутворення, хронічні захворювання нирок, печінки, лімфогранулематоз, лімфолейкоз тощо. Кількість γ-глобулінів зменшується при лікуванні цитостатиками, імунодепресантами, може бути наслідком рентгенівського опромінення, застосування радіонуклідів чи променевої терапії.
Глікопротеїди (сполучення вуглеводів та протеїнів) — складова основної речовини сполучної тканини. При ревматичних хворобах відзначають дезорганізацію сполучної тканини, тому вміст глікопротеїдів підвищується.
Сіалові кислоти — це звичайні компоненти тканин та біологічних речовин організму людини, глікопротеїди. Кількість їх збільшується при станах, пов’язаних із запаленням та деструкцією сполучної тканини при ревматичних захворюваннях. Нормальний вміст у сироватці крові — 2,0–2,4 ммоль/л (135–200 ум. од., 620–730 мг/л).
Серомукоїдні білки — це глікопротеїди, що мають властивість розчинятися у хлорній кислоті. Нормальний вміст у сироватці крові — 1,2–1,6 ммоль/л (0,13–0,2 од., 0,22–0,28 г/л). Концентрація їх підвищується при гострих запальних процесах — «білки гострої фази».
Гаптоглобін — вміст у сироватці крові підвищується при різних формах запалення. Концентрація у плазмі крові в нормі — 400–1800 мг/л (0,4–1,8 г/л).
Фібриноген — важливий компонент системи згортання крові. Він є маркером активного запалення. Збільшення його кількості має місце не лише за наявності процесів гіперкоагуляції, а також при гострих та затяжних запальних, імунних, деструктивних процесах. Гіперфібриногенемію виявляють при активному ревматичному процесі, системних мікротромбоваскулітах, загостренні хронічного гломерулонефриту, гнійних хворобах легень, туберкульозі, інфекційному ендокардиті (ІЕ), ішемічній хворобі серця, атеросклерозі. Концентрація його у плазмі крові в нормі — 2000–4500 мг/л (2–4 г/л). Підвищується при ревматичному процесі: І ступінь активності — 5 г/л, II — 5–9 г/л, III — 9–10 г/л.
Маркери, що свідчать про ураження нирок, частіше виявляють у хворих на СЧВ, ССД, системний васкуліт, РА, АС, подагру, а також за наявності супутніх захворювань: серцевої недостатності, амілоїдозу, інфекції сечової системи, діабетичної нефропатії. Слід пам’ятати про такі гострі ураження нирок, як склеродермічний нирковий криз, які швидко ведуть до ниркової недостатності та смерті. Контроль цих показників у динаміці необхідний для раннього виявлення нефротоксичної дії НПЗП, БПЗП.
Ураження нирок виявляють у осіб із ревматоїдними хворобами за наявністю маркерів захворювання в крові, сечі, збільшення артеріального тиску та за даними візуалізації структури нирок, рідше —за допомогою біопсії нирки.
Для оцінки функції нирок у міжнародній практиці використовують швидкість клубочкової фільтрації (ШКФ), яку визначають за показниками креатиніну крові з урахуванням маси тіла та віку пацієнта або радіонуклідним методом під час виконання реносцинтиграфії. У світі ШКФ визначають за допомогою формул, рекомендованих нефрологічними асоціаціями.
Формула для визначення ШКФ Cockroft — Gault (Кокрофта — Голта):
ШКФ = (140 — вік у роках) ∙ маса тіла (кг) / креатинін крові (ммоль/л) ∙ 810.
У більшості здорових людей віком до 30 років ШКФ становить у середньому 125 мл/хв/1,73 м2, з віком знижується на 1 мл/хв /1,73 м2 щороку.
В Україні функцію нирок визначають за креатинінемією. У здорових чоловіків концентрація креатиніну у сироватці крові становить 0,062 — 0,105 ммоль/л, у жінок — 0,044–0,097ммоль/л. Слід пам’ятати, що вміст креатиніну крові починає підвищуватися за наявності >50% непрацюючих нефронів, коли ШКФ вже знижена на 50% норми. Крім того, рівень креатиніну крові залежить від віку, статі, раси та поверхні тіла хворого.
Стадії ниркової недостатності: І (компенсована) — ШКФ дорівнює 89–60 мл/хв/1,73 м2, креатинін крові 0,105–0,176 ммоль/л; II (субкомпенсована) — 59–30 та 0,177–0,351; III (некомпенсована) — 29–15 та 0,351–0,440; IV (діалізна) — <15 та >0,440 відповідно.
Найбільш раннім важливим маркером ураження і прогресування хвороби нирок є персистуюче підвищення вмісту білка в сечі. У практичній діяльності виділяють: протеїнурію — підвищена екскреція білка з сечею, включаючи альбуміни та інші протеїни, альбумінурію — підвищена екскреція альбуміну, мікроальбумінурію — екскреція 30–300 мг/добу альбуміну. Виявлення мікроальбумінурії є найбільш раннім і чутливим методом виявлення протеїнурії. Збільшення екскреції альбуміну є важливим симптомом патології клубочків, а збільшення екскреції низькомолекулярних глобулінів свідчить про тубулоінтерстиціальне пошкодження. Фізіологічну протеїнурію відзначають після великих фізичних навантажень, емоцій, багатої білками їжі, при лихоманці. Оцінка добової екскреції білка з сечею може бути кількісною ознакою як ураження нирок, так і серцево-судинного ризику, а також може використовуватися в динаміці для оцінки ефективності терапевтичних заходів. Альтернативою показнику добової протеїнурії може бути визначення відношення альбуміну до креатиніну в разовій порції сечі. У нормі цей показник не перевищує 30 мг/г. Терміну «клінічна протеїнурія» відповідає відношення альбуміну до креатиніну >300 мг/г у жінок та >200 мг/г — у чоловіків.
Мікроскопічне дослідження сечового осаду допоможе виявити еритроцитурію, лейкоцитурію, циліндрурію, які виявляють при пошкодженні нирок при СЧВ; васкуліті, пурпурі Шенлейна — Геноха, МПА та ін. Кристали сечової кислоти виявляють у сечі при порушенні пуринового обміну та подагрі.
Визначення питомої ваги сечі дозволяє оцінити концентраційну функцію нирок та виявити ниркову недостатність.
Глюкозурія може свідчити про наявність цукрового діабету, може мати ренальне походження, але можлива також при прийомі ГК, після стресу, вживанні значної кількості вуглеводів. Вміст білірубіну в сечі підвищується при ураженні паренхіми печінки, порушеннях відтоку жовчі, уробіліногену — при захворюваннях печінки, кишечнику, гемолітичних станах, кетонурія з’являється при некомпенсованому цукровому діабеті, тяжкій лихоманці, алкогольній інтоксикації, голодуванні, коматозних станах.
Пошкодження печінки може розвиватися при різних ревматоїдних хворобах, функцію печінки необхідно визначати перед призначенням цитостатичних та інших препаратів. До функціональних печінкових проб відносять визначення активності у сироватці крові: аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ), білірубіну, лужної фосфатази (ЛФ), гамма-глутамілтрансферази, а також кількості альбуміну, протромбінового часу.
Концентрацію сечової кислоти в сироватці крові необхідно визначати всім пацієнтам із подагрою, що важливо для визначення терапевтичної тактики та контролю адекватності терапії. Однак слід пам’ятати, що в період гострого подагричного нападу підвищується екскреція сечової кислоти нирками і урикемія майже в половини хворих буває в межах норми. Урикемію на початку лікування контролюють раз на 2–4 тиж, надалі — кожні 6 міс. Межа розчинності уратів, тобто рівень, вище якого утворюються кристали моноурату натрію, становить 0,41 ммоль/л (7,0 мг/дл), цей рівень раніше вважали верхньою межею нормального вмісту сечової кислоти в сироватці крові (урикемії). Відповідно до рекомендацій EULAR, зараз гіперурикемією слід вважати рівень сечової кислоти у сироватці крові >0,36 ммоль/л (6,0 мг/дл).
Гіперурикемія та подагра можуть бути не лише первинними, але також можуть розвиватися при ряді захворювань і станів, при яких спостерігається посилений катаболізм нуклеопротеїнів: саркоїдозі, псоріазі, мієло- і лімфопроліферативних захворюваннях, гемолітичних анеміях, явній поліцитемії, рентгенотерапії, при швидкій втраті маси тіла (схудненні). Недостатнє виведення уратів спостерігається при порушенні функції нирок при хронічній хворобі нирок, нирковій недостатності, полікістозі нирок, діабетичному кетоацидозі, при кето- і лактоацидозі, нецукровому діабеті, синдромі Бартера, зневодненні, при отруєнні свинцем (свинцева подагра); гіперпаратиреозі й гіпотиреозі, респіраторному ацидозі та інших станах.
Для діагностики ураження м’язів визначають концентрацію ферментів у сироватці крові, що належать до м’язових. До найбільш специфічних та чутливих належить креатинфосфокіназа (КФК), іноді відзначають підвищення рівня лише альдолази. Визначення рівня АсАТ, АлАТ, лактатдегідрогенази (ЛДГ) слід віднести до найменш специфічних м’язових маркерів. КФК наявна у тканинах людини у вигляді трьох ізомерів: КФК-1 (КФК-ВВ), КФК-2 (КФК-МВ), КФК-3 (КФК-ММ). У скелетних м’язах міститься переважно КФК-ММ (98%), у серцевому м’язі — КФК-МВ (40%) і КФК-ММ (60%). 20–40% загальної активності КФК-МВ становить активність за рахунок міокарда, лише ≈3% — становить активність цього фермента за рахунок скелетних м’язів. Загальна активність КФК у сироватці крові становить 10–195 МО/л, 94–96% цього рівня становить активність ММ-фракції. Рівень активності МВ-фракції в нормі становить 6% загальної активності, що дорівнює 0–24 МО/л. Альдолаза — 1,0–7,5 ОД/л. Підвищення рівня КФК і/або альдолази в сироватці крові є лабораторним маркером поліміозиту та ДМ, а також корелює з рівнем м’язової слабкості. Ураження скелетних м’язів, а не міокарда, підтверджує підвищення активності МВ ізофермента КФК. Активність КФК підвищується також при травмах м’язів, м’язовій дистрофії, міокардиті, токсичній міопатії, у разі прийому ГК, НПЗП, пеніциламіну, солей золота, метаболічних ураженнях м’язів (гіпотиреоз), гіпоксії скелетних м’язів.
ЛФ надходить у кров із печінки та Ктк, з плаценти у період вагітності та з пухлинної тканини (карциноми). Маркерами кісткоутворення є остеокальцин та дві основні ізоформи ЛФ, кісткова та печінкова. Кісткова фракція ЛФ продукується остеобластами, вона — більш специфічний маркер формування Ктк. При хворобах, що супроводжуються підвищенням активності остеобластів, у крові відзначають підвищення концентрації загальної та кісткової ізоформи ЛФ. Це спостерігається при хворобі Педжета, остеомаляції.
Ліпіди — найважливіший показник серцево-судинного ризику у пацієнтів із ревматичними хворобами. Порушення функції та/чи складу ліпідів і ліпопротеїнів крові визначають як дисліпідемію. Відповідно до перших Європейських настанов (2011) щодо ведення пацієнтів із дисліпідемією основним пріоритетом у ліпідному контролі залишається холестерин (ХС) ліпопротеїнів низької щільності (ЛПНЩ). Беруть до уваги також такі показники: загальний ХС або ХС не-ліпопротеїнів високої щільності (ХС не-ЛПВЩ), ХС ліпопротеїнів дуже низької щільності (ЛПДНЩ), ХС ЛПВЩ, тригліцериди, аполіпопротеїн В. Зазвичай лабораторним шляхом визначають три параметри ліпідограми: ХС, тригліцериди, ХС ЛПВЩ. ХС не-ЛПВЩ підраховується як загальний ХС мінус ХС ЛПВЩ. ХС ЛПНЩ обчислюють за формулою Friеdewald (Фридвальда):
ХС ЛПНЩ (ммоль/л) = загальний ХС — ХС ЛПВЩ — (0,45 · тригліцериди).
Лабораторні показники активності ревматизму наведено у табл. 7.16, а основні біохімічні показники крові — у табл. 7.17.
Таблиця 7.16
Лабораторні показники активності ревматизму
|
Показник |
Неактивна фаза |
Активна фаза, ступінь |
||
| І | ІІ | ІІІ | ||
|
Лейкоцити, 109/л |
6–7 |
8–10 |
10–12 |
≥12 |
|
Особливості лейкоцитарної формули |
Немає |
Немає |
Нейтрофільоз, моноцитоз, нерізко виражені |
Виражені нейтрофільоз, моноцитоз, можлива еозинофілія |
|
ШОЕ, мм/год |
<10 |
Періодично <20 |
20–40 |
≥40 |
|
Фібриноген, г/л |
До 4,0 |
4–5 |
5–6 |
≥7 |
|
Фібрин, мг/мл |
11–14 |
11–14 |
16–21 |
23–28 |
|
Серомукоїд, од. опт. щіл. |
0,20 |
0,20–0,22 |
0,22–0,30 |
>0,30 |
|
Серомукоїд, ммоль/л |
0,99–1,32 |
0,99–1,32 |
1,65–4,4 |
4,95–5,5 |
|
Гексози, г/л |
0,8–1,0 |
1,0–1,2 |
1,2–1,8 |
>1,8 |
|
Сіалові кислоти, од. опт. щіл. |
0,20 |
0,20–0,25 |
0,25–0,30 |
0,35–0,40 |
|
СРБ |
– |
– чи + |
++ |
+++ чи ++++ |
|
Альфа-2-глобуліни, % г/л |
6–10 <0,08 |
<10 0,08–0,12 |
11,5–16 0,12–0,15 |
16–25 >0,15 |
|
Гаммаглобуліни, % г/л |
12–21 <0,16 |
До 19 0,16–0,20 |
21–23 0,20–0,25 |
23–25 >0,25 |
|
Титр АСЛ-О |
1:160–1:250 |
1:250–1:300 |
1:300–1:600 |
1:600–1:1200 |
Таблиця 7.17
Основні біохімічні показники крові та їх зміни при різних станах
|
Показник |
Збільшення |
Зменшення |
|
Азот |
Захворювання нирок, дегідратація, шлунково-кишкові кровотечі, лейкоз, серцева недостатність, шок, постренальна азотемія, обструкція сечових шляхів, гострий інфаркт міокарда |
Печінкова недостатність, надмірна гідратація, період вагітності, акромегалія, дотримання певної дієти, повністю парентеральне харчування |
|
АлАТ |
Гепатит, цироз печінки, метастази в печінці, обтураційна жовтяниця, інфекційний мононуклеоз, застійна печінка, панкреатит, хвороби нирок, зловживання алкоголем |
Недостатність піридоксину (вітаміну В6) |
|
Альбумін |
Дегідратація, нецукровий діабет |
Надмірна гідратація, недостатнє харчування, синдроми мальабсорбції, нефроз, печінкова недостатність, опіки, мієломна хвороба, пухлини, що метастазують |
|
Амілаза |
Панкреатит, кишкова непрохідність, мезентеріальний тромбоз та інфаркт кишечнику, макроамілаземія, паротит, хвороби нирок, розрив труби при позаматковій вагітності, рак легені, гостре алкогольне отруєння, стан після операції на черевній порожнині |
Виражена деструкція підшлункової залози |
|
АсАТ |
Інфаркт міокарда, серцева недостатність, міокардит, перикардит, міозит, м’язова дистрофія, травми, захворювання печінки, панкреатит, інфаркт нирок, еклампсія, злоякісні пухлини, пошкодження мозку, епілептичні припадки, гемоліз, зловживання алкоголем |
Недостатність піридоксину (вітаміну В6), термінальні стадії захворювань печінки |
|
Білірубін |
Захворювання печінки, обтураційна жовтяниця, гемолітична анемія, інфаркт легені, хвороба Жильбера, синдром Дубіна — Джонсона, жовтяниця новонароджених |
|
|
Глюкоза |
Цукровий діабет, в/в введення глюкози, застосування тіазидів та ГК, феохромоцитома, гіпертиреоз, синдром Кушинга, акромегалія, мозкова травма, хвороби печінки, нефроз, гемохроматоз, стрес (наприклад емоційний, при опіках, шоці та анестезії), гострий або хронічний панкреатит, енцефалопатія Верніке (недостатність вітаміну В1), введення епінефрину, естрогенів, етанолу, фенітоїну, пропранололу, хронічний надлишок вітаміну А |
Надлишок інсуліну, інсулінома, Аддісонова хвороба, мікседема, печінкова недостатність, синдроми мальабсорбції, панкреатит, недостатність глюкагону, позапанкреатичні пухлини, початкові стадії цукрового діабету, ураження вегетативної нервової системи, стан після гастректомії, ідіоматична чутливість до лейцину, ферментопатії (хвороба Гірке, непереносимість фруктози), безконтрольне вживання пероральних гіпоглікемічних препаратів, недостатнє харчування, алкоголізм |
|
Калій |
Гіперкаліємічний ацидоз, діабетичний ацидоз, гіпофункція надниркових залоз, спадкова гіперкаліемія, гемоліз, міоглобінурія, прийом калійзберігаючих діуретиків та інгібіторів АПФ, велике навантаження екзогенним К, ниркова тубулопатія, тромбоцитоз |
Цироз печінки, недостатність харчування, блювання, метаболічний алкалоз, діарея, нефроз, застосування діуретиків, гіперфункція надниркових залоз, надмірна ектопічна продукція адренокортикотропного гормону, недостатність β-гідроксилази |
|
Кальцій |
Гіперпаратиреоз, метастази в Ктк, мієломна хвороба, саркоїдоз, гіпертиреоз, надлишок вітаміну D, злоякісні пухлини без метастазів у Ктк, молочно-лужний синдром (синдром Бернетта) |
Гіпопаратиреоз, печінкова недостатність, синдроми мальабсорбції, панкреатит, гіпоальбумінемія, недостатність вітаміну D, гіпергідратація |
|
Кисла фосфатаза |
Рак передміхурової залози, масаж передміхурової залози, простатит, інфаркт міокарда, підвищена деструкція тромбоцитів, хвороби печінки, хвороби кісток |
|
|
Креатинін |
Ниркова недостатність, обструкція сечових шляхів, дегідратація, |
Старіння |
|
КФК |
Інфаркт міокарда, хвороби м’язів, опіки, травми, ураження скелетних м’язів, системні хвороби сполучної тканини, менінгіт, застосування деяких лікарських засобів (преднізолон, статини), епілепсія, психоз, ішемічний інсульт, гіпертермія, гіпотиреоз, міокардит, стан після хірургічної операції, вживання алкоголю |
Тиреотоксикоз |
|
ЛДГ |
Інфаркт міокарда, інфаркт легені, гемолітична анемія, перніціозна анемія, лейкози, лімфоми, інші злоякісні новоутворення, хвороби печінки, інфаркт нирки, епілептичні напади, спру, травма (у тому числі черепно-мозкова) |
|
|
Лактаза |
Те ж саме, що й у разі амілази (за винятком паротиту), макроамілаземія |
|
|
Магній |
Захворювання нирок, надлишок магнію (після в/в введення або прийомі всередину) |
Діарея, синдроми мальабсорбції, нирковий канальцевий ацидоз, гострий канальцевий некроз, хронічний гломерулонефрит, застосування деяких лікарських засобів (діуретики, антибіотики), альдостеронізм, гіпертиреоз, гіперкальціємія, некомпенсований цукровий діабет, недостатність харчування |
|
Міоглобін |
Інфаркт міокарда, обширні травми, ураження скелетних м’язів, синдром тривалого здавлення, термічні опіки, електрошок, артеріальна оклюзія з ішемією м’язів |
|
|
Тропонін Т |
Інфаркт міокарда |
|
|
Сечова кислота |
Подагра, ниркова недостатність, лікування діуретиками, перніціозна анемія, лейкоз, лімфома, поліцитемія, ацидоз, псоріаз, гіпотиреоз, еклампсія, мієломна хвороба, некроз тканин, запальні процеси, наявність подагри в родині (вірогідність підвищеного рівня сечової кислоти — 25%), протипухлинна хіміотерапія (зокрема вінкристином, азотистим іпритом, меркаптопурином), гемолітична анемія, серповидноклітинна анемія, високобілкова дієта для схуднення, свинцеве отруєння, синдром Леша — Найхана, полікістоз нирок, системний та обмежений кальциноз, гіпопаратиреоз, саркоїдоз, підвищена концентрація тригліцеридів у сироватці крові |
Застосування урикозуричних засобів та алопуринолу, гепатолентикулярна дегенерація (хвороба Вільсона), вітамін С у високих дозах, синдром Фанконі, ксантинурія |
|
Натрій |
Дегідратація, нецукровий діабет, надмірне вживання кухонної солі, цукровий діабет (залежно від діурезу), діуретична фаза гострого канальцевого некрозу, гіперкальціємічна нефропатія (залежно від діурезу), есенціальна гіпернатріємія при ураженнях гіпоталамуса |
Гіперсекреція антидіуретичного гормону, нефроз, гіпофункція надниркових залоз, мікседема, серцева недостатність, діарея, блювання, діабетичний ацидоз, прийом діуретиків, недостатність кори надниркових залоз, хибна гіпонатріємія (осмотичний тиск сироватки крові нормальний або підвищений; для запобігання помилкам виконують пряму потенціометрію з використанням іонселективного електрода), гіперліпідемія (Na+ у сироватці знижується на 1 мекв/л при підвищенні рівня ліпідів на 46 г%), гіперглікемія (Na+ у сироватці знижується на 3 мекв/л при підвищенні концентрації глюкози на 100 г%), введення манітолу, гіперпротеїнемія (наприклад при мієломній хворобі) |
|
Загальний білок |
Мієломна хвороба, мікседема, СЧВ, саркоїдоз, нецукровий діабет, дегідратація, колагенози |
Опіки, цироз печінки, недостатнє харчування, нефротичний синдром, синдроми мальабсорбції, надмірна гідратація, втрата білка через ШКТ |
|
Тригліцериди |
Нефротичний синдром, холестаз, панкреатит, цироз печінки, цукровий діабет, гепатит, надмірне харчування, спадкові фактори |
Недостатнє харчування |
|
α-Фетопротеїн |
Гематома, пухлина яєчка, гепатит |
|
|
Фосфор |
Ниркова недостатність, гіпопаратиреоз, діабетичний ацидоз, акромегалія, гіпертиреоз, підвищене надходження фосфору (в/в або внутрішньо), інтоксикація вітаміном D, лактоацидоз, лізис клітин, лейкоз, гіповолемія, підвищення внаслідок тривалого зберігання проб у холодильнику або забруднення натрієвою сіллю гепарину, гіпербілірубінемія, гіперліпідемія, диспротеїнемія |
Гіперпаратиреоз, остеомаляція, рахіт, синдром Фанконі, цироз печінки, гіпокаліємія, надмірне введення глюкози (в/в), респіраторний алкалоз, недостатність фосфору в раціоні, прийом антацидів що зв’язують фосфор, алкоголізм, подагра, гемодіаліз |
|
ХС загальний |
Гіпотиреоз, обтураційна жовтяниця, нефротичний синдром, цукровий діабет, панкреатит, період вагітності, фактори спадкової схильності, метаболічний синдром, ожиріння |
Гіпертиреоз, інфекції, недостатнє харчування, серцева недостатність, злоякісні пухлини, тяжке ураження печінки (хімічне, медикаментозне чи гепатит) |
|
ХС ЛПНЩ |
Атеросклероз, метаболічний синдром, ожиріння, нефротичний синдром, цукровий діабет |
|
|
ХС ЛПВЩ |
Важке фізичне навантаження, підвищена елімінація тригліцеридів, помірне вживання алкоголю, введення інсуліну чи естрогенів |
Голодування, ожиріння, паління, цукровий діабет, гіпотиреоз, хвороби печінки, нефроз, уремія |
|
ЛФ |
Зростання кісток, метастази в Ктк, хвороба Педжета, рахіт, переломи що загоюються, гіперпаратиреоз, захворювання печінки, обтураційна жовтяниця, метастази в печінці, інфаркт легені, серцева недостатність, період вагітності |
Перніціозна анемія, гіпопаратиреоз, гіпофосфатазія |
Нормативні показники біохімічних методів дослідження
|
Глюкоза крові |
4,44–6,66 ммоль/л |
|
Загальний білок |
65–85 г/л |
|
56–66% |
|
3–6% |
|
7–10% |
|
7–12% |
|
13–19% |
|
Загальні ліпіди |
4–8 г/л |
|
ХС загальний |
3,38–5,2 ммоль/л |
|
ХС ЛПНЩ |
2,2 ммоль/л |
|
ХС ЛПВЩ |
0,9–1,9 ммоль/л |
|
Тригліцериди |
0,5–1,86 ммоль/л |
|
Коагулограма |
|
|
Протромбіновий індекс |
80–105% |
|
Фібриноген |
5,9–11,7 мкмоль/л |
|
Фібриноген В |
Негативний |
|
Час осідання крові (за Лі — Уайтом) |
5–10 хв |
|
Тривалість кровотечі (за Дюке) |
≤4 хв |
|
Час рекальцифікації плазми крові |
60–120 с |
|
Тромботест |
IV–V ступінь |
|
Толерантність плазми крові до гепарину |
3–6 (7–11) хв |
|
Рефракція кров’яного згустка |
44–65% |
|
Загальний білірубін |
8,55–20,5 мкмоль/л |
|
Білірубін прямий |
0–5,1 мкмоль/л |
|
Білірубін непрямий |
6,5–16,5 мкмоль/л |
|
АсАТ |
0,1–0,45 ммоль г/л |
|
АлАТ |
0,1–0,68 ммоль г/л |
|
Глутаматдегідрогеназа |
0–0,9 ммоль г/л |
|
Сорбітдегідрогеназа |
0–0,02 ммоль г/л |
|
ЛДГ |
0,8–4,0 ммоль г/л |
|
КФК |
10–195 МЕ/л |
|
МВ-КФК |
0–24 МЕ/л |
|
ЛФ |
0,5–1,3 ммоль/ч⋅л |
|
Міоглобін
|
22–66 мкг/л 21–49 мкг/л |
|
Тропонін Т |
0–0,1 нг/мл |
|
Тимолова проба |
0–4 ОД |
|
Сулемова проба |
до 1,7 мл |
|
Проби на активність запального процесу |
|
|
СРБ |
Негативний |
|
Сіалові кислоти |
0,18–0,2 ОД |
|
Церулоплазмін |
0,23–0,5 г/л |
|
Антистрептолізин-О |
1:250 |
|
Міоглобін сироватки крові |
1:2–1:64 |
|
Показники мінерального обміну |
|
|
3,8–5,2 ммоль/л |
|
138–148 ммоль/л |
|
95–105 ммоль/л |
|
3,23–6,46 ммоль/л |
|
0,088–0,105 ммоль/л |
|
14,28–28,56 ммоль/л |
|
0,188–0,36 ммоль/л |
Трактування результатів аналізу гістологічного дослідження шкіри, м’язів, синовіальної оболонки
Отриманий при біопсії чи аутопсії матеріал можна фіксувати в 10% нейтральному формаліні. У зв’язку з більш м’якою дією та скороченням часу дегідратації користуються сумішшю 70% спирту та 10% формаліну у співвідношенні 1:1. Шматочки розмірами до 1 мм можна фіксувати протягом 3–4 год, шкіряні шматочки товщиною 5–6 мм потрібно витримувати у фіксуючій рідині 1–2 доби. Зневоднення та заливку матеріалу парафіном проводять звичайним способом. Препарати виготовляють товщиною 4–5 нм, депарафінують і фарбують рутинними методами.
Патологічні процеси при ревматичних захворюваннях різноманітні, але є деякі закономірності: спостерігається системна, прогресуюча дезорганізація сполучної тканини, яка складається із мукоїдного набухання, фібриноїдних змін, запальних клітинних реакцій (дифузних та вогнищевих) і склерозу.
Мукоїдне набухання характеризується неглибоким, поверхневим ураженням колагенових волокон. Відзначається підвищення судинної та тканинної проникності, а також клітинна запальна реакція. На цьому етапі процес зворотний.
Фібриноїдні зміни — спостерігаються глибоке, незворотне ураження колагенових волокон, пов’язане з їх деспіралізацією та некрозом. Деструкція сполучної тканини супроводжується клітинною запальною реакцією.
Склероз — це наступний етап після фібриноїдних змін. Ділянки склерозу можуть знову стати місцем локалізації загострення та повторного запального процесу.
Зміни колагенових волокон та основної речовини сполучної тканини поєднуються з ураженням артеріол, капілярів, а також венул. Можливі тромбози та крововиливи.
Поряд із загальнопатологічними процесами дезорганізації сполучної тканини кожне ревматичне захворювання має свої клініко-морфологічні особливості, зумовлені локалізацією змін у тих чи інших органах і тканинах.
Аналіз синовіальної рідини (СР) використовують у диференційній діагностиці хвороб суглобів.
При показаннях проводять пошук кристалів у поляризованому світлі та бактеріоскопію, посів на мікробіологічні середовища.
Кількість — у нормі 0,2–2 мл. При запальних процесах — до 30–50 мл.
Колір — у нормі світло-жовтий, при незапальних суглобових захворюваннях — світло-жовтий, солом’яний, при запальних — від світло-жовтого до бурого.
Прозорість. Розрізняють 4 ступені прозорості СР: прозора, напівпрозора, помірно каламутна, інтенсивно каламутна. У нормі СР — прозора, при незапальних ураженнях — прозора або напівпрозора, а при запальних процесах — помірно або інтенсивно каламутна.
Осад. У нормі осаду немає, при незапальних процесах немає або аморфний незначний. При запальних процесах осад виявляється майже завжди. Це уламки клітинних мембран, фібринових ниток, колагенових волокон, кристали. Можна спостерігати зернистий осад, який нагадує рисові зерна, утворені з мікроскопічних фрагментів та насичені фібрином некротичної СО.
Щільність муцинового згустку. Розрізняють 4 ступені щільності: щільний (осад лишається щільною грудкою), помірно щільний (осад набуває вигляду розгалудженої структури), помірно рихлий та рихлий (осад більш-менш розпадається на дрібні частини).
В’язкість. 1–2 краплі СР наносять на предметне скло і відтягують скляною паличкою. Розрізняють 3 ступені в’язкості: низька — ≤1 см, середня — ≤5 см, висока — >5 см. У нормі в’язкість СР висока, при незапальних захворюваннях суглобів — середня а при запальних — низька.
Цитоз. При незапальних захворюваннях суглобів загальна кількість клітин не перевищує 3•109/л, при запальних коливається в межах від 3 до 50•109/л. У септичній СР — >50•109/л.
Синовіоцитограма. При незапальних захворюваннях у СР переважають лімфоцити (до 80%), при запальних — нейтрофіли поліморфно-ядерні до 90%.
Рагоцити — зеленкуваті включення в цитоплазмі лейкоцитів, що містять РФ (імунні комплекси IgG, IgM, IgC1). При незапальних ураженнях та серонегативному спондилоартриті — 2–15%, а при РА ≥40% залежно від ступеня місцевої запальної активності.
Кристали
Загальний білок. У нормі — 15–20 г/л, незапальних — 22–37 г/л, а при запальних — 35–48 г/л, при РА — до 60 г/л.
Глюкоза. У нормі та при незапальних процесах глюкоза СР — 3,5–5,5 ммоль/л, при запальних — 2,0–5,5 ммоль/л, а при септичних може зовсім не визначатися.
До особливостей СР у хворих на РА відносять наявність значної частки нейтрофілів, фагоцитів, пухкого муцинового згустку, а також низький рівень комплементу.
Глава 8. Інструментальні методи дослідження в ревматології
Оцінка результатів рентгенологічного дослідження суглобів
Основні рентгенографічні ознаки ОА — звуження СЩ, субхондральний остеосклероз та остеофіти.
Звуження СЩ — найважливіший рентгенологічний симптом. Рентгенологічна СЩ у різних відділах суглоба має різну ширину, відповідно до рекомендацій її необхідно вимірювати у найвужчому місці.
Субхондральний остеосклероз — ущільнення Ктк, розміщеної під суглобовим хрящем (СХ). Цей симптом виявляється зазвичай у пізніх стадіях, тоді коли СЩ значно звужена.
Остеофіти — обмежені патологічні кісткові нарости різної форми та розмірів на краях суглобових поверхонь кісток. У початкових стадіях ОА вони мають вид загострень на краях суглобових поверхонь та в місцях прикріплень власних зв’язок суглобів. У міру прогресування захворювання вони набирають вигляду «губ», «гребенів», прямолінійних або пишних кісткових розростань на широкій або вузькій основі. На рентгенографії суглобів також можна виявити такі симптоми: білясуглобовий крайовий дефект Ктк, субхондральні кісти, внутрішьосуглобові звапнені хондроми.
Рентгенографічне дослідження КуС проводиться у двох взаємно перпендикулярних проекціях: прямій задній та боковій. Рентгенографія у прямій задній проекції може бути для одного або двох суглобів. Для найкращого виведення СЩ проводиться ротація досліджуваної кінцівки (або обох) на 10–12◦ до середини. Бокову проекцію можна знімати з відведенням стегна або без — хворий лежить на столі і згинає кінцівку у КС та КуС та максимально відводить її зовні.
У початкових стадіях ОА КуС при рентгенологічному дослідженні визначається: незначне звуження рентгенологічної СЩ, слабо виражений субхондральний остеосклероз, крапчасті кальцифікати в ділянці зовнішнього краю покриву вертлюжної западини (початкові явища остеофітозу), загострення країв ямки головки стегнової кістки (СтК) в ділянці прикріплення круглої зв’язки головки СтК. На пізніх стадіях захворювання відзначають прогресуюче звуження рентгенологічної СЩ, формування різної форми та розмірів остеофітів на краях суглобових поверхонь вертлюжної западини головки СтК (вона може набувати грибовидної форми) та її латеральне зміщення, заглиблення вертлюжної западини (її протрузія на фоні ОП), виражений субхондральний остеосклероз, виникнення кісткових кіст, асептичний некроз головки СтК, підвивихи СтК, ущільнення Ктк і скорочення шийки СтК, вільні внутрішньосуглобові тільця.
Рентгенографічне дослідження КС проводиться у прямій задній, боковій та аксіальній проекціях. При проведенні рентгенографії в прямій задній проекції хворий лежить на спині, нижні кінцівки витягнуті, стопи розміщені перпендикулярно до площини стола. Бокової проекції КС досягають при положенні хворого на боці, а досліджувана кінцівка трохи зігнута і зовнішньою стороною прилягає до столу. Особливістю проведення рентгенографії в аксіальній проекції є: хворий лежить на животі і максимально згинає КС. Проводиться рентгенографія КС зі згинанням на 30; 60 та 90° (функціональні тести).
Для визначення рентгенологічної стадії ОА КС застосовують класифікацію I. Kellgren та I. Lawrence, за якою:
0 — відсутність рентгенологічних змін;
І — сумнівна;
ІІ — мінімальна;
ІІІ — середня;
ІV — виражена.
Можливе застосування іншої класифікації — за A. Larsen, де:
0 — відсутність рентгенологічних ознак;
І — звуження рентгенологічної СЩ на <50%;
ІІ — звуження рентгенологічної СЩ на >50%;
ІІІ — слабка ремодуляція;
ІV — середня ремодуляція;
V — виражена ремодуляція.
Для більш детального вивчення стану рентгенологічної СЩ КС можна вимірювати висоту в міліметрах у зовнішній, середній та внутрішніх третинах тибіофеморального відділу латерально та медіально.
Ранні рентгенологічні ознаки ОА КС: витягування та загострення країв міжвиросткового підвищення великої гомілкової кістки, незначне звуження СЩ медіально, загострення країв суглобових поверхонь виростків стегнової та великогомілкової кісток. У пізні стадії визначають: подальше звуження рентгенологічної СЩ, розвиток субхондрального остеосклерозу, появу множини великих остеофітів на бокових, передніх та задніх суглобових поверхнях, зрідка виявляють субхондральні кісти, вторинний синовіт (кіста Бейкера, субпателярна кіста), нерівність і сплощення суглобових поверхонь стегнової та великогомілкової кістки, неправильну форму сесамовидної кісточки, можливо — виявлення хондром із вапняним включенням. Досить часто артоз КС проявляється у вигляді артрозу пателофеморального відділу, який найкраще візуалізується у боковій проекції: звужується рентгенологічна СЩ між надколінком та СтК, остеофіти на задніх кутах надколінка та виростків стегна, субхондральний остеосклероз надколінка, поодинокі субхондральні кісти зі склерозованим обідком.
Для вивчення середнього та дистального відділів кисті проводять рентгенографію у прямій долонній та навскісній долонній проекціях. Для вивчення пальців використовують пряму долонну та бокову проекції.
Для початкових проявів ОА проксимальних та дистальних міжфалангових суглобів характерно: невеликі загострення країв або остеофіти з нерізким субхондральним остеосклерозом, дрібні, субхондральні кісти, нормальна чи трохи звужена рентгенологічна СЩ, дрібні кальцифікати у м’яких тканинах біля бокових країв суглобів. При вираженому артозі: помірні або великі остеофіти, деформація країв суглобових поверхонь кісток, значне звуження рентгенологічної СЩ, остеосклероз (вузлики Гебердена у дистальних та вузлики Бушара — у проксимальних міжфалангових суглобах), кісти зі склеротичним обідком, крайові дефекти суглобових поверхонь.
Оцінка результатів рентгенологічного дослідження серця
Стандартне рентгенологічне обстеження серця включає рентгенографію в передньозадній (прямій) та боковій проекціях. Для уточнення розмірів та форми окремих камер за показаннями використовують також праву та ліву косі проекції.
Пряма проекція
Серце та великі судини утворюють інтенсивну й однорідну тінь, яка розташована щодо серединної площини асиметрично таким чином, що ⅔ її знаходяться ліворуч, а ⅓ — праворуч. Розрізняють правий і лівий контури серцево-судинної тіні.
По правому контуру зазвичай диференціюються дві дуги. Верхня дуга утворена верхньою порожнистою веною і частково — висхідною аортою, нижня — правим передсердям. Верхня дуга має різну інтенсивність та форму залежно від судини, що формує крайовий відділ. Верхня порожниста вена виступає праворуч від хребта на 0,5–1,0 см. Чіткий і рівний її контур дещо нижче груднино-ключичного суглоба плавно повертає зовні, утворюючи вигин у місці переходу в праву плечоголовну вену (зображення якої перестає диференціюватись на рівні І ребра). Непарна вена проектується дещо правіше серединної лінії, утворюючи інтенсивну однорідну тінь округлої чи овальної форми до 12 мм. Вона визначається в правому трахеобронхіальному куті на фоні верхньої порожнистої вени. При розвороті аорти (у осіб віком старше 40 років) верхня дуга правого контуру судинного пучка на всьому протязі зумовлена висхідною аортою, яка перекриває впродовж контур верхньої порожнистої вени. Аорта має більшу інтенсивність, утворює випуклий контур, який повертає ліворуч, плавно переходить в дугу аорти.
Нижня дуга правого контуру утворена правим передсердям, випукла, найбільш виступаюча точка її на відстані до 2,5 см від правого контуру грудних хребців.
На місці об’єднання верхньої та нижньої дуги правого контуру серцево-судинної тіні утворюється правий серцево-судинний, або атріовазальний кут. У осіб астенічної конституції у правому серцево-діафрагмальному куті у фазу глибокого вдиху між серцем та діафрагмою може бути видно додаткову тінь нижньої порожнистої вени.
По лівому контуру розрізняють чотири краєутворюючих дуги. Послідовно зверху донизу їх утворюють дуга та початковий відділ низхідної аорти, легеневий стовбур, вушко лівого передсердя та лівий шлуночок.
Аорта утворює верхню (першу) дугу, розташовану на 1–2 см нижче груднино-ключичного суглоба, займає простір першого міжреберного простору. З віком закругленість контуру дуги аорти збільшується. При цьому нерідко визначається стрічковидна тінь низхідної аорти, яка розміщена паралельно хребту або дуговидно відхиляється вліво від нього. У зв’язку з цим спостерігається розширення тіні судинного пучка.
Легеневий стовбур разом із початковим відділом легеневої артерії утворюють сплощену другу дугу, яка розташована донизу від першої, відповідно до ІІ міжреберного простору та верхньої частини кореня легень.
Ліве вушко є краєутворюючим у ≈30% випадків, оскільки ліве передсердя в основному розташоване позаду. Утворена лівим вушком третя дуга прямолінійна чи дещо увігнута, вона найкоротша і займає простір біля половини ІІІ міжреберного простору. Нерідко друга і третя дуги разом розташовані на рівні ІІ міжреберного простору. Стравохід щільно прилягає до задньої поверхні лівого передсердя. У нормі тінь контрастованого стравоходу на рівні прилягання його до лівого передсердя розташовується майже прямолінійно по серединній лінії.
Лівий шлуночок утворює найбільш довгу та опуклу четверту дугу, яка простежується на рівні двох-трьох міжреберних просторів (IV–VI). Найбільш віддалена точка лівого шлуночка в нормі розташована на 1,0–1,5 см всередину від середньоключичної лінії чи на її рівні. Місце переходу дуги лівого шлуночка в нижній контур серця, що відповідає його діафрагмальній поверхні, називають верхівкою серця. Вона має різний ступінь закругленості й розташована над діафрагмою. В утворенні верхівки серця беруть участь обоє шлуночків, або при високому розташуванні лівого купола діафрагми — лише лівий шлуночок. У осіб пікнічної статури верхівка серця проектується на діафрагму і чітко визначається на фоні газового пухіря шлунка. Діафрагмальна поверхня серця не має диференційованого зображення, оскільки зливається з тінню діафрагми та печінки. Серце, прилягаючи до діафрагми, утворює з обох боків серцево-діафрагмальні кути. Враховуючи, що у більшості осіб перикард повторює форму серця, зливається з його тінню і не має диференційованого зображення, ці кути гострі. Іноді перикард широко прикріплюється до діафрагми і не повторює контурів серця у ділянках серцево-діафрагмальних кутів. При цьому перикард разом із невеликою кількістю перикардіальної рідини утворює однорідні трикутної форми тіні, розташовані зовні від тіні серця, переважно зліва. Ці тіні менш інтенсивні, ніж тінь серця. Зовнішні контури їх чіткі, прямолінійні чи дещо увігнуті. У осіб із надмірною масою тіла між волокнистою сумкою перикарда та середостінною плеврою відкладається жир, який теж утворює затемнення в ділянці серцево-діафрагмальних кутів. Жирові накладення, на відміну від перикарда, мають менш однорідну, іноді часточкову структуру, нерівні хвилясті й дещо опуклі зовнішні контури.
У прямій проекції мітральний клапан проектується на 1–2,5 см вліво від серединної лінії відповідно рівню ІV груднино-реберного з’єднання.
Клапани аорти проектуються над мітральним клапаном на 1–1,5 см вліво від серединної лінії на рівні ІІІ міжреберного простору.
Тристулковий клапан розташований майже по серединній лінії або на 0,5–1 см вправо на рівні V реберного хряща на 1–2 см вище купола діафрагми.
Клапани легеневої артерії розміщені на 1–2 см вліво від серединної лінії відповідно рівню ІІ міжреберного простору або ІІІ реберного хряща.
Дослідження серця в прямій проекції має значення для визначення розмірів обох шлуночків та передсердь, уточнення положення та розмірів аорти і верхньої порожнистої вени.
При збільшенні лівого шлуночка відзначають подовження та закругленість його дуги, занурення верхівки серця в діафрагму та виявлення її на фоні газового міхура шлунка. При нормальному розташуванні лівого купола діафрагми зовнішній контур лівого шлуночка серця різною мірою зміщується зовні від лівої середньоключичної лінії.
Збільшення лівого передсердя супроводжується подовженням та вибуханням дуги лівого вушка по лівому контуру серця. При значному збільшенні воно може утворювати контур по правому контуру серця — виявляється додаткова опукла дуга на рівні правого передсердя та розщеплення його дуги. На переекспонованих знімках ознакою збільшення лівого передсердя є підсилення інтенсивності тіні серця у верхньому відділі та відхилення контрастованого стравоходу на рівні лівого передсердя вправо від серединної лінії. У ряді випадків верхній контур лівого передсердя давить на головні бронхи (більше лівий), відхиляє його доверху і збільшує кут роздвоєння трахеї до 100–120°.
Збільшення правого шлуночка призводить до утворення більш опуклої правої нижньої дуги з підкресленим її закругленням за рахунок зміщення вправо правого передсердя, більш високого розташування передсердно-судинного кута, вибухання та подовження легеневого стовбура. Окрім того, можливе збільшення розмірів коренів легень внаслідок розширення легеневих артерій.
Збільшення правого передсердя характеризується зміщенням зовні правого контура серця. Воно буває такого обсягу, що справа від серединної лінії розташовані половина, або навіть ⅔ тіні серця. Правий передсердно-судинний кут розташований вище, ніж звичайно, тінь верхньої порожнистої вени розширена.
Права передня коса проекція
Серцево-судинна тінь у цій проекції має форму косо лежачого подовженого овалу.
По передньому контуру розрізняють три дуги. Верхня з них утворена висхідною аортою і частково її дугою. Середня дуга відповідає артеріальному конусу правого шлуночка, у верхній її частині на невеликій відстані — легеневому стовбуру. Нижня дуга переднього контуру утворена лівим шлуночком, частково його верхівкою.
Задній контур серцево-судинного пучка повернений до хребта. Верхня дуга утворена верхньою порожнистою веною та частково аортою, розташована майже прямолінійно, диференціюється нечітко (послаблення тіні судинного пучка трахеєю). Нижче розташовані обоє передсердь, які утворюють одну трохи опуклу дугу. Ліве передсердя розташоване вище правого, яке лежить на діафрагмі. По довжині вони майже рівні. У задньому серцево-діафрагмальному куті між діафрагмою та нижньою порожнистою веною часто видно нижню порожнисту вену, яка утворює трикутну тінь меншої інтенсивності, з чітким, дещо увігнутим, косо розміщеним контуром. Стравохід прилягає до задньої поверхні лівого передсердя. Між заднім контуром серця та хребтом визначається поздовжньо розташована прозора ділянка шириною 2–3 см, зумовлена проекцією легеневої тканини, так званий ретрокардіальний простір. Таким чином, у правій передній боковій проекції по задньому контуру розташовані обоє передсердь, по передньому — обидва шлуночки.
При збільшенні передсердь, особливо лівого, визначається різний ступінь звуження ретрокардіального простору чи його повне зникнення, тінь контрастованого стравоходу.
Ліва передня коса проекція
Серцево-судинна тінь у цій проекції має вигляд вертикально розміщеного округлого утворення. Передній контур серцево-судинної тіні представлений двома дугами: верхня зумовлена висхідною аортою, а нижня дуга — вушком правого передсердя та правим шлуночком.
Передній контур висхідної аорти опуклий і плавно переходить доверху і назад в дугу та низхідну аорту, тінь якої нечітко диференціюється в осіб молодого та середнього віку. Вушко правого передсердя та правий шлуночок у нормі не відокремлені й утворюють одну плавну опуклу дугу, яка виступає вперед більше, ніж дуга аорти. Краєутворююча дуга серця займає майже ⅔ переднього контуру серцево-судинної тіні.
По задньому контуру зверху вниз розміщені аорта, легеневий стовбур, ліве передсердя та лівий шлуночок. Задню поверхню висхідної аорти і трохи нижче неї розташований легеневий стовбур видно не дуже добре внаслідок проекційного накладання трахеї, правого головного бронха та частково — кореня правої легені. Обоє судин утворюють увігнутий вперед контур серця, який плавно переходить вниз у підкреслену опуклу дугу контура серця. Вона утворена зверху лівим передсердям, знизу — лівим шлуночком. ⅓ дуги у верхньому відділі займає ліве передсердя, ⅔ — займає лівий шлуночок. На межі прилягання серця до діафрагми утворюються гострі серцево-діафрагмальні кути, з яких задній більш глибокий та гострий. Передній кут буває затемнений перикардом або жировими нашаруваннями. При глибокому вдосі в самому нижньому відділі по контуру дуги лівого шлуночка може визначатися невелике втягнення, яке наче розділяє опуклість двох нижніх дуг тіні серця. Це відповідає розміщенню міжшлуночкової перегородки в нижньому її відділі. У цій проекції висхідна та низхідна аорта не нашаровуються одна на одну і їх видно окремо. Вони утворюють дугоподібно розташовану однорідну тінь до 3–4 см, яка поступово втрачається у осіб молодого віку на фоні хребта. Світлий, овальний або округлий простір обмежений спереду висхідною аортою і лівим передсердям, зверху — дугою, а позаду — низхідною аортою, називають аортальним вікном. Прозорість його зумовлена сумацією проекційного зображення легеневої тканини, трахеї та головних бронхів. На рівні аортального вікна під дугою аорти чітко видно роздвоєння трахеї. У нижній частині аортального вікна видно стовбур та ліву легеневу артерію, які утворюють дугоподібну тінь, майже повторюючи вигин аорти.
Бокова проекція
Передній контур серцево-судинної тіні зверху вниз утворюють дуги висхідної аорти та правого шлуночка. Визначається дещо опуклий контур передньої стінки висхідної аорти, який зверху плавно переходить в дугу та низхідну аорту. Судини, які відходять від дуги аорти (плечоголовний стовбур, загальна сонна та підключична артерії), разом із відповідними венами утворюють єдину вертикально розташовану тінь розмірами до 2 см. Вона лежить попереду від трахеї і поступово втрачається в напрямку до верхнього отвору грудної клітини. Верхня порожниста вена перекривається висхідною аортою, не утворює краю і не має диференційованого зображення. Нижня дуга утворена правим шлуночком. Верхній відділ його утворений артеріальним конусом. На межі артеріального конуса та висхідної аорти утворюється кут, відкритий спереду. Правий шлуночок у наддіафрагмальній ділянці протягом 5–6 см прилягає до груднини. Прозора ділянка між задньою поверхнею груднини і передньою поверхнею серцево-судинної тіні називається ретростернальним простором. Він має форму неправильного трикутника із загостреним нижнім кутом.
Задній контур серцево-судинної тіні неоднаково диференціюється на різному рівні. Задня поверхня висхідної аорти перекривається легеневим стовбуром і частково судинами коренів легень, і не має диференційованого зображення, лише донизу від тіней коренів легень видно задній контур серця. Він утворений лівими відділами серця. Дуга лівого передсердя в цій проекції дещо більша, ніж лівого шлуночка. Нижня порожниста вена на рівні заднього серцево-діафрагмального кута утворює трикутної форми тінь, менш інтенсивну, ніж серце, із чітким, дещо ввігнутим заднім контуром. У осіб астенічної статури при глибокому вдосі цю структуру видно найкраще. Протяжність діафрагмальної поверхні серця майже така ж, як і протяжність прилягання правого шлуночка до груднини. Це співвідношення становить 1:1.
Ретрокардіальний простір чітко простежується в нижній частині, найбільш прозорий — над діафрагмою. Тінь контрастованого стравохода розміщена дуже близько до задньої поверхні серця, а саме до лівого передсердя, і лежить на цій ділянці майже прямолінійно.
Розміри серця вираховують у прямій проекції — кардіоторакальний індекс. Кардіоторакальний індекс — відношення найбільшого поперечного розміру серця до найбільшого поперечного внутрішнього діаметра грудної клітини, в нормі становить не більше 50%.
Збільшення лівого шлуночка. Рання ознака — заокруглення верхівки серця, потім збільшення дуги лівого шлуночка, підвищується кардіоторакальний індекс.
Збільшення правого шлуночка. Рентгенологічні ознаки здебільшого непрямі.
Збільшення стовбура легеневої артерії:
- округлена та піднята доверху верхівка серця (форма дерев’яного черевичка-сабо);
- зміщення правого передсердя зовні та вверх;
- верхня частина ретростернального простору заповнена збільшеним правим шлуночком (у боковій проекції).
Збільшення лівого передсердя:
- відхилення контрастованого стравоходу в боковій проекції;
- вибухання вушка лівого передсердя в прямій проекції;
- утворення різко збільшеним лівим передсердям додаткової нижньої дуги правого контура серця в прямій проекції.
Збільшення правого передсердя:
- збільшення випуклості та вибухання дуги у прямій проекції;
- зміщення доверху правого атріовазального кута.
Мітральна конфігурація:
- подовження та збільшення дуг стовбура легеневої артерії;
- згладженість талії;
- зміщення правого атріовазального кута доверху.
Аортальна конфігурація:
- збільшення лівого шлуночка;
- підкреслена талія серця;
- розширення висхідної частини аорти.
Куляста конфігурація:
- збільшення дуг правого передсердя та лівого шлуночка;
- талія збережена;
- зменшення аорти.
Оцінка даних електрокардіографічного обстеження (норма, гіпертрофія та перевантаження відділів, порушення ритму)
Показання: захворювання серцево-судинної системи.
Протипоказання: практично немає.
Можливості методу. ЕКГ залишається одним із найважливіших і найбільш розповсюджених методів дослідження в кардіології. Вона є найкращим методом для визначення порушень ритму серця та провідності. Ніякі інші методи дослідження не можуть в цьому відношенні конкурувати з ЕКГ. Велике значення має ЕКГ також при діагностиці різних форм ішемічної хвороби серця, в тому числі гострого коронарного синдрому, інфаркту міокарда. Аналіз ЕКГ дозволяє виявити наявність гіпертрофії чи перевантаження різних камер серця і деякою мірою — характер цього перевантаження — систолічне або діастолічне. ЕКГ також дозволяє оцінити зміни функціонального стану міокарда, порушення обміну речовин, в тому числі електролітів — К, Nа та ін. Особливого значення набуває ЕКГ при реєстрації під час функціональних проб, у тому числі з фізичним навантаженням. Це дозволяє в комплексі з іншими методами оцінити фізичну працездатність обстежуваного та контролювати її динаміку.
При аналізі ЕКГ необхідно перш за все оцінити ритм серця, у разі наявності його порушення, визначити які. Потім слід підрахувати кількість скорочень серця за хвилину, для цього потрібно визначити тривалість інтервалу R–R, далі визначити електричну вісь та позицію серця, тривалість інтервалів P–Q, P–R та Q–T. У подальшому аналізувати комплекси QRS та зубець Т, а також положення сегмента ST в різних відведеннях. За допомогою таблиць визначають кут α, на підставі цих даних роблять загальну оцінку ЕКГ.
Слід підкреслити, що інтерпретація даних ЕКГ можлива лише за умови зіставлення їх із клінічним станом обстежуваного.
Амплітуду зубців та зміщення сегментів вимірюють у міліметрах, а їх тривалість — у секундах. Кожному міліметру на папері при швидкості руху стрічки 50 мм/с відповідає 0,02 с.
Обов’язково розраховуються всі інтервали (табл. 8.1).
Таблиця 8.1
Показники нормальної ЕКГ
|
Показник |
Характеристика |
|
Зубець Р |
1) Тривалість зубця Р не перевищує 0,1 с, а амплітуда — 1,5–2,5 мм; 2) у нормі зубець Р завжди позитивний у відведеннях I, II, aVF, V2–V6; 3) у відведеннях III, aVL, V1 зубець Р може бути позитивним, двофазним, III, aVL — може бути від’ємним; 4) у відведенні aVR зубець Р завжди негативний |
|
Інтервал P–Q (R) |
Вимірюється від початку зубця Р до початку шлуночкового комплексу QRS. Тривалість інтервалу P–Q (R) коливається від 0,12 до 0,20 с та залежить від частоти серцевих скорочень (чим більша частота, тим коротший інтервал) |
|
Зубець Q |
1) У нормі зубець Q може бути зареєстрований в усіх стандартних та посилених однополюсних відведеннях від кінцівок і в грудних відведеннях V4–V6; 2) в усіх відведеннях, за винятком aVR, амплітуда нормального зубця Q не перевищує ¼ висоти зубця R, а його тривалість — 0,03 с; 3) у відведенні aVR у здорової людини може бути зафіксований глибокий та широкий зубець Q або навіть комплекс QS |
|
Зубець R |
1) У нормі зубець R може реєструватися в усіх стандартних відведеннях та посилених відведеннях від кінцівок; у відведенні aVR зубець R може бути відсутнім; 2) у грудних відведеннях амплітуда зубця R поступово збільшується від V1 до V4, а потім дещо зменшується у V5–V6; іноді зубець R у V1 може бути відсутнім; 3) зубець R у V1–V2 відображає розповсюдження збудження по міжшлуночковій перетинці, а зубець R у V4,V5, V6 — по м’язу лівого і правого шлуночків; 4) інтервал внутрішнього відхилення у відведенні V1 не перевищує 0,03 с, а у відведенні V6 — 0,05 с |
|
Зубець S |
1) У здорової людини амплітуда зубця S коливається в різних відведеннях у великих межах і не перевищує 20 мм; 2) при нормальному положенні серця у грудній клітці у відведеннях від кінцівок амплітуда S мала, окрім відведення aVR; 3) у грудних відведеннях зубець S поступово зменшується від V1,V2 до V4, а у відведеннях V5, V6 має малу амплітуду або відсутній зовсім; 4) рівність зубців R та S у грудних відведеннях («перехідна зона») зазвичай реєструються у відведенні V3 або (рідше) між V2 та V3 або V3 та V4. Максимальна тривалість шлуночкового комплексу не перевищує 0,10 с |
|
Сегмент R–ST |
1) У здорової людини сегмент R–ST у відведеннях від кінцівок розташований на ізолінії (±0,5 мм); 2) у нормі в грудних відведеннях V1–V3 може спостерігатися невелике зміщення сегмента R–ST догори від ізолінії (не більше 2 мм), а у відведеннях V4,V5, V6 — вниз (не більше 0,5 мм) |
|
Зубець Т |
1) У нормі зубець Т завжди позитивний у відведеннях I, II, aVF, V2–V6, причому ТI>TIII а TV6>ТV1; 2) у відведеннях III, aVL та V1 зубець Т може бути позитивним, двофазним та негативним; 3) у відведенні aVR зубець Т у нормі завжди негативний |
|
Інтервал Q–T (QRS–T) |
Тривалість інтервалу Q–T в першу чергу залежить від частоти ритму. Нормальна тривалість визначається за формулою Базетта |
|
Зубець U |
Іноді, особливо в правих грудних відведеннях, реєструється одразу після зубця Т. Походження зубця U невідоме |
Загальна схема (план) розшифровки ЕКГ. Оцінка ЕКГ включає вимірювання різних зубців та інтервалів і їх інтерпретацію.
1. Аналіз серцевого ритму та провідності:
- оцінка регулярності серцевих скорочень;
- підрахунок частоти серцевих скорочень;
- визначення джерела збудження;
- оцінка функції провідності.
2. Визначення поворотів серця навколо передньозадньої, поздовжньої та поперечної осі:
- визначення положення електричної осі серця у фронтальній площині;
- визначення поворотів серця навколо поздовжньої осі;
- визначення поворотів серця навколо поперечної осі.
3. Аналіз передсердного зубця Р.
4. Аналіз шлуночкового комплексу QRST:
- аналіз комплексу QRS;
- аналіз сегмента RS–T;
- аналіз зубця Т;
- аналіз інтервалу Q–T.
5. ЕКГ-висновок:
Необхідно зазначити:
- джерело ритму (синусовий чи ектопічний);
- регулярність(правильний чи неправильний);
- частоту серцевих скорочень;
- положення електричної осі серця;
- наявність 4 ЕКГ-синдромів:
- порушення ритму;
- порушення провідності;
- гіпертрофії;
- ушкодження міокарда (ішемія, дистрофія, некроз, рубець).
Аналіз серцевого ритму включає визначення регулярності та частоти серцевих скорочень, визначення джерела збудження, оцінку функції провідності (за: Мурашко В.В., Струтинський А.В., 1991) (табл. 8.2–8.6).
Таблиця 8.2
Аналіз серцевого ритму та провідності
|
Характер аналізу |
ЕКГ-ознаки |
|
Аналіз регулярності серцевих скорочень |
Регулярність оцінюється шляхом порівняння тривалості інтервалів R–R між серцевими циклами. При регулярному (правильному) ритмі інтервали R–R однакові (±10%) |
|
Підрахунок частоти серцевих скорочень |
При правильному ритмі число 60 ділять на тривалість інтервалу R–R у секундах. При неправильному ритмі підраховують число комплексів QRS протягом 3 с, отриманий результат множать на 20. Можна обмежитися визначенням мінімальної та максимальної частоти серцевих скорочень. Мінімальна частота серцевих скорочень визначається за тривалістю найбільшого інтервалу R–R, максимальна — найменшого інтервалу R–R |
|
Визначення джерела збудження |
|
|
Синусовий ритм |
Характеризується: 1) наявністю у II стандартному відведенні позитивних зубців Р, що передують кожному комплексу QRS; 2) постійною однаковою формою всіх зубців Р |
|
Передсердний ритм, ритм з АВ-з’єднання, шлуночковий (ідіовентрикулярний) ритм |
1) Передсердний ритм із нижніх відділів передсердь характеризується наявністю від’ємних зубців P у II, III відведеннях та незмінених комплексів QRS; 2) для ритмів з АВ-з’єднання характерні: а) відсутність зубця Р (зливається з комплексом QRS); б) негативні зубці Р після незмінених комплексів QRS; 3) шлуночковий (ідіовентрикулярний) ритм характеризується: а) повільним шлуночковим ритмом (<40 за 1 хв); б) розширеними і деформованими комплексами QRS; в) відсутністю закономірного зв’язку комплексів QRS і зубців Р |
|
Оцінка функції провідності |
Швидкість проведення електричного імпульсу по передсердям характеризує тривалість зубця Р; швидкість проведення по передсердях, АВ-вузлу та системі Гіса відображає тривалість інтервалу P–Q (R); проведення збудження по шлуночках — загальна тривалість комплексу QRS. Слід враховувати швидкість реєстрації ЕКГ. Збільшення тривалості зубців та інтервалів відповідає сповільненню проведення у відповідному відділі провідної системи |
Таблиця 8.3
Визначення поворотів серця навколо передньозадньої, поздовжної та поперечної осей
|
Характер поворотів |
ЕКГ-ознаки |
|
Поворот серця навколо |
Розрізняють такі варіанти положення електричної осі серця: 1) нормальне (кут α становить від +30 до 69◦); 2) вертикальне положення (+70—90◦); 3) горизонтальне (від 0 до +29◦); 4) відхилення осі вправо (від +91 до +180◦); 5) відхилення осі вліво (0—90◦). Слід враховувати, що нормальне, горизонтальне та вертикальне положення електричної осі серця (від 0 до +90◦) можливе у здорових людей та у хворих із гіпертрофією шлуночків або порушеннями внутрішньошлуночкової провідності. Відхилення електричної осі вправо (більше +90◦), або вліво (менше 0◦) свідчить про наявність патологічних змін у серцевому м’язі. Кут α краще визначати за допомогою візуального методу, який базується на двох принципах: 1) максимальне позитивне значення алгебраїчної суми зубців комплексу QRS спостерігається у тому ЕКГ-відведенні, вісь якого співпадає з розташуванням електричної осі серця, паралельна їй; 2) комплекс типу RS, в якому алгебраїчна сума зубців рівна нулю (R=S або R=Q+S), записується у тому відведенні, вісь якого перпендикулярна електричній осі серця. При нормальному положенні електричної осі серця: а) RII>=RI>=RIII; б) у відведеннях III та aVL зубці R і S приблизно рівні. При горизонтальному положенні або відхиленні електричної осі серця вліво: а) високі зубці R фіксуються у відведеннях I та aVL, причому RI> RII>RIII; б) глибокий зубець S реєструється у відведенні III. При вертикальному положенні або відхиленні електричної осі серця вправо: а) високі зубці R реєструються у відведеннях III і aVF, причому RIII>=RII>RI; б) глибокі зубці S реєструються у відведеннях I та aVL |
|
Поворот серця навколо поздовжньої осі за часовою стрілкою |
Характерні ознаки: 1) комплекс QRS форми RS у відведенні V6, а також у I стандартному відхиленні; 2) можливе зміщення перехідної зони вліво у відведеннях V4–V5 |
|
Поворот серця навколо поздовжньої осі проти часової стрілки |
ЕКГ-ознаки: 1) комплекс QRS форми QR у відведенні V6, а також у I стандартному відведенні; 2) можливе зміщення перехідної зони вправо до відведення V2 |
|
Поворот серця навколо поперечної осі верхівкою вперед |
Шлуночковий комплекс QRS у стандартних відведеннях має форму qRI, qRI та qRIII |
|
Поворот серця навколо поперечної осі верхівкою назад |
Шлуночковий комплекс у стандартних відведеннях набуває форми RSI, RSII, RSIII |
Таблиця 8.4
ЕКГ-ознаки порушення утворення імпульсу
|
Характер порушення |
ЕКГ-характеристика |
|
Порушення автоматизму синоатріального вузла (номотопні аритмії) |
|
|
Синусова тахікардія |
Основними ЕКГ-ознаками синусової тахікардії є: 1) збільшення частоти серцевих скорочень до 90–180 уд./хв, скорочення інтервалу R–R; 2) збереження правильного синусного ритму (правильне чергування зубця Р і комплексу QRS в усіх циклах та позитивний зубець P в I, II відведеннях. aVF, V4–V6) |
|
Синусова аритмія |
Основними ознаками є: 1) коливання тривалості інтервалів R–R, що перевершують 0,15 с та пов’язані з диханням; 2) збереження всіх ЕКГ-ознак синусного ритму (чергування зубця Р і комплексу QRST) |
|
Синдром слабкості синоатріального вузла |
Характерними ознаками є: 1) стійка синусова брадикардія; 2) періодична поява ектопічних ритмів; 3) наявність синоатріальної блокади; 4) синдром брадитахікардії |
|
Ектопічні (гетеротопні) ритми, зумовлені переважанням автоматизму ектопічних центрів |
|
|
Повільні (заміщуючі) висковзуючі ритми і комплекси |
Для них характерні: 1) правильний ритм шлуночків із частотою серцевих скорочень, що не перевищує 60 уд./хв; 2) наявність у кожному комплексі PQRST ознак несинусового — передсердного, АВ-з’єднання чи шлуночкового водія ритму. Ознаками повільних (заміщуючих) висковзуючих комплексів є: 1) наявність на ЕКГ окремих несинусових комплексів, що виходять із передсердь, АВ-з’єднання чи шлуночків; 2) інтервал R–R, що передує висковзуючому ектопічному комплексу подовжений, а наступний за ним R–R нормальний або скорочений |
|
Прискорені ектопічні ритми (непароксизмальна тахікардія) |
Характерні ознаки: 1) ненападоподібне поступове прискорення серцевого ритму до 90–130 уд./хв; 2) правильний ритм шлуночків; 3) наявність у кожному зареєстрованому комплексі PQRST ознак несинусового — передсердного, АВ- чи шлуночкового водія ритму |
|
Міграція суправентрикулярного водія ритму |
Основні ознаки: 1) поступова від циклу до циклу зміна форми та полярності зубця Р; 2) зміна тривалості інтервалу Р–Q залежно від локалізації водія ритму; 3) нерізко виражені коливання тривалості інтервалів R–R (P–P) |
|
Ектопічні (гетеротопні) цикли та ритми, переважно не пов’язані з порушенням автоматизму |
|
|
Екстрасистолія |
|
|
Передсердна |
Характерні: 1) передчасна позачергова поява зубця Р і слідуючого за ним комплексу QRST; 2) деформація та зміни полярності зубця Р екстрасистоли; 3) наявність незміненого екстрасистолічного шлуночкового комплексу QRST, подібного за формою на звичайні нормальні комплекси QRST синусового походження; 4) наявність після передсердної екстрасистоли неповної компенсаторної паузи |
|
Екстрасистола із АВ-з’єднання |
Її ознаками є: 1) передчасна позачергова поява на ЕКГ незміненого шлуночкового комплексу QRS, подібного за формою на решту комплексів QRST синусового походження; 2) негативний зубець Р у відведеннях II, III та aVF після екстрасистолічного комплексу QRS або відсутність зубця Р (злиття Р і QRS); 3) наявність неповної компенсаторної паузи |
|
Шлуночкова екстрасистолія |
Основні ознаки: 1) передчасна позачергова поява на ЕКГ зміненого шлуночкового комплексу QRS; 2) значне розширення та деформація екстрасистолічного комплексу QRS; 3) розташування сегмента RS–T і зубця T екстрасистоли дискордантно напрямку основного зубця комплексу QRS |
|
Пароксизмальна тахікардія |
|
|
Передсердна |
Характерні ознаки: 1) напад прискорення серцевих скорочень до 140–250 уд./хв при збереженні правильного ритму, що раптово починається і раптово закінчується; 2) наявність перед кожним шлуночковим комплексом QRS зниженого, деформованого, двофазного чи від’ємного зубця Р; 3) нормальні незмінені шлуночкові комплекси QRS, схожі з тими, що реєструвалися до виникненя нападу пароксизмальної тахікардії (за винятком рідкісних випадків з аберацією шлуночкового проведення); 4) у деяких випадках спостерігається погіршення АВ-провідності з розвитком АВ-блокади I або II ступеня з періодичним випадінням окремих комплексів QRS (ознака непостійна) |
|
Із АВ-з’єднання |
Її ознаки: 1) напад прискорення серцевих скорочень до 140–220 уд./хв при збереженні правильного ритму, що починається раптово і раптово закінчується; 2) наявність у відведеннях II, III та aVF від’ємних зубців Р, розташованих позаду комплексів QRS або таких, що зливаються з ними і не реєструються на ЕКГ; 3) нормальні незмінені (не розширені й недеформовані) шлуночкові комплекси QRS, що схожі на QRS, зареєстровані до виникнення нападу пароксизмальної тахікардії (за винятком рідкісних випадків із аберацією шлуночкового проведення) |
|
Шлуночкова |
Найбільш характерні ознаки: 1) напад прискорення серцевих скорочень до 140–220 уд./хв при збереженні у більшості випадків правильного ритму, який починається і закінчується раптово; 2) деформація і розширення комплексу QRS більше 0,12 с із дискордантним розташуванням сегмента RS–T і зубця Т; 3) наявність АВ-дисоціації — повного роз’єднання частого ритму шлуночків (комплексу QRS) і нормального ритму передсердь (зубець Р); зрідка реєструються поодинокі нормальні незмінені комплекси QRST синусового походження («захоплені» скорочення шлуночків) |
|
Миготлива аритмія |
|
|
Тріпотіння передсердь |
Ознаки: 1) наявність на ЕКГ частих — до 200–400 уд./хв — регулярних, подібних одна до одної, передсердних хвиль F, що мають характерну пилоподібну форму (відведення II, III, aVF, V1,V2); 2) у більшості випадків правильний регулярний ритм шлуночків з однаковими інтервалами F–F (за винятком випадків зміни ступеня АВ-блокади на момент реєстрації ЕКГ); 3) наявність нормальних незмінених шлуночкових комплексів, яким передує певна (частіше постійна) кількість передсердних хвиль F (2:1, 3:1, 4:1 тощо) |
|
Миготіння (фібриляція) передсердь |
Характерними ознаками є: 1) відсутність зубця Р на всіх ЕКГ-відведеннях; 2) наявність хвиль f, розташованих без всякого порядку, різної форми і амплітуди; вони добре реєструються у відведеннях V1, V2, II, III і aVF; 3) нерегулярність шлуночкових комплексів QRS, різні за тривалістю інтервали R–R; 4) наявність комплексів QRS, що мають у більшості випадків нормальний незмінений вигляд без деформації та розширення |
|
Інші порушення автоматизму синоатріального вузла |
|
|
Тріпотіння та миготіння (фібриляція) шлуночків |
При тріпотінні шлуночків на ЕКГ спостерігаються часті (до 200–300 уд./хв) регулярні, одинакові за формою і амплітудою хвилі тріпотіння, що нагадують синусоїдальну криву. При миготінні (фібриляції) шлуночків на ЕКГ реєструються часті (від 200 до 500 уд./ хв) нерегулярні хвилі, які відрізняються за формою та амплітудою |
Таблиця 8.5
ЕКГ-ознаки порушення функції провідності
|
Варіанти |
Характеристика |
|
Синоатріальна блокада |
Ознаки неповної синоатріальної блокади включають: 1) періодичні випадіння окремих серцевих циклів (зубців Р і комплексів QRS–T); 2) збільшення в момент випадіння серцевих циклів паузи між двома сусідніми зубцями Р або R майже в 2 рази (рідше в 3 або 4 рази) порівняно зі звичайними інтервалами Р–Р або R–R |
|
Внутрішньопередсердна |
Характерно: 1) збільшення тривалості зубця Р більше 0,11 с; 2) розщеплення зубця Р |
|
АВ-блокада I ступеня |
Характеризується сповільненням передсердно-шлуночкової провідності, що на ЕКГ проявляється постійним збільшенням інтервалу P–Q(R) більше 0,20 с |
|
АВ-блокада II ступеня |
Мобітц 1: Характерні періоди поступового збільшення інтервалу Р–Q (R) з подальшим випадінням шлуночкого комплексу — періоди Самойлова — Венкебаха. Мобітц 2: Випадіння окремих шлуночкових скорочень не супроводжується поступовим збільшенням інтервалу P–Q (R), який залишається постійним (нормальним або збільшеним). III тип АВ-блокади II ступеня: Має назву АВ-блокади високого ступеня або блокади II ступеня, що далеко зайшла. Випадає кожний другий (2:1) або ≥2 підряд шлуночкових комплексів (блокади 3:1, 4:1 і т.д.). Це призводить до різкої брадикардії, яка сприяє появі заміщуючих (висковзуючих) скорочень та ритмів |
|
АВ-блокада III ступеня |
Характеризується повним припиненням проведення імпульсу від передсердь до шлуночків, в результаті чого передсердя та шлуночки збуджуються і скорочуються незалежно один від одного. Джерелами збудження являються АВ-з’єднання, провідна система шлуночків. Шлуночки збуджуються регулярно з частотою 60–30 за 1 хв |
|
Синдром Моргані — Адамса — Стокса |
АВ-блокади II та III ступеня супроводжуються гемодинамічними порушеннями, зумовленими зменшенням хвилинного об’єму крові та гіпоксією головного мозку. При асистолії більше 10–20 с відзначається втрата свідомості, розвивається судомний синдром |
|
Синдром Фредеріка |
Це поєднання повної АВ-блокади з миготінням або тріпотінням передсердь. Реєструються хвилі миготіння (f) або тріпотіння (F) передсердь, комплекси QRST часто розширені й деформовані. Ритм правильний, частота шлуночкових скорочень становить 30–60 уд./хв |
|
Блокада ніжок та гілок пучка Гіса |
|
|
Блокада правої ніжки пучка Гіса |
Ознаки повної блокади: 1) наявність у грудних відведеннях V1, V2 (рідше у відведеннях від кінцівок, III і aVF) комплексів QRS типу rSR або rsR, що мають М-подібний вигляд, при цьому R>r; 2) наявність у лівих грудних відведеннях (V5, V6), відведеннях I, aVL розширеного, можливо з зазубринами зубця S; 3) збільшення ширини комплекса QRS більше 0,12 с; 4) наявність у відведенні V1 (більш рідко в III) депресії сегмента RS–T з випуклістю, зверненою догори, та від’ємного або двофазного (–+) асиметричного зубця Т. Неповна блокада: 1) наявність у відведені V1 комплексу QRS типу rSr або rSR, а у відведенях I і V6 злегка розширеного зубця S; 2) тривалість комплексу QRS становить 0,09–0,11 с |
|
Блокада лівої передньої гілки пучка Гіса |
Характерні: 1) різке відхилення електричної осі серця вліво (кут α ≤–30◦); 2) QRS у відведеннях I, aVL типу qR, III aVF, II типу rS; 3) загальна тривалість комплексу QRS — 0,08–0,11 с |
|
Блокада лівої задньої гілки пучка Гіса |
Характерні: 1) різке відхилення електричної осі вправо (кут α ≥+120◦; 2) форма комплексу QRS у відведеннях I і aVL типу rS, а у відведеннях III, aVF — типу qR; 3) тривалість комплексу QRS у межах 0,08–0,11 с |
|
Блокада лівої ніжки пучка Гіса (поєднана блокада обох лівих гілок пучка Гіса) |
Характерними для повної блокади є: 1) наявність у відведеннях V5, V6, I, aVl розширених деформованих шлуночкових комплексів типу R із розщепленою чи широкою верхівкою; 2) наявність у відведеннях V1, V2, III, aVF розширених деформованих шлуночкових комплексів, що мають вигляд QS або rS з розщепленою або широкою верхівкою зубця S; 3) загальна тривалість комплексу QRS більше 0,12 с; 4) наявність у відведеннях V5, V6, I, aVL дискордантного по відношенню до QRS зміщення сегмента RS–T і від’ємних або двофазних (–+) асиметричних зубців Т; 5) часто спостерігається відхилення електричної осі серця вправо. Для неповної блокади характерно: 1) у відведеннях I, aVL, V5, V6 наявні високі розширені, інколи розщеплені зубці R (зубець qV6 відсутній); 2) у відведеннях III, aVF, V1,V2 наявні розширені та глибокі комплекси типу QS або rS, іноді з початковим розщепленням зубця S (або комплексу QS); 3) збільшення тривалості QRS до 0,10–0,11 с; 4) відхилення електричної осі вліво (ознака непостійна) |
|
Блокада правої ніжки і лівої передньої гілки пучка Гіса |
При поєднанні блокади правої ніжки та лівої передньої гілки пучка Гіса на ЕКГ у грудних відведеннях фіксуються ознаки, характерні для блокади правої ніжки (див. вище). Одночасно у фронтальній площині визначається різке відхилення електричної осі серця вліво, що найбільш характерно для блокади лівої передньої гілки пучка Гіса |
|
Блокада правої ніжки і лівої задньої гілки пучка Гіса |
Про поєднання блокади правої ніжки і блокади лівої задньої гілки пучка Гіса свідчить поява на ЕКГ ознак блокади правої ніжки пучка Гіса переважно у правих грудних відведеннях (V1, V2) і відхилення електричної осі серця вправо (кут α ≥120◦), якщо відсутні клінічні дані про наявність гіпертрофії правого шлуночка |
|
Блокада трьох гілок пучка Гіса |
Характерними ЕКГ-ознаками блокади трьох гілок є: 1) наявність на ЕКГ ознак АВ-блокади I, II і III ступеня; 2) наявність ЕКГ-ознак блокади двох гілок пучка Гіса |
|
ЕКГ при синдромі Вольфа — Паркінсона — Уайта |
Основними ЕКГ-ознаками синдрому WPW є: 1) скорочення інтервалу P–Q (R); 2) наявність у складі комплексу QRS додаткової хвилі збудження — дельта-хвилі; 3) збільшення тривалості та невелика деформація комплексу QRS; 4) зміщення сегмента RS–T дискордантне комплексу QRS, а також зміна полярності зубця Т (непостійні ознаки) |
|
Синдром скороченого інтервалу P–Q (R) |
Для синдрому CLC характерні скорочення інтервалу P–Q (R) менше 0, 12 с та вузькі, нормальної форми комплекси без дельта-хвилі |
Таблиця 8.6
Характеристика ЕКГ при гіпертрофіях передсердь і шлуночків
|
Відділ серця |
Ознаки |
|
Гіпертрофія |
Характерно: 1) роздвоєння та збільшення амплітуди зубців Р у відведеннях I, II, AVL, V5,6 (P-mitrale); 2) збільшення амплітуди і тривалості другої від’ємної (лівопередсердної) фази зубця Р у відведенні V1 (рідше — у V2) або формування від’ємного зубця P у відведенні V1; 3) негативний та двофазний (+–) зубець PIII (непостійна ознака); 4) збільшення ширини зубця Р більше 0,1 с |
|
Гіпертрофія правого |
ЕКГ-ознаки: 1) у відведеннях II, III, aVF зубці Р високоамплітудні із загостреною верхівкою (P-pulmonale); 2) у відведеннях V2 зубець Р (або його перша правопередсердна фаза) позитивний із загостреною вершиною (P-pulmonale); 3) у відведеннях I, aVL, V5, V6 зубець Р низької амплітуди, а в aVL може бути від’ємним (ознака непостійна); 4) тривалість зубців Р не перевищує 0,10 с |
|
Перевантаження |
Основними ознаками являються: 1) транзиторні зміни амплітуди, форми і тривалості зубців Р, що нагадує ознаки гіпертрофії правого чи лівого передсердя; ці зміни розвиваються на фоні гострих клінічних ситуацій, які ведуть до гемодинамічного перевантаження; 2) при нормалізації стану хворого спостерігається швидка позитивна динаміка ЕКГ |
|
Гіпертрофія |
ЕКГ-ознаки: 1) збільшення амплітуди зубця R у лівих грудних відведеннях (V5, V6) та амплітуди зубця S у правих грудних відведеннях) V1, V2). При цьому RV1<RV5 або RV4<RV6; RV5,6 >25 мм або RV5,6 + SV1 ≥35 мм (на ЕКГ осіб віком старше 40 років) та ≥45 мм (на ЕКГ осіб молодого віку); 2) ознаки повороту серця навколо поздовжньої осі проти часової стрілки: зміщення перехідної зони вправо у відведення V2 (рідше у V1); зубці S у лівих грудних відведеннях (V5, V6); 3) зміщення електричної осі серця вліво, при цьому R1 ≥5, RaVL ≥11 мм або R1 + SIII ≥25 мм; 4) зміщення сегмента RS–T у відведеннях V5, V6, I, aVL нижче ізолінії та формування від’ємного або двофазного (+–) зубця Т у відведеннях I, aVL та V5, V6; 5) збільшення тривалості інтервалу внутрішнього відхилення QRS у лівих грудних відведеннях (V5, V6) більше за 0,05 с |
|
Гіпертрофія правого шлуночка |
ЕКГ-ознаки: 1) зміщення електричної осі серця вправо (кут α >+100◦); 2) збільшення амплітуди зубця R у правих грудних відведеннях (V1, V2) та амплітуди зубця S у лівих грудних відведеннях (V5, V6). При цьому кількісними критеріями можуть бути: амплітуда RV1 ≥7 мм або RV1 + SV5,6 ≥10,5 мм; 3) поява у відведенні V1 комплексу QRS типу rSR або QR; 4) ознаки повороту серця навколо поздовжньої осі за часовою стрілкою (зміщення перехідної зони вліво, до відведень V5, V6, та поява у відведеннях V5, V6 комплексу QRS типу RS); 5) зміщення сегмента RS–T вниз та поява від’ємних зубців Т у відведеннях III, aVF, V1, V2; 6) збільшення тривалості інтервалу внутрішнього відхилення в правому грудному відведенні (V1) більше за 0,03 с |
|
Комбінована гіпертрофія обох |
Характерні ознаки: 1) якщо переважає гіпертрофія лівого шлуночка, супутня гіпертрофія правого шлуночка діагностується при: а) різкому збільшенні амплітуди R у відведеннях V1, V2 (більше 7 мм); б) появі у V1, V2 комплексу QRS типу rSr; в) наявності ознак повороту серця навколо поздовжньої осі за часовою стрілкою (комплекс QRS у відведенні V6 типу RS); г) появі депресії сегмента RS–T та інверсії зубця Т у відведеннях V1, V2; д) наявності ознак гіпертрофії правого передсердя (Р-pulmonale); 2) якщо переважає гіпертрофія правого шлуночка, діагноз супутньої гіпертрофії лівого шлуночка встановлюється при: а) збільшенні амплітуди R у відведеннях V5, V6 або зміні співвідношення R у V4–V6 (RV4 ≤RV5 >RV6 або RV4 <RV5 ≤RV6); б) поглиблення S у відведеннях V1 або V2; в) відхиленні електричної осі серця вліво; г) наявність ознак повороту серця навколо осі проти часової стрілки (комплекс QRS у відведенні V6 типу QR) |
|
Перевантаження шлуночків |
Основними ЕКГ-ознаками являються: 1) депресія сегмента RS–T та інверсія Т відповідно у лівих (V5, V6) та правих (V1, V2) грудних відведеннях; 2) порівняно швидка позитивна динаміка ЕКГ при нормалізації стану хворого |
Оцінка даних ехокардіографічного обстеження
Показання: діагностика клапанних змін, визначення розмірів, товщини стінок, оцінка скоротної здатності, наявність пухлини.
Протипоказання: не існують.
ЕхоКГ — один із найбільш інформативних методів діагностики захворювань серця і судин. При обстеженні серця використовують три режими роботи — М-модальний режим (одномірна ехоКГ) дає дані про рух різних структур серця, які перетинаються УЗ-променем. В-режим дозволяє отримати на екрані двовимірне зображення серця, на якому добре видно взаємне розміщення окремих структур серця. Допплерівський режим обстеження використовується для якісної та кількісної характеристики внутрішньосерцевих та внутрішньосудинних потоків крові.
Дослідження лівого шлуночка (ЛШ) — найважливіша мета використання ехоКГ. Важливе значення має дослідження систолічної функції серця, особливо значним показником якої є фракція викиду ЛШ.
Найчастіше систолічну функцію ЛШ оцінюють із парастернального доступу за формулою Тейхольца. При цьому вимірюють кінцево-діастолічний (КДР) та кінцево-систолічний розмір (КСР) ЛШ (табл. 8.7), а інші показники отримують розрахунковим шляхом.
Таблиця 8.7
За допомогою ехоКГ визначають показники, які в нормі мають такі величини
|
КСР ЛШ — 22–38 мм |
КДР ЛШ — 38–56 мм |
|
МШП Д — 7–10 мм |
МШП С –12–15 мм |
|
ЗСЛШ Д — 8–11 мм |
ЗСЛШ С — 12–15 мм |
|
ДЛП –19–33 мм |
КДР ПШ — 15–22 мм |
|
ДА — 20–36 мм |
Амплітуда розкриття АК >18 мм |
|
ФВ — 55–65% |
ХВО — 3,5–4,5 л/хв |
|
УО — 60–80 мл |
КСО — 45–75 мл |
|
КДО — 110–145 мл |
SМО — 4–6 см2 |
МШП Д — міжшлуночкова перетинка, діастола; МШП С — міжшлуночкова перетинка систола; ЗСЛШ Д — задня стінка лівого шлуночка, діастола; ЗСЛШ С — задня стінка лівого шлуночка, систола; ДЛП — діаметр лівого передсердя; КДР ПШ — кінцево-діастолічний розмір правого шлуночка; ДА — діаметр аорти; АК — аортальний клапан; ФВ — фракція викиду; ХВО — хвилинний об’єм; УО — ударний об’єм; КСО — кінцево-систолічний об’єм; КДО — кінцево-діастолічний об’єм; SМО — площа мітрального отвору.
За допомогою ехоКГ можна виявити локальні порушення скоротної здатності ЛШ (а-, гіпо- та дискінезія). Основними причинами порушення скоротної здатності ЛШ можуть бути: інфаркт міокарда, постінфарктний кардіосклероз, дилатаційна та гіпертрофічна кардіоміопатія, порушення внутрішньошлуночкової провідності. Зниження фракції викиду до 20–30% є ознакою дилатаційної кардіоміопатії.
Причинами систолічної дисфункції правого шлуночка можуть бути: недостатність трикуспідального клапана, легеневе серце, мітральний стеноз, дефекти міжпередсердної перетинки, вроджені вади серця, недостатність клапанів легеневої артерії, первинна легенева гіпертензія, гострий інфаркт міокарда правого шлуночка (ПШ).
Асиметрична гіпертрофія міокарда ЛШ виявляється при стенозі гирла аорти, вроджених вадах серця, а первинна — при гіпертрофічній кардіоміопатії.
Діастолічна функція ЛШ. Будь-який патологічний процес, що впливає на систолічну функцію ЛШ, змінює і його діастолічну функцію. За даними останніх років у ⅓ хворих із проявами застійної серцевої недостатності систолічна функція ЛШ не є порушеною, тобто наявна діастолічна дисфункція. Крім того, порушення діастолічної функції з’являються раніше, ніж порушення систолічної, таким чином методи виявлення діастолічної дисфункції є більш ранніми та чутливими. При нормальному функціонуванні ЛШ навіть виражені об’ємні навантаження не повинні впливати на діастолічний тиск, що особливо важливо під час фізичного навантаження.
У М-режимі для діагностики порушень діастолічної функції ЛШ можна використовувати лише непрямі показники — це амплітуда руху кореня аорти, форма руху мітрального клапана (МК) та розміри лівого передсердя.
Найбільш інформативним і точним методом дослідження діастолічної функції ЛШ є дослідження трансмітрального кровотоку в імпульсному допплерівському режимі.
Вади серця. ЕхоКГ — один із найбільш інформативних методів для верифікації діагнозу та встановлення ступеня вад серця.
Мітральний клапан. У нормі передня стулка МК рухлива. Рух стулок М-подібний, різноспрямований. При цьому рух задньої стулки менший за амплітудою, ніж передньої, але є її дзеркальним відображенням.
Мітральний стеноз. Анатомічно мітральний стеноз проявляється зрощенням комісур між передньою та задньою стулками і зміною підклапанного апарату — укороченням хорд. У результаті зменшується площа мітрального отвору, що призводить до обструкції діастолічного кровотоку з лівого передсердя в ЛШ. Також змінюється траекторія руху стулок, він стає П-подібним. У В-режимі стулки клапана куполоподібно вигинаються, особливо передня. Площу МК вимірюють на рівні кінчиків стулок. При допплерівському дослідженні можна побачити зростання піку Е до 1,6–2,0 м/с (в нормі — 1–1,2 м/с). Також у цьому режимі можна вирахувати площу отвору за часом напівзменшення градієнта тиску між лівим передсердям та ЛШ.
Непрямі методи оцінки ступеня мітрального стенозу — визначення ступеня укорочення хорд, вираженість кальцинації стулок МК, ступеня збільшення лівого передсердя, зміни об’ємів ЛШ та правих відділів.
Недостатність МК. Для діагностики недостатності МК (причиною якої може бути пролапс, ревматизм, ДКМП, ГКМП, ішемічна хвороба серця, бактеріальний ендокардит, вроджені вади) найкраще використовувати допплерівське дослідження як кольорове, так і в імпульсному режимі.
Приблизно 40–60% здорових людей має регургітацію на МК, пов’язану із вродженою недостатністю задньомедіальної комісури МК, але вона виражена слабко і не перевищує 2 см.
Бактеріальний ендокардит. Основною ознакою для діагностики бактеріального ендокардиту є виявлення вегетацій на стулках, вони зазвичай рухливі.
Аортальний клапан та корінь аорти. У нормі в В-режимі парастернально по короткій осі аортальний клапан виглядає як перевернута емблема автомобіля «Мерседес». Ексцентричне розташування місця змикання стулок примушує запідозрити вроджену ваду — двостулковий аортальний клапан.
Корінь аорти рухливий, в систолу його амплітуда становить ≈7 мм, а діаметр не перевищує 3,5 см. При допплерівському скануванні потік направлений вниз, швидкість — 1–1,5 м/с.
Аортальний стеноз. У М-режимі можна побачити, що стулки клапана ущільнені, зменшується їх систолічне розкриття (якщо менше 8 мм — можна запідозрити стеноз). У В-режимі можна виявити ступінь кальцинозу клапана, форму та амплітуду його рухів. Також визначають наявність і ступінь постстенотичного розширення аорти, товщину стінок ЛШ, розміри лівого передсердя. У пацієнтів із компенсованим аортальним стенозом виявляють гіпертрофію ЛШ та збільшення його фракції викиду.
При допплерівському дослідженні можемо визначити швидкість кровотоку і оцінити ступінь стенозу: V >4 м/с — критичний стеноз, V <3 м/с — нетяжкий стеноз.
Ступені аортального стенозу за площею отвору:
- Незначний — площа отвору — 2–1,2 см2;
- Помірний — 0,75–1,2 см2;
- Тяжкий компенсований — <0,75 см2.
Аортальна недостатність.E М-режимі ознакою аортальної регургітації є діастолічне тремтіння передньої стулки МК. Це залежить від того, яка стулка клапана уражена і куди спрямований струмінь регургітації. У режимі кольорового допплерівського картування можна оцінити ступінь регургітації. Важливим показником є час напівзменшення швидкості регургітації, якщо вона менше 200 мс — тяжка недостатність, більша 400 мс — легка.
Ступені аортальної регургітації:
- незначна (І) <25%;
- помірна (ІІ) 25–45%;
- значна (ІІІ) 45–63%;
- виражена (ІV) >63%.
При ревматичному ураженні клапанів вони потовщуються, деформуються, але зазвичай аортальне кільце не втягується в патологічний процес.
Трикуспідальний клапан. Трикуспідальний клапан (ТК) має передню, септальну та задню стулки. У нормі у 80% людей спостерігається регургітація через ТК.
За наявності недостатності ТК додатково виявляють дилатацію правих відділів серця, парадоксальний рух міжшлуночкової перетинки, систолічну пульсацію нижньої порожнинної вени та зменшення розкриття клапана легеневої артерії. Найчастіше недостатність ТК пов’язана з декомпенсацією ПШ при ураженні ЛШ.
Також важливим показником для оцінки ТК кровотоку є спадання нижньої порожнистої вени. Так, якщо нижня порожниста вена на глибокому вдосі спадається на ≥50% — тиск у правому передсерді 5 мм рт. ст., якщо менше — тиск у правому передсерді 15 мм рт. ст.
Стеноз ТК важкий для виявлення, що ускладнюється його поєднанням із недостатністю. Основні причини: ревматизм, карциноїдний синдром, пролабування через ТК пухлини правого передсердя.
Геодинаміка стенозу ТК. Зі зменшенням площі отвору ТК (4–6 см2) підвищується тиск у правому передсерді, що призводить до його дилатації. В діастолу кров поступає через звужений отвір з правого передсердя в ПШ. Збільшується швидкість транстрикуспідального потоку. В систолу у зв’язку з неповним змиканням стулок ТК має місце патологічна регургітація.
Клапан легеневої артерії. У здорових людей може виявлятися регургітація на клапані легеневої артерії. За наявності перешкоди надходженню крові в систолу з ПШ у легеневій артерії тиск у ПШ зростає. Це призводить до формування гіпертрофії стінок ПШ, з часом може розвинутися дилатація порожнини ПШ. Праве передсердя також дилатується і тиск в ньому зростає в результаті патологічної ТК регургітації. Швидкість потоку в систолу через клапан легеневої артерії збільшується. При ексцентричному розташуванні потоку може розвинутись постстенотична дилатація легеневої артерії.
Оцінка даних ультразвукового дослідження суглобів
На сьогодні УЗД — провідний інструментальний метод ранньої діагностики патології опорно-рухового апарату (ОРА) при ревматичних хворобах, а також моніторингу стану компонентів ОРА під впливом лікування конкретних хворих (Manger B., Kalden J.R., 1995; Manger B., Backhaus M., 1997; Alassaarela E. et al., 1998; Grassi W., Cervini C., 1998; Gibbon W.W., Wakefield R.J., 1999; Backhaus M. et al., 2001; Коваленко В.М., Шуба Н.М., 2008; Рекалов Д.Г., Борткевич О.П., 2011; Шманько О.В., 2011). Удосконалення технічних можливостей УЗД ОРА, в тому числі розробка високочастотних датчиків, зробило УЗД методом для основи оцінки патології м’яких тканин (у тому числі основних компонентів суглобів — хряща, СО, поверхневих кісткових структур; періартикулярних м’яких тканин — зв’язково-сухожильного апарату, шкіри та підшкірно-жирової клітковини, що має велике значення при проведенні диференційної діагностики новоутворень у зазначених структурах), виявленні рідини та характеристиці її властивостей, що визначає тактику локальної, в тому числі внутрішньосуглобової терапії. Основними недоліками УЗД є неможливість візуалізації структури Ктк, а також «оператор-залежність» процедури, що цілком залежить від кваліфікації лікаря-функціоналіста, який проводить УЗД. На жаль, недостатнім є застосування УЗД в діагностиці ревматичних хвороб суглобів, в першу чергу, РА та спондилоартропатії. УЗД не надається достатньої уваги з боку спеціалістів-ревматологів, що спричинено недостатньою обізнаністю спеціалістів цього профілю з методом УЗД ОРА, а також самою методикою проведення відповідного дослідження.
Звичайно, структура Ктк є недосяжною для цієї методики, але УЗД дозволяє детально дослідити кісткову поверхню, в тому числі періостальну реакцію, зокрема зміни в режимі енергетичного допплерівського дослідження та ін. (Grassi W. еt al., 1993; 1999; Backhaus M. еt al., 1999).
Неінвазивність (на відміну від артроскопії), доступність, простота дослідження, економічність (порівняно із КТ і МРТ) забезпечили методу УЗД ОРА пріоритет серед інших інструментальних методів дослідження суглобів і м’яких тканин.
Техніка виконання УЗД щодо виявлення патологічних змін ОРА особливо важлива і потребує від лікаря, який виконує дослідження, детального знання можливостей сучасних діагностичних УЗ-апаратів, а також УЗ-анатомії досліджуваної ділянки та найбільш типових проявів патологічних змін.
УЗД ОРА має виконуватися за допомогою високочастотного лінійного датчика, що працює в діапазоні 7–20 МГц. Зазвичай достатньо для отримання зображення навіть поверхневих структур діапазону до 12,5 МГц. Застосування датчика з меншою робочою частотою (3,5–5) МГц обмежується лише дослідженням КуС і дослідженням суглобів у пацієнтів із надмірною масою тіла. Важливо також вибрати правильні програми дослідження для різних суглобів. Багато УЗ-приладів уже сьогодні містять набір стандартних програм для дослідження різних відділів ОРА. Сучасні УЗ-апарати оснащені також більшою кількістю додаткових режимів сканування, які дозволяють значно розширювати діагностичні можливості звичайного сірошкального сканування — такі, як режим нативної або тканевої гармоніки, режим панорамного сканування та режим тривимірної реконструкції. Так, сканування в режимі нативної гармоніки дозволяє одержати більш контрастне, ніж при звичайному сіро-шкальному скануванні, зображення ніжних гіпоехогенних структур, що відображають ділянки розривів зв’язкового апарату або меніска. Режим панорамного сканування дозволяє одержати розширене зображення відразу декількох структур, наприклад тих, що утворюють суглоб, і відобразити їхнє просторове розташування. Тривимірна реконструкція забезпечує одержання не лише волюметричної інформації, але надає можливість отримувати багатоплощинні зрізи досліджуваних структур (у тому числі фронтальні). Принципово новим є застосування високочастотних УЗ-датчиків, що забезпечують можливість візуалізації різних за ехогенністю та глибиною залягання структур. В останніх використовується вузький УЗ-промінь, що працює у високочастотному діапазоні, що сприяє значному підвищенню латеральної розв’язної здатності в ділянці УЗ-фокуса. Можливості УЗД також істотно розширилися у зв’язку із впровадженням у практику нових УЗ-технологій, заснованих на ефекті Допплера. Нові методики УЗ-ангіографії дозволяють візуалізувати патологічний кровоток у ділянці запальних змін органів і тканин (наприклад при синовіті).
Досвід застосування ультразвукового дослідження при патології опорно-рухового апарату
На базі ДУ «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України» проводиться УЗД ОРА на апаратах KONTRON MEDIKAL SAS, серії SIGMA 5000 (Франція) датчиком 5–12 МГц та MEDISON SONOACE X8 (Корея), датчиком 5–12 МГц, згідно з сучасними рекомендаціями (Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005).
УЗД ОРА виконується з використанням лінійних датчиків з робочою частотою ≥7,5 МГц, в разі дослідження найбільш поверхнево розташованих структур, чи конвексних датчиків з меншою робочою частотою — 3,5–5 МГц, що використовуються при дослідженні КуС, або інших великих суглобів у пацієнтів із надмірною масою тіла (Михайлов Е.Е. и соавт., 1999).
Згідно з методикою, оцінюються кісткові суглобові поверхні (зміни поверхні субхондральної кістки — наявність кист, ерозій, інших дефектів), СЩ, СО, навколосуглобові м’які тканини, наявність випоту, кровотоку в СО, зміни зв’язкового апарату тощо. Загальний протокол УЗ-обстеження пацієнта на ревматичні захворювання суглобів, який розроблений авторами, наведено нижче (табл. 8.8).
Таблиця 8.8
Протокол обстеження ОРА (програма «Ортопедія»)
|
Показник |
|
|
Суглобові компоненти |
Опис |
|
Суглобові співвідношення |
збережені ________ |
|
Контури суглобових компонентів |
чіткі / нечіткі /________ голівка не змінена / сплощена / деформована / фрагментована ________________ |
|
Висота гіалінового СХ |
нормальна / знижена / нерівномірно знижена ________________ |
|
СЩ |
не розширена / звужена / розширена ________________ |
|
Випіт |
однорідний / неоднорідний / об’єм____мл |
|
СО |
не стовщена / стовщена / нерівномірно стовщена / наявність / відсутність розростань |
|
Кровотік у СО |
не фіксується / фіксується параметри кровотоку ________________ |
|
Навколосуглобові м’які тканини |
|
|
Висновок: ________________ |
|
Для оцінки вираженості синовіту та кровотоку в СО використовується допплерівське дослідження в кольоровому й енергетичному режимах. Поперечні скани розділялися нами на три рівних сегменти — радіальний, медіальний і ульнарний — для зручності оцінки пануса і васкуляризації. Оцінка проводиться за методикою, запропонованою M. Hau та співавторами (1999), що включає трибальну шкалу (0 — відсутність візуалізації пануса та/чи кольорових сигналів на отриманому зображенні в аналізованій ділянці; 1 — незначна візуалізація пануса і/або одиничні кольорові сигнали; 2 — помірна візуалізація пануса чи помірна кількість кольорових сигналів; 3 — максимальна візуалізація пануса і/або висока щільність кольорових сигналів, що зливаються на отриманому зображенні) і розрахунок «судинного індексу» (vessel index — СІ), що дорівнює сумі усіх кольорових сигналів, зафіксованих в аналізованій ділянці на поздовжніх і поперечних сканах, поділеній на число обстежених суглобів у кожній дослідженій підгрупі хворих.
Дані ультразвукового дослідження опорно-рухового апарату при ревматичній патології
1. Патологія м’язів:
а) Перерозтягання (пошкоджується <5% поперечного перетину м’яза). Дані УЗД: мікророзриви у вигляді множинних кістозних ділянок, що при поздовжньому скануванні мають витягнуту структуру.
б) Частковий розрив (УЗД-ознака — гіпоехогенна гематома в зоні пошкодженої ділянки м’язової тканини зі зникненням типового волокнистого малюнка в зоні розриву (рис. 8.1, 8.2)). У пізній стадії розриву за скороченням м’яза можна провести диференційну діагностику: ушкоджений м’яза/ехогенна гематома різного генезу.
в) Повний розрив (УЗД-ознака — гематома в місці м’язового/сухожильного переходу). М’яз при поперечному УЗ-скануванні «відірваний» від місця прикріплення. Давність гематоми визначається за такими ознаками: реєстрація перифокального кровотоку за даними допплерівського УЗД, а також наявність гіперехогенних включень («нитки» фібрину) свідчить про підгострий/хронічний процес.
г) Осифікуючий міозит локалізується найчастіше в ліктьовій, кульшовій, сідничній ділянках. За генезом у 60–75% — посттравматичний, постінфарктний, ідіопатичний, нейрогенного генезу. УЗД-ознаки — гіперехогенні структури у проекції м’язів, що скануються, з акустичною тінню (рис. 8.3).
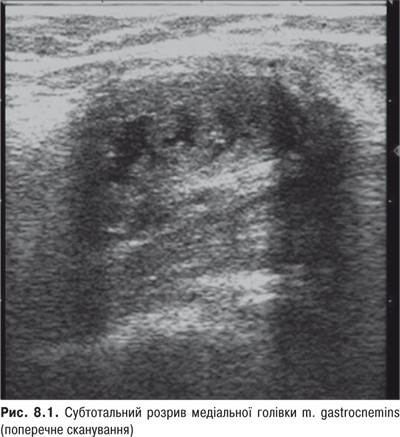

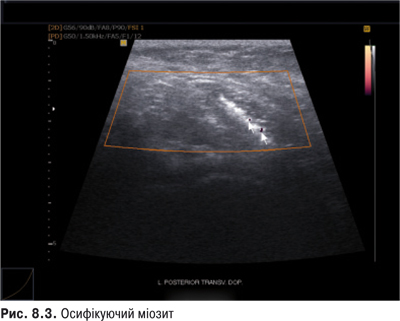
2. Патологія зв’язок та сухожиль:
а) Частковий чи повний розрив сухожилля (рис. 8.4, 8.5) — найчастіше виникає в місці прикріплення сухожилля до кістки чи м’яза (УЗД-ознака сухожиль з СО — часткове порушення фібрилярної структури сухожилля з формуванням анехогенного дефекту у вигляді синовіального випоту навколо ураженого сухожилля; сухожиль без СО — локальне потовщення сухожилля з порушенням контурів та фібрилярної структури останнього в місці дефекту; анехогенною ділянкою навколо ураженої зони за рахунок накопичення рідини в місці розриву. Розірвані кінці сухожиль, що не мають СО, скорочені, з повним порушенням їх фібрилярної структури, заповненням дефекту анехогенною рідиною (кров, жирова тканина, чи СР).
б) Гострий тендиніт:
- сухожилля без СО: потовщені, ехогенність останніх знижена локально/дифузно. Ехоструктура неоднорідна, з наявністю дрібних гіпоехогенних ділянок, що нагадують мікророзриви, значним посиленням кровотоку за ходом сухожильних волокон при поздовжньому скануванні (рис. 8.6);
- сухожилля з СО: потовщені, їх ехоструктура зазвичай не змінена, у більшості випадків спостерігаються явища тендосиновіту (наявність анехогенної ділянки, обмеженої контуром СО — рідини, що свідчить про запальний процес vaginae tendinum) (рис. 8.7).
в) Хронічний тендиніт: частіше спостерігається в сухожиллях надколінка, ротаторної манжети, ахілловому (рис. 8.8):
- сухожилля без СО: потовщені, ехоструктура неоднорідна, іноді — наявність гіперехогенних включень — ділянок фіброзу чи кальцифікатів по ходу сухожильних волокон;
- сухожилля з СО: потовщені, можливі зміни ехоструктури (частіше — зниження ехогенності), часто — помірні явища тендосиновіту з накопиченням незначної кількості рідини;
- кальцифікуючий тендиніт: виникає частіше в сухожиллях верхньої кінцівки на фоні змішаного захворювання сполучної тканини та метаболічних розладів (наприклад подагри та метаболічної артропатії). При УЗД виявляються гіперехогенні включення (найчастіше — точкові, іноді — більші) в сухожиллях; останні часто потовщені.
г) Ентезит та ентезопатія (рис. 8.9). Досвід ревматологів-клініцистів свідчить, що протягом тривалого часу ентезити (запалення ентезів — місць прикріплення до кістки зв’язок, сухожиль, апоневрозів, суглобових капсул) можуть бути єдиними клінічними ознаками ревматичного захворювання в дебюті їх розвитку, а також передують розвитку синовітів суглобів нижніх кінцівок у хворих на РА та АС (McGonagle D. et al., 1998; Коваленко В.Н., Борткевич О.П., 2004; Рекалов Д.Г., Борткевич О.П., 2011).
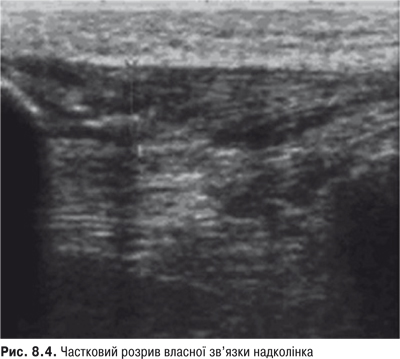
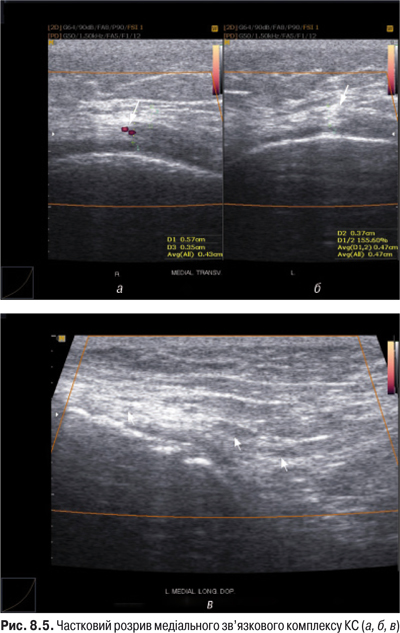

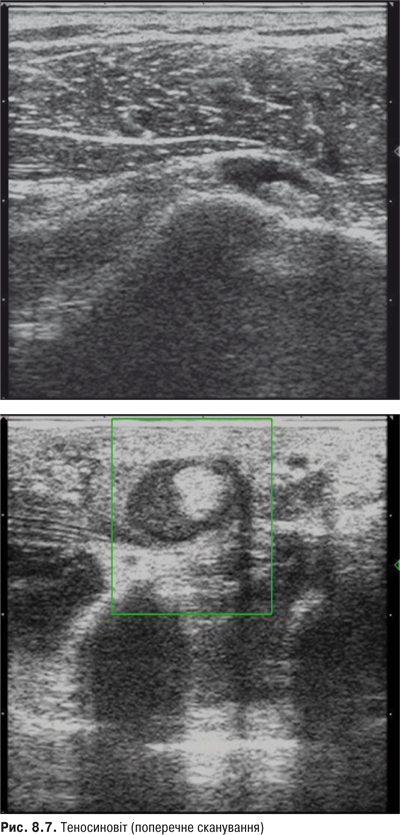
Таким чином, УЗД — набагато інформативніший метод ранньої діагностики порівняно зі стандартним рентгенологічним дослідженням.
3. Патологія суглобових сумок (бурсит):
а) Гострий та хронічний бурсит (рис. 8.10): частіше спостерігаються у верхньому та задньому заворотах КС, міжфасціальних просторах гомілки (особливо при розриві кісти Бейкера — рис. 8.11), субакроміально-субдельтовидній, локтьовій, позап’ятковій сумках; рідше спостерігаються інші локалізації бурситів. УЗ-ознаки — збільшення розмірів сумки, анехогенна зона в проекції ураженої сумки (наявність вільної рідини), обмежена гіперехогенною оболонкою (стінка сумки):
- геморагічний бурсит: виникає внаслідок прямої/непрямої травми ураженої ділянки, розриву прилеглого сухожилля/сухожиль, перелому кісток, патології згортання крові тощо. УЗ-ознаки: розміри суглобової сумки більше, ніж при звичайному гострому бурситі, стадійність змін ехоструктури вільної рідини в порожнині сумки швидка (див. нижче диференційні ознаки гострого та хронічного бурситу).
Диференційними УЗ-ознаками гострого та хронічного бурситу є:
- Товщина стінки сумки (при гострому бурситі стінки тонкі, при хронічному — товсті, досить часто — з нерівними контурами).
- Особливості ехоструктури рідини в порожнині сумки: при гострому бурситі — гомогенна анехогенна, при хронічному — часто негомогенна, з наявністю ехо «+» включень, рухомих при проведенні функціональних проб, різного розміру та ехо-щільності.
- Наявність васкуляризації при допплерівському дослідженні (при гострому бурситі найчастіше кровоток у стінці сумки відсутній, при хронічному — спостерігається часто).

4. Патологія підшкірно-жирової клітковини:
а) Набряк спостерігається при запальному процесі (артрит, періартрит тощо), хронічній серцевій та венозній недостатності (рис. 8.12), лімфедемі, целюліті тощо). При УЗ-дослідженні визначають збільшення об’єму підшкірно-жирової клітковини (рис. 8.13), зміни ехогенності (найчастіше суттєва гіпоехогенність сполучнотканинних фіброзних перетинок на фоні відносно гіперехогенних прошарків жирової тканини).
б) Локальні патологічні утворення при ревматичних захворюваннях (у тому числі ревматоїдні вузлики при РА, вузлуваті утворення, переважно в м’яких тканинах гомілки, при вузлуватій еритемі, депозити при подагірі та метаболічних артропатіях), інородні тіла тощо.
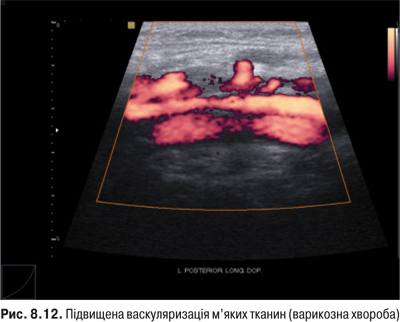

5. Патологія суглобів:
а) Випіт у порожнині суглоба (рис. 8.14).
б) Гіпертрофія СО (рис. 8.15).
в) Кровотік у СО (рис. 8.16).
г) Зміни кортикального шару кісткових суглобових поверхонь (ерозивні (рис. 8.17), дегенеративні, в тому числі остеофітоз (рис. 8.18); пухлинні ураження; патологія періосту, в тому числі при остеомієліті; переломи/тріщини тощо).
д) Зміни СХ, менісків (у тому числі часткові та повні розриви) (рис. 8.19), кісти (рис. 8.20) судин та інших м’якотканинних структур ділянки, що сканується.
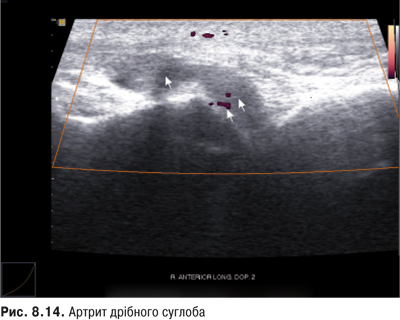
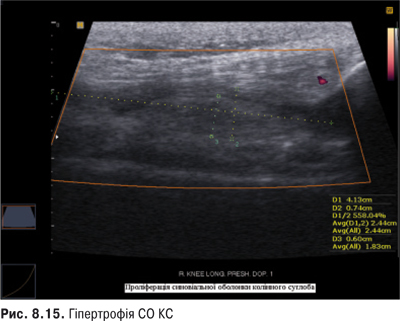
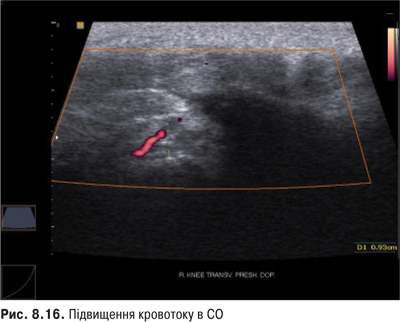


Методики ультразвукового дослідження окремих суглобів
Нижня кінцівка
КуС
Кульшова ділянка є місцем проходження великих судинно-нервових пучків, зоною метастазування пухлин і поширення запальних процесів із черевної порожнини й малого таза, а також із нижніх кінцівок (Івашкін В.Т., Султанов В.К., 2005). Хоча найбільш інформативним методом виявлення уражень КуС є МРТ, УЗД має переваги у виявленні невеликого випоту в суглобі (навіть менше 1 мл), а також порушень стану навколосуглобових м’яких тканин на ранніх стадіях розвитку ревматичних захворювань суглобів. Дослідження проводиться за допомогою лінійного чи конвексного датчика в діапазоні 3,5–7,5 МГц залежно від конституційних особливостей пацієнта.
Анатомічні дані
КуС відноситься до зчленувань кулястого типу, має здатність виконувати великий обсяг рухів, характеризується вираженою стабільністю і відіграє провідну роль у підтримці маси тіла й пересуванні людини. Голівка СтК, розміщена на подовженій шийці, глибоко проникає у вертлюжну западину, утворену з’єднанням клубової, сідничної та лонної кісток таза (рис. 8.21).
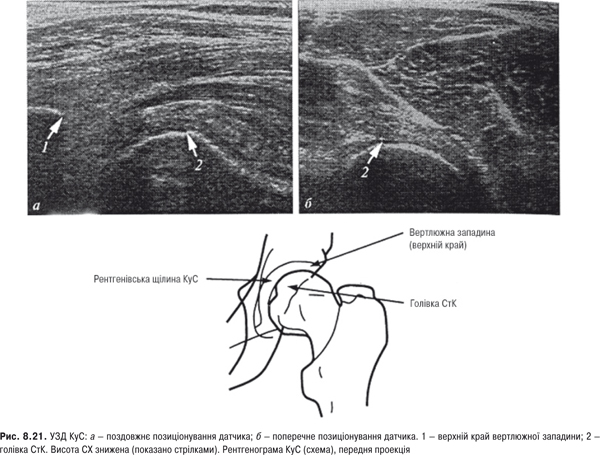
Вертлюжна западина поглиблена за рахунок фіброзно-хрящової губи, що формує «комір» навколо голівки СтК. Через щілину в нижній частині губи (вертлюжну вирізку) «перекидається» поперечне зв’язування, що утворює в такий спосіб отвір, через який в порожнину КуС проходять кровоносні судини. СХ вертлюжної западини має підковоподібну форму, що відкрита вниз. Дно вертлюжної западини заповнене жировою тканиною. Усередині КуС проходить кругла зв’язка, що починається від поперечної зв’язки та прикріплюється до ямки на голівці СтК. Кругла зв’язка несе кровоносні судини, її основна функція полягає в живленні центральної частини голівки стегнової кістки. СО покриває капсулу, губу й жирову подушку, але не включає круглу зв’язку. КуС оточений міцною фіброзною капсулою, укріпленою міцними зв’язками, такими як lig. inguinale, lig. iliopectineum, lig. lacunare, lig. sacrotuberosum). Навколо суглоба розташовано кілька сумок, серед яких: bursa trochanterica musculi glutaei maximi, b. tuberis ischiadici тощо. У безпосередній близькості від КуС попереду проходить судинно-нервовий пучок, позаду — сідничний нерв. Стандартні проекції та позиціонування датчика при УЗД КуС наведено в табл. 8.9.
Таблиця 8.9
Стандартні проекції та позиціонування датчика при УЗД КуС (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
Суглобова поверхня СтК, у тому числі голівка СтК; СЩ та капсула КуС; вертлюжна западина (acetabulum); СХ; періартикулярні м’які тканини, в тому числі прилеглі м’язи; СО |
|
|
Стандартні сканування |
|
|
1. Переднє поздовжнє |
Суглобова поверхня СтК, у тому числі голівка СтК; СЩ та капсула КуС; дах acetabulum; СХ; періартикулярні м’які тканини, зокрема прилеглі м’язи; СО Патологія, що виявляється: випіт у порожнині КуС, з розширенням СЩ, наявністю гіперехогенних включень при тривалому перебігу запального процесу; проліферація СО (у тому числі гроновидна при РА); патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни при РА та утворення остеофітів — при ОА), проліферація СО та кровотік в останній, порушення структури м’язів при патології останніх, патологія інших м’яких тканин, у тому числі кістоподібні утворення, пухлини тощо |
|
2. Переднє поперечне |
|
|
3. Латеральне поздовжнє сканування |
Великий виросток СтК (trochanter major). Патологія, що виявляється: запальні зміни, в тому числі бурсити ділянки, що досліджується (trochanteritis) |
Дослідження проводиться зазвичай з переднього доступу (поздовжня і поперечна позиції датчика), у положенні пацієнта на спині з випрямленими ногами. Кістковими орієнтирами є крило клубової кістки і півколо голівки СтК. З переднього доступу добре візуалізується гіпоехогенний гіаліновий СХ, синовіальна суглобова капсула КуС. Для візуалізації великого вертела і вертельної сумки, розміщеної над ним поверхово підшкірно, використовується латеральний доступ. Сідничний бугор досліджується із заднього доступу в положенні пацієнта лежачи на боці з зігнутою і приведеною до живота досліджуваною кінцівкою.
КС
Незважаючи на те що УЗД повністю не може замінити такі високоінформативні методики, як МРТ і стандартне рентгенівське дослідження, при дослідженні КС воно має певні переваги. Однією з найважливіших переваг УЗД є оцінка м’яких тканин КС, включаючи зв’язування, сухожилля, сполучнотканинні елементи, жирову клітковину, судинно-нервові пучки.
Можливості УЗД в оцінці внутрішньосуглобових елементів, таких як меніски, хрестоподібні зв’язування й СХ, обмежені, в основному за рахунок недостатнього акустичного вікна. Тому у всіх випадках результати УЗД при патології менісків, СХ і хрестоподібних зв’язувань мають бути підтверджені за допомогою МРТ і рентгенографії.
Однак простота проведення УЗД, його доступність і низька вартість зумовлюють вибір останнього при первинній діагностиці та моніторингу захворювань КС, у тому числі ревматичних захворювань ОРА. УЗД КС проводять високочастотними датчиками з базовими частотами 5–7,5 МГц. При проведенні дослідження потрібно пам’ятати про ефект анізотропії, в основному при дослідженні сухожильно-зв’язкового апарату. Необхідно також ураховувати дані анамнезу, що в ряді випадків значно полегшує діагностику.
Анатомічні дані
КС — найбільше зчленування виросткового типу.
Він з’єднує три кістки: стегнову, великогомілкову та надколінок, що являє собою найбільшу сесамовидну кістку скелета людини та утримується сухожиллям квадрицепса попереду від СтК. КС включає три відділи, що утворюють загальну суглобову порожнину: медіальний і латеральний великогомілково-стегнові (в закордонній літературі — медіальний і латеральний тибіо-феморальні відділи/департаменти КС) й надколінково-стегновий (патело-феморальний відділ) (рис. 8.22, 8.23).
Порожнина КС перегороджена двома менісками, які являють собою фіброзні хрящі напівмісячної форми. Латеральний меніск кріпиться до підколінної ямки, він більш рухливий, ніж медіальний меніск (останній прикріплюється центрально до міжвиросткових горбків, а медіально — до капсули КС. По обидва боки від верхніх кутів надколінка з обидвох сторін СО КС утворює завороти, які легко розтягуються рідиною при патологічному (в першу чергу, запальному) процесі.
КС містить ряд синовіальних сумок. Сумки, що розташовані в передньому відділі КС (препателярна, поверхнева та глибока інфрапателярні, гусяча), не сполучаються з суглобовою порожниною, а ті, що перебувають у підколінній ямці (напівперетинчаста, латеральна та медіальна mm. gasrocnemia, ікроножні) — сполучаються.
По обидва боки КС укріплений колатеральними зв’язками (рис. 8.24). Медіальна колатеральна зв’язка прикріплена до суглобної капсули та медіального меніска, а латеральна — йде від СтК до малогомілкової кістки, і не має зв’язку з капсулою. Крім того, дві хрестоподібні зв’язки (передня та задня) розташовані в порожнині КС, де прикріплені до міжвиросткових поглиблень (рис. 8.25).
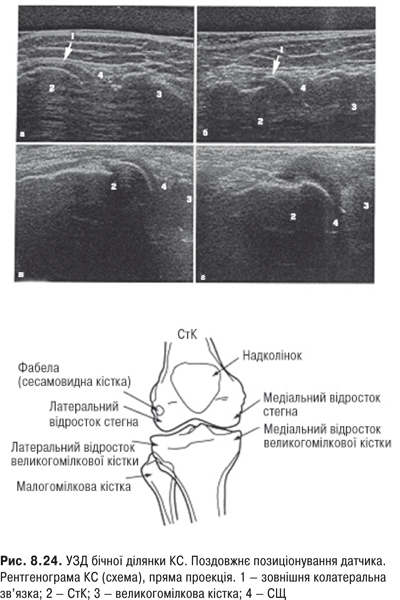
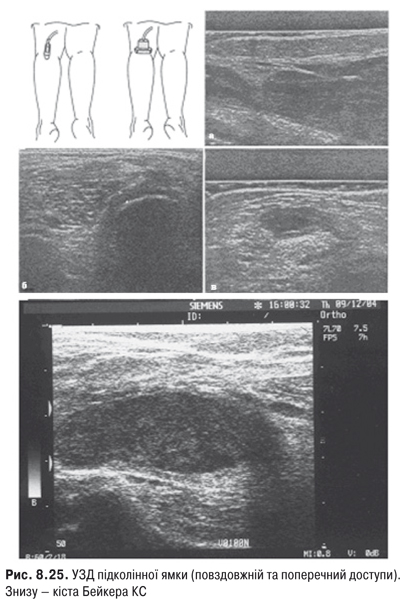
Розроблена рядом авторів методика проведення УЗД дозволяє визначати основні ознаки патологічних процесів КС — травматичних ушкоджень, дегенеративно-дистрофічних і запальних процесів при ревматичних захворюваннях суглобів та ін. (табл. 8.10). Згідно з цією методикою, УЗД зазвичай починають із супрапателярної ділянки. Тут добре візуалізується при поздовжньому і поперечному скануванні сухожилля чотириглавого м’яза стегна, контури верхнього полюса надколінка, супрапателярна сумка (так званий верхній заворот), дослідження якої при ревматичних захворюваннях суглобів особливо інформативно для діагностики вираженості дегенеративно-дистрофічних і запальних уражень (рис. 8.26, 8.27).
Таблиця 8.10
Стандартні проекції та позиціонування датчика при УЗД КС (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
Структури КС, у тому числі прилеглі м’якотканинні (сухожилля, зв’язковий апарат, м’язи, жирове тіло КС), УЗ-СЩ, гіаліновий СХ, латеральний/медіальний меніски, судинно-нервовий пучок підколінної ямки |
|
|
Стандартні сканування |
|
|
1. Надколінкове (suprapatellaris) поздовжнє |
СтК, верхній край надколінкової кістки (patella), m. quadriceps femori, його сухожилля та місце прикріплення до кістки, верхній заворот суглобової капсули КС. Патологія, що виявляється: випіт у порожнині КС (верхнього завороту), в тому числі гемартроз (при лікуванні антикоагулянтами), з розширенням СЩ, наявністю гіперехогенних включень при тривалому перебігу запального процесу; проліферація СО (у тому числі гроноподібна при РА); патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни при РА та утворення остеофітів — при ОА) стегнової та великогомілкової/малогомілкової кісток, бурсит, проліферація СО та кровотік в останній, порушення цілісності та тендосиновіт прилеглих сухожиль, кістоподібні утворення м’яких тканин, пухлини (в першу чергу, підколінної ділянки) |
|
2. Надколінкове поперечне сканування в нейтральній позиції |
Див. 1. + плеснофаланговий суглоб (звуження УЗ-СЩ, наявність остеофітів тощо) |
|
3. Надколінкове поперечне сканування при максимальному згинанні КС |
Плеснофаланговий суглоб (явища запалення, накопичення випоту та особливості останнього, проліферація СО, нерівномірність гіалінового СХ) |
|
4. Піднадколінкове (infrapatellaris) поздовжнє сканування |
Жирове тіло КС, суглобові поверхні кісток, що сполучаються |
|
5. Піднадколінкове (infrapatellaris) поперечне сканування |
Гіаліновий СХ у медіальній/латеральній ТФД, суглобові поверхні кісток, що сполучаються |
|
6. Медіальне поздовжнє сканування |
Роги медіального меніска КС, медіальна СЩ КС |
|
7. Латеральне поздовжнє сканування |
Роги латерального меніска КС, латеральна СЩ КС |
|
8. Заднє медіальне поздовжне сканування |
Задній ріг медіального меніска КС, медіальна СЩ КС, частково — задній заворот КС, кісткові поверхні |
|
9. Заднє латеральне поздовжне сканування |
Задній ріг латерального меніска КС, латеральна СЩ КС, частково — задній заворот КС, кісткові поверхні |
|
10. Заднє поперечне сканування |
Задній заворот КС, судинно-нервовий пучок, періартикулярні м’які тканини, кісткові поверхні |
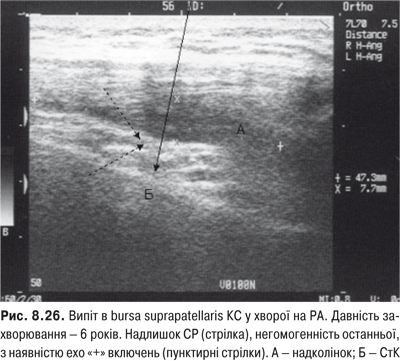
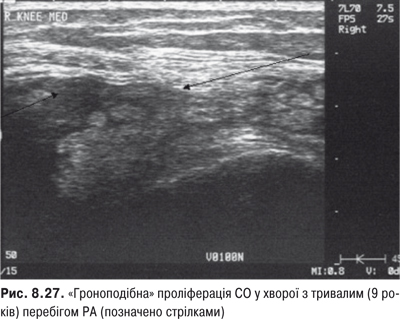
Аналіз отриманих нами даних УЗД дозволив нам розділити синовіт КС на стадії (рис. 8.28):
І стадія — розмір верхнього завороту 40,0 х 5,0 мм, локальне стовщення СО до 5 мм;
ІІ стадія — розмір верхнього завороту 50,0 х 7,0 мм, локальне стовщення СО до 6–7 мм, дифузне — до 5 мм;
ІІІ стадія — діаметр завороту >50,0 х 7,0 мм, локальне стовщення СО >8 мм, дифузне — >5 мм.
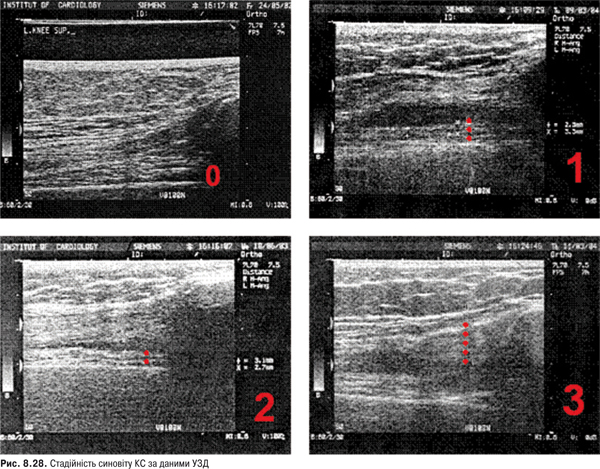
Подальше дослідження при згинанні КС і переміщення датчика в поперечне положення дозволяє візуалізувати ділянку пателофеморального відділу, зокрема гіаліновий хрящ і наявність або відсутність над ним надлишку рідини. Переміщення датчика на ділянку нижче надколінка дає можливість визначити поверхнево розміщену власну зв’язку надколінка, її структуру, піднадколінкове жирове тіло, піднадколінкову синовіальну складку, глибше якої розташована передня хрестоподібна зв’язка. Таке положення датчика дозволяє візуалізувати СХ латерального і медіального виростків, зміни форми суглобових поверхонь СтК (сплощення та ін.). Постановка датчика на внутрішні й зовнішню бічну поверхні КС дозволяє візуалізувати відповідно внутрішню і зовнішню колатеральні зв’язки, крайові кісткові розростання стегнової та великогомілкової кісток, наявність або відсутність випоту (рис. 8.29–8.32).
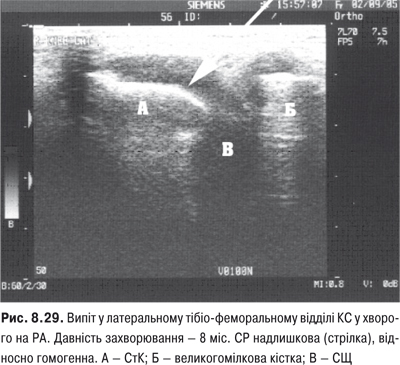
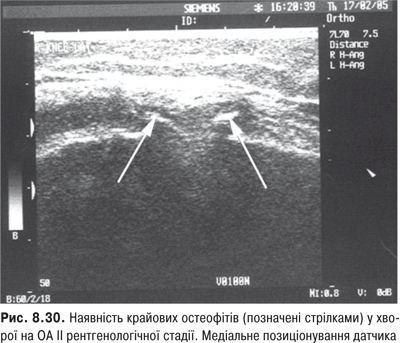
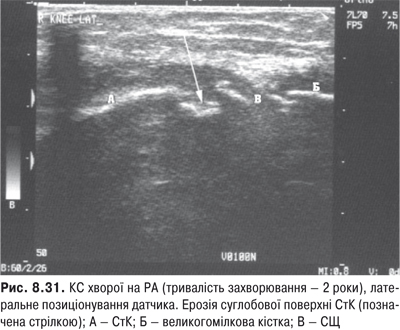
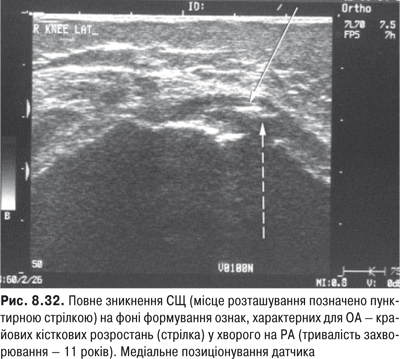 При УЗД підколінної ямки (рис. 8.33) можна візуалізувати патологічні утворення цієї ділянки, у тому числі наявність випоту в задньому завороті (так звана кіста Бейкера), оцінити стан СХ латерального та медіального виростків СтК, задні частини медіального і латерального виростків СтК, задні роги латерального і медіального менісків, а також частину зв’язкового апарату — в цій проекції найкраще візуалізується задня хрестоподібна зв’язка.
При УЗД підколінної ямки (рис. 8.33) можна візуалізувати патологічні утворення цієї ділянки, у тому числі наявність випоту в задньому завороті (так звана кіста Бейкера), оцінити стан СХ латерального та медіального виростків СтК, задні частини медіального і латерального виростків СтК, задні роги латерального і медіального менісків, а також частину зв’язкового апарату — в цій проекції найкраще візуалізується задня хрестоподібна зв’язка.
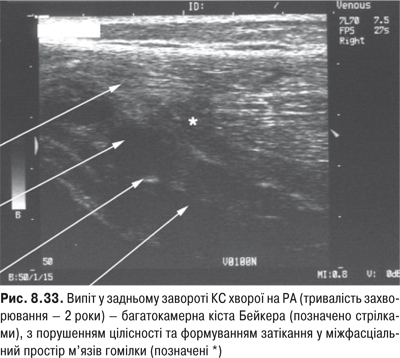
Досвід власних досліджень дозволив нам також провести аналіз УЗ-ознак уражень окремих структур КС при РА залежно від особливостей перебігу захворювання та визначити стадії уражень за ступенем їх тяжкості (табл. 8.11).
Таблиця 8.11
Стадійність УЗ-ознак РА
|
Структура КС |
Норма |
Стадія |
||
| І | ІІ | ІІІ | ||
|
СХ* |
Висота 3–4 мм, рівномірний за товщиною, однорідний за структурою, поверхня рівна, чітка |
Висота 3–6 мм, часто — потовщення внаслідок набряку, або ж УЗ-CЩ значно розширена за рахунок випоту до 12,1 мм |
Висота 1,5–2,5 мм, рівномірне чи нерівномірне стоншення, поява ехо«+» та ехо«–» включень |
Висота <1,5 мм, негомогенна ехо-структура, місцями не візуалізується |
|
СО |
Не візуалізується |
Не візуалізується або локальне потовщення до 5 мм без розростань, або поодинокі дрібні (до 0,4–1,0 мм) вузликоподібні розростання) |
Локальне стовщення до 6–7 мм, дифузне — до 5 мм, множинні гроноподібні розростання |
Локальне стовщення >8 мм, дифузне — >5 мм |
|
Періартикулярні м’які тканини |
Відсутність набряку |
Незначний набряк |
Виражений набряк |
Значно виражений набряк |
|
Суглобові сумки та завороти |
Гіпоехогенне утворення з наявністю складок та розгалужень, без випоту |
Випіт об’ємом 5–12,5 мл, який локалізується в 1–2 синовіальних сумках (частіше — верхній заворот та латеральна тибіо-феморальна ділянка). Розмір верхнього завороту до 40,0 х 5,0 мм |
Розмір верхнього завороту до 50,0 х 7,0 мм |
Розмір верхнього завороту більше 50,0 х 7,0 мм |
|
Суглобова порожнина |
Без випоту |
Випіт у незначній кількості (до 7,5–10 мл), гомогенної анехогенної структури |
Випіт у помірній кількості (до 25–30 мл), можлива наявність дрібних ехо«+» включень |
Випіт у великій кількості (>30 мл), наявність гіперехогенних утворень неправильної форми до 10–15 мм в діаметрі (фібринові згустки) |
|
Суглобові поверхні |
Рівні, чіткі контури, |
Норма або нечіткість контурів кортикального шару, ерозії відсутні |
Нечіткість («розмитість») контурів, наявність поодиноких невеликих ерозій. Сплощення суглобових поверхонь |
Значна деформація, нерівність контурів, множинні ерозії різного розміру |
|
Крайові кісткові розростання (остеофіти) |
Відсутні |
Відсутні |
У поодиноких випадках — формування невеликих остеофітів |
Трапляються за рахунок формування вторинного ОА |
|
СХ* |
Висота 3–4 мм, рівномірний за товщиною, однорідний за структурою, поверхня рівна, чітка |
Висота 3–6 мм, часто — потовщення внаслідок набряку, або ж УЗ-CЩ значно розширена за рахунок випоту до 12,1 мм |
Висота 1,5–2,5 мм, рівномірне або нерівномірне стоншення, поява ехо«+» та ехо«–» включень |
Висота <1,5 мм, негомогенна ехо-структура, місцями не візуалізується |
*Висоту та ехо-властивості СХ при РА визначали за умови усунення випоту в порожнині суглоба (після діагностично-лікувальної пункції).
- Верхній заворот не змінений (розширений, з наявністю надлишку однорідної чи неоднорідної рідини, СО не візуалізується (стовщена, рівномірно чи нерівномірно чи з наявністю розростань).
- Кровотік у СО відсутній (наявний, інтенсивність у балах).
- Товщина СХ у ділянці пателофеморального відділу суглоба, латерального і медіального виростків в межах норми до 3 мм (зменшена, збільшена), рівномірна (нерівномірна), структура однорідна (з наявністю включень, опис).
- Контури субхондральної кісти не змінені (нерівні, з наявністю кіст, поверхневих дефектів, ерозій).
- Цілісність чотириголового м’яза стегна і власної зв’язки надколінка не порушена, ligg. collaterales не змінені, цілісність волокон збережена (УЗ-ознаки часткового ушкодження або повного розриву).
- Передня хрестоподібна зв’язка не змінена (наявні ознаки кальцифікації). Меніски (зовнішній, внутрішній) — структура однорідна, контури чіткі, рівні (УЗ-ознаки ушкодження — фрагментація, кальцифікація та ін.).
- Функціональні проби (симптом переднього висувного ящика) +/–.
Була встановлена відповідність УЗ-ознак і послідовності їх виникнення залежно від стадійності процесу за рентгенологічною класифікацією. Особливістю УЗД виявилося раннє виявлення проліферативних змін СО, змін гіалінового СХ і ерозивних змін. Ці симптоми виявлено при 0–I стадії рентгенологічних змін, коли не можна ні за клінічними, ні за рентгенологічними ознаками встановити діагноз конкретному хворому.
У цілому чутливість УЗД при 0-І рентген-стадії РА склала 88,1%, специфічність — 70,6% (Терзов К.А. та співавт., 2006). Для рентгенологічних методів чутливість становить 60,1%, специфічність — 48,1% (Спузяк М.И., 1988). На наступних етапах розвитку РА інформативність УЗД була також високою, що особливо стосувалося патологічних змін у м’яких періартикулярних тканинах і гіаліновому СХ.
Протокол УЗД КС пацієнта із ревматичними захворюваннями суглобів розроблено нами на основі існуючих методик та власного досвіду (макет див. нижче):
- Суглобові співвідношення збережені (порушені, утрачені), без деформації (сплощені, деформовані).
- Крайові кісткові розростання стегнової та великогомілкової кісток не визначаються (наявні, розмір, локалізація).
Гомілковостопні суглоби
Гомілковостопні суглоби — зчленування шарнірного типу між медіальною щиколоткою малогомілкової кістки і таранною кісткою. Капсула міцніша з медіального та латерального боку, де вона зв’язана зі зв’язками. Стабільність гомілковостопних суглобів підтримується колатеральними зв’язками: медіальною (дельтоподібною) та латеральною (складається з 3 пучків (передньої та задньої таранно-малогомілкової та п’ятково-малогомілкової)). Нижнє великогомілково-малогомілкове зчленування становить синдесмоз і практично нерухоме.
За латеральною щиколоткою проходять сухожилля м’язів, що підвертають стопу всередину, а за медіальною — сухожилля м’язів, що підвертають стопу назовні й згинають I палець. Кожне сухожилля оточене своєю піхвою, і всі вони притискаються до щиколоток м’язами-утримувачами, відповідно — retinaculum peroneum (латеральна щиколотка) і retinaculum flexorum (медіальна щиколотка). Медіальний утримувач утворює передплесновий (тарзальний) канал, через який проходить великогомілковий нерв. Попереду й більш поверхово стосовно гомілковостопних суглобів під retinaculum extensorum розміщуються три сухожильних піхви м’язів-розгиначів (табл. 8.12).
Суглоби стопи
Анатомічні дані
У передній частині стопи розташовані суглоби стопи — плеснофалангові та міжфалангові суглоби шарнірного типу, подібні до плеснофалангових і міжфалангових суглобів кистей. Стабільність плеснофалангового суглоба визначається в основному міцністю капсули, укріпленої по обидва боки колатеральними зв’язками, зверху — сухожиллям м’яза-розгинача, а знизу — плантарним сухожиллям. У середній частині стопи розташовується міжпередплесновий суглоб плоского типу, що становить функціональне об’єднання таранно-п’ятково-човновидного та п’ятково-кубовидного суглобів. Він дозволяє виконувати внутрішнє і зовнішнє підвертання передньої частини стопи. У задній частині стопи розташований підтаранний суглоб, що утворюється увігнутою суглобовою поверхнею п’яткової кістки та опуклою нижньою поверхнею таранної кістки. Цей суглоб уможливлює внутрішнє та зовнішнє підвертання задньої частини стопи. У результаті того, що в передній частині стопи кістки розташовані щільно одна до одної, а в задній частині — лежать одна на іншій, формуються два зведення: поздовжнє і поперечне. У передній частині стопи іноді розташовані сумки над медіальною частиною I плеснофалангового суглоба і латеральною частиною V плеснофалангового суглоба . Ахіллове сухожилля (загальне для mm. gastrocnemius та m. soleus) прикріплюється до задньої частини п’яткової кістки й відділене від її позап’яткової (преахіллової) сумки. Крім того, в ділянці п’яти є сумки між ахілловим сухожиллям і шкірою (ретроахіллова сумка), а також між шкірою й нижньою поверхнею п’яткової кістки (підп’яткова сумка). Плантарна фасція починається від серединного виступу п’яткової кістки, а в проксимальному відділі, розділяючись на пучки, прикріплюється до голівок плеснових кісток (табл. 8.13).
Таблиця 8.12
Стандартні проекції та позиціонування датчика при УЗД гомілковостопних суглобів (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
Гомілковостопні суглоби, прилеглі м’якотканинні структури |
|
|
Стандартні сканування |
|
|
1. Переднє поздовжнє сканування |
Аrt. tibio-talare, talo-naviculare, cуглобові поверхні великогомілкової та таранної кістки, malleolus med., прилеглі сухожилля та місця їх прикріплень до кісток, гіаліновий СХ, СО, a. tibialis ant. Патологія, що виявляється: Випіт у порожнині гомілковостопних суглобів, гемартроз (у тому числі при лікуванні антикоагулянтами), тендосиновіт, патологія суглобових поверхонь великогомілкової та таранної кістки, субдельтовидний/субакроміальний бурсит, проліферація СО, порушення цілісності сухожиль, патологія СХ (перш за все явища ОА) |
|
2. Переднє поперечне сканування |
Суглобова поверхня таранної кістки, гіаліновий СХ. Патологія, що виявляється: патологія суглобової поверхні таранної кістки, патологія СХ (перш за все явища ОА) |
|
3. Перикісточкове медіальне поздовжнє сканування |
Суглобова поверхня таранної кістки, гіаліновий СХ, malleolus med., tendo m. tibialis post., СО. Патологія, що виявляється: тендосиновіт і порушення цілісності сухожилля, ділянки гіпертрофії СО та наявність кровотоку в останній, патологія СХ та субхондральної кістки (перш за все зумовлені ОА та РА) |
|
4. Перикісточкове медіальне поперечне сканування |
Мalleolus med., tendіnes mm. tibialis post., flexor digitorum long., hallucis long., судини. Патологія, що виявляється: тендосиновіт і порушення цілісності сухожиль, патологічні зміни судин (у тому числі судинної стінки, порушення кровотоку) |
|
5. Перикісточкове латеральне поздовжнє сканування |
Мalleolus lat., tendines mm. peronaeа. Патологія, що виявляється: тендосиновіт і порушення цілісності сухожиль, патологічні зміни malleolus lat |
|
6. Перикісточкове латеральне поперечне сканування |
Див. 5 |
|
7. Заднє поздовжне сканування |
Поверхня п’яткової кістки, tendo calcaneus (ахіллове сухожилля), bursa tendinis calcanei. Патологія, що виявляється: тендосиновіт, порушення цілісності та ентезопатія ахіллова сухожилля, проліферація СО, патологія п’яткової кістки та оточуючих м’яких тканин (у тому числі гострий та хронічний позап’ятковий бурсит), ерозивні зміни п’яткової кістки |
|
8. Заднє поперечне сканування |
Див. 7 |
Таблиця 8.13
Стандартні проекції та позиціонування датчика при УЗД суглобів стопи (за: Backhaus M. et al., 2001; EULAR, Working Party on 8.9 Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
Суглоби стопи, прилеглі м’якотканинні структури |
|
|
Стандартні сканування |
|
|
1. Підошовне поздовжнє сканування |
П’яткова кістка, підошовна фасція, патологічні зміни СО. Патологія, що виявляється: фасцит підошовної фасції, п’яткова «шпора», зміни кісткових поверхонь |
|
2. Підошовне поперечне сканування |
Див. 1 |
|
3. Дорзальне поздовжне сканування а) плеснофалангові суглоби б) міжплесневі суглоби |
Суглобові поверхні кісток, що сполучаються, УЗ-СЩ, СО, прилеглі м’якотканинні структури. Патологія, що виявляється: випіт у порожнині суглобів (в тому числі з наявністю множинних ехо «+» включень, які мають специфічний вигляд (часто описують як «снігову бурю») і характерні для мікрокристалічних артропатій, перш за все подагри); зміни УЗ-СЩ (розширення за наявності випоту, звуження при розвитку, перш за все ОА); проліферативні зміни СО та кровотік у ній; зміни суглобових поверхонь кісток, що сполучаються (ерозивні — при РА, спондилоартропатіях, ПсА тощо; формування остеофітів, характерне для розвитку ОА); зміни в періартикулярних м’яких тканинах (запальні — у вигляді гіпоехогенних ділянок, часто — зі втратою типової ехоструктури, дегенеративно-дистрофічні — гіперехогенні зони, дифузно чи локально по ходу сухожиль тощо; наявність гіперехогенних включень різного розміру, що відображають кальциноз чи відкладення кристалів при подагрі (найчастіше) чи інших мікрокристалічних артропатіях |
|
4. Дорзальне поперечне сканування |
Див. 3 |
|
5. Латеральне поздовжнє сканування а) перший плеснофаланговий суглоб б) п’ятий плеснофаланговий суглоб |
Див. 3 |
Верхня кінцівка
Плечові суглоби (ПС)
Ураження ПС при ревматичних захворюваннях суглобів має велике значення, оскільки пов’язане зі значним порушенням функціональної здатності хворого, а також, поряд з ураженням інших великих суглобів, зумовлює несприятливий прогноз перебігу цих хвороб (Борткевич О.П., 2003). Так, ураження ПС при РА зумовлено як синовітом, так і залученням дистальної третини ключиці, різних синовіальних сумок та м’язів плечового поясу, шиї та грудної клітки (Насонова В.А., Бунчук Н.В., 1997; Коваленко В.Н. и соавт., 2001; Сигидин Я.А., Лукина Г.В., 2001).
Ураженню ПС при ревматичних захворюваннях суглобів зазвичай притаманний біль, що викликає обмеження рухливості в цьому суглобі, що, в свою чергу, призводить до слабкості й атрофії навколишніх м’язів — дельтоподібної, надосної, підосної, двоголової та триголової (Сигидин Я.А., Лукина Г.В., 2001). Перші три із цих м’язів утримують лопатку в нормальному положенні. Внаслідок слабкості м’язів лопатка зміщується в передньолатеральному напрямку, у зв’язку із чим ПС при огляді видається висунутим уперед. Крім того, при зсуві лопатки вперед зменшується стабільність ПС. Компенсаторно відновлюючи цю стабільність, великий грудний м’яз приводить плечову кістку в позицію приведення та внутрішньої ротації. Цей механізм пояснює часте обмеження зовнішньої ротації плеча у хворих на РА. Крім того, виражена атрофія м’язів та слабкість допомагають відрізнити ураження ПС при РА від плечолопаткового періартриту (Насонова В.А., Бунчук Н.В., 1997).
Порівняно рідко при РА спостерігається явна припухлість ділянки ПС, яка зазвичай більш виражена на передній поверхні чи в пахвовій ямці. Почергове натиснення пальцями на передню й латеральну поверхні ПС іноді виявляє балотування, що свідчить про внутрішньосуглобове накопичення рідини. Температура шкіри над ПС часто підвищена, що свідчить про активний запальний процес (Коваленко В.Н. и соавт., 2001).
Однією з найважливіших причин патології ПС є залучення до патологічного процесу так званої ротаторної манжети плеча — сухожиль надосного, підосного та малого круглого м’язів, що знаходяться поруч і прикріплюються до великої бугристості плечової кістки (van Holsbeck M.T. et al., 1995; Martinoli C. et al., 2003). Важливою функцією ротаторної манжети плеча є стабілізація голівки плечової кістки в суглобовій западині: сухожилля створюють своєрідний дах ПС, перешкоджаючи надмірному зсуву голівки нагору. У результаті запалення при РА ці сухожилля можуть дистрофічно змінюватися й надриватися (van Holsbeek M.T. et al., 1995). Основна причина подібних ушкоджень, оскільки зазначені сухожилля частково проходять у порожнині ПС — проліферативний синовіт; інші причини — вікові дистрофічні зміни зв’язок, фізичні перевантаження, травми/мікротравматизація (Alasaarela E. et al., 1997) (табл. 8.14).
Ослаблення нормального напруження ротаторної манжети плеча і тим більше її розриви призводять до підвивиху голівки догори та різкого порушення функції ПС. Невеликі надриви сухожиль, що поступово розвиваються, зазвичай не мають характерних клінічних ознак, в той час як значні розриви, що розвиваються раптово, супроводжуються гострим болем і суттєвими зовнішніми ознаками запалення (виражена припухлість, гіпертермія шкіри) (рис. 8.34). Останнє потребує диференційної діагностики, насамперед, з інфекційним артритом, причому слід враховувати, що останній є одним із першочергових невідкладних станів у ревматологічній практиці (Сигидин Я.А., Лукина Г.В., 2001). Також важливо, що припухлість (особливо обмежена) передньолатеральної ділянки ПС може бути викликана не власне артритом, а субакроміальним (субакроміально-субдельтовидним) бурситом (Martinoli C. et al., 2003; EULAR, Working Party on Imaging in Rheumatology, 2005). На відміну від розриву ротаторної манжети плеча, припухлість при бурситі зазвичай супроводжується значно меншим болем і обмеженням обсягу рухів у ПС (Сигидин Я.А., Лукина Г.В., 2001).
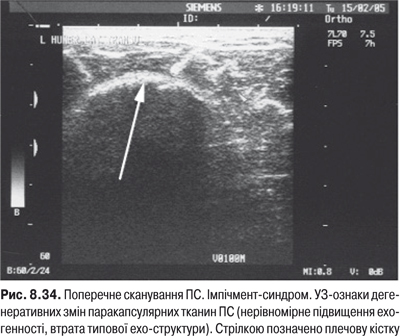
З метою систематизації отриманих УЗ-даних при дослідженні ПС використовуються такі УЗ-ознаки (Коваленко В.М. та співавт., 2006; Борткевич О.П., Терзов К.А., 2006):
- Потовщення синовіальної сумки >2 мм або наявність випоту в субакроміально-субдельтовидній сумці — наявність проліферативних або запальних змін.
- Гіпоехогенна зона, що повністю оточує сухожилля, свідчить про випіт у порожнині сухожильної піхви, причому наявність випоту свідчить про активний запальний процес.
- Потовщення або нерівність контуру сухожильної оболонки є ознакою гіпертрофії СО сухожильної піхви.
- Зміни сухожилля m. supraspinatus, які розділені нами на: 1) повний розрив, 2) зміни ехогенної структури сухожилля (включаючи часткове порушення цілісності чи тендинопатію). Повний розрив діагностувався, коли дефект (гіпоехогенна ділянка) розповсюджувався на всю УЗ-структуру сухожилля, або якщо візуалізовувалося локальне стоншення з чіткими краями розриву, з повною втратою типової ехоструктури сухожилля. Зміни ехогенної структури сухожилля m. supraspinatus діагностувалися за наявності гіпо-/гіперехогенних ділянок у типовій структурі обстежуваного за допомогою УЗД сухожилля.
- Випіт/гіпертрофія СО art. glenohumerale оцінювалися при скануванні зони labrum glenoidale, при задньому сагітальному позиціонуванні датчика, перпендикулярно до голівки плечової кістки, що співпадає з проекціями, які використовуються при стандартній рентгенографії ПС (Kellgren J.H., Lawrence J.S., 1957; Beltran J. et al., 1987).
- Ерозії та нерівність контурів суглобових кісткових поверхонь реєструвалися в передньомедіальній та задньолатеральній проекції голівки плечової кістки, та в зоні великої бугристості плечової кістки.
- Для уточнення УЗ-картини нами також проведено УЗД в положенні пацієнтів лежачи, з обстежуваною верхньою кінцівкою, що знаходилася у вільному положенні, задля зручності встановлення датчика на досліджувану поверхню.
Таблиця 8.14
Стандартні проекції та позиціонування датчика при УЗД ПС (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
ПС, прилеглі м’якотканинні структури |
|
|
Стандартні сканування |
|
|
1. Переднє поперечне сканування в нейтральній позиції на рівні прикріплення m. biceps brachii |
Голівка плечової кістки, сухожилля m. biceps та місце його прикріплення до плечової кістки, дельтовидний м’яз, фрагмент ротаторної манжети плеча, гіаліновий СХ. Патологія, що виявляється: тендосиновіт m. biceps, патологія великого та малого виростків плечової кістки, субдельтовидний/субакроміальний бурсит, проліферація СО, порушення цілісності сухожиль та ротаторної манжети плеча, патологія підшкірної жирової клітковини |
|
2. Переднє поперечне сканування у позиції максимальної внутрішньої ротації |
Голівка плечової кістки, сухожилля m. suprapinatus, дельтовидний м’яз, фрагмент ротаторної манжети плеча, гіаліновий СХ. Патологія, що виявляється: тендосиновіт m. supraspinatus та порушення цілісності, проліферація СО, кальцифікатні депозити тощо |
|
3. Переднє поздовжнє сканування |
Див. 1 |
|
4. Переднє поздовжнє/поперечне сканування у позиції максимальної внутрішньої ротації |
Див. 1 |
|
5. Латеральне поздовжнє/поперечне сканування в нейтральній позиції та при максимальній внутрішній ротації |
Голівка плечової кістки, акроміон, сухожилля m. supraspinatus, дельтовидний м’яз, фрагмент ротаторної манжети плеча. Патологія, що виявляється: підвивихи/вивихи/нестабільність голівки плечової кістки, тощо (див. також 1) |
|
6. Заднє поперечне сканування в нейтральній позиції та при максимальній внутрішній ротації |
Голівка плечової кістки, губа ПС (labrum glenoidale), сухожилля m. infraspinatus, дельтовидний м’яз, фрагмент ротаторної манжети плеча, випіт у порожнині ПС. Патологія, що виявляється: зумовлена ураженням структур, що візуалізуються при УЗД |
|
7. Аксилярне (підпахвове) сканування при піднятому плечі |
Голівка плечової кістки, art. glenohumerale, проліферація СО, випіт у порожнині ПС, фрагмент ротаторної манжети плеча. Патологія, що виявляється: зумовлена ураженням структур, що візуалізуються при УЗД. Наявність випоту в ПС |
|
8. Сканування art. acromioclaviculare |
Акроміон, ключиця, акроміо-ключичний суглоб, прилеглі м’які тканини. Патологія, що виявляється: зумовлена ураженням структур, що візуалізуються при УЗД |
У режимі допплерівського дослідження проводилася оцінка за 3-бальною шкалою M. Hau та співавторів (1999):
0 балів — відсутність візуалізації пануса/кольорових сигналів на отриманому зображенні в аналізованій ділянці;
1 — незначно візуалізований панус і/або одиничні кольорові сигнали;
2 — помірна візуалізація пануса чи помірна кількість кольорових сигналів;
3 — максимальна візуалізація пануса і/або висока щільність кольорових сигналів, що зливаються на отриманому зображенні. Проведене зіставлення УЗ-оцінки СО з клінічними та лабораторними параметрами, що характеризують активність РА.
Дані щодо патології, виявленої за допомогою УЗД ПС у хворих на РА та в контрольній групі, наведені в табл. 8.15.
Таблиця 8.15
УЗД-зміни в обстежених групах, n/%
|
Показник |
Група |
||
| 1-ша (n=44) | 2-га (n=40) | контрольна (n=80) | |
|
Випіт у порожнині ПС |
44/100,0 |
12/30,0 |
1/1,25 |
|
Зміни в СО:
|
40/90,9 22/50,0 20/45,4 14/31,8 20/45,4 |
18/45,0 11/27,5 6/15,0 6/15/0 8/20,0 |
1/1,25 1/1,25 0 0 0 |
|
Оцінка СО за шкалою Hau M. et al., 1999:
|
24/54,5 9/20,4 5/11,4 6/13,6 |
32/80,0 5/12,5 3/7,5 0/0,0 |
0 0 0 0 |
|
Субакроміально-субдельтовидний бурсит |
21/47,7 |
26/65,0 |
6/7,5 |
|
Синовіт art. glenohumerale |
28/63,6 |
14/35,0 |
0 |
|
Тендиніт сухожилля m. biceps brachii Повний розрив сухожилля m. biceps brachii |
12/27,3 4/9,1 |
9/22,5 2/5,0 |
6/7,5 0/0,0 |
|
Тендиніт сухожилля m. supraspinatus, n/% |
10/22,7 |
4/10,0 |
2/2,5 |
|
Зміни субхондральної кістки:
|
39/88,6 18/40,9 8/18,2 32/72,7 |
34/85,0 18/45,0 12/30,0 31/77,5 |
8/10,0 0 8/10,0 6/7,5 |
|
Ентезопатія:
|
44/100,0 28/63,6 12/27,3 18/20,9 11/25,0 |
38/95,0 36/90,0 2/5,00 6/15,0 5/12,5 |
8/10,0 6/7,5 0/0,0 2/2,5 2/2,5 |
Як видно (див. табл. 8.15), для пацієнтів з РА були характерними такі УЗ-ознаки, що свідчили про наявність ревматоїдного запалення: зміни в СО (90,9% хворих 1-ї та 45,0% — 2-ї групи); наявність випоту в суглобовій порожнині (100,0% хворих 1-ї та 30,0% — 2-ї групи); зміни субхондральної кістки (88,6 хворих 1-ї та 85,0 — 2-ї групи), причому вірогідні ерозії за даними УЗД спостерігалися в 40,9% хворих 1-ї та 45,0% — 2-групи; ентезопатії — 100,0% хворих 1-ї та 95,0% — 2-ї групи. Також частими були зміни окремих сухожиль у вигляді тендиніту/тендосиновіту, який у більшості випадків супроводжувався порушенням цілісності сухожиль (часткова втрата типової ехоструктури) аж до повного розриву сухожиль.
Наявність запальних змін, виявлених при УЗД в окремих осіб КГ (випіт у порожнині суглоба в 1 (1,25%) особи, УЗ-ознаки субакроміально-субдельтовидного бурситу — в 6 (7,5%), ентезопатії — у 8 (10,0%)), а також зміни сухожиль можемо пояснити хронічним фізичним перевантаженням в цій групі (робота на присадибних ділянках, фізична праця за місцем роботи тощо). Крім того, наявність розростань кісткових суглобових поверхонь (остеофітів) в цій групі може пояснюватися безсимптомним розвитком ОА (Коваленко В.М., Борткевич О.П., 2005).
УЗД дозволило виявити запальні зміни ПС у більшості обстежених пацієнтів із раннім РА (тривалість захворювання — до 2 років), навіть за відсутності ознак ураження ПС (табл. 8.16).
Таблиця 8.16
УЗД-зміни в обстежених групах хворих на ранній РА та контрольної групи, n/%
|
Показник |
Група |
|
|
1-ша (n=14) |
2-га (n=16) |
|
|
Випіт у порожнині ПС |
14/100,0 |
10/62,5 |
|
Зміни в СО:
|
8/57,1 6/42,9 2/14,3 1/7,2 5/35,7 |
9/56,2 9/56,2 2/12,5 1/6,3 1/6,3 |
|
Оцінка СО за шкалою M. Hau et al., 1999:
|
9/64,3 3/21,4 0/0,0 2/14,3 |
15/93,7 0/0,0 1/6,3 0/0,0 |
|
Субакроміально-субдельтовидний бурсит |
13/92,9 |
10/62,5 |
|
Синовіт art. glenohumerale |
4/28,6 |
7/43,7 |
|
Тендиніт m.biceps brachii Повний розрив сухожилля m. biceps |
10/71,4 2/14,3 |
4/25,0 1/6,3 |
|
Тендиніт сухожилля m. supraspinatus |
10/71,4 |
6/37,5 |
|
Зміни субхондральної кістки:
|
12/87,1 8/57,1 1/7,2 12/87,1 |
15/93,7 7/46,7 2/12,5 14/87,5 |
|
Ентезопатія:
|
13/92,9 13/92,9 3/21,4 4/25,7 2/14,28 |
12/75,0 9/56,2 1/6,25 2/12,5 0/0,00 |
Зазначимо, що проведення УЗД в положенні пацієнта сидячи, згідно з рекомендаціями EULAR, не дозволяло повною мірою оцінити наявність запальних змін у ПС. За нашими даними, УЗ-ознаки субакроміально-субдельтовидного бурситу виявлялися в положенні пацієнта з РА сидячи в 1-й групі у 47,7% випадків, а у 2-й групі — в 65,0%. При УЗ-обстеженні хворого в положенні лежачи виявність цієї патології становила відповідно 63,4 та 75,0%. Це дає підстави говорити про субклінічний перебіг запального ураження аналізованої ділянки у частини хворих на РА.
Наведені в табл. 8.17 дані свідчать про те, що дані УЗД слабко співвідносяться з активністю РА за лабораторними параметрами, але у групі хворих на ранній РА з ураженням ПС рівні ШОЕ та СРБ відповідають вищому ступеню активності РА за УЗ-даними (2–3 бали за: Hau M. et al., 1999). Таким чином, УЗД може визначати рівень активності захворювання на РА в ранній стадії його розвитку.
Таблиця 8.17
УЗД СО хворих на РА (Hau M. et al., 1999) залежно від лабораторних показників активності захворювання
|
Оцінка СО в обстежених хворих |
ШОЕ, мм/год |
СРБ, мг/л |
||||
| ≤15 | 16–30 | >31 | <10,0 | 10,0–20,0 | >20,0 | |
|
Усі хворі на РА (n=84) 1-ша група (n=44) 0 балів 1 бал 2 бали 3 бали 2 група (n=40) 0 балів 1 бал 2 бали 3 бали |
6 0 0 0
8 0 0 0 |
13 4 1 1
18 3 1 0 |
5 5 4 5
6 2 2 0 |
13 2 3 1
18 2 2 0 |
9 6 2 4
11 3 1 0 |
0 1 1 2
0 0 2 1 |
|
Хворі на ранній РА: 1-ша підгрупа (n=14) 0 балів 1 бал 2 бали 3 бали 2-га підгрупа (n=16) 0 балів 1 бал 2 бали 3 бали |
0 0 0 0
2 0 0 0 |
6 1 0 0
10 0 0 0 |
3 2 0 2
3 0 1 0 |
3 0 0 0
7 0 0 0 |
4 3 0 2
8 0 1 0 |
0 0 1 1
0 0 0 0 |
УЗ-ознаками ураження ПС у хворих на РА є субакроміально-субдельтовидний бурсит, тендиніт m. biceps та m. supraspinatus, ентезопатії сухожиль м’язів, що становлять «ротаторну манжету» ПС, а також зміни СО (потовщення, наявність кровотоку) та субхондральної кістки (нечіткість контурів, ерозивні зміни).
УЗД дозволяє виявити патологію ПС та ураження періартикулярних м’яких тканин у ранній стадії розвитку РА, що надає УЗД переваги перед традиційною рентгенографією і має велике значення для діагностики раннього РА за відсутності ерозивних уражень суглобів.
УЗД, поряд із лабораторними параметрами (ШОЕ, СРБ тощо), може визначати рівень активності захворювання на РА з ураженням ПС в ранній стадії розвитку захворювання.
Проведення УЗД має проводитися також у положенні пацієнта лежачи, для більш точної верифікації наявності запального ураження ПС, особливо за наявності субакроміально-субдельтовидного бурситу.
Ліктьові суглоби
Таблиця 8.18
Стандартні проекції та позиціонування датчика при УЗД ліктьових суглобів (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
|
Ліктьові суглоби, прилеглі м’якотканинні структури |
|
|
Стандартні сканування |
|
|
1. Переднє плечопроменеве поздовжнє |
Суглобові поверхні плечової та променевої кісток, СХ, періартикулярні м’які тканини (в тому числі м’язові структури), суглобова порожнина. Патологія, що виявляється: випіт у порожнині ліктьових суглобів із розширенням СЩ, проліферація СО, патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни) |
|
2. Переднє плечоліктьове поздовжнє сканування |
Суглобові поверхні плечової та ліктьової кісток, processus coronoideus, СХ, періартикулярні м’які тканини (в тому числі м’язові структури), суглобова порожнина. Патологія, що виявляється: випіт у порожнині ліктьових суглобів із розширенням СЩ, проліферація СО, патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни) та proc. coronoideus |
|
3. Переднє поперечне сканування |
Дистальний епіфіз плечової кістки, гіаліновий СХ, періартикулярні м’які тканини (в тому числі м’язові структури). Патологія, що виявляється: випіт у порожнині ліктьових суглобів із розширенням СЩ, проліферація СО, патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни) |
|
4. Заднє поздовжнє сканування |
Оlecranon, fossa olecrani, частково — поверхня os humeri, m. triceps та місце його прикріплення до кістки. Патологія, що виявляється: випіт у порожнині ліктьових суглобів з розширенням СЩ, проліферація СО, патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни), ентезопатія m.triceps |
|
5. Заднє поперечне сканування |
Див. 4 |
|
6. Латеральне поздовжнє сканування |
Частково — поверхня плечової та променевої кісток, сухожилля м’язів-розгиначів та місце прикріплення останніх до кісткової поверхні. Патологія, що виявляється: патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни), ентезопатії, тендосиновіт та порушення цілісності сухожиль |
Променезап’ясткові суглоби та дрібні суглоби кистей

Оцінка дрібних суглобів кистей та променезап’ясткових суглобів. УЗД (табл. 8.19) виконується при стандартних — поздовжньому і поперечному — позиціонуваннях датчика з дорзального боку кистей, причому суглоби знаходилися в положенні 20◦ долонного згинання для оцінки СЩ і стану СХ (рис. 8.36–8.39).
Таблиця 8.19
Стандартні проекції та позиціонування датчика при УЗД дрібних суглобів кистей (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення:
|
Структури, що візуалізуються |
| Суглобові та періартикулярні структури плеснофалангового суглоба, проксимальних і дистальних міжфалангових суглобів, поверхневі та глибокі сухожилля mm. flexor./extensores та їх оболонки з типовою «фібрилярною» ехо-структурою; прилеглі м’якотканинні структури, судини сканованої ділянки (в тому числі mm. thenar, aa. digitales palmares propriae). | |
|
Стандартні сканування |
|
|
1. Дорзальне поздовжнє сканування: а) плеснофаланговий суглоб б) проксимальні міжфалангові суглоби в) дистальні міжфалангові суглоби |
Патологія, що виявляється: РА: ерозивні зміни суглобових кісткових поверхонь (у тому числі — у вигляді «втрати білої кортикальної лінії при УЗ-скануванні), гіпо-/анехогенне розширення УЗ-СЩ (з наявністю ехо «+» включень, часто — рухомих при проведенні функціональних проб); проліферація СО (при РА часто — у вигляді гроноподібних розростань), патологічні зміни сухожиль м’язів-екстензорів/флексорів — розширення сухожильної оболонки, порушення типової структури сухожиль при поздовжньому та поперечному скануванні, наявність УЗ-«розриву» в типовій структурі сухожиль, гіпо-/анехогенна ділянка в проекції сканованого сухожилля); ентезопатія сухожиль, що скануються; відкладення тофусів при мікрокристалічних артропатіях (перш за все подагрі) у вигляді множинних ехо «+» включень, при тривалому перебігу захворювання або вираженому запальному процесі — гомогенно гіпо-/анехогенних зон); зміни періартикулярних м’яких тканин (потовщення, зміни ехогенності, кальцифікати м’яких тканин у вигляді дифузних/лінійчатих/точкових гіперехогенних включень у м’яких тканинах, в першу чергу — проекціях сухожиль, місцях прикріплення останніх до кісткової поверхні); синовіальні кісти, пухлини |
|
2. Дорзальне поперечне сканування: а) плеснофаланговий суглоб б) проксимальні міжфалангові суглоби |
|
|
3. Долонне (пальмарне) поздовжнє сканування: а) плеснофаланговий суглоб б) проксимальні міжфалангові суглоби в) дистальні міжфалангові суглоби г) дистальні фаланги пальців |
|
|
4. Долонне (пальмарне) поперечне сканування: а) плеснофаланговий суглоб б) проксимальні міжфалангові суглоби |
|
|
5. Поздовжнє сканування thenar |
|
|
6. Поперечне сканування thenar |
|
|
7. Латеральне поздовжнє сканування: а) плеснофаланговий суглоб |
|

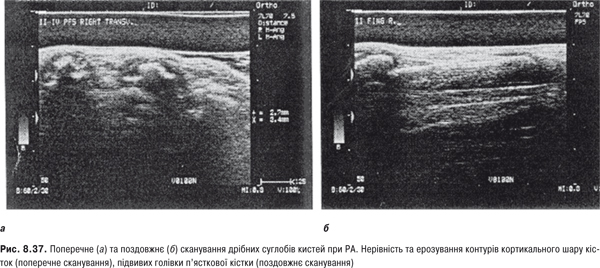
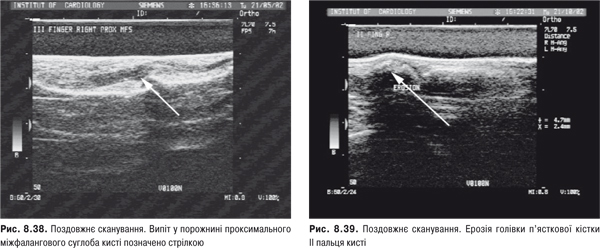
Скронево-нижньощелепний суглоб
Скронево-нижньощелепний суглоб характеризується фіброзно-волокнистим хрящем, що покриває його суглобові поверхні, на відміну від інших синовіальних суглобів, вкритих гіаліновим СХ. Діагностична значимість: часто уражається при аутоімунних та імунозапальних захворюваннях ОРА, в тому числі РА. УЗ-діагностика, в тому числі диференційна, утруднена. Вдається виявити випіт у скронево-нижньощелепний суглоб, та частково — диференціювати гостре та хронічне запалення в суглобі.
Стернально-манубріальне зчленування
Стернально-манубріальне зчленування утворене тілом (corpus sterni) та рукояткою (manubrium sterni) груднини. Діагностична значимість: звуження при АС (рис. 8.40).

Оцінка даних магнітно-резонансного томографічного дослідження суглобів та хребта
МРТ за останні роки стала одним із провідних методів неінвазивної діагностики ревматичних захворювань суглобів. З 1970-х років, коли принципи магнітного резонансу (МР) уперше стали використовуватися для дослідження людського тіла, до сьогодні цей метод медичної візуалізації невпізнанно змінився й продовжує швидко розвиватися. Удосконалюються технічне оснащення, програмне забезпечення, розвиваються методики одержання зображень, розробляються МР-контрастні препарати. Це дозволяє постійно знаходити нові сфери застосування МРТ. Якщо спочатку її застосування обмежувалося лише дослідженнями ЦНС, то зараз МРТ з успіхом застосовується практично у всіх галузях медицини, в тому числі для дослідження ОРА (рис. 8.41).
Процес переходу електронів ядра зі збудженого стану в рівноважне називається спин-решітковим релаксаційним процесом, або поздовжньою релаксацією. Він характеризується Т1 — спін-решітковим часом релаксації, необхідним для переходу 63% ядер у стан рівноваги після їх порушення 90° імпульсом. Виділяють також Т2 — спін-спіновий час релаксації.
Існує ряд способів одержання МР-томограм, які відрізняються порядком і характером генерації радіочастотних імпульсів, методами аналізу МР-сигналів. Найбільше поширення мають два способи: спін-решітковий та спін-еховий. При спін-решітковому аналізують головним чином час релаксації T1. Різні тканини (сіра й біла речовина головного мозку, спинномозкова рідина, пухлинна тканина, хрящ, м’язи тощо) мають у своєму складі протони з різним часом релаксації T1. Із тривалістю T1 пов’язана інтенсивність МР-сигнала: чим коротший T1, тим інтенсивніший МР-сигнал і тим світліше виглядає це місце зображення на телемоніторі. Жирова тканина на МР-томограмах — біла, слідом за нею за інтенсивністю МР-сигналу в порядку зменшення йдуть головний і спинний мозок, щільні внутрішні органи, судинні стінки та м’язи. Повітря, кістки й кальцифікати практично не дають МР-сигналу, тому відображаються чорним кольором. Зазначені взаємини часу релаксації T1 створюють передумови для візуалізації нормальних і змінених тканин на МР-томограмах.
При іншому способі МР-томографії, який має назву спін-ехового, на пацієнта направляють серію радіочастотних імпульсів, що повертають прецесуючі протони на 90°. Слідом за припиненням подачі імпульсів реєструють відповідні МР-сигнали. Однак інтенсивність відповідного сигналу по-іншому пов’язана із тривалістю Т2: чим коротший Т2, тим слабкіший сигнал й, отже, нижче яскравість світіння екрану телемонітора. Таким чином, підсумкова картина МРТ за способом Т2 протилежна МРТ за T1 (як негатив позитиву, за винятком сигналу від жирової тканини, який є високоінтенсивним як за Т1, так і за Т2).
МРТ-обстеження зазвичай проводят у трьох взаємноперпендикулярних анатомічних площинах: корональній (фронтальній), аксіальній (трансверзальній або горизонтальній), сагітальній. В окремих випадках потрібні додаткові косокорональні або косоаксіальні проекції. Раніше при МРТ застосовувалися стандартні спін-ехо (Spin Echo — SE) Т1- та Т2-зважені послідовності, які потребували досить тривіалого часу на сканування. Тому зараз перевагу віддають швидким коротким імпульсним послідовностям, таким як турбо спін-ехо (Turbo Spin Echo — TSE) або фаст спін-ехо (Fast Spin Echo — FSE) та удосконаленим Т1- та Т2-градієнт-ехо (Gradient Echo — GE), завдяки яким час сканування значно зменшився. Залежно від часу релаксації отримані зображення прийнято називати відповідно Т1-або Т2-зважені зображення (Т1-ЗЗ або Т2-ЗЗ).
На МР-томограмах краще, ніж на комп’ютерних томограмах, відображаються м’які тканини: м’язи, жирові прошарки, хрящі, судини. На деяких апаратах можна одержати зображення судин, не вводячи в них контрастний засіб (МР-ангіографія). Внаслідок невеликого вмісту води в Ктк остання не створює ефекту, що екранує, як при рентгенівській КТ, тобто не заважає зображенню, наприклад спинного мозку, міжхребцевих дисків тощо. Звичайно, ядра водню втримуються не тільки у воді, але в Ктк вони фіксовані в дуже великих молекулах і щільних структурах і не є перешкодою для МР-томографії.
Переваги й недоліки методу
Основні переваги МРТ: неінвазивність, нешкідливість (відсутність променевого навантаження), тривимірний характер одержання зображень, природний контраст від крові, що рухається, відсутність артефактів від Ктк, висока диференціація м’яких тканин, можливість виконання МР-спектроскопії для прижиттєвого вивчення метаболізму тканин in vivo. МРТ дозволяє одержувати зображення тонких шарів тіла людини в будь-якому перетині — у фронтальній, сагітальній, аксіальній і косій площинах. Можна реконструювати об’ємні зображення органів, синхронізувати одержані томограми із зубцями ЕКГ.
До основних недоліків зазвичай відносять досить тривалий час, необхідний для отримання зображень (зазвичай хвилини), що приводить до появи артефактів від дихальних рухів (що особливо знижує ефективність дослідження легень), аритмії (при дослідженні серця), неможливість надійного виявлення каменів, кальцифікатів, деяких видів патології кісткових структур, досить висока вартість устаткування і його експлуатації, спеціальні вимоги до приміщень, у яких перебувають прилади (екранування від перешкод), неможливість обстеження хворих із клаустрофобією, штучними водіями ритму, великими металевими імплантатами з немедичних металів.
Протипоказання до проведення МРТ (табл. 8.20).
Таблиця 8.20
Відносні й абсолютні протипоказання до проведення МРТ
|
Протипоказання |
|
|
абсолютні |
відносні |
|
Кардіостимулятори |
Інші стимулятори (інсулінові насоси, нервові стимулятори) |
|
Феромагнітні або електронні імплантати середнього вуха |
Неферомагнітні імплантати внутрішнього вуха, протези клапанів серця (у високих полях, при підозрі на дисфункцію) |
|
Кровоспинні кліпси |
Кровоспинні кліпси іншої локалізації, декомпенсована серцева недостатність, період вагітності, клаустрофобія, необхідність фізіологічного моніторингу |
До абсолютних протипоказань відносять стани пацієнтів, при яких проведення дослідження створює загрозливу для їхнього життя ситуацію. Наприклад, наявність імплантатів, які активуються електронним, магнітним або механічним шляхами, — це в першу чергу штучні водії ритму. Вплив радіочастотного випромінювання МР-томографа може порушити функціонування стимулятора, що працює в системі запиту, тому що зміни магнітних полів можуть імітувати серцеву діяльність. Магнітне тяжіння може викликати також зсув стимулятора в гнізді й зрушити електроди. Крім того, магнітне поле створює перешкоди для роботи феромагнітних або електронних імплантатів середнього вуха. Наявність штучних клапанів серця становить небезпеку і є абсолютним протипоказанням лише при дослідженні на МР-томографах з високими полями, а також якщо клінічно запідозрено ушкодження клапана. До абсолютних протипоказань до дослідження належить також наявність невеликих металевих хірургічних імплантатів (гемостатичні кліпси) у ЦНС, оскільки зсув їх внаслідок магнітного притягання загрожує кровотечею. Крім потенційної небезпеки, наявність металевих імплантатів із магнітними властивостями викликає артефакти, що ускладнюють інтерпретацію результатів дослідження.
Відносними протипоказаннями, крім вищезазначених, є також декомпенсована серцева недостатність, необхідність фізіологічного моніторингу (механічна вентиляція легень, електричні інфузійні насоси). Клаустрофобія є перешкодою для проведення дослідження в 1–4% випадків. Перебороти його можна, з одного боку, використанням приладів з відкритими магнітами, з іншого боку — докладним поясненням пристрою апаратури та процедури обстеження. Якщо МРТ є життєво необхідним для пацієнта з клаустрофобією або у дітей дошкільного віку, обстеження проводиться під загальною анестезією. Що стосується обстеження вагітних, свідчень негативної дії МРТ на ембріон або плід не отримано, однак рекомендується уникати МРТ у перші 3 міс вагітності. Застосування МРТ у період вагітності показано у випадках, коли інші неіонізуючі методи візуалізації не дають задовільної інформації. МРТ-дослідження потребує більшої участі в ньому хворого, ніж КТ, тому що рухи хворого під час дослідження сильніше впливають на якість зображень, тому дослідження хворих із гострою патологією, порушенням свідомості, спастичними станами, деменцією та дітей нерідко є важким.
Різниця сигналів від різних тканин, тобто контрастність MР-зображення може бути істотно поліпшена МР-контрастними агентами (МР-КА). Суть їх застосування полягає у зміні магнітних параметрів протонів тканин/органів, тобто зміні часу релаксації Т1- і Т2-протонів.
На сьогодні існує кілька класифікацій МР-КА. За переважним впливом на час релаксації МР-КА ділять на Т1-КА (укорочують Т1, збільшують інтенсивність МР-сигналу тканин — позитивні) і Т2-КА (укорочують Т2, зменшують інтенсивність МР-сигналу — негативні). Залежно від магнітних властивостей МР-КА розділяють на парамагнітні та суперпарамагнітні.
Парамагнітні КА. Парамагнітні властивості мають атоми з одним або декількома неспареними електронами — магнітні іони гадолінію (Gd), хрому, нікелю, заліза, марганця. Найбільш широке клінічне застосування одержали з’єднання гадолінію. Парамагнетики зараз найбільш широко застосовують у ревматологічній практиці.
Суперпарамагнітні контрастні засоби. Суперпарамагнітний оксид заліза, феромагнітні КА, до складу яких входять феромагнітні оксиди заліза, структурно подібні з ферритом магнетиту (Fe2 + OFe23 + O3).
Ще одна класифікація заснована на фармакокінетиці КА (Сергєєв П.В. та ін., 1995): позаклітинні (тканинонеспецифічні); шлунково-кишкові; органотропні (тканиноспецифічні); макромолекулярні (використовують для визначення отвору судин).
В Україні відомі такі МР-КА — позаклітинні водорозчинні парамагнітні КА (табл. 8.21). Позаклітинні КА вводять в/в, на 98% виділяються нирками, не проникають через гематоенцефалічний бар’єр, мають низьку токсичність, відносяться до групи парамагнетиків.
Таблиця 8.21
Позаклітинні водорозчинні МР-КА
|
Міжнародна |
Хімічна формула |
Структура |
|
Гадопентетова кислота |
(NMG)2Gd-DTPA |
Лінійна, іонна |
|
Гадотерова кислота |
(NMG)Gd-DOTA |
Циклічна, іонна |
|
Гадодіамід |
Gd-DTPA-BMA |
Лінійна, неіонна |
|
Гадотерідол |
Gd-HP-DO3A |
Циклічна, неіонна |
Слід зауважити, що при використанні МР-КА час Т2-релаксації при низьких концентраціях скорочується в десятки разів слабше, ніж Т1. Т2-ефект полягає в зниженні МР-сигналу (негативне контрастування), він стає особливо помітним при болюсному введенні КА, та візуалізувати це зниження можна лише за допомогою надшвидких ехопланарних імпульсних послідовностей. Саме з цих причин в практиці використовують переважно позитивне контрастування.
Позитивні МР-КА, а саме хелати гадолінію, які переважно використовуються сьогодні в практиці, не впливають на час релаксації Т2, тільки вкорочують час релаксації Т1. Після введення контрасту виконуються виключно Т1-ЗЗ, при чому при обстеженні суглобів та м’язів виконують Т1 fs — fat saturation — пригнічення жиру, щоб зони накопичення контрасту відрізнити від жиру, який на Т1-ЗЗ також дає гіперінтенсивний сигнал.
Саме через однаково високоінтенсивний сигнал від жиру як на Т1-ЗЗ, так і на Т2-ЗЗ виникла необхідність отримання зображень з пригніченням сигналу від жиру. Це стало можливим завдяки використанню інверсії-відновлення (Inversion Recovery). До таких послідовностей відноситься STIR (Short T1 Inversion Recovery) — коротка Т1 інверсія-відновлення, послідовність Т1, що за фізичними параметрами сканування дозволяє отримувати зображення з пригніченням сигналу від жиру та зробити ділянки рідинної інфільтрації більш чіткими та видимими. Аналогічними послідовностями, які пригнічують сигнал від жирової тканини, є TIRM, T2 FS, PD FS.
МРТ СХ. МР-картина СХ відбиває сукупність його гістологічної будови й біохімічного складу. СХ є гіаліновим, не має власного кровопостачання, лімфатичного дренажу й інервації. СХ складається з води й іонів, волокон колагену ІІ типу, хондроцитів, агрегованих протеогліканів й інших глікопротеїнів.
На сьогодні МРТ та УЗД — основні способи візуалізації гіалінового СХ. МРТ здійснюється в основному з використанням градієнт-ехо послідовностей. МРТ відбиває вміст води в СХ. Вміст і розподіл гідрофільних молекул протеогліканів та анізотропна організація колагенових фібрил впливає не тільки на сумарну кількість води (протонну щільність, у СХ), але й на стан релаксаційних властивостей, тобто Т2, цієї води, даючи хрящу характерні «зональні» або «розшаровуючі» зображення на МРТ, які відповідають гістологічним шарам СХ.
На дуже коротких Т-зображеннях (<5мс) більш високе розрізнення зображень СХ в типовому випадку має двошаровий вигляд: глибокий шар — розташований ближче до кістки — має низький сигнал, оскільки присутність кальцію значно скорочує ТR (Time Relaхation — час релаксації) і не дає зображення; поверхневий шар — дає середньоінтенсивний/високоінтенсивний МР-сигнал.
На проміжних Т-зображеннях (5–40 мс) СХ має тришаровий вигляд: поверхневий шар з низьким сигналом; перехідний шар і глибокий шар, що має низький МР-сигнал. При Т2-зважуванні сигнал не включає проміжний шар; інтенсивність зображення СХ є гомогенно низькою.
На сьогодні вважається, що для оцінки стану СХ в рутинній практиці краще використовувати послідовності в режимі PD FS (Proton Dencity Fat Saturatiоn — протонна щільність з жиропригніченням), які дозволяють оцінити та визначити рідинне насичення хряща, є найбільш чутливими в диференціації гіперінтенсивної СР від середньоінтенсиного СХ. Звичайні Т2-ЗЗ можуть давати хибнопозитивні результати, що зумовлено недостатньою контрастністю між СХ та кортикальним шаром кістки (David W. Stoller. Magnetic Resonance Imaging in Orthopaedics and Sports Medicine, 3rd Edition, 2007).
МРТ кістки й кісткового мозку. Корковий шар і трабекули кістки містять мало протонів Н+ й багато кальцію, що сильно скорочує TR (Time Relaхation — час релаксації) і тому не дає певного МР-сигналу. На МР-томограмах вони мають зображення кривих ліній з відсутністю сигналу (темних смуг), окреслюють середньоінтенсивні та високоінтенсивні тканини (кістковий мозок, жирову тканину тощо). МРТ завдяки багатоплощинним томографічним можливостям є більш чутливою, ніж рентгенографія або КТ, для візуалізації більшості змін цих структур. Остеофіти, особливо центральні, які характерні для ОА, досить чітко візуалізуються при МРТ, більшою мірою на Т1-ЗЗ, як і при звичайній рентгенографії. Кістковий склероз також добре виявляється при МРТ і має низьку інтенсивність сигналу у всіх імпульсних послідовностях, що зумовлено кальцифікацією та фіброзом. При МРТ також можна виявити запалення ентезисів і періостит. Цей метод може використовуватися також для вивчення трабекулярної мікроархітектоніки кісток, що актуально для моніторингу трабекулярних змін субхондральної кістки при розвитку й прогресуванні ревматичних захворювань суглобів, у тому числі РА, ОА, АС тощо.
МРТ є унікальною можливістю для одержання зображення кісткового мозку й зазвичай дуже чутлива, хоча не дуже специфічна технологія для виявлення остеонекрозу, остеомієліту, первинної інфільтрації та травм, особливо кісткової контузії й переломів без зміщення. Ознаки цих захворювань на рентгенограмах не виявляються доти, поки кортикальний й/або трабекулярний відділи кістки не будуть уражені. У кожному із зазначених випадків збільшується вміст вільної води, що має вигляд сигналу низької інтенсивності на Т1-ЗЗ, й сигналу високої інтенсивності на Т2-ЗЗ. Та на Т2 FSE (Fast Spin Echo — швидкий спін-ехо — це послідовність, заснована на ехо-ланцюгах проміжної довжини, що дозволяє значно зменшити час сканування, в машинах виробництва «SIEMENS» іменується TSE-Turbo Spin Echo) зображення жиру й води мають сигнал високої інтенсивності й потребують пригнічення жиру для одержання контрасту між цими складовими. Послідовності градієнт-ехо, принаймні з великою силою поля, в основному нечутливі до патології кісткового мозку, тому що магнітні ефекти пригнічуються кісткою. Ділянки набряку субхондрального кісткового мозку часто видні в суглобах хворих із прогресуючим АС, ОА. Зазвичай ці ділянки локального набряку кісткового мозку розвиваються в місцях запального процесу (наприклад крижово-клубові зчленування при АС), або втрати СХ/хондромаляції при ОА. Іноді епіфізарний набряк кісткового мозку видний на деякій відстані від суглобової поверхні або ентезису. Залишається невідомим, яка величина й поширеність цих кістково-мозкових змін сприяє виникненню локальної болісності й слабкості суглоба, а також, коли вони є предикторами прогресування ревматичних захворювань суглобів.
МРТ СО й СР
Нормальна СО в основному занадто тонка для візуалізації при звичайних послідовностях МРТ, її складно відрізнити від поруч розташованої СР або СХ. У нормі в суглобах утримується невелика кількість СР, що у різних суглобах варіює. У гомілковостопному суглобі наприклад, може втримуватися відносно велика кількість СР в нормі. Досі невідомо, яку ж кількість СР варто розцінювати як патологічну. За допомогою 3-D-реконструкції при МРТ можливий підрахунок кількості вільної СР у суглобах. Для моніторингу відповіді на лікування в пацієнтів із ревматичними захворюваннями суглобів або вивчення нормального фізіологічного функціонування СР в суглобі in vivo ця методика може бути дуже корисною. МР-сигнал негеморагічної СР має низьку інтенсивність на Т1-ЗЗ і високу на Т2-ЗЗ завдяки наявності вільної води. Геморагічна СР може містити метгемоглобін, що має короткий Т1 і дає високоінтенсивний сигнал на Т1-ЗЗ, і/або дезоксигемоглобін, що має вигляд низькоінтенсивного сигналу на Т2-ЗЗ. При хронічному рецидивуючому гемартрозі в СО відкладається гемосидерин, що дає низькоінтенсивний сигнал на Т1- і Т2-ЗЗ. Геморагії часто розвиваються в підколінних кістах (містяться переважно в м’яких тканинах задньої поверхні гомілки). Витікання СР з ушкодженої кісти Бейкера може нагадувати форму пера при посиленні КА, що містить гадоліній. При в/в введенні КА він розташовується уздовж поверхні фасції між м’язами дозаду від суглобової капсули КС.
Збуджена, набрякла СО зазвичай має повільне Т2, відображаючи високий вміст інтерстиціальної рідини (МР-сигнал високої інтенсивності на Т2-ЗЗ). На Т1-ЗЗ стовщення СО має низько- або середньоінтенсивний МР-сигнал. Однак стовщену СО складно відрізнити від прилеглих м’яких тканин, наприклад СО, чи СХ. Відкладення гемосидерину, або хронічний фіброз, можуть знижувати інтенсивність сигналу гіперплазованої СО на Т2-ЗЗ, а іноді навіть на Т1-ЗЗ, які зважені за щільністю протонів; у всіх градієнт-ехо послідовностях (рис. 8.42–8.53).
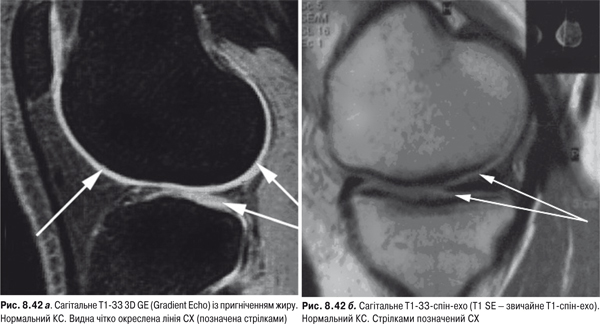




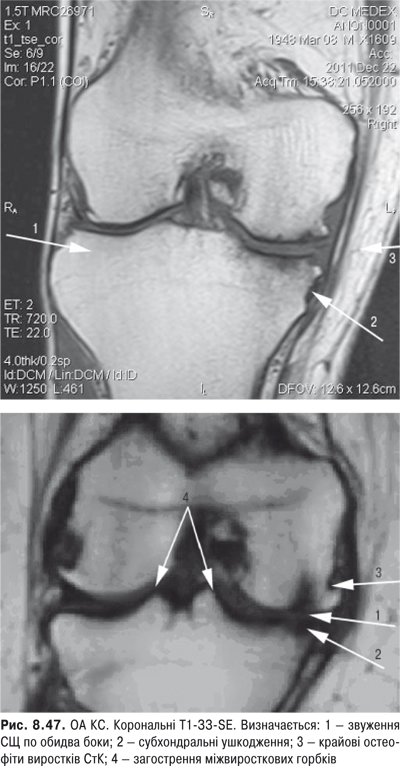
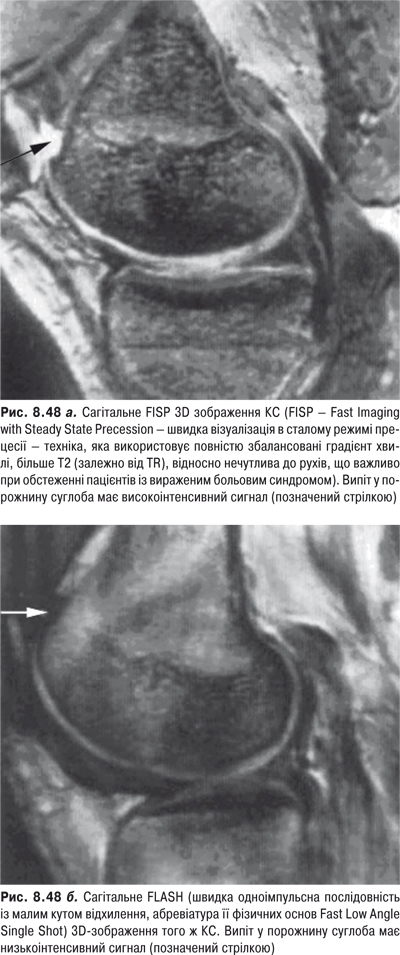
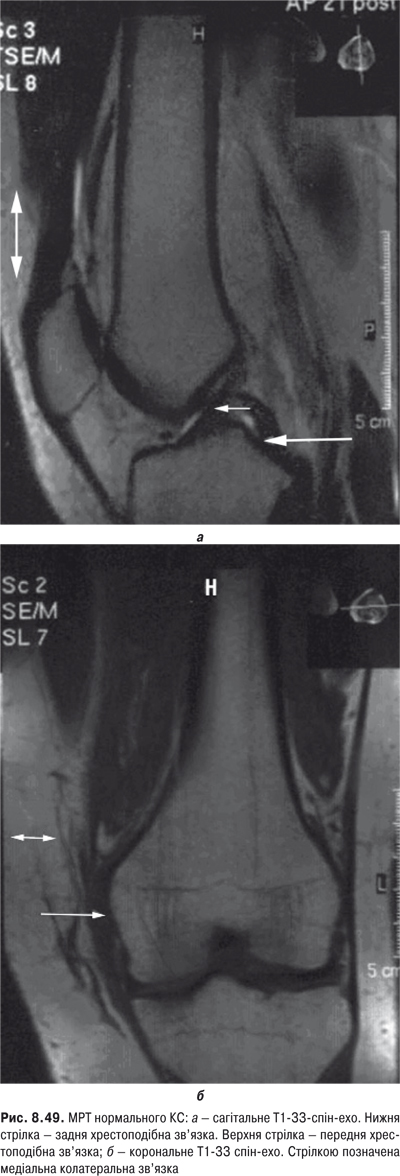
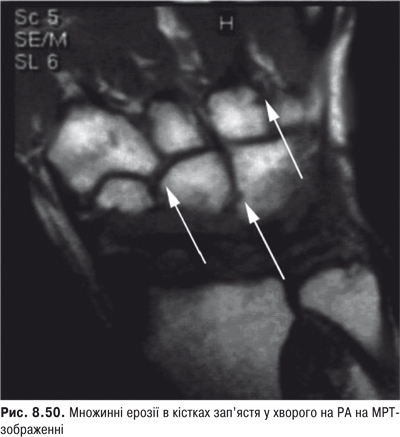

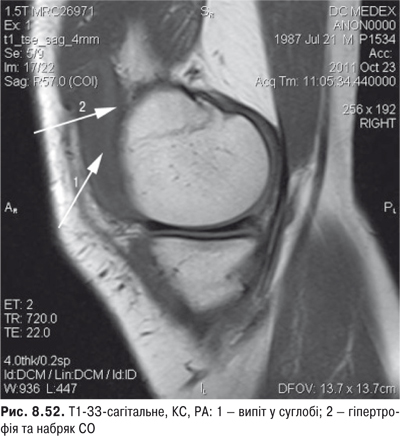
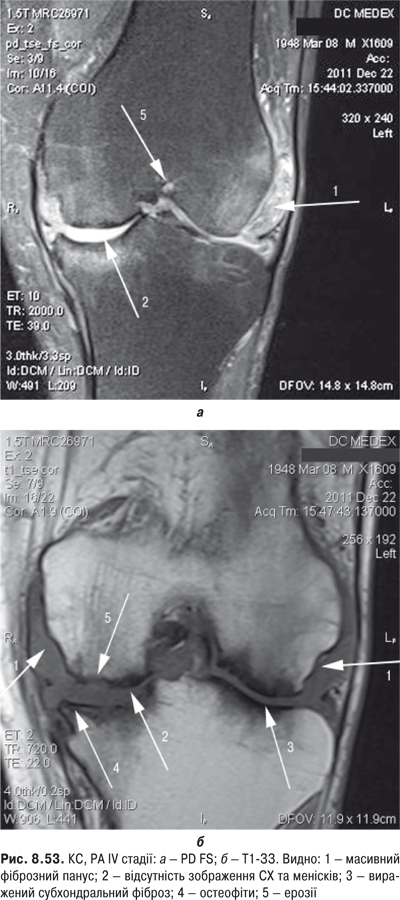
При в/в введенні КА швидко розподіляється по гіпервaскуляризованим тканинам (наприклад СО). Хелатний комплекс гадолінію має відносно малі молекули, що швидко дифундують усередину навіть через нормальні капіляри і (як недолік) з часом у СР. Після болюсного в/в введення КА (через 30–40 хв пасивного очікування або через 15–20 хв після активних рухів) СО може візуалізуватися окремо від інших структур. Контрастне відображення СО та жирової тканини може бути збільшене методикою пригнічення жиру. Швидкість, з якою відбувається контрастне посилення СО, залежить від багатьох факторів: швидкості струму крові в СО, обсягу гіперплазованої синовіальної тканини і свідчить про активність процесу при ревматичних захворюваннях суглобів. Крім того, визначення кількості й розподілу збудженої СО та СР в суглобах при ревматичних захворюваннях суглобів дає можливість встановлення ступеня вираженості синовіту шляхом моніторингу швидкості синовіального посилення з Gd-утримуючим КА в період спостереження хворого. Висока швидкість синовіального посилення й швидке досягнення піка посилення при болюсному введенні КА свідчить про активне запалення чи гіперплазію, в той час як повільне посилення відповідає хронічному фіброзу СО. Хоча складно контролювати тонкі відмінності у фармакокінетиці Gd-утримуючого КА при МР-дослідженнях у різні періоди хвороби в одного й того ж хворого, швидкість і пік синовіального посилення можуть служити критеріями для призначення чи скасування відповідної протизапальної терапії, в тому числі з використанням базисних чинників. Високі показники цих параметрів є ознаками гістологічно активного синовіту.
МРТ інших компонентів суглоба
Допоміжний апарат суглоба, тобто зв’язки, меніски, сухожилля, суглобова губа, є важливим для підтримки статичної та динамічної стабільності, розподілу механічного навантаження й функціональної цілісності суглобів. Втрата цих функцій підвищує біомеханічне зношування і є причиною ушкодження суглоба. Неушкоджені зв’язки мають вигляд темних смуг, переривання їх є прямою ознакою розриву зв’язувань. Однак необхідно враховувати, що імітація розриву зв’язкового апарату можлива при одержанні косої площини зрізу через інтактне зв’язування, тому для зображення деяких зв’язувань може бути необхідний вибір спеціальної площини. Наприклад, переднє хрестоподібне зв’язування КС найкраще видно на косих сагітальних зображеннях коліна в нейтральній позиції чи прямих сагітальних зображеннях із невеликим відведенням гомілки.
Меніски складаються з фіброзного хряща й містять велику кількість колагенових волокон, просторово розташованих так, щоб протистояти силі натягу при впливі вагових навантажень. Волокна орієнтовані переважно циркулярно, особливо в периферичній частині меніска, що пояснює схильність до розривів, які розташовані поздовжньо, тому лінійні тріщини між волокнами колагену утворюються частіше, ніж поперек волокон. Коли відбувається локальна втрата колагену, наприклад при міксоїдній або еозинофільній дегенерації, що зазвичай теж супроводжується локальним збільшенням вмісту води, знижується ефект укорочення Т2, а сигнал від води не маскується й проявляється у вигляді округлої чи лінійної ділянки з середньоінтенсивним сигналом усередині меніска на коротких Т-зображеннях (Т1-зважених за протонною щільністю спін-ехо або градієнт-ехо) і має схильність поступово зникати при довгому Т1. Ці патологічні сигнали не є розривами, на відміну від порушення цілісності меніска, розрив меніска може бути пов’язаний із грубою деформацією поверхні меніска. Іноді велика кількість суглобової рідини окреслює контур розриву меніска, причому він візуалізується на Т2-ЗЗ. Короткі Т-зображення є, таким чином, високочутливими (>90%), але часто неспецифічними для розривів меніска, тоді як довгі Т-зображення є нечутливими, хоча високоспецифічними, коли вони візуалізуються.
МРТ є чутливим методом щодо всього спектра патології сухожиль і виявляє тендиніт і розриви сухожиль у більшості випадків з більшою точністю, ніж клінічне обстеження або УЗД (особливо це стосується глибоко розміщених зв’язок та сухожиль, недоступних для УЗД). Нормальні сухожилля мають рівні краї та гомогенний сигнал низької інтенсивності при Т2-ЗЗ та низької або середньої інтенсивності — на Т1-ЗЗ. Розрив сухожилля може бути частковим або повним, зображується різними ступенями переривання сухожилля (високоінтенсивним сигналом усередині сухожилля на Т2-ЗЗ). При тендосиновіті рідина може бути видна під сухожильною оболонкою, але саме сухожилля має нормальний вигляд. Тендиніт зазвичай є результатом розширення й нерівності сухожилля, але більш надійний симптом — підвищення інтенсивності сигналу всередині сухожилля на Т2-ЗЗ. Розрив сухожилля при ревматичних захворюваннях суглобів може бути результатом механічного зношування, що виникає внаслідок тертя об зазубрені остеофіти й гострі краї ерозій або первинного запалення в самому сухожиллі. Відрив сухожилля від місця прикріплення може бути гострим чи виникати внаслідок постійної мікротравматизації/запалення. Частіше розриваються сухожилля екстензорів зап’ястя чи кисті, ротаторної манжети плеча, сухожилля заднього великогомілкового м’яза в гомілковостопному суглобі. Тендиніт і розрив ротаторної манжети плеча й сухожилля довгої голівки біцепса в більшості випадків проявляється болем і нестабільністю у ПС. Повний розрив ротаторної манжети плеча — результат переднього підвивиху голівки плечової кістки — часто є провідним при ревматичних захворюваннях суглобів.
М’язи містять менше колагену, тому мають сигнал середньої інтенсивності на Т1- і Т2-ЗЗ. Запалення м’язів іноді видно разом із запальним артритом і має сигнал високої інтенсивності на Т2-ЗЗ, тому що в обох випадках з інтерстиціальним набряком підвищується вміст води, а подовження Т2 пов’язане із втратою колагену. І навпаки, фіброз як наслідок запалення має тенденцію до зниження інтенсивності сигналу на Т2-ЗЗ, у той час як мармурова жирова атрофія м’язів має високоінтенсивний сигнал жиру на Т1-ЗЗ та на Т2-ЗЗ.
На ранній стадії РА на МР-томограмах спостерігаються характерні ознаки первинного ураження СО суглоба. Ексудативна фаза гострого синовіту проявляється наявністю випоту в порожнині суглоба, гіпертрофією СО вздовж суглобової капсули та навколо зв’язок. Паралельно можуть визначатися набряк кісткового мозку в субхондральних відділах, набряк періартикулярних м’яких тканин та періартикулярні синовіальні кісти.
На другій (помірній) стадії РА МРТ дозволяє виявити ознаки хронічного проліферативного синовіту та початкові прояви ураження СХ, фіброзних структур і субхондральної кістки. На МР-томограмах виявляється суглобовий випіт, виражена гіпертрофія СО, нерівність контуру та ділянки хондромаляції. При МРТ візуалізуються крайові узури та субхондральні ерозії, ділянки субхондрального набряку та фіброзу кісткового мозку.
При РА ІІІ (тяжкої) стадії на МР-томограмах виявляється комплекс виражених проліферативних змін у порожнині суглоба з формуванням фіброзного пануса (рис. 8.54, 8.55).
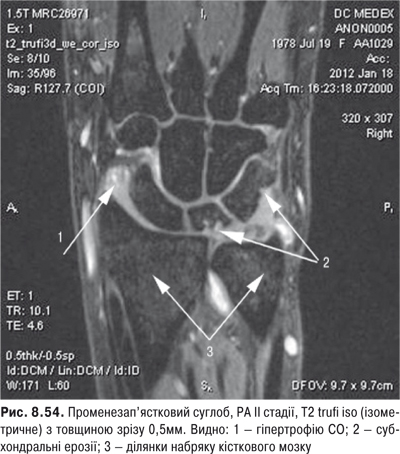
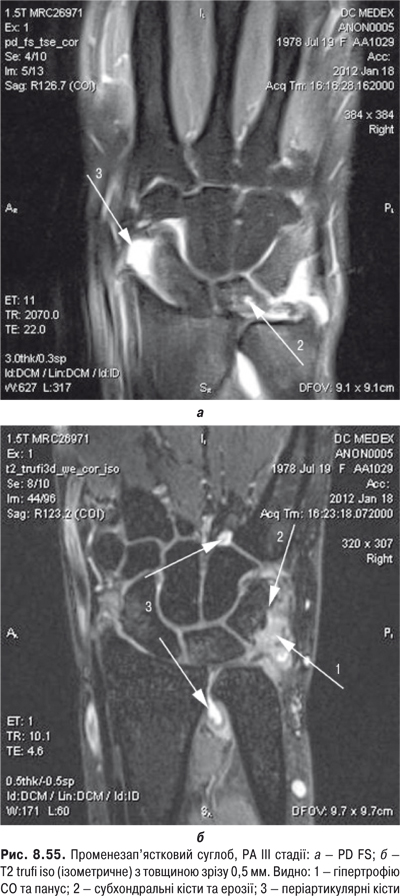
Визначається виражена гіпертрофія та фіброз СО, на фоні яких можна побачити невеликі рідинні скупчення та періартикулярні синовіальні кісти. Також мають місце множинні дефекти СХ, аж до повної відсутності хрящового покриття. Значно виражені ерозії суглобових поверхонь, субхондральний фіброз кісткового мозку, субхондральні та внутрішньоепіфізарні кісти, деформації та підвивихи кісток.
При РА ІV стадії (стадія завершення) визначається масивний фіброзний панус у суглобовій порожнині, відсутність зображення СХ, менісків, хрестоподібних зв’язок КС. Наявні виражений субхондральний фіброз, ерозії та краєві остеофіти, атрофія періартикулярних тканин, груба деформація та порушення співвідношення кісток.
Зразки протоколів та рекомендації групи OMERACT 2002 RAMRIS для оцінки ураження суглобів кистей при РА за допомогою MPT (EULAR, 2005)
Зразки протоколів, які можуть бути застосовані для оцінки плеснофалангових (А) та зап’ясткових (Б) суглобів за допомогою OMERACT 2002 RAMRIS (Outcome Measures in Rheumatology Clinical Trials RA MRI scoring system).
Протокол OMERACT RAMRIS (із застосуванням атласу MPT для PA, EULAR-OMERACT)
(А) П’ястково-фалангові суглоби
Ідентифікаційні дані пацієнта______________
Центр, де проводилося дослідження__________
Прилад, за допомогою якого проведена МРТ___
Оцінені послідовності__________________
______________Лікар
Підрахунок синовіту
|
П’ястково-фалангові суглоби |
||||
| 2 | 3 | 4 | 5 | |
|
Синовіт (0–3) |
||||
Підрахунок кісткових ерозій та набряку кісток
|
П’ястково-фалангові суглоби |
|||||
| 2 | 3 | 4 | 5 | ||
|
Кісткові ерозії, 0–10 |
Проксимальні |
||||
|
Дистальні |
|||||
|
Кістковий набряк, 0–3 |
Проксимальні |
||||
|
Дистальні |
|||||
Кісткові ерозії підраховують від 0 до 10 і 0 відповідно до частки залученої кістки (за приростом на 10%): 0:0%, 1:1–10%, 2:11–20%, …, 10:91–100%.
Кістковий набряк підраховують від 0 до 3 відповідно до частки залученої кістки (за приростом на 33%): 0:0%, 1:1–33%, 2:34–66%, 3:67–100%.
Підрахунок здійснюють від хрящової поверхні (за відсутності її — від місця кращої візуалізації) на глибину 1 см.
(Б) Зап’ясткові суглоби
Ідентифікаційні дані пацієнта_______________
Центр, де проводилося дослідження___________
Прилад, за допомогою якого проведена МРТ___
Оцінені послідовності___________________
______________Лікар
Підрахунок синовіту
|
Дистальний променеліктьовий суглоб |
Променезап’ястковий суглоб |
Міжп’ясткові зап’ястно-п’ясткові суглоби |
|
|
Синовіт (0–3) |
Підрахунок кісткових ерозій та набряку кісток
Кісткові ерозії підраховують від 0 до 10 відповідно до частки залученої кістки (за приростом на 10%): 0: 0%, 1: 1–10%, 2: 11–20%, …, 10:91–100%.
Кістковий набряк підраховують від 0 до 3 відповідно до частки залученої кістки (за приростом на 33%): 0:0%, 1:1–33%, 2:34–66%, 3:67–100%.
Для зап’ясткових кісток підрахунок здійснюють по всій кістці. Для довгих кісток підраховують від хрящової поверхні (а за її відсутності — від місця кращої візуалізації) на глибину 1 см.
|
Основа п’ясткових кісток |
|||||
| 1 | 2 | 3 | 4 | 5 | |
|
Кісткові ерозії, 0–10 |
|||||
|
Кістковий набряк, 0–3 |
|||||
|
Кістка-трапеція |
Трапецієподібна кістка |
Головчаста кістка |
Гачкоподібна |
|
|
Кісткові ерозії, 0–10 |
||||
|
Кістковий набряк, 0–3 |
|
Човноподібна кістка |
Місяцеподібна кістка |
Трикутна кістка |
Горохоподібна кістка |
|
|
Кісткові ерозії, 0–10 |
||||
|
Кістковий набряк, 0–3 |
|
Дистальна частина променевої кістки |
Дистальна частина |
|
|
Кісткові ерозії, 0–10 |
||
|
Кістковий набряк, 0–3 |
Рекомендації групи OMERACT з РА щодо базисних МРТ-послідовностей, визначень можливих патологічних МРТ-змін суглобів при РА та їх підрахунку (OMERACT 2002 RAMRIS)
A. Базисні МРТ-послідовності.
Передбачається, що наступні МРТ-дослідження, метою яких буде оцінка запальних та деструктивних змін при РА, будуть включати принаймні:
- візуалізацію у двох площинах* Т1-зважених зображень до та після в/в введення контрасту гадолінію**;
- Т2-зважену послідовність та послідовності з пригніченням сигналу від жирової тканини (STIR, TIRM, T2 FS, PD FS);
*Можуть бути отримані як послідовність у двох вимірах у двох площинах або як послідовність у трьох вимірах з ізометричними елементами об’ємного зображення в одній площині, що дозволяє реконструкцію в інших площинах.
**Ймовірно, в/в введення гадолінію не обов’язкове, якщо немає необхідності оцінити деструктивні зміни (ерозії), достовірно виявити та оцінити гіпертрофію СО та наявність панусу.
Б. Визначення важливих патологічних МРТ-змін суглобів.
- Синовіт: ділянка СО, товщина якої збільшується* після введення гадолінію — порівняно з нормальною синовією.
- МРТ-кісткова ерозія: кісткове ушкодження з гострими краями, з чіткою юкста-артикулярною локалізацією і типовими характеристиками сигналу**, яке візуалізується у двох площинах з обривом кортикального шару, що видно принаймні в одній площині***.
- МРТ-кістковий набряк: ушкодження**** в трабекулярній кістці з нечітко визначеними краями та характеристиками сигналу, які відповідають підвищеному вмісту води*****.
*Збільшення (посилення) визначають при порівнянні Т1-зважених зображень, отриманих до та після в/в введення гадолінію.
**Т1-зважене зображення — це втрата нормальної низької інтенсивності сигналу від кортикальної кістки і втрата нормальної високої інтенсивності сигналу від трабекулярної кістки.
***Швидке постгадолінове посилення означає наявність активного гіперваскуляризованого панусу в ерозії. Необхідно розглядати також інші фокусні кісткові ушкодження, в тому числі метастази, але зазвичай їх відрізняють за допомогою додаткових зображень та клінічних проявів.
****Можуть бути ізольованими або оточеними ерозіями чи іншими аномаліями кісток.
*****Висока інтенсивність сигналу на Т2-зважених та STIR-зображеннях та низька інтенсивність сигналу на Т1-зважених зображеннях.
B. Підрахункова система (OMERACT 2002 RAMRIS).
- Синовіт оцінюють у трьох локусах зап’ястка (дистальний променеліктьовий суглоб, променезап’ястковий суглоб, міжп’ясткові та зап’ястно-п’ясткові суглоби) та в кожному плеснофаланговому суглобі. Не оцінюють І зап’ястно-п’ястковий та І плеснофаланговий суглоби. Шкала 0–3 бали: 0 — норма; 1–3 — синовіт (слабкий, помірний, виражений) — за ⅓ припущеного максимального об’єму потовщеної СО.
- Кісткові ерозії: оцінюють окремо кожну кістку (зап’ясток — зап’ясткові кістки, дистальний відділ променевої та дистальний відділ ліктьової кістки, основи п’ясткових кісток; плеснофалангові суглоби — головки п’ясткових кісток та основи фаланг). Шкала 0–10 балів, градуйована за часткою ерозованої кістки в «оціненому обсязі кістки» на всіх доступних зображеннях: 0 — ерозій немає; 1 — 1–10% кістки ерозовані; 2 — 11–20% і т.д. Для довгої кістки «оцінений обсяг кістки» — від хрящової поверхні (за відсутності її — від місця кращої візуалізації) на глибину 1 см. Зап’ясткову кістку оцінюють всю.
- Кістковий набряк підраховують для кожної кістки окремо (як для ерозій). Шкала 0–3, градуйована за часткою кістки з набряком, наприклад: 0 — набряку немає; 1 — набряклі 1–33% кістки; 2 — 34–66%; 3 — 67–100%.
Для встановлення діагнозу гострого сакроілеїту згідно з МР-показань, відповідно до рекомендацій Міжнародної асоціації з вивчення анкілозуючого спондиліту (ASAS), вважалося за необхідне виявлення набряку (запалення) кісткового мозку крижово-здухвинних з’єднань, що виявлялося за допомогою імпульсних послідовностей із пригніченням МР-сигналу від жиру (STIR,TIRM, Т2 TSE FS) або остеїту (T1 після контрастування гадолінієм), які локалізувалися в типових анатомічних ділянках: у субхондральному чи періартикулярному кістковому мозку. З метою діагностики сакроілеїту вважалося достатнім виявлення більше 1 сигналу (1 зони змін) на одному зрізі. У разі виявлення на одному зрізі лише 1 сигналу (1 зони змін) для діагностики сакроілеїту необхідне виявлення аналогічного сигналу хоч би ще на одному зрізі. Згідно з рекомендаціями ASAS, наявність набряку м’яких тканин, що свідчить про синовіт, ентезит, капсуліт, а також структурних змін у крижово-здухвинних з’єднаннях (жирова інфільтрація, склероз, ерозії чи кістковий анкілоз), що відображають попереднє запалення, якщо вони не супроводжуються ознаками набряку кісткового мозку (остеїтом), на сьогодні вважають недостатніми для встановлення діагнозу сакроілеїту за даними МРТ (рис. 8.56), однак вони використовуються для всебічної оцінки стану здухвинно-крижових з’єднань.

За даними МРТ ентезит виявляється як гіперінтенсивний МР-сигнал у послідовностях із пригніченням МР-сигналу від жиру в місцях прикріплення сухожиль та зв’язок до кістки, а також включаючи ділянку за суглобом (рис. 8.57).

При капсуліті простежується гіперінтенсивний МР-сигнал в ділянці капсули суглоба, яка спереду переходить на окістя здухвинної кістки, що пояснює розповсюдження капсуліту (рис. 8.58) в ряді випадків медіально та латерально на окістя.
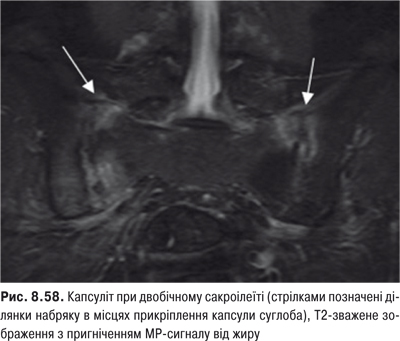
Хронічні зміни у здухвинно-крижових з’єднаннях, що відображають попереднє запалення, відносять до структурних змін. До них належать склероз, ерозія, жирова інфільтрація, кістковий анкілоз. Ці зміни краще виявляються на Т1-зважених зображеннях (Т1WI).
Жирова інфільтрація характеризується на МР-зображеннях (рис. 8.59) сигналом підвищеної інтенсивності на Т1WI та є результатом відкладання жирних кислот у вогнищах запалення, часто в кістковому мозку, розміщеному періартикулярно. Застосування послідовностей із пригніченням МР-сигналу від жиру дає можливість виявити ділянки гострого («активного») запального процесу на фоні хронічних змін.
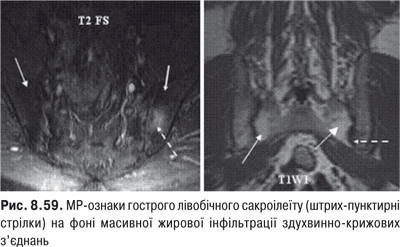
Ерозивні зміни проявляються у вигляді крайових дефектів кістки. Можуть виявлятися впродовж усієї хрящової частини суглоба. У разі злиття ерозій може відзначатися псевдорозширення здухвинно-крижового з’єднання (рис. 8.60).

Кістковий анкілоз є кінцевою стадією запального процесу і добре діагностується за даними рентгенографії та СКТ. На МРТ (рис. 8.61) СЩ не простежується, відзначаються кісткові містки та зрощення суглобів.

Гострі запальні зміни проявляються набряком кісткового мозку, який може локалізуватися:
- у тілах хребців (передній і задній спондиліт);
- у субхондральних відділах кісток в ділянці реберно-хребцевих або поперечно-реберних суглобів (артрит);
- у дужках хребців;
- у поперечних або остистих відростках;
- у міжостистих або інших зв’язках хребта.
Ці зміни найкраще виявляються в режимах із пригніченням МР-сигналу від жиру (STIR,TIRM, Т2 TSE FS) (рис. 8.62).
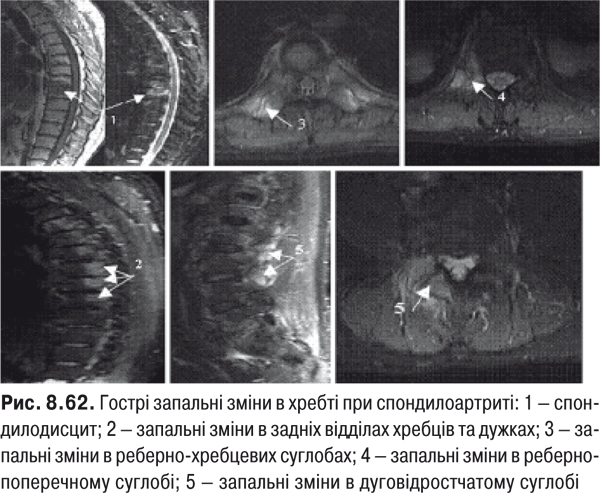
Хронічні запальні (структурні) зміни виявляються у вигляді субхондрального склерозу, ерозій, жирової інфільтрації, синдесмофітів та анкілозу (рис. 8.63). Ці зміни добре діагностуються за даними рентгенографії та спіральної КТ. На МРТ вони краще виявляються на Т1-зважених зображеннях та відображають попереднє запалення.
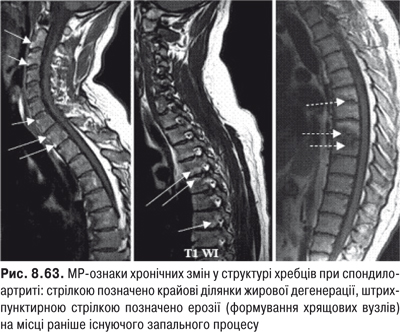
Доцільним та високоінформативним є МРТ при подагрі (рис. 8.64). На МР-томограмах достовірно виявляються подагричні тофуси, характерно розміщені в ділянці плеснофалангового суглоба І пальця та навколо інших суглобів стопи. Також можна спостерігати запальний набряк кісткового мозку (рис. 8.65).
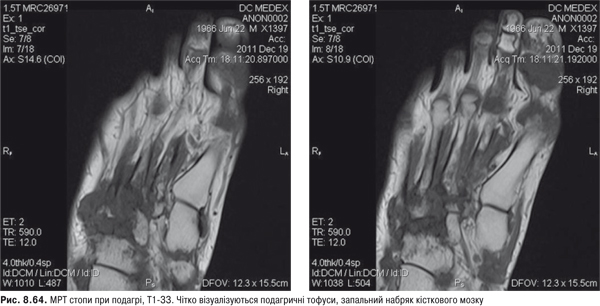
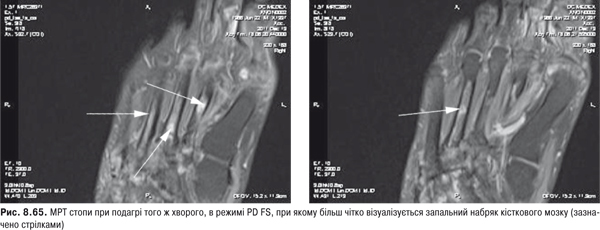
Висновок
МРТ — високоефективний діагностичний неінвазивний метод, що відображає всі складові частини суглоба одночасно й сприяє вивченню структурних і функціональних параметрів при захворюваннях суглобів.
МРТ може виявляти дуже ранні зміни, пов’язані з дегенерацією СХ, набряком кісткового мозку суглобових кінців, ранні ексудативні та проліферативні зміни СО, коли клінічні симптоми ревматичних захворювань суглобів мінімальні чи відсутні. Раннє виявлення пацієнтів, у яких є ризик прогресування захворювання, виявлений при МРТ, дозволяє призначити відповідне лікування набагато раніше, ніж їх виявлення при інших клінічних, лабораторних і радіологічних методах.
Застосування МР-КА дозволяє значно підвищити інформативність методу при ревматичних захворюваннях суглобів, оскільки може забезпечувати об’єктивні й кількісні виміри тонких, незначних морфологічних і структурних змін різних тканин суглоба протягом часу, і тому більш надійно відображає прогресування захворювання, а також дозволяє проводити моніторинг відповіді на лікування пацієнтів із ревматичними захворюваннями суглобів. Це полегшує оцінку нових препаратів для лікування при ревматичних захворюваннях суглобів і може дозволяти швидше проводити дослідження в деяких пацієнтів.
Необхідна подальша робота для оптимізації МРТ, оскільки остання може бути застосована як потужний об’єктивний метод дослідження патофізіології ревматичних хвороб суглобів, а також моніторингу ефективності дії потенційно нових препаратів для лікування пацієнтів.
Оцінка даних ультразвукової та рентгенівської денситометрії
Ультразвукова денситометрія
Перевагами подібних приладів є неінвазивність, висока точність (до 1,5%), легкість обслуговування, неіонізуюче випромінювання, портативність і компактність, що надзвичайно важливо для епідеміологічних досліджень.
Методика дозволяє оцінити такі параметри:
Швидкість поширення ультразвуку (ШПУ) — характеризує швидкість проходження ультразвуку через кістку.
Широкополосне ослаблення ультразвуку (ШОУ) — характеризує ослаблення інтенсивності УЗ-хвилі в середовищі поширення. Показник дозволяє оцінити кількість, розміри й просторову орієнтацію трабекулярної Ктк, тобто її мікроархітектоніку та якісні властивості.
Індекс міцності Ктк (ІМ) — розраховується на основі двох попередніх показників за формулою:
ІМ = 0,5 • (nШОУ + nШПУ),
де nШОУ = (ШОУ — 50) / 75 • 100,
nШПУ = (ШПУ — 1380) / 180 • 100.
Показник характеризує щільність Ктк:
Z-показник — відображає відхилення МЩКТ від середнього значення цього показника у практично здорових осіб тієї ж вікової групи. Виражається в одиницях SD (стандартного відхилення від середнього рівня).
Т-показник — відображає відхилення від референтного значення пікової кісткової маси здорових людей віком 25–30 років. Виражається в одиницях SD.
Однофотонна абсорбціометрія
Однофотонну абсорбціометрію виконують за допомогою приладу кісткового денситометра NK-364A (виробництво «GAMMA Muvek Corp.») як джерела моноенергетичного випромінювання, в якому застосовується йод-125, 78% випромінювання якого має енергію 27 КеВ. Точність виміру апаратом або відтворюваність, що оцінюється як коефіцієнт варіабельності декількох вимірів за короткий період (показник VK%), у середньому становить 1–2%. Дані денситометрії виражаються показниками (в іноземній літературі використовується термін ВМС — bone mineral content) — вмістом мінеральних речовин у Ктк або мінеральною насиченістю (г/см), і (в іноземній літературі BMD — bone mineral density) — проекційною МЩКТ (г/см2), які, у свою чергу, оцінюються шляхом порівняння з відомими для кожної вікової групи й статі величинами з використанням двох систем оцінки: Т-рахунку і Z-рахунку. У системі Z-рахунку порівнюються показники обстежуваного пацієнта із середніми показниками здорових осіб тієї ж вікової групи. У системі Т-рахунку дані обстежуваного хворого оцінюються шляхом порівняння із середніми показниками здорових людей молодого віку, що мають пік кісткової маси. Стан Ктк на основі даних кісткової денситометрії визначають відповідно до сучасної класифікації остеопенії та ОП (Techn. Rep. of a WHO study group, 1994):
- Норма: зміна BMD у межах 1 стандартного відхилення (SD) від референтного значення (отриманого в результаті виміру BMD в осіб не старше 30 років) — Т-індекс.
- Зменшення кісткової маси (остеопенія): зниження BMD >1 SD й <2,5 SD від референтного значення.
- ОП: зниження BMD >2,5 SD від референтного значення.
- Тяжкий ОП: зниження BMD > 2,5 SD від референтного значення у поєднанні з ≥1 переломами кісток.
Виміри проводяться в режимі сканування стандартних ділянок дистальної та проксимальної частин променевої кістки (½ та ⅓ довжини передпліччя відповідно). Вибір цих ділянок для виміру зумовлений вмістом переважно губчастого (дистальний відділ) або компактного (проксимальний відділ) речовин Ктк.
Кількісна комп’ютерна томографія
Кількісна КТ вперше уможливила неінвазивне дослідження губчастої речовини Ктк окремо, що надзвичайно важливо в тому плані, що кістковий метаболізм її набагато більш інтенсивний, ніж компактної, а, отже, і ознаки рарефікації проявляються раніше.
У цей час у клінічній практиці використовують КТ з одним рівнем енергії (80 кВмакс) і двома рівнями енергії (80 кВмакс/140 кВмакс).
Порівняно з іншими методиками діагностики кількісна КТ має такі переваги:
- трансаксіальне зображення хребта дає уяву про загальну його анатомію, дозволяє роздільно оцінити кортикальний шар, губчасту речовину кістки й загальний вміст мінералів;
- дозволяє визначити коефіцієнт лінійної абсорбції для певного обсягу кістки (істинний вимір щільності);
- на точність виміру МЩКТ не роблять істотного впливу розбіжності в обсязі м’яких тканин (дворівнева кількісна КТ).
Спочатку роблять бічну КТ для локалізації ділянки виміру, потім — сканування на рівні середини тіл хребців. КТ на рівні 2–4 тіл хребців дозволяє одержати кількісні дані в ділянці, що викликає інтерес, в обсязі 3–4 см3 у кожному хребці.
Час дослідження — ≈10–15 хв, доза опромінення — ≈2 мзв (1/10 дози, одержуваної при проведенні однієї звичайної КТ). Коефіцієнт варіабельності при використанні однорівневої КТ становить 1–3%, дворівневої — 3,5%.
У людей похилого віку точність вимірів трохи знижується (до 75–80%), що пов’язано в основному з різним вмістом жиру в тілах хребців; у цьому разі для підвищення точності діагностики рекомендується використання шкал регресії, співвіднесених за статтю й віком.
Визначення структурно-функціонального віку кісткової системи
Для оцінки функціонального стану кісткової системи можна застосовувати математичні моделі, розроблені на основі використання методу покрокового регресійного аналізу в Інституті геронтології імені Д.Ф. Чеботарьова НАМН України (Поворознюк В.В., 1994). Подібні моделі дають можливість оцінити темп старіння кісткової системи й віддиференціювати зміни, що носять фізіологічний (віковий) і патологічний характер. Ці моделі розраховані на використання даних фотонної абсорбціометрії та УЗ-остеометрії.
Зазначені моделі можна рекомендувати для проведення масових обстежень, тривалих лонгітудинальних спостережень, донозологічної та нозологічної діагностики ОП, оцінки ефективності антиостеопоротичної терапії.
Рентгенівська денситометрія
Інструментальні методики оцінки структурно-функціонального стану кісткової тканини та її системних змін
Наявні в сучасній літературі дані про поширеність остеопенії і ОП серед хворих ревматологічного профілю відрізняються значною варіабельністю, а при деяких ревматичних захворюваннях суглобів їхня частота і поширеність не визначена. Аналіз даних про порушення в Ктк при ревматичних захворюваннях суглобів дуже складний внаслідок великої кількості факторів, які необхідно враховувати: стать і вік хворих, тривалість і вираженість запального компонента захворювання, менопаузальний статус у жінок, рухова активність, ступінь вимушеної іммобілізації та ін. Саме це призводить до труднощів при узагальненні та зіставленні результатів досліджень. Не останню роль відіграє і лікування самого ревматичних захворюваннях суглобів, особливо ГК, що значно впливають на процеси кісткового ремоделювання. Крім того, механізми дії деяких антиостеопоротичних препаратів також можуть бути частково опосередкованими їх впливом на запальні й імунні процеси, що мають відношення до патогенезу як ОП, так і запальних ревматичних захворювань.
Завдяки появі сучасних денситометричних методик (однофотонна абсорбціометрія, УЗ-денситометрія, двофотонна абсорбціометрія і рентгенівська денситометрія — DEXA, кількісна КТ та ін.) (табл. 8.22) значно вдосконалилась діагностика, а також виявилось можливим уточнити особливості розвитку і перебігу остеопенічного синдрому при ревматичних захворюваннях суглобів.
Таблиця 8.22
Деякі характеристики методик вимірів МЩКТ
|
Методика |
Час процедури, хв |
Доза опромінення, мбер |
Похибка вимірювань, % |
Тип апаратури |
|
Однофотонна абсорбціометрія |
10–15 |
3 |
2–3 |
Стаціонарний |
|
Двофотонна абсорбціометрія |
15–20 |
5 |
2–4 |
Стаціонарний |
|
Подвійна рентгенівська абсорбціометрія |
2–10 |
3 |
0,5–2 |
Стаціонарний |
|
Метод нейтронної активації |
15 |
300–600 |
4–10 |
Стаціонарний |
|
УЗ-денситометрія |
5 |
– |
1,5–5 |
Портативний |
|
КТ |
8–10 |
>3000 |
0,5 |
Стаціонарний |
Рентгенологічне дослідження
Для проведення діагностики й диференційної діагностики ОП на сьогодні найбільш широко використовуваним методом залишається рентгенологічне дослідження. Проведення комплексного аналізу стану Ктк за даними рентгенографії потребує виконання п’яти знімків осьового скелета — грудного й поперекового відділів хребта у двох проекціях, оглядового знімка кісток таза з обома виростками СтК, знімка черепа в бічній проекції та кистей рук у прямій проекції (Франке Ю., Рунге Г., 1995). При аналізі рентгенограм звертають увагу на наявність візуальних рентгенологічних ознак ОП (Спузяк М.И., 1988; Франке Ю., Рунге Г., 1995):
- Атрофія кісткового малюнка на рентгенограмі, зумовлена витонченням кортикального шару в результаті розрідження кісткової речовини по його зовнішній і внутрішній поверхні, а також зниженням щільності трабекулярних структур. Внаслідок зникнення трабекулярного малюнка (розмитість структури) хребець здається пустотілим; відзначається підкресленість контурів кортикального шару навколо всієї кістки (наприклад «рамкова» структура хребця).
- Поява великопетльової кісткової структури у зв’язку із розсмоктуванням частини кісткових балок, компенсаторної гіпертрофії трабекул, що залишилися, і збільшенням кістковомозкового простору. На думку деяких авторів (Спузяк М.И., 1988), перебудова кісткової структури, що характеризується зменшенням кількості кісткових балок в одиниці об’єму, з компенсаторним стовщенням тих, що залишилися, є окремим видом ОП, названого автором гіпертрофічний ОП.
- Розширення кістковомозкового каналу в результаті розвитку в його стінках резорбтивного процесу.
- Спонгіозування кортикального шару довгих і коротких трубчастих кісток, що виникає у зв’язку з розсмоктуванням у ньому частини кісткових елементів.
- Слабовиражені дегенеративні зміни у вигляді спондильозу.
Вищенаведені ознаки є загальними для цілого ряду захворювань, що характеризуються остеопенічним синдромом. За характером рентгенологічної картини ОП може бути рівномірним (дифузним) і нерівномірним (плямистим, дрібновогнищевим). В останньому випадку на рентгенограмах визначаються множинні, з нечіткими контурами, різні за формою ділянки рарефікації губчастої речовини кістки; Ктк поза цими ділянками має нормальну структуру й щільність. Коркова речовина зазвичай не змінена або незначно розріджена (Спузяк М.И., 1988). У діафізах довгих кісток рентгенологічні ознаки ОП виявляються значно пізніше, ніж у метаепіфізах, що зумовлено особливостями кісткового метаболізму.
Для візуальної оцінки ступеня розрідження Ктк можна використати таку ознаку: тінь тіла хребця на рентгенограмі в нормі більш щільна, ніж тінь ребер; при ОП щільність ребер і хребців стає однаковою, визначається також підкресленість коренів дужок. Оскільки ця ознака досить суб’єктивна, діагноз ОП потребує підтвердження даними біопсії (див. нижче). По бічній рентгенограмі (рис. 8.66) розраховуються висота задньої поверхні тіла хребця (НР), передньої (НА) і висота тіла хребця посередині (НМ). Знаючи ці параметри, можна визначити характер деформації за її наявності за формулами:
Індекс клиноподібності = НА – НР /НР.
Індекс увігнутості = НМ – НР / НР.
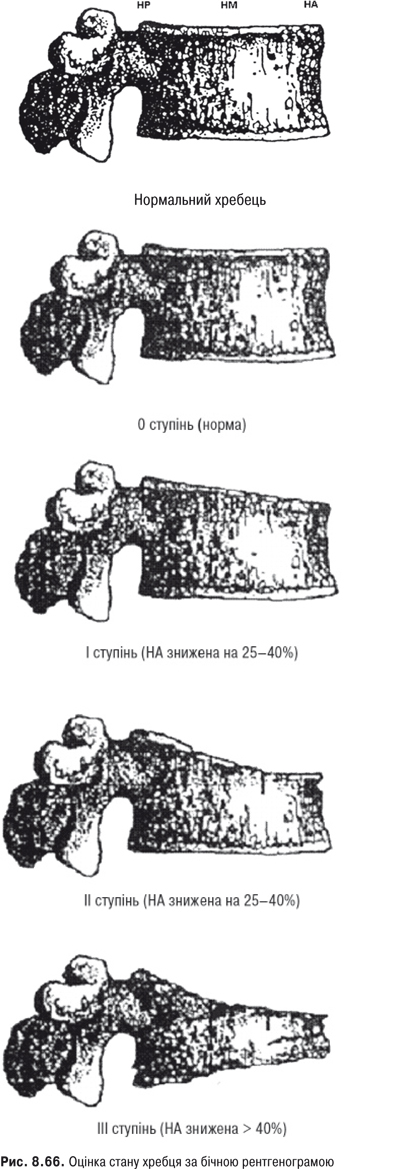
Досить чіткими ознаками ОП є зміни форми хребців внаслідок повзучої деформації чи переломів. Більш ранніми змінами вважаються двоввігнута форма хребців внаслідок посилення ввігнутості верхньої та нижньої опорних площадок їх тіл, що особливо характерно для поперекового відділу. У міру прогресування процесу хребці здобувають характерну форму (так звані риб’ячі хребці). Характерно також утворення вузлів Шморля у результаті пролабування опорних площадок тіл хребців. Для грудного відділу характерна клиноподібна деформація внаслідок зменшення висоти переднього краю тіл хребців, добре помітна на бічній рентгенограмі (див. рис. 8.66). На рисунку представлена кількісна оцінка вираженості клиноподібної деформації хребців (за: Jergas та Genant, 1993). Найчастіше деформуються найбільш навантажені відділи хребта, так звані перехідні зони — ThXII, ThXI, LI, LIV, LV. Практично не піддаються деформації тіла хребців вище ThIV; у разі подібної деформації необхідно підозрювати перш за все метастаз або спондиліт. Трапляється при ОП і рівномірна компресія хребця (так званий плаский хребець).
Для характеристики тяжкості ОП за рентгенологічним даними найчастіше застосовують класифікацію, запропоновану Smith, Rizek (1966), Goldsmith та співавторами (1971), Kruse (1978) (табл. 8.23).
Таблиця 8.23
Класифікація ОП за рентгенологічним даними
|
Ступінь тяжкості |
Рентгенологічна картина |
|
0 (норма) |
Зміни відсутні |
|
І (граничні зміни) |
Підозра на зниження МЩКТ, редукування трабекул |
|
ІІ (легкий ОП) |
Виражене стоншення трабекул, підкресленість контурів замикальних пластинок, зниження МЩКТ |
|
ІІІ (помірно виражений ОП) |
Значне зниження МЩКТ, двоввігнута форма тіл хребців, клиноподібна форма одного хребця |
|
IV (тяжкий ОП) |
Тяжка демінералізація, множинні «риб’ячі» та/або клиноподібні хребці |
Для оцінки вираженості рентгенологічних проявів у зіставленні з клінічною картиною, є доцільною 3-ступенева класифікація вираженості ОП-змін (рис. 8.67).
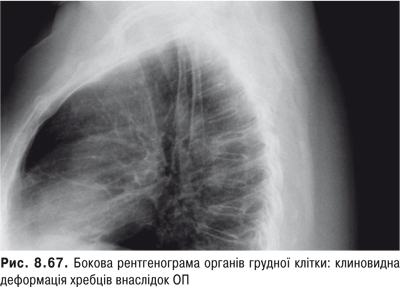
Нерізко виражений ОП. На рентгенограмах відзначається початкове дифузне руйнування губчастої Ктк зі стоншенням кісткових балок, більш чітка диференціація розміщених за силовими лініями трабекулярних структур із періодичним порушенням їх безперервності. ОП проявляється частіше в окремих кістках або одному відділі скелета (хребет, кінцівка тощо); клінічні прояви помірні й неспецифічні або відсутні.
Виражений ОП. Рентгенологічні ознаки «змазаності» трабекулярних кісткових структур, виявляються ділянки просвітлень, різних за формою та розмірами, де Ктк не виявляється, а також стоншення та підкресленість кортикального шару кісток і замикальних кісткових пластинок, розширення кістково-мозкового каналу. Форма кісток змінена (наприклад знижена висота тіл хребців). Процес поширюється на один або кілька відділів скелета. Клінічно — минущий ниючий, тупий біль переважно в хребті або нижніх кінцівках.
Різко виражений ОП. На рентгенограмі — різко виражене розрідження Ктк, що поширюється на весь скелет, значне стоншення (на ≥50%) кортикального шару кісток і замикальних кісткових пластинок, виражене розширення кістково-мозкового каналу, наявність просвітлень більших розмірів у багатьох ділянках кісток (кісткова структура вкрай розріджена) і одиничних товстих трабекул, розміщених по осі навантаження. Форма кістки значно змінена. Клінічно — інтенсивна хворобливість (постійна чи періодична) уражених відділів, порушення функції органа, сегмента чи відділу скелета.
При проведенні диференційної діагностики слід мати на увазі наступні ознаки (табл. 8.24).
Таблиця 8.24
Диференційно-діагностичні ознаки уражень Ктк (за даними рентгенографії)
|
Захворювання |
Ознаки |
|
Остеомаляція |
Зони перебудови Лоозера |
|
Первинний |
Кістозна остеодистрофія (хвороба Реклінгхаузена), зрідка — субперіостальні узури, дрібні кісти, порушення цілісності твердої альвеолярної пластинки |
|
Ниркова |
Череп, «посипаний перцем і сіллю», акроостеоліз, остеоліз суглобів, кальцифікація м’яких тканин і капсул, хребет Руджер — Джерсе |
|
Плазмоцитома |
«Штамповані» дефекти черепа |
|
Метастази |
Зникнення коренів дужки хребця |
Діагностика ОП залишається одним із найбільш актуальних завдань сучасної рентгенології з огляду на суб’єктивний характер більшості вищенаведених рентгенологічних ознак, а також обмежені можливості методу — низьку чутливість (рентгенологічно ОП виявляють лише при втраті ≈25–30% мінерального компонента Ктк і труднощі кількісної оцінки вираженості ОП.
Для об’єктивізації результатів дослідження іноді застосовують такі методики, як рентгеноденситометрія та рентгенограмаметрія.
Рентгеноденситометрія
Суть методу полягає в тому, що рентгенографію досліджуваних відділів скелета проводять одночасно із каліброваним клином-еталоном, виготовленим із матеріалів, близьких за ступенем ослаблення випромінювання до кістки (частіше алюмінію або гідроксиапатиту). Після прояву плівки проводять фотометричну обробку: кожній ділянці кістки на знімку відповідає певна товщина клина, що дає ідентичне почорніння плівки. Ступінь мінеральної насиченості кістки, яку відображає оптична щільність на рентгенограмі, визначають за допомогою мікрофотометрів. Методика має ряд недоліків, які ведуть до значної похибки вимірювань: неоднорідність інтенсивності випромінювання по полю, різна якість плівок та ін. Крім того, негативний вплив на точність результатів мають різні щільність і товщина об’єкта зйомки, перешкоди за рахунок м’яких тканин. З огляду на витрати часу, необхідність складної апаратури, рентгеноденситометрію не можна застосовувати для масових досліджень, а також ранньої діагностики остеопенічних станів.
Рентгенограмаметрія заснована на кількісному аналізі рентгенограм шляхом обчислення спеціальних індексів:
метакарпальний індекс (периферичний індекс Barnett, Nordin) (Barnett, Nordin, 1960) розраховують на рентгенограмах СтК (ділянка на 10 см нижче малого виростка) і кистей у прямої проекції (середина ІІ п’ясткової кістки) за формулою:
МКІ = TW — MW / TW,
де TW — ширина (діаметр) кістки; MW — ширина (діаметр) медулярної порожнини.
Про наявність ОП свідчать метакарпальний індекс п’ясткової кістки <0,45 ум. од., стегнової — <0,54; при значеннях цього індексу <0,35 і <0,45 відповідно — про різко виражений ОП.
Індекс Exton, що розраховують на рентгенограмах кистей у прямій проекції за формулою:
ІЕ = TW2 — MW2 /4L · TW,
де TW — ширина (діаметр) ІІ п’ясткової кістки в її середині; MW — ширина (діаметр) медулярної порожнини; L — довжина II п’ясткової кістки.
Похідні цих параметрів, що обчислюють за формулами:
|
Частка кортикального поля (СА): %СА = p/4 ⋅ (TW2 — MW2) |
|
Загальна міцність кістки (WBD): WBD = %CA ⋅ 2,0 г/мл |
|
Загальна зола кістки (WBA): WBA = %CA ⋅ 1150 мг/мл |
|
Загальний кальцій кістки (WBCa): WBCa = %CA ⋅ 450 мг/мл |
Індекс Рохліна розраховують на рентгенограмі хребта в бічній проекції за формулою:
ІР = H / L,
де L — довжина хребця (по центру від переднього краю до заднього); Н — висота центральної частини хребця.
Центральний індекс Barnett, Nordin (Barnett, Nordin, 1960) розраховують на рентгенограмі хребта в бічній проекції та визначають як відношення висоти тіла хребця в центральному відділі до висоти в передньому відділі, помножене на 100. Значення індексу <80% свідчить про ОП хребта.
ОП-індекс розраховують також на бічних рентгенограмах поперекового й грудного відділів хребта за формулою:
R = S1 / S2,
де S1 — площа малого прямокутника, розташованого посередині тіла хребця; S2 — площа великого прямокутника, розташованого назовні тіла хребця.
У нормі значення ОП-індексу 0,9–1 ум. од., при помірно вираженому ОП — 0,6–0,9 ум. од., при різко вираженому — < 0,5 ум. од.
Дисковий коефіцієнт (Нейко Є.М. та співавт., 1999) — відношення висоти міжхребцевого диска до висоти суміжних із ним хребців (табл. 8.25).
Таблиця 8.25
Значення дискового коефіцієнта у практично здорових осіб віком 25–35 років
|
Відділ хребта |
Значення |
|
Верхньо-грудний Середньо-грудний Нижньо-грудний Поперековий |
1/7–1/6 1/6–1/5 1/5–1/4 1/3 |
Мікрорадіоскопія
На думку Ю. Франке, Г. Рунге (1995), метод має цінність у розпізнаванні метаболічних остеопатій, у тому числі ОП. Суть методу полягає у визначенні різних форм кісткової резорбції в п’ясткових кістках, на підставі чого можна встановити генез остеопатії. Рентгенограму кисті досліджуваного (у прямій проекції) знімають на дрібнозернистій (технічній) плівці з використанням рентгеновипромінювання підвищеної жорсткості (10 мГр). Отриманий знімок аналізують за допомогою збільшувальної техніки.
Розрізняють ендостальну, інтракортикальну та субперіостальну резорбцію (табл. 8.26).
Таблиця 8.26
Вид резорбції
|
Вид резорбції |
Патологія |
|
Ендостальна |
Фізіологічна вікова атрофія Інволютивний ОП Гіперпаратиреоз Локальна декальцинація РА Пухлини кісток Іммобілізаційний ОП |
|
Інтракортикальна |
Гіпертиреоз Гіперпаратиреоз Акромегалія Ниркова остеопатія |
|
Субперіостальна |
Гіперпаратиреоз Гіпертиреоз |
Морфологічні методи оцінки стану кісткової тканини
Провести діагностику ОП, а також провести його диференційну діагностику з остеопатіями іншого генезу, особливо на початкових етапах розвитку, іноді неможливо без проведення біопсії ділянки Ктк. На сьогодні достатньо розроблена техніка біопсії Ктк та методичні рекомендації, що дозволяють оцінити різні параметри процесів, що відбуваються в Ктк. Дослідження біоптата дозволяє на мікроскопічному рівні оцінити товщину кортикальної пластинки, кількість і ширину трабекул, вміст остеоїда, поверхневу щільність остеобластів, остеокластичну резорбцію, характер мінералізації, а також інші параметри.
Оцінка гістологічних препаратів
Гістологічне дослідження проводиться на недекальцинованих препаратах кістки (табл. 8.27).
Таблиця 8.27
Кількісна оцінка параметрів стану Ктк
|
Об’єм губчастої кістки |
Об’єм |
Ширина |
Товщина коркової частини |
Щільність остеобластів й остеокластів |
|
Розширення міжтрабекулярного простору |
Вогнища розрідження та лізису в Ктк |
|||
При проведенні диференційної діагностики за даними біопсії варто враховувати такі ознаки (табл. 8.28).
Таблиця 8.28
Диференційно-діагностичні ознаки (за даними біопсії Ктк)
|
Захворювання |
Ознаки |
|
ОП |
Об’ємна щільність губчастої речовини знижена, розрідження та стоншення трабекул, спонгіоїзація та стоншення кортикального шару |
|
Остеомаляція |
Збільшення поверхні та товщини остеоїда, уповільнена мінералізація (тетрациклінова мітка, див. нижче) |
|
Кишкова остеомаляція |
Гігантоклітинна остеоклазія |
|
Первинний |
Фіброостеоклазія (утворення волокнистого кісткового мозку, гігантоклітинні остеокласти в глибоких гаушипових лакунах) |
|
Ниркова остеопатія:
|
Фіброостеоклазія Збільшення поверхні й товщини остеоїда Фіброостеоклазія, збільшення поверхні і товщини остеоїда |
|
Поромаляція |
Об’ємна щільність губчастої речовини знижена, поверхня остеоїду збільшена |
|
Метастази, плазмоцитома |
Пухлинні й плазматичні клітини |
Техніка виконання біопсії
За допомогою спеціального трепана в проекції гребеня здухвинної кістки витягається стовпчик тканини, що містить зовнішній та внутрішній кортикальний шари (за: Kaplan F.S., 1983).
Вивчення динаміки формування Ктк. Тетрациклінова мітка
Тетрациклін — флуоресціюючий маркер, що дає можливість оцінити апозиційний ріст кістки та її ремоделювання. Кістка поглинає тетрациклін, і він накопичується в ділянках з активною мінералізацією. Метод дозволяє відмежувати мінералізовану Ктк від тої, що формується у фазі утворення остеоїду.
Хворим призначають два курси тетрацикліну: за 14 і 13 діб до початку процедури (біопсії); потім — за 3–4 доби перед біопсією (з перервою в 10 діб). 600 мг тетрацикліну призначають за 1 год до або через 2 год після їжі. Матеріали біопсії фіксують у 70° етиловому спирті.
Тести для самоконтролю
- Крiоглобулiнами називають iмуноглобулiни, якi випадають в осад при температурi:
- –5…–10 ◦С
- 0–50 ◦С
- 6–100 ◦С
- 11–200 ◦С
- 21–250 ◦С
- Про пiдвищення яких «бiлкiв гострої фази запального процесу» свiдчить пiдвищення вмiсту фракцiї α-глобулiнiв?
- СРП
- α1-антитрипсину
- α1-кислого протеїну
- сироваткового амiлоїдного бiлку
- гаптоглобiну
- Про пiдвищення яких «бiлкiв гострої фази запального процесу» свiдчить пiдвищення вмiсту фракцiї α2-глобулiнiв?
- церулоплазмiну
- гаптоглобiну
- мікроглобуліну
- СРБ
- комплементу
- Про пiдвищення яких «бiлкiв гострої фази запального процесу» свiдчить пiдвищення вмiсту фракцiї β-глобулiнiв?
- фiбриногену
- С-компонента комплементу
- СРБ
- гаптоглобiну
- бiлка в сироватці крові
- Зазначте характернi лабораторнi ознаки ревматичного процесу III ступеня активностi:
- нейтрофільний лейкоцитоз — 10–12, серомукоїд — 0,2–0,6
- ШОЕ >40 мм/г, ДФА — 0,25–0,5 ОД, АСЛ-О, АСГ, АСК — вище контрольних показників у 3–5 разів
- СРБ (+++)– (++++) або >12 мг/л у 3–5 разів
- α2-глобуліни 13–14%, гаммаглобуліни — 25%
- фiбриноген 4,5 г/л, СРБ (+)
- Зазначте характернi лабораторнi ознаки ревматичного процесу II ступеня активностi:
- нейтрофільний лейкоцитоз — до 10, серомукоїд — 0,2–0,6
- ШОЕ 20–30 мм/г, ДФА — 0,25–0,3 ОД, АСЛ-О, АСГ, АСК — вище контрольних показників у 1,5–2 рази
- СРБ (+)–(++) або >12 мг/л у 3–5 разів
- α2-глобуліни 11–13%, гаммаглобуліни — 22–25%
- фiбриноген 4 г/л, СРБ (+)
- Характернi лабораторнi ознаки (фiбриноген, С-реактивний бiлок) ревматичного процесу I ступеня активностi:
- фiбриноген 6,0 г/л, СРБ (++)
- фiбриноген 7,0 г/л, СРБ (+++)
- фiбриноген 8,0 г/л, СРБ (++++)
- фiбриноген 6—9,0 г/л, СРБ (+)—(+++)
- фiбриноген 5,0 г/л або норма, СРБ (+) або (–) або до 12 мг/л
- Характерними лабораторними ознаками (α2— i гаммаглобулiну) ревматичного процесу III ступеня активностi є:
- α2-глобулін >17%, гамма-глобулін — 23–25%
- α2-глобулін — 10%, гамма-глобулін — 20%
- α2-глобулін – 8%, гамма-глобулін — 22%
- α2-глобулін – 16%, гамма-глобулін — 21%
- α2-глобулін – 14%, гамма-глобулін — 22,5%
- Зазначте характернi лабораторнi ознаки (α2- i гаммаглобулiну) ревматичного процесу II ступеня активностi:
- α2-глобулін — 11,5–17%, гаммаглобулін — 21–23%
- α2-глобулін — 17,5%, гаммаглобулін — 24%
- α2-глобулін — 10,5%, гаммаглобулін — 20,5%
- α2-глобулін — 10–8,0%, гаммаглобулін — 23–25%
- α2-глобулін — 18%, гаммаглобулін — 24%
- Зазначте характернi лабораторнi ознаки (α2- i гаммаглобулiну) ревматичного процесу I ступеня активностi:
- α2-глобулін — 12%, гаммаглобулін — 21,5%
- α2-глобулін <11,5%, гаммаглобулін — до 21%
- α2-глобулін — 12,5%, гаммаглобулін — 12%
- α2-глобулін — 11,8%, гаммаглобулін — 22%
- α2-глобулін — 16%, гаммаглобулін — 4%
- Зазначте характерні лабораторні ознаки (серомукоїд i ДФА в од.) ревматичного процесу III ступеня активностi:
- серомукоїд ≥0,6; ДФА — 0,35—0,5
- серомукоїд — 0,4; ДФА — 0,3
- серомукоїд — 0,5; ДФА — 0,32
- серомукоїд — 0,55; ДФА — 0,3
- серомукоїд — 0,3; ДФА — 0,25
- Зазначте характернi лабораторнi ознаки (серомукоїд i ДФА в од.) ревматичного процесу II ступеня активностi:
- серомукоїд — 0,65; ДФА — 0,4
- серомукоїд — 0,3 — 0,6; ДФА — 0,25—0,35
- серомукоїд — 0,25; ДФА — 0,36
- серомукоїд — 0,20; ДФА — 0,20
- серомукоїд — 0,2 — 0,5; ДФА — 0,2—0,4
- Зазначте характернi лабораторнi ознаки (серомукоїд i ДФА в од.) ревматичного процесу I ступеня активностi:
- серомукоїд — 0,25; ДФА — 0,3
- серомукоїд — 0,454 ДФА — 0,3—0,4
- серомукоїд — до 0,3; ДФА — до 0,25
- серомукоїд — до 0,7; ДФА — до 0,3
- серомукоїд — 0,4; ДФА — 0,35
- LE-клiтини — це:
- нейтрофiльний лейкоцит, який фагоцитував частини зруйнованого ядра
- лiмфоцит із залишками ядра в цитоплазмi
- ретикулоцити
- зруйнованi еритроцити
- змiненi моноцити
- До морфологiчних змiн при СЧВ належать:
- фiбриноїднi змiни
- склероз
- некроз серцевого м’яза
- утворення гематоксилiнових тiлець
- судиннi змiни
- Гiстологiчнi та iмунологiчнi змiни при люпус-нефритi:
- пролiферацiя клiтинних елементiв
- фiбриноїднi вiдкладання у капiлярах
- ядерна патологiя
- гіперкомплементемія
- фiксацiя iмунних комплексiв на базальнiй мембранi капiлярiв
- За наявностi у хворих на СЧВ позитивної реакцiї Вассермана для верифiкації АФС необхідне визначення таких показників:
- антитiла до кардiолiпiну
- вовчаковий антикоагулянт
- LE-клiтини
- антитiла до ДНК
- Якi антигени системи HLA найчастіше сприяють розвитку системних захворювань сполучної тканини?
- HLA-DR3, -B8
- HLA-B27, -A11
- HLA-DR8, -C3
- HLA-A9, -DR35
- HLA-C4, -C25
- Який показник найбiльш достовiрно пiдтверджує дiагноз мiкроскопiчного полiангiїту?
- залiзодефiцитна анемiя
- лейкоцитоз
- антитiла до нейтрофiлiв, що реагують із протеїназою-3
- підвищене ШОЕ
- антитiла до нейтрофiлiв, що реагують із мiєлопероксидазою
- Назвіть типові лабораторні зміни для панікуліту:
- підвищення ШОЕ
- зниження ШОЕ
- лейкоцитоз
- лейкопенія
- еозинофілія
- Визначіть показання до проведення ехоКГ:
- шум при аскультацiї серця
- змiни на оглядовiй рентгенограмi розмiрiв та форми серця, аорти
- задишка, яка виникає при певному положеннi тiла
- лихоманка нез’ясованого генезу
- синкопе та порушення кровообiгу (особливо у осіб молодого віку)
- збільшення інтервалу Q–T на ЕКГ
- За допомогою ехоКГ за недостатностi аортального клапана можна виявити:
- вiбрацiю передньої стулки МК, дилатацiю ЛШ
- гiперкiнез стiнок ЛШ
- вібрацію задньої стулки МК
- гіпертрофію стінок ЛШ
- Визначте ехоКГ-ознаку, характерну для мiтрального стенозу:
- збiльшення порожнини ЛШ
- збiльшення порожнини лiвого передсердя
- деформацiя, потовщення i кальцифiкацiя стулок МК
- зниження швидкостi прикриття передньої стулки i зменшення амплiтуди її вiдкриття
- однонаправлений рух передньої та задньої стулок МК
- Який із перерахованих методiв iнструментального i лабораторного дослiджень включено в перелiк обов’язкових для дiагностики ревматичних хвороб в полiклiнiках та стаціонарах (наказ МОЗ від 12.10.2006 р. № 676):
- артроскопiя
- велоергометрiя
- визначення сечової кислоти в кровi, сечi
- визначення антинуклеарних антитіл
- визначення активностi трансамiназ
- РФ
- При внутрiшньошлуночковiй блокадi спостерiгається:
- розширення комплексу QRS >0,12 с
- нерегулярна поява зубця Р
- фiбриляцiя передсердь
- повна дисоцiацiя скорочень передсердь та шлуночкiв
- синусова аритмiя
- Подовження iнтервалу P–R >0,2 с спостерiгається при:
- АВ-блокадi I ступеня
- фiбриляцiї передсердь
- синусовiй брадикардiї
- бiгемiнiї
- альтернуючому пульсi
- Площа правого АВ-отвору порiвняно з лiвим:
- така ж
- бiльша
- менша
- Площа аортального отвору в нормi становить (см2):
- 1,5
- 2,0
- 2,5
- 3,0
- 3,5
- Якi рентгенологiчнi ознаки можуть свiдчити про збiльшення лiвого передсердя:
- вiдхилення контрастованого стравоходу у боковій проекції
- вибухання вушка лівого передсердя (третьої дуги лiвого контура серця)
- згладжений лiвий контур серця утворення додаткової нижньої дуги правого контуру серця
- зменшення висхідної частини аорти
- Рентгенологiчні ознаки аортального стенозу:
- розширення контуру ЛШ
- розширення початкового вiддiлу аорти
- подовження контуру ЛШ
- гiпертрофiя ПШ
- пiдкреслена талiя серця
- кальциноз стулок аорти
- При розвитку блокади лiвої нiжки пучка Гiса у хворих на аортальний стеноз на ЕКГ вiдзначається:
- розширення комплексу QRS
- зникнення зубцiв R у вiдведеннях V1, V2
- зникнення зубцiв Q у вiдведеннях V5, V6
- підйом сегмента ST
- негативний T
- При недостатностi МК за допомогою ехоКГ виявляють:
- дискордантнiсть руху передньої та задньої стулок МК в дiастолу
- збiльшення швидкостi руху передньої стулки
- ознаки фiброзу стулок
- гіпертрофію лівого передсердя
- гіпертрофію ЛШ
- Визначте ехоКГ-симптом, характерний для аортального стенозу:
- концентрична гiпертрофiя стiнок ЛШ
- зменшення розкриття стулок аортального клапана в систолу
- кiнцевий дiастолiчний розмiр ЛШ не змiнений
- дiастолiчне тремтiння стулок МК
- гiпертрофiя мiжшлуночкової перетинки
- Визначте ехоКГ-ознаку, характерну для недостатностi аортального клапана:
- потовщення стулок аортального клапана
- сепарацiя стулок аортального клапана
- дилатацiя ЛШ
- зменшення розкриття стулок аортального клапана в систолу
- дiастолiчне тремтiння стулок мiтрального клапана
- Зазначте найчастіший рентгенологiчний варiант вiдхилення стравоходу при мiтральному стенозi:
- за дугою малого радiуса
- за дугою середнього радiуса
- за дугою великого радiуса
- стравохiд не вiдхилений
- можливi рiзнi варiанти
- ЕКГ-ознакою гiпертрофiї лiвого передсердя у хворих на мiтральний стеноз є:
- поява двовершинного зубця Р у вiдведеннях I, II, аVL, V5–6
- у вiдведеннi III значне збiльшення за амплiтудою i тривалістю другої негативної фази зубця Р
- зiльшення часу внутрiшнього вiдхилення зубця Р >0,06 с
- гострокінечний зубець Р
- від’ємний зубець Р
- Тривалiсть iнтервалу Q–I тон при вираженому мiтральному стенозi становить (с):
- 0,04–0,05
- 0,05–0,06
- 0,06–0,08
- 0,08–0,10
- 0,10–0,12
- ЕхоКГ-ознаки мiтрального стенозу:
- однонаправлений рух передньої та задньої стулки МК
- зниження швидкостi раннього дiастолiчного закриття передньої стулки
- зменшення амплiтуди руху передньої стулки
- гіпертрофія правого передсердя
- гіпертрофія лівого передсердя
- Величина градiєнта тиску ЛШ — аорта при вираженому аортальному стенозi може сягати (мм рт. ст.):
- 30
- 50
- 100
- 150
- 200
- Критична площа аортального отвору при «чистому» аортальному стенозi (см2):
- 0,3
- 0,5
- 0,7
- 1,0
- 1,5
- Рентгенологiчно при недостатностi МК найчастіше спостерiгається вiдхилення стравоходу:
- по дузi малого радiуса
- по дузi великого радiуса
- по дузi середнього радiуса
- стравохiд не вiдхилений
- При ехоКГ-дослідженні у хворих із рестриктивною кардіоміопатією виявляють:
- нормальну систолічну функцію ЛШ
- порушення діастолічної функції
- зниження тиску в легеневій артерії
- мітральну регургітацію
- трикуспідальну регургітацію
- Які методи діагностики застосовують при підозрі на гiпертрофiчну кардiомiопатiю:
- холтерівське моніторування
- ехокардіографія
- радіонуклідна вентрикулографія
- УЗД суглобів
- МРТ
- Змiни ЕКГ у хворих із гiпертрофiчною кардiомiопатiєю характеризуються:
- ознаками гiпертрофiї мiокарда
- синдромом Вольфа — Паркiнсона — Уайта
- патологiчним зубцем Q
- зниженням сегмента ST i негативним зубцем T
- розширенням зубця Р
- Раннiй рентгенологiчний симптом лiвошлуночкової недостатностi:
- збiльшення серця i накопичення рiдини у плевральних порожнинах
- розширення коренiв легень
- розширення верхньодольових вен
- розширення стовбуру легеневої артерiї та зменшення розгалужень на периферiї
Правильні відповіді: 1) 2; 2) 2, 4; 3) 1, 2; 4) 1, 2; 5) 1, 2, 3, 4; 6) 1, 2, 3, 4; 7) 5; 8) 1; 9) 1; 10) 2; 11) 1; 12) 2; 13) 3; 14) 1; 15) 1, 2, 3, 4; 16) 1, 2, 3, 5; 17) 1, 2, 4; 18) 1; 19) 5; 20) 1, 3, 5; 21) 1,2,3,4,5; 22) 1, 2, 3; 23) 2, 3, 4, 5; 24) 1, 3, 4, 5, 6; 25) 1; 26) 1; 27) 2; 28) 4; 29) 1, 2, 3, 4; 30) 1, 2, 3, 5, 6; 31) 1, 2, 3; 32) 1, 2, 3; 33) 1, 2, 3, 5; 34) 1, 2, 3, 5; 35) 1; 36) 1, 2, 3; 37) 4; 38) 1, 2, 3; 39) 5; 40) 2; 41) 2; 42) 1, 2, 4, 5; 43) 1, 2, 3, 5; 44) 1, 2, 3, 4; 45) 2