Значний прогрес у розумінні патофізіології та еволюції ОА привів не тільки до поліпшення діагностики захворювання, але й до переоцінки методології та метрології проведення клінічних досліджень при ОА. Клінічна метрологія ОА утруднена.
Це пов’язано з низкою факторів (Bellamy N., 1997):
- нерідко безсимптомністю хвороби;
- дисоціацією між рентгенологічною картиною і клінічною маніфестацією;
- частою невідповідністю даних артроскопії та рентгенографії уражених суглобів;
- відсутністю надійних БМ хрящового метаболізму, що відображають прогресування ОА та мають прогностичне значення;
- індивідуальними для кожної локалізації ОА (кисті, колінні, кульшові суглоби та ін.) критеріями оцінки, однак разом узяті вони не підходять для генералізованої форми ОА.
У зв’язку з появою на фармацевтичному ринку нових препаратів для терапії ОА та великою кількістю публікацій з результатами контрольованих досліджень виникла необхідність розробки уніфікованих критеріїв ефективності. Список показників, які могли б бути включені до протоколу клінічного дослідження ОА, досить великий (табл. 9.1). Ці показники можна умовно розділити на суб’єктивні (показники болю, функціональної здатності, якості життя) і об’єктивні —характеризують прогресування хвороби (за даними рентгенографії, МРТ, артроскопії, УЗД, радіоізотопного сканування; БМ).
Таблиця 9.1
Перелік імовірних показників для використання в клінічних дослідженнях при ОА (за: Bellamy N., 1997, зі змінами)
| Показник | Гонартроз | Коксартроз | ОА кистей | Генералізований ОА |
| І. Клінічні | ||||
Біль
|
+
+ |
+
+ |
+
+ |
+
+ |
Ранкова скутість
|
+
+ |
+
+ |
+
+ |
+
+ |
| Почервоніння шкіри над суглобом | — | — | ? | — |
Фізична активність
|
—
+ ? + — — |
—
+ ? — + + |
+
— — — — — |
—
? ? — — — |
Припухлість суглоба
|
—
? + |
—
— — |
—
? ? |
?
— — |
Оцінка здоров’я
|
+
+ — — + + + + |
+
+ — — + + + + |
—
— + + + + + + |
—
— — — + + + + |
Оцінка якості життя
|
?
? ? ? |
?
? ? ? |
?
? ? ? |
?
? ? ? |
| II. Інструментальні | ||||
Рентгенографія
|
+
+ |
+
+ |
+
+ |
?
? |
| МРТ | ? | ? | ? | — |
| Сцинтиграфія | ? | ? | ? | ? |
| УЗД | ? | ? | ? | ? |
| Артроскопія | + | ? | ? | ? |
БМ
|
?
? ? ? ? ? ? |
—
— — — — — ? |
—
— — — — — ? |
—
— — — — — ? |
«+» рекомендований; «—» не рекомендований; «?» використання сумнівне; СР — синовіальна рідина.
Біль. Найчастіше для оцінки больового синдрому у хворих на ОА використовують візуальну шкалу болю (ВАШ Хаскісона) і шкалу Лікерта (Huskisson E.S., 1982; Bellamy N., 1993a). Результати численних досліджень продемонстрували їхню високу інформативність (Bellamy N., 1993b–d). Перша являє собою вертикальну або горизонтальну пряму довжиною 10 см (0 см — немає болю, 10 см — максимально виражений біль), друга — таку ж пряму, на якій відкладені «бали болю» від 0 (немає болю) до 5 (максимально виражений біль) (див. главу 12). Варіанти класичних аналогових шкал — хроматична аналогова шкала (Grossi E. et al., 1983), Анкета болю МакГілла (Melzack R., 1975) та інші — рідко використовуються в клінічних дослідженнях ОА. Так як біль є суб’єктивним симптомом, його вираженість на відповідній шкалі пацієнт повинен позначати сам.
Ранкова скутість у хворих на ОА — симптом непостійний; порівняно з хворими на РА її тривалість значно коротша (не більше 30 хв). Тому вона має менше значення в оцінці статусу хворого на ОА, ніж, наприклад, біль у суглобах. N. Bellamy і W.W. Buchanan (1986) запропонували пацієнтам з ОА самим оцінити важливість цього симптому. Більшість хворих визнали ранкову скутість помірно важливим симптомом. Враховуючи невелику тривалість цього симптому, доцільно оцінювати його тяжкість, а не тривалість (на відміну від РА). Для полегшення оцінки аналогові шкали (див. главу 12) адаптовані для показника ранкової скутості (Bellamy N., 1993b, c, d).
Час проходження 50 футів. Цей показник застосовується тільки при дослідженні хворих на ОА суглобів нижніх кінцівок. Результати дослідження, проведеного N. Bellamy і W.W. Buchanan (1984), показали, що навіть у хворих на гонартроз і коксартроз цей показник малоінформативний, тому використання показника часу проходження 50 футів у клінічних дослідженнях у хворих на ОА сумнівне (Bellamy N., 1993b, c, d).
Аналогічно попередньому показник часу підйому по сходах застосовується лише при ураженні суглобів нижніх кінцівок. Для нього не визначені стандарти (наприклад необхідна кількість сходів). Крім того, ряд супутніх хвороб (серцево-судинні захворювання, хвороби нервової системи) можуть значно впливати на виконання цього тесту. Таким чином, використання показника часу підйому по сходах при ОА також недоцільне (Bellamy N., 1997).
Визначення обсягу рухів у хворих на ОА придатне тільки для колінного суглоба. Обмежений обсяг рухів у колінному суглобі може відображати не тільки зміни в суглобовому хрящі, але й у суглобовій капсулі, навколосуглобових м’язах, зв’язковому апараті. При згинанні кінцівки в колінному суглобі взаємне розміщення осей стегнової та великогомілкової кісток змінюється таким чином, що стандартний механічний гоніометр не зможе правильно виміряти кут. Однак відповідним чином підготовлений фахівець може грамотно виміряти кути згинання та розгинання в колінному суглобі, у такому випадку цей тест можна включити до протоколу дослідження (Bellamy N., 1993b, c, d). Необхідно зауважити, що в клінічних дослідженнях виявлена статистично значима різниця обсягів рухів у колінному суглобі між хворими, що одержували активне лікування (НПЗП) і плацебо (Bellamy N., Buchanan W.W., 1984).
Відстань між щиколотками при максимальному розведенні нижніх кінцівок. Цей тест, що характеризує обсяг приведення в кульшовому суглобі, може бути досить інформативним, якщо проводиться вмілим фахівцем (Bellamy N., 1993b, c, d). Його інформативність продемонстрована в дослідженнях ефективності НПЗП у хворих на коксартроз (Bellamy N., Buchanan W.W., 1984). Однак, подібно до інших показників геометрії суглобів, цей тест не рекомендується використовувати в клінічних дослідженнях.
Відстань між медіальними виростками стегнових кісток при максимальному розведенні нижніх кінцівок — багатоплановий тест, що характеризує обсяги приведення та зовнішньої ротації в кульшових суглобах і обсяг згинання в колінних — може бути інформативним тільки у випадку виконання підготовленим фахівцем (Bellamy N., 1993b, c, d). Аналогічно попередньому інформативність цього показника продемонстрована в клінічному дослідженні застосування НПЗП при ОА (Bellamy N., Buchanan W.W., 1984). Необхідність включення цього тесту до протоколу дослідження сумнівна.
Індекс Дойла являє собою адаптований індекс Річі, розроблений спеціально для РА та ОА (Doyle D.V. et al., 1981). Методика тесту включає оцінку по бальній системі чутливості суглобів при їхній пальпації, при рухах у них, а також оцінку припухлості суглоба. За незрозумілих причин він не викликав інтересу у ревматологів, його інформативність ніхто не визначав. Не виключено, що після проведення додаткових досліджень індекс Дойла буде рекомендований для включення до протоколу клінічних досліджень пацієнтів з генералізованим ОА.
Оцінка припухлості суглоба є суперечливою, оскільки у хворих на ОА вона може бути зумовлена не тільки набряклістю м’яких тканин, але й розростанням кісткової. У першому випадку на фоні лікування можна чекати динаміку відповідних показників, у другому — ні. Незважаючи на те що вимірювання окружності суглобів у сантиметрах було включене до протоколу декількох досліджень (Bellamy N., Buchanan W.W., 1984; Bellamy N., 1993e), інформативність цього тесту обмежена і залежить від ступеня підготовленості дослідника. Вимірювання окружності застосовують лише до колінних суглобів і суглобів кистей. У першому випадку можна використовувати стандартну сантиметрову стрічку, у другому — спеціальні пластикові або дерев’яні кільця різних розмірів (Bellamy N., 1993e). Навіть у клінічних дослідженнях, при яких досвід використання цього тесту значно більший, його рідко включають до протоколу дослідження (Bellamy N., 1993b, c, d, e).
Оцінка кистьової сили за допомогою пневматичного динамометра рідко включається в протоколи дослідження ОА, імовірно, тому що ці дослідження рідко фокусуються на ОА кистей (Bellamy N., Buchanan W.W., 1984; Bellamy N., 1993e). Цей тест, безумовно, повинен виконувати спеціально підготовлений дослідник (Bellamy N., 1993b, c, d). При захваті щипком динамометра I і II пальцями можна окремо оцінити перший зап’ястково-п’ястковий суглоб кисті хворого при ураженні ОА. Складність інтерпретації динаміки показника кистьової сили знижує цінність тесту для клінічних досліджень.
Застосування анальгетиків. При оцінці ефективності симптоматичних препаратів, які застосовують у терапії ОА, головним критерієм є біль у суглобах. У таких випадках для додаткової оцінки динаміки больового синдрому використовують показник прийому анальгетиків. Зазвичай для цього застосовують парацетамол. Поряд з досліджуваним препаратом пацієнтові у ході дослідження рекомендують при необхідності приймати парацетамол з обов’язковим заповненням спеціально розробленого щоденника. Для додаткової оцінки впливу на больовий синдром препаратів, що не належать до групи симптоматичних (наприклад хондропротекторів), замість парацетамолу можна використовувати НПЗП із наступним перерахуванням прийнятої дози на еквівалент диклофенаку (табл. 9.2). Враховуючи більш високу частоту розвитку побічних ефектів при призначенні НПЗП, перевагу все-таки слід віддавати парацетамолу. Для об’єктивізації обліку знеболювальних препаратів розробляються спеціальні контейнери з мікрочіпом, поміщеним у кришку, який записує кількість відкривань контейнера.
Таблиця 9.2
Дози НПЗП, еквівалентні 150 мг диклофенаку (Рекомендації Міністерства охорони здоров’я Франції по проведенню клінічних досліджень ОА, цит. за: Mazieres B. et al., 1992)
| НПЗП | Доза, еквівалентна 150 мг диклофенаку, мг |
| Напроксен | 1100 |
| Ібупрофен | 2400 |
| Індометацин | 100 |
| Флурбіпрофен | 300 |
| Кетопрофен | 300 |
| Піроксикам | 20 |
Загальна оцінка. Таким методом можна оцінити:
- ефективність лікування;
- переносимість лікування;
- функціональну здатність хворого;
- вираженість больового синдрому.
Перші три пункти незалежно один від одного оцінюють лікар і хворий, останній — тільки хворий. Зазвичай загальна оцінка здійснюється по бальній системі (табл. 9.3, 9.4).
Таблиця 9.3
Загальна оцінка ефективності лікування лікарем і пацієнтом (приклад)
| Бал | Оцінка |
| 4 | Значне поліпшення |
| 3 | Помірне поліпшення |
| 2 | Незначне поліпшення |
| 1 | Відсутність динаміки |
| 0 | Погіршення |
Таблиця 9.4
Загальна оцінка переносимості лікування лікарем і пацієнтом (приклад)
| Бал | Переносимість |
| 4 | Відмінна |
| 3 | Добра |
| 2 | Задовільна |
| 1 | Незадовільна |
Оцінка здоров’я. Методи оцінки здоров’я хворих на ОА можна розділити на специфічні та генеричні (Bellamy N., 1997). Такий розподіл трохи штучний, однак він дозволяє диференціювати методи, що використовуються для всіх суглобів одночасно (специфічні) і для окремих суглобових груп (генеричні).
Індекс WOMAC (Western Ontario and McMaster Universities osteoarthritis Index). Тест WOMAC являє собою анкету для самостійного заповнення хворим, складається з 24 питань, що характеризують вираженість болю (5 питань), скутість (2 питання) і функціональну здатність (17 питань) хворих на гонартроз і коксартроз (Bellamy N. et al., 1988). Для заповнення анкети WOMAC потрібно 5–7 хв. Індекс WOMAC — високоінформативний показник, який можна використовувати для оцінки ефективності медикаментозного і немедикаментозного (хірургічного, фізіотерапевтичного) лікування.
Альгофункціональні індекси Лекена. M. Lequesne розробив два альгофункціональні індекси — для ОА колінного і кульшового суглобів (Lequesne M.G. et al., 1987; 1997). Тести Лекена також являють собою анкети для самостійного заповнення хворим, питання розділені на три групи — біль або дискомфорт, максимальна дистанція ходьби та повсякденна активність (див. главу 12). Питання, що стосується сексуальної сфери хворого, включене автором в анкету для коксартрозу, не обов’язкове для дослідження ефективності протиревматичних препаратів (Bellamy N., 1997). Індекси Лекена були рекомендовані EULAR (European League Against Rheumatism) у якості критерію ефективності при проведенні клінічних досліджень у хворих на ОА (WHO, 1985), а поряд з індексом WOMAC — для оцінки ефективності так званих повільно діючих препаратів (SADOA (Slow Acting Drug in Osteoarthritis)) (Lequesne M.G. et al., 1994). Статистично інформативність і надійність індексів WOMAС і Лекена однакова (Bellamy N., 1995).
Альгофункціональний індекс Драйзера розроблений спеціально для клінічних досліджень при ОА суглобів кистей, являє собою анкету з десяти пунктів (Dreiser R.L. et al., 1995). Дев’ять із десяти питань стосуються функції суглобів кистей, а десятий (наскільки охоче пацієнт відповідає на рукостискання) скоріше відбиває вираженість больового синдрому. Індекс Драйзера — відносно новий і маловивчений тест, тому до з’ясування ступеня його інформативності та надійності краще не включати його до протоколу дослідження.
Анкета оцінки здоров’я (HAQ — Health Assessment Questionnaire) розроблена в Стенфордському університеті J.F. Fries та співавторами (1978), тому має ще й другу назву — Стенфордська анкета.
HAQ — один із перших методів, спеціально розроблених для вивчення в проспективних і перехресних дослідженнях довгострокового впливу різних хронічних хвороб на стан здоров’я пацієнтів. HAQ як кількісний метод, що характеризується надійністю, обґрунтованістю й достатньою демонстративністю, відіграє значну роль в оцінці кінця хронічних хвороб.
Оскільки Стенфордська анкета має ревматологічне походження, іноді її розглядають як специфічну для ОА, хоча її структура, зміст і досвід застосування ставлять під сумнів це твердження. HAQ скоріше є генеричним, ніж специфічним інструментом, оскільки дозволяє оцінити функціональну недієздатність, побічні ефекти препаратів, економічні витрати та інші аспекти, кожний з яких не характерний для будь-якої хвороби.
HAQ існує у трьох форматах: повному (розширеному), короткому (2-сторінковому) і модифікованому. Перший (класичний) формат анкети останнім часом майже не використовується. Для оцінки здоров’я найчастіше застосовують короткий (short or 2-page HAQ) і модифікований (mhaq) формати (див. главу 13).
Повний HAQ дозволяє зібрати інформацію з 5 показників здоров’я:
- недієздатність (disability);
- біль або дискомфорт;
- побічна дія лікування;
- вартість лікування;
- відстрочення смерті.
Також анкета містить додаткові показники: демографічна інформація, спосіб життя і звички.
2-сторінкова анкета HAQ складається з індексу недієздатності HAQ (HAQ Disability Index, HAQ-DI), ВАШ болю та ВАШ загальної оцінки здоров’я пацієнтом.
HAQ-DI оцінює ступінь функціональної здатності пацієнта та включає 20 питань, розділених на 8 категорій, що характеризують рух у верхніх і нижніх кінцівках. Кожне питання побудоване за схемою «Чи здатні ви виконати ту або іншу дію протягом останнього тижня?». Відповіді пацієнта являють собою 4-бальну шкалу від 0 (дієздатність збережена) до 3 (повністю недієздатний). У результаті HAQ-DI являє собою середнє арифметичне отриманих відповідей. ВАШ болю призначена для оцінки наявності або відсутності болю, пов’язаного з артритом, і ступеня його тяжкості за останній тиждень.
Найпоширенішим форматом Стенфордської анкети є її модифікований варіант, що складається з 8 питань, відповіді на які також оцінюються за 4-бальною шкалою (див. главу 13).
Дані клінічних досліджень свідчать про те, що мінімальною клінічно значимою різницею для HAQ є зміна на 0,22 бала (B. Bruce, J.Fries, 2003).
Однак HAQ має ряд недоліків, наприклад, за допомогою анкети неможливо оцінити недієздатність при дисфункції органів чуття або в психіатричній практиці, задоволеність пацієнта і його соціальні зв’язки.
HAQ зазвичай використовують для оцінки здоров’я пацієнта з генералізованим ОА.
AIMS (Arthritis Impact Measurement Scale) розроблена R.F. Meenan та співавторами (1980). 46 питань анкети AIMS розділені на 9 категорій — рухливість, фізична активність, спритність, соціальна роль, соціальна активність, повсякденне життя, біль, депресія, занепокоєння (див. главу 12). G. Griffiths та співавтори провели порівняльне дослідження анкет WOMAС, HAQ і AIMS та виявили деяку перевагу першої. Автори рекомендують використовувати анкету WOMAC у дослідженнях ОА колінного та/або кульшового суглоба, а анкети HAQ і AIMS — у дослідженнях генералізованого ОА.
KOOS (Knee injury and Osteoarthritis Outcome Score (Roos E.M., Lohmander L.S., 2003) являє собою специфічний для колінного суглоба опитувальник, створений для оцінки різного роду уражень колінних суглобів (ОА, травми) і результатів протезування (Roos E.M., Toksvig-Larsen S., 2003). Основою для його створення стало те, що травми суглобів зазвичай супроводжують ушкодження багатьох структур (зв’язок, менісків, хряща та ін.), а результатом травм колінного суглоба часто буває ОА. На думку авторів, KOOS дозволяє спостерігати пацієнта, стежити за еволюцією симптомів, функцій і т.д. протягом тривалого часу після травми.
Анкета KOOS складається з 42 питань, розділених на 5 груп:
P — біль (9 питань);
S — симптоми (7 питань);
ADL — обмеження повсякденної життєдіяльності (17 питань);
SP — спорт і розваги (5 питань);
QOL — якість життя, пов’язана з колінним суглобом (4 питання).
Відповіді на запитання в анкеті КOOS можна кодувати у вигляді ВАШ Лікерта (0–4) або у вигляді 10 см, або 100 мм ВАШ (див. главу 13).
HOOS (Hip Disability and osteoarthritis outcome score). Для оцінки результатів протезування кульшових суглобів на сьогодні існує більше 20 скорінгових систем. Для високочутливої та специфічної оцінки клінічних змін через деякий час після тотальної артропластики кульшових суглобів A.K. Nilsdotter та співавтори (2003) розробили на основі WOMAC LK 3.0 і KOOS спеціальний опитувальник HOOS. Останній складається з 5 рубрик (усього 50 питань), що дозволяють оцінити:
Р — біль (12 питань);
S — симптоми, включаючи скутість і обсяг руху в суглобах (10 питань);
АDL — обмеження повсякденної життєдіяльності (18 питань);
SP — спорт і розваги (6 питань);
QOL — якість життя, пов’язану з кульшовим суглобом (4 питання).
Відповіді на запитання у анкеті HOOS можна також кодувати у вигляді ВАШ Лікерта (0–4) або у вигляді 10 см, або 100 мм ВАШ (див. главу 13).
HOOS включає всі питання WOMAC LK 3.0 у незміненому вигляді, що дозволяє одночасно оцінити статус пацієнта за WOMAC.
FSI (Functional Status Index) розроблений A.M. Jette, O.L. Deniston (1978) як частина Pilot Geriatric Arthritis Project. Існують дві версії FSI: класична, що складається з 45 питань, класифікованих на три категорії (залежність, біль, повсякденна активність), для заповнення якої потрібно 60–90 хв, і скорочена (переглянута), що складається з 18 питань, розділених на 5 груп (загальна рухливість, рухливість кисті, самообслуговування, робота по будинку, міжособистісні контакти), для заповнення якої потрібно 20–30 хв. Особливістю FSI є обов’язкова участь особи, що опитує (лікаря, дослідника), при заповненні анкети. FSI можна використовувати при проведенні клінічних досліджень у пацієнтів з генералізованим ОА, хоча перевагу все-таки слід віддавати HAQ і AIMS.
Якість життя. В останні роки оцінка якості життя хворого стала надзвичайно важливою і актуальною частиною оцінки якості лікування та кінця хвороби. Для популяції пацієнтів із хронічними захворюваннями оцінка якості життя дає можливість визначити вплив лікувальних програм у випадках, коли лікування неможливе.
QOLS (Quality of Life Scale). Автором першої шкали якості життя є американський психолог Джон Фланаган (Flanagan J.C., 1978). За останні 20 років створено кілька сотень різних методик оцінки якості життя (із більшістю з них можна ознайомитися на сайті www.qolid.org). На думку P.M. Fayers та співавторів (1997), за рідкісним винятком сучасні методи оцінки якості життя є скоріше випадковими ознаками якості життя.
На сьогодні назріла необхідність, щоб лікарі знали про існування поняття концептуального визначення якості життя й не плутали його з функціональним статусом, симптомами, природним перебігом хвороби або побічними ефектами лікування (Leplege A. et al., 1997; Anderson K.L. et al., 1999; Haas B.K., 1999; Smith K.W. et al., 1999). Загальноприйняте визначення якості життя усе ще перебуває в стадії розробки. Найбільш вдалим, на наш погляд, є визначення D.A. Revicki та співавторів (2000): «Якість життя являє собою широкий спектр подій, що належать до загального благополуччя людини. Вона має на увазі суб’єктивну оцінку функціонування порівняно з особистими очікуваннями та визначається суб’єктивною оцінкою подій, станів і сприйняттів. За своєю природою якість життя індивідуальна, однак інтуїтивно піддається інтерпретації й розумінню більшістю людей». Це визначення виводить за рамки здоров’я поняття якості життя. Перша шкала якості життя (Quality of Life Scale), розроблена Д. Фланаганом, найбільш точно підходить під це визначення (Flanagan J.C., 1978, 1982).
Оригінальна шкала Фланагана складалася з 15 пунктів, які дозволяли виміряти 5 концептуальних областей якості життя: матеріальне і фізичне благополуччя, взаємини з іншими людьми, соціальну, суспільну та цивільну діяльність, особистий розвиток і почуття задоволення, розваги (табл. 9.5). Пізніше Фланаган увів у свою шкалу ще одну категорію — незалежність, тобто можливість обходитися без сторонньої допомоги в побуті. Для розробки шкали Д. Фланаган у середині 70-х років ХХ ст. обстежив близько 3000 осіб різного віку, статі, раси, рівня освіти з усіх регіонів США. Фланаган додавав максимум зусиль для того, щоб серед опитаних були представлені етнічні меншості, жителі сільської місцевості, діти, представники категорії населення з низьким матеріальним статком. За словами самого Д. Фланагана, метою охоплення широких верств населення було не отримання точних даних, а бажання переконатися у тому, що в шкалі враховані різні точки зору й досвід (Flanagan J.C., 1982). До сьогодні ніякий інший метод оцінки якості життя, крім QOLS Д. Фланагана, не створювався з такою винятковою увагою до різноманіття та індивідуальності аспектів якості життя.
Таблиця 9.5
Quality of Life Scale Д. Фланагана: оригінальні концептуальні категорії та пункти (Flanagan D., 1978)
| Концептуальні категорії | Пункти шкали |
| Матеріальне і фізичне благополуччя | Матеріальне благополуччя та фінансова безпека
Здоров’я і особиста безпека |
| Взаємини з іншими людьми | Відносини з батьками, братами/сестрами, іншими родичами
Наявність дітей, їх виховання Відносини з чоловіком/дружиною або дуже близьким другом/подругою Відносини з друзями |
| Соціальна, суспільна та цивільна діяльність | Діяльність, пов’язана з допомогою і підтримкою інших людей
Діяльність, пов’язана з місцевим або національним управлінням |
| Розвиток особистості та почуття задоволення | Інтелектуальний розвиток
Особисте розуміння Професійна роль Креативність і самовираження |
| Розваги | Спілкування
Пасивний відпочинок Активний відпочинок, участь у розважальних заходах |
Другим кроком Д. Фланагана до створення свого інструмента оцінки якості життя стало обстеження 3000 людей віком 30, 50 і 70 років з використанням 5-пунктової шкали важливості і задоволення потреби. У результаті виявилося, що опитані особи незалежно від віку і статі вважали задані їм питання важливими, за винятком пунктів, що стосуються участі в місцевому або національному управлінні (більшість 30-літніх вважали це не істотним), а також креативність і самовираження, спілкування та пасивний відпочинок (більшість чоловіків вважали не істотним) (Flanagan J.C., 1982).
Розбудовуючи концепцію оцінки якості життя, професор Д. Фланаган допускав, що його шкала потребує деякої адаптації для хронічних хворих, і в 1981 р. він дав на це авторський дозвіл. Новий метод одержав назву «Адаптована шкала якості життя (Adapted Quality of Life Scale) або шкала якості життя Фланагана» (Flanagan Quality of Life Scale) (Flanagan J.C., 1982; Burckhardt C.S. et al., 2003).
До сьогодні розроблено кілька методів оцінки якості життя. У клінічних дослідженнях у хворих на ОА частіше використовують Short Form-36 (SF-36) Health Status Questionnaire (Ware J.E. et al., 1992), EuroQol (Hurst N.P. et al., 1994), Health Utilities Index (Feeny D. et al., 1992) і Nottingham Health Profile (Hunt S.M. et al., 1981).
Short Form-36 (SF-36) Health Status Questionnaire (Ware J.E. et al., 1992) складається з 36 питань для самостійного заповнення пацієнтом протягом 5 хв (див. главу 13). SF-36 і наведена нижче анкета EuroQol розроблені таким чином, що вони можуть бути заповнені інтерв’юером по телефону або розіслані хворим поштою.
EuroQol (European Quality of Life Questionnaire) (Hurst N.P. et al., 1994) складається із двох частин — безпосередньо опитувальника з 5 питань і ВАШ, по якій пацієнт оцінює стан свого здоров’я (див. главу 13).
Анкета Health Utilities Index (HUI) (Feeny D. et al., 1992) була спільно розроблена Health Utility Inc. і університетом McMaster. Перша версія HUI (HUI I) була створена спеціально для оцінки кінця у немовлят з дефіцитом маси тіла. Ґрунтуючись на цьому досвіді, автори почали розробку HUI II, розрахованої спеціально на дітей зі злоякісними пухлинами, що відображає все різноманіття форм і наслідків раку. Надалі HUI II знайшла своє застосування у різних пацієнтів: від хворих з пухлинами до пацієнтів із хворобою Альцгеймера. Розробляючи HUI III, автори прагнули створити інструмент для оцінки якості життя, який застосовують як у клінічних випробуваннях, так і в дослідженнях загальної популяції населення (Horsman J. et al., 2003).
HUI являє собою шкалу з 8 показників (зір, слух, мова, ходьба, спритність, емоції, когнітивна здатність, біль), які стандартизовано оцінюються за 4–6-бальною шкалою (див. главу 13). Для кількісної обробки отриманих результатів використовуються спеціальні таблиці перерахування, які також наведені в главі 13. Існують два методи перерахування HUI — моноатрибутивна (HUI Single-Attribute Utility Function) і мультиатрибутивна (HUI Multi-Attribute Utility Function) функції корисності. Перший метод дуже простий у використанні: сума балів, відповідних до рівнів кожної ознаки стану здоров’я, і є індексом HUI. Останній — оцінюють за динамікою, його зміна на ≥0,05 бала вважається клінічно значущою (Horsman J. et al., 2003). Існують дані, які свідчать про те, що значущою може бути зміна HUI навіть на 0,03, а в деяких випадках — і на 0,01 бала (Drummond M., 2001). При використанні мультиатрибутивної системи перерахування підсумковий індекс являє собою точку «Смерть» на шкалі (0 балів), а ідеальний стан здоров’я відповідає 1 балу.
Найчастіше HUI використовують у проспективних дослідженнях як засіб кількісного і якісного опису стану здоров’я. Цю анкету дуже рідко застосовують для оцінки якості життя хворих ревматичного профілю. Зазвичай перевагу віддають SF-36, рідше — EuroQol.
Анкета Nottingham Health Profile (Hunt M. et al., 1981) включає 38 пунктів, розділених на 6 секцій: рухливість, біль, сон, соціальна ізоляція, емоційні реакції, рівень активності. Цю анкету хворий може заповнювати самостійно. Як і попередню анкету, Nottingham Health Profile вкрай рідко використовують у ревматології.
На жаль, на сьогодні не існує специфічної для ОА анкети, що дозволяє оцінити якість життя хворого. Зазвичай у клінічних дослідженнях з цією метою використовують анкети SF-36, її модифікації та EuroQol, рідше — інші анкети. Основним їхнім недоліком є неспецифічність для ОА та обмежена клінічна значимість. Так, результати анкетування можуть продемонструвати статистично значиму або незначиму зміну якості життя у процесі прогресування хвороби або на фоні лікування, а також відмінність якості життя і її компонентів у хворих на ОА та пацієнтів з іншими ревматичними або неревматичними хворобами, а також здорових осіб. Водночас неможливо визначити, наскільки змінилася якість життя у пацієнта з SF-36, що становлять 30,4 бала, або індексом EuroQol 1,2 бала.
Мінімальна клінічно значима різниця
Інформативність цього показника для аналізу оцінювання пацієнтами з ОА та РА болю, активності хвороби, загального стану здоров’я була підтверджена в численних дослідженнях (Goldsmith S. et al., 1993; Wells G.A. et al., 1993; Guyatt G. et al., 1998; Sloan J. et al., 2003).
Методи визначення мінімальної клінічно значимої різниці для анкет, що використовують відповіді пацієнтів, можна розділити на 2 категорії (Samsa D. et al., 1999):
- якірні, або засновані на безпосередніх спостереженнях («якорем» у цьому випадку можуть виступати нормативні дані або результати, отримані в рандомізованому клінічному дослідженні з використанням іншого критерію ефективності, та ін.) (Zhao S.Z. et al., 1999; Enrich E.W. et al., 2000);
- розподільні, або засновані на методі статистичного розподілу.
Якірний метод може бути прямим, проспективним і перехресним. При використанні прямого якірного методу пацієнтів опитують, щоб оцінити відносну різницю між двома станами здоров’я (наприклад без змін vs трохи покращилося або трохи погіршилося). Кожному зі станів властивий певний бал, різниця між якими — мінімальна клінічно значима. При перехресному підході порівнюють показник якості життя двох популяцій з різним ступенем вираженості хвороби. У цьому випадку мінімальна клінічно значима різниця являє собою різницю між цими показниками. Проспективний метод дає можливість розрахувати мінімальну клінічно значиму різницю на основі зіставлення показників стану здоров’я пацієнтів на початку та наприкінці певного періоду спостереження.
Методи візуалізації. До сьогодні ні для однієї лікарської речовини не доведені хондропротективні властивості, які визначені як здатність сповільнювати, зупиняти або обертати дегенеративний процес в гіаліновому хрящі у хворих на ОА (Lequesne M.G. et al., 1994; Bellamy N., 1997). Багато в чому це пояснюється тим, що питання про спосіб ідентифікації феномену хондропротекції і можливості в цьому плані рентгенографії або альтернативних методів (артроскопія, МРТ) дотепер широко не обговорювалося.
Рентгенографія. В останні роки з’явилася велика кількість публікацій, присвячених рентгенографії суглобів, уражених ОА (див. главу 7). Удосконалено методики зйомки, з’явилася безліч кількісних (вимірювання ширини суглобової щілини) і напівкількісних (оцінка в балах, ступенях) методів оцінки рентгенограм у хворих на ОА. При проведенні великих контрольованих досліджень рентгенографія — найкращий метод візуалізації, який може опосередковано охарактеризувати динаміку морфологічних змін у тканинах суглоба, ураженого ОА.
Використання МРТ у контрольованих дослідженнях при ОА обмежене високою ціною та малою доступністю. Більше того, є дані про лише часткову конкордантність ушкоджень суглобового хряща, що виявляють на МРТ і при артроскопії (Adams M.E. et al., 1991). L. Pilch та співавтори (1994) виявили помилки в програмному забезпеченні комп’ютера, що використовувався для волюметричних досліджень суглобового хряща при ОА. Таким чином, необхідне подальше вивчення можливостей МРТ при проведенні клінічних досліджень хворих на ОА.
P. Dieppe та співавтори (1993) підтвердили здатність сцинтиграфії в прогнозуванні звуження суглобової щілини при ОА. Однак її роль в оцінці динаміки морфологічних змін у тканинах уражених суглобів при проведенні клінічних досліджень залишається сумнівною.
S.L. Myers та співавтори (1995) in vitro продемонстрували, що високочастотне УЗД забезпечує точне вимірювання товщини суглобового хряща людини, а також відтворює точне зображення його поверхні. Крім того, УЗД — досить доступний метод, не пов’язаний з променевим навантаженням. Однак здатність визначати хондропротекторні властивості лікарських речовин за допомогою УЗД не доведена. Потрібне подальше вивчення можливостей УЗД у цьому напрямку.
Артроскопія дає найбільш достовірну інформацію про стан суглобового хряща і тканин порожнини суглоба. Розроблена велика кількість систем оцінки хондроскопії (див. главу 7). Незважаючи на це, висока інвазивність методу різко обмежує його використання в клінічних дослідженнях.
БМ, а також їх переваги і недоліки докладно описані в главі 8.
Різні ревматологічні та неревматологічні організації (наприклад EULAR, FDA (Food and Drug Administration), SADOA, ORS (Osteoarthritis Research Society)) опублікували рекомендації з дизайну досліджень ОА (табл. 9.6). На сьогодні найбільш широке розповсюдження отримали рекомендації OMERACT III (Outcome Measures in Arthritis Clinical Trials) і рекомендації ORS щодо дизайну та проведення клінічних досліджень при ОА.
Таблиця 9.6
Рекомендації з дизайну клінічних досліджень ОА (за: Bellamy N., 1995)
| Рекомендації | Показник |
| EULAR |
|
| FDA |
|
| SADOA |
|
OMERACT III
Основним результатом першої конференції OMERACT (OMERACT I), яка відбулася у 1992 р., була розробка рекомендацій з проведення клінічних досліджень при РА. Саме ці рекомендації лягли в основу критеріїв поліпшення РА, що з’явилися пізніше. У ході наступної конференції OMERACT II розглядалися питання вимірювання токсичності лікарських препаратів, які використовуються в лікуванні ревматичних хвороб, оцінки якості життя хворих ревматичного профілю та питання фармакоекономіки. Третя конференція OMERACT (1996) закінчилася розробкою рекомендацій з проведення клінічних досліджень при ОА та остеопорозі.
Із усього вищесказаного зрозуміло, що рух OMERACT вийшов за межі вивчення РА, що було споконвічно відображено в його назві. Тому було запропоновано перейменувати його в OMR (Outcome Measures in Rheumatology), а після включення остеопорозу — в OMMSCT (Outcome Measures in Musculoskeletal Clinical Trials). Головним чином через благозвучність першої абревіатури було вирішено залишити назву OMERACT.
Ще до початку конференції учасникам запропонували заповнити анкети для визначення показників, які потенційно могли б бути критеріями ефективності при проведенні клінічних досліджень ОА. Потім була запропонована інша анкета, у якій учасників просили ранжирувати за значимістю показники залежно від локалізації ОА (колінного, кульшового суглобів, суглобів кистей і генералізований ОА), від класу досліджуваних лікарських препаратів (симптоматичні або ті, що модифікують структуру хряща), від класу показників (клінічні, інструментальні та БМ). Друге завдання виявилося складним, оскільки лише 15 заповнених анкет були повернуті в секретаріат конференції.
Уже в ході OMERACT III учасники конференції мали запропонувати перелік показників (табл. 9.7) для включення їх в:
- основний перелік критеріїв ефективності (обов’язковий для клінічних досліджень III фази хворих на ОА колінних, кульшових суглобів, суглобів кистей);
- додатковий перелік критеріїв ефективності (тобто тих, які в майбутньому можуть бути включені в основний);
- перелік критеріїв, які не ввійдуть ні в основний, ні в додатковий.
Таблиця 9.7
Переваги учасників OMERACT III при складанні переліку критеріїв ефективності для клінічних досліджень ІІІ фази у хворих на гонартроз, коксартроз і ОА суглобів кистей (за: Bellamy N. et al., 1997)
| Показник | Кількість, що проголосували за включення, % | Кількість, що проголосували проти включення в обидва переліки, % | Загальна кількість, що голосували | |
| в основний перелік | у додатковий перелік | |||
| Біль | 100 | 0 | 0 | 75 |
| Фізична функція | 97 | 1 | 1 | 76 |
| Візуалізація* | 92 | 7 | 1 | 76 |
| Загальна оцінка хворим | 91 | 1 | 1 | 75 |
| Загальна оцінка лікарем | 52 | 21 | 27 | 73 |
| Якість життя | 36 | 58 | 6 | 69 |
| Ранкова скутість | 14 | 61 | 25 | 72 |
| Інші** | 13 | 69 | 19 | 16 |
| Запалення | 8 | 70 | 22 | 74 |
*Стандартна рентгенографія; після демонстрації переваг порівняно з рентгенографією — інші методи (МРТ, УЗД та ін.).
**Наприклад, болісність при пальпації, активних і пасивних рухах; кількість загострень, БМ.
Після оприлюднення результатів голосування (див. табл. 9.6) виникли кілька важливих питань, що вимагали розв’язання (Bellamy N. et al., 1997):
1. Чи є генералізований ОА окремим від інших форм захворювання об’єктом для клінічного дослідження? (Резолюція — надалі генералізований ОА не розглядати в якості об’єкта для клінічного дослідження).
2. Чи визначає час початку дії досліджуваної лікарської речовини необхідність різних критеріїв ефективності? (Резолюція — час початку дії визначає скоріше коли досліджувати, ніж що досліджувати).
3. Чи вимагають дослідження ефективності простих анальгетиків та НПЗП різних критеріїв? (Резолюція — групи критеріїв ті самі, а методи їх визначення можуть варіювати).
4. Чи повинні бути різними критерії ефективності для симптоматичних лікарських препаратів (symptom modifying drugs) і препаратів, що модифікують структуру хряща (structure modifying drugs)? (Резолюція — групи показників, що входять в основний перелік, повинні бути однаковими).
5. Передбачається, що БМ у майбутньому будуть важливою частиною протоколу клінічного дослідження ОА, однак на сьогодні переконливих даних, що свідчать про значення БМ в оцінці ефективності лікування хворих, а також про їхнє прогностичне для ОА значення недостатньо.
6. Було визнано, що ні для одного з існуючих методів оцінки якості життя не продемонстровано переваг порівняно з іншими. Відзначена важливість оцінки якості життя при проведенні клінічних досліджень при ОА. (Резолюція — не включати оцінку якості життя в основний перелік критеріїв ефективності, але рекомендувати її використовувати при проведенні досліджень III фази тривалістю не менше 6 міс; у найближчі 3–5 років визначити роль показника якості життя при проведенні клінічних досліджень).
7. Було відзначено, що не виключається використання в майбутньому при дослідженні ефективності щойно створених препаратів тих критеріїв, які не ввійшли в основний і додатковий переліки.
8. Чи необхідно включати симптом скутості у будь-який із переліків критеріїв ефективності; чи належить біль і скутість до однієї й тієї ж групи показників; чи розуміють хворі на ОА саму концепцію скутості; наскільки існуючі методи здатні оцінити скутість? (Резолюція — для оцінки скутості у хворих на ОА колінного або кульшового суглоба слід використовувати WOMAC або індекс Лекена).
9. Обговорювалося питання інформативності показника «загальна оцінка лікаря» при проведенні клінічних досліджень у хворих на ОА (аналогічну проблему обговорювали в ході OMERACT I відносно РА); незважаючи на те що лише 52% учасників конференції висловилися за включення його у основний перелік критеріїв ефективності, показник не був виключений.
При складанні переліку критеріїв вирішено включати не самі показники, а їх групи, залишаючи остаточний вибір методу оцінки за дослідником. Більше 90% учасників конференції OMERACT III висловилися за включення в основний перелік наступних показників (або їх груп) (рис. 9.1):
- біль;
- фізична функція;
- загальна оцінка хворим;
- методи візуалізації (при тривалості дослідження ≥1 рік у якості критерію ефективності та безпеки препаратів, що модифікують структуру хряща).
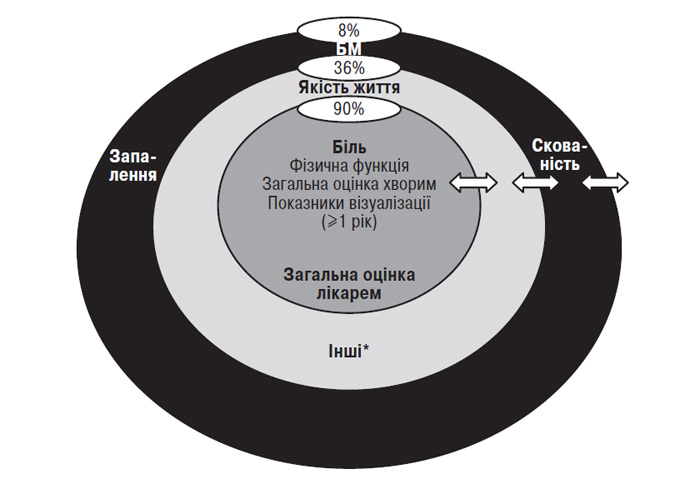
Рис. 9.1. Основна концепція OMERACT III (за: Bellamy N. et al., 1997). У білих овалах — кількість, що проголосували за включення в основний перелік критеріїв, у темно-сірому — основний перелік критеріїв, у світло-сірому — критерії вибору, настійно рекомендовані до включення в протокол дослідження, у чорному — критерії вибору (залежать від думки дослідника). *Інші критерії — скутість (за WOMAC або індексом Лекена), БМ, запалення, кількість загострень, застосування анальгетиків та ін.
ORS
В основі рекомендацій ORS є поділ протиартрозних препаратів, запропонований WHO і ILAR, на дві групи — симптоматичні (швидко- і повільнодіючі) і ті, що модифікують структуру хряща. Вочевидь, що демонстрація переваг цих препаратів багато в чому буде залежати від дизайну дослідження й обраних критеріїв ефективності. При цьому дизайн дослідження буде залежати від механізму дії лікарської речовини та очікуваного результату.
При плануванні дослідження необхідно враховувати наступні фактори:
- фармакодинаміку препарату;
- час від початку прийому препарату до появи ефекту;
- тривалість збереження ефекту, отриманого в результаті лікування, після скасування препарату;
- шлях застосування препарату (місцево, внутрішньо, парентерально та ін.);
- частоту й вираженість побічних ефектів;
- вплив на больовий синдром;
- вплив на запалення;
- вплив на інші симптоми хвороби.
Більшість членів комітету, що брали участь у вивченні цього питання, схилялися до думки, що відносно дизайну клінічних досліджень ОА немає необхідності розділяти симптоматичні препарати на два підкласи — швидко- і повільнодіючі (Altman R.D. et al., 1996). До перших належать ненаркотичні анальгетики та НПЗП, до других — препарати, для яких симптоматична дія не є основною, — гіалуронова кислота, хондроїтину сульфат, глюкозамін, діацереїн. Таким чином, у цих рекомендаціях термін «симптоматичні лікарські засоби» використовується як для швидко-, так і для повільнодіючих симптоматичних препаратів. При складанні протоколу дослідження слід мати на увазі, що симптоматичний препарат може мати властивості модифікувати структуру хряща (сприятливі та несприятливі).
Незалежно від впливу на симптоми хвороби препарат може виявляти дію на структуру або функцію ураженого суглоба. Протокол дослідження ефективності препаратів, що, імовірно, модифікують патологічний процес при ОА, повинен включати критерії, що відображають зміну структури суглоба. Такі препарати можуть:
- запобігати розвитку ОА та/або
- запобігати, сповільнювати прогресування наявного ОА або стабілізувати стан хворого.
Препарат, що володіє патогенетичною дією, не обов’язково повинен впливати на симптоми ОА. Симптоматичного ефекту такого препарату слід очікувати лише після тривалого періоду лікування. У мету дослідження ефективності препарату, що модифікує структуру хряща, не обов’язково включати вивчення його симптоматичного ефекту.
Препарати, потенційно здатні модифікувати структуру хряща, називають хондропротекторами, препаратами, що модифікують хворобу (Dmoads — Disease Modifying OA drugs), препаратами, що модифікують анатомію, препаратами, що модифікують морфологію, і т.д. (Altman R.D. et al., 1996). На жаль, немає єдиної думки щодо терміна, який найбільш повно відображав би дію цих агентів. ORS у своїх рекомендаціях використовує термін «препарати, що модифікують структуру», і відзначає, що до теперішнього часу ні для одного агента не доведені властивості модифікувати структуру хряща in vivo у людини.
Рівні клінічних досліджень ОА. У ході передклінічних досліджень вивчають потенційний механізм дії та терапевтичну широту (ефективна — токсична дози) препарату. Результати передклінічного дослідження можуть скоротити тривалість клінічного дослідження потенційного препарату, що модифікує структуру хряща.
I фаза клінічних випробувань. Вивчають фармакокінетику і безпеку препарату, іноді додатково — дози препарату. Залежно від поставлених завдань об’єктами дослідження зазвичай виступають здорові волонтери або хворі на ОА без супутньої патології. Оптимальним для вивчення безпеки випробуваного препарату в I фазі є подвійне сліпе плацебо-контрольоване дослідження з однієї або декількома дозами препарату. Оцінка ефективності лікування може виступати в якості другорядного завдання.
II фаза клінічних випробувань. Метою II фази є визначення ідеальної терапевтичної широти й режимів дозування досліджуваного препарату. Тривалість дослідження й кількість пацієнтів залежать від механізму дії препарату, тривалості його дії, критеріїв ефективності, які будуть використані в протоколі дослідження, варіабельності досліджуваних параметрів, а також популяції хворих. У цьому й наступних дослідженнях необхідно визначити мінімальну ефективну та максимальну переносиму дози препарату, а також профіль ефектів цих доз у хворих на ОА.
Дослідження симптоматичного лікарського засобу II фази повинне бути плацебо-контрольованим рандомізованим і подвійним сліпим. Ефективність препаратів може бути продемонстрована протягом декількох днів випробувань. Більш тривале дослідження (протягом декількох тижнів) може знадобитися для демонстрації повільного початку дії препарату або тривалості отриманого ефекту. Для вивчення безпеки препарату може знадобитися ще більш тривале дослідження. При проведенні тривалих випробувань симптоматичних препаратів може знадобитися призначення знеболювальних препаратів. Із цією метою слід призначати анальгетики короткої дії після відповідного періоду вимивання (washout).
Метою III фази клінічних випробувань є переконлива демонстрація ефективності та безпеки оптимальних доз досліджуваного препарату та режимів дозування. У ході дослідження оцінюється тільки один суглоб (зазвичай колінний, при двобічному ОА — найбільш уражений). У цій фазі клінічних випробувань необхідно остаточно визначити дози препарату і режим дозування, які будуть рекомендовані для використання в клінічній практиці, продовжити вивчення його токсичності, а також зрівняти препарат, що тестується з референтним і/або плацебо. Обсяг і тривалість дослідження повинні бути сплановані таким чином, щоб після закінчення необхідного періоду часу визначити клінічно й статистично значиму різницю параметрів ефективності препарату між основною і контрольною групою хворих. Необхідна кількість пацієнтів і тривалість дослідження безпеки препарату розраховують, виходячи з рекомендацій для хронічних захворювань Guidelines for Industry.
Тривалість ІІІ фази клінічних випробувань ефективності швидкодіючих симптоматичних препаратів повинна бути не більше 4 тиж (іноді значно менше). Для об’єктивізації дослідження необхідний адекватний період вимивання (washout). З метою глибшого вивчення безпеки швидкодіючого симптоматичного агента за коротким подвійним сліпим дослідженням можна провести більш тривале подвійне сліпе або відкрите випробування. Для демонстрації ефективності повільно діючих симптоматичних засобів знадобиться більш тривалий період, а також додаткове знеболювання.
Обсяг дослідження, необхідного для демонстрації ефективності препаратів, що модифікують структуру хряща, не визначений. Тривалість такого випробування не повинна бути менше 1 року. Головними або первинними критеріями ефективності повинні бути структурні зміни в суглобах, уражених ОА. Чисельність досліджуваної популяції слід розрахувати, виходячи з результатів ІІ фази.
IV фаза клінічних випробувань проводиться після дозволу відповідними органами клінічного застосування препарату. Дослідження IV фази проводяться з метою глибшого вивчення даних клінічних спостережень, в результаті яких розширюється перелік показань. Крім того, у ході дослідження вивчають побічні явища, які рідко відзначають, а також ефективність тривалого лікування препаратом, що тестується. Деякі дослідження IV фази можуть бути відкритими.
Включення пацієнтів у дослідження. Для вивчення симптоматичного ефекту агента, що тестується, важливим є вихідний рівень вираженості симптомів, який дозволить оцінити їх динаміку. Таким чином, обов’язковими критеріями включення хворих у дослідження ефективності симптоматичних препаратів є наступні:
- вираженість больового синдрому за ВАШ не менше 2,5 см або за 5-бальною шкалою Лікерта — не менше 1 бала (див. главу 12);
- наявність певних рентгенологічних критеріїв ОА, наприклад II стадія (або вище) за класифікацією Келлгрена — Лоуренса для ТФВ колінного суглоба (тобто наявність визначених остеофітів) або II стадія (або вище) за модифікованою шкалою Croft для кульшових суглобів.
Серед критеріїв включення у дослідження ефективності препаратів, що модифікують структуру хряща, обов’язковими є наступні:
- для вивчення здатності запобігати розвитку змін, властивих ОА 0 або I стадії на рентгенограмах за класифікацією Келлгрена — Лоуренса (тобто відсутність визначених остеофітів); для вивчення здатності сповільнювати патологічний процес II або III стадії або запобігати його прогресуванню за класифікацією Келлгрена — Лоуренса, при яких ступінь звуження суглобної щілини дозволяє оцінити прогресування захворювання;
- наявність болю в досліджуваних суглобах у момент включення або в анамнезі не обов’язкова; динаміка больового синдрому може бути вивчена як вторинний (додатковий) критерій ефективності.
У дослідженнях препаратів, що модифікують структуру хряща, важливим є вибір субпопуляції пацієнтів з високим ризиком швидкого прогресування ОА. Для визначення такої субпопуляції можна використовувати деякі БМ, здатні прогнозувати прогресування змін на рентгенограмах уражених суглобів.
Крім того, серед критеріїв включення необхідно вказати вік і стать досліджуваних хворих, які діагностичні критерії будуть використовуватися, які суглоби, уражені ОА, будуть вивчатися (наприклад колінні чи кульшові).
Критерії виключення також повинні бути чітко окреслені; у них необхідно вказати наступне:
- ступінь вираженості симптомів ОА;
- ступінь рентгенографічних змін;
- супутні хвороби;
- наявність пептичної виразки в анамнезі (якщо передбачається токсичність препарату відносно слизової оболонки травного тракту);
- супутня терапія;
- вагітність/контрацепція;
- внутрішньосуглобові ін’єкції депо-кортикостероїдів або гіалуронової кислоти;
- приливно-відливний лаваж;
- наявність вторинного ОА.
Інтервал часу, що пройшов після останньої внутрішньосуглобової ін’єкції депо-кортикостероїдного препарату або гіалуронової кислоти, є важливим критерієм виключення. Він необхідний для оптимальної мінімізації можливого впливу внутрішньосуглобових ін’єкцій на симптоми ОА. Рекомендований інтервал становить не менше 3 міс. Дослідник може збільшити цей інтервал при використанні гіалуронової кислоти, оскільки достовірні дані про тривалість її симптоматичного ефекту відсутні. При проведенні тривалих (>1 року) досліджень необхідна стратифікація пацієнтів, що отримували внутрішньосуглобові ін’єкції до початку випробування.
Додатковими критеріями виключення є:
- тяжка травма ураженого суглоба протягом 6 міс до початку дослідження;
- артроскопія протягом 1 року до початку дослідження;
- ураження хребта або суглобів нижніх кінцівок, що супроводжується вираженим больовим синдромом, що може утруднити оцінку досліджуваного суглоба;
- використання хворим допоміжних пристосувань для пересування (за винятком тростини, милиці);
- супутні ревматичні хвороби (наприклад фіброміалгія);
- тяжкий загальний стан хворого.
Жінки репродуктивного віку повинні бути обстежені на наявність вагітності та при її виявленні виключені з дослідження.
Клінічна характеристика хворих повинна включати:
- локалізацію ОА;
- кількість симптоматичних суглобів з клінічною симптоматикою;
- наявність суглобів кистей, уражених ОА (вузлики Гебердена, Бушара, ерозивний ОА);
- тривалість симптомів ОА;
- період з моменту встановлення діагнозу ОА;
- попереднє лікування (препарати, дози, тривалість терапії);
- хірургічне лікування досліджуваного суглоба в анамнезі (включаючи артроскопію) з обов’язковою вказівкою дат;
- використання допоміжних пристосувань (тростини, милиці, наколінники);
- внутрішньосуглобові ін’єкції в анамнезі (препарат, доза, кратність ін’єкцій, тривалість лікування, кількість курсів) із вказівкою дат останніх ін’єкцій.
Додатково в клінічній характеристиці хворих можна вказати:
- тютюнопаління (скільки сигарет у день, як давно курить; якщо в цей час не курить — скільки років курив і як давно відмовився від тютюнопаління);
- гормональний статус (період постменопаузи);
- супутні хронічні захворювання;
- супутня терапія (наприклад естрогени, протизапальні препарати).
Протокол дослідження обмежується оцінкою однієї групи суглобів (наприклад колінного або кульшового). При двобічному ураженні оцінюють суглоб з найбільш вираженими симптомами ураження. Зміни в контралатеральному суглобі можуть розглядатися в якості вторинних критеріїв. При вивченні ефективності потенційних препаратів, що модифікують структуру хряща, зміни в контралатеральному суглобі, який на початку дослідження був інтактним або з мінімальними змінами, можуть виявитися клінічно та статистично значимими. Цей факт необхідно враховувати при складанні протоколу дослідження й аналізу отриманих результатів.
При фізикальному обстеженні досліджуваних суглобів необхідно звернути увагу на наявність запалення (наприклад суглобового випоту), зменшення обсягу рухів, деформацій і контрактур суглоба. Наявність вираженої вальгусної/варусної деформації великих суглобів є критерієм виключення.
При оцінці ступеня функціональних порушень у досліджуваному суглобі перед початком дослідження необхідно використовувати систему WOMAC або альгофункціонального індекса Лекена.
Загальне фізикальне обстеження слід зробити на початку та наприкінці дослідження.
Важливою умовою включення хворого в дослідження є підписання інформованої згоди на участь у дослідженні, складеної відповідно до Гельсинкської декларації останнього перегляду і затвердженої відповідною структурою дослідницької установи.
Процедура проведення дослідження. Дослідження ефективності препаратів, які застосовують при ОА, повинні бути контрольованими рандомізованими подвійними сліпими за участю паралельних груп. На початку дослідження використовують скринінговий і базисний (рандомізаційний) візити, у ході яких збирають анамнез, проводять дослідження крові та інші аналізи, перевіряють, чи відповідає хворий критеріям включення та ін.; потім рандомізують хворих згідно з попередньо розробленою схемою.
Під час кожного візиту, крім дослідження ураженого суглоба, необхідно також виміряти артеріальний тиск, пульс, визначити масу тіла хворого, а також розпитати його про побічні ефекти лікування. Для об’єктивізації отриманої інформації хворого повинен обстежувати один і той самий лікар, бажано в один і той же час доби і день тижня протягом усього дослідження.
При складанні протоколу дослідження необхідно виділити первинний (бажано один) критерій ефективності. Вибір цього/цих критеріїв залежить від завдань дослідження та класу препарату, що тестується. Для посилення дизайну дослідження протокол слід доповнити одним або декількома вторинними критеріями.
Вимоги періоду вимивання (washout). За певний період до початку лікування симптоматичним препаратом, що тестується, необхідно скасувати всі знеболювальні та протизапальні препарати, включаючи засоби місцевої дії. Тривалість цього періоду зумовлена часом, необхідним для припинення клінічного ефекту (наприклад 5 періодів напіввиведення препарату). Протягом washout-періоду хворі можуть приймати парацетамол до 4 мг/добу (у США) і до 3 мг/добу (у країнах Європи). Останній також скасовують, виходячи з того, щоб до початку прийому препарату, що тестується, його дія була припинена. Погіршення симптомів ОА в washout-період необхідно відзначити в протоколі.
При проведенні досліджень препаратів, що модифікують структуру хряща, washout-період не потрібен. Якщо є необхідність вивчення симптоматичної дії агента, що тестується, washout-період включають до протоколу.
Призначення досліджуваного препарату. Контрольні препарати можуть включати плацебо або активний агент, наприклад анальгетик або НПЗП. Перевагою другого є можливість продемонструвати перевагу ефективності досліджуваного агента над препаратами, які широко застосовують на сьогодні. У випадку застосування референтного препарату як контролю потрібна більша кількість пацієнтів. При лікуванні внутрішньосуглобовими ін’єкціями часто відзначають плацебо-ефект, тому дослідження ефективності препаратів, що вводяться внутрішньосуглобово, повинні бути плацебо-контрольованими.
Препарати місцевої дії повинні видаватися пацієнтам у таких же контейнерах, що й препарати порівняння (лікарський засіб або плацебо). Плацебо повинне повністю імітувати досліджуваний препарат за видом, запахом і локальним впливом на шкіру. Чіткі інструкції з використання препарату мають бути викладені хворому лікарем особисто у письмовій формі, а також наведені в інформованій згоді. Акуратність застосування препарату перевіряється шляхом зважування повернутої пацієнтом туби з мазевою, гелевою або іншою формою або шляхом вимірювання об’єму рідини у флаконі.
Вид препаратів для перорального і для парентерального застосування (у тому числі внутрішньосуглобового), а також їх упакування повинні бути ідентичні таким агентів порівняння або плацебо. Пероральні препарати краще видавати в блістерах з обов’язкою наявністю ярликів, що клеяться, на яких зазначені точна дата й час видачі. Моніторинг прийому препарату хворими здійснюється шляхом підрахунку невикористаних таблеток (драже, капсул).
Препарати для супутньої терапії (наприклад анальгетики або НПЗП при дослідженнях препаратів, що модифікують структуру хряща) можна видавати у флаконах. Під час кожного візиту роблять підрахунок використаних таблеток. Увечері напередодні візиту, а також у день візиту не слід приймати супутній знеболювальний або протизапальний препарат, оскільки це може вплинути на оцінку больового синдрому.
Якщо немає можливості забезпечити ідентичність препарату, що тестується для парентерального прийому, агентові порівняння, безпосереднє введення його повинне здійснювати третя особа (наприклад інший лікар або медсестра), не повідомляючи хворому й дослідникові, який саме препарат уводився.
Перед внутрішньосуглобовими ін’єкціями із суглобової порожнини витягають випіт, його об’єм відзначають у протоколі.
При проведенні всіх клінічних досліджень ОА необхідно проводити фармакоекономічний аналіз.
Супутня медикаментозна терапія. Нелогічно очікувати, що пацієнти візьмуть участь у тривалому дослідженні без додаткового використання симптоматичних препаратів. Тому прийом анальгетиків слід дозволити, але обмежити. Обмежують перелік препаратів, максимальні дози, а також час прийому (за день до візиту й у день візиту не слід приймати знеболювальний засіб). Протокол повинен обов’язково включати розділ, у якому відзначають застосування анальгетиків і НПЗП, виконання внутрішньосуглобових ін’єкцій. Якщо внутрішньосуглобове введення депо-кортикостероїдів не є частиною протоколу дослідження, їх використання забороняється.
Супутня терапія може перешкодити адекватній оцінці ефективності DMO AD. Однак при проведенні тривалих досліджень недоцільно й неетично виключати всі супутні препарати. Виключенню підлягають лише ті, які можуть вплинути на структуру суглобів. Супутню терапію необхідно стандартизувати, здійснювати її моніторинг і реєструвати в протоколі при кожному візиті. Як ми вже відзначали, перевагу віддають парацетамолу. У день візиту, а також ввечері напередодні візиту препарат супутньої терапії не приймають.
Супутню немедикаментозну терапію (фізіотерапію, трудотерапію, лікувальну фізкультуру) також слід стандартизувати і привести у відповідність із протоколом таким чином, щоб вона не впливала на результат дослідження. У протоколі необхідно виділити розділ, у якому буде фіксуватися інформація про зміни маси тіла (зменшення/збільшення), про використання допоміжних пристосувань (тростини, милиці та ін.), а також призначення або зміну процедур і т.д.
Лабораторні тести. Для більшості багатоцентрових досліджень рутинні лабораторні тести (загальний аналіз крові, аналіз сечі, біохімічний аналіз крові) слід проводити в центральних лабораторіях.
Рутинний аналіз синовіальної рідини повинен включати дослідження клітин і кристалів.
Побічні ефекти фіксують у протоколі при кожному візиті й між візитами. Вказують дату виникнення, ступінь тяжкості, відношення до досліджуваного препарату (пов’язане/не пов’язане), призначене лікування і його тривалість, розв’язання побічної реакції.
Порушення протоколу. Повторне порушення протоколу хворим є підставою для виключення його з дослідження. Причини припинення участі в дослідженні у зв’язку з порушенням протоколу повинні бути специфіковані. До них можуть належати прийом не дозволених для такого дослідження препаратів, використання допоміжних пристосувань для полегшення болю та ін.
Критерії ефективності лікування ОА. У клінічних дослідженнях ОА необхідно використовувати опубліковані критерії, які застосовували інші автори у своїх роботах, що дозволяє порівнювати результати досліджень різних агентів. Основний перелік критеріїв включає показники:
- болю;
- фізичної функції;
- загальної оцінки стану хворого;
- рентгенологічного або інших методів візуалізації (для досліджень ≥1 року).
Додатковими критеріями ефективності, які також рекомендують включати до протоколу, є показники:
- якості життя (обов’язковий);
- загальна оцінка лікаря.
Критерії вибору для досліджень ОА включають показники:
- запалення;
- БМ;
- скутості;
- що потребуюють виконання певної роботи (час проходження певної дистанції, подолання певної кількості сходів, кистьова сила та ін.);
- кількість загострень;
- прийом анальгетиків;
- обсяг рухів;
- відстань між щиколотками;
- відстань між медіальними виростками стегнових кісток;
- окружність суглоба та ін.
Первинним критерієм ефективності симптоматичних препаратів є біль. Його дослідження повинно проводитися через рівні проміжки часу, тривалість яких залежить від досліджуваного суглоба і завдань дослідження (мінімум 1 міс).
Оцінку вираженості болю в ураженому суглобі слід робити з використанням 5-бальної шкали Лікерта (0 — немає болю, 1 — слабкий біль, 2 — помірний біль, 3 — сильний біль, 4 — дуже сильний біль) або 10 см ВАШ. Крім того, необхідно уточнити, що викликає (наприклад носіння важких речей, фізичні вправи, підйом по сходах) і/або коли виникає біль (наприклад уночі, у спокої). Для додаткової характеристики болю можна використовувати деякі системи оцінки здоров’я (WOMAC, HAQ, AIMS).
Для оцінки функції уражених колінних і/або кульшових суглобів у хворих на ОА рекомендується використовувати WOMAC або альгофункціональний індекс Лекена, меншою мірою HAQ і AIMS.
Оцінку загального стану пацієнта їм самим і лікарем слід проводити з використанням шкали Лікерта або ВАШ.
Визначення якості життя хворих на ОА в ході дослідження є обов’язковим, хоча й не належить до первинних критеріїв. Остаточний вибір системи оцінки якості життя (наприклад SF-36, EuroQol) — за дослідником.
Інформативність вищезгаданих критеріїв вибору остаточно не визначена, тому їх включення до протоколу дослідження не обов’язкове.
У дослідженнях препаратів, що модифікують структуру хряща, первинним критерієм ефективності є оцінка морфології ураженого суглоба, яку здійснюють за допомогою непрямих (рентгенографія, УЗД, МРТ) і прямих (артроскопія) методів візуалізації. Клінічне спостереження хворих, що одержують ці препарати, проводиться з інтервалами ≤3 міс.
Рентгенографія. Оцінюють рентгенограми одного суглоба (колінного, кульшового) або уражених суглобів досліджуваної кисті. Незважаючи на те що оцінювати слід динаміку не тільки морфології хряща, але й кістки, первинним рентгенологічним критерієм для досліджень прогресування гонартрозу або коксартрозу повинне бути вимірювання (мм) висоти суглобової щілини, оскільки цей показник більш чутливий, ніж методи оцінки за бальною системою або ступенями. Остеофітоз та інші зміни кістки слід вивчати у якості вторинних критеріїв або вимірюючи в міліметрах, або за ступенями з використанням опублікованих атласів. При вивченні факторів, що запобігають розвитку ОА, первинним критерієм є остеофітоз, оскільки саме ця ознака асоційована з болем у колінному суглобі, входить у класифікаційні критерії ACR для гонартрозу і є критерієм рентгенологічної класифікації гонартрозу за класифікацією Келлгрена — Лоуренса. Критерії для ОА кистей повинні бути засновані на опублікованих у спеціальних атласах.
Виконання рентгенологічного обстеження досліджуваних суглобів при кожному візиті — важлива умова адекватної оцінки прогресування ОА. Рентгенографію потрібно виконувати з чітким дотриманням умов стандартизованого протоколу, який розробляють на основі опублікованих рекомендацій, оскільки варіабельність вимірювання висоти суглобової щілини залежить від положення пацієнта (вертикальне або weight-bearing, горизонтальне), самої процедури рентгенографії та інших факторів.
МРТ дозволяє візуалізувати усі суглобові структури одночасно, що дає можливість оцінити суглоб як орган. Крім того, МРТ дозволяє кількісно оцінити ряд морфологічних параметрів ОА. Розроблені неінвазивні методи кількісної оцінки обсягу суглобового хряща, його товщини, вмісту води, особливо на ранніх стадіях хвороби, імовірно, будуть широко використовуватися в терапевтичних дослідженнях у майбутньому.
Інформативність комп’ютерної томографії, УЗД та сцинтиграфії недостатньо вивчена, тому перераховані методи не рекомендується використовувати в тривалих дослідженнях.
Артроскопія здатна безпосередньо візуалізувати суглобовий хрящ та інші внутрішньосуглобові структури, включаючи меніски, синовіальну оболонку, зв’язки, хондрофіти. Спроби кількісно оцінити цю інформацію призвели до розробки двох типів систем напівкількісної оцінки. Одна з них кодує інформацію про кожне ушкодження хряща (головним чином глибину й площу ушкодження) у балах, які потім підсумовуються, друга використовує глобальну оцінку лікарем дегенерації хряща у різних відділах, яка фіксується на ВАШ.
Інформативність молекулярних маркерів як критеріїв ефективності патогенетичної терапії ОА не доведена (див. главу 8). Однак БМ можна використовувати для оцінки дії препаратів на певні патогенетичні механізми, а також для вивчення фармакодинаміки в І фазі клінічних досліджень.