У більшості випадків у хворих на ОА відсутні зміни в аналізах крові та сечі, за винятком випадків синовіту зі значним випотом, коли можуть виникнути підвищення ШОЕ, гіпергаммаглобулінемія, підвищення рівня показників гострої фази — СРБ, фібриногену та ін. При дослідженні синовіальної рідини значних відмінностей від нормальних показників не виявляють.
В останні роки ведеться інтенсивний пошук можливих біохімічних маркерів (БМ) деградації та репарації тканин суглобів (головним чином хрящової і кісткової). БМ повинні відображати ці динамічні зміни, служити предикторами прогнозу ОА і маркерами ефективності патогенетичного лікування. Відкриття нових і більш глибоке вивчення відомих БМ дозволить краще зрозуміти механізми патогенезу ОА. Однак головне завдання використання БМ хрящового метаболізму — оцінка хондропротекторних властивостей лікарських препаратів і моніторинг лікування препаратами, що належать до групи DМО АD — модифікатори хвороби.
При ОА патологічні зміни відбуваються головним чином у суглобовому хрящі, а також у субхондральній кістці, синовіальній оболонці, інших м’яких тканинах суглоба. Оскільки наші можливості безпосередньо досліджувати ці структури обмежені, найбільш важливими джерелами для забору БМ є кров, сеча та синовіальна рідина (рис. 8.1).
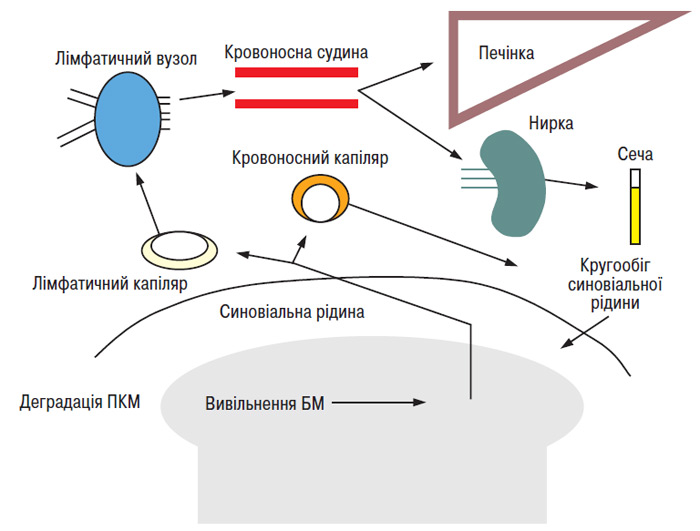
Рис. 8.1. Походження та міграція БМ. Фрагменти молекул, що утворювалися в результаті деградації ПКМ суглобового хряща або виділені синовіальною оболонкою або кістковою тканиною в синовіальну рідину, потрапляють через синовіальну мембрану в лімфатичні судини. Деякі фрагменти елімінуються або зазнають подальшої деградації в регіональних лімфатичних вузлах. Багато (можливо більшість) продуктів метаболізму ПКМ суглобового хряща захоплюються клітинами печінки та деградують у них. Деякі специфічні фрагменти, наприклад поперечні зв’язки колагену, не метаболізуються і виявляються в сечі (за: Lohmander L.S., 1991)
Надається перевага дослідженню сечі, оскільки воно не пов’язане з якими-небудь інвазивними процедурами. На наш погляд, ідеальним матеріалом для дослідження є добова сеча. Аналіз ранкової порції сечі був би більш доцільним, однак можливість її використання ґрунтується лише на тому, що саме такий аналіз використовують для визначення БМ кісткового метаболізму при остеопорозі: відомо, що БМ підпорядковуються циркадним ритмам, а пік концентрації БМ кісткового метаболізму припадає на нічний час. До сьогодні в літературі відсутні відомості про циркадні ритми БМ м’яких тканин, хряща, тому остаточне рішення про вибір адекватного аналізу сечі буде прийнято після проведення відповідних досліджень.
Дослідження крові належить до рутинних клінічних аналізів. Деякі БМ у крові визначають уже сьогодні, наприклад показники гострої фази, інші, можливо, в найближчому майбутньому ввійдуть у стандартний перелік біохімічних тестів. Для кожного БМ необхідно уточнити, у якому компоненті крові його слід визначати — у плазмі або сироватці. Результати досліджень свідчать про те, що концентрація БМ у плазмі крові значно відрізняється від такої в сироватці. Зазвичай БМ визначають у сироватці крові. За даними V. Rayan та співавторів (1998) концентрації БМ у крові, взятої з вени поблизу ураженого суглоба і з більш віддаленої вени, різні. Ці дані свідчать про необхідність стандартизації забору крові для дослідження БМ.
За даними L.J. Attencia та співавторів (1989) хрящ синовіальних суглобів дорослої людини становить усього 10% від загальної маси гіалінового хряща організму, включаючи міжхребцеві диски. Таким чином, визначення БМ у крові та сечі скоріше відображає системний метаболізм, ніж місцеві зміни в ураженому ОА суглобі. Синовіальна рідина перебуває ближче всього до патологічного вогнища при ОА та, ймовірно, найбільш точно відображає процеси, що відбуваються в ураженому суглобі. Концентрація БМ у синовіальній рідині може бути значно вищою, ніж у крові, а отже, її легше визначити. Прикладами можуть служити епітоп 846 агрекану — у синовіальній рідині його в 40 разів більше, ніж у сироватці крові (Poole A.R. et al., 1994), хрящові олігомерні матричні білки (ХОМБ) — в 10 разів більше, ніж у сироватці крові (Saxne Т., Heinegard D., 1992). Продукти деградації в синовіальній рідині більш точно відображають катаболічні процеси у суглобовому хрящі. Дренаж молекул із синовіальної рідини через місцеву лімфатичну систему може призвести до зменшення їх розмірів (Fraser J.R.E., Laurent T.C., 1989) і навіть до їхнього руйнування (Heinegard D. et al., 2000).
Незважаючи на інвазивність методики забору синовіальної рідини і пов’язані з нею ряд можливих ускладнень, цінність визначення БМ у ній очевидна. Для запобігання проблем з так званим сухим суглобом безпосередньо перед вилученням рідини в суглоб можна ввести 20 мл ізотонічного розчину NaСl. Негайно після ін’єкції ізотонічного розчину пацієнт повинен зробити 10 раз згинання-розгинання кінцівки в суглобі, за цим іде швидка аспірація розведеної синовіальної рідини. На думку E.M.-J.A. Thonar (2000), таке розведення синовії впливає на метаболізм у суглобовому хрящі. Однак результати дослідження F.C. Robion та співавторів (2001) свідчать про те, що повторний лаваж колінних суглобів коней не викликає істотних змін метаболізму хряща. Ці дані, безумовно, вимагають підтвердження. Отже, для кожного БМ на етапі передклінічних досліджень у тварин необхідно визначати вплив лаважа суглоба на зміну його концентрації.
Наступним важливим моментом є визначення для кожного БМ часу напівжиття в синовіальній рідині та у крові. Без таких даних інтерпретація результатів аналізів буде утруднена. Звичайний час напівжиття біологічно активних речовин у крові менший, ніж в інших рідких середовищах у зв’язку з ефективним кліренсом печінкою і нирками. Таким чином, для кожного БМ також необхідно визначати шлях елімінації. Так, N-пропептид колагену ІІІ типу виділяється печінкою шляхом рецепторопосередкованого ендоцитозу (Smedsrod B., 1988), а неглікозильовані фрагменти колагену виводяться головним чином з сечею так само, як остеокальцин (Price P.A. et al., 1981). На ендотеліальних клітинах синусів печінкових часточок є рецептори до глікозаміногліканів, тому гіалуронова кислота та протеоглікани елімінуються печінкою. Час напівжиття гіалуронової кислоти в крові становить 2–5 хв (Fraser J.R.E., Laurent T.C., 1989). Наявність синовіту може прискорювати кліренс БМ з суглобів (Wallis W.J. et al., 1987; Myers S.L. et al., 1995; 1996), хоча у дослідженнях на кроликах не виявлено істотних відмінностей кліренсу протеогліканів при наявності та відсутності синовіту (Page-Thomas D.P. et al., 1987). Таким чином, необхідно досліджувати вплив запалення на зміни концентрації БМ у рідких середовищах організму.
Нирки селективно фільтрують БМ. Так, глікозаміноглікани, що несуть великий негативний заряд, можуть не проникати через базальну мембрану нирок, тоді як такі глікозаміноглікани, як хондроїтин-6-сульфат і хондроїтин-4-сульфат, визначаються в сечі (Lee G.J.L., Tieckelmann H., 1981).
Крім патології (зокрема ОА) на концентрацію БМ у рідких середовищах організму можуть впливати ряд факторів:
1. Циркадні ритми досліджені лише для невеликої кількості БМ. Для маркерів кісткового метаболізму вони вивчені. Так, пік концентрації остеокальцину припадає на нічний час (Gundberg C.M. et al., 1985), а поперечних зв’язок колагену на ранкові — на 8.00 (Gertz B.J. et al., 1998). При РА пік активності ІЛ-6 також припадає на нічний час (близько 2.00), причому раніше, ніж в остеокальцину (Arvidson N.B. et al., 1994). Ці дані становлять певний інтерес відносно участі ІЛ-6 у запаленні та фізіології кісткової тканини. ФНП-α, навпаки, не має циркадних ритмів (Arvidson N.B. et al., 1994). Однак рецептори цього цитокіну можуть підпорядковуватися їм.
2. Перистальтика. Гіалуронова кислота синтезується синовіальними клітинами (а також багатьма іншими клітинами) і є потенційним маркером синовіту при ОА і РА. Однак найбільш висока концентрація гіалуронату виявляється в лімфатичній системі кишечнику (Engstrom-Laurent A., 1989). Не дивно, що концентрація циркулюючої гіалуронової кислоти може підвищуватися після їжі. Таким чином, забір крові для визначення БМ слід робити натще або через 3 год після їжі. А вплив перистальтики на рівень БМ у крові вимагає вивчення.
3. Фізична активність зранку після сну призводить до підвищення концентрації гіалуронової кислоти в крові (Engstrom-Laurent A., Hallgren R., 1985), ММП-3 і епітопу кератан-сульфату (Manicourt D.H. et al., 1999) у здорових осіб. Фізичне навантаження може змінювати концентрацію деяких маркерів як у синовіальній рідині, так і в сироватці крові (Roos H. et al., 1995). Таке підвищення більш виражене у хворих на РА, більш того концентрація БМ корелює з клінічним станом цих хворих.
4. Хвороби печінки і нирок. Цироз печінки викликає значне підвищення рівня гіалуронової кислоти в сироватці крові (Engstrom-Laurent A., 1989) і, імовірно, впливає на елімінацію протеогліканів. Відомо, що хвороби нирок впливають на концентрацію остеокальцину. Ця проблема також вимагає більш глибокого вивчення.
5. Вік і стать. У процесі росту організму підвищується активність клітин пластинки росту, що супроводжується підвищенням концентрації скелетних БМ у сироватці крові. Прикладом може служити підвищення концентрації фрагментів агрекану і колагену ІІ типу в периферичній крові і сечі у зростаючих тварин (Thonar E.M.-J.A. et al., 1988; Carey W. et al., 1997). Таким чином, інтерпретація аналізів БМ у дітей і підлітків з захворюваннями опорно-рухового апарату утруднена. Для багатьох БМ виявлене підвищення концентрації при старінні. У чоловіків концентрація БМ значно перевищує таку у жінок у хрящовій (Poole A.R. et al., 1990) і кістковій (del Pino J. et al., 1991) тканинах. Крім того, у жінок у менопаузальний і постменопаузальний періоди можна чекати змін концентрації БМ метаболізму хрящової тканини, подібних тим, що спостерігаються в кістковій тканині.
6. Хірургічні операції також можуть впливати на рівень БМ, більше того, цей ефект може тривати кілька тижнів.
Основою концепції БМ ОА є припущення, що вони відбивають певні сторони метаболічних процесів у тканинах суглобів. Однак взаємовідносини між концентраціями БМ у рідких середовищах організму і метаболізмом хрящової, синовіальної та інших тканин виявилися дуже складними (рис. 8.2).
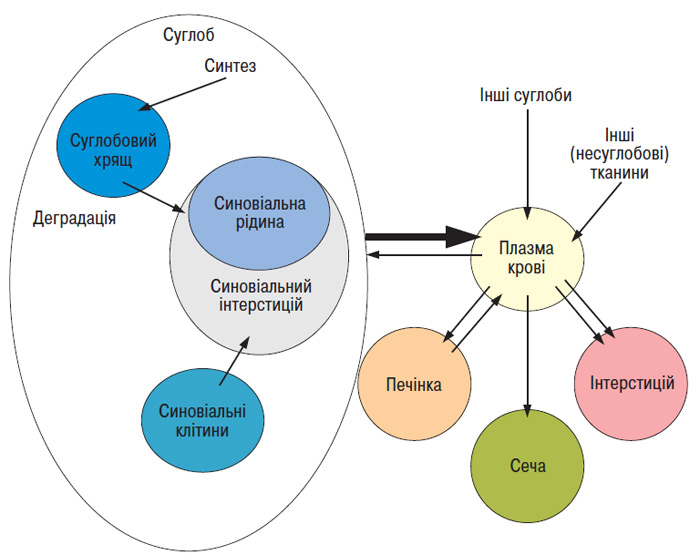
Рис. 8.2. Взаємозв’язок концентрації БМ у рідких середовищах організму, таких як синовіальна рідина, кров, сеча, і метаболізму в тканинах суглобів. Концентрація БМ деградації суглобового хрящу в синовіальній рідині залежить не тільки від ступеня деградації тканини, але й від інших факторів, таких як кліренс фрагментів молекул із синовіальної рідини (підвищений при запаленні) і кількість хрящової тканини, що залишилася в суглобі. Концентрація БМ у сироватці крові залежить від багатьох факторів, наприклад від функції печінки (за: Aigner T. et al., 1992)
Так, наприклад, концентрація маркерів деградації ПКМ суглобового хряща в синовіальній рідині може залежати не тільки від ступеня деградації самого матриксу, але й від інших факторів, таких як ступінь елімінації фрагментів молекул із синовії, про що вже було сказано вище (Wallis W.J. et al., 1987; Levick J.R., 1992; Simkin P.A., Bassett J.E., 1995), а також від кількості хрящової тканини, що залишилася в суглобі (Dahlberg L. et al., 1992).
Незважаючи на вищенаведені факти, концентрація БМ у синовіальній рідині загалом корелює з метаболізмом молекул ПКМ суглобового хряща (Lohmander L.S., 1994). Так, наприклад, зміни концентрації фрагментів агрекану, епітопу 846, ХОМБ і С-пропептиду колагену ІІ в синовіальній рідині після травми суглобу і при розвитку ОА співвідносяться зі змінами інтенсивності метаболізму агрекану, ХОМБ і колагену ІІ в експериментальних моделях ОА у тварин in vivo і в суглобовому хрящі хворих з ОА in vitro (Eyre D.R. et al., 1980; Carney S.L. et al., 1984; Aigner T. et al., 1992; Lohmander L.S. et al., 1993; 1994; 1996; 1998; Heinegard D. et al., 1998).
Ідентифікація специфічних джерел молекулярних фрагментів — складний процес. Підвищення ступеня вивільнення фрагментів молекул може відбуватися як за рахунок загального посилення процесів деградації, які не компенсуються синтетичними процесами, так і за рахунок посилення деградації з одночасним підвищенням інтенсивності синтезу тих же молекул ПКМ; в останньому випадку концентрація молекул ПКМ не змінюється. Таким чином, необхідний пошук маркерів, специфічних для деградації і для синтезу. Прикладом перших можуть бути фрагменти агрекану, а других — С-пропептид колагену ІІ.
Навіть якщо БМ пов’язаний з певним аспектом метаболізму, необхідно враховувати специфічні особливості цього процесу. Наприклад, фрагменти, що ідентифікуються, можуть утворюватися в результаті деградації синтезованої de novo молекули, яка ще не встигнула вмонтуватися у функціональний ПКМ, молекули, яка була тільки що вбудована у ПКМ і, нарешті, постійної молекули ПКМ, яка є важливою функціональною частиною зрілого матриксу. Проблемою також є визначення специфічної зони матриксу (перицелюлярний, територіальний і міжтериторіальний матрикс), яка стала джерелом БМ, виявленого в синовіальній рідині, крові або сечі. Дослідження in vitro свідчать про те, що інтенсивність метаболізму в окремих зонах ПКМ суглобового хрящу може бути різною (Mok S.S. et al., 1994). Дослідження деяких епітопів, пов’язаних із сульфатуванням хондроїтину сульфатів, можуть сприяти ідентифікації популяції синтезованих de novo молекул агрекану (Visco D.M. et al., 1993; Poole A.R. et al., 1994; Plaas A.H.K. et al., 1997; 1998; Lohmander L.S. et al., 1998).
Можна припустити, що поява в суглобовій рідині фрагментів молекул, у нормі присутніх у ПКМ хряща, пов’язана з метаболізмом хрящового матриксу. Однак це не завжди так, оскільки залежить від ряду факторів, зокрема від того, наскільки концентрація цієї молекули в суглобовому хрящі перевищує таку в інших тканинах суглоба та наскільки інтенсивність її метаболізму в хрящі перевищує таку в інших тканинах суглоба. Так, загальна маса агрекану в суглобовому хрящі значно перевищує таку, наприклад у менісках колінного суглоба, при цьому загальна маса ХОМБ у менісках практично не відрізняється від такої в суглобовому хрящі (Hauser N. et al., 1995). І хондроцити, і синовіцити виробляють стромелізин-1, однак загальна кількість клітин у синовіальній оболонці перевищує таку в хрящі, тому значна частина виявленого в синовіальній рідині стромелізину-1 швидше за все синовіального походження (Wolfe G.C. et al., 1993). Таким чином, ідентифікація специфічного джерела БМ надзвичайно складна і часто неможлива.
При дослідженні БМ у сироватці крові і сечі з’являється проблема визначення можливого його позасуглобового джерела. Крім того, при моноартикулярному ураженні БМ, які виділяються ураженим суглобом, можуть змішуватися з маркерами, які виділяються інтактними суглобами, у тому числі і контралатеральними. До складу суглобового хряща входить менше ніж 10% загальної маси гіалінового хряща організму (Lohmander L.S., 1999). Таким чином, визначення БМ у крові і сечі може бути обґрунтованим скоріше при поліартикулярних, або системних хворобах (стосовно до ОА — при генералізованому ОА).
У табл. 8.1 наведено неповний перелік передбачуваних БМ метаболізму суглобового хряща, кістки та синовіальної оболонки в синовіальній рідині, сироватці крові та сечі.
Таблиця 8.1
Передбачувані БМ метаболізму тканин суглобів у синовіальній рідині та сироватці крові хворих на ОА
| БМа | Процесb | У синовіальній рідиніc, d (посилання) | У сироватці кровіc, d (посилання) |
| І. Хрящ | |||
| Агрекан | |||
| Фрагменти стрижневого білка | Деградація агрекану | ↑ (Lohmander L.S. et al., 1989; 1993) | ↑↓↔ (Thonar E.J.M.A. et al., 1985; Campion G.V. et al., 1989; Mehraban F. et al., 1991; Spector T.D. et al., 1992; Lohmander L.S., Thonar E.J.M.A., 1994; Poole A.R. et al., 1994)
↑ (Poole A.R. et al., 1994) |
| Епітопи стрижневого білка (специфічні неоепітопи зони відщеплення) | Деградація агрекану | ↑ (Sandy J.D. et al., 1992; Lohmander L.S. et al., 1993; Lark M.W. et al., 1997е) | |
| Епітопи кератан сульфатів | Деградація агрекану | ↑ (Campion G.V. et al., 1989; Belcher C. et al., 1997) | |
| Епітопи хондроїтину сульфатів (846, 3В3, 7D4 та ін.) | Синтез/деградація агрекану | ↑ (Poole A.R. et al., 1994; Hazell P.K. et al., 1995; Slater R.R. Jr. et al., 1995; Plaas A.H.K. et al., 1997е; 1998е; Lohmander L.S. et al., 1998a) | |
| Співвідношення хондроїтин-6- і хондроїтин-4-сульфатів | Синтез/деградація агрекану | ↓ (Shinmei M. et al., 1993) | |
| Малі протеоглікани | Деградація малих протеогліканів | ↑е (Witsch Prehm P. et al., 1992) | |
| Матричні білки хряща | |||
| ХОМП | Деградація ХОМП | ↑ (Saxne T., Heinegerd D., 1992b; Lohmander L.S. et al., 1994; Petersson I.F. et al., 1997) | ↑ (Sharif M. et al., 1995) |
| Колагени хряща | |||
| С-пропептид колагену ІІ типу | Синтез колагену ІІ | ↑ (Shinmei M. et al., 1993; Yoshihara Y. et al., 1995; Lohmander L.S. et al., 1996a) | |
| Фрагменти α-ланцюга колагену ІІ типу | Деградація колагену ІІ | ↑е (Hollander A.P. et al., 1994; Billinghurst R.C. et al., 1997; Atley L.M. et al., 1998) | |
| ММП та їх інгібітори | Синтез і секреція | ↑ (Із синовії або суглобового хряща?) | ↑↔ |
| ІІ. Меніски | |||
| ХОМП | Деградація ХОМП | ↑ (Із суглобового хряща, менісків або синовії?) | |
| Малі протеоглікани | Деградація малих протеогліканів | ||
| ІІІ. Синовіальна оболонка | |||
| Гіалуронова кислота | Синтез гіалуронової кислоти | ↑ (Goldberg R.L. et al., 1991; Hedin P.J. et al., 1991; Sharif M. et al., 1995) | |
| ММП та їх інгібітори | |||
| Стромелізин (ММП-3) | Синтез і секреція ММП-3 | ↑ (Lohmaner L.S. et al., 1993) | ↑↔ (Zucker S. et al., 1994; Yoshihara Y. et al., 1995) |
| Інтерстиціальна колагеназа (ММП-1) | Синтез і секреція ММП-1 | ↑ (Clark I.M. et al., 1993; Lohmander L.S. et al., 1993) | ↔ (Manicourt D.H. et al., 1994) |
| ТІМП | Синтез і секреція ТІМП | ↑ (Lohmander L.S. et al., 1993; Manicourt D.H. et al., 1994) | ↔ (Yoshihara Y. et al., 1995) |
| N-пропептид колагену ІІІ типу | Синтез/деградація колагену ІІІ | ↑ (Sharif M. et al., 1996) | ↑ (Sharif M. et al., 1996) |
| IV. Кістка | |||
| Кісткові сіалопротеїни | Синтез/деградація сіалопротеїни | ↑↔ (Lohmander L.S. et al., 1996) | ↑f (Lohmander L.S. et al., 1996) |
| Остеокальцин | Синтез остеокальцину | ↑↔ (Sharif M. et al., 1995) | ↔ (Campion G.V. et al., 1989) |
| 3-гідроксіпиридинові поперечні зв’язкиg | Деградація кісткових колагенів | ||
↑↓↔ — відповідно підвищення, зниження та відсутність змін концентрацій порівняно зі здоровими особами;
азазначені основні джерела БМ;
bяк було зазначено в цій главі, багато БМ можуть свідчити як про процеси синтезу, так і про процеси деградації;
cпідвищення/зниження концентрації БМ описане у хворих з активним ОА, а не в пацієнтів з кінцевою стадією хвороби;
dнаведені тільки деякі посилання, ця таблиця не є повним оглядом;
eу хрящі хворих на ОА;
fпісля гострої травми суглоба;
gрезультати опубліковані тільки відноcно сечі, продемонстрована підвищена екскреція.
Вимоги до БМ залежать від того, з якою метою їх застосовують — у якості діагностичного, прогностичного або оціночного тесту. Наприклад, діагностичний тест визначає відмінності між здоровими особами та пацієнтами з ОА, що виражається поняттям чутливості та специфічності тесту. Прогностичний тест виявляє в групі осіб, у яких найбільш імовірне швидке прогресування хвороби. І нарешті, оціночний тест базується на здатності маркера моніторувати зміни в часі в окремого пацієнта. Крім того, БМ можна застосовувати для визначення чутливості пацієнтів до того або іншого препарату.
Спочатку припускали, що БМ можуть служити діагностичними тестами, які допоможуть відрізнити уражений ОА суглоб від інтактного, а також провести диференціальну діагностику з іншими хворобами суглобів. Так, визначення концентрації кератан сульфату в сироватці крові розглядали як діагностичний тест для генералізованого ОА (Thonar E.J.-M.A. et al., 1985). Однак наступні дослідження показали, що цей БМ може лише відображати деградацію протеогліканів хряща в деяких ситуаціях (Spector T.D. et al., 1992; Thonar E.J.-M.A. et al., 1993; Poole A.R. et al., 1994). Виявилося, що концентрації БМ у сироватці крові залежать від віку і статі обстежуваної особи (Lohmander L.S., Thonar E.J.-M.A., 1994).
Ряд досліджень продемонстрували відмінності концентрацій фрагментів агрекану, ХОМП і ММП та їх інгібіторів у суглобовій рідині колінних суглобів здорових волонтерів, пацієнтів з РА, реактивним артритом або ОА (Saxne T. et al., 1987; Lohmander L.S. et al., 1993; 1994; Petersson I.F. et al., 1997). Незважаючи на те що автори демонструють значні відмінності середніх концентрацій БМ, інтерпретація даних утруднена, оскільки проведений порівняльний аналіз був профільним і ретроспективним. Прогностичні властивості цих тестів необхідно підтвердити в проспективних дослідженнях.
БМ можна використовувати для оцінки тяжкості перебігу хвороби або стадії патологічного процесу. Стосовно ОА тяжкість перебігу хвороби та її стадії визначають за результатами рентгенологічних досліджень, артроскопії, а також за вираженістю больового синдрому, обмеженням функції уражених суглобів і функціональною здатністю пацієнта. L. Dahlberg та співавтори (1992), T. Saxne і D. Heinegard (1992) запропонували використовувати деякі молекулярні маркери метаболізму суглобового хряща для додаткової характеристики стадій ОА. Однак для впровадження таких БМ у медичну практику необхідне подальше проведення досліджень у цьому напрямку.
Є повідомлення про можливе використання БМ у якості прогностичних тестів. Наприклад, було показано, що концентрація гіалуронової кислоти (але не кератан сульфату) у сироватці крові у пацієнтів з ОА колінного суглоба на початку дослідження свідчить про прогресування гонартрозу протягом 5 років спостереження (Sharif M. et al., 1995a). У тій же популяції хворих продемонстровано, що підвищений вміст ХОМБ у сироватці крові у пацієнтів з гонартрозом протягом першого року після початку дослідження асоціювався з рентгенологічним прогресуванням протягом 5 років спостереження (Sharif M. et al., 1995b). Дослідження БМ у хворих на РА показали, що концентрація в сироватці крові ХОМБ, епітопу 846, хондроїтину сульфату асоційована з більш швидким прогресуванням хвороби (Mansson B. et al., 1995). Ці результати, отримані у невеликих групах хворих, часто не демонструють силу зв’язку між рівнем БМ і прогресуванням хвороби, тобто необхідні подальші дослідження, проспективні і на великих групах пацієнтів.
Серією досліджень доведено можливий зв’язок тяжкості клінічного перебігу ОА кульшового або колінного суглоба зі зростанням рівня СРБ, але не ШОЕ (Wolfe F., 1997). Так, рівень СРБ був достовірно зв’язаний з непрацездатністю (оцінювалася за шкалою Health Assessment Questionnaire), болючістю при пальпації суглобів, інтенсивністю больового синдрому, рівнем втоми, оцінкою загального стану здоров’я та депресією. Медіана СРБ — 5,9 μг/мл. Рівень ШОЕ був пов’язаний лише з функціональною непрацездатністю. При цьому рівень СРБ був вищим у хворих з ерозивним (середнє значення — 4,7 мг/л) порівняно з неерозивним (середнє значення — 2,1 мг/л) ОА міжфалангових суглобів (Punzi L. et al., 2005). Крім того, підвищений рівень СРБ частіше асоціюється з генералізованою, ніж негенералізованою формою ОА (Takahashi M. et al., 2004), а також корелює з інтенсивністю болю у кульшовому суглобі (Garnero P. et al., 2005).
T.D. Spector та співавтори (1997) виявили невелике підвищення рівня СРБ у сироватці крові пацієнтів з раннім ОА і повідомили, що СРБ може служити предиктором прогресування ОА. У цьому випадку підвищення рівня СРБ відображає процеси ушкодження тканин суглобів і може бути пов’язане з підвищенням рівня гіалуронової кислоти, що також свідчить про прогресування хвороби (Sharif M. et al., 1995a). Не виключено, що синовіальна оболонка відповідальна за більшу частину гіалуронової кислоти, яку виявляють у сироватці крові, що свідчить про наявність легкого синовіту. Підвищення концентрації ММП стромелізину в синовіальній рідині і сироватці крові хворих на ОА та після травми суглоба також може бути пов’язане з легким синовітом (Clark I.M. et al., 1993; Lohmander L.S. et al., 1993; Manicourt D.H. et al., 1994; Zucker S. et al., 1994; Yoshihara Y. et al., 1995). Але водночас відсутність зростання рівня СРБ або його зв’язку з активністю захворювання було відзначене у 274 пацієнтів з ОА колінних суглобів, у яких високі рівні розчинних рецепторів ФНП-1 асоціювалися з нижчим рівнем функціональної здатності, вищою інтенсивністю симптоматики у колінному суглобі та вищими рентгенологічними стадіями патологічного процесу (Penninx B.W. et al., 2004).
Але незважаючи на те що при використанні високочутливих методів визначення у більшості хворих на ОА виявляють середній рівень зростання СРБ, не проводили досліджень, у яких визначення СРБ при ОА відбувалося після поправки на наявність серцево-судинних захворювань або на інші причини підвищення рівня СРБ. Саме тому достовірність визначення СРБ для діагностичних цілей або моніторингу активності ОА потребує уточнення.
Нарешті, БМ можна використовувати в якості критеріїв ефективності в клінічних дослідженнях препаратів, а також для моніторування патогенетичного лікування. Однак існують дві взаємозалежні проблеми: відсутність препаратів з доведеними властивостями модифікувати структуру або модифікувати хворобу багато в чому пов’язана з відсутністю надійних БМ і навпаки, відсутність специфічних маркерів метаболізму тканин суглобів багато в чому зумовлена недоліком контрольованих досліджень препаратів названих груп.