Для діагностики ОА з метою більшої точності, оцінки динаміки захворювання та ефективності лікування на сьогодні використосовують різні інструментальні методи дослідження: рентгенографію, артроскопію, ультрасонографію, комп’ютерну томографію, магнітно-резонансну томографію (МРТ), сцинтиграфію, теплобачення.
За допомогою зазначених методик можна оцінити товщину хряща і синовіальної оболонки, виявити наявність ерозій у субхондральній кістці, визначити кількість і характер рідини у різних відділах суглобів, оцінити кровотік у синовіальній оболонці, який свідчить про активне запалення в суглобі, а також оцінити стан і характер ураження деяких суглобових (наприклад меніски) та позасуглобових (зв’язковий апарат, періартикулярні м’які тканини) структур опорно-рухового апарату. Слід підкреслити найбільш ранні зміни при ОА: від легкої нерівномірності УЗ-структури хряща, аж до глибоких псевдоерозій.
Рентгенографія
Залишається найпоширенішим об’єктивним методом діагностики і контролю ефективності лікування ОА. Це зумовлене доступністю методу, простотою дослідження, економічністю та достатньою інформативністю. Ознаки ОА — звуження суглобової щілини, субхондральний остеосклероз і наявність остеофітів. Ширина рентгенівської суглобової щілини (РСЩ) досі використовується як основний показник у діагностиці ОА, а стандартна рентгенографія колінних суглобів у прямій і бічний проекціях рекомендується WHO та ILAR як метод вибору для оцінки динаміки змін у суглобовому хрящі при проведенні клінічних випробувань лікарських препаратів.
Артроскопія — пряме візуальне дослідження порожнини суглоба, яке дозволяє встановлювати запальні, травматичні або дегенеративні ураження менісків, зв’язкового апарату, хряща, синовіальної оболонки. При цьому є можливість проведення прицільної біопсії уражених ділянок суглобів.
Гістоморфологічні методи — біопсія синовіальної оболонки
Біопсію синовіальної оболонки проводять двома способами — за допомогою пункції суглоба чи під час артроскопії. Надалі будуть характеризуватися різні патоморфологічні зміни синовії, характерні для тих або інших нозологічних форм ураження суглобів. При дифузних захворюваннях сполучної тканини виконують також біопсію шкіри, внутрішніх органів.
Радіоізотопна сцинтиграфія
Радіоізотопну сцинтиграфію суглобів проводять за допомогою остеотропних радіофармацевтичних препаратів (пірофосфат тощо), мічених 99mTc. Зазначені препарати переважно накопичуються в місцях активного кісткового і колагенового метаболізму. Особливо інтенсивно вони накопичуються в запалених тканинах суглобів, що видно на сцинтиграмах суглобів.
Метод радіоізотопної сцинтиграфії використовують для ранньої діагностики артритів, виявлення субклінічних фаз ураження суглобів, диференційної діагностики запальних і дистрофічних уражень суглобів.
Термографія
Термографія (теплобачення) — метод дослідження інтенсивності інфрачервоного випромінювання тканинами. За допомогою цього методу дистанційно вимірюється температура шкіри в ділянці суглобів, яка записується на фотопапері у вигляді контурної тіні суглоба.
Метод може вважатися візуалізаційним і водночас індикаторним, оскільки дозволяє судити про активність запального ураження суглобів.
МРТ
На МР-томограмах краще, ніж на комп’ютерних томограмах, відображаються м’які тканини: м’язи, жирові прошарки, хрящі, судини. На деяких апаратах можна одержати зображення судин, не вводячи в них контрастний засіб (МР-ангіографія). Внаслідок невисокого вмісту води у кістковій тканині остання не створює екрануючого ефекту, як при рентгенівській комп’ютерній томографії, тобто не заважає зображенню, наприклад спинного мозку, міжхребцевих дисків та ін.
УЗД
Використовується для оцінки патології м’яких тканин і виявлення рідини, візуалізації суглобового хряща, поверхні кісткових структур, синовіальної оболонки, періартикулярних м’яких тканин тощо (Борткевич О.П., Терзов К.А., 2005; Коваленко В.М. та співавт., 2008; Grassi W. et al., 1993; 1999; Backhaus M. et al., 1999).
ПРЯМА ВІЗУАЛІЗАЦІЯ СУГЛОБОВОГО ХРЯЩА (АРТРОСКОПІЯ)
На сьогодні лікування ОА спрямоване не стільки на покращання симптоматики (перш за все усунення больового синдрому), але й на запобігання структурним змінам у суглобовому хрящі — основному субстраті патологічного процесу при ОА. Вже розроблено ряд препаратів, відносно яких доведені властивості змінювати перебіг ОА: запобігати, затримувати розвиток змін у суглобах або навіть викликати їх зворотний розвиток (так звані хондропротектори). Подальше проведення подібних досліджень потребує стандартизованих і відтворюваних оцінок змін у суглобах для чіткої оцінки результатів лікування. Це стосується, перш за все, оцінки кількості, цільності та/чи якості суглобового хряща (Brandt K. et al., 1994).
В останні роки артроскопію розглядають як метод ранньої діагностики ОА, оскільки вона дозволяє виявляти вищезазначені зміни хряща навіть у разі відсутності рентгенологічних ознак хвороби. Зокрема, щодо колінного суглоба, цей метод забезпечує пряму, включаючи збільшення, візуалізацію шести поверхонь суглоба, причому методика є більш чутливою, ніж рентгенографія чи МРТ, щодо ушкоджень хряща (Blackburn P.M. et al., 1994). Переваги артроскопії були підставою вважати цей метод золотим стандартом оцінки стану суглобового хряща (Fife R.S. et al., 1991). Деякі автори з урахуванням цих переваг називають методику хондроскопією (Ayral X. et al., 1993). Пряма візуалізація дозволяє оцінювати синовіальну оболонку, вираженість синовіту, а також спрямовано проводити біопсію, що набуває особливого значення для передніх відділів колінного суглоба, зміни в яких при ОА часто фрагментарні (Lindblad S., Hedfors E., 1987; Kurosaka M. et al., 1991; Ayral X. et al., 1996).
До основних проблем артроскопії на сьогодні належать такі: її інвазивний характер, недостатньо розроблені стандартизовані системи оцінки хондропатії при ОА, а також рекомендації щодо уніфікації візуалізації поверхонь суглобового хряща.
Методика проведення артроскопії
Артроскопію, що виконується з лікувальною метою, часто проводять під загальною чи спиномозковою анестезією, тоді як діагностичну артроскопію можна проводити під місцевою (підшкірною чи внутрішньосуглобовою) анестезією, що робить процедуру більш безпечною, доступною і низьковартісною. Е. Еriksson та співавтори (1986) при порівнянні результатів різних методик проведення артроскопії виявили, що проведенням цієї процедури під місцевою чи спиномозковою анестезією були задоволені близько 77% пацієнтів, у той час як під загальною — 97%. P.M. Blackburn та співавтори (1994) виявили хорошу переносимість артроскопії, проведеної під місцевою анестезією, порівняно із МРТ колінних суглобів у всіх обстежених 16 пацієнтів, причому 8 із них віддали перевагу артроскопії, 2 — МРТ, а 6 вважали однаково хорошою переносимість обох процедур.
У проспективному дослідженні, проведеному X. Ayral та співавторами (1993), 84 хворим провели хондроскопію під місцевою анестезією, причому переносимость оцінили як «хорошу» 62% пацієнтів, «дуже хорошу» — 28%. 25% цих хворих взагалі не відчували болю, а 75% відзначали незначний біль під час процедури або безпосередньо після неї. Щоденна рухова активність після артроскопії була утруднена у 79% пацієнтів (до 1 дня — у 44%, до 2 днів — у 55%, до 1 тиж — у 79%). До кінця 1-го місяця після хондроскопії 82% пацієнтів відзначали поліпшення стану.
J.B. Mcginty і R.A. Matza (1978) оцінили діагностичну точність артроскопії, проведеної під загальною чи місцевою анестезією, шляхом постартроскопічної візуалізації за допомогою артротомії. Виявлено, що артроскопія була дещо точнішою, якщо проводилася під місцевою анестезією (95%), ніж під загальною (91%). Однак слід підкреслити, що проведення артроскопії під місцевою анестезією потребує більшої підготовки, навіть для досвідчених артроскопістів.
Артроскоп із малою скляною лінзою
Артроскопію колінного суглоба часто проводять за допомогою артроскопу з 4-міліметровою скляною лінзою та 5,5-міліметровим троакаром. У деяких хворих із контрактурами зв’язок або залишковим м’язовим напруженням (внаслідок місцевої анестезії) задня частина ТФВ суглоба може виявитися недоступною для стандартного артроскопу (4 мм). Артроскоп з 2,7-міліметровою лінзою має поле огляду, порівнянне зі стандартним артроскопом, і в більшості випадків дозволяє досліджувати всі відділи суглоба. Постійна ірригація колінного суглоба, що забезпечується 2,7-міліметровим артроскопом, достатня для очищення суглоба від крові та різних часток і забезпечення чіткого поля для візуалізації (Ayral X. et al., 1993). Технічно 25–30° кут огляду забезпечує широкий і кращий огляд. Волоконно-оптичні артроскопи меншого діаметру (1,8 мм) можна вводити в суглоб через пункційний отвір, а не через розріз, однак вони мають ряд недоліків: менше поле огляду, більш тьмяне й зернисте зображення, що пов’язано з переносом зображення по волокнах, і гіршою ірригацією, а також тенденцією до перегинів і поломки оптичних волокон, що часто призводить до одержання лише прямого зображення (Ike R.W., Rourke K.S., 1993). За даними цих авторів чутливість подібних артроскопів порівняно зі стандартними у виявленні дефектів хряща становить 89%, а синовіальної оболонки — 71%.
Результати проспективного відкритого неконтрольованого дослідження, проведеного Х. Ayral та співавторами (1993), свідчать про поліпшення самопочуття у 82% пацієнтів через 1 міс після хондроскопії. Вважається, що лаваж порожнини суглоба, проведений під час процедури (зазвичай близько 1 л ізотонічного розчину натрію хлориду) забезпечує клінічне покращання з боку проявів суглобового синдрому, що підтверджують дані контрольованих досліджень (Livesley P.J. et al., 1991; Ike R.W. et al., 1992; Chang R.W. et al., 1993), і нівелює потенційну шкоду цієї інвазивної процедури.
Артроскопічна оцінка вираженості ураження хряща при ОА
1. Традиційні класифікаційні системи
Для оцінки динаміки ураження суглобового хряща при ОА, особливо під впливом проведеного лікування, необхідні кількісні системи оцінки, що передбачають три основні параметри цих уражень: глибину, розмір і локалізацію. На сьогодні відомо багато різних артроскопічних класифікаційних систем (Outerbridge R.E., 1961; Cassels S.W., 1978; Ficat R.P. et al., 1979; Beguin J., Locker B., 1983; Bently G., Dowd J., 1984; Insall J.N., 1984 та ін.).
Деякі з класифікаційних систем (Beguin J., Locker B., 1983; Insall J.N., 1984) враховують тільки глибину уражень суглобового хряща і надають якісну інформацію про поверхню хряща, не забезпечуючи кількісний підхід до урахування хрящових уражень. В інших системах (Outerbridge R.E., 1961; Cassels S.W., 1978; Ficat R.P. et al., 1979; Bently G., Dowd J., 1984) враховується комбінація глибини й розміру найбільш тяжкої хондропатії суглобової поверхні за однією описовою категорією, однак є й багато розбіжностей. Коротка характеристика класифікаційних систем наведена нижче (табл. 7.1).
Таблиця 7.1
Характеристика класифікаційних систем для артроскопічної оцінки ураження суглобового хряща
| Автор | Опис поверхні суглобового хряща | Діаметр | Локалізація |
| Outerbridge R.E., 1961 | I — потовщення та набряклість | I — опис відсутній | Починається найчастіше на медіальній поверхні надколінка; потім «дзеркально» поширюється на латеральну поверхню міжвиросткової ділянки виростків стегнової кістки; верхній край медіального виростку стегнової кістки |
| II — фрагментація та утворення тріщин | II — <0,5 дюйма | ||
| III — фрагментація та утворення тріщин | III — >0,5 дюйма | ||
| IV — ерозування хряща та субхондральної кістки | IV — опис відсутній | ||
| Cassels S.W., 1978 | I — поверхневі ерозії хряща | I — ≤1 см | Надколінок і передні поверхні стегнової кістки |
| II — більш глибокі ерозії хряща | II — 1–2 см | ||
| III — хрящ повністю ерозований, залучена субхондральна кістка | III — 2–4 см | ||
| IV — суглобовий хрящ повністю деструктурований | IV — «широка площа» | ||
| Ficat R.P. et al., 1979 | I — закрита хондромаляція; просте потовщення (прості пухирі) макроскопічно, поверхня інтактна, різний ступінь вираженості від простого потовщення до «глибокого набряку», втрата еластичності | I — 1 см2, а потім ураження поширюється прогресивно у всіх напрямках | Латеральна поверхня |
| II — відкрита хондромаляція:
а) тріщини — поодинокі чи множинні, відносно неглибокі або такі, що поширюються до субхондральної кістки б) ульцерація — локалізована «втрата» хрящової субстанції із залученням субхондральної кістки. Поверхня кістки може виглядати «відполірованою» (ебурнеація кістки) в) хондросклероз — хрящ ненадлишково ущільнений, нестискуваний |
II — опис відсутній | Медіальна поверхня (порушення суглобових співвідношень ≥2°) | |
| III — формування «осколків» хряща — множинних, відділених один від одного глибокими тріщинами, що поширюються до субхондральної кістки
Поверхневі зміни — розволокнення хряща; поздовжні борозни, що визначаються по осі руху суглоба |
III — не локалізований, однак залучена вся зона контакту | Із центром на гребені, що відокремлює медіальну та віддалені поверхні | |
| Beguin J., Locker B., 1983 | I — розм’якшення, набряклість
II — поверхневі тріщини III — глибокі тріщини, що поширюються до субхондральної кістки IV — залучення субхондральної кістки |
Опис відсутній | Опис відсутній |
| Insall J.N., 1984 | I — набряклість і розм’якшення хряща (закрита хондромаляція)
II — глибокі тріщини, що поширюються до субхондральної кістки III — розволокнення IV — ерозивні зміни та залучення субхондральної кістки (остеоартроз) |
Опис відсутній | I–IV — центр гребеня надколінка з поширенням однаково до медіальної та латеральної поверхонь надколінка
IV — залучені також протилежні або «дзеркальні» поверхні стегнової кістки. Верхня й нижня третина надколінка частіше малоушкоджені, стегнова кістка залучена незначно |
| Bently G., Dowd J., 1984 | I — розволокнення чи утворення тріщин | I — <0,5 см | Найчастіше в місці з’єднання медіального й віддалених поверхонь надколінка |
| II — розволокнення чи утворення тріщин | II — 0,5–1 см | ||
| III — розволокнення чи утворення тріщин | III — 1–2 см | ||
| IV — розволокнення із залученням субхондральної кістки або без такого | IV — >2 см |
Класифікаційна система, запропонована R.E. Outerbridge (1961) (див. табл. 7.1), поділяє ушкодження хряща на ступені: I ступінь — розм’якшення і набряклість хряща без тріщин (істинна хондромаляція); II — фрагментація хряща та утворення тріщин діаметром ≤0,5 дюйма; III — фрагментація хряща та утворення тріщин діаметром >0,5 дюйма; IV — ерозії хряща із залученням субхондральної кістки. Видно, що II і III ступені мають однакову глибину і для них описаний розмір, тоді як I і IV ступені детально не оцінені. Крім того, розмір тріщин (II і III ступені) не є постійною величиною.
R.P. Ficat та співавтори (1979) розподілили ураження хряща на закриту й відкриту хондромаляцію, причому закрита хондромаляція (І ступінь) становить дійсну хондромаляцію (розм’якшення й набряклість), а відкрита (ІІ ступінь) — відкриту (з наявністю тріщин) хондропатію. Згідно з цією системою ураження, що відповідає І ступеню, починається з 1 см2 площі та прогресивно поширюється у всіх напрямках. Подібний опис веде до непогодженості в питанні про сумарну зону ураження площі поверхні хряща. ІІ ступінь включає три різні глибини хондропатії: поверхневі та глибокі тріщини й залучення у процес субхондральної кістки без зазначення розмірів. Отже, у цій системі відсутній точний кількісний підхід до оцінки ступеня руйнування суглобового хряща.
У класифікації, запропонованій G. Bently, J. Dowd (1984), ступені І, ІІ та ІІІ мають однакові ознаки (розволокнення чи утворення тріщин), а відмінності між ступенями ґрунтуються на діаметрі уражень (див. табл. 7.1). Відсутнє згадування про істинну хондромаляцію. Ступеню IV відповідають дві різні глибини хондромаляції: розволокнення з або без залучення субхондральної кістки, із фіксованим розміром >2 см. Виникає резонне питання, якому ступеню уражень відповідає залучення субхондральної кістки з діаметром <2 см?
S.W. Cassels (1978) оцінював діаметр уражень у сантиметрах і відносну глибину уражень, спочатку вважаючи, що меншій глибині уражень відповідає їх менший діаметр (див. табл. 7.1). Тоді, який же ступінь відповідає поверхневим ураженням, що уражують всю суглобову поверхню?
Таким чином, вищеописані системи не забезпечують достатньої інформації про глибину, розмір і локалізацію ушкоджень хряща. Крім того, система оцінки має бути застосовна як до колінного суглоба в цілому, так і до кожного з його трьох відділів: ПФВ, медіального та латерального ТФВ. Проте без кількісного картування суглоба опис локалізації хондропатії поза цією суглобовою поверхнею залишається якісним.
2. Сучасні класифікаційні системи
В 1989 р. F.R. Noyes, C.L. Stabler запропонували свою систему градації ушкоджень суглобового хряща (табл. 7.2).
Таблиця 7.2
Класифікація уражень суглобового хряща (Noyes F.R., Stabler C.L., 1989)
| Опис поверхні | Обсяг уражень | Діаметр, мм | Локалізація | Обсяг згинання коліна |
| 1. Поверхня хряща інтактна | А. Певне розм’якшення із залишковою еластичністю
В. Значне розм’якшення із втратою еластичності (деформація) |
<10
10–15 16–20 21–25 >25 |
Надколінок
А. Проксимальна третина Середня третина Дистальна третина В. Віддалені поверхні Медіальна поверхня Латеральна поверхня Міжвиросткова ямка Медіальний виросток стегнової кістки: а) передня третина б) середня третина с) задня третина Латеральний виросток стегнової кістки: а) передня третина б) середня третина с) задня третина Медіальний виросток великогомілкової кістки: а) передня третина б) середня третина с) задня третина Латеральний виросток великогомілкової кістки: а) передня третина б) середня третина с) задня третина |
Обсяг згинання в коліні, коли ураження перебуває в контакті при навантаженні вагою (наприклад 20–45°) |
| 2. Поверхня хряща порушена: щілини, тріщини, розволокнення чи фрагментація | А. Менше половини товщини
В. Половина товщини і більше |
|||
| 3. Залучення кістки | А. Поверхня кістки інтактна
В. Виразки поверхні кістки (кавітація) |
Вони розділили опис суглобової поверхні (хряща/субхондральної кістки), глибини ураження, діаметр і локалізацію уражень. Автори розрізняють три ступені порушення суглобової поверхні: 1-й ступінь — суглобова поверхня інтактна; 2-й — суглобова поверхня порушена, відкрите ураження; 3-й — залучення кістки. Кожен із цих ступенів розділений на типи А або В залежно від глибини ураження. Ступінь 1 означає хондромаляцію. Тип 1А відповідає помірному ступеню розм’якшення суглобового хряща; тип 1В — значному розм’якшенню з набряклістю суглобової поверхні. Ступінь 2 характеризується будь-якими руйнуваннями суглобової поверхні без візуального залучення кістки. Тип 2А уражень включає поверхневі тріщини (менше половини товщини хряща); тип 2В — більше половини товщини (глибокі тріщини аж до кістки). Ступінь 3 означає залучення кістки. Тип 3А припускає, що нормальний контур кістки збережений; тип 3В — свідчить про кавітацію або ерозування поверхні кістки. На діаграмі колінного суглоба відзначаються всі виявлені ушкодження, а діаметр кожного з них оцінюється дослідником у міліметрах з використанням спеціального градуйованого «гачка». Залежно від діаметра і глибини ураження використовується точкова шкала для кількісної оцінки вираженості хондропатії для кожного відділу суглоба та в результаті — для проведення загального суглобового рахунку.
Система F.R. Noyes, C.L. Stabler була першою спробою дослідників зробити кількісну оцінку хондропатії, тому вона не позбавлена недоліків:
- Всі ушкодження хряща наведені на діаграмах колінного суглоба у вигляді повного кола з діаметром, що визначається за допомогою градуйованого «гачка». Це недостатньо об’єктивний метод оцінки розміру, тому що більшість уражень хряща не мають чітко круглої форми, часто вони овальні або не мають певної форми. Крім того, дегенеративні зміни хряща часто можуть мати форму з найбільш глибоким ураженням в центрі, оточеним зоною більш поверхневого ураження; причому до цієї зони «навколишнього ураження», що має кроноподібну форму, діаметр не може бути застосований.
- Будь-яке ураження <10 мм у діаметрі не враховується як клінічно значиме, що призводить до втрати чутливості методики. При моніторуванні дії базисного препарату будь-які, навіть найменші, ураження мають бути описані.
- Точкова шкала оцінки одночасно глибини та діаметру ушкоджень хряща довільна; вона базується ні на статистичній методології, ні на клінічній оцінці та урахуванні тяжкості цих уражень.
Найновіші із методик артроскопічної оцінки хондропатії запропоновані X. Ayral та співавторами (1993; 1994), M. Dugados та співавторами (1994).
Перша з цих методик ґрунтується на суб’єктивній загальній оцінці хондропатії дослідником; вона базується на 100-міліметровій шкалі ВАШ, причому «0» відповідає відсутності хондропатії, а «100» — найбільш тяжкій хондропатії (Ayral X. et al., 1993). Одна ВАШ використовується для кожної суглобової поверхні колінного суглоба: надколінка, блоку (trochlea), медіального і латерального виростків, медіального і латерального плато великогомілкової кістки. Розрахунок ВАШ проводиться для кожного з трьох відділів колінного суглоба і отримується шляхом усереднення розрахунків ВАШ для двох відповідних суглобових поверхонь відділу суглоба.
Друга методика (Ayral X. et al., 1994; Dougados M. et al., 1994) — більш об’єктивна й ґрунтується на аналітичному підході, який включає суглобову діаграму колінного суглоба із градуюванням локалізації, глибини та розмірів усіх наявних ушкоджень хряща (табл. 7.3).
Таблиця 7.3
Калькуляція SFA-рахунку та SFA-ступеня ураження суглобового хряща у пацієнта з ОА за даними артроскопічної візуалізації. Запис діаграми колінного суглоба і заповнення індивідуальної форми пацієнта
Діаграма правого колінного суглоба
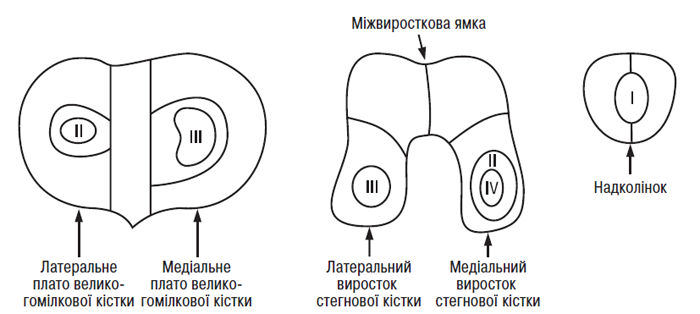
Індивідуальна карта пацієнта з ОА (локалізація)
| Ступінь | Медіальний відділ | Латеральний відділ | ПФВ | ||||||
| Стегнова кістка | Великогомілкова кістка | Середнє значення | Стегнова кістка | Великогомілкова кістка | Середнє значення | Надколінок | Виросткова ямка | Середнє значення | |
| 0 | 60 | 65 | 62,5 | 80 | 75 | 77,5 | 80 | 100 | 90 |
| I | 0 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 10 |
| II | 30 | 0 | 15 | 0 | 25 | 12,5 | 0 | 0 | 0 |
| III | 0 | 35 | 17,5 | 20 | 0 | 10 | 0 | 0 | 0 |
| IV | 10 | 0 | 5 | 0 | 0 | 0 | 0 | 0 | 0 |
Примітки:
1. Кожне значення означає розмір ушкоджень відповідних до ступеня, вираженого у % від загальної суглобової поверхні. Сумарне значення в кожному стовпчику становить 100%.
2. 0 — норма, I — розм’якшення/набряклість, II — поверхневі тріщини, III — глибокі тріщини, IV — оголена поверхня субхондральної кістки.
3. SFA-рахунок = розмір (%) уражень І ступеня х 0,14 + розмір (%) уражень ІІ ступеня х 0,34 + розмір (%) ураження ІІІ ступеня х 0,65 + розмір (%) ураження IV ступеня х 1
- Медіальний рахунок: 15 х 0,34 + 17,5 х 0,65 + 5 х 1,00 = 21,475
- Латеральний рахунок: 12,5 х 0,34 + 10 х 0,65 = 10,75
- Пателофеморальний рахунок: 10 х 0,14 = 1,4
4. SFA-ступінь (визначення див. у табл. 7.4)
- Медіальний ступінь = IV
- Латеральний ступінь = III
- Пателофеморальний ступінь = I
Локалізація
Методика включає 6 зон визначення: надколінок, блок (міжвиросткова ямка), медіальний і латеральний виростки (окремо), медіальне і латеральне плато великогомілкової кістки (окремо).
Глибина
Система ґрунтується на класифікації хондропатії, запропонованій французькими артроскопістами J. Beguin, B. Locker (1983), у ній виділяється 4 ступені уражень хряща (рис. 7.1, 7.2):
Ступінь 0 — нормальний хрящ;
Ступінь І — хондромаляція, що включає розм’якшення з набряклістю чи без неї; може відповідати ступеню І, типам А і В за F.R. Noyes, C.L. Stabler (1989);
Ступінь ІІ — у хрящі є поверхневі поодинокі або множинні тріщини, що надають поверхні «оксамитовий» вигляд; цей ступінь також включає поверхневі ерозії. Тріщини та ерозії не досягають поверхні субхондральної кістки. Може відповідати ступеню 2А за F.R. Noyes, C.L. Stabler (1989) (тобто ураження, що займають менше половини товщини хряща);
Ступінь III — є глибокі тріщини хрящової поверхні до субхондральної кістки, які прямо не візуалізуються, однак можуть бути виявлені за допомогою артроскопічного зонду; ступінь ІІІ може бути у вигляді «рота акули» чи окремої частини хряща, що утворився через поодиноку глибоку тріщину, «крабового м’яса» через множинні глибокі розриви. Ступінь ІІІ також включає глибоку ульцерацію хряща, що утворює кратер, який залишається вкритим тонким прошарком хряща. Може відповідати ступеню 2В за F.R. Noyes, C.L. Stabler (1989) (тобто ураження, що займають більше половини товщини хряща);
Ступінь IV — субхондральна кістка оголена, причому її поверхня може бути інтактною чи з наявністю порожнин. Може відповідати ступеню ІІІ (А і В типу) за F.R. Noyes, C.L. Stabler (1989).
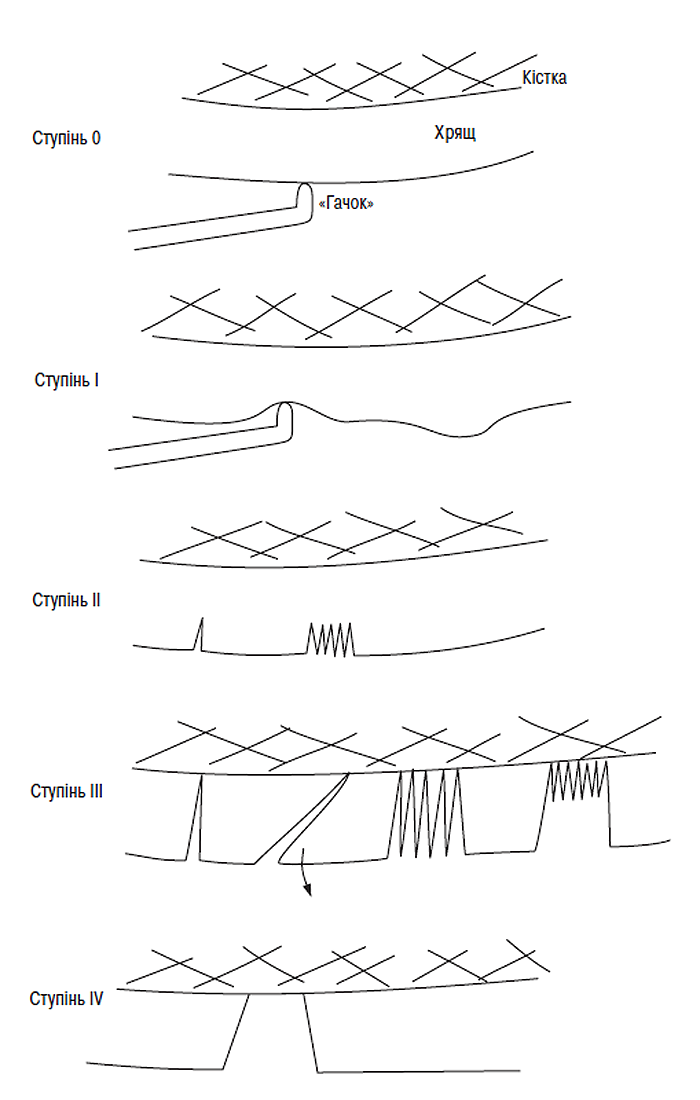
Рис. 7.1. Глибина уражень суглобового хряща відповідно до класифікації, запропонованої J. Beguin, B. Locker (1983). Діаграма ступеня тяжкості (пояснення в тексті)

Рис. 7.2. Артроскопічна картина хондропатії різних ступенів (за: Ayral X., Dougados M., 1999), отримана за допомогою 2,7-міліметрового артроскопу. Ступінь 0 — незмінний медіальний ТФВ колінного суглоба; ступінь I — набряклість латерального виростка стегнової кістки; ступінь II — «оксамитовий» вигляд надколінка; ступінь III (А) — надколінок має вигляд «крабового м’яса»; ступінь III (Б) — глибока ульцерація медіального виростка стегнової кістки; ступінь VI — ушкодження субхондральної кістки медіального виростка стегнової кістки
При ОА колінного суглоба руйнування суглобового хряща часто проявляється у вигляді комбінації різних ступенів тяжкості, коли найбільш тяжкі зони ураження оточені зонами менш виражених ушкоджень (див. табл. 7.3).
Розмір
Розмір і форма для кожного ступеня хондропатії записується артроскопістом на діаграмі колінного суглоба (див. табл. 7.3). Потім розмір оцінюється у відсотках до суглобової поверхні (остання приймається за 100%) за допомогою комп’ютерної техніки або вручну (при достатній навичці експерта). Так, якщо відстежена хондропатія 4 рази на діаграмі виростка стегнової кістки заповнює її, то розмір цієї хондропатії становить 25% виростка стегнової кістки (результат одержаний шляхом ділення 100% суглобової поверхні виростка стегнової кістки на 4). Зразки різних розмірів хондропатії наведено на рис. 7.3.
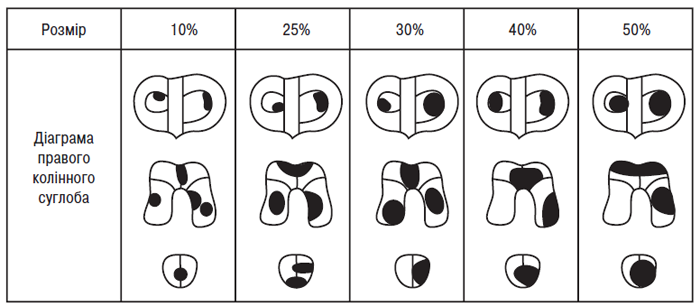
Рис. 7.3. Розміри ушкоджень суглобового хряща. Кожна ізольована площа чорного кольору відповідає величині ушкодженого хряща кожної із суглобових поверхонь
Локалізація, глибина та розмір різних хондропатій наведені у спеціальній формі (див. табл. 7.3). Ця форма включає 8 різних кількісних величин, тобто хондропатії I–IV ступеня для кожного відділу суглоба. Порівняння тяжкості хондропатії у різних пацієнтів і/або артроскопічних даних того самого пацієнта, отриманих у різний час, потребують об’єднання цих величин у єдиний рахунок хондропатій. З цією метою Французьке артроскопічне товариство (Societe Francaise d’arthroscopie, SFA) провело проспективне багатоцентрове дослідження, що включило 14 артроскопістів зі значним досвідом роботи та 755 пацієнтів, яким проводили артроскопію колінного суглоба. Критеріями оцінки тяжкості хондропатії стали: 1) загальна оцінка дослідником з використанням 100-міліметрової шкали ВАШ; 2) глибина, розміри й локалізація ушкоджень хряща, записані на діаграму. Для створення уніфікованого рахунку хондропатій застосовували багатоваріантний аналіз із використанням логістичної множинної регресії, у якій залежною величиною була загальна оцінка хондропатії дослідником із використанням ВАШ, а незалежними — глибина й розмір уражень. Таким чином, створено дві системи оцінки хондропатій: SFA-система підрахунку (SFA-scoring system) і SFA-система ступенів (SFA-grading system) (Ayral X. et al., 1994; Dougados M. et al., 1994).
SFA-рахунок — змінна зі значеннями від «0» до «100», що одержують для кожного відділу суглоба за формулою:
SFA-рахунок = А + В + С + D,
де А = розмір (%) ушкоджень I ступеня х 0,14;
В = розмір (%) ушкоджень IІ ступеня х 0,34;
С = розмір (%) ушкоджень ІІI ступеня х 0,65;
D = розмір (%) ушкоджень IV ступеня х 1,00.
Розмір (%) = середній відсоток поверхні медіального виростка стегнової кістки та медіального плато великогомілкової кістки (медіальний тибіофеморальний відділ — ТФВ), латерального виростка стегнової кістки та латерального плато великогомілкової кістки (латеральний ТФВ) або trochlea і надколінка (пателофеморальний відділ — ПФВ).
Коефіцієнти тяжкості хондропатії (0,14; 0,34; 0,65; 1,00) отримані шляхом параметричного багатоваріантного аналізу.
SFA-ступінь — напівкількісна величина. Вищезазначені величини (розмір (%) ушкоджень I–IV ступеня) підставляються у формулу для одержання сумарного ступеня (або категорії тяжкості хондропатії відділу) для кожного з відділів колінного суглоба (табл. 7.4). Формула для кожного відділу отримана непараметричним багатоваріантним аналізом із використанням регресійного аналізу; усього — 6 категорій для ПФВ (0–V) і 5 категорій для медіального й латерального ТФВ (0–IV). Приклад підрахунку SFA -рахунку та SFA -ступеня — див. табл. 7.3.
Система ACR
У 1995 р. комітет ACR запропонував систему підрахунку уражень хряща (Scoring system for cartilage) (Klashman D. et al., 1995). Ця система враховує глибину, розмір і локалізацію уражень хряща з подальшим внесенням даних у діаграму колінного суглоба. Глибина кожного ураження оцінюється за ступенем (класифікація Noyes F.R., Stabler C.L., 1989); розмір кожного ураження — у відсотках. Точкова шкала використовується для обчислення загального рахунку, так званого підрахунку уражень (damage score). Вірогідність останнього була оцінена D. Кlashman та співавторами (1995) у сліпому дослідженні: відеоплівки 10 артроскопій переглянуті двічі трьома ревматологами-артроскопістами, причому була показана висока вірогідність як даних одного експерта у двох дослідженнях (r=0,90; 0,90; 0,80; p<0,01 для кожного), так і між експертами (r=0,82; 0,80; 0,70; p<0,05 для кожного).
Таблиця 7.4
Система Французького артроскопічного товариства (SFA) для артроскопічної оцінки ступеня хондропатії в колінному суглобі (Dougados M. et al., 1994)
| Категорія | Ступінь* 90 (%**) | Ступінь III (%) | Ступінь IV (%) |
| Медіальний ТФВ | |||
| 0
I II III IV |
100
≥80 <100 <80 <80 або ≥65 <65 |
<15
≥15 |
0
0 0 ≥1 ≥1 |
| Латеральний ТФВ | |||
| 0
I II III IV |
100
≥85 <100 <85 |
<10
<10 ≥10 |
<10
<10 <10 ≥10 |
| ПФВ | |||
| 0
I II III IV V |
100
≥85 <100 <85 |
<10
<10 ≥10 |
<2,5
<2,5 <2,5 ≥2,5 <25 ≥25 |
*Ступінь отримано шляхом оцінки змін поверхні хрящу (класифікація: Beguin J., Locker B., 1983) (див. текст і табл. 7.3); **відсоток отримано шляхом розрахунків ураженої поверхні з урахуванням ступеня змін (див. текст і табл. 7.3).
Порівняльний аналіз вірогідності, значимості та чутливості до змін артроскопічних систем SFA, VAS
X. Ayral та співавтори (1996) виявили тісний кореляційний зв’язок між артроскопічною кількісною оцінкою хондропатії й рентгенологічною оцінкою звуження РСЩ в умовах навантаження вагою, а саме такими показниками: 1) загальною оцінкою хондропатії (ВАШ) і звуженням рентгенологічної суглобової щілини (РСЩ) медіального відділу суглоба, вираженими у % (r=0,646; p<0,0001); 2) SFA-рахунком і звуженням РСЩ у медіальному і латеральному ТФВ (мм) (r=–0,59; p<0,01 і r=–0,39; p<0,01 відповідно); 3) SFA-ступенем і звуженням РСЩ у медіальному й латеральному ТФВ (мм) (r=–0,48; p<0,01 і r=–0,31; p<0,01 відповідно). Незважаючи на ці результати, артроскопія була більш чутливим методом, ніж рентгенографія: навіть глибокі й розповсюджені ерозії хряща можуть залишатися недіагностованими на рентгенограмах, навіть при проведенні рентгенографії з навантаження вагою (Fife R.S. et al., 1991; Ayral X. et al., 1993; 1996). Із 33 пацієнтів з ОА, достовірним за критеріями ACR, звуження РСЩ медіального відділу суглоба у яких було <25% при проведенні навантажувальної рентгенографії, у 30 при артроскопії була виявлена хондропатія з середнім ВАШ — рахунком 21 мм (2–82 мм), причому >10 мм — у 24 пацієнтів (Ayral X. et al., 1993).
X. Ayral та співавтори (1996) виявили статистично достовірну кореляцію (p<0,05) між ушкодженням суглобового хряща: 1) трьох відділів колінного суглоба (медіального, латерального, ПФВ) і віком пацієнтів; 2) медіального відділу суглоба й індексом маси тіла. При проведенні ж повторної артроскопії через 1 рік (41 пацієнт) тими ж авторами виявлено, що зміни тяжкості ушкодження хряща корелювали зі змінами функціональної недостатності опорно-рухового апарату (індекс Lequesne: r=0,34; p=0,03) і якості життя (AIMS2: r=0,35; p=0,04). У цьому ж дослідженні ВАШ-рахунок медіального відділу суглоба змінювався з 45±28 на початку дослідження до 55±31 через 1 рік (р=0,0002), а SFA-рахунок — з 31±21 до 37±24 (p=0,0003). Подібні результати, що свідчать про високу чутливість артроскопії щодо динамічних змін у хрящі, отримані також Y. Fujisawa та співавторами (1979), T. Raatikainen та співавторами (1990), а також V. Listrat та співавторами (1997) при динамічній артроскопічній оцінці змін у суглобовому хрящі хворих на ОА під дією хондропротекторної терапії (гіалуронан).
Застосування мікроскопічної техніки дозволяє артроскопічно візуалізувати зміни, недоступні іншим методам дослідження (рис. 7.4а, б).
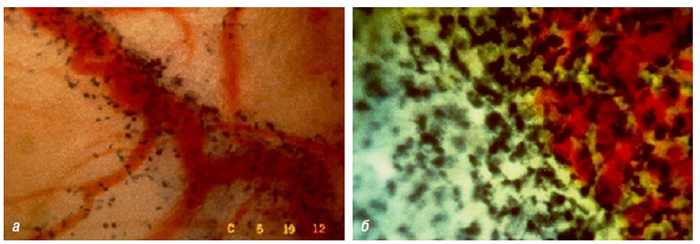
Рис. 7.4. Мікроартроскопія. Синовіт при ОА (х130) (за: Frizzero L., Zizzi F., Reta M.; www.eular.org): а — гіперемія синовіальної мембрани: кровоносні судини розширені, прямі, з наявністю периваскулярних інфільтратів; б — численні овальні/круглі клітини; мережа кровоносних судин розширена, звивиста
Таким чином, артроскопія, проведена під місцевою анестезією, є адекватним методом інструментальної діагностики ОА, а також може використовуватися для контролю ефективності лікування, перш за все препаратами, що модифікують перебіг захворювання (DМОАD).
РЕНТГЕНОЛОГІЧНА ДІАГНОСТИКА ОА
Незважаючи на бурхливий розвиток в останні роки таких сучасних методів медичної візуалізації, як МРТ, рентгенівська комп’ютерна томографія, розширення можливостей УЗ-діагностики, рентгенографія залишається найпоширенішим об’єктивним методом діагностики й контролю ефективності лікування ОА. Це зумовлене доступністю цього методу, простотою дослідження, економічністю та достатньою інформативністю.
Загалом рентгенологічна діагностика ОА ґрунтується на виявленні звуження суглобової щілини, субхондрального остеосклерозу й остеофітів, причому основне діагностичне значення має ступінь звуження РСЩ. На рентгенограмах суглобів можуть визначатися ділянки осифікації суглобової капсули (пізній ОА). При вузликовій формі ОА найбільше діагностичне значення має виявлення остеофітів, що іноді супроводжуються вираженою деструкцією суглобових поверхонь (так званий ерозивний артроз) (рис. 7.5, 7.6).
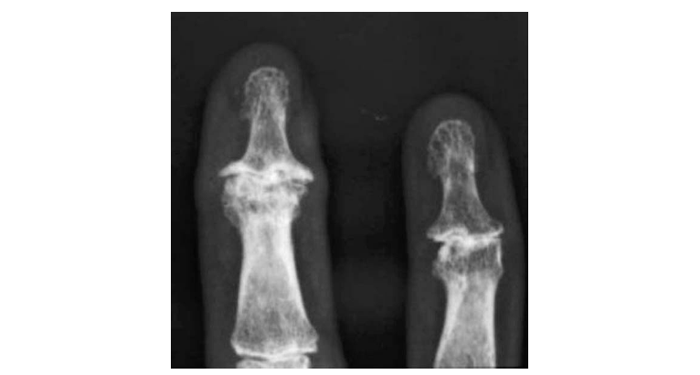
Рис. 7.5. Ерозивний ОА дистальних міжфалангових суглобів III–IV пальців кисті (відповідає III–IV стадії за класифікацією Келлгрена — Лоуренса)
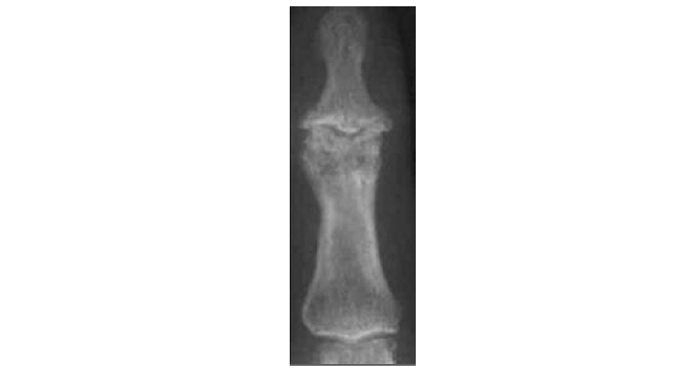
Рис. 7.6. Ерозивний ОА дистального міжфалангового суглоба II пальця кисті (відповідає III–IV стадії за класифікацією Келлгрена — Лоуренса)
РСЩ, будучи заповненою хрящем і прошарком синовіальної рідини, що не дають зображення на рентгенограмах, має вигляд більш прозорої смуги між суглобовими поверхнями.
Сумарна товщина суглобового хряща на рентгенограмах визначається вимірюванням ширини РСЩ між суглобовими поверхнями епіфізів кісток. Зазначимо, що ширина РСЩ досі використовується як основний показник у діагностиці ОА, а стандартна рентгенографія колінних суглобів у прямій і бічний проекціях рекомендується WHO і ILAR як метод вибору для оцінки динаміки змін у суглобовому хрящі при проведенні клінічних випробувань лікарських препаратів. Звуження РСЩ відповідає зменшенню обсягу суглобового хряща, а субхондральний остеосклероз і остеофіти на краях суглобових поверхонь більшість дослідників розглядають як відповідну реакцію кісткової тканини на збільшення механічного навантаження на суглоб, що, у свою чергу, є результатом дегенеративних змін і зменшення в обсягу суглобового хряща. Зазначене важливе не тільки для діагностики ОА, але й для оцінки прогресування захворювання та проведеного лікування.
Наведені рентгенологічні симптоми вважаються специфічними для ОА і включені до переліку рентгенологічних критеріїв діагностики цього захворювання поряд із клінічними.
Рентгенологічні симптоми, обов’язкові для встановлення діагнозу первинного ОА
Звуження РСЩ — один із найважливіших рентгенологічних симптомів, що має прямий корелятивний зв’язок з патологічними змінами, що відбуваються в суглобовому хрящі. РСЩ у різних відділах суглоба має різну ширину, що пов’язано з нерівномірним зменшенням обсягу суглобового хряща на різних ділянках суглобової поверхні. Згідно з рекомендаціями WHO/ILAR ширину РСЩ необхідно вимірювати в найбільш звуженій ділянці. Вважають, що в патологічно зміненому суглобі саме ця ділянка несе максимальне механічне навантаження (для колінного суглоба — це частіше медіальні відділи, для кульшового суглоба — верхньомедіальні, рідше — верхньолатеральні відділи). До анатомічних орієнтирів, що використовуються для вимірювання суглобової щілини на рентгенограмах великих суглобів, належать:
- для випуклих поверхонь (голівка та виростки стегнової кістки) — кортикальний шар замикальної пластинки суглобової поверхні кістки;
- для ввігнутих поверхонь (край вертлюжної западини, проксимальні виростки великогомілкових кісток) — край суглобової поверхні в основі суглобової западини.
Субхондральний остеосклероз — ущільнення кісткової тканини, безпосередньо розташованої під суглобовим хрящем. Зазвичай цей рентгенологічний симптом — наслідок тертя оголених зчленованих нерівних суглобових кісткових поверхонь одна об одну — виявляють на пізніх стадіях ОА, коли суглобова щілина різко звужена. Цей симптом свідчить про глибокий дегенеративно-деструктивний процес у суглобовому хрящі або навіть про зникнення останнього. Порушення цілості суглобового хряща, що передує його кількісному зменшенню, може бути результатом ущільнення кортикальної і трабекулярної кісткової тканини, безпосередньо розташованих під хрящем. Ущільнення субхондральної кісткової тканини в ділянці суглобових поверхонь кісток вимірюється у трьох рівновіддалених точках впродовж суглобового краю; результати виміру при цьому можуть бути усереднені.
Остеофіти — обмежені патологічні кісткові вирости різної форми й розмірів, що виникають при продуктивному запаленні окістя на краях суглобових поверхонь кісток — характерний рентгенологічний симптом ОА. У початкових стадіях розвитку ОА вони мають вигляд загострень або невеликих (до 1–2 мм) кісткових утворень на краях суглобових поверхонь і в місцях прикріплення власних зв’язок суглобів (у колінних суглобах — по краях міжвиросткових виступів великогомілкових кісток, у місцях прикріплення хрестоподібних зв’язок; у кульшових суглобах — по краях ямки голівки стегнової кістки, на медіальній її поверхні, у місці прикріплення власної зв’язки голівки стегнової кістки).
У міру зростання тяжкості ОА й прогресування звуження суглобової щілини остеофітів збільшуються в розмірах, набувають різних форм у вигляді «губ» або «гребенів», прямолінійних або «пишних» кісткових розростань на широкій або вузькій основі (Смирнов А.В., 2001). При цьому суглобові голівка й западина можуть значно збільшуватися в поперечнику, ставати більш масивними та «розплющеними». Кількість остеофітів можна підрахувати окремо чи сумарно в обох суглобах, а їх розміри визначити за шириною в основі та довжиною. Зміна кількості остеофітів і їх розмірів — чутливий індикатор прогресування ОА та контролю ефективності його лікування.
Рентгенологічні симптоми, необов’язкові для встановлення діагнозу первинного ОА
Навколосуглобовий крайовий дефект кісткової тканини. Хоча цей рентгенологічний симптом, який може спостерігатися при ОА, визначений R.D. Аltman та співавторами (1990) як «ерозія суглобової поверхні», термін «навколосуглобовий крайовий дефект кісткової тканини» кращий, оскільки точної гістологічної характеристики цим рентгенологічно виявленим змінам досі не надано. Крайові дефекти кісткової тканини можуть бути виявлені і на ранніх стадіях ОА, причому їх поява може бути викликана запальними змінами в синовіальній оболонці. Подібні зміни описані у великих суглобах і суглобах кистей. Зазвичай при ОА ці дефекти невеликих розмірів, з ділянкою остеосклерозу в основі. На відміну від істинних ерозій, що виявляються при РА, які не мають склеротичних змін в основі та часто визначаються на фоні навколосуглобового остеопорозу, кісткова тканина, що оточує навколосуглобовий крайовий дефект, при ОА не розріджена.
Субхондральні кісти формуються в результаті резорбції кісткової тканини в ділянці з високим внутрішньосуглобовим тиском (у місці найбільшого навантаження на суглобову поверхню). На рентгенограмах вони мають вигляд кільцеподібних дефектів трабекулярної кісткової тканини в субхондральній кістці із чітко визначеним склеротичним обідком. Найчастіше субхондральні кісти розташовуються в найбільш вузькій частині суглобової щілини і виникають при загостренні захворювання. Вони характерні для ОА кульшових суглобів, причому можуть виявлятися як у голівці стегнової кістки, так і в даху вертлюжної западини. Динаміку змін субхондральних кіст можна визначати за їх кількістю та розмірами.
Внутрішньосуглобові кальциновані хондроми утворюються з ділянок некротизованого суглобового хряща, а також можуть бути фрагментом кісткової тканини (остеофіти) або продукуватися синовіальною оболонкою. Зазвичай вони досягають невеликих розмірів, розташовані між суглобовими поверхнями кісток або збоку від епіфізів кісток, мають різну форму (округлу, овальну, подовжену) і нерівномірну точкову структуру, що зумовлено відкладанням кальційвмісних речовин у хрящовій тканині. У суглобі зазвичай виявляють не більше 1–2 хондром.
У колінному суглобі за кальциновану хондрому можна прийняти сесамоподібну кістку (fabella) у підколінній ямці, яка при ОА колінного суглоба також змінює свою форму, положення і розміри. Деформація fabella є одним із симптомів ОА колінного суглоба.
Нижче описані особливості діагностики ОА окремих суглобів, методики оцінки виявлених змін.
Рентгенологічна діагностика ОА кульшових суглобів (коксартрозу)
Точність оцінки ширини РСЩ у кульшових суглобах визначається правильним позиціонуванням хворого, поворотом кінцівки й центруванням рентгенівських променів при проведенні рентгенографії. У положенні хворого стоячи ширина РСЩ вірогідно менша, ніж у положенні лежачи. РСЩ звужена більше при повороті стопи всередину. Рекомендується, щоб центральний рентгенівський промінь проходив через центр голівки стегнової кістки, оскільки зсув рентгенівської трубки вбік від центру суглоба може вірогідно змінити ширину суглобової щілини. Однак роздільна рентгенографія кульшових суглобів призводить до підвищення променевого навантаження на пацієнта.
На початкових стадіях коксартрозу (I–II стадія за класифікацією Келлгрена — Лоуренса) при рентгенологічному дослідженні визначають:
- незначне звуження РСЩ;
- слабовиражений субхондральний остеосклероз;
- точечні кальцифікати в ділянці зовнішнього краю даху вертлюжної западини (початкові явища остеофітозу);
- загострення країв ямки голівки стегнової кістки в ділянці прикріплення круглої зв’язки голівки стегнової кістки.
На пізніх стадіях захворювання (III–IV стадія за класифікацією Келлгрена — Лоуренса) відзначаються:
- прогресуюче звуження РСЩ;
- формування різної форми й розмірів остеофітів на краях суглобових поверхонь вертлюжної западини, голівки стегнової кістки, тому вона може набувати грибоподібної форми. У середній частині вертлюжної западини можливе формування клиноподібного остеофіта, який може зумовити латеральний зсув голівки стегнової кістки (рис. 7.7);
- поглиблення вертлюжної западини, що може бути викликане ростом остеофітів (її протрузія можлива на фоні остеопорозу або стоншення кісток, що складають дно вертлюжної западини);
- виражений субхондральний остеосклероз, який проявляється спочатку в ділянці даху вертлюжної западини, потім — у верхньому відділі голівки стегнової кістки;
- у тяжких випадках — зменшення в обсязі та сплощення суглобової поверхні голівки стегнової кістки на фоні вираженої кистоподібної перебудови кісткової тканини, що чергується з ділянками субхондрального остеосклерозу;
- кісткові кісти — поодинокі або множинні — виникають у верхній частині вертлюжної западини або в зоні найбільшого навантаження на суглобову поверхню голівки стегнової кістки;
- асептичний некроз голівки стегнової кістки;
- підвивихи стегнової кістки: частіше — нагору/латерально, рідше — нагору/медіально;
- ущільнення кісткової тканини та вкорочення шийки стегнової кістки;
- вільні внутрішньосуглобові тільця (при коксартрозі виявляють рідко).
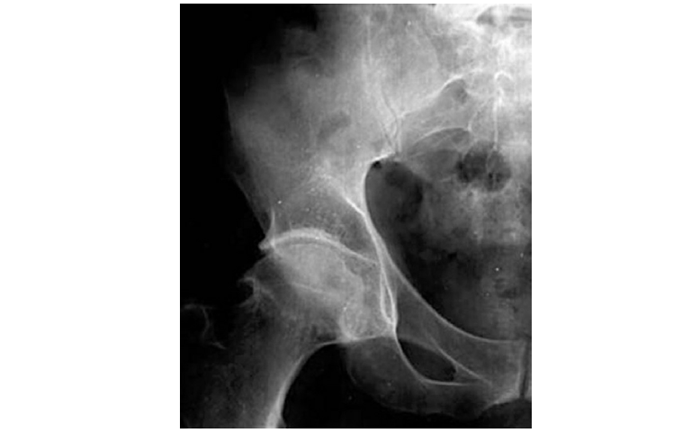
Рис. 7.7. Оглядова рентгенографія кульшового суглоба в прямій проекції. ОА III стадії за класифікацією Келлгрена — Лоуренса. Видно великі остеофіти на краях суглобових поверхонь, грибоподібна деформація голівки стегнової кістки
При вторинному диспластичному коксартрозі всі рентгенологічні симптоми розвиваються рано (у молодому чи середньому віці) і можуть закінчитися асептичним некрозом голівки стегнової кістки та підвивихом або повним вивихом стегна.
Описаний також ішемічний коксартроз зі швидким звуженням суглобової щілини, перебудовою кісткової структури в голівці та шийці стегнової кістки, ранніми остеосклеротичними змінами, але без значного остеофітозу, з досить швидким розвитком деструкції голівки стегнової кістки.
Рентгенологічна діагностика ОА колінних суглобів (гонартрозу)
Колінні суглоби — одні з найскладніших зчленувань для правильного рентгенологічного дослідження через їх структурну складність і широкий діапазон рухів. Гонартроз може локалізуватися тільки в певному відділі суглоба, що також утруднює діагностику суглобових змін.
Анатомічні та біомеханічні особливості колінного суглоба з самого початку зумовлюють значну частоту ураження не тільки кісткових структур, але й зв’язково-меніскового комплексу. Тому високий відсоток первинних діагностичних помилок при аналізі рентгенограм можна пояснити тим, що основна увага приділяється тільки змінам у кісткових структурах. Аналізувати та припускати з великою долею ймовірності на підставі певних ознак наявність ушкоджень зв’язково-меніскового комплексу при проведенні рентгенографії дозволяють численні функціональні проби і укладання. З урахуванням виявлених змін рентгенологічне дослідження може бути доповнене іншими методами візуалізації — УЗД, МРТ та ін.
Основним правилом при рентгенологічному дослідженні колінного суглоба є поліпозиційність.
До стандартних проекцій, що застосовуються при рентгенографії колінного суглоба, належать пряма (передньозадня) і бічна (рис. 7.8, 7.9). У міру необхідності їх доповнюють правою чи лівою косою, а також аксіальною та іншими проекціями.
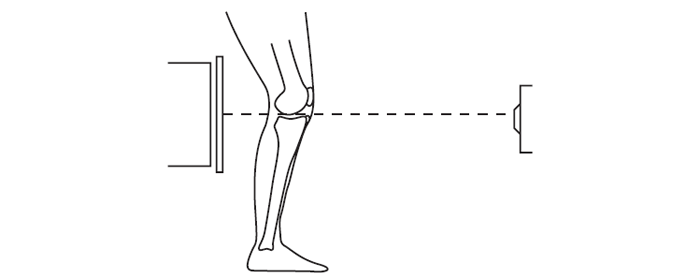
Рис. 7.8. Схема розташування нижньої кінцівки пацієнта щодо рентгенівської трубки (праворуч) і приймаючого пристрою з рентгенівською плівкою (ліворуч). У цій позиції плато великогомілкової кістки розташоване горизонтально, паралельно центральному пучку рентгенівських променів (переривчаста лінія) і перпендикулярно до рентгенівської плівки
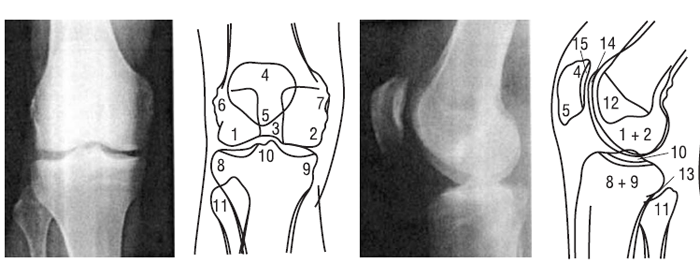
Рис. 7.9. Стандартні рентгенограми і схеми колінного суглоба: 1 — латеральний виросток стегнової кістки; 2 — медіальний виросток стегнової кістки; 3 — міжвиросткова ямка; 4 — основа надколінка; 5 — верхівка надколінка; 6 — латеральний надвиросток стегнової кістки; 7 — медіальний надвиросток стегнової кістки; 8 — латеральний виросток великогомілкової кістки; 9 — медіальний виросток великогомілкової кістки; 10 — міжвиросткові горбики; 11 — голівка малогомілкової кістки; 12 — «пляма» Людлофа; 13 — РСЩ великогомілкового/малогомілкового суглоба; 14 — суглобова поверхня голівки стегнової кістки; 15 — суглобова поверхня надколінка
Ефективність рентгенодіагностики уражень колінного суглоба багато в чому залежить від якості рентгенограм (табл. 7.5).
Таблиця 7.5
Критерії якості рентгенограм
| У прямій проекції |
|
| У бічній проекції |
|
| У всіх проекціях |
|
У прямій проекції внутрішній і зовнішній контури РСЩ мають різну кривизну та орієнтацію, внаслідок чого вони не можуть бути отримані як ідеальна єдина лінія на тому самому знімку. Внутрішню її частину краще видно, коли центральний рентгенівський промінь перпендикулярний поверхні стола, а зовнішню — при каудокраніальному зсуві променя на 5–7°. Компроміс досягається залежно від зони інтересу. Вісь ротації коліна проходить через медіальну ділянку суглоба, яка частіше зазнає змін порівняно із зовнішньою. Отже, при виконанні знімка коліна в прямій проекції кращим вважається укладання, коли суглоб перебуває в стані максимального розгинання з перпендикулярним напрямком центрального променя до об’єкта дослідження і центруванням його на серединну точку коліна, трохи зміщену всередину.
Знімок, виконаний у положенні максимального розгинання коліна, є стандартним для передньозадньої проекції. Він дозволяє досліджувати передню частину РСЩ.
Прямі знімки, виконані при згинанні коліна на 30° (укладання Шусса) або на 45° (укладання Фіка), проводяться для оцінки стану задніх відділів РСЩ, на рівні яких найчастіше й виявляються ушкодження субхондральних відділів кісток (остеонекрози) і хрящових структур (остеохондрити).
Ці укладання зручні для вивчення міжвиросткового простору, який у цьому положенні виявляється максимально доступним для огляду, а також дозволяють виявляти вільні сторонні предмети в порожнині суглоба, що утворюються як наслідок ушкодження суглобових хрящів.
Знімок колінного суглоба в прямій проекції можна виконувати в положенні хворого лежачи та стоячи. Коли патологія має механічну природу і передбачається ушкодження зв’язкового апарату, найкраще виконувати рентгенографію стоячи як при навантаженні, так і в розслабленому стані для дослідження РСЩ і осі суглоба.
Рентгенологічне дослідження колінного суглоба в прямій проекції обов’язково доповнюється знімком у бічній проекції.
При бічній рентгенографії центральний промінь проходить по суглобовій щілині з відхилом на 10° у каудокраніальному напрямку. При цьому краї виростків стегнової кістки накладаються один на одного, а їх суглобові поверхні зміщуються у своїй задній нижній частині. Це дозволяє добре розрізняти їхні контури та оцінити стан ПФВ зчленування.
Знімок колінного суглоба в бічній проекції проводиться чи в положенні пацієнта лежачи на боці при повному розслабленні суглоба, чи стоячи без навантаження на досліджуваний суглоб. Легке згинання коліна (30° або 15°) дозволяє визначити стан ПФВ зчленування. Згинання призначене для візуалізації надколінка в момент його входження у міжвиросткову ділянку.
Проведення рентгенографії в бічній проекції дозволяє виявити транзиторну нестабільність (затримку входження надколінка в міжвиросткову ямку), яка може зникнути при 30° згинанні або не виявлятися на аксіальному знімку, коли мінімальне згинання дорівнює 30, а також оцінити висоту надколінка і стан його суглобової поверхні.
Різні зони суглобової поверхні коліна на бічному знімку мають характерні відмінні риси (табл. 7.6). Ці відмінності пов’язані з функціональними особливостями кожної ділянки. Форма виростків стегнової кістки — це дзеркальна картина передньої частини відповідного тибіального плато, з якою встановлюється контакт при крайньому розгинанні коліна.
Таблиця 7.6
Візуальні особливості кісток колінного суглоба при аналізі рентгенівських знімків (Степанченко А.П., 2002)
| Суглобовий відрізок стегнової кістки | Внутрішній виросток — випинається внизу і назад, з’єднується з діафізом стегнової кістки дуже круто, горбик прикріплення великого привідного м’яза покриває його ззаду; на рівні його передньої третини є вирізка (кондилотрохлеарна вирізка).
Зовнішній виросток — передній і задній його краї більш округлі, ніж внутрішнього виростка; з’єднується з діафізом стегнової кістки більш похило; кондилотрохлеарна вирізка розташована нижче й більше назад, її видно менш чітко, ніж на внутрішньому виростку. Міжвиросткова борозна — її зовнішню щоку краще видно, ніж внутрішню, має краніальний напрямок |
| Суглобовий відрізок великогомілкової кістки | Внутрішнє плато — завжди випукле, його задній край випинається назад.
Зовнішнє плато — ввігнуте в 2/3 або пласке в ⅓ випадків; його задній край проектується більше вперед, ніж задній край внутрішнього плато; з’єднується з діафізом великогомілкової кістки похило спереду і круто ззаду; розташовується більш ззаду, ніж внутрішнє плато. Міжвиросткове підвищення — дуже крутий передній край і похилий задній |
При наявності транзиторної нестабільності надколінка чи при підозрі на ушкодження хрестоподібних зв’язок необхідне додаткове проведення навантажувальних тестів.
Для виявлення нестабільності надколінка знімок колінного суглоба виконують у момент скорочення чотириголового м’яза стегна, що дозволяє побічно оцінити стан зв’язкового апарату й висоту стояння надколінка.
При підозрі на ушкодження хрестоподібних зв’язок додатково виконують бічну рентгенографію в умовах фізичного навантаження. Для цього хворого просять перемістити масу тіла на ушкоджену кінцівку. При ушкодженнях хрестоподібних зв’язок відбувається зсув кінців кісток колінного суглоба відносно одна одної залежно від ушкодженої структури. Так, зсув суглобового кінця стегнової кістки щодо великогомілкової кістки вперед більше ніж на 5 мм свідчить про розрив задньої хрестоподібної зв’язки, тоді як при зсуві назад слід припускати розрив передньої хрестоподібної зв’язки.
Особливо велике значення бічного знімка для вивчення ПФВ зчленування.
При оцінюванні топографії надколінка застосовуються різні коефіцієнти вимірювання, з яких найчастіше використовується — індекс Катона (рис. 7.10). Для вимірювання цього індексу потрібен знімок, зроблений при згинанні колінного суглоба на 30°.
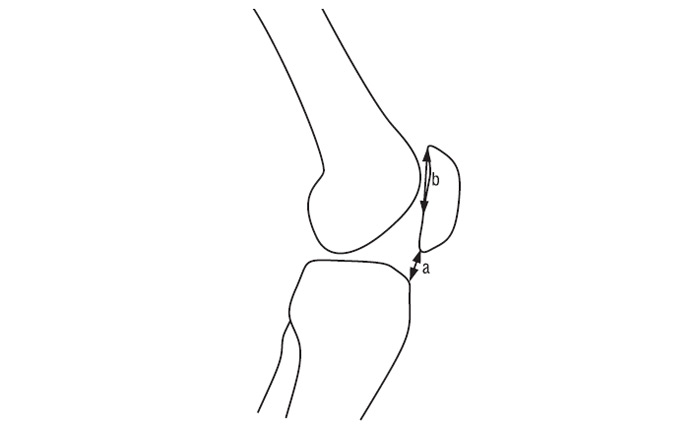
Рис. 7.10. Індекс Катона
Індекс Катона є співвідношенням відстані від нижнього краю надколінка до передньоверхнього кута великогомілкової кістки (а) до довжини суглобової поверхні надколінка (b). У нормі це співвідношення зазвичай становить 1,0±0,3.
Занадто високе розташування надколінка (patella alta) призводить до запізнілого його входження в трохлеарне устя, що може бути причиною надколінково-стегнової нестабільності. Для діагностики цієї нестабільності використовують надколінковий індекс (рис. 7.11).
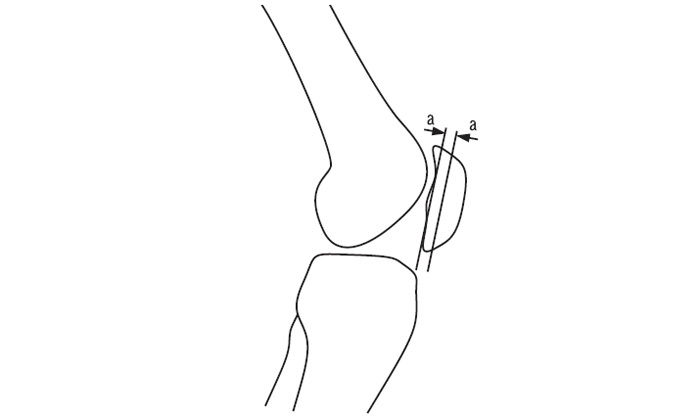
Рис. 7.11. Надколінковий індекс
На бічному знімку профіль надколінка має дві задні лінії, одна з яких відповідає гребеню надколінка, а інша, більш щільна, — його зовнішньому краю. Відстань між цими двома лініями (а–а) і є надколінковим індексом (у нормі — 5 мм). Значення <2 мм свідчить про нестабільність, яка, однак, може бути транзиторною, що зникає при згинанні під кутом більше 15–30°.
Бічний знімок порівняно з аксіальними проекціями дає можливість аналізу руху надколінка на самому початку згинання (0–30°), коли він починає входити в міжвиросткову ямку. У цей момент можна оцінити глибину міжвиросткової ямки та встановити її дисплазію, яка може виявитися причиною нестабільності.
Трохлеарний індекс (рис. 7.12) вимірюється від дна міжвиросткової ямки (а) до суглобової поверхні надколінка, а саме до його гребеня (а), і визначається на відстані 1 см від верхнього краю міжвиросткової поверхні, що відповідає зоні входження надколінка на самому початку згинання. У нормі він має дорівнювати 1 см. Значення <1 см свідчать про дисплазію надколінка, яка часто поєднується з недорозвиненням суглобової поверхні надколінка. При більших значеннях індексу слід думати про зайву глибину міжвиросткової ямки, що підвищує ризик розвитку хондропатії надколінка.
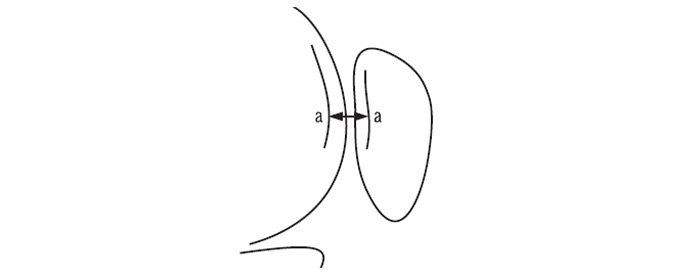
Рис. 7.12. Трохлеарний індекс
Певна роль у діагностиці уражень колінного суглоба приділяється пателофеморальним аксіальним проекціям.
На цих проекціях зіткнення ПФВ варіює залежно від кута згинання коліна — 30, 60° або 90° (рис. 7.13).
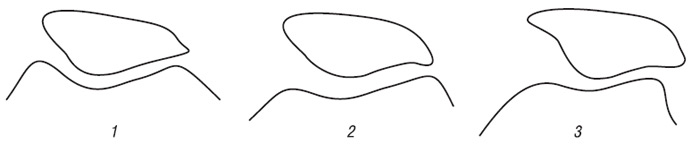
Рис. 7.13. Аксіальні знімки ПФВ суглоба: 1 — виконаний при згинанні коліна на 30°; 2 — виконаний при згинанні коліна на 60°; 3 — виконаний при згинанні коліна на 90°
Рентгенографія при 30° згинанні найбільш інформативна для вивчення РСЩ ПФВ. При меншому згинанні товщина м’яких тканин, через які проходить промінь, велика, що негативно позначається на якості зображення. Ця аксіальна проекція відрізняється від інших, з більшим кутом згинання, візуалізацією країв трохлеарної вирізки. Внутрішній край міжвиросткової ямки дуже короткий, внутрішній і зовнішній краї мають кутастий вигляд, значно більш гострі, ніж у нижньому і середньому сегментах трохлеї. Зовнішня частина ПФВ суглоба зазнає більш значного навантаження, ніж внутрішня. Тому субхондральна кістка щільніша на рівні зовнішньої ділянки, а кісткові трабекули орієнтовані назовні.
Аксіальний знімок при 30° найбільш зручний для виявлення нестабільності надколінка (зовнішні транзиторні підвивихи надколінка відбуваються тільки на самому початку згинання) і початкового ОА латерального ПФВ суглоба (див. нижче).
Традиційно для визначення рентгенологічної стадії ОА колінних суглобів використовується класифікація Келлгрена — Лоуренса (1957), удосконалена M. Lequesne в 1982 р., що базується на оцінці ступеня вираженості звуження РСЩ, субхондрального остеосклерозу та величини крайових кісткових розростань; у ній виділяються чотири стадії.
Стадії ОА (за класифікацією Келлгрена — Лоуренса, 1957):
0 — відсутність рентгенологічних ознак
I — сумнівна
II — мінімальна
III — середня
IV — виражена
Незважаючи на певну умовність подібного розподілу ОА на рентгенологічні стадії, ця методика успішно застосовується в сучасній рентгенології при дотриманні ряду умов. Зокрема, для своєчасного виявлення гонартрозу необхідно досліджувати суглоб у трьох проекціях: передній, бічній і аксіальній, що дозволяє оцінити медіальну, латеральну, ПФВ та ТФВ суглоба.
Для більш точної оцінки рентгенологічних змін при ОА A. Ларсен (1987) запропонував більш складну методику, що дозволяє кількісно оцінити ступінь тяжкості ОА.
Критерії ОА (Larsen A., 1987):
0 — відсутність рентгенологічних ознак
I — звуження РСЩ менше ніж на 50%
II — звуження РСЩ більше ніж на 50%
III — слабка ремодуляція
IV — середня ремодуляція
V — виражена ремодуляція
Ранні рентгенологічні ознаки (відповідають I–II стадії артрозу за класифікацією Келлгрена — Лоуренса):
- витягування та загострення країв міжвиросткового підвищення великогомілкової кістки (у місці прикріплення хрестоподібної зв’язки);
- невелике звуження суглобової щілини (частіше — в медіальному відділі суглоба);
- загострення країв суглобових поверхонь виростків стегнової та великогомілкової кістки, частіше — в медіальному відділі суглоба (пов’язане з більшим навантаженням на цей відділ суглоба), особливо при наявності варусної деформації; рідше — у латеральній частині або одночасно в обох половинах суглобової поверхні (рис. 7.14).
Рис. 7.14. Рентгенографія колінних суглобів у бічній проекції. ОА ПФВ колінних суглобів (більше ліворуч). ОА колінних суглобів (І стадія за класифікацією Келлгрена — Лоуренса праворуч, IV стадія за класифікацією Келлгрена — Лоуренса ліворуч)
Рентгенологічні ознаки прогресування артрозу колінних суглобів (відповідають III–IV стадії артрозу за класифікацією Келлгрена — Лоуренса)
- збільшення звуження РСЩ;
- розвиток субхондрального остеосклерозу в найбільш навантаженій частині суглоба;
- поява множинних великих остеофітів на бічних, передніх і задніх краях суглобових поверхонь;
- субхондральні кісти (виявляються рідко);
- вторинний синовіт із розвитком субпателярної чи підколінної кісти Бейкера;
- сплощення і нерівність суглобових поверхонь стегнової та великогомілкової кістки, втрата їх анатомо-функціональної диференціації;
- багатогранна неправильна форма сесамоподібної кістки (fabella);
- можливе виявлення кальцинованих хондром;
- можливий розвиток асептичних некрозів виростків кісток (рідко).
Досить частo о ОА колінних суглобів проявляється у вигляді артрозу ПФВ (майже завжди зовнішнього, іноді зовнішнього та внутрішнього, рідко тільки внутрішнього).
Зовнішній артроз ПФВ суглоба зазвичай проявляється на початку свого розвитку на рівні верхнього хрящового сектору міжвиросткової борозни і нижнього хрящового сектору надколінка, відповідного до тієї частини ПФВ суглоба, яка візуалізується в цій проекції. Найбільше навантаження на субхондральні відділи кісток відзначається на самому початку згинання колінного суглоба, у той момент, коли надколінок починає входити в міжвиросткову ямку. Тому зміни в ПФВ суглоба відзначаються досить часто, але, як правило, рідко діагностуються вчасно. Основною причиною несвоєчасної діагностики є те, що на практиці рентгенографічні аксіальні проекції не використовуються в достатній мірі. Отже, пряму рентгенографію колінних суглобів необхідно обов’язково доповнювати прицільним знімком надколінка в бічній або аксіальній проекції.
До рентгенологічних ознак ОА ПФВ колінного суглоба в бічний і аксіальній проекціях належать:
- звуження РСЩ між надколінком і стегновою кісткою;
- остеофіти на задніх кутах надколінка та виростків стегнової кістки;
- субхондральний остеосклероз надколінка;
- одиничні субхондральні кісти зі склеротичним обідком.
Слід зазначити, що рентгенологічно розрізняють три стадії ОА ПФВ (рис. 7.15). Субхондральна остеоконденсація і посилення трабекулярного малюнка зовнішнього краю надколінка, що несе найбільші зовнішні навантаження («синдром гіпертиску»), відповідають I стадії артрозу. При II стадії спостерігається обмеження (локальне звуження) суглобової щілини, навіть при відсутності ознак підвивиху надколінка. III стадія артрозу ПФВ характеризується практично повним зникненням РСЩ, ущільненням субхондрального кортикального шару, в товщі якого утворюються ділянки розрідження — кортикальні кісти, і появою перихондральних остеофітних дзьобоподібних утворень. Виявлення крайових остеофітів надколінка дозволяє з великою часткою вірогідності припускати ураження суглобового хряща. Наявність їх по контурах зовнішнього та внутрішнього виростків стегнової та великогомілкової кісток вказує на ушкодження меніска відповідної сторони. Виражений артроз найчастіше виникає при зсуві осі надколінка внаслідок зовнішнього його підвивиху, що виникає в результаті дисплазії чи порушення суглобових взаємовідносин ПФВ зчленування. На рис. 7.16, 7.17 наведена рентгенологічна картина ОА ПФВ колінного суглоба.
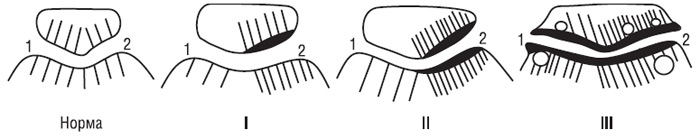
Рис. 7.15. Стадії ОА ПФВ суглоба: 1 — медіальний виросток; 2 — латеральний виросток
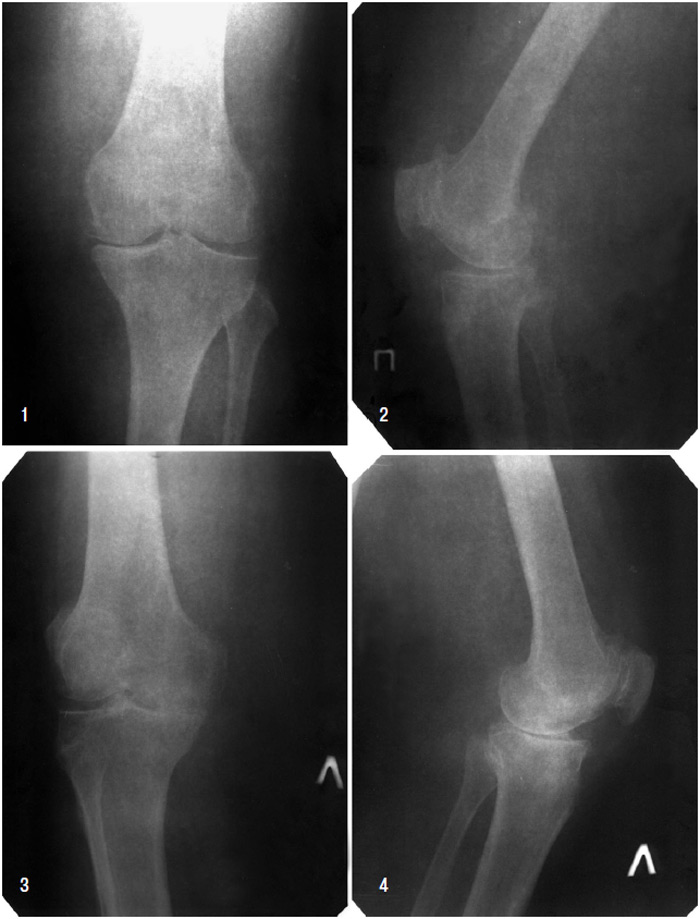
Рис. 7.16. Рентгенографія правого (1, 2) і лівого (3, 4) колінних суглобів. Явища ОА ПФВ обох колінних суглобів. ОА колінних суглобів (III стадія за класифікацією Келлгрена — Лоуренса)
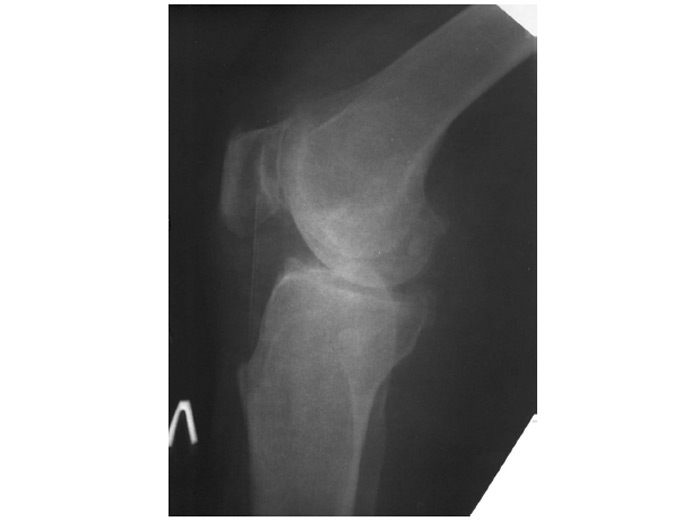
Рис. 7.17. Рентгенографія лівого колінного суглоба в бічній проекції. Явища ОА ПФВ колінного суглоба. ОА лівого колінного суглоба (II–III стадія за класифікацією Келлгрена — Лоуренса)
Використання аксіального знімка при 30° дозволяє також розрахувати індекс Бернажо — відстань між передньою горбистістю великогомілкової кістки (а) і міжвиростковою ямкою (b), в нормі становить від 10 до 15 мм (рис. 7.18). Зменшення чи збільшення цієї відстані зазвичай свідчить про дисплазію виростків стегнової кістки або надколінка, що виражається в нестабільності ПФВ зчленування.
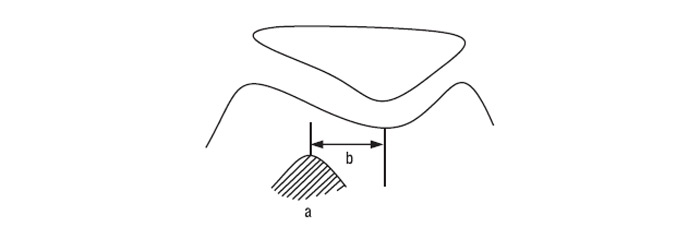
Рис. 7.18. Індекс Бернажо
Вивчення РСЩ ПФВ при згинанні коліна на 60 і 90° дозволяє детально вивчити середню й нижню частини міжвиросткового простору та верхню частину надколінка. Зазвичай патологічні зміни в цих зонах спостерігаються пізніше, ніж у верхніх відділах міжвиросткової ямки.
Стандартна оцінка рентгенограм суглобів за класифікацією Келлгрена — Лоуренса підходить головним чином для використання в повсякденній клінічній практиці. При проведенні клінічних і епідеміологічних досліджень часто потрібна більш докладна класифікація тяжкості ОА. З цією метою висоту суглобової щілини ТФВ колінного суглоба вимірюють тонкою пластиковою лінійкою, градуйованою по 0,5 мм, або кронциркулем. Така кількісна оцінка буде більш точною, якщо використовувати спеціальні комп’ютерні програми обробки рентгенограм.
J.C. Buckland-Wright та співавтори (1995) запропонували вимірювати висоту РСЩ (мм) на макрорентгенограмах колінних суглобів у зовнішній, середній і внутрішній третинах ТФВ медіально та латерально.
Для полегшення вимірювання висоти РСЩ за цією методикою нами запропонований такий алгоритм (рис. 7.19). Через центр міжвиросткової борозни опускається перпендикуляр (а), потім суворо перпендикулярно йому проводиться лінія (b), що проходить через дві найбільш віддалені точки латерального і медіального виростків стегнової кістки. Таким чином, лінія а ділить лінію b на дві частини — b1 і b2. На медіальну і латеральну пластинки великогомілкової кістки від b1 і b2 опускаються по два перпендикуляри, що ділять b1 і b2 на три рівні частини. Через середину кожної третини (зовнішньої, середньої, внутрішньої) медіальної та латеральної частини ТФВ колінного суглоба опускаються перпендикуляри — O1, M1, I1 і O2, M2, I2. Здійснюють вимірювання останніх шести (по три з кожної сторони) ліній.
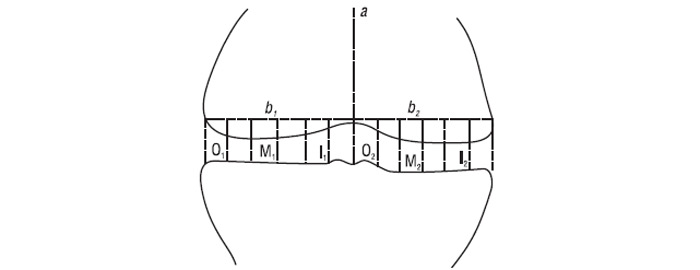
Рис. 7.19. Схема вимірювання висоти суглобової щілини на макрорентгенограмах ТФВ колінних суглобів. Пунктиром зазначені допоміжні лінії, суцільною лінією — лінії виміру висоти суглобової щілини в зовнішній (О), середній (М) і внутрішній (I) третині медіальної та латеральної частини ТФВ колінного суглоба
Очевидно, що при оцінці рентгенограм суглобів хворих на ОА не можна обмежуватися лише дослідженням висоти суглобової щілини, тому кращими є методики напівкількісної оцінки, які широко використовуються при проведенні масштабних клінічних і епідеміологічних досліджень. Усі ці методики мають загальний принцип — найбільш важливі рентгенологічні симптоми ОА (висота суглобової щілини, остеофітоз, субхондральний склероз, субхондральні кісти) оцінюються в балах або ступенях (зазвичай від 0 до 3).
Одним із перших напівкількісну оцінку рентгенограм колінних суглобів запропонував S. Ahlback (1968). Згідно з цією методикою чотири вищезазначені рентгенологічні критерії ОА оцінюють у балах від 0 до 3 у ПФВ і ТФВ. Основними недоліками цієї шкали є відсутність оцінки ПФВ колінного суглоба та висока ймовірність двозначного трактування рентгенологічних симптомів різними фахівцями. Аналогічну систему розробили R.D. Altman та співавтори (1987). Враховуючи основний недолік цих двох систем (оцінка тільки ТФВ колінного суглоба), T.D. Spector та співавтори (1992) запропонували метод напівкількісної оцінки рентгенограм колінних суглобів у проекції «sunrise», яка дозволяє оптимально досліджувати ПФВ. У «Рентгенографічному атласі остеоартрозу» S. Barnett і співавторів (1994) до оцінки ПФВ суглоба в проекції «sunrise» додана оцінка у стандартній бічній проекції.
Пропонуємо свій метод напівкількісної оцінки прогресування гонартрозу:
1. Зниження висоти суглобової щілини:
0 — відсутнє;
1 — незначне;
2 — помірне;
3 — повна облітерація міжкісткового простору.
2. Остеофіти:
0 — відсутні;
1 — 1–2 дрібних остеофітів;
2 — один великий або 3 дрібних остеофітів і більше;
3 — ≥2 великих остеофіти.
3. Субхондральні кісти:
0 — відсутні;
1 — 1–2 дрібні кісти;
2 — 1 велика або 3 дрібні кісти і більше;
3 — 2 великі кісти і більше.
4. Субхондральний склероз:
0 — відсутній;
1 — незначний, локальний (у медіальній або латеральній частині ТФВ або ПФВ суглоба);
2 — помірний;
3 — значно виражений, поширений.
R.D. Altman та співавтори (1995) об’єднали в єдину систему напівкількісну оцінку обох відділів колінного суглоба й видали «Атлас індивідуальних рентгенологічних симптомів остеоартрозу», який одержав другу назву «Атлас ORS». До переваг цієї системи можна також віднести те, що в ній наведені реальні рентгенограми колінних суглобів з ОА. Поряд із цим «Атлас ORS» має ряд недоліків. Серед них можна виділити такі:
- градації звуження суглобової щілини і збільшення розмірів остеофітів мають неоднакові інтервали;
- на деяких рентгенограмах колінних суглобів наведені типи остеофітів, що рідко виявляються;
- якість рентгенівських знімків варіює, що утруднює їх порівняння;
- наявність декількох рентгенологічних симптомів (звуження суглобової щілини, остеофітоз та ін.) на одному рентгенівському знімку, що утруднює роботу з «Атласом» і може призвести до упередженої оцінки реальних ренгенограм;
- великий обсяг «Атласу», що ускладнює його використання.
Y. Nagaosa та співавтори (2000) врахували недоліки попередніх систем напівкількісної оцінки рентгенограм колінних суглобів і розробили свій атлас, ілюстративний матеріал, у якому — графічне зображення контурів складових колінного суглоба в прямій проекції (ТФВ суглоба) і в проекції «sunrise» (ПФВ суглоба) (рис. 7.20–7.26). Важливою перевагою системи Y. Nagaosa та співавторів є не лише те, що вони окремо розглядають медіальну й латеральну частини ТФВ і ПФВ колінного суглоба, але й те, що рентгенологічні симптоми ОА представлені окремо для чоловіків і для жінок.
При обстеженні 104 хворих із достовірним ОА колінних суглобів (згідно з критеріями ACR, 1990) нами вивчені розміри й напрямок росту остеофітів і оцінені можливі зв’язки між їх розмірами та іншими рентгенологічними даними, що мають зв’язок із ростом остеофітів.
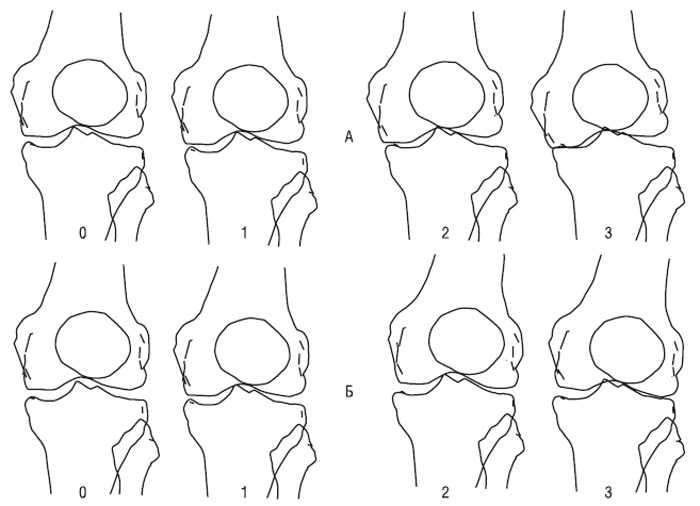
Рис. 7.20. Ступені звуження РСЩ медіального (А) і латерального (Б) ТФВ колінного суглоба у жінок
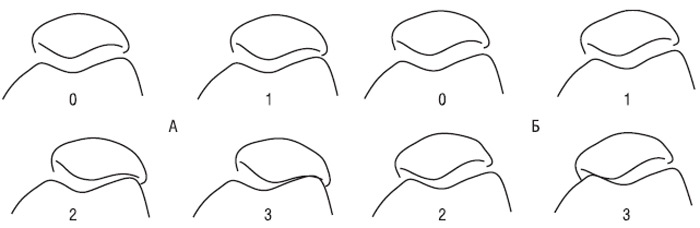
Рис. 7.21. Ступені звуження РСЩ латерального (А) і медіального (Б) ПФВ колінного суглоба у жінок
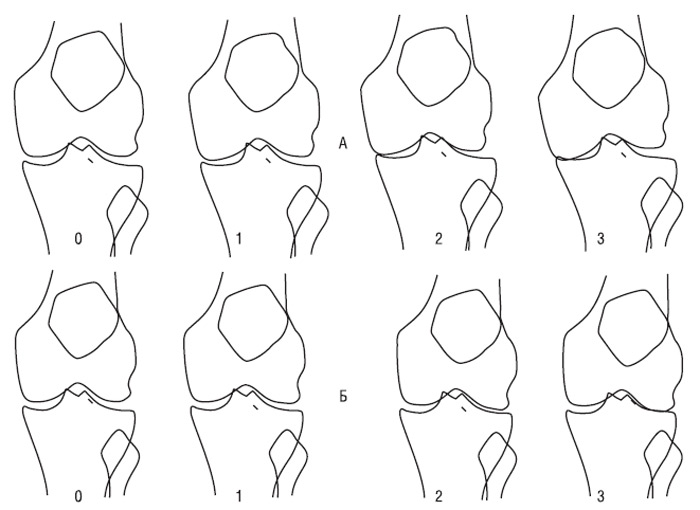
Рис. 7.22. Ступені звуження РСЩ медіального (А) і латерального (Б) ТФВ колінного суглоба в чоловіків
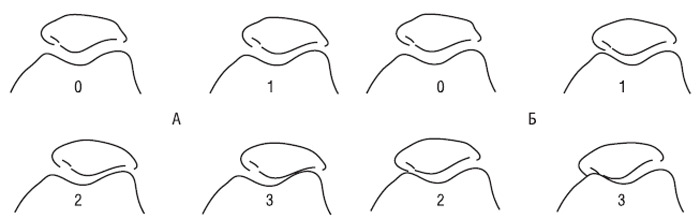
Рис. 7.23. Ступені звуження РСЩ латерального (А) і медіального (Б) ПФВ колінного суглоба у чоловіків
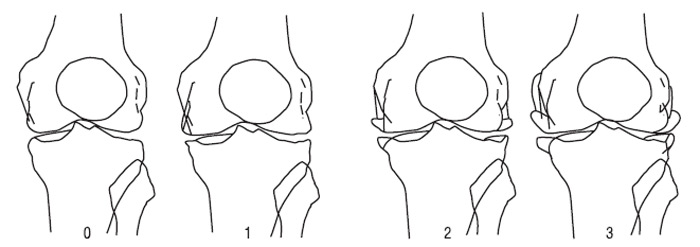
Рис. 7.24. Остеофіти ТФВ колінного суглоба (усі ділянки)
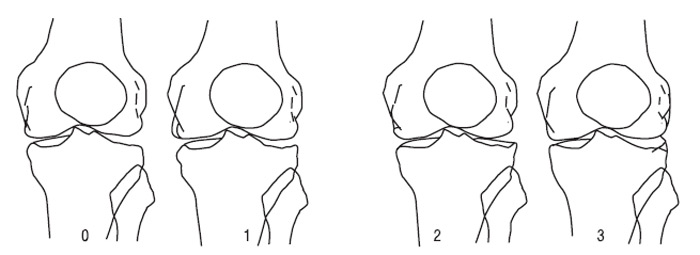
Рис. 7.25. Остеофіти латеральної частини великогомілкової кістки (цей рисунок слід використовувати, якщо контури остеофітів цієї локалізації значно відрізняються від таких на рис. 7.24)
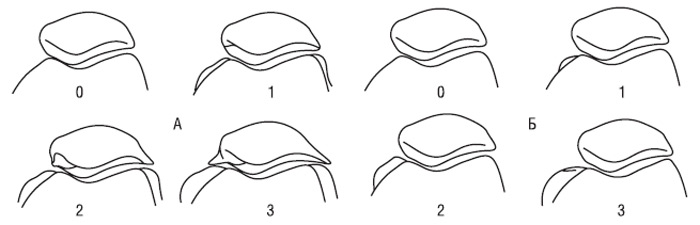
Рис. 7.26. А — остеофіти ПФВ колінного суглоба (усі відділи); Б — медіальний трохлеарний остеофіт стегнової кістки (слід використовувати, якщо контури медіального трохлеарного остеофіта стегнової кістки значно відрізняються від таких на рис. 7.26 А)
Аналізували стандартні рентгенограми обох колінних суглобів (за винятком хворих, які перенесли пателектомію чи артропластику). Рентгенологічно гонартроз визначали як наявність рівномірного чи нерівномірного звуження РСЩ і крайових остеофітів (критерії ACR, 1990). Рентгенографію колінних суглобів виконували у стандартних проекціях: передньозадній із повним розгинанням нижніх кінцівок і аксіальній.
При оцінці рентгенограм колінний суглоб умовно поділяли на відділи згідно з сучасними рекомендаціями (Nagaosa Y. et al., 2000): латеральний і медіальний ТФВ, латеральний і медіальний ПФВ. Звуження РСЩ у кожному з цих відділів, а також розміри остеофітів на кожній з 6 ділянок: латеральна і медіальна суглобові поверхні стегнової кістки (відповідно ЛС і МС), великогомілкової кістки (ЛВГ і МВГ), надколінка (ЛН і МН), а також остеофітів латерального й медіального виростків стегнової кістки (ЛВ і МВ) оцінювали за шкалою від 0 до 3 за атестаційною системою Logically derived line drawing atlas for grading of knee osteoarthritis (Nagaosa Y. et al., 2000). Напрямок росту остеофітів поділяли візуально на 5 категорій — вгору (висхідний ріст), вгору латерально, латерально, вниз латерально або вниз (низхідний ріст).
Порушення коркового шару кістки (локальна деформація чи «зношування» кістки) і хондрокальциноз у ТФВ і ПФВ оцінювали за 2-бальною системою (0 — відсутній, 1 — наявний). Тибіофеморальний кут, індикатор варусної деформації, оцінювався в передньозадній проекції. Підвивих надколінка на знімках коліна в аксіальній проекції медіально оцінювався 0–1, латерально 0–3. Звуження РСЩ у кожному досліджуваному відділі та латеральний підвивих надколінка були також відповідно поділені на ступені 0–3 (Nagaosa Y. et al., 2000).
У 92 пацієнтів виявлено тісну кореляцію між даними рентгенографії правого й лівого колінних суглобів (табл. 7.7).
Таблиця 7.7
Коефіцієнт кореляції (r) деяких рентгенологічних показників між правим і лівим колінними суглобами
| Показник, що аналізується | Коефіцієнт кореляції (r) | |
| мінімальний | максимальний | |
| Звуження РСЩ | 0,64 | 0,78 |
| Наявність остеофітів | 0,50 | 0,72 |
| Локальна деформація кістки | 0,40 | 0,63 |
| Хондрокальциноз | 0,79 | 0,88 |
Остеофіти виявлялися у всіх досліджуваних ділянках (табл. 7.8), причому були відзначені різні форми й напрямки їх росту.
Таблиця 7.8
Деякі співвідношення між наявністю остеофітів та їх розмірами з іншими рентгенологічними даними
| Локалізація остеофітів | Загальна кількість остеофітів | Напрямок росту остеофітів (відмінність між 0–1 і 2–3 ступенями розміру остеофітів) | Напрямок росту остеофітів (відмінність між 0–1 і 2–3 ступенями локального звуження РСЩ) |
| ЛС | 42 | p=0,011 | p=0,006 |
| ЛВГ | 48 | p>0,1 | p<0,001 |
| МС | 53 | p=0,003 | p=0,001 |
| МВГ | 49 | p<0,05 | p<0,05 |
| ЛН | 28 | p=0,002 | p>0,1 |
| ЛВ | 30 | p>0,1 | p<0,001 |
| МН | 28 | p>0,1 | p>0,1 |
| МВ | 34 | p=0,019 | p>0,1 |
Як видно на рис. 7.27 (передньозадня проекція), малі остеофіти (0–1 ступінь) на ділянках МС, МВГ і ЛС мали головним чином горизонтальний напрямок, тоді як більші остеофіти на цих ділянках були спрямовані в основному вертикально щодо лінії суглобової щілини. Остеофіти у ЛВГ, незалежно від їх розміру, в основному були спрямовані вгору відносно лінії суглобової щілини. На рис. 7.27 (аксіальна проекція) малі остеофіти МВГ із однаковою частотою спрямовані вгору медіально або вниз латерально від лінії суглобової щілини, а більші — в основному вниз; остеофіти у ЛВГ — головним чином вниз латерально від цієї лінії, проте великі остеофіти розташовані більш латерально, ніж малі. Найменші остеофіти в ділянці МН розташовані паралельно суглобовій щілині, а великі — під кутом, тоді як у ЛН малі остеофіти головним чином ростуть в основному під кутом, а великі — перпендикулярно лінії суглобової щілини. Таким чином, на деяких ділянках напрямок росту малих і великих остеофітів значно відрізняється.
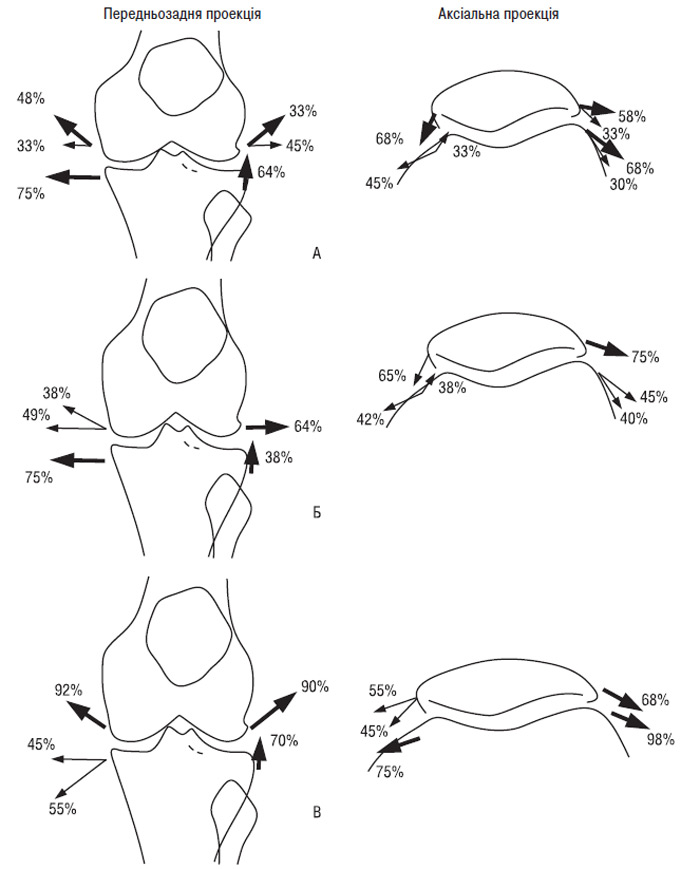
Рис. 7.27. Спрямованість росту остеофітів у обстежених хворих на ОА: А — загалом у групі; Б — остеофіти 1 ступеня; В — остеофіти 2–3 ступеня
Подібні закономірності спостерігалися і при аналізі напрямку росту остеофітів залежно від ступеня локального звуження суглобової щілини (див. табл. 7.8, рис. 7.28). У ЛС, МС, МВГ, ЛВ вираженість локального звуження щілини була пов’язана з напрямком росту великих остеофітів. Напрямок росту остеофітів у ЛВГ був пов’язаний не з розміром остеофітів, а з локальним звуженням суглобової щілини латерального й медіального ТФВ, а в МН він не корелював ні з розміром остеофітів, ні зі ступенем локального звуження.
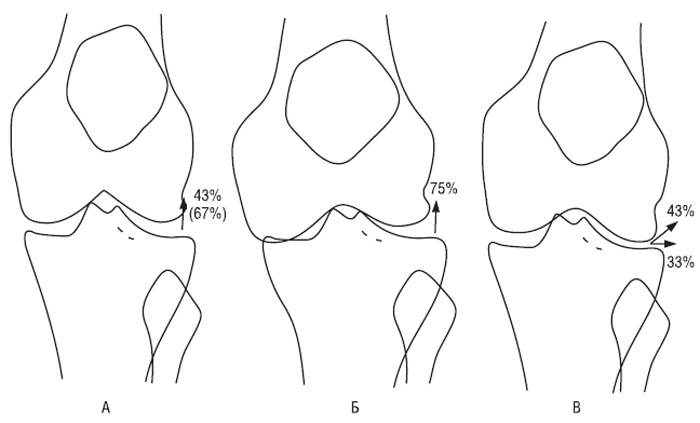
Рис. 7.28. Спрямованість росту остеофітів залежно від їх розміру та ступеня звуження суглобової щілини: А — 0–1 ступінь звуження суглобової щілини медіального (латерального) ТФВ; Б — 2–3 ступінь звуження суглобової щілини медіального ТФВ; В — 2–3 ступінь звуження суглобової щілини латерального ТФВ
Позитивна кореляція між розміром остеофітів і ступенем локального звуження суглобової щілини була виявлена у всіх відділах, крім медіального ПФВ. В останньому розміри остеофітів надколінка та МВ позитивно корелювали зі звуженням щілини медіального ТФВ. Розмір остеофітів у ЛС і ЛВГ латерального ТФВ позитивно корелювали зі ступенем звуження латерального ПФВ.
Для уточнення зв’язків між деякими рентгенологічними та загальноклінічними даними із розміром остеофітів останні були проаналізовані за допомогою багатофакторного аналізу. У табл. 7.9 зазначені ті фактори, які виявилися статистично значимими після проведення останнього (для кожної досліджуваної ділянки асоційовані фактори розташовані в порядку їх значимості).
Таблиця 7.9
Фактори, асоційовані з наявністю остеофітів, залежно від розміру останніх
| Ділянка | Фактор | |
| Остеофіти 0–1 ступеня | Остеофіти 2–3 ступеня | |
| ЛС | Локальна деформація ПФВ | Хондрокальциноз |
| Хондрокальциноз | Локальна деформація ТФВ | |
| Звуження суглобової щілини латерального ТФВ | ||
| ЛВГ | Хондрокальциноз | Жіноча стать |
| Локальна деформація ПФВ | Хондрокальциноз | |
| Звуження суглобової щілини латерального ПФВ | Локальна деформація ТФВ | |
| Звуження суглобової щілини медіального ТФВ | ||
| МС | Латеральний підвивих надколінка | Локальна деформація ТФВ |
| Звуження суглобової щілини медіального ТФВ | Загальна кількість остеофітів | |
| Жіноча стать | Жіноча стать | |
| Варусна деформація | ||
| МВГ | Локальна деформація ТФВ | Хондрокальциноз |
| Звуження суглобової щілини медіального ТФВ | Вік | |
| Варусна деформація | ||
| ЛН | Локальна деформація ПФВ | Локальна деформація ПФВ |
| Латеральний підвивих надколінка | Латеральний підвивих надколінка | |
| Хондрокальциноз | ІМТ | |
| ІМТ | ||
| ЛВ | Латеральний підвивих надколінка | Латеральний підвивих надколінка |
| Локальна деформація ПФВ | Звуження суглобової щілини латерального ПФВ | |
| Хондрокальциноз | Варусна деформація | |
| Медіальний підвивих надколінка | ||
| МН | Звуження суглобової щілини медіального ПФВ | Варусна деформація |
| МВ | Звуження суглобової щілини медіального ТФВ | Звуження суглобової щілини медіального ТФВ |
| Загальна кількість остеофітів | ||
| ІМТ | ||
Локальне звуження щілини було пов’язане з наявністю остеофітів у більшості аналізованих ділянок. Остеофіти у ЛВГ пов’язані зі звуженням щілин медіального ТФВ і латерального ПФВ. Остеофіти у ЛН і ЛВ корелювали більше з латеральним підвивихом надколінка, ніж з локальним звуженням. Остеофіти 2–3 ступеня медіального ПФВ не пов’язані з локальним звуженням, але пов’язані з варусною деформацією та звуженням щілини медіального ТФВ. Ступінь локальної деформації ТФВ асоціювався з наявністю остеофітів 2–3 ступеня як у латеральних, так і медіальних ТФВ, тоді як локальна деформація ПФВ — з наявністю остеофітів (1 ступінь і вище) як у латеральному ТФВ, так і (остеофіти 2–3 ступеня) у латеральному ПФВ. Хондрокальциноз був викликаний ростом остеофітів на багатьох ділянках. Наявність латерального підвивиху надколінка тісно корелювала з ростом остеофітів у латеральному ПФВ, а варусна деформація — з наявністю остеофітів 2–3 ступеня в медіальному ТФВ. Загальна кількість остеофітів корелювала з числом остеофітів у МС і МВ.
Розміри зростаючих назустріч один одному остеофітів у тому самому відділі корелювали у всіх аналізованих відділах: коефіцієнт кореляції r становив 0,64 для латерального ТФВ, 0,72 — для медіального ТФВ, 0,49 — для латерального ПФВ і 0,42 — для медіального ПФВ.
Отже, у всіх відділах колінного суглоба, крім ЛВГ і МН, напрямок росту остеофітів змінюється зі збільшенням розмірів останніх і ступенем звуження суглобової щілини. Виявлені кореляції підтримують гіпотезу про вплив як загальних, так і місцевих біомеханічних факторів на формування остеофітів. Про вплив останніх свідчить виявлена нами кореляція між такими параметрами:
- розмір остеофітів у медіальному ПФВ та звуження щілини медіального ТФВ;
- розмір остеофітів ЛВГ і звуження щілини як медіального ТФВ, так і латерального ПФВ;
- розмір остеофітів у латеральному ПФВ та латеральний підвивих надколінка;
- розмір остеофітів медіальних ТФВ і ПФВ та наявність варусної деформації. Навпаки, при аналізі зв’язків хондрокальцинозу із загальною кількістю остеофітів виявлені різноспрямовані зміни.
Можна припустити, що локальна нестабільність — важливий пусковий біомеханічний механізм формування остеофітів. В експериментальних моделях OA продемонстровано, що формування остеофітів при нестабільності суглоба прискорюється при рухах у цьому суглобі й сповільнюється при іммобілізації (Palmoski M.J., 1982). Як відзначено L.A. Рottenger та співавторами (1990), хірургічне видалення остеофітів при проведенні артропластики колінного суглоба у хворих на OA призводить до збільшення нестабільності в суглобі, що дозволяє говорити про стабілізуючу роль остеофітів при даній патології. Наше спостереження про те, що латеральний ріст остеофітів сприяє збільшенню навантажуваної площі суглобової поверхні, підтверджується даними, одержаними J.M. Williams і K.D. Brandt (1984). Для остеофітів малого розміру переважаючий напрямок росту — латеральний (за винятком ЛВГ, де остеофіти ростуть переважно вгору, за умови, що щілина медіального ТФВ звужена, а латеральний ТФВ мінімально залучений у процес). L.A. Pottenger та співавтори (1990) показали, що навіть вертикальні остеофіти можуть стабілізувати суглоб, очевидно, шляхом формування новоствореної поверхні великогомілкової кістки та обмеження надлишкового вальгусного руху. На відміну від малого, великий остеофіт росте переважно вгору або вниз. Це явище може відображати анатомічне обмеження «латерального» росту суміжними періартикулярними структурами або компенсаторні процеси розширення та механічного посилення основи остеофітів для запобігання вивихів.
Серед подібних компенсаторних змін слід назвати й так звані лінії припливу, що є зонами кальцифікації, які з’єднують гіаліновий хрящ із субхондральною кісткою. В нормі вони хвилясті й тому ефективно протидіють значним навантаженням. При ОА у зв’язку з тим, що хрящ руйнується, а новий хрящ формується у вигляді остеофітів, ця зона перебудовується. Отже, одним із проявів ОА є наявність множинних ліній припливу. Оскільки суглобова поверхня кістки оголена, то компенсаторним механізмом стає формування щільного склерозу (ебурнеація), що часто поєднується з утворенням глибоких борозен (поглиблень). Останні особливо часто виявляються в колінному суглобі (ПФВ), де можуть вважатися засобом, що стабілізує суглоб, забезпечуючи його «рейками» (Watt I., 2000). Ці борозни добре візуалізувалися на аксіальних зображеннях ПФВ у пацієнтів, які були нами обстежені.
У нашому дослідженні тісна кореляція спостерігалася між розміром остеофітів і локальним стоншенням хряща, особливо в медіальному ТФВ та латеральному ПФВ. Однак розмір остеофітів у латеральному ТФВ більше корелював зі звуженням суглобових щілин медіального ТФВ і латерального ПФВ, а не його власної суглобової щілини, а розмір остеофітів у медіальному ПФВ корелював не з локальним звуженням щілини, а із звуженням у медіальному ТФВ. Очевидно (van Beuningen H.M. et al., 1994; 1999), на розмір остеофітів можуть впливати як зміни в суміжних ділянках суглоба, так і локальні, що може опосередковуватися біохімічними або механічними факторами росту остеофітів. Останніми з найбільшою ймовірністю може бути пояснений зв’язок розмірів остеофітів медіальних ТФВ і ПФВ із варусною деформацією. G.I.van Osch та співавтори (1996) припустили, що процеси ураження хряща і формування остеофітів прямо не пов’язані, але викликані тим самим фактором і розвиваються незалежно один від одного. Подібний незалежний розвиток спостерігається в латеральному ПФВ та медіальному ТФВ, причому розмір остеофітів пов’язаний більше з латеральним підвивихом надколінка і варусною деформацією, ніж із локальним звуженням суглобової щілини.
Зв’язок між загальною кількістю остеофітів і їх розташуванням на кількох ділянках підтримує концепцію конституціональної зумовленості формування остеофітів і «гіпертрофічної» відповіді кістки (Solomon L., 1983). Можливо, є індивідуальні відмінності у вираженості відповіді на дію деяких факторів росту, наприклад ТФР-β (van Вeuningen Н.M., 1994; van den Berg W.B., 1995) або кісткового протеїну-2, що бере участь у рості остеофітів (bone morphogenic proteine-2) (van Beuningen H.M., 1999). Цікавим спостереженням є зв’язок хондрокальцинозу та кількості остеофітів: клінічні дослідження припускають наявність специфічних відносин між кристалами пірофосфату кальцію (зазвичай причиною хондрокальцинозу) і «гіпертрофічним» результатом OA (Doherty M., Dieppe P.A., 1988; Felson D.T. et al., 1989). ТФР-β1, крім стимуляції росту остеофітів, збільшує виробіток хондроцитами позаклітинного пірофосфату (Rosen F. et al., 1997), а механічна стимуляція хондроцитів збільшує виробіток ATФ, потужного джерела позаклітинного пірофосфату (Graff R.D. et al., 2000), тим самим сприяючи утворенню кристалів останнього.
Одержані нами дані припускають участь у патогенезі ОА ряду факторів, включаючи місцеві біомеханічні, конституційні та ін., що визначають розмір і спрямованість росту остеофітів, що формуються в процесі прогресування захворювання.
ОА проксимальних і дистальних міжфалангових суглобів
Стандартна рентгенографія кистей проводиться в прямій проекції. Пальці розміщені разом, кисті лежать рівно на касеті на одній лінії з віссю, що проходить через передпліччя і зап’ясток (рис. 7.29).
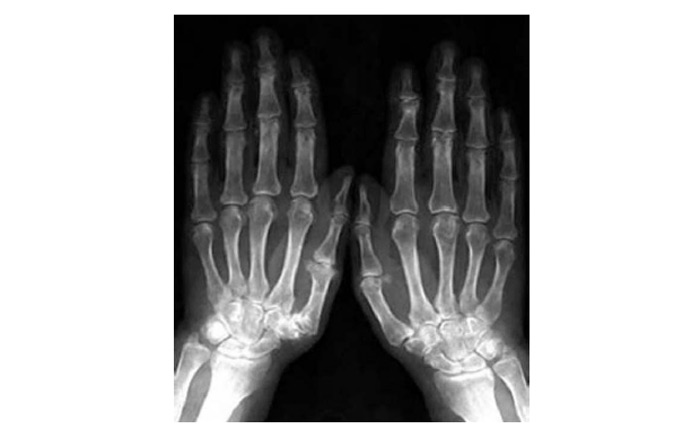
Рис. 7.29. Оглядова рентгенографія кистей. Множинні артрози дистальних і проксимальних міжфалангових суглобів. Множинні вузлики Гебердена і Бушара. Виражений артроз зап’ястково-п’ясткового суглоба I пальця лівої кисті
Початкові прояви (відповідають I–II стадії артрозу за класифікацією Келлгрена — Лоуренса):
- невеликі загострення країв або остеофітів із нерізким субхондральним остеосклерозом;
- дрібні, субхондрально розташовані кісти;
- нормальна чи злегка звужена РСЩ;
- наявність дрібних кальцинатів у м’яких тканинах у ділянці бічних країв суглобових поверхонь кісток.
Виражені зміни (відповідають III–IV стадії артрозу за класифікацією Келлгрена — Лоуренса):
- помірно виражені або великі остеофіти;
- деформація країв суглобових поверхонь кісток;
- значне звуження РСЩ;
- остеосклероз (вузлики Гебердена в дистальних міжфалангових суглобах і вузлики Бушара в проксимальних);
- кісти зі склеротичним обідком;
- крайові дефекти суглобових поверхонь (при цьому кісткові виступи з однієї сторони можуть вклинюватися в іншу), зазвичай оточені зоною остеосклерозу (рис. 7.30; див. також рис. 7.5, 7.6).
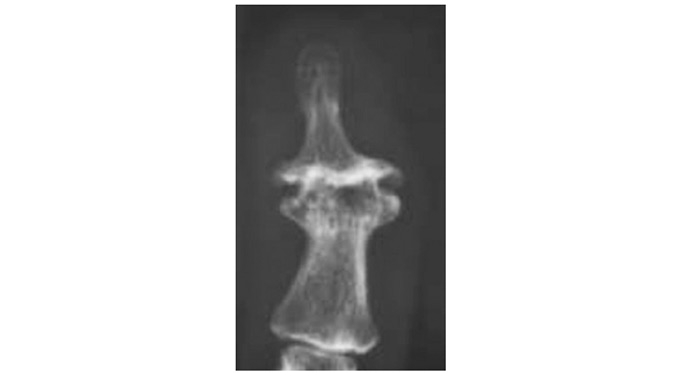
Рис. 7.30. Рентгенографія кисті в прямій проекції. ОА дистального міжфалангового суглоба III пальця
Дорсопальмарне зображення кисті
Напівкількісна оцінка
D.A. Kallman та співавтори (1989), R.D. Altman та співавтори (1995) у своїх методиках оцінки індивідуальних рентгенологічних змін при ОА враховують остеофіти, звуження РСЩ і періартикулярні субхондральні ерозії для оцінки дистальних і проксимальних міжфалангових суглобів і зап’ястково-п’ясткового суглоба I пальця. Додаткові дані оцінки включають періартикулярний субхондральний склероз і зсув у суглобі без підвивихів.
Чотирибальна шкала оцінки вищезазначених змін (Altman R.D. et al., 1995) не вміщає весь комплекс анатомічних змін, що спостерігалися і описані G. Verbruggen, E.M. Veys (1995). Ці автори виділяють 5 фаз прогресування захворювання (рис. 7.31). Неуражений суглоб (N), стаціонарна фаза ОА (S), що базуються на наявності остеофітів і/або звуження РСЩ і/або субхондрального склерозу. Більшість суглобів на цій стадії залишаються у фазі S від 2 до 3 років. Потім відбувається облітерація суглобової щілини (J-фаза), яка також триває 2–3 роки. Ця фаза передує чи співіснує з появою субхондральних кіст, що порушують цілість субхондральної пластинки (ерозивна або Е-фаза). Ерозивні епізоди стихають спонтанно, змінюючись відновленням уражень і ремоделюванням (R-фаза). Ця остання фаза веде до регенерації субхондральної пластинки, що вкривається хрящовою тканиною, з формуванням великих остеофітів, які надають ураженим суглобам вузлуватий вид (рис. 7.32, 7.33). G. Verbruggen, E.M. Veys (1995) вважають, що запропонований ними метод забезпечує швидку оцінку прогресування ОА.
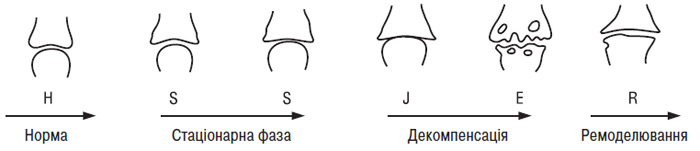
Рис. 7.31. Діаграма рентгенологічних змін, що використовуються для оцінки прогресування ОА суглобів пальців кисті (за: Verbruggen G., Veys E.M., 1995)
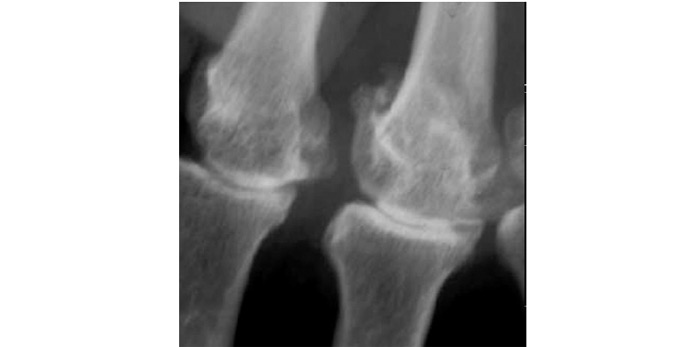
Рис. 7.32. Рентгенографія кисті в прямій проекції. ОА п’ястково-фалангових суглобів II–III пальців
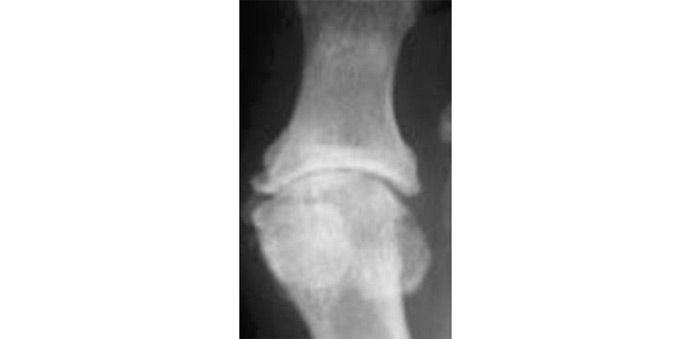
Рис. 7.33. ОА плесно-фалангового суглоба I пальця
Дані про кількісний розподіл частоти утворення остеофітів (%) у суглобах кистей і променево-зап’ясткових суглобах хворих на ОА (за: Вuckland-Wright C., 1999) наведені на рис. 7.34.
Рис. 7.34. Розподіл частоти утворення остеофітів у суглобах кистей і променево-зап’ясткових суглобах хворих на ОА (за Buckland-Wright J.C., 1999)
Методи оптимізації рентгенологічної діагностики ОА
Як уже зазначалося, методи оцінки прогресування ОА ґрунтуються на виявленні рентгенологічної динаміки в суглобах. Слід враховувати, що динаміка рентгенологічних змін при ОА відрізняється повільним темпом: швидкість звуження РСЩ у хворих на гонартроз становить приблизно 0,3 мм/рік. Результати тривалих досліджень рентгенологічних змін у пацієнтів на ОА колінних суглобів, які одержували негормональне протизапальне лікування, показали відсутність рентгенологічного прогресування захворювання після 2 років спостереження і мінімальні відмінності між групами хворих, які одержували лікування, і контролем. Відсутність достовірних змін при тривалих дослідженнях дає підставу припускати, що рентгенологічні симптоми ОА при стандартній рентгенографії суглобів залишаються відносно стабільними протягом тривалого часу. Отже, для оцінки динаміки змін краще використовувати більш чутливі рентгенівські технології, до однієї з яких належить мікрофокусна рентгенографія суглобів.
У мікрофокусних рентгенівських апаратах застосовуються спеціальні рентгенівські трубки із точковим джерелом випромінювання. Кількісна мікрофокусна рентгенографія із прямим збільшенням зображення показує достатню чутливість щодо виявлення дрібних змін у структурі кісток. За допомогою цього методу прогресування ОА та ефект від проведеного лікування може бути зареєстрований і точно виміряний за досить короткий час між дослідженнями. Це досягається завдяки стандартизації дослідження та використання рентгенографічної вимірювальної процедури, поліпшенню якості одержуваних рентгенограм суглобів із прямим збільшенням зображення, що дозволяє реєструвати невидимі на стандартних рентгенограмах структурні деталі кістки. WHO/ILAR рекомендують вимірювати ширину РСЩ вручну методом Lequesne з використанням збільшувальної лінзи й розрахунками ширини РСЩ у різних точках. Отримані результати свідчать, що при повторних вимірах коефіцієнт варіації становить 3,8%. Розвиток мікрокомп’ютерної та аналізуючої зображення техніки забезпечує більш точну оцінку змін анатомії суглобів, ніж ручні методи. Цифрова обробка рентгенівського зображення суглоба дозволяє автоматично вимірювати ширину суглобової щілини за допомогою комп’ютера. Помилка дослідника практично виключається, оскільки точність при повторних вимірах встановлюється самою системою.
З погляду оперативності діагностики, простоти й зручності використання особливий інтерес становлять пересувні рентгендіагностичні апарати з поліпозиційним штативом типу С-дуга, що широко застосовуються у світовій практиці. Апарати цього класу дозволяють проводити обстеження пацієнта в будь-яких проекціях без зміни його положення.
Заслуговує на увагу метод функціональної рентгенографії колінних суглобів (Алешкевич А.И., 1999; 2000), що полягає у виконанні 2 послідовних рентгенівських знімків колінного суглоба в положенні хворого стоячи у прямій передній проекції з переважаючою опорою на досліджувану кінцівку (1-й знімок — при повністю випрямленому колінному суглобі, 2-й — при згинанні під кутом 30°). Контури кісткових елементів, що утворюють РСЩ, з 1-ї та 2-ї рентгенограм переводили на папір і сканером послідовно вводили в комп’ютер, після чого за різницею співвідношення латеральної та медіальної площі між 1-ю і 2-ю рентгенограмами визначали ступінь ураження гіалінового хряща колінного суглоба (стадію ОА оцінювали за Hellgen). У нормі вона становила 0,05±0,007; для I стадії — 0,13±0,006; для II — 0,18±0,011; для III — 0,3±0,03. Між показниками в нормі та при I стадії є істотна відмінність (р<0,001): між I і II стадією різниця достовірна (р<0,05), між II і III стадією ОА — істотна відмінність (р<0,001).
Отримані показники свідчать, що рентгенопланіметрія колінного суглоба при функціональній рентгенографії об’єктивно відображує стадійність ОА колінного суглоба.
Метод функціональної рентгенографії з навантаженням дозволив встановити, що у 8 пацієнтів, у яких при традиційній рентгенографії не виявлено патологічних змін, є вихідне зниження висоти РСЩ. У 7 пацієнтів встановлено більш тяжкий ступінь ураження. Таким чином, діагноз було змінено у 15 (12,9±3,1%) хворих.
Поряд із традиційною методикою рентгенографії колінного суглоба — дослідженням колінного суглоба у стандартних проекціях при горизонтальному положенні хворого — існує методика дослідження цього суглоба при вертикальному положенні. На думку В.А. Попова (1986), знімок колінного суглоба, виконаний у горизонтальному положенні, не відображає реальних механічних умов суглоба в стані навантаження масою тіла. Він запропонував проводити дослідження колінного суглоба в ортостатичному положенні з переважною опорою на досліджувану кінцівку. S.S. Messich та співавтори (1990) висловили думку, що найкращим положенням для діагностики ОА є згинання колінного суглоба на 28° при вертикальному положенні хворого також із переважною опорою на досліджувану кінцівку, оскільки проведені біомеханічні дослідження показали, що початкове ураження гіалінового хряща колінного суглоба відзначається в задніх відділах виростків стегна, що перебувають під кутом 28° у сагітальній площини, тому що саме в цьому положенні діє основне за часом механічне навантаження на хрящ (фізіологічне положення колінного суглоба). H. Petterson та співавтори (1995) запропонували методику рентгенографії колінного суглоба з навантаженням, при якому нижня частина гомілки перебуває під кутом 5–10° до площини рентгенівської плівки і додатково суглоб згинається під кутом 10–15°. На думку авторів, у цьому положенні центральний промінь направляється по дотичній до площини великогомілкового виростка і суглобовий простір буде правильно зображений на знімку.
Таким чином, цілеспрямоване використання можливостей класичної рентгенографії з урахуванням клінічних проявів дозволяє в багатьох випадках підтвердити або як мінімум запідозрити наявність ураження тієї або іншої структури зв’язково-меніскового комплексу колінного суглоба і вирішити питання про необхідність дообстеження хворого за допомогою інших засобів медичної візуалізації.
МРТ
МРТ за останні роки стала одним із провідних методів неінвазивної діагностики. З 70-х років ХХ ст., коли принципи магнітного резонансу (МР) вперше стали використовувати для дослідження організму людини, до сьогодні цей метод медичної візуалізації докорінно змінився і продовжує швидко розвиватися. Удосконалюються технічне оснащення, програмне забезпечення, розвиваються методики одержання зображень, розробляються МР-контрастні препарати. Це дозволяє постійно знаходити нові сфери застосування МРТ. Якщо спочатку її застосування обмежувалося лише дослідженнями ЦНС, то зараз МРТ із успіхом застосовують практично у всіх галузях медицини.
У 1946 р. групи дослідників зі Стендфордського та Гарвардського університетів незалежно один від одного відкрили явище, яке було названо ядерно-магнітним резонансом (ЯМР). Суть його полягала в тому, що ядра деяких атомів, перебуваючи в магнітному полі, під дією зовнішнього електромагнітного поля здатні поглинати енергію, а потім випускати її у вигляді радіосигналу. За це відкриття Ф. Блоч і Е. Пармель у 1952 р. були удостоєні Нобелівської премії. Новий феномен незабаром навчилися використовувати для спектрального аналізу біологічних структур (ЯМР-спектроскопія). У 1973 р. Пол Лаутербур винайшов, як використовувати градієнт та продемонстрував можливість одержати зображення тіла за допомогою ЯМР-сигналів. Так з’явилася ЯМР-томографія. Раймонд Дамадіан виявив, що злоякісна тканина відрізняється від нормальної за ЯМР-характеристиками. Перші ЯМР-томограми внутрішніх органів живої людини були продемонстровані у 1982 р. на Міжнародному конгресі радіологів у Парижі.
Слід надати два пояснення. Незважаючи на те що метод ґрунтується на явищі ЯМР, його називають МР, опускаючи слово «ядерний». Це зроблено для того, щоб у пацієнтів не виникало думки про радіоактивність, пов’язану з розпадом ядер атомів. І друга обставина: МР-томографи не випадково «настроєні» саме на протони, тобто на ядра водню. Цього елементу в тканинах дуже багато, а ядра його мають найбільший магнітний момент серед усіх атомних ядер, що зумовлює досить високий рівень МР-сигналу.
Якщо в 1983 р. в усьому світі налічувалося лише кілька приладів, придатних для клінічних досліджень, то до початку 1996 р. у світі працювало близько 10 тис. томографів. Щорічно в практику вводиться 1 тис. нових приладів. Більше 90% парку МР-томографів становлять моделі з надпровідними магнітами (0,5–1,5 Тл).
Моделі із середнім і навіть низьким полем відрізняються від систем із високим полем, у системах із низьким та середнім полем використовують магніти постійного типу та резистивні, у системах із високим полем використовуть надпровідні магніти. Постійні магніти мають такі переваги, як низьке споживання електроенергії та затрати на експлуатацію і первинне встановлення, при цьому немає необхідності забезпечення рідким гелієм, але ці магніти порівняно важкі, відсутня можливість аварійного відключення магнітного поля. У сучасних магнітах постійного типу використовується магнітне поле напругою 0,35 Тл. Магніти резистивного типу мають свої недоліки та переваги над магнітами постійного типу; серед переваг слід відмітити відносно невелику вагу магніту, можливість відключення магнітного поля, але його недоліками є надвисокі затрати на електроенергію при експлуатації, що не надають йому переваги при виборі типу магніту при розгляді можливості встановлення у лікарському закладі системи з низьким полем. Ще одна з переваг постійного магніту — поле невпевненого прийому досить мале.
При розгляданні систем із високим полем слід відмітити значні технічні складнощі, пов’язані з кріогенним забезпеченням системи. Але незважаючи на це та високі ціни на надпровідні магніти вони найбільш широко використовуються. Це зумовлено їх технічними характеристиками — високою напругою та однорідністю магнітного поля, високим співвідношенням сигнал/шум. Крім того, лише на високопольних МР-сканерах можна отримати високу швидкість сканування, можливість проведення МР-спектроскопії, наукових досліджень.
На сьогодні в Україні представлені МР-томографи різних класів, серед яких особливе місце за якістю зображення, клінічними можливостям і швидкістю МР-досліджень займає «Siemens MAGNETOM Avanto Tim [76×18] SQ-engine» — одна з найбільш досконалих МР-систем у медицині в класі 1,5 Тл сканерів з унікальною технологією нульового випаровування гелію з періодичністю дозаправки гелію всього лише 1 раз на 10 років (http://dcmedex.com).
Це перша МР-система, оснащена унікальною технологією Tim, що дозволяє працювати клініці на принципово вищому рівні, як за якістю отримуваних діагностичних зображень, так і за спектром клінічних завдань, що вирішуються. Технологія матричних катушок дозволяє досліджувати будь-яку ділянку тіла без необхідності перекладання пацієнта і без перевстановлення катушок (аж до сканування всього тіла 205 см). «MAGNETOM Avanto» має можливість подальшої технологічної модернізації в майбутньому із збереженням наявного парку катушок.
Принцип методу
Основними компонентами МР-томографа (рис. 7.35) є: надсильний магніт, радіопередавач, приймальна радіочастотна котушка, комп’ютер і пульт керування. Більшість апаратів мають магнітне поле з магнітним моментом, паралельним довгій осі тіла людини. Сила магнітного поля вимірюється в теслах (Тл). Для клінічної МРТ використовують поля із силою 0,2–1,5 Тл.
Рис. 7.35. Основні компоненти МР-томографа
Коли пацієнта поміщають у сильне магнітне поле, усі протони, що є магнітними диполями, розвертаються в напрямку зовнішнього поля (подібно компасній стрілці, що орієнтується на магнітне поле Землі). Крім цього, магнітні осі кожного протона починають обертатися навколо напрямку зовнішнього магнітного поля. Цей специфічний обертовий рух називають процесією, а його частоту — резонансною частотою. При пропусканні через тіло пацієнта коротких електромагнітних радіочастотних імпульсів магнітне поле радіохвиль змушує магнітні моменти всіх протонів обертатися навколо магнітного моменту зовнішнього поля. Для того щоб це відбулося, необхідно, щоб частота радіохвиль дорівнювала резонансній частоті протонів. Це явище називають магнітним резонансом. Для зміни орієнтації магнітних протонів магнітні поля протонів і радіохвиль повинні резонувати, тобто мати однакову частоту.
У тканинах пацієнта створюється сумарний магнітний момент: тканини намагнічуються та їх магнетизм орієнтується строго паралельно зовнішньому магнітному полю. Магнетизм пропорційний кількості протонів в одиниці об’єму тканини. Величезне число протонів (ядер водню), що містяться в більшості тканин, зумовлює той факт, що чистий магнітний момент досить великий для того, щоб індукувати електричний струм у розташованій поза пацієнтом приймаючій котушці. Ці індуковані МР-сигнали використовуються для реконструкції МР-зображення.
Процес переходу електронів ядра зі збудженого стану в рівноважний називається спін-ґратчастим релаксаційним процесом або поздовжньою релаксацією. Він характеризується Т1 — спін-ґратчастим часом релаксації — часом, необхідним для переводу 63% ядер у стан рівноваги після їх збудження 90° імпульсом. Виділяють також Т2 — спін-спіновий час релаксації.
Існує ряд способів одержання МР-томограм. Їх відмінність полягає в порядку й характері генерації радіочастотних імпульсів, методах аналізу МР-сигналів. Найбільш поширені два способи: спін-ґратчастий і спін-еховий. При спін-ґратчастому аналізують головним чином час релаксації T1. Різні тканини (сіра й біла речовина головного мозку, спинномозкова рідина, пухлинна тканина, хрящ, м’язи та ін.) мають у своєму складі протони з різним часом релаксації T1. Із тривалістю T1 пов’язана інтенсивність МР-сигналу: чим коротший T1, тим інтенсивніший МР-сигнал і тим світліше виглядає це місце зображення на телемоніторі. Жирова тканина на МР-томограмах — біла, слідом за нею за інтенсивністю МР-сигналу в порядку зменшення йдуть головний і спинний мозок, щільні внутрішні органи, судинні стінки та м’язи. Повітря, кістки і кальцинати практично не дають МР-сигналу і тому відображаються чорним кольором. Зазначене взаємовідношення часу релаксації T1 створює передумови для візуалізації нормальних та змінених тканин на МР-томограмах.
При іншому способі МР-томографії, названому спін-еховим, на пацієнта спрямовують серію радіочастотних імпульсів, що повертають прецесуючі протони на 90°. Слідом за припиненням подачі імпульсів реєструють відповідні МР-сигнали. Однак інтенсивність відповідного сигналу по-іншому пов’язана із тривалістю Т2: чим коротший Т2, тим слабший сигнал і, отже, нижча яскравість світіння екрана телемонітора. Таким чином, підсумкова картина МРТ за способом Т2 протилежна такій за способом T1 (як негатив позитиву).
У сучасних апаратах є опції турбо-режиму (turbo, наприклад турбо-спін-ехо — tse), що значно зменшує час для отримання зображень, внаслідок чого покращує якість зображення, виключаючи можливі артефакти руху під час тривалого сканування звичайними послідовностями (спін-ехо — se), використовується і швидке покращене спін-ехо (haste), для МР-холангіопанкреатографії з високою якістю отриманих зображень, наприклад на «Siemens MAGNETOM Avanto». Також за потребою суміжних медичних спеціалістів можлива комплектація спеціалізованими робочими станціями та програмами, що дозволяє визначати об’єми, зокрема синовіальної рідини, робити реконструкції отриманих зображень.
На МР-томограмах краще, ніж на комп’ютерних томограмах, відображаються м’які тканини: м’язи, жирові прошарки, хрящі, судини. На деяких апаратах можна одержати зображення судин, не вводячи в них контрастний засіб (МР-ангіографія). Внаслідок невисокого вмісту води в кістковій тканині остання не створює ефекту, що екранує, як при рентгенівській комп’ютерній томографії, тобто не заважає зображенню, наприклад спинного мозку, міжхребцевих дисків тощо. Звичайно, ядра водню містяться не лише у воді, але в кістковій тканині вони фіксовані в дуже великих молекулах та щільних структурах і не перешкоджають при МРТ.
Переваги та недоліки методу
До основних переваг МРТ належать неінвазивність, нешкідливість (відсутність променевого навантаження), можливість отримання зображень у будь-яких площинах і можливість робити тривимірні реконструкції, природний контраст від крові, що рухається, відсутність артефактів від кісткових тканин, висока диференціація м’яких тканин, можливість виконання МР-спектроскопії для прижиттєвого вивчення метаболізму тканин in vivo. МРТ дозволяє одержувати зображення тонких шарів тіла людини у будь-якому перетині — у фронтальній, сагітальній, аксіальній та косих площинах. Можна реконструювати об’ємні зображення органів, синхронізувати одержання томограм із зубцями електрокардіограми.
До основних недоліків зазвичай відносять досить тривалий час, необхідний для одержання зображень (як правило, хвилини), що призводить до появи артефактів від дихальних рухів (у сучасніх МР-системах з високою напругою магнітного поля та градієнтом сканування може проводитися за час, що відповідає можливості затримки дихання пацієнта і не є обмеженням), аритмій (при дослідженні серця), не досить надійне виявлення каменів, кальцинатів, деяких видів патології кісткових структур, висока вартість обладнання та його експлуатації, спеціальні вимоги до приміщень, у яких розташовані прилади (екранування від перешкод), неможливість обстеження хворих із клаустрофобією, штучними водіями ритму, великими металевими імплантатами з немедичних металів.
Протипоказання до проведення МРТ
До абсолютних протипоказань відносять стани, при яких проведення дослідження є загрозливим для життя пацієнтів. Наприклад, наявність імплантатів, які активуються електронним, магнітним або механічними шляхами, — це перш за все штучні водії ритму. Вплив радіочастотного випромінювання МР-томографа може порушити функціонування стимулятора, що працює в системі запиту, оскільки зміни магнітних полів можуть імітувати серцеву діяльність. Магнітне притягання може викликати також зсув стимулятора у гнізді та зрушити електроди. Крім того, магнітне поле створює перешкоди для роботи феромагнітних або електронних імплантатів середнього вуха. Наявність штучних клапанів серця становить небезпеку і є абсолютним протипоказанням лише при дослідженні на МР-томографах із високими полями, а також якщо клінічно передбачається ушкодження клапана. До абсолютних протипоказань до дослідження належить також наявність невеликих металевих хірургічних імплантатів (гемостатичні кліпси) у ЦНС, тому що зсув їх внаслідок магнітного притягання загрожує кровотечею. Їх наявність в інших частинах тіла має меншу загрозу, тому що після лікування фіброз та інкапсулювання затисків допомагають втримати їх у стабільному стані. Однак, крім потенційної небезпеки, наявність металевих імплантатів із магнітними властивостями в кожному разі викликає артефакти, що створюють трудності для інтерпретації результатів дослідження (табл. 7.10).
Таблиця 7.10
Протипоказання до проведення МРТ
| Абсолютні | Відносні |
| Кардіостимулятори | Інші стимулятори (інсулінові насоси, нервові стимулятори) |
| Феромагнітні або електронні імплантати середнього вуха | Неферомагнітні імплантати внутрішнього вуха, протези клапанів серця (у високих полях, при підозрі на дисфункцію) |
| Кровоспинні кліпси судин головного мозку | Кровоспинні кліпси іншої локалізації, декомпенсована серцева недостатність, період вагітності, клаустрофобія, необхідність у фізіологічному моніторингу |
До відносних протипоказань, крім вищезазначених, належать також серцева недостатність у стадії декомпенсації, необхідність фізіологічного моніторингу (механічна вентиляція легень, електричні інфузійні насоси, імплант з автоматичної подачі інсуліну та інших лікарських засобів). Клаустрофобія є перешкодою для проведення дослідження в 1–4% випадків. Подолати її можна, з одного боку, використанням приладів із відкритими магнітами, з іншого боку — докладним поясненням будови апаратури й ходу обстеження. Свідчень ушкоджувальної дії МРТ на ембріон або плід не одержано, однак рекомендовано уникати МРТ в I триместр вагітності. Застосування МРТ у період вагітності показано у тих випадках, коли інші неіонізуючі методи діагностичної візуалізації не дають задовільної інформації. МРТ-дослідження потребує більшої участі в ньому пацієнта, ніж комп’ютерна томографія, оскільки рухи хворого під час дослідження значно сильніше впливають на якість зображень, тому обстеження пацієнтів із гострою патологією, порушеною свідомістю, спастичними станами, деменцією, а також дітей нерідко буває утрудненим.
Контрастні речовини для МРТ
На початку використання МРТ вважалося, що природна контрастність між різними тканинами виключає необхідність застосування контрастних речовин. Згодом було виявлено, що різниця в сигналах між різними тканинами, тобто контрастність MР-зображення може бути суттєво поліпшена контрастними засобами. Коли перший МР-контрастний засіб (що містить парамагнітні іони гадолінію) став комерційно доступним, діагностична інформативність МРТ значно зросла. Суть застосування МР-контрастного засобу полягає в тому, щоб змінити магнітні параметри протонів тканин і органів, тобто змінити час релаксації (TR) Т1 і Т2 протонів. На сьогодні існує кілька класифікацій МР контрастних засобів (або, точніше, контрастних агентів — КА).
За переважним впливом на час релаксації МР-КА ділять на:
- Т1-КА, які вкорочують Т1 і тим самим підвищують інтенсивність МР-сигналу тканин. Їх ще називають позитивними КА.
- Т2-КА, які вкорочують Т2, знижуючи інтенсивність МР-сигналу. Це негативні КА.
Залежно від магнітних властивостей МР-КА поділяються на парамагнітні і суперпарамагнітні:
Парамагнітні контрастні засоби. Парамагнітні властивості мають атоми з одним або кількома неспареними електронами. Це магнітні іони гадолінію (Gd), хрому, нікелю, заліза, а також марганцю. Найшироке клінічне застосування одержали сполуки гадолінію. Контрастуючий ефект гадолінію зумовлений вкороченням часу релаксації Т1 і Т2. У низьких дозах переважає вплив на Т1, що підвищує інтенсивність сигналу. У високих дозах переважає вплив на Т2 зі зниженням інтенсивності сигналу. Парамагнетики нині найширше використовуються у клініко-діагностичній практиці.
Суперпарамагнітні контрастні засоби. Домінуючим впливом суперпарамагнітного оксиду заліза є вкорочення релаксації Т2. З підвищенням дози відбувається зниження інтенсивності сигналу. До цієї групи КА можна віднести й феромагнітні КА, до складу яких входять феромагнітні оксиди заліза, структурно подібні з феритом магнетиту (Fe2+OFe23+O3).
Нижченаведена класифікація ґрунтується на фармакокінетиці КА (Сергеев П.В. и соавт., 1995):
- позаклітинні (тканинонеспецифічні);
- шлунково-кишкові;
- органотропні (тканиноспецифічні);
- макромолекулярні, які використовують для визначення судинного простору.
В Україні відомі чотири МР-КА, які є позаклітинними водорозчинними парамагнітними КА (табл. 7.11), із них широко використовують гадодіамід і гадопентетову кислоту. Інші групи КА (2–4) проходять стадію клінічних випробувань за кордоном.
Таблиця 7.11
Позаклітинні водорозчинні МР-КА
| Міжнародна назва | Хімічна формула | Структура |
| Гадопентетова кислота | Гадолінію димеглюміну діетилентриамінпентаацетат ((NMG)2Gd-DTPA) | Лінійна, іонна |
| Кислота гадотерова | (NMG)Gd-DOTA | Циклічна, іонна |
| Гадодіамід | Гадолінію діетилентриамінпентаацетат-біс-метиламід (Gd-DTPA-BMA) | Лінійна, неіонна |
| Гадотеридол | Gd-HP-DO3A | Циклічна, неіонна |
Позаклітинні КА вводять внутрішньовенно, на 98% вони виділяються нирками, не проникають через гематоенцефалічний бар’єр, мають низьку токсичність, належать до групи парамагнетиків.
МРТ суглобового хряща
МРТ-картина суглобового хряща (рис. 7.36, 7.37) відображає сукупність його гістологічної будови та біохімічного складу (Jeffery A.K. et al., 1991; Mow V.C. et al., 1992). Суглобовий хрящ є гіаліновим, який не має власного кровопостачання, лімфатичного дренажу та іннервації. Він складається з води та іонів, волокон колагену II типу, хондроцитів, агрегованих протеогліканів та інших глікопротеїнів (Mow V.C. et al., 1992; Watt I., 2000). Колагенові волокна прикріплюються в субхондральному шарі кістки, як якір, і йдуть перпендикулярно до поверхні суглоба, де вони розходяться горизонтально (Jeffery A.K. et al., 1991). Між волокнами колагену розташовані великі молекули протеоглікану, що мають значний негативний заряд, який інтенсивно притягує молекули води. Хондроцити хряща розміщені рівними колонами. Вони синтезують колаген і протеоглікани, а також розщеплювальні ферменти в неактивній формі та інгібітори ферментів.
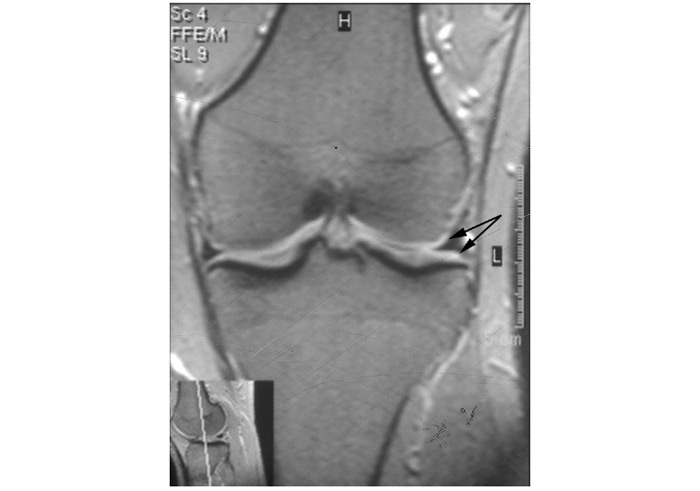
Рис. 7.36. Корональне Т1-ЗЗ 3D GE. Нормальний колінний суглоб. Чітко видно лінію суглобового хряща (зазначена стрілками)
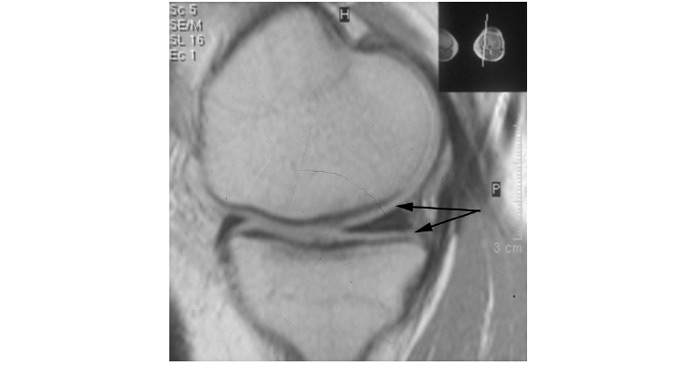
Рис. 7.37. Сагітальне Т1-ЗЗ SE. Нормальний колінний суглоб. Стрілками зазначено суглобовий хрящ
Гістологічно визначено 3 шари хряща у великих суглобах, таких як колінний і стегновий (Cova M. et al., 1998; Uhl M. et al., 1998). Найглибший шар становить з’єднання хряща й субхондральної кістки та виконує роль шара, що прикріплює велику мережу колагенових волокон, що поширюються від нього до поверхні щільними пучками, з’єднаними численними перехресними єднальними фібрилами. Він названий радіальним шаром. У напрямку до суглобової поверхні окремі колагенові волокна стають тонші та зв’язуються разом у більш регулярні й компактні паралельні масиви із меншою кількістю перехресних зв’язків (Rubеnstein J.D. et al., 1993). Середній шар — перехідний, або проміжний, містить більше невпорядкованих колагенових волокон, більшість з яких косо орієнтована з метою протистояння вертикальним навантаженням, тиску й поштовхам (Mow V.C. et al., 1992). Найбільш поверхневий шар суглобового хряща, відомий як тангенційний, — тонкий шар щільно влаштованих, тангенційно орієнтованих колагенових волокон, що протистоять розтягувальним силам, що діють при навантаженні стисканням і формують водонепроникний бар’єр для інтерстиціальної рідини, що запобігає її втратам у процесі стискання (Mow V.C. et al., 1992). Найбільш поверхневі колагенові волокна цього шару розташовані горизонтально, утворюють щільні горизонтальні пластини на суглобовій поверхні, хоча фібрили поверхневої тангенційної зони необов’язково з’єднані з такими більш глибоких шарів (Hwang W.S. et al., 1992).
Як відзначено, всередині цієї складної пористої мережі волокон розташовані агреговані гідрофільні молекули протеогліканів (Mow V.C. et al., 1992). Ці великі молекули мають на кінцях своїх численних відгалужень негативно заряджені фрагменти SO–3 і COO–, які інтенсивно притягують протилежно заряджені іони (зазвичай Nа+), що, у свою чергу, сприяє осмотичному проникненню води у хрящ. Тиск усередині колагенової мережі величезний, а хрящ функціонує як надзвичайно ефективна гідродинамічна подушка. Компресія суглобової поверхні викликає горизонтальний зсув води, що втримується у хрящі, оскільки мережа колагенових волокон стискується. Вода перерозподіляється всередині хряща так, що його загальний обсяг не може змінитися. Коли компресія після навантаження суглоба зменшується чи зникає, вода рухається назад, внаслідок притягання негативним зарядом протеогліканів (Watt I., 2000). Такий механізм підтримує високий вміст води і тим самим високу протонну щільність хряща. Найвищий вміст води відзначається ближче до суглобової поверхні та знижується в напрямку до субхондральної кістки (Mow V.C. et al., 1992; Paul P.K. et al., 1993). Концентрація ж протеогліканів підвищена в глибоких шарах хряща (Paul P.K. et al., 1993).
На сьогодні МРТ — це основний спосіб одержання зображення гіалінового хряща, що здійснюється в основному при використанні градієнт-ехо (GE) послідовностей (Watt I., 2000) (див. рис. 7.36, рис. 7.38). МРТ відображає вміст води у хрящі. Однак важливо, яку кількість протонів води містить хрящ. Вміст і розподіл гідрофільних молекул протеогліканів та анізотропна організація колагенових фібрил впливає не лише на сумарну кількість води, тобто протонну щільність, у хрящі, але й на стан релаксаційних властивостей, а саме Т2 цієї води, даючи хрящу характерні «зональні» або розшаровні зображення на МРТ, які, як вважають деякі дослідники, відповідають гістологічним шарам хряща (Fry M.E. et al., 1991; Modl J.M. et al., 1991; Paul P.K. et al., 1993; Cova M. et al., 1998; Uhl M. et al., 1998) (рис. 7.39, 7.40).
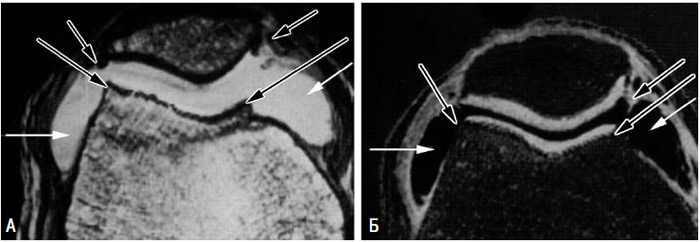
Рис. 7.38. ОА ПФВ суглоба. Аксіальні T2-GE-зображення: А — суглобовий хрящ погано візуалізується; Б — техніка вирахування переносу намагніченості дозволяє чітко продемонструвати суглобовий хрящ. Обидва зображення виявляють формування остеофітів по краях суглоба (чорні стрілки) і надлишкову кількість синовіальної рідини — випіт (білі стрілки)
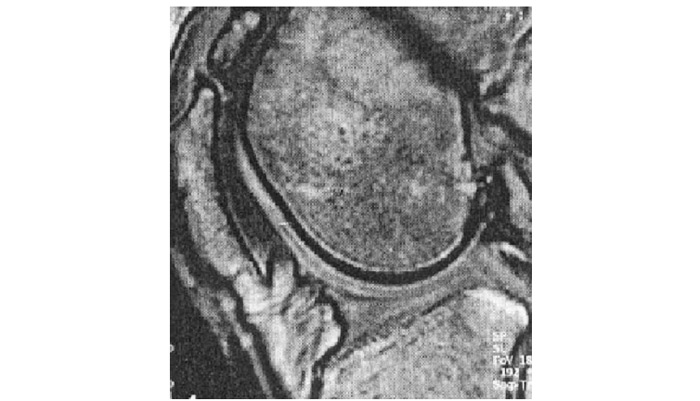
Рис. 7.39. SE-зображення, зважене по протонній щільності виростка стегнової кістки. Тришаровий вигляд хряща
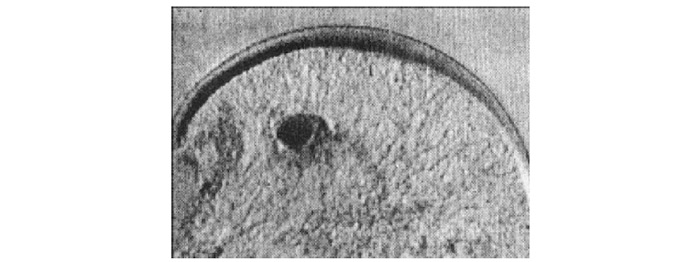
Рис. 7.40. SE-зображення, зважене по протонній щільності нормальної голівки стегнової кістки людини. Видно тришарову структуру хряща (за: Cova М. et al., 1998)
На дуже коротких зображеннях часу ехо (ТЕ) (<5 мс) більш високе розрізнення зображень хряща в типовому випадку показує двошарове зображення: глибокий шар розташований ближче до кістки в зоні попередньої кальцинації та має низький сигнал, тому що присутність кальцію сильно скорочує ТR і не дає зображення; поверхневий шар дає средньоінтенсивний або високоінтенсивний МР-сигнал (Lehner K.B. et al., 1989; Watt I., 2000).
На проміжних ТЕ-зображеннях (5–40 мс) хрящ має тришаровий вигляд: поверхневий шар із низьким сигналом; перехідний шар із сигналом проміжної інтенсивності; глибокий шар, що має низький МР-сигнал (Peterfy C.G., Genant H.K., 1996; Dardizinski B. et al., 1997). При Т2-зваженні сигнал не включає проміжний шар, і зображення хряща стає гомогенно низької інтенсивності. Коли використовується низька просторова розрізненість, на коротких ТЕ-зображеннях іноді з’являється додатковий шар, що відбувається внаслідок артефактів косих зрізів і високого контрасту на поверхні хрящ/рідина (Rubenstein J.D. et al., 1993), цього можна уникнути шляхом збільшення розміру матриці.
Крім того, деякі із цих зон (шарів) можуть бути невидимі за певних умов. Наприклад, при зміні кута між віссю хряща й основним магнітним полем вигляд хрящових шарів може змінюватися, а хрящ може мати гомогенне зображення. Цей феномен автори пояснюють анізотропною властивістю колагенових волокон і різною орієнтацією їх всередині кожного шару (Fullerton G. et al., 1985; Rubenstein J.D. et al., 1993; Peterfy C.G., Genant H.K., 1996).
Інші автори вважають, що одержання пошарового зображення хряща невірогідне і є артефактом. Думки дослідників розходяться також щодо інтенсивності сигналів від отриманих тришарових зображень хряща. Дані дослідження дуже цікаві й потребують, звичайно ж, подальшого вивчення.
Структурні зміни хряща при ОА
На ранніх стадіях ОА відбувається деградація колагенової мережі в поверхневих шарах хряща, що призводить до розволокнення поверхні й підвищеної проникності для води (Dodge G.R., Poole A.R., 1989). У міру руйнування частини протеогліканів з’являється більше негативно заряджених глікозаміногліканів, які притягують катіони й молекули води, у той же час, протеоглікани, що залишилися, втрачають здатність притягувати та утримувати воду (Lehner K.B. et al., 1989; Buckwalter J. et al., 1990; Mow V.C. et al., 1990; 1992). Крім того, втрата протеогліканів знижує їх гальмуючий вплив на інтерстиціальну течію води. У результаті хрящ набрякає, «не спрацьовує» механізм стиснення (утримання) рідини та знижується компресійна стійкість хряща. Відбувається ефект переносу більшої частини навантаження на вже ушкоджений твердий матрикс (Mow V.C. et al., 1992), а це призводить до того, що набряклий хрящ стає більш сприйнятливим до механічних ушкоджень. Врешті хрящ або відновлюється, або продовжує руйнуватися.
Крім ушкодження протеогліканів частково руйнується й колагенова мережа, яка вже не відновлюється, і в хрящі з’являються вертикальні щілини й виразки. Ці ушкодження можуть поширюватися вниз по хрящу до субхондральної кістки. Продукти розпаду й суглобова рідина поширюються до базального шару, що призводить до появи дрібних, а надалі — великих ділянок остеонекрозу (рис. 7.41а–д) і субхондральних кіст (рис. 7.42а–в) (Watt I., 2000).
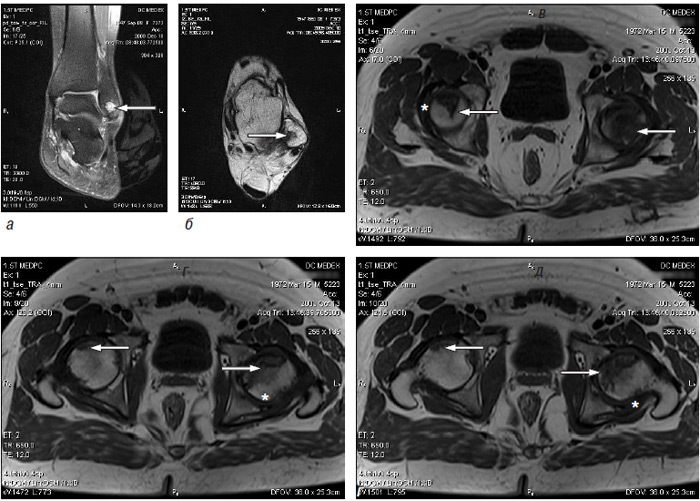
Рис. 7.41. МРТ: а, б — остеонекроз дистального відділу малогомілкової кістки при ОА (зображення отримано на апараті «Siemens MAGNETOM Avanto Tim [76×18] SQ-engine» (http:dcmedex. om): а — верхнє ліве зображення PD tse в корональній проекції; б — верхнє середнє зображення Т2 tse в аксіальній площині; в, г, д — остеонекроз різного ступеня вираженості голівок стегнових кісток при ОА (позначено стрілками), гіперплазія синовіальної оболонки (*)
Рис. 7.42. МРТ субхондральної кістки при ОА: а — плечового, б — колінного, в — кульшового суглоба (зображення отримано на апараті «Siemens MAGNETOM Avanto Tim [76×18] SQ-engine»): а — верхнє праве зображення PD FS tse в корональній площині; б — верхнє ліве зображення Т1 tse в аксіальній площині; в — верхнє середнє зображення Т1 tse в сагітальній площині. FS — fat saturation — пригнічення сигналу жира
Паралельно з цими процесами хрящ піддається ряду репаративних змін зі спробою відновлення ушкодженої суглобової поверхні, що включають формування хондрофітів. Останні згодом піддаються енхондральній осифікації та стають остеофітами.
Гостра механічна травма і компресійне навантаження можуть призвести до розвитку горизонтальних тріщин у глибокому кальцинованому шарі хряща (Vener M.J. et al., 1992) та відшаруванню хряща від субхондральної кістки (Armstrong C.G., Mow V.C., 1982). Базальне розщеплення чи делімінація хряща подібним чином може служити механізмом дегенерації не тільки нормального хряща в умовах механічного перевантаження, але й при ОА, у разі нестабільності суглоба. Якщо гіаліновий хрящ повністю зруйнований і оголена суглобова поверхня, то можливі два процеси: перший — утворення щільного склерозу на поверхні кістки, який називається ебурнеацією; другий — ушкодження та компресія трабекул, що на рентгенівських знімках виглядає як субхондральний склероз. Відповідно, перший процес можна розглядати як компенсаторний, другий же явно є фазою руйнування суглоба (Watt I., 2000).
Підвищення вмісту води в хрящі підвищує протонну щільність хряща й усуває Т2-укорочуючі ефекти протеоглікан-колагенового матрикса (Konig H. et al., 1987), який має високу інтенсивність сигналу в ділянках ушкодження матрикса на звичайних МРТ послідовностях. Ця рання хондромаляція, що є найбільш ранньою ознакою ураження хряща, може бути помітна до того, як відбудеться навіть незначне його стоншення. У цій стадії також можлива наявність слабкого потовщення чи «розбухання» хряща. Структурні й біомеханічні зміни суглобового хряща постійно наростають, відбувається втрата основної речовини. Ці процеси можуть бути локальними чи дифузними, обмеженими поверхневим стоншенням і розволокненням або ж повним зникненням хряща. У деяких випадках локальне потовщення чи «розбухання» хряща може спостерігатися без розриву суглобової поверхні (Hwang W.S. et al., 1992). При ОА часто можна спостерігати локальне підвищення інтенсивності сигналу хряща на Т2-зважених зображеннях, що підтверджується артроскопічно наявністю поверхневих, трансмуральних і глибоких лінійних змін (Rose P.M. et al., 1994). Останні можуть відображати глибокі дегенеративні зміни, що починаються головним чином у вигляді відшарування хряща від кальцинованого шару або лінії припливу (Armstrong C.G., Mow V.C., 1982; Vener M.J. et al., 1992). Ранні зміни можуть обмежуватися тільки глибокими шарами хряща, у цьому разі вони не виявляються при артроскопічному огляді суглобової поверхні, хоча локальне розволокнення глибоких шарів хряща може вести до ураження суміжних шарів, часто з розростанням субхондральної кістки у формі центрального остеофіта.
У зарубіжних джерелах літератури є дані про можливість одержання кількісної інформації про склад суглобового хряща, наприклад про вміст фракції води та дифузійний коефіцієнт води в хрящі (Burstein D. et al., 1993; Xia Y. et al., 1994). Це досягається за допомогою спеціальних програм МР-томографа чи при МР-спектроскопії. Обидва ці параметри збільшуються при ушкодженні протеоглікан-колагенового матрикса при ураженні хряща. Концентрація рухливих протонів (вміст води) у хрящі знижується у напрямку від суглобової поверхні до субхондральної кістки.
Кількісна оцінка змін можлива й на Т2-зважених зображеннях (Dardizinski B. et al., 1997). Узагальнивши дані зображень того самого хряща, отримані з різними ТЕ, автори оцінювали Т2-зважені зображення (ЗЗ) хряща за допомогою відповідної експоненційної кривої від отриманих величин інтенсивності сигналу на кожний піксель. Т2 оцінюється в певній зоні хряща або відображується на карті всього хряща, в якій інтенсивність сигналу кожного пікселя відповідає Т2 у цьому місці (рис. 7.43) (Dardizinski B. et al., 1997). Однак, незважаючи на досить великі можливості й відносну легкість вищеописаного методу, роль Т2 недооцінюється, частково внаслідок підвищення дифузійно-пов’язаних ефектів зі збільшенням ТЕ (Xia Y. et al., 1997). В основному недооцінюють Т2 у хрящі при хондромаляції, коли дифузія води підвищена. Якщо не застосовувати спеціальних технологій, потенційне збільшення Т2, що вимірюється при цих технологіях у хрящі при хондромаляції, буде незначно пригнічувати дифузійно-пов’язані ефекти.

Рис. 7.43. МР-картування товщини суглобового хряща колінного суглоба (поверхня великогомілкових кісток) in vivo. Регіональна товщина хряща (перпендикуляр до лінії хрящ — кістка) виражена в інтервалах 1 мм (за: Reginster J.-Y. et al., 1999)
Таким чином, МРТ — досить перспективний метод для виявлення та моніторингу ранніх структурних змін, характерних для дегенерації суглобового хряща.
Морфологічні зміни хряща при ОА
Оцінка морфологічних змін хряща залежить від високої просторової розрізненості та високої контрастності від поверхні суглоба до субхондральної кістки. Це найкраще досягається застосуванням жиропригнічуваної Т1-зваженої 3D GЕ-послідовності (Peterfy C.G., Genant H.K., 1996), яка точно відображає виявлені локальні дефекти, що верифікуються як при артроскопії, так і на аутопсійному матеріалі. Зображення хряща також може бути одержане з переносом намагніченості шляхом віднімання зображень, тоді суглобовий хрящ має вигляд окремої смуги з високою інтенсивністю сигналу, що чітко контрастує із поруч розташованими низькоінтенсивними суглобовою рідиною, інтраартикулярною жировою тканиною та субхондральним кістковим мозком. Однак при використанні цього методу одержання зображення відбувається в 2 рази повільніше, ніж жиропригнічуване Т1-ЗЗ, тому не так широко застосовується (Peterfy C.G. et al., 1994a; b).
Крім того, можливе одержання зображень локальних дефектів, нерівності поверхні та генералізованого стоншення суглобового хряща із використанням звичайних МР-послідовностей (рис. 7.44). За даними деяких авторів, морфологічні параметри — товщина, обсяг, геометрія й топографія поверхні хряща — можуть бути кількісно обчислені за допомогою 3D МРТ-зображень (Peterfy C.G. et al., 1998). Шляхом сумації вокселів, що становлять 3D-реконструйоване зображення хряща, може бути визначено точне значення цих комплексно пов’язаних структур. Більше того, вимірювання загального обсягу хряща, отриманого з окремих зрізів, є більш простим методом у зв’язку з меншими змінами у площині одного зрізу й більш достовірним у просторовому розрізненні. При вивченні цілих ампутованих колінних суглобів і зразків надколінків, отриманих під час артропластики цих суглобів, визначали загальний обсяг суглобового хряща стегнової, великогомілкової кісток і надколінка та виявили кореляції обсягів, отриманих при МРТ та відповідних обсягів, визначених при відділенні хряща від кістки й вимірюванні його гістологічно (Peterfy C.G. et al., 1994b). Отже, ця технологія може бути корисна для динамічної оцінки змін обсягу хряща у пацієнтів з OA. Одержання необхідних і точних зрізів суглобового хряща, особливо у пацієнтів з ОА, потребує достатніх навичок і досвіду лікаря, що проводить дослідження, а також наявності відповідного програмного забезпечення МР-томографа.
Вимірювання загального обсягу містять небагато інформації про розповсюджені зміни та чутливі, відповідно, для локальної втрати хряща. Теоретично втрату хряща чи його стоншення на одній ділянці може врівноважити еквівалентне збільшення обсягу хряща в іншім місці суглоба, і вимірювання загального обсягу хряща не показало будь-якого відхилення від норми, тому такі зміни не піддавалися б визначенню цим методом. Розподіл суглобового хряща за допомогою 3D-реконструкції на окремі дрібні ділянки дало можливість оцінити обсяг хряща в певних ділянках, зокрема на поверхнях, що зазнають силового навантаження (Pilch L. et al., 1994). Проте точність вимірів при цьому зменшується, тому що виконується дуже малий розподіл. Зрештою, надзвичайно висока просторова розрізненість є необхідною для підтвердження точності вимірів. Якщо може бути досягнута достатня просторова розрізненість, перспектива складання карти товщини хряща in vivo стає можливою (Ateshian G.A. et al., 1994; Eckstein F. еt al., 1995). Карти товщини хряща можуть відтворювати локальні ураження при прогресуванні OA.
МРТ кістки та кісткового мозку при ОА
Корковий шар і трабекули кістки містять мало протонів водню і багато кальцію, який значно скорочує TR, і тому не дають будь-якого певного МР-сигналу. На МР-томограмах вони мають зображення кривих ліній з відсутністю сигналу, тобто темних смуг. Вони створюють силует середньоінтенсивним і високоінтенсивним тканинам, окреслюючи їх, наприклад кістковий мозок і жирову тканину. Патологія кістки, зумовлена ОА, включає утворення остеофітів, субхондральний кістковий склероз, утворення субхондральних кіст, псевдоерозій і набряк чи склерозування кісткового мозку (див. рис. 7.44, рис. 7.45–7.48). МРТ внаслідок її багатоплощинних томографічних можливостей є більш чутливою, ніж рентгенографічна чи комп’ютерна томографія, для візуалізації більшості з цих видів змін. Остеофіти до того ж краще зображуються при МРТ, ніж при звичайній рентгенографії — особливо центральні остеофіти, які дуже складно виявити рентгенографічно. Причини утворення центральних остеофітів дещо інші, ніж крайових, і тому мають інше значення. Кістковий склероз також добре виявляється при МРТ і має низьку інтенсивність сигналу у всіх імпульсних послідовностях, зумовлену кальцинацією та фіброзом. При МРТ також можна виявити запалення ентезіса та періостит. МРТ із високою розрізненістю є також основною МР-технологією для вивчення трабекулярної мікроархітектури. Це може бути корисним для моніторингу трабекулярних змін у субхондральній кістці для того, щоб визначити їх значення у розвитку та прогресуванні ОА.
Рис. 7.44. МРТ: ОА гомілковостопного суглоба. Корональне Т1-ЗЗ SE (А) і сагітальні (Б) T1-ЗЗ SE і Т2-ЗЗ GE (В). Видно звуження суглобової щілини, формування остеофітів, деструкція суглобового хряща, кістоподібні зміни в субхондральній зоні
Рис. 7.45. ОА колінного суглоба. Корональне T1-ЗЗ SE. Визначаються звуження суглобової щілини з медіального боку, стоншення хряща та субхондральний склероз медіального виростку стегнової кістки. Є крайові остеофіти медіальних виростків стегнової та великогомілкової кісток, загострення міжвиросткових горбиків
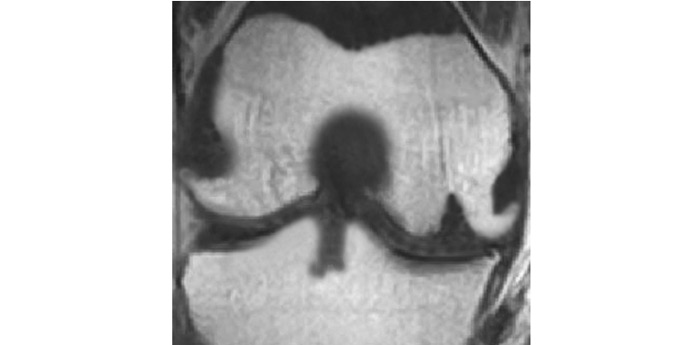
Рис. 7.46. ОА колінного суглоба. Корональне Т1-ЗЗ SE. Визначаються звуження суглобової щілини по обидва боки, субхондральні ушкодження, крайові остеофіти виростків стегнової кістки, загострення міжвиросткових горбиків
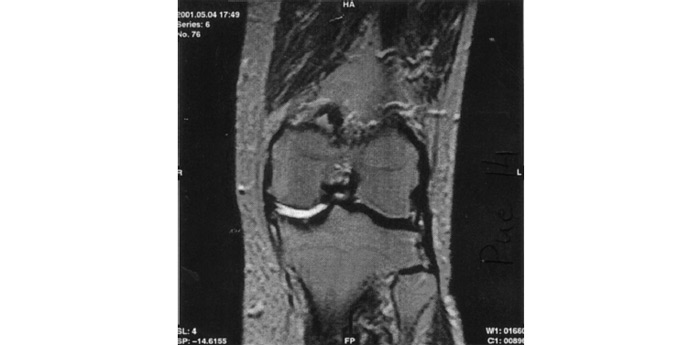
Рис. 7.47. ОА колінного суглоба. Корональне 3D-ЗЗ GE із пригніченням жиру. Видно дифузне стоншення суглобового хряща з латерального боку. Наявність остеофітів по бічних поверхнях виростків стегнової та великогомілкової кісток
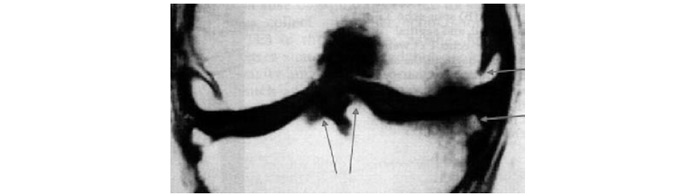
Рис. 7.48. ОА колінного суглоба. Корональне Т1-ЗЗ GE. Видно великі крайові остеофітів виростків стегнової, великогомілкової кісток і міжвиросткового підвищення (зазначені стрілками)
МРТ є унікальною можливістю для одержання зображення кісткового мозку та зазвичай дуже чутлива, хоча не дуже специфічна технологія для виявлення остеонекрозу, остеомієліту, первинної інфільтрації і травм, особливо кісткової контузії та переломів без зсуву (рис. 7.49, 7.50). Ознаки цих захворювань на рентгенограмах не виявляються доти, поки кортикальний і/або трабекулярний відділи кістки не будуть уражені. У кожному із наведених випадків підвищується вміст вільної води, яка має вигляд сигналу низької інтенсивності на Т1-ЗЗ та сигналу високої інтенсивності на Т2-ЗЗ, що відображують високий контраст із нормальним кістковим жиром, що має сигнал високої інтенсивності на Т1-ЗЗ та низький сигнал на Т2-ЗЗ (див. рис. 7.44в). Виключенням є Т2-ЗЗ FSE (швидке спін-ехо), на якому зображення жиру і води мають сигнал високої інтенсивності та потребують пригнічення жиру для одержання контрасту між цими складовими. Послідовності GE, принаймні, з великою силою поля, в основному не чутливі до патології кісткового мозку, тому що магнітні ефекти пригнічуються кісткою. Ділянки набряку субхондрального кісткового мозку часто видно в суглобах із прогресуючим ОА. Зазвичай ці ділянки локального набряку кісткового мозку при ОА розвиваються в місцях втрати суглобового хряща чи хондромаляції. Гістологічно ці ділянки є типовою фіброваскулярною інфільтрацією. Вони можуть бути зумовлені механічним ушкодженням субхондральної кістки, викликаним зміною точок дотику суглоба в місцях біомеханічно слабкого хряща і/або втратою стабільності суглоба, або, можливо, внаслідок затікання синовіальної рідини через дефект в оголеній субхондральній кістці. Іноді епіфізарний набряк кісткового мозку видно на деякій відстані від суглобової поверхні чи ентезіса. Залишається нез’ясованим, яка величина й поширеність цих кістковомозкових змін сприяє виникненню локальної болісності та слабкості суглоба і коли вони є провісниками прогресування захворювання.
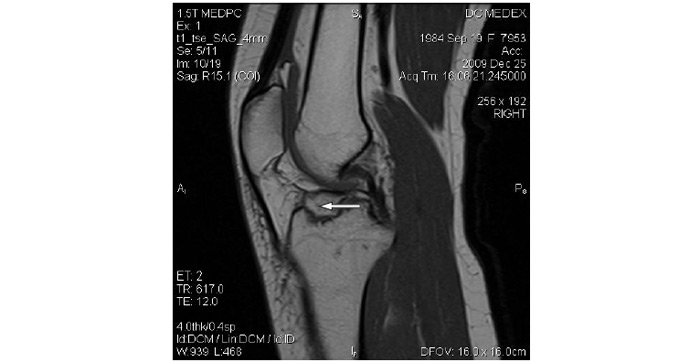
Рис. 7.49. Відрив площадки великогомілкової кістки в місці прикріплення передньої хрестоподібної зв’язки. Т1 tse в сагітальній проекції
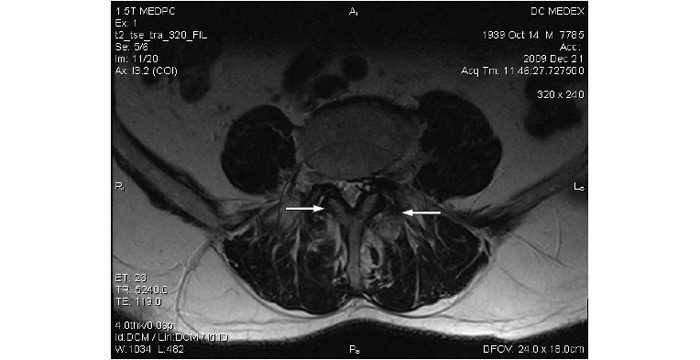
Рис. 7.50. Дегенеративні зміни фасеткових (дуговідросткових) суглобів при ОА поперекового відділу хребта. Зображення Т2 tse в аксіальній проекції
МРТ синовіальної оболонки та синовіальної рідини
Нормальна синовіальна оболонка загалом занадто тонка для візуалізації при звичайних послідовностях МРТ і її складно відрізнити від розташованої поруч суглобової рідини або хряща. У більшості випадків при ОА може спостерігатися невелике потовщення синовіальної оболонки у залучених у процес суглобах (Fernandez-Madrid F., 1995). (див. рис. 7.41в–д). Залишається нез’ясованим, чи дійсно синовіт спричиняє втрату суглобового хряща чи він виникає вторинно в результаті реакції на руйнування хряща (Brandt K.D., 1995).
У нормі в суглобах утримується невелика кількість синовіальної рідини, кількість якої в різних суглобах варіює. У гомілковостопному суглобі, наприклад, може міститися відносно велика кількість синовіальної рідини в нормі (Schweitzer M.E. et al., 1994). Досі невідомо, яку ж кількість рідини слід розцінювати як патологічну. За допомогою 3D-реконструкції можливий підрахунок кількості вільної рідини в суглобі при МРТ (Heuck A.F. et al., 1989). Для моніторингу відповіді на лікування у пацієнтів з ОА або для вивчення нормального фізіологічного функціонування синовіальної рідини в суглобі in vivo ця методика досить корисна.
МР-сигнал негеморагічної синовіальної рідини має низьку інтенсивність на Т1-зважених зображеннях і високу на Т2-зважених зображеннях завдяки наявності вільної води (рис. 7.51–7.54).
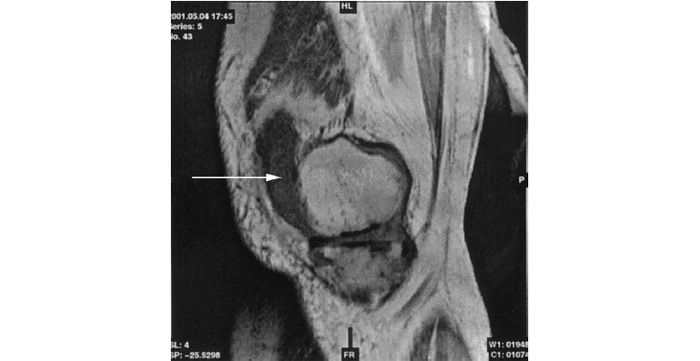
Рис. 7.51. Сагітальне Т1-ЗЗ SE. Випіт в burse suprаpаrtellaris має низькоінтенсивний сигнал (зазначений стрілкою)
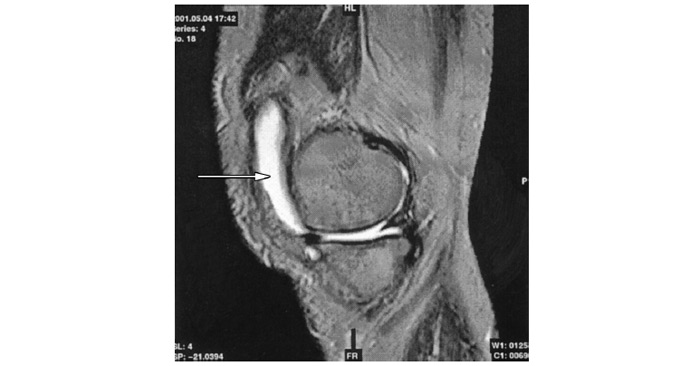
Рис. 7.52. Сагітальне Т1-ЗЗ GE. Зображення того ж колінного суглоба (див. рис. 7.51). Випіт у порожнину суглоба має високоінтенсивний сигнал (зазначений стрілкою)
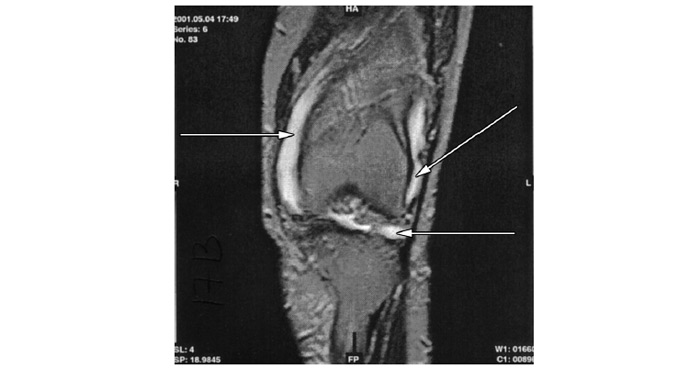
Рис. 7.53. Корональне Т1-ЗЗ GE колінного суглоба. Випіт у порожнину суглоба має високоінтенсивний сигнал (зазначений стрілками)
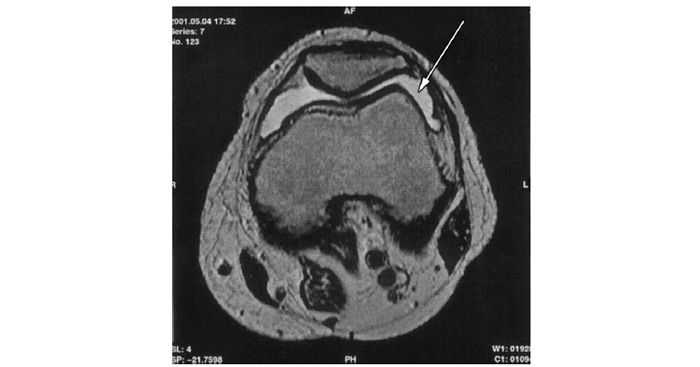
Рис. 7.54. Аксіальне Т1-ЗЗ GE колінного суглоба. Випіт у порожнину суглоба має високоінтенсивний сигнал (зазначений стрілкою)
Геморагічна синовіальна рідина може містити метгемоглобін, який має короткий Т1 і дає високоінтенсивний сигнал на Т1-ЗЗ і/або дезоксігемоглобін, який має вигляд низькоінтенсивного сигналу на Т2-ЗЗ. При хронічному рецидивному гемартрозі в синовіальній оболонці відкладається гемосидерин, який дає низькоінтенсивний сигнал на Т1- і Т2-ЗЗ. Геморагії часто розвиваються в підколінних кістах, вони розташовуються між литковим і камбалоподібним м’язами по задній поверхні гомілки, а також у зв’язковому апараті. Зазначимо, що гемартроз або наявність крові у зв’язковому апараті на Т1-зображеннях дають високий сигнал (на відміну від ексудату та трансудату, які виглядають темними), тільки в «підгострій» стадії крововиливу (чи на 3–7-й день після травми або патологічної події). Витікання синовіальної рідини з ушкодженої кісти Бейкера може нагадувати форму пера при посиленні гадолінійвмісними контрастними агентами. При внутрішньовенному введенні КА він розміщується уздовж поверхні фасції між м’язами ззаду від суглобової капсули колінного суглоба (Eich G.F. et al., 1994).
Синовіальна оболонка з ознаками запалення, набряку зазвичай має повільний Т2, відображаючи високий вміст інтерстиціальної рідини (має МР-сигнал високої інтенсивності на Т2-ЗЗ). На Т1-ЗЗ потовщення синовіальної тканини має низько- чи середньоінтенсивний МР-сигнал. Однак потовщену синовіальну тканину складно відрізнити від розміщених поруч синовіальної рідини чи хряща. Відкладання гемосідерину або хронічний фіброз може знижувати інтенсивність сигналу гіперплазованої синовіальної тканини на зображеннях із довгим ТЕ (Т2-ЗЗ) та іноді навіть на зображеннях з коротким ТЕ (Т1-ЗЗ; зображеннях, зважених за щільністю протонів; у всіх GЕ-послідовностях).
Як відзначалося вище, КА зумовлює парамагнітний ефект на розташовані поруч протони води, викликаючи їх швидшу релаксацію Т1. Водомісткі тканини, що накопичили КА (містять хелат Gd), відображають підвищення інтенсивності сигналу на Т1-ЗЗ пропорційно до концентрації КА, що накопичився у тканині. При внутрішньовенному введенні КА швидко розподіляється по гіпервaскуляризованим тканинам, таких як запалена синовіальна оболонка. Хелатний комплекс гадолінія має відносно малі молекули, що швидко дифундують всередину навіть через нормальні капіляри та, як недолік, із часом у розташовану поруч синовіальну рідину (Drape J.-L. еt al., 1993; Winalski C.S. et al., 1993; Peterfy C.G. et al., 1994a). Безпосередньо після болюсного внутрішньовенного введення КА синовіальну оболонку суглоба може бути видно окремо від інших структур, тому що вона інтенсивно посилена. Контрастне відображення високоінтенсивних синовіальної оболонки й розташованої поруч жирової тканини може бути збільшено методикою пригнічення жиру. Швидкість, з якою відбувається контрастне посилення синовіальної оболонки, залежить від кількох факторів, що включають швидкість течії крові в синовії, обсяг гіперплазованої синовіальної тканини та свідчать про активність процесу.
Крім того, визначення кількості та розподілу запальної синовіальної оболонки і рідини в суглобах при артриті (в тому числі ОА, який роглядається як «остеоартрит» в більшості розвинутих країн з огляду на доведену роль запального компонента в розвитку суглобових уражень) надає можливість встановити ступінь вираженості синовіту шляхом моніторингу швидкості синовіального посилення з GD, що містить КА протягом періоду спостереження хворих (Konig H. еt al., 1990; Drape J.-L. еt al., 1993; Yamato M. et al., 1993; Tamai K. et al., 1994), можливе використання спеціальних програм типу OSIRIX для вимірювання кількості рідини в порожнині суглоба, складках синовії. Висока швидкість синовіального посилення та швидке досягнення піка посилення, що є наслідком болюсного введення КА, належать до активного запалення чи гіперплазії, в той час як повільне посилення відповідає хронічному фіброзу синовіальної оболонки. Хоча складно контролювати тонкі відмінності у фармакокінетиці GD, що містить КА, при МРТ-дослідженнях у різні періоди захворювання того самого хворого, швидкість і пік синовіального посилення можуть бути критеріями для призначення чи відміни відповідної протизапальної терапії (Tamai K. et al., 1994; Stiskal M.A. et al., 1995). Високі показники цих параметрів характерні для гістологічно активного синовіту.
МРТ інших компонентів суглоба
Допоміжний апарат суглоба, тобто зв’язки, меніски, сухожилля, суглобова губа є важливими у підтримці статичної та динамічної стабільності, розподілі механічного навантаження й функціональної цілості суглобів. Втрата цих функцій підвищує біомеханічне зношування і є причиною ушкодження суглоба, що підтверджується значним зниження ризику виникнення ОА після меніскектомії (Lynch M.A. et al., 1983; Jiang Y. et al., 1997; White D. et al., 1998), при розривах хрестоподібних зв’язок і ротаторної манжети плеча (Jiang Y. et al., 1996). Ці структури складаються переважно з колагену, який забезпечує силу натягу, а також утримує протони води. Т2 колагену зазвичай такий швидкий (<1 мс) (Fullerton G. еt al., 1985), що в більшості випадків має вигляд сигналу низької інтенсивності у всіх імпульсних послідовностях, окресленого високоінтенсивними структурами, такими, як жирова тканина чи синовіальна рідина.
Неушкоджені зв’язки мають вигляд темних смуг (рис. 7.55, 7.56). Переривання їх є прямою ознакою розриву зв’язок. Однак необхідно враховувати, що імітація розриву зв’язки можлива при одержанні косої площини зрізу через інтактну зв’язку. Для зображення деяких зв’язок може знадобитися спеціальний вибір площини. Передню хрестоподібну зв’язку колінного суглоба найкраще видно на косих сагітальних зображеннях коліна в нейтральній позиції або на прямих сагітальних із невеликим відведенням гомілки, в той час як нижня lig. glenohumerale плечового суглоба в принципі статично стабільна при відведенні плеча й складна для візуалізації, якби не положення плеча у стані відведення і зовнішньої ротації (Tirman P.F.J. et al., 1994). Багатоплощинна 3D-реконструкція досить повно аналізує цілість зв’язок, але не є первісно отриманим зображенням.
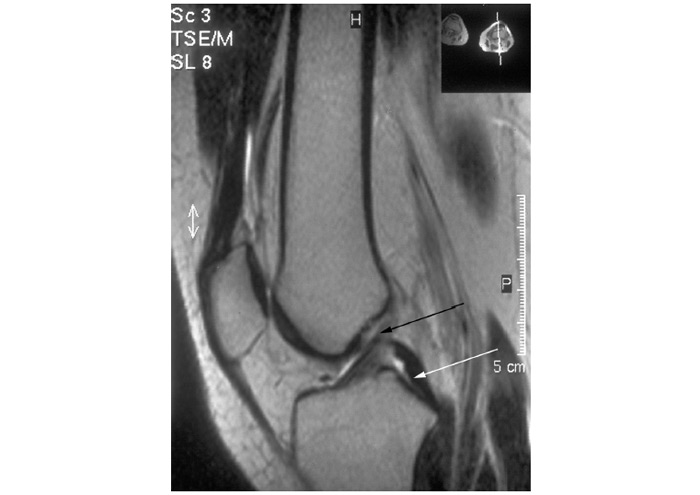
Рис. 7.55. МРТ нормального колінного суглоба. Сагітальне ТІ-ЗЗ SE. Біла стрілка — задня хрестоподібна зв’язка. Чорна стрілка — передня хрестоподібна зв’язка
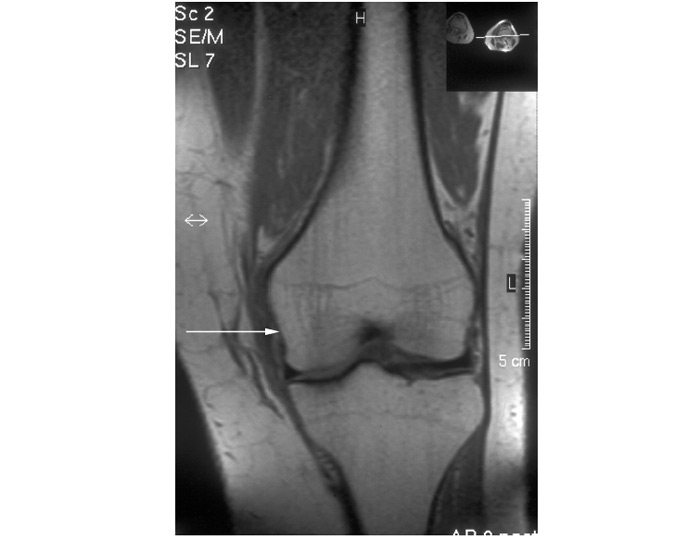
Рис. 7.56. МРТ нормального колінного суглоба. Корональне Т1-ЗЗ SE. Медіальна колатеральна зв’язка (зазначена стрілкою)
Меніски складаються з фіброзного хряща і містять велику кількість колагенових волокон, просторово розташованих так, щоб протистояти силі натягу при впливі навантажень вагою. Волокна орієнтовані переважно циркулярно, особливо в периферичній частині меніска, що пояснює схильність до розривів (рис. 7.57а, б), які йдуть поздовжньо, тому лінійні тріщини між волокнами колагену утворюються частіше, ніж впоперек волокон. Коли відбувається локальна втрата колагену, наприклад при міксоїдній або еозинофільній дегенерації, яка зазвичай теж супроводжується локальним підвищенням вмісту води, зменшується ефект укорочення Т2, а сигнал від води не маскується й проявляється у вигляді округлої чи лінійної ділянки з середньоінтенсивним сигналом всередині меніска на коротких ТЕ-зображеннях (Т1-ЗЗ по протонній щільності SE або GE), має схильність поступово зникати при довгому ТЕ. Ці патологічні сигнали не є розривами, на відміну від порушення цілості меніска. Розрив меніска може бути зумовлений грубою деформацією його поверхні. Іноді велика кількість синовіальної рідини окреслює контур розриву меніска і він візуалізуєтся на Т2-ЗЗ, але в більшості випадків невиявлені розриви менісків не видно на довгих ТЕ-зображеннях. Короткі ТЕ-зображення є, таким чином, високочутливими (>90%), але частково неспецифічними для розривів меніска, тоді як довгі ТЕ-зображення є нечутливими, хоча високоспецифічними, коли їх видно.
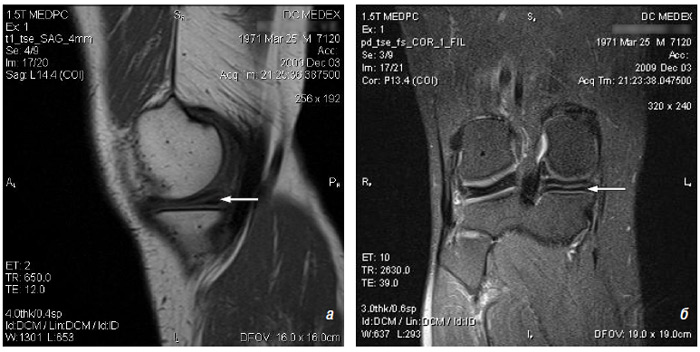
Рис. 7.57. Крайовий розрив меніска колінного суглоба: а — верхнє ліве зображення Т1 tse в сагітальній проекції; б — верхнє праве зображення PD FS tse в корональній проекції
МРТ чутлива до всього спектра патології сухожиль і виявляє тендиніти й розриви в більшості випадків з більшою точністю, ніж клінічне обстеження (Rubens D.J. et al., 1993). Нормальні сухожилля мають рівні краї та гомогенний сигнал низької інтенсивності при довгому ТЕ (Т2-ЗЗ) (див. рис. 7.55). Розрив сухожилля може бути частковим або повним і зображується різними ступенями переривання сухожилля високоінтенсивним сигналом всередині сухожилля на Т2-ЗЗ при МРТ. При теносиновіті рідину може бути видно під сухожильною оболонкою, але саме сухожилля має нормальний вигляд. Тендиніт зазвичай є результатом розширення й нерівності сухожилля, але більш надійний симптом — це підвищення інтенсивності сигналу всередині сухожилля на Т2-ЗЗ. Розрив сухожилля може бути результатом механічного зношування, що виникає внаслідок тертя по зазубрених остеофітах і гострих краях ерозій, або первинного запалення в самому сухожиллі (Williamson S.C., Feldon P., 1995). Відрив сухожилля від місця прикріплення може бути гострим. Частіше розриваються сухожилля екстензорів зап’ястка чи кисті, ротаторної манжети плеча та сухожилля заднього великогомілкового м’яза в гомілковостопному суглобі. Тендиніт і розрив ротаторної манжети плеча та сухожилля довгої голівки біцепса в більшості випадків проявляються болем і нестабільністю плечового суглоба. Повний розрив ротаторної манжети плеча — результат переднього підвивиха голівки плечової кістки і часто є основним при ОА.
М’язи містять менше колагену і тому мають сигнал середньої інтенсивності на Т1- і Т2-ЗЗ. Запалення м’язів іноді супроводжує артрит і має сигнал високої інтенсивності на Т2-ЗЗ, тому що в обох випадках з розвитком інтерстиціального набряку підвищується вміст води і подовження Т2 пов’язане із втратою колагену. І навпаки, післязапальний фіброз має тенденцію до зниження інтенсивності сигналу на Т2-ЗЗ, в той час як мармурова жирова атрофія м’язів має високоінтенсивний сигнал жиру на Т1-ЗЗ. Для м’язів типова локалізація процесу.
Можна зробити висновок, що МРТ — високоефективний діагностичний, неінвазивний метод, що дає інформацію про всі складові суглоба одночасно, що сприяє вивченню структурних і функціональних параметрів при захворюваннях суглобів. МРТ може виявляти дуже ранні зміни, пов’язані з дегенерацією хряща, коли клінічні симптоми мінімальні або відсутні. Раннє виявлення пацієнтів із ризиком прогресування захворювання, відзначений при МРТ-дослідженні, дозволяє призначити відповідне лікування набагато раніше, ніж при використанні клінічних, лабораторних і радіологічних методів. Застосування МР-контрастних агентів значно підвищує інформативність методу при ревматичних захворюваннях суглобів. Більше того, МРТ забезпечує об’єктивні й кількісні вимірювання тонких, ледь вловимих морфологічних і структурних змін різних тканин суглоба з перебігом часу і тому є більш надійним і легко відтворюваним методом, який допомагає здійснювати моніторинг перебігу ОА. МРТ також полегшує оцінку ефективності нових препаратів для лікування хворих на ОА та дозволяє швидко проводити дослідження. Необхідна подальша оптимізація цих вимірювань, оскільки вони можуть бути застосовані як потужні об’єктивні методи для дослідження патофізіології ОА.
УЗД СУГЛОБІВ ПРИ ОА
Застосування УЗД (сонографії) в ревматології — відносно новий і перспективний напрямок діагностики ОА, який набув широкого розповсюдження, в тому числі в нашій країні. Враховуючи недоліки стандартної рентгенографії у виявленні ранніх змін у кістковій тканині, в тому числі остеофітозу при ОА, а також відсутність візуалізації м’яких тканин суглоба та прилеглих ділянок, УЗД стало першим методом практичного лікаря-ревматолога щодо ранньої діагностики ревматичних хвороб суглобів (Коваленко В.Н., Борткевич О.П., 2004; 2005; Терзов К.А. и соавт., 2006). Крім того, необмеженість кількості УЗД опорно-рухового апарату, безпека методу для пацієнта зумовлюють значні можливості УЗД як методу моніторингу фармакотерапії хворих на ОА. В останнє десятиріччя методика УЗД набула широкого розповсюдження як техніка візуалізації при обстеженні пацієнтів із ревматичними захворюваннями суглобів, а також контролю над лікуванням (Manger B., Kalden J.R., 1995; Manger B., Backhaus M., 1997; Grassi W., Cervini C., 1998; Gibbon W.W., Wakefield R.J., 1999). Це стало можливим завдяки вдосконаленню комп’ютерної техніки та розробці датчиків із більш високою частотою. Зазвичай сонографія використовується для оцінки патології м’яких тканин і виявлення рідини, але дозволяє також візуалізувати хрящ і поверхні кісткових структур (Grassi W. et al., 1993; 1999; Backhaus M. et al., 1999).
Ряд безсумнівних переваг — неінвазивність (на відміну від артроскопії), доступність, простота, економічність (порівняно з комп’ютерною томографією і МРТ) — забезпечили методу УЗД опорно-рухового апарату пріоритет серед інших інструментальних методів дослідження суглобів і м’яких тканин. УЗД опорно-рухового апарату високоінформативне у відображенні дрібних деталей поверхні кісток, зв’язково-сухожильного апарату, а також дозволяє виявляти і контролювати запальні зміни у тканинах. Перевагою УЗД перед рентгенологічним методом є також те, що положення датчика визначається винятково цілями, встановленними дослідником, тому, на відміну від рентгенографії, немає необхідності суворого позиціювання пацієнта для одержання стандартних проекцій, тобто датчик може бути поліпозиційним. При проведенні рентгенологічного дослідження для візуалізації певних структур у стандартних проекціях часто доводиться робити знімки кілька разів, що призводить до збільшення часу дослідження, додаткової витрати матеріалів (плівки) та опромінення пацієнта і персоналу лабораторії. До основних недоліків УЗД належать неможливість візуалізації структури кісткової тканини, суб’єктивність оцінки отриманих даних.
У зв’язку з вищезазначеним дуже важливо правильно використовувати можливості УЗД для виявлення патологічних змін у різних суглобах і м’яких тканинах, для чого необхідно знати не лише можливості сучасної діагностичної апаратури, але й УЗ-анатомію досліджуваної ділянки та найтиповіші прояви захворювання.
Обладнання та методики проведення УЗД
УЗД м’яких тканин і суглобів слід виконувати за допомогою високочастотного лінійного датчика, що працює в діапазоні 7–12 МГц. Застосування датчика з меншою робочою частотою (3,5–5 МГц) обмежується тільки дослідженням кульшового суглоба і дослідженням суглобів у пацієнтів із надмірною масою тіла. Частота датчика ≥7,5 МГц дозволяє сканувати поверхневі структури (шкіра, підшкірна клітковина, судини даного басейну, інші м’якотканинні структури, а також ділянки поверхонь кісток, що прилягають до них).
Важливо також вибрати правильні програми дослідження для різних суглобів. Багато УЗ-приладів вже сьогодні містять набір стандартних програм для дослідження різних відділів опорно-рухового апарату. Сучасні УЗ-апарати оснащені також великою кількістю додаткових режимів сканування, які дозволяють значно розширювати діагностичні можливості звичайного сірошкального сканування, таких як режим нативної чи тканинної гармоніки, режим панорамного сканування та режим тривимірної реконструкції. Так, сканування у режимі нативної гармоніки дозволяє одержати більш контрастне, ніж при звичайному сірошкальному скануванні, зображення ніжних гіпоехогенних структур, що відображають зони розривів зв’язок або меніска. Режим панорамного сканування дозволяє одержати розширене зображення відразу декількох структур, наприклад структур, що утворюють суглоб, і відобразити їх просторове розташування й відповідність. Тривимірна реконструкція забезпечує одержання не лише волюметричної інформації, але й дає можливість одержувати багатоплощинні зрізи досліджуваних структур, у тому числі й фронтальні. Принципово новим є застосування високочастотних УЗ-датчиків, які забезпечують можливість візуалізації різних за ехогенністю і глибиною залягання структур. Ці датчики значно підвищили розрізняльну здатність у близьких до датчика зонах з одночасним підвищенням проникаючої здатності УЗ-променя. У них використовується вузький УЗ-промінь, що працює у високочастотному діапазоні, що сприяє значному підвищенню латеральної розрізняльної здатності в зоні УЗ-фокуса. Можливості УЗ-сканування також суттєво розширилися у зв’язку із впровадженням у практику нових УЗ-технологій, заснованих на ефекті Допплєра. Нові методики УЗ-ангіографії дозволяють візуалізувати патологічний кровотік у органах і тканинах із запальними змінами (наприклад при синовіті).
Спрощена схема одержання УЗ-зображення
Артефакти
Усі артефакти, що виникають при проведенні УЗД опорно-рухового апарату, розділяються умовно на стандартні, що виникають при всіх УЗД, і специфічні, характерні для УЗД зв’язок і сухожиль.
Артефакти, що виникають за рахунок рефракції УЗ-променя. По краях округлих структур на межі двох різних акустичних середовищ може виникати дистальна тінь. У нормі цей ефект можна спостерігати при поперечному скануванні ахіллового сухожилля. Внутрішньом’язові перегородки також можуть давати позаду тінь. За рідинними структурами виникає ефект посилення УЗ-сигналу. Тому структури, що розташовуються за утримуючими рідину об’єктами, можуть виглядати більш ехогенними, ніж у нормі. Наприклад, наявність невеликого випоту в синовіальній оболонці сухожилля підвищує його ехогенність (рис. 7.58). Для порівняння на рис. 7.59 наведена УЗ-картина розгиначів кисті контралатеральної сторони у тієї самої хворої.
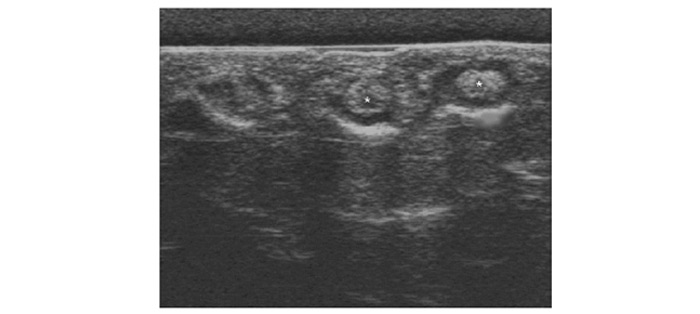
Рис. 7.58. Тендосиновіт розгиначів кисті у пацієнтки із ОА. Поперечне сканування. Наявність випоту в синовіальній піхві сухожиль (позначені *)
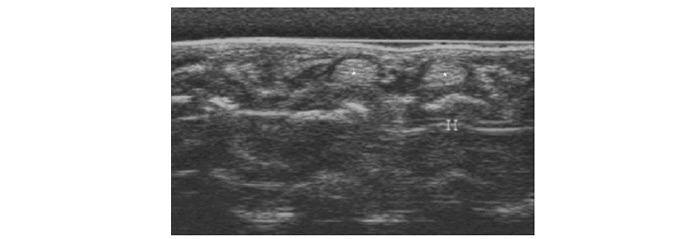
Рис. 7.59. Контралатеральна сторона у тієї самої пацієнтки. Поперечне сканування. Відсутність випоту в синовіальній піхві сухожиль (позначені *)
Реверберація. Цей ефект може виникати позаду високовідбивних об’єктів, таких як кістка, діафрагма, призводячи до появи дзеркальних або фантомних зображень. При дослідженні опорно-рухового апарату такий ефект можна спостерігати за малогомілковою кісткою. Металеві й скляні об’єкти викликають ефект реверберації, що одержав назву «хвіст комети». Як правило, при дослідженні органів опорно-рухового апарату він може спостерігатися при наявності металевих протезів або металевих (скляних) сторонніх тіл.
Рефракція. Виникає на межі відбивних середовищ з різною звукопровідністю (наприклад жирова тканина і м’язи) в результаті заломлення УЗ-променя, що призводить до дислокації зображуваних структур. Для зменшення рефракції слід тримати датчик перпендикулярно до досліджуваних структур.
Анізотропія — специфічний для УЗД опорно-рухового апарату артефакт, що виникає при УЗ-скануванні лінійним датчиком сухожиль, коли скануючий УЗ-промінь не падає на них чітко перпендикулярно. На тій ділянці сухожилля, де немає точного перпендикулярного відображення УЗ-променя, будуть з’являтися зони зниженої ехогенності, які можуть симулювати наявність патологічних змін. М’язи, зв’язки й нерви також мають слабкий ефект анізотропії. Зниження ехогенності сухожилля призводить до погіршення якості візуалізації його фібрилярної структури. Однак у ряді випадків, коли необхідно візуалізувати сухожилля на фоні ехогенної клітковини, змінюючи кут сканування, сухожилля буде виглядати контрастним (гіпоехогенним) на фоні ехогенної жирової клітковини. Для того щоб уникнути анатомічної неясності результатів УЗД опорно-рухового апарату (наприклад щодо стандартних рентгенологічних стереотипів, добре знайомих фахівцям), ми визнали за необхідне надалі поруч із УЗ-зображеннями розмістити схеми рентгенограм досліджуваних суглобів із зазначенням основних анатомічних орієнтирів.
Дані УЗД опорно-рухового апарата в нормі
УЗ-зображення структури хряща, м’яких періартикулярних тканин, в тому числі зв’язок, сухожиль та м’язових структур, при умові дотримання правил УЗД щодо окремих анатомічних утворень, є чіткими та інформативно зіставними з анатомічними структурами. Необхідно порівнювати УЗ-зображення ураженої ділянки із контралатеральною стороною!
Структури опорно-рухового апарату за даними УЗД в нормі
Шкіра та підшкірна жирова клітковина. Найкраще візуалізується при скануванні високочастотними датчиками (12,5–20 МГц) у вигляді гіперехогенної відносно гомогенної ділянки з різною товщиною, що залежить від локалізації ділянки, що сканується, віку та статі хворих. Зазначимо, що у чоловіків товщина шкіри більша, ніж у жінок. Шари шкіри (епідерміс та дерма) практично не диферненціюються при проведенні УЗД.
Кісткові структури. УЗД дозволяє отримати лише зображення поверхні кістки у вигляді гіперехогенної лінії. Поздовжнє та поперечне сканування слід проводити перпендикулярно до кісткової поверхні. При ревматичних захворюваннях суглобів можлива візуалізація ураженого періоста у вигляді нечіткої гіперехогенної смуги (артрит, в тому числі РА, спондилоартропатія, «псевдоерозивний» варіант ОА тощо).
Суглобова капсула. У нормі виглядає як контрастна непотовщена гіперехогенна лінія. При більшості ревматичних захворюваннях суглобів змінюються УЗ-характеристики (збільшується товщина, з’являються ознаки розволокнення, часткових і суцільних надривів/розривів, витікання синовіальної рідини (наприклад при кисті Бейкера).
Синовіальна оболонка. У нормі не візуалізується. Набуває характерної ехо-структури при запальних процесах (РА, спондилоартропатія, ОА з вираженим запальним компонентом тощо).
Гіаліновий суглобовий хрящ. Гіпо-/анехогенна структура, розташована на суглобовій поверхні кісток. У нормі ехогенність збільшується з віком, при розвитку ОА, хондрокальцинозу.
Суглобовий хрящ (типовий приклад — структури менісків колінного суглоба). У нормі виглядає гіперехогенним внаслідок великої кількості різноспрямованих колагенових волокон.
Сухожилля — при проведенні УЗД добре візуалізуються як при поздовжніх, так і поперечних скануваннях, у вигляді лінійно розташованих фібрилярних гіпер-/гіпоехогенних структур із досить чіткими контурами та візуалізацією волокнистої структури.
Деякі сухожилля (m. biceps brachii, m.quadriceps femori тощо), оточені гіпоехогенною зоною «хало» (Зубарев А.В., 2002), яка відображає наявність синовіальної оболонки, що містить невелику кількість рідини навіть у нормі.
Інші сухожилля (наприклад ахіллове, не мають синовіальної оболонки, оточені сполучною тканиною, що формує навколосухожильний простір; у місці прикріплення завжди формують сухожильні сумки (бурси).
Зв’язки — за ехоструктурою подібні до сухожиль. При УЗД виглядають як:
- Гіперехогенні фібрилярні структури (власна зв’язка надколінка, lig. collater. med. тощо)
- Змішані фібрилярні структури (lig. collater. lat. тощо) — за рахунок контралатерально спрямованих волокон
- Гіпоехогенні структури (ligg. cruciata ant. et post. та інші фрагменти внутрішньосуглобових структур) — за рахунок неперпендикулярного розташування ходу УЗ-променя.
М’язові структури — гіпоехогенні порівняно із підшкірно-жировою клітковиною, сухожиллями. Проведення функціональних проб зі скорочення м’язів приводить до зміни ходу м’язевих волокон та незначного зниження ехогенності досліджуваного м’яза.
- Поздовжнє сканування: відносно гомогенні гіпоехогенні пучки, які «окреслені» паралельними гіперехогенними утвореннями (сполучно-тканинні прошарки — фасції тощо) у вигляді «пера», що поступово переходять в сухожильну частину досліджуваного м’яза (Зубарев А.В., 2002)
- Поперечне сканування: гіпоехогенна мілкокрапчаста структура з гіперехогенними (фіброзними) прошарками та переходом у сухожильну тканину.
Дані УЗД опорно-рухового апарата при патології
1. Патологія м’язів:
а) перерозтягання (пошкоджується <5% поперечного перетину м’яза. Дані УЗД: мікророзриви у вигляді множинних кістозних ділянок, що при поздовжньому скануванні мають витягнуту структуру;
б) частковий розрив (УЗД-ознака — гіпоехогенна гематома в зоні пошкодженої ділянки м’язової тканини зі зникненням типового волокнистого малюнка в зоні розриву. У пізню стадію розриву за скороченням м’яза можна провести диференційну діагностику: ушкоджений м’яз/ехогенна гематома різного генезу;
в) повний розрив (УЗД-ознака — гематома в місці м’язово-сухожильного переходу). М’яз при поперечному УЗ-скануванні «відірваний» від місця прикріплення. Давність гематоми визначається за такими ознаками: реєстрація перифокального кровотоку за даними допплєрівського УЗД, а також наявність гіперехогенних включень («нитки» фібрину) свідчить про підгострий/хронічний процес;
г) осифікуючий міозит локалізується найчастіше в ліктьовій, кульшовій, сідничій ділянках. За генезом у 60–75% — посттравматичний, постінфарктний, ідіопатичний, нейрогенного генезу. УЗ-ознаки — гіперехогенні структури в проекції м’язів, що скануються, з акустичною тінню.
2. Патологія зв’язок та сухожиль:
а) частковий чи повний розрив сухожилля найчастіше виникає в місці прикріплення сухожилля до кістки чи м’яза (УЗ-ознака сухожиль із синовіальною оболонкою — часткове порушення фібрилярної структури сухожилля із формуванням анехогенного дефекту у вигляді синовіального випоту навколо ураженого сухожилля; сухожиль без синовіальної оболонки — локальне потовщення сухожилля з порушенням контурів та фібрилярної структури останнього в місці дефекту; анехогенною ділянкою навколо ураженої зони за рахунок накопичення рідини в місці розриву. Розірвані кінці сухожиль, що не мають синовіальної оболонки, скорочені, з повним порушенням їх фібрилярної структури, заповненням дефекту анехогенною рідиною (кров, жирова тканина чи синовіальна рідина).
б) гострий тендиніт:
- сухожилля без синовіальної оболонки: потовщені, ехогенність останніх знижена локально/дифузно. Ехоструктура неоднорідна, з наявністю дрібних гіпоехогенних ділянок, що нагадують мікророзриви, значним посиленням кровотоку за ходом сухожильних волокон при поздовжному скануванні;
- сухожилля із синовіальною оболонкою: потовщені, їх ехоструктура, як правило, не змінена, у більшості випадків спостерігаються явища тендосиновіту (наявність анехогенної ділянки, обмеженої контуром синовіальної оболонки — рідини, що свідчить про запальний процес vaginae tendinum).
в) хронічний тендиніт: частіше спостерігається у сухожиллях надколінка, ротаторної манжети, ахілловому:
- сухожилля без синовіальної оболонки: потовщені, ехоструктура неоднорідна, іноді — наявність гіперехогенних включень — ділянок фіброзу чи кальцинатів по ходу сухожильних волокон;
- сухожилля із синовіальною оболонкою: потовщені, можливі зміни ехоструктури (частіше — зниження ехогенності), часто — помірні явища теносиновіту з накопиченням незначної кількості рідини;
- кальцифікуючий тендиніт: виникає частіше у сухожиллях верхньої кінцівки на фоні системних захворювань сполучної тканини та метаболічних розладів (наприклад подагра та метаболічні артропатії). При УЗД виявляються гіперехогенні включення (найчастіше — точкові, іноді — крупніші) в сухожиллях, останні часто потовщені;
г) ентезити та ентезопатії. Досвід ревматологів-клініцистів свідчить, що протягом тривалого часу ентезити (запалення ентезів — місць прикріплення до кістки зв’язок, сухожиль, апоневрозів, суглобових капсул) можуть бути єдиними клінічними ознаками ревматичного захворювання, особливо серонегативних спондилоартропатій, в тому числі анкілозивного спондиліту (в останньому випадку навіть при відсутності болю у крижовій ділянці, спині, чи периферичного артриту (Агабабова Э.Р., 2001). За даними В.М. Коваленка, О.П. Борткевича (2004) і D. McGonagle та співавторів (1998) ентезити передують розвитку синовітів суглобів нижніх кінцівок у хворих на анкілозивний спондиліт (табл. 7.12).
Таблиця 7.12
Критерії ранньої діагностики анкілозивного спондиліту: зіставлення результатів рентгенографії та УЗД ентезів (14 локалізацій) (Коваленко В.Н., Борткевич О.П., 2004)
| Локалізація ентезу | Кількість | |||
| ерозій кісткової тканини | ентезофітів | |||
| Рентген | УЗД | Рентген | УЗД | |
| Гребні тазових кісток (n=96) | 2/2,1 | 18/18,8 | 6/6,5 | 28/29,17 |
| Медіальний виросток стегнової кістки (n=96) | 3 /3,1 | 19/19,8 | 6/6,5 | 32/33,33 |
| Латеральний виросток стегнової кістки (n=96) | 3/3,1 | 13/13,54 | 5/5,21 | 30/31,25 |
| Верхній полюс надколінка (n=96) | 4/4,17 | 31/32,29 | 8/8,33 | 34/35,42 |
| Нижній полюс надколінка (n=96) | 2/2,1 | 11/11,5 | 7/7,29 | 25/26,04 |
| Ахіллове сухожилля (n=96) | 6/6,25 | 28/29,17 | 11/11,5 | 49/51,04 |
| Підошовний апоневроз (n=96) | 3/3,1 | 27/28,13 | 4/4,17 | 44/45,83 |
| Всього (n=672) | 23/3,42 | 147/21,88 | 47/6,99 | 242/62,21 |
Як видно (див. табл. 7.12), УЗД — набагато інформативніший метод ранньої діагностики порівняно зі стандартним рентгенологічним дослідженням.
3. Патологія суглобових сумок (бурсити):
а) гострий та хронічний бурсит: частіше спостерігаються у верхньому і задньому заворотах колінного суглоба, міжфасціальних просторах гомілки (особливо при розриві кісти Бейкера), субакроміально-субдельтовидній, ліктьовій, позап’ятковій сумках; рідше спостерігаються інші локалізації бурситів. УЗ-ознаки — збільшення розмірів сумки, анехогенна зона в проекції ураженої сумки (наявність вільної рідини), обмежена гіперехогенною оболонкою (стінка сумки):
- геморагічний бурсит: виникає внаслідок прямої/непрямої травми цієї ділянки, розриву прилеглого сухожилля/сухожиль, перелому кісток, патології згортанняі крові тощо. УЗ-ознаки: розміри суглобової сумки більше, ніж при звичайному гострому бурситі, стадійність змін ехоструктури вільної рідини в порожнині сумки швидка (див. нижче диференційні ознаки гострого та хронічного бурситу).
Диференційні УЗ-ознаки гострого та хронічного бурситу:
- Товщина стінки сумки (при гострому бурситі стінки тонкі, при хронічному — товсті, досить часто — з нерівними контурами).
- Особливості ехоструктури рідини в порожнині сумки (при гострому бурситі — гомогенна анехогенна, при хронічному — часто негомогенна, з наявністю ехо«+» включень, рухомих при проведенні функціональних проб, різного розміру та ехощільності).
- Наявність васкуляризації при допплєрівському дослідженні (при гострому бурситі — найчастіше кровотік в стінці сумки відсутній, при хронічному — спостерігається часто).
4. Патологія підшкірно-жирової клітковини:
а) набряк: спостерігається при запальному процесі (артрит, периартрит тощо), хронічній серцевій та венозній недостатності, лімфедемі, целюліті тощо). При УЗ-дослідженні визначають збільшення об’єму підшкірно-жирової клітковини, зміни ехогенності (найчастіше суттєва гіпоехогенність сполучнотканинних фіброзних перетинок на фоні відносно гіперехогенних прошарків жирової тканини);
б) локальні патологічні утворення при ревматичних захворюваннях (в тому числі ревматоїдні вузлики при РА, вузлуваті утворення, переважно в м’яких тканинах гомілки, при вузлуватій еритемі, депозити при подагрі та метаболічних артропатіях), інородні тіла тощо.
5. Патологія суглобів*:
а) випіт у порожнині суглоба;
б) гіпертрофія синовіальної оболонки;
в) кровотік у синовіальній оболонці;
г) зміни кортикального шару кісткових суглобових поверхонь (ерозивні, дегенеративні, в тому числі остеофітоз; пухлинні ураження; патологія періосту, в тому числі при остеомієліті; переломи/тріщини тощо);
д) зміни суглобового хряща, менісків (в тому числі часткові та повні розриви), судин та інших м’якотканинних структур ділянки, що сканується.
*Детально патологічні зміни суглобів при ОА викладені при розгляді УЗ-ознак ураження окремих суглобів.
Колінний суглоб
Як відомо, рентгенографія в більшості випадків дозволяє визначити ураження колінного суглоба при залученні в патологічний процес елементів кістки. Часто ці зміни вже необоротні, лікування таких хворих утруднене.
Перевагами УЗД колінного суглоба є доступність, економічність, відсутність променевого навантаження на пацієнта, можливість візуалізації м’якотканинних компонентів суглоба, що дозволяє виявити ранні ознаки уражень, які практично не визначаються при рентгенографії.
Незважаючи на те що УЗД повністю не може замінити такі високоінформативні методики, як МРТ і стандартне рентгенівське дослідження при дослідженні колінного суглоба, воно має свої певні переваги. Однією із найважливіших переваг УЗД є оцінка м’яких тканин колінного суглоба, включаючи зв’язки, сухожилля, сполучнотканинні елементи, жирову клітковину, судинно-нервові пучки.
Можливості УЗД в оцінці внутрішньосуглобових елементів, таких як меніски, хрестоподібні зв’язки і суглобовий хрящ обмежені, в основному, за рахунок недостатнього акустичного вікна. Тому у всіх випадках результати УЗД при патології менісків, суглобового хряща і хрестоподібних зв’язок потребують підтвердження за допомогою МРТ і рентгенографії.
Однак простота проведення УЗД, його доступність і низька вартість, роблять вибір на користь останнього при первинній діагностиці та моніторингу захворювань колінного суглоба, в тому числі ревматичних захворювань опорно-рухового апарата. УЗД колінного суглоба проводять високочастотними датчиками з базовими частотами 5–7,5 Мгц. При проведенні дослідження слід пам’ятати про ефект анізотропії, в основному при дослідженні сухожильно-зв’язкового апарата. Необхідно також враховувати дані анамнезу, що в ряді випадків значно полегшує діагностику.
Анатомічні дані
Колінний суглоб — найбільше зчленування виросткового типу. Він з’єднує три кістки: стегнову, великогомілкову, та надколінок, що є найбільшою сесамовидною кісткою скелета людини та утримується сухожиллям квадрицепса попереду від стегнової кістки. Колінний суглоб включає три відділи, що утворюють загальну суглобову порожнину: медіальний і латеральний великогомілково-стегнові (у зарубіжних джерелах — медіальний і латеральний ТФВ/департменти колінного суглоба), і надколінково-стегновий (ПФВ/департмент).
Порожнина колінного суглоба перегороджена двома менісками, які є фіброзними хрящами напівмісячної форми. Латеральний меніск кріпиться до підколінної ямки, він більш рухливий, ніж медіальний меніск (останній прикріплюється центрально до міжвиросткових горбків, а медіально — до капсули колінного суглоба. По обидва боки від верхніх кутів надколінка синовіальна оболонка колінного суглоба утворює завороти, які легко розтягуються рідиною при патологічному (перш за все, запальному) процесі.
Колінний суглоб містить ряд синовіальних сумок. Сумки, розташовані в передньому відділі колінного суглоба (препателярна, поверхнева та глибока інфрапателярні, гусяча), не сполучаються із суглобовою порожниною, а ті, що перебувають у підколінній ямці (напівперетинчаста, латеральна та медіальна mm. gasrocnemia, литкові) — сполучаються.
По обидва боки колінний суглоб укріплений колатеральными зв’язками. Медіальна колатеральна зв’язка прикріплена до суглобової капсули та медіального меніска, а латеральна йде від стегнової до малогомілкової кістки і не має зв’язку з капсулою. Крім того, дві хрестоподібні зв’язки (передня та задня) розташовані у порожнині колінного суглоба, де прикріплені до міжвиросткових поглиблень.
Розроблена рядом авторів та вдосконалена нами (Коваленко В.М. та співавт., 2008) методика проведення УЗД дозволяє визначати основні ознаки патологічних процесів колінного суглоба — травматичних ушкоджень, дегенеративно-дистрофічних і запальних процесів при ревматичних захворюваннях суглобів, тощо. Згідно з цією методикою УЗД зазвичай починають із супрапателярної ділянки. Тут добре візуалізується при поздовжньому і поперечному скануванні сухожилля чотириголового м’яза стегна, контури верхнього полюса надколінка, супрапателярна сумка (так званий верхній заворот), дослідження якої при ревматичних захворюваннях суглобів особливо інформативне для діагностики вираженості дегенеративно-дистрофічних і запальних уражень (табл. 7.13).
Таблиця 7.13
Стандартні проекції та позиціювання датчика при УЗД колінного суглоба (за: M. Backhaus et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення |
Структури, що візуалізуються |
|
структури колінного суглоба, в тому числі прилеглі м’якотканинні (сухожилля, зв’язковий апарат, м’язи, жирове тіло колінного суглоба), УЗД суглобової щілини, гіаліновий суглобовий хрящ, латеральний/медіальний меніски, судинно-нервовий пучок підколінної ямки |
| Стандартні сканування | |
| 1. Надколінкове (suprapatellaris) поздовжнє сканування | Стегнова кістка, верхній край надколінкової кістки (patella), m. quadriceps femori, його сухожилля та місце прикріплення до кістки, верхній заворот суглобової капсули колінного суглоба.
Патологія, що виявляється:випіт у порожнині колінного суглоба (верхнього завороту) в тому числі гемартроз (при лікуванні антикоагулянтами), із розширенням суглобової щілини, наявністю гіперехогенних включень при тривалому перебігу запального процесу; проліферація синовіальної оболонки, (в тому числі гроновидна при РА); патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни при РА та утворення остеофітів при ОА) стегнової та великогомілкової/ малогомілкової кісток, бурсити, проліферація синовіальної оболонки та кровотік в останній, порушення цілісності та тендосиновіт прилеглих сухожиль, кістоподібні утворення м’яких тканин, пухлини (перш за все, підколінної ділянки) |
| 2. Надколінкове поперечне сканування в нейтральній позиції | Див. 1. + ПФВ (звуження УЗ-суглобової щілини, наявність остеофітів тощо) |
| 3. Надколінкове поперечне сканування при максимальному згинанні колінного суглоба | ПФВ (явища запалення; накопичення випоту та особливості останнього; проліферація синовіальної оболонки; нерівномірність гіалінового суглобового хряща) |
| 4. Піднадколінкове (infrapatellaris) поздовжнє сканування | Жирове тіло колінного суглоба, суглобові поверхні кісток, що сплучаються |
| 5. Піднадколінкове (infrapatellaris) поперечне сканування | Гіаліновий суглобовий хрящ у медіальній/латеральній ТФВ, суглобові поверхні кісток, що сплучаються |
| 6. Медіальне поздовжнє сканування | Роги медіального меніска колінного суглоба, медіальна суглобова щілина колінного суглоба |
| 7. Латеральне поздовжнє сканування | Роги латерального меніска колінного суглоба, латеральна суглобова щілина колінного суглоба |
| 8. Заднє медіальне поздовжнє сканування | Задній ріг медіального меніска колінного суглоба, медіальна суглобова щілина колінного суглоба, частково — задній заворот колінного суглоба, кісткові поверхні |
| 9. Заднє латеральне поздовжнє сканування | Задній ріг латерального меніска колінного суглоба, латеральна суглобова щілина колінного суглоба, частково — задній заворот колінного суглоба, кісткові поверхні |
| 10. Заднє поперечне сканування | Задній заворот колінного суглоба, судинно-нервовий пучок, періартикулярні м’які тканини, кісткові поверхні |
Аналіз отриманих даних УЗД дозволив нам розділити синовіт колінного суглоба на стадії:
І стадія — розмір верхнього завороту 40,0 х 5,0 мм, локальне потовщення синовіальної оболонки — до 5 мм;
ІІ стадія — розмір верхнього завороту 50,0 х 7,0 мм, локальне потовщення синовіальної оболонки — до 6–7 мм, дифузне — до 5 мм;
ІІІ стадія — діаметр завороту більше 50,0 х 7,0 мм, локальне потовщення синовіальної оболонки більше 8 мм, дифузне — більше 5 мм.
Подальше дослідження при згинанні колінного суглоба і переведення датчика в поперечне положення дозволяє візуалізувати ділянку ПФВ, зокрема гіаліновий хрящ і наявність або відсутність над ним надлишку рідини. Переведення датчика на ділянку нижче надколінка дає можливість визначити поверхнево розташовану власну зв’язку надколінка, її структуру, піднадколінкове жирове тіло, піднадколінкову синовіальну складку, глибше якої розташована передня хрестоподібна зв’язка. Це положення датчика дозволяє візуалізувати суглобовий хрящ латерального і медіального виростків, зміни форми суглобових поверхонь стегнової кістки (сплощення тощо). Постановка датчика на внутрішню і зовнішню бічну поверхні колінного суглоба дозволяє візуалізувати, відповідно, внутрішню і зовнішню коллатеральні зв’язки, крайові кісткові розростання стегнової та великогомілкової кісток, наявність або відсутність випоту.
При УЗД підколінної ямки можна візуалізувати патологічні утворення цієї ділянки, в тому числі наявність випоту у задньому завороті (так звана кіста Бейкера), оцінити стан суглобового хряща латерального і медіального виростків стегнової кістки, задні частини медіального і латерального виростків стегнової кістки, задні роги латерального і медіального менісків, а також частину зв’язкового апарата — в цій проєкції найкраще візуалізується задня хрестоподібна зв’язка.
УЗД зазвичай починають із супрапателярної ділянки. Тут добре візуалізується при поздовжньому та поперечному скануванні (позиціювання датчика зображене на рис. 7.60а і на рис. 7.61 відповідно) сухожилля чотириголового м’яза стегна, контури верхнього полюса надколінка, супрапателярна сумка (верхній заворот), дослідження якої при ОА особливо інформативне для діагностики вираженості дегенеративно-дистрофічних і запальних уражень. У нормі синовіальна оболонка не візуалізується (рис. 7.60б). При деформівному ОА із синовітом відзначають збільшення сумки, випрямлення складок, наявність надлишку рідини (рис. 7.60в–е).
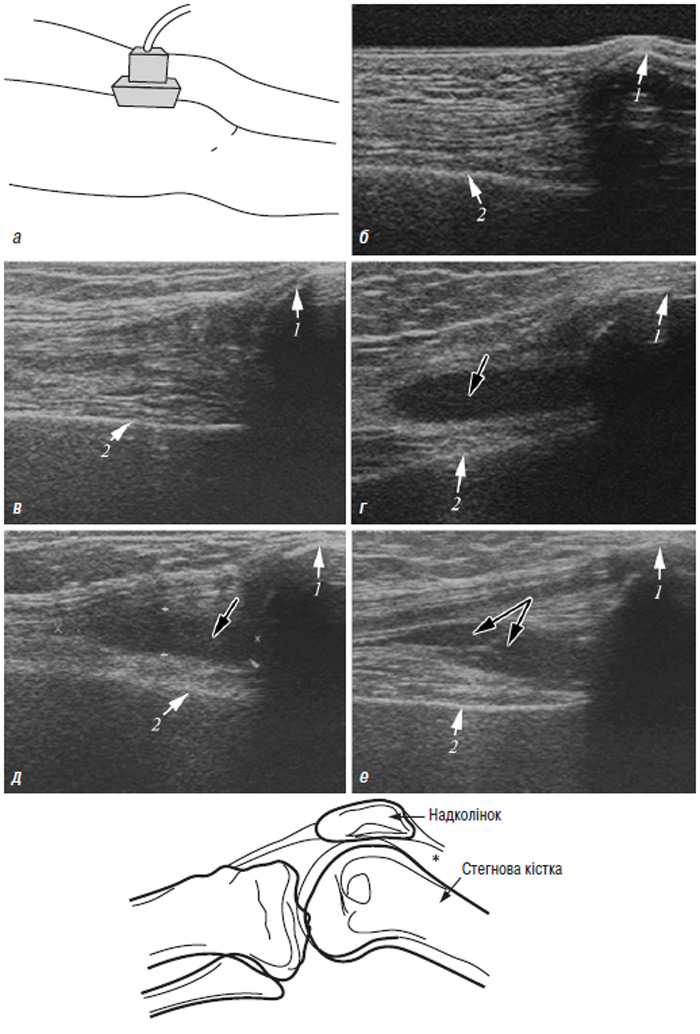
Рис. 7.60. Дослідження супрапателярної ділянки. Поздовжня позиція датчика. Чорними стрілками зазначений випіт в bursa suprapatellaris: 1 — надколінок; 2 — стегнова кістка. Рентгенограма колінного суглоба (схема), бічна проекція. *Локалізація bursa suprapatellaris
Рис. 7.61. Дослідження супрапателярної ділянки. Поперечна позиція датчика
Подальше дослідження при згинанні колінного суглоба і переміщенні датчика в поперечне положення дозволяють візуалізувати ПФВ суглоба, зокрема гіаліновий хрящ і наявність або відсутність над ним надлишку рідини (рис. 7.61). Переведення датчика на ділянку нижче надколінка дає можливість визначити поверхнево розташовану власну зв’язку надколінка, її структуру, піднадколінкове жирове тіло, піднадколінкову синовіальну складку, глибше якої розташована передня хрестоподібна зв’язка. Поперечне положення датчика (рис. 7.62а) дозволяє візуалізувати суглобовий хрящ латерального і медіального виростків, зміни форми суглобових поверхонь стегнової кістки (сплощення тощо) (рис. 7.62б–е). Встановлення датчика на внутрішню і зовнішню бічну поверхні колінного суглоба дозволяє візуалізувати відповідно внутрішню і зовнішню колатеральні зв’язки, крайові кісткові розростання стегнової та великогомілкової кісток, наявність або відсутність випоту (рис. 7.63, 7.64).
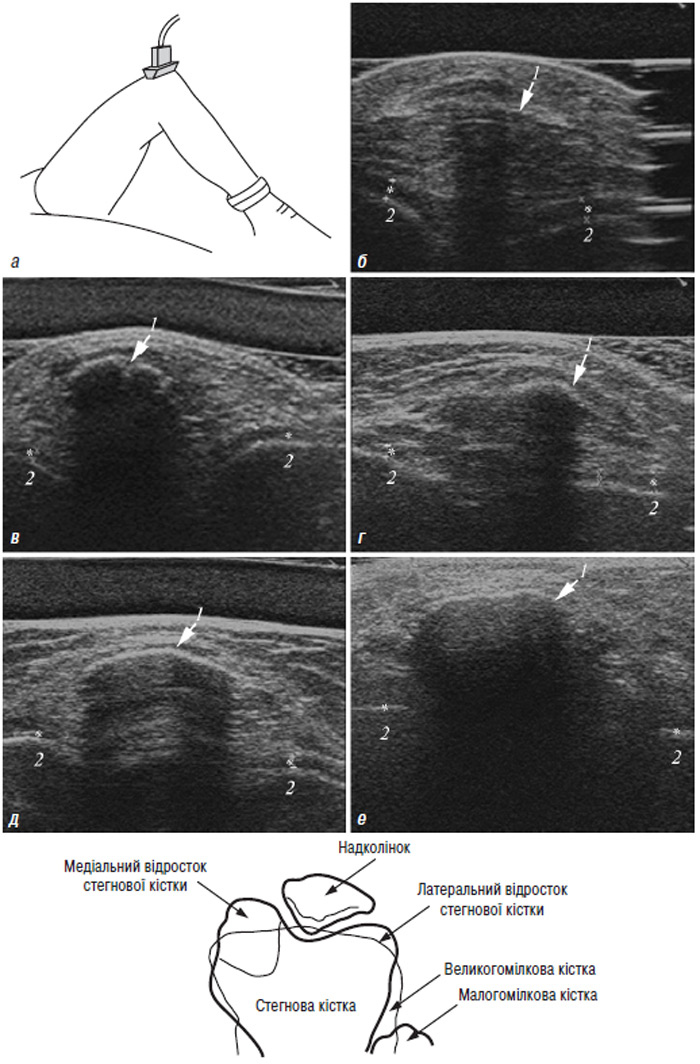
Рис. 7.62. Дослідження інфрапателярної ділянки колінного суглоба. Поперечна позиція датчика (1 — надколінок; 2 — стегнова кістка; *суглобова щілина). Рентгенограма колінного суглоба (схема), аксіальна проекція
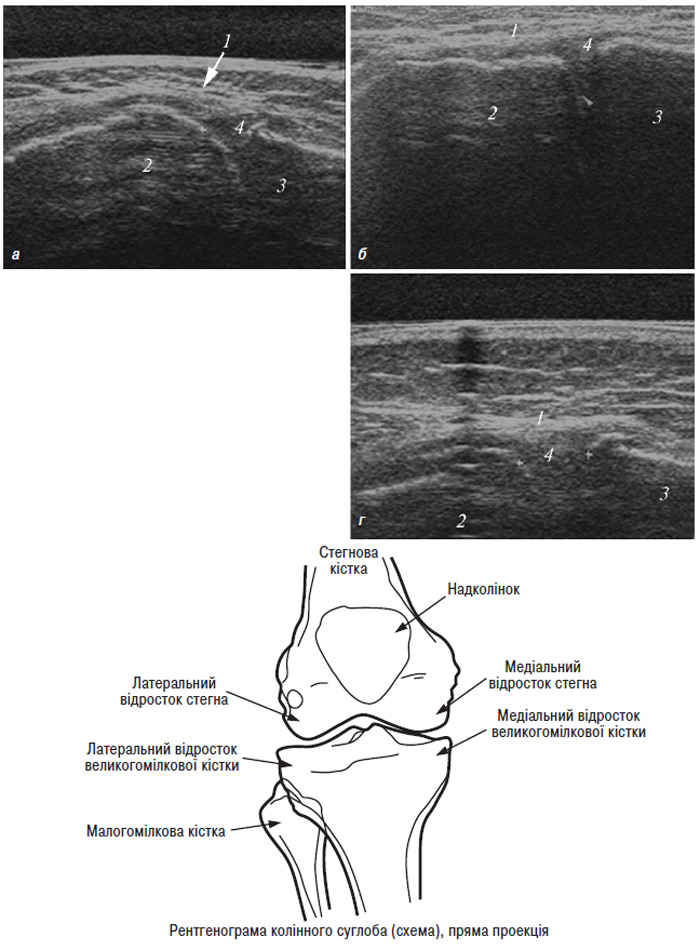
Рис. 7.63. Дослідження медіальної ділянки колінного суглоба (1 — внутрішня колатеральна зв’язка; 2 — стегнова кістка; 3 — великогомілкова кістка; 4 — суглобова щілина)
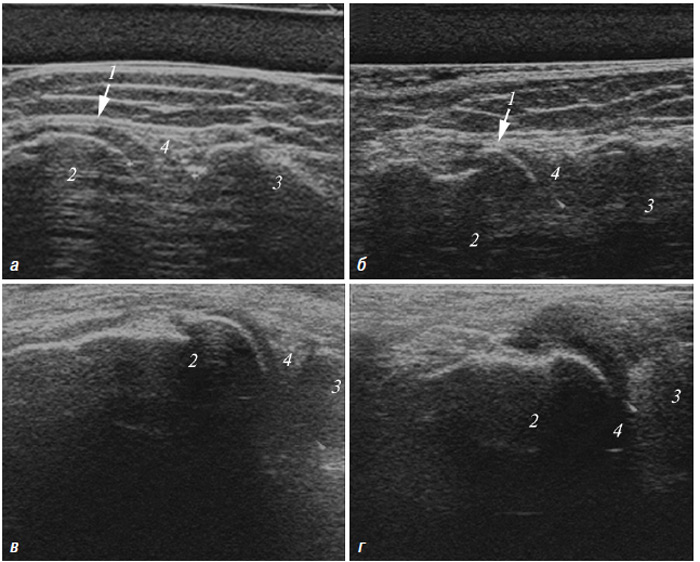
Рис. 7.64. Дослідження латеральної ділянки колінного суглоба (1 — зовнішня колатеральна зв’язка; 2 — стегнова кістка; 3 — великогомілкова кістка; 4 — суглобова щілина)
При УЗД підколінної ямки можна візуалізувати патологічні утворення цієї ділянки (кіста Бейкера), суглобові хрящі латерального і медіального виростків, задні частини медіального та латерального виростків, задні роги латерального і медіального менісків, задню хрестоподібну зв’язку.
Нами обстежено 62 хворих на гонартроз при цьому проведено порівняльну оцінку даних УЗД і термографії (див. нижче). УЗД опорно-рухового апарату проводили на апараті «SONOLINE Omnia (Siemens)» з лінійним датчиком 7,5L70 (частота — 7,5 МГц) у режимі «ortho» у стандартних позиціях. Оцінювали стан суглобових поверхонь кістки (включаючи стан кортикального шару, у тому числі й субхондральної кістки), суглобових щілин, навколосуглобових м’яких тканин, наявність випоту і його особливості, зміни зв’язково-сухожильного апарату й деякі інші параметри.
За даними УЗД, у пацієнтів із гонартрозом спостерігалися: звуження суглобової щілини за рахунок зниження висоти суглобового хряща (поперечна позиція датчика), кісткові розростання (остеофіти) і/або дефекти суглобових поверхонь кісток, зміни синовіальної мембрани та наявність випоту в суглобах, зміни параартикулярних м’яких тканин (усі позиції). Зміни поверхні кортикального шару суглобових поверхонь (нерівність, формування дефектів поверхні) реєстрували вже на початкових стадіях захворювання (I рентгенологічна стадія за класифікацією Келлгрена — Лоуренса) (див. рис. 7.63а) і досягали максимальної вираженості при ІІІ та IV стадії. Так, на рис. 7.63а–в зображено формування остеофітів на кісткових суглобових поверхнях медіальної ділянки колінного суглоба, на рис. 7.64 а–г — латеральної ділянки. Зв’язковий апарат — внутрішня (великогомілкова) колатеральна зв’язка та зовнішня (малогомілкова) колатеральна зв’язка позначені відповідно на рис. 7.63 і 7.64.
Випіт у суглобі відзначали у 28 (45,16%) пацієнтів із гонартрозом, переважно при ІІ і ІІІ стадії захворювання, він в основному локалізувався у верхньому завороті (в 32,3% хворих) (див. рис. 7.60г–е), у латеральній частині суглобової щілини (в 17,7%) (див. рис. 7.64г), рідше — у медіальній частині суглобової щілини (в 9,7%) і в задньому завороті (в 3,2%) (рис. 7.65а, в). На рис. 7.65б для порівняння показана поперечнозадня проекція при дослідженні нормального колінного суглоба, а під нею — та ж проекція пацієнтки з ОА та кістою Бейкера. Випіт мав гомогенну анехогенну ехоструктуру за умови тривалості клінічної симптоматики ОА до 1 міс (див. рис. 7.60г), а у хворих із клінічними ознаками персистуючого запалення в суглобі — негомогенну, з наявністю включень різного розміру й ехощільності (див. рис. 7.60д, е). Товщина синовіальної оболонки була збільшена у 24 (38,7%) обстежених, а нерівномірне її потовщення реєструвалося у 14 з них (див. рис. 7.60е). Хотілося б відзначити, що середня тривалість захворювання у цих пацієнтів була більшою, ніж у групі хворих на гонартроз в цілому (6,7±2, 4 року), причому у пацієнтів із нерівномірним потовщенням синовіальної оболонки вона була ще більшою (7,1±1,9 року). Таким чином, особливості синовіту відображали тривалість гонартрозу та гостроту процесу на момент обстеження.
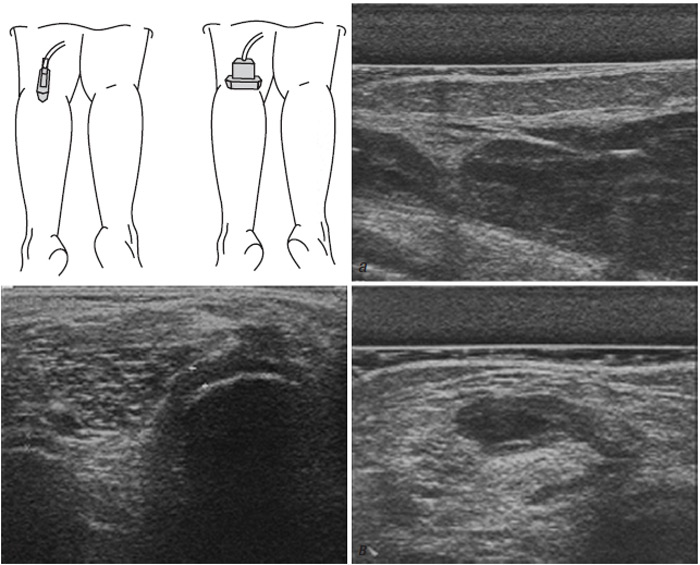
Рис. 7.65. Дослідження підколінної ямки
Оцінку гіалінового хряща суглоба (піднадколінковий доступ, поперечна позиція датчика) (див. рис. 7.62а) проводили за такими критеріями: товщина, рівномірність товщини, структура, поверхня, зміни поверхні субхондральної кістки (наявність кіст, ерозій, інших дефектів). Відзначимо, що висота хряща більше зменшувалася на медіальному виростку відповідно до більшого механічного навантаження на цю ділянку (див. рис. 7.62в–д, рис. 7.63а, б). Стадійність змін у хрящі та субхондральній кістці наведена на рис. 7.62б–е.
На рис. 7.62б зображений нормальний гіаліновий хрящ медіального (ліворуч) і латерального (праворуч) виростків стегнової кістки, на рис. 7.62в–д — зменшення висоти гіалінового хряща у пацієнтів із гонартрозом, причому видно його негомогенну структуру, а також наявність включень і нерівність контурів субхондральної кістки (позначені стрілками). На рис. 7.62е — УЗ-картина колінного суглоба в інфрапателярній поперечній проекції у хворого на гонартроз III стадії за класифікацією Келлгрена — Лоуренса. Видно різке зменшення висоти суглобового хряща (зазначений стрілками), деформація надколінка.
Заслуговують на увагу результати, отримані при зіставленні даних дистанційної термографії та УЗД (табл. 7.14). Сильний або дуже сильний прямий зв’язок за даними кореляційного аналізу виявлений між градієнтом температур у медіальній і латеральній ділянках колінних суглобів, з одного боку, і випотом у суглобі та потовщенням синовіальної оболонки за даними УЗД — з іншого. Більш слабкий зв’язок виявлено між наявністю кісткових розростань у медіальній ділянці колінних суглобів (дані УЗД) і градієнтом температур у всіх досліджених ділянках суглобів.
Таблиця 7.14
Зіставлення результатів дистанційної термографії (градієнтів температур) і УЗД
| УЗД-критерії гонартрозу | ΔТм | ΔТл | ||
| r | p | r | p | |
| Зменшення висоти суглобового хряща (поперечна позиція датчика) | 0,63 | 0,0002 | 0,3 | 0,10 |
| Наявність випоту в суглобі | 0,91 | <0,00001 | 0,89 | <0,00001 |
| Потовщення синовіальної оболонки | 0,82 | <0,00001 | 0,7 | <0,0001 |
| Кісткові розростання в медіальній ділянці суглобової щілини | 0,61 | 0,003 | 0,65 | 0,0001 |
| Кісткові розростання в латеральній ділянці суглобової щілини | 0,37 | 0,04 | 0,51 | 0,004 |
Отже, УЗД і термографія є взаємодоповнюючими методами у діагностиці ОА колінних суглобів, що особливо стосується активності процесу та вираженості дегенеративних змін суглобів.
Кульшовий суглоб
Кульшова ділянка є місцем проходження великих судинно-нервових пучків, зоною метастазування пухлин і поширення запальних процесів із черевної порожнини і малого таза, а також із нижніх кінцівок (Ивашкин В.Т., Султанов В.К., 2005). Хоча найбільш інформативним методом виявлення уражень кульшового суглоба є МРТ, УЗД має переваги у виявленні невеликого випоту в суглобі (навіть <1 мл), а також порушень стану навколосуглобових м’яких тканин на ранніх стадіях розвитку ревматичних захворювань суглобів. Дослідження проводиться за допомогою лінійного чи конвексного датчика в діапазоні 3,5–7,5 мГц, залежно від конституційних особливостей пацієнта.
Анатомічні дані
Кульшовий суглоб належить до зчленувань кулястого типу, має здатність виконувати великий обсяг рухів, характеризується вираженою стабільністю і відіграє провідну роль у підтримці маси тіла та пересуванні людини. Голівка стегнової кістки розташована на подовженій шийці, глибоко проникає у вертлюжну западину, що утворена з’єднанням клубової, сідничної та лонної кісток таза.
Вертлюжна западина поглиблена за рахунок фіброзно-хрящової губи, що формує «комір» навколо голівки стегнової кістки. Через щілину в нижній частині губи (вертлюжну вирізку) «перекидається» поперечна зв’язка, що утворює в такий спосіб отвір, через який в порожнину кульшового суглоба проходять кровоносні судини. Суглобовий хрящ вертлюжної западини має підковоподібну форму, що відкрита вниз. Дно вертлюжної западини заповнене жировою тканиною. Всередині кульшового суглоба проходить кругла зв’язка, що починається від поперечної зв’язки та прикріплюється до ямки на голівці стегнової кістки. Кругла зв’язка несе кровоносні судини, її основна функція полягає в живленні центральної частини голівки стегнової кістки. Синовіальна оболонка покриває капсулу, губу й жирову подушку, але не включає круглої зв’язки. Кульшовий суглоб оточений міцною фіброзною капсулою, укріпленою міцними зв’язками, такими як ligg. inguinale (ligg. iliopectineum, lacunare), lig. sacrotuberosum. Навколо суглоба розташовано кілька сумок, серед яких: bursa trochanterica musculi glutaei maximi, b. tuberis ischiadici тощо. У безпосередній близькості від кульшового суглоба попереду проходить судинно-нервовий пучок, позаду — сідничний нерв.
Дослідження проводиться зазвичай з переднього доступу (поздовжня і поперечна позиції датчика — рис. 7.66), у положенні пацієнта на спині з випрямленими ногами. Кістковими орієнтирами є верхній край вертлюжної западини та півколо голівки стегнової кістки (рис. 7.67а). Із переднього доступу добре візуалізуються гіпоехогенний гіаліновий хрящ, синовіальна суглобова капсула кульшового суглоба (представлена волокнами сіднично-стегнової, лобково-стегнової та здухвинно-стегнової зв’язок — рис. 7.67б). Для візуалізації великого вертлюга та вертлюгової сумки, що розташовується над ним поверхнево підшкірно, використовується латеральний доступ. Сідничний бугор досліджується із заднього доступу в положенні пацієнта лежачи на боці із зігнутою і приведеною до живота досліджуваною кінцівкою (табл. 7.15).
Рис. 7.66. Дослідження кульшового суглоба. Поздовжня (а) і поперечна (б) позиція датчика
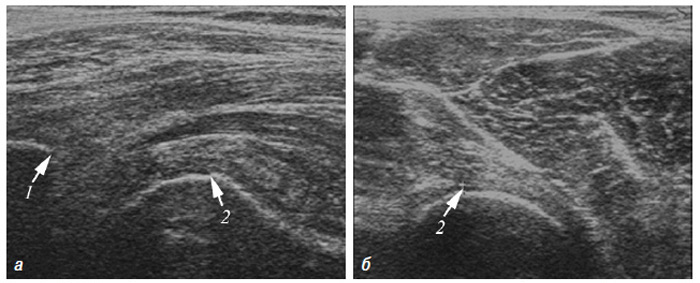
Рис. 7.67. Дослідження кульшового суглоба: а — поздовжня позиція датчика (1 — верхній край вертлюжної западини; 2 — голівка стегнової кістки); б — поперечна позиція датчика. ОА кульшового суглоба. Висота суглобового хряща знижена (зазначений стрілками)
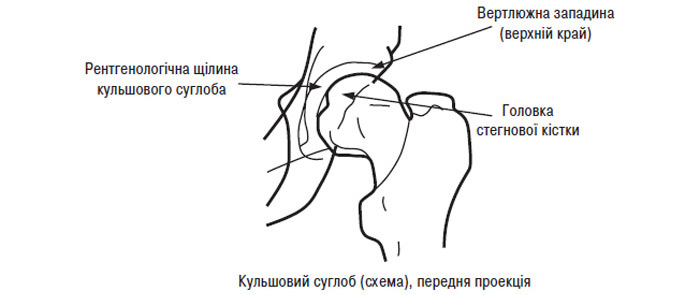
Таблиця 7.15
Стандартні проекції та позиціювання датчика при УЗД кульшового суглоба (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення |
Структури, що візуалізуються |
| положення пацієнта лежачи на спині, кульшовий суглоб у нейтральній позиції | Суглобова поверхня стегнової кістки, в тому числі голівка стегнової кістки; суглобова щілина та капсула кульшового суглоба; вертлюжна западина (acetabulum); суглобовий хрящ; періартикулярні м’які тканини, в тому числі прилеглі м’язи; синовіальна оболонка |
| Стандартні сканування | |
| 1. Переднє поздовжнє сканування | Суглобова поверхня стегнової кістки, в тому числі голівка стегнової кістки; суглобова щілина та капсула кульшового суглоба; дах acetabulum; суглобовий хрящ; періартикулярні м’які тканини, в тому числі прилеглі м’язи; синовіальна оболонка.
Патологія, що виявляється Випіт у порожнині кульшового суглоба, із розширенням суглобової щілини, наявністю гіперехогенних включень при тривалому перебігу запального процесу; проліферація синовіальної оболонки (у тому числі гроновидна при РА); патологія суглобових кісткових поверхонь (у тому числі ерозивні зміни при РА та утворення остеофітів — при ОА), проліферація синовіальної оболонки та кровотік у останній, порушення структури м’язів при патології останніх, патологія інших м’яких тканин, у тому числі кістоподібні утворення, пухлини тощо |
| 2. Переднє поперечне сканування | |
| 3. Латеральне поздовжнє сканування | Великий виросток стегнової кістки (trochanter major).
Патологія, що виявляється Запальні зміни, в тому числі бурсити ділянки, що досліджується (trochanteritis) |
Хоча провідним методом виявлення коксартрозу є МРТ, УЗД має переваги у виявленні невеликого випоту в кульшовому суглобі (навіть <1 мл), а також порушень стану навколосуглобових м’яких тканин на ранніх стадіях розвитку захворювання. Дослідження здійснюється за допомогою лінійного чи конвексного датчика в діапазоні 3,5–7 МГц залежно від конституційних особливостей пацієнта.
Нами проведено УЗД у 54 хворих на коксартроз (діагностичні критерії ACR, 1990) у пацієнтів віком 41–74 роки (середній вік — 56,44±7,12 року); з них чоловіків — 22, жінок — 32, тривалість захворювання становила 0,6–37 років (у середньому — 8,3±3,48 року). Дані УЗД у пацієнтів із коксартрозом залежно від клініко-рентгенологічної стадії захворювання наведені в табл. 7.16.
Таблиця 7.16
Дані УЗД у пацієнтів із коксартрозом
| УЗД-ознака | Кількість хворих з ознаками ОА за даними УЗД,% | ||||
| Рентгенологічна стадія | |||||
| 0 (n=12) | I (n=13) | II (n=15) | III (n=10) | IV (n=4) | |
| Зміни суглобового хряща | 5 (41,7%) | 10 (76,9%) | 15 (100%) | 10 (100%) | 4 (100%) |
| Дефекти суглобових поверхонь кістки | 1 (8,3%) | 3 (23%) | 8 (53,3%) | 8 (80%) | 4 (100%) |
| Кісткові розростання | 0 (0%) | 1 (7,7%) | 6 (40%) | 8 (80%) | 4 (100%) |
Зміни синовіальної мембрани
|
0 (0%)
— — |
1 (7,7%)
+3,2 — |
4 (26,7%)
+11,8 1 (6,7%) |
5 (50%)
+24,9 2 (20%) |
1 (25%)
+11,6 1 (25%) |
| Випіт у суглобі | 0 (0%) | 1 (7,7%) | 4 (26,7%) | 6 (60%) | 1 (25%) |
| Зміни навколосуглобових м’яких тканин | 1 (8,3%) | 3 (23%) | 9 (60%) | 9 (90%) | 4 (100%) |
Наявність випоту в кульшовому суглобі діагностували за умови, що відстань між поверхнею шийки стегнової кістки та суглобовою капсулою перевищувала 9–10 мм (Зубарєв А.В., 2002).
Гомілково-ступневі суглоби
Гомілково-ступневі суглоби — зчленування шарнірного типу між медіальною щиколоткою малогомілкової кістки і таранною кісткою. Капсула міцніша з медіальної та латеральної сторін, де вона зв’язана зі зв’язками. Стабільність гомілково-ступневого суглоба підтримується колатеральними зв’язками: медіальною (дельтоподібною) та латеральною (складається із 3 пучків (переднього і заднього таранно-малогомілкового та п’ятково-малогомілкового). Нижнє великогомілково-малогомілкове зчленування становить синдесмоз і практично нерухоме.
За латеральною щиколоткою проходять сухожилля м’язів, що підвертають стопу всередину, а за медіальною — сухожилля м’язів, що підвертають стопу назовні та згинають I палець. Кожне сухожилля оточене своєю піхвою, і всі вони притискаються до щиколоток м’язами-утримувачами, відповідно — retinaculum peroneum (латеральна щиколотка) і retinaculum flexorum (медіальна щиколотка). Медіальний утримувач утворює передплюсневий (тарзальний) канал, через який проходить великогомілковий нерв. Попереду й більш поверхнево відносно гомілково-ступневого суглоба під retinaculum extensorum розташовуються три сухожильних піхви м’язів-розгиначів.
Для візуалізації гомілково-ступневих суглобів використовують такі стандартні проекції та позиціювання датчика при УЗД (табл. 7.17).
Таблиця 7.17
Стандартні проекції та позиціювання датчика при УЗД гомілково-ступневого суглоба (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
|
Загальні положення |
Структури, що візуалізуються |
|
Гомілково-ступневий суглоб, прилеглі м’якотканинні структури |
| Стандартні сканування | |
| 1. Переднє поздовжнє сканування | Аrt. tibio-talare, talo-naviculare, cуглобові поверхні великогомілкової та таранної кістки, malleolus med., прилеглі сухожилля та місця їх прикріплень до кісток, гіаліновий суглобовий хрящ, синовіальна оболонка, a. tibialis ant.
Патологія, що виявляється Випіт у порожнині гомілково-ступневого суглоба, гемартроз (в тому числі при лікуванні антикоагулянтами), тендосиновіт, патологія суглобових поверхонь великогомілкової та таранної кістки, субдельтовидний/субакроміальний бурсит, проліферація синовіальної оболонки, порушення цілісності сухожиль, патологія суглобового хряща (перш за все явища ОА) |
| 2. Переднє поперечне сканування | Суглобова поверхня таранної кістки, гіаліновий суглобовий хрящ.
Патологія, що виявляється Патологія суглобової поверхні таранної кістки, патологія суглобового хряща (перш за все, явища ОА) |
| 3. Перикісточкове медіальне поздовжнє сканування | Суглобова поверхня таранної кістки, гіаліновий суглобовий хрящ, malleolus med., tendo m. tibialis post., синовіальної оболонки.
Патологія, що виявляється Тендосиновіт і порушення цілісності сухожилля, ділянки гіпертрофії синовіальної оболонки та наявність кровотоку в останній, патологія суглобового хряща та субхондральної кістки (перш за все, зумовлені ОА та РА) |
| 4. Перикісточкове медіальне поперечне сканування | Мalleolus med., tendіnes mm. tibialis post., flexor digitorum long., hallucis long., судини.
Патологія, що виявляється Тендосиновіт і порушення цілісності сухожиль, патологічні зміни судин (в тому числі судинної стінки, порушення кровотоку) |
| 5. Перикісточкове латеральне поздовжнє сканування | Мalleolus lat., tendines mm. peronaeа.
Патологія, що виявляється Тендосиновіт і порушення цілісності сухожиль, патологічні зміни malleolus lat. |
| 6. Перикісточкове латеральне поперечне сканування | Див. 5 |
| 7. Заднє поздовжнє сканування | Поверхня п’яткової кістки, tendo calcaneus (ахіллово сухожилля), bursa tendinis calcanei.
Патологія, що виявляється Тендосиновіт, порушення цілісності та ентезопатія ахіллова сухожилля, проліферація синовіальної оболонки, патологія п’яткової кістки та оточуючих м’яких тканин (в тому числі гострий та хронічний позап’ятковий бурсит), ерозивні зміни п’яткової кістки |
| 8. Заднє поперечне сканування | Див. 7. |
Суглоби стопи
Анатомічні дані
У передній частині стопи розташовані суглоби стопи — плеснофалангові та міжфалангові шарнірного типу, подібні до п’ястково-фалангових і міжфалангових суглобів кистей. Стабільність плеснофалангових суглобів визначається в основному міцністю капсули, що укріплена по обидва боки колатеральними зв’язками, зверху — сухожиллям м’яза-розгинача, а знизу — плантарним сухожиллям. У середній частині стопи розміщується міжзаплесновий суглоб плоского типу, що являє собою функціональне об’єднання таранно-п’ятково-човноподібного та п’ятково-кубоподібного суглобів. Він дозволяє виконувати внутрішнє і зовнішнє підвертання передньої частини стопи. У задній частині стопи розташований підтаранний суглоб, що утворюється увігнутою суглобовою поверхнею п’яткової кістки та випуклою нижньою поверхнею таранної кістки. Цей суглоб робить можливим внутрішнє й зовнішнє підвертання задньої частини стопи. У результаті того, що в передній частині стопи кістки розташовані щільно одна до одної, а в задній частині — лежать одна на одній, формуються два зведення: поздовжнє і поперечне. У передній частині стопи іноді розташовані сумки над медіальною частиною I плеснофалангового суглоба і латеральною частиною V плеснофалангового суглоба. Ахіллове сухожилля (загальне для mm. gastrocnemius та m. soleus) прикріплюється до задньої частини п’яткової кістки й відділене від її позап’яткової (преахіллової) сумки. Крім того, в ділянці п’ятки є сумки між ахілловим сухожиллям і шкірою (ретроахіллова сумка), а також між шкірою й нижньою поверхнею п’яткової кістки (підп’яткова сумка). Плантарна фасція починається від серединного виступу п’яткової кістки, а в проксимальному відділі, розділяючись на пучки, прикріплюється до голівок плеснових кісток.
Для візуалізації гомілково-ступеневих суглобів використовують такі стандартні проекції та позиціювання датчика при УЗД (табл. 7.18).
Таблиця 7.18
Стандартні проекції та позиціювання датчика при УЗД суглобів стопи (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
| Загальні положення | Структури, що візуалізуються |
|
Суглоби стопи, прилеглі м’якотканинні структури |
| Стандартні сканування | |
| 1. Підошовне поздовжнє сканування | П’яткова кістка, підошовна фасція, патологічні зміни синовіальної оболонки. Патологія, що виявляється
Фасціїт підошовної фасції, п’яткова «шпора», зміни кісткових поверхонь |
| 2. Підошовне поперечне сканування | Див. 1 |
| 3. Дорзальне поздовжнє сканування
а) плеснофалангові суглоби б) міжплесневі суглоби |
суглобові поверхні кісток, що сполучаються, УЗ-суглобової щілини, синовіальна оболонка, прилеглі м’якотканинні структури.
Патологія, що виявляється Випіт у порожнині суглобів (в тому числі з наявністю множиних ехо«+» включень, які мають специфічний вигляд (часто описують як «снігову бурю») і характерні для мікрокристалічних артропатій, перш за все, подагри); зміни УЗ-суглобової щілини (розширення при наявності випоту, звуження при розвитку, перш за все, ОА); проліферативні зміни синовіальної оболонки та кровоток у ній; зміни суглобових поверхонь кісток, що сполучаються (ерозивні — при РА, спондилоартропатії, псоріатичному артриті тощо; формування остеофітів, характерне для розвитку ОА); зміни в періартикулярних м’яких тканинах (запальні — у вигляді гіпоехогенних ділянок, часто із втратою типової ехоструктури, дегенеративно-дистрофічні гіперехогенні зони, дифузно чи локально по ходу сухожиль тощо; наявність гіперехогенних включень різного розміру, що відображають кальциноз чи відкладення кристаллів при подагрі (найчастіше) або інших мікрокристалічних артропатіях. |
| 4. Дорзальне поперечне сканування | Див. 3. |
| 5. Латеральне поздовжнє сканування
а) І плеснофаланговий суглоб б) V плеснофаланговий суглоб |
Див. 3. |
На рис. 7.68б — УЗ-картина суглобів заплесни при ОА при поздовжньому позиціюванні датчика (для порівняння на рис. 7.68а наведена норма в тій же проекції). Видно різко звужені суглобові щілини (зазначені стрілками), нерівність контурів кісток, наявність кісткових розростань.
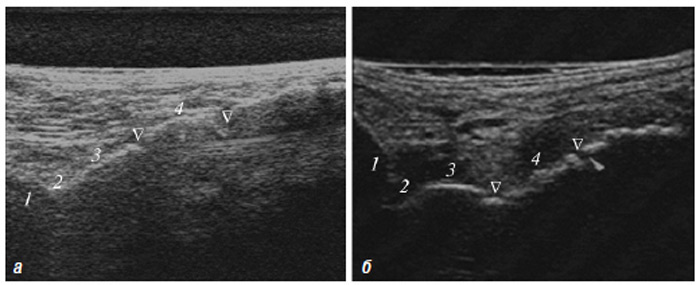
Рис. 7.68. УЗ-картина суглобів стопи в нормі (а) і при ОА (б). Поздовжня позиція датчика. ∇ — суглобові щілини, 1 — великогомілкова кістка; 2 — гомілковостопний суглоб; 3 — таранна кістка; 4 — човноподібна кістка
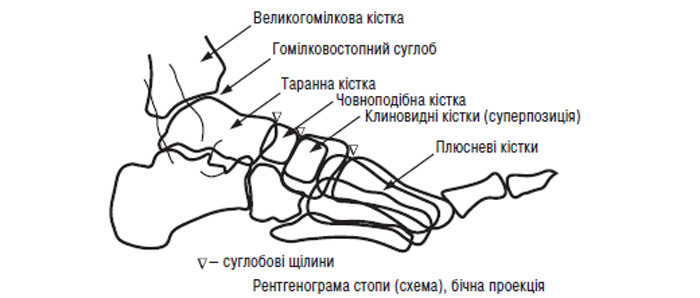
Плечовий суглоб
Плечовий суглоб є одним із найзручніших для УЗД, особливо тому, що багато патологічних змін відбуваються в його м’яких тканинах. Через низьку інформативність рентгенологічного методу у відображенні саме змін у м’яких тканинах, УЗД поряд із МРТ на сьогодні є основними в дослідженні плечового суглоба.
Ураження плечового суглоба при ревматичних захворюваннях суглобів дуже важливе, оскільки пов’язане зі значним порушенням функціональної здатності хворого, а також, окрім ураження інших великих суглобів, зумовлює несприятливий прогноз перебігу цих хвороб (Борткевич О.П., 2003а, б). Так, ураження плечового суглоба при РА зумовлено як синовітом, так і залученням дистальної третини ключиці, різних синовіальних сумок та м’язів плечового поясу, шиї та грудної клітини (Насонова В.А., Бунчук Н.В., 1997; Коваленко В.Н. и соавт., 2001; Сигидин Я.А., Лукина Г.В., 2001).
Для ураження плечового суглоба при ревматичних захворюваннях суглобів зазвичай притаманний біль, що викликає обмеження рухливості в цьому суглобі, що, в свою чергу, приводить до слабкості та атрофії навколишніх м’язів — дельтоподібного, надосного, підосного, двоголового та триголового (Сигидин Я.А., Лукина Г.В., 2001). Перші три із цих м’язів утримують лопатку в нормальному положенні. Внаслідок слабкості м’язів лопатка зміщується в передньо-латеральному напрямку, у зв’язку із чим плечовий суглоб при огляді видається висунутим вперед. Крім того, при зсуві лопатки вперед зменшується стабільність плечового суглоба. Компенсаторно відновлюючи цю стабільність, великий грудний м’яз приводить плечову кістку в позицію приведення та внутрішньої ротації. Цей механізм пояснює часте обмеження зовнішньої ротації плеча у хворих на РА. Крім того, виражена атрофія м’язів та слабкість допомагають відрізнити ураження плечового суглоба при РА від плече-лопаткового периартриту (Насонова В.А., Бунчук Н.В., 1997).
Порівняно рідко при РА спостерігається явна припухлість ділянки плечового суглоба, яка зазвичай більше виражена на передній поверхні чи в пахвовій ямці. Почергове натискання пальцями на передню і латеральну поверхні плечового суглоба іноді виявляє балотування, що свідчить про внутрішньосуглобове накопичення рідини. Температура шкіри надплечового суглоба часто підвищена, що свідчить про активний запальний процес (Коваленко В.Н. и соавт., 2001).
Однією з найважливіших причин патології плечового суглоба є залучення до патологічного процесу так званої ротаторної манжети плеча — сухожиль надосного, підосного та малого круглого м’язів, що розміщені поруч і прикріплюються до великої бугристості плечової кістки (Martinoli C. et al., 2003; van Holsbeck M.T. et al., 1995). Важливою функцією ротаторної манжети є стабілізація голівки плечової кістки в суглобовій западині: сухожилля створюють своєрідний «дах» плечового суглоба, перешкоджаючи надмірному зсуву голівки вгору. В результаті запалення при РА ці сухожилля можуть дистрофічно змінюватися і надриватися (van Holsbeek M.T. et al., 1995). Основна причина подібних ушкоджень, оскільки зазначені сухожилля частково проходять у порожнині плечового суглоба — проліферативний синовіт; інші причини — вікові дистрофічні зміни зв’язок, фізичні перевантаження, травми/мікротравматизація (Alasaarela E. et al., 1997).
Ослаблення нормального напруження ротаторної манжети і тим більше її розриви приводять до підвивиху голівки вгору та різкого порушення функції плечового суглоба. Невеликі надриви сухожиль, що поступово розвиваються, зазвичай не мають характерних клінічних ознак, в той час як значні розриви, що розвиваються раптово, супроводжуються гострим болем і суттєвими зовнішніми ознаками запалення (виражена припухлість, гіпертермія шкіри). Останнє потребує диференційної діагностики, насамперед, з інфекційними артритами, причому слід враховувати, що останні є одними із першочергових невідкладних станів у ревматологічній практиці (Сигидин Я.А., Лукина Г.В., 2001). Також важливо, що припухлість (особливо обмежена) передньо-латеральної ділянки плечового суглоба може бути викликана не власне артритом, а субакроміальним (субакроміально-субдельтовидним) бурситом (Martinoli C. et al., 2003; EULAR, Working Party on Imaging in Rheumatology, 2005). На відміну від розриву ротаторної манжети, припухлість при бурситі зазвичай супроводжується значно меншою вираженістю болю і обмеженням обсягу рухів у плечовому суглобі (Сигидин Я.А., Лукина Г.В., 2001).
Анатомічні дані
Плечовий суглоб належить до кулястих зчленувань. Суглобова ямка його розширена за рахунок фіброзно-хрящової суглобової губи, однак вона залишається досить неглибокою. Капсула плечового суглоба відносно тонка та слабка, а сильні поперечні зв’язки відсутні. Зазначені фактори зменшують стабільність плечового суглоба, і внаслідок цього він характеризується найбільшим порівняно з усіма суглобами обсягом рухів. Стабільність плечового суглоба забезпечується в основному за рахунок так званої ротаторної манжети, що включає чотири м’язи: до малого горбка плечової кістки кріпиться підлопатковий м’яз, що починається на передній поверхні лопатки, а до великого горбка — м’язи, що починаються ззаду на лопатці — надосний, підосний та малий круглий м’язи. Зверху плечовий суглоб захищений «аркою», що утворюється клювоподібним і акроміальним відростками, та клювоподібно-акроміальною зв’язкою. У капсулі плечового суглоба є два отвори. Один із них дозволяє довгій голівці сухожилля m. biceps пройти по міжвиростковій борозні, при цьому випинання синовіальної оболонки створює сухожиллю синовіальну піхву. Через другий отвір відбувається випинання синовіальної оболонки, що утворює піхву для підлопаткового м’яза. Плечовий суглоб оточений кількома сумками, які іноді сполучаються з суглобовою порожниною. Так, більша субакроміальна сумка забезпечує гладке ковзання між ротаторною манжетою і нижньою поверхнею акроміального відростка. Завдяки її розширенню в латеральному напрямку виникає субакроміально-субдельтовидна синовіальна сумка. Між клювоподібним відростком і капсулою розташована підклювоподібна сумка.
Для візуалізації гомілково-ступеневих суглобів використовують такі стандартні проекції та позиціювання датчика при УЗД (табл. 7.19).
Таблиця 7.19
Стандартні проекції та позиціювання датчика при УЗД плечового суглоба (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
| Загальні положення | Структури, що візуалізуються |
|
Плечовий суглоб, прилеглі м’якотканинні структури |
| Стандартні сканування | |
| 1. Переднє поперечне сканування в нейтральній позиції на рівні прикріплення m. biceps brachii | Голівка плечової кістки, сухожилля m. biceps та місце його прикріплення до плечової кістки, дельтовидний м’яз, фрагмент ротаторної манжети, гіаліновий суглобовий хрящ.
Патологія, що виявляється Тендосиновіт m. biceps, патологія великого та малого виростків плечової кістки, субдельтовидний/субакроміальний бурсит, проліферація синовіальної оболонки, порушення цілісності сухожиль таротаторної манжети, патологія підшкірної жирової клітковини |
| 2. Переднє поперечне сканування у позиції максимальної внутрішньої ротації | Голівка плечової кістки, сухожилля m. suprapinatus, дельтовидний м’яз, фрагмент ротаторної манжети, гіаліновий суглобовий хрящ.
Патологія, що виявляється Тендосиновіт m. supraspinatus та порушення цілісності, проліферація синовіальної оболонки, кальциновані депозити тощо |
| 3. Переднє поздовжнє сканування | Див. 1 |
| 4. Переднє поздовжнє/поперечне сканування у позиції максимальної внутрішньої ротації | Див. 1 |
| 5. Латеральне поздовжнє/поперечне сканування в нейтральній позиції та при максимальній внутрішній ротації | Голівка плечової кістки, акроміон, сухожилля m. supraspinatus, дельтовидний м’яз, фрагмент ротаторної манжети.
Патологія, що виявляється Підвивихи/вивихи/нестабільність голівки плечової кістки тощо (див. також 1) |
| 6. Заднє поперечне сканування в нейтральній позиції та при максимальній внутрішній ротації | Голівка плечової кістки, губа плечового суглоба (labrum glenoidale), сухожилля m. infraspinatus, дельтовидний м’яз, фрагмент ротаторної манжети, випіт у порожнині плечового суглоба.
Патологія, що виявляється Зумовлена ураженням структур, що візуалізуються при УЗД |
| 7. Аксилярне (підпахвове) сканування при піднятому плечі | Голівка плечової кістки, art. glenohumerale, проліферація синовіальної оболонки, випіт у порожнині плечового суглоба, фрагмент ротаторної манжети.
Патологія, що виявляється Зумовлена ураженням структур, що візуалізуються при УЗД. Наявність випоту у плечовому суглобі |
| 8. Сканування art. cromioclaviculare | Акроміон, ключиця, акроміо-ключичний суглоб, прилеглі м’які тканини.
Патологія, що виявляється Зумовлена ураженням структур, що візуалізуються при УЗД |
З метою систематизації отриманих УЗ-даних при дослідженні плечового суглоба використовують такі УЗ-ознаки (Коваленко В.М. та співавт., 2001–2006; Борткевич О.П., Терзов К.А., 2006):
- Потовщення синовіальної сумки >2мм або наявність випоту в субакроміально-субдельтовидній сумці — наявність проліферативних або запальних змін
- Потовщення чи нерівність контуру сухожильної оболонки — ознака гіпертрофії синовіальної оболонки сухожильної піхви
- Гіпоехогенна зона, яка повністю оточує сухожилля, свідчить про випіт в порожнині сухожильної піхви, причому наявність випоту свідчить про активний запальний процес
- Зміни сухожилля m. supraspinatus, розділені нами на: 1) повний розрив, 2) зміни ехогенної структури сухожилля (включаючи часткове порушення цілісності чи тендинопатію). Повний розрив діагностували у тому разі, якщо дефект (гіпоехогенна зона) розповсюджувався на всю УЗ-структуру сухожилля або якщо візуалізовувалося локальне стоншення із чіткими краями розриву, з повною втратою типової ехоструктури сухожилля. Зміни ехогенної структури сухожилля m. supraspinatus діагностувалися при наявності гіпо-/гіперехогенних ділянок у типовій структурі обстежуваного сухожилля за допомогою УЗД
- Випіт/гіпертрофія синовіальної оболонки art. glenohumerale оцінювалися при скануванні зони labrum glenoidale, при задньому сагітальному позиціюванні датчика, перпендикулярно голівці плечової кістки, що співпадає з проекціями, які використовуються при стандартній рентгенографії плечового суглоба (за класифікацією Келлгрена — Лоуренса (1957); Beltran J. et al., 1987)
- Ерозії та нерівність контурів суглобових кісткових поверхонь реєстрували в передньомедіальній та задньолатеральній проекції голівки плечової кістки, та в зоні великої бугристості плечової кістки.
Для уточнення УЗ-картини нами також проводилися УЗД в положенні пацієнта лежачи, з обстежуваною верхньою кінцівкою, що знаходилася у вільному положенні, задля зручності встановлення датчика на досліджувану поверхню.
Зазначимо, що проведення УЗД в положенні пацієнта сидячи, згідно рекомендаціям EULAR, не дозволяло повною мірою оцінити наявність запальних змін у плечовому суглобі. За нашими даними, УЗ-ознаки субакроміально-субдельтовидного бурситу виявлялися в положенні пацієнта з РА сидячи в 1-й групі у 47,7% випадків, а у 2-й — у 65,0%. При УЗ-обстеженні хворого в положенні лежачи виявленість цієї патології становила 63,4 та 75,0% відповідно. Це дає підставу говорити про субклінічний перебіг запального ураження ділянки, що аналізується у частини хворих на РА.
УЗ-ознаками ураження плечового суглоба у хворих на ОА можуть бути: субакроміально-субдельтовидний бурсит, тендиніт m. biceps та m. supraspinatus, ентезопатії сухожиль м’язів, що становлять ротаторну манжету плечового суглоба, а також зміни синовіальної оболонки (потовщення, наявність кровотоку) та субхондральної кістки (нечіткість контурів, ерозивні зміни).
УЗД дозволяє виявити патологію плечового суглоба та ураження періартикулярних м’яких тканин на ранній стадії розвитку РА, що надає УЗД переваги перед традиційною рентгенографією і має велике значення для діагностики раннього РА при відсутності ерозивних уражень суглобів.
УЗД, поряд із лабораторними параметрами (ШОЕ, СРБ тощо), може визначати рівень активності захворювання на РА з ураженням плечового суглоба, у ранній стадії розвитку захворювання.
УЗД має проводитися також у положенні пацієнта лежачи, для більш точної верифікації наявності запального ураження плечового суглоба, особливо при наявності субакроміально-субдельтовидного бурситу.
Особливу увагу при дослідженні слід приділяти ротаторній манжетці, сформованій сухожиллями чотирьох м’язів: надостного, підостного, підлопаткового та малого круглого. При цьому обов’язковими проекціями є відведення руки пацієнта в позицію зовнішньої ротації (для дослідження підлопаткового м’яза) з пасивним внутрішнім і зовнішнім обертанням кінцівки пацієнта, заведення досліджуваної руки за спину з поперечним позиціюванням датчика (для оцінки сухожилля надостного м’яза). У практиці часто відзначають розриви ротаторної манжетки, які можуть бути повними, частковими, поздовжніми і поперечними.
Необхідно враховувати, що йдеться не лише про травматичні ушкодження цього утворення, але й про те, що у осіб з ОА, особливо похилого віку, розриви часто настають внаслідок дегенеративних змін у суглобі та його складових елементах, внаслідок яких виникає протрузійний тендиніт, аж до повного дегенеративного розриву ротаторної манжети плеча. Це може супроводжуватися бурситом не тільки в підакроміальній, але й у піддельтоподібній сумці. Найчастіше ці зміни локалізуються в основі сухожилля надостного, підостного м’яза та великого горбика плечової кістки.
Усі ці зміни можуть призвести до розвитку так званого імпінджемент-синдрому, який характеризується стійкими дегенеративними змінами перикапсулярних тканин плечового суглоба, що часто супроводжуються вираженим больовим синдромом, різним ступенем обмеження обсягу рухів у суглобі. Причинами розвитку імпінджемент-синдрому, поряд з ОА, є мікротравматичні ушкодження капсули, травма плечового суглоба, ускладнена розривом ротаторної манжети, а також такі захворювання, як РА і діабетична артропатія.
Розрізняють три стадії захворювання:
- Перша стадія — набряк і крововилив. Біль проявляється після фізичного навантаження, характерний біль, що виникає вночі. На цьому етапі визначається симптом «дуги» або «арки болісного відведення», коли при відведенні хворої руки з’являється біль у межах 60–120° активної абдукції. Це свідчить про те, що відбувається зіткнення великого горбика плечової кістки, передньозовнішнього краю акроміона і дзьобоподібно-ключичної зв’язки. Між цими структурами в місці прикріплення ротаторної манжети відбувається її защемлення. При УЗД в суглобовій сумці відзначається нерівномірне потовщення сухожилля надостного м’яза з наявністю гіперехогенних ділянок фіброзу. У проекції верхівки акроміального відростку лопатки, в місці прикріплення сухожилля надостного м’яза до великого горба плечової кістки, відзначаються його потовщення і субакроміальний бурсит.
- Друга стадія — фіброз і тендиніт. Спостерігаються больові явища в плечовому суглобі при повній відсутності активних рухів. У сухожильно-м’язовому та зв’язковому комплексі плечового суглоба відбуваються дегенеративні зміни. В результаті знижується стабілізуюча функція сухожильного апарату. При УЗД відзначається неоднорідність структури сухожилля надостного м’яза, поява множинних дрібних гіперехогенних включень. У міжгорбиковій ямці візуалізуються потовщені, нерівні контури довгої голівки двоголового м’яза плеча з поодинокими точковими кальцинатами і випотом.
- Третя стадія — розриви ротаторної манжети. Характеризується стійкою больовою контрактурою при пасивних рухах і майже повною втратою рухів у плечовому суглобі. Порожнина плечового суглоба значно зменшується в об’ємі, суглобова капсула стає ригідною та болючою. У періартикулярних тканинах розвивається адгезивний капсуліт.
Дегенеративно-дистрофічні зміни при ОА інших суглобів ехографічно також проявляються звуженням суглобових щілин, зменшенням висоти хряща, змінами періартикулярних м’яких тканин і кісткових суглобових поверхонь із формуванням при тривалому перебігу остеофітозу, що характерно при гонартрозі або коксартрозі, тому на них ми докладно не зупиняємося.
Ліктьовий суглоб
Ліктьовий суглоб містить три зчленування: плечоліктьове, плечопроменеве та проксимальне (верхнє) променеволіктьове. Плечоліктьове зчленування — шарнірний тип суглоба між блоком плечової кістки та блоковидною вирізкою ліктьової кістки. Плечопроменеве зчленування також є шарнірним суглобом між голівкою латерального виростка плечової кістки і ямкою голівки променевої кістки. Два зазначених зчленування забезпечують згинання та розгинання ліктьового суглоба. Проксимальне променеволіктьове зчленування утворено суглобовою окружністю променевої кістки та променевою вирізкою ліктьової кістки. Ліктьовий суглоб укріплений кільцеподібним зв’язуванням, що йде по лінії суглобового хряща та охоплює голівку променевої кістки. Міцна міжкісна фасція передпліччя перешкоджає паралельному зсуву ліктьової та променевої кісток. Верхній променеволіктьовий суглоб здійснює ротацію передпліччя (пронацію та супінацію), у яких беруть участь також дистальний променеволіктьовий суглоб і частково — плечопроменеве зчленування.
Усі три зчленування ліктьового суглоба оточені загальною капсулою. На променевій кістці капсула утворює «кишеню» нижче кільцеподібного зв’язування, а в трьох поглибленнях на плечовій кістці лежать більші жирові подушки, що є опорою при крайніх положеннях ліктьового суглоба. Стабільність ліктьового суглоба забезпечується його блоковидною формою, тяжами зв’язок. Колатеральна зв’язка разом із ліктьовим згиначем зап’ястя утворює кубітальный канал, через який проходить ліктьовий нерв. Від кісток і зв’язок ліктьової ділянки відходять м’язи передпліччя. Початок розгиначів кисті знаходиться на латеральному виростку плечової кістки, а згиначів — на медіальному. Навколо ліктьового суглоба є кілька синовіальних сумок, які не з’єднуються з порожниною ліктьового суглоба. Найбільш значима з них — поверхнева сумка ліктьового відростка (olecranon), що лежить в ділянці його узвишшя.
Для візуалізації гомілково-ступеневих суглобів використовують такі стандартні проекції та позиціювання датчика при УЗД (табл. 7.20).
Таблиця 7.20
Стандартні проекції та позиціювання датчика при УЗД ліктьового суглоба (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
| Загальні положення | Структури, що візуалізуються |
|
Ліктьовий суглоб, прилеглі м’якотканинні структури |
| Стандартні сканування | |
| 1. Переднє плечопроменеве поздовжне сканування | Суглобові поверхні плечової та променевої кісток, суглобовий хрящ, періартикулярні м’які тканини (в тому числі м’язові структури), суглобова порожнина.
Патологія, що виявляється Випіт у порожнині ліктьового суглоба з розширенням суглобової щілини, проліферація синовіальної оболонки, патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни) |
| 2. Переднє плечоліктьове поздовжнє сканування | Суглобові поверхні плечової та ліктьової кісток, processus coronoideus, суглобовий хрящ, періартикулярні м’які тканини (в тому числі м’язові структури), суглобова порожнина.
Патологія, що виявляється Випіт у порожнині ліктьового суглоба з розширенням суглобової щілини, проліферація синовіальної оболонки, патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни) та proc. coronoideus |
| 3. Переднє поперечне сканування | Дистальний епіфіз плечової кістки, гіаліновий суглобовий хрящ, періартикулярні м’які тканини (в тому числі м’язові структури).
Патологія, що виявляється Випіт у порожнині ліктьового суглоба з розширенням суглобової щілини, проліферація синовіальної оболонки, патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни) |
| 4. Заднє поздовжнє сканування | Оlecranon, fossa olecrani, частково — поверхня os humeri, m. triceps та місце його прикріплення до кістки.
Патологія, що виявляється Випіт у порожнині ліктьового суглоба з розширенням суглобової щілини, проліферація синовіальної оболонки, патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни), ентезопатія m. triceps |
| 5. Заднє поперечне сканування | Див. 4 |
| 6. Латеральне поздовжнє сканування при згинанні ліктьового суглоба на 90º | Частково — поверхня плечової та променевої кісток, сухожилля м’язів-розгиначів та місце прикріплення останніх до кісткової поверхні.
Патологія, що виявляється Патологія суглобових кісткових поверхонь (в тому числі ерозивні зміни), ентезопатії, тендосиновіт і порушення цілісності сухожиль |
Променезап’ясткові суглоби та дрібні суглоби кистей
Анатомічні дані
Променезап’ясткові суглоби (променева кістка з’єднується з проксимальним рядом кісток зап’ястя, це еліпсоподібне зчленування, що характеризується значною рухливістю. Нижній (дистальний) променеліктьовий суглоб разом з аналогічним верхнім (проксимальним) суглобом на рівні ліктя забезпечує супінацію і пронацію. Дистально цей суглоб відмежований трикутним фіброзно-хрящовим диском, що виконує роль своєрідної зв’язки та служить основним стабілізатором променезап’ясткового суглоба.
Сухожилля згиначів кисті проходять у єдиному сухожильному мішку, за винятком довгого згинача великого пальця, що зазвичай має власну піхву. На рівні зап’ястя ці сухожилля покриті утримуючою зв’язкою згиначів — retinaculum flexorum, що утворює так званий карпальний канал, у якому проходить також серединний нерв, а в медіальній частині є гуйонський канал, через який проходять ліктьові артерія та нерв. Долонна фасція проксимальним своїм відділом прикріплена до зв’язки згиначів, а дистальним — до глибокої поперечної зап’ястної зв’язки. Сухожилля м’язів-розгиначів з тилу зап’ястя покриті утримуючою зв’язкою розгиначів — retinaculum extensorum. Виняток становлять сухожилля м’язів короткого розгинача та довгого абдуктора великого пальця, які мають власний фіброзний канал в ділянці proc. styloideus променевої кістки.
П’ястково-фалангові суглоби та міжфалангові суглоби кистей — шарнірні зчленування. На долонній поверхні кисті положення п’ястково-фалангового суглоба проектується на дистальну долонну складку. В основі всіх проксимальних фаланг пальців є хрящові долонні пластинки/зв’язки, які від вказівного пальця до мізинця з’єднані між собою глибокою поперечною долонною зв’язкою зап’ястя. Аналогічні долонні пластинки є в основі середніх/дистальних фаланг пальців. Крім того, кожний п’ястково-фаланговий/міжфаланговий суглоб укріплений радіальною та ульнарною латеральними зв’язками.
П’ясткові кістки утворюють суглоби з дистальним рядом кісток зап’ястя. Серед них тільки суглоб між I п’ястковою кісткою та кісткою-трапецією, що належить до сідлоподібного типу суглобів, є рухливим, тоді як II і III зап’ястково-п’ясткові суглоби нерухомі, а IV і V — малорухомі. Міжзап’ястковий суглоб, що з’єднує дистальний ряд зап’ясткових кісток (кістка-трапеція, трапецієподібна, голівчаста, гачкоподібна) із проксимальним (човноподібна, напівмісячна, тригранна), є плоским і допускає лише мінімальний обсяг рухів. Він має окремий синовіальний простір, що часто сполучається з зап’ястково-п’ястковими суглобами.
На рис. 7.69 наведене поздовжнє позиціювання датчика для дослідження дрібних суглобів кистей. Ехографічна картина п’ястково-фалангових і проксимальних міжфалангових суглобів при ОА — на рис. 7.70. На рис. 7.70а показана нормальна УЗ-картина п’ястково-фалангового і проксимального міжфалангового суглобів ІІ пальця кисті. На рис. 7.70б–ж відзначаються УЗ-ознаки ОА п’ястково-фалангових і проксимальних міжфалангових суглобів пальців кистей, з наявністю синовіту цих суглобів (рис. 7.70в–е), звуження суглобових щілин (рис. 7.70б, в, д, є), наявністю розростань кісткових суглобових поверхонь — остеофітів (рис. 7.70б, е, є). На рис. 7.70ж представлена картина ерозивного ОА ІІ пальця кисті (видно ерозію (+) голівки п’ясткової кістки ІІ пальця, її розміри наведені праворуч).
Рис. 7.69. Позиціювання датчика (поздовжнє) для дослідження суглобів пальців
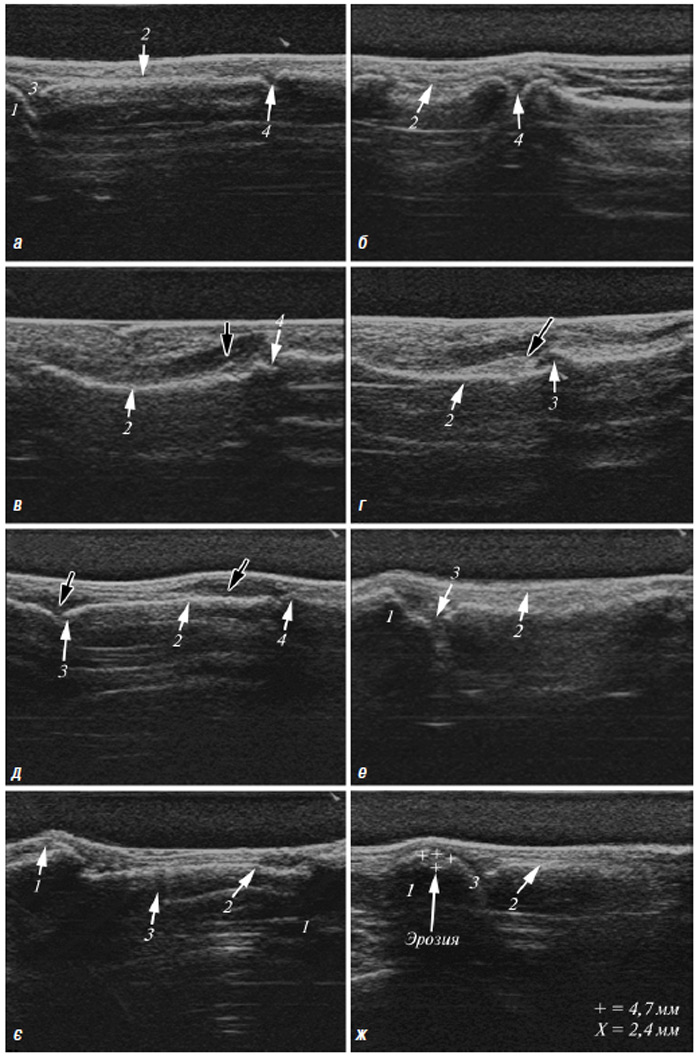
Рис. 7.70. УЗД п’ястково-фалангових і проксимальних міжфалангових суглобів кистей у нормі та при ОА (1 — голівка п’ясткової кістки; 2 — проксимальна фаланга; 3 — п’ястково-фаланговий суглоб; 4 — міжфалангові суглоби). Випіт зазначений чорними стрілками
Оцінка дрібних суглобів кистей та п’ястково-зап’ясткових суглобів
УЗД виконується при стандартних — подовжньому і поперечному — позиціюваннях датчика з дорзальної сторони кистей, причому суглоби знаходяться в положенні 20° долонного згинання для оцінки суглобової щілини і стану суглобового хряща (табл. 7.21).
Таблиця 7.21
Стандартні проекції та позиціювання датчика при УЗД дрібних суглобів кистей (за: Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005)
| Загальні положення | Структури, що візуалізуються |
|
Дрібні суглоби кистей, прилеглі м’які структури |
| Стандартні сканування | |
| 1. Дорзальне поздовжнє сканування
а) п’ястково-фалангові суглоби б) проксимальні міжфалангові суглоби в) дистальні міжфалангові суглоби |
Суглобові та періартикулярні структури п’ястково-фалангових суглобів, проксимальних та дистальних міжфалангових суглобів, поверхневі та глибокі сухожилля mm. flexor/extensores та їх оболонки з типовою «фібрилярною» ехо-структурою; прилеглі м’якотканинні структури, судини ділянки, що сканується (в тому числі mm. thenar, aa. proper. digit. palm.).
Патологія, що виявляється РА: ерозивні зміни суглобових кісткових поверхонь (в тому числі — у вигляді «втрати білої кортикальної лінії при УЗ-скануванні), гіпо-/анехогенне |
| 2. Дорзальне поперечне сканування
а) п’ястково-фалангові суглоби б) проксимальні міжфалангові суглоби |
|
| 3. Долоневе (пальмарне) поздовжнє сканування
а) п’ястково-фалангові суглоби б) проксимальні міжфалангові суглоби в) дистальні міжфалангові суглоби г) дистальні фаланги пальців |
розширення УЗ-суглобової щілини (з наявністю ехо«+» включень, часто рухомих при проведенні функціональних проб); проліферація синовіальної оболонки (при РА часто у вигляді гроноподібних розростань), патологічні зміни сухожиль м’язів-екстензорів/флексорів — розширення сухожильної оболонки, порушення типової структури сухожиль при поздовжньому та поперечному скануванні, наявність УЗ-«розриву» в типовій структурі |
| 4. Долоневее (пальмарне) поперечне сканування
а) п’ястково-фалангові суглоби б) проксимальні міжфалангові суглоби |
Сухожиль, гіпо-/анехогенна ділянка в проекції сухожилля, що сканується); ентезопатії сухожиль, що скануються; відкладення тофусів при мікрокристалічних артропатіях (перш за все, подагрі) у вигляді множинних«ехо+» включень, при тривалому перебігу захворювання чи вираженому запальному процесі — гомогенно гіпо-/анехогенних зон); зміни періартикулярних м’яких тканин (потовщення, зміни ехогенності, кальцинати м’яких тканин у вигляді дифузних/лінійчатих/точкових гіперехогенних включень у м’яких тканинах, перш за все у проекціях сухожиль, місцях прикріплення останніх до кісткової поверхні); синовіальні кісти, пухлини |
| 5. Поздовжнє сканування thenar | |
| 6. Поперечне сканування thenar | |
| 7. Латеральне поздовжнє сканування
а) п’ястково-фалангові суглоби |
|
На рис. 7.58 — УЗ-картина тендосиновіту розгиначів кисті у хворої на ОА (поперечне сканування). Видно наявність випоту в синовіальній піхві сухожиль. Для порівняння на рис. 7.59 представлена контралатеральна сторона у тієї ж хворої при тій же позиції датчика. Видно відсутність випоту в синовіальній піхві сухожиль.
Скронево-нижньощелепний суглоб
Скронево-нижньощелепний суглоб характеризується фіброзно-волокнистим хрящем, що покриває його суглобові поверхні, на відміну від інших синовіальних суглобів, які вкриті гіаліновим суглобовим хрящом. Діагностична значимість: часто уражується при захворюваннях опорно-рухового апарата, в тому числі ОА. УЗ-діагностика, в тому числі, диференційна, утруднена. Вдається виявити випіт у скронево-нижньощелепному суглобі та частково диференціювати гостре та хронічне запалення в суглобі.
Таким чином, УЗД має переваги перед традиційною рентгенографією для раннього виявлення локальних змін у суглобах і навколосуглобових м’яких тканинах хворих на ОА.
Наводимо приблизний протокол обстеження опорно-рухового апарату (програма «Ортопедія») і зразок УЗД при гонартрозі:
| Суглоб | |
| Суглобові компоненти | Опис |
| Суглобові співвідношення |
|
| Контури суглобових компонентів |
|
| Висота суглобового хряща |
|
| Суглобова щілина |
|
| Випіт |
|
| Синовіальна оболонка |
|
| Кровоток у синовії |
|
| Навколосуглобові м’які тканини | ………………….. |
| Висновок: | |
Приклад протоколу УЗД хворого з гонартрозом
Суглобові співвідношення збережені (порушені, втрачені), без деформації (сплощені, деформовані). Крайові кісткові розростання стегнової та великогомілкової кісток не визначаються (наявні до …мм, локалізація). Верхній заворіт не змінений (розширений, з наявністю надлишку однорідної чи неоднорідної рідини, синовіальна оболонка не візуалізується чи потовщена). Товщина гіалінового хряща в ділянці патело-феморального суглоба, латерального й медіального виростка в межах норми до 3 мм (зменшена, збільшена), рівномірна (нерівномірна), структура однорідна (з наявністю включень, опис). Контури субхондральної кістки не змінені (нерівні, з наявністю кіст, поверхневих дефектів, ерозій). Цілість чотириголового м’яза стегна та власної зв’язки надколінка не порушена, ligg. collaterales не змінені, цілість волокон збережена (УЗ-ознаки часткового ушкодження чи повного розриву). Передня хрестоподібна зв’язка не змінена (є ознаки кальцинації). Меніски (зовнішній, внутрішній) — структура однорідна, контури чіткі, рівні (УЗ-ознаки ушкодження — фрагментація, кальцинація тощо).
РАДІОІЗОТОПНА СЦИНТИГРАФІЯ
Радіоізотопна сцинтиграфія суглобів проводиться за допомогою остеотропних радіофармацевтичних препаратів (пірофосфат, фосфон, мічених 99mTc). Зазначені препарати інтенсивно накопичуються в місцях активного кісткового і колагенового метаболізму. Особливо інтенсивно вони накопичуються в запалених тканинах суглобів, що відображається на сцинтиграмах суглобів.
Метод радіоізотопної сцинтиграфії використовують для ранньої діагностики артритів, виявлення субклінічних фаз ураження суглобів, диференційної діагностики запальних і дистрофічних уражень.
Для ранньої діагностики патологічних змін у суглобах, виявлення реактивного запалення може бути використана сцинтиграфія скелета з пірофосфатом, міченим 99mTc (рис. 7.71). Гіперфіксація з дифузним розподілом радіоізотопу відзначається при наявності реактивного синовіту. У гіповаскулярних ділянках епіфізів кісток на сцинтиграмах у зонах ішемії визначається зниження накопичення радіофармпрепарату, тоді як у місцях посиленого кровопостачання, що відповідає ділянкам перебудови кістки, накопичення його рівномірно підвищено. При порівнянні даних сцинтиграфії з результатами внутрішньокісткової флебографії та вимірювань внутрішньокісткового тиску відзначено, що венозний стаз і підвищений тиск у кістковомозковому каналі поєднуються з аномально високим поглинанням радіофармпрепарату. При цьому ступінь поглинання його прямо пропорційний стадії дегенеративно-дистрофічного процесу. Аналіз розподілу радіонукліда при коксартрозі виявив підвищене накопичення міченої сполуки в зонах посиленого навантаження, в основному в стінках кіст і остеофітів, а також у зонах утворення нової кістки.
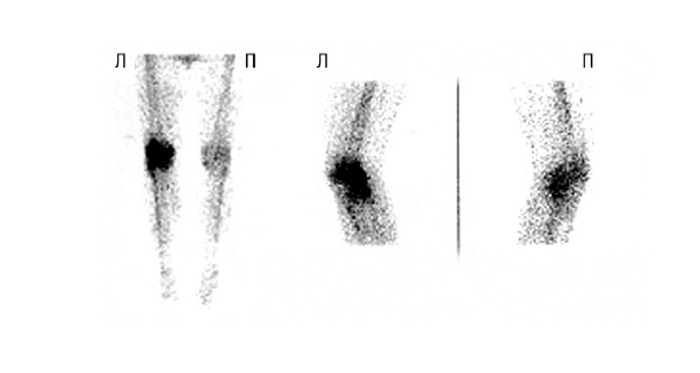
Рис. 7.71. Сцинтиграфія колінних суглобів з 99mTс. Гіперфіксація радіоізотопу у відділах зчленування стегнової та великогомілкової кісток, надколінка і м’яких тканинах лівої підколінної ділянки (Л — ліва, П — права)
ТЕРМОГРАФІЯ
У широкому розумінні слово «термографія» означає вироблену різними способами графічну реєстрацію теплового поля об’єктів, тобто поля їх інфрачервоного випромінювання (Карпужанский А.Л., 1979). Термограмою називають фіксоване двомірне зображення температурного поля частини або всього тіла обстежуваного (Розенфельд Л.Г. и соавт., 1988).
Термографія є допоміжним діагностичним тестом, який необхідно розшифрувати у єдиному зв’язку із клінічними, лабораторними, анамнестичними даними, отриманими відповідно до діагностичного алгоритму. На думку Л.Г. Розенфельда та співавторів (1988), основні переваги термографії:
- Абсолютна безпека. Організм людини не зазнає ні опромінення, ні ушкодження. Можливо багаторазове дослідження того самого суб’єкта.
- Швидкість дослідження. Залежно від типу термографа потрібно від 1/16 хв до 4 хв. Час, необхідний для врівноваження температури шкіри хворого та навколишнього повітря (15 хв), можна суттєво скоротити при відповідному оснащенні кабінету термографії.
- Висока точність. Мінімальний градієнт температури, що реєструється між двома точками на відстані 1 мм, становить 0,1 °С. Така точність дозволяє здійснити попередню топічну діагностику вогнища ураження.
- Можливість вибору послідовності безпечних дослідницьких процедур для жінок у період вагітності та дітей.
- Можливість одночасної оцінки функціонального стану кількох систем організму (при оглядовій термографії).
Важливим моментом точного виконання термографії є правильне оснащення кабінету, а також підготовка пацієнта до дослідження. У кабінеті мають бути створені умови для стабілізації впливу факторів зовнішнього середовища на термодіагностичну апаратуру і пацієнта. Для цього двері й вікна завішують щільними світлозахисними шторами. Можливі джерела інфрачервоного випромінювання (батареї центрального опалення) екранують. В оглядовому приміщенні рекомендується підтримувати температуру 22±1 °С, оскільки при більш високій спостерігається зниження контрастності термограм, а при більш низькій температурі у пацієнтів розвивається вазоконстрикція, що різко знижує інформативність методу (Howell K.J., 1998). Відносна вологість повітря у приміщеннях кабінету має бути в межах 40–70%. Швидкість руху повітряних потоків у приміщенні не повинна перевищувати 0,15–0,2 м/с. Цим вимогам відповідає закрите приміщення, обладнане кондиціонером (Мельникова В.П., Суханова В.Ф., 1982).
При захворюваннях суглобів різної локалізації слід дотримуватися таких правил підготовки пацієнта до термографічного обстеження:
А. Верхні кінцівки:
- Руки повинні бути чистими, лак з нігтів слід зняти.
- Протягом доби перед обстеженням не застосовують креми, не приймають фізіотерапевтичні процедури, судинорозширювальні або судинозвужувальні засоби.
- При обстеженні руки звільняють від одягу і вкладають на столик-підставку.
Б. Нижні кінцівки:
- Ноги звільняють від будь-яких пов’язок, компресів і оголюють для адаптації шкіри до температури приміщення.
- Протягом доби перед обстеженням не приймають лікарських засобів і не проводять фізіотерапевтичних процедур.
- Напередодні ввечері необхідно зробити ванну для ніг з метою зняття шкірного сала і епідермісу, що відшарувався; лак з нігтів зняти.
- Обстеження пацієнта проводять у положенні лежачи на спині, рідше — у положенні стоячи.
Дослідженню має передувати період температурної адаптації, який у дорослого становить 10–15 хв. У зв’язку з тим, що температурні показники організму людину змінюються протягом доби кожні 3–4 год із коливаннями 0,2–0,4 °С, порівняльні (динамічні) дослідження рекомендується здійснювати в ті самі години. Також необхідно враховувати, що максимальна температура тіла у здорових людей відзначається о 15–16 год.
Правильна інтерпретація термограм потребує знань із загальної фізіології, анатомії та спеціальних галузей медицини. В нормі у здорової людини існують зони гіпер- і гіпотермії, зумовлені рядом причин. Поява зон гіпертермії може бути викликана:
- підвищеним обміном речовин у цьому органі або тканині в певний проміжок часу (наприклад молочні залози в період лактації);
- «порожнинним ефектом» (ділянки орбіт, пупка, міжсіднична складка, пахвові, пахвинні ділянки, міжпальцьові проміжки, медіальні поверхні зведених разом нижніх або верхніх кінцівок, щільно притиснутих до тіла).
Деякі топографічні особливості нормальних термограмм
Спина і хребет на термограмах представлені гомогенною термотопографією при наявності незначної гіпертермії в серединній частині поперекової ділянки. Іноді спостерігається помірна гіпертермія міжлопаткового простору.
На термограмі спини можна виділити 4 постійні зони гіпертермії (Лихтерман Л.Б., 1983):
- у проекції остистих відростків, починаючи з рівня средньогрудного відділу хребетного стовпа; ширина першої зони дещо більша в нижньогрудному і верхньопоперековому відділах порівняно з нижньопоперековим;
- у проекції міжсідничної складки;
- дві симетричні зони в проекції крижово-клубових зчленувань (латеральніше і дещо вище міжсідничної складки);
- у проекції нирок (симетрично розташовані ділянки гіпертермії нерівномірної інтенсивності).
Попереково-крижовий корінцевий синдром призводить до зниження температури шкіри ноги в зоні іннервації цього корінця на 0,7–0,9 °С з одночасною легкою гіпертермією сегмента на рівні відповідних сполучних гілок симпатичного стовбура. Блокада прокаїном ураженого корінця нормалізує температуру поверхні адекватного дерматому кінцівки і знижує температуру сегмента в попереково-крижовій ділянці на 0,2–0,3 °С. Через 10–12 хв після завершення прокаїнової чи тримекаїнової блокади поперекових симпатичних вузлів підвищується температура шкіри стопи і гомілки відповідної сторони на 0,7—0,9 °С, що зберігається протягом 2—3 хв (Розенфельд Л.Г. и соавт., 1988).
Середня температура шкіри в ділянці спини й хребта — 33,5–34,2 °С (Розенфельд Л.Г. и соавт., 1988).
Верхні кінцівки. Термографічне зображення обох верхніх кінцівок характеризується симетричністю, хоча за даними Г.М. Фролова та співавторів (1979), відзначається незначна термоасиметрія верхніх кінцівок, викликана переважним розвитком правої чи лівої кінцівки або різницею артеріального тиску.
Зони гіпертермії на термограмах верхніх кінцівок у нормі визначаються в ділянці проходження судинних пучків — внутрішня поверхня плеча, ліктьового суглоба, передпліччя, пахвова ділянка. Відносна гіпотермія характерна для зовнішньої поверхні плеча і передпліччя, пальців (порівняно з долонями). У ділянці І пальця кисті, міжпальцьових проміжків, по ходу великих вен на тильному боці кисті відзначається помірна гіпертермія (Лихтерман Л.Б., 1983). Середня температура шкіри в ділянці верхніх кінцівок (крім пальців) — 31,2–32,6 °С, пальців кистей — 27,2–28,6 °С (Розенфельд Л.Г., 1988).
Нижні кінцівки. Термографічне зображення обох нижніх кінцівок також симетричне. У верхній і середній третинах гомілок визначаються зони вираженої гіпертермії, тоді як у ділянці колінного суглоба, нижній третині гомілки і стопи відзначаються ділянки гіпотермії.
На термограмах тильної поверхні стоп реєструється гетерогенна картина з тенденцією до зменшення гіпертермії зверху вниз — у ділянці пальців визначається зона гіпотермії. На підошовній поверхні стоп інтенсивність гіпертермії більш виражена вздовж медіального краю, особливо в проекції склепіння стопи. По латеральному краю і в ділянці пальців реєструються зони гіпотермії.
На задній поверхні стегон визначаються зона вираженої гіпотермії в проекції сідниць і зона гіпертермії у верхній третині стегон, підколінній ямці, верхній третині гомілок. Для гомілок характерна тенденція до зменшення інтенсивності гіпертермії в дистальному напрямку. Над ахілловим сухожиллям визначається зона гіпотермії. Середнє значення температури шкірного покриву в ділянці нижніх кінцівок (крім пальців стопи) — 32,1–32,4 °С, пальців стопи — 23,3–23,9 °С (Розенфельд Л.Г., 1988).
Аналіз і обробка термограм проводиться за такими термографічними ознаками (Розенфельд Л.Г., 1988):
- виявлення термоасиметрії;
- вивчення площі асиметричної ділянки (зони гіпо- чи гіпертермії): розміри, ступінь однорідності, характеристика границь тощо;
- визначення температурного градієнта і обчислення його коефіцієнта, що виражає відношення різниці температури між точками й відстані між ними;
- визначення максимальної, мінімальної та середньої абсолютної температури симетричних ділянок;
- визначення термографічного індексу (ТІ) — це відношення суми температур, що відповідають кожному ізотермічному полю, до загальної площі зони патологічної термоасиметрії:
ТІ = ε (ΔТ °С·а) / А,
де ε — сума температур, що відповідають кожному ізотермічному полю; ΔТ — різниця між температурою кожного температурного градієнта і стандартом, відповідним до середньої температури цієї ділянки поверхні тіла людини; а — виявлена температура кожного градієнта; А — загальна площа зони патологічної термоасиметрії.
У нормі термографічний індекс знаходиться у межах 4,62―4,94, і становить в середньому 4,87 (Collins A. et al., 1974).
За даними Н.К. Тернового та співавторів (1988), при ОА І рентгенологічної стадії за Н.С. Косинським спостерігаються термоасиметрія суглобів, зона гіпотермії над ділянкою суглоба, що поступово переходить у зону гіпертермії вище й нижче розташованих сегментів кінцівки. Градієнт температур у зоні гіпотермії становить 0,6±0,2 °С.
На термограмах хворих на ОА ІІ–ІІІ стадії спостерігаються термоасиметрія, зона гіпертермії над ураженим суглобом різного рельєфу й ступеня вираженості, що свідчить про гіперваскуляризацію суглоба й асептичне запалення в синовіальній оболонці суглоба і параартикулярній клітковині. Градієнт температур патологічно зміненого суглоба становить 1±0,2 °С.
У разі ефективного лікування термограма характеризується зменшенням температурної асиметрії, зниженням інтенсивності гіпертермії, градієнт температур падає до 0,4–0,8 °С.
В Українському ревматологічному центрі нами проведене дослідження зв’язку між даними дистанційної комп’ютерної термографії (ДКТ), рентгенографії та УЗД колінних суглобів, уражених ОА.
У дослідженні брали участь 62 хворих на ОА колінних суглобів, що відповідають класифікаційним критеріям ACR (1986), з них 43 (69,4%) — жінки, 19 (30,6%) — чоловіки віком 47―69 років (у середньому — 57,4±6,2 року), тривалість хвороби яких становила від 1,5 до 12 років (в средньому — 5,6±2,6 року). Моноартикулярне ураження колінних суглобів виявлено у 44 (71%) пацієнтів, двобічне — у 18 (29%), у такий спосіб загалом було обстежено 80 колінних суглобів у пацієнтів основної групи. I рентгенологічну стадію за класифікацією Келлгрена — Лоуренса діагностували у 23 (28,8%), II — у 32 (40%), III — у 19 (23,8%) і IV — у 6 (7,4%) хворих. Для порівняння використовували 54 рентгенограми колінних суглобів 27 осіб, що становили контрольну групу, у яких в анамнезі відсутні дані про травматичне чи будь-яке інше ураження колінних суглобів, а також судин, м’яких тканин, кісток та інших суглобів нижніх кінцівок. Серед 27 осіб контрольної групи було 18 (66,7%) жінок і 9 (33,3%) — чоловіків віком 31–53 років (у середньому — 41,5±4,9 року).
Рентгенографію колінних суглобів виконували у передньозадній проекції за стандартною методикою. Градацію рентгенологічних критеріїв ОА від 0 до 3 ступеня (зниження висоти суглобової щілини і остеофітоз) здійснювали з використанням Атласу градацій ОА колінних суглобів Y. Nagaosa та співавторів (2000).
При проведенні ДКТ за допомогою тепловізора «Веселка-1» використовували рекомендації Л.Г. Розенфельда (1988). На термограмі колінного суглоба вибирали дві симетричні ділянки розміром 35х35 мм, які відповідали медіальній та латеральній частинам ТФВ колінного суглоба (ТФКС), де визначали середню температуру. Для математичної обробки результатів ДКТ визначали показник градієнта температур за формулою:
ΔТм = Тм — Трм і ΔТл = Тл — Трл,
де ΔТ — градієнт температур, Тм і Тл — температури ділянок у проекції медіальної та латеральної ділянок ТФКС, Трм і Трл — референтні значення температур ділянок у проекції медіальної та латеральної ділянок ТФКС, отримані при обстеженні здорових осіб контрольної групи.
Всім обстеженим особам проведено УЗД колінних суглобів на апараті «SONOLINE Omnia (Siemens)» з лінійним датчиком 7,5L70 (частота — 7,5 Мгц) у режимі «ortho» у стандартних позиціях (Backhaus M. et al., 2001). Оцінювали стан кісткових суглобових поверхонь (включаючи наявність «розпушення» кортикального шару і його дефектів), суглобових щілин, навколосуглобових м’яких тканин, наявність випоту, змін зв’язкового апарату та деякі інші параметри.
У хворих основної групи вивчали також клінічні ознаки суглобового синдрому. З цією метою використовували альгофункціональний індекс Лекена тяжкості гонартрозу (Lequesne M., 1997), який визначали за характером больового синдрому (час виникнення, максимальна дистанція ходи без болю), тривалості ранкової скутості тощо. Ступінь тяжкості гонатрозу кодували в балах (1–4 — слабкий, 5–7 — середній, 8–10 — виражений, 11–13 — значно виражений, більше 14 — різко виражений). Інтенсивність больового синдрому оцінювали з використанням ВАШ болю (Huskisson E.C., 1982), де відсутність болю відповідає 0 мм, а максимальний біль — 100 мм.
Статистичний аналіз отриманих результатів проводили за допомогою комп’ютерної програми STATGRAPHICS plus v.3. При проведенні кореляційного аналізу коефіцієнт кореляції r<0,37 свідчив про наявність слабкого, 0,37≤r<0,05 — помірного, 0,5≤r<0,7 — значного, 0,7≤r<0,9 — сильного і r ≥0,9 — дуже сильного зв’язку. Значення р<0,05 вважали достовірним.
Клінічне обстеження пацієнтів виявило слабкий ступінь тяжкості гонартрозу в 8 (12,9%), середній —13 (20,9%), виражений —21 (33,9%), значно виражений —15 (24,2%), різко виражений —5 (8,1%) хворих. Дев’ять (14,5%) пацієнтів не скаржилися на біль в уражених суглобах, інші 53 (85,5%) — оцінили інтенсивність болю за ВАШ від 5 до 85 мм. Обмеження обсягу руху від 75 до 125° виявлено у 38 (61,2%), збільшення обсягу розгинання — від 5 до 20° — у 19 (30,6%) хворих (табл. 7.22).
Таблиця 7.22
Клінічна характеристика суглобового синдрому в обстежених хворих на ОА
| Показник | М±σ |
| Альгофункціональний індекс Лекена | 8,87±3,9 |
| ВАШ болю, мм | 35,48±23,3 |
| Обсяг згинання, ° (в нормі 130–150°) | 128,15±20 |
| Обсяг розгинання, ° (в нормі 0°) | 3,23±5,7 |
Вивчення термограм колінних суглобів у обстежених хворих на ОА показало, що в середньому ДТм дорівнював 0,69±0,26 °С, а ДТл — 0,63±0,26 °С (р=0,061). Кореляційний аналіз виявив статистично значимий зв’язок між ДТм і всіма досліджуваними клінічними показниками, а також між ДТл і Альгофункціональним індексом Лекена, ВАШ болю і обсягом згинання (табл. 7.23).
Таблиця 7.23
Зв’язок між клінічною характеристикою суглобового синдрому за даними ДКТ у хворих на ОА
| Клінічні показники суглобового синдрому | ΔТм | ΔТл | ||
| r | p | r | p | |
| Альгофункціональний індекс Лекена | 0,71 | <0,0001 | 0,54 | 0,002 |
| ВАШ болю, мм | 0,65 | 0,0001 | 0,48 | 0,007 |
| Обсяг згинання, ° | –0,52 | 0,003 | –0,49 | 0,006 |
| Обсяг розгинання, ° | 0,38 | 0,04 | 0,34 | 0,07 |
При проведенні кореляційного аналізу виявлена наявність статистично істотного прямого зв’язку між градієнтом температур у медіальному ТФКС і звуженням РСЩ у медіальній ділянці, а також остеофітозом у медіальній та латеральній ділянках, в той час як градієнт температур латерального ТФКС корелював зі звуженням РСЩ і остеофітозом лише в латеральному ТФКС (табл. 7.24).
Таблиця 7.24
Зіставлення результатів ДКТ (градієнта температур) і рентгенографії
| Рентгенологічні критерії ОА | ΔТм | ΔТл | ||
| r | p | r | p | |
| Звуження РСЩ у медіальній ділянці ТФКС | 0,57 | 0,001 | 0,19 | 0,32 |
| Звуження РСЩ у латеральній ділянці ТФКС | 0,09 | 0,61 | 0,45 | 0,011 |
| Остеофітоз у медіальній ділянці ТФКС | 0,6 | 0,0005 | 0,35 | 0,06 |
| Остеофітоз у латеральній ділянці ТФКС | 0,37 | 0,04 | 0,5 | 0,005 |
За даними УЗД у хворих на ОА виявили звуження РСЩ за рахунок зменшення висоти суглобового хряща (поперечна позиція датчика), кісткові розростання (остеофіти) і/або дефекти суглобової поверхні кісток, зміну синовіальної мембрани і наявність випоту в суглобі, зміна параартикулярних м’яких тканин (всі позиції). Зміни поверхонь кортикального шару суглобової поверхні кісток (нерівність, формування дефектів поверхні) реєстрували вже на початкових стадіях хвороби (I стадія) і досягали максимальної вираженості при III–IV стадії.
Випіт у суглобі реєстрували у 28 (45,16%) хворих, переважно при II і III стадії ОА, який в основному локалізувався у верхньому завороті (32,3% хворих у латеральній ділянці РСЩ (17,7%), рідше — у медіальній (9,7%) і в задньому завороті (3,2%). Випіт мав гомогенну анехогену ехоструктуру за умови клінічної симптоматики тривалістю до 1 міс, а у хворих із клінічними ознаками персистуючого запалення — негомогенну із включеннями різного розміру і ехощільності. Товщина синовіальної оболонки була збільшеною у 24 (38,7%) хворих, а нерівномірне її потовщення реєстрували в 14 із них. Середня тривалість захворювання в цій групі була більшою, ніж загалом (6,7±2, 4 року), причому у хворих з нерівномірним потовщенням синовіальної оболонки вона була ще більшою (7,1±1,9 року). Таким чином, особливості синовіту відображали тривалість хвороби й гостроту перебігу на момент обстеження. Заслуговують на увагу дані порівняння результатів ДКТ і УЗД (табл. 7.25).
Таблиця 7.25
Зіставлення результатів ДКТ (градієнта температур) і УЗД
| УЗД-критерії ОА | ΔТм | ΔТл | ||
| r | p | r | p | |
| Зменшення висоти суглобового хряща (поперечна позиція) | 0,63 | 0,0002 | 0,3 | 0,10 |
| Наявність випоту в суглобі | 0,91 | <0,00001 | 0,89 | <0,00001 |
| Потовщення синовіальної оболонки | 0,82 | <0,00001 | 0,7 | <0,0001 |
| Кісткові розростання в медіальній ділянці | 0,61 | 0,003 | 0,65 | 0,0001 |
| Кісткові розростання в латеральній ділянці | 0,37 | 0,04 | 0,51 | 0,004 |
Сильний або дуже сильний прямий зв’язок за даними кореляційного аналізу (див. табл. 7.23) відзначається між градієнтом температур у медіальному і латеральному ТФКС, з одного боку, і випотом у суглоб та потовщенням синовіальної оболонки за даними УЗД — з іншого. Більш слабкий зв’язок виявлено між наявністю кісткових розростань у медіальній ділянці ТФКС (дані УЗД) і градієнтом температур у всіх досліджуваних ділянках суглоба.
Таким чином, виявлено кореляційний зв’язок між даними ДКТ, з одного боку, і клінічною характеристикою суглобового синдрому у обстежених пацієнтів із ОА, рентгенологічною стадією хвороби і результатами УЗД — з іншого. Отримані дані свідчать про доцільність використання комплексу інструментальних діагностичних методів, які включають рентгенографію, ДКТ і УЗД, що забезпечує більший обсяг інформації про стан не тільки внутрішньосуглобових, але й позасуглобових тканин.