ПРИНЦИПИ ДОКАЗОВОЇ МЕДИЦИНИ В ІНТЕРВЕНЦІЙНІЙ КАРДІОЛОГІЇ
Принципи доказової медицини розроблені для того, щоб лікарі вибираючи той чи інший метод лікування конкретного хворого, використовували найбільш об’єктивні сучасні докази ефективності та безпеки обраного методу. Такі докази одержують на основі аналізу результатів різних наукових досліджень. Зрозуміло, що якість доказів, одержаних у конкретному дослідженні (рівень доказовості результатів дослідження), залежить як від якості проведення дослідження, так і від якості аналізу результатів цього дослідження.
Наукові дослідження, в яких визначається ефективність та безпека препарату або способу лікування, можуть бути різними за величиною (кількістю хворих, що ввійшли в дослідження), критеріями відбору хворих, методами дослідження, що проводиться, термінами його проведення, а також за способом оцінки результатів дослідження.
Кількість хворих, що включені в дослідження, може варіюватися від кількох десятків до кількох тисяч; дослідження можуть проводиться як в одному, так і в декількох наукових центрах, що знаходяться в різних країнах. У найбільших дослідженнях (мегадослідженнях) зазвичай беруть участь від десяти тисяч хворих і більше. Результати таких досліджень є основою для застосування (або незастосування) тих чи інших препаратів (способів лікування) в клінічній практиці. Мегадослідження, на відміну від досліджень серед невеликих груп хворих, дозволяють виявити навіть незначний позитивний ефект досліджуваного препарату або способу лікування, оскільки на результати таких досліджень надзвичайно мало впливають спонтанні коливання в динаміці обраних показників. На результати мегадосліджень не впливає гетерогенність груп відібраних у дослідження хворих, що зазвичай наявна, не дивлячись на критерії включення хворих у дослідження (наприклад відмінність пацієнтів за стадіями захворювання).
Для одержання доказів ефективності та безпеки лікарських засобів та способів лікування також застосовується методика метааналізу результатів, що отримані в ході декількох контрольованих досліджень, присвячених одній проблемі. Завданням метааналізу є об’єднання та оцінка результатів цих досліджень. Для проведення якісного метааналізу необхідно, щоб усі дослідження, які включені до нього, мали схожі протоколи та кінцеві точки. Результати метааналізу, як правило, підтверджуються результатами мегадослідження, хоча є випадки їх невідповідності. Це зумовлено високою гетерогенністю груп хворих, що входять до різних досліджень, кінцевими точками у малих дослідженнях, які не завжди співпадають, різною кількістю пацієнтів, що входять у досліджувану та контрольну групи (наприклад в одних дослідженнях контрольними групами є як група плацебо, так і група осіб, що одержує ефективний препарат порівняння, в інших — тільки одна з цих груп), та іншими подібними факторами. Крім того, для високої доказовості метааналізу необхідна висока статистична достовірність відмінностей між порівнюваними групами (p<0,001). Не дивлячись на це, доказовість метааналізу є високою.
Доказовість досліджень, порівняно невеликих за обсягом, також може бути високою в тому випадку, якщо протокол і проведення дослідження відповідають сучасним міжнародним вимогам. Ці вимоги визначені в документах GCP (Good Clinical Practice).
Відповідно до вимог GCP наукове дослідження нового препарату або способу лікування повинно бути контрольованим.
Контрольоване дослідження повинне включати наступні етапи:
- етап відбору хворих;
- контрольний період (відсутність у призначеннях досліджуваного препарату та препаратів подібної дії);
- етап рандомізації хворих за групами.
Без контрольного періоду та періоду рандомізації дослідження не може вважатися контрольованим, оскільки недотримання цих умов не забезпечує об’єктивності дослідження.
Далі йде період застосування досліджуваного препарату (у досліджуваній групі) та препарату порівняння (у контрольній групі). У багатьох дослідженнях участникам контрольної групи замість препарату порівняння призначається плацебо (пустушка, від латинського placebo — доставляти задоволення). Призначення плацебо дозволяє відрізнити об’єктивний ефект лікування як від психологічно зумовленого ефекту, так і від спонтанних ремісій у ході перебігу захворювання.
Метод застосування як досліджуваного препарату, так і препарату порівняння (або плацебо) може бути сліпим або подвійним сліпим. При сліпому методі хворий не знає, який препарат приймає; при подвійному сліпому — не знає ні хворий, ні дослідник. Результати подвійного сліпого дослідження мають найбільшу об’єктивність.
На рівень доказовості дослідження, крім дотримання вимог до його контрольованості, впливає правильність оцінки його результатів. Результати дослідження оцінюють на основі порівняння досягнутих кінцевих точок у групах дослідження та контролю. Під терміном «кінцеві точки» розуміють критерії результату захворювання. По мірі зменшення їх значимості кінцеві точки поділяються на первинні, вторинні та третинні. До первинних кінцевих точок належать такі показники, як загальна смертність, смертність від серцево-судинних захворювань (ІМ та інсультів). До вторинних кінцевих точок належать серцево-судинні захворювання, які не призвели до смерті (нефатальні ІМ та інсульти). До третинних кінцевих точок належать показники, які безпосередньо не впливають на тривалість життя та її якість, проте здатні впливати на фактори ризику розвитку захворювань, наприклад АГ, гіперхолестеринемії. Існує таке поняття, як «сурогатні кінцеві точки» — сумарні показники результату захворювання, наприклад загальна смертність + смертність від серцево-судинних захворювань + нефатальні ІМ. На сьогодні в більшості досліджень, у яких розглядається ефективність та безпека ПКВ, проводиться оцінка результатів за критерієм MACE (Major Adverse Cardiac Events — тяжкі побічні реакції з боку серця). У це поняття включені такі показники, як смертність від серцево-судинних захворювань, не-фатальні ІМ, необхідність повторної реваскуляризації міокарда.
На основі результатів проведених досліджень формуються та видаються рекомендації з лікування різних захворювань (наприклад рекомендації щодо ведення хворих зі стабільною стенокардією, рекомендації щодо ведення хворих з гострим коронарним синдромом). Рекомендації також можуть бути присвячені застосуванню певного способу лікування при певній патології (наприклад рекомендації щодо проведення ПКВ при різних клінічних формах коронарного атеросклерозу).
Для створення подібних документів існують комітети по розробці практичних рекомендацій при великих наукових товариствах (транснаціональних, континентальних), таких як ACC і AHA в США, European Society of Cardiology (Європейське кардіологічне товариство — ESC) у Європі. Із провідних фахівців цієї гілки формується робоча група — група авторів рекомендацій, що розробляються.
У 2005 р. Європейським кардіологічним товариством видано рекомендації щодо проведення ПКВ. У цьому документі розглянуті показання до ПКВ при стабільному перебігу ІХС та гострого коронарного синдрому, допоміжне лікування при ПКВ. Надані рекомендації щодо застосування додаткових технологій ПКВ; в окремій главі розглянуті можливості імплантації елютинг-тестів.
Під час роботи над рекомендаціями з ПКВ робоча група взяла за основу результати досліджень, які були або опубліковані на момент створення рекомендацій, або представлені на великих кардіологічних конференціях.
Нижче наведені ті основні дослідження, на результати яких посилається Європейське кардіологічне товариство в рекомендаціях щодо проведення ПКВ.
ПКВ при стабільній стенокардії: ACME, ACIP, BENESTENT I, STRESS, SAVED, AWESOME, RITA-2.
ПКВ при гострих коронарних синдромах без елевації сегмента ST: FRISC II, TACTICS-TIMI 18, RITA-3, ISAR-COOL.
ПКВ при гострих коронарних синдромах з елевацією сегмента ST: PAMI, Stent-PAMI, GUSTO IIb, C-PORT, PRAGUE 1, 2, DANAMI 2, STOPAMI 1, 2.
Ефективність стентування (порівняно з балонною ангіопластикою): Stent-PAMI, CADILLAC.
Елютинг-стенти: RAVEL, SIRIUS, TAXUS IV, TAXUS VI.
Метааналізи: RESCUE I, II.
ACME (Angioplasty Compared to MEdicine)
Мета: порівняти результати медикаментозного та інтервенційного (ПКВ) лікування пацієнтів з коронарною хворобою при наявності односудинного ураження за період 6-місячного спостереження.
Дослідження: одноцентрове рандомізоване.
Популяція хворих: пацієнти із стабільною стенокардією або недавно перенесеним ІМ, з поодиноким стенозом >70% у проксимальному сегменті однієї із коронарних артерій, при наявності депресії ST >1 мм під час тестування з фізичним навантаженням або виявлених оборотних дефектів за допомогою перфузійної сцинтиграфії.
Період спостереження: 6 міс.
Кінцеві точки: підвищення толерантності до фізичного навантаження; зменшення нападів стенокардії.
Висновки: при односудинному ураженні виконання балонної ангіопластики порівняно з медикаментозним лікуванням достовірно знижує інтенсивність нападів стенокардії та підвищує толерантність до фізичного навантаження.
ACIP (Asymptomatic Cardiac Ischemia Pilot study)
Мета: визначити, чи може активне медикаментозне лікування порівняно з реваскуляризацією покращити результати захворювання у пацієнтів з ІХС за даними стрес-тестів та амбулаторного моніторування ЕКГ.
Дослідження: багатоцентрове подвійне сліпе плацебо-контрольоване рандомізоване.
Популяція хворих: клінічно стабільні хворі з ішемією, що виявляються за допомогою стрес-тесту або 48-годинного моніторування ЕКГ. Коронарна анатомія, що підходить для процедури реваскуляризації: односудинна (і більше) коронарна хвороба при наявності стенозів >50% (без ураження стовбура лівої коронарної артерії).
Період спостереження: 2 роки.
Кінцеві точки: загальна кількість смертей + нефатальні ІМ + випадки повторної госпіталізації (включаючи непротокольні реваскуляризації).
Висновки: стратегія первинної реваскуляризації порівняно з медикаментозним лікуванням дозволяє покращити прогноз у визначеної популяції пацієнтів з ІХС та німою ішемією.
BENESTENT I (BElgian NEtherlands STENT I)
Мета: порівняти ефективність та безпеку коронарного стентування і балонної ангіопластики.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти зі стабільною стенокардією, відібрані для ангіопластики, у яких були поодинокі ураження протяжністю <15 мм, розміщені в судинах діаметром >3,0 мм.
Період спостереження: 6 міс.
Кінцеві точки: клінічні — загальна кількість смертей + нефатальні ІМ + випадки повторної ре-васкуляризації + цереброваскулярні ускладнення. Ангіографічні — мінімальний діаметр просвіту; бінарний рівень рестенозів (звуження судини >50%).
Висновки: клінічні та ангіографічні результати були кращими у хворих, яким проводилося стентування, порівняно із хворими, яким проводилася стандартна балонна ангіопластика.
STRESS (Stent Restenosis Study)
Мета: порівняти ефективність стентування та балонної ангіопластики за клінічними результатами та кількістю рестенозів, визначених ангіографічно.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти із стабільною стенокардією, що відібрані для ангіопластики, у яких були поодинокі ураження протяжністю <15 мм, розміщені у судинах діаметром >3,0 мм.
Кінцеві точки: ангіографічні — бінарний рівень рестенозів (звуження судини >50%), мінімальний діаметр просвіту. Клінічні — успішне виконання процедури (залишковий стеноз <50% при відсутності внутрішньолікарняних ускладнень); загальна кількість смертей + нефатальні ІМ + повторна реваскуляризація судини протягом 7-місячного спостережения.
Висновки: імплантація стентів порівняно з балонною ангіопластикою підвищує рівень успішного проведення процедури, знижує рівень рестенозів, визначених ангіографічно, зменшує кількість клінічно несприятливих результатів.
SAVED (Saphenous Vein Graft De Novo)
Мета: порівняти клінічні та ангіографічні результати стентування та балонної ангіопластики при обструкції венозних шунтів.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти, у яких знову виникли ураження у венозних шунтах, що проявляється стенокардією та/або об’єктивними ознаками ішемії міокарда. Звуження просвіту >60%. Діаметр судини — 3–5 мм.
Кінцеві точки: первинні — бінарні рестенози (звуження просвіту >50%), що виявлені на ангіограмах протягом 6-місячного спостереження. Виживаність без ускладнень (смерть, ІМ, повторна реваскуляризація в шунті) протягом 240-добового спостереження. Вторинні — ефективність виконаної процедури (діаметр стеноза <50% + відсутність внутрішньолікарняних ускладнень).
Висновки: стентування обструкцій у венозних шунтах порівняно з балонною ангіопластикою призводить до кращих результатів процедури та зменшує кількість кардіальних ускладнень. За кількістю рестенозів достовірної різниці між групами хворих не виявлено.
AWESOME (Angina With Extremely Serious Operative Mortality Evaluation, n=2431; randomized 454)
Мета: порівняти коротко- і довгострокові результати ПКВ та коронарного шунтування у хворих з медикаментозною зворотною кардіальною ішемією та високим ризиком несприятливих результатів захворювання.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з медикаментозною зворотною ішемією та не менше ніж одним із факторів ризику несприятливого результату захворювання при коронарному шунтуванні, до яких відносять перенесені раніше операції на відкритому серці, вік >70 років, ФВ <35%, ІМ у межах 7 днів до втручання та балонна контрпульсація, що проводилася раніше.
Спостереження: 30 днів; 3 роки.
Кінцева точка: показники виживаності.
Висновки: перкутанна коронарна інтервенція є хорошою альтернативою коронарному шунтуванню для хворих з медикаментозною рефрактерною кардіальною ішемією та високим ризиком несприятливих результатів
RITA-2 (Randomised Intervention Treatment of Angina, n=1018)
Мета: порівняти довгострокові результати медикаментозної терапії і ПКВ у хворих, у яких можливе проведення обох видів лікування.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з ІХС, що підтверждена ангіографічно, які мають поодинокий стеноз діаметром >70% або багатосудинну хворобу, при якій можливе виконання ПКВ або проведення медикаментозної терапії.
Спостереження: у середньому — 2,7 року.
Кінцеві точки: сумарна кількість смертей та нефатальних ІМ.
Висновки: виконання ПКВ призводить до більш вираженого зменшенню симптоматики. При виконанні ПКВ є незначне підвищення ризику розвитку нефатальних ІМ та смертей, що викликане ускладненнями, пов’язаними з процедурою.
FRISC II (Fast Revascularization during Instability in Coronary Artery Disease)
Мета: порівняти клінічну ефективність раннього інвазивного та неінвазивного видів лікування хворих з гострим коронарним синдромом без елевації сегмента ST.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з нестабільною стенокардією, у яких визначається депресія сегмента ST не менше 1 мм/інверсія зубця T та/або підвищення рівня МВ фракції (серцевої) КФК/позитивний тест на тропонін T.
Кінцеві точки: кількість смертей, ІМ, повторних госпіталізацій, необхідність реваскуляризації після первинних госпіталізацій.
Висновки: раннє інвазивне лікування достовірно зменшує кількість смертей, ІМ, повторних госпіталізацій та реваскуляризацій. Інвазивне лікування хворих з нестабільною стенокардією є більш прийнятним порівняно з медикаментозною терапією.
TACTICS TIMI 18 (Treat angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy-Thrombolysis in Myocardial Infarction 18, n=2457)
Мета: порівняти клінічні результати інвазивного (коронарографія + реваскуляризація) та медикаментозного лікування у хворих з гострим коронарним синдромом без елевації сегмента ST.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти, госпіталізовані з приводу гострого коронарного синдрому без елевації сегмента ST (загрудинний біль >20 хв + депресія сегмента ST >1 мм та/або позитивний тест на тропонін T та/або анамнез ІХС).
Спостереження: 180 днів.
Кінцеві точки: смерть, ІМ, повторна госпіталізація з приводу гострого коронарного синдрому.
Висновки: для хворих з гострим коронарним синдромом без елевації сегмента ST переважаючим є інвазивне лікування.
RITA 3 (Randomised Intervention Treatment of Angina, n=1810)
Мета: визначити, чи може раннє (<72 год від початку розвитку симптомів) інтервенційне лікування дати кращі, порівняно з медикаментозним, результати при 5-річному спостережені хворих з гострим коронарним синдромом без елевації сегмента ST.
Дослідження: проспективне багатоцентрове рандомізоване.
Популяція хворих: пацієнти з нестабільною стенокардією класу IIIb при депресії або транзиторній елевації сегмента ST, інверсії зубця T, наявності «старого» зубця Q або з анамнезом ІХС.
Кінцеві точки: смерть та ІМ.
Висновки: рутинна інвазивна стратегія дає кращі результати (зниження смертності та ІМ) при віддаленому спостереженні хворих з гострим коронарним синдромом без елевації сегмента ST в основному у хворих з високим ризиком розвитку ускладнень.
ISAR COOL (Intracoronary Stenting With Antithrombotic Regimen Cooling Off, n=410)
Мета: визначити, чи може негайне (<6 год від початку симптоматики) ПКВ під прикриттям ацетилсаліциловою кислотою, клопідогрелом і тирофібаном дати кращі результати, ніж відстрочене (>73 год) ПКВ із застосуванням вказаних лікарських засобів у хворих із гострим коронарним синдромом без елевації сегмента ST .
Дослідження: одноцентрове рандомізоване.
Популяція хворих: пацієнти з гострим коронарним синдромом, відібрані для ПКВ.
Кінцеві точки: сукупно смерть + нефатальний великовогнищевий ІМ протягом 30 днів.
Висновки: затримка ПКВ на 73 год погіршує результати лікування хворих з гострим коронарним синдромом без елевації сегмента ST порівняно з негайним ПКВ під прикриттям антитромбоцитарною терапією.
PAMI (Primary Angioplasty in Myocardial Infarction, n=395)
Мета: порівняти результати первинної ангіопластики і тромболітичної терапії у хворих з гострим ІМ.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з гострим ІМ (за-грудинний біль, елевація сегмента ST ) протягом 12 год від початку симптоматики.
Кінцеві точки: смертність, нефатальні реінфаркти, показники ФВ ЛШ (за даними радіонуклідного обстеження).
Висновки: негайна ПКВ зменшує кількість смертей та ІМ, пов’язана з меншою кількістю внутрішньочерепних кровотеч. ФВ у групах хворих подібна.
Stent-PAMI (Stent-Primary Angioplasty in Myocardial Infarction, n=1458)
Мета: порівняти результати стентування (стенти Palmas — Schatz) та балонної ангіопластики у хворих з гострим ІМ.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з гострим ІМ (загрудинний біль, елевація сегмента ST) протягом 12 год від початку симптоматики.
Спостереження: 6 міс (з повторною коронарографією).
Кінцеві точки первинні — сумарна кількість смертей, нефатальних реінфарктів, інсультів, повторних реваскуляризацій в ураженій судині протягом 6-місячного спостереження. Ангіографічно — бінарні рестенози (звуження >50%) на повторних коронарограмах.
Висновки: порівняно з ПКВ стентування покращує клінічні та ангіографічні результати у хворих з гострим ІМ. У першу чергу це стосується повторних реваскуляризацій.
GUSTO IIb (Global Use of Strategies To Open occluded arteries in acute coronary syndromes, n=1138)
Мета: порівняти клінічні результати у хворих з гострим ІМ після первинної ангіопластики і тромболітичної терапії.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з гострим ІМ (елевація ST) у перші 12 год від початку симптоматики.
Кінцеві точки: сумарна кількість смертей, повторних ІМ, інсультів протягом 30 днів.
Висновки: первинна ПКВ порівняно з тромболітичною терапією зумовлює деяке покращання клінічних результатів у період нетривалого спостереження у тих клініках, де є достатній досвід проведення цієї процедури.
C-PORT (Atlantic Cardiovascular Patient Outcomes Research Team, n=451)
Мета: порівняти результати первинного ПКВ і тромболітичної терапії у хворих з гострим ІМ, яким проводилося лікування у лікарнях, де відсутня кардіохірургічна допомога і попередні програми по проведенню ПКВ.
Дослідження: багатоцентрове рандомізоване (11 лікарень загального профілю).
Популяція хворих: пацієнти з гострим ІМ у перші 12 год від початку симптоматики.
Кінцеві точки: сумарна кількість смертей, повторних ІМ, інсультів протягом 6-місячного спостереження.
Висновки: виконання первинного ПКВ у лікарнях, де відсутня кардіохірургічна допомога, призводить до кращих клінічних результатів протягом перших 6 міс після гострого ІМ.
PRAGUE (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis, n=300)
Мета: визначити кращу стратегію лікування хворих з гострим ІМ, госпіталізованих у лікарні, де немає можливості виконати ПКВ.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з гострим ІМ (елевація ST), госпіталізовані в перші 6 год від початку захворювання у лікарні, де не проводиться інтервенційна кардіологічна допомога (відстань до найближчого центру, де виконується ПКВ, — 5–74 км).
Кінцеві точки: сумарна кількість смертей, повторних ІМ, інсультів протягом 30 днів спостереження.
Висновки: транспортування хворих з гострим ІМ, що супроводжується елевацією сегмента ST, у центри, де є можливість виконати первинне ПКВ, є безпечним та можливим. Така стратегія ведення хворих призводить до зменшення кількості повторних ІМ і сумарної кількості смертей, повторних ІМ та інсультів.
PRAGUE-2 (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis 2, n=850)
Мета: порівняти результати ранньої фібринолітичної терапії та первинного ПКВ, для проведення якого виникла потреба в дальньому транспортуванні хворих з місця їх первинної госпіталізації.
Дослідження: багатоцентрове рандомізоване (41 клініка загального профілю; 7 центрів, у яких виконувалося первинне ПКВ).
Популяція хворих: пацієнти з гострим ІМ (елевація ST ) протягом перших 12 год від моменту надходження в клініку загального профілю. Відстань до центру, де виконувалося ПКВ, — 5–120 км. Протипоказання до проведення тромболізису були відсутніми.
Кінцеві точки: первинна смертність протягом 30 днів. Вторинна — сумарна кількість смертей, нефатальних реінфарктів (больовий синдром + зростання фракції MB КФК).
Висновки: дальнє транспортування хворих з гострим ІМ до центрів, де виконувалося первинне ПКВ, не є небезпечним. У групі ПКВ відзначається тенденція до зниження 30-денної смертності. Якщо час від початку симптоматики до моменту госпіталізації в клініку загального профілю складав <3 год, то в таких випадках 30-денна смертність суттєво знижувалася.
ZWOLLE (Zwolle, The Netherlands, n=498; randomized 224)
Мета: порівняти ефективність первинної балонної ангіопластики та первинного стентування у хворих з гострим ІМ протягом 6-місячного спостереження.
Дослідження: одноцентрове рандомізоване.
Популяція хворих: пацієнти віком <75 років з гострим ІМ (загрудинний біль, елевація ST) у перші 6 год від початку симптоматики.
Кінцеві точки: смерть, нефатальний реінфаркт, повторні реваскуляризаційні процедури; сумарний показник трьох вказаних параметрів.
Висновки: у відібраної групи хворих первинне стентування зменшило кількість реінфарктів і повторних реваскуляризацій в інфарктзумовлюючих артеріях.
DANAMI (DANish trial in Acute Myocardial Infarction I, n=1008)
Мета: порівняти клінічні результати інвазивної (коронарографія + реваскуляризація) і консервативної стратегії у хворих з документованою ішемією міокарда протягом 1-го тижня після тромболітичної терапії, проведеної з приводу гострого ІМ.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з Q–ІМ, яким в перші 12 год проведена тромболітична терапія і у яких упродовж 1-го тижня після тромболізису розвинулася спонтанна або стрес-індукована ішемія міокарда.
Спостереження: у середньому — 2,4 року.
Кінцеві точки: сумарна кількість смертей, реінфарктів та нестабільних стенокардій, що розвинулися в період спостереження.
Висновки: інвазивне лікування хворих, у яких після тромболітичної терапії розвинулася рефрактерна ішемія, призводить до зменшення кількості реінфарктів, нестабільної стенокардії, а також зменшує кількість хворих зі стабільною стенокардією, що виникає протягом 1-го року спостереження. Пацієнтів, яким була проведена тромболітична терапія з приводу гострого ІМ і у яких протягом госпітального періоду документована ішемія міокарда, необхідно направляти на коронарографію з наступною реваскуляризацією.
DANAMI-2 (DANish trial in Acute Myocardial Infarction 2, n=1572)
Мета: порівняти результати негайної тромболітичної терапії та ПКВ, проведення яких потребувало тривалого транспортування хворих з гострим ІМ (елевація ST).
Дослідження: багатоцентрове рандомізоване (24 клініки загального профілю; 5 центрів, у яких проводять ПКВ).
Популяція хворих: пацієнти з гострим ІМ у перші 12 год від початку симптоматики, які госпіталізовані в клініки загального профілю, де проводився їх відбір і транспортування в центри для виконання ПКВ (у середньому на відстань 56 км; час транспортування <3 год).
Кінцеві точки: сумарна кількість смертей, нефатальних реінфарктів, інсультів протягом 30-денного спостереження.
Висновки: реперфузійна стратегія, що включає транспортування хворих у центри, де проводять ПКВ, є більш прийнятним видом лікування, ніж тромболітична терапія, особливо у тих випадках, коли транспортування займає не більше 2 год.
REACT (Rapid Early Action for Coronary Treatment, n=427)
Мета: порівняти результати консервативного лікування, повторного тромболізису та рятівного ПКВ у хворих з гострим ІМ (елевація ST) після безуспішної тромболітичної терапії.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з ІМ (елевація ST) після безуспішної тромболітичної терапії (відсутність успіху тромболітичної терапії визначалася на основі зниження елевації ST <50% у тому відведенні, де вона початково була найвищою).
Спостереження: 6 міс.
Кінцеві точки: сумарна кількість значних кардіальних та цереброваскулярних ускладнень (смерть, реінфаркт міокарда, інсульт, тяжка СН).
Висновки: виживаність без ускладнень була достовірно вищою у хворих, яким проводили рятівне ПКВ.
SIAM III (Southwest German Interventional study in Acute Myocardial infarction III, n=197)
Мета: порівняти клінічну і ангіографічну (за станом інфарктзумовлюючої артерії) ефективність раннього (виконаного впродовж перших кількох годин після тромболітичної терапії) та відкладеного (виконаного впродовж 2 тиж після тромболітичної терапії) стентування.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти з гострим ІМ у перші 12 год від початку захворювання, у яких після тромболітичної терапії проводили ангіографію, за даними якої в інфарктзумовлюючій артерії виявлено стеноз, придатний для стентування (стеноз >70% з кровотоком TIMI (Thrombolysis in Myocardial Infarction) <3 в артерії, що має діаметр >2,5 мм).
Кінцеві точки: первинні — сумарна кількість смертей, реінфарктів, повторних реваскуляризацій у цільовій судині, ішемічних ускладнень (госпіталізація й ангіографія з приводу стенокардії, що розвинулася протягом 6 міс спостереження).
Висновки: раннє стентування порівняно з відстроченим забезпечує кращі клінічні та ангіографічні результати.
GRACIA (Grupo de Analisis de la Cardiopatia Isquemica. Aguda, n=500)
Мета: оцінити ефективність стратегії ранньої інтервенції після тромболізису, який проводився з приводу гострого ІМ (елевація ST) в епоху стентування і нових тромботичних препаратів.
Дослідження: багатоцентрове рандомізоване.
Популяція хворих: пацієнти, яким упродовж перших 12 год проведено тромболізис з приводу гострого ІМ з елевацією ST (з дослідження виключалися хворі з кардіогенним шоком).
Кінцеві точки: первинні — сумарна кількість смертей, нефатальних реінфарктів, повторних реваскуляризацій з приводу ішемії міокарда протягом 1 року спостереження після виписки хворих зі стаціонару. Інші — реваскуляризація в госпітальний період, що проводилася в госпітальний період з приводу спонтанної стенокардії.
RAVEL (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent, n=238)
Мета: оцінити ефективність та безпеку стен-тів BX Velocity, елютинуючих сіролімус, який блокує клітинний цикл у фазі G1.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: пацієнти з поодиноким ураженням коронарної артерії de novo, яке звужує діаметр просвіту <100%. Ураження повністю вкривалися стентами довжиною 18 мм. Діаметр ураженої судини складав від 2,5 до 3,5 мм. Хворих з гострим ІМ та ураженням стовбура лівої коронарної артерії у дослідження не включали.
Кінцеві точки: первинні — зменшення середнього діаметра просвіту на ангіограмі, виконаної через 6 міс після стентування. Інші — середній діаметр просвіту, діаметр стенозу (у відсотках), рівень рестенозів, тяжкі побічні реакції з боку серця протягом 6 міс і 1 року.
Висновки: імплантація стентів, елютинуючих сіролімус, є безпечною, що підтверджується відсутністю гострих, підгострих та пізніх тромботичних ускладнень. Імплантація сіролімус-елютинг стентів призвела до нульового рівня як клінічних, так і ангіографічних рестенозів.
RAVEL 3 YRS (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent during 3 Years, n=238)
Мета: визначити, чи зберігається позитивний ефект імплантації елютинг-стентів на період більше ніж 1 рік спостереження.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: див. RAVEL.
Спостереження: 3 роки.
Кінцеві точки: тяжкі побічні реакції з боку серця.
Висновки: імплантація стентів, елютинуючих сіролімус, у сегменти нативних коронарних артерій з новими ураженнями, зменшують кількість тяжких побічних реакцій з боку серця протягом 3-річного спостереження.
SIRIUS (SIRolImUS-coated BX VELOCITY® Balloon Expandable Stent in the treatment of patients with de novo coronary artery lesions, n=1058)
Мета: оцінити ефективність імплантації сіролімус-елютинг-стентів щодо профілактики рестенозів.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: пацієнти з поодинокими ураженнями de novo <100% діаметра просвіту довжиною 15–30 мм. У дослідження не включали хворих з ураженням стовбура лівої коронарної
артерії та гострим ІМ.
Кінцеві точки: коронарна недостатність у зоні стентованої судини (смерть, гострий ІМ, реваскуляризація стентованої судини) протягом 9 міс спостереження. Рестенози з внутрішнього боку стента і в стентованому сегменті (стент + 5 мм дистальніше та проксимальніше стента) за даними ангіографій, що проведені через 8 міс після стентування.
Висновки: імплантація стентів, елютинуючих сіролімус, достовірно зменшує кількість клінічних та ангіографічних рестенозів.
SIRIUS. TWO YEARS RESULTS (n=1058)
Мета: оцінити ефективність стентів, елютинуючих сіролімус, щодо профілактики рестенозів на основі 2-річного спостереження.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: див. SIRIUS.
Кінцеві точки: недостатність стентованої судини (смерть, гострий ІМ у зоні стентованої судини, повторна реваскуляризація стентованої судини).
Висновки: лікування коронарних уражень за допомогою стентів Cypher призводить до достовірного зменшення кількості повторних реваскуляризацій у стентованому сегменті та стентованій судині. При цьому докази гострих та віддалених тромбозів у стентованому сегменті відсутні.
E-SIRIUS (European version of SIRIUS, n=352)
Мета: оцінити ефективність стентів, елютинуючих сіролімус, щодо попередження рестенозів у хворих з поширеними атеросклеротичними ураженнями в артеріях малого діаметра.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: пацієнти з поодинокими ураженнями de novo довжиною 15–30 мм у судинах, що мають діаметр <3 мм. Хворих з ураженням стовбура лівої коронарної артерії і гострим ІМ у дослідження не включали.
Кінцеві точки: первинні — середній діаметр просвіту в стентованому сегменті, визначений на основі коронарографії, яку проведено через 8 міс після стентування. Інші — рівень бінарних рестенозів у стенті та стентованому сегменті (стент + 5 мм проксимальніше та дистальні-ше стента); тяжкі побічні реакції з боку серця (смерть, ІМ, повторна реваскуляризація).
Висновки: у популяції хворих з високим ризиком розвитку рестенозів (довгі ураження в судинах малого діаметра) імплантація стентів, елютинуючих сіролімус, достовірно зменшує кількість клінічних та ангіографічних рестенозів.
C-SIRIUS (Canadian version of SIRIUS, n=100)
Мета: порівняти результати імплантації непокритих металічних та елютинг-стентів у сегменти коронарних артерій малого діаметра, які мали поширені атеросклеротичні ураження.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: пацієнти зі стабільною, безсимптомною німою і нестабільною стенокардією, які мають ураження коронарних артерій зі звуженням просвіту на 50–90%, довжиною 15–30 мм у судинах діаметром 2,5–3,0 мм.
Кінцеві точки: первинні — середній діаметр просвіту в місці імплантації стента за даними ангіографії, яку виконано через 8 міс після стентування. Вторинні — кількість ангіографічних рестенозів; тяжкі побічні реакції з боку серця.
Висновки: імплантація стентів, елютинуючих сіролімус, достовірно зменшила кількість рестенозів та покращила клінічні результати лікування у досліджуваній популяції хворих.
TAXUS IV (trial with paclitaxel eluting stent system, n=1314)
Мета: оцінити ефективність стентів, елютинуючих паклітаксел, щодо зниження кількості рестенозів при широкому спектрі уражень коронарних артерій.
Дослідження: багатоцентрове подвійне сліпе рандомізоване.
Популяція хворих: пацієнти з поодинокими ураженнями коронарних артерій, що вперше виникли. Звуження просвіту <100%; довжина стенозів 10–28 мм; діаметр уражених сегментів коронарних артерій 2,5–3,75 мм. Хворих з ураженням стовбура лівої коронарної артерії і гострим ІМ у дослідження не включали.
Кінцеві точки: повторна реваскуляризація у стентованих судинах протягом 9-місячного спостереження, тяжкі побічні реакції з боку серця, кількість бінарних рестенозів.
Висновки: імплантація стентів, елютинуючих паклітаксел, достовірно зменшувала кількість ангіографічних та клінічних рестенозів. Результат підтверджений у всіх підгрупах дослідження.
Наведені дослідження лягли в основу класифікації користі та ефективності ПКВ при різних формах ІХС. У класифікації розглядаються такі критерії, як класи рекомендацій та рівні доказовості (табл. 1.1).
Таблиця 1.1. Критерії класів рекомендацій та рівнів доказовості
| Класи рекомендацій | |
| I | Докази та/або загальна згода з тим, що ця діагностична процедура або вид лікування є успішними, корисними та ефективними |
| II | Суперечливі докази та/або розходження в думці щодо ефективності або користі цього методу |
| IIa | Переважання доказів (думок) на користь ефективності цього методу |
| IIb | Користь та ефективність методу недостатньо добре визначені на основі доказів або думок |
| Рівні доказовості | |
| A | Дані, що отримані на основі великої кількості рандомізованих клінічних досліджень або на основі метааналізу |
| B | Дані, що отримані на основі одного рандомізованого або кількох нерандомізованих досліджень |
| C | Згода щодо думки експертів та/або дані, що отримані на основі малих або ретроспективних досліджень, або від реєстрів |
Оцінка результатів інтервенційного лікування ІХС проводиться в багатьох дослідженнях (у тому числі і мегадослідженнях) та метааналізах. Багато досліджень завершені, їх результати опубліковані, проте на сьогодні велику кількість досліджень ще не завершено. Особливий інтерес для інтервенційних кардіологів становлять результати проведених мегадосліджень, у яких визначається ефективність та безпека імплантації елютинг-стентів. Як відзначається в рекомендаціях Європейського товариства кардіологів, результати цих досліджень повинні суттєво розширити показання до застосування інтервенційних методів лікування при таких ураженнях коронарних артерій, стентування яких може призвести до несприятливих результатів. До таких уражень належать ураження коронарних артерій малого діаметра, довгі ураження, коронарний атеросклероз у хворих на цукровий діабет і деякі інші. Особливий інтерес являють собою дослідження, присвячені інтервенційному лікуванню уражень стовбура лівої коронарної артерії, незахищеного шунтом.
АПАРАТУРА ТА ІНСТРУМЕНТАРІЙ, ЩО ЗАСТОСОВУЮТЬСЯ ПРИ ІНТЕРВЕНЦІЙНОМУ ЛІКУВАННІ ІХС
Інтервенційні методи лікування коронарного атеросклерозу за останні кілька десятиріч суттєво закріпили свої позиції в ряді інших методів лікування цієї патології. Цьому сприяв розвиток нових ефективних технологій інтервенційної кардіології, зокрема стентів, а також стентів, що елютинують лікарські речовини. Водночас два основних принципи інтервенційних процедур — рентгенівський контроль і застосування катетерної техніки — залишаються незмінним атрибутом цих процедур.
Ангіографічна апаратура
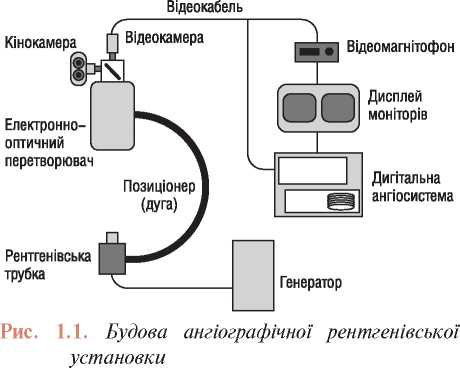
Ангіографічні установки, що використовуються в інвазивній кардіології, складаються з кількох основних компонентів: рентгенівської трубки, генератора, електронно-оптичного перетворювача (підсилювача зображення), оптичної системи розподілу світлового потоку, систем запису й відтворення зображення (рис. 1.1). Удосконалювання ангіографічної апаратури, зумовлене бурхливим розвитком інвазивних катетеризаційних методів лікування різних судинних захворювань, не вплинуло на принципи одержання зображення. Нові технології виробництва поліпшили характеристики компонентів ангіографічних установок, а застосування цифрового запису значно підвищило якість ангіограм, внаслідок чого розширилися можливості їх аналізу.
Рентгенівське випромінювання і його перетворення в потік світлових променів (рентгенівські трубки, генератори і електронно-оптичні перетворювачі)
У всіх сучасних рентгенівських установках радіаційне випромінювання утворюється за методом, відкритим наприкінці XIX ст. Рентгеном. Утворення радіаційного випромінювання відбувається в рентгенівській трубці (рис. 1.2а), що містить позитивно заряджений вольфрамовий електрод (анод), який «бомбардується» електронами, що виходять із негативно зарядженого електрода (катода). Електрони, проходячи від катода до анода в електричному полі, розганяються до високих швидкостей і, потрапляючи на анодну пластинку, взаємодіють із атомами вольфраму, утворюючи рентгенівські промені: під час проходження через щільні позитивно заряджені атоми вольфраму електрони різко втрачають швидкість; при цьому енергія гальмування перетворюється в потік рентгенівських фотонів.
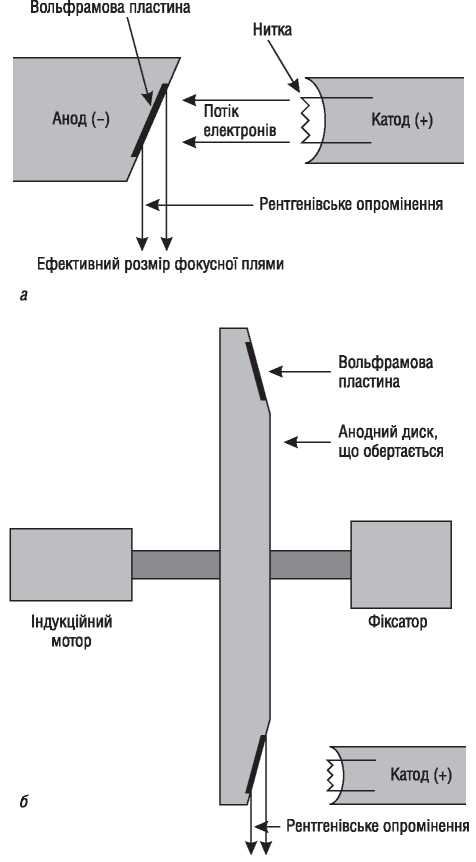
Рис. 1.2. Будова рентгенівської трубки: а) найпростіша рентгенівска трубка; б) рентгенівська трубка з анодним диском, що обертається
Швидкість, з якою електрони атакують вольфрамовий анод, залежить від різниці потенціалів між електродами. У рентгенівських трубках, що застосовуються в ангіографії, ця різниця потенціалів повинна становити 60–120 тис. В (60–120 кВ потенціалів; кВп). Рівень енергії рентгенівських фотонів також визначається різницею потенціалів і вимірюється в кілоелектронвольтах (кеВ). Пік різниці потенціалів між електродами рентгенівської трубки відповідає максимальній енергії рентгенівських фотонів у промені. Обсяг електронного потоку між катодом і анодом визначає кількість продукованих рентгенівських фотонів і вимірюється в міліамперах (мА). В ангіографічній апаратурі використовується принцип пульсуючого утворення рентгенівських променів з короткою (кілька мілісекунд) експозицією, що відповідає часу відкриття стулок кінокамери, який визначає експозицію кожного кадру кінофільму.
Катодний електронний потік фокусується на малу зону анода (фокусна пляма), з якої виходить потік рентгенівських фотонів. При порівняно великих розмірах фокусної плями контури досліджуваного об’єкта визначаються нечітко, що значно погіршує якість ангіограм. Проте зменшення розміру фокусної плями шляхом простого звуження пучка електронного потоку неможливе. Відомо, що при влученні електронів на анод виділяється велика кількість тепла і, незважаючи на високу температуру плавлення вольфраму, малий розмір фокусної плями при тій високій інтенсивності роботи трубки, яку вимагає ангіографія, призведе до плавлення анода. Для того щоб цього не відбулося, анод закріплюють на диску, який обертається з такою швидкістю, при якій кожний наступний імпульс потрапляє на іншу точку анода. Швидкість обертання диска при цьому повинна перевищувати 10 000 обертів за 1 хв. Для того щоб співвідношення між дійсною та ефективною фокусною плямою було оптимальним, анодну пластинку встановлюють під кутом до потоку електронів (рис. 2б). В ангіографічних трубках визначають два діаметра ефективної площі фокусної плями — малий і великий (відповідно 0,6 і 0,9 мм). Потужність рентгенівської трубки повинна відповідати розмірам фокусної плями: 40 кВт — для малої фокусної плями і 80 кВт — для великої.
Ще однією важливою характеристикою рентгенівської трубки є її здатність зберігати й розсіювати тепло. Цей показник вимірюється в теплових одиницях (кВп/мА/c). У сучасних ангіографічних установках застосовують керамічні або графітові рентгенівські трубки, які здатні витримувати великі теплові навантаження, що підвищує термін експлуатації таких трубок і виправдовує їх високу вартість.
Оптимальні характеристики рентгенівських трубок, які застосовують в інвазивній кардіології, наведені в табл. 1.2.
Таблиця 1.2. Характеристика рентгенівських трубок ангіографічних установок
| Характеристика | Значення |
| Розмір фокусної плями, мм | |
| малий | 0,5 |
| великий | 1 |
| Потужність рентгенівської трубки, кВт | |
| для малої плями | 40–60 |
| для великої плями | 80–100 |
| Анодні характеристики | |
| Кути, ° | |
| для малої плями | 7 |
| для великої плями | 7 |
| Теплова потужність, тепл. од. | 700 000 |
| Ступінь охолодження (макс.), тепл. од./хв | 150 000 |
| Характеристика корпусу трубки | |
| Теплова потужність, тепл. од. | 1 750 000 |
| Ступінь охолодження системи | |
| Циркуляція рідини (макс.), тепл. од./хв | 150 000 |
Генератори ангіографічних установок виконують кілька важливих функцій. По-перше, трансформують напругу побутової мережі до високовольтного рівня, по-друге, перетворюють змінний струм мережі в постійний, що необхідно для утворення односпрямованого потоку електронів у рентгенівській трубці. Від якості випрямлення струму залежить наявність більшої або меншої кількості осциляцій на виході генератора. Сучасні моделі генераторів дають мінімальну осциляцію на виході, хоча деякі відмінності у виготовленні окремих моделей все ще залишаються. Вихідна потужність генераторів вимірюється у кВт, що повинно відповідати потужності рентгенівської трубки. Так, для трубки потужністю 80 кВт (при великій фокусній плямі) потужність генератора повинна становити 80–125 кВт.
Основні характеристики генераторів, які використовуються в ангіографічних установках, наведені в табл. 1.3.
Таблиця 1.3. Характеристика генераторів ангіографічних установок
| Характеристика | Значення |
| кВп | |
| мін. | 40 |
| макс. | 150 |
| мА | |
| макс. | 200 |
| Максимальний час експозиції | |
| пульсове, мс | 5 |
| Потужність, кВт | |
| при 80 кВп | 100 |
| Автоматичний контроль експозиції, мА — кВп | Комбінований |
Для перетворення рентгенівського випромінювання у світлові промені, а також збільшення зображення застосовують електронно-оптичні перетворювачі (підсилювачі зображення) (рис. 1.3). Вхідний флюоресцентний фосфорний екран абсорбує кожний рентгенівський фотон, трансформуючи його енергію в безліч (більше тисячі) світлових фотонів. Цей екран змонтований у безпосередній близькості від фотокатода (металевого екрана, що випромінює фотоелектрони при його освітленні). Фотоелектрони, спрямовані фокусуючими пластинами, попадають до анода, який знаходиться біля вихідного флюоресцентного екрана. Анод розганяє фотоелектрони до високих швидкостей; вихідний флюоресцентний екран починає випромінювати світлові фотони після того, як на нього попадають значно прискорені анодом фотоелектрони.
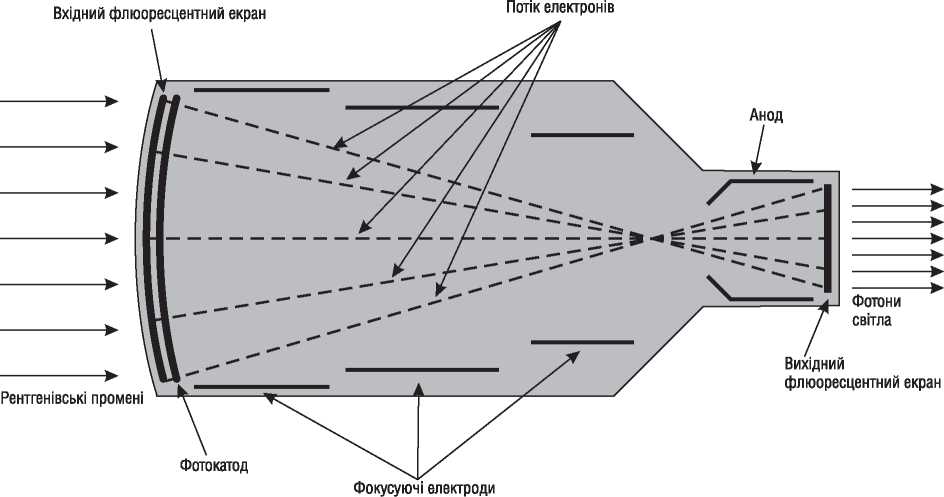
Рис. 1.3. Схематичне зображення та принцип роботи електронно-оптичного підсилювача зображення
Збільшення розмірів зображення порівняно з натуральними розмірами об’єкта відбувається внаслідок того, що кожний фотон рентгенівського випромінювання на вхідному екрані і фотокатоді викликає випромінювання великої кількості фотоелектронів, які прискорюючись, у свою чергу викликають випромінювання великої кількості світлових фотонів. Крім того, розміри вихідного флюоресцентного екрана значно менші розмірів вхідного, що призводить до концентрації фотонів у меншому, але значно більш яскравому полі. Без такого посилення яскравості неможливе проведення ангіоскопії та ангіографії. Усі ангіографічні установки оснащені розподільником світлового потоку (напівпосріблене дзеркало), який дає можливість проводити кіноангіографію і флюороскопію одночасно.
Електронно-оптичні перетворювачі сучасних ангіографічних установок дозволяють покроково збільшувати зображення досліджуваного об’єкта або, інакше кажучи, зменшувати діаметр досліджуваного поля. Стандартні діаметри досліджуваного поля становлять 22–25 см (мінімальне збільшення), 15–17 см (середнє збільшення) і 10–12 см (максимальне збільшення). Режим збільшення вибирають відповідно до об’єкта та мети дослідження. Так, для дослідження великих судин, таких як аорта, магістральні артерії нижніх кінцівок і т.п., необхідно використовувати мінімальне збільшення. Для коронарографії та аналізу характеру атеросклеротичного ураження коронарних артерій прийнятним є середнє і максимальне збільшення.
Характеристики рентгенівської трубки і генератора ангіографічних установок відіграють важливу роль в інвазивній кардіології й, зокрема, для візуалізації стентів при їх імплантації.
Рентгенівська візуалізація матеріалу залежить від поглинання цим матеріалом рентгенівських променів, що у свою чергу залежить від якості випромінювання (фотонової енергії) і атомного числа досліджуваного матеріалу (кількості електронів). У тканинах людини найбільш рентгенопоглинаючим матеріалом є кальцій (атомне число — 20). Йодовмісне контрастне середовище має атомне число 53.
Більшість стентів, що імплантується в коронарні артерії, виготовлені з нержавіючої сталі (металу з атомним числом близько 26), проте деякі внутрішньокоронарні стенти виготовляють із металів з великою атомною масою, наприклад із платини (атомне число — 78) або танталу (атомне число — 73).
Таким чином, кількість фотонів, що поглинаються, а отже, і рентгеноконтрастність стентів, залежить від кількості і якості випромінювання, а також від кількості і якості матеріалу, з якого виготовлений стент.
На візуалізацію стентів впливає такий фактор, як маса пацієнта. При надмірній масі для візуалізації об’єкта потрібно більше фотонної енергії (кВп) (фотонна енергія — якісний рентгенографічний показник). Збільшення кВп призводить до більшого розсіювання радіації; інтенсивність сірого кольору поля підвищується, деталі досліджуваного об’єкта втрачаються, тобто підвищення якісного рентгенографічного показника призводить до втрати якості візуалізації стентів (рис. 1.4, 1.5).

Рис. 1.4. Знімок, виконаний при низькому показнику фонової енергії (70 кВп)

Рис. 1.5. Знімок, виконаний при високому показнику фонової енергії (110 кВп)
Важливим фактором для візуалізації стента є однократна доза (кількісний рентгенологічний показник) для ангіографії або ангіоскопії. Занадто низька доза не дозволяє візуалізувати стент у квантовому шумі; занадто висока доза робить стент невидимим на фоні поля інтенсивного сірого кольору. Прийнятними рівнями дози радіації для сучасних ангіографічних установок при використанні поля 17 см (7 дюймів) є наступні. Для ангіоскопії — 32 нГр/кадр; при частоті імпульсів 12,5 на 1 с рівень дози становить 400 нГр. Для ангіографії — 100 нГр/кадр при цифровому записі і 150 нГр/кадр — для кінозапису.
На чіткість візуалізації стентів впливає також розмір фокусної плями. При фокусній плямі розміром >1 мм металеві дротяні конструкції з діаметром дроту <1 мм у деяких випадках можуть не візуалізуватися (рис. 1.6 ). Як було відзначено вище, розмір фокусної плями в сучасних ангіографічних установках повинен бути <0,8 мм при ангіографії та <0,5 мм при ангіоскопії (рис. 1.7).

Рис. 1.6. Знімок, виконаний при розмірі фокусної плями 1,2 мм
Рис. 1.7. Знімок, виконаний при розмірі фокусної плями 0,3 мм
У сучасних ангіографічних установках використовують пульсову ангіоскопію (рис. 1.8–1.10), яка підвищує якість зображення і знижує дозу опромінення.

Рис. 1.8. Послідовна (стандартна) флюороскопія у момент руху стентів. Імітується реальна ситуація візуалізації стента, розміщеного в коронарній артерії

Рис. 1.9. Пульсова (сучасна) флюороскопія у момент руху стентів. Імітується реальна ситуація візуалізації стента, розміщеного в коронарній артерії
Рис. 1.10. Пульсова (сучасна) флюороскопія у момент руху стентів з використанням спеціального дигітального фільтра, що покращує зображення. Імітується реальна ситуація візуалізації стента, розміщеного в коронарній артерії
Записуюча й відтворююча апаратура
У перших ангіографічних установках для запису ангіограм використовували кіноапаратуру. Якість ангіограм залежала від якості кіноплівки, умов її обробки та зберігання і тому подібних факторів. У колишніх настановах з інвазивної кардіології цим питанням приділяли велику увагу. На сьогодні необхідність у цьому зникла, оскільки на зміну кінозапису повсюдно прийшли цифрові технології запису та відтворення ангіограм.
На перших етапах застосування цифрової ангіографії існували труднощі в перегляді ангіограм, записаних на різних ангіографічних установках, що було зумовлено різними стандартами в програмному забезпеченні різних виробників апаратури. Крім того, були обмеження в архівуванні цифрових фільмів через їх великі обсяги, тому випускали ангіографічні установки, що дозволяли проводити як цифровий, так і аналоговий запис ангіограм. Сучасні комп’ютерні системи, що забезпечують запис і відтворення цифрових ангіограм, не мають цих недоліків. Питання архівації ангіограм успішно вирішені за допомогою збільшення обсягу пам’яті як твердих, так і інших цифрових носіїв інформації.
Якість цифрового відеозапису, безумовно, вища аналогового, тому застосування цифрового запису дозволяє лікарям одержувати більш повний обсяг інформації й краще контролювати процеси, що відбуваються під час ендоваскулярних процедур. Так, з’явилася можливість цифрової обробки кількісних характеристик атеросклеротичних уражень коронарного русла, що дає можливість більш точного відбору інструментів для ПКВ. Цифровий запис дозволяє більш точно оцінити якісні характеристики атеросклеротичних уражень; покращання контрастності зображення на цифрових ангіограмах дозволяє, наприклад, більш точно деталізувати ознаки пристінкового тромбоутворення, дисекції або інших видів руйнування досліджуваного атеросклеротичного ураження, що також визначає вибір тактики інтервенційного лікування і відбір інструментів для інтервенційних втручань у кожному конкретному випадку.
Інструментарій, який застосовується при ПКВ
Діагностичний інструментарій
Для проведення діагностичної коронаровентрикулографії, яка виконується при коронарному атеросклерозі, потрібна порівняно невелика кількість інструментів: голки для пункції артерій, дротяні провідники, перфоратори, інтродюсери і ангіографічні катетери. На сьогодні у зв’язку з розповсюдженням методів ендоваскулярної реконструкції коронарних артерій при їх атеросклеротичному ураженні ці інструменти в різних модифікаціях у великій кількості випускають різні фірми-виробники. Правильний вибір операційного інструментарію значно полегшує виконання операції. Тому ми вважаємо за необхідне викласти інформацію про переваги й недоліки різних модифікацій інструментів.
Пункційні голки
Для черезшкірного доступу в артеріальне русло використовують пункційні голки двох типів, що відповідають двом видам техніки пункції судин — прямій і сельдингерівській.
Голка Сельдингера (рис. 1.11) складається з кількох компонентів: металевої оболонки, що не має гострокутового зрізу, і одного або двох стилетів. Внутрішній стилет голки Сельдингера просвіту не має; він захищає голку від блокування її просвіту шкірою та підшкірними тканинами.
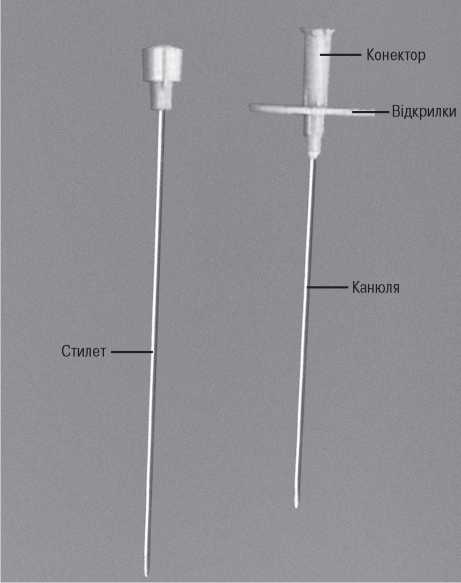
Рис. 1.11. Багатокомпонентна голка Сельдингера для пункції артерії
Канюля голки Сельдингера містить луерівський конектор і відкрилки. Відкрилки канюлі дозволяють виконувати пункцію судини однією рукою, тримаючи голку великим, вказівним і середнім пальцями, як того вимагає техніка Сельдингера; при цьому положення голки контролюється рукою, а не приєднаним до голки шприцом. Деякі виробники («Argon Inc.») випускають голки Сельдингера зі знімними пластмасовими конекторами різної форми. Це дозволяє хірургові вибрати конектор, що найбільш підходить для кожного конкретного випадку.
Голки Сельдингера нумеруються відповідно до їх зовнішнього діаметра: чим більший зовнішній діаметр голки, тим менший її номер (табл. 1.4). Для пункції артерій найбільш підходящими є голки Сельдингера № 18; внутрішній діаметр таких голок пропускає стандартні металеві провідники діаметром 0,035–0,038 дюйма. Сучасна технологія виробництва голок Сельдингера дозволяє, зберігаючи необхідний внутрішній діаметр голки, зменшити її зовнішній діаметр, що знижує ризик травми артерії.
Таблиця 1.4. Система нумерації голок Сельдингера
| Калібрувальний номер голки | Зовнішній діаметр, дюймів |
| 13 | 0,095 |
| 14 | 0,083 |
| 15 | 0,072 |
| 16 | 0,065 |
| 17 | 0,058 |
| 18 | 0,049 |
| 19 | 0,042 |
| 20 | 0,035 |
Стандартна довжина голок — 2,75–3 дюйма. Вибір довжини голки зазвичай залежить від ступеня вираженості підшкірно-жирової клітковини в скарповському трикутнику. Наконечник стилета повинен бути скошений під менш гострим кутом, ніж у звичайних ін’єкційних голок, і в той же час стилет повинен бути досить гострим, щоб не розшарувати стінку артерії, що пунктується. Стилет виготовляють з твердого металу; це є необхідною умовою для його вільного проходження через змінені стінки артерії або рубцеві підшкірні тканини.
При пункційній техніці голкою Сельдингера передбачається прокол задньої стінки артерії. При сучасному методі медикаментозного супроводу ПКВ додаткова травма стінки артерії може стати причиною істотних геморагічних ускладнень під час пункції. Цей факт значно обмежив застосування голок Сельдингера. На сьогодні практично завжди використовують голки для прямої артеріальної пункції (one touch needle).
Голка, призначена для прямої пункції артерій (рис. 1.12), за своєю конструкцією майже не відрізняється від звичайної пункційної голки. Відсутність стилета в цій голці дозволяє одержати артеріальний кровотік через її просвіт при проколі передньої стінки артерії без ушкодження задньої стінки.
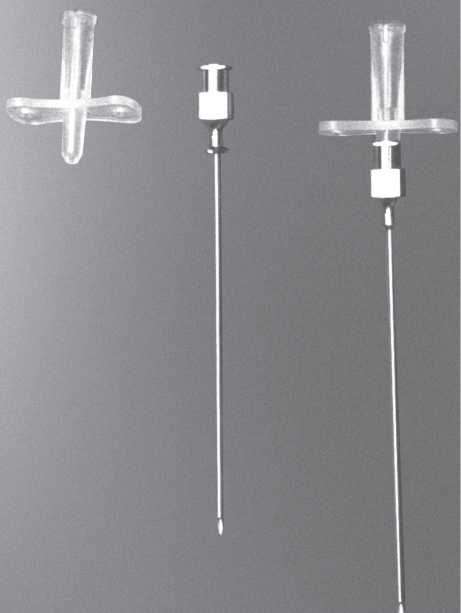
Рис. 1.12. Однокомпонентна тонкостінна голка (front wall needle) зі знімним конектором
Металічні дротяні провідники
Базова конструкція металевих провідників, що використовуються при катетеризації артеріального русла, наведена на рис. 1.13.
Основу провідника становить металевий стрижень, обмотаний тонким дротом з тефлоновим покриттям. Дротяна обмотка провідника, запаяна на дистальному кінці, довша стрижня, що забезпечує рухливість дистального сегмента провідника. До дистального кінця обмотки припаяна струна, яка розміщується між обмоткою і стрижнем по всій довжині провідника. Довжина дистального сегмента провідника, що не має стрижня, може бути різною; вона визначає ту відстань, на яку провідник може пройти за перешкоду (стеноз або вигин артерії) до того, як з цією перешкодою зустрінеться стрижень провідника. Стрижень, що поступово звужується, робить плавним перехід від рухливої верхівки провідника до твердого стрижня. Перевагою провідників зі стрижнями, що поступово звужуються, є також те, що ймовірність відриву рухливого сегмента провідника від твердого стрижня значно знижується.
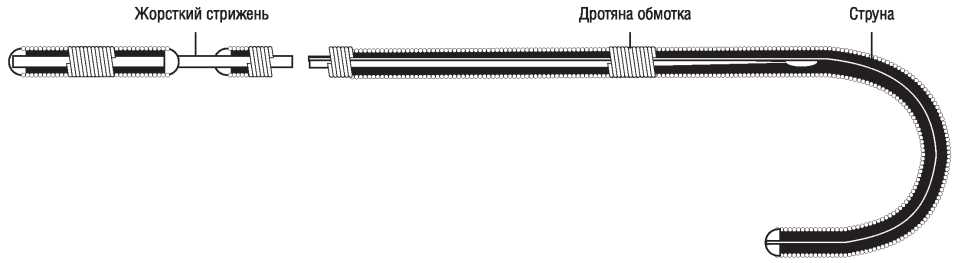
Рис. 1.13. Базова конструкція судинних металічних провідників
Зовнішнє тефлонове покриття провідника зменшує тертя між провідником і внутрішньою поверхнею катетера, що знижує ймовірність тромбоутворення. Однак, незважаючи на тефлонове покриття, у місцях вигинів провідників можуть утворюватися тромби, тому провідники повинні перебувати в просвіті судини протягом тільки того мінімального часу, який необхідно для встановлення катетера.
Довжина провідників може варіювати від 35 до 300 см. При виборі провідників для ендоваскулярних втручань необхідно пам’ятати, що довжина провідника повинна бути не менше ніж на 20 см більша довжини катетера. При виконанні звичайної коронаровентрикулографії застосовують провідники довжиною 145 см. Проте бувають ситуації, коли прохід провідника і катетерів через сегменти артеріального русла утруднений, внаслідок надмірної звивистості або складного атеросклеротичного ураження. У таких випадках застосовують провідники більшої довжини (240–260 см), що дозволяє при зміні катетерів залишати дистальний відділ провідника за зміненою ділянкою артерії. Така тактика зводить до мінімуму ймовірність травми судинної стінки.
Для катетеризації коронарних артерій і ЛШ використовують провідники діаметром 0,035–0,038 дюйма. Хоча всі провідники зазначених діаметрів вільно проходять через голки Сельдингера № 18 та сумісні зі звичайними ангіографічними катетерами, у більшості випадків перевагу слід віддавати провідникам меншого діаметра, оскільки проходження таких провідників через просвіт голки не створює додаткового тертя, що дозволяє відчути мінімальне утруднення руху провідника у зміненому сегменті артерії. Застосування твердих провідників більшого діаметра (0,038 дюйма) виправдано при катетеризації ЛШ через стенозоване устя аорти.
Дистальний відділ провідника може бути як прямим, так і у формі букви «J» (рис. 1.14). Провідники «J» маркіруються за діаметром кривизни дистального сегмента (наприклад 3 мм). Використання провідників «J» дозволяє уникнути попадання в бічні гілки судини, не допускає дисекції інтими судини в місці вигину артерії або локалізації бляшки, що досить часто трапляється у випадках прикладання оператором надмірного зусилля в тій ситуації, коли верхівка прямого провідника упирається в перешкоду. Єдиний недолік провідників «J» полягає в труднощах їх введення в просвіт пункційної голки. Цей недолік легко усувається за рахунок застосування прямих пластикових інтродюсерів, які знаходяться в упаковці всіх провідників «J».
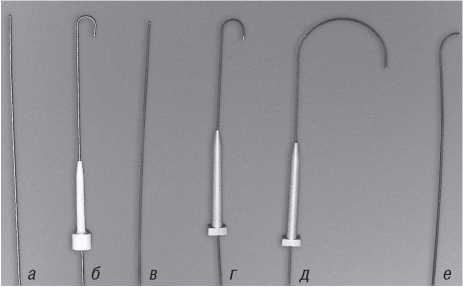
Рис. 1.14. Типи металічних дротяних провідників для катетеризацій великих артерій: стальні прямий і «J» (3 мм) провідники (а, б); прямий і «J» (3 мм) провідники з тефлоновим покриттям (в, г); провідник «J» (16 мм) с тефлоновим покриттям (д); провідник Terumo «m» (е)
Перфоратори та інтродюсери
Одним із найголовніших завдань при кардіальній катетеризації є постійна підтримка доступу в артеріальне русло через пункційний отвір, що забезпечується за допомогою спеціальних ангіографічних інструментів — перфораторів («пробійників») та інтродюсерів (рис. 1.15).

Рис. 1.15. Перфоратори та інтродюсери різної довжини і діаметра (пояснення в тексті)
Перфоратори забезпечують проходження тонкостінної пластикової оболонки — інтродюсера через підшкірні тканини та стінку артерії в її просвіт. Інтродюсер, введений у просвіті артерії, значно полегшує процедуру катетеризації, зводячи до мінімуму травмування судинної стінки. Крім того, у випадку виконання реконструкції коронарної артерії із застосуванням антитромботичних препаратів і/або антикоагулянтів, інтродюсер можна залишити в просвіті артерії після операції на той час, який необхідний для інактивації певних лікарських речовин. Наявність інтродюсера в просвіті артерії після операції полегшує повторний ургентний доступ до судинного русла у випадку раннього тромбозу коронарної артерії після її реконструкції.
Для кардіальної катетеризації застосовують перфоратори різного діаметра і довжини, однак усі вони повинні відповідати загальним вимогами і бути виготовлені з твердого пластику (тефлону або поліетилену), що забезпечує їх проведення через склерозовані підшкірні тканини або кальциновану стінку артерії. Для того, щоб травма судини була мінімальною, стінка перфоратора в дистальному відділі повинна поступово стоншуватися; діаметр внутрішнього просвіту при цьому повинен залишатися однаковим на всьому протязі. Діаметр внутрішнього просвіту перфоратора повинен точно відповідати діаметру провідника для того, щоб, по-перше, проведення перфоратора по провіднику було вільним, по-друге, кількість крові між перфоратором і провідником була мінімальною. Конектори перфораторів відповідають канюлям луерівських шприців. На канюлі перфоратора зазначені його розміри.
Діаметр і довжина інтродюсерів також значно варіюють. Інтродюсери виготовляють із нетром-богенного матеріалу (зазвичай тефлону або поліетилену), який повинен бути міцним, тонким, гнучким і рентгеноконтрастним. Під час виготовлення інтродюсера його верхівку рівномірно стоншують. Це забезпечує мінімальну травму артерії при введенні в її просвіт інтродюсера, розміщеного зверху перфоратора.
Конектори інтродюсерів мають особливу конструкцію. Вони забезпечені гемостатичним клапаном і бічною поліетиленовою трубкою, яка закінчується краном з кількома виходами. Наявність бічної трубки та крана з кількома виходами дозволяє одночасно використовувати апаратуру для моніторування АТ, промивати інтродюсер і вводити лікарські засоби в артеріальне русло. Деякі конектори з’єднуються з інтродюсером за типом гармошки (фірма «Arrow Inc.»), що дозволяє змінювати кут між конектором і трубкою інтродюсера; інші коннектори з’єднані з трубкою інтродюсера за типом муфти.
Конструкція гемостатичних клапанів інтродюсерів може бути різною. Фірма «Cordis» випускає інтродюсери з одно- і двостулковими клапанами, фірма «USCI» — інтродюсери з клапанами, що складаються з О-подібного гумового кільця. Нещодавно налагоджено виробництво клапанів з багатошаровою діафрагмою, яка складається з гумових смужок, що перекриваються. Фірма «Terumo Radiofocus» випускає інтродюсери з клапанами у вигляді силіконової пробки з поперечними волокнами, що забезпечує як герметичність, так і мінімальне тертя катетера під час маніпуляцій. Деякі фірми випускають конектори інтродюсерів зі знімними клапанами; це дозволяє приєднати до конектора луерівський шприц або накидний кран.
Іноді інтродюсери випускають у комплекті з обтураторами, що дозволяє закрити просвіт інтродюсера у тому випадку, якщо він залишений у просвіті артерії після операції. Обтуратор не тільки герметично закриває просвіт інтродюсера, але й виключає можливість вигину трубки інтродюсера в місці пункції артерії.
Добре виготовлені інтродюсери значно полегшують процедуру кардіальної катетеризації; неякісні ж інструменти не тільки утруднюють виконання операції, але й можуть стати причиною ряду ускладнень процедури, основним з яких є неконтрольована артеріальна кровотеча.
Ангіографічні катетери
Найбільш важливими й складними інструментами, що застосовуються при коронаровентрикулографії, є ангіографічні катетери. Їх різноманітність зумовлена в основному різною конфігурацією дистальних сегментів. При цьому принципова конструкція всіх діагностичних катетерів однакова. У коронаро- і вентрикулографічних катетерах розрізняють наступні компоненти: конектор; тіло катетера; дистальний сегмент катетера, що має один або кілька вигинів; верхівка катетера (рис. 1.16 ).


Рис. 1.16. Компоненти ангіографічного катетера: а) дистальний відділ ангіографічного катетера; б) типи конекторів ангіографічного катетера
Порядковий рахунок вигинів дистального сегмента починається від верхівки катетера. Верхівка катетера може мати одне (торцеве) або кілька отворів (торцеве і кілька бічних). Наявність бічних отворів дозволяє збільшити швидкість і кількість контрасту, що вводиться, знижуючи при цьому віддачу. Конектор герметично з’єднаний з тілом катетера за типом муфти. Має або квадратну конфігурацію, або відкрилки. Це полегшує виконання ротації катетера та інших маніпуляцій. На конекторі позначається специфікація катетера.
Кардіальні діагностичні катетери можуть складатися з одного або кількох шарів (рис. 1.17). На сьогодні в основному використовують багатошарові катетери. Компоненти, що складають шари стінки катетера, визначають його технічні характеристики. Більшість багатошарових катетерів містить внутрішню тефлонову трубку, вкриту шаром нейлону або дакрону, який має оплетення із нержавіючої сталі. Для зміцнення внутрішніх шарів зверху них наплавляється третій (зовнішній) шар з поліетилену або поліуретану. Внутрішній шар повинен забезпечити максимально гладку внутрішню поверхню катетера для вільного проходження металевого провідника та контрастної маси. Ця умова необхідна не тільки для полегшення проведення процедури, але й для запобігання тромбоутворення всередині просвіту катетера.
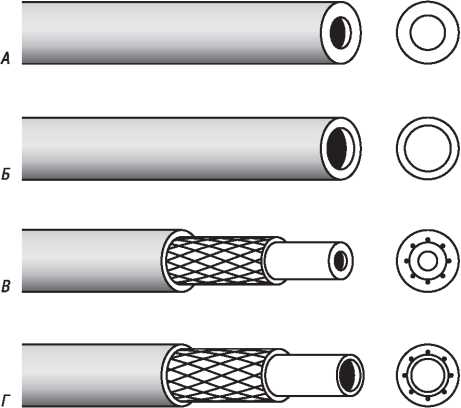
Рис. 1.17. Базова конструкція ангіографічного катетера: стандартний одношаровий катетер (А); тонкостінний одношаровий катетер (Б); стандартний багатошаровий катетер (В); тонкостінний багатошаровий катетер (Г)
Жорсткість катетера залежить від товщини та щільності матеріалу, з якого виготовлений середній шар. Жорсткість є важливою якістю катетера: чим жорсткіше катетер, тим легше ним управляти. Останні моделі катетерів мають більш тонкі стінки. Це досягається введенням оплетення у внутрішньому шарі. Зменшення товщини стінок катетера дозволяє збільшити діаметр внутрішнього просвіту при збереженні зовнішнього діаметра, однак жорсткість катетера при цьому знижується. Використання для середнього шару нейлону (наприклад у катетерах Edwards «Uniweave») підвищує жорсткість і термостійкість катетерів.
Однією з якостей, яку повинен мати зовнішній шар катетера, є рентгеноконтрастність. Це досягається просочуванням зовнішнього шару катетера барієм або вісмутом. Процес просочування розм’якшує зовнішній шар і може залишати вади на його поверхні, що збільшує тромбогенність катетера. Для того щоб максимально знизити можливість тромбоутворення, катетери покриваються тонким шаром силікону або іншого нетромбогенного матеріалу. Властивості поліетилену і поліуретану, які застосовуються для зовнішнього шару катетерів, різні. Поліетилен більш стійкий до розм’якшуючого ефекту, контрастного просочення, проте він менш термостійкий і може порівняно легко відділятися від інших шарів стінки катетера, тому поліетиленові катетери не можна піддавати термічній обробці. Поліуретан є більш термостійким матеріалом, що покращує «пам’ять» катетера. На сьогодні випускають катетери одноразового використання, тому для зовнішнього шару застосовується поліетилен.
Ангіографічні катетери характеризуються трьома основними розмірами: діаметром просвіту, зовнішнім діаметром і довжиною катетера. Діаметр просвіту визначається максимальним діаметром провідника, який можна провести через цей катетер, і виражається або в дюймах, або в міліметрах. Зовнішній діаметр катетера визначається в одиницях French (F). У табл. 1.5 наведені розміри зовнішніх і внутрішніх діаметрів стандартних і тонкостінних катетерів в одиницях French, дюймах і міліметрах. Ці таблиці свідчать, що застосування тонкостінних катетерів значно зменшує розмір пункційного отвору артерії при однакових діаметрах просвіту стандартних і тонкостінних катетерів.
Таблиця 1.5. Зовнішні та внутрішні діаметри стандартних і тонкостінних катетерів
| Розмір, F | Зовнішній діаметр | Внутрішній діаметр | ||||
| стандартний | тонкостінний | |||||
| дюйми | мм | дюйми | мм | дюйми | мм | |
| 5 | 0,065 | 1,67 | 0,026 | 0,66 | 0,034 | 0,86 |
| 6 | 0,078 | 2 | 0,036 | 0,91 | 0,046 | 1,1 |
| 7 | 0,091 | 2,33 | 0,046 | 1,17 | 0,058 | 1,47 |
| 8 | 0,104 | 2,67 | 0,056 | 1,42 | 0,068 | 1,73 |
| 9 | 0,118 | 3 | 0,064 | 1,63 | 0,078 | 1,98 |
Довжина катетерів варіює залежно від мети застосування, їх конфігурації та місця передбачуваної пункції артерії (використання плечового або стегнового доступу). Наприклад, довжина катетерів pigtail зазвичай становить 110 см; катетерів Judkins — 100 см; брахіальних катетерів — 80—100 см.
Для катетеризації різних відділів серцево-судинної системи (ЛШ, великих судин і їх гілок) застосовують катетери різної конфігурації. При атеросклерозі аорти і коронарних артерій виконують вентрикулографію, аортографію і коронарографію, тому в цій главі буде розглянута конфігурація катетерів, призначених для проведення цих досліджень.
Для виконання аортовентрикулографії застосовують катетери (NIH, Gensini, Lehman, pigtail; рис. 1.18) з кількома ( від 4 до 8) отворами на верхівці, причому торцевий отвір може бути як відкритим, так і запаяним.
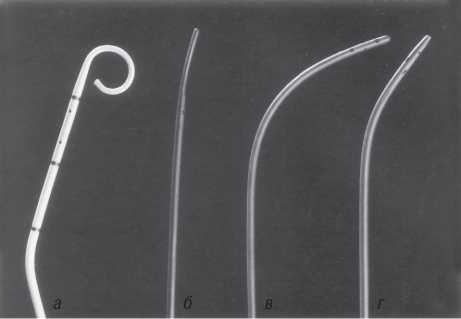
Рис. 1.18. Катетери для аорто- і вентрикулографії: вентрикулографічний катетер pigtail (а); вентрикулографічний катетер Lehman (б); катетер NIH (в); катетер Gensini (г)
Катетери NIH — товстостінні катетери з рухливою верхівкою, що мають 6 бічних отворів; торцевий отвір верхівки цих катетерів запаяний.
Катетери цього типу вводяться в просвіт артерії через артеріотомний отвір або інтродюсер; при цьому зазвичай використовують плечовий доступ. Ці катетери легко проходять через стенозований аортальний отвір. Незважаючи на закритий торцевий отвір, вони зберігають стабільне положення при введенні великої кількості контрасту з великою швидкістю.
Катетери Lehman — тонкостінні катетери із плетеного дакрону, які мають закриту верхівку, що стоншується, з 4 бічними отворами. Ці катетери застосовують для виконання вентрикуло- і аортографії через плечовий доступ.
Катетери Gensini також є тонкостінними дакроновими катетерами, однак, на відміну від попередніх катетерів, крім 6 бічних мають також і торцевий отвір. Їх застосування та спосіб введення в артеріальне русло такі самі, як і для катетерів Lehman.
Найчастіше для аортовентрикулографії застосовують катетери pigtail. Їх стійке положення при швидкому введенні великої кількості контрасту забезпечується за допомогою завитої верхівки, яка має торцевий і велику кількість бічних отворів. Дистальний сегмент катетерів pigtail може бути прямим або вигнутим стосовно тіла катетера під кутом 145 або 155°, що полегшує катетеризацію ЛШ при стенозі аортального отвору в комбінації з горизонтальним положенням осі серця. Кількість бічних отворів може бути різною — від 4 до 6. Більша кількість отворів не дає ефекту підвищення швидкості введення контрасту й разом з тим підвищує ймовірність тромбоутворення у верхівці катетера, оскільки контраст може не доходити до торцевого отвору.
Для коронарографії застосовують катетери Sones, Amplatz, Judkins, багатоцільові катетери і катетери для шунтів коронарних артерій.
Катетери Sones (рис. 1.19) так само, як і багатоцільові катетери Schoonmaker and King (рис. 1.20), призначені для селективної катетеризації як лівої, так і правої коронарної артерії. За допомогою багатоцільових катетерів може бути також виконана вентрикулографія. Спочатку коронарографію за методикою Sones виконували шляхом введення катетера через артеріотомний отвір після виділення плечової артерії, пізніше ці катетери стали вводити в артеріальне русло шляхом черезшкірного плечового доступу з використанням інтродюсерів. Багатоцільові катетери, конфігурація яких подібна до конфігурації катетерів Sones, призначені для виконання вентрикулокоронарографії через стегновий доступ. На сьогодні катетери Sones і багатоцільові катетери використовують рідко.

Рис. 1.19. Катетери Sones

Рис. 1.20. Катетери Schoonmaker and King: багатоцільовий катетер (а); катетер для шунта правої коронарної артерії (далі в рисунках і таблицях — ПКА) (б); катетер для шунта лівої коронарної артерії (далі в рисунках і таблицях — ЛКА) (в); катетер для внутрішньої грудної артерії (г)
Катетеризація коронарних артерій катетерами Judkins і Amplatz проводиться черезшкірно зі стегнового доступу. Для катетеризації як лівої, так і правої коронарної артерії в обох випадках використовують два різні типи катетерів. Техніка катетеризації коронарних артерій за допомогою катетерів Judkins (рис. 1.21, 1.22) порівняно з катетерами Amplatz (рис. 1.23, 1.24) є більш простою, однак катетери Amplatz можна з успіхом застосовувати у тих випадках, коли катетеризація коронарних артерій катетерами Judkins утруднена, особливо тоді, коли устя коронарних артерій розміщені високо. Техніка катетеризації коронарних артерій цими катетерами буде докладно викладена нижче.
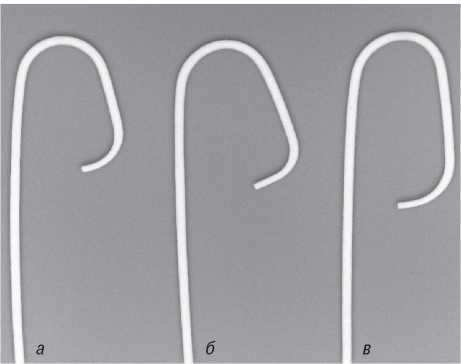
Рис. 1.21. Катетери Judkins для катетеризації ЛКА: JL 3.5 (а); JL 4.0 (б); JL 5.0(в)
Рис. 1.22. Катетери Judkins для катетеризації ПКА: JR 4.0(а); JR 5.0(б); JR 6.0(в)

Рис. 1.23. Катетери Amplatz для катетеризації ЛКА: ALI (а); ALII (б); ALIII (в)

Рис. 1.24. Катетери Amplatz для катетеризації ПКА: ARI (а); ARII (б)
Є кілька модифікацій катетерів, призначених для дослідження аортокоронарних шунтів і шунтів від лівої внутрішньої грудної артерії (див. рис. 1.20б, в, г). Техніка катетеризації венозних шунтів має особливості, тому в цих випадках можна використовувати катетери різної конфігурації.
Інструментарій для лікувальних інтервенційних процедур
Провідникові катетери
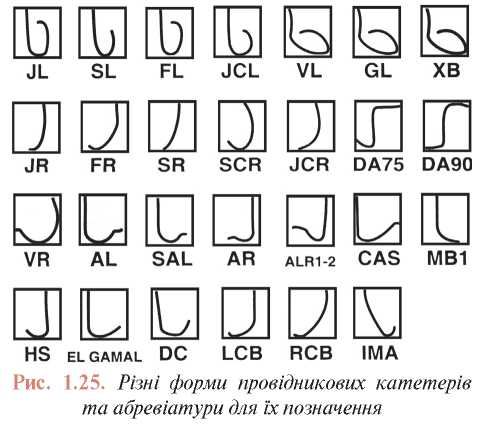
При проведенні коронарних втручань використовують велику кількість різних варіантів провідникових катетерів (рис. 1.25). Багато компаній-виробників випускають провідникові катетери різної форми, структури й розміру.
Однією із важливих фізичних характеристик провідникового катетера є співвідношення зовнішнього діаметра катетера та його внутрішнього просвіту (товщини стінки катетера) (табл. 1.6).
Таблиця 1.6. Стандартні, великі та дуже великі провідникові катетери
| Розмір, F | Стандарт | Великі | Дуже великі |
| 6 | <0,061 | 0,062–0,065 | >0,066 |
| 7 | <0,071 | 0,072–0,075 | >0,076 |
| 8 | <0,079 | 0,080–0,085 | >0,086 |
| 9 | <0,089 | 0,090–0,095 | >0,096 |
| 10 | <0,099 | 0,100–0,107 | >0,108 |
Внутрішній діаметр провідникового катетера забезпечує адекватне проходження обладнання для проведення втручань (внутрішньокоронарний провідник, балон-катетер, стент на балоні, ротаблатор, апарат для атеректомії і т.п.) (табл. 1.7).
Таблиця 1.7. Пристрої для коронарних втручань та мінімальний рекомендований внутрішній діаметр провідникового катетера
| Пристрій | Внутрішній діаметр | Дюйми |
| Балон-катетер | Стандартний | 0,060 |
| «Балони, що цілуються» | 0,086 | |
| Перфузійний | 0,070 | |
| Стенти | GRS 2 мм; 2,5 мм | 0,077 |
| GRS 3 мм | 0,080 | |
| GRS 3,5 мм; 4 мм | 0,086 | |
| PSS | 0,086 | |
| Ротаблатор (розмір бура) | 1,25 мм; 1,5 мм | 0,076 |
| 1,75 мм | 0,084 | |
| 2 мм; 2.15 мм | 0,092 | |
| 2,25 мм; 2,38 мм; 2,5 мм | 0,107 | |
| Лазерна коронарна ангіопластика (ексимерний лазер) | 1.4 мм | 0,084 |
| 1,8 мм | 0,084 | |
| 2 мм | 0,092 | |
| DCA Atherocath | 5 F | 0,105 |
| 6 F | 0,105 | |
| 7 F, 7 FG | 0,105 | |
| TEC Catheter | 5,5 F, 6 F | 0,092 |
| 6,5 F, 7 F | 0,100 | |
| 7,5 F | 0,107 | |
| IVUS (катетер для інтракоронарного УЗД) | 0,076 | |
| Ангіоскопічний катетер | 0,077 | |
Деякі виробники випускають провідникові катетери «пасивного дизайну». Вони досить жорсткі, але міцні, проте їх не можна використовувати для активних маніпуляцій під час катетеризації (введення катетера із глибоким фіксуванням при усуненні суперпроксимальних уражень лівої і правої коронарної артерії, при катетеризації артерій, розміщених нетипово).
Слід зазначити, що існують провідникові катетери «активного дизайну». Подібні катетери характеризуються м’якою, але міцною стінкою, більшою рухливістю в просвіті аорти та мають властивості, які допомагають активно маніпулювати ними в усті коронарної артерії.
Усі провідникові катетери мають подібну структуру: жорстку основу, що складається з переплетених між собою сталевих дротів, які визначають як жорсткість, так і гнучкість катетера; захисну (зовнішню) оболонку, виготовлену із сучасного полімеру, яка має усі необхідні властивості, що забезпечують атромбогенність, пов’язану з підвищеною гладкістю поверхні; внутрішню поверхню катетера, вкриту PTFE або силіконом, що забезпечує безперешкодне ковзання всіх інструментів, необхідних для проведення втручання (див. табл. 1.7).
Найбільш важливими характеристиками провідникового катетера є здатність забезпечувати коаксіальне розміщення верхівки катетера щодо устя коронарної артерії (подібна позиція оптимальна для проведення всіх втручань) і висока опірність катетера поздовжньому скручуванню (kinking control). Особливістю сучасних провідникових катетерів також є атравматичність і рентгеноконтрастність верхівки катетера (забезпечує безпечне й зручне розміщення верхівки катетера щодо устя артерії). Великий просвіт артерії дає можливість адекватно контрастувати коронарне русло при розміщенні в просвіті катетера різних інструментів для ангіопластики, а особливі (спеціальні) форми катетера дозволяють стійко й безпечно катетеризувати устя лівої і правої коронарної артерії при будь-якому варіанті відходження з коронарного синуса (див. табл. 1.7; 1.8, рис. 1.26).
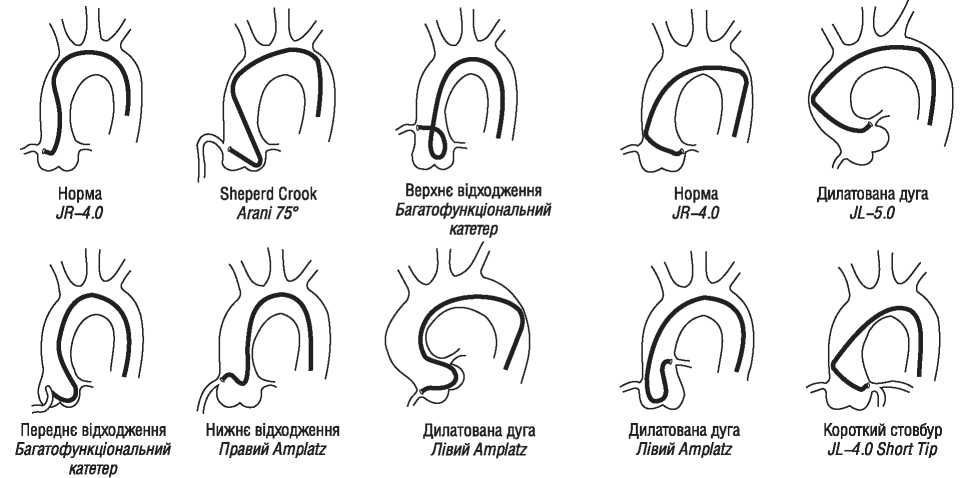
Рис. 1.26. Вибір форми провідникового катетера на основі анатомічних особливостей пацієнта (форма аорти та місце формування устя коронарних артерій)
Таблиця 1.8. Рекомендації щодо використання провідникових катетерів залежно від їх конфігурації
| Конфігурація | Провідниковий катетер | Характеристика катетерів
Рекомендації щодо їх використання |
| Judkins left | JL | Більшість випадків втручань на ЛКА |
| Fermoral left | FL | |
| Jadkins «C» left | JCL | Має більш м’який перехід у згинах і, отже, може використовуватися для проведення DCA в ЛКА, при встановленні біліарних стентів і ротаблатора |
| Voda left | VL | Катетер має хорошу «протидію до відштовхування» із використанням протилежної стінки аорти. Доцільно використовувати при складних анатомічних особливостях (звивисті артерії, стенози на згинах, кальциновані стенози, повні оклюзії і т.п.) у басейні ЛКА у випадках, коли необхідна підвищена «підтримка до відштовхування» |
| Voda left, high takeoff | VLHT | |
| Extra-backup | XB | Катетер має хорошу «протидію до відштовхування» із використанням протилежної стінки аорти. Доцільно використовувати при складних анатомічних особливостях (звивисті артерії, стенози на згинах, кальциновані стенози, повні оклюзії і т.п.) в басейні ЛКА у випадках, коли необхідна підвищена «підтримка до відштовхування |
| Geometic left | GL | Катетер має хорошу «протидію до відштовхування» із використанням протилежної стінки аорти. Доцільно використовувати при складних анатомічних особливостях (звивисті артерії, стенози на згинах, кальциновані стенози, повні оклюзії і т.п.) у басейні ЛКА у випадках, коли необхідна підвищена «підтримка до відштовхування |
| Amplatz left | AL | Завдяки багатофункціональній конфігурації катетер можна застосовувати при передньо-верхньому розміщенні устя ПКА. Доцільно використовувати при складних анатомічних особливостях у басейні ЛКА (особливо при «незручному» відходженні огинаючої гілки (тут і далі в рисунках і таблицях — ОГ ЛКА), а також при катетеризації венозних шунтів |
| Judkins right | JR | Використовують при катетеризації ПКА, при більшості катетеризацій венозних шунтів на ЛКА. Може забезпечити коаксіальне розміщення верхівки катетера по відношенню до устя венозного шунта до ПКА |
| Femoral right | FR | Використовують при катетеризації ПКА, при більшості катетеризацій венозних шунтів на ЛКА. Може забезпечити коаксіальне розміщення верхівки катетера відносно устя венозного шунта до ПКА |
| No-torque right | NR | |
| Shephеrd Crook right | SCR | При катетеризації ПКА типу Shephеrd Crook можна використовувати для катетеризації венозних шунтів на ЛКА |
| Shani right | SHR | При катетеризації ПКА типу Shephеrd Crook можна використовувати для катетеризації венозних шунтів на ЛКА |
| Judkins «C» right | JCR | Використовують при проведенні DCA у ПКА та венозних шунтах на ЛКА з горизонтальним нижнім відходженням устя, а також для проведення біліарних стентів |
| Double-loop Arani (75°, 90°) | DA 75,90 | Відмінна «протидія відштовхуванню» під час катетеризації ПКА при наявності складних анатомічних особливостей або типу Shephеrd Crook |
| Voda right | VR | Відмінна «протидія відштовхуванню» під час катетеризації ПКА при наявності складних анатомічних особливостей або типу Shepherd Crook, або венозних шунтів на ЛКА |
| Voda right, Shephеrd Crook | VRSC | Відмінна «протидія відштовхуванню» під час катетеризації ПКА при наявності складних анатомічних особливостей або типу Shepherd Crook, або венозних шунтів на ЛКА |
| Amplatz right | AR | Використовують для втручань на ПКА або венозних шунтах ПКА |
| Amplatz left–right (modified Amplatz) | ALR 1-2 | Те саме, що AL і AR. Дещо довший, ніж AR, і коротший, ніж AL. Використовують як універсальний катетер для катетеризації ПКА і ЛКА |
| Multipurpose | MP | Використовують для катетеризації ПКА або венозних шунтів до ПКА, для різних модифікацій шунтів до ЛКА, а також для катетеризації ПКА або венозних шунтів до ПКА |
| Sones | SON | Використовують для катетеризації ПКА або венозних шунтів до ПКА, для різних модифікацій шунтів до ЛКА. Використовують при катетеризації ПКА або венозних шунтів до ПКА |
| Hockey — Stick | HS | Зручний провідниковий катетер для катетеризації устя ПКА при горизонтальному відходженні устя або венозних шунтів на ЛКА |
| Champ | Champ | Зручний провідниковий катетер для катетеризації устя ПКА при горизонтальному відходженні устя або венозних шунтів на ЛКА |
| EL Gamal bypass | ELG | Зручний провідниковий катетер для катетеризації устя ПКА при горизонтальному відходженні устя або венозних шунтів на ЛКА |
| Left coronary bypass | LCB | Використовують у тих самих випадках, що JR і HS, а також для катетеризації венозних шунтів на ЛКА при горизонтальному розміщенні устя |
| Right coronary bypass | RCB | Використовують для катетеризації венозних шунтів на ЛКА з горизонтальним розміщенням устя, може забезпечити коаксіальне розміщення верхівки катетера відносно устя венозного шунта на ПКА |
| Internal mammary | IMA | При проведенні коронарних втручань на лівій та правій грудній артерії або в нативних артеріях позаду артеріальних анастомозів |
| Castillo | CAS | Нагадує конфігурацію лівого катетера типу Amplatz. Часто застосовують при бронхіальному доступі до ЛКА (те саме, що Simmons) |
| Doctor’s choice | DS | Багатофункціональний катетер для ПКА або ЛКА з хорошою «протидією до відштовхування» від протилежної стінки аорти |
Коронарна ангіопластика в передній міжшлуночковій гілці лівої коронарної артерії (див. рис. 1.26; табл. 1.9). Ліва коронарна артерія, як правило, відходить від передньоверхньої частини коронарного синуса (позиція anterior — superior). Для катетеризації лівої коронарної артерії в більшості випадків придатний катетер JL-4 (Judkins-4.0). У ситуаціях, коли устя лівої коронарної артерії розміщені у верхній частині коронарного синуса або корінь аорти менший нормального, використовують катетер JL-3.5. Після катетеризації устя лівої коронарної артерії та фіксації верхівки провідникового катетера у стовбурі лівої коронарної артерії необхідно «м’яко» повернути катетер проти годинникової стрілки, щоб надати верхівці катетера напрямок у передній міжшлуночковій гілці (направити верхівку катетера в передній міжшлуночковій гілці лівої коронарної артерії). У випадку визначення у пацієнта короткого стовбура (<1 см) з метою уникнення обструкції огинаючої гілки або передньої міжшлуночкової гілки раціонально використовувати провідникові катетери типу Judkins зі спеціально вкороченою верхівкою. Коаксіальне розміщення верхівки катетера і стовбура лівої коронарної артерії оптимально визначати в проекції LAO-50° і Caudal-30°. У деяких випадках можна використовувати проекцію RAO-5° і Caudal-20°.
Таблиця 1.9. Рекомендації щодо вибору провідникових коронарних катетерів
| Судина | Конфігурація | Варіант провідникового катетера |
| ПКА | Дуга аорти | |
| нормальна | JR 4.0, AL 1.0, AR 1.0 | |
| дилатована | JR>5.0, AL>2.0, AR>2.0 | |
| звужена | JR 3.0, AL<0.75 | |
| Орієнтація устя коронарної артерії | ||
| нормальна | JR, AL, AR | |
| передньоверхня | AL, HS, MP, HS | |
| нижня | MP, AR, JR | |
| типу Shephеrd Crook | AL, SCR, VR, VRSC, DA, ELG, SHR, Champ | |
| горизонтальна | JR, HS | |
| ЛКА | Дуга аорти | |
| нормальна | JR 4.0, AL 2.0, VL 4.0,
GL 4.0 |
|
| дилатована | JR>5.0, AL>2.0, VL>4.0, GL>4.0 | |
| звужена | JR 3.5, VL3.5, GL3.5 | |
| Орієнтація устя коронарної артерії | ||
| нормальна, передня | JL, AL, VL, GL | |
| задня | AL, VL, GL | |
| верхня | JL, VL, GL | |
| суперверхня | ||
| ПМШГ* ЛКА | JL3.5, JL (передня) | |
| ОГ ЛКА | JL4.5, AL, JL (задня) | |
| Венозний шунт до ПКА | Орієнтація устя коронарної артерії | |
| нижня | MP, AL, AR, JR | |
| горизонтальна | JR, AL, MP | |
| Венозний шунт до ЛКА | Орієнтація устя коронарної артерії | |
| горизонтальна | JR, HS, MP, AL, RCB, AR | |
| верхня | HS, ELG, LCB, MP, SCR, Champ, SHR | |
*Тут і далі в таблицях та рисунках: передня міжшлуночкова гілка.
Коронарна ангіопластика в огинаючій гілці лівої коронарної артерії (див. рис. 1.26, табл. 1.9). Ангіопластика в огинаючій гілці лівої коронарної артерії часто пов’язана зі складнощами в проведенні внутрішньо-коронарного провідника і балона-катетера через уражений сегмент або через сегмент устя огинаючої гілки лівої коронарної артерії без вираженого звуження. Така складність визначається насамперед відходженням огинаючої гілки від стовбура лівої коронарної артерії (ця анатомічна особливість добре візуалізується в додатковій проекції Spider (LAO-55 і caudal-20 ). Стабільного коаксіального розміщення верхівки провідникового катетера щодо устя огинаючої артерії можна досягти за допомогою «м’якої» ротації провідникового катетера за годинниковою стрілкою при використанні конфігурації катетера JL-4.0 при наявності великого стовбура лівої коронарної артерії. Катетер JL-5.0 може бути ефективно використаний при дилатованому корені аорти або у випадку, якщо устя лівої коронарної артерії відходить у передньому напрямку (позиція anterior). Провідниковий катетер типу Amplatz можна ефективно використовувати при дуже гострому куті відходження огинаючої гілки від стовбура лівої коронарної артерії або при нижній позиції (inferior) огинаючої гілки лівої коронарної артерії. Катетер типу Amplatz має виражений «опір до відштовхування», що необхідний при проходженні коронарного провідника через оклюзії, субтотальні стенози або звивисті сегменти коронарних артерій або при занадто дистальному розміщенні стенозу. Проте при глибокій фіксації верхівки катетера в руслі лівої коронарної артерії необхідно уникати повної інтубації стовбура (!) або однієї з великих гілок лівої коронарної артерії. Крім того, при надмірно активному маніпулюванні навіть «м’якою» верхівкою провідникового катетера можлива дисекція стінки стовбура, передньої міжшлуночкової гілки або огинаючої гілки лівої коронарної артерії ще на етапі катетеризації устя (лівої коронарної артерії). Для найбільш досвідчених кардіологів при проведенні втручань на огинаючій гілці або передній міжшлуночковій гілці лівої коронарної артерії рекомендується також використання катетерів типу Vodaleft або катетерів, схожих за формою (XB, Ebu-medtronic). При застосуванні цих катетерів використовується протилежна стінка аорти для посилення «опору до відштовхування». Необхідність у цьому виникає у результаті проходження коронарного провідника, балона-катетера або системи стент + балон через різко звужені сегменти, звивисті артерії, хронічні оклюзії.
Коронарна ангіопластика в правій коронарній артерії. Особливістю катетеризації правої коронарної артерії часто є повна інтубація верхівкою провідникового катетера просвіту устя правої коронарної артерії, що призводить до різкого зниження тиску в просвіті коронарної артерії (див. рис. 1.26, табл. 1.9; рис. 1.27). Клінічно це проявляється різкою ішемією міокарда у відповідній ділянці, а ангіографічно виглядає як тривала затримка контрасту в правій коронарній артерії після припинення його введення через провідниковий катетер. Як правило, для стандартного відходження правої коронарної артерії та усунення стенозів у середній третині судини використовують катетери типу JR-4.0. Проте у випадку потреби посилення «підтримки відштовхуванню» провідникового катетера (при проходженні складних стенозів, оклюзій і т.п.) використовують катетери типу Amplatz-left і Hocky-Stick при відходженні правої коронарної артерії з верхньої частини коронарного синуса (позиція Superior, Shepherd Crook). Часто використовують катетери Amplatz-left, Hocky-Stick, катетер для внутрішньої грудної артерії, El Gamal, Voda right і катетер Arani із подвійною петлею (75°), які забезпечують найкраще коаксіальне розміщення верхівки катетера порівняно зі стандартним катетером Judkins. Хоча катетер Arani з подвійною петлею забезпечує відмінну «підтримку відштовхуванню», проте часто виникають складнощі з його установкою в устя коронарної артерії, у той час як катетер Voda right також забезпечує стійку підтримку, значно легше й безпечніше фіксується в усті коронарної артерії.
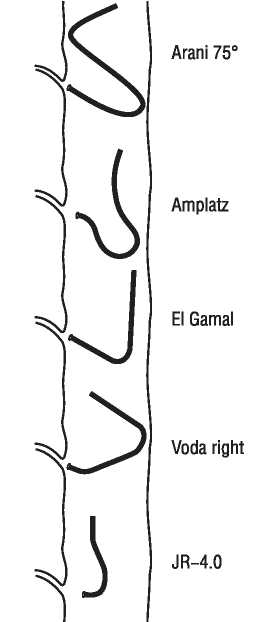
Рис. 1.27. Вибір форми катетера та спосіб катетеризації устя ПКА (типу Shepherd Crook)
Коронарна ангіопластика у венозних шунтах
Венозні шунти до правої коронарної артерії, як правило, відходять від передньої стінки аорти на кілька сантиметрів вище кореня аорти й зручно катетеризуються JR, багатофункціональним катетером або Amplatz (лівим або правим). Венозні шунти до передньої міжшлуночкової гілки лівої коронарної артерії і огинаючої гілки лівої коронарної артерії зазвичай починаються вище й латеральніше шунтів до правої коронарної артерії (див. табл. 1.9). Для катетеризації шунтів на передній міжшлуночковій і огинаючій гілці лівої коронарної артерії, крім правого коронарного катетера, можуть знадобитися катетери El Gamal, катетер для лівого венозного шунта Hochey-Stick, JR або Amplatz.
Коронарна ангіопластика у внутрішній грудній
артерії . Внутрішня грудна артерія найкраще катетеризується з використанням спеціального провідникового катетера для внутрішньої грудної артерії. У всіх видах провідникових катетерів можуть бути або не бути бічні отвори, розміщені на верхівці і які забезпечують додатковий кровотік при глибокому фіксуванні провідникового катетера в системі коронарних артерій. Саме такі катетери доцільно вибирати при проведенні втручань на оклюзованих сегментах, звивистих артеріях і дистально розміщених коронарних стенозах, оскільки в процесі катетеризації устя коронарної артерії може знадобитися глибока фіксація катетера. Наявність бічних отворів у дистальній частині катетера призводить до втрати контрастної речовини при контрольному контрастуванні, особливо якщо в просвіті катетера розміщені різні інструменти (внутрішньокоронарний провідник, балон-катетер, балон + стент). Крім того, бічні отвори дещо знижують пружність катетера й призводять до поперечного зламу катетера в місці розміщення цих отворів. Таким чином, розміщення бічних отворів забезпечує додатковий коронарний кровотік при складних катетеризаціях під час втручання на коронарних артеріях, однак це не зменшує травматизм устя коронарної артерії. Крім того, їх наявність погіршує якість контрольного контрастування коронарного русла до і після втручання.
Балони-катетери
Типи балонів-катетерів
На сьогодні для виконання ПКВ використовують катетери двох типів: «over-the-wear» (катетери навколо провідника) і «rapid exchange», або «monorail» (швидкозамінні катетери) (рис. 1.28).
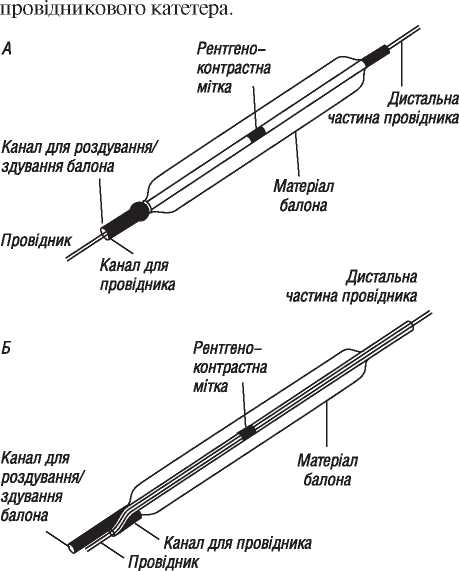
Рис. 1.28. Типи балонів-катетерів: балон-катетер «over-the-wire» (А); балон-катетер «monorail» (Б)
Катетери «over-the-wire» (рис. 128А) — стандартні двопросвітні балони-катетери із просвітом для провідника по всій довжині. У цій системі внутрішньокоронарний провідник і балон-катетер рухаються незалежно один від одного, що дозволяє залишати провідник за місцем ушкодження коронарної артерії, у той час як балон-катетер віддаляється з артерії у просвіт провідникового катетера. Ця система дозволяє також міняти провідники як поза провідниковими катетерами, так і в тих випадках, коли балон-катетер перебуває в просвіті
Недоліком балонів-катетерів «over-the-wire» є порівняно великий профіль, який не дозволяє застосовувати їх з провідниковими катетерами малого діаметра. Ці балони потребують значної підтримки з боку провідникового катетера при їх проведенні через ушкоджену ділянку коронарної артерії. Для зміни балона-катетера цього типу зі збереженням положення верхівки провідника за ушкодженою ділянкою коронарної артерії необхідні провідники, що мають подвійну довжину (>3 м). Для керування цією системою необхідно два лікаря.
Будова балонів-катетерів «monorail» (рис. 1.28Б) дозволяє проводити їх швидку заміну в коронарному руслі, використовуючи коронарні провідники звичайної довжини. Ці катетери по всій своїй довжині містять тільки один просвіт, який служить для роздування балона, а другий просвіт, де утримується провідник і який відкривається торцевим дистальним отвором, займає тільки 10–15 см дистального відділу. Внаслідок того, що подвійний просвіт є тільки в дистальній частині катетерів «monorail», товщина таких катетерів менша, ніж систем «over-the-wire», що поліпшує візуалізацію артерії при контрольній коронарографії, яку проводять з балоном, залишеним всередині провідникового катетера.
Переваги цих катетерів над катетерами «over-the-wire» полягають у тому, що, по-перше, вони не вимагають довгих провідників для зміни балонів-катетерів, а по-друге, такими системами під час операції може керувати один хірург без допомоги асистента. Недоліком катетерів «monorail» є необхідність значної підтримки з боку провідникових катетерів, причому маніпулюючи одночасно провідником, провідниковим катетером і балоном-катетером, лікар стикається з певними труднощами. Крім того, у тих випадках, коли необхідна зміна провідника, потрібно видалення із провідникового катетера всієї системи.
Перфузійні балони-катетери є варіантом катетерів «monorail», які, на відміну від інших систем, мають бічні отвори більш проксимально і дистально балона, у просвіті, що призначений для провідника. При цьому течія крові потрапляє в коронарну артерію дистальніше роздутого балона, що дозволяє збільшити час його роздування. Фірми-виробники випускають перфузійні катетери двох розмірів: 60S і 40S. Катетери 60S перфузують через балонну систему 40–50 мл крові за 1 хв. Катетери 40S більш низькопрофільні, проте через них у дистальне русло проходить 30–40 мл крові за 1 хв. Застосування цих катетерів показано в тих випадках, коли хворий не може перенести тривалого роздування балона внаслідок ішемії міокарда, що розвивається. Перфузійні катетери застосовують при тяжкій стенокардії, зниженій функції ЛШ або в тих випадках, коли морфологія атеросклеротичного ураження артерії вимагає пролонгованого роздування балона (кальциновані або фіброматозні бляшки). Застосування перфузійних катетерів обмежує їх порівняно велика товщина, яка утруднює або унеможливлює їх просування по звивистих ділянках артерії.
Характеристики балонів-катетерів і вибір балонних систем для ПКВ
Балони в балонах-катетерах усіх систем виготовлені з матеріалу, який більшою або меншою мірою стійкий до нагнітання тиску. За цією характеристикою всі балони поділяють на «піддатливі» і «непіддатливі». Роздування піддатливих балонів вище номінального («паспортного») тиску призводить до збільшення діаметра роздутого балона приблизно на 10–20% понад установленого. Непіддатливі балони зберігають свій розмір навіть у тих випадках, коли тиск у них перевищує номінальний на кілька атмосфер (рис. 1.29).
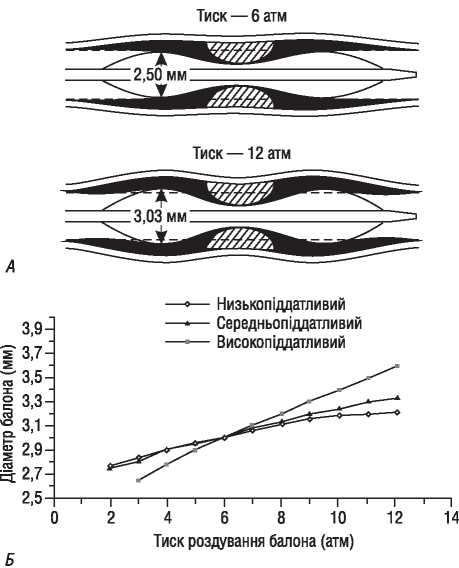
Рис. 1.29. Схема дилатації балоном-катетером ригідного стенозу з використанням різного тиску (А); криві залежності розміру балона (Б) від внутрішньобалонного тиску для трьох видів матеріалів різної піддатливості. Усі три балони при тиску 6 атм. мають номінальний розмір 3 мм
Балони, виготовлені з різних матеріалів, мають переваги і недоліки. Піддатливі балони дешевші; це дозволяє використовувати кілька балонів-катетерів при проведенні однієї операції, але піддатливі балони при роздуванні (особливо при повторних) під дією тиску вище номінального перевищують заданий розмір, що призводить до дисекції інтими. У тих випадках, коли такі балони використовують для ПКВ при множинних ураженнях коронарних артерій, ангіопластику необхідно виконувати спочатку в судинах малого діаметра.
Важливими характеристиками балонів-катетерів є їх здатність легко просуватися по руслу до місця ушкодження коронарних артерій (trackability) і передавати прикладену хірургом силу по катетеру до балона (pushability). Ці характеристики залежать від властивостей матеріалу, з якого виготовлений балон-катетер.
Здатність катетера легко просуватися всередині артерії — функція як балона-катетера, так і провідника. Тяжке просування балона всередині судини, незважаючи на прикладені зусилля, може бути викликане тертям балона-катетера або об провідник, або провідниковий катетер, або стінку судини. Хоча балони-катетери і маркуються за цією характеристикою, її важко оцінити об’єктивно. Також важко оцінити об’єктивно здатність катетера передавати прикладену хірургом силу. У більшості стандартних систем цей показник приблизно однаковий.
Більшість балонів-катетерів пропускають внутрішньокоронарні провідники товщиною 0,010–0,014 дюйма. Однак при виборі балона-катетера для ПКВ необхідно враховувати, що в певних випадках (наприклад при субтотальних стенозах) можуть знадобитися тверді внутрішньокоронарні провідники розміром 0,018 дюйма. У таких випадках для ангіопластики необхідно вибирати системи «over-the-wire», провідниковий просвіт яких здатний пропускати подібні провідники.
При виборі діаметра балона для ПКВ виходять із того, що співвідношення діаметра роздутого балона і діаметра артерії, що дилатується, повинне бути 1:1. Співвідношення розмірів балона та просвіту артерії більше 1,2:1,0 може призвести до розвитку ускладнень. Діаметр просвіту артерії визначають за сегментом, який йде за ураженою ділянкою. Для визначення діаметра просвіту артерії використовують відомий діаметр провідникового катетера (7 F — 2,31 мм, 8 F — 2,64 мм, 9 F — 2,97 мм, 11 F — 3,63 мм). Просте візуальне визначення необхідного розміру балона менш точне, проте більшість хірургів застосовують цей метод.
Ще одним важливим параметром є довжина балона, яка повинна максимально відповідати довжині ураженого сегмента.
При виборі балона для ангіопластики особливу увагу приділяють його профілю (розміру балона у стиснутому стані). Низькопрофільні балони краще проходять через звивисті та змінені сегменти коронарних артерій. В більшості сучасних систем для ПКВ профіль балона становить <1 мм (0,033–0,035 дюйма).
Внутрішньокоронарні провідники
Внутрішньокоронарний провідник — керований металевий дріт малого діаметра (0,010–0,018 дюйма), яка проникає по коронарним артеріям та їх гілкам до місця атеросклеротичного ураження і проходить через це місце в дистальний відділ ураженої судини. Здатність внутрішньокоронарних провідників проникати в різні гілки коронарного русла багато в чому залежить від варіантів конфігурації їх верхівки, яких існує велика кількість (табл. 1.10). На характеристики провідника також впливає конструкція їх центрального стрижня (рис. 1.30). Більш коротка відстань від дистального кінця стрижня до верхівки роблять провідник більш твердим і поліпшують можливості керування провідником, проте при більшій відстані від дистального кінця стрижня до верхівки збільшується гнучкість провідника, що поліпшує його прохідність у звивистих і уражених сегментах коронарних артерій.
Таблиця 1.10. Верхівки внутрішньокоронарних провідників для ПКВ
| Кількість вигинів | Параметри верхівки | Локалізація ураження | Характеристика коронарної анатомії | Застосування |
| Один вигин | Вигин малий або середній. Діаметр вигину менше діаметра стовбура ЛКА (подібний J) | Проксимальні відділи ПМШГ, ОГ і ПКА | Судини прямі, кут відходження від стовбура невеликий, діаметри стовбура і артерій, що відходять, практично не відрізняються | Максимально доступні ураження |
| Два вигини | Проксимальний і дистальний, вигини малі або середні.
Загальний діаметр кривизни приблизно дорівнює діаметру стовбура. Діаметр дистального вигину дорівнює діаметру гілки |
Проксимальний і середній відділи ПМШГ, ОГ і ПКА | Звивистість судин середня, гілки відходять під малим або середнім кутом, різниця діаметра стовбура і гілок, що відходять, невелика | Проксимальний кут покращує доступ до бокових гілок великих судин. Дистальний кут полегшує доступ до гілок малого діаметра |
| Малий дистальний вигин.
Проксимальний вигин більш крутий |
Проксимальний середній і дистальний відділи ПМШГ, ОГ і ПКА | Щільні стенози. Наявність трифуркації або двох гілок, що відходять у різних направленнях (наприклад септальна і діагональна гілки ПМШГ) | Малий діаметр дистального вигину спрямований до локалізації в центрі просвіту, не дозволяючи провіднику потрапляти в бокові гілки | |
| Крутий дистальний вигин.
Коротке плече і мала відстань між вигинами; проксимальний вигин такий самий |
Дистальні судини; переважно гілка тупого краю | Судини, що мають виражені вигини. Різниця діаметрів донорської судини і гілок значна (гілка відходить під гострим кутом і вигином подібним латинській букві h) | Крутий дистальний кут дозволяє проходити в бокові гілки під необхідним кутом і по вигинам артерії | |
| Довге проксимальне плече | У випадках, коли стовбур ЛКА має великий діаметр, а кут відходження гілок (особливо ОГ) значний | Довге проксимальне плече збільшує діаметр кривизни, покращуючи доступ у великі гілки | ||
| Дуже довге проксимальне плече (дистальне — коротке) | Тяжкі стенози проксимальних відділів ОГ (рідше — ПМШГ) | Кут відходження судини від стовбура приблизно 90° із наступним вигином. Стеноз складний, локалізований одразу за вигином | Дуже довге проксимальне плече робить дистальний вигин незалежним, що покращує проходження місця ураження | |
| Обидва плеча довгі | Великі некоронарні артерії (аорта, здухвинні артерії) | Обидва великих плеча необхідні для проходження по ексцентричному просвіту, часто — в зоні аневризми | ||
| Потрійний або множинний вигин | Вигини середні: дистальне плече коротке, загальний діаметр великий | Середній і дистальний відділи всіх великих судин | Різниця в діаметрах між стовбуром ЛКА і гілками дуже виражена; круте відходження ОГ або ПМШГ | Перехід від довгого до короткого плеча плавний; проходження провідника по вигнутому проксимальному сегменту артерії гладке |
Довжина провідника може бути стандартною (140 см) і збільшеною до 280–300 см. Довгі провідники мають таку ж будову, як і стандартні. Їх використовують для зміни балонів-катетерів системи «over-the-wire» у тих випадках, коли дистальний кінець провідника повинен залишатися за місцем ураження артерії. Іншим способом зміни такого катетера є приєднання до початкового провідника іншого дроту довжиною 125–140 см. Катетери системи «monorail» припускають їх заміну за допомогою внутрішньокоронарних провідників звичайної довжини.
Характеристики внутрішньокоронарних провідників
При виборі внутрішньокоронарних провідників звертають увагу на такі характеристики, як жорсткість, керованість і гнучкість.
Жорсткість. Вибір провідників певної жорсткості залежить від мети, яку переслідує хірург. Більш м’які провідники є більш безпечними й легко проходять через звивисті ділянки. Більш жорсткі провідники краще піддаються контролю при їх обертанні й легше проходять через тяжкі стенози та оклюзії. Наджорсткі провідники забезпечують найкращу внутрішньокоронарну підтримку при установці стентів.
Керованість. Рух верхівки провідника, адекватний маніпуляціям, що виконуються хірургом, є однією з найбільш важливих характеристик провідника.
Гнучкість внутрішньокоронарного провідника залежить від відстані між його верхівкою і центральним стрижнем. Від цієї характеристики залежить імовірність травмування стінки судини при перетинанні провідником місця ураження.
Зрозуміло, що три перераховані характеристики провідників взаємозалежні. Так, при більшій жорсткості поліпшується керованість верхівкою провідника, однак втрачається її гнучкість, і навпаки.
Ще однією важливою характеристикою провідників є рентгеноконтрастність його дистальної частини. Рентгеноконтрастне покриття дистальної частини провідника дозволяє спостерігати за її просуванням у коронарному руслі, однак надмірна контрастність провідника може призвести до приховування важливих ангіографічних деталей ушкодження артерії, наприклад невеликої дисекції.
Додатковий інструментарій, що використовується при ПКВ
Y-подібні конектори. Для того щоб у провідниковий катетер можна було ввести контраст у той час, коли в ньому перебуває дилатаційна система, до проксимального отвору провідникового катетера приєднують Y-подібний конектор. Один з відділів Y-подібного конектора має ротаційний адаптер (Tuohy — Borst). Y-подібний конектор — акцесуарний інструмент, що дозволяє звести до мінімуму кровотечу, коли дилатаційна система перебуває у провідниковому катетері. Y-подібний конектор дозволяє також вводити контрастну речовину і вимірювати тиск в артерії незалежно від того, перебуває балонна система в провідниковому катетері чи ні. Якщо Y-подібний конектор приєднати до балона-катетера «over-the-wire», можна вимірювати тиск у коронарній артерії дистальніше місця її ушкодження.
Шприци для роздування балона. Для роздування балона існують одноразові шприци, за допомогою яких у балон під тиском вводять рідину (зазвичай — суміш контрастної речовини з 0,9% розчином натрію хлориду). Прилад для виміру тиску, наявний у шприці, дозволяє точно фіксувати тиск у роздутому балоні. Зазвичай балон роздувається під тиском 4–12 атм. до повного зникнення «зубця», який видно на початку роздування балона, у випадку правильної установки останнього. Проте деякі атеросклеротичні ураження містять кальцифікати або складаються переважно з фіброзної тканини, що іноді вимагає роздування балона під тиском >14 атм. Перероздування балона може призвести до дисекції судини або розриву балона.
Пристосування для керування провідником . На проксимальний відділ внутрішньокоронарного провідника, який розміщується поза балоном-катетером, насаджують і фіксують невеликий циліндричний затискач, що дозволяє хірургові маніпулювати провідником.
Інтродюсер для введення внутрішньокоронарного провідника в просвіт балона-катетера. Цей інструмент являє собою дуже тонку трубку, схожу на голку, з конічним дистальним відділом, що звужується. По цій трубці внутрішньокоронарний провідник вводять у провідниковий просвіт балона-катетера або Y-подібного конектора.
Коронарні стенти
За останні два десятиріччя ПКВ міцно зайняла одне з основних місць серед методів лікування хворих з коронарним атеросклерозом. Однак є дані, що балонна дилатація зруйнованої атеросклеротичної бляшки із супутнім пристінковим тромбоутворенням у 30–40% випадків ускладнюється гострою тромботичною оклюзією судини; всього ж тромботичні ускладнення виявляють у 2–12% випадків від загальної кількості коронарних ангіопластик. Ці ускладнення суттєво обмежують можливості ПКВ. Крім того, незважаючи на постійне вдосконалювання інструментарію й методів медикаментозного ведення хворих, яким виконують ПКВ, частота рестенозів практично залишається незмінною і становить приблизно 30% загальної кількості виконуваних балонних ангіопластик і значно підвищується у випадку дилатації хронічної оклюзії коронарних артерій і атеросклеротичної деструкції венозних шунтів. Для зменшення кількості несприятливих результатів ПКВ, а також для забезпечення тривалої стабільної функції коронарних артерій після проведення балонної ангіопластики розроблена методика імплантації стентів. Коронарний стент являє собою трубчастий металевий каркас судинної стінки, який імплантують у внутрішній просвіт у місце атеросклеротичного ураження коронарної артерії.
Перші експериментальні роботи з імплантації внутрішньосудинних протезів проведені ще наприкінці 60-х років ХХ ст. У 1969 р. опубліковані результати імплантації стентів у периферичні (стегнову й підколінну) артерії собак, виконані Ch. Dotter. При проведенні цього дослідження застосовували як пластикові трубки, так і спіралеподібні протези з нержавіючої сталі. Тромботична оклюзія всіх пластикових стентів відбувалася протягом перших 24 год. Імплантація спіралеподібних протезів з нержавіючої сталі сприяла частковому зниженню ризику тромбоутворення в стентованих сегментах. Проте від перших публікацій робіт Dotter до впровадження стентів у кардіологічну практику пройшло 18 років. Такий великий термін потрібен був для проведення значної кількості експериментальних досліджень, під час яких вибирали матеріали, придатні для імплантації в судинне русло, а також проводили розробки оптимальної конструкції стентів. Стенти повинні бути досить жорсткими для того, щоб чинити опір силі стиснення стінки артерії, і в той же час достатньо гнучкими для того, щоб їх можна було імплантувати у звивисті сегменти коронарних артерій або ж провести через такі сегменти. Ці властивості забезпечуються конструкцією стентів і характеристиками матеріалу, з якого вони виготовлені. Крім того, необхідно, щоб стент був нетромбогенним і стійким до корозії.
На сьогодні матеріали, з яких роблять стенти, що імплантуються в коронарні артерії, в основному відповідають перерахованим вище вимогам. Більшість стентів виготовляють із різних сплавів нержавіючої сталі (Wallstent, AVE Microstent, стенти Gianturco — Roubin, Palmaz — Schatz, ACS Multilink, NIR); застосовують також і інші метали: тантал (стенти Wiktor, Cordis, Strecker, Mayo), нітинол — сплав нікелю й титану (стенти Angiomed-USCI, SCIMED, INSTENT CardioCoil). Проводяться дослідження з використання полімерів (biodegradable stents). Переваги й недоліки кожного з перерахованих матеріалів будуть розглянуті нижче.
Коронарні стенти виготовляють або у вигляді трубок, що мають щілиноподібні прорізи (стенти Palmaz — Schatz, ACS Multilink, BeStent, NIR, SCIMED), сітчастих трубок (Wallstent), або у вигляді кільцеподібних дротяних конструкцій (стенти Gianturco — Roubin, Wiktor, Cordis, Strecker, INSTENT CardioCoil). Кожна конструкція має свої переваги й недоліки: трубчасті стенти не мають такої поздовжньої гнучкості, як стенти, що мають кільцеподібну дротяну конструкцію, проте вони здатні чинити більший опір радіальній силі, яку зумовлює стінка артерії. З цією метою конструкція кільцеподібних дротяних стентів була вдосконалена: розроблена конструкція дротяних стентів із з’єднаними між собою замкненими кільцями, що мають зиґзаґоподібний або синусоїдоподібний профіль (стенти Wiktor, Strecker, Cordis). Такі стенти, зберігаючи гнучкість, характерну для дротяних конструкцій, можуть чинити достатній опір радіальній силі судинної стінки. Дротяні стенти можуть бути виготовлені з цільного дроту або з декількох дротів, сплетених між собою (Wallstent, стент Angiomed-USCI).
За способом імплантації розрізняють стенти, що саморозширюються (Wallstent, INSTENT CardioCoil, Angiomed-USCI), та стенти, що розширюються за допомогою балона (стенти Palmaz — Schatz, Gianturco — Roubin, Cordis, Wiktor, ACS Multilink та ін. Стенти, що саморозширюються, підводять до місця ураження коронарної артерії за допомогою спеціальних катетерних систем доставки, які мають механізм фіксації стента в стисненому стані (оболонку). Стент після його доставки до місця ураження коронарної артерії вивільняється із системи доставки і самостійно розширюється; система доставки видаляється з коронарного русла. Стенти, що розширюються за допомогою балона, доставляють до місця ураження коронарної артерії в стисненому стані на балоні-катетері та імплантують після роздування балона. Для імплантації стентів як першого, так і другого типу потрібна попередня балонна дилатація ураженого сегмента коронарної артерії (предилатація). Ця процедура дозволяє зруйнувати атеросклеротичні бляшки, що мають жорстку фіброзну структуру; для цього при необхідності можна застосувати високий тиск при роздуванні балона. Повного руйнування подібних бляшок при імплантації стента без предилатації може не відбутися. Крім того, предилатація дозволяє створити канал, по якому стент буде підведений до місця ураження коронарної артерії без прикладання надмірних зусиль, що може стати причиною деформації стента.
Морфологічні зміни в стінці судини після імплантації стентів
Реакція судинної стінки на імплантацію стентів вивчена в кількох експериментальних дослідженнях. Стенти діаметром від 3 до 6 мм і довжиною від 15 до 50 мм, виготовлені з різних матеріалів різної конструкції, імплантували різним тваринам (кроликам, собакам, вівцям) у периферичні і коронарні судини, після чого проводили гістологічне дослідження стентованих сегментів у різні періоди після імплантації. Дослідження продемонстрували відсутність запальної і некротичної реакції з боку судинної стінки, однак відзначене деяке стоншення й незначно виражений фіброз медіальної стінки судини. Вживлення стента в судинну стінку і процес ендотелізації відбуваються протягом 3–8 тиж. Уже протягом перших кількох годин після імплантації поверхня стента покривається тонким шаром фібрину й тромбоцитів, що створює умови для подальшої ендотелізації. Стент поступово вростає в інтиму, його поверхня вкривається неоендотелієм. Кількість часу, яка потрібна для цього процесу, залежить від типу стента й виду експериментальних тварин. Palmaz і співавтори в експерименті на кроликах відзначали наявність незрілого ендотелію до кінця 1-го тижня; завершення ендотелізації відбувалося до кінця 8-го тижня. У собак ті ж стенти вкривалися ендотелієм протягом 3 тиж. За даними електронної мікроскопії встановлено, що структура ендотелію, що покриває стент, нічим не відрізняється від структури ендотелію нативної судинної стінки. Є деякі докази того, що ступінь ендотелізації стента перебуває в обернено пропорційній залежності від товщини стінки самого стента. Так, товщина ендотеліального шару, що вкривав стенти Palmaz — Schatz, склала близько 90 мкм, у той час як товщина ендотелію над стентами Gianturco — Roubin і Wallstent — 150–350 мкм, проте прямо порівнювати дані цих досліджень не можна через відмінності в технологіях, що застосовуються при їх виконанні. Дослідження на тваринах показали, що устя бічних гілок, що відходять від сегмента артерії, у якому було проведено стентування, залишаються відкритими, ці судини функціонують нормально.
В одному із ранніх досліджень по імплантації стентів у коронарні й периферичні артерії собак виявлено, що ендоваскулярні стенти мають низьку тромбогенність. Незважаючи на те що антикоагулянти і антитромботичні препарати експериментальним тваринам у цьому дослідженні не вводили, симптомів порушення кровообігу в руслі стентованих артерій у всіх дослідних собак не відзначено аж до закінчення експерименту (9 міс). При дослідженні судин цих тварин наявність необструктивного пристінкового тромбу виявили лише в 1 випадку; в інших артеріальних сегментах, де проведено стентування, ознак тромбоутворення не виявлено.
В експериментальних дослідженнях при імплантації стентів підбирали різні антикоагулянтні та антитромбоцитарні препарати. Найнижчий рівень тромбогенності відзначений у тварин, яким вводили гепарин, ацетилсаліцилову кислоту, дипіридамол і низькомолекулярні декстрани, порівняно з показником у контрольних тварин, яким медикаментозне лікування не проводили, а також у тварин, які одержували тільки ацетилсаліцилову кислоту, гепарин і дипіридамол.
Таким чином, в експериментальних дослідженнях встановлено, що стенти можуть бути з успіхом імплантовані як у периферичні, так і коронарні артерії. Виявлено, що стенти мають низьку тромбогенність, тому гостра тромботична оклюзія у стентованих артеріальних сегментах не є серйозною проблемою. Результати експериментальних досліджень були підставою для застосування стентів у кардіологічній практиці.
Саморозширювальний сітчастий стент Wallstent
У 1986 р. у коронарні артерії людині вперше імплантований саморозширювальний сітчастий стент Wallstent («Medinvent SA», Швейцарія). Цей стент є багатоволоконною конструкцією: складається з 20 металевих пасм, сплетених у подвійну спіраль (сітку), кожна з яких діаметром 0,06–0,09 мм (рис. 1.31).

Рис. 1.31. Саморозширювальний стент (Wallstent) під час імплантації в скляну трубку. Двошарова оболонка частково вилучена. Стенти нової модифікації (Wallstent Magic) вкриті оболонкою, яка при русі з цієї позиції вперед може повертатися у вихідне положення (можливо репозиціонування стента)
Спочатку Wallstent робили з хірургічної нержавіючої сталі Mediloy («Medinvent»); на сьогодні існують конструкції Wallstant, виготовлені з неферомагнітного сплаву на основі кобальту. Маса такого стента діаметром 5 мм становила 1,4 мг на 1 мм його довжини. Для імплантації в коронарні артерії й венозні шунти застосовують стенти довжиною від 15 до 30 мм.
Wallstent постачається в комплекті разом з катетерною системою доставки стента до місця ураження коронарної судини. Стент фіксований у дистальному відділі системи доставки у витягнутому за довжиною і стиснений за діаметром стані й покритий двошаровою оболонкою (мембраною). Катетерна система доставки стента має два просвіти: один (відкритий) служить для проведення системи по коронарному провіднику, інший (закритий) з’єднується із простором між зовнішнім і внутрішнім шарами мембрани. Під час підготовки стента до імплантації простір між зовнішнім і внутрішнім шарами мембрани заповнюють контрастним середовищем під тиском 3 атм.; при цьому повітря видаляють через мікроотвори, що є в дистальному відділі зовнішньої мембрани. Після наповнення міжмембранного простору контрастною речовиною кран цього просвіту закривають і відкритий просвіт системи промивають 0,9% розчином натрію хлориду. При промиванні цього просвіту відбувається зрошення стента через бічні отвори в стінці, прилягаючій до стента. Після установки стента в необхідному сегменті артерії оболонку, яка покриває стент, видаляють, відбувається мимовільне розширення стента з одночасним зменшенням його довжини. Великі бічні гілки і гілки, що відходять від основної артерії, частіше зберігають свою прохідність (рис. 1.32). Проте перший досвід імплантації сітчастих стентів свідчить, що оптимальні результати можна одержати при стентуванні венозних шунтів.
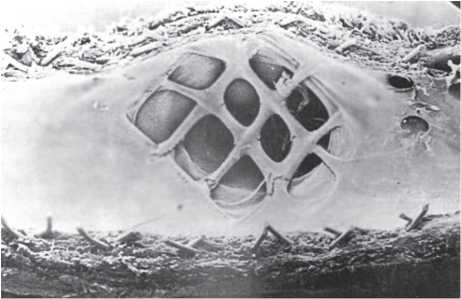
Рис. 1.32. Саморозширювальний стент (Wallstent) після імплантації у велику артерію в місці відходження бокової гілки (пояснення в тексті)
Сучасні модифікації Wallstent мають кут сплетення 110–130°, що знижує радіальний тиск стінки судини на 30% і дозволяє зменшити кількість металу на одиницю довжини стента на 7%. Укорочення сучасних конструкцій Wallstent після їх розширення значно менше порівняно з класичними конструкціями. Застосування полімерних технологій при виготовленні мембран, що покривають стент, дозволило створити низькопрофільні оболонки. Діаметр стисненого і покритого оболонкою Wallstent становить 1,57 мм. Перед імплантацією Wallstent виконують стандартну балонну ангіопластику ураження коронарної артерії з використанням провідникових катетерів 8 F і довгих триметрових внутрішньокоронарних провідників (або провідників magnetic). Діаметр стента в розширеному стані повинен перевищувати діаметр неушкодженого сегмента артерії, що прилягає до ушкодженого сегмента, на 10–20%. Ця відмінність у діаметрі сприяє більш щільному контакту стента із судинною стінкою й виключає мимовільну міграцію стента. Довжина стента повинна перевищувати довжину ураженого сегмента: стент повинен повністю покривати ділянку дисекції. Після підготовки, техніка якої описана вище, стент по внутрішньокоронарному провіднику підводять до місця деструкції артерії, після чого видаляють оболонку. У момент початку видалення оболонки й розширення дистальної ділянки стента до того, як відбулося зіткнення стента зі стінкою судини, хірург повинен візуально переконатися в тому, що стент встановлений у правильній позиції: у цей момент положення стента ще піддається корекції. Для зведення травми до мінімуму не можна вживати спроб змінити положення стента після того, як його дистальний кінець розкрився й вступив у контакт зі стінкою судини. Системи нового зразка дозволяють просувати оболонку в колишню позицію по частково розкритому стенту, що дає можливість перемістити його в іншу позицію. Переконавшись у тому, що стент розміщений правильно, проводять роздування просвіту між зовнішньою та внутрішньою мембраною під тиском 4 атм. і плавно витягають оболонку під рентгенологічним контролем; у міру видалення оболонки стент мимовільно розширюється та імплантується в стінку ураженого сегмента артерії. Наприкінці процедури до місця імплантації стента по провіднику вводять балон-катетер і роздувають його, що дозволяє розширити стент до заданого діаметра і ввести металевий каркас у судинну стінку (іноді цю процедуру називають «Swiss kiss»).
Саморозширювальні сітчасті стенти типу Wallstent достатньо гнучкі для проникнення у звивисті ділянки артерій та імплантуватись в такі ділянки. Ці стенти легко візуалізуються завдяки мембрані, наповненій контрастною речовиною. Еластичні сили стента після його імплантації створюють достатній опір контрактильній силі судинної стінки і суворо зберігають заданий діаметр просвіту. Дротяна сітчаста трубка є геометрично стабільною конструкцією: перекосів і міграції при встановленні таких стентів не відзначено — вони швидко розширюються до певного рівня і адаптуються до сегментів судин з діаметром, що зменшується. Таким чином, саморозширювальні сітчасті стенти поєднують позитивні якості трубчатих та кільцеподібних стентів, хоча є менш жорсткими, ніж перші, та менш гнучкими, ніж другі.
Імплантацію перших саморозширювальних стентів у коронарні артерії виконували в ургентних випадках з приводу гострих тромботичних ускладнень ПКВ як альтернативу ургентним шунтувальним операціям. Досвід цього дослідження показав, що ургентна імплантація стентів у таких ситуаціях є більш перспективною операцією, ніж ургентна операція АКШ: жоден з 17 випадків ургентної імплантації стентів не завершився гострою оклюзією, що ускладнилася гострим ІМ або смертю хворого, у той час як внутрішньогоспітальна смертність після ургентної АКШ, виконаної з приводу гострої оклюзії, викликаною ПКВ, становить 15%, а частота ІМ у цих випадках коливається від 31 до 71%. Пізніше було опубліковано повідомлення про імплантацію саморозширювальних сітчастих стентів 38 хворим з гострою тромботичною оклюзією коронарних артерій, що розвинулася після ПКВ. Гострий або підгострий тромбоз стентованих сегментів відзначений у 5 хворих, у результаті чого настала смерть 1 хворого, ще у 1 діагностований Q-ІМ; у 2 хворих виконували АКШ. Частота ускладнень після ургентного стентування, що виконувалося з приводу гострих оклюзій, які виникли в результаті ускладнень ПКВ, була значно нижчою, ніж при ургентних АКШ. У 34 хворих цієї групи через 5 і 23 міс виконували контрольну коронарографію, при якій у 4 з них виявлені рестенози в області імплантації. Таким чином, частота рестенозів при ургентній імплантації стентів значно нижча такої після планових і ургентних ПКВ. На сьогодні вважається, що гостра оклюзія коронарних артерій є найбільш документованим показанням до імплантації стентів. Перші планові імплантації саморозширювальних сітчастих стентів були проведені в Лозанні з приводу рестенозів коронарних артерій, що розвинулися після ПКВ. У цьому дослідженні у 50 хворих з рестенозами після ПКВ проведена успішна імплантація стентів. У госпітальний період значні ускладнення (Q-ІМ, ургентне АКШ, смерть) розвинулися у 3 хворих (1 хворий помер під час ургентного АКШ внаслідок хірургічного ускладнення — нерозпізнаної тампонади серця). Контрольну коронарографію виконували у 34 хворих цієї групи протягом 8 міс спостереження. Рестенози у стентованих сегментах виявлені у 4 хворих; оклюзія в місці імплантації стента — у 3. У 1991 р. опублікований результат багатоцентрового дослідження імплантації саморозширювальних стентів. Ці результати не можна назвати оптимальними, однак при їх оцінці необхідно враховувати, що це були перші клінічні дослідження з імплантації стентів, тому показання, техніка імплантації, методи післяопераційного ведення хворих ще не були остаточно визначені.
Перші саморозширювальні стенти імплантували також у стенозовані венозні шунти; негайні і відстрочені результати таких імплантацій виявилися кращими, ніж результати імплантації стентів у нативні коронарні артерії. Автори досліджень вважають, що це пов’язано з тим, що венозні шунти мають більший діаметр порівняно з коронарними артеріями й, отже, у венозні шунти потрібні стенти більшого діаметра (у дослідженні Urban і співавторів середній діаметр стентів, імплантованих у венозні шунти, склав 4,7 мм). Можливо, важливу роль відіграє також відсутність у венозних шунтах вазомоторного тонусу. Поєднання незначної кількості ускладнень і рестенозів при імплантації стентів у венозні шунти свідчить про доцільність використання при цьому саморозширювальних сітчастих стентів.
Таким чином, показаннями до імплантації Wallstent є гострі тромбози коронарних артерій та рестенози, що розвиваються після ПКВ, а також деструкції венозних шунтів.
На сьогодні Wallstent та інші стенти імплантують з метою профілактики гострих тромбозів і рестенозів коронарних артерій під час первинних ендоваскулярних втручань, проведених при гострих і хронічних клінічних формах коронарного атеросклерозу. На підставі експериментального й клінічного досвіду автори Wallstent визначили протипоказання до його імплантації:
- Виражена лійкоподібність сегмента (внаслідок циліндричної форми стентів, що виготовляються на сьогодні)
- Дуже сильний вигин ураженого сегмента
- Поганий кровотік в ураженому сегменті артерії після імплантації стента внаслідок недостатнього дистального відтоку або вираженої колатералізації
- Труднощі, що виникають при дотриманні антитромбоцитарного і антикоагулянтного режимів.
Відзначено також, що причиною гострого тромбозу є стенти малого діаметра, тому автори не рекомендують імплантувати саморозширювальні сітчасті стенти в артерії діаметром <3 мм.
Як відзначалось вище саморозширювальні сітчасті стенти стали першими стентами, імплантованими в судинне русло людини. З часів перших імплантацій розроблена велика кількість інших модифікацій стентів, що викликало зменшення кількості імплантацій Wallstent, проте інтенсивні роботи з удосконалення саморозширювальних стентів продовжуються. Для виробництва само-розширювальних стентів на сьогодні використовується нітинол (сплав нікелю і титану) — метал, що має пам’ять. З цього матеріалу виготовлені саморозширювальні стенти «Angiomed-USCI», «INSTENT CardioCoil». He всі саморозширювальні стенти, виготовлені із нітинолу, мають багатоволоконну сітчасту конструкцію. Деякі з них («INSTENT») виготовляють у вигляді простої одноволоконної нітинолової спіралі. Впровадження нітинолових стентів на сьогодні перебуває в стадії клінічного тестування.
Трубчастий стент Palmaz — Schatz
Одними з перших балон-розширюваних стентів, які почали застосовуватися в клінічній практиці, є стенти Palmaz — Schatz. Роботи з конструювання перших балон-розширюваних стентів розпочаті в 1981 р. J. Palmaz. У 1986 р. з’явилася публікація, у якій повідомлялося про досвід імплантації великих (6; 8 і 10 мм у діаметрі) внутрішньосудинних протезів у здухвинні артерії собак. Незважаючи на те що в цьому дослідженні гепарин тваринам не призначали, просвіт здухвинних артерій у 10 випадках з 11 залишався відкритим і лише в одному випадку розвинулася гостра тромботична оклюзія судини. Ендотелізація стентів завершувалася на 3-й тиждень. Такі ж результати отримані в експериментах з імплантацією стентів в атеросклеротично змінену аорту кроликів. Роботи з імплантації стентів у коронарні артерії собак виконані разом з R. Schatz. При цьому застосовували стандартні балони для коронарної ангіопластики. Діаметр стентів становив 3–3,5 мм. Перші досвіди показали, що стент є занадто ригідним, щоб проходити через звивисті сегменти артерій або встановлюватися в них; такий стент був придатний тільки для імплантації в проксимальний відділ правої коронарної артерії. Для створення більшої гнучкості стент Palmaz довжиною 15 мм був розділений на два трубчасті сегменти по 7 мм кожний, з’єднані між собою гнучкою металевою розпіркою довжиною 1 мм («суглоб» стента). На сьогодні стент у стисненому стані являє собою дві трубки з діаметром 1,6 мм і довжиною 7 мм кожна, що мають велику кількість щілеподібних прорізів довжиною 3,5 мм і з’єднаних між собою гнучким тонким дротом довжиною 1 мм. У розширеному стані стент за конфігурацією нагадує кристалічну структуру алмазу (рис. 1.33). Сучасна система доставки стента включає стент Palmaz — Schatz, розміщений на гнучкому поліетиленовому балоні, що має рентгеноконтрастні відмітки для ідентифікації проксимальної й дистальної точок стента. Система доставки має також оболонку, що покриває всю систему ( у тому числі стент) і забезпечує збереження стента під час доставки до ураженого сегмента коронарної артерії. Дистальна точка оболонки також має рентгеноконтрастний маркер. Стенти Palmaz — Schatz виготовляють із нержавіючої сталі.
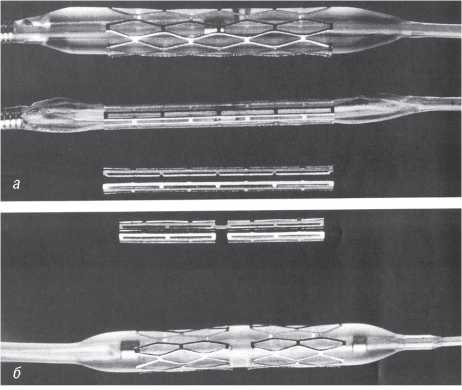
Рис. 1.33. Трубчатий стент Palmaz — Schatz: оригінальний коронарний стент Palmaz — Schatz (а); стент Palmaz — Schatz складається із двох сегментів довжиною 7 мм кожний, що з’єднані металевою розпіркою («суглобом») для збільшення гнучкості (б)
Для імплантації стентів Palmaz — Schatz існують деякі анатомічні обмеження:
- наявність атеросклеротичного ураження в артеріальному сегменті, діаметр якого <3 мм;
- наявність ураження, довжина якого >10 мм;
- наявність великих артеріальних гілок, що відходять від ураженого сегмента.
При імплантації стентів Palmaz — Schatz застосовують провідникові катетери 8 F із внутрішнім діаметром 0,079 або 0,084 дюйма. Застосування провідникових катетерів із внутрішнім діаметром 0,084 дюйма переважає, оскільки введення контрастної речовини, необхідне при імплантації стента, по такому провіднику проводиться легше. Після катетеризації устя коронарної артерії виконують предилатацію стенозу балоном діаметром 2,5 мм; при цьому необхідно використовувати коронарні провідники довжиною 3 м для заміни балона-катетера на систему доставки з фіксованим на ній стентом. По створеному каналу до місця ушкодження артерії підводять стент. Вирішальним моментом є ретельний вибір положення стента у місці ураження артерії. Для цього при виборі позиції слід контрастувати русло артерії і, орієнтуючись на рентгеноконтрастні маркери, встановити стент так, щоб центр стенозу збігався із центром стента. Переконавшись, що ця умова дотримана, оболонку, що покриває стент, видаляють і проводять роздування балона, на якому розміщено стент. Оскільки балон, що застосовується у системі доставки, не є достатньо міцним, то повного розширення стента при його роздуванні не відбувається, тому необхідне додаткове розширення стента іншим балоном.
Рестенози після імплантації стентів Palmaz — Schatz
Імплантацію перших стентів Palmaz — Schatz виконували в плановому порядку у хворих зі стабільною стенокардією. Результати лікування перших 213 хворих опубліковано в 1991 р. Імплантація 1 стента виконана у 88% випадків; іншим пацієнтам імплантовані >2 стентів, оскільки довжина уражень у цих хворих перевищувала 15 мм. У пацієнтів, яким імплантували 1 стент, рестенози відзначені в 20% випадків. Кількість рестенозів збільшилася до 50% у хворих, яким імплантовано декілька стентів. Fajadet і співавтори повідомили про досвід імплантації стентів Palmaz — Schatz у 79 хворих. Загальне число рестенозів у цих хворих протягом 6-місячного спостереження склало 15,2%. У 1992 р. з’явилося повідомлення про первинні результати багатоцентрового дослідження, у яке ввійшли 206 хворих, 97% з яких перебували під спостереженням 6 міс. Рестенози в популяції хворих високого ризику (імплантація 2 стентів або імплантація стентів при рестенозі) спостерігалися в 36% випадків; при імплантації одиничних стентів при первинних стенозах частота рестенозів склала 16% (якщо після імплантації стента залишковий стеноз не спостерігався, то в цих випадках частота рестенозів становила 6%). Подібні дані отримані в дослідженні Savage і співавторів: імплантація стентів при первинних стенозах ускладнилася рестенозом у 14% випадків, у той час як при імплантації стентів при рестенозі повторний стеноз відзначений у 38% хворих. У багатоцентровому дослідженні, що проводилося в Бельгії та Нідерландах (BENESTENT), порівнювали віддалені результати ПКВ (258 пацієнтів) та імплантації стентів Palmaz — Schatz (262 пацієнти) при стабільній стенокардії й первинних ураженнях коронарних артерій. Отримані віддалені результати кількісного ангіографічного дослідження, проведеного у 92% цих хворих. Частота рестенозів у групі хворих, яким виконували імплантацію стентів, склала 22%; у групі ПКВ — 32%. У рандомізованому дослідженні Stent Restenosis Study (STRESS) також порівнювали результати ПКВ й імплантації стентів Palmaz — Schatz у хворих зі стабільною стенокардією і об’єктивним підтвердженням ішемії. Критерії дослідження включали:
1. Наявність первинних уражень нативних коронарних артерій.
2. Стенози довжиною <15 мм.
3. Діаметр уражених сегментів >3 мм.
Частота успішно проведеної процедури при імплантації стентів склала 96,1% (усього — 207 хворих); при ПКВ — 83% (усього — 203 хворих). Частота рестенозів у групі пацієнтів з імплантованими стентами склала 29,1%, а в групі хворих, яким виконана ПКВ, — 42,7%. Таким чином, за результатами вищенаведених досліджень встановлено, що частота рестенозів при оптимальних результатах імплантації стентів у нативні коронарні артерії при їх первинному ураження та довжині стенозів <15 мм значно нижча, ніж при ПКВ цих же уражень.
Стенти Palmaz — Schatz можуть бути успішно імплантовані при атеросклеротичному ураженні венозних аортокоронарних шунтів. За даними різних досліджень загальна частота рестенозів при імплантації стентів у венозні шунти перебуває в межах від 16 до 29%; при цьому відзначено, що при імплантації стентів у сегменти шунтів, що раніше були дилатовані, частота рестенозів підвищується до 47%. Однак і цей показник нижчий, ніж частота рестенозів після ПКВ венозних шунтів. За результатами ретроспективного дослідження, проведеного Douglas і співавторами, рестенози після ПКВ розвиваються в 64% випадків, їх кількість збільшується до 80% при ПКВ стенозів аортовенозного сполучення.
У публікації про багатоцентрове дослідження, що проводилося з 1988 по 1991 р. за участю 1189 хворих, повідомляється про перебіг стенокардії внаслідок рестенозів після імплантації стентів Palmaz — Schatz. Стенокардія середнього й високого функціонального класу у хворих з рестенозом (звуження просвіту >50%) після стентування спостерігалася тільки в 32,5% випадків. Медикаментозну терапію проводили у 30,3% хворих з ангіографічно підтвердженим рестенозом (ступінь звуження становив у середньому 69%), у 16% хворих зі ступенем звуження просвіту в середньому до 80% виконали планову АКШ; у цих хворих симптоматика була більш виражена. Повторну балонну ангіопластику виконували у 39,7% пацієнтів. Ускладнень після ПКВ не відзначено. Дані ангіографічного та ендоваскулярного УЗД підтверджують теорію механізму виникнення рестенозів, що розвиваються в місці імплантації стентів. Згідно з цією теорією рестенози є результатом вторинної проліферації неоінтими через отвори трубчастого стента — реакцією на компресію стінки судини, що чинить стент.
У клінічній практиці імплантація трубчастих стентів Palmaz — Schatz при дотриманні умов, про які згадувалося вище, викликає відносно малу кількість тромботичних ускладнень і ресте-нозів. Про популярність стентів цієї конструкції свідчить той факт, що до 1997 р. їх продано більше чверті мільйона. У 1994 р. стенти Palmaz — Schatz схвалені FDA (США) для лікування пацієнтів із симптоматичною ІХС. До недоліків застосування цих стентів можна віднести їх ригідність і анатомічні обмеження. Зараз розробляються та впроваджуються інші конструкції трубчастих стентів з використанням інших матеріалів і з різними варіантами базисного дизайну і довжини.
Дротяний стент Gianturco — Roubin
Дротяний кільцеподібний балон-розширюваний стент Gianturco — Roubin (Cook Inc.) виготовляють із одноволоконного дроту хірургічної нержавіючої сталі діаметром 0,006 дюйма. Дріт обгорнутий навколо дуже м’якого балона-катетера таким чином, що через кожний повний оберт навколо балона дріт U-подібно «розвертається назад» на 180° (рис. 1.34, 1.35). Така конструкція стента дозволяє йому вільно розширюватися при роздуванні балона без зміни довжини. Матеріал, з якого виготовлений балон, товстіший та м’якший матеріалу, з якого виготовляють балони для звичайної ангіопластики. Застосування цього матеріалу збільшує профіль балона, проте значно знижує ризик ушкодження стента при його доставці до ураженого сегмента. Стенти довжиною 12 і 20 мм (розміри визначаються від першого до останнього повного кільця) монтуються виробником на балони довжиною 20 і 30 мм відповідно. На балон нанесено два рентгеноконтрастні маркери, що позначають проксимальну і дистальну точки стента. Перше й останнє повні кільця стента розміщуються на 2–3 мм у напрямку внутрішньо від маркерів. Мінімальний діаметр стентів Gianturco — Roubin при їх розширенні становить 2 мм; максимальний — 4 мм. Випускають також стенти діаметром 2,5; 3 і 3,5 мм.
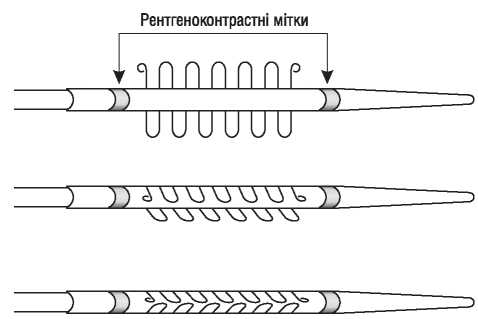
Рис. 1.34. Дротяний стент Gianturco — Roubin. Стент виготовлено із хірургічно нержавіючого стального дроту діаметром 0,006 дюйма, накручується по типу серпантину на балон. Два рентгеноконтрастних маркера відзначають проксимальну і дистальну точки стента
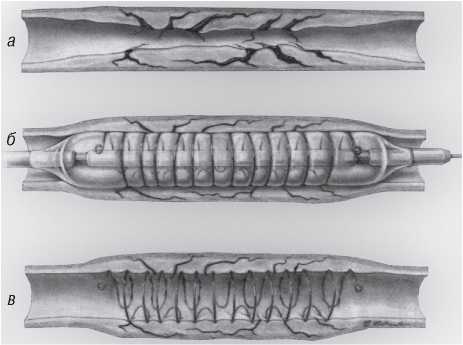
Рис. 1.35. Імплантація дротяного стента Gianturco — Roubin у коронарну артерію після її попередньої дилатації балоном-катетером. Зона коронарного стенозу після предилатації: відзначаються ділянки розриву і відшарування інтими (а). Імплантація стента за допомогою роздутого балона (б). Оптимальний геометричний ефект після імплантації стента (в)
Розробку стента почав C. Gianturco у 1979 р. Автор досліджував можливості застосування стен-та в периферичних артеріях. У 1985 р. стент адаптований для використання в коронарному руслі в спільній роботі з G. Roubin. Перші експерименти на собаках продемонстрували можливість легкої імплантації стента в коронарні артерії собак, а також стійке збереження функції стентованих сегментів. У 1987 р. FDA дало згоду на проведення першого етапу дослідження стента в клінічній кардіології, спонсорованого автором (G. Roubin).
У цьому дослідженні стент застосовували при гострих тромботичних ускладненнях ПКВ. Розвитку Q-ІМ у хворих, яким був імплантований стент, не відзначено; до 8-го дня вони були виписані зі стаціонару. На підставі результатів першого етапу дослідження FDA схвалило проведення подальших багатоцентрових досліджень, спонсорованих власником патенту і виробниками стента. 1 червня 1993 р. FDA дозволило застосування стента в широкій клінічній практиці.
При імплантації стентів Gianturco — Roubin необхідно приділити особливу увагу відбору додаткового інструментарію. Для імплантації стентів діаметром <3 мм придатні провідникові катетери 8 F із внутрішнім діаметром 0,077 дюйма. Для стентів діаметром 3,5 або 4 мм використовують провідникові катетери 8 F із внутрішнім діаметром 0,089 дюйма або провідникові катетери 9 F. Рекомендується, щоб діаметр розширеного стента на 0,5 мм перевищував діаметр стентованого сегмента. Отже, у випадку ураження сегмента артерії діаметром 3 мм необхідний провідниковий катетер із внутрішнім діаметром 8 F або катетер 9 F. Для проведення балона зі стентом потрібні адаптери Tuohy — Borst з великим просвітом (>6 F). Зазвичай при імплантації стентів Gianturco — Roubin застосовують правий і лівий катетери Judkins, віддаючи перевагу катетерам з короткою верхівкою. При низькому відходженні устя лівої коронарної артерії, при вираженій звивитості її проксимального відділу, а також при катетеризації венозних шунтів, що мають сполучення з лівою стінкою аорти, використовують катетери left Amplatz. Для катетеризації венозних шунтів, що мають сполучення із правою стінкою аорти і відходять низько, застосовують багатоцільові катетери. Необхідно вибирати такі провідникові катетери, які створюють достатню підтримку системі доставки стента при перетинанні місця ураження артерії.
Для імплантації стентів Gianturco — Roubin найчастіше користуються надгнучкими коронарними провідниками діаметром 0,016 дюйма (USCI Hyperflex). Не так часто застосовують провідники діаметром 0,018 дюйма (USCI Hyperflex або ACS High Torque Floppy). Ці провідники необхідні для створення більшої сили підтримки при проведенні системи доставки стента через коронарне русло в тих випадках, коли ушкодження артерії локалізується в середніх або дистальних відділах за звивистими ділянками артерій. При імплантації стентів відбирають провідники, довжина яких дозволяє зробити заміну балона-катетера на систему доставки стента.
Імплантацію стента Gianturco — Roubin виконують у тих випадках, коли після первинної ПКВ визначається значна дисекція інтими, при якій існує ризик гострої оклюзії артерії. По можливості (у тих випадках, коли довжина ураженої ділянки не перевищує 1 см) необхідно віддавати перевагу стентам довжиною 12 мм, оскільки вони містять меншу кількість металу й, отже, є менш тромбогенними, ніж стенти довжиною 20 мм. Крім того, ці стенти легше проходять у звивисті ділянки артерій. У тих випадках, коли є труднощі при ангіографічній оцінці ступеня дисекції артерії, автори рекомендують застосовувати довгі стенти. Досвід показав, що дисекція, не покрита стентом, найчастіше є причиною гострого тромбозу стентованого сегмента артерії. Результати тривалих спостережень продемонстрували, що найкращі результати досягаються в тих випадках, коли співвідношення діаметра стента та діаметра артерії становить 0,9±1,1.
При проведенні стента по судинному руслу за допомогою системи доставки не повинно виникати відчуття опору, що вимагає додаткового надмірного зусилля. Якщо в проксимальній ділянці артерії є звуження, які будуть перешкоджати проведенню стента, необхідно виконати попередню дилатацію цих сегментів. Перед імплантацією хірург повинен переконатися в тому, що в місці стенозу відсутні ділянки кальцифікації, що утруднюють дилатацію, оскільки кальцифікати можуть зігнути кільця стента при його розширенні. Безпосередньо перед розширенням стента необхідно впевнитися у тому, що позиція стента обрана правильно. При цьому необхідно пам’ятати, що повні (360°) кільця стента розміщуються на 3 мм всередину від кожного маркера. Контрольна коронарографія допомагає візуалізувати кільця, розміщені між проксимальним і дистальним маркерами, і вибрати точне положення стента. Розмістивши стент у точній відповідності з ушкодженням артерії, проводять роздування балона під тиском 4–5 атм. протягом 15–30 с, на якому розміщений стент. Спочатку роздувають балон до 4 атм. Якщо цього недостатньо для повного розширення стен-та, необхідно роздувати балон до 5–6 атм. Високий тиск при роздуванні стента не рекомендується, тому що це може призвести до деформації кілець стента: діаметр балона на 0,5 мм більший діаметра стента, а стенти Gianturco — Roubin виготовлені з досить піддатливого матеріалу. Проте у судинах діаметром >4 мм (наприклад у венозних шунтах) допускається роздування балона під більш високим тиском (максимум 9 атм.). Після повного розширення стента балон протягом 15 с здувають до мінімального профілю і поступово видаляють у просвіт провідникового катетера, залишаючи внутрішньокоронарний провідник за стентованим сегментом; виконують контрольну коронарографію. У деяких випадках, незважаючи на точну оцінку довжини ушкодженої ділянки, виявляється, що дистальніше місця імплантації стента спостерігається залишкова дисекція. У таких ситуаціях може бути виконана імплантація другого стента в дистальний сегмент. При цьому перевагу слід віддавати стенту довжиною 12 мм, оскільки такі стенти більш вільно проходять через стентовані сегменти. Проходження другого стента здійснюється легше в тих випадках, коли раніше стентована ділянка не зігнута; це виключає зіткнення першого стента з другим і їх ушкодження. Якщо ж попередньо було визначено, що ділянка дисекції >20 мм, можна планувати імплантацію двох стентів, однак при цьому перший стент імплантують у дистальний сегмент, а другий — у проксимальний. Унаслідок того, що кільця в стентах Gianturco — Roubin не є замкненими, не можна виключити пролапс інтими, що відшарувалася в просвіт судини. Цей дефект може бути виправлений шляхом повторного роздування балона; для цього рекомендується використовувати балон, здатний витримати високий тиск зі збільшеною експозицією роздування. Крім цього, може бути виконана імплантація другого стента всередині стентованого сегмента.
За даними багатоцентрового реєстраційного дослідження, проведеного з серпня 1988 по лютий 1992 р., виконано 1255 імплантацій стентів Gianturco — Roubin; у 779 випадках імплантували довгі стенти (20 мм), у 476 — короткі (12 мм). Імплантація довгих стентів проведена успішно в 95% випадків; коротких — у 96,9%. Смертність при імплантації довгих стентів склала 2,7%; Q-ІМ діагностований у 3% випадків, не-Q-ІМ — у 4,2%. Ургентну ПКВ виконали у 4,6% хворих. При імплантації коротких стентів ці показники склали 4,1; 5,6; 4,7 і 3,6% відповідно.
У дослідженні, проведеному в Університетському госпіталі Алабами (США), імплантація стентів Gianturco — Roubin виконана у 118 хворих, у 7,6% з них імплантація стентів ускладнилася тромбозом. У всіх випадках, крім одного, ПКВ була проведена успішно; в одному випадку виконане ургентне АКШ.
Аналіз даних іншого дослідження визначив фактори, що були причиною тромбозів стентованих сегментів. До них належать:
- залишкова ділянка дисекції, непокрита стентом;
- малий (<2,5 мм) діаметр стента.
Залишкову дисекцію відзначено в 6,4% випадків без розвитку тромботичних ускладнень і в 44% випадків імплантація стентів ускладнилася тромбозом. Малий діаметр стента також є значним і незалежним предиктором тромбоутворення в стентованому сегменті.
У багатоцентровому реєстраційному дослідженні є дані аналізу коронарограм, виконаних у 338 хворих у віддалений післяопераційний період (181±47 днів). Середній ступінь первинних стенозів склав 46,3±31,3%. Рестенози, які визначалися як повторні звуження стентованих сегментів артерій на >50%, виявлені у 136 хворих. Опубліковані дані віддаленого (5±2 міс) коронарографічного обстеження хворих, яким в Університетському госпіталі Алабами проведена імплантація стентів Gianturco — Roubin у 146 коронарних сегментах. Загальна кількість рестенозів у цьому дослідженні склала 45%. При аналізі різних коронарографічних умов імплантації стентів виявлені деякі фактори, що впливають на розвиток рестенозів. По-перше, стентування простих стенозів супроводжувалося розвитком рестенозів у 14%, а складних стенозів — у 50% випадків (р<0,002). По-друге, імплантація стентів малих (<2,5 мм) діаметрів викликала розвиток рестенозів у 55% випадків, у той час як імплантація стентів діаметром >3 мм супроводжувалася розвитком рестенозу в 31% випадків (р<0,02). По-третє, у тих випадках, коли співвідношення діаметра стента й діаметра судини відповідало 0,9–1,1, кількість рестенозів склала 30%; коли ж це співвідношення було вище або нижче зазначених цифр, рестенози відзначали відповідно у 48 і 55% випадків (р<0,02). Таким чином, імплантація стентів великого діаметра в артеріальні сегменти, в яких локалізуються неускладнені атеросклеротичні бляшки, при співвідношенні діаметра стента й стентованого сегмента 0,9–1,1 максимально зменшить кількість рестенозів. Опубліковані дані, що при імплантації стентів у венозні шунти рестенози відзначені в 30% випадків. Така порівняно невелика кількість рестенозів при імплантації стентів у венозні шунти зумовлена, мабуть, великим діаметром шунтів.
Імплантація стентів Gianturco — Roubin при гострих оклюзіях, що розвиваються після ПКВ, значно зменшила кількість реоклюзій, які є причиною внутрішньогоспітальної смертності, розвитку гострих ІМ і вимагаючих виконання ургентного АКШ. Незважаючи на те що кількість рестенозів, що розвиваються після імплантації стентів Gianturco — Roubin, порівняно велика, необхідно брати до уваги той факт, що виконання повторної балонної ангіопластики в цих ситуаціях при низькій частоті успішного виконання цієї процедури призводить до ще більшої кількості рестенозів.
Танталовий стент Wiktor
Стенти Wiktor виготовляють із одноволоконного танталового дроту діаметром 0,125 мм. Танталовий дріт забезпечує хорошу візуалізацію стен-та під час рентгеноскопії. Після імплантації танталовий дріт окиснюється, утворюючи стабільне біосумісне з’єднання, яке не піддається корозії. Стенти Wiktor складаються з кілець з’єднаних між собою, що мають синусоподібний профіль (рис. 1.36). Кільцеподібна дротяна конструкція стентів Wiktor не викликає вираженого тромбоутворення в місці їх імплантації, тому що стент покриває <10% поверхні ендотелію в стентованому сегменті судини. Крім того, така конструкція значно збільшила гнучкість цих стентів порівняно зі стентами трубчастої конструкції. Разом з тим синусоподібний профіль кілець підвищує резистентність стента до радіальної сили судинної стінки. Стенти Wiktor мають довжину 14–16 мм і поставляються на стандартному балонному катетері з поліетиленовим балоном довжиною 25 мм.
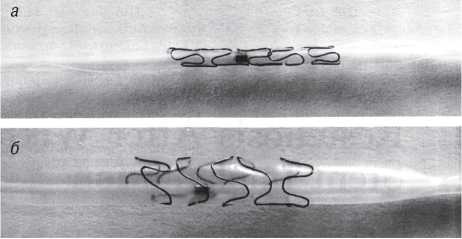
Рис. 1.36. Танталовий стент Wiktor: одноволоконна кільцева (із синусоподібним профілем) дротяна конструкція, розміщена на балоні; стент Wiktor, розміщений на нероздутому балоні-катетері (а); стент Wiktor, розміщений на роздутому балоні-катетері (б)
Техніка імплантації стента Wiktor подібна до техніки імплантації інших стентів, що розширюються за допомогою балона. Профіль стента в стисненому стані становить 1,5 мм. Після предилатації ураженої ділянки коронарної артерії стент за стандартною методикою підводять до місця імплантації й розширюють при роздуванні балона під тиском 8 атм.; якщо необхідно трохи збільшити остаточний просвіт стента, тиск у балоні може бути підвищений до 10–11 атм. Збільшення діаметра стента не викликає зменшення його довжини.
Як зазначено вище, у деяких європейських клініках на сьогодні проходить багатоцентрове тестування стентів Wiktor.
З грудня 1990 по червень 1992 р. у різних медичних центрах Європи виконана імплантація стентів Wiktor у 210 хворих з приводу гострої або загрозливої тромботичної оклюзії коронарних артерій. Імплантацію стентів не проводили при хронічних оклюзіях, оклюзіях венозних і артеріальних шунтів, дифузному ураженні коронарного русла (трисудинному ураженні або наявності декількох стенозів в одній коронарній артерії), а також при вираженому порушенні функції ЛШ (ФВ <30%). Крім того, стентування не проводили при ураженні судин, діаметр яких був <3 мм. Протипоказанням також були захворювання, які могли призвести до розвитку геморагічних ускладнень (виразкова хвороба і цереброваскулярні порушення).
У дослідженні проведена спроба імплантації 231 стента у 210 хворих; успішними були 219 (у 198 хворих). Стенти імплантували в передню міжшлуночкову гілку лівої коронарної артерії у 52%, у праву коронарну артерію — у 34%, в огинаючу гілку лівої коронарної артерії — у 13%, у стовбур лівої коронарної артерії ( внаслідок ушкодження устя під час коронарографії) — у 1% випадків. Сприятливі клінічні результати отримано в 74,2% випадків. Смертність у цьому дослідженні склала 3,5%: 4 хворих померли під час ургентного АКШ, 2 — внаслідок гострих тромбозів стентованих коронарних артерій, 1 — від кардіогенного шоку, що розвинувся після імплантації стента в місці дисекції стовбура лівої коронарної артерії, не захищеного шунтом. АКШ виконано у 35 хворих: 25 з них — в ургентному порядку, 10 — у плановому. Ургентне АКШ проводили після безуспішних спроб імплантації стентів (7 хворих), триваючої ішемії міокарда (6), тромбозу стентованих сегментів (12). Планове АКШ виконували в тих випадках, коли при можливому тромбозі стентованого сегмента артерії під загрозою ушкодження виявлялася велика зона міокарда. Q-ІМ розвинувся у 16 хворих: у 4 — при невдалій спробі імплантації стентів (зона ішемії міокарда в цих випадках була малою для виконання АКШ) і у 12 — внаслідок тромбозу стентованого сегмента. У 10 хворих розвинувся не-Q-ІМ.
Найбільш частим ускладненням імплантації стентів Wiktor була гостра тромботична оклюзія стентованих сегментів, відзначена у 28 хворих: у 12 з них це ускладнення розвинулося протягом перших 24 год, в останніх — протягом наступних 24 днів. Повторну ПКВ виконали у 3 хворих, ургентне АКШ — у 13. Медикаментозне лікування призначене 12 пацієнтам.
Контрольну коронарографію проводили через 6 міс після операції у 110 хворих, що успішно перенесли імплантацію стентів. Рестеноз (звуження стентованих сегментів на >50%) виявлений у 29 пацієнтів; тільки у 8 з них рестенози викликали симптоми стенокардії. Повторну ПКВ виконали у 9 хворих, у 1 — планове АКШ, 12 хворих отримували медикаментозну терапію, у 7 хворих лікування не проводили.
За даними багатоцентрового дослідження встановлено, що за такими показниками, як кількість успішних імплантацій, рівень сприятливих клінічних результатів, результати імплантації стентів Wiktor можуть бути порівняні з результатами імплантацій стентів інших конструкцій, які проводили при гострій і загрозливій оклюзії коронарних артерій. Частота ретромбозів хоча й залишається досить високою (14%), однак також може порівнюватися з результатами аналогічних досліджень, причому у всіх дослідженнях чітко простежується така закономірність: чим менший діаметр артеріального стентованого сегмента, тим вища ймовірність його ретромбозу.
Перевагою стентів Wiktor є їх рентгеноконтрастність: хороша візуалізація стента під час імплантації скорочує час процедури. Ця обставина особливо цінна при імплантації стентів в ургентних ситуаціях. Однак рентгеноконотрастність цих стентів заважає вірогідно оцінити результати імплантації: рентгеноконтрастні синусоподібні кільця стентів можуть приховувати рентгенологічну картину пристінкового тромбоутворення або дисекції.
Таким чином, дротяні кільцеподібні стенти Wiktor можна успішно застосовувати у випадках гострої і загрозливої оклюзії, що розвинулася у результаті ускладнень ПКВ. Для зниження частоти тромботичних ускладнень після імплантації цих стентів розробляються моделі з гепариновим і гірудиновим покриттям. Зараз налагоджено випуск танталових стентів Cordis. За конструкцією ці стенти подібні стентам Wiktor. Стенти Cordis проходять клінічні випробування під контролем FDA (США).
Нові моделі внутрішньокоронарних стентів
Широке клінічне застосування перших зразків внутрішньокоронарних стентів (ці стенти називають також стентами першої генерації), опис яких наведено вище, продемонструвало, що стентування коронарних артерій дозволяє суттєво зменшити кількість гострих тромбозів, значних кардіальних ускладнень, а також рестенозів, що розвиваються в результаті ПКВ.
Довівши практичну користь створення штучного каркаса стінки артерії в місці її атеросклеротичного ураження, дослідники продовжували й продовжують удосконалювати конструкцію стентів. Ці удосконалення спрямовані в першу чергу на усунення таких недоліків, як низькі гнучкість і жорсткість стентів. Недостатня поздовжня гнучкість стентів обмежує їх застосування в дистальних відділах коронарних артерій при наявності проксимальних вигинів, а також утруднює стентування звивистих сегментів. Слабка жорсткість стента не дозволяє створити достатній опір стретчинговій силі (силі радіального стиснення у відповідь на розтягання) з боку стінки артерії. На зазначені якості впливають такі фактори, як матеріал, з якого виготовляють стент; конфігурація ланок або кілець стента; використання дротяної або трубчастої конструкції; спосіб з’єднання ланок.
Крім того, важливими характеристиками стентів є розмір їх діаметра в стисненому стані (профіль стента), а також стан зовнішньої поверхні стента. Ці характеристики впливають на здатність стента вільно пересуватися в просвіті коронарних артерій при його доставці до мети.
Покращання якості стентів, що останніми роками випускаються промисловістю, розширило спектр показань до стентування коронарних артерій. Практично всі останні конструкції стентів придатні для стентування за переліченими показаннями.
Розглянемо характеристики коронарних стентів, конструкції яких розроблені нещодавно. Незважаючи на те що клінічні випробування ще тривають, ці стенти, внаслідок того, що на сьогодні вони мають найкращі якості, широко застосовують у багатьох клініках світу. Проте, беручи до уваги безперервне вдосконалення конструкцій стентів, є підстави вважати, що в недалекому майбутньому з’являться ще більш вдосконалені зразки.
Стент ACS Multi-link Tristar (Guidant Vascular Intervention Group, Santa Clara, CA, USA)
Стенти ACS Multi-link Tristar (рис. 1.37) складаються з безлічі ланок, які мають вигляд рифлених кілець. Стенти ACS Multi-link Tristar вирізають променем лазера із цільної сталевої трубки (нержавіюча сталь 316 L). Ширина сталевої смужки, що залишається після обробки трубки лазером, становить 0,10 мм; товщина — 0,14 мм. Стент, діаметр якого після розширення становить 3,0 мм, займає 15% площі стентованої стінки артерії. Довжина стентів ACS Multi-link Tristar після їх розширення до заданого діаметра зменшується на 2,7%.

Рис. 1.37. Стент ACS Multi-link Tristar. Тубулярний балон-розширюваний стент. Дизайн стента забезпечує йому максимальну гнучкість при проходженні звивистих сегментів коронарних артерій
Стенти ACS Multi-link Tristar випускають довжиною 8; 13; 18; 23; 28; 33 і 38 см; діаметр у розширеному стані може становити 2,5; 2,75; 3,0; 3,5 і 4,0 мм. Ці стенти мають високу поздовжню гнучкість, витримують силу радіального тиску на стиснення до 35 psi.
Стенти ACS Multi-link Tristar розширюються за допомогою балона. Для доставки й імплантації цих стентів використовується балонна система monorail S.T.E.P. (Short Transitional Edge Protection). Ця система має конфігурацію, яка дозволяє використовувати мінімальну кількість балонного матеріалу (XCELON), що розміщується поза стентом, що в свою чергу зводить до мінімуму ризик дисекції інтими судини поза стентом (рис. 1.38). Рекомендований тиск при роздуванні балона — від 8 до 16 атм. (при тиску 14 атм. і вище діаметр балона збільшується на 0,25 мм). На балоні є проксимальний і дистальний рентгенконтрастні маркери. Система доставки, так само, як і стент, має високу поздовжню гнучкість.
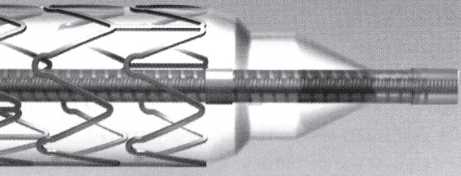
Рис. 1.38. Стент ACS Multi-link Tristar. Стент фіксований на балоні-катетері системи S.T.E.P., яка мінімізує вплив тиску балона на стінку артерії, що не підлягає стентуванню
Повідомлення про перші клінічні випробування стентів ACS Multi-link опубліковані в 1993 р. У 1994 р. почате багатоцентрове дослідження стентів ACS Multi-link. З 1995 р. стенти ACS Multi-link використовують у клініках Європи, Азії й Канади. У 1996 р. отримане схвалення FDA для застосування цих стентів у США. З 1997 р. випускають стенти ACS Multi-link Duet, а з 1999 — стенти ACS Multilink Tristar. На сьогодні ці стенти застосовують у клініках Європи, Азії й Канади.
Клінічні дослідження стентів ACS Multi-link Tristar тривають. Нижче ми наводимо результати деяких з них.
1. WEST I (West European Stent Trial I, стент ACS Multi-link). У дослідження включено 102 хворих. Частота розвитку серйозних кардіальних ускладнень, що розвинулися протягом 1-го місяця спостереження, склала 5,9%; протягом 6 міс — 17,6%; протягом 1 року — 18,8%. Частота рестенозів у стентованих сегментах коронарних артерій протягом 1 року спостережень — 12%.
2. WEST II (West European Stent Trial II, стент ACS Multi-link). У дослідження включено 165 хворих. Частота розвитку гострих післяопераційних тромбозів склала 1,2%, серйозних кардіальних ускладнень протягом 1 міс спостереження — 1,8%; протягом 6 міс — 9,1%. Для оцінки результатів застосовувалися коронарографічне і внутрішньосудинне УЗД.
3. ASCENT (ACS Multilink Stent Trial). У дослідженні проводили порівняння результатів імплантації стентів ACS Multi-link і Palmaz — Schatz у 1040 хворих, яких спостерігали протягом 9 міс. Проводили оцінку клінічних і ангіографічних даних. Частота розвитку гострих тромбозів при імплантації стентів Palmaz — Schatz склала 1,7% порівняно з 0,6% при імплантації стентів ACS Multi-link. Частота серйозних коронарних ускладнень, що розвинулися протягом 9 міс після імплантації стентів Palmaz — Schatz, склала 15,9%; при імплантації стентів ACS Muiti-link — 12,5%. Частота рестенозів при імплантації стентів Palmaz — Schatz склала 22,1%; при імплантації стентів ACS Multi-link — 16,1%.
4. ASCENT (Restenosis Registry) (розділ у дослідженні ASCENT). Проведено спостереження 201 хворого протягом 9 міс, у яких виконано стентування з приводу рестенозів, що розвинулися в результаті ПКВ. Частота розвитку серйозних кардіальних ускладнень склала 13,9%.
5. High ASCENT (розділ у дослідженні ASCENT). Проведене 30-денне спостереження 101 хворого, у яких при імплантації стента ACS Multi-link проводили роздування балона під більшим тиском. Частота розвитку серйозних кардіальних ускладнень, що розвинулися за період спостереження, склала 2,0%.
6. Long ASCENT (розділ у дослідженні ASCENT). У дослідженні проводили 30-денне спостереження хворих, у яких були імплантовані стенти ACS Multilink довжиною >10 мм (15; 25 і 35 мм). Частота розвитку серйозних кардіальних ускладнень за час спостереження склала 3,5%.
7. IVUS (Intravascular ultrasonography) (стент ACS Multi-link). Проводили 12-місячне спостереження 49 хворих із застосуванням внутрішньокоронарного УЗД. Частота розвитку серйозних кардіальних ускладнень за період спостереження склала 2%. Відзначене значне збільшення середніх значень ширини просвіту в місці імплантації стентів при роздуванні балона до 12 атм. (порівняно з результатами при роздуванні балона під тиском 8 атм.).
8. Japan (Стент ACS Multi-link). Спостерігали 1123 хворих протягом 6 міс після імплантації стен-та. Частота розвитку рестенозів у місці імплантації стента склала 14%.
9. DUET US (Стент ACS Multi-link Duet). Проведене 6-місячне клінічне і коронарографічне обстеження 270 хворих. Частота розвитку серйозних кардіальних ускладнень, що розвинулися протягом 30 днів після втручання, склала 2,2%.
10. DUET Europe (Стент ACS Multi-link Duet). Проведене 6-місячне спостереження 210 хворих, у яких виконана імплантація стентів ACS Multilink Duet у місцях атеросклеротичних уражень довжиною від 8 до 23 мм. Частота розвитку серйозних кардіальних ускладнень, що розвинулися протягом перших 30 днів, склала 4,3%; протягом 6-місячного спостереження — 16,7%. Частота рестенозів за 6 міс спостереження склала 16,3%.
Ряд досліджень, що проводять оцінку результатів імплантації стентів ACS Multi-link Duet (CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications) — 2000 хворих; SOS (Stent or Surgery) — 1000 хворих; AMIGO (Atherectomy before MULTI-LINK Improves Lumen Gain and Clinical Outcomes) — 750 хворих; DESIRE (Drug-Eluting Stents for In-Stent Restenosis) — 500 хворих), ще не завершені; їх результати не опубліковані. Влітку 1999 р. почалося дослідження SLIDE US, метою якого є оцінка результатів імплантації стента ACS Multi-link Tristar у 250 хворих.
На рис. 1.39 наведені коронарограми, виконані до імплантації стента ACS Multi-link (а), безпосередньо після операції (б) та після 6-місячного спостереження (в). Результат стентування хороший.
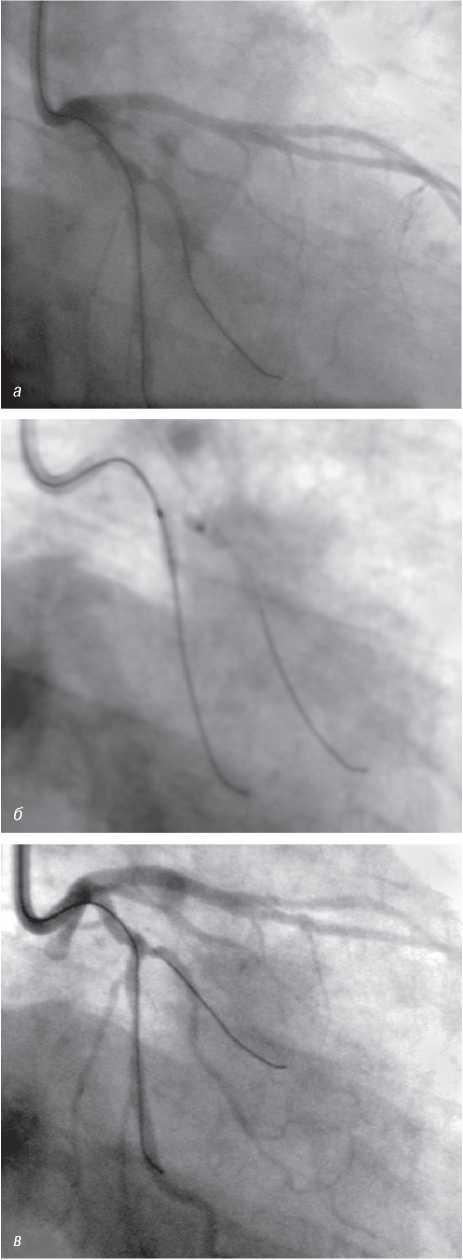
Рис. 1.39. Коронарограма хворого з біфуркаційним стентуванням до ПКВ (а), у момент проведення ангіопластики («kissing-balloon») (б), після ПКВ (після 6-місячного спостереження) (в)
Стент BeStent Brava; моделі BES і BEM (Medtronic AVE, Santa Rosa, CA, USA)
Основною особливістю стентів BeStent (рис. 1.40) є їх конструкція, виконана у вигляді циркулярних і поздовжніх металевих смуг, що з’єднуються і мають вигляд серпантину. Під час розширення стента відбувається обертання в місцях з’єднання смуг, що призводить до їх випрямлення (рис. 1.41); таким чином, BeStent при розширенні зовсім не стає коротшим, а ортогональна концентрація стретчингової сили стінки артерії, спрямованої радіально, не виявляє деформуючої дії.
Рис. 1.40. Немонтований стент BeStent Brava до і після розкриття. Золоті маркери допомагають чітко визначати положення стента до і після імплантації
Рис. 1.41. Схема механізму розправлення стента BeStent Brava
BeStent виготовляють із нержавіючої сталі. Основою стента є цільний сталевий циліндр, з якого вирізають серпантинову сітку. Зварювання при виготовленні цього стента не застосовується. Площа, яку займає стент у розширеному стані, становить 12–19% площі судини (для моделі BES) і 10–14% (для моделі BEM). Розміри циркулярних смуг: товщина — 0,07 мм; ширина — 0,11 мм. Розміри поздовжніх смуг: товщина — 0,07 мм; ширина — 0,75 мм. Розміри розширених стентів: 2,5–3,8 мм (для моделі BES) і 3,0-4,8 мм (для моделі BEM). Стретчинговий тиск, що витримується стентом, становить не менш 450 мм рт. ст. Довжина стентів, що випускаються, на сьогодні складає 8; 15 і 25 мм. BeStent моделі BES призначений для стентування судин діаметром від 2,5 до 3,0 мм; BeStent моделі BEM — для стентування судин діаметром від 3,0 до 4,5 мм. BeStent має хорошу поздовжню гнучкість. На стенті є 2 рентгенконтрастні золоті маркери, що позначають проксимальний і дистальний відділи стента.
BeStent є балон-розширюваним стентом. Система доставки стента — monorail з фіксованим на балоні стентом. Мінімальний діаметр провідникового катетера, по якому може пройти система доставки BeStent, — 1,6 мм (катетери 6 F). Діаметр провідникового просвіту системи доставки становить 0,36 мм. Тиск, при якому може відбутися розрив балона, що має діаметр 4 мм, — 14 атм. Рекомендований тиск у балоні при імплантації стента — 6 атм. (після здування балона рекомендується його повторне надування під тиском до 12 атм.).
Перші експерименти по імплантації стента у тварин розпочаті в 1995 р. У 1996 р. виконані імплантації BeStent у пацієнтів у Кейптауні (ПАР), Хайфі (Ізраїль), Мілані (Італія) і Роттердамі (Нідерланди). Пілотні дослідження, за якими проводилася оцінка стентів BeStent, виконані у 8 центрах Європи також у 1996 р. У це дослідження включили 217 хворих як з первинними атеросклеротичними ураженнями коронарних артерій різної довжини й складності, так і рестенозами. Опубліковані результати річного спостереження 100 перших хворих, у яких була виконана імплантація стентів BeStent. Відсутність значних кардіальних ускладнень відзначена у 82% цих хворих. У дослідження Rose (Registry for Optimal Stent Evaluation) ввійшло 120 хворих як зі стабільною, так і нестабільною стенокардією. Проводилася імплантація стентів у сегменти коронарних артерій, що мають поодинокі ураження довжиною до 15 мм. Діаметр уражених сегментів становив 2,85±0,52 мм. Частота розвитку рестенозів за 6-місячний період спостереження склала 21%; річна виживаність хворих при відсутності значних кардіальних ускладнень — 75%. Дослідження результатів імплантації стентів BeStent триває в 3 початих дослідженнях: BESMART (BEstent in SMall ARTeries; Франція; 380 хворих); SISA (Stanting in Small Arteries; Європа, Азія, Канада; 350 хворих); RAPS (Radial Artery Patency Study; Іспанія; 440 хворих). У всіх цих дослідженнях проводиться порівняння результатів ПКВ та імплантації BeStent у судини малого діаметра. У всіх 3 дослідженнях проводиться спостереження клінічного стану хворих, що доповнюється ангіографічним контролем. У США проводиться дослідження, в якому порівнюються результати імплантації стентів Palmaz — Schatz і BeStent.
Стент BX Velocity (Cordis, A Johnson & Johnson Company, Warren, NJ, USA)
Стенти BX виготовляють із нержавіючої сталі. Конструкція складається із замкнених гнізд, з’єднаних між собою гнучкими металевими нитками. Така конструкція має достатню гнучкість при збереженні значної жорсткості. Чарункова структура стента забезпечує хороший доступ до бічних гілок, що відходять від стентованого сегмента артерії. Площа, яку займає стент, становить 20% загальної площі стінки стентованого сегмента. Товщина нитки — 0,14 мм; ширина — 0,13 мм. Стенти BX випускають довжиною 8; 13; 18; 23; 28 і 33 мм; діаметром — 2,25; 2,5; 2,75; 3; 3,5; 4; 4,5 і 5 мм.
Стенти BX є балон-розширюваними. Для доставки стентів, що мають діаметр від 2,25 до 4,5 см, потрібен провідниковий катетер 6 F; для стента діаметром 5 мм — 7 F. Доставка стентів проводиться як системами rapid exchange (monorail), так і системами over-the-wire.
Балон у системі доставки виготовляють із матеріалу Duralin. Цей матеріал є досить міцним (тиск, при якому може відбутися розрив балона, становить 16 атм.), хоча й піддатливим (при тиску близько 15 атм. діаметр балона може збільшитися на від заданого).
Система доставки має високу поздовжню гнучкість. Добре утримує балон при проведенні його до мети, а також легко проходить повторно через стентовані сегменти артерій.
У лютому 1997 р. завершилися експериментальні випробування стента BX. Досвіди показали, що стент BX, порівняно зі стентом Palmaz — Schatz, набагато рідше ушкоджує судинну стінку (0,05±0,15 проти 0,44±0,44; p<0,01) і викликає меншу гіперплазію неоінтими (1,09±0,25 мм2 для стентів BX порівняно з 2,92±2,26 мм2 для стентів Palmaz — Schatz). Імплантація першої генерації стентів BX виконана в клініці Мілана в травні 1997 р. Після деякої доробки створена друга генерація стентів BX (BX Velocity), імплантація яких з січня 1999 р. проводиться в клініках Мілана і Тулузи. Хоча результати клінічних випробувань стентів BX Velocity до цього часу не опубліковані, високі потенціальні можливості (низький профіль, висока поздовжня гнучкість при значній жорсткості) свідчать про те, що у цих стентів є певне майбутнє.
Стент Coroflex (Braun Melsungen AG, Berlin, Germany)
Стент Coroflex (рис. 1.42) — балон-розширюваний, його вирізають зі сталевої трубки (нержавіюча сталь 316 L) лазерним променем з наступним електрополіруванням. Стент складається з великої кількості синусоїдальних кілець, з’єднаних містками в середніх точках (рис. 1.43); така конструкція надає стенту виняткову гнучкість.

Рис. 1.42. Стент Coroflex
Рис. 1.43. Зображення стента Coroflex з використанням скануючого електронного мікроскопа з різним збільшенням
Імплантований стент Coroflex займає 12% внутрішньої поверхні стентованого сегмента. Товщина металевої смужки становить 0,09 мм. Профіль стента, монтованого на балоні, — 0,97 мм. Діаметр стентів Coroflex, що випускаються, — 2,5; 3; 3,5 і 4,0 мм; довжина — 8; 13; 16 і 25 мм. При розширенні довжина стента зменшується на 1–3%. Імплантований стент витримує стретчингову силу до 0,6 атм.
Система доставки складається з балона-катетера Larus, на якому монтується стент. Балон-катетер належить до типу monorail, виготовлений з високоміцного матеріалу Pamax, який при роздуванні здатний витримати тиск до 12 атм. при імплантації стентів діаметром 4 мм і 15 атм. при імплантації 2,5–3,5-міліметрових стентів. Рекомендований тиск у балоні при імплантації стента Coroflex — 8–12 атм. Проксимальний і дистальний відділи балона мають рентгенконтрастні мітки. Провідниковий просвіт у балоні-катетері діаметром 0,36 мм. Для імплантації стентів Coroflex потрібні провідникові катетери розміром 6 F. Поздовжня гнучкість системи доставки, як і стента Coroflex, дуже висока. Клінічні випробування стента почалися в 1998 р. — у Європі проведене дослідження безпеки стента; у 1999 р. відкрито міжнародний реєстр. З 1999 р. формується проспективне багатоцентрове дослідження безпосередніх і віддалених результатів імплантації стентів Coroflex.
Стент Coronary R-Stent (New Medical Technologies, Inc., Ft Coroflex Lauderdale, FL, USA)
Coronary R-Stent виготовляють зі сталевої трубки (нержавіюча сталь 316 L). Являє собою конфігурацію подвійної спіралі і складається з п’яти зон: двох кінцевих, двох перехідних і однієї центральної (рис. 1.44). Кінцеві зони складаються з подвійної випрямленої решітки, мають слабку гнучкість, проте наявність випрямлених країв дає можливість операторові встановити стент так, що він не буде захоплювати здорову ділянку артерії. Перехідні зони забезпечують плавний перехід від твердих кінцевих зон до дуже гнучкої центральної зони. Остання складається з подвійної спіральної решітки, що забезпечує стенту достатню рухливість і жорсткість. Розмір гнізд розширеного стента не менше 4,5 мм, що забезпечує хороший доступ до бічних гілок у стентованому сегменті артерії.

Рис. 1.44. Схема будови стента R-Stent (пояснення в тексті)
Імплантований стент займає 18% поверхні стентованого сегмента артерії. Ширина металевої полоски — 0,1 мм; товщина — 0,12 мм (у стентів діаметром >3 мм товщина смужки становить 0,13 мм). R-Stent випускають як змонтованим на балоні, так і поза системою доставки. Діаметр стентів — від 2,5 до 3 мм (стенти цих діаметрів мають довжину 9; 16; 25 і 35 мм) і від 3 до 4 мм (довжина цих стентів — 9; 18; 28 і 38 мм). При розширенні стенти діаметром 2,5–3 мм скорочуються на 5%; діаметром 3–4 мм — на 0–3%. Рекомендований тиск при імплантації стентів діаметром 2,5–3 мм — 10 атм., діаметром 3–4 мм — 7–9 атм. Стент витримує радіальну силу на стиснення до 25 psi. Профіль згорнутого балона — від 1,5 до 3 мм.
R-Stent належить до балон-розширюваних. Система доставки rapid exchange (monorail) має провідниковий просвіт діаметром 0,36 мм. Для системи доставки потрібен провідниковий катетер із внутрішнім діаметром 5 F. Максимальний тиск, що витримується балоном, становить 16 атм.; номінальний рекомендований тиск для першого роздування балона — 6 атм. Система доставки досить вільно проходить по артеріальному руслу.
У 1997 р. R-Stent пройшов доклінічні випробування; у цьому ж році в Роттердамі виконані перші імплантації у пацієнтів. У дослідженні (квітень–листопад 1998 р.) у 27 хворих (46% — зі стабільною стенокардією; 54% — з нестабільною стенокардією) проведені спроби імплантації 33 R-Stents. 80% хворих до стентування перенесли або гострий ІМ, або хірургічне втручання (шунтувальну операцію або ПКВ) з приводу коронарного атеросклерозу. Більшість атеросклеротичних уражень являли собою або оклюзії, або стенози зі складною анатомією. Імплантація стента проведена успішно в 32 випадках з 33 спроб (у 26 із 27 хворих). У ранній післяопераційний період гострих тромботичних ускладнень не було. У всіх успішно прооперованих хворих кровотік у стентованому сегменті відповідав ТІМІ 3 (Thrombolysis in Myocardial Infarction). За 30-денний період спостереження випадків смерті, ІМ, підгострого тромбозу, повторних ендоваскулярних втручань і шунтувальних операцій не було.
Стент InFlow Flex (InFlow Dynamics AG, Munich, Germany)
Стент InFlow Flex виготовляють зі сталевої трубки (нержавіюча сталь 316 L). Для створення більш гладкої зовнішньої поверхні стенти останнім часом покривають шаром золота товщиною 5 мкм, що також робить стент InFlow Flex висококонтрастним. Конфігурація стента — множинні ланки, що мають вид синусоїдальних кілець. Зона, яку займає імплантований стент, становить залежно від діаметра стента від 10 до 20% (залежність між діаметром стента та зоною, яку він займає, обернено пропорційна; стент діаметром 3,0 мм займає 14% поверхні стентованої судини). Товщина дроту — 0,075 мм. Ступінь скорочення стента — від 1% (при діаметрі 2,5 мм) до 17% (при діаметрі 5,0 мм); при діаметрі стента 3 мм ступінь скорочення становить 4%. Стенти InFlow Flex випускають діаметром від 2,5 до 5 мм; довжиною — 8; 12; 16; 20; 24 мм.
Балон-розширювані стенти InFlow Flex випускають без системи доставки. Стент перед його імплантацією в коронарні артерії монтується на балон відповідного розміру.
Перша імплантація стента InFlow Flex у людини виконана на початку 1996 р. До кінця 1996 р. проведено 4000 імплантацій цього стента, а до середини 1997 р. — >10 тис. стентувань. На сьогодні виконується ряд досліджень, у яких проводиться оцінка результатів стентування стентами InFlow Flex. У цих дослідженнях порівнюються результати стентування звичайним стентом і стентом, що має золоте покриття. Випробовуються також стенти InFlow Flex, що мають біодеградуюче покриття, що вивільняє гірудин.
Стенти InFlow Flex відрізняються високим рівнем успішних спроб імплантації; у більшості випадків процедура завершується успішно навіть у випадку невдалої спроби імплантації стентів іншого типу.
Група коронарних стентів JOSTENT (JOMED AB, Helsingborg, Sweden)
JOSTENT Flex. Стенти JOSTENT Flex (рис. 1.45) розроблені спеціально для імплантації в сегменті артерій, що містять складні стенози. Ці стенти мають хорошу поздовжню гнучкість, властиву дротяним стентам, і високу опірність силі радіального стиснення, яка характерна для трубчастих стентів. Розмір гнізд стента достатньо великий для того, щоб забезпечити вільний доступ до гілок стентованих сегментів артерій.
![]()
Рис. 1.45. Стент JOSTENT на системі, що доставляє
Стент вирізають променем лазера зі сталевої трубки і полірують. Імплантований стент займає 14–19% поверхні стентованого сегмента артерії. Товщина дроту стента — 0,09 мм. Профіль стента — 1 мм. Ступінь скорочення для стента діаметром 3,5 мм — <3%. Діаметри стентів, що виготовляються, — 2–3,5 мм (конструкції для малих судин) і 3–5 мм (стандартні конструкції).
Балон-розширювані стенти JOSTENT Flex постачаються із системою доставки. Мінімальний внутрішній діаметр провідникового катетера, необхідний для системи доставки, — 6 F. Балон має рентгеноконтрастні маркери в проксимальному та дистальному відділах. Стенти JOSTENT Flex можуть постачатися також без систем доставки.
JOSTENT Plus. Конструкція стентів JOSTENT Plus (рис. 1.46) базується на багаточарунковій основі, що оптимізує опірність цих стентів силі радіального стиснення. Зона кожної ланки навмисно збільшена, що дозволяє розширювати стенти до великих діаметрів (від 3 до 6 мм); можна використовувати стенти JOSTENT Plus у великих сегментах, якими, наприклад, є устя правої і лівої коронарних артерій, а також устя великих епікардіальних гілок. Стент сконструйований таким чином, що при максимальному розширенні його скорочення мінімальне.

Рис. 1.46. Стент JOSTENT без системи доставки
Стент JOSTENT Plus вирізають із цільної сталевої трубки (нержавіюча сталь 316 L). Основні технічні характеристики стента подібні характеристикам стента JOSTENT Plus, за винятком довжини (9; 17; 25 і 33 мм) і максимального діаметра (6 мм) моделей. Є конструкції JOSTENT Plus для стентування здухвинних артерій.
JOSTENT Sidebranch. Стент JOSTENT Sidebranch (рис. 1.47) є першим стентом, розробленим спеціально для доступу до бічних гілок; з цієї причини має великогніздну структуру, яка зводить до мінімуму ризик оклюзії бічних гілок, що відходять від стентованого сегмента артерії. Стент JOSTENT Sidebranch є комбінацією конструкцій стентів JOSTENT Flex і JOSTENT Plus. Проксимальний і дистальний відділи стента JOSTENT Sidebranch мають дизайн Plus, який забезпечує високу радіальну резистентність, у той час як середня порція сконструйована за принципом спіральних ланок (Flex), що дозволяє максимально збільшувати розмір ланок.

Рис. 1.47. Стент JOSTENT Sidebranch
Стент JOSTENT Sidebranch виготовляють таким же способом, як і інші стенти групи JOSTENT. Зона, яку займає імплантований стент, становить 14–19% внутрішньої поверхні стентованого сегмента артерії. Товщина дроту стента — 0,13 мм; профіль стента — 1 мм. Діаметри стентів JOSTENT Sidebranch, що випускаються, — від 3 до 6 мм; довжина — 18 і 26 мм.
JOSTENT Bifurcation. Стент JOSTENT Bifurcation (рис. 1.48) являє собою оригінальну конструкцію, що дозволяє імплантувати стен-ти в місця біфуркації коронарних артерій. Як і в попередньому випадку, конструкція JOSTENT Bifurcation являє собою комбінацію конструкцій Flex і Plus. Конструкція дистального відділу JOSTENT Bifurcation заснована на конструкції Plus і має значну жорсткість, яка робить дистальний відділ стента стійким до сили радіального тиску. Проксимальний відділ представляє конструкцію Flex, у якій використовуються спіральні ланки, що дозволяють максимально збільшити доступ до устя судини, що відходить від основного стовбура. Гнізда великих розмірів дозволяють системі доставки другого стента пройти крізь каркас стента, імплантованого в основну судину (рис. 1.49).
Рис. 1.48. Стент JOSTENT Bifurcation
Рис. 1.49. Схема стентування біфуркаційного ураження за допомогою стента JOSTENT Bifurcation і стента JOSTENT Sidebranch. Стент JOSTENT Sidebranch встановлений у батьківській артерії (А); стент JOSTENT Bifurcation проведений у бічну гілку (Б); другий стент встановлений у дочірній артерії (остаточний результат — В)
Матеріал і спосіб виготовлення стента JOSTENT Bifurcation такі ж, як і інших стентів групи JOSTENT. Площа імплантованого стента — 14–19% поверхні стентованого сегмента артерії. Товщина дроту стента — 0,13 мм. Профіль стента — 1 мм. Стент має високу поздовжню гнучкість. Ступінь скорочення стента діаметром 3 мм — <3%. Діаметри стентів, що випускаються, — від 3 до 6 мм; довжина — 16 і 28 мм.
JOSTENT Coronary Stent Graft. JOSTENT Coronary Stent Graft (рис. 1.50) являє собою унікальну конструкцію, що з’єднує металевий каркас і тонкий шар матеріалу PTFE, що має здатність розтягуватися, таким чином ця конструкція поєднує властивості коронарного стента й шунта.

Рис. 1.50. JOSTENT Coronary Stent Graft без системи доставки
У конструкції JOSTENT Coronary Stent Graft застосований «принцип сендвіча»: надтонкий матеріал, що розтягується, PTFE розміщується між двома стентами, привареними один до одного з обох кінців. Стент має велику поздовжню гнучкість і стійкість до сили радіального стиснення.
JOSTENT Coronary Stent Graft можна з успіхом застосовувати в таких екстремальних ситуаціях, як наявність загрозливої для життя дисекції інтими коронарної артерії, перфорації судини і аневризми артерії.
JOSTENT Coronary Stent Graft виготовляють із нержавіючої сталі 316 L і надтонкої тканини, що розтягується, PTFE. Товщина стінки стента — 0,3 мм; профіль стента — 1,6 мм. Діаметр стентів, що випускаються, — від 2,5 до 5 мм; довжина — 9; 12; 16; 19 і 26 мм. JOSTENT Coronary Stent Graft використовують при лікуванні здухвинних і периферичних артерій.
Є клінічний досвід застосування JOSTENT Coronary Stent Graft (Heuser R., Lopez A., Reifart N., Stoerger H.; Phoenix Heart Center, Phoenix, Arizona, USA; Red Cross Hospital, Frankfurt, Germany). У дослідження, проведене цими авторами, включили 76 хворих, у яких проводили імплантацію 83 стентів у передню міжшлуночкову гілку лівої коронарної артерії (20 випадків), огинаючу гілку лівої коронарної артерії (6 випадків), праву коронарну артерію (26 випадків), венозних шунтів (24 випадки). Показаннями до імплантації JOSTENT Coronary Stent Graft були аневризми (22 випадки), пухкі венозні шунти (15 випадків), тромботичні бляшки (7 випадків), перфорації артерій (4 випадки), атеросклеротичні ураження судин, що вперше виникли (20 випадків), і рестенози (8 випадків, з них 6 — рестенози в місцях імплантації стентів). Імплантація проведена успішно в 97% випадків (74/76), у тому числі — у всіх 4 випадках перфорацій судин. У середньому до втручання стеноз становив 81,5±15,4%; після — 7,6±18,1%. У 6 хворих цієї групи через 6 міс була виконана контрольна коронарографія. Рестеноз виявлений у 2 хворих: в 1 випадку був дифузним і звужував просвіт артерії на 60%; в іншому — локальним у місці краю стента.
Стент LP Stent (International Technologies Europe Ltd., Republic of Ireland)
LP Stent належить до трубчастих стентів третього покоління. Для його виготовлення використовується трубка з нержавіючої сталі і унікальна технологія хімічного травлення металу, при якій метал набуває гладкої поверхні і значної опірності здавлюючій силі. Оригінальна форма каркаса (трапецієподібні гнізда) (рис. 1.51) дозволяє не застосовувати значної сили для розширення стента, що захищає стінку судини від надмірного стиснення. Крім того, LP Stent практично не стає коротшим при розширенні, має мінімальну силу віддачі (зменшення діаметра після розширення стента) і дуже високу опірність силі радіального стиснення.

Рис. 1.51. LP Stent без системи доставки
LP Stent має діаметри 2,5; 3; 3,5 і 4 мм; довжина стентів — 8; 12; 18 і 24 мм. Профіль LP Stent — 1,2 мм.
Балон-розширюваний LP Stent постачається монтованим на балоні системи доставки, для підведення якої до коронарного русла потрібен провідниковий катетер розміром не менше 6 F. Балон має дистальний і проксимальний рентгеноконтрастні маркери.
Перша імплантація LP Stent людині була виконана в травні 1998 р. У 1999 р. заплановано впровадження LP Stent у країни Європи та Азії. У листопаді 1999 р. у Бельгії почате дослідження результатів лікування коронарного атеросклерозу за допомогою LP Stent, у яке планувалося включити до 200 хворих.
Стент Nexus (Occam International BV, Eindhoven, The Netherlands)
Стент Nexus (рис. 1.52) — трубчастий балон-розширюваний, виготовляється з високоякісної нержавіючої сталі. Стент має множинні гнізда, що з’єднуються між собою за допомогою V-подібних з’єднань. У стенті поєднуються хороша поздовжня гнучкість і виражена опірність радіальній силі. Імплантований стент діаметром 3,5 мм займає 11,7% поверхні стентованого сегмента артерії. Ширина металевої смужки стента становить 0,105 мм; товщина — 0,12 мм, профіль стента — 0,9—1,0 мм. Укорочення стента діаметром 3 мм при його розширенні становить 2,6%. Діаметр стентів, які виготовляються, — 2,5; 3; 3,5 і 4 мм; довжина — 8; 12; 18; 23 і 28 мм.
Рис. 1.52. Розширений та нерозширений стент Nexus без системи доставки. Тубулярний дизайн стента з V-подібними гніздами забезпечує стенту високу радіальну пружність
Стенти Nexus постачаються як у вигляді заздалегідь змонтованих на балоні систем доставки, так і без систем, а також у «вільному» вигляді. Система доставки належить до типу monorail. До неї входить балон, що витримує тиск до 14 атм. і роздувається до заданих діаметрів (2,5; 3; 3,5 і 4 мм). На проксимальному та дистальному відділах балона є рентгеноконтрастні маркери.
Перші стенти Nexus виготовлені в 1998 р.; у цьому ж році виконана перша імплантація стента в клініці. З 1999 р. стент застосовується в клініках Європи. На сьогодні плануються дослідження, у яких буде проводитися оцінка результатів імплантації стентів Nexus.
Стент Sorin Carbostent (Sorin Biomedica S.p.A., Saluggia (VC), Italy)
Стент Sorin Carbostent (рис. 1.53) є балон-розширюваним трубчастим стентом нового покоління, який виготовляють з нержавіючої сталі 316 LVM, вкритої тонким шаром (0,3–0,5 мкм) оригінального матеріалу Carbofilm. Стент складається з гнізд унікальної форми. Sorin Carbostent постачається змонтованим на системі доставки, що належить до типу monorail.

Рис. 1.53. Sorin Carbostent до (верхній) та після (нижній) покриття Carbofilm
Гнізда стента Sorin Carbostent складаються із сегментів, які мають викривлення різної форми. Кожний сегмент має різну товщину металу. Така конструкція гнізд сприяє оптимальній механічній відповіді стента на його розширення, згинання й скручування (рис. 1.54). Гнізда з’єднуються в середніх точках найбільш довгих сегментів (рис. 1.55). При такій схемі з’єднання досягаються дві важливі переваги: а) з’єднання між гніздами еластичні, що підвищує поздовжню гнучкість стента; б) при такому з’єднанні укорочення стента при його розширенні зводиться до нуля. Конструкція Sorin Carbostent робить неможливим концентрацію сили на одній ділянці стентованого сегмента; при цьому також відсутня еластична деформація судинної стінки, яка стимулює надмірну проліферацію неоінтими.
Рис. 1.54. Будова стента Sorin Carbostent (пояснення в тексті)
Рис. 1.55. Структура гнізд Sorin Carbostent (пояснення в тексті)
Ця конструкція забезпечує оптимальний контакт стента з тканинами судинної стінки. Довжина зразків Sorin Carbostent, що випускаються, — 9; 15 і 25 мм. Існують п’яти- і шестигніздні варіанти Sorin Carbostent; у першому випадку діаметр стента становить 3 і 3,5 мм, у другому — 4 і 4,5 мм. У точках з’єднань на обох краях стента є рентгеноконтрастні платинові маркери, які дозволяють візуалізувати кінцеві точки стента навіть у випадку наповнення судини контрастною речовиною. Зовнішня поверхня стента піддається алмазному шліфуванню до дзеркального стану. Шліфування також закруглює кути металу. Це значно полегшує просування стента в судинному руслі і зводить до мінімуму можливість ушкодження судинної стінки.
Sorin Carbostent покривають тонкою плівкою вуглецю (покриття Carbofilm), що має турбостатичні властивості. Це покриття робить стент тромборезистентним і біосумісним з тканинами судини та кров’ю. У кардіохірургічній практиці вже більш 30 років застосовують клапани з вуглецевим покриттям, що прекрасно зарекомендували себе. Плівкове покриття Carbofilm не впливає на фізичні властивості матеріалу, що покривається. У судинних протезах, покритих Carbofilm, відзначається ослаблення адгезії та активації тромбоцитів, що різко знижує ризик утворення тромбів.
Унаслідок своєї високої поздовжньої гнучкості Carbostent має здатність легко проходити звивисті, кальциновані сегменти, а також стентовані сегменти артерій. Наявність висококонтрастних маркерів, поряд з відсутністю укорочення стента під час його розширення, дає можливість провести імплантацію стента максимально точно. Ця властивість стента особливо важлива при імплантації Carbostent в устя артерій, у місця біфуркації або поблизу відходження бічних гілок. Конструкція стента запобігає концентрації сили на одній ділянці стентованого сегмента та еластичній деформації стінки судини, що в свою чергу призводить до зменшення кількості рестенозів. Нарешті, висока гемосумісність і атромбогенність Carbostent суттєво знижують ризик гострих тромботичних ускладнень стентування навіть при наявності атеросклеротичних бляшок з ускладненою морфологічною структурою.
У 1997 р. проведені доклінічні випробування Carbostent. З квітня 1998 по січень 1999 р. у двох італійських клініках проведене відкрите проспективне дослідження, у якому оцінювалися результати імплантації стентів Sorin Carbostent. У дослідження включили 112 пацієнтів, у 55,4% яких відзначали симптоми нестабільної стенокардії. Ураження коронарних артерій (усього — 132), згідно з класифікацією АСС/АНА, належали до уражень середнього ступеня складності. Середня довжина стенозів склала 12,5±7,2 мм; 71,3% стенозів локалізувалися в судинах малого діаметра (<2,9 мм). Імплантація стентів проведена успішно в 100% випадків, що підтверджено коронарографічно. Середній діаметр залишкових стенозів склав 4±7% при вихідному середньому діаметрі 79±12%. У післяопераційний період усі хворі отримували ацетилсаліцилову кислоту і тиклопідин. Значне кардіальне ускладнення (не-Q-ІМ) у госпітальний період відзначено в 1 (0,9%) випадку. Протягом 6-місячного спостереження значні кардіальні ускладнення розвинулись у 18% хворих. Частота рестенозів склала 11%.
Стент Terumo (Terumo Corpiration, Tokyo, Japan)
Стент Terumo (рис. 1.56) належить до балон-розширюваних трубчастих стентів. Матеріал, з якого виготовляють стент Terumo, — нержавіюча сталь 316 L. Особливістю цього стента є його одноланкова конструкція у вигляді кристала алмаза з одиничним конектором. Така конструкція забезпечує стент хорошою поздовжньою гнучкістю та високою опірністю силі радіального стиснення стента. Смужка металу в стенті Terumo має дуже низький профіль (0,08 мм), що (разом з особливостями конфігурації балона) зводить до мінімуму ймовірність ушкодження судинної стінки в місці імплантації стента.

Рис. 1.56. Стент Terumo без системи доставки
Стент випускається змонтованим на балоні системи доставки. Проксимально дистально від країв стента є кулеподібні «пробки», що запобігають деформації стента під час його просування по артеріальному руслі. Балон циліндричної форми без звужень по краях. Довжина балона відповідає довжині стента. Така конфігурація балона зводить до мінімуму можливе ушкодження ендотелію судини поза імплантованим стентом.
На сьогодні у країнах Далекого Сходу проводяться та плануються дослідження, які дозволять оцінити результати імплантацій стента Terumo у коронарні артерії.
Стент V-FLEX Plus (Cook Group Inc., Broomfield, CO, USA)
Стент V-FLEX Plus (рис. 1.57) є балон-розширюваним трубчастим стентом, сконструйованим із зиґзаґоподібних кілець, які скріплені V-подібними і полоскоподібними з’єднаннями, що чергуються, завдяки чому стент має високу гнучкість і твердість. Довжина стента — 8; 12; 16; 20 і 24 мм; діаметр — від 2,5 до 3,8 мм. Площа в стентованому сегменті становить <15%. Профіль стента — <1 мм.

Рис. 1.57. Стент V-FLEX Plus без системи доставки
Стент монтується на системі доставки, яка містить балон з поліетилену, що витримує роздування при тиску 12 атм. Рекомендований тиск при першому роздуванні балона — 7 атм. Мінімальний діаметр необхідного провідникового катетера — 6 F.
Конструкція стента V-FLEX Plus розроблена наприкінці 1996 р. У лютому 1997 р. виконані перші імплантації стента у тварин; у цьому ж році проведена перша клінічна імплантація стента.
Автори стента виконали дослідження, що дозволило оцінити результати 33 спроб імплантації стента V-FLEX Plus. У цьому дослідженні 42% уражень мали тип С за класифікацією АСС/АНА. Усі спроби імплантації стентів V-FLEX Plus були успішними; у госпітальний період тромботичні та значні кардіальні ускладнення не були відзначені.
De Scheerder і співавтори повідомили про перший досвід імплантації стентів V-FLEX Plus 100 пацієнтам, у яких було 125 уражень коронарних артерій (44% — тип С за класифікацією АСС/ АНА). Усі спроби імплантації (134 стента, з яких 35% мали довжину >2 мм) виконані успішно.
Серйозні кардіальні ускладнення в період госпіталізації не відзначені. Частота рестенозів за 6-місячний період спостереження склала 18%.
Стенти NIR і NIROYAL (Medinol/Scimed Life Systems, Maple Grove, MN, USA)
Конструкція стента NIR є, на наш погляд, однією із найвдаліших конструкцій серед усіх стентів, які застосовують на сьогодні. Дотепер при створенні стентів використовувався принцип компромісу між двома найважливішими якостями цього інструмента — твердістю та гнучкістю. Деякі стенти (наприклад дротяні) мають велику гнучкість за рахунок твердості; інші (ранні трубчасті) — при значній твердості не мають достатньої гнучкості. Автори стента NIR справедливо відзначили, що ці дві якості, що суперечать одна одній, необхідні стенту не одночасно, а на двох різних етапах втручання. Гнучкість необхідна для підведення стента до місця ураження судини (тобто до розширення стента), а твердість потрібна вже після імплантації для створення опору силі радіального стиснення з боку стінки судини. Стент NIR сконструйований таким чином, що проходячи в стисненому стані вигнутий сегмент артерії, його гнізда, розміщені за великою кривизною судини, подовжуються (рис. 1.58А), а ті гнізда, які розміщені за малою кривизною, навпаки, вкорочуються (рис. 1.58Б). Після розширення стента за допомогою балона і його імплантації в судинну стінку гнізда набувають форми кристалічних ґрат алмаза (рис. 1.59), що надає конструкції надзвичайну твердість.

Рис. 1.59. Стент NIR після розправлення (пояснення в тексті)
Стенти NIR мають хороші загальні характеристики. Їх виготовляють із нержавіючої сталі. Після імплантації займають 11–18% площі внутрішньої поверхні стентованого сегмента. Товщина дроту — 0,1 мм. Профіль стента в стисненому стані — <1 мм. Діаметри, що випускаються, — від 2 до 5 мм; довжина — 9; 16; 25 і 32 мм. Балонна система доставки стента потребує застосування провідникового катетера із внутрішнім діаметром 6 F. Балон має проксимальну і дистальну рентгеноконтрастні мітки.
Стенти NIROYAL від стентів NIR відрізняються наявністю золотого покриття, що значно поліпшує їх візуалізацію. За конструкцією та іншим характеристикам ці стенти не мають відмінностей.
Так як стенти NIR і NIROYAL сконструйовані зовсім недавно, офіційних даних про результати їх клінічного застосування на сьогодні немає.
Елютинг-стенти
Елютинг-стенти перебувають у центрі уваги інтервенційних кардіологів з того часу, як у вересні 2001 р. на Конгресі Європейського кардіологічного товариства повідомлені результати дослідження RAVEL. З того часу досліджені можливості великої кількості препаратів, що вивільняються з різних стентових платформ як за допомогою полімерної основи, так і без такої. У великій кількості досліджень проводили оцінку ефекту різних антипроліферативних і протизапальних субстанцій, таких як сіролімус, паклітаксел, такролімус, еверолімус та інших препаратів, таких як дексаметазон, естрадіол, батимастат, дактиноміцин, метотрексат, інгібітори тирозинкінази, вінкристин, циклоспорин і C-myc antisense-technology (Resten-ng, AVI-4126). У якості препаратів, що вивільняються зі стентів, були також запропоновані статини, абциксимаб і трапідил. Внутрішньокоронарна імплантація за допомогою елютинг-стентів деяких антипроліферативних і протизапальних препаратів була припинена, незважаючи на сприятливі попередні експериментальні та клінічні результати, у зв’язку з тим, що клінічні дослідження виявили їх шкідливу дію (наприклад дактиноміцин у дослідженні ACTION (A Coronary disease Trial Investigating Outcome with Nifedipine GITS)) або недостатню ефективність (наприклад дексаметазон у дослідженні STRIDE (Study of Antirestenosis With the Biodivysio Dexamethasone-Eluting Stent); навіть високі дози дексаметазону, загруженого на стент, не приводили до істотного зниження проліферації). Результати цих досліджень показують, що препарати антипроліферативної групи неоднорідно демонструють притаманні їм властивості відносно запобігання рестенозів.
Первинні кінцеві точки рандомізованих досліджень елютинг-стентів були як ангіографічними (більш пізнє зменшення просвіту), так і клінічними (повторна реваскуляризація в стентованій судині). Для пацієнтів більш важливі клінічні прояви, ніж ангіографічні параметри. Оскільки значимість рандомізованих досліджень залежить від обраних кінцевих точок, дослідники зосередили свою увагу на рандомізованих дослідженнях, присвячених імплантації елютинг-стентів, що вивчали клінічні кінцеві точки. На сьогодні опубліковані результати тільки 4 рандомізованих досліджень, що оцінювали клінічні кінцеві точки і які мають адекватний інтервал спостереження. Паклітаксел, що не має полімерної основи, не досягав клінічної первинної кінцевої точки, на противагу позитивним ангіографічним результатам, продемонстрованим у дослідженні DELIVER-I (Drug Eluting coronary stent systems In the treatment of patients with de novo native coronary lesions). На противагу цьому, вивільнюючись із полімерної основи, паклітаксел значно поліпшив клінічні результати, як це показали дослідження TAXUS-IV і TAXUS-VI. Таким чином, не всі елютинг-стенти з паклітакселом є рівноцінними. Клінічне тестування сіролімусу проводили тільки зі стентами, що мали полімерну основу (дослідження SIRIUS). Хоча мрія — «жодного рестенозу» поки не реалізована, елютинг-стенти привели нас до поодиноких рестенозів за 9-місячний період спостереження. У реальному житті (реєстр RESEARCH) ризик повторної реваскуляризації за клінічними показниками при імплантації сіролімус-елютинг-стентів становить 3,7%. За даними реєстру Swiss рівень виживаності без значних несприятливих кардіальних подій протягом 6–9 міс спостереження склав 95,6%. При імплантації сіролімус-елютинг-стентів у передню міжшлуночкову гілку отримані показники, ідентичні тим, які були при реваскуляризації однієї судини із застосуванням шунтування. Перші результати проспективного рандомізованого порівняння стентів Cypher і Taxus (дослідження TAXi) показало, що високі рівні успіху, що досягаються при імплантації обох стентів, які отримані у раніше проведених рандомізованих дослідженнях, можуть бути перенесені у повсякденну клінічну практику. Результати цього малого дослідження, у яке включили 202 пацієнти, не продемонстрували ніяких переваг одного стента над іншим.
АНАТОМІЯ КОРОНАРНИХ АРТЕРІЙ. КОМПЛЕКСНИЙ АНАЛІЗ КОРОНАРОГРАМ
Серце людини кровопостачається лівою і правою коронарними артеріями, які відходять від висхідного відділу дуги аорти в лівому і правому коронарних синусах (рис. 1.60–1.62). Найбільш достовірним методом прижиттєвої візуалізації коронарних артерій на сьогодні є коронарографія. Аналіз атеросклеротичних уражень, виявлених на коронарограмах, визначає тактику лікування хворих з коронарним атеросклерозом. Для одержання найбільш повноцінної інформації необхідно мати знання про анатомічну і коронарографічну анатомію коронарних артерій, а також володіти методами комплексного коронарографічного аналізу.
Рис. 1.60. Топографічна анатомія коронарних артерій серця: 1 — стовбур ЛКА; 2 — ПМШГ ЛКА; 3 — ОГ ЛКА; 4 — гілка лівого передсердя; 5 — перша септальна гілка; 6 — діагональна гілка (ДГ); 7 — гілка тупого кінця; 8 — ПКА; 9 — конусова артерія; 10 — передсердна гілка; 11 — м’язові гілки; 12 — артерія синусного вузла; 13 — гілка гострого кінця; 14 — артерія AV-вузла; 15 — ліва латеральна гілка; 16 — задня міжшлуночкова гілка ПКА
Рис. 1.61. Топографічна анатомія артерій серця: 1 — аорта; 2 — ПКА; 3 — артерія синусного вузла; 4 — верхня порожниста вена; 5 — передсердна гілка; 6 — нижня порожниста вена; 7 — артерія AV-вузла; 8 — легеневі вени; 9 — гілка лівого передсердя; 10 — ОГ ЛКА; 11 — легенева артерія; 12 — гілка тупого кінця; 13 — ПМШГ ЛКА
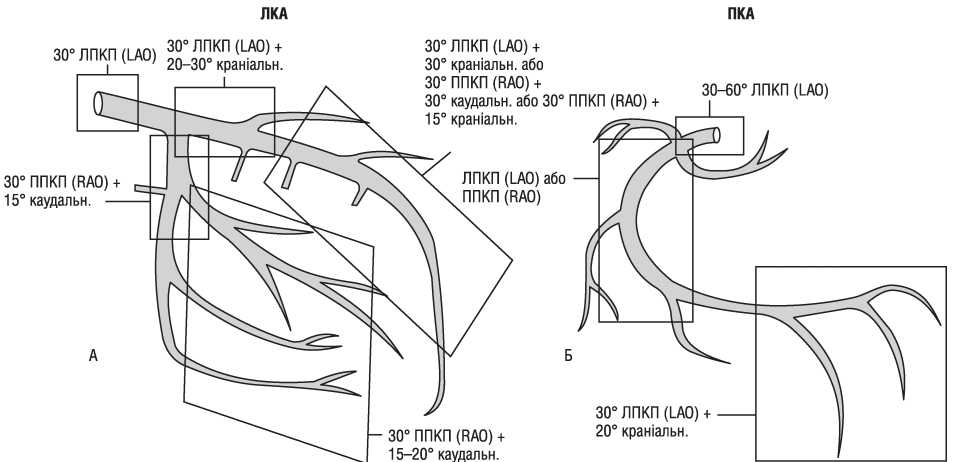
Рис. 1.62. Зображення ЛКА в правій передній косій проекції (ППКП) (а); ПКА в лівій передній косій проекції (ЛПКП) (б)
Нормальна і коронарографічна анатомія коронарних артерій. Коронарографічні проекції
Кровопостачання серця людини здійснюється трьома практично рівноцінними судинами. Такими є передня міжшлуночкова, огинаюча гілка лівої коронарної артерії, що утворюються при перекалібровці стовбура лівої коронарної артерії, а також права коронарна артерія.
Ліва коронарна артерія
Устя лівої коронарної артерії відкривається в стінці висхідної аорти у верхній частині лівого коронарного синуса, трохи вперед, у просторі між ЛА й вушком лівого передсердя. Стовбур лівої коронарної артерії (сегмент лівої коронарної артерії від устя до місця її розподілу на передню міжшлуночкову гілку, огинаючу гілку лівої коронарної артерії) може мати різну довжину. Може закінчуватися трифуркацією, що включає, крім передньої міжшлуночкової гілки та огинаючої гілки, діагональну гілку, що ділить кут між передньою міжшлуночковою гілкою і огинаючою гілкою лівої коронарної артерії. Як правило, від стовбура лівої коронарної артерії не відходять додаткові гілки. Устя й проксимальний сегмент лівої коронарної артерії краще визначаються в проекції «павук». У цій же проекції добре візуалізується відходження огинаючої гілки лівої коронарної артерії від основної магістралі. Ці особливості проекції можна використовувати при визначенні кута відходження огинаючої гілки лівої коронарної артерії при установці стентів (чим гостріший кут відходження, тим складніше доставляти трубчасті стенти в уражений сегмент огинаючої гілки лівої коронарної артерії).
Передня міжшлуночкова гілка лівої коронарної артерії
Передня міжшлуночкова гілка є продовженням стовбура лівої коронарної артерії, відходячи від нього вперед і вниз і розташовуючись у передній міжшлуночковій борозні. У більшості пацієнтів ця гілка продовжується до верхівки і бере участь у кровопостачанні її переднього відділу. Іноді передня міжшлуночкова гілка лівої коронарної артерії розміщується інтраміокардіально і тоді під час систоли можна спостерігати переривчастий перебіг контрасту внаслідок стиснення цієї артерії м’язовими містками. Проксимальний відділ передньої міжшлуночкової гілки найкраще визначається в лівій передній косій проекції (LAO) (від 30 до 60°) із краніальною ангуляцією 20–30°. Середня й дистальна частини передньої міжшлуночкової гілки лівої коронарної артерії краще видно в лівій передній косій проекції або правій передній косій проекції (RAO) (від 30 до 60°) без сагітальної ангуляції. Для того щоб уникнути накладання діагональних гілок у середньому відділі передньої міжшлуночкової гілки, можна в правій передній косій проекції використовувати невелику (15–20°) краніальну або каудальну ангуляцію.
Септальні та діагональні гілки
Септальні гілки відходять від передньої між-шлуночкової гілки під прямим кутом і глибоко проникають у міжшлуночкову перегородку. Кількість септальних гілок може бути різною. Іноді перша септальна гілка має діаметр, достатній для проведення ангіопластики та стентування. Наявність септальних гілок у великій артерії підтверджує, що це передня міжшлуночкова гілка. Часто саме ця ознака є диференціальною в складних випадках при аналізі коронарограм. Септальні гілки, що відходять від передньої міжшлуночкової гілки, кровопостачають 2/3 міжшлуночкової перегородки і формують анастомози із септальними гілками від задньої міжшлуночкової артерії, що відходить або від правої коронарної артерії, або від огинаючої гілки лівої коронарної артерії. Перші септальні гілки найкраще візуалізуються в лівій передній косій проекції 30° з краніальною ангуляцією 30° або в правій передній косій проекції 30° з каудальною ангуляцією 15°. Діагональні гілки (див. рис. 1.60–1.62) відходять від передньої міжшлуночкової гілки під гострим кутом і, розміщуючись під епікардом, підходять до тупого краю серця. Кількість діагональних гілок може бути різною, але зазвичай перші дві гілки досить великі для проведення ангіопластики й стентування. Проксимальний відділ першої діагональної гілки найкраще визначається в лівій передній косій проекції 30–45°. Для того щоб уникнути накладання інших артерій, краще використовувати праву передню косу проекцію 30° з каудальною (15)° або краніальною (30)° ангуляцією.
Огинаюча гілка лівої коронарної артерії
Огинаюча гілка лівої коронарної артерії відходить від стовбура під вушком лівого передсердя. Продовжується ліворуч і назад в лівій частині коронарної борозни. Після відходження кількох задніх лівошлуночкових гілок, що опускаються до тупого краю серця паралельно діагональним гілкам, які відходять від передньої міжшлуночкової гілки, огинаюча гілка лівої коронарної артерії «віддає» гілку тупого краю серця, яка проходить уздовж нього. Подальше продовження огинаючої гілки лівої коронарної артерії значно варіює. У людей з анатомічним переважанням огинаючої гілки лівої коронарної артерії, вона продовжується вираженою задньою міжшлуночковою гілкою. У більшості ж випадків огинаюча гілка закінчується малими термінальними задніми лівошлуночковими гілками й не переходить у задню міжшлуночкову борозну. Проксимальний відділ огинаючої гілки лівої коронарної артерії найкраще візуалізується в правій передній косій проекції 30° з каудальною ангуляцією 15°, у цій же проекції добре видно гілку тупого краю.
Права коронарна артерія
Від правого коронарного синуса відходять 5–6 дрібних артерій, що живлять передню поверхню правого й лівого передсердь. Устя правої коронарної артерії відкривається в передній стінці висхідної частини дуги аорти в середній частині правого коронарного синуса й розміщується трохи нижче устя лівої коронарної артерії. Права коронарна артерія продовжується вправо і проходить у правій частині AV-борозни. Першою гілкою правої коронарної артерії є конусова гілка, що кровопостачає проксимальний легеневий конус і ПШ. Іноді конусова гілка починається окремим устям і при селективній коронарографії права коронарна артерія не визначається. Від правої коронарної артерії вперед відходять 1–3 правошлуночкові гілки, що проходять по діагоналі ПШ, а ззаду — артерія синусного вузла, що проходить в краніальному напрямку до місця впадіння верхньої порожнистої вени. На межі середньої та нижньої третини правої коронарної артерії відходить велика гілка гострого краю, яка зазвичай кровопостачає тільки міокард ПШ. У більшості людей права коронарна артерія проходить уздовж діафрагмальної поверхні серця до crux (місце з’єднання правого й лівого передсердя, ПШ і ЛШ). У більшості (90%) випадків від правої коронарної артерії відходить артерія AV-вузла, після чого права коронарна артерія проходить у задній міжшлуночковій борозні у вигляді задньої міжшлуночкової гілки. Діаметр цієї артерії значно варіює, однак у більшості хворих він досить великий для виконання ангіопластики й стентування. Проходячи в задній міжшлуночковій борозні, права коронарна артерія «віддає» септальні гілки, які, відходячи під прямим кутом, кровопостачають нижню третину міжшлуночкової перегородки. Ці гілки можуть забезпечити достатній колатеральний кровотік через септальні артерії в систему лівої коронарної артерії.
Устя й проксимальний відділ правої коронарної артерії найкраще видно в лівій передній косій проекції 45–60°. Середній відділ правої коронарної артерії добре візуалізується як у правій передній косій проекції, так і лівій. Іноді використовують латеральну проекцію для візуалізації середньої третини правої коронарної артерії, яка в ділянці crux і задньої міжшлуночкової борозни визначається в лівій передній косій проекції 30° з краніальною (20–30°) ангуляцією або в правій передній косій проекції 30° з невеликою (15–20°) краніальною ангуляцією.
Аналіз коронарограм при коронарному атеросклерозі
Незважаючи на те що селективну коронарографію в кардіологічній практиці застосовують уже понад 30 років, методи аналізу коронарограм продовжують розвиватися та удосконалюватися. Цей процес нерозривно пов’язаний із впровадженням принципово нових способів лікування хворих з коронарним атеросклерозом. Прижиттєва візуалізація коронарного русла дозволила в першу чергу вірогідно констатувати сам факт атеросклеротичного ураження коронарних артерій і тим самим диференційовано підійти до лікування пацієнтів з різними формами ІХС. З розвитком кардіальної хірургії (впровадження операцій обхідного шунтування коронарних артерій) з’явилася необхідність у більш ретельному аналізі коронарограм: без відомостей про локалізацію атеросклеротичних обструкцій, ступеня ураження артерій і поширеності процесу неможливе виконання шунтувальних операцій. Упровадження й широке поширення інвазивних внутрішньокоронарних методів лікування коронарного атеросклерозу стимулював розвиток нових методів аналізу коронарограм. Так, якщо для проведення шунтувальних операцій відомостей про ступінь, локалізацію й поширеність атеросклеротичного процесу досить, то для виконання внутрішньокоронарних втручань потрібна додаткова інформація. Це зумовлено тим, що точкою прикладання внутрішньокоронарних втручань є не вся уражена коронарна судина, а безпосередньо той морфологічний субстрат, який викликав критичне зменшення просвіту артерії. Після впровадження методу ПКВ цю операцію виконували у хворих тільки з хронічною клінічною формою коронарного атеросклерозу і тільки у випадках, коли при коронарографії у них було виявлено поодиноке атеросклеротичне ураження коронарної артерії у вигляді концентричного дискретного стенозу, що звужував просвіт артерії на 50–95%. Зараз цю операцію виконують як при хронічній, так і при гострій формах коронарної хвороби; як при односудинному, так і при дво-, трьосудинному ураженні коронарного русла; як при стенозах, так і при оклюзіях коронарних артерій. Не дивно, що при цьому збільшилася кількість безуспішних спроб і ускладнень ПКВ.
Аналізуючи первинні (виконані до ПКВ) коронарограми хворих, у яких після проведення ангіопластики виникли ускладнення, дослідники звернули увагу на те, що атеросклеротичні бляшки, що були піддані дилатації, мають нетипову коронарографічну конфігурацію. Цей факт дозволив припустити, що «неправильна» конфігурація стенозів виявлена на коронарограмах, відображає морфологічні зміни, що відбуваються у цих бляшках, а саме — процеси їх руйнування і внутрішньо-просвітного тромбоутворення. Дослідження Levin і Fallon, у якому проведене порівняння даних посмертного коронарографічного і патоморфологічного дослідження коронарних артерій тих самих хворих, що померли від ускладнень коронарного атеросклерозу, підтвердили правильність цих припущень. Це дослідження, а також ряд інших поклали початок впровадження методу якісного аналізу коронарограм. Цей метод, на сьогодні удосконалений, дозволяє з високим ступенем вірогідності визначити прижиттєвий морфологічний стан атеросклеротичних обструкцій коронарних артерій хворих з коронарним атеросклерозом. Прижиттєва інформація про морфологічний стан атеросклеротичних уражень важлива як для прогнозу перебігу коронарного атеросклерозу (відомо, що деструкція атеросклеротичних бляшок є основною умовою переходу хронічної форми коронарного атеросклерозу в гострі — нестабільну стенокардію та ІМ), так і для визначення показань до ПКВ і прогнозування можливих ускладнень цієї операції.
Таким чином, для того щоб вибрати правильну тактику лікування хворих з коронарним атеросклерозом і визначити показання до того чи іншого виду оперативного втручання, необхідно використовувати кілька методик аналізу коронарограм. По-перше, слід встановити загальні коронарографічні характеристики атеросклеротичного ураження коронарних артерій (кількість атеросклеротичних обструкцій і їх посегментну локалізацію в коронарному руслі). По-друге, провести кількісний коронарографічний аналіз кожної з обструкцій (визначити ступінь звуження просвіту й довжину обструкції). По-третє, проаналізувати якісні коронарографічні характеристики обструкцій (визначити ознаки руйнування атеросклеротичних бляшок і внутрішньопросвітного тромбоутворення, а також вираженість цих процесів). Крім того, на результати інтервенційних процедур впливають деякі анатомічні особливості локалізації обструкцій (розміщення обструкції в місці значного вигину артерії, дистальніше кількох вигинів, у місці біфуркації артерії і т.п.). Ці особливості також необхідно враховувати при визначенні показань до операцій.
Аналіз загальних і кількісних коронарографічних характеристик
При оцінці коронарограм слід проводити аналіз загальних і кількісних коронарографічних характеристик атеросклеротичного ураження коронарних артерій у повному обсязі. Аналізуючи загальні ко-ронарографічні характеристики ураження коронарного русла, необхідно визначити кількість уражених коронарних артерій, кількість ушкоджень у кожній артерії, посегментну локалізацію обструкцій в епі-кардіальних судинах, наявність уражень в артеріях другого й третього порядку, стан дистального русла.
При виборі тактики лікування хворих з коронарним атеросклерозом дуже важлива правильна оцінка загальних коронарографічних характеристик. Так, наявність багатосудинного дифузійного ураження є, як правило, показанням до проведення шунтувальної операції (хоча необхідно відзначити, що останнім часом при багатосудинному ураженні все частіше проводять ендоваскулярні втручання); наявність же уражень у дистальних (з діаметром просвіту <1 мм) відділах артерій зазвичай є протипоказанням до їх шунтування. При звуженні стовбура лівої коронарної артерії показана як операція обхідного шунтування, так і стентування. Як уже зазначено, наявність поодинокого дискретного ураження в коронарному руслі є показанням до проведення ПКВ або інтракоронарного стентування; виконання шунтувальних операцій у цих випадках недоцільне.
Кількісний аналіз коронарограм, як і аналіз загальних коронарографічних характеристик коронарного атеросклерозу, є одним з перших методів коронарографічного аналізу, що застосовується в кардіології. Такими критеріями є ступінь звуження просвіту коронарної артерії внаслідок кожної атеросклеротичної обструкції і довжина атеросклеротичної обструкції. Ступінь звуження просвіту визначається відношенням ширини максимального звуження просвіту в зоні ураження до ширини просвіту неураженої ділянки артерії, розміщеної дистально безпосередньо біля обструкції, і виражається у відсотках (рис. 1.63). Існує кілька класифікацій ступеня стенозування коронарних артерій. Найпоширенішою з них є класифікація Conti і співавторів (1977).
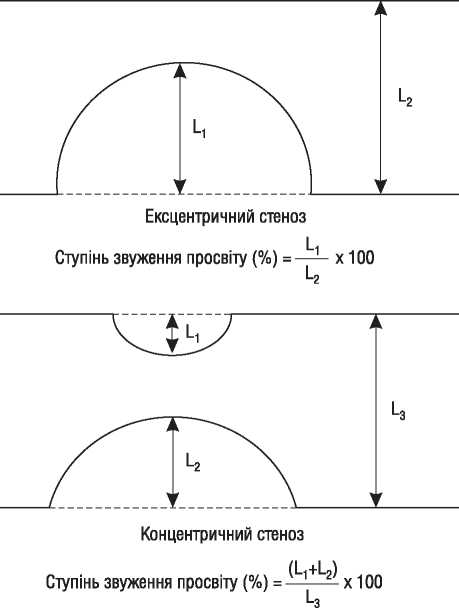
Рис. 1.63. Визначення ступеня звуження просвіту артерії
Довжина уражень визначається відстанню між проксимальною й дистальною точками видимої на коронарограмі зміни просвіту артерії й виражається в міліметрах. Для визначення справжнього ступеня звуження просвіту так само, як і справжньої довжини стенозу, необхідно враховувати погрішність ангіографічної і проекційної апаратури. Для цього в якості константної величини використовується співвідношення між дійсною шириною дистальної частини коронарографічного катетера і шириною цього катетера, видимого на коронарограмі. Як було встановлено в дослідженнях, у тому числі проведених у Національному науковому центрі «Інститут кардіології ім. М.Д. Стражеска», результати коронарної ангіопластики суттєво залежать від довжини стенозу: при довжині стенозів >2 см підвищується ймовірність їх неповної дилатації.
Сучасна ангіографічна апаратура оснащена пристосуваннями, які дозволяють проводити комп’ютерну обробку коронарографічних даних, що значною мірою спрощує аналіз кількісних коронарографічних характеристик атеросклеротичних уражень коронарних артерій. Проте на підставі даних кількісного аналізу коронарограм не можна прогнозувати розвиток гострих коронарних ішемічних синдромів, тому що відомо, що їх розвиток залежить не від ступеня тяжкості ураження коронарних артерій, а від процесів, що зумовили ускладнений ріст атеросклеротичних бляшок. Процеси руйнування атеросклеротичних бляшок і внутрішньопросвітного тромбоутворення при житті хворих з коронарним атеросклерозом можна визначити на підставі критеріїв якісного аналізу коронарограм.
Аналіз якісних коронарографічних характеристик
Прижиттєва інформація про морфологічний стан атеросклеротичних обструкцій коронарних артерій безсумнівно важлива, оскільки дозволяє прогнозувати клінічний перебіг коронарного атеросклерозу й припустити можливі несприятливі результати внутрішньокоронарних втручань. Проте кардіологи не завжди досить точно інтерпретують якісні коронарографічні характеристики коронарного атеросклерозу. Це дає підставу більш детально описати критерії якісного аналізу коронарограм, які застосовуються в сучасній кардіології.
Уже згадувалося, що дослідження, виконане Levin і Fallon у 1982 р., стало основним у розвитку якісного аналізу коронарограм. Ці автори виконали посмертну коронарографію у 39 хворих з коронарним атеросклерозом, які померли від гострого ІМ або під час проведення шунтувальних операцій. Дані посмертної коронарографії порівнювали з гістологічними зрізами в місцях уражень коронарних артерій. Проведено аналіз 73 стенозів коронарних артерій (від 50 до 99%), виявлених у цих хворих. Гістологічний аналіз зрізів коронарних артерій проводили в точній відповідності з кожною зоною звуження, визначеного на посмертних коронарограмах.
Усі стенози, виявлені на посмертних коронарограмах, автори розподілили на 2 групи: стенози типу I (прості), що мають широку основу і чіткий рівний контур (конфігурація «годинникового скла») без випинань усередину просвіту судини по контуру стенозу, і стенози типу II (складні), що мають нерівний контур у вигляді виразкових ніш і/або внутрішньопросвітних випинань. За результатами гістологічного дослідження атеросклеротичні обструкції розподілили на неускладнені (з інтактною інтимою) і ускладнені (з розривами і виразками інтими, крововиливами в тканину бляшки, внутрішньобляшковими та внутрішньопросвітними тромбами). Ангіографічне і гістологічне дослідження простих стенозів і неускладнених обструкцій збіглося у 88% випадків (31 із 35); складних стенозів і ускладнених обструкцій — у 78% випадків (30 із 38). За даними цього дослідження чутливість методу визначення морфологічного стану атеросклеротичних бляшок на посмертних коронарограмах склала 88%; специфичність — 79%.
Подібне дослідження виконано в Національному науковому центрі «Інститут кардіології ім. М.Д. Стражеска». У цьому дослідженні, на відміну від роботи Levin і Fallon, крім співставлення результатів посмертних коронарограм і патоморфологічного дослідження, порівнювали також дані прижиттєвих коронарограм 28 хворих, що померли від ускладнень коронарного атеросклерозу. При цьому особливу увагу звертали на можливість прижиттєвого виявлення коронарографічних ознак руйнування атеросклеротичних бляшок і внутрішньопросвітного тромбоутворення, прижиттєву диференціальну діагностику ознак руйнування і ознак тромбоутворення, визначення коронарографічних ознак інтенсивності кожного із цих процесів. Крім того, аналізували можливість прижиттєвого визначення характеру оклюзії коронарних артерій (диференційована оцінка коронарографічних ознак гострого тромботичного і хронічного атеросклеротичного процесів).
Результати дослідження показали, що аналіз прижиттєвих коронарограм дозволяє з високим ступенем вірогідності (чутливість методу — 92%, специфичність — 83%) визначити ускладнений ріст атеросклеротичних бляшок і морфологічний характер оклюзії, диференціювати ознаки руйнування бляшок і внутрішньопросвітного тромбоутворення, встановити інтенсивність цих процесів.
На підставі даних наведених морфологічних досліджень, а також ряду клінічних досліджень, присвячених застосуванню методу якісного аналізу коронарограм як для прогнозування клінічного перебігу ІМ і нестабільної стенокардії, так і для визначення ймовірності можливих несприятливих результатів коронарної ангіопластики при гострих і хронічних клінічних формах коронарного атеросклерозу, ми пропонуємо наступну схему якісного аналізу коронарограм:
- визначення морфологічного типу стенозу (за класифікацією Ambrose, 1985);
- диференційоване визначення коронарографічних ознак руйнування атеросклеротичних бляшок і внутрішньопросвітного тромбоутворення, а також встановлення вираженості кожного із цих процесів;
- вирахування індексу виразковості (вкриття виразками) атеросклеротичних бляшок (за методикою Wilson);
- визначення коронарографічних ознак морфологічного стану оклюзії (диференціація гострої тромботичної і хронічної атеросклеротичної оклюзії).
За класифікацією Ambrose всі стенози, що визначаються на коронарограмах, поділяються на наступні типи (рис. 1.64):
- концентричні;
- ексцентричні типу I;
- ексцентричні типу II;
- стенози із множинними звуженнями.
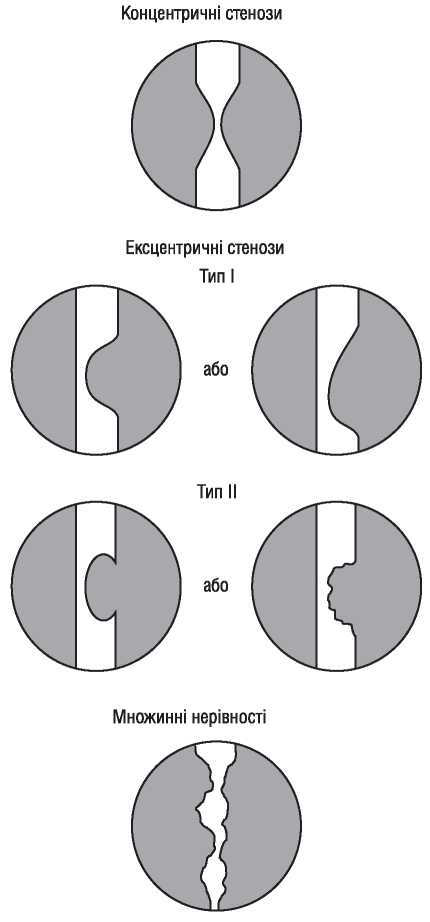
Рис. 1.64. Морфологічні типи стенозів (за класифікацією Ambrose, 1985)
Концентричними (рис. 1.65) вважаються ті стенози. при яких просвіт артерії симетрично звужений по контуру обох стінок судини, при цьому концентричність стенозу визначається у всіх коронарографічних проекціях. Ексцентричними вважаються стенози. що звужують просвіт судини по контуру однієї з його стінок. або якщо звуження просвіту по контуру однієї судинної стінки значно перевищує звуження по контуру протилежної. Для ексцентричних стенозів типу I (рис. 1.66. 1.67) характерна наявність широкої основи і чіткого рівного контуру. Ексцентричні стенози типу II характеризуються або нерівністю контуру (при цьому звуження просвіту артерії чергується з деяким його розширенням і наступним повторним звуженням), або вузькою основою і нависаючими над стінкою судини проксимальним і/або дистальним краями. Стенози із множинними звуженнями характеризуються декількома (>3) звуженнями в межах одного ураження.
Рис. 1.65. Коронарограма хворого В.: концентричний стеноз
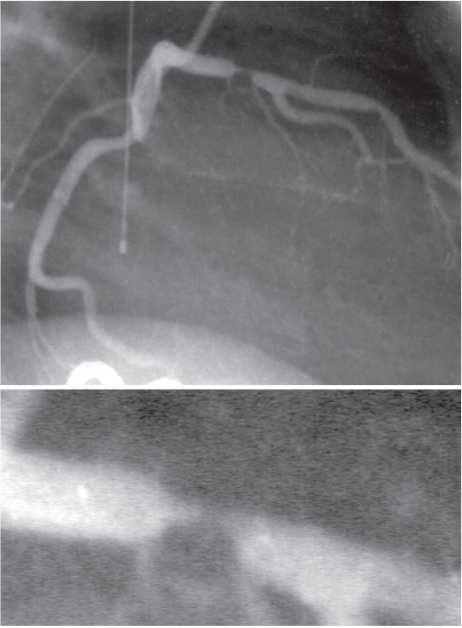
Рис. 1.66. Коронарограма хворого С.: ексцентричний стеноз типу I
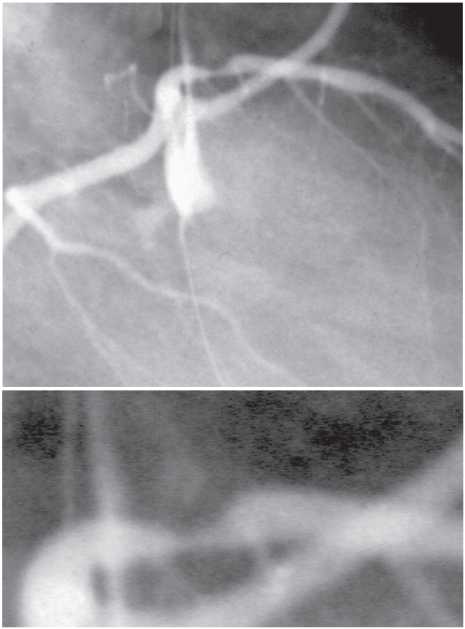
Рис. 1.67. Коронарограма хворого К.: ексцентричний стеноз типу I
Згідно з цією класифікацією концентричні стенози та ексцентричні стенози типу I є не-ускладненими (простими) і відображають відсутність деструктивних процесів в атеросклеротичній бляшці; ексцентричні стенози типу II, а також стенози із множинними звуженнями вважаються ускладненими (складними) і відображають або процес руйнування атеросклеротичної бляшки, або більш-менш виражене внутрішньопросвітне тромбоутворення в зоні деструкції. Необхідно відзначити, що стенози із множинними звуженнями на коронарограмах хворих з коронарним атеросклерозом відзначають досить рідко; наявність подібних стенозів, як правило, супроводжується коронарографічними ознаками кальцинозу в зонах цих обструкцій (IV стадія атеросклеротичного процесу).
Класифікація Ambrose дозволяє виявити коронарографічні ознаки деструкції атеросклеротичних бляшок. Однак, щоб прогнозувати ускладнений перебіг коронарного атеросклерозу й особливо ризик розвитку можливих ускладнень коронарної ангіопластики, необхідно вірогідно визначити вираженість внутрішньопросвітного тромбоутворення в зонах атеросклеротичної обструкції. У дослідженні Cowley і співавторів проведена спроба систематизувати коронарографічні ознаки тромбоутворення. У клініко-морфологічному дослідженні, виконаному в Національному науковому центрі «Інститут кардіології ім. М.Д. Стражеска», встановлено, що кожному етапу ускладненого перебігу коронарного атеросклерозу відповідає певна ангіографічна картина. Коронарографічними ознаками руйнування атеросклеротичних бляшок є:
- негомогенність контрастування або нечіткий («розмитий») контур стенозу (рис. 1.68);
- нерівний контур стенозу, що має поглиблення у вигляді виразкової ніші (симптом «мінус тканина») (рис. 1.69а, б).
Рис. 1.68. Коронарограма хворого Н.: негомогенне контрастування, розмитий контур стенозу
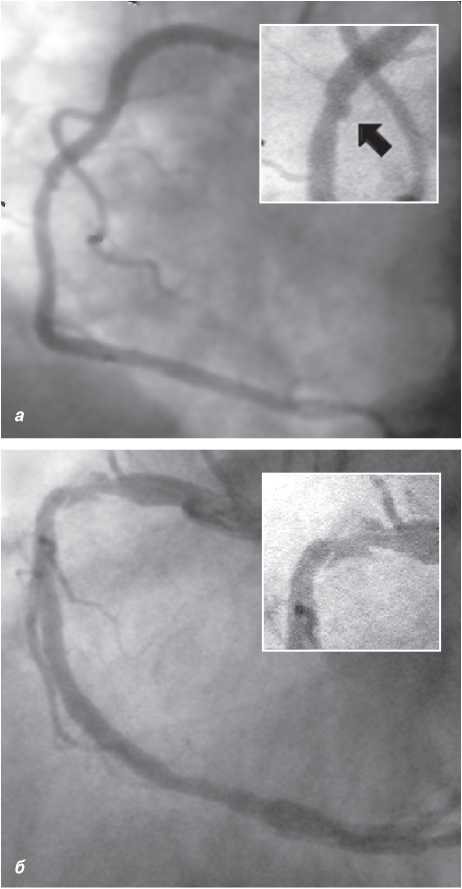
Рис. 1.69. Коронарограма хворого П.: симптом «мінус тканина»; виразкова ніша (а). Коронарограма хворого З.: симптом «мінус тканина»; виразкова ніша з тромбом у бляшці (б)
До коронарографічних ознак внутрішньопросвітного тромбоутворення належать:
- нерівність контуру стенозу у вигляді внутрішньопросвітних випинань (симптом «плюс тканина») (рис. 1.70а, б);
- стенози з вузькою основою і нависаючими над стінкою артерії проксимальним і/або дистальним краями (рис. 1.71а, б);
- внутрішньопросвітні дефекти наповнення, що проявляються на коронарограмах у вигляді дискретних внутрішньопросвітних утворень, оточених гомогенним непрозорим контрастом, які локалізуються на стенозі або безпосередньо поруч із ним (рис. 1.72а, б).
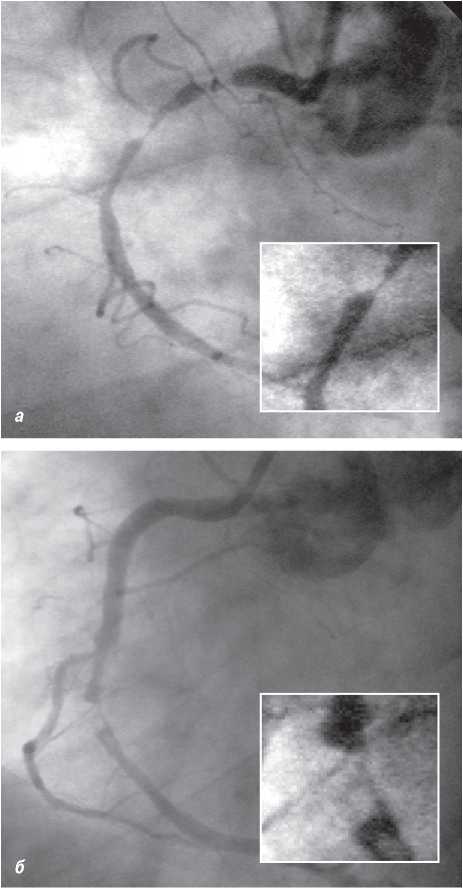
Рис. 1.70. Коронарограма хворого Б.: симптом «плюс тканина»; внутрішньопросвітне випинання (а). Коронарограма хворого К.: симптом «плюс тканина»; внутрішньопросвітне випинання (б)
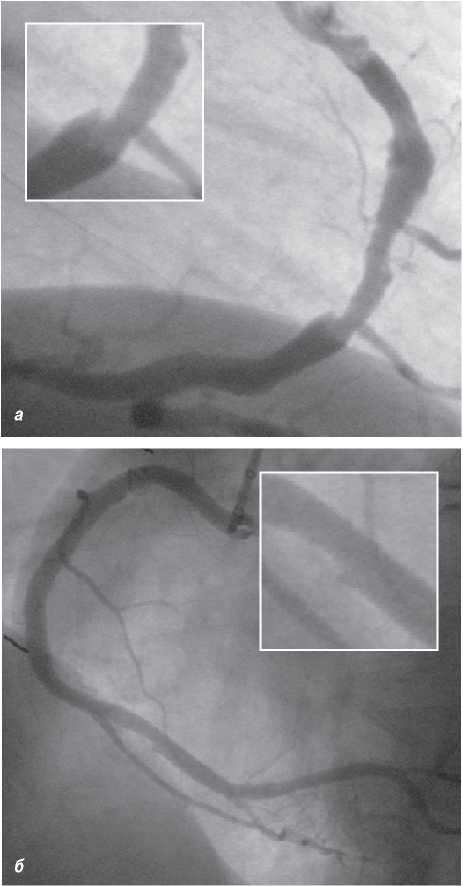
Рис. 1.71. Коронарограма хворого А.: нависаючий дистальний край стенозу (а). Коронарограма хворого С.: нависаючий дистальний край стенозу (б)
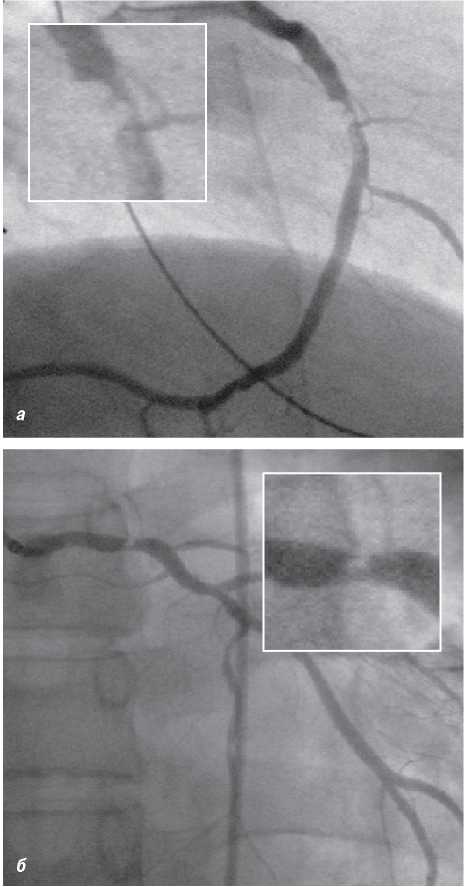
Рис. 1.72. Коронарограма хворого Т.: внутрішньо-просвітний дефект наповнення (а). Коронарограма хворого Я.: внутрішньопросвітний дефект наповнення (б)
Результати цього дослідження також показали, що негомогенність контрастування просвіту й нечіткий контур стенозу є ознаками незначного руйнування атеросклеротичних бляшок, у той час як наявність виразкової ніші свідчить про глибоке руйнування атеросклеротичної бляшки із проникненням деструкції в м’язовий шар коронарної артерії. Нерівність контуру у вигляді внутрішньопросвітних випинань є ознакою незначного внутрішньопросвітного тромбоутворення, а наявність стенозів з нависаючими краями або внутрішньо-просвітних дефектів наповнення — значного внутрішньопросвітного тромбозу.
Важливим показником якісного аналізу коронарограм є визначення індексу виразковості за методикою Wilson. У дослідженні Wilson і співавторів, виконаному в 1986 р., встановлено, що при наявності коронарографічних ознак значного руйнування атеросклеротичних бляшок (виразкова ніша, симптом «мінус тканина») доцільно визначати індекс виразковості, оскільки за даними дослідження величина цього показника перебуває в обернено пропорційній залежності від імовірності загострення клінічного перебігу коронарного атеросклерозу. Індекс виразковості (за Wilson) визначається як відношення ширини просвіту в місці найменшого звуження до максимальної ширини просвіту в межах аналізованого стенозу (рис. 1.73). У дослідженні Wilson і співавторів виявлено, що при стенозах, які зумовили розвиток ІМ, величина індексу виразковості склала 0,61±0,03, у той час як при стенозах, що не викликали гострих порушень коронарного кровообігу, — 0,90±0,02. Величина індексу виразковості в артеріях, що зумовили нестабільну стенокардію, склала 0,62±0,05, а у хворих зі стабільною стенокардією — 0,96±0,05.
Рис. 1.73. Визначення індексу виразковості (ІВ) (вкривання виразками) за методикою Wilson (1986)
Прижиттєве морфологічне визначення обструкцій коронарних артерій, що зумовили їх повну оклюзію, також є важливим етапом якісного аналізу коронарограм. У дослідженнях Ellis і співавторів, Ryan і співавторів встановлено, що при визначенні показань для проведення ПКВ необхідно враховувати характер оклюзії: ймовірність успішного виконання коронарної ангіопластики значно вища при гострій тромботичній оклюзії на відміну від хронічної атеросклеротичної оклюзії.
У дослідженні, проведеному Ю.М. Соколовим і співавторами, встановлено, що якісний аналіз прижиттєвих коронарограм дозволяє диференціювати ці види оклюзії: гострий тромботичний характер оклюзії на коронарограмі проявляється у вигляді різкого обриву просвіту артерії з перпендикулярним стінці або опуклим у проксимальний бік її краєм (рис. 1.74); хронічний атеросклеротичний характер оклюзії проявляється поступовим «конусоподібним» звуженням просвіту артерії до її повної оклюзії (див. рис. 1.74).
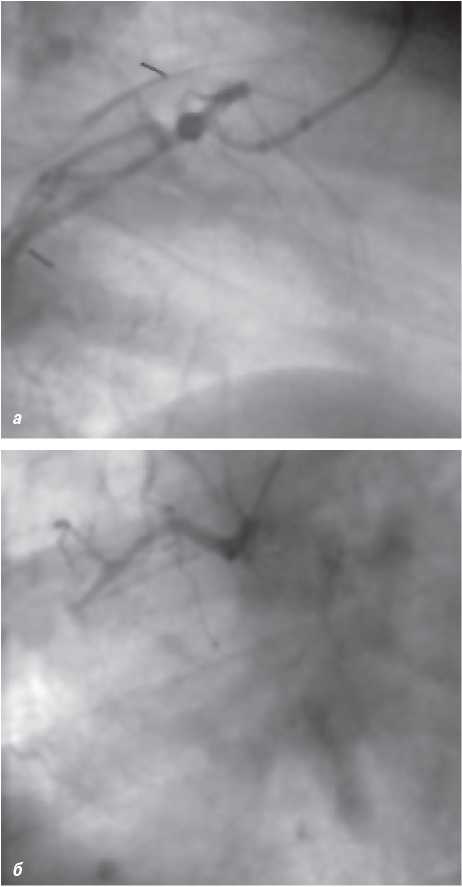
Рис. 1.74. Коронарограма хворого Р.: гостра тромботична оклюзія у проксимальному сегменті ПМШГ ЛКА (а). Коронарограма хворого Т.: хронічна оклюзія у проксимальному сегменті ПКА (б)
Аналіз якісних коронарографічних характеристик атеросклеротичних уражень коронарних артерій має велику інформативну цінність, проте є досить трудомісткою процедурою. Його проведення вимагає дотримання ряду умов. Під час вивчення коронарограми слід вибрати ту проекцію, у якій ознаки деструкції аналізованої атеросклеротичної бляшки проявляються найбільш виражено. Якщо аналіз коронарограми проводять по кінофільму, то після вибору оптимальної проекції необхідно відібрати 6 кінокадрів, відповідних кінцю діастоли, коронарографічну картину збільшити в 3 рази відносно дійсних розмірів і за отриманим зображенням провести якісний аналіз коронарограм. Крім того, враховуючи суб’єктивність методу, рекомендується, щоб якісний аналіз коронарограм проводив лікар (краще — група лікарів), який не ознайомлений з клінічним перебігом захворювання у цього пацієнта і який не виконував коронарографію. Проте, незважаючи на деяку громіздкість і суб’єктивність, якісний аналіз коронарограм на сьогодні є єдиним методом, який з високим ступенем вірогідності дозволяє визначити прижиттєвий морфологічний стан атеросклеротичних уражень коронарних артерій у хворих з коронарним атеросклерозом.
Аналіз анатомічних особливостей локалізації атеросклеротичних уражень у коронарному руслі
Досвід виконання внутрішньокоронарних лікувальних втручань при коронарному атеросклерозі показав, що на їх результати значно впливають анатомічні особливості локалізації атеросклеротичних обструкцій: ураження дистальніше значної звивистості коронарної артерії (>2 вигини) (рис. 1.75); локалізація в місці значного вигину судини (рис. 1.76); в місці біфуркації коронарної артерії (рис. 1.77); в усті епікардіальної судини (рис. 1.78).
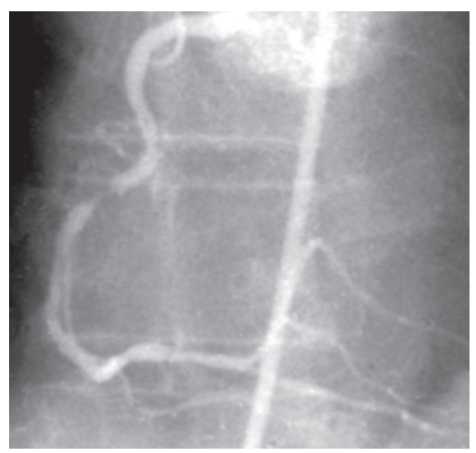
Рис. 1.75. Локалізація атеросклеротичного ураження дистальніше 2 вигинів коронарної артерії
Рис. 1.76. Локалізація атеросклеротичного ураження в місці значного вигину коронарної артерії
Рис. 1.77. Локалізація атеросклеротичного ураження в місці біфуркації коронарної артерії
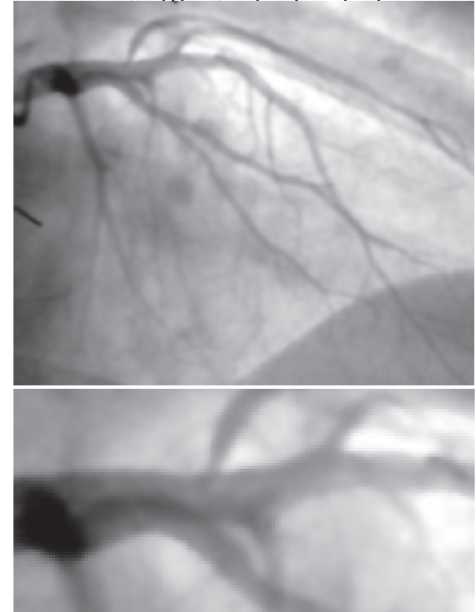
Рис. 1.78. Локалізація атеросклеротичного ураження в усті ДГ ЛКА
При визначенні звивистості коронарної артерії враховують кількість вигинів, що розташовуються проксимальніше атеросклеротичної обструкції. Звивистість проксимального відділу артерії вважається значною в тому випадку, якщо в цьому відділі визначають >2 вигини. У випадку локалізації атеросклеротичної обструкції в місці вигину коронарної артерії необхідно визначити його кут. Вигин артерії визначається кутом, який утворений відрізком прямої, що є продовженням поздовжньої осі відділу артерії, розміщеної проксимальніше вигину, і відрізком поздовжньої осі артерії дистальніше вигину (рис. 1.79). Вигин артерії вважається значним, якщо рівний або перевищує 60°. Біфуркаційними вважаються ті стенози, які локалізуються в місці перекалібровки епікардіальної артерії і уражують устя обох дочірніх артерій. Стенозами устя артерії є стенози, що розміщуються в місцях перекалібровки коронарної артерії і які уражують устя однієї з гілок.
Рис. 1.79. Визначення кута вигину коронарної артерії
Комплексний аналіз коронарограм
У табл. 1.11 представлені критерії комплексного аналізу коронарограм, які повинні бути відображені в коронарографічному протоколі з урахуванням загальних, кількісних, якісних і анатомічних характеристик атеросклеротичного ураження коронарних артерій. На підставі цих критеріїв визначають імовірність безуспішних спроб і ускладнень внутрішньокоронарних втручань. Крім того, у протоколі коронарографічного аналізу повинно бути приведене зображення стенозів і оклюзій (у випадку аналізу кінокоронарограм — зображені в трикратному збільшенні на міліметровому папері).
Таблиця 1.11. Критерії комплексного аналізу коронарограм, які необхідно відображати в коронарографічному протоколі
| Критерії аналізу коронарограм | |
| Кількісні | Якісні |
| — ступінь звуження просвіту артерії;
— довжина стенозу |
Стенози:
— тип стенозу за класифікацією Ambrose; — ознаки руйнування або тромбоутворення (для стенозів типу II за класифікацією Ambrose); — індекс виразковості за Wilson; — рівень перфузії за шкалою TIMI Оклюзії: — тип оклюзії |
| Анатомічні | |
| — кут артерії у місці деструкції
— кількість проксимальних вигинів — стеноз біфуркації — стеноз устя — кальцифікація — колатеральний кровотік |
|
Згідно з результатами деяких досліджень прогнозувати ускладнення клінічного перебігу коронарного атеросклерозу можна тільки на підставі комплексного аналізу коронарограм. На підставі загального й кількісного аналізу можна визначити тяжкість атеросклеротичного ураження коронарного русла, однак припустити можливість розвитку гострих коронарних ішемічних синдромів на підставі цих даних не можна. Прогнозувати розвиток ІМ і нестабільної стенокардії можна на підставі аналізу якісних коронарографічних характеристик: ознаки руйнування атеросклеротичних бляшок і внутрішньопросвітного тромбоутворення дозволяють припустити ускладнення клінічного перебігу коронарного атеросклерозу. Ця інформація дозволяє визначити строки проведення внутрішньосудинних втручань у хворих з коронарним атеросклерозом. На підставі комплексного аналізу коронарограм можна прогнозувати невдалі спроби та ускладнення внутрішньокоронарних лікувальних процедур. Великий відсоток невдалих спроб коронарної ангіопластики відзначений при дилатації хронічної атеросклеротичної оклюзії, а також локалізації стенозів у місцях значних вигинів артерій або дистальніше значної звивистості судини. Ускладнення ПКВ у вигляді гострої тромботичної оклюзії в місці частково відкритого просвіту артерії часто відзначають при дилатації стенозів з коронарографічними ознаками вираженого тромбоутворення. Таким чином, комплексний аналіз коронарограм дає можливість прогнозувати як клінічний перебіг коронарного атеросклерозу, так і результати ендоваскулярних втручань. Без комплексної коронарографічної оцінки не можна вибрати адекватну тактику лікування хворих з коронарним атеросклерозом, визначити показання й строки виконання тих або інших оперативних втручань.
ЗАСТОСУВАННЯ ВНУТРІШНЬОСУДИННОГО УЛЬТРАЗВУКУ ДЛЯ ОЦІНКИ АТЕРОСКЛЕРОТИЧНИХ УРАЖЕНЬ КОРОНАРНИХ АРТЕРІЙ І РЕЗУЛЬТАТІВ СТЕНТУВАННЯ
Внутрішньосудинне УЗД — інвазивний діагностичний метод, що забезпечує прижиттєву візуалізацію структур, які перебувають усередині просвіту та стінки судин. Для виконання внутрішньосудинного УЗД необхідні інструменти малих розмірів. Створенню мініатюрної ультразвукової апаратури, що має високу розрізняльну здатність, сприяв розвиток п’єзоелектричної і мікроелектронної технології.
Техніка виконання внутрішньосудинного УЗД полягає в стандартній селективній катетеризації судини з наступним підведенням ультразвукового датчика до досліджуваного об’єкта (атеросклеротичної бляшки). На відміну від ангіографії, при якій досягається силуетне зображення ураження судинної стінки на фоні заповненого контрастом просвіту, внутрішньосудинне УЗД дозволяє візуалізувати зміни судинної стінки в проекції поперечного зрізу, тобто томографічно. Такий спосіб візуалізації дає можливість визначити не тільки лінійні параметри (діаметр просвіту), але й площу поперечного перерізу просвіту в місці звуження артерії. Крім того, ґрунтуючись на відмінності тканин за ехогенною щільністю, внутрішньосудинне УЗД дозволяє отримати картину морфологічного складу атеросклеротично зміненої інтими артерії.
Концепція про можливість УЗД судин з боку просвіту висловлена ще в початковий період застосування ультразвуку в кардіологічній практиці. У 1960 р. Cieszynski повідомив про перші досвіди застосування внутрішньосудинного ультразвуку для визначення розмірів камер серця у собак. Проводячи це дослідження, автор користувався ультразвуковим датчиком, розміщеним на верхівці внутрішньосудинного катетера. Прототип сучасних ультразвукових внутрішньосудинних катетерів розроблений Bom і співавторами в 1972 р. Однак у ті ж роки широку популярність набув метод неінвазивного трансторакального УЗД серця (ехоКГ), тому метод внутрішньосудинного УЗД виявився тимчасово незатребуваним.
Наприкінці 70-х років ХХ ст. з’явилися і отримали всесвітнє визнання нові інвазивні методи лікування хворих з атеросклерозом, що сприяло відродженню інтересу до внутрішньосудинних УЗД, тому що для нових лікувальних процедур була потрібна особлива інформація про стан судинного русла та характер атеросклеротичних уражень. У середині 80-х років ХХ ст. створено кілька груп, що займалися удосконаленням внутрішньосудинної ультразвукової апаратури, і в 1988 р. Yock і його співробітники представили перші результати використання нового покоління внутрішньосудинної ультразвукової техніки in vivo. Зменшення розмірів і підвищення гнучкості ультразвукових катетерів зробили процедуру внутрішньосудинного УЗД рутинною.
Інструментарій
Принцип роботи внутрішньосудинної та інших видів ультразвукової апаратури ґрунтується на генеруванні і прийманні ультразвукових хвиль, після чого проводиться обробка інформації і отримання зображення. Внутрішньосудинне УЗД відрізняється частотними параметрами: внутрішньосудинна ультразвукова апаратура працює в режимі 10–40 МГц, а не в режимі 2–10 МГц (як звичайна ультразвукова апаратура) з тенденцією до підвищення частоти для поліпшення просторового розрізнення.
Головною технічною відмінністю звичайної ультразвукової апаратури від внутрішньосудинної є те, що в останній ультразвукові датчики розміщуються на катетерах, що доставляють датчики в просвіт досліджуваної судини до місця її ураження. Діаметр перших зразків внутрішньосудинних ультразвукових катетерів був досить великим — 5 F. Сучасні ультразвукові катетери мають малі діаметри — від 2,9 до 3,5 F. Ці катетери не тільки легкі в керуванні, але й сприяють кращій якості зображення.
Для того щоб отримати зображення поперечного перерізу судини, ультразвуковий імпульс від датчика направляють у певну точку, від якої сигнал відображається та фіксується. При обертанні датчика цей процес послідовно багаторазово повторюють, поки не досягається зображення поперечного перерізу судини. Напрямок, по якому проходить ультразвуковий імпульс, прийнято називати ультразвуковим променем.
Удосконалювання внутрішньосудинної ультразвукової апаратури зумовило 2 технічно різних дизайни цієї апаратури: ті, що механічно обертаються і багатооболонкові електронні системи (рис. 1.80). Механічні ультразвукові системи виготовляють багато фірм; багатоелементні електронні катетери — «Endosonics Corp., Rancho Cordova», США. Електронні катетери мають хорошу гнучкість і керованість, проте зображення, яке можна отримати при використанні цих катетерів, нижчої якості.
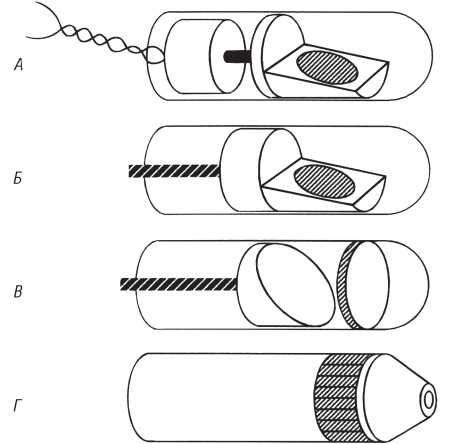
Рис. 1.80. Основні типи ультразвукових внутрішньосудинних систем: механічні ультразвукові системи (А–В); багатооболочкова електронна ультразвукова система (Г); система, що використовує мікромотор (А); системи кабельного керування (Б, В); система з обертовим трансдюсером (Б); система з обертовим Дзеркалом (В)
Як і в усі катетерні системи, в комплект інструментарію, призначеного для внутрішньосудинного УЗД, входять дротяні провідники. За розміщенням провідника відносно ультразвукового датчика (стрижня катетера) розрізняють 4 типи внутрішньосудинних ультразвукових систем:
1. Системи з фіксованими провідниками.
2. Системи з концентрично розміщеними провідниками (багатошарові електронні катетери).
3. Системи з ексцентричними провідниками (механічні катетери).
4. Системи з ексцентричними провідниками й рухливими датчиками (рис. 1.81)
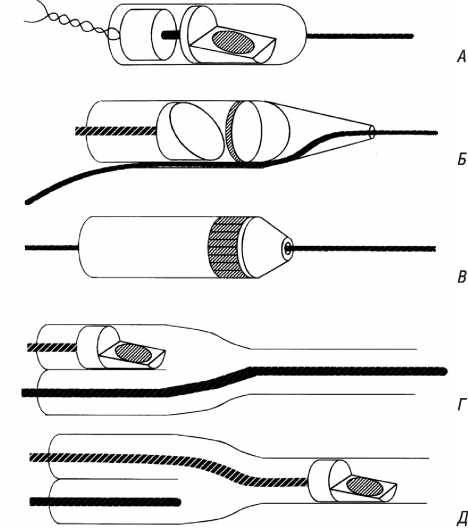
Рис. 1.81. Провідники для ультразвукових внутрішньосудинних систем: фіксований центральний провідник (А); ексцентрично розміщений провідник (Б, Г, Д); центрально розміщений провідник (В); датчик в активному положенні (Г); провідник в активному положенні (Д)
Артефакти, що виникають під час внутрішньо-судинного УЗД, і обмеження методу
Використання сучасної внутрішньосудинної ультразвукової апаратури може викликати артефакти, які негативно позначаються на якості зображення. Механічні датчики під час обертання призводять до осциляції — феномену, відомого за назвою «неоднорідне осциляційне викривлення», який виникає при механічному гальмуванні керуючого вала катетера під час будь-якої фази ротаційного циклу. Неоднорідне ротаційне викривлення проявляється найсильніше, коли вал катетера, що обертається, перебуває у звивистому сегменті судини; при цьому зображення має вигляд неправильного овалу, розтягнутого з одного боку і стисненого — з іншого (рис. 1.82).
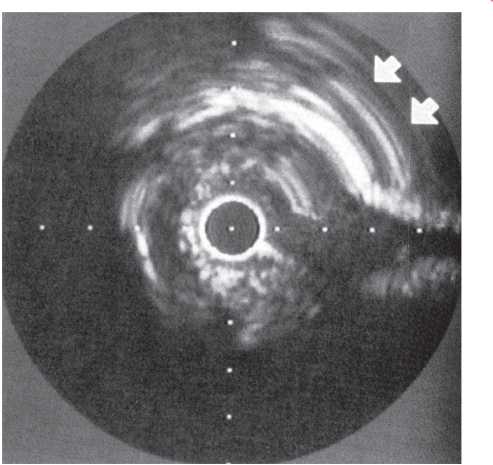
Рис. 1.82. Неоднорідне осциляційне викривлення. Розтягнення зображення викликане обертанням датчика (вказано стрілками)
Причиною іншого артефакту є акустичні осциляції, вихідні від п’єзоелектричного матеріалу датчика. Ці осциляції викликають високоамплітудні сигнали, які роблять зображення прилеглого поля тьмяним, і його акустичні розміри перевищують фізіологічні.
Обмеженням інформативності всіх внутрішньосудинних ультразвукових систем є вигнуте зображення, що отримується внаслідок косого розміщення датчика відносно поперечного перерізу судини. Коли ультразвуковий потік розміщений не ортогонально відносно судинної стінки, зображення має вигляд еліпса.
Спосіб отримання ультразвукового зображення також є причиною обмеження інформативності внутрішньосудинного ультразвукового зображення. Дія всіх ультразвукових систем ґрунтуються на переведенні у відеозображення інформації, отриманої на підставі відбиття ультразвуку тканинами, які мають різну акустичну щільність. У результаті цього можна отримати схоже зображення тканин, які мають різну структуру, але однакові акустичні властивості. Тому важливо розуміти, що внутрішньосудинне ультразвукове зображення демонструє ехогенність і акустичну щільність досліджуваних структур судинної стінки, а не їх гістологічний склад.
У деяких дослідженнях повідомлялося про те, що під час внутрішньокоронарних УЗД приблизно в 5% випадків відбувається транзиторна ішемія міокарда, ультразвуковий датчик може тимчасово закрити або різко зменшити просвіт коронарної артерії під час його просування в зоні твердого стенозу або в гілці артерії малого діаметра. Якщо катетер швидко вилучити, хворі зазвичай не пред’являють скарг на загрудинний біль. Після внутрішньокоронарного введення нітрогліцерину ішемія швидко проходить.
Незважаючи на відносну безпеку внутрішньосудинного УЗД, цей метод, як і будь-який інший, при якому проводяться внутрішньосудинні маніпуляції, пов’язаний з ризиком ушкодження судинної стінки. Тому щоб уникнути розвитку клінічних ускладнень персонал повинен бути готовий до проведення ургентного ПКВ.
Внутрішньокоронарне УЗД
Ультразвукова морфологія коронарних артерій
Ультразвукове зображення неураженої коронарної артерії має вигляд правильного кола, у якому відсутні структури зі значною акустичною щільністю (рис. 1.83). Хоча просвіт судини звукопроникний, датчики, у яких використовується частота >25 МГц, проявляють усередині просвіту деяку ехогенність. Причиною цієї ехогенності є рух крові, що визначається у вигляді туманної, вихреподібної ехогенної щільності. Нечітке димкоподібне зображення може утруднити ідентифікацію елементів судинної стінки, особливо в тих випадках, коли ці структури сполучаються із просвітом судини, наприклад при дисекції інтими.
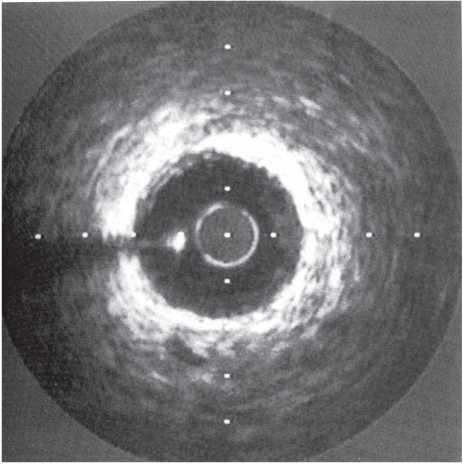
Рис. 1.83. Ультразвукове зображення неураженої коронарної артерії. Простір між мітками складає 1 мм. Товщина інтими не повинна перевищувати 0,25 мм
Є публікації, у яких описана ультразвукова картина неураженої стінки коронарної артерії. У більшості людей ендотелій неураженої судинної стінки з багатошаровою структурою. У деяких пацієнтів (особливо молодого віку) при УЗД виявляють одношарову структуру внутрішнього шару судинної стінки; цей факт, імовірно, свідчить про те, що ендотелій неушкоджених коронарних артерій є одношаровим. Товщина ендотелію в нормі становить 0,15±0,07 мм; межа товщини нормального ендотелію — 0,25–0,3 мм.
У всіх атеросклеротично змінених коронарних артеріях на ультразвуковому зображенні визначається тришарове потовщення інтими. Типова атеросклеротична бляшка виглядає як ехогенне випинання («вторгнення») всередину просвіту артерії (рис. 1.84–1.86). Під атеросклеротичною бляшкою виявляють звукопроникну смугу, яка, як встановлено в дослідженнях in vitro, відповідає м’язовому шару артерії.
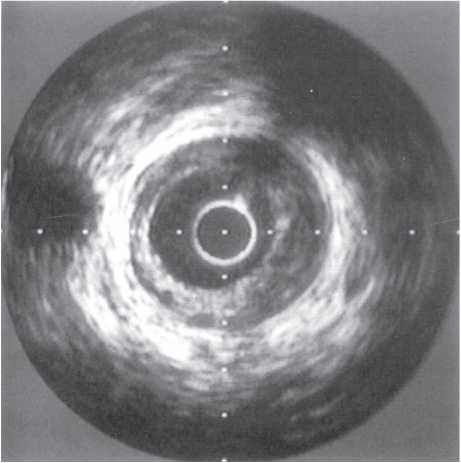
Рис. 1.84. М’яка атерома. Максимальне атероматозне ущільнення розміщене на «3 години». Ехогенність атероми нижча ехогенності адвентиції
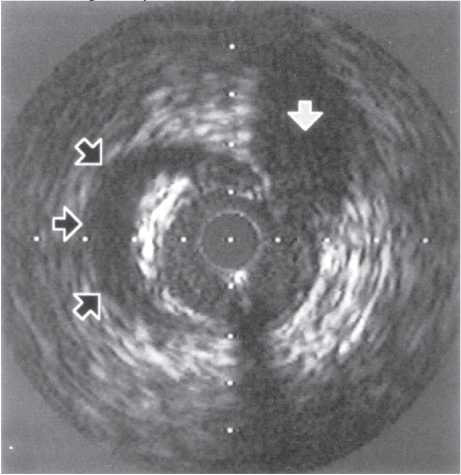
Рис. 1.85. Складна атерома із жорсткою фіброзною капсулою і звукопроникною зоною (чорні стрілки). Біла стрілка вказує на бічну гілку
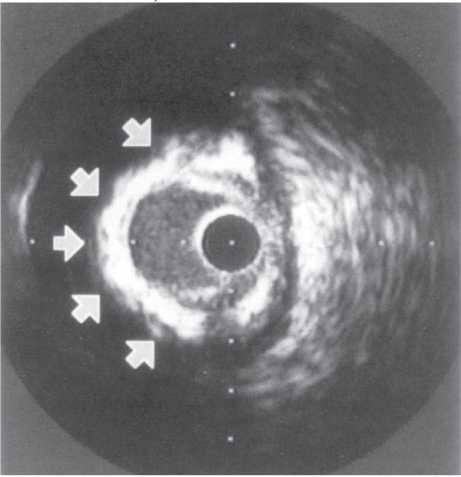
Рис. 1.86. Висококальцифікована атерома
Коронарні атероми, ехогенна щільність яких нижча щільності адвентиції, називаються м’якими бляшками (див. рис. 1.84). Ці бляшки з високою звукопроникністю містять велику кількість ліпідів. Ехогенна щільність таких бляшок може значно варіювати. Зі зменшенням кількості ліпідів і збільшенням кількості колагену ехогенність бляшки підвищується.
Бляшки з високою акустичною щільністю називаються твердими (див. рис. 1.85). У дослідженнях встановлено, що у твердих бляшках утримується велика кількість фіброзної тканини. Такі бляшки вимагають іншого підходу під час проведення лікувальної процедури, наприклад більш високого тиску при дилатації.
При проведенні гістологічних досліджень у бляшках, що містять ділянки дуже високої ехогенності, виявляли кальцифікати (див. рис. 1.86). Кальцифіковані бляшки мають виражену ригідність; при їх дилатації необхідний дуже високий тиск. Щільна кальцифікована атерома виявляє виражений тканинний опір при виконанні спрямованої атеректомії, тому атеротом Сімпсона для усунення подібних уражень не застосовують.
Внутрішньосудинне УЗД дозволяє виявити атеросклеротичні зміни коронарних артерій навіть у тих випадках, коли ці зміни неможливо визначити ангіографічно. Кількісна коронарографічна оцінка ураженого сегмента ґрунтується на порівнянні звуженої ділянки артерії з розміщеним поряд здоровим сегментом. Коронарографічна оцінка стану здорового сегмента не завжди буває достовірною. Glagov і співавтори довели, що наявність атеросклеротичної бляшки в стінці не завжди змінює ширину просвіту судини, що пояснюється компенсаторним ремоделюванням судинної стінки, яке дозволяє зберегти просвіт артерії незміненим. Крім того, ангіографічний аналіз не завжди дозволяє вірогідно визначити ступінь звуження просвіту при наявності дифузного атеросклеротичного ураження артерії. У цьому випадку судина звужена на значній ділянці і фокальні стенози на коронарограмах виявити важко.
Вимірювання кількісних показників просвіту артерії при її атеросклеротичному ураженні
Внутрішньосудинне УЗД дозволяє визначити площу поперечного перерізу просвіту в місці звуження артерії, на підставі чого можна визначити резерв коронарного кровотоку. Цей кількісний показник є більш достовірним, ніж конкретизація діаметра просвіту судини на підставі ангіографічного аналізу, навіть при використанні декількох проекцій. Було проведене дослідження, у якому визначали розбіжність в оцінці ступеня звуження просвіту коронарних артерій за ульразвуковими та коронарографічними даними.
Майже повний збіг цих даних відзначають при наявності концентричних стенозів (r=0,92). При наявності ексцентричних стенозів розбіжність в оцінці ступеня звуження на підставі ультразвукових і коронарографічних даних збільшувалася (r=0,78); зниження кореляції в таких випадках може бути пояснено тим, що ексцентричні стенози часто мають неправильну томографічну форму. Внутрішньосудинне УЗД дозволяє точніше, ніж коронарографія, визначити ступінь залишкового стенозу після коронарної ангіопластики: оцінка залишкового стенозу, за даними коронарографічного дослідження і УЗД, має досить низьку кореляцію: r=0,40–0,60.
Визначення розміру інструмента (наприклад дилатаційного балона), необхідного для виконання операції, ґрунтується на оцінці просвіту в неураженому сегменті артерії, розміщеному поруч з ураженим. При оцінці неураженого сегмента, за даними коронарографічного дослідження і УЗД, встановлена середня кореляція результатів: r=0,70. Порівняння цих даних виявило досить велику стандартну похибку — близько 0,5 мм. Цей факт являє собою досить серйозну проблему для інтервенціоністів, які повинні вибрати інструментарій для операції максимально точного розміру: використання інструментів малих розмірів може не дати бажаних результатів, на відміну від інструментів великого діаметра, при застосуванні яких можуть розвинутися різні ускладнення.
Проведення внутрішньокоронарного УЗД при виконанні внутрішньокоронарних втручань
Розглянемо критерії внутрішньокоронарного УЗД, на підставі яких визначають показання до ендоваскулярних втручань, що виконуються при лікуванні хворих з коронарним атеросклерозом, а також проведемо ультразвукову оцінку результатів цих втручань.
Балонна ангіопластика. Визначення ступеня залишкового стенозу на підставі діаметра звуженого сегмента (за силуетним методом) і площі поперечного перерізу (за томографічним методом) є стандартною технікою оцінки результатів ангіопластики. У дослідженні, проведеному Tobis і співавторами, встановлена дуже низька кореляція між ультразвуковою та коронарографічною оцінкою ступеня залишкового стенозу (r=0,30). Ця невідповідність, як вважають автори, зумовлена різницею оцінки як залишкового стенозу, так і розміщеного поруч неураженого сегмента артерії.
Причиною невідповідності при оцінці залишкового стенозу є форма просвіту артерії (рис. 1.87). Внутрішньосудинне УЗД демонструє різний спектр морфологічних змін, які відбулися в результаті ангіопластики. Ці зміни включають складні розриви інтими та дисекцію судинної стінки. Максимальне викривлення форми просвіту, що відзначається при ангіопластиці, може стати причиною суперечливого трактування післяопераційної ангіографічної картини. Наявність контрастних екстравазатів в інтимі, м’язовому шарі та під адвентицією може дати хибне уявлення про збільшення діаметра просвіту судини на коронарограмі. У таких випадках визначається широкий просвіт судини, проте контури судини нечіткі. УЗД при цьому може виявляти мінімальне збільшення просвіту судини.
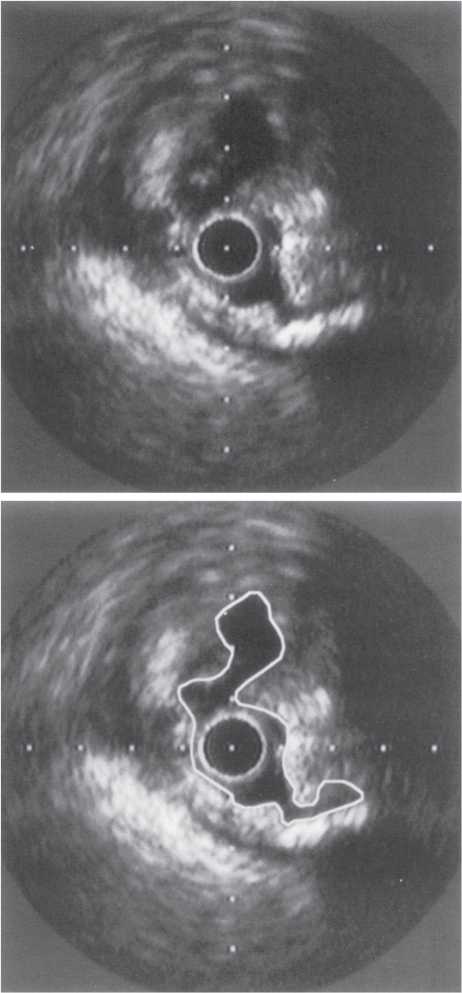
Рис. 1.87. Складна дисекція коронарної артерії після ПКВ
На підставі результатів внутрішньокоронарного УЗД можна оцінити механізм, завдяки якому в кожному конкретному випадку відбувається збільшення просвіту судини після дилатації. У багатьох випадках головним (а іноді і єдиним) механізмом збільшення просвіту при ангіопластиці є розрив інтими. При цьому за даними УЗД можна легко визначити глибину травматизації, яка варіює від поверхневого розриву інтими до вираженого периадвентиціального щілиноутворення. При дисекції бляшки зазвичай відзначають одиничний розрив, однак бувають випадки утворення декількох щілин. Типовим місцем дисекції є зона з’єднання твердих і м’яких елементів бляшки.
За результатами УЗД у деяких хворих виявляють альтернативний механізм збільшення просвіту судини після ангіопластики. Цим механізмом є розтягання (стретчинг) судинної стінки. Аналіз внутрішньосудинної картини підтверджує подібний ефект при збільшенні адвентиціального діаметра в місці ангіопластики.
У деяких хворих просвіт судини збільшується після ангіопластики в результаті зменшення площі поперечного перерізу атеросклеротичного ураження. Це явище відзначається як внаслідок дійсного стиснення тканин бляшки, так і через осьовий перерозподіл цих тканин; думки з цього питання досить суперечливі.
Спрямована атеректомія. УЗД успішно застосовують при проведенні спрямованої атеректомії. Оптимальною метою спрямованої атеректомії є ексцентрична бляшка. Проте відомо, що поширеність атероми, визначена ангіографічно, не завжди відповідає ультразвуковій картині. Так, стенози, які на коронарограмі мають вигляд концентричних, на ультразвуковому зображенні можуть мати вигляд ексцентричних і навпаки. Слабка кореляція поширеності атеросклеротичного процесу, за даними коронарографічного дослідження та УЗД, відображає недоліки силуетного методу порівняно з томографічним.
На результати спрямованої атеректомії і її вираженість впливає наявність кальцифікації судинної стінки. Значна кальцифікація коронарної артерії, виявлена під час рентгенологічного дослідження, традиційно є протипоказанням до виконання цієї операції. Проте у дослідженнях, у яких використовують внутрішньокоронарний ультразвук, встановлено, що значна кальцифікація насправді буває частіше, ніж її виявляють під час рентгенологічного дослідження. На відміну від рентгенографії, УЗД дозволяє визначити локалізацію кальцифікату за окружністю судини і виявити глибину ураження. Як було зазначено, поширена кальцифікація судинної стінки робить неможливим проведення спрямованої атеректомії, проте у судинах з великими, але глибоко розміщеними кальцифікатами проведення атеректомії можливе. Навпаки, при поверхово розміщених кальцифікатах атеректомія не показана, а саме такі кальцифікати важко виявити на ангіограмах.
За результатами внутрішньокоронарного УЗД можна визначити локалізацію, ступінь і поширеність атеросклеротичного ураження, що дозволяє підібрати відповідний розмір інструмента і правильно зорієнтувати атеректомічний ніж. Однак використовувати цю операційну техніку може тільки досвідчений хірург з проведенням ретельної оцінки стану пацієнта. Хоча за даними УЗД можна отримати досить повну інформацію, проблема орієнтації інструмента щодо будь-яких маркерів, визначених на ультразвуковому зображенні, на сьогодні до кінця не вирішена. Досвідчені дослідники ретельно аналізують уражений сегмент для виявлення анатомічних орієнтирів з метою їх використання під час операції. Наприклад, за даними УЗД, виявлено, що атеросклеротична бляшка розміщена в передній міжшлуночковій гілці коронарної артерії в місці відходження септальної гілки на контралатеральній стінці. Знаючи це, хірург правильно розмістить інструмент відносно ураженої ділянки артерії.
Ротаційна абляція . Ультразвукова оцінка ураженого сегмента коронарної артерії дозволяє правильно визначити показання до ротаційної абляції, що позитивно відображається на результатах цієї операції. Застосування ротаблатора особливо ефективне при наявності кальцифікатів. Як відзначалося вище, внутрішньосудинне УЗД дозволяє визначити локалізацію та ступінь кальцифікації судинної стінки. Визначення точного розміру просвіту судини дозволяє відібрати для операції бур необхідного розміру. УЗД, проведене після кожної маніпуляції ротаблатором, дозволяє з’ясувати розміри новоствореного просвіту та морфологічний стан атеросклеротичної бляшки, що залишилася (рис. 1.88).

Рис. 1.88. Круглий просвіт артерії після ротаційної абляції
На основі цих даних для продовження операції хірург може вибрати інструментарій необхідного розміру. Якщо після перших маніпуляцій ротаблатором кальцифікатів не залишилося, то для продовження операції можна використовувати атеротом Сімпсона. Навпаки, поширена кальцифікація вимагає продовження ротаційної абляції з можливим доповненням її ангіопластикою.
Імплантація стентів. Оцінка результатів імплантації стентів на основі аналізів коронарограм не завжди буває точною, тому що просвіт артерії може бути штучно збільшений за рахунок структури самого стента. Післяопераційне УЗД дозволяє більш точно визначити адекватне розтягання стента і впровадження його в судинну стінку (рис. 1.89). На цій підставі можна зробити висновок про необхідність повторної дилатації в місці стентування коронарної артерії. УЗД дозволяє визначити необхідність проведення інтракоронарного стентування для профілактики ускладнень ангіопластики, оскільки це дослідження дає можливість вірогідно судити про інтенсивність післяопераційної дисекції і стан просвіту судини після ангіопластики.
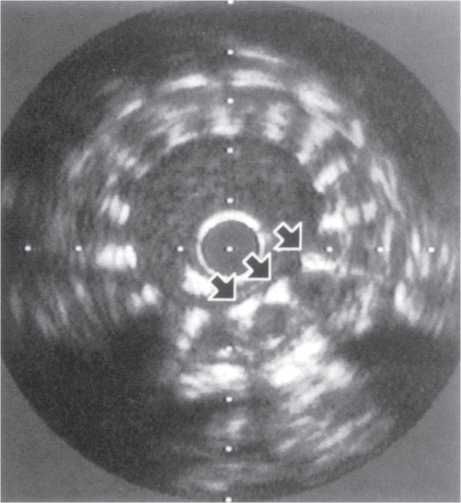
Рис. 1.89. Неповна імплантація стента в стінку коронарної артерії: видно 3 виступи неповністю розправленого стента (зазначено стрілками)
Внутрішньосудинне УЗД дозволяє суттєво доповнити дані інших методів (неінвазивних та інвазивних), проведених при обстеженні хворих з коронарним атеросклерозом. Це дає можливість уточнити показання до тих або інших видів інтракоронарних втручань, що виконуються
при атеросклеротичному ураженні коронарних артерій. Так, за результатами цього методу обстеження, що забезпечує зображення сегмента артерії в поперечному розрізі, можна визначити площу поперечного перерізу просвіту судини, що є більш точним кількісним показником, ніж діаметр просвіту ураженого сегмента, який визначається на силуетному зображенні ураженого сегмента. УЗД, використовуючи принцип різної акустичної щільності тканин, дає можливість визначити морфологічну структуру атеросклеротичної бляшки. Крім того, внутрішньокоронарне УЗД дозволяє оцінити результати втручань, що виконуються при атеросклеротичному ураженні коронарних артерій. Ця інформація особливо цінна при виконанні коронарної ангіопластики, оскільки за даними УЗД можна визначити дійсні розміри просвіту після дилатації, а також оцінити інтенсивність і глибину дисекції.
На жаль, на підставі цього методу обстеження не можна вірогідно визначити ознаки руйнування атеросклеротичної бляшки, а також ознаки тромбоутворення як у тканинах бляшки, так і всередині просвіту артерії. Інформацію про дестабілізацію атеросклеротичної бляшки може дати аналіз коронарограм, хоча критерії цього методу є непрямими, тому що вони базуються на оцінці силуетного зображення атеросклеротичних уражень коронарних артерій. Безумовно, удосконалення внутрішньосудинного ультразвукового інструментарію дасть можливість одержати більш детальне зображення атеросклеротичного ураження судин, що дозволить визначити прямі ознаки дестабілізації бляшки.
ПКВ ПРИ ХРОНІЧНІЙ ІХС
Епоха ПКВ, що виконуються при коронарному атеросклерозі, займає надзвичайно малий історичний відрізок часу: всього близько 30 років від дня першої балонної ангіопластики, виконаної в клініці A. Gruentzig. За цей час процедура нехірургічного відновлення просвіту коронарних артерій не тільки отримала глобальне визнання і небувале поширення в усьому світі, але й значно удосконалилася технічно. Зараз важко назвати галузь природничих наук, яка не задіяна у створенні нового інструментарію для ПКВ. Кожний із новостворених інструментів вирішував якусь проблему, що виникала на шляху розвитку ПКВ. Так, проблема проходження коронарного провідника, балона або системи «стент на балоні» через уражений сегмент коронарної артерії призвела до створення нових провідникових катетерів, здатних збільшити підтримку проходження, нових коронарних провідників, нових конструкцій стентів, що мають підвищену гнучкість при збереженні необхідної жорсткості. Розроблено ряд небалонних систем для механічної або термічної (у тому числі лазерної) ремоделяції атеросклеротичних бляшок (хоча практика показала, що основним недоліком застосування цих інструментів є надмірно високий рівень наступних рестенозів).
Однією з головних проблем, з якою довелося стикнутися інтервенційним кардіологам при реваскуляризації міокарда, стали тромботичні ускладнення, що виникають як під час ангіопластики, так і в ранній післяпроцедурний період (протягом від першої години до першої доби після процедури). Головною причиною гострих тромбозів, що розвиваються після балонної ангіопластики, є мікро- або макротріщини (дисекції) інтими, що виникають після роздування балона. Механізм утворення тромбів у цій ситуації такий самий, як і при природному руйнуванні атеросклеротичних бляшок з наступним тромбозом і, як наслідок, розвитком гострого коронарного синдрому. Необхідно відзначити, що балонна ангіопластика складних стенозів (тобто таких, які мають ангіографічні ознаки руйнування атеросклеротичної бляшки із пристінковим тромбозом) набагато частіше ускладнювалася тромбозом, ніж дилатація простих стенозів. Так, балонна ангіопластика нестабільних атеросклеротичних бляшок (бляшка зі зруйнованою поверхнею та пристінковим тромбом при частково збереженому просвіті артерії) часто закінчувалася тотальним тромбозом артерії і розвитком гострого ІМ, а то й смертю хворого на операційному столі. Ця обставина стала причиною обмеження застосування ангіопластики при нестабільній стенокардії. На сьогодні від перипроцедуральних тромботичних ускладнень практично вдалося позбутися завдяки двом нововведенням: імплантації стентів і принципово новому медикаментозному супроводі ПКВ.
Інша серйозна проблема інтервенційних процедур, що виконуються при коронарному атеросклерозі — рестенози. Рестенози (повторні пізні звуження просвіту артерії, що розвиваються як природна відповідь на механічне ушкодження стінки судини гіперплазією її тканин) розвивалися в 30–45% випадків балонної ангіопластики. ПКВ із застосуванням стентів знизили цей показник до 12–15%. Однак у деяких анатомічних і клінічних ситуаціях (хронічні оклюзії, ураження в судинах малого діаметра, довгі ураження, цукровий діабет) рівень рестенозів, що розвиваються після стентування, залишався, як і раніше, високим (40–45%). Для розв’язання цієї проблеми розроблені стенти нового покоління. Застосування нових стентів, покритих лікарською речовиною, яка блокує гіперплазію і може дозовано виділятися (елютинувати) у стінку артерії, призвело до чергового розширення показань до виконання ПКВ при коронарному атеросклерозі.
Елютинг-стенти, суттєво вплинувши на розвиток рестенозів, поставили перед вченими нове завдання: з’ясувалося, що цитостатична властивість елютинуючих лікарських речовин є причиною пізніх рестенозів, тому що нарівні з блокуванням гіперплазії тканин стінки судини блокується ріст ендотелію, що покриває стент. Зараз проводяться випробування стентів, які елютинують цитостатики і одночасно з цим розсмоктуються. Є підстави вважати, що в недалекому майбутньому ці стенти будуть широко застосовуватися в клінічній практиці.
На сьогодні показання до ПКВ при хронічній ІХС розглядаються в основному в аспекті анатомічних і морфологічних особливостей атеросклеротичного ураження коронарних артерій. Під анатомічними особливостями мається на увазі наявність одно- або багатосудинного ураження коронарного русла, ураження стовбура коронарних артерій, біфуркаційні ураження, ураження артерій малого діаметра. До морфологічних особливостей належать довгі атеросклеротичні ураження, дифузні ураження, ураження зі складною ангіографічною морфологією (з ознаками руйнування атеросклеротичної бляшки й тромбоутворення), хронічні оклюзії коронарних артерій. Окрему групу складають хворі із супутнім цукровим діабетом.
ПКВ при одиничних дискретних ураженнях коронарних артерій, дифузних стенозах, багатосудинному ураженні при ІХС
ПКВ при односудинному ураженні при ІХС і одиничних дискретних стенозах
З моменту виконання першої коронарної ангіопластики визначені основні коронарографічні показання до проведення цього втручання. До уражень, при яких показане проведення балонної ангіопластики, належать одиничні проксимальні гемодинамічно значимі дискретні некальцифіковані стенози у пацієнтів зі збереженою функцією ЛШ. Подібні ураження, за даними сучасних досліджень, і зараз є найбільш сприятливими для ПКВ. Однак рідко згадується про те, що під терміном «проксимальні стенози» А. Gruentzig розумів ураження стовбура лівої коронарної артерії, тобто саме того сегмента коронарного русла, ураження якого згодом стало протипоказанням до проведення втручання. На сьогодні у великих клініках проводять ангіопластику стенозів, розміщених у стовбурі коронарної артерії, як під прикриттям коронарного шунта, так і у пацієнтів без попереднього АКШ. Цей приклад ілюструє, як динамічно, у міру накопичення клінічного досвіду і розвитку катетерних технологій, змінюються погляди в інвазивній кардіології.
У пацієнтів з односудинним ураженням при ІХС відзначений хороший рівень виживаності (смертність не більше 1% на рік). Проте єдиний гемодинамічно значимий стеноз у коронарній артерії може зумовити розвиток вираженої стенокардії напруження, а іноді й спокою, різко знизити толерантність до фізичного навантаження (рис. 1.90а, б; 1.91а, б). Потенційно єдиний стеноз у коронарній артерії може викликати дестабілізацію хворих і, можливо, розвиток ІМ у зоні звуження. Отже, при наявності одного гемодинамічно значимого стенозу в епікардіальній артерії серця може розвинутися резистентність пацієнта до медикаментозної терапії, що визначає абсолютні показання для проведення коронарної ангіопластики (рис. 1.92а–в; 1.93а–в).
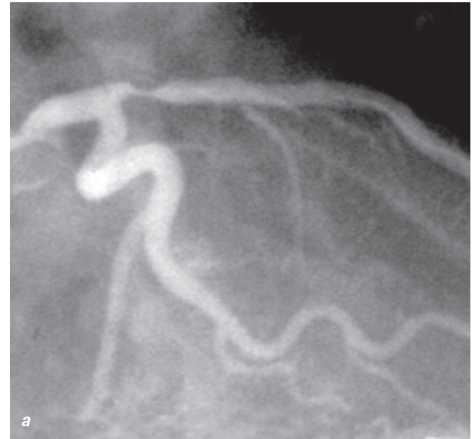
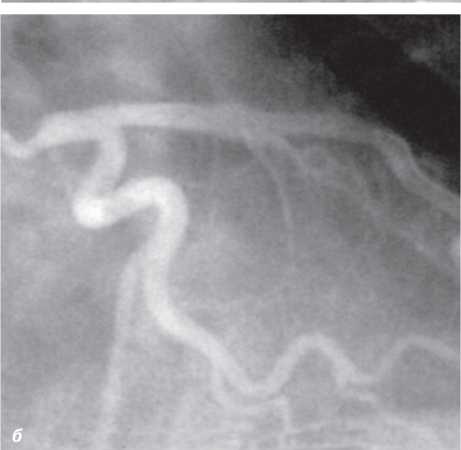
Рис. 1.90. Коронарограма хворого із односудинним ураженням ПМШГ ЛКА до ангіопластики (а) та після ангіопластики (б)
Рис. 1.91. Коронарограма хворого із односудинним ураженням ПКА до ангіопластики (а) та після ангіопластики (б)
Рис. 1.92. Коронарограма хворого зі стенозом у проксимальному сегменті ПМШГ ЛКА 75% до проведення ПКВ (а) та після проведення ПКВ (б); момент роздування балона-катетера при проведенні ангіопластики (в)
Рис. 1.93. Коронарограма хворого зі стенозом у проксимальному сегменті ПМШГ ЛКА 75% до проведення (а) та після проведення ПКВ (б); момент роздування балона-катетера при проведенні ангіопластики (в)
У цій ситуації ПКВ дає ранній позитивний результат, що робить цей вид лікування в таких хворих найкращим.
У дослідження ACIP (Asymptomatic Cardiac Ischemia Pilot) включили пацієнтів з тяжкою щоденною ішемією. Хворі, що ввійшли у це дослідження, поділені на групи стресіндуктивної стенокардії та німої ішемії (принаймні один епізод німої ішемії, відзначений під час холтерівського моніторування протягом 24 год). Протягом 2-річного спостереження смертність у группах хворих, що отримували медикаментозне лікування, склала 6,6% (хворі із симптомами стенокардії) і 4,4% (хворі з ЕКГ-ознаками ішемії міокарда); у групі хворих, яким була проведена реваскуляризація, цей показник склав 1,1% (рекомендації для проведення ПКВ при об’єктивно вираженій ішемії: IA).
Якщо односудинне ураження з одиничним дискретним стенозом є абсолютним показанням до ПКВ, то при наявності дифузного ураження навіть в одній коронарній артерії не всі види ПКВ є однаково безпечними та ефективними. На коронарограмах дифузні ураження проявляються у вигляді довгих стенозів, які мають кілька звужень, що чергуються з розширеннями просвіту. За критеріями якісного аналізу коронарограм такі стенози належать до складних і відображають наявність атеросклеротичних бляшок із застарілим руйнуванням структур і сформованими раніше пристінковими тромбами, що проросли сполучною тканиною і частково кальцифіковані. Подібні ураження можуть займати декілька сегментів артерії, що розміщені поруч. Виконання ПКВ в таких випадках не показане, тому що балонна дилатація в місцях таких складних атеросклеротичних бляшок є причиною значних дисекцій стінки судини з наступним розвитком гострих тромботичних ускладнень. Імплантація непокритих металевих стентів у подібні сегменти також не показана через високу ймовірність розвитку рестенозів. У цих випадках оптимальним видом ПКВ є імплантація елютинг-стентів великої довжини або стентування кількома елютинг-стентами за методом «жакетування» (накладання дистального відділу наступного стента на проксимальний відділ попереднього). Імплантація елютинг-стентів за методом «жакетування» проводиться також, якщо на коронарограмі визначається кілька стенозів, розміщених поруч в одній коронарній артерії, що часто відзначається у хворих на цукровий діабет.
ПКВ при багатосудинному ураженні при ІХС
Однією з дискусійних проблем сучасної інтервенційної кардіології є питання проведення багатосудинної ангіопластики у пацієнтів з розповсюдженим коронарним атеросклерозом. Вирішення цього питання вимагає аналізу багатьох факторів: визначення багатосудинного ураження, можливість і доцільність проведення повної і неповної реваскуляризації міокарда, аналіз віддалених результатів багатосудинної ангіопластики і т.п. Ці фактори слід враховувати при відборі пацієнтів для проведення багатосудинної коронарної ангіопластики.
Поняття «багатосудинне ураження» коронарних артерій у різних дослідженнях має різне трактування. Існує 3 основні визначення багато-судинного ураження. Ураження вважається багатосудинним при наявності:
- стенозу >70% у 2 коронарних артеріях (70%–70%);
- стенозу >70% в одній і >50% в другій коронарній артерії (70%–50%);
- стенозу >50% у 2 коронарних артеріях (50%–50%).
Безумовно, відновлення коронарного кровотоку по всіх судинах серця є найбільш ефективним способом реваскуляризації міокарда і саме повна реваскуляризація — основна мета ангіопластики і АКШ (рис. 1.94а–г; 1.95а–г). Проте анатомічні особливості коронарних артерій, клінічний стан хворого й технічні можливості клініки не завжди дозволяють відновити коронарний кровотік у всіх уражених артеріях. Основною причиною використання тактики неповної реваскуляризації міокарда є анатомічна неможливість дилатації стенозу або реканалізації оклюзії в ураженому сегменті коронарної артерії. Однак обговорюється й інша причина розвитку неповної реваскуляризації міокарда при багатосудинному ураженні, пов’язана насамперед із рестенозом. У більше ніж И пацієнтів після коронарної ангіопластики діагностують рестеноз у раніше ураженому сегменті, що вимагає повторного обстеження і лікування. При багатосудинному ПКВ підвищується ймовірність утворення повторних звужень у найближчий період після лікування. Більше того, рестенотичне ушкодження уражених сегментів буває більш гемодинамічно значимим, ніж раніше наявний стеноз (якщо його первинний розмір не перевищує 75%). У деяких клініках не вважають обов’язковим проводити ангіопластику в уражених сегментах <70%, щоб не провокувати повторне, рестенотичне звуження цього сегмента в найближчі 3–6 міс.
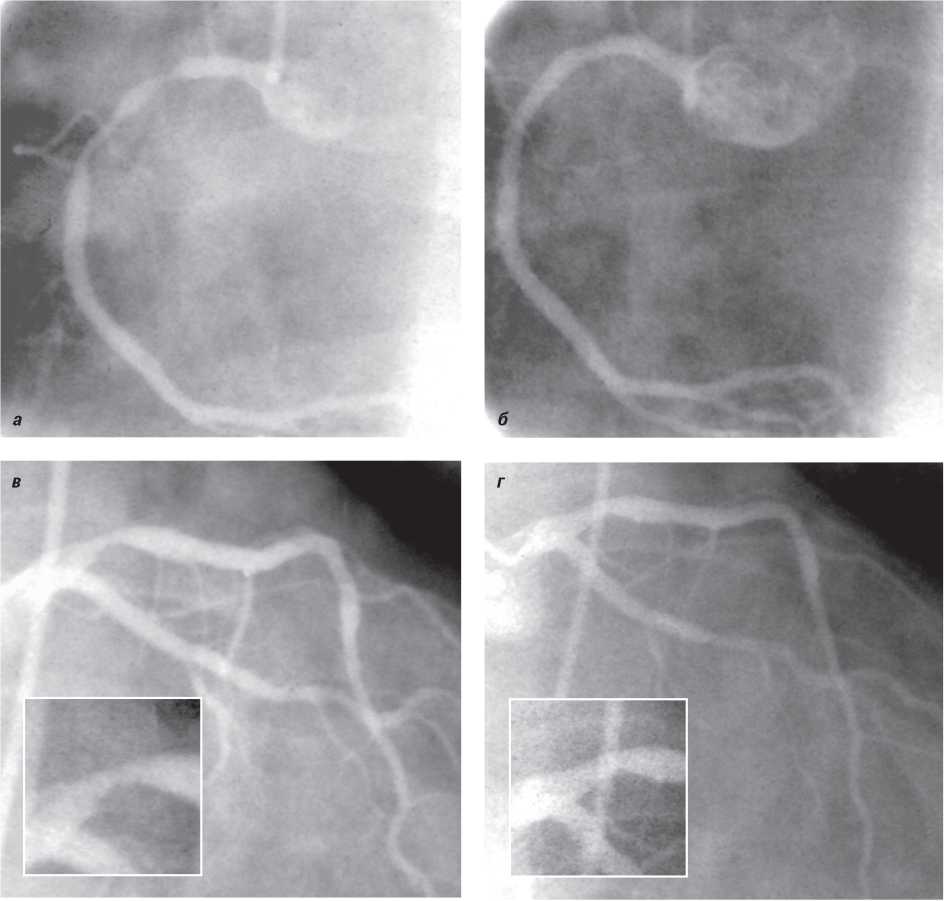
Рис. 1.94. Коронарограма ПКА хворого М. із багатосудинним ураженням до (а) та після (б) першого ПКВ в ПКА; коронарограма ЛКА хворого М. зі стенозом у проксимальному сегменті ПМШГ ЛКА із багатосудинним ураженням до проведення другого ПКВ в ПМШГ ЛКА (в) та після проведення другого ПКВ в ПМШГ ЛКА (г)
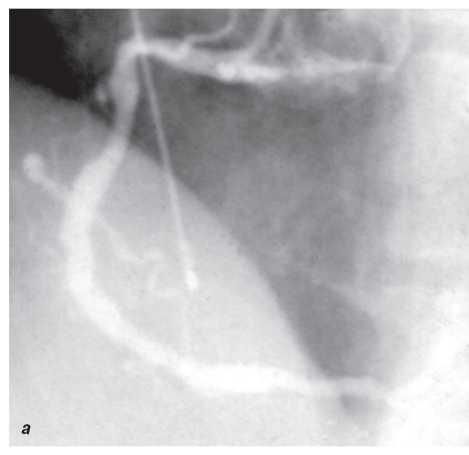
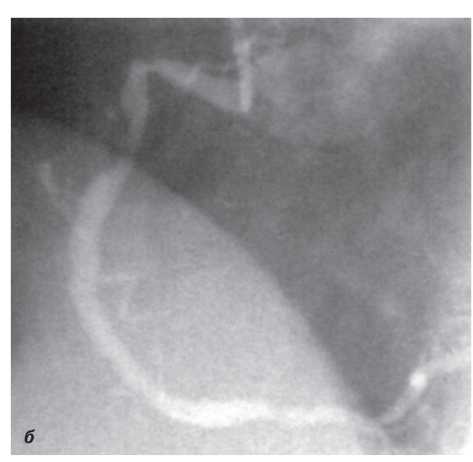
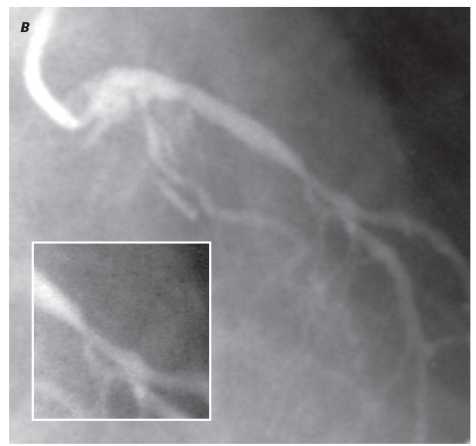
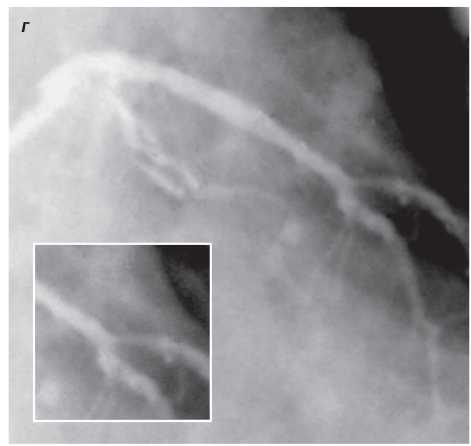
Рис. 1.95. Коронарограма ПКА хворого О. із багатосудинним ураженням до (а) та після (б) першого ПКВ в ПКА; коронарограма ЛКА зі стенозом у середньому сегменті ПМШГ ЛКА хворого М. із багатосудинним ураженням до проведення другого ПКВ в ПМШГ ЛКА (в) та після проведення другого ПКВ в ПМШГ ЛКА. Діагностовано спазм в усті ДГ після проведення ангіопластики (г)
Концепція повної та неповної реваскуляризації вперше запропонована й обговорювалася в перші роки появи коронарної хірургії. Використання цих стратегій значно поліпшувало стан пацієнтів з ІХС, підвищувало толерантність до фізичного навантаження після АКШ.
Згодом досвід ПКВ підтвердив концепцію повної та неповної реваскуляризації. У період розвитку коронарної ангіопластики неповну реваскуляризацію проводили у пацієнтів груп високого ризику (вік, низька функція ЛШ, виражена супутня патологія, складна коронарна морфологія). У багатьох дослідженнях вивчали ступінь реваскуляризації і її вплив на виживаність пацієнтів, але відмінності у виживаності пацієнтів без гострого ІМ при проведенні повної реваскуляризації не виявлені. Однак повторні ангіопластики або АКШ у групах неповної реваскуляризації виконували частіше, ніж у пацієнтів після повної реваскуляризації міокарда.
На сьогодні реваскуляризацію поділяють на 3 групи: повна анатомічна, повна функціональна та неповна функціональна (табл. 1.12). На жаль, на сьогодні немає точного визначення оптимальної реваскуляризаційної стратегії, однак можна припустити. що ключовим фактором у виборі стратегії буде функція ЛШ.
Таблиця 1.12. Перкутанна реваскуляризаційна стратегія
| Реваскуляризаційна стратегія | Визначення | Очікуваний клінічний результат |
| Повна анатомічна реваскуляризація | Дилатація всіх стенозів >50% у судинах не менше 1,5 мм у діаметрі | Відповідає повній функціональній реваскуляризації |
| Повна функціональна реваскуляризація | Дилатація тільки тих стенозів, які можуть бути причиною ішемії | Такий самий результат, як і при повній анатомічній реваскуляризації, у пацієнтів із збереженою функцією ЛШ.
Анатомічна реваскуляризація більш доцільна у пацієнтів з вираженою дисфункцією ЛШ |
| Неповна функціональна реваскуляризація | Неможливість дилатувати всі стенози, які викликають ішемію | Результат гірше, ніж у 2 попередніх групах |
Отже, повна реваскуляризація міокарда є основною метою коронарної ангіопластики. У міру розширення показань до інтервенційних втручань при ІХС усе частіше застосовують спосіб повної функціональної реваскуляризації міокарда, який значно зменшує вираженість, а іноді повністю усуває симптоми захворювання.
Неповну функціональну реваскуляризацію, як правило, використовують у тих клінічних ситуаціях, коли технічно неможливо відновити кровотік по одному (декільком, але не всім) з уражених сегментів коронарного русла. Однак для зменшення вираженості симптоматики та часткового відновлення кровопостачання міокарда проводять неповну реваскуляризацію в якості паліативного втручання (рис. 1.96а). Таким чином, на схемі визначається оклюзія правої коронарної артерії з одночасною наявністю субтотального стенозу передньої міжшлуночкової гілки лівої коронарної артерії (див. рис. 1.96а). Після інфаркту задньої стінки ЛШ оклюзія правої коронарної артерії призвела до акінезії інфарктної зони при наявності субтотального стенозу в передній міжшлуночковій гілці лівої коронарної артерії. Відновлення кровотоку по передній міжшлуночковій гілці лівої коронарної артерії в цьому випадку може привести до повного зникнення симптомів стенокардії. Це буде повна функціональна реваскуляризація, тому що адекватно усунуте основне джерело, пов’язане з ішемізацією міокарда (субтотальний стеноз передньої міжшлуночкової гілки). Проте, якщо оклюзована права коронарна артерія у пацієнта буде забезпечена колатеральним кровотоком з лівої коронарної артерії і буде визначатися контрактильність задньої стінки ЛШ, то ангіопластика в передній міжшлуночковій гілці буде розцінена як неповна функціональна реваскуляризація (рис. 1.96б). Але навіть у цьому випадку адекватність втручання може визначатися ступенем колатерального кровотоку та гемодинамічною значимістю правої коронарної артерії. Наприклад, виражений колатеральний кровотік з передньої міжшлуночкової гілки і наявність лівого типу кровопостачання задньої стінки ЛШ може визначити цей варіант реваскуляризації як адекватний. Подібний приклад колатерального кровотоку третього ступеня з передньої міжшлуночкової гілки в оклюзовану праву коронарну артерію наведений на рис. 1.97а, б.
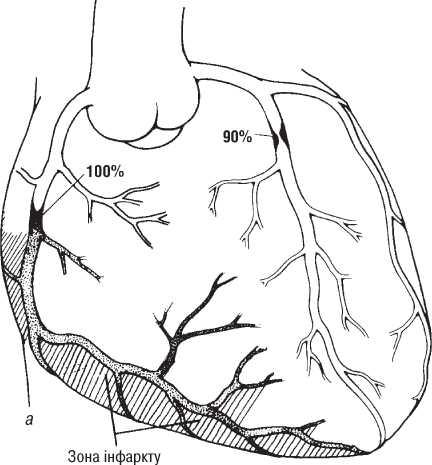
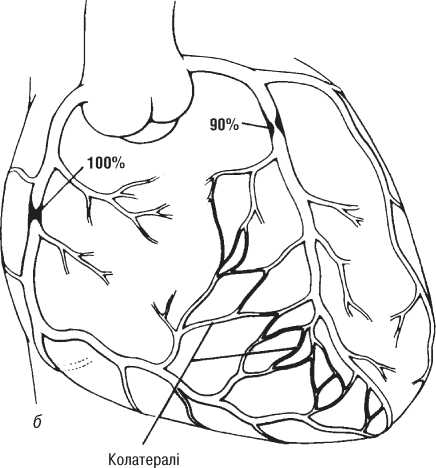
Рис. 1.96. Коронарні артерії серця: оклюзія ПКА, субтотальний стеноз у ПМШГ ЛКА та відсутність колатерального кровотоку (а); оклюзія ПКА, субтотальний стеноз у ПМШГ ЛКА і колатеральний кровотік зі звуженої ПМШГ в оклюзовану ПКА (б)
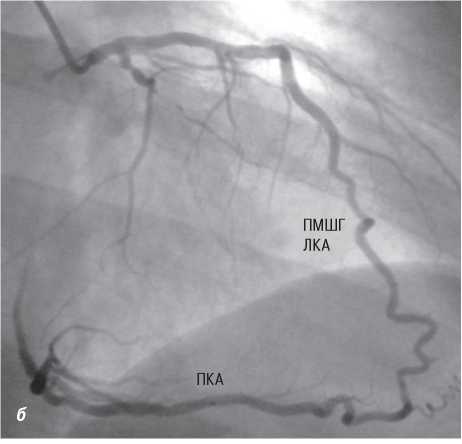
Рис. 1.97. Коронарограма ЛКА хворого з колатеральним кровотоком 3-го ступеня із ПМШГ в оклюзовану ПКА (а); коронарограма хворого із оклюзією ПКА і колатеральним кровотоком (б)
Серед пацієнтів, у яких ангіопластику виконують для поліпшення віддаленої виживаності, підвищення толерантності до фізичного навантаження, неповна, але адекватна реваскуляризація (повна функціональна реваскуляризація) абсолютно виправдана і досягає своєї мети. У доповіді CASS Registry зазначено, що не існує різниці у віддалених клінічних результатах АКШ у пацієнтів із трисудинним ураженням і проведенням повної анатомічної і повної функціональної реваскуляризації. У пацієнтів з вираженою стенокардією і зниженою функцією ЛШ повна реваскуляризація (шунтування >3 артерій) була пов’язана з покращанням виживаності при використанні багатоваріантного аналізу. Публікації співробітників клініки Mayo (Bell, 1990) підтверджують, що у пацієнтів з тяжким перебігом стенокардії після ангіопластики також відзначені кращі результати при використанні методики повної реваскуляризації (повна анатомічна), ніж у пацієнтів зі стенокардією середнього ступеня тяжкості. Серед 867 пацієнтів з ІХС і багатосудинним ураженням, у яких успішно проведена коронарна ангіопластика, повна функціональна реваскуляризація не була пов’язана зі збільшенням кількості ускладнень протягом кількох років після проведення втручання. Проте за даними багатоваріантного аналізу виявлено, що у 937 пацієнтів після коронарної ангіопластики з вихідною стенокардією спокою тактика неповної реваскуляризації була прямо пов’язана з ускладненнями захворювання, які розвинулися в найближчі кілька років після коронарної ангіопластики. Таким чином, клінічний стан хворих, тобто тяжкість стенокардії, може визначати віддалені результати лікування, якщо проводять повну функціональну реваскуляризацію міокарда. Чим більше виражені симптоми стенокардії і чим нижча фракція ЛШ, тим більш повну ревакуляризацію необхідно проводити у цих хворих для досягнення стійкого віддаленого результату лікування. У пацієнтів зі стенокардією середнього ступеня вираженості неповну (але функціонально виправдану) реваскуляризацію можна більш широко використовувати у складних випадках, коли проведення анатомічно повної реваскуляризації міокарда за допомогою катетерної техніки неможливе.
Вплив кількості уражених артерій на ускладнення, які виникають в період проведення коронарної ангіопластики, проаналізовано у 1764 пацієнтів у другому дослідженні (NHLBI (the National Heart, Lung, and Blood Institute) PTCA (Percutaneous Transluminal Coronary Angioplasty) Registry) за період з 1985 по 1986 р. (табл. 1.13).
Таблиця 1.13. Залежність ускладнень ПКВ від кількості уражених артерій, що виникають у період проведення коронарної ангіопластики
| Ускладнення | Ураження , % | p | ||
| односудинне (n=838) | двосудинне (n=559) | трисудинне (n=367) | ||
| Смерть | 2 (0,2) | 5 (0,9) | 8 (2,2) | <0,001 |
| Нефатальний ІМ | 29 (3,5) | 29 (5,2) | 19 (5,2) | Недостовірно |
| Термінове АКШ | 24 (2,9) | 22 (3,9) | 16 (4,4) | Недостовірно |
Серйозні ускладнення (смерть, нефатальний ІМ або екстрене АКШ) відзначені у 5,5% пацієнтів з односудинним ураженням, у 8,1% — з двосудинним і у 9,3% — із трисудинним. Периферичні ускладнення, тобто ті, які пов’язані з пункцією стегнової артерії і потребують хірургічного втручання на периферичних судинах, або необхідність у проведенні гемотрансфузії виникали приблизно у 2,5% пацієнтів з багатосудинним ураженням після проведення ПКВ.
Багатосудинна ангіопластика у пацієнтів зі збереженою функцією ЛШ
З метою визначення оптимального способу реваскуляризації обстежили >4000 пацієнтів з ІХС і багатосудинним ураженням коронарного русла, які були рандомізовані в 6 дослідженнях. У кожному дослідженні порівнювали результати багатосудинної коронарної ангіопластики (ПКВ) і АКШ. Критерії включення і виключення пацієнтів з цих досліджень наведені в табл. 1.14, а базові характеристики — у табл. 1.15 і 1.16.
Таблиця 1.14. Рандомізовані дослідження ПКВ порівняно з АКШ: критерії включення та виключення пацієнтів з дослідження
| Назва дослідження | n | Критерій |
| RITA | 1011 | Включення: одно-, дво- і трисудинного ураження (75% стеноз). Уражена артерія кровопостачає не менше 20% міокарда. У всіх пацієнтів є стенокардія і об’єктивні ознаки ішемії міокарда. Реваскуляризація можлива як при ПКВ, так і при АКШ.
Виключення: попередні ПКВ або АКШ, ураження стовбура ЛКА, виражені гемодинамічні ураження клапанів серця |
| ERACI | 127 | Включення: багатосудинна коронарна хвороба (>2 судин із >70% стенозом).
Виключення: дилатаційна ішемічна кардіоміопатія, виражене трисудинне ураження з ФВ <35%, значне звуження стовбура ЛКА, виражене ураження клапанного апарату, гострий ІМ |
| GABI | 358 | Включення: вік <75 років, стенокардія II ФК, багатосудинне ураження коронарних артерій (>2 судин зі стенозом >70%).
Виключення: попередня ПКВ або АКШ, повна оклюзія, стеноз стовбура ЛКА >30%, ФВ ЛШ >50%, довжина ураження >2 см, дифузна коронарна хвороба, ІМ протягом 4 тиж |
| CABRI | 1054 | Включення: вік до 76 років, багатосудинне ураження (не менше 2 судин зі стенозом >50%).
Виключення: попередня ПКВ або АКШ, ураження стовбура ЛКА >50%, перші 10 днів гострого ІМ, ФВ — 35%, нещодавно перенесений інсульт, різна супутня патологія |
| EAST | 392 | Включения: дво- або трисудинне ураження, стенокардія, об’єктивно підтверджена результатами неінвазивних методів діагностики.
Виключення: попередня ПКВ, не більше 2 тотальних оклюзій, ФВ — 25%, ІМ протягом перших 5 днів |
| BARI | 1011 | Включення: вік від 17 до 80 років, багатосудинне ураження (судини зі стенозом не менше 50%) з клінічно підтвердженою стенокардією (ФК III–IV, нестабільна стенокардія). Нещодавно перенесений не-Q-ІМ або стенокардія напруження (I–II ФК) з вираженою ішемією під час навантажувального тестування. Нещодавно перенесений Q-ІМ або ФВ ЛШ <50% або без стенокардії, але з вираженою ішемією, яка підтверджена результатами неінвазивного тестування.
Виключення: екстрена реваскуляризація, стеноз стовбура — 50%, первинний коронарний спазм, виражена аортальна кальцифікація |
Таблиця 1.15. Рандомізовані дослідження ПКВ порівняно з АКШ: дизайн дослідження та базові характеристики
| Показник | RITA | ERACI | GABI | CABRI | EAST | BARI |
| Кількість хворих, n | 1011 | 127 | 359 | 1054 | 392 | 1829 |
| Дизайн дослідження | ||||||
| Запланований період спостереження, років | 10 | 3 | 1 | 5-10 | 5 | 10 |
| Необхідність у повній реваскуляризації | Так | Ні | Так | Ні | Ні | Ні |
| Включення пацієнтів з тотальними оклюзіями | Так | Так | Ні | Так | Ні | Так |
| Використання нових пристроїв | Ні | Ні | Ні | Так | Ні | Так |
| Втручання на внутрішній грудній артерії, % | 74 | 77 | 37 | 81 | 90 | 82 |
| Базові характеристики | ||||||
| Вік, років | 57 | 57 | — | 60 | 61 | 61 |
| Чоловіки, % | 81 | 54 | 80 | 78 | 73 | 74 |
| Попередній ІМ, % | 43 | 31 | 47 | 43 | 41 | 55 |
| Нестабільна стенокардія, % | 59 | 53 | 14 | 15 | 62 | 65 |
| ФВ ЛШ, % | — | 61 | 56 | 63 | 62 | 57 |
| 1 уражена артерія, % | 45 | 0 | 0 | 0 | 0 | 0 |
| 2 уражені артерії, % | 43 | 55 | 82 | 58 | 60 | 59 |
| 3 уражені артерії, % | 12 | 45 | 18 | 40 | 40 | 41 |
Таблиця 1.16. Рандомізовані дослідження ПКВ порівняно з АКШ: ефективність ПКВ та ступінь реваскуляризації
| Назва дослідження | Ефективність ПКВ (%) | Ступінь реваскуляризації |
| RITA | 87 | Повна функціональна реваскуляризація у пацієнтів із дво- і трисудинним ураженням. ПКВ проведений відповідно в 81 і 63% випадків |
| ERASI | 92 | Повна функціональна реваскуляризація досягнута у 89% випадків |
| GABI | 92 | Повна анатомічна реваскуляризація досягнута у 86% випадків |
| CABRI | 91 | Повна функціональна реваскуляризація |
| EAST | 88 | Повна функціональна реваскуляризація |
| BARI | 88 | Повна функціональна реваскуляризація |
Коронарну ангіопластику проводили, як правило, у судинах зі стенозом >50% і діаметром не менше 1,5 мм. Більше того, виживаність тканини міокарда в зоні ураженого сегмента судин визначали за допомогою неінвазивних методів. Нестандартні способи для відновлення кровотоку у звужених коронарних артеріях такі, як атеректомія і стенти, застосовували тільки в дослідженнях CABRI (Coronary Angioplasty Bypass Revascularization Investigation) і BARI (Bypass Angioplasty Revascularization Investigation). Внутрішню грудну артерію використовували при проведенні АКШ у 75%, крім дослідження GABI (German Angioplasty Bypass Surgery Investigation) — 37%.
Результати лікування в госпітальний період
Особливості госпітального періоду пацієнтів після багатосудинної ангіопластики зумовлені насамперед тим, що дилатація артерії в ураженому сегменті часто призводить до мікроскопічних дисекцій у місці дилатації. Одним з механізмів коронарної ангіопластики, що визначає збільшення просвіту артерії після втручання, є мікроскопічне розтріскування стінки артерії після роздування балона. Щоб знизити ризик великої дисекції, деякі дослідники використовують балон-катетер за розміром менший передбачуваного діаметра артерії або тиск у балоні нижчий номінального.
Проте подібна практика успішна тільки при наявності дуже м’яких атеросклеротичних бляшок. Найчастіше такий спосіб призводить до вираженого залишкового стенозу (рис. 1.98а, б) і поверненню клінічних проявів у результаті активації «зворотної тяги» (стретчинг) артерії.
Однак у деяких випадках дисекція може бути досить великою і видимою на ангіограмі. У цьому випадку існує небезпека різкого порушення кровотоку в цій артерії і виникнення гострого тромбозу дилатованого сегмента. Процес тромбоутворення, як правило, відбувається протягом 1-ї години–1-ї доби після втручання (тобто в період госпіталізації). Саме тому дуже важливо оцінювати результати лікування в госпітальний період після багатосудинної ангіопластики.
У рандомізованих дослідженнях ПКВ була успішною у 87–92% випадків, смертність склала 0,7–5%, ІМ розвинувся в 2,3–6,3% випадків (у період госпіталізації), екстрене АКШ виконане у 1,5–10,3% хворих (див. табл. 1.16; 1.17). Летальність у групах хворих після ангіопластики і АКШ була приблизно однаковою, хоча у пацієнтів після ангіо-пластики відзначена нижча частота госпітальних ІМ і коротший період перебування в стаціонарі.
Рис. 1.98. Коронарограма хворого з 90% стенозом у проксимальному сегменті ПМШГ ЛКА до ангіопластики (а) та після ангіопластики. Залишковий стеноз — 50% (б)
Таблиця 1.17. Рандомізовані дослідження ПКВ порівняно з АКШ: внутрішньогоспітальні результати
| Назва дослідження | Метод | Ускладнення, % | Коментарі | ||
| Смерть | ІМ | АКШ | |||
| RITA | ПКВ
АКШ |
0,7
1,2 |
3,5
2,4 |
4,5
— |
Тривалість госпіталізації: ПКВ — 4 дні, АКШ — 12 днів |
| ERASI | ПКВ
АКШ |
1,5
4,6 |
6,3
6,2 |
1,5
— |
Інсульт: ПКВ — 1,5%, АКШ — 3,1% |
| GABI | ПКВ
АКШ |
1,1
2,5 |
2,3
8,1* |
2,8
— |
Інсульт: ПКВ — 0%, АКШ — 1,2%; пневмонія після ПКВ — 1,1%, після АКШ — 10,6%, p<0,001; госпіталізація: ПКВ — 5 днів, АКШ — 19 днів; стенокардія після ПКВ — 18%, після АКШ — 7%, p<0,005 |
| CABRI | ПКВ
АКШ |
1,3
1,3 |
—
— |
3,3
— |
— |
| EAST | ПКВ
АКШ |
1
1 |
3
10,3* |
10,1
— |
Інсульт: ПКВ — 0,5%, АКШ — 1,5% |
| BARI | ПКВ
АКШ |
1,2
1,3 |
2,1
4,6* |
6,3
— |
Інсульт: ПКВ — 0,2%, АКШ — 0,8%; дихальна недостатність після ПКВ — 1%, АКШ — 2,2%, p<0,05 |
*р<0,01.
Віддалені результати
У клінічних спостереженнях протягом 1–3 років пацієнтів після АКШ та ангіопластики не відзначені серйозні відмінності за такими показниками, як смертність, ІМ, толерантність до фізичного навантаження. Проте, порівнюючи результати АКШ та коронарної ангіопластики, необхідно відзначити, що в групі ПКВ більше пацієнтів з рекурентною стенокардією, ніж у групі АКШ (30–40% порівняно з 20–25%), у 3–10 раз частіше проводили повторну реваскуляризацію тієї ж артерії в групі ПКВ (32–54% — у групі ПКВ і 2–13% — у групі АКШ). Проведення АКШ було показане приблизно 20% хворих після коронарної ангіопластики (табл. 1.18).
Таблиця 1.18. Рандомізовані дослідження ПКВ порівняно з АКШ: віддалені результати
| Назва дослідження | Час спостереження, років | Метод | Ускладнення, % | |||
| Смерть | ІМ | Повторна реваскуляризація | Відсутність симптомів захворювання | |||
| RITA | 2,5 | ПКВ | 3,1 | 3,6 | 35 | 69 |
| АКШ | 3,6 | 3,9 | 3,8 | 79 | ||
| ERASI | 1 | ПКВ | 3,2 | 3,2 | 32 | — |
| АКШ | 0 | 1,8 | 3,2 | — | ||
| GABI | 3 | ПКВ | — | 37 | 60 | |
| АКШ | — | — | 3,2 | 80 | ||
| 1 | ПКВ | 2,6 | 4,5 | 44 | 71 | |
| АКШ | 6,5 | 9,4 | 6 | 74 | ||
| CABRI | 1 | ПКВ | 3,9 | 4,9 | 35,6 | 67 |
| АКШ | 2,7 | 3,5 | 2,1 | 75 | ||
| EAST | 3 | ПКВ | 7,1 | 14,6 | 54 | 80 |
| АКШ | 6,2 | 19,6 | 13 | 88 | ||
| BARI | 5 | ПКВ | 14 | 8 | 54 | — |
| АКШ | 11 | 9 | 8 | — | ||
| Пацієнти з цукровим діабетом | ПКВ | 35 | — | 62 | — | |
| АКШ | 19 | — | 8 | — | ||
Allis і співавтори проаналізували результати 2-річного лікування 350 пацієнтів з ІХС і багатосудинним ураженням та багатосудинною ангіопластикою з метою визначення частоти виживаності. Після аналізу ангіографічних і клінічних даних визначені незалежні предиктори серйозних коронарних подій (смерть, ІМ або необхідність проведення АКШ). У такий спосіб у всіх пацієнтів без стенокардії спокою, цукрового діабету і стенозу в проксимальному сегменті передньої міжшлуночкової гілки відзначена 97% дворічна виживаність без нападів стенокардії. У період спостереження всі пацієнти цієї групи були живі. У пацієнтів з 2 і більше із перерахованих факторів (стенокардія спокою, цукровий діабет і стеноз у проксимальному сегменті передньої міжшлуночкової гілки) показник 2-річної смертності становив >25%, а виживаності з відсутністю стенокардії — <50%. Збережена функція ЛШ була найбільш потужним протектором виживаності.
У роботі В. Meier і співавторів частота задовільних віддалених результатів через 14 міс після ангіопластики склала 84% (критерії: зникнення нападів стенокардії, значне поліпшення результатів функціональних тестів), проте вона була вірогідно нижчою, ніж відсоток успішних віддалених результатів після АКШ (94% пацієнтів без симптомів захворювання через 26 міс після операції АКШ).
Протилежні результати встановлені в дослідженні D. Holmes і співавторів. Серед обстежених пацієнтів через 1 рік після ангіопластики у 96% хворих не відзначена клініка стенокардії порівняно з 88% пацієнтів, у яких було виконане АКШ. Аналогічні дані наводяться в іншому багатоцентровому дослідженні, проведеному в США.
Функціональне покращання та зникнення симптомів стенокардії були відзначені у 88% пацієнтів через 3–18 міс після ангіопластики. З них у 9,4% пацієнтів проводили повторний ПКВ і у 6,3% — АКШ у той самий період. Згідно з даними Американського реєстру коронарної ангіопластики у 74% пацієнтів через 24 міс після коронарної ангіопластики відзначені хороші та задовільні віддалені результати. За результатами дослідження М. Bertrand у 86% пацієнтів через 6 міс після втручання не відзначали клінічних симптомів стенокардії та об’єктивних ознак ішемії міокарда.
Дані різних центрів і результати багатоцентрових досліджень щодо кардіальних ускладнень і рецидивів стенокардії протягом 1 року після коронарної ангіопластики наведені в табл. 1.19.
Таблиця 1.19. Результати досліджень щодо кардіальних ускладнень і рецидиву стенокардії протягом 1 року після коронарної ангіопластики
| Kлінічні фактори | NHLBI (США) | Рочестер (Великобританія) | Лілль (Франція) | Середні дані |
| Повторна ангіопластика, % | 12 | 10 | 22 | 14 |
| АКШ, % | 11 | 12 | 1 | 9 |
| ІМ, % | 3 | 3 | 1 | 2 |
Тезис про залежність віддалених результатів коронарної ангіопластики від ступеня реваскуляризації міокарда побічно підтверджується при порівнянні цих результатів після ангіопластики поодиноких і множинних уражень коронарного русла. Через 1–5 років після втручання при поодиноких ураженнях у 70–85% пацієнтів були відсутні симптоми захворювання, а при множинних ураженнях зникнення симптомів стенокардії через 1–6 років після ангіопластики відзначене у 50–75% пацієнтів (табл. 1.20, 1.21).
Таблиця 1.20. Віддалені результати коронарної ангіопластики у пацієнтів з односудинним ураженням коронарного русла
| Автор (рік) | Kількість хворих, n | Період спостереження, років | Смертність, % | ІМ, % | АКШ, % | Kоронарна ангіопластика, % | Без симптомів, % |
| Kent et al. (1984) | 1115 | 2 | 2,2 | 3,4 | 12 | 14 | 74 |
| Faxon et al. (1983) | 214 | 1,5 | 2,6 | 9,5 | 38 | 9 | 82 |
| Gruentzig et al. (1987) | 98 | 6 | 3,0 | — | 12 | 18 | 62 |
| Talley et al. (1988) | 369 | 5 | 3,5 | 5,5 | 16 | 20 | 84 |
| Mabin et al. (1985) | 87 | 1,2 | 0,1 | 3,0 | 10 | 17 | 74 |
| Detre et al. (1988) | 709 | 1,0 | 1,3 | 1,7 | 5,5 | 21 | 76 |
| Середні дані | 2,1 | 4,6 | 15,6 | 18,5 | 75,3 |
Таблиця 1.21. Віддалені результати коронарної ангіопластики у пацієнтів з багатосудинним ураженням коронарного русла
| Автор (рік) | Kількість хворих, n | Період спостереження, років | Смертність, % | ІМ, % | АКШ, % | Kоронарна ангіопластика, % | Без симптомів, % |
| Hartzler et al. (1983) | 90 | 1,0 | 2,0 | — | 6 | 8 | — |
| Vliestra et al. (1983) | 100 | 0,5 | 2,0 | 12 | 19 | 56 | |
| Kent et al. (1986) | 282 | 2,0 | 6,4 | 6,0 | 38 | 14 | 56 |
| Dorros et al. (1984) | 285 | 1,0 | 0,3 | 6 | 20 | — | |
| Cowley et al. (1985) | 44 | 2,0 | — | 2 | 18 | 10 | 48 |
| Gruentzig et al. (1987) | 71 | 6,0 | 8 | — | 7 | 13 | 72 |
| DiSciascio et al. (1988) | 50 | 0,5 | 4 | 4,0 | 4 | 30 | 74 |
| Detre et al. (1988) | 703 | 1,0 | 2,6 | 3,4 | 7,4 | — | 76 |
| Середні дані | 3,0 | 12,3 | 16,3 | 60,7 |
При багатосудинному ураженні коронарного русла віддалені результати після коронарної ангіопластики були дещо гірші (див. табл. 1.21). Незважаючи на більш високий відсоток пацієнтів без симптомів захворювання після ангіопластики односудинних уражень, інші показники, зокрема смертність, частота ІМ і повторних втручань (ПКВ або АКШ), порівнянні в групах з одно- і багатосудинними ураженнями.
При тривалому спостереженні 2271 хворого К. Kent і співавтори дійшли висновку, що після 1 року спостереження відзначена значна потреба в повторній реваскуляризації міокарда (14% — при повторній ангіопластиці та 12% — при АКШ). При цьому у 67% хворих відзначали стійке покращання. Частота смертності протягом 1 року склала 1,6%. J. Talley і співавтори отримали аналогічні результати при 5-річному спостереженні 424 хворих після ПКВ.
К. Detre і співавтори аналізували віддалені результати коронарної ангіопластики у хворих з одно- (46%) і багатосудинним ураженням коронарного русла (54%). Більш успішний результат відзначений у хворих з односудинним ураженням. За результатами спостереження протягом 1 року встановлено, що у хворих з багато- і односудинним ураженням летальність склала відповідно 4,6 і 1,8%, частота нефатального ІМ — 8,8 і 5,4%, частота повторної коронарної ангіопластики — 18,8 і 18,1%, кількість операцій АКШ — 15,3 і 10,7%. Слід зазначити, що подібні дослідження проводили також багато інших авторів.
ПКВ у пацієнтів з ІХС і багатосудинним ураженням та/або цукровим діабетом
У хворих із багатосудинним ураженням та іншими ознаками високого ризику ускладнень виконання АКШ, порівняно з ПКВ, дає кращі показники виживаності. Однак відмінності стосовно вартості лікування і якості життя між результатами АКШ і ПКВ втрачаються протягом 10–12-річного спостереження. Рішення про повну реваскуляризацію або про відновлення просвіту тільки в тій артерії, яка викликає ішемію, приймається індивідуально.
Хоча формальні дані порівняння результатів ПКВ і АКШ при цукровому діабеті відсутні, інваріабельний аналіз post hoc показав, що результати ПКВ гірші, ніж результати АКШ. У дослідженні ARTS (Artery Revascularization Therapies Study), у якому порівнювали результати ПКВ і АКШ у пацієнтів з багатосудинним ураженням та цукровим діабетом, виявили, що результати обох видів лікування не є задовільними; при цьому результати ПКВ гірші результатів АКШ. Смертність протягом 3 років після ПКВ 7,1%; після АКШ — 4,2%. Відзначена значима відмінність у показниках виживаності без ускладнень: у групі ПКВ цей показник склав 52,7%; у групі АКШ — 81,3%. У випадках багатосудинного ураженням, коли є 1 або 2 гемодинамічно значимих стенози (фракційний резерв кровотоку <0,75), результати ПКВ такі ж сприятливі, як і результати АКШ, яке виконується при >3 значимих стенозах, незважаючи на однакову ангіографічну поширеність хвороби (Рекомендації для ПКВ при багатосудинному ураженні та/або цукровому діабеті: клас IIb, рівень доказовості C). Дані про застосування елютинг-стентів у пацієнтів з багатосудинним ураженням та/або цукровим діабетом, що надходять, можуть змінити цю ситуацію.
Порядок дилатації коронарних стенозів при багатосудинному ураженні
Черговість, з якою відбувається дилатація коронарних стенозів, прямо пов’язана з безпекою та ефективністю ангіопластики. Повні оклюзії, які забезпечуються колатералями з інших артерій, дилатують у першу чергу, потім дилатації піддають гемодинамічно значимі стенози в артеріях, які кровопостачають іншу частину міокарда.
Якщо основний гемодинамічний стеноз розміщений в артерії, яка кровопостачає невелику частину міокарда, ми пропонуємо проводити дилатацію стенозованих сегментів у найбільш важливих артеріях, тобто в тих, які відповідають за найбільш функціональні ділянки міокарда (передня міжшлуночкова гілка лівої коронарної артерії і т.д.). Якщо 2 стенози розміщені в судинах однакового діаметра, то в першу чергу ангіопластику проводять у сегменті артерії з кращим колатеральним кровотоком. При наявності проксимального й дистального стенозу однієї артерії ми пропонуємо спочатку проводити ангіопластику дистального стенозу (це правило не поширюється на стентування стовбура лівої коронарної артерії). У цьому випадку можна обмежитися використанням лише одного балона-катетера, який може успішно пройти через проксимальний стеноз, і провести дилатацію в дистальному сегменті, а потім після тракції вже використаного балона провести ангіопластику в проксимальному сегменті коронарної артерії. Однак у деяких ситуаціях, коли використовувати один балон при дилатації двох стенозів в одній артерії неможливо (значна зміна калібру сегмента в 2 уражених ділянках артерії), черговість ангіопластики не має великого значення для клінічного та ангіографічного ефекту втручання.
Нечасті випадки багатосудинної хвороби і ангіопластика: ПКВ артерії, коли інші артерії оклюзовані
У деяких дослідженнях оцінювали результати коронарної ангіопластики єдиної прохідної артерії в тому випадку, якщо інші артерії були оклюзовані. Згідно з даними табл. 1.22 успіх і ускладнення цих втручань цілком порівнянні. Проте багато лікарів направляють таких пацієнтів для проведення АКШ, особливо якщо оклюзована артерія кровопостачає велику зону міокарда, функція ЛШ низька, а підходящий для коронарної ангіопластики стеноз має складну морфологію (пристінковий тромбоз, розміщення на вигині артерії і т.д.). Проте можливе і проведення інвазивних втручань (див. табл. 1.22) з достатньою ефективністю та безпекою. Однак кожний із пацієнтів повинен мати вичерпну інформацію про можливість повторних втручань і про те, що при успішному проведенні коронарної ангіопластики існує реальна можливість повторення реваскуляризації (включаючи АКШ), що може виникнути у 30–40% випадків.
Таблиця 1.22. ПКВ однієї великої артерії при оклюзії інших артерій
| Дослідник (рік) | Метод лікування | Кількість пацієнтів, n | Госпітальний період, % | Віддалений період, % | Немає стенокардії, % | |
| Смерть/Q-ІМ/АКШ | Місяці спостереження | Смерть/Q-ІМ/ПКВ/АКШ | ||||
| Lafont (1993) | ПКВ ПМШГ ЛКА або ПКА, коли друга артерія оклюзована | 193 | 0,5/0,5/5,7 | 33 | 4,7/3,7/23,6/13,1 | 76 |
| ПКВ ПМШГ + ПКА | 214 | 0,5/0,5/3,3 | 5,3/4,3/11,6/8,2 | 80 | ||
| АКШ ПМШГ + ПКА | 194 | 1,5/1,0/0 | 8,5/3,7/1,6/2,1 | 74 | ||
| DeBruyne (1991) | ПКВ ПМШГ або ОГ ЛКА, коли ПКА оклюзована | 61 | 0/0/4,9 | 5 | -/-/25/5 | 65 |
| Teirstein (1990) | ПКВ ЛКА: | |||||
| ПКА оклюзована | 65 | 1,5/-/0 | 17 | 8/3/-/18 | 61 | |
| ПКА неоклюзована | 105 | 0/-/1,5 | 7/1/-/9 | 84 | ||
ПКВ при хронічних оклюзіях
На сьогодні частота ПКВ хронічної повної оклюзії становить до 20% усіх ангіопластик (рис. 1.99а, б). Хоча в багатьох клінічних ситуаціях добре розвинутий колатеральний кровотік забезпечує достатнє кровопостачання відповідної ділянки міокарда в стані спокою або при помірному фізичному навантаженні, проте інтра- та інтеркоронарні колатералі часто неадекватно функціонують в періоди різкого підвищення потреби міокарда в кисні, що є причиною виникнення постоклюзійної стенокардії.
Розглядаючи проблему реканалізації оклюзованих артерій необхідно чітко визначити природу оклюзії. Стан артерії до виникнення повної оклюзії значною мірою визначає клінічні прояви
хвороби, наявність колатерального кровотоку, виживаність міокарда та природу коронарної обструкції. Розглянемо 2 типи утворення оклюзії.
Перший тип (табл. 1.23, рис. 1.100) — гостра оклюзія, що виникла в результаті утворення тромбу в місці помірного стенозу коронарних артерій. У більшості випадків оклюзія такого типу клінічно проявляється у вигляді гострого ІМ. Колатеральний кровотік зазвичай відсутній або слабко виражений. Відновлення кровотоку по оклюзованій артерії після гострої оклюзії протягом 4, 6 або 12 год сприяє значному поліпшенню прогнозу при гострому ІМ. Патофізіологічно тромботична обструкція складається зі зруйнованої бляшки та свіжих тромботичних мас. Подібного типу оклюзії добре реканалізуються провідниками звичайного типу, успіх втручання становить >90%. Ефективність реканалізації коронарної артерії, що зумовила інфаркт, з часом (місяці, роки) знижується, що пов’язано з реорганізацією свіжих тромбів, які зазнають фіброзу та кальцифікації.
Таблиця 1.23. Повна коронарна оклюзія: клінічні і патоморфологічні особливості
| Показник | Гостра оклюзія | Хронічна оклюзія |
| Прояви | Гострий ІМ | Зміни ангінозного статусу. Зазвичай стенокардія напруження (недостатність колатерального кровотоку) |
| Гістологія | Зруйнований фіброзний ковпачок м’якої атероматозної бляшки. Як правило, оклюзуючий тромб у просвіті артерії | Складний комплекс у вигляді фіброзних і кальцинованих ділянок атеросклеротичної бляшки з організованими тромбами, розміщеними пошарово |
| Спонтанна реканалізація | Достатньо часто | Рідко |
| Інтракоронарні колатералі | Рідко | Достатньо часто (місткоподібні колатералі) |
| Інтеркоронарні колатералі | Іноді | Як правило |
| Виживаність тканини міокарда | Дуже рідко, при наявності колатерального кровотоку | Часто: колатералі підтримують виживаність. Можлива нормальна скоротність стінки лівого шлуночка у випадку дуже вираженого колатерального кровотоку в оклюзованій артерії |
| Ефективність ПКВ | Висока | Варіює. Залежить від часу утворення і морфології оклюзії |
Рис. 1.100. Коронарограма хворого із хронічною оклюзією в ПМШГ ЛКА
Другий тип (див. табл. 1.23; рис. 1.101) оклюзії коронарної артерії можна визначити як повну хронічну оклюзію, що утворилася в результаті тривалого перебігу захворювання в місці субтотального звуження коронарної артерії. Клінічно виникнення хронічної оклюзії найчастіше проявляється зміною ангінозного статусу і рідше — гострим ІМ. Як правило, добре розвинутий колатеральний кровотік може забезпечувати дистальне заповнення артерії, що відповідає стенозу 90–95%. Це приводить до збереження виживаності міокардіальної тканини і запобігає розвитку стенокардії спокою. Загальна скоротлива здатність міокарда може бути нормальною (при вираженому колатеральному кровотоці) або помірно зниженою, регіональна скоротність, як правило, змінена і пов’язана з гібернацією міокарда або субендокардіальним ІМ. Патофізіологічно більшість хронічних оклюзій утворюється в місці розміщення кальцинованої атеросклеротичної бляшки. Ці обструкції, як правило, виявляються резистентними до проходження внутрішньокоронарного провідника, що зумовлює нижчу (від 50 до 70%) ефективність реканалізації.
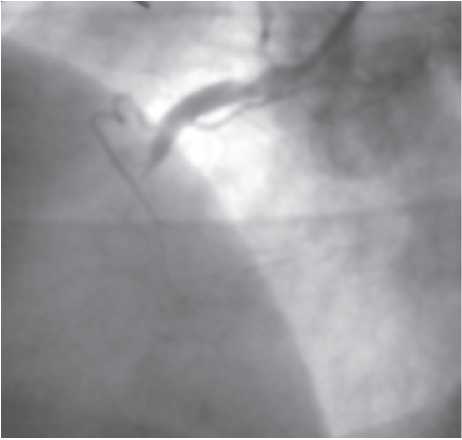
Рис. 1.101. Коронарограма хворого із тромботичною оклюзією в ПМШГ ЛКА
Перкутанна реканалізація оклюзованих артерій
Показання і результати втручання
Основні показання:
- стенокардія, рефрактерна до медикаментозної терапії;
- наявність великої площі ішемізованої зони за даними неінвазивних досліджень;
- наявність ангіографічних особливостей оклюзії, які можуть сприяти успішній реканалізації (рис. 1.102).
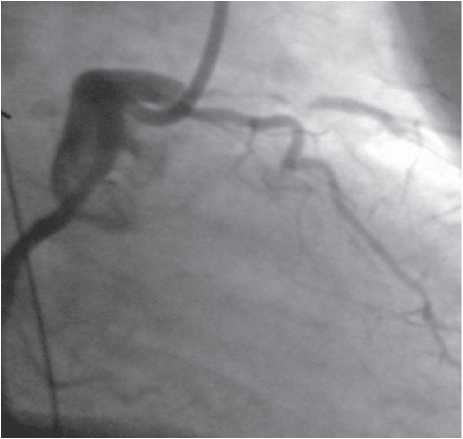
Рис. 1.102. Коронарограма хворого з функціональною оклюзією в ПМШГ ЛКА
Очікувані результати успішного втручання:
- зменшення вираженості або зникнення стенокардії напруження;
- покращання функції ЛШ і підвищення толерантності до фізичного навантаження;
- зменшення необхідності у проведенні АКШ на 50%.
Можливі результати успішного втручання:
- потенціальне джерело колатерального кровотоку до інших судин;
- покращання процесів ремоделювання ЛШ після гострого ІМ;
- покращання виживаності пацієнтів без стенокардії.
Успіх втручання
За даними порівняльного аналізу ефективність реваскуляризації функціональних та повних хронічних оклюзій, на жаль, залишається невисокою (табл. 1.24). Опубліковані серії досліджень, які загалом становлять 4400 хронічних коронарних оклюзій, підтверджують, що в середньому рівень успіху становить >69% (від 47 до 81%) (табл. 1.25).
Таблиця 1.24. Коронарна ангіопластика неповних, функціональних та повних хронічних оклюзій: негайні результати
| Автор дослідження (рік) | Група | Кількість оклюзій, n | Ефективність, % | Ускладнення, %
Смерть/ІМ/АКШ |
Гостра оклюзія, % |
| Berger (1996) | Неповна | 1295 | — | 0/0,14/0 | — |
| Повна | 139 | — | 0/1,5/0,3 | — | |
| Favereau (1995) | Неповна | 2065 | 96 | 1,4 | 1,8 |
| Повна | 292 | 67 | 1,7 | 8 | |
| Tan (1995) | Неповна | 1157 | 93 | 0,4/0,7/2,1 | 3,3 |
| Повна | 91 | 66 | 0/0/0 | 0 | |
| Ruocco (1992) | Неповна | 1429 | 82 | 0,7/4,8/3,5 | 1,5 |
| Повна | 271 | 59 | 1,8/3,6/3,3 | 4,1 | |
| Myler (1992) | Неповна | 779 | 94 | 1,7 | — |
| Повна | 122 | 76 | 1,6 | — | |
| Plante (1991) | Неповна | ||||
| Стабільна стенокардія | 637 | — | 4 | — | |
| Нестабільна стенокардія | 442 | — | 8 | — | |
| Повна | |||||
| Стабільна стенокардія | 44 | 48 | 2,5 | — | |
| Нестабільна стенокардія | 46 | 65 | 2 | — | |
| Stone (1990) | Неповна | 6950 | 96 | 0,9/1,5/1,7 | — |
| Повна | 905 | 72 | 0,8/0,6/0,8 | — | |
| Safian (1988) | Неповна | 711 | 90 | 0,4/3/2 | — |
| Функціональна | 102 | 78 | 1/3/3 | — | |
| Повна | 169 | 63 | 0/0/2 | — | |
Неповна оклюзія — 51–99% (TIMI >2). Функціональна оклюзія — 99% (TIMI=1). Повна оклюзія — 100% (TIMI=0).
Таблица 1.25. Коронарна ангіопластика хронічних повних оклюзій: негайні результати
| Автор дослідження (рік) | Кількість пацієнтів, n | Ефективність,
% |
Ускладнення, %
Смерть/ІМ/АКШ |
Інші ускладнення |
| Berger (1996) | 139 | — | 0/1,4/2,9 | — |
| Favereau (1995) | 367 | 67 | 1,7 | — |
| Kinoshita (1995) | 443 | 81 | 0,3/0/0 | Тампонада серця (1%) |
| Tan (1995) | 91 | 66 | 0/0/0 | Гостра оклюзія (0%) |
| Ishizaku (1994) | 111 | 62 | 0/1,6/0 | Не-Q-ІМ (5%) |
| Tan (1993) | 312 | 61 | 0,3/—/1,6 | — |
| Shimizu (1993) | 468 | 75 | — | |
| Stewart (1993) | 100 | 47 | 1/0/— | Не-Q—ІМ (5%) |
| Maiello (1992) | 365 | 64 | 0/0,6/0,3 | Перфорація 0,6% |
| Myler (1992) | 122 | 76 | 1,6 | — |
| Ivanhoe (1992) | 480 | 66 | 1/2/— | — |
| Ruocco (1992) | 271 | 59 | 2/1/2 | Гостра оклюзія (4%) |
| Bell (1991) | 354 | 66 | 0,3/1,7/2,5 | — |
| Stone (1990) | 971 | 72 | 0,8/0,6/0,8 | — |
| Усього | 4450 | 69 |
Найбільш частою (80%) причиною невдалої реканалізації коронарної артерії є неможливість проведення коронарного провідника через оклюзію. Одна із причин (15%) невдалої реканалізації — неможливість проведення балона через зону оклюзії, а також неможливість дилатувати оклюзію (5%) в результаті її вираженої кальцифікації.
Предиктори успіху (табл. 1.26–1.28). Вибір пацієнта для проведення реканалізації повністю оклюзованої артерії залишається найбільш важливим предиктором успішної ангіопластики. Залежно від наявності клінічних і ангіографічних умов частота реканалізації становить 18–87% (див. табл. 1.26–1.28, рис. 1.102). Важливою умовою успішної реканалізації є «вік» оклюзії (див. табл. 1.26). Чим «молодша» оклюзія, тим вища ймовірність її успішної реканалізації. Оптимальний період для проведення реканалізації — 3 міс від передбачуваного моменту оклюзії артерії. Не менш важлива особливість успішної реканалізації повністю оклюзованої коронарної артерії — адекватні рентгеноморфологічні умови втручання (див. табл. 1.28; рис. 1.103).
Таблиця 1.26. Вплив «віку» оклюзії на результати коронарної ангіопластики
| Автор дослідження (рік) | «Вік» оклюзії | Кількість оклюзій, n | Ефективність, % |
| Tan (1995) | <3 міс
>1 міс |
42
49 |
76
57 |
| Ishizaku (1994) | <1 міс
>1 міс |
11
100 |
91
56 |
| <1 тиж | 99 | 87 | |
| Myler (1992) | 1–12 тиж | 73 | 88 |
| >3 міс | 49 | 59 | |
| <1 тиж | 60 | 74 | |
| Bell (1992) | 1–4 тиж
1–3 міс |
15
243 |
93
67 |
| >3 міс | 45 | 64 | |
| <1 міс | 73 | 89 | |
| Maiello (1992) | 1–3 міс | 77 | 87 |
| >3 міс | 110 | 45 | |
| Stone (1990) | <12 тиж
>12 тиж |
29
39 |
90
74 |
Таблиця 1.27. Хронічна повна коронарна оклюзія: предиктори успішної ангіопластики
| Ефективність втручання | Неефективність втручання |
| Функціональна оклюзія | Повна оклюзія |
| Оклюзія <12 тиж | Оклюзія >12 тиж |
| Довжина не більше 15 мм | Довжина >15 мм |
| Конусоподібна кукса | «Обрубана» кукса |
| Відсутня бічна гілка у місці оклюзії | Присутня бічна гілка у місці оклюзії |
| Немає інтеркоронарних місткоподібних колатералей | Виражені місткоподібні колатералі («голова медузи») |
Таблиця 1.28. Вплив різних характеристик оклюзії на результат реканалізації
| Автор дослідження (рік) | Ефективність втручання, % | |||||||
| Довжина оклюзії | Тип оклюзії | Оклюзія конусоподібної кукси | «Місткоподібні» колатералі | |||||
| коротка | довга | функціональна | повна | Так | Ні | Так | Ні | |
| Kinoshita (1995) | — | — | — | — | — | — | 75 | 83 |
| Tan (1993) | — | — | — | — | 69 | 43 | 70 | 20 |
| Maiello (1992) | 71 | 60 | 68 | 69 | 83 | 51 | 67 | 29 |
| Ivanhoe (1992) | — | — | 78 | 60 | 73 | 60 | — | — |
| Stone (1990) | 85 | 69 | 83 | 74 | 88 | 59 | 18 | 85 |
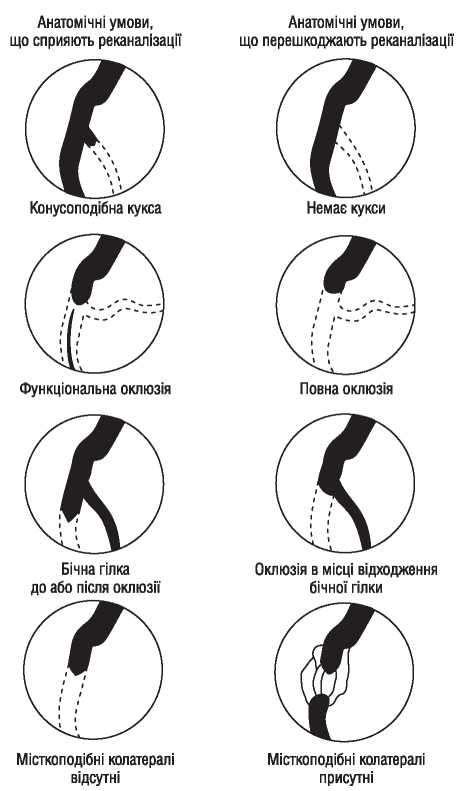
Рис. 1.103. Анатомічні умови, які сприяють або перешкоджають проведенню реканалізації коронарної оклюзії
Функціональна оклюзія
Функціональна оклюзія (рис. 1.102–1.104) — це варіант ураження коронарної артерії, при якому перешкодою кровотоку є ступінь стенозу близько 99%, що призводить до часткового заповнення дистальної частини артерії контрастною речовиною та візуалізації постоклюзійного сегмента артерії із затримкою контрастної речовини в дистальній частині судини (див. рис. 1.104). У різних клінічних дослідженнях визначали, що ймовірність реканалізації функціональної оклюзії вища, ніж повної оклюзії (76% порівняно з 67%). Основною диференціальною особливістю функціональної оклюзії є наявність інтракоронарних (внутрішньобляшкових) каналів (див. рис. 1.104). Основною ознакою хронічної повної оклюзії можуть бути інтеркоронарні канали, які часто називають місткоподібними колатеральними судинами (розміщуються вздовж артерії і сприяють заповненню дистального русла оклюзованої судини із проксимального сегмента в антеградному напрямку).
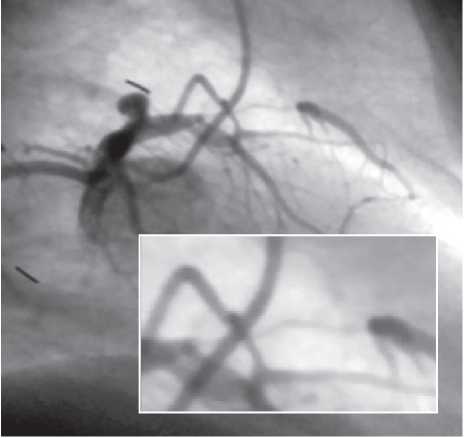
Рис. 1.104. Коронарограма ЛКА з функціональною оклюзією в проксимальному сегменті ПМШГ ЛКА (визначається канал з проксимальної культі в дистальний сегмент артерії)
Час від початку оклюзування (вік оклюзії)
Вік оклюзії може бути визначений як інтервал між моментом обстеження і появою виражених симптомів ішемії міокарда у хворого з гострим ІМ, виникненням стенокардії, різкою зміною ангінального статусу у пацієнтів із симптомами ІХС. Найбільш ефективною реканалізація була при усуненні оклюзії «молодше» 1 тиж, проміжні результати визначають при лікуванні оклюзії від 2 до 12 тиж, нижчі результати відзначені при реканалізації оклюзії >3 міс. Не можна вважати «вік» оклюзії єдиною умовою успішної реканалізації без врахування рентгеноморфологічних критеріїв відбору. Більше того, «старі» оклюзії не є безперспективними для реканалізації (імовірність успіху реканалізації оклюзії старше 6 міс може становити 50–75%), проте ймовірність успіху втручання знижується з «віком» оклюзії. У деяких випадках «вік» оклюзії визначають за непрямими ознаками і він не може вважатися абсолютно точним.
Поширеність оклюзій (довжина ураження)
Загальним правилом є той факт, що при довжині оклюзії >15 мм ефективність реканалізації низька, хоча й цю характеристику не можна відокремити від інших предикторів успішної ангіопластики оклюзії («вік» оклюзії, анатомічні й рентгеноморфологічні фактори і т.д.).
Розміщення бічної гілки в місці коронарної оклюзії (див. рис. 1.104)
Подібна характеристика оклюзії пов’язана з низькою ефективністю реканалізації. Причиною цього може бути те, що провідник по шляху проходження оклюзії йде в більш доступну частину відкритої артерії, тобто в бічну гілку. Більше того, якщо лікар використовує неоптимальну проекцію, то створюється враження, що дистальна частина провідника пройшла через оклюзію, у той час як дріт розміщений у бічній гілці. Найважливішим фактором успішної реканалізації є визначення адекватності проходження коронарного провідника через оклюзію з розміщенням верхівки провідника у просвіті дистальної частини оклюзованої судини.
Наявність конусоподібної кукси
Конусоподібну куксу (див. рис. 1.102, 1.103) дилатують більш успішно, на відміну від оклюзії без конусоподібної форми. Конусоподібні оклюзії складаються з невеликих каналів (200 мк у діаметрі кожний), які можна визначити за допомогою ангіографії, і які забезпечують потенційно більш високу ефективність ангіопластики.
Однак слід враховувати, що кукса, як правило, розміщена ексцентрично щодо просвіту артерії. Тому при надмірно агресивному просуванні провідника існує ймовірність проведення його під інтимою. Саме з цієї причини необхідно уважно стежити за проекцією провідника і при потребі змінювати ангіографічні проекції, використовуючи додаткові ін’єкції контрастної речовини для визначення реального положення провідника. При недотриманні цих правил і надмірній поступальній активності коронарного провідника можна порушити цілість стінки артерії аж до перфорації і вірогідної тампонади.
У деяких випадках конусоподібна кукса може продовжуватися в дуже тонкий канал (див. рис. 1.104), що часто забезпечує контрастування дистальної частини артерії. Подібна особливість підвищує успіх втручання, тому що канал сприяє правильному напрямку провідника в бік дистальної частини оклюзії та більш вільній доставці балона-катетера в оклюзований сегмент.
Інтеркоронарні (місткоподібні) колатералі
Результати невеликих серій дослідження ангіопластики оклюзій підтверджують, що місткоподібні колатералі (див. рис. 1.103, 1.105) є найбільш важливими детермінантами хронічних тотальних оклюзій і знижують імовірність проведення успішних ангіопластик. Проте у недавньому дослідженні Kinoshita і співавторів опубліковано практично еквівалентні результати ангіопластики у 109 тотальних оклюзіях з наявністю місткоподібних колатералей і у 124 оклюзіях без подібних морфологічних особливостей (75% порівняно з 83%, р=0,07). Інші автори пояснюють високу ефективність реканалізації повністю оклюзованих артерій великим досвідом лікаря, який проводить втручання та активним використанням жорстких коронарних провідників.
Рис. 1.105. Коронарограма ПКА з повною оклюзією та інтеркоронарними (місткоподібними) колатеральними судинами
Оклюзії, які розвивалися поступово (про що свідчить виражений інтеркоронарний кровотік у вигляді місткоподібних колатералей типу «голова медузи»), рідко зазнають успішної реканалізації і мало підходять для проведення коронарної ангіопластики (в середньому ефективність цього втручання становить <20%). Видимі місткоподібні колатералі — це дилатовані судини артерій (vasa vasorum), які в нових умовах кровопостачання перетворилися в неоваскулярні канали з дуже тендітною структурою та малим діаметром.
Інші фактори
Інші фактори, які зумовлюють високий і низький рівень реканалізації повністю оклюзованих артерій: кальцифікація, звивистість проксимальної частини оклюзованої артерії, дистальна локалізація оклюзії, оклюзія правої коронарної артерії або огинаючої гілки, ІХС із багатосудинним ураженням, нестабільна стенокардія.
Ускладнення коронарної ангіопластики повністю оклюзованої артерії
Коронарна ангіопластика повної хронічної оклюзії, як правило, пов’язана з низьким ризиком втручання (але це не означає, що ризику не існує взагалі!). У декількох повідомленнях визначений еквівалентний рівень ускладнень у повних оклюзіях і субтотальних стенозах. Більше того, наявність повної хронічної оклюзії до втручання є незалежним предиктором гострої оклюзії після втручання. Частота гострої коронарної оклюзії при спробі реканалізації хронічної оклюзії становить 5–10%, гострого ІМ — 0–2%, екстреного АКШ — 0–3%, смерті — 0–1% (табл. 1.29, 1.30). За даними деяких досліджень 8% успішно дилатованих повних оклюзій (без імплантації коронарних стентів) реоклюзувалися протягом 24 год порівняно з 1,8% гострої оклюзії після ПКВ субтотальних стенозів. Однак у 87% випадків реоклюзії носили безсимптомний характер (див. табл. 1.29, 1.30). В іншому дослідженні частота ускладнень реканалізації повних хронічних оклюзій складала 20% у пацієнтів з нестабільною стенокардією та 2,5% — зі стабільною стенокардією. Гострі ішемічні ускладнення коронарної ангіопластики повної хронічної оклюзії пов’язані з дисекцією або тромбозом раніше дилатованого сегмента, з оклюзією бічної гілки або з дистальною емболізацією. Ускладненнями, що відзначаються рідко, є перфорація оклюзованої артерії, розрив або руйнування коронарного провідника або нефропатія в результаті передозування контрастної речовини. Гострі оклюзії після успішної река-налізації оклюзії можуть бути причиною різкої клінічної нестабільності в результаті поновлення колатерального кровотоку, який припиняється після успішної реканалізації і значно повільніше відновлюється після гострої оклюзії.
Таблиця 1.29. Ангіопластика повних хронічних оклюзій: симптомний статус при віддаленому спостереженні
| Автор дослідження (рік) | Успішна ангіопластика, випадки | Спостереження, міс | Пацієнти без симптомів стенокардії, % |
| Berger (1996) | 139 | 6 | 87 |
| Stewart (1993) | 45 | 12 | 68 |
| Ivanhoe (1992) | 264 | 36 | 69 |
| Ruocco (1992) | 160 | 24 | 69 |
| Bell (1991) | 234 | 32 | 76 |
Таблиця 1.30. Рівень рестенозів і реоклюзій після реканалізації коронарних оклюзій
| Автор дослідження (рік) | Тип оклюзії | Кількість оклюзій, n | Рестеноз, % | Реоклюзія, % |
| Berger (1993) | Повна
Неповна |
193
1295 |
49
42 |
19
7 |
| Kinoshita (1995) | Повна | 433 | 55 | 15 |
| Violaris (1995) | Повна | 266 | 45 | 19 |
| Неповна | 3317 | 34 | 5 | |
| Абсолютна | 109 | 45 | 24 | |
| Функціональна | 157 | 45 | 16 | |
| Ishizaku (1995) | Повна | 62 | 55 | 18 |
| Bell (1995) | Повна | 69 | 59 | 14 |
| Ivanoe (1992) | Повна | 175 | 54 | 16 |
| Anderson (1997) | Повна | 70 | 71 | 34 |
Віддалені результати реканалізації повної хронічної оклюзії
У переважної більшості пацієнтів після успішної ангіопластики повністю оклюзованої коронарної артерії протягом тривалого часу відсутні симптоми захворювання (див. табл. 1.29). У 3 великих дослідженнях у 76; 69 і 66% пацієнтів не було симптомів захворювання відповідно протягом 1, 2 і 4 років після коронарної ангіопластики. Відсутність симптомів стенокардії не виключає наявність рестенозів, які є в 40% випадків при відсутності стенокардії після реканалізації повністю оклюзованої артерії (табл. 1.31, 1.32).
Таблиця 1.31. ПКВ неповних та повних хронічних коронарних оклюзій: віддалені результати
| Автор дослідження (рік) | Тип оклюзії | Період спостереження, міс | Смертність, % | ІМ, % | АКШ, % | ПКВ, % |
| Berger (1996) | Повна
Неповна |
6 | 1,4
0,5 |
2,9
2,4 |
— | — |
| Violaris (1995) | Повна
Неповна |
6 | 0
0,2 |
3,6
2,8 |
3,6
2,4 |
21
17 |
| Ruocco (1992) | Повна
Неповна |
2 | — | 5
9 |
19
15 |
9
20 |
| Safian (1988) | Повна
Неповна |
2 | — | — | 14
8 |
— |
Таблиця 1.32. Успішна ангіопластика хронічної повної оклюзії: віддалені результати
| Автор дослідження (рік) | Результат | Період спостереження, міс | Смертність, % | ІМ, % | АКШ, % | ПКВ, % |
| Stewart (1993) | Успіх
Невдача |
12 | 2,2
4,1 |
— | 16
45 |
13
16 |
| Ivanhoe (1992) | Успіх
Невдача |
4 | — | — | 13
36 |
— |
| Bell (1991) | Успіх
Невдача |
5–7 | 18
25 |
11
5 |
18
58 |
— |
| Finci (1990) | Успіх
Невдача |
2 | 5
3 |
— | 7
37 |
— |
Функції ЛШ
Незважаючи на те що даних про функцію ЛШ після ефективної реканалізації недостатньо, успішна коронарна ангіопластика поліпшує як загальну, так і регіональну функцію ЛШ. В одному із досліджень у пацієнтів, яким успішно провели реканалізацію з наступною прохідністю у раніше ураженій артерії й нормальним коронарним кровотоком, відзначені краща загальна ФВ ЛШ і менша дилатація порожнини ЛШ порівняно з пацієнтами, яким реканалізацію не проводили.
У більшості досліджень установлено, що успішна реканалізація хронічної повної оклюзії зменшує необхідність у проведенні АКШ в 50–75% випадків. Проте коронарна ангіопластика порівняно з АКШ не має ні переваг, ні недоліків відносно виживаності та розвитку більш пізніх ІМ у пацієнтів цієї групи.
Вибір необхідного інструмента для проведення коронарної ангіопластики у пацієнтів при повній хронічній оклюзії
Коронарна ангіопластика повної хронічної оклюзії є одним з найбільш складних втручань в інтервенційній кардіології. Порівняно з неповною (функціональною) оклюзією ПКВ при повній оклюзії є більш вартісним втручанням (що пов’язано з великою кількістю необхідних провідникових катетерів, внутрішньокоронарних провідників, балонів і т.п.). Слід зазначити, що подовжується час процедури та установлені вищі показники променевого навантаження як для пацієнта, так і для лікаря.
Провідниковий катетер
Обов’язковою умовою для вибору провідникового катетера є максимальний опір відштовхуванню, що необхідно для проходження коронарного дроту, а потім і балона-катетера через коронарну оклюзію. Для реканалізації хронічної оклюзії в басейні лівої коронарної артерії найчастіше використовують катетери типу Voda і Amplatz для лівої коронарної артерії, які забезпечують їх максимально стабільну фіксацію в усті лівої коронарної артерії. У басейні правої коронарної артерії рекомендується катетер типу Amplatz для лівої коронарної артерії й типу Voda — для правої коронарної артерії. Якщо використовувати провідниковий катетер типу Junkins або багатофункціональний провідниковий катетер, то ми рекомендуємо застосовувати систему глибокої фіксації катетера в усті коронарної артерії для посилення стійкої фіксації верхівки катетера. Розмір внутрішнього просвіту провідникового катетера також визначає жорсткість фіксації катетера в усті коронарної артерії. Чим більший діаметр катетера, тим стійкіше він буде фіксуватися в усті артерії. Компромісним розміром (діаметр — жорсткість) є провідниковий катетер 8 F. Однак при використанні провідникових катетерів розміром 8 F і більше лікар обмежений у просуванні верхівки катетера в просвіт коронарної артерії, тобто у застосуванні прийому «глибоко фіксованого катетера».
Метою цього прийому є створення більш жорсткої конструкції провідниковий катетер + устя артерії. Цей ефект полягає в більш глибокому проникненні дистальної частини катетера в устя коронарної артерії та більш жорсткій фіксації його в просвіті (рис. 1.106А–В). Коли коронарний провідник проведений через уражений сегмент, при цьому балон, що йде по провіднику, не може перетнути зону ураження (причини: жорсткий стеноз, звивистий сегмент, повна хронічна оклюзія та ін.) (див. рис. 1.106А), а провідниковий катетер не виявляє достатньої підтримки, можлива тракція балона-катетера (див. рис. 1.106Б) у зворотному напрямку (до провідникового катетера) під контролем якісного флюороскопічного зображення. Не змінюючи позиції провідника, одночасно просувають вперед дистальну частину провідникового катетера (див. рис. 1.106В). Після цієї маніпуляції верхівку провідникового катетера просувають дещо вперед і міцніше фіксують в усті артерії (див. рис. 1.106Б). Після цього необхідно повторити спробу просування балона через зону ураження. Цю методику можна застосовувати при наявності провідникового катетера не більш 7 F і бічних перфузійних отворів у вигнутій частини катетера зі спеціальною атравматичною верхівкою. Стовбур лівої коронарної артерії повинен бути досить великим (>4 мм) і без ознак коронарного атеросклерозу (звуження, видимий кальциноз).
Внутрішньокоронарні провідники
Серії провідників типу floppy, стандартні та провідники із проміжними властивостями — найбільш популярні пристрої для проходження хронічних повних оклюзій, але деякі лікарі віддають перевагу використанню твердих провідників або провідників типу gliadewire (з особливим ковзним покриттям).
М’які (floppy) коронарні провідники успішно проходять через оклюзію в 30–50% випадків при «віці» оклюзії не більше 6 міс. Жорсткі коронарні дроти підвищують ефективність втручання ще на 25%, однак ці додаткові 25% оклюзованих артерій не могли бути реканалізовані за допомогою будь-яких інших коронарних провідників. Безумовно, для реканалізації можна вибрати коронарні провідники розміром 0,014 дюйма, проте частіше використовують дріт розміром 0,016 або 0,018 дюйма з метою підвищення їх прохідності. Дуже рідко використовують провідники розміром 0,035–0,038 дюйма для проходження повної оклюзії. Проте ми не рекомендуємо використовувати провідники розміром >0,021 дюйма для проходження оклюзованого сегмента з метою запобігання субінтимального ушкодження оклюзованої артерії і перфорації судини.
Якщо при проведенні контрольної коронарографії можна візуалізувати постоклюзивне заповнення коронарної артерії (при наявності адекватного колатерального кровотоку), то доцільно використовувати стоп-кадр контрольної коронарографії (freeze-frame, подібна можливість існує у всіх сучасних дигітальних ангіографічних системах) для того, щоб визначити напрямок просування коронарного дроту через оклюзію. Додаткова прохідність коронарного дроту може бути досягнута за допомогою балона-катетера або спеціального транспортного катетера (probing catheter, «катетер без балона», «коронарний буж»), який розміщують на 1-2 см позаду верхівки коронарного провідника. Якщо хоча б один раз вдається пройти коронарним провідником через зону оклюзії і підтвердити це проходження, то не можна змінювати позицію дроту до проведення ангіопластики (інакше друга спроба успішного проходження дроту може не повторитися!). Основними ознаками успішного проведення коронарного дроту через оклюзований сегмент є вільна ротація верхівки провідника (видима на флюороскопічному зображенні) і можливість безперешкодної тракції коронарного провідника у напрямку вперед — назад. Найбільш чітким підтвердженням інтралюмінального розміщення дистальної частини коронарного провідника в артерії є ін’єкції контрастної речовини через устя основної артерії або просвіт транспортного катетера (probing catheter). Можливими ознаками неправильної установки коронарного провідника (паравазальна позиція) можуть бути відсутність вільної ротації дистальної частини провідника та безперешкодного руху провідників вперед — назад, неможливість проходження балона-катетера через оклюзований сегмент. Якщо перераховані особливості визначаються в процесі втручання, то коронарний провідник розміщений у субінтимальному просторі або в одній з невеликих місткоподібних колатералей. У цьому випадку балонна ангіопластика поза оклюзованим сегментом може призвести до розвитку коронарних ускладнень.
Gliadewire (виробник «Mansfield/Scimed») — це коронарний провідник, який був успішно використаний при периферичних ангіопластиках і встановленні стентів, а тепер і в кардіології. Особливістю цього провідника є те, що він виготовлений з титанонікелевого сплаву (нітинолу) і має гідрофільне поліуританове покриття, яке надає цьому провіднику високу гнучкість і прохідність через дуже звивисті та оклюзовані сегменти, а також високу опірність до зламу й деформації. Трисантиметрова верхівка цього провідника дуже м’яка й гнучка, що сприяє атравматичному проходженню дроту в малодоступні сегменти коронарного русла. Невеликі серії досліджень підтверджують той факт, що Gliadewire може бути успішно використаний в 36–60% випадків оклюзій, де застосування стандартних внутрішньокоронарних провідників було неефективним (табл. 1.33).
Таблиця 1.33. Результати використання різних провідників для реканалізації оклюзій
| Автор дослідження (рік) | Кількість оклюзій, n | Ефективність приладу, % | Кінцева ефективність, % | Коментар |
| Gliadewire | ||||
| Freed (1993) | 59 | 54 | 39 | Немає перфорацій |
| Rees (1991) | 33 | 58 | 52 | 52% дисекцій, які не обмежують кровотік |
| Hosney (1990) | 8 | — | 88 | Дроти типу gliadewires розміром 0,025″ і 0,035″ |
| Magnum Wire (MW) | ||||
| Pande (1992) | 28 | 45 | 39 | Ефективність реканалізації MW після невдалої ПКВ складає 39%, ефективність реканалізації після невдалої MW — 12% |
| Haerer (1991) | 102 | 32 | 32 | — |
| Lasewire | ||||
| Serruys (1996) | 252 | 58 | — | Коронарна перфорація (21%); тампонада серця (0,8%); ІМ без зубця Q (1,6%) |
| Ultrasound Wire | ||||
| Rees (1995) | 18 | 89 | 78 | — |
| ROTACS | ||||
| Danchin (1995) | 50 | — | 66 | — |
| Kaltenbach (1991) | 152 | — | 65 | Дисекція стовбура ЛКА (1,5%); без смерті або перфорації; рестеноз (54%) |
Розміри дроту Gliadewire — від 0,016 до 0,025 дюйма. Недоліками цього дроту є недостатня візуалізація в коронарному руслі і неможливість змінити форму в дистальній частині провідника.
Провідник для реканалізації Magnum — Meier
Особливістю провідникової системи Magnum — Meier є розміщена на верхівці провідника олива, яка перешкоджає перфорації коронарних артерій, а жорсткість дистальної частини провідника забезпечує хорошу прохідність дроту через оклюзію, розміри цього пристрою коливаються від 0,014 до 0,021 дюйма. Для підвищення ефективності реканалізації за допомогою цього коронарного провідника виробник (фірма «Schneider/Scimed») виготовив спеціальний балон Magnum — Meier, адаптований до дроту розміром 0,021 дюйма. Результати рандомізованих досліджень ефективності реканалізації подібної системи варіюють: в одному дослідженні отримані вищі результати, ніж при використанні звичайного коронарного провідника. В іншому дослідженні не виявлені особливі переваги провідника Magnum — Meier при реканалізації оклюзованих артерій.
Балон-катетер
Основними якостями балонів-катетерів, що використовуються для реканалізації повних хронічних оклюзій після проходження коронарного провідника, є низькопрофільність, високий ступінь прохідності (як правило, ці балони обробляють спеціальним ковзним біопокриттям, яке сприяє кращій прохідності через оклюзії і субтотальні стенози). Середня і проксимальна частини балона-катетера повинні бути досить жорсткими, щоб максимально ефективно передавати тиск до дистальної частини провідника для проходження різко звуженого або оклюзованого сегмента. Найбільш ефективним способом проходження балона через оклюзію є постійний тиск у напрямку оклюзії. Це більш ефективно, ніж періодичне «постукування» (чергування поступальних рухів вперед — назад) балоном в області оклюзованого сегмента. Якщо балон адекватного розміру неможливо провести через оклюзію, то його можна замінити балоном меншого діаметра для предилатації (2,5–2,0 мм у діаметрі), після чого використовувати балон адекватного розміру для завершення процесу ангіопластики.
Якщо існує можливість провести вимірювання діаметра прилеглого неураженого сегмента коронарної артерії та визначити передбачуваний діаметр оклюзованого сегмента, то необхідно використовувати балон з розміром передбачуваного діаметра оклюзії у співвідношенні 1:1. При наявності вираженого кальцинозу оклюзованого сегмента раціонально використовувати балони-катетери високого тиску з низькою піддатливістю, які значно менше змінюють форму залежно від тиску і зберігають діаметр балона на фоні високого тиску (до 16 атм.).
Додаткова тромболітична терапія
З патофізіологічної точки зору у «свіжих» повних оклюзіях можна виявити невеликі вогнища тромбоутворення в найбільш «свіжій» частині оклюзії. Отже, можна використовувати тромболітичні препарати для проведення коронарного тромболізису з метою лізирування незначних тромботичних мас у місці оклюзії. Існують дані невеликих досліджень, у яких хворим призначали різні тромболітичні препарати та інфузійні режими і проводили пролонгований коронарний тромболізис для підвищення ефективності реканалізації практично повністю оклюзованої артерії. Серед 56 оклюзій (комбіновані дані 3 досліджень) постлітична (часткова) реканалізація кровотоку в коронарній артерії, а згодом і ангіопластика була ефективною в 63–73% випадків (табл. 1.34).
Таблиця 1.34. Інтеркоронарний тромболізис оклюзії, резистентної до проходження внутрішньокоронарного провідника
| Автор дослідження (рік) | Кількість пацієнтів | Тромболітик, режим введення | Результат | Коментар |
| Ajluni
(1995) |
25 | Урокіназа (100 000–240 000 ОД/год протягом 8–25 год) через інфузійний дріт + провідниковий катетер | Збільшення коронарного кровотоку (28%); успіх ПКВ (52%) | ІМ (8%); виражена кровотеча (8%); строк госпіталізації — 5,1 дня |
| Kaplan
(1995) |
60 | Урокіназа (протягом 8 год) через інфузійний дріт + провідниковий катетер | Успіх ПКВ (52–56%) для всіх доз | Більше ускладнень при використанні тромболітику у високих дозах |
| Cecena
(1993) |
20 | Урокіназа болюсно 120 000–200 000 ОД/год протягом 24 год через інфузійний дріт + провідниковий катетер | Збільшення коронарного кровотоку на 90%; ефективність ПКВ — 94% | Немає ІМ, екстреного АКШ, переливання крові в 10% випадків |
| Vaska
(1991) |
11 | tPA (5–10 мг/год протягом 6 год) через інфузійний дріт | Збільшення коронарного кровотоку на 91%; ефективність ПКВ — 82% | Без смерті, ІМ або екстреного АКШ, гостра оклюзія в 10% випадків |
Таким чином, успішна реканалізація повної хронічної коронарної оклюзії, з одного боку, призводить до покращання симптоматичного статусу, підвищення толерантності до фізичного навантаження і зменшення необхідності проведення АКШ надалі на 50%, а з другого — пов’язана з відносно низькою ефективністю втручання і високою вартістю інструментарію. Проте віддалені результати втручання найчастіше зумовлені розвитком реоклюзій і стенозів, які у більшості випадків мають безсимптомний перебіг. Слід зазначити, що частота ускладнень при реканалізації оклюзій невисока, ефективність втручання коливається від 20 до 80% залежно від досвіду лікарів та техніки, що використовується.
ПКВ при наявності вигинів у руслі коронарних артерій, ураженнях устя, кальцинованих ураженнях, довгих ураженнях
Ангіопластика у звивистих артеріях і атеросклеротичні ураження, розміщені на вигинах артерій
Немає єдиного визначення артерії з проксимальної звивистістю, яке б свідчило про всі можливі ускладнення та проблеми лікування бляшки в цьому сегменті. Однак у різних дослідників для опису особливостей цього ураження існують подібні визначення. Артерія із проксимальною звивистістю — це судина з >2 вигинами (>75°), що розміщені проксимальніше стенозу, який планується дилатувати, і з одним проксимальним вигином >90% (рис. 1.107). Стеноз, розміщений на вигині артерії, представлено на рис. 1.108а, б. Один із варіантів визначення звивистих проксимальних сегментів пов’язаний з наявністю значного вигину артерії проксимальніше стенозу, який планується дилатувати. Усунення стенозів, розміщених у дистальній частині звивистого сегмента, є однією з деяких особливостей коронарної ангіопластики, пов’язаної з анатомією судини, а не з патологічним процесом у його стінці. Інакше кажучи, звивистий проксимальний сегмент не є патологічною структурою судинного русла, проте може значно ускладнити проведення ангіопластики, а в деяких випадках зробити цю процедуру неможливою.
Рис. 1.107. Коронарограма хворого з проксимальною звивистістю і дистальними звуженнями
Рис. 1.108. Коронарограма хворого зі стенозом у ПКА до ПКВ (а) та із залишковим стенозом після ПКВ (б)
При наявності подібних анатомічних особливостей насамперед виникають труднощі при проведенні коронарного провідника через звивистий сегмент. При наявності субтотального стенозу дистальніше звивистого сегмента ймовірність адекватного проходження коронарного провідника різко знижується. Ще однією проблемою, пов’язаною зі звивистим проксимальним сегментом, є неадекватне встановлення провідникового катетера. У деяких випадках неможливо використовувати провідниковий катетер стандартної кривизни для адекватної фіксації його в усті коронарної артерії при проходженні провідника через звивистий сегмент. У подібних ситуаціях показано застосування провідникових катетерів з вираженим «опором відштовхуванню» (Extra Backup Support).
У складних випадках, коли катетеризація артерії із проксимальною звивистістю поєднується з кальцинозом судини і тяжким станом пацієнта, багаторазові спроби провести внутрішньокоронарний провідник через звивистий сегмент, а потім через патологічне звуження в артерії можуть закінчитися виникненням ускладнень (табл. 1.35).
Таблиця 1.35. Вплив проксимальної звивистості артерії на результати коронарної ангіопластики дистально розміщеного стенозу
| Автор дослідження (рік) | Кількість пацієнтів, n | Характеристика | Ефективність, % | Ускладнення | |
| Вид | % | ||||
| Tan (1995) | 965 | Немає проксимальної звивистості | 93 | Гостра оклюзія | 3 |
| 142 | Помірна звивистість | 93 | 4,3 | ||
| 50 | Сильна звивистість | 84 | 6 | ||
| Ellis (1990) | 189 | Стеноз типу А | 92 | Гострі ускладнення | 2 |
| 65 | Проксимальна звивистість | 72 | 15 | ||
| Grossman (1988) | 53 | Використання катетера з кривизною Shepherd Crook | 98 | Труднощі проходження провідника через ураження | 13 |
| 51 | Катетер з кривизною Shepherd Crook не використовували | 86 | 33 | ||
При аналізі цієї таблиці необхідно враховувати, що різні дослідники по-різному визначали ступінь звивистості тих або інших проксимальних сегментів. Однак усі 3 автори у дослідженні за участю пацієнтів різних груп переконливо довели, що чим більш звивистий проксимальний сегмент, тим нижчий успіх коронарної ангіопластики і тим більше гострих коронарних ускладнень виникає при проведенні втручання, найбільш тяжким з яких є гостра оклюзія. Імовірність виникнення оклюзії підвищується більш ніж в 2 рази при наявності звивистого проксимального сегмента перед патологічно звуженим сегментом коронарної артерії.
У більшості випадків вдається пройти коронарним провідником через звивистий проксимальний сегмент, а потім провести провідник через зону стенозу в дистальну частину артерії. Однак серйозною проблемою може бути доставка балона-катетера (або іншого пристрою) для проведення коронарної ангіопластики. Сучасні балони для коронарної ангіопластики мають достатню гнучкість і високу прохідність через просвіт звивистих артерій. Останнім часом багато виробників інструментів для ендоваскулярних втручань використовують спеціальне «ковзне» покриття, яке нанесено на поверхню упакованого балона (іноді й іншої частини катетера). Подібне покриття сприяє значному зниженню тертя балона об стінки звивистої артерії і призводить до підвищення прохідності балона через звивисті артерії і субтотальні стенози. Однак необхідно відзначити, що в деяких випадках лікарі намагаються використовувати такі менш гнучкі пристрої, як атеротоми, лазерні дроти та ін., які мають меншу гнучкість і прохідність в подібних випадках. Найбільш адаптованим у цій складній ситуації є ротаблатор. Активований бур значно знижує фрикційний опір обладнання при проходженні звивистого сегмента і дозволяє долати помірно і навіть значно звивисті сегменти коронарної артерії.
Особлива проблема, що вимагає свого розв’язання, це доставка коронарних стентів в уражені сегменти, розміщені дистальніше звивистих ділянок артерій. Якщо балонна ангіопластика може бути успішно проведена з використанням сучасних низькопрофільних балонів зі спеціальним ковзним покриттям, то використання фіксованих на балонах стентів, як правило, поєднується з проблемою проходження системою балон + стент через звивисті сегменти артерії до місця імплантації. Тубулярні стенти, маючи високу радіальну резистентність та відносно низький профіль, іноді ускладнюють процес стентування у зв’язку з недостатньою гнучкістю після встановлення на балон. Слід зазначити, що дротяні стенти мають більшу гнучкість при доставці через звивисті сегменти. Однак конструкція дротяних стентів не припускає вираженої радіальної резистентності після імплантації, а отже, їх рідше встановлюють у жорстких і субтотальних стенозах з ознаками кальцинозу (можлива наявність залишкового стенозу, а у подальшому — тромбозу, зумовленого високим радіальним опором кальцинованих стенозів).
Технічні особливості і добір необхідних інструментів для проведення ангіопластики при наявності звивистого проксимального сегмента в коронарній артерії
Для успішного проведення ангіопластики в артерії з проксимальною звивистістю необхідно підібрати всі елементи системи для ангіопластики відповідно до анатомічних особливостей цієї артерії. Насамперед необхідно правильно вибрати та адекватно встановити провідниковий катетер в усті коронарної артерії. Основною особливістю провідникового катетера є стабільна фіксація верхівки провідникового катетера в усті. Найбільш оптимальна позиція — це коаксіальне розміщення катетера щодо устя коронарної артерії, тобто кут між устям артерії і верхівкою катетера повинен становити 180°. Наступною особливістю є здатність верхівки катетера до обертання. Ця властивість особливо необхідно при глибокій фіксації катетера в усті коронарної артерії. М’яка верхівка катетера також відіграє важливу роль при адекватній установці провідникового катетера в усті коронарної артерії. У деяких випадках саме адекватне обертання провідникового катетера (при наявності атравматичної верхівки) може зіграти вирішальну роль при катетеризації устя або проходженні коронарного провідника через звивистий сегмент коронарної артерії. Обов’язковою умовою успішного втручання є провідниковий катетер з вираженим «опором відштовхуванню» (Extra Backup Support). Ця особливість провідникового катетера може визначити успіх втручання і, як правило, залежить від форми провідникового катетера та відповідності його розміру дузі аорти.
При виборі внутрішньокоронарного провідника необхідно враховувати його властивості. Існують принципові особливості, пов’язані з фізичними властивостями коронарних провідників і їх впливом на результативність втручання. З одного боку, провідники розміром >0,018 дюйма мають чудову прохідність через звивисті артерії, гнучкість, керованість та виражений «опір відштовхуванню». З іншого боку, низькопрофільні балони-катетери, які використовують при дилатації стенозів дистальної частини звивистих сегментів, адаптовані під коронарні провідники розміром 0,014 дюйма. Таким чином, необхідний компроміс при використанні дроту розміром 0,014 дюйма з високими показниками керованості, гнучкості й вираженим «опором відштовхуванню». Жорсткість коронарного дроту, необхідна для проходження звивистого сегмента, визначається довжиною звивистого сегмента та кількістю вигинів. Чим більше вигинів і чим більша довжина звивистого сегмента коронарної артерії, тим більш жорсткий провідник раціонально використовувати. Це пов’язано з тим, що м’який коронарний провідник втрачає властивості прохідності пропорційно кількості звивистих сегментів (ця властивість визначає довгий м’який сегмент дистальної частини провідника). У тому випадку, якщо сегмент артерії має один (навіть дуже звивистий) вигин, раціонально використовувати м’який коронарний провідник. При наявності декількох вигинів і тривалого звивистого сегмента краще застосовувати жорсткий або напівжорсткий провідник з коротким м’яким сегментом, який підвищить його прохідність при наявності декількох вигинів коронарної артерій. Після проходження м’якої частини провідника в дистальний сегмент коронарної артерії жорстка частина провідника дозволить дещо змінити кривизну коронарної артерії, що в майбутньому може спростити проходження балона-катетера через звивистий сегмент коронарної артерії.
Сучасні балони-катетери виготовляють з урахуванням можливості використання їх при проходженні звивистих сегментів артерій. Практично всі балони-катетери у своїх характеристиках визначаються як обладнання з високим ступенем гнучкості та прохідності через звивисті і субтотально звужені коронарні артерії. Однак у клінічній практиці це буває далеко не завжди, що пов’язано з тим, що профіль, прохідність і гнучкість коронарних балонів визначають in vitro . Найбільш раціонально використовувати балони системи «Monorail system». Цей вибір пов’язаний з меншим тертям у системі балон + коронарний провідник, можливістю швидкої заміни балона-катетера та зручністю використання цієї системи одним лікарем.
У хворих з патологією периферичних артерій більш раціонально використовувати довгі інтродюсери (30 см), щоб максимально вирівняти можливі звивисті ділянки здухвинного сегмента, тим самим спростивши обертання катетера та посиливши «опір відштовхуванню» провідникового катетера. Як правило, у подібних ситуаціях вибирають розмір провідникового катетера 8 F, тому що катетери 6 і 7 F меншою мірою виявляють «опір відштовхуванню» при проведенні втручання.
Ангіопластика кальцинованих атеросклеротичних уражень
У деяких клінічних ситуаціях кальциновані стенози коронарних артерій (рис. 1.109) можуть бути серйозною перешкодою до проведення коронарної ангіопластики. Насамперед видимий без введення контрастної речовини кальциноз у паравазальній ділянці біля атеросклеротичної бляшки свідчить про те, що стеноз має більш жорстку структуру. Отже, будь-яка дія тиском (ПКВ або стентування) на цей стеноз може призвести до деструкції стенозу в момент втручання. Іншими словами, при ангіопластиці кальцинованих звужень високий ризик виникнення складної дисекції, що поглиблюється тим, що для адекватної дилатації стенозів необхідно використовувати більш високий тиск у балоні порівняно зі стенозами без ознак кальцинозу. Вищий тиск балона для дилатації стенозу при наявності кальцинозу може призвести до стійкої глибокої дисекції артерії, а потім і гострого тромбозу дилатованого сегмента. Саме тому в одній із перших рекомендацій ACC/AHA, опублікованій у 1988 р., відзначено: «Стеноз типу В (це кальцинований стеноз від помірного до тяжкого) розглядається як ураження високого процедурального ризику гострої оклюзії».
Рис. 1.109. Коронарограма хворого з ангіографічними ознаками кальцинозу у місці ураження стовбура ЛКА
Найбільш доступний метод визначення кальцинованих атеросклеротичних бляшок коронарних артерій — це коронарографія. Проте за допомогою цього методу можна виявити тільки частину кальцинованих бляшок. Оптимальним способом для морфологічного аналізу атеросклеротичної бляшки є інтракоронарне УЗД (IVUS). Саме цей спосіб дозволяє реально оцінити глибину, поширеність кальцифікації коронарної артерії та підтвердити чутливість і специфічність коронарографії у визначенні кальцинозу в стінці артерії. Деякі дослідники наводять дані про те, що після інтракоронарного УЗД, яке дозволяє визначити поширеність і глибину кальцинозу бляшки, у 40% пацієнтів був змінений план проведення втручання.
Найближчі результати ангіопластики в кальцинованих стенозах різні. Деякі автори вважають, що наявність кальцію в бляшці знижує успіх втручання та призводить до розвитку виражених побічних ефектів коронарної ангіопластики. Інші дослідники висловлюють думку про те, що наявність кальцинозу не впливає на результат втручання (табл. 1.36). Ще одна група дослідників розцінює кальциновані стенози як незалежний предиктор виражених резидуальних стенозів після ангіопластики (досліджували 3679 дилатованих уражень). Лише одне можна стверджувати: механізм субоптимальних ангіографічних результатів коронарної ангіопластики кальцинованих стенозів включає 2 складові частини: надрив стінки артерії для збільшення діаметра судини не може бути безпечним та еластична зворотна тяга неураженої стінки артерії після коронарної ангіопластики.
Таблиця 1.36. Вплив кальцинованих стенозів на ефективність коронарної ангіопластики
| Автор дослідження (рік) | Морфологія стенозу | Кількість стенозів, n | Ефективність, % |
| Tan (1995) | Кальцинований | 81 | 74 |
| Некальцинований | 1076 | 94 | |
| Myler (1995) | Кальцинований | 140 | 92 |
| Некальцинований | 639 | 95 |
Деякі автори визначають кореляцію між кальцинованими стенозами і розвитком ІМ у момент втручання, екстреним АКШ і смертю, інші не виявляють подібних змін (табл. 1.37 ).
Таблиця 1.37. Вплив кальцинованого стенозу на ішемічні ускладнення коронарної ангіопластики
| Автор дослідження (рік) | Морфологія стенозу | Кількість стенозів, n | Ускладнення, % | Коментар |
| Tan
(1995) |
Кальциноз | 81 | 14 | — |
| Відсутність кальцинозу | 1076 | 2,5 | — | |
| Danchin
(1994) |
Смерть/ІМ/АКШ | — | ||
| Кальциноз | 285 | 0,8/3,5/0 | — | |
| Відсутність кальцинозу | 1801 | 0,7/3/1 | — | |
| Hermans
(1993) |
Кальциноз | 69 | Кальциноз стенозу не визначений як предиктор серйозних ускладнень | |
| Myler
(1992) |
Кальциноз | 140 | 3,6 | — |
| Відсутність кальцинозу | 639 | 1,3 | — | |
| Ellis
(1990) |
Кальциноз | 46 | — | — |
Внутрішньосудинне УЗД дає можливість об’єктивно визначити роль відкладання кальцію в атеросклеротичній бляшці у виникненні ішемічних ускладнень в момент проведення коронарної ангіопластики ураженого сегмента. В одному із досліджень оцінювали результат коронарної і периферичної ангіопластики бляшок з наявністю кальцинозу і без нього. За результатами дослідження встановлено, що глибокі й небезпечні дисекції відзначали значно частіше серед кальцинованих стенозів. Існує припущення, що дисекція бляшки виникає спочатку в проміжку між кальцинованою та некальцинованою частиною атеросклеротичної бляшки. Можливо, цей процес пов’язаний з розподілом сили розширюваного балона між цими двома частинами ураженого сегмента. Деякі дослідники наводять дані про кальциновані стенози та різні способи їх усунення. При використанні пристрою, який не виявляє вираженого тиску на стінку артерії — ротаблатора, дисекції стінки артерії виявляють у 22%, а при звичайній ангіопластиці — у 77% випадків.
Технічні особливості ангіопластики при кальцинозі ураженого сегмента
При балонній ангіопластиці кальцинованого стенозу, як правило, необхідний високий тиск у балоні для того, щоб провести адекватну дилатацію ураженого сегмента. Саме той факт, що тиск у балоні для проведення оптимальної ангіопластики вищий звичайного, пояснює більшу травму судини у місці роздування. Отже, підвищується ризик дисекції артерії та виникнення гострого тромбозу. Один із дослідників наводить дані про те, що 89% кальцинованих стенозів були успішно дилатовані тиском <10 атм. При більш вираженому кальцинозі необхідно підвищити тиск >12 атм. і частіше використовувати додаткові коронарні провідники, які встановлюють у просторі між балоном і стінкою артерії, що сприяє більш щадному поширенню тиску на кальциновану бляшку. Тому в реальній клінічній практиці доцільно використовувати звичайний (6–8 атм.) тиск у балоні-катетері для проведення першої ангіопластики кальцинованого стенозу. У більшості випадків цього тиску досить для проведення адекватної ангіопластики. Подібна методика дозволяє уникнути розвитку більшості ускладнень, пов’язаних з високим тиском у балоні, що необхідно для дилатації кальцинованого стенозу. Якщо першої дилатації звичайним тиском недостатньо, через кілька хвилин необхідно провести ПКВ балоном високого тиску (балон «з низькою піддатливістю») і тиску вище номінального, що дозволить успішно завершити коронарну ангіопластику кальцинованого стенозу. Якщо дисекція кальцинованого стенозу виникає, то для адекватного завершення втручання необхідно використовувати внутрішньокоронарний стент.
Ангіопластика уражень устя коронарних артерій
ПКВ устя коронарної артерії можна розглядати як ангіопластику стенозу, що розміщений в місці утворення артерії (аортокоронарне співустя) або її гілки (устя бічної гілки) (рис. 1.110а, б). Наприклад, перша діагональна гілка, що відходить від передньої міжшлуночкової гілки лівої коронарної артерії і яка має стеноз у місці відходження, — стеноз устя першої діагональної гілки. Стенозом устя можна також назвати стеноз місця утворення правої коронарної артерії в синусі аорти (стовбур лівої коронарної артерії розглядається в окремій клінічній групі).
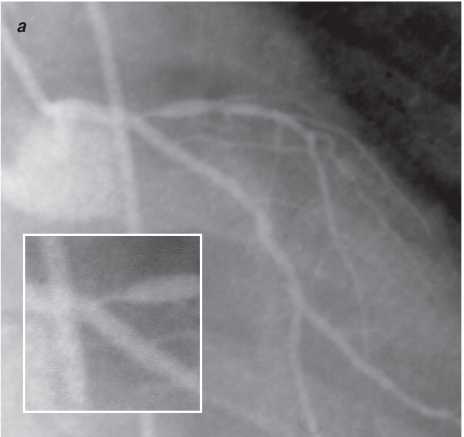
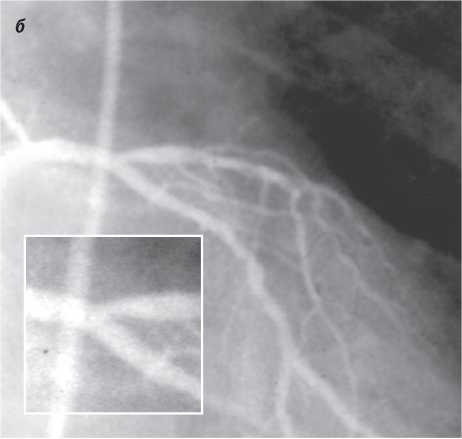
Рис. 1.110. Коронарограма хворого зі стенозом устя ПМШГ ЛКА до ангіопластики (а) та після ангіопластики (б)
Усунення стенозів устя коронарних артерій — специфічна проблема в інтервенційній кардіології. Основна особливість ПКВ в усті артерії пов’язана із субоптимальним ангіографічним результатом, який, як правило, залежить від ригідності та еластичної тяги цих сегментів коронарного русла. Для усунення подібних явищ дослідники використовують агресивні підходи з метою збільшення просвіту коронарної артерії, що часто призводить до посилення стретчингу, утворення дисекції та високої частоти розвитку рестенозів після ангіопластики устя коронарних артерій. Таким чином, чим більша судина, у якій виявлено атеросклеротичне ураження устя, тим складніше досягти оптимальних результатів ПКВ і тим серйозніші можуть бути ускладнення, пов’язані із дисекцією устя. Саме тому стеноз в усті правої коронарної артерії є найбільш складним варіантом ураження в усті. За результатами ранніх досліджень встановлено, що коронарна ангіопластика в усті правої коронарної артерії була ефективною в 79% випадків, а необхідність проведення екстреного АКШ виникала в 9% випадків. Ці результати пояснювалися неадекватним використанням провідникових катетерів, коронарних провідників, більшою кількістю ригідних уражень і частим стретчингом в усті правої коронарної артерії. Крім того, негативний вплив на результати виявляла дисекція, яка виникала в результаті використання балона високого тиску в місці устя правої коронарної артерії.
На сьогодні ефективність втручання значно зросла, а частота ускладнень знизилася (табл. 1.38). Покращання негайних результатів лікування пов’язане з розвитком нових технологій (стенти, коронарні провідники, провідникові катетери) і накопиченням досвіду проведення подібних втручань.
Таблиця 1.38. Коронарна ангіопластика устя коронарної артерії: негайні результати
| Автор дослідження (рік) | Ураження | n | Ефективність, % | Ускладнення, %
Смерть/Q—ІМ/АКШ |
Інші особливості |
| Tan (1995) | Устя не уражене | 1080 | 93 | — | Гостра оклюзія — 0% |
| Устя ПКА + устя бічної гілки | 77 | 94 | — | Гостра оклюзія — 3,5% | |
| Tan (1994) | Устя не уражене | 48 | 90 | 6 | Резидуальний стеноз, кількість роздувань балона і тиск роздування вищий при дилатації устя ПКА |
| Устя ПКА | 34 | 85 | 6 | ||
| Устя бічної гілки | 116 | 87 | 7 | ||
| Boehrer (CAVEAT; 1995) | ПМШГ | 33 | 87 | 0/0/3 | Рестеноз — 46% |
| Sawada (1994) | ПМШГ/ОГ | 80 | 90 | — | Рестеноз — 61%.
Повторна реваскуляризація — 58% |
| Brown (1993) | Устя ПМШГ | 40 | 100 | 0/—/0 | — |
| Устя ПМШГ не уражене | 40 | 98 | 0/—/0 | ||
| Myler (1992) | Устя ПКА + устя бічної гілки | 14 | 93 | 0 | — |
| Bedotto (1991) | Устя ПКА | 60 | 85 | 0 | — |
| Mathias (1991) | Устя бічної гілки | 106 | 74 | 13 | — |
| Topol (1987) | Устя ПКА | 53 | 79 | 94 | — |
Наступною за важливістю особливістю коронарної ангіопластики в усті коронарної артерії є залишковий стеноз. Деякі дослідники, які оцінювали результат ангіопластики в устях артерій за допомогою кількісної ангіографії, визначали розмір резидуальних стенозів у місці лікування від 40 до 50% просвіту артерії порівняно з 2535% при стенозах у стандартних сегментах (без ураження устя) коронарних артерій. Крім того, стретчинг після втручання змінював остаточний результат коронарної ангіопластики, знову звужуючи просвіт артерії до 50%, причому еластична зворотна тяга в усті артерії часто проявлялася при відсутності типових характеристик, що забезпечують подібний ефект в інших сегментах: кальцифікація, ексцентрична морфологія стенозу та ін. При цьому, як правило, не виникали гострі ішемічні ускладнення, але цей результат міг впливати на вищу частоту рестенозів у найближчий час і необхідність повторення коронарної ангіопластики стенозу.
Технічні особливості проведення коронарної ангіопластики стенозів устя коронарних артерій
Провідникові катетери. Найчастіше устя правої коронарної артерії досить успішно катетеризують за допомогою катетерів типу Judkins Right і Amplatz Right або Hockey Stick — для лівої коронарної артерії. Для устя лівої коронарної артерії, огинаючої гілки, бічних гілок та інших основних артерій у системі лівої коронарної артерії, як правило, використовують провідниковий катетер типу Judkins Left, а іноді й інші форми катетерів, що забезпечують кращий «опір відштовхуванню» при проходженні коронарного провідника через стенози в усті (Voda, Extra Backup Support та ін.). Якщо катетер при фіксації в усті артерії різко зменшує або припиняє адекватний коронарний кровотік, необхідно використовувати провідникові катетери з бічними отворами, які забезпечують доступ крові (додаткова перфузія) через провідниковий катетер під час втручання. Встановлювати провідниковий катетер рекомендується максимально коаксіально, тобто устя коронарної артерії повинне бути продовженням верхівки провідникового катетера. У цьому випадку лікар піддає мінімальному ушкоджуючому впливу устя коронарної артерії і одержує можливість більш вільно маніпулювати провідниковим катетером у межах устя коронарної артерії. При ангіопластиці устя правої коронарної артерії доцільно змістити верхівку провідникового катетера (рис. 1.111а, б) перед роздуванням балона. «М’яке» роздування балона-катетера (1–2 атм.) може допомогти лікареві зафіксувати балон в усті і одночасно провести тракцію провідникового катетера (див. рис. 1.111б). Балон не слід повністю роздувати, якщо частина його ще перебуває у верхівці провідникового катетера. У деяких випадках при наявності ознак кальцинозу в усті правої коронарної артерії і при проведенні коронарної ангіопластики стенозу в усті проявляється ефект «насіння кавуна», який полягає в проксимальній або дистальній міграції балона-катетера під час його роздування (рис. 1.112а, б). Ця проблема менш суттєва в тому випадку, якщо використовують довгий балон (30–40 мм) з низьким ступенем піддатливості.
Рис. 1.111. Схема балонної дилатації стенозу устя ПКА (пояснення в тексті)
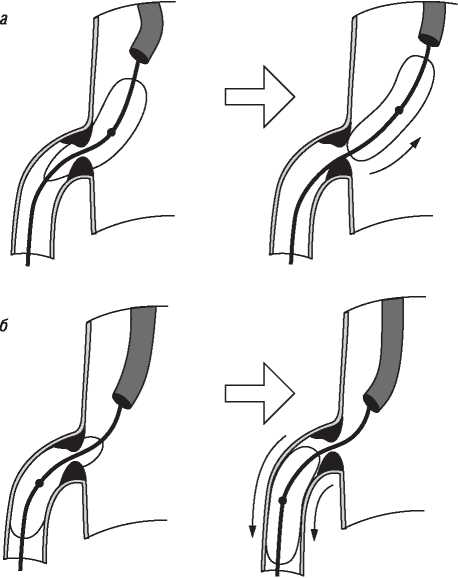
Рис. 1.112. Схема балонної дилатації стенозу устя ПКА. Ефект «насіння кавуна» (пояснення в тексті)
Коли відбувається дилатація стенозу в усті бічної гілки (особливо при стенозі в передній міжшлуночковій гілці лівої коронарної артерії або огинаючій гілці) балон необхідно розміщувати таким чином, щоб уникнути повної обструкції коронарного кровотоку в основній артерії без атеросклеротичного ураження, що необхідно підтвердити ін’єкцією контрастної речовини під час роздування балона.
Довгі стенози
Довгі стенози в коронарних артеріях — це атеросклеротичні ураження довжиною >20 мм (рис. 1.113). Хоча ефективність ангіопластики при довгих стенозах дещо нижча загальних показників при ПКВ, реально досягти оптимального ефекту можна в середньому у 87% випадків (74–97%) при ураженнях довжиною >20 мм (табл. 1.39). У таблиці розглядаються випадки використання балонів стандартної довжини (20 мм) для проведення ангіопластики довгих стенозів (>20 мм). Проте ці дані не рандомізовані, а в дослідженнях використовували різні протоколи.
Рис. 1.113. Коронарограма ЛКА з довгим складним стенозом у ПМШГ ЛКА
Таблиця 1.39. Коронарна ангіопластика довгих стенозів: негайні результати
| Автор дослідження (рік) | Довжина балона, мм | Довжина стенозу, мм | Кількість стенозів, n | Успіх, % | Ускладнення, %
Смерть/Q-ІМ/АКШ |
Дисекція, % | Гостра оклюзія, % |
| Appelman (1996) | — | >10 | 157 | 79 | 0/1,3/1,9 | 55 | 0,6 |
| Tan (1995) | 20–40 | <10 | 959 | 95 | — | — | 1,5 |
| 10–20 | 153 | 85 | — | — | 11 | ||
| >20 | 45 | 74 | — | — | 16 | ||
| Kaul (1995) | 20–40 | 11–20 | 112 | 96 | 1/1/1 | 24 | 3 |
| >20 | 29 | 97 | 0/3/0 | 32 | 3 | ||
| Cates (1994) | 80 | >40 | 54 | 91 | —/—/4 | — | — |
| Mooney (1993) | — | >10 | 327 | 93 | 0/1/1,5 | 29 | 5 |
| Myler (1992) | — | 10 | 365 | 95 | 2,1 | — | — |
| 11–20 | 278 | 91 | 0 | — | — | ||
| >20 | 136 | 89 | 0 | — | — | ||
| Zidar (1992) | 20 | <10 | 579 | 95 | 1,2/—/4,8 | 6,6 | 5,9 |
| 20 | >10 | 149 | 90 | 0,7/—/8,1 | 18,1 | 14,1 | |
| 30 | >10 | 90 | 98 | 1,1/—/3,3 | 8,9 | 5,6 | |
| Savas (1992) | 40 | >20 | 109 | 90 | 2 | 35 | 7 |
| 40 | >20 (кут >45°) | 69 | 88 | 1 | 20 | 7 | |
| Goudreau (1991) | 20 | >20 | 39 | 97 | 2,5 | — | — |
У рандомізованому дослідженні Amsterdam — Rotterdam (AMRO), у якому визначали ефективність усунення довгих стенозів за допомогою лазерної і звичайної ангіопластики, ефективність ПКВ склала тільки 79%. При проведенні інтракоронарного УЗД встановлено, що резидуальні стенози після ПКВ довгих стенозів визначають значно частіше, ніж при звичайній ангіографії. Цей факт пояснюється тим, що в нормальному сегменті коронарної артерії, який вважається не-ураженим і непіддається ангіопластиці, існують виражені зміни та звуження, які визначаються в процесі інтракоронарного УЗД. Для правильної оцінки результатів власних або опублікованих досліджень важливо визначити різницю між «довгим стенозом» і «дифузним ураженням». Ці поняття часто взаємно замінюють одне одного. Проте довгі стенози — це стенози довжиною >20 мм, а дифузні ураження, як правило, мають звуження (>50%) не менше, ніж у 1/3 ураженої судини.
Дані про частоту розвитку ускладнень після ангіопластики довгих стенозів різні. Деякі дослідники вказують на те, що ПКВ довгих стено-зів пов’язана з підвищенням ризику коронарної дисекції та гострої оклюзії. У цих дослідженнях гостру оклюзію відзначали в 1–6% випадків при ураженнях довжиною <10 мм і в 9–14% — при стенозах довжиною >10 мм. Існують результати досліджень, у яких не встановлено зв’язок між довжиною ураження, гострою оклюзією і серйозними ускладненнями. Відмінність результатів даних досліджень можна пояснити клінічними особливостями пацієнтів, наявністю або відсутністю багатосудинного ураження, різними морфологічними особливостями стенозів (крім їх довжини) і використанням для ангіопластики балонів різної довжини.
Вплив довжини стенозу на ризик виникнення рестенозу після вдалої ангіопластики також різний. У дослідженні Multy-Hospital Eastern Atlantic Restenosis Trial (M-HEART) встановлений прямий зв’язок між довжиною стенозу та рестенозу в дилатованому сегменті. Довжина стенозу від 0,3–2,9 мм; 3–4,6 мм; 4,7–7 мм; 7,1–28 мм сприяла виникненню рестенозів відповідно в 32, 33, 42 і 49% випадків. В інших дослідженнях подібного зв’язку не виявлено. Незважаючи на наявність публікацій, у яких підтверджується той факт, що після ангіопластики довгих стенозів просвіт артерії протягом 6 міс звужується дещо більше (не завжди до рівня рестенозу), ніж після дилатації стенозів звичайної довжини. це не завжди корелює із клінічними проявами рестенозів.
Довгі балони (30–40 мм). У багатьох клінічних дослідженнях підтверджено той факт. що при використанні довгих балонів відзначені кращі негайні результати після коронарної ангіопластики. ніж після ангіопластики коротким балоном у довгому стенозі. Це факт пояснюється більш рівномірним розподілом тиску балона за всією довжиною ураженого сегмента. особливо в місці переходу ураженого сегмента в здорову тканину судини. Саме в цьому місці найчастіше відбувається дисекція інтими (можливо медії і т.д.) (рис. 1.114а, б).
При використанні балонів більшої довжини (30–40 мм) порівняно зі стандартними (20 мм) ефективність дилатації довгих стенозів вища, а частота ускладнень у вигляді дисекції та гострих оклюзій нижча. Фактично балонна ангіопластика довгих стенозів довгими балонами так само ефективна, як і ангіопластика локальних стенозів за допомогою стандартних балонів (10–20 мм). В одному з оглядових досліджень 69 довгих (53 мм) і розміщених на вигині артерії (>45°) уражень були успішно дилатовані за допомогою довгих балонів у 88% випадків і гострої оклюзії — у 7%. Частота розвитку ішемічних ускладнень склала <1%. У невеликому (n=44) рандомізованому дослідженні при використанні довгих балонів відзначено менше дисекцій (18% порівняно з 55%) і меншу кількість роздувань порівняно із застосуванням балонів стандартної довжини. Таким чином, довгі балони порівняно зі стандартними при усуненні довгих стенозів мають перевагу й забезпечують максимальну ефективність і мінімальну частоту «небезпечної» дисекції, а отже, й ускладнень.
Конусоподібні балони. У більшості коронарних артерій зменшується діаметр на 0,5 мм на кожні 20 мм довжини судини (середня «конусоподібність» дорівнює 0,22 мм на кожні 10 мм довжини артерії). Значне й різке зменшення калібру артерії може стати перешкодою для проведення оптимальної балонної ангіопластики, особливо довгих стенозів (рис. 1.115а–г). Для розв’язання цієї проблеми Banka і співавтори виконували ангіопластику спеціальними конусоподібними балонами (зменшення діаметра на 0,5 мм кожні 25 мм довжини балона). Ефективність ПКВ при використанні подібних балонів склала 80%, а ангіографічно доведену дисекцію визначали тільки в 2% зі 101 пацієнта з конусоподібним звуженням артерії і стенозом у ній. Конусоподібні балони також можна використовувати при високому тиску (12 атм) для досягнення оптимального ефекту при стентуванні конусоподібних артерій.
Рис. 1.115. Схема балонної дилатації довгого стенозу конусоподібним балоном (пояснення в тексті)
Таким чином, балонна ангіопластика довгих стенозів може бути ефективною, хоча ризик гострих оклюзій і рестенозів може бути дещо вищим порівняно з ангіопластикою стенозів звичайного розміру. Нові інвазивні технології, такі як лазерна ангіопластика, і атероектомічні пристрої із додатковою ангіопластикою і без такої не виявили переваг над ангіопластикою довгими балонами, а результат стентування довгих стенозів ще має бути оцінений в найближчому майбутньому.
Медикаментозна підтримка при проведенні ПКВ. Ведення хворих у ранній і пізній період після стентування
До проведення процедури рекомендується болюсне внутрішньокоронарне введення нітрогліцерину, що дозволяє оцінити дійсні розміри судини та знизити ризик вазоспастичної реакції під час процедури (Рекомендації для нітрогліцерину: IC). Введення нітрогліцерину можна проводити повторно під час процедури або після неї, враховуючи показники АТ. У нечастих випадках вазоспазму, резистентного до нітрогліцерину, можна успішно застосовувати верапаміл.
Є кілька повідомлень про дослідження, що вивчали внутрішньокоронарне введення різних доз верапамілу і аденозину при синдромі «no reflow». Прямий донор нітрооксиду — нітропрусид також дозволяє ефективно й безпечно впоратися із ситуацією, при якій зменшення кровотоку пов’язане з виконанням ПКВ. Лікування слід доповнити застосуванням контрпульсатора. Призначення комбінації аденозину і нітропрусиду, порівняно з одним аденозином, більш ефективне (Рекомендації із застосування верапамілу, аденозину і нітропрусиду при синдромі «no reflow»: IIaC).
Ацетилсаліцилова кислота
Від початку розвитку інтервенційної кардіології антитромбоцитарні препарати були наріжним каменем допоміжної терапії при ПКВ, тому що будь-яке втручання супроводжується травмою ендотелію і більш глибоких шарів, що викликає активацію тромбоцитів. Основні фармакологічні властивості антитромботичних препаратів і їх застосування при атеросклеротичній серцево-судинній патології були нещодавно розглянуті в погоджувальному документі Європейського кардіологічного товариства. Рекомендації з проведення ПКВ адресують свої показання до більш вузьких проблем, що стосуються застосування коронарних інтервенцій.
Метааналіз «Antithrombotic Trialists» Collaboration показав, що ацетилсаліцилова кислота, порівняно з плацебо, на 22% знижує рівень судинних смертей, гострих ІМ і інсультів у всіх пацієнтів, що мають високий ризик розвитку судинних ускладнень. Проведене одне плацебо-контрольоване дослідження (M-HEART II) із застосуванням при ПКВ тільки ацетилсаліцилової кислоти показало достовірне покращання клінічних результатів порівняно з групою плацебо. Застосування ацетилсаліцилової кислоти призводить до достовірного зниження інфарктів (з 5,7% до 1,2%). На сьогодні ацетилсаліцилова кислота продовжує відігравати важливу роль у зниженні ішемічних ускладнень, пов’язаних з ПКВ. У тих випадках, коли хворі не одержували ацетилсаліцилової кислоти попередньо або коли є сумніви щодо цього питання, за 3 год до процедури дається вступна доза ацетилсаліцилової кислоти 500 мг per os і як мінімум 300 мг внутрішньовенно безпосередньо перед процедурою. У випадку встановленої алергічної реакції ацетилсаліцилова кислота не призначається. Як відзначено в погоджувальному документі Європейського кардіологічного товариства, при довгостроковому застосуванні ацетилсаліцилової кислоти доза не повинна перевищувати 100 мг/добу (Рекомендації для призначення ацетилсаліцилової кислоти при ПКВ для хворих зі стабільною стенокардією: I B).
Тиклопідин і клопідогрел
Тиклопідин і клопідогрел є потужними антитромботичними препаратами. Є незаперечні докази того, що комбінація ацетилсаліцилової кислоти і тієнопіридинів дає кращі результати щодо гострих і підгострих тромботичних ускладнень ПКВ, ніж застосування однієї ацетилсаліцилової кислоти або ацетилсаліцилової кислоти в комбінації з пероральними антикоагулянтами (Milan/Tokyo, ISAR (Intracoronary Stenting and Antithrombotic Regimen)), STARS (Stent Anti-thrombotic Regimen Study), FANTASTIC (Full Anticoagulation versus Ticlopidine plus Aspirin after Stent Implantation) і MATTIS (Multicenter Aspirin and Ticlopidine Trial after Intracoronary Stenting). За даними результатів 3 рандомізованих контрольованих досліджень CLASSICS (Clopidogrel Aspirin Stent International Cooperative Study), TOPPS (Ticlid Or Plavix PostStent), Bad Krozingen, а також деяких реєстрів і метааналізів відзначається, що клопідогрел ефективний не менше ніж тиклопідин. У той же час клопідогрел не має таких побічних дій, як тиклопідин і, крім того, краще переноситься (Рекомендації для призначення тиклопідину або клопідогрелу на додаток до ацетилсаліцилової кислоти протягом 3–4 тиж після імплантації непокритих стентів у випадку стабільної стенокардії: IA).
Так як на сьогодні переважна більшість ПКВ у підсумку закінчується імплантацією стентів, то всім хворим, що готуються до ПКВ, незалежно від того, планується імплантація стента чи ні, у підготовчий період слід призначити клопідогрел. Проте одноразового призначення клопідогрелу в дозі 300 мг за 2,5 год до процедури може бути недостатньо. Для досягнення повної антитромботичної активності клопідогрел повинен призначатися принаймні за 6 год до ПКВ у початковій дозі 300 мг. В ідеалі клопідогрел призначається за добу до планованого ПКВ (дослідження CREDO (Clopidogrel for the Reduction of Events During Observation), аналіз TARGET (Do Tirofiban and Reopro Give Similar Efficacy Outcome). У випадку неможливості виконати зазначені рекомендації допускається призначення клопідогрелу не пізніше 2 год до початку процедури в початковій дозі 600 мг, проте повністю опублікованих даних з приводу цього дозування на сьогодні немає. У тих випадках, коли коронарографія не виявила змін, хворому не було імплантовано стентів або передбачається виконання шунтувальної операції, клопідогрел відміняють. Пацієнти, яким клопідогрел до ПКВ не призначався, повинні одержати по можливості найбільшу дозу клопідогрелу негайно після процедури (Рекомендації для призначення клопідогрелу не пізніше, ніж за 6 год до ПКВ: IC).
Пролонговане (>4 тиж) призначення клопідогрелу після імплантації стентів не є доцільним, за винятком тих випадків, коли проводилася брахітерапія або ж імплантувались елютинг-стенти (Рекомендації для призначення клопідогрелу на 12 міс після брахітерапії або на 6–12 міс після імплантації елютинг-стентів: IC).
Нефракціонований гепарин, гепарини з низькою молекулярною масою, бівалірудин
В інтервенційній кардіології нефракціонований гепарин почав застосовуватися з часу проведення перших ПКВ. Нефракціонований гепарин використовується з метою профілактики утворення тромбів на інструментарії та максимального зменшення тромбозу в місцях штучного ушкодження судинної стінки або руйнування бляшки.
Очевидно, що провести плацебо-контрольовані дослідження, які показали б недоліки проведення будь-якого внутрішньокоронарного втручання при відсутності антикоагулянтної терапії, неможливо. Нефракціонований гепарин вводиться внутрішньовенно болюсно під контролем показника часу активації тромбоцитів (час активації тромбоцитів повинен бути в межах 250–350 с; у випадку призначення інгібіторів глікопротеїнових рецепторів тромбоцитів (GP) IIb/IIIa — 200–250 с). Дозу нефракціонованого гепарину можна також вирахувати на основі маси тіла хворого (зазвичай 100 ОД/кг або при призначенні інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa приблизно 50–60 ОД/кг). Внаслідок значної варіабельності біологічної активності гепарину дозу нефракціонованого гепарину краще визначати за допомогою оцінки часу активації тромбоцитів, особливо у випадках тривалих процедур, коли потрібне повторне введення гепарину. Терапевтичний ефект нефракціонованого гепарину важко передбачити. Є інформація про те, що користь не-фракціонованого гепарину залежить від ефективної дози, хоча під час рутинних процедур зазвичай застосовують низькі дози (<5000 ОД). Подальша гепаринізація після закінчення процедури як до видалення інтродюсера, так і після цього не рекомендується.
Як нефракціонований гепарин, так і гепарини з низькою молекулярною масою взаємодіють з антитромбіном III, прискорюючи процес інгібування тромбіну. Проте нефракціонований гепарин має деякі недоліки: внаслідок вираженої здатності нефракціонованого гепарину зв’язуватися з білками плазми крові рівень вільного гепарину є непередбачуваним, внаслідок чого нефракціонований гепарин може виявляти різний антитромботичний ефект. Нефракціонований гепарин з однаковим ступенем інтенсивності інгібує як фактор Xa, так і тромбін; гепарини з низькою молекулярною вагою переважно і більш інтенсивно інгібують фактор Xa. Гепарини з низькою молекулярною масою є більш передбачуваним антикоагулянтом внаслідок того, що їх рівень у плазмі крові є більш постійним. Тому при призначенні гепаринів з низькою молекулярною масою не потрібно проведення лабораторного моніторингу.
Інформація про застосування гепарину з низькою молекулярною масою як єдиного антикоагулянту при стабільній стенокардії обмежена. Хворим, яким у передопераційний період планується призначення гепарину з низькою молекулярною масою, може додатково, з метою безпеки, вводитися нефракціонований гепарин, якщо ці хворі одержували гепарини з низькою молекулярною масою. Нефракціонований гепарин може призначатися пацієнтам на догоспітальному етапі в інтервалі між останнім введенням гепарину з низькою молекулярною масою та наступним введенням гепарину з низькою молекулярною масою в стаціонарі залежно від тривалості цього інтервалу.
На відміну від аналогів гірудину (дезирудину і лепірудину), пригнічення тромбіну бівалірудином оборотне протягом приблизно 25 хв. Незважаючи на те що дослідження проведені з гірудином демонстрували підвищення ризику кровотеч, результати застосування бівалірудину при ПКВ цілком обнадійливі. CACHET (Comparison of Abciximab Complications with Hirulog for Ischemic Events Trial) було першим рандомізованим дослідженням, яке показало, що при проведенні ПКВ результати застосування абциксимабу в якості препарату, що використовується одноразово, в комбінації з бівалірудином як постійним антитромботичним агентом, принаймні не гірше, ніж призначення абциксимабу та гепарину. На сьогодні вважається, що бівалірудин може замінити нефракціонований гепарин, тому що бівалірудин дає вірогідно меншу кількість кровотеч, ніж нефракціонований гепарин (дослідження BAT (Bivalirudin Angioplasty Trial)). Більше того, у дослідженні REPLACE-2 (Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events) бівалірудин не прямо, але проспективно порівнювався з гепарином: рівень умовної різниці склав 0,62, що відповідає статистичним критеріям, які показують перевагу бівалірудину над гепарином. При призначенні бівалірудину відновлення показника часу активації тромбоцитів до норми відбувається швидше, ніж при призначенні гепарину, хоча рівень цього показника при призначенні бівалірудину може бути значно вищим, а субтерапевтична доза нижчою (Рекомендації щодо заміщення нефракціонованого гепарину й гепаринів з низькою молекулярною масою на бівалірудин для зменшення кількості кровотеч: IIaC).
На сьогодні бівалірудин, безумовно, рекомендується для заміщення як нефракціонованого гепарину, так і гепаринів з низькою молекулярною масою в тих ситуаціях, коли у хворих спостерігається гепарин-індукована тромбоцитопенія (кількість тромбоцитів <150 000/100 мл). Використання бівалірудину в таких хворих є безпечним і забезпечує ефективний антикоагулянтний ефект під час ПКВ у цієї підгрупи хворих (Рекомендації щодо заміщення нефракціонованого гепарину й гепаринів з низькою молекулярною масою на бівалірудин у хворих з гепарин-індукованою тромбоцитопенією: IC).
Інгібітори глікопротеїнових рецепторів тромбоцитів IIb/IIIa
У дослідженні ISAR-REACT (Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment) пацієнтам з ІХС, що представляють групу низького ризику ІХС, рандомізовано призначали абциксимаб або плацебо (були виключені хворі з гострим коронарним синдромом, інсулінозалежні хворі на цукровий діабет і хворі з візуалізованими тромбами) (табл. 1.40). У цій групі низького ризику ІХС, що перенесли планове коронарне стентування, абциксимаб не досяг первинної кінцевої точки. Хоча ретроспективний аналіз результатів лікування підгрупи хворих на цукровий діабет дослідження EPISTENT (Evaluation of Platelet Iib/Iiia Inhibitor for Stenting), у яку були включені хворі зі стабільною і нестабільною стенокардією, показав прогностичну перевагу призначення абциксимабу хворим, у яких проводили стентування, проспективне дослідження ISAR-SWEET (Intracoronary Stenting and Antithrombotic Regimen: Is abciximab a Superior Way to Eliminate Elevated Thrombotic risk in diabetics), проведене серед хворих зі стабільною стенокардією, що не включало хворих із гострим коронарним синдромом і/або видимим тромбом, не підтверджує цю концепцію. Враховуючи загальний низький рівень ризику виконання ПКВ у хворих зі стабільною стенокардією, інгібітори глікопротеїнових рецепторів тромбоцитів IIb/IIIa не є частиною стандартної перипроцедуральної терапії для хворих групи низького ризику зі стабільною стенокардією, беручи до уваги підвищений ризик кровотеч, пов’язаний із їх застосуванням, а також вартість цих препаратів.
Таблиця 1.40. Дані рандомізованих досліджень з використання інгібіторів глікопротеїнових IIb/Ша-рецепторів тромбоцитів з одночасним проведенням інвазивного лікування у пацієнтів з гострим коронарним синдромом
| Показник | CAPTURE | PERSUIT | PRISM-PLUS | Комбіноване використання | ||||
| Абциксимаб | Ептифібатид | Тирофібан | GP Ilb/IIIa | |||||
| не використовували | використовували | не використовували | використовували | не використовували | використовували | не використовували | використовували | |
| Результати застосування препарату при проведенні PCI* | ||||||||
| Смертність, % | 0,2 | 0 | 0,8 | 0,4 | 0,6 | 0,3 | 0,7 | 0,4
(р=0,001) |
| Смерть або нефатальний ІМ, % | 2,8 | 1,3
(р=0,032) |
4,4 | 3,2
(р=0,003) |
3,8 | 1,8
(р=0,016) |
3,8 | 2,5
(0=0.006) |
| Результати застосування препарату протягом 48 год після проведення PCI | ||||||||
| Смертність (%) | 0,5 | 0,3 | 1,1 | 0,7 | 0,7 | 0,7 | 0,8 | 0,5
(р=0,375) |
| Смерть або нефатальний ІМ, % | 5,8 | 2,8
(р=0,009) |
10,3 | 7,6
(о=0,105) |
8,0 | 2,9 | 8,0 | 4,9
(р=0,001) |
*PCI — перкутанне коронарне втручання.
Незважаючи на результати великого кумулятивного метааналізу, проведеного на підставі даних про 20 186 хворих, який пропонує рутинне призначення інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa, а також незважаючи на результати метааналізу, проведеного нещодавно (8004 хворих), який продемонстрував зниження смертності при стентуванні пацієнтів з негострою формою ІХС, застосування інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa при виконанні ПКВ з приводу стабільної стенокардії слід періодично розглядати. У тих випадках, коли рівень ризику виконання ПКВ при стабільній стенокардії перевищує середній, призначення інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa є доцільним. Інгібітори глікопротеїнових рецепторів тромбоцитів IIb/IIIa необхідно призначати хворим з нестабільними ураженнями в якості симптоматичної терапії при загрозі або вже розвиненій оклюзії судини, видимому тромбі та при синдромі no/slow reflow. Застосування інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa також корисне при складних втручаннях (Рекомендації щодо застосування інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa у хворих зі стабільною стенокардією при наявності складних уражень, загрозі або розвиненій оклюзії, видимих тромбах, синдромі no/slow reflow: IIaC).
ПКВ, медикаментозне лікування та АКШ при хронічній формі ІХС
ПКВ і медикаментозне лікування
Метааналіз рандомізованих контрольованих досліджень показав, що ПКВ порівняно з медикаментозним лікуванням призводять до більш вираженого зменшення симптомів стенокардії. Водночас дослідження не включали достатньої кількості хворих для інформативної оцінки впливу ПКВ на наступний розвиток інфарктів, смертей або необхідності проведення повторної реваскуляризації. За даними дослідження TIME (Tirofiban In Myocardial Infarction Evaluation) довгострокова виживаність у хворих зі стабільною стенокардією класу II і вище (за Канадською класифікацією) у хворих віком старше 75 років була схожою в групах ПКВ і медикаментозного лікування із застосуванням як мінімум 2 антиангінальних препаратів. Хоча в обох групах відзначали зменшення симптоматики стенокардії та покращання якості життя, нефатальні ускладнення частіше відзначали в групі хворих, що одержували медикаментозне лікування. Метааналіз рандомізованих контрольованих досліджень показав, що ПКВ порівняно з медикаментозним лікуванням призводить до більш вираженого зменшення симптомів стенокардії. Водночас дослідження не включали достатньої кількості хворих для інформативної оцінки впливу ПКВ на наступний розвиток інфарктів, смертей або необхідності проведення повторної реваскуляризації.
ПКВ і шунтувальні операції
Дані порівняння ПКВ і АКШ представлені в 13 дослідженнях, проведених з 1987 по 1999 р. У цих дослідженнях були рандомізовані 7964 хворих. На 1-й, 3-й і 8-й рік 8-річного спостереження (за винятком результатів 5-го року) статистично значимих відмінностей за рівнем смерті серед груп різної стратегії реваскуляризації не відзначали. На результати досліджень вплинуло використання стентів: у ранніх дослідженнях, у яких стенти не використовували, відзначали тенденцію до кращих результатів АКШ протягом 3-річного строку спостереження; цього не відзначали у більш пізніх дослідженнях, у яких застосовували стенти. Тенденція до кращих результатів АКШ порівняно з ПКВ в цей час зводиться до нуля, незважаючи на те, що результати цієї операції останнім часом покращали (смертність у групах АКШ у тих дослідженнях, коли стентування не застосовувалося, становила 5,2%; у більш пізніх дослідженнях — 3,5%). Стентування порівняно з АКШ наполовину знижує ризик повторної реваскуляризації. Виконання ПКВ, так само, як і АКШ, вірогідно зменшує симптоматику стенокардії.
ІНТЕРВЕНЦІЙНІ МЕТОДИ ДІАГНОСТИКИ ТА ЛІКУВАННЯ ГОСТРИХ КОРОНАРНИХ СИНДРОМІВ
ПКВ при гострому коронарному синдромі без елевації сегмента ST
Коронарографічна морфологія атеросклеротичних уражень при гострому коронарному синдромі без елевації сегмента ST
Розвиток гострого коронарного синдрому прямо пов’язаний з ускладненим ростом атеросклеротичної бляшки, який супроводжується утворенням тромбів різного об’єму і локалізації відносно структури бляшки.
Морфологічний склад стабільних атеросклеротичних бляшок може відрізнятися за співвідношенням структур, що сприяють її стабілізації або дестабілізації. При достатній кількості в структурі бляшки функціонуючих гладком’язових клітин, що беруть участь у формуванні сполучнотканинного матриксу, бляшка і її капсула являють собою міцне стабільне утворення. У тому випадку, якщо в структурі атеросклеротичної бляшки переважають елементи, що сприяють її деструкції (клітини запалення, пінні клітини, окиснені ЛПНЩ, що локалізуються в ліпідних озерах), така бляшка є слабкою, схильною до руйнування.
Руйнування структури бляшки починається з капсули. При переважанні в структурі капсули клітин руйнування, особливо макрофагів, що синтезують металопротеїнази, колагенова структура капсули стає неоднорідною; утворюються її «слабкі місця», де й відбувається розрив, що супроводжується контактом крові із тромбогенними тканинами бляшки і наступним тромбоутворенням.
Інша причина розвитку тромбозу — ерозія ендотелію. Такий варіант тромбоутворення виявляють приблизно в 30% випадків; частіше у жінок. Тромби, що при цьому утворюються, не такі масивні, як при деструкції капсули. Їх основний компонент — тромбоцити, які, продукуючи тромбоцитарний фактор росту, сприяють проліферації гладком’язових клітин і їх міграції в структуру бляшки. При невеликій площі ерозії та відповідно невеликому об’ємі пристінкового тромбу переважають процеси реконструкції капсули, що індукуються гладком’язовими клітинами, над процесами руйнування. Такий варіант деструкції закінчується загоєнням ураженої поверхні бляшки та стабілізацією клінічного стану хворого. Важливу роль у процесі стабілізації відіграє співвідношення систем «тромбоутворення/тромболізис».
У будь-якому разі активізація процесів деструкції ендотелію, фіброзної капсули та інших структур бляшки з наступним пристінковим тромбозом призводить до розвитку гострого коронарного синдрому без елевації ST. Ознаки початкової деструкції атеросклеротичної бляшки на коронарограмах визначають на підставі наявності негомогенності контрастування в зоні стенозу або незначної нерівності («шорсткості») контуру стенозу (симптом «плюс тканина») (рис. 1.116, 1.117). У випадку вираженого пристінкового тромбозу, коли тромб є основною складовою звуження просвіту, його легко можна виявити на коронарограмі. Основна ознака — це дефект наповнення просвіту судини. Сюди ж належить симптом «нависаючого краю стенозу над стінкою судини», який був описаний J. Ambrose у 1986 р. (рис. 1.118, 1.119).
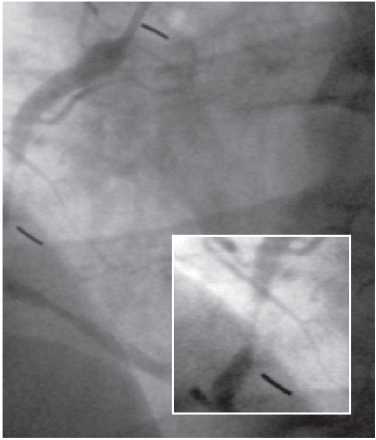
Рис. 1.116. Коронарограма хворого на етапі збалансованості процесів тромбоутворення і спонтанного тромболізису
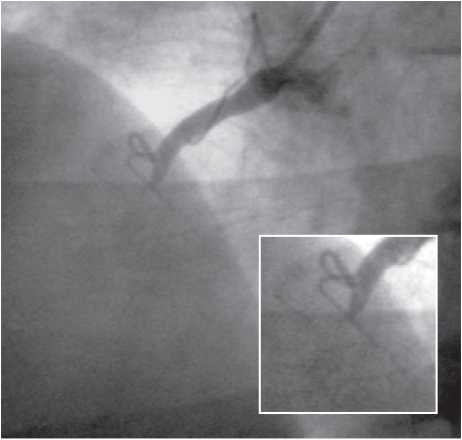
Рис. 1.117. Коронарограма того самого хворого на етапі превалювання процесів тромбоутворення і розвитку гострого ІМ
Рис. 1.118. Розрив фіброзної капсули бляшки та крововилив в тканину бляшки
Рис. 1.119. Розрив капсули бляшки з крововиливом у неї та внутрішньопросвітним тромбоутворенням
Визначення ступеня ризику швидкого прогресування хвороби при гострому коронарному синдромі без елевації сегмента ST
Важливість розподілу хворих з нестабільною стенокардією та ІМ без елевації сегмента ST на групи високого й низького ризику розвитку ускладнень обґрунтована тим, що явна перевага виконання ранньої коронарографії і при необхідності ПКВ визначена тільки у хворих групи високого ризику розвитку ускладнень.
У рекомендаціях Європейського кардіологічного товариства щодо лікування гострого коронарного синдрому без елевації ST даються характеристики пацієнтів, що належать до групи високого ризику різкого прогресування хвороби з наступним розвитком ІМ або смерті. Коронарографія у таких хворих повинна бути виконана протягом перших 48 год. Характеристики хворих, що належать до групи високого ризику розвитку гострих тромботичних ускладнень гострого коронарного синдрому без елевації ST, такі:
- Напади стенокардії, що повторюються
- Динамічні зміни сегмента ST
- Підвищені рівні тропонінів
- Нестабільність гемодинаміки
- Виражені аритмії (шлуночкові)
- Рання постінфарктна стенокардія
- Цукровий діабет.
Крім цього, при оцінці ризику можливих ускладнень гострого коронарного синдрому без елевації ST необхідно брати до уваги супутні маркери, що впливають на розвиток ускладнень у віддалений термін захворювання. До цих маркерів належать:
- Вік >65–70 років
- Наявність симптомів ІХС, раніше перенесених інфарктів, ПКВ та АКШ в анамнезі
- Виражена СН, набряк легень, шуми, що з’явилися, характерні для недостатності мітрального клапана
- Зростання маркерів запалення (СРБ, фібриногену, інтерлейкіну-6)
- Ниркова недостатність.
Аналіз дослідження TACTICS-TIMI 18, проведений post hoc (ретроспективний), показав, що раннє інвазивне лікування хворих похилого віку з гострим коронарним синдромом без елевації ST вірогідно зменшує вираженість ішемії міокарда.
Тактика виконання ПКВ при гострому коронарному синдромі без елевації сегмента ST
Нещодавно опубліковані огляди свідчать, що ПКВ проводяться менше ніж у 50% хворих з гострим коронарним синдромом без елевації ST (GRACE (Global Registry of Acute Coronary Events), CRUSADE (Coronary Revascularization Ultrasound Angioplasty Device trial)). Прихильники медикаментозного лікування пацієнтів з нестабільною стенокардією та ІМ без елевації сегмента ST ґрунтуються на результатах досліджень TIMI IIIB (Thrombolysis in Myocardial Infarction IIIB Substudy), MATE (Medicine vs. Angiography in Thrombolytic Exclusion) і VANQWISH (Veterans Affairs Non-Q Wave Infarction Strategies In Hospital).
Зазначені дослідження мають деякі методологічні недоліки (високі рівні, що пересікаються, відсутність або мінімальне використання стентів, відсутність у медикаментозному супроводі інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/ IIIa), внаслідок чого висновки цих досліджень являються невідповідними нинішньої ситуації. У дослідженні GUSTO IV-ACS (Global Use of Strategies To Open Occluded Coronary Arteries IV-Acute Coronary Syndrome) встановлено, що реваскуляризація, проведена протягом перших 30 днів, поліпшує прогноз. Порівняно висока смертність, що відзначалася в цьому дослідженні в групі медикаментозного лікування, може бути частково пов’язана з відбором хворих. Крім 2 менших за обсягом європейських досліджень (TRUCS (Treatment of Refractory Unstable Angina in Geographically Isolated Areas Without Cardiac Surgery) і VINO (Value of First Day Coronary Angiography/Angioplasty in Evolving Non-ST-segment Elevation Myocardial Infarction)), перевага раннього інвазивного лікування перед медикаментозним ґрунтується на результатах трьох досліджень (FRISC II, TACTICS-TIMI 18 і RITA-3), що включали 6487 хворих (табл. 1.41, 1.42, рис. 1.120) (Рекомендації для раннього ПКВ — лікування хворих групи високого ризику з гострим коронарним синдромом без елевації сегмента ST: IA).
Таблиця 1.41. Результати інвазивного лікування і медикаментозної терапії хворих з нестабільною стенокардією: TIMI-3B
| Результат | Інвазивне лікування, % | Медикаментозна терапія, % | p |
| Катетеризація | |||
| Первинна госпіталізація | 98 | 57 | 0,001 |
| 6 тиж | 98 | 64 | 0,001 |
| 1 рік | 99 | 73 | 0,001 |
| ПКВ | |||
| Первинна госпіталізація | 37 | 23 | 0,001 |
| 6 тиж | 38 | 26 | 0,001 |
| 1 рік | 39 | 32 | 0,001 |
| АКШ | |||
| Первинна госпіталізація | 24 | 18 | 0,003 |
| 6 тиж | 25 | 23 | 0,17 |
| 1 рік | 30 | 30 | 0,50 |
| ПКВ або АКШ | |||
| Первинна госпіталізація | 60 | 40 | 0,001 |
| 6 тиж | 61 | 48 | 0,001 |
| 1 рік | 64 | 58 | 0,001 |
Таблиця 1.42. Результати ПКВ порівняно з АКШ при нестабільній стенокардії
| Дослідження | Кількість хворих, n | Нестабільна стенокардія, % | Результат |
| CABRI | 1054 | 15 | Відсутність різниці в показниках СН і ІМ в 1-й рік спостереження |
| RITA | 1011 | 59 | Відсутність різниці в показниках СН і ІМ при спостереженні протягом 2 років |
| EAST | 392 | 60 | Відсутність різниці в показниках СН і ІМ або ішемії міокарда, що підтверджено результатами проби з 201Tl протягом 3 років |
| CABI | 359 | 14 | Підвищення ризику розвитку ІМ при АКШ |
| ERACI | 127 | 83 | Відсутність різниці в показниках СН і ІМ в 1-й рік спостереження |
| BARI | 1829 | 64 | Відсутність різниці в показниках СН і ІМ протягом 5 років спостереження |
| VA | 700 | 100 | Відсутність різниці в показниках СН і ІМ в 1-й рік спостереження |
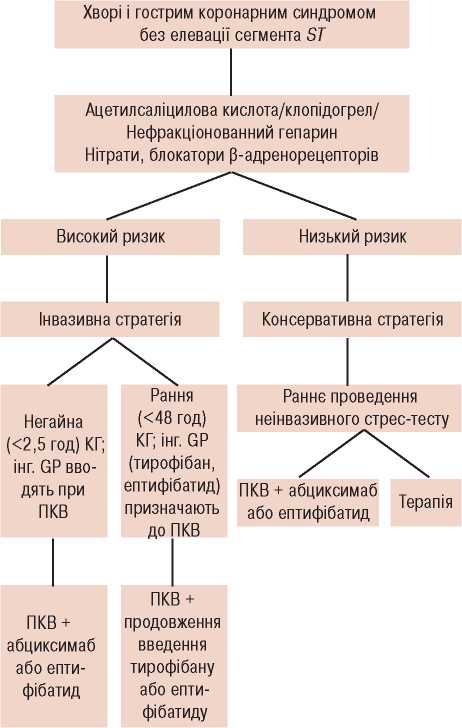
Рис. 1.120. Діаграма проведення коронарографії (КГ) та ПКВ при гострому коронарному синдромі без елевації ST. Інг. GP — інгібітори глікопротеїнових рецепторів IIb/IIIa
Є дані, що може існувати відмінність у результатах лікування гострого коронарного синдрому без елевації ST залежно від статі хворих, хоча інтерпретація цих даних вимагає обережності. У деяких дослідженнях, що перебувають на стадії розробки (наприклад ICTUS (Invasive Versus Conservative Treatment in Unstable Coronary Syndromes Investigators)), застосовується більш потужний режим антитромбоцитарної терапії, що дозволяє заперечувати існуючу на сьогодні інтервенційну стратегію. У дослідженні ISAR-COOL порівнювали терапевтичну («холодну») стратегію (пролонгована антитромботична підготовка перед інтервенцією) і негайне виконання ПКВ у хворих групи високого ризику з депресією сегмента ST (65%) і підвищеним рівнем тропоніну T (67%). Середній термін катетеризації в групі з «холодною» стратегією склав 86 год; у групі негайної катетеризації — 2,4 год. Первинні кінцеві точки, визначені як смерть внаслідок будь-якої причини та обширний нефатальний ІМ протягом 30 днів, у групі з «холодною» стратегією відзначали в 11,6%; у групі з негайною інвазивною стратегією — 5,9% (p=0,04). На цей результат мали вплив ускладнення, що настали до катетеризації. Автори роблять висновок, що у хворих з гострим коронарним синдромом без елевації ST , які належать до групи високого ризику, відстрочка інтервенції не дає покращання результатів, а антитромботична підготовка повинна займати той мінімум часу, який потрібний для організації кардіальної катетеризації і реваскуляризації (Рекомендації щодо негайного, тобто раніше ніж через 2,5 год виконання ПКВ у хворих з гострим коронарним синдромом без елевації ST , що належать до групи високого ризику: IC).
Якщо з будь-яких причин час між коронарографією і ПКВ доходить до 24 год, можна також призначати абциксимаб. Еноксапарин може розглядатися як препарат, який призначається замість нефракціонованого гепарину хворим групи високого ризику ускладнень гострого коронарного синдрому без елевації сегмента ST у тих випадках, коли інвазивну тактику лікування застосувати не можна.
Отже, хворі з гострим коронарним синдромом без елевації сегмента ST (нестабільна стенокардія або ІМ без елевації сегмента ST) спочатку повинні бути стратифіковані за групами ризику. Явна перевага ранньої ангіографії й наступної реваскуляризації (ПКВ або АКШ) доведена тільки для хворих групи високого ризику. Відстрочка інтервенції не призводить до поліпшення результату. Прогнозованість і безпосередня безпека рутинного стентування дають підставу рекомендувати цей вид лікування.
Гострий коронарний синдром з елевацією сегмента ST
Розвиток гострої тромботичної оклюзії коронарної артерії
У незміненій артерії інтактне ендотеліальне покриття запобігає контакту тромбоцитів із субінтимальними компонентами, такими як колаген, фактор Віллебранда і фібринонектин, які є стимуляторами тромбоцитарної агрегації. При використанні експериментальних моделей доведено, що порушення цілісності ендотелію відіграє роль у розвитку тромбозу при наявності певних умов. У ході експериментальних досліджень встановлено, що ріст тромбу залежав від рівня кровотоку та кількості наявної в ділянці бляшки сполучної тканини без ендотеліального захисту; чим глибше ушкодження інтими, тим вища ймовірність тромбоутворення, а в клінічній практиці — чим глибша і триваліша дисекція, тим вища ймовірність тромбозу.
В одному із досліджень з вивчення структури бляшок (166 коронарних тромбозів на посмертних коронарограмах) встановлено, що в 42 (25,3%) випадках інтима, що покриває стеноз, виглядала інтактною. У більшості (74,7%) бляшок, покритих тромбами, виявляли щілини й розриви інтими з наступним глибоким ушкодженням. У тромбах, у місцях утворення яких не спостерігалося розривів бляшок, виявляли втрату ендотеліального покриття, наявність великої кількості макрофагів, що більш поверхово прилягали до інтими на фоні субтотальних стенозів. Проте щілиноутворення в бляшці, що викликає тромбоз, часто відбувається в тих випадках, коли вихідний стеноз має незначні розміри і часто не є гемодинамічно значимим. Цей факт знайшов підтвердження в клінічних дослідженнях, у яких коронарографію виконували за кілька тижнів або місяців до гострого ІМ.
Відмінності між двома формами коронарних тромбів — поверхневих, розміщених на інтактній бляшці, і глибоких, викликаних щілиноутворенням, — описані багато років тому. Глибокі ушкодження інтими, при яких розриви майже досягають медії судини, відрізняються від поверхневих ушкоджень інтими за двома значними параметрами:
1) при глибокому ушкодженні незахищеною від тромбоцитів виявляється велика кількість колагену, що призводить до утворення тромбів великих розмірів;
2) такі тромби утворюються спочатку всередині самої бляшки. Ця маса внутрішньоінтимальних тромбів може змінити конфігурацію бляшки, раптово збільшуючи її розмір, що викликає місцеве зниження кровотоку, і потенційно сприяє подальшому тромбозу (вже всередині артеріального просвіту). Розриви інтими й відкладання тромбів можуть індукувати місцевий артеріальний спазм, що призводить до ще більшого зниження кровотоку.
Ушкодження інтими — від тріщин і щілин малих розмірів до виразки коронарних великих бляшок — можна спостерігати при проведенні коронарографії (рис. 1.121, 122). Процес щілиноутворення, розриву, розтріскування, виразки бляшок описаний ще в 1926 р. Сучасні дослідження доводять, що ексцентричні стенози, які відзначаються на посмертних коронарограмах і мають нерівні контури і внутрішньопросвітні дефекти наповнення, є зруйнованими бляшками. Незабаром стало зрозуміло, що подібні ознаки можна виявити на коронарограмах пацієнтів з гострим ІМ, нестабільною стенокардією, а також у хворих, реанімованих при кардіогенному шоці.
Рис. 1.121. Коронарограма хворого з виразкою бляшки в проксимальному сегменті ПКА (пояснення в тексті)
Рис. 1.122. Коронарограма хворого з виразкою бляшки в середньому сегменті ПКА («випорожнена бляшка»)
Патогістологічні дослідження хворих, що померли від коронарного атеросклерозу, дозволили ідентифікувати три стадії тромбозу, пов’язаного із щілиноутворенням. У ранній стадії відзначається розрив інтими артерії, що пов’язує просвіт артерії з багатою ліпідами бляшкою; це призводить до утворення тромботичних мас усередині інтими. Такі тромби ще не є внутрішньопросвітними. Наступний етап розвитку тромбу пов’язаний із випинанням тромботичних мас у просвіт артерії (рис. 1.123).
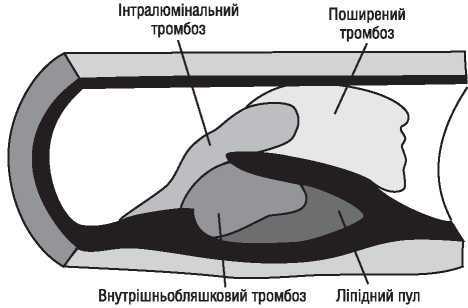
Рис. 1.123. Схема послідовних стадій утворення внутрішньосудинного тромбу (пояснення в тексті)
Внутрішньосудинний тромботичний компонент є пристінковим, і в зоні тромбу все ще зберігається антеградний кровотік. Подібні пристінкові тромби можна діагностувати при житті за допомогою ангіоскопічного дослідження у хворих з нестабільною стенокардією, а також визначити на коронарограмах як внутрішньопросвітні дефекти наповнення поблизу стенозів з нерівними контурами або нависаючими краями (тип II) при нестабільній стенокардії та ІМ. В останній стадії процесу, яка не є неминучою при розриві бляшки, внутрішньопросвітний тромб стає оклюзуючим. У пристінковому компоненті внутрішньопросвітного тромбу, коли він закриває щілину бляшки, міститься більше фібрину, ніж тромбоцитів, і фактично відсутні клітини червоної крові. Оклюзуючий компонент внутрішньопросвітного тромбу, особливо якщо він має дистальне продовження, сформований з фібринової сітки, яка обплутує велику кількість еритроцитів і тільки незначну — тромбоцитів. Пристінкові неоклюзуючі тромби є причиною дистальної емболії малими тромбоцитарними тромбами як у експериментальних тварин, так і у людей. Ці емболи завжди перебувають у басейні артерії, що містить розщеплену бляшку. Є дані клінічних досліджень, одержані за допомогою радіомаркування як фібриногену, так і тромбоцитів, які доводять, що розростання тромбу триває після початку формування ІМ.
Ангіографічне дослідження при гострому ІМ дозволяє спостерігати трансформацію тромбів від пристінкових до оклюзуючих і навпаки. При проведенні серійного ангіографічного дослідження при успішній тромболітичній терапії тромбу в оклюзованій артерії спочатку відбувається швидке відновлення антеградного кровотоку в зоні крайових тромботичних мас (рис. 1.124 а, б), що розміщуються всередині просвіту. Після повного усунення внутрішньопросвітного тромбу на місці тромботичної оклюзії виявляють розщеплену бляшку з нависанням фрагментів стенозу та нерівними контурами (рис. 1.125). Це саме те морфологічне утворення, яке викликало агрегацію та утворення тромбу. І саме ця бляшка може призвести до реінфаркту або розвитку постінфарктної стенокардії на етапах реабілітації хворого.
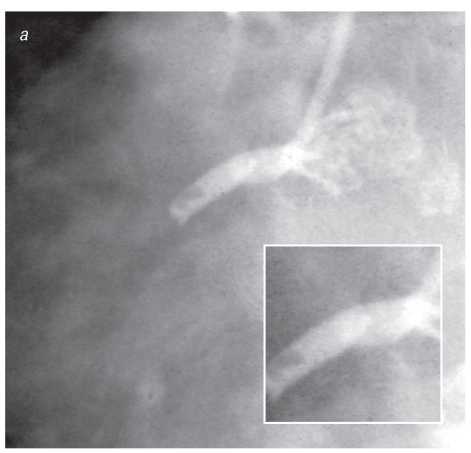
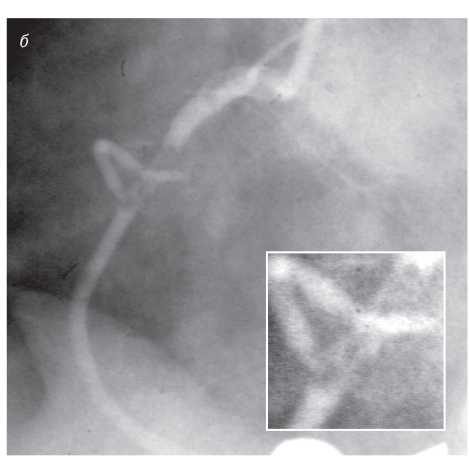
Рис. 1.124. Коронарограма хворого з гострим ІМ. Тромботична оклюзія проксимального сегмента ПКА До початку проведення внутрішньокоронарного тромболізису (а); коронарограма хворого в період проведення внутрішньокоронарного тромболізису з руйнуванням тромботичних мас в крайовій пристінковій ділянці (б) (пояснення в тексті)
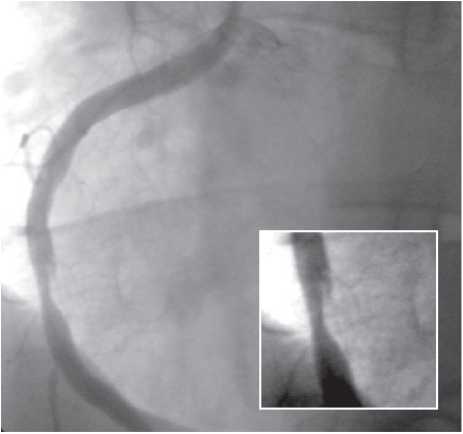
Рис. 1.125. Коронарограма хворого з ознаками розтріскування атероматозної бляшки (пояснення в тексті)
Проте залишається нез’ясованим, як оцінити вплив тромболітику або первинної ангіопластики на інтрамуральні тромби (рис. 1.126). У випадках коли значна частина тромбу є інтраінтимальною, просвіт судини значно здавлюється ззовні або випинається інтимальний клапан (що утруднює кровотік), який складно усунути за допомогою первинної ПКВ і ще складніше провести його лізис тромболітиком. Однак шляхом первинного коронарного стентування в період гострого ІМ можна розв’язати цю проблему.
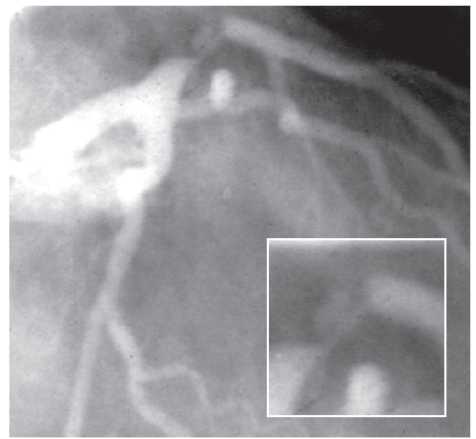
Рис. 1.126. Коронарограма хворого з внутрішньобляшковим розміщенням тромбу і контрастуванням внутрішньої частини бляшки. Люмінальний кровотік не блокований (пояснення в тексті)
У випадках коли тромболізис комбінували з ангіопластикою (проведення рятівної або негайної ПКВ, див. далі), можливе утворення великих субінтимальних гематом, що здавлюють просвіт судини іззовні. Імовірно, що в деяких випадках саме цей фактор знижує ефективність рятівної ангіопластики після невдалого тромболізису й призводить до ішемічних ускладнень при проведенні негайної ПКВ після успішного тромболізису.
Ускладнений ріст атеросклеротичної бляшки
Руйнування бляшки
При патологоанатомічному дослідженні коронарних артерій осіб з коронарним атеросклерозом, які померли від некоронарогенних захворювань (без АГ і цукрового діабету), хоча б одна зруйнована атеросклеротична бляшка була виявлена в 8,7% артерій. У померлих, в анамнезі яких були вказівки на цукровий діабет і АГ, кількість зруйнованих бляшок збільшувалася до 16,7%. При раптовій кардіальній смерті осіб, що померли від гострого ІМ і нестабільної стенокардії, кількість розщеплених бляшок і внутрішньокоронарних тромбів значно збільшується. Епізод розриву бляшки неминуче призводить до збільшення її обсягу. Розмір щілини в бляшці після її розтріскування — одна з детермінант утворення внутрішньопросвітних тромбів.
Відновлення бляшки
Репаративні процеси в стінці артерії при розтріскуванні і ангіопластиці дуже схожі. Проліферація гладком’язових клітин швидко «пломбує» малі бляшкові щілини, «замикаючи в собі» в такий спосіб тромби всередині бляшки. Організація і перетворення цих «замкнених» тромбів у сполучнотканинне утворення супроводжуються проростанням нових судин і фібробластів із сусідньої медії. Стійкість тромботичного матеріалу всередині просвіту артерії є чинником, що у подальшому визначає ступінь резидуального стенозу. Якщо протягом 24–28 год не відзначається повного лізису резидуального внутрішньопросвітного тромбу, то він є каркасом для збільшення як кількості ендотеліальних, так і гладком’язових клітин, що призводить до нового сполучнотканинного утворення всередині просвіту. При віддалених спостереженнях пацієнтів з гострим коронарним синдромом відзначено, що після стабілізації зруйнованої бляшки репаративні процеси набувають хронічного характеру і на повторних коронарограмах виявляються відновлені сегменти артерій у місці раніше зруйнованих стенозів (рис. 1.127, 1.128).
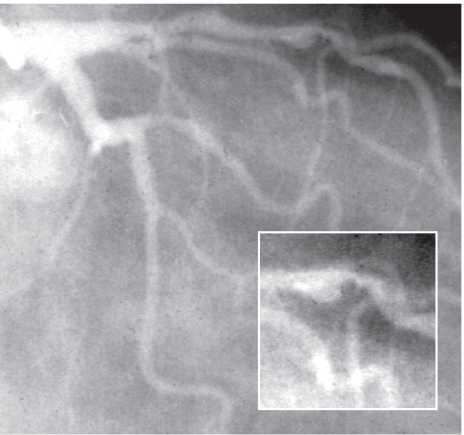
Рис. 1.127. Коронарограма хворого з виразкою бляшки в середній третині ПМШГ ЛКА. Перший етап руйнування бляшки (пояснення в тексті)
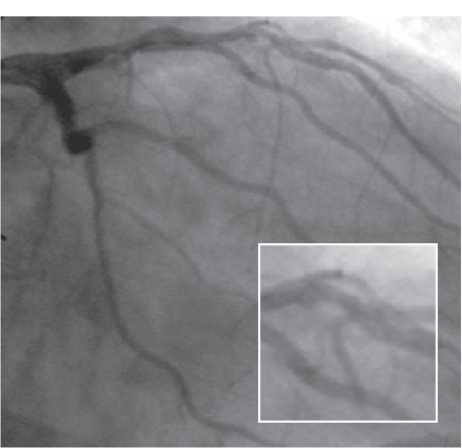
Рис. 1.128. Коронарограма хворого з виразкою бляшки в середній третині ПМШГ ЛКА. Перший етап відновлення (через 6 міс) бляшки (пояснення в тексті)
Таким чином, результатами щілиноутворення в бляшці можуть бути (рис. 1.129):
1) підвищення ступеня стенозу;
2) залишкові стенози високого ступеня з наявністю одноканального просвіту;
3) наявність декількох малих каналів (при реканалізації внутрішньопросвітного тромбу);
4) повна хронічна оклюзія.
Рис. 1.129. Схема можливих результатів розвитку атеросклеротичної бляшки (пояснення в тексті)
Зв’язок між щілиноутворенням в бляшці, крововиливом і васкуляризацією через медію
Щілиноутворення в бляшці неминуче «відкриває ворота» для проходження крові із просвіту судини в глибину бляшки. При цьому в області щілини накопичується велика кількість тромбоцитів. Морфологічні дані свідчать, що внутрішні шари бляшки повинні бути відкриті в просвіт досить тривалий час, необхідний для утворення турбулентного току крові всередині бляшки, щоб накопичити велику кількість тромбоцитів. Звільнення АДФ з еритроцитів є одним із факторів, що ініціюють тромбоутворення. На аутопсії в бляшках з великою кількістю тромбоцитів завжди виявляють щілину, що з’єднує просвіт судини із внутрішніми шарами бляшки. Ця форма крововиливу в бляшку більше відома під назвою «дисекційний крововилив».
Бляшки з інтактним покриттям, без з’єднання ліпідних озер і просвіту судини навіть на серійних зрізах можуть містити тільки незначну кількість еритроцитів, але не тромбоцити. Із сусідньої медії через тканини бляшки проходять тонкостінні капіляри, крізь стінки яких еритроцити попадають у тканину бляшки. Гематоми всередині бляшки, які достатньо великі, щоб значно здавити просвіт ззовні, завжди містять велику кількість тромбоцитів, які проникають всередину бляшки із просвіту артерії через тріщину(и) в стінці судини. При дослідженні 86 зруйнованих бляшок виявлено, що у 83% випадків розрив інтими пов’язує просвіт з озерами позаклітинних ліпідів. Найбільш частим місцем розриву було те, де покриття ексцентрично розміщеної багатої ліпідами бляшки з’єднувалося з неураженою частиною стінки артерії.
Тромбогенез
Тріада Вірхова (судина, потік і кров) лежить в основі складного багатофакторного процесу, що називається тромбогенезом. Індивідуальна значимість кожного з цих факторів та їх динамічна взаємодія при утворенні коронарного тромбу відображені на рис. 1.130.
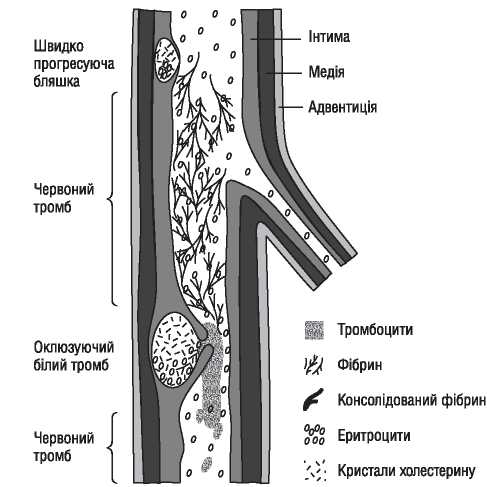
Рис. 1.130. Схема утворення внутрішньокоронарного тромбозу (пояснення в тексті)
Морфологія коронарних атеросклеротичних бляшок варіює в широких межах, причому на одному краю перебуває «тверда», багата на колаген бляшка з невеликим вмістом ліпідів, а на другому — «м’яка» бляшка з вираженим пулом позаклітинних ліпідів (напіврідких при температурі 36–37 °С), що відділена від артеріального просвіту ковпачком з фіброзної тканини. М’які бляшки значно небезпечніші, оскільки у них вища чутливість до ушкодження: фіброзний ковпачок, що покриває ліпідний пул, може тріснути і тромбогенний матеріал потрапляє в кровотік.
Руйнування (розтріскування) атероматозної бляшки (див. рис. 1.130) — основна причина фатального коронарного тромбозу, яку виявляють більше ніж у 75% випадків коронарного тромбозу. Роль розриву бляшки як пускового механізму очевидна: у місці розриву тромб складається головним чином зі скупчення тромбоцитів, атероматозний матеріал бляшки часто витісняється і виявляється фіксованим глибоко в люмінальному тромбі. Така мікроструктура є свідченням того, що деструкції поверхні стенозу передував процес утворення люмінального тромбу. Цей же механізм, очевидно, лежить в основі розвитку нефатального коронарного тромбозу.
Механізми, що лежать в основі раптового розриву поверхні бляшки, точно не встановлені. Розірвані бляшки часто виявляють у коронарних артеріях пацієнтів, що загинули як від коронарогенних, так і некоронарогенних причин. Цей факт свідчить про те, що розрив поверхні бляшки може бути і випадковою подією в процесі розвитку і росту атеросклеротичного ураження. Розірвані ковпачки при патоморфологічному дослідженні часто визначаються як тонкі структури з вираженою інфільтрацією пінистими клітинами. Можливо, цей факт визначає чутливість цієї частини бляшки до механічних і гемодинамічних стресів, які пов’язані з АТ і ЧСС пацієнта.
Проте зруйнована «м’яка» бляшка необов’язково присутня під коронарними тромбами. Приблизно в 20% тромбів, що досліджувалися після смерті пацієнтів, виявляють тільки незначне та поверхневе ушкодження інтими, зазвичай у комбінації з вираженим атеросклеротичним стенозом. Більшість зруйнованих бляшок дають початок невеликому пристінковому тромбу і тільки іноді розвивається оклюзуючий коронарний тромб.
Стимулятори тромбоутворення
У ході експериментальних досліджень висловлено припущення, що кількість і характер тромбогенного матеріалу, що відкрився в просвіт артерії, мають першорядне значення. Таким чином, можна припустити, що «оголені» структури атеросклеротичної бляшки та стінки артерії можуть виявляти виражену тромбогенну дію.
Кров відіграє основну роль у рівновазі між тромбозом і тромболізисом. Саме цей факт пояснює ефективність використання антитромбоцитарних і антикоагулянтних препаратів (ацетилсаліцилової кислоти), тиклопідину та антикоагулянтів (гепарину, варфарину) у пацієнтів з високим ризиком розвитку тромбозу. Найбільш вивченим, найменш токсичним і широко відомим препаратом групи антиагрегантів, що застосовуються при гострих і хронічних проявах ІХС, є ацетилсаліцилова кислота. Ефективність цього препарату доведена при лікуванні хворих з нестабільною стенокардією і гострим ІМ, а також для профілактики гострих ускладнень у період проведення коронарної ангіопластики і стентування. Проте ацетилсаліцилова кислота перешкоджає тільки одному із існуючих шляхів активації тромбоцитів, пов’язаному з тромбоксаном А2. Таким чином препарат не може повністю запобігти розвитку тромботичних ускладнень. Раціональним є сумісне призначення ацетилсаліцилової кислоти та антикоагулянтів, що гальмує активацію тромбоцитів і впливає на утворення тромбіну (рис. 1.131). Тромбін є не тільки сильним активатором тромбоцитів, але й посилює утворення та сплетення волокон фібрину, що забезпечують каркас для росту тромбоцитарних тромбів (див. рис. 1.131).
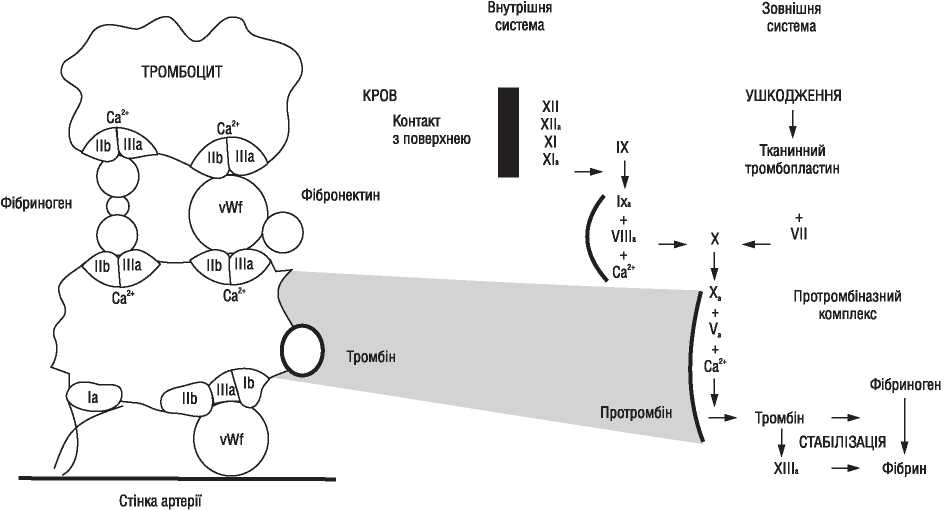
Рис. 1.131. Схема активації тромбоцитів та утворення внутрішньосудинного тромбу (пояснення в тексті)
Гемодинамічні сили течії крові
Добре відомо, що стаз зумовлює коагуляцію і венозний тромбоз, але та обставина, що точно такі самі умови течії крові зумовлюють артеріальний тромбоз, не одержало загального визнання. В експериментальних дослідженнях встановлено, що наслідки розриву бляшки залежать від ступеня вихідного стенозу, а ймовірність оклюзуючого тромбозу збільшується з підвищенням ступеня стенозу до його руйнування. Однак стаз не завжди має вирішальне значення, оскільки багато атеросклеротичних стенозів, які викликають тромбоз, не є гемодинамічно значимими і не викликають зниження кровотоку. Проте при найбільш незначних ушкодженнях стінки бляшки (артерії) наявність поруч розміщеного стенозу може різко погіршити клінічну ситуацію. Часто на ургентних коронарограмах у пацієнтів у період гострого ІМ виявляємо два стенози (один за одним, «гуськом») в коронарної артерії, що зумовила інфаркт, що збільшує ризик розвитку тромбозу. Отже, стеноз зумовлює виникнення артеріального тромбозу, його причина — велика швидкість кровотоку, яка підвищується у звуженому сегменті й призводить до локального відтискування тромбоцитів, що сприяє їх пристінковому розміщенню в течії крові та індукує агрегацію in vitro та in vivo.
Утворення тромбу зазвичай відбувається в межах стенозу з порушеною поверхнею. Він може також утворюватися або поширюватися в постстенотичному напрямку, де розподіл потоку рециркуляція — турбулентність створює ідеальні умови з погляду гемодинаміки рідини для прогресуючого збільшення тромбу за рахунок подальшої агрегації тромбоцитів (див. рис. 1.130). Однак процес постстінкового тромбоутворення, як правило, відбувається до найближчої великої бічної гілки. Вільно плаваючий «хвіст» тромбу, утворений далі за течією крові від місця стенозу, що складається з агрегованих тромбоцитів, вказує на те, що в основі цього явища лежить не застій крові, а інші тромбогенні фактори (основний з яких — руйнування атеросклеротичної бляшки).
Патогенез і клінічна значимість тромбів, що утворюються в межах стенозів або дистальніше них, можливо, відрізняються. Відносно невеликий компонент тромбу, що утворився в межах стенозу, очевидно, є найнебезпечнішою його частиною, оскільки найбільша обструкція потоку крові відбувається в найбільш звуженій частині стенозу; найбільш активний ріст тромбу до повної оклюзії відзначається саме тут; тромб, що утворився в межах стенозу, є дуже стійким утворенням і може персистувати навіть після успішного тромболізису (рис. 1.132а, б). З іншого боку, «хвіст» тромбу, що вільно плаває витягається за напрямком потоку крові, має значно вищий потенціал у відношенні емболізації та периферичної оклюзії дистальної частини коронарного русла (див. рис. 1.132б).
Рис. 1.132. Ургентна коронарограма хворого зі стенозом у проксимальному сегменті ПМШГ ЛКА в період проведення внутрішньокоронарного тромболізису. Рівень кровотоку TIMI-3 (а); коронарограма хворого зі стенозом у проксимальному сегменті ПМШГ ЛКА. Пристінкові тромби персистують після тромболізису з емболізацією (вказано стрілкою) фрагментів внутрішньокоронарного тромбу в ДГ ЛКА (б)
У >80% тромбів, сформованих у межах стенозу, відзначають шарувату структуру з матеріалів різного «віку», що свідчить про епізодичний ріст за рахунок багаторазових пристінкових відкладань. У пацієнтів, що померли незабаром після початку гострого серцевого нападу, тромбоцити є головним компонентом найбільш свіжої частини тромбу, розміщеної центрально (ранній тромбоцитарний тромб), тоді як «старіші» тромби розміщуються ближче до судинної стінки й значно більше містять фібрину (консолідований тромбоцитарний тромб). Таким чином, і тромбоцити, і фібрин відіграють роль в еволюції коронарного тромбу: первинна перешкода течії крові зазвичай виникає внаслідок агрегації тромбоцитів, але ранній тромбоцитарний тромб дуже нестабільний і може бути легко зруйнований течією крові, поки фібрин не сплете тромбоцити і тим самим не стабілізує тромб. Саме тому пацієнтам з ризиком розвитку коронарного тромбозу показано призначення як антитромбоцитарних препаратів, так і антикоагулянтів. Результати такої тимчасової взаємодії між тромбоцитами й фібрином узгоджуються з даними експериментальних досліджень і пояснюють, чому «молоді» тромби легше зазнають лізису, ніж «старіші». Саме з цієї причини ранній тромболізис і первинна ПКВ найбільш ефективні для руйнування тромбів.
Більше того, епізодичний ріст, очевидно, чергується з фрагментацією тромбу і периферичною емболізацією, що ангіографічно проявляється частим виявленням невеликих фрагментів тромбу в дистальній частині коронарного русла (див. рис. 1.132а, б). Такі мікроемболи особливо часто виникають при раптовій ішемічній смерті, якій передувала нестабільна стенокардія.
Таким чином, коронарний тромбоз — це динамічний процес, при якому тромбоутворення наростає й згасає протягом певного періоду, створюючи інтермітуючу непрохідність коронарної артерії на фоні процесів тромбозу і тромболізису.
Червоний тромб (див. рис. 1.130) може бути довгим (кілька сантиметрів), особливо у венозних трансплантатах, де немає бічних гілок, та в правій коронарній артерії з її нечисленними бічними дочірніми артеріями. Великий тромб може важко піддаватися лізису, що визначає один з механізмів, який лежить в основі безуспішного тромболізису. Невдалі спроби відкрити обтуровану тромбом артерію за допомогою тромболітичної терапії ще не свідчить про те, що ця оклюзія є нетромботичною. Проте серйозні «бляшкові катастрофи» можуть призводити до появи шматків інтими, що виступають у просвіт артерії та перешкоджаючих течії крові. У цьому випадку коронарна ангіопластика з наступним стентуванням артерії, що зумовила інфаркт, може бути єдиним способом відновлення коронарного кровотоку.
Інтервенційне лікування гострого коронарного синдрому з елевацією сегмента ST
Первинне ПКВ
Первинне ПКВ можна визначити як втручання, що спрямоване на «винну» судину, виконане протягом перших 12 год від початку за-грудинного болю або іншої симптоматики, без попередньої (повної або фацилітативної) тромболітичної або іншої тромборозчинної терапії. Перше первинне ПКВ виконане в 1979 р., тобто всього через 2 роки після впровадження ПКВ. Дотепер рандомізовані контрольовані дослідження демонструють, що в якості ургентного лікування первинне ПКВ порівняно з тромболізисом є кращим видом лікування (краще розкриття просвіту судини, менше випадків зворотної ішемії міокарда, менша кількість реоклюзій, менше повторних інфарктів, краща резидуальна функція ЛШ та кращі клінічні результати, включаючи меншу кількість інсультів). Вважається, що виконання первинного ПКВ має особливу перевагу над тромболізисом у жінок і людей похилого віку (рис. 1.133).
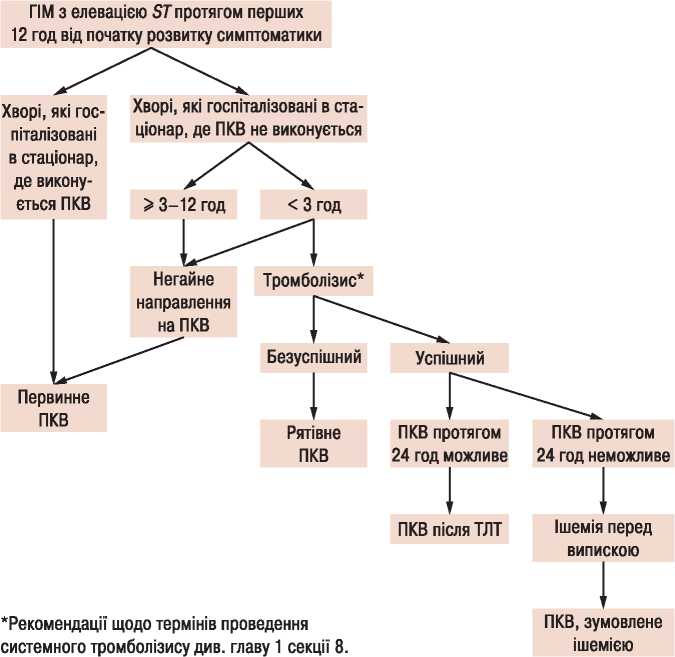
Рис. 1.133. Інтервенційне лікування гострого ІМ з елевацією сегмента ST протягом перших 12 год
Протягом перших 3 год тромболізис може бути альтернативою ПКВ. Якщо тромболізис протипоказаний або хворий належить до групи високого ризику, негайно рекомендується направлення на ПКВ, перевага якого над тромболізисом у перші 3 год полягає у запобіганні інсультів; у період від 3 до 12 год — у кращому захисті міокарда та профілактиці інсультів.
Проведений метааналіз 23 рандомізованих досліджень, у які ввійшло 7739 пацієнтів з гострим ІМ, що не мають протипоказань до проведення тромболітичної терапії. Хворі були розподілені на групу первинного ПКВ і групу тромболізису. Результати аналізу показали, що первинне ПКВ перевершує тромболізис за кількістю смертей за короткий (4–6 тиж) період спостереження (9,3 проти 7,0%; p=0,0002), кількості нефатальних повторних інфарктів (6,8 проти 2,5%; p=0,0001), кількості інсультів (2,0 проти 1,0%; p=0,0004) і за комбінованою кінцевою точкою, що включає смерть, нефатальні реінфаркти та інсульти (14,5 проти 8,2%; p<0,0001). Довготривале спостереження продемонструвало такі ж результати: кількість смертей 12,8 проти 9,6%; кількість реінфарктів — 10,0 проти 4,8%; комбінована кінцева точка (смерть, реінфаркт, інсульт) — 19 проти 12%.
Найбільш виражена відмінність між первинним ПКВ і тромболізисом відзначена при порівнянні рівнів зворотної ішемії при короткотривалому (21 проти 6%; p<0,0001) і довготривалому спостереженні (39 проти 22%; p<0,0001) (Рекомендації щодо первинного ПКВ при гострому ІМ з елевацією сегмента ST: IA).
Основними дослідженнями, що підтвердили рівень доказовості IA для первинного ПКВ, були PAMI, GUSTO-IIb, C-PORT, PRAGUE-1, PRAGUE-2 і DANAMI-2.
Направлення хворих для виконання первинного ПКВ
Немає сумнівів у тому, що пацієнти, які мають протипоказання до тромболізису, у перші 12 год від початку симптоматики гострого ІМ повинні бути направлені в той стаціонар, у якому можливе проведення коронарографії і первинного ПКВ, оскільки первинне ПКВ є для таких хворих єдиною можливістю швидко відкрити артерію. Абсолютними протипоказаннями до тромболізису є наступні стани: дисекція аорти, перенесений геморагічний інсульт, значна недавня травма або операція, шлунково-кишкова кровотеча протягом останнього місяця або інші відомі розлади, що викликають кровотечу. Відомо, що у пацієнтів, що мають протипоказання до тромболізису, рівень показників захворюваності і смертності вищий, ніж у інших. Формальна оцінка первинного ПКВ у цієї підгрупи хворих у рандомізованих контрольованих дослідженнях відсутня, проте показано, що ця процедура в більшості випадків виконується успішно (Рекомендації для первинного ПКВ у хворих, що мають протипоказання до тромболізису: IC).
Рішення про направлення на первинне ПКВ залежить від оцінки клінічного ризику в кожному окремому випадку. Вибір між ПКВ і тромболізисом часто диктується обмеженнями в поінформованості та затримкою транспорту. Дослідженнями, у яких оцінювалася можлива перевага первинного ПКВ перед тромболізисом у тих випадках, коли була необхідність переведення хворого з однієї клініки в іншу, є Limburg (LIMI — Limburg Myocardial Infarction), PRAGUE-1, PRAGUE-2, Air-PAMI і DANAMI-2.
У дослідженні DANAMI-2 вперше встановлена достовірна перевага первинного ПКВ з оцінки кінцевих точок (смерть, реінфаркт та інсульт), незважаючи на затримки з направленням хворих. Дослідження PRAGUE-2 було достроково припинене внаслідок 2,5-кратного перевищення смертності в групі тромболізису серед хворих, яким тромболізис проводили після 3 год від початку появи симптоматики. Смертність у цій групі хворих досягла 15,3%; у групі ПКВ — 6% (p<0,02). Відмінності щодо смертності серед хворих, яким тромболізис або первинне ПКВ виконувалося до 3 год, не було (7,4% — при тромболізису і 7,3% — при первинному ПКВ). У цьому дослідженні у 2/3 хворих тромболізис або ПКВ були виконані до 3 год від початку симптоматики, тому шансів досягти кінцевих точок у дослідженні PRAGUE-2 не було.
За даними досліджень PRAGUE-2, STOPAMI-1 і -2, MITRA (Maximal Individual Therapy in Acute Myocardial Infarction) і MIR (Myocardial Infarction Registry), а також дослідження CAPTIM (Comparison of Angioplasty and Prehospital Thrombolysis in Acute Myocardial Infarction), у якому тромболізис проводили на догоспітальному етапі, ранній тромболізис є життєздатною альтернативою. Таким чином, первинне ПКВ і тромболізис, виконані в перші 3 год, дають однакові результати щодо зменшення зони інфаркту та зниження смертності. Піддане сумніву ствердження про перевагу первинного ПКВ перед тромболізисом, проведеним у перші 3 год, вивчалося на підставі комбінованого аналізу у дослідженнях STOPAMI-1 і -2. «Індекс порятунку міокарда» при первинному ПКВ і тромболізисі, що виконані в перші 165 хв, не мав достовірної відмінності (0,45 проти 0,56), проте відзначена достовірна перевага при виконанні цих процедур у строки від 165 до 280 хв (0,29 проти 0,57; р=0,003), а також після 280 хв (0,20 проти 0,57).
Перевага ПКВ над тромболізисом, що пов’язана з часом (зі збільшенням часу проведення процедури кількість значних несприятливих кардіальних подій після тромболізису збільшується, а при первинному ПКВ залишається відносно стабільною), відзначена також в метааналізі PCAT (Primary Coronary Angioplasty versus Thrombolysis), що розглядав результати лікування 2635 хворих, і в реєстрах MITRA і MIR, коли догоспітальна відстрочка перевищувала 3 год. Таким чином, «пізно» не означає «занадто пізно».
Основна причина, по якій первинне ПКВ має перевагу над тромболізисом навіть у перші 3 год від початку інфаркту, — профілактика інсультів. Метааналіз 23 рандомізованих досліджень показав, що кількість інсультів після первинного ПКВ в 2 рази нижча, ніж після тромболізису (1,0 проти 2,0%). За даними метааналізу PCAT первинне ПКВ порівняно з тромболізисом зменшує кількість інсультів у перші 2 год на 0,7%; у період від 2 до 4 год — на 1,2%; у період з 4 до 12 год — на 0,7%. Ці дані можуть бути порівняні з результатами дослідження CAPTIM, у якому кількість інсультів при тромболізисі склало 1% (4/419); при первинному ПКВ — 0% (0/421). Метааналіз досліджень, присвячений вибору лікування хворих з гострим ІМ продемонстрував достовірне (на 1,2%) зменшення кількості інсультів: 1,88% — при тромболізисі і 0,64% — при первинному ПКВ. Таким чином, перевага первинного ПКВ перед тромболізисом у період від 3 до 12 год від початку захворювання пояснюється не тільки більшим збереженням міокарда при ПКВ, але й запобіганням інсультів (Рекомендації для первинного ПКВ при гострому ІМ у період від 3 до 12 год від початку клініки: IC).
Результати досліджень PRAGUE-2 і DANAMI-2 особливо важливі, оскільки в цих дослідженнях показано, що первинне ПКВ може успішно виконуватися у великих зонах частково урбанізованої Європи. Первинне ПКВ при гострому ІМ з елевацією ST і високим ризиком ускладнень може виконуватися в лікарнях, де кардіальні операції не проводяться, оскільки цей метод є безпечним і ефективним (Рекомендації для стентування для хворих з гострим ІМ і елевацією сегмента ST: IA).
Фацилітивне ПКВ, рятівне ПКВ, рутинна коронарографія і ПКВ після тромболітичної терапії
Фацилітивне ПКВ
Фацилітивне (полегшене) ПКВ — це планова інтервенція, що виконується в перші 12 год від початку інфарктної симптоматики, незабаром після проведення тромболітичної (clotdissolving) терапії, яка проводиться для того, щоб з’єднати розрив між першим лікарським контактом і первинним ПКВ. Термін «фацилітивне ПКВ» іноді застосовується для позначення інших ситуацій, проте повинен застосовуватися для позначення попередньо запланованого ПКВ, проведеного незабаром після початку тромболізису та/або введення інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/ IIIa. Таким чином, у всіх дослідженнях, які проводять оцінку концепції фацилітивного ПКВ, всім хворим, незалежно від того, чи проводилося у них попереднє лікування, повинно бути виконане планове первинне ПКВ.
Первинне фацилітивне ПКВ із тромболізисом
Результати фацилітивного ПКВ визначалися в малих групах досліджень PRAGUE-1 і SPEED (GUSTO-4 Pilot; SPEED — Strategies for Patency Enhancement in the Emergency Department). Показано, що застосування половинної дози t-PA (активатор тканинного плазміногену) перед плановим первинним ПКВ призводить до збільшення кількості пацієнтів з кровотоком (TIMI-3) до моменту їх направлення в катетеризаційну лабораторію, проте цей результат не переходить у клінічне покращання після проведення ПКВ (PACT (Pravastatin in Acute Coronary Treatment)). У дослідженні BRAVE (Bavarian Reperfusion Alternatives Evaluation) хворі перед тим як направлятися на планове первинне ПКВ зі стентуванням, були рандомізовані на групу половинної дози ретеплази + абциксимаб і групу абциксимабу. Показано, що раннє введення ретеплази та абциксимабу не призводить до зменшення зони інфаркту порівняно з введенням одного абциксимабу. Хоча концепція «низької дози тромболітику», комбінованого із клопідогрелом та інгібіторами глікопротеїнових рецепторів тромбоцитів IIb/IIIa, що вводяться хворим з гострим ІМ та елевацією ST незадовго до стентування, є цікавою, дослідження, присвячені фацилітивному ПКВ не продемонстрували покращання результатів або потенційної шкоди. Більшу кількість даних дадуть дослідження ASSENT-4 (The ASsessment of the Safety and Efficacy of a New Treatment Strategy for Acute Myocardial Infarction), які проводяться на сьогодні, рандомізуючі хворих на групи фацилітивного ПКВ із застосуванням тенектеплази і первинного ПКВ із застосуванням інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/ IIIa за необхідністю, і FINESSE (Facilitated Intervention with Enhanced Reperfusion Speed to Stop Events), рандомізуюче хворих на групи фацилітивного ПКВ із застосуванням ретеплази, фацилітивного ПКВ із застосуванням абциксимабу і нефацилітивного первинного ПКВ. Проте на сьогодні немає підстав рекомендувати фацилітивне ПКВ з тромболізисом.
Первинне фацилітивне ПКВ з інгібіторами глікопротеїнових рецепторів тромбоцитів IIb/IIIa
Дослідження ADMIRAL (Abciximab before Direct Angioplasty and Stenting in Myocardial Infarction Regarding Acute and Long-term follow-up) показало, що в групі хворих, які отримували до проведення ПКВ абциксимаб на догоспітальному етапі або в ургентному відділенні, результати лікування були кращими, ніж у хворих, яким ці лікарські засоби призначалися пізніше, що показало переваги «фацилітування». У дослідженні ON-TIME (Ongoing Tirofiban In Myocardial infarction Evaluation) хворі були проспективно рандомізовані на групу раннього догоспітального початку введення тирофібану (рання група) та групу, у якій тирофібан починали вводити в катетеризаційній лабораторії (пізня група). Під час первинної коронарографії визначене збільшення, що не має вірогідності, кількості хворих з кровотоком (TIMI-3) у ранній групі (19 проти 15%). Переваг після ПКВ за даними коронарографії, а також за клінічними результатами не виявлено.
Незважаючи на те що дослідження TIGER-PA pilot (Tirofiban Given in the Emergency Room before Primary Angioplasty) і BRIDGING (досліджували вплив абциксимабу на ранню ре-перфузію при ІМ з елевацією сегмента ST до або під час первинної перкутанної коронарної ангіопластики) показали, що раннє введення тирофібану або абциксимабу поліпшують ангіографічні результати лікування хворих, яким проводилося первинне ПКВ, і незважаючи на те, що метааналіз 6 рандомізованих досліджень показав, що раннє введення інгібіторів глікопротеїнових рецепторів тромбоцитів IIb/IIIa покращує прохідність артерій і відзначається тенденція до поліпшення клінічних результатів, на сьогодні немає доказової бази для того, щоб рекомендувати первинне фацилітивне ПКВ з інгібіторами глікопротеїнових рецепторів тромбоцитів IIb/IIIa.
Рятівне ПКВ після невдалого тромболізису
Рятівним називається ПКВ, що виконується в коронарній артерії, яка залишилася закритою, незважаючи на проведену тромболітичну терапію. Безуспішність тромболітичної терапії можна припускати в тих випадках, коли через 45–60 хв від початку тромболізису хворий продовжує скаржитися на біль у грудній клітці і на ЕКГ не визначається зниження елевації сегмента ST . Це згодом підтверджується корона-рографічно: наявність вираженого ураження в епікардіальній артерії, що супроводжується зниженням коронарного кровотоку (<TIMI 3). Цінність рятівного ПКВ після безуспішного тромболізису визначали в Клівлендському клінічному дослідженні. У цьому дослідженні одній групі хворих після безуспішного тромболізису призначали медикаментозне лікування (ацетилсаліцилова кислота, гепарин, кардіальні вазодилататори); хворі іншої групи отримували таку ж терапію, однак їм було проведене ПКВ. Рятівне ПКВ достовірно знизило результати в кінцевих точках (смерть або тяжка СН) з 17 до 6%. Метааналіз досліджень RESQUE I, RESQUE II, а також інших клінічних досліджень продемонстрував перевагу рятівного ПКВ. З іншого боку, у дослідженні MERLIN (Middlesbrough Early Revascularization to Limit Infarction) не виявили поліпшення виживаності в групі рятівного ПКВ, хоча виживаність без ускладнень була вищою, в основному за рахунок меншої кількості повторних реваскуляри-зацій. Однак серйозні обмеження дослідження MERLIN зробили його недостатньо об’ємним.
Недавно завершене дослідження REACT (Rapid Early Action for Coronary Treatment). у яке були включені хворі з елевацією ST. що не знизилася протягом 90 хв від початку тромболізису мінімум в 2 рази від вихідної. показало. що у хворих з відсутністю реперфузії після тромболізису результати рятівного ПКВ кращі. ніж при проведенні повторного тромболізису або при медикаментозному лікуванні. Протягом 6 міс спостереження будь-які ускладнення в групі рятівного ПКВ були майже в 2 рази нижчі. ніж у групі повторного тромболізису та консервативного лікування (наприклад смерть — 9 проти 18%). Порівняно з дослідженням MERLIN у цьому дослідженні стентування та інгібітори глікопротеїнових рецепторів тромбоцитів IIb/IIIa застосовували частіше; час від початку симптоматики ІМ до проведення рятівного ПКВ був коротшим. При рятівному ПКВ. як і при первинному ПКВ. стентування має переваги перед простою балонною ангіопластикою (Рекомендації для рятівного ПКВ для хворих після безуспішного тромболізису: IB).
Рутинна коронарографія в ранній період після тромболізису
У дослідження ALKK (Arbeitsgemeinschaft Leitende Kardiologische Krankenhausarzte — дослідження подібне GRACIA. яке проводили в Німеччині). у якому були рандомізовані 300 хворих (спочатку планувалося 800) для проведення ПКВ або медикаментозного лікування. Перед рандомізацією у 63% хворих групи ПКВ і у 57% групи медикаментозного лікування був проведений тромболізис. ПКВ в середньому проводили протягом перших 24 днів від розвитку ІМ з елевацією ST. Показник виживаності без ускладнень протягом 1 року в групі ПКВ мав тенденцію до поліпшення порівняно з групою медикаментозного лікування (90 проти 82%). Ця відмінність була зумовлена в основному відмінністю в кількості повторних реваскуляризацій (5,4 проти 13,2%; p=0,03).
Багаторівневий аналіз результатів лікування хворих, що ввійшли в дослідження ASSENT-2. продемонстрував нижчу смертність у тих країнах, де рівень ПКВ, що виконуються після тромболізису, вищий. Метааналіз результатів лікування 20 101 хворого, що ввійшли в дослідження TIMI 4, 9 і 10B, а також у дослідження TIMI-II, показав, що в тих пацієнтів, яким ПКВ було виконане в період госпіталізації, рівень внутрішньогоспітальних реінфарктів був нижчим (4,5 проти 1,6%; p<0/001), так само, як і рівень смертності за 1 рік (11,6 проти 5,6%; p<0,001). Проспективне дослідження, проведене Шведським національним реєстром причин смерті, підтримує застосування інвазивної техніки в ранній період гострого ІМ. За даними дослідження GUSTO-I кількість кардіальних катетеризацій і реваскуляризацій, виконаних за період стаціонарного лікування хворих з гострим ІМ, у США більша, ніж у Канаді, 5-річна смертність серед цих хворих у США становить 19,6%; у Канаді — 21,4% (p=0,02). Таким чином, консервативне лікування таких хворих порівняно з тактикою ранньої реваскуляризації дає негативний результат за показником довгострокової виживаності.
Необхідність проведення рутинної ангіографії і при необхідності стентування показана в 4 дослідженнях: SIAM III (Southwest German Interventional study in Acute Myocardial infarction), GRACIA-1, CAPITAL-AMI (Combined Angioplasty and Pharmacological Intervention Versus Thrombolytics Alone in Acute Myocardial Infarction) і LPLS (Leipzig Prehospital Lysis Study). Результати цих 4 досліджень наведені в табл. 1.43.
Таблиця 1.43. Клінічні результати та розміри зони інфаркту у хворих, яких рутинно направляють на коронарографію (РКГ) та при необхідності перкутанне коронарне втручання (ПКВ), після тромболітичної терапії (ТЛТ) порівняно тільки з тромболізісом та інвазивною стратегією, зумовленою ішемією
| Показник | SIAM-III | GRACIA-1 | CAPITAL-AMI | LPLS |
| Кількість хворих | 197 | 500 | 170 | 164 |
| Критерії включення | ГІМ з ST <12 год | ГІМ з ST <12 год | ГІМ з ST <6 год | ГІМ з ST <4 год |
| Виконання ТЛТ | У лікарні | У лікарні | У лікарні | До лікарні |
| Тромболітичний препарат | Ретеплаза (повна доза) | Ретеплаза (прискорена доза) | Тенектеплас (повна доза) | Півдози ретеплази + абциксімаб |
| Час між ТЛТ і РКГ в групі ПКВ | <6 год | <12 год | Негайне направлення | Негайне направлення |
| Первинні кінцеві точки (ПКТ) | Смерть, ре-ІМ, ішемія, реваскуляризація | Смерть, ре-ІМ, реваскуляризація | Смерть, ре-ІМ, ішемія, інсульт | Зона інфаркта |
| Період спостереження, міс | 6 | 12 | 1 | 6 |
| Результати по ПКТ (ТЛТ/ТЛТ + РКГ ± ПКВ) | 50,6%/ 25,6%* | 21,9%* | 21,4%/ 9,3%* | 11,6%/ 6,7%* |
| ПКТ досягнуті | Так | Так | Так | Так |
*p<0,05.
Таким чином, дослідження SIAM III, GRACIA-1, CAPITAL-AMI і LPLS, а також аналіз ASSENT-2, метааналіз досліджень TIMI 4, 9, 10B, TIMI-II і GUSTO-1 показали, що реінфаркти є «ахілесовою п’ятою» тромболізису. Таким чином, тромболізис. навіть якщо він був проведений успішно, не повинен розглядатися як остаточний етап лікування: «зараз лізис, потім стент» (Рекомендації для рутинної коронарографії і при необхідності ПКВ після успішного тромболізису: IB).
ПКВ після тромболізису при наявності ішемії
Дослідження DANAMI-1 було першим і єдиним проспективним рандомізованим дослідженням, у якому порівнювали інвазивну тактику (ПКВ, АКШ) лікування хворих з першим гострим ІМ і елевацією ST, у яких до виписки зі стаціонару були ознаки кардіальної ішемії, з консервативною тактикою лікування таких хворих. Первинні кінцеві точки (смерть, повторний інфаркт, розвиток нестабільної стенокардії) при інвазивній тактиці лікування були вірогідно нижчі: 15,4 проти 29,5% протягом 1-го року спостереження; 23,5 проти 36,6% протягом 2 років спостереження й 31,7 проти 44,0% протягом 4 років спостереження. Таким чином, хворі з першим гострим ІМ з елевацією ST, яким була проведена тромболітична терапія і у яких до виписки відзначалися прояви міокардіальної ішемії, повинні направлятися на коронарографію і процедуру реваскуляризації, незалежно від інтенсивності проведеного медикаментозного лікування (Рекомендації для ПКВ після тромболізису при наявності ішемії: IB).
ПКВ для хворих, яким процедури по відновленню перфузії проводили пізніше 12 год
Часто хворі звертаються за лікарською допомогою пізно, внаслідок чого реперфузійне лікування у них або не проводиться, або неефективне. Пізнім реперфузійним лікуванням вважаються ПКВ або тромболізис, які починалися після 12 год від моменту розвитку симптоматики гострого ІМ. Тромболітична терапія, що застосовувалася в пізній термін гострого ІМ з елевацією ST, не зменшує зони інфаркту і не зберігає функцію ЛШ внаслідок своєї неефективності у відновленні просвіту коронарної артерії.
Результати досліджень PCAT, PRAGUE-2 і CAPTIM дозволяють з обережністю зробити висновок, що пізнє ПКВ, імовірно, може дати позитивні результати. Однак ці висновки не узгоджуються з результатами меншого дослідження TOAT (The Open Artery Trial), яке виявило несприятливий ефект пізнього ПКВ в ремоделюванні ЛШ. У дослідженні DECOPI (DEsobstruction COronaire en Post-Infarctus) хворі з першим Q-ІМ і закритою артерією, що зумовила інфаркт, були розділені на групу медикаментозного лікування та групу, у якій ПКВ виконувалося через 2–15 діб від початку розвитку симптоматики. Первинними кінцевими точками були кардіальна смерть, нефатальний ІМ і шлуночкова тахіаритмія. Хоча в 6-місячному спостереженні виявили достовірну різницю (5%) у ФВ ЛШ на користь інвазивної групи, а кількість відкритих коронарних артерій в інвазивній групі було достовірно більша (82,8 проти 34,2%), спостереження протягом в середньому 34 міс показало майже однакові результати за первинними кінцевими точками між групою медикаментозного лікування й групою ПКВ (8,7 проти 7,3% відповідно). Оскільки кількість хворих, що брали участь у дослідженні, була меншою запланованої й, отже, кількість ускладнень також була меншою, то вірогідність результатів цього дослідження суттєво знижена. Таким чином, хоча «гіпотеза пізнього відкриття артерії» є привабливою, для остаточних висновків необхідні результати дослідження OAT (Occluded Artery Trial). На сьогодні ще немає повної згоди щодо лікувальних рекомендацій для цієї групи хворих.
Ургентне ПКВ при кардіогенному шоці
Клінічно кардіогенний шок визначається наступними показниками: зниженням САТ <90 мм рт. ст, капілярним блоком з тиском >20 мм рт. ст або серцевим індексом <1,8 л/хв/м2 (рекомендації Європейського кардіологічного товариства щодо ведення гострого ІМ з елевацією ST). У цих ситуаціях ПКВ або хірургічне втручання є процедурами, що рятують життя хворого; їх необхідно виконувати в найкоротший термін. У тих випадках, коли обставини не дозволяють провести механічну реваскуляризацію або ж її можна виконати тільки з великою відстрочкою, необхідно проводити тромболітичну терапію. Незалежно від виду проведеного лікування, смертність від кардіогенного шоку у жінок вища, ніж у чоловіків.
У 2 рандомізованих контрольованих дослідженнях (SHOCK (Should We Emergently Revascularize Occluded Coronary Arteries for Cardiogenic Shock) і SMASH (Swiss Multicenter trial of Angioplasty SHock)) оцінювали ранню (ПКВ або АКШ) реваскуляризацію у хворих з кардіогенним шоком, який виник у результаті гострої дисфункції ЛШ при гострому ІМ з елевацією сегмента ST. ПКВ при кардіогенному шоці відрізняється від ПКВ при гострому ІМ, що не супроводжується кардіогенним шоком, з елевацією ST двома особливостями: 1) звичайне часове вікно для проведення ПКВ (12 год від початку симптоматики) повинно бути розширене; 2) при багатосудинному ураженні обов’язково повинна бути розглянута можливість проведення багатосудинного ПКВ. Всі дослідження, присвячені первинному ПКВ, розглядали тактику ургентної реваскуляризації тільки однієї судини, що зумовила інфаркт. Тільки при кардіогенному шоці рекомендується виконувати ПКВ в місцях усіх значних уражень. Обов’язково повинно бути розглянуте питання балонної контрпульсації. Якщо не вдається виконати порівняно повну перкутанну реваскуляризацію, у таких випадках слід проводити шунтувальну операцію. У дослідженні Benchmark Counterpulsation Outcome Registry (25 136 пацієнтів) внутрішньолікарняна смертність серед хворих, яким проводили тільки медикаментозне лікування, склала 32,5%; при перкутанному втручанні — 18,8%, при хірургічному втручанні — 19,2%. Необхідно пам’ятати, що смертність серед хворих з кардіогенним шоком при гострому ІМ без елевації ST така сама, як і серед хворих з кардіогенним шоком при гострому ІМ з елевацією ST. Внутрішньогоспітальна смертність у хворих з кардіогенним шоком при гострому ІМ залишається високою. Серед хворих віком старше 75 років з гострим ІМ, ускладненим кардіогенним шоком, результати лікування будуть краще очікуваних у випадку проведення раннього ПКВ. У цій групі пацієнтів з тих 56%, які виживають у стаціонарі, відзначається 75% виживаність протягом 1 року. В останні роки відзначають збільшення кількості реваскуляризацій серед хворих з кардіогенним шоком, імовірно, внаслідок збільшення частоти направлення хворих у стаціонар, де проводять такі процедури (Рекомендації для проведення ургентного ПКВ хворим з кардіогенним шоком: IC).
Мінімізація відстрочки початку лікування
Існує одностайна думка, що для всіх видів інтервенційного лікування пацієнтів з гострим ІМ з елевацією ST (табл. 1.44), повинні бути прикладені всі зусилля, щоб максимально зменшити строк від початку розвитку загрудинного болю та іншої симптоматики до початку безпечної та ефективної реперфузійної тактики лікування хворих з гострим ІМ і елевацією ST. Зменшення загального часу ішемії є вирішальним не тільки при проведенні тромболізису, але й при виконанні первинного ПКВ (рис. 1.134). Зменшення строків від початку симптоматики до початку лікування вірогідно поліпшує клінічний результат, у той час як збільшення цих строків асоціюється з погіршенням перфузії міокарда, незалежно від стану епікардіального кровотоку. Зусилля з мінімізації відстрочки повинні починатися з підвищення інформованості населення й включати поліпшення організації служби швидкої допомоги, як і оптимізацію проведення процедур у лікарнях і приватних клініках (див. рис. 1.134).
Таблиця 1.44. Показання до перкутанного коронарного втручання (ПКВ) при гострому коронарному синдромі з елевацією ST (гострий ІМ з елевацією ST)
| Процедура | Показання | Клас рекомендацій і рівень доказовості | Рандомізовані дослідження для рівня A або B |
| Первинне ПКВ | Хворі з загрудинним болем або іншою симптоматикою <12 год; час від кваліфікованого лікарського контакту до ПКВ <90; досвідчена процедурна бригада | IA | PAMI, GUSTO-IIB, C-PORT, PRAGUE-1 і -2, DANAMI-2 |
| Первинне стентування | Стентування під час первинного ПКВ | IA | Zwolle, Stent-PAMI, CADILLAC |
| Первинне ПКВ | При протипоказаннях до тромболізису | IC | — |
| Первинне ПКВ | Краще тромболізису, якщо час від початку симптоматики становить >3 год і <12 год | IC | — |
| Рятівне ПКВ | Якщо тромболізис неефективний протягом 45-60 хв від моменту його початку | IB | REACT |
| Ургентне (багатосудинне) ПКВ | При кардіогенному шоці, навіть у строки >12 год (до 36 год) з контрпульсатором | IC | — |
| Рутинна коронарографія і по можливості ПКВ | До 24 год після тромболізису, незалежно від наявності болю або інших проявів ішемії | IA | SIAM III, GRACIA-1, CAPITAL-AMI |
| ПКВ при ішемії після успішної ТЛТ | Внутрішньолікарняна стенокардія і/або ішемія при (першому) гострому ІМ, яке лікували за допомогою ТЛТ | IB | DANAMI-1 |
Рис. 1.134. Вірогідні варіанти відстрочки початку реперфузійної терапії у хворих з гострим ІМ з елевацією ST
Якщо передбачається виконання первинного ПКВ, всі зусилля повинні бути спрямовані на те, щоб час від першого контакту з лікарем (від моменту госпіталізації) до ПКВ становив <90 хв, включаючи час «від дверей до балона». Час «від дверей до балона» може бути зменшений при прямому направленні хворих з гострим ІМ і елевацією ST у катетеризаційну лабораторію, минаючи блок інтенсивної терапії. Однак хворим з більш тривалою відстрочкою також повинне проводитися первинне ПКВ, навіть якщо час від початку симптоматики становить 3 год. Питання про проведення реперфузійної терапії із застосуванням фібринолітиків другого — третього покоління може бути розглянутий тільки при ймовірній значній відстрочці початку первинного ПКВ (>2–3 год від моменту направлення).
Відстрочка початку лікування залежить не стільки від доклінічної організації допомоги (також як і внутрішньолікарняної допомоги), скільки від грамотності хворих, яка дозволяє мінімізувати час від початку захворювання до дзвінка до швидкої допомоги.
Показання до ПКВ при гострому коронарному синдромі з елевацією ST (гострий ІМ з елевацією ST)
Можна зробити висновок, що для хворих з гострим ІМ і елевацією ST первинне ПКВ є операцією вибору, якщо пацієнт перебуває у клініці, де є можливість виконати ПКВ і є досвідчений персонал. Хворих, що мають протипоказання до тромболізису, слід негайно направити на первинне ПКВ, оскільки тільки ця процедура дозволяє відкрити у них коронарну артерію. Ургентне ПКВ з повною реваскуляризацією є процедурою, що рятує життя хворим з кардіогенним шоком, і її проведення повинно бути розглянуте в найбільш ранні строки. У дослідженнях, у яких хворих направляли на первинне ПКВ в спеціалізовані кардіохірургічні відділення, відзначили, що порівняно з тромболізисом первинне ПКВ дає кращі клінічні результати, незважаючи на значну відстрочку початку лікування від моменту рандомізації. Перевага первинного ПКВ над тромболізисом особливо виражена в тих випадках, коли первинне ПКВ і тромболізис проводять між 3 і 12 год від початку симптоматики. Ця перевага виражається в більшій цілості міокарда при виконанні первинного ПКВ. Більше того, при збільшенні часу від початку захворювання до початку тромболізису збільшується кількість значних несприятливих кардіальних подій; збільшення часу при виконанні первинного ПКВ не впливає на рівень значних несприятливих кардіальних подій.
Обидві реперфузійні тактики, що застосовуються протягом перших 3 год, однаково ефективно зменшують зону інфаркту та знижують смертність. Таким чином, тромболізис все ще можна розглядати як діючу альтернативу первинному ПКВ, якщо його проводити протягом перших 3 год від початку симптоматики. Первинне ПКВ порівняно з тромболізисом вірогідно зменшує кількість інсультів. Тому з метою профілактики інсультів у перші 3 год від початку симптоматики необхідно проводити первинне ПКВ, а не тромболітичну терапію. У строки від 3 до 12 год також слід виконувати первинне ПКВ, оскільки воно краще рятує міокард і не ускладнюється такою кількістю інсультів, як тромболізис. На сьогодні немає доказів, що дозволяють рекомендувати фацилітивне ПКВ.
У тих випадках, коли тромболітична терапія неефективна протягом перших 45–60 хв від її початку, рекомендується виконувати рятівне ПКВ. Рекомендується проведення рутинної коронарографії і при можливості ПКВ протягом перших 24 год після успішного тромболізису навіть при відсутності симптоматики й доказової ішемії, оскільки ця тактика поліпшує результати лікування. Якщо проведення ПКВ в перші 24 год було неможливим, а у хворих, незважаючи на успішну тромболітичну терапію, є докази спонтанної або навантажувальної ішемії, пацієнтів необхідно направляти на коронарографію і реваскуляризацію, незалежно від максимальної медикаментозної терапії.
ЛІТЕРАТУРА
- Albiero R., Hall P., Itoh A. et al. (1997) Results of a consecutive series of patients receiving only antiplatelet therapy after optimized stent implantation Comparison of aspirin alone versus combined ticlopidine and aspirin therapy Circulation, 95: 1 145-1 156.
- Alcan K.E., Stertzer S.H., Wallsh E. et al. (1983) The role of intra-aortic balloon counterpulsation in patients undergoing percutaneous transluminal coronary angioplasty. Am. Heart J. 105(3): 527-530.
- Andrade J., Hiady V. (1987) Plasma protein absorption. The big twelve. In: Leonard E., Turitto V., Vroman L. (Eds.) Blood in Contact with Natural and Artificial Surfaces. New York Academy of Science New York, 158-172.
- Anwar A., Mooney M.R., Stertzer S.H. (1990) Intra-aortic balloon counterpulsation for elective coronary angioplasty in the setting of poor left ventricular function. A two center experience. J. Invas. Cardiol., 1(4): 175-180.
- Ardehali A., Ports T.A. (1990) Myocardial oxygen supply and demand. Chest, 98: 699-705.
- Ayers S.M. (1988) The prevention and treatment of shock in acute myocardial infarction. Chest, 93(Suppl. I): 17S-21S.
- Ballantyne C.M., Verani M.S., Short D. (1987) Delayed recovery of severely «stunned» myocardium with the support of a left ventricular assist device after coronary artery bypass graft surgery. J. Am. Coll. Cardiol., 10(3): 710-712.
- Barragan P., Samsous J., Silvestn M. et al. (1997) Coronary artery stenting without anticoagulation, aspirin, ultrasound guidance, or high balloon pressure prospective study of 1051 consecutive patients. Cathet. Cardiovasc. Diagn., 42: 367-373.
- Bavaria J.E., Furukawa S., Kreiner G. (1990) Effect of circulatory assists devices on stunned myocardium. Ann. Thorac. Surg., 49: 123-128.
- Bellinger R.L., Califf R.M., Mark D.B. (1988) Helicopter transport of patients during acute myocardial infarction. Am. J. Cardiol., 61: 718-722.
- Berger P.B., Bell M.R., Hasdai D. et al. (1999) Safety and efficacy of ticlopidine for only 2 weeks after successful mtracoronary stent placement. Circulation, 99: 248-253.
- Berger R.L., Saini V.K., Long W. (1973) The use of diastolic augmentation with the intra-aortic balloon in human septic shock with associated coronary artery disease. Surgery, 74(4): 601-606.
- Bertrand M.E., Legrand V., Boland J. et al. (1998) Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy m unplanned and elective coronary stenting. The Full Anticoagulation versus Aspirin and Ticlopidine (FANTASTIC) Study. Circulation, 98: 1597-1603.
- Bitti J.A., Strony J., Bnnker J.A. et al. (1995) Treatment with bivalirudin (Hirulog) as compared with heparin during coronary angioplasty for unstable or postinfarction angina Hirulog Angioplasty Study Investigators. N. Engl. J. Med., 333: 764-769.
- Bolooki H. (1989) Emergency cardiac procedures in patients in cardiogenic shock due to complications of coronary artery disease. Circulation, 79(Suppl. l): l-137-l-148.
- Braunwald E., Gurfmkel E. (1999) Advances in unstable angina the role of low molecular weight heparins Introduction and Chairmen’s summary. Heart, (Suppl. 1): II-121.
- Braunwald E., Kloner R.A. (1982) The stunned myocardium: Prolonged, postischemic ventricular dysfunction. Circulation, 66(6): 1146-1149.
- Braunwald E., Rutherford J.D. (1986) Reversible ischemic left ventricular dysfunction: Evidence for the «hibernating myocardium». J. Am. Coll. Cardiol., 8(6): 1467-1470.
- Buchwald A.B., Hammerschmldt S., Stevens J. et al. (1996) Inhibition of neointimal proliferation after coronary angioplasty by low molecular weight heparin (clivarine) and polyethyleneglycol hirudin. J. Cardiovasc. Pharmacol., 28: 481-487.
- Califf R.M., Ohman E.M. (1990) Reocclusion after thrombolytic therapy and percutaneous transluminal coronary angioplasty. Cardiac. Assists., 5(2): 1-6.
- CAPRIE Steering Committee A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) (1996) Lancet, 348: 1329-1339.
- Clinical Application of Infra-Aortic Balloon Pump. Second Edition. Bolooki H. (Ed.) (1984) Futura Publishing Company Inc.
- Cohen M., Demers C., Gurfmkel E.P. et al. (1997) A comparison of low molecular weight heparin with unfractionated heparin for unstable coronary artery disease Efficacy and Safety of Subcutaneous Enoxapann in Non Q Wave Coronary Events Study Group. N. Engl. J. Med., 337: 447-452.
- Coller B. (1992) Platelets in cardiovascular thrombosis and thrombolysis In Fozzard et al. The Heart and Cardiovascular System New York, Raven Press, 219-273.
- Coller B.S. (1985) A new munne monoclonal antibody reports an activation dependent change in the conformation and/or microenvironment of the platelet glycoprotem IIb/IIIa complex. J. Clin. Invest., 76: 101-108.
- Coller B.S., Folts J.D., Scudder L.E. et al. (1986) Antithrombotic effect of a monoclonal antibody to the platelet glycoprotem IIb/IIIa receptor in an experimental animal model. Blood, 68: 783-786.
- Colombo A., Hall P., Nakamura S. et al. (1995) Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation, 91: 1676-1688.
- Costa M.A., Sabat M., van der Giessen W.J. et al. (1999) Late coronary occlusion after intracoronary brachytherapy. Circulation, 100: 789—792.
- de Jaegere P., Mudra H., Figulla H. et al. (1998) Intravascular ultrasound guided optimized stent deployment Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur. Heart J., 19: 1214-1223.
- Demas C., Flancbaum L., Scott G. (1987) The intra-aortic balloon pump as an adjunctive therapy for severe myocardial contusion. Am. J. Emerg. Med., 5(6): 499-502.
- Emmerman C.L., Pinchak A.C., Hagen J.F. et al. (1989) Hemodynamic effects of the intraaortic balloon pump during experimental cardiac arrest. Am. J.Emerg. Med., 7: 373-383.
- Eow molecular weight heparin during instability in coronary artery disease, Fragmin during Instability in Coronary Artery Disease (FRISC) study group [see comments] (1996) Lancet, 347: 561-568.
- Faxon D.P., Spiro T.E., Minor S. et al. (1994) Eow molecular weight heparin in prevention of restenosis after angioplasty Results of Enoxaparin Restenosis (ERA) Trial. Circulation, 90: 908-914.
- Ferguson J., Waly H., Wilson J. (1998) Fundamentals of coagulation and glycoprotein IIb/IIIa receptor inhibition. Eur. Heart J., 19(Suppl. D): D3-D9.
- Fisch C., DeSanctis R.W., Dodge H.T. et al. (1988) Guidelines for percutaneous transluminal coronary angioplasty. Circulation, 78(2): 486-502.
- Fischman D.L., Leon M.B., Baim D.S. et al. (1994) A randomized comparison of coronary stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N. Engl. J. Med., 331: 496-501.
- Folts J. (1995) Drugs for the prevention of coronary thrombosis from animal model to clinical trials. J. Cardiovasc. Drugs. Ther, 9: 31-43.
- Fuchs R.M., Brin K.P., Brinker J.A. et al. (1983) Augmentation of regional coronary blood flow by intra-aortic balloon counterpulsation in patients withunstable angina. Circulation, 68: 1 1 1-123.
- Funk M., Gleason J., Foell D. (1989) Lower limb ischemia related to the use of the intra-aortic balloon pump. Heart and Lung, 18: 542-552.
- Gawaz M., Neumann F.J., Ott I. et al. (1996) Platelet activation and coronary stent implantation Effect of antithrombotic therapy. Circulation, 94279-94285.
- George B.S. (1988) Thrombolysis and intra-aortic balloon pumping following acute myocardial infarction-Experience in four TAMI studies. Cardiac. Assists., 4(3): 1-6.
- Georgen R.F., Dietrick J.A., Pifarre R. (1989) Placement of intra-aortic balloon pump allows definitive biliary surgery in patients with severe cardiac disease. Surgery, 106(4): 808-814.
- Goods C.M., al Shaibi K.F., Liu M.W. et al. (1996) Comparison of aspirin alone versus aspirin plus ticlopidine after coronary artery stenting. Am. J. Cardiol., 78: 1042-1044.
- Goodwin M., Hartman J., McKeever L. et al. (1989) Safety of intra-aortic balloon counterpulsation in patients with acute myocardial infarction receiving streptokinase intravenously. Am. J. Cardiol., 64: 937-938.
- Gottlieb S.O., Brinker J.A., Borken A.M. et al. (1984) Identification of patients at high risk for complications of intra-aortic balloon counterpulsation: A multivariate risk factor analysis. Am. J. Cardiol., 53: 1135-1139.
- Gottlieb S.O., Chew P.H., Chandra N. (1986) Portable intraaortic balloon counterpulsation: Clinical experience and guidelines for use. Cath. Cardiovasc. Diag., 12: 18-22.
- Grotz R.L., Yeston N.S. (1989) Intra-aortic balloon counterpulsation in high-risk cardiac patients undergoing non-cardiac surgery. Surgery, 106(1): 1-5.
- Gunnar R.M., Boudillon P.D.V., Dixon D.W. (1990) Guidelines for the early management of patience with acute myocardial infarction. J. Am. Coll. Cardiol., 16: 249-292.
- Gunnar R.M., Loeb H.S. (1983) Shock in acute myocardial infarction: Evolution of physiologic therapy. J. Am. Coll. Cardiol., 1: 154-163.
- Gurfmkel E.P., Manos E.J., Mejail R.I. et al. (1995) Low molecular weight heparin versus regular heparin or aspirin in the treatment of unstable angina and silent ischemia. J. Am. Coll. Cardiol., 26: 313-318.
- Hall P., Nakamura S., Maiello L. et al. (1996) A randomized comparison of combined ticlopidine and aspirin therapy versus aspirin therapy alone after successful intravascular ultrasound guided stent implantation. Circulation, 93: 215-222.
- Haycraft J. (1884) On the action of a secretion from the medicinal leech on the coagulation of blood. Proc. R. Soc. Lond. Ser. B., 36: 478-487.
- Kahn J.K., Rutherford B.D., McConahay D.R. (1990) Supported «high risk» coronary angioplasty intra-aortic balloon pump counterpulsation. J. Am. Coll. Cardiol., 51: 1151-1155.
- Kantrowitz A., Wasfie T., Freed P.S. et al. (1986) Intra-aortic balloon pumping 1967 through 1982: Analysis of complications in 733 patients. Am. J. Cardiol., 57: 976-983.
- Karsch K.R., Preisack M.B., Baildon R. et al. (1996) Eow molecular weight heparin (revipann) percutaneous translummal coronary angioplasty Results of a randomized, double blind, unfractionated heparin and placebo controlled, multicenter trial (REDUCE trial) Reduction of Restenosis After PTCA, Early Administration of Reviparin in a Double Blind Unfractionated Hepann and Placebo Controlled Evaluation. J. Am. Coll. Cardiol., 28: 1437-1443.
- Kereiakes D.J., Emcoff A.M., Miller D.P. et al. (1998) Abciximab therapy and unplanned coronary stent deployment favorable effects on stent use, clinical outcomes, and bleeding complications EPIEOG Trial Investigators. Circulation., 97: 857-864.
- Koch K.T., Piek J.J., de Winter R.J. et al. (1999) Two hour ambulation after coronary angioplasty and stenting with 6 F guiding catheters and low dose heparin. Heart, 81: 53-56.
- Kormos R.L. (1987) The role of the intra-aortic balloon as a bridge to cardiac transplantation. Cardiac. Assists., 3(2): 1-4.
- Kramer R.P. (1988) J. Helicopter- transported intra-aortic balloon pumping: Advanced technology made airborne. Cardiac. Assists., 4(2).
- Kuntz R., Baim D., Popma J. et al. (1997) Late clinical results of the stent anticoagulation regimen study (STARS) (abstract). Circulation, 96(Suppl.): I 594.
- Lablanche J.M., McFadden E.P., Meneveau N. et al. (1997) Effect of nadroparin, a low molecular weight heparin, on clinical and angiographic restenosis after coronary balloon angioplasty the FACT study Fraxiparine Angioplastie Coronaire Translummale. Circulation, 96: 3396-3402.
- Lane A.S., Woodward A.C., Goldman M.R. (1987) Massive propranolol overdose poorly responsive to pharmacologic therapy: Use of the intra-aortic balloon pump. Ann. Emerg. Med., 16(12): 1381-1383.
- Lefkovits J., Topol E. (1999) Role of platelet inhibitor agents in coronary artery disease: In Topol E., (Ed.) Textbook of Interventional Cardiology 3rd edn Philadelphia WB Saunders, 3-24.
- Lembo N.J. (1989) Failed angioplasty and intra-aortic balloon pumping. Cardiac. Assists., 5(1): 5-7.
- Leon M.B., Baim D.S., Popma J.J. et al. (1998) A clinical trial comparing three antithrombotic drug regimens after coronary artery stenting Stent Anticoagulation Restenosis Study Investigators. N. Engl. J. Med., 339: 1665-1671.
- Leon M.B., Popma J.J., Gordon P.C. et al. (1998) A clinical trial comparing three antithrombotic drug regimens after coronary artery stenting Stent Anticoagulation Restenosis Study Investigators. N. Engl. J. Med., 339: 1665-1671.
- Lincoff A.M., Cahff R.M., Mohterno D.J, et al. (1999) Complementary clinical benefits of coronary artery stenting and blockade of platelet glycoprotein IIb/ IIIa receptors Evaluation of Platelet IIb/IIIa Inhibition in Stenting Investigators. N. Engl. J. Med., 341: 319-327.
- Maalej N., Folts J. (1996) Increased shear stress overcomes the antithrombotic platelet inhibitory effect of aspirin in stenosed dog coronary arteries. Circulation, 93: 1201-1205.
- Maccioli G.A., Lucas W.J., Norfleet E.A. (1988) The intra-aortic balloon pump: A review. J. Cardiother. Anesth., 2: 365-373.
- Mangano D.T., Browner W.S., Hollenberg M. (1990) Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery. N. EngI. J. Med. 323(26): 1781-1788.
- Mehan V.K., Saizmann C., Kaufmann U. et al. (1995) Coronary stenting without anticoagulation. Cathet. Cardiovasc. Diagn., 34: 137-140.
- Mehran R., Popma J., Baim D. et al. (1998) Routine high pressure post stent dilatation did not influence clinical restenosis in STARS (abstract). J. Am. Coll. Cardiol., 31(Suppl.): 80A.
- Mercer D., Doris P., Salerno T.A. (1981) Intra-aortic balloon counterpulsation in septic shock. Can. J. Surg., 24(6): 643-645.
- Moliterno D. (1999) Anticoagulants and their use in acute coronary syndromes: In: Topol E, Textbook of Interventional Cardiology 3rd edn Philadelphia WB Saunders, 25-51.
- Nanns C., Hillegass W., Nelson C. et al. (1996) Relation between activated clotting time during angioplasty and abrupt closure. Circulation, 93: 667-671.
- Ohman M.E., Califf R.M., George B.S. et al. (1991) The use of intra-aortic balloon pumping as an adjunct to reperfusion therapy in acute myocardial infarction. Am. Heart J., 121: 895-901.
- Patrono C. (1994) Aspirin as an antiplatelet drug. N. Engl. J. Med., 330: 12871294.
- Pennington D.G., Swartz M.T. (1990) Mechanical circulatory support prior to cardiac transplantation. Sem. Thor.&Cardiovasc. Surg., 2(2): 125-134.
- Pepme C.J., Holmes D.R. Jr. (1996) Coronary artery stents American College of Cardiology. J. Am. Coll. Cardiol., 28: 782-794.
- Placebo controlled trial Randomised of effect of eptifibatide on complications of percutaneous coronary intervention IMPACT II Integnlin to Minimise Platelet Aggregation and Coronary Thrombosis II (1997) Lancet, 349: 1422-1428.
- Povenmire-lzor K., House M.A. (1989) Acute crack cocaine intoxication: A case study. Focus Crit. Care., 16(2): 112-119.
- Preiss J., Lecompte T., Ainot Y. (1996) Serial antiplatelet effects of combined treatment with ticlopidine and aspirin after stent implantation (abstract). Circulation, 94 (Suppl.)I: 685.
- Qumn M.J., Fitzgerald D.J. (1999) Ticlopidine and clopidogrel. Circulation, 100: 1667-1672.
- Randomised placebo controlled and balloon angioplasty controlled trial to assess safety of coronary stenting with use of platelet glycoprotein IIb/IIIa blockade The EPISTENT Investigators Evaluation of Platelet IIb/IIIa Inhibitor for Stenting (1998) Lancet, 352: 87-92.
- Rodnguez J., Fernandez Jurado A. et al. (1994) Ticlopidine and severe aplastic anemia (letter). Am. J. Hematol., 47: 332.
- Rupprecht H.J., Darius H., Borkowski U. et al. (1998) Comparison of antiplatelet effects of aspirin, ticlopidine, or their combination after stent implantation. Circulation, 97: 1046-1052.
- Schomig A., Neumann F.J., Kastrati A. et al. (1996) A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary artery stents. N. Engl. J. Med., 334: 1084-1089.
- Serruys P.W., de Jaegere P., Kiemeneij F. et al. (1994) A comparison of balloon expandable stent implantation with balloon angioplasty in patients with coronary artery disease Benestent Study Group. N. Engl. J. Med., 331: 489-495.
- Serruys P.W., di Mario C., Piek J. et al. (1997) Prognostic value of Intracoronary flow velocity and diameter stenosis in the short-and long-terin outcomes of coronary balloon angioplasty: the DEVATE Study (Doppler Endpoints Balloon Angioplasty Trail Europe). Circulation, 96: 3369-3377.
- Serruys P.W., Herrman J.P., Simon R. et al. (1995) A comparison of hirudin with heparin in the prevention of restenosis after coronary angioplasty Helvetica Investigators. N. Engl. J. Med., 333: 757-763.
- Serruys P.W., van Hout B., Bonnier H. et al. (1998) Randomised comparison of implantation of hepann coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II) [published erratum appears in. Lancet 1998, 352 1478]. Lancet, 352: 673-681.
- Shah P.B., Ahmed W.H., Ganz P. et al. (1997) Bivalirudm compared with heparin during coronary angioplasty for thrombus containing lesions. J. Am. Coll. Cardiol., 30: 1264-1269.
- Stemhubl S.R., Lauer M.S., Mukherjee D.P. et al. (1998) The duration of pretreatment with ticlopidine prior to stenting is associated with the risk of procedure related non Qwave myocardial infarctions. J. Am. Coll. Cardiol., 32: 1366-1370.
- Szto G., Lmnemeier T., Lewis S. et al. (1998) Safety of 10 days of ticlopidine after coronary stenting a randomized comparison with 30 days Strategic Alternatives with Ticlopidine in Stenting Study (SALTS) (abstract). J. Am. Coll. Cardiol., 31 (Suppl.): 352A.
- The EPILOG Investigators (1997) Effect of the platelet glycoprotein IIb/IIIa receptor inhibitor abciximab with lower heparin dosages on ischemic complications of percutaneous coronary revascularization. N. Engl. J. Med., 336: 1689-1696.
- Topol E.J., Cahff R.M., Weisman H.F. et al. (1994) Randomised trial of coronary intervention with antibody against platelet IIb/IIIa integrin for reduction of clinical restenosis: results at six months. The EPIC Investigators. Lancet, 343: 881-886.
- Topol E.J., Ferguson J.J., Weisman H.F. et al. (1997) Long term protection from myocardial ischemic events in a randomized trial of brief integrin beta 3 blockade with percutaneous coronary intervention EPIC Investigator Group Evaluation of Platelet IIb/IIIa Inhibition for Prevention of Ischemic Complication. JAMA, 278479-278484.
- Use of a monoclonal antibody directed against the platelet glycoprotem IIb/ IIIa receptor in high risk coronary angioplasty The EPIC Investigation (1994). N. Engl. J. Med., 330: 956-961.
- Van de Loo A., Nauck M., Noory E. et al. (1998) Enhancement of platelet inhibition of ticlopidine plus aspirin versus aspirin alone given prior to elective PTCA. Eur. Heart J., 19: 96-102.
- Van den Bos A.A., Deckers J.W., Heyndnck G.R. et al. (1993) Safety and efficacy of recombmant hirudin (CGP 39 393) versus heparin in patients with stable angina undergoing coronary angioplasty. Circulation, 88: 2058-2066.
- Wolvek S. (1989) The evolution of the intra-aortic balloon: The Datascope contribution. J. Biomaterials. AppI., 3: 527-542.