ЗАГАЛЬНІ ПОЛОЖЕННЯ
Значення гострого коронарного синдрому, до якого належить як ІМ, так і нестабільна стенокардія, у формуванні структури захворюваності і смертності від ІХС неодноразово демонструвалося авторитетними клінічними дослідженнями. Так, відповідно до європейського регістру Euro Heart Survey on Acute Coronary Syndromes I (ACS-I, Європейського кардіологічного дослідження гострого коронарного синдрому), що охоплював 25 країн Європи, в 2000–2001 рр. смертність і розвиток нефатального ІМ за 6 міс після розвитку гострого коронарного синдрому становили 10,2% (рис. 2.1).

Рис. 2.1. Смертність хворих із гострим коронарним синдромом без елевації ST за даними Euro Heart Survey on Acute Coronary Syndromes. НС — нестабільна стенокардія; NSTEMI — ІМ без елевації сегмента ST; Re-MI — повторний ІМ; Other CV — інші кардіоваскулярні захворювання; Cancer – онкологічні захворювання; Non-CV – некардіоваскулярні захворювання
ACS-I включав 10 484 пацієнти, виписаних з діагнозом «гострий коронарний синдром». Euro Heart Survey on Acute Coronary Syndromes II (ACS-II) включав 6385 пацієнтів (2004 р.) з 190 клінік 32 країн. Розподіл за типами гострого коронарного синдрому був порівнянний в обох дослідженнях — 42 і 47% склали хворі з ІМ, інші — виписані з діагнозом «гострий коронарний синдром без елевації ST» (NSTE-ACS). Середній вік пацієнтів становив 65 років, ⅔ з них чоловіки. 30-денна смертність при гострому коронарному синдромі без елевації ST практично не відрізнялася у двох дослідженнях і становила 3,5 та 3,4%, при ІМ знизилася з 8,4 до 6,4%.
Автори відзначили збільшення кількості інвазивних процедур при гострому коронарному синдромі без елевації ST. Збільшилася кількість пацієнтів, яким проводили коронароангіографію, з 52 до 63%, підвищилася також частота проведення перкутанного коронарного втручання — з 25 до 37%, включаючи стентування — 18% в ACS-I та 34% в ACS-II. Частота призначення оптимальної медикаментозної терапії (блокатори β-адренорецепторів, антиагреганти, інгібітори АПФ, статини) також підвищилася з 2001 по 2004 р. Особливо значно збільшилася частка статинів — з 53% в ACS-I до 80% в ACS-II і клопідогрела — з 29 до 61%.
Регістр GRACE (Global Registry of Acute Coronary Events), що охоплює 30 країн світу, дає приблизно такі ж числа. Цікаво, що обидва регістри фіксують переважно хворих із гострим коронарним синдромом без елевації сегмента ST (у GRACE — це 63%). Канадський регістр гострого коронарного синдрому зареєстрував найвищу смертність протягом року саме серед пацієнтів із не-Q-інфарктом — майже 10%.
Регістр гострого коронарного синдрому — CRUSADE (Coronary Revascularization UltraSound Angioplasty DEvice trial) у США демонструє значною мірою аналогічні цифри. Ангіографія проводиться в 62% випадків, перкутанне коронарне втручання — в 37%, АКШ — в 12%. Призначення медикаментозної терапії при виписці з клініки також аналогічне — ацетилсаліцилова кислота в 90% випадків, блокатори β-адренорецепторів – 83%, інгібітори АПФ — 61%, статини — 79%, клопідогрел — 56%. Середня 7-денна смертність становить 4,7%.
КЛАСИФІКАЦІЯ
Згідно з наказом № 436 Міністерства охорони здоров՚я України від 03.07.2006 р. у затверджених протоколах надання медичної допомоги за фахом «Кардіологія» у частині «Надання медичної допомоги хворим з гострим коронарним синдромом без елевації ST (ІМ без зубця Q і нестабільна стенокардія)» ці патологічні стани відносяться до рубрики I20–I22 за МКХ-10.
ОЗНАКИ ТА КРИТЕРІЇ ДІАГНОСТИКИ ЗАХВОРЮВАННЯ
Гострий коронарний синдром – група симптомів і ознак, що дозволяють запідозрити гострий ІМ або нестабільну стенокардію.
Термін «гострий коронарний синдром» використовується при першому контакті із хворими як попередній діагноз. Включає гострий коронарний синдром зі стійкою елевацією сегмента ST на ЕКГ і без такої. Перший у більшості випадків передує гострому ІМ із зубцем Q на ЕКГ, другий — гострому ІМ без зубця Q і нестабільній стенокардії (заключні клінічні діагнози).
Гострий ІМ — це некроз будь-якої маси міокарда внаслідок гострої тривалої ішемії. Нестабільна стенокардія — гостра ішемія міокарда, тяжкість і тривалість якої недостатня для розвитку некрозу міокарда. Гострий ІМ без підйому ST без Q відрізняється від нестабільної стенокардії підвищенням рівня біохімічних маркерів некрозу міокарда в крові, які при нестабільній стенокардії відсутні.
Практично можна виділити дві категорії пацієнтів із гострим коронарним синдромом (визначення Європейського товариства кардіологів):
- Пацієнти з можливим гострим коронарним синдромом і тривалим дискомфортом у грудній клітці та персистувальною елевацією сегмента ST (або блокадою лівої ніжки пучка Гіса, яка виникла). Збереження елевації сегмента ST звичайно свідчить про гостру тотальну коронарну оклюзію. Мета терапії — швидка, повна та стійка реканалізація шляхом застосування фібринолітиків (якщо вони не протипоказані) або виконання первинної ангіопластики (якщо це технічно можливо).
- Пацієнти з болем у грудній клітці і змінами на ЕКГ, які можуть свідчити про ІХС. При цьому немає персистувальної елевації сегмента ST, але є стійка або короткострокова депресія сегмента ST або інверсія зубця Т, сплощення зубця Т, псевдонормалізація зубців Т або неспецифічні зміни ЕКГ; при госпіталізації хворого може зберігатися нормальна картина ЕКГ. У цю категорію включають пацієнтів із характерними для ішемії змінами ЕКГ, але без симптомів («німа ішемія»).
Зараз очевидно, що гострі коронарні синдроми, а саме нестабільна стенокардія й ІМ, мають загальний анатомічний субстрат. Паталогоанатомічні, ангіоскопічні та біологічні спостереження довели, що нестабільна стенокардія й ІМ характеризуються різними клінічними проявами, але мають однаковий патофізіологічний механізм, а саме розрив атеросклеротичної бляшки або її ерозію, з різним ступенем накладення тромбу або дистальної емболізації. Розроблено клінічні критерії, що дозволяють клініцистові приймати своєчасні рішення і обирати найкращу тактику лікування, опираючись на стратифікацію ризику і патогенетичний підхід до втручання.
Стратегія ведення пацієнтів із гострими коронарними синдромами полягає в корекції ішемії і симптомів, динамічному спостереженні шляхом серійної реєстрації ЕКГ, повторних вимірах маркерів некрозу міокарда (тропоніну і МВ-фракції КФК) і початку відповідної терапії після підтвердження діагнозу.
Ці рекомендації стосуються лише ведення пацієнтів з підозрою на гострий коронарний синдром без стійкою елевації сегмента ST.
Слід вказати на кілька обмежень. Ці рекомендації максимально відповідають рекомендаціям Європейського товариства кардіологів 2007 р. (Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. European Heart Journal (2007) 28, 1598–1660). Вони базуються на доказах, отриманих у багатьох клінічних дослідженнях. Необхідно пам՚ятати, що ці дослідження виконували на відібраних популяціях з певними клінічними характеристиками, які не завжди відображають реальну клінічну практику лікаря. Варто визнати також швидкий прогрес у вивченні гострих коронарних синдромів; ці рекомендації відображають накопичені на цей час знання. Варто також відзначити, що рекомендації відображають найбільш сучасні технології лікування гострого коронарного синдрому, включаючи інвазивні втручання, можливість виконання яких є далеко не у всіх клініках України, але лікарі повинні знати сучасний алгоритм лікування гострого коронарного синдрому і намагатися виконувати його.
ПАТОФІЗІОЛОГІЯ
Дослідження, виконані протягом останніх десятиліть, дозволили зрозуміти і значною мірою розкрити складні механізми виникнення гострого коронарного синдрому. Взагалі, гострі коронарні синдроми зумовлені гострим або підгострим первинним зниженням постачання міокарда киснем, що провокується розривом атеросклеротичної бляшки, асоційованим із запаленням, тромбозом, вазоконстрикцією і мікроемболізацією (рис. 2.2).
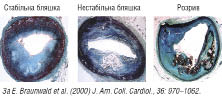
Рис. 2.2. Секційні дані
Розрив бляшки та ерозія
Доведено, що атеросклероз — це не поступовий, лінійний процес, а скоріше захворювання з фазами стабільності і нестабільності, раптова і непередбачувана зміна симптомів, пов՚язаних з розривом бляшки. Бляшки, схильні до розриву, мають велике ліпідне ядро, низьку щільність гладком՚язових клітин, високу щільність макрофагів, тонку фіброзну пластинку з дезорганізованого колагену, а також високу концентрацію тканинного фактора. Ліпідне ядро формує клітинну масу усередині колагенового матриксу бляшки. Після загибелі тучних клітин ліпідне ядро може створюватися шляхом активного розчинення колагену металопротеїназами, а не тільки шляхом пасивного накопичення. Ліпідне ядро бляшок, схильних до розриву, характеризується високим вмістом ефірів ХС зі значною часткою поліненасичених жирних кислот. На граничних ділянках розірваних бляшок частка поліненасичених жирних кислот менша порівняно з центром. Відносна пропорція різних жирних кислот може впливати на локальне формування тромбоцитарних згустків і тромбу.
Активний розрив, імовірно, пов՚язаний із секрецією протеолітичних ензимів макрофагами, які можуть послабити фіброзну покришку. Пасивний розрив бляшки пов՚язаний з фізичними силами, які діють у найслабшій ділянці фіброзної покришки в місці з՚єднання бляшки і прилеглої «нормальної» стінки. Вразливість бляшки може залежати від кругового напруження стінки, розміщення, розміру і складу ліпідного ядра, а також впливу потоку крові на поверхню стінки бляшки. Крім розриву бляшки, як один із базисних механізмів патогенезу гострого коронарного синдрому описували ерозію бляшки, що виявляють частіше у жінок, пацієнтів із цукровим діабетом і АГ. Є певні докази того, що ерозія більше поширена на фоні стенозу високого ступеня, а також при локалізації стенозу в правій коронарній артерії. При гострій коронарній смерті її поширеність оцінюють в 40%, при гострому ІМ — в 25%. Для розриву бляшки ці показники становлять відповідно 37% у жінок і 18% у чоловіків. Коли виникає ерозія, тромб прилипає до поверхні бляшки, а коли бляшка розривається, тромб утягують глибші шари бляшки, аж до ліпідного ядра; коли остання ситуація не коригується відповідними структурними змінами, вона може сприяти росту і швидкому прогресуванню атеросклеротичної бляшки (рис. 2.3).
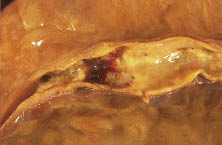
Рис. 2.3. Секційні дані — деструкція бляшки і тромбоз
Запалення
Клінічний перебіг ІХС часто характеризується непрогнозованістю, більше ніж у 60% випадків гострий коронарний синдром розвивається на фоні незначного гемодинамічного стенозу, що не перевищує 50% і не викликає ішемічних явищ. За даними метааналізу 4 великих досліджень тільки в 14% випадків гострий ІМ виникав на фоні стенозу вираженістю >70%, а ангіографічно встановлено менш інтенсивне ураження коронарних артерій в осіб з попереднім гострим коронарним синдромом або ІМ, ніж у пацієнтів зі стабільною стенокардією.
Дані клінічних спостережень свідчать про те, що причиною розвитку гострого коронарного синдрому є не вираженість стенозу, а нестабільність атеросклеротичної бляшки, тому реваскуляризаційні втручання зменшують тяжкість симптомів стенокардії, підвищують якість життя хворих з ІХС, але мало відбиваються на ризику розвитку ІМ. З іншого боку, ліпідокоригувальна терапія, практично не впливаючи на тяжкість стенозу, має виражену попереджувальну дію відносно кінцевих точок.
В останні роки накопичується все більше фактів, що свідчать про провідну роль запалення не тільки в ініціації і прогресуванні атеросклерозу, але і у розвитку його гострих клінічних проявів, оскільки нестабільність бляшки визначається насамперед поточним запальним процесом у ній. У багатьох випадках розвиток гострого коронарного синдрому провокується інфікуванням, адже відомо, що частота розвитку ІМ і кардіальна смертність значно зростають під час і після бактеріальних інфекцій та епідемій грипу.
Більшість дослідників розділяє точку зору, що активація системного запалення у хворих з гострим коронарним синдромом є первинною і лежить в основі його розвитку, а не відображає реакцію на ураження міокарда, хоча сам по собі некроз міокарда — потужний прозапальний стимул. Підвищений вміст у крові маркерів запалення є особливо значимою прогностичною ознакою коронарних подій в осіб зі стабільним або безсимптомним перебігом ІХС. Це переконливо свідчить на користь того, що запалення, яке лежить в основі дестабілізації ІХС, має самостійний характер і значною мірою незалежне як від вираженості стенозувального ураження коронарних судин, так і некрозу міокарда.
Передумовою для розвитку нестабільності бляшки є і нагромадження в ній позаклітинних ліпідів, зумовлене інтенсивним апоптозом пінистих клітин макрофагальної природи. У бляшці виникає «зона смерті», де цитотоксичне з՚єднання типу оксистеролів, що входять до складу модифікованих ліпопротеїнів, захоплених макрофагами, зумовлюють їх дисфункцію та апоптоз.
Гепатоцити секретують СРБ через 6 год після специфічної стимуляції. Тому наявність високого рівня СРБ у період до 6 год після появи симптоматики гострого коронарного синдрому не може бути пов՚язана з некрозом міокарда і відбиває рівень локального запалення в бляшці до її руйнування. Це підтверджувалося й відсутністю в досліджених хворих підвищеного рівня в плазмі крові МВ-фракції КФК або тропоніну Т. Проведення секційного дослідження померлих від ІМ показало, що рівень СРБ корелював з кількістю схильних до руйнування тонкостінних бляшок. Ці дані свідчать про те, що підвищений рівень СРБ у перші 6 год розвитку гострого коронарного синдрому відбиває запальну активність у зруйнованій бляшці.
У той же час високий рівень білків гострої фази у пацієнтів із нестабільною стенокардією не корелює ізольовано ні з вираженістю атеросклеротичного ураження судин, ні з вираженістю некрозу міокарда. Чіткіша залежність відзначена між активністю системного запалення і характером динаміки процесу після гострого коронарного синдрому, вираженість гострої фази прямо корелювала як з коротко-, так і з довгостроковим прогнозом. У 45% пацієнтів із нестабільною стенокардією, у яких рівень СРБ залишається підвищеним протягом 3 міс, ризик повторних дестабілізацій протягом 1 року був вищим.
Однією з безпосередніх причин дестабілізації атеросклеротичної бляшки може бути дія окислених ЛПНЩ на лектиноподібні рецептори LOX-1, що експресуються гладком՚язовими клітинами, з розвитком їх апоптозу. Цей ефект найбільш характерний для країв бляшки, найбільш схильних до руйнування; він повністю відтворюється в умовах культури, де окислені ЛПНЩ у концентрації >60 мкг/мл викликали загибель гладком՚язових клітин за допомогою апоптозу.
Таким чином, аналіз даних літератури дозволяє зробити висновок, що причиною руйнування бляшки з розвитком гострого коронарного синдрому є активація в ній поточного локального запального процесу, що призводить до деструкції фіброзної капсули в поєднанні зі зростанням активності клітинних і плазмових факторів системи згортання крові і пригніченням фібринолітичої системи. Активність локального запалення в судинній стінці може зростати спонтанно або потенціюватися зовнішніми факторами — системним запальним процесом з інфекційним, імунним або аутоімунним компонентами, гемодинамічними впливами, насамперед підвищенням АТ, оксидантним стресом. Дія кожного з потенціюючих факторів буде відображатися наявністю в крові відповідних маркерів — білків гострої фази, гідроперекисами ліпідів, серопозитивністю до певних збудників, антитілами до модифікованих ліпопротеїнів, HSP (білкам теплового шоку). Саме тому наявність вираженого системного запального процесу, високий рівень СРБ у плазмі крові істотно підвищують ризик руйнування атеросклеротичної бляшки і розвитку гострих коронарних явищ, але не є обов՚язковими для них. Гострий коронарний синдром може розвиватися і без вираженого підвищення вмісту в крові маркерів запалення, тому що рівень продукції запальних медіаторів безпосередньо в бляшці не завжди достатній для того, щоб суттєво вплинути на їхній вміст в системній циркуляції. Це пояснює, чому приблизно в 50% випадків гострий ІМ може розвиватися на фоні нормального вмісту в крові СРБ та інших маркерів системного запального процесу.
В епідеміологічних дослідженнях навіть помірне підвищення вмісту в плазмі крові СРБ у здорових осіб поєднується з підвищеним ризиком розвитку атеросклерозу та ІХС. Показано, що в чоловіків у верхньому квінтилі вмісту СРБ (>2,1 мг/л) ризик розвитку ІМ підвищений в 3 рази, мозкового інсульту — в 2 рази порівняно з особами в нижньому квінтилі (0,55 мг/л). У проспективному дослідженні 144 пацієнти, у яких розвилося симптоматичне ураження периферичних артерій, рівень СРБ виявився на 35% вище (1,34 порівняно з 0,99 мг/л відповідно), ніж у 144 учасників дослідження, що не мали судинних уражень протягом 60 міс спостереження. При цьому ризик розвитку ураження зростав прогресивно в кожному наступному квартилі концентрації СРБ.
Незалежне прогностичне значення рівня СРБ у визначенні ризику коронарних подій як у пацієнтів з ІХС, так і у здорових осіб показане в результатах ряду багатоцентрових досліджень. В учасників дослідження зі вмістом СРБ у верхньому квартилі ризик розвитку ІМ був вищим у 2,9 раза, ця залежність зберігалася протягом 6 років спостереження. Серед 936 здорових учасників дослідження ризик розвитку основних кардіальних явищ протягом 8 років спостереження у верхньому квінтилі розподілу концентрації СРБ був у 3 рази вище, ніж в осіб у нижньому квінтилі.
Крім цього, рівень СРБ є достовірним показником результату дестабілізації клінічного плину ІХС — летальний кінець був відзначений відповідно в 2,2; 3,6 і 7,5% випадків у кожному наступному тертилі розподілу його концентрації в плазмі крові у хворих із гострим коронарним синдромом. В іншому дослідженні протягом 8 років спостереження в осіб у верхньому квартилі вмісту СРБ ризик розвитку ІМ був в 2,9, а інсульту — в 1,9 раза вищим, ніж у нижньому.
Результати ряду великих багатоцентрових досліджень підтвердили, що підвищений рівень СРБ у крові поєднується з несприятливим коротко- і довгостроковим прогнозом ІХС, підвищеним ризиком розвитку коронарних випадків. Встановлено, що концентрація СРБ у крові в здорових осіб і у хворих з ІХС корелює з ризиком розвитку гострого коронарного синдрому, інсульту або раптової смерті і є їх достовірною прогностичною ознакою. У проспективному дослідженні встановлено, що вміст СРБ у плазмі крові в пацієнтів з ІХС, у яких розвинувся гострий ІМ, був підвищений в 4 рази порівняно з нормою і в 2 рази — порівняно із вмістом в осіб з неускладненим перебігом ІХС. У хворих з нестабільною стенокардією рівень СРБ >3 мг/л поєднувався з більш ніж дворазовим підвищенням ризику розвитку ІМ, ця залежність підсилювалася при підвищенні його рівня >10 мг/л. Підвищений рівень СРБ є достовірним предиктором підвищеного ризику розвитку ІМ, інсульту і необхідністю коронарної реваскуляризації навіть в осіб із вмістом ХС ЛПНЩ <130 мг/дл.
Рівень СРБ у крові у пацієнтів із нестабільною стенокардією не менш інформативний у прогнозуванні ризику розвитку кардіальної смерті, ніж рівень маркерів некрозу міокарда. Показано, що серед пацієнтів із рівнем тропоніну Т <0,06 мкг/л летальний кінець протягом 37 міс спостереження виникав у 1,2% випадків, до 0,6 мкг/л — у 8,7% випадків і з рівнем, що перевищує 0,6 мкг/л, — в 15,4%. Серед пацієнтів із рівнем СРБ <2 мг/л смертність склала 5,7%, <10 мг/л — 7,8%, >10 мг/л — 16,5%. Серед пацієнтів із вмістом фібриногену в крові <3,4 г/л кардіальна смерть відзначена в 5,4% випадків, із рівнем <3,9 г/л — в 12%, >4,0 г/л — в 12,9%. Між вмістом у крові СРБ і фібриногену, з одного боку, і тропоніну Т — з іншого, не відзначено достовірної залежності, яка б свідчила про те, що системне запалення більшою мірою є причиною розвитку гострого ІМ, ніж його наслідком. Встановлено також наявність кореляції між ризиком розвитку тяжких клінічних наслідків після проведення коронарної ангіопластики і вихідним рівнем СРБ: до 30-го дня — у нижньому квартилі його вмісту частота розвитку ускладнень склала 3,9%, у верхньому — 14,2%. У той же час сама ангіопластика та імплантація стента також призводять до розвитку запалення і значного зростання вмісту в крові СРБ через 48–72 год після втручання.
Трансформація стабільної стенокардії в нестабільну зазвичай поєднується з підвищенням рівня СРБ, сироваткового амілоїду А (SAA) і інтерлейкіну-6 у плазмі крові, що свідчить про активацію локального і розвиток системного запального процесу.
У хворих, що перенесли нестабільну стенокардію, підвищений рівень СРБ (>3 мг/л) є провісником повторної дестабілізації.
У той же час, незважаючи на відзначуване в більшості пацієнтів із гострим коронарним синдромом підвищення вмісту в крові маркерів запалення і високого рівня СРБ як предиктора кардіальних випадків у здорових осіб, осіб групи високого ризику і пацієнтів зі стабільною стенокардією, питання про те, у якому ступені запалення є причиною дестабілізації процесу, а в який воно виникає як наслідок ураження міокарда, залишається суперечливим. Некроз міокарда може бути потужним стимулом для продукції СРБ, і тому його рівень у крові розглядається не тільки як провісник, але і маркер ураження серця. Показано, що концентрація СРБ зростає через 4–6 год після розвитку ІМ і, подвоюючись кожні 6 год, підвищується через 24–96 год у ≥100 разів.
У ряді досліджень встановлено кореляцію між рівнем СРБ у крові, вивільненням КФК, розміром зони некрозу, ризиком розвитку недостатності ЛШ і розривів його стінки. Протягом 1 року після перенесеного ІМ концентрація СРБ >20 мг/л була показником високого ризику розвитку аневризми шлуночка, СН і кардіальної смерті.
Однак в інших роботах встановлено, що рівень СРБ вірогідно підвищується у хворих з гострим ІМ переважно в тих випадках, де його розвитку передував досить тривалий період нестабільної стенокардії, тоді як гострий розвиток ІМ може не супроводжуватися підвищенням вмісту в крові СРБ. Високий рівень СРБ при гострому коронарному синдромі відзначений і у пацієнтів без біохімічних ознак некрозу міокарда (тропонін-негативних) і тому може бути відображенням активації хронічного запального стану, характерного для атеросклерозу, що призводить до руйнування бляшки. В осіб з гострим коронарним синдромом, але без ознак ураження міокарда і підвищення рівня тропоніну I, вміст СРБ <5 мг/л не супроводжувався повторним розвитком кардіальних подій, >5 мг/л — в 11% випадків. Крім того, у здорових учасників дослідження прийом ацетилсаліцилової кислоти і статинів запобігав розвитку кардіальних випадків тільки при високих показниках СРБ. Крім цього, виживаність осіб із гострим коронарним синдромом максимальна при нормальному рівні СРБ та тропоніну і мінімальна при зростанні рівня обох, а підвищене значення кожного з показників — тропоніну, СРБ та інтерлейкіну-6 є достовірним провісником тяжкого наслідку. Найбільший ризик розвитку повторних коронарних випадків протягом 6 міс у осіб із гострим коронарним синдромом відзначається при одночасному підвищенні рівня СРБ і тропоніну I, тоді як при відсутності цих змін повторні кардіальні випадки не спостерігалися. Ці дані також свідчать про самостійне прогностичне значення рівня СРБ у крові, що не залежить від наявності некрозу міокарда.
Прогностична значимість рівня СРБ у плазмі крові у осіб з ІХС визначається наявністю прямої його залежності від стану бляшки. Так, при постмортальному дослідженні 302 випадків раптової смерті середнє значення СРБ становило 3,2 мг/л при гострому розриві бляшки, 2,9 мг/л — при її ерозії, 2,5 мг/л — при стабільній бляшці і 1,4 мкг/мл — у контролі, стан бляшки корелював з рівнем СРБ незалежно від віку, статі, паління та ІМТ. Інтенсивність фарбування макрофагів атеросклеротичних уражень СРБ була вірогідно вищою у випадках підвищеного його вмісту в плазмі крові, що означає наявність в осіб з ІХС прямого зв՚язку вмісту СРБ у плазмі крові і атеросклеротичній бляшці. Існування цього зв՚язку патогенетично зумовлене тим, що СРБ може синтезуватися не тільки в печінці, але й безпосередньо в макрофагах у зоні запалення. Показано, що в бляшках СРБ локалізується в пінистих клітинах або зв՚язаний позаклітинно з білками комплементу.
Наведені дані означають, що СРБ прямо бере участь у розвитку запального компонента атеросклерозу, ІХС і її гострих форм і може бути як показником активності процесу, так і однією з мішеней при проведенні ангіопротекторних втручань.
Наведені дані свідчать про те, що запалення відіграє визначальну роль не тільки у виникненні, але також у прогресуванні і руйнуванні атеросклеротичної бляшки, а високий рівень СРБ і ряду інших маркерів активності запалення прямо корелює з ризиком розвитку тяжких коронарних випадків.
Тромбоз
Тромбоз індукується в місці розриву або ерозії бляшки. Може призвести до швидких змін вираженості стенозу, субтотальної або тотальної оклюзії судини. Наповнене ліпідами ядро, що відкривається після розриву бляшки, є високотромбогенним і характеризується вищою концентрацією тканинного фактора, ніж інші компоненти бляшки. Більше того, існує сильний зв՚язок між активністю тканинного фактора і присутністю макрофагів. Системна прокоагулянтна активність моноцитів критично зростає при нестабільній стенокардії. Можуть також втягуватися інші фактори, які сприяють системній гіперкоагуляції; в утворенні тромбу беруть участь також гіперхолестеринемія, фібриноген, порушення фібринолізу й інфекція. Тромб, що з՚являється при гострому коронарному синдромі, переважно багатий тромбоцитами. Минущі епізоди оклюзії або субтотальної оклюзії судин і асоційовані з цим минущі симптоми і зміни ЕКГ можливо пояснити спонтанним тромболізисом.
Однак порушення цілісності атеросклеротичної бляшки не є єдиною детермінантою розвитку гострого коронарного синдрому. За результатами аутопсій безсимптомне руйнування бляшок в коронарних артеріях відзначається приблизно в 9% здорових осіб, в 22% пацієнтів із цукровим діабетом і АГ. В той же час у осіб, померлих від кардіальних причин, менше 50% всіх бляшок, що зруйнувалися (в середньому >2 у кожному випадку) призводять до розвитку внутрішньосудинного тромбозу, достатнього для відтворення критичного обмеження кровотоку.
Питання про те, як оклюзуючий тромбоз коронарної артерії з наступним розвитком ІМ може виникати на фоні помірного стенозування і зменшення судинного просвіту тільки на 50–60%, тривалий час залишалося нез՚ясованим. Відомо, що для розвитку стабільного тромбу в місці ураження судинної стінки необхідне зменшення просвіту не менше ніж на 90–95%, інакше пристіночний тромб змивається потоком крові у зв՚язку з високою швидкістю руху в коронарних артеріях і більшому градієнті тиску, що виникає в місці оклюзії. Це ймовірне протиріччя отримало чітке роз՚яснення в дослідженні, заснованому на зіставленні коронароангіограм, отриманих в 20 хворих у межах 1 тиж до розвитку ІМ, з тими, реєстрація яких передувала ІМ на 3–6 міс. Результати цього аналізу свідчили про те, що руйнування бляшки і виникнення оклюзуючого тромбу з розвитком ІМ розділені значним проміжком часу. В період, що передував ІМ за кілька тижнів або місяців, стеноз був слабко виражений (у середньому 30%), дуже рідко мав ексцентричний характер і нерівності. За 3 дні до розвитку ІМ на фоні клінічних ознак нестабільної стенокардії уражений коронарний сегмент характеризувався значним стенозом (у середньому 71%), ексцентрично розташованим ураженням і множинними нерівностями — індикаторами руйнування бляшки.
На підставі цих даних автори прийшли до висновку, що руйнування бляшки поєднується з геморагією в ній і розвитком інтрамурального тромбу, у результаті чого різко зростає вираженість стенозу, виникають умови для утворення оклюзуючого внутрішньосудинного тромбу, припинення кровотоку і розвитку ІМ. Тому кровотеча в зруйновану бляшку, розвиток інтрамурального тромбу і різке зростання ступеня стенозу є компонентами гострого коронарного синдрому, що зумовлюють розвиток оклюзуючого тромбу і гострого ІМ в осіб, у яких за кілька днів до загострення стеноз міг навіть не досягати гемодинамічно значимого рівня.
Внутрішньосудинне тромбоутворення навіть в умовах виражених порушень цілісності судинної стінки є патологічним процесом і може виникати тільки при підвищеній активності згортальної системи крові. Тому порушення гемостатичної функції є однією з найважливіших складових патогенезу гострого коронарного синдрому і особливо його трансформації в ІМ. Багаторазово показано, що ліпіди і ліпопротеїни впливають на експресію і функцію тромботичних, фібринолітичних, реологічних факторів і на гемостаз у цілому.
Особливо це характерно для ліпопротеїнів, багатих ТГ (ХМ і їх ремнантів, ЛПДНЩ), які підвищують активність фактора VII (проконвертину), інгібітору активації плазміногену 1-го типу (PAI-1), в՚язкість крові і плазми крові. Вони також активують тромбоцити, стимулюють експресію транскрипційних факторів клітинами ендотелію, тоді як ЛПВЩ інгібують агрегацію тромбоцитів і еритроцитів, зменшують в՚язкість крові, придушують активність транскрипційних факторів і інгібітору активації плазміногену 1-го типу. Тому характер реакції системи згортання і ризик розвитку оклюзуючого тромбу після руйнування або ерозії бляшки значною мірою визначаються рівнем і спектром ліпопротеїнів крові.
Гіпертригліцеридемія та аліментарна гіперліпідемія супроводжуються підвищенням активності фактора VII у результаті того, що вільні жирні кислоти, що утворюються при гідролізі ТГ до ЛПДНЩ, частково залишаються асоційованими з їхньою поверхнею, зумовлюючи появу на ній негативного заряду і активацію зовнішнього шляху згортання крові. Ці ефекти особливо виражені у осіб з порушеннями ліпідного обміну, характерними для цукрового діабету, і неодноразово встановлено, що рівень ТГ, глюкози і інсуліну в крові прямо корелює з активністю інгібітору активації плазміногену 1-го типу і зворотно — з активністю тканинного активатора плазміногену (t-PA). Крім цього, підвищення вмісту ХМ, ЛПДНЩ і ЛПНЩ у крові супроводжується зростанням її в՚язкості, вона істотно підвищена у хворих із фенотипом IV (сімейна гіпертригліцеридемія) і IIb (сімейна гіперхолестеринемія). Поєднання цих змін зумовлює значне зростання тромбогенної активності у осіб з підвищеним вмістом у крові ремнант ліпопротеїнів, багатих ТГ.
Тромб, сформований у місці розриву бляшки, може ділитися на невеликі фрагменти, які мігрують разом з потоком крові, викликаючи оклюзію артеріол і капілярів. Ці тромбоцитарні емболи можуть бути причиною невеликих ділянок некрозу (мінімальне ураження міокарда, малі інфаркти) при відсутності оклюзії епікардіальної коронарної артерії.
Вазоконстрикція
Багатий на тромбоцити тромб може виділяти вазоконстриктивні субстанції, такі як серотонін і тромбоксан А2. Це визначає вазоконстрикцію в місці розриву бляшки або в мікроциркуляторному руслі. Описаний ефект є домінуючим чинником варіантної стенокардії Принцметала, що характеризується минущим, раптовим звуженням сегмента коронарної артерії, якому не передує підвищення потреби міокарда в кисні. Ці епізоди гострої трансмуральної ішемії провокуються локалізованим коронарним вазоспазмом, що веде до сильного звуження або оклюзії однієї або кількох більших епікардіальних коронарних судин.
Міокард
Паталогоанатомічні дослідження у пацієнтів із гострим коронарним синдромом без персистувальної елевації сегмента ST дозволили виявити широкий спектр патологічних змін у міокарді, які пов՚язані з ураженою судиною. При нестабільній стенокардії міокард може залишатися незміненим або з різним ступенем вираженості некрозу. У деяких пацієнтів виявляють ділянки некрозу клітин у міокарді, появу яких пояснювали повторними епізодами емболізації.
Серцевий тропонін Т або тропонін I є найбільш чутливими і специфічними маркерами міокардіального некрозу, які стали методами вибору в обстеженні пацієнтів із підозрою на гострий коронарний синдром. Обмежені ділянки некрозу часто не вдається виявити звичайними вимірами КФК або МВ-фракції КФК. Вміст цих ферментів може залишатися в межах норми або трохи вищим верхньої границі норми. Підвищені рівні серцевого тропоніну при відсутності змін МВ-фракції КФК позначають як «мінімальне ураження міокарда». Ця концепція має велике практичне значення щодо несприятливого результату і вибору режиму терапії.
ДІАГНОЗ
Скарги
Клінічна картина гострого коронарного синдрому включає широке різноманіття симптомів. Класичні риси типового ішемічного серцевого болю добре відомі. Звичайно розрізняють кілька варіантів клінічного перебігу: тривалий (>20 хв) — ангінозний біль у спокої, виникнення вперше в житті тяжкої стенокардії (III ФК за класифікацією Канадського товариства з серцево-судинних захворювань) або недавня дестабілізація попередньо стабільної стенокардії з досягненням принаймні III ФК (прогресуюча стенокардія). Тривалий біль відзначають у 80% пацієнтів, тоді як тяжку стенокардію, яка вперше виникла, або прогресуючу стенокардію — лише у 20%.
Утім, досить розповсюдженими є атипові варіанти перебігу гострого коронарного синдрому. Вони частіше спостерігаються в пацієнтів молодого (25–40 років) і старечого (>75 років) віку, пацієнтів із цукровим діабетом і жінок. До атипових проявів нестабільної стенокардії належать біль, переважно в спокої, біль в епігастральній ділянці, порушення з боку ШКТ, пульсуючий біль у грудній клітці, біль з деякими ознаками плевриту, наростання задишки. В одному із багатоцентрових досліджень гостру ішемію міокарда діагностували в 22% пацієнтів, яких госпіталізували у відділення невідкладної допомоги з ріжучим або пульсуючим болем у грудній клітці, в 13% пацієнтів із болем типу плевриту і лише в 7% пацієнтів, у яких біль у грудній клітці відтворювався шляхом пальпації. Крім того, варіантну стенокардію, що становить частину спектра нестабільної стенокардії, нерідко не вдається діагностувати при обстеженні хворих.
Фізикальне обстеження
При фізикальному обстеженні, що включає, зокрема, огляд грудної клітки, аускультацію, вимір ЧСС і АТ нерідко не виявляють патологічних змін. Мета обстеження — виключити некардіальні причини болю в грудній клітці, можливість неішемічних серцевих розладів (перикардит, захворювання клапанів серця), потенційних сприятливих екстракардіальних факторів, пневмотораксу, ознак гемодинамічної нестабільності і дисфункції ЛШ.
ЕКГ
Реєстрація ЕКГ у спокої — ключовий елемент обстеження пацієнтів із підозрою на гострий коронарний синдром. Це корисний засіб скринінгу пацієнтів з атиповими скаргами, що дозволяє виявити ознаки інших захворювань, таких як перикардит, легенева емболія або кардіоміопатія. Бажано здійснити запис ЕКГ у момент виникнення симптомів і порівняти її графіку з моментом, коли симптоми зникнуть. Дуже важливу інформацію дає порівняння з попередніми ЕКГ, особливо у пацієнтів із супутньою серцевою патологією, такою як ГЛШ або перенесений раніше ІМ. Виражені зубці Q, які можуть свідчити про попередній ІМ, дозволяють запідозрити виражений атеросклероз коронарних артерій, але не обов՚язково свідчать про нестабільність стану на момент обстеження.
Зрушення сегмента ST і зміни зубця Т — найбільш надійні ЕКГ-індикатори нестабільної фази перебігу ІХС. Депресія сегмента ST більше ніж на 1 мм у двох або більше відведеннях ЕКГ, що виникає на фоні відповідного клінічного стану, з високою ймовірністю свідчить про гострий коронарний синдром, так само як інверсія зубців Т (більш ніж на 1 мм) у відведеннях з домінуючим зубцем R, хоча остання зміна менш специфічна.
Глибока симетрична інверсія зубців Т у передніх грудних відведеннях часто пов՚язана з тяжким стенозом проксимального відділу лівої передньої низхідної коронарної артерії. Нетипові зміщення сегмента ST і зміни зубця Т (менше ніж на 1 мм) менш специфічні. Їх нерідко виявляють у пацієнтів, у яких іншими методами вдалося виключити нестабільну стенокардію. Іноді під час ішемічних нападів виникають епізоди блокади ніжки пучка Гіса. Слід визнати, що повністю нормальна картина ЕКГ у пацієнтів з типовими ангінозними симптомами не виключає можливості гострого коронарного синдрому. Приблизно в 5% хворих із нормальною картиною ЕКГ, яких виписували з відділень невідкладної допомоги, в кінцевому результаті діагностували гострий ІМ або нестабільну стенокардію. Крім того, реєстрація нормальної ЕКГ у пацієнта з вираженим болем у грудній клітці свідчить про необхідність розгляду інших можливих причин больового синдрому.
Елевація сегмента ST свідчить про наявність трансмуральної ішемії, викликаної коронарною оклюзією. Персистувальна елевація сегмента ST характерна для формування ІМ. Минущу елевацію сегмента ST відзначають при гострому коронарному синдромі і особливо при стенокардії Принцметала.
Для виявлення або виключення наявності змін сегмента ST під час зворотних епізодів болю в грудній клітці або при німій ішемії міокарда корисне проведення моніторингу сегмента ST у множинних відведеннях.
Біохімічні маркери ураження міокарда
Серед маркерів некрозу міокарда зараз віддають перевагу серцевому тропоніну Т або тропоніну I, які є більш специфічними і надійними в цих умовах, ніж традиційні серцеві ензими, такі як КФК або її ізоензим — МВ-фракція КФК. Встановлено, що будь-яке підвищення вмісту тропоніну Т або I відображає некроз клітин міокарда. При наявності ознак ішемії міокарда (біль у грудях, зміни сегмента ST) ці зміни розцінюють як ІМ.
Комплекс тропоніну формується трьома відмінними структурними протеїнами (тропоніни I, С і Т). Розміщується в тонких волокнах скорочувального апарату тканини скелетних і серцевих м՚язів, що регулює кальційзалежну взаємодію міозину та актину. Серцеві ізоформи всіх трьох тропонінів кодуються різними генами, їх можна відрізнити моноклональними антитілами, які розпізнають певну послідовність амінокислот. Серцеві ізоформи тропоніну Т і I є винятково в кардіоміоцитах. Тому виявлення серцевого тропоніну Т або тропоніну I специфічне для ураження міокарда, що дозволяє говорити про ці маркери як про новий золотий стандарт діагностики. При умовах «псевдопозитивного» підвищення вмісту МВ-фракції КФК, наприклад при травмі скелетних м՚язів, дослідження тропонінів дозволяє виявити наявність будь-якого ураження серця. У пацієнтів із ІМ початковий ріст концентрації тропонінів у периферичній крові спостерігається через 3–4 год, що зумовлено їхнім вивільненням з депо, а при персистувальній елевації втримується протягом до 2 тиж, що пов՚язано із протеолізом контрактильного апарату. Значне пропорційне підвищення тропонінів і низькі концентрації тропоніну в плазмі крові в здорових осіб дозволяють виявляти ураження міокарда приблизно в ⅓ пацієнтів, які надходять із нестабільною стенокардією, навіть без зміни активності МВ-фракції КФК. Важливо підкреслити, що підвищення тропоніну можливе при інших небезпечних для життя станах, які проявляються болем у грудній клітці, таких як розшаровуюча аневризма аорти або емболія легенів. Це необхідно враховувати при проведенні диференціальної діагностики.
Слід визнати, що однократного визначення вмісту тропоніну при госпіталізації пацієнта недостатньо, оскільки в 10–15% пацієнтів зміни вмісту тропоніну виявляють у більш пізній період. Для того, щоб встановити або виключити наявність ураження міокарда, протягом перших 6–12 год після госпіталізації або після будь-яких наступних епізодів сильного болю в грудній клітці необхідно повторювати аналізи крові. Якщо останній епізод болю в грудній клітці був більш ніж за 12 год до першого визначення тропоніну, друге визначення можна пропустити при відсутності інших підстав підозрювати ІМ.
Підвищення вмісту серцевих тропонінів також спостерігається в умовах неішемічного ураження міокарда. Це не слід розглядати як псевдопозитивний результат тестів, а скоріше як відображення чутливості маркера. Справжні псевдопозитивні результати документовані для тропоніну Т при скелетних міопатіях або ХНН, а для тропоніну I — у зв՚язку із взаємодією імунних реактивів з ланцюгами фібрину або гетерофільними антитілами. Сучасні реактиви дозволяють перебороти ці обмеження, хоча іноді можуть спостерігатися псевдопозитивні результати.
Варто пам՚ятати, що ряд патологічних станів також може викликати підвищення рівня тропоніну:
- Контузія серця або інші травматичні ураження, включаючи операції шунтування, абляції, установка штучного водія ритму та інших.
- Застійна СН — гостра і хронічна.
- Розшарування аорти, захворювання аортальних клапанів.
- ГКМП.
- Тахі- або брадиаритмія, блокада.
- Апікальний «балонний» синдром.
- Рабдоміоліз з ураженням міокарда.
- Емболія ЛА, легенева гіпертензія.
- Ниркова недостатність.
- Гострі неврологічні захворювання, включаючи інсульт або субарахноїдальна кровотеча.
- Інфільтративні захворювання, такі як амілоїдоз, саркоїдоз, склеродермія.
- Запальні захворювання, такі як міокардит, перикардит, ендокардит.
- Отруєння токсинами або лікарським засобом.
- У пацієнтів у критичному стані, особливо з дихальною недостатністю або сепсисом.
- Опіки, особливо при >30% ураженні площі тіла.
- Екстремальні перевантаження.
Не існує фундаментальних відмінностей між оцінкою тропоніну Т і тропоніну I. Відмінності результатів досліджень переважно пояснюються різними критеріями включення пацієнтів, відмінностями способу отримання зразків крові для аналізу, використанням реактивів з різними діагностичними границями.
Зміни в часі різних маркерів некрозу міокарда наведені на рис. 2.4.
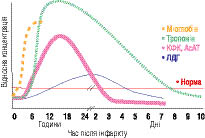
Рис. 2.4. Зміни за часом концентрації в крові маркерів ураження міокарда
Міоглобін — відносно ранній маркер, тоді як зміна рівня МВ-фракції КФК або тропоніну з՚являються пізніше. У пацієнтів із великим ІМ концентрація тропоніну залишається підвищеною протягом 1–2 тиж. Це може ускладнювати діагностику повторного некрозу (реінфаркту) у пацієнтів з недавно перенесеним ІМ. У цьому випадку перевага для виявлення реінфаркту має повторний вимір МВ-фракції КФК або міоглобіну.
Рекомендації по діагностиці
- У пацієнтів із підозрою на гострі форми ІХС діагноз повинен базуватися на комплексному аналізі клінічної картини, ЕКГ, рівня біомаркерів.
- Реєстрацію 12 відведень ЕКГ у спокої необхідно провести в межах 10 хв від моменту першого контакту хворого з лікарем і повторювати при поновленні симптомів, через 6 і 24 год і при виписці з госпіталю.
- Вимір рівня тропоніну Т або I необхідно здійснювати при госпіталізації хворого протягом 60 хв і повторити через 6–12 год при первинному негативному результаті.
- У пацієнтів без поновлення ангінозного болю при нормальній ЕКГ і негативному тропоніновому тесті показано перед випискою проведення неінвазивних стрес-тестів.
ОЦІНКА РИЗИКУ
Вибір тактики ведення пацієнтів із встановленим діагнозом «гострий коронарний синдром» визначається ризиком прогресування в гострий ІМ і ризиком смерті.
Гострі коронарні синдроми діагностують у гетерогенній групі пацієнтів з різноманітними клінічними проявами, відмінностями ступеня і вираженості коронарного атеросклерозу та різним ризиком формування тромбозу
(а саме зі швидким прогресуванням у ІМ). Для індивідуалізованого вибору адекватного лікування необхідно повторно оцінювати ризик виникнення тяжких наслідків гострого коронарного синдрому. Таку оцінку варто проводити від моменту встановлення діагнозу або при госпіталізації хворого, базуючись на доступній клінічній інформації і даних лабораторних досліджень. Первинна оцінка пізніше доповнюється інформацією про динаміку симптомів, ЕКГ-проявах ішемії, результатами лабораторних тестів і функціонального стану ЛШ. Крім віку і попереднього анамнезу ІХС, ключовими елементами оцінки ризику є клінічне обстеження, оцінка ЕКГ і біохімічних параметрів.
Фактори ризику
Похилий вік і чоловіча стать асоціюються з більш тяжким перебігом ІХС і підвищеним ризиком несприятливого наслідку. Виникнення в минулому таких проявів ІХС, як тяжка або тривала стенокардія або попередній ІМ, також асоціюється з більш частими наступними подіями. Інші фактори ризику — наявність в анамнезі дисфункції ЛШ або застійної СН, а також цукровий діабет і АГ. Більшість гарно відомих факторів ризику є також індикаторами більш поганого прогнозу у пацієнтів з нестабільним перебігом ІХС.
Клінічна картина
Важливу інформацію для оцінки прогнозу забезпечують оцінка клінічної картини, тривалість періоду після останнього епізоду ішемії, наявність стенокардії в спокої і відповідь на медикаментозне лікування. Класифікація, запропонована Ю. Браунвальдом, базується на клінічних особливостях і дозволяє оцінити клінічні результати. Саме цією класифікацією переважно користуються в наукових дослідженнях. Але для вибору оптимальної тактики лікування варто також брати до уваги інші індикатори ризику.
ЕКГ
ЕКГ — найважливіший метод не тільки для встановлення діагнозу, але й для прогностичної оцінки. У пацієнтів із депресією сегмента ST ризик розвитку наступних серцевих подій вищий, ніж у таких з ізольованою інверсією зубця Т, у яких у свою чергу ризик вищий, ніж у випадку нормальної картини ЕКГ при госпіталізації.
Результати деяких досліджень породжують сумніви щодо прогностичного значення ізольованої інверсії зубця Т. Стандартна ЕКГ у спокої не відображає адекватно динаміку розвитку коронарного тромбозу та ішемії міокарда. Майже ⅔ епізодів ішемії при дестабілізації ІХС німі і тому з низькою ймовірністю можуть бути виявлені при звичайній реєстрації ЕКГ. Корисну інформацію може дати холтерівський моніторинг ЕКГ, але його результати отримують лише через кілька годин або днів після запису. Перспективною методикою є комп՚ютеризований моніторинг ЕКГ в 12 відведеннях у режимі реального часу (on-line). У 15–30% пацієнтів із дестабілізацією ІХС виявляють минущі епізоди коливань сегмента ST, переважно депресії. У цих пацієнтів ризик розвитку наступних кардіальних подій зростає. Крім реєстрації ЕКГ у спокої та інших розповсюджених клінічних параметрів, незалежну прогностичну інформацію забезпечує моніторинг ЕКГ. У пацієнтів із кількістю ішемічних епізодів >0–2 на добу частота смерті або розвитку ІМ через 30 днів становила 9,5%, у пацієнтів із кількістю ішемічних епізодів >2–5 та >5 — 12,7 та 19,7% відповідно.
Маркери ураження міокарда
У пацієнтів з нестабільним перебігом ІХС і з підвищеними рівнями тропоніну ранні і віддалені клінічні результати несприятливі порівняно з такими в пацієнтів без змін рівня тропоніну. Поява в крові маркерів некрозу міокарда, зокрема серцевих тропонінів на фоні серцевої події, асоціюється з ризиком розвитку реінфаркту і серцевої смерті. Ризик виникнення нових подій корелює зі ступенем підвищення рівня тропоніну. За даними B. Lindahl, виражене підвищення рівня тропоніну асоціюється з високою смертністю при тривалому спостереженні, зниженою функцією ЛШ, але помірним ризиком реінфаркту. Підвищення ризику, пов՚язане зі зміною рівнів тропоніну, не залежить від інших факторів ризику, зокрема змін ЕКГ у спокої або при тривалому моніторингу ЕКГ, а також маркерів запальної активності. Негайна оцінка рівня тропоніну корисна для визначення раннього ризику в пацієнтів із гострим коронарним синдромом. Виявлення пацієнтів із підвищеними рівнями тропоніну також корисно для вибору тактики лікування в осіб з нестабільним перебігом ІХС. У недавно закінчених дослідженнях показано, що особливу користь при підвищенні рівня тропоніну дають низькомолекулярні гепарини та інгібітори глікопротеїнових рецепторів IIb/IIIa на відміну від випадків, коли рівень тропоніну не підвищується.
Маркери запальної активності
Повідомлялось про те, що факторами ризику в пацієнтів із гострим коронарним синдромом є підвищення рівнів фібриногену і СРБ, але ці дані підтверджуються не у всіх дослідженнях. Наприклад, у дослідженні FRISC (FRagmin during InStability in Coronary artery disease) підвищення рівня фібриногену асоціювалося з підвищеним ризиком смерті при короткому і тривалому спостереженні і/або підвищеним ризиком подальшого розвитку ІМ. Прогностичне значення рівня фібриногену не залежало від даних ЕКГ і рівнів тропоніну. Втім, у дослідженні ТIМ III (Thrombolysis In Myocardial Infarction) гіперфібриногенемія асоціювалася з більшою кількістю ішемічних епізодів під час перебування пацієнтів у госпіталі; разом з тим не відзначали зв՚язку з випадками смерті або ІМ під час 42-денного спостереження. Прогностичне значення підвищення рівня СРБ відзначається найбільш високим у пацієнтів з ознаками ураження міокарда. У деяких дослідженнях підвищення концентрації СРБ переважно пов՚язане з ризиком смерті при тривалому спостереженні на відміну від рівня фібриногену, що пов՚язаний з ризиком подальшого виникнення ІМ і смертністю (рис. 2.5).
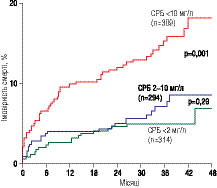
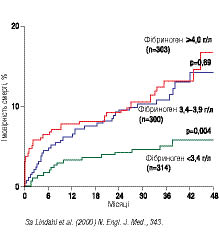
Рис. 2.5. Прогностичне значення концентрації в крові СРБ і фібриногену: зв’язок зі смертністю при нестабільній ІХС
Тропонін Т і СРБ сильно корелюють з ризиком серцевої смерті при тривалому їхньому виявленні і є незалежними факторами ризику, але їхні ефекти адитивні один до одного і до інших клінічних маркерів.
Сильними предикторами смертності при нетривалому і тривалому спостереженні є підвищені рівні МНУП і інтерлейкіну-6.
У пацієнтів із гострими коронарними синдромами виявили раннє підвищення вмісту розчинних внутрішньоклітинних молекул адгезії та інтерлейкіну-6. Підвищені рівні інтерлейкіну-6 дозволяють також ідентифікувати пацієнтів з максимальною очікуваною користю від ранньої інвазивної стратегії і тривалого антитромботичного лікування. Більш детальне вивчення цих маркерів може забезпечити додаткову інформацію про патогенез гострих коронарних синдромів.
Маркери тромбозу
Зв՚язок між підвищеним утворенням тромбіну і несприятливим результатом у пацієнтів з нестабільною стенокардією виявляли в деяких, але не у всіх дослідженнях.
З формуванням венозного тромбозу асоційовані такі зміни антикоагулянтної системи, як дефіцит протеїну С (активованого фактора коагуляції XIV), протеїну S (кофактора протеїну С), антитромбіну. Але ризик гострого коронарного синдрому не пов՚язаний із жодним із цих факторів. У популяції й у пацієнтів із нестабільною стенокардією ризик майбутніх коронарних подій був вищим у пацієнтів зі зниженою фібринолітичною активністю крові. Дотепер проведено лише кілька великих досліджень фібринолітичної активності та її зв՚язку з гострофазовими протеїнами у пацієнтів із дестабілізацією ІХС. Зараз дослідження маркерів гемостазу не рекомендують для стратифікації ризику або вибору індивідуалізованого лікування при дестабілізації ІХС.
Ехокардіографія
Систолічна функція ЛШ — важливий параметр для оцінки прогнозу, який можна легко і точно оцінити методом ехоКГ. Під час ішемії виявляють ділянки минущої гіпокінезії або акінезії сегментів стінки ЛШ, функція яких може відновитися після нормалізації кровотоку. Фонова дисфункція ЛШ, а також інші стани, такі як аортальний стеноз або ГКМП, мають важливе значення в прогностичній оцінці і веденні таких хворих.
Навантажувальний тест перед випискою
Після стабілізації стану і перед випискою хворого корисним засобом верифікації діагнозу ІХС, оцінки раннього і віддаленого ризику розвитку коронарних подій є стрес-тест.
Проба з фізичним навантаженням має високу негативну прогностичну цінність. Параметри, що відображають функцію серця, дають принаймні таку ж корисну прогностичну інформацію, як індекси ішемії міокарда, а об՚єднання цих параметрів забезпечує додаткову інформацію для оцінки прогнозу. Чимало пацієнтів не можуть виконати пробу з фізичним навантаженням, і це свідчить про поганий прогноз. Для підвищення чутливості і специфічності оцінки прогнозу в цих випадках, особливо в жінок, використовують такі методи візуалізації серця, як перфузійна сцинтиграфія міокарда і стрес-ехоКГ. Але тривалих досліджень прогностичного значення стрес-ехоКГ у пацієнтів, які перенесли епізод дестабілізації ІХС, до цього часу недостатньо.
Коронарна ангіографія
Це дослідження дає унікальну інформацію про наявність і тяжкість ІХС. У пацієнтів із множинним ураженням судин, а також зі стенозом стовбура лівої коронарної артерії ризик розвитку тяжких серцевих подій вищий. Ангіографічна оцінка характеристик і локалізації ураження судин здійснюється у тих випадках, коли розглядається необхідність реваскуляризації. Індикаторами ризику є складні, поздовжні і сильно кальцифіковані ураження, ангуляції судин. Але найвищим є ризик при наявності дефектів наповнення, які вказують на внутрішньокоронарний тромбоз.
Рекомендації зі стратифікації ризику
Оцінка ризику повинна бути точною, надійною і бажано нескладною і доступною, пов՚язаною з найменшими витратами. Рекомендується використовувати метод оцінки ризику за допомогою програми GRACE (Global Registry of Acute Coronary Events), що завантажується із сайту: www.outcomes.org/grace. Після відповіді на питання програми отримані підсумкові цифри розміщують у табл. 2.1, що допоможе визначити коротко- і довгостроковий ризик перебігу ІХС у пацієнтів, що перенесли гострий коронарний синдром.
Таблиця 2.1
Прогнозування у хворих, які перенесли гострий коронарний синдром
| Категорії ризику, розраховані за прогнозуванням госпітальної смертності та смертності через 6 міс (GRACE risk score) | ||
| Категорія ризику | Бали ризику за шкалою GRACE | Госпітальна летальність, % |
| Низький
Проміжний Високий |
<108
109–140 >140 |
<1
1–3 >3 |
| Категорія ризику | Бали ризику за шкалою GRACE | Смертність за 6 міс, % |
| Низький
Проміжний Високий |
<88
89–118 >118 |
<3
3–8 >8 |
ЛІКУВАННЯ
Протиішемічні засоби
Ці препарати зменшують споживання міокардом кисню через зниження ЧСС, АТ або ослаблення скоротливості ЛШ або викликають вазодилатацію.
Блокатори β-адренорецепторів
Докази сприятливих ефектів блокаторів β-адренорецепторів при нестабільній стенокардії базуються на результатах невеликих за обсягом рандомізованих досліджень, патофізіологічних міркуваннях і екстраполяції досвіду лікування стабільної стенокардії та гострого ІМ. Блокатори β-адренорецепторів — конкурентні інгібітори ефектів циркулюючих катехоламінів. При нестабільній стенокардії первинні ефекти блокаторів β-адренорецепторів зумовлені їхнім впливом на β1-адренорецептори і зменшенням споживання міокардом кисню.
За даними метааналізу лікування блокаторами β-адренорецепторів асоціюється зі зниженням на 13% ризику прогресування в гострий ІМ. Крім того, у рандомізованих дослідженнях доведений достовірний ефект блокаторів β-адренорецепторів на зниження смертності при гострому ІМ. Блокатори β-адренорецепторів рекомендують при гострому коронарному синдромі при відсутності протипоказань; у пацієнтів груп високого ризику перевагу віддають внутрішньовенному введенню цих препаратів (рівень доказовості В). Переконливих даних про те, що певний препарат групи блокаторів β-адренорецепторів більш ефективний при нестабільній стенокардії, немає. Якщо ймовірність виникнення побічних ефектів висока, зокрема при фоновому легеневому захворюванні або дисфункції ЛШ, на початку лікування перевагу частіше віддають препарату короткої дії. Початок парентеральної терапії блокаторами β-адренорецепторів вимагає ретельного контролю функції життєво важливих органів і бажано тривалого моніторингу ЕКГ. Потім переходять на пероральне застосування блокаторів β-адренорецепторів для досягнення цільової ЧСС 50–60 уд./хв. Протипоказаннями до призначення блокаторів β-адренорецепторів є тяжкі порушення AV-провідності, анамнестичні вказівки про БА або гостру дисфункцію ЛШ.
Нітрати
Застосування нітратів при нестабільній стенокардії переважно базується на патофізіологічних міркуваннях і клінічному досвіді. Сприятливий ефект нітратів й інших класів препаратів, таких як сидноніміни, пов՚язаний з їхнім впливом на периферичний і коронарний кровообіг. Насамперед терапевтична дія нітратів визначається ефектом венодилатації, зменшенням переднавантаження і КДО ЛШ, що веде до зменшення споживання міокардом кисню. Крім того, нітрати розширюють нормальні та атеросклеротично змінені коронарні артерії, збільшують коронарний колатеральний кровотік і пригнічують агрегацію тромбоцитів.
Дослідження ефективності нітратів при нестабільній стенокардії були невеликими за обсягом і носили характер спостережень.
Дотепер не проводили рандомізованих плацебо-контрольованих досліджень, у яких був би доведений сприятливий ефект цього класу препаратів у зменшенні вираженості симптомів і кількості несприятливих серцевих подій, а також представлені відмінності різних способів введення нітратів (внутрішньовенного, перорального, букального) щодо зменшення вираженості клінічних симптомів.
У пацієнтів із гострими коронарними синдромами, що потребують госпітального лікування, при відсутності протипоказань варто розглянути необхідність внутрішньовенного введення нітратів (рівень доказовості С). Дозу потрібно титрувати до зникнення симптомів або до появи побічних ефектів (особливо головного болю або артеріальної гіпотензії). Обмеженням для тривалої терапії нітратами є феномен толерантності, що залежить від призначеної дози і тривалості лікування.
Після досягнення клінічного ефекту внутрішньовенне введення нітратів можна замінити альтернативними методами непарентерального введення з достатніми інтервалами між прийомами препарату. Інший можливий шлях пов՚язаний із застосуванням нітратоподібних засобів, таких як сидноніміни і активатори калієвих каналів.
Блокатори кальцієвих каналів
Блокатори кальцієвих каналів — вазодилатуючі препарати. Крім того, вони безпосередньо впливають на AV-провідність імпульсів і ЧСС. За хімічною структурою і фармакологічними ефектами розрізняють три підкласи блокаторів кальцієвих каналів: дигідропіридінові похідні (ніфедипін), похідні бензотіазепіну (дилтіазем) і похідні фенілалкіламіну (верапаміл). Препарати кожного підкласу відрізняються за своєю вазодилатуючою дією, здатністю пригнічувати скорочувальну функцію міокарда і сповільнювати AV-провідність імпульсів. AV-блокаду можуть викликати фенілалкіламіни. Ніфедипін і амлодипін зумовлюють найбільш виражену дилатацію периферичних артерій, тоді як дилтіазем характеризується найбільш слабким вазодилатуючим ефектом. Усі підкласи забезпечують подібну коронарну вазодилатацію.
У декількох рандомізованих клінічних дослідженнях встановлено, що блокатори кальцієвих каналів ефективні щодо зменшення вираженості симптомів у пацієнтів із нестабільною стенокардією, причому їхній ефект подібний тому, що викликають блокатори β-адренорецепторів. При порівнянні ніфедипіну і метопрололу виявлено, що при лікуванні ніфедипіном відзначається тенденція до підвищення ризику розвитку ІМ або зворотної стенокардії порівняно з плацебо, тоді як при застосуванні метопрололу або комбінації двох препаратів частота цих подій знизилася. В одному дослідженні пацієнтам із нестабільною стенокардією протягом 51 тиж після виписки призначали блокатори β-адренорецепторів або дилтіазем. На фоні дилтіазему відзначали недостовірне підвищення ризику смерті (33% проти 20%) і повторної госпіталізації (рівень ризику 1,4). Утім, у двох інших дослідженнях дилтіазем зумовлював незначний сприятливий ефект.
Результати метааналізу ефектів блокаторів кальцієвих каналів у пацієнтів із нестабільною стенокардією дозволили припустити, що ці препарати не запобігають розвитку гострого ІМ і не знижують смертність. Зокрема, лікування короткодіючим ніфедипіном може асоціюватися з дозозалежним негативним ефектом щодо смертності в пацієнтів з ІХС. З іншого боку, існують докази захисного впливу дилтіазему і верапамілу при ІМ без елевації сегмента ST (рівень доказовості С).
Блокатори кальцієвих каналів забезпечують зменшення вираженості симптомів у пацієнтів, які вже отримують нітрати і блокатори β-адренорецепторів; їхнє призначення доцільне пацієнтам із протипоказаннями до блокаторів β-адренорецепторів, а також у підгрупі пацієнтів із варіантною стенокардією. Ніфедипін та інші похідні дигідропіридину не слід застосовувати без супутньої терапії блокаторами β-адренорецепторів. Застосування препаратів групи блокаторів кальцієвих каналів необхідно уникати при вираженій дисфункції ЛШ або порушеннях AV-провідності імпульсів.
Таким чином, антиішемічна терапія зводиться до наступного:
- Блокатори β-адренорецепторів рекомендовані при відсутності протипоказань, особливо при наявності АГ або тахікардії (IB).
- Внутрішньовенне або пероральне введення нітратів використовується для купірування ангінозних атак (IC).
- Блокатори кальцієвих каналів призначають як симптоматичну терапію додатково до нітратів і блокаторів β-адренорецепторів або пацієнтам з протипоказаннями до блокаторів β-адренорецепторів або в підгрупах з вазоспастичною стенокардією (IB).
- Ніфедипін або інші дигідропіридинові препарати не застосовують (IIIB), особливо в комбінації з блокаторами β-адренорецепторів.
Антитромбінові препарати
Внутрішньокоронарний тромбоз має істотне значення в патогенезі гострих коронарних синдромів. Виходячи з того, що тромб складається з фібрину і тромбоцитів, запобігти його формуванню і сприяти його розчиненню можуть такі групи препаратів:
- інгібітори тромбіну: прямі (гірудин) і непрямі (нефракціоновані гепарини, низькомолекулярні гепарини);
- антитромбоцитарні засоби (ацетилсаліцилова кислота, тіклопідин, блокатори глікопротеїнових рецепторів IIb/IIIa);
- фібринолітичні засоби.
Гепарини і низькомолекулярні гепарини
У попередніх рекомендаціях з лікування пацієнтів із нестабільною стенокардією та ІМ без елевації сегмента ST нефракціонований гепарин був визнаний засобом вибору при проведенні антитромбінової терапії. Втім, докази ефективності нефракціонованого гепарину менш переконливі, ніж інші стратегії лікування. У клінічній практиці підтримка терапевтичного протромбінового контролю ускладнена в зв՚язку з непрогнозованим зв՚язуванням гепарину з протеїнами плазми крові. Крім того, гепарин характеризується обмеженою ефективністю у випадках, коли тромбін зв՚язаний зі згустками, багатими тромбоцитами.
Недоліки нефракціонованого гепарину:
- гепарин зв՚язується з білками плазми крові, адсорбується на поверхні ендотеліальних клітин, фагоцитується макрофагами — втрата біологічної активності введеного гепарину і погана передбачуваність антикоагулянтного ефекту в конкретного хворого;
- при призначенні гепарину з лікувальною метою необхідний ретельний індивідуальний лабораторний контроль. В одному з великих досліджень TIMI 9B встановлено, що під час внутрішньовенного введення гепарину АЧТЧ перебувало в межах терапевтичних значень тільки близько 30% усього часу протягом доби;
- практично складно забезпечити як мінімум 48 (краще 72) год безперервної внутрішньовенної інфузії препарату;
- тромбоцитарний фактор IV здатний інактивувати гепарин, крім цього тромбоцити здатні зв՚язувати фактор Xa і у такий спосіб захищати його від дії гепарину;
- гепарин через великі розміри своєї молекули не здатний інактивувати тромбін, зв՚язаний з фібрином і субендотеліальними структурами, у такий спосіб гепарин не може активно протидіяти фібриноутворенню в місці розриву бляшки;
- гепарин здатний підсилювати агрегацію тромбоцитів під впливом різних індукторів, крім тромбіну;
- показано, що при нестабільній стенокардії застосування гепарину з підтримкою АЧТЧ у 2 рази вище контролю супроводжується швидким зниженням рівня фібринопептиду А, однак зниження рівня фрагмента протромбіну 1+2 (F1+2) не відбувається. Таким чином, знижуючи активність тромбіну, гепарин не впливає на його утворення і ризик розвитку тромбозу під час терапії гепарином зберігається;
- дія гепарину триває тільки протягом його безперервної внутрішньовенної інфузії, більше того, після припинення гепаринотерапії відзначають реактивацію тромботичного процесу з можливим розвитком ІМ;
- частота імунної тромбоцитопенії на фоні введення гепарину становить 1–3%, її виникнення пов՚язане з появою антитіл до гепарину і компонентів мембрани тромбоцитів, які активують тромбоцити і викликають розповсюджений тромбоз мікросудин, сама тромбоцитопенія носить вторинний характер і утворюється в результаті споживання тромбоцитів у тромбах, що утворюються.
При відсутності ацетилсаліцилової кислоти лікування гепарином асоціюється з більш низькою частотою виникнення рефрактерної стенокардії, ІМ і смерті порівняно з плацебо (зниження ризику на 29%), тоді як ацетилсаліцилова кислота знижує ризик порівняно з плацебо на 56%. Комбінація ацетилсаліцилової кислоти і гепарину не мала вірогідно більшого захисного ефекту, ніж ацетилсаліцилова кислота в якості монотерапії. Початковий захисний ефект гепарину зникав після припинення терапії (феномен рикошету). Відповідно не було доказів стійкого захисного ефекту гепарину.
За даними метааналізу ефектів гепарину на додаток до терапії ацетилсаліциловою кислотою у пацієнтів із нестабільною стенокардією (6 рандомізованих досліджень) частота смерті або ІМ у групі ацетилсаліцилова кислота + гепарин становила 7,9%, у групі монотерапії ацетилсаліциловою кислотою — 10,3% (абсолютне зниження ризику на 2,4%; співвідношення ризику 0,74 (95% довірчі інтервали (ДІ) 0,5–1,09); p=0,10 (рівень доказовості В).
Ці результати не дозволяють впевнено говорити про доцільність призначення гепарину на додаток до ацетилсаліцилової кислоти. Втім, більші за обсягом дослідження дотепер не проводилися. Незважаючи на це, в клінічних керівництвах рекомендують застосовувати стратегію одночасного використання нефракціонованого гепарину та ацетилсаліцилової кислоти, що можна розцінювати як прагматичну екстраполяцію існуючих доказів.
Порівняно з нефракціонованим гепарином низькомолекулярні гепарини характеризуються посиленою активністю проти фактора Ха, порівняно з активністю проти фактора анти-IIа (антитромбінова активність). Крім того, низькомолекулярні гепарини менш чутливі до тромбоцитарного фактора IV і мають більш прогнозований антикоагулянтний ефект з нижчою ймовірністю виникнення тромбоцитопенії.
Перевагами низькомолекулярного гепарину також є:
- значно краща порівняно зі звичайним гепарином прогностичність антитромботичного ефекту через відсутність зв՚язування з білками плазми крові і мембранами ендотеліоцитів, відповідно терапія низькомолекулярними гепаринами не вимагає настільки ретельного індивідуального лабораторного контролю;
- вища біодоступність (до 90% після глибокої підшкірної ін՚єкції) низькомолекулярних гепаринів, що дозволяє призначати їх підшкірно не тільки з профілактичною, але й лікувальною метою;
- більш тривала антитромботична активність (період напіввиведення >4,5 год після внутрішньовенного введення проти 50–60 хв у звичайного гепарину) з можливістю призначення 1–2 рази на добу.
Ці препарати можна призначати підшкірно, виходячи з дози, що залежить від маси тіла пацієнта; при цьому не потрібен лабораторний контроль. Різні низькомолекулярні гепарини характеризуються подібною активністю в запобіганні і лікуванні венозного тромбозу, незважаючи на деякі відмінності у фармакології і періоді напіввиведення. У декількох клінічних дослідженнях, проведених останнім часом, порівнювали ефективність низькомолекулярних гепаринів з плацебо або з нефракціонованим гепарином.
У дослідженні FRISC довели користь застосування дальтепарину порівняно з плацебо у пацієнтів із нестабільною стенокардією або ІМ без елевації сегмента ST, які одержували фонову терапію ацетилсаліциловою кислотою, а також доцільність призначення такого лікування протягом тривалого періоду. У 4 рандомізованих дослідженнях порівнювали ефективність різних низькомолекулярних гепаринів і нефракціонованого гепарину.
Результати метааналізу 4 досліджень не дозволили отримати переконливі докази відмінності безпеки та ефективності між низькомолекулярними гепаринами і нефракціонованим гепарином. Метааналіз свідчив про те, що тривале застосування низькомолекулярних гепаринів асоціювалося з підвищенням ризику великих кровотеч (співвідношення ризику 2,26; 95% ДІ 1,63–3,41; p<0,0001).
Проте результати подальших досліджень змінили точку зору на ефективність низькомолекулярних гепаринів. Існують переконливі докази того, що в пацієнтів, які отримують ацетилсаліцилову кислоту, низькомолекулярні гепарини більш ефективні порівняно з плацебо (рівень доказовості А). У 2 дослідженнях отримані дані на користь низькомолекулярного гепарину (еноксапарину) порівняно з нефракціонованим гепарином при застосуванні на початку лікування.
Оскільки у хворих, яким вводять низькомолекулярні гепарини, важко визначити рівень активності антикоагулянту (наприклад визначити АЧТЧ), кардіологи відділень інтенсивної терапії висловлюють побоювання з приводу заміни нефракціонованого гепарину низькомолекулярним для хворих, яким планується проведення катетеризації з можливим перкутанним коронарним втручанням.
У дослідженні NIСЕ-1 внутрішньовенне введення еноксапарину (1,0 мг/кг маси тіла) здійснювали в 828 хворих із наступним спостереженням після елективної ангіопластики без внутрішньовенного введення інгібітору глікопротеїнових рецепторів IIb/IIIа. Частота кровотеч (1,1% для великих кровотеч і 6,2% — для малих через 30 днів) була порівнянна з частотою, виявленою в попередніх дослідженнях, у яких пацієнтам вводили нефракціонований гепарин.
Як вже вказувалося, порівняння низькомолекулярних гепаринів з нефракціонованим гепарином проводили в 4 великих рандомізованих дослідженнях (рис. 2.6).
У дослідженні FRIC (фрагмін при нестабільної ІХС) 1482 хворим із нестабільною стенокардією або ІМ без підйому сегмента SТ вводили дальтепарин (120 МО/кг підшкірно 2 рази на добу) або нефракціонований гепарин протягом 6 днів. З 6-го по 45-й день хворі були знову рандомізовані по групах для введення дальтепарину (подвійна сліпа фаза) (120 МО/кг 1 раз на добу) або плацебо. Протягом першого етапу дослідження ризик смерті, розвитку ІМ або зворотної стенокардії був недостовірно вищим при застосуванні дальтепарину (9,3% порівняно з 7,65%; р=0,33), а ризик смерті або розвитку ІМ не змінювався (3,9% порівняно з 3,6%; р=0,8). Частота летального результату при застосуванні дальтепарину також була трохи вищою (1,5% порівняно з 0,4% при введенні нефракціонованого гепарину; р=0,057). У період з 6-го по 45-й день частоту летального кінця, розвиток ІМ або зворотної стенокардії було порівняно в групах застосування препарату і плацебо.
Рис. 2.6. Результати 4 досліджень ефективності гепаринів при гострому коронарному синдромі. NSTEMI — ІМ без елевації сегмента ST; НМГ — низькомолекулярні гепарини; НФГ — нефракціонований гепарин; ВР — відносний ризик; NS — відсутність статистично достовірних відмінностей; FRAXIS — Fraxiparine in Ischemic Syndrome; FRIC — Fragmin in Unstable Coronary Artery Disease; ESSENCE — Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q wave Coronary Events
У дослідженні ЕSSENCЕ еноксапарин (1 мг/кг 2 рази на добу підшкірно) порівнювали зі стандартним нефракціонованим гепарином (5000 ОД болюсно) з наступною інфузією при корекції дози за величиною АЧТЧ у межах від 55 до 86 і введенням протягом від 48 год до 8 днів (середня тривалість в обох групах — 2,6 дня). При застосуванні нефракціонованого гепарину необхідна величина АЧТЧ досягалася в період від 12 до 24 год тільки у 46% хворих. Комплексний показник, що включає смертність, розвиток ІМ або зворотної стенокардії, знижувався при застосуванні еноксапарину на 16,2% через 14 днів (19,8% для нефракціонованого гепарину порівняно з 16,6% для еноксапарину; р=0,019) і на 19% через 30 днів (23,3% проти 19,8%; р=0,017). Смертність не змінювалася, а для частоти летального результату і розвитку ІМ відзначали тенденцію до зниження на 29% (р=0,06) через 14 днів і на 26% (р=0,08) через 30 днів.
У дослідженні ТIМI 11B 3910 хворих із UA/NSTEMI (Unstable Angina/Non–ST-Elevation Myocardial Infarction) рандомізованих по групах введення еноксапарину (30 мг внутрішньовенні болюсні ін՚єкції, потім по 1 мг/кг підшкірно через кожні 12 год) або нефракціонованого гепарину (болюсна ін՚єкція 70 ОД/кг, потім інфузія — 15 ОД/кг/год із корекцією дози за величиною АЧТЧ до досягнення величини АЧТЧ, що перевищує в 1,5–2,5 раза контрольну). Після терапії хворих переводили на амбулаторне лікування, під час якого тим, кому раніше вводили нефракціонований гепарин, 2 рази на добу призначали еноксапарин або плацебо. Ця стадія дослідження була рандомізована подвійна сліпа. Еноксапарин вводили в середньому 4,6 дня, а нефракціонований гепарин — 3 дні. Комплексний показник, що включав смертність, частоту розвитку ІМ і потребу ургентної реваскуляризації (кількість нападів зворотної стенокардії, що вимагає негайного проведення коронарної реваскуляризації в період госпіталізації або після виписки, що призвело до повторної госпіталізації і проведення коронарної реваскуляризації), знижувався на 8-му добу з 14,5 до 12,4%; р=0,048; через 43 дні — з 19,6 до 17,3%; р=0,048. Смертність або частота розвитку ІМ через 14 днів знижувалася з 6,9 до 5,7%; р=0,114; через 43 дня — з 8,9 до 7,9%; р=0,276. Амбулаторне лікування не мало істотних переваг, більше того, при амбулаторному лікуванні ризик виникнення сильної кровотечі вірогідно підвищувався. Застосування еноксапарину як при стаціонарному, так і при амбулаторному лікуванні супроводжувалося також підвищенням ризику розвитку малих кровотеч.
Дослідження FRAXIS включало три паралельні групи і було присвячене порівнянню низькомолекулярного гепарину надропарину, що вводиться протягом 6 або 14 днів, з нефракціонованим гепарином, що застосовували як контроль. У дослідження були включені 3468 хворих із UA/NSTEMI. Комплексний показник, що включав смертність, частоту розвитку ІМ або рефрактерної стенокардії, становив через 14 днів 18,1% у групі нефракціонованого гепарину, 17,8% — у групі хворих, яким вводили надропарин протягом 6 днів, і 20,0% — у групі осіб, з призначенням надропарину протягом 14 днів. Через 3 міс цей показник відповідно становив 22,2; 22,3 і 26,2%; р<0,03 при порівнянні даних у групі 14-денного застосування надропарину та у групі введення нефракціонованого гепарину. У хворих, яким призначали надропарин, в усі періоди дослідження відзначали тенденцію до підвищення смертності і комплексного показника, що характеризує смертність і частоту розвитку ІМ.
Таким чином, у 2 дослідженнях з еноксапарином продемонстрована перевага цього препарату порівняно з нефракціонованим гепарином, а в 2 дослідженнях (одне —з дальтепарином, друге — з надропарином) продемонстрована нейтральна дія або виявлені несприятливі тенденції. Такі різнорідні результати можна пояснити цілим рядом причин — розходженнями в групах хворих, типі дослідження, дозуваннях гепарину, властивостях різних низькомолекулярних гепаринів (різну молекулярну масу і співвідношення антифактора Ха і антифактора IIа), а також іншими неідентифікованими впливами. При метааналізі результатів 2 досліджень з еноксапарином за участю 7081 хворого виявлене статистично достовірне зниження (приблизно на 20%) смертності, частоти розвитку ІМ або потреби в терміновій реваскуляризації на 2-; 8-; 14-й та 43-й день і смертності або частоти розвитку ІМ на 8-; 14-й та 43-й день. На 8-; 14-й та 43-й день відзначали також тенденцію до зниження смертності.
Незважаючи на привабливість порівняння відносних ефектів лікування за допомогою різних низькомолекулярних гепаринів (див. рис. 2.6), варто визнати обмеженість такого непрямого порівняння. Єдино надійним є безпосереднє порівняння в ході проведення добре спланованого клінічного дослідження або декількох досліджень. Порівняння різних терапевтичних засобів (наприклад різні препарати низькомолекулярних гепаринів) зі стандартним препаратом (наприклад нефракціонованим гепарином) у різних дослідженнях не дозволяє зробити висновок про відносну ефективність різних низькомолекулярних гепаринів, що зумовлено варіабельністю оцінюваних параметрів як у контрольній, так і експериментальній групі внаслідок розходжень у протоколах дослідження, у супутньому лікуванні і т.д. Подібні міркування застосовні і до порівняння дії інгібіторів тромбоцитарних глікопротеїнових рецепторів IIb/IIIа.
У дослідженнях FRISC, FRIC, ТIMI 11В, а також в FRISC II оцінювали можливі переваги тривалого введення низькомолекулярних гепаринів після виписки з лікарні. У перших 3 дослідженнях не вдалося продемонструвати переваги такого лікування після гострої фази захворювання. У дослідженні FRISC з 6-го по 35-й або 45-й день вводили дальтепарин у більш низьких дозах; у дослідженні FRIC хворих після первісного 6-денного лікування повторно рандомізували по групах для додаткового введення дальтепарину протягом 40 днів. У дослідженні ТIMI 11В період амбулаторного лікування становив від 5 до 6 тиж, а в дослідженні FRAXIS — 1 тиж. Дослідження FRISC II відрізнялося за своїм типом: дальтепарин вводили всім хворим мінімум 5 днів. Потім хворі були рандомізовані по групах для введення плацебо або дальтепарину 2 рази на добу протягом 90 днів. При аналізі результатів досліджень виявлене значне зниження в групі дальтепарину комплексного показника, що включав смертність і частоту розвитку ІМ, через 30 днів (3,1% порівняно з 5,9%; р=0,002), але не через 3 міс (6,7% порівняно з 8,0%; р=0,17). Показник, що характеризує смертність, частоту розвитку ІМ або частоту реваскуляризації протягом усього періоду лікування, знизився через 3 міс (29,1% порівняно з 33,4%; р=0,031). Переваги тривалого застосування дальтепарину проявлялися лише в тих хворих, які відповідали на лікування і у яких на початку дослідження був підвищений рівень тропоніну Т. Ці результати можуть бути одним з показань для тривалого застосування низькомолекулярних гепаринів у деяких хворих, які піддаються лікуванню або в яких відкладене проведення ангіографії.
Загалом можна зробити висновок про те, що «гостре» застосування низькомолекулярних гепаринів принаймні не менш ефективне, ніж нефракціонованого гепарину (рівень доказовості А). Утім, еноксапарин мав переваги порівняно з нефракціонованим гепарином у 2 дослідженнях по прямих порівняннях препаратів (по комбінованій кінцевій точці — сумі випадків смерті, ІМ і зворотної стенокардії).
Низькомолекулярні гепарини мають важливі практичні переваги, які полягають в простоті застосування, більш стійкому антитромбіновому ефекті, відсутності потреби в моніторингу, а також у профілі безпеки застосування, подібному нефракціонованому гепарину. Результати спостережень дозволяють припустити подібність профілю безпеки низькомолекулярних гепаринів і нефракціонованого гепарину при застосуванні разом з інгібіторами глікопротеїнових рецепторів IIb/IIIa (дослідження NICE, 2000). Помірні за обсягом дослідження за участю 750 пацієнтів свідчать про кращу ефективність і безпеку еноксапарину порівняно з нефракціонованим гепарином у пацієнтів, які також отримували ептіфібатид. Утім, докази на користь тривалого амбулаторного застосування низькомолекулярних гепаринів менш переконливі.
Інгібітори фактора Ха
Упродовж останніх кількох років проводилися дослідження селективного блокатора фактора Ха, синтетичного пентасахариду фондапаринуксу. У дослідженні OASIS-5 (Organization to Assess Strategies for Ischaemic Syndromes) порівнювали ефективність застосування 2,5 мг фондапаринуксу підшкірно 1 раз на добу з еноксапарином — 1 мг кг 2 рази на добу протягом 8 днів (у середньому — 5,2 дня). Первинні кінцеві точки — смерть, ІМ або стійка ішемія на 9-й день зафіксовані однаково часто — в 5,7% у групі еноксапарину і 5,8% — фондапаринуксу, але частота великих кровотеч у групі фондапаринуксу була майже вдвічі менша — 2,2% проти 4,1% у групі еноксапарину; р<0,001. Таким чином, комбінована кінцева точка спостерігалася частіше в групі еноксапарину — 9,0% проти 7,3%; р<0,001. На 30-й день відзначали більш низьку смертність у групі фондапаринуксу — 2,9% проти 3,5%; р<0,02; така ж тенденція спостерігалася через 6 міс після гострого коронарного синдрому — смертність у групі фондапаринуксу становила 5,8% проти 6,5% у групі еноксапарину; р<0,05. Комбінована кінцева точка, що включала смерть, ІМ або інсульт через 6 міс, також була менше при застосуванні фондапаринуксу — 11,3% проти 12,5%; р<0,007.
Прямі інгібітори тромбіну
У дослідженні GUSTO IIb (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries) оцінювали ефективність прямого інгібітору тромбіну гірудину і гепарину у пацієнтів із гострим коронарним синдромом, які не отримували тромболітичних засобів. Сприятливі наслідки терапії гірудином спостерігали в ранній термін (через 24 год і 7 днів), але на 30-й день відмінність між клінічними групами не була статистично достовірною.
У дослідженні OASIS-2 оцінювали ефективність застосування гірудину в більш високій дозі протягом 72 год порівняно з нефракціонованим гепарином. Первинною кінцевою точкою була смерть від серцево-судинних причин або ІМ через 7 днів, що відбулася в 4,2% пацієнтів у групі нефракціонованого гепарину і в 3,6% у групі гірудину; р=0,077. Ефект лікування досягався протягом перших 72 год (відносний ризик 0,76; ДІ 0,59–0,99). Кількість кровотеч, які вимагали трансфузії, збільшилася (1,2% проти 0,7%), але кількість небезпечних для життя кровотеч або інсультів не збільшилася.
Дані комбінованого аналізу результатів досліджень OASIS-1, OASIS-2 і GUSTO IIb вказують на те, що ризик серцево-судинної смерті або ІМ знизився на 22% через 72 год, на 17% — через 7 днів і на 10% — через 35 днів після початку лікування (рівень доказовості В). Результати статистично достовірні через 72 год і 7 днів і характеризуються граничною вірогідністю через 35 днів; р=0,057. Гірудин визнали як засіб для лікування пацієнтів з гепариніндукованою тромбоцитопенією, але жоден з гірудинів до цього часу не отримав офіційного дозволу для лікування гострого коронарного синдрому.
Ефективність ще одного прямого інгібітору тромбіну — бівалірудину порівняно з нефракціонованим гепарином вивчали у хворих, яким проводили перкутанне коронарне втручання. Дослідники встановили вірогідно нижчу частоту значних кардіальних ускладнень (смерть, ІМ, повторні реваскуляризації) у групі бівалірудину (6,2% проти 7,9%; р<0,039) і частоту кровотеч (3,5 й 9,3% відповідно; р<0,001) на 7-й день дослідження. Таким чином, бівалірудин розглядається як альтернативна ургентна антикоагулянтна терапія при проведенні перкутанного коронарного втручання.
У дослідженні ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) порівнювали ефективність 3 медикаментозних стратегій у хворих із гострим коронарним синдромом середнього і високого ризику, у більшості з яких проведене перкутанне коронарне втручання (56,3%) і шунтування (11,1%). На 30-й день порівнювали частоту значних коронарних подій (смерті від будь-якої причини, ІМ або позапланової реваскуляризації внаслідок повторної ішемії) і частоту кровотеч на тлі застосування нефракціонованого гепарину або низькомолекулярних гепаринів поєднано з інгібіторами глікопротеїнових рецепторів IIb/IIIa (1-ша група — 4603 хворих); бівалірудин поєднано з інгібіторами глікопротеїнових рецепторів IIb/IIIa (2-га група — 4604 хворих); тільки бівалірудин (4612 хворих). Не виявлено відмінності в частоті кардіальних ускладнень у всіх трьох групах, але частота кровотеч була нижчою у хворих, що отримували бівалірудин, порівняно з 1-ю групою (3,0% проти 5,7%; р<0,001).
Антагоністи вітаміну К
Незважаючи на те що в невеликих дослідженнях поєднання антагоністів вітаміну К з ацетилсаліциловою кислотою давало виграш у частоті кардіальних кінцевих точок, підвищена частота кровотеч перекривала цей позитивний ефект, а з огляду на досить вдалу комбінацію (ацетилсаліцилова кислота + клопідогрел), антагоністи вітаміну К у стандартних ситуаціях не використовуються і можуть розглядатися як терапія при фібриляції передсердь.
Корекція ускладнень антитромбінової терапії, пов՚язаних з кровотечами
При незначних кровотечах зазвичай досить припинити введення антитромбінових засобів. При виражених кровотечах, зокрема блюванні кров՚ю, мелені або внутрішньочерепних геморагіях, необхідним може виявитися введення антагоністів гепарину, що зумовлює підвищення ризику рикошетного тромботичного феномену. Антикоагулянтні і геморагічні ефекти нефракціонованого гепарину коригуються протаміном сульфату в еквімолярній концентрації. Протамін нейтралізує активність антифактора IIа, але лише частково нейтралізує антифактор Ха низькомолекулярного гепарину.
Таким чином, рекомендації із застосування антикоагулянтів наступні:
- Антикоагулянти рекомендуються всім пацієнтам із гострим коронарним синдромом на додаток до антитромбоцитарної терапії (IA).
- Антикоагулянти підбирають відповідно до певного ризику розвитку кровотечі та ішемічних подій (IB). Показано такі антикоагулянти, як нефракціонований гепарин, низькомолекулярні гепарини, фондапаринукс, бівалірудин. Вибір залежить від обраної стратегії — ургентної інвазивної, ранньої інвазивної або консервативної (IB).
- У випадку ургентної інвазивної стратегії нефракціонований гепарин (IC) або еноксапарин (IIa), або бівалірудин (IB) необхідно призначити негайно.
- При відсутності ургентної ситуації і наявності часу для вибору стратегії лікування рекомендується призначення фондапаринуксу, який має кращий профіль ефективність/безпека (IA). Еноксапарин демонструє менш оптимальне співвідношення ефективність/безпека (IIa).
- При інвазивних втручаннях введення нефракціонованого гепарину (IC), еноксапарину (IIa) або бівалірудину (IB) необхідно продовжувати під час проведення процедури.
- Введення антикоагулянтів повинне бути припинене протягом 24 год після інвазивної процедури (IIa). При консервативній стратегії введення фондапарину, еноксапарину або інших низькомолекулярних гепаринів може тривати до виписки з госпіталю (IB).
Антитромбоцитарні засоби
У розумінні стратегії антитромбоцитарної терапії важливо знати, що за добу виробляється приблизно 1011 тромбоцитів у фізіологічних умовах, при необхідності інтенсивність вироблення може збільшитися в 10 разів.
Тривалість життя тромбоцитів становить приблизно 10 днів. Таким чином, тромбоцити — без՚ядерні клітини крові, які забезпечують оборотне джерело хемокінів, цитокінів і факторів росту, які брикетуються і упаковані в гранулах. Крім того, активовані тромбоцити можуть синтезувати простаноїди (насамперед тромбоксан A2) з арахідонової кислоти фосфоліпідів за допомогою швидко скоординованої активації фосфоліпази, ЦОГ-1 і тромбоксансинтетази-3. Недавно сформовані тромбоцити також стимулюють утворення ізоформ ЦОГ (ЦОГ-2) і простагландин E-синтази, це явище помітно асоційоване з прискореною регенерацією тромбоцитів, і хоча активовані тромбоцити не можуть синтезувати білки de novo, вони можуть транслювати конститутивну мРНК (матричну РНК) у білки. Таким чином, тромбоцити можуть брати участь у запаленні і судинному пошкодженні, антитромбоцитарні ефекти можуть впливати на білки (похідні тромбоцитів), сигнальні для ініціації запальної і/або проліферативної відповіді.
Утворення тромбу в результаті розриву атеросклеротичної бляшки
У процесі розриву атеросклеротичної бляшки відбувається оголення прокоагулянтних субстанцій субендотеліального простору судини, а також ліпідного ядра бляшки, у нормі ізольованих від протікаючої крові клітинами ендотелію.
Такими субстанціями є компоненти сполучнотканинного матриксу судин — головним чином колаген, а також фібронектин, ламінин, вітронектин та ін. Висока тромбогенність ліпідного ядра бляшки пояснюється нагромадженням у ній у великих кількостях тканинного фактора (тканинного тромбопластину), що звільняється при руйнуванні пінистих клітин і макрофагів, також тканинний фактор утримується і в ендотеліальних клітинах, але в нормі їм більш властиві антитромботичні функції.
Ендотелій, крім бар՚єрної функції, активно перешкоджає адгезії та агрегації тромбоцитів за рахунок синтезу простацикліну (простагландину I2), ендотеліального релаксуючого фактора, а також активаторів плазміногену тканинного і урокіназного типів, крім того, на поверхні ендотеліальних клітин виявлений глікопротеїд тромбомодулін, що має здатність до зв՚язування і інактивації тромбіну.
На початковому етапі коагуляційного каскаду відбувається адгезія (злипання) тромбоцитів у місці ураження ендотелію. Процес адгезії здійснюється завдяки наявності специфічних глікопротеїдних комплексів (рецепторів) у мембрані тромбоциту, що моментально зв՚язуються зі своїми лігандами в екстрацелюлярному матриксі. При цьому для процесу взаємодії між лігандом і рецептором мембрани тромбоцита необхідна присутність фактора Віллебранда, що також синтезується клітинами ендотелію судин.
Таким чином, у результаті адгезії на поверхні розриву ендотелію формується моношар тромбоцитів. Зв՚язування рецепторів мембрани тромбоцита зі своїми лігандами в субендотелію є пусковим чинником для наступної стадії тромбоутворення — стадії агрегації тромбоцитів. При цьому тромбоцити змінюють свою форму, стаючи з дискоїдних сферичними, на поверхні їхньої мембрани з՚являються псевдоподії. Одночасно відбувається вивільнення вмісту щільних гранул тромбоцитів, секретуються індуктори агрегації тромбоцитів — АДФ і серотонін, фактор ІV тромбоцитів, тромбоцитарний фактор росту та ін. Також відбувається підвищення активності фосфоліпаз А2 і C, які, розщеплюючи мембранні фосфоліпіди, призводять до вивільнення арахідонової кислоти. Далі арахідонова кислота під впливом ЦОГ і тромбоксансинтетази перетворюється через проміжну стадію ендопероксидів у тромбоксан А2. Тромбоксан А2, будучи потужним індуктором агрегації тромбоцитів, також викликає виражену вазо- і бронхоконстрикцію.
У результаті вивільнення в кровотік численних проагрегантів (АДФ, серотонін, тромбоксан А2, адреналін, тромбін та ін.) відбувається здійснення механізму позитивного зворотного зв՚язку, що проявляється в посиленні первинної агрегації тромбоцитів з одночасним залученням у процес агрегації сусідніх неактивованих клітин.
Одночасна дія декількох індукторів агрегації (інакше в кровоносному руслі постійно утворювалися б тромбоцитарні тромби) є стимулом до початку загального фінального етапу агрегаційного процесу: на мембранах псевдоподій відбуваються конформаційні зміни IIb/IIIа рецепторів, що супроводжуються багаторазовим збільшенням їх афінності до своїх лігандів, насамперед до фібриногену і фактора Віллебранда. Молекули фібриногену і фактора Віллебранда, будучи мультивалентними, здатні взаємодіяти одночасно з більшою кількістю тромбоцитів, що приводить до утворення численних міжклітинних «мостиків».
Таким чином, заключною стадією процесу активації тромбоцитів є побудова тромбоцитарного агрегату, що представляє собою безліч активованих тромбоцитів, з՚єднаних між собою за допомогою молекул фібриногену і фіксованих до місця ураження ендотелію за допомогою фактора Віллебранда.
Однак активації тромбоцитів і формування тромбоцитарного тромбу недостатньо для розвитку симптомокомплексу гострої коронарної недостатності (гострого коронарного синдрому), більше того, більшість розривів бляшок протікає безсимптомно і виявляється в аутопсійному матеріалі в померлих від некардіальних причин хворих. Крім безпосереднього розриву бляшки, для розвитку того або іншого варіанта гострого коронарного синдрому необхідний одночасний збіг багатьох сприяючих факторів: уповільнення току крові по судині, співвідношення між активністю систем згортання крові і фібринолізу, стану тромбоцитів. Велике значення в розвитку тромбозу має звільнення в момент розриву бляшки тканинного фактора, зосередженого головним чином у ліпідному ядрі і ендотеліоцитах покришки бляшки, що в комплексі з активною формою фактора VII є активатором зовнішнього шляху коагуляції. Концентрація фактора VII під час розриву бляшки багато в чому визначально впливає на подальший розвиток коронарного тромбозу і формування симптомокомплексу гострого коронарного синдрому.
Таким чином, крім активації тромбоцитарної ланки гемостазу, для виникнення клінічних проявів гострого коронарного синдрому необхідний вихідний стан гіперкоагуляції до моменту розриву бляшки. Щодо цього особливо показові дані досліджень концентрації в сироватці крові фібринопептиду А і фрагменту протромбіну 1+2 (F1+2) — маркерів перетворення фібриногену у фібрин під дією тромбіну та протромбіну в тромбін відповідно. У хворих із різними клінічними проявами гострого коронарного синдрому вміст у крові фібринопептиду А і фрагменту протромбіну 1+2 значно підвищений, більше того, на сьогодні продемонстроване значення показників фібринопептиду А і фрагменту протромбіну 1+2 у плані оцінки віддаленого прогнозу хворих після перенесеного епізоду гострої коронарної недостатності. У ході досліджень, поряд з підвищенням концентрації фібринопептиду А і фрагменту протромбіну 1+2 у гострий період, виявлене збереження високих значень фрагменту протромбіну 1+2 через 6 міс після перенесеного епізоду нестабільної стенокардії або нетрансмурального ІМ, що вказує на персистувальну тромбінемію навіть у категорії відносно стабілізованих хворих. З огляду на те, що тромбін на сьогодні є найсильнішим з відомих індукторів агрегації тромбоцитів, можна припустити, що саме тромбінемія (попередня), яка зберігається, створює сприятливий ґрунт для розвитку коронарного тромбозу при виникненні розриву атеросклеротичної бляшки. Ця гіпотеза перевірена в ході багатоцентрового клінічного дослідження GUSTO IIb з використанням прямого інгібітору тромбіну — рекомбінованого гірудину. Однак після підведення підсумків лікування >8 тис. хворих із нестабільною стенокардією та ІМ без зубця Q не отримано статистичних розходжень у кінцевих точках (смерть, ІМ із зубцем Q, проведення коронарної ангіопластики) між досліджуваною і контрольною (ацетилсаліцилова кислота + нефракціонований гепарин) групами хворих. Можливо, поясненням цьому є низька доза застосовуваного гірудину (в дослідженні GUSTO IIa продемонстрований реальний геморагічний ефект повної дози гірудину) і відповідний незначний його вплив на характеристики утворення тромбіну.
Принаймні 4 різних білки тромбоцитів серед відомих представляють можливий ланцюг оборотної інгібіції зі змінними ефектами антитромбоцитарних агентів, тобто ЦОГ-1, глікопротеїнові рецептори IIb/IIIa, простагландин H2/тромбоксан А2-рецептори і АДФ-рецепторы P2Y12. Неповне, оборотне інгібування тромбоцитарної ЦОГ-1 традиційними НПЗП (NSAIDs) демонструє клінічний ефект, непідтверджений у рандомізованих клінічних дослідженнях.
Різні неселективні НПЗП можуть сповільнювати тромбоксан А2-залежну функцію тромбоцита шляхом конкурентного, оборотного інгібування ЦОГ-1. При застосуванні у звичайній протизапальній дозі ці лікарські засоби сповільнюють активність тромбоцитарної ЦОГ-1 від 70 до 90%. Таке інгібування може бути недостатнім, щоб блокувати скупчення тромбоцитів in vivo. Деякі інгібітори ЦОГ-1, які були досліджені на антитромботичну ефективність у відносно невеликих рандомізованих клінічних дослідженнях, — сульфінпіразон, флурбіпрофен, індобуфен і тріфлусал — не схвалені як антитромбоцитарні засоби в США, хоча доступні в деяких європейських країнах.
Тромбоксан А2/простагландин H2-рецептори щеплені з рецепторами G-протеїну, які в результаті стимуляції приводять до активації фосфоліпази С і підвищення внутрішньоклітинної концентрації іонів Ca2+.
Були синтезовані потужні (Kd (константа дисоціації ліганд-рецепторного комплексу) щонайменше наномолярний діапазон) і з тривалою дією (період напіврозпаду >20 год) антагоністи рецепторів тромбоксану А2/простагландину H2, включаючи GR 32191 (вапіпрост), BMS-180291 (іфетробан), і BM 13.177 (сулотробан). Незважаючи на антитромботичний ефект, виявлений у тварин, і цікавий кардіопротекторний вплив, виявлений у собак і тхорів, ці препарати дали невтішні результати у фазі II/III клінічних випробувань.
Антагоніст рецепторів тромбоксану А2/простагландину H2 С-18886 недавно завершив другу фазу клінічних випробувань з обнадійливим результатом.
Новий клас прямих P2Y12-антагоністів (наприклад AR-C69931MX (кангрелор)) у цей час вивчається, попередні результати говорять про більш ефективну блокаду цих рецепторів, ніж клопідогрелом.
Класифікація антитромбоцитарних препаратів
- Інгібітори адгезії: антитіла до глікопротеїну Ib, антитіла до фактора Віллебранда.
- Інгібітори агрегації:
- Інгібітори глікопротеїнових рецепторів IIb/IIIa.
- Інгібітори АДФ-рецепторів.
- Інгібітори тромбіну (гірудин).
- Інгібітори ЦОГ (ацетилсаліцилова кислота).
- Інгібітори тромбоксансинтетази (пірмагрел).
- Інгібітори тромбоксансинтетази і рецепторів до тромбоксану (рідогрел).
- Активатори аденілатциклази (простациклін, алпростадил).
- Інгібітори ФДЕ (пентоксіфілін).
Ацетилсаліцилова кислота
Ацетилсаліцилова кислота пригнічує ЦОГ-1 і блокує формування тромбоксану А2. У такий спосіб блокується агрегація тромбоцитів, індукована через цей шлях. В 3 рандомізованих дослідженнях ацетилсаліцилова кислота знижувала ризик смерті або ІМ у пацієнтів із нестабільною стенокардією. Дані метааналізу свідчили про те, що ацетилсаліцилова кислота в дозі 75–150 мг не менш ефективна, ніж у більш високих дозах.
При гострому ІМ антитромбоцитарна терапія (майже винятково ацетилсаліциловою кислотою) здатна зменшувати кількість судинних подій (рис. 2.7). Крім короткочасного ефекту, ацетилсаліцилова кислота забезпечує також поліпшення прогнозу при подальшому лікуванні. Побічні ефекти з боку ШКТ при застосуванні ацетилсаліцилової кислоти в таких низьких дозах відзначають відносно нечасто, а з появою кишковорозчинних форм ацетилсаліцилової кислоти ці ускладнення майже зникли. Існують деякі протипоказання, до яких належать активна пептична виразка, локальна кровотеча або геморагічний діатез. Прояви алергії спостерігаються рідко. З огляду на це, ацетилсаліцилову кислоту рекомендують призначати всім пацієнтам з підозрою на гострий коронарний синдром при відсутності протипоказань (рівень доказовості А) і надалі для тривалого лікування (рівень доказовості А).
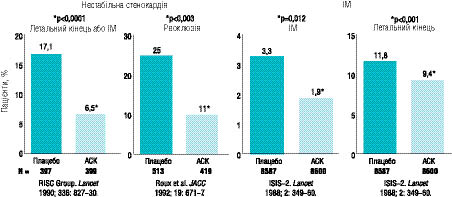
Рис. 2.7. Вплив ацетилсаліцилової кислоти (АСК) на судинні події (гострий коронарний синдром)
Антагоністи рецепторів АДФ: тієнопіридини
Тіклопідин і його дериват клопідогрел — інгібітори АДФ, що спричиняє агрегацію тромбоцитів. Ефективність тіклопідину вивчали лише в 1 дослідженні. Відносно часто на фоні застосування цього препарату спостерігають шлунково-кишкові розлади та алергічні реакції. Крім того, можуть виникати нейтропенія або тромбоцитопенія. Препаратом, що замінив тіклопідин, став клопідогрел.
Ефективність клопідогрелу досліджували на фоні прийому ацетилсаліцилової кислоти в дозі 75–325 мг у пацієнтів із гострим коронарним синдромом у великому клінічному дослідженні CURE (Clopidogrel in Unstable angina to prevent Recurrent ischaemic Events) за участю 12 562 пацієнтів. Включали хворих, госпіталізованих протягом 24 год після виникнення симптомів зі змінами ЕКГ або підвищенням рівня міокардіальних ферментів. Рандомізовано призначали навантажувальну дозу 300 мг клопідогрелу і подальшу дозу препарату 75 мг 1 раз на добу та порівнювали з пацієнтами, що приймали плацебо, протягом 9 міс. Кількість первинних результатів (смерть від серцево-судинних причин, нефатальний ІМ або інсульт) вірогідно зменшилася з 11,4 до 9,3% (зниження абсолютного ризику на 2,1%; відносний ризик 0,80; 95% ДІ 0,72–0,90; p<0,001). Частота випадків рефрактерної ішемії під час першої госпіталізації істотно (p=0,007) знизилася з 2,0 до 1,4% (зниження абсолютного ризику на 0,6%, відносний ризик 0,68; 95% ДІ 0,52–0,90), але істотно не відрізнялася після виписки (7,6% в обох групах). Масивні кровотечі вірогідно частіше відзначали в групі клопідогрелу — 3,7% проти 2,7% (підвищення абсолютного ризику на 1%, відносний ризик 1,38; 95% ДІ 1,13–1,67; p=0,001). Кількість пацієнтів, яким було необхідне переливання двох або більше одиниць, було більше в групі клопідогрелу порівняно з плацебо (2,8% проти 2,2%; p=0,02). Масивні кровотечі виявляли приблизно так само часто, як під час раннього лікування (<30 днів), так і пізнього (>30 днів після рандомізації) (2,0 і 1,7% відповідно). Малі кровотечі розвивалися частіше в групі клопідогрелу, ніж плацебо (5,1% проти 2,4%; p<0,001). Трохи менша кількість пацієнтів у групі клопідогрелу мали потребу в коронарній реваскуляризації (36% проти 36,9%). Незважаючи на це, варті уваги результати дослідження, отримані у 1822 пацієнтів в групі клопідогрелу, у яких здійснили хірургічне шунтування коронарних артерій. Після проведеного втручання не відзначали достовірного збільшення кількості епізодів масивних кровотеч (1,3% проти 1,1%). Але серед 912 пацієнтів, які не припинили застосування досліджуваного препарату за 5 днів перед втручанням, частота масивних кровотеч була вище в групі клопідогрелу (9,6% проти 6,3%; p=0,06).
Чітке підвищення ризику розвитку кровотечі відзначали при підвищенні дози ацетилсаліцилової кислоти (з 100 до 100–300 та >300 мг у пацієнтів груп плацебо (відповідно 2,0; 2,2 та 4,0% масивних кровотеч) і клопідогрелу (2,5; 3,5 та 4,9%). У дослідженнях CURE і APT (Anti Platelet Trialist’s Collaboration) не спостерігали чітких ознак поліпшення результату при підвищенні дози ацетилсаліцилової кислоти. Рекомендують застосовувати клопідогрел поєднано з підтримувальними дозами ацетилсаліцилової кислоти (100 мг).
У субаналізі PCI-CURE (Percutaneous Coronary Intervention-Clopidogrel in Unstable Angina to Prevent Recurrent Events) виявлено, що у пацієнтів, яким виконували ангіопластику, застосування клопідогрелу більш ніж за 6 год до втручання супроводжувалося зниженням ризику до 28-го дня на 38%. При цьому загальна частота розвитку кровотеч була такою ж, а шлунково-кишкових кровотеч — нижче (на 9,3%), ніж після застосування ацетилсаліцилової кислоти.
У дослідженні CAPRIЕ (Clopidogrel versus. Aspirin in Patients at Risk. of Ischemic Events) порівнювали ефективність клопідогрелу і ацетилсаліцилової кислоти відносно попередження ішемічного інсульту, ІМ або «судинної» смерті в 19 185 хворих з ознаками атеросклеротичного захворювання судин (що перенесли ішемічний інсульт, ІМ або з захворюванням периферичних артерій). Середня тривалість спостереження — 1,91 року. Це дослідження також показало перевагу клопідогрелу над ацетилсаліциловою кислотою. Ще одне дослідження — CREDO (Clopidogrel for the Reduction of Events During Observation ), в якому вже цілеспрямовано вивчали ефективність зазначених препаратів після проведення внутрішньосудинних втручань, продемонструвало зниження ризику розвитку комбінованої кінцевої точки на 27% порівняно з ацетилсаліциловою кислотою. У дослідженні CLASSICS (CLopidogrel ASpirin Stent International Cooperative Study) вивчали порівняльну безпеку і ефективність комбінацій: ацетилсаліцилова кислота + клопідогрел та ацетилсаліцилова кислота + тіклопідин. Перша комбінація виявилася практично вдвічі безпечніша в плані частоти розвитку кровотеч.
Останнє велике дослідження — CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance), результати якого опубліковані в 2006 р. Протягом мінімум 1 року спостерігали 15 603 пацієнтів, і знову була підтверджена перевага клопідогрелу над ацетилсаліциловою кислотою у хворих з документованими проявами ІХС, але не в пацієнтів, у яких відзначали тільки фактори ризику розвитку ІХС.
В останні роки ведуться пошуки нових антиагрегантів, що мають той же механізм блокади АДФ-рецепторів тромбоцитів. Так, у дослідженні (JUMBO)-TIMI 26 (The Joint Utilization of Medications to Block Platelets Optimally) вивчали ефекти прасугрелe — як частоту кровотеч, так і кардіальних подій у хворих, що піддавалися ургентному перкутанному коронарному втручанню, порівняно з клопідогрелом. У цьому обмеженому дослідженні (904 пацієнти) не відзначено достовірних відмінностей ні в частоті кровотеч (1,7 та 1,2% відповідно), ні у впливі на кінцеві точки. У недавно закінченому дослідженні цього препарату в 13 608 хворих із гострим коронарним синдромом TRITON-TIMI-38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel — Thrombolysis in Myocardial Infarction) прасугрел продемонстрував кращий, ніж у клопідогрелу, ефект відносно кардіальных подій, але він супроводжувався більшою частотою кровотеч, у тому числі фатальних.
Ефективність ще одного антиагреганта — AZD6140 порівнювали з ефектами клопідогрелу в дослідженні DISPERSE 2 (Dose confIrmation Study assessing anti-Platelet Effects of AZD6140 vs clopidogRel in non-ST-segment Elevation myocardial infarction), результати якого обнародувані на сесії АСС в 2006 р. Відзначені хороша переносимість і дозозалежний ефект препарату стосовно інтенсивності агрегації тромбоцитів, що перевищував такий у клопідогрелу. У цей час проводиться велике дослідження AZD6140, PLATO (A Study of Platelet Inhibition and Patient Outcomes), у яке включено 16 000 хворих у 1000 клініках 40 країн.
Таким чином, рекомендації із застосування пероральних антиагрегантів наступні:
- Ацетилсаліцилова кислота рекомендується всім пацієнтам із гострим коронарним синдромом без елевації ST, без протипоказань, у навантажувальній дозі 160–325 мг (IA) з наступним застосуванням 75 або 100 мг тривалий час (IA).
- Усім пацієнтам призначають клопідогрел у навантажувальній дозі 300 мг, надалі 75 мг/добу (IA). Клопідогрел приймають 12 міс при відсутності загрози кровотечі (IA).
- Клопідогрел також призначають всім пацієнтам із протипоказаннями до ацетилсаліцилової кислоти (IB).
- Пацієнтам перед інвазивною процедурою клопідогрел призначають у дозі 600 мг (навантажувальна) (IIa).
- У пацієнтів, що приймають клопідогрел, при можливому хірургічному втручанні (АКШ) операцію необхідно відкласти на 5 діб з відміною препарату (IIa).
- НПЗП (селективні інгібітори ЦОГ-2) не рекомендується призначати в комбінації з ацетилсаліциловою кислотою або клопідогрелом (IIIС).
- Клопідогрел можна застосовувати в комбінації з усіма статинами (IВ).
- Тимчасове або повне припинення застосування ацетилсаліцилової кислоти, клопідогрелу або обох препаратів необхідно ретельно оцінювати з урахуванням високого ризику повторення коронарних подій, особливо після установки певного типу стентів.
Блокатори глікопротеїнових рецепторів IIb/IIIa
Активовані глікопротеїнові рецептори IIb/IIIa зв՚язуються з фібриногеном, що призводить до формування містків між активованими тромбоцитами і утворенню тромбоцитарних тромбів. Розроблено прямі інгібітори глікопротеїнових рецепторів IIb/IIIa. Їх ефективність оцінювали в клінічних ситуаціях, при яких важливе значення відводили активації тромбоцитів, зокрема під час перкутанних коронарних втручань, при гострому коронарному синдромі, а також у пацієнтів, що отримують тромболітичну терапію з приводу гострого ІМ.
Проведено надзвичайно велику кількість досліджень із застосуванням препаратів цієї групи, що зумовлено надією, що покладали на них кардіологи і яка поки виправдалася лише частково.
При гострих коронарних синдромах вивчали чотири препарати групи блокаторів рецепторів глікопротеїну IIb/IIIa для внутрішньовенного введення.
Абциксімаб — моноклональне антитіло. Неспецифічний блокатор, що тісно зв՚язується з рецептором і характеризується повільним зникненням ефекту пригнічення тромбоцитів після припинення лікування.
Ептіфібатид — циклічний пептид, що селективно пригнічує рецептори гликопротеїну IIb/IIIa. Характеризується коротким періодом напівжиття, пригнічення тромбоцитів зникає через 2–4 год після припинення терапії.
Тірофібан — непептидний антагоніст, що нагадує трипептидну послідовність фібриногену. Блокада рецепторів швидка (5 хв), селективна і швидко оборотна (від 4 до 6 год).
Ламіфібан — синтетичний, непептидний селективний блокатор рецепторів із періодом напіввиведення близько 4 год.
Оцінюють також ефективність блокаторів рецепторів глікопротеїну IIb/IIIa для перорального застосування, зокрема ортофібану, сибрафібану, ледрафібану та інших препаратів.
З огляду на результати ряду рандомізованих досліджень, лікування препаратами групи блокаторів рецепторів глікопротеїну IIb/IIIa рекомендують усім пацієнтам із гострим коронарним синдромом, яким виконують перкутанне коронарне втручання (рівень доказовості А). Інфузія повинна тривати протягом 12 год (абциксімаб) або 24 год (ептіфібатид, тірофібан) після процедури.
Проведено 7 рандомізованих досліджень, у яких блокатори рецепторів глікопротеїну IIb/IIIa систематично застосовували на додаток до ацетилсаліцилової кислоти і «стандартного» нефракціонованого гепарину у пацієнтів із гострим коронарним синдромом (EPIC (Evaluation of 7E3 for the Prevention of Ischemic Complications), CAPTURE (Chimeric C7E3 Fab Antiplatelet Therapy in Unstable Refractory angina), EPILOG (Evaluation of PTCA to Improve Long-term Outcome by c7E3 GP IIb/IIIa Receptor Blockade), EPISTENT (Evaluation of Platelet IIb/IIIa Inhibitor for Stenting), RESTORE (Randomized Efficacy Study of Tirofiban for Outcomes and REstenosis), IMPACT II (IMProving Asthma Control Trial), ESPRIT (European/Australasian Stroke Prevention in Reversible Ischaemia Trial)). Загалом їхні результати свідчать про помірний, але достовірно знижений ризик смерті або ІМ через 30 днів у пацієнтів з гострим коронарним синдромом без стійкої елевації сегмента ST. Медикаментозна терапія блокаторами рецепторів глікопротеїну IIb/IIIa у перші дні після госпіталізації хворого, після чого здійснюється перкутанне коронарне втручання або шунтування коронарних артерій, вірогідно знижує ризик смерті або ІМ з 4,3 до 2,9%.
З огляду на результати 3 рандомізованих досліджень, можливість призначення блокаторів глікопротеїнових рецепторів IIb/IIIa в доповнення до ацетилсаліцилової кислоти і гепарину в низькій дозі, що коригували залежно від маси тіла, необхідно розглядати для всіх пацієнтів із гострим коронарним синдромом і підвищеним рівнем тропоніну Т або тропоніну I, яким планують ранню реваскуляризацію (рівень доказовості А).
Разом з тим тривале пероральне застосування цих препаратів у хворих із гострим коронарним синдромом або після коронарних втручань не супроводжувалося поліпшенням прогнозу. Метааналіз виявив навіть помірне, але достовірне підвищення смертності.
Таким чином, рекомендації щодо застосування блокаторів глікопротеїнових рецепторів IIb/IIIa зводяться до наступного:
- У пацієнтів із помірним або високим ризиком, особливо з підвищеним рівнем тропоніну, депресією сегмента ST або цукровим діабетом ептіфібатид або тірофібан можна розглядати як допоміжну антиагрегантну терапію (IIaА).
- Обов՚язково оцінити ризик розвитку кровотечі при одночасному призначенні антиагрегантів і антикоагулянтів.
- Пацієнти, які отримували терапію ептіфібатидом або тірофібаном, перед проведенням ангіографії повинні продовжувати це лікування протягом і після процедури перкутанного коронарного втручання.
- Пацієнтам групи високого ризику, яким не були призначені інгібітори глікопротеїнових рецепторів IIb/IIIa перед процедурою перкутанного коронарного втручання, рекомендується призначення абциксімабу негайно після процедури. Користь від застосування ептіфібатиду або тірофібану в цьому випадку не доведена.
- Інгібітори глікопротеїнових рецепторів IIb/IIIa необхідно комбінувати з антикоагулянтами (IА).
- Бівалірудин може бути використаний як альтерантива комбінації: інгібітори глікопротеїнових рецепторів IIb/IIIa + гепарин (IIаВ).
- Якщо ураження коронарної артерії встановлене і перкутанне коронарне втручання планується протягом 24 год з використанням інгібіторів глікопротеїнових рецепторів IIb/IIIa, найбільш безпечне і ефективне застосування абциксімабу (IIаВ).
Дози і режими застосування препаратів
Пероральна антиагрегантна терапія
- Ацетилсаліцилову кислоту призначають у початковій дозі 160–325 мг некишковорозчинні форми, надалі — 75–100 мг/добу.
- Клопідогрел 75 мг/добу після навантажувальної дози 300 мг (600 мг — якщо цього вимагає гострота ситуації).
Антикоагулянти
- Фондапаринукс 2,5 мг підшкірно 1 раз на добу.
- Еноксапарин 1 мг/кг маси тіла підшкірно кожні 12 год.
- Дальтепарин 120 МО/кг кожні 12 год.
- Надропарин 86 МО/кг кожні 12 год.
- Нефракціонований гепарин внутрішньовенно болюсно 60–70 МО/кг (максимум — 5000 МО) з наступної інфузії 12–15 МО/кг/год (максимум — 1000 МО/год), підтримуючи АЧТЧ у 1,5–2,5 раза вище контрольного значення.
- Бівалірудин внутрішньовенно болюсно 0,1 мг/кг із наступної інфузії 0,25 мг/кг/год. Додаткове внутрішньовенне введення болюсно 0,5 мг/кг та інфузією у підвищеній дозі 1,75 мг/кг/год перед проведенням перкутанного коронарного втручання.
Інгібітори глікопротеїнових рецепторів IIb/IIIa
- Абциксімаб 0,25 мг/кг внутрішньовенно болюсно з наступної інфузії 0,125 мг/кг/хв (максимум — 10 мг/хв) протягом 12–24 год.
- Ептіфібатид 180 мг/кг внутрішньовенно болюсно (другий болюс через 10 хв після перкутанного коронарного втручання), надалі — інфузія 2,0 мг/кг/хв протягом 72–96 год.
- Тірофібан 0,4 мг/кг/хв внутрішньовенно протягом 30 хв з наступної інфузії 0,10 мг/кг/хв протягом 48–96 год. Режим з більш високою дозою (болюс 25 мг/кг + інфузія 0,15 мг/кг/хв протягом 18 год) зараз проходить тестування в клінічних дослідженнях.
Корекція ускладнень терапії блокаторами рецепторів глікопротеїну IIb/IIIa, пов՚язаних із кровотечами
Ризик розвитку кровотеч, пов՚язаних із застосуванням антитромбоцитарних засобів і, зокрема, блокаторів рецепторів глікопротеїну IIb/IIIa, безпосередньо залежить від дози одночасно застосовуваного гепарину, тому при використанні цих препаратів рекомендують особливий режим дозування гепарину. За умови перкутанного коронарного втручання недоцільно підвищувати дозу гепарину >70 МО/кг маси тіла, а цільовий активований час згортання становить 200 с. При виникненні локальних ускладнень, таких як виражена гематома або тривала кровотеча в місці пункції, може з՚явитися потреба в хірургічному втручанні.
У незначної частини пацієнтів при парентеральному застосуванні блокаторів глікопротеїнових рецепторів IIb/IIIa може виникнути тромбоцитопенія. Після припинення введення препарату рівень тромбоцитів звичайно нормалізується. Для абциксімабу може бути актуальною проблема повторного призначення, оскільки цьому препарату властива імуногенність. Утім, за даними реєстрів безпека і ефективність абциксімабу виявилися не гірше, ніж при першому застосуванні препарату.
У недавніх рекомендаціях «The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology» підсумкова таблиця застосування антиагрегантів виглядає таким чином (табл. 2.2).
Таблиця 2.2
Рекомендації по застосуванню антиагрегантів згідно з «The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology»
| Захворювання | Рекомендації | Примітка | Рівень доказовості |
| ІХС | |||
| Стабільна стенокардія | Ацетилсаліцилова кислота | 1A | |
| Клопідогрел | Як альтернатива ацетилсаліциловій кислоті | 1C+ | |
| Гострий коронарний синдром із перкутанним коронарним втручанням | Ацетилсаліцилова кислота | 1A | |
| Без стійкої елевації сегмента ST | Клопідогрел + ацетилсаліцилова кислота | Більш ефективне, ніж монотерапія ацетилсаліциловою кислотою | 1A |
| Внутрішньовенно інгібітори глікопротеїнових рецепторів IIb/IIIa | При внутрішньосудинних втручаннях | 1A | |
| Без перкутанного коронарного втручання | Ацетилсаліцилова кислота | 1A | |
| Клопідогрел + ацетилсаліцилова кислота | Більш ефективне, ніж монотерапія ацетилсаліциловою кислотою | 1A | |
| Внутрішньовенно інгібітори глікопротеїнових рецепторів IIb/IIIa | Тирофібан або ептіфібатид | 2A | |
| Гострий ІМ | Ацетилсаліцилова кислота | 1A | |
| З первинним перкутанним коронарним втручанням | Внутрішньовенно інгібітори глікопротеїнових рецепторівIIb/IIIa | Абциксімаб | 1A |
| Попередній ІМ | Ацетилсаліцилова кислота | 1A | |
| Клопідогрел | Як альтернатива ацетилсаліциловій кислоті | 1A | |
| Після коронарного шунтування | Ацетилсаліцилова кислота | 1A | |
| Перкутанне коронарне втручання | Ацетилсаліцилова кислота | 1A | |
| Клопідогрел | При стентуванні | 1A | |
| Тіклопідин | При стентуванні | 1A | |
| Внутрішньовенно інгібітори глікопротеїнових рецепторів IIb/IIIa | Можливе при стабільній стенокардії | 2A | |
| Ішемічний інсульт | Ацетилсаліцилова кислота | 1A | |
| Попередній інсульт | Ацетилсаліцилова кислота | 1A | |
| Клопідогрел | Як альтернатива ацетилсаліциловій кислоті | 1A | |
| Захворювання периферичних судин | Ацетилсаліцилова кислота | 1C+ | |
| Клопідогрел | Як альтернатива ацетилсаліциловій кислоті | 1A | |
| Первинна профілактика в групах високого ризику | |||
| Цукровий діабет | Ацетилсаліцилова кислота | 2B | |
| АГ | Ацетилсаліцилова кислота | 2A | |
| Фібриляція передсердь | Ацетилсаліцилова кислота | При середньому і високому ступені ризику одночасно з варфарином | 1A |
| Захворювання клапанів серця | Ацетилсаліцилова кислота | Ревматичні вади клапанів серця без застосування варфарину | 1B |
| Оперовані клапани серця | Ацетилсаліцилова кислота | У комбінації з варфарином у пацієнтів зі штучними клапанами | 2B |
Фібринолітична терапія
Фібринолітична терапія зменшує розмір внутрішньокоронарного тромбу і вірогідно поліпшує виживаність у пацієнтів із гострими коронарними синдромами, які супроводжуються елевацією сегмента ST. Разом з тим при нестабільній стенокардії стрептокіназа, аністреплаза, тенектеплаза і урокіназа в декількох дослідженнях незмінно погіршували виживаність.
Ризик смерті та ІМ у загальному аналізі даних декількох досліджень, у які включили 2859 пацієнтів, становив 9,8% при терапії фібринолітиками і 6,9% — у контрольній групі. Подібні результати отримані також у метааналізі результатів лікування 3563 пацієнтів. Отже, тромболітичну терапію не рекомендують пацієнтам із гострим коронарним синдромом без стійкою елевації сегмента ST.
Коронарна реваскуляризація
Мета виконання реваскуляризації (шляхом перкутанного коронарного втручання або шунтування коронарних артерій) — лікування при поворотній або триваючій ішемії міокарда, запобігання розвитку ІМ або смерті. Показання для реваскуляризації і вибір стратегії лікування визначаються поширеністю та ангіографічними характеристиками ураження коронарних артерій.
Коронарна ангіографія
Коронарна ангіографія — єдиний метод дослідження, що дозволяє оцінити наявність і ступінь вираженості ураження коронарних артерій. Рішення про виконання хірургічного втручання базується на даних коронарної ангіографії. Частота здійснення коронарної ангіографії відрізняється в різних країнах. Згідно з даними EuroHeart Survey серед 5367 пацієнтів із гострим коронарним синдромом без елевації сегмента ST коронарна ангіографія була виконана в 52%.
Показання і терміни виконання коронарної ангіографії обговорюються далі в розділі, присвяченому стратегіям ведення хворих із гострими коронарними синдромами. Виконання коронарної ангіографії не має особливих застережень. Лише у випадках гемодинамічної нестабільності (набряк легень, артеріальна гіпотензія, тяжка життєво небезпечна аритмія) іноді бажано здійснити втручання із застосуванням внутрішньоаортальної балонної помпи, обмежити кількість коронарних ін՚єкцій і не виконувати вентрикулографію, що може зумовити дестабілізацію нестійкого стану гемодинаміки. У цих випадках функцію ЛШ можна оцінити ехоКГ-методом.
Результати досліджень TIMI IIIB та FRISC ІІ свідчать про те, що в 30–38% пацієнтів із нестабільними коронарними синдромами діагностують ураження однієї, а в 44–59% — декількох коронарних артерій. Частота незначного ураження коронарних артерій становить від 14 до 19%. Стеноз стовбура лівої коронарної артерії діагностують у 4–8% випадків. Оцінка змін ЕКГ при госпіталізації допомагає встановити ураження, що, ймовірно, призводить до гострого коронарного синдрому. Важливим маркером ризику є присутність тромбу в місці ураження судини. Маркерами високого ризику є ексцентричність, нечіткі границі, покритість виразками, нечіткість зображення і дефекти наповнення. Порівняно з ангіоскопією коронарна ангіографія характеризується високою специфічністю і низькою чутливістю до виявлення тромбів. Опис «причинного» ураження є надзвичайно істотним фактором вибору відповідних втручань. Важливі дані, які виключають можливість коронарного втручання з імплантацією стента — надмірна звивистість судин, кальцифікація і стеноз у місці згину. Ці зміни часто виявляють у пацієнтів похилого віку.
Перкутанне коронарне втручання
Безпека та ефективність перкутанного коронарного втручання при гострих коронарних синдромах істотно покращилися завдяки застосуванню стентів і блокаторів глікопротеїнових рецепторів IIb/IIIa. У EuroHeart Survey в 25% загальної популяції виконували перкутанне коронарне втручання, в 74% — імплантацію стенту, в 27% — призначали блокатори глікопротеїнових рецепторів IIb/IIIa.
Імплантація стента при нестабільних формах ІХС — відносно безпечна процедура, що дозволяє механічно стабілізувати розірвану бляшку в місці ураження. Така перевага стентування особливо вагома при ураженнях із високим ризиком, але при належному медикаментозному супроводі.
За даними дослідження BENESTENT II (BElgium, NEtherlands STENT II trial, 1998) імплантація стента — безпечна процедура й асоціюється з нижчим ризиком рестенозу протягом 6 міс, ніж балонна дилатація.
Фрагмент дослідження EPISTENT показав, що сполучення імплантації стента і введення абциксімабу асоціювалося з вірогідно нижчою частотою значних ускладнень, ніж при стентуванні на фоні введення плацебо. Ефективність комбінації стентування і введення абциксімабу була вищою, ніж балонна ангіопластика і абциксімаб. Ці дані відзначали також у підгрупі пацієнтів із нестабільними формами ІХС.
Необхідно пам՚ятати, що результат коронарної реваскуляризації значною мірою визначає активність системного запалення. Встановлено, що запалення і мобілізація нейтрофільних гранулоцитів в уражену судинну стінку після імплантації стента є найважливішими факторами розвитку рестенозу, частота якого на сьогодні досягає 25–30%. Основною причиною посиленого утворення неоінтими в цих умовах є зростання експресії адгезивних молекул (CD11b/CD18) лейкоцитами, відповідальними за їхню міцну адгезію до тромбоцитів і фібриногену на стінці ураженої судини.
Поверхневе ураження судинної стінки поєднується з ранньою і транзиторною інфільтрацією нейтрофільних гранулоцитів, тоді як викликане стентуванням глибоке ураження призводить до мобілізації моноцитів/макрофагів тривалістю від днів до тижнів. На матеріалах аутопсій показано, що через 1 міс після імплантації стента в коронарні артерії джерелом 30% неоінтимальних клітин є гладком՚язові клітини, 70% — моноцити. У дослідженні, проведеному за участю 62 пацієнтів з імплантацією стента, встановлена експресія CD11b на поверхні нейтрофільних гранулоцитів уже через 24 год після втручання, що прогресує до 48 год. Ці зміни були більш виражені у пацієнтів з наступним розвитком рестенозу. Застосування статинів протягом 1 року після реваскуляризації дозволяє знизити вміст СРБ у плазмі крові, зменшити на 40% частоту розвитку рестенозів та ІМ, на 50% — частоту смерті. Таким чином, слід завжди пам՚ятати, що встановлюючи стент, ми втручаємося в надзвичайно тонкі механізми функціонування судинної стінки, що може спровокувати самостійні інтенсивні ураження із запуском каскаду запалення — утворення/загострення запалення атеросклеротичної бляшки — тромбозу. Саме це й було доведено в останніх клінічних дослідженнях ефективності різних типів стентів як при хронічній ІХС, так і при гострих її формах.
У 2005 р. прийняті рекомендації Європейського товариства кардіологів по інвазивним втручанням — Guidelines for Percutaneous Coronary Interventions, The Task Force for Percutaneous Coronary Interventions the European Society of Cardiology.
Показання для термінової (протягом 48 год) ангіографії наступні:
- Біль у спокої, що повторюється.
- Динаміка сегмента ST — депресія >0,1 мВ або транзиторна (<30 хв) елевація ST >0,1 мВ.
- Підвищення рівня тропоніну I, тропоніну Т або МВ-фракції КФК.
- Гемодинамічна нестабільність.
- Загрозливі аритмії (шлуночкова тахікардія, фібриляція шлуночків).
- Рання постінфарктна стенокардія.
- Цукровий діабет.
- В інших випадках проводять оптимальну медикаментозну терапію з відстроченою ангіографією після стабілізації стану.
Ці ж рекомендації звучали на 13-й конференції American Academy of Emergency Medicine (AAEM) у березні 2007 р., де також підкреслювалося, що перкутанне коронарне втручання має перевагу над оптимальною медикаментозною терапією лише у хворих з підвищеним ризиком.
Таким чином, рекомендації Європейського товариства кардіологів 2007 р. відносно інвазивної тактики у хворих із гострим коронарним синдромом без елевації ST виглядають так:
- Ургентна коронаровентрикулографія рекомендується пацієнтам із рефрактерною або поворотною стенокардією в поєднанні з динамічними змінами ST, зі СН, що загрожують порушеннями ритму або гемодинамічною нестабільністю (IC).
- Рання (<72 год) коронаровентрикулографія з наступною реваскуляризацією (перкутанне коронарне втручання або АКШ) рекомендується хворим із середнім і високим ризиком (IA).
- Рутинна інвазивна тактика пацієнтам без середнього або високого ризику не рекомендується (IIIC).
- Перкутанне коронарне втручання без встановленого ураження судин (за даними ангіографії) не рекомендується (IIIC).
- При виборі типу стента (BMS або DES) необхідно враховувати можливі некардіальні хірургічні втручання, що вимагають скасування антиагрегантів (IC).
Хірургічне шунтування коронарних артерій
Дані EuroHeart Survey свідчать, що частота виконання АКШ становить 5,4% з істотними відмінностями в різних країнах. Застосування сучасних хірургічних методів асоціюється з низькою операційною смертністю. У дослідженні FRISC II смертність становила 2% через 1 міс, у дослідженні TACTICS (Treat Angina with Aggrastat and Determine Cost of Therapy with an Invasive or Conservative Strategy) — 1,7%. Хірургічне лікування постінфарктної (<30 днів) нестабільної стенокардії асоціюється з більш високою (6,8%) операційною смертністю (від 0 до 16%) і частотою розвитку периопераційного ІМ (5,9%, діапазон від 0 до 15%). У пацієнтів із нестабільними формами ІХС, яким виконують АКШ, профілі ризику різні. Периопераційна смертність і захворюваність вищі у пацієнтів із тяжкою нестабільною стенокардією, а також із нестабільною стенокардією після недавнього (<7 днів) ІМ. Утім, слід згадати, що в останніх дослідженнях по інвазивним втручанням АКШ асоціювалося з низькою (2,1%) смертністю, незважаючи на те що більшість втручань виконували у пацієнтів із захворюванням стовбура або декількох коронарних артерій і в ранні строки після ІМ (<7 днів).
З урахуванням результатів ряду досліджень попередня агресивна антитромбоцитарна терапія повинна розглядатися як відносне протипоказання до раннього АКШ, але може вимагати специфічних хірургічних заходів щодо зменшення кровотечі, у деяких випадках — переливання тромбоцитів. Утім, якщо немає показань для невідкладного хірургічного втручання, краще припинити застосування препарату і виконати втручання через 5 днів.
Протизапальне лікування
З огляду на те що патофізіологія запалення викладена вище, а деякі методи впливу на процеси запалення (зокрема статини) наведені у відповідному розділі, назвемо лише ряд досліджень, у яких автори намагалися впливати на клінічний перебіг гострого коронарного синдрому за допомогою антибіотиків. Проведено досить багато досліджень, у яких відзначали дію антибіотиків і противірусних препаратів на деякі показники запалення, але дотепер істотні клінічні ефекти не отримані.
Заслуговує уваги кілька недавніх спостережень, у яких відзначені позитивні зміни в клінічному перебігу ІХС у тому випадку, коли в гострий період хворим були виконані щеплення проти грипу.
На Європейському конгресі кардіологів в 2002 р. були повідомлені результати дослідження, проведеного в Аргентині (E. Gurfinkel1, E. Beck, J. Bono, J. Santopinto, G. Bozovich, B. Mautner, Buenos Aires, Argentina). 100 пацієнтів у перші 72 год після розвитку ІМ були щеплені вакцинами A/Moscow/10/99-like virus, A/New Caledonia/20/99 (H1N1)-like virus та AB/Sichuan/379/99-like virus. Через 6 міс виявилося, що в комбінованій кінцевій точці (смерть, нефатальний ІМ і поворотна ішемія) група лікування продемонструвала кращий клінічний перебіг ІХС (10%) проти контрольної групи (24%; р=0,008). Ці дані дозволяють припустити корисність протигрипозних щеплень у пацієнтів із високим ступенем ризику, особливо в наших широтах із частими епідеміями грипу.
Вибір тактики ведення хворих: перкутанне коронарне втручання або АКШ
У випадках односудинного ураження з показаннями для реваскуляризації зазвичай виконують перкутанне коронарне втручання з імплантацією стента і супутнім призначенням блокаторів глікопротеїнових рецепторів IIb/IIIa. Хірургічну реваскуляризацію виконують лише в тому випадку, коли анатомія коронарного русла не сприяє безпечному виконанню перкутанного втручання (наприклад при надмірних поворотах судини або вираженій ангуляції).
У випадках ураження стовбура або трьох судин, особливо при наявності дисфункції ЛШ, зазвичай проводять операцію АКШ, що поліпшує прогноз виживаності хворих, якість життя і знижує частоту повторних госпіталізацій. Більше того, АКШ характеризується кращим, порівняно з перкутанним втручанням, співвідношенням вартості та ефективності, оскільки ефективніше забезпечує зменшення вираженості симптомів і знижує потребу в повторному втручанні.
У випадках двосудинного або трисудинного ураження, при можливості стентування вибір тактики ведення пацієнтів здійснюється індивідуально. Аналіз підгрупи пацієнтів із нестабільними формами ІХС у дослідженнях CABRI (Coronary Angioplasty versus Bypass Revascularization Investigation, 1996) і BARI (Bypass Angioplasty Revascularization Investigation, 1997) не виявив достовірних відмінностей внутрішньогоспітальної смертності і кількості випадків ІМ у групах ангіопластики та АКШ. Проте кількість повторних процедур реваскуляризації була більшою при виконанні перкутанних втручань (40–60%), ніж АКШ (5–10%). Спостереження в дослідженні BARI тривало 7 років; за цей період не виявлено відмінності в рівні смертності. Лише в підгрупі пацієнтів із цукровим діабетом результат був кращим при виконанні АКШ, ніж ангіопластики.
У рандомізованому дослідженні ARTS (Arterial Revascularization Therapies Study) порівнювали результати і співвідношення витрат та ефективності виконання стентування порівняно з АКШ в 1200 пацієнтів з множинними ураженнями судин серця, серед яких було 36% пацієнтів із нестабільними формами ІХС. Лікування було успішним у 97% пацієнтів у групі стентування і в 96% — хірургічного втручання. Сумарна кількість несприятливих подій (смерть, ІМ, інсульт, потреба в реваскуляризації) через 30 днів становила 8,7% у групі стентування і 6,8% — у групі АКШ (відмінності недостовірні). При 2-річному спостереженні помітили різницю між групами (20,5% проти 15,2%) внаслідок потреби в подальшому виконанні реваскуляризації у групі стентування. Інші дослідження дали суперечливі результати.
Загалом немає чітких доказів переваг однієї стратегії лікування порівняно з іншою. Втім, у багатьох пацієнтів із множинним ураженням судин серця деякі ураження судин не можуть бути усунуті шляхом ангіопластики і стентування, тому хірургічне втручання повинне бути методом першого вибору.
У деяких пацієнтів із множинним ураженням судин, які мають потребу в тотальній реваскуляризації (що неможливо досягти при перкутанному втручанні), але в яких рання операція асоціюється з дуже високим ризиком, можна віддати перевагу стратегії первинного перкутанного втручання, спрямованого лише на причинне ураження. Поетапне перкутанне лікування можна виконувати також особам із тяжкими супутніми захворюваннями. У пацієнтів зі звуженням стовбура лівої коронарної артерії і тяжкими супутніми захворюваннями у певних випадках обирають ангіопластику з імплантацією стента.
Інвазивна або консервативна стратегія лікування
У 2 рандомізованих дослідженнях порівнювали результати сучасних хірургічних втручань і медикаментозної терапії. У дослідження FRISC II (1999) включили 2457 пацієнтів із нестабільними формами ІХС груп високого ризику. У всіх пацієнтів протягом останніх 48 год виник біль у грудній клітці, що супроводжувався на ЕКГ депресією сегмента ST, інверсією зубця Т або біохімічними маркерами ураження міокарда. У групі ранньої інвазивної стратегії виконували перкутанне втручання в середньому через 4 дні або АКШ — через 8 днів. В іншій групі втручання виконували лише у випадку тяжкої стенокардії. Процедури реваскуляризації здійснили протягом перших 10 днів у 71% пацієнтів у першій (інвазивній) і в 9% у другій (консервативній) групі, а протягом перших 12 міс — відповідно в 78 і 43% пацієнтів. Зокрема через 1 рік перкутанне коронарне втручання виконали в 44 і 21% пацієнтів; АКШ — у 38 і 23%. Через 1 рік спостереження простежили ймовірну різницю загальної смертності: 2,2% проти 3,9% (відносний ризик 0,57; 95% ДІ 0,36–0,90), а також ІМ: 8,6% проти 11,6% (відносний ризик 0,74; 95% ДІ 0,59–0,94) на користь інвазивної стратегії. Кількість пацієнтів із симптомами стенокардії, які вимагали нових госпіталізацій, у групі інвазивної стратегії була вдвічі меншою.
У дослідженні TACTICS включили 2220 пацієнтів із гострим коронарним синдромом без персистувальної елевації сегмента ST, яких рандомізували в групи ранньої (2–48 год) інвазивної стратегії, включаючи рутинну коронарну ангіографію з подальшою реваскуляризацією (якщо вона була необхідною) і більш консервативної стратегії, коли катетеризацію виконували лише у випадку об՚єктивних ознак зворотної ішемії або патологічних результатів стрес-тесту. У цьому дослідженні 60% пацієнтів групи здійснили процедуру інвазивної терапії, тоді як 36% пацієнтів групи здійснили процедуру медикаментозної реваскуляризації. Незважаючи на це, частота первинної кінцевої точки (загальна кількість випадків смерті, нефатального ІМ і регоспіталізації внаслідок гострого коронарного синдрому) вірогідно знизилася при 6-місячному спостереженні в групі інвазивної стратегії (19,4 і 15,4%, абсолютне зниження ризику — 4%, відносний ризик 0,78; p=0,025).
Кілька метааналізів, проведених S.R. Mehta і співавторами (7 досліджень), показали перевагу рутинної (тобто для всіх хворих із нестабільною стенокардією) процедури перкутанного коронарного втручання над селективною (за показниками), але автори відзначають складність цього аналізу у зв՚язку з переходом хворих з однієї групи в іншу вже після рандомізації. У більш пізніх дослідженнях встановлено, що при тривалому спостереженні інвазивна тактика переважає консервативну тільки у хворих з підвищеним рівнем тропоніну (тобто високого ризику).
Що стосується ефективності стентування залежно від типів стентів (металевих стентів — BMS), покритих ліками (елютинг-стентів — DES), в останні 2 роки з՚явилися дослідження та аналізи національних реєстрів гострого коронарного синдрому, у яких піддавалися сумніву переваги DES-стентів. Так, аналіз шведського реєстру Swedish Coronary Angiography and Angioplasty Registry (SCAAR) включав всіх пацієнтів, яким у 2003 і 2004 р. імплантовані DES (6033 хворих) і металеві стенти (13 738 пацієнтів). Виявилося, що через 3 роки не було розходжень в частоті кардіальної смерті та ІМ у двох групах. Через 6 міс у групі DES частіше відзначали тверді кінцеві точки з достовірною різницею. Автори вважають, що зниження частоти смерті/ІМ протягом перших 6 міс на 13,7% компенсується їхнім підвищенням на 12,7% протягом наступного року при DES-стентуванні. Між 6 міс і 3 роками тільки ризик смерті був на 30% вищим у пацієнтів DES-групи.
На конгресі в Барселоні Robbert de Winter представив остаточні результати дослідження ICTUS (Invasive Versus Conservative Treatment in Unstable Coronary Syndromes ). Протягом 3 років спостерігали 1200 пацієнтів, що перенесли гострий коронарний синдром без підйому сегмента ST. Хворих розподілили на дві групи — групу з ранньою (протягом 48 год після появи симптомів і підвищення рівня тропоніну) інвазивною стратегією і групу селективної стратегії, у якій проводили оптимальне медикаментозне лікування, а перкутанне коронарне втручання проводили тільки у випадку рефрактерної ішемії або наявності ішемії при навантажувальному тестуванні перед випискою. Дослідження показало відсутність переваги ранньої інвазивної стратегії у цих хворих порівняно з оптимальною медикаментозною терапією. Частота первинних точок — смертність, ІМ або повторна госпіталізація з приводу гострого коронарного синдрому не відрізнялися в обох групах при спостереженні протягом 3 років. Ці результати відрізняються від опублікованих раніше — FRISC II і RITA-3 (Randomized Intervention Trial of Unstable Angina).
Сучасна інвазивна стратегія після попереднього застосування сучасних протиішемічних і протитромботичних лікарських засобів у пацієнтів із нестабільною стенокардією тільки з високим ступенем ризику знижує ймовірність смерті, ІМ, кількість симптомів і повторних госпіталізацій порівняно з консервативною стратегією (рівень доказовості А).
Тактика ведення хворих із гострим коронарним синдромом в окремих популяційних групах
Пацієнти похилого віку
Через те, що кількість хворих з гострим коронарним синдромом у світі збільшується майже пропорційно подовженню життя (у Європі кількість хворих із гострим коронарним синдромом віком >75 років становить 27–34%), а частота смерті в них у 2 рази перевищує таку в пацієнтів віком <75 років, особливості лікування цієї категорії хворих привертають усе більшу увагу дослідників.
Насамперед у пацієнтів похилого віку утруднена діагностика коронарної події у зв՚язку з поліморфізмом скарг (внаслідок значної кількості супутніх захворювань), значними вихідними змінами ЕКГ, більшою кількістю випадків ХСН.
Лікування пацієнтів із гострим коронарним синдромом ускладнюється підвищеним ризиком кровотеч внаслідок застосування антикоагулянтів, особливо поєднано з антиагрегантами. Тому у хворих похилого віку необхідна ретельна оцінка можливої ефективності і ризику розвитку кровотечі при застосуванні цих препаратів.
Рекомендації
- У пацієнтів старечого віку (>75 років) часто відзначають атипові коронарні симптоми. Активне виявлення гострого коронарного синдрому в цих хворих повинне базуватися на більш ретельному аналізі, ніж у пацієнтів молодшого віку.
- Планування рутинної ранньої інвазивної стратегії повинне виходити з можливості підвищеного ризику ускладнень процедури, особливо у випадку АКШ.
Залежність від статі
Відомо, що у жінок перші симптоми ІХС виникають у середньому на 10 років пізніше, ніж у чоловіків. Європейські регістри гострого коронарного синдрому відзначають переважну кількість випадків у жінок віком 65 років проти 71 року у чоловіків, при цьому в 45% жінок із гострим коронарним синдромом вік >75 років. Не набагато частіше у жінок реєструють цукровий діабет — 26% проти 22%. З огляду на ці фактори ризику, смертність (у 30-денний строк) серед жінок із гострим коронарним синдромом без елевації сегмента ST за даними GUSTO IIb вища, ніж серед чоловіків. Водночас європейські реєстри зафіксували, що сучасні лікувальні стратегії у жінок (клопідогрел, перкутанне коронарне втручання) застосовують значно рідше, ніж у чоловіків. Таким чином, рекомендується однакове лікування при гострому коронарному синдромі, включаючи перкутанне коронарне втручання, незалежно від статі (з огляду на гендерні супутні захворювання).
Супутній цукровий діабет
Наявність цукрового діабету у хворих із гострим коронарним синдромом є незалежним фактором ризику смерті, що в 2 рази вищий, ніж смертність при гострому коронарному синдромі без супутнього цукрового діабету. У пацієнтів із цукровим діабетом відзначають також велику кількість супутніх захворювань — порушення функції нирок, СН, перенесений інсульт і загальне ураження судинної системи. Загалом приблизно в 20–30% хворих із гострим коронарним синдромом без елевації сегмента ST — цукровий діабет переважно II типу з інсулінорезистентністю, виявляють його частіше у жінок — 41,6% проти 30,7% у чоловіків. Крім того, у пацієнтів із цукровим діабетом частота АГ (81% проти 66% у хворих без цукрового діабету) і ожиріння (28,5% проти 18,6%) значно вище. Якщо враховувати не тільки клінічний діагноз «цукровий діабет», а й порушення толерантності до глюкози або підвищений рівень глюкози натще, у ⅔ пацієнтів із хронічною або гострою формою ІХС відзначають проблеми з регуляцією метаболізму глюкози. Тому пацієнти з цукровим діабетом мають потребу в більш інтенсивному спостереженні, насамперед контролі рівня глюкози (є дані, що підвищення на 3 ммоль/л глюкози у хворих з ІМ підвищує смертність на 20% при тривалому спостереженні).
Слід пам՚ятати, що у пацієнтів із гострим коронарним синдромом без елевації сегмента ST у поєднанні з цукровим діабетом процедури ангіографії і/або ангіопластики можуть викликати контрастіндуковану нефропатію. З огляду на це, метформін необхідно скасовувати за 24 год до проведення процедури або на 1 добу після її проведення. Ризик кетоацидозу в цьому випадку незначний, але попереджується підвищений ризик нефропатії. Застосування метформіну можна відновити через 48 год після проведення процедури, якщо немає симптомів прогресування ниркової недостатності.
У цілому рекомендується проведення інвазивних процедур у поєднанні з антитромботичною терапією. У двох дослідженнях FRISC ІІ та TACTICS-TIMI-18 (Treat angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy — Thrombolysis in Myocardial Infarction 18), зареєстровано 22–27% зниження частоти смерті і нефатального ІМ у хворих на цукровий діабет після ранньої інвазивної стратегії порівняно з консервативною.
З огляду на високу частоту множинного ураження судин коронарного русла у хворих на цукровий діабет частіше проводять АКШ, що має хороший результат за даними дослідження BARI (Bypass Angioplasty Revascularization Investigation). У ряді досліджень при порівнянні ефективності перкутанного коронарного втручання і СABG (Coronary Artery Bypass Graft) у хворих на цукровий діабет і з гострим коронарним синдромом без елевації ST після неефективної консервативної терапії не відзначено переваг — 3-річна виживаність у групі перкутанного коронарного втручання становила 81%, СABG — 72% (статистично недостовірно). Застосування більш сучасних методик стентування і медикаментозного супроводу не змінило картину, хоча у цих пацієнтів раннє стентування має перевагу над консервативною терапією. Супутнє застосування блокаторів глікопротеїнових рецепторів IIb/IIIa при стентуванні підвищує виживаність за даними метааналізу 6 великих рандомізованих досліджень. У 6458 хворих на цукровий діабет і з гострим коронарним синдромом без елевації ST застосування блокаторів глікопротеїнових рецепторів IIb/IIIa приводило до зниження 30-денної смертності на 26% (6,2% проти 4,6%; р<0,007). Проте навіть Європейські реєстри гострого коронарного синдрому дають менший відсоток застосування цієї групи препаратів у хворих на цукровий діабет, ніж у недіабетиків, що вимагає корекції.
Таким чином, рекомендації щодо лікування при гострому коронарному синдромі без елевації ST із супутнім цукровим діабетом зводяться до наступного:
- Жорсткий контроль рівня глюкози і досягнення нормоглікемії, наскільки це можливо, у всіх пацієнтів із цукровим діабетом і гострим коронарним синдромом без елевації ST.
- Інфузія інсуліну можлива для досягнення нормоглікемії у частини хворих із гострим коронарним синдромом без елевації ST із високим рівнем глюкози.
- У хворих із супутнім цукровим діабетом рекомендується раннє інвазивне втручання.
- У хворих на цукровий діабет внутрішньовенне введення блокаторів глікопротеїнових рецепторів IIb/IIIa повинне передувати і супроводжувати процедуру перкутанного коронарного втручання.
ЛІКУВАННЯ ПАЦІЄНТІВ ІЗ ХРОНІЧНИМИ ЗАХВОРЮВАННЯМИ НИРОК
Як відомо, існує 5 ступенів ниркової недостатності, зумовлених рівнем гломерулярної фільтрації — від >90 мл/хв/1,73 м2 (I стадія) до <15 мл/хв/1,73 м2 (V стадія). Однак у клінічній практиці частіше використовують показник кліренсу креатиніну. Дані національних реєстрів Європи і США демонструють підвищену майже в 2 рази частоту кардіальної смертності та смертності від інших причин у хворих із хронічними захворюваннями нирок, навіть включаючи I ступінь недостатності. Таким чином, хронічні захворювання нирок є новим нетрадиційним фактором ризику, таким як показники запалення, гіпергомоцистемія і протромботичний стан. Варто пам՚ятати, що причиною ниркової недостатності приблизно в 50% випадків є цукровий діабет. Хворі з гострим коронарним синдромом без елевації сегмента ST демонструють таку ж частоту ниркової недостатності, як і інші хворі з гострими і хронічними формами ІХС. У Європейських рекомендаціях наведена таблиця застосування ряду кардіологічних препаратів при ренальній дисфункції, але в коментарях до неї є вказівка, що таблиця не є остаточною, оскільки існують значні відмінності в рекомендаціях різних країн і в інструкціях до застосування препаратів.
Рекомендації для пацієнтів із гострим коронарним синдромом без елевації ST і супутніми хронічними захворюваннями нирок
- Кліренс креатиніну і/або гломерулярної фільтрації необхідно розраховувати для кожного пацієнта, госпіталізованого з приводу гострого коронарного синдрому без елевації ST (IВ). У чоловіків і жінок похилого віку, а також у хворих із недостатньою масою тіла нормальний рівень креатиніну в плазмі крові може не відповідати наявним у них зниженим рівням кліренсу креатиніну і гломерулярної фільтрації (IВ).
- Пацієнти з хронічними захворюваннями нирок повинні отримувати таку ж терапію першої лінії, як і інші хворі.
- У пацієнтів із кліренсом креатиніну <30 мл/хв або гломерулярною фільтрацією <30 мл/хв/1,73 м2 потрібна обережність при призначенні антикоагулянтів і корекції дози, слід також враховувати протипоказання (IС).
- Рекомендується регулювати введення нефракціонованого гепарину відповідно до показників АЧТЧ при кліренсі креатиніну <30 мл/хв або гломерулярній фільтрації <30 мл/хв/1,73 м2.
- Блокатори глікопротеїнових рецепторів IIb/IIIa можна застосовувати в цих хворих, але необхідно коригувати дозу ептіфібатиду і тирофібану. Необхідна обережність з урахуванням високого ризику розвитку кровотеч при використанні абциксімабу (IВ).
- У пацієнтів із хронічними захворюваннями нирок і кліренсом креатиніну <60 мл/хв відзначають підвищений ризик розвитку кардіальних ускладнень, тому вони мають потребу в проведенні реваскуляризації при першій можливості (IIаВ).
- Слід враховувати можливість розвитку контрастіндукованої нефропатії (IВ).
Лікування хворих із гострим коронарним синдромом без елевації сегмента ST із супутньою анемією
Частота випадків анемії у хворих із гострим коронарним синдромом може становити 5–10% (діагноз анемії встановлюють відповідно до рекомендацій ВООЗ — гематокрит <39% для чоловіків і <36% для жінок і рівень гемоглобіну <13 г/дл для чоловіків і <12 г/дл для жінок). Метааналіз досліджень, у які включили близько 40 000 хворих з гострим коронарним синдромом (включаючи ІМ), встановив у них достовірний вплив анемії на 30-денні кінцеві точки. Підвищення частоти смерті, ІМ і повторним ішемічним атакам зареєстровані при рівні гемоглобіну <11 г/дл — 1,45% на кожен 1 г/дл порівняно з хворими з рівнем гемоглобіну 15–16 г/дл. Але частота кардіоваскулярних ускладнень також підвищувалася при рівні гемоглобіну >16 г/дл. Наявність анемії частіше виявляють як супутнє захворювання у пацієнтів похилого віку, з цукровим діабетом і нирковою недостатністю. Анемія погіршує прогноз при проведенні перкутанного коронарного втручання або СABG.
Рекомендації для пацієнтів із гострим коронарним синдромом без елевації сегмента ST із супутньою анемією
- Низький вихідний рівень гемоглобіну є незалежним маркером ризику розвитку ішемічних подій і кровотеч протягом 30 діб захворювання. Це слід враховувати при визначенні ступеня ризику (IВ).
- Всі необхідні аналізи повинні бути виконані перед визначенням тактики лікування.
- Незначна анемія у хворих із гострим коронарним синдромом без елевації ST не вимагає гемотрансфузії, за винятком випадків анемії внаслідок застосування відповідних препаратів.
ТРИВАЛЕ ВЕДЕННЯ ХВОРИХ
Більшість серцевих подій реєструють протягом декількох місяців після перших клінічних проявів гострого коронарного синдрому. Початкова стабілізація стану пацієнта не означає стабілізації базисного патологічного процесу. Даних щодо тривалості процесу загоєння розірваної бляшки небагато. Деякі дослідження свідчать про можливості швидкого прогресування «причинних» уражень при гострому коронарному синдромі, незважаючи на початкову клінічну стабілізацію на фоні медикаментозної терапії. Підвищене утворення тромбіну відзначали протягом 6 міс після епізоду нестабільної стенокардії або ІМ.
Крім того, дослідження, у яких оцінювали ефективність гепарину на додаток до ацетилсаліцилової кислоти, свідчили про підвищення ймовірності клінічних подій після припинення введення гепарину. Незважаючи на це, у дослідженні FRISC II продовження терапії низькомолекулярним гепарином було корисним лише у пацієнтів, що очікують інвазивних втручань.
Агресивна модифікація факторів ризику показана всім пацієнтам, у яких діагностований гострий коронарний синдром.
Пацієнтам слід припинити курити. Їх потрібно проінформувати про шкідливість тютюнопаління як важливого фактора ризику. Лікареві необхідно підкреслювати необхідність фізичної активності і дієти відповідно до критеріїв лікування і профілактики хронічних форм ІХС.
Необхідно коригувати масу тіла, чому сприяє фізична активність. Зменшення маси тіла у свою чергу нормалізує ліпідний профіль і обмін глюкози. Теоретично метою є зниження ІМТ <25 кг/м2 або об՚єму талії <102 см у чоловіків і 88 см у жінок. На практиці хорошим результатом є зменшення маси тіла на 10% вихідного рівня як перший крок.
Необхідно оптимізувати контроль рівня АТ. Він не повинен перевищувати 140/90 мм рт. ст. у пацієнтів без цукрового діабету і 130/80 мм рт. ст. — при цукровому діабеті або хронічній ренальній дисфункції. Цьому частково також сприяє зменшення маси тіла і фізична активність.
Особливої уваги потребують хворі на цукровий діабет (слід проводити всі вищевказані заходи). У пацієнтів із встановленим діагнозом варто підтримувати рівень Hb1c <6,5%.
Зміна ліпідного профілю
Ліпідознижувальну терапію необхідно почати негайно. Активний вплив на ЛПНЩ і ЛПДНЩ, ТГ і ЛПВЩ слід проводити, починаючи з перших годин загострення ІХС, і продовжувати тривалий час відповідно до рекомендацій по лікуванню хронічної ІХС.
Статини
Інгібітори ГМГ-КоА-редуктази істотно знижують смертність та ймовірність коронарних подій у пацієнтів із високим, середнім або навіть низьким (<3,0 ммоль/л) рівнем ХС ЛПНЩ. Дані, отримані в невеликих підгрупах пацієнтів в 4 дослідженнях (PURSUIT (Platelet Glycoprotein IIb-IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy), PRISM (Platelet Receptor Inhibition in Ischemic Syndrome Management), PRISM-PLUS (Platelet Receptor Inhibition in Ischemic Syndrome Management in Patients Limited by Unstable Signs and Symptoms) і TACTICS), дозволяють припустити, що статини здатні забезпечити швидкий результат у пацієнтів із гострим коронарним синдромом, але ці дані отримані без рандомізації (рис. 2.8).
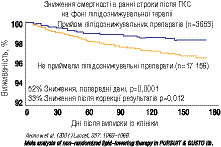
Рис. 2.8. Ефективність застосування статинів у гострий період ІХС. ГКС — гострий коронарний синдром
У шведському реєстрі RIKS-HIA (Register of Information and Knowledge about Swedish Heart Intensive Care Admission) смертність протягом 1 року була нижчою у пацієнтів з ІМ без елевації сегмента ST, виписаних на фоні терапії статинами, ніж без цих препаратів. В інших дослідженнях оцінювали наявність негайного ефекту статинів при гострому коронарному синдромі (дослідження A to Z) та ефективність застосування препаратів у високих дозах порівняно із середніми (TNT (Treating to New Targets), SEARCH (Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine), IDEAL (Incremental Decrease in Clinical Endpoints Through Aggressive Lipid Lowering). Кілька ангіографічних досліджень ефекту ліпідознижувальної терапії дозволяють припустити, що поліпшення клінічного результату не обов՚язково супроводжується регресією атеросклерозу, а може бути пов՚язане з деактивацією збудженої бляшки, зворотним розвитком ендотеліальної дисфункції, зниженням активності протромботичних факторів.
Згідно з даними реєстру GRACE результати гострого коронарного синдрому у хворих, що приймали попередньо статини і не приймали їх, виглядають у такий спосіб (табл. 2.3).
Таблиця 2.3
Вплив попереднього застосування статинів на результати гострого коронарного синдрому
| Госпітальна подія, % | Попередньо приймали статини (n=4056) | Не приймали статини (n=15 481) | p |
| Остаточний діагноз: ІМ з елевацією сегмента ST |
18,4 | 37,6 | <0,001 |
| Рівень КФК у 2 рази перевищує норму | 24,7 | 45,0 | <0,001 |
| ІМ через 24 год або рецидивуючий ІМ | 6,9 | 10,1 | <0,001 |
| Застійна СН | 12,4 | 15,6 | <0,001 |
| Кардіогенний шок | 2,3 | 5,0 | <0,001 |
| Набряк легень | 5,2 | 6,8 | <0,001 |
| Зупинка серця | 2,6 | 5,9 | <0,001 |
| Серцевий напад | 0,8 | 1,1 | 0,078 |
| Смерть | 3,1 | 6,9 | <0,001 |
Так, попередній прийом статинів у 2 рази знижував частоту різних ускладнень гострого періоду ІМ, включаючи смерть.
У 2006 р. закінчене велике дослідження PROVE-IT (TIMI 22) (Pravastatin or Atorvastatin Evaluation and Infection Therapy) — подвійне сліпе рандомізоване дослідження за участю 4160 пацієнтів із гострим коронарним синдромом тривалістю <10 днів і загальним ХС ≤240 мг/дл. На фоні прийому ацетилсаліцилової кислоти + стандартної терапії хворі у двох основних групах приймали 40 мг правастатину або 80 мг аторвастатину (агресивна терапія) протягом 2 років. Кожна група ділилася ще на 2 групи, пацієнти однієї з яких приймали антибіотик гатіфлоксацин 400 мг 10 днів на місяць.
Первинні кінцеві точки: смерть, ІМ, інсульт, нестабільна стенокардія, що вимагає госпіталізації або реваскуляризації (>30 днів після рандомізації). Агресивна терапія аторвастатином виявилася на 16% (р<0,005) ефективнішою, ніж правастатином. У той же час застосування антибіотика практично нічого не додало до позитивних ефектів лікування.
Метааналіз 8 великих рандомізованих досліджень, присвячених застосуванню статинів у гострий період ІХС, показав достовірне зниження смертності, реінфарктів і реваскуляризації. Аналіз включав 15 995 пацієнтів із гострим коронарним синдромом, рандомізованих за ознакою призначення агресивної терапії статинами (n=8037) порівняно зі звичайною консервативною терапією стандартними дозами статинів або плацебо (n=7958). Статини призначали між 6 год і 10 добами після госпіталізації; середня тривалість терапії становила 15 міс. Загальна смертність знизилася на 25% більше в групі агресивної терапії, кардіоваскулярна смертність знизилася більше ніж на 22%. Не виявлено достовірної різниці в зниженні частоти повторних ІМ, відзначена тенденція до зниження частоти розвитку інсультів у групі агресивної терапії. На думку авторів, зниження ХС при гострому коронарному синдромі повинне досягати 50–70 мг/дл.
У 2004 р. на сесії АНА Фаді А. Сааб із Кардіоваскулярного центру університету Мічигану доповів про результати спостереження 2523 хворих із гострим коронарним синдромом (ІМ і нестабільна стенокардія) у 1999–2002 рр. в університетській клініці. 884 пацієнти були виключені із групи, оскільки їм не призначали статини або вони приймали статини перед захворюванням. Пацієнти, що залишилися, були рандомізовані на 2 групи — 1-ша (1284) — хворі, що отримували статини, починаючи з перших 24 год від початку розвитку гострого коронарного синдрому, і 2-га (355) — пацієнти, яким статини призначили пізніше. Кінцевими точками були смерть, ІМ, інсульт, реінфаркт, СН і комбінована точка — смерть, інсульт, реінфаркт.
Частота розвитку комбінованої кінцевої точки в госпітальний період виявилася істотно нижчою у групі хворих, що приймали статини починаючи з перших 24 год — 10,4% проти 15,7% (р<0,03), у них також рідше розвивалися ознаки СН.
При аналізі NRMI 4 (National Registry of Myocardial Infarction 4) автори встановили, що статини були призначені 39 096 з 174 635 (22,4%) пацієнтів у перші 24 год госпіталізації. Це дало зниження ризику госпітальної смертності порівняно з групою пацієнтів, що не приймали статини (4,0% проти 15,4%; відносний ризик 0,23; 95% ДІ 0,22–0,25). У пацієнтів групи високого ризику, яким скасували статини, був такий же високий ризик смертності — 16,5% проти 15,4%.
T. Lenderink та співавтори вивчили 7-денну смертність 10 484 хворих із гострим коронарним синдромом, 1426 з яких статини призначали в перші 24 год захворювання, іншим — по закінченню цього терміну. Смертність у групі раннього застосування статинів виявилася вірогідно нижчою — 0,4% порівняно з «пізньою» групою — 2,6%.
У реєстрі ACSIS (Acute Coronary Syndrome Israeli Survey, Реєстр гострих коронарних синдромів Ізраїлю) оцінювали вплив терапії статинами, що передує гострим коронарним синдромам, на результат захворювання. В аналіз увійшли хворі, госпіталізовані в березні–квітні 2006 р. З них приймали статини перед госпіталізацією (Stat+) 938 пацієнтів і не приймали (Stat-) 1108. Первинна кінцева точка була комбінованою — смерть, СН або поворотна ішемія між випискою з госпіталю і 30-м днем захворювання. Мультиваріантний аналіз показав розходження при виписці у 2 групах на користь Stat+ — 35% (відносний ризик 0,65; p=0,01). На 30-й день розходження практично не змінилося — відносний ризик 0,69.
З՚явилися дані про вплив терапії статинами на динаміку насосної функції у хворих із гострим коронарним синдромом. У реєстрі гострого коронарного синдрому (STEMI (ST-Elevation Myocardial Infarction), NSTEMI, UA) German MITRA PLUS (Maximal Individual Therapy of Acute Myocardial Infarction PLUS registry) піддалися аналізу 18 936 пацієнтів, виписаних після перенесеного гострого коронарного синдрому. Кінцеві точки, включаючи динаміку ФВ, враховували через 14 міс (у середньому 399 днів). Порівнювали вплив терапії статинами на смертність хворих з різною вихідною насосною функцією міокарда (ФВ <40% і >40%) в клініці. 14-місячна смертність на фоні терапії статинами в обох групах була практично в 2 рази нижчою, ніж у хворих, що не приймали статини, як при ФВ >40% (3,8% проти 7,4%; відносний ризик 0,74), так і при ФВ <40% (12,8% проти 22,3%; відносний ризик 0,67).
Крім того, встановлено, що попередній прийом аторвастатину поліпшує перебіг гострого коронарного синдрому у хворих, що піддалися ранньому перкутанному коронарному втручанню (результати ARMYDA-ACS (Atorvastatin for Reduction of Myocardial Damage During Angioplasty-Acute Coronary Syndromes)).
171 пацієнт із гострим коронарним синдромом без елевації сегмента ST був рандомізований за ознакою застосування аторвастатиу (80 мг за 12 год до проведення перкутанного коронарного втручання з наступним прийомом 40 мг, n=86) або плацебо (n=85). Через 30 днів реєстрували стандартні тверді кінцеві точки MACE (Major Adverse Cardiac Event) (смерть, ІМ, ургентна реваскуляризація). Первинні кінцеві крапки зареєстровані в 5% пацієнтів, що приймали аторвастатин, і в 17% — плацебо (p=0,01). Це розходження забезпечувалося переважно за рахунок частоти розвитку ІМ (5% проти 15%; p=0,04). При мультиваріантному аналізі попереднє застосування аторвастатину зумовило зниження ризику MACE протягом 30 днів на 88% (OR=0,12; 95% ДІ; p=0,004).
Наші дослідження впливу симвастатину і аторвастатину також дозволяють рекомендувати ці препарати вже з перших годин гострого коронарного синдрому, виявлені багатогранні ефекти цієї групи препаратів — зниження рівня СРБ на 40% уже через 2 міс, закономірне зниження рівня ЛПНЩ і ТГ, інтенсивності перекисного окислювання ЛПНЩ, зменшення вираженості синдрому інсулінорезистентності у хворих із гострим коронарним синдромом.
Рекомендації із застосування статинів у хворих із гострим коронарним синдромом:
- Гіполіпідемічну терапію статинами необхідно призначати всім пацієнтам (при відсутності протипоказань) незалежно від рівня ХС якомога раніше (протягом 1–4 днів після госпіталізації) для зниження рівня ХС ЛПНЩ <100 мг/дл (<2,6 ммоль/л) (IB).
- Інтенсивна ліпідознижувальна терапія з метою зниження рівня ХС ЛПНЩ <70 мг/дл (<1,81 ммоль/л) може тривати 10 днів після госпіталізації (IIa).
На підставі численних досліджень доведена необхідність застосування ацетилсаліцилової кислоти в дозі 75–150 мг. Згідно з даними метааналізу призначення ацетилсаліцилової кислоти в більш високих дозах не має переваг. У пацієнтів, які раніше перенесли ІМ, застосування ацетилсаліцилової кислоти протягом у середньому 27 міс дозволяє зменшити кількість судинних подій — 36 на 1000 пацієнтів, при цьому випадків нефатального ІМ на 18 менше, випадків смерті — на 14.
З огляду на результати дослідження CURE, клопідогрел у дозі 75 мг необхідно призначати протягом принаймні 9 міс, можливо 12 міс. У цьому випадку дозу ацетилсаліцилової кислоти потрібно знизити до 75–100 мг.
Блокатори β-адренорецепторів поліпшують прогноз у пацієнтів, які перенесли ІМ, і після перенесеного гострого коронарного синдрому лікування цими препаратами необхідно продовжувати.
Самостійне значення у вторинній профілактиці коронарних синдромів можуть мати інгібітори АПФ. У рандомізованих дослідженнях SOLVD (Studies of Left Ventricular Dysfunction) і SAVE (Survival and Ventricular Enlargement, 1992) у пацієнтів із ІХС і ураженням ЛШ частота серцевих подій на фоні застосування інгібіторів АПФ знизилася. Ефект запобігання ІМ ставав очевидним через 6 міс активного лікування. Ці дані є сильним аргументом на користь того, що ефекти інгібіторів АПФ не обмежуються контролем рівня АТ. Переваги інгібіторів АПФ можуть бути пов՚язані зі стабілізацією атеросклеротичної бляшки. У дослідженні HOPE (Heart Outcomes Prevention Evaluation, 2000) у пацієнтів з атеросклеротичними ураженнями судин без СН або дисфункції ЛЖ на фоні лікування раміприлом протягом 4–6 років смертність від серцево-судинних причин знизилася на 25% порівняно з плацебо (p=0,0002), частота випадків ІМ — на 20% (p=0,005). Утім, у дослідженні HOPE не отриманий ефект у підкатегорії пацієнтів із нестабільною стенокардією, що визначали по змінах сегмента ST і зубця Т, але це могло бути зумовлене випадковими факторами.
Таким чином, крім вищевказаних методів лікування, хворим після перенесеного гострого коронарного синдрому рекомендується призначати:
- Блокатори β-адренорецепторів — усім хворим зі зниженою ФВ (IA).
- Інгібітори АПФ — усім пацієнтам із ФВ ЛШ <40% і пацієнтам із цукровим діабетом, АГ або хронічним захворюванням нирок (IA).
- Інгібітори АПФ — й іншим пацієнтам із гострим коронарним синдромом для попередження повторних ішемічних подій (IIa).
- Блокатори ангіотензинових рецепторів — пацієнтам, стійким до інгібіторів АПФ і/або з СН на фоні ІМ із ФВ ЛШ <40% (IB).
- Блокатори альдостеронових рецепторів — пацієнтам після ІМ, які вже приймають інгібітори АПФ і блокатори β-адренорецепторів та у яких зберігається ФВ ЛШ <40% і є цукровий діабет або СН (при відсутності ниркової дисфункції або гіперкаліємії (IB).
Ускладнення, пов’язані з лікуванням
Кровотечі
Кровотеча є найбільш частим некардіальним ускладненням у пацієнтів із гострим коронарним синдромом без елевації ST. Взагалі використовують загальні дефініції кровотеч TIMI або GUSTO, у яких наведена локалізація і необхідність гемотрансфузії. Найбільше повинні привертати увагу масивні кровотечі, клінічно очевидні (у тому числі і видимі) з втратою >5 г/дл гемоглобіну, а також інтракраніальні геморагії.
У цілому виявляють від 2 до 8% кровотеч у хворих із гострим коронарним синдромом без елевації сегмента ST, найчастіше пов’язаних із застосуванням антитромботичних препаратів або прийомом їх у високих дозах, а також інвазивних процедур. Реєстр GRACE при аналізі 24 045 пацієнтів зареєстрував 3,9% масивних кровотеч у хворих з ІМ, 4,7% — при гострому коронарному синдромі без елевації сегмента ST і 2,3% — при нестабільній стенокардії. Незалежними предикторами ризику розвитку кровотеч, відповідно до цього реєстру, є вік (підвищення частоти на 1,22% кожні 10 років), жіноча стать, застосування перкутанного коронарного втручання, ниркова недостатність, застосування блокаторів глікопротеїнових рецепторів IIb/IIIa, гепарину, тромболітиків, діуретиків, внутрішньовенне введення інотропних агентів.
Звичайно, кровотеча значно погіршує прогноз для хворих. Результати метааналізів, реєстрів і досліджень свідчать, що масивні кровотечі в 4 рази підвищують ризик смерті, в 5 разів — ризик розвитку повторного ІМ і в 3 рази — ризик інсульту в перші 30 діб. За даними вже згадуваного OASIS-5 ризик розвитку ішемічних ускладнень корелював із частотою кровотеч. Так, частота смерті становила 12,9% проти 2,8%, ризик розвитку ІМ — 13,9% проти 3,6%, ризик інсульту — 3,6% проти 0,8% у хворих із кровотечами порівняно з неускладненим перебігом гострого коронарного синдрому протягом 30 діб.
З урахуванням вищевикладеного при загрозі кровотечі рекомендується:
- визначення ризику можливого виникнення кровотечі як важливого і необхідного компонента лікування. Ризик підвищується при застосуванні антитромботичних препаратів у високих або надмірних дозах, при тривалому їхньому використанні, комбінації декількох антитромботичних агентів, у похилому віці, при наявності ренальної дисфункції, при недостатній масі тіла, у хворих жіночої статі і при проведенні перкутанного коронарного втручання (IВ);
- брати до уваги певний ризик розвитку кровотечі при плануванні лікувальної стратегії;
- враховувати, що невеликі кровотечі можуть усуватися без припинення основного лікування;
- враховувати, що гемотрансфузія може призводити до негативних наслідків, її призначення варто визначати індивідуально, не рекомендується її застосування в гемодинамічно стабільних пацієнтів із гематокритом >25% або рівнем гемоглобіну >8 г/л (IС).
Реабілітація
Крім модифікації факторів ризику і медикаментозної терапії, хворі, які перенесли гострий коронарний синдром без елевації сегмента ST, мають потребу в реабілітаційних заходах. Кожному хворому необхідно проводити повторний тест із фізичним навантаженням через 4–7 тиж після виписки. З урахуванням результатів всіх проведених досліджень пацієнта слід проінформувати про припустимі фізичні навантаження, можливу інтенсивність і вид робіт, сексуальну активність.
В Україні діє система поетапної реабілітації хворих, які перенесли гострий коронарний синдром, включаючи гострий коронарний синдром без елевації сегмента ST. Відповідно до цієї системи пацієнти, які працюють, незалежно від віку, після виписки з реабілітаційного або кардіологічного відділення повинні бути направлені в реабілітаційне відділення санаторію відповідної області. Основний критерій напрямку в санаторії — стабілізація стану і можливість фізичного навантаження, адекватній ходьбі на 1000 м без ангінозного болю і змін на ЕКГ (докладно методики реабілітації на стаціонарному і санаторному етапах викладені у відповідних рекомендаціях).
СТРАТЕГІЯ ВЕДЕННЯ ПАЦІЄНТА З ГОСТРИМ КОРОНАРНИМ СИНДРОМОМ
У цьому розділі обговорюється стратегія, прийнятна для більшості пацієнтів з підозрою на гострий коронарний синдром. Слід визнати, що специфічні дані в окремих пацієнтів можуть зумовити необхідність відхилення від запропонованої стратегії. У кожному випадку лікар повинен приймати рішення, з огляду на особливості анамнезу, клінічні прояви, дані, отримані під час спостереження і обстеження в клініці, доступне лікування. Ці рекомендації слід розглядати як такі, які підходять для більшості випадків, хоча в певних пацієнтів і при особливих умовах можливий вибір інших шляхів.
Тактика ведення хворих із гострим коронарним синдромом без елевації ST представлена на схемі 2.1.
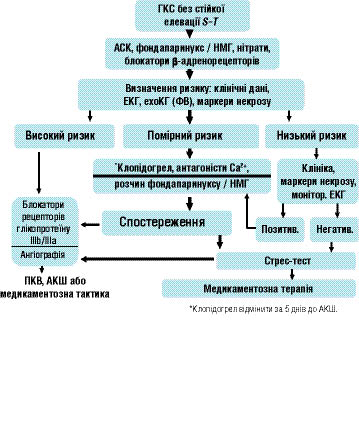
Схема 2.1. Рекомендації Європейского товариства кардіологів по тактиці ведення хворих з підозрою на гострий коронарний синдром. ГКС — гострий коронарний синдром; АСК — ацетилсаліцилова кислота; НМГ — низькомолекулярний гепарин
Необхідно відзначити, що майже ідентичний алгоритм лікування хворих із гострим коронарним синдромом без елевації сегмента ST прийнятий у 2007 р. АНА (схема 2.2).

Схема 2.2. Алгоритм лікування хворих із гострим коронарним синдромом без елевації сегмента ST, прийнятий АНА (UA/NSTEMI AHA/ACC, 2007). АСК — ацетилсаліцилова кислота; НФГ — нефракціонований гепарин
Перший крок: оцінка при госпіталізації
У більшості пацієнтів можна виявити лише дискомфорт у грудній клітці (біль у грудній клітці), підозра на гострий коронарний синдром є попереднім діагнозом.
Початкове обстеження включає:
- Детальне опитування і точний опис симптомів. Необхідне фізикальне обстеження з урахуванням можливої наявності захворювання клапанів серця (аортальний стеноз), ГКМП, СН і захворювання легень.
- Визначення ймовірності ІХС (включаючи комплексний аналіз віку, факторів ризику, що передують ІМ, АКШ, перкутанного коронарного втручання).
- Необхідно зареєструвати ЕКГ. Порівняння з попередньою ЕКГ, якщо така є, дуже корисне, зокрема у пацієнтів з фоновою серцевою патологією, такою як ГЛШ або раніше діагностована ІХС.
- На основі цих даних, які необхідно отримати за 10 хв після першого спілкування з пацієнтом, хворих підрозділяють на три великі групи:
- ІМ, що має потребу в негайній реперфузії;
- гострий коронарний синдром без елевації сегмента ST;
- сумнівний гострий коронарний синдром.
Лікування пацієнтів із ІМ описано у відповідних рекомендаціях. Сумнівний гострий коронарний синдром слід встановлювати з обережністю і після виключення всіх можливих подібних станів, включаючи травми. Рекомендується також реєстрація правих грудних відведень ЕКГ.
Проведення на додаток до вищесказаного аналізів крові, які повинні бути отримані протягом 60 хв (тропонін Т або I, МВ-фракція КФК, креатинін, гемоглобін і кількість лейкоцитів), дозволяє перейти до другого кроку визначення стратегії лікування хворих, віднесених у групу гострого коронарного синдрому без елевації сегмента ST.
Другий крок: уточнення діагнозу і визначення ризику
У випадках гострого коронарного синдрому без стійкої елевації сегмента ST (депресія сегмента ST, негативні зубці Т, псевдонормалізація Т або нормальна картина ЕКГ) необхідно проводити початкове лікування відповідно до наведеного переліку (табл. 2.4).
Таблиця 2.4
Початкове лікування при гострому коронарному синдромі без стійкої елевації сегмента ST
| Кисень | Інгаляція (4–8 л/хв), якщо сатурація <90% |
| Нітрати | Сублінгвальне або внутрішньовенне застосування (при САТ не нижче 90 мм рт. ст.) |
| Ацетилсаліцилова кислота | Стартова доза 160–325 мг некишковорозчинної форми з подальшим переходом на 75–150 мг/добу. Внутрішньовенне введення може розглядатися |
| Клопідогрел | Навантажувальна доза 300 мг (або 600 мг при швидкому плануванні інвазивного втручання) з подальшим переходом на 75 мг/добу |
| Антикоагулянти | Вибір залежить від стратегії лікування: |
| Нефракціонований гепарин внутрішньовенно болюсно 60–70 МО/кг маси тіла (максимум — 5000 МО) з подальшою інфузією 12–15 МО/кг/год (максимум — 1000 МО/год) до підвищення АЧТЧ у 1,5–2,5 раза | |
| Фондапаринукс 2,5 мг/добу підшкірно | |
| Еноксапарин 1 мг/кг 2 рази на добу підшкірно | |
| Дальтепарин 120 МО/кг 2 рази на добу підшкірно | |
| Надропарин 86 МО/кг 2 рази на добу підшкірно | |
| Бівалірудин 0,1 мг/кг болюсно з подальшим введенням 0,25 мг/кг/год | |
| Морфін | 3–5 мг внутрішньовенно або підшкірно, залежно від інтенсивності болю |
| Пероральні блокатори β-адренорецепторів | Переважно при тахікардії або АГ при відсутності проявів СН |
| Атропін | 0,5–1,0 мг внутрішньовенно при брадикардії |
Протягом цього кроку інші діагнози повинні бути підтверджені або виключені, особливо гостра анемія, емболія ЛА, аортальна дисекція.
Визначення ризику розвитку коронарних подій у ранньому і відстроченому (<6 міс) прогнозі розглядалося у відповідному розділі. Слід вказати, що вибір стратегії лікування хворих із гострим коронарним синдромом без елевації сегмента ST повинен базуватися на об’єднанні оцінки ризиків як коронарних подій, так і можливих кровотеч, у тому числі при проведенні ангіографії (з місця пункції артерії) і застосуванні антитромботичних заходів. Необхідно враховувати інструкції до відповідних препаратів.
Третій крок: інвазивна стратегія
Серцева катетеризація рекомендується як засіб запобігання ускладнень захворювання і оцінки відстроченого прогнозу. Необхідність і терміновість інвазивної стратегії встановлюють після визначення ризику і віднесення хворих до однієї з 3 груп: консервативної, ранньої інвазивної або ургентної інвазивної.
Консервативна стратегія
Пацієнти, які цілком відповідають нижченаведеним критеріям, відносять до групи низького ризику без необхідності застосування ранньої інвазивної стратегії:
- без повторного ангінозного болю;
- без симптомів СН;
- без патологічних змін на ЕКГ при надходженні або при повторній її реєстрації через 6–12 год;
- без підвищення рівня тропоніну (вихідного і через 6–12 год).
Такі пацієнти надалі можуть проходити лікування як особи з хронічною ІХС, перед випискою проводять стрес-тест. Пацієнтів, що не відповідають всім наведеним критеріям, необхідно направляти на катетеризацію.
Ургентна інвазивна стратегія
Цю стратегію необхідно застосовувати у хворих, які перебувають на ранній стадії міокардіального ураження за даними ЕКГ або належать до групи високого ризику кардіальних ускладнень. Це пацієнти:
- із рефрактерним ангінозним болем;
- із повторюваним болем і депресією сегмента ST, незважаючи на інтенсивну антиангінальну терапію;
- із клінічними симптомами СН або гемодинамічною нестабільністю (у тому числі шок);
- із загрозливою для життя аритмією (фібриляція шлуночків або шлуночкова тахікардія).
Рання інвазивна стратегія
Значна частина пацієнтів позитивно відповідають на оптимальну медикаментозну терапію, але все-таки мають підвищений ризик і мають потребу в проведенні ангіографії. Час її проведення встановлюють з урахуванням наявних можливостей, але не пізніше 72 год від початку захворювання. Наступні критерії вимагають проведення ранньої ангіографії:
- підвищений рівень тропоніну;
- динаміка сегмента ST або зубця Т на ЕКГ (больова або німа) >0,5 мм;
- наявність цукрового діабету;
- знижена функція нирок (гломерулярна фільтрація <60 мл/хв/1,73 м2);
- зниження ФВ ЛШ <40%;
- рання постінфарктна стенокардія;
- проведене протягом попередніх 6 міс перкутанне коронарне втручання;
- попереднє АКШ;
- помірний ризик відповідно до таблиці визначення ризику.
Блокатори глікопротеїнових рецепторів IIb/IIIa (тирофібан, ептифібатид) необхідно додавати до стандартної терапії перед проведенням катетеризації у випадках підвищеного рівня тропоніну, динаміки ST/T, цукрового діабету.
Четвертий крок: визначення методики реваскуляризації
Якщо на ангіограмах не виявлено критичного ураження коронарних судин, хворому призначають медикаментозну терапію, одночасно уточнюють діагноз «гострий коронарний синдром». Звичайно, відсутність ангіографічних ознак ураження коронарних судин не може бути приводом для зняття діагнозу «гострий коронарний синдром» при наявності симптомів ішемії, підтверджених біомаркерами. У цих випадках хворі продовжують приймати лікування, визначене для гострого коронарного синдрому без елевації сегмента ST. У пацієнтів із ураженням однієї судини показане перкутанне коронарне втручання зі стентуванням цієї артерії. У пацієнтів із множинним ураженням судин тактику реваскуляризації (перкутанного коронарного втручання або АКШ) необхідно визначати індивідуально. Переважно проводять послідовне використання перкутанного коронарного втручання ураженої артерії, відповідальної за гостру ішемію, з наступним шунтуванням.
Не рекомендується міняти антикоагулянти при проведенні перкутанного коронарного втручання. Пацієнтам, що приймали фондапаринукс, перед проведенням перкутанного коронарного втручання може бути доданий нефракціонований гепарин. Пацієнти, що отримували тирофібан або ептифібатид, повинні одержувати інфузії цих препаратів під час перкутанного коронарного втручання. Пацієнтам, що не отримували терапію блокаторами глікопротеїнових рецепторів IIb/IIIa, слід переважно призначати абциксімаб перед перкутанним коронарним втручанням.
При плануванні АКШ необхідно скасувати клопідогрел і відкласти операцію на 5 діб, якщо клінічна ситуація дозволяє.
П’ятий крок: виписка і ведення хворих після виписки
Хоча більшість кардіальних подій у хворих із гострим коронарним синдромом без елевації сегмента ST приходиться на гострий період, ризик ІМ і смерті може зростати протягом наступних місяців, тому пацієнти потребують посиленого спостереження. Звичайно, проведення ранньої реваскуляризації знижує ризик аритмічної смерті до 2,5% порівняно з майже 80% у перші 12 год, але прогресування атеросклеротичного ураження при неналежному медикаментозному лікуванні і спостереженні може призводити до повторних епізодів гострого коронарного синдрому. Необхідна також інтенсивна модифікація факторів ризику у всіх пацієнтів.
На закінчення ще раз підкреслюємо, що гострий коронарний синдром без елевації сегмента ST часто дає гірший прогноз, ніж гострий ІМ, і з огляду на це вимагає такого ж інтенсивного лікування в гострий період і спостереження після виписки. Слід пам’ятати, що підтверджений гострий коронарний синдром є найбільш надійною верифікацією ІХС, що вимагає подальшого лікування відповідно до рекомендацій по лікуванню хронічної ІХС як пацієнтів із найбільш високим ризиком ускладнень.
ЛІТЕРАТУРА
- Насонов Е.Л. (1999) Маркеры воспаления и атеросклероз: значение С-реактивного белка. Кардиология, 39: 81–85.
- ACSIS (2007) Eur. Heart J., 28 (Abstr. Suppl.): 835.
- Akkerhuis K.M., Klootwijk P.A., Lindeboom W. et al. (2001) Recurrent ischaemia during continuous multilead ST-segment monitoring identifies patients with acute coronary syndromes at high risk of adverse cardiac events; meta-analysis of three studies involving 995 patients. Eur. Heart J., 22: 1997–2006.
- American College of Cardiology 55th Annual Scientific Session, Presented by Anthony A., Bavry M.D., MPH, fellow in the Department of Medicine at the Cleveland Clinic Foundation in Ohio.
- Antithrombotic, Trialist, Collaboration (2002) Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ, 324: 71–86.
- Antman E.M., Cohen M., Radley D. et al. (1999) Assessment of the treatment effect of enoxaparin for unstable Angina/Non-Q-wave myocardial infarction: TIMI 11B-ESSENCE meta-analysis. Circulation, 100: 1602–1608.
- Antman E.M., McCabe C.H., Gurfinkel E.P. et al. (1999) Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) 11B trial. Circulation, 100: 1593–1601.
- Anzai T., Yoshikawa T., Shiraki H. et al. (1997) C-reactive protein as a predictor of infarct expansion and cardiac rapture after a first Q-wave acute myocardial infarction. Circulation, 96: 778–784.
- Ardissino D., Merlini P.A., Gamba G. et al. (1996) Thrombin activity and early outcome in unstable angina pectoris. Circulation, 93: 1634–1639.
- ARMYDA-ACS randomized trial (2007) Eur. Heart J., 28 (Abstr. Suppl.): 731.
- BARI investigators (1997) Five-year clinical and functional outcome comparing bypass surgery and angioplasty in patients with multivessel coronary disease. A multicenter randomized trial. Writing Group for the Bypass Angioplasty Revascularization Investigation (BARI) Investigators. JAMA, 277: 715–721.
- Bartnik M. (2004) The prevalence of abnormal glucose regulation in patients with coronary artery disease acrfoss Europe.The Euro Heart Survey on diabetes and the heart. Eur. Heart J., 25: 1880–1890.
- Becker R.C.C., Bovill E. et al. (1996) Prognostic value of plasma fibrinogen concentration in patients with unstable angina and non-Q-wave myocardial infarction (TIMI IIIB trial). Am. J. Cardiol., 78: 142–147.
- Bitti J.A. et al. (2001) Bivalirudin versus heparin during coronary angioplasty for unstable or postinfarction angina: final report reanalysis of the Bivalirudin Angioplasty Study. Am. Heart J., 142: 952–959.
- Braunwald E. (1989) Unstable angina. A classification. Circulation, 80: 410–414.
- Burke A.P., Tracy R.P., Kolodgie F. et al. (2002) Elevated C-reactive protein values and atherosclerosis in sudden coronary death. Association with different pathologies. Circulation, 105: 2019–2023.
- CABRI Investigators (1996) First-year results of CABRI (Coronary Angioplasty versus Bypass Revascularization Investigation. Circulation, 93: 847.
- Cairns J.A., Singer J., Gent M. et al. (1989) One year mortality outcomes of all coronary and intensive care unit patients with acute myocardial infarction, unstable angina or other chest pain in Hamilton, Ontario, a city of 375,000 people. Can. J. Cardiol., 5: 239–256.
- Campbell R.W.F., Turpie A.G.G., Maseri A. et al. (1998) Management strategies for a better outcome in unstable coronary artery disease. Clin. Cardiol., 21: 314–322.
- Cannon C.P., Weintraub W.S., Demopoulos LA. et al. (2001) Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein Ilb/IIIa inhibitor tirofiban. N. Engl. J. Med., 344: 1879–1887.
- Davies E., Gawad Y., Takahashi M. et al. (1997) Analytical performance and clinical utility of a sensitive immunoassay for determination of human cardiac troponin I. Clin. Biochem., 30: 479–490.
- DePace N., Herling I.M., Kotler M.N. et al. (1982) Intravenous nitroglycerin for rest angina. Potential pathophysiologic mechanisms of action. Arch. Intern. Med., 142: 1806–1809.
- Eikelboom J.W., Anand S.S., Malmberg K. et al. (2000) Unfractionated heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a meta-analysis. Lancet; 355: 1936–1952.
- EPISTENT Investigators (1998) Randomised placebo-controlled and balloon-angioplasty-controlled trial to assess safety of coronary stenting with use of platelet glycoprotein- IІb/IIIa blockade. The EPISTENT Investigators. Evaluation of Platelet IІb/IIIa Inhibitor for Stenting. Lancet, 352: 87–92.
- Ernofsson M., Strekerud F., Toss H. et al. (1998) Low-molecular weight heparin reduces the generation and activity of thrombin in unstable coronary artery disease. Thromb Haemost, 79: 491–501.
- Falk E., Shah P., Fuster V. (1995) Coronary plaque disruption. Circulation, 92: 657–671.
- Ferguson J.J. (2000) Combining low-molecular-weight heparin and glycoprotein Ilb/IIIa antagonists for the treatment of acute coronary syndromes: the NICE 3 story. National Investigators Collaborating on Enoxaparin. J. Invas. Cardiol., 12 (Suppl. E): E10-3; discussion E25-8.
- Fisch C. (1997) The clinical ECG; sensitivity and specificity. Elsevier.
- Fonarow G.C., Wright R.S., Spencer F.A. (2005) National Registry of Myocardial Infarction 4 Investigators. Effect of statin use within the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am. J. Cardiol., 96: 611–616.
- Fox K.A. (1999) Implications of the Organization to Assess Strategies for Ischemic Syndromes-2 (OASIS-2) study and the results in the context of other trials. Am. J. Cardiol., 84: 26M–31M.
- FRISC study group (1996) Low-molecular-weight heparin during instability in coronary artery disease, Fragmin during Instability in Coronary Artery Disease (FRISC) study group. Lancet, 347: 561–568.
- FRISCII investigators (1999) Invasive compared with non-invasive treatment in unstable coronary- artery disease: FRISC II prospective randomised multicentre study. FRagmin and Fast Revascularisation during Instability in Coronary artery disease Investigators. Lancet, 354: 708–715.
- FTT Trialists (1994) Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomised trials of more than 1000 patients. Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Lancet, 343: 311–322.
- German MITRA PLUS (2007) Eur. Heart J., 28 (Abstr. Suppl.): 520.
- Gottsauner-Wolf M., Zasmeta G., Hornykewycz S. et al. (2000) Plasma levels of C-reacive protein after coronary stent implantation. Eur. Heart. J., 102: 2165–2168.
- 36. Gusto IIB investigators (1996) A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes. The Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO) lib investigators. N. Engl. J. Med., 335: 775–782.
- Hamm C.W., Heeschen C., Goldmann B. et al. (1999) Benefit of abciximab in patients with refractory unstable angina in relation to serum troponin T levels. c7E3 Fab Antiplatelet Therapy in Unstable Refractory Angina (CAPTURE) Study Investigators. N. Engl. J. Med., 340: 1623–1629.
- Haverkate F., Thompson S.G., Pyke S.D.M. (1997) Production of C-reactive protein and risk of coronary events in stable and unstable angina. Lancet, 349: 462–466.
- Held P.Y.S., Furberg C.D. (1989) Calcium channel blockers in acute myocardial infarction and unstable angina: an overview. Br. Med. J., 299: 1187–1192.
- Kaplan K.D.R., Parker M., Przybylek J. et al. (1983) Intravenous nitroglycerin for the treatment of angina at rest unresponsive to standard nitrate therapy. Am. J. Cardiol., 51: 694–698.
- Karlsson J.E., Berglund U., Bjorkholm A. et al. (1992) Thrombolysis with recombinant human tissue-type plasminogen activator during instability in coronary artery disease: effect on myocardial ischemia and need for coronary revascularization. TRIG Study Group. Am. Heart J., 124: 1419–1426.
- Kataoka H., Kume N., Miyamoto S.et al. (2001) Oxidized LDL modilates Bax/Bcl-2 through the lectinlike ox-LDL receptor-1 in vascular smooth muscle cells. Arterioscl. Thromb. Vasc. Biol., 21: 955–960.
- Katus H.A., Looser S., Hallermayer K. et al. (1992) Development and in vitro characterization of a new immunoassay of cardiac troponin T. Clin. Chem., 38: 386–393.
- Lagerqvist B. et al. (2006) 5-year outcomes in tye FRISC – II randomised trial of an invasive versus a noninvasive strategy in non-ST-elevation acute coronary syndrome: a follow-up study. Lancet, 368: 998–1004.
- Leebeek F.W.G., Boersma E., Cannon C.P. et al. (2002) Oral glycoprotein Ilb/IIIa receptor inhibitors in patients with cardiovascular disease: why were the results so unfavourable. Eur. Heart J., 23: 444–457.
- Lenderink T. et al. (2006) Eur. Heart J., 27(15): 1799–1804.
- Lindahl B. (1996) Biochemical markers of myocardial damage for early diagnosis and prognosis in patients with acute coronary syndromes. Minireview based on a doctorial thesis. Ups. J. Med. Sci, 101: 193–232.
- Lindemann S., Tolley N.D., Dixon D.A. et al. (2001) Activated platelets mediate inflammatory signaling by regulated interleukin 1 p synthesis. J. Cell. Biol., 154: 485–490.
- Lindmark E., Diderholm E., Wallentin L. et al. (2001) Relationship between interleukin 6 and mortality in patients with unstable coronary artery disease: effects of an early invasive or noninvasive strategy. JAMA, 286: 2107–2113.
- McGuire et al. (2000) Influence of diabetes mellitus on clinical outcomes across the spectrum of acute coronary syndromes. Findings from the GUSTO – IIb study. GUSTO – IIb investigators. Eur. Heart J., 21: 1750–1758.
- Mehta S.R. et al. (2005) Randomized, blinded trial comparing fondaparinucs with unfractionated heparin in patients undergoing contemporary percutaneous coronare intervention: Arixtra Study in Percutaneous Coronary intervention (ASPIRE) Pilot Trial. Cisrculation, 111: 1390–1397.
- Mehta S.R. et al. (2005) Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomised trials. JAMA, 293: 2908–2917.
- Miami Trial research group (1985) Metoprolol in myocardial infarction. Eur. Heart J., 6: 199–226.
- Morrow D.A., Rifai N., Antman E.M. et al. (2000) Serum amiloid A predicts early mortality in acute coronary syndromes: a substudy. JACC, 35: 358–362.
- Nyman I., Areskog M., Areskog N.H. et al. (1993) Very early risk stratification by electrocardiogram at rest in men with suspected unstable coronary heart disease. The RISC Study Group. J. Intern. Med., 234: 293–301.
- Nyman I., Wallentin L., Areskog M. et al. (1993) Risk stratification by early exercise testing after an episode of unstable coronary artery disease. The RISC Study Group. Int. J. Cardiol., 39: 131–142.
- Ojio S., Takatsu H., Tanaka T. et al. (2000) Considerable time from the onset of plaque rupture and/or thrombi until the onset of acute myocardial infarction in humans. Coronary angiographic findings within 1week before the onset of infarction. Circulation, 102: 2063–2069.
- Oler A., Whooley M.A., Oler J. et al. (1996) Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina. A meta-analysis. JAMA, 276: 811–815.
- Parodi O., Simonetti I., Michelassi C. (1986) Comparison of verapamil and propanolol therapy for angina pectoris at rest. A randomized, multiple crossover, controlled trial in the coronary care unit. Am. J. Cardiol., 57: 899–906.
- Patrono C. (1998) Pharmacology of antiplatelet agents. In: Loscalzo J, Schafer Al, editors. Thrombosis and Hemorrhage. Williama Wilkins, Baltimore, 1181–1192.
- Patrono C., Coller B., Dalen J.E. et al. (2001) Platelet-Active Drugs: The relationships among dose, effectiveness, and side effects. Chest., 119: 395–635.
- Patrono C., Patrignani P., Garcia Rodriguez L.A. (2001) Cyclooxygenase-selective inhibition of prostanoid formation: transducing biochemical selectivity into clinical read-outs. J. Clin. Invest., 108: 7–13.
- Ridker P.M., Rifai N., Clearfield M., et al. (2001) Measurement of C-reactive protein for the targeting of statin therapy in the primary prevention of acute coronary events. N. Engl. J. Med., 344: 1959–1965.
- Roffi M. et al. (2002) Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA, 288: 2411–2420.
- Rosenson R.S., Lowe G.D.O. (1998) Effects of lipids and lipoproteins on thrombosis and rheology. Atherosclerosis, 140: 271–280.
- Roubin G.S.H.P., Eckhardt I. et al.(1982) Intravenous nitroglycerine in refractory unstable angina pectoris. Aust. N. Z. J. Med., 12: 598–602.
- Sabatine M.S. et al. (2005) Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation, 111: 2042–2049.
- Sano T., Tanaka A., Namba N. et al. (2003) C-Reactive protein and lesion morphology in patients with acute myocardial infarction. Circulation.,108: 282–285.
- Savonitto S., Ardissino D., Granger C.B. et al. (1999) Prognostic value of the admission electrocardiogram in acute coronary syndromes. JAMA, 281: 707–713.
- Schreiber T.L., Macina G., Bunnell P. et al. (1990) Unstable angina or non-Q wave infarction despite long-term aspirin: response to thrombolytic therapy with implications on mechanisms. Am. Heart J., 120: 248–255.
- Schreiber T.L., Macina G., McNulty A. et al. (1989) Urokinase plus heparin versus aspirin in unstable angina and non-Q-wave myocardial infarction. Am. J. Cardiol., 64: 840.
- Schreiber T.L., Rizik D., White C. et al. (1992) Randomized trial of thrombolysis versus heparin in unstable angina. Circulation., 86: 1407–1414.
- Serruys P.W., Unger F., Sousa J.E. et al. (2001) Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N. Engl. J. Med., 344: 1117–1124.
- Serruys P.W., van Hout B., Bonnier H. et al. (1998) Randomised comparison of implantation of heparin-coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II). Lancet, 352: 673–681.
- Stenestrand U., Wallentin L. (2002) Early revascularization and 1-year survival in 14-days survivors of acute myocardial infarction: a prospective cohort study. Lancet, 359: 1805–1811.
- Stone G.W. et al. (2006) Bivalirudin for patients with acute coronary syndromes. N. Engl. J. Med., 355: 2203–2216.
- The GUSTO Investigators (1993) An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N. Engl. J. Med., 329: 673–628.
- The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology (2004) Eur. Heart J., 25: 166–181.
- Theroux P., Ouimet H., McCans J. et al. (1988) Aspirin, heparin, or both to treat acute unstable angina. N. Engl. J. Med., 319: 1105–1111.
- Theroux P., Taeymans Y., Morissette D. et al. (1985) A randomized study comparing propranolol and diltiazem in the treatment of unstable angina. J. Am. Coll. Cardiol., 5: 717–722.
- Theroux P., Waters D., Qiu S. et al. (1993) Aspirin versus heparin to prevent myocardial infarction during the acute phase of unstable angina. Circulation, 88: 2045–2048.
- TIMI IIIB investigators (1994) Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-wave myocardial infarction. Results of the TIMI IIIB Trial. Thrombolysis in Myocardial Ischemia. Circulation, 89: 1545–1556.
- Toschi V.G.R., Lettino M., Fallen J.T. (1997) Tissue factor predicts the thrombogenicity of human atherosclerotic components. Circulation, 95: 594–599.
- Toss H., Lindahl B., Siegbahn A. et al. (1997) Prognostic influence of increased fibrinogen and C-reactive protein levels in unstable coronary artery disease. FRISC Study Group. Fragmin during Instability in Coronary Artery Disease. Circulation, 96: 4204–4210.
- van Domburg R.T., van Miltenburg-van Zijl A.J., Veerhoek R.J. et al. (1998) Unstable angina: good long-term outcome after a complicated early course. J. Am. Coll Cardiol., 31: 1534–1539.
- van Miltenburg-van Zijl A.J., Simoons M.L., Veerhoek R.J. et al. (1995) Incidence and follow-up of Braunwald subgroups in unstable angina pectoris. J. Am. Coll. Cardiol., 25: 1286–1292.
- Virmani R., Kolodgie F.D., Burke A.P. et al. (2000) Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler. Thromb. Vase Biol., 20: 1262–1275.
- Wilcox I., Freedman S.B., Allman K.C. et al. (1991) Prognostic significance of a predischarge exercise test in risk stratification after unstable angina pectoris. J. Am. Coll. Cardiol., 18: 677–683.
- Wiviott S.D., Braunwald E., McCabe C.H. et al. (2007) Prasugrel vs clopigogrel in patients with acute coronary syndromes. N. Eng. J. Med., 357: 2001–2015.
- Yusuf S. et al. (2006) Efficacy and safety of fondaparinux compared to enoxaparin in 20,078 patients with acute coronary syndromes without ST-segment elevation. The OASIS (Organization to Acute ischemic Synromes)-5 investigators. N. Engl. J. Med., 354: 1464–1476.
- Yusuf S., Wittes J., Friedman L. (1988) Overview of results of randomized clinical trials in heart disease. II. Unstable angina, heart failure, primary prevention with aspirin, and risk factor modification. JAMA, 260: 2259–2263.
- Yusuf S., Zhao F., Mehta S.R. et al. (2001) Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N. Engl. J. Med., 345: 494–502.
- Yusuf S., Zucker D., Chalmers T.C. (1994) Ten-year results of the randomized control trials of coronary artery bypass graft surgery: tabular data compiled by the collaborative effort of the original trial investigators. Part 1 of 2. Online. J. Curr. Clin. Trials., Doc. No. 145.