ВСТУП
Термін «вторинна гіпертензія» прийнятий ВООЗ (1978) для визначення АГ, причину якої можна виявити. Він відповідає поширеному в нашій країні терміну «симптоматична АГ».
Артеріальна гіпертензія — найпоширеніше хронічне захворювання у світі і значною мірою визначає високу смертність та інвалідність від серцево-судинних і цереброваскулярних захворювань. Приблизно кожний третій дорослий страждає від цього захворювання. У 2007 р. в Україні офіційно зареєстровано >11 млн хворих з АГ, що становить >30% дорослого населення країни. Близько 5% усіх хворих з АГ мають певні форми вторинних АГ, при яких за допомогою радикального втручання (частіше хірургічного) пацієнт може бути практично вилікований. Але й 5% хворих з АГ — це сотні тисяч пацієнтів в Україні, яких назавжди можна вилікувати від цієї недуги. До таких форм АГ належить більшість ендокринних гіпертензій.
Перед лікарем, який приймає пацієнта із синдромом АГ, завжди стоїть кілька діагностичних питань і перше серед них — яка форма артеріальної гіпертензії у хворого — есенціальна чи вторинна? Для встановлення правильного діагнозу АГ необхідно відштовхуватися від симптомів, що не характерні для есенціальної гіпертензії. Для останньої властиві: розвиток у осіб віком між 30–50 роками; повільно прогресуючий перебіг, часто безсимптомний характер хвороби до появи ураження органів-мішеней. Поштовхом для розширеного обстеження пацієнта з АГ повинні стати: юнацький і молодий вік, раптовий початок або погіршення захворювання, тяжка АГ — АТ >180/120 мм рт. ст., рефрактерний або злоякісний характер перебігу, наявність будь-яких симптомів, властивих вторинним АГ.
Пацієнти із вторинною або симптоматичною АГ становлять приблизно 5–10% усіх хворих з підвищеним АТ, а частка ендокринних АГ у загальній популяції хворих з АГ за даними різних авторів — 0,2–1%. За даними відділення симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України, серед 3495 первинних хворих, які перебували у відділенні протягом 1994–2003 рр., вторинні форми АГ склали 26,8%. Частота різних форм вторинних АГ у нашому спостереженні представлена на рис. 2.1. Безумовно, що у загальній популяції хворих з АГ і відповідно на прийомі у дільничного (сімейного) лікаря їх частка буде менша. У 99% пацієнтів з вторинними АГ відзначають такі її форми: ренопаренхиматозні, реноваскулярні та ендокринні.
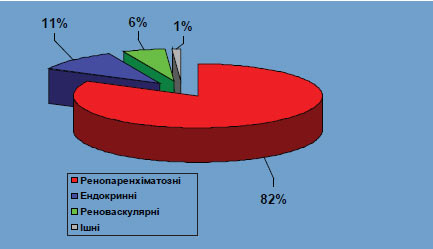
Рис. 2.1. Частота різних типів вторинних АГ серед первинних хворих, госпіталізованих у спеціалізоване відділення для хворих з АГ
До ренопаренхіматозних АГ належать усі типи АГ при ураженні паренхіми нирок. Кодування за МКХ-10: I12 — гіпертензивна [гіпертонічна] хвороба з переважним ураженням нирок. Сюди належать усі захворювання, включені в рубрику N18, N19, N26. Крім цього, використовують код I15.1 — гіпертензія вторинна відносно до інших уражень нирок.
До реноваскулярних АГ належить АГ при атеросклерозі ниркових артерій, фібромускулярній дисплазії і неспецифічному аортоартеріїті. Код діагнозу за МКХ-10: I15.0 — реноваскулярна гіпертензія.
До ендокринних АГ належать:
- феохромоцитома;
- первинний мінералокортицизм;
- гіперкортицизм (синдром і хвороба Кушинга);
- акромегалія;
- гіперпаратиреоз;
- гіпер- і гіпотиреоз;
- первинний гіперренінізм;
- ендотелінпродукуючі пухлини.
Код діагнозу за МКХ-10: I15.2 — гіпертензія вторинна по відношенню до ендокринних порушень.
Слід підкреслити, що в більшості випадків вторинних АГ прогноз життя хворого визначається розвитком серцево-судинних ускладнень, але звичайне рутинне застосування антигіпертензивних препаратів у більшості випадків не дозволяє стабілізувати стан хворого та попередити виникнення ускладнень. Діагностика і лікування хворих із вторинними формами АГ є предметом професійної діяльності лікарів різних спеціальностей: терапевтів, кардіологів, ендокринологів, нефрологів, хірургів. Але, як відомо, у семи няньок дитина без ока. Поява нових методів діагностики та лікування протягом останніх 25 років значно розширили можливості медицини в цьому напрямку. Своєчасне хірургічне втручання при деяких нозологічних формах дозволяє у значної кількості хворих досягти нормалізації АТ і припинити постійний прийом антигіпертензивних засобів. У більшості випадків для досягнення успіху необхідна чітка робота цілої команди. Потенційна курабельність вторинних АГ вимагає від кожного фахівця чіткого розуміння своєї ролі в сучасному алгоритмі ведення таких пацієнтів.
АГ, яка виникає у хворих на цукровий діабет, не належить до групи ендокринних АГ і розглядається як есенціальна (первинна) АГ у комбінації із цукровим діабетом, або як вторинна ренопаренхіматозна — при діабетичному ураженні нирок.
РЕНОПАРЕНХІМАТОЗНА АГ
Визначення
Ренопаренхіматозна (ренопаренхімна) АГ — синдром, при якому стійке підвищення АТ зумовлене ураженням паренхіми при різних захворюваннях нирок.
Епідеміологія
Ренопаренхіматозна АГ — найбільш часта форма вторинної АГ. Частота її серед усіх хворих з АГ — 5–7%. У спеціалізованих відділеннях, де перебувають хворі з рефрактерними формами АГ, частота ренопаренхіматозної досягає 30–40%. За даними відділення симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України, серед 3495 первинних хворих АГ, які лікувалися у відділенні протягом 1994–2003 рр., діагноз «ренопаренхіматозна АГ», підтверджений інструментальними та лабораторними дослідженнями, був поставлений 784 пацієнтам, що становить 22,4%. Таким чином, ренопаренхіматозна АГ є другою за частотою причиною хронічного підвищення АТ після есенціальної АГ.
На початку ХIХ ст. англійський лікар R. Bright описав взаємозв’язок захворювань нирок, розвитку серцево-судинних ускладнень і смерті у таких пацієнтів. Цей момент можна вважати початковим у дослідженні ролі ниркових факторів при АГ. У 30–50-ті роки ХХ ст. колективи дослідників під керівництвом H. Goldblatt, F. Gross та деяких інших поклали початок дослідженню біохімії РААС. Це сприяло накопиченню даних про нормальну та патологічну фізіологію серцево-судинної системи, патогенез АГ і її ускладнення. Отримані в останні десятиріччя факти дозволили кардинально змінити наші уявлення про ці процеси, а також розробити принципово нові класи ефективних лікарських засобів.
Етіологія і патогенез
Як ми вже відзначали, ураження паренхіми нирок з наступним підвищенням АТ може виникнути внаслідок різних нозологічних форм захворювань нирок. Незалежно від етіологічного фактора, який призвів до первинного ураження нирок, подальший перебіг захворювання, його прогресування характеризується загальними закономірностями патогенетичних механізмів та стадійністю. З часом, при відсутності адекватного лікування, виникає порушення функції нирок, яке поступово прогресує до її крайнього прояву — ХНН. При цьому АГ спочатку може бути наслідком, а потім важливим патогенетичним фактором подальшого прогресування захворювання. Така схожість патогенетичних факторів прогресування ураження нирок призвела до впровадження в клінічну практику з початку 2000-х років поняття «хронічне захворювання (ураження) нирок» (ХЗН) за аналогією з «серцево-судинним захворюванням». Цей термін був запропонований АНФН і в цей момент є прийнятим фахівцями в усьому світі. За літературними даними залежно від стадії ХЗН підвищений АТ виявляють у 60–90% таких хворих. Поява АГ у хворих на ранніх стадіях ХЗН асоціюється зі швидким подальшим прогресуванням ураження нирок і розвитком ХНН.
Традиційно в нашій країні кардіологи і терапевти велику увагу приділяють лікуванню пацієнтів зі СН і ІХС і вважають компетенцією нефрологів ведення пацієнтів із захворюваннями нирок. Але найбільш частими причинами виникнення ураження нирок у сучасному світі вважаються АГ і цукровий діабет. При цьому, з одного боку, підвищений АТ є причиною ХЗН, з другого — ренопаренхіматозна АГ є другою за частотою причиною хронічного підвищення АТ після есенціальної. За останні 10 років кількість таких пацієнтів з ХЗН у США та Західній Європі подвоїлася. У США у 1998 р. було 326 тис. таких хворих, у 2000 р. — уже 372 тис., а у 2010 р. очікується 650 тис. Приблизно 20–25% хворих із ХНН — це пацієнти з так званим гіпертензивним нефросклерозом (у нашій країні більш розповсюдженим вважається термін «первинно зморщена нирка»), який є прямим наслідком прогресування ураження нирок при АГ. Більше того, серцево-судинні ускладнення і смерть внаслідок зазначених уражень у пацієнтів з ХЗН відзначають частіше, ніж смерть від ниркової недостатності. Таким чином, необхідно розглядати ХЗН як незалежний фактор виникнення серцево-судинних ускладнень і кардіальної смерті. Виникнення навіть незначних ознак порушення функції нирок (підвищення вмісту креатиніну, зниження кліренсу креатиніну, поява мікро- і макроальбумінурії) означає достовірне значне підвищення ризику розвитку серцево-судинних ускладнень і кардіальної смерті.
Патогенетичні аспекти ренопаренхіматозної АГ, роль РААС
Основними механізмами, які підтримують підвищення АТ при ХЗН, вважають підвищення ЗПСО і затримку рідини. Відповідно найбільш ефективними засобами для контролю АТ будуть вазодилататори і діуретики, а також препарати, які блокують РААС.
Як відомо, РААС забезпечує в організмі регуляцію кровообігу, водно-сольового обміну, бере участь у процесах диференціації тканин, запалення, регенерації, розвитку гіпертрофії, склерозу. У загальних рисах функціонування РААС здійснюється таким чином: секреція нирками ензиму реніну в кров є першим етапом у каскаді реакцій, які призводять до продукції вазоконстрикторного пептиду — ангіотензину II (А II). Крім того, ренін і АПФ беруть участь в активації А II у тканинах усього організму, зокрема в нирках, міокарді, судинах, мозковій тканині та інших, що мають відношення до сфери регуляції. Циркулююча РААС відповідає за швидкі й короткочасні ефекти (наприклад компенсаторні реакції під час виникнення кровотечі, гострої СН або гіпертензивного кризу), тоді як тканинна РААС — тривалі ефекти на органному рівні (структурно-функціональні зміни судин і серця при АГ, ХСН та ін.). Нирки відіграють провідну роль у регуляції АТ, яка реалізується шляхом впливу А II на кровообіг у нирці та функції канальців. Причому вплив А II однаковий як при есенціальній, так і вторинній АГ. Надлишок А II внаслідок активації РААС відіграє провідну роль у прогресуванні ХЗН, затримці натрію при АГ і СН, вивільненні альдостерону.
Основні ниркові ефекти РААС представлені в табл. 2.1. У фізіологічних умовах у нирках при зниженні перфузійного тиску постійний рівень гломерулярної фільтрації підтримується шляхом підвищення тонусу еферентних артеріол і підвищенням ниркового судинного опору. Крім того, А II також регулює тонус мезангіальних клітин і кількість гломерулярних капілярів, які беруть участь у процесі фільтрації (площа фільтрації). У випадку виникнення гіповолемічних ситуацій під впливом А II знижується ниркова екскреція натрію за допомогою регуляції клубочкового кровообігу, процесів фільтрації та реабсорбції.
Таблиця 2.1
Ниркові ефекти РААС
| Регуляція ренального кровообігу |
| Регуляція швидкості гломерулярної фільтрації:
а) вазоконстрикція аферентної та еферентної артеріоли б) скорочення мезангіуму в) зміна коефіцієнта проникності фільтрувальної мембрани |
| Канальцева реабсорбція натрію |
| Вплив на концентраційний механізм |
| Модуляція ренальної симпатичної активності |
| Медіація запалення |
| Вплив на гіпертрофію та гіперплазію |
| Взаємодія з нирковими простагландинами |
Провідна роль нирок у розвитку й підтримці АГ вимагає обговорення ролі ренальних ефектів А II, які викликають зміни у водно-сольовому гомеостазі та регуляції АТ. Затримка натрію реалізується шляхом кількох механізмів: ренальної вазоконстрикції, прямого впливу А II на стан канальців і підвищення секреції альдостерону. На моделі АГ у щурів з однобічним накладанням кліпси на ниркову артерію (модель Goldblatt) показано, що підвищений рівень А II впливає на обидві нирки, і в неоперованій нирці виникають зміни порушення екскреції натрію як у стані нормотензії, так і при підвищенні тиску. У щурів зі спонтанною АГ також показано, що вплив А II на нирки призводить до порушення їх екскреторної функції, причому цей факт пов’язують з генетично зумовленим підвищенням чутливості до А II на рівні рецепторів.
Участь А II у розвитку й підтримці підвищеного рівня АТ показано в клінічних умовах при есенціальній АГ. Вазоконстрикція судин нирки, яку відзначають при АГ, у більшої частини хворих зумовлена відповіддю нирки на підвищений рівень А II в органі. У літературі підкреслюється зв’язок між змінами ренальної гемодинаміки і їх впливом на регуляцію натрієвого гомеостазу нирками з розвитком АГ і підтримкою хронічно підвищеного АТ. Таким чином, А II сприяє проявленню патологічного процесу у нирках, що в свою чергу сприяє розвитку АГ. Крім вазоконстрикторної дії, А II як стимулятор клітинного росту, в тому числі для клітин гладких м’язів, відіграє ключову роль у розвитку гломерулосклерозу, викликаючи гіпертрофію мезангіальних клітин.
При ХЗН активація РААС є одним із провідних компонентів патогенезу захворювання. При цьому у значної частини таких хворих визначається нормальний або дещо знижений рівень активності реніну плазми крові у той час, як активність РААС у тканинах, у тому числі в нирках, підвищується в кілька разів. У численних дослідженнях доведена роль РААС, особливо її локальної експресії в нирках, у прогресуванні ХНН. Різні гемодинамічні і негемодинамічні ефекти РААС, включаючи підвищення системного та інтрагломерулярного тиску, активацію росту ниркових тканин та прогресування в них запалення, підвищення реабсорбції натрію, створення умов для протеїнурії (підвищення мезангіальної проникності для макромолекул) беруть участь у прогресуванні захворювання. Показано, що активація РААС у нирках відбувається переважно в ділянках, які оточують уже сформовану рубцеву тканину.
Таким чином, при ХЗН має місце системна і локальна активація РААС, яка у свою чергу призводить до підвищення ступеня ушкодження нирки: порочне коло замикається. Взаємозв’язок АГ і факторів патогенезу ХЗН зображено на рис. 2.2.
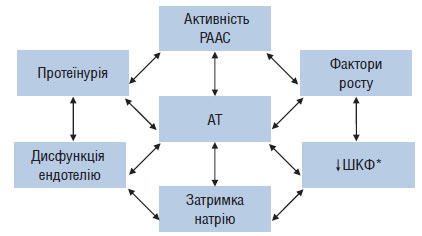
Рис. 2.2. Взаємозв’язок АГ та інших факторів у патогенезі прогресування ХЗН
*ШКФ — швидкість клубочкової фільтрації.
Ще один важливий механізм прогресування ХЗН пов’язаний із протеїнурією. У нормі із сечею екскретується незначна кількість білка. Постійне підвищення вмісту білка в сечі є важливим симптомом ураження нирок. Специфічність екскреції білків — альбуміну або низькомолекулярних глобулінів залежить від типу захворювання нирок. Так, наприклад, екскреція альбуміну є важливим маркером ХЗН внаслідок АГ, цукрового діабету або патології клубочків. Підвищення екскреції низькомолекулярних глобулінів є маркером тубулоінтерстиціального ураження нирок.
Важливою причиною виникнення протеїнурії вважається порушення автономної регуляції кровообігу в нирках. При ХЗН, АГ, цукровому діабеті високий АТ передається на клубочкові артеріоли і виникає стабільна внутрішньоклубочкова гіпертензія, яка призводить до гіперфільтрації та протискування білка через мембрану під дією високого гідростатичного тиску. Крім того, виникненню протеїнурії сприяє порушення функції ендотелію та підвищення проникності базальної мембрани. Транспорт білка через мембрану призводить до розвитку в ній патологічних процесів: порушення проникності, активації запалення, її стовщення і, нарешті, порушення функції. Таким чином, при ХЗН протеїнурія — не тільки симптом захворювання, але й важливий патогенетичний механізм його прогресування.
Класифікація
Для оцінки функціонального стану нирок використовується кілька різних класифікацій. На нашу думку, найбільш простою і раціональною слід визнати класифікацію АНФН, яка виділяє 5 стадій ураження нирок (табл. 2.2). Показник ШКФ прийнятий як найкращий індекс для оцінки загальної функції нирок як у здорових, так і у пацієнтів з патологією. Як відзначалося, у нормі показник ШКФ залежить від статі, маси тіла й знижується з віком. Тривале (>3 міс) зниження величини ШКФ <60 мл/хв/1,73 м2 є критерієм діагнозу ХЗН незалежно від наявності інших ознак ураження або захворювання нирок, оскільки при такому значенні цього показника слід констатувати втрату половини нормальної функції нирок, що означає високий ризик розвитку ниркових і серцево-судинних ускладнень.
В Україні існує класифікація ХНН, яка була затверджена наказом МОЗ України № 05/462 від 30.09.2003 р. (табл. 2.3). Відмінності між наведеними класифікаціями полягають у тому, що перша характеризує стадію захворювання, а друга лише стадію ХНН. Відомо, що на ранніх стадіях ураження при АГ відзначають підвищення ШКФ (>133 мл/хв/1,73 м2) і появу мікроальбумінурії. Цей стан ще не є ХНН, про яку можна говорити тільки при зниженні ШКФ, але ознаки ураження нирок уже можна констатувати. На ранніх стадіях ХЗН (пієлонефриту, гломерулонефриту) відзначають зміни в осаді сечі, протеїнурію, морфологічні порушення за даними УЗД, проте при збереженні нормальної ШКФ ХНН ще не діагностується. Тому класифікація АНФН є більш універсальною і придатною для практики.
Таблиця 2.3
Ступені ХНН
| Ступінь | ШКФ (мл/хв/1,73 м2) |
Рівень креатиніну (мкмоль/л) |
| 1 | <90>60 | >123<176 |
| 2 | <60>30 | >176<352 |
| 3 | <30>15 | >352<528 |
| 4 | <15 | >528 |
Клінічна картина
Клінічна оцінка пацієнтів із ХЗН і АГ
У пацієнтів із ХЗН необхідно визначити тип ураження (захворювання) нирок, коморбідні стани, тяжкість порушення функції нирок (кількісно), ризик прогресування ниркової дисфункції, наявність і ризик розвитку серцево-судинних і ниркових ускладнень. Захворювання нирок визначають при наявності клінічних ознак їх ураження, а також значимих характерних змін в аналізах крові, сечі або показниках візуалізуючих обстежень. Перелік основних причин ХЗН наведений у табл. 2.4.
Таблиця 2.4
Типи ХЗН
| Діабетичне ураження нирок | — тип I і II цукрового діабету |
| Недіабетичне ураження нирок | — ураження клубочків (аутоімунне захворювання, системна інфекція, дія токсичних речовин і ліків, пухлина)
— ураження судин (патологія великих артерій, АГ, мікроангіопатія) — тубулоінтерстиціальна патологія (інфекція сечовивідних шляхів, сечокам’яна хвороба, обструкція сечовивідних шляхів, дія токсичних речовин та ліків) — кістозне ураження (полікістоз нирок) |
| Ураження трансплантованої нирки | — реакція відторгнення
— дія токсичних речовин та ліків (у тому числі циклоспорину) — гломерулопатія трансплантата — вторинні ураження клубочків |
Усім хворим при підозрі на наявність ХЗН необхідно контролювати рівень АТ. Крім того, слід визначити рівень креатиніну в сироватці крові (критичним, на думку експертів, є значення 133 мкмоль/л (1,5 мг/дл) для чоловіків і 124 мкмоль/л (1,4 мг/дл) для жінок) і обчислити ШКФ, а також провести загальний аналіз сечі з мікроскопією осаду і визначенням протеїнурії. При наявності ознак патології обов’язковим є проведення УЗД нирок, визначення електролітного балансу крові й спеціальних аналізів сечі для визначення добової протеїнурії (при необхідності мікроальбумінурії), лейкоцитурії та концентраційної функції нирок. Клінічними передумовами для розширеного обстеження повинні бути наявність АГ, цукрового діабету, аутоімунних захворювань, інфекції сечовивідних шляхів, сечокам’яної хвороби, обструкції нижнього відділу сечовивідних шляхів (у тому числі аденоми простати), неоплазм нирок і сечового тракту, сімейний нирковий анамнез, перенесений епізод ГНН, втрата нирокової маси (операція, травма, інфаркт), недостатня маса тіла при народженні, застосування нефротоксичних речовин. Крім того, необхідно визначити рівень ХС і його фракцій у сироватці крові. У пацієнтів з ХЗН частіше, ніж у загальній популяції, відзначають дисліпідемії, які, безумовно, підвищують ризик серцево-судинних ускладнень.
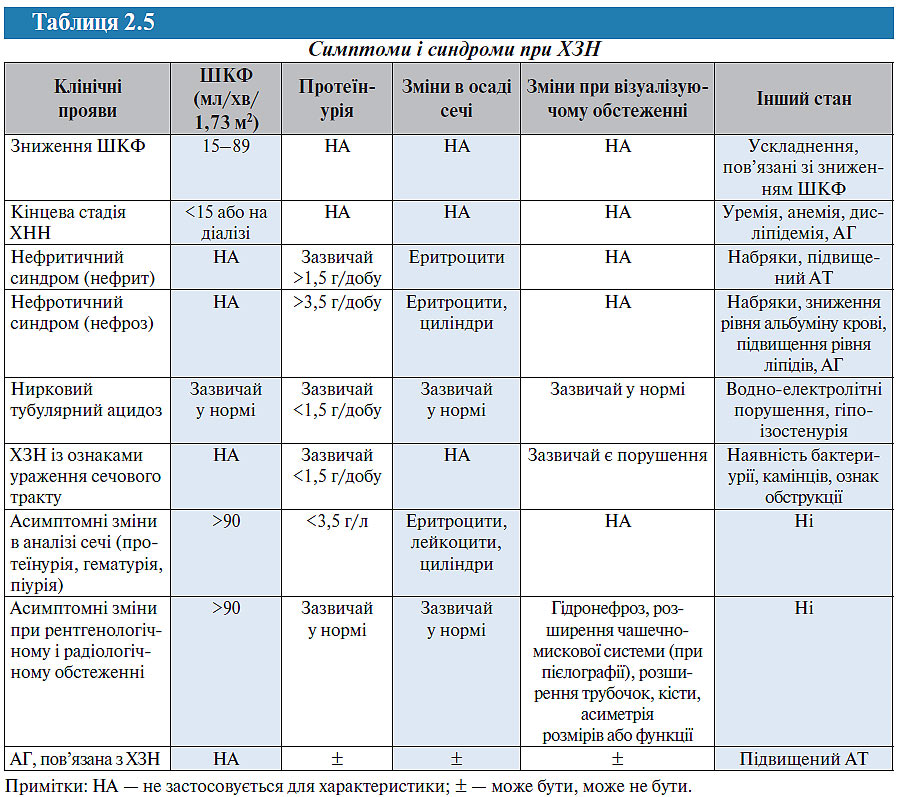
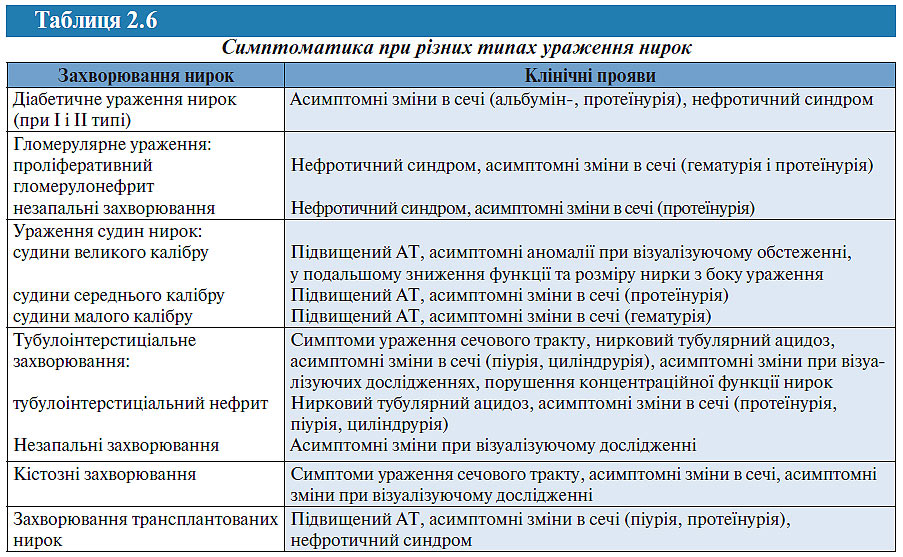
У табл. 2.5 представлений взаємозв’язок між клінічними проявами при ХЗН, а в табл. 2.6 — взаємозв’язок між типом ураження нирок і клінічними проявами.
У рекомендаціях Європейського товариства гіпертензії і Європейського товариства кардіологів (2007) та Української асоціації кардіологів (2008) значна увага приділяється стратифікації ризику виникнення серцево-судинних ускладнень залежно від рівня АТ, наявності загальних факторів ризику, ураження органів-мішеней і клінічних станів, пов’язаних з АГ, що визначає терапевтичну тактику ведення хворих. Згідно з цими рекомендаціями наявність незначного порушення функції нирок при рівні АТ >130–139/85–89 мм рт. ст. характеризується високим (20–30%) або дуже високим (>30%) ризиком виникнення серцево-судинних ускладнень протягом наступних 10 років і потребує активного терапевтичного втручання. Порушення функції нирок визначається за підвищенням рівня креатиніну в сироватці крові (>107 мкмоль/л у жінок та >115 мкмоль/л у чоловіків), зниженням величини клубочкової фільтрації (<60–70 мл/хв) і наявністю мікро- (30–300 мг/добу) або макропротеїнурії (>300 мг/добу).
Діагностика
Лабораторні та інструментальні методи обстеження пацієнтів з ХЗН
Визначення ШКФ. Найбільш точно діагноз ХЗН може бути встановлений за допомогою лабораторних та інструментальних методів дослідження. Навіть у здорової дорослої людини з віком функція нирок погіршується: в середньому після 40 років ШКФ знижується на 1% за рік (1–2 мл/хв). Наявність ХЗН прискорює зниження функції нирок, а розвиток АГ ще більше прискорює цей процес — у нелікованих пацієнтів з ХЗН і АГ зниження ШКФ становить 12–15 мл/хв. Моніторинг ШКФ дозволяє лікареві чітко прогнозувати перебіг захворювання та оцінювати ефективність лікувальних заходів.
Таким чином, основою для оцінки функції нирок є визначення ШКФ. У клініці для її визначення використовують ряд різних методів, які дозволяють лікареві в реальних умовах оцінювати ступінь ураження нирок. Найбільш точним методом є визначення ШКФ за принципом кліренсу — «очищення», який вперше запропонував Van Slyke у 1929 р. У клініці для характеристики величини ШКФ методом прямого виміру кліренсу найчастіше застосовуються такі речовини, як інулін, ендогенні креатини, сечовина, ЕДТА-51Cr (ЕДТА — етилендиамінтетраоцетова кислота), ДТПА-99mТс (ДТПА — диетилентриамінопентаоцетова кислота), 125I, 131I натрію йоталамат і згідно з останніми дослідженнями — цистатин-С.
Широке впровадження радіоізотопів у медичну практику зробили більш доступним визначення величини ШКФ за допомогою сполук, які екскретуються нирками тим же шляхом, що й інулін: ЕДТА-51Cr, натрію йоталамат, ДТПА-99mТс.
Виміри проводяться за стандартною методикою кліренсу, коли речовина, мічена ізотопом, вводиться внутрішньовенно, після чого через певні проміжки часу беруть 1 або частіше 2 проби крові та збирають сечу. За активністю ізотопу в сечі та крові, відповідно до концентрації сполук, визначають величину кліренсу. Цей метод є золотим стандартом (кореляція із кліренсом інуліну 0,97) для визначення величини ШКФ.
Таким способом ШКФ можна визначити окремо для кожної нирки. Особливу увагу слід приділяти тому, щоб перед проведенням дослідження хворий вів звичайний спосіб життя і не мав значних обмежень щодо вживання рідини.
Переваги цього методу дослідження — точність визначення ШКФ і відносна простота виконання. Недоліки: 1) необхідність мати спеціалізовану лабораторію з підготовленим персоналом і дорогою технікою; 2) відносно висока вартість дослідження, що не дозволяє проводити дослідження всім хворим з АГ; 3) неможливість, особливо для реносцинтиграфії, частого проведення й відповідно застосування для контролю терапевтичного втручання.
Враховуючи актуальність визначення стану нирок широкого кола пацієнтів (з АГ, ХЗН) та технічні труднощі визначення кліренсів речовин, були запропоновані розрахункові методи оцінки фільтраційної функції нирок тільки за концентрацією креатиніну сироватки крові з урахуванням статі, віку, маси тіла і раси пацієнта.
Найбільш широко й тривало застосовується формула Cockroft — Gault (1976):
де КК (кліренс креатиніну) вимірюється в мл/хв, маса тіла — у кг, вік — у роках, креатинін сироватки крові — у мг/дл (при необхідності для перерахунку мкмоль/л ділять на коефіцієнт 88). Величина КК дорівнює стандартизованому відповідно до площі тіла рівню ШКФ. Ця формула використовується для визначення наявності і ступеня ниркової недостатності, при підборі дози препаратів, які екскретуются нирками, при оцінці ефективності терапії з метою попередження або сповільнення прогресування ХЗН.
Крім того, найбільше розповсюдження за більшу точність одержала в останні роки скорочена формула дослідження MDRD (Modification of Diet in Renal Disease), у якій враховується вік, стать, раса та рівень креатиніну сироватки крові:
ШКФ = 186 × (креатинін сироватки крові)-1,154 × (вік)-0,203 × (0,742 якщо жіноча стать) × (1,210 якщо негроїдна раса),
де ШКФ — у мл/хв/1,73 м2, вік — у роках, креатинін сироватки крові — у мг/дл.
У багатоцентрових дослідженнях, у тому числі MDRD, була доведена достатня точність розрахункових методів визначення ШКФ для використання на популяційному рівні, а також економічна недоцільність використання прямих методів оцінки ШКФ для широкої популяції хворих. Визначення ШКФ за формулою Cockroft — Gault у дорослих як стандарт рекомендований АНФН і визнається в усьому світі. Ця формула простіша для розрахунків (не потрібно визначати складний корінь) і, на думку провідних експертів України, є досить точною для нашої популяції, оскільки кількість пацієнтів негроїдної раси в повсякденній практиці дуже незначна.
У відділенні симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» було проведено проспективне дослідження щодо визначення динаміки стану нирок у хворих з ренопаренхіматозною АГ на фоні лікування.
У дослідження був включений 51 пацієнт з різним ступенем ренопаренхіматозної АГ і середнім віком 56,5±1,2 року. Жінки склали 37,3%, чоловіки — 62,7%. Тривалість спостереження склала в середньому 29,4±1,1 міс. У ході дослідження показана відсутність достовірної різниці між величиною ШКФ, визначеною за формулою Cockroft — Gault, і радіоізотопної реносцинтиграфії, а також існування достовірної кореляції між цими показниками — 112,2±7,8 проти 106,1±1,9 мл/хв (R=0,65, р=0,02) (рис. 2.3).

Рис. 2.3. Взємозв’язок між величиною ШКФ, визначеною за допомогою реносцинтиграфії та КК за формулою Cockroft — Gault
Таким чином, немає необхідності проводити більш високовартісні дослідження функції нирок (у тому числі реносцинтиграфію). Застосування розрахункового методу визначення ШКФ дозволяє швидко і з достатньою точністю виявити та оцінити ступінь ураження нирок. Крім того, за допомогою розрахункового методу можна проводити моніторинг стану нирок з тією частотою, яка буде необхідна (ізотопну реносцинтиграфію не рекомендується застосовувати частіше 1 разу на рік).
У 7-й доповіді Американського національного об’єднаного комітету з діагностики та лікування АГ (2003) до переліку основних серцево-судинних факторів ризику додана мікроальбумінурія або рівень ШКФ (розрахований) <60 мл/хв/1,73 м2. Таким чином, відповідно до сучасних вимог обчислення цього показника повинно стати рутинною практикою для кожного кардіолога. У нормі величина ШКФ становить 110–120 мл/хв/1,73 м2. При цьому у різних людей при однаковому рівні креатиніну сироватки крові можуть відзначати різний рівень ШКФ і відповідно різний рівень ураження нирок і кардіоваскулярний ризик, який підтверджує необхідність визначення ШКФ.
Усім пацієнтам з ХЗН (у тому числі при АГ) слід проводити визначення креатиніну сироватки крові та величини ШКФ не менше 1 разу на рік. Частіше його необхідно визначати при наявності рівня ШКФ <60–70 мл/хв/1,73 м2 або КК <60 мл/хв; швидкому прогресуванні погіршення стану нирок (зниження ШКФ >4 мл/хв/1,73 м2 або КК >4 мл/хв за рік); наявності факторів ризику більш швидкого прогресування дисфункції нирок (анемія, високий АТ, цукровий діабет, запалення та ін.); призначенні терапії, спрямованої на сповільнення прогресування ураження нирок (призначення інгібіторів АПФ або блокаторів рецепторів А II — БРА II).
Це дозволяє прогнозувати перебіг захворювання з визначенням строків розвитку ХНН, а також оцінювати ефективність лікувальних заходів, спрямованих на сповільнення прогресування захворювання.
Визначення мікро- і макропротеїнурії. У практичній діяльності виділяють протеїнурію при збільшенні екскреції альбуміну та інших білків, альбумінурію — при збільшеній екскреції саме альбуміну, а також мікроальбумінурію. Крім того, бажано обчислювати співвідношення протеїн (альбумін)/креатинін у сечі. Клінічне трактування зазначених показників наведене в табл. 2.7.

Для визначення альбумінурії та мікроальбумінурії необхідно використовувати спеціальні лабораторні набори. У більшості випадків застосовують смужкові експрес-тести, які дозволяють швидко без спеціальної підготовки й додаткового устаткування визначати наявність і рівень протеїнурії у будь-якій медичній установі.
Наявність мікроальбумінурії у хворих з АГ є незалежним чинником ризику ураження нирок, а також розвитку серцево-судинних ускладнень — наявність мікроальбумінурії підвищує ризик більше ніж у 2 рази. У деяких сучасних рекомендаціях мікроальбумінурія визначається як маркер системного ураження ендотелію.
Ризик розвитку серцево-судинних ускладнень і прогресування ураження нирок пропорційно зростає з підвищенням рівня екскреції білка. Величина добової протеїнурії >1 г є критичною і такі хворі потребують додаткових терапевтичних заходів, у тому числі більш жорсткого контролю АТ (див. нижче). Оцінка добової екскреції білка із сечею може бути як кількісною ознакою ураження нирок, так і використовуватися в динаміці для оцінки ефективності терапевтичних заходів.
Лікування
Враховуючи прогресуючий характер перебігу ХЗН, завдання лікаря — виявлення таких хворих на ранніх стадіях захворювання, коли функція нирок не змінена (рівень ШКФ високий) і призначення максимально агресивної терапії, спрямованої на нормалізацію АТ і нефропротекцію для сповільнення виникнення та прогресування ниркової дисфункції. Таким чином, при ранній діагностиці та лікуванні можна попередити або сповільнити несприятливий перебіг захворювання (як АГ, так і ХЗН).
Стратегія антигіпертензивної терапії при ХЗН
Антигіпертензивна терапія призначається для:
a) зниження АТ (клас рекомендацій I, рівень доказовості А);
б) знижения ризику серцево-судинних захворювань у хворих з АГ (клас рекомендацій I, рівень доказовості B) і без (клас рекомендацій I, рівень доказовості B);
в) уповільнення прогресування ураження нирок у хворих з АГ (клас рекомендацій I, рівень доказовості A) і без (клас рекомендацій I, рівень доказовості A, C).
Антигіпертензивну терапію слід погодити з іншим лікуванням ХЗН як головну частину комплексного підходу. При наявності розбіжностей між лікуванням, спрямованим на сповільнення прогресування ураження нирок і зниження ризику серцево-судинних захворювань, остаточне рішення повинно базуватися на індивідуальній стратифікації ризику у конкретного хворого.
Мета антигіпертензивної терапії при ХЗН:
- зниження АТ;
- сповільнення прогресування ураження нирок;
- зниження серцево-судинного ризику.
Стратегія лікування включає модифікацію способу життя, дієту, призначення антигипірертензивних засобів, а також інших препаратів.
Терапевтична мета: рівень АТ, протеїнурія, ступінь зниження ШКФ. Сучасні цільові настанови при лікуванні ХЗН представлені в табл. 2.8.
Таблиця 2.8
Цільові установки при лікуванні АГ у пацієнтів з ХЗН
| Цільовий показник |
Рекомендований рівень |
| Цільовий АТ | Для всіх <130/80 мм рт. ст.
При протеїнурії ≥1 г/добу — <125/75 мм рт. ст. |
| Рівень протеїнурії | Максимальне зниження до його відсутності |
| Зниження ШКФ | <2 мл/хв/1,73 м2 за 1 рік |
Зниження АТ саме по собі призводить до зниження ризику прогресування ХЗН. При цьому абсолютний ефект (кількість випадків на 1000 пацієнтів за рік) у попередженні серцево-судинних ускладнень при зниженні АТ на 10/5 мм рт. ст. становить >7–10 випадків; на 20/10 мм рт. ст. — >11–17 випадків. Аналіз даних багатоцентрових досліджень, проведених за останні роки, показує, що для попередження прогресування ураження нирок у хворих з АГ необхідно забезпечити жорсткий контроль АТ, а також коригувати інші фактори ризику (гіперглікемія, дисліпідемія та ін.). Останні рекомендації ВООЗ і МТГ (Міжнародне товариство по гіпертензії) JNC-7 (7-ма доповідь Об’єднаного національного комітету, 2003) і Європейських товариств гіпертензії і кардіологів (2007) визначають як цільовий рівень АТ — 130/80 мм рт. ст., а при виявленні протеїнурії >1 г/добу — <125/75 мм рт. ст.
Усі класи антигіпертензивних препаратів, знижуючи АТ, знижують ступінь ураження нирок. У прямих порівняльних дослідженнях антигіпертензивних препаратів різних класів було показано, що застосування інгібіторів АПФ більшою мірою ніж діуретиків, блокаторів β- адренорецепторів, антагоністів кальцію зменшує макро- і мікроальбумінурію, сповільнює прогресування ниркової дисфункції і підвищує виживаність хворих з АГ та ураженням нирок. В останні роки аналогічні дані отримані для БРА II. Наявність таких доказів дозволила визначити інгібітори АПФ і БРА II як препарати вибору для лікування пацієнтів з АГ з ураженням нирок. Експерти підкреслюють, що зазначені ефекти препаратів безпосередньо не пов’язані з їх впливом на рівень АТ. На сьогодні інтенсивно дискутується ефективність одночасного комбінованого призначення інгібіторів АПФ і БРА II при ХЗН і АГ. Попередні результати показують вищу ефективність такої комбінації порівняно з монотерапією (дослідження CALM (Candesartan and Lisinopril Microalbuminuria study) і COOPERATE (Комбіноване лікування БРА II та інгібіторами АПФ при недіабетичних захворюваннях нирок).
Водночас у мегадослідженні ONTARGET у хворих високого серцево-судинного ризику було показано, що одночасне призначення раміприлу та тельмізартану підвищувало ймовірність появи ниркових ускладнень (ХНН, гіперкаліємії) порівняно з монотерапією.
У табл. 2.9 представлені загальні рекомендації АНФН 2004 р. щодо застосування антигіпертензивної терапії у пацієнтів з ХЗН.
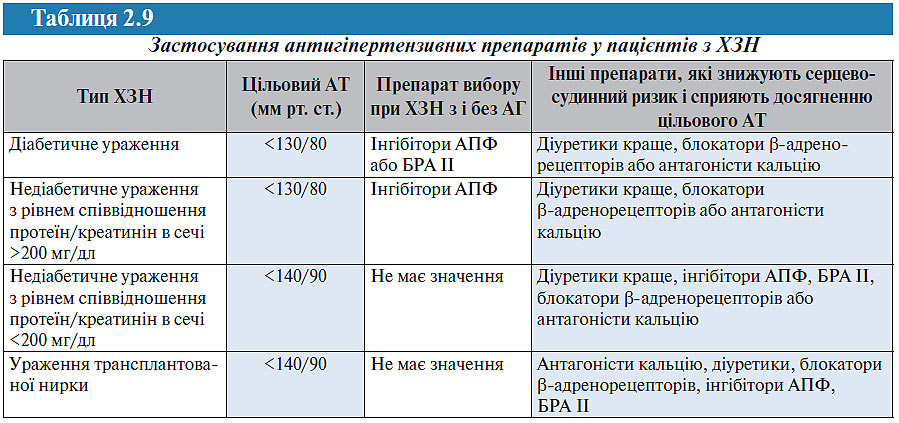
Дані багатоцентрових досліджень показують, що для досягнення цільового АТ у пацієнтів із ХЗН було необхідно застосовувати комбінацію від 2,6 (UKPDS — United Kingdom Prospective Diabetes Study) до 3,6 (MDRD — Modification of Diet in Renal Disease) — 3,7 (AASK — African-American Study of Kidney Disease and Hypertension) препаратів. При виборі антигіпертензивних засобів особливу увагу слід приділяти раціональному комбінуванню та максимальному спрощенню схеми їх прийому за рахунок використання готових комбінованих препаратів. Простота схеми прийому призначених ліків буде сприяти підвищенню комплаєнтності хворих до призначеної терапії. Слід підкреслити, що у хворих з ренопаренхіматозною АГ практично обов’язковим другим компонентом антигіпертензивної терапії повинен бути діуретик (див. нижче).
Важливими складовими лікування АГ і ХЗН для попередження ризику розвитку серцево-судинних ускладнень і прогресування ураження нирок, крім антигіпертензивних препаратів, є жорсткий контроль рівня глюкози крові (при цукровому діабеті), обмеження дієтичного споживання протеїнів, ліпідознижувальна і антитромбоцитарна терапія, корекція анемії та дисбалансу електролітів (при їх наявності).
Патогенетичне обґрунтування ефектів блокаторів РААС при ренопаренхіматозній АГ
Ефективна антигіпертензивна терапія забезпечує захист органів-мішеней і таким чином сприяє зниженню ризику виникнення серцево-судинних ускладнень і смерті. Проте до сьогодні більшість експертів дуже песимістично оцінювали значення традиційної антигіпертензивної терапії (діуретики і блокатори β-адренорецепторів) для попередження прогресування нефросклерозу. Відомо, що локальна активація РААС відіграє ключову роль у виникненні й прогресуванні ураження нирок у хворих з АГ. Тому існують вагомі теоретичні аргументи на користь застосування засобів, які зменшують або блокують ефекти РААС, для попередження прогресування ураження нирок у хворих з АГ, а саме: зниження АТ, зміни внутрішньониркової гемодинаміки, інгібування факторів росту ниркової тканин та її запалення, зниження проникності мембрани клубочків і транспорту білків, поліпшення функції ендотелію.
На рис. 2.4 схематично зображений вплив блокаторів РААС на внутрішньониркову гемодинаміку та протеїнурію. У лівій його частині зображені типові зміни гемодинаміки у пацієнтів з ХЗН, коли високий АТ передається на клубочкові артеріоли і виникає стабільна внутрішньоклубочкова гіпертензія, яка призводить до гіперфільтрації та продавлювання білка через мембрану під дією високого гідростатичного тиску. У правій половині зображені зміни внутрішньониркової гемодинаміки під впливом блокаторів РААС. Як і всі антигіпертензивні засоби, інгібітори АПФ і БРА II викликають дилатацію привідної артерії, але на відміну від інших класів препаратів, призводять до розширення відвідної артерії, що значно знижує тиск крові всередині клубочка. Зниження гідростатичного тиску в клубочку призводить до значного зниження гіперфільтрації і зниження або припинення протеїнурії.
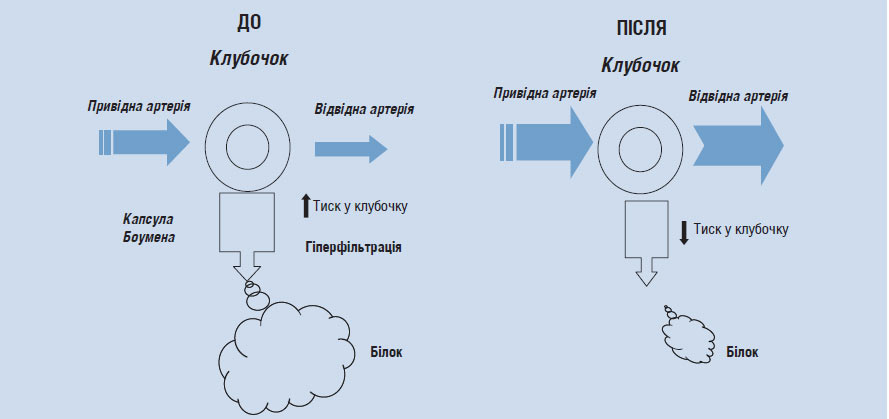
Рис. 2.4. Вплив блокаторів РААС на внутрішньониркову гемодинаміку (пояснення в тексті)
Інгібітори АПФ і БРА II слід використовувати в середніх і високих дозах, як це було доведено в клінічних дослідженнях (клас рекомендацій I, рівень доказовості А). Інгібітори АПФ і БРА II необхідно використовувати як альтернативу один одному, якщо препарат вибору не визначений чи немає можливості застосувати (клас рекомендацій I, рівень доказовості B). При тривалому лікуванні інгібіторами АПФ і БРА II слід моніторувати рівень АТ, зниження ШКФ і гіперкаліємії (клас рекомендацій I, рівень доказовості А). Інтервал для моніторування залежить від їх початкового рівня (клас рекомендацій I, рівень доказовості B). У більшості хворих необхідно продовжувати терапію інгібітором АПФ або БРА II навіть при зниженні ШКФ до <30% протягом 4 міс і підвищенні рівня калію в сироватці крові до 5,5 ммоль/л (клас рекомендацій I, рівень доказовості B) (див. нижче).
Вибір антигіпертензивного препарату при діабетичній нефропатії
Діабетична нефропатія або ураження нирок при цукровому діабеті (діабетичний гломерулосклероз, синдром Киммелстила — Уїлсона) — специфічне прогресуюче ураження нирок. Термін «діабетична нефропатія» — найбільш сучасний і найчастіше використовується у науковій літературі. Рубрика за МКХ-10: Е10–Е14.2.
Діабетичну нефропатію відзначають приблизно у 50% хворих, які страждають цукровим діабетом протягом тривалого часу — >20 років. Це найбільш часта причина розвитку ХЗН і ХНН. По своїй суті вона являє собою типове ураження клубочків, але внаслідок високої частоти виявлення в популяції пацієнтів ХЗН, діабетичну нефропатію виділяють як окрему форму ураження нирок (див. табл. 2.4).
Початок клінічного застосування інгібіторів АПФ при ураженні нирок було покладено у 80-ті роки ХХ ст. групами H.-H. Parving і S. Bjork, які досліджували ефективність каптоприлу у пацієнтів з інсулінозалежним цукровим діабетом. Роботами перших було показано, що застосування каптоприлу порівняно з плацебо вірогідно знижувало альбумінурію та сповільнювало прогресування ураження нирок. У роботах групи S. Bjork було встановлено, що застосування каптоприлу порівняно зі звичайною антигіпертензивною терапією (блокатори β-адренорецепторів, антагоністи кальцію, гідралазин) у пацієнтів з діабетичною нефропатією не тільки не погіршувало контроль АТ, але й у результаті прийому протягом 2 років попереджало погіршення функції нирок при однаковому зниженні АТ. В іншому дослідженні S. Bjork і співавторів був показаний позитивний ефект еналаприлу порівняно з блокаторами β-адренорецепторів у хворих на цукровий діабет I типу з ознаками нефропатії та ниркової дисфункції на процес зниження рівня гломерулярної фільтрації. Особливо відзначено, що ці ефекти не залежали від впливу препарату на рівень АТ. Попередні результати були підтверджені у більш масштабних багатоцентрових подвійних сліпих дослідженнях як у США, так і в Європі і переконливо довели, що застосування інгібіторів АПФ у хворих на цукровий діабет I типу сповільнювало розвиток ниркової недостатності, поліпшувало симптоматику, і, що найбільш важливо, збільшувало тривалість життя таких пацієнтів.
Успіхи, досягнуті при застосування інгібіторів АПФ у хворих на цукровий діабет I типу, спонукали до більш широкого вивчення їх ефективності при діабеті II типу. Численні дослідження показали, що застосування інгібіторів АПФ у пацієнтів з АГ і цукровим діабетом II типу порівняно з плацебо приводило до значного зниження мікро- і макроальбумінурії. Так само, як і у випадку із плацебо, у значній кількості прямих порівняльних досліджень ефективності інгібіторів АПФ із препаратами інших класів першого ряду (діуретиками, блокаторами β- адренорецепторів і антагоністами кальцію) було показано достовірно більш значне зниження екскреції білка із сечею. Ефективне зниження макро- і мікроальбумінурії при АГ і цукровому діабеті II типу дозволили більшості експертів зробити висновок про прямі нефропротекторні властивості інгібіторів АПФ і у такого контингенту хворих.
Значний вплив на практику застосування інгібіторів АПФ у пацієнтів з АГ і цукровим діабетом мали результати дослідження HOPE (Heart Outcomes Prevention Evaluation) і його гілки MICRO-HOPE (MICRO — Microalbuminuria, Cardiovascular and Renal Outcomes). У 3577 хворих, які брали участь у цьому дослідженні, діагностований цукровий діабет II типу. Застосування раміприлу протягом 4,5 року призвело до достовірного на 25% зниження частоти розвитку ІМ, інсульту або смерті, пов’язаної із серцево-судинною патологією. Позитивний ефект препарату не залежав від його впливу на рівень АТ. У дослідженні MICRO-HOPE було показано, що застосування раміприлу вірогідно (на 24%) знижувало ризик розвитку мікроальбумінурії. Терапія раміприлом була ефективною і у підгрупі хворих з I стадією ХНН.
Протягом останніх 10 років були опубліковані результати численних досліджень, у яких вивчався ефект БРА II на перебіг діабетичної нефропатії. Результати цих досліджень становлять особливий інтерес, оскільки включали значну кількість хворих на цукровий діабет II типу, а кінцеві точки були чітко пов’язані з нефропатією. У першому з них — IRMA (Irbesartan in patients with type II diabetes and microalbuminuria), заснованому на спостереженні 590 хворих на цукровий діабет з мікроальбумінурією, було показано, що прийом БРА II ірбесартану протягом 2 років приводив до відновлення нормоальбумінурії у третини хворих. Виражена нефропатія розвивалася в 3 рази рідше у пацієнтів, які приймали БРА II.
В іншому дослідженні — MARVAL (Microalbuminuria Reduction With Valsartan) проводили порівняльну ефективність вальзартану і антагоніста кальцію амлодипіну протягом 24 тиж у 332 хворих. Було показано, що лікування вальзартаном приводило до істотного зниження протеїнурії (до 56% початкового рівня), у той час як терапія амлодипіном практично не впливала на цей показник, незважаючи на однаковий ступінь зниження АТ в обох групах. У хворих, які приймали вальзартан, у 2 рази частіше відзначали регрес нефропатії до нормоальбумінурії, ніж у групі, що приймала амлодипін.
У двох інших дослідженнях — RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan) і IDNT (Irbesartan in Diabetic Nephropathy Trial) вивчалася ефективність БРА у пацієнтів із уже розвиненою діабетичною нефропатією. Результати досліджень показали ефективність цього класу антигіпертензивних засобів щодо попередження прогресування ураження нирок (розвиток термінальних стадій ХНН) порівняно з плацебо та антагоністами кальцію (амлодипін). Оскільки ступінь зниження АТ у групах порівняння була однаковою, то автори цих досліджень вважають, що нефропротекторний ефект БРА II не залежав від їх антигіпертензивної дії.
Базуючись на результатах цих досліджень, Управління по контролю над продуктами харчування й лікарськими засобами (Food and Drug Administration — FDA) США рекомендувало БРА II як препарати вибору для лікування таких пацієнтів.
Порівняння нефропротекторних властивостей інгібіторів АПФ і БРА II було вивчено у дослідженні DETAIL (Diabetics Exposed to Telmisartan and Enalapril). Первинною точкою була оцінка ступеня зниження ШКФ, визначення якої проводили прямим методом. У 5-річне спостереження були включені 250 хворих, які отримували терапію тельмізартаном або еналаприлом. При необхідності додавали інші антигіпертензивні засоби до досягнення цільового рівня АТ — <130/80 мм рт. ст. При абсолютно еквівалентному зниженні АТ в обох групах відзначали однакову ступінь зниження ШКФ. Слід підкреслити, що в дослідженні в обох групах було досягнуто цільового рівня зниження ШКФ — <2 мл/хв за рік, а частота смерті, пов’язаної із серцево-судинною патологією, склала всього 5% (!).
У триваючих багатоцентрових дослідженнях продовжується вивчення ефективності інших препаратів із цієї групи: вальзартану, тельмізартану, епрозартану, ольмезартану. Проводяться дослідження щодо порівняння нефропротекторних властивостей БРА II тельмізартану та інгібітору АПФ раміприлу, тельмізартану і вальзартану, ольмезартану і лозартану та ін.
Останнім часом з’явилися дані щодо додаткового нефропротекторного ефекту при додаванні прямого блокатора реніну аліскірену до БРА II при діабетичній нефропатії.
Безпека застосування блокаторів РААС при ренопаренхіматозній АГ
У деяких підручниках і настановах по лікуванню синдрому АГ або СН містяться положення щодо наявності протипоказань для призначення інгібіторів АПФ у хворих з порушеною функцією нирок. Автори пояснюють такі протипоказання можливим погіршенням функції нирок при застосуванні цього класу лікарських засобів. Слід підкреслити, що жодна з фармацевтичних компаній, які розробили й виробляють інгібітори АПФ на світовому ринку, не включила такі протипоказання в інструкції для медичного застосування цих препаратів. Дослідження останніх років повністю підтвердили доцільність і необхідність призначення інгібіторів АПФ при захворюваннях нирок.
Враховуючи можливе упереджене відношення лікарів до призначення інгібіторів АПФ, у 2001 р. АHA затвердила принципи застосування інгібіторів АПФ у хворих з ураженням нирок (табл. 2.10). Особливо слід підкреслити положення, що при призначенні антигіпертензивної терапії та зниженні АТ протягом перших 2–3 міс може відзначатися транзиторне зниження гломерулярної фільтрації й незначне підвищення рівня креатиніну.

У таких випадках необхідно ретельно моніторувати ці показники, не відміняючи лікування. У переважної більшості хворих через деякий час функціональний стан нирок поліпшується. У пацієнтів з прогресуючим погіршенням функції нирок на фоні антигіпертензивної терапії, особливо при застосуванні інгібіторів АПФ і БРА II, слід підозрювати стеноз ниркової артерії.
У літературі висловлюються спекулятивні припущення, що при нормальній функції нирок інгібітори АПФ, що мають нирковий шлях виведення, можуть мати переваги над іншими, що виводяться печінковим або печінково-нирковим шляхом. З іншого боку, при наявності ниркової дисфункції слід призначати препарати, що виводяться подвійним шляхом. Експерти Європейського товариства кардіологів у своєму Консенсусі по застосуванню інгібіторів АПФ при серцево-судинних захворюваннях (2004) висловили думку, що зазначені фармакологічні властивості не мають значення для досягнення клінічних ефектів цих препаратів.
У хворих з вираженою ХНН перевагу слід віддавати препаратам без або з мінімальним нирковим шляхом виведення (фозиноприл, спіраприл, моексиприл). Дозу всіх препаратів, крім моексиприлу, необхідно знизити. Препарати, що блокують активність РААС, слід призначати під контролем рівня калію в сироватці крові.
Принципи призначення діуретиків у хворих з ренопаренхіматозною АГ
Призначення діуретиків є важливим компонентом лікування хворих з ренопаренхіматозною АГ. З одного боку, діуретики є патогенетично обґрунтованими засобами для зниження АТ у цієї категорії хворих — вони зменшують об’єм рідини в організмі, у тому числі у судинному руслі, зменшують набряки. З іншого боку, без їх застосування практично неможливо досягти ефективного контролю АТ і покращити функцію нирок. Діуретики потенціюють антигіпертензивний ефект інших препаратів, особливо інгібіторів АПФ і БРА II. Лікування починають зі звичайних доз, при необхідності дозу підвищують до максимальної. При рівні креатиніну >2,5 мг/дл (220 мкмоль/л) тіазидні діуретики будуть неефективними, а калійзберігаючі діуретики протипоказані. При необхідності діуретики з коротким періодом напіввиведення (фуросемід) слід призначати 2–3 рази на добу.
У рекомендаціях АНФН (2004) вказано, що у більшості пацієнтів з ХЗН необхідно використовувати діуретики (клас I, рівень доказовості А). Діуретики слід призначати, керуючись наступними принципами:
- тіазидні діуретики можуть призначати на стадії 1–3, (рівень доказовості А) — ШКФ >40 л/хв/1,73 м2 або рівень креатиніну сироватки крові <2,5 мг/дл (220 мкмоль/л);
- петльові діуретики можуть призначати на всіх стадіях ХЗН (рівень доказовості А);
- калійзберігаючі діуретики не призначають:
- на стадії ХЗН 4–5;
- у хворих, які приймають інгібітори АПФ або БРА II (рівень доказовості А).
У випадку тривалого застосування діуретиків для попередження ризику виникнення побічних ефектів терапії слід моніторувати:
- гіповолемію (можливість розвитку артеріальної гіпотензії і , як наслідок, зниження функції нирок — зниження ШКФ);
- гіпокаліємію та інші електролітні порушення. Інтервал для моніторування залежить від їх вихідного рівня (див. нижче).
При лікуванні АГ перевагу слід віддавати діуретикам тривалої дії та/або їх комбінації (краще фіксованим) з іншими антигіпертензивними препаратами для підвищення комплаєнтності хворих до терапії.
Спостереження за хворими з ренопаренхіматозною АГ
Амбулаторне лікування АГ проводиться безперервно протягом життя. Хворі з АГ підлягають диспансерному спостереженню дільничними терапевтами або сімейними лікарями за місцем проживання. При наявності серцево-судинних ускладнень або високого ризику їх розвитку — спостереження у кардіолога. При виявленні ХЗН до програми спостереження слід підключити нефролога та ендокринолога (при наявності цукрового діабету). Контролю підлягають цільові показники АТ, ШКФ, альбумін- (протеїн)урія. Крім того, додатково слід контролювати вміст електролітів (калію, при необхідності натрію, хлору, кальцію), глюкози, ХС та його фракцій у сироватці крові. У випадку виявлення порушень підлягають контролю показники білкового обміну. Частота візитів та контроль біохімічних показників залежить від ступеня їх порушення. Хворі з ренопаренхіматозною АГ можуть направлятися на МСЕК (медико-соціальну експертну комісію) у зв’язку із втратою працездатності.
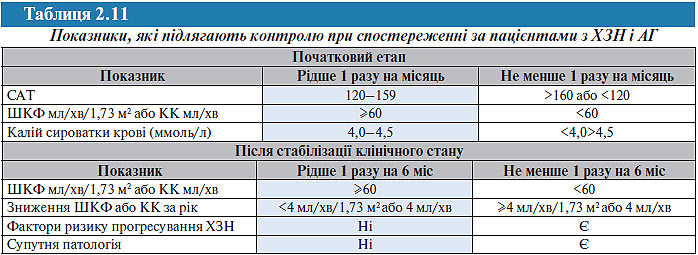
У табл. 2.11 наведені основні показники, що підлягають контролю при спостереженні за пацієнтами з ХЗН і АГ, а також частота їх визначення залежно від ступеня їх початкових змін.
ЛІТЕРАТУРА
- Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2008) Київ, 80 с.
- 1999 WHO — ІSH guіdelіnes for the management of hypertensіon (1999) J. Hypertensіon, 11: 905–916.
- 2003 European Socіety of Hypertensіon — European Socіety of Cardіology guіdelіnes for management of arterіal hypertensіon (2003) J. Hypertensіon, 21: 1011–1053.
- 2007 Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.
- Bart B.A. (1999) Concern for azotemіa wіth convertіng enzyme іnhіbіtors: publіc health іmplіcatіons and clіnіcal relevance. Am. Heart J., 138: 801–803.
- Bjork S., Mulec H., Johnsen S.A. et al. (1992) Renal protectіve effects of enalaprіl іn dіabetіc nephropath. Br. Med. J., 304: 339–343.
- Bjork S., Nyberg G., Mulec H. et al. (1986) Benefіcіal effects of angіotensіn convertіng enzіme іnhіbіtіon on renal functіon іn patіents wіth dіabetіcs wіth nephropathy. Br. Med. J., 293: 471–474.
- de Zeeuw D., Cooper M.E., Keane W.F. et al. for RENAAL Іnvestіgators. Results of losartan organ protectіon study. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertensіon, 19(Suppl. 2): S16.
- Epsteіn M., Tobe S. (2001) What іs the optіmal strategy to іntensіfy blood pressure control and prevent progressіon of renal dіsease? Current Hypertensіon Reports, 3: 422–428.
- Hallan S., Asberg A., Lіndberg M., Johnsen H. (2004) Valіdatіon of the Modіfіcatіon of Dіet іn Renal Dіsease formula for estіmatіng GFR wіth specіal emphasіs on calіbratіon of the serum creatіnіne assay. Am. J. Kіdney Dіs., 44: 84–93.
- Hannendouche T., Landoіs P., Goldfarb B. et al. (1994) Randomіzed controlled trіal of enelaprіl and beta-blockers іn non-dіabetіc chronіc renal faіlure. Br. Med. J., 309: 833–837.
- Hansson L., Zanchettі A. et al. for the HOT Study Group. (1998) Effects of іntense blood pressure lowerіng and low-dose aspіrіn іn patіents wіth hypertensіon. Prіncіpal results of the Hypertensіon Optіmal Treatment (HOT) randomіzed trіal. Lancet, 351: 1755–1762.
- Hebert L.A., Baіn R.P., Verme D. et al. (1994) Remіssіon of nephrotіc range proteіnurіa іn type І dіabetes. The Collaboratіve Study Group. Kіdney Іnt., 46: 1688–1693.
- Heіnіg R.E. (2002) What should the role of ACE іnhіbіtors be іn the treatment of dіabetes? Lessons from HOPE and MІCRO-HOPE. Dіabetes Obes. Metab., 4(Suppl. 1): S19–S25.
- Hypertensіon Prіmer. The essentіals of hіgh blood pressure. Thіrd edіtіon. From the councіl on hіgh blood pressure research Amerіcan Heart Assocіatіon (2003) 532 p.
- Levey A.S., Perrone R.D., Madaіo M.P. (1991) Laboratory assessment of renal dіsease: clearance, urіanalysіs and renal bіopsy. Іn B.M. Brenner and E.R. Rector Edіtіon. The Kіdney. W.B. Saunders, Phіladelphіa, 919–968.
- Lewіs E.J., Hunsіker L.G., et al. (1994) The effect of ACE іnhіbіtіon on dіabetіc nephropathy. The Collaboratіve Study Group. N. Engl. J. Med., 329: 1456–1462.
- Mathіnsen E.R., Hommel E., Gіese J. et al. (1991) Effіcacy of captoprіl іn postponіng nephropathy іn normotensіve іnsulіn dependent dіabetіc patіents wіth macroalbumіnurіa. Br. Med. J., 303: 81–87.
- Moser M., Basіle J., Mіller E.R. et al. (2002) Roundtable Dіscussіon: Hypertensіon, Renal Dіsease and Dіabetes. J. Clіn. Hypertensіon, 4: 113–119.
- Natіonal Kіdney Foundatіon. Clіnіcal Practіce Guіdelіnes for Chronіc Kіdney Dіsease: Evaluatіon, Classіfіcatіon and Stratіfіcatіon. Executіve Summary (2002) New York, 94 p.
- Natіonal Kіdney Foundatіon. Kіdney Dіsease Outcomes Qualіty Іnіtіatіve. K/DOQІ clіnіcal practіce guіdelіnes on hypertensіon and antіhypertensіve agents іn chronіc kіdney dіsease (2004) Am. J. Kіdney. Dіs., 43(5 Suppl. 1): 1–290.
- Parvіng H.-H., Hommel E., Smіdt U.M. (1988) Protectіon of kіdney functіon and decrease іn albumіnurіa by captoprіl іn іnsulіn dependent dіabetіcs wіth nephropathy. Br. Med. J., 297: 1086–1091.
- Rodby R., Ruіlope L., Hunsіcker L. et al. for the Collaboratіve Study Group. Results of the іrbesartan type ІІ dіabetіc nephropathy trіal. 11th European meetіng on hypertensіon. Abstracts (2001) J. Hypertensіon, 19(Suppl. 2): S16.
- Ruіlope L.M. (1995) Effects of angіotensіn-convertіng enzyme іnhіbіtors on the progressіon of dіabetіc nephropathy. J. Hypertensіon,13(Suppl. 2): S91–S93.
- Rule D., Tіmothy S., Larson M. et al. (2004) Usіng Serum Creatіnіne to estіmate glomerular fіltratіon rate: accuracy іn good health and іn chronіc kіdney dіsease. Ann. Іnternal Med., 141: 929–937.
- Schoolwerth A.C., Sіca D.A. et al. (2001) Renal Consіderatіons іn Angіotensіn Convertіng Enzyme Іnhіbіtor Therapy. AHA Scіentіfіc Statement. Cіrculatіon, 104: 1985–1991.
- Taal M.W., Brenner B.M. (2002) Combіnatіon ACEІ and ARB therapy: addіtіonal benefіt іn renoprotectіon. Curr. Opіn. Nephrol. Hypertens., 11: 377–381.
- The Seventh Report of the Joіnt Natіonal Commіttee on Preventіon, Detectіon, Evaluatіon and Treatment of Hіgh Blood Pressure. US Department of Health and Human Servіce. NІH Publіcatіon No. 03-5233 (2003) 34 p.
- Toto R.D. (2004) Hypertensіon іn chronіc kіdney dіsease. Іn Secondary Hypertensіon ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, р. 39–62.
- Vervoort G., Hans L., Wіllems F. et al. (2002) Assessment of glomerular fіltratіon rate іn healthy subjects and normoalbumіnurіc dіabetіc patіents: valіdіty of a new (MDRD) predіctіon equatіon. Nephrol. Dіalysіs Transpl., 17: 1909–1913.
- Vіbertі G., Mogensen C.E., Groop L.C. et al. (1994) Effect of captoprіl on progressіon to clіnіcal proteіnurіa іn patіents wіth іnsulіn-dependent dіabetes mellіtus and mіcroalbumіnurіa. J.A.M.A., 271: 275.
РЕНОВАСКУЛЯРНА АГ
Визначення
Реноваскулярна АГ зумовлена одно- або двобічним стенотичним ураженням ниркових артерій. Слід чітко поділяти поняття «реноваскулярна АГ» і «ураження (хвороби) судин нирок», оскільки реноваскулярна АГ виникає внаслідок різних захворювань ниркових артерій, які мають своє походження, патогенез, перебіг, лікування та прогноз. Не всі стенотичні ураження ниркових артерій, що виявляються при ангіографічному дослідженні, призводять до розвитку реноваскулярної АГ.
Важливість своєчасної діагностики цієї вторинної форми АГ зумовлена тим, що вона може бути причиною підвищення АТ у молодому віці і в 30% випадків зумовлює злоякісний перебіг. Прогресування реноваскулярної АГ призводить до розвитку тяжких серцево-судинних ускладнень, у тому числі ХСН, а також ХНН. Водночас своєчасна корекція виявленого стенозу ниркових артерій у ряді випадків дозволяє нормалізувати рівень АТ або (у більшості пацієнтів) полегшити його контроль, а також попередити розвиток серцево-судинних або ниркових ускладнень.
Епідеміологія
Поширеність реноваскулярної АГ у популяції хворих з АГ становить 1–5%. У профільних відділеннях хворих, що спеціалізуються на лікуванні хворих з рефрактерними формами АГ, частота виявлення реноваскулярної АГ досягає 10%. За даними відділення симптоматичних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України, із 3495 первинних хворих з АГ, обстежених у відділенні за період з 1994 по 2003 р., діагноз «реноваскулярна АГ», підтверджений ангіографічним дослідженням або під час оперативного втручання, встановлений 56 пацієнтам (1,6%).
Після впровадження в практику моделювання АГ у собак методом Goldblatt на початку 30-х років ХХ ст. було висловлено припущення про можливий розвиток АГ за подібним механізмом у частини пацієнтів. Уперше клінічне значення стенозу ниркових артерій для розвитку вторинної АГ було описано Leadbetter і Burkland у 1938 р. Sensenbach у 1944 р. описав лікування АГ після видалення нирки з атеросклеротично зміненими артеріями. У 1957 р. Poutasse і Dustan описали інші ознаки цього захворювання і запропонували показання для проведення ангіографії. У 1960 р. у США було почате кооперативне багатоцентрове дослідження реноваскулярної АГ (Cooperative Study of Renovascular Hypertension), що поклало початок сучасним уявленням про це захворювання.
Як зазначено вище, не кожне звуження ниркових артерій і не у всіх пацієнтів призводить до розвитку АГ. Стеноз ниркових артерій можуть відзначати і в осіб з нормальним рівнем АТ. У пацієнтів старше 60 років ураження ниркових артерій атеросклеротичної природи відзначається майже в 50% випадків при нормальному рівні АТ. За даними K. Hooly і співавторів при проведенні серійних селективних ангіографічних досліджень стеноз ниркових артерій відзначали у 49% осіб з нормальним та у 77% пацієнтів з підвищеним АТ. Таким чином, доведено, що рутинне проведення ангіографії серед усіх хворих з підвищеним АТ для виявлення реноваскулярної АГ буде малоефективним.
Патогенез
Вважають, що реноваскулярна АГ розвивається при наявності функціонально значимого стенозу ниркової артерії, при виникненні ішемії нирок. Гемодинамічно значимим вважають стеноз, при якому зменшення просвіту артерії в ділянці ураження досягає 50–70%. До формування реноваскулярної АГ призводять наступні захворювання: атеросклероз, фібромускулярна дисплазія, неспецифічний аортоартеріїт; рідше — аневризми ниркових артерій, пухлини або кісти, що здавлюють нирки або ниркові артерії, патологічно рухливі нирки (перегини артерій при нефроптозі або після хірургічної фіксації нирки), гіпоплазія основних ниркових артерій та деякі інші нечасті причини. Водночас за даними J. Crowley і співавторів при повторних ангіографічних обстеженнях прогресування ураження ниркових артерій у середньому через 2,6 року відзначали у 11,1% хворих з первинно виявленим стенозом. При цьому прогресування стенозу асоціювалося зі зниженням функції нирок.
У патогенезі АГ при цьому захворюванні провідна роль належить зменшенню ниркового кровотоку, що виникає при звуженні ниркової артерії, ішемії тканини нирок та компенсаторній активації РААС. У юкстагломерулярному апараті нирок з А I під дією реніну утворюється А II — високоактивний вазопресорний пептид, який діє як безпосередньо на артеріоли з підвищенням їх тонусу і периферичного опору, так і опосередковано — шляхом стимуляції секреції альдостерону. У фізіологічних умовах цей механізм спрямований на підтримку стабільності ниркового кровотоку при різних коливаннях АТ, у першу чергу при його зниженні під час кровотечі і травми. У цьому випадку цей механізм запускає патологічний процес і бере участь у його прогресуванні. У більшості хворих зі стенозом ниркових артерій, особливо при однобічній його локалізації, АГ є ренінзалежною. Тривала активація РААС призводить до розвитку вторинного гіперальдостеронізму, накопичення натрію в стінці артеріол, підвищення їх чутливості до дії ряду вазопресорних агентів. Таким чином, запускаються нові ланки патогенезу, включаються численні пресорні й депресорні фактори, які й визначають характер перебігу АГ. Клінічний перебіг реноваскулярної АГ може мати різні особливості залежно від етіології захворювання, яке призводить до стенозу ниркових артерій. У практичній діяльності лікаря при виявленні випадків підвищеного рівня АТ у пацієнтів важливим є розпізнавання найбільш частих захворювань, що призводять до розвитку реноваскулярної АГ, а саме атеросклерозу, фібромускулярної дисплазії, неспецифічного аортоартеріїту. За вищеописаним механізмом можливий розвиток АГ внаслідок хронічної ішемії нирок при коарктації аорти.
Клінічні форми реноваскулярної АГ
Атеросклероз
Атеросклероз — найбільш часта причина (80–90%) стенозу ниркових артерій. У більшості випадків атеросклеротичне ураження ниркових артерій відзначають у чоловіків віком старше 50 років, частіше воно буває однобічним (зліва). У більш старшому віці виявляють множинні стенози, у тому числі двобічні. Типові стенози виявляються в усті та в середній частині ниркових артерій. Найчастіше одночасно відзначають й інші локалізації атеросклеротичних уражень: у коронарних і мозкових артеріях, в артеріях нижніх кінцівок. Фактори ризику, патогенетичні механізми й ускладнення атеросклерозу різної локалізації слід розглядати в цілому в контексті одного захворювання (див. відповідний розділ).
Проте атеросклеротичне ураження ниркових артерій, яке призводить до розвитку реноваскулярної АГ, може мати свої специфічні симптоми. При атеросклерозі ниркових артерій ураження має прогресуючий характер, можуть мати місце оклюзії. На фоні атеросклерозу ниркових артерій перебіг АГ у 25–30% випадків має злоякісний характер, ще частіше відзначають рефрактерність до проведеної антигіпертензивної терапії: пацієнти приймають 3–4 препарати у високих дозах з недостатнім ефектом.
При атеросклеротичному стенозі ниркових артерій порівняно з іншими формами реноваскулярної АГ частіше й швидше відзначають розвиток ХНН. Це відбувається тому, що при гемодинамічно значимих стенозах артерій обох нирок або основної артерії єдиної нирки формується гіпоперфузія ниркових клубочків, їх ішемія і прогресивно розвиваються фіброзні та атрофічні зміни в нефронах. Та частина нирок, яка функціонує, заміщається рубцевою тканиною. Тривало існуюча ішемія нирок за аналогією з ІХС у літературі іменується ішемічною хворобою нирок (ІХН), або ішемічною нефропатією. ІХН може розвиватися і при емболії дрібних гілок ниркових артерій кристалами ХС, а також інших проявах атеротромбозу. Перебіг захворювання може ускладнитися раптовим розвитком або прогресуванням ниркової недостатності. Частіше це відзначають у хворих похилого віку, ускладнення поєднується з атеросклеротичним ураженням артерій інших басейнів: головного мозку, серця та нижніх кінцівок з типовими клінічними проявами. У більшості хворих відзначаються клінічні прояви ІХС (стенокардія, перенесений ІМ, СН, порушення ритму серця). Прогресуюча ниркова недостатність у пацієнтів з тяжкою або рефрактерною АГ на фоні розповсюдженого атеросклерозу — типові клінічні прояви ІХН. Сучасні настанови рекомендують цей процес також розглядати як прояв ХЗН і класифікувати відповідно до існуючих стадій (див. розділ «Ренопаренхіматозна АГ»).
Атеросклероз ниркових артерій може ускладнюватися гострим тромбозом або емболією з розвитком інфарктів нирок. Гостра оклюзія ниркових артерій, що виникає внаслідок цих процесів, проявляється у вигляді больового, сечового й гіпертензивного синдромів. Больовий синдром характеризується болем у животі або поперековій області; біль носить постійний характер і може не віддавати в пахвинну ділянку, що відрізняє її від нападів ниркової коліки. Тривалість больового синдрому — від декількох годин до кількох діб. Сечовий синдром проявляється зменшенням кількості сечі аж до олігурії, протеїнурії, гематурії (частіше незначної). Гіпертензивний синдром проявляється у вигляді появи (наростання) стійкої, прогресуючої АГ. Певне значення при наведеній симптоматиці має поява нейтрофільного лейкоцитозу з підвищенням ШОЕ.
Крім зазначених ситуацій, при атеросклеротичному ураженні аорти може розвинутися розшаровуюча аневризма черевного відділу. При цьому може виникнути клініка як хронічного (при тривалому існуванні цього стану), так і гострого стенозу ниркових артерій.
Фібромускулярна дисплазія
Фібромускулярна дисплазія (ФМД) ниркових артерій — друга за частотою причина реноваскулярної АГ (10–15% випадків). ФМД — неатеросклеротичне, незапальне захворювання, яке вражає переважно ниркові і сонні артерії, вкрай рідко — обидва басейни артерій. Захворювання описане у 1955 р. Л. Маккорміком. ФМД частіше хворіють молоді жінки й діти, хоча у дітей не відзначається виражених статевих відмінностей за частотою її розвитку. Патогенез захворювання дотепер не визначений. Вважається, що головну роль відіграють генетичні, гормональні та механічні фактори, а також ішемія артеріальної стінки, носійство антигену Н1А–DRw6. Відзначено успадковування хвороби за аутосомно-домінантним типом. Більшу частоту захворювання у жінок пов’язують із впливом ендо- і екзогенних естрогенів. Крім цього, факторами ризику є тютюнопаління, сімейний анамнез щодо АГ, а також ураження vasa vasorum.
Захворювання може вражати кожний із шарів артеріальної стінки — інтиму, медію та адвентицію. У 80–85% хворих відзначають ураження медії (у дистальному відділі основної ниркової артерії і її гілок). Звуження просвіту судини відбувається у результаті концентричного або ексцентричного відкладання колагену в просвіт судини. При цьому внутрішня еластична мембрана тоншає або фрагментується. Патологічний процес проявляється мультифокальним, тубулярним або монофокальним стенозом. При цьому відзначають ураження артерій малого та середнього калібру. На додаток до звужень у судинній стінці розвиваються слабкі місця, у яких виявляють аневризматичні розширення, що при ангіографічному дослідженні дає типову картину, що нагадує чотки або намисто з перлів. Частіше відзначають однобічне ураження, проте у ⅓ пацієнтів може бути ураження багатьох басейнів.
Природній перебіг захворювання переважно доброякісний. Досить довго захворювання має безсимптомний перебіг. Описані випадки знахідок ФМД ниркових артерій при скринінгових дослідженнях донорів для пересадки нирок. Нечастий тип ураження — в області інтими та/або періартеріально частіше відзначають у дітей і осіб молодого віку (15–30 років), захворювання має швидко прогресуючий перебіг.
Розвиток реноваскулярної АГ є типовим проявом ФМД ниркових артерій. Надалі в клінічній картині домінують симптоми АГ, а також її ускладнень. Рідко першим виявленим симптомом захворювання, може бути прояв ниркової недостатності. До такого стану може призвести неправильний прийом деяких лікарських препаратів: інгібіторів АПФ, антагоністів ангіотензинових рецепторів, стероїдних і НПЗП. Наявні в літературі спостереження свідчать, що при своєчасному виявленні захворювання й проведенні інтервенційного або хірургічного втручання у більшості хворих із ФМД (>80%), у тому числі і дітей, відзначають нормалізацію АТ та сприятливий довгостроковий прогноз.
Неспецифічний аортоартеріїт
Неспецифічний аортоартеріїт (хвороба Такаясу, брахіоцефальний артеріїт) — системне запальне захворювання аутоімунного характеру з переважаючим ураженням аорти і її гілок порівняно з іншими, розглянутими раніше захворюваннями, є нечастою причиною розвитку реноваскулярної АГ. Переважно (близько 90%) хворіють жінки, частіше вихідці з азіатського регіону. Зазвичай хворіють особи молодого віку, частіше 20–40 років, вкрай рідко — після 50 років.
Ураження ниркових артерій при захворюванні рідко буває ізольованим. Частіше відзначають множинні ураження різних артеріальних судинних басейнів різної довжини з розвитком тяжких ішемічних порушень з боку життєво важливих органів. При активному запальному процесі в клініці домінує синдром гострофазних реакцій (субфебрильна температура, підвищення ШОЕ, збільшення вмісту СРБ). При неспецифічному аортоартеріїті патологічний процес у ниркових артеріях локалізується переважно в ділянці устя або дещо дистальніше від нього (до 1,5 см). Оклюзії артерій нирок відзначають рідше, ніж стенози; двобічні ураження — дещо частіше, ніж однобічні. АТ у більшості випадків досягає високого рівня, часто до 180–300/100–160 мм рт. ст., а у половини хворих розвивається синдром злоякісної АГ.
Згідно з рекомендаціями Американської колегії ревматологів (ACR, 1990) діагностичними критеріями артеріїту є наступні ознаки: початок захворювання у осіб віком до 40 років, ослаблення пульсу на плечовій артерії, різниця АТ на плечових артеріях >10 мм рт. ст., шум на уражених артеріях (аорта та її гілки), зміни на ангіограмі. Діагноз може бути встановлений при наявності 3 і більше діагностичних критеріїв (чутливість — 90,5%, специфічність — 97,8%).
Діагностика
Як відзначалося вище, проведення скринінгу серед усіх пацієнтів з підвищеним АТ для виявлення реноваскулярної АГ неефективне і тому вважається недоцільним. У діагностиці АГ вазоренального походження можна виділити ряд етапів: виявлення лікарем часу першого контакту клінічних проявів захворювання, які можуть вказувати на вірогідність реноваскулярної АГ; виявлення власне стенозу ниркових артерій; встановлення залежності між стенозом ниркових артерій і АГ; встановлення етіології захворювання, що призводить до стенозування ниркових артерій і виникнення реноваскулярної АГ. У табл. 2.12 узагальнені симптоми, наявність яких у хворого з підвищеним АТ повинна викликати підозру на реноваскулярну АГ.
Таблиця 2.12
Симптоми, які дозволяють запідозрити наявність реноваскулярної АГ
| • Вік <30 і >55 років |
| • Швидкопрогресуючий перебіг АГ |
| • Рефрактерність до терапії АГ (при комбінованому застосуванні ≥3 препаратів, у тому числі діуретика) |
| • Порушення функції нирок невизначеної етіології |
| • Розвиток азотемії при призначенні інгібітору АПФ або БРА II |
| • Шум над проекцією ниркових судин, що визначається аускультативно |
| • Множинні стенотичні ураження коронарних, мозкових, периферичних судин |
| • Рецидиви епізодів набряку легень на фоні високого АТ |
Уже на першому етапі обстеження хворих з АГ можна запідозрити вазоренальний генез АГ. Попередній діагноз цієї форми АГ ґрунтується на характері перебігу і даних анамнезу захворювання. До типових ознак належать:
- наявність у молодих жінок високої стабільної АГ, особливо при злоякісному перебігу, а також наявність високого АТ, рефрактерного до медикаментозної терапії (ФМД);
- злоякісний перебіг АГ у пацієнтів віком 50 років і старше (атеросклероз);
- раптовий розвиток АГ після епізоду болі в ділянці нирок (тромбоз ниркових артерій).
У деяких випадках вдається виявити факт погіршення функції нирок на фоні призначення інгібіторів АПФ або БРА II: швидке підвищення рівня креатиніну в сироватці крові при їх прийомі.
Дані фізикального обстеження дозволяють визначити прояви, типові для реноваскулярної АГ:
- при аускультації — систолічний шум над черевним відділом аорти, який рідко може вислуховуватися у хворих з однобічним стенозом і частіше — у хворих з двобічним стенозом. Шум над стенозами ниркових артерій вислуховується на середині відстані між мечоподібним відростком і пупком;
- асиметрія АТ і пульсу на верхніх кінцівках;
- наявність градієнта САТ між верхніми та нижніми кінцівками. Асиметрія АТ на кінцівках та систолічний шум над нирковими артеріями характерні для системних захворювань: атеросклерозу і хвороби Такаясу.
Загальний аналіз сечі і крові обов’язкові на першому етапі діагностики, з їх допомогою також оцінюють функціональний стан нирок (ШКФ). Як правило, у загальному аналізі сечі виражена патологія відсутня. При розвитку ХЗН (нефросклерозу або ішемічного зморщування) з’являється помірно виражена альбумінурія.
Наступним найважливішим етапом діагностики реноваскулярної АГ є поглиблене біохімічне дослідження. Як ми вже відзначали, в основі патогенезу реноваскулярної АГ лежить підвищення продукції реніну нирками у відповідь на їх недостатнє кровопостачання. Водночас підвищений рівень реніну у венозній крові виявляли лише у 50–70% пацієнтів з реноваскулярною АГ. Проте у 15–20% хворих з есенціальною АГ активність реніну плазми крові також підвищена, тому ця ознака не є специфічною. У зв’язку з цим рутинне визначення активності реніну в плазмі крові для діагностики реноваскулярної АГ не рекомендується. З метою підвищення специфічності визначення активності реніну була запропонована функціональна проба з інгібітором АПФ каптоприлом. Під впливом прийому інгібітору АПФ у відповідь на зниження ниркової перфузії з боку стенозу підвищується продукція реніну, що призводить до підвищення АТ. Вимірюють первинний рівень АТ і через 1 год після прийому 25 мг каптоприлу: при високій активності реніну, яка характерна для вторинного гіперальдостеронізму — важливої ланки в патогенезі реноваскулярної АГ, — відзначають виражене зниження АТ. Більш показова модифікація цієї проби з дослідженням активності реніну в плазмі крові первинно і через 1 год після прийому каптоприлу. F. Muller і співавтори (1986) запропонували наступні діагностичні критерії для пацієнтів з однобічним стенозом і збереженою функцією нирок, які, за їх даними, мають високу чутливість (79%) і специфічність (89%):
- Підвищення рівня активності реніну в плазмі крові після прийому каптоприлу >12 нг/мл/год.
- Абсолютне підвищення активності реніну в плазмі крові >10 нг/мл/год.
- Підвищення активності реніну в плазмі крові порівняно з початковим рівнем >150% або >400% — при початковому його рівні <3 нг/мл/год.
На жаль, практика показує, що не у всіх хворих є можливим провести зазначений тест. На діагностичну значимість проби з каптоприлом може впливати прийом більшості антигіпертензивних препаратів. Тому за 2–4 тиж до проведення цієї проби слід відзначити лікарські засоби, які можуть впливати на РААС. При необхідності для корекції АТ призначають блокатори кальцієвих каналів. Дані більш сучасних досліджень показують, що тест із каптоприлом може давати до 43% псевдонегативних і 34% псевдопозитивних результатів.
Дуже важливе діагностичне значення мають інструментальні (візуалізуючі) методи для оцінки асиметрії розмірів, форми та функції нирок. З цією метою застосовують методи, які дозволяють роздільно оцінити стан обох нирок. Стенозувальне ураження артерії з подальшим зниженням кровотоку у нирці веде до зниження її функції, а потім і розмірів органа на ураженій ділянці. Зниження внутрішньониркового перфузійного тиску і поступово прогресуючий процес зморщування нирок призводить до розвитку їх асиметрії. Виявлення асиметрії розмірів нирок — ознака, типова для однобічного ураження.
Незважаючи на те що провідна роль у визначенні локалізації та характеру ураження ниркових артерій на сьогодні приділяється рентгеноконтрастній ангіографії, на початковому етапі діагностики застосовуються простіші і разом з тим досить інформативні методи: УЗД нирок, радіонуклідна ренографія (сцинтиграфія), екскреторна урографія. На першому етапі дослідження широко використовується УЗД у В-режимі. Різниця в поздовжньому розмірі нирок, що перевищує 15 мм, — характерна ознака реноваскулярної АГ. Зазначену асиметрію можна виявити тільки у 60–70% хворих. Дуплексне сканування ниркових артерій з кольоровою допплєрівською приставкою дозволяє діагностувати стенози ниркових артерій, особливо при переважній їх локалізації в ділянці устя. При дуплексному скануванні важливого значення набувають локалізація пікової швидкості кровотоку, зміна його спектра, підвищення лінійної швидкості кровотоку по нирковим артеріям, асиметрія швидкісних показників. Діагностичне значення має підвищення пікової швидкості кровотоку в артеріях нирок >180 см/с або збільшення співвідношення швидкості потоку крові в ниркових артеріях до швидкості в аорті більше ніж в 3,5 раза. За даними спеціалізованих клінік чутливість цього методу становить 88–95%, а специфичність — 90–99%.
З діагностичною метою при нормальній функції нирок застосовують радіонуклідні дослідження. Проведення ренографії з 131I-гіппураном часто дозволяє виявити зниження функції нирки з боку стенозу (сповільнення досягнення піка кривої). При цьому відсутність асиметрії при наявності стенозу пояснюють двобічним симетричним ураженням ниркових артерій, а у деяких хворих — розвитком колатералей. Успішно застосовується динамічна нефроангіосцинтиграфія з 99mТс-диетилентриамінпентаацетатом. Швидкість елімінації цього ізотопу залежить від клубочкової фільтрації. Дослідження дозволяє оцінити перфузію нирок, їх розміри та екскреторну функцію. Діагностичну значимість цього дослідження можна підвищити при його комбінації з каптоприловою пробою: візуалізацію нирок проводять до і після прийому 25–50 мг каптоприлу, що дозволяє виявити функціональний резерв нирок. Такий підхід дозволяє не тільки виявити стеноз ниркових артерій, але й оцінити його функціональну значимість. Визначають асиметрію накопичення ізотопу на 1,5–2-й хвилині і його секрецію на 15–20-й хвилині після ін’єкції. За даними деяких досліджень чутливість методу становить 45–94%, а специфічність — 81–100%.
Внутрішньовенна екскреторна урографія є більш трудомістким методом дослідження і проводиться у тих випадках, коли дані УЗД і радіонуклідних методів не дозволили уточнити діагноз, а проведення контрастної ангіографії вважається передчасним і переноситься на наступний етап діагностики. Необхідно враховувати, що екскреторна урографія, як і всі рентгеноконтрастні методи дослідження, протипоказана при непереносимості йодовмісних контрастних речовин, а також при значному зниженні функції нирок внаслідок розвитку ХНН. При проведенні екскреторної урографії при наявності однобічного стенозу ниркової артерії виявляють асиметрію функції нирок, затримку появи контрастної речовини на ураженій ділянці на ранніх і підвищену концентрацію її в ураженій нирці на пізніх етапах дослідження. Чутливість методу становить 74%, специфічність — 86%.
Спіральна КТ із контрастуванням дозволяє неінвазивно й досить точно візуалізувати ниркові артерії. За даними ряду досліджень чутливість методу при виражених стенозах (>50%) становить 90%, а специфічність — 97%. Недоліком методу є необхідність використання контрастної речовини, яка має нефротоксичний потенціал і обмежує застосування методу у хворих з порушеною функцією нирок. На рис. 2.5 зображена КТ-ангіограма з типовими змінами судин нирок при ФМД.
Рис. 2.5. Дані КТ ангіографії хворої П., 19 років; множинні стенози ниркової артерії при ФМД (позначені стрілкою)
МРТ є альтернативним методом, що забезпечує проведення безпечної (ненефротоксичної) неінвазивної ангіографії. Її використання для візуалізації ниркових артерій виправдано у хворих із значними порушеннями функції нирок. Чутливість методу досягає 100%, а специфічність — 92–96%.
Важливу роль у діагностиці реноваскулярної АГ відіграє ангіографія черевної частини аорти і селективно — ниркових артерій. Цей метод залишається золотим стандартом діагностики стенозів артерій нирок. Його застосування дає можливість встановити локалізацію стенозу, його довжину, ступінь розвитку колатералей, а у фазі нефрограм визначити розміри нирок. Основна ангіографічна ознака наявності стенозу — локальне зменшення діаметра судини (рис. 2.6). Гемодинамічно значимим стенозом вважають зменшення діаметра артерії в області її ураження на 50% порівняно з незміненою ділянкою, а зменшення на ≥70% розцінюють як критичний стеноз. Трансфеморальна контрастна ангіографія дозволяє виявити не тільки стеноз ниркової артерії, але й диференціювати його етіологію. Зокрема, при ФМД визначають множинні звуження з постстенотичною дилатацією ниркової артерії (характерна картина «намиста із перлів» — рис. 2.7). Чутливість методу досягає 100%. AHA у 2006 р. рекомендувала проводити ангіографію ниркових артерій при проведенні планової коронарографії всім пацієнтам, у яких відзначають симптоми, характерні для реноваскулярної АГ (див. табл. 2.12). Водночас контрастна селективна ангіографія має свої недоліки, оскільки несе певний ризик для хворого: інвазивна артеріальна катетеризація з усіма її можливими ускладненнями, токсична дія контрасту (у тому числі нефротоксична), рентгенівське опромінення.
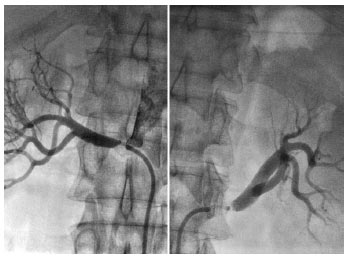
Рис. 2.6. Дані аортографії хворого П., 65 років: двобічні стенози устів ниркових артерій при атеросклеротичному ураженні
Для зниження потенційного ризику інвазивної ангіографії був запропонований метод комп’ютерної апроксимації зображення нирок при внутрішньовенному введенні контрастної речовини — цифровій субтракційній ангіографії. Для її проведення контрастну речовину достатньо ввести у вену, що дозволяє знизити ризик, пов’язаний з катетеризацією артерії. Зображення ниркових артерій виглядає як усереднення при багаторазовому проходженні контрастної речовини по артеріальному руслу. Дослідження виконується амбулаторно. Чутливість методу становить 87,6%, а специфічність — 89,5% (R. Khauli et al., 1994).
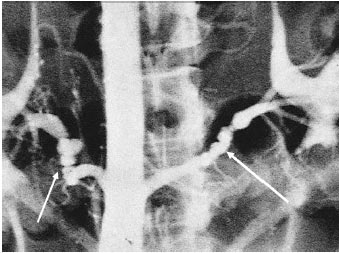
Рис. 2.7. Дані аортографії хворої М., 24 роки: множинні двобічні стенози ниркових артерій при ФМД — «намисто із перлів» або «чотки»
Для встановлення взаємозв’язку між виявленим стенозом і АГ необхідно оцінити функціональну значимість стенозу. З цією метою слід провести селективну катетеризацію ниркових вен з визначенням активності реніну у відтікаючій крові. Таке дослідження активності реніну в пробах крові, взятих з ниркових вен, дозволяє судити про функціональну значимість стенозу як етіологічного фактора АГ. З боку стенозу в нирковій вені визначається вищий рівень активності реніну в плазмі крові, ніж у нижній порожнистій вені. Величина співвідношення >1,5 вважається діагностичним критерієм реноваскулярної АГ (чутливість — 80%, специфічність — 82%). Ряд експертів вважають, що цей критерій можна використовувати для визначення прогнозу ефективності ендоваскулярного або хірургічного лікування.
У рекомендаціях ACC і AHA 2005 р. (ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease) зазначено, що для діагностики стенозу ниркових артерій слід використовувати наступні методи: дуплексне УЗД ниркових артерій (клас рекомендацій I, рівень доказовості В), КТ (у хворих з нормальною функцією нирок) (клас рекомендацій I, рівень доказовості В), МРТ (клас рекомендацій I, рівень доказовості В). Селективну ангіографію можна використовувати в тих випадках, коли дані неінвазивних досліджень не дозволяють встановити або виключити діагноз (клас рекомендацій I, рівень доказовості В). У цих самих Рекомендаціях зазначено про недоцільність рутинного визначення активності реніну в плазмі крові (клас рекомендацій III, рівень доказовості В), селективної катетеризації ниркових вен з визначенням активності реніну в пробах (клас рекомендацій III, рівень доказовості В), проведення проби з каптоприлом (клас рекомендацій III, рівень доказовості В) і сцинтиграфії нирок з каптоприлом (клас рекомендацій III, рівень доказовості С).
Диференційна діагностика
При підозрі на реноваскулярну АГ проводять стандартну диференційну діагностику між АГ і вторинними формами АГ різного генезу, а при виявленні ознак, характерних для реноваскулярної АГ, метою диференційної діагностики є встановлення безпосередньої причини патологічного процесу, тобто встановлення етіологічної форми реноваскулярної АГ. У більшості випадків для есенціальної АГ характерний відносно доброякісний перебіг, проте деякі симптоматичні АГ також можуть мати відносно доброякісний перебіг. Відрізнити АГ при ХЗН дозволяють клінічні прояви патології нирок, наявність сечового синдрому, дані інструментальних і лабораторних методів дослідження. АГ ендокринного генезу виключається на підставі аналізу клінічної симптоматики, оскільки в ряді випадків ці форми мають типові особливості клінічного перебігу. Дані дослідження рівня гормонів у крові та відповідні методи візуалізації ендокринних органів дозволяють уточнити діагноз. Аналіз анамнезу захворювання, вік виявлення підвищеного АТ, дані фізикального обстеження дозволяють виявити симптоми, на підставі яких можна припустити зв’язок АГ з ураженням ниркових артерій. Труднощі діагностики можуть бути пов’язані з необхідністю диференціювати стенози ниркових артерій, що виникли вторинно у пацієнтів з АГ або при ХЗН. Встановити діагноз у таких випадках дозволяє проведення пункційної біопсії нирок. Слід підкреслити, що необхідність проведення диференційної діагностики у таких випадках часто носить більш теоретичний, ніж практичний характер.
На ймовірність вазоренального походження АГ можуть вказувати деякі клінічні прояви: висока, особливо злоякісна АГ в осіб молодого віку (молодше 30 років) або прогресуючий перебіг АГ у осіб старшого віку (старше 55 років); раптовий розвиток АГ після нападу болі в області нирок (тромбоз ниркових артерій); систолічний шум над черевним відділом аорти (частіше прослуховується при двобічних стенозах); асиметрія АТ і характеристик пульсу на кінцівках; погіршення функціонального стану нирок при прийомі інгібітору АПФ або антагоністів рецепторів А II. Застосування неінвазивних методів дослідження вже на ранніх етапах діагностики дозволяє виявити ознаки, характерні для реноваскулярної АГ. Виявлення асиметрії у розмірах, формі та функції нирок свідчить на користь стенозу ниркових артерій. Уточнити функціональну значимість стенозу дозволяє дослідження активності реніну плазми крові при проведенні проби з каптоприлом, а краще — сцинтиграфія нирок. При необхідності проводять селективну катетеризацію ниркових вен з визначенням асиметрії рівня активності реніну в плазмі крові.
Проведення диференційної діагностики для встановлення етіології виявлених змін ниркових артерій у більшості випадків дозволяє визначити тактику лікування. Проводять диференційну діагностику з різними захворюваннями, які призводять до розвитку реноваскулярної АГ: атеросклерозом, ФМД, неспецифічним аортоартеріїтом. Атеросклерозу і неспецифічному аортоартеріїту властивий системний характер захворювання: множинне ураження різних сегментів аорти та магістральних артерій. При диференційній діагностиці цих захворювань слід мати на увазі, що неспецифічний аортоартеріїт відзначають переважно у молодих жінок віком 20–30 років, в анамнезі — періоди активності запального процесу змінюються періодами ремісії, часто відсутня пульсація на одній із променевих артерій. Атеросклеротичні зміни частіше відзначають у чоловіків віком старше 50 років, визначаються порушення ліпідного обміну, інші ознаки атеросклерозу. На користь атеросклеротичного генезу АГ свідчать дані про розвиток АГ після появи ознак атеросклерозу та/або виникнення високої АГ і її прогресуючого перебігу в осіб похилого віку. Аналіз локалізації і характеру поширення патологічного процесу також сприяє уточненню діагнозу. У хворих з неспецифічним аортоартеріїтом виявляються пролонговані сегментарні звуження артерій, які плавно переходять у незмінені ділянки, тоді як для атеросклерозу характерне локальне звуження артерій, зазвичай в місці їх біфуркації, з нерівними контурами. При ФМД на ангіограмах ниркові артерії мають типовий вигляд намиста або чоток.
Лікування
При відсутності своєчасного адекватного лікування у хворих з реноваскулярною АГ розвиваються тяжкі серцево-судинні ускладнення та/або ХНН. Це визначає значимість своєчасної діагностики і при підтвердженні діагнозу «реноваскулярна АГ» направлення у спеціалізовані центри для визначення тактики лікування. На сьогодні є три підходи до лікування хворих з реноваскулярною АГ: медикаментозна терапія, хірургічна реваскуляризація і внутрішньосудинна балонна ангіопластика. Зазначені методи лікування не виключають, а доповнюють один одного.
Медикаментозна терапія у хворих з реноваскулярною АГ, як і у всіх хворих з підвищеним АТ, у першу чергу спрямована на зниження його рівня. Цільовий АТ у хворих з реноваскулярною АГ не повинен відрізнятися від такого у пацієнтів з іншими формами АГ: необхідно прагнути до досягнення рівня <140/90 мм рт. ст. для всіх пацієнтів без ознак порушення функції нирок, <130/80 — при наявності симптомів ураження нирок, а також <125/75 мм рт. ст. — при протеїнурії >1 г/добу.
При наявності доказів атеросклеротичного процесу крім антигіпертензивної терапії проводять відповідну терапію: рекомендують відмову від тютюнопаління, призначають статини для корекції дисліпідемії та ацетилсаліцилову кислоту. При неспецифічному аортоартеріїті додаткове лікування повинне бути спрямоване на пригнічення активності запального процесу. Це ж лікування продовжують після проведення інтервенційного або хірургічного лікування.
Медикаментозна антигіпертензивна терапія при встановленому діагнозі «реноваскулярна АГ» проводиться всім пацієнтам:
- до оперативного або інтервенційного втручання — при підготовці хворих з реноваскулярною АГ до хірургічного або інтервенційного лікування;
- при залишковій АГ — у випадках недостатнього антигіпертензивного ефекту після проведення процедур реваскуляризації, як правило, у більшості пацієнтів з атеросклеротичним стенозом;
- для первинної та вторинної профілактики тяжких серцево-судинних ускладнень, коли хірургічне лікування не може бути виконане;
- при відмові пацієнта від проведення ендоваскулярних втручань і/або хірургічного лікування.
Оскільки для реноваскулярної АГ характерний перебіг з високим рівнем АТ (2–3-й ступінь підвищення АТ), з урахуванням сучасних рекомендацій із самого початку доцільне призначення комбінованої антигіпертензивної терапії препаратами тривалої дії. При виборі антигіпертензивної медикаментозної терапії перевагу віддають препаратам із групи блокаторів кальцієвих каналів, прийом яких не погіршує перфузію нирок (клас рекомендацій I, рівень доказовості А). Без додаткових обмежень можуть застосовуватися блокатори β-адренорецепторів (клас рекомендацій I, рівень доказовості А), діуретики, а також, можливо, блокатори α-адренорецепторів і агоністи імідазолінових рецепторів.
Основне місце в лікуванні хворих з реноваскулярною АГ займають препарати, що блокують активність РААС — інгібітори АПФ, і потенційно БРА II. Необхідно підкреслити, що безконтрольна терапія інгібіторами АПФ і БРА II може призвести до погіршення функції нирок, особливо при початковому її зниженні. Зменшення утворення А II і послаблення його вазоконстрикторної дії на еферентні артеріоли на фоні прийому препаратів, що блокують РААС, веде до зниження внутрішньоклубочкового тиску і клубочкової фільтрації, що може призвести до розвитку ГНН. Тривала терапія препаратами цих груп протипоказана хворим із двобічним стенозом ниркових артерій або стенозом артерії єдиної нирки, що функціонує.
На сьогодні накопичена достатня кількість доказів ефективності інгібіторів АПФ у хворих з реноваскулярною АГ, зумовленою однобічним стенозом. Переважна більшість досліджень проведена у хворих з атеросклеротичним ураженням ниркової артерії. При цьому обов’язковою умовою медикаментозного лікування є постійний контроль за функціональним станом нирок: необхідно регулярно контролювати вміст креатиніну в сироватці крові, протеїнурію, динаміку ШКФ. Рівень креатиніну в сироватці крові не повинен підвищуватися більше ніж на 10–15% порівняно з початковим рівнем. Застосування інгібіторів АПФ ефективно навіть у хворих з АГ, рефрактерною до лікування іншими антигіпертензивними препаратами. Також встановлено, що крім антигіпертензивного ефекту терапія інгібіторами АПФ забезпечувала ефективну нефропротекторну дію (клас рекомендацій I, рівень доказовості А). Терапію препаратами цієї групи починають з низьких доз, які потім титрують до максимально переносимих. Тільки за умови застосування інгібіторів АПФ у максимальних дозах можна чекати ефективної нефропротекторної дії. Важливо також контролювати рівень калію в сироватці крові під час лікування. При тенденції до гіперкаліємії не рекомендується поєднувати інгібітори АПФ з калійзберігаючими діуретиками, у тому числі зі спіронолактоном. Застосування БРА II у лікуванні реноваскулярної АГ на сьогодні ґрунтується на меншій доказовій базі, їх ефективність ще має бути підтверджена в спеціально спланованих клінічних дослідженнях (клас рекомендацій I, рівень доказовості В). Найбільш ефективними комбінаціями для інгібіторів АПФ і БРА II вважають їх застосування в комбінації з діуретиками та/або блокаторами кальцієвих каналів.
При проведенні тривалої антигіпертензивної терапії у хворих з підтвердженим діагнозом реноваскулярна АГ важливо розуміти, що навіть при адекватному контролі рівня АТ наявність існуючого неусунутого стенозу неухильно веде до прогресуючого зниження функції нирки та її зморщування, а при відсутності належного контролю рівня АТ, особливо у хворих зі злоякісним перебігом АГ, призводить до розвитку нефросклерозу в контралатеральній нирці і до наступних серцево-судинних та інших ускладнень. Очікувальна тактика в таких випадках невиправдана: показане направлення у спеціалізовані центри для визначення оптимального способу усунення стенозу ниркової артерії.
Прямим показанням як до внутрішньосудинної, так і хірургічної корекції реноваскулярної АГ є діагностований, гемодинамічно і функціонально значимий стеноз ниркової артерії (>50%).
Для корекції стенозу проводять різні реконструктивні втручання і операції, вид яких визначається етіологією і поширеністю ураження ниркових артерій, черевної аорти та інших її гілок. При визначенні показань до внутрішньосудинного і хірургічного лікування враховують ряд клінічних факторів: наявність супутньої патології, у першу чергу ступінь ураження серцево-судинної системи, ураження коронарних судин, функціональний стан обох нирок, тривалість існуючої АГ. Протипоказаннями до проведення реконструктивних судинних втручань є термінальна стадія ниркової недостатності і наявність порушень мозкового або коронарного кровообігу протягом останніх 3 міс. Внутрішньосудинне або хірургічне втручання у хворих з неспецифічним аортоартеріїтом слід проводити у фазі лабораторної і морфологічної ремісії не раніше ніж через 3 міс після нормалізації лабораторних показників.
Стійкий антигіпертензивний ефект після втручання залежно від етіології захворювання досягається у 30–80% пацієнтів. Водночас повну нормалізацію АТ відзначають тільки у 25–50% хворих. Проведення реваскуляризації крім власне антигіпертензивного ефекту дозволяє досягти стабілізації функції нирок і зменшення кількості та/або зниження дози антигіпертензивних препаратів, необхідних для досягнення ефективного контролю над рівнем АТ. У віддалений термін після внутрішньосудинного або хірургічного втручання у 10–25% хворих виявляють рецидив реноваскулярної АГ, зумовлений прогресуючим перебігом основного захворювання і розвитком рестенозів ниркової артерії в зоні проведеної ангіопластики або розвитком «свіжих» стенозів або оклюзій іншої ділянки ниркової артерії, що вимагає повторного ендоваскулярного або хірургічного втручання.
З метою усунення стенозу і нормалізації кровопостачання нирок в останні 15 років найбільш широко використовується ендоваскулярна балонна дилатація — розширення стенозованої ділянки ниркової артерії за допомогою дилатаційних балонних катетерів. На сьогодні найчастіше застосовують ангіопластику в комбінації зі стентуванням ураженої артерії (клас рекомендацій IIА, рівень доказовості В). Переваги цього методу — низька травматичність, менша тривалість перебування хворого у стаціонарі, можливість застосування у тяжкого контингенту хворих, зокрема у осіб похилого віку при наростаючій нирковій недостатності (клас рекомендацій IIА, рівень доказовості В), дихальній недостатності, у пацієнтів із нестабільною стенокардією (клас рекомендацій IIА, рівень доказовості В), ХСН (клас рекомендацій I, рівень доказовості В), при кризовому перебігу АГ. Впровадження стентування порівняно зі звичайною ангіопластикою дозволило підвищити ефективність процедури реваскуляризації, забезпечити кращі віддалені результати прохідності артерії і знизити частоту рестенозування. Ефективність цього методу лікування не залежить від віку і статі пацієнтів.
Застосування ангіопластики та стентування ниркових артерій призводить до нормалізації АТ або поліпшення перебігу АГ у переважної більшості (>90%) хворих з ФМД у період спостереження до 3 років. Проте тільки 50% таких пацієнтів можуть повністю відмовитися від прийому антигіпертензивних препаратів (Mansoor G., 2004). Крім того, за цей же період у 8–25% випадків розвивається рестеноз в області раніше виконаної ангіопластики з рецидивом реноваскулярної АГ, що вимагає проведення повторних рентгенхірургічних втручань.
У хворих з атеросклеротичним ураженням ниркових судин ефективність внутрішньосудинних втручань значно нижча: поліпшення стану хворих відзначають у 50–60% випадків, можливість повністю припинити прийом антигіпертензивних засобів — менше ніж у 10% хворих (Morganti A., 2000). Метааналіз досліджень ефективності стентування ниркових артерій при атеросклеротичному ураженні продемонстрував високу результативність самої процедури (98%) і прийнятну частоту розвитку рестенозів (17%) (Leertouwer T. і співавт., 2000). Пряме порівняння ефективності інтервенційних підходів і ізольованого медикаментозного лікування підтвердило переваги стратегії реваскуляризації в покращанні контролю рівня АТ, попередженні розвитку ниркової недостатності.
Ефективність хірургічної реваскуляризації при стенозах ниркових артерій досить висока — нормалізація ниркової перфузії досягається у 97% випадків. Проте в останні роки відзначають значне звуження показань до проведення реваскуляризації хірургічним шляхом. Це зумовлене розвитком внутрішньосудинних інтервенційних технологій, поліпшенням результатів медикаментозного лікування. Пряме порівняння результатів традиційної хірургічної та внутрішньосудинної балонної реваскуляризації у хворих з реноваскулярною АГ з атеросклеротичним ураженням, проведене H. Weibull і співавторами (1993), не виявило переваг хірургічного методу над внутрішньосудинним втручанням протягом 2 років спостереження. Таким чином, автори рекомендували проводити балонну ангіопластику хворим, у яких проводиться вибір між внутрішньосудинним втручанням і традиційним хірургічним методом лікування.
У Рекомендаціях АCC і AHA 2005 р. (ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease) чітко визначені сучасні показання для проведення хірургічного лікування стенотичного ураження ниркових артерій: повномасштабне хірургічне втручання показане хворим з ФМД при наявності складних судинних уражень із залученням сегментарних артерій і наявністю макроаневризм (клас рекомендацій I, рівень доказовості В), у хворих із множинним атеросклеротичним ураженням артерій малого калібру або початкових відділів основної ниркової артерії (клас рекомендацій I, рівень доказовості В), у хворих з атеросклеротичним ураженням при необхідності проведення реконструктивних втручань на аорті (клас рекомендацій I, рівень доказовості С). Тип хірургічної операції (ендартеректомія, шунтування або більш складні реконструктивні ангіопластичні втручання) визначається типом і обсягом ураження судин, станом аорти і тяжкістю стану хворого.
Важливим моментом є ухвалення рішення про проведення нефректомії. Нефректомію виконують тільки у тих випадках, коли проведення реконструктивних операцій уже недоцільне: при необоротному ураженні або ішемічній атрофії нирки. Її клінічними ознаками є зменшення розмірів нирки <5 см, уражена нирка забезпечує <10% загальної ниркової функції, наявність ознак розповсюдженого кортикального інфаркту нирки.
Після будь-яких ендоваскулярних або хірургічних втручань на ниркових артеріях хворим з реноваскулярною АГ слід перебувати на диспансерному спостереженні з регулярним контролем АТ і прохідності зони реконструкції артерії (методом УЗД, МРТ та іншими неінвазивними методами діагностики). За їх даними в ході динамічного спостереження проводиться комплексна антигіпертензивна та гіполіпідемічна терапія, корекція супутніх факторів ризику серцево-судинних ускладнень. Крім забезпечення антигіпертензивного ефекту, комплексна медикаментозна терапія реноваскулярної АГ передбачає необхідність впливу на основний патогенетичний процес при визначенні етіології АГ. Терапія реноваскулярної АГ атеросклеротичної етіології включає застосування гіполіпідемічних препаратів (статинів) і ацетилсаліцилової кислоти в низьких дозах. Є дані про те, що тривалий прийом статинів при атеросклеротичному ураженні судин нирок забезпечує нефропротекторний ефект у цієї категорії хворих. Протизапальна терапія при реноваскулярній АГ на фоні неспецифічного аортоартеріїту повинна бути спрямована на пригнічення активності запального процесу та його профілактику. З цією метою застосовують ГКС і цитостатики. При виявленні розшаровуючої аневризми черевного відділу аорти хворого в екстреному порядку необхідно направити в спеціалізований центр судинної хірургії для проведення необхідного лікування.
ЛІТЕРАТУРА
- Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2008) Київ, 80 с.
- Руководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
- Функція нирок у хворих з артеріальною гіпертензією: методи дослідження та стратегія корекції порушень. Методичні рекомендації МОЗ та АМН України (2006) Київ, 38 с.
- Чихладзе Н.М., Чазова И.Е. (2006) Симптоматические артериальные гипертонии. Диагностика и лечение. Вазоренальная артериальная гипертония. Болезни сердца и сосудов, 3: 30–34.
- 1999 WHO — ISH guidelines for the management of hypertension (1999) J. Hypertension, 11: 905–916.
- 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertension, 21: 1011–1053.
- 2007 European Society of Hypertension — European Society of Cardiology Guidelines for the management of arterial hypertension (2007) J. Hypertension, 25: 1105–1187.
- ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic). A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) (2006) Circulation, 113: 463–654.
- Canzanello V.J. (2004) Medical management of renovascular hypertension. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, р. 91–107.
- Mansoor G. (2004) Interventional treatments for renal artery stenosis. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, р. 83–90.
- Meyers K., Sharma N. (2007) Fibromuscular dysplasia in children and adolescents. Cath. Lab. Digest., 15: 1 & 11–13.
- National Kidney Foudation. Kidney Disease Outcomes Quality Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease (2004) Am. J. Kidney Dis., 43(5 Suppl. 1): 1–290.
- Stanley J.C., Ernst C.B., Fry W.J. (1984) Renovascular hypertension. W.B. Saunders Co., Philadelphia/London/Toronto/Mexico/Rio de Janeiro/Sydney/Tokyo, 384 p.
- Thavarajah S., White W. (2004) Diagnostic evaluation for patients with endovascular hypertension. In Secondary Hypertension ed. G.A. Mansoor. Humana Press, Totowa, New Jersy, 63–82.
- The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service. NIH Publication No. 03-5233 (2003), 34 p.
СИМПТОМАТИЧНІ АГ ЕНДОКРИННОГО ПОХОДЖЕННЯ
Визначення
Причиною підвищення АТ при цих формах симптоматичної (вторинної) АГ є патологія ендокринної системи. Поява нових методів діагностики і лікування протягом останніх 20 років значно розширили можливості медицини в цьому напрямку.
Слід підкреслити, що у більшості випадків ендокринних АГ прогноз для життя хворого визначається розвитком серцево-судинних ускладнень, однак звичайне застосування антигіпертензивних препаратів у більшості випадків не дозволяє стабілізувати стан хворого та попередити виникнення ускладнень.
Своєчасне хірургічне втручання при деяких нозологічних формах ендокринних АГ дозволяє досягти нормалізації АТ і відмовитися від постійного прийому антигіпертензивних засобів у частини хворих. У більшості випадків для досягнення успіху необхідна чітка послідовна робота цілої команди клінічних фахівців. Потенційна курабельність ендокринних АГ вимагає чіткого розуміння своєї ролі на кожному етапі ведення таких пацієнтів.
З позицій доказової медицини слід зазначити, що дотепер у хворих з ендокринними АГ не проведено жодного рандомізованого дослідження, яке б могло стати основою для тих або інших рекомендацій. Терапевтичні підходи у таких хворих базуються на ретроспективному аналізі, думці експертів і власному досвіді.
Епідеміологія
Як ми вже відзначали, АГ є найпоширенішим хронічним захворюванням у світі і значною мірою визначає високий рівень смертності та інвалідності від серцево-судинних і цереброваскулярних захворювань. Частка ендокринної АГ у популяції хворих з підвищеним АТ за даними різних дослідників становить 0,2–1%, а частка ендокринної АГ серед усіх випадків симптоматичної (вторинної) АГ — близько 15%. За даними відділення симптоматичної артеріальної гіпертензії Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска», з 3495 первинних хворих, обстежених за період з 1994 по 2003 р., частота ендокринних форм АГ склала 3%. Серед усіх форм вторинної АГ ендокринні склали 11%. У загальній популяції хворих з АГ, наприклад на прийомі у дільничного (сімейного) лікаря, їх частка буде значно нижчою. Але й 1% хворих з ендокринними формами АГ — це десятки й сотні тисяч пацієнтів в Україні, яких потенційно можна вилікувати від цієї недуги.
Класифікація
Виділяють симптоматичну АГ при наступних ендокринних захворюваннях:
- феохромоцитома;
- первинний мінералокортицизм, у тому числі:
а) первинний гіперальдостеронізм (синдром Кона);
б) дезоксикортикостеронпродукуючі пухлини надниркової залози;
в) адреногенітальний синдром/вроджена адреналова гіперплазія;
- гіперкортицизм (синдром Кушинга);
- акромегалія;
- гіперпаратиреоз;
- гіпер- і гіпотиреоз;
- первинний гіперренінізм;
- ендотелінпродукуючі пухлини.
Феохромоцитома
Феохромоцитома являє собою катехоламінпродукуючу пухлину з нейроектодермальної тканини, яка у 85% випадків локалізується в мозковій частині надниркової залози і у 15% хворих — екстраадренально, переважно в грудному або черевному відділі симпатичного стовбура. Дуже рідко пухлина може локалізуватися в серці, сечовому міхурі, передміхуровій і підшлунковій залозі, яєчниках. Приблизно у 10% хворих феохромоцитома має спадковий характер з аутосомно-домінантним типом передачі. Феохромоцитома — переважно доброякісна пухлина, однак приблизно в 10% випадків відзначається її злоякісне переродження. У таких випадках пухлина може метастазувати. У ⅔ випадків клітини пухлини секретують адреналін і норадреналін, а в ⅓ випадків — тільки норадреналін. У випадку злоякісного переродження пухлина здатна секретувати допамін. Як правило, не існує залежності між розміром пухлини та рівнем гормональної активності. Є деякі супутні спадкові захворювання, при яких феохромоцитому виявляють набагато частіше: множинна ендокринна неоплазма, нейрофіброматоз, ангіоматоз сітківки і мозку (хвороба Хіппеля — Ліндау).
Поширеність феохромоцитоми серед хворих з АГ, за даними різних дослідників, варіює від 0,04 до 2% (у середньому близько 0,1%). З 3495 первинних хворих із вторинною АГ, госпіталізованих у відділення симптоматичної артеріальної гіпертензії Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» з 1994 по 2003 р., діагноз «феохромоцитома», підтверджений гістологічно після оперативного лікування, встановлений у 0,3% випадків.
Часто основним симптомом захворювання є пароксизмальна і/або стійка АГ і пов’язана з нею клінічна симптоматика. Потовиділення, головний біль, тахікардія, ортостатичні порушення, тремор, порушення зору, раптова блідість або гіперемія шкіри, нудота/блювання, відчуття страху та інші симптоми можуть виникати пароксизмально або бути присутніми постійно. Нечасто АГ може мати безсимптомний перебіг, при цьому основними скаргами стають симптоми росту пухлини: біль у животі або грудній клітці, відчуття наповнення або розпирання, ознаки здавлювання інших органів. Приблизно у ⅓ пацієнтів відзначають пароксизмальне або стійке підвищення концентрації глюкози в крові та сечі. Нерідко виявляють зменшення маси тіла. Нечасто на фоні катехоламінового ураження серця (токсична кардіоміопатія) розвиваються аритмії та симптоми СН. Частота виявлення основних симптомів при феохромоцитомі представлена в табл. 2.13. Підставою для підозри на феохромоцитому є виявлення характерної «гіпертензивної тріади»: АГ, гіперглікемії та гіперметаболізму (без гіпертиреозу).
Таблиця 2.13
Частота основних клінічних симптомів при феохромоцитомі (Stimpel M., 1995)
| Симптом | Частота, % |
| АГ:
— стійка — стійка + пароксизмальна — пароксизмальна |
>90 |
| 60 | |
| 50 | |
| <30 | |
| Головний біль | 80 |
| Ортостатичні порушення | 60 |
| Підвищене потовиділення | 65 |
| Тахікардія | 60 |
| Нервозність, підвищена збудливість | 45 |
| Блідість шкірних покривів | 45 |
| Тремор | 35 |
| Біль у животі | 15 |
| Порушення зору | 15 |
Через мозаїчність клінічної картини при феохромоцитомі діагноз не може бути встановлений тільки на підставі клінічних проявів хвороби. Важливим кроком у встановленні діагнозу є виявлення біохімічних ознак гіперпродукції катехоламінів. Катехоламіни частково метаболізуються у самій пухлині або в печінці і виводяться через нирки у вигляді сполучень ванілілміндальної кислоти, метильованих метаболітів (метанефринів) або вільних катехоламінів. Визначення рівня катехоламінів і їх метаболітів (ванілілміндальної кислоти і метанефринів) у добовій сечі належить до стандартних діагностичних процедур при підозрі на феохромоцитому. Хворим, яких направляють на такий аналіз, необхідно за певний час до його проведення відмінити лікарські засоби, які пригнічують або збільшують ексрецію катехоламінів (блокатори адренорецепторів, адреноміметики, у тому числі центральної дії, інгібітори МАО та ін.). Додаткове значення в діагностиці має визначення продуктів метаболізму катехоламінів після гіпертензивного кризу, причому можна порівняти їх базальний добовий рівень і підвищення його на фоні кризу. Виявлення патологічного підвищення рівня катехоламінів у плазмі крові має додаткове діагностичне значення, але воно має сенс лише при заборі крові через венозний катетер, який встановлений за 30–60 хв до забору крові за умови, що пацієнт весь цей час перебував у стані спокою. Інші умови можуть призвести, з одного боку, до появи псевдопозитивних результатів, а з другого — додаткових діагностичних витрат.
Якщо визначення вмісту катехоламінів не дозволяє встановити діагноз, використовують функціональні тести із пригніченням або стимуляцією секреції катехоламінів. Секреція катехоламінів у фізіологічних умовах пригнічується під впливом клонідину. На практиці можна використовувати тест із визначенням вмісту катехоламінів у плазмі крові до і протягом 3 год після прийому клонідину в дозі 0,15–0,3 мг. Простіший у використанні тест із визначенням нічної супресії секреції катехоламінів під впливом клонідину. У здорових осіб або у хворих з есенціальною АГ під впливом клонідину відзначають значне зниження вмісту катехоламінів у сечі, зібраній за нічний період. У той самий час секреція катехоламінів феохромоцитомою не пригнічується під впливом клонідину.
Нечасто з великою обережністю застосовують стимуляційні тести з гістаміном, тираміном або краще всього — із глюкагоном. При їх проведенні у хворих з феохромоцитомою відзначають значне підвищення рівня АТ і рівня катехоламінів (у кілька разів). Для попередження критичного підвищення АТ пацієнтові попередньо дають блокатори α-адренорецепторів або антагоністи кальцію. Їх призначення не впливає на підвищення секреції катехоламінів.
Важливим етапом підтвердження діагнозу «феохромоцитома» є проведення візуалізуючих процедур: КТ та/або МРТ. Візуалізація пухлин при їх локалізації в наднирковій залозі, як правило, труднощів не викликає. Найчастіше навіть за допомогою УЗД надниркової залози можна виявити певні структурні зміни і потім підтвердити наявність пухлини при КТ або МРТ. Виявлення пухлин екстраадреналової локалізації значною мірою залежить від досвіду лікаря, а часто відбувається випадково. За допомогою візуалізуючих процедур виявляють до 95% феохромоцитом розміром >1 см при їх локалізації у наднирковій залозі та <2 см — при абдомінальній локалізації.
Для додаткового виявлення феохромоцитоми може бути рекомендована сцинтиграфія з міченим 131I-метайодбензилгуанідином після попередньої блокади щитовидної залози. Деякі дослідники навіть при виявленні феохромоцитоми методами візуалізації (КТ, МРТ) рекомендують проведення сцинтиграфії інших ділянок тіла для виключення наявності інших катехоламінпродукуючих пухлин в організмі.
Високоспецифічним методом підтвердження наявності феохромоцитоми є визначення підвищеного рівня катехоламінів у крові, взятої з відповідних гілок нижньої порожнистої вени. При наявності пухлини концентрація катехоламінів у витікаючій з місця локалізації пухлини крові в кілька разів вища, ніж в інших місцях. Незважаючи на досить високу діагностичну точність методу, він застосовується лише в нечастих складних випадках через інвазивність, складність виконання і можливий ризик для хворого. Формалізований діагностичний алгоритм при підозрі на феохромоцитому наведений на рис. 2.8.
Рис. 2.8. Діагностичний алгоритм при феохромоцитомі
Хірургічне лікування обов’язкове при відсутності протипоказань для проведення операції. В останні роки частіше застосовують лапароскопічний доступ, який зменшує травматичність операції для хворого та скорочує строки госпіталізації. Ефективність хірургічного втручання при феохромоцитомі дуже висока: у більше ніж 90% хворих відзначають нормалізацію або стійке зниження АТ. Нечасто виявляють рецидиви пухлини або феохромоцитоми іншої локалізації. Лікування їх повинно проводитися також хірургічним шляхом. Якщо пухлину неможливо видалити хірургічним шляхом, то застосовують променеву і хіміотерапію, особливо при метастазуванні. Опромінення та застосування цитостатиків призводить до зменшення розміру і зниження активності пухлини, що відповідно супроводжується поліпшенням стану хворих.
Для медикаментозного контролю АТ застосовують блокатори α-адренорецепторів (празозин, доксазозин та інші), у разі необхідності і при кризах — внутрішньовенно (фентоламін). Можливе досягнення хорошого ефекту при застосуванні комбінації або комбінованих блокаторів α- і β-адренорецепторів (лабеталол, карведилол). Використання чистих неселективних блокаторів β-адренорецепторів недоцільне, оскільки може призвести до підвищення АТ. Серед інших антигіпертензивних препаратів слід зазначити антагоністи кальцію і препарати центральної дії (клонідин, агоністи імідазолінових рецепторів). За останні роки з’явилися повідомлення про успішне застосування блокатора синтезу допаміну — метилтирозину. Препарат на ранніх стадіях синтезу блокує утворення катехоламінів, що дозволяє успішно контролювати АТ і належним чином підготувати хворого до операції. Застосування препарату рекомендоване Європейським товариством гіпертензії (2003).
При проведенні анестезії слід уникати застосування фентанілу і дроперидолу, які можуть стимулювати додаткову секрецію катехоламінів. Рекомендують ретельне моніторування функції серцево-судинної системи під час введення в наркоз, операції та першої доби після операції: можливий розвиток як гіпертензивних, так і гіпотензивних станів, тяжких аритмій. Важливе значення надають заміщенню об’єму рідини для запобігання гіповолемії. Через 2 тиж після операції рекомендується перевірити рівень катехоламнів у сечі.
Первинний мінералокортицизм
Первинний мінералокортицизм — термін, під яким поєднують ряд ендокринних порушень, асоційованих з АГ і ендогенною гіперпродукцією альдостерону або мінералокортикоїдів і продуктів їх біосинтезу. До первинного мінералокортицизму належать первинний альдостеронізм, дезоксикортикостеронпродукуючі пухлини надниркової залози і адреногенітальний синдром/вроджена адреналова гіперплазія. Загальною ознакою для мінералокортикоїдасоційованої АГ є гіпокаліємія різного ступеня вираженості.
Первинний альдостеронізм характеризується автономною (незалежної від інших причин) гіперпродукцією альдостерону залозистою зоною надниркової залози. Його слід відрізняти від вторинних альдостеронізмів, які є наслідком підвищення вмісту реніну, часто реактивного характеру. Близько 75% усіх випадків первинного альдостеронізму становить аденома надниркової залози (синдром Кона), рідко виявляють карциному надниркової залози, а також первинну одно- і двобічну гіперплазію надниркової залози і дексаметазон-супресивну (що піддається лікуванню ГКС) гіперплазію.
Уперше клінічні прояви первинного мінералокортицизму описав американський ендокринолог J.W. Conn у 1955 р. у 34-річної жінки з високим АТ. За даними літератури синдром Кона виявляють у 0,5–1% хворих з АГ. У жінок відзначають майже вдвічі частіше, ніж у чоловіків. За даними відділення симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска», серед 3495 первинних хворих, які перебували у відділенні протягом 1994–2003 рр., діагноз «первинний альдостеронізм», підтверджений гістологічним дослідженням після операції, встановлений у 0,3% хворих.
Протягом останнього десятиріччя завдяки широкому використанню граничного значення співвідношення альдостерон/активність реніну плазми крові >30 у якості дігностичного критерію первинного альдостеронізму частота виявлення захворювання за даними різних дослідників досягає 5–10% у популяції пацієнтів з підвищеним АТ і до 25% серед хворих з рефрактерною АГ.
Патогенез захворювання включає підвищення реабсорбції натрію в дистальних канальцях і заміну ним калію та іонів водню. Вважають, що однією із причин АГ при цьому є збільшення внутрішньосудинного об’єму крові. Серед інших причин розглядають центральні механізми, пов’язані з впливом альдостерону на мозкові центри регуляції серцево-судинної системи, секрецію вазоконстрикторних субстанцій, а також ряд периферичних: прямий вазоконстрикторний ефект альдостерону, накопичення натрію в стінці резистивних артерій з підвищенням чутливості до пресорних агентів і т.п. Втрата калію носить поступово прогресуючий характер, при цьому гіпернатріємію практично не відзначають.
Клінічні симптоми не носять специфічного характеру і практично не мають значення для диференційної діагностики (табл. 2.14).
Таблиця 2.14
Частота симптомів при первинному гіперальдостеронізмі
| Симптом | Частота виявлення, % |
| АГ | 100 |
| Гіпокаліємія | 90 |
| Зміни на ЕКГ | 80 |
| М’язова слабкість | 80 |
| Поліурія | 70 |
| Головний біль | 65 |
| Полідипсія | 45 |
| Парестезії | 25 |
| Порушення зору | 20 |
| Стомлюваність | 20 |
| Переміжні паралічі | 20 |
| Переміжна тетанія | 20 |
Симптоматика первинного альдостеронізму включає АГ, гіпокаліємію, метаболічний алкалоз і гіпоренінемію. Важливим етапом диференційної діагностики первинного гіперальдостеронізму є виключення станів, при яких існує інша (вторинна) причина активації РААС: нераціональне застосування салуретиків, кортикоїдних гормонів, проносних засобів, хвороби ШКТ і т.п. Наявність первинного гіперальдостеронізму слід завжди виключати при рефрактерній АГ, причому нормокаліємія автоматично не виключає гіперпродукцію альдостерону: приблизно у 20% хворих з первинним гіперальдостеронізмом гіпокаліємія проявляється тільки через кілька днів сольового навантаження (див. нижче).
Серед лабораторних тестів найбільш значимим є визначення рівня гормонів РААС. Важливою передумовою для проведення такого дослідження повинна стати ретельна підготовка хворого: бажано за 14 днів відмінити всі антигіпертензивні засоби, збалансувати дієту, забезпечити певний режим спокою, ретельно виконувати необхідні умови забору проб. На цей період хворих краще госпіталізувати. Визначення вмісту альдостерону і калію в плазмі крові, а також активності реніну плазми крові є стандартними процедурами діагностики. Можна доповнити ці дослідження визначенням концентрації або активності реніну плазми крові до і при необхідності після прийому 40 мг фуросеміду.
Особливе значення для діагнозу має визначення співвідношення вмісту альдостерону (нг/дл) й активності реніну плазми крові (нг/мл/год). Нормальне значення цього співвідношення повинно бути <20, діагностичним порогом є величина >30, а значення >50 має найвищу чутливість і специфічність. Підвищення діагностичного порога співвідношення дозволило забезпечити специфічність до 94% без істотного зниження чутливості. Відповідно до Рекомендацій Європейського товариства по гіпертензії і Європейського товариства кардіологів (2003) слід використовувати величину співвідношення >50 як абсолютний діагностичний критерій цієї патології незалежно від наявності інших симптомів, включаючи гіпокаліємію.
При сумнівному результаті дослідження доповнюють тестами з навантаженням сіллю або прийомом каптоприлу. Навантаження сіллю (150–200 ммоль натрію або 6–9 г солі на добу) призводить до підвищення ниркового калій/натрієвого обміну, який демаскує латентну гіпокаліємію. Навантаження сіллю підвищує специфічність визначення вмісту альдостерону в плазмі крові: тільки при вторинному гіперальдостеронізмі додаткове надходження натрію пригнічує секрецію альдостерону. Тест із прийомом 25 мг каптоприлу ґрунтується на пригніченні синтезу А II, внаслідок чого знижується АТ, а також рівень альдостерону у хворих з есенціальною та ренальною формами АГ. При первинному гіперальдостеронізмі змін рівня альдостерону не відзначають. Проба має високу чутливість і специфічність.
Присутність пухлини в області надниркової залози можна визначити за допомогою УЗД, але негативний його результат не може повністю виключити наявність аденоми або гіперплазії. Приблизно 20% пухлин мають розмір <1 см. Більш точні методи КТ або МРТ є найбільш важливими методами візуалізації при первинному гіперальдостеронізмі. Проведення однієї з цих діагностичних методик необхідне навіть при ультразвуковому виявленні змін структури надниркової залози. Найбільш інформативним методом для диференційної діагностики при первинному гіперальдостеронізмі є селективне визначення рівня альдостерону в крові з надниркових вен. Однобічне підвищення буде означати наявність однобічної аденоми, а двобічне — найчастіше дифузну гіперплазію обох надниркових залоз.
В останні роки, враховуючи широке впровадження в клінічну практику визначення співвідношення альдостерон/ренін, у спеціалізованих клініках перед проведенням хірургічного втручання рекомендують проведення цього тесту для підтвердження гормональної активності пухлини.
Дексаметазон-супресивна гіперплазія або форма первинного гіперальдостеронізму, що піддається лікуванню ГКС, є рідкісною формою спадкового захворювання з аутосомно-домінантним типом передачі і характеризується станом, коли симптоми альдостеронізму зникають при застосуванні ГКС у низьких дозах, наприклад дексаметазону. У хворих відзначають підвищену чутливість до альдостеронстимулювальної дії АКТГ. Показано, що причиною захворювання є аномальний ген, який виникає при нерівномірному розподілі хромосоми 8q, у результаті чого порушується порядок кодування альдостерон-синтази. В організмі це призводить до підвищення продукції альдостерону, а також конверсії кортизолу в гідрокси- і оксикортизол. Захворювання може бути діагностоване за допомогою молекулярно-генетичного аналізу, і при підвищенні доступності технологій у майбутньому тестування слід проводити всім хворим із сімейною формою первинного гіперальдостеронізму.
Дуже рідкісною формою первинного гіперальдостеронізму є так званий адреногенітальний синдром або вроджена гіперплазія надниркової залози, що складає групу захворювань, для яких характерний дефект ензимів стероїдного синтезу. АГ виникає при дефіциті 11β- або 17α-гідроксилази, при наявності яких відзначають накопичення активних проміжних продуктів мінералокортикоїдного синтезу. Перший тип супроводжується вірилізацією, при цьому часто відзначають вроджені зміни статевих органів: у хлопчиків — макрогенітосомія, у дівчаток — урогенітальний синус або гіпертрофія клітора. Другий тип, навпаки, — затримкою розвитку статевих органів і вторинних статевих ознак (псевдогермафродитизм).
Ще одним рідкісним захворюванням із цієї групи АГ є синдром Ліддла, описаний як спадкове захворювання з аутосомно-домінантним типом успадкування в 1963 р. У хворих відзначають всі ознаки гіперпродукції мінералокортикоїдів, але рівень альдостерону залишається нормальним. У крові не виявляється підвищення ні однієї з відомих мінералокортикоїдактивних субстанцій, а також призначення антагоністів або блокаторів синтезу альдостерону не призводить до зниження АТ. Спостереження показали, що застосування діуретиків, які пригнічують реабсорбцію натрію в дистальних канальцях (амілорид, тріамтерен), може нормалізувати АТ і гіпокаліємію. На сьогодні вважають, що захворювання є наслідком генетичного дефекту β- або γ-субодиниці натрієвого каналу епітелію, який призводить до активації каналу, підвищення реабсорбції натрію (підвищення АТ) і екскреції калію (гіпокаліємія).
Лікування первинного альдостеронізму залежить від його причини (табл. 2.15). Методом вибору для пацієнтів з однобічною аденомою або карциномою надниркової залози є хірургічне видалення пухлини. Консервативне лікування в таких випадках застосовують тільки при наявності протипоказань для операції. Хірургічне лікування також рекомендують хворим з однобічною гіперплазією. Застосовують бічний розріз або лапароскопічну техніку. Після адреналектомії, за даними різних авторів, нормалізацію АТ відзначають у 40–70% хворих. Застосування хірургічних підходів при двобічних ураженнях сприяє нормалізації АТ менше ніж у 20% хворих.
Таблиця 2.15
Лікування первинного гіперальдостеронізму
| Тип | Випадки, % | Лікування |
| Однобічна альдостеронпродукуюча аденома | 60–70 | Хірургічне |
| Двобічна гіперплазія | 20–30 | Медикаментозне |
| Однобічна гіперплазія | ≤1 | Хірургічне |
| Форма, що піддається лікуванню ГКС | <1 | Медикаментозне |
| Альдостеронпродукуюча карцинома | <1 | Хірургічне |
| Адреногенітальний синдром | <1 | Медикаментозне |
| Альдостеронпродукуюча ренінзалежна аденома | <1 | Хірургічне/медикаментозне |
Медикаментозне лікування включає призначення специфічного блокатора альдостерону — спіронолактону, а також калійзберігаючих діуретиків (амілориду, тріамтерену). Лікування спіронолактоном починають із високих доз (200–400 мг/добу), але після стабілізації АТ і корекції гіпокаліємії дозу можна значно знизити. Калійзберігаючі діуретики призначають у звичайних дозах. При стабільному рівні калію можна застосовувати тіазидні діуретики в низьких дозах.
Недостатній контроль АТ вимагає призначення іншого класу антигіпертензивних засобів: антагоністів кальцію тривалої дії. Кращий ефект дають дигідропіридинові препарати (ніфедипін, амлодипін). У хворих з двобічною гіперплазією надниркової залози хороший ефект дають інгібітори АПФ.
В останні роки в багатьох країнах зареєстрований новий селективний блокатор альдостеронових рецепторів — еплеренон. Його ефективність була доведена в клінічних випробуваннях при лікуванні хворих зі СН. Водночас досвід його застосування для лікування первинного альдостеронізму обмежений. Вважається раціональним використання цього препарату для лікування хворих, у яких відзначають побічні ефекти при застосуванні спіронолактону.
У пацієнтів з формою захворювання, яка піддається лікуванню ГКС, відзначають незадовільну відповідь на прийом звичайних антигіпертензивних засобів, однак призначення ГКС навіть у низьких дозах (краще дексаметазон у дозі 0,5–2 мг/добу) дає значний ефект уже протягом перших 2–4 днів. Для повної корекції АТ необхідно більше часу — кілька тижнів. Для запобігання побічних ефектів ГКС рекомендують їх комбінувати з калійзберігаючими діуретиками.
Гіперкортицизм
Гіперкортицизм може бути як залежним від гіперпродукції АКТГ, так і АКТГ-незалежним. Приблизно 65–80% випадків становлять хворі з підвищеною секрецією АКТГ і вторинною гіперплазією надниркової залози. При такому типі (центральному або хворобі Кушинга) підвищення виділення АКТГ є наслідком або порушень на рівні гіпоталамуса з підвищенням виділення кортикотропін-рилізинг-гормону, або наявності аденоми гіпофіза.
За даними деяких дослідників концепція хвороби Іценка — Кушинга включає первинну патологію лімбічної системи і ретикулярної формації, яка призводить до порушення нейронально-медіаторного контролю секреції рилізинг-факторів, у тому числі кортикотропін-рилізинг-гормону. Дуже рідко продукція АКТГ або кортикотропін-рилізинг-гормону може бути викликана ектопічно розміщеною пухлиною (наприклад дрібноклітинна бронхіальна карцинома, пухлини вилочкової залози, матки). Майже у 20% випадків гіперсекреція ГКС пов’язана з первинним процесом у наднирковій залозі (синдром Кушинга). Однобічний процес — це найчастіше або аденома, або карцинома. Двобічний процес — двобічна мікро- або макровузлова гіперплазія. Проте описані випадки двобічної аденоми. Сучасна класифікація гіперкортицизму представлена в табл. 2.16.
Таблиця 2.16
Класифікація гіперкортицизму (модифіковано з J.A. Whithworth, 2004)
| Тип захворювання | Частота виявлення, % |
| Спонтанний гіперкортицизм | |
| Хвороба Кушинга (пітуїтарний гіперкортицизм) | 65–67 |
| Ектопічна продукція АКТГ | 15% |
| Ектопічна продукція кортикотропін-рилізинг-гормону | Дуже рідко |
| Синдром Кушинга (адреналовий гіперкортицизм) | 9% |
| Карцинома надниркової залози | 8% |
| Гіперплазія надниркової залози | Рідко |
| Спадкові форми (синдроми Карні, МакКлурі — Олбрайта) | Рідко |
| Ятрогенний гіперкортицизм | |
| Прийом АКТГ | Рідко |
| Прийом ГКС | Найчастіше |
| Псевдосиндром Кушинга (алкогользалежний, депресія, ВІЛ-інфекція) | Рідко |
В Україні хвороба і синдром Кушинга називають Іценка — Кушинга на честь М.М. Іценка, який уперше описав клінічну картину цієї патології в 1924 р. За даними літератури хворобу відзначають у 0,1% серед усього населення, причому у 75–80% з них виявити пухлину дуже важко. Захворювання відзначають частіше у жінок, найчастіше віком 20–40 років. Серед 3495 первинних хворих із синдромом АГ, які були госпіталізовані у відділення симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» з 1994 по 2003 р., різні форми гіперкортицизму, підтверджені гістологічно після оперативного лікування, виявлені в 0,17% випадків.
АГ виникає приблизно у 80% пацієнтів з гіперкортицизмом. Патогенез АГ у пацієнтів з гіперкортицизмом мультифакторіальний:
- мінералокортикоїдні ефекти високого рівня кортизолу із затримкою натрію та води;
- підвищена секреція субстанцій з мінералокортикоїдною активністю;
- викликана кортизолом активація РААС;
- викликана кортизолом активація САС;
- підвищена чутливість гладком’язових клітин судин до вазопресорів;
- зниження продукції простаноїдів-вазодилататорів.
Хронічний вплив гіперсекреції ГКС призводить до типових змін зовнішності хворих — кушингоїдний тип ожиріння. Характерними ознаками є місяцеподібне обличчя з багрово-синім кольором щік, відкладання жиру в області шиї (шия бізона), тулуба, плечей, живота і стегон, при цьому гомілки і передпліччя залишаються худими й тонкими. На стегнах, животі, під пахвами з’являються характерні атрофічні смуги червоно-фіолетового кольору довжиною 15–20 см (striae rubra). На шкірі обличчя, спини, грудей виникає багато вугрів, петехій. Поступово зменшується м’язова маса, хворі сутуляться, втрачають поставу, виглядають дуже немічними. Часто відзначають гіпокаліємію. Прогресує остеопороз з больовим синдромом і можливими переломами кісток. У чоловіків з’являються ознаки демаскулінізації: порушується потенція, виникає гіпотрофія яєчок, сповільнюється ріст бороди і т.п. У жінок виявляють аменорею, атрофію молочних залоз, ознаки маскулінізації (борода, вуса, ріст волосся на лобку і грудях).
Зміни стосуються і психічного стану: втрачається інтерес до зовнішніх факторів, виникає апатія, сонливість, зниження інтелектуальних здібностей. Іноді виникають маніакальні або параноїдальні стани, галюцинації. Відомі випадки самогубств.
Найчастіше диференційний діагноз проводять зі звичайним ожирінням, яке нерідко супроводжує есенціальну АГ. Крім можливості впливу дієти і регулярних фізичних вправ при аліментарному ожирінні, значна роль у діагностиці належить лабораторним тестам. До вторинних лабораторних змін при гіперкортицизмі належать гіпокаліємія, метаболічний алкалоз, гіперліпідемія, гіперглікемія, еозинопенія.
Найбільш точним є визначення підвищеного рівня кортизолу в крові або в добовій сечі. Разове визначення в крові з негативним результатом не виключає діагнозу «гіперкотицизм» внаслідок значних фізіологічних коливань рівня гормону. У сечі рекомендують визначати вільний кортизол, а не рівень 17-кетостероїдів і 17-гідроксикетостероїдів. Дослідження необхідно провести мінімум у двох послідовних пробах сечі, що не є складним навіть для амбулаторних пацієнтів.
Крім простого визначення кортизолу, рекомендують проби з дексаметазоном. Призначення 1 мг дексаметазону на ніч пригнічує екскрецію кортизолу навіть у хворих з ожирінням. При синдромі Кушинга екзогенні ГКС не впливають на виділення кортизолу.
Низький рівень АКТГ у плазмі крові означає наявність первинного процесу в наднирковій залозі. Нормальний або дещо підвищений рівень АКТГ при негативному дексаметазоновому тесті буде означати, що причиною є АКТГ-залежний механізм (хвороба Кушинга або активація кортикотропін-залежних механізмів). У таких випадках можна застосувати тест із введенням 2–8 мг дексаметазону. АКТГ-залежна активація секреції пригнічується введенням високих доз ГКС, тоді як ектопічна — не змінюється. За даними літератури чутливість і специфічність дексаметазонового тесту для поділу АКТГ-залежного і АКТГ-незалежного типу гіперкортицизму становила близько 81 і 67% відповідно.
Також для диференціації центрального і ектопічного вогнищ застосовують тест зі стимуляцією кортикотропін-рилізинг-гормоном. Після введення 100 мкг гормону при хворобі Кушинга відзначають підвищення вмісту АКТГ і кортизолу. При ектопічній пухлині їх рівень не змінюється. Деякі автори пропонують проводити цей тест із забором крові з нижнього кам’янистого синуса (sinus petrosus inferior). Якщо концентрація АКТГ у крові із синуса буде як мінімум в 3 рази вища, ніж у периферичній вені, то гіпофізарна локалізація пухлини не викликає сумніву. Проведення такого білатерального тесту може допомогти визначити місце локалізації пухлини. Необхідно підкреслити, що подібні маніпуляції повинні виконуватися у спеціальних центрах досвідченими лікарями.
Чітка візуалізація пухлини і її структури є основою для проведення хірургічного лікування. Діагноз «первинний гіперкортицизм» (синдром Кушинга) підтверджують за допомогою візуалізуючих процедур КТ або МРТ. При хворобі Кушинга вважають, що наявність мікроаденоми діаметром ≥5 мм у гіпофізі, є незаперечним доказом її наявності. Найбільш чутливим методом у таких випадках є МРТ. У випадках ектопічної локалізації рекомендують дуже ретельно, послідовно за допомогою візуалізуючих методів вивчити стан грудної та черевної порожнини. Слід пам’ятати, що такі пухлини можуть бути дуже малі за розміром, незважаючи на їх високу гормональну активність.
Прогноз захворювання при відсутності лікування, як правило, вкрай несприятливий — 5-річна виживаність становить 50%. Основною причиною смерті є серцево-судинні ускладнення. Особливо несприятливий прогноз при злоякісних формах пухлини.
Радикальним лікуванням як хвороби, так і синдрому Кушинга, що гарантує тривалий ефект, є хірургічне видалення гормонально активної пухлини. Навіть однобічна адреналектомія при білатеральній гіперплазії надниркової залози поліпшує перебіг захворювання. Радикальне хірургічне лікування необхідне і при ектопічно розміщених гормонально активних пухлинах. Для поліпшення результатів хірургічне лікування комбінують із променевою терапією.
Розвиток хірургічної техніки селективного видалення аденом гіпофіза радикально змінив результати лікування таких пацієнтів. Зазвичай використовують транссфеноїдальний доступ, який дозволяє мінімізувати травматичність операції. Оперативне лікування в таких випадках проводиться в нейрохірургічних відділеннях. Частота повного вилікування за даними кращих світових клінік становить >80%.
Фармакологічне лікування гіперкотицизму дуже обмежене і може включати 3 напрямки:
- модуляція секреції АКТГ;
- модуляція секреції ГКС;
- модуляція клітинних ефектів ГКС.
Для модуляції секреції АКТГ можна застосовувати ципрогептадин, бромокриптин, соматостатин.
Для пригнічення секреції ГКС: кетоконазол, мітотан, аміноглутетимід, метирапон. Для блокування ГКС-рецепторів запропонований мифепристон. Деякі дослідники у випадку позитивної відповіді організму пропонують призначати дексаметазон у низьких дозах — 0,25–0,75 мг/добу. Ефективність більшості з перерахованих лікарських засобів, на жаль, не виходить за рамки обмежених досліджень і не знайшла широкої підтримки медичної громадськості.
Для лікування АГ при гіперкортицизмі пропонують спіронолактон у звичайних терапевтичних дозах, калійзберігаючі діуретики, інгібітори АПФ, селективні блокатори β-адренорецепторів у звичайних дозах. Необхідно уникати застосування препаратів, які можуть спровокувати метаболічні та електролітні розлади. Слід пам’ятати, що медикаментозна терапія у цьому випадку є тільки тимчасовим етапом перед радикальним хірургічним втручанням.
Акромегалія
Гіперпродукція гормону росту перед закриттям епіфізарних пластинок (зон росту) призводить до гігантизму, а після закінчення періоду росту — до акромегалії. Майже у всіх випадках причиною гіперпродукції гормону росту є аденома гіпофіза. АГ серед пацієнтів з акромегалією виявляють приблизно в 40–50%, що частіше, ніж у загальній популяції. Причиною АГ вважають затримку натрію під впливом високої концентрації гормону росту. При цьому не існує прямої залежності між ступенем підвищення АТ і рівнем гормону росту. Значна ГЛШ, яку часто виявляють при акромегалії, пояснюється більшою мірою гормональним впливом, ніж ступенем підвищення АТ.
Зовнішні клінічні ознаки акромегалії досить характерні, що дозволяє запідозрити наявність хвороби навіть лікареві-новачкові: масивна нижня щелепа, надбрівні дуги, ніс, вуха, значно збільшені кисті та стопи, кістки. У випадках з менш вираженою симптоматикою доцільно порівняти фотографії пацієнта в більш молодому віці або фото близьких родичів. Для встановлення остаточного діагнозу необхідно провести визначення рівня гормону росту в плазмі крові, а також ІФР. Вміст гормону росту в крові значно коливається, але у здорових осіб ніколи не перевищує 10 мкг/л. Для акромегалії також характерно, що високий рівень гормону росту не знижується після прийому 100 г глюкози (супресивний тест).
Рівень серцево-судинних ускладнень у пацієнтів з акромегалією залишається дуже високим — смертність досягає 100% протягом 15 років. Агресивна антигіпертензивна терапія є головним чинником, що позитивно впливає на тривалість життя таких пацієнтів. Принципи медикаментозної терапії АГ при акромегалії не відрізняються від загальноприйнятих рекомендацій: застосовують будь-які препарати першого ряду або їх комбінації. Успішне радикальне лікування основного захворювання (видалення пухлини гіпофіза) приведе до зниження або нормалізації АТ у більшості хворих. Після видалення пухлини вміст гормону росту знижується на 50–90%. За даними літератури 10-річна смертність після успішної операції становила 7%, відносний ризик порівняно з загальною популяцією — 1,17.
Показано, що короткочасне застосування аналога соматостатину — октреотиду пригнічує секрецію гормону росту і знижує АТ. На фоні такого лікування відзначають зменшення розмірів пухлини та значне зменшення вираженості клінічних симптомів. Але тривалі результати такого лікування на сьогодні залишаються невивченими. За даними деяких дослідників застосування бромокриптину може привести до нормалізації рівня гормону росту приблизно у 20% пацієнтів з акромегалією. Таке лікування також супроводжується зниженням рівня АТ.
Гіперпаратиреоз
Первинний гіперпаратиреоз — захворювання, яке характеризується первинним підвищенням секреції паратгормону. Найчастіше причиною захворювання є аденома або гіперплазія паращитовидної залози. АГ відзначають приблизно у 70% хворих з первинним гіперпаратиреозом. Вторинний гіперпаратиреоз виникає при ХНН, надмірному споживанні вітаміну D, кальцію, зниженні рівня фосфатів і т.п. Наявність АГ у комбінації з гіперкальціємією завжди повинна спонукати лікаря до думки про гіперпаратиреоз — захворювання, яке відзначають у хворих з АГ приблизно у 10 разів частіше, ніж у популяції в цілому, і яке залишається у більшості випадків недіагностованим. У ряді випадків гіперпаратиреоз є одним із синдромів множинної ендокринної неоплазми.
Патогенез гіперпаратиреозу відзначається порушенням обміну кальцію та фосфору внаслідок надмірної продукції паратиреоїдного гормону. При цьому захворюванні відзначають посилене вимивання кальцію з кісток, підвищення вмісту кальцію в крові і його виділення із сечею, зниження вмісту фосфору внаслідок зниження його реабсорбції з первинної сечі. Підвищений вміст кальцію та фосфору в сечі призводить до утворення конкрементів у сечовивідних шляхах. У кістках внаслідок вимивання кальцію відзначають заміщення кісткової тканини сполучною.
Ситуація з патогенезом АГ виглядає дещо парадоксальною, тому що при одноразовому внутрішньовенному введенні паратгормону відзначають вазодилататорний і антигіпертензивний ефект. Формування АГ при цьому пов’язують із кількома факторами: гіперкальціємією, порушенням функції нирок при тривалому перебігу захворювання, можливою додатковою продукцією так званого паратиреоїдного гіпертензивного фактора — гормону, який продукується паратиреоїдною залозою одночасно з паратгормоном, активацією РААС. Ще одним механізмом, доведеним експериментально, вважають втрату чутливості гладком’язових клітин судин до внутрішніх вазодилататорних агентів на фоні тривалого впливу високих концентрацій паратгормону. Наскільки ці механізми реалізуються через зміни трансмембранного транспорту та внутрішньоклітинної концентрації кальцію на сьогодні не відомо. Крім того, експериментально доведено, що хронічне введення паратгормону призводить до підвищення секреції АКТГ і відповідно глюко- і мінералокортикоїдів.
Симптоми захворювання неспецифічні. Клінічними проявами захворювання часто стають симптоми з боку нирок (сечокам’яна хвороба, вторинний пієлонефрит, ниркова недостатність) і кісток (больовий синдром, переломи). Відповідно до переважаючих симптомів виділяють 2 форми захворювання: ниркову й кісткову. Як наслідок ренального ефекту високої концентрації паратгормону можуть відзначати порушення електролітного балансу: гіперфосфатемію, гіперфосфатурію, гіперкальціурію, гіпохлоремію, гіпокаліємію. При рентгенологічному дослідженні відзначають симптоми генералізованого остеопорозу. Підвищення АТ виявляють вже на початкових стадіях захворювання. Ураження органів-мішеней відзначають раніше, ніж при есенціальній АГ.
Діагноз «гіперпаратиреоз» вважають достовірним при наявності підвищеної концентрації паратиреоїдного гормону в крові в комбінації з гіперкальціємією. Нормальний рівень паратгормону — 10–70 пг/мл, причому верхня границя підвищується з віком.
Зазвичай паращитовидна залоза може бути візуалізована за допомогою УЗД. При сумнівній картині проводять томографію і сцинтиграфію.
Хірургічне лікування є безпечним і ефективним: повне одужання відзначають більше ніж у 90% випадків. АТ нормалізується після операції за різним даними у 20–100% хворих. Медикаментозне лікування АГ у пацієнтів з гіперпаратиреозом проводять згідно з загальними принципами лікування АГ.
Гіпер- і гіпотиреоз
Гіпертиреоз або тиреотоксикоз є наслідком гіперпродукції тиреоїдних гормонів, що призводить до підвищення серцевого викиду, ЧСС, показників скоротливої здатності міокарда. Наслідками тиреотоксикозу також є збільшення ОЦК, зниження ЗПСО. Частота АГ при тиреотоксикозі становить близько 40%. Домінує систолічна АГ внаслідок вищезгаданих гемодинамічних змін. Більшість серцево-судинних симптомів при тиреотоксикозі — прояви активації САС, хоча вміст адреналіну нормальний або дещо знижений, що пояснюється збільшенням щільності та чутливості β-рецепторів під впливом тиреоїдних гормонів.
За даними відділення симптоматичних артеріальних гіпертензій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска», серед 3495 первинних хворих, які перебували у відділенні протягом 1994–2003 рр., ураження щитовидної залози діагностоване у 5,2%, при цьому в більшості з них — 4% виявлений гіпертиреоз. Безумовно, епідеміологічні дані будуть різними як у різних географічних регіонах, так і в різних за профілем медичних установах.
Діагноз захворювання підтверджують визначенням рівня гормонів щитовидної залози в крові — тироксину (Т4) і трийодтироніну (Т3). Скринінговим методом виявлення пацієнтів із порушенням функції щитовидної залози є визначення вмісту тиреотропного гормону в крові. При його нормальному вмісті, як правило, функція щитовидної залози не порушена, при підвищеному — функція знижена, а при зниженому — функція підвищена. У табл. 2.17 наведені основні зміни серцево-судинної та ендокринної систем при гіпер- і гіпотиреозі.
Таблиця 2.17
Ендокринні і серцево-судинні зміни при захворюваннях щитовидної залози (адаптовано з Y. Shenker, 2003)
| Функціональні параметри | Гіпертиреоз | Гіпотиреоз |
| Вміст катехоламінів у крові | Нормальний або знижений | Підвищений |
| Щільність β-адренорецепторів | Підвищена | Знижена |
| Активність реніну плазми крові | Підвищена | Знижена |
| Вміст альдостерону в крові | Підвищений | Знижений |
| ОЦК | Підвищений | Знижений |
| Серцевий викид | Підвищений | Знижений |
| ЧСС | Підвищена | Знижена |
| ЗПСО | Знижений | Підвищений |
Вибір тактики лікування тиреотоксикозу залежить від його причини і його деталізація може стати предметом іншої монографії. Говорячи про антигіпертензивну терапію, слід зазначити, що лікування гіпертиреозу і відновлення еутиреоїдного стану, як правило, призводить до нормалізації АТ. Наведені патогенетичні механізми АГ визначають найбільш ефективну симптоматичну антигіпертензивну терапію у таких хворих — прийом блокаторів β-адренорецепторів. Застосовують як селективні, так і неселективні препарати. В ряді досліджень було показано, що неселективні блокатори β-адренорецепторів можуть знижувати синтез Т3 і Т4. Важливо, що при призначенні блокаторів β-адренорецепторів зменшується кількість аритмій, а при постійній формі фібриляції передсердь досягається ефективний контроль ЧСС, а іноді відновлюється синусовий ритм.
Для контролю АТ можна застосовувати недигідропіридинові антагоністи кальцію, які сповільнюють ЧСС. Призначення діуретиків добре потенціює ефект обох зазначених груп препаратів. У ряді випадків хороший ефект відзначають при застосуванні препаратів центральної дії внаслідок їх седативного ефекту. Небажано використовувати дигідропіридинові антагоністи кальцію та блокатори α-адренорецепторів, тому що можливе посилення тахікардії. При вираженій ГЛШ призначають інгібітори АПФ або БРА II.
Гіпотиреоз або мікседема є наслідком зниження секреції або доступності тиреоїдних гормонів для тканин організму. Гемодинамічно гіпотиреоз характеризується низьким серцевим викидом, зниженням ЧСС, підвищенням ЗПСО, зменшенням ОЦК. Підвищення АТ відзначають у 30–50% пацієнтів з гіпотиреозом.
Виникнення АГ пов’язують зі значною активацією САС. Рівень адреналіну і норадреналіну в крові підвищений, особливо при наявності АГ. Певну патогенетичну роль у формуванні АГ пов’язують зі зниженням щільності β-адренорецепторів, що сприяє додатковій відносній стимуляції α-адренорецепторів і призводить до периферичної вазоконстрикції. Деякі дослідники вважають підвищення ЗПСО елементом компенсації: підвищення перфузійного тиску у відповідь на зниження серцевого викиду.
Клінічні симптоми гіпотиреозу у дорослих включають сонливість, загальну й м’язову слабкість, сухість шкіри та слизових оболонок, збільшення маси тіла, облисіння, зниження ментальних функцій, появу характерних набряків. Синдром АГ у більшості пацієнтів з гіпотиреозом характеризується підвищенням ДАТ. САТ підвищується значно менше. Вважають, що тяжкість гіпотиреозу корелює зі ступенем підвищення ДАТ. Часто відзначається синусова брадикардія. Вважають, що внаслідок супутніх порушень ліпідного обміну при гіпотиреозі існують додаткові умови для швидкого прогресування атеросклерозу.
Підтвердженням гипотиреозу є визначення низького рівня тиреоїдних гормонів у крові. Важливо визначати загальний вміст гормонів, їх вільної форми і співвідношення. У 10–15% хворих можуть діагностувати нормальний або субнормальний рівень гормонів у крові. У таких випадках додатковим заходом є визначення тиреотропного гормону. При мікседемі його концентрація значно підвищена.
Лікування гіпотиреозу включає замісну терапію гормонами щитовидної залози (їх синтетичними аналогами). Досягнення еутиреоїдного стану в більшості випадків призводить до нормалізації АТ. У хворих похилого віку та при значній тривалості АГ динаміка АТ менш позитивна, і виникає необхідність у додатковому призначенні антигіпертензивних препаратів. Лікування АГ рекомендують починати з препаратів у низьких дозах. Перевагу віддають засобам з периферичним вазодилататорним ефектом: інгібіторам АПФ, дигідропіридиновим антагоністам кальцію і блокаторам α-адренорецепторів у звичайних дозах. Діуретики можна призначати для посилення ефекту інших засобів.
Первинний ренінізм
Ізольовану гіперпродукцію реніну із вторинним гіперальдостеронізмом як причину АГ відзначають дуже рідко: у світі описано не більше 50 випадків цього захворювання. Більшість із них являли собою гормонально активні пухлини всередині нирок. Гістологічною основою є юкстагломерулярні пухлини, гемангіоперицитоми, гамартоми, пухлини Вільмса і рак нирки. Ектопічну продукцію реніну можуть відзначати при ракових захворюваннях печінки, підшлункової залози, яєчників, бронхів.
Основою діагнозу є виключення інших станів, які можуть супроводжуватися значним підвищенням рівня реніну і прореніну в крові. Диференційний діагноз «первинний ренінізм» слід проводити при вторинному гіперальдостеронізмі з ознаками гіпокаліємії і АГ, який часто пояснюють терапією діуретиками, стенозом ниркової артерії, феохромоцитомою, полікістозом нирок. Основним методом лікування є хірургічне видалення гормонально активної пухлини. Ефективний контроль АТ може бути досягнуться при призначенні препаратів, які блокують активність РААС — інгібіторів АПФ і БРА. Останнім часом у клінічну практику впроваджують селективний блокатор реніну — аліскірен. Є відомості про його успішне призначення при есенціальній АГ. Водночас даних про його ефективне застосування при первинному ренінізмі в доступній літературі не зафіксовано.
Ендотелінпродукуючі пухлини
Ендотелін-1 являє собою поліпептид з дуже сильним вазоконстрикторним ефектом, який у нормальних умовах синтезується і виділяється ендотеліальними клітинами. Ендотелін-1 при взаємодії з його антагоністом оксидом азоту відіграє важливу роль у процесах локальної ауторегуляції кровообігу, судинних процесів і т.п. Значна частка ефектів ендотеліну-1 і його участь у фізіологічних і патологічних реакціях є предметом найбільш сучасних експериментальних і клінічних досліджень. На сьогодні достеменно відомо про можливість виникнення специфічної форми АГ, пов’язаної з наявністю ендотелінпродукуючих пухлин. Описано кілька випадків гемангіоендотеліоми, яка виробляла ендотелін-1, що супроводжувалося значним стійким підвищенням АТ. Після видалення пухлини відзначали нормалізацію АТ і вмісту ендотеліну-1 у плазмі крові.
Висновок
Таким чином, своєчасна діагностика та правильне лікування ендокринних форм АГ можуть призвести до стійкої нормалізації АТ без регулярного прийому антигіпертензивних препаратів, що найчастіше може бути розцінено як повне одужання.
ЛІТЕРАТУРА
- Арабидзе Г.Г. (1982) Симптоматические артериальные гипертензии. Руководство по кардиологии. Медицина, Москва, 4: 65–100.
- Бобров В.А., Давыдова И.В. (2003) Симптоматические гипертензии. Руководство для врачей. Четверта хвиля, Киев, 256 с.
- Рекомендації Української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії (2008) Київ, 80 с.
- Руководство по артериальной гипертонии (2005) Под ред. Е.И. Чазова, И.Е. Чазовой. Медиа медика, Москва, 784 с.
- Сіренко Ю.М., Маньковський Б.М. (2004) Артеріальні гіпертензії при ендокринних захворюваннях. Четверта хвиля, Київ, 165 с.
- 2003 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension (2003) J. Hypertension, 21: 1011–1053.
- 2007 Guidelines for the management of arterial hypertension. J. Hypertension, 25: 1105–1187.
- Laragh J.H., Brenner B.M. (1995) Hypertension. Raven Press, New York, 3219 p.
- Martin S.A., Mynderse L.A., Lager D.J. et al. (2001) Juxtaglomerular cell tumors: a clinicopathologic study of four cases and review of literature. Am. J. Clin. Pathol., 116: 854–863.
- Mayet J., Coats A.S. (1998) Diagnosis and investigation of essential and secondary hypertension. Eur. Heart J., 19: 372–377.
- Secondary Hypertension. Clinical Presentation, Diagnosis, and Treatment. (2004) Edited by G.A. Mansoor. Humana Press, Totowa, New Jersy, 352 p.
- Shapiro L.M., Buchalter M. (1991) A colour atlas of hypertension. Wolfe Publishing Ltd., London, 159 p.
- Stimpel M. (1996) Arterial hypertension. Walter de Gruyter, Berlin — New York, 356 p.