Однією з актуальних проблем сучасної кардіології залишається своєчасний прогноз електричної нестабільності міокарда, що є ключовим при прогнозуванні розвитку потенційно небезпечних аритмій. Впровадження комп’ютерних технологій, сучасних методів цифрової обробки ЕКГ-сигналу зумовили розробку і все більш широке використання в повсякденній клінічній практиці комп’ютерних ЕКГ-систем.
Сучасний розвиток комп’ютерних технологій дав можливість проводити аналіз ЕКГ-сигналу на якісно більш високому рівні, що відкрило нові можливості в діагностиці кардіологічної патології. Особливо актуально це при виявленні електричної нестабільності міокарда, діагностиці загрозливих для життя порушень ритму і ризику раптової серцевої смерті. Дані проспективних досліджень показали, що за останні два десятиріччя загальна частота раптової серцевої смерті, незважаючи на застосування нових методів діагностики і профілактики, істотно не змінилася і становить близько 20–25% усіх випадків гострих серцевих нападів. В абсолютній більшості випадків механізмом виникнення раптової серцевої смерті є розвиток шлуночкових тахіаритмій. Проблема раптової серцевої смерті ускладнюється ще й тим, що летальні аритмії можуть виникати при відсутності гострої ішемії і виражених функціональних та анатомічних змін, хоча часто поєднуються з ними. Виділення предикторів електричної нестабільності міокарда, розробка способів виявлення груп хворих із високим ризиком аритмічних подій — основні шляхи зниження частоти раптової серцевої смерті. Значну роль у вирішенні цієї проблеми відводять методам аналізу ЕКГ-сигналу з використанням електронно-обчислювальної техніки.
В останні роки все більший розвиток отримує ЕКГ високого розрізнення (ЕКГ ВР) — метод дослідження, що дозволяє за допомогою комп’ютерної обробки ЕКГ-сигналу реєструвати низькоамплітудні високочастотні сигнали, невидимі на звичайній ЕКГ.
Широке застосування знайшло виявлення так званих ППШ і ППП за допомогою спеціальної методики запису ЕКГ. Ця методика передбачає фільтрацію сигналу, посилення його в десятки тисяч разів і виділення з нього корисної інформації за допомогою методу усереднення.
Реєстрація сигналів із поверхні тіла розширює можливості використання методу ЕКГ ВР у клінічній практиці. Це зумовлено тим, що на сьогодні відсутні абсолютно надійні тести для прогнозування надшлуночкових порушень ритму, хоча фібриляція/тріпотіння передсердь вважаються найпоширенішими формами порушення ритму серця і відзначаються в 0,4% випадків серед дорослого населення. Їх поширеність підвищується з віком, і у осіб віком старше 60 років доходить до 2–10% випадків.
ЕЛЕКТРОФІЗІОЛОГІЧНІ ОСНОВИ ППШ І ППП
Електрофізіологічний субстрат ППШ являє собою зони міокарда з низькоамплітудною, фрагментованою, сповільненою активністю і затримкою шлуночкової деполяризації, які отримали назву «аритмогенний субстрат», є анатомічною основою для запуску шлуночкових тахіаритмій за механізмом re-entry.
На сьогодні вважається, що переважна більшість шлуночкових тахіаритмій виникає за механізмом повторного входу хвилі збудження. Для розвитку цього феномену необхідний ряд умов. Головне — це сповільнення швидкості проведення збудження в певній ділянці міокарда. Проте одного лише сповільненого проведення недостатньо для виникнення аритмії. Необхідна також фрагментація електричної активності, що виникає в ділянках, де м̓язові волокна розділені сполучною тканиною. Найчастіше такі ділянки виявляються на межах зон ІМ, де острівці життєздатної тканини чергуються з вогнищами фіброзу. Отже, зони неоднорідності тканини призводять до фрагментації електричних сигналів і сповільненого поширення деполяризації, а реєстрація ППШ свідчить про наявність цих зон у міокарді. Оскільки при записі усередненої ЕКГ ці зони міокарда реєструються у вигляді низькоамплітудних сплесків активності наприкінці шлуночкового комплексу або виникають на початку сегмента SТ, вони і отримали свою назву — ППШ.
В останні роки вчені звернулися до проблеми пошуку маркерів субстрату фібриляції передсердь, передсердної тахікардії. У більшості проведених досліджень виявлено, що дійсно у пацієнтів із пароксизмальною формою фібриляції передсердь відзначають низькоамплітудні сигнали наприкінці зубця Р, так звані ППП, які відображають наявність сповільненої фрагментованої деполяризації передсердь і є маркерами фізіологічного субстрату таких надшлуночкових тахіаритмій, як фібриляція передсердь і пароксизмальна передсердна тахікардія, що розвиваються за механізмом re-entry.
МЕТОДИ РЕЄСТРАЦІЇ ППШ І ППП
Неінвазивна реєстрація ППШ і ППП з поверхні тіла пов’язана з рядом труднощів, зокрема з тим, що їх амплітуда є значно меншою, ніж амплітуда шумів від різних зовнішніх джерел. Навіть при прямому записі з поверхні тіла вона дуже невисока і тому на звичайній ЕКГ ППШ і ППП не реєструються. Проте їх можна зафіксувати, використовуючи методику усередненої ЕКГ ВР. Ця методика передбачає посилення ЕКГ-сигналу щонайменше в 20–50 тис. разів з подальшим поділом (фільтрацією) «корисних» високочастотних компонентів сигналу ЕКГ, низькочастотних його складових і позасерцевої електричної активності, тобто шумів. Шуми мають як мінімум три джерела: фізіологічний шум внаслідок активації скелетної мускулатури, електронний шум підсилювачів, які використовуються при реєстрації ЕКГ ВР, і фоновий (мережевий) шум. Головна проблема полягає в тому, що при посиленні сигналу разом з підвищенням амплітуди «корисних» сигналів відзначають ріст рівня шуму, тому виникає необхідність застосування методів для його усунення.
Основним способом усунення шуму, крім використання екранованого кабелю та безшумових вхідних передпосилювачів, є застосування методу комп’ютерного усереднення сигналу. Цей метод дозволяє відокремити сигнали від шумів шляхом істотного поліпшення співвідношення сигнал/шум. Оскільки шуми є випадковими сплесками, то при усередненні вони не синхронізуються з досліджуваним сигналом і тому від комплексу до комплексу накладаються хаотично (випадково), що призводить до істотного зниження їх амплітуди. У той же час «корисний» сигнал, на відміну від шумів, повторюється з певним інтервалом (тобто не хаотично), тому при усередненні його амплітуда стабілізується і зростає, збільшуючи таким чином співвідношення сигнал/шум. Величина шуму взаємозалежна з кількістю усереднених комплексів. Нагромадження 100 серцевих циклів знижує рівень шуму в 10 разів. Відповідно до міжнародних рекомендацій методика ЕКГ ВР передбачає реєстрацію та аналіз від 100 до 400 ЕКГ-комплексів.
При реєстрації ППШ необхідним є також усунення низькочастотних компонентів сигналу, які виникають при дихальних коливаннях. Для цього застосовують спеціальні двонаправлені чотириполюсні фільтри Баттерворта в діапазонах 25–250 і 40–250 Гц.
Ще однією умовою для усереднення сигналу є ідентичність (подібність) досліджуваних шлуночкових комплексів. При цьому важливим є відкидання передчасних порушень і досить «зашумлених» сигналів. Вирішують цю проблему таким способом: за еталон приймають перші 8 комплексів після початку усереднення у випадку, якщо середнє стандартне відхилення сигналу <20 мкВ. Інші порушення порівнюються з еталоном і автоматично відкидаються електронно-обчислювальною машиною, якщо величина погрішності більша, ніж подвійне стандартне відхилення порівняно з еталоном.
Особливості проведення імпульсу по передсердям, що виражають в поздовжньому напрямку просування передсердної активності (а не трансмуральної, як при активації шлуночків), а також у накладанні потенціалів пучка Гіса, що відповідають за часом ізоелектричному простору між кінцем зубця Р і комплексом QRS, ускладнюють виявлення сповільненої фракціонованої активності передсердь.
Устаткування, необхідне для реєстрації і аналізу ЕКГ ВР, включає триканальний електрокардіограф, що повинен бути підключений до персональної ЕОМ за допомогою апаратного блоку. Цей блок складається зі смугових фільтрів, тригерного пристрою, масштабних підсилювачів, аналого-цифрового перетворювача і плато інтерфейсу для введення сигналу в комп’ютер. Складові частини пристрою з’єднуються між собою оптоволоконною лінією зв’язку.
АНАЛІЗ ЕКГ ВР
При дослідженні ЕКГ ВР розрізняють часові, амплітудні і частотні параметри сигналу. У зв’язку з цим виділяють три підходи до виявлення зон сповільненої деполяризації: часову, спектральну і спектрально-часову. На сьогодні найпоширенішим є метод часового аналізу ППШ і ППП, оскільки найбільші величини чутливості і специфічності, а також найбільш високі значення відтворюваності більшість авторів отримали, використовуючи саме часовий метод аналізу усередненої ЕКГ. Для реєстрації ППШ і ППП ЕКГ-сигнал записується в трьох ортогональних відведеннях за Франком (Х, Y, Z). Після посилення і фільтрації цей сигнал комбінується для одержання векторної величини: –√XІ+YІ+ZІ, що називається «відфільтрований комплекс QRS». Далі за допомогою автоматичного алгоритму виводяться кількісні показники ППШ і ППП. До уваги приймаються наступні параметри:
- тривалість відфільтрованого комплексу QRSf QRSd;
- тривалість низькоамплітудних (<40 мкВ) сигналів у термінальній частині (останні 40 мс) відфільтрованого шлуночкового комплексу — LAS40;
- середньоквадратична амплітуда коливань в останні 40 мс комплексу QRS (RMS40).
ППШ при застосуванні фільтра 40–250 Гц констатують за такими критеріями: QRSf >114 мс, LAS >38 мс, RMS <20 мкВ. Виявлення як мінімум двох із трьох вищезгаданих показників свідчить про наявність ППШ.
При використанні фільтра 25–250 Гц, за даними більшості авторів, критеріями ППШ є QRSf >120 мс, LAS >38 мс, RMS <25 мкВ.
До часових параметрів відфільтрованого зубця Р належать наступні показники:
- Тривалість відфільтрованого зубця Р (FiР);
- Різниця між тривалістю відфільтрованого та невідфільтрованого зубця Р (FiР— Un FiР);
- Тривалість сигналів <5 мкВ (D5).
Амплітудні параметри ППП — це середньоквадратична амплітуда (RMS):
- Усього зубця Р (RMSP);
- Останніх 10–20–30 мс (Last 10–20–30 або RMS 10–20–30 ).
Найчастіше використовується показник RMS 20.
Сучасне програмне забезпечення методу ЕКГ ВР дозволяє встановлювати режими усереднення кардіоциклів із синхронізацією за зубцями Р, Q, R. При аналізі ППП режим усереднення із синхронізацією за зубцями Р має ряд переваг порівняно з режимом усереднення та синхронізацією за зубцем R. Помилки і неточності, що неминуче виникають і призводять до послаблення корисного сигналу наприкінці зубця Р при усередненні і синхронізації за зубцем R, є результатом, з одного боку, мінливості інтервалу P–Q від циклу до циклу, з іншого — неможливості виключення з процесу усереднення ектопічних передсердних комплексів, які нерідко мають місце у пацієнтів із надшлуночковими тахіаритміями.
Характеристики FiР також залежать від смуги пропускання частот фільтра, що застосовується. При використанні фільтра з діапазоном пропускання частот в 20–30 Гц виникають труднощі у визначенні термінальної частини сигналу зубця Р через їх перекриття сигналами зубця R. У той же час при застосуванні фільтрів у 60–80 Гц сигнали FiР наближаються до сигналів стандартної ЕКГ. Вважається, що використання високочастотних фільтрів у 40 Гц є оптимальним у цій методиці для ідентифікації пацієнтів із пароксизмальною формою фібриляції передсердь. Значно змінюють показники ЕКГ ВР з виділення ППП типи застосовуваних фільтрів (двонаправлені, вперед- або назаднаправлені). Н. Ozawa і співавтори у своєму повідомленні приходять до висновку, що двонаправлені фільтри кращі, ніж інші, оскільки відображають справжню тривалість FiР. При цьому одержуване значення часових характеристик FiР менше, ніж при використанні вперед- і назаднаправлених фільтрів.
На рис. 6.1 представлений приклад наявності ознак ППП при аналізі зубця Р.
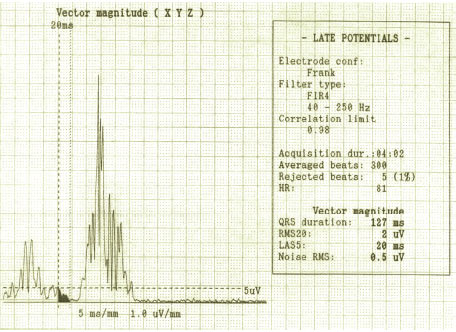
Рис. 6.1. Приклад наявності ознак ППП при аналізі зубця Р
ІМ І ППШ
У здорових людей ППШ реєструють у 0–6% випадків. Поява ППШ у пацієнтів із гострим ІМ залежить від часу, що пройшов від початку захворювання, локалізації зони некрозу та методів лікування. Дані про вираженість ППШ у гострій фазі ІМ суперечливі. ППШ у цей період характеризуються вираженою нестабільністю. За даними різних авторів вони реєструвалися в 20–60% випадків, але більше ніж у половини пацієнтів пізніше відзначали нормалізацію параметрів ЕКГ ВР і зникнення ППШ. Нестійкий характер ППШ у гострій фазі ІМ свідчить про те, що вони відображають скоріше ступінь вираженості ішемії, ніж наявність аритмогенного субстрату, необхідного для виникнення шлуночкових тахіаритмій.
Найчастіше ППШ реєструються в період між 6–30-м днем захворювання. Надалі частота виявлення ППШ повільно знижується. Так, за даними Й. Кіспаг і співавторів, серед пацієнтів з ІМ на момент виписки зі стаціонару ППШ реєструвалися у 82%, через 1 рік — у 61%, а через 5 років — лише у 48%. Проте у пацієнтів зі стійкою шлуночковою тахікардією ППШ не зникали. За даними ряду авторів частота виявлення ППШ останнім часом знижується, що пояснюється більш широким використанням тромболітичної терапії і балонної ангіопластики. Проте реєстрація ППШ залишається незалежним фактором ризику розвитку шлуночкових тахіаритмій. Це ствердження отримало право на життя після того, як був доведений безумовний зв’язок між ППШ і загрозою розвитку небезпечних шлуночкових порушень ритму. Тому сьогодні рекомендовано проводити реєстрацію ЕКГ ВР з метою виявлення ППШ усім хворим, що перенесли ІМ.
У хворих після гострого ІМ зі стійкою шлуночковою тахікардією, індукованою під час ЕФД серця, ППШ фіксувалися у 80–100% випадків. У пацієнтів із постінфарктним кардіосклерозом наявність ППШ також корелює з виникненням спонтанних шлуночкових тахікардій. T.G. Turritto і співавтори вважають, що реєстрація патологічних параметрів усередненої ЕКГ — найбільш точний скринінг-метод для виявлення імовірності індукції шлуночкових тахікардій. Частота виникнення ППШ залежить від типу тахіаритмій. M. Simson і співавтори показали, що у пацієнтів із великовогнищевим ІМ при стійкій шлуночковій тахікардії ППШ реєструвалися в 91% випадків, а при фібриляції шлуночків тільки в 52%. За даними інших авторів при виникненні фібриляції шлуночків ППШ відзначали тільки в 12–18% випадків. R. Freedman і співавтори помітили, що частота виявлення ППШ майже в 3 рази вища у пацієнтів зі стійкою шлуночковою тахікардією, ніж при фібриляції шлуночків. Такі ж результати отримані при дослідженні хворих, успішно реанімованих після раптової зупинки серця. Ці результати свідчать про існування різних механізмів виникнення шлуночкової тахікардії і фібриляції шлуночків. Тому питання прогностичного значення ППШ щодо розвитку небезпечних для життя порушень ритму остаточно не вирішено. Безумовно, що висока прогностична значимість відсутності ППШ дозволяє з упевненістю віднести хворих з ІМ без ППШ до категорії низького ризику розвитку шлуночкової тахікардії та раптової серцевої смерті. У той же час низькі величини позитивної прогностичної значимості (10–35%) свідчать про велику кількість псевдопозитивних результатів. Не у всіх пацієнтів із порушеннями показників усередненої ЕКГ розвиваються шлуночкова тахікардія і фібриляція шлуночків, оскільки ППШ відображають лише зони сповільненого проведення імпульсу в міокарді, що є необхідною, але не завжди достатньою умовою для виникнення тахіаритмії за механізмом повторного входу. Тому для підвищення прогностичної значимості виявлення електричної нестабільності серця, крім ППШ, в останні роки рекомендується досліджувати варіабельність ритму серця, дисперсію Q–T-інтервалу та здатність індукування шлуночкової тахікардії/фібриляції шлуночків при проведенні програмованої стимуляції шлуночків.
У ряді досліджень проаналізований зв’язок ППШ з функцією ЛШ. Зареєстровано, що в міру погіршення функції ЛШ відзначають зростання частоти ППШ і їх тривалості. Це свідчить про те, що анатомічним субстратом ППШ є патологічно змінений міокард, а ППШ можна розглядати як своєрідний «місток» між електрофізіологічними порушеннями збудливості і провідності та механічних розладів.
Частота реєстрації ППШ залежить також від локалізації ІМ. При нижній локалізації ППШ реєструються вірогідно частіше. Це пов’язано з нерівномірністю проходження збудження в міокарді: нижньобазальні ділянки виходять з електричного збудження останніми, що полегшує реєстрацію ППШ, якщо вони виникають у цих ділянках. Міжшлуночкова перегородка та передня стінка активуються раніше, тому ППШ при наявності аритмогенного субстрату в цих зонах можуть з’являтися ще до закінчення шлуночкового комплексу і маскуватися ним.
ЗВ’ЯЗОК МІЖ РЕВАСКУЛЯРИЗАЦІЄЮ МІОКАРДА І ППШ
Останнім часом багато уваги приділяється впливу тромболітичної терапії і ангіопластики зі стентуванням при ІМ на шлуночкові тахіаритмії і виявлення ППШ. Дані більшості досліджень показали, що при тромболітичній терапії ППШ реєструються в середньому в 2–3 рази рідше порівняно з пацієнтами, у яких ця терапія не проводилася. При цьому ППШ частіше відзначали при збереженій коронарній оклюзії (у 37–80%), у той час як у випадках успішного відновлення коронарної перфузії вони фіксувалися набагато рідше (16–25%). Таким чином, повторні реєстрації ЕКГ ВР можуть бути ще одним неінвазивним маркером успішної реваскуляризації, оскільки шлуночкові порушення ритму в перші 24 год від початку ІМ, згідно з сучасними поглядами, є ознакою реперфузії і не пов’язані з реєстрацією ППШ. Вважається, що коронарна оклюзія є незалежним чинником появи ППШ, а успішна реперфузія сприятливо впливає на аритмогенний субстрат, маркером якого є ППШ.
МИНУЩА ІШЕМІЯ МІОКАРДА І ППШ
Аналіз часових параметрів ЕКГ ВР під час гострої ішемії, викликаної проведенням транслюмінальної балонної коронарної ангіопластики, показав зниження амплітуди і збільшення тривалості високочастотних коливань (RMS і LAS) при незмінній величині тривалості фільтрованого шлуночкового комплексу (QRSf). При цьому минуща ішемія була причиною появи ППШ у 48% хворих. У той же час провокація ішемії міокарда за допомогою дозованих фізичних навантажень при здійсненні ВЕМ і тредмілергометрії, інфузії дипіридамолу або добутаміну не викликали появи ППШ як у хворих зі стенокардією, так і у пацієнтів після перенесеного ІМ.
Таким чином, питання про те, чи має прогностичне значення персистування ППШ внаслідок перехідної ішемії міокарда щодо виникнення шлуночкової тахікардії, на сьогодні залишається відкритим.
ЕКГ ВР І СИНКОПАЛЬНІ СТАНИ НЕВІДОМОЇ ЕТІОЛОГІЇ
Пацієнтів із синкопальними станами невідомої етіології часто направляють для проведення ЕФД з метою індукування стійких шлуночкових тахікардій і таким способом підтвердження аритмогенного генезу синкопальних станів. Виділення неінвазивних методів діагностики загрозливих для життя аритмій як безпосередньої причини синкопальних станів є надзвичайно важливим. Більші перспективи в цьому контексті належать ППШ як неінвазивним маркерам електричної нестабільності міокарда. У дослідженні D. Kuchar і співавторів (150 хворих із синкопальними станами) ППШ були виявлені у 16 з 22 пацієнтів зі шлуночковими тахікардіями (чутливість — 73%, специфічність — 89%). В інших дослідженнях також підтверджувалося, що наявність ППШ у хворих із синкопальними станами збігається зі стійкою шлуночковою тахікардією або її індукцією при проведенні ЕФД (позитивна прогностична точність коливалася в межах 40–83%, а негативна прогностична точність у всіх дослідженнях становила більш ніж 90%). Базуючись на цих даних, можна стверджувати, що ЕКГ ВР має високу цінність при обстеженні хворих із синкопальними станами, причиною яких є шлуночкові тахіаритмії. Особливе клінічне значення ППШ представляє їх висока негативна прогностична точність. Нормальні значення параметрів ЕКГ ВР у пацієнтів із синкопальними станами та низькою загрозою виникнення шлуночкової тахікардії, за даними інших методів діагностики (виявлення шлуночкової екстрасистолії високих градацій, подовженого Q–T-інтервалу, дисфункції ЛШ), свідчать про низьку імовірність аритмогенного генезу синкопальних станів. Але при виявленні ППШ загроза розвитку порушень ритму серця не завжди висока.
ППШ І ХВОРОБИ МІОКАРДА НЕІШЕМІЧНОГО ПОХОДЖЕННЯ
Клінічне значення ППШ найбільш глибоко досліджене при ІХС. Набагато менше уваги приділялося вивченню параметрів усередненої ЕКГ при інших серцево-судинних захворюваннях. Проте ряд досліджень показав, що ЕКГ ВР може бути корисною у виділенні групи ризику виникнення шлуночкових тахіаритмій серед пацієнтів із кардіоміопатіями. D. Roll і співавтори виявили, що у хворих із ДКМП 83% пацієнтів із шлуночковою тахікардією мали ППШ, у той час як серед осіб без порушень ритму серця ППШ реєструвалися лише в 14% випадків. За даними інших авторів частота виявлення ППШ при ДКМП коливається від 30 до 45%.
D. Manchini і співавтори відзначили, що виживаність хворих із кардіоміопатіями протягом року при відсутності ППШ була на рівні 95%, у той час як при їх наявності становила тільки 39%.
Реєстрація ППШ при ДКМП свідчить про можливості індукції шлуночкової тахікардії при проведенні ЕФД серця. Це підтверджується тісним кореляційним зв’язком між реєстрацією ППШ і шлуночковою тахікардією, індукованими при проведенні програмованої стимуляції серця.
Виявлення ППШ корелює з даними біопсії у хворих із ДКМП: вони присутні у випадках виражених дегенеративно-дистрофічних змін у міокарді, які супроводжуються значною дилатацією шлуночків.
У пацієнтів з ознаками ГКМП вірогідно частіше відзначали патологічне значення однієї з характеристик ЕКГ ВР — тривалості низькоамплітудної, фрагментованої активності, але прогностичне значення цього феномену остаточно не з’ясоване.
Частота фіксування ППШ при ГКМП становила за даними різних авторів 10–20%. Прогностична цінність ППШ щодо виявлення електричної нестабільності серця була відносно високою у хворих зі шлуночковою тахікардією (чутливість — 75%, специфічність — 62%) і набагато нижчою у пацієнтів із фібриляцією шлуночків (чутливість — 47%, специфічність — 23%).
Отже, наявність ППШ при ГКМП не є надійним предиктором шлуночкових тахіаритмій і ризику раптової серцевої смерті.
Ряд авторів виявили появу ППШ у пацієнтів із гіпертонічною хворобою (частота ППШ становила від 2 до 27% випадків). При цьому встановлено, що ППШ відзначають у 5% хворих без ГЛШ, у 13% — при наявності концентричної гіпертрофії і у 48% — з асиметричною гіпертрофією. Кореляція між ППШ і шлуночковою тахікардією виявлена лише у хворих при концентричній ГЛШ. Це свідчить про те, що у осіб з АГ ППШ більшою мірою є предикторами вираженості гіпертрофії, ніж шлуночкових порушень ритму серця. Тісна кореляція між ППШ і гіпертрофією міокарда пояснюється ростом маси міокарда, що приймає участь у деполяризації, а також збільшенням ділянок фіброзної тканини, що виникає при наявності у пацієнта АГ і викликає затримку активації міокарда.
Серед хворих з порушеннями шлуночкового ритму без клінічних проявів захворювань серця (пацієнти з так званими ідіопатичними шлуночковими тахікардіями) ППШ відзначали у 18–20% випадків. Реєстрація ППШ корелювала з патологічними результатами біопсії міокарда (надмірний розвиток фіброзу). При цьому констатовано, що ППШ не є досить чутливим маркером для прогнозування змін при біопсії міокарда (63%) і індукованості шлуночкової тахікардії під час ЕФД (37%), незважаючи на те, що мають високу специфічність (84 і 100% відповідно).
В окремих роботах вивчалися ППШ у хворих із вродженими вадами серця (особливо при вадах Фалло), гемодинамічно значимим пролапсом мітрального клапана, міокардитом, аритмогенною дисплазією ПШ. Проте в ці дослідження була включена невелика кількість хворих, що є недостатнім для вирішення питання про прогностичне значення ППШ при цих захворюваннях.
АНТИАРИТМІЧНІ ПРЕПАРАТИ І ППШ
Згідно з результатами більшості досліджень зміни параметрів ЕКГ ВР, які відзначають під впливом різних антиаритмічних засобів, не мають істотного значення в прогнозуванні ефективності лікування. Тільки в деяких роботах у невеликої кількості хворих показано, що поява ППШ або збільшення їх кількісних параметрів на фоні прийому антиаритмічних препаратів збігалося з більш легкою індукованістю шлуночкової тахікардії під час програмованої стимуляції шлуночків серця.
Антиаритмічні засоби, блокуючи іонні канали клітинних мембран серця, сповільнюють проведення електричних імпульсів і збільшують рефрактерність (крім препаратів IВ групи), що теоретично повинно викликати не зникнення ППШ, а навпаки, зростання частоти їх реєстрації. R. Freedman і співавтори показали, що застосування антиаритмічних засобів IА і особливо IС груп призводило до значного збільшення тривалості низькоамплітудних сигналів у кінцевій частині шлуночкового комплексу, пов’язаного з подовженням циклу індукованої шлуночкової тахікардії. При лікуванні флекаїнідом частота виявлення ППШ підвищувалася від 43 до 62%, при терапії пропафеноном — від 29 до 48%, тоді як при лікуванні мексилетином не змінювалися параметри усередненої ЕКГ.
Аміодарон і соталол мало впливають на показники ЕКГ ВР. За даними C. Hofman і співавторів у пацієнтів з наявністю шлуночкових екстрасистол високих градацій зміни параметрів усередненої ЕКГ, викликані дією аміодарону, не корелювали з ефективністю лікування. В інших дослідженнях показано, що у хворих з індукцією шлуночкової тахікардії під час ЕФД застосування аміодарону викликає появу ППШ.
Отже, зміни ЕКГ ВР на фоні антиаритмічної терапії не були пов’язані з її ефективністю, з’являлися незалежно від природи основного захворювання і клініко-анамнестичних даних і не дозволяли прогнозувати результати лікування.
АКШ, ХІРУРГІЧНЕ ЛІКУВАННЯ АРИТМІЙ І ППШ
Згідно з даними ряду досліджень після операції АКШ зникнення ППШ відзначали приблизно у 40–50% хворих. ППШ після АКШ реєстрували у пацієнтів із низькою ФВ і частою шлуночковою екстрасистолією, проте при проспективному спостереженні протягом 3 років випадки раптової смерті не фіксувалися, тому прогностичне значення ППШ у цього контингенту хворих залишається нез’ясованим.
Хірургічна деструкція аритмогенних зон призводить до зникнення ППШ. Крім того, нормалізація параметрів усередненої ЕКГ збігається з усуненням можливості повторної індукції шлуночкової тахікардії, тобто усереднена ЕКГ може бути корисною в прогнозуванні ефективності хірургічного лікування у пацієнтів з наявністю ППШ до операції. За даними N. Marcus і співавторів у 90% хворих із нормальними показниками ЕКГ ВР після лікування не вдалося запустити будь-який вид шлуночкової тахікардії під час ЕФД. З іншого боку, ряд досліджень показали, що у 85–100% пацієнтів, у яких стійка шлуночкова тахікардія залишалася і після хірургічного усунення аритмогенного вогнища, ППШ продовжували виявляти і в післяопераційний період. У той же час приблизно у половини хворих зі збереженими ППШ після лікування стійка шлуночкова тахікардія не індукувалася. Причина в тому, що реєстрація ППШ тісно пов’язана з величиною ділянок уповільненої деполяризації міокарда. Про це свідчить кореляція між низькоамплітудними сигналами поверхневої усередненої ЕКГ, з одного боку, кількістю ділянок уповільненої активації міокарда і її тривалістю за даними ендокардіального картування — з іншого. Персистування ППШ є доказом того, що в серці залишаються зони сповільненого проведення імпульсу і загроза аритмії остаточно не усунута.
Таким чином, незважаючи на ряд невирішених питань діагностичного та прогностичного значення ППШ, широке використання методики ЕКГ ВР у клінічній практиці дозволяє виявляти серед пацієнтів кардіологічного профілю осіб з високим ризиком розвитку небезпечних для життя шлуночкових порушень ритму та оптимізувати тактику їх лікування.
ІНФОРМАТИВНІСТЬ ПОКАЗНИКІВ ППП
Закордонні і вітчизняні автори виявили високу прогностичну цінність ЕКГ ВР в оцінці ризику виникнення пароксизмів фібриляції передсердь. Доведено, що ППП реєструють у 63–93% хворих з пароксизмами фібриляції передсердь.
Пропоновані в літературі значення показників ЕКГ ВР зубця Р для використання як критерії виявлення хворих із фібриляцією передсердь представлені в табл. 6.1.
Таблиця 6.1
Прогнозовані граничні значення показників ЕКГ ВР зубця Р для виявлення хворих із фібриляцією передсердь
|
Автори |
Рік |
Критерії |
Чутливість |
Специфічність |
|
G. Opolski |
1990 |
FiP >104 |
76 |
90 |
|
P. Marconi |
1991 |
FiP >130 |
68 |
92 |
|
M. Fukunami та співавтори |
1991 |
FiP >120 |
95 |
54 |
|
J. Stainberg |
1993 |
FiP >135 |
63 |
98 |
|
А.У. Елеуов |
1993 |
FiP >140 |
85 |
74 |
|
S. Guidera |
1993 |
FiP >155 |
80 |
93 |
|
Y. Abe |
1994 |
FiP >125 і RMS-20 <3,0 |
87 |
93 |
|
D. Kontoyannis та співавтори |
1995 |
FiP >120 |
90 |
84 |
|
P. Stafford |
1995 |
FiP >155 |
81 |
93 |
|
N. Gondo та співавтори |
1995 |
FiP >120 |
85 |
84 |
Таким чином, очевидний широкий розкид граничних величин, що пропонуються для виділення ППП. Це пов’язано з технічною недосконалістю методу та відсутністю єдиних методологічних підходів.
Незважаючи на те, що метод ЕКГ ВР використовують для визначення таких діагностичних показників, як ППШ і ППП, можливості його застосування в діагностичних цілях цим не обмежені. Дані, отримані при дослідженні за допомогою ЕКГ ВР зміни тривалості зубця Р і його дисперсії, відкривають нові діагностичні можливості. Як відомо, дисперсія зубця Р є маркером гетерогенного імпульсного проведення і може бути використана як ЕКГ-маркер для виявлення пацієнтів із фібриляцією передсердь, її обчислюють як різницю між максимальною та мінімальною тривалістю зубця Р.
За даними G. Villani і співавторів індекс дисперсії зубця Р при комбінації з показником тривалості відфільтрованого сигналу дозволяє значно підвищити чутливість і специфічність методу ЕКГ ВР при ідентифікації пацієнтів з високим ризиком розвитку пароксизмів фібриляції передсердь. Порівнювалися показники ЕКГ ВР — FiР, RMS 20 і Р-дисперсії (у відведеннях X, Y, Z) у 40 пацієнтів з пароксизмальною формою фібриляції передсердь і контрольною групою. У 1-й групі порівняно з контролем були вищими показники FiР (138 614 мс проти 120 612 мс; р<0,0005) і Р-дисперсії (862 мс проти 161 мс; р<0,0001). Показники RMS 20 не відрізнялися. Встановлено, що FiР і Р-дисперсія дозволяють ідентифікувати пацієнтів із високим ризиком розвитку пароксизмів фібриляції передсердь.
ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА ПОЯВУ ППП
Розглядаючи питання реєстрації ППП, слід враховувати можливість впливу на них ряду факторів, серед яких необхідно відзначити:
- перевантаження передсердь об’ємом і тиском;
- гіпертрофію передсердь і її ступінь;
- наявність або відсутність структурного захворювання серця;
- давність виникнення пароксизмів, їх тривалість і частоту;
- наявність синдрому слабкості синусного вузла.
При цьому зазначені аспекти недостатньо вивчені і потрібне проведення подальших досліджень. Крім того, мабуть, необхідно враховувати можливість накладання потенціалів пучка Гіса.
Розширенню передсердь, зокрема лівого, надається велике значення як факторові виникнення фібриляції/тріпотіння передсердь. Дійсно, вважається логічним, що чим значніші розміри передсердь, тим більше виражена зміна їх ультраструктури і, отже, підвищується ймовірність появи і частоти пароксизмів тахікардії за механізмом re-entry. Встановлено залежність між імовірністю збереження синусового ритму після кардіоверсії протягом 6 міс і розмірами порожнини лівого передсердя — ймовірність зриву ритму висока при його розмірі 4,5–5,0 см. Також має значення співвідношення розмірів порожнини лівого передсердя і розміру кореня аорти. Запропоновано поняття «критичний поріг» збільшення порожнини лівого передсердя, при якому аритмії стають неминучими.
Н. Ozawa і співавтори досліджували вплив перевантаження лівого передсердя на значення показників ЕКГ ВР. У дослідження включили 10 здорових осіб (1-ша група), 25 пацієнтів із пароксизмальною формою фібриляції передсердь (2-га група), 17 хворих без фібриляції передсердь, але зі збільшенням розмірів лівого передсердя >40 мм (3-тя група). Автори не знайшли будь-якої істотної різниці в тривалості FiР-хвилі у всіх групах. Тривалість FiР як у пацієнтів із фібриляцією передсердь, так і у хворих зі збільшеним розміром лівого передсердя була довшою, ніж у здорових. Значної різниці в цих показниках у пацієнтів 2-ї і 3-ї груп не було. Дослідники зробили висновок про те, що перевантаження лівого передсердя у пацієнтів без порушення ритму серця також впливають на часові показники ЕКГ ВР, що необхідно враховувати при використанні цього методу на практиці.
Проте в літературі практично немає робіт, що аналізують залежність показників ЕКГ ВР від розмірів правого передсердя в поєднанні з пароксизмами фібриляції передсердь і без них.
G. Turitto і співавтори провели співставлення показників ЕКГ ВР та ехоКГ у пацієнтів із пароксизмальною формою фібриляції і тріпотіння передсердь. Тривалість FiР була збільшена як у тих, так і у інших (150 і 147 мс) відповідно. Встановлено достовірну кореляцію між тривалістю FiР і об’ємом лівого передсердя. Дослідники вважають, що за допомогою часового показника FiР неможливо визначити, чи є у пацієнта фібриляція або тріпотіння передсердь. Тривалість FiР відображає лише збільшений об’єм лівого передсердя. Амплітуда і тривалість потенціалів області сповільненого проведення в нижньозадній стінці правого передсердя — потенційного електрофізіологічного субстрату розвитку тріпотіння передсердь — недостатньо великі для того, щоб викликати подовження FiР. За сукупністю збільшених показників тривалості FiР та об’єму правого передсердя можна прогнозувати розвиток тріпотіння передсердь. ППП дещо частіше виявляють у пацієнтів із пароксизмальною формою фібриляції передсердь, ніж у пацієнтів із передсердною тахікардією, що розвивається за механізмом re-entry.
Kontoyannis і співавтори провели дослідження ЕКГ ВР із синхронізацією і накопиченням за зубцем Р у трьох групах хворих: 1-ша — здорові (30 осіб); 2-га — з пароксизмальною формою фібриляції передсердь (38 осіб); 3-тя — з пароксизмальною передсердною тахікардією (29 осіб).
ППП були виявлені у 10% у 1-й групі, 84% — у 2-й, 79% — у 3-й групі. Специфічність і чутливість порівняно з 1-ю групою склали відповідно: для 2-ї — 90 і 84%, для 3-ї — 90 і 79%. Передбачається, що сповільнена фрагментована активність при пароксизмальній передсердній тахікардії недостатня (за кількістю) для того, щоб бути зареєстрованою з поверхні тіла порівняно з субстратом аритмії при фібриляції передсердь.
У 1993 р. G. Villani і співавтори опублікували результати роботи, метою якої було вивчення можливості застосування нової діагностичної методики аналізу усередненого сигналу зубця Р, використовуючи черезстравохідний запис сигналу. Ці автори встановили більш високу чутливість, специфічність і прогнозуючу цінність цієї модифікації за рядом показників. Так, тривалість FiР у групі пацієнтів із фібриляцією передсердь була більшою (126,6±12,4 мс), ніж у контрольній (96,8±12,5 мс), р<0,001, а амплітудні показники — нижчими. Чутливість, специфічність і прогнозуюча цінність склали: для тривалості FiР — 85, 100, 100%; RMS 20 — 84; 90 і 96% відповідно.
Досить важливе визначення електричної нестабільності передсердь при ГКМП. Розвиток фібриляції передсердь у цієї категорії хворих є несприятливим чинником і у ряді випадків вимагає проведення термінових втручань. A. Voss і співавтори спостерігали пацієнтів із ГКМП протягом 10 років. Провівши багатофакторний аналіз, дослідники прийшли до висновку, що тільки тривалість FiР (порівнювали показники розміру лівого передсердя, товщини стінки ЛШ, ФК СН) є незалежною величиною, пов’язаною з ризиком виникнення фібриляції передсердь.
Велике практичне значення мають роботи з вивчення застосування ЕКГ ВР у прогнозуванні розвитку фібриляції передсердь у пацієнтів після хірургічних кардіовтручань. Пароксизмальна форма фібриляції передсердь — найпоширеніша форма аритмії, що виникає після АКШ, її виявляють у 10–40% випадків. Незважаючи на те що при цій аритмії рідко виникають серйозні, небезпечні для життя ускладнення, вона може викликати гемодинамічні розлади, системну тромбоемболію, подовжує госпітальний період. Показник FiР >155 мс дозволяє ідентифікувати пацієнтів з вірогідністю появи фібриляції/тріпотіння передсердь у післяопераційний період після проведення АКШ із чутливістю 69%, специфічністю 79%, позитивною прогнозуючою цінністю 65% і негативною прогнозуючою цінністю 82%.
Ю.А. Істоміна і співавтори провели дослідження з метою, по-перше, порівняти показники ЕКГ ВР у хворих зі збільшеним правим і лівим передсердям та контрольної групи, по-друге, оцінити частоту реєстрації ППП у хворих при різній патології зі збільшенням правого і лівого передсердя, по-третє, співставити часові показники ЕКГ ВР у хворих із частими або нечастими пароксизмами аритмії. Усього обстежено 85 осіб (70 хворих і 15 здорових). З них 22 пацієнта з ІХС, включаючи постінфарктний кардіосклероз, стенокардію напруження II–III ФК, 15 хворих з АГ, 7 — з алкогольною міокардіодистрофією у поєднанні з пароксизмами фібриляції передсердь, 10 — з ідіопатичною формою пароксизмальної фібриляції передсердь, 16 — із захворюваннями, що супроводжуються збільшенням правого передсердя (ХОХЛ, первинна легенева гіпертензія, вторинна легенева гіпертензія на фоні мітрального стенозу). Контрольну групу склали 15 добровольців.
Хворі, включені в дослідження, отримували тільки базову патогенетичну терапію після купірування пароксизму фібриляції передсердь лікарськими засобами і були обстежені з урахуванням періоду напіввиведення препарату. Усі пацієнти незалежно від нозологічної форми були розділені на 4 групи: 1-ша — з нормальними розмірами лівого і правого передсердя (16), 2-га — зі збільшеним розміром лівого передсердя ≥4,0 см при вимірюванні з парастернального доступу (38), 3-тя — зі збільшеним розміром правого передсердя, що виміряно з верхівкової позиції, або передбаченим збільшенням на підставі підвищення тиску в ЛА >20 мм. рт. ст. (9), 4-та — зі збільшеним правим і лівим передсердям (7). Крім того, всі хворі з пароксизмами фібриляції передсердь були поділені на 2 групи: 1-ша — з частими пароксизмами, 2-га — з нечастими пароксизмами.
Отримані дані свідчать, що мінімальну частоту виявлення ППП відзначали при ідіопатичній формі пароксизмальної фібриляції передсердь — 60% і при збільшеному правому передсерді без пароксизмів фібриляції передсердь — 40%, у той час як при інших нозологічних формах вона склала 85–100%. Що стосується показника RMS 20, то виявляли розходження в групі хворих з ідіопатичною формою пароксизмальної фібриляції передсердь порівняно з контрольною та іншими нозологічними формами. Результати дослідження підтверджують незалежність показника RMS 20 від виду патології, за винятком ідіопатичної форми пароксизмальної фібриляції передсердь. Згідно з отриманими даними вид патології істотно впливає на частоту виявлення ППП. Достовірність відмінності показників FiР і RMS 20 при патології різних видів порівняно з нормою (група контролю) представлена в табл. 6.2.
Таким чином, у пацієнтів зі збільшеним правим відділом серця у поєднанні з пароксизмальною фібриляцією передсердь показники ЕКГ ВР вірогідно відрізнялися від груп контролю і хворих зі збільшеним правим передсердям без пароксизмів фібриляції передсердь.
Безсумнівно, найбільшу практичну цінність становлять прогностичні дослідження, що дозволяють оцінити ризик виникнення фібриляції передсердь або переходу пароксизмальної форми фібриляції передсердь у постійну форму. Y. Abe і співавтори проводили спостереження 71 пацієнта з пароксизмальною формою фібриляції передсердь. Виявлено, що у 10 з них за 22 міс встановилася постійна форма фібриляції передсердь, а у 61 пацієнта за 31 міс змін не відбулося. На думку авторів, такі критерії ЭКГ ВР, як тривалість FiР >145 мс і RMS 20 <3,0 мкВ, дозволяють прогнозувати ризик переходу пароксизмальної форми фібриляції/тріпотіння передсердь у постійну форму з чутливістю 75% і специфічністю 93,7%.
На сьогодні відсутні однозначні дані про взаємозв’язок ППП зі ступенем вираженості гіпертрофії передсердь, морфологічними змінами міокарда, їх гемодинамічним перевантаженням і ступенем гіпертрофії, характером і ступенем вираженості порушень процесу охоплення збудженням передсердь. Немає чіткого розуміння внеску кожного з передсердь у появу фрагментованої високочастотної активності кінцевої частини зубця Р. Ці питання вимагають вивчення та уточнення.
ЛІТЕРАТУРА
1. Буланова Н.А. (1998) Прогностическое значение метода ЭКГ ВР у больных с пароксизмальной формой мерцательной аритмии. Кардиология, 3: 24–32.
2. Истомина Т.А., Говша Ю.А., Воронин И.М., Иванов Г.Г. (1999) Роль увеличения левого и правого предсердия в генезе поздних потенциалов предсердий. Кардиология, 7: 31–37.
3. Савельева И.В., Меркулова И.Н., Стражеско И.Д., Швилкин А.В., Абугов С.А., Руда М.Я. (1998) Влияние преходящей ишемии миокарда на поздние потенциалы при транслюминальной коронарной ангиопластике. Кардиология, 11: 32–36.
4. Abe Y., Fukunami M., Shimonagata T. (1997) Prediction of paroxysmal atrial fibrillation in patients with congestive heart failure: a prospective study. Circulation, 29: 2612–2616.
5. ACC/AHA/ESC (2006) quidelines for the management of patients with atrial fibrillation – executive summary. Eur. Heart J., 27: 1979–2030.
6. Dibs S.R., Ng J., Arora R., Passman R.S., Kadish A.H., Goldberger J.J. (2008) Spatiotemporal characterization of atrial activation in persistent human atrial fibrillation: multisite electrogram analysis and surface electrocardiographic correlations — a pilot study. Heart Rhythm. May; 5(5): 686–693. Epub 2008 Jan 29. PMID
7. El-Sherif N., Gomes J., Restivo M. et al. (1998) Late potentials and arrhythmogenesis. Pace, 8: 440–462.
8. Josephson M., Horowitj L., Farshidi A. (1998) Continuous local electrical activity: A mechanism of recurrent ventricular tachycardia. Circulation, 57: 659–665.
9. Kuchar D., Rosenbaum D., Ruskin J. (2001) Late potentials on the signal-averaged electrocardiogram after canine myocardial infarction: correlation with induced ventricular arrythmias during the healing phasae. J. Amer. Coll. Cardiol., 75: 1365–1369.
10. Priori S. et al. (2004) Early afterdepolarisations induced in vivo by reperfusion of ischemic myocardium. A possible mechanism for reperfusion arrhytmias. Circulation, 81: 1911–1920.
11. Stafford P., Turner I., Vincent R. (1999) Quantitative analysis of signal-averaged P-waves in idiopathic paroxysmal atrial fibrillation. Amer. J. Cardiol., 68: 751–755.
12. Swerdlow C.D., Zhou X., Voroshilovsky O., Abeyratne A., Gillberg J. (2008) High amplitude T-wave alternans precedes spontaneous ventricular tachycardia or fibrillation in ICD electrograms. Heart Rhythm., May, 5(5): 670–676. Epub 2008 Feb 16. PMID: 18452868
13. Zipes W. (1997) Genesis of cardiac arrhythmias: electrophysiological consideration heart disease. A textbook of cardiovascular medicine. Ed. E. Braunwald. Philadelphia; Toronto: Lippincoft: Williams Wilcins, 548–592.