ЕФД І ПОКАЗАННЯ ДО ЙОГО ПРОВЕДЕННЯ
Більше 30 років тому вперше за допомогою електродного катетера зареєстрована електрична активність пучка Гіса. Це відкриття стало новим кроком у розвитку існуючих уявлень про механізми порушень ритму серця і провідності. Спочатку ця методика отримала назву «дослідження пучка Гіса», але вже в 1970 р. (Sheslag et al.) впроваджено термін «електрофізіологічне дослідження» (ЕФД). Відтоді ЕФД активно розвивається і широко застосовується в клінічній практиці. Застосування ЕФД дає можливість не тільки по-новому розглянути і зрозуміти механізми порушень ритму та провідності серця, але й підібрати оптимальну тактику лікування пацієнтів. Сформувалися принципово нові уявлення про механізми дії антиаритмічних засобів. Завдяки активному впровадженню ЕФД у клініку отримали інтенсивний розвиток кардіохірургічні методи лікування аритмій, з’явився новий терапевтичний метод — катетерна радіочастотна деструкція.
Завдання внутрішньосерцевого ЕФД
- Визначення функціональних характеристик провідної системи серця;
- Вивчення механізмів аритмії, факторів її індукції і припинення, виявлення анатомічних субстратів аритмії на основі анатомо-електрофізіологічних характеристик;
- Точна топічна діагностика субстрату аритмії перед радикальним хірургічним втручанням або катетерною абляцією;
- Виявлення аритмічної патології у хворих із синкопальними станами, виявлення хворих із ризиком раптової смерті;
- Здійснення підбору медикаментозної терапії (медикаментозне тестування);
- Підбір режимів антитахікардитичної електрокардіостимуляції, режимів кардіоверсії і дефібриляції при імплантації кардіовертерів-дефібриляторів;
- Проведення катетерної деструкції субстратів аритмії.
Вимоги до електрофізіологічних лабораторій
Інвазивні ЕФД повинні виконуватися в центрах, які мають кардіологічну, анестезіологічну і кардіохірургічну служби, при наявності обладнаного кабінету ЕФД, персоналу, підготовленого з клінічної електрофізіології серця. Неінвазивне ЕФД можуть виконувати на базі кабінетів функціональної діагностики кардіологічних відділень при забезпеченні їх ефективними швидкодіючими препаратами, дефібриляторами та можливостями швидкого транспортування хворого в реанімаційне відділення.
Вимоги до персоналу лабораторії ЕФД
У проведенні ЕФД беруть участь такі фахівці: 2 лікаря-електрофізіолога, анестезіолог, інженер-електронщик і медична сестра. Персонал лабораторії працює в умовах рентгенівського опромінення. Кардіохірурги залучаються для надання хірургічної допомоги при виникненні загрозливих для життя ускладнень.
Устаткування лабораторії ЕФД
1. Рентгенотелевізійна система пересувного або стаціонарного типу.
2. Універсальний електрокардіостимулятор.
3. Багатоканальний реєструючий пристрій для синхронної реєстрації ЕКГ і внутрішньосерцевих електрограм.
4. Ендокардіальні електроди.
5. Устаткування для проведення реанімації.
Протокол ЕФД
Під місцевою анестезією пунктують і катетеризують велику вену (зазвичай стегнову або підключичну) і під рентгенологічним контролем встановлюють ендокардіальні електроди в різних відділах серця. Стандартними позиціями електродів є верхні відділи правого передсердя (HRA, high right atrium), коронарний синус серця (СS, coronary sinus), AV-з’єднання з пучком Гіса (НВ, His band), верхівковим відділом ПШ (RV, right ventricular). Для розміщення електрода в коронарному синусі його вводять у ліву підключичну або яремну вену. Після проведення електродів у типові позиції реєструють порожнинні ендокардіальні електрограми, зазвичай у біполярному режимі з синхронним записом стандартних і грудних відведень на різній швидкості протягу стрічки (50 і 100 мм·с-1). Після аналізу базових інтервалів гістограми на синусовому ритмі виконують стимуляцію різних камер серця. Зазвичай застосовують біполярну стимуляцію з дистальним полюсом електрода як катода. У більшості вживаних тепер протоколів стимуляцій використовується сила струму, що в 2 рази перевищує поріг стимуляції (1–4 мА). Тривалість стимулюючого імпульсу зазвичай 1–2 мс.
На електрограмі визначають такі інтервали (рис. 5.1).

Рис. 5.1. Провідна система серця
РА — час проведення по правому передсердю — від початку Р до передсердного потенціалу А на електрограмі пучка Гіса (в нормі 20–50 мс);
АН — час проведення по AV-вузлу — інтервал між початком активації передсердь (А) і початком активації пучка Гіса (Н) на електрограмі пучка Гіса (у нормі — 50–140 мс);
Н — час проведення по пучку Гіса — ширина потенціалу пучка Гіса (Н) на електрограмі пучка Гіса (у нормі не більше 25 мс);
НV — час проведення по системі Гіса — Пуркіньє — інтервал від початку потенціалу Н на електрограмі пучка Гіса до початку комплексу QRS на поверхневій ЕКГ (у нормі — 30–55 мс)
При проведенні ЕФД рекомендують таку послідовність виконання протоколу дослідження:
- Аналізують стан провідної системи серця на початковому ритмі згідно з базовими показниками електрограми;
- Оцінюють функцію синусного вузла;
- Проводять зростаючу за частотою стимуляцію передсердя для оцінки антероградного проведення і точки Венкебаха;
- Програмована стимуляція правого передсердя одним і подвійним екстрастимулом на спонтанному і заданому ритмі (2–3 базових цикли);
- Стимуляція ПШ спочатку на верхівці, потім при необхідності на вихідному тракті в 2–3 базових циклах одним або двома екстрастимулами;
- Далі можна виконувати медикаментозні проби, направлені на виявлення минущих порушень функції синусного вузла і AV-провідності або провокацію пароксизмальних тахіаритмій.
Послідовність виконання програми дослідження може відрізнятися залежно від мети дослідження, патології і конкретної ситуації, що виникає в процесі проведення ЕФД. Для отримання максимально можливої інформації слід дотримуватися деяких принципових моментів.
ЕФД У ВИВЧЕННІ ФУНКЦІЇ СИНУСНОГО ВУЗЛА
ЕКГ-прояви дисфункції синусного вузла включають синусову брадикардію у стані спокою, неадекватну хронотропну відповідь на навантаження або стрес, синоатріальну блокаду виходу або зупинку синусного вузла. Загальні прояви включають втрату свідомості, переднепритомний стан, короткочасне запаморочення або виражену слабкість. Аритмії зазвичай зумовлені одним або декількома перерахованими факторами: ураження власне синусного вузла (наприклад ідіопатична дегенерація, фіброз, ішемія або хірургічна травма), порушення функції автономної нервової системи, а також дією препаратів. Клінічне виявлення можливої дисфункції синусного вузла часто викликає труднощі, оскільки симптоми аномалії можуть бути короткочасними і доброякісними, а у пацієнтів, що не мають симптомів, можливо значна зміна синусового ритму. Були запропоновані різні інвазивні тести для оцінки функції синусного вузла.
Час відновлення функції синусного вузла (ЧВФСВ) використовується для оцінки впливу надчастої стимуляції на автоматизм синусного вузла. Часто вноситься поправка на тривалість синусового циклу (СЦ), що визначається як коригований час відновлення функції синусного вузла (КЧВФСВ = ЧВФСВ – СЦ). У нормі ЧВФСВ не перевищує 1500–2000 мс, а КЧВФСВ — 600 мс. Чутливість обох показників до 60%, специфічність — 88%. Таким чином, нормальні їх значення не завжди дають можливість виключити наявність дисфункції синусного вузла. Рекомендації щодо проведення ЕФД для оцінки функції синусного вузла наведені в табл. 5.1.
Таблиця 5.1
Рекомендації щодо проведення ЕФД для оцінки функції синусного вузла
|
Показання |
Клінічні групи пацієнтів |
|
Абсолютно показано |
Пацієнти з клінічною симптоматикою, у яких як причина симптомів підозрюється дисфункція синусного вузла, але після ретельного обстеження причинний зв’язок між аритміями та симптомами не встановлено |
|
Ефективно |
1. Пацієнти із документованою дисфункцією синусного вузла, у яких оцінка його функції, AV- або вентрикулоатріальної провідності, індукції аритмій, залежно від ділянки стимуляції, може допомогти вибору найбільш доцільного режима стимуляції 2. Пацієнти з електрокардіографічно підтвердженими синусовими брадиаритміями з метою визначення, чи пов’язана аномалія з органічною дисфункцією синусного вузла, дисфункцією автономної нервової системи або зумовлена впливом лікарських засобів для визначення оптимального варіанта терапевтичного лікування 3. Пацієнти з клінічною симптоматикою з підтвердженою синусовою брадиаритмією для виявлення вірогідної наявності іншої аритмії як причини симптомів |
|
Не показано |
1. Пацієнти з клінічною симптоматикою, у яких встановлений зв’язок між симптомами і документованою брадиаритмією та результати ЕФД яких не впливають на вибір наступної терапії 2. Пацієнти без клінічної симптоматики із синусовими брадиаритміями або з паузами (за типом синус-ареста), що виникають тільки під час сну (включаючи апное під час сну) |
Синоатріальна провідність може бути визначена безпосередньо або за допомогою нанесення передсердного екстрастимулу на фоні синусового ритму або при стимуляції передсердя.
Синопередсердна пароксизмальна тахікардія
1. Під час тахікардії потенціал верхньої частини правого передсердя передує потенціалу нижньої його частини й істотно не відрізняється від такого на фоні синусового ритму.
2. Тахікардія провокується електростимулом, нанесеним у період серцевого циклу, що передує блокаді його проведення в синусний вузол. Інтервал зчеплення такого електростимулу дещо коротший ніж інтервал, при якому електростимул заміщає синусовий імпульс.
3. Одиничний електростимул, нанесений на передсердя з дещо меншим інтервалом зчеплення, ніж той, при якому виник пароксизм, здатний припинити напад тахікардії.
4. Часта стимуляція також провокує і пригнічує ектопічний ритм.
5. Додатковими критеріями діагностики є виникнення блокади II ступеня антероградного проведення імпульсу в AV-вузлі під час тахікардії, що не супроводжується припиненням нападу, а також ретроградна блокада проведення імпульсу при штучній стимуляції шлуночків.
Передсердна пароксизмальна тахікардія
1. Потенціал передсердя передує потенціалу пучка Гіса.
2. Послідовність поширення порушення по передсердю в деяких випадках порушена. Якщо ектопічний водій ритму розміщений у нижній частині передсердя, потенціал його передує потенціалу верхньої частини правого передсердя; якщо водій ритму перебуває в лівому передсерді, то воно збуджується раніше правого передсердя.
3. У деяких випадках зареєстровані передсердні потенціали мають різну конфігурацію (кілька вогнищ ектопічного ритму).
4. Одиничними електростимулами неможливо припинити пароксизм. Часта стимуляція може лише тимчасово придушити ектопічний ритм. У тих випадках, коли прогнозують реципрокний механізм тахікардії, найважливішою діагностичною ознакою вважають погіршення внутрішньопередсердної провідності в момент провокації пароксизму.
5. Додатковою ознакою є антероградна або ретроградна блокада проведення імпульсу по AV-вузлу, оскільки наявність цих порушень виключає вузлову пароксизмальну тахікардію.
AV-вузлова пароксизмальна тахікардія
1. Передсердні електростимули з інтервалом зчеплення, що постійно стає коротшим, викликають пароксизм тахікардії, виникненню якого передує раптове або поступове подовження інтервалу P–R.
2. Потенціал пучка Гіса передує під час тахікардії потенціалу шлуночка.
3. Потенціал нижньої частини передсердя передує потенціалу його верхньої частини і за часом виникнення збігається з потенціалом шлуночка.
4. Стимуляція шлуночка зі зростаючою частотою або за допомогою одиничних імпульсів з інтервалом зчеплення, що постійно коротшає, супроводжується поступовим уповільненням ретроградного поширення збудження по передсердю. Це вказує на те, що імпульс проводиться AV-вузлом, а не по додатковому передсердно-шлуночковому з’єднанню.
5. Припинення пароксизму відбувається лише в результаті блокування імпульсу в AV-вузлі.
Фібриляція, тріпотіння передсердь
Діагноз пароксизмальної миготливої аритмії звичайно не викликає утруднень, тому ЕФД проводити не обов’язково. Лише при необхідності диференціації між шлуночковою екстрасистолією і аберантними комплексами слід провести реєстрацію електрограми пучка Гіса. Реєстрація потенціалу пучка Гіса на гісограмі і нормальної тривалості інтервалу Н–V дає можливість стверджувати, що шлуночкові комплекси є аберантними. І, навпаки, відсутність потенціалу Н або значне укорочення інтервалу Н–V є характерним для шлуночкових екстрасистол. При тріпотінні передсердь дуже чітко виділяються хвилі f, пов’язані або частково дисоційовані зі шлуночковими комплексами.
ЕФД У ПАЦІЄНТІВ ІЗ НАБУТОЮ AV-БЛОКАДОЮ/ХРОНІЧНИМ ПОРУШЕННЯМ AV-ПРОВІДНОСТІ
Можливість реєстрації потенціалу пучка Гіса під час ЕФД дає можливість описати 3 анатомічні ділянки AV-блокади:
а) Проксимальний (над пучком Гіса) — затримка проведення або блокада в AV-вузлі.
б) Інтрагісовий — затримка проведення або блокада в межах пучка Гіса.
в) Дистальний — розміщений дистальніше пучка Гіса і розміщується на рівні ніжок пучка Гіса.
Така діагностика є вкрай важливою, оскільки прогноз хворих із AV-блокадою залежить від рівня блокади: чим нижче рівень блокади, тим гірше прогноз.
При прогресуючому підвищенні частоти стимуляції правого передсердя відзначають поступове подовження інтервалу А–Н до розвитку AV-блокади II ступеня на рівні AV-вузла — «точка Венкебаха». У нормі цей показник перевищує 110–130 імпульсів за хвилину.
Є певні кореляції між картиною ЕКГ і рівнем блокади. При AV-блокаді II ступеня I типу з вузькими комплексами QRS блокада зазвичай виникає на рівні AV-вузла, рідше може локалізуватися в пучку Гіса. При AV-блокаді II ступеня тип I з широкими комплексами QRS (блокада гілки пучка Гіса) блокада проведення може виникати на рівні AV-вузла, всередині або нижче пучка Гіса. AV-блокада II ступеня II типу зазвичай виникає на рівні пучка Гіса або нижче й частіше поєднується з блокадою ніжки пучка Гіса. Зрідка AV-блокада II типу виникає в AV-вузлі. При повній AV-блокаді з ритмом, що висковзає, і вузькими комплексами QRS місце блокади може локалізуватися в AV-вузлі або пучку Гіса. При повній AV-блокаді з ритмом, що висковзає, з широкими комплексами QRS місце блокади може розміщуватися в AV-вузлі, всередині або нижче пучка Гіса. Зазвичай вона розміщена нижче пучка Гіса.
Прогноз пацієнтів із AV-блокадою залежить від рівня її виникнення. Хронічна AV-блокада I ступеня, особливо блокада на рівні AV-вузла, зазвичай має доброякісний перебіг. Ця аномалія часто пов’язана з прийомом лікарських препаратів і має оборотний характер. Клінічний перебіг вузлової AV-блокади II ступеня зазвичай доброякісний, прогноз залежить від наявності і стану основного захворювання серця. Прогноз пацієнтів із AV-блокадою II ступеня на рівні пучка Гіса неоднозначний. У таких пацієнтів часто виникають втрата свідомості та прояви СН. При відсутності лікування AV-блокада II ступеня на рівні нижче пучка Гіса має поганий прогноз, блокада у таких пацієнтів часто прогресує до більш високих ступенів, з’являється симптоматика з втратою свідомості. У пацієнтів із набутою повною AV-блокадою без лікування часто відзначають симптоматику незалежно від рівня блокади (табл. 5.2).

Згідно з електрокардіографічною класифікацією внутрішньошлуночкова провідна система складається із 3 пучків: переднього і заднього пучків лівої ніжки пучка Гіса та правої ніжки пучка Гіса. Анатомічна основа розподілу провідної системи у людини на 3 пучки не зовсім зрозуміла. Пацієнти з двопучковою блокадою мають підвищений ризик розвитку повної трипучкової блокади.
Раптова смерть пацієнтів із двопучковою блокадою може бути викликана не тільки розвитком повної трипучкової блокади, але також і розвитком шлуночкових тахіаритмій. Останні можуть відігравати важливу роль у пацієнтів із прогресуючим захворюванням серця і двопучковою блокадою. З цієї причини ЕФД пацієнтів з дефектами внутрішньошлуночкового проведення і нечіткими симптомами повинно також включати дослідження AV-провідної системи і оцінку функції синусного вузла, а також програмовану передсердну і шлуночкову стимуляцію з метою провокації тахіаритмії для виявлення схильності до розвитку як брадиаритмій, так і тахіаритмій (табл. 5.3).
Таблиця 5.3
Рекомендації щодо проведення ЕФД
|
Показання |
Клінічні групи пацієнтів |
|
Абсолютно показано |
Пацієнти з наявністю клінічних симптомів, у яких причина симптомів не встановлена |
|
Показано |
Пацієнти, що не мають симптомів, з блокадою гілки пучка Гіса, якщо планується проведення фармакотерапії, яка може збільшити затримку проведення або викликати AV-блокаду |
|
Не показано |
1. Пацієнти, що не мають симптомів, пов’язаних із затримкою внутрішньошлуночкового проведення 2. Пацієнти з наявністю клінічних симптомів, у яких симптоми можна пояснити або виключити на основі даних ЕКГ |
ЕФД У ПАЦІЄНТІВ ІЗ ТАХІКАРДІЄЮ І ШИРОКИМИ КОМПЛЕКСАМИ QRS
При широких комплексах QRS (>120 мс) важливо диференціювати надшлуночкову тахікардію від шлуночкової тахікардії. Щоб відрізнити надшлуночкові тахікардії від шлуночкових наявність стійких симптомів тахікардії не показова. Якщо діагноз надшлуночкової тахікардії неможливо підтвердити або встановити, то тахіаритмію слід розцінювати як шлуночкову тахікардію і лікувати відповідно.
Тахікардія з широкими комплексами QRS може бути поділена на 3 групи: надшлуночкова тахікардія з блокадою ніжок пучка Гіса, надшлуночкова тахікардія з проведенням по додатковому передсердно-шлуночковому з’єднанню і шлуночкова тахікардія. ЕФД дозволяє точно діагностувати практично всі тахікардії з широкими комплексами, а також визначити послідовність та співвідношення між активацією передсердь і шлуночків. При цьому можна зареєструвати електрограми від структур, які не відображаються на стандартній ЕКГ (таких як пучок Гіса або додаткові шляхи проведення), а також можуть бути проаналізовані відповіді на різні проби зі стимуляцією. Оскільки знання механізму аритмії зазвичай має критичне значення для вибору належної терапії, ЕФД часто займають важливе місце в клінічній діагностиці у пацієнтів, що мають тахікардії з широкими комплексами (табл. 5.4).
Таблиця 5.4
Рекомендації щодо проведення ЕФД у пацієнтів із тахікардією і широкими комплексами QRS
|
Показання |
Клінічні групи пацієнтів |
|
Абсолютно показано |
Пацієнти з тахікардією та широкими комплексами QRS, із невстановленим точним діагнозом (після аналізу доступних записів ЕКГ), встановлення якого необхідно для вибору тактики лікування |
|
Не показано |
Пацієнти зі шлуночковою тахікардією або надшлуночковими тахікардіями з аберантним проведенням або синдромом передзбудження, які діагностуються на основі чітких критеріїв ЕКГ і відносно яких дані ЕФД не впливають на вибір терапії. Проте дані, отримані при початковому ЕФД, у цих пацієнтів можуть розглядатися як настанова для подальшої терапії. |
ЕФД У ПАЦІЄНТІВ ІЗ ТАХІКАРДІЄЮ І ВУЗЬКИМИ КОМПЛЕКСАМИ QRS
Таблиця 5.5
Рекомендації щодо проведення ЕФД у пацієнтів із тахікардією і вузькими комплексами QRS
|
Показання |
Клінічні групи пацієнтів |
|
Абсолютно показано |
1. Пацієнти з частими нападами тахікардії або при їх поганій переносимості, які не дають адекватної відповіді на медикаментозну терапію і у яких інформація про місце виникнення, механізм та електрофізіологічні властивості провідних шляхів тахікардії важливі для вибору відповідної терапії (препарати, катетерна абляція, електростимуляція або хірургічне втручання) 2. Пацієнти, які віддають перевагу абляції, а не медикаментозній терапії |
|
Показано |
Пацієнти з частими епізодами тахікардії, яким необхідна медикаментозна терапія і відносно яких є припущення про проаритмічний ефект препаратів або про вплив антиаритмічних препаратів на синусний вузол або AV-провідність |
|
Не показано |
Пацієнти з тахікардіями, вагусними пробами, які легко контролюються, та/або хорошою переносимістю медикаментозної терапії, які не є кандидатами на немедикаментозне лікування |
ЕФД У ПАЦІЄНТІВ ІЗ ПОДОВЖЕНИМ ІНТЕРВАЛОМ Q–T
Подовження інтервалу Q–T, пов’язане з потенційною загрозою виникнення небезпечних для життя аритмій, може реєструватися постійно або періодично як прояв вродженого синдрому подовженого інтервалу Q–T або може виникати внаслідок метаболічних, токсичних або патофізіологічних факторів. ЕФД має обмежене значення для виявлення, постановки діагнозу або підбору терапії при вродженому або набутому подовженні інтервалу Q–T. ЕФД у пацієнтів із вродженим синдромом подовженого Q–T нерідко призводить до запуску шлуночкових аритмій, тоді як його діагностичне значення невисоке або відсутнє зовсім (табл. 5.6).

НАДШЛУНОЧКОВІ ТАХІКАРДІЇ ПРИ ДОДАТКОВИХ ШЛЯХАХ ПРОВЕДЕННЯ
Додаткові шляхи Кента і Джеймса
1. Нав’язування ритму передсердя, що постійно зростає за частотою, або нанесення окремих стимулів із постійним укороченням інтервалу зчеплення при наявності пучка Кента призводить до росту вираженості хвилі дельта, інтервал Р–дельта-хвиля залишається стабільним. При цьому як для пучка Кента, так і для пучка Джеймса характерний на певному етапі стрибкоподібний перехід проведення імпульсів лише по додатковому передсердно-шлуночковому з’єднанню.
2. Програмована стимуляція передсердя, викликаючи пароксизм тахікардії, не виявляє відмінностей, властивих AV-вузловій тахікардії, тобто раптового подовження інтервалу А–Н або появи періодики Венкебаха.
3. Програмована стимуляція шлуночка не супроводжується збільшенням часу ретроградного проведення збудження на передсердя, що відображає його поширення по додатковому передсердно-шлуночковому з’єднанню, а не по AV-вузлу.
4. Виявляє порушення послідовності ретроградного поширення хвилі збудження на передсердя. Це проявляється тим, що потенціал лівого передсердя реєструється раніше, ніж правого.
5. Додатковою ознакою є реєстрація нижньопередсердного потенціалу на гістограмі після шлуночкового комплексу на відміну від вузлової тахікардії, при якій цей потенціал за часом виникнення збігається зі шлуночковим.
Додатковий шлях Махайма
1. Потенціал Н на гістограмі за часом виникнення збігається з деформованим шлуночковим комплексом у відведенні електрограми від шлуночка і передує йому, тоді як комплекс QRS, що реєструється, нормальної форми.
2. Часта стимуляція передсердя призводить до подовження інтервалу P–Q і укороченню інтервалу H–V або навіть до його злиття зі шлуночковим комплексом, що поєднується з виникненням його аберації за типом блокади однієї з ніжок пучка Гіса.
3. Аберантний шлуночковий комплекс нормалізується після введення атропіну або на фоні стимуляції пучка Гіса.
ЕФД у пацієнтів із WPW-синдромом

ЕФД У ПАЦІЄНТІВ ЗІ ШЛУНОЧКОВИМИ ЕКСТРАСИСТОЛАМИ, ПАРНИМИ ЕКСТРАСИСТОЛАМИ І НЕСТІЙКОЮ ШЛУНОЧКОВОЮ ТАХІКАРДІЄЮ
Таблиця 5.8
Рекомендації щодо проведення ЕФД у пацієнтів зі шлуночковими екстрасистолами, парними екстрасистолами і нестійкою шлуночковою тахікардією
|
Показання |
Клінічні групи пацієнтів |
|
Показано |
1. Пацієнти з додатковими факторами ризику відносно виникнення аритмій: низька ФВ ЛШ, наявність пізніх потенціалів на сигнал-посилень ЕКГ, нестійка шлуночкова тахікардія при амбулаторному моніторуванні ЕКГ. Пацієнтам, у яких ЕФД буде використане для подальшого уточнення факторів ризику і підбору терапії при індукованій шлуночковій тахікардії 2. Пацієнти з вираженою клінічною симптоматикою, викликаною одиничними, парними мономорфними шлуночковими екстрасистолами, нестійкою шлуночковою тахікардією за даними амбулаторного моніторування ЕКГ, у яких розглядається можливість катетерної абляції |
|
Не показано |
Пацієнти з поодинокими, парними шлуночковими екстрасистолами або нестійкою шлуночковою тахікардією при відсутності симптомів або незначній їх вираженості, без інших факторів ризику розвитку стійких аритмій |
Пароксизмальні шлуночкові тахікардії
1. Наявність передсердно-шлуночкової дисоціації, що реєструється на електрограмі пучка Гіса. Цей критерій є дуже важливим, проте не абсолютним, тому що виявляється, хоча й дуже рідко, при надшлуночкових тахікардіях з аберантною шлуночковою провідністю.
2. Відсутність потенціалу Н перед шлуночковими комплексами або значне укорочення інтервалу Н–V на гісограмі.
3. Часта і програмована стимуляція ПШ у більшості випадків призводить до виникнення шлуночкової тахікардії. Конфігурація комплексів при цьому аналогічна тим, які виникають під час нападу, що виник спонтанно.
4. Програмована стимуляція шлуночків у більшості випадків призводить до припинення тахікардії. Шлуночкова тахікардія з частотою ритму <175 уд./хв припиняється окремими електростимулами або за допомогою нав’язування штучного шлуночкового ритму невеликої частоти. Для її припинення при тахікардії >175 уд./хв використовують парні стимули або часту стимуляцію шлуночків.
ЕФД У ПАЦІЄНТІВ ІЗ НЕЗ’ЯСОВАНОЮ ВТРАТОЮ СВІДОМОСТІ

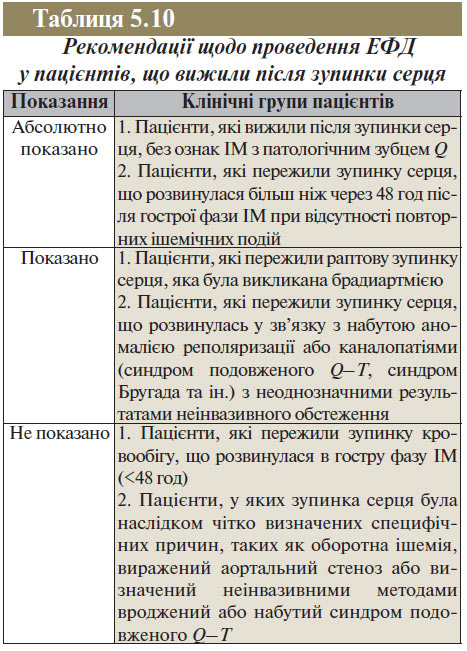
ЕФД У ПАЦІЄНТІВ, ЩО ВИЖИЛИ ПІСЛЯ ЗУПИНКИ СЕРЦЯ
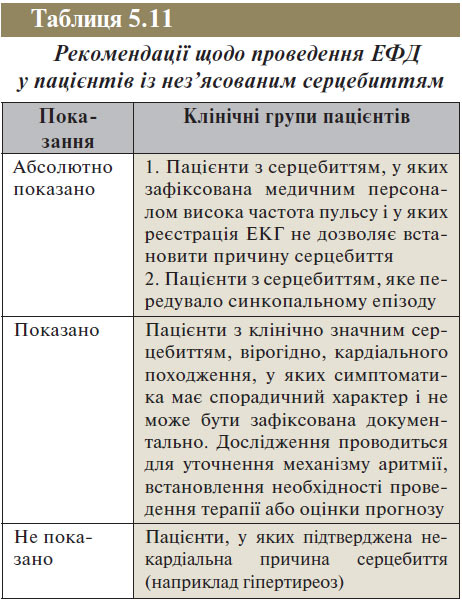
ЕФД У ПАЦІЄНТІВ ІЗ НЕЗ’ЯСОВАНИМ СЕРЦЕБИТТЯМ
ЕФД ПРИ ПІДБОРІ АНТИАРИТМІЧНОЇ ТЕРАПІЇ У РІЗНИХ ГРУП ПАЦІЄНТІВ
ЕФД дозволяє серійно оцінювати зміни провідності і рефрактерності тканин серця, викликаних лікарськими препаратами, а також особливості аритмій, включаючи індукованість; при індукованих аритміях — оцінити частоту, морфологію та гемодинамічні наслідки. Після базового дослідження (бажано без препаратів), протягом якого індукується аритмія, призначається препарат і повторюється електрична стимуляція. Передбачається, що викликане антиаритмічним препаратом зниження можливості повторно індукувати аритмію свідчить про відсутність рецидивів аритмії. Навпаки, якщо аритмія залишається індукованою, то вірогідність повтору аритмії вища, ніж у групі хворих, де вдалося досягти її припинення препаратами. Такий підхід використовується насамперед у пацієнтів зі стійкими шлуночковими тахікардіями і у пацієнтів, які вижили після зупинки серця, хоча проведення ЕФД можливо і у пацієнтів із надшлуночковими аритміями (табл. 5.12).

ЕФД У ПАЦІЄНТІВ, ЯКІ Є КАНДИДАТАМИ АБО ВЖЕ МАЮТЬ ІМПЛАНТОВАНІ АНТИАРИТМІЧНІ ПРИСТРОЇ

ЛІТЕРАТУРА
1. Бредикис Ю.Ю. (1967) Электрическая стимуляция сердца в клинической практике. Медицина, Москва, 200 с.
2. Бредикис Ю.Ю., Дрогайцев А.Д., Стирбис П.П. (1983) Физиологическая электростимуляция сердца: Обзор. Кардиология, 9: 114–118.
3. Емельяненко В.М., Ефремов А.И., Кофаль Л.А. и др. (1995) Критерии клинической оценки тяжести нарушений ритма сердца. Клин. мед. и патофизиол., 2: 92–93.
4. Ревишвили А.Ш. (1990) Электрофизиологическая диагностика и хирургическое лечение наджелудочковых тахиаритмий. Кардиология, 11: 56–59.
5. Черняк Б.А., Никитина Т.Н., Фукс Р.А. и др. (1983) Клинико-функциональная характеристика синдрома преждевременной реполяризации желудочков. Тер. арх., 4: 57–61.
6. Шевченко Н.М. (1997) Рациональная кардиология. Стар' Ко, Москва, 256 с.
7. Шубик Ю.В. (1999) Неинвазивное электрофизиологическое исследование при аномалиях проводящей системы сердца. ИНКАРТ, Санкт-Петербург, 84 с.
8 Akhtar M., Achord J.L., Reynolds W.A. (1994) Clinical competence in invasive cardiac electrophysiological studies. ACP/ACC/AHA Task Force on Clinical Privileges in Cardiology. J. Am. Coll. Cardiol., 23: 1258–1261.
9. Andresen D., Steinbeck G., Habort R. et al. (1990) Programmed ventricular stimulation: Prognostic value of noninducibility in patients with malignant ventricular tachyarhythmias. Eur. Heart J., 11 (Abstr. Suppl. 3).
10. Blomstrm-Lundqvist, Scheinman М.М. et al. ACC/AHA/ESC Guidelines for the Management of Patients With Supraventricular Arrhythmias — Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias).
11. Brembilla-Perrot B., Spatz F., Khaldi E. et al. (1990) Value of esophageal pacing in evaluation of supraventricular tachycardia. Am. J. Cardiol., 65: 322–330.
12. Flowers N.C., Abildskov J.A., Armstrong W.F. et al. (1991) ACC policy statement: recommended guidelines for training in adult clinical cardiac electrophysiology. Electrophysiology. Electrocardiography Subcommittee, American College of Cardiology. J. Am. Coll. Cardiol., 18: 637–640.
13. Gallagher J.J., Smith W.M., Kerr C.R. et al. (1982) Esophageal pacing: a diagnostic and therapeutic tool. Circulation, 65(2): 336–341.
14. Hall R.J.C., Boyle R.M., Webb-Peploe M. et al. (1995) Guidelines for specialist training in cardiology. Council of the British Cardiac Society and the Specialist Advisory Committee in Cardiovascular Medicine of the Royal College of Physicians. Br. Heart J., 73: 1–24.
15. Hindricks G., for the Multicentre European Radiofrequency Survey (MERFS) investigators of the Working Group on Arrhythmias of the European Society of Cardiology (1993) The Multicentre European Radiofrequency Survey (MERFS): complications of radiofrequency catheter ablation of arrhythmias, fur Heart J., 14: 1644–1653.
16. Horowitz L.N., Josephson M.E. (1990) Intracardiac electrophysiological study as a method of optimization of drug therapy in chronic V.T. Progr. Cardiovasc. Res., 2: 381–389.
17. Josephson M.E., Maloney J.D., Barold S.S. (1995) Guidelines for training in adult cardiovascular medicine. Core Cardiology Training Symposium (COCATS) Task Force 6: training in specialized electrophysiology, cardiac pacing and arrhythmia management. J. Am. Coll. Cardiol., 25: 23–26.
18. Miller J.M. (1996) Therapy of Wolff-Parkinson-White syndrome and concealed bypass tracts. J. Cardiovasc. Electrophysiol., 7(1): 85–93.
19. Santini M., Ansalone G., Cacciatore G. et al. (1990) Transesophageal pacing. PACE, 13(10): 1298–1323.
20. Snezhitsky V.A., Baranovsky P.A., Roman T.S. et al. (1994) Transesophageal atrial programmed pacing for assessment of atrioventricular conduction function. RBM, 16(3–4): 120–123.
21. Zipes D.P., DiMarco J.P., Gillette P.C. et al. (1995) Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures. A report of the American College of Cardiology. American Heart Association Task Force on practice guidelines. J. Cardiovasc. Electrophysiol., 6(8): 652–679.
22. Zipes D.P., DiMarco J.P., Gillette P.C. et al. (1995) Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology. American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures), developed in collaboration with the North American Society of Pacing and Electrophysiology. J. Am. Coll. Cardiol., 26: 555–573.