ТЕРМІНОЛОГІЯ ЗГІДНО З МКХ-10
Метаболічний синдром являє собою кластер чотирьох кардіометаболічних факторів ризику, які згідно з МКХ-10 визначені так:
- ожиріння — Е65–Е68;
- дисліпідемія — Е78;
- АГ — I10–I15;
- порушена толерантність до глюкози або цукровий діабет — E10–E14.
КЛАСИФІКАЦІЯ МЕТАБОЛІЧНОГО СИНДРОМУ
У Методичному посібнику з діагностики і лікування цукрового діабету, предіабету і серцево-судинних захворювань, розробленому Європейським кардіологічним товариством (ESC) разом з Європейською асоціацією по вивченню цукрового діабету (EASD) у 2007 р. наведені три варіанти ідентифікації метаболічного синдрому: відповідно до рекомендацій ВООЗ (1998), Adult Treatment Panel III (ATP-III, 2001) і Міжнародної Федерації по вивченню цукрового діабету (IDF, 2005).
1. Критерії метаболічного синдрому, що рекомендуються ВООЗ:
- Інсулінорезистентність, яка ідентифікується за одним із таких станів:
- цукровий діабет II типу;
- гіперглікемія натще;
- порушення толерантності до глюкози;
- або при нормальному рівні глікемії натще (<6,1 ммоль/л (<110 мг/дл)), засвоєння глюкози менше нижнього квартиля для загальної популяції в умовах гіперінсулінемії та еуглікемії.
- Плюс наявність будь-яких двох факторів з нижчеперелічених:
- наявність АГ (САТ ≥140 мм рт. ст. або ДАТ ≥90 мм рт. ст.) і проведення антигіпертензивної терапії;
- рівень ТГ у плазмі крові ≥1,7 ммоль/л (≥150 мг/дл) і/або рівень ХС ЛПВЩ<0,9 ммоль/ л (<35 мг/дл) у чоловіків або <1,0 ммоль/л (<39 мг/дл) у жінок;
- ІМТ <30 кг/м2 і/або коефіцієнт окружності талія/стегно >0,9 у чоловіків і >0,85 у жінок;
- рівень альбумінурії ≥20 мкг/хв або співвідношення альбумін/креатинін ≥30 мг/м.
2. Критерії метаболічного синдрому, що рекомендуються ATP III (Adult Treatment Panel III або Третього звіту групи експертів по виявленню, оцінці і лікуванню гіперхолестеринемії в дорослих у рамках Національної освітньої програми США/NCEP/по ХС):
- Абдомінальний тип ожиріння, виражений як окружність таліїа, b:
- >102 см (>40 дюймів) для чоловіків;
- >88 см (>35 дюймів) для жінок.
- Рівень ТГ ≥1,7 ммоль/л (≥150 мг/дл).
- Рівень ХС ЛПВЩ:
- <1,03 ммоль/л (<40 мг/дл) для чоловіків;
- <1,29 ммоль/л (<50 мг/дл) для жінок.
- Рівень АТ ≥130/≥85 мм рт. ст.
- Рівень глюкози в плазмі крові натще ≥6,1 ммоль/л (≥110 мг/дл)с.
Примітки:
анаявність надмірної маси тіла та ожиріння пов’язують із резистентністю до інсуліну і метаболічним синдромом. Проте ожиріння за абдомінальним типом більшою мірою корелює із метаболічним синдромом, ніж підвищений ІМТ. Тому звичайне вимірювання окружності талії рекомендується для виявлення «вагового» компоненту метаболічного синдрому;
bу деяких пацієнтів чоловічої статі можуть розвиватися множинні метаболічні фактори ризику, якщо окружність талії погранично збільшений (наприклад 94–102 см/37–39 дюймів). Такі хворі можуть мати значну генетичну схильність до розвитку інсулінорезистентності. Корекція способу життя забезпечує таким пацієнтам значну перевагу;
сАмериканською асоціацією по вивченню цукрового діабету (ADA) нещодавно встановлений граничний рівень, що становить 5,6 ммоль/л або 100 мг/дл, перевищення якого свідчить про наявність предіабету — порушення толерантності до глюкози, або цукрового діабету. Цей новий граничний рівень може бути використаний для встановлення більш низької межі визначення рівня глюкози як одного з критеріїв метаболічного синдрому.
3. Критерії метаболічного синдрому, що рекомендуються Міжнародною федерацією по вивченню цукрового діабету (IDF):
- Наявність ожиріння центрального типу, яке визначається як окружність талії (у см), з урахуванням специфіки для різних етнічних груп:
- європейці: ≥94 см у чоловіків, ≥80 см у жінок; у США, ймовірно, у клінічній практиці будуть як і раніше використовувати критерії, що рекомендуються ATP (102 см у чоловіків і 88 см у жінок);
- жителі Південної Азії: ≥90 см у чоловіків і ≥80 см у жінок;
- жителі Китаю, Малайзії, азійсько-індійська популяція:
- китайці: у чоловіків ≥90 см, у жінок ≥80 см;
- японці: у чоловіків ≥85 см, у жінок ≥90 см;
- етнічні центрально- та південноамериканці — необхідне використання рекомендацій для жителів Південної Азії до одержання більш специфічних даних;
- африканці, що проживають на півдні від Сахари — слід використовувати рекомендації для європейців до одержання більш специфічних даних;
- східно-середземноморська та середньосхідна (араби) популяції — слід використовувати рекомендації для європейців до одержання більш специфічних даних;
- Плюс наявність будь-яких двох факторів із чотирьох нижчеперелічених:
- підвищений рівень ТГ: ≥1,7 ммоль/л (150 мг/дл) або проведення специфічної гіполіпідемічної терапії;
- знижений рівень ХС ЛПВЩ: <1,03 ммоль/л (40 мг/дл) у чоловіків і <1,29 ммоль/ л (50 мг/дл) у жінок, або проведення специфічної терапії із приводу дисліпідемії;
- АГ (рівень САТ ≥130 мм рт. ст. або ДАТ ≥85 мм рт. ст.), або гіпотензивна терапія із приводу раніше діагностованої АГ;
- підвищений рівень глюкози в плазмі крові натще ≥5,6 ммоль/л (100 мг/дл), або раніше діагностований цукровий діабет II типу. При значенні показника >5,6 ммоль/л або 100 мг/дл настійно рекомендується проведення пероральної проби на толерантність до глюкози, однак це не є необхідним для визначення наявності синдрому.
Крім класичного уявлення про метаболічний синдром, викладеного в трьох вищеперерахованих документах, у 1997 р. C. Spencer зі співавторами була висунута концепція менопаузального метаболічного синдрому. На підставі ретельного аналізу робіт, присвячених впливу менопаузи на чутливість до інсуліну, показники ліпідного і вуглеводного обміну, розподіл жирової тканини і систему гемостазу, а також даних про вплив замісної гормональної терапії на перераховані параметри у жінок, запропоновано виділяти менопаузальний метаболічний синдром як патогенетический комплекс факторів ризику серцево-судинних захворювань, і в першу чергу ІХС, в основі якого лежить дефіцит естрогенів.
ЕПІДЕМІОЛОГІЯ МЕТАБОЛІЧНОГО СИНДРОМУ
Поширеність метаболічного синдрому серед дорослого населення, оцінена навіть за допомогою більш м’яких критеріїв 2001 р., досить висока і в США становить 23,7% (24% серед чоловіків і 23,4% серед жінок). При цьому у вікових групах 20–49 років метаболічний синдром частіше відзначають у чоловіків, у хворих віком 50–69 років поширеність метаболічного синдрому практично однакова у чоловіків і жінок, у той час як в осіб старше 70 років метаболічний синдром частіше виявляють у жінок. Прийнято вважати, що вища, порівняно з чоловіками, частота метаболічного синдрому в жінок старших вікових груп зумовлена настанням менопаузи. Цей висновок підтверджується даними дослідження, проведеного в США серед жінок-емігранток з колишнього СРСР. У 25% жінок відзначали метаболічний синдром за критеріями Національної освітньої програми по ХС, при цьому частота його була вищою у жінок у період постменопаузи. При багатофакторному аналізі у жінок з урахуванням віку і менопаузального статусу тільки постменопауза була незалежним предиктором компонентів метаболічного синдрому.
ЕТІОЛОГІЯ І ПАТОГЕНЕЗ МЕТАБОЛІЧНОГО СИНДРОМУ
На початку третього тисячоліття для людства, що перебороло протягом багатовікової історії епідемії життєво небезпечних інфекцій, на перше місце за актуальністю серед всіх причин захворюваності і смертності вийшла проблема серцево-судинних захворювань. Значну роль у цьому зіграла модифікація способу життя, пов’язана із обмеженням фізичної активності, підвищенням калорійності харчових продуктів і невпинним зростанням емоційно-стресових навантажень. Усе це потенціювало основні фактори ризику виникнення серцево-судинних захворювань, які можуть бути модифіковані, що стали негативним надбанням прогресу, такі як: підвищення АТ, дисліпідемії, цукровий діабет і ожиріння. З 1988 р. після Бантинговської лекції G. Reaven взаємозалежне поєднання даних патологій прийнято позначати єдиним терміном «метаболічний синдром Х».
Основна ідея створення концепції метаболічного синдрому полягає у виділенні популяції пацієнтів із високим серцево-судинним ризиком, у яких проведення профілактичних заходів, що включають модифікацію способу життя і застосування адекватних лікарських засобів може значимо вплинути на основні показники здоров’я. Виділення пацієнтів з метаболічним синдромом має також велике клінічне значення, оскільки, з одного боку, цей стан є зворотним, тобто при відповідному лікуванні можна домогтися зникнення або принаймні, зменшення вираженості основних його проявів, з іншого — воно передує виникненню такої патології, як цукровий діабет II типу і атеросклероз, що нерозривно пов’язано із підвищенням смертності в популяції.
Ключовим моментом формування метаболічного синдрому є інсулінорезистентність, що запускає порочне коло симптомів, що призводять, у підсумку, до появи тяжких серцево-судинних ускладнень — ІМ, мозкового інсульту і недостатності кровообігу. У той же час інсулінорезистентність не виникає спонтанно, а, за сучасними уявленнями, ініціюючим моментом як інсулінорезистентності, так і всього метаболічного каскаду найчастіше служить ожиріння, яке в свою чергу призводить до розвитку АГ і здатне спричиняти зниження чутливості периферичних тканин до інсуліну і наступного накопичення надмірної маси тіла. Ймовірність розвитку АГ і всієї серцево-судинної патології в осіб з надмірною масою тіла на 50% вище, ніж в осіб з нормальною масою тіла за даними Фремінгемського дослідження. Відповідно до критеріїв ВООЗ, виявлення і визначення ступеня надмірної маси тіла проводиться за ІМТ, який у нормі становить 18,5–24,9 кг/м2. Існують переконливі відомості про те, що ожиріння може бути як незалежним фактором ризику, так і обтяжуючим моментом, що значно погіршує перебіг і прогноз як АГ, так і ІХС. Відзначено, що ризик розвитку серцево-судинної і загальної смертності підвищується навіть при досягненні меж верхньої границі норми маси тіла. За результатами дослідження здоров’я медичних сестер (Nurses Health Study), у жінок, ІМТ яких перебував у межах верхньої межі норми (від 23 до 24,9), відзначали в 2 рази вищий ризик розвитку ІХС, ніж у їх колег з ІМТ <21 кг/м2.
Встановлено, що у пацієнтів із АГ і ожирінням ризик розвитку ІХС підвищений у 2–3 рази, а ризик інсульту — в 7 разів. За результатами Фремінгемського дослідження відзначено, що як САТ, так і ДАТ підвищувалися в середньому на 1 мм рт. ст при збільшенні маси тіла на 1 кг.
Ступінь серцево-судинного ризику при ожирінні залежить від розподілу жирової тканини в організмі і значно вищий при так званому центральному або андроїдному типі, тобто при локалізації жиру переважно в області тулуба порівняно зі стегнами і сідницями. У пацієнтів з ожирінням відзначають збільшення серцевого викиду з метою заповнення зростаючих метаболічних потреб, яке досягається не за рахунок підвищення ЧСС, а за рахунок збільшення ударного об’єму. Високий серцевий викид веде до розвитку ексцентричної ГЛШ і діастоличної дисфункції. Якщо ж потовщення стінки шлуночка відбувається несинхронно з дилатацією його порожнини, то створюються умови для формування систолічної дисфункції з наступним розвитком кардіоміопатії ожиріння і застійної СН на фоні збільшення внутрішньосудинного об’єму. Попередня наявність або приєднання до клінічної картини АГ збільшує прогресування структурно-функціональних порушень у міокарді. Формування ж ГЛШ є самостійним предиктором розвитку раптової смерті, причому, за даними Фремінгемського дослідження, половина чоловіків віком старше 45 років з ЕКГ-ознаками ГЛШ помирала протягом наступних 8 років.
Відомо, що адипоцити вісцеральної жирової тканини секретують вільні жирні кислоти, що потрапляють у воротну вену печінки. Високі концентрації вільних жирних кислот пригнічують поглинання інсуліну печінкою, що призводить до гіперінсулінемії і відносної інсулінорезистентності, які поєднуються з гіперглікемією і гіпертригліциридемією. У свою чергу гіперінсулінемія призводить до розвитку АГ внаслідок посилення реабсорбції натрію в нефронах і затримки рідини; стимуляції САС; підвищення змісту внутрішньоклітинного кальцію і ремоделювання артерій з потовщенням їх медії. Згідно з сучасними уявленнями, поєднуючою основою всіх проявів метаболічного синдрому є первинна інсулінорезистентність і супутня системна гіперінсулінемія. При цьому інсулінорезистентність — це зниження реакції інсулінчутливих тканин на інсулін при його достатній концентрації. Наявність цукрового діабету значно підсилює патогенний вплив основних факторів ризику і пред’являє більш жорсткі вимоги до максимально припустимих величин АТ, з іншого боку, контроль АТ, гіперліпідемії та гіперглікемії позитивно відображається на прогнозі для життя хворого.
Як уже згадувалося, найбільш патогенним у розвитку метаболічного синдрому є абдомінальний тип ожиріння. КТ і МРТ дозволили вивчити особливості розподілу жирової тканини при абдомінальному типі ожиріння. На підставі отриманих даних жирову тканину поділяють на вісцеральну (інтраабдомінальну) та підшкірну. Саме підвищення кількості вісцерального жиру, як правило, поєднується з гіперінсулінемією, інсулінорезистентністю, АГ та ліпідними порушеннями. Будова вісцеральної жирової тканини характеризується морфологічними та функціональними відмінностями. Інтраабдомінальні адипоцити мають більшу щільність β-адренорецепторів, кортикостероїдних та андрогенних рецепторів і відносно меншу щільність α2-адренорецепторів і рецепторів до інсуліну. Це визначає високу чутливість вісцеральної жирової тканини до ліполітичної дії катехоламінів і низьку — до антиліполітичної дії інсуліну. Інтенсивний ліполіз в інтраабдомінальних адипоцитах призводить до вивільнення великої кількості вільних жирних кислот, які надходять по воротній вені в печінку, а потім у системний кровотік. Печінка піддається потужному і постійному впливу вільних жирних кислот, що призводить до цілого ряду метаболічних порушень, розвивається інсулінорезистентність, а потім системна гіперінсулінемія.
Вільні жирні кислоти в печінці утилізуються двома шляхами: або активують глюконеогенез, сприяючи збільшенню продукції глюкози і зниженню активності нозитол-3-кінази інсулінового рецептору, порушуючи транспорт глюкози всередину клітин, що призводить до розвитку гіперглікемії (ефект ліпотоксичності); або використовуються для синтезу ТГ. Характер розподілу жирової тканини оцінюють за допомогою відношення окружності талії до окружності стегон (ОТ/ОС) пацієнта, вимірених за допомогою сантиметрової стрічки. За наявності абдомінального ожиріння цей показник перевищує 1,0 у чоловіків і 0,8 у жінок. Розподіл жирової тканини в тілі людини піддається генетичному контролю.
Інсулінорезистентність, яка виникає завдяки надмірному накопиченню жирової тканини, служить сполучною ланкою між ожирінням, порушенням толерантності до глюкози, АГ і дисліпідемією.
Слід вказати, що схильність до інсулінорезистентності — це історично сформований механізм адаптації організму людини до зміни зовнішніх умов для підтримки енергетичного балансу і нормального функціонування всіх органів і систем. Для пояснення цієї генетичної схильності до інсулінорезистентності J. Neel у 1962 р. висунув теорію ощадливого генотипу. Відповідно до цієї теорії організм людини в часи благополуччя і статку в харчуванні накопичував жири і вуглеводи, а в періоди дефіциту їжі зберігав нормоглікемію і більш ощадливо витрачав енергію за рахунок зниження рівня утилізації глюкози в м’язовій тканині, посилення глюконеогенезу і ліпогенезу. Таким чином, інсулінорезистентність сприяла виживанню людини в періоди голоду. Інсулінорезистентність протягом певного часу підтримує організм у стані між здоров’ям і хворобою. Однак сьогодні в умовах гіподинамії й хронічного переїдання жирів, а також за наявності інших несприятливих факторів, цей механізм стає патологічним і призводить до розвитку цукрового діабету II типу, АГ, атеросклерозу (Himsworth H., 1936; Reaven G., 1988; Warram J. и соавт., 1990).
У сучасній літературі прийнято вказувати, що у 1988 р. G. Reaven ввів термін «синдром Х» або «метаболічний синдром», критерії якого були уточнені в 2001 р. у рекомендаціях Національного інституту здоров’я США, і який нерідко називають також смертельним квартетом, оскільки він включає:
- ожиріння;
- АГ;
- інсулінорезистентність;
- дисліпідемію.
Однак розгляд проблеми метаболічного синдрому розпочався значно раніше. У 1966 р. J. Camus запропонував проаналізувати взаємозв’язок між розвитком гіперліпідемії, цукрового діабету II типу і подагри. Подібний вид порушень обміну речовин він назвав метаболічним трисиндромом (trisyndrome metabolique). У 1968 р. Н. Mehnert і Н. Kuhlmann описали взаємозв’язок факторів, що призводять до обмінних порушень при АГ і цукровому діабеті, і ввели поняття «синдром достатку». Пізніше у 1980 р. М. Henefeld і W. Leonhardt подібний вид порушень стали описувати як метаболічний синдром. А вже наприкінці 1980-х років кілька авторів (Christlieb A.R. et al., 1985; Modan М. et al., 1985; Landsberg L., 1986; Ferranini Е. et al., 1987; Lithell Н. et al., 1988) незалежно один від одного відзначили взаємозв’язок між розвитком у пацієнтів АГ, гіперліпідемії, інсулінорезистентності та ожиріння.
І лише в 1988 р. G. Reaven у своєї Бантинговській лекції, згодом опублікованій у журналі «Diabetes», запропонував термін «синдром X», до якого він включав тканинну інсулінорезистентність, гіперінсулінемію, порушення толерантності до глюкози, гіпертригліцеридемію, зниження ХС ЛПВЩ і АГ. Після чого в 1989 р. N. Kaplan показав, що в більшості пацієнтів із цим синдромом спостерігають центральне ожиріння, а для розгорнутої клінічної картини такого виду метаболічних порушень запропонував термін «смертельний квартет» (ожиріння, АГ, цукровий діабет, гіпертригліцеридемія). Пізніше був виявлений цілий ряд станів, які асоціюються із синдромом інсулінорезистентності: ГЛШ із порушенням діастолічної дисфункції, підвищення внутрішньосудинної зсілості крові та ін. На сьогодні найбільш вживаним терміном є «метаболічний синдром». З огляду на ведучий патогенетичний механізм його розвитку нерідко як синонім використовують термін «синдром інсулінорезистентності».
Золотим стандартом виявлення інсулінорезистентності є еуглікемічна клемп-методика з використанням біостатора. Суть її полягає в тому, що пацієнтові у вену одночасно вводять розчини глюкози та інсуліну. Причому кількість інсуліну постійна, а глюкози — змінюється для того, щоб підтримувати певний (нормальний) рівень глюкози в крові. Кількість глюкози, що вводиться, оцінюють у динаміці. Швидкість введення глюкози відображає біологічну ефективність інсуліну. Визначення інсулінорезистентності цим методом можливе лише за наявності відповідного устаткування. Непрямими показниками інсулінорезистентності можна вважати:
- рівень базальної інсулінемії;
- індекс Саго — відношення глюкози (ммоль/л) до рівня інсуліну натще (МО/мл) у нормі перевищує 0,33;
- критерій Ноmа — (інсулін натще (МО/мл) · глюкоза натощак (ммоль/л) : 22,5) у нормі не перевищує 2,77.
M.N. Duncan і співавтори встановили, що також можна використовувати індекс інсулінорезистентності = (глікемія натще) · (базальний рівень імунореактивного інсуліну) : 25.
Підвищене надходження вільних жирних кислот у печінку та інсулінорезистентність гепатоцитів призводять до підвищення синтезу ТГ і ЛПДНЩ. При інсулінорезистентності знижується активність ліпопротеїнліпази, яка контролюється інсуліном. Виникає характерний тип дисліпідемії, пов’язаний із вісцеральним ожирінням: підвищення концентрації ЛПДНЩ і ТГ, зниження концентрації ЛПВЩ і збільшення кількості дрібних щільних часток ЛПНЩ. Таким чином, ожиріння та інсулінорезистентність сприяють розвитку порушень ліпідного профілю, які поряд з гіперглікемією і АГ призводять до більш раннього і швидкого розвитку атеросклерозу у хворих з порушеннями вуглеводного обміну та вісцеральним ожирінням.
За результатами Фремінгемського дослідження, збільшення маси тіла на 10% супроводжувалося підвищенням концентрації ХС у плазмі крові на 0,3 ммоль/л.
У той же час сама концепція метаболічного синдрому як кластера факторів ризику цукрового діабету і серцево-судинних захворювань зазнала за минулі роки ряд еволюційних перетворень. До 2005 р. відповідно до рекомендацій АНА і Європейського товариства кардіологів верифікацію метаболічного синдрому проводили згідно з критеріями, викладеними в 2001 р. у програмі АТР-III. Однак отримані останнім часом дані внесли істотні корективи в профілактичну концепцію метаболічного синдрому. Нова редакція визначення метаболічного синдрому була представлена у квітні 2005 р. на І Міжнародному конгресі по предіабету та метаболічному синдрому в Берліні, що проводився Міжнародною федерацією по цукровому діабету та на 75-му конгресі Європейського товариства по атеросклерозу в Празі.
Основною мотивацією для висування нового консенсусу по метаболічному синдрому стало бажання примирити фахівців з різними точками зору; визначити об’єднаний робочий діагностичний алгоритм і підкреслити ті області, де більш необхідне накопичення наукових знань. Принципово новою позицією було затвердження абдомінального ожиріння як основного критерію діагностики метаболічного синдрому та більш жорстких нормативних параметрів окружності талії (<94 см для чоловіків і <80 см для жінок), ЛПВЩ (>0,9 ммоль/л для чоловіків і >1,1 ммоль/л для жінок) і визначення гіперглікемії натще при рівні >5,6 ммоль/л глюкози. При цьому ще раз було підкреслено, що макросудинні ускладнення (ІХС, ІМ, церебральний інсульт) є головною причиною смерті пацієнтів з метаболічним синдромом і цукровим діабетом. Ризик виникнення смерті хворого з метаболічним синдромом без клінічних проявів коронарної недостатності внаслідок основних серцево-судинних ускладнень такий же, як і у хворих, які раніше перенесли ІМ без метаболічного синдрому на момент включення в дослідження. Крім того, ще раз була підкреслена необхідність адекватності вибору патогенетично обґрунтованого антигіпертензивного лікування, здатного захистити органи-мішені, оскільки саме контроль АТ є першорядним завданням для терапії такого контингенту хворих, дозволяючи на 51% зменшити кількість основних серцево-судинних подій, у той час як контроль гіперліпідемії знижує ризик смерті від ІХС на 36%, а корекція рівня гіперглікемії може знизити частоту розвитку ІМ тільки на 16%.
Слід зазначити, що єдиної концепції метаболічного синдрому для осіб чоловічої і жіночої статі не існує, оскільки формування метаболічного синдрому в чоловіків перебуває в прямій залежності від вираженості абдомінального ожиріння, а в жінок така залежність від ожиріння з’являється тільки з настанням менопаузи і гіпоестрогенемії. Менопаузальний метаболічний синдром ми свідомо виділяємо тому, що 50% пацієнтів з АГ становлять жінки в період менопаузи, частота виявлення цукрового діабету II типу в жінок віком 40–50 років — 3–5%, а у жінок віком 60 років — 10–20%, тобто з віком прогресують порушення вуглеводного обміну.
Розходження ступеня ризику виникнення фатальних серцево-судинних захворювань знайшло своє відображення в системі SCORE, презентованій ще в 2003 р. на конгресі Європейського товариства кардіологів. Воно свідчить про те, що в чоловіків серцево-судинні захворювання починають прогресувати з досягненням 40-річного віку, тоді як в жінок така закономірність виникає лише з досягненням віку 50–55 років і настанням менопаузи.
У дослідженні DECODE установлено, що підвищення АТ і порушення чутливості до інсуліну підвищують ризик розвитку серцево-судинних захворювань у жінок у постменопаузальний період навіть при незначних змінах АТ і чутливості до інсуліну. Найбільш вразливий період перехідного віку жінок — пременопауза, тобто початковий період зниження функції яєчників (в основному у жінок віком старше 45 років і до настання менопаузи), що супроводжується критичним зниженням рівня естрогенів. Реалізація дефіциту естрогенів у період менопаузи включає вплив на метаболізм ліпопротеїнів, прямий вплив на біохімічні процеси в стінці судин через специфічні рецептори до естрогенів, а також опосередкований вплив через метаболізм глюкози, інсуліну, гомоцистеїну, систему гемостазу та ін.
Логічним продовженням таких поглядів стала презентація гіпотези про гендерне розходження в патогенезі метаболічного синдрому в чоловіків і жінок у рамках секційних засідань «Жінки у серці» у вересні 2005 р. на черговому Конгресі європейського товариства кардіологів. Основна ідея цієї гіпотези базується на постулаті про те, що в чоловіків провідним предиктором метаболічного синдрому є абдомінальне ожиріння незалежно від віку; у жінок основні пускові механізми формування метаболічного синдрому — цукровий діабет і менопауза. Висловлено думку про те, що менопауза — це природна модель імунорезистентного стану і ендотеліальної дисфункції.
КЛІНІКА І ДІАГНОСТИКА МЕТАБОЛІЧНОГО СИНДРОМУ, ЦУКРОВОГО ДІАБЕТУ І ПРЕДІАБЕТУ
Неухильне прогресування всесвітньої епідемії цукрового діабету і метаболічного синдрому не залишило байдужими більшість практикуючих лікарів, які прийшли до висновку, що тільки полісистемний підхід до рішення цього завдання може увінчатися успіхом. Цукровий діабет і захворювання серцево-судинної системи часто являють собою дві сторони однієї медалі: з одного боку, цукровий діабет можна розцінювати як стан, що сприяє розвитку ІХС, а з іншого боку — у багатьох пацієнтів із уже існуючою ІХС відзначають цукровий діабет або предіабетичний стан. Таким чином, давно назріла необхідність виробити спільний підхід до цієї проблеми з боку кардіологів та ендокринологів, який дозволить підвищити якість діагностики і лікування в рамках єдиної медичної допомоги мільйонам пацієнтів із серцево-судинними і метаболічними захворюваннями.
Подібний кардіодіабетологічний підхід не тільки вкрай важливий для пацієнтів, але й відкриває шлях для подальшого прогресу в області кардіології і діабетології. Європейське кардіологічне товариство (ESC) і Європейська асоціація по вивченню цукрового діабету (EASD), відповідаючи на цей заклик, ухвалили рішення щодо розробки об’єднаних, заснованих на принципах доказової медицини, рекомендацій із лікування цукрового діабету та серцево-судинних захворювань. Мета впровадження цих рекомендацій полягає в поліпшенні лікувально-профілактичної допомоги пацієнтам з маніфестним цукровим діабетом, хворим з порушеною толерантністю до глюкози і високим ризиком розвитку цукрового діабету, а також у підвищенні ефективності терапії серцево-судинних захворювань у цій популяції.
У рекомендаціях були прийняті класи рекомендацій і рівні доказовості для оцінки терапевтичних підходів, що стали вже традиційними для більшості подібних методичних настанов. Суть єдиного підходу робочої групи до розглянутої проблеми виражена на рис. 4.1.
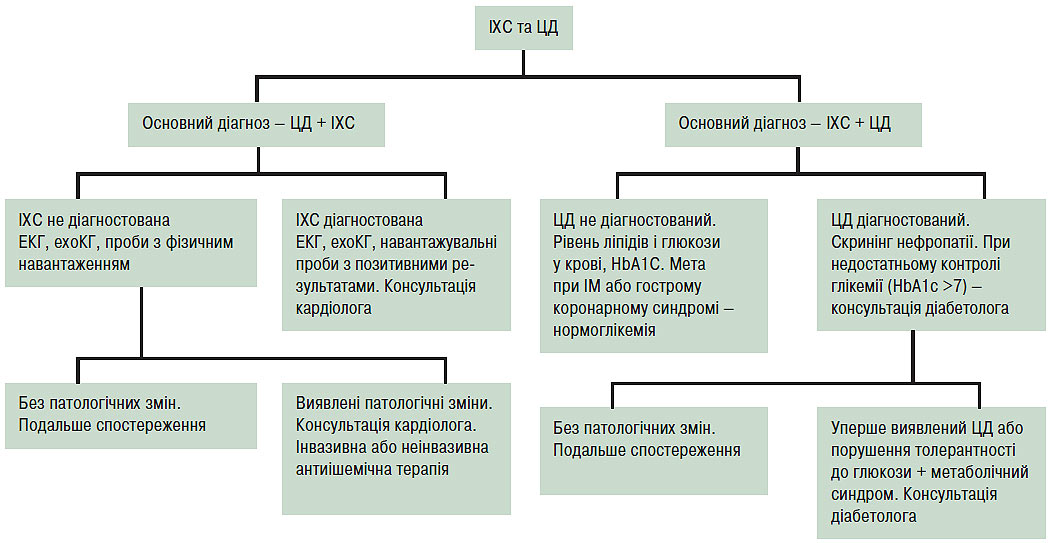
Рис. 4.1. Єдиний алгоритм обстеження пацієнтів із цукровим діабетом та ІХС. ЦД — цукровий діабет
Наріжний камінь терапії кожного з патологічних станів — встановлення діагнозу та вибір найбільш адекватної терапії. Для цього необхідним буде знайомство кардіологів з канонічним для діабетологів підходом для верифікації основного діагнозу відповідно до критеріїв ВООЗ (1999) і ADA (1997, 2003) (табл. 4.1)
Таблиця 4.1
Критерії, які використовуються у глюкометаболічній класифікації відповідно до рекомендацій ВООЗ (1999) і ADA за 1997 і 2003 рр.
|
Глюкометаболічна категорія |
Джерело |
Класифікаційні критерії, ммоль/л (мг/дл)* |
|
Нормальна регуляція рівня глюкози в крові |
ВООЗ ADA (1997) ADA (2003) |
FPG <6,1 (110), 2-h PG <7,8 (140) FPG <6,1 (110) FPG <5,6 (100) |
|
Гіперглікемія натще |
ВООЗ ADA (1997) ADA (2003) |
FPG ≥6,1 (110), але <7,0 (126); 2-h PG <7,8 (140) FPG ≥6,1 (110), але <7,0 (126) FPG ≥5,6 (100) але <7,0 (126) |
|
Порушення толерантності до глюкози |
ВООЗ |
FPG <7,0 (126); 2-h PG ≥7,8, але <11,1 (200) |
|
Порушення глюкозного гомеостазу |
ВООЗ |
Як для гіперглікемії натще або порушення глюкозного гомеостазу |
|
Цукровий діабет |
ВООЗ ADA (1997) ADA (2003) |
FPG ≥7,0 (126) або 2-h PG ≥11,1 (200) FPG ≥7,0 (126) FPG ≥7,0 (126) |
*Значення наведені для рівня глюкози в плазмі венозної крові; FPG — рівень глюкози в плазмі крові натще; 2-h PG — рівень глюкози в плазмі крові через 2 год після навантажувальної проби (1 ммоль/л відповідає 18 мг/дл).
З огляду на той факт, що левова частка в поширеності діабету в популяції належить цукровому діабету II типу, автори настанови, проте, приділили належну увагу етіологічній класифікації порушень вуглеводного обміну, усвідомлюючи те, що уважне ставлення до першопричини захворювання є запорукою вірного вибору терапевтичних лікувальних заходів.
Етіологічна класифікація була представлена таким чином:
- Цукровий діабет I типу (внаслідок загибелі бета-клітин, яка зазвичай веде до абсолютної інсулінової недостатності):
- аутоімунний;
- ідіопатичний.
- Цукровий діабет II типу (може варіювати в межах від переважної резистентності до інсуліну в поєднанні з відносною інсуліновою недостатністю до переважно секреторного дефекту з резистентністю до інсуліну або без неї).
- Інші специфічні типи цукрового діабету:
- зумовлений генетичними дефектами функції бета-клітин;
- зумовлений генетичними дефектами в дії інсуліну (наприклад ліпоатрофічний діабет);
- при захворюваннях екзокринного відділу підшлункової залози (наприклад панкреатит, травма, панкреатектомія, неоплазія, муковісцидоз);
- при ендокринопатіях (наприклад синдром Кушинга, акромегалія, феохромоцитома, гіпертиреоз);
- медикаментозно або хімічно індукований (наприклад спричинений кортизолом, антидепресантами, тіазидами та ін.);
- спричинений інфекцією (цитомегаловірус);
- рідкісні форми імунологічно зумовленого цукрового діабету;
- інші генетичні синдроми, що іноді пов’язуються із цукровим діабетом (наприклад синдром Дауна, атаксія Фрідрейха, синдром Клайнфелтера, синдром Вольфрама).
- Діабет вагітних (включає категорії гестаційного порушення толерантності до глюкози і власне гестаційний діабет).
Беручи до уваги труднощі інтерпретації рівня глюкози в різних середовищах, з якими стикається практикуючий лікар, доцільним, на наш погляд, є використання коефіцієнтів перерахунку, представлених у табл. 4.2.
Таблиця 4.2
Коефіцієнти для перерахунку рівня плазматичного рівня глюкози
|
№ з/п |
Перерахунок для обчислення плазматичного рівня глюкози |
|
1 |
Глюкоза плазми крові (ммоль/л) = 0,668+1,119 · глюкоза в цільній крові (ммоль/л) |
|
2 |
Глюкоза плазми крові (ммоль/л) = 0,102+1,066 · глюкоза капілярної крові (ммоль/л) |
|
3 |
Глюкоза плазми крові (ммоль/л) = –0,137+1,047 · глюкоза сироватки (ммоль/л) |
Первинний скринінг для виявлення потенційних хворих на цукровий діабет II типу найбільш ефективний при використанні шкали для неінвазивного визначення ризику (приклад подібної шкали наведений на рис. 4.2) у поєднанні із проведенням діагностичної пероральної проби толерантності до глюкози в осіб з високим ступенем ризику по цій шкалі. Виявлення і діагностична класифікація цукрового діабету та предіабетичних станів повинні ґрунтуватися на рівні можливого наступного ризику серцево-судинних ускладнень. Кардіологам добре відомий високий ступінь серцево-судинного ризику, характерний для пацієнтів із цукровим діабетом, відповідно до якого такі хворі, навіть без проявів ІХС, мають такий же ступінь ризику розвитку основних серцево-судинних подій, як і хворі з постінфарктним кардіосклерозом.
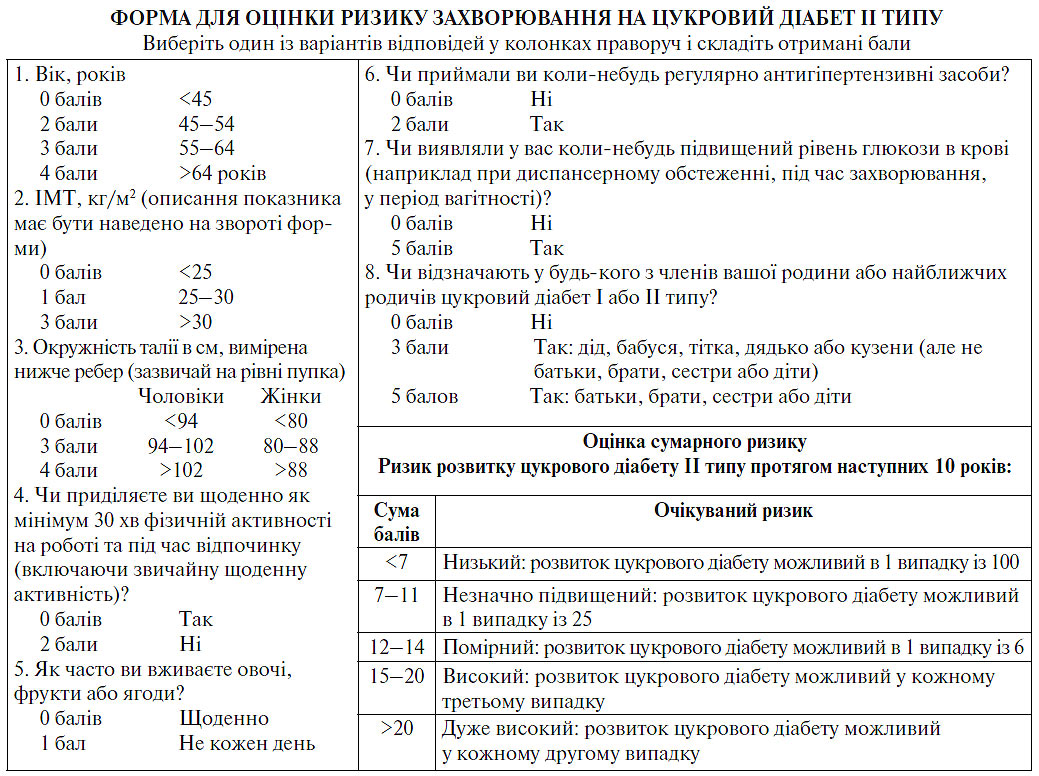
Рис. 4.2. Шкала FINDRISK
Для зручності оцінки ступеня ризику захворювання цукровим діабетом протягом 10-річного періоду в дорослих лікарям запропоновано використовувати шкалу FINDRISK (FINnish Diabetes Risk Score) (див. рис. 4.2).
З огляду на широку поширеність порушень вуглеводного обміну необхідно адекватно оцінювати епідеміологію цукрового діабету, а також порушень толерантності до глюкози та їх співвідношення з ризиком розвитку серцево-судинних ускладнень. Гіперглікемію слід розглядати в нерозривному зв’язку з ІХС. Кожному підвищенню рівня HbA1c на 1% відповідає певний приріст ризику ІХС. Ризик розвитку ІХС для пацієнтів із вираженим цукровим діабетом підвищений у 2–3 рази у чоловіків і в 3–5 разів у жінок порівняно з особами без діабету. Показник постпрандіальної (післянавантажувальної) глікемії більш інформативний для оцінки потенційного ризику ІХС, ніж показник рівня глюкози натще, а постпрандіальна (післянавантажувальна) гіперглікемія також є предиктором підвищеного серцево-судинного ризику в осіб з нормальним рівнем глюкози в крові натще. Підвищення контролю постпрандіальної глікемії дозволяє знизити рівень серцево-судинного ризику і смертності. Глюкометаболічні порушення являють собою особливо високий ризик серцево-судинної захворюваності і смертності в жінок, які потребують у зв’язку із цим особливої уваги. Ризик розвитку інсульту підвищений у пацієнтів із цукровим діабетом і порушенням толерантності до глюкози. У пацієнтів з інсультом приховану (невизначену) гіперглікемію більшою мірою виявляють при проведенні перорального тесту толерантності до глюкози. Цільовий рівень глікемії при лікуванні хворих на цукровий діабет, що рекомендується різними організаціями, наведено у табл. 4.3.
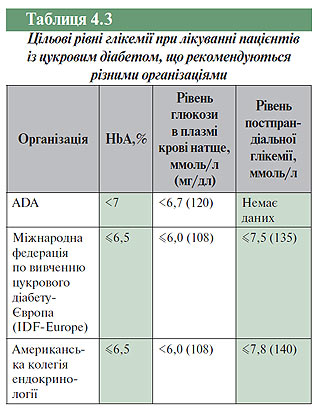
Застосування перорального тесту толерантності до глюкози у пацієнтів з метаболічним синдромом дозволяє ідентифікувати осіб з вищим ризиком серцево-судинних ускладнень, хоча й не може забезпечити більш ефективний або надійний прогноз серцево-судинного ризику, ніж використання шкали, що базується на основних показниках серцево-судинного ризику (рівень АТ, тютюнопаління, рівень ХС у плазмі крові). Разом з тим слід зазначити, що визначення рівня глюкози натще — нечутливий метод для виявлення прихованої гіперглікемії. Оцінка ризику передбачуваного розвитку цукрового діабету II типу повинна бути частиною загальної програми рутинної медичної допомоги, що використовує всі доступні методи оцінки ризику. Пацієнтам без встановленого діагнозу цукрового діабету II типу, але з діагностованою ІХС, слід проводити пероральну пробу на толерантність до глюкози. Особи з високим ступенем ризику розвитку цукрового діабету II типу повинні одержати консультацію в плані корекції способу життя, а за необхідності — отримувати адекватну фармакотерапію для зниження ризику розвитку цукрового діабету. Ці заходи також здатні знизити ризик розвитку ІХС. Поява цукрового діабету в осіб з порушеною толерантністю до глюкози може бути відстрочена застосуванням деяких препаратів (наприклад метформіну, акарбози і розиглітазону). Пацієнти з цукровим діабетом повинні підтримувати достатню фізичну активність для зниження ризику серцево-судинних ускладнень.
ЛІКУВАННЯ І ПРОФІЛАКТИКА МЕТАБОЛІЧНОГО СИНДРОМУ, ДІАБЕТУ Й ПРЕДІАБЕТУ
Першорядне завдання, що стоїть перед лікарями, — вчасно почате лікування, яке включає немедикаментозні і медикаментозні методи корекції метаболічних порушень і ожиріння, а при виборі лікарських засобів необхідно враховувати їх метаболічні ефекти та органопротекторну дію. Терапія метаболічного синдрому має на меті виконання 5 основних завдань: нормалізації маси тіла, підвищення фізичної активності, проведення антигіпертензивної терапії, застосування ліпідознижувальних препаратів і дезагрегантної терапії з використанням ацетилсаліцилової кислоти.
Первинними повинні бути заходи, спрямовані на зменшення маси тіла і нормалізацію метаболічних порушень. Вплив зменшення маси тіла на рівень АТ був продемонстрований у ряді великих багатоцентрових досліджень, таких як ТОНР-1, TAIM, TOMHS, XENDOS.
Відзначено, що немедикаментозна терапія, пов’язана з корекцією способу життя, поліпшує метаболічний контроль; самоспостереження поліпшує глікемічний контроль; контроль рівня глюкози в периферичній крові, що забезпечує рівень нормоглікемії (HbA1c=6,5%), знижує частоту мікро- і макросудинних ускладнень; інтенсивна інсулінотерапія при цукровому діабеті I типу знижує захворюваність і смертність; рання інтенсифікація терапії для досягнення встановлених цілей лікування поліпшує комбінований показник захворюваності і смертності при цукровому діабеті II типу; у пацієнтів із цукровим діабетом II типу при невдалій спробі досягти цільового рівня глюкози слід розглянути можливість раннього призначення інсулінотерапії; метформін рекомендується як препарат першого ряду у пацієнтів з надмірною масою тіла і цукровим діабетом II типу.
Доцільність призначення адекватної гіпоглікемізуючої терапії підтверджена можливістю її впливу на прогностично значимий показник глікозильованого гемоглобіну (HbA1c, %). При цьому слід прагнути до досягнення цільового рівня HbA1c, який асоціюється з максимально позитивним клінічним ефектом терапії.
Украй важливим є і той факт, що у хворих на цукровий діабет II типу можуть відзначатися порушення ліпідного обміну, підвищений АТ, а також високий ризик розвитку ІХС. Слід проводити модифікацію всіх основних серцево-судинних факторів ризику.
Корекція дисліпідемії
Хворим із вираженої дисліпідемією, яка не піддається корекції дієтотерапією, призначають гіполіпідемічні препарати: статини (симвастатин, правастатин, аторвастатин) або фібрати. Рішення про медикаметозне лікування дисліпідемії базується як на даних визначення рівня ліпідів після дотримання гіполіпідемічної дієти протягом не менше 3–6 міс, так і на результатах визначення сумарного ступеня ризику розвитку атеросклерозу. При відсутності ефекту немедикаментозних методів і гіпоглікемізуючої терапії, а в деяких уже згаданих випадках — одночасно із цими заходами, використовують гіполіпідемічні засоби. Закінчено цілий ряд досліджень, у яких проаналізовано результати застосування ліпідознижувальних засобів, насамперед статинів, у підгрупі хворих на цукровий діабет II типу. Так, у дослідженні 4S (Scandinavian Simvastatin Survival Study) симвастатин значно зменшував кількість ускладнень ІХС у пацієнтів з цукровим діабетом II типу і високим рівнем ЛПНЩ. Загальна смертність під впливом симвастатину знизилася на 45% у групі хворих на цукровий діабет II типу (на 29% — у групі пацієнтів без цукрового діабету II типу), а ризик ІМ — на 55% (на 32% у групі хворих без цукрового діабету II типу).
У дослідженні CARE (Cholesterol and Recurrent Events) інший інгібітор ГМГ-КоА-редуктази — правастатин у хворих з ІХС і цукровим діабетом II типу з помірним підвищенням ЛПНЩ також вірогідно на 25% попереджав ускладнення ІХС.
У дослідженні HPS (Heart Protection Study), у яке були включені >4 тис. пацієнтів із цукровим діабетом II типу без ІХС, симвастатин на 25% знижував ризик розвитку гострого коронарного синдрому, інсульту і необхідність у реваскуляризації. І, нарешті, в 2004 р. були отримані результати багатоцентрового рандомізованого, подвійного сліпого плацебо-контрольованого дослідження CARDS, яке стало першим у вивченні застосування статинів для первинної профілактики, проведеним винятково у пацієнтів з цукровим діабетом II типу. Учасники CARDS приймали аторвастатин у дозі 10 мг/добу (в групі з підвищеним ризиком серцево-судинної захворюваності і смертності, але без встановленого серцево-судинного захворювання). При цьому середній вихідний рівень ХС ЛПНЩ склав 3,0 ммоль/л (117 мг/дл). Відповідно до отриманих результатів аторвастатин забезпечив позитивний вплив у пацієнтів із цукровим діабетом II типу, у яких не було в анамнезі серцево-судинних захворювань і був нормальний або незначно підвищений рівень ХС. У результаті виявлене зниження частоти серйозних серцево-судинних подій на 37% (р=0,001); інсульту — на 48% (р=0,016); смертності від усіх причин — на 27% (р=0,059). При цьому позитивний ефект не залежав від вихідного рівня ліпідів, статі або віку. Доповідь, присвячена дослідженню CARDS, закінчувалася риторичним висловлюванням: «Дебати щодо того, чи для всіх пацієнтів із цукровим діабетом II типу виправдане лікування статинами, нині повинні сфокусуватися на тому, чи існують пацієнти з досить низьким ризиком, щоб не призначати їм лікування статинами». Таким чином, статини сьогодні — єдині гіполіпідемічні препарати, що зарекомендували себе як ефективні в декількох багатоцентрових контрольованих дослідженнях у попередженні серцево-судинних ускладнень у хворих на цукровий діабет II типу.
Підвищений рівень ХС ЛПНЩ і знижений ХС ЛПВЩ є важливими факторами ризику в осіб із цукровим діабетом. Хворим на цукровий діабет при супутній ІХС терапію статинами слід призначати незалежно від вихідного ХС ЛПНЩ і проводити, орієнтуючись на досягнення цільового рівня показника <1,8–2,0 ммоль/л (<70–77 мг/дл). Слід розглянути можливість призначення статинів дорослим пацієнтам із цукровим діабетом II типу без супутньої ІХС, якщо рівень загального ХС >3,5 ммоль/л (>135 мг/дл); мета цієї терапії — домогтися зниження рівня ХС ЛПНЩ у крові на 30–40%. З урахуванням ризику розвитку ІХС терапію статинами слід призначати всім пацієнтам з цукровим діабетом I і II типу пожиттєво. Додатковим аргументом відносно статинотерапії хворих з метаболічним синдромом служать результати дослідження JUPITER (2008), у якому прийом розувастатину у пацієнтів з невисоким рівнем ХС ЛПНЩ (<3,4 ммоль/л) та підвищеним рівнем С-реактивного протеїну знизив ризик виникнення інфаркту міокарда на 54%, реваскуляризації — на 46%, кардіоваскулярної смертності — на 47%, що практично відповідало поширенню синдрому інсулінорезистентності. У хворих на цукровий діабет з гіпертригліцеридемією >2 ммоль/л (177 мг/дл), яка зберігається після досягнення цільового рівня ХС ЛПНЩ за допомогою статинів, терапія статинами повинна бути інтенсифікована для зниження до цільового рівня змісту ХС не-ЛПВП, не пов’язаного із ЛПНЩ. У деяких клінічних ситуаціях доцільно розглянути можливість комбінованої терапії з додаванням езетимібу, нікотинової кислоти або фібратів.
Нормалізація рівня АТ — найважливіший аспект лікування хворих на цукровий діабет
Цільовий рівень АТ, що рекомендується пацієнтам із цукровим діабетом і АГ, <130/80 мм рт. ст. Ризик розвитку серцево-судинних ускладнень у пацієнтів із цукровим діабетом і АГ значно підвищений. Цей ризик може бути ефективно знижений проведенням антигіпертензивної терапії. У хворих на цукровий діабет для задовільного контролю рівня АТ зазвичай необхідне призначення комбінації кількох гіпотензивних засобів. Схема гіпотензивної терапії у пацієнтів із цукровим діабетом повинна включати застосування інгібітору РААС.
Антигіпертензивними препаратами першого вибору в таких хворих є інгібітори АПФ, оскільки в ряді великих багатоцентрових досліджень було досить переконливо доведене їх метаболічно нейтральна і органопротекторна дія. Результати досліджень UKPDS, ABCD, CAPPP, FACET продемонстрували нейтральну дію інгібіторів АПФ на вуглеводний і ліпідний обмін.
У дослідженнях HOPE, CAPPP, LIFE встановлено позитивний ефект використання інгібіторів АПФ і антагоністів рецепторів ангіотензину-II при тривалому застосуванні, який виражається в зниженні ризику розвитку цукрового діабету II типу. Така дія може бути пов’язана з їх здатністю блокувати утворення і дію ангіотензину на функцію ендотелію, на чутливість периферичних тканин до інсуліну і зниження інсулінорезистентності.
Цілеспрямоване виявлення мікроальбумінурії і адекватна гіпотензивна терапія, яка включає застосування інгібіторів АПФ і блокаторів рецепторів ангіотензину-II, знижує частоту мікро- і макроваскулярних порушень при цукровому діабеті I і II типу.
Відповідно до цього субдослідження PERSUADE у пацієнтів з ІХС і цукровим діабетом, проведеного в рамках EUROPA (березень 2004 р.), периндоприл у дозі 8 мг протягом 4 років дозволив знизити ризик виникнення первинної кінцевої точки на 19%, ІМ — на 23%, нефатального ІМ — на 34%, СН — на 46%. Відзначено, що абсолютна ефективність інгібітору АПФ периндоприлу була вищою у пацієнтів із цукровим діабетом в 2 рази, що підтверджує ефективність і обґрунтовану доцільність лікування хворих, у яких серцево-судинний ризик вищий.
Важливе місце займають антагоністи кальцію пролонгованої дії для лікування АГ у хворих з метаболічним синдромом, оскільки доведена їх метаболічно нейтральна дія на вуглеводний і ліпідний обмін (амлодипін у дослідженні ALLHAT), а також кардіо- і ренопротекторний ефекти.
Блокатори β-адренорецепторів з високою селективністю здатні вибірково блокувати β1-адренорецептори, такі як бетаксолол, бізопролол, небіволол, можуть успішно використовуватися в лікуванні метаболічного синдрому. Застосування діуретиків показане таким хворим у зв’язку з наявністю в патогенезі АГ при метаболічному синдромі затримки натрію і гіперволемії. Однак не всі діуретики безпечні та ефективні у хворих з метаболічними порушеннями. На сьогодні широке застосування отримали нові тіазидоподібні препарати, що значно відрізняються своїми властивостями, такі як індапамід.
Пацієнтам із метаболічним синдромом показане застосування препаратів центральної дії, а саме активатора I2-імідазолінових рецепторів (моксонідин). Ця група препаратів має властивість підвищувати чутливість тканин до інсуліну, здатністю зменшувати ГЛШ, що поступається тільки інгібіторам АПФ, спричиняє виражену кардіопротекторну дію. Зважаючи на те, що в розвитку метаболічного синдрому основну роль грають активація симпатичної нервової системи, інсулінорезистентність, гіперінсулінемія, а також наявність виражених метаболічних порушень, одним із класів рекомендованих гіпотензивних препаратів є препарати центрального типу дії, зокрема моксонідин, який приводить до нормалізації рівня глюкози в крові, зниженню інсулінорезистентності, поліпшенню показників ліпідного обміну. Експериментальні та клінічні дослідження показали, що моксонідин діє на ключові елементи метаболічного синдрому. Сьогодні проводяться кілька досліджень із застосуванням моксонідину в пацієнтів з метаболічним синдромом. Переваги моксонідину — простота застосування, висока ефективність і хороша переносимість як при монотерапії, так і в комбінації, поліпшення метаболічних показників.
Прогностична важливість адекватного лікування ІХС у хворих на цукровий діабет
Рання стратифікація ризику має бути частиною оцінки стану пацієнтів із цукровим діабетом після гострого коронарного синдрому. При лікуванні кожного пацієнта із цукровим діабетом після перенесеного гострого коронарного синдрому слід прагнути досягти цілей терапії, перелічених у табл. 4.4. Пацієнтам з гострим ІМ і цукровим діабетом показане призначення тромболітичної терапії на тих же підставах, що й хворим без цукрового діабету. Пацієнтам із цукровим діабетом і гострим коронарним синдромом по можливості слід проводити ранню ангіографію й механічну реваскуляризацію. Застосування блокаторів β-адренорецепторів дозволяє знизити захворюваність і смертність у пацієнтів із цукровим діабетом і гострим коронарним синдромом.
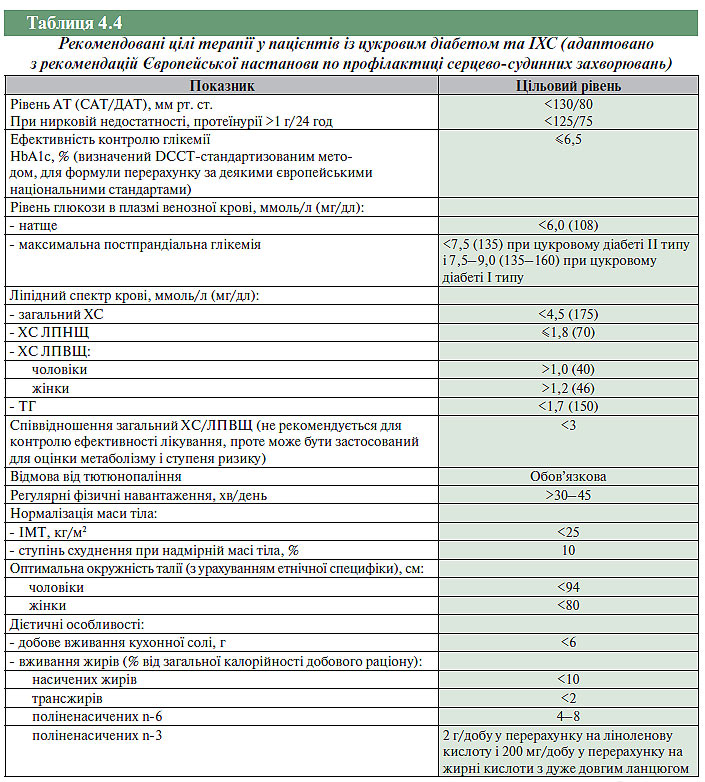
Найважливішим лікувальним заходом щодо попередження тромботичних ускладнень метаболічного синдрому рекомендоване призначення ацетилсаліцилової кислоти (HOT, USPHS, ETDRS), яка вірогідно знижує ризик розвитку основних серцево-судинних ускладнень. Повноцінна реалізація всіх перелічених вище терапевтичних підходів може істотно вплинути на якість життя пацієнтів і запобігти виникненню загрожуючих життю серцево-судинних ускладнень. Ацетилсаліцилову кислоту пацієнтам із цукровим діабетом призначають за тими ж показанням і в тих же дозах, що й пацієнтам без цього захворювання. Хворим на цукровий діабет з гострим коронарним синдромом додатково до застосування ацетилсаліцилової кислоти можна призначати інгібітори агрегації тромбоцитів, індукованою активацією АДФ-рецепторів (клопідогрел).
Призначення інгібітору АПФ додатково до іншої терапії знижує ризик розвитку серцево-судинних ускладнень у пацієнтів із цукровим діабетом і діагностованою ІХС. Ефективний глюкометаболічний контроль забезпечує перевагу пацієнтам із цукровим діабетом і гострим ІМ. Він дозволяє максимально ефективно реалізовувати різні терапевтичні стратегії.
Ретельний облік і аналіз факторів ризику дозволяє виділити контингент хворих із високою загрозою розвитку основних серцево-судинних ускладнень. Акцентування уваги в клінічній практиці на пацієнтах із цукровим діабетом, порушеною толерантністю до глюкози і надмірною масою тіла дасть можливість модифікувати фактори ризику, а значить, позитивно вплинути на прогноз цього серйозного кардіологічного контингенту пацієнтів.
ЛІТЕРАТУРА
- World Health Organization — International Society of Hypertension (1999) Guidelines for the Management of Hypertension. J. Hypertension; 17(2): 151–183; 30(Suppl. 2): 1–7.
- Ackroff K., Sclafani A. (1996) Effects of the lipase inhibitor orlistat on intake and preference for dietary fat in rats. Am. J. Physiol., 271(1Pt2): R48–54.
- Adult Treatment Panel III (2002) Third Report of the National Cholesterol Education Programme (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel Ill) Final report. Сirculation, 106(25): 3143–3421.
- Alberti K.G., Zimmet P.Z. (1998) Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet. Med., 15(7): 539–553.
- Alberti K.G., Zimmet P., Sbaw J. (2005) The metabolic syndrome — a new worldwide definition. Lancet, 366(9491): 1059–1062.
- Alessi M.C., Perietti F., Morange P. et al. (1997) Production of plasminogen activator inhibitor 1 by human adipose tissue: possible link between visceral fat accumulation and vascular disease. Diabetes, May, 46(5): 860–867.
- American College of Endocrinology (2002) American College of Endocrinology Consensus Statement on Guidelines for Glycemic Control. Endocr. Pract., 8(Suppl. 1): 1–82.
- Best J., Nicholson G.O., Neal et al. (1996) Atorvastatin and simvastatin reduce elevated cholesterol in non-insulin dependent diabetes. Diabetes Nutr Metab, 9: 74–80.
- Bjorntop P. (1990) «Portal» adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Aterosclerosis, 10: 493–496.
- Borkan G.A., Sparrow D., Wisnrewski C. et al. (1986) Body weight and coronary disease risk: patterns of risk factor change associated with lon-term weight change. The normative ageing study. Am. J. Epidemiol., 124: 410–9.
- Broun A. (1998) Treating patients with documented atherosclerosis to national cholesterol education program-recommended low-density-lipoprotein cholesterol goals with atorvastatin, fluvastatin, lovastatin and simvastatin. JACC, 32: 665–672.
- Collins R., Yusuf S. (2001) HPS-Simvastatin and anti-oxidants. Americal Heart Association Scientific Sessions; November 11–14, Anaheim, California, Plenary Session VII: Late — Breaking Clinical Trials.
- De Backer G., Ambrosioni K., Borch-Johnsen K. et al. Third Joint Task Force of the European and Other Societies (2003) European guidelines on cardiovascular disease prevention. Eur. J. Cardiovasc. Prev. Rehab., 10(Suppl. 1): Sl–S78.
- Fogari R., Preti P., Banderali A. et al. (1999) ACE-inhibition but not angiotensin II antagonism improves fibrinolisis and sensitivity in hypertensive post-menopausal women. J. Hypertens., 17(Suppl. 3): S143.
- Frithz G. (2001) Influense on plasma-insulin and blood-glucose by treatment with bisoprolol in hypertensive, non-diabetic patients. J. Clin. Basic. Cardiol., 4: 229–230.
- Genuth S., Alberti K.G., Bennett P. et al.; Expert Committee on the Diagnosis and Classification of Diabetes. Mellitus (2003) Followup report on the diagnosis of diabetes mellitus. Diabetes Care, 26(11): 3160–3167.
- Grimm R.H., Grandits G.A., Culter J.A. et al. (1997) Relationship of quality of life measures to long-term lifestyle and drug treatment in the treatment of mild hypertension study (TOMHS). Arch. Intern. Med., 157: 638–648.
- Hansson L., Zanchetti A., Carruthers S.G. et al. (1998) Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet, 351: 1755–1762.
- Mallion J.M., Gaudemaris R.D. et al. (1990) Day and night blood pressure values in normotensive and essential hypertensive subjects assessed by twenty-four-hour ambulatory monitoring. J. Hypertens., 8: 49–55.
- Prichard B.N.S., Simmons R., Rooks M.J. et al. (1992) A double — blind comparison of moxonidine and atenolol in the management of patients with mild — to — moderate hypertension. J. Cardiovsc. Pharmacol., 20(Suppl. 4): S45–16.
- Reaven G.M. (1988) Role of insulin resistance in human disease. Diabetes, 37: 1595–1607.
- Ryden L., StandI E. еt al. Task Force on Diabetes and Cardiovascular Diseases of European Society of Cardiology (ESC), European Association for the study of Diabetes (EASD) (2007) Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur. Heart J., 28(I): 88–136.
- Schernthaner G., Matthews D.R., CharbonneI B. et al.; Quartet [corrected] Study Group (2004) Efficacy and safety of pioglitazone versus rnetformin in patients with type 2 diabetes rnellitus: a double-blind, randomized trial. J. Clin. Endocrinol. Metab., 89 (12): 6068–6076.
- Standl E., Fuchtenbusch M. (2003) The role of oral antidiabetic agents: why and when to use an early-phase insulin secretion agent in Type II diabetes mellitus. Diabetologia, 46(Suppl. I): M30–M36.
- Weidmann P. (2001) Metabolic profile of indapamide sustained-release in patients with hypertension. Drug safety, 24: 1155–1165.
- WHO Consultation (1999) Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus. Geneva: World Health Organization; Report no. 99.2.
- Мітченко О.І. (2004) Патогенетичні основи метаболічного синдрома. Нова медицина, 4: 20–24.
- Мітченко О.І. (2005) Менопаузальний метаболічний синдром. Нова медицина, 4: 18–23.
- Мычка В.Б., Богиева Р.М., Чазова И.Е. (2003) Акарбоза — средство профилактики множественных сердечно-сосудистых факторов риска метаболического синдрома. Клин. фармакол. и тер., 12(2): 80–83.
- Чазова И.Е., Мычка В.Б. (2003) Метаболический синдром. Кардиоваскулярная терапия и профилактика, 3: 32–38.